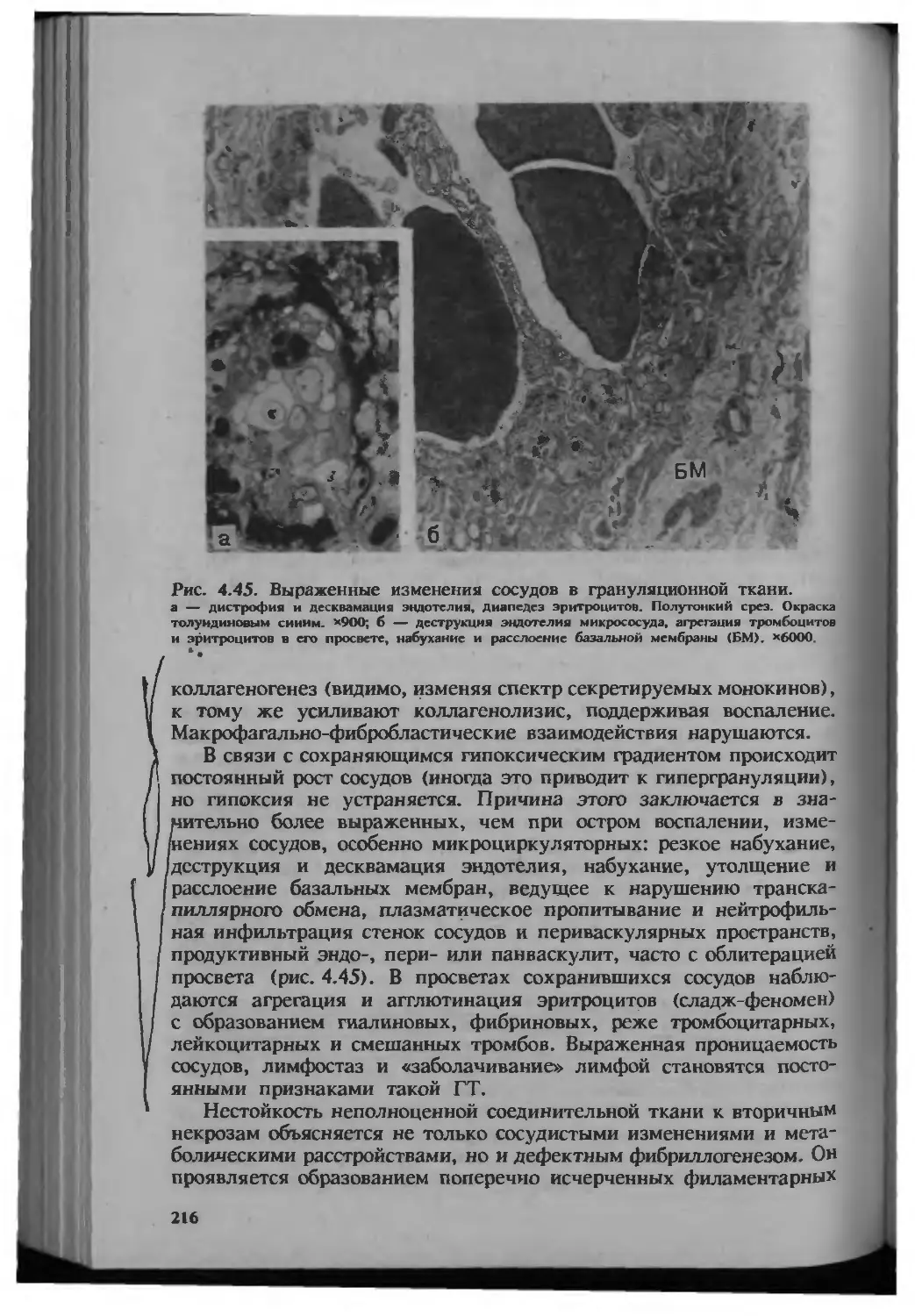
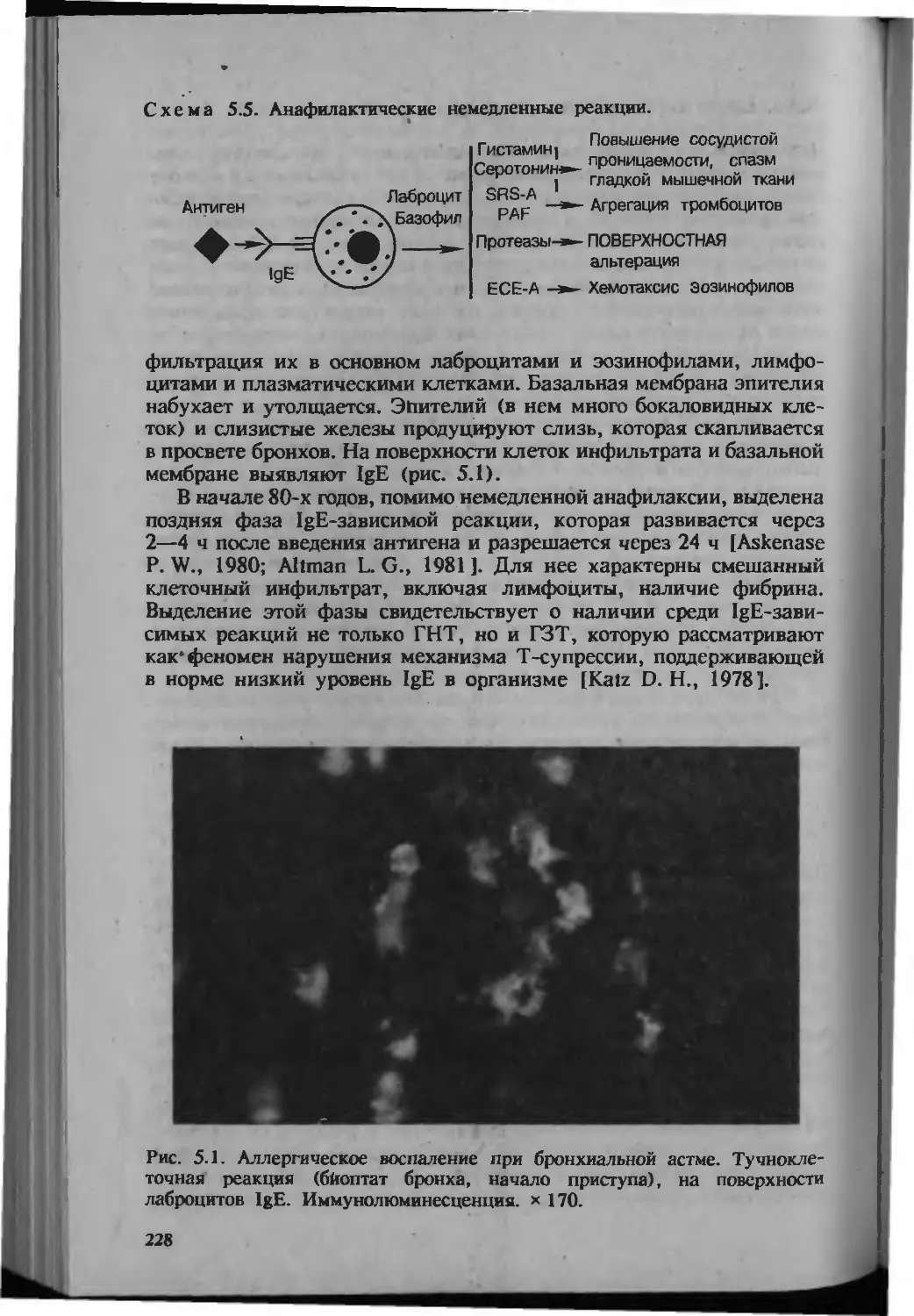
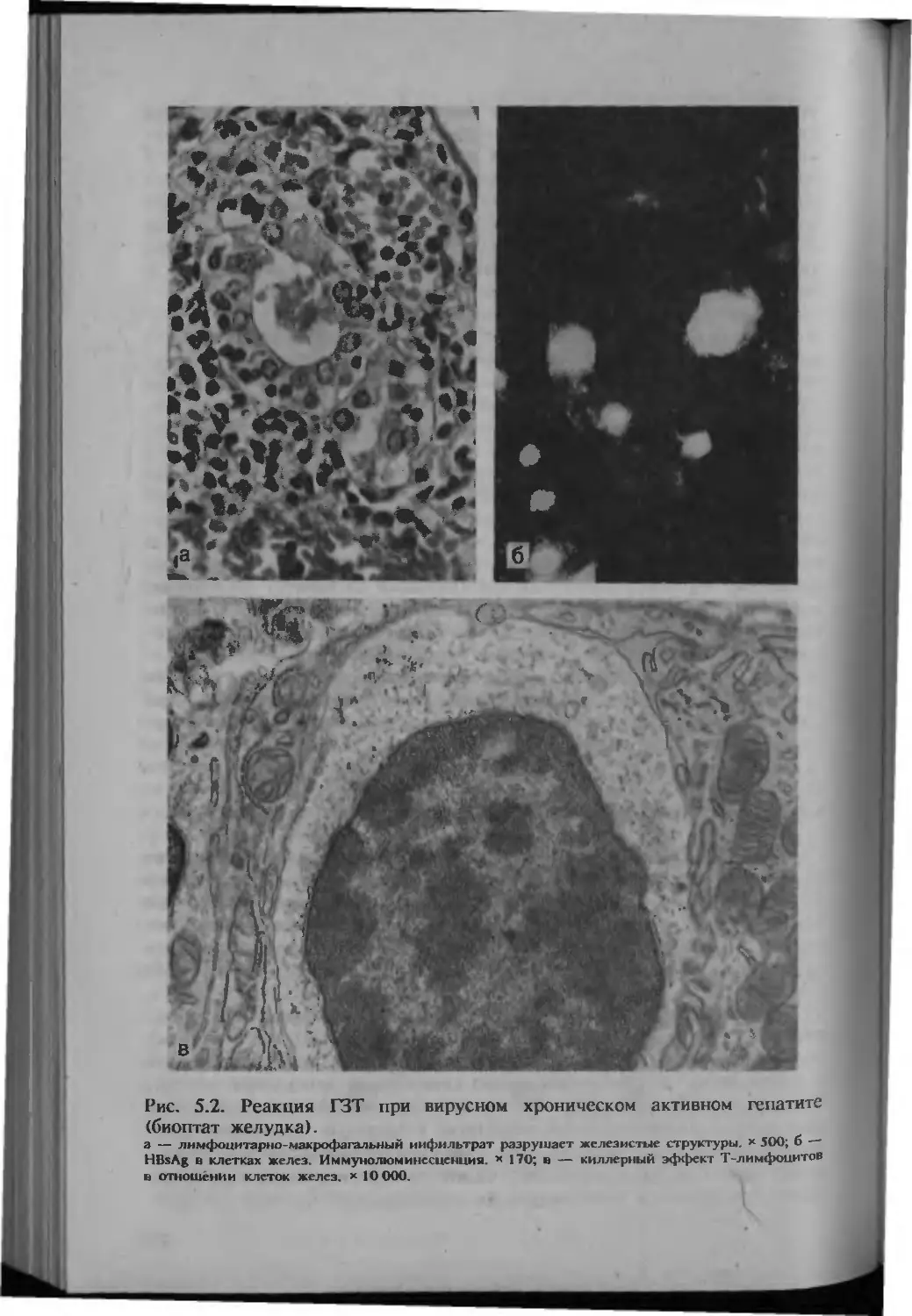
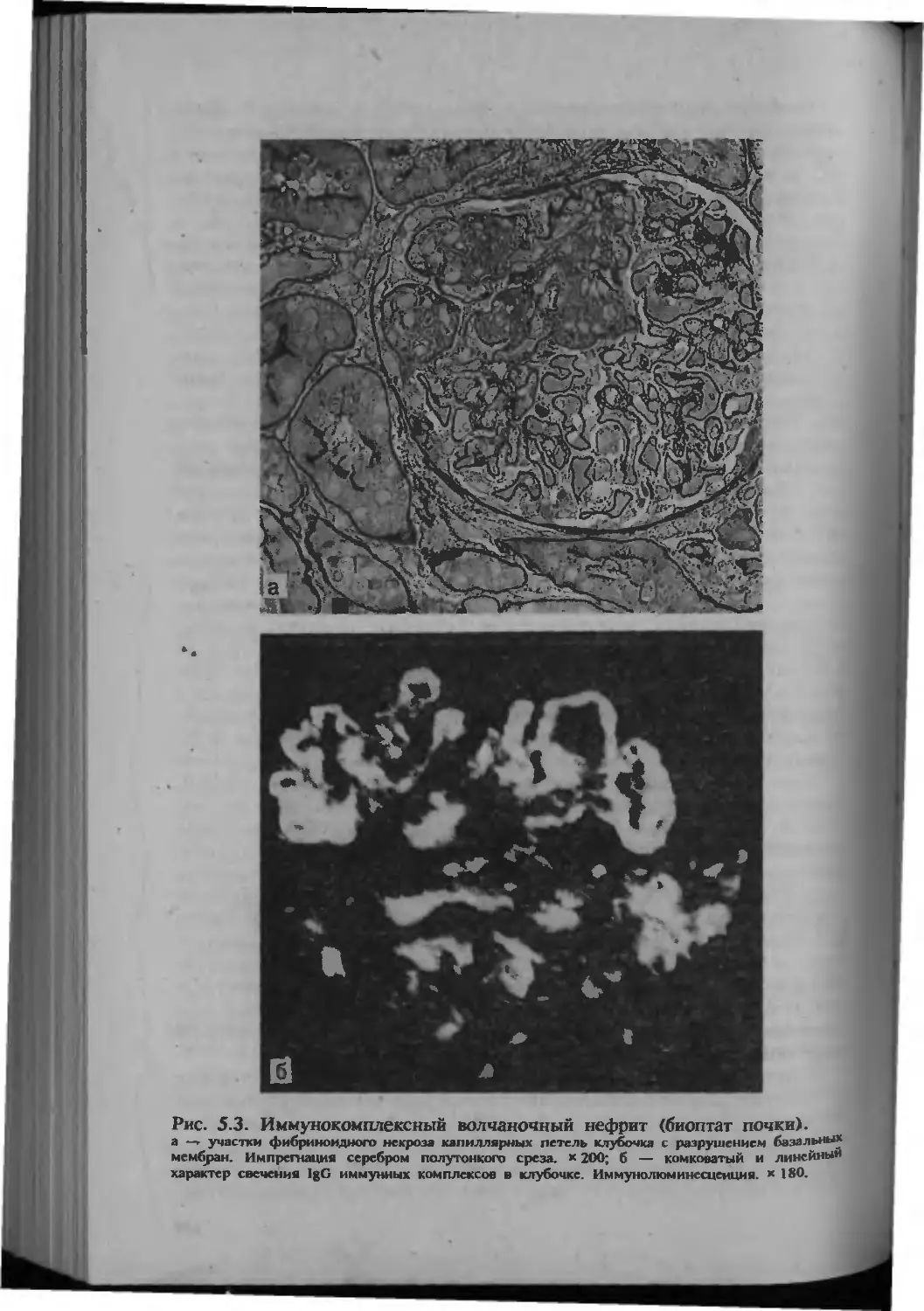
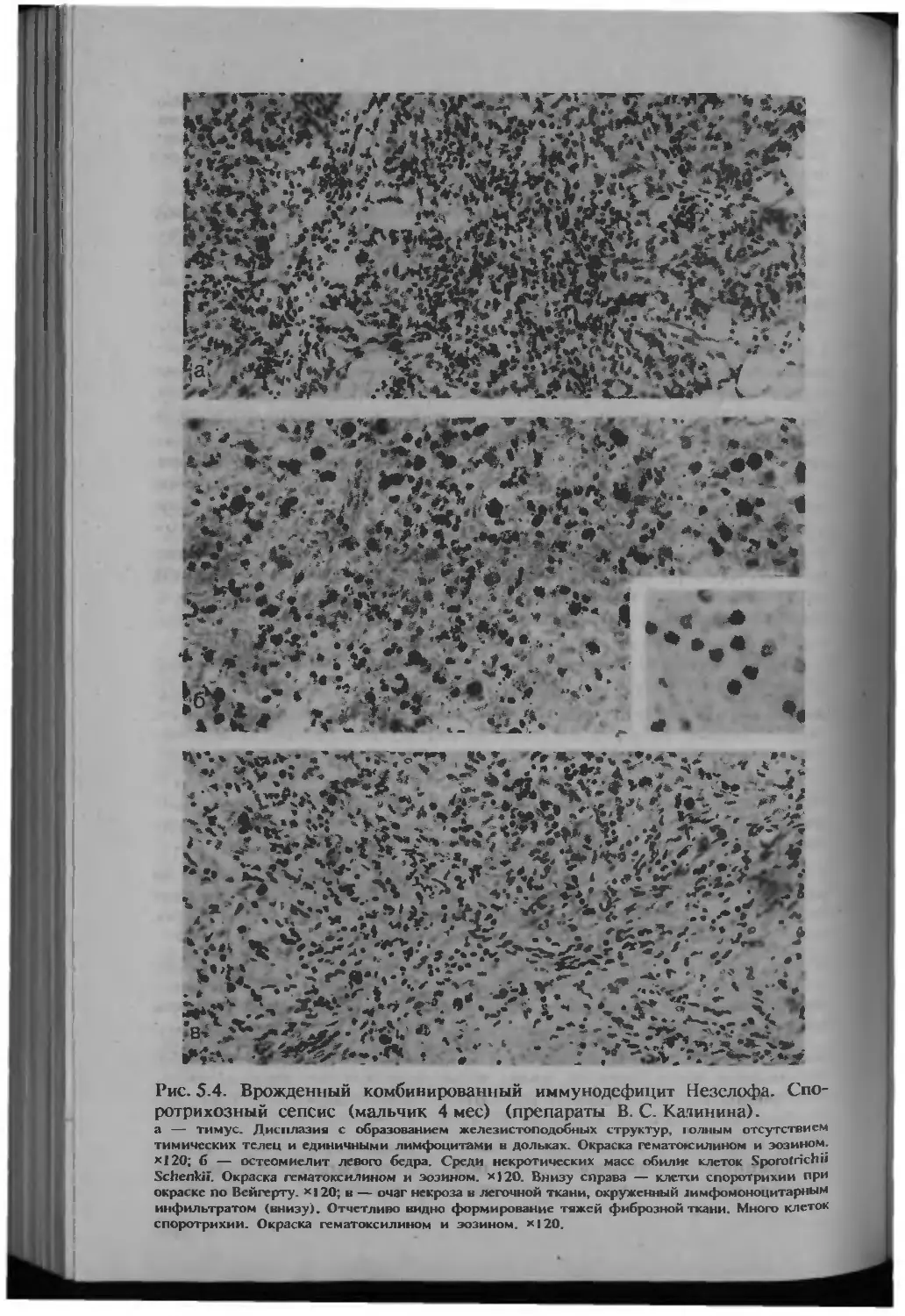
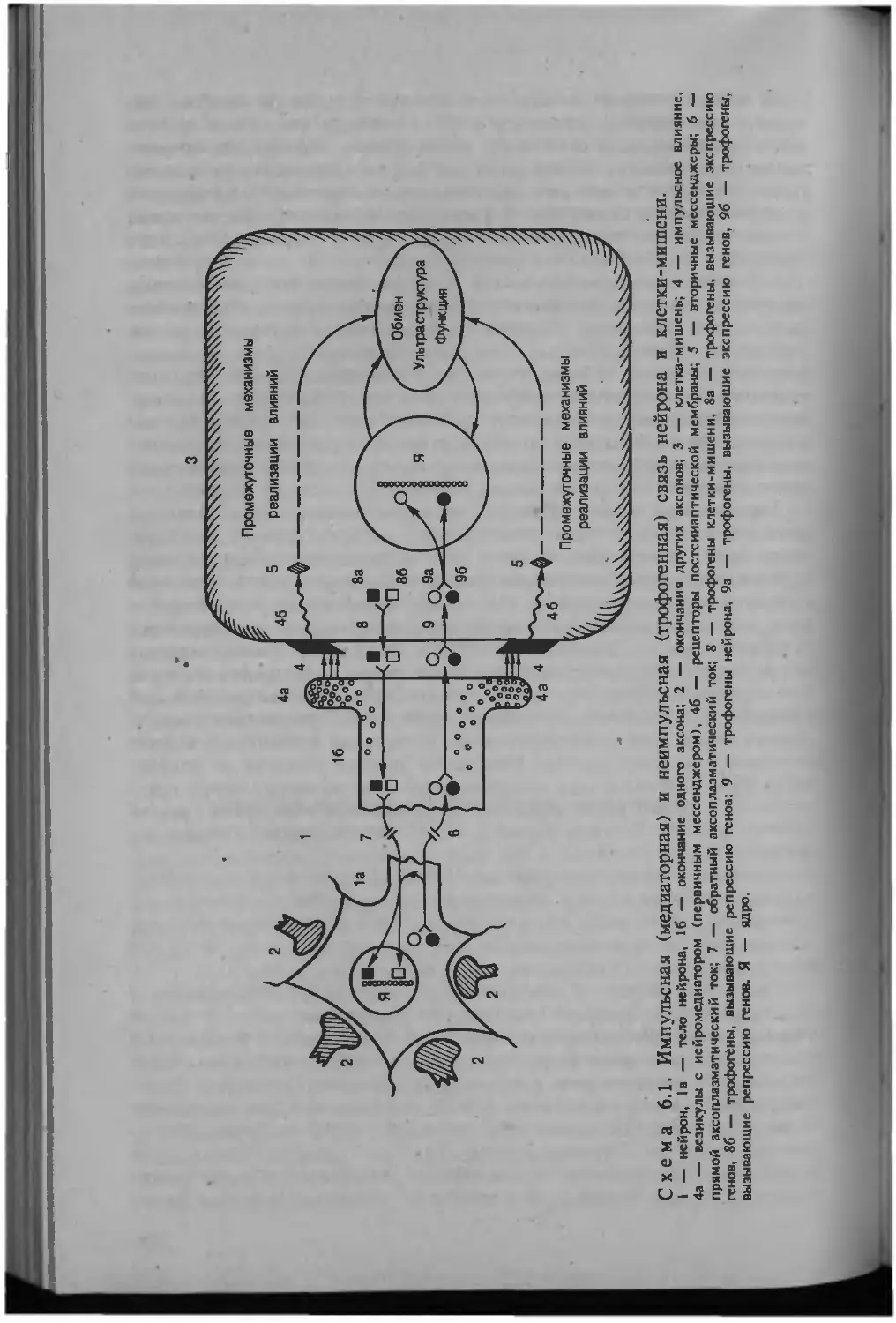
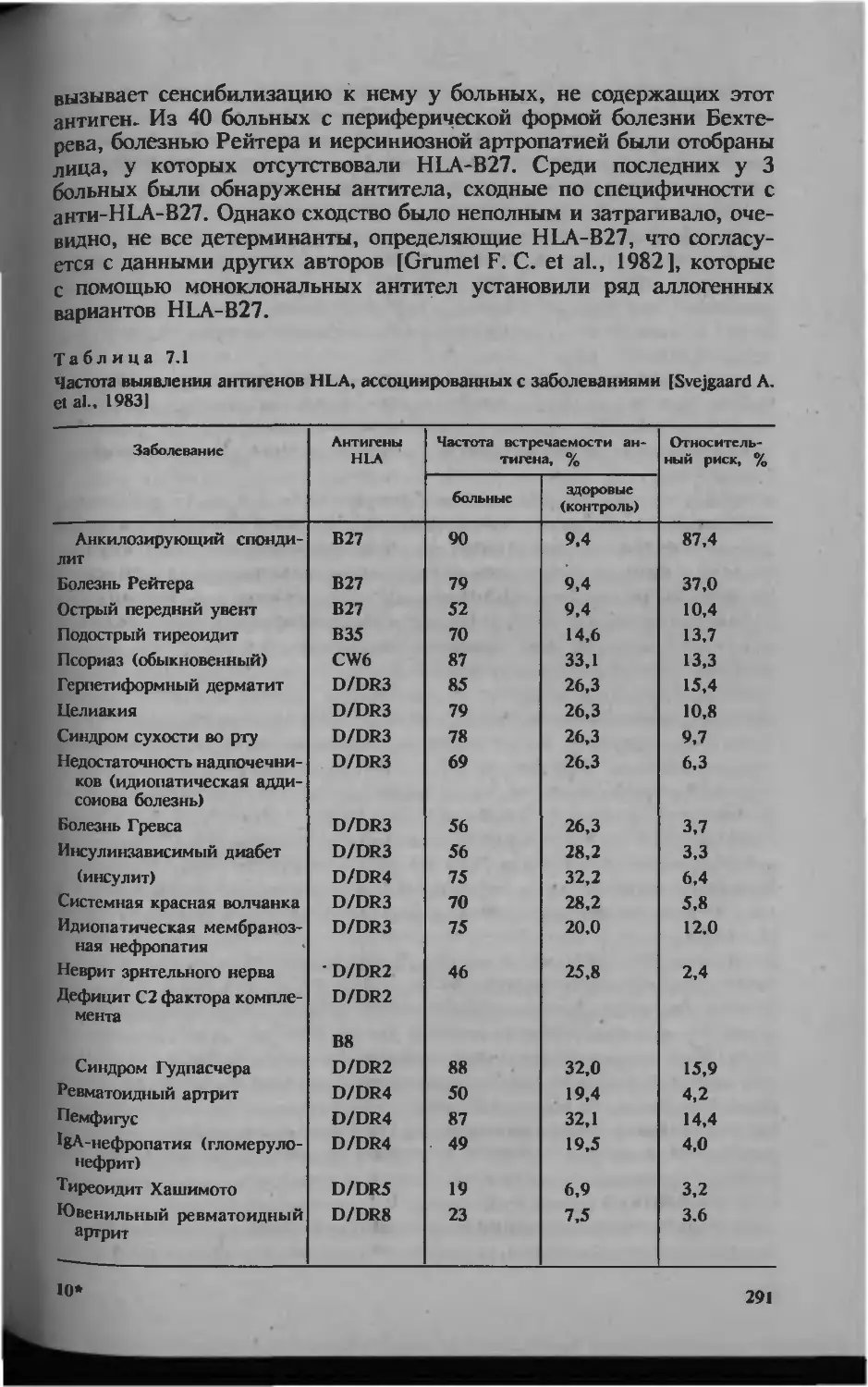
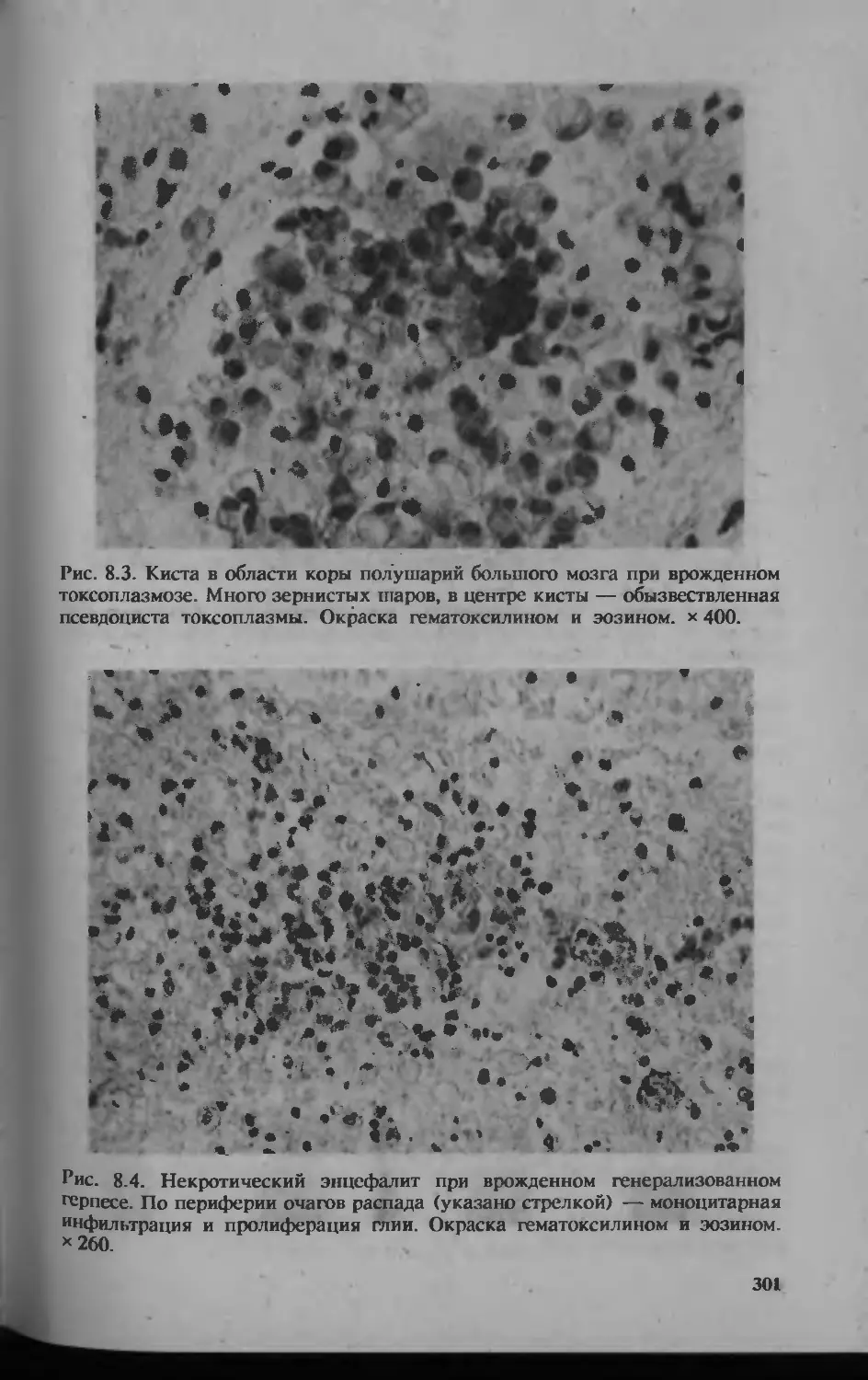
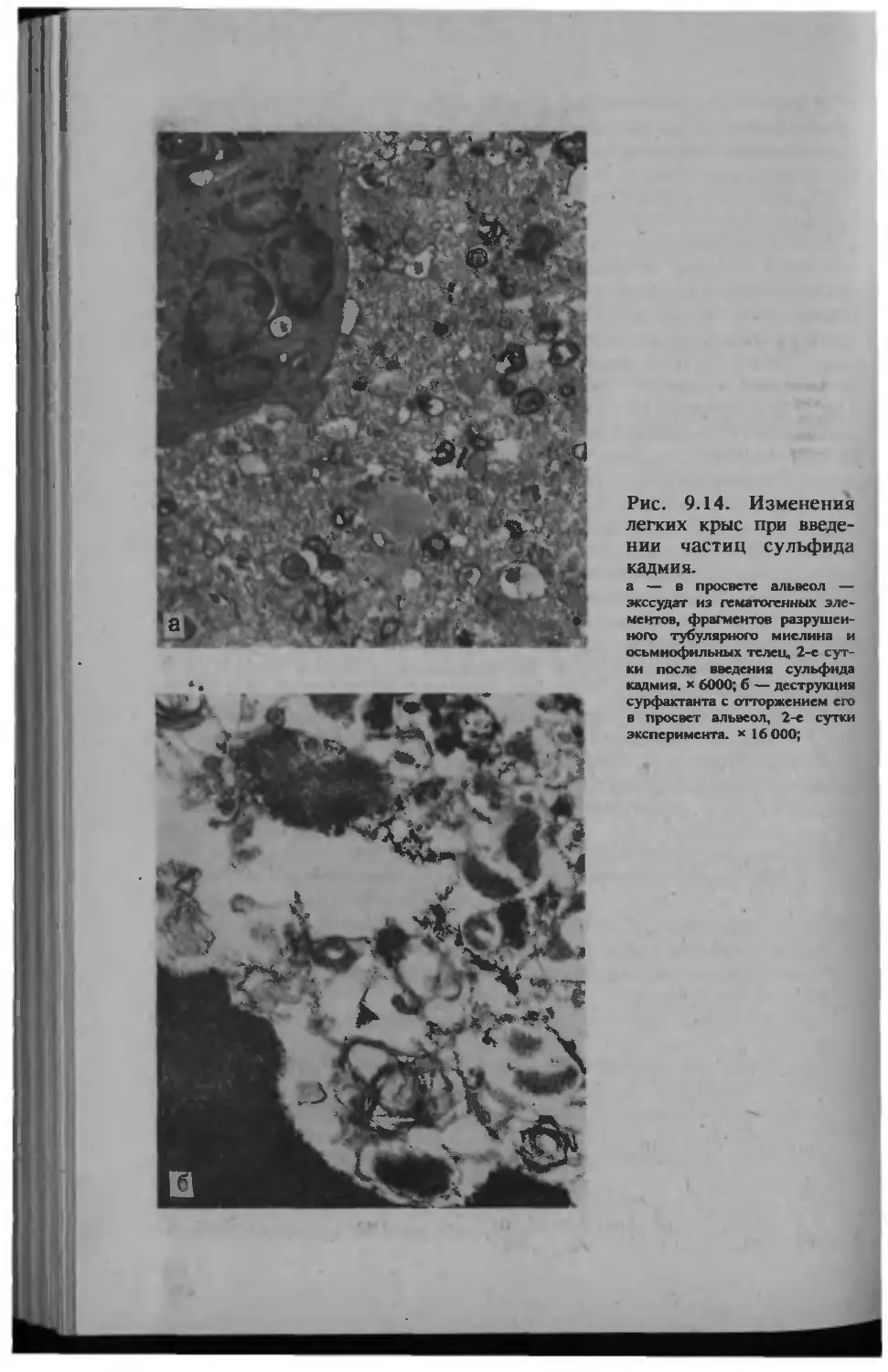
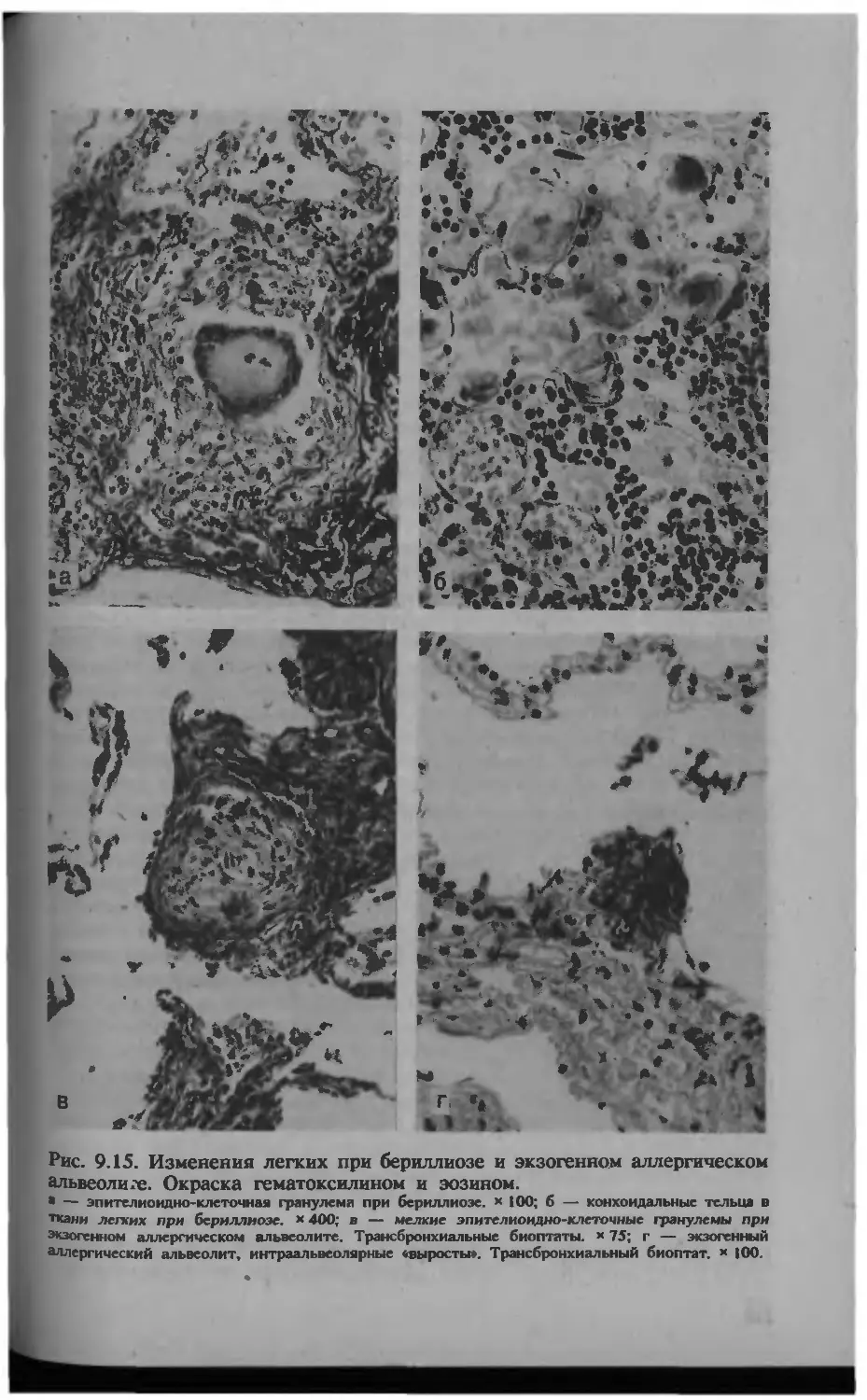
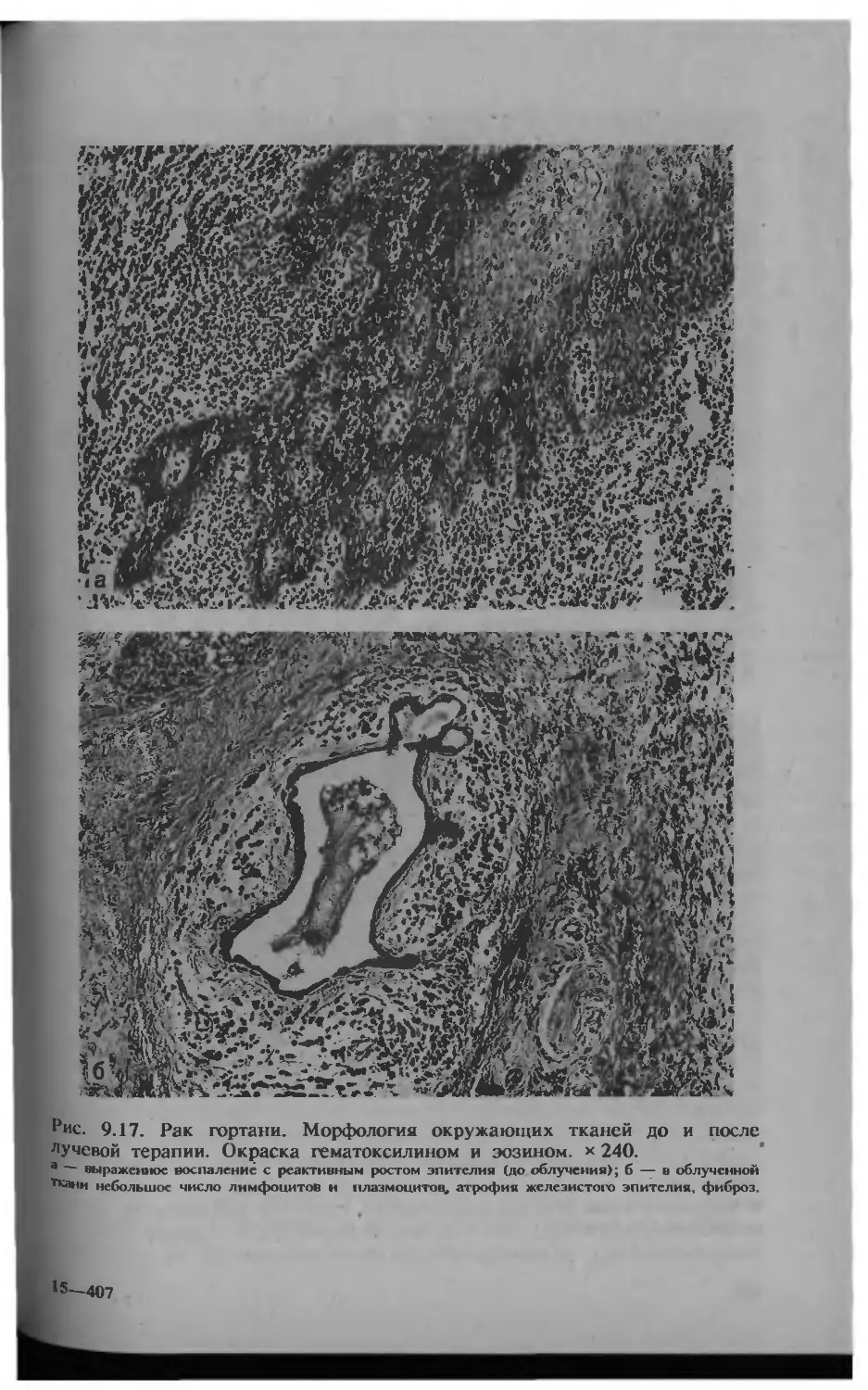
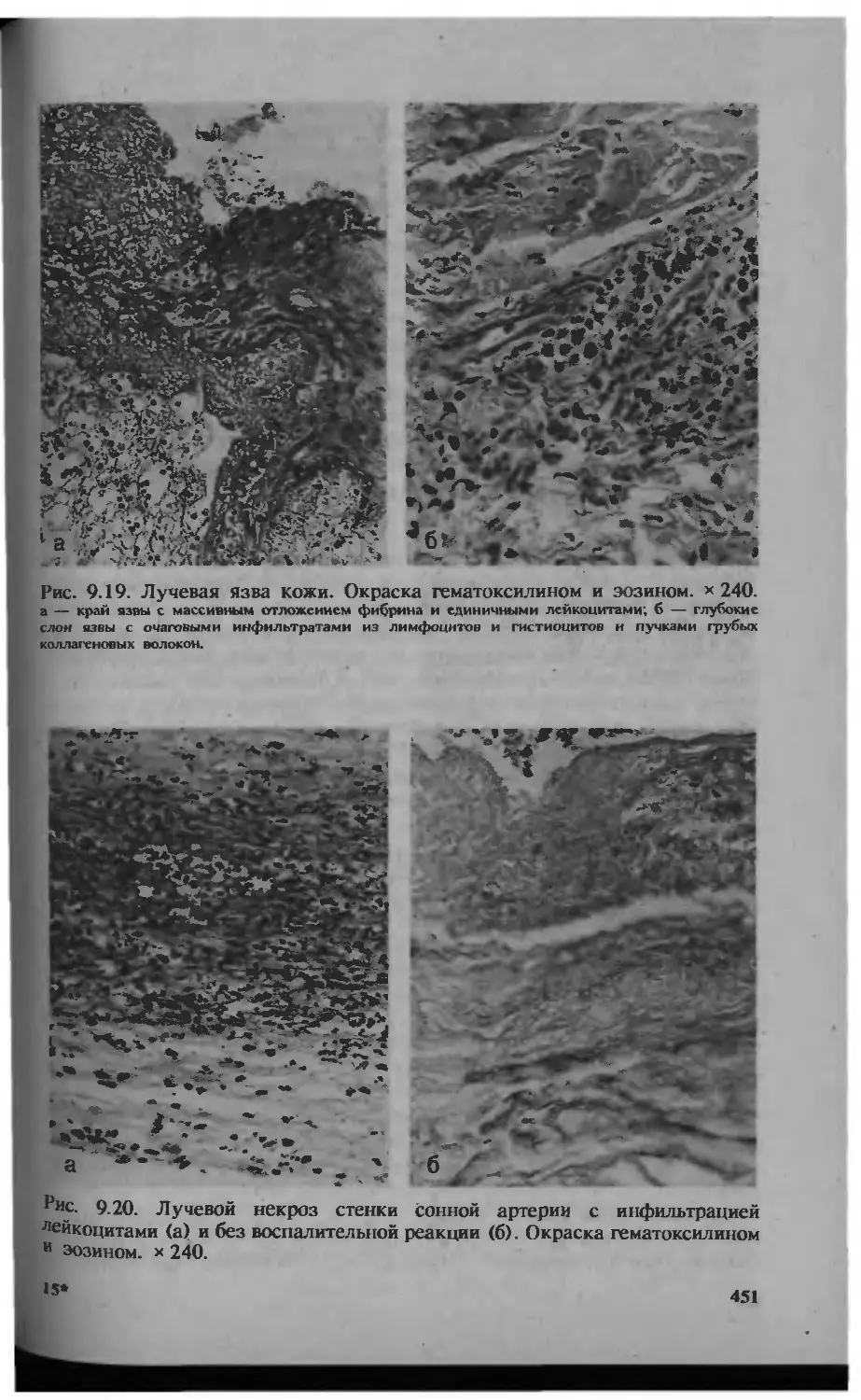
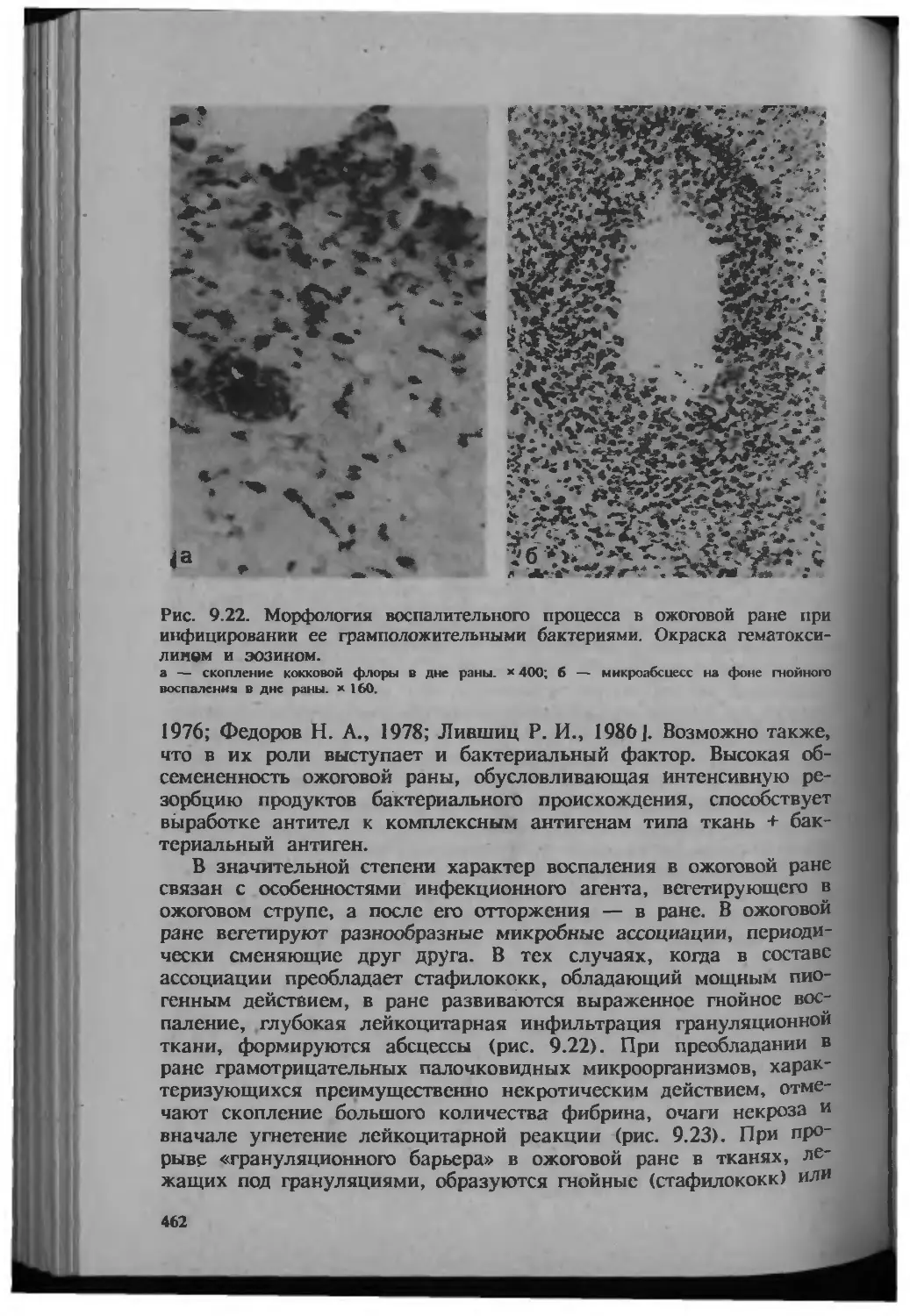
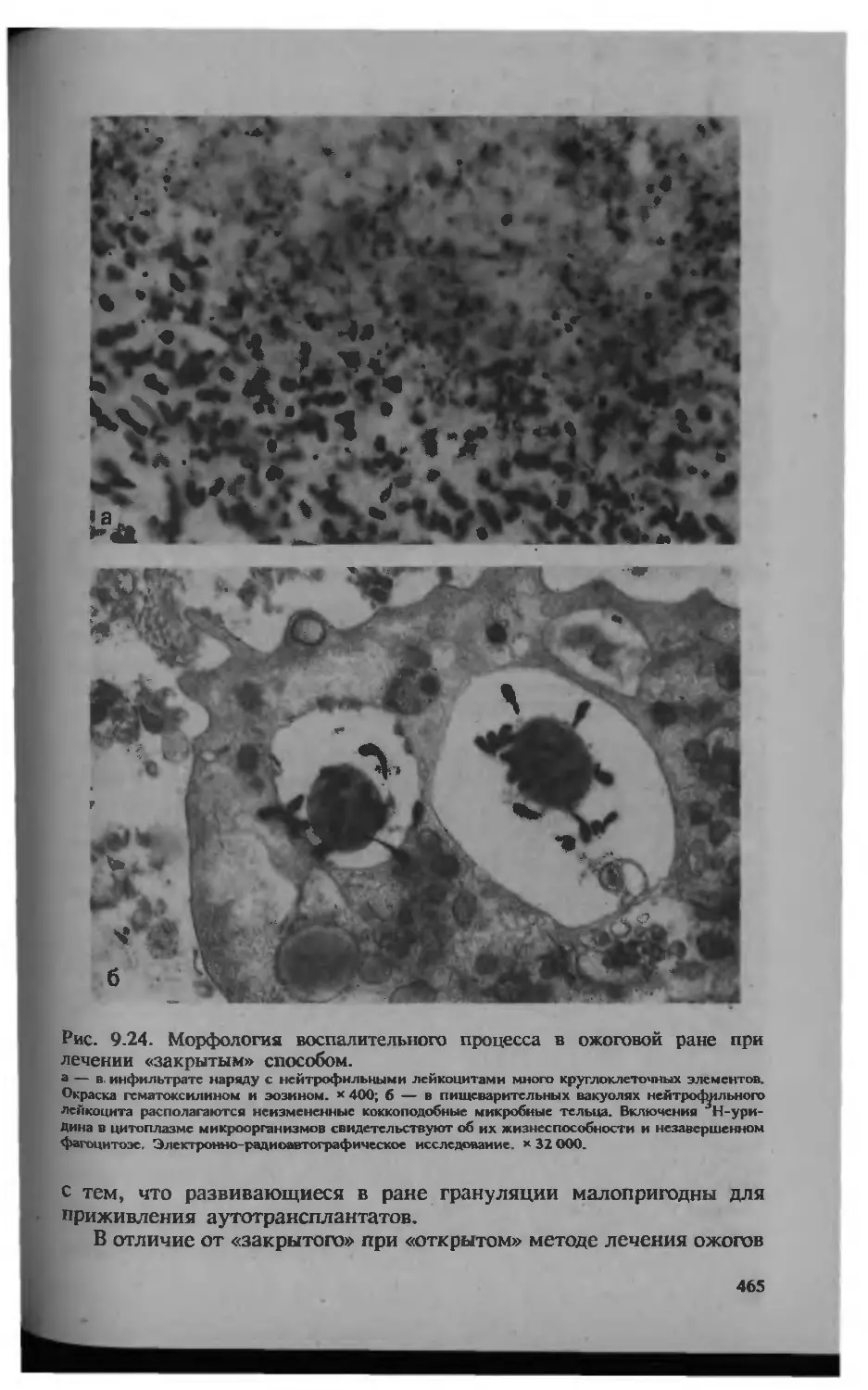
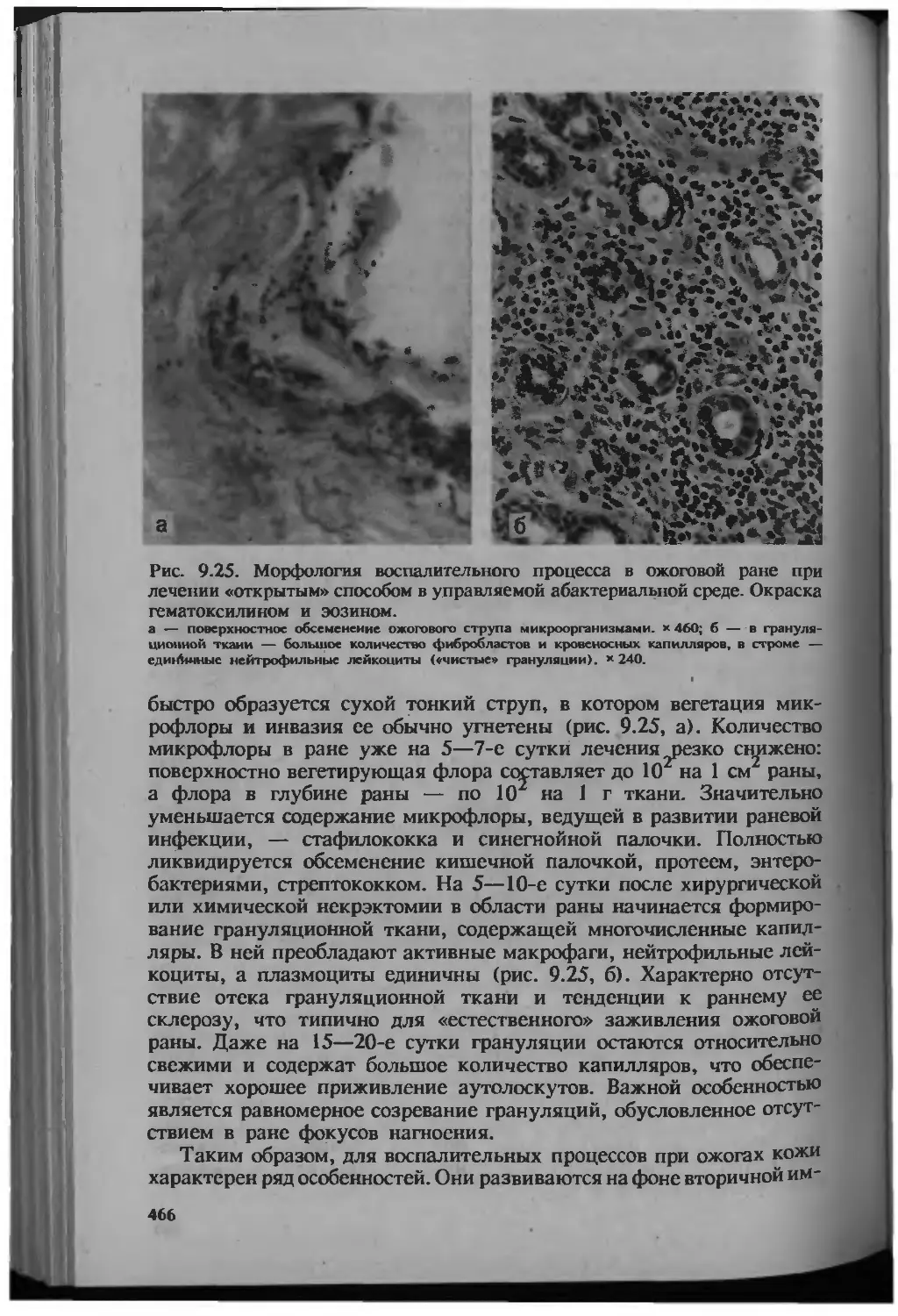
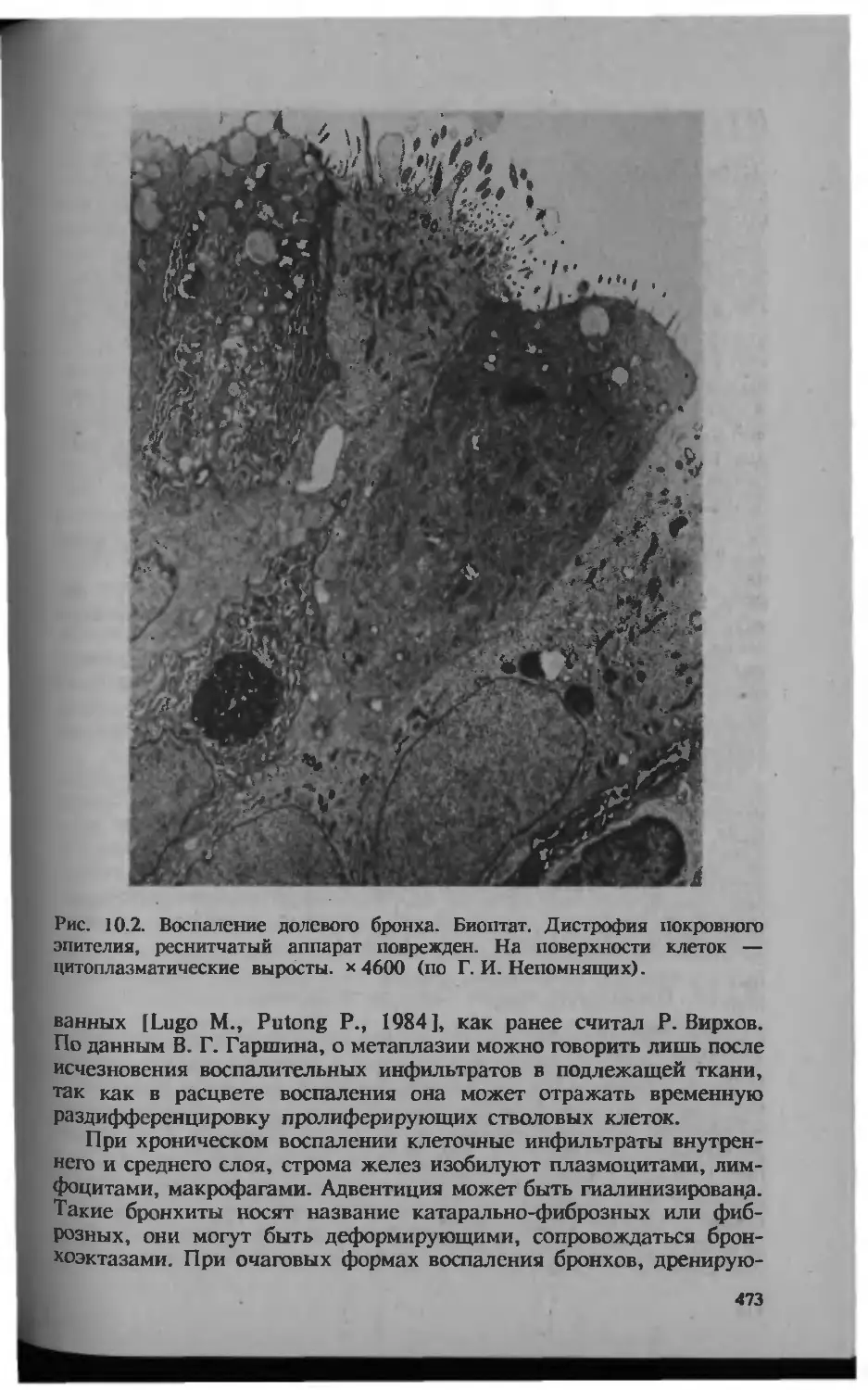
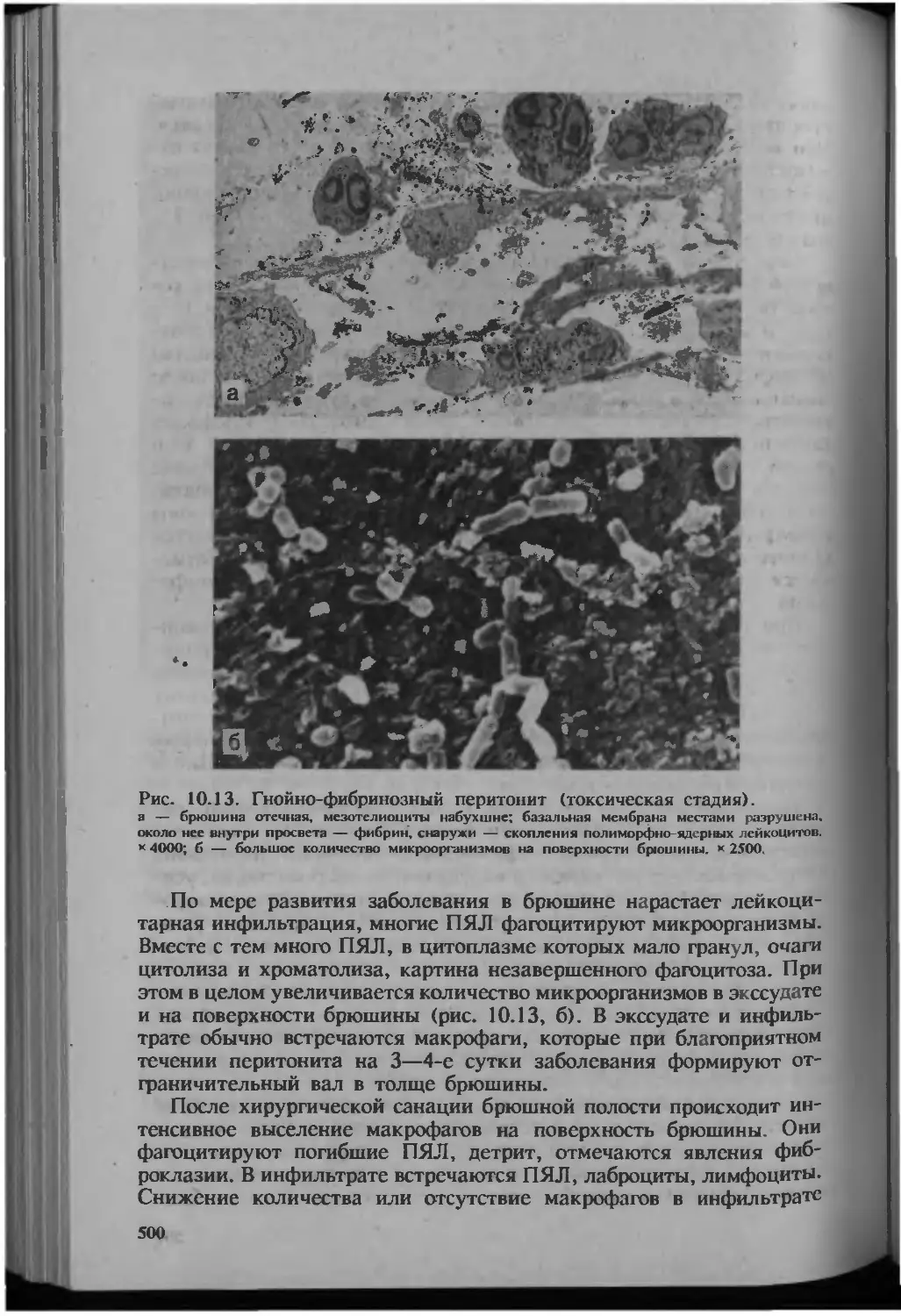
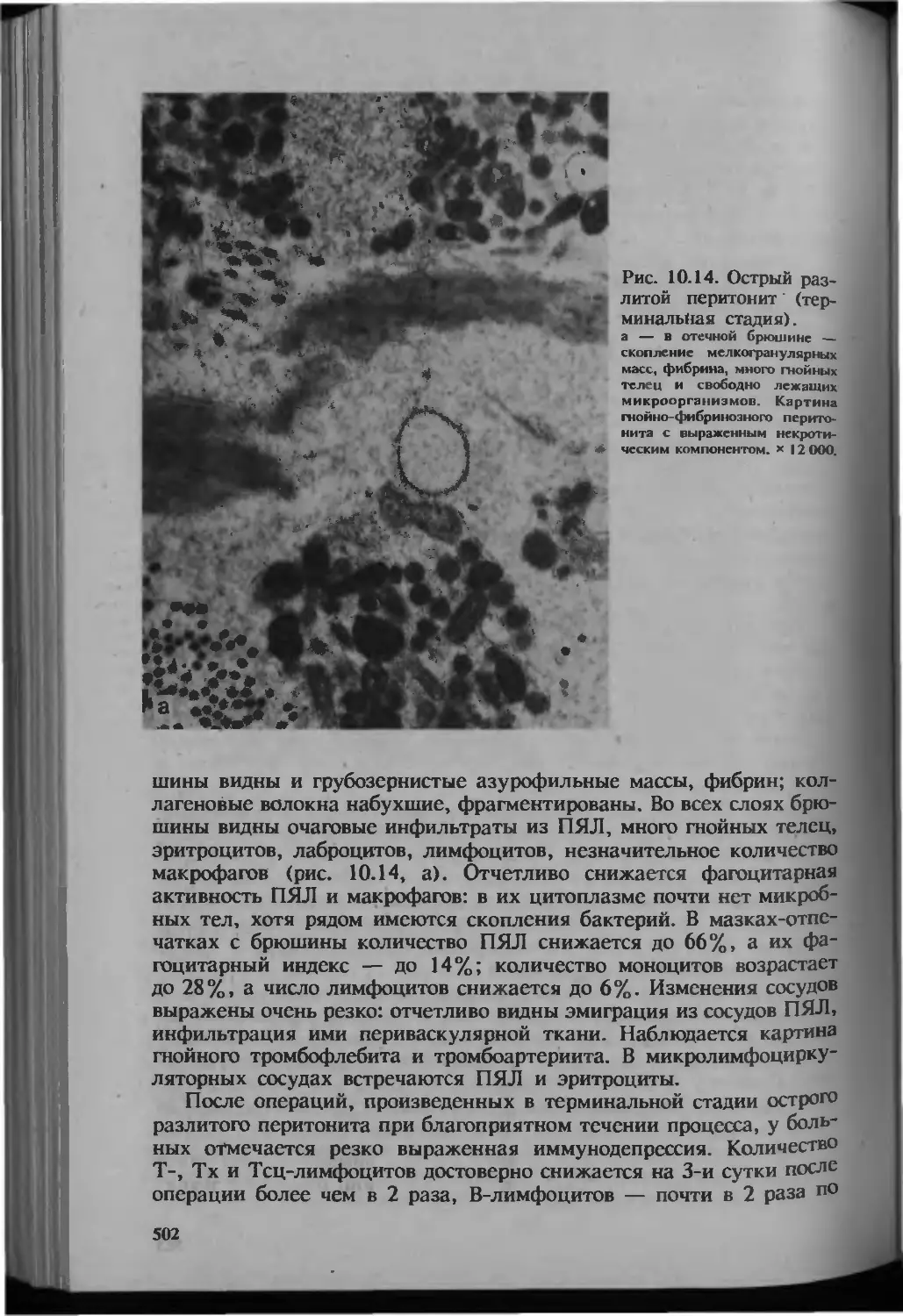
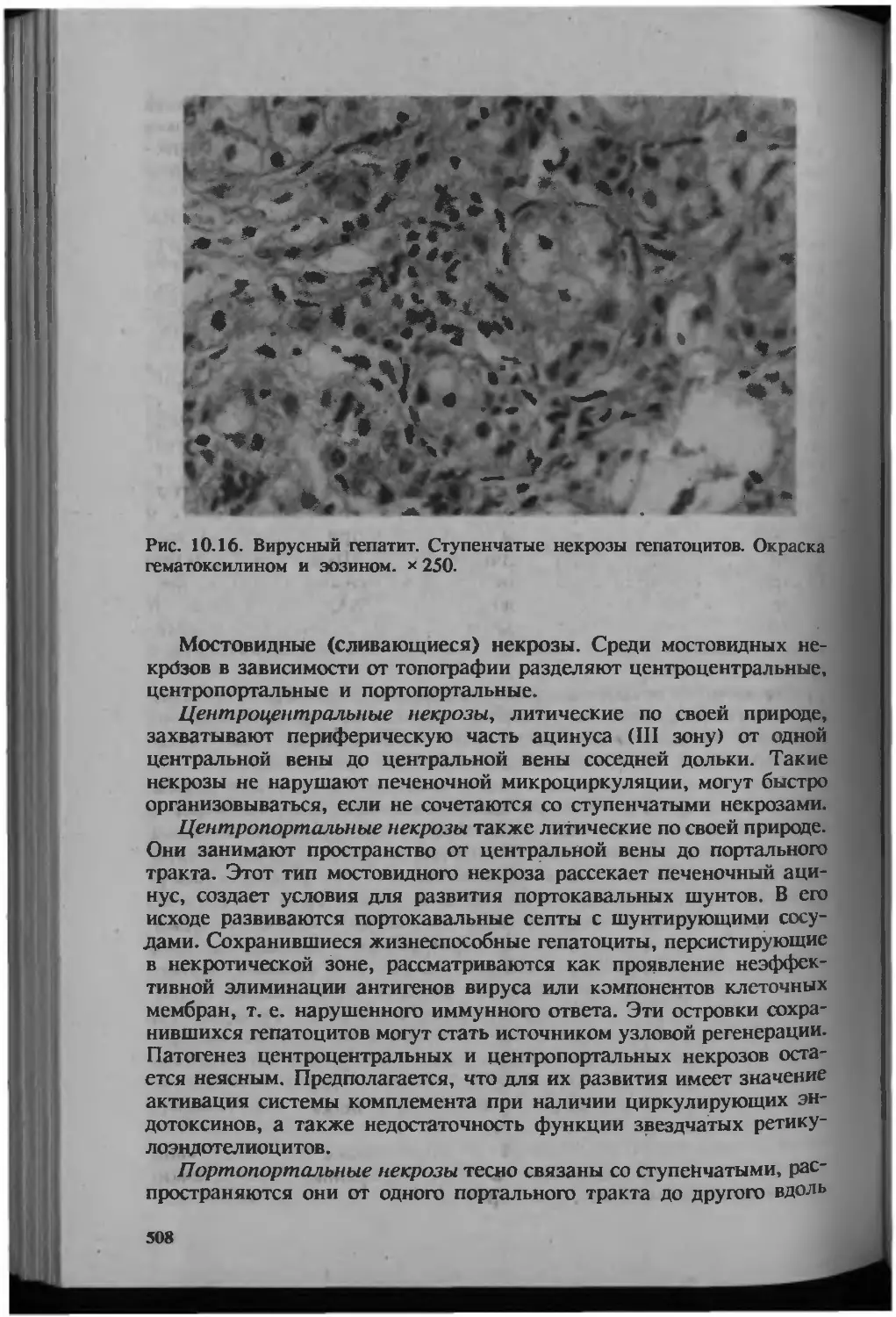
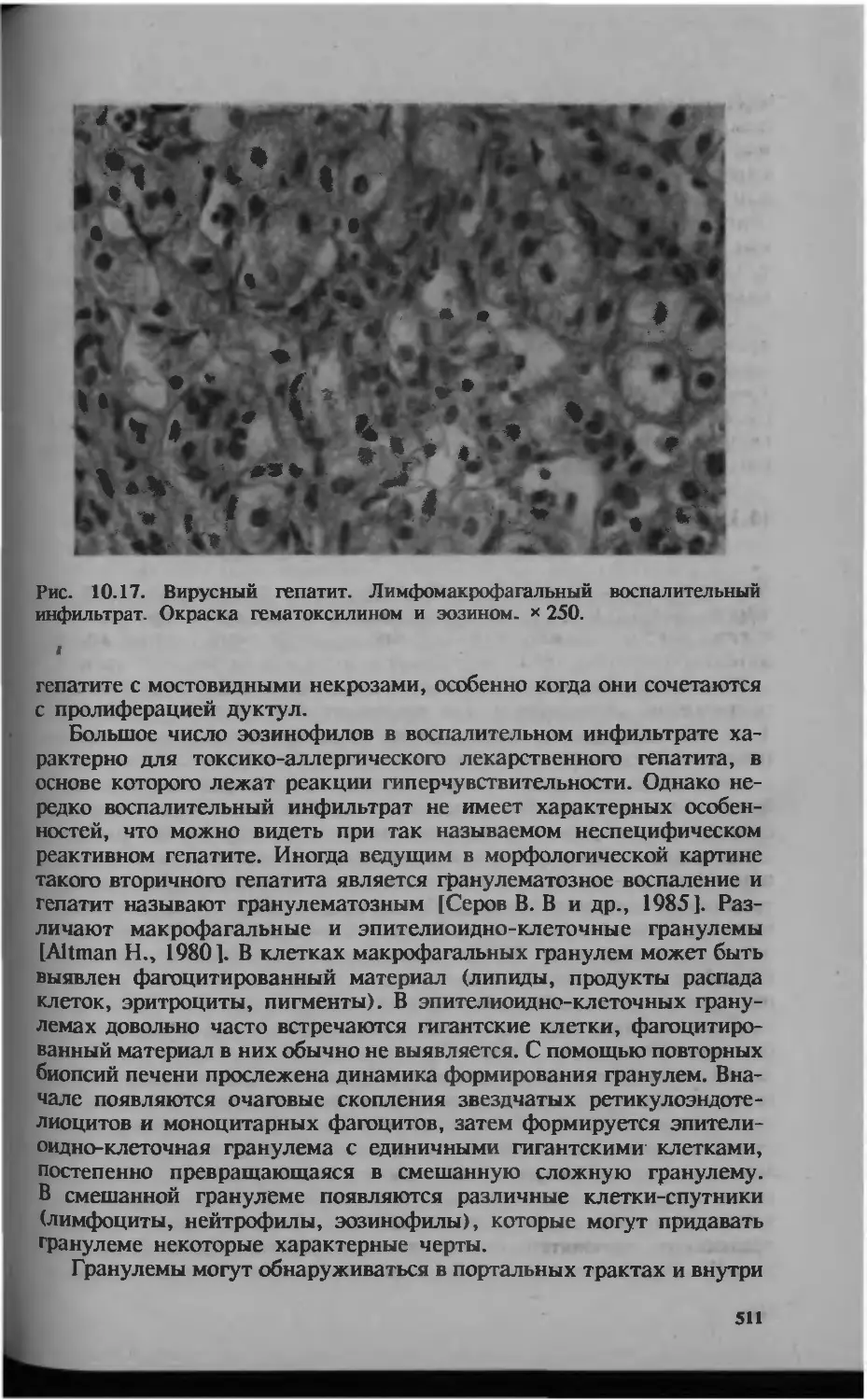
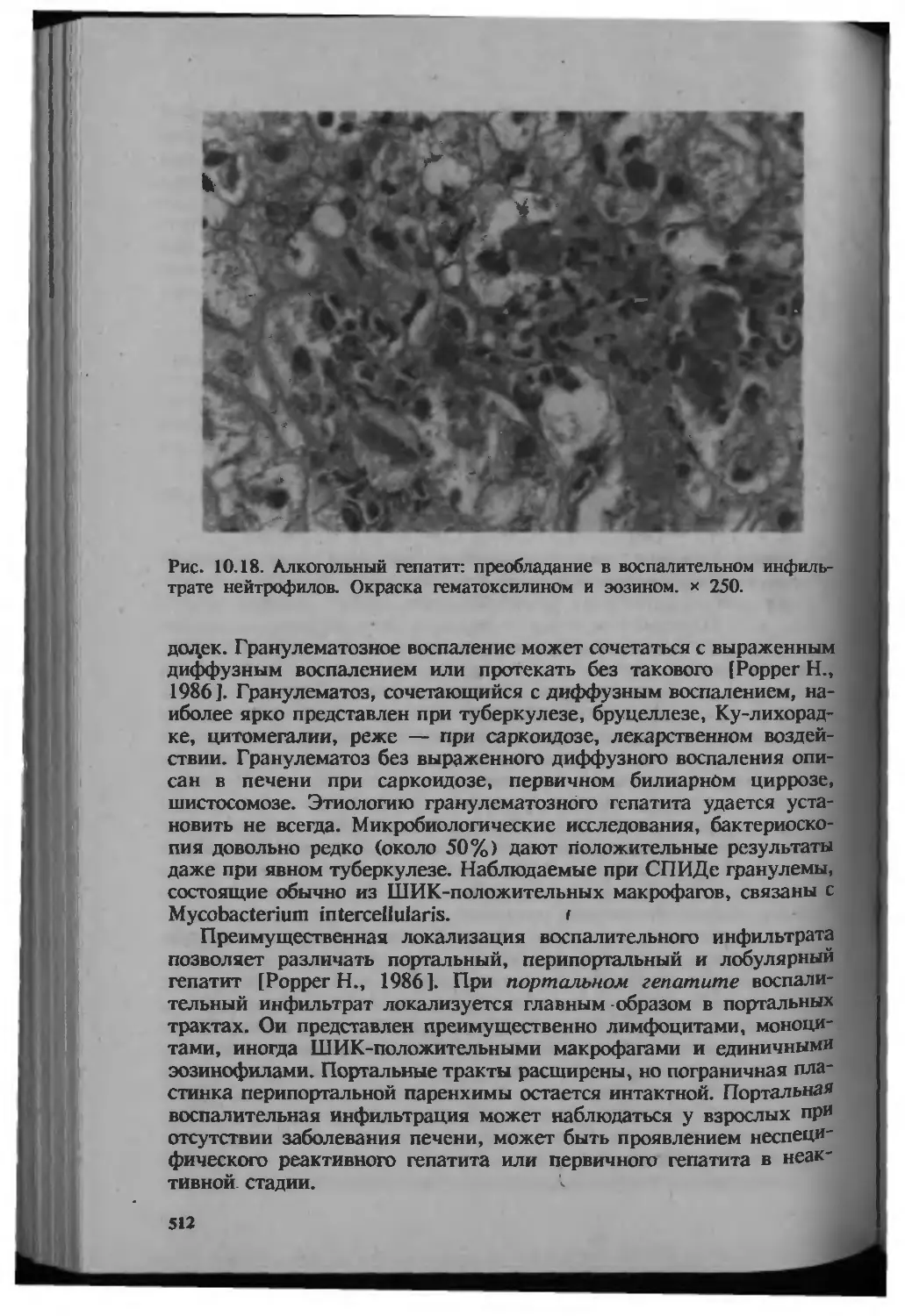
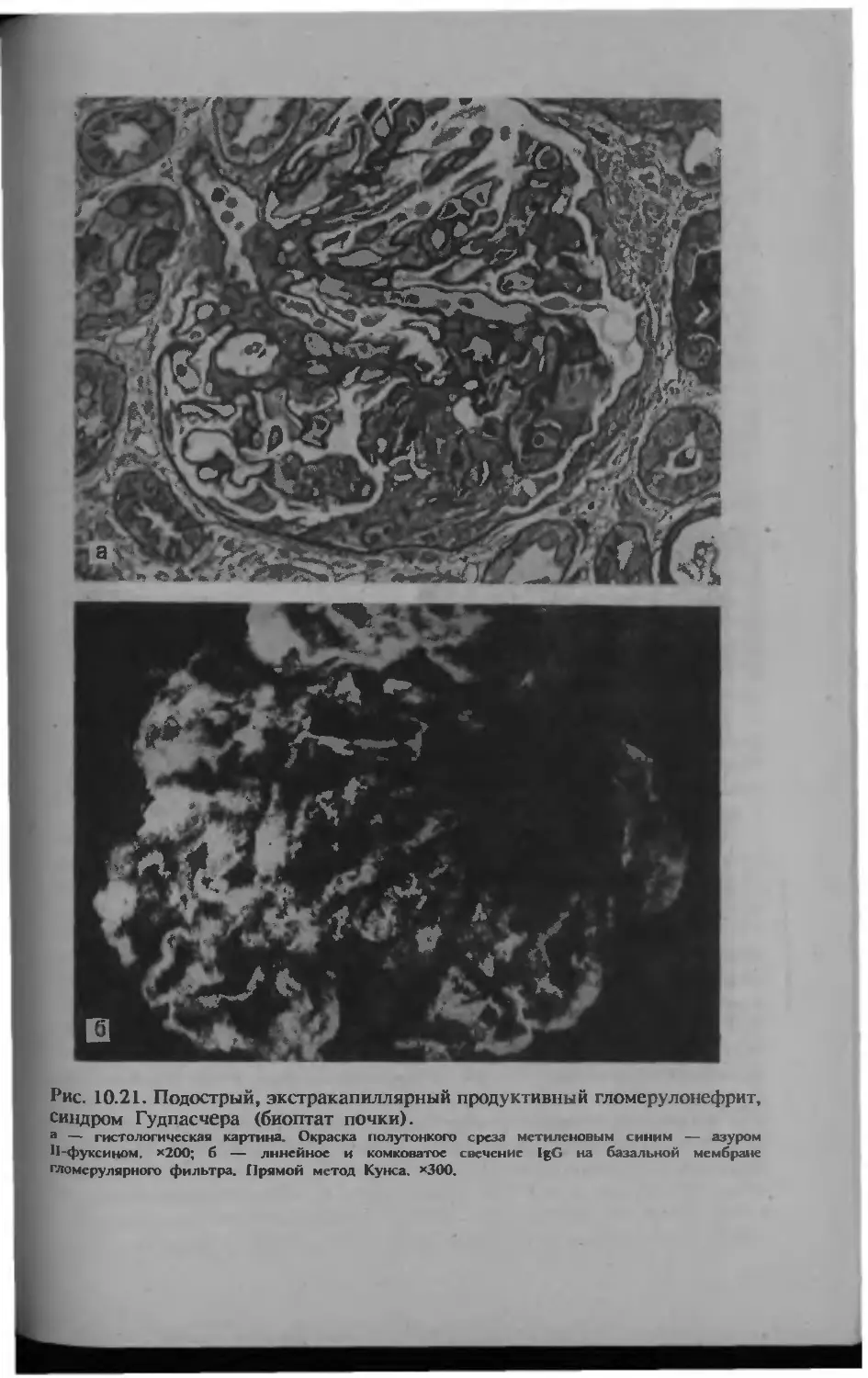
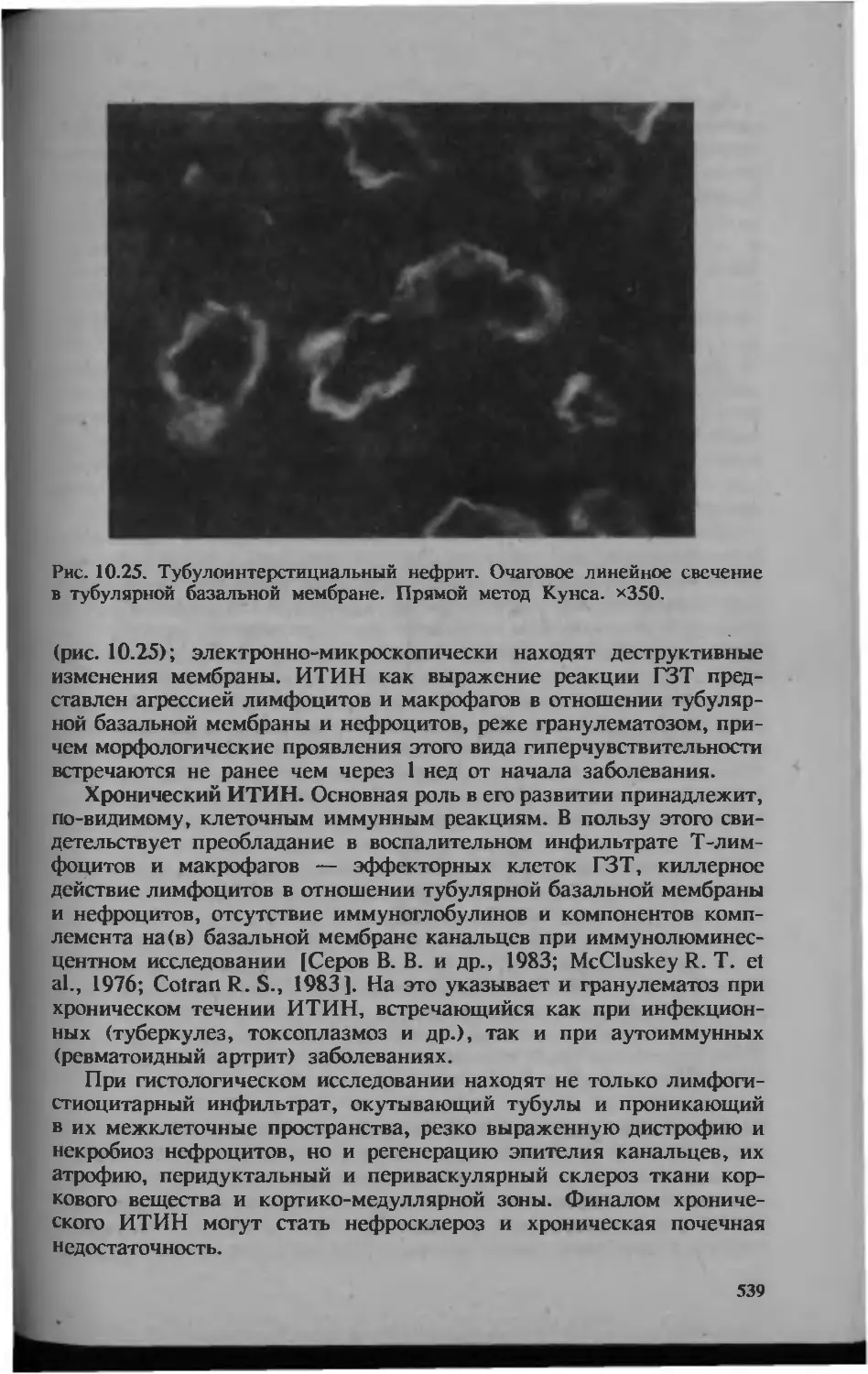
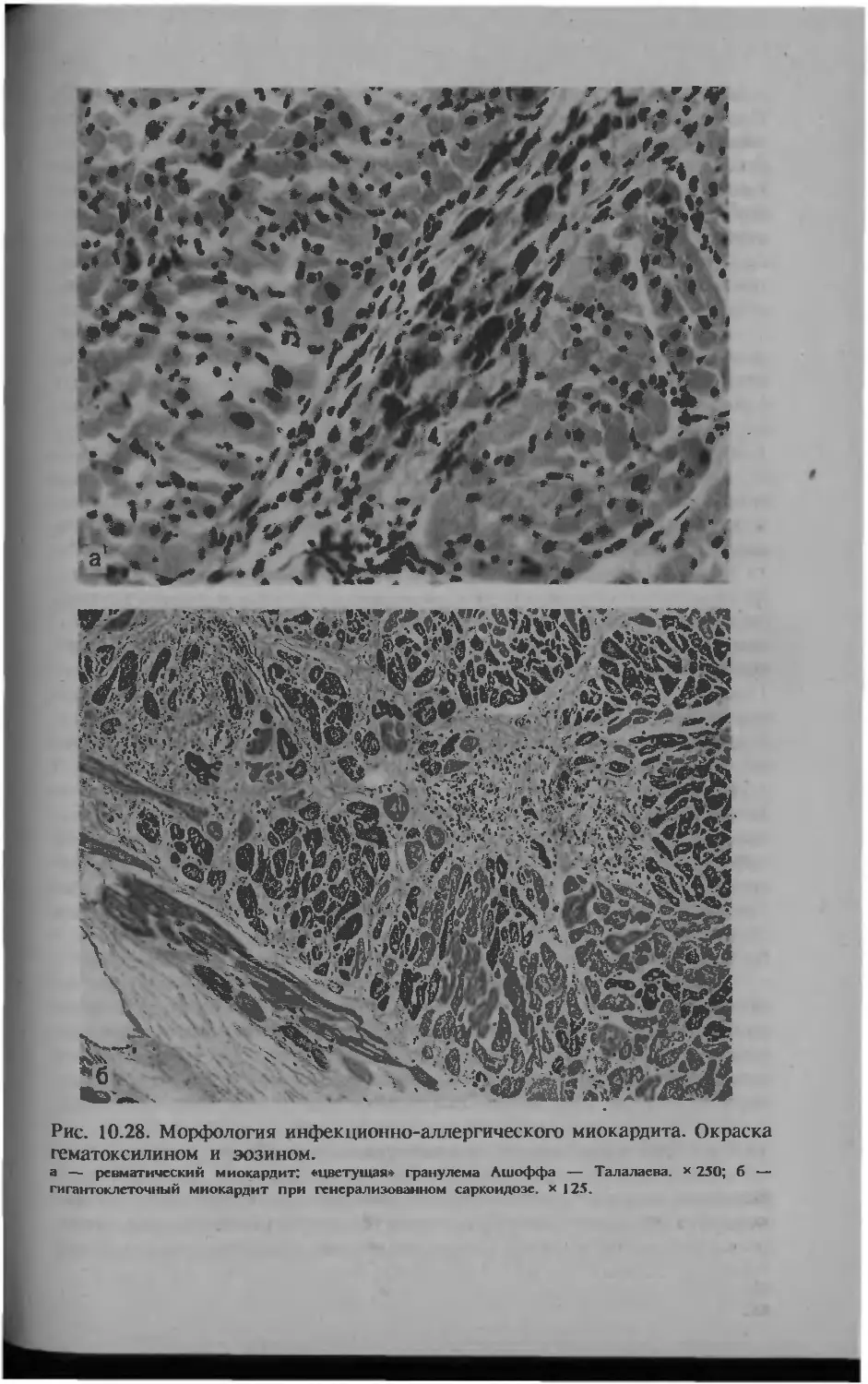
Автор: Серов В.В.
Теги: воспаление раздражение застойная гиперемия слизистая гиперемия общая патология медицина
ISBN: 5-225-02111-5
Год: 1995
Текст
РУКОВОДСТВО
ВОСПАЛЕНИЕ
«МЕДИЦИНА*
ВОСПАЛЕНИЕ
РУКОВОДСТВО
ДЛЯ ВРАЧЕЙ
Под редакцией
В. В. Серова и В. С. Паукова
МОСКВА «МЕДИЦИНА» 1995
ББК 52.5
В77
УДК 616-002(035)
Воспаление. Руководство для врачей/Под ред. В. В. Серова,
В77 В. С. Паукова. — М.: Медицина, 1995. — 640 с.: ил.
ISBN 5-225-02111-5
В руководстве дана оценка состояния проблемы воспаления как защитной
реакции организма и как проявления болезни. Приведены материалы по истории
учения о воспалении, его сущности, месте в биологии, медицине и патологии;
рассмотрены физиология, биохимия и морфология воспаления, ее стадии и
формы. Освещены иммунологические и иммунопатологические аспекты воспа-
ления, роль нарушений нервной трофики, генетических и возрастных факторов,
определяющих характер воспалительной реакции. Особое внимание уделено
характеру воспаления в зависимости от особенностей причинного фактора и
структурно-функциональных свойств органов и тканей.
Для патофизиологов, патоморфологов и клиницистов.
4107010000—60
039(01)—95
Без объявл;
ББК 52.5
Руководство
ВОСПАЛЕНИЕ
Зав. редакцией А. К. Владимирова. Научный редактор М. Н. Ланцман. Редакторы из-
дательства Н. В. Кирсанова и И. Н. Кононова. Редактор Н. Д. Карцева. Художествен-
ный редактор Т. С. Тихомирова. Художник В. С. Сергеева. Технический редактор
Г. Н. Жильцова. Корректор М. П. Молокова.
ЛР № 010215 от 11.03.92. Сдано в набор 06.06.95. Подписано к печати 25.08.95. Формат
бумаги 60^90/16. Бумага кн.-ж. офс. Гарнитура Таймс. Печать офсетная. Усл. печ. л. 40,0.
Усл. кр.-отт. 40,0. Уч.-изд. л. 47,23. Тираж 5000 экз. Заказ N° 407. «С* 060.
Ордена Трудового Красного Знамени издательство «Медицина» 101000, Москва, Петрове-
ригский пер., 6/8
АООТ «Ярославский полиграфкомбинат» 150049, Ярославль, ул. Свободы, 97.
ISBN 5-225-02111-5 © Коллектив авторов, 1995
2
Светлой памяти учителя академика
Апипшлия Ик»анивича Струмлэи
тгСолы^аем
ПРЕДИСЛОВИЕ
В общей патологии воспаление принято рассматривать как
«ключевой» общепатологический и вместе с тем биологиче-
ский процесс, при этом всегда подчеркивается «физиологи-
ческий прототип» воспаления. Особенность воспаления как
биологического процесса заключается в его защитно-приспо-
собительной функции, которая состоит в сосудисто-мезенхи-
мальной реакции на повреждение, направленной на ликви-
дацию повреждающего агента и восстановление поврежден-
ной ткани. Эта реакция циклична: гемо- и лимфососудистый
ответ на альтерацию обеспечивает повышение сосудистой
проницаемости как для плазмы, так и для клеток крови
(экссудация); это приводит к появлению клеточного воспа-
лительного инфильтрата, служащего прежде всего фагоци-
тозу, вторичной деструкции ткани (очищению). В течение
всего процесса в очаге воспаления происходит смена клеточ-
ных коопераций, осуществляется трансформация клеток и
сосудов, направленная на образование регенеративного про-
лиферата и завершающаяся дифференцировкой клеток и ре-
парацией. При этом вряд ли можно точно сказать, где кон-
чается собственно пролиферативная фаза воспаления, а где
начинается репаративная регенерация. Важно другое: цик-
лической воспалительной реакцией «руководят» рождающи-
еся в альтерации медиаторные системы воспаления (плаз-
менные и клеточные). Они определяют сопряжение альте-
рации, сосудистой реакции и фагоцитоза. Взаимодействие
клеток воспалительного инфильтрата (макрофаг-лимфоцит)
включает иммунную систему защиты. Клеточные коопера-
ции и экстрацеллюлярный матрикс, взаимодействуя, приво-
3
дят к активации фибробластов, замещению тканевых дефек-
тов соединительной тканью.
Система медиаторов «работает» на рецепторных связях.
Она последовательно «втягивает» в процесс не только глав-
нейшие плазматические системы (калликреин-кининовая,
свертывающая и противосвертывающая, система комплемен-
та) , но и все клеточные системы защиты организма (система
полиморфно-ядерного лейкоцита, моноцитарно-фагоцитар-
ная, иммунная, система фибробласта и коллагена). Особую
роль в воспалительной реакции играет иммунитет как со-
ставная часть воспаления [Movat Н. Z., 1975], хотя «полом»
иммунитета может быть причиной воспаления.
Как видно, воспаление — это не только местная сосуди-
сто-мезенхимальная реакция иа повреждение, но и местная
реакция на повреждение всех гуморальных и клеточных
систем защиты, направленная на репарацию; участие этих
систем в воспалительной реакции филогенетически строго
запрограммировано и жестко контролируется медиаторно-
рецепторными связями с надежной системой «поддержки».
Нельзя не вспомнить гениального И. И. Мечникова, про-
пагандировавшего в «Лекциях о сравнительной патологии
воспаления» (1892) идею совершенства защитно-приспосо-
бительной реакции на повреждение, которой является вос-
паление. Однако он говорил и об «относительном совершен-
стве» защитно-приспособительных реакций — целесообраз-
ность в природе редко достигает своего идеала.
Воспаление довольно часто предстает как защитно-при-
способительная реакция в своем несовершенном виде. В па-
тологии, будучи чаще реакцией не видовой, а индивидуаль-
ной, воспаление зависит от особенностей как повреждающего
агента и повреждения, так и неспецифической и специфи-
ческой реактивности организма. Воспаление в этих условиях
из феномена биологического нередко становится чисто ме-
дицинским. Особенности повреждающего агента и реактив-
ности организма, получившего повреждение, определяют
Своеобразие воспаления как конкретной болезни. О воспа-
лительных болезнях не прекращаются'споры со времен Гип-
пократа, Цельса и Галена, которым мы больше всего обязаны
описанием воспаления как болезни. Таким образом, налицо
двойственность воспаления: воспаление — защитно-приспо-
собительная реакция, воспаление — болезнь. Это. не игра в
диалектику — это «капризы» законов естествознания.
Исследователей чаще всего интересует какая-либо одна
сторона «двуликого» понятия «воспаление» — биологическая
или медицинская. В последние годы биологи и медики все
больше внимания уделяют изучению иммунологических и
молекулярных аспектов воспаления и предпринимают по-
пытки применить полученные данные в лечебных целях. Это
наиболее современный, но менее доступный медицинской
4
практике путь понимания «дуализма» воспаления. Необхо-
димо широкое освещение биологических, биолого-медицин-
ских и медицинских аспектов проблемы воспаления — все
еще молодой, хотя и очень старой, как сама медицина.
В связи с этим мы сочли необходимым создать руковод-
ство, в котором были бы объединены и в доступной форме
изложены вопросы биологического и медицинского в воспа-
лении, показаны современные методы изучения биомедицин-
ских феноменов воспалительной реакции вплоть до молеку-
лярного уровня.
Мы исходили также из того, что в нашей стране руко-
водство по воспалению не издавалось в течение долгого вре-
мени. Монография А. М. Чернуха «Воспаление» (1979) но-
сила характер очерков патологии и экспериментальной те-
рапии воспаления. За 20 лет до ее появления были изданы
только две книги, посвященные проблеме воспаления:
Д. Е. Альперн «Воспаление (вопросы патогенеза)» (1959) и
В. В. Воронин «Воспаление» (1959). Эти книги отражают
взгляды на проблему более чем тридцатилетней давности,
поэтому явно устарели, хотя, безусловно, представляют биб-
лиографическую ценность.
Как это ни странно, но и за рубежом очень мало книг,
широко охватывающих проблему воспаления. Можно назвать
лишь несколько таких руководств, например «Inflammation»
(1988) под редакцией I. Gallin и соавт., монографию Р. Sehgal
и G. Grininger (1989) о регуляции острой фазы воспаления.
Большинство зарубежных публикаций посвящено иммуно-
логическим и молекулярным аспектам воспаления.
Предлагаемое нами руководство включает 10 глав: «Ис-
тория учения о воспалении», «Сущность воспаления, его
место в биологии и медицине», «Физиология и биохимия
воспаления», «Морфология воспаления», «Иммунологиче-
ские и иммунопатологические аспекты воспаления», «Нерв-
ная трофика и воспаление», «Система HLA и воспаление»,
«Возраст и воспаление», «Характер воспаления в зависимости
от особенностей причинного фактора», «Характер воспаления
в зависимости от структурно-функциональных особенностей
органов и тканей».
Руководство является коллективным трудом. В работе над
ним приняли участие сотрудники кафедр и лабораторий Мо-
сковской медицинской академии им. И. М. Сеченова
(В. В. Серов, В. С. Пауков, Ю. Г. Алексеевских, О. К. Кауф-
ман, К. А. Рогов, О. О. Орехов, С. М. Секамова, О. В. Зай-
ратьянц, А. Б. Шехтер, Н. К. Хитров), Российского медицин-
ского университета им. И. П. Пирогова (Т. Е. Ивановская),
Университета дружбы народов им. П. Лумумбы (И. К. Еси-
пова) , Санкт-Петербургского педиатрического медицинского
института (А. В. Цинзерлинг), Института морфологии чело-
века РАМН (Т. Н. Копьева, Л. В. Кактурский), Института
5
хирургии им. А. В. Вишневского РАМН (Д. С. Саркисов,
А. А. Пальцын, Р. И. Каем), Центрального научно-исследо-
вательского института гастроэнтерологии (Л. И. Аруин), Ге-
матологического научного центра Минздрава РФ (Е. Н. Зо-
тиков), Научно-исследовательского института медицинской
радиобиологии (Е. Ф. Лушников), Московского государст-
венного университета им. М. В. Ломоносова (С. М. Струко-
ва), Научно-производственного объединения «Косметика»
(Г. М. Цветкова). Общую редакцию книги осуществляли
акад. РАМН В. В. Серов и проф. В. С. Пауков.
ГЛАВА 1
ИСТОРИЯ УЧЕНИЯ О ВОСПАЛЕНИИ
В этой главе мы остановимся лишь на главных, поворотных моментах
многовековой истории учения о воспалении.
Изложение истории учения о воспалении принято начинать с
великого древнегреческого врача Гиппократа (460—377 гг. до н. э.),
хотя, несомненно, вполне определенные представления о динамике
воспалительного процесса, его признаках, формах и исходах сло-
жились еще до него. В главе «О древней медицине» Гиппократ
пишет: «...одержимые горячкой, воспалением легких или другими
сильными болезнями не скоро освобождаются от жара.., боль, жар
и наибольшее воспаление до тех пор удерживаются, пока истечение
не будет сварено, не сделается гуще и не образуется из него гной...;
когда истечения сделаются гуще, переварятся и освободятся от
всякой остроты, тогда уже перестают и лихорадки, и все то, что
мучает человека». В разделе «Прогностика» он сравнивает разные
формы воспаления и отмечает, что легче протекает воспаление,
«стремящееся к остроконечной форме» (скорее всего речь идет о
фурункуле), по сравнению с «плоским воспалением без сильного
покраснения» (т. е. флегмоной). Описав клиническую картину эм-
пиемы плевры, он заключает: «Остаются в живых после болезни
скорее всего те, которых лихорадка оставляет в тот же день после
прорыва» (надо полагать, гноя). Неоднократные упоминания об
особенностях течения воспаления можно найти и в его «Афоризмах»:
«При начале нагноения страдания и лихорадка происходят больше,
чем когда оно уже совершилось» и т. д.
Важно подчеркнуть, что «воспаление» и «болезнь» Гиппократ
везде употребляет как тождественные понятия. В связи с этим
попытки некоторых авторов, например В. Менкина (1948), приписать
Гиппократу представления, в которых можно было бы обнаружить
элементы концепции приспособительной природы воспаления, не-
обоснованны. Для Гиппократа воспаление было только наиболее
характерной формой болезни, без труда обнаруживаемой при ви-
зуальном наблюдении.
Римский ученый-энЦиклопедист А. Цельс (около 25—30 г. до
н. э. — 50 г. н. э.) в своем трактате «О медицине» выделил следу-
ющие основные симптомы воспаления: красноту (rubor), опухоль
(tumor), жар (calor) и боль (dolor). Римский врач и естествоиспы-
татель К. Гален считал воспаление наиболее частой болезнью. Он
впервые ввел понятие о воспалении как о местной лихорадке. К че-
тырем признакам воспаления, выделенным А. Цельсом, он прибавил
7
Heat Redness Swelling Pain
Loss of
Function—Ц
Рис. l.L. Карикатура P. Cull на описание основных признаков воспаления
доктором A. A. Willoughby.
пятый — нарушение функции (functio laesa), пульсацию. Голлан-
дский врач, ботаник и химик Г. Бургав (1668—1738) высказал точку
зрения, согласно которой сущность воспаления заключается в на-
рушениях кровообращения в виде повышения вязкости крови, застоя
и даже разрыва мелких сосудов.
Несмотря на многочисленность клинико-анатомических и био-
логических исследований воспалительного процесса и выделение
крупнейшим представителем патологической анатомии довирховско-
го периода К. Рокитанским (1846) таких форм воспаления, как
катаральное, флегмонозное, гнойное, острое, хроническое и др., все
эти исследования проводились в основном путем визуальных на-
блюдений (рис. 1.1).
Р. Вирхов в «Целлюлярной патологии» (1858) не только положил
начало новому, микроскопическому, периоду в изучении патологи-
ческих процессов вообще и воспаления в частности, но, по-видимому,
одним из первых отказался от традиционной трактовки этой реакции
как болезни, отнеся ее к «процессам смешанным, активно-пассив-
ным». Активный компонент воспалительного процесса, по мнению
Р. Вирхова, состоит в том, что экссудат уносит с собой из воспа-
ленной ткани значительную часть образующихся в ней вредных
веществ, «имеет значение процесса отвлекающего или очиститель-
8
ного». Однако он при этом уточнял, что на воспаление следует
смотреть «не как на процесс, существенно отличный от других
болезненных процессов, а как на отличающийся от них только своей
формой или течением». Каждый из четырех основных симптомов
воспаления Р. Вирхов уже рассматривает как процесс, имеющий
свои механизмы развития. Так, краснота, по его мнению, возникает
в связи с гиперемией (на этом основана «васкулярная теория»
воспаления). Причиной развития припухлости является скопление
экссудата. Боль Р. Вирхов связывает с повреждением элементов
ткани. Он приходит к выводу о том, что все новейшие школы
сошлись по крайней мере в одном: что к четырем характеристическим
симптомам воспаления, принимавшимся древними, следует приба-
вить еще расстройство отправления — functio leasa. Р. Вирхову
принадлежит классификация воспаления, включающая паренхима-
тозное воспаление, при котором процесс протекает внутри ткани и
сопровождается изменением ее элементов без выступающего на
открытую поверхность выпота, и отделительное (экссудативное),
делящееся на катаральное и фибринозное.
В ближайшие годы после выхода «Целлюлярной патологии» сло-
жились современные представления о формах воспалительной ре-
акции (серозное, катаральное, флегмонозное, крупозное, гнойное и
т. д.) и динамике ее развития в микроскопическом изображении
(гиперемия, экссудация, выход из кровяного русла клеточных эле-
ментов и т. д.). Среди проведенных исследований как один из важ-
нейших этапов в развитии учения о воспалении следует отметить
известные работы Ю. Конгейма (1878). Он впервые представил де-
тальную микроскопическую характеристику сосудистого компонента
воспалительной реакции, обратил внимание на разнообразие причин
воспаления, среди которых особое значение придавал бактериям,
установил зависимость проявлений воспалительной реакции от кон-
ституциональных особенностей организма. Несмотря на то что ис-
следования Ю. Конгейма по проблеме воспаления нельзя назвать
иначе, как фундаментальными, он, представив многочисленные но-
вые факты по этой проблеме, тем не менее воздержался от оценки
значения и роли воспалительной реакции при болезнях. В «Общей
патологии» (1878) он пишет: «...все старания ныне установить все-
объемлющую гипотезу для объяснения сущности воспалительных
изменений мне кажутся бесплодными».
Поворотным моментом в истории учения о воспалительной ре-
акции явилось создание И. И. Мечниковым фагоцитарной теории
воспаления. Исследования, приведшие к обоснованию этой концеп-
ции, были начаты И. И. Мечниковым в 1865 г. в Гиссене, где он
изучал реснитчатого червя и обнаружил, что пищеварение у червей
происходит внутриклеточно, как у простейших животных, а не
внеклеточно, в специальной пищеварительной полости, как у вы-
сших животных. Клетки, в которых проходит процесс пищеварения,
являются мезодермальными и характеризуются некоторой подвиж-
ностью. В 1882 г., т. е. спустя 17 лет, в течение которых продол-
жались эти исследования, у И. И. Мечникова созрела гипотеза о
9
роли внутриклеточного пищеварения в защите организма от мик-
робов. И. И. Мечников так описывает ее зарождение: «...наблюдая
за жизнью подвижных клеток у прозрачной морской звезды, меня
сразу осенила новая мысль. Мне пришло в голову, что подобные
клетки должны служить в организме для противодействия вредным
деятелям. Я сказал себе, что если мое предположение справедливо,
.то заноза, вставленная в тело личинки морской звезды, должна в
короткое время окружиться налезшими на нее подвижными клет-
ками, подобно тому, как это наблюдается у человека, занозившего
палец... Я сорвал несколько розовых шипов и тотчас же вставил
их под кожу великолепных, прозрачных, как вода, личинок морской
звезды. Я, разумеется, всю ночь волновался в ожидании результата
и на другой день утром с радостью констатировал удачу опыта.
Этот последний и составил основу теории фагоцитов, разработке
которой были посвящены последующие 25 лет моей жизни» (цит.
по Л. А. Зильберу, 1948).
Так родилась фагоцитарная теория, однако нужно было провести
еще большое количество остроумных опытов, потребовалось много
труда и участие в спорах, чтобы теория стала убедительной для
других. По просьбе И. И. Мечникова венский зоолог Р. Клаус по-
добрал греческий эквивалент слов «пожирающие клетки». Так возник
термин «фагоцит».
В 1883 г. на съезде естествоиспытателей и врачей в Одессе
И. И. Мечников сделал сообщение «О целебных силах организма».
Основные положения этого доклада: фагоциты — армия организма,
которая защищает его от нашествия врагов; фагоцитоз — целебная
реакция организма. Эти положения И. И. Мечников развивал убе-
дительно и с азартом, хотя к тому времени он еще ни разу не
видел поглощения фагоцитами болезнетворных микроорганизмов.
Между тем в это время бактериология совершила свой триумфальный
марш. Были открыты возбудители туберкулеза и холеры. У И. И.
Мечникова не было опыта работы с болезнетворными для высших
организмов микробами, и он исследовал дафний, пораженных гриб-
ком. Ученый получает первые данные о том, что фагоциты дафний
захватывают споры грибка и переваривают их. Если же фагоцитам
не удается их переварить, споры прорастают, грибки наводняют
дафнию и она погибает.
Фагоцитарная теория воспаления получила признание не сразу.
Возникла острая дискуссия по вопросу о том, только ли фагоциты
ответственны за защиту организма от болезнетворных микробов и
можно ли все формы защиты организма свести к фагоцитозу. Вопрос
ставился так потому, что были обнаружены вещества — бактери-
олизины, действующие против микробов и находящиеся в жидкостях
организма, в том числе в сыворотке крови, при их внедрении.
Наиболее активно выступали против теории фагоцитоза Р. Кох,
П. Эрлих и др. [Зильбер Л. А., 1948]. Эти исследователи, особенно
П. Эрлих, обосновали гуморальную теорию иммунитета, которая в
дальнейшем получила полное подтверждение. Противопоставление
фагоцитарной и гуморальной теорий, казавшееся в то время есте-
10
ственным, на самом деле отражало разные формы иммунитета.
Концепция И. И. Мечникова лишь на первых порах казалась нере-
альной, фантастической, ее иронически называли «восточной сказ-
кой». Однако по мере получения новых данных она приобретала
все больше приверженцев. Признанием заслуг обоих творцов учения
об иммунитете явилось присуждение в 1908 г. И. И. Мечникову и
П. Эрлиху (совместно) Нобелевской премии.
В нобелевской речи И. И. Мечников в сжатой форме подвел
итог своим исследованиям, проведенным за 25 лет. Основной упор
он сделал на положение о том, что большинство проявлений
инфекционного иммунитета обусловлено деятельностью лейкоци-
тов: лейкоциты поглощают и переваривают микроорганизмы, они
же вырабатывают специальные вещества — амборецепторы, бак-
териотропины, подготавливая тем самым микробы к фагоцитозу:
«...если бы было установлено вполне достоверно, что при приоб-
ретенном иммунитете способность фагоцитов поглощать микробов
совершенно не изменилась, то этот вывод ни в какой степени не
умалил бы основного положения об увеличении предохранительной
силы фагоцитарной системы. Усиление защиты сводится при этом
к перепроизводству фагоцитами веществ, подготавливающих фа-
гоцитоз».
Исследования И. И. Мечникова имели столь важное и принци-
пиальное значение для дальнейшего развития учения о воспалении,
что по существу вся теория этого учения может быть разделена на
два периода — домечниковский и послемечниковский. Это объяс-
няется тремя обстоятельствами. Во-первых, несмотря на то что и
до И. И. Мечникова была известна способность лейкоцитов не толь-
ко к амебоидному движению, но и к поглощению инородных частиц
[Lieberkuhn N., 1854; Rekhlinghausen F., 1863], можно с полным
правом утверждать, что именно И. И. Мечникову принадлежит честь
открытия, детальной разработки и общебиологической интерпрета-
ции центрального звена воспалительной реакции — фагоцитоза.
Во-вторых, в связи с утверждением фагоцитарной теории впервые
к традиционной оценке воспалительной реакции как синонима бо-
лезни присоединилась принципиально иная ее трактовка: воспале-
ние — это не основное проявление болезни, а, наоборот, защитная
реакция организма. У этого взгляда на значение и сущность вос-
палительной реакции были предшественники, однако данная гипо-
теза, высказанная за много десятилетий до И. И. Мечникова, не
была подкреплена фактическими данными и осталась лишь догадкой,
не оказавшей серьезного влияния на развитие учения о воспалении.
В. В. Подвысоцкий (1899) подчеркивал, что «...взгляд на воспаление
как на спасительную реакцию известной, именно поврежденной, но
еще живой части организма по отношению к раздражающему агенту
высказывался в последнее время не раз отдельными авторами. Фак-
тическое обоснование этому взгляду положено, однако, лишь Меч-
никовым в 1883 г.». Наконец, следует подчеркнуть, что, изучив
фагоцитарную реакцию в филогенезе, И. И. Мечников оказался пи-
онером в создании не только сравнительной патологии воспаления,
и
но и сравнительной патологии вообще, что было вполне созвучно
утверждавшемуся в то время эволюционному учению Ч. Дарвина.
После создания И. И. Мечниковым фагоцитарной теории разви-
тие учения о воспалении шло по двум основным направлениям: с
одной стороны, все более углубленно разрабатывались морфологи-
ческие, биохимические, патофизиологические, иммунологические и
конституциональные основы воспалительной реакции, а с другой —
вспыхнули и до сих пор не стихают дискуссии о сущности и значении
этой реакции для организма.
Развитие представлений о морфологических основах воспаления в
течение нескольких десятилетий после создания И. И. Мечниковым
фагоцитарной теории проходило по пути дальнейшего изучения с по-
мощью светового микроскопа деталей сосудистой реакции, механиз-
мов диапедеза, фагоцитоза, характеристики клеточных элементов,
участвующих в каждой из стадий воспалительной реакции и при ее
различных формах, и т. д. Это было по существу продолжение того
«микроскопического» периода в истории патологической анатомии, ко-
торый начался после выхода в свет «Целлюлярной патологии» Р. Вир-
хова, но протекающего теперь в области изучения воспаления под до-
минирующим влиянием фагоцитарной теории И. И. Мечникова.
Принципиально новый этап в изучении морфологии воспали-
тельной, реакции начался в связи с развитием электронной микро-
скопии. Известная еще с прошлого века морфологическая картина
воспаления предстала перед исследователем в своем тончайшем
структурном изображении. Стала известна в мельчайших деталях
динамика изменений эндотелиальных и других клеток микроцир-
куляторного русла в стадии гиперемии, были уточнены механизмы
прохождения клеточных элементов через стенку сосуда, тщательно
прослежен процесс поглощения лейкоцитами микробов, инородных
частиц и их переваривания обнаруженными с помощью электронного
микроскопа специфическими органеллами клетки — лизосомами
(И. И. Мечников называл их «цитазами»), изучена ультраструктура
клеточных элементов крови, соединительной ткани, различных видов
воспалительного инфильтрата и т. д. Дальнейшее развитие получили
представления И. И. Мечникова не только о микрофагах, т. е. о
-полиморфно-ядерных лейкоцитах, но и о макрофагах — клетках,
совокупность которых первоначально была выделена в ретикулоэн-
дотелиальную систему [Aschoff L., 1913; Аничков Н. Н., 1937], а
в настоящее время — в систему мононуклеарных фагоцитов [van
Furtt R., 1981], объединяющую несколько типов таких клеток.
Характерной особенностью этих исследований, отличающей их
от исследований прошлых лет, является то, что морфологический
(электронно-микроскопический) анализ все чаще проводят в комп-
лексе с гистохимическими, иммуногистохимическими, радиоавто-
графическими и другими исследованиями, что позволило не только
констатировать различные изменения ультраструктур ядра и цитоп-
лазмы клетки, но и определить функциональное значение этих
изменений. В результате проведения тонкого структурно-функцио-
нального анализа было установлено, что такие медиаторы воспале-
12
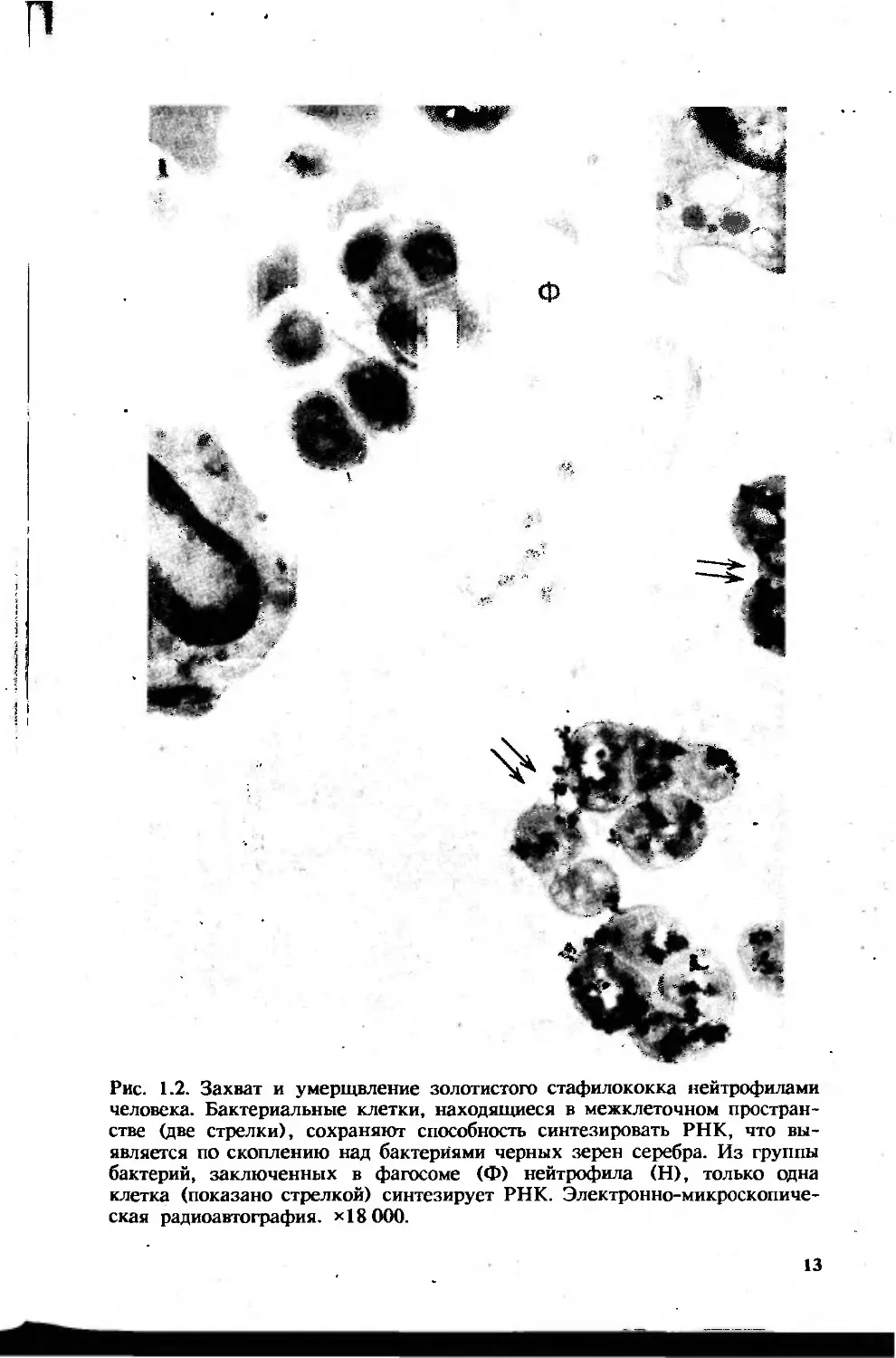
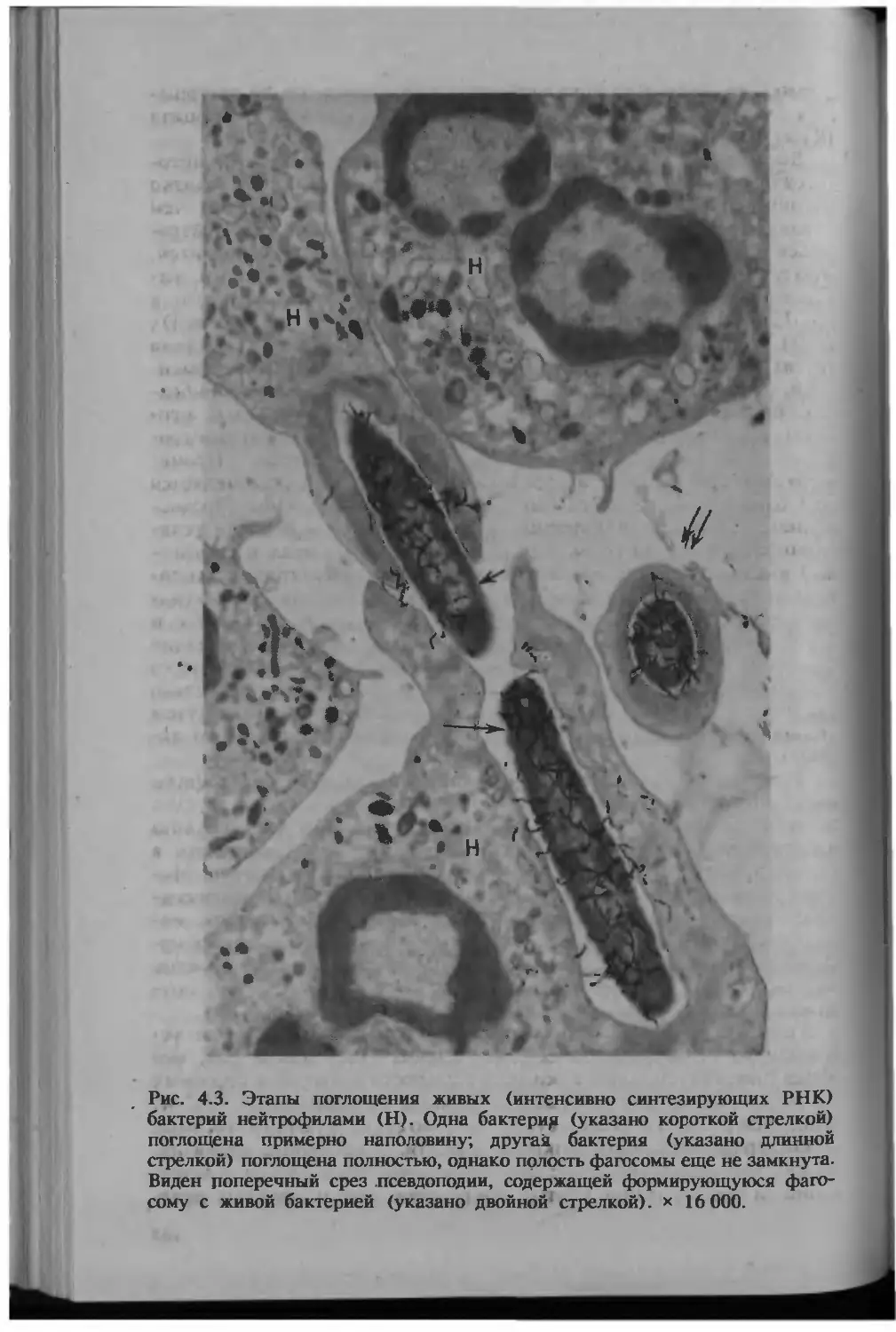
Рис. 1.2. Захват и умерщвление золотистого стафилококка нейтрофилами
человека. Бактериальные клетки, находящиеся в межклеточном простран-
стве (две стрелки), сохраняют способность синтезировать РНК, что вы-
является по скоплению над бактериями черных зерен серебра. Из группы
бактерий, заключенных в фагосоме (Ф) нейтрофила (Н), только одна
клетка (показано стрелкой) синтезирует РНК. Электронно-микроскопиче-
ская радиоавтография. Х18 000.
13
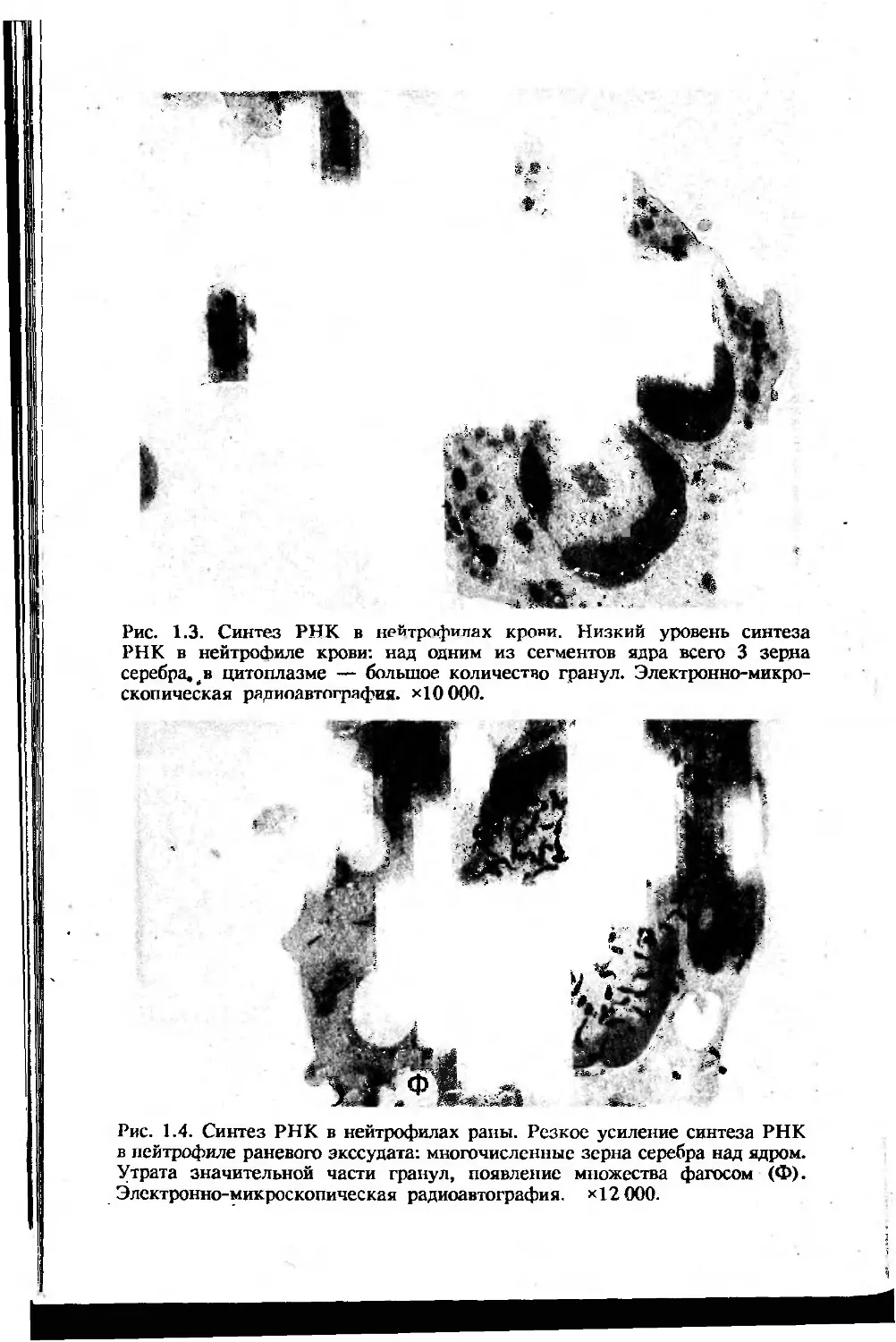
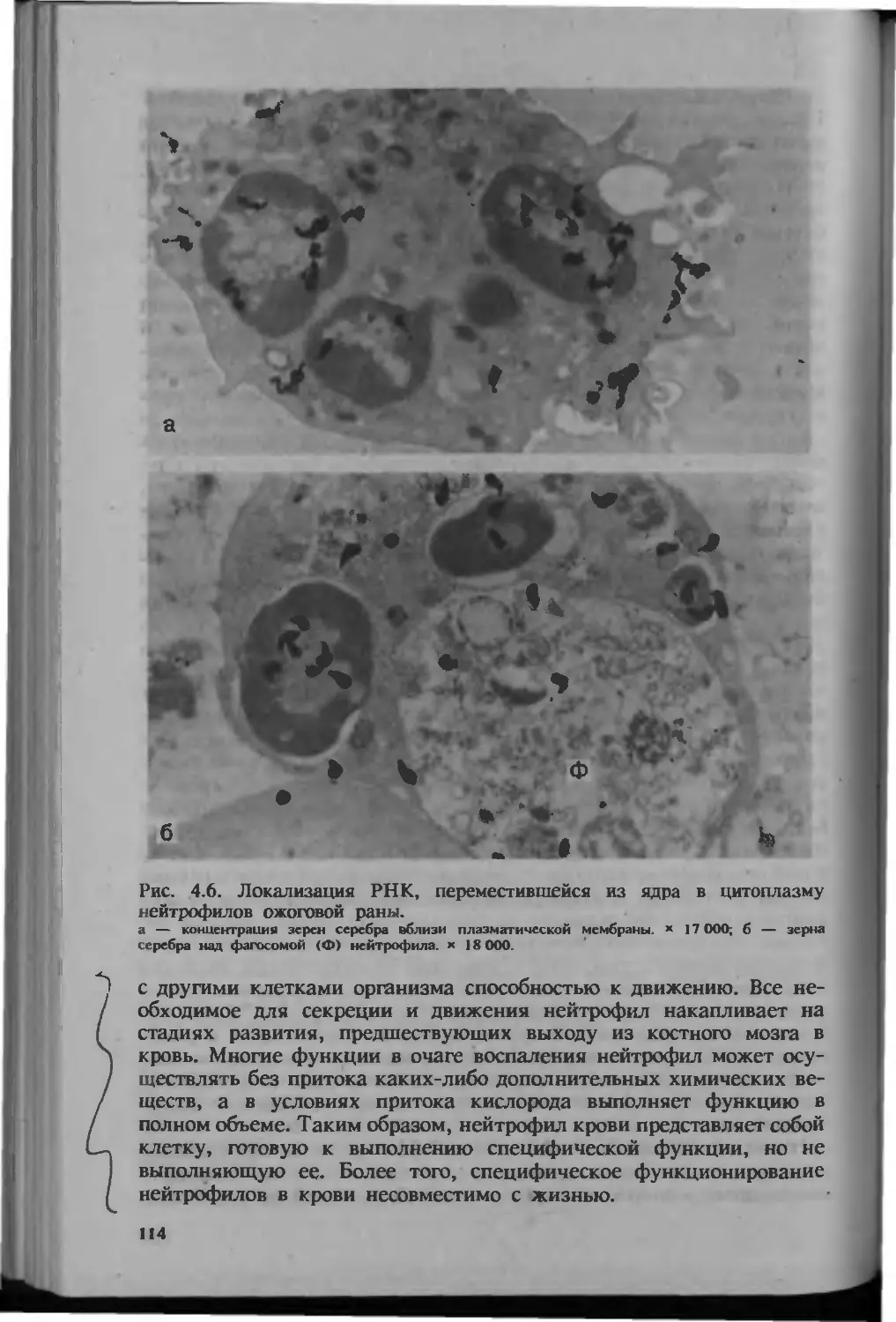
Рис. 1.3. Синтез РНК в нейтрофилах крови. Низкий уровень синтеза
РНК в нейтрофиле крови: над одним из сегментов ядра всего 3 зерна
серебра. # в цитоплазме — большое количество гранул. Электронно-микро-
скопическая рядиоавтография. хЮООО.
Рис. 1.4. Синтез РНК в нейтрофилах раны. Резкое усиление синтеза РНК
в нейтрофиле раневого экссудата: многочисленные зерна серебра над ядром.
Утрата значительной части гранул, появление множества фагосом (Ф).
Электронно-микроскопическая радиоавтография. *12 000.
ния, как гистамин, серотонин и гепарин, образуются и выделяются
тучными клетками (лаброцитами), выработка антител происходит
в плазматических клетках, трансформирующихся из В-лимфоцитов,
лизосомы обеспечивают переваривание микробов и инородных ча-
стиц благодаря тому, что в них содержатся кислые гидролазы.
Достаточно подробно были изучены гранулы полиморфно-ядерных
лейкоцитов (ПЯЛ): стали известны основные химические компо-
ненты, благодаря которым клетка умерщвляется и переваривает
захваченный ею объект, прослежены этапы слияния гранул с обра-
зовавшейся фагосомой.
Применение электронно-микроскопической радиоавтографии по-
зволило наблюдать за тончайшими структурно-функциональными
изменениями как клеточных органелл, так и микробных клеток на
всех этапах их взаимодействия вплоть до полного переваривания
последних в фагосомах (рис. 1.2). В процессе этих исследований
было обнаружено неизвестное и пока трудно объяснимое явление —
значительное увеличение синтеза РНК в полиморфно-ядерных лей-
коцитах, находящихся в экссудате, в отличие от очень низкого
уровня ее образования в лейкоцитах крови (рис. 1.3, 1.4) [Пальцын
А. А., 1985]. Характерно, что особенно высок синтез РНК в по-
лиморфно-ядерных лейкоцитах, фагоцитировавших детрит, а не
микробов.
А. А. Пальцын (1988) показал, что зрелые нейтрофилы пребы-
вают в двух состояниях: покоя и активации. Покоящиеся и акти-
вированные нейтрофилы различаются по функции, структуре и
локализации в организме. Покоящиеся нейтрофилы находятся в
костном мозге и крови. Первый шаг к активации совершается ней-
трофилами еще в крови, где они разделяются на циркулирующие,
т. е. выходящие при повреждении сосуда, и пристеночные, или
маргинальные, прилегающие к эндотелию. Превращение циркули-
рующего нейтрофила в пристеночный происходит за счет некоторого
повышения адгезивности, поэтому его можно рассматривать в ка-
честве первого шага к активации — состоянию, для которого, кроме
прочих изменений, характерно резкое увеличение способности клет-
ки к адгезии. Превращение нейтрофилов в пристеночные — обра-
тимый процесс. Так, при введении адреналина количество цирку-
лирующих нейтрофилов временно увеличивается за счет перехода
в циркуляцию части пристеночных клеток.
Активация — необратимое изменение функции, структуры, ло-
кализации нейтрофилов. Под действием активирующих факторов
повышается адгезивность в пристеночных нейтрофилах, появляется
способность к хемотаксису, они проникают через стенку сосуда в
ткани и в них отмечаются все остальные признаки активации.
Это — респираторный взрыв, приводящий к выделению биоокси-
дантов, поглощение объектов фагоцитоза, интра- и экстрацеллю-
лярная дегрануляция, микробицидность и цитотоксичность, внут-
риклеточный и внеклеточный лизис поврежденных тканей и самих
распадающихся нейтрофилов, сопровождающийся появлением био-
логически активных продуктов расщепления, синтез некоторых мак-
15
ромолекулярных веществ, в частности РНК. В кровоток активиро-
ванные нейтрофилы не возвращаются, они погибают в тканях, раз-
рушаясь вместе с фагоцитированным материалом и окружающей
клетку тканью.
Неизвестно, под влиянием каких факторов активируются нейт-
рофилы в нормальных тканях. Можно предположить, что эти фак-
торы лишь количественно отличаются от тех, которые активируют
нейтрофилы в очаге воспаления: продукты расщепления компле-
мента и разрушения клеток, пептиды и некоторые другие соедине-
ния, выделяемые бактериями. Эти вещества, по-видимому, могут
появляться и в нормальных тканях, граничащих с внешней средой,—
коже, слизистой оболочке дыхательных путей, пищеварительного трак-
та и др.
Согласно современным представлениям, активирующие факторы
включают цепь многообразных превращений нейтрофила, воздей-
ствуя на рецепторы плазматической мембраны. Наиболее подробно
исследованы рецепторы для опсонинов — СЗЬ-субкомпонента ком-
племента и" для иммуноглобулинов, т. е. для факторов, выделяю-
щихся из сыворотки крови. Активация нейтрофилов в отсутствие
сыворотки возможна, однако не только поглощение, по которому
судят об опсоническом эффекте, но и все остальные признаки
активации без сыворотки выражены значительно слабее. Более того,
некоторые признаки активации нейтрофилов проявляются только в
присутствии сыворотки. Так, синегнойная палочка в среде без сы-
воротки активирует нейтрофилы, что характеризуется усилением
синтеза1-РНК, однако эта активация недостаточна для поглощения
синегнойной палочки, которое происходит лишь в присутствии сы-
воротки [Саркисов Д. С. и др., 1986].
Усиление активации нейтрофилов под воздействием сывороточ-
ных факторов определяют не только по поглощению, но и по
способности убивать поглощенные и непоглощенные бактерии. Ней-
трофилы ожоговых больных поглощают золотистый стафилококк без
сыворотки, но не способны его убить. При добавлении сыворотки
к этим нейтрофилам отмечается выраженный бактерицидный эффект
в отношении не только поглощенных стафилококков, но и стафи-
лококков, находящихся в межклеточном пространстве среди акти-
вированных нейтрофилов [Саркисов Д. С. и др., 1988].
Дальнейшее развитие получило учение об экзоцитозе, т. е. о
выделении лейкоцитами секреторных гранул во внеклеточную среду.
Представления о фагоцитозе и экзоцитозе нейтрофилов были вы-
двинуты почти одновременно более 100 лет назад: первое —
И. И. Мечниковым, второе — П. Эрлихом. Однако в дальнейшем
теория фагоцитоза успешно развивалась, а концепция экзоцитоза,
или экстрацеллюлярной секреции, была забыта примерно на 80 лет.
В настоящее время феномен экзоцитоза вновь привлекает к себе
внимание исследователей. Давно известное лизирующее действие
ПЯЛ на омертвевшие ткани объясняют выходом гранул из разру-
шающихся нейтрофилов, что позволяет говорить о последних как
о секреторных клетках с голокриновым типом секреции. В некоторых
16
работах приведены данные, свидетельствующие о том, что нейтро-
филы могут выделять во внеклеточную среду свои секреты путем
экзоцитоза и без разрушения клеток, т. е. до некоторого момента
секреция не сопровождается разрывами клеточной мембраны —
происходит секреция по мерокриновому типу [Пигаревский В. Е.,
1982].
Дегрануляция нейтрофилов при экзоцитозе существенно отли-
чается от интрацеллюлярной дегрануляции, которая всегда сопро-
вождается выделением в фагосому как первичных, так и вторичных
гранул. В отличие от этого некоторые стимуляторы экзоцитоза
вызывают выделение из неразрушенных клеток в окружающую
среду только вторичных гранул. Такое действие оказывает ионофор
кальция микробного происхождения [Wright D. et al., 1977; Weissman
G. et al., 1980]. Выделение вторичных гранул в окружающую среду
происходит даже без каких-либо специальных воздействий просто
при инкубации в физиологической среде [Wright D., Gallin J., 1979].
Экзоцитоз вторичных гранул значительно усиливается в ответ на
присутствие непоглощенных иммунных комплексов, лекарственных
препаратов и др. Очень важным свойством секреторной функции
нейтрофилов является то, что наряду с гранулами и их содержимым
эти клетки могут выделять во внеклеточную среду биологически
активные оксиданты [Klebanoff S., Clark R., Weissman G. et al.,
1980].
Биологическое значение экзоцитоза недостаточно ясно. Наиболее
очевидна его роль в регуляции воспаления. Выделяя многочисленные
нейтральные и кислые протеазы и некоторые неферментные белки,
нейтрофилы тем самым обеспечивают расщепление комплемента,
антител и других гуморальных факторов. При таком расщеплении
образуется ряд медиаторов, влияющих как на сами нейтрофилы,
так и на другие клетки, участвующие в воспалении. Медиаторы
нейтрофилов вызывают, в частности, дегрануляцию лаброцитов,
высвобождение вазоактивных аминов из тромбоцитов, усиливают
синтез ДНК в лимфоцитах.
Роль экзоцитоза в антимикробной защите изучена мало. Резуль-
таты исследований, проведенных В. Е. Пигаревским (1978), свиде-
тельствуют о том, что лизосомные катионные белки и гистоны,
выделяющиеся из разрушенных нейтрофилов, могут подавлять жиз-
неспособность возбудителя кандидамикоза, авирулентного штамма
псевдотуберкулезной палочки и двух видов риккетсий — возбудителя
менингопневмонии у мышей и возбудителя орнитоза. На стафило-
кокк и некоторые другие бактерии катионные белки и гистоны не
действуют.
До сих пор не решена чрезвычайно важная проблема: каковы
функции нейтрофилов в здоровом организме. Пока неизвестно, как
действуют те 1011 нейтрофилов, которые ежедневно разрушаются
и погибают. Нельзя исключить, что в функции этого огромного
количества нейтрофилов экзоцитоз (экстрацеллюлярная секреция)
занимает более важное место, чем фагоцитоз. Об этом свидетель-
ствует отсутствие выраженного фагоцитоза в здоровых тканях. В от-
17
С хема 1.1. Клеточные системы защиты и кинетика воспалительной
- реакции.
Повреждение
Медиация
(аутокатализ)
Клеточные
кооперации
Лимфоцит
ПЯЛ
к
Рецепция
v
Макрофаг
--- Фибробласт
Клеточные «трансформации^
Репарация
личие от фагоцитоза экстрацеллюлярная секреция может иметь
профилактическое значение, т. е. создавать неблагоприятные усло-
вия для развития бактерий еще до их контакта с клетками, что и
наблюдается у здорового человека.
В цзучении воспаления И. И. Мечников остановился на фагоци-
тозе, назначение которого — элиминация повреждающего агента и
очищение поля воспаления от продуктов распада клеток и ткани.
Однако конечная цель воспалительной реакции — репарация. —
достигается не в результате «работы» нейтрофила, а благодаря вза-
имосвязи макрофага и фибробласта, кооперация которых взаимо-
действует как с ПЯЛ, так и с лимфоцитом. Таким образом, для
достижения конечной цели воспалительной реакции необходимо
согласованное действие всех клеточных систем защиты — фагоци-
тарной и иммунной системы, с одной стороны, и системы соедини-
тельной ткани — с другой (схема 1.1). Этот процесс осуществляется
с помощью гуморальных и клеточных посредников, или медиаторов
воспаления [Серов В. В., 1983].
Не менее далеко продвинулись исследователи в изучении био-
химии воспалительной реакции. Еще в начале века A. Wright и S.
Dauglas (1903) выделили сывороточные факторы — опсонины, ко-
торые «подготавливают» бактерии к поглощению их нейтрофилами
и макрофагами. В отсутствие опсонинов фагоцитоз значительно
менее эффективен или вообще не происходит. В настоящее время
наиболее важными сывороточными опсонинами, способствующими
фагоцитозу бактерий нейтрофилами и моноцитами, считают систему
комплемента и иммуноглобулины. Полагают, что опсонирующий
эффект дают также неферментные и неиммуноглобулиновые белки
сыворотки крови. Опсонизирующий эффект плазмы обусловливается
18
тем, что содержащиеся в ней иммуноглобулины одной частью своей
молекулы связываются с поверхностью микроба, а другой — с
нейтрофилами, в результате чего и происходит фиксация микроба
на поверхности последних.
Г. Шаде (1923), изучив ионный состав воспалительного экссудата,
создал теорию о «гиперплетии», объединяющую совокупность ха-
рактерных для воспаления нарушений физико-химических констант
тканей (Н—ОН- и Na—К—Са-изоиония, изотермия и изотония).
С позиций физико-коллоидной химии Г. Шаде были рассмотрены
проблемы иммунитета, фагоцитоза, механизмы сосудистых реакций
при воспалении, агглютинации и т. д. В. Оствальд (1935), подошед-
ший к трактовке воспалительной реакции, как и Г. Шаде, с позиций
физико-коллоидной химии, считал эту реакцию результатом изме-
нения коллоидного состояния клеток с последующим сдвигом их
проницаемости для коллоидной плазмы и набуханием поверхностных
слоев клеток.
Важное место в представлениях о механизмах развития воспа-
лительной реакции занимает учение о медиаторах воспаления, т. е.
о биологически активных веществах, под влиянием которых, как
считали раньше, возникают лишь начальные стадии воспалительной
реакции, главным образом микроциркуляторные изменения. В связи
с этим их называют пусковыми механизмами воспаления. В. Менкин
(1948) выделил из экссудата вещество, названное им лейкотаксином,
которое влияет на сосудистую реакцию и движение лейкоцитов.
В дальнейшем было установлено, что лейкотаксин представляет со-
бой химически сложное вещество, включающее в себя ряд медиа-
торов воспаления.
Один из медиаторов воспаления — гистамин — был впервые
выделен в 1909 г. Н. Dale и Р. Laidaw. Значительно позже был
обнаружен другой медиатор воспаления — серотонин. В настоящее
время принято выделять плазменные (циркулирующие) медиаторы,
представленные калликреин-кининовой системой, системой компле-
мента и системой свертывания крови, а также клеточные (локаль-
ные) медиаторы, связанные со многими клетками: лаброцитами,
тромбоцитами, базофилами, нейтрофилами, макрофагами, лимфо-
цитами и др. [Austin К. F. et al., 1974]. Однако и плазменные, и
клеточные медиаторы тесно связаны и действуют при воспалении
как аутокаталитическая система. Клеточные медиаторы воспале-
ния — лейкокины, монокины, лимфокины и фиброкины — являются
локальными регуляторами кооперации клеток (полиморфно-ядерно-
го лейкоцита, макрофага, лимфоцита и фибробласта) в очаге вос-
паления [Серов В. В., Шехтер А. Б., 1981 ]. Они определяют после-
довательность и долю участия в воспалении фагоцитарной, иммунной
систем и системы соединительной ткани.
Течение воспалительной реакции, как и всех других реакций
организма, в каждом конкретном случае в значительной степени
определяется его реактивностью. В зависимости от этого наряду с
так называемым нормергическим (типично протекающим) воспале-
нием выделены гиперергическое и гипергическое, характеризующи-
19
еся соответственно необычно бурным или вялым течением. Изме-
нение характера воспалительной реакции зависит от многих причин.
Важную роль в этом играет состояние нервной, иммунной, эндок-
ринной и других систем. Так, при одном и том же возбудителе
изменение состояния центральной нервной системы сопровождается
качественными изменениями экссудата: вместо гнойного он стано-
вится геморрагическим, серозным и т. д. [Саркисов Д. С., 1956].
Огромное, пожалуй, определяющее значение для развития того
или иного вида воспалительной реакции имеет состояние иммунной
системы. Еще в начале века было установлено, что при повторном
введении животным чужеродного белка может развиться бурная
реакция, сопровождающаяся некротическими изменениями тканей.
В дальнейшем это явление, получившее название «феномен Артюса»,
стало предметом многочисленных экспериментальных исследований,
а также было использовано в клинике в качестве диагностического
теста измененной реактивности организма. К. Пирке (1907), пред-
ложивший этот тест для диагностики туберкулеза, назвал реакции
организма на повторные введения чужеродного белка аллергически-
ми. Морфологическое изучение таких реакций, проведенное Р. Рёс-
сле (1914), показало, что при этом наблюдается экссудативное
воспаление, сопровождающееся дистрофическими и некротическими
изменениями мезенхимы, микротромбозами, кровоизлияниями и т. д.
Эту бурно протекающую реакцию Р. Рёссле назвал гиперергическим
воспалением. В дальнейшем А. И. Абрикосов (1933) обнаружил такие
проявления аллергических реакций, как фибриноидное набухание
и фибриноидный некроз соединительной ткани, экссудативное вос-
паление и т. д., при некоторых болезнях человека: ревматизме,
злокачественном нефросклерозе, облитерирующем тромбангите, и
объединил подобные изменения тканей под названием «аллергиче-
ское воспаление».
В. Г. Гаршин (1939) придерживался иного взгляда на сущность
и причины возникновения гиперергического воспаления. Он рас-
сматривал его не как бурную, сверхсильную реакцию организма,
а, наоборот, как свидетельство понижения его реактивности и не-
способности развернуть полноценную защитную реакцию. Что ка-
сается истории этого вопроса, то следует упомянуть, что первым
выдвинул положение о разных степенях выраженности воспаления
Р. Вирхов (1859), который уже в то время писал об астеническом
и гиперстеническом воспалении. Под последним, в частности, он
понимал такое, «...в котором вследствие особенного предрасположе-
ния или особенного свойства раздражающего влияния вызывается
столь большое развитие силы, или, другими словами, столь значи-
тельное разложение материи, что воспаленная часть через это со-
вершенно умирает («антонов огонь») или происходит беспрерывное
развитие новых воспалительных продуктов».
Учение о воспалении все больше сближается с учением об им-
мунитете, иммунных и иммунопатологических реакциях организма.
В начале XX в. стыки между ними еще только намечались и развитие
этих учений шло в основном параллельно. В 1928 г. И. В. Давы-
20
довский уже подчеркивал, что «...проблемы воспаления и иммуни-
тета очень близко соприкасаются между собой», а в настоящее время
воспалительную и иммунную реакции все чаще рассматривают в
неразрывном единстве. Это объясняется успехами в изучении как
биохимических, так и морфологических основ иммунитета и вос-
паления, в частности установлением теснейшего взаимодействия
всех клеточных систем, которые обеспечивают как клеточные, так
и гуморальные реакции, — лимфоцитов и их производных, поли-
морфно-ядерных лейкоцитов, макрофагов, фибробластов. Изучение
различных сторон взаимодействия этих клеток позволило А. И.
Струкову (1982) сформулировать представление об иммунном вос-
палении, охарактеризовать его различные фазы, последовательность
участия в нем различных клеточных элементов, особенности вос-
палительной и иммунной реакций в этих условиях и т. д.
Накопленные к настоящему времени данные о деятельности им-
мунофагоцитарной системы свидетельствуют о сложных связях меж-
ду различными клеточными популяциями и неклеточными хими-
ческими субстанциями в воспалительном ответе. Различие первич-
ных стимулов определяет разнообразие реакций как по механизму
возникновения, так и по характеру участия отдельных гуморальных,
тканевых и клеточных компонентов этой системы. Иммунофагоци-
тарную систему условно можно разделить на три составные части,
каждая из которых ответственна за формирование определенной
формы ответа на внешние воздействия. К первой следует отнести
систему Т- и В-лимфоцитов. Название «иммунные» прочно закре-
пилось за процессами, связанными с реакциями антиген—антитело,
циркулирующими иммунными комплексами и клеточным цитоли-
зом. Эти реакции, как правило, влекут за собой включение в процесс
других клеточных популяций. В тех случаях, когда .параллельно с
иммунным конфликтом и деятельностью лимфоидных элементов
или вслед за ними начинают действовать ПЯЛ, процесс приобретает
характер упомянутого выше иммунного воспаления. Первая, им-
мунная, специфическая, фаза сменяется в этих случаях второй,
неспецифической, фазой — воспалительной.
Вторая часть иммунофагоцитарной системы — система моноци-
тарных фагоцитов. В рамках ее деятельности развивается грануле-
матозное воспаление. Оно является результатом воздействия раз-
личных агентов — микробов (микобактерия туберкулеза, бледная
трепонема, грибы и др.), химически активных или инертных веществ
и т. д., обладающих способностью активировать систему моноцитар-
ных фагоцитов, или гистиоцитарно-макрофагальную систему. Скоп-
ление вокруг чужеродного агента клеток макрофагального проис-
хождения, т. е. образование гранулемы, обусловливает отграничение
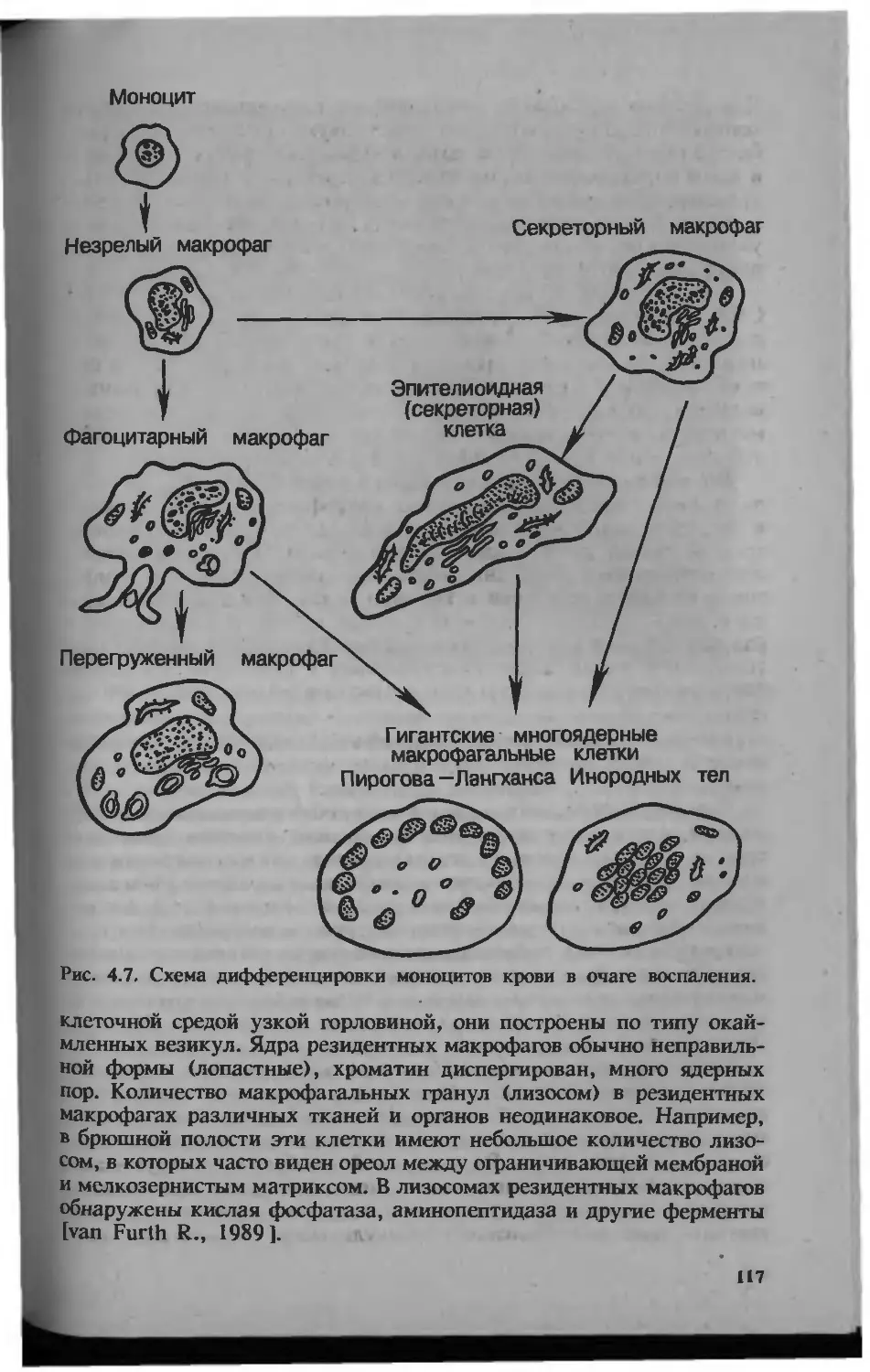
возбудителя, фагоцитоз и элиминацию. Общепринятой является сле-
дующая трансформация клеточных представителей системы моно-
цитарных фагоцитов: моноцит — макрофаг — эпителиоидная клет-
ка — гигантская клетка инородных тел — гигантская клетка
Пирогова—Лангханса. Поскольку по мере трансформации моноци-
тарных фагоцитов и макрофагов в эпителиоидные и гигантские
21
клетки возможность фагоцитоза прогрессивно уменьшается, подме-
няясь эндоцитобиозом, гранулема становится выражением реакции
гиперчувствительности замедленного типа.
Третью часть иммунофагоцитарной системы составляет система
полиморфно-ядерных лейкоцитов, которая реагирует на внедрение
большинства бактерий фагоцитозом и «запускает» иммунный ответ
(гуморальный инфекционный иммунитет). При этом воспалительная
реакция сопровождается гистолизом (гнойное воспаление).
Все три клеточные популяции — лимфоциты, моноцитарные
фагоциты (макрофаги) и полиморфно-ядерные лейкоциты, взаимо-
действуя между собой, определяют многообразие реакций иммуно-
фагоцитарного ответа. С помощью макрофага, его монокинов в
содружественную клеточную реакцию включается фибробласт, слу-
жащий репарации — конечной цели воспалительной реакции. Кле-
точные взаимодействия, меняющиеся в различных стадиях воспа-
лительной реакции и доминирующие- в виде отдельных вариантов
при той или иной форме воспаления, определяются медиаторно-ре-
цепторными ’ связями. Таким образом, есть основания говорить о
гуморально-клеточных кооперативных взаимоотношениях в ходе
развития иммунофагоцитарного ответа [Серов В. В., 1983]. Следует,
однако, подчеркнуть, что каждая из этих клеточных популяций в
конкретных ситуациях способна реагировать достаточно автономно.
Р. Рёссле (1925) подчеркивал, что «...в сущности все так называемые
реакции иммунитета демонстрируют нам совершенствование воспа-
лительных способностей мезодермы в смысле усиленной и ускорен-
ной переваривающей способности ее по отношению к тому или
иному раздражителю». Другими словами, иммунные реакции — это
компенсаторно-приспособительный механизм, филогенетически бо-
лее поздний, чем собственно воспаление. Они возникли в качестве
«дополнения», дальнейшего развития и повышения эффективности
этой защитной реакции организма.
Все изложенное выше свидетельствует о том, что на протяжении
более 100 лет после создания И. И. Мечниковым фагоцитарной те-
ории воспаления структурно-функциональная характеристика его
непрерывно углублялась и детализировалась по мере совершенст-
вования методического уровня морфологических, биохимических,
иммунологических и других исследований.
Изменились ли за тот же длительный период представления о
сущности воспаления и его значении для организма при различных
болезнях? Нет, в этих представлениях не произошло коренных
изменений. Еще в 1928 г. И. В. Давыдовский высказал положение,
которое в полной мере сохраняет значение и в настоящее время:
«Следует заметить, что с открытием новых технических возможно-
стей споры о воспалении по существу отнюдь не стали менее ост-
рыми». Правда, в теорию воспаления время от времени вносили
изменения и дополнения. Так, одной из «поправок» к мечниковской
теории явилась точка зрения о том, что фагоцитоз нельзя рассмат-
ривать в качестве эквивалента воспаления: это важное звено вос-
паления, но все-таки лишь звено в цепи других биологических
22
явлений, из совокупности которых складывается воспалительная
реакция в целом. Эту точку зрения одним из первых высказал
Р. Рёссле (1923), и, как следует из представленных выше данных
о роли гуморальных факторов в воспалительной реакции, можно
считать, что она нашла свое подтверждение в современных иссле-
дованиях. Вместе с тем необходимо учитывать, что фагоцитоз по-
прежнему нужно рассматривать в качестве центрального звена вос-
паления.
Р. Рёссле (1925) также было выдвинуто положение о физиоло-
гическом и патологическом воспалении. По его мнению, они отли-
чаются друг от друга тем, что физиологическое воспаление пред-
ставляет собой нормальное явление, протекающее постоянно и име-
ющее эндогенное происхождение, в то время как патологическое
воспаление — это следствие случайного воздействия экзогенных
повреждающих факторов. В основе того и другого лежат одни и те
же механизмы, но при патологическом воспалении развивается «бо-
лезненно-повышенная функция» мезодермальных производных, спо-
собных очищать соединительную ткань органов от инородных ве-
ществ. Р. Рёссле (1925) подчеркивал, что «...физиологическое вос-
паление — и это существенно важно — состоит из тех же проявлений
и ведет к той же цели, что и патологическое». Еще раньше Г. Рибберт
(1905) писал, что «...и в нормальном организме постоянно незамет-
ным образом протекают незначительные воспалительные процессы.
Мы видели, что в наши легкие постоянно попадают частички пыли,
которые возбуждают в них слабые воспаления, а кроме того, не-
сомненно, что и бактерии часто проникают туда и по большей части
быстро погибают.'.. Таким образом, местное воспаление можно смело
рассматривать как происходящую также при нормальных условиях,
но вследствие по незначительности незаметную, повышенную фун-
кцию тканей».
А. И. Абрикосов (1949), хотя и указывает на качественное раз-
личие между физиологическим и патологическим воспалением,
соглашается с тем, что то и другое развиваются на основе одних
и тех же механизмов и сопровождаются в принципе однотипными
явлениями. Он пишет: «Если всмотреться в сущность изменений,
совершающихся в тканях при воспалении, то оказывается, что
все они имеют место в нормальной жизни индивидуума: так, мы
постоянно наблюдаем альтеративные проявления в виде некроби-
отических изменений (отживание клеток) и так называемых мик-
ронекрозов ткани; непрерывно идет выпотевание из сосудов в
ткань жидкости, выхождение лейкоцитов, явления фагоцитоза лей-
коцитами и макрофагами белковых, жировых и других частиц,
пролиферации клеток... Воспаление представляет собой как бы
резкое повышение амплитуды физиологических процессов». Это
высказывание следует понимать как признание существования так
называемого физиологического прототипа воспаления, наблюдае-
мого в условиях патологии. С. С. Вайль и Л. Б. Нейнина (1935)
указывают на существование качественных различий физиологи-
ческого и патологического воспаления при сравнении пищевари-
23
тельного лейкоцитоза в желудке и гастрита только на основании
различной топографии лейкоцитарного инфильтрата в слизистой
оболочке, а также отсутствии ее повреждения при пищеваритель-
ном лейкоцитозе. Именно вопрос о повреждении тканей при вос-
палении имеет принципиальное значение.
Является ли повреждение (альтерация) неотъемлемой частью
воспалительной реакции или это лишь фактор, «запускающий» его?
Во всех без исключения современных учебниках четко указано, что
воспаление всегда включает три основных компонента: альтерацию
(повреждение), экссудацию и пролиферацию, т. е. повреждение рас-
сматривается в качестве первого этапа воспалительной реакции.
Однако эту точку зрения разделяют не все авторы, особенно так
называемые старые.
В большинстве прежних руководств по общей патологии и па-
тологической анатомии изложение морфологических изменений, ха-
рактеризующих воспаление, начинается с описания сосудистых из-
менений, а некоторые авторы даже подчеркивают, что повреждение
не является составной частью воспалительной реакции. Так,
Ю. Конгейм (1900) пишет: «...с воспалением эти явления (повреж-
дение, раздражение. — Примеч. авторов) ничего общего не
имеют, потому что можно доказать наиположительнейшим образом,
что они могут быть без последующего воспаления и что — и это
еще убедительнее — воспаление развивается очень часто без пред-
варительного наступления этих явлений». Позже эту точку зрения
поддержал Г. Рибберт: «Дегенерация и некроз могут протекать как
в виде самостоятельных первичных процессов, так и в качестве
сопутствующего явления при воспалении, не отличаясь при этом
по своему существу».
Д. И. Головин (1961), рассматривая повреждение тканей в ка-
честве компонента воспалительной реакции, в то же время проводил
четкую грань между тем, что является в воспалительном процессе
поломом, а что — реакцией ткани на этот полом. Он отмечал:
«Итак, воспаление представляет собой противоречивый процесс, в
котором сочетаются явления полома и защиты, т. е., с одной стороны,
картины гибели клеток и тканей, с другой — воспалительные реации,
ведущие к уборке всего мертвого и нежизнеспособного. Изучения
в сравнительном аспекте заслуживают прежде всего воспалительные
реакции». Хотя этот принципиальный вопрос в современной лите-
ратуре практически не дискутируется и альтерация, как правило,
рассматривается в качестве обязательной составной части воспале-
ния, есть достаточные основания для того, чтобы вновь вернуться
к его обсуждению.
Действительно, во-первых, повреждение, полом не является спе-
цифическим компонентом воспалительной реакции, так как он мо-
жет выражаться в глубоких дистрофических изменениях тканей, не
сопровождающихся воспалением. Во-вторых, полом как таковой,
например перелом кости, ожоговую рану, инфаркт миокарда, мы
так и называем, и не говорим о воспалении, которое может быть
реактивным или вовсе отсутствовать, особенно при использовании
24
современных методов лечения. Мы также не рассматриваем разрыв
сосуда в качестве составной части следующего за ним сложного
процесса тромбообразования, а подчеркиваем, что последнее есть
реакция на повреждение сосуда. Поскольку все согласны с тем, что
воспаление представляет собой сосудисто-мезенхимальную реакцию
на повреждение [Мовет Г. 3., 1975], которая направлена на устра-
нение его последствий, логично было бы четко различать непосред-
ственный эффект действия патогенного фактора и те ответные меры
организма, которые он принимает для восстановления гомеостаза.
В середине 60-х годов появились работы J. Alexander и соавт.
(1964), в которых был изложен необычный взгляд на сущность
воспалительной реакции. Опираясь на собственные данные о сни-
жении фагоцитарной активности ПЯЛ у больных с ожогами, эти
авторы предположили, что развитие инфекционных осложнений и
воспалительных процессов у таких больных обусловлено поврежде-
нием лейкоцитов и в связи с этим утратой ими способности эф-
фективно бороться с микробами. Таким образом, было предложено
рассматривать воспаление как реакцию на несостоятельность фаго-
цитарной системы, а последнюю — в качестве этиологического
фактора воспалительной реакции. Другими словами, «центр тяже-
сти» в вопросе о причине возникновения воспаления был перенесен
с микроба на лейкоциты, т. е. на ту систему организма, которая,
как всегда считали, является его основным оружием в борьбе с
инфекцией. Понятно, что при такой постановке вопроса воспаление
следует рассматривать уже не как приспособительную, защитную
реакцию организма, а как чисто патологический процесс. Поскольку
эта точка зрения не осталась незамеченной, на ней следует оста-
новиться несколько подробнее, при этом нужно подчеркнуть, что
она не может быть принята как состоятельная по следующим при-
чинам.
Действительно, возможны случаи, когда патологический процесс
связан с первичной, генетически обусловленной несостоятельностью
системы полиморфно-ядерных лейкоцитов. Это бывает, в частности,
при клеточно-зависимом дефекте хемотаксиса лейкоцитов, наруше-
нии формирования цитоскелета, дефиците актинсвязывающего про-
теина, отсутствии лизоцима и лактоферрина, дефиците пируваткина-
зы, миелопероксидазы, 6-фосфатдегидрогеназы, что приводит к
уменьшению образования перекиси водорода. Основными причинами
нарушения бактерицидной функции лейкоцитов могут являться де-
фекты комплемента или дефекты либо ингибиторы сывороточных фак-
торов хемотаксиса и др. Некоторые врожденные (так же как и наслед-
ственные) дефекты фагоцитарной системы имеют характерную кли-
ническую картину и выделены в такие синдромы, как, например,
хроническая (фатальная) гранулематозная болезнь, синдромы Чеди-
ака—Хигаси, Джоб, Алиуга—Гриньяки, Костманна. Описаны редкие
формы дефектов фагоцитарной активности ПЯЛ с невыясненными
первичными механизмами, приводящие к избирательному снижению
устойчивости к какой-либо определенной таксономической группе
бактерий или даже к отдельным видам микроорганизмов.
25
Аналогичная ситуация наблюдается в тех случаях, когда организм
не в состоянии эффективно нейтрализовать микрофлору вследствие
не врожденного, а приобретенного повреждения системы ПЯЛ, на-
пример при агранулоцитозе и резком снижении общей реактивности
организма в связи с тяжелыми болезнями. Возможен, наконец, и
такой вариант взаимодействия макро- и микроорганизмов, когда
функционально не измененная система ПЯЛ взаимодействует с
бактериальным агентом очень высокой вирулентности. В этих слу-
чаях система неспецифической антибактериальной защиты неспо-
собна противостоять исключительно сильному по патогенности или
массивности бактериальному воздействию. Речь идет в первую оче-
редь об особо опасных инфекциях — чуме, сибирской язве и др.
Во всех перечисленных случаях врожденная или приобретенная
дефектность фагоцитарной активности не только не способствует
развитию полноценной воспалительной реакции, как это должно
быть, согласно точке зрения J. Alexander (1964), а наоборот, по-
следняя, как правило, оказывается в той или иной мере извращенной
либо полностью подавленной. Так, при агранулоцитозе, когда фа-
гоцитарная активность организма резко снижена и нарушена, в
ответ на инфекцию развиваются не выраженное воспаление, а яз-
венно-некротические процессы при минимальных воспалительных
изменениях, что и дало повод говорить о том, что не воспаление,
а невозможность его развития приводит таких больных к смерти.
Именно слабая выраженность воспалительной реакции и ее извра-
щенный характер часто бывают одними из первых сигналов, пре-
дупреждающих врача о тяжелом течении болезни в связи с «анер-
гией», «снижением реактивности» и др.
С точкой зрения J. Alexander (1964) о том, что этиологическим
фактором воспаления является низкая фагоцитарная активность
полиморфно-ядерных лейкоцитов, нельзя согласиться и потому, что
его исследования, основанные на определении фагоцитарной актив-
ности лейкоцитов в пробирке, т. е. в отсутствие многочисленных
сывороточных факторов, в значительной мере искусственны и далеки
от условий, в которых протекает фагоцитоз в организме. Другие
авторы в отличие от J. Alexander и соавт. в аналогичных исследо-
ваниях не получили столь же четких результатов, свидетельству-
ющих о значительном снижении фагоцитарной активности у ожо-
говых больных. Кроме того, как было отмечено выше, стали известны
существенные различия фагоцитарной функции полиморфно-ядер-
ных лейкоцитов крови и функции этих клеток, вышедших из кро-
вяного русла и действующих в ране [Пальцын А. А., 1985].
В целом можно утверждать, что снижение реактивности орга-
низма вследствие различных поломов в его фагоцитарной системе
обусловливает не возникновение воспалительной реакции, а ее ча-
стичную или полную несостоятельность в борьбе с активирующейся
в этих условиях инфекцией и другими патогенными факторами.
Следует учитывать и то обстоятельство, что снижение реактивности
организма чаще всего обусловлено не только дефектами в системе
фагоцитарной защиты, так как это реакция организма как единого
26
целого, обусловленная участием всех регуляторных систем организ-
ма — нервной, эндокринной, иммунной и др.
После частных замечаний в отношении теории воспалительной
реакции вернемся к общей характеристике ее эволюции. После того
как Р. Вирхов высказал точку зрения, согласно которой воспале-
ние — процесс «смешанный, активно-пассивный», а И. И. Мечни-
ков, создав фагоцитарную теорию воспаления, объяснил, в чем
именно состоит этот активный компонент воспалительной реакции,
вопрос о сущности последней и ее месте среди других так называемых
типовых общепатологических процессов как бы остановился в не-
котором среднем, неопределенном положении, о котором можно
сказать, что «с одной стороны, это так, но с другой...». Так, прак-
тически все исследователи рассматривают воспаление как «защит-
ную», «компенсаторно-приспособительную» реакцию и в то же время
подчеркивают, что она может проявлять и свои отрицательные
стороны, а в некоторых случаях оказаться даже губительной.
А. Хорст (1982) в связи с этим отмечает, что в развитии представ-
лений относительно природы воспалительного процесса большое зна-
чение имели работы Р. Вирхова, который выдвинул концепцию «де-
генеративных» изменений соединительной ткани, Ю. Конгейма, при-
знававшего, что воспаление возникает вследствие повреждения
сосудов, И. И. Мечникова, обнаружившего, что в месте повреждения
ткани или попадания в нее чужеродного агента происходит скопление
лейкоцитов и других клеток мезенхимального происхождения, а
затем — фагоцитоз одновременно с инактивацией бактерий или
прочих агентов, вызывающих воспаление. В настоящее время, спустя
почти 100 лет, можно признать правильность всех трех теорий,
поскольку лишь комплексный подход к исследованию воспаления
(с точки зрения морфологии, биохимии, патофизиологии, иммуно-
логии, фармакологии и клиники) позволил осветить на современном
уровне этот чрезвычайно важный биологический процесс. Достиже-
ние последнего периода в изучении воспаления — установление
механизмов его репаративного компонента.
Одной из самых трудных задач было раскрытие общебиологиче-
ской роли воспаления. Этот процесс расценивают исключительно
как защитную реакцию организма, и в то же время с самого начала
существования человечества воспаление считают синонимом болез-
ни, а характеристика признаков воспаления (tumor, rubor, calor,
dolor...) не утратила актуальности и спустя тысячелетия. Воспале-
ние — это нечто, с чем врач был обязан бороться всеми доступными
средствами, но это противоречило представлениям о защитной при-
роде данного процесса.
Действительно, многие вопросы, касающиеся классификации вос-
паления, его взаимоотношения с другими реакциями организма,
анализа биологической сущности этого процесса, его клинического
значения и др., подлежат обсуждению и дальнейшему изучению.
Даже в уже, казалось бы, вполне утвердившихся положениях со-
временного учения о воспалении многое остается условным и не-
ясным. Еще Н. И. Пирогов (1961), обсуждая проблему воспаления,
27
ставил вопросы, которые в настоящее время не могут не привлекать
внимания: «...не в праве ли мы вообще сомневаться, существует ли
воспаление как патологический процесс sui generis со своими осо-
бенными патологическими признаками? Не называем ли мы одним
и тем же именем несколько процессов, сходных между собой только
одною стороною или тем, чем сходны все органические процессы
между собой? Или, наоборот, не различаем ли мы под именем
воспаления — вовсе без нужды и без всякого логического основа-
ния — процесс, в сущности тождественный с многими другими
органическими процессами?» И. В. Давыдовский, комментируя это
высказывание Н. И. Пирогова, писал: «Пирогов был прав. Прав он
оказался и сейчас, поскольку под воспалением скрываются дейст-
вительно разнокачественные процессы. Количество таких процессов
за истекшие 90 лет даже выросло, если принять во внимание нео-
бозримое поле так называемого серозного воспаления и продуктивное
воспаление с формированием гранулем. И действительно, что общего
между гранулемой и экссудативным воспалением? Что общего (кли-
нически, морфологически, иммунологически) между диффузным и
узелковым ревматическим миокардитом?».
Н. И. Пирогов прав был хотя бы и потому, что в настоящее
время создалась реальная угроза трансформировать все процессы,
сопровождающиеся повышенной проницаемостью сосудов и выходом
серозной жидкости в стенку сосуда или окружающие ткани, в так
называемое серозное воспаление (печени, почек, артерий и др.).
Формализм и морфологизм, умозрение, принятие части за целое
(pars-pro toto) — таковы принципиальные ошибки, вскрытые ясным
умом Пирогова, но продолжающие давить на наше сознание и
сейчас... Несомненно, что воспаление — реальный продукт эволю-
ции, выработанный организмами в процессе их жизнедеятельности.
Однако воспаление как некоторое биологическое качество имеет
немало степеней этого качества, которые уводят нас то в область
патологического и притом разнообразного по своему клинико-фи-
зиологическому и морфологическому содержанию, то в область фи-
зиологического или чего-то пограничного. Это пограничное пред-
ставляет особый теоретический интерес, так как оно фактически
разрушает ошибочный узкомедицинский взгляд на воспаление, де-
лающий последнее явлением абсолютно патологическим. Н. И. Пи-
рогову был чужд этот онтологический взгляд, что ставит его в один
ряд с крупнейшими представителями своего и нашего века».
Продолжая рассуждения Н. И. Пирогова и И. В. Давыдовского,
мы можем поставить вопрос о правомочности понятия о так назы-
ваемом геморрагическом воспалении: не идет ли здесь речь о том,
что организм в условиях резко измененной реактивности отвечает
на действие патогенного фактора развитием не типичного воспале-
ния, а совсем иной реакции, попросту кровоизлиянием? Этот нео-
бычный ответ организма требует такого же тщательного структур-
но-функционального анализа, как и классические формы воспале-
ния. Принципиальное значение имеет и до сих пор остающийся
открытым вопрос о паренхиматозном, или альтернативном, воспа-
28
лении. Далее следует обсудить вопрос об условности понятий «спе-
цифическое» и «банальное» (неспецифическое) воспаление: глубо-
кого биологического смысла в этом делении нет, так как любая
форма воспаления, развивающаяся в ответ на действие данного
агента, имеет право быть названной специфической. Неясно, почему
микобактерия туберкулеза и бледная трепонема имеют какое-то
преимущество (специфичность) перед кокками, вирусами, грибами
и др., кстати, нередко вызывающими значительно более тяжелые
формы болезней, чем туберкулез и сифилис. С одной стороны,
В. Д. Цинзерлинг и А. В. Цинзерлинг (1963) установили, что пнев-
монии, обусловленные пневмококками, стафилококками, стрепто-
кокками и другими «банальными» бактериями, также имеют харак-
терные морфологические признаки, а с другой — специфичность
воспалительной реакции при туберкулезе, сифилисе и других забо-
леваниях далеко не абсолютна: она может частично или полностью
утрачивать свою «специфичность» в зависимости от особенностей
органа, состояния реактивности организма и т. д. В интересах ра-
циональной терапии специфичность любого патологического про-
цесса необходимо оценивать прежде всего по этиологическому при-
знаку. Клиника постепенно отходит от формально-морфологического
объединения патологических процессов, идя по пути их все более
глубокой этиологической и патогенетической дифференциации с
целью разработки специфических методов лечения.
История учения о воспалении — один из наиболее ярких при-
меров того, что объединяющие заключения следует делать лишь
после тщательной дифференциации наблюдаемых процессов, уста-
новления всех черт, которые являются общими и одновременно
специфическими для каждого из них. Только на этой основе со
временем можно будет создать краткие, простые и точные класси-
фикации тех реакций, с помощью которых организм нейтрализует
действие патогенных факторов и поддерживает постоянство своей
внутренней среды.
29
ГЛАВА 2
СУЩНОСТЬ ВОСПАЛЕНИЯ,
ЕГО МЕСТО В БИОЛОГИИ И МЕДИЦИНЕ
2.1. ВОСПАЛЕНИЕ КАК ЗАЩИТНО-
ПРИСПОСОБИТЕЛЬНАЯ РЕАКЦИЯ
Воспаление относится к тем феноменам, дискуссии о сущности
которых на протяжении веков ведут медики, биологи и философы.
Однако до сих пор нет единого представления о том, где же место
воспаления в биологии, медицине и патологии, поэтому не суще-
ствует пока исчерпывающего определения этого процесса. Одни
исследователи, давая определение воспаления, вообще не указывают,
к какой категории биологических процессов оно относится [Чернух
А. М., 1979; Саркисов Д. С., 1988], другие, считая воспаление при-,
способительной реакцией, тем не менее подчеркивают его относи-
тельную целесообразность [Струков А. И., Серов В. В., 1985], третьи
рассматривают воспаление как патологическую реакцию, связанную
прежде всего с врожденными и приобретенными дефектами лейко-
цитоД- [Alexander J., 1964; Таланкин В. Н., 1988 ]. Существует точка
зрения, согласно которой воспаление — это лишь реакция на по-
вреждение тканей [Ebert Н. Е., Grant L., 1974 ]. Наиболее полное
определение сущности воспаления дал Г. 3. Мовэт (1975): «Воспа-
ление — это реакция живой ткани на повреждение, заключающаяся
в определенных изменениях терминального сосудистого ложа, крови,
соединительной ткани, направленных на уничтожение агента, вы-
зывающего повреждение, и на восстановление поврежденной ткани».
В настоящее время большинство специалистов считают, что воспа-
ление — это защитно-приспособительная, гомеостатическая реакция.
И. И. Мечников, проследив эволюцию воспаления в филогенезе,
показал, как с помощью этой реакции осуществляются физиологи-
ческие, защитные и приспособительные функции различных орга-
низмов. Однако он, как и многие другие исследователи, подчеркивал
относительную целесообразность воспаления, несовершенство этой
реакции, так как воспаление нередко становится основой заболева-
ния, приводящего больного к смерти.
Если воспаление существует так же долго, как и жизнь на Земле,
о чем свидетельствуют работы И. И. Мечникова, то возникает вопрос:
может ли несовершенная реакция существовать миллионы лет?
Ч. Дарвин (1859) убедительно показал, что все несовершенное в
процессе эволюции вида должно отмереть. Воспаление же присуще
абсолютно всему живому. На этот вопрос отвечает И. В. Давыдов-
ский, который рассматривает приспособительные процессы, в том
30
числе и воспаление, в двух аспектах — видовом и индивидуальном.
Для человека как биологического вида приспособление целесооб-
разно и совершенно. Вместе с тем приспособление как индивиду-
альная реакция не является абсолютно целесообразным и в патологии
человека нередко принимает черты болезни, поэтому «...только взя-
тый в целом приспособительный процесс получает характеристику
прогрессивного» [Давыдовский И. В., 1962 ]. В связи с тем что
видовые реакции всегда имеют приоритет перед индивидуальными,
воспаление как одна из видовых приспособительных реакций с точки
зрения целесообразности для человека как биологического вида
достаточно совершенно. Смерть индивидуумов не имеет существен-
ного значения для вида, более того, через нее биологический вид
приобретает новые приспособительные механизмы, позволяющие
ему сохраниться во взаимодействии с меняющейся внешней средой.
Таким образом, исходя из трактовки приспособления И. В. Давы-
довским, о несовершенстве воспаления как защитно-приспособитель-
ной реакции можно говорить лишь условно. Мы считаем, что такой
диалектический подход к пониманию воспаления помогает раскрыть
его сущность. При этом следует подчеркнуть, что как совершенная
защитно-приспособительная реакция воспаление выступает только
по отношению к биологическому виду.
Биологический смысл воспаления как эволюционно сложившегося
процесса заключается в ликвидации или отграничении очага по-
вреждения и вызвавших его патогенных агентов. Воспалительной
реакцией организм отвечает на воздействие многочисленных как
экзогенных, так и эндогенных патогенных раздражителей (см. главу
9). Среди последних можно назвать собственные структуры и про-
дукты обмена веществ, свойства которых изменились в результате
некроза тканей, агрегации белков крови (иммунные комплексы),
токсичные продукты азотистого обмена и т. п., а среди первых —
многочисленные биологические агенты, пыль, лекарственные пре-
параты, излучение и т. д.
Если сопоставить биологический смысл воспаления и иммунитета,
то бросается в глаза общность этих процессов в достижении конечной
цели (см. главу 5): и воспаление, и иммунитет направлены на
«очищение» внутренней среды организма от чужеродного фактора
или поврежденного, измененного «своего» с последующим отторже-
нием этого повреждающего фактора и ликвидацией последствий
повреждения, поэтому неудивительно, что между воспалением и
иммунитетом существует как прямая, так и обратная связь. При
воспалении происходит не только «отделение своего от несвоего»
путем отграничения этого «чужого» или «измененного своего» от
внутренней среды организма (первое защитное действие), но и
высвобождение антигенных структур повреждающего агента или/и
поврежденных тканей. Так в воспалении рождаются иммунные ре-
акции, воспаление служит иммунитету. В то же время от состоя-
тельности иммунного ответа зависит судьба самого воспаления. В том
случае, когда иммунные средства защиты эффективны, воспаление
как патологическая реакция не развивается. При возникновении
31
реакций гиперчувствительности (иммунокомплексных или иммуно-
клеточных) воспаление становится морфологическим проявлением
этих реакций — развивается так называемое иммунное воспаление,
описанное А. И. Струковым (1981). Характер воспаления в очень
большой степени зависит от состояния иммунного дефицита. На-
пример, организм животных, у которых имеются дефекты системы
Т-лимфоцитов (nude-мыши), не способен ответить развитием эф-
фективной отграничительной воспалительной реакции на воздейст-
вие гноеродных микробов, и животные быстро погибают от сепсиса.
То же обычно наблюдается при тяжелых врожденных иммунодефи-
цитах у людей независимо от того, недостаточность какого звена
иммунитета — гуморального или клеточного — у них имеется
(тяжелые комбинированные иммунодефициты, синдромы Ди Джор-
джи, Вискотта—Олдрича, Луи-Бар и др.).
Таким образом, из изложенного выше видно, что существует
тесная связь между воспалением и иммунитетом. Однако воспали-
тельная ’ реакция зависит от состояния не только специфической
(иммунной), но и неспецифической защиты, т. е. от состояния ре-
активности организма. Это положение ярко иллюстрирует тот факт,
что воспалительная реакция в различные возрастные периоды жизни
человека имеет особенности (см. главу 8). Так, начиная от периода
новорожденности и кончая пубертатным периодом, у детей еще
недостаточно развита способность к отграничению воспалительного
очага и репарации поврежденной ткани (доминирует альтеративный
компонент воспаления), чем объясняется склонность к генерализа-
ций воспалительного и инфекционного процессов. В основе этой
особенности — отсутствие жесткого баланса регулирующих систем
организма, прежде всего иммунной, эндогенной и нервной. В ста-
рости воспаление «впадает в детство», причиной чего является раз-
балансирование иммунной (иммунный дефицит), нервной (потеря
наиболее молодых формаций коры головного мозга) и эндокринной
(возрастные полиорганные эндокринопатии) систем. Как не вспом-
нить в связи с этим биоэнергетический закон Э. Геккеля: «В течение
своего индивидуального развития живые существа повторяют глав-
нейшие этапы развития всего ряда предковых форм».
Следует отметить, что особенности воспалительной реакции оп-
ределяются также наследственностью, о чем свидетельствуют ре-
зультаты изучения антигенов гистосовместимости при воспалении
(см. главу 7).
2.2. ВОСПАЛЕНИЕ КАК КАТЕГОРИЯ ОБЩЕЙ ПАТОЛОГИИ
Рассматривая воспаление как общепатологический процесс, следует
подчеркнуть его неоднозначность. С одной стороны, воспаление
обладает всеми особенностями, присущими общепатологическим про-
цессам, с другой — для него характерен ряд особенностей, благодаря
которым оно значительно шире других реакций этой категории. Как
индивидуальная реакция воспаление носит гомеостатический харак-
32
тер. Вместе с тем оно включает в себя многие известные общепа-
тологические процессы. Более того, оно является связующим звеном
между ними, начиная от альтерации и кончая репарацией очага
повреждения ткани.
О воспалении можно говорить в том случае, когда имеется со-
четание альтерации, нарушений крово- и лимфообращения, ведущих
к экссудации, и пролиферации, завершающейся чаще всего репа-
ративной регенерацией. Благодаря этой особенности воспаление яв-
ляется уникальной общепатологической реакцией. Вместе с тем в
основе воспаления, составляющих его компонентов, как и в основе
всех общепатологических процессов, лежат физиологические меха-
низмы [Давыдовский И. В., 1961 ]. Так, морфология альтерации
сопровождает отправление большинства физиологических функций
(функциональное отправление — это утрата части структуры, осо-
бенно на субклеточном и молекулярном уровнях). Несомненно,
фагоцитоз (один из ключевых моментов воспалительной реакции)
в норме обеспечивает тканевый гомеостаз, способствует поддержа-
нию определенного клеточного состава организма. Физиологические
реакции гемокоагуляции, фибринолиза и транссудации — основа
воспалительной экссудации. Естественные процессы образования и
созревания клеток составляют основу пролиферативного компонента
воспаления и репарации. Для воспаления как комплексной реакции
также можно найти физиологический аналог. Один из них — «смена
эндометрия» в течение менструального цикла. Этот процесс наряду
с родами относится, по И. В. Давыдовскому (1962), к тем «дуали-
стическим процессам», которые имеют все признаки болезни и
вместе с тем, несомненно, являются категорией физиологии; понять
их суть можно только с общебиологических позиций.
Однако в подавляющем большинстве случаев воспаление — это
патология, общепатологическая реакция, имеющая защитно-приспо-
собительный характер. Наиболее ярко воспаление проявляется как
местная реакция. Альтерация порождает комплекс местных биохи-
мических реакций, суть которых сводится к развитию хемоаттракции
для привлечения в очаг повреждения ряда клеток — продуцентов
медиаторов воспаления. С помощью медиаторов воспаления вклю-
чается сосудистая реакция, в результате чего в очаг повреждения
поступает плазма крови, содержащая разнообразные биологически
активные вещества, характеризующаяся очень широким спектром
действия, а также клетки крови. Безусловно значение свойств самой
плазмы как «жидкости для смывания патогенных факторов» с по-
врежденных структур, особенно со слизистых и серозных оболочек.
Все эти реакции направлены на локализацию агрессивного агента
в очаге повреждения и отграничение самого очага. Это филогене-
тически детерминированная местная тканевая реакция [Мечни-
ков И. И., 1892[.
На ранних этапах воспаления отграничение поврежденных тка-
ней происходит с помощью клеток крови — ПЯЛ и моноцитов,
трансформирующихся в макрофаги. При абсцессе грануляционная
ткань включается в процесс отграничения только на 3-и сутки и
2—407
33
позже, а при распространенном воспалении она вообще не образу-
ется. В зависимости от особенностей воспаления ПЯЛ и макрофаги
ведут себя по-разному: либо в результате их «деятельности» про-
исходит инкапсуляция очага воспаления, либо отграничение его не
наступает. Однако при любом виде воспаления в очаг первыми и
в большом количестве «приходят» ПЯЛ, причем при гнойном вос-
палении их действие направлено в основном на локализацию и
уничтожение инфекта [Галанкин В. Н„ 1984]. Вследствйе этого при
инфекции их миграция из сосудов значительно интенсивнее и фун-
кциональная активность выше, чем при асептическом воспалении.
Роль макрофагов более многообразна. Она заключается в отгра-
ничении очага воспаления, нейтрализации токсинов, индукции им-
мунных реакций, регуляции разнообразных клеточных систем. При
этом выявляются тесные функциональные связи между ПЯЛ и
макрофагами. Динамика макрофагальной инфильтрации тесно свя-
зана с динамикой течения гнойного воспаления. Так, при благо-
приятном течении разлитого гнойного перитонита количество мак-
рофагов резко увеличивается как в экссудате, так и в брюшине.
При этом наблюдается активный фагоцитоз погибших клеток и
тканей. Однако способность макрофагов убивать микробы менее
выражена, чем у ПЯЛ. Известно, например, что при хронической
гранулематозной болезни нарушение бактерицидной функции ПЯЛ
не компенсируется гиперплазией клеток системы мононуклеарных
фагоцитов [Bliitmann В. et al., 1981 ]. В отсутствие зоны отграничения
из макрофагов гнойное воспаление прогрессирует, при этом грану-
ляцйонная ткань вокруг зоны нагноения обычно не развивается. В
то же время хорошо выраженный отграничительный вал из макро-
фагов сочетается с формированием капсулы из молодой соедини-
тельной ткани [Пауков В. С., 1986 ]. Вероятно, имеется особый
аспект взаимодействия ПЯЛ и макрофагов: очищая кровь от токсинов
и попавших в нее бактерий, макрофагальная система обеспечивает
большую сохранность ПЯЛ в кровяном русле.
Не менее интересно функциональное взаимодействие при вос-
палении макрофагов и лимфоцитов, макрофагов и фибробластов.
Взаимодействие макрофагов и лимфоцитов наиболее отчетливо вы-
ражено при реакциях гиперчувствительности замедленного типа
(ГЗТ) в виде иммунного цитолиза и гранулематоза, причем «ко-
нечный результат» этих реакций в отношении патогенного фактора
диаметрально противоположный: имунный цитолиз приводит к лик-
видации этого фактора, а гранулематоз — к сохранению его при
относительной «изоляции» от внутренней среды организма. Взаи-
модействие макрофагов и фибробластов направлено на стимуляцию
коллагено- и фибриллогенеза посредством воздействия моноцитов
на функциональную активность коллагенсинтетических клеток [Се-
ров В. В., Шехтер А. Б., 1981 ]. Эти взаимоотношения служат ре-
паративной фазе воспалительной реакции.
Особо следует отметить, что характер воспаления существенно
зависит от структурно-функциональных особенностей органов и тка-
ней. Это касается по существу всех форм воспаления.
34
Воспаление как местная реакция организма характеризуется не
только местными, но и общими проявлениями: лихорадкой, лейко-
цитозом, изменениями состава белков крови, увеличением СОЭ и
т. д. Его трудно отделить и от интоксикации, которая связана не
только с самим воспалением, но и с особенностями повреждающего
фактора, прежде всего с характером инфекционного агента. Уста-
новлено, что по мере увеличения площади повреждения и выра-
женности альтерации усиливается резорбция токсичных продуктов
и нарастает интоксикация.
Интоксикация, ее взаимоотношения с воспалением — это особый
вопрос, требующий специального рассмотрения. Следует лишь от-
метить, что интоксикация, угнетая различные гомеостатические си-
стемы организма (иммунокомпетентную, кроветворную, макрофа-
гальную) , оказывает модулирующее влияние на течение и характер
воспаления [Пауков В. С., Петров В. И., 1983], обусловливая в ряде
случаев то самое его «несовершенство», которое подчеркивается при
определении понятия «воспаление». Очевидно, с этим в первую
очередь связана недостаточная эффективность воспаления как за-
щитной реакции при остром разлитом перитоните, ожоговой болезни,
травматической болезни и многих хронически текущих инфекци-
онных заболеваниях.
Наконец, необходимо отметить, что с воспалением, особенно
хроническим, может быть связано развитие аутоиммунизации, в
результате чего образуется порочный круг, так как реакции гипер-
чувствительности, обусловленные аутоиммунизацией, реализуются
в виде иммунного воспаления.
Таким образом, сможет ли воспаление выполнить свое назначение
защитно-приспособительной реакции или оно окажется губительным
для больного, зависит от многих факторов, но прежде всего от
реактивности организма, которая в свою очередь обусловлена воз-
растом больного, его конституцией и многими другими факторами,
как наследственными, так и приобретенными на протяжении жизни.
В этом проявляется диалектическая сущность воспаления как одной
из основных защитно-приспособительных гомеостатических реакций.
2.3. «МЕСТНОЕ» И «ОБЩЕЕ» В ВОСПАЛЕНИИ
В очаге воспаления возникает гамма чрезвычайно сложных процес-
сов, которые не могут протекать автономно, не являясь сигналом
для включения в воспалительную реакцию различных систем ор-
ганизма. Материальный субстрат этих сигналов — накопление и
циркуляция в крови биологически активных веществ, в том числе
так называемых аутокоидов—кининов, компонентов комплемента,
простагландинов, интерферона и др. [Bekemeier Н., Hirschelmann R.,
1987 ]. Из факторов, обусловливающих взаимосвязь местных и общих
изменений при воспалении, большое значение имеют и так назы-
ваемые реактанты острой фазы [Breilsford S. et al., 1985; Damas J.,
1987]. Эти вещества неспецифичны для воспаления, они появляются
2*
35
через 4—6 ч после разнообразных повреждений тканей, в том числе
после повреждения при воспалении. Наибольшее значение из них
имеют С-реактивный белок, интерлейкин-1, «-1-гликопротеид, Т-
кининоген, пептидогликаны, трансферрин, апоферритин [Gandio J.
et al., 1987].
Большинство реактантов острой фазы синтезируется макрофага-
ми, гепатоцитами и другими клетками [Glibetic М. D., Baumann Н.,
1986]. Интерлейкин-1 влияет на функцию клеток воспалительного
очага и Т-лимфоцитов, активирует ПЯЛ, стимулирует синтез про-
стагландинов и простациклинов в эндотелиоцитах, способствует ге-
мостатической реакции в очаге повреждения и т. д. (см. главу 3).
Концентрация С-реактивного белка при воспалении увеличивается
в 100—1000 раз. Этот белок активирует цитолитическую активность
естественных Т-лимфоцитов-киллеров [Baum L. L. et al., 1987],
ингибирует агрегацию тромбоцитов [Foreman J. С., 1987], Т-кини-
ноген, уровень которого при воспалении заметно повышается, яв-
ляется предшественником кининов и ингибитором «-цистеиновых
протеиназ [Damas J., 1987]. Воспаление индуцирует синтез в печени
апоферритина, который способен стимулировать выработку ПЯЛ
супероксидных бактерицидных ионов [Breilsford S. et al., 1985].
Реактанты острой фазы определяют неспецифический ответ ор-
ганизма, создающий условия для развития местной воспалительной
реакции [Ganz Т., 1987 ]. Вместе с тем они стимулируют включение
в процесс других систем организма, способствуя взаимодействию
«местного» и «общего» при воспалении.
Как уже отмечалось выше, величина и распространенность очага
повреждения, а также особенности повреждающего агента оказывают
выраженное влияние на взаимосвязь местных и общих изменений
при воспалении. Начиная с некоторых критических размеров этого
очага, развитие воспаления сочетается с рядом нарушений гоме-
остаза, вызванных как продуктами повреждения тканей и медиа-
торами воспаления, так и стрессом (болевым, эмоциональным и
др.). При этом в воспалительной реакции взаимодействуют лимфо-
идные и нелимфоидные клетки, различные биологически активные
вещества — аутокоиды, монокины, лимфокины, гормоны, нейро-
пептиды, регуляторные клетки мозга, мембранные и внутриклеточ-
ные рецепторы; а также полярины — пептиды с иммунорегулятор-
ными свойствами [Chipens G. et al., 1987]. К ним наряду с имму-
ноглобулинами, гормонами тимуса, гликопротеинами примыкают
нейропептиды [Cornaglia-Ferraris Р. et al., 1986; Hartung Н.-Р. et
al., 1986], в частности P-субстанция, активирующая функцию ней-
трофильных гранулоцитов и моноцитов крови через специфические
рецепторы [Ruff М. R., 1985]. Это взаимодействие происходит путем
включения в воспалительную реакцию не только системы микро-
циркуляции, но также иммунной, эндокринной и нервной систем.
Взаимоотношения между специфическими реакциями иммунной
реактивности и воспалением весьма сложные [Мовэт Г. 3., 1975].
В последние годы получены новые данные об иммунных механизмах
воспаления, позволившие говорить о его иммунологических аспек-
36
тах, преобладании иммунного компонента при воспалении, пато-
генной иммунологической реакции, наконец, об иммунном воспа-
лении как самостоятельной форме воспаления (см. главу 5). Зна-
чение иммунных механизмов в динамике развитие воспаления было
показано при стимуляции и угнетении функционального состояния
системы фагоцитирующих мононуклеаров [Даабуль С. и др., 1988 ].
Активация функции системы макрофагов сопровождалась формиро-
ванием в более ранние сроки более мощной соединительно-тканной
капсулы вокруг очага воспаления. В то же время угнетение функции
этой системы приводило к увеличению зоны некроза и нагноения,
сочетавшемуся с меньшей выраженностью соединительнотканной
отграничительной капсулы. При использовании некоторых препа-
ратов, влияющих в основном на клеточный иммунитет, особенно
тактивина и продигиозана, как в клинических условиях, так и в
эксперименте было отмечено более быстрое заживление гнойных
ран [Гусейнов А. 3., 1988].
Включение в воспалительный процесс иммунной системы не
ограничивается ее влиянием на очаг воспаления. Показано, что уже
через 6 ч после возникновения в организме появляются зоны, в
которых ответ на раздражение в виде воспалительной реакции менее
выражен [Fauve R. М., 1987 ]. Это связано с действием ряда эндо-
генных веществ с мощным иммуномодулирующим эффектом —
а 1-глобулина крови, действующего в синергизме с у-интерфероном,
белков, участвующих в гемопоэзе, эндогенных глюкокортикоидов.
При воспалении возникают сложные двунаправленные взаимодей-
ствия иммунной и нейроэндокринной систем [Cavagnaro J. Н., 1986].
Механизмы участия в воспалении эндокринной и нервной систем \
также сложны и недостаточно изучены. Однако об их важной роли
в этом процессе свидетельствуют наличие на клеточных мембранах
иммунокомпетентных клеток и лейкоцитов крови адренергических
рецепторов [De Blasi A. et al., 1987], разнонаправленное модули-
рующее действие на воспаление симпатической и парасимпатической /
нервной системы, регулирующее влияние гипоталамуса на имму- '
нитет.
Включение в воспаление иммунной, нервной, эндокринной и
других систем организма обеспечивает ряд процессов, оказывающих
мощное, часто адекватное раздражителю влияние на местную вос-
палительную реакцию [Чернух А. М., 1979]. Это воздействие осу-
ществляется через образование и накопление специфических анти-
тел, реакции клеточного иммунитета, стимуляцию костного мозга,
стрессорные механизмы, обусловленные болью, лихорадкой и т. п.
Далеко не все механизмы этих взаимовлияний можно считать рас-
крытыми.
Отмеченные факты показывают, что воспаление, являясь местной
реакцией, может протекать как болезнь, с участием всех систем
организма, составляя основное звено патогенеза заболевания. При
этом сам повреждающий фактор, т. е. этиология болезни, может
быть различным — от разнообразных микробов до воздействия
физических или химических факторов.
37
Изложенное выше показывает, что воспаление — уникальная
реакция организма. Она обеспечивает сохранение биологического
вида в постоянно меняющихся взаимодействиях его представителей
и окружающей их среды. Воспаление — это и уникальная категория
общей патологии, значительно более широкая по сравнению с дру-
гими общепатологическими процессами. Как категория общей па-
тологии воспаление имеет гомеостатический характер, в результате
чего в самой альтерации тканей заложена их будущая репарация
после отграничения и элиминации патогенного фактора. Вместе с
тем, начавшись как местная реакция, воспаление «включает» все
другие интегрирующие и регулирующие системы организма. Это
«включение» наиболее характерно для воспалительного заболевания,
которое может привести больных к смерти или инвалидизации, но
чаще заканчивается выздоровлением. В последнем случае организм
человека нередко, приобретает новые свойства, позволяющие ему
значительно эффективнее взаимодействовать с окружающей средой.
38
ГЛАВА 3
ФИЗИОЛОГИЯ И БИОХИМИЯ ВОСПАЛЕНИЯ
3.1. РЕАКЦИЯ СОСУДОВ В ОЧАГЕ ВОСПАЛЕНИЯ
Изменения крово- и лимфообращения в ткани возникают практи-
чески сразу после действия раздражителя, вызывающего воспали-
тельную реакцию. Являясь обязательным компонентом местного
воспалительного процесса, эти изменения формируются под влия-
нием как самого раздражителя, так и вызываемого их повреждения
тканевых элементов. При воспалении наиболее выраженные изме-
нения обнаруживают в микроциркуляторном русле, но они могут
распространяться на артерии и вены мелкого и среднего калибра.
Особенности крово- и лимфообращения в очаге воспаления зависят
от многих факторов, в том числе от характера и тяжести повреж-
дения, вида поврежденного органа и ткани, стадии развития вос-
паления, близости сосудов к центру очага повреждения и др. Не-
маловажное значение в развитии местных реакций имеет реактив-
ность организма, зависящая от состояния нейроэндокринной,
иммунной, выделительной и других систем.
В очаге воспаления происходят структурно-функциональные из-
менения сосудов: изменяются тонус сосудов и перфузия их кровью
или лимфой, структурно-функциональная организация стенок и их
проницаемость, реологические свойства крови и лимфы вследствие
изменения состава плазмы и состояния форменных элементов, по-
ведение лейкоцитов в токе крови и т. д.
J. Cohnheim (1878) был одним из первых исследователей, с вы-
сокой точностью описавших микроскопическую картину изменения
кровообращения в очаге воспаления. Он охарактеризовал ряд сосу-
дистых реакций, в том числе активную вазодилатацию, описал
изменение скорости и характера кровотока, установил повышение
сосудистой проницаемости, возникновение отека, эмиграцию лей-
коцитов. Фундаментальная работа в этой области принадлежит так-
же и G. Eppinger (1938).
3.1.1. Изменения диаметра сосудов и перфузии
их кровью и лимфой
В динамике воспаления обнаруживают определенную последователь-
ность изменений крово- и лимфообращения в ткани очага воспале-
ния. Первоначальная реакция мелких артерий и артериол на по-
39
вреждение обычно проявляется их констрикцией и резким умень-
шением скорости кровотока. Эта реакция может быть настолько
сильной, что вызывает стаз крови в капиллярах.
Однако возникающая вследствие артериальной вазоконстрикции
ишемия всегда кратковременна. При сравнительно легком повреж-
дении ткани эта реакция продолжается 3—5 с, а при тяжелом
повреждении, например глубоком ожоге, — несколько минут [Groer
М. W., Shekleton М. Е., 1983; Robbins J. L. et al., 1984]. Вместе с
тем нередко, особенно в паренхиматозных органах, артериальная
вазоконстрикция не развивается. В этих случаях с момента повреж-
дения ткани в ней происходит расширение сосудов [Чернух А. М.
и др., 1984; Hay J. В., Movat Н., 1985]. В связи с этим некоторые
авторы не рассматривают вазоконстрикцию как обязательный этап
изменения микроциркуляции при воспалении. А. И. Струков (1982)
считал, что в самом начале повреждения ткани возможны спонтанная
«игра вазомоторов» и кратковременный спазм артериол, вызываю-
щий уменьшение притока крови к капиллярам.
Механизмы артериальной вазоконстрикции неизвестны. Возмож-
но, в возникновении спазма мелких артерий и артериол имеют
значение возбуждение (в том числе рефлекторное) симпатических
волокон и усиленное высвобождение норадреналина. Некоторые ав-
торы указывают, что такой же эффект может дать серотонин, в
большом количестве высвобождающийся из лаброцитов и тромбо-
цитов при повреждении ткани [Robbins S. L. et al., 1984 ]. Следует
учесть также, что первоначальная реакция при непосредственном
повреждении мелких артерий состоит в сокращении мышечных кле-
ток и вазоконстрикции. Прямое повреждение артериол и их ответная
констрикция могут отмечаться прежде всего в центре очага воспа-
ления. Первоначальный спазм мелких артерий — одна из наиболее
древних реакций на местное повреждение ткани, в том числе на
непосредственное раздражение сосудистой стенки. Возникающая
ишемия сопровождается ограничением доставки кислорода и суб-
стратов, вследствие чего в клетках этой зоны ослабляется тканевое
дыхание, усиливается анаэробный гликолиз и возникает ацидоз,
что способствует появлению медиаторов воспаления.
Очень быстро вслед за этой сосудистой реакцией расширяются
мелкие артерии и артериолы, а затем капилляры и венулы, начинают
функционировать резервные кровеносные и лимфатические капил-
ляры, увеличивается объем крови, притекающей к тканям.
В сравнительно крупных сосудах расширяется плазматическое
пространство и суживается осевой цилиндр, в котором перемещаются
форменные элементы крови, значительно возрастают лимфообразо-
вание и лимфообращение. Эти изменения кровообращения в очаге
острого воспаления обеспечивают активную гиперемию, которая
отличается от артериальной гиперемии невоспалительного проис-
хождения.
Уже на начальном этапе воспаления расширяются не только
артериолы, но и венулы, вследствие чего увеличиваются приток и
отток крови. Вместе с тем, несмотря на расширение венул, приток
40
крови превышает ее отток, поэтому гидродинамическое давление в
сосудах и скорость кровотока повышаются. При этом возможна даже
усиленная экссудация жидкой части крови во внесосудистую среду
[Groer М. W., Shekleton М. Е., 1983; Robbins S. L. et al., 1984].
Активная гиперемия может продолжаться в течение нескольких
часов и суток. Ее механизмы исследованы значительно лучше, чем
первоначальной вазоконстрикции, но тем не менее еще далеко не
полностью. Выделяют ряд механизмов, которые играют роль в раз-
витии активной гиперемии при остром воспалении. Прежде всего
это так называемый паралич симпатических вазоконстрикторов,
приводящий к снижению тонуса мелких артерий и артериол. Вы-
падение реакции микрососудов на действие агентов связано с уси-
ленным разрушением последних оксидазами, а также снижением
чувствительности адренорецепторов сосудов в условиях ацидоза и
избытка внеклеточного калия [Хитров Н. К., 1980]. Эти физико-
химические изменения могут возникать во время повреждения ткани
в связи с ишемией, обусловленной первоначальной вазоконстрик-
цией. В развитии активной вазодилатации при воспалении немало-
важную роль играет возбуждение парасимпатических нервов, вы-
деляющих ацетилхолин. Усиление парасимпатических влияний про-
исходит рефлекторно при включении разных уровней ЦНС, а также
в результате аксон-рефлекса. Ацетилхолин в отличие от норадре-
налина может длительное время оказывать вазодилатирующее дей-
ствие в очаге воспаления. Еще один механизм, который не только
способствует дилатации артериол, но также обусловливает расши-
рение капилляров и венул, связан с такими медиаторами, как
гистамин, кинины, лейкотриены и др. В том же направлении дей-
ствуют изменения ионного баланса тканей (Н - и К -гипериония).
Активная гиперемия имеет важное значение в формировании
внешних проявлений воспаления, а именно: покраснения и повы-
шения температуры ткани. Она устраняет последствия артериальной
вазоконстрикции и ацидоз; усиливает оксигенацию ткани, повышает
биологическое окисление в клетках. Усиление оксигенации очага
воспаления становится важным фактором генерации активных форм
кислорода, которые рассматривают как своеобразные медиаторы по-
вреждения и защиты организма от агентов, вызывающих воспаление.
Описанные изменения сосудистого русла наиболее выражены вокруг
зоны альтерации. В самой этой зоне возможна даже остановка
кровотка. Активная гиперемия способствует притоку гуморальных
факторов защиты организма (комплемент, пропердин, фибронектин
и др.), лейкоцитов и антител к очагу воспаления. Вместе с тем она
сопровождается усиленным вымыванием продуктов измененного об-
мена веществ и токсинов микроорганизмов при воспалении, вызван-
ном инфекцией. Вследствие повышения гидродинамического давле-
ния уже в начальном периоде процесса могут возникнуть разрывы
стенок сосудов и микрокровоизлияния.
С развитием воспаления, уже в начале фазы экссудации, тка-
невое кровообращение значительно изменяется. На смену актив-
ной, преимущественно артериальной, вазодилатации с увеличенной
41
скоростью кровотока постепенно приходит пассивная, преимуще-
ственно венозная, вазодилатация с уменьшенной скоростью кро-
вотока. Такое полнокровие по происхождению и проявлениям во
многом схоже с венозной (застойной) гиперемией. В период экс-
судации артериолы и капилляры остаются расширенными, но од-
новременно значительно расширяются венулы и мелкие вены?
Последние становятся извитыми, линейная и объемная скорость
кровотока в сосудах уменьшается, появляется толчкообразное дви-
жение крови. В сравнительно крупных сосудах плазматический
слой сужается и даже исчезает, осевой цилиндр резко увеличи-
вается и форменные элементы соприкасаются со стенками сосудов.
Во многих капиллярах может развиться стаз крови.
В возникновении пассивной гиперемии в очаге воспаления имеют
значение разнообразные внутрисосудистые и внесосудистые факторы.
К внутрисосудистым факторам, вызывающим уменьшение просвета
вен, относятся микротромбы, образующиеся в это время вследствие
изменения свойств стенок сосудов, реологии крови и ее состава,
отек и выбухание в просвет сосуда эндотелиальных клеток, сладжи
эритроцитов, выстилание стенок микрососудов лейкоцитами и др.
Из внесосудистых факторов наибольшее значение имеет отек ткани,
возникающий в результате экссудации жидкой части крови, которая,
начавшись в период активной гиперемии, довольно быстро достигает
максимума. Вследствие воспалительного отека происходит сдавление
стенок сосудов, в первую очередь тонкостенных венул и мелких
вен, лимфатических сосудов, в результате чего отток крови и лимфы
из ткани резко уменьшается.
В этот период в результате нарушения обмена веществ в мы-
шечных клетках сосудов и физико-химических отклонений меж-
клеточной среды нервные влияния на сосуды ослабевают, их тонус
снижается и возникает паретическое расслабление их мышечных
клеток. Снижению мышечного тонуса способствует распад коллаге-
новых и эластических волокон в стенке сосудов, а также их ба-
зальных мембран под влиянием соответствующих ферментов лизосом
макрофагов и ПЯЛ. На данном этапе воспаления возникают выра-
женные изменения структурной организации сосудов микроцирку-
лярного русла, что проявляется варикозным расширением капилля-
ров, особенно в венозной части, разрывами стенок микрососудов и
появлением микрокровоизлияний [Струков А. И., 1982].
Указанные сосудистые изменения в очаге воспаления способст-
вуют образованию стаза крови. Остановка кровотока в капиллярах
является результатом совместного действия всех описанных выше
механизмов. Следует, однако, заметить, что иногда она происходит
без предшествующих сосудистых реакций. Такое явление наблюда-
ется при очень интенсивном действии повреждающего фактора,
например при сильном ожоге, хотя и в этом случае в зоне, окру-
жающей обожженную ткань, иногда могут развиваться описанные
выше сосудистые реакции. Стае, завершающий предшествующие
сосудистые изменения, по происхождению является венозным. Од-
нако в дальнейшем при значительном повреждении стенок капил-
42
ляров и изменении свойств форменных элементов крови он стано-
вится истинным, или капиллярным. Продолжительность и исход
стаза различны в зависимости от степени повреждения стенок ка-
пилляров и венул. Он может сохраняться в течение нескольких
часов и даже дней, сопровождаться агрегацией форменных элементов
крови, возникновением микротромбов и микрокровоизлияний.
Стаз и пассивная гиперемия приводят к нарушениям обмена
веществ вследствие гипоксии и ацидоза в очаге воспаления. Пас-
сивная гиперемия является важным условием развития экссудации
при остром воспалении и тем самым определяет возникновение
воспалительного отека. Эти и ряд других метаболических нарушений
в паренхиматозных клетках влекут за собой снижение или даже
утрату специализированной функции. Вместе с тем пассивная ги-
перемия способствует току жидкости к центру очага воспаления и
уменьшает резорбцию из него продуктов распада собственных тка-
ней, а также инфекционных агентов. Онг! обеспечивает краевое
стояние лейкоцитов и способствует их эмиграции в ткань. Пассивная
гиперемия играет важную роль в развитии соединительной ткани
и тем самым в формировании ограничительного вала, отделяющего
очаг воспаления от окружающей нормальной ткани.
Приведенная последовательность изменений сосудистых реакций
в динамике развития острого воспаления является лишь общей
схемой, которая может значительно варьировать как по выражен-
ности, так и по продолжительности изменений каждой реакции.
Факторы, определяющие эти вариации, также весьма разнообразны:
от свойств повреждающего агента до свойств самого организма.
Играя важную роль в развитии воспалительного процесса, сосудистые
изменения, различаясь по выраженности и продолжительности, мо-
гут во многом определять особенности течения воспаления, иногда
приобретая большое значение в возникновении нарушений цент-
рального кровообращения и состояния организма в целом.
3.1.2. Проницаемость стенок микрососудов
и механизмы экссудации
Наряду с изменениями диаметра сосудов и перфузии их кровью й
лимфой в очаге воспаления происходит значительное повышение
проницаемости сосудистых стенок. Оно становится важным фактором
развития новых явлений в очаге воспаления — усиленной экссудации
жидкой части крови в ткань, эмиграции лейкоцитов и диапедеза
эритроцитов, которые составляют основу серии последующих про-
цессов, играющих важную роль в развитии воспаления. В частности,
усиленная экссудация может усугублять изменения реологических
свойств крови и микроперфузии в результате сгущения крови, из-
менения состава плазмы при выходе в ткань определенных белков,
сдавления микрососудов отечной жидкостью, нарушения ламинар-
ное™ тока крови и др. Вместе с тем эти процессы обеспечивают
43
нормальное протекание фагоцитоза, его достаточную активность,
участвуют в восстановлении поврежденной ткани.
Проницаемость биологических мембран, в том числе таких
сложных, как стейка микрососудов, является многогранной реак-
цией, отражающей разнообразные процессы с различным метабо-
лическим, структурным и регуляторным обеспечением. К этим
процессам относят фильтрацию, диффузию (пассивную, облегчен-
ную и активную) и микровезикулярный транспорт. Уже в первые
минуты действия повреждающего агента на ткань повышается
проницаемость стенок микрососудов, что вызывает усиленный вы-
ход воды с растворенными в ней веществами, в том числе белками,
во внесосудистую среду. Увеличение проницаемости наблюдается
уже во время активной гиперемии и достигает максимума при
пассивной гиперемии. Наиболее выраженное увеличение проница-
емости при остром воспалении наблюдается в веиулах. Известно,
что обмен жидкостью между сосудом и тканью определяется гид-
родинамическим давлением в сосуде и коллоидно-осмотическим
давлением крови. В физиологических условиях в артериальном
колене капилляра гидродинамическое давление превышает колло-
идно-осмотическое давление крови и жидкость переходит в ткань.
В венозном колене капилляра гидродинамическое давление стано-
вится ниже коллоидно-осмотического давления крови, и жидкость
из ткани поступает в сосуд. На участке воспаления гидродина-
мическое давление в сосудах возрастает, а коллоидно-осмотическое
давление крови снижается вследствие увеличения проницаемости
сосудистой стенки и выхода белков плазмы в ткань, а также
воздействия ряда других факторов. В итоге в артериальном колене
капилляра выход жидкости из сосуда в ткань резко возрастает,
но и в венозном колене вместо резорбции наблюдается поступление
жидкости из сосуда в ткань (рис. 3.1).
Существуют два пути прохождения веществ через стенку сосуда,
которые сочетаются, дополняя друг друга [Чернух А. М. и др., 1984;
Robbins S. L. et ial., 1984 ]. Первый путь — хГежэндотелиальный: в нор-
ме, а особенно при воспалении, компоненты крови, в том числе ее
форменные элементы, выходят из сосуда в ткань через межэндотели-
альные щели. Этому предшествует сокращение эндотелиальных кле-
ток, вследствие чего межклеточные щели расширяются, обнажая ба-
зальную мембрану. Второй путь прохождения— трансэндотелиаль-
ный: в норме, а особенно при воспалении, в эндотелиальных клетках
образуются направленные внутрь выпячивания плазмолеммы, в кото-
рых находится плазма. Таким образом образуются везикулы, которые
передвигаются на противоположную сторону клетки. Здесь они рас-
крываются, освобождая содержимое. Пузырьки с той и другой стороны
клетки могут сливаться, образуя каналы, по которым проходят раз-
личные вещества (микровезикулярный транспорт). Возможна комби-
нация двух способов прохождения веществ через стенку сосуда. В за-
висимости от характера повреждающего агента, свойств макромолекул
или частиц, а также особенностей сосуда может преобладать первый
либо второй способ транспорта (рис. 3.2).
44
Рис. 3.1. Гидростатическое давление в капилляре и онкотическое давление
плазмы крови (АБ) в нормальной (а) и воспаленной (б) тканях [по Wright
G. Р., 1958].
а — нормальное гидростатическое давление составляет около 32 мм рт. ст. в артериальной
части капилляра и 12 мм рт. ст. в венозной части; б — острое воспаление. Гидростатическое
давление увеличено вследствие артериальной гиперемии, а онкотическое давление снижено
вследствие повышения проницаемости сосудистой стенки и выхода белков. В результате
увеличивается выход жидкости из сосуда в ткань.
Время, ч
Рис. 3.2. Повышение сосудистой проницаемости при воспалении [по Robbins
S.L. et al., 1984].
А — немедленный — мимолетный — ответ; Б — отставленный ответ; В — немедленный —
продолжительный — ответ сосудистой стенки.
Морфологически при воспалении в эндотелии микрососудов пер- '
воначально обнаруживают признаки повышенной активности в виде
усиленного пинопитоза. Затем эндотелиальные клетки сокращаются,
округляются и выбухают в просвет венулы, расширяются эндоте-
лиальные щели [Струков А. И., 1982; Пауков В. С., Петров В. И.,
1983]. При нарастании воспалительного процесса усиливаются ве-
зикуляция эндотелия и выход плазмы крови и медиаторов воспа-
ления во внеклеточную среду.
Наибольшее значение в повышении шюницаемости стенок мик-
рососудов в воспалительном очаге имеют медиаторы воспаления.
В динамике воспаления, при нарастании изменений обмена веществ
в тканях и повреждении клеточных и субклеточных мембран к
действию медиаторов воспаления присоединяются эффекты других
факторов. Из них важную роль играют гидролитические ферменты
лизосом различных фагоцитов и паренхиматозных клеток, в част-
ности коллагеназа, эластаза и др. Такое же действие оказывают
ферменты микроорганизмов, высвобождающиеся при инфекционном
воспалении в ткани, например гиалуронидаза [Movat Н., 1985].
Повышение проницаемости сосудистых мембран вызывают также
недоокисленные продукты обмена веществ, накапливающиеся в очаге
воспаления вследствие гипоксии. Из них важное значение имеют
аденозин и, возможно, другие продукты аденилового происхождения,
Н и К , особенно при одновременном уменьшении уровня Caz .
Принято считать, что характер веществ, выходящих из просвета
сосуда во внесосудистую среду, зависит от степени повышения про-
ницаемости стенок. Умеренное увеличение проницаемости приводит
к выходу мелкодисперсных фракций белков, прежде всего альбу-
минов. При значительном увеличении проницаемости происходит
выход глобулинов, а при еще более выраженном — фибриногена,
который во внесосудистом русле образует сгустки фибрина. Тяжелые
повреждения стенок микрососудов в виде фибриноидного некроза
сопровождаются диапедезом эритроцитов и возникновением крово-
излияний. Однако нарушение проницаемости стенок микрососудов
при воспалении нельзя свести лишь к количественной характери-
стике ее степени. Известно, что довольно часто наблюдается изби-
рательная повышенная проницаемость для определенных веществ
или клеток. Так, через стенку сосуда усиленно выходят фибриноген
и эритроциты, в то время как альбумины и глобулины проходят в
незначительном количестве. В связи с этим выделяют различные
формы экссудата и виды воспаления. Проблема качественного, из-
бирательного, изменения проницаемости микрососудов остается
предметом дальнейших исследований.
Из механизмов экссудации большое значение имеют также ос-
мотический, онкотический и гидродинамический факторы воспали-
тельного отека. В ткани очага воспаления повышается осмотическое
давление (гиперосмия), при этом осмотическое давление крови обыч-
но не изменяется. Так, при остро развивающемся асептическом
воспалении осмотическое давление в ткани может возрастать до 19
атм (осмотическое давление нормальной тканевой жидкости 7,5—8
46
атм). Возникающий градиент осмотического давления крови и ткани
является важным фактором усиления экссудации и развития отека.
Гиперосмия тканей возникает в результате повышения в них кон-
центрации осмоактивных частиц (ионы, соли, органические соеди-
нения с низкой молярной массой). К факторам, вызывающим ги-
перосмию, относятся усиленная диссоциация солей вследствие аци-
доза тканей, повышенный распад сложных органических соединений
на менее сложные, мелкодисперсные и др.
В ткани очага воспаления повышается также и онкотическое
давление (гиперонкия), в то время как в крови онкотическое дав-
ление, как правило, снижается (гипоонкия). Гипоонкия плазмы
крови при тяжелом воспалении может быть связана с нарушением
функции печени и уменьшением образования альбуминов гепато-
цитами, увеличением синтеза менее онкоактивных глобулинов и
соответственно снижением альбумин-глобулинового коэффициента.
Возникновению гипоонкии плазмы крови способствует переход плаз-
менных белков, в первую очередь альбуминов, из сосудов в ткань
очага воспаленния при его большой распространенности. Вместе с
тем в самой ткани усиливается распад сложных макромолекул вслед-
ствие их расщепления лизосомными протеазами, в результате чего
возрастают концентрация и дисперсность белковых продуктов. По-
мимо этого, повышается гидрофильность белков под влиянием ряда
ионов, накапливающихся в очаге воспаления (СГ, Na+, Н+). Все
это в целом, а также появление во внесосудистой среде кровяных
белков приводит к гиперонкии тканей. Градиент онкотического дав-
ления ткани и плазмы крови — важный фактор усиления экссудации
и развития отека.
В динамике развития острого воспаления рассмотренные меха-
низмы экссудации и формирования воспалительного отека включа-
ются не сразу, а в определенной последовательности. В начале
воспаления очень быстро повышается проницаемость стенок микро-
сосудов и усиливается выход жидкости с умеренным содержанием
белка. Вместе с тем онкотическое и осмотическое давление ткани
в очаге воспаления временно-сохраняется неизменным. Гиперосмия
и гиперонкия ткани приобретают важное значение позднее, в период
тяжелых расстройств микроциркуляции и возникновения гипоксии.
Возрастание гидродинамического давления, по-видимому, имеет
меньшее значение в развитии воспалительного отека, чем другие
факторы.
Представленные отношения следует рассматривать лишь как на-
иболее общие закономерности. Действительно, при различных фор-
мах воспаления в зависимости от характера и интенсивности дей-
ствия повреждающего фактора, а также от локализации воспа-
лительного процесса отмечаются особенности изменения прони-
цаемости стенок сосудов. S. L. Robbins и соавт. (1984) приводят три
установленных в эксперименте типа изменения проницаемости сте-
нок микрососудов кожи, определяющихся интенсивностью повреж-
дения. Используя данные J. V. Hurley (1983) и других авторов, эти
исследователи выделяют немедленное — мимолетное, немедлен-
47
ное — продолжительное и отсроченное — пролонгированное уве-
личение проницаемости стенок микрососудов при воспалении. Пер-
вый тип обнаруживают при сравнительно слабом повреждении, на-
пример ожоге кожи морской свинки, возникающем при воздействии
водой температуры 54 °C в течение 5 с. В этом случае повышение
проницаемости возникает практически сразу, достигает максимума
в течение 5—10 мин и исчезает через 15—30 мин. Оно связано с
высвобождением гистамина, серотонина и брадикинина. Под влия-
нием гистамина происходят сокращение эндотелиальных клеток и
расширение межэндотелиальных щелей в мелких и средних венах.
Проницаемость стенок капилляров при этом практически не изме-
няется. Повышение проницаемости в такой ситуации устраняют
антигистаминными препаратами. Аналогичное увеличение проница-
емости наблюдается при местной аллергии, вызванной реагинами
(тип I по Gell-Coombs). По мнению С. Heltianu и соавт. (1982),
эндотелиальные клетки мелких и средних вен имеют больше соот-
ветствующих гистаминовых рецепторов, чем аналогичные клетки
капилляров и артериол, поэтому последние не вовлекаются в ре-
акцию при данном типе изменения проницаемости сосудистых сте-
нок.
Второй тип обнаруживают при глубоком повреждении микросо-
судов, например в случае распространенного тяжелого ожога. Резкое
повышение проницаемости стенок микрососудов при этом возникает
сразу после повреждения, нарастает в течение 1—5 ч и сохраняется
1—5 сут. В результате патогенного воздействия гибнут эндотели-
альные клетки сосудов всех уровней микроциркуляции, включая
венулы, артериолы и капилляры. Процесс завершается либо репа-
рацией сосудов, либо тяжелым тромбозом. Полагают, что при этом
происходит прямое повреждение микроциркуляторных сосудов фак-
тором, вызывающим воспаление, с последующей плазмореей.
Третий тип изменений сосудистой проницаемости характеризу-
ется сравнительно продолжительным латентным периодом после
повреждения с последующим быстрым увеличением проницаемости,
продолжающимся несколько часов или дней. Такой тип ответа со-
судов наиболее часто встречается в патологии: при легком и среднем
по тяжести термическом повреждении, ионизирующем и ультрафи-
олетовом облучении, действии бактериальных токсинов, аллергии
замедленного типа (тип IV по Gell-Coombs) и др. В этих случаях
характерного сокращения и округления эндотелиальных клеток не
происходит, а нарушаются межэндотелиальные сцепления в капил-
лярах и венулах. Предполагают, что увеличение проницаемости
при этом обусловлено прямым действием патогенных факторов, но
в полной мере механизмы расстройств не изучены.
Наряду с указанными типами повышения сосудистой проница-
емости, вызывающими развитие воспалительного отека, возможны
и другие варианты. В динамике воспаления не исключено также
сочетание рассмотренных выше типов изменения проницаемости
стенок сосудов.
Усиленная экссудация вызывает отек, боль — вследствие сдав-
48
ления нервных окончаний и проводников, нарушения функции —
в результате увеличения диффузионного расстояния от капилляров
до паренхиматозных клеток, а также их сдавления. Она может
усугублять расстройства микроциркуляции, вызывая чрезмерную
гемоконцентрацию, сладжирование эритроцитов и способствуя об-
разованию тромбов. Вместе с тем увеличенная экссудация является,
вероятно, одним из наиболее древних механизмов ослабления дей-
ствия на организм агентов, вызывающих воспаление.
3.1.3. Эмиграция форменных элементов крови
из сосудистого русла
Сосудистые изменения в очаге воспаления связаны с транформацией
тока жидкой части крови и поведения ее форменных элементов.
По L. Flurey (1970), в воспалительном очаге обнаруживают шесть
фаз изменения микроциркуляции и поведения клеток крови. Уже
в начале развития пассивной гиперемии в венулах наблюдается
расширение осевого цилиндра, но клетки крови временно сохраняют
свое положение в центре сосуда (фаза I). Далее по мере замедления
кровотока форменные элементы в осевом цилиндре перераспреде-
ляются, лейкоциты выходят на границу осевого цилиндра и плаз-
матического слоя, а в дальнейшем подходят к стенке сосуда и
начинают прикрепляться к ней (фаза II). При еще большем замед-
лении кровотока адгезия лейкоцитов нарастает и клетки образуют
муфты вдоль стенок сосудов, нарушая ламинарность кровотока (фа-
за III). Постепенно лейкоциты начинают проходить через стенку
сосуда и эмигрировать в ткань (фаза IV). Одновременно происходит
выраженное набухание эндотелия, еще более нарушается ток крови
в микрососудах, с помощью того же механизма эмиграции формен-
ных элементов из сосудов выходят эритроциты, что свидетельствует
о грубых нарушениях проницаемости стенок венул (фаза V). По
мере развития процесса на фоне толчкообразного движения крови
или стаза разобщаются эндотелиальные клетки, нарушается целость
стенок посткапилляров и венул, возникают тяжелые биохимические
изменения, крови и появляются микрокровоизлияния (фаза VI).
В период краевого стояния привлекают внимание два основных
явления — выход лейкоцитов из осевого цилиндра к его краю и
приклеивание (адгезия) их к стенке сосуда. Еще А. Шкляревский
(1868) в модельных экспериментах показал, что частицы с низким
удельным весом, какими являются лейкоциты, в случае замедления
тока жидкости относятся к стенке сосуда, а частицы с более высоким
удельным весом (эритроциты) продолжают движение в центре со-
суда. Однако известно, что повышение удельного веса лейкоцитов
за счет поглощения ими введенной в кровоток животных киновари
не предотвращает выход лейкоцитов в плазматический слой и их
краевое стояние. S. L. Robbins и соавт. (1984) рассматривают мар-
гинацию лейкоцитов как результат другого процесса: в застойном
кровотоке эритроциты объединяются в «монетные столбики», кото-
49
рые занимают всю осевую часть сосуда, и лейкоциты оказываются
в плазматическом слое.
Более полно раскрыты механизмы прохождения и прикрепления
лейкоцитов к стенке сосуда в области развивающегося воспаления.
Для осуществления краевого стояния необходимы два условия: по-
вышение адгезивных свойств эндотелиальных клеток и активиро-
ванное состояние лейкоцита, направляющегося в определенное место
стенки сосуда. Важное значение имеет устранение отрицательного
заряда эндотелиальной клетки и лейкоцита, в нормальных условиях
предупреждающего адгезию. Отрицательный заряд мембраны эндо-
телиальной клетки уменьшается вследствие накопления в очаге
воспаления Н+ и К+. Определенное значение в этом имеют также
катионные белки, выделяемые активированными лейкоцитами. Дру-
гим механизмом адгезии считают действие двухвалентных катионов
плазмы — Са , Мп2+ и Mg +, которые снижают отрицательный
заряд эндотелиальной клетки и лейкоцита и, помимо этого, акти-
вируют его ферменты, увеличивающие адгезивность. Все же наи-
более важным представляется значение естественных факторов за-
щиты (комплемента, фибронектина, иммуноглобулинов) и медиа-
торов воспаления (гистамин, лейкотриены) в инициации адгезии
лейкоцитов к стенке сосуда при воспалении. Комплемент (С5а) и
IgG (Fc-фрагмент) обладают мощными хемоаттрактантными и ад-
гезивными свойствами в отношении лейкоцитов в очаге воспаления.
Связывание этих соединений с соответствующими рецепторами на
мембране грануло- и агранулоцитов определяет их активацию и
направленную хемоаттракцию к эндотелиальным клеткам сосудов.
Фибронектин имеет ряд активных центров (доменов), каждый из
которых связывается с соответствующим лигандом ~ коллагеном,
фибрином, некоторыми микроорганизмами и, что особенно важно,
со специализированными рецепторами лейкоцитов. Фибронектин
находится не только в плазме, но и на коллагеновых волокнах, и
на мембране эндотелиальных клеток, осуществляя направленную
аттракцию ПЯЛ и мононуклеаров крови. Эффективность хемоатт-
рактантного и адгезивного влияния фибронектина наиболее высока,
если наряду с ним на соответствующих рецепторах цитолеммы
лейкоцитов имеются С 1,3-фрагменты комплемента и Fc-фрагменты
IgG. Вероятно, в данном случае активность лейкоцитов возрастает
в результате межрецепторного взаимодействия. Важная роль меди-
аторов воспаления в процессах миграции лейкоцитов подробно рас-
смотрена ниже. Полученные в настоящее время данные о роли
многочисленных биохимических факторов в этом процессе полно-
стью подтверждают предположения И. И. Мечникова (1892), выска-
занные им в прошлом веке. Он полагал, что лейкоцит не просто
привлекается в очаг воспаления внешними по отношению к нему
силами, а наоборот, его роль активна. Фагоциты, обладающие чув-
ствительностью, воспринимают сигналы из окружающей среды и
реагируют на них изменением своего состояния и движением в
направлении этих сигналов.
При прохождении лейкоцита через стенку микрососуда наблю-
50
Рис. 3.3. Динамика эмиграции лейкоцитов в очаге воспаления. Краевое
стояние лейкоцита и его прохождение через стенку сосуда. *5800.
даются выраженные изменения всех взаимодействующих при этом
компонентов: лейкоцита, эндотелиальной клетки, межэндотелиаль-
ных контактов, базальной мембраны и периваскулярной ткани. Этот
сложный процесс отражает также взаимосвязь и взаимодействие
различных клеток. После адгезии к цитомембране эндотелиальной
клетки лейкоцит перемещается по ее поверхности к межэндотели-
альной щели, которая значительно расширена вследствие сокраще-
ния эндотелиальных клеток (рис. 3.3). Лейкоцит образует ложно-
ножку, которая передвигается через межэндотелиальную щель в
подэндотелиальное пространство. Предполагают, что реакция эндо-
телиоцитов и расширение межэндотелиальной щели связаны с фер-
ментативной активностью лейкоцита. В ложноножку перемещается
все содержимое лейкоцита, и он размещается между эндотелиаль-
ными клетками и базальной мембраной микрососуда. Затем лейкоцит
проходит через базальную мембрану стенки сосуда и оказывается
за его пределами. Перемещение лейкоцита через стенку сосуда, так
же как его движение в ткани, представляет собой сложный процесс,
51
важную роль в котором играют коллоидно-динамические изменения
в его цитоплазме и содержащиеся в ней сократительные белки.
Внутрисосудистые перемещения лейкоцитов, включая краевое сто-
яние, занимают несколько часов, в то время как через стенку сосуда
они проходят сравнительно быстро — за 30 мин — 1ч. Вместе с
тем эти временные интервалы весьма относительны и зависят от
многих факторов, в первую очередь от стадии развития воспаления,
типа сосуда и вида эмигрирующих клеток. Следует отметить, что
первичная или вторичная недостаточность фагоцитоза может нега-
тивно отразиться не только на стадии приближения, поглощения
или внутриклеточного переваривания, но и на эффективности эмиг-
рации. Это наблюдается, например, при синдроме «ленивых лейко-
цитов», который характеризуется нейтропенией, снижением их спон-
танной активности и ослаблением реакции на хемотаксические сти-
мулы. Сходные явления отмечаются при некоторых лейкозах,
недостаточности системы комплемента и других состояниях.
В большинстве случаев острого воспаления первыми эмигрируют
нейтрофилы, доминирующее положение в эмиграции они занимают
в первые 6—24 ч. Через 24—48 ч наибольшее значение в эмиграции
приобретают моноциты. Одновременно или несколько позднее эмиг-
рируют лимфоциты [Robbins S. L. et al., 1984]. Считают, что одним
из наиболее важных механизмов, определяющих такую последова-
тельность эмиграции, является высвобождение специфических для
каждого вида лейкоцитов хемотаксических факторов. В частности,
нейтрофилы в< процессе активизации высвобождают хемотаксические
факторы для моноцитов [Robbins S. L. et al., 1984]. Наряду с этим
следует отметить, что рассмотренный порядок эмиграции весьма
вариабелен. Известно много состояний, при которых первоначально
в эмиграции доминируют лимфоциты (вирусные инфекции, тубер-
кулезная инфекция) или эозинофилы (аллергические реакции).
3.2. ГУМОРАЛЬНЫЕ ГОМЕОСТАТИЧЕСКИЕ СИСТЕМЫ
ПРИ ВОСПАЛЕНИИ
3.2.1. Активация тромбоцитарного звена гемостаза
Повреждение (альтерация) тканей и клеток в первой фазе воспа-
ления ведет к появлению клеточных и плазменных медиаторов
воспалительного процесса — биологически активных веществ, ока-
зывающих воздействие на его пато- и морфогенез. Эти вещества
возникают при активации защитных протеолитических систем крови:
свертывающей, фибринолитической, калликреин-кининовой и ком-
плементарной. Активация свертывания происходит на поверхности
эндотелия, поврежденного либо непосредственно инфицирующим
агентом (например, эндотоксином), либо клеточными медиаторами
(цитокинами), освобождаемыми этими агентами. Эндотоксин, ци-
токины — интерлейкин-1 (ИЛ-1) и фактор некроза опухоли
(ФИО) — стимулируют синтез и экспрессию на поверхности эндо-
телия, моноцитов, макрофагов и тканевого фактора (ТФ), который
52
активирует механизм свертывания крови. Таким образом, медиаторы
иммунного ответа, в том числе провоспалительные цитокины, сти-
мулируют свертывание крови. Первым этапом свертывания является
активация тромбоцитов и других клеток крови, экспрессия на по-
верхности клеток рецепторов (гликопротеинов ПЬ и Ша) адгезивных
белков: фактора Виллебранда (ФВ), фибриногена, тромбоспондина,
фибронектина и др. Происходят адгезия и агрегация тромбоцитов,
организация на их поверхности и поверхности активированного
эндотелия фермент-кофакторных комплексов, которые ускоряют
превращение проферментов системы свертывания крови в ферменты
и приводят к образованию тромбина. Тромбин «переводит» фибри-
ноген крови в фибрин, который откладывается в очаге воспаления.
Провоспалительное действие тромбина проявляется в стимуляции
адгезии нейтрофилов к эндотелию, продукции эндотелием фактора,
активирующего тромбоциты (ФАТ), — мощного медиатора воспа-
ления, активирующего агрегацию, хемотаксис и связывание нейт-
рофилов с эндотелием, продукцию эндотелием ИЛ-1. Тромбин и
ИЛ-1 оказывают сходное действие на эндотелий, стимулируя синтез
простагландинов, образование ФАТ, активатора плазминогена, по-
вышая адгезию лейкоцитов. Существует положительная обратная
связь между тромбином и ИЛ-1, так как ИЛ-1 — потенциальный
индуктор синтеза эндотелием прокоагулянта — ТФ, а образующийся
затем в процессе свертывания крови тромбин индуцирует продукцию
ИЛ-1 этими клетками.
Наряду с прокоагулянтным и провоспалительным тромбин ока-
зывает антикоагулянтное действие, активируя противосвертываю-
щие механизмы, препятствующие тромбообразованию. При воспа-
лении эти механизмы нарушаются. Так, плазменные ингибиторы
активных факторов свертывания подвергаются протеолизу и окис-
лению агентами, секретируемыми активированными лейкоцитами
(токсические метаболиты кислорода, лизосомальные протеиназы).
Преобладание в комплексе реакций, возникающих при воспалении,
процессов свертывания или фибринолиза реализуется в развитии
микротромбоза либо геморрагии. Чаще всего возникает синдром
диссеминированного внутрисосудистого свертывания (ДВС-синд-
ром) — комплекс тромбогеморрагических нарушений, характери-
зующийся образованием диссеминированных сгустков крови в мик-
роциркуляторном русЛе в сочетании с несвертываемостью крови
вследствие активации и потребления факторов свертывания, тром-
боцитопении, тромбоцитопатии и сопутствующей активации фиб-
ринолитической системы. Таким образом, повреждение эндотелия
и тканей при воспалении вызывает дисфункцию противосверты-
вающих и гемостатических механизмов, ведущую к нарушению
микроциркуляции и геморрагическому диатезу, а также к вклю-
чению механизмов активации протеолитических Систем.
Обычно эндотелий служит не тромбогенным барьером между
циркулирующей кровью и стенкой сосуда, осуществляя активный
транспорт метаболитов между кровью и периваскулярными тканями.
Кроме того, в эндотелии синтезируются и разрушаются метаболиты,
53
ВНЕШНЯЯ
СИСТЕМА
СВЕРТЫВАНИЯ
Альтернативный
зависимый от
эндотелия путь
ВНУТРЕННЯЯ
СИСТЕМА
СВЕРТЫВАНИЯ
Калликреин -е----Прекалликреин 1ВМК|
Xlla-
.Са’*
Фосфо-
липиды
ГЕПАРИН
I
♦
Комплексы
с белками
I 4
♦
Претромбин
Антитромбин
Активатор
\ плазминогена
ПРОТИВОСВЕРТЫВАЮЩАЯ
СИСТЕМА
Контакт
к\х
Стенка 4
сосудач
ТРОМБОЦИТ
Ca-
ФИБРИНОГЕН
ПЛАЗМИНОГЕН —
Х1а^1__Х|И
Активатор
плазминогена
!Ха I*-Гсросфо- | VI
|липиды L~["
__VI] ________—----------1
I с поверхностью
ТРОМБИН
Протеин
Са‘
ХШа-*-----XIII
ФИБРИН
нерастворимый
"(фосфо-1 У111а:к|^~ j----VIIIrK
ЛМПМПк1 1 . 1 i'
Протромбиназа
V
ФИБРИН
мономер
♦
ФИБРИН
полимер
Тромбов-
модулин4
2* L ♦
фосфрт Протвин
-^ПЛАЗМИН
IX - —
Схема 3.1. Взаимодействия основных компонентов гемостаза и реали-
зация альтернативного пути свертывания крови при повреждении эндотелия.
Сплошные линии — действие, прерывистые — превращение, стрелка — ингибирование, S —
протеин, S — кофактор протеина Са, ВМК — высокомолекулярный кининоген, VIII: К —
фактор, VIII коагулянт, ФВ — фактор Виллебранда.
I которые регулируют взаимодействие компонентов крови со стенкой
| сосуда. К ним относятся прокоагулянты — ТФ, фактор V сверты-
вания крови, ФАТ; вазоактивные пептиды — эндотелины, или
вазоконстрикторы длительного действия; эндотелиальный фактор
роста; адгезивные белки, которые отвечают за контакт и распла-
стывание тромбоцитов и других клеток на стенке сосуда: ФВ, фиб-
ронектин, тромбоспондин, ламинин.
При повреждении и активации эндотелиальных клеток инфици-
рующим агентом или медиатором воспаления их прокоагулянтная
активность проявляется в стимуляции синтеза и экспрессии на
поверхности эндотелия ТФ — инициатора альтернативного, зави-
сящего от эндотелия, пути свертывания крови.
ТФ катализирует активацию фактором VII фактора IX, связан-
ного со стенкой сосуда (схема 3.1). Образующийся фактор 1Ха
(активный) превращает фактор X (связанный с эндотелием) в Ха,
который превращает протромбин в тромбин [Stern D. et al., 1985].
Таблица 3.1
Взаимодействие тромбина с рецепторами, клеток, субстратами и ингибиторами
Лиганды Константы связывания Реакция, продукты реакции или агенты, вы- свобождаемые из клеток
Рецепторы JQ ~ 10-9 Стимуляция секреции: ФВ, тромбоспон- дина, фибронектина, ТФ, простациклина, тканевого активатора плазминогена или его ингибитора, эцдотелинов, ФРЭ
Тромбомодулин эндотелия Ка ~ 10~9 Активация системы протеина С; инакти- вация свертывающей, прокоагулянтной и тромбоцитоактивирующей активности тром- бина
Рецепторы тромбоцитов Kj ~ 10-9 Стимуляция секреции: ФВ, фибриноге- на, тромбоспондина, фибронектина, фак- тора V, тромбоцитарного фактора 4, В- тромбоглобулина, ФАТ, АДФ, серотонина, тромбоксана Аг и др.
Рецепторы моноцитов (макрофагов) Ка ~ 10“ 9 Стимуляция хемотаксиса, агрегации, про- лиферации, синтеза ДНК макрофагоподоб- ных клеток
Рецепторы фиб- робластов Ка ~ 10-9 Стимуляция синтеза ДНК, пролифера- ции
Хеморецепторы ПСС Kj ~ 10-9 Освобождение гепарина и тканевого ак- тиватора плазминогена в гуморальном акте ПСС
Факторы V и VIII Кт ~ 10~8 Активация в факторы Va и VIIIa-кофак- торы образования тромбина и фактора Ха
Антитромбин III (+гепарин) /Q - 10~7 Инактивация тромбина и других серино- вых протеиназ
Фибриноген Кт ~ 10~б Отщепление фибринопептидов и образо- вание фибрина
Фактор XIII Кт ~ Ю-5 Активация в фактор XUIa, стабилизиру- ющий фибрин
55
По классическому внутреннему механизму свертывания крови фак-
тор IX активируется в плазме фактором Х1а контактной фазы
тромбиногенеза. Альтернативный путь — тот эффективный меха-
низм, который ведет к появлению небольших количеств тромбина,
еще недостаточных для свертывания фибриногена, но специфически
активирующих клетки эндотелия, тромбоциты, лейкоциты (табл.
3.1). Стимуляция синтеза и экспрессии ТФ на поверхности эндотелия
лежит в основе тромботических реакций в очаге воспаления. Наряду
с этими процессами на поверхности поврежденного эндотелия про-
исходит активация контактной фазы свертывания крови.
Наряду с прокоагулянтами, вазоконстрикторами и адгезивными
белками эндотелий синтезирует вещества, обеспечивающие его не-
тромбогенность. Механизмы тромборезистентности эндотелия вклю-
чают синтез и освобождение простациклина (ПГ1г) — мощного
ингибитора агрегации тромбоцитов, и фактора релаксации, произ-
водимого эндотелием (ФРЭ), — синергиста ППг; образование 13-
гидроксиоктадекадиеновой кислоты (13-НОДЭ) с антиадгезивными
свойствами; синтез и секрецию активаторов плазминогена тканевого
и урокиназного типов; синтез тромбомодулина, который, связывая
тромбин, лишает его свертывающей активности, но катализирует
способность фермента активировать антикоагулянтную систему про-
теина С; синтез протеина S, кофактора протеина С; синтез и экс-
прессию на поверхности эндотелия антикоагулянтных протеоглика-
нов — гепаран-сульфата [Buchanan М. R., 1988; Libby Р., 1987].
При повреждении сосудов тканей происходят изменения мемб-
ранной структуры эндотелия, обнажение субэндотелия, экспрессия
адгезивных белков и рецепторов на поверхности клеток, повышение
прокоагулянтной активности ТФ и снижение антикоагулянтной и
антиагрегационной активности тромбомодулина, простациклина, по-
тенциальной фибринолитической активности тканевого активатора
плазминогена. Реактивность субэндотелия к адгезии клеток опре-
деляется количеством и функциями входящих в него компонентов.
Различают три типа белков, связывающих клетки: I тип — струк-
турные молекулы внеклеточного матрикса, такие, как коллагены,
которые непосредственно взаимодействуют с плазматической мем-
браной клеток через специфические участки связывания на фиб-
риллах; II тип — растворимые связывающие белки, которые содер-
жат особые участки для связывания клеток и для связывания суб-
страта (ФВ, фибриноген, тромбоспондин); III тип — комбинированный.
К нему относится фибронектин, который выполняет функцию струк-
турного матрикса и опосредует серию реакций поперечного связы-
вания клеток с коллагенами и фибрином [Yamada К. et al., 1985].
Фибронектин прикрепляет макрофаги к коллагену и инородным
веществам при фагоцитозе, вовлекается в различные фазы воспа-
ления и сопряженные гомеостатические реакции. После расщепления
фибронектина его фрагменты служат хемоаттрактантами для мак-
рофагов и фибробластов. Все адгезивные белки участвуют в регу-
ляции функций клеток в очаге воспаления.
Начальное прикрепление и распластывание тромбоцитов на суб-
56
Рис. 3.4. Взаимодействие фактора Виллебранда (ФВ), фибриногена (ФБ),
тромбоспондина (ТС) и фибронектина с гликопротеидными комплексами
(ГП Ib/IX и ГП ПЬ/Ша) поверхности тромбоцитов.
эндотелии регулирует синтезируемый клетками эндотелия белок
ФВ, служащий кофактором адгезии тромбоцитов к субэндотелию
артерий и сосудов микроциркуляции, а также переносчиком фактора
VIII свертывания крови. При воспалении освобождение ФВ из ак-
тивированных клеток нарушается: освобождаемый моноцитами ме-
диатор воспаления ИЛ-1 снижает уровень мРНК, кодирующий ФВ,
и, соответственно, уровень этого белка во всех компартментах.
Функции ФВ обусловлены существованием в его структуре не-
скольких доменов, отвечающих за связывание фактора с белками
и рецепторами клеток, ФВ — типичный пример модулярных гли-
копротеидов (ГП), характеризующихся тем, что они имеют функ-
57
циональные единицы, соответствующие структурным доменам, от-
носительно устойчивым к протеиназам, но соединенным участками,
чувствительными к протеолизу. В структуре ФВ найдены домены,
определяющие способность белка связываться с фактором VIII свер-
тывания крови, клеточными рецепторами-гликопротеидами (ГП) —
lb и ПЬ/Ша, гепарином, коллагеном, клетками [Ginna J. Р. et al.,
1987]. Домены состоят из нескольких пептидных блоков с гомоло-
гичной последовательностью. В структуре домена, связывающего
ФВ с рецепторным комплексом гликопротеида ПЬ/Ша, обнаружен
уникальный трипептид, состоящий из остатков аргинина (Apr), гли-
цина (Гли) и аспарагиновой кислоты (Асп), идентичный «узнаю-
щему» гликопротеид ПЬ/Ша реактивному центру в структуре других
адгезивных белков — фибриногена, фибронектина и тромбоспондина.
Рецептор ФВ на поверхности тромбоцитов — ГП 1b — гетеро-
димер, который образует на мембране клетки комплексы с ГП IX,
а также актинсвязывающим белком (АСБ) и филаментами актина
цитоскелета тромбоцита. Благодаря доменной структуре ФВ способен
связывать коллаген субэндотелия и рецептор ГП 1b тромбоцитов,
выполняя функции «мостика» между клетками и стенкой сосуда на
ранней, контактной, стадии адгезии (рис. 3.4). За этой стадией
следует вторая — распластывание тромбоцитов на субэндотелии,
что обусловлено изменением цитоскелета клеток. Эта стадия обес-
печивается взаимодействием ФВ с комплексом ГП ПЬ/Ша, орга-
низуемым на поверхности клеток, активированных тромбином (или
АДФ). Активация тромбоцитов индуцируется связыванием агониста
(трЬмбина) с рецептором ГП 1Ь на поверхности клетки и осущест-
вляется в результате генерации внутриклеточных сигналов в цикле
реакций, опосредованных гидролизом фосфоинозитидов с образова-
нием вторичных мессенджеров — диацилглицерина, активирующего
протеинкиназу С, и инозитол-1,4,5-трифосфата, мобилизирующего
внутриклеточный кальций. Происходят быстрая полимеризация и
реорганизация актина, как мембранного скелета, так и цитоплазма-
тического, образование филоподий, централизация гранул, которая
обеспечивается взаимодействием актина с фосфорилированным ми-
озином.
При активаций клеток активируются кальцийзависимые про-
теазы, происходят кластерирование комплексов ГП ПЬ/Ша, пе-
рераспределение их в филоподии и экспрессия на мембране, на-
рушение связывания ГП 1Ь с мембранным скелетом, потеря спо-
собности ГП 1Ь связывать лиганды (ФВ, тромбин) и в конце
/ концов разрушение мембранного скелета и распластывание тром-
боцитов [Fox J. Е. В., 1987]. Структурные изменения тесно связаны
с реакцией высвобождения содержимого «-гранул, которые секре-
тируют ФВ, фибриноген, тромбоспондин, фактор V свертывания
крови, а также тромбоцитарный фактор роста (ТФР) — хемоат-
трактант для эозинофилов и индуктор миграции и пролиферации
гладкомышечных клеток из медии в интиму; тромбоцитарный
фактор 4 (ТФ4) и /?-тромбоглобулин с провоспалительными свой-
, ствами. Из плотных гранул секретируются АДФ и серотонин.
58
Арахидоновая кислота под влиянием циклооксигеназ превращается
в тромбоксан Аг — мощный индуктор необратимой агрегации, а
липоксигеназ — в 12-гидроксиейкозатетраеновую кислоту (12-
НЕТЕ) — хемоаттрактант нейтрофилов, включающихся в микро-
тромбы в очаге воспаления [Marcus A. J., 1988 ]. Кроме того, осво-
бождается ФАТ — индуктор необратимой агрегации и медиатор
воспалительных процессов и аллергических реакций (см. ниже).
Таким образом, для связывания ФВ с тромбоцитами существуют
два механизма: один опосредованный ГП 1Ь и другой — ГП ПЬ/Ша.
Особенность последнего механизма в том, что в ответ на действие
индуктора мобилизуется Са , ингибируется цАМФ и из гранул
секретируется АДФ. Зависимое от АДФ и Са2+ функционирование
рецепторного комплекса ГП ПЬ/Ша характерно для связывания
другого адгезивного белка — фибриногена.
Фибриноген — крупный модулярный димер, который состоит из
трех пар неидентичных полипептидных цепей, соединенных на ами-
ноконцевом участке в центральный домен Е. Этот домен связан с
двумя концевыми D-доменами гибкими участками, образованными
скрученными вместе Аа-, В/3- и у-цепями [Doolittle R. F., 1984].
Превращение фибриногена в фибрин завершает процесс свертывания
крови и требует значительно больших количеств тромбина, чем
активация тромбоцитов (см. табл. 3.2). Очень низкие концентрации
тромбина (10 нМ), которые образуются за несколько секунд эндо-
телийзависимым механизмом, взаимодействуют с рецептором на
тромбоците (ГП 1Ь) и индуцируют экспрессию на поверхности клеток
рецептора фибриногена — комплекса ГП ПЬ/Ша. Экспрессия ком-
плекса ингибируется агентами, которые увеличивают концентрацию
цАМФ в клетке и подавляют метаболизм арахидоновой кислоты,
ведущей к синтезу тромбоксана Аг. Фибриноген плазмы и секре-
тируемый а-гранулами тромбоцитов взаимодействует с комплексом
ГП ПЬ/Ша определенными участками в доменах D и Е. В Аа-цепи
локализован уникальный пептид Арг-Гли-Асп, который отвечает за
связывание фибриногена и других адгезивных белков с рецептором.
Фибриноген выполняет функции зависимого от кальция мостика в
связывании активированных тромбоцитов, опосредуя их первичную
обратимую агрегацию (см. рис. 3.4).
За этой фазой, ведущей к образованию микроагрегатов и обра-
тимых агрегатов, следует фаза необратимой агрегации и образования
первичного тромбоцитарного тромба. Эта стадия опосредуется вы-
свобождением тромбоспондина из а-гранул. Тромбоспондин — мо-
дулярный ГП, состоящий из трех мономеров [Nachman R. L. et al.,
1987]. В тромбоспондине идентифицированы структурные домены,
отвечающие за связывание белка с фибриногеном, коллагеном ти-
па V, фибронектином, плазминогеном, гепарином, а также домены,
связывающие кальций и мембранные ГП. В отличие от других
адгезивных белков тромбоспондин связывается с небольшим коли-
чеством участков на неактивированных тромбоцитах и служит эн-
догенным лектином тромбоцитов. Тромбоспондин стабилизирует свя-
зывание фибриногена с клеткой, усиливает межклеточные взаимо-
59
действия и превращает обратимые микро- и макроагрегаты в необ-
ратимые. В тромбоцитах, моноцитах и клетках эндотелия обнаружен
ГП IV, который связывает тромбоспондин. Комплекс фибриногена
с ГП ПЬ/Ша соседних тромбоцитов превращается в стабильный
вследствие прикрепления тромбоспондина к фибриногену на одном
участке и к ГП IV на другом.
Тромбоспондин способен ассоциироваться с волокнами фибрина
и, подобно фибриногену, полимеризоваться. Полимеры тромбоспон-
дина стабилизируются фактором XIII свертывания крови в присут-
ствии тромбина, с которым он также образует комплекс. Тромбо-
спондин специфически связывается с моноцитами, которые могут
(как и макрофаги) его синтезировать и секретировать, и служит
молекулярным мостиком между активированными тромбоцитами и
моноцитами на участках повреждения сосуда и тромбообразования
при воспалении. При заживлении раны и в очаге воспаления тром-
боспондин, стабилизированный макрофагальным фактором XIII, об-
наруживается как часть внеклеточного матрикса вокруг макрофагов.
Поскольку тромбоспондин обнаружен в клетках эндотелия, фибро-
бластах, гладкомышечных клетках, моноцитах и др., он функцио-
нирует как один из основных белков внеклеточного матрикса, опос-
редующий взаимодействие типа клетка — субстрат [Tuszynski G.,
1987].
Стимуляция тромбоцитов тромбином вызывает высвобождение и
связывание на поверхности клеток фибронектина наряду с тром-
боспондином, фибриногеном и ФВ. Их совместное действие приводит
к увеличению отложений фибрина на стенке сосуда, способствует
организации и локализации тромба. Фибронектин — основной ком-
понент соединительнотканного матрикса и тканевых жидкостей с
множеством функций, опосредованных мультидоменной структурой.
Фибронектин — модулярный ГП, выполняющий роль и структурного
матрикса, и белка, обеспечивающего прикрепление клеток к фиб-
риллам матрикса. Молекула фибронектина — димер или полимер,
состоящий из нескольких схожих между собой субъединиц. Каждая
субъединица содержит ряд функциональных доменов, состоящих из
повторяющихся пептидных блоков трех типов (I, II, III) с гомоло-
гичной последовательностью. Пять блоков типа I образуют амино-
концевой домен, связывающий фибрин, а последовательность типа
III служит основой домена, обеспечивающего связывание фибронек-
тина с клеткой [Yamada К. et al., 1985].
В разных клетках синтезируются разные варианты фибронектина,
что имеет функциональный смысл. Так, фибронектин плазмы крови,
синтезированный гепатоцитами, не содержит определенной после-
довательности типа III и свободно циркулирует в крови. В фибро-
нектине, синтезируемом фибробластами, эта последовательность
всегда присутствует, и он легко полимеризуется с образованием
нерастворимого фибриллярного матрикса. На этом матриксе адге-
зируют клетки через особый связывающий домен, в структуре ко-
торого найден трипептид Арг-Гли-Асп, используемый рядом белков
для прикрепления клеток. Различные типы клеток (эпителиальные,
60
фибробласты, хондроциты, миобласты и др.) синтезируют фибро-
нектин, особенно после стимуляции, как, например, эндотелиальные
клетки на участке повреждения сосуда, фибронектин связывается
с мембраной активированных клеток специфически, с большим ко-
личеством мест связывания, что позволяет считать его одним из
основных компонентов клеточной поверхности. Рецепторы фибро-
нектина на фибробластах не идентифицированы, но ими могут быть
гликопротеиды клеточной мембраны 140 КДа или определенные ган-
глиозиды [Yamada К., 1985].
Фибронектин связывается с рецепторами поверхности клетки
и актиновыми филаментами внутри нее. Трансмембранная связь
с актином осуществляется через комплекс 140 КДа, взаимодейст-
вующий с фибронектином при адгезии клеток [Hynes R. О., 1985].
Участки специфического связывания фибронектина, обнаруженные
на тромбоцитах после их активации, идентифицированы как ком-
плекс ГП ПЬ/Ша, который отличается от аналогичных белков
фибробластов. Различие между гликопротеидами тромбоцитов и
фибробластов отражает различие в способе адгезии. Для тромбо-
образования необходимо прочное прикрепление тромбоцитов к мат-
риксу кровяного сгустка, нарушаемое при его ретракции. Прочное
связывание обеспечивается кластерированием рецепторов, концен-
трацией их на участке взаимодействия пучка микрофиламентов
клетки с фибронектином. Фибробласты же способны передвигаться
по матриксу фибронектина, и прочность их адгезии не должна
препятствовать миграции. Структурное обеспечение этих требова-
ний достигается тем, что рецепторы фибронектина на мигрирую-
щих клетках расположены диффузно в мембране, мобильны и не
все связывают фибронектин [Duband J. L. et al., 1986]. На участке
повреждения сосуда фибронектин связывает не только клетки, но
также коллаген и фибрин. Фибронектин, ковалентно связанный с
фибрином, служит аттрактантом для фибробластов, мигрирующих
к участку повреждения и заполняющих рану в процессе ее за-
живления.
Фибронектин важен для фибринолиза, так как, усиливая фа-
гоцитоз, ускоряет удаление фибрин-мономеров. Фрагменты фиб-
ронектина, связывающие гепарин, которые могут образоваться в
результате протеолиза его тромбином, плазмином, а также ка-
тепсином G или лейкоцитарной эластазой, появляющимися при
воспалительных реакциях, участвуют в регуляции ангиогенеза.
Протеолиз фибронектина при ДВС-синдроме или фибринолизе ве-
дет к образованию фрагментов, стимулирующих освобождение ней-
трофилами эластазы, и Повреждению эндотелия. Секрецию нейт-
рофилами эластазы индуцирует реактивный тетрапептид фибро-
нектина — Арг-Гли-Асп-Сер, связывающий клетки [Gustafson Е. J.,
Colman R.W., 1987].
Таким образом, адгезивные белки обеспечивают адгезию тром-
боцитов к субэндотелию, агрегацию тромбоцитов и лейкоцитов и,
кроме того, могут быть медиаторами воспаления, стимулируя ней-
трофилы и направленное движение клеток к очагу воспаления.
61
3.2.2. Активация свертывания крови
и тромбообразования
Адаптивные изменения эндотелия под влиянием воспалительных
стимулов реализуются в развитии внутри- или внесосудистого свер-
тывания фибриногена, тесно связанного с формированием тромбо-
цитарного тромба. Эндотелиальные клетки синтезируют и освобож-
дают активаторы и ингибиторы свертывания и фибринолиза, взаи-
модействуют с лейкоцитами и тромбоцитами, которые в свою очередь
влияют на свертывание и фибринолиз. На поверхности активиро-
ванных тромбоцитов, лейкоцитов и эндотелия экспрессируются и
адгезируют факторы свертывания, формируются комплексы акти-
ватор — фермент — субстрат, провоцирующие образование фибри-
на, который ограничивает очаг воспаления.
Клетки эндотелия индуцируют к экспрессии прокоагулянтов ин-
фицирующие агенты (эндотоксин, вирусы), иммунные комплексы
или освобождаемые клетками медиаторы воспаления, среди которых
цитокины — ИЛ-1 и ФНО. Основная известная функция ИЛ-1 —
индукция пролиферации Т-лимфоцитов, ведущая к секреции Т-
клетками ИЛ-2. При острой воспалительной реакции эндотоксин
стимулирует синтез и секрецию моноцитами (макрофагами) ИЛ-1
и ФНО, которые так же, как известные хемоаттрактанты — ком-
поненты комплемента, лейкотриены (ЛТВд), бактериальные пептиды
(f-Мет-Лей-Фен), вызывают миграцию нейтрофилов и их скопление
в очаге воспаления [Movat Н. Z. et al., 1987]. ИЛ-1 вызывает сис-
темные эффекты: повышение температуры тела, лейкоцитоз, синтез
белков острой фазы в печени. Нейтрофилы, индуцированные ИЛ-1
и ФНО, секретируют лизосомальные протеазы — эластазу, колла-
геназу, токсичные метаболиты кислорода (Ог, ОН , Н2О2), кото-
рые повреждают микроциркуляторное русло, вызывая повышение
сосудистой проницаемости, геморрагию и микротромбоз. Действие
гидролаз реализуется в развитии некроза эндотелия, разрушении
базальной мембраны, фибронектина, коллагена, эластина, протео-
гликанов и облегчении эмиграции гранулоцитов. Субстратами про-
теаз служат также фибриноген, фибрин, плазминоген, иммуногло-
булины, антитромбин III. Эластаза расщепляет тромбин в Э-форму,
сохраняющую только 14% способности фермента к агрегации тром-
боцитов. Цитокины действуют непосредственно на эндотелиальные
клетки, повышая их адгезивность для лейкоцитов и модулируя их
прокоагулянтную и антикоагулянтную активность.
Один из механизмов повышения адгезивности, индуцируемой
цитокинами, — экспрессия на поверхности «эндотелиальной, адге-
зирующей лейкоциты молекулы» (Э-АЛМ), которая связывает ней-
трофилы [Bevilacqua М., Gimbrone М., 1987 ]. Моноклональные ан-
титела к Э-АЛМ-1 ингибируют адгезию нейтрофилов, вызываемую
ИЛ-1. Однако индукция Э-АЛМ-1 — не уникальный механизм,
опосредующий адгезию клеток к эндотелию. В этом процессе при-
нимает активное участие ФАТ (см. ниже). Другой механизм адгезии
62
лейкоцитов — индуцируемая медиаторами воспаления быстрая мо-
билизация из внутриклеточного пула моноцитов и гранулоцитов и
экспрессия на их поверхности семейства интегринов — гликопро-
теидов рецепторов — Mac-1, LFA-1 и р-150, 95 [Kishimoto et al.,
1987]. Экспрессия гетеродимерного комплекса Мас-1 на поверхности
клеток значительно повышает их адгезивные свойства. Дефект в
структуре рецепторов или их экспрессии ведет к нарушению адге-
зивных свойств лейкоцитов. У больных с «дефицитом адгезии лей-
коцитов» (ДАЛ) дефект проявляется опасными для жизни бактери-
альными инфекциями. Мас-1 структурно и функционально отлича-
ется от рецепторов фибробластов и тромбоцитов, связывающих
адгезивные белки. Генетические дефекты рецепторов не перекры-
ваются. У больных с ДАЛ не обнаружено нарушения функций
кровяных пластинок и фибронектина, а дефицит ГП ПЬ/Ша у
больных тромбастенией Гланцманна не влияет на адгезивные фун-
кции лейкоцитов. Кроме обеспечения адгезии клеток к эндотелию,
рецептор Мас-1 отвечает за образование на их поверхности ассо-
циации белков системы свертывания крови. Мас-1 идентифицирован
как клеточный рецептор фактора X, так как моноциты, активиро-
ванные АДФ, специфически связывают его в реакции, зависимой
от кальция [Altier D., Edgington Т., 1988]. Кроме того, стимулиро-
ванные моноциты связывают фибриноген. -Локализация и концент-
рация на активированных моноцитах фибриногена и фактора X —
субстратов специфических протеаз крови, ведет к реализации как
внешнего, так и внутреннего механизмов свертывания, указывая
на тесную взаимосвязь между клеточными защитными механизмами,
адгезией клеток и протеолитическими системами при воспалении.
Адгезия и иммобилизация на эндотелии эмигрирующих из цир-
куляции лейкоцитов, секреция ими цитокинов приводят к экспрессии
на клетках рецепторов факторов свертывания крови. Высокая про-
коагулянтная активность, индуцируемая на поверхности эндотелия
и адгезированных клеток в участке воспаления, обусловлена экс-
прессией ТФ, активность которого возрастает в ответ на действие
эндотоксина в 10—40 раз в течение 4—5 ч [Muller-Berghaus G.,
1987]. ИЛ-1 также индуцирует прокоагулянтную активность сосу-
дистой стенки [Nawroth Р. Р., Stern D. М., 1987], стимуляция ФИО
прокоагулянтной активности клеток эндотелия опосредована синте-
зом и освобождением ИЛ-1. Экспрессия ТФ на эндотелиальных
клетках индуцирует организацию ассамблеи комплексов факторов
свертывания, активация которых по альтернативному пути приводит
к появлению фибрина в очаге воспаления. ТФ — липопротеид,
состоит из белка — апопротеина III и фосфолипидов. Его рассмат-
ривают как мембранный клеточный рецептор фактора VII, поскольку
связывание фактора VII с ТФ, экспрессированным на моноцитах
или эндотелии, специфично и обратимо [Fair D. S., 1987]. На по-
верхности моноцитов, стимулированных эндотоксином, обнаружи-
вают несколько тысяч высокоаффинных рецепторов фактора VII,
идентифицированных как ТФ. В очаге воспаления активированные
моноциты/макрофаги могут синтезировать фактор VII [Ploplis V. А.
63
et al., 1987 ], который связывается по крайней мере с двумя участками
ТФ.
Фактор VII — витамин К-зависимый гликопротеин, который
циркулирует в крови как одноцепочечный предшественник серино-
вой протеазы. Первичная структура фактора VII характеризуется
высокой степенью гомологии с другими зависимыми от витамина К
факторами протромбинового комплекса — протромбином, факторами
IX и X, протеинами С и S. В N-концевой области молекулы фактора
VII локализован Гла-домен, содержащий остатки у-карбоксиглута-
миновой кислоты (Гла), ответственный за связывание Са2+ и фос-
фолипидов. Фактор VII превращается в двухцепочечную протеина-
зу — фактор Vila вследствие гидролиза одной связи фактором Ха
[Berrettini М. et al., 1987 ]. Легкая цепь фактора Vila содержит
Гла-домен и два домена эпидермального фактора роста (ЭФР), а
тяжелая — типичную структуру сериновой протеазы. Хотя фактор
VII циркулирует в крови в активной форме, он не гидролизует свои
специфические субстраты — факторы X и IX в отсутствие абсолютно
необходимого ТФ. Экспрессированный на поверхности клеток ТФ
рецептирует фактор VII, и этот комплекс катализирует образование
небольших количеств фактора Ха, который активирует фактор VII.
Далее высокоактивный комплекс ТФ — фактор Vila существенно
ускоряет реакции активации факторов X и IX [Rao L. V. Н. et al.,
1986]. ТФ бифункционален, так как стимулирует активацию фак-
тора X фактором Vila и превращение фактора VII в Vila фактором
Ха, повышая скорость реакции более чем на 2 порядка [Nenerson
Y.‘-Repke D., 1985].
На поверхности активированных в очаге воспаления эндотели-
альных клеток комплекс ТФ—фактор VII Превращает связанный с
эндотелием фактор IX в протеазу — фактор 1Ха, который в при-
сутствии кофактора — фактора VIII и Са2+ превращает фактор X
в фактор Ха [Stern D. М. et al., 1985]. Более того, активированный
эндотелий, подобно тромбоцитам, синтезирует и экспрессирует фак-
тор V — рецептор фактора Ха, гидролизирующего протромбин до
тромбина (см. схему 3.1). Этот зависимый от эндотелия альтерна-
тивный путь свертывания, включающий компоненты внешнего и
внутреннего механизмов свертывания, ведет к тромбообразованию
при воспалении. Он менее эффективен по сравнению с классическим
внешним механизмом непосредственной активации фактора X ком-
плексом ТФ — фактор VII, обеспечивающим гемостаз, который
требует быстрого и полного ответа на повреждение, чтобы предот-
вратить потерю крови и поддержать гемодинамику. В эксперименте
установлено, что медиатор воспаления ИЛ повышает прокоагулян-
тный потенциал крови только через несколько часов после его
введения и микротромбообразование реализуется при совместном
действии этого медиатора воспаления и дополнительных тромбоген-
ных стимулов, например замедления тока крови [Nawroth Р., Stern
D. М., 1987].
Ассоциация факторов свертывания на поверхности эндотелия
создается благодаря существованию 20—40 тыс. рецепторов (на клет-
64
ку), связывающих факторы 1Х/1Ха и Х/Ха с K<j 10 нМ [Rodgers
С. М., Shuman М. А., 1986; Stern.D. М. et al., 1983]. Сродство фак-
тора 1Ха к эндотелию возрастает на порядок в присутствии суб-
страта — фактора X и кофактора — фактора VII1:K вследствие
индукции новых участков связывания фактора 1Ха на эндотелии.
Фактор IX — витамин К-зависимый фактор протромбинового
комплекса. Двухцепочечный фактор 1Ха образуется из фактора IX
в результате гидролиза двух связей комплексом ТФ — фактор
VIIa/Ca2+ или фактором Х1а/Са2+ внутреннего пути свертывания.
Связанный с фосфолипидной поверхностью фактор 1Ха превращает
фактор X в Ха, который расщепляет протромбин до тромбина.
Протромбин — основной фактор протромбинового комплекса,
синтез которого происходит в гепатоцитах под контролем витамина
К. В молекуле протромбина выделяют три структурных домена:
N-концевой фрагмент 1, содержащий Гла-домен; фрагмент 2, ко-
торый отвечает за связывание молекулы с факторами Va и Ха;
С-концевдй домен (каталитический) претромбин 2 — одноцепочеч-
ный предшественник тромбина! Гидролиз в его структуре одной
связи фактором Ха ведет к появлению свертывающей активности
тромбина [Струков А. И., Струкова С. М., 1990].
В отличие от протромбина фактор X состоит из двух полипеп-
тидных цепей: легкой и тяжелой. Реакция активации фактора X и
протромбина требует кофакторов: фактора VIII:K и фактора V, а
также Са2+ и фосфолипидов. Оба кофактора активируются тромби-
ном или фактором Ха и инактивируются протеином С. Фактор
VIII- — макромолекулярный комплекс собственно фактора VIII:K и
кофактора адгезии тромбоцитов к субэндотелию — ФВ, который
доставляет к участку повреждения сосуда чрезвычайно лабильный
и содержащийся в плазме в следовых количествах фактор VIII:K.
Фактор V — высокомолекулярный, лабильный, медьсодержащий
белок, имеющий выраженную гомологию аминокислотной последо-
вательности с фактором VIII [Кайе W. Н., Davie Е. W., 1988 ]. Каж-
дый из белков содержит два N-концевых А-домена., составляющих
тяжелую цепь, соединенную «связывающей» областью с доменами,
образующими С-концевую легкую цепь. А-домены имеют 30% го-
мологию с тремя доменами церулоплазмина — белка плазмы, свя-
зывающего медь, который может быть эндогенным противовоспали-
тельным фактором, так как проявляет супероксиддисмутазную ак-
тивность, направленную на нейтрализацию токсических метаболитов
кислорода, освобождаемых активированными нейтрофилами в очаге
• воспаления.
Известный эффект ингибирования острого воспаления препара-
тами меди [Струков А. И., 1983] может быть обусловлен суперок-
сидцисмутазной активностью церулоплазмина. Основная функция
факторов V и VIII — ускорять образование тромбина и фактора
Ха, которые активируют кофакторы. Положительная обратная связь
обеспечивает дальнейшую активацию факторов V и VIII, приводя
к более быстрому образованию протеаз (см. схему 3.1). При акти-
вации от кофакторов отщепляется большая часть связывающей об-
3—407
65
ласти и образуются гетеродимеры — факторы УШа и Уа, состоящие
из тяжелой и легкой цепей, соединенных Са2+ [Kane W. Н., Davie
Е. W., 1988]. В отсутствие активных кофакторов, фосфолипидов и
Са2+ активация фактора X фактором 1Ха и протромбина фактором
Ха происходит очень медленно. Однако скорость катализа резко
(примерно в 1000 раз) возрастает в присутствии факторов Уа и
УШа. Основным промежуточным продуктом активации протромбина
комплексом кофактор — фактор Уа, фермент — фактор Ха на
фосфолипидной поверхности, называемым протромбиназой, является
мейзотромбин, который затем превращается в тромбин. В присут-
ствии фактора Уа образуется претромбин 2 [Rosing J. et al., 1986].
Протромбиназа, гидролизующая протромбин, формируется не только
на поверхности тромбоцитов, но также на мембране моноцитов,
лимфоцитов и нейтрофилов [Tracy Р., Mann К. G., 1986].
Таким образом, в тромботический процесс при воспалении вносят
вклад активированные тромбоциты, иммунореактивные клетки и
клетки эндотелия, на поверхности которых формируются указанные
выше комплексы. Создание каталитической поверхности с высокой
локальной концентрацией субстратов и ферментов ведет к каскад-
ному ускорению процесса свертывания и образованию тромбина —
сериновой протеазы, которая свертывает фибриноген и активно
включается в регуляцию свертывания крови и сопряженных про-
цессов. Основная функция тромбина — протеолитическое отщепле-
ние фибринопептцдов А и В от фибриногена, приводящее к обра-
зованию сгустков фибрина [Белицер В. А., 1982; Струкова С. М. и
др.‘,*1989; Струков А. И., Струкова С. М., 1990; Doolittle R. F., 1984 ].
Тромбин участвует в регуляции процессов положительной обратной
связи, направленных на ускорение свертывания крови, индуцирует
адгезию клеток к поврежденной стенке сосуда и их агрегацию,
стимулирует синтез прокоагулятных простагландинов, освобождение
клетками ФАТ, ФВ, фибронектина и других белков и индукторов
агрегации клеток, активирует регуляторные белки — факторы VIII,
V, а также фактор XIII — фибринстабилизирующий фактор (см.
схему 3.1).
Тромбин регулирует процессы отрицательной обратной связи,
направленные на торможение свертывания, запуская реакцию фи-
зиологической противосвертывающей системы (ПСС), стимулируя
освобождение из эндотелия сосудов мощного ингибитора агрегации
тромбоцитов — простациклина, активируя (в комплексе с тромбо-
модулином эндотелия сосудов) ингибитор свертывания, протеин С,
блокирующий активность факторов Va и Villa и способный повышать
фибринолитическую активность крови. Тромбин может регулировать
локальный фибринолиз, стимулируя продукцию клетками эндотелия
сосудов тканевого активатора плазминогена или его ингибитора. Со
многими клетками крови, соединительной и нервной ткани тромбин
взаимодействует специфически. Связываясь с лейкоцитами, он ак-
тивирует систему комплемента и, кроме того, индуцирует хемотаксис
моноцитов, синтез ДНК и пролиферацию фибробластов, эндотели-
альных и других клеток. Эти эффекты тромбин вызывает в кон-
66
центрациях, соответствующих тем, которые могут возникать в крови.
Взаимодействуя со всеми звеньями гемостаза — белками, клетками
крови и стенками сосудов, тромбин участвует в регуляции проти-
воположно направленных процессов, связанных как со. свертыванием
крови, так и с сохранением ее жидкого состояния в кровеносном
русле. В этих реакциях проявляются как протеолитические, так и
гормоноподобные функции тромбина.
Полифункциональность действия тромбина обусловлена особен-
ностями его строения [Струкова С. М., 1982, 1983; Серейская А. А.,
Струкова С. М., 1985; Струкова С. М. и др., 1989 ]. В В-цепи моле-
кулы тромбина наряду с собственно активным центром обнаружен
дополнительный участок — центр узнавания (сопряжения) высоко-
молекулярных соединений. Посредством ионных и гидрофобных кон-
тактов дополнительный центр «узнает» и связывает комплементар-
ный ему участок субстрата или рецептора клетки, индуцируя кон-
формационные изменения, создающие благоприятную ориентацию
субстрата в активном центре фермента. Дополнительный центр —
своеобразный аллостерический центр, стимулирующий каталитиче-
скую функцию фермента при его связывании с модулятором. В роли
модулятора выступает определенный участок специфического суб-
страта, ингибитора или рецептора. Дополнительный центр необходим
для осуществления некоторых сложных функций тромбина, не тре-
бующих протеолиза: стимуляции ПСС, хемотаксиса моноцитов, про-
лиферации лимфоцитов определенного типа [Струкова С. М. и др.,
1989]. В организме свойство тромбина автономно связываться с
субстратом по дополнительному центру без участия активного центра
может быть использовано также для регуляции или ограничения
процесса свертывания, например при связывании тромбина рецеп-
торами эндотелия. Таким образом, дополнительный центр тромбина
служит важным инструментом регуляторного действия тромбина как
протеолитической, так и гормоноподобной природы.
3.2.3. Противовоспалительное действие тромбина
Тромбин реализует свое действие в очаге воспаления не только как
фермент, ответственный за микротромбообразование, но и как гу-
моральный медиатор воспаления, который стимулирует адгезию ней-
трофилов к эндотелию, синтез ФАТ эндотелиальными клетками,
хемотаксис моноцитов, пролиферацию фибробластов, эндотелиаль-
ных и других клеток. Другими словами, тромбин реализует свое
действие посредством механизмов, связывающих воспалительные
реакции и систему свертывания крови.
Биологически активный фосфолипид с провоспалительными и
протромботическими свойствами ФАТ действует на различные типы
клеток, включая нейтрофилы, эозинофилы, моноциты, макрофаги,
тромбоциты и клетки эндотелия [Braquet Р. et al., 1987, 1989]. ФАТ
вызывает лейкопению вследствие агрегации клеток, хемотаксиса,
диапедеза и инфильтрации стенки сосуда; сладж-феномен в микро-
з*
67
циркуляции; транссудацию плазмы с последующим интерстициаль-
ным отеком, артериальной гипотензией и шоком. ФАТ — в 1000
раз более сильный индуктор повышения сосудистой проницаемости,
чем гистамин. Образование воспалительного экссудата, богатого бел-
ком (наряду с увеличением адгезии лейкоцитов к эндотелию), —
характерная особенность воспалительного ответа, вызываемого ФАТ
in vivo [Garcia J. G. N., 1988 ].
Тромбин не вызывает освобождения ФАТ, но усиливает его
синтез, активируя специфическую ацетилтрансферазу. При стиму-
ляции эндотелия тромбином ФАТ остается экспрессированным на
наружной мембране клеток. Индукция синтеза ФАТ эндотелиаль-
ными клетками изменяет их взаимодействие с нейтрофилами. Так,
если в отсутствие агониста только 10% нейтрофилов адгезирует к
эндотелию, то тромбин увеличивает количество адгезированных кле-
ток на 50% [Zimmerman С. A. et al., 1987]. Адгезия нейтрофилов,
стимулированная тромбином, происходит быстро, достигая макси-
мума через 5—10 мин и носит дозозависимый характер. Реакция
специфична, так как фактор Ха, а также протромбин и фибриноген
не стимулируют адгезию клеток к эндотелию. Обратимая адгезия
нейтрофилов к эндотелию и морфологические изменения клеток
являются ранними стадиями, необходимыми для хемотаксиса ней-
трофилов в очаге воспаления. %
Быстрое и обратимое увеличение количества связанных нейтро-
филов обусловлено изменением свойств поверхности эндотелия, вы-
зываемым как тромбином, так и другими агонистами синтеза ФАТ,
такими, как гистамин, АТФ, брадикинин, вазопрессин, лейкотриены
С4 и D4, ангиотензин II [Zimmerman G. A. et al., 1986, 1987]. Таким
образом, реализация синтеза ФАТ происходит в ответ на действие
специфических лигандов, а не поврежденных клеток. Индуцирование
синтеза ФАТ тромбином опосредовано взаимодействием этого аго-
ниста с рецепторами клеточной поверхности, мобилизацией внут-
риклеточного Са; стимуляцией Na+/H+ обмена [Braquet Р., 1989].
С продукцией ФАТ при активации эндотелия тесно коррелирует
адгезия нейтрофилов, которая имеет схожие временные и концен-
трационные характеристики. Кроме того, ФАТ непосредственно сти-
мулирует активацию и адгезию нейтрофилов, опосредуя взаимодей-
ствия типа клетка — клетка [Garcia J. G. et al., 1988; Zimmer-
man ..G. A. et al., 1987]. Увеличение адгезии нейтрофилов к
эндотелию зависит от времени возникновения реакции и дозы ме-
' диатора, действие которого вначале направлено на эндотелий и не
зависит от метаболита арахидоновой кислоты — простациклина.
Полагают, что ФАТ реализует свои функции с помощью рецептора,
расположенного на поверхности эндотелия [Garcia J. G. N. et al.,
1988]. Очевидно, эндотелиальные клетки также являются клетка-
ми-мишенями ФАТ, который, модифицируя кальциевый гомеостаз
клеток, индуцирует перестройку цитоскелета и контракцию клеток.
Вследствие молекулярных и морфологических изменений, вызыва-
емых ФАТ, повышается адгезивность эндотелия для нейтрофилов
и эритроцитов [Bussolino’F. et al., 1988].
68
ФАТ — важный модулятор острого воспаления, один из агентов,
лревращающих острое воспаление в хроническое, так как в очень
низкой концентрации стимулирует макрофаги к синтезу цитоки-
нов — ИЛ-1, ФНО, которые вызывают пролиферацию клеток, де-
струкцию тканей и дальнейшую продукцию ФАТ.
Цитокины — ИЛ-1 и ФНО — стимулируют адгезию лейкоцитов,
зависящую от эндотелия, и синтез ФАТ, но для развития ответа
требуются несколько часов и синтез белка de novo, в отличие от
адгезии нейтрофилов и синтеза ПАФ стимулируемого тромбином,
лейкотриенами и другими агонистами быстрого (минуты) действия
[Braquet Р. et al., 1989]. При обработке клеток эндотелия ФНО
синтез ФАТ происходит быстрее (за 4—6 ч), чем при действии ИЛ-1
(от 8—12ч). При этом, однако, ИЛ-1 стимулирует синтез ФАТ в
более низких концентрациях, чем ФНО (на два порядка).
При иммунном воспалении повреждение эндотелия происходит
вследствие стимуляции механизмов положительной обратной связи
между макрофагами, нейтрофилами, эозинофилами и тромбоцитами,
в которые вовлечены гуморальные и клеточные медиаторы воспа-
ления — ФАТ, ИЛ-1, ФНО и тромбин как основные векторы
сложной системы связи различных типов клеток [Braquet Р. et al.,
1989 ]. Как видно из схемы 3.2, эндотоксин (или антиген) не только
стимулирует освобождение медиаторов воспаления — ФНО, ИЛ-1,
лейкотриенов, компонента комплемента С5а, фактора, стимулиру-
ющего образование колоний гранулоцитов/моноцитов (ГМ-КСФ),
радикалов кислорода, но и запускает работающие с ускорением
механизмы обратной связи, в которых синтезированный ФАТ резко
активирует продукцию медиаторов воспаления, хемоаттрактантов и
цитотоксических агентов, повреждающих эндотелий. Так, ФАТ по-
тенцирует хемотаксис нейтрофилов, вызывает освобождение иона
супероксида, агрегацию и дегрануляцию клеток; служит хемотак-
сическим фактором для эозинофилов и вызывает освобождение ими
основных белков, свободных радикалов и лейкотриенов (^-компо-
нентов, вызывающих выраженные повреждения микрососудов; сти-
мулирует освобождение лейкоцитами цитокинов (ФНО, ИЛ-1), ко-
торые в свою очередь индуцируют синтез ФАТ и хемотаксис ней-
трофилов. Кроме того, ФАТ, так же как ИЛ-1 и ФНО, усиливает
синтез ГМ-КСФ макрофагами, клетками эндотелия и моноцитами.
Именно действием ФАТ можно объяснить катастрофическое увели-
чение уровня ГМ-КСФ в крови при остром воспалении [Metcalf D.,
1987]. Освобождение супероксида и лейкотриена С4 эозинофилами
стимулирует синтез ГМ-КСФ. В комплексе с ИЛ-3 ГМ-КСФ инду-
цирует секрецию ФНО из моноцитов, увеличивая их цитотоксич-
ность [Cannistra S. A. et al., 1988]. Кроме того, ФАТ стимулирует
экспрессию адгезивных белков нейтрофилов, усиливая их миграцию
и повреждающее действие на эндотелий.
Вызываемая эндотоксином агрегация тромбоцитов опосредована
активацией нейтрофилов/моноцитов и освобождением ими ФАТ.
Действие ФАТ на тромбоциты реализуется как в освобождении
хемотаксических факторов для эозинофилов (ТФ4 и ТФР), так и
69
Схема 3.2. Механизмы положительных обратных связей между клетками
крови, эндотелием, гуморальными и клеточными медиаторами воспаления
(BraquetP. et al., 1989].
Л ПС — липополисахарид; ФАТ — фактор, активирующий тромбоциты; ФНО — фактор
некроза опухоли; ИЛ-1 — интерлейкин-1; ГМ-КСФ — фактор, стимулирующий колонии
гранулоцитов/моноцитов; ЛТ — лейкотриены; С5а — компонент комплемента; 02 — токсические
метаболиты кислорода; ТФ4 — тромбоцитарный фактор 4; ТФР — тромбоцитарный фактор
роста.
в образовании на их поверхности тромбина, который в свою очередь
стимулирует синтез эндотелием ФАТ. Завершает цикл положитель-
ной обратной связи активация тромбоцитов и нейтрофилов с по-
мощью ФАТ (см. схему 3.2).
Механизмы положительных обратных связей свидетельствуют о
существовании жесткой системы контроля, ограничивающего раз-
витие воспалительных процессов [Braquet Р. et al., 1988, 1989].
Воспаление контролируется сбалансированной системой цитотокси-
ческих и ингибиторных механизмов. Если воспалительный ответ не
регулируется механизмами обратной связи, усиливается синтез и
освобождение медиаторов воспаления, критически снижается уро-
вень ингибиторов, то локальные реакции развиваются в обширные
процессы, которые приводят к повреждению эндотелия, избыточной
клеточной инфильтрации, повышению сосудистой проницаемости и
микроциркуляторному коллапсу.
Участие тромбина в остром воспалительном ответе определяется
также его способностью непосредственно стимулировать хемотаксис
и митогенез моноцитов и макрофагоподобных клеток [Bar-Shavit R-
et al., 1983, 1986а, Ь]. Он стимулирует направленное движение
только моноцитов/макрофагов. За эту функцию тромбина отвечает
70
специфическая область молекулы фермента — хемотаксический до-
мен, входящий в дополнительный центр узнавания (сопряжения)
высокомолекулярных соединений, локализованный вне активного
центра и обеспечивающий гормоноподобные функции тромбина
[Струкова С. М., 1982; Струкова С. М. и др., 1989]. Независимо от
протеолитической активности тромбин способен стимулировать про-
лиферацию моноцитов и макрофагоподобных клеток. В структуре
хемотаксического домена тромбина обнаружен уникальный тетра-
декапептид (входящий в р -домен тромбина) — Тир-Про-Про-Трп-
Асп-Лиз-Асн-Фен-Тре-Глу-Асн-Асп-Лей-Лей, который стимулирует
синтез ДНК и пролиферацию макрофагоподобных клеток. Синте-
зирован гомологичный пептид, который также функционирует как
фактор роста моноцитов/макрофагов.
Таким образом, тромбин или его фрагменты могут модулировать
воспалительный ответ, участвуя в регуляции роста и движения ряда
клеток в зоне сосудистого повреждения.
3.2.4. Механизмы ограничения тромбообразования
и их нарушения при воспалении
Естественные механизмы ограничения тромбообразования включают
инактивацию тромбина и активных факторов свертывания плазмен-
ными ингибиторами протеиназ в жидкой фазе и на поверхности
эндотелия сосудов; инактивацию тромбина тромбомодулином эндо-
телия и блокирование образования тромбина системой протеина С,
прерывающее каскад свертывания на его ранних этапах; освобож-
дение антикоагулянта гепарина, синтезируемого и депонируемого
лаброцитами, и гепариноподобных гликозаминогликанов (ГАГ), вы-
рабатываемых эндотелием; освобождение эндотелием тканевого ак-
тиватора плазминогена и антиагрегационных простагландинов (схе-
ма 3.3). Все эти механизмы в той или иной мере вовлекаются в
общую противосвертывающую систему (ПСС) организма, которая
активируется при появлении тромбина и возникновении угрозы
тромбообразования [Кудряшов Б. А., 1975, 1986; Струкова С. М.,
Струков А. И., 1990].
Действие ПСС реализуется по крайней мере на двух тесно
связанных уровнях: 1) молекулярном и клеточном: инактивация
тромбина плазменными ингибиторами в реакциях, катализируемых
гепарином или гепариноподобными ГАГ, связывание тромбина тром-
бомодулином эндотелия и последующая интернализация и деграда-
ция либо активация антикоагулянтной системы протеина С, проте-
олиз тромбина до некоагулятных форм эластазой нейтрофилов в
очаге воспаления; 2) оранизменном: запуск тромбином нейрогумо-
ральной рефлекторной реакции, эффекторным актом которой явля-
ется освобождение.из тканевых депо гепарина и тканевого активатора
плазминогена, поступающих в кровоток (см. схему 3.1). В последнем
случае ПСС возбуждается при взаимодействии тромбина (в кон-
центрации 1—10 нМ) со специфическими хеморецепторами, лока-
71
Схема 3.3. Механизмы ограничения тромбообразования, зависимые от
эндотелия.
ПС — протеин С; ПСа — протеин Са-протеаза; ns — комплекс протеин Са-протеазы с
протеином S; Va, VIIIa — активированные факторы свертывания; VH, VIIIH — неактивированные
факторы свертывания; ТАП — тканевый активатор плазминогена; И — ингибитор ТАП; АТШ —
антитромбин Ш, Г-ГАГ — гепариноподобные гликозаминогликаны; ПП1 — простациклин;
ФРЭ — фактор релаксации, производимый эндотелием.
лизованными в определенных зонах сосудистого русла (дуга аорты,
каротидный синус, почка).
Клеточный уровень регуляции — первая линия защиты от мик-
ротромбообразования в локальном очаге воспаления. Прямая инак-
тивация тромбина и других протеаз крови осуществляется семей-
ством серпинов (ингибиторы сериновых протеиназ), включающих
ai-ингибитор протеиназ (aj-ИП, син. a-антитрипсин), антитромбин
III (АТШ), кофактор II гепарина (КГ) — антихимотрипсин, инги-
битор протеина С, аз-антиплазмин (аг-АП), ингибиторы активаторов
плазминогена, С-1-ингибитор (С-1-И) и др. [Carrell R.W. et al.,
1987], и, кроме того, аг-макроглобулином (а2-М). В большинстве
случаев ингибирование протеиназ характеризуется образованием не-
обратимых комплексов между реактивным участком ингибитора и
активным центром протеиназы.
Семейство серпинов происходит от общего предшественника. Не-
смотря на высокую степень гомологии аминокислотной последова-
тельности АТШ и ai-ИП их специфичность различна. Это обуслов-
лено существованием в реактивном участке АТШ пептидной связи
72
Арг-Сер, расщепляемой тромбином, а в реактивном участке ai-ИП
связи Мет-Сер, гидролизуемой эластазой нейтрофилов. Описан слу-
чай, когда замена реактивного метионина в мутантной молекуле
щ-ИП Питтсбург была причиной сильных продолжительных крово-
течений у больного, поскольку дефектный «i-ИП, содержащийся в
плазме в высокой концентрации (2,5 г/л), приобретал свойства АТШ
[Carrell R.W. et al., 1987].
Эффективность ингибирования протеиназы «i-ИП убывает в ряду
эластаза лейкоцитов, химотрипсин, катепсин G, трипсин, протеин
С, плазмин и тромбин. Как видно, «ц-ИП — физиологически ак-
тивный ингибитор эластазы, протеина С, но не тромбина. щ-ИП,
подобно другим серпинам, состоит из одной полипептидной цепи,
которая имеет напряженную («стрессированную») конформацию до
образования комплекса с протеазой. После гидролиза пептидной
связи Мет-Сер эластазой происходят значительное изменение кон-
формации ингибитора, его разворачивание, так называемая релак-
сация молекулы [CarrellR.W. et al., 1987].
Подобные структурные перестройки претерпевают и другие сер-
пины (АТШ, КГ), превращаясь в форму, которую «узнают» рецеп-
торы гепатоцитов, осуществляющих клиренс комплексов ингиби-
тор — фермент [Pratt С. W. et al., 1988]. АТШ ингибирует почти
все протеиназы внутреннего механизма свертывания крови (пре-
имущественно тромбин и фактор Ха) путем образования эквимо-
лярного стехиометрического комплекса в результате взаимодействия
аргинина реактивного участка ингибитора с серином активного цен-
тра фермента. Кофактор II гепарина, в реактивном участке которого
вместо аргинина обнаружен лейцин, ингибирует только тромбин.
Образование комплекса ингибитор — фермент происходит медленно,
но прогрессивно ускоряется под влиянием гепарина, который ката-
лизирует инактивацию протеиназ, повышая скорость реакции более
чем в 1000 раз.
Чрезмерное повышение скорости ингибирования тромбина АТШ
в присутствии каталитических количеств гепарина обусловлено свя-
зыванием этого полианиона с остатками лизина, аргинина и пролина,
формирующими гепаринсвязывающий домен в антитромбине III [Liu
С.-S., ChanJ.-Y., 1987].
Для эффективного ингибирования тромбина КГ требуется в 10 раз
больше гепарина, чем в случае с АТШ. Механизм и последствия свя-
зывания гепарина различны, так как связывание гепарина с кофакто-
ром не ведет к конформационному сдвигу в ингибиторе и является
одностадийным процессом [Киреева Е. Г., Струкова С. М., 1987].
Дерматан-сульфат, входящий в состав гликозаминогликанов ин-
тимы сосудов, примерно в 1300 раз повышает скорость ингибиро-
вания фермента КГ, но не АТШ. В участке повреждения эндотелия
эту реакцию могут ускорять фибробласты и гладкомышечные клетки
благодаря экспрессии дерматан-сульфата на их поверхности
[McGuire Е. A., Tollefsen D. М., 1987]. Молекулярной основой дей-
ствия дерматан-сульфата служит специфическая олигосахаридная
последовательность. Химотрипсин и катепсин G лейкоцитов также
73
ингибируются КГ, но реакция не ускоряется под влиянием гепарина
или другого ГАГ.
Источником гепариноподобных ГАГ служат лаброцйты и клетки
эндотелия. Последние синтезируют гепариноподобные ГАГ, содер-
жащие критический пентасахарид, и экспрессируют их на поверх-
ность клеток. Обнаружено около 50 тыс. участков на клетку, свя-
зывающих АТШ [Rosenberg R. D., Bauer К. А., 1987]. В создание
этих участков вносят вклад и лаброцйты. Меченый гепарин, вве-
денный внутривенно животным, депонируется лаброцитами, а при
активации ПСС тромбином секретируется в кровоток и обнаружи-
вается как в жидкой фазе, так и на люминальной поверхности
сосудистой стенки [Умарова Б. А. и др., 1989]. По-видимому, осво-
бодившиеся из эндотелия или лаброцитов гепариноподобные ГАГ
отвечают за активацию АТШ на поверхности эндотелия в участке
его повреждения и образования прокоагулянтных протеаз. Нетром-
богенность эндотелиального монослоя обусловлена в основном син-
тезируемыми этими клетками гепариноподобными ГАГ.
Биохимический уровень регуляции тромбообразования наруша-
ется при воспалении вследствие повреждения серпинов, вызванного
их протеолизом или окислением продуктами, секретируемыми па-
тогенными бактериями или активированными лейкоцитами [Carrell
R. W. et al., 1987 ]. Токсические метаболиты кислорода и эластаза
нейтрофилов — важнейшие продукты, освобождаемые активирован-
ными лейкоцитами в очаге воспаления. Радикалы кислорода быстро
окисляют метионин реактивного участка (ai-ИП) в метионина суль-
фоксид. Хотя в реактивном участке АТШ нет метионина, ингибитор
инактивируется при окислении метаболитами кислорода, вызываю-
щими изменение третичной структуры белков [Stief Т. W. et al.,
1988]. Окисленный ai-ИП теряет способность инактивировать эла-
стазу нейтрофилов, которая разрушает соединительную ткань и
подавляет ингибиторы протеиназ, включая АТШ и С-1-ингибитор.
Ограниченный протеолиз пептидных связей эластазой или ме-
таллопротеиназой бактерий вблизи реактивного участка АТШ при-
водит к изменению нативной «стрессированной» конформации ин-
гибитора в «релаксированную» форму и полной его инактивации
[Carrel R. W., Owen М. С., 1985]. Таким образом, при воспалении
возникает дисбаланс между сериновыми протеиназами и их инги-
биторами вследствие протеолиза ингибиторов, а также их окисле-
ния — специфического (по реактивному участку «i-ИП) или не-
специфического, обусловленного нарушением нативной структуры
белка. Массивная активация нейтрофилов при септицемии и эндо-
токсемии и нарушение механизмов регуляции протеиназ приводят
к шоку и активации протеолитических систем, что проявляется в
диссеминированном внутрисосудистом свертывании, освобождении
кининов, активации системы комплемента и в конце концов к
шоковому легкому.
Важную роль в качестве противовоспалительного фактора вне
кровеносного русла, в органах и тканях, может играть низкомоле-
кулярный продукт ограниченного протеолиза in vivo интер-а-инги-
74
битора трипсина — кислотостабильный ингибитор протеиназ, пре-
имущественно эластазы и кининогеназы [Оглобина О. Г., 1988].
Менее 25% антитромбинового потенциала крови обеспечивает
высокомолекулярный тетрамер а2-М, блокирующий активность тром-
бина, калликреина, плазмина и активатора плазминогена. Особен-
ностью ингибирования а2-М является экспозиция специальной струк-
туры при образовании его комплекса с протеиназой, которая «уз-
нается» высокоаффинными рецепторами клеток макрофагально-
моноцитарной системы, обеспечивающей клиренс комплекса, что
свидетельствует о важной роли этой реакции в очаге скопления
лейкоцитов и активных протеаз при воспалении [Веремеенко К. Н.
и др., 1987; Straight Е. I. et al., 1988].
В регуляцию тромбообразования активно включается также про-
теин С, проявляющий антикоагулянтную и непрямую фибриноли-
тическую активность [Esmon С; Т., 1987; Strickland D. К., Kessler
С. М., 1987]. Протеин С — витамин К-зависимый белок протром-
бинового комплекса плазмы — циркулирует в крови в форме двух- ’
цепочечного предшественника, активируемого тромбином. Способ-
ность тромбина активировать протеин С повышается при связывании
его с тромбомодулином, мембранным белком эндотелия кровеносных
и лимфатических сосудов всех органов, кроме головного мозга.
Тромбомодулин образует с тромбином стехиометрический комплекс,
который увеличивает скорость активации протеина С на три порядка
в присутствии Са . Тромбин, связанный с тромбомодулином, теряет
способность свертывать фибриноген, активировать фактор V, инду-
цировать агрегацию тромбоцитов, но блокируется антитромбином
III, что объясняется взаимодействием тромбомодулина с центром
узнавания в молекуле тромбина и доступностью активного центра
фермента для ингибитора.
Протеин Са избирательно инактивирует факторы V/Va,
Viy/VIIIa, и скорость реакции возрастает в 50 раз в присутствии
Са2 и фосфолипидов. В протромбиназном комплексе фактор Va
защищен от протеолиза протеином Са. Кофактором антикоагулян-
тной активности протеина С является протеин S — витамин К-за-
висимый белок протромбинового комплекса. Эндотелий, активно
синтезируя (наряду с гепатоцитами) и секретируя протеин S, служит
поверхностью для комплекса протеин Са — протеин S. Кроме того,
протеин S — регулятор системы комплемента, поскольку половина
всего пула протеина в плазме существует в нековалентном комплексе
с С4ь-связывающим белком — регулятором системы комплемента.
В этом комплексе протеин S не проявляет протеин С-кофакторной
активности.
Протеин Са наряду с антикоагулянтной обладает профибрино-
литической активностью, значительно уменьшая время лизиса сгу-
стков крови и увеличивая активность тканевого активатора плаз-
миногена в крови. Одним из возможных механизмов стимуляции
фибринолиза и тромболизиса протеином Са является нейтрализация
ингибитора тканевого активатора плазминогена, что приводит к
75
повышению активности активатора и ускорению превращения плаз-
миногена в плазмин, лизирующий сгустки фибрина.
Во время вызванного эндотоксином внутрисосудистого свертыва-
ния, а также после введения ИЛ-1 снижается способность сосудистой
стенки стимулировать активацию системы протеина С. Если после
введения ИЛ-1 активность ТФ стенки сосуда возрастает более чем
в 10 раз, то зависимая от эндотелия функциональная активность
системы протеина С снижается более чем на 90% [Nawroth Р. et
al., 1986]. Одним из возможных механизмов подавления активности
системы протеина С при введении эндотоксина могут быть вызы-
ваемые медиатором воспаления — фактором некроза опухоли, ос-
вобождаемым моноцитами/макрофагами, интернализация и после-
дующее разрушение тромбомодулина эндотелия — основного ко-
фактора активации протеина С тромбином [Moore К. L. et al., 1989 ].
Быстрое снижение активности протеина С при ДВС-синдроме, вы-
званном введением тромбопластина, происходит вследствие интен-
сивной активации и потребления протеина С при тромбинообразо-
вании и свидетельствует о высокой реактивности и лабильности
этой антикоагулянтной системы [Струкова С. М. и др., 1990].
Ограничение тромбообразования в участке повреждения эндоте-
лия вызывает простациклин (ПГ1г) — простагландин, синтезируе-
мый и освобождаемый эндотелием (см. схему 3.3). ПГ1г — основной
сосудистый метаболит арахидоновой кислоты, служит мощным ин-
гибитором агрегации тромбоцитов и вазодилататором. Действие про-
стациклина опосредовано активацией аденилатциклазы кровяных
пластинок, повышением уровня внутриклеточного цАМФ и сниже-
нием концентрации цитоплазматического кальция. Простациклин
вовлекается в механизм отрицательной обратной связи, ограничивая
тромбообразование, стимулируемое тромбином и тромбоксаном Аг,
ускоряющим рост тромбоцитарного тромба. Кроме тромбина, синтез
и освобождение простациклина эндотелием стимулируют брадики-
нин, компонент С5а комплемента, лейкотриен (JIT) С4 и др. [Levin
R. Т. et al., 1984]. Освобожденный простациклин регулирует взаи-
модействие с эндотелием не только тромбоцитов, но и гранулоцитов,
которые принимают участие в повреждении сосудов, вызванном
эндотоксином. Эндогенные опиоидные пептиды (например, энкефа-
лины) подавляют опосредованное гранулоцитами повреждение эн-
дотелия, стимулируя образование простациклина [Boogaerts М. А.
et al., 1983]. ИЛ-1 также активирует синтез простациклина сосу-
дистыми клетками, причем реакция требует длительного (более 6 ч)
взаимодействия лиганда с клетками, тогда как тромбин катализирует
эту реакцию за 2—3 мин. Несмотря на то что эндотоксин высво-
бождает ПГ1г из эндотелия, его ингибиторного влияния на агрегацию
тромбоцитов и взаимодействие гранулоцитов с эндотелием недоста-
точно, чтобы предотвратить активацию внутрисосудистого сверты-
вания.
В вазомоторные реакции и ингибирование агрегации наряду с
ПГ1г вовлекается фактор релаксации, производимый эндотелием
(ФРЭ), идентифицированный как окись азота, синтезируемая клет-
76
ками эндотелия сосудов из L-аргинина [Moncada S. et al., 1988 ].
Расслабление гладких мышц сосудов ФРЭ обусловлено активацией
гуанилатциклазы, увеличением содержания цГМФ в клетках и уси-
лением захвата Caz+ во внутриклеточные депо. ФРЭ очень лабилен
и чувствителен к анактивации Ог и О2. ФРЭ опосредует расслабление
гладких мышц сосуда, вызываемое различными стимулами: ацетил-
холином, тромбином, веществом Р, брадикинином, некоторыми пеп-
тидами и ионофорами. В регуляции взаимодействия тромбоцитов со
стенкой сосуда ППг и ФРЭ — синергисты.
ФРЭ может действовать как цитопротекторный агент либо вслед-
ствие повышения цГМФ, либо благодаря его способности реагировать
с токсическими радикалами кислорода и инактивировать их. Кроме
эндотелия, ФРЭ, который, по-видимому, является окисью азота,
производят макрофаги и нейтрофилы [Rimele Т. J., 1988]. Нет со-
мнения в том, что освобождаемые эндотелием ФРЭ и ППг служат
регуляторами не только сосудистого тонуса, но также реакций типа
тромбоцит — стенка сосуда и лейкоцит — стенка сосуда, вовлека-
емых в процесс воспаления.
3.2.5. Контактная фаза свертывания крови.
Фибринолиз и воспаление
Взаимодействие на отрицательно заряженной поверхности повреж-
денного при воспалении эндотелия или обнажившегося субэндотелия
факторов контакта — фактора XII, прекалликреина (ПК) и высо-
комолекулярного кининогена (ВМК), приводит к образованию фак-
тора ХПа и гидролизу фактора XI до Х1а, который катализирует
превращение фактора IX в 1Ха внутренней системы свертывания
крови (схема 3.4). Кроме того, фактор ХПа запускает механизм
образования кининов, вызывающих боль, вазодилатацию и увели-
чение сосудистой проницаемости, активирует фибринолитическую
систему, лизирующую сгустки фибрина, стимулирует секрецию ней-
трофилами эластазы и метаболитов кислорода [Gustafson Е.,
Colman R.W., 1987].
Полифункциональность фактора XII обусловлена его модулярной
структурой. При контакте его определенного домена с отрицательно
заряженной поверхностью (например, коллагеном) фактор XII ста-
новится высокочувствительным к протеолитической активации кал-
ликреином и превращается в протеазу — a-фактор ХПа. ПК, су-
ществующий в плазме в комплексе с кофактором — ВМК (так же,
как фактор XI), который связывает его с поверхностью, превраща-
ется в калликреин при участии протеолиза, ограниченного фактором
ХПа. Затем калликреин диссоциирует с поверхности поврежденных
клеток эндотелия и катализирует активацию связанного фактора
XII, осуществляя реципрокный протеолитический цикл. а-Фактор
ХПа превращается калликреином в р-форму — протеазу, не свя-
занную с поверхностью. Отрицательно заряженная поверхность,
связывая белки контактной фазы, стимулирует структурные изме-
77
Схема 3.4. Участие факторов фазы свертывания крови в воспалении.
Фибронектин
К — калликреин; ПК — прекалликреин; XllT XI 1а — кэлликреинкатализирующие факторы;
02 — токсические метаболиты кислорода; «1-ИП — ингибитор эластазы и других протеаз;
«t-ИПн — неактивный ai-ИП; ВМК — высокомолекулярный киииноген; С1-И — активный
ингибитор факторов свертывания; С1-Ин — неактивный ингибитор факторов свертывания;
«1>ИТП — ингибитор тиоловых протеаз.
нения фактора XII, способствующие формированию продуктивного
ферментсубстратного комплекса, а также взаимодействие ПК и фак-
тора XII, зависимое от ВМК, приводя к реципрокной активации
проферментов, и, наконец, зависимую от ВМК активацию фактора
XI связанным с поверхностью фактором ХПа [Vanlwaarden F., Bouma
В. N„ 1987].
ВМК в контактной активации ускоряет активацию а-фактором
ХПа ПК и фактора XI, а также активацию связанного с поверхностью
фактора XII. Зависимая от ВМК активация фактором ХПа ПК и
фактора XI реализуется в стимуляции нескольких протеолитических
систем крови. Если фактор Х1а запускает каскад реакций генерации
тромбина во внутренней системе свертывания, то калликреин, не-
смотря на высокую степень гомологии последовательности ПК и
фактора XI, проявляет широкую субстратную специфичность, ак-
тивируя (через фактор XII) не только систему свертывания: он
освобождает кинины из кининогенов, активирует плазминоген и
проурокиназу; стимулирует воспалительные реакции, индуцируя
хемотаксис и агрегацию нейтрофилов (независимую от компонента
С5 комплемента) и секрецию ими эластазы (см. схему 3.4). Плазмин,
образующийся при расщеплении плазминогена калликреином, гид-
ролизует фибронектин до фрагментов, которые связываются с ней-
трофилами и вызывают освобождение эластазы [Gustafson Е.,
78
Colman R. W., 1987]. Эластаза повреждает компоненты стенки со-
суда, а также гидролизует ВМК, калликреин, фактор XII и основной
ингибитор фактора ХПа и калликреина — CI-ингибитор (С1-И),
что приводит к не контролируемой ингибитором активации контак-
тной фазы свертывания. В перитонеальной жидкости больных острым
панкреатитом обнаружены высокая активность калликреина и сни-
жение активности ВМК [Lasson A., Ohlsson К., 1984 ]. Кининогены —
ВМК и НМК (низкомолекулярный), помимо классических функ-
ций — освобождение кининов и стимуляции контактной инактива-
ции (ВМК), выполняют альтернативную функцию; эффективно ин-
гибируют тиоловые протеиназы, такие, как катепсины L и Н, кал-
паины. При анализе первичных структур выявлена идентичность
ВМК и НМК соответственно сц- и а2-ингибиторам тиоловых проте-
иназ — ИТП [Muller-Esterl W., 1987]. Кроме того, Т-кининоген —
основной острофазный белок (ai-MAP) — подобен, но не идентичен
ai-ИТП.
Активация контактной фазы свертывания крови при грамотри-
цательной септицемии, брюшном тифе, нефротическом синдроме
сопровождается снижением уровня фактора XII вследствие его ак-
тивации. Фактор ХПа, подобно калликреину, вовлекается в воспа-
лительные реакции, связывая нейтрофилы и стимулируя их агре-
гацию, секрецию эластазы и повреждение эндотелия сосудов
[Wachtfogel Y. et al., 1986]. Высвобождаемые нейтрофилами мета-
болиты кислорода окисляют ингибитор эластазы о^-ИП, инактивируя
его (см. схему 3.4). Снижение уровня факторов контактной фазы
отмечается у больных с ДВС-синдромом, в патогенезе которого
большое значение имеет повреждение эндотелия при инфекциях,
шоке, активирующих внутреннюю и внешнюю системы свертывания
крови и сопряженные протеолитические системы [Струков А. И.,
Струкова С. М., 1990; BickR. L., 1988]..
Факторы контактной фазы участвуют в реализации не только
внутрисосудистого свертывания, но и фибринолиза, ограничиваю-
щего тромбообразование в очаге воспаления благодаря синтезу плаз-
мина. Основной путь локальной активации фибринолитической си-
стемы в участке отложения фибрина — взаимодействие на его
поверхности активаторов, проферментов, ферментов и ингибиторов.
Ферменты — активаторы плазминогена (ПА) — тканевого (ТПА)
и урокиназного (УПА), а также плазминоген содержат в С-концевой
части «узнающие» домены, гомологичные участкам в фибронектине
и протромбине, а в С-концевой части — каталитическую область.
Основные ингибиторы — активатора плазминогена (АПИ-1) и плаз-
мина — антиплазмин («2-АП) принадлежат к семейству серпинов
и регулируют фибринолиз. Высокий фибринолитический потенциал
в участке образования сгустков фибрина обеспечивается способно-
стью ТПА эффективно связываться с фибрином и экспрессировать
в присутствии фибрина высокую активность. Высоким сродством
ТПА, связанного с фибрином, к плазминогену объясняются эффек-
тивная генерация плазмина на сгустке и незначительная активация
79
плазминогена в плазме. Превращение нативного Глу-плазминогена
в Глу-плазмин обусловлено специфическим и эффективным гидро-
лизом ТПА одной связи Арг-Вал.
Модулятором фибринолитической активности может быть тром-
боспондин, который связывает плазминоген и даже в отсутствие
фибрина способен ускорять гидролиз плазминогена ТПА, что очень
важно при активации, агрегации клеток и миграции их в очаге
воспаления вне сосуда [Bachmann F., 1987].
Недостаток участков высокоаффинного связывания фибрина ха-
рактерен для УПА, выделяемого из мочи и культивируемых клеток
почек. Присутствие в его структуре домена Э.ФР обеспечивает свя-
зывание УПА с мембраной клеток, на поверхности которых обна-
ружены его рецепторы и осуществляется активация плазминогена
в плазмин. Путь фибринолиза через УПА более эффективен после
активации контактной фазы свертывания. Калликреин, подобно
плазмину, превращает одноцепочечный УПА в высокоактивный
двухцепочечный УПА. Реакция не происходит в плазме, в которой
отмечается недостаток калликреина.
Связанный со сгустками фибрина или клетками плазмин защи-
щен от действия ат АП, который регулирует фибринолитическую
активность, конкурируя с фибрином за связывание с плазминогеном.
В плазме аг-АП чрезвычайно быстро реагирует с плазмином, необ-
ратимо ингибируя его. Кроме того, «2-АП ковалентно связывается
с фибрином в реакции, катализируемой фактором XIII (фибринста-
билизирующий), повышая устойчивость фибрина к лизису. В кон-
троле фибринолиза важную роль играют также ингибиторы акти-
ватора плазминогена (ПАИ), синтезируемые эндотелием. Система
протеина С также модулирует фибринолитический потенциал крови,
так как протеин Са связывает ПАИ-1 и блокирует его действие.
При врожденном дефиците протеина С или приобретенном (ДВС-
синдром) неконтролируемое увеличение ПАИ-1 ведет к блокаде
фибринолиза. При сепсисе также нарушаются механизмы регуляции
фибринолиза. Эндотоксин, ФНО, ИЛ-1 стимулирует резкое увели-
чение активности ПАИ-1, тем самым подавляя фибринолитический
потенциал крови. Увеличение активности ПАИ-1 обнаружено при
многих патологических состояниях, на основании чего сделан вывод
о том, что ПАИ-1 — острофазный реагент и его активность может
возрастать при воспалении различной этиологии [Bachmann F.,
1987]. В развитие микротромбозов и повреждение эндотелия, вы-
званных эндотоксином при бактериальной септицемии, вносят оп-
ределенный вклад ингибирование фибринолиза, активация сверты-
вания и вазомоторные реакции [Muller-Berghaus G., 1987].
В зависимости от интенсивности реакции организма на эндоток-
син и от преимущественной активации свертывания или фибрино-
лиза в участке локального повреждения эндотелия развиваются
микротромбоз, геморрагия или ДВС-синдром. Причинами геморрагии
могут быть потребление факторов свертывания и тромбоцитов, сдвиг
биохимической регуляции в сторону активации фибринолиза, ин-
гибирования активации тромбоцитов.
80
3.3. МЕДИАТОРЫ ВОСПАЛЕНИЯ
Медиаторы воспаления — биологически активные вещества, которые
обязательно содержатся в воспаленной ткани и оказывают воздей-
ствие на пато- и морфогенез воспаления. В условиях эксперимента
они вызывают основные проявления воспаления, и воздействие на
образование, высвобождение или рецепцию этих медиаторов при-
вадит к изменению течения воспалительной реакции. Известно, что
разнообразные по происхождению повреждающие факторы вызыва-
ют во многом стереотипный в своих проявлениях процесс, включа-
ющий местные изменения в виде альтерации, экссудации и проли-
ферации. В связи с этим естественно предположить, что такая
неспецифичность изменения тканей при воздействии различных по-
вреждающих факторов связана с реализацией их влияния через
общий механизм, который в свою очередь формирует основные
проявления воспалительного процесса. Толчком к изучению роли
медиаторов в патогенезе воспаления явились исследования W. Menkin
(1948), хотя далеко не все соединения, выделенные им из воспа-
лительного очага, сейчас относят к медиаторам воспаления.
К настоящему времени обнаружено большое количество таких
медиаторов, являющихся посредниками в реализации действия
агентов, вызывающих воспаление (гистамин, брадикинин и др.).
Влияние на эти медиаторы с помощью лекарственных препаратов
(пипольфен, трасилол) используют в терапии той или иной формы
воспаления. Высвобождаясь под воздействием повреждающего аген-
та, медиаторы изменяют самые разнообразные процессы, проис-
ходящие в тканях, — тонус сосудов, проницаемость их стенок,
эмиграцию лейкоцитов и других форменных элементов крови, их
адгезивную и фагоцитарную активность, вызывают боль, усили-
вают секрецию желез и т. д. Действие медиаторов воспаления
характеризуется каскадным эффектом.
3.3.1. Классификация медиаторов воспаления
Существуют различные критерии систематизации медиаторов вос-
паления. Их часто классифицируют по химической структуре, на-
пример биогенные амины (гистамин, серотонин), полипептиды (бра-
дикинин, каллидин) и белки (фракции комплемента, лизосомные
ферменты), производные арахидоновой кислоты (простагландины и
лейкотриены). Нередко медиаторы разделяют по их происхождению
на гуморальные (СЗ и С5 фракции комплемента, например анафи-
латоксин) и клеточные (гистамин, гранулоцитарные факторы, лим-
фокины). Гуморальные (плазменные) медиаторы обычно характе-
ризуются генерализованными эффектами, и спектр их действия
шире, чем клеточных медиаторов, эффекты которых локальны.
В свою очередь клеточные медиаторы могут быть разделены по виду
клеток, высвобождающих медиаторы воспаления (факторы ПЯЛ,
монокины, лимфокины). Медиаторы воспаления по особенностям их
81
выхода из клеток можно классифицировать на медиаторы нецито-
токсического и цитотоксического высвобождения. В первом случае
отмечается стимулированный через соответствующий рецептор клет-
ки выход медиаторов путем физиологического экзоцитоза, во вто-
ром — происходит разрушение клетки, в результате чего медиаторы
выходят из нее в окружающую среду. Один и тот же медиатор
(гистамин или серотонин) может поступать в нее и тем, и другим
путем (из лаброцита или тромбоцита). В зависимости от скорости
включения в процесс воспаления различают медиаторы немедленного
(кинины, анафилатоксины) и замедленного (монокины, лимфокины)
типа действия [Lewis J., 1975]. Выделяют также медиаторы непос-
редственного, или прямого, и опосредованного, или непрямого, дей-
ствия. К первым относят медиаторы, которые в процессе воспа-
ления высвобождаются очень быстро, вероятно, под влиянием
самого раздражителя (гистамин, серотонин и др.), ко вторым —
медиаторы, появляющиеся позднее, часто в результате действия
первых медиаторов (фракции комплемента, гранулоцитарные фак-
торы ПЯЛ).
Разделение медиаторов воспаления на группы в известной мере
условно и может быть использовано лишь для общей ориентировки
в тех сложных механизмах развития воспалительного процесса,
которые имеются в реальных условиях. Действительно, при раз-
делении медиаторов воспаления на гуморальные и клеточные не
учтено функциональное и структурное единство гуморальных и
клеточных механизмов защиты организма от повреждающих воз-
действий. Фракции комплемента С1 и СЗ, высвобождающиеся в
плазме крови и действующие как медиаторы воспаления, связы-
ваются со специализированными рецепторами цитолеммы ПЯЛ и,
возможно, моноцитов, обеспечивая хемоаттрактантный эффект и
на основе опсонизирующего влияния активируя фагоцитоз. Фрак-
ции СЗ- и С5-комплемента стимулируют лаброциты, высвобождая
клеточный медиатор гистамин. Таким же образом на лаброциты
может действовать гуморальный медиатор брадикинин. В литера-
туре нередко выделяют медиаторы воспаления и медиаторы ал-
лергии. Благодаря достижениям современной биохимии, патофи-
зиологии и патоморфологии установлено тесное взаимодействие
ПЯЛ, моноцитов и лимфоцитов, которое строится на основе сиг-
нальных связей. В норме такие связи обеспечиваются теми же
медиаторами, которые в условиях патологии принимают участие
в развитии неиммунного и иммунного воспаления. Выделение ме-
диаторов воспаления и медиаторов аллергии отражает устаревшие
взгляды, поскольку установлено, что иммунофагоцитарный ответ
организма на чужеродные воздействия и его медиаторное обеспе-
чение сформировались в процессе эволюции и иммунный процесс
как возникший позднее включился в древний воспалительный
процесс, дополнил и усовершенствовал его [Струков А. И., Сар-
кисов Д. С., 1988 ].
82
3.3.2. Характеристика основных групп медиаторов
воспаления
Основными группами медиаторов воспаления являются биогенные
амины (гистамин, серотонин); плазменные системы (система кини-
нов, система гемостаза и фибринолиза, фрагменты комплемента);
производные арахидоновой кислоты (простагландины, лейкотриены,
хемотаксические липиды); кислородные радикалы и гидроперекиси
липидов; медиаторы ПЯЛ, моноцитов и лимфоцитов. Они объеди-
нены в соответствии с их химической структурой и происхождением.
Последовательность расположения групп в определенной мере от-
ражает их место в развитии острого воспалительного процесса.
Биогенные амины. Одним из наиболее важных медиаторов
воспаления является гистамин (схема 3.5). У разных видов
животных и человека гистамин находится в лаброцитах, базофилах
и тромбоцитах. Он образуется из аминокислоты гистидина под
влиянием фермента гистидиндекарбоксилазы и депонируется в гра-
нулах вместе с другими соединениями (гепарин, ФАТ). После
высвобождения гистамин очень быстро разрушается ферментом
гистаминазой.
Схема 3.5. Гистамин:
воспаления.
метаболизм, высвобождение и действие в очаге
83
Из лаброцитов или базофилов гистамин может высвобождаться
регуляторно в результате физиологического экзоцитоза или нере-
гуляторно при повреждении и распаде этих клеток. Либераторы
гистамина многообразны: травма, термические агенты, бактериаль-
ные токсины, протеазы, антигены, взаимодействующие с IgE, фик-
сированным на мембране лаброцита, СЗ- и С5-фракции компле-
мента, катионные белки ПЯЛ и др. [Мусил Я., 1985].
Регуляторное высвобождение гистамина происходит и в нормаль-
ных условиях, когда он выполняет функцию тканевого гормона,
регулирующего микроциркуляцию. Механизм высвобождения гис-
тамина — сложный многоэтапный процесс. По К. F. Austen (1982),
активация лаброцита, которая проявляется секрецией гистамина,
происходит следующим образом. Связывание антигена с антителом
(например, IgE), фиксированным на мембране лаброцита, приводит
к увеличению уровня внутриклеточного цАМФ. Он в свою очередь
активирует внутриклеточные протеинкиназы, которые ответственны
за фосфорилирование белков мембраны гранул лаброцитов, что
приводит к повышению ее проницаемости по отношению к воде и
Са2+, Результатом этого являются разбухание гранул вследствие
накопления в них воды и активация микромиофйламентов под
влиянием Са2 . Контрактильные элементы микромиофиламентов и
цитоскелета обеспечивают транспорт гранул, готовых к экзоцитозу,
по направлению к цитолемме лаброцита с последующим выходом
гистамина.
Установлено, что в гранулах лаброцитов и базофилов, помимо
гистамина, имеются хемотаксический фактор эозинофилов (ХФЭ),
хемотаксический фактор нейтрофилов (ХФН), фактор активации
тромбоцитов (ФАТ) и нейтральные протеазы [Robbins S. L. et al.,
1984]. Действие гистамина реализуется с помощью специализиро-
ванных рецепторов, находящихся на мембранах разных клеток.
Вазодилатация и повышение проницаемости сосудов при остром
воспалении обусловлены стимуляцией главным образом Hi-рецеп-
торов сосудистой системы. В очаге острого воспаления гистамин
вызывает также боль,, повышает адгезивные свойства эндотелия
сосудов, способствует эмиграции лейкоцитов, стимулирует фагоци-
тоз и т. д.
Высвобождение гистамина — одна из первых реакций ткани на
повреждение. Эффекты этого медиатора проявляются уже через
несколько секунд после действия повреждающего агента, в резуль-
тате чего (после почти мгновенной вазоконстрикции) очень быстро
развивается вазодилатация и появляется первая волна увеличения
проницаемости микрососудов. Вследствие быстрого разрушения ги-
стамина его действие вскоре прекращается, и изменения микроцир-
куляции поддерживают уже другие медиаторы воспаления.
Другим биогенным амином, принимающим участие в развитии
ранних признаков воспаления, является серотонин. Он пред-
ставляет собой производное аминокислоты триптофана—5-гидро-
кситриптамин, образующийся при ее декарбоксилировании. Серо-
тонцн разрушается аминоксидазами с образованием 5-оксииндолук-
84
сусной кислоты, которая выводится из организма. Этот медиатор
содержится в нейронах мозга, энтерохромаффинных клетках пище-
варительного тракта, лаброцитах, базофилах. Большое количество
серотонина у разных видов животных и у человека находится в
тромбоцитах, где он не синтезируется, а депонируется в соответст-
вующих гранулах [Хорст А., 1982; Мусил Я., 1985].
Секреция серотонина (часто вместе с гистамином) из тромбоцитов
в процессе реакции высвобождения или агрегации происходит под
влиянием различных активаторов — коллагена, тромбина, АДФ,
комплексов антиген—антитело, ФАТ и др. [Robbins S. L. et al.,
1984 ]. Хотя действие серотонина в организме многообразно, в очаге
воспаления его эффекты, по-видимому, ограничены. В умеренных
концентрациях он вызывает расширение артериол, сокращение ми-
оцитов в стенках венул и венозный застой. В высоких концентрациях
серотонин обусловливает спазм артериол и в случае их повреждения
способствует остановке кровотечения.
Плазменные системы. Как отмечалось выше, существуют три '
важнейшие системы плазмы, тесно связанные между собой и явля-
ющиеся источниками многих медиаторов воспаления, — системы
кининов, гемостаза и фибринолиза^ комплемента. Изменение ак-
тивности одной из этих систем под влиянием повреждающего фак-
тора обычно приводит к перестройке деятельности других, что в
свою очередь отражается на состоянии первоначально измененной \
системы [Кузник Б. И. и др., 1989].
Система кининов имеет существенное значение в развитии
воспаления. Наиболее важными кининами являются брадикинин и
каллидин. Включение кининов в патогенез острого воспаления оз-
начает начало деятельности второго каскада медиаторов. Появление
кининов в крови и ткани очага воспаления связано с активацией
плазменных и клеточных протеолитических ферментов (схема 3.6).
Химическая сущность кининов описана выше. Напомним лишь,
что кинины образуются в крови и тканях из а2-глобулина плазмы
(кининоген). Расщепление кининогена происходит под влиянием
протеолитических ферментов — калликреинов (калликреин-I, или
плазменный калликреин, и калликреин-П, или тканевый каллик-
реин). Оба фермента в обычном состоянии не активны и существуют
в форме прекалликреинов (калликреиногены), активируемых раз-
личными факторами, из которых важнейшим является XII фактор
свертывания крови (фактор Хагемана), осуществляющий связь си-
стемы кининов и гемостаза. Необходимо отметить, что калликреины
сами могут активировать XII фактор свертывания крови и поддер-
живать в устойчивом состоянии систему образования кининов
[Wigins R. S., 1979]. Калликреины также обладают свойствами ме-
диаторов воспаления, хемотаксической активностью и вызывают
агрегацию форменных элементов крови.
В общем виде включение кининов в развитие воспаления про-
исходит следующим образом. При действии повреждающих агентов
вследствие изменения описанных выше свойств стенок сосудов и
микроциркуляции очень быстро активируется XII фактор сверты-
85
Схема 3.6. Система кининов: активация, ингибирование и действие в
очаге воспаления. В скобках указано количество аминокислот в составе
кинина.
вания крови, и через несколько секунд после этого в крови появ-
ляются кинины. Повышение проницаемости стенок микрососудов
под влиянием гистамина приводит к выходу белков плазмы, в том
числе кининогена, во внесосудистую среду. Из паренхиматозных
клеток, например поджелудочной железы, при их распаде может
высвобождаться калликреин-П и вызывать образование кининов не-
посредственно в ткани. Активаторами системы кининов в тканях
могут стать гистамин, разнообразные протеазы собственных распав-
шихся клеток, катионные белки ПЯЛ и др.
В очаге воспаления кинины расширяют артериолы и венулы,
повышают проницаемость микрососудов и усиливают экссудацию,
вызывают сокращение гладких мышц, с ними связано появление
боли. При избытке в крови кининов возникают общие расстройства,
такие, как острая артериальная гипотония, бронхоспазм, гиперсек-
реция желез слизистых оболочек. Вместе с тем действие кининов
в крови и тканях обычно непродолжительно, так как они быстро
разрушаются кининазами, широко представленными в клетках крови
и тканях: эритроцитах, ПЯЛ, мононуклеарных клетках, особенно
сосудов легких, и др. Существуют и другие инактиваторы системы
кининов, например ингибитор С-фракции комплемента, cj-анти-
трипсин и др.
Система гемостаза и фибринолиза непосредственно
участвует в генерации высокоактивных медиаторов воспаления.
86
В приведенном выше подробном описании процесса тромбообразо-
вания в сосудах очага воспаления показаны механизмы трансфор-
мации фибрина из фибриногена и появления фибринопептидов. Эти
соединения могут вызвать значительное повышение проницаемости
микрососудов и обладают хемотаксической активностью. В системе
фибринолиза наибольшее значение для генерации медиаторов вос-
паления имеет полифункциональный протеолитический фермент
плазмин, который активирует XII фактор свертывания крови и
таким образом стимулирует образование кининов. Как и тромбин,
плазмин активирует С8-фракцию комплемента [Хорст А., 1982].
При расщеплении фибринного сгустка под влиянием плазмина об-
разуются активные продукты распада, вызывающие повышение про-
ницаемости микрососудов [Robbins S. L. et al., 1984 ].
Комплемент представляет собой сложную плазменную сис-
тему, включающую не менее 18 белков и по многогранности функций
не уступающую системе свертывания крови. Он является неспеци-
фическим механизмом иммунитета, обеспечивающим лизис чуже-
родных и собственных измененных клеток. В онтогенезе система
комплемента сформировалась сравнительно рано, и дальнейшее по-
явление других механизмов иммунитета на основе взаимодействия
комплемента, фагоцитов и лимфоцитов обеспечило тесную взаимо-
связь неспецифических и специфических путей защиты организма.
Являясь полифункциональной системой, комплемент тесно связан
с деятельностью систем фибронектина, гемостаза, фибринолиза и
фагоцитов, а также иммунной системой [Кульберг А. Я., 1986;
Pommier С. G. et al., 1983; Cosio F. G., 1984].
Существуют два основных пути активации системы комплемента.
Первый, классический, включается антителами классов IgG и IgM.
Вариабельный Fab-фрагмент иммуноглобулинов связывается с ан-
тигенами, а константный Fc-фрагмент соединяется с комплементом,
активируя его. Вместе с тем классический путь может активироваться
другими факторами, например С-реактивным белком и онкогенными
РНК-содержащими вирусами. Этот путь представляет собой каскад
ферментативных реакций, в результате которых на каждом этапе
образуются физиологически активные фрагменты комплемента. Вто-
рой, альтернативный, путь включается разнообразными факторами
(яд кобры, липополисахариды бактерий, плазмин, тромбин, каллик-
реин, протеазы бактерий и собственных клеток и др.), но при этом
необходимо участие группы специфических плазменных факторов,
из которых наиболее важным является пропердин. Считают, что
альтернативный путь активации комплемента может включаться
также IgA, IgD, IgE.
Каждый активированный фрагмент комплемента имеет соответ-
ствующий ферментный инактиватор, вследствие чего система в слу-
чае необходимости может вернуться в обычное состояние. Система
комплемента играет важную роль в формировании воспаления и
аллергии, при наследственной или приобретенной недостаточности
системы комплемента ослабляются разнообразные защитно-приспо-
собительные реакции. Вместе с тем нарушения в организме могут
87
возникать и при чрезмерной активности системы комплемента в
случае недостаточности его ферментных инактиваторов. Результатом
этого является усиление воспалительных и аллергических реакций.
Высвобождающиеся при активации фрагменты компле-
мента — важнейшие медиаторы воспаления и аллергии
[Sandberg A. L., 1981 ]. Активированный С2-фрагмент обладает
свойствами кининов, а СЗ-фрагмент повышает сосудистую прони-
цаемость и проявляет хемотаксическую активность в отношении
гранулоцитов. С5-фрагмент обладает аналогичными свойствами,
но значительно более активен; он высвобождает лизосомные гид-
ролазы нейтрофилов и моноцитов. С5—С9-фрагменты обеспечива-
ют серию реакций, направленных на лизис чужеродных и собст-
венных клеток. СЗ- и С5-фрагменты комплемента являются ана-
филатоксином, высвобождающимся при анафилактическом шоке и
вызывающим острую гипотонию, бронхоспазм, гиперсекрецию же-
лез слизистых оболочек и другие эффекты. Считают, что анафи-
латоксин действует главным образом путем высвобождения гиста-
мина и других медиаторов гранул лаброцитов и тромбоцитов.
С5-фрагмент комплемента является одним из наиболее мощных
медиаторов воспаления. Он стимулирует липоксигеназный путь
распада арахидоновой кислоты, участвуя в образовании лейко-
триенов, усиливает генерацию радикалов кислорода и гидропере-
кисей липидов [Robbins S. L. et al., 1984 ].
Производные арахидоновой кислоты. Арахидоновая кислота —
важный компонент фосфолипидов мембран разных клеток — явля-
ется источником образования трех групп соединений, оказывающих
влияние на развитие воспаления, — простагландинов, лейкотриенов
и хемотаксических липидов. Они синтезируются в мембранах лей-
коцитов, тромбоцитов, лаброцитов и базофилов, эндотелиальных
клеток и т. д. и, высвобождаясь, действуют как высокоактивные
соединения локально на внутриклеточные и внеклеточные процессы
[Pinckard N., 1982].
Арахидоновая кислота выделяется из фосфолипидов мембран под
влиянием фермента фосфолипазы А? (схема 3.7). Этот фермент
активируется многими факторами: токсинами микробов, кининами,
С5-фрагментом компонента, тромбином, антигенами и комплексами
антиген—антитело, Са2+ и др. [Мусил Я., 1985; Robbins S. L. et
al., 1984]. Расщепление арахидоновой кислоты (арахидоновый ка-
скад) может происходить либо по циклооксигеназному пути с об-
разованием простагландинов, либо по липоксигеназному пути с
образованием лейкотриенов.
Простагландины (ПГ) синтезируются очень быстро. Пер-
воначально под влиянием фермента циклооксигеназы из арахидо-
новой кислоты продуцируется эндопероксид — ПГСг, который пе-
реходит в ПГНг. С этого момента биосинтез простагландинов может
идти по следующим направлениям. Первое — с помощью фермента
просгациклинсинтетазы ПГНг превращается в ППг, или проста-
циклин, второе — при участии фермента тромбоксансинтетазы из
ПГНг образуется тромбоксан Аг, третье — с помощью фермента
88
Схема 3.7. Арахидоновый каскад. Образование простагландинов (ПГ),
лейкотриенов (ЛТ) и хемотаксических липидов, их действие в очаге
воспаления. ГПЕТЕ — гидропероксид эйкозотетраеновой кислоты.
простагландинизомеразы из ПГНг синтезируются более устойчивые
соединения: ПГЕг, ПГЕг и ПГЭг [Хорст А., 1982; Weissmann G.,
1981 [. Высвобождающиеся простагландины взаимодействуют со спе-
циализированными рецепторами клеточных мембран; в реализаций
действия одних простагландинов (ПГЕг) принимает участие цАМФ,
других (ПГЕга) — цГМФ. После воздействия на рецепторы разных
клеток простагландины очень быстро разрушаются простагландин-
Дсгидрогеназой, содержащейся в разных тканях.
Особенно важное значение при остром воспалении имеют про-
тивоположно действующие ППг (простациклин) и тромбоксан Аг.
Эндотелиальными клетками микрососудов продуцируется ПГ1г. Он
тормозит агрегацию тромбоцитов, поддерживая жидкое состояние
крови, и, помимо этого, вызывает вазодилатацию. Тромбоксан Аг,
наоборот, образуется тромбоцитами при их активации, вызывает
агРегацию пластинок, секрецию других медиаторов из их гранул и
89
обусловливает вазоконстрикцию микрососудов. Из более устойчивых
простагландинов важную роль при воспалении играет ПГЕг. Он
вызывает вазодилатацию и повышение проницаемости микрососудов,
боль, а при резорбции — лихорадку. Некоторые эффекты проста-
гландинов могут реализоваться через высвобождение или усиление
действия гистамина и брадикинина [Williams Т. J., Peck М. J., 1977 ].
Лейкотриены (ЛТ) также синтезируются из арахидоновой
кислоты в мембранах разных клеток (тромбоциты, базофилы, эн-
дотелиальные клетки и др.), но под влиянием фермента липоокси-
геназы. Одним из важных исходных продуктов, дающим две основ-
ные линии лейкотриенов, является ЛТА4. Из этого соединения
образуется ЛТВ4 и, кроме того, группа ЛТС4, JITD4 и ЛТЕ4.
Особенно большое значение в очаге воспаления имеет ЛТВ4, который
выделяется эндотелиальными клетками, обладает хемотаксической
активностью, вызывает адгезию нейтрофилов к эндотелию и агре-
гации лейкоцитов [Palmblad J. et al., 1981 ]. Группа лейкотриенов —
ЛТС4, ЛТО4 и ЛТЕ4 — выделяется в основном лаброцитами и
базофилами. Они вызывают вазоконстрикцию микрососудов, повы-
шение проницаемости их стенок, особенно значительное в венулах,
и бронхоспазм [Danlen S. Е. et al., 1981].
Лейкотриены играют важную роль в патогенезе анафилаксии;
они вызывают сокращение бронхиол и гиперсекрецию слизистых
оболочек бронхов, что может привести к приступу бронхиальной
астмы. Медленно реагирующее вещество анафилаксии (МРВ-А)
представляет собой совокупность лейкотриенов — ЛТС4, JITD4 и
ЛТЕ4 [Orning L. et al., 1980; Weiss W. et al., 1982; Lee C. W. et
al., 1983].
Установлено, что существует неэнзиматическая пероксидация
арахидоновой кислоты свободными радикалами кислорода, в резуль-
тате чего образуются активные липидные гидроперекиси — хемо-
таксические липиды. Эти липиды в очаге воспаления про-
являют высокую хемотаксическую активность в отношении ПЯЛ,
обеспечивая их адгезию к эндотелиальным клеткам и эмиграцию с
дальнейшей инфильтрацией ткани [Perez Н. D. et al., 1980].
Кислородные радикалы и гидроперекиси липидов. В аэробных
биологических системах существуют два пути использования кис-
лорода: оксидазный и оксигеназный. Оксидазный путь окисления
связан с фосфорилированием АДФ и ресинтезом АТФ в митохон-
дриях. Оксигеназный путь использования кислорода приводит к
образованию различных гидроперекисей. Среди радикалов кислорода
наибольшее значение имеют такие его активные формы, как су-
пероксидный анионрадикал (02 ), перекись водорода (Н2О2) и гид-
роксильный радикал (ОН). Эти формы кислорода образуются глав-
ным образом в митохондриях и микросомах клеток.
Характерным для радикалов кислорода является их высокая ре-
акционная способность, и они взаимодействуют с разными субстра-
тами клетки, особенно с липидами мембран. При свободнорадикаль-
ном перекисном .окислении липидов образуются липидные гидропе-
рекиси. Перекисное окисление липидов существует в нормально
90
функционирующих клетках, где постоянно содержатся липидные
гидроперекиси в невысокой концентрации. Весь комплекс процессов,
включающих систему генерации радикалов кислорода и липидных
гидроперекисей, носит название «оксидантная система». Активность
этой системы в тканях контролируется антиоксидантной системой,
которая представлена группой ферментных (супероксиддисмутаза,
каталаза, глютатионпероксидаза) и неферментных (а-токоферол,
витамин К, метионин и др.) факторов. В нормальных условиях
оксидантная и антиоксидантная системы обеспечивают регуляцию
активности ферментов мембран путем изменения свойств их липи-
дов. Радикалы кислорода также служат для уничтожения экзогенных
и эндогенных чужеродных или вредных продуктов в клетках, в том
числе в фагоцитах. Активация гидроперекисных процессов проис-
ходит либо в результате чрезмерно усиленной генерации активных
радикалов кислорода, либо вследствие недостаточности антиокси-
дантных механизмов, либо при сочетании двух этих явлений.
В очаге воспаления свободнорадикальные процессы могут зна-
чительно активироваться, что связано с активной гиперемией, со-
провождающейся повышением доставки кислорода в ткани
[Robbins S. L. et al., 1984]. Однако даже при гипоксии свободнора-
дикальные процессы могут происходить активно в присутствии до-
статочного количества липидных субстратов. Кроме того, фагоци-
тирующие клетки, инфильтрирующие очаг воспаления, усиленно
продуцирует свободные радикалы кислорода, галоидов (HOCI) и
перекись водорода с помощью миелопероксидазы. Активные ради-
калы кислорода выбрасываются фагоцитами в окружающую среду,
повреждая мембраны микробных и собственных клеток, способствуя
расщеплению антигенов и иммунных комплексов. Это накопление
свободных радикалов во внеклеточной среде в литературе называют
«окислительный взрыв» или «окислительный фагоцитоз» [Панчен-
ко Л. Ф. и др., 1981]. Генерация активных форм кислорода проис-
ходит и в процессе внутриклеточного переваривания, являясь одним
из основных механизмов бактерицидной активности фагоцитов. У
больных с миелопролиферативными заболеваниями лейкоциты ут-
рачивают способность генерировать активные радикалы, одновре-
менно резко снижается их антимикробная деятельность. Наоборот,
при стимуляции фагоцитов воздействием С1-фрагмента комплемен-
та, Fc-фрагмента иммуноглобулинов или фибронектина активиру-
ются радикальные процессы и повышается интенсивность фагоцитоза
[Proctor R. A. et al., 1985]. Наконец, важным фактором усиления
свободнорадикальных процессов в очаге воспаления является по-
вреждение паренхиматозных клеток. Любое повреждение включает
свободнорадикальный и гидроперекисный механизмы нарушения их
обмена, структуры и функции [Демуров Е. А., Игнатова В. А., 1985;
Preeman В. A., Crspo J. D., 1982].
Свободные радикалы кислорода фагоцитарного и паренхиматоз-
ного происхождения не только дают «очистительный» эффект, но
также могут оказывать прямое и опосредованное, через химические
медиаторы, влияние на разнообразные структуры очага воспаления
91
и их функцию. Поданным F. Del Maestro и соавт. (1981), повышение
генерации 02 под влиянием ксантиноксидазы вызывает увеличение
проницаемости капилляров, а повреждение, эндотелиальных клеток
и повышение проницаемости микрососудов, вызываемое С5-фраг-
ментом комплемента, опосредуется радикалами кислорода
[Fantone J. С., Ward Р. А., 1982]. Свободные радикалы кислорода
имеют непосредственное отношение к сосудисто-тромбоцитарному
механизму тромообразования (см. выше). Кроме того, они непос-
редственно участвуют в синтезе неэнзиматическим путем из ара-
хидоновой кислоты хемотаксических липидов, определяющих эмиг-
рацию лейкоцитов и лейкоцитарную инфильтрацию тканей. Сво-
боднорадикальные процессы могут изменять деятельность систем,
ответственных за разрушение медиаторов воспаления. В частности,
установлено, что радикалы кислорода инактивируют a i -антитрип-
син, повышая тем самым протеолитическую активность плазмы
крови и способствуя образованию кининов [Janoff A., Carp Н.,
1982]. При остром воспалении свободнорадикальные процессы вы-
зывают разрушение межклеточного матрикса, но могут также сти-
мулировать синтез его волокон; они оказывают повреждающее дей-
ствие на фибробласты, но могут участвовать в их пролиферации и
созревании [Герасимов А. М., Фурцева Л. Н., 1986; Robbins S. L.
et al., 1984 ]. В связи с важной ролью свободнорадикальных процессов
в патогенезе воспаления естественные и синтетические антиокси-
данты используют в терапии определенных форм воспаления.
. Медиаторы полиморфно-ядерных лейкоцитов, моноцитов и лим-
фоцитов. Гранулоциты не только осуществляют фагоцитоз, но и
выделяют группу высокоактивных химических медиаторов, которые
вызывают различные реакции в очаге воспаления, формируя его
проявления. Ряд медиаторов, выделяемых ПЯЛ, вырабатывается не
только этими клетками, но и моноцитами, лаброцитами и эндоте-
лиальными клетками. К таким медиаторам относятся ФАТ и ХФЭ
[Pincard N., 1982; Movat Н., 1985]. ФАТ представляет собой про-
изводное фосфорилхолина; помимо агрегации и реакции высвобож-
дения тромбоцитов, он повышает проницаемость микрососудов, уси-
ливает экссудацию плазмы и эмиграцию лейкоцитов во внесосуди-
стую среду. При остром воспалении действие ФАТ может
реализоваться с помощью гистамина и серотонина, которые высво-
бождаются из тромбоцитов при действии на них этого фактора.
ФАТ усиливает высвобождение гидролитических ферментов из ли-
созом ПЯЛ и стимулирует в них свободнорадикальные процессы,
сопровождающиеся усилением выделения радикалов кислорода. ХФЭ
высвобождается из ПЯЛ, лаброцитов и базофилов. Этот медиатор
обеспечивает скопление эозинофильных лейкоцитбв в очаге воспа-
ления, вызываемого паразитами и аллергенами. Эозинофилы имеют
также важное значение в прекращении местных воспалительных
изменений.
В очаге воспаления ПЯЛ выделяют и более специфические для
них вещества, которые называются гранулоцитарными факторами.
К ним относятся катионные белки, нейтральные и кислые протеазы.
92
Катионные белки способны высвобождать гистамин и с его помощью,
а также непосредственно воздействуя на микрососуды, повышать
их проницаемость, они обладают хемотаксическими свойствами в
отношении моноцитов, ингибируют миграцию гранулоцитов. Среди
нейтральных протеаз имеются эластаза, коллагеназа, некоторые
катепсины и протеаза с кининогенной активностью. Основной эф-
фект нейтральных протеаз в очаге острого воспаления состоит в
деструкции волокон базальной мембраны сосудов и повышении со-
судистой проницаемости. Кислые протеазы проявляют свою актив-
ность в условиях ацидоза и воздействуют на мембраны микроорга-
низмов и собственных структур [Movat Н., 1985].
Моноциты (A-система) и лимфоциты (В- и Т-система) выделяют
большое количество соединений — монокинов и лимфокинов, ко-
торые составляют ряд медиаторов, принимающих участие главным
образом в развитии иммунного воспаления. Их делят на три группы:
лимфотоксины, факторы бласттрансформации, или митогенные фак-
торы, и факторы, изменяющие течение иммунных реакций [Хаи-
тов Г. А., Атауллаханов Р. И., 1981; Rocklin R. Е., 1980].
Лимфотоксины реализуют киллерную активность моноцитов и
лимфоцитов, которые активируются антигенами или митогенами и
вызывают лизис клеток-мишеней. Они представляют собой белковые
вещества, обладающие свойствами цитотоксинов. Уничтожение кле-
ток-мишеней может осуществляться фагоцитами с помощью свобод-
норадикального и лизосомного механизмов, а также их комбинации
[Беклемишев Н. Б., 1986]. При клеточно-опосредованном лизисе
антитела фиксируются на объекте лизиса, к ним с помощью Fc-pe-
цепторов присоединяются фагоциты или Т-киллеры, а в дальнейшем
происходит либо фагоцитоз (при небольшом размере объекта), либо
экстрацеллюлярное уничтожение с помощью радикалов кислорода
и лизосомных ферментов (при большом размере объекта). Предпо-
лагают, что при гранулематозном воспалении свободнорадикальный
механизм, осуществляемый моноцитами, наиболее активно дейст-
вует в начале образования гранулемы и на высоте ее развития, но
по периферии узелка. Иными словами, этот механизм лизиса кле-
ток-мишеней эффективен лишь в аэробных условиях, в отсутствие
тяжелой гипоксии тканей. Моноциты, находящиеся в центре гра-
нулемы на высоте ее развития, подвергаются кислородному голо-
данию. По мнению Н. Б. Беклемишева (1986), в этих условиях
генерация активных форм кислорода ограничена и наиболее эффек-
тивным становится лизосомный механизм уничтожения клеток-ми-
шеней. Вместе с тем маловероятно, что гипоксия тканей ограничи-
вает свободнорадикальные процессы; наоборот, есть много данных,
свидетельствующих об усилении перекисного окисления липидов
при гипоксическом и ишемическом повреждении [Демуров Е. А.,
Игнатова В. А., 1985]. Из лизосомных ферментов наибольшее зна-
чение имеют эластаза, коллагеназа и катепсины, разрушающие
эластичный каркас тканей, коллагеновые волокна и белковые струк-
туры, например, хряща, как при ревматоидном артрите. Генерация
эктивных форм кислорода и интенсивность лизосомного расщепления
93
клеток-мишеней моноцитами зависят от действия медиаторов, мо-
дулирующих иммунную реакцию, например интерлейкинов.
Факторы бласттрансформации, или митогенные факторы, обес-
печивают пролиферацию и созревание иммуноцитов при действии
на них соответствующего антигенного стимула. Из этих медиаторов
наибольшее значение имеет группа веществ, продуцируемых мак-
рофагами и Т-лимфоцитами, которые получили название «интер-
лейкины» (ИЛ-1, ИЛ-2, ИЛ-3 и др.). Данные медиаторы представ-
ляют собой белки, отличающиеся друг от друга по физико-хими-
ческим свойствам, структуре и функциональной активности
[Беклемишев Н. Д., 1986; Кульберг А. Я., 1986]. ИЛ-1 продуциру-
ется макрофагами под влиянием антигенов, комплексов антиген—
антитело и др. Он усиливает индуцированную митогенами проли-
ферацию Т-лимфоцитов и антигензависимую активацию В-лимфо-
цитов, а также трансформацию последних в плазматические клетки,
продуцирующие иммуноглобулины. Помимо этого, ИЛ-1 стимули-
рует образование гепатоцитами белков острой фазы воспаления,
повышает синтез простагландинов соединительнотканными клетка-
ми, активирует выработку коллагеназы лизосомами моноцитов и
вызывает пролиферацию фибробластов, способствуя формированию
гранулем. ЙЛ-1 обладает пирогенной активностью; не исключено,
что он идентичен или подобен лейкоцитарному пирогену [Duff G.,
Duvum S., 1983]. Есть основания предполагать, что действие ИЛ-1
на Т-лимфоциты и другие клетки не прямое, а опосредуется ИЛ-2.
ИЛ-2 вырабатывается Т-лимфоцитами, и эти же клетки чувстви-
тельны к ИЛ-1.
ИЛ-2 представляет собой белок, чувствительный к действию
протеаз. Рецепторы к ИЛ-2 имеются на мембранах Т-хелперов и
других субпопуляций Т-лимфоцитов с регуляторными и эффектор-
ными свойствами. ИЛ-2 значительно усиливает реакцию бласттранс-
формации Т-лимфоцитов на митогены и стимулирует продукцию
ими интерферона, ответственного за регуляцию образования имму-
ноглобулинов. ИЛ-3 является гликопротеидом, который продуциру-
ется клетками костного мозга и относится к ростовым факторам.
Он усиливает пролиферацию предшественников клеток гранулоци-
тарного ряда, а также полипотентных предшественников эритроид-
ного и лимфоидного ростков кроветворения [Greenberger J. et al.,
1983]. Количество выделенных интерлейкинов продолжает увели-
чиваться [Епифанова О. И. и др., 1988 ]. Обнаружено, что Т-хелперы
продуцируют ИЛ-4, представляющий собой белок, стимулирующий
пролиферацию не только некоторых типов Т-лимфоцитов, но и
лаброцитов. Цитотоксические Т-лимфоциты вырабатывают полипеп-
тид ИЛ-5, усиливающий пролиферацию и дифференцировку В-лим-
фоцитов.
Среди факторов, изменяющих течение иммунных воспалитель-
ных реакций, внимание привлекает фактор, тормозящий миграцию
макрофагов (MIF), который способствует их скоплению в очаге
воспаления. Он повышает фагоцитарную активность макрофагов и
принимает участие в формировании гранулем. M1F Представляет
94
собой белок, синтезируемый В- и Т-лимфоцитами при их антигенной
или митогенной стимуляции. Помимо этого медиатора, макрофаги
и лимфоциты выделяют хемотаксические факторы, обеспечивающие
скопление ПЯЛ разных видов в очаге иммунного воспаления, фак-
торов, повышающих проницаемость сосудов, и др.
Немаловажное значение в развитии иммунного воспаления име-
ет белок интерферон (IFN); его разновидности образуют целое
семейство. IFN-« и IFN-j? имеют характерное для всего семейства
свойство тормозить трансляцию мРНК вирусного или клеточного
происхождения [Epstein F. et al., 1980]. Именно этот эффект
лежит в основе типичного для всех интерферонов торможения
размножения клеток. Есть основания предполагать, что антипро-
лиферативная активность интерферона может реализоваться не
только непосредственно, но через другие медиаторы, в частности
путем увеличения образования простагландинов, некоторые из ко-
торых обладают такой способностью [Fuse A. et al., 1982 ]. IFN-«
и IFN-/? оказывают влияние не только на пролиферацию, но и
эффекторную функцию клеток; интерфероны этих типов повыша-
ют реактивность цитотоксических Т-лимфоцитов [Toy J., 1983].
Сенсибилизированные В- и Т-лимфоциты при действии на них
специфического аллергена или митогена выделяют IFN-y, который,
помимо антипролиферативного эффекта, обеспечивает регуляцию
фагоцитарной активности макрофагов. Последние под влиянием
данного интерферона приобретают способность фагоцитировать
опухолевые и микробные клетки. Моноциты и лимфоциты, помимо
названных выше, выделяют большое количество (не менее 100)
других медиаторов, однако их действие соответствует действию
медиаторов описанных выше групп (см. также соответствующие
разделы главы 4).
3.3.3. Взаимодействие медиаторов
в динамике воспаления
Взаимодействие медиаторов в динамике воспаления весьма разно-
образно. Некоторые из них депонируются вместе в одних клетках
и, высвобождаясь, формируют различные проявления воспаления.
Так, при повреждении тканей из лаброцитов или базофилов вместе
с гистаминами может высвобождаться ФАТ. В результате этого
наряду с характерными эффектами гистамина активируется система
гемостаза и могут возникать тромбы в микрососудах. В другом
случае, например при тяжелом иммунном воспалении, может по-
нижаться свертываемость крови вследствие усиленного высвобожде-
ния из лаброцитов гепарина вместе с гистамином. Связь отдельных
медиаторов или их групп может быть обусловлена общими законо-
мерностями их образования. Например, в зависимости от конкретных
Условий каскадный процесс превращения арахидоновой кислоты идет
Разными путями с образованием ПГ12, тромбоксана Аг или ПГЕг.
95
В соответствии с этим могут преобладать различные проявления
воспаления. Из одного субстрата (арахидоновая кислота) образуются
разные медиаторы — простагландины и лейкотриены, и в зависи-
мости от направления синтеза возможны модуляции проявлений
воспаления.
Связь отдельных медиаторов осуществляется и другими путями.
Некоторые медиаторы воспаления могут потенцировать определен-
ные эффекты других медиаторов. Простагландины, например, уси-
ливают действие гистамина, а интерферон реализует свой антипро-
лиферативный эффект через простагландины. Все же характерным
для взаимосвязи медиаторов или их групп является то, что они
стимулируют образование (высвобождение) или подготавливают ус-
ловия для проявления действия других медиаторов. Так, кинины,
фрагменты комплемента, тромбин активируют фосфолипазу Аг, а
высвобождение арахидоновой кислоты является важным условием
усиленного образования простагландинов, лейкотриенов или хемо-
таксических липидов. С5-фрагмент комплемента способен усиливать
высвобождение гистамина, стимулировать свободнорадикальные про-
цессы и, следовательно, обеспечивать условия для эмиграции лей-
коцитов и лейкоцитарной инфильтрации тканей. Сами медиаторы
могут способствовать накоплению в очаге воспаления ферментов,
которые разрушают эти медиаторы. Высвобождаемый из лаброцитов
ХФЭ привлекает сюда эозинофильные лейкоциты, которые содержат
большое количество ферментов, разрушающих медиаторы. Наряду
скатим возможны ситуации, при которых медиаторы длительное
время сохраняют высокую эффективность. Известно, что накапли-
вающиеся в очаге воспаления радикалы кислорода инактивируют
а 1-антитрипсин и стабилизируют таким образом кинины плазмы
крови и тканей [Janoff A., Carp Н., 1982].
Медиаторы воспаления представляют собой сигналы, обеспечи-
вающие обмен информацией между клетками, взаимодействие их
в процессе уничтожения повреждающих агентов. С этой точки зре-
ния, всю совокупность медиаторов следует рассматривать как единую
систему управления, все компоненты которой связаны между собой.
Система медиаторов не только вызывает разнообразные реакции в
очаге воспаления, но и определяет их связи и взаимозависимость.
В результате этого отмечается стереотипность проявлений воспале-
ния, обязательно включающего разнообразные компоненты — аль-
терацию, экссудацию, инфильтрацию, фагоцитоз, пролиферацию и
др. Наряду с этим система медиаторов определяет индивидуальные
характеристики воспалительного процесса, связанные с вариациями
синтеза, высвобождения и распада, а также особенностями связи
различных медиаторов воспаления. Отношения, которые складыва-
ются между различными группами медиаторов, определяют поддер-
жание интенсивности воспалительного процесса или его затухание.
Особенно отчетливо системность управления проявляется в динамике
развития воспаления.
Воспаление является развивающимся процессом, имеющим ряд
стадий, закономерно сменяющих друг друга. На каждой стадии
96
развития воспаления при прочих равных условиях основное значение
имеет определенная группа (или группы) медиаторов/ Так, при
остром воспалении первоначально наиболее важную роль в форми-
ровании его проявлений играют биогенные амины — гистамин и
серотонин. Эти медиаторы, повышая проницаемость стенок микро-
сосудов и вызывая усиленную экссудацию, а в некоторых случаях
непосредственно воздействуя на заинтересованные процессы, вклю-
чают систему кининов, комплемента и гемостаза. В дальнейшем
вследствие активации фосфолипазы Аг, накопления радикалов кис-
лорода и других факторов стимулируется арахидоновый каскад и
усиливается образование простагландинов и лейкотриенов. Наконец,
позднее особенно активно включаются клеточные механизмы защи-
ты. Вначале лейкоцитарная инфильтрация происходит за счет ПЯЛ,
а затем — моноцитов и лимфоцитов. В результате этого уничто-
жаются или элиминируются повреждающий агент, а также продукты
распада собственных тканей.
Представленную последовательность включения медиаторов в
патогенез и морфогенез воспаления следует рассматривать лишь
как общую схему, которая может иметь место при остром вос-
палении. При этой форме, а тем более других формах воспаления
возможны иные закономерности включения медиаторов. Даже при
остром воспалении медиаторы, которые образуются (высвобожда-
ются) одними из первых, могут одновременно включать несколько
последующих групп. Например, высвобождение гистамина может
привести сразу и к активации системы кининов, и включению
свободнорадикальных механизмов, и лейкоцитарной инфильтрации.
В то же время ПЯЛ в определенных ситуациях, особенно в случае
ухудшения течения процесса, дополнительно стимулируют лабро-
циты (гранулоцитарные факторы), активируют систему кининов
(кининоактивирующий фактор) и, генерируя радикалы кислорода,
усиливают образование простагландинов и лейкотриенов. Предпо-
ложительно рассмотренные выше обратные связи обеспечивают
пролонгирование воспаления, ухудшение течения процесса или его
периодические обострения.
3.3.4. Понятие об антимедиаторах воспаления
Наличие своеобразного каскада тесно связанных между собой ме-
диаторов воспаления ставит важный вопрос о механизмах самосто-
ятельного прекращения воспаления в том случае, когда поврежда-
ющий агент уничтожен, структура и функция ткани восстановлена.
Не менее важен и другой вопрос, касающийся механизмов предуп-
реждения избыточного накопления медиаторов воспаления и их
поступления в общую систему циркуляции крови, что в ряде случаев
приводит к крайне опасным состояниям — шоку, коллапсу, ДВС-
синдрому и др.
На всех этапах развития воспаления высвобождаются и начинают
Действовать вещества, которые предупреждают избыточное накоп-
4—407
97
ление или прекращают влияние медиаторов. В своей совокупности
данные вещества, как и сами медиаторы гуморального и клеточного
происхождения, могут быть объединены в систему антимедиаторов
воспаления.
Соотношение медиаторов и антимедиаторов воспаления во многом
определяет особенности формирования, развития и прекращения
воспалительного процесса.
Среди антимедиаторов воспаления наиболее видное место за-
нимают ферменты: гистаминаза, разрушающая гистамин; карбок-
сипептидазы, вызывающие распад кининов; эстеразы, ингибирую-
щие фракции комплемента; простагландиндегидрогеназа, разруша-
ющая простагландины; супероксиддисмутаза и каталаза, инакти-
вирующие радикалы кислорода, и др. Важную роль в образовании
и доставке антимедиаторов в очаг воспаления играют эозинофилы.
Помимо своей специфической функции в развитии иммунного
воспаления или воспаления, вызываемого паразитами, эти клетки
выполняют функцию фактора, прекращающего воспалительный
процесс. Важно то, что клетки, которые принимают наиболее
активное участие в формировании острого воспаления (лаброциты,
базофилы и нейтрофилы), высвобождают ХФЭ, обеспечивающий
скопление в очаге эозинофильных лейкоцитов. Эозинофилы по-
глощают антигены и иммунные комплексы, а также выделяют
практически все антимедиаторные ферменты. Кроме названных
выше ферментов, в эозинофилах содержится арилсульфатаза, раз-
рушающая лейкотриены (МРВ-А), не только ферментные, но и
неферментные антиоксиданты.
Помимо местных механизмов, оптимальный медиаторный ре-
жим воспалительного процесса поддерживают системные гумораль-
ные, в том числе нервные, влияния, которые могут выполнять
антимедиаторную функцию. Такую роль играет а] -антитрипсин,
представляющий собой гликопротеид плазмы, образующийся в ге-
патоцитах. Он является ингибитором протеаз (трипсина, хемо-
трипсина, плазмина, тромбина, калликреина и др.), и на его долю
приходится 88% всей антипротеазной активности плазмы крови.
Остальную часть антипротеазной активности плазмы обеспечивают
а 2-макроглобулин и интер-а-трипсин-ингибитор [Мусил Я., 1985].
Один из наиболее важных эффектов этих антипротеаз состоит в
торможении образования кининов. К антимедиаторам воспаления
следует отнести глюкокортикоидные гормоны (кортизол, кортизон
и кортикостерон), обладающие противовоспалительной и противо-
аллергической активностью. Кортикостероиды ослабляют проявле-
ния воспаления, воздействуя на разные процессы; в очаге воспа-
ления ослабляют сосудистые реакции, стабилизируют мембраны
микрососудов, уменьшают экссудацию и эмиграцию лейкоцитов,
ослабляют фагоцитоз. Немаловажное значение при этом играют
антимедиаторные эффекты кортикостероидов. Последние уменьша-
ют образование и высвобождение гистамина, снижают чувстви-
тельность Hi-гистаминовых рецепторов, стабилизируют мембраны
лизосом и снижают активность кислых лизосомных гидролаз, а
98
также выработку кининов и простагландинов [Ошват IL, 1983].
Особенно ярко антимедиаторные эффекты глюкокортикоидов про-
являются при иммунном воспалении. Ослабляя образование анти-
тел и иммунных лимфоцитов, они предупреждают или уменьшают
включение медиаторов в патохимическую стадию аллергии. По-
мимо этого, кортикостероиды уменьшают образование медиаторов
не только немедленной, но и замедленной гиперчувствительно-
сти, в результате чего снижается киллерная активность Т-лим-
фоцитов, тормозятся их пролиферация и созревание [Ошват П.,
1983].
ГЛАВА 4
МОРФОЛОГИЯ ВОСПАЛЕНИЯ
4.1. ЭФФЕКТОРНЫЕ КЛЕТКИ ВОСПАЛЕНИЯ
Процесс воспаления складывается из биохимических и морфологи-
ческих реакций, которые невозможно отделить друг от друга. Однако
для того чтобы механическое, физическое, химическое или инфек-
ционное повреждение тканей привело к их воспалению, необходимо
множество химических веществ, обладающих хемотаксическими
свойствами, благодаря которым в очаге повреждения образуется
специфическая клеточная кооперация. Клетки, взаимодействуя меж-
ду собой, выделяют свойственные им медиаторы воспаления, в ре-
зультате чего и появляются морфологические особенности, харак-
теризующие воспаление.
4.1.1. Полиморфно-ядерные лейкоциты
В воспалительном процессе полиморфно-ядерные лейкоциты (ПЯЛ),
или нейтрофилы, нейтрофильные гранулоциты, нейтрофильные лей-
коциты, выполняют две функции: ретулируют поведение клеток,
участвующих в воспалении; разрушают и удаляют вызвавшие вос-
паление агенты и поврежденные ткани, образовавшиеся в результате
действия этих агентов. Первую функцию осуществляют все виды
гранулоцитов: эозинофилы, базофилы, нейтрофилы. Выполнение
второй функции связано со способностью к фагоцитозу. В опреде-
ленной степени этой способностью обладают все виды гранулоцитов,
однако по существу уничтожение агентов воспаления и поврежден-
ных тканей сводится к участию в этом процессе нейтрофилов. Это
связано с тем, что эозинофилы и базофилы существенно уступают
нейтрофилам в реакции фагоцитоза.
В созревании ПЯЛ различают следующие стадии: 1) стволовая
плюрипотентная клетка костного мозга; 2) миелобласт; 3) проми-
елоцит; 4) миелоцит; 5) метамйелоцит; 6) палочкоядерный нейт-
рофил; 7) зрелый гранулоцит. В первых четырех стадиях клетки
способны к синтезу ДНК и делению путем митоза, на следующих
происходит дифференцировка без митоза.
Нейтрофилы — чрезвычайно своеобразные клетки; они сущест-
венно отличаются от других клеток организма, которые характери-
зуются сбалансированным обменом с периодическими отклонениями
уровней синтеза и распада и возвратами их к положению равновесия.
100
Нейтрофил — клетка с небольшой, измеряемой часами, продолжи-
тельностью жизни, основная функция которой заключается в раз-
рушении возбудителей инфекции, видоизмененных клеток и тканей,
а также в регулировании функции других клеток. Как разрушение,
так и регуляторные функции осуществляются в значительной сте-
пени за счет веществ, образованных и накопленных в нейтрофиле
в предшествующих стадиях развития. Исключением являются био-
оксиданты, образующиеся в уже зрелом нейтрофиле, хотя и с уча-
стием накопленного ранее гликогена. Эволюция, превратившая ней-
трофил в хранилище разрушающих и токсичных веществ, «сделала
исключение» для биооксидантов только потому, что они не могут
накапливаться и храниться в клетке, а используются по мере об-
разования. Биооксиданты существенно дополняют микробицидный
и цитотоксический потенциалы нейтрофила и образуют ряд биоло-
гически активных веществ за счет окисления веществ-предшествен-
ников из состава самих клеток и жидкостей организма (см. выше).
Будучи специализированным разрушителем, нейтрофил в ходе этой
деятельности разрушается и сам.
Синтез и распад в нейтрофиле осуществляются не одновременно,
как в других клетках, а последовательно: вначале происходйт на-
копление веществ, затем — их расходование. Преобладание процесса
ассимиляции или диссимиляции на отдельных этапах развития ней-
трофилов настолько выраженное, что клетка приобретает соответ-
ственно превалирующему в ней процессу особую морфологию, по
которой ее идентифицируют. Выраженные различия в скорости ас-
симиляции четко выявляются при электронно-радиоавтографическом
исследовании синтеза макромолекулярных веществ (рис. 4.1). Таким
образом, если иметь в виду относительные уровни процессов асси-
миляции и диссимиляции, то следует различать нейтрофил пери-
ферической крови, в котором оба процесса находятся на крайне
•низком уровне, и нейтрофил очага воспаления, где преобладает
диссимиляция. Процесс ассимиляции превалирует в стадиях созре-
вания нейтрофилов.
Специфические для нейтрофилов структуры появляются в стадии
промиелоцита. Это самая большая клетка в ходе развития нейтрофила.
Увеличение ее размера происходит за счет расширения зоны цито-
плазмы, которой присущи черты, характерные для клеток с выраженной
продукцией белка: обилие элементов гранулярной цитоплазматиче-
ской сети, хорошо развитый пластинчатый комплекс. В ядре промие-
лоцита еще содержится ядрышко. Особенность промиелоцита — появ-
ление первичных, азурофильных, пероксидазоположительных гранул.
Выявление миелопероксидазы — лучший энзиматический маркер пер-
вичных гранул. Продукцией гранул объясняются свойственные про-
миелоцитам черты клетки — производителя белка. О занятости бел-
кового «конвейера» наработкой первичных гранул свидетельствует тот
факт, что гранулярная цитоплазматическая сеть и пластинчатый ком-
плекс промиелоцита оказываются пероксидазоположительными. Бла-
годаря наличию кислой фосфатазы и многих других кислых гидролаз
первичные гранулы нейтрофилов относят к лизосомам.
101
Рис. 4.1. Изменение синтеза РНК на этапах развития нейтрофилов.
Большое число зерен серебра над ядром промиелоцита (П) указывает на
интенсивный синтез РНК в этой клетке. В расположенном рядом зрелом
нейтрофиле (Н) синтеза РНК не происходит. Электронно-микроскопиче-
ский радиоавтограф клеток крови больного сепсисом. * 22 000.
Количество первичных гранул увеличивается по мере созрева-
ния промиелоцита, и, наконец, в клетке появляются вторичные,
специфические гранулы. Они называются так потому, что не
102
содержат кислых гидролаз и, следовательно, не являются лизосо-
мами, т. е. свойственны не многим видам клеток, а только ней-
трофилам. Появление вторичных гранул означает переход пред-
шественника нейтрофила в следующую стадию — миелоцит. На
этой стадии в ядре клетки уже нет ядрышка; гранулярная ци-
топлазматическая сеть и пластинчатый комплекс сохраняются, но
перестраиваются на производство вторичных гранул, о чем сви-
детельствуют отрицательные результаты окраски этих элементов
цитоплазмы на пероксидазу. Количество первичных гранул в клет-
ке уже не увеличивается, у человека они утрачивают азурофилию,
становятся нейтрофильными, а количество специфических гранул
нарастает. К концу стадии миелоцита их становится больше, чем
первичных. Во вторичных гранулах содержится щелочная фасфа-
таза, но у человека она не является их специфическим маркером,
поскольку ее обнаруживают и в других структурах клетки. На
стадии миелоцита в цитоплазме клетки происходит накопление
гликогена.
Следующие стадии развития (метамиелоцит, юный и сегменто-
ядерный нейтрофил) протекают без митоза и морфологически ха-
рактеризуются нарастанием конденсации ядра, а затем его разде-
лением на сегменты, уменьшением количества элементов грануляр-
ной цитоплазматической сети, пластинчатого комплекса, рибосом,
митохондрий.
Относительно продолжительности развития и жизни нейтрофилов
в норме имеются следующие данные: митотические стадии клетка
проходит в костном мозге за 5—7 дней; постмитотические, до выброса
из костного мозга в кровь — приблизительно за 5 дней; циркуляция
в крови длится около 10 ч; в тканях зрелый нейтрофил живет 1—2
дня. Очень важный аспект созревания нейтрофилов — увеличение
способности к реагированию на специфические стимулы и образо-
вание рецепторов клеточной поверхности для связывания антител
и комплемента.
Костный мозг человека с массой тела до 70 кг ежедневно выделяет
в кровь около 1011 нейтрофилов. Место специфической функции и
соответственно деструкции этого огромного количества' клеток в
здоровом организме пока точно не известно. Вполне вероятно, что
нейтрофилы гибнут, обеспечивая стерильность подкожной и под-
слизистой тканей (прежде всего пищеварительного и дыхательного
трактов); указанный ежедневный оборот является «платой» за под-
держание здоровья.
Зрелый нейтрофил может существовать в двух состояниях —
покоя и активации. Покоящиеся нейтрофилы находятся в крови,
активированные — в тканях или очаге воспаления. В крови нейт-
рофил не может осуществлять специфическую функцию. Пребыва-
ние в крови является для нейтрофилов лишь способом перемещения
от места образования (костный мозг) к месту выполнения специ-
фической функции (ткани, очаг воспаления). Эта реакция — по-
вышение адгезивности, благодаря которой нейтрофил из циркули-
рующего становится маргинальным и прилипает к стенке сосуда.
ЮЗ
Рис. 4.2. Фиксация стафилококков на поверхности нейтрофилов (Н). К
плазматической мембране нейтрофила примыкают живые кокки, сохранив-
шие способность синтезировать РНК, на что указывают зерна серебра
над бактериальными клетками (короткие стрелки). Поглощенный нейтро-
филом кокк (указан длинной стрелкой) убит, и зерна серебра над ним
отсутствуют, к 32 000.
Затем он мигрирует из сосуда и под действием медиаторов воспа-
ления и других факторов, присутствующих в поврежденной ткани,
осуществляет адгезию, хемотаксис, респираторный взрыв, поглоще-
104
ние, дегрануляцию, экстрацеллюлярную секрецию, антимикробное
и цитотоксическое действие; внутриклеточный и внеклеточный лизис
поврежденных тканей и самих распадающихся нейтрофилов, при-
водящий к появлению биологически активных продуктов расщеп-
ления; синтез некоторых макромолекулярных веществ, вг частности
РНК.
В зависимости от вида и концентрации раздражителя может
существенно меняться и реакция нейтрофила [Andrews Р.,
Babior В., 1984]. Эта реакция модулируется количественно и даже
качественно факторами, образующимися в очаге воспаления или
присутствующими в плазме крови [Саркисов Д. С. и др., 1986].
Наиболее известные из них — комплемент и иммуноглобулины.
По исторически сложившейся традиции опсонизацию, т. е. воздей-
ствие комплемента и иммуноглобулинов на функцию нейтрофилов,
выявляют и оценивают количественно по поглощению объектов
фагоцитоза, хотя как раз на поглощение опсонины, возможно,
вообще не влияют, по крайней мере об этом ничего не известно.
Наиболее подробно изучено влияние опсонинов, особенно имму-
ноглобулинов, на адгезию объектов фагоцитоза к нейтрофилам.
Установлено, что иммуноглобулины одной частью своей молекулы,
обозначенной как F(ab) 2-фрагмент, связываются с поверхностью
фагоцитируемого объекта, а другая часть молекулы — терминаль-
ные концы тяжелых цепей (Fc-фрагмент) — остается свободной
на внешней поверхности комплекса объект фагоцитоза—антитело.
На клеточной поверхности нейтрофилов и других фагоцитов име-
ются рецепторы для Fc-фрагмента. Взаимодействие рецепторов и
Fc-фрагментов обеспечивает фиксацию (адгезию) фагоцитируемых
объектов на поверхности фагоцита (рис. 4.2). Если микроб или
другой объект фагоцитоза окружен Fc-фрагментами со всех сторон
и все фрагменты свяжутся с рецепторами клеточной поверхности,
то фагоцитируемый объект окажется погруженным в фагоцит (фа-
госому) полностью (рис. 4.3).
В случае опсонизации комплементом происходит его активация
по классическому (взаимодействие с комплексом иммуноглобулин —
антиген) или альтернативному (взаимодействие с липосахаридами
клеточной стенки и капсулы бактерий и других микроорганизмов)
пути. При активации компонент комплемента СЗ разделяется на
Два фрагмента — СЗа и СЗЬ. Фрагмент СЗ связывается с поверх-
ностью объекта фагоцитоза, другой частью молекулы этот фрагмент
способен связываться со специфическим рецептором на поверхности
нейтрофила. Следовательно, комплемент вносит значительный вклад
в опсонизацию как в иммунизированных (классический путь), так
и в неиммунизированных (альтернативный путь) организмах. Вы-
делены бактериальные протеиназы, которые могут расщеплять СЗ
на СЗа и СЗЬ, минуя ферментные системы классического и альтер-
нативного путей [А. Н. Маянский, Д. Н. Маянский, 1983]. Это обес-
печивает дополнительные возможности опсонизации комплементом
в неиммунизированных организмах. Таким образом, способствуя
адгезии, опсонины значительно усиливают поглощение фагоцити-
105
Рис. 4.3. Этапы поглощения живых (интенсивно синтезирующих РНК)
бактерий нейтрофилами (Н). Одна бактерир (указано короткой стрелкой)
поглощена примерно наполовину; другая бактерия (указано длинной
стрелкой) поглощена полностью, однако полость фагосомы еще не замкнута.
Виден поперечный срез .псевдоподии, содержащей формирующуюся фаго-
сому с живой бактерией (указано двойной стрелкой), х 16 000.
руемых объектов. В благоприятных условиях поглощение заверша-
ется через 10—30 с . после контакта этого объекта и фагоцита
[Ryter A., De Chastellier Ch., 1983].
Доказано, что опсонизация повышает микробицидносгь, цито-
токсичность и переваривающую способность нейтрофилов, однако
механизм этого повышения исследован в меньшей степени, чем
механизм адгезии. Микробицидносгь и цитотоксичность нейтро-
филов в значительной степени связаны с. действием оксидантов,
образующихся в зрелом активированном нейтрофиле при так на-
зываемом респираторном взрыве (см. выше) — значительном, в
10—15 раз, увеличении потребления кислорода клетками [Roos D.,
1980]. Респираторный взрыв нейтрофилов отличается от дыхания
других клеток: он осуществляется немитохондриальными фермен-
тами, расположенными на плазматической и фагосомной мембра-
нах. Восстановление потребляемого нейтрофилами кислорода про-
исходит не до молекул воды, как это свойственно митохондри-
альной цитохромной системе, а до перекиси водорода. Проме-
жуточным радикалом при образовании перекиси водорода является
еще один токсичный оксидант — супероксидный анион. Предпо-
лагают, что при респираторном взрыве образуются и такие реак-
ционноспособные частицы, как гидроксильный радикал и синглет-
ный кислород. Между моментом связывания стимулятора с рецеп-
торами клеточной поверхности и началом образования супероксид-
ного аниона имеется лаг-период продолжительностью 16—60 с и
более в зависимости от вида стимулятора. Скорость поглощения
кислорода и образования супероксида начинает снижаться через
20—30 мин после активации и через 1 ч становится в несколько
раз ниже начальной скорости. Эта дезактивация необратима: путем
вторичной стимуляции не удается возобновить респираторную ак-
тивность.
Функции, не связанные с образованием оксидантов, нейтрофилы
могут нормально осуществлять и в отсутствие кислорода за счет
энергии анаэробного гликолиза. Эффект основного биооксиданта
нейтрофилов — перекиси водорода — многократно усиливается в
случае присутствия в фагосоме миелопероксидазы и галогена. Ми-
елопероксидаза — перекись водорода — галоген образуют антимик-
робную систему нейтрофила, токсичную для бактерий, грибов, ми-
коплазм, вирусов, хламидий и многих мелких многоклеточных ор-
ганизмов. Эта система токсична также для некоторых клеток
млекопитающих: сперматозоидов, эритроцитов, тромбоцитов, опу-
холевых клеток.
Гипоксия ингибирует микробицидносгь нейтрофилов, но не ус-
траняет ее полностью. Более того, имеются сведения о том, что
эффективность подавления жизнедеятельности бактерий в аэробных
и анаэробных условиях может существенно не различаться [Vel W.
et al., 1984 ]. Это свидетельствует о том, что существуют независимые
°т кислорода механизмы микробицидности. В настоящее время из-
вестно, что гидролитические ферменты первичных гранул ответст-
венны за переваривание убитых микроорганизмов и тканевых фраг-
107
ментов, поглощенных нейтрофилами. Подавление жизнеспособности
осуществляют оксиданты, а также специальные вещества, содержа-
щиеся в гранулах: пептидные антибиотики — дефензины (первичные
гранулы); лизоцим, катионные белки (первичные и вторичные гра-
нулы); кобалофилин, лактоферрин (вторичные гранулы). Эти ве-
щества тормозят рост микробов и действуют микробицидно, но не
имеют существенного значения для переваривания.
Принципиальным отличием заключенных в гранулах антимик-
робных факторов от оксидантной системы является то, что их об-
разование не зависит от стимуляции клеток. Создаваясь в процессе
гранулогенеза, они присутствуют в зрелом покоящемся нейтрофиле
в полном объеме, а при стимуляции лишь расходуются. Префор-
мирование многих важных для специфической функции веществ и
свойств нейтрофила находит отражение и в том, что значительное
количество микробицидных и цитотоксических реакций осуществ-
ляется одинаково как живыми, так и убитыми и разрушенными
нейтрофилами [Пигаревский В. Е., 1978; Lundgren J. et al., 1968].
Для исследования микробицидной и переваривающей способности
нейтрофилов большое значение имели эксперименты, выполненные
с помощью электронно-микроскопической радиоавтографии [Паль-
цын А. А. и др., 1987, 1988], позволившие не только наблюдать,
но и количественно определять микробицидную и переваривающую
способности каждой клетки (рис. 4.4).
Существование экстрацеллюлярной секреции нейтрофилов пред-
полагал еще П. Эрлих (1887). Однако в дальнейшем о ней забыли
и считали, что гранулы нейтрофилов выделяются только в фагосомы.
Это представление сложилось под влиянием авторитета И. И. Меч-
никова, а затем укрепилось благодаря обнаружению гидролитиче-
ских ферментов в первичных гранулах, что указывало на их лизо-
сомальную природу и хорошо' согласовывалось с учением о внут-
риклеточном разрушении, происходящем во многих типах клеток с
помощью лизосом. К идее экстрацеллюлярной секреции вернулись
только в 60—70 гг. XX века, когда стали обнаруживать компоненты
гранул во внеклеточной среде' при токсических воздействиях на
нейтрофилы и в ходе фагоцитоза. В настоящее время получены
данные, свидетельствующие о том, что вторичные гранулы и их
содержимое выделяются легче, чем первичные. Например, лизоцим
и лактоферрин быстрее и в большем количестве появляются во
внеклеточной среде, чем кислые гидролазы и пероксидазы [Wright
D. G., 1982]. Детальные исследования экстрацеллюлярной секреции
показали, что не только при фагоцитозе, но и при ряде других
воздействий (неспецифическая адгезия, влияние хематтрактантов)
вторичные гранулы проявляют более выраженную способность к
выходу во внеклеточную среду, чем первичные. Более того, были
обнаружены стимулы, которые вызывают выброс только вторичных
гранул [Anderson R., Loone G., 1984]. Выделение вторичных гранул
в окружающую среду происходит даже без каких-либо с ециальных
воздействий — при инкубации клеток в изотоническом растворе
хлорида натрия — и заметно усиливается когда нейтрофилы при-
108
Рис. 4.4. Микробицидное и переваривающее действие нейтрофила. Бактерии
2, 3, 4 поглощены нейтрофилом, не утратили жизнеспособности и
сохраняют способность синтезировать РНК. Бактерия 5, морфологически
не отличающаяся от бактерий 3 и 4, убита нейтрофилом; синтез РНК в
ней не выявляется. Бактерия 6 не убита и в значительной степени
переварена. Электронно-микроскопический радиоавтограф, х 25 000.
липают к поверхности стекла или нейлона. Селективное выделение
вторичных гранул является важным отличием экстрацеллюлярной
Дегрануляции от интрацеллюлярной, которая происходит при фа-
гоцитозе и проявляется выделением в фагосому гранул обоих типов.
109
Очень важным следствием экстрацеллюлярной секреции нейтро-
филов является регуляция воспаления. Выбрасывая многочисленные
протеазы, нейтрофилы разрыхляют базальную мембрану эндотелия,
обеспечивают расщепление комплемента, антител и других гумо-
ральных факторов с образованием ряда медиаторов, влияющих как
на сами нейтрофилы, так и на другие клетки, участвующие в
воспалении. Протеазы нейтрофилов могут разрушать медиаторы и
тем самым ослаблять воспаление. Интересная особенность функции
нейтрофилов была выявлена при изучении секреции коллагеназы
[Weiss S. J. et al., 1985]. Установлено, что коллагеназа «хранится»
в специфических гранулах в неактивной форме. Само по себе ее
выделение во внеклеточную среду не вызывает расщепления кол-
лагена. Именно в такой неактивной форме оказывается в межкле-
точном пространстве секретируемый нейтрофилами фермент при
хроническом гранулематозном воспалении. При нормальном же вос-
палении экстрацеллюлярная секреция коллагеназы сопряжена с ре-
спираторным взрывом. Генерируемая при этом перекись водорода
способствует активации коллагеназы, в результате которой в меж-
клеточную среду попадает функционально полноценный фермент.
Образованием белковых продуктов не исчерпываются возможно-
сти нейтрофилов влиять на течение воспаления. При расщеплении
фосфолипидов плазматической мембраны образуются (и секретиру-
ются) некоторые медиаторы: тромбоксаны, простагландины. При
окислительном метаболизме арахидоновой кислоты и других по-
линенасыщенных жирных кислот продуцируется еще одна группа
биологически активных веществ — лейкотриенов. Для того чтобы
представить возможности нейтрофилов в регуляции патологических
процессов хотя бы с помощью лейкотриенов, достаточно упомянуть,
что среди последних есть вещества, действующие на сосуды, бронхи,
проницаемость, адгезию нейтрофилов к эндотелиальным клеткам,
экстравазацию лейкоцитов, хемотаксис нейтрофилов, эозинофилов
и макрофагов, экстрацеллюлярную секрецию и продукцию окси-
дантов нейтрофилами. Многочисленные данные свидетельствуют о
взаимодействии нейтрофилов с гуморальными факторами и клетками
соединительной ткани [Маянский А. Н., Маянский Д. Н., 1983].
Принципиально важно, что регуляцию воспаления не может
обеспечивать клетка, секретирующая фермент только в полость
фагосомы. Регуляция воспаления, несомненно, осуществляется пу-
тем выброса активных веществ во внеклеточное пространство. Что
же касается такого фактора воспаления, как микроб, то его роль в
интра- и экстрацеллюлярной микробицидности еще до конца не
изучена. Уничтожение микробов нейтрофилами чаще связывают
только с фагоцитозом. В то же время уже получено немало данных,
свидетельствующих о принципиальной возможности микробицидного
и цитотоксического действия экстрацеллюлярной секреции.
Расположение ферментного комплекса, ответственного за про-
дукцию оксидантов, на плазматической мембране приводит к важ-
ному следствию — экстрацеллюлярному выделению биологически
активных кислородных метаболитов при соответствующей стимуля-
110
ции [Klebanoff S. J., Clark R. A., 1978]. Возможно, экстрацеллю-
лярная концентрация оксидантов не бывает столь высока, как в
фагосоме, по крайней мере микробицидный эффект ее пока доста-
точно определенно не установлен. В противоположность этому ци-
тотоксический эффект секретируемых экстрацеллюлярно оксидантов
не вызывает сомнений [Suttorp N., Simon L., 1982; Dallegri F. et
al., 1984; Kaul T. W. et al., 1984].
В соответствии с представлением о нейтрофиле как о клетке,
почти ничего не производящей, а лишь расходующей то, что создали
ее предшественники, исследователи уделяли явно недостаточно вни-
мания особенностям синтеза в этой клетке макромолекулярных
веществ. В немногочисленных работах отмечалось, что из огромного
количества белков, имеющихся в нейтрофиле, в зрелой клетке при
ее активации образуются только пироген, хемотаксический фактор,
индуцируемый поглощением кристаллов, активатор плазминогена и
плазмокоагулирующий фактор. Эти белки, однако, синтезируются
в небольших количествах. Их производство активированными клет-
ками происходит на фоне снижения или прекращения синтеза многих
других белков, поэтому при определении общего уровня синтеза
белка по включению меченых аминокислот активированные нейт-
рофилы оказываются мечеными слабее, чем даже покоящиеся ней-
трофилы крови [Cline М. et al., 1968; Stoic V., 1981 ]. Такое снижение
белково-синтетической функции согласуется с морфологическими
изменениями активированных нейтрофилов. Если в покоящихся ней-
трофилах крови еще можно обнаружить, хотя и редуцированные,
остатки гранулярной эндоплазматической сети, рибосом и пластин-
чатого комплекса, то в активированных нейтрофилах раны исчезают
и эти остатки белково-синтетического «конвейера» [Саркисов Д. С.
и др., 1986].
Исследования включения меченых предшественников РНК по-
коящимися нейтрофилами крови показали, что в этих клетках синтез
РНК едва уловим или вообще не обнаруживается [Саркисов Д. С.
и др., 1980; Cline М., 1975]. Эти данные также хорошо сочетаются
с морфологическими характеристиками нейтрофила: отсутствием яд-
рышка в ядре, высокой степенью конденсации хроматина. Если
добавить к этому, что ингибирование синтеза РНК не отражается
на поглощении объектов фагоцитоза, интенсивности респираторного
взрыва, микробицидности и цитотоксичности [Cline М., 1975;
Dalemetall М., 1984], то можно полагать, что ядро в нейтрофиле
не выполняет никакой функции и представляет собой примерно
такой же рудимент, как ядро в эритроцитах птиц и некоторых
Ивкопитающих.
Первым фактом, противоречащим этому предположению, было
наблюдавшееся М. Cline (1966) усиление включения меченого ури-
дина в нейтрофилы человека, активированные фагоцитозом шариков
синтетического латекса. В дальнейшем сходные результаты были
получены в экспериментах с клетками, активированными эндоток-
сином кишечной палочки и конканавалином. Д. С. Саркисов и соавт.
(1986) установили, что синтез РНК в нейтрофилах повышается при
ш
Рис. 4.5. Синтез РНК в нейтрофилах ожоговой раны.
а — значительное число зерен серебра над адром нейтрофила, в цитоплазме которого резко
уменьшено количество гранул (Г); много фагосом (Ф) с тканевым детритом; наблюдается
интрацеллюлярная дегрануляция — перемещение гранул в фагосомы <Ф1>. х18 000.
б — интенсивный синтез РНК в нейтрофиле с разрушенной цитоплазмой. Большая часть
клетки занята фагосомой (Ф> с тканевым детритом. * 20 000.
фагоцитозе бактерий, причем пропорционально интенсивности фа-
гоцитоза. Однако особенно высокого уровня синтез РНК достигает
при естественной активации нейтрофилов, переместившихся в ожо-
говую рану in vivo (см. рис. 4.1, рис. 4.5, а) [Саркисов Д. С. и др.,
1984, 1986].
При дальнейшем исследовании синтеза РНК в нейтрофилах
112
ожоговой раны в этом процессе обнаружен ряд неожиданностей.
Прежде всего, высокий уровень синтеза РНК не соответствовал
упомянутым выше данным о снижении общей выработки белка в
активированных нейтрофилах. Важной морфологической особенно-
стью нейтрофилов ожоговой раны было образование многочислен-
ных фагосом, из которых лишь очень небольшая часть содержала
бактерии, а подавляющее большинство — тканевый детрит. Ней-
трофилы раны подвергались быстрому разрушению с исчезновением
гранул и других различимых в цитоплазме структур. Нередко
интенсивный синтез РНК обнаруживали в тех нейтрофилах, ко-
торые уже не содержали гранул и сохранили лишь небольшие по
объему деструктивно измененные участки цитоплазмы, а большая
часть клетки была занята фагосомами с детритом (рис. 4.5, б).
Иными словами, интенсивный синтез РНК выявляли в почти
полностью разрушенных клетках.
При определении скорости включения меченых аминокислот в
нейтрофилы раны было установлено, что белок они либо не син-
тезируют, либо синтезируют в значительно меньшем количестве,
чем нейтрофилы крови, значительно уступающие нейтрофилам
раны по интенсивности синтеза РНК [Учанеишвили Э. К., 1987].
Этот факт указывает на то, что функция синтезирующейся в
активированных нейтрофилах РНК — не обеспечение синтеза
белка, а какая-то иная. О том же свидетельствовали наблюдения
за перемещением РНК в нейтрофилах [Саркисов Д. С. и др.,
1986]. Установлено, что РНК, вновь синтезированная в активи-
рованных нейтрофилах, перемещается из ядра в цитоплазму, как
и в других клетках. Однако в отличие от них в цитоплазме
нейтрофилов РНК локализуется не на структурах белкового «кон-
вейера», которых в нейтрофилах раны практически нет, а в бес-
структурных остатках цитоплазмы, вблизи плазматической мемб-
раны и в фагосомах (рис. 4.6). Локализация РНК около плазма-
тической мембраны и в фагосомах дает основание предполагать
возможность выхода РНК за пределы клетки. Вероятно, нейтро-
филы способны синтезировать РНК не только для собственных
нужд, но и «на экспорт», т. е. не только для выполнения функций
внутри клетки, но и вне ее. До настоящего времени образование
клетками РНК «на экспорт» не описывалось, однако имеется до-
вольно обширная литература, в которой приведены данные, сви-
детельствующие о том, что с помощью искусственного введения
экзогенной РНК можно индуцировать процессы дифференцировки,
развития, регенерации и адаптации [Смирнова А. В., 1988]. Ре-
гулирование нейтрофилами функции других "клеток еще и с по-
мощью РНК кажется наиболее правдоподобным объяснением син-
теза этой нуклеиновой кислоты при активации нейтрофилов,
однако для подтверждения этого необходимы дальнейшие иссле-
дования.
Приведенные выше данные о структуре и функции нейтрофилов
дают основания считать его секреторной (включая в это понятие и
секрецию оксидантов) клеткой с наиболее развитой по сравнению
ИЗ
Рис. 4.6. Локализация РНК, переместившейся из ядра в цитоплазму
нейтрофилов ожоговой раны.
а — концентрация зерен серебра вблизи плазматической мембраны. * 17 000; б — зерна
серебра над фагосомой (Ф) нейтрофила. * 18 000.
с другими клетками организма способностью к движению. Все не-
обходимое для секреции и движения нейтрофил накапливает на
стадиях развития, предшествующих выходу из костного мозга в
кровь. Многие функции в очаге воспаления нейтрофил может осу-
ществлять без притока каких-либо дополнительных химических ве-
ществ, а в условиях притока кислорода выполняет функцию в
полном объеме. Таким образом, нейтрофил крови представляет собой
клетку, готовую к выполнению специфической функции, но не
выполняющую ее. Более того, специфическое функционирование
нейтрофилов в крови несовместимо с жизнью.
114
Из изложенного выше вытекает очень важное обстоятельство.
Результаты повсеместно практикуемого исследования нейтрофилов
крови при различных заболеваниях способны лишь в малой степени
отразить особенности функционирования их при данной болезни.
Нейтрофилы крови, если исключить сравнительно редкие генети-
ческие дефекты этих клеток, потенциально всегда готовы к функ-
циональной активности во всех или почти во всех ее проявлениях.
Нельзя отрицать, что исходное состояние нейтрофилов может не-
сколько меняться в зависимости от течения болезни, но еще более
верно то, что в гораздо большей степени характер функциональной
активности нейтрофилов определяется наличием и концентрацией
многочисленных стимуляторов, модуляторов и гуморальных факто-
ров в очаге воспаления. Следовательно, чтобы получить истинное
представление о роли нейтрофилов в данном патологическом про-
цессе, нужно исследовать клетки из очага воспаления в комплексе
с влияющими на эти клетки факторами. Выполнить такое исследо-
вание намного сложнее, чем изучать нейтрофилы крови и их среду.
Следует подчеркнуть своеобразие секреторной функции грану-
лоцитов. Мишени секреторной активности гранулоцитов в отличие
от мишеней эндо- и экзокринных клеток характеризуются непосто-
янством локализации и времени присутствия в организме. Грану-
лоциты сами транспортируют секрет в нужное место, отыскивая
мишени по градиенту концентрации хематтрактантов. Секреция
гранулоцитов отличается от других видов секреции максимальной
избирательностью: она нередко оказывается направленной всего на
одну клетку и даже на одиночный макромолекулярный комплекс
(антиген — антитело — комплемент), которые в таком случае могут
заключаться в фагосому (интрацеллюлярная секреция). Сфера дей-
ствия экстрацеллюлярной секреции гранулоцита также может ог-
раничиваться одиночными или небольшим количеством макромоле-
кулярных комплексов, или клеток-мишеней. Доставка секрета к
столь малым и точно выбираемым мишеням обеспечивается как
благодаря высокой чувствительности самих гранулоцитов к хемат-
трактантам, так и вследствие кооперации их с лимфоцитами и
другими клетками, которые с помощью иммуноглобулинов и ком-
племента помогают гранулоцитам «узнавать» мишени интра- и экс-
трацеллюлярной секреции.
4.1.2. Макрофаги
в клеточных «ансамблях», последовательно выступающих на «арену»
воспалительного процесса, важнейшую роль играют макрофаги. Эти
клетки относятся к системе мононуклеарных фагоцитов (СМФ),
формируемой единой клеточной линией, источником происхождения
которой является плюрипотентная кроветворная стволовая клетка
костного мозга [van Furth R., 1975, 1989]. При ее делении наряду
с предшественниками гранулоцитов возникают недифференцирован-
ные предшественники моноцитов — монобласты [Adams D., 1983].
115
При делении монобласта возникают два промоноцита, каждый из
которых еще раз делится и дает начало двум моноцитам. Последние
быстро выходят из костного мозга в кровь, как правило, не делятся
и через определенное время из крови переходят в органы и ткани,
превращаясь в макрофаги. Часть моноцитов, пришедших из крови
в ткани, может один раз разделиться, однако основной источник
увеличения их количества в каком-либо участке организма — это
приток моноцитов из крови.
Следовательно, по мере созревания выделяют следующие клетки
СМФ: 1) костно-мозговые предшественники — стволовые и полу-
стволовые (коммитированные) клетки, монобласты, промоноциты,
моноциты; 2) моноциты крови; 3) тканевые макрофаги разной сте-
пени зрелости. В условиях воспаления, особенно гранулематозного,
последние проходят стадии тканевого моноцита, незрелого и зрелого
макрофага, эпителиоидной и гигантской многоядерной клетки (рис.
4.7) [van Furth R., 1988, 1989; Ros Ke A., Lipsky P., 1989].
По локализации и морфофункциональным характеристикам сре-
ди тканевых макрофагов выделяют макрофаги серозных полостей,
в частности перитонеальные и плевральные; гистиоциты соедини-
тельной ткани; купферовские клетки печени (звездчатые ретику-
лоэндотелиоциты); свободные и фиксированные макрофаги лимфа-
тических узлов, селезенки и костного мозга; альвеолярные макро-
фаги легких; клетки Лангерганса кожи; клетки микроглии цент-
ральной нервной системы; остеокласты [Карр Я., 1978; Фрейдлин
И. С., 1984, и др.]. Каждая из указанных систем тканевых макро-
фагбв является, по-видимому, открытой и пополняется за счет по-
стоянного притока из крови моноцитов, которые затем дифферен-
цируются в местные тканевые макрофаги. Этот процесс резко уси-
ливается при действии воспалительного или других повреждающих
стимулов.
Однако в интактных органах и тканях (особенно органах брюшной
полости, рыхлой соединительной ткани, центральной нервной сис-
теме, а также интерстиции легких) существуют клеточные линии,
по всем признакам относящиеся к СМФ, ио самоподдерживающиеся
в результате постоянного медленного самообновления. Это так на-
зываемые резидентные макрофаги, которые, по-видимому, заселили
конкретную тканевую область на ранних этапах развития организма.
Некоторые авторы считают, что резидентные макрофаги являются
«сигнальными» клетками, дающими информацию о состоянии своего
тканевого региона [Карр Я., 1978; Шехтер А. Б. и др., 1981, 1987;
Daems W. et al., 1975; Daems W., 1980].
Цитолемма резидентных макрофагов имеет складки, пальцеоб-
разные выросты, вуали, а при контрастировании рутениевым крас-
ным на ней виден надмембранный слой толщиной до 60 нм, в состав
которого входят, в частности, кислые гликозаминогликаны и мем-
бранные гликопротеины. Под наружной мембраной обнаруживают
актиновые филаменты. В цитол мме имеются лакуны и инвагинации,
распространяющиеся в глубину клеток, а также много везикул и
вакуолей (рис. 4.8). Маленькие везикулы могут соединяться с вне-
Моноцит
Рис. 4.7. Схема дифференциров и моноцитов крови
в очаге воспаления.
клеточной средой узкой горловиной, они построены по типу окай-
мленных везикул. Ядра резидентных макрофагов обычно неправиль-
ной формы (лопастные), хроматин диспергирован, много ядерных
пор. Количество макрофагальных гранул (лизосом) в резидентных
макрофагах различных тканей и органов неодинаковое. Например,
в брюшной полости эти клетки имеют небольшое количество лизо-
сом, в которых часто виден ореол между ограничивающей мембраной
и мелкозернистым матриксом. В лизосомах резидентных макрофагов
обнаружены кислая фосфатаза, аминопептидаза и другие ферменты
[van Furth R., 1989].
117
Рис. 4.8. Фрагмент резидентного макрофага брюшной полости. Ядро
лопастное, с четкой зоной гетерохроматина; в цитоплазме — развитая
зерйястая эндоплазматическая сеть и пластинчатый комплекс. * 800.
В моноцитах различают первичные и вторичные гранулы [Гавриль-
чак А. В., 1980], имеющие пероксидазную активность, причем во вто-
ричных гранулах, возможно, содержится больше каталазы. По
W. Т. Daems (1980), оба типа гранул могут быть первичными лизосо-
мами. Гранулы могут сливаться с фагосомами, при этом происходит
освобождение ферментов. По мере созревания макрофагов первичные
и вторичные моноцитарные гранулы исчезают, но вместе с тем появ-
ляются округлые гранулы больших размеров — макрофагальные гра-
нулы с характерным ореолом между матриксом и мембраной.
Характерно, что пероксидазная активность резидентных макро-
фагов по своей локализации в везикулах пластинчатого комплекса,
зернистой эндоплазматической сети и перинуклеарном пространстве
отличается от пероксидазной активности в моноцитарных макрофа-
гах, в которых она связяна с лизосомами, — так называемая эн-
догенная пероксидазная активность [van der Rhee, 1979; Daems W.,
1980; van Furth R., 1981]. При этом в «пришлых» Макрофагах
пероксидазную активность имеют первичные и вторичные гранулы.
В ряде случаев в тесной связи с зернистой эндоплазматической
сетью обнаруживают микропероксисомы [Novikoff А. В. et al., 1972].
В резидентных макрофагах наряду с микротрубочками и актиновыми
филаментами имеются филаменты толщиной 10 нм. Роль последних
еще до конца не изучена, хотя предполагают, что они связаны с
118
Рис. 4.9. Фрагмент экссудативного перитонеального макрофага. Наряду с
расширенными канальцами зернистой эндоплазматической Сети видны
макрофагальные гранулы и множество везикул. х 13 000.
процессами эндоцитоза. Резидентные макрофаги могут делиться пу-
тем митоза в месте своего расположения, что косвенно подтверждает
их принадлежность к самоподдерживающейся клеточной линии.
В эксперименте после введения в брюшную полость некоторых
веществ (раствор гликогена, пептон, крахмал, коллаген, тиоглико-
лат, минеральное масло и т. п.) развивается асептическое воспаление
и в экссудате увеличивается количество клеток. При этом появляется
много моноцитов и экссудативных макрофагов (рис. 4.9), характе-
ристика которых дана ниже (табл. 4.1). Очень важный признак
экссудативных макрофагов — возникновение пероксидазной актив-
ности в пластинчатом комплексе, зернистой эндоплазматической
сети и околоядерном окружении в особых условиях (например, при
инъекции сыворотки и др.), но это явление временное [van Rhee
et al., 1979]. Сама пероксидаза цитохимически отличается от пе-
роксидазы резидентных макрофагов.
Следует отметить, что нет единого мнения о происхождении
резидентных перитонеальных макрофагов. Одни авторы считают,
что это особая клеточная популяция [Daems W., 1980], другие
полагают, что резидентные макрофаги происходят из моноцитов
крови [van Furth R., 1988].
119
Таблица 4.1
Цитологические особенности моноцитов, зрелых макрофагов и эпителиоидных
Признаки Моноциты Незрелые макрофаги
Диаметр клетки, мкм 7—10 10—12
Клеточный край Немного коротких мик- ровиллей, мало окаймлен- Преобладают короткие, однако появляются и длин-
ных макропиноцитозных везикул ные микровилли и инваги- нации
Ядро Бобовидное, овальное» с маргинацией гетерохрома- Бобовидное, овальное, лопастное с перифериче-
тина ской зоной гетерохромати- на
Лизосомные гранулы Много первичных и вто- ричных моноцитарных гранул Небольшое количество моноцитарных гранул
Фагосомы, вторичные ли- Единичные Немногочисленные
зосомы, остаточные тель- ца
Пластинчатый комплекс Умеренно развит, встре- чаются расширенные цис- терны »
Зернистая эндоплазмати- Развита слабо Развита умеренно
ческая сеть
СвЬбодные рибосомы Многочисленные обособ- ленные » »
Митохондрии Умеренное количество, овальные или круглые Многочисленные оваль- ные или вытянутые
4.1.2.1. Разновидности макрофагов
Макрофаги соединительной ткани (гистиоциты)
детально охарактеризованы в монографии В. В. Серова и А. Б. Шех-
тера (1981). Гистиоциты имеют округлую, но слегка уплощенную
форму, неровные контуры цитоплазмы, почковидное или овальное
ядро, более плотное, чем у фибробластов (рис. 4.10). При скани-
рующей электронной микроскопии обнаруживают, что их поверх-
ность покрыта гребневидными выростами, складками и ворсинками.
В цитоплазме определяются ШИК-позитивные включения, устой-
чивые к амилазе, а также высокая активность лизосомальных фер-
ментов (неспецифической эстеразы и кислой фосфатазы). Выявлены
также липазы, ^-глюкуронидаза, лизоцим, моноаминоксидаза, ами-
нопептидаза и другие ферменты. При электронно-микроскопическом
исследовании в цитоплазме определяют макрофагальные гранулы
(первичные лизосомы) с характерным просветлением по периферии,
вторичные лизосомы, фагоцитарные и пиноцитарные вакуоли, муль-
тивезикулярные тельца, аутофагосомы, остаточные пластинчатые
120
клеток [Шехтер А. Б. и др., 1985; Carr J„ 1979]
Зрелые макрофаги Эпителиоидные клетки
фагоцитарные секреторные
12—20 Много длинных инвагина- ций, микровиллей, окайм- ленных везикул 12—17 Меньше длинных микро- виллей, окаймленных ве- зикул и инвагинаций 20—40 Много длинных микро- виллей, около 10 окайм- ленных везикул
Овальное, лопастное с пе- риферической зоной гете- рохроматина Большое количество макро- фагальных гранул Овальное, лопастное с периферической зоной ге- терохроматина Немного макрофагаль- ных гранул Вытянутое, лопастное с преобладанием эухромати- на и большим количеством вдерных пор Много эпителиоидно- клеточных гранул
Множественные Немногочисленные Немногочисленные
» Развита умеренно » » Многочисленные овальные или удлиненные Хорошо развит, много- численные вакуоли, воз- можно, транспортные Хорошо развита, есть расширенные цистерны, много удлиненных Многочисленные обособ- ленные и в агрегатах То же » Многочисленные корот- кие цистерны То же Многочисленные, чаще удлиненные
тельца. В зависимости от функциональной активности макрофагов
отмечается значительная вариабельность ультраструктурных при-
знаков.
Легочные макрофаги располагаются в интерстиции аль-
веолярных септ (интерстициальные макрофаги) либо на поверх-
ности или в просвете альвеол (альвеолярные макрофаги, рис.
4.11). С помощью хромосомальных маркеров установлено, что
альвеолярные макрофаги имеют костномозговое происхождение и
дифференцируются из моноцитов крови, в то время как часть
макрофагов интерстиция, возможно, образует относительно авто-
номную и самоподдерживающуюся клеточную линию [Pin Kett
М. et al., 1966; Gamwerky Ch. et al., 1980]. По данным боль-
шинства исследователей, при световой микроскопии альвеолярные
макрофаги представлены в основном относительно крупными клет-
ками с вакуолизированной цитоплазмой, содержащей разнообраз-
ные включения [Шехтер А. Б. и др., 1983, 1985, 1989]. Ядра
овальные и изредка имеют лопастную форму, гетерохроматин
расположен маргинально. Края клеток ворсинчатые, цитоплазма
относительно плотная, богата микрофиламентами, микротрубочка-
Рио., 4.10. Фрагмент макрофага грануляционной ткани в подкожной
клетчатке (имплантация губки). Видны макрофагальные гранулы с зоной
просветления («гало») под мембраной, к 15 000.
ми, скоплениями гранул гликогена, свободными рибосомами, мик-
ровезикулярными структурами и крупными вакуолями. Лизосо-
мальные гранулы многочисленны. Можно выделить два типа мак-
рофагов легких по их морфофункциональной характеристике, не
зависящей от расположения клеток: первый — секреторный, с
развитыми органеллами синтеза и секреции; второй — фагоци-
тарный, содержащий в цитоплазме фагосомы и остаточные тельца.
Интерстициальные макрофаги находятся в межальвеолярных сеп-
тах, в периваскулярной и перибронхиальной строме. Они пред-
ставлены в основном моноцитоидными формами и секреторным
типом клеток с развитым пластинчатым комплексом.
Макрофаги печени (звездчатые ретикулоэндотелиоциты,
или купферовские клетки печени) располагаются по ходу синусов,
выступая в их просвет, характеризуются выраженной фагоцитарной
активностью [Маянский Д. Н., 1981; Wisse Е., 1974, 1978]. Они
имеют многочисленные вуалевидные выпячивания поверхности
[Карр Я., 1978], но во многих купферовских клетках наблюдаются
глубокие трубчатые инвагинации [Toro I. et al., 1962; Orei L. et
al., 1968], которые образуют систему узких канальцев (рис. 4.12),
предназначенных для захвата мелких частиц, в том числе колло-
||
122
Рис. 4.11. Незрелый альвеолярный макрофаг легкого крысы. Поверхность
макрофага неровная, с выбуханиями; в цитоплазме — макрофагальные
гранулы, к 5000.
идных растворов. В макрофагах печени имеются первичные и вто-
ричные лизосомы, иногда в последних обнаруживают ферритин.
Следует отметить, что по распределению пероксидазной активности
и ультраструктуре купферовские клетки напоминают резидентные
перитонеальные макрофаги [Howard Y. G., 1970; Wisse Е., 1974,
1978]. Существует точка зрения, согласно которой купферовские
клетки имеют местное происхождение. Вместе с тем А. Н. Маянский
и Д. Н. Маянский (1983), R. van Furth (1980), а также другие
авторы приводят веские доказательства в пользу происхождения
купферовских клеток из моноцитов.
Макрофаги лимфатических узлов, селезенки,
костного мозга. Часть этих клеток имеет типичную структуру
и функцию макрофагов' (рис. 4.13). Они располагаются внутри
или снаружи синусов, среди адвентициальных или паренхиматоз-
ных клеток, имеют неровную поверхность с многочисленными
гребнями и содержат много лизосом. В некоторых клетках развиты
зернистая эндоплазматическая сеть и пластинчатый комплекс. Ми-
тохондрии часто имеют вытянутую форму. Для макрофагов лим-
фатических узлов характерны микрофибриллы и развитая система
микротрубочек. В макрофагах селезенки также развиты пластин-
123
Рис. 4.12. Фрагменты звездчатых ретикулоэндотелиоцитов (ЗР) печени
обезьяны.
а — видны узкие темные канальцы для захвата коллоидных частиц, х 7000; б — активированный
ретикулоэндотелиоцит с крупными макрофагальными гранулами в цитоплазме. * 15 000.
чатый комплекс, сеть микрофиламентов, лизосомальный аппарат.
При поглощении коллоидного. угля отростки макрофагов (псевдо-
подии) проникают в просветы синусов между эндотелиоцитами.
Макрофаги костного мозга, так же как и макрофаги селезенки,
окружены эритробластами. В цитоплазматических отростках мак-
рофагов довольно мало везикул, однако много лизосом с большим
количеством ферритина.
Помимо типичных макрофагов, в лимфатических узлах и селе-
зенке находятся стромальные элементы, которые некоторые авторы
считают разновидностью макрофагов [Marshal А. Н., White R. G.,
1950]. Такие клетки имеют отростки и называются дендритными.
В фолликулах лимфатических узлов и селезенки, богатых В-лим-
фоцитами, преобладают именно дендритные клетки. Они имеют
124
Рис. 4.13. Фрагмент активированного макрофага лимфатического узла
крысы. Макрофагальные гранулы и развитая зернистая эндоплазматическая
сеть; с макрофагом контактирует плазматическая клетка. 10 000.
костномозговое происхождение, хотя и отличаются от клеток крови
[Фриденштейн А. Я., 1983]. Некоторые авторы считают дендритные
клетки одной из форм лейкоцитов, способных к интенсивному об-
новлению [Fossum S., 1989]. Дендритные клетки могут мигрировать
из нелимфоидных органов через кровь или лимфу в селезенку и
лимфатические узлы [Austyn J. М., 1989]. В лимфе клетки имеют
вуалевидную форму. Существует точка зрения, согласно которой
резидентные эпидермальные клетки Лангерганса кожи являются
депо предшественников дендритных клеток лимфатических узлов
[Romani N., Schuler G., 1989]. Основная функция указанных клеток
в лимфатических узлах — антигенпредставляющая [Braa Thend К.
et al., 1984; Knight S. С. et al., 1985; Villa M. L. et al., 1985]. Bo
внутренней части коркового вещества лимфатических узлов и в
периартериолярных лимфатических муфтах селезенки, богатых Т-
лимфоцитами, клетки стромы имеют полиморфное ядро и особой
формы отростки, напоминающие переплетающиеся пальцы. Эти
большие клетки, в цитоплазму которых глубоко проникают либо
часть лимфоцита, либо весь лимфоцит, называются интердигити-
рующими клетками, которые в последнее время также относят к
дендритным [Adams D. О., Hamilton Т. А., 1988; van Furth R., 1989].
Интердигитирующие клетки через комплекс секреторных продуктов,
очевидно, влияют на дифференцировку Т-лимфоцитов.
125
Эпидермальные макрофаги (клетки Лангерганса).
Этим клеткам посвящены обзоры И. С. Персиной (1985), J. Hunter
(1983), J. Braatnen и соавт. (1984), R. М. Steinman (1989). Впервые
они были описаны немецким патологоанатомом П. Лангергансом
в 1968 г. и подробно изучены в последние годы. Эпидермальные
макрофаги являются наиболее яркими представителями системы
дендритных клеток и встречаются в эпидермисе кожи, эпителии
слизистой оболочки полости рта, пищевода, дыхательных путей,
конъюнктивы, влагалища шейки матки, а также в лимфатических
узлах, миндалинах, тимусе. Это отростчатые клетки с крупным
ядром округлой или неправильной формы. При электронно-мик-
роскопическом исследовании у них определяется сравнительно не-
широкий ободок цитоплазмы, в которой обнаруживают развитые
зернистую эндоплазматическую сеть, пластинчатый комплекс, ми-
тохондрии, относительно немного лизосом и фибриллярных струк-
тур. Для этих клеток характерны гранулы Бирбека, имеющие вид
теннисной ракетки, окруженной мембраной, к которой прилегает
мелкозернистый слой.
Микроглиальные клетки были детально изучены
Р. Hortega (1932). По данным S. Mori и С. Р. Leblond (1969), они
имеют мелкие ядра с хорошо окрашенным хроматином и большим
количеством лизосом, нередко занимают периваскулярное поло-
жение, имитируя перициты. На электронограммах в цитоплазме
микроглиальных клеток видны мелкие гомогенные гранулы и боль-
шие гранулы неравномерной плотности, а также липидные ваку-
оли.
Остеокласты и другие типы клеток, сходные с макрофагами,
имеют меньшее значение в пато- и морфогенезе воспаления.
4.1.2.2. Макрофаги в очагах острого и хронического
воспаления
Приходящие в очаг воспаления клетки СМФ претерпевают ряд
последовательных морфофункциональных изменений, тесно связан-
ных с их ролью в этом очаге [Adams D., Hami G., 1988; Snyderman
R., Pike M. C., 1989]. Вначале в зону воспаления интенсивно миг-
рируют моноциты крови, которые затем трансформируются в вос-
палительные или экссудативные макрофаги (см. рис. 4.7). Процесс
последовательной дифференцировки моноцита в незрелый макрофаг,
а последнего — в различные формы зрелых макрофагов возможен
как при остром, так и при хроническом воспалении. Трансформация
же в эпителиоидные и гигантские многоядерные клетки отмечается
в основном в очагах хронического, преимущественно гранулематоз-
ного, воспаления.
Следует отметить, что в очаге воспаления в первые часы после
начала процесса преобладают экссудативные моноциты, пришедшие
из крови. Такие моноциты отличаются от моноцитов, циркулиру-
ющих в крови, тем, что их первичные (палочковидные) и вторичные
Рис. 4.14. Моноцит экссудата брюшной полости.
Видны лопастное ядро и 2 типа гранул (вытянутые и округлые). * 5000.
Рис. 4.15. Незрелый макрофаг экссудата брюшной полости. По сравнению
с моноцитом (см. рис. 4.14) увеличено количество гранул и органелл
* 10 000.
Рис. 4.16. Макрофаг фагоцитарного типа из грануляционной ткани под-
кожной клетчатки (имплантация губки). Видны макрофагальные гранулы,
фдгосомы (Ф). к 10 000.
Рис. 4.17. Альвеолярный макрофаг фагоцитарного типа с большим числом
фагосом в цитоплазме, к 15 000.
Рис. 4.18. Секреторный макрофаг рыхлой соединительной ткани (имплан-
тация губки). Цитоплазма содержит развитую зернистую эндоплазмати-
ческую сеть, на поверхности — множественные микроворсинки, х ] 2 000.
Рис. 4.19. Секреторный альвеолярный макрофаг, х 10 000.
5—407
(округлые) гранулы диаметром около 190 нм располагаются по
периферии клетки, а не вблизи пластинчатого комплекса. Экссуда-
тивные моноциты трансформируются в незрелые макрофаги, кото-
рых в очаге воспаления вначале немного, но затем их количество
увеличивается. Сохраняя сходство с экссудативными моноцитами,
в частности бобовидное ядро, незрелые макрофаги отличаются от
них более обильной и светлой цитоплазмой (рис. 4.14, 4.15) и
редкими микроворсинками на поверхности клеток. В них меньше
первичных и вторичных моноцитарных гранул, но появляются мак-
рофагальные гранулы диаметром около 280 нм, имеющие лизосом-
ную природу. Пластинчатый комплекс и зернистая эндоплазмати-
ческая сеть обычно более развиты, чем у моноцитов, увеличиваются
размеры центриолей, на клеточной поверхности появляются выросты
и инвагинации.
Зрелые макрофаги представлены двумя основными субпопуля-
циями: с преимущественно фагоцитарной (рис. 4.16, 4.17) и пре-
имущественно секреторной (рис. 4.18) функцией, что проявляется
в их ультраструктурных особенностях [Шехтер А. Б. и др., 1985;
Snyderman Р., Pike М., 1989]. Размер фагоцитарных макрофагов
12—20 мкм, на их поверхности много инвагинаций, лакун, паль-
цевидных отростков, ветвящихся в анастомозирующих друг с дру-
гом. Пластинчатый комплекс хорошо выражен, зернистая эндо-
плазматическая сеть представлена короткими и узкими профилями
цистерн. Большинство макрофагальных гранул расположено в об-
ласти пластинчатого комплекса (рис. 4.19). Моноцитарных гранул
обычно нет, увеличивается количество разных включений. По
мере созревания клеток возрастает содержание фагосом и гетеро-
фаголизосом, содержащих фагоцитированный материал, увеличи-
вается также количество везикул и мультивезикулярных телец.
Секреторные макрофаги отличаются особенно развитыми зернистой
эндоплазматической сетью и пластинчатым комплексом: аппарат
синтеза и секреции значительно преобладает над лизосомно-фа-
гоцитарным аппаратом. Очевидно, что эти макрофаги специали-
зированы на синтез и секрецию разнообразных макрофагальных
факторов и ферментов.
Эпителиоидные клетки образуются в очагах гранулематозного
воспаления начиная с 7-го дня формирования гранулем и выпол-
няют в основном секреторную функцию. Они имеют полигональ-
ную форму, овальное ядро с дисперсным хроматином, двумя или
больше ядрышками, большим количеством адерных пор. В цито-
плазме определяются многочисленные цитоплазматические орга-
неллы, включая митохондрии, лизосомы и большие вакуоли (рис.
4.20), имеется много пузырьков с гомогенным содержимым, в
котором заметны плотные включения, по-видимому, остатки фа-
гоцитарных вакуолей. Клеточный центр более объемный, чем в
зрелых макрофагах. В цитоплазме заметно повышается плотность
филаментов, которые имеют радиальную ориентацию. Диаметр
одних филаментов 5—6 нм, других — около 10 нм. Для эпите-
лиоидных клеток характерно наличие в области пластинчатого
Рис. 4.20. Фрагмент цитоплазмы эпителиоидной клетки. Характерно на-
личие пальцевидных выростов на поверхности; в цитоплазме — множество
везикул, х 5600.
комплекса не только окаймленных, но и гладких везикул с плот-
ным центром, а также большое количество (более 100) крупных
гранул диаметром до 340 нм с тонкогранулярным матриксом,
более светлым, чем в макрофагальных гранулах, иногда с пери-
гранулярным ореолом. Всегда определяются псевдоподии в виде
тонких удлиненных отростков с повышенным количеством везикул.
Для эпителиоидных клеток характерна их агрегация с образова-
нием тесных интердигитарных (межпальцевых) сцеплений по типу
застежки «молния». По представлениям D. О. Adams (1976, 1980),
эпителиоидные клетки являются гиперстимулированными, «сверх-
зрелыми» макрофагами. Существует, однако, точка зрения, со-
гласно которой эпителиоидные клетки непосредственно дифферен-
цируются из моноцитов [Williams G. Т., Williams W. Y., 1983],
причем к такой дифференцировке, по-видимому, способна лишь
°пределенная часть специализированных моноцитов.
Эпителиоидные клетки неоднозначны по своей морфологии и,
по-видимому, функции. G. Т. Williams и М. Y. Williams (1983) раз-
личают эпителиоидные клетки двух типов: плазмоцитоидные, ко-
торые по структуре ядра и развитию зернистой эндоплазматической
5*
131
сети напоминает плазматические клетки (тип А), и везикулирован-
ные (тип В). Клетки первого типа чаще встречаются на ранних
стадиях образования гранулем, клетки второго типа — в более
позднем периоде. Вероятно, особенности структуры эпителиоидных
клеток отражают выраженность их секреторной функции. Показано,
что везикулы этих клеток продвигаются к плазмолемме и выбра-
сывают свое содержимое во внеклеточную среду. Учитывая набор
ферментов в эпителиоидных клетках типа В (кислая фосфатаза,
р-галактозидаза, неспецифическая эстераза, лизоцим), а также на-
личие ангиотензинконвертирующего фермента, можно полагать, что
эпителиоидные клетки играют важную регуляторную функцию при
образовании гранулем. Ангиотензинконвертирующий фермент может
играть роль фактора, ингибирующего миграцию макрофагов (МИФ),
что важно для процесса формирования клеточного агрегата при
образовании гранулемы [Williams G. Т., Williams W. J., 1983]. Ус-
тановлено также, что возможность экспрессии антигена на повер-
хности эпителиоидных клеток, что способствует их иммунологиче-
скому воздействию с Т-лимфоцитами.
Хотя эпителиоидные клетки по сравнению с макрофагами обла-
дают более низкой фагоцитарной способностью, их бактерицидная
и секреторная активность в эпителиоидной гранулеме выражена
сильнее. Установлено, что зрелость эпителиоидной гранулемы кор-
релирует со способностью эпителиоидной гранулемы уничтожать
микобактерии туберкулеза [Lurie М. В., 1964]. В цитоплазме эпи-
телиоидных клеток обнаруживают липиды — остатки убитых и
переваренных туберкулезных микобактерий, а также кристаллоид-
ные структуры, астероидные тельца, образования типа фагосом и
мультивезикулярных телец.
Среди гигантских многоядерных клеток выделяют клетки двух
типов. 1-й тип — клетки Пирогова —Лангханса, которые содержат
не более 30 правильно расположенных ядер по периферии цитоп-
лазмы в виде кольца (рис. 4.21). В центральной части цитоплазмы
имеется гигантская центросфера с собранными в группу (агрегиро-
ванными) центриолями, количество которых соответствует числу
ядер. При небольшом количестве ядер (2, 3, 4) видны немногочис-
ленные первичные и вторичные моноцитарные гранулы. При боль-
шом количестве ядер эти гранулы не определяются, но имеются
гранулы, родственные макрофагальным и эпителиоидно-клеточным.
Многоядерные гигантские клетки с 30 и более ядрами носят
название гигантских клеток инородных тел. Их ядра рассеяны по
цитоплазме или собраны в группы, иногда в центре клетки (рис.
4.22). Центриоли редки, так как отмечается их редукция. Наблю-
даются парные центриоли, но никогда не встречаются их агрегаты.
Структуры центросферы и центриолей считают наиболее характер-
ным признаком этого типа гигантских клеток [Rigby Р. J., Papadimit-
rionj. М., 1984]. Исходя из сроков появления указанных типов
клеток, а также их структурных особенностей, Н. J. van Rhee et al.
(1979) предположили, что все типы гигантских клеток связаны
происхождением и взаимными переходами: гигантские клетки типа
132
Рис. 4.21. Гигантская многоядерная клетка П рогова — Лангханса с
упорядоченным кольцевидным расположением ядер по периферии клетки.
Окраска гематоксилином и эозином, х 1050 (hmmi рсия).
Рис. 4.22. Гигантская многоядерная клетка инородных тел; ядра сгруп-
пированы в центре. Окраска гематоксилином и эозином, х 1050 (иммерсия).
Пирогова — Лангханса переходят по мере созревания в гигантские
клетки инородных тел. Однако не исключено, что гигантские мно-
гоядерные клетки инородных тел могут переходить в клетки Пи-
рогова — Лангханса.
В отношении механизма образования гигантских клеток предпо-
лагается возможность деления ядер без деления клетки, слияние
макрофагов между собой, а также сочетание этих процессов.
Н. Г. Хрущов и др. (1978), Я. Карр (1978), Н. J. van Rhee et al.
(1979) показали, что слияние клеток происходит всегда в той их
части, где расположен пластинчатый комплекс, так что к месту
слияния обращена вогнутая часть ядра. Это в какой-то мере про-
тиворечит* мнению тех авторов, которые считают, что слияние яв-
ляется результатом фагоцитоза одной крупной частицы несколькими
клетками. Особенности структуры гигантских клеток свидетельст-
вуют о том, что они составляют неоднородную популяцию: есть
клетки с преимущественно секреторной функцией и клетки с вы-
раженной пиноцитарной или фагоцитарной функцией [Шехтер А. Б.
и др., 1985, 1987, 1989; Струков А. И., Кауфман О. Я., 1989;
Black М. М., Epstein W. L., 1974 ]. Можно полагать, что это не ге-
нотипические, а фенотипические субпопуляции, т. е. клетки, раз-
вивающиеся из одного источника, но в зависимости от условий
по-разному дифференцирующиеся — с преобладанием той или иной
из двух функций.
4.Т.2.З. Макрофаги как фагоцитарные
и секреторные клетки
Макрофаги играют одну из ведущих ролей в обеспечении гомеостаза,
неспецифической и специфической иммунной защите, регуляции
обмена веществ, противоопухолевой защите [Adams D. О., Hamilton
Т. А., 1988; van FurthR., 1989; Shyderman R., Pike M., 1989]. Они
являются ключевыми клетками сложных межклеточных взаимодей-
ствий в норме, при воспалении, регенерации и склеротических
процессах. Лучше других изучена роль макрофагов как «третьей
клетки» иммунного ответа в специфическом иммунитете, а также
в процессах неспецифической защиты и ремодуляции соединитель-
ной ткани.
Антигенпредставляющая и иммунорегулирующая функция кле-
ток системы моноцитарных фагоцитов (СМФ), в первую очередь
макрофагов, тесно связана со специализированной и дифференци-
рованной способностью этих клеток к эндоцитозу [Snyderman R.,
Pike М., 1989], в связи с чем эти клетки называют также профес-
сиональными фагоцитами. Эндоцитоз включает пиноцитоз — по-
глощение капель низкомолекулярных растворов и мельчайших ча-
стиц, например ферритина, и фагоцитоз — поглощение крупных
частиц. Обе формы поглощения (эндоцитоза) завершаются попада-
нием поглощенного материала в цитоплазму макрофага. Фагоцити-
рованные частицы отделены от цитоплазматического матрикса кле-
134
точной мембраной, которая вместе с частицей перемещается от
поверхности клетки в глубь нее [RyterA., de Chastellner Cha.,
1983]. Затем фагосома или пиносома, т. е. пузырек, содержащий
поглощенную клетку или капельку жидкости, сливаются с лизосо-
мой, формируя вторичную лизосому. Обычно в этот период живые
организмы, поглощаемые фагоцитом, оказываются убитыми. Гибель
поглощаемых живых организмов,- например бактерий, может про-
исходить еще до фагоцитоза, вследствие выделения макрофагом
веществ за пределы клетки [Пигаревский В. Е., 1978 ]. При слиянии
фагосомы и лизосомы на поглощенные тела или растворы начинают
действовать гидролитические ферменты, которые в большинстве слу-
чаев растворяют захваченные образования. Если фагоцитированные
структуры оказываются устойчивыми к ферментам фагоцита, на-
пример частицы двуокиси кремния, то они могут его повреждать и
ускорять естественную гибель клетки. При этом поглощенные об-
разования вновь оказываются вне клетки, но рядом с ними распо-
лагаются продукты распада фагоцита, лизосомные ферменты и дру-
гие вещества, способные оказывать повреждающее воздействие на
окружающие ткани, что поддерживает хроническое воспаление.
В фагоцитозе различают несколько фаз. Первая — адгезия (при-
липание) макромолекул или частиц к поверхности фагоцита. Она
обеспечивается Электростатическими силами, наличием гликокалек-
са на поверхности фагоцита и полисахаридов на поверхности по-
глощаемой частицы, гидрофильностью или гидрофобностью послед-
ней [СароС. et al., 1981; Warr G. A. et al., 1981]. Однако для
фагоцитарной активности макрофага наибольшее значение имеет
специфическое связывание частиц, обусловленное специализирован-
ными рецепторами. Таких рецепторов у макрофагов несколько де-
сятков. Так, по данным С. Unkeless и соавт. (1977, 1980), имеются
рецепторы для Fc-фрагмента IgG двух типов — устойчивые к трип-
сину и чувствительные к нему. Эти рецепторы обеспечивают им-
мунное связывание и поглощение частиц, покрытых IgG, или им-
мунных комплексов [Arend W. Р., Mannik М., 1978; Griffin F. М. et
al., 1981 ]. При этом обнаружены специализированные рецепторы
для связывания различных субклассов IgG, IgGi, IgGiB, IgGa, a
также для IgE, IgA и рецепторы для многих компонентов компле-
мента — Cig, СЗ, C3i, C3d, С5а [Adams D. О., Hamilton Т. А., 1988 ].
Рецепторы макрофагов другого типа служат для связывания СЗ
компонента системы комплемента, который также участвует в свя-
зывании, а возможно, и в переваривании поглощенных частиц
[MuschelR. I. et al., 1977]. Также имеются лектинподобные рецеп-
торы, которые очень важны для захвата ряда бактерий и грибов,
рецепторы для гормонов (тиреоидина, глюкокортикоидов), около
Десятка рецепторов для регуляторных и вспомогательных (фибро-
нектин) белков.
Вторая фаза фагоцитоза — поглощение частиц. Важную роль
пРи перемещении поглощенных частиц играют сократительные
^Руктуры макрофага — микротрубочки и цитофиламенты. После
Связывания и поглощения частицы происходит стимуляция окисли-
135
тельных процессов в фагоците, что сопровождается выделением
бактерицидных продуктов [Ryter A. de Chastellier Ch., 1982], к ко-
торым относятся лизосомные ферменты и катионные неферментны
белки [Пигаревский В. Е., 1978]. В большинстве случаев это обес-
печивает уничтожение поглощенного агента. Однако некоторые ча-
стицы, в частности неорганической природы, могут оказаться ус-
тойчивыми к такому воздействию и даже вызвать повреждение
макрофага. Живые агенты — микробы, грибы, риккетсии — могут
обладать защитными механизмами, позволяющими им выжить в
цитоплазме макрофага. Кроме того, некоторые из живых или не-
живых агентов (например, микобактерии и мелкие частицы окиси
бериллия) обладают способностью интенсивно воздействовать на
иммунную систему организма, в который они попали. В такой
ситуации макрофаги выполняют свою защитную функцию другим
способом: они окружают трудно перевариваемые частицы и образуют
клеточное скопление — узелок или гранулему. Таким образом,
основной клеткой, принимающей участие в образовании и прогрес-
сивном развитии гранулемы при гранулематозном воспалении, яв-
ляется макрофаг.
В настоящее время особенно интенсивно изучается секреторная
активность макрофагов. При воспалении, а также при действии
лимфокинов макрофаги переходят в активное состояние и начинают
секретировать большое количество (около 60) растворимых субстан-
ций — монокинов. К секреторным продуктам макрофагов относят
различные ферменты, наибольшая активность которых проявляется
в йейтральной среде (коллагеназа, эластаза, нейтральная протеи-
наза, фермент, вызывающий денатурацию протеогликанов и мие-
лина, активатор плазминогена, фермент, вызывающий конверсию
ангиотензина) или в кислой (кислая фосфатаза, катепсины, проте-
азы, рибонуклеазы, глюкуронидазы, эстеразы). Наряду с этим мак-
рофаги секретируют ингибиторы ферментов (а-1-антитрипсин, ин-
гибитор плазмина), лизоцим, компоненты комплемента, пропердин,
факторы В и D, а также окислительные метаболиты: супероксид,
перекись водорода, перекисный радикал; эндогенные пирогены; био-
активные липиды. Последняя группа вещества включает различные
производные арахидоновой кислоты, в частности простагландины,
тромбоксан, а также активатор тромбоцитов. Макрофаги также спо-
собны выделять факторы, обладающие выраженной опсонинной ак-
тивностью (фибронектин), циклическую АМФ, белок, связывающий
витамин В12.
Важнейшими продуктами секреции макрофагов являются фак-
торы, стимулирующие или ингибирующие клеточную пролифера-
цию. К первым относятся факторы, стимулирующие пролиферацию
Т- и В-лимфоцитов, предшественников миелоидного ряда (колоние-
стимулирующий фактор), эндотелиоцитов (усиливающих рост мел-
ких кровеносных сосудов). К факторам, ингибирующим клеточную
пролиферацию, относятся те, которые ингибируют пролифераци
лимфоцитов, опухолевых клеток, вирусов [Adams D. О., 1983]. Роль
макрофагов в очаге воспаления заключается не только в фагоцитозе
136
биологических патогенных раздражителей, представлении антигенов
[Chaturvedi U. С. et al., 1987] и регуляции межклеточных взаимо-
действий с помощью монокинов. Макрофаг является одной из ос-
новных клеток, регулирующих процессы регенерации, т. е. переход
от собственно воспаления к восстановлению дефекта ткани, возник-
шего вследствие повреждения. Особенно четко это проявляется в
соединительной ткани, в том числе в строме внутренних органов
[Серов В. В., Шехтер А. Б., 1981; Diegelmann et al., 1982; Kuhn С.,
1982]. Одним из проявлений такого участия макрофагов в регене-
рации является процесс отграничения очага воспаления, особенно
гнойного. В этой ситуации активность макрофагов прямо пропор-
циональна мощности отграничительной капсулы [Пауков В. С.,
1986; ДаабульС. и др., 1987]. В то же время ферменты, секрети-
руемые макрофагами, в частности протеазы, могут повреждать ок-
ружающие ткани и быть источником вторичных воспалительных
изменений, способствуя тем самым хронизации процесса [Gordon S.,
1980; Tracey D., 1983]. При этом важным моментом является то,
что макрофаги способны распознавать и элиминировать поврежден-
ные или выходящие из жизненного цикла клетки организма [Saviel J.
et al., 1990].
Таким образом, макрофаги представляют собой сложнейшие по-
лифункциональные комплексы, способные влиять в качестве кле-
ток-регуляторов на разнообразные процессы в организме. Вместе с
тем они сами являются объектом регуляторных влияний различных
клеточных систем, в первую очередь лимфоцитов.
4.1.З. Лаброциты, базофильные и эозинофильные
гранулоциты
4.1.З.1. Тучные клетки и базофильные гранулоциты
Лаброциты, или тучные клетки, были описаны П. Эрлихом еще в
прошлом столетии (1877). Для них характерно большое количество
гранул, интенсивно окрашивающихся основными красителями. Эти
клетки выявляют в соединительной ткани, в том числе в строме
органов, в слизистых оболочках, коже, синовиальной ткани
[Wasserman S.I., 1989 ]. Концентрация лаброцитов в коже составляет
Ю~20»1(г клеток на 1 мм , из брюшной полости крыс удается
получить 1*106 клеток [Siraganian R.P., 1988], в легких человека
количество лаброцитов, согласно результатам аффинной хроматог-
рафии, составляет 0,25*10” клеток на 1 г ткани [van Overveld F. et
а1-> 1988 ], в рыхлой соединительной ткани их содержание достигает
'0% от всех клеток [Линднер Д. И., Коган Э. М., 1976]. Лаброциты
называют также тканевыми базофилами [Проценко В. А. и др.,
*587], тем самым подчеркивая их близость к базофильным грану-
лоцитам крови. Основанием для этого служит тот факт, что клетки
этих двух типов имеют общее происхождение — из костномозгового
предшественника, идентичного предшественникам других клеток ми-
137
елоидного ряда [Siraganian R. Р., 1988]. Базофильные гранулоциты
крови созревают в костном мозге, а лаброцйты — в местах своей
окончательной локализации. На дифференцировку и рост этих кле-
ток оказывает регулирующее влияние ИЛ-3, продуцируемый Т-лим-
фоцитами, и клеточное микроокружение (фибробласты или эпите-
лиальные клетки). В табл. 4.2 представлены признаки сходства и
различия лаброцитов и базофильных гранулоцитов крови человека.
Таблица 4.2
Особенности лаброцитов и базофильных гранулоцитов крови человека [Siragaman
R. Р„ 1988)
Признаки Базофильные гранулоци- ты Лаброцйты
Диаметр, мк 7—10 14—20
Ядро Многодольчатое Однодольчатое
Содержание гистамина 1 пкг/клетку 3 пкг/клетку
Период жизни Короткий (часы) Длинный (месяцы)
Морфология дегрануляции Выход содержимого Выход гранул
гранул
Метаболиты арахидоновой кис-
лоты:
лейкотриены 1ЛС4 LTQ
циклоксигеназы — PG2, тромбоксан
Фактор, активирующий — +
цгомбоциты
Стимуляторы секреции;
IgE + +
Са2+-ионофор + +
полиаргинин + +
гиперосмоляркость + +
СЗа, С5а + —
Ф-Мет-Лейц-Фен + —
ТРА + —
морфин — +/-
ионофор 40/80 — +/-
фармакологическая модуляция
^-адренергические +/- +
вещества
теофиллин + +
Нг-агонисты + —
аденозин + —
простагландины + +
стероиды + —
индометацин + —
Примечание. «-(-» — ответ на действие стимулятора секреции, или фар-
макологический агент тормозит процесс высвобождения; «—»— нет ответа на
действие стимулятора секреции, или фармакологический агент неэффективен
Из данных, представленных в табл. 4.2, видно, что наряду с
общими чертами (особенности биохимической структуры гранул,
наличие рецепторов для IgE на клеточной поверхности) эти клетки
имеют и существенные морфофункциональные различия, касающи-
еся продолжительности жизни клеток, содержания гистамина в пе-
ресчете на каждую клетку, чувствительности клеток к различным,
в том числе фармакологическим, воздействиям.
Наиболее молодые формы этой клеточной линии имеют вид
лимфоцитоподобных клеток, и лишь позднее, в процессе диффе-
ренцировки, в их цитоплазме формируются гранулы, хорошо окра-
шиваемые толуидиновым синим, азуром А, сафранином и другими
основными красителями [Проценко В. А. и др., 1987 ]. В онтогенезе
в стадии базофильного промиелоцита происходит отшнуровка не-
зрелых светлых гранул от пластинчатого комплекса, в дальнейшем
в гранулах появляются белковые структуры в виде волокнистых
нежнофибриллярных образований, формируется белковый матрикс,
причем белок поступает из канальцев зернистой эндоплазматической
сети, тесно контактирующих с гранулами [Проценко В. А. и др.,
1987]. Позднее к белковому матриксу присоединяется гепарин, син-
тезируемый в пластинчатом комплексе [Виноградов В. В., Воробь-
ев Н. Ф., 1972]. Диаметр гранул от 0,3 до 2 мкм, при этом, на-
пример, у крыс среднее количество гранул на одну клетку достигает
1000 [Bloom С., 1984 ]. Диаметр базофильных гранулоцитов крови
10—12 мкм, тогда как размеры лаброцитов колеблются от 3,5 до
100 мкм в зависимости от органа и вида животных, составляя в
среднем 10—30 мкм [Серов В. В., ШехтерА. Б., 1981].
Базофильные гранулоциты крови имеют двудольчатое или мно-
годольчатое ядро, гомогенные гранулы, окруженные двухслойной
мембраной, большое количество цитоплазматических везикул, со-
держащих гликоген. Пластинчатый комплекс и эндоплазматическая'
сеть не развиты [HastieR., 1974]. Следует отметить, что у базо-
фильных гранулоцитов крови человека плотность клеточных гранул
варьирует. Лаброциты человека имеют тенденцию к околососуди-
стому расположению (рис. 4.23), на их поверхности много тонких
микроворсинок, клеточное ядро у этих клеток округлое, имеется
немного митохондрий, эндоплазматическая сеть и пластинчатый
комплекс не развиты [Galli S.Y.et al., 1984 ], цитоплазма содержит
промежуточные филаменты, липидные капли, включающие арахи-
доновую кислоту. Гранулы лаброцитов более гетерогенны, чем ба-
зофильных гранулоцитов, они имеют неодинаковую величину и
плотность (рис. 4.24), а также различную внутреннюю структуру:
наряду с мелкогранулярным и тонкофибриллярным содержимым в
них могут быть пластинчатые, спиралевидные и кристаллические
элементы. Эта гетерогенность структуры гранул зависит от степени
дифференцировки лаброцитов, их функционального состояния и
Цикла секреции [Проценко В. А. и др., 1987 ].
Различают лаброциты двух основных типов: лаброциты соеди-
нительной ткани и слизистых оболочек. Признаки клеток этих типов
представлены в табл. 4.3. Следует отметить, что клетки обоих типов
139
Рис. 4.23. Тучная клетка, располагающаяся вблизи микрососуда, х 5600.
Рис. 4.24. Гранулы тучной клетки соединительной ткани. Гранулы имеют
разные плотность и структуру, х 10 000 (препарат А. В. Гавричак).
имеют общее происхождение, их дифференцировка в тот или другой
тип определяется микроокружением и интерлейкинами, продуциру-
емыми лимфоцитами [Siraganian R. Р., 1988 ]. В частности, для фор-
мирования лаброцитов соединительной ткани необходимо присутст-
вие фибробластов [Levi-Schaffer Fr. et al., 1986].
Таблица 4.3
Особенности лаброцитов [Siraganian R. Р„ 1988]
Особенности Лаброциты соединитель- ной ткани Лаброциты слизистых оболочек
Окраска (альциановый Красно-голубая Голубая
синий — сафранин)
Диаметр, мкм 9—20 Меньше 9
Гранулы Большие, много одинакового разме- ра Мелкие, разного размера
Т-клеточнозависимая + —
пролиферация
Миграция Не мигрируют Мигрируют
Продолжительность жизни Длинная Короткая
Протеогликаны Гепарин Хондроитинсульфаты
Гистамин 10—30 пкг/клетку Менее 2 пкг/клетку
Тип протеазы Тип I Тип II
Стимуляторы секреции:
IgE + +
Са2+-ионофор + +
ионофор 40/80 + —
брадикинин + —
соматостатин + —
лекарственные опиаты + —
метаболиты арахидоновой кислоты PGD2 LTC4 PGD2
Примечание. «+» и «—» то же, что в табл. 4.2.
Каждый лаброцит представляет собой сложную систему, содер-
жащую большое количество биологически активных веществ. В гра-
нулах этих клеток имеются гепарин, гистамин, у некоторых видов
животных (мыши, крысы) — серотонин. Здесь обнаружены также
Допамин, хондроитинсульфаты, гиалуроновая кислота, гликопроте-
ИДЫ и фосфолипиды [Серов В. В., Шехтер А. Б., 1981 ]. В составе
основных белков гранул есть нейтральные протеазы: триптаза, име-
ющая свойства кининогеназы и активирующая кининоген [Proud
et al., 1988 ], химаза, эстеразы, липаза, моноаминоксидаза, фер-
менты цикла Кребса, анаэробного гликолиза и пентозного шунта
ICepoB В. В., Шехтер А. Б., 1981 ]. В условиях патологии лаброциты
активно синтезируют и высвобождают производные ненасыщенных
141
Рис. 4.25. Дегрануляция тучных клеток при перитоните: нарушение
цитоплазматической мембраны и выход гранул в межклеточное вещество
(голокриновая секреция). х 3600.
жирных кислот, в' частности простагландины, тромбоксан, проста-
циклины и лейкотриены, играющие важную роль в сосудистых
реакциях и сокращении гладких мышц внутренних органов. По
мнению М. Lawrence (1983), в аллергических реакциях наиболее
важны три медиатора: гистамин, медленно реагирующая субстанция
анафилаксии (МРС-А) и анафилактический хемотаксический фактор
эозинофилов. В то же время в последние годы получены важные
данные о значении ФАТ — фактора, активирующего тромбоциты
[Pretolani М., Vargaflig В., 1987]. Именно ФАТ индуцирует гипер-
реактивность бронхов у человека и лабораторных животных, уси-
ливает сосудистую проницаемость, отек и инфильтрацию тканей
клетками, особенно эозинофилами в легких.
В лаброцитах кожи и аденоидов человека при определенных
условиях фиксации в перинуклеарных цистернах, зернистой эндо-
плазматической сети и изредка в периферических цистернах пла-
стинчатого комплекса выявляют эндогенную пероксидазу, чувстви-
тельную к глютаровому альдегиду [Escribanol М. et al., 1987]. В лаб-
роцитах содержится также большое количество гистамина. Так,
например, в синовиальных лаброцитах человека оно составляет 4,3 ±
0,5 нг на клетку [Kopicky-Burg Y. A. et al., 1988 ]. Гистамин частично
(42
синтезируется в самих лаброцитах, а некоторое количество его
накапливается в них за счет захвата из микроокружения, тогда как
гепарин накапливается в основном в результате его синтеза этими
клетками [Серов В. В., Шехтер А. Б., 19811. Цитохимически В. В.
Серов и А. Б. Шехтер (1981) выделяют три типа клеток: 1) отно-
сительно мелкие клетки с ортохроматической окраской зернистости
при использовании толуидинового синего, дающего положительную
[ЛИК-реакцию; 2) более крупные клетки с обильной метахромати-
ческой ШИК-негативной зернистостью; 3) клетки с выраженной
детрануляцией (выход гранул в межклеточное вещество; рис. 4.25).
Выделяют также четвертую форму лаброцитов, опустошенных в
результате секреции, которые совсем или почти совсем не содержат
гранул. Вероятно, гетерогенность лаброцитов определяется межтка-
невой интеграцией [Ляпунов Ж. К., Гордон Д. С., 1986]. Особенно-
сти морфофункциональной организаций лаброцитов и базофильных
гранулоцитов включают не только наличие указанных биологически
активных веществ, но и большое количество высокоаффинных ре-
цепторов для IgE на их поверхности. Высвобождение биологически
активных веществ из гранул происходит в том случае, когда ре-
цепторы IgE подвергаются перекрестно «сшивке», которая может
быть вызвана поливалентным антигеном в комплексе с IgE, аггре-
гированным IgE, IgE и двухвалентными антителами к IgE, двухва-
лентными антителами к рецепторам [Паркер Ч. В., 1989]. Поскольку
на поверхности лаброцитов, кроме того, имеются рецепторы и для
компонентов комплемента, то выброс медиаторов из клеток могут
вызвать также СЗ, С5а, С4а; СЗа. Дегрануляцию лаброцитов клеток
могут вызвать также ионофоры, некоторые щелочные олигопептиды,
белки нейтрофилов, морфин, полимиксин В, рентгеноконтрастные
средства, протеиназы, нейропептиды, в том числе вещество Р, кап-
сацеин, филломедузин, лимфокины, соматосгатин-тетрадекапептид
и др. [Паркер Ч. В., 1989; ChugvetM. R., 1989]. Наконец, установ-
лено, что лаброциты и базофильные гранулоциты активируются
лимфокинами, монокинами, катионными белками и протеиназами
нейтрофилов [Паркер Ч. В., 1989]. Использование моноклональных
антител к Fc-рецептору позволило определить наличие различных
механизмов высвобождения содержимого гранул лаброцитов. В не-
которых из таких механизмов задействованы не только перекрестно
связанные Fc-рецепторы, но и активация р -адренергических рецеп-
торов [Undent В. J. et al., 1988].
Согласно данным В. В. Серова и А. Б. Шехтера (1983), сущест-
вует два основных типа высвобождения содержимого гранул во
внеклеточную среду, соответствующие апокриновой и мерокриновой
секреции: дегрануляция (выход гранул) и гранулолизис за счет
секреции их содержимого. В некоторых ситуациях секреция может
происходить по голокриновому типу, что обычно сопровождается
гибелью клетки.
В молекулярных механизмах дегрануляции лаброцитов можно
выделить две стадии процесса. В I стадии происходят зависящая от
антител, но независимая от ионов кальция активация клеток, свя-
143
зывание IgE рецепторами клеточной поверхности, последующее свя-
зывание IgE-антигена, иммобилизация и интернализация ре^пто-
ров, активация протеаз, высвобождение внутриклеточного Са2 , что
приводит к его экструзии, увеличение цАМФ, фосфорилизация бел-
ков. Во II, кальцийзависимой, стадии наблюдаются активация ме-
тилтрансферазы, открытие кальциевых каналов и увеличение кон-
центрации кальция, активация фосфорилазы-А2, фосфорилазы-Ц,
изменения в цитоскелете с перемещением гранул к плазменной
мембране, открытие гранул во внеклеточное пространство с исте-
чением содержимого и высвобождением медиаторов [Ishizaka Т. et
al., 1986; Siraganian R. Р., 1988].
Лаброциты и базофильные гранулоциты играют основную роль
в ряде патологических процессов с выраженным воспалительным
компонентом. В частности, они имеют отношение к патогенезу
аллергического ринита, воспалительных заболеваний кишечника,
бронхиальной астмы, атопического и контактного дерматитов, хро-
нической крапивницы, прогрессирующего системного склероза, ле-
гочного фиброза, саркоидоза, заболеваний венечных артерий сердца
[Holgate S. Т., Church М. К., 1989]. При этом в одних реакциях
участвуют прежде всего лаброциты, в других — базофильные лей-
коциты крови. Так, для человека лаброциты являются основным
источником медиаторов при отеке и гиперемии кожи, возникающих
в ответ на воздействие антигена. В то же время базофилы играют
основную роль при аллергических реакциях в слизистой оболочке
нфса и конъюнктиве глаза. В общем плане участие лаброцитов и
базофильных гранулоцитов в воспалении осуществляется по трем
основным направлениям: 1) они играют основную роль в иммуно-
патологических процессах, прежде всего анафилактического типа,
и в некоторых реакциях ГЗТ; 2) медиаторы лаброцитов и базофилов
влияют на микроциркуляцию и лейкоциты крови, что имеет особенно
большое значение в период становления воспалительной реакции;
3) лаброциты и базофилы участвуют в поствоспалительных репара-
тивных процессах и поддержании гомеостаза соединительной ткани.
При реакциях анафилактического типа происходит массивная
дегрануляция указанных клеток, приобретающих характерную уль-
траструктуру [Popov А., 1988 ]. В наиболее тяжелых случаях воз-
никает клиническая картина анафилактического шока, в других
случаях — бронхоспастическая реакция (приступ бронхиальной аст-
мы) или распространенная кожная реакция.
Возможны также местные реакции по типу ГЗТ, связанные с
базофильными гранулоцитами. Так, у человека и морских свинок
может развиваться так называемая кожная базофильная гиперчув-
ствительность, или реакция Джонса — Мота. Она возникает в тех
случаях, когда иммунизирущий стимул слаб (например, при имму-
низации неполным адъювантом Фрейнда). Многие контактные ал-
лергии у человека относятся к этому типу гиперчувствительности.
Реакция возникает также при введении растворимых паразитарных
антигенов, живых паразитов или клещей, контактных аллергенов,
опухолевых или аллогенных клеток [Паркер Ч. В., 1989]. При этом
144
Рис. 4.26. Организация экссудата на поверхности брюшины на 5-е сутки
разлитого перитонита (повторная операция после хирургической санации).
Тучная клетка среди макрофагов и нейтрофильных гранулоцитов, х 7200.
процесс характеризуется покраснением кожи, ее умеренным уплот-
нением, а гистологически — очаговой инфильтрацией базофилами.
Считают также, что базофилы играют роль в развитии воспаления
при хроническом интерстициальном нефрите, патогенезе некоторых
форм иммунокомлексного нефрита, при отторжении трансплантата,
подостром и хроническом воспалительном ответе на паразитарные
кишечные инфекции [Паркер Ч. В., 1989].
Механизмы действия медиаторов лаброцитов на микроциркуля-
цию и хемотаксис лейкоцитов в очаге воспаления подробно описаны
в литературе [Чернух А. М., 1979; Despoil., LemanskeR., 1988;
Kaud I., 1989[. Показано, что именно вещества, продуцируемые
этими клетками в зоне действия раздражителя, являются пусковыми
факторами воспаления. В то же время в серии работ, выполненных
А. М. Чернухом и его учениками (1979—1989), и в опытах с дози-
рованной дегрануляцией лаброцита показано, что даже дегрануляция
одиночной клетки вызывает гиперемию и повышение сосудистой
проницаемости в участке воздействия. Установлено также, что вы-
свобождение гистамина из лаброцитов почек вызывает повышение
сосудистой проницаемости внутрипочечных микрососудов и усили-
145
вает продукцию ренина. В изолированных почках морских свинок,
предварительно сенсибилизированных овальбумином, введение этого
белка в дозе 200 мкг вызывало сужение почечных сосудов на 5—'25
мин и уменьшение скорости кровопотока на 21—99%. Этот эффект
обусловлен в первую очередь тромбоксаном, выделяемым лаброци-
тами почки, а также лейкотриеном С4 и Гистамином [Assem Е. et
al., 1987].
Хотя и лаброциты, и базофильные гранулоциты крови продуци-
руют вещества с выраженной окисляющей способностью (перокси-
даза, супероксид, перекись водорода), в воспалительной реакции
они играют скорее регуляторную роль и не выполняют защитную
функцию при бактериальной или паразитарной инвазии. В то же
время регуляторная роль лаброцитов в воспалительном процессе
проявляется и в их влиянии на рост и созревание соединительной
ткани в зоне воспаления, где количество лаброцитов, особенно в
фазе пролиферации, возрастает [Choi К., Claman Н., 1977; Druvetors
Р., Normy К., 1988 ]. Мы также наблюдали это при разлитом гнойном
перитоните в фазе репарации и организации экссудата (рис. 4.26).
Установлена корреляционная связь между процессами дегрануляции
лаброцитов и пролиферацией клеток мезензимального генеза [Про-
ценко В. А. и др., 1987].
Таким образом, лаброциты участвуют в запуске и регуляции
воспалительных реакций. Функция этих клеток в значительной
степени коррелирует с функцией эозинофильных гранулоцитов.
4.1.3.2. Эозинофильные {ацидофильные) гранулоциты
Эозинофильные гранулоциты образуются из миелоидной стволовой
клетки, при делении которой формируется линия предшественников
эозинофилов. Они составляют 1—4% всех лейкоцитов, выявляемых
в мазках периферической крови (120—350 клеток в 1 мм , или
1,2—3,5• 10ь на 1 л). Концентрация эозинофилов в крови и пери-
ферических тканях, в том числе в зоне воспаления, ре1улируется
их дифференцировкой в костном мозге под влиянием колониести-
мулирующих факторов, а также изменением скорости привлечения
эозинофилов в определенные регионы с помощью факторов, хемо-
таксичных для этих клеток. Существует особая разновидность ко-
лониестимулирующего фактора (КСФ) человека, который способ-
ствует превращению клеток-предшественников в эозинофилы
[Vadas М. А., 1983 ]. Установлен суточный ритм изменения содержания
эозинофилов в периферической крови, при этом максимум их при-
ходится на ночные часы, а минимум — на утренние (Хем А., Кормак
Д., 1983]. Диаметр эозинофилов составляет 17 мкм, их ядра состоят
из двух долек, соединенных перемычкой. Наиболее ярким признаком
эозинофильных гранулоцитов является наличие характерных гранул,
окрашивающихся эозином в красный цвет. При воздействии зеленого
прочного такие гранулы приобретают изумрудно-зеленые цвета, что
свидетельствует о высоком содержании в них катионных белков.
146
Рис. 4.27. Эозинофильный гранулоцит брюшины: светлая, кристаллоидная
центральная часть гранул и более темная периферическая, к 5600.
В эозинофилах человека в среднем содержится около 200 гранул
на клетку. Каждая гранула окружена мембраной, в центре зрелых
гранул имеется прямоугольная кристаллоидная сердцевина разной
электронной плотности (рис. 4.27). Размер гранул 0,5—1,5*0,3- 1
мкм. Кроме специфических гранул, в цитоплазме эозинофилов об-
наружены мелкие округлые гомогенные гранулы диаметром 0,1—0,5
мкм, содержащие арилсульфатазу и кислую фосфатазу. Большую
часть специфических гранул эозинофильных гранулоцитов состав-
ляет основной белок со щелочными свойствами, содержащий зна-
чительное количество аргинина [Кей А. Б., 1983]. По данным S. I.
Ackerman и соавт.' (1983), в специфических гранулах эозинофилов
человека имеются главный (основной) белок, катионный белок и
нейротоксин.
В поверхностных слоях эозинофильных гранул в большом коли-
честве содержится пероксидаза, которая отличается от пероксидазы
нейтрофильных гранулоцитов как по биохимическим, так и по
антигенным свойствам. Кроме того, в специфических гранулах эози-
нофилов в основном выявлены те же ферменты, что и в азурофиль-
ных гранулах нейтрофилов. Одним из ферментов, обнаруживаемых
147
в мелких гранулах эозинофилов, является арилсульфатаза. По дан-
ным А. Б. Кей (1983), арилсульфатаза эозинофилов человека и мор-
ских свинок относится к типу ПВ и может инактивировать медленно
реагирующую субстанцию анафилаксии. Фосфолипаза этих клеток
способна инактивировать фактор, активирующий тромбоциты. Та-
ким образом, оба указанных фермента выполняют регуляторную
функцию в реакциях анафилаксии. В эозинофилах имеется и гис-
таминаза, которая также может играть определенную роль в об-
менной и регуляторной функции эозинофилов. Кроме того, продукты
расщепления гистамина оказывают хемотаксическое действие на
эозинофилы, так как последние имеют рецепторы к IgA, IgM, IgG,
IgE, а также к компонентам комплемента [Кей А. Б., 1983; Пар-
кер И. В., 1989].
Одна из функций эозинофилов — цитотоксическая. Главный
белок способен повреждать эпителиальные клетки дыхательных пу-
тей, нейтрализовать гепарин, оказывать влияние на свертывание
крови. КСФ человека усиливает цитотоксическую функцию эози-
нофилов по отношению к паразитам, йодирование и продукцию
супероксида. Существует генетический контроль эозинофилии в от-
вет на введение антигена [Vadas М. А., 1983]. Так, у мышей кон-
тролирующий ген сцеплен с комплексом Н-2.
Продукция хемотаксических для эозинофилов факторов пред-
ставляет собой сложную и многостороннюю проблему. Эти факторы
образуются при клеточных и гуморальных иммунных реакциях
[CohenS., 1983], анафилактических реакциях, реакциях типа фе-
номена Артюса. Показано их образование из С5-компонента ком-
племента. Кроме того, хемотаксическими для эо инофилов факто-
рами могут быть лимфокины и монокины. Мононуклеарные клетки
крови человека в покое и после стимуляции ипополисахаридами,
а также Т-лимфоциты после стимуляции КонА выделяют вещества,
усиливающие киллерный эффект эозинофилов на личинки аскарид
[Lenz Н. et al., 1985]. Лимфокины способны индуцировать высво-
бождение ферментов из эозинофилов, угнетать их миграцию, кон-
тролировать другие биохимические эффекторные реакции эозино-
филов [Yoshida Т., Jones М. L., 1983]. При эозинофильном воспа-
лении кожи, вызванном у морской свинки иммунизацией экстрактом
аскарид с последующим введением разрешающей дозы, различают
раннюю и позднюю фазы кожной реакции [Hirashima М. et al.,
1983]. Ранняя фаза находится под контролем раннего хемотакси-
ческого фактора (РХФ), который представляет собой низкомолеку-
лярный полипептид с молекулярной массой 0,3 кД. Этот фактор
устойчив к прогреванию (30 мин при 56°С) и по своим свойствам
соответствует эозинофильному фактору анафилаксии, высвобожда-
емому лаброцитами. Через 24 ч в зоне воспаления появляются два
поздних хемотаксических фактора (ПХФ) массой около 70 кД.
Инкубация эозинофилов с иммобилизованным иммунным комплек-
сом приводит к появлению на их поверхности белков с массой 58,
55, 13 и 18 кД, которые, по-видимому, участвуют во взаимодействии
эозинофилов с иммунными комплексами. Приведенные данные по-
148
называют, что эозинофилы играют роль в воспалении, вызванном
иммунными комплексами.
Особое место среди воспалительных реакций, связанных с эози-
нофильными гранулоцитами, занимают состояния гиперчувствитель-
ности немедленного типа (ГНТ) и паразитарные заболевания. При
этом важно то, что многие гельминты выделяют хемотаксический
для эозинофилов фактор. Инфильтрация эозинофилами ткани в
очаге воспаления зависит, по-видимому, не только от характера
повреждающего агента, но и от фазы воспаления, а также от наличия
других заболеваний у пациента. Dunn Coliny и соавт. (1988) изучали
изменения в трахеобронхиальном дереве сенсибилизированных и
несенсибилизированных к овальбумину морских свинок. Спустя
8 мин после провокации этим же белком у сенсибилизированных
животных развивалось краевое стояние нейтрофильных гранулоци-
тов и эозинофилов в бронхиальных микрососудах. Через 6 ч начи-
налась миграция эозинофилов в перибронхиальную ткань, а к концу
1-х суток эти клетки скапливались в большом количестве в слизистой
оболочке и перибронхиальной мышечной ткани, являясь, по-види-
мому, источником бронхоспастических факторов. Такая картина
сохранялась в течение 7 сут после провокации. Эозинофильные
гранулоциты, несомненно, не только обладают противопаразитарной,
антигельминтной и антигрибковой активностью, но также играют
роль в повреждении бронхиального и респираторного отделов легких,
а также в поддержании бронхоспастического синдрома. Существуют
также легочные эозинофильные инфильтраты, сочетающиеся с си-
стемными васкулитами, которые могут протекать как форма узел-
кового периартериита. Эозинофилы, несомненно, играют роль при
эозинофильной гранулеме легких, которую X. Б. Визнер (1984) от-
носит к гистиоцитозу X. Наряду с легочной эозинофилией сущест-
вуют и другие органные эозинофилии. Так, имеются данные о
наличии эозинофилии в слизистой оболочке кишечника при кишеч-
ной форме ГНТ.
Таким образом, проблема участия эозинофилов в иммунном
воспалении, несмотря на несомненность такого процесса, нуждается
в дальнейшем изучении. Недостаточно разработаны и вопросы ан-
тимикробной функции эозинофильных гранулоцитов, однако можно
считать установленным, что эозинофилы менее эффективно, чем
нейтрофилы, убивают обычные бактерии, поэтому при нейтрофи-
лопении с гиперэозинофилией имеется предрасположенность к бак-
териальным инфекциям. Хотя эозинофил содержат большое коли-
чество протеиназ, они не вызывают гнойного расплавления тканей.
В то же время эозинофилы способны продуцировать больше перекиси
водорода, чем нейтрофилы, и содержат больше пероксидазы, которая
отличается от пероксидазы нейтрофилов, в частности по бактери-
цидной активности. Кроме того, эо инофильные гранулоциты отли-
чаются от нейтрофильных более низкой фагоцитарной активностью.
Однако имеются сведения, что при некоторых заболеваниях толстой
кишки человека (биопсииныи материал) суммарная фагоцитарная
активность эозинофилов может быть выше, чем у нейтрофильных
149
Рис.*4.28. Эозинофильные гранулоциты в клеточном инфильтрате стенки
тонкой кишки при остром перитоните: контакт эозинофильного гранулоцита
с макрофагом, х 5000.
гранулоцитов и макрофагов [Beeken W. et al., 1987 ]. В связи с этим
необходимо по-новому рассмотреть роль эозинофильных гранулоци-
тов в защите от инфекции. Несомненно, важны сведения о так
называемых активированных эозинофилах [КадА. В., 1985], кото-
рые характеризуются изменениями кристаллоидных структур и мем-
бран гранул и, по-видимому, выполняют защитную функцию.
Важна и обменная роль эозинофилов. Ранее уже отмечалось их
участие в утилизации гистамина и других веществ, связанных с
анафилаксией. Так, по данным О. Г. Васадзе (1982), при внутри-
перитонеальном введении крысам крахмала происходит увеличение
концентрации гистамина в перитонеальном экссудате и резко воз-
растает количество эозинофилов, «работающих» в синергизме с лаб-
роцитами и макрофагами (рис. 4.28). Метаболической функции
эозинофилов соответствует их чувствительность к содержанию не-
которых гормонов в тканях или крови, в частности к эстрогенам.
Интерес представляет и тот факт, что эозинофилы, как и лаброциты,
накапливаются в органах, сообщающихся с внешней средой, где
существует постоянная контаминация микроорганизмами: в легких,
кишечнике, матке, слизистых оболочках верхних дыхательных пу-
тей, мочеполовой системе [Пигаревский В. Е., 1978]. Хотя основная
150
функция эозинофильных гранулоцитов состоит в противопаразитар-
ной защите организма [Беклемишев Н. Д., 1986], причем такая
защита нередко более эффективна при сочетанном действии про-
дуктов эозинофильных гранулоцитов и лаброцитов, однако, веро-
ятно, имеются и другие аспекты участия указанных клеток в вос-
палении, поэтому роль эозинофильных гранулоцитов в условиях
патологии нуждается в дальнейшем изучении.
4.1.4. ЛимфОЦИТЫ
Лимфоциты — основные функциональные компоненты иммунной
системы, морфологический субстрат которой представлен совокуп-
ностью лимфоидных органов й тканей. Лимфоидная система обладает
тремя особенностями: она генерализована по всему телу, ее клетки —
лимфоциты постоянно рециркулируют и несут на мембране специ-
ализированные рецепторы, обеспечивающие им способность ответа
на антиген, в том числе выработку антиген-специфических антител
[Петров Р. В., 1976]. Масса лимфоидной ткани у человека достигает
1,5—2 кг, общее количество лимфоцитов 1012, а количество лим-
фоцитов с различными антигенсвязывающими рецепторами 10°
[Петров Р. В., 1976; Пол У., 1987]. Тип рецепторов у каждого лим-
фоцита генетически запрограммирован, но в последнее время вы-
сказано предположение, что, возможно, лимфоциту обладают уни-
кальной способностью формировать рецепторы к антигенам не в
результате генетически заданной программы, а непосредственно в
ходе иммунной реакции, в процессе их дифференцировки и адап-
тации [Пол У., 1987]. Другой важной особенностью лимфоцитов
является наличие двух этапов созревания и дифференцировки —
антигеннезависимого, на котором формируются зрелые антигенспе-
цифические лимфоциты, и антигензависимого, в ходе которого ак-
тивированные лимфоциты дают начало антигеннеспецифическим
клонам лимфоцитов-эффекторов, регуляторов, антителопродуцентов
и клеток памяти.
Многообразие функций иммунной системы и ее саморегуляция
обеспечиваются гетерогенностью популяций лимфоцитов. Различают
два основных класса клеток — Т-лимфоциты (Thymus-зависимые),
осуществляющие спектр клеточных реакций иммунитета (ГЗТ,
трансплантационный иммунитет, регуляция иммунного ответа и
ДР-), и В-лимфоциты (Bursa-, или Bone marrow-зависимые), участ-
вующие в реакциях гуморального иммунитета, — предшественники
антителопродуцентов. Деятельность В-лимфоцитов контролируется
Регуляторными Т-лимфоцитами. Кроме того, выделяют 0-клетки,
не несущие маркеров Т- или В-лимфоцитов; D-клетки с поверхно-
стными антигенами как Т-, так и В-лимфоцитов; К-клетки, осу-
ществляющие антителозависимый цитолиз, и NK-клетки, выполня-
ющие антителонезависимый цитолиз.
151
4.1.4.1. Центральные и периферические лимфоидные органы
Лимфоциты локализуются в центральных и периферических лим-
фоидных органах, которые объединяют лимфоциты в особые взаи-
модействующие системы и регулируют эффективность этого взаи-
модействия. В центральных лимфоидных органах происходят анти-
геннезависимое созревание и дифференцировка лимфоцитов. К этим
органам относят костный мозг (у плода в различные периоды эм-
бриогенеза — желточный мешок, печень, селезенка) — место со-
зревания В-лимфоцитов и пре-Т-лимфоцитов; тимус (рис. 4.29) —
орган, принимающий пре-Т-лимфоциты, обеспечивающий созрева-
ние, отбор и избирательное высвобождение на периферию антиген-
неспецифических Т-лимфоцитов [Muller Hermelink Н., 1986]. Про-
цесс созревания как В-, так и Т-лимфоцитов заключается в экс-
прессии генов в определенной последовательности и происходит под
влиянием специализированного микроокружения благодаря прямым
мембранным контактам и воздействию короткодистантных, реже
дальнодействующих медиаторов.
Выход лимфоцитов из органов иммуногенеза, их циркуляция и
последующая рециркуляция зависят от появления на мембране кле-
ток особых homing-рецепторов, например у Т-лимфоцитов к по-
сткапиллярным венулам с высоким эндотелием в периферических
лимфоидных органах [Reichert К. et al., 1986 ]. К последним относят
селезенку, лимфатические узлы, неинкапсулированные лимфатиче-
ские фолликулы в рыхлой соединительной ткани слизистых оболочек
дыхательного, пищеварительного и мочеполового трактов, а также
кровь. В этих органах происходит в основном антигензависимое
взаимодействие зрелых циркулирующих клеток. Распределение лим-
фоцитов по органам и тканям зависит от характера homing-рецептора
и местной пролиферации из антигенстимулированных предшествен-
ников. Так, например, Т-лимфоциты составляют в селезенке 35%,
в лимфатических узлах 70%, в групповых лимфатических фолли-
кулах тонкой кишки 10—30%, в крови 50—80% от всех лимфоцитов
[Пол У., 1987]. Кроме того, различные субпопуляции Т- и В-лим-
фоцитов также распределены неравномерно: соотношение субпопу-
ляций Т4/Т8-лимфоцитов в крови составляет 1,5—3; Т4-лимфоциты
(хелперы-индукторы) преобладают в мозговом веществе тимуса,
Т-зависимых зонах лимфатических узлов и селезенки, Т8-лимфо-
циты (супрессоры и киллеры) — среди интраэпителиальных лим-
фоцитов и в костном мозге; IgA-продуцирующие В-лимфоциты со-
средоточены в основном в неинкапсулированных лимфатических
фолликулах слизистых оболочек.
Сходные рецепторы регулируют миграцию Т- и В-лимфоцитов
в иелимфоидные органы, что определяет особенности локального
иммунного ответа. Так, от спектра иммунорегуляторных клеток в
инфильтрате зависит тип гиперчувствительности. При реакциях ГЗТ
может сохраняться соотношение Т4/Т8, равное 2:1, но могут пре-
обладать Т4-лимфоциты (при туберкулезе, ревматоидном артрите),
либо Т8-лимфоциты (в коже при псориазе). При антигенной сти-
152
Рис. 4.29. Тимус: а— долька тимуса с широким корковым веществом,
богатым созревающими Т-лимфоцитами. Окраска гематоксилином и эози-
ном. х 100; б — тимические гормоны (полипептиды тималина) в субкап-
сулярных эпителиальных клетках коркового вещества. Непрямой имму-
нофлюоресцентный метод с антисывороткой к полипептидам тималина.
* 400; в — Т-лимфоциты коркового вещества. * 8000.
муляции происходит потеря homing-рецепторов и способности лим
фоцитов рециркулировать, что приводит к накоплению в очаге
воспаления или периферических лимфоидных органах антигенспе-
цифических лимфоцитов. Антигеннеспецифические Т-лимфоциты
активируются и накапливаются там же благодаря повышению в
тканях концентрации la-подобных молекул и у-интерферона [Че-
редеев А. Н., Ковальчук Л. В., 1989].
Хотя пути миграции Т-и и В-лимфоцитов сходны —межэндо-
телиально, через посткапиллярные венулы с высоким эндотелием,
их локализация в периферических лимфоидных органах различна.
Это связано со взаимодействием лимфоцитов со стромальными не-
лимфоидными клетками и выделением Т-и В-лимфоцитами фак-
торов, ингибирующих спонтанную агрегацию друг друга [Rouse R.
et al., 1984 ]. К Т-зависимым зонам относят периартериальные муфты
селезенки, паракортикальную зону лимфатических узлов, межфол-
ликулярную зону групповых лимфоидных фолликулов тонкой киш-
ки. Там располагаются интердигитирующие клетки, репрезентир -
ющие антиген, экспрессирующие HLA-DR-антигены и регулирую-
щие Т—Т- и Т—В-клеточную кооперацию. Аналогично построены
и периваскулярные виутридольковые пространства тимуса. В-зави-
симые зоны включают лимфатические фолликулы селезенки, кор-
тикальную зону и мякотные тяжи лимфатических узлов, фоллику-
лярную зону и купол групповых лимфатических фолликулов тонкой
кишки. В них локализованы дендритные (фолликулярные дендрит-
ные) клетки, репрезентирующие антиген и кооперирующиеся с
В-лймфоцитами. Однако в В-зависимых зонах присутствует 5—15%
Т-лимфоцитов, в основном их субпопуляция Т4 (хелперы), участ-
вующих в антигензависимой дифференцировке В-лимфоцитов [Че-
редеев А. Н., Ковальчук Л. В., 1989; Nieuwenuis Р., Opsten D., 1984].
4.1.4.2. Система Т-лимфоцитов'
Т-лимфоциты в отличие от В-лимфоцитов способны распознавать
антигенные детерминанты, ассоциированные с поверхностными мем-
бранными продуктами, либо антигенами I или II класса системы
HLA, либо антигенами иммуноглобулинов (феномен двойного рас-
познавания). Светооптические и электронно-микроскопические ме-
тоды выявления Т-лимфоцитов малодостоверны, результат во многом
зависит от степени дифференцировки и активации этих клеток.
Так, «малый» Т- и В-лимфоцит — клетка размером 6—9 мкм с
округлым ядром, содержащим плотный хроматин, маскирующий
ядрышко, узкой, слабобазофильной цитоплазмой. Активированный
лимфоцит (лимфобласт) — клетка размером 9—10 мкм с просвет-
ленным ядром, содержащим несколько ядрышек, более широкой,
пиронинофильной и базофильной цитоплазмой. Светооптически зре-
лые Т-лимфоциты в отличие от В-лимфоцитов нередко характери-
зуются положительной реакцией на кислую фосфатазу и неспеци-
фическую эстеразу. В реакции на неспецифическую а-нафтилаце-
154
Рис. 4.30. Т-лимфоциты (а) и В-лимфоциты (б). Сканирующая электронная
микроскопия, к 7000 (препарат В. М. Чернова и Л. Г. Кузьменко).
татэстеразу мелкогранулярный продукт реакции наблюдается в ци-
топлазме Т-супрессоров (киллеров), единичные крупные гранулы —
ч у Т-хелперов [Вылков И., 1980; Сидоренко С. П. и др., 1982]. Элек-
тронно-микроскопически Т-лимфоциты отличаются обилием лизо-
сом. При изучении в сканирующем электронном микроскопе повер-
хность покоящихся клеток чаще гладкая (рис. 4.30). Иммуномор-
фологический метод с использованием моноклональных антител
позволяет достоверно выявить Т-лимфоциты и их субпопуляции.
В табл. 4.4 приведены некоторые дифференцировочные антигены
(сокращенно CD) Т-лимфоцитов человека.
Таблица 4.4
Номенклатура дифференцировочных антигенов Т-лимфоцитов. человека [матери-
алы III Международного совещания по лейкоцитарным дифферёнцировочпым ан-
тигенам человека, 1986]
CD* Выявляемые клетки
CD1 Тимоциты корковой зоны
CD2 Т-лимфоциты и тимоциты, образующие розет-
I ' А..- ки с эритроцитами барана
СОЗ Все зрелые Т-лимфоциты
• CD4 Т-хелперы/индукторы
CD5 Все Т-лимфоцнты, некоторые субпопуляцин
CD6 В-лимфоцитов
Зрелые Т-лимфоциты, некоторые субпопуля- ции В-лимфоцитов, клетки Лангерганса
CD7 Все Т-лимфоциты
CD8 Т-су прессоры/киллеры
* CD (ciasters differentiation) — кластер! дифференцировки.
Функции Т-лимфоцитов заключаются в распознавании антиген-
ных детерминант, элиминации антигенов сенсибилизированными
лимфоцитами (киллерами) и регуляции иммунного ответа. Кроме
того, Т-лимфоциты участвуют в регуляции гемопоэза, осуществляют
перенос морфогенетической информации, стимулируют либо пре-
кращают пролиферацию нелимфоидных клеток, контролируя таким
образом структурный гомеостаз [Фриденштейн А. Я. и др., 1984;
Бабаева А. Г., 1985]. Рециркулирующие Т-лимфоциты живут 4—
6 мес, Т-клетки памяти сохраняются в лимфоидных органах в те-
чение многих лет.
Популяция Т-лимфоцитов гетерогенна, но до настоящего времени
нет единого мнения о степени их разнообразия, а также четких
различиях отдельных субпопуляций у человека. Многие данные,
полученные в экспериментах на лабораторных животных и in vitro,
не проверены in vivo. Неясно, совпадает ли фенотип Т-лимфоцитов
с их функциональными особенностями, как, например, это иаблю-
156
дается у мышей для антигенов Т-лимфоцитов системы «Lyt». У че-
ловека ее «эволюционным аналогом» считают систему CD. По фе-
нотипу, в целом отражающему функциональные особенности, у
человека выделяют две основные линии Т-лимфоцитов: Т4 (CD4) —
генетически запрограммированные индукторы размножения и/или
дифференцировки лимфоидных и других клеток (в основном Т-хел-
перы, индукторы), распознающие антиген в комплексе с продуктами
II класса системы HLA (на В-лимфоцитах, макрофагах, других
клетках), и Т8 (СО8)-киллеры (цитотоксические) и супрессоры,
«узнающие» антиген с продуктами I класса системы HLA на любых
клетках организма [Пол У., 1987; Чередеев А. Н., Ковальчук Л. В.,
1989]. Созревание и дифференцировка Т4- и Т8-лимфоцитов, на-
чинаясь одновременно, с определенного этапа происходят раздельно.
Система Т4-л и м ф о ц и т о в. Т4-лимфоцитам отводится
главная роль в деятельности иммунной системы — распознавание
антигена, запуск реакций клеточного и гуморального иммунитета,
регуляция Т—Т и Т—В-клеточного взаимодействия, продукция лим-
фокинов, прежде всего интерлейкинов 2—6, /-интерферона. Однако
основная их функция — хелперное влияние на эффекторные клетки
и индукция регуляторных Т-лимфоцитов. Различают Т4-хелперы,
«узнающие» продукты II класса системы HLA, необходимые для
пролиферации и дифференцировки В-лимфоцитов в плазматические
клетки; Т4-хелперы, реагирующие с антигенами иммуноглобулинов,
ведущие отбор В-лимфоцитов с наиболее аффинными к антигену
иммуноглобулинами по изотипу, классу и идиотипу; Т4-хелперы,
секретирующие антигенспецифические и антигеннеспецифические
лимфокины, играющие основную роль в индукции ГЗТ. Также
выделяют Т4-индукторы хелперов и супрессоров, активирующие
Т4- и Т8-лимфоциты, Т4-амплифайеры и трансдукторы, передаю-
щие модифицированный сигнал на различные Т-лимфоциты. Кроме
того, в особых условиях Т4-лимфоциты могут осуществлять суп-
рессию и даже иммунный цитолиз, выполняя роль Т-киллеров [Че-
редеев А. Н., Ковальчук Л. В., 1989 ].
Система Т8-л имфоцитов. Так же как и Т4-лимфоциты,
система Т8-лимфоцитов неоднородна по фенотипу и функциональ-
ным свойствам. В зависимости от состояния лимфоцита и клетки-
мишени они могут оказывать и супрессорный, и хелперный эффект.
Продолжительность жизни Т8-лим(]х>цитов меньше, чем Т4-лимфо-
Цитов. Выделяют две основные популяции Т8-лимфоцитов — Т8-
супрессоры и Т8-киллеры. Линия Т8-супрессоров включает в себя
Tsi—Tsi-индукторы супрессии, которые распознают антиген, секре-
тируют лимфокины супрессии и активируют Tsa-супрессоры, взаи-
модействующие уже непосредственно с другими Т- и В-лимфоци-
тами. Обнаружены Т-супрессоры, «узнающие» антигены I класса
системы HLA, иммуноглобулины (их классы, изотипы, идиотипы).
Т4-хелперы/индукторы и Т8-супрессоры относят к регуляторным
Т-лимфоцитам, а Т8-киллеры являются эффекторными клетками
клеточного иммунитета. Они «узнают» антиген в комплексе с про-
дуктами I класса системы HLA и путем прямого контакта и/или
1ST
секретируя цитотоксические лимфокины осуществляют иммунный
цитолиз. Лизис клетки-мишени происходит в результате повышения
проницаемости ее мембран и осмотического набухания [Пол У.,
1987]. Т-киллеры активируются или подавляются Т-хелперами и
Т-супрессорами.
Кроме этих основных субпопуляций Т-лимфоцитов, в зависимо-
сти от функциональных особенностей выделяют ряд других, напри-
мер Т-контрсупрессоры, предотвращающие инактивацию Т-хелпера
Т-супрессором, Т-дифференцирующие, влияющие на пролифера-
цию, дифференцировку и миграцию стволовой клетки [Фриденштейн
А. Я. и др., 1984], Т-лимфоциты памяти.
При антигенной или митогенной активации Т-лимфоцитов на-
чинается второй этап их созревания и дифференцировки — сложный
процесс молекулярных перестроек с экспрессией рецепторов к раз-
личным медиаторам, образованием антигенспецифических клонов,
продукцией различных лимфокинов. Роль лимфокинов состоит в
индукции созревания и дифференцировки лимфоцитов, мобилизации
лимфоцитов и других клеток воспалительной реакции, регуляции
межклеточных взаимодействий, активации лимфоидных клеток. Из-
вестно несколько десятков различных лимфокинов, которые делятся
на антигенспецифические и антигеннеспецифические, среди них
основные — интерлейкины 2—6 [Чередеев А. Н., Ковальчук Л. В.,
1989].
4.1.4.3. Система В-лимфоцитов
В-лимфоциты участвуют в реакциях гуморального иммунитета, слу-
жат предшественник ми шмуноглобулинпродуцирующих клеток —
плазмоцитов. Морфлогическими особенностями В-лимфоцитов яв-
ляются наличие ШИК-положительных гранул в цитоплазме и вор-
синчатая поверхность клетки, обнаруживаемые при исследовании в
сканирующем электронном микроскопе [Вылков И., 1980]. Однако
единственно надежный метод их выявления — иммуноморфологи-
ческий, при котором обнаруживают мембранные иммуноглобулины,
отсутствующие у Т-лимфоцитов.
Антигеннезависимый этап созревания и дифференцировки В-лим-
фоцитов происходит в костном мозге, где под влиянием локального
микроокружения в стволовой клетке-предшественнице осуществля-
ются перестройка и экспрессия генов иммуноглобулинов. Обнаружен
костномозговой аналог тимических гормонов — стимулятор анти-
телопродуцентов, названный В-активином [Петров Р. В. и др., 1981 ].
Созревание В-лимфоцита сопровождается появлением мембранных
иммуноглобулинов, HLA-DR-антигенов и homing-рецепторов. Эмиг-
рация В-лимфоцитов происходит в основном в селезенку, более*
зрелые из них затем поступают в другие периферические лимфо-
идные органы. По мере созревания В-лимфоцитов мембранные IgM
сменяются IgD, появляются рецепторы к комплементу, Fc-фрагменту
иммуноглобулинов, далее синтез иммуноглобулинов переключается
на продукцию IgG, IgA и IgE. Одна клетка может синтезировать
158
Рис. 4.31. Лимфатический узел в условиях антигенной стимуляции, а —
крупные лимфоидные фолликулы кортикальной (В-зависимой) зоны, опу-
стошение субкортикальной (Т-зависимой) зоны. Окраска гематоксилином
и эозином, к 100; б — депозиты на дендритных клетках светлого центра
лимфоидного фолликула, к 400; в — плазматические клетки, содержащие
IgG в мозговом веществе (прямой метод Кунса с антисывороткой к IgG).
*200.
До трех классов иммуноглобулинов, например IgM, IgG и IgA од-
новременно [Пол У., 1987].
Популяция В-лимфоцитов гетерогенна. Клетки отличаются друг
от друга мембранными иммуноглобулинами, что обеспечивает кло-
159
Схема 4.1. Антигенсвязанный этап дифференцировки В-лимфоцитов
[Пол У., 1987].
Пролиферация Дифференцировка
Малый покоящийся
В-лимфоцит
t
Антиген
Антитела
Интерлейкин-1
Т-хелпер
Большой активированный Большой активированный
В-лимфоцит В-лимфоцит "
Фактор роста
В-лимфоцитов
t
Фактор дифференцировки
В-лимфоцитов
Иммунобласт
(лимфобласт)
В-лимфоцит-(клетки памяти^
Плазмобласт
Плазмоцит
нальный отбор под влиянием антигена. По степени зрелости выде-
ляют два типа В-лимфоцитов — незрелые и зрелые. Незрелые несут
минимальное количество поверхностных IgD, при их активации
продукции иммуноглобулинов не происходит. Возможно, они вы-
полняют роль В-супрессоров, предотвращая появление аутореактив-
ного клона. Зрелые В-лимфоциты характеризуются минимальным
количеством мембранного IgM и максимальным IgD, при антигенной
активации зрелые В-лимфоциты превращаются в плазматические
клетки. У мышей обнаружено еще два типа В-лимфоцитов — Lyb
5+ и Lyb 5’, отличающиеся друг от друга по условиям активации
при встрече с антигеном. Различают факторзависимую активацию,
в которой участвуют В Lyb 5-лимфоциты, не требующую взаимо-
действия с Т-хелпером и происходящую под влиянием антигена и
хелперных медиаторов (ИЛ-1, факторы роста и дифференцировки
В-лимфоцитов), и активацию, рестриктированную по HLA с обя-
зательным контактом с Т-хелпером, в которой участвуют В Lyb 5"
и, возможно, В Lyb 5*-лимфоциты [Пол У., 1987 ].
Антигенсвязанный этап дифференцировки В-лимфоцитов проис-
ходит во вторичных лимфатических фолликулах лимфатических
узлов и заключается в превращении их в плазматические клетки
и В-клетки памяти (рис. 4.31, схема 4.1). Морфологически иммуно-
бласт характеризуется положительной реакцией на щелочную фос-
фатазу и глюкозо-6-фосфатдегидрогеназу, плазмобласт — появле-
нием хорошо развитой гранулярной цитоплазматической сети и
пластинчатого комплекса. Во вторичных лимфатических фолликулах
лимфатических узлов выделяют также пролимфоцит с расщеплен-
ным ядром, который трансформируется в лимфобласт (иммуиб-
160
Таблица 4.5
Физические, химические и биологические свойства иммуноглобулинов человека [Пол У., 1987]
Свойство IgG IgA IgM IgD IgE
Обычная молекулярная форма Мономер Мономер, димер и т. д. Пентамер Мономер Мономер
Молекулярная формула Другие цепи Х2?2 ИЛИ Х2у2 (хгаг)" или (Азсх?)" 1-цепь (хгцг),-) или (А?ц2>5 1-цепь Х2П2 ИЛИ Х2О2 х2е2 или Х2Г2
Подклассы 1—4 1—2 Нет Нет Нет
Молекулярная масса 150 000 160 000 950 000 175 000 190 000
Коэффициент седиментации 6,6s 7s, 9s, Us, 14s 19s 7s 8s
Количество (мг) в 100 мл сыво- 1250±300 210±50 125+50 4 0,03
ротки крови человека
Синтез иммуноглобулинов сы- 75—85 7—15 5—10 0,3 0,003
воротки крови, %
Время полураспада, сут 23 5,8 5,1 2,8 2,5
Фиксация комплемента +(IgGl,2,3) — + — —
Активация комплемента по аль- +(IgG4) + — + —
тернативному пути
Связывание с клетками Макрофаги, нейтро- филы — — ? Лаброциты
Биологические свойства Вторичный иммун- ный перенос через плаценту Секреторный ответ Первичный иммун- ный ответ, РА- фактор Поверхностный на В-лимфоцитах Гомоцитотропные антитела анафи- лаксии
бласт), мигрирующий в перифолликулярную зону, а затем — в
мякотные тяжи [Вылков И., 1980; Nieuwenhuis Р., Opsten D., 1984-
Пол У., 1987].
Плазматическая клетка — это крупная (диаметр 11—15 мкм),
неподвижная, редко делящаяся, короткоживущая (2—3 сут) имму-
ноглобулинпродуцирующая клетка. В 1 с она синтезирует несколько
тысяч молекул иммуноглобулинов — своих измененных рецепторов.
В отличие от В-лимфоцита она теряет рецепторы к антигенам
HLA-DR, СЗ-фракции комплемента, мембранные иммуноглобулины.
Показано, что 90% иммуноглобулинов крови продуцируется плаз-
матическими клетками в костном мозге [Пол У., 1987 ]. Некоторые
важнейшие свойства иммуноглобулинов представлены в табл. 4.5.
К. Lennert (1978) выделил три типа плазматических клеток. Рети-
кулярная, или обычная, плазматическая клетка имеет округлое ядро
с рисунком хроматина в виде спиц колеса, широкую базофильную
цитоплазму, и хорошо развитые гранулярную цитоплазматическую
сеть и пластинчатый комплекс. Лимфатическая плазматическая
клетка (лимфоплазмоцитоид) характеризуется меньшими размера-
ми, менее развитыми цитоплазматической сетью и пластинчатым
комплексом. Полагают, что она может образовываться без непос-
редственного контакта с Т-лимфоцитами, продуцирует IgM, часто
встречается при вирусных инфекциях. Т-связанная плазматическая
клетка обнаруживается в паракортикальной зоне лимфатических
узлов, сходна с лимфобластом, но ее цитоплазма красится по Гимзе
в серо-голубой цвет. Эндоплазматическая сеть развита слабо, фун-
кции ее неизвестны.
В-лимфоциты памяти представляют собой гетерогенные по ве-
личине долгоживущие клетки, экспрессирующие продукты II класса
системы HLA, синтезирующие различные мембранные иммуногло-
булины. Известно, что чем более длительным было воздействие
антигена, тем реже происходит синтез IgD [Пол У., 1987].
4.1.4.4. Особые типы лимфоцитов
Различают четыре типа лимфоцитов, не относящихся к линии Т
или В. 0-Лимфоциты, или То-клетки, не имеют маркеров Т- или
В-лимфоцитов, составляют 5—10% лимфоцитов крови. Они могут
осуществлять антителозависимый клеточный цитолиз без участия
комплемента при обработке клетки-мишени антителами IgG*L- и
К-клетки — гетерогенная группа 0- и Т-лимфоцитов, моноцитов,
даже полиморфно-ядерных нейтрофилов, объединеннных наличием
мембранного рецептора к Fc-фрагменту IgG. Они осуществляют
антителозависимый цитолиз без участия комплемента. N К-клетки —
естественные киллеры — особый класс лимфоцитов, по поверхно-
стным антигенам близкий к Т-лимфоцитам (обнаружены слабоаф-
финные рецепторы к эритроцитам барана), хотя при дефектах
Т-системы иммунитета они не страдают. Осуществляют спонтанный,
не опосредованный антителами, лизис клеток-мишеней. Активиру-
ются под влиянием а-, р- или у-интерферона, могут продуцировать
162
ИЛ-1. Эти клетки играют решающую роль в противоопухолевом
иммунитете и, вероятно, при вирусных инфекциях, не исключено,
нто могут элиминировать стареющие клетки.
D-клетки — лимфоциты, несущие одновременно маркеры и Т-,
и В-лимфоцитов, составляют 1—2% лимфоцитов в крови, роль их
Ееизвестна [Чередеев А. Н., Ковальчук Л. В., 1989; Пол У., 1987 ].
4.1.4.5. Межклеточные взаимодействия в системе лимфоцитов
Иммунная система представляет собой комплекс взаимодействующих
клеток с внутренними регуляторными принципами, а иммунный
,ответ является детально регулируемым процессом, где антиген —
инициатор, вовлекающий в процесс хелперные, супрессорные и
эффекторные клетки, в результате чего происходит его нейтрали-
зация. Согласно современным представлениям, лимфоцит находится
в состоянии динамического равновесия стимулирующих и супрес-
сорных воздействий. Однако большинство лимфоцитов до встречи
с антигеном пребывают в фазе G, т. е. в нестимулированном состо-
янии, поэтому эта система приводится в действие только после
антигенной активации [Пол У., 1987 ]. Помимо саморегуляции, осу-
ществляемой регуляторными Т-лимфоцитами, клеточные и тумо-
ральны реакции иммунитета контролируются нейроэндокринной
системой (схема 4.2), циркадные ритмы которой связаны с ритмами
Схема 4.2. Нейроэндокринная регуляция иммунного ответа [Besedovsky Н.,
1984; Martini., 1984].
Антиген
в иммунной системе [Martini., 1984; Besedovsky Н. et al., 1984].
В конечной части иммунного ответа подключаются эффекторные
механизм в том числе специфические — цитотоксические Т-лим-
фоциты (киллеры), антителозависимая клеточная цитотоксичность
<К-клетки), а также неспецифические — естественные киллеры
(NK-клетки), другие клетки — ПЯЛ, макрофаги, лаброциты и др.,
система комплемента и другие медиаторы воспаления.
Различ ют три типа взаимодействия клеток в иммунном ответе:
О сочетанное распознавание (когнатное взаимодействие), характе-
ризующееся непосредственным контактом Т-лимфоцита с В-лимфо-
Читом или макрофагом с помощью антигенного мостика и антигенов
* класса системы HLA; 2) поликлональное взаимодействие, при
б*
163
котором контакт между клетками происходит за счет продуцируемых
ими медиаторов, прежде всего лимфокинов; это взаимодействие
ацтигеннеспецифическое; 3) иммуноглобулинрестриктированное
(идиотип-антиидиотипическое), в котором участвуют Т-лимфоциты,
распознающие на мишенях (Т- и В-лимфоциты) антигены имму-
ноглобулинов [Пол У., 1987 ].
В зависимости от участия различных клеток выделяют также
Т—В-, Т—Т- и В—В-взаимодействия, но иммунный ответ обычно
начинается с кооперации макрофага с Т-лимфоцитом.
Макрофаг — Т-л и м ф о ц и т. Макрофаг представляет Т4-
лимфоцитам антиген, ассоциированный с антигенами II класса си-
стемы HLA. Монокины макрофага (ИЛ-1 и др.) активируют раз-
личные субпопуляции лимфоцитов. Т8-лимфоциты «узнают» анти-
ген в комплексе с продуктами I класса системы HLA, В-лимфоци-
ты — благодаря мембранным иммуноглобулинам.
Т—В-л имфоциты- Это взаимодействие лежит в основе гу-
морального иммунного ответа. Для активации большинства В-лим-
фоцитов после встречи с антигеном необходимо взаимодействие с
регуляторными Т-лимфоцитами. Различают хелперное и супрессор-
ное взаимодействия, которые могут быть когнатными, поликлональ-
ными или иммуноглобулинрестриктированными. В хелперном вза-
имодействии участвуют Т4-лимфоциты, специфичные к носителю
(распознают продукты II класса комплекса HLA), классам, изотипу
и идиотипу иммуноглобулинов. Т4-лимфоциты, специфичные к ан-
.тигену, контролируют продукцию иммуноглобулинов, остальные —
отбор клонов В-лимфоцитов, синтезирующих наиболее аффинные
иммуноглобулины. В супрессорном взаимодействии участвуют Т8-
лимфоциты, принципы этого взаимодействия такие же, как хелпер-
ного.
Т—Т-л имфоциты. Этот вид взаимодействия необходим как
для осуществления клеточных реакций иммунитета, так и для ре-
гуляции Т-хелперов и супрессоров, участвующих в реакциях гумо-
рального иммунитета. Известны хелперное, супрессорное, когнатное,
поликлональное и иммуноглобулинрестриктированное взаимодейст-
вия.
В—В-л имфоциты. Этот вид взаимодействия служит как для
стимуляции, так и для подавления гуморального иммунного ответа,
осуществляется с участием В-лимфоцитов-регуляторов путем пря-
мого контакта и, возможно, с помощью иммуноглобулинов (антител)
и иммунных комплексов.
Механизмы, обеспечивающие участие клеток иммунной системы
в реакциях воспаления, рассмотрены в главе 5.
4.1.5. Фибробласты
Фибробласт — основная клетка соединительной ткани, в том числе
грануляционной и фиброзной, развивающейся в результате воспа-
лительного процесса. Функциями этих клеток являются продукция
164
всех компонентов межклеточного матрикса (коллаген, эластин, про-
теогликаны, гликопротеины, фибронектин), регуляция метаболизма,
эпителиально-мезенхимальных взаимодействий, структурной ста-
бильности и архитектоники ткани, которые определяются взаимо-
отношениями фибробластов с волокнистыми компонентами. В эмб-
риогенезе фибробласты дифференцируются из мезенхимальных кле-
ток.
Происхождение фибробластов в постнатальном онтогенезе, в ча-
стности при воспалении, до конца неясно. Многочисл иные пред-
положения (основанные на анализе так называемых переходных
форм) о том, что фибробласты могут трансформироваться из разных
клеток (эндотелиальных, моноцитов, лимфоцитов, нейтрофилов,
.тучных клеток и т. д.), а также превращаться в эти клетки, в
«настоящее время следует признать анахронизмом. Представление о
том, что фибробласты имеют общую стволовую клетку с клетками
крови и при воспалении их предшественники мигрируют в ткань
из костного мозга через кровь [Хрущов Н. Г., 1976], не получило
достаточных подтверждений. Преобладает мнение, что фибробласты
образуются из местных недифференцированных предшественников
фибробластического ряда, возможно, перицитов [RossR., 1975;
LeblondC. Р., Laurie J., 1986]. Однако не исключено, что часть
фибробластов । очаге воспаления может иметь костномозговых пред-
шественников, не зависящих от стволовой кроветворной клетки
{Фриденштейн А. Я., Лурия Е. А., 1980].
4.1.5.1. Структурно-функциональные типы
фибробластов
Морфологические особенности фибробластов связаны со степенью
их дифференцировки и функциональной специализацией. При хро-
ническом воспалении в ткани одновременно можно встретить ши-
рокий диапазон клеточных форм. Обычно выделяют три основных
типа: малодифференцированные, зрелые фибробласты и фиброциты
[Хрущов Н. Г., 1976; Ross R., 1975], которые различаются светооп-
тическими, гистохимическими и ультраструктурными признаками.
На основании результатов собственных исследований очагов воспа-
ления, заживающих ран, различных склеротических и рубцовых
.процессов мы выделяем следующие структурно-функциональные ти-
пы фибробластов [Шехтер А. Б., 1978, 1990; Серов В. В., Шех-
тер А. Б., 1981 ].
Малодифференцированные фибробласты, ко-
торые обнаруживают в очаге воспаления возле сосудов и реже в
экссудате уже в 1-е сутки процесса, характеризуются упрощенной
организацией, свойственной эмбриональным мезенхимальным клет-
кам. Круглое или овальное ядро имеет 1—2 ядрышка, цитоплазма
содержит немногочисленные изолированные профили зернистой ци-
топлазматической сети и элементы пластинчатого комплекса, не-
большие митохондрии с плотным матриксом, иногда включения
липидов. Такая организация характерна для клеток с интерцеллю-
165
лярным обменом <не для внешней секреции). Следует отметить
что при световой (а иногда и при электронной) микроскопии эти
клетки нелегко отличить от других малодиффе енцированных кле-
ток, в частности клеток моноцитоидного ряда. К малодифференци-
рованным фибробластам относятся, очевидно, и активированные
перициты, еще не потерявшие связи со стенкой микрососуда: в них
набухает и просветляется ядро, в цитоплазме увеличивается зер-
нистая цитоплазматическая сеть.
Юные фибробласты, как и малодифференцированные,
обладают пролиферативными потенциями (среди них встречаются
клетки с фигурами митоза), но они уже настолько дифференциро-
ваны, что начинают осуществлять биосинтез коллагена и активно
секретируют кислые гликозаминогликаны. Этому соответствует пре-
имущественное развитие пластинчатого комплекса, где синтезиру-
ются гликозаминогликаны, хотя происходит и гиперплазия зернистой
цитоплазматической сети, представленной узкими, реже слегка рас-
ширенными цистернами (рис. 4.32, а). В этих клетках увеличено
содержание свободных рибосом и полисом. При световой микроско- J
пии эти клетки имеют уже характерную для фибробласта верете-
нообразную или звездчатую структуру, крупное светлое ядро с
маргинальным расположением хроматина, богатую РНК цитоплазму.
В последней выявляют активность неспецифической эстеразы, кис- I
лой фосфатазы (непостоянно), щелочной фосфатазы, аминопепти- I
дазы, ферментов цикла Кребса и гликолиза [Lindner L., 1983].
результаты электронной радиоавтографии с двойной меткой ( п- 1
уридин и ’Н-пролин) свидетельствуют о чередовании синтеза РНК
и белка (коллагена) в клетках [Пальцын А. А., Колокольчико- I
ва Е. Г., 1979]. На светооптическом уровне исследования малодиф-1
ференцированный и юный фибробласты соответствуют так называ- 1
емым полибластным и эпителиоидным клеткам по терминологии а
старых авторов, хотя с современных позиций эти термины нельзя 1
считать адекватными.
Зрелые фибробласты дифференцируются из юных форм I
и, вероятно, неспособны к пролиферации. Они представлены тремя I
основными типами.
Основной функцией коллагенобластов является био-
синтез и секреция коллагена. В зависимости от интенсивности этой 1
функции различают две разновидности коллагенобластов. В одних
клетках сохраняется выраженный пластинчатый комплекс (синтез
гликозаминогликанов), но зернистая цитоплазматическая сеть, пред-
ставленная многочисленными тесно расположенными узкими цис-
тернами, занимает более V з объема цитоплазмы. В просвете цистерн
содержится тонковолокнистое или мелкозернистое содержимое (кол-
лаген в дофибриллярной форме), которое перемещается в вакуоли
пластинчатого комплекса (по результатам электронной радиоавто-
графии), а затем в секреторные вакуоли, выходящие из клетки
[Marchi F., Leblond С. Р., 1984 ], т. е. осуществляется мерокринная
секреция белка (рис. 4.32, б).
В клетках другого типа расширенные цистерны зернистой ци-
166
Ьоплазматической сети занимают почти всю цитоплазму, которая
на полутонких срезах выглядит вакуолизированной. Часто обнару-
живают слияние мембран цистерн с цитолеммой, разрушение мем-
бран и выход в межклеточное пространство содержимого цистерн,
отдельных цистерн и отшнуровавшихся от них везикул, явления
клазмоцитоза (разрушение цитолеммы). Все это указывает на воз-
можност голокринной секреции коллагена.
Фиброкласты относятся к клеткам фибробластического ряда, ос-
новной функцией которых является фиброклазия: фагоцитоз и внут-
риклеточный лизис коллагеновых фибрилл [Шехтер А. Б., 1975,
1978; Ten Cate А., 1975; Nemetschek-Gansler А., 1988]. Эти клетки
обнаружены в грануляционной ткани, инволюционирующих рубцах
кожи и сердца при хроническом воспалении и т. п. Они играют
важнейшую роль в перестройке (ремоделяция) и инволюции сое-
динительной ткани. В вакуолях, содержащих коллагеновые фибрил-
лы в разных стадиях лизиса (рис. 4.32, в), обнаружена кислая
фосфатаза, что опровергает точку зрения о том, что в вакуолях
происходит внутриклеточный фибриллогенез. Постоянно наблюда-
ется слияние лизосом с фагоцитарными вакуолями. За исключением
последних, клетки имеют обычную структуру зрелых фибробластов
с хорошо развитой зернистой цитоплазматической сетью. Они четко
отличаются от макрофагов, тем более что последние фагоцитируют
не поперечно исчерченные фибриллы, а только разрушенный кол-
лагеновый материал.
Миофибробласты, или контрактильные фибробласты,
близки по структуре (но не идентичны) активированным, или сек-
реторным, гладкомышечным клеткам [Шехтер А. Б., 1978, 1982;
GuberS. A., Rudolf Б., 1978; GabbianiG., 1980]. Они обнаружены
в грануляционной ткани, рубцах, склерозированной ткани печени,
легких и др. До половины объема цитоплазмы занято пучками
сократительных филаментов и плотными тельцами (рис. 4.32, г).
Ядра клеток, как правило, удлинены и имеют глубокие инвагинации.
।Миофибробласты играют важную роль в контракции раны и сокра-
щении фиброзной ткани. Следует подчеркнуть, что актиновые пучки
цитофиламентов, но без плотных телец, расположенные в краевых
зонах клеток, свойственны и обычным фибробластам, они осуще-
ствляют функцию цитоскелета и органоидов движения.
Большинство описанных выше зрелых форм фибробластов раз-
рушаются в процессе активной жизнедеятельности, но часть их
переходит в неактивную долгоживущую форму (конечная стадия
дифференцировки) — фиброциты. Эти клетки имеют узкую
веретенообразную или палочковидную форму, плотное ядро зани-
мает большую часть клетки, цитоплазма бедна органеллами, в ней
овышено количество лизосом и липопигментных гранул; синтез
коллагена резко снижен. Функция этих клеток в зрелой фиброзной
ткани состоит в регуляции метаболизма и механической стабиль-
ности матрикса.
Следует отметить, что все перечисленные формы не являются
абсолютно специализированными, в них в той или иной степени
167
Рис. 4.32. Формы фибробластов.
а — юный фибробласт с хорошо выраженным пластинчатым комплексом (ПК) и умеренно
развитой зернистой цитоплазматической сетью (ЗЦС). х 10 000; б — зрелый фибробласт
(коллагенобласт), хорошо развитая зернистая цитоплазматическая сеть (ЗЦС). Секреция
коллагена осуществляется через секреторные вакуоли (СВ). Формирование коллагеновых
фибрилл (КФ) вблизи клетки и в ее инвагинациях. * 28 000;
Рис. 4.32. Продолжение.
в — в цитоплазме фиброкласта — многочисленные фагоцитарные вакуоли, содержащие
коллагеновые фибриллы (ФК). * 20 000; г — миофибробласт с развитыми зернистой
Цитоплазматической сетью и пластинчатым комплексом, а также с хорошо развитым миофиб-
Риллярным аппаратом (МФ) и плотными тельцами (ПТ); Я — ядро, х 10 000.
осуществляется продукция коллагена и гликозаминогликанов, име-
ются сократительные филаменты и могут встречаться отдельные
фагоцитарные вакуоли с коллагеновыми фибриллами. Это позволяет
предположить, что они являются не продуктами независимых линий
дифференцировки, а функциональными (фенотипическими) вари-
антами фибробласта, способными к взаимопревращениям в зависи-
мости от функциональных потребностей ткани в тот или иной
период.
4.1.5.2. Синтез, секреция, фибриллогенез
и катаболизм коллагена
Одной из основных функций фибробластов является продукция
элементов матрикса, особенно коллагеновых волокон. Биохимиче-
ские исследования позволили создать достаточно полную концепцию
внутриклеточного биосинтеза и внеклеточной модификации колла-
гена [Kuhn К., 1986; Nimni М., Harkness К. D., 1988].
На рибосомах, фиксированных к мембранам зернистой цито-
плазматической сети, происходит сборка из аминокислот одинарных
спиральных a-цепей, а с помощью пролил- и лизилгидроксилаз
образуются специфические для коллагена оксипролин и оксилизин.
Затем три a-цепи соединяются в трехспиральную молекулу прокол-
лагенов, которая характеризуется наличием на обоих концах не-
спиральных пептидов, предотвращающих внутриклеточную агрега-
цию молекул. После выхода проколлагена из клетки концевые
N- и С-пропептиды отщепляются проколлагенпептидазами, но на кон-
цах молекулы остаются небольшие неспиральные остатки — тело-
пептиды. Молекулы тропоколлагена агрегируют в фибриллы, после
чего в присутствии фермента лизилоксидазы и меди происходит
образование поперечных ковалентных межмолекулярных связей.
Протофибриллы (диаметр 3—5 нм) в свою очередь объединяются
в фибриллы с типичной периодичностью 64 нм, что объясняется
сдвигом молекул на четверть длины при латеральной агрегации.
Фибриллы формируют (на светооптическом уровне) волокна, а те
в свою очередь — пучки волокон. При этом на всех уровнях
сохраняется спиральное скручивание элементов в структуры следу-
ющего распорядка, что придает коллагеновым образованием особую
прочность и сопротивляемость растяжению.
Представленная схема фибриллогенеза относится к коллагенам
I—III типов. Однако в настоящее время известны уже 13 типов
коллагена [Kuhn К., 1986, 1989; Miller J.M., 1988], отличающихся
друг от друга комбинацией «-цепей, имеющих различия в амино-
кислотной последовательности, количестве и расположении (на кон-
цах или внутри молекулы) неспиральных участков (доменов), длине
макромолекулы и локализации в тканях (табл. 4.6). Большинство
видов соединительной ткани состоит из коллагенов I и III типов
(по мере созревания соотношение изменяется в сторону преобладания
I типа) с примесью коллагенов V и VI типов. Основу ретикулярных
170
волокон, а также незрелых аргирофильных коллагеновых волокон
[составляет коллаген III типа [Montes J. S., Junquera L. С., 1983]. В
хрящах и клапанах сердца преобладает коллаген II типа с примесью
[X—XII типов, в базальных мембранах — коллаген IV типа с при-
месью XIII типа. При этом молекулы коллагена IV типа не образуют
фибрилл, так как они соединяются в своеобразную сетевую струк-
туру-
Результаты ультраструктурных иммунохимических исследований
показывают, что коллаген I типа образует типичные периодические
фибриллы, коллаген III типа представлен более тонкими фибрил-
лами диаметром 10—15 нм, которые сплетают в виде сети фибриллы
I типа [Amenta J. et al., 1986]. Очень тонкие филаменты (диаметр
6—10 нм), тесно связанные с фибриллами коллагенов I и III типов,
состоят из коллагенов V и VI типов, которые, кроме того, покрывают
поверхность фибрилл I типа, усиливая «рисунок периодичности», а
коллаген V типа — еще и поверхность клеток. Фибронектин также
связан с поверхностью фибрилл, хотя выявляется в виде глобул и
филаментов в межфибриллярном пространстве.
Следует отметить, что с помощью рутениевого красного выяв-
ляются кислые гликозаминогликаны также в виде чехлов вокруг
фибрилл, филаментов в межфибриллярном пространстве и хлопье-
видного материала между пучками фибрилл. Особенно много гли-
козаминогликанов и фибронектина обнаруживают в незрелых во-
локнах, которые в световом микроскопе характеризуются аргиро-
филией при серебрении, что связано с наличием большого количества
углеводных групп. Фибронектин, кроме того, играет важную роль
в связывании матрикса с клетками (особенно фибробластами), чему
Способствует наличие в его молекуле различных доменов, специ-
фически связывающихся с клеточной поверхностью, коллагеном,
гепарином [Colvin R. В., 1989]. В последние годы обнаружен особый
гликопротеин, названный интегрином, соединяющий фибронектин
с мембраной фибробласта и даже с белком цитоскелета клетки —
актином [Tamkin J., 1986].
Таблица 4.6
Вокализация и надмолекулярная организация коллагеновых белков
Тип Состав а-цепей Локализация в тканях Надмолекулярная организация и тинктори- альные свойства
электронная мик- роскопия световая микроскопия
I Две ах (I) и одна «2 (I) Рыхлая и плот- ная соединитель- ная ткань, кость, дентин Периодичные фибриллы тол- щиной 50—120 нм Волокна, пучки во- локон толщиной 2—10 мк, фуксинофильны, неаргирофильны, ани- зотропны, желто-крас- ные при окраске Сири- усом красным
171
Продолжение
Тип Состав сг-цепей Локализация в тканях Надмолекулярная организация и тимктори- альные свойства
электронная мик- роскопия световая микроскопия
II Три ai (II) Хрящ, стекло- видное тело, кла- паны сердца Сеть перио- дичных фибрилл толщиной 20— 40 нм Сеть плохо различи- мых волокон, слабые фуксинофильность, ШИК-реакция и ани- зотропия
ш Три ai (III) Рыхлая соеди- нительная ткань, кожа, селезенка, лимфатические узлы, костный мозг Периодичные фибриллы тол- щиной 25—45 нм и неперио- дичные 10—15 нм Рыхлая сеть тонких коллагеновых и рети- кулярных ВОЛОКОН тол- щиной 0,5—1,5 мк, не- фуксинофильны, арги- рофильны, слабо анизотропны, зеленые при окраске Сириусом красным
IV Две ai (IV) од- на CQ (IV) Базальные мембраны Сеть микро- филаментов Аморфные базаль- ные мембраны, аргиро- фильны, слабо анизот- ропны
V ai, 02, 03 (V) Рыхлая соеди- нительная ткань, кожа Тонкие фила- менты толщиной 6—10 нм Связаны с волокна- ми I типа и клетками, видны только при ре- акции с антителами
VI «1, 02, 03 (VI) То же Топкие фила- менты, зебро- видные тельца (агрегаты) То же
VII Неизвестен Кожа, легкие и др. Якорные фиб- риллы Не ВИДНЫ
VIII Три ai (VIII) Эндотелий — » >
IX ai, аз. аз(1Х) Хрящ — » »
X Три ai (X) Гипертрофи- ческий хрящ — » »
XI <ч, аз, аз Хрящ На клетках? » >
XII Неизвестен Хрящ — » »
XIII » Базальные мембраны » »
Катаболизм коллагена, как и его биосинтез, является функцией
фибробластов, хотя продукция специфических коллагеназ осущест-
вляется также макрофагами, нейтрофилами, эпителиальными и дру-
гими клетками. Тканевая коллагеназа расщепляет при нейтральном
pjl молекулу коллагена I и III типов на два термобильных фрагмента
v/4 и ‘/4 длины молекулы), которые теряют спиральную конфи-
гурацию и затем разрушаются неспецифическими протеазами, осо-
бенно катепсинами. Известны специфические коллагеназы и для
172
других типов коллагена. Продукция коллагеназ и активация их
латентных форм регулируется гормонами, лимфокинами, моноки-
нами, факторами лаброцитов и эозинофилов [Stricklin J. Р. et al.,
1988 ].
Таким образом, в соединительной ткани, в том числе образую-
щейся в результате воспалительного процесса, существует динами-
ческое равновесие между, биосинтезом и катаболизмом коллагена,
причем оба процесса являются альтернативными функциями фиб-
робластов. При росте соединительной ткани преобладает синтез
коллагена, при ее инволюци — фиброклазия, а ремоделяция, при
которой происходит разрушение одних (избыточных, функционально
инертных) и продукция других коллагеновых структур, сопровож-
дается интенсификацией обоих процессов. Согласно выдвинутой на-
ми концепции «биомеханического контроля морфогенеза» [Се-
ров В. В., Шехтер А. Б., 1981; Shekhter А. В., 1986], фибробласт
является не только «строителем», но и «архитектором» соединитель-
ной ткани, используя микрорельеф клеточной поверхности при фиб-
риллогенезе, ориентацию своих отростков, траекторию движения
клетки, межклеточные связи и выбраковку функционально не на-
груженных деталей путем фиброклазии для формирования специа-
лизированной архитектоники соединительной ткани, соответствую-
щей ее локальным функциям. Эти представления соответствуют
данным литературы [Trelstad R. L., BirkD., 1985].
4.1.5.3. Фибробласт как регуляторная клетка,
участие в межклеточном взаимодействии
Системный анализ соединительной ткани показывает, что в регу-
ляции ее состава, роста и функций, в том числе при воспалительных
процессах, помимо центральных (нервных, эндокринных) механиз-
мов, т. е. вертикальной, стратегической регуляции, важнейшую роль
играет внутритканевая (горизонтальная, тактическая) регуляция,
основанная на межклеточном и коллаген-клеточном взаимодействии
по механизму обратной связи [Серов В. В., Шехтер А. Б., 1981;
Шехтер А. Б., 1982, 1986]. Фибробласт, как и другие клетки, опос-
редует центральные регуляторные влияния (гормонов, медиаторов
и др.). В то же время, являясь локальным «короткодистантным
регулятором» своего микро- и макроокружения, он взаимодействует
с клетками соединительной ткани, сосудов, крови и эпителия по-
средством прямых межклеточных контактов, растворимых (фибро-
кины) и нерастворимых (коллаген, фибронектин, протеогликан)
медиаторов, которые также выполняют информационо-регулирую-
Щую функцию.
Примером значения прямых межклеточных и коллаген-клеточ-
ных контактов являются макрофагально-фибробластические контак-
ты, которым мы придаем особое значение в механизмах ауторегу-
ляции роста соединительной ткани при патологических процессах
(Шехтер А. Б., 1977, 1986]. Этот механизм заключается в том, что
продукты распада коллагена и клеток (при повреждении, воспале-
на
нии) активируют фагоцитирующие их макрофаги, которые проду-
цируют факторы роста фибробластов, усиливая пролиферацию фиб-
робластов и синтез коллагена. Факторы роста фибробластов пере-
даются и путем прямых межклеточных контактов. Затем избыточно
продуцированные коллагеновые волокна, контактно взаимодействуя
с фибробластами, приводят к усилению фиброклазии, снижению
синтетической активности фибробластов и их деструкции. Описаны
также регулирующие контактные взаимодействия фибробластов с
лимфоцитами, нейтрофилами, лаброцитами.
Участие лимфоцитов в десмопластическом и десмолитическом
действии фибробластов определяет эти процессы как иммунологи-
ческие, действующие через цепочку лимфоцит (лимфокины) —
макрофаг (монокины) — фибробласт — матрикс [Бобро Л. И., 1990].
Лимфокины могут и непосредственно воздействовать на пролифе-
ративную, коллагенсинтетическую и коллагенолитическую функции
фибробластов. Регулирующее влияние на фибробласты Т-лимфоциты
оказывают и путем переноса в них «регенерационной информа-
ции» — интерферона и интерлейкина-4 [Wahl S. М., 1986;
Dieqelmann R. et al., 1988].
Имеется обширная литература, посвященная факторам, которые
усиливают или тормозят пролиферацию, дифференцировку, хемо-
таксис, адгезию, биосинтетическую и десмолитическую активность
фибробластов [Postlethwaite А. Е. et al., 1988; CastorC. W., 1989].
Эти, чаще всего пептидные, факторы продуцируются различными
клеточными системами: макрофагами, Т-лимфоцитами, нейтрофи-
лами, тромбоцитами, опухолевыми клетками, системой комплемен-
та, эндотелием и эпителиальными клетками (табл. 4.7). Однако и
сами фибробласты продуцируют факторы, активно влияющие как
на функцию их собственной популяции (стимуляторы и ингибиторы
роста), так и на функции других клеточных систем: 1) колониести-
мулирующий фактор; 2) фактор роста макрофагов; 3) фактор, ин-
дуцирующий дифференцировку моноцитов; 4) фактор угнетения
миграции макрофагов; 5) факторы, влияющие на перенос микро-
окружения и дифференцировку иммунных клеток; 6) факторы, ин-
дуцирующие дифференцировку эпителиальных клеток; 7) интер-
лейкин-6 (ИЛ-6), выполняющий разнообразные функции [Се-
ров В. В., ШехтерА. Б., 1981; Pawanda М. С. et al., 1988; Castor
С. W., 1989]. Подобные факторы (дистантные регуляторы) по ана-
логии с монокинами мы обозначили как фиброкины [Шехтер А. Б.,
1982].
Следует добавить, что продуцируемые фибробластами фибронек-
тин, кислые гликозаминогликаны, коллагены различных типов также
являются короткодистантными регуляторами, влияющими на фун-
кцию, хемотаксис и пролиферацию макрофагов, лимфоцитов, лаб-
роцитов, тромбоцитов, эндотелия, мышечных клеток, эпителиальных
клеток различных тканей [Лебедев Д. А., 1979, 1990; Серов В. В.,
ШехтерА. Б., 1981; Бобро Л. И., 1990; Jrinnel F., 1982; Nimni М. Е.
et al., 1988].
174
Таблица 4.7
Факторы, влияющие на рост и функцию фибробластов
Фактор Пролифе- рация Хемотак- сис, миг- рация Продук- ция кол- лагена Источники
Фактор роста фибробла- стов (FgF) I и II Тромбоцитарный фактор роста (PDgF) 1 1 1 1 Мозг и другие ткани Тромбоциты, макрофа- ги, эндотелий
Пептид, активирующий соединительную ткань, III (СТАР-Ш) CTAP-PMN Фактор роста эпидермиса (EgF) Инсулиноподобные факто- ры роста I и II (IgF) Соматомедин А и С Макрофагальный фактор роста (MgF> Интерлейкин-1 (а- и 1* t t t It Тромбоциты Нейтрофилы Тромбоциты Плазма крови Плазма крови Макрофаги, эндотелий Макрофаги
/З-ИЛ-1) Фактор некроза опухолей > >> Макрофаги
(кахектин) Т-клеточный фактор роста Трансформирующий фак- ft Т-лимфоциты Тромбоциты
тор роста fi (TgF-/?> Фибронектин > > Т-лимфоциты, макро-
Коллаген I—III типов, > > фаги Макрофаги, фибробла-
коллагеновые пептиды, а цепи Эластин, пептиды эласти- на Лимфоцитарный хемотак- сический фактор Сывороточный хемотакси- ческий фактор Лейкотриен В< у- и а-Интерферон t t t ti сты Т-лимфоциты Комплемент (С5) Лейкоциты
Простагландин Ег <— <— <
Сывороточный ингибитор миграции Нейтрофильный ингибитор миграции Макрофагальный фактор синтеза коллагена (CEMF) Т-клеточный фактор син- теза коллагена <— —> Плазма крови Нейтрофилы Макрофаги Т-лимфоцит
175
Продолжение
Фактор Пролифе- рация Хемотак- сис, миг- рация Продук- ция кол- лагена Источники
В-клеточный ингибитор синтеза коллагена Макрофагальный ингиби- тор синтеза коллагена Витамин С Инсулин Глюкокортикоиды Ретиноиды Витамин Е Витамин А —> <— i 1 ИЦ и. В-клетки Макрофаги
Условные обозначены я: стимуляция ->, ингибиция<-.
Все это свидетельствует о важной роли фибробластов в коопе-
ративных клеточных взаимоотношениях, обусловливающих гомео-
статическую регуляцию и «нормативное» протекание таких выра-
ботанных в процессе эволюции реакций, как воспаление и регене-
рация. Нарушение этих взаимоотношений приводит к срыву
адаптивных реакций и переходу к хроническому воспалению и
дисрегенерации.
4.2. СТАДИИ ВОСПАЛЕНИЯ
Выделяют три стадии воспаления: альтерации, экссудации и про-
лиферации.
4.2.1. Стадия альтерации
Это — начальная, пусковая стадия воспаления, характеризующаяся
повреждением тканей. Она включает разнообразные изменения кле-
точных и внеклеточных компонентов в месте действия повреждаю-
щего фактора, в том числе активацию физиологических процессов.
Стадию альтерации следует рассматривать как диалектическое един-
ство изменений, вызванных действием агрессоров, и ответных за-
щитных местных реакций организма на эти изменения.
Различают биохимическую и морфологическую фазы альтера-
ции [Струков А. И. и др., 1989]. Для начала воспаления прежде
всего имеют значение характер и выраженность биохимических
изменений в зоне повреждения тканей. При этом в инициации
процесса наиболее важную роль играют вазоактивные и хемотак-
176
сические вещества, которые и определяют выраженность основных
проявлений воспаления. Еще И. И. Мечников указывал на наличие
в очаге повреждения особых веществ — хемоаттрактантов, при-
тягивающих или отталкивающих лейкоциты. Они продуцируются
клетками, микробами, а также содержатся в плазме крови. Не-
посредственно после повреждения ткани из ее клеток выделяются
просеринэстераза [Чернух А. М., 1979], тромбин, кинин и другие
хемотаксические факторы, а при повреждении сосудов — фибри-
ноген и активированные компоненты комплемента (см. главу 3).
В соединительнотканном компоненте тканей в очаге воспаления
происходит деполимеризация белково-гликозаминогликановых ком-
плексов, появляются свободные аминокислоты, уроновые кислоты,
аминосахара, полипептиды, низкомолекулярные полисахариды.
В результате этого повышается осмотическое давление в тканях,
п]х)исходят их набухание и задержка в них воды. Накопление
продуктов жирового (жирных кислот) и углеводного (молочной
кислоты) обмена приводит к тканевому ацидозу и гипоксии. Важ-
ное значение имеет активация перекисного окисления липидов,
сопровождающаяся повреждением мембранных структур клеток.
Эндотелиоциты микрососудов в ответ на повреждение также про-
дуцируют ряд факторов, обеспечивающих хемотаксис [Dejana Е.
et al., 1987; MontovaniA., Dejana Е., 1987]. Кроме того, различные
бактерии, находящиеся в очаге повреждения, могут стимулировать
определенные клетки к образованию хемоаттрактантов. Так, стреп-
тококки способствуют выработке макрофагами СЗ-компонента ком-
племента [Goodrum К. J., 1987], эндотоксины грамотрицательных
бактерий стимулируют макрофаги к секреции фактора, притяги-
вающего нейтрофильные лейкоциты [Fox et al., 1986].
Важное значение в развитии воспаления имеет степень очаговой
концентрации бактериальных хемоаттрактантов [Vicker М. G. et
al., 1986]. Эти вещества оказывают выраженное хемотаксическое
действие на клетки — продуценты медиаторов воспаления —
лаброциты, моноциты, базофильные, нейтрофильные и эозино-
фильные гранулоциты и др. Определенную роль в хемоаттракции
играют и резидентные макрофаги, продуцирующие монокины. Оче-
видно, именно хемоаттракция как первичный компонент медиации
воспаления обусловливает поступление в очаг повреждения ука-
занных клеток, создавая определенную клеточную кооперацию и
вызывая начало воспалительного'процесса. Только находясь в очаге
повреждения, эти клетки обеспечивают выброс соответствующих
медиаторов, вызывающих реакции микроциркуляторного русла. Хе-
моаттракция — процесс каскадный. По мере его нарастания ко-
операция клеток не только увеличивается в количественном от-
ношении, но и становится разнообразнее. Более разнообразным
становится и действие продуцируемых ими веществ, оказывающих
влияние на все более широкий круг реакций, поддерживающих
воспаление, в том числе усиливающих или модулирующих хемо-
аттракцию.
Возникшая в очаге воспаления клеточная кооперация характе-
177
ризуется ауторегуляторными механизмами, цикличностью развития
и разделением функций между клетками в пределах кооперации
[Серов В. В., Шехтер А. Б., 1981 ]. При этом особое место в клеточ-
ной кооперации и во всем воспалительном процессе принадлежит
макрофагу. Эта клетка обладает рядом свойств, позволяющих ей
выступать в качестве местного регулятора воспалительного процесса,
а также связующего звена между местными проявлениями воспа-
ления и общими реакциями организма на них. Кроме того, что
макрофаг оказывает хемотаксическое действие, обеспечивающее
первичную клеточную кооперацию и последующее ее развитие в
очаге воспаления, он, вырабатывая колониестимулирующий фактор,
усиливает образование и дифференцировку в костном мозге пред-
шественников гранулоцитов, а с помощью ряда других веществ
(ИЛ-1, а-интерферона и др.) стимулирует функции эндотелиоцитов
и нейтрофильных гранулоцитов в очаге воспаления [Кгапе S. М. et
al., 1985; Bekemeier Н., Hirschelmann R., 1987]. Тем самым макро-
фаг, являясь клеткой местного воспалительного очага, способствует
включению в процесс других систем организма.
Очень важна инициальная активация системы комплемента,
системы плазмина и свертывающей системы крови, которая яв-
ляется результатом прямого или опосредованного действия агрес-
сора (см. главу 3). В динамике стадии альтерации вследствие
прямых воздействий повреждающего фактора и развивающихся
биохимических изменений в очаге воспаления появляются и на-
растают морфологические изменения в клетках и тканях в виде
дистрофий, а затем некроза с высвобождением из погибших тканей
биологически активных продуктов с вазомоторным действием и
хемоаттрактантов.
Таким образом, в стадии альтерации возникают разнообразные
биохимические и морфологические изменения, направленные на
включение в воспалительный процесс местных реакций в виде
реакций сосудов микроциркуляции и некроза тканей в очаге по-
вреждения, а также интегральных регуляторных систем всего ор-
ганизма.
4.2.2. Стадия экссудации
Продукты, накапливающиеся в зоне местного нарушения гомеостаза,
вызывают изменение проницаемости стенок сосудов микроциркуля-
торного русла в зоне воспаления и поступление в эту зону из крови
клеточных элементов, в первую очередь различных лейкоцитов,
часть из которых способна к пролиферации. С этого момента вос-
паление переходит в экссудативную стадию. В ней различают два
этапа — плазматической экссудации и клеточной инфильтрации.
Следовательно, стадия экссудации предполагает не только пассивное
прохождение через сосудистую стенку плазмы и форменных эле-
ментов крови, но и клеточную инфильтрацию, т. е. активное внед-
рение клеток, в основном лейкоцитов, в измененные ткани.
178
Сосудистые реакции играют чрезвычайно важную роль при вос-
палении, причем они неоднозначны и зависят от причины воспаления
и условий, в которых оно развивается (см. главу 3). При вовлечении
в воспалительную реакцию сосудистого компонента важное значение
приобретают эндотелиоциты как регуляторы местного проявления
воспаления и связующее звено между местной и общей реакциями
организма. В ответ на повреждение они продуцируют вещества,
хемотаксичные для макрофагов и ПЯЛ, простагландины и другие
медиаторы воспаления [Dejana Е. et al., 1987; Elgebaby S. et al.,
1987], в том числе коротко- и длиннодистантные регулирующие
факторы, в частности факторы, способствующие прилипанию ней-
трофильных гранулоцитов к поверхности сосудов в очаге воспаления
[Pham Hun Т. et al., 1987; Pohlman Т. Н. et al., 1987]. Имеются
сведения о том, что эндотелиоциты могут выполнять функцию
антигенпредставляющих и регулирующих клеток иммунокомпетен-
тной системы, которые оказывают влияние на гранулоциты
[Grolnewegen G. et al., 1986; Issekutz A. et al., 1987 ]. Таким образом, ’
вклю ение в воспалительный процесс сосудистого компонента со-
провождается повышением локальной концентрации хемоаттрактан-
тов — различных белков, полисахаридов, продуктов метаболизма х
жирных кислот и др. *
Вместе с тем, если кровеносные сосуды при воспалении изучают
со времен Ю. Конгейма (1887), то лимфатическим сосудам уделяют
значительно меньше снимания. В настоящее время известно, что
основное значение имеют терминальные отделы лимфатической
системы, где происходит транссудация жидкости, коллоидных и
кристаллоидных растворов [Караганов Я. Л., Банин В. В., 1981].
В составе терминальных отделов лимфатической системы разли-
чают структуры двух типов: 1) инициальную лимфатическую си-
стему терминальных лимфатических капилляров; 2) «ультрацир-
куляторную» систему тканевых (интерстициальных) каналов. Все
компоненты гемо- и лимфомикрососудистых систем находятся в
тесной структурной и функциональной связи друг с другом [Куп-
риянов В. В. и др., 1987]. В условиях воспаления отмечается
высокая чувствительность венулярного отдела гемомикрососудисто-
го русла к действию медиаторов и других раздражителей; здесь
происходят выраженная миграция клеток и пропотевание плазмы
(рис. 4.33). Рано вовлекаются в процесс корни «ультрациркуля-
торной» системы интерстициальной ткани (интерстициальные ка-
налы). Это приводит к нарушению кроветканевого баланса, из-
менению виесосудистол циркуляции тканевой жидкости, возник-
новению отека и набуханию ткани, усиливающихся при развитии
лимфостаза. При этом наблюдается альтерация эндотелия иници-
альных лимфатических капилляров, просвет этих сосудов пере-
полняется лимфой, и межэндотелиальные щели расширяются, лим-
фа выходит в ткань, и в самом начале экссудативной стадии
возникает острый лимфатический отек, который сохраняется до
окончания воспалителшого процесса.
Содружественно с сосудистой реакцией происходит эмиграция
179
Рис. 4.33. Экссудативная стадия воспаления. Эмиграция клеток, в основном
нейтрофильных лейкоцитов, из венулы. Окраска гематоксилином и эозином.
х420.
лейкоцитов, которую в настоящее время детально изучают, в том
числе с помощью электронной микроскопии (см. рис. 4.33). При
воспалении, сопровождающемся выраженной интоксикацией и от-
ложением в стенке сосудов иммунных комплексов или агрегирован-
ного иммуноглобулина, возможны дегрануляция ПЯЛ в просвете
сосуда и повреждение их гидролазами сосудистой стенки (рис. 4.34).
Клеточная кооперация, возникшая в очаге воспаления в резуль-
тате альтерации тканей и экссудации, характеризуется ауторегуля-
торными механизмами, цикличностью развития и разделением фун-
кций между клетками в пределах кооперации. При этом в проти-
вомикробной защите, особенно при гноеродной инфекции, основную
роль играют нейтрофильные лейкоциты. Они первыми вступают в
контакт с инфектом и блокируют его проникновение во внутреннюю
среду организма. ПЯЛ, по-видимому, не обладают специфичностью
по отношению к патогенному раздражителю: они реагируют на
любой инфект, уничтожая его с помощью фагоцитоза и экзоцитоза,
и при этом погибают. ДЯД_ являются ка^_Лы^ежурны\1и^клетками.
.системы неспециФической резистентности организма. Поступившие
в очаг воспаления нейтрофильные гранулоциты и макрофаги вы-
полняют бактерицидную и фагоцитарную функции, а также про-
дуцируют биологически активные вещества, обеспечивающие раз-
нообразные эффекты, но прежде всего вызывающие усиление самой
сосудистой реакции и хемоаттракции воспаления. Нередко такая
180
Рис. 4.34. Экссудативная стадия воспаления. Дегрануляция нейтрофильного
лейкоцита в просвете сосуда, х 5600.
ранняя нейтрофильная инфильтрация при наличии высокой кон-
центрации соответствующих хемоаттрактантов заканчивается на-
гноением зоны воспаления. Позднее к нейтрофильной инфильтрации
присоединяется макрофагальная, что характеризует собой начало
инкапсуляции, отграничения зоны воспаления за счет не только
ферментного расплавления измененных и поврежденных тканей, но
и формирования периферического клеточного вала [Пауков В. С.,
1986; Даабуль С., 1988 ].
Несомненно, важным компонентом воспаления является разви-
тие некроза тканей. Вероятно, некротизированная ткань выполняет
несколько функций. С позиций биологической целесообразности
развитие некроза выгодно для организма, поскольку в очаге не-
кроза должен погибнуть патогенный фактор, и чем скорее разо-
вьется некроз, тем меньше будет осложнений воспаления. Это
объясняет не только образование многими клетками в очаге вос-
паления большого количества различных гидролаз, но и развитие
тромбоза сосудов вокруг воспаленного участка тканей. Вероятно,
тромбоз сосудов, наступающий, однако, после эмиграции лейко-
цитов в очаг повреждения, не только отграничивает воспаленную
область, но также способствует развитию гипоксии тканей и их
некрозу. С этой точки зрения понятен тот факт, что в разгар
экссудативной воспалительной реакции, когда всё поле воспаления
инфильтрировано лейкоцитами и концентрация гидролитических
181
ферментов в нем, очевидно, очень высока, макрофаги практически
не поступают в очаг, а концентрируются на его периферии, так
как в этот период они погибнут в очаге воспаления, в то время
как функция их сложнее и значительнее, нежели простой фаго-
цитоз инфекта.
Макрофаги играют особую роль в воспалении. Эти клетки
обладают свойствами, позволяющими им выступать в качестве
местного регулятора воспаления, а также связующего звена между
местными проявлениями этого процесса и общими реакциями на
него организма. Выше уже отмечались хемотаксические свойства
макрофагов, обеспечивающие первичную клеточную кооперацию
и последующее ее развитие в очаге воспаления. Кроме того,
макрофаги играют важную роль как первое звено становления
иммунитета в динамике воспаления. При этом задачей фагоцитоза,
Л осуществляемого макрофагом, является, по-видимому, не столько
I уничтожение инфекта для снижения его концентрации в очаге
воспаления (хотя, разумеется, и эта функция свойственна мак-
I рофагу), сколько выявление его антигенных детерминант и по-
следующая передача информации об этом в иммунокомпетентную
V систему. С этих позиций понятно, почему фагоцитарная актив-
ность макрофагов по отношению к гноеродной инфекции значи-
тельно ниже, чем нейтрофильных лейкоцитов; почему макрофаги
не поступают в очаг гнойного воспаления в разгар экссудации и
наиболее выраженной лейкоцитарной инфильтрации, а располага-
ются на периферии зоны воспаления, формируя второй отграни-
чивающий барьер [Пауков В. С., 1986]; почему при асептическом
воспалении, когда в очаге повреждения нет чужеродных антигенов,
но есть свои измененные антигены, макрофаги заполняют зону
повреждения после «ухода» из нее лейкоцитов. Объясним и тот
факт, что при хроническом, особенно специфическом, воспалении,
когда антигенная структура инфекта уже известна, для макрофагов
характерен незавершенный фагоцитоз, и, то, что при стимуляции
иммунной системы значительно увеличивается количество макро-
\ фагов, участвующих в отграничении .очага воспаления.
Таким образом, при воспалении местно возникает ряд чрезвы-
чайно сложных процессов, которые, начинаясь автономно, служат
сигналом для включения в воспалительную реакцию различных
систем организма.
4.2.3. Продуктивная (пролиферативная)
стадия
Третья стадия воспаления называется продуктивной, или пролифе-
ративной. А. Поликар (1965) называет ее стадией репарации, что
более точно, и указывает на суть процесса в этот период, а также
на биологическое значение воспаления, связывающего между собой
результат повреждающего действия агрессора с процессами репара-
ции [Чернух А. М., 1979]. Пролиферация начинается уже на фоне
182
экссудативной стадии. Для нее характерен выход в очаг воспаления
большого количества макрофагов, которые не только размножаются
в этой зоне, но и выделяют биологически активные вещества —
монокины, притягивающие фибробласты и стимулирующие их раз-
множение, а также активирующие неоангиогенез. В инфильтрате
обычно выявляют лимфоциты, иногда плазмоциты, т. е. клетки,
относящиеся к иммунной системе. Однако клетки инфильтрата по-
степенно разрушаются и в очаге воспаления начинают преобладать
фибробласты.
Пролиферация возникает уже спустя несколько часов после на-
чала воспаления. В итоге происходит формирование молодой сое-
динительной ткани — грануляционной, характеризующейся особой
архитектоникой сосудов с образованием капиллярных петель вблизи
очага воспаления. Грануляционная ткань обладает большой резорб-
ционной способностью, но в то же время представляет собой барьер
для возбудителей воспаления, что детально изучено еще в конце
прошлого века, в том числе М. Н. Никифоровым (1895).
Продуктивная стадия воспаления протекает в несколько этапов,
которые имеют определенную специфику в различных органах и
тканях. В случае субституции (а именно такая форма репарации
более характерна для исхода воспаления) этапы стадии пролифе-
рации близки к тем, которые выделили В. В. Серов и А. Б. Шехтер
(1983) для соединительной ткани: новообразование молодой (гра-
нуляционной) соединительной ткани, а затем формирование и пе-
рестройка рубца. В случае реституции после воспаления наряду с
перечисленными этапами продуктивной стадии можно выделить и
другие, специфичные для конкретного органа или ткани.
Таким образом, воспаление в целом представляет собой сочетание
стадий альтерации, экссудации и пролиферации.
4.3. ФОРМЫ ВОСПАЛЕНИЯ
Клинико-анатомические формы воспаления определяются преобла-
данием в его динамике либо экссудации, либо пролиферации. Раньше
выделяли и воспаление с преобладанием альтерации, которое на-
блюдали в основном в паренхиматозных органах, однако в настоящее
время большинство специалистов не признают эту форму, так как
воспаление — это процесс, который развивается в любых тканях и
органах, а не только в паренхиматозных. Кроме того, наличие
альтеративных изменений в отсутствие или при слабой выражен-
ности экссудативно-пролиферативной реакции не позволяет выде-
лять эту форму воспаления [Струков А. И., 1982].
При систематизации форм воспаления учитывают: 1) временную
характеристику процесса (острое и хроническое); 2) морфофункци-
ональные особенности воспаления; 3) патогенетическую специфику
воспаления (иммунное воспаление).
Процесс считают острым, если длительность его до 4—6 нед,
однако в большинстве случаев он заканчивается в течение 1,5—2
183
нед. Классическим острым воспалением издавна считают экссуда-
тивное. Выделяют следующие его виды: 1) серозное; 2) фибринозное;
3) гнойное; 4) гнилостное; 5) геморрагическое. Кроме того, при раз-
витии воспаления слизистых оболочек, когда к экссудату примеши-
вается слизь, говорят о катаральном воспалении, которое обычно
сочетается с экссудативным воспалением других видов (серозно-ка-
таральное, гнойно-катаральное и др.>. Наблюдаются также комби-
нации указанных видов экссудативного воспаления (смешанное вос-
паление).
4.3.1. Экссудативное воспаление
Серозное воспаление характеризуется мутноватым экссудатом, со-
держащим небольшое количество клеточных элементов, единичные
ПЯЛ, спущенные эпителиальные клетки и до 2—2,5% белка. Со-
отношение альбуминов и глобулинов в экссудате колеблется от
0,55:1 до 2,7:1, концентрация солей — от 0,3 до 0,7%, pH экссудата
7—7,1. Причиной серозного воспаления обычно являются яды или
токсины, а также физические или химические факторы. Классиче-
ским примером серозного воспаления можно считать пузырь на
коже при ожоге. При этой форме воспаления оно, вероятно, про-
исходит не столь активно, как при других, вследствие чего так
слабо выражена клеточная инфильтрация.
..Серозное воспаление развивается в слизистых и се-
розных оболочках (рис. 4.35), интерстициальной ткани, коже, кап-
сулах клубочков почек, перисинусоидальных пространствах печени.
Серозный экссудат, очевидно, способствует смыванию (вымыванию)
с поврежденной поверхности микробов и их токсинов. Такая за-
щитная реакция особенно целесообразна при воспалении слизистых
оболочек, когда к экссудату примешивается слизь (серозный катар).
Вместе с тем серозный экссудат в мозговых оболочках может сдав-
ливать мозг, влияя на его функцию. Серозное пропитывание аль-
веолярных септ легких является одной из причин развития синдрома
острой дыхательной недостаточности.
Исход серозного воспаления обычно благоприятный: экссудат
рассасывается и процесс заканчивается путем реституции. Иногда
после серозного воспаления паренхиматозных органов в них разви-
вается диффузный склероз.
Фибринозное воспаление характеризуется образо-
ванием экссудата, содержащего большое количество фибриногена,
который выпадает в тканях в виде свертков фибрина. Этиологи-
ческим фактором воспаления этого вида могут быть дифтерийная
коринебактерия, пневмококки, фридлендеровская палочка, дипло-
кокки Френкеля, стрептококки, стафилококки, микобактерия ту-
беркулеза, некоторые вирусы, возбудители дизентерии, экзогенные
и эндогенные токсические факторы. Фибринозное воспаление чаще
возникает на слизистых или серозных оболочках. Экссудации пред-
шествуют некроз тканей и агрегация тромбоцитов в очаге по-
184
Рис. 4.35. Серозное воспаление- брюшины. Набухание и слущивание
мезотелиоцитов, отек ткани, умеренная клеточная инфильтрация. Окраска
гематоксилином и эозином. * 120.
вреждения. Фибринозный экссудат пропитывает мертвые ткани,
образуя светло-серую пленку, толщина которой определяется глу-
биной некроза. Последняя в значительной степени зависит от
структуры эпителиальных покровов и особенностей подлежащей
соединительной ткани. При однослойном эпителиальном покрове
слизистой оболочки органа или серозной оболочки и плотной
тонкой соединительнотканной основе развивается тонкая легко
снимающаяся фибринозная пленка. Такое фибринозное воспаление
называется крупозным. Оно встречается на слизистых оболочках
трахеи и бронхов, серозных оболочках, характеризуя фибринозные
плеврит, перикардит, перитонит, а также в виде фибринозного
альвеолита, захватывающего долю легкого, развивается при кру-
позной пневмонии. Многослойный плоский неороговевающий эпи-
телий или рыхлая широкая соединительнотканная основа органа
способствуют развитию глубокого некроза и формированию тол-
стой, трудно снимающейся фибринозной пленки, после удаления
которой остаются глубокие язвы. Такое фибринозное воспаление
называется дифтеритическим. Оно развивается в зеве, на слизи-
стых оболочках матки и влагалища, кишечника и желудка, мо-
чевого пузыря, в ранах кожи и слизистых оболочек.
Исходом фибринозного воспаления слизистых оболочек являются
расплавление фибринозных пленок с помощью гидролаз ПЯЛ и
образование язв. Слизистая оболочка в области поверхностных язв
185
Рис. 4.36. Гнойный перитонит. Ткань брюшины отечна, инфильтрована
нейтрофильными лейкоцитами, лимфоцитами, небольшим количеством мак-
рофагов. В венуле — лейкоцитарный тромб; мезотелий слущен. Окраска
гематоксилином и эозином, х 120.
обычно регенерирует путем реституции, при глубоких язвах могут
образовываться рубцы. На серозных оболочках фибринозный экс-
судат чаще подвергается организации, в результате чего образуются
спайки, шварты, нередко фибринозное воспаление полости тела
заканчивается их облитерацией.
Гнойное воспаление — форма воспаления, при которой
наиболее хорошо выражены все особенности этого процесса. Гнойный
экссудат представляет собой сливкообразную массу, состоящую из
детрита, клеток, микробов (рис. 4.36). Количество форменных эле-
ментов в нем колеблется от 17 до 29%, причем подавляющее
большинство из них составляют жизнеспособные и погибшие гра-
нулоциты. Кроме того, в экссудате встречаются лимфоциты и мак-
рофаги.
Гной имеет специфический запах и синевато-зеленоватую окра-
ску с различными оттенками. Содержание белка в гнойном экссудате
3—7% и более, причем в нем обычно преобладают глобулины.
186
Количество жира в экссудате достигает 7% сухого остатка, pH гноя
5,6—6,9 [Сиротинин Н. Н., 1940].
Гнойный экссудат обладает рядом качеств, определяющих био-
логическую значимость этой формы воспаления. В частности, в нем
содержатся различные ферменты, в первую очередь протеазы, спо-
собные расщеплять погибшие и дистрофически измененные струк-
туры в очаге повреждения, в том числе коллагеновые и эластические
волокна. Наряду с лейкоцитами, способными фагоцитировать и уби-
вать микробы, в экссудате имеются различные бактерицидные фак-
торы, которые секретируются жизнеспособными лейкоцитами, об-
разуются при распаде погибших лейкоцитов и поступают в экссудат
с элементами плазмы крови, — иммуноглобулины, компоненты
комплемента и др. В связи с этим гной задерживает рост бактерий,
возможно даже их полное уничтожение в нем. ПЯЛ гноя (хотя
иногда в нем бывает много лимфоцитов, эозинофильных грануло-
цитов) имеют разнообразную структуру, что связано с разным вре-
менем поступления их из крови в зону нагноения. Через 8—12 ч
ПЯЛ в гное превращаются в гнойные тельца. Для гнойного воспа-
ления характерен лизис тканей. Причиной этого воспаления явля-
ются гноеродные микробы — стафилококки, стрептококки, гонокок-
ки, менингококки, диплококки Френкеля, брюшнотифозная палочка
и др. Гнойное воспаление возникает практически в любой ткани и
во всех органах. Течение его может быть острым и хроническим.
Основными формами гнойного воспаления являются абсцесс,
флегмона, эмпиема, гнойная рана. Абсцесс — отграниченное
гнойное воспаление, сопровождающееся образованием полости (ок-
руглой или сложной формы), заполненной гнойным экссудатом. Он
возникает или в уже погибших тканях, в которых нарастают мик-
робно-химические процессы аутолиза (например, при травме), или
в жизнеспособных тканях, подвергающихся сильному воздействию
микробов (например, при инфекциях). По периферии это скопление
гноя окружено валом грануляционной ткани, через сосуды которой
в полость абсцесса поступают лейкоциты (в основном ПЯЛ) и
частично удаляются из нее продукты распада. Эта грануляционная
ткань, отграничивающая полость абсцесса от окружающих тканей,
называется пиогенной капсулой. Следует отметить, что отграничение
гноя в абсцессе носит нестабильный характер, имеется тенденция
к прогрессирующему расплавлению окружающих его тканей. Вместе
с тем, если абсцесс приобретает хроническое течение, в пиогенной
мембране образуются два слоя: внутренний, обращенный в полость
и состоящий из грануляций, и наружный, образующийся в резуль-
тате созревания грануляционной ткани и превращения ее в зрелую
соединительную ткань.
Абсцесс обычно заканчивается спонтанным опорожнением и вы-
ходом гноя на поверхность тела, в полые органы или полости тела.
Прорыв на поверхность тела или в полые органы нередко приводит
к ликвидации абсцесса путем рубцевания его полости. Изредка
абсцесс подвергается инкапсуляции. При этом гной сгущается, а в
его капсуле появляются ксантомные клетки. Абсцессы, возникающие
вокруг животных паразитов, иногда петрифицируются. Если сооб-
щение абсцесса с поверхностью тела недостаточно и его стенки не
спадаются, то формируется свищ — узкий канал, выстланный гра-
нуляционной тканью или эпителием и соединяющий полость абс-
цесса с поверхностью тела или полым органом. В некоторых случаях
под влиянием силы тяжести гной может стекать по ходу мышеч-
но-сухожильных влагалищ, нервно-сосудистых пучков, жировых
прослоек в нижележащие отделы и образовывать там вторичные,
так называемые холодные абсцессы, или натечники.
Флегмона — гнойное неограниченное диффузное воспале-
ние, при котором гнойный экссудат пропитывает и расслаивает
ткани. Образование флегмоны зависит от патогенностй возбудителя,
состояния защитных систем организма, а также от структурных
особенностей тканей, в которых она возникла и где есть условия
для распространения гноя, поэтому флегмона обычно образуется в
подкожной жировой клетчатке, межмышечных прослойках и т. п.
Флегмону волокнисто-жировой клетчатки называют целлюлитом.
Флегмона может быть мягкой, если отсутствуют очаги некроза в
тканях, подвергшихся флегмонозному воспалению, и твердой, когда
во флегмоне возникает коагуляционный некроз тканей, не подвер-
гающихся лизису, но постепенно отторгающихся.
Флегмонозное воспаление может осложняться тромбозом крове-
носных сосудов, при этом возникает некроз пораженных тканей.
В случае их контакта с внешней средой говорят о вторичной ган-
грене. Гнойное воспаление может распространиться на лимфатичекие
сосуды и вены, и в этих случаях возникают гнойные тромбофлебиты
и лимфангиты. Процесс заживления флегмонозного воспаления на-
чинается с его отграничения с последующим образованием грубого
соединительнотканного рубца. При неблагоприятном исходе может
наступить генерализация инфекции с развитием сепсиса.
Гнойное воспаление полостей тела или полых органов называется
эмпиемой. Причиной развития эмпием являются как наличие
очагов гнойного воспаления в соседних органах (при абсцессе лег-
кого), так и нарушение оттока гноя при гнойном воспалении полых
органов — желчного пузыря, червеобразного отростка, маточной
трубы, мочеточника, сустава и т. д. При этом отмечаются нарушение
местных защитных механизмов, к которым относится и постоянное
обновление содержимого полых органов, а также поддержание нор-
мального внутриполостного давления, что определяет состояние кро-
вообращения в стенке полого органа, продукцию и секрецию за-
щитных веществ, в том числе секреторных иммуноглобулинов. При
длительном течении эмпиемы слизистые, синовиальные или серозные
оболочки некротизируются, на их месте развивается грануляционная
ткань, которая, созревая, обусловливает образование шварт или
облитерацию полостей.
Особой формой гнойного воспаления является гнойная рана,
которая возникает либо вследствие нагноения травматической, в
том числе хирургической, или другой раны, либо в результате
вскрытия во внешнюю среду очага гнойного воспаления и образо-
188
вания раневой поверхности. Различают первичное и вторичное на-
гноение в ране. Первичное возникает непосредственно после травмы
и травматического отека, вторичное является рецидивом гнойного
воспаления {Давыдовский И. В., 1952]. Участие бактерий в нагно-
ении составляет часть процесса биологического очищения раны.
В тех случаях, когда имеется раневой канал, по его ходу могут
возникать абсцессы, формирование которых связано с нарушением
оттока содержимого раневого канала. Своеобразным процессом яв-
ляются нагноительные девиации раневого канала [Давыдов-
ский И В., 1952], которые возникают при наличии в нем осколка
или пули. Последние оказывают давление на прилежащие ткани,
что вызывает их некроз с последующим распространением в этом
направлении нагноения, по ходу которого под действием собственной
тяжести смещается и сам снаряд.
Гнилостное, или ихорозное, воспаление развива-
ется преимущественно при попадании гнилостной микрофлоры в
очаг гнойного воспаления с выраженным некрозом тканей. Обычно
воспаление этого вида возникает у ослабленных больных с обшир-
ными, длительно не заживающими ранами или хроническими абс-
цессами. При этом гнойный экссудат приобретает неприятный запах,
иногда с оттенком сероводорода или аммиака. В морфологической
картине превалирует прогрессирующий некроз тканей, причем без
склонности к отграничению. Некротизированные ткани превраща-
ются в зловонную массу, что сопровождается нарастающей инток-
сикацией, от которой больные обычно и умирают.
Геморрагическое воспаление как форма серозного,
фибринозного или гнойного воспаления характеризуется примесью
эритроцитов к экссудату (например, серозно-геморрагическое или
гнойно-геморрагическое воспаление). При распаде находящихся в
экссудате эритроцитов и происходящих при этом своеобразных пре-
вращениях гемоглобина экссудат может стать черным. Трактовка
экссудата, содержащего примесь крови, как проявления геморраги-
ческого воспаления — не всегда простая задача [Давыдовский И. В.,
1961 ]. Так, геморрагическое воспаление характерно для чумы, си-
бирской язвы, натуральной оспы, а также для тяжелых форм гриппа,
характеризующихся резким повышением проницаемости стенок со-
судов микроциркуляторного русла (рис. 4.37). Вместе с тем при
гнойном воспалении возможны аррозия кровеносного сосуда и кро-
вотечение, но это не означает, что такое воспаление становится
геморрагическим. В случае присоединения геморрагического воспа-
ления обычно ухудшается течение болезни, исход которой зависит
от вызвавшей ее причины.
Катаральное воспаление (как и геморрагическое) не
является самостоятельной формой воспаления. Оно развивается на
слизистых оболочках и характеризуется примесью слизи к любому
экссудату. Причиной катарального воспаления могут быть различные
инфекции, продукты нарушенного обмена, аллергические раздра-
жители, термические и химические факторы. При аллергических
ринитах, например, слизь примешивается к серозному экссудату.
189
Рис. 4.37. Геморрагическое воспаление.
а — выраженный диапедез эритроцитов при серозно-геморрагическом воспалении. *5600; б
гной но-геморрагический экссудат. *6800.
Часто наблюдается гнойный катар слизистой оболочки трахеи и
бронхов, иногда — слизистой оболочки носа и прямой кишки.
Следует отметить, что секреция слизи в физиологических условиях
является защитной реакцией, которая при действии патологического
раздражителя приобретает резко выраженный характер.
Течение катарального воспаления может быть острым и хрони-
ческим. Острые катары продолжаются 2—3 нед и, заканчиваясь,
обычно не оставляют следов. В исходе хронического катарального
воспаления могут развиваться атрофические или гипертрофические
изменения слизистой оболочки. Значение катарального воспаления
для организма определяется его локализацией и характером течения.
Смешанные формы воспаления наблюдаются в тех
случаях, когда к одному виду экссудата присоединяется другой.
В результате этого возникают серозно-гнойное или гнойно-фибри-
нозное воспаление либо любые другие комбинации. Такие формы
обычно развиваются при присоединении новой инфекции к уже
текущему воспалению.
4.3.2. Продуктивное воспаление
Продуктивное, или пролиферативное, воспаление характеризуется
преобладанием пролиферации клеточных элементов. При этом, по-
видимому, имеется особая реактивность организма, а кроме того,
190
очевидно, сам этиологический фактор обусловливает пролифератив-
ную клеточную реакцию, что особенно характерно для вирусов и
риккетсий. Продуктивное воспаление чаще протекает как хрониче-
ское, что связано и с персистенцией этиологического фактора, и с
включением иммунопатологических процессов.
Различают три основные формы продуктивного воспаления: I) ин-
терстициальное диффузное; 2) гранулематозное; 3) воспалительные
гиперпластические (гиперрегенераторные) разрастания.
4.З.2.1. Интерстициальное диффузное воспаление
Воспаление этого вида может развиваться во всех паренхиматозных
органах, локализуясь преимущественно в их строме, где происходит
накопление воспалительных и иммунокомпетентных клеток. Осо-
бенностями этого воспаления в острой фазе являются значительное
количество мононуклеаров (моноцитов) в экссудате, а также дист-
рофические и некробиотические повреждения паренхиматозных эле-
ментов органа. Наиболее яркая картина интерстициального продук-
тивного воспаления наблюдается при острых и хронических интер-
стициальных пневмониях. Этиологическим фактором острых
интерстициальных пневмоний являются вирусы, риккетсии и ми-
коплазма. При острых интерстициальных пневмониях наряду с про-
дуктивной реакцией наблюдается экссудация с отеком интерстиция
и клеточной инфильтрацией. Продуктивный компонент представлен
пролиферацией поврежденных пневмоцитов II типа, альвеолярных
макрофагов, септальных клеток, эндотелиоцитов.
Хроническая интерстициальная пневмония известна под назва-
нием «фиброзирующий альвеолит». Эта форма продуктивного вос-
паления легких не всегда имеет отчетливую этиологию, но в ряде
случаев может быть вызвана токсичными веществами или лекарст-
венными препаратами [Путов Н. В., Илькович М. М., 1986]. При
этом в ответ на повреждение клеточных и внеклеточных структур
альвеолярных септ возникают пролиферация эндотелиоцитов и пнев-
моцитов II типа, инфильтрация интерстиция альвеолярных септ
гематогенными воспалительными и иммунокомпетентными клетка-
ми, пролиферация там же фибробластов с развитием позднее сеп-
тоальвеолярного склероза.
Интерстициальные миокардиты чаще всего вызываются инфек-
ционными или токсическими воздействиями [Абрикосов А. И., 1947 ].
При этом выделяют преимущественно экссудативные и преимуще-
ственно продуктивные формы интерстициальных миокардитов. К по-
следним, в частности, относится идиопатический миокардит Абра-
мова — Фидлера, имеющий аллергическую природу (см. главу 10).
Интерстициальный нефрит часто возникает при нарушении оттока
мочи из почрчной лоханки и развитии гнойного воспаления в по-
следней (проявление пиелонефрита). При этом в остром периоде
наблюдается гнойная инфильтрация интерстиция, и лишь при хро-
низации процесса развиваются фиброз и лимфоидная инфильтрация
191
межуточной ткани. При длительном приеме препаратов фенацетина
может развиться фенацетиновый межуточный нефрит. Интерстици-
альный воспалительный процесс в печени всегда сочетается с вос-
палительными повреждениями паренхимы. Так, хронический гепа-
тит сопровождается инфильтрацией мононуклеарами склерозирован-
ных портальных трактов.
4.3.2.2. Гранулематозное воспаление
Данную форму можно определить как хроническое воспаление,
вызванное нерастворимыми или медленно разрушающимися (пер-
систирующими) раздражителями и сопровождающееся образованием
гранулем. Последние представляют собой компактное скопление
макрофагов (рис. 4.38) и/или эпителиоидных клеток, которое может
сопровождаться рядом дополнительных признаков: 1) инфильтра-
цией другими клетками — лимфоцитами, плазматическими клет-
ками, нейтрофильными или эозинофильными гранулоцитами; 2) на-
личием фибробластов и развитием склероза; 3) развитием деструк-
тивных изменений и некроза [Adams D. О., 1983].
Наряду с такой трактовкой гранулематозного воспаления, которая
является общепринятой, встречаются указания на развитие острых
инфекционных гранулем (сыпной и брюшной тифы, бешенство и
т. д.). Необходимо дальнейшее изучение таких гранулем, в частности
природы клеток гранулем при брюшном тифе. Некоторые авторы
считают, что подобные узелковые воспалительные структуры целе-
сообразно относить к очаговым доброкачественным неопухолевым
моноцитозам [Струков А. И., Кауфман О. Я., 1989; Diaz Н. et al.,
1983].
Различают эндогенные и экзогенные этиологические факторы
гранулем. Среди первых следует отметить труднорастворимые про-
дукты повреждения тканей, в первую очередь жировой (например,
мыла), а также продукты нарушенного обмена, такие, как ураты.
Экзогенными факторами, вызывающими образование гранулем, мо-
гут быть биологические факторы (бактерии, грибы, простейшие,
гельминты и т. д.), органические и неорганические вещества (пыли,
аэрозоли, дымы и т. д.), в том числе лекарственные средства.
К. Warren (1976) выделил три группы гранулематозных поражений
экзогенной этиологии: инфекционные гранулемы, гранулемы ино-
родных тел и гранулемы неизвестной природы. К инфекционным
он отнес гранулемы при. туберкулезе, сифилисе, актиномикозе, юж-
ноамериканском бластомикозе, гистоплазмозе, амебиазе, шистосо-
мозе и др. В группу гранулем инородных тел включены крахмальные
и тальковые гранулемы, шовные гранулемы, вызванные экзогенными
жирами, сульфатом бария, ртутью. Гранулемы неизвестной природы
характерны для регионарного энтерита, саркоидоза, гранулематоз-
ного гастрита, эозинофильной гранулемы, аллергических гранулем,
первичного билиарного цирроза печени.
В зависимости от скорости обновления клеток выделяют быстро
192
Рис. 4.38. Формирование гранулемы при экзогенном аллергическом аль-
веолите. Компактное скопление макрофагов разной степени зрелости.
хЗООО.
и медленно обновляющиеся гранулемы. Образование последних
обычно связано с действием агентов с низкой токсичностью, поэтому
клетки в них живут иногда годами (гранулемы при татуировке,
гранулемы, вызванные карригинаном, сульфатом бария, частицами
сажи и т. д.), при этом каждая клетка успевает поглотить большое
количество раздражителя. Образование быстро обновляющихся гра-
нулем вызывают очень токсичные вещества, в первую очередь ин-
фекционные агенты. При этом клетки гранулемы быстро погибают
и в течение 1—2 нед заменяются новыми. На быстроту обновления
клеток влияют также иммунные механизмы.
Один и тот же агент в зависимости от иммунной реактивности
организма может вызвать образование и медленно, и быстро обме-
нивающихся гранулем. В этом отношении весьма показательна леп-
Ра. При низкой иммунной реактивности развивается лепроматозная
форма болезни, для которой характерны поражения, сходные с
гранулемами инородных тел, и медленное обновление клеточных
элементов, а при высокой иммунной реактивности и наличии ГЗТ
развивается туберкулоидная форма болезни, характеризующаяся
формированием эпителиоидно-клеточных гранулем и быстрым об-
новлением клеток. По этому признаку К. Warren (1976) различает
иммунное и неиммунное гранулематозное воспаление. Первое со-
провождается образованием клеточно-опосредованных иммунных
7—407
193
гранулем, в частности вызванных яйцами Schistosoma mansoni, и
антительно-опосредованных, обусловленных, например, Schistosoma
japonicum. Неиммунное гранулематозное воспаление включает боль-
шинство гранулем, образующихся вокруг инородных тел. Эти гра-
нулемы подразделяют на неактивные, или доброкачественные, и
активные, или цитотоксические [Warren К., 1976; Epstein W. L.,
1980]. Первые вызывают пластмассовые гранулы, бентонин, латекс
и т. п., вторые — частицы двуокиси кремния, оболочки стрептококка
и др.
По А. И. Струкову и О. Я. Кауфману (1989), классификация гра-
нулем состоит из трех частей (табл. 4.8): в части А гранулемы
сгруппированы по этиологии, в части Б — по гистологии, в части
В — по патогенезу. По этиологии гранулемы подразделяют на две
группы —установленной и неустановленной этиологии (А.1 и А.2).
Морфологически различают два основных вида гранулем: зрелая
макрофагальная и эпителиоидно-клеточная. В части В все гранулемы
разделены на две группы: иммунные (гиперсенситивные) гранулемы,
среди которых различают четыре подвида в зависимости от характера
иммунопатологического механизма, лежащего в ее основе; неим-
мунные гранулемы, имеющие два подвида, различающихся по эти-
ологии и характеру воздействия на ткань патогенного фактора. Эта
группа включает гранулемы, возникающие при острых инфекциях
(токсико-инфекционные гранулемы), и большинство гранулем, об-
разующихся вокруг инородных тел (токсические неиммунные гра-
нулемы) .
Таблица 4.8
Рабочая классификация гранулем
А. Этиология
АЛ.
А.1.1.
А. 1.2.
А.1.2.1.
А. 1.2.2.
А. 1.2.3.
А. 1.2.4.
АЛ.2.4.1.
АЛ .2.4.2.
А.2.
Б. Гистология
Б.1.
Б.1.2.
Б.1.3.
Б. 1.4.
Гранулемы установленной этиологии
Гранулемы инфекционные
Гранулемы неинфек ионные
Пылевые гранулемы (пыли неорганические)
Пылевые гранулемы (пыли органические)
Гранулемы медикаментозные
Гранулемы вокруг инородных тел
Гранулемы вокруг экзогенных инородных тел
Гранулемы вокруг эндогенных инородных тел
Гранулемы неустановленной этиологии
Зрелые макрофагальные гранулемы с указанием размера
Без гигантских многоядерных клеток
Без эпителиоидных клеток
С гигантскими многоядерными клетками (с указа-
нием типа этих клеток и соотношения различных ти-
пов)
С небольшим количеством эпителиоцдных клеток
Продолжение
Б. 1.5. С наличием инородных частиц (с характеристикой рас- положения частиц: внеклеточно, внутриклеточно, с ука- занием процента клеток, содержащих частицы, и по воз- можности их химического состава: гемосидерин, уголь, кремеиь и т. д.)
Б.2.1. Эпителиоидно-клеточные гранулемы с указанием раз- мера (малые и большие, или туберкулы)
Б.2.2. С гигантскими многоядерными клетками (тип клеток, количественная оценка соотношения типов и общего чис- ла)
Б.2.3. Б.2.4. Б.2.4.1. Б.2.4.2. Б.2.5. В. Патогенез В.1. В.1.1. С фиброзными изменениями С некрозом в центре С казеозным некрозом С фибриноидным некрозом С нагноением в центре Иммунные гнперчувствительные гранулемы Иммунные гранулемы, возникающие на основе грану- лематозной гиперчувствительности (ГГ) и гиперчувст- вительности замедленного типа (ГЗТ) с преобладанием в структуре гранулем эпителиоидных клеток
В.1.1.1. В.1.1.2. В. 1.2. Гранулемы с установленным антигеном Гранулемы с неустановленным антигеном Иммунные гранулемы, возникающие в результате ГНТ с образованием циркулирующих иммунных комплексов, поражением сосудов (капилляры, артерии, вены), по- вышением сосудисто-тканевой проницаемости, развити- ем гранулематозно-некротических васкулитов (антиген в большинстве случаев не устанавливается)
В.1.3. В.1.3.1. Иммунные гранулемы смешанного типа Гранулемы с установленным антигеном, инфекционио-
В. 1.3.2. В. 1.4. аллергические Гранулемы с неустановленным антигеном Иммунные гранулемы при лекарственной гиперчувстви- тельности» иммуноаллергические
В.2. Неиммунные гранулемы, участие иммунных механиз- мов при образовании которых не доказано
В.2.1. Неиммунные гранулемы инфекционно-токсические, возникающие при острых инфекционных болезнях
В.2.2. Неиммунные гранулемы токсические (большинство как экзогенных, так и эндогенных гранулем, образующихся вокруг инородных тел)
Термин «гранулема инородных тел» употребляется как показа-
тель реакции на инородное тело независимо от характера структуры
гранулемы. Обычно в зрелой макрофагальной гранулеме имеются
гигантские многоядерные клетки.
Согласно определению W. Т. Epstein (1980), гранулема инород-
ных тел является неиммунной реакцией мононуклеарных фагоцитов
на нерастворимый эндогенный или экзогенный стимул.
Различают эпителиоидно-клеточные гранулемы двух типов: не-
казеинфицируклциеся саркоидного типа (рис. 4.39) и эпителиоид-
Но-клеточные с казеозным некрозом (рис. 4.40). Основой эпители-
7*
195
Рис. 4.39. Эпителиоидно-клеточные гранулемы саркоидного типа.
а — группа гранулем в легком при саркоидозе. * 120; б — гранулема подкожной клетчатки
при саркоидозе образована эпителиоидными клетками с гигантской многоядерной клеткой
Пирогова—Лангханса в центре. «250; в — гранулема саркоидного типа в стенке тонкой кишки
при болезни Крона, в центре гранулемы — гигантская многоядерная клетка Пирогова—Лангханса.
*400 (препарат Л. Л. Капуллера); г — гранулема саркоидного типа вокруг яиц паразита при
шистосомозе, локализующаяся в подслизистом слое тонкой кишки, к 250 (препарат А. И. Тю-
кова).
Рис. 4.40. Гранулема туберкулоидного типа с казеозным некрозом в центре
при туберкулезе. Окраска гематоксилином и эозином, х 120.
оидно-клеточных гранулем саркоидного типа являются эпителиоид-
ные клетки, которые могут быть гипертрофированными и атрофи-
рованными [FuseJ., HiragaJ., 1972]. Гипертрофированные клетки
располагаются в центре свежих гранулем [Уварова О. А. и др.,
1982], атрофированные — по периферии старых. В гипертрофиро-
ванных эпителиоидных клетках хорошо развиты эндоплазматическая
гранулярная сеть, пластинчатый комплекс, много митохондрий и
лизосом, дающих выраженную реакцию на кислую фосфатазу. В ат-
рофированных эпителиоидных клетках уменьшается количество кле-
точных органелл. Гигантские многоядерные клетки в саркоидных
гранулемах имеют структуру, сходную с таковой клеток типа Пи-
рогова—Лангханса и гигантских клеток инородных тел. В цитоп-
лазме гигантских многоядерных клеток и эпителиоидных клетках
встречаются особые включения (астероидные тельца, тельца Шау-
мана). Иногда в центре гранулемы может определяться зона фиб-
риноидного некроза.
Эпителиоидно-клеточная гранулема с казеозным некрозом ха-
рактерна для туберкулеза. Она состоит в основном из эпителиоидных
клеток. По периферии бугорка располагаются 1—2 гигантские мно-
гоядерные клетки типа Пирогова—Лангханса. Часто на высоте кле-
точной пролиферации центр бугорка подвергается казеозному не-
крозу. Сходную структуру имеют и БЦЖ-гранулемы [Dan-
nenberg А. М. et al., 1980].
Механизмы, регулирующие неиммунные гранулемы, различны.
197
Рис. 4.41. Нагноение в центре эпителиоидно-клеточной грану/емы сарко-
идного типа при псевдотуберкулезе. Окраска гематоксилином и эозином.
*4Q0 (препарат А. А. Жаворонкова).
В неиммунных гранулемах, образующихся вокруг инородных тел,
преобладают механизмы ауторегуляции за счет биологически ак-
тивных веществ, прежде всего простагландинов, синтезируемых мак-
рофагами гранулем, а также других производных арахидоновой
кислоты [Epstein W. L., 1980]. Важную роль играют и производные
калликреин-кининовой системы, а также систем свертывания крови
и фибринолиза. Большое значение в механизмах гранулематозного
воспаления при неиммунных, так же как при иммунных, гранулемах
имеют нейтрофильные и кислые (лизосомные) протеазы макрофагов.
Продукты тканевого повреждения могут быть источником ан-
тигенного раздражения и включать иммунные механизмы грану-
лемообразования. В эпителиоидно-клеточных гранулемах важную
роль играют механизмы клеточно-опосредованного иммунитета, в
частности ГЗТ, которая участвует в развитии большигства таких
гранулем, хотя и не является достаточным и обязательным фак-
тором для их образования. Тем не менее гранулематозный ответ
резко усиливается и ускоряется при наличии ГЗТ [Adams D. О.,
1983].
Гранулематозное воспаление, как и всякое другое, вротекает в
виде циклической реакции. Возможны следующие исхода и ослож-
нения гранулематозного воспаления: I) рассасывание клеточного ин-
фильтрата; 2) сухой (казеозный) или влажный некроз с образова-
нием дефекта тканей; 3) нагноение в гранулеме с формированием
198
абсцесса (рис. 4.41); 4) фиброзное превращение гранулемы с обра-
зованием фиброзного узелка или рубца; 5) рост гранулемы, иногда
с формированием псевдоопухоли.
Гранулематозное воспаление лежит в основе так называемых
гранулематозных болезней. При этом важно подчеркнуть нозоло-
гический принцип классификации гранулематозных болезней. Со-
гласно этому принципу, гранулематозное воспаление не обяза-
тельно должно наблюдаться во всех стадиях и при всех формах
гранулематозных болезней, но оно должно быть структурной ос-
новой наиболее характерных и морфогенетически значимых стадий.
Особенно это важно для таких болезней, как лепра, сифилис,
туберкулез. Лепроматозная форма лепры, диффузные лимфоидно-
плазмоцитарные инфильтраты при сифилисе, возможность разви-
тия казеозной пневмонии при туберкулезе не противоречат отне-
сению указанных заболеваний к гранулематозным болезням. В то
же время гранулемы, связанные с татуировкой, не составляют
основу гранулематозной болезни, поскольку при этом нет болезни
как таковой.
Выделение группы гранулематозных болезней имеет значение
не только в диагностике, но и в плане лечения и прогноза, например
при криптогенном фиброзирующем альвеолите или облитерирующем
бронхиолите. В зависимости от качества отграничиваемого субстрата
воспаление может или затухать, и тогда формируется соединитель-
нотканная капсула с очаговыми скоплениями лимфоцитов, или пер-
систировать (инфицированные костные секвестры, пролежни при
нарушениях нервной трофики и т. п.).
4.3.2.3. Воспалительные гиперпластические
(гиперрегенераторные) разрастания
Воспаление этого вида имеет хроническое течение и сопровождается
формированием гиперрегенераторных (гиперпластических) полипов
или остроконечных кондилом. При этом на слизистой оболочке носа,
желудка или кишечника формируются выросты, состоящие из сое-
динительной ткани, инфильтрированной воспалительными и имму-
нокомпетентными клетками и покрытой эпителием. В желудке раз-
личают две формы гиперпластических полипов в зависимости от
структуры эпителиальной части: фовеолярную гиперплазию и ги-
перплазиогенный полип. Строма полипа обычно инфильтрирована
плазматическими клетками, лимфоцитами, ПЯЛ, среди которых
может быть много эозинофилов. Воспалительные полипы мотуг
встречаться и в кишечнике, особенно часто в толстой кишке, в
бронхах (полипозный или полипозно-язвенный бронхит, бронхио-
лит). В настоящее время показано, что связь между воспалением
и гиперпластическими полипами может иметь более сложный ха-
рактер, чем это представлялось ранее [Самсонов В. А., 1989].
При хронических воспалительных процессах в слизистой обо-
лочке шейки матки и вокруг заднепроходного отверстия гипер-
199
пластические эпителиальные разрастания могут иметь вид остро-
конечных кондилом, структура которых напоминает папиллому с
густо инфильтрированной поли- и мононуклеарами стромой.
4.4. ВОСПАЛЕНИЕ И РЕГЕНЕРАЦИЯ
Репаративная регенерация, возникающая в ответ на повреждение
тканей или органов, как правило, тесно связана с другими выра-
ботанными в процессе эволюции стереотипными реакциями на по-
вреждение — воспалением и склерозом (фиброзом). Примером таких
ситуаций являются заживление наружных кожных и кожно-мышеч-
ных дефектов (раны, ожоги, вскрытые абсцессы и флегмоны, тро-
фические язвы), а также язвенных дефектов слизистых оболочек
желудка, кишечника, ротовой полости, переломов костей, воспали-
тельных процессов в подкожной жировой клетчатке, мышцах, сус-
тавах, паренхиматозных органах, других повреждений и некрозов
тканей и органов экзо- и эндогенной природы (в том числе инфар-
ктов), организация гематом и тромбов, локальные, органные и
системные склерозы и циррозы.
Морфологическое изучение этих процессов в клинике и экспе-
рименте позволяет наряду с органно-тканевой, этиологической и
патогенетической спецификой установить также и общие законо-
мерности. Учитывая важнейшее и часто решающее значение сое-
динительной ткани, для изучения этих процессов мы применили
ранее разработанные нами основные принципы ее системного ана-
лиза [Серов В. В., ШехтерА. Б., 1981; Shekhter А. В., 1986 J.
4.4.1. Ауторегуляция соединительной ткани
Системный подход требует рассматривать сложные системы как
совокупность элементов, взаимодействие которых порождает новое
качество. В соответствии с этим основные функции соединительной
ткани — биомеханическая, трофическая, защитная и морфогенети-
ческая, а также ее интегральная функция — поддержание гомео-
и морфостаза (постоянство структуры) органов и всего организма —
реализуются в результате кооперативного взаимодейст-
вия клеток соединительной ткани (фибробластов, макрофагов,
лаброцитов, лимфоцитов, эндотелия) между собой, с межклеточным
матриксом (коллагеном, протеогликанами, фибронектином и др.),
клетками крови и паренхиматозными элементами на основе обрат-
ных связей.
Отдаленные, короткодистантные и контактные межклеточные
взаимодействия осуществляются посредством: 1) растворимых меди-
аторов (лимфокины, монокины, фиброкины и лаброкины); 2) нера-
створимых, или иммобилизованных, медиаторов (коллагены, фиб-
ронектин, протеогликаны); 3) прямых межклеточных контактов;
4) продуктов распада клеток и коллагена (активные пептиды, нук"
200
леотиды и т. д.). На кооперативном межклеточном и клеточно-мат-
риксном взаимодействии основана сетевая ауторегуляция структуры
и функции соединительной ткани в норме и при патологии, в том
числе при воспалении и репаративной регенерации. Соединительную
ткань можно рассматривать как саморегулирующуюся систему,
функционирующую под контролем высших регуляторных систем —
нервной, эндокринной и иммунной.
Ауторегуляция осуществляется на разных структурных уровнях —
от функционального элемента (гистион) до уровня организма. Акти-
вация каким-либо фактором одних клеточных систем (лаброциты,
макрофаги и др.) вследствие сложной сети взаимодействий включает
другие системы, происходит каскад клеточных реакций, т. е. соедини-
тельная ткань реагирует как единая функциональная система. Все ре-
акции направлены на инактивацию действующего фактора, репара-
цию повреждения либо адаптацию к новым условиям. В случае слабых
(локальных или общих) воздействий цепная реакция клеточных под-
систем соединительной ткани вследствие отрицательных обратных
связей, на которых основан гомеостаз, приводит к затуханию реакции
без выраженных структурных изменений и клинической манифеста-
ции, т. е. на уровне физиологических «доклинических» сдвигов.
Для приспособления к более длительным или стрессовым воз-
действиям (иммобилизация, перегрузки, голод, гипоксия и др.) тре-
буется длительная активация клеточных систем соединительной тка-
ни и формирование новых типов клеточного взаимодействия. Есте-
ственно, при этом возрастает роль других физиологических систем
и адаптационных механизмов, особенно синдрома Селье. При силь-
ных, длительных или повторяющихся патогенных воздействиях и
достаточно обширных повреждениях разворачивается цепь последо-
вательного включения механизмов, ведущих к формированию сте-
реотипных воспалительных, регенераторных и фибропластических
процессов, а через них либо к гомеостазу, либо хронической пато-
логии.
Вероятно, основанный на межклеточном взаимодействии меха-
низм адаптационной реакции соединительной ткани, неразрывно
связанный с иммунной реакцией, вместе с адаптационным синдромом
и реакцией нервной системы образует триаду основных регуляторных
приспособительных механизмов.
4.4.2. Воспалительно-репаративная реакция
как стереотипный процесс
В общем процессе репаративной регенерации (как при заживлении
тканевых дефектов, так и при других отмеченных выше ситуациях)
ярко проявляется единство воспаления, регенерации и фиброза,
которые по существу являются неразрывными компонентами цело-
стной тканевой реакции на повреждение [Шехтер А. Б., 1984, 1987].
Весь процесс представляет собой динамическую саморегулирующу-
юся систему (схема 4.3).
201
Схема 4.3. Кинетика воспалительно-репаративной реакции.
Повреждение
Микроциркуляторная и медиаторная реакции,
реакция тромбоцитов и лаброцитов
Экссудация, реакция нейтрофилов
i
Макрофагальная реакция
I
Пролиферация и миграция фибробластов,
рост сосудов, грануляционная ткань
Биосинтез и фибриллогенез коллагена
I
Созревание грануляционной ткани, фиброз
Реорганизация и инволюция рубца
Регенерация паренхиматозных элементов, субституция
Эта автоматическая реакция принципиально не зависит от типа
повреждающего фактора, хотя он и определяет ее своеобразие.
Каждая из фаз причинно-следственной цепи подготавливает и за-
пускает следующую, определяя ее интенсивность и распространен-
ность. Непрерывно осуществляемая на каждом этапе ауторегуляция
с помощью межклеточных взаимодействий в целом обеспечивает
адекватность воспаления. Конечной целью этой автоматической ре-
акции является ликвидация повреждения, т. е. максимальное ана-
томическое восстановление ткани с минимальными в данных усло-
виях функциональными нарушениями. Это относится и к неполной,
или заместительной, регенерации (субституция), когда паренхима-
тозные клетки замещаются соединительной тканью.
Механизмы репаративной регенерации эволюционно основаны
на механизмах физиологического воспаления и физиологической
регенерации. Достаточно вспомнить физиологическую (постменст-
руальную или послеродовую) регенерацию слизистой оболочки мат-
ки, протекающую с воспалительной реакцией на повреждение. Ре-
паративная регенерация является регенерацией при патологическом
состоянии, но в неосложненных случаях она остается стереотипным,
202
адекватным процессом защитно-приспособительного характера, т. е.
адаптивной регенерацией, хотя и включает элементы повреждения.
Это распространяется и на заместительную регенерацию путем руб-
цевания, за исключением случаев, когда рубец (например, в про-
водящей системе сердца) резко нарушает функцию органа.
Следует отметить, что единство воспалительного и собственно
репаративного компонента целостной реакции репаративной реге-
нерации сохраняется как во времени, так и в пространстве. Про-
лиферативная фаза воспаления одновременно является и фазой
репаративной регенерации. Воспаление и регенерация разделены
лишь условно, все фазы процесса накладываются друг на друга:
пролиферация фибробластов начинается уже в 1-е сутки после
повреждения, а экссудация и инфильтрация, постепенно уменьша-
ясь, остаются практически до окончания заживления. Условно также
разделение регенерации и фиброза, особенно при заместительной
регенерации. В пространстве (в разных участках ткани' и слоях
раны) процессы экссудации, пролиферации и фиброза идут с разной
скоростью, поэтому могут протекать одновременно. При этом все
компоненты взаимозависимы: пролонгация или хронизация воспа-
лМия~~тЗрмЬзит^регенерацию, несостоятельность регенерации^ или
фиброза пролонгируег воспаление-Илй-обусловливает его хоониче-,
ское течение. Воспаление, регенерация и фиброз находятся, по-ви-
димому, в реципрокных отношениях.
Целостная воспалительно-репаративная реакция тесно связана с
иммунитетом. Особенно четко это выявляется при анализе воспа-
ления, различные типы которого нередко представляют собой мор-
фологическое проявление форм иммунного ответа: гиперчувстви-
тельности немедленного или замедленного типа, гранулематозного
воспаления [Струков А. И., Кауфман О. Я., 1989; Серов В. В., 1990].
Заживление ран (в частности, скорость очищения и пролиферации)
также зависит от иммунного статуса организма, особенно от ГЗТ
[Линднер Д.П. и др., 1982].
Особенно ярко проявляется тесная взаимосвязь всех клеток со-
единительной ткани, крови и микрососудов, фибронектина и кол-
лагенов, формирующих системность реакции при воспалении. Ини-
циальные механизмы и все фазы воспаления — реакция микросо-
судов и крови (изменение кровотока, стаз или агрегация эритро-
цитов, микротромбоз), лимфостаз, повышение проницаемости стенок
капилляров и венул, хемотаксис и эмиграция клеток, фагоцитоз,
смена клеточных популяций и новые клеточные взаимоотношения,
пролиферация фибробластов и фибриллогенез — все это происходит
под влиянием медиаторов воспаления. К ним относятся гуморальные
медиаторы (факторы Хагемана, калликреин-кининовой системы, си-
стем комплемента, свертывания крови и т. д.) и медиаторы клеточ-
ного происхождения — лаброцитов, базофилов крови, нейтрофилов,
эозинофилов, тромбоцитов, моноцитов-макрофагов, лимфоцитов,
Фибробластов, клеток АПУД-системы и др., а также фибронектин
и коллаген, активно влияющие на хемотаксис и функции клеток
свертывающей системы крови.
203
В ранних фазах воспаления важную роль в клеточном «ан-
самбле» играют лаброциты, нейтрофилы и макрофаги (при им-
мунном воспалении — лимфоциты, при аллергии немедленного
типа — эозинофилы), которые взаимодействуют между собой не
только через клеточные медиаторы, но и посредством прямых
межклеточных контактов, часто выявляющихся при ультраструк-
турном исследовании. Функциональную роль подобных контактов
еще предстоит изучить: в одних случаях это «предъявление» ан-
тигена (макрофаг-лимфоцит), в других — последовательный или
сочетанный фагоцитоз (макрофаг-нейтрофил), в третьих — пере-
дача определенных экономно секретируемых факторов или специ-
фическое воздействие на "рецепторы клеточных мембран. Для лаб-
роцитов такими факторами могут быть гистамин, гепарин, хондро-
итинсульфаты, протеазы и другие субстанции, для лимфоцитов —
лимфокины, для нейтрофилов и макрофагов — лизосомные фер-
менты, лизоцим, простагландины, лейкотриены, интерлейкины,
многочисленные монокины и др.
Клеточные взаимодействия оказывают модулирующее (индукция
или ингибиция) влияние на хемотаксис, размножение и функцию
клеток инфильтрата. Следует отметить, что гистохимически и уль-
траструктурно во время взаимодействия клеток, в том числе кон-
тактного, отмечаются признаки активации как секреторной (экзо-
цитоз гранул, клазматоз и др.), так и фагоцитарной (активация
кислой фосфатазы и эстеразы, фагосомы, лизосомы, пиноцитоз,
остаточные тельца и др.) функции клеток.
‘В разных фазах воспаления и регенерации по мере «выхода на
арену» новых клеточных популяций меняются типы клеточных вза-
имодействий, роль «дирижера клеточных ансамблей» переходит от
одних клеточных популяций к другим. В фазе микроциркуляторной
реакции основную регуляторную роль, по-видимому, играют лаб-
роциты, способные к активным взаимодействиям с сосудистыми
элементами, эозинофилами и нейтрофилами, лимфоцитами, макро-
фагами, фибробластами, межклеточным матриксом, свертывающей
системой крови, иммунной системой и др. [Проценко В. А. и др.,
1987; Parwaresch М. et al., 1985]. Важную роль играют тромбоциты,
генерирующие тромбоксаны и тромбоцитарный активирующий фак-
тор — PAF (на самом деле включающий целый класс фосфолипидных
медиаторов), который воздействует на нейтрофилы, эозинофилы,
макрофаги, активируя их хемотаксис, агрегацию, продукцию су-
пероксидных анионов, лейкотриенов, монокинов и др., на эндотелий
и гладкие мышцы сосудов, а также на сами тромбоциты [Bonveniste
J., Pretolani М., 1986; Pinckard R. N. et al., 1988]. Интересно, что
источником PAF являются также лаброциты и базофилы, моноци-
ты-макрофаги и эндотелий, что свидетельствует о наличии обратной
связи у всех этих клеток.
Следует упомянуть, что тромбоциты продуцируют также ряд
факторов, усиливающих пролиферацию и хемотаксис фибробластов
к очагу повреждения: тромбоцитарный фактор роста фибробластов
(PDGF), трансформирующий фактор роста (TCFp), фактор роста
204
эпидермиса и фибробластов (EGF), пептид, активирующий соеди-
нительную ткань (СТАР-3) и др. [Postlethwaite А. Е., Kang А. Н.,
1988; CastorC., 1989]. Учитывая, что лаброциты через гистамин и
лейкотриен В4 влияют на фибробласты [Choi К. L., Claman G. N.,
1987], следует думать, что подготовка репаративной фазы процесса
начинается на самых ранних стадиях воспаления.
В нейтрофильной фазе воспаления особое значение приобретают
нейтрофилы (иногда эозинофилы), формирующие авангардную ли-
нию защиты организма в области первичного повреждения. Грану-
лоциты весьма чувствительны к активации различными гумораль-
ными и клеточными факторами, в то же время продукты стиму-
лированных нейтрофилов активируют систему комплемента,
хемотаксис, взаимодействуют с IgG и IgA, калликреин-кининовоц
системой, системами свертывания и фибринолиза, фактором Хаге-
мана, производными арахидоновой кислоты.
Хорошо известны и взаимодействия нейтрофилов с лимфоцитами:
выработка последними факторов торможения миграции нейтрофи-
лов, усиление их бактерицидности, стимуляция кислородного мета-
болизма, влияние ферментов нейтрофила на бласттрансформацию
лимфоцитов и т. д. [Маянский А. Н., Маянский Д. Н., 1983]. Ней-
трофилы взаимодействуют с лаброцитами, вызывая их дегрануля-
цию, а также с тромбоцитами.
Взаимодействие нейтрофилов и макрофагов в разные фазы и при
разных типах воспаления, по-видимому, значительно варьирует:
преобладают то активирующие, то тормозящие влияния. Стимуляция
нейтрофилами хемотаксиса моноцитов, вероятно, является одной из
основных причин смены этих клеточных популяций в очаге воспа-
ления. Лизоцим и фактор иммобилизации нейтрофилов, выделяемые
мононуклеарами, тормозят хемотаксис нейтрофилов [Merril W. et
al., 1980], хотя известны также факторы, усиливающие миграцию
нейтрофилов [Snyderman R. et al., 1989]. Очевидно, между этими
клеточными популяциями существует обратная связь, регулирующая
развитие воспаления, а нарушение ее приводит к пролонгации и
хронизации процесса.
Сведения относительно взаимодействия нейтрофилов с фибро-
бластами немногочисленны. При электронной микроскопии обнару-
живают межклеточные контакты на ранних стадиях заживления
ран [Верченко Г. Н., Шехтер А. Б., 1985], хотя функциональное
значение их неясно. Нейтрофилы продуцируют, с одной стороны,
пептид, активирующий рост фибробластов (CTAP-PMN), и лейко-
триен В4, усиливающий их миграцию, с другой — фактор ингибиции
миграции [CastorC. W., 1989]. Результаты проведенных нами мор-
фологических исследований свидетельствуют о том, что пролифе-
рация фибробластов тормозится как при избытке нейтрофилов (при
гнойном воспалении), так и при их недостатке (например, при
обработке раны излучением лазера). На межклеточный матрикс
нейтрофилы воздействуют путем секреции коллагеназы, эластазы,
нейтральных протеиназ, катепсинов, кислых гидролаз. Коллаген и
его пептиды в свою очередь влияют на хемотаксис макрофагов и
205
фибробластов [Diegelman R. et al., 1981; Postlethwaite A. E. et al.,
1988]. Таким образом, нейтрофилы, реактивные и способные к
быстрой мобилизации клетки, являющиеся источниками разнооб-
разных медиаторов, поддерживают каскад воспалительно-репаратив-
ного процесса.
Начиная с макрофагальной фазы воспаления, роль ключевой
клетки — «дирижера клеточного ансамбля» переходит к макрофагу.
Взаимодействия его с. другими клеточными популяциями и меж-
клеточным матриксом реализуются благодаря большому количеству
(известно более 40) секретируемых макрофагом медиаторов —
монокинов. Следует отметить важнейшую роль макрофагов в со-
пряжении экссудативной и пролиферативной фаз воспаления, ре-
генерации и фиброза. В кооперации с нейтрофилами они осуще-
ствляют бактерицидную функцию и функцию детоксикации, очи-
щают ткань от продуктов распада клеток и межклеточного
матрикса путем фагоцитоза и внеклеточного лизиса с помощью
секреции ферментов: коллагеназы, эластазы, нейтральных проте-
иназ, кислых гидролаз и др.
Макрофаги отграничивают очаг повреждения от окружающих
тканей, последовательно формируя нейтрофильно-макрофагальный,
макрофагальный и макрофагально-фибробластический барьеры,
предшествующие грануляционной ткани. Через монокины макро-
фаги влияют на дифференцировку из стволовых клеток, миграцию,
пролиферацию и функцию моноцитов (предшественники макрофа-
гор), нейтрофилов и лимфоцитов. В кооперации с Т- и В-лимфо-
цитами макрофаги участвуют в иммунном ответе организма, тесно
связанном с воспалением. Сопряжение воспаления, регенерации и
фиброза реализуется благодаря макрофагально-фибробластическому
взаимодействию, играющему ключевую роль в регуляции роста и
инволюции соединительной ткани, основанной на обратной связи
между распадом и продукцией коллагена [Шехтер А. Б., 1977; Серов
В. В., Шехтер А. Б., 1981 ]. Продукты распада коллагена, образую-
щиеся при повреждении тканей протеазами, стимулируют хемотак-
сис макрофагов [Postlethwaite A. F. et al., 1976; Digelman R. F. et
al., 1981]. Последние фагоцитируют продукты распада и, активи-
руясь, секретируют факторы роста фибробластов и индукторы син-
теза коллагена, передавая их фибробластам, в том числе и посред-
ством отмеченных нами прямых межклеточных контактов (рис.
4.42). В настоящее время выявлены и охарактеризованы следующие
факторы (см. 4.1.5): 1) индукторы пролиферации фибробластов (мак-
рофагальный фактор роста — MDGF, фактор альвеолярных макро-
фагов — AMDGF, ИЛ-1*, фактор некроза опухолей — кахектин),
причем макрофаги способны продуцировать еще и тромбоцитарные
факторы роста — PDGF и TGF-p; 2) индукторы хемотаксиса фиб-
робластов (фибронектин, PDGF, TGF-р, ИЛ-1, кахектин); 3) ин-
дукторы синтеза коллагена макрофагальный стимулятор синтеза —
CEMF, ИЛ-1, кахектин, TGF-0; 4) ингибитор биосинтеза коллагена;
5) индукторы продукции коллагеназы, ИЛ-1, кахектин [Wahl S. М-,
1986; Postlethwaite А. Е., KangG. N., 1988; CastorS. W., 1989].
206
Рис. 4.42. Межклеточный контакт макрофага (Мф) и юного фибробласта
(Фб). Х10 000.
Макрофагально-фибробластическое взаимодействие приводит к
миграции и ускоренной пролиферации фибробластов, их дифферен-
цировке, синтезу и секреции коллагена и других компонентов мат-
рикса, активному фибриллогенезу. Подтверждением этого может
служить эффективность лекарственных коллагеновых препаратов,
значительно ускоряющих репаративные процессы (заживление ран,
язв, ожогов, дефектов внутренних органов, костей, сосудов), осо-
бенно при осложненном течении [Сыченников И. А. и др., 1978;
Шехтер А. Б., 1971]. При изучении механизма этого эффекта ус-
тановлено, что цельные перитонеальные макрофаги, предварительно
стимулированные коллагеном, и продукты их ультразвуковой де-
струкции при введении в ткань активируют хемотаксис собственных
макрофагов и фибробластов, резко ускоряют пролиферацию и со-
зревание фибробластов, при этом в необычно ранние сроки проис-
ходит фиброгенез [Гаврильчак А. В., Шехтер А. Б., 1985].
Следует отметить, что, помимо макрофагов, в развитие фибро-
бластической реакции значительный вклад вносят и лимфоциты,
особенно активирующиеся при иммунном взаимодействии Т-клетки.
Так, среди, лимфокинов обнаружены Т-клеточный фактор (FAF),
активирующий пролиферацию клеток, а также продукцию колла-
геназы, лимфоцитарный хемотаксический фактор для фибробластов
(LDCF-F), коллагенпродуцирующий фактор (CPF), В-клеточный
ингибитор продукции коллагена, фибробластингибирующий фактор
207
(FIF), тормозящий хемотаксис, ингибиторный фактор роста (IgF).
Такие продукты лимфоцитов, как у- и а-интерфероны, тормозят
хемотаксис, пролиферацию и синтез коллагена [Wahl S. М., 1986-
CastorC. W., 1989]. Все это свидетельствует о регуляторной роли
иммунных лимфоцитов в процессе роста соединительной ткани, что
осуществляется ими во взаимодействии с макрофагами: монокины
активируют лимфоциты, а лимфокины — макрофаги, стимулируя
выработку соответствующих факторов для фибробластов. Регуля-
торная функция лимфоцитов соответствует современным представ-
лениям о роли клеток в регенерации [Бабаева А. Г., 1985 ].
По мере накопления фибробластов рост их тормозится в резуль-
тате остановки деления зрелых клеток, перешедших к биосинтезу
коллагена. Новые же клетки «не рекрутируются» из предшествен-
ников вследствие истощения ростковых факторов (клеток инфиль-
трата становится значительно меньше), а также благодаря выработке
самими фибробластами при их контактном взаимодействии ингиби-
торов роста — кейлонов [Романов Ю. А., Кетлинский С. А., 1984;
Houck J. С., 1976]. Необходимо отметить также, что взаимодействие
фибробластов с макрофагами и лимфоцитами не является односто-
ронним. Фибробласты сами секретируют ряд веществ (фиброкины),
оказывающих стимулирующее или ингибирующее влияние на другие
клетки, особенно на макрофаги. Можно привести также данные о
макрофагактивирующих факторах, выделенных из культуры фиб-
робластов [OkaiY., 1986].
Известно, что продукция межклеточного матрикса (коллагены
I, III, V типов, ГАГ, фибронектин и др.) является прерогативой
фибробластов. Однако в последние годы установлено, что и эта
функция осуществляется кооперативно. В частности, фибронектин
вырабатывается макрофагами, коллагены I, III, IV, V, VI и VIII
типов — эпителиальными клетками (печени, легких и других ор-
ганов), коллагены IV и V типов — макрофагами, лимфоцитами,
нейтрофилами [Digelmann R. F. et al., 1988 ].
Следующий этап ауторегуляции роста соединительной ткани, по
нашим данным, заключается в том, что функционально-избыточные
коллагеновые волокна в фазе рубцевания тесно взаимодействуют с
цитолеммой фибробластов, ингибируя синтез и секрецию коллагена,
что приводит к деструкции мембран и разрушению большей части
клеток, к превращению оставшейся части в малоактивные фибро-
циты. Одновременно усиливается и феномен фиброклазии, т. е.
резорбция фибробластами коллагеновых волокон путем их фагоци-
тоза или секреции коллагеназы. Такое своеобразное «контактное
ингибирование» приводит к остановке роста соединительной ткани,
затем к ее перестройке (ремоделяции), когда в одних участках
продолжается накопление волокон, а в других (функционально инер-
тных) — их лизис, а затем к частичной или неполной инволюции
рубца [Шехтер А. Б., 1978, 1986]. Помимо фибробластов, в колла-
генолизе (обратное развитие фиброза) принимают участие эозино-
филы, продуцирующие коллагеназу, лимфоциты и лаброциты, вы-
рабатывающие факторы, которые стимулируют коллагенолиз
208
[Stricklin P. et al., 1988 ]. Большую роль играют и макрофаги, которые
не только секретируют коллагеназу, но и выделяют факторы, сти-
мулирующие ее продукцию в фибробластах, усиливающие фагоцитоз
фибрилл фиброкластами [Hibs М. S. et al., 1983; Posthletwaite А. Е.
et al., 1988 ].
На последних этапах воспалительно-репаративного процесса важ-
нейшую роль играет паренхиматозно-стромальное взаимодействие.
Эпителий продуцирует коллагеназу, а стромальные клетки (лим-
фоциты, макрофаги и фибробласты) секретируют факторы индукции
и ингибиции регенерации эпителия и мышц. Получено очень много
данных о влиянии на паренхиматозные элементы коллагенов, осо-
бенно I, III, IV, V, VIII, XIII типов, протеогликанов и фибронектина,
рейдирующих рост, функцию и архитектонику эпителиальной и
мышечной ткани в молочной и поджелудочной железах, печени,
коже, нервной системе, мышцах и др. [Лебедев Д. А., 1979, 1990;
Серов В. В., ШехтерА. Б., 1981; Nimni М. Е. et al., 1988].
Основную роль в росте и инволюции соединительной ткани в
стромально-паренхиматозном взаимодействии принадлежит фибро-
бластам, к которым, начиная с фазы пролиферации, переходит роль
«дирижера клеточного ансамбля», так как они становятся не только
основными эффекторными, но и главными регуляторными клетками.
В соответствии с влиянием микроокружения и гуморальными сти-
мулами изменяется соотношение между альтернативными функци-
ями фибробласта (синтез всех макромолекул и ферментов, регули-
рующих фибриллогенез, а также продукция коллагеназы, эластазы
и глюкуронидаз), таким образом контролируются темпы роста, фиб-
розирования и инволюции соединительной ткани, стромально-па-
ренхиматозные взаимоотношения. В соответствии с концепцией «био-
механического соответствия» фибробласт определяет не только со-
став, но и архитектуру межклеточного матрикса. В связи с этим
понятна важность участия в регенерации специализированных фиб-
робластов данной ткани, так как «пришлые» клетки формируют
неспециализированную рубцовую ткань.
4.4.3. Грануляционная ткань — продукт
воспалительно-репаративного процесса
Под грануляционной тканью (ГТ) следует понимать особую, богатую
сосудами, молодую соединительную ткань. Это не только ткань,
заполняющая раневые и язвенные дефекты кожи, но и близкая ей
по структуре ткань, образующаяся при повреждении слизистых
оболочек и внутренних органов, переломах костей, организации
гематом, тромбов, очагов некроза и инфарктов, воспалительного
экссудата, инородных тел и т. д., а также вследствие хронических
воспалительных процессов. Это специализированная форма соеди-
нительной ткани, своеобразный «временный орган», создаваемый
организмом в условиях патологии для осуществления определенных
Функций и исчезающих после их выполнения. Функции его соот-
209
ветствуют общим функциям всей системы соединительной ткани,
но они локализованы и специализированы. Механическая функция
заключается в заполнении дефекта или области повреждения, а
также контракции ГТ, трофическая — в рефляции микроциркуля-
ции, транспорте кислорода и метаболитов, выборочной фильтраци
веществ и т. д., морфогенетическая — во влиянии на дифференци-
ровку эпителия и мышечной ткани. Однако основными функциями
ГТ являются защитная (предотвращение влияния факторов внешней
среды, инфекции и интоксикации, инкапсуляция очагов некроза и
инородных тел) и репаративная (восстановление анатомической и
функциональной целостности тканей путем полной или неполной
регенерации).
Формирование ГТ не строго обязательно и связано с величиной
и глубиной первичного повреждения. При заживлении ушитых кож-
ных ран или мелких дефектов слизистой оболочки и других тканей
«первичным натяжением» вследствие слабой травматизации ткани
и малой микробной инвазии дистрофические и некробиотические
изменения клеток и волокон минимальны. Первичная реакция лаб-
роцитов и сосудов микроциркуляции относительно слаба, поэтому
экссудация умеренна и имеет серозный или серозно-фибринозный
характер («травматический отек»). Нейтрофильная и макрофагаль-
ная фазы воспалительно реакции укорочены вследствие небольшой
концентрации медиаторов, ощеделяющих хемотаксис этих клеток.
Это приводит к быстрому очищению ткани и переходу к пролифе-
ративной фазе воспаления, однако пролиферация фибробластов, а
особенно новообразование капилляров не интенсивны, ГТ не обра-
зуется, рубец быстро созревает и инволюционнрует. Быстро купи-
рующееся острое (реже подострое) воспаление также не приводит
к заметному формированию ГТ.
Заживление под струпом является промежуточным между пер-
вичным и вторичным натяжением [Шехтер А. Б., Берченко Г. Н.,
1984]. Более значительная травматизация тканей и обширная (пер-
воначально открытая) раневая поверхность, подвергающаяся воз-
действию внешней среды и микробной инвазии, а затем таких
факторов, как гипоксия и ацидоз ткани, приводят к более распро-
страненному некробиозу клеток и волокон подлежащих тканей.
Воспалительная реакция также более интенсивна, но адекватна
повреждению. В сосудах микроциркуляции отмечаются стаз эрит-
роцитов, лимфостаз, повышенная проницаемость лейкоцитов, эрит-
роцитов и плазмы, наблюдается значительная экссудация фибрина,
последовательно протекает нейтрофильная, макрофагальная и про-
лиферативная (фибробластическая) стадии воспаления. Тяжи фиб-
робластов постепенно заполняют дефект, наблюдаются многочис-
ленные макрофагально-фибробластические контакты (см. рис. 4.42).
Макрофаги и фибробласт имеют ультраструктурные и гистохими-
ческие признаки функциональной активации.
Рост микрососудов в грануляционной ткани осуществляется син-
хронно с пролиферацией фибробластов и всегда в сопровождении
последних. Этот давно известный" факт находит теперь объяснение
210
в том, что на рост эндотелия и фибробластов воздействуют схожие
факторы. В частности, макрофаги, помимо факторов роста, миграции
фибробластов и синтеза коллагена, секретируют также фактор роста
сосудов [Clark К. A. et al., 1976, 1982]. Для стимуляции роста
эндотелия в культуре' используют факторы роста эндотелиальных
клеток [Macing Т. et al., 1981 ], которые оказались идентичными
факторам роста фибробластов (FGF) кислого (I) и щелочного (II)
типов [LobbR. et al., 1986]. При этом сами эндотелиальные клетки
секретируют FGF щелочного типа [Schweigerer L. et al., 1987], т. е.
имеется и обратная связь. На рост капилляров влияют также не-
которые лимфокины, тромбоцитарные факторы, в частности упо-
минавшийся выше тромбоцитарный активирующий фактор PAF, а
также fi -трансформирующий фактор роста фибробластов (TGF-/3),
продуцируемый тромбоцитами, макрофагами и Т-лимфоцитами
[HeimarkR. L. et al., 1986]. Есть сведения о том, что ПГЕг, инги-
бирующий рост и миграцию фибробластов, является фактором ан-
гиогенеза [Form D. М., Anerbach R., 1982 ].
Синхронизация роста фибробластов и сосудов достигается также
путем взаимодействия между ними. Фибробласты секретируют фиб-
ронектин, Гаг, коллагены, необходимые для регуляции ангиогенеза.
Показательно, что для роста эндотелия в культуре необходима
коллагеновая «подложка», а если они культивируются в трехмерном
коллагеновом геле, то из клеток формируются анастомозирующие
капиллярные трубки с просветом [Лебедев Д. А. и др., 1990;
Montesano, 1986]. В свою очередь эндотелий продуцирует ИЛ-1,
усиливающий пролиферацию и миграцию фибробластов, синтез кол-
лагена [Misisses Р. et al., 1986], а также FGF и тромбоцитарный
фактор роста (PDGF) фибробластов [DiCorleto Р. Е., Bowen-
Pope Ь. F., 1983; Colins Т. et al., 1987]. Обнаружена секреция
эндотелием коллагенов не только IV и XIII типов (базальная мем-
брана), но и специфичного для эндотелия VIII типа, а также I, III,
V и VIII типов коллагена, эластина, фибронектина, ламенина, тром-
боспондина, кислых ГАГ, коллагеназы, регулирующих рост фиброб-
ластов и образование межклеточного матрикса [Sage Н., 1984; Jaffe
Е., 1988]. Наконец, следует вспомнить и о возможном гистогене-
тическом единстве: по некоторым данным, перициты являются об-
щим источником фибробластов, эндотелия и гладких мышц сосудов
[Saeki К., 1978; Rask D., 1986].
ГТ начинает формироваться в подлежащих тканях (подкожной
жировой клетчатке, мышцах), затем сосуды и клетки прорастают
фибринозно-лейкоцитарный слой, постепенно образуя типичную
структуру ГТ: вертикальные капиллярные петли и горизонтально
расположенные между ними веретенообразные фибробласты (рис.
4.43, а). Большое количество капилляров, растущих по кислородному
(гипоксичёскомуУ градиенту, объясняется необходимостью метабо-
лического и энергетического обеспечения клеток: для роста фиб-
ЕРбластов необходим рОг не менее 10 мм рт. ст., а для синтеза
коллагена — 20 мм рт, ст. (Hunt Т-Н- et al., 1985]. Это еще одна
п1ЯГчйна синхронизации роста фибробластов и сосудов. После уст-
211
Рис. 4.43. Неосложненное заживление кожной раны.
а — грануляционная ткань с вертикальными сосудистыми петлями и горизонтально ориен-
тированными фибробластами, в поверхностном слое — макрофагальная инфильтрация; б —
фиброзко-рубцовая трансформация грануляционной ткани, регенерация эпидермиса. Окраска
ге Метокс ил ином и эозином. >100.
^ранения гипоксического градиента рост сосудов прекращается. Так
осуществляется сосудисто-кислородный гомеостаз ГГ.
дифференцировка фибробластов, продукция ~ГАГ, биосинтез,
фибриллогенез и фиброгенез коллагена, взаимодействие волокон с
фибробластами, обусловливающее прекращение пролиферации, раз-
рушение клеток и фиброклазию, — все это приводит к созреванию,
перестройке и к фиброзно-рубцовой трансформации ГТ, начинаю-
щейся с ее глубоких слоев. При этом происходит перекалибровка
сосудистой сети с образованием артериовенозных анастомозов и
регрессией большинства капилляров. Одновременно идут контракция
(сокращение) и эпителизация ГТ, причем рост эпителия и созре-
вание ГТ тесно взаимосвязаны (рис. 4.43, б).
Те же закономерности имеет развитие ГТ при имплантации
биологически или химически активных материалов, заживлении
относительно крупных дефектов слизистых оболочек (например, язв
желудка), внутренних органов и мышц, переломов костей, органи-
зации больших тромбов, гематом, фибринных выпотов, инфарктов
и т. д. Однако образующаяся ГТ и рубцовая ткань везде имеют
специфическую архитектонику, соответствующую местным особен-
ностям механического напряжения и трофики. Вертикальные сосу-
дистые петли, в частности, образуются обычно в открытых дефектах
кожи и слизистых оболочек.
212
Активную микробную инвазию и выраженную воспалительную
реакцию (нагноение) И. В. Давыдовский (1950) рассматривал при
заживлении ран вторичным натяжением в условиях большого и
глубокого, открытого дефекта, не защищенного струпом, как био-
логически целесообразный процесс очищения раны с участием бак-
териальных протеаз. Саморегулирующаяся стереотипная динамика
воспалительно-репаративного процесса принципиально не наруша-
ется, но в соответствии с выраженным повреждением все остальные
звенья цепи (фазы процесса) интенсифицируются и пролонгируются,
а заживление затягивается. ГТ долго имеет выраженные признаки
воспаления [Верченко Г. И., Шехтер А. Б., 1985] и многослойную
структуру, описанную Н. Н. Аничковым и соавт. (1951): поверхно-
стный лейкоцитарно-некротический слой, слой сосудистых петель,
слой вертикальных сосудов, созревающий слой, слой горизонтальных
фибробластов, фиброзный слой. Таким образом, при условии нор-
мальной реактивности организма заживление вторичным натяже-
нием следует считать адекватной приспособительной реакцией, не
выходящей за рамки гомеостатической функции соединительной
ткани, что соответствует взглядам И. В. Давыдовского.
4.4.4. Дисрегенерация как результат нарушения
и извращения кинетики воспалительно-
репаративной реакции
Опыт изучения разнообразных патологических процессов свидетель-
ствует о том, что при определенных условиях адекватная воспали-
тельно-репаративная реакция может перейти в хронический пато-
логический процесс. Полом гомеостатических механизмов на разных
уровнях регуляции приводит к нарушению и извращению стерео-
типной кинетики процесса, разобщению воспаления и регенерации,
неадекватному фиброзу. Процесс теряет защитно-приспособитель^
ный характер, и его по аналогии с введенными Г. Селье терминами
«стресс» и «дистресс» можно назвать дисрегенерацией (патологиче-
ская регенерация). Ее не следует идентифицировать с регенерацией
патологически измененных органов, так как при последней не всегда
нарушается стереотипная защитная реакция, а регенерация может
Даже ослабить патологический процесс, как это происходит при
резекции цирротической печени, включающей коллагенолитические
механизмы [Солопаев Б. М., 1986].
Проявления дисрегенерации можно условно разделить на не-
сколько групп: 1) выраженное торможение репарации с возможным
Рецидивированием (длительно незаживающие кожные раны и тро-
фические язвы, хронические язвы слизистых оболочек, замедленное
заживление инфарктов и других некрозов органов и тканей и т. д.);
2) хронические воспалительные процессы; 3) склеротические про-
цессы, если они имеют неадекватный и прогрессирующий характер
и ведут к нарушению функции органа (цирроз печени, пневмоск-
213
лероз, кардиосклероз, нефросклероз и др.). При этом важно отме-
тить, что компоненты повреждения, воспаления и склероза имеются
во всех группах. Особую группу составляют так называемые фиб-
роматозы (келоидные рубцы, контрактура Дюпюитрена, узелковый
фиброзит, десмоид и т. д.), которые относят к псевдоопухолевым
процессам. В этиологии их важное значение имеет наследственная
дисплазия, а провоцирующими моментами являются травма, вос-
паление, ишемия [Вихерт А. М. и др., 1982].
Причины перехода регенерации в дисрегенерацию могут быть
разнообразными. Важную роль играют изменения реактивности ор-
ганизма, которые могут быть связаны с: 1) врожденной или приоб-
ретенной неполноценностью фагоцитоза и секреции нейтрофилов и
макрофагов; 2) иммунным дефицитом, нарушением ГЗТ или анти-
телогенеза; 3) нарушением межклеточных и межтканевых корреля-
ций; 4) неполноценностью сложных систем регуляции пролиферации
и хемотаксиса фибробластов, биосинтеза, фибриллогенеза и лизиса
коллагена; 5) нарушениями нейроэндокринной регуляции; Нередко
отмечаются сочетания этих причинных факторов. Неполноценность
может быть на уровне молекулярных и внутриклеточных нарушений
(лизосомы, цитоскелет, рнергетический, белково-синтезируюший ап-
парат и др.), межклеточных, тканевых и сывороточных факторов
регуляции. Большое значение имеет обширное повреждение и осо-
бенно пёрманевтное-действие повреждающих факторов, так как они
Вызывают истощение защитных механизмов. Не менее важную роль
играют сопутствующие состояния: недостаточность сосудистой или
нервной трофики (тромбоз, венозный застой, лимфостаз, перерезка
нерва и т. д.), авитаминоз, сахарный диабет, угнетение кроветво-
рения, воздействие ионизирующего излучения, заболевания печени
и др.
Результаты изучения проявлений дисрегенерации позволяют на-
ряду с патогенетическими и морфологическими особенностями вы-
делить важные общие закономерности, связанные с нарушением
межклеточных взаимодействий [Шехтер А. Б., 1984, 1986]. В боль-
шинстве случаев наблюдается ослабленный и незавершенный фаго-
цитоз микробов нейтрофилами, при инфекции — снижение в них
уровня гликогена, слабая активность щелочной и кислой фосфатаз,
интенсивный распад клеток. Это свидетельствует о расстройстве
нейтрофильного звена реакции, хотя количество клеток может быть
большим. Выраженное и распространение расстройство микроцир-
куляции привбДйУ к усиленной альтерации вплоть до формирования
“крупных фокусов некрозаГОтчетливо проявляется нарушение мак-
рофагального звена^)ёгуляции. Миграция моноцитов и содержание
макрофагов часто значительно уменьшены, по-ввдимому, в связи с
расстройством медиаторного взаимодействия и хемотаксиса.
Фагоцитарная функция макрофагов угнетена: снижена актив-
ность кислой фосфатазы и эстеразы7~УменыпенЬ количество лизосом
и фагосом, выявляются признаки деструкции клеток. Резко замед~
ляется очищение ткани от продуктов распада. Значительно умень-
шено содержание макрофагов секреторного~Типа, количество мак-
214
Рис. 4.44. Неполноценная грануляционная ткань: выраженный отек, ней-
трофильная и лимфоидная инфильтрация, немногочисленные фибробласты,
продуктивно-инфильтративный васкулит. Окраска по методу Ван-Гизона.
*200.
рофагально-фибробластических и других межклеточных контактов.
Все это приводит к выраженному торможению пролиферативной
фазы процесса. Практически отсутствуют митозы фибробластов,
замедлена их дифференцировка в зрелые формы, отсутствуют или
слабо выражены ультраструктурные признаки секреции коллагена
и протеогликанов, фибрилле- и фиброгенеза, созревания коллаге-
новых волокон. В фибробластах часто отмечаются признаки де-
струкции ядра, митохондрий, других органелл и клеточных мембран
вплоть до распада клеток. Вследствие небольшого количества мио-
фибробластов тормозится контракция, регенерация эпителия или
мышечной ткани замедлена из-за воспалительной инфильтрации,
незрелости или вторичных некротических изменений ГТ, нарушения
стромально-паренхиматозных взаимоотношений.
Формируется неполноценная ГТ, бедная фибробластами и во-
локнами, с резким отеком межуточного .вещества, инфильтрирован-
ная нейтрофилами, а часто и лимфоцитами с цитотоксическими
свойствами (рис74.44). Возможно, меняется спектр секреции лим-
Фокинов с преобладанием ингибирующих, а не индуцирующих фак-
торов. В части случаев при хроническом воспалении отмечается
избыточная и персистирующая макрофагальная инфильтрация (осо-
бенно при гранулематозных процессах). Однако в этих условиях
Макрофаги часто не стимулируют, а тормозят рост фибробластов_-и—
215
Рис. 4.45. Выраженные изменения сосудов в грануляционной ткани.
а — дистрофия и десквамация эндотелия, диапедез эритроцитов. Полутонкий срез. Окраска
толуидиновым синим. *900 б — деструкция эндотелия микрососуда, агрегация тромбоцитов
и эритроцитов в его просвете, набухание и расслоение базальной мембраны (БМ). *6000
коллагеногенез (видимо, изменяя спектр секретируемых монокинов),
к тому же усиливают коллагенолизис, поддерживая воспаление.
Макрофагально-фибробластические взаимодействия нарушаются.
В связи с сохраняющимся гипоксическим градиентом происходит
постоянный рост сосудов (иногда это приводит к гипергрануляции),
но гипоксия не устраняется. Причина этого заключается в зна-
чительно более выраженных, чем при остром воспалении, изме-
нениях сосудов, особенно микроциркуляторных: резкое набухание,
деструкция и десквамация эндотелия, набухание, утолщение и
расслоение базальных мембран, ведущее к нарушению транска-
пиллярного обмена, плазматическое пропитывание и нейтрофиль-
ная инфильтрация стенок сосудов и периваскулярных пространств,
продуктивный эндо-, пери- или панваскулит, часто с облитерацией
просвета (рис. 4.45). В просветах сохранившихся сосудов наблю-
даются агрегация и агглютинация эритроцитов (сладж-феномен)
с образованием гиалиновых, фибриновых, реже тромбоцитарных,
лейкоцитарных и смешанных тромбов. Выраженная проницаемость
сосудов, лимфостаз и «заболачивание» лимфой становятся посто-
янными признаками такой ГТ.
Нестойкость неполноценной соединительной ткани к вторичным
некрозам объясняется не только сосудистыми изменениями и мета-
болическими расстройствами, но и дефектным фибриллогенезом. Он
проявляется образованием поперечно исчерченных филаментарных
216
Схема 4.4. Формирование патологических взаимосвязей между повреж-
дением, воспалением и регенерацией.
Прогрессирующий Незаживающие раны Хроническое
склероз и язвы, гипергрануляции воспаление
агрегатов (зебровидных телец), состоящих из коллагена VII типа и
других несовершенных форм фибрилл, нестойких к протеазам, ко-
торые продуцируются не только фибробластами, но и клетками
воспалительного инфильтрата. В связи с нарушением регуляции
созревания и инволюции ткани происходят неравномерный склероз
и гиалиноз с последующими волнами вторичного некроза и воспа-
ления, которое переходит в хроническое.
Часто присоединяются гиперергические, иммунокомплексные
реакции, проявляющиеся в фибриноидном некрозе стенок сосудов
ткани. Воспалительная реакция приобретает черты хронического
иммунного воспаления. Вследствие чередования неполноценного
склероза, повторного некроза и обострения воспаления резко из-
меняется структура ГТ: исчезают вертикальные сосуды, образуются
ячейки плотно расположенных измененных сосудов, окруженных
разрушающимися рубцовыми полями; нарушаются коррелятивные
взаимосвязи соединительной ткани и эпителия. Волнообразное
склерозирование и разрушение грануляционной и рубцовой ткани
ярко проявляются при многих инфекционных хронических воспа-
лительных процессах, трофических язвах, хронических язвах же-
лудка и др.
Во всех этих ситуациях в связи с нарушением ауторегуляторных
механизмов заживления извращаются взаимосвязи между повреж-
дением, воспалением, регенерацией и фиброзом: персистирующее
повреждение (некроз) приводит к хроническому воспалению, по-
следнее — к незавершенной регенерации (персистирующей грану-
ляционной ткани), а та в свою очередь — к прогрессирующему
склерозу, причем неполноценная грануляционная и фиброзная ткани
склонны к вторичной деструкции (схема 4.4). «Порочный круг» за-
мыкается, формируется патологическая самоподдерживающаяся си-
217
стема, выходящая в известной мере из-под регулирующего влияния
организма.
С наибольшей полнотой эта схема относится к незаживающим
дефектам, хроническому воспалению, поствоспалительным склеро-
зам органов и в меньшей мере — к склерозам органов, в которых
дистрофические изменения паренхимы превалируют над воспале-
нием и не формируются ГТ. Однако и последнее можно считать
проявлением (исходом) дисрегенерации.
Условиями развития прогрессирующего склероза можно считать:
1) диффузное повреждение паренхимы, которое приводит к разру-
шению структурно-функциональных элементов (гистионов или мик-
рорайонов) и дезинтеграции паренхиматозно-стромальногр взаимо-
действия; 2) длительное, постоянное или возобновляющееся действие
внешних или эндогенных факторов (персистирующей вирусной или
бактериальной инфекции, токсинов и др.), что приводит к перма-
нентным дистрофическим процессам, изменению микрососудов, рас-
стройству кровообращения, иногда хроническому воспалению; 3) по-
лом общих и локальных регуляторных систем; 4) врожденные или
приобретенные дефекты системы синтеза и катаболизма коллагена.
Вконечном счете нарушается ауторегуляция роста соединитель-
ной ткани, индукция пролиферации клеток и коллагеногенез начи-
нают преобладать над ингибицией, а синтез коллагена — нац его
катаболизмом, что приводит к прогрессированию склероза, завер-
шающегося структурной перестройкой органа (цирроз). Подобная
ситуация является извращением морфогенетической функции сое-
динительной ткани, которая как бы Отмежевывается от паренхимы,
действует в интересах сохранения формы органа, «жертвуя» его
функцией.
В заключение следует подчеркнуть, что, так же как адекватная
воспалительно-репаративная реакция в основном сохраняет свою
стереотипную динамику, несмотря на специфику повреждающих
факторов, разные этиологические и патогенетические механизмы
нарушения этой реакции приводят к принципиально сходным мор-
фогенетическим последствиям этого нарушения. Полом одного из
звеньев вызывает последовательные изменения всей цепи.
ГЛАВА 5
ИММУНОЛОГИЧЕСКИЕ И ИММУНОПАТОЛОГИЧЕСКИЕ
аспекты воспаления
В этой главе рассмотрен широкий круг вопросов, из которых основное
внимание уделено взаимоотношению воспаления и реакций гипер-
чувствительности, аутоиммунизации и воспаления, иммунодефицит-
ных состояний и воспаления.
О сопряжении воспаления и гиперчувствительности впервые на-
иболее определенно и ясно писал канадский патолог Н. Movat (1971).
Сопряжение воспаления и гиперчувствительности он видит в им-
мунитете, доказывая это результатами анализа мировой литературы
50—60-х годов. Однако Н. Movat далек от теоретического анализа
конкретных связей воспаления, иммунитета и гиперчувствительно-
сти. Интенсивное изучение в последние десятилетия многих разделов
общей патологии физиологами, биохимиками, морфологами и им-
мунологами позволяет наметить пути такого анализа. Уже в начале
80-х годов можно было говорить о неразрывной связи (прямой и
обратной) между воспалением и гиперчувствительностью. Об этом,
в частности, свидетельствуют материалы VII Всесоюзного съезда
патологоанатомов (1983).
5.1. ВОСПАЛЕНИЕ И ИММУНИТЕТ
Связь воспаления и гиперчувствительности можно раскрыть, исходя
из содержания воспалительной реакции. Воспаление — наиболее
древняя и сложная сосудисто-мезенхимальная реакция на повреж-
дение, направленная не только на ликвидацию повреждающего аген-
та, но и на восстановление поврежденной ткани. Этим объясняется
тесная связь воспаления как с иммунитетом (становление иммуни-
тета осуществляется «посредством воспаления», достаточно вспом-
нить постинфекционный иммунитет), так и с регенерацией (третья
фаза воспаления — репарация). Связь воспаления с иммунитетом
и регенерацией подтверждает ставшее аксиомой положение: имму-
нологический гомеостаз — это гомеостаз структурный.
Сопряжение воспаления с иммунитетом для.пепяряциц обеспе-
чивается участием всех систем защиты организма в уникальной _
реакции ~¥ерминальных сосудов и соединительной ткани, которая
^Вставляет сущность воспаления. В настоящее время считают, что
защиту организма определяют неспецифические факторы и имму-
нологическая реактивность, или иммунный ответ (табл. 5.1). Не-
смотря на принципиальное различие этих понятий, заключающееся
219
в специфичности иммунного ответа и неспецифичности неиммунных
факторов защиты, нельзя не видеть участия неспецифических фак-
торов, прежде всего фагоцитоза и комплемента, в становлении
иммунитета при воспалении [Петров Р, В., 1982],
Таблица 5.1
Неспецифические факторы защиты и иммунологическая реактивность [Петров Р. В.,
1982]
Неспецифические факторы защиты Иммунологическая реактивность (иммунный ответ)
Фагоцитоз Комплемент Интерферон Лизоцим Пропердин Гидролитические ферменты Бактерицидные субстанции тканей Непроницаемость покровов Антитела Гиперчувствительность немедленного типа Гиперчувствительность замедленного типа Иммунологическая память Иммунологическая толерантность Идиотипы-антиидиотипы Фагоцитоз Комплемент •
Место фагоцитоза, осуществляемого ПЯЛ и моноцитарным фа-
гоцитом (макрофагом), в системе иммугЛгтета определяется тем,
чтй; несмотря на неспецифичность самого акта фагоцитоза, фаго-
циты, особенно макрофаги, принимают участие в переработке их в
иммуногенную форму. Место макрофагов в системе иммунитета
определяется также участием Т- и В-лимфоцитов в кооперации,
необходимой для становления иммунного ответа, поэтому фагоцитоз
и дополняет формы реакций иммунологической реактивности. Си-
стема комплемента участвует в специфических реакциях, присое-
диняя свои компоненты к молекулам антител, что обеспечивает
лизис антигенных субстанций, против которых выработаны антитела;
она инактивирует иммунные комплексы. Из этого следует, что
комплемент как один из неспецифических факторов защиты при-
нимает участие в иммунном ответе, поэтому он, как и фагоцитоз,
дополняет формы иммунологической реактивности. Таким образом,
включение иммунного ответа при воспалении обеспечивается двумя
клеточными системами неспецифической защиты — системой ПЯЛ
и системой моноцитарных фагоцитов, а также плазменной систе-
мой — системой комплемента.
Кинетика воспалительной реакции для достижения конечной
цели — элиминации повреждающего агента и репарации ткани —
характеризуется сменой взаимоотношений клеточных систем защиты
между собой и с системой соединительной ткани, что определяется
медиаторной регуляцией. Из этого не следует, что в воспалительной
реакции участвуют лишь ПЯЛ, макрофаг, лимфоцит и фибробласт.
Клетки — носители вазоактивных аминов (лаброциты, базофилы,
тромбоциты), как и сдерживающие их функциональную активность
220
эозинофилы, имеют огромное значение для развития собственно
сосудистой реакции воспаления. Однако они не причастны в основ-
ному назначению воспалительной реакции — элиминации повреж-
дающего начала и репарации повреждения. Как цепная, в значи-
тельной мере саморегулирующаяся реакция она укладывается в
универсальную схему: повреждение — медиация — рецепция —
клеточная кооперация — клеточные «трансформации» — репарация.
Повреждение (альтерация) — обязательный компонент
воспаления. Это изначально то, на что возникает сосудисто-мезен-
химальная реакция, составляющая сущность воспаления. Можно ли
считать альтерацию фазой воспаления? Ответ на этот вопрос не
однозначен. Одни современные патологи не выделяют альтерацию
как таковую, подменяя ее нарушениями микроциркуляции и рео-
логических свойств крови [Cottier Н., 1980; Robbins S. et al., 1981 ].
А. М. Чернух в монографии «Воспаление» (1979) первой стадией
воспаления называет сосудистую, выделяя в ней две фазы. Д. С. Сар-
кисов и В. Н. Таланкин (1988) рассматривают альтерацию как не-
специфический компонент воспаления, причем не всегда обязатель-
ный (В. Н. Таланкин) для развития последующей экссудации и про-
лиферации. Иными словами, допускается возможность развития
воспаления без повреждения, причем альтерация в такой ситуации
подменяется функциональной недостаточностью полиморфно-ядер-
ных лейкоцитов. Эта позиция В. Н. Таланкина, даже условно до-
пускаемая (Д. С. Саркисов), исключает понимание воспаления как
сосудисто-мезенхимальной реакции на повреждение. Многие пато-
логи отстаивают необходимость выделения альтернативной фазы
воспаления, характеризующей инициальные процессы (дистрофия,
некроз) и выделение медиаторов [Струков А. И., 1972; Cottier Н.,
1980]. Вероятно, у патологоанатома есть для этого все основания,
так как данная фаза имеет конкретное морфологическое и биохи-
мическое выражение. Однако сохранение альтеративной фазы вос-
палительной реакции не определяет выделения альтеративной фор-
мы воспаления, при которой сама сосудисто-мезенхимальная реакция
на повреждение практйчески отсутствует. В связи с этим следует
согласиться с большинством современных патологов в том, что при-
знание альтеративного воспаления, выделяемого классической па-
тологией, противоречит сути воспалительной реакции в ее совре-
менном толковании.
Повреждение и медиаторы воспаления неразрывны,
поскольку медиаторы «рождаются» в самом повреждении, альтерации.
Как известно, принято выделять [Austen К. F. et al., 1974 ] плазменные
(циркулирующие) медиаторы, представленные калликреин-кинино-
вой системой, системой комплемента и системой свертывания крови,
а также клеточные (локальные) медиаторы, связанные со многими
клетками: лаброцитами, тромбоцитами, базофилами, ПЯЛ, макрофа-
гами, лимфоцитами и др. Однако и плазменные, и клеточные медиа-
торы тесно связаны и «работают» при воспалении как аутокаталити-
ческая система, использующая принципы «обратной связи», «дубли-
рования», «необходимого разнообразия» и «антагонизма».
221
Эти принципы системы позволяют циркулирующим медиаторам
обеспечить повышение сосудистой проницаемости и активацию хе-
мотаксиса ПЯЛ для фагоцитоза, а внутрисосудистую коагуляцию в
отводящих из очага воспаления сосудах — для отграничения воз-
будителя и самого очага воспаления (барьерная функция очага
воспаления). При этом основные этапы сосудистой реакции — по-
вышение проницаемости, активация хемотаксиса ПЯЛ и фактора
Хагемана — дублируются несколькими медиаторами (схема 5.1).
Те же принципы системы в аутокаталитической реакции клеточных
медиаторов обеспечивают не только повышение сосудистой прони-
цаемости, фагоцитоз и вторичную деструкцию, но и включение
иммунного ответа для элиминации повреждающего агента и про-
дуктов повреждения, а также репарацию ткани путем пролиферации
и дифференцировки клеток в очаге воспаления. При этом наиболее
ярко принцип дублирования выражен среди клеток — носителей
вазоактивных веществ (лаброциты, базофилы, тромбоциты), а ан-
тагонистические начала — у этих клеток и эозинофильных лейко-
цитов: медиаторы лаброцитов и базофилов стимулируют хемотаксис
эозинофилов, последние же способны инактивировать эти медиаторы
и фагоцитировать гранулы лаброцитов (схема 5.2). Таким образом,
среди клеток, несущих медиаторы сосудистой проницаемости, воз-
никает «антагонистическое равновесие», определяющее своеобразие
морфологии сосудистой фазы воспаления, особенно при аллерги е-
ских реакциях.
Клеточные медиаторы — лейкокины, монокины (интерлейкин
I), лимфокины (интерлейкин II—VI) и фиброкины — являются
локальными регуляторами кооперации клеток в очаге воспаления —
ПЯЛ, макрофага, лимфоцита и фибробласта [Серов В. В., Шехтер
А. Б., 1981]. Другими словами, они определяют последовательность
и долю участия в воспалении фагоцитарной и иммунной систем, с
оДной стороны, и системы соединительной ткани — с другой. Ди-
рижером’ ансамбля "клеточных медиаторов следует считать мойокины
макрофагов (схема 5.3). Макрофаги, поддерживаемые медиаторной
ауторегуляцией, способны управлять с помощью монокинов диффе-
ренцировкой гранулоцитов и моноцитов из стволовой клетки, а
также пролиферацией этих клеток, т. е. являются регуляторами
фагоцитоза. Макрофаги не только влияют на функциональную ак-
тивность Т- гПЗ^лимфоцитов, "принимают участие'вих кооперации,
но ^секретируют 6 первых компонентов комплемента, т, е. являются
Посредниками привлечения иммунной системы в воспалительную
(\ дгеакцгПО. Макрофаги индуцируют рост фибробластов и синтез кол^
I лагена, являясь стимуляторами завершающей фазы репаративной
реакции при воспалении. Вместе с тем сами макрофаги испытывают
/ регуляторное влияние лимфокинов и фиброкинов, т. е. в локальной
/ клеточной регуляции теснейшим образом связаны с лимфоцитом и
[ фибробластом [Серов В. В., Шехтер А. Б., 1981; Маянский А. Н-.
Маянский Д. Н., 1983].
Клеточная рецепция играет очень важную роль в локаль-
ной клеточной регуляции при воспалении. С нею связано привле-
222
Схема 5.1. Взаимосвязь медиаторов плазменного происхождения.
Обратная связь
Дублирование
Г--------- Кинины-------------
С' Калликреины-----------»•
___Фактор XII-----------*
Плазмин------------->-
---* СЗ, С5---------------*"
Повышение сосудистой проницаемости
Активация хемотаксиса ПЯЛ и фактора ХИ
Активация кининовой системы
Повышение сосудистой проницаемости
Повышение сосудистой проницаемости
Активация хемотаксиса ПЯЛ и фактора XII,
стимуляция фагоцитоза и др.
Схема 5.2. Взаимосвязь медиаторов клеточного
телей вазоактивных аминов.
происхождения — носи-
Антагонизм
Дублирование
—Лаброциты,
базофилы:
гистамин,
серотонин,
SRS-A
лейкотриены
ECF-A ---------
PAF --------
Тромбоциты:
серотонин,
гистамин
Лизосомные ферменты *
Повышение сосудистой
проницаемости
Хемотаксис эозинофилов
Агрегация тробоцитов
Повышение сосудистой
проницаемости
Эозинофильные
лейкоциты
Ингибиция медиации лаброцитов и базофиле
Лизосомные ферменты
Фагоцитоз гранул лаброцитов
чение в очаг воспаления компонентов иммунных реакций, так как
У всех эффекторных клеток воспаления обнаружены Fc-рецепторы
иммуноглобулинов и С-рецепторы комплемента. В связи с этим
становятся понятны неразрывная связь и неравнозначное во времени
сопряжение фагоцитарной системы, иммунной системы и системы
Соединительной ткани в реализации конечной цели воспалительной
Реакции (схема 5.4).
223
Схема 5.3. Монокины и кооперация клеток при воспалении.
Комплемент
ПЯЛ
Регуляция дифференцировки
гранулоцитов из стволовой
клетки
Стимуляция миграции
гранулоцитов
Ингибиция миграции гранулоцитов
Моноцитарные фагоциты
Регуляция дифференцировки
моноцитов из стволовой клетки
Ингибиция пролиферации
моноцитов
Активация роста макрофагов
Секреция Clq - Cg
Макрофаги-
монокины
(ИЛ-1)
----- Лимфоциты-лимфокины (ИЛ-2)
Активация Т-лимфоцитов
Ингибиция трансформации
Т-лимфоцитов
Активация В-лимфоцитов
Кооперация Т- и В-лимфоцитов
----- Фибробласты — фиброкины
Индукция роста фибробластов
____ Индукция синтеза коллагена
Схема 5.4. Межклеточное взаимодействие при воспалении.
Варианты этого сопряжения, зависящие от особенностей как
повреждающего агента, так и организма, органа, ткани, реагирую-
щих на повреждение, должны, вероятнее всего, определять развитие
той. или иной формы воспаления. Так, гнойное воспаление, по-ви-
димому, отражает особую форму сопряжения функционально несо-
стоятельной системы ПЯЛ с макрофагами, ^огда^макрофаги, уси-
ленно фагоцитирующие распаляющиеся ПЯЛ, становятся устойчи-
выми к возбудителю. В. Е. Пигаревскии’ (1978), изучающий это
особое взаимоотношение двух систем фагоцитоза, называет его ре-
зорбтивной клеточной резистенцией. Как видно, оно отражает вто-
ричную несостоятельность фагоцитарной функции макрофагов при
первичной несостоятельности фагоцитоза ПЯЛ. Первичная и изби-
рательная несостоятельность системы моноцитарных фагоцитов, раз-
общение ее с системой ПЯЛ лежат в основе гранулематозного
воспаления. Фагоцитарная недостаточность макрофагов определяет
224
образование из них эпителиоидных и гигантских клеток, теряющих
фагоцитарные функции [Струков А. И., Кауфман О. Я., 1989;
Adams S. О., 1976]. Фагоцитоз подменяется отграничением, перси-
стенцией возбудителя. В связи с незавершенным фагоцитозом сга-
новится незавершеннойГи несовершенной сама воспалительная ре-
акция' (ЗпаТлужит выражением реакции гиперчувртвительности
замедленного типа.
Очевидно также, что из-за наследственных дефектов каждой из
систем защиты, как и систем соединительной ткани, довольно часто
воспалительная реакция также дефектна как по форме ее проявления
и течению, так и по возможности реализации конечной цели. До-
статочно вспомнить наследственную недостаточность бактерицидных
систем ПЯЛ и моноцитов, наиболее ярко выраженную при хрони-
ческой гранулематозной болезни детей, наследственные и врожден-
ные иммунные дефициты и фатальность развивающейся при них
гнойной инфекции, врожденную несостоятельность соединительной
ткани и упорство хронического воспаления. Нельзя не упомянуть
и о наследственных ^дефицитах системы комплемента, особенно ее
СЗ- и С5-компонентов, проявляющихся либо рецидивирующей гной-
ной инфекцией, либо волчаночноподобным синдромом. При воспа-
лении, особенно вызываемым бактериальными агентами, появляются
как циркулирующие в крови, так и локальные гетерологичные
иммунные комплексы, при хроническом течении воспаления они
могут быть и аутологичными. Так при воспалении «рождаются»
иммунокомплексные реакции — наиболее часто встречающиеся из
реакций гиперчувствительности немедленного типа.
5.2. РЕАКЦИИ ГИИЕРЧУВСТВИТЕЛЬНОСТИ
И ВОСПАЛЕНИЕ
Не меньший интерес представляет связь иммунных реакций в сен-
сибилизированном организме с воспалением, или, иначе, tгиперчув-
ствительности и воспаления. Эта связь известна давно, со времени
формирования С. F. Pirquet и В. Schick (1905) понятия «аллергия».
С. F. Pirquet предложил выделять немедленную (ускоренную) и за-
медленную (растянутую) формы аллергических реакций. Однако
лишь после работ R. Rossie (1914) и А. И. Абрикосова (1933, 1963)
стала понятна гиперергическая сущность аллергического воспаления.
Однако потребовалось несколько десятков лет поисков и находок
иммунологов и морфологов, для того чтобы показать, что в основе
немедленной и замедленной аллергии лежат иммунопатологические
реакции, представленные своеобразным воспалением, которое не
без оснований стали называть иммунным [Струков А. И., 1979;
Струков А. И. и др., 1982].
Иммунное воспаление — это сосудисто-мезенхимальная реакция
на иммунное повреждение, на иммунную альтерацию. Из этого
следует, что альтерация иммунного воспаления в подавляющем
большинстве случаев специфична, а сама реакция на иммунное
8—407
225
Таблица 5.2
Классификация реакций гиперчувствительности
Типы иммунопатологических механизмов
по Р. Gell и R.' Coombs (1968) по S. Sell (1975) по О. Giinther (1977)
Тип I Анафилаксия Атопия Атопический Анафилактический
Тип II Цитотоксичность, цитолиз Инактивация, нейтрализация Цитотоксический Цитолитический
Тип III Реакция Артюса, образование токси- ческих комплексов Токсический им- мунокомплексный, феномен Артюса
Тип IV ГЗТ: клеточные реакции гранулематоз Поздняя реакция туберкулинового ти- па
Первичные специфические иммунологи- ческие реакции Вторичные неспецифические реакции, приводящие к по- вреждению тканей и клеток
антитело, эффек- торные клетки антиген
IgE (реагины) на лаброцитах и базо- филах IgGij,, Ig.M, IgG IgGuj Антитело (IgG) против ферментов, гормонов, факт°Р°в свертывания Антитело (IgG) в крови, комплексах, стенке сосудов Сенсибилизирован- ные Т-лимфоциты, кооперация Т- и В- клеток Сенсибилизирован- ные Т-лимфоциты В тканях, на сли- зистых оболочках, в крови Клеточный и тка- невый (структурный) или тесно сцеплен- ный с клетками и тканями На мембранах клеток Биологически ак- тивные молекулы, клеточные рецепторы В крови, комплек- сах, стенке сосудов Тканевый, клет- ки-мишени Дегрануляция лаброцитов и базофилов, высвобождение меди- аторов Активация системы компле- мента, клеточная цитотоксич- ность, опосредованная антитела- ми (К- и NK-клетки), макрофаги Активация системы компле- мента, лизис клеток Потеря биологически актив- ных молекул, блокада или акти- вация рецепторов Активация системы компле- мента, клеток—носителей меди- аторов при взаимодействии им- мунных комплексов с Ig-рецепто- рами; высвобождение биологически активных веществ Высвобождение лимфокинов, активация макрофагов, лаброци- тов, базофилов'
повреждение неспецифична, поэтому А. И. Струков (1979) разли-
чает специфическую, иммунную, и неспецифическую, собственно
воспалительную, фазы иммунного воспаления. Он считает, что,
помимо этого, для иммунного воспаления характерны и другие
общепатологические признаки: 1) развивается в сенсибилизирован-
ном организме (тканях) и отличается от обычного воспаления как
количественными, так и качественными параметрами; 2) возникает
на основе определенных иммунопатологических механизмов; 3) раз-
вивается в результате взаимодействия гуморальных и клеточных
механизмов' (факторов), причем по ходу иммунного воспаления
может происходить смена этого взаимодействия, что отражается на
его морфологической картине; 4) имеет склонность к «самовоспро-
изведению» и’непрерывному течению с чередованием периодов за-
тихания и обострения воспаления.
Важно особо отметить, что характер иммунного воспаления, т. е.
морфологии реакций гиперчувствительности, полностью зависит от
особенностей иммунопатологического механизма [Серов В. В., 1983].
Механизмы реакций гиперчувствительности неоднозначны, что вид-
но из классификации, предложенной Р. Gell и R. Coombs (1968),
которая с дополнениями S. Sell (1975) и О. Gunther (1977) считается
наиболее приемлемой (табл. 5.2). При этом цитотоксические и
цитолитические реакции и реакции токсических иммунных комп-
лексов (типы 11 и III) лежат в основе ГНТ. Близки ГНТ анафи-
лактические немедленные реакции (тип I); особое место занимают
выделенные S. Sell (1975) реакции инактивации и нейтрализации.
Гранулематоз рассматривают как особую форму ГЗТ.
При анализе каждой из реакций гиперчувствительности необхо-
димо учитывать не только пусковой иммунопатологический меха-
низм, но и вторичную реакцию, приводящую к.повреждению клеток
и тканей [Серов В. В., 1983].
5.2.1. Анафилактические реакции
При анафилактических немедленных реакциях, в
основе которых лежит взаимодействие антигена с IgE лаброцитов
и базофилов, вторичные реакции, составляющие сущность аллерги-
ческого воспаления, определяются особенностями действия медиа-
торов, высвобождающихся из эффекторных клеток при реакции
антиген — антитело (схема 5.5). Преобладают сосудисто-экссуда-
тивные изменения: тучноклеточную реакцию с выявлением на по-
верхности лаброцитов IgE сменяет эозинофильный инфильтрат; аль-
терация поверхностная, что можно объяснить отсутствием компле-
мента в реагинзависимых реакциях. <
Немедленная анафилаксия характерна для ряда аллергических
заболеваний, классическим примером которых является бронхиаль- I
чая астма. Во время ее приступа в стенке бронха (бронхобиоптат)
Развиваются выраженное полнокровие сосудов микроциркуляции,
плазморрагия, отек слизистой оболочки и подслизистого слоя, ин-
8* 227 ’,
Схема 5.5. Анафилактические немедленные реакции.
Гистамин. Повышение сосудистой
Серотонин— проницаемости, спазм
। гладкой мышечной ткани
SRS-A 1
рдр —— Агрегация тромбоцитов
Протеазы-»- ПОВЕРХНОСТНАЯ
альтерация
ЕСЕ-А -— Хемотаксис Эозинофилов
фильтрация их в основном лаброцитами и эозинофилами, лимфо-
цитами и плазматическими клетками. Базальная мембрана эпителия
набухает и утолщается. Эпителий (в нем много бокаловидных кле-
ток) и слизистые железы продуцируют слизь, которая скапливается
в просвете бронхов. На поверхности клеток инфильтрата и базальной
мембране выявляют IgE (рис. 5.1).
В начале 80-х годов, помимо немедленной анафилаксии, выделена
поздняя фаза IgE-зависимой реакции, которая развивается через
2—4 ч после введения антигена и разрешается через 24 ч [Askenase
Р. W., 1980; Altman L. G., 1981 ]. Для нее характерны смешанный
клеточный инфильтрат, включая лимфоциты, наличие фибрина.
Выделение этой фазы свидетельствует о наличии среди IgE-зави-
симых реакций не только ГНТ, но и ГЗТ, которую рассматривают
как* феномен нарушения механизма Т-супрессии, поддерживающей
в норме низкий уровень IgE в организме [Katz D. Н., 1978].
Рис. 5.1. Аллергическое воспаление при бронхиальной астме. Тучнокле-
точная реакция (бйоптат бронха, начало приступа), на поверхности
лаброцитов IgE. Иммунолюминесценция, х 170.
228
5.2.2. Цитотоксические реакции
Цитотоксические реакции неоднородны и могут быть опосредованы
либо комплементом, либо антителами. Опосредованная ком-
плементом цитотоксичность, возникающая при взаимо-
действии антител со структурным антигеном клеток и тканей, хо-
рошо изучена. Активация системы комплемента приводит к ряду
иммунологических феноменов, завершающихся альтерацией — ли-
зисом клеток. Иммунное прилипание, хемотаксис и анафилактиче-
ская активность, закрепленные за определенными активированными
компонентами комплемента, готовят лизис клеток-мишеней с по-
мощью активации фагоцитоза, эк; оцитоза гранул нейтрофилов, вы-
деления ферментов и биологически активных веществ эффекторными
клетками, устремляющимися к месту иммунной реакции. Те же
активированные компоненты комплемента обеспечивают не только
костномозговой ответ нейтрофилов, но и активацию макрофагов с
регургитацией лизосомных ферментов и протеолизом.
Опосредованная комплементом цитотоксичность вызывает тяже-
лую клеточную и тканевую деструкцию, что и определяет своеоб-
разие морфологии этого вида реакции гиперчувствительности.
Достаточно вспомнить, например, изменения эритроцитов при ауто-
иммунной гемолитической анемии, легких и почек при пневморе-
нальном синдроме Гудпасчера, особенно морфологию характерного
для этого синдрома экстракапиллярного продуктивного гломеруло-
нефрита с деструкцией базальных мембран капилляров, внутри- и
внекапиллярным фибрином.
Цитотоксичность, опосредованная антителами,
связана с К- и NK-клетками. Она не требует комплемента. Как
известно, К-клетки,.представляющие собой гетерогенную популяцию
(В- и Т-лимфоциты, нулевые клетки, макрофаги), объединяет спо-
собность лизировать покрытые антителами кдетки-мишени (схема
5.6). Эта способность К-клеток проявляется в их реакции со спе-
цифическими IgG, фиксированным на клетке-мишени [Лесков В. П.
и др., 1981; Albini В. et al., 1979]. Механизм цитолиза изучен
недостаточно. N К-клетки — разновидность клеток-киллеров (есте-
ственные, нормальные киллеры), несущих Fc-рецепторы. Цитоток-
сический эффект может наблюдаться при фиксации специфического
IgG на NK-клетках через Fc-рецептор (схема 5.7), что приводит к
выделению факторов, осуществляющих лизис клетки [Лесков В. П.
и др., 1981 ].
Нетрудно заметить, что К- и NK-клетки, осуществляющие кле-
точную цитотоксичность с помощью антител, связывают цитоток-
сические и цитолитические реакции гиперчувствительности (II тип)
с цитопатогенным действием сенсибилизированных лимфоцитов.
Речь идет о клеточной цитотоксичности, обусловленной Т-киллерами
(Т-эффекторами), об основном проявлении реакции ГЗТ (IV тип).
Различие лишь в том, что Т-киллеры выполняют литическую фун-
кцию в отношении клеток-мишеней с помощью собственного ре-
цепторного аппарата, не нуждаясь ни в антителах, ни в комплементе,
229
Схема 5.6. Цитотоксичность, опосредованная антителами и комплементом
а лишь в кооперации с макрофагом (см. схему 5.7). Взаимоотношения
Т-эффектора и макрофага в реакции ГЗТ чрезвычайно сложны и
опосредованы многими факторами, прежде всего медиаторами ГЗТ,
но важно одно: макрофаг — активный помощник в лизисе клетки-
мишени лимфоцитом. Цитолиз, связанный с Т-киллерами, имеет
достаточно характерное как светооптическое, так и электронно-мик-
роскопическое выражение. Возможны два вида взаимодействия Т-
киллера с клеткой-мишенью: для одного из них требуется участие
лимфотоксина, для другого — прямые контакты плазматических
мембран киллеров и клеток-мишеней, что обусловлено вовлечением
различных субпопуляций Т-клеток. Макрофаги, как и Т-киллеры,
способны оказывать специфическое действие на клетки-мишени.
Клеточный цитолиз широко представлен в клинической патоло-
гии. Это прежде всего контактный аллергический дерматит (кон-
Схема 5.7. Клеточный цитолиз.
Т-хелпер Т-супрессор Макрофаг
230
тактная гиперчувствительность), синдром и болезнь Шегрена, ряд
инфекционных, особенно вирусных, заболеваний, классическим при-
мером которых может служить вирусный гепатит В (острый и
хронический активный). Гепатоциты, содержащие антигены вируса
гепатита В (HBsAg, HBcAg и др.), становятся клетками-мишенями
для киллеров и макрофагов, что приводит к возникновению очагов
некроза печеночной паренхимы (лобулярные, мостовидные, ступен-
чатые некрозы — рис. 5.2), которые составляют клиническую и
морфологическую сущность этого заболевания.
Цитотоксическим реакциям близки реакции инактивации
и нейтрализации [SellS., 1975, 1978], в основе которых лежит
воздействие антител на биологически активные молекулы фермен-
тов, гормонов, факторов свертывания, а главное, на рецепторы
клеток, что приводит к их инактивации (нейтрали ации) без по-
вреждения клеток и тканей. Заболевания, при которых рецепторы
клеток становятся мишенью для аутоантител (инактивация, реже
стимуляция рецепторов), выделены в особую группу «антительные
болезни рецепторов» [Flier J., 1982]. Примером таких заболеваний
с антительной инактивацией рецепторов могут служить: 1) инсу-
линрезистентный сахарный диабет, при котором антитела против
клеточных рецепторов к инсулину блокируют эти рецепторы и не
позволяют клетке отвечать на инсулиновый сигнал; 2) миастения,
в развитии которой участвуют антитела к ацетилхолиновым рецеп-
торам нервно-мышечной пластинки. Выявление болезней, при ко-
торых рецепторы клеток становятся мишенью иммунных реакций, —
перспективная и важная задача, решение которой позволит уточнить
патогенез и сущность многих забол ваний 3) тиреотоксикоз, при
котором происходит стимуляция специфических рецепторов; 4) ва-
рианты гиперпаратиреоза (см. 5.3.2).
5.2.3. Иммунокомплексные реакции
Реакции гиперчувствительности, обусловленные воздействием ток-
сических иммунных комплексов, или иммунокомплексные
реакции (III тип), заслуживают особого внимания по многим
причинам. Во-первых, они лежат в основе патогенеза многих бо-
лезней и синдромов, что послужило основанием для выделения
группы иммунокомплексных болезней [Dixon F. J., 1973;
Cochrane С. G., Koffler D., 1973; Leber P. D., McCluskey R. T.,
1974]. Во-вторых, сложны условия реализации иммунокомплексных
реакций. Среди них наиболее важными считают: I) качественные
особенности иммунных комплексов, зависящие от свойств антигенов
и генетически детерминированного своеобразия иммунного ответа;
2) снижение функциональной активности системы моноцитарных
фагоцитов, элиминирующей иммунные комплексы (врожденная не-
достаточность этой системы или конкурентная блокада клеточных
Рецепторов в связи с гиперпродукцией иммунных комплексов, син-
тезом гуморальные ингибиторов фагоцитоза, воздействием лекарст-
231
Рис. 5.2. Реакция ГЗТ при вирусном хроническом активном гепатите
(биоптат желудка).
з — лимфоцитарно-макрофагальный инфильтрат разрушает железистые структуры, х 500; о
HBsAg в клетках желез. Иммунолюминесценция. х 170; в — киллерный эффект Т-лимфоцитов
в отношении клеток желез, х 10 000.
венных препаратов) [Серия тех-
нических докладов ВОЗ № 606:
«Роль иммунных комплексов при
заболеваниях», Женева, 1978 ].
Элиминация иммунных комплек-
сов из циркуляторного русла,
осуществляемая моноцитарными
фагоцитами печени и селезенки,
опосредована клеточной рецеп-
цией (Fc-фрагмент IgG и СЗЬ-
компонент комплемента). При
этом фагоцитоз комплексов, со-
держащих IgM и СЗЬ, осуществ-
ляется преимущественно звездча-
тыми эндотелиоцитами печени,
имеющими рецепторы к этим
компонентам комплексов; элими-
нация эритроцитов, нагруженных
'IgG, происходит в синусоидах се-
лезенки с помощью моноцитар-
ных клеток, содержащих рецеп-
торы К этому иммуногяобупину. В
возможность дефекта элиминации
Схема 5.8. Иммунокомплексная
реакция.
Иммунный комплекс
Антитело
Антиген
Активация кининовой и
свертывающей систем крови
I
Внутрисосудистая коагуляция
связи с этим становится понятна
иммунных комплексов в системе
моноцитарных фагоцитов как селезенки, так и печени, что опре-
деляет особенности иммунокомплексного процесса.
Большое значение имели исследования, в которых было установ-
лено, что иммунные комплексы могут вызывать разные иммунопато-
логические эффекты: индукцию ГНТ (наиболее частый эффект), ин-
дукцию ГЗТ, блокаду иммунологических механизмов. Индукция ре-
акций ГНТ, характеризующаяся картиной острого иммунного
воспаления, может осуществляться двумя путями [Струков А. И.,
Грицман А. Ю., 1978; Sell S., 1978]. Первый путь — включение сис-
темы комплемента, активированные компоненты которого взаимодей-
ствуют с клетками-носителями медиаторов (схема 5.8). Как видно из
схемы, активированные компоненты комплемента определяют хемо-
таксис ПЯЛ, фагоцитоз и выброс медиаторов, выделение лизосомных
протеаз и повреждение мембран сосудов, активацию кининовой сис-
темы и фактора Хагемана, что завершается внутрисосудистой коагу-
ляцией. Индукция ГНТ иммунными комплексами также может осу-
ществляться, минуя систему комплемента, благодаря взаимодействию
Fc-фрагмента иммуноглобулинов, входящих в иммунный комплекс, с
рецепторами клеток-носителей медиаторов (второй путь). Таким об-
разом, иммунные комплексы, как содержащие, так и не содержащие
комплемент, способны индуцировать острое иммунное воспаление, для
которого характерны резкое повышение сосудистой проницаемости,
инфильтрация ПЯЛ, повреждение сосудистой стенки вплоть до ее фиб-
риноидного некроза, выпадение фибрина, образование тромбов. Есте-
ственно, что при индукции ГНТ по второму пути лейкоцитарная ин-
фильтрация выражена меньше.
233
Возможность индукции иммунными комплексами реакций ГЗТ,
проявляющихся иммунным цитолизом, определяется наличием на
поверхности Т-лимфоцитов-киллеров рецепторов для Fc-фрагмента
IgG, что приводит к активации киллерного механизма и развитию
специфического иммунного цитолиза. При этом взаимодействие ак-
тивированных иммунным комплексом Т-киллеров с клетками-ми-
шенями сопровождается выделением медиаторов клеточного имму-
нитета — лимфокинов, необходимых прежде всего для привлечения
и активации макрофагов, которые, как и Т-киллеры, оказывают
спецйфическое цитолитическое действие на клетки-мишени.
Блокаду иммунологических механизмов иммуными комплексами
объясняют воздействием ряда факторов. Считают, например, что
иммунные комплексы могут стимулировать Т-супрессоры [Фонта-
лин Л. Н., Певницкий Л. А., 1978 ], которые имеют рецепторы не
только для Fc-фрагмента IgG и IgM, но и для СЗ. Установлено,
что активность как Т-, так и В-лимфоцитов, имеющих Fc-рецепторы
для иммуноглобулинов, при взаимодействии с этими рецепторами
антител иммунного комплекса может быть изменена. В определенных
ситуациях иммунные комплексы причастны к угнетению Т-лимфо-
цитов-хелперов.
В связи с разнообразием иммунопатологических реакций, инду-
цируемых иммунными комплексами, встает вопрос об условиях,
которые определяют преобладание той или иной из них, и прежде
всего реакции ГНТ или ГЗТ, хотя, естественно, понятна и возможная
смена этих реакций в ходе заболевания. Основным условием следует
считать особенности самого иммунного комплекса, прежде всего в
отношении наличия в нем комплемента; особенности антигена и
антител иммунного комплекса; количественные соотношения им-
мунного комплекса с антигеном (при избытке антигена — обычно
ГНТ, при избытке антител — чаще ГЗТ); длительность антигенной
стимуляции, т. е. персистенции иммунных комплексов.
Не меньший интерес представляет вопрос об избирательности
иммунокомплексного повреждения, т. е. об условиях, определяющих
преимущественную локализацию реакций гиперчувствительности.
Среди этих условий можно выделить три главных. Первое — размеры
иммунных комплексов, от которых зависит возможность проникно-
вения в ткани. Установлено, что развитие наиболее типичных про-
явлений ИКБ, например васкулита, связано с мелкими (менее 15 S)
и так называемыми промежуточными (15 S — 19 S) иммунны и
комплексами, которые по сравнению с крупными (20 S и более)
хуже элиминируются моноцитарными макрофагами, более длительно
циркулируют в кровотоке и имеют тенденцию откладываться в
различных тканях. Второе условие — локализующие свойства ан-
тигена иммунного комплекса [Kaplan М. Н., 1963]. Речь идет об
аффинитете антигена иммунного комплекса к тканевому антигену
(например, о высоком аффинитете ДНК циркулирующего иммунного
комплекса к базальной мембране капилляров почечных клубочков
при системной красной волчанке) либо о перекрестно реагирующих
антигенах (например, о кардиопатогенном 5-м типе и нефритогенном
234
12-м типе /J-гемолитического стрептококка А). Третье условие —
наличие у клеток тканевых структур специфических рецепторов
для компонентов иммунного комплекса, прежде всего для Fc-фраг-
мента IgG и СЗ-компонента комплемента [Williams R. S., 1980].
Такие рецепторы обнаружены у подоцитов и мезангиоцитов почеч-
ных клубочков, клеток синовиальной оболочки, нефроцитов и клеток
почечного интерстиция, эндотелия сосудов, клеток церебрального
сосудистого сплетения. Значение клеточной рецепции в избиратель-
ной локализации иммунных комплексов дополняется ролью местных
факторов, ведущих к повышению сосудистой проницаемости [Су-
ра В. В. и др., 1980].
Как уже отмечалось выше, иммунокомплексные реакции состав-
ляют основу группы заболеваний, получивших название «иммуно-
комплексны болезни». Понятие «иммунокомплексная болезнь» по-
явилось в медицине недавно, хотя ее аналог — сывороточная бо-
лезнь — известен с 1905 г. благодаря работам С. F. Pirquet и
В. Schick. Считают, что впервые в 1974 г. Р. D. Leber и
R. Т. McCluskey сочли возможным назвать болезнью иммунного
комплекса (правильнее иммунокомплексной болезнью — ИКБ) груп-
пу заболеваний, развитие которых связано с циркулирующими им-
мунными комплексами антиген — антитело. Однако ранее о болезни
иммунного комплекса писали С. G. Cochrane и D. Koffler (1973),
F. J. Dixon (1973).
Иммунокомплексная болезнь как общебиологическая категория
широко представлена современной нозологией. Количество болезней
как неинфекционной, так и инфекционной природы у взрослых и
детей, развитие которых связывают с циркулирующим иммунным
комплексом, достаточно велико и с каждым годом увеличивается.
Это ревматоидный артрит, смешанная криоглобулинемия, системная
красная волчанка, гломерулонефрит и тубулоинтерстициальный
нефтрит, тромбоцитопеническая пурпура (Шенлейна—Геноха), си-
стемные васкулиты, болезнь Рейно, легочный геморрагический син-
дром типа Гудпасчера, синовиты, серозиты, синдром (болезнь) Шег-
рена, герпетиформный дерматит, большая группа инфекционных
болезней, в частности инфекционный эндокардит, лимфопролифе-
ративные заболевания, некоторые виды анемий, параонкологические
заболевания, осложнения трансплантации почек.
В связи с тем что особенности иммунопатологического процесса
и его преимущественная локализация определяются прежде всего
характером антигена иммунного комплекса и его самого, этот при-
знак следует считать главным и наиболее удобным при системати-
зации иммунокомплексных болезней. Помимо характера антигена
иммунного комплекса, следует учитывать и его источник (эндоген-
ные, экзогенные, неустановленные антигены).
В классификационной схеме иммунокомплексных болезней сре-
ди эндогенных антигенов различают следующие (табл. 5.3): 1)
Ig-антигены, с которыми связано развитие^ ревматоидного артрита.
Ряда проявлений смешанной криглобулинемии, гипергаммаглобу-
линемии; 2) ядерные антигены, характерные для иммунных ком-
235
плексов при системной красной волчанке; 3) специфические кле-
точные (тканевые) антигены, причастные к развитию «вторых»,
в том числе параонкологических, заболеваний, аутоиммунных рас-
стройств.
Группа экзогенных антигенов, с которыми связано развитие им-
мунокомплексных болезней, особенно велика. Она включает ятро-
генные антигены (сывороточная болезнь, лекарственная аллергия);
антигены окружающей среды (аллергический альвеолит, герпети-
формный дерматит); антигены вирусов (вирусный гепатит, гемор-
рагическая лихорадка денге); антигены бактерий (постстрептокок-
ковый гломерулонефрит, бактериальный эндокардит, лепра, менин-
гококковая инфекция и др.); антигены простейших (малярия,
трипанос моз); антигены гельминтов (шистосомоз, онкоцеркоз, аль-
веококкоз). Помимо этого, существует группа иммунокомплексных
заболеваний с неустановленным антигеном, к которым можно от-
нести хронический гломерулонефрит, первичные васкулиты, сухой
синдром и др.
Таблица 5.3
Классификация иммунокомплексных болезней
Антигены иммунного комплекса Заболевания, синдромы, реакции
источник характер
Эндогенные Ig-антигеиы Ядерные Специфические клеточные (тканевые) Ревматоидный артрит, проявления сме- шанной криоглобулинемии, гипергаммаг- лобулинемия Системная красная волчанка «Вторые» болезни, параонкологические синдромы, аутоиммунные реакции
Экзогенные Ятрогенные Антигены окружаю- щей среды Антигены вирусов Антигены бактерий Антигены простей- ших Антигены гельмин- тов Сывороточная болезнь, лекарственная аллергия Аллергический альвеолит, герпетифор- мный дерматит Вирусный гепатит, геморрагическая ли- хорадка денге Стрептококковый гломерулонефрит, бактериальный эндокардит, лепра, менин- гококковая инфекция Малярия, трипаносомоз Онкоцеркоз, альвеококкоз, шистосомоз
Неустановлен- ные — Хронический гломерулонефрит, пер- вичные васкулиты, сухой синдром (бо- лезнь) Шегрена
Следует коротко остановиться на некоторых иммунокомплексных
болезнях, с тем чтобы показать их морфологические и морфогене-
тические различия в зависимости от особенностей антигена и им-
мунного комплекса.
236
Особенность ревматоидного артрита, одного из наиболее ярких
представителей группы иммунокомплексных болезней, связанной с
lg-антигенами, состоит в том, что иммунные комплексы из молекул
IgG и молекулы анти-IgG (IgM или IgG) не только циркулируют
в крови, но и накапливаются в синовиальной жидкости. Потому-то
при ревматоидном артрите возникают как висцеральные, так и
внутрисуставные иммунокомплексные повреждения. Первые пред-
ставлены васкулитом, плевритом, перикардитом, вторые — синови-
том и деструкцией хряща, при этом синовиальная оболочка в ответ
на местную аутоагрессию иммунных комплексов становится «им-
мунокомпетентным органом» [Струков А. И., Грицман А. Ю., 1978].
Ярким примером «второй» болезни, возникающей в связи с цир-
куляцией иммунных комплексов, которые содержат специфические
клеточные (тканевые) антигены, является гломерулонефрит. Он мо-
жет возникать при многих опухолях и связан в таких случаях с
циркуляцией иммунных комплексов, в состав которых входит опу-
холевый или карциноэмбриональный антиген. Такой гломерулонеф-
рит, обычно мембранозный с выраженным нефротическим синдро-
мом, будучи «второй» болезнью, становится первым проявлением
опухоли. Недавно был раскрыт патогенез гломерулонефрита при
алкогольных поражениях печени. Иммунокомплексный механизм
развития этого нефрита связан с синтезом гепатоцитами особого
белка — алкогольного гиалина. Доказаны антигенная природа ал-
когольного гиалина (специфический тканевый антиген), возмож-
ность циркуляции в крови антигена алкогольного гиалина (AHAg)
и антител к нему (АНАЬ) в разгар алкогольного поражения печени.
В связи с циркуляцией иммунного комплекса развивается мезангио-
пролиферативный гломерулонефрит, при этом в гломерулярном
фильтре почек обнаруживают как AHAg, так и AhAb [Серов В. В.,
Лапиш К., 1989].
Иммунокомплексный гломерулонефрит можно считать своеоб-
разной моделью «болезни иммунного комплекса», так как гломеру-
лярный фильтр почек выступает в роли не только «механической
ловушки», но и «ловушки специфической рецепции» иммунного
комплекса [Серов В. В. и др., 1979], поскольку гломерулярные
клетки (мезангиальные и подоциты) имеют на своей поверхности
рецепторы для СЗ-компонента комплемента и Fc-фрагмента IgG и
IgM. Своеобразие этой модели состоит в том, что она позволяет
изучать и общепатологические закономерности реакции на иммун-
ный комплекс, и морфогенез гломерулонефрита иммунокомплекс-
ного генеза, развитие которого может быть связано как с эндоген-
ными (рис. 5.3) и экзогенными антигенами, так и с циркулирующими
иммунными комплексами, антиген которых не установлен.
С позиций ИКБ заслуживает внимания и оценка системных
васкулитов. Для большинства из них доказан иммунокомплексный
механизм [Ярыгин Н. Е. и др., 1980], хотя антиген иммунного
комплекса по-прежнему неизвестен. В зависимости от преобладания
того или иного вида гиперчувствительности различают три группы
системных васкулитов: 1) васкулиты преимущественно реакции
237
Рис. 5.3. Иммунокомплексный волчаночный нефрит (биоптат почки).
а —г участки фибриноидного некроза капиллярных петель кл^^бочка с разрушением базальных
мембран. Импрегнация серебром полутонкого среза. * 200; б — комковатый и линейным
характер свечения IgG иммунных комплексов в клубочке. Иммунолюминесцеиция. * 180.
ГНТ — деструктивные васкулиты, некротические артерииты: узел-
ковый периартериит, аллергический гранулематоз, системный не-
кротизирующий васкулит, гранулематоз Вегенера, лимфатический
синдром-с—поражением кожи и слизистых оболочек; 2) васкулиты
преимущественно реакции 13’1 — продуктивные васкулиты, грану-
лематозные артерииты: неспецифический аортоартериит (болезнь
Такаясу) и височный артериит (болезнь Хортона). Характерно, что
и при продуктивных системных васкулитах, например болезни Хор-
тона, при иммуногистохимическом исследовании можно обнаружить
компоненты иммунного комплекса. Естественно, что «уложить» си-
стемные васкулиты в эти две крайние группы нельзя; 3) васкулиты
реакций гиперчувствительности смешанного типа, существование
которых необходимо учитывать при оценке морфологических изме-
нений переходных форм системных васкулитов.
Приведенные примеры не исчерпывают клинико-морфологиче-
ского разнообразия иммунокомплексных болезней.
Анализ сопряжения гиперчувствительности и воспаления позво-
ляет заключить: без глубокого знания сущности той или иной
реакции гиперчувствительности нельзя понять специфики ее мор-
фологических признаков, т. е. формы иммунного воспаления, и осо-
бенностей клинических проявлений, или характера аллергии.
5.2.4. Гранулематоз
Гранулематоз, как уже отмечалось, отражает несостоятельность си-
стемы моноцитарных фагоцитов. Главным условием его развития
является стойкость раздражителя (возбудителя) по отношению к
макрофагам, поэтому они вынуждены не только локально размно-
жаться, но и искать новые формы в виде эпителиоидных и гигантских
клеток, фагоцитарная активность которых не возрастает, а, наоборот,
Снижается. Это и определяет ni рсистенцию раздражителя (возбу-
дителя) в клетках гранулемы, фагоцитоз сменяется эндоцитобиозом,
гранулема становится выражением ГЗТ. S. Sell (1978) рассматривает
гранулематоз как особую форму аллергии, связанную с ГЗТ.
Гранулематоз — саморегулирующийся процесс, так как размно-
жение и трансформация клеток гранулемы регулируется медиато-
рами — монокинами [Чернух А. И., 1979] и лимфокинами [Jahnson
R. L., Liff М., 1976]. Он иммунологически специфичен, переносится
Т-лимфоцитами, подавляется у животных с помощью тимэктомии
или антилимфоцитарной сыворотки [Adams D. О., 1976].
Гранулематоз зависит от раздражителя (возбудителя), который
может иметь инфекционную (туберкулез, бруцеллез, гистоплазмоз)
или неинфекционную (бериллиоз, силикоз) природу, в раде случаев
°на неизвестна (саркоидоз). В связи с этим гранулематоз охватывает
большую группу заболеваний, которые называют «гранулематозные
болезни» [Струков А. И., Кауфман О. Я., 1989].
Таким образом, воспаление и гиперчувствительность — процессы
отряженные и в патологии человека находятся в причинно-следст-
239
венной зависимости; их связующим звеном является иммунитет: им-
мунные реакции, возникающие при воспалении для ликвидации по-
вреждающего агента и репарации, при извращении кинетики воспа-
ления могут стать реакциями «больного иммунитета» — реакциями
гиперчувствительности, ведущими к повреждению и иммунному вос-
палению. Подобная взаимосвязь воспаления и гиперчувствительности
определяет особенности течения заболеваний, сопровождающихся им-
мунными нарушениями, для которых характерно волнообразно теку-
щее хроническое воспаление. В то же время иммунное воспаление,
служащее проявлением аутоаллергии, способно поддерживать ауто-
иммунизацию, что находит выражение в том же волнообразнотекущем
хроническом воспалительном процессе.
Среди факторов, которые реализуют сопряжение воспаления, им-
мунитета и гиперчувствительности в патологии человека, важное ме-
сто занимают наследственно-конституциональные. В настоящее время
появилась возможность изучения генного контроля за иммунным от-
ветом (речь идет о генетической системе гистосовместимости). Анти-
гены гистосовместимости контролируются генами, расположенными в
хромосомах в тех областях, которые определяют силу и характер им-
мунного ответа. Это — маркеры антигенной индивидуальности чело-
века, которые выполняют рецепторно-распознавательную и регуля-
торную функции [Зотиков Е. А., 1982; Петров Р. В., 1982}.
Современные данные об антигенах гистосовместимости позволяют
понять патогенетические особенности «болезней гиперчувствитель-
ности». Доказана жесткая связь между антигенами HLA-B27 и та-
кими болезнями, как анкилозирующий спондилит, синдром Рейтера,
ревматоидный и сальмонеллезный артрит. Эту связь можно объяс-
нить тем, что HLA-B27 сцеплен с геном слабого иммунного ответа;
это и определяет хронизацию воспалительного процесса. Не менее
характерна связь между антигенами HLA-B8, HLA-D/DR и ауто-
иммунными заболеваниями: системной красной волчанкой, ревма-
тоидным артритом, идиопатической аддисоновой болезнью, синдро-
мом Гудпасчера, болезнью Шегрена, идиопатической мембранозной
нефропатией. Аутоиммунизацию при этих заболеваниях можно объ-
яснить, во-первых, тем, что с локусом HLA-A, В, С (I класс системы
HLA) связан феномен Т-клеточного узнавания в генерации цито-
токсических лимфоцитов и Т-супрессоров [Panayi С. S., 1982], к
тому же HLA-B8, DR-3 сцеплен с геном слабого «функционирования
Т-супрессоров; во-вторых, нарушениями взаимодействия между мак-
рофагами, Т-хелперами, Т-супрессорами и В-лимфоцитами, так как
антигены HLA-DR (II класс системы HLA) ответственны за передачу
иммунологической информации этими клетками, а также их коо-
перацию.
Как видно из изложенного выше, проблема сопряжения воспа-
ления и гиперчувствительности с иммунитетом охватывает огромный
круг вопросов морфологии, молекулярной биологии, иммунологии
и генетики. Понимание этого сопряжения открывает возможность
глубокого познания иммунопатологии, представленной во всех раз-
делах современной медицины.
240
5.3. АУТОИММУНИЗАЦИЯ И ВОСПАЛЕНИЕ
Вопрос о взаимоотношениях аутоиммунизации и воспаления есте-
ствен: ведь аутоиммунизация проявляется реакциями гиперчувст-
вительности, которые представлены различными видами иммунного
воспаления, за исключением реакций нейтрализации и инактивации.
5.3.1. Сущность и механизм развития
аутоиммунизации
Понятия «аутоиммунизация» (аутоиммунные процессы) и «аутоим-
мунные болезни» неоднозначны. Под аутоиммунизацией понимают
реагирование иммунной системы на нормальные (неизмененные)
антигены собственных тканей — аутоантигены [Петров Р. В., Ора-
довская И. В., 1988 ]. Ранее аутоантигенам я считали как неизменные
антигены, так и приобретенные: модифицированные, интегрирован-
ные и комплексные антигены [Чернушенко Е. Ф. и др., 1985]. Такое
толкование аутоантигенов следует признать несостоятельным, поэ-
тому оно должно быть оставлено [Петров Р. В., 1982; Sell S., 1980],
хотя его еще принимают некоторые клинические иммунологи
[Sonnichsen N., Apostoloff Е., 1987]. Модифицированные, интегри-
рованные и комплексные антигены являются чужеродными для ор-
ганизма и вызывают иммунный, а не аутоиммунный ответ; лишь
в определенных условиях они, по-видимому, могут служить «пус-
ковым» моментом в развитии аутоиммунных болезней.
Нельзя признать правильным и принятое в течение длительного
периода времени отождествление аутоиммунизации с нарушением
«самораспознавания», т. е. представление об аутоиммунных процес-
сах только как о патологических — нарушении деятельности им-
мунной системы [Насонов Е. Л., Сура В. В., 1984; Серов В. В.,
Зайратьянц О. В., 1992]. Такая трактовка аутоиммунизации была
основана на постулате Р. Ehrlich и J. Morgenroth, позднее поддер-
жанном F. Burnet n J. Mackay (1963), о невозможности реагирования
иммунной системы на собственные антигены организма. Однако к
настоящему времени получено достаточно данных, свидетельству-
ющих о том, что аутоиммунные процессы представляют собой один
из механизмов нормальной деятельности иммунной системы, позво-
ляющих ей осуществлять контроль и регуляцию структурного и
биохимического гомеостаза; лишь выход таких процессов за пределы
физиологических границ приводит к развитию заболевания.
Так, показано, что аутоантитела (обычно IgM в низких титрах),
а также ауто-Т- и В-лимфоциты являются нормальным и постоянным
компонентом иммунной системы и их активность контролируется
Регуляторными субпопуляциями Т-лимфоцитов и другими механиз-
мами [Йегер Л., 1990]. В норме не выявляются лишь цитотокси-
ческие аутоантитела и лимфоциты. Титры различных аутоантител
повышаются при стрессе, беременности, старении и практически
при всех заболеваниях [Лямперт И. М., 1988; Cohen I., 1986].
241
Последнее обстоятельство ранее служило причиной необоснованного
расширения круга аутоиммунных болезней. Таким образом, в на-
стоящее время имеется достаточно оснований для утверждения прин-
ципиально важного положения о гетерогенности аутоиммунных про-
цессов, которые можно разделить на физиологические (гомеостати-
ческие) и патологические.
Физиологические аутоиммунные процессы — это антигензави-
симое взаимодействие клеток иммунной системы между собой, а
также с клетками и межклеточными структурами других систем;
они участвуют в осуществлении контроля за постоянством внутрен-
ней среды организма, как это впервые предположил Р. Grabar в
1958 г. [цит. по Чернушенко Е. Ф. и др., 1985]. Следует различать
регуляторные и «санитарные» физиологические аутоиммунные про-
цессы. К регуляторным нужно отнести прежде всего те, которые
осуществляют антигензависимое межклеточное взаимодействие в
самой иммунной системе. Распознавание Т- и В-лимфоцитами ауто-
антигенов I и II классов системы HLA, идиотипов и других антигенов
на собственных клетках организма, продукция блокирующих, ан-
тиидиотипических антител — это по своей сути аутоиммунные
процессы, причем именно адекватность таких реакций конкретным
условиям обеспечивает естественную иммунологическую толерант-
ность [Йегер Л., 1990]. Регуляторные аутоиммунные процессы осу-
ществляют также взаимодействие клеток иммунной и нейроэндок-
ринной систем наряду с другими известными механизмами, обес-
печивающими информационный обмен между этими системами
(посредством гормонов, нейроиммунотрансмиттеров, нейроиммуно-
пептидов и др.). При этом главную роль играют аутоантитела к
гормонам, медиаторам и их рецепторам, которые модулируют эн-
докринное межклеточное взаимодействие [Cumming I., 1980]. Вза-
имосвязь на разных уровнях иммунной и нейроэндокринной систем
с участием различных механизмов (нервных, гуморальных, ауто-
иммунных) настолько тесна, что можно говорить о существова> ии
единой гомеостатической нейроэндокринно-иммунной системы.
Физиологические аутоиммунные процессы могут лежать в основе
контроля иммунной системы пролиферации и дифференцировки
тканей при физиологической и репаративной регенерации, при этом
важную роль отводят Т-лимфоцитам, переносящим «регенерацион-
ную информацию» [Бабаева А..Г., 1972]. Близки к последним «са-
нитарные» аутоиммунные процессы, направленные на элиминацию
и утилизацию отмирающих клеток. Выработка таких аутоантител,
по-видимому, маскируя аутоантигены, может препятствовать раз-
витию аутоиммунного заболевания. Титры «санитарных» аутоанти-
тел повышаются при повреждении тканей в ходе различных болезней
[Чернушенко Е. Ф. и др., 1985; Йегер Л., 1990]. Таким образом,
физиологические аутоиммунные процессы — это один из механизмов
контроля и регуляции структурного и биохимического гомеостаза
единой нейроэндокринно-иммунной системой, отличающийся анти-
гензависимым межклеточным взаимодействием.
Можно полагать, что патологические аутоиммунные процессы
242
развиваются на основе физиологических. Наиболее удачным следует
признать их определение как процессов, развивающихся вследствие
нарушения регуляции иммунного ответа на аутоантигены при со-
хранении основных функций иммунной системы — распознавания
и элиминации антигенов [Петров Р. В., Орадовская И. В., 1988].
В зависимости от того, какую роль играют патологические аутоим-
мунные процессы в патогенезе заболевания — первичную или вто-
ричную, различают аутоиммунные болезни и заболевания, сопро-
вождающиеся вторичными аутоиммунными нарушениями.
Этиология и патогенез аутоиммунных болезней связаны с фак-
торами, нарушающими антигенспецифическое взаимодействие им-
мунокомпетентных клеток с клетками и межклеточными структу-
рами различных органов и тканей. В результате этого развиваются
либо локальное или системное иммунное воспаление, либо моно- и
полиорганные дистрофические, атрофические или гиперпластические
процессы [Йегер Л., 1990; Sell S., 1980]. Среди этиологических
факторов основное значение придают вирусным и прочим биологи-
ческим, а также физическим (охлаждение, облучение) и химическим
(чаще лекарственным) воздействиям, которые реализуются на оп-
ределенном генетическом фоне. Этиология аутоиммунных болезней
неотделима от их патогенеза. Многочисленные концепции этиопа-
тогенеза таких заболеваний можно разделить на три группы: свя-
зывающие их развитие с изменениями аутоантигенов клеток-мише-
ней (первая группа), наличием перекрестно реагирующих антигенов
(вторая группа) и нарушениями, происходящими главным образом
в самой иммунной системе (третья группа).
Согласно наиболее известной из концепций первой группы, ауто-
иммунные болезни возникают вследствие утраты естественной им-
мунологической толерантности к так называемым изолированным
аутоантигенам «забарьерных» тканей тела, к которым относили
аутоантигены, локализующиеся за гистогематическими барьерами в
период становления иммунной системы в онтогенезе, а именно:
аутоантигены миелина нервной системы, аутоантигены передней
камеры глаза, семенников, щитовидной железы. Изолированность
многих аутоантигенов опровергнута: в крови у здоровых лиц выяв-
ляют аутоантитела к хрусталику глаза, сперматозоидам, тиреогло-
булину. Кроме того, у больных аутоиммунными болезнями щито-
видной железы или семенников одновременно выявляют широкий
спектр аутоантител не только к «забарьерным» тканям [Carlson Н.,
1983]. Такие аутоиммунные болезни, как энцефаломиелит, симпа-
тическая офтальмия, варианты увеита и орхита, далеко не всегда
развиваются после повреждения гистогематических барьеров: на-
пример, наиболее известная в этом плане симпатическая офтальмия
возникает лишь у 0,1—3% больных после проникающего ранения
Другого глаза. К тому же выявляющиеся аутоантитела могут быть
«санитарными» и выполнять защитную функцию. Иммунологическая
толерантность должна была бы отсутствовать к 1-антигену эритро-
цитов, который появляется после созревания иммунной системы и
не защищен каким-либо барьером, но аутоиммунная гемолитическая
243
анемия с холодовыми агглютининами (аутоантитела к 1-антигену) —
редкое заболевание [Йегер Л., 1990].
Большое значение придают изменениям концентрации аутоан-
тигенов в крови и на клеточных мембранах, а также демаскировке
внутриклеточных корпускулярных аутоантигенов. Полагают, что
нарушению естественной иммунологической толерантности могут
способствовать как увеличение, так и снижение концентрации таких
антигенов, хотя сверхвысокие дозы антигена, наоборот, индуцируют
толерантность [Йегер Л., 1990]. В настоящее время обсуждается
роль нарушения экспрессии антигенов клеточных мембран в пато-
генезе аутоиммунных эцдокринопатий, первичного билиарного цир-
роза печени и болезни Шегрена. На мембране клеток-мишеней при
этих аутоиммунных болезнях появляются (в отличие от нормы)
HLA-DR-антигены, что позволяет клеткам представлять свои ауто-
антигены Т-хелперам без участия макрофага и, по-видимому, минуя
регуляторные системы [Schatz Н., Doniach D., 1984].
Концепции второй группы основаны на работах М.Kaplan (1958)
и И. М. Лямперт (1988). Перекрестно реагирующими антигенами
называют общие антигенные детерминанты тканей животных и мик-
роорганизмов; известны также эндогенные перекрестно реагирующие
антигены. Хотя развитие аутоиммунных болезней на основе пере-
крестно реагирующих антигенов возможно, но обычно такие анти-
гены обусловливают продукцию нецитотоксических аутоантител.
Вследствие этого, несмотря на большое количество перекрестно ре-
агирующих антигенов, аутоиммунные болезни возникают достаточно
редко. В последние годы такие антитела обнаружены в системе
идиотип-антиидиотипических антител [Drachman D., 1987; Miiller-
Hermelink Н., 1987].
Из изложенного выше видно, что при трансформации физиоло-
гических аутоиммунных процессов в патологические «работают»
дополнительные и, возможно, решающие факторы — врожденные
или приобретенные нарушения регуляторных механизмов в иммун-
ной системе.
Концепции этиологии и патогенеза аутоиммунных болезней, вхо-
дящих в третью группу, характеризуются выделением особой роли
дисфункции иммунной системы. Среди них исключительное значе-
ние в свое время придавали концепции F. Burnet и J. Mackay (1963)
о мутациях лимфоцитов с нарушением элиминации в тимусе воз-
никающих при этом аутоагрессивных клонов. Это положение впер-
вые связало аутоиммунные болезни с дефектами самой иммунной
системы, возвело их в ранг болезней аутоиммунной системы, при
этом впервые была поднята проблема нарушений регуляторных
механизмов иммунной системы и роли дисфункции тимуса в пато-
генезе аутоиммунных болезней. В настоящее время аутоиммунные
болезни рассматривают не как проявление гиперфункции иммунной
системы, а как следствие ее дисфункции в связи с недостаточностью
регуляторных механизмов, т. е. как своеобразный иммунный дефи-
цит [Петров Р. В., Орадовская И. В., 1988; Fudenberg Н. et al.,
1980]. Не случайно выявлена высокая частота аутоиммунных бо-
244
лезней на фоне врожденных и приобретенных иммунных дефицитов:
примерно у 13% больных с врожденными иммунодефицитными
синдромами. В то же время иммунный дефицит клеточного звена
иммунной системы наблюдается у 50—90% больных системной крас-
ной волчанкой, у 20—40% — аутоиммунными тиреоидитами, не-
редко при других, особенно органонеспецифических, аутоиммунных
болезнях [Петров Р. В., Орадовская И. В., 1988]. Основным усло-
вием, необходимым для развития аутоиммунных болезней, является
неэффективность супрессорных механизмов в иммунной системе,
которые представлены субпопуляциями регуляторных Т-лимфоцитов
(Т-супрессоры, Т-индукторы супрессии, вето-клетки и др.), субпо-
пуляциями В-лимфоцитов, идиотип-антиидиотипической сетью ан-
тител и т. д. [Лямперт И. М., 1988; Чередеев А. Н., Ковальчук Л. В.,
1989; Cohen 1., 1986; Mackay I., 1987]. Согласно концепции об
«иммунологических часах», или «компасе» [Чередеев А. Н., Коваль-
чук Л. В., 1989], аутоиммунные болезни развиваются при условии
увеличения коэффициента Т-хелперы/Т-супрессоры в связи с аб-
солютным или относительным дефицитом Т-супрессоров в резуль-
тате уменьшения их продукции, нарушения дифференцировки, бло-
кады антителами или иммунными комплексами, активации Т-контр-
супрессоров, ауто-Т-хелперов, Т-индукторов, иммунного конфликта
между субпопуляциями лимфоцитов. Не исключена роль уменьше-
ния количества естественных клеток-киллеров и вето-клеток (одна
из субпопуляций Тв-лимфоцитов). Дефицит супрессии может быть
следствием нарушений в системе идиотип-антиидиотипических ан-
тител, которые могут быть как протекторами, предотвращая или
прекращая аутоиммунную болезнь, так и одной из причин ее раз-
вития [Насонов Е. Л., Сура В. В., 1984; Drachman D., 1987].
Таким образом, концепция иммунодефицита при аутоиммунных
болезнях получила в последнее время разнообразные подтверждения
и, во-первых, ставит под сомнение целесообразность иммунодепрес-
сивной терапии, широко применяемой при лечении ряда таких
болезней, во-вторых, указывает на возможность лечения по крайней
мере некоторых аутоиммунных расстройств иммуномодуляторами,
например гормонами тимуса [Amor В. et al., 1987].
Наиболее удачно этиология и патогенез аутоиммунных болезней
обобщены I. Mackay (1987), который выделил предрасполагающие,
инициирующие и способствующие их развитию факторы (схема 5.9).
К первым следует отнести генетически обусловленные: наличие
определенных генов системы HLA, связанных с генами иммунного
ответа; генетические особенности рецепторов лимфоцитов, синтеза
иммуноглобулинов, а также клеток-мишеней; гормональный фон,
зависящий, в частности, от пола. Большинство аутоиммунных бо-
лезней сочетаются с генами HLA В8, DR3, которые обусловливают
относительную гипофункцию Т-супрессоров, ослабление элимина-
ции иммунных комплексов в связи с особенностями макрофагальной
системы печени и селезенки [Насонов Е. Л., Сура В. В., 1984;
Mackay J., 1987]. Роль пола в развитии аутоиммунных болезней (у
*енщин их частота в 4—6 раз выше) обусловлена локализацией
245
Схема 5.9. Этиологические и патогенетические факторы аутоиммунизации
[Mackay I., 1987].
Инициирующие факторы: Предрасполагающие факторы. Способствующие факторы-
физические, химические и биологические (вирусы, бактерии и др.) воздей- ствия на органы иммун- ной системы и клетки- мишени определенные гены HLA; эндокринные и иммунные особенности, связанные с полом; генетически обусловленные особен- ности клеток органов- мишеней дисфункция иммунной системы- снижение ак- тивности супрессорных Т-лимфоцитов и нару- шения в системе идио- тип-анти идиотипических антител
Аутоиммунизация
ряда генов иммунного ответа в Х-хромосоме и высоким уровнем
эстрагенов, повышающих активность Т-хелперов, продукцию ин-
терлейкинов и ослабляющих элиминацию иммунных комплексов.
При сочетании нескольких предрасполагающих факторов риск раз-
вития аутоиммунной болезни достигает 50%.
Инициирующими факторами мотут быть модифицированные, ин-
тегрированные и комплексные антигены, другие изменения аутоан-
тигенов, перекрестно реагирующие антигены, а также прямое по-
вреждение иммунной системы [Mackay I., 1987].
* Способствующие факторы — это любые нарушения регуляторных
механизмов в иммунной системе [Cohen I., 1986; Mackay 1., 1987].
Для каждой аутоиммунной болезни указанные выше факторы
могут быть разными, что обусловливает «полиэтиологичность» таких
болезней, однако общим звеном патогенеза является недостаточность
супрессорных механизмов в иммунной системе.
5.3.2. Принципы классификации аутоиммунных
болезней
Общепринятой классификации аутоиммунных болезней нет. Боль-
шинство авторов делят аутоиммунные болезни в зависимости от
степени доказанности роли аутоиммунных процессов в их патогенезе,
характера аутоантигена и предполагаемых особенностей патогенеза.
Различают заболевания, аутоиммунный характер которых доказан
(аутоиммунные гемоцитопении, эндокринопатии, болезни нервной
системы и глаз, системная красная волчанка, ревматоидный артрит,
миастения и др.), наиболее вероятен (узелковый периартериит,
склеродермия) и лишь предполагается (эпилепсия, паркинсонизм,
шизофрения и др.). Выделяют аутоиммунные болезни, при которых
аутоиммунизация является основным фактором патогенеза («истин-
ные» аутоиммунные болезни), и заболевания, характеризующиеся
вторичными аутоиммунными нарушениями (варианты гепатитов,
246
нефритов, ожоговая и лекарственная болезни, постинфарктный, по-
сткардиотомический синдромы и т. д.).
Особо выделяют группу антительных болезней рецепторов, в
основе которых лежат реакции нейтрализации и инактивации, со-
провождающиеся выработкой нецитотоксических аутоантител к ре-
цепторам гормонов и медиаторов. При таких болезнях не развивается
иммунное воспаление, а изменения тканей-мишеней представлены
дистрофическими, атрофическими или гиперпластическими процес-
сами [Йегер Л., 1990; Sell S., 1980]. Среди них наиболее известны
диффузный токсический зоб, варианты идиопатической аддисоновой
болезни, гиперпаратиреоидизма, сахарного диабета I типа, а также
миастения, рассеянный склероз и др. [Йегер Л., 1990; Carlson Н.,
1983; Schatz Н., Doniach D., 1984 ]. К таким аутоиммунным болезням
близки те, в основе которых также лежат реакции нейтрализации
и инактивации, но аутоантитела вырабатываются не к рецепторам,
а непосредственно к гормонам и медиаторам (варианты сахарного
диабета I типа, идиопатической аддисоновой болезни, гипотиреоза,
пернициозная анемия, коагулопатии).
Отдельно следует выделить ряд аутоиммунных эндокринных за-
болеваний: тиреоидиты гиперпластические (Хашимото) и атрофи-
ческие, аутоиммунные гипофизит, тиреотоксикоз, первичная мик-
седема, гипер- и гипопаратиреозы, сахарный диабет I типа, ауто-
иммунная аддисонова болезнь. Хотя в клинической картине этих
болезней на первый план выступает поражение какой-либо одной
железы, реже — двух или трех, но повышается обычно титр антител
к группе эндокринных органов — теория «айсберга» [Cumming I.,
1980]. По сходному признаку выделяют и аутоиммунные болезни
крови.
Основной рабочей классификацией аутоиммунных болезней яв-
ляется их деление на органоспецифические и органонеспецифиче-
ские [Йегер Л., 1990], хотя для части из них оно условно. О группе
так называемых промежуточных аутоиммунных болезней [Пет-
ров Р. В., 1982] в настоящее время не говорят [Йегер Л., 1990].
Органоспецифические аутоиммунные болезни характеризуются
наличием одного, реже нескольких патогенетически значимых ауто-
антигенов (аутоантител), органо-, но не видоспецифичных, редко
сочетаются с выраженным иммунным дефицитом. К ним относят
аутоиммунные гемоцитопении (гемолитическая анемия, лейкопении
и др.), эндокринопатии аутоиммунного генеза, аутоиммунный ат-
рофический гастрит, иммунные коагулопатии, синдром Гудпасчера,
пузырчатку и подобные ей формы, интерстициальный нефрит, ауто-
иммунные болезни нервной системы и глаз [Йегер Л., 1990; Cruse J.,
Lewis R., 1985; Cohen I., 1986].
К органонеспецифическим относят аутоиммунные болезни, ха-
рактеризующиеся иммунным ответом на многие аутоантигены раз-
ных тканей и органов; они часто сопровождаются иммунным дефи-
цитом и иммунокомплексным поражением сосудистого русла, встре-
чаются в различных сочетаниях [Cruse J., Lewis R., 1985; Cohen
L, 1986]. Это прежде всего ревматические болезни (системная крас-
247
ная волчанка, ревматоидный артрит, склеродермия, узелковый пе-
риартериит, дермато- и полимиозит, болезнь Шегрена), а также
аутоиммунный хронический гепатит, первичный билиарный цирроз
печени, язвенный колит, миастения [Йегер Л., 1990; Cohen I
19861.
5.3.3. Морфология аутоиммунных процессов
и болезней
Морфологическая картина при аутоиммунных болезнях складыва-
ется из двух категорий изменений, различающихся по иммуноло-
гической сущности. Изменения первой категории отражают напря-
женный, а точнее, извращенный иммуногенез и касаются лимфо-
идных органов. При этом нередко наблюдаются признаки иммунного
дефицита, например атрофия истинной паренхимы тимуса (коры и
мозгового вещества), сопровождающаяся сниженной продукцией ти-
мических гормонов, в сочетании с гиперплазией его внутридольковых
периваскулярных пространств и развитием в них лимфоидных фол-
ликулов (так называемая гиперплазия тимуса с лимфоидными фол-
ликулами). Изменения второй категории представлены морфологией
реакций гиперчувствительности, или иммунным воспалением, за
исключением реакций нейтрализации и инактивации, при которых
могут наблюдаться только гиперпластические, атрофические или
дистрофические процессы, например в эндокринных железах.^Для
мн гих-Аутоиммунных болезней характерно чередование pea [
ГНТ (при обострении) и ГЗТ (в фазе ремиссии).
' "Морфология реакций гиперчувствительности при аутоиммунных
болезнях определяется как природой антигена, длительностью его
циркуляции в крови, так и качеством образующихся иммунных
комплексов (циркулирующих комплементсвязывающих или местно-
образованных за счет структурного антигена ткани) и аутоантител.
При этом циркулирующие комплементсвязывающие иммунные ком-
плексы обычно вызывают иммунное воспаление типа реакции ГНТ,
а местно-образующие иммунные комплексы, содержащие тканевый
антиген, чаще приводят к изменениям типа реакции ГЗТ. Из ауто-
антител обычно преобладают антитела класса G, реже — М. Они
могут быть активирующими продукцию гормонов (например, TSAb
при тиреотоксикозе), активирующими рост клеток (TDI при тирео-
токсикозе и IgG при экзофтальме), блокирующими рецепторы и
вызывающими атрофию желез при аутоиммунных эндокринных бо-
лезнях (нарушения нервно-мышечной передачи при миастении), а
также цитотоксическими [Carlson Н., 1983; Schatz Н., Doniach D.,
1984]. С цитотоксическими аутоантителами связаны деструктивно-
пролиферативные процессы в тканях. Однако основную роль в по-
вреждении тканей и органов играют реакции клеточного иммунитета
[Струков А. И., Грицман А. Ю., 1978; Sell S., 1980]: при аутоим-
мунных процессах выявлены цитотоксическое действие лимфоцитов
на ткани (Т-киллеры, К-клетки), инфильтрация их лимфоцитами
248
и макрофагами; возможность пассивного переноса аутоиммунного
процесса лимфоцитами, а не сывороткой; прямая корреляция между
реакцией ГЗТ к антигенам тканей и развитием состояния аутоим-
мунизации в эксперименте. В этих случаях при многих аутоиммун-
ных болезнях в тканях преобладает инфильтрация лимфоцитами и
макрофагами, выражен клеточный цитолиз, ведущий к разрушению
паренхиматозных клеток.
При развитии иммунокомплексных повреждений по типу ре-
акций ГНТ нередко выявляют ряд характерных признаков, зави-
сящих от особенностей иммунного комплекса. Например, гисто-
логические и гистохимические признаки изменений при системной
красной волчанке (гематоксилиновые тельца, кариорексис, выще-
лачивание ядер, резкая пиронинофилия и фельген-положительная
реакция фибриноида) связаны прежде всего с особенностью цир-
кулирующего при этой болезни иммунного комплекса, содержащего
продукты распада клеточных ядер, нуклеопротеиды (антиген) и
IgG (антинуклеарные антитела). С ецифика морфологических из-
менений при ревматоидном артрите, как уже отмечалось, также
определяется особенностью аутологичного иммунного комплекса и
местом его образования.
В тех случаях, когда в развитии аутоиммунизации основную
роль играют реакции инактивации и нейтрализации (антительные
болезни рецепторов), иммунного воспаления в органах-мишенях не
наблюдается, а преобладают гиперпластические, атрофические или
дистрофические процессы.
Для аутоиммунных заболеваний характерно появление в ряде
органов и тканей-мишеней структур, сходных с Т- и В-зонами
периферических лимфоидных органов, например лимфоидных фол-
ликулов в щитовидной железе при тиреотоксикозе и тиреоидитах,
в периартикулярной ткани при ревматоидном артрите. .
5.3.4. Воспаление как возможная причина
аутоиммунного процесса
Как было отмечено выше, воспаление, вызванное вирусами или
другими микроорганизмами, может быть способств ющим или ини-
циирующим фактором в патогенезе аутоиммунизации. Воспаление,
особенно хроническое, может привести к возникновению вторичного
иммунного дефицита с подавлением активности Т-супрессоров и
нарушениями в сети идиотип-антиидиотипических антител; поли-
клональной активации В-лимфоцитов и синтезу аутоантител; уси-
лению экспрессии на некоторых эпителиальных клетках, например
тиреоцитах, антигенов HLA-DR (И класс комплекса гистосовмести-
мости), с которыми могут реагировать рецепторы регуляторных
Т-лимфоцитов и В-лимфоциты; появлению перекрестно реагирую-
щих антител.
Важно помнить, что, помимо аутоиммунных болезней, сущест-
вует ряд заболеваний воспалительной природы, при которых ауто-
249
иммунизация не является их содержанием, а возникает вторично
в связи с основным процессом и в дальнейшем в значи'ельной мере
определяет прогрессирование и исход болезни. Это таи называемые
болезни с аутоиммунными нарушениями, к которым (тносят неко-
торые типы гломерулонефрита вирусный гепатит, цгрроз печени
ожоговую болезнь, аллергические анемии, агранулоцц-оз, лекарст-
венную болезнь, ряд форм хронических неспецифичес<их воспали-
тельных заболеваний легких и др. Изменение свойггв тканей и
органов при этих заболеваниях, связанное прежде всего с модифи-
кацией аутоантигенов под влиянием физических, химических и
биологических факторов, ведет к развитию реакцш, близких к
аутоиммунным, а затем и к собственно аутоиммуннцм. Физиоло-
гическая роль этих реакций, вероятно, состоит в эльминации по-
врежденных элементов ткани, и если повышенный тит) аутоантител
наблюдается практически при всех инфекционно-вогпалительных
заболеваниях, то клиническое значение они имеют да^ко не всегда.
Возникающие при «вторичной» аутоиммунизации органные из-
менения отражают морфологию реакций ГНТ и ГЗТ
5.4. ИММУНОДЕФИЦИТНЫЕ СОСТОЯНИЯ
И ВОСПАЛЕНИЕ
Прежде чем осветить вопрос об особенностях воспаления при врож-
денных, так называемых первичных, иммунодефицитах, следует
уточнить терминологию, которую мы полагаем использовать в даль-
нейшем. Термин «первичный иммунодефицитный синдром» нам
представляется не совсем точным, так как он подразумевает пре-
имущественно генетически обусловленный иммунный дефицит или
спонтанно возникающую мутацию генов хромосомного аппарата
яйцеклетки, сперматозоида или гаметы, приводящую к возникно-
вению иммунодефицитного синдрома. Следовательно, о «первично-
сти» в данных случаях речи не идет, так как синдром иммуноде-
фицита имеет наследственную этиологию. В настоящее время точно
установлено, что наряду с наследственными иммунодефицитами
возможны иммунодефициты, приобретенные внутриутробно под вли-
янием вирусов, в частности вируса иммунодефицита человека
(ВИЧ), обусловливающего СПИД (ВИЧ-инфекцию) у детей. В на-
стоящее время большинство исследователей считают, что заражение
ВИЧ происходит вертикальным путем от матери к плоду в анте-
натальном или, чаще, в интранатальном периоде [Albrecht-Werner
D. et al., 1987; Contani A., 1987; Lesgold-Belman A. et al., 1988;
Terragne A. et al., 1988].
Из данных литературы следует, что проявления ВИЧ-инфекции
при антенатальном заражении наблюдаются в раннем фетальном
периоде, о чем свидетельствует преимущественное поражение зрелых
лимфоцитов тимуса—хелперов с маркером СВ-4, дифференцирую-
щихся во внутренней зоне коры тимуса не раныце 9-й недели
беременности [Авцын А. П. и др., 1989; Йегер Л_, 1990]. При
250
ВИЧ-инфекции наблюдаются также микроцефалия (у 30% зара-
женных новорожденных) [Lesgold-Belman A., Diamond G. et al.,
1988], прогрессирующая идиопатическая острая энцефалопатия,
проявляющаяся сразу после рождения! Из заболеваний иммунных
органов, кроме типичной для СПИДа лимфаденопатии, наблюдаются
гепато- и спленомегалия (у 93% зараженных) [Cantani А., 1987]
с обширными очагами миелоцитарного кроветворения, которое в
норме прекращается в печени к моменту рождения. Данных отно-
сительно явлений дисплазии тимуса, развития которой можно было
бы ожидать, если бы заболевание возникло в эмбриональном периоде,
в литературе мы не встретили. Закладка тимуса начинается на
6—7-й неделе беременности, полная его дифференцировка закан-
чивается на 17-й неделе, т. е. после завершения периода эмбриоге-
неза в раннем фетальном периоде [Gandecker Р., 1986]. В этом
периоде происходит также активная дифференциация полушарий
головного мозга. Следовательно, атрофия тимуса без его дисплазии
и микроцефалия наряду с выраженными симптомами энцефалопа-
тии, которая, по данным литературы, весьма вероятно, вызывается
ВИЧ [Авцын А. П. и др., 1989; Biggeman В. et al., 1987], указывают
на то, что проявления заболевания в некоторых случаях могут
наблюдаться не только после рождения, но и внутриутробно, скорее
всего в раннем фетальном периоде. Об этом же свидетельствует
повреждение зрелых лимфоцитов — хелперов, приводящее к не-
зрелости либо атрофии тимуса.
Кроме внутриутробных вирусных повреждений иммунной систе-
мы, описаны иммунодефициты, возникающие под влиянием неко-
торых применяемых во время беременности лекарств. Так, имеются
наблюдения, свидетельствующие о том, что лечение изотретиноином
приводит не только к возникновению множественных врожденных
пороков развития (МВПР), но и к прогрессирующему истощению
клеточного звена иммунитета в первые месяцы жизни [Cohen М.
et al., 1987]. Наконец, встречаются врожденные иммунодефициты,
при которых наблюдается либо выраженная гипоплазия, либо аге-
незия тимуса (синдром Ди Джорджи) в сочетании с другими МВПР,
этиология которых, как и многих других врожденных пороков раз-
вития, неясна.
В связи с изложенным выше следует придерживаться термина
«врожденные», а не «первичные» иммунодефици-
ты , так как этиология их столь же разнообразна, как и других
врожденных пороков на любом уровне — системном, органном,
тканевом и клеточном. Приведенные данные еще раз доказывают,
что термины «первичный» и «вторичный» иммунодефицит неудачны.
Любой из названных повреждающих факторов (вирус, химические
агенты и др.), равно как и их сочетания с генетическими дефектами,
могут привести к развитию врожденного иммунодефицитного син-
дрома (ВИДС). В данном случае наблюдается полная аналогия с
Другими врожденными пороками развития, которые, однако, в те-
ратологии не делят на «первичные» и «вторичные».
Термин «вторичный врожденный порок развития» в тератологии
251
употребляют лишь в тех случаях, когда возникновение порока па-
тогенетически связано с основным нарушением формирования ор-
гана.
5.4.1. Особенности воспалительной реакции у детей
с врожденными иммунодефицитными синдромами
Переходя непосредственно к рассмотрению вопроса о воспалении в
условиях врожденных иммунодефицитных синдромов, необходимо
отметить, что те черты воспалительной реакции, которые наблю-
даются во внутриутробном периоде, встречаются у новорожденных,
особенно у недоношенных, а иногда и у детей первых лет жизни
вследствие позднего созревания их иммунной системы, по существу
не отличаются от проявлений воспаления в условиях ВИДС (см.
8.1). Однако при ВИДС все указанные черты воспалительной ре-
акции обычно бывают резко утрированными: альтеративный ком-
понент воспаления отчетливо превалирует над другими, причем это
наблюдается не только у недоношенных и новорожденных, но и у
детей второго полугодия и первых лет жизни. У детей без ВИДС
преобладание альтеративного компонента — это в известной мере
лишь проявление склонности к возникновению такого рода воспа-
лительных реакций, выраженной тем сильнее, чем ближе возраст
ребенка к пренатальному периоду и, следовательно, его иммунная
система более незрелая. При ВИДС, наоборот, воспаление с пре-
обладанием альтеративного компонента встречается почти как пра-
вило.
Следует сделать оговорку, так как существует определенная
зависимость преобладания альтеративного и других компонентов
воспаления от тяжести и характера иммунного дефицита. Так,
при тяжелых комбинированных иммунодефицитных синдромах
(ТКИДС) альтеративный компонент наиболее выражен, а экссуда-
тивная реакция, как правило, подавлена. Для изолированных де-
фицитов, например хронической гранулематозной болезни, сущность
которой заключается в наличии дефекта фагоцитарной системы, в
частности в неспособности микрофага к киллерному действию в
отношении микробных тел, характерны экссудативный (гнойный)
компонент и формирование макрофагальных гранулем. Иногда в
гистиомоноцитарных гранулемах обнаруживают большое количество
гигантских клеток [Caluser J., Floresen Р., 1978; Bultman В.,
Wildfeuer et al., 1981 J, однако и они имеют гистиомоноцитарный
генез. При этом гнойный экссудат лишен своего основного дейст-
вия — не вызывает лизиса микробных тел.
При некоторых изолированных иммунодефицитах больные не
умирают в раннем детском возрасте, воспалительный процесс у них
может иметь характер реакции ГНТ или ГЗТ. Становясь взрослыми,
такие больные, например с дефицитом IgA, IgE, IgD или компле-
ментарной системы, приобретают склонность к заболеваниям ин-
фекционно-аллергической, аллергической или аутоиммунной при-
252
роды. Чаще, чем у лиц, не имеющих указанных дефицитов, у них
встречаются бронхиальная астма, отек Квинке, узелковый периар-
териит и другие ревматические заболевания, неспецифический яз-
венный колит и др. [Steihm Е., Fulginiti V., 1980]. Местный вос-
палительный очаг при реакции ГНТ характеризуется выраженным
отеком, альтеративными некротическими изменениями соединитель-
ной ткани, стенок сосудов, эозинофильной инфильтрацией. При
реакции ГЗТ на первый план выступают лимфомоноцитарная ин-
фильтрация, наличие плазматических клеток, продуктивных васку-
литов с пролиферацией указанных клеточных элементов.
При некоторых нозологических формах возможна комбинация
реакции ГНТ и ГЗТ, как, например, при формировании ревмати-
ческой гранулемы: вокруг очага фибриноидного некроза отмечается
выраженная пролиферация базофильных гистиомоноцитарных кле-
ток и лимфоцитов с последующим формированием фибробластиче-
ской организации. При перечисленных врожденных иммунодефи-
цитах описанный местный воспалительный процесс не имеет ка-
ких-либо особых черт, которые позволили бы отличить его от
подобной воспалительной реакции у больных без указанных врож-
денных дефицитов. Однако течение процесса обычно бывает более
тяжелым, а прогноз менее благоприятным.
В детском возрасте, как показали наши наблюдения, воспали-
тельный процесс чаще всего локализуется в органах, сообщающихся
с внешней средой, — в коже, слизистых оболочках пищеваритель-
ного, дыхательного и мочевого тракта [Ивановская Т. Е., 1981,
1983]. Следует отметить, что такая локализация, если речь идет о
воспалении, обусловленном инфекционными агентами, характерна
также для лиц, не имеющих дефектов иммунной системы, но течение
процесса и его исход у больных с ВИДС значительно тяжелее, чем
при нормальном иммунном статусе.
Расположение воспалительного очага в известной мере зависит
от характера дефицита. Так, при агаммаглобулинемии Брутона и
дисгаммаглобулинемиях очаг воспаления чаще локализуется в ды-
хательном тракте и околоносовых пазухах. Кроме того, на большом
материале прозектуры Детской клинической больницы № 1 Москвы
показано, что у большинства детей, умерших от пневмонии, особенно
деструктивного типа, на основании морфологии иммунных органов
и выявления продукции иммуноглобулинов с помощью иммуно-
флюоресцентного метода диагностирован иммунодефицит гумораль-
ной В-зависимой системы [Катасонова Л. П., 1984 ]. Такие же данные
получены Л. М. Матвеевой (1988). Децифит IgA чаще обусловливает
поражение пищеварительного тракта. Для хронической гранулема-
тозной болезни (дефект микрофага) типичны поражения кожи. Де-
фициты клеточного типа характеризуются многообразием локали-
зации воспалительных очагов, так как они неизбежно сочетаются
с нарушениями В-звена иммунной системы вследствие того, что в
выработке специфических антител участвуют Т-хелперы и Т-суп-
Рессоры. Так, по данным Е. Л. Кипарисовой (1984), врожденные
классифицируемые иммунодефициты, чаще комбинированные, на-
253
блюдались у 7% из 57 обследованных больных, преимущественно
с пупочным сепсисом. Неклассифицируемые ВИДС с преобладанием
дефекта Т-звена иммунитета встречались гораздо чаще — у 35,2%
обследованных.
Необходимо отметить, что возбудители воспалительного процесса
у больных с ВИДС имеют свои особенности, относясь преимущест-
венно к условно-патогенной флоре — так называемым оппортуни-
стическим инфекционным агентам (от лат. opportunismus — удоб-
ный, выгодный, в смысле удобства их размножения и патогенности
в условиях дефицита иммунной системы). Определенный тип воз-
будителя, как и предпочтительная локализация процесса, обуслов-
лены в известной мере также характером иммунного дефицита, что
было установлено W. Hizig (1975). Так, например, при нарушениях
клеточного звена иммунитета возбудителями инфекционного про-
цесса чаще всего служат грамотрицательная микробная флора, ви-
русы (цитомегалии, ветряной оспы, простого герпеса и др.), грибы
(Candida albicans, Aspergillus, Sporotrichum Schenki и др.), пневмо-
циста, токсоплазма, туберкулезная палочка (главным образом ее
вакцинальная форма). При дефиците гуморального звена иммуни-
тета основной флорой, обусловливающей инфекционный процесс,
являются грамположительные бактерии. Из этого не следует, что
существует строгая специфичность указанных возбудителей для оп-
ределенной формы ВИДС. Например, нам приходилось наблюдать
семью с наследственной дисгаммаглобулинемией в виде гипергам-
маглобулинемии IgM, в которой оба ребенка умерли от интерсти-
циальной пневмоцистной пневмонии в раннем грудном возрасте.
При обследовании у матери и отца этих детей также была обна-
ружена гипергаммаглобулинемия IgM (ген дефицита передается по
рецессивному типу). Мы наблюдали также случай наследственного
дефицита гранулоцитов, когда после вакцинации БЦЖ развилась,
как это происходит при дефиците клеточного звена иммунитета, ее
генерализация [Ивановская Т. Е. и др., 1988].
Иногда преобладание той или иной формы тесно связано с ха-
рактером иммунного дефекта, и в этих случаях, естественно, тип
возбудителя строго зависит от дефекта иммунной системы. Так,
при хронической гранулематозной болезни воспалительный процесс
никогда не бывает обусловлен стрептококком и пневмококком, по-
скольку эти микробы продуцируют перекись водорода, к выработке
которой не способны сегментоядерные' лейкоциты больного из-за
ферментного дефекта гексозомонофосфатного шунта, необходимого
для киллерного эффекта микрофага. При синдроме Вискотта—Ол-
дрича отмечается неспособность к выработке антител только к тем
микробам, антигены которых содержат полисахариды. При этом
иммунодефиците в основном наблюдается дефект Т-иммунитета,
который увеличивается с возрастом, что подтверждается постепенно
прогрессирующим морфологическим истощением Т-зон перифери-
ческих лимфоидных органов и вариабельными изменениями тиму-
са — от его тяжелой дисплазии до нормальной структуры с разви-
тием атрофических процессов [Nezelof Ch., 1986].
254
Для исхода воспалительного процесса у больных ВИДС так же,
как у плодов пренатального периода и недоношенных новорожден-
ных, характерны неспособность к отграничению воспалительного
очага и развитие генерализации процесса. Собственно говоря, «за-
щитная» роль воспаления, на которую указывал еще И. И. Мечни-
ков, у детей с ВИДС отсутствует.
В качестве иллюстрации такого течения воспалительного процесса
приводим два наблюдения тяжелых врожденных комбинированных
иммунодефицитов (наследственное и приобретенное)1.
Первое наблюдение. Мальчик выписан из родильного дома в хорошем состоянии
на 5-е сутки жизни. Из анамнеза известно, что первый ребенок родителей (брат
мальчика) умер в возрасте 4 мес через 6 сут после того, как был переведен из Института
педиатрии РАМН в отделение реанимации Детской клинической больницы № 1
Москвы в тяжелом состоянии (клинический диагноз: муковисцидоз, легочная форма).
В моче ребенка выявлено большое количество дрожжевых клеток неидентифициро-
ванного гриба. На вскрытии установлены сливная деструктивная пневмония и микро-
цефалия. При микроскопическом исследовании в очагах деструкции легочной ткани
обнаружено большое количество дрожжевых клеток, напоминающих дрожжевые клет-
ки Sporotrichum Schenki. В лимфатических узлах почти полностью отсутствуют лим-
фоциты. встречаются лишь единичные В-фолликулы в корковой зоне. В селезенке —
единичные В-фолликулы. На основании состояния периферических лимфоидных ор-
ганов заподозрены ТКИД и пневмония, обусловленная споротрихией. Второй брат
мальчика умер в возрасте 5 мес; вскрытие производили в прозектуре Детской клини-
ческой больницы № 9 Москвы, где был также поставлен диагноз легочной формы
муковисцидоза, подтвержденный на вскрытии (наличие кист в легком и поджелудочной
железе).
Мальчик, третий в семье, заболел в возрасте 3 мес: появились ограничение дви-
жений левой ножкой, общее беспокойство. Затем состояние резко ухудшилось, и он
был госпитализирован в связи с подозрением на остеомиелит или злокачественную
опухоль левой бедренной кости. На 10-й день болезни на рентгенограмме выявлена
массивная деструкция костной ткани левой бедренной кости. Состояние ухудшилось,
появилась геморрагическая сыпь на коже. При пункции бедра гнойный экссудат не
получен За 4 сут до смерти у ребенка возникли желтуха и резко выраженная тахи-
кардия. Мальчик умер через 16 дней после поступления. Клинический диагноз:
сепсис; острый гематогенный остеомиелит; фульминантный гепатит; отек и набухание
головного мозга.
Протокол вскрытия. Кожные покровы бледные, с множественными пете-
хиями на наружных поверхностях конечностей, отчетливый дисморфизм лица: ушные
раковины асимметричны, гипертелоризм, макроглоссия. Склеры лимонно-желтого цве-
та. Объем средней трети бедра слева 23,5 см, справа 20,5 см. На разрезе мягкие ткани
левого бедра тусклые, местами плотноватые, кое-где более мягкой консистенции,
желтовато-серого цвета с черноватыми очагами кровоизлияний, экссудат отсутствует,
костная ткань здесь полностью разрушена, серого цвета, легко крошится, костный мозг
серовато-красный. Слизистая оболочка верхних дыхательных путей бледная В легких
в толще органа и под плеврой определяются плотные округлые очаги диаметром 1 см,
ив разрезе они желтовато-белесоватые, окружены геморрагическим венчиком. Масса
сеРДца 35 г (норма 31 г), миокард дряблый, тусклый. Имеет место относительная
узость легочного ствола по отношению к периметру аорты над клапанами. Левый
желудочек сердца соответственно умеренно гипертрофирован. Почки иа разрезе без
изменений. На слизистой оболочке желудка по вершинам складок видны точечные
геморрагии. В тонкой кишке слизистая оболочка бледная, групповые лимфатические
Фолликулы отчетливо выражены. Толстая кишка без изменений. Каловые массы
зеленовато-коричневого цвета. Печень на разрезе зеленоватая, не увеличена, парен-
Любезно предоставлены нам доцентом В. С. Калининым и прозектором Детской
клинической больницы № 1 Москвы Е. Л. Элбакидзе, за что выражаем им большую
признательность.
255
хима ее пестрая за счет чередования множественных мелких белесоватых и темно-
вишневых участков неправильной формы диаметром до 0,4 см, встречаются участки
сероватого цвета, окруженные геморрагическим венчиком диаметром до 0,5 см. При
надавливании на желчный пузырь желчь в двенадцатиперстную кишку не выделяется.
Желчный пузырь небольшой, спавшийся, содержит прозрачную коричневатую жид-
кость. Поджелудочная железа дольчатая, масса ее 15 г (норма 11г). Тимус массой
3 г (иорма 10 г) расположен в нижней трети переднего средостения в области сосу-
дистого пучка, в капсуле его видны черноватые кровоизлияния, структура дольчатая.
Масса селезенки 150 г (норма 17 г), на разрезе определяются мелкие (диаметр 0,3 см)
беловатые плотноватые очажки. Лимфатические узлы (паховые, подмышечные, бры-
жеечные, шейные, области бифуркации трахеи) макроскопически не определяются.
Надпочечники листовидные, с узкой корой, щитовидная железа без изменений. Мягкая
мозговая оболочка полнокровная, отечная. Вещество мозга кашицеобразной консистен-
ции, располагается на столе.
Патологоанатомический диагноз (после микроскопического исследо-
вания): тяжелый комбинированный (наследственный) иммунодефицит — синдром
Незелофа; дисплазия тимуса, агенезия лимфатических узлов, наличие В-зависимых
фолликулов в селезенке и лимфатическом аппарате тонкой кишки; выраженный
дисморфизм — асимметрия ушных раковин, гипертелоризм, макроглоссия; относи-
тельная узость легочного ствола; умеренная гипертрофия левого желудочка сердца;
генерализованный споротрихоз; очаговые некрозы с образованием по их периферии
фиброзной ткани в легких; альтеративиый гематогенный остеомиелит; массивные очаги
некроза мягких тканей дистального эпифиза левого бедра с разрушением костной
ткани; очаговые некрозы и кровоизлияния в печени.у селезенке; тотальный некроти-
ческий энцефалит полушарий большого мозга; множественные кровоизлияния в ткань
легких, капсулу и строму тимуса, кожные покровы конечностей.
В приведенном наблюдении 3 ребенка мужского пола в одной
семье умерли в первое полугодие жизни, что характерно для син-
дрома Незелофа, при котором патологический ген сцеплен с Х-хро-
мосомой. Как правило, болеют мальчики. К сожалению, отдаленный
семейный анамнез проследить не удалось. В лимфоидном аппарате
селезенки и кишечника В-зависимые зоны сохранены. В тимусе
выраженные явления дисплазии (рис. 5.4, а). При синдроме Незе-
лофа, который, согласно классификации ВОЗ (1978), относят к
тяжелым комбинированным иммунодефицитам, В-система сохране-
на, но активно не действует из-за отсутствия клеточного звена
иммунитета. Особенностью данного случая, отличающей его от клас-
сического описания синдрома, является агенезия лимфатических
узлов и сочетание с другими врожденными пороками развития —
дисморфизмом лица, пороком развития крупных стволовых сосудов
сердца. Генерализованный споротрихоз — типичная оппортунисти-
ческая инфекция, встречающаяся у детей раннего возраста только
в условиях тяжелого иммунного дефекта [Eipstein-Knesch Е. et al.,
1985]. Sporotrichum — сапрофит, широко распространенный во внеш-
ней среде (пищевых продуктах, воде, пыли, растениях), поражаются
преимущественно легкие, печень, почки, функции опорно-двига-
тельного аппарата нарушаются, по данным О. К. Хмельницкого
(1973), у 10% больных.
В приведенном наблюдении и брат мальчика умер от пневмонии.
При исследовании его легкйх был заподозрен споротрихоз, однако
оно, к сожалению, не было доведено до конца. Споротрихии в виде
дрожжевых клеток обнаруживали в большом количестве во всех
пораженных органах (головном мозге, печени, селезенке, легких,
256
а также в некротических массах тканей левого бедра) (рис. 5.4, в).
При этом в легких некротические очаги были окружены отчетливо
выраженной фиброзной капсулой. Кроме некротических изменений,
по периферии некроза расположена весьма умеренная зона моно-
цитарной и лимфоидной инфильтрации. В крупных сосудах — из-
менения в виде продуктивного эндоваскулита с перекалибровкой
сосудов. При окраске препаратов по Вейгерту, которую О. К. Хмель-
ницкий (1973) рекомендует проводить для подтверждения диагноза
споротрихоза, дрожжевые клетки выявляются очень хорошо (см.
рис. 5.4, б).
Приведенное наблюдение подтверждает тот факт, что при ВИДС
в воспалительном очаге преобладает альтеративный компонент вос-
паления. В данном наблюдении, вероятно, процесс начался с пора-
жения легких, так как изменения в них были давними. Об этом
свидетельствует наличие фиброзного вала вокруг очагов распада и
склеротических изменений сосудов. Вслед за поражением легких,
протекавшим бессимптомно, произошла гематогенная диссеминация
с генерализацией, клинически проявившаяся в виде гематогенного
остеомиелита левого бедра. Последнее подтверждает указанную нами
особенность воспаления при ВИДС — полную неспособность орга-
низма ребенка, в данном случае с синдромом Незелофа, к отгра-
ничению местного процесса, что приводит к развитию тяжелого
генерализованного заболевания в виде споротрихозного сепсиса с
поражением многих органов.
Второе наблюдение. Новорожденный мужского пола, родившийся на 41-й неделе
беременности от матери 20 лет, перенесшей до настоящих родов эндометрит после
аборта. Масса тела ребенка при рождении 4700 г, длина 56 см, что расценивается как
макросомия (крупный плод). При рождении состояние средней тяжести. Через 7 ч
оно резко ухудшилось: одышка (80 дыханий в 1 мин), серый цвет кожных покровов,
рвота измененной кровью, кровавая пена нз отверстий носа и рта, увеличение печени
др 4 см. В крови — высокий лейкоцитоз со сдвигом влево. На 7-е сутки жизни ребенок
умер.
Протокол вскрытия. Новорожденный мальчик повышенного питания, кож-
ные покровы желтушные. Кости черепа очень плотные. Головной мозг дряблый,
оболочки его прозрачные, полнокровные, на разрезе дифференцировка на серое и
белое вещество не выражена, желудочки щелевидные. В области коры и зрительного
бугра с обеих сторон видны мелкие сероватые кашицеобразные очажки неправильной
формы. В области задних рогов боковых желудочков перивентрикулярно располагаются
несколько плотных фокусов, беловато-желтого цвета, неправильной формы. Висце-
ральная плевра обоих легких тусклая с пленчатыми наложениями. Субплеврально
видны множественные округлые очажки беловатого цвета размером 0.1 см. Такого же
вида и размера очажки встречаются в миокарде, слизистой оболочке пищеварительного
тракта, под капсулой печени, селезенки, почек, надпочечников, поджелудочной же-
лезы. Лимфатические узлы мелкие. Тимус массой 5 г (норма 12,8 г), резко уменьшен
в размерах.
Патологоанатомический диагноз (после микроскопического исследова-
ния): врожденный генерализованный кандидоз; множественные гранулемы в пищевари-
тельном тракте, печени, селезенке, почках, поджелудочной железе, миокарде, легких,
надпочечниках, в головном мозге они сочетаются с очагами периваскулярной лейкома-
ляцнн н размягчения вещества мозга в области коры и зрительных бугров; аспирационная
очаговая пневмония с фибринозно-гнойным плевритом; дистрофия паренхиматозных
органов; врожденный (приобретенный) неклассифицируемый иммунодефицит, преиму-
щественно клеточного типа; гипоплазия и незрелость ткани тимуса (ранняя фетопатия)
и Т-зависимых зон лимфатических узлов и селезенки; макросомия.
9—407
257
Рис. 5.4. Врожденный комбинированный иммунодефицит Незелофа. Спо-
ротрихозный сепсис (мальчик 4 мес) (препараты В. С. Калинина).
а — тимус. Дисплазия с образованием железистоподобных структур, полным отсутствием
тимических телец и единичными лимфоцитами в дольках. Окраска гематом:илином и эозином.
*120; б — остеомиелит левого бедра. Среди некротических масс обилие клеток Sporotrichii
Schenki?. Окраска гематоксилином и эозином. «120. Внизу справа — клетки споротрихии при
окраске по Вейгерту. х 120; в — очаг некроза в легочной ткани, окруженный лимфомоноцитарным
инфильтратом (внизу). Отчетливо видно формирование тяжей фиброзной ткани. Много клеток
споротрихии. Окраска гематоксилином и эозином. * 120.
При микроскопическом исследовании в гранулемах с центральными некрозами
обнаружены мицелий PAS-позитивного гриба, морфологически соответствующего ми-
целию Candida aibicans. По периферии некрозов — гистиоциты, лимфоциты и еди-
ничные сегментоядериые лейкоциты (рис. 5.5, а, б). При окраске по Левадити листерии
и бледная трепанема не обнаружены.
Во втором наблюдении, судя по изменениям тимуса, в некоторых
дольках которого обнаружены тимические тельца с инверсией слоев
и опустошением корковой зоны лимфоцитами, можно говорить о
попытке реакции органа на антигенную стимуляцию наряду с его
незрелостью в виде образования мелких фестончатых долек
(рис. 5.5, в) и незавершенного заселения корковой зоны большин-
ства долек лимфоцитами. Дефект развития центрального органа
иммуногенеза возник в период внутриутробного развития под вли-
янием инфекционного агента, вероятно Candida albicans, о чем
свидетельствует, кроме того, эндометрит, перенесенный матерью
(данные анамнеза). По данным А. Ф. Яковцевой (1988), макросомия
плода указывает на врожденный дисбаланс его эндокринно-иммун-
ного статуса. Явилась ли макросомия следствием воздействия экзо-
генного фактора, обусловившего развитие энцефалита, или была
генотипической, точно установить невозможно. Так или иначе сле-
дует полагать, что в данном случае иммунодефицит возник в период
внутриутробного развития при почти полностью сформированной
иммунной системе. В связи с этим мы считаем, что кандидоз у
этого ребенка является основным заболеванием, а иммунодефицит
— его осложнением.
Таким образом, оба приведенных наблюдения иллюстрируют тот
факт, что при ВИДС воспалительный процесс имеет преимущест-
венно альтеративный характер со слабовыраженным продуктивным,
почти полным отсутствием экссудативного компонента и чрезвы-
чайно резко выраженной генерализацией инфекционного процесса,
обусловленного условно-патогенной (оппортунистической) флорой.
Врожденный характер иммунодефицитных синдромов, описанных
нами, подтверждает, кроме того, возможность не только наследст-
венной этиологии иммунодефицитов, но и прямой связи их с внут-
риутробным инфицированием, которое прежде всего сказывается на
структуре центрального органа иммуногенеза — тимусе и дает
возможность судить с большей или меньшей степенью вероятности
об этиологии врожденного иммунодефицитного синдрома.
Из изложенного выше следует, что при врожденных иммуноде-
фицитных синдромах любой этиологии (наследственной или внут-
риутробно приобретенной) воспалительный процесс обладает рядом
особенностей, имеющих большое сходство с проявлениями воспали-
тельной реакции в антенатальном периоде, у недоношенных детей,
новорожденных и детей грудного возраста вследствие незрелости их
иммунного статуса. Однако при ВИДС эти особенности воспали-
тельной реакции выражены более резко, встречаются более посто-
янно, особенно у больных с тяжелыми комбинированными имму-
нодефицитами. Морфологические особенности выражаются, во-пер-
вых, в преобладании альтеративно-продуктивных компонентов
9*
259
Рис. 5.5. Врожденный (приобретенный) неклассифицируемый иммуноде-
фицит преимущественно клеточного типа. Врожденный генерализованный
кандидоз.
а — в очагах некроза ткани головного мозга определяются мицелии Candida albicans. По
периферии этих очагов — умеренная пролиферация глии моноцитарными клеточными эле-
ментами. ШИ К-реакция. >120; б — множественные сливающиеся гранулемы почки, среди
которых видны единичные сохранившиеся почечные клубочки. Окраска гематоксилином и
эозином. >120; в — дольки незрелого тимуса имеют фестончатые очертания, единичные
лимфоциты. Окраска гематоксилином и эозином. >120 (препараты И. Л. Элбакидзе).
воспалительной реакции с пролиферацией филогенетически более
древних клеточных популяций; во-вторых, в отсутствие способности
к отграничению воспалительного процессса, что приводит к его
генерализации с развитием очагов-отсевов альтеративного или гра-
нулематозного характера. Следует иметь в виду, что характер вос-
палительного процесса, его локализация и этиология (инфекционный
агент), как и исход, в известной степени связаны с определенной
формой иммунодефицита (комбинированной, клеточной, гумораль-
ной, фагоцитарной) и различными вариантами форм. Приведенные
данные еще раз подтверждают тесную связь воспалительного про-
цесса с состоянием иммунной системы организма.
ГЛАВА 6
НЕРВНАЯ ТРОФИКА И ВОСПАЛЕНИЕ
6.1. НЕКОТОРЫЕ ИСТОРИЧЕСКИЕ АСПЕКТЫ ИЗУЧЕНИЯ
НЕРВНОЙ ТРОФИКИ В НОРМЕ И ПРИ ПАТОЛОГИИ
Проблема нервной трофики в экспериментальной и клинической
медицине остается предметом оживленной и даже острой полемики,
хотя мало кто отрицает существование и важное значение нервно-
трофических влияний в жизнедеятельности организма, работе сис-
тем, органов, клеток в нормальных условиях и при патологии. Пока
трудно дать однозначный ответ на вопросы, каким образом реали-
зуются нервнотрофические влияния, в чем состоит их связь с фун-
кциональными влияниями нервов, каковы конкретные интрацеллю-
лярные механизмы нервнотрофического контроля и его значение
при разнообразных патологических процессах. Мы приведем лишь
наиболее распространенные точки зрения на те или иные аспекты
нервной трофики, не претендуя на полное раскрытие всей проблемы.
Основоположники учения о нервной трофике М. Magendie (1824)
и S. Samuel (1879) достаточно определенно высказывались о ее
сущности и общебиологическом значении. Они считали, что обмен
веществ в клетках, их деятельность и поддержание структурной
организации могут осуществляться и без нервных влияний. Вместе
с тем в условиях денервации все эти процессы становятся инертными,
не совпадают с потребностями организма и зависят главным образом
от прямого воздействия тех или иных раздражителей, изменяясь в
соответствии с их характером и интенсивностью. Благодаря нервным
влияниям деятельность клеток колеблется в широких пределах,
быстро изменяется от состояния относительного покоя до высокого
напряжения. В этих сигнальных реакциях клеток также отражены
свойства раздражителя, но одновременно и свойства организма, и
реакции клеток направлены на его приспособление к условиям
окружающей среды. Таким образом, уже в то время справедливо
полагали, что нервные влияния обеспечивают защитно-приспособи-
тельную и компенсаторную перестройку относительно самостоятель-
но протекающих обмена веществ, обновления структур и функции
клеток организма.
По мнению И. П. Павлова (1898), нервнотрофические влияния
регулируют «уровень интенсивности» внутриклеточного обмена, они
имеют особенно важное значение в приспособительной перестройке
метаболизма в рамках целого организма. В данном случае речь идет
не о запуске или остановке метаболизма и деятельности клеток, а
262
о приспособительной тонкой регуляции текущего «самостоятельно»
и «независимо» от нервной системы внутриклеточного обмена ве-
ществ [Саркисов Д. С., 1977].
Как известно, И. П. Павлов выявил три формы нервного конт-
роля: вазомоторный, трофический и функциональный. На совре-
менном уровне развития медицины трофические (обменные) и фун-
кциональные изменения в клетке рассматривают в неразрывном
единстве со структурными перестройками. Функциональные и тро-
фические влияния нервной системы в нормальных условиях реали-
зуются не только в сфере деятельности и обмена веществ, но и в
сфере обновления ультраструктур клетки, изменения их количества
или массы, массы всего органа. Важным в представлениях И. П. Пав-
лова является то, что он распространил учение о рефлекторной
деятельности нервной системы на нервнотрофические процессы, вы-
двигая и развивая проблему трофических рефлексов. По его мнению,
рефлекторная деятельность нервной системы обеспечивает целост-
ность организма и особенности его взаимодействия с окружающей
средой в связи не только с оптимальной интеграцией различных
функции, но и с соответствующим изменением обмена веществ в
разных органах.
Представление о нервной трофике как фундаментальном меха-
низме тонкой приспособительной регуляции текущего «независимо»
от нервной системы обмена веществ в клетках является краеуголь-
ным камнем в учении Л. А. Орбели об адаптационно-трофической
функции симпатической нервной системы (1938). Л. А. Орбели и
его сотрудники на основании полученных фактов (феномен Орбе-
ли—Гинецинского, Орбели—Кунстман) аргументировали наличие
трофического влияния соответствующих нервных волокон на разные
структуры. По мнению Л. А. Орбели, симпатические влияния обес-
печивают адаптивное изменение обмена веществ в органах и тканях
в соответствии с их функциональной активностью. При этом нер-
внотрофические влияния определяют функциональные свойства и
ультраструктурное обеспечение не только клеток и органов-испол-
нителей, но также чувствительных нейронов и нейронов высших
отделов мозга. Это означает, что данные влияния определяют осо-
бенности восприятия сигналов из внутренней и внешней среды, а
также их переработку мозгом. По Л. А. Орбели, в условиях пато-
логии, например в случае тяжелой гипоксии, функциональные вли-
яния, стимулирующие деятельность органа и вызывающие повыше-
ние энергозатрат, могут выпадать, однако при этом сохраняются
более древние нервнотрофические влияния, способствующие сохра-
нению обмена веществ в тканях на относительно устойчивом, хотя
и сниженном уровне, а также структуры клеток. Таким образом,
в условиях патологии возможно ограничение нервных влияний сфе-
рой метаболических процессов в тканях или, как писал Л. А. Орбели,
«переход регуляции в область обмена веществ».
К. М. Быковым (1954) получены данные, свидетельствующие о
Функциональной связи коры полушарий большого мозга и внутрен-
них органов, обеспечивающих постоянство внутренней среды и нор-
263
мальное течение трофических процессов в организме. В этих исс-
ледованиях установлено существование двух видов влияния нейронов
коры полушарий большого мозга на внутренние органы — пусковых
и корригирующих. Пусковые влияния обеспечивают переход органа
от состояния относительного покоя к деятельности, а корригирую-
щие — изменяют текущую работу органа в соответствии с потреб-
ностями организма в изменяющихся условиях. И пусковые, и кор-
ригирующие влияния включаются на основе интероцептивных ус-
ловнорефлекторных связей мозга, обеспечивая нормальное, течение
обмена веществ в тканях. Расстройства коркового управления вис-
церальными функциями разного происхождения могут привести к
нейродистрофическим процессам в тканях, например к появлению
язв в желудочно-кишечном тракте.
А. Д. Сперанским (1955) установлено, что нарушение нервно-
трофических процессов в организме может возникнуть при дей-
ствии раздражителей разной природы и повреждении любого уча-
стка периферической или центральной нервной системы. Ди-
строфические процессы в разных органах появляются и при
раздражении периферических нервов, и нервных ганглиев, и самого
мозга. Эти факты позволили, разработать важное для патологии
положение о существовании стереотипной формы нейрогенных рас-
стройств трофики — нейродистрофии. Нейродистрофия может ле-
жать в основе разнообразных заболеваний как нервной системы,
так и других систем и органов, а также сопутствовать развитию
многих болезней. Известно положение А. Д. Сперанского о роли
следовых реакций нервной системы в рецидивировании патологи-
ческих процессов. Он установил, в частности, что рецидив забо-
левания, например столбняка, может возникать в результате не-
специфической рефлекторной или центрогенной стимуляции моз-
говых образований («второй удар»).
Результаты клинических наблюдений свидетельствуют о тесной
связи состояния нервной системы и трофики тканей. Описаны ней-
рогенные атрофии при денервации органов, особенно поперечнопо-
лосатых мышц, нейрогенные трофические язвы, появляющиеся при
разного рода повреждениях нервной системы. Объяснения этим яв-
лениям находили, как правило, в ослаблении функции органов
(атрофия от бездеятельности), снижении устойчивости тканей к
действию повреждающих факторов, а также факторов, вызывающих
дистрофию’ и воспаление, нарушении органного и микроциркуля-
торного кровообращения. Трофические расстройства обнаруживали
не только при нарушениях целостности нервов, сплетений или
повреждениях мозга, но и при так называемых функциональных
расстройствах нервной деятельности, например при неврозах. В оте-
чественной клинической медицине идея нервной трофики и важной
роли ее нарушений в патологии была активно воспринята, развита
и внедрена в практику А. В. Вишневским (1936). Используя ново-
каиновую блокаду при различных формах патологии, он не огра-
ничивал ее позитивное влияние прерыванием патологических «оча-
гов» в мозге, а считал следствием «сложившихся в нервной системе
264
патологических комбинаций» и нарушении нервнотрофических про-
цессов в организме.
И. В. Давыдовский (1969) указывал на широкое распространение
нервнотрофических нарушений в патологии, считая их ответствен-
ными за возникновение дистрофии, некроза и воспаления при ави-
таминозах, лепре, язве стопы, болезни Рейно, пролежнях, отморо-
жениях и многих других патологических процессах и заболеваниях.
Он справедливо указывал на сложность и многообразие механизмов
возникновения нервнотрофических расстройств, среди которых на-
иболее важное место занимают собственно обменные, вазомоторные
нарушения, нарушения чувствительности, снижающие устойчивость
тканей к действию повреждающих агентов.
В настоящее время отсутствуют доказательства существования
особой трофической иннервации, т. е. таких специализированных
нейронов, которые регулируют только обмен веществ в тканях и
развитие клеток, не изменяя их деятельности в нормальных усло-
виях. Наряду с этим установлено, что и в норме, и при патологии
отмечается сопряженность функциональных и метаболических ре-
гуляторных влияний, находящих соответствующее отражение в уль-
траструктурных изменениях клеток. Изменение функции и адек-
ватное новому состоянию метаболическое обеспечение сопровожда-
ются перестройкой биогенеза внутриклеточных структур, в котором
обычно участвует генетический аппарат клетки [Саркисов Д. С.,
1977]. Взаимозависимость функции, структуры и обмена веществ в
клетке, сопряженность их изменений под влиянием нейромедиатора,
действие которого реализуется через единый рецепторный аппарат,
является одним из важнейших механизмов сохранения ее целост-
ности и нормальной деятельности.
Вместе с тем связь нейрона и исполнительной клетки, носящая
импульсный характер и обусловленная высвобождением и действием
нейромедиаторов, не единственная. Эта форма нервной регуляции
основана на чрезвычайно быстро возникающих и прекращающихся
процессах, а именно: нервных импульсах, синаптических реакциях
и изменениях функции в результате смещения ионных градиентов
на мембранах клетки-мишени. Существует другая, более древняя,
форма взаимодействия нейрона и иннервируемой клетки, не свя-
занная с импульсной активностью нейрона, а обусловленная прин-
ципиально иными механизмами. Эта форма нервной регуляции,
наоборот, основана на медленно происходящих процессах, связанных
с перемещением в нейронах синтезируемых веществ нейроплазма-
тическим током и поступлением данных соединений в иннервиру-
емую клетку, что обеспечивает ее созревание, дифференцировку,
поддержание структуры и характерный для зрелой клетки обмен
веществ.
Такая неимпульсная активность нейрона обеспечивает передачу
клеткам-мишеням долгосрочной информации и, перестраивая в них
обмен веществ и ультраструктуру, определяет функциональные свой-
ства.
265
6.2. СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ
О НЕРВНОТРОФИЧЕСКОЙ ФУНКЦИИ
6.2.1. Межклеточное взаимодействие
и нервная трофика
Проблема нервной трофики является одним из аспектов межкле-
точного взаимодействия; в этом плане изучение трофических связей
клеток одной популяции (нейрон — нейрон) и разных популяций
(нейрон — исполнительная клетка) представляется чрезвычайно
перспективным [Струков А. И., 1982]. Принято считать, что един-
ство и целостность организма определяются прежде всего деятель-
ностью нервной системы, ее импульсной (сигнальной) и рефлектор-
ной активностью, которая обеспечивает функциональные связи меж-
ду клетками, органами и анатомо-физиологическими системами.
Наряду с этим известно, что существуют живые организмы, в
которых развитая нервная система отсутствует, а в раннем периоде
эмбриогенеза живой сложный организм развивается до возникнове-
ния нервной системы. Кроме того, с точки зрения принципа нервизма
неясно, какими механизмами обеспечивается общий план строения
самой нервной системы всех животных. Он устанавливается в эм-
бриональном периоде до появления импульсной активности нейронов
[Кокина Н. Н., 1974 ]. Важно также, что в процессе эмбрионального
развития или после денервации органа у взрослого каждое нервное
волокне.растет по направлению к своему, и только своему адресату
(рецептор, эффектор, нейрон); это явление существует до возник-
новения импульсной активности в эмбриогенезе или при прерывании
распространения потенциалов в случае повреждения нерва. По мне-
нию Г. И. Косицкого и Г. Г. Ревич (1975), принцип нервизма при-
обретает более глубокий смысл, если учесть, что нервная система
не только регулирует функцию органов и тканей путем передачи
сигналов (импульсов), но и организует структуру этих органов и
тканей, обеспечивая саму сигнальную регуляцию и существование
организма как целого.
Организм простейшего существа — это одна клетка, которая
самостоятельно осуществляет многообразные процессы жизнедея-
тельности. Эволюция шла по пути создания многоклеточности, диф-
ференциации клеток и «разделения труда», рассчитанного на спе-
циализацию функции и соответственно своеобразие обмена и струк-
туры клеток. Все клетки многоклеточного организма имеют общий
набор генов, так как они происходят из одной оплодотворенной
яйцеклетки, а специализация обмена, структуры и функции обес-
печивается разнообразием репрессированных и депрессированных
генов. «Разделение труда» обеспечило выполнение узкоспециализи-
рованной деятельности, а следовательно, высокую степень приспо-
собляемости к изменяющейся среде. При этом клетки в той или
иной степени утратили многие процессы, характерные для однокле-
точных, потеряли самостоятельность и стали зависеть от других.
Чем выше степень специализации, тем более клетка зависит от
266
других клеток, с которыми она кооперативно взаимодействует
[Шмальгаузен И. И., I960].
Межклеточное взаимодействие не может осуществляться только на
основе нервно-импульсных связей, так как они появляются в эмбрио-
генезе позднее, уже после реализации плана строения нервной системы
и организма. Нервно-импульсные влияния не могут обеспечивать рас-
познавание клетки клеткой, выбор ею единственного партнера среди
множества других клеток и образования единственного контакта, т. е.
формирование упорядоченной структуры. Межклеточное взаимодей-
ствие такого характера, которое обеспечивает упорядоченную струк-
туру и соответствие степени зрелости клеток, может быть достигнуто
только с помощью сложных, длительно действующих химических со-
единений, несущих многообразную информацию, а не сравнительно
простых, быстро распадающихся веществ, какими являются нейроме-
диаторы [Косицкий Г. И., Ревич Г. Г., 1975].
Значение взаимодействия клеток одной популяции, вероятно,
состоит в поддержании их оптимального для организма количества
в рамках детерминированного региона, координации функции и
распределении нагрузки в соответствии с принципом функциональ-
но-структурной гетерогенности, сохранении функциональных воз-
можностей органа и их оптимального структурного обеспечения и
др. Значение взаимодействия клеток разных популяций состоит в
обеспечении их питания и созревания, соответствия друг другу по
уровню дифференцировки, функциональным и структурным воз-
можностям, взаиморегуляции, определяющей целостность органа на
основе взаимодействия разных тканей, и т. п.
В целом следует считать, что нервнотрофическое влияние — это
лишь одно из проявлений межклеточного взаимодействия клеток
одинаковых или разных популяций. В литературе приведена точка
зрения, согласно которой каждый нейрон и иннервируемые им клет-
ки, а также клетки-сателлиты (глия, шванновские клетки, клетки
соединительной ткани) составляют регионарную трофическую мик-
росистему. Эта система функционирует как единое образование, и
это единство обеспечивается межклеточным взаимодействием с по-
мощью трофогенов, т. е. регионарными механизмами саморегуляции.
Наряду с этим регионарная система находится под контролем эн-
докринной, иммунной и других систем [Крыжановский Г. Н., 1989].
Межклеточное взаимодействие' нервнотрофического характера
осуществляется с помощью нейроплазматического тока, т. е. дви-
жения нейроплазмы от ядра к периферии нейрона и в обратном
направлении. Нейроплазматический ток делят на аксоплазматиче-
ский (аксоток) и дендроплазматический (дендроток), а также на
прямой и обратный (ретроградный). Ток нейроплазмы — универ-
сальное явление, характерное для животных всех видов, имеющих
нервную систему; он происходит как в центральных, так и в пе-
риферических нейронах.
Р. Н. Глебов и Г. Н. Крыжановский (1978) выделяют следующие
Функции тока нейроплазмы: обеспечение эффективности и надежной
передачи нервных импульсов; восполнение запаса ферментов, ме-
267
таболитоз и органелл в нервных окончаниях; осуществление роста
отростков у нейробластов и нейронов растущего организма, регене-
рации нервов и пресинаптических образований; реализация транс-
синаптической передачи трофогенов и трофического материала эф-
фекторным структурам; передача от синапсов к телу нейрона с
помощью обратной связи информации (обратный нейроплазматиче-
ский ок); поддержание высокого уровня синтетической активност
в нейроне и др. Различают медленный (0,5—5 мм/с) и быстрый
(10—500 мм/с) аксоток.
Основная роль медленного аксотока состоит в перемещении мо-
лекул и структур, входящих в транспортную систему цитоплазма-
тических волокон (нейрофиламенты и микротрубочки), которые в
свою очередь обеспечивают быстрый аксоток. С помощью быстрого
аксотока транспортируются органеллы (синаптические пузырьки,
митохондрии, лизосомы, фрагменты цитоплазматической сети),
структурные белки, нейроспецифические белки, ферменты, амино-
кислоты и т. п. Обратный аксоток осуществляется в меньшем объеме,
чем прямой. С его помощью удаляются продукты обмена из тер-
миналей, регулируются объем и скорость транспорта веществ по
аксонам, внутриклеточная регенерация, осуществляется обратная
связь нервных окончаний и тела нейрона. Обратным аксотоком в
тело нейрона доставляются трофогены регулируемых клеток. При
денервации в этих клетках выработка трофогенов, стимулирующих
рост нервных волокон, увеличивается. При регенерации нерва и
врастднии волокон в ткань выработка этих трофогенов в клетках-
мишенях на уровне генетического аппарата может угнетаться, но
при этом начинается образование других трофогенов, поддержива-
ющих стационарное состояние межклеточных синапсов [Крыжанов-
ский Г. Н., 1989].
6.2.2. Значение нервнотрофических влияний
и их механизмы
Трофическое влияние нейрона на другие нейроны или исполнитель-
ные клетки осуществляется с помощью особых соединений, пол-
учивших название «трофогены». Эти вещества белковой и, возможно,
нуклеиновой или другой природы выделяются из окончаний аксона
и поступают в синаптическую щель, из которой они перемещаются
в иннервируемую клетку. К трофогенам, в частности, относятся
вещества белковой природы, способствующие росту нервов (факторы
роста нервов). Эти соединения в большом количестве обнаруживают
в развивающейся нервной системе в эмбриональном периоде, а
также при регенерации нервов после их повреждения. При интак-
тных нейронах синтез этих белков угнетен вследствие репрессии
соответствующих генов [Крыжановский Г. Н., 1989]. Биосинтез тро-
фогенов регулируется агентами, которые высвобождаются при по-
вреждении мембран нейронов или их естественной стимуляции, а
также в случае угнетения активности нейронов.
268
В плазматической мембране нейронов содержатся ганглиозиды
(сиалогликолипвды), например GM-1, которые усиливают рост и
регенерацию нервов, повышают устойчивость нейронов к повреж-
дению, вызывают гипертрофию сохранившихся нервных клеток.
Предполагают, что ганглиозиды активируют образование трофогенов
и вторичных мессенджеров. К регуляторам этого процесса относят
также классические нейромедиаторы, которые изменяют уровень
вторичных внутриклеточных мессенджеров; цАМФ и соответственно
цАМФ-зависимые протеинкиназы могут воздействовать на ядерный
аппарат и изменять активность генов, определяющих образование
трофических факторов. Сходную функцию могут выполнять актив-
ные пептиды (энкефалины, /?-эндорфин, вещество Р и др.), играющие
роль модуляторов нейротрансмиссии. Они также имеют большое
значение как индукторы трофогенов или даже непосредственно вы-
полняют функцию трофогенов [Крыжановский Г. Н., 1989]. Данные
о важной роли нейромедиаторов и активных пептидов в осуществ-
лении нервнотрофической функции свидетельствуют о тесной связи
функциональных и трофических влияний.
Установлено, что трофическое влияние нейрона на клетку-ми-
шень реализуется через ее генетический аппарат (схема 6.1). Полу-
чено много доказательств того, что нервнотрофические влияния
определяют степень дифференцировки ткани и денервация приводит
к утрате дифференцировки. По своему метаболизму, структуре и
функциональным свойствам денервированная ткань приближается
к эмбриональной [Зайко Н. Н., 1974]. Поступая в клетку-мишень
путем эндоцитоза, трофогены непосредственно включаются в струк-
турно-метаболические процессы или воздействуют на генетический
аппарат, обусловливая либо экспрессию, либо репрессию опреде-
ленных генов. При непосредственном включении формируются срав-
нительно кратковременные изменения обмена веществ и ультра-
структуры клетки, а при опосредованном включении, через гене-
тический аппарат, долговременные и устойчивые изменения свойств
клетки-мишени [Крыжановский Г. Н., 1989]. В частности, в процессе
эмбрионального развития и при регенерации перерезанных аксонов
врастающие в ткань нервные волокна выделяют трофогены, обес-
печивающие созревание и высокую дифференцировку ре!улируемых
клеток. Наоборот, сами эти клетки выделяют свои трофогены, ори-
ентирующие и стимулирующие рост нервных волокон, а также
обеспечивающие установление их синаптических связей.
Трофогены определяют функциональные свойства иннервируе-
мых клеток, особенности обмена и ультраструктуры, а также
степень их дифференцировки. При постганглионарной денервации
чувствительность этих клеток-мишеней к нейромедиаторам резко
возрастает в соответствии с законом Кэннона—Розенблюта. Изве-
стно, что к моменту рождения вся поверхность волокон скелетных
мышц животных обладает чувствительностью к нейромедиатору
ацетилхолину, а в процессе постнатального развития зона холи-
иорецепции суживается, ограничиваясь постсинаптической мемб-
раной. Б случае денервации мышцы зона холинорецепции вновь
269
3
Схема 6.1. Импульсная (медиаторная) и неимпульсная (трофогенная) связь нейрона и клетки-мишени.
I — нейрон, 1а — тело нейрона, 16 — окончание одного аксона; 2 — окончания других аксонов; 3 — клетка-мишень; 4 — импульсное влияние,
4а — везикулы с нейромедиатором (первичным мессенджером), 46 — рецепторы постсииаптической мембраны; 5 — вторичные мессенджеры; 6 —
прямой аксоплазматический ток; 7 — обратный аксоплазматический ток; $ — трофогены клетки-мишени, 8а — трофогены, вызывающие экспрессию
генов, 86 — трофогены, вызывающие репрессию геноа; 9 — трофогены нейрона, 9а — трофогены, вызывающие экспрессию генов, 96 — трофогены,
вызывающие репрессию генов. Я — ядро.
расширяется, распространяясь на всю поверхность мышечного во-
локна, однако она суживается при реиннервации. Установлено,
что в процессе врастания нервных волокон в мышцу трофогены,
переходя в нее транссинаптическим путем, вызывают репрессию
синтеза холинорецепторов на уровне транскрипции, поскольку в
условиях денервации их усиленное образование тормозится инги-
биторами синтеза белка и РНК [Глебов Р. Н., Крыжановский Г. Н.,
1978].
При денервации (перерезка или экстирпация нервных элементов,
иммуносимпатэктомия) возможно растормаживание пролифератив-
ной потенции, например эпителия роговицы и ткани хрусталика
глаза, клеток кроветворной ткани. В последнем случае при сме-
шанной (афферентно-эфферентной) денервации участка костного
мозга увеличивается количество клеток с хромосомными аберраци-
ями. Вероятно, в этом случае происходит не только нарушение
метаболизма на денервируемом участке, но и расстройство элими-
нации мутантных клеток [Волкова О. В., 1974]. В денервированной
ткани изменяется антигенный состав, и в результате этого возникает
индукция аутоиммунной реакции, что может стать основой развития
реакции отторжения [Зайко Н. Н., 1974]. Сходные результаты при-
водит 3. И. Собиева (1974), которая показала, что при спинальной
или вагусной деафферентации нарушается антигенная структура
миокарда и в крови животных появляются кардиальные аутоанти-
тела. Иннервационный аппарат имеет непосредственное отношение
к субклеточной организации цитоплазмы. Он определяет степень
дифференцировки и структурную зрелость субклеточных органелл.
Иннервационный аппарат во многом определяет реактивные свойства
органов в отношении регулирующих влияний. При денервации эн-
докринные железы неадекватно реагируют на тропные гормоны
[Волкова О. В., 1974], изменяются метаболические реакции разных
органов и тканей (желудок, скелетные мышцы, матка) на гидро-
кортизон и эстрадиол, что, вероятно, связано с изменением уровня
цАМФ и цГМФ в тканях [Зайко Н. Н. и др., 1989; Harris А. I.,
1974].
6.2.3. Нервнотрофические влияния на разных
уровнях нервной системы
Трофические функции свойственны не только конечным нейронам,
регулирующим деятельность клеток исполнительных органов, но
также центральным и афферентным нейронам. Известно, что пе-
ререзка афферентных нервов вызывает дистрофические изменения
в тканях; в то же время вещества, образующиеся в этой ткани,
могут поступать по афферентным нервам в чувствительные нейроны
и даже в нейроны центральной нервной системы (ЦНС) [Гут-
ман Н. Э., 1979]. По данным Г. Г. Князева и соавт. (1990), пере-
резка как нейритов, так и дендритов чувствительных нейронов
тройничного (гассерова) узла приводит к одинаковым дистрофиче-
271
ским изменениям в роговице глаза белых крыс. Аналогичные рас-
стройства возникают при фармакологической деафферентации глаза
при ретробульбарном введении анестетика тримекаина. При этом
указанные расстройства не связаны с изменением функциональных
влияний вегетативных нервов или вторичным нарушением деятель-
ности гипофиза, так как десимпатизация, введение М-холинолитиков
и гипофизэктомия не предупреждают развития нейропаралитиче-
ского кератита при деафферентации.
Н. И. Гращенков (1964) и другие авторы выделили и описали
общий нейродистрофический синдром, возникающий после перене-
сенных энцефалитов, черепно-мозговых травм, сосудистых и других
поражений мозга. Этот синдром проявляется распространенной ли-
подистрофией, гемиатрофией лица, пигментной дистрофией Лешке,
тотальным облысением, нарушением трофики костной ткани, оте-
ками кожи и подкожной жировой клетчатки и др. Получены данные,
свидетельствующие о том, что нейродистрофический синдром воз-
никает как следствие дистрофических процессов, происходящих в
ядрах гипоталамуса. В его развитии важную роль играют нарушение
функции эндокринных желез, вегетативно-сосудистые расстройства,
нарушение терморегуляции, сна, аппетита и т. д.
Крайне тяжелые изменения обмена веществ с развитием атрофии
или дистрофии возникают при различных по происхождению пора-
жениях эфферентных нервов, обеспечивающих трофическими вли-
яниями слизистые оболочки, кожу, мышцы, кости, внутренние ор-
ганы* и другие образования. Нарушения трофической деятельности
эфферентных нейронов могут возникать не только в результате их
непосредственного поражения, но и вследствие нарушения деятель-
ности центральных, в том числе вставочных, или афферентных,
нейронов. Из этого следует, что нейрон рефлекторной дуги может
оказывать, помимо импульсного, трофическое влияние на нейроны
другого уровня. Так, афферентный нейрон контролирует трофиче-
ские процессы в центральном, а через него во вставочном или
эфферентном нейроне.
В то же время ткани-мишени ретроградно могут оказывать тро-
фическое влияние на эффекторные нейроны, а через них на вста-
вочные, центральные и афферентные нейроны. В этом смысле ка-
жется справедливым положение о том, что каждый нерв, какую бы
функцию он ни выполнял, является одновременно и трофическим
нервом [Сп ранский А. Д., 1955 ]. По мнению Г. Н. Крыжановского
(1989), нервная система представляет собой единую нервнотрофи-
ческую сеть, в которой соседние и отдаленные нейроны обмениваются
не только импульсными, но и трофическими сигналами, а также
своим пластическим материалом. По этой сети могут распростра-
няться как экзогенные патогенные факторы, например яды, ней-
ротропные вирусы, так и эндогенные патогенные факторы нейро-
нов — патотрофогены.
272
6.3. РАССТРОЙСТВА НЕРВНОЙ ТРОФИКИ
Нервнотрофическая функция может нарушаться как при поражении
самой нервной системы, так и при патологических процессах в
регулируемых органах. Это приводит к выраженным расстройствам
в них обмена веществ, структуры и деятельности, которые прояв-
ляются, в частности, в форме дистрофии. Предполагают, что воз-
никновение собственно нервнотрофических расстройств, т. е. свя-
занных с нейроплазматическим током, возможно при уменьшении
(прекращении) или увеличении поступления в регулируемые клетки
трофогенов, а также в случае поступления ненормальных, патоло-
гических трофогенов, или патотрофогенов [Крыжановский Г. Н.,
1989]. Патотрофогены, вероятно, появляются в нейронах при де-
репрессии генов, вследствие чего синтезируются соединения, которые
в нормальной зрелой клетке не обнаруживают.
Наиболее изученным механизмом нарушения нервной трофики
клеток-мишеней является прекращение поступления в них трофо-
генов при повреждении нервных волокон. В этом случае формируется
денервационный синдром с комплексом функциональных, структур-
ных и метаболических расстройств. Наиболее ярко денервационный
синдром проявляется при перерезке аксона мотонейрона или раз-
рушении последнего, хотя сходный процесс наблюдается и в других
тканях (кожа, слизистые оболочки и др.).
Характерной особенностью денервированной ткани является уп-
рощение структурной организации ее органелл, которые становятся
похожи на эмбриональные. В денервированной ткани обычно умень-
шается концентрация РНК и белков, снижается активность дыха-
тельных ферментов и повышается активность ферментов анаэробного
гликолиза. В мышце при денервации изменяются физико-химиче-
ские свойства миозина и снижается его АТФазная активность.
В последние годы установлено, что при денервации происходит
активация перекисного окисления липидов, хотя ферментная анти-
оксидантная активность ткани, по-видимому, может сохраняться.
Предполагают, что усиление свободнорадикальных процессов при-
водит к изменению структуры мембран митохондрий и других ор-
ганелл. При использовании антиоксидантов («-токоферол) снижается
интенсивность перекисного окисления липидов и повышается ак-
тивность дыхательных ферментов при денервации [Данилова Л. Я.
и др., 1989 ]. Восстановление иннервации во многих случаях приводит
к нормализации физиологических свойств, структуры и обмена ве-
ществ в ткани.
При местной нейрогенной дистрофии, возникающей в результате
нарушения локальной иннервации, обычно развивается прогресси-
рующий язвенный процесс. Кроме местной дистрофии, возможен
генерализованный дистрофический процесс, который формируется
при повреждении высших вегетативных центров. В этих ситуациях
в эксперименте наблюдаются поражение слизистой оболочки полости
Рта (язвы, афтозный стоматит), выпадение зубов, кровоизлияния в
легких и очаговая пневмония, эрозии и кровоизлияния в слизистой
273
оболочке желудка и кишечника и др. Вследствие ослабления внут-
риклеточной и клеточной регенерации такие язвенные процессы
приобретают хронический рецидивирующий характер, имеют тен-
денцию к генерализации, нередко происходит отторжение органа
или его участка.
Механизмы развития нейрогенной дистрофии в разных органах
нельзя свести только к дефициту трофогенов или изменению их
свойств, хотя этот механизм, по-видимому, один из наиболее важ-
ных. Во всяком случае многие проявления нейродистрофии при
денервации воспроизводятся блокатором аксоплазматического тока
колхицином [Гутман Э., 1979]. При денервации большое значение
может иметь выпадение действия на клетки-мишени соответствую-
щего нейромедиатора и выключение или ослабление функции органа.
Это связано с тем, что нейромедиаторы сами могут оказывать ре-
гулирующее влияние на образование и высвобождение трофогенов
из нервных окончаний и клеток-мишеней через циклические нук-
леотиды или другие вторичные мессенджеры. Кроме того, действие
нейромедиаторов обязательно включает метаболический компонент,
направленный на трофическое обеспечение усиленной функции
клетки. Выпадение такого метаболического влияния нейромедиатора,
реализуемого через соответствующий рецептор, нарушает воспро-
изводство и ферментов, и внутриклеточных органелл, участвующих
в этих метаболических процессах. Наконец, выпадение функции
(например, поперечнополосатых мышц) или ее ослабление (при
денервации или трансплантации сердца) само по себе отражается
на обмене веществ и приводит к атрофии вследствие бездеятельности.
В условиях развития нейродистрофического процесса взаимосвязь
импульсных и трофических влияний, вероятно, еще более сложная,
поскольку не учитывалась вполне определенная последовательность
выпадения различных влияний нейрона на регулируемую клетку.
В процессе эволюционного и онтогенетического развития разные
формы межкл ’точного взаимодействия, в частности нейрон—нейрон
и нейрон—эффекторная клетка, сформировались неодномоментно.
Трофогенное взаимодействие, обеспечивающее созревание клеток, ус-
тановление их синаптических связей, а также метаболическое и струк-
турное соответствие, сформировалось раньше других и стало основой
для возникновения импульсной, нейромедиаторной, регуляции [Ко-
сицкий Г. Н., Ревич Г. Г., 1975 ]. Вероятно, при повреждении нейронов
в условиях патологии прекращение импульсной активности нейронов
на определенном этапе развития может произойти при сохранении
влияния их трофогенов, поддерживающих структурную целостность
клеток-мишеней в неблагоприятных условиях.
Соотношение функционального и метаболического влияния нейро-
медиатора на регулируемый орган при патологии также может быть
неодинаковым и варьировать в зависимости от конкретных условий, в
частности характера и тяжести патологического процесса, интенсив-
ности нервных влияний и состояния самого органа. При гипоксии край-
ней степени тяжести действие нейромедиаторов норадреналина и аце-
тилхолина на сократительную, а в дальнейшем и ритмическую дея-
274
тельность сердца ослабляется, эффективность влияния симпатическо-
го и блуждающего нерва снижается, вследствие чего сердце переходит
на авторитмический режим функционирования. Такая функциональ-
ная изоляция сердца от нервных влияний экономит энергозатраты,
предупреждает повреждения миокарда избыточным количеством ней-
ромедиаторов, депонирование, которых при тяжелой гипоксии нару-
шается [Хитров Н. Е., Пауков В. С., 1991 ]. Вместе с тем в такой си-
туации норадреналин, действие которого на функцию сердца значи-
тельно ослабляется, продолжает оказывать стабилизирующее влияние
на ионный баланс миокарда, поддерживая его авторитмическую дея-
тельность [Хитров Н. К., 1980].
Более древнее метаболическое влияние медиаторов, как и еще
более древнее трофогенное влияние нейронов, является более ус-
тойчивым и сохраняется в течение длительного периода времени.
Вероятно, оно реализуется до тех пор, пока не произойдет истощение
запаса нейромедиаторов и трофогенов или же такое угнетение ме-
таболических процессов, при котором они не реагируют на данные
регуляторы. В условиях патологии наблюдается диссоциация фун-
кциональных и метаболических влияний нейромедиаторов, которая
в зависимости от конкретных условий может иметь приспособитель-
ное значение и быть проявлением тяжелого повреждения клеток.
Таким образом, в динамике развития лейродистрофического про-
цесса в зависимости от степени его повреждающего влияния в одно
время возможны различные формы взаимосвязи между нейронами
и регулируемыми клетками: только трофогенное и метаболическое
влияние нейромедиаторов или же трофогенное вместе с метаболи-
ческим и функциональным влиянием нейромедиаторов. Такая ге-
терохронность, расщепление действия нейронов, отражается на ме-
таболизме, структуре и функциях разных клеток органа и имеет
несомненное значение в развитии дистрофии.
Помимо выпадения трофогенных и нейромедиаторных влияний,
в развитии нейрогенной атрофии и дистрофии большое значение
имеют возникающие при этом расстройства органного кровообра-
щения и микроциркуляции [Сукманский О. И. и др., 1989 ]. В раз-
витии нейрогенной дистрофии важную роль играет изменение ре-
активности денервированной ткани по отношению к эндокринным
влияниям, действию тканевых гормонов, в частности кининов и
простагландинов, а также аутоиммунная реакция организма. По-
следняя проявляется инфильтрацией ткани лимфоцитами и ПЯЛ,
высвобождением лизосомных гидролаз, увеличивающих поврежде-
ние ткани и ее отторжение как чужеродной [Зайко Н. Н., 1974;
Крыжановский Г. Н., 1989].
6-4. НЕРВНОТРОФИЧЕСКАЯ ФУНКЦИЯ И ВОСПАЛЕНИЕ
Наличие воспаления у одноклеточных организмов в форме фагоци-
тоза, а у многоклеточных, еще до появления у них сосудисто-нер-
вных структур, не только в форме фагоцитоза, но и с участием
275
своеобразных межклеточных взаимодействий, указывает на возмож-
ность возникновения и развития воспаления независим» от влияний
нервной системы. Это положение подтверждается тем, что воспа-
ление, хотя и в упрощенной форме, может возникать в денервиро-
ванной ткани, изолированном органе и тканевой культуре. Вместе
с тем это не означает, что нервная система не оказывает влияния
на возникновение, развитие и завершение воспалительного процесса
в организме высших живых существ [Давыдовский И. А., 1969}. По
мере формирования в процессе эволюции сосудистой, иммунной,
эндокринной и нервной систем, включения новых механизмов ре-
гуляции жизнедеятельности воспаление становилось все более слож-
ным и совершенным. Нервные механизмы регуляции наряду с дру-
гими стали принимать участие в формировании взаимодействия
клеток и их реакции на повреждение, координации деятельности
разных органов и физиологических систем, которые также вклю-
чаются в развитие воспалительного процесса.
Состояние нервной системы во многом определяет вероятность воз-
никновения воспаления и степень выраженности первичного повреж-
дения ткани. Это понятно, если учесть, что интегральным проявлением
нарушения нервнотрофических и других связей нейронов и клеток-
мишеней служит снижение их устойчивости к разным повреждающим
факторам. Нередки ситуации, в которых обычные, не повреждающие
в норме воздействия вызывают альтерацию. Так, при перерезке седа-
лищного нерва у крыс даже механическое давление трущихся повер-
хностей скакательного сустава и напряжение кожи в этой области спо-
собствуют развитию артрита и язв на коже коленного сустава [Е. Н.
Блинова, 1989]. Нарушение смачивания роговицы глаза и ее подсы-
хание при перерезке ветви тройничного нерва приводит к возникно-
вению язвенного кератита [Князев Г. Г. и др., 1990 ]. Хотя эти данные
получены в экспериментальных условиях, они определенно показы-
вают, что нарушение деятельности нервной системы и ослабление ее
нейротрофической функции является фактором, под воздействием ко-
торого снижается естественная устойчивость тканей к повреждающим
агентам и в ряде случаев возникает воспаление. Эти данные соответ-
ствуют результатам известных клинических наблюдений, в которых
снижение общей резистентности организма вследствие старения, тя-
желых неврозов, заболеваний периферической нервной системы спо-
собствовало увеличению частоты возникновения и тяжести течения
воспалительных процессов.
Вопрос о конкретной роли нервной системы вообще и ее трофиче-
ских влияний в частности в процессе развития воспаления является
предметом дискуссии. По мнению одних авторов, определенная дея-
тельность нервной системы, а не «нарушение ее трофической функ-
ции» обусловливает закономерное для данного организма развитие
воспалительного процесса [Давыдовский И. В., 1969]. Высказывалось
и крайнее утверждение, что именно нервная система «организует» вос-
паление [Сперанский А. Д., 1955]. Другие авторы, наоборот, полага-
ют, что, лишь повреждение нервной системы, в первую очередь рас-
стройства ее трофической функции, определяет развитие воспаления,
276
особенно его негативных последствий. Так, А. М. Чернух (1979) счи-
тает, что при нарушении нервнотрофических влияний в ткани созда-
ются условия, способствующие развитию воспаления хотя бы по той
причине, что снижается ее устойчивость к альтерирующим агентам.
При повреждении ткани под влиянием тех или иных факторов нару-
шаются нервнотрофические влияния, что способствует развитию вос-
паления, поэтому нормализация нервнотрофических влияний обус-
ловливает благоприятное течение и завершение воспаления.
Вероятнее всего, эти две точки зрения не исключают друг друга
и отражают реальные события, происходящие в очаге воспаления
и организме в целом. Альтерирующий агент и вызываемое им
местное повреждение тканей могут изменять состояние рецепторов,
афферентных и эфферентных нервных волокон, тел нейронов, в
результате чего перестраиваются транспорт, высвобождение и дей-
ствие трофогенов, функциональные и метаболические влияния ней-
ромедиаторов. Очевидно, что изменения нервнотрофических влияний
не только способствуют возникновению воспаления, но и являются
обязательным механизмом формирования его местных проявлений.
Наряду с этим очаг воспаления в периферических тканях или в
самой ЦНС изменяет ее деятельность различными путями, участвуя
наряду с другими механизмами в формировании многообразных
общих проявлений (боль, тревога, депрессия, общее недомогание и
слабость, бессонница, снижение аппетита и т. д.).
Значение нервной системы в динамике воспаления подтвержда-
ется многочисленными случаями возникновения признаков ожога у
пациентов под влиянием внушения при гипнозе. В психиатрической
клинике неоднократно отмечали, что у больных во время маниа-
кального возбуждения при местном действии повреждающих фак-
торов появляются признаки гиперергического воспаления, а во время
тяжелой депрессии, наоборот, — гипергического. В эксперименте с
перерезкой периферических нервов у больных с центральным или
периферическим параличом при местном действии повреждающих
агентов, как и в обычных условиях, воспаление развивается, однако
влияние денервации при этом неоднозначно: в одних случаях внеш-
ние признаки воспаления становятся более выраженными, чем в
норме, в других выраженность их уменьшается.
Таким образом, значение нервной системы в динамике воспале-
ния и формировании его местных и общих проявлений не вызывает
сомнений. Сложнее вопрос о конкретных механизмах нейрогенных
влияний и их значении в развитии альтеративных, сосудисто-экс-
сУдативных и пролиферативных процессов.
6 <1. Нервнотрофические влияния и альтеративные
процессы при воспалении
Еще в 30 — 40-х годах XX века было установлено, что в очаге
воспаления наблюдается мозаичность структуры рецепторов и пе-
риферических нервных волокон, сопровождающаяся разнообразными
277
изменениями их функциональных свойств — от угнетения до чрез-
мерного раздражения. При этом характер изменений нервных ап-
паратов зависит от близости к центру очага воспаления, где по-
вреждение ткани наиболее выражено. Иными словами, состояние
нервных образований в очаге воспаления определяется тяжестью
альтеративных изменений ткани.
При выраженной альтерации ткани повреждения рецепторов,
нервных проводников и нейронов могут быть настолько значитель-
ными, что трудно говорить о сохранении их возбудимости и про-
водимости. Причиной этого являются тяжелые расстройства микро-
циркуляции, местная гипоксия и энергетический дефицит, ацидоз
и ферментные аутолитические процессы в ткани, находящейся в
центре очага воспаления. Указанные процессы приводят к угнетению
энергозависимого образования и депонирования медиаторов, распаду
везикул, а в дальнейшем самих рецепторов, нервных волокон и
нейронов. Действие высвобождающихся из нервных окончаний ней-
ромедиаторов, например норадреналина и ацетилхолина, на миоциты
сосудов и паренхиматозные клетки ослабляется вследствие снижения
чувствительности соответствующих рецепторов в условиях гипоксии,
ацидоза и нарушения баланса ионов [Хитров Н. К., 1980]. Следо-
вательно, при альтерации в очаге воспаления, где возникают такие
явления, из-за нарушения пре- и постсинаптических механизмов
могут ослабляться нервные влияния. В результате этого формируется
«денервация», точнее — своеобразная функциональная и структур-
ная ^изоляция участка поврежденной ткани от нервных влияний.
Такую изоляцию, вероятно, можно рассматривать как один из ме-
ханизмов отграничения очага повреждения от окружающих тканей
и организма в целом, так как в' результате функциональных и
структурных нарушений нервных аппаратов могут выпадать и ме-
стные рефлексы, аксон-рефлексы, и рефлексы, замыкающиеся на
разных уровнях ЦНС [Хитров Н. К., Пауков В. С., 1991 ].
В процессе развития воспаления вокруг области первичного по-
вреждения формируется периферическая зона вторичной альтера-
ции, где может происходить раздражение нервных структур-рецеп-
торов, проводников и нейронов. Стимуляция нервных аппаратов, в
том числе болевых рецепторов, возникает под влиянием медиаторов
воспаления (гистамин, кинины, ПГ и _^р.), метаболитов (лактат,
пируват, кетокислоты) и ионов (Н+, К+ и др.). Эти факторы вы-
зывают многообразные рефлекторные реакции, изменяющие обмен
веществ и кровообращение в самой воспаленной ткани и влияющие
на состояние разнообразных систем организма, в том числе эндок-
ринной, иммунной, выделительной и др. Это не означает, что в
формировании местных и общих проявлений воспаления главную
роль играют рефлекторные влияния из очага воспаления. В развитии
не только местных, но и общих изменений важное место занимают
медиаторы воспаления, например гистамин и кинины, вызывающие
гипотензивные реакции при поступлении в циркуляцию; ИЛ-1,
принимающий участие в формировании лихорадки и усилении об-
разования глобулинов гепатоцитами; ФАТ и гепарин, изменяющие
278
свертываемость крови, и др. Наряду с этим рефлекторные реакции
и высвобождающиеся нейромедиаторы и трофогены вносят свой
.вклад в формирование как местных, особенно в периферической
зоне, так и общих проявлений воспаления.
Таким образом, в процессе альтерации в очаге воспаления могут
наблюдаться явления двух видов, различающиеся по характеру из-
менения нервной регуляции ткани и значению в деятельности кле-
ток. В результате прямого и опосредованного (нарушение кровооб-
ращения, гипоксия, ацидоз, ферментативные процессы) повреждения
рецепторов, проводников и нейронов, а также их синаптических
контактов формируется функционально-структурная изоляция ткани
от нервных влияний. Хотя это явление возникает вследствие по-
вреждения ткани, оно предупреждает поступление интенсивных, в
том числе болевых, сигналов из очага воспаления и ограничивает
эффекты нейромедиаторов, усиленно высвобождающихся при нару-
шении целости нервных окончаний. Такие изменения нервной ре-
гуляции клеток наиболее характерны для зоны выраженной альте-
рации, локализованной в центре очага воспаления. В динамике
воспаления в перифокальной зоне деятельность нервных аппаратов
сохраняется, происходит их раздражение и формируются разнооб-
разные рефлексы, которые реализуются местно и в других анато-
мо-физиологических системах. Именно в этой зоне реактивных из-
менений ткани проявляется влияние ЦНС, разных ее регулирующих
уровней, а также эндокринной и других систем.
Возникновением разных по регулируемости явлений в ткани при
воспалении объясняются весьма выраженные различия результатов
изучения влияния денервации на местные признаки воспаления.
Известно, что в одних случаях при действии повреждающего фактора
на денервированную ткань или орган альтерация усугубляется и
пролонгируется во времени, а пролиферативная фаза, особенно по
периферии очага воспаления, становится слабовыраженной. Наряду
с этим описано много случаев, когда в условиях денервации при
местных повреждающих воздействиях, например воспалении кожи,
вызванном ожогом, проявления альтерации, а также сосудисто-экс-
судативные изменения менее выражены, чем в обычных условиях.
Вместе с тем усугубление воспалительного процесса все же проис-
ходит вследствие ослабления репарации ткани, наиболее выраженной
на периферии очага воспаления. Вероятно, нервные влияния в вос-
паленной ткани имеют неодинаковое значение в месте непосредст-
венного действия повреждающего агента и окружающей области,
где формируются разнообразные реакции клеток, межклеточного
вещества и микрососудов на это повреждение.
Представленные выше закономерности изменения регуляции, хо-
тя и раскрывают динамичность нервных влияний в зависимости от
^епени повреждения ткани и стадии развития воспаления, однако
являются в значительной мере схематическими и могут служить
лишь общим ориентиром при анализе происхождения и значения
проявлений альтерации в сфере нервной регуляции ткани при вос-
палении. Возможны варианты этой общей схемы, которые зависят
279
от степени изоляции органа или его участка от нервных влияний,
их распространенности по клеточным территориям, продолжитель-
ности воспаления и особенностей альтеративного компонента. Важно,
что в ткани очага воспаления и особенно в перифокальной области
могут наблюдаться переходные состояния нервных проводников,
характеризующиеся частичной изоляцией воспалительного участка.
Выше рассматривалось выпадение влияний нейромедиаторов на фун-
кцию клеток при сохранении их эффектов и действия трофогенов
на метаболические процессы.
Альтерация ткани, в том числе нервных образований, приводит
к высвобождению из них нейромедиаторов и трофогенов, которые
могут вызывать различные местные и общие изменения, выполняя
роль классических медиаторов воспаления. Нейромедиаторы норад-
реналин и ацетилхолин, малоактивные в зоне первичной альтерации,
в окружающей области оказывают влияние на диаметр и проница-
емость стенок микрососудов, лаброциты, лейкоциты и тромбоциты.
Катехоламины и ацетилхолин регулируют высвобождение гистамина
из лаброцитов, а первые, помимо этого, могут активизировать си-
стему кининов и тромбоцитарное звено гемостаза, усиливая высво-
бождение ФАТ из лейкоцитов. Катехоламины усиливают генерацию
активных форм кислорода и перекисное окисление липидов, в этой
связи могут стимулировать образование ПГ и ЛТ, дестабилизировать
мембраны лизосом и способствовать высвобождению лизосомных
гидролаз. В свою очередь некоторые виды ПГ тормозят высвобож-
дение норадреналина из нервных волокон и в результате понижают
уровень цАМФ в регулируемых клетках (см. главу 3).
Вследствие разрушения или раздражения из нервных волокон,
находящихся в очаге воспаления, высвобождаются активные нейро-
пептиды, которые в обычных условиях выполняют роль модуляторов
нервного возбуждения: субстанция Р, соматостатин, вазоактивный
пептид — ВИП, опиоидные пептиды. Синтез этих пептидов в пе-
риферических и центральных нейронах контролируется трофогена-
ми, так как количество пептидов в нервных волокнах увеличивается
при регенерации перерезанного нерва по мере увеличения концен-
трации фактора роста [Nielsh V., 1984]. Особенно большое значение
имеют нейропептиды в формировании рефлекторных, в первую
очередь болевых, реакций, инициируемых очагом воспаления.
Образующиеся в очаге воспаления медиаторы боли (гистамин,
кинины, ПГ,' Н ) стимулируют ноцицепторы С-афферентных воло-
кон и нейронов, которые обеспечивают передачу этих сигналов с
помощью субстанции Р, соматостатина и ВИП [Hunt S. Р., Rossi I.,
1985]. Распад нервных волокон вследствие местной гипоксии, аци-
доза и ферментативного аутолиза приводит к высвобождению этих
соединений, которые, поступая в окружающую ткань очага воспа-
ления, реализуют болевые эффекты и участвуют в сосудистых ре-
акциях. Субстанция Р транспортируется в нейронах аксоплазмати-
ческим током и высвобождается в мозге и периферических тканях
из С-волокон, воздействуя на микрососуды; она вызывает вазоди-
латацию и повышение сосудистой проницаемости [Каминская М. М.,
280
1988]. Вещество Р может активизировать лаброциты и усиливать
высвобождение классических медиаторов воспаления — гистамина,
ФАТ и др. [Chall L., 1984]. Противоположное влияние на сосуды,
особенно на венулы (веноспастический эффект), оказывает сомато-
статин, который также высвобождается в ткани при воспалении из
С-афферентных волокон [Dow LingJ., 1983].
Опиоидные пептиды (/?-эндорфины, энкефалины и динорфин)
также относятся к модуляторам и изменяют действие различных
нейромедиаторов на их рецепторы. Эти пептиды обнаруживают в
разных нейронах, вырабатывающих классические нейромедиаторы
(норадреналин, ацетилхолин, дофамин и др.). Опиоидные рецепторы
в большом количестве представлены в разных структурах мозга, но
они имеются и в периферических органах на нервных окончаниях,
в надпочечниках, миоцитах стенки желудка и кишечника, иммунных
клетках. Опиоидные пептиды и рецепторы тормозят формирование
боли при разных повреждениях тканей, в том числе при воспалении,
на уровне периферических афферентов и ЦНС, регулируют обра-
зование и высвобождение либеринов и статинов в гипоталамусе,
контролируя эндокринную систему, модулируют клеточные меха-
низмы иммунитета, оказывая влияние на пролиферацию и диффе-
ренцировку иммуноцитов [Шухов В. С., 1990].
6.4.2. Нервнотрофические влияния и сосудисто-
экссудативные изменения в процессе
развития воспаления
Получены данные, свидетельствующие о том, что повреждение или
стимуляция нервных аппаратов в очаге воспаления вызывает изме-
нения микроциркуляторного кровообращения. Так, например, при
деафферентации тканей глазного яблока у кроликов наиболее ярко
выраженными и рано наступающими изменениями являются мик-
рососудистые, которые выражаются в замедлении кровотока и по-
вышении проницаемости стенок микрососудов. В дальнейшем это
приводит к развитию отека и лейкоцитарной инфильтрации ткани.
Очевидно, последовательность событий при таком нейропаралити-
ческом кератите аналогична той, которая наблюдается при баналь-
ном воспалении [Князев Г. Г. и др., 1990]. Вместе с тем в подобных
исследованиях не сопоставляют скорость изменения метаболических
процессов в клетках с сосудистыми нарушениями, а это могло бы
Раскрыть их причинно-следственную связь при нарушениях иннер-
вации и кератите.
Динамическое исследование морфологии ткани сердца и легких
при экспериментальном .неврите блуждающего нерва, вызванном
введением в его ствол в шейной области осмоленного скипидара,
показало, что у кроликов уже через 1—2 сут на вскрытии обнару-
живают массивные ателектазы легких. В сроки от 3 до 6 сут воз-
никают очаговые или очагово-сливные пневмонии. В ткани сердца
в тех же условиях эксперимента обнаруживают стазы в микросо-
281
судах, кровоизлияния и очаги некроза; регистрируется перераспре-
деление форменных элементов крови в микрососудах; в альвеолах
легких появляются активированные макрофаги, поглотившие эрит-
роциты и ПЯЛ.
Особенностью микрососудов легких рри экспериментальном не-
врите блуждающего нерва являются повышение их проницаемости
и транспорт путем микровезикуляции введенных в кровь чужерод-
ных частиц. При этом в самом нервном стволе возникают отек,
кровоизлияния и очаги некроза ткани, которые прерывают и аксоток,
и распространение возбуждений. Сходные изменения стенок мик-
рососудов наблюдаются при денервации в скелетных мышцах у
крыс, а также у людей в микрососудах мышц при различных формах
амиотрофий, вызванных поражением надсегментарных структур моз-
га, спинальных мотонейронов, их аксонов и мионевральных синапсов
[Чернух А. М., 1979 ].
Анализ приведенных выше данных показывает, что нарушение
нервных влияний, которое может наблюдаться в ткани очага вос-
паления, вызывает сходные изменения местного кровообращения и
микроциркуляции. Как и при воспалении, эти расстройства в боль-
шей степени выражены в капиллярах и венулах, проявляются в
первую очередь повышением проницаемости стенок микрососудов с
последующими изменениями интраваскулярных процессов. Важно,
что нарушение нервных влияний на орган или ткань, первоначально
проявляясь расстройствами обмена веществ и микроциркуляции, во
многих случаях способствует развитию воспаления. Эти закономер-
ности обнаруживаются в разных органах и тканях (глаз, миокард,
скелетная мышца, легкое) у живых существ разных видов (кролик,
крыса, человек) и при повреждении различных регуляторных уров-
ней нервной системы (афферентный, центральный, эфферентный).
Можно считать доказанным, что изменения нервных влияний и
нейротрофической функции в очаге воспаления отражаются на мик-
роциркуляции и принимают участие в формировании сосудисто-экс-
судативных процессов, но конкретные механизмы этих влияний
пока неясны. Дискутируется вопрос о том, что вызывает изменение
свойств микрососудов при воспалении — нарушение их нервной
регуляции или расстройства обмена веществ в тканях, возникающие
в результате изменения этой регуляции. Если принять, что в по-
явлении расстройств проницаемости стенок сосудов в очаге воспа-
ления участвуют нервные влияния, то возникает другой вопрос: в
«какой мере расстройства микроциркуляции и органного кровообра-
щения обусловлены изменением нервнотрофических влияний и вы-
свобождением нейромедиаторов? И, наконец, в какой зависимости
находятся перестройка нервного контроля гемомикроциркуляции и
постоянно участвующие в этом процессе классические медиаторы
воспаления, например гистамин, кинины, ПГ и ЛТ?
В полной мере ответить на эти вопросы в настоящее время вряд
ли возможно, и все же можно привести ряд фактов, раскрывающих
некоторые из названных положений. Показано, что при стимуляции
симпатических нервов, которая может наблюдаться на ранних этапах
282
I
воспаления, практически немедленно в икроножной мышце живо-
f тных происходит усиление свободнорадикальных процессов, регист-
рируемых с помощью хемолюминесценции [Лазуткина И. Н., 1989].
Способность симпатического нейромедиатора норадреналина при его
накоплении во вненейрональной среде резко усиливать свободнора-
дикальные процессы общеизвестна. Радикалы кислорода и галоидов,
а также продукты перекисного окисления липидов в ткани очага
воспаления непосредственно могут резко увеличивать проницаемость
стенок микрососудов и повреждать эндотелиальные клетки [Del
Maestro F. et al., 1981]. Действие радикалов кислорода на микро-
циркуляцию в очаге воспаления может реализоваться и опосредо-
ванно, в частности в результате активации арахидонового каскада
и усиления биосинтеза ПГ и ЛТ, ингибирования антимедиаторов
воспаления, например ai-антитрипсина, и усиления образования
кининов, разрушения межклеточного матрикса и т. п. (см. главу 3).
Изменение не только нервно-импульсных, но и собственно нервно-
трофических влияний имеет большое значение в изменении свойств
микрососудов, хотя данные, свидетельствующие об этом, пока не-
многочисленны. В качестве примера можно привести следующие
факты: сопоставление изменений свойств микрососудов слизистой
оболочки полости рта при денервации и блокаде аксотока колхи-
цином в тригеминальных нейронах позволило установить, что в
возникновении нейрогенного язвенного стоматита принимают уча-
стие и расстройства импульсной активности нерва, и нарушения
аксотока. Денервация тканей на разных уровнях вызывает большие
трофические и микроциркуляторные расстройства, чем одна блокада
аксотока колхицином [Сукманский О. И. и др., 1989]. Нейромеди-
аторы могут модулировать эмиграцию лейкоцитов и фагоцитоз в
очаге воспаления при изменении нервных влияний.
Учитывая изложенные выше современные данные, а также тот
факт, что высвобождающиеся нейромедиаторы и трофогены могут
оказывать влияние и на фагоциты, активируя в них свободноради-
кальные процессы, можно предположить, что изменение нервных
влияний может отражаться не только на адгезивных свойствах эн-
дотелия, но и на способности полимоноцитов к адгезии и краевому
стоянию, эмиграции и фагоцитарной активности.
6.4.3. Нервнотрофические влияния
и пролиферация при воспалении
Нервнотрофические влияния определяют уровень зрелости ткани и
ее способность к обновлению белкового состава, биогенезу ультра-
структур, пролифераций клеток и межклеточного вещества. Эти
интра- и экстрацеллюлярные процессы контролируются трофогена-
ми, в связи с чем при изменениях нервных аппаратов в ткани очага
воспаления возможны определенные вариации в пролиферативных
явлениях, развивающихся в этой ткани. Важным аргументом в
пользу данного положения является тот факт, что в эксперименте
283
искусственное повреждение нервной системы на том или ином уров-
не, как правило, пролонгирует и затрудняет завершение воспаления.
По данным А. М. Чернуха (1965), инфекционное воспаление у крыс
при разрушении чувствительной иннервации в отличие от естест-
венного развития процесса сопровождается беспорядочным разра-
станием ткани и характеризуется инертностью ее восстановления.
Д. Е. Альперн (1966) приводит многочисленные данные, свидетель-
ствующие о том, что при выключении афферентных проводников
значительно усиливаются альтеративные процессы и ослабляется
репарация паренхиматозных клеток в ткани органов при воспалении.
Исследования, проведенные в последние годы, подтвердили эти
факты и показали, что афферентные влияния играют важную роль
в восстановлении целости ткани при местных расстройствах крово-
обращения в очаге воспаления. Так, экстирпация спинномозговых
узлов и задних корешков на уровне Liv—Lyn приводит к значи-
тельному замедлению репарации зоны ишемического некроза ткани
коленного сустава [Блинова Е. Н., 1989; Зайко Н. Н. и др., 1989].
Ослабление репаративных процессов в очаге воспаления обнаружи-
вают при различных повреждениях высших отделов мозга у живо-
тных в эксперименте и у больных в клинике. Не только денервация,
но и чрезмерная стимуляция нервных проводников может вызвать
нарушения течения восстановительных процессов в очаге воспале-
ния; раздражение симпатических нервов пролонгирует воспаление,
вызванное ожогом; течение его вялое, и в отличие от обычного
репаративные процессы в коже по периферии очага воспаления
выражены слабо [Альперин Д. Е., 1966].
Очевидно, при естественном течении воспалительного процесса
нормализация свойств поврежденных рецепторов, проводников, си-
наптических контактов и нейронов является важным условием раз-
вития пролиферации и восстановления целости ткани. Нервные
влияния нарушаются в случае искусственного, в эксперименте, из-
менения репарации нервных аппаратов в воспалительной ткани.
Функциональные свойства нейронов нормализуются главным обра-
зом благодаря усилению внутриклеточной регенерации ультраструк-
тур, а поврежденные рецепторные аппараты, нервные волокна и
синаптические образования восстанавливаются за счет внутрикле-
точной регенерации, в том числе компенсаторной гиперплазии, про-
являющейся на месте гибели этих нервных структур [Саркисов Д. С.
и др., 1987]. Важным механизмом восстановления иннервации яв-
ляется воздействие таких трофогенов, как факторы роста нерва,
ганглиозиды, циклические нуклеотиды и другие соединения, высво-
бождающиеся в очаге воспаления в процессе повреждения самих
нервных образований [Крыжановский Г. Н., 1989]. Пролифератив-
ный процесс, особенно интенсивный на периферии очага воспаления,
где в большей степени и регенерируют нервные волокна, характе-
ризуется высокой интенсивностью анаболизма. Трофические нерв-
ные влияния контролируют этот процесс, причем имеется опреде-
ленная последовательность в высвобождении из нервных волокон
трофогенов, активирующих их созревание. В нейронах дерепрессия
284
Схема 6.2. Вероятные закономерности изменения нервных влияний в
очаге воспаления на разных стадиях его развития.
генов, обеспечивающих синтез трофогенов созревания клеток-ми-
шеней, сопровождается репрессией генов, вызывающих синтез тро-
фогенов пролиферации клеток-мишеней [Крыжановский Г. Н.,
1989].
В настоящее время большое значение в регуляции образования
трофогенов в нейронах и реализации их трофического влияния на
органы-мишени придают циклическим нуклеотидам — цАМФ и
цГМф. Повышение уровня цАМФ в интра- или экстрацеллюлярной
сРеде ингибирует митотическую активность клеток, а снижение ее
Уровня способствует делению клеток. Обратное влияние на проли-
ферацию клеток оказывает цГМФ. Наряду с этим цАМФ и акти-
®аторы аденилатциклазы, определяющей синтез цАМФ, стимулиру-
Ют дифференцировку клеток [Саркисов Д. С., 1990 ]. Вероятно,
трофогены разных классов, обеспечивающие пролиферацию и со-
285
зрсвание клеток-мишеней в очаге воспаления, реализуют влияние
через различные циклические нуклеотиды.
В регуляции пролиферации и восстановлении нормальных па-
ренхиматозно-стромальных отношений в очаге воспаления могут
принимать участие и активные нейропептиды, особенно опиоидные
пептиды. При стимуляции этими пептидами опиоидных рецеп-
торов афферентных С-волокон ослабляется боль [Fields Н. L.,
Basbaum A. J., 1985], уменьшается высвобождение норадреналина
из симпатических нервных окончаний [Шухов В. С., 1990] и вслед-
ствие этого прекращается активация лаброцитов и тромбоцитов,
устраняются микроциркуляторные расстройства, нарушения гемо-
стаза, активация свободнорадикальных процессов, зависящих от
катехоламинов (схема 6.2).
ГЛАВА 7
СИСТЕМА HLA И ВОСПАЛЕНИЕ
Учение об антигенах гистосовместимости (система HLA) внесло
большой вклад не только в трансплантологию, но и в понимание
(расшифровку) причин ряда патологических процессов, в патогенезе
которых иммунный компонент играет определенную роль. Воспале-
ние в этом отношении не является исключением. Особенно четко
прослеживается связь HLA. с «инфекционным» воспалением. Только
на основе HLA организм способен распознать чужеродный антиген —
инфекционный агент и запустить весь каскад взаимосвязанных и
взаимообусловленных процессов. Анализ особенностей HLA каждого
индивидуума открывает новые возможности объяснения различного
течения воспаления у разных людей, их неодинаковой реактивности.
В настоящее время для объяснения остроты и типа воспалительной
реакции необходимо использовать не только представление о виру-
лентности микроорганизмов* и довольно расплывчатое определение
общего состояния организма, но и более конкретные иммуногене-
тические параметры индивидуума. В одном организме разные при-
чины могут вызывать различные разновидности воспалительной ре-
акции — гиперергическую и гипоергическую. Наоборот, один и тот
же фактор у разных людей обусловливает разные картины воспа-
лительной реакции. Одной из причин такого различия в ответе,
очевидно, являются индивидуальные особенности спектра антигенов
гистосовместимости. Общность некоторых антигенов макро- и мик-
роорганизмов создает условия, которые не способствуют существен-
ной активации иммунной системы. Адекватный анализ различной
реактивности организмов представителями любой медицинской спе-
циальности возможен на основании знания об антигенах гистосов-
местимости и их гомеостатической роли в организме.
Представления об антигенах гистосовместимости человека за свою
непродолжительную историю с начала 60-х годов XX века до на-
стоящего времени существенно изменились. Первоначально HLA
рассматривали в качестве продуктов генов клеток, обусловливающих
аллогенные антигенные различия людей и вызывающие при транс-
плантации реакции тканевой несовместимости. Далее представления
° HLA пополнились сведениями о их важной роли: 1) в межкле-
точных кооперативных взаимоотношениях в качестве маркеров, осу-
ществляющих антигенное считывание и генетическую рестрикцию,
и Универсальных рецепторов, «представляющих» чужеродные анти-
гсны; 2) в индукции ряда гуморальных клеточных медиаторов, уча-
ствующих в формировании воспаления.
287
HLA являются гликопротеидами клеточных мембран, широко
представленными в организме человека: насчитывают около 130
HLA. Они контролируются генами, расположенными в коротком
плече 6-й пары хромосом [FranckeU., Pellegrino М., 1977]. Разли-
чают шесть локусов, контролирующих HLA: А, В, С, D/DR, DR,
DQ. Каждый локус представлен множественными аллелями, коди-
рующими альтернативные варианты HLA. В большом комплексе
гистосовместимости человека, по данным Дж. Снелл и соавт. (1979),
размещается не менее 105 генов. Наследование HLA происходит
кодоминантно гаплотипам1 и подчиняется законам Менделя. Нару-
шение этого правила обусловливает большую предрасположенность
членов одной семьи к болезням. Например, в семьях, где один
ребенок болен острым лейкозом, нередко наблюдается нарушение
менделевского (1:1) распределения гаплотипов каждого родителя
[Зотиков Е. А. и др., 1989 ]. Последнее, по-видимому, связано с
презиготической селекцией, в частности с преобладанием гамет
одного отцовского и одного материнского HLA гаплотипов.
В соответствии с особенностями строения антигенов гистосовме-
стимости выделяют два класса HLA [Klein J., 1977]. К I классу
относят HLA, кодируемые локусами генов А, В, С. Продукты генов
1 класса определяют с помощью сывороток в лимфоцитотоксическом
тесте. Молекула HLA I класса состоит из двух полипептидных
цепей: а (тяжелой) и fi (легкой). Легкая цепь является константой.
Она представлена Д2-микроглобулином и имеет молекулярную массу
12 000 [Wernet Р., 1976; Snary D. et al., 1977]. Молекулярная масса
тяжелой цепи 44 000. Внецеллюлярная часть молекулы состоит из
274 аминокислот и включает три домена. Полиморфизм HLA I
класса определяется тяжелой a-цепью. Установлено, что отличия
HLA определяются их аминокислотным составом. HLA-A2 и HLA-
А28 различаются 10 аминокислотами, входящим в «1- и а2-домены
[ОггН. Т. et al., 1979; Lopez de Castro J. A. et al., 1982;
Jensenius J. C., Williams A. F., 1982 ]. Два антигена сплиты HLA-B51
и HLA-B52, ранее входившие в HLA-B5, различаются только двумя
аминокислотами «2-домена [Hayashi Н. et al., 1989]. HLA I класса
маркируют все ядросодержащие клетки, а также секретируемые ими
жидкости.
Ко II классу HLA относятся антигены, кодируемые локусами
DR, DP, DQ. Продукты аллелей локусов DR и DQ устанавливают
с помощью тестовых анти-НЬА-сывороток в лимфоцитотоксическом
тесте. Продукты аллелей локуса DP определяют с помощью одной
из разновидностей смешанной культуры лимфоцитов — примиро-
ванных лимфоцитов — primed lymphocyte typing [Sheehy M. et
al., 1975]. Молекула HLA II класса состоит из двух цепей. Мо-
лекулярная масса а-цепи 34 000, £-цепи 28 000. Внеклеточная
часть обеих цепей включает 198 аминокислот и состоит из двух
доменов. Полиморфизм HLA определяется главным образом
* Гаплотип — гены, расположенные на одной хромосоме (отцовской или мате-
ринской).
288
в-цепью. а- и /3-цепи кодируются разными участками HLA-D
региона: D/DRC, D/DR/?, D/DQa, D/DQ/3, D/DP/? [Stetler D. et
al., 1982; CordobaS. et al., 1989].
HLA II класса экспрессированы в норме не на всех клетках
человека. Их обнаруживают на клетках иммунной системы (моно-
цитах — макрофагах, В-лимфоцитах, активированных Т-лимфоци-
тах, ПЯЛ), а также на ряде клеток, прямо не связанных с иммунной
системой. К ним относятся в первую очередь клетки так называемых
пограничных тканей, к которым причисляют клетки эпителия кожи
и слизистых оболочек, эндотелий кровеносных сосудов, а также
дендритные клетки.
В организме HLA I и II классов выполняют важную функцию.
Они маркируют все ядросодержащие клетки и обеспечивают рас-
познавание по этим антигенам собственных клеток организма. Мар-
керная функция определяет также индивидуальный тип работы
клеточных систем иммунитета, в том числе эффекторных и регу-
ляторных клеток. Речь идет о способности иммунных Т-лимфоцитов
(Т-киллеров) уничтожать пораженные вирусом клетки лишь в том
случае, если они имеют одинаковые HLA. Это явление получило
название HLA-ограничения клеточного лизиса — HLA restriction of
cell lysis RCL [Zinkernagel R. M., Doherty P. C., 1974]. Разрушение
клеток-мишеней антигенной принадлежности HLA-B7, инфициро-
ванной вирусом гриппа, киллерами, включающими HLA-B7, зна-
чительно выраженнее, чем киллерами, не имеющими этого антигена
[Dickmeiss Е. et al., 1977; McMichael A. J. et al., 1977 ].
Определенное значение в генетической рестрикции принадлежит
также HLA II класса. Некоторые авторы обнаружили, что лизис
инфицированных вирусом простого герпеса клеток-мишеней наи-
лучшим образом осуществляется аутолитичными с маркером CD4
или CD8 лимфоцитами иммунных лиц. Несколько меньшей актив-
ностью обладают аллогенные лимфоциты, полученные от HLA-DR-
совместимых лиц. Более чем в 4 раза снижается активность лим-
фоцитов, полученных от HLA-несовместимых лиц [Тогреу D. et al.,
1988; Schmid D. S., 1988]. В опытах in vitro показано, что межкле-
точные регуляторные взаимодействия, в частности ингибиция роста
эритроидных и гранулоцитарно-макрофагальных колоний человека,
осуществляются Т-клетками супрессорного типа при условии ре-
стрикции по HLA II класса [Torok-Storb В., Hansen J., 1982;
Lipton J. М., 1985; Vinci G. et al., 1988].
He лишено определенного основания суждение о том, что гене-
тическая рестрикция функции Т-лимфоцитов с маркером CD8 осу-
ществляется через HLA I класса. В то же время функция Т-лим-
фоцитов с маркером CD4 ресгриктируется через HLA II класса
[Blustone J. A., Matis L. А., 1989].
С HLA II класса связана важная функция презентации макро-
фагом или другой клеткой чужеродного антигена Т-хелперу. При-
нято считать, что сначала вспомогательные клетки фагоцитируют
(пиноцитируют) чужеродный антигенный материал и расщепляют
его до пептидов. Фрагментированные пептиды путем экзоцитоза
Ю—407
289
транспортируются HLA II класса на поверхность клетки, где они и
распознаются Т-лимфоцитом. Стимулированный Т-хелпер активи-
рует определенный клон В-лимфоцитов, осуществляет запуск их
пролиферации и последующей дифференцировки. Процесс наработки
антител находится под контролем Т-супрессоров, которые останав-
ливают их излишнюю продукцию, когда у организма отпала в этом
необходимость.
Таким образом, имеются несомненные свидетельства участия
HLA I и II классов в процессах клеточных взаимодействий иммунной
системы. Последние обусловливают формирование антител и эф-
фекторных клеток, осуществляющих основные функции при им-
мунном воспалении.
Полученные данные, свидетельствующие о выраженной предрас-
положенности к определенным заболеваниям лиц, имеющих в своем
генотипе некоторые HLA. Речь идет, очевидно, о заболеваниях,
обусловленных существованием общих антигенов у макроорганизма
и инфекционного агента, вызвавшего заболевание. Наиболее четкая
корреляция установлена в отношении антигена HLA-B27 у бол1 ных
с выраженной воспалительной реакцией, характеризующейся пора-
жением костей, синовиальных и слизистых оболочек. Этот антиген
среди смешанной популяции людей, проживающих в средней части
Европы, встречается с частотой около 9%. Частота выявления ан-
тигена возрастает до 96% у больных анкилозирующим спондилитом
(АС) и до 70—80% у больных с синдромом Рейтера [Schlosstein L.
et al., 1973; Morris R. I. et al., 1974].
•В литературе имеется единая точка зрения, согласно которой
бактерии рода Klebsiella и Yersinia выступают в качестве патоге-
нетического начала рассматриваемых артропатий и поражений сли-
зистых оболочек. Некоторым исследователям удалось установить,
что антигенная близость клебсиеллы и больного, положительного
по HLA-B27, лежит в основе пониженного антибактериального им-
мунитета к этому инфекционному агенту [EbringerR. et al., 1979;
Geczy A. F. et al.,. 1983]. Установлено, что лимфоциты HLA-B27-
положительных больных не показывали бластной трансформации в
краткосрочной культуре при стимуляции ее клебсиеллой в отличие
от лимфоцитов здорового лица. Иммунные антитела к клебсиелле
были способны разрушать in vitro лимфоциты больных АС. В то же
время сыворотка не реагировала с лимфоцитами здоровых лиц,
содержащими HLA-B27. Важно отметить, что сыворотка против
клебсиеллы в семейных исследованиях лизировала лимфоциты толь-
ко членов семьи пробанда, содержащие HLA-B27. В культуре ткани
клебсиелла была способна в течение нескольких часов трансформи-
ровать антиген. Однако это касалось лишь лимфоцитов HLA-B27-
положительных лиц. Имеются и другие факты, свидетельствующие
о том, что в основе предрасположенности лиц, положительных по
HLA-B27, лежит антигенное сходство индивидуума с инфекционным
агентом [Зотиков Е. А. и др., 1985].
Согласно предположениям этих авторов, присутствие в инфек-
ционном агенте антигена, сходного или тождественного HLA-B27,
290
вызывает сенсибилизацию к нему у больных, не содержащих этот
антиген- Из 40 больных с периферической формой болезни Бехте-
рева, болезнью Рейтера и иерсиниозной артропатией были отобраны
лица, у которых отсутствовали HLA-B27. Среди последних у 3
больных были обнаружены антитела, сходные по специфичности с
анти-НЬА-В27. Однако сходство было неполным и затрагивало, оче-
видно, не все детерминанты, определяющие HLA-B27, что согласу-
ется с данными других авторов [Grumet F. С. et al., 1982], которые
с помощью моноклональных антител установили ряд аллогенных
вариантов HLA-B27.
Таблица 7.1
Частота выявления антигенов HLA, ассоциированных с заболеваниями [Svejgaard А.
et а!.. 1983]
Заболевание Антигены HLA Частота встречаемости ан- тигена, % Относитель- ный риск, %
больные здоровые (контроль)
Анкилозирующий спонди- В27 90 9.4 87,4
лит Болезнь Рейтера В27 79 9,4 37,0
Острый передний увент В27 52 9,4 10,4
Подострый тиреоидит В35 70 14,6 13,7
Псориаз (обыкновенный) CW6 87 33,1 13,3
Герпетиформный дерматит D/DR3 85 26,3 15,4
Целиакия D/DR3 79 26,3 10,8
Синдром сухости во рту D/DR3 78 26,3 9,7
Недостаточность надпочечни- D/DR3 69 26.3 6,3
ков (идиопатическая адди- сонова болезнь)
Болезнь Гревса D/DR3 56 26,3 3,7
Инсулинзависимый диабет D/DR3 56 28,2 3,3
(инсулит) D/DR4 75 , 32,2 6,4
Системная красная волчанка D/DR3 70 28,2 5,8
Идиопатическая мембраноз- D/DR3 75 20,0 12.0
ная нефропатия
Неврит зрительного нерва • D/DR2 46 25,8 2,4
Дефицит С2 фактора компле- D/DR2
мента
Синдром Гуднасчера В8 D/DR2 88 32,0 15,9
Ревматоидный артрит D/DR4 50 . 19,4 4,2
Пемфигус D/DR4 87 32,1 14,4
IeA-нефропатия (гломеруло- D/DR4 49 19,5 4,0
нефрит)
Тиреоидит Хашимото D/DR5 19 6,9 3,2
Ювенильный ревматоидный D/DR8 23 7,5 3.6
артрит
10*
291
За последние годы установлены высококоррелятивные связи меж-
ду рядом воспалительных заболеваний и HLA II класса (табл. 7.1).
Установление причин образования этих ассоциаций на клеточном,
молекулярном и генетическом уровнях остается задачей ближайшего
будущего. Пока же можно лишь отметить, что лица, имеющие в
своем генотипе аллели D/DR3, D/DR4, D/DR5, в значительной
мере подвержены риску заболеть аутоиммунным заболеванием —
идиопатической аддисоновой болезнью, инсулинзависимым диабетом
(инсулит), тиреоидитом Хашимото и др., в основе которых лежит
иммунное воспаление. Упомянутые заболевания определенным об-
разом связаны с генетическими особенностями экспрессии HLA (см.
ниже).
Антигены гистосовместимости человека играют определенную
роль и при неиммунном воспалении. Последнее развивается вскоре
после воздействия фактора, нарушающего антигенный гомеостаз
организма. Эта реакция возникает значительно раньше иммунного
воспаления.
С антигенами гистосовместимости прочно связывают продукцию
некоторых гуморальных клеточных медиаторов, осуществляющих
запуск воспаления или участвующих в опосредовании этой реакции.
Наряду с клетками иммунной системы в этом процессе участвуют
также клетки неиммунной системы, в естественных условиях со-
держащие антигены HLA II класса. Пусковым моментом, очевидно,
служит взаимодействие чужеродного антигена с HLA II класса,
который клетка воспринимает как сигнал к наработке ряда биоло-
гически активных веществ — цитокинов, в том числе и многих
медиаторов воспаления. Речь идет о выработке интерлейкина 1 (ИЛ-
1), что показано in vitro, клетками моноцитарно-макрофагального
происхождения, В-лимфоцитами, эпителием кожи (клетками Лан-
герганса), эндотелием крупных кровеносных сосудов, дендритными
клетками [BjerkeS., GandernavK G., 1985; Dibby Р. et al., 1986;
Naneroth P. P. et al., 198С]. Отмечена продукция ИЛ-1 также ке-
ратиноцитами кожи [Luger Т. A. et al., 1985]. Этому процессу,
очевидно, предшествует активация генов гистосовместимости чело-
века, обусловливающая экспрессию HLA II класса [Basham Т. Y. et
al., 1985].
Другим цитокином, также нарабатывающимся клеткой в резуль-
тате презентации чужеродного антигена HLA II класса, является
фактор некроза опухоли (ФНО), получивший в англоязычной ли-
тературе название «tumor necrotic factor (TNF)», или «кахексии».
Последний представляет собой полипептид с небольшой молекуляр-
ной массой, выделяемый макрофагами, как это было показано в
ранних работах. В настоящее время установлено, что ФНО проду-
цируется также эндотелием и гладкомышечными клетками крупных
сосудов [WarnerS. J., Libby Р. Р., 1989]. Заслуживает внимания оп-
ределенная взаимозависимость действия этих двух цитокинов.
В литературе сложилось определенное представление, что ФНО
выступает в качестве индуктора наработки моноцитами крови и
эндотелием сосудов ИЛ-1 [Libby Р. Р. et al., 1986; Naneroth Р. Р- et
292
al., 1986]. Более того, обнаружены звенья, обусловливающие зам-
кнутый самоподдерживающийся процесс. Это касается еще одной
группы клеточных медиаторов — интерферонов, участвующих в
рассматриваемых клеточных взаимодействиях. Речь идет об усиле-
нии под действием ФНО синтеза эндогенного интерферона [Kohage
М. et al., 1986], который в культуре ткани усиливает экспрессию
HLA. Это показано в отношении антигенов I класса эндотелия
сосудов, HLA антигенов кератиноцитов человека, клеток лимфо-
бластоидных линий человека [Basham Т. Y. et al., 1985; Collins Т.
et al., 1986; Amaldi I. et al., 1989]. Выраженная экспрессия антигенов
гистосовместимости отмечалась уже через 24—48 ч после начала
культивирования клеток лимфобластоидной линии. Некоторые ав-
торы даже высказывают суждение, что интерферон ведет себя в
качестве промотора генов HLA [Виггопе О. R. et al., 1985;
Girdlstone J., Milstem С., 1988; HakemR. et al., 1989].
Таким образом, можно в общих чертах представить себе картину
каскада взаимообусловливающих действий цитокинов. Поступление
в организм чужеродного антигена, например вируса или эндотоксина
бактерий, быстро, еще до появления ранних признаков иммунной
реакции, приводит к ряду важных событий в клетке. Последнее
связано с соединением эндотоксина или другого антигена с HLA II
класса, которые выступают в качестве универсальных рецепторов.
В этом процессе принимает участие ряд клеток иммунной и неим-
мунной системы. Обязательным условием участия этих клеток в
происходящих событиях является экспрессия на них в естественных
условиях HLA II класса.
Взаимодействие HLA II класса с чужеродным антигеном вос-
принимается клеткой как сигнал, на который она реагирует про-
дукцией ряда цитокинов (ФНО и ИЛ-1), которые не только запу-
скают иммунитет* но и участвуют в формировании реакции им-
мунного воспаления. Оба цитокина ведут себя как эндогенные
пирогены. Появление их в организме сопровождается выраженным
повышением температуры тела. Местно эти клеточные медиаторы
обусловливают дилатацию мелких сосудов и нарушение гемодина-
мики (замедление кровотока), увеличение прокоагулянтной актив-
ности крови, возрастание способности лейкоцитов прикрепляться к
эндотелию сосудов [Nawroth Р. Р., Stern D. М., 19^6; PaberJ.S. et
al;, 1986; BeutlerB., CeramiA., 1987]. В силу того что указанные
выше проявления воспаления часто приводили к некрозу опухолевой
ткани, один из упомянутых выше цитокинов получил первоначально
название «фактор некроза опухоли», закрепившееся за ним, хотя
рамки его физиологического действия значительно шире. Большин-
ство эффектов воспаления могут быть объяснены с позиции участия
Цитокинов. Более того, имеются данные, свидетельствующие о том,
ито биологически активные вещества, общепризнанные медиаторы
воспаления, —: гистамин и серотонин вызывают секрецию ИЛ-1
мононуклеарными клетками [Paegelov I. A., Werner Н., 1988]. В свя-
зи с этим не вызывает удивления тот факт, что дексаметазон
(противовоспалительный препарат негормональной природы) оказы-
293
вает выраженное влияние на уровень ИЛ-1, оказывая ингибирующее
действие на его продукцию (Durum S. К. et al., 1985]. Можно поэтому
предполагать, что характер воспалительных и иммунных процессов
в большой степени определяется активностью генов гистосовмести-
мости.
Участие в иммунных реакциях «неиммунных» клеток позволяет
по-новому взглянуть на роль HLA в реакции воспаления, в частности
в локальных поражениях тканей при некоторых аутоиммунных
заболеваниях; Установлено, что поражение поджелудочной железы
человека при диабете (инсулит) развивается путем инфильтрации
инсулярного аппарата железы эффекторными клетками, аналогич-
ными тем, которые вызывают ГЗТ. Показано заметное уменьшение
при этом количества 0-клеток. Важно отметить, что установлена
выраженная экспрессия HLA-DR на клетках, продуцирующих ин-
сулин, в то время как в норме клетки инсулярной ткани не экс-
прессируют HLA II класса [Bottazzo G. F. et al., 1985].
Эти данные приобретают особый интерес, если учесть, что по-
добные аберрации в сторону повышенной экспрессии HLA II класса
были отмечены в отношении эпителиальных клеток щитовидной
железы при аутоиммунном тиреоидите [Bottazzo G. F. et al., 1983;
Hanafusa Т. et al., 1983], эпителия мелких протоков печени при
билиарном циррозе [Ballardini G. et al., 1984], эпителия толстой
кишки при болезни Крона и язвенном колите [Jewell D. Р.,
Lowes J. R., 1987]. В литературе сложилось вполне определенное
мнение, что несвойственное клетке усиление экспрессии на ней
HLA II класса — весьма характерный признак ранних стадий ауто-
иммунного процесса, морфологическим выражением Которого явля-
ется воспаление.
Некоторые особенности имеет течение иммунного воспалитель-
ного процесса в коже. Исследователи сходятся во мнении, что
наряду с тимусом кожа представляет собой иммунный орган, в
котором происходит постимическое дозревание лимфоцитов
[Wolff К., Stingl G., 1987]. Важную часть этого органа составляют
эпителиальные клетки (клетки Лангерганса), на поверхности ко-
торых имеется молекула CD4, свойственная Т-хелперам. Очевидно,
этим объясняется преимущественно Т-хелперная маркерная при-
надлежность опухолевых клеток при кожных проявлениях Т-кле-
точного ХЛЛ-синдрома Сезари. Последнее обстоятельство дало ос-
нование некоторым исследователям утверждать, что клетки Лан-
герганса могут служить мишенью поражения их вирусом
активно-приобретенного иммунодефицита человека (ВИЧ) и яв-
ляются для него своеобразным резервуаром, где этот вирус со-
храняется [Tschachler Е. et al., 1987].
/ Из общего количества эпителиальных клеток 3—4% составляют
дендритные, располагающиеся глубоко в толще эпителия кожи на
базальной мембране. Дендритные и эпителиальные клетки кожи
обладают способностью представлять чужеродный антиген через по-
средство экспрессированных на них HLA II класса и запускать
систему Т-лимфоцитов [Wolff К., Stingl G., 1987]. По функциональ-
294
ным свойствам среди дендритных клеток выделяют два типа: от-
ветственные за созревание Т-хелперов и обусловливающие созре-
вание Т-супрессоров. Участием этих популяций клеток, а также
цитокинов в большой степени объясняют полиморфизм в коже вос-
палительной реакции при хроническом псориатическом дерматите,
локальной инфильтрации дермы и эпидермиса лимфоцитами, мак-
рофагами и нейтрофилами [Takematsu Н. etal., 1986; Christophers Е.
et al., 1987].
Отмеченными особенностями экспрессии генов HLA и способно-
стью эпителия кожи и кишечника («пограничных тканей») участ-
вовать в иммунологической и воспалительной реакциях, очевидно,
можно объяснить те выраженные локальные клинические проявления
в этих тканях, которые наблюдаются при острой реакции «транс-
плантат против хозяина» (graft versus host reaction) в условиях
аллогенной трансплантации костного мозга.
Приведенные данные литературы позволяют высказать некоторые
соображения относительно общей схемы возможного участия HLA
в воспалении. Началом процесса, по-видимому, служит вирусное
или бактериальное воздействие на организм. В ответ на контакт
чужеродного антигена с HLA II класса макрофаги, В-лимфоциты и
другие клетки иммунной системы отвечают выработкой ряда цито-
кинов — медиаторов воспаления (ФНО, ИЛ-1). В этом процессе
также участвуют клетки неиммунной системы («пограничных тка-
ней») с экспрессированными на них молекулами HLA II класса.
Действие цитокинов, кроме запуска иммунитета, реализуется в
активации общих и местных систем воспаления (схема 7.1), причем
неиммунное воспаление развивается существенно раньше, чем по-
являются первые признаки иммунной реакции. На этом процесс,
однако, не останавливается. Развитие его происходит по каскадному
принципу. Циклокины ФНО и ИЛ-1 индуцируют наработку эндо-
генного интерферона (ФНО) и других клеточных медиаторов, ко-
торые местно обладают способностью воздействовать на систему
генов гистосовместимости. Действие интерферона представляется
чрезвычайно важным. Во-первых, он усиливает экспрессию HLA на
клетках моноцитарно-макрофагального ряда, обычно «презентиру-
ющих» чужеродные антигены. Во-вторых, он обусловливает экс-
прессию HLA II класса на некоторых неиммунных клетках, которые
в нормальных условиях не имеют этих антигенов. Это вызывает
несвойственные им функции «презентации» чужеродных антигенов,
что расширяет наработку цитокинов — медиаторов воспаления и
местные проявления этой реакции. Кроме того, появление клеток,
удерживающих чужеродные антигены или их фрагменты, приводит
к накоплению вокруг них ПЯЛ, лимфоцитов, макрофагов и других
клеток, участвующих в кооперативных взаимоотношениях при фор-
мировании иммунного ответа и фактически осуществляющих вос-
палительную инфильтрацию ткани. Результатом развертывающихся
событий становится воспаление, сопровождающееся развитием ауто-
иммунного поражения клеток, взявших на себя несвойственную
функцию «презентации» чужеродных антигенов. Продукты дегра-
295
Схема 7.1. Участие системы Н1Л в развитии воспаления.
дирующих клеток активируют макрофагальную систему с последу-
ющей наработкой специфических антител и эффекторных клеток —
иммунных киллеров, выполняющих главную функцию в иммунном
воспалении. Антигены гистосовместимости осуществляют важную
гомеостатическую функцию видовой и индивидуальной реакции ор-
ганизма на чужеродный антиген микробного и, очевидно, тканевого
происхождения.
ГЛАВА 8
ВОЗРАСТ И ВОСПАЛЕНИЕ
8.1. ОСОБЕННОСТИ ВОСПАЛИТЕЛЬНОЙ РЕАКЦИИ
У ЗАРОДЫША И ДЕТЕЙ РАЗНОГО ВОЗРАСТА
В .воспалении как сложной местной реакции организма в ответ на
внешнее раздражение, направленной на удаление раздражителя,
задействованы поврежденные тканевые элементы, клетки крови,
микроциркуляторное русло, местные клетки фагоцитарного ряда,
местный нервный аппарат и многочисленные гуморальные факторы.
Эта реакция осуществляется в полной мере лишь в тех случаях,
когда все перечисленные структурные элементы в той ли иной
степени получили развитие в онтогенезе. Таким образом, воспали-
тельная реакция в развернутом виде невозможна у человеческого
зародыша, не достигшего определенной фазы развития, в которой
имеются тканевые элементы, необходимые для такого сложного
реактивного патологического процесса, каким является воспаление.
Очевидно также, что до тех пор, пока не будет достигнута опре-
деленная степень структурного развития задействованных в воспа-
лительной реакции тканевых единиц, воспаление носит редуциро-
ванный характер. При этом частично или полностью выпадают те
ее звенья, осуществление которых невозможно в данный конкретный
момент из-за отсутствия или недостаточного развития определенных
тканевых комплексов в процессе онтогенеза.
К воспалительной реакции можно отнести высказанное Э. Гек-
келем еще в прошлом веке положение (биогенетический закон):
«Закономерное соотношение между индивидуальным развитием фор-
мы и течением эволюционного процесса (филогенеза); в течение
своего индивидуального развития (особенно зародышевого) живые
существа повторяют главнейшие этапы развития всего ряда пред-
ковых форм». Иными словами, онтогенез в общих чертах повторяет
филогенез.
В области патологии основной биогенетический закон Геккеля
был подтвержден И. И. Мечниковым, создателем учения о сравни-
тельной патологии воспаления. В экспериментах И. И. Мечников
проследил местный ответ на введение раздражителя, начиная от
простейших одно- и многоклеточных и кончая позвоночными жи-
вотными, обладающими сосудистой и нервной системами, и уста-
новил, что воспаление прогрессивно изменяется по мере усложнения
структуры живых организмов. Если у простейших единственный
ответ на действие раздражителя — альтеративный процесс, то у
297
животных, обладающих различными тканевыми компонентами, по-
является пролиферативный ответ, преимущественно со стороны кле-
ток мезенхимального гистогенеза. По мере эволюции организмов в
филогенезе с появлением сосудистого русла воспалительная реакция
усложняется благодаря присоединению ответа со стороны кровяного
русла и возникновению экссудативного компонента.
Закон Геккеля о фило- и онтогенезе и учение И. И. Мечникова
о сравнительной патологии воспаления полностью находят свое под-
тверждение при изучении особенностей воспалительной реакции как
в пренатальном онтогенезе человеческого зародыша, так и в ранние
периоды детства.
8.1.1. Воспаление у зародыша человека
На ранних этапах эмбриогенеза воспалительная реакция как таковая
не возникает. В период бластулы экзогенные раздражители, чаще
всего инфекционной природы, приводят к гибели зародыша. При
образовании эмбрио- и трофобласта возможны не только гибель
зародыша, но и повреждения части названных структур. В таких
случаях могут возникать общие тяжелые пороки развития эмбриона
или его провизорных органов. При дальнейшем формировании за-
родышевых листков в начальных фазах органогенеза могут погибнуть
зачатки органов или отдельные части зачатков органов зародыша.
В том случае, если зародыш продолжает развиваться, все перечис-
ленные повреждения приводят к образованию врожденных пороков,
развития (ВПР), причем чаще, особенно при экзогенных воздейст-
виях, ВПР носят множественный характер — множественные врож-
денные пороки развития (МВПР) как самого зародыша, так и его
провизорных органов. Примером такого экзогенного патологического
влияния на зародыш может служить синдром Грегга (описан в
1951 г.), обусловленный воздействием вируса краснухи. В связи с
этим в настоящее время акушеры предпочитают производить ис-
кусственное прерывание беременности в тех случаях, когда женщина
перенесла краснуху, особенно в первом триместре беременности.
Синдром Грегга имеет хорошо изученную типичную морфологию
МВПР, преимущественно органов эктодермального гистогенеза —
зачатков глаза, органов слуха, головного мозга. Наблюдается также
ВПР мезодермального происхождения — сердца, почек и других
органов [Когой Т. Ф., Ивановская Т. Е., 1979].
Если повреждающий агент воздействует в более поздние периоды
развития зародыша — в период конца эмбриогенеза, когда в основном
заканчивается формирование органов, или в ранний период фето-
генеза, когда начинается дальнейшая дифференциация тканей ор-
ганов, реактивные возможности зародыша расширяются и начинает
отчетливо выступать продуктивный компонент реакции, особенно
со стороны мезенхимальных элементов как кроветворного, так и
стромального ряда. Реактивное разрастание стромы как результат
ответа на действие раздражителя удачно названо немецким пато-
298
логом Н. Essbach (1961) «мезенхимозом», который часто сопровож-
дается усиленной пролиферацией кроветворных элементов, в част-
ности эозинофилов. Чем объяснить пролиферацию именно эозино-
филов, которую патологоанатомы особенно часто наблюдают у не-
доношенных новорожденных по ходу портального тракта печени, в
соединительнотканных септах тимуса и некоторых других органов?
Возможно, это явление представляет собой отражение какого-то
иммунного ответа на внешнее раздражение, идущее со стороны
материнского организма. В некоторых случаях ответ кроветворной
ткани включает преимущественную пролиферацию миелоидного ро-
стка, превалирующего над клетками эритроцитарного reMono33aj
пролиферация которого, как правило, имеет место как физиологи-
ческое явление в печени плода до конца антенатального периода.
«Мезенхимозы» могут иметь характер диффузного фиброза, на-
пример, при врожденном сифилисе в селезенке и печени (рис. 8.1).
Иногда «мезенхимоз» сопровождается тканевыми пороками развития
органа, например, при так называемом врожденном холангиодисп-
ластическом псевдоциррозе печени, фиброэластозе эндокарда
(рис. 8.2), фиброзе стромы поджелудочной железы в сочетании с
разрастанием жировой ткани и отсутствием в некоторых случаях
экскреторного аппарата железы. Этиология перечисленных «мезен-
химозов», как правило, остается неясной, хотя врожденный липо-
матоз поджелудочной железы многие исследователи связывают с
внутриутробным влиянием энтеровирусов, в частности вируса Кок-
саки.
В позднем фетальном периоде, соответствующем 28 нед бере-
менности [Лазюк Г. И., 1981 ], когда в основном завершается созре-
вание большинства органов плода, воспалительная реакция по-преж-
нему имеет альтеративно-продуктивный характер, однако с присо-
единением экссудативного компонента и реакции со стороны
микроциркуляторного русла. Воспалительный процесс в фетальном
периоде имеет еще одну особенность: неизбежна генерализация
воспалительного процесса, правда, с преимущественной локализа-
цией поражений в том или ином органе в зависимости от особен-
ностей возбудителя. Примером может служить ветряная оспа, при
которой у детей обычно поражаются только кожные покровы, а у
плода и недоношенного новорожденного возникают генерализован-
ные, почти ареактивные некрозы во многих органах и на слизистых
оболочках, где, как правило, возникают эрозии. Вирус герпеса II ти-
па, а также токсоплазма вызывают преимущественное поражение
ЦНС с образованием обширных очагов некроза в головном мозге
(рис. 8.3) с последующим возникновением диффузного глиоза при
герпетической инфекции или многочисленных кист, содержащих
зернистые шары и псевдоцисты, при токсоплазмозе (рис. 8.4). Вирус
Коксаки В имеет преимущественный тропизм к ЦНС и миокарду
(«энцефаломиокардит» — рис. 8.5). Однако при названных инфек-
ционных процессах, как правило, во многих органах плода можно
обнаружить признаки генерализации процесса, часто в виде интер-
стициальной продуктивной реакции или очагов некроза в паренхи-
299
Рис. 8,1. Диффузный фиброз с атрофией печеночных балок;- внизу
гранулема, состоящая из моноцитарных и миелоидных клеток (врожденный
сифилис у девочки 2 мес). Окраска гематоксилином и эозином, х 260
(препарат Т. Б. Илютович).
Рис. 8.2. Фиброэластоз эндокарда левого желудочка сердца.
300
Рис. 8.3. Киста в области коры полушарий большого мозга при врожденном
токсоплазмозе. Много зернистых шаров, в центре кисты — обызвествленная
псевдоциста токсоплазмы. Окраска гематоксилином и эозином. * 400.
Рис. 8.4. Некротический энцефалит при врожденном генерализованном
герпесе По периферии очагов распада (указано стрелкой) — моноцитарная
инфильтрация и пролиферация глии. Окраска гематоксилином и эозином.
* 260.
301
Рис. 8.5. Очаговая гибель кардиомиоцитов, пролиферация лимфо- и мо-
ноцитов при врожденной инфекции Коксаки В. Окраска гематоксилином
и эозином, х 600 (препарат Л. Н. Каск).
матозных органах. Таковы поражения печени при инфекции, вы-
званной вирусом Коксаки В, и герпесе II типа с характерными
внутриядерными включениями при герпетической инфекции.
Кроме генерализованных некрозов, для фетального периода ха-
рактерно образование гранулем, однако их состав, как правило, не
имеет специфического характера. Так, при врожденном туберкулезе
гранулемы не содержат типичных гигантских клеток Лангханса и
эпителиоидных клеток, а представляют собой очаги казеозного не-
кроза, изобилующие возбудителем, окруженные моноцитарными и
миелоцитарными клетками, т. е. представителями наиболее фило-
генетически древних клеточных популяций [Essbach Н., 1961 ]. При
врожденном сифилисе, кроме «мезенхимоза», могут образовываться
милиарные гранулемы, однако также лишенные специфического для
сифилиса признака — наличия гигантских и плазматических клеток.
В качестве примера приведем наблюдение врожденного листе-
риоза, которое иллюстрирует особенности воспалительной реакции
в фетальном периоде1.
Недоношенный мертворожденный мальчик от первых родов на 35-й неделе бере-
менности. Масса тела плода 850 г, длина 35 см. Выраженная мацерация кожи и
аутолиз внутренних органов. Несмотря на явления аутолиза в паренхиме и под вис-
Наблюдение любезно предоставлено И. Л. Элбакидзе, которой мы выражаем
свою признательность.
302
Рис 8.6. Очаг некроза в дечени с начинающейся пролиферацией по
периферии лимфомоноцитарных клеток при гранулематозном листериозном
сепсисе у мертворожденного. Окраска гематоксилином и эозином, к 160
(препарат И. Л. Элбакидзе).
Рис. 8.7. То же наблюдение. В области некроза гранулемы много листерий.
Серебрение^ по Левадити. х 650 (препарат И. Л. Элбакидзе).
303
Рис. 8.8. Листериозная гранулема в печени при гранулематозном листе-
риозном сепсисе новорожденного. Окраска гематоксилином и эозином.
х 120 (препарат Т. М. Лариной).
церальной плеврой, а также в паренхиме печени (рис. 8,6), почек, надпочечников,
селезенки и в пищеводе хорошо различимы точечные сероватые округлые очажки,
при микроскопическом исследовании оказавшиеся множественными инициальными
некрозами, являющимися начальной стадией листериозной гранулемы. При серебре-
нии по Левадити в очажках обнаружено большое количество листерий (рис. 8.7).
Листерии, кроме того, найдены в базальном слое децидуальной оболочки и ворсинах
хориона, где некротические фокусы окружены лейкоцитарными инфильтратами.
Патологоанатомический диагноз: внутриутробный гранулематозный листериозный
сепсис, множественные инициальные некрозы в легких, печени, селезенке, надпочеч-
никах, почках, пищеводе; антенатальная гибель плода; мацерация кожных покровов,
начинающийся аутолиз внутренних органов, выраженный аутолиз головного мозга;
не^ношенность; базальный листериозный децидуит и виллузит.
Заражение плода в данном случае произошло незадолго до родов,
так ка$ первая фаза формирования листериозных гранулем в виде
.очагов инициального некроза развивается к концу 1-х суток после
заражения [Kreutner А., 1985]. После этого срока начинается про-
лиферация клеток гистиомоноцитарного типа, формирующая лис-
териозную гранулему (рис. 8.8) с последующим вторичным некрозом
ее центра, изобилующего возбудителем. Поражение базального слоя
децидуальной оболочки и ворсин хориона в приведенном наблюдении
свидетельствует о гематогенном заражении плода.
Таким образом, на ранних этапах онтогенеза воспалительная
реакция как таковая отсутствует. Единственным ответом зародыша
в это время является альтеративный процесс, что приводит к его
гибели или гибели отдельных зачатков органов с исходом в фор"
304
мирование ВПР. Редуцированным прообразом воспалительной ре-
акции в конце эмбриогенеза и в раннем фетальном периоде является
пролиферация клеток гемопоэза и стромы органов в виде так на-
зываемых мезенхимозов в сочетании с ВПР на тканевом уровне.
В позднем фетальном периоде в воспалительной реакции преобла-
дают ее ал итеративный и продуктивный компоненты, отсутствует
способность к отграничению воспалительного очага, образуются ге-
нерализованные очаги некроза в органах или гранулемы, содержащие
большое количество возбудителя из-за отсутствия способности ме-
стных тканей и иммунной системы плода к его элиминации.
8.1.2. Воспаление у новорожденных
и детей грудного возраста
Чем ближе возраст ребенка к периоду его внутриутробного суще-
ствования, тем больше сходства имеет возникающая у него воспа-
лительная реакция с таковой у плода. Для иллюстрации этого
положения приведем описание уникальной нозологической формы,
наблюдающейся только у новорожденных, — флегмоны новорож-
денных. Как следует из названия, болеют дети 1-го месяца жизни —
новорожденные. До открытия сульфаниламидных препаратов и ан-
тибиотиков возбудителем заболевания был, как правило, стрепто-
кокк, затем его сменил устойчивый к антибиотикам стафилококк.
В настоящее время вновь появились данные об этиологическом
значении р -стрептококка. Раньше при этом заболевании отмечалась
высокая летальность и оно встречалось относительно часто в педи-
атрической практике. По наблюдениям С. Д. Терновского (1953),
из 30 заболевших новорожденных, лечившихся в хирургическом
отделении больницы им. Н. Ф. Филатова, умерло 25 детей. По дан-
ным централизованной прозектуры Детской клинической больницы
№ 1 Москвы, за период с 1985 по 1988 г. не наблюдалось случаев
смерти от флегмоны новорожденных. Клинически процесс начина-
ется с очага умеренной гиперемии, приобретавшей затем синюшный
оттенок. Процесс локализуется преимущественно в поясничной и
крестцовой областях, на спине, реже — в подмышечной и затылочной
областях или на груди. Участок гиперемии быстро распространяется,
занимая все большую площадь. При оперативном вмешательстве из
раны выделяется небольшое количество мутноватого серозного экс-
судата, содержащего фрагменты некротизированных мягких тканей.
На вскрытии обнаруживают массивный некроз мягких тканей, вклю-
чая мышцы, а также поражение надкостницы и подлежащей костной
ткани. Воспаление начинается в глубине дермы, вокруг потовых
желез, а затем процесс переходит на окружающие ткани. Эпидермис
на значительном протяжении отслаивается, подвергаясь в дальней-
шем некрозу. Воспалительная реакция носит преимущественно не-
кротический характер с очень скудной лейкоцитарной инфильтра-
цией (рис. 8.9). Гнойный экссудат как таковой отсутствует [Ива-
новская Т. Е., 1976].
305
Рис. 8.9. Флегмона новорожденного. Тотальный некроз кожи, подкожной
клетчатки и подлежащей мышечной ткани, скудная лейкоцитарная ин-
фильтрация. Окраска гематоксилином и эозином, х 50.
Из приведенного описания не следует делать вывода, что у
новорожденных и детей первых месяцев жизни преобладает альте-
ративно-продуктивный тип воспаления. В позднем фетальном пе-
риоде и периоде новорожденности постепенно начинает преобладать
экссудативный компонент воспаления и частота гнойных воспали-
тельных процессов становится высокой [Скворцов М. А., 1961 ]. Тем
не менее особые нозологические формы типа флегмоны новорож-
денных повторяют черты воспалительной реакции пренатального
периода и в некоторых случаях могут наблюдаться даже у детей
раннего грудного возраста и первых лет жизни.
Та же закономерность отмечается и при образовании специфи-
ческих гранулем. По данным Е. Potter и J. Craig (1976), специфи-
ческие гранулемы, в частности при заражении грцбами, у детей
1-го полугодия жизни обычно имеют характер множественных очагов
некроза с обилием возбудителя, окруженных реактивными проли-
фератами моноцитарно-гистиоцитарных клеток, которые иногда мо-
гут наблюдаться за пределами этих очагов — в регионарных и
отдаленных лимфатических узлах, селезенке, костном мозге и дру-
гих органах.
У детей 2-го полугодия и первых лет жизни более выражена
склонность к формированию специфических гранулем. Тем не менее
следует отметить, что и у детей 1-го полугодия иногда формируются
такие гранулы, что, вероятно, как и при возникновении любой
306
реакции организма, зависит от гено- и фенотипических особенностей
индивидуума.
Для фетального периода характерно также отсутствие способно-
сти к отграничению воспалительного процесса; эта особенность со-
храняется и в постнатальном периоде. Как показали наблюдения
многих авторов, сепсис с преобладанием фазы септицемии у детей
раннего возраста встречается значительно чаще, чем у взрослых
[Гуревич П. С., Барсуков В. С., 1982; Цеттерштрем Р. и др., 1983;
Norska-Borowka J., Godula-Stuglik U., 1983].
И. И. Мечников рассматривал фагоцитоз, являющийся основным
звеном воспаления, как «защитную» реакцию. Согласно современ-
ным представлением, эта наиболее древняя в филогенезе реакция
иммунитета, как правило, завершает воспалительный процесс, оп-
ределяя тем самым прямую связь воспалительной реакции с реак-
циями иммунитета. Результаты некоторых исследований свидетель-
ствуют о том, что у детей первых 2—3 мес жизни отмечаются
незрелость рецепторов мембран фагоцитов, влияющая на процессы
опсонизации, относительно низкая пластичность мембран самих фа-
гоцитов и сниженная активность бактерицидного эффекта [Вельти-
щев Ю. Е., Ананенко А. А., 1983]. Кроме того, имеет значение не-
зрелость свертывающей и противосвертывающей систем, что обус-
ловливает склонность детей указанного возраста (особенно
недоношенных) к геморрагиям. Это препятствует образованию тром-
бов в венозном и лимфатическом русле очага воспаления, что в
свою очередь противодействует усилению экссудации с последующим
отеком на пораженном участке [Струков А. И., 1982].
Местные факторы, безусловно, препятствуют отграничению воспа-
лительного очага у детей. Очевидно, играют роль также общие особен-
ности реакции тканей ребенка, обусловленные характером обменных
процессов, ионного равновесия, реакции со стороны мастоцитов, ком-
плементарной системы и др. Нельзя забывать, что местный процесс у
детей в периоде новорожденное™ и особенно у недоношенных и детей
2—3 мес протекает при незрелости регулирующих систем организма,
прежде всего иммунной системы, становление которой происходит в
1-й год жизни, а в некоторых случаях еще позднее. Все указанные
выше факторы определяют частоту генерализации воспаления с раз-
витием тех же генерализованных процессов в органах, которые наблю-
даются в фетальном периоде, с той лишь разницей, что в этом периоде
генерализация возникает как правило, а у детей встречается чаще,
чем в другие возрастные периоды.
Таким образом, особенности воспалительной реакции с преоб-
ладанием альтеративного и продуктивного компонентов, а также
склонность к генерализации, характерные для воспалительного про-
цесса в фетальном периоде, наблюдаются также в периоде ново-
рожденности, особенно у недоношенных и детей первого полугодия
жизни. Из этого не следует делать вывод, что у детей первых
месяцев жизни и даже в позднем фетальном периоде не бывает
экссудативных гнойных процессов. Однако среди разных типов вос-
палительных реакций встречается и альтеративно-продуктивный тип
307
воспаления, который в другие возрастные периоды наблюдается
только в особых, экстремальных условиях. Развитие продуктивного
компонента воспаления в виде гранулем у новорожденных и детей
первых месяцев жизни, так же как в фетальном периоде, не всегда
имеет специфический для данного возбудителя характер. Однако
это не исключает возможности развития специфических гранулем
и у детей раннего возраста.
При определении типа воспалительной реакции у детей первых ме-
сяцев жизни в каждом конкретном случае необходимо учитывать их
генетические и фенотипические особенности. Воспалительный очаг,
так же как в фетальном периоде, не имеет склонности к отграничению,
что зависит в основном от местной реактивности детей этого возраста
и незрелости прежде всего иммунной системы. Вследствие этого у но-
ворожденных, особенно недоношенных, и детей первых месяцев жизни
намного чаще, чем в другие возрастные периоды, происходит генера-
лизация процесса с развитием сепсиса, генерализованного продуктив-
ного процесса, в частности гранулематоза, или множественных очагов
некроза. Все особенности воспалительной реакции у детей наблюда-
ются тем чаще, чем ближе возраст ребенка к периоду антенатального
(внутриутробного) существования.
8.1.3. Воспаление у детей в отроческом
и пубертатном периодах
Всегда следует иметь в виду, что в детском возрасте имеется одна
закономерность, которая отличает течение воспаления от такового
у взрослых. Речь идет о способности организма ребенка к отграни-
чению воспалительного очага с последующим заживлением и уда-
лением того раздражителя, который вызвал этот местный процесс.
Защитная роль воспаления, заключающаяся в отграничении его от
окружающих тканей, которая была установлена И. И. Мечниковым,
сближает воспаление с иммунными процессами. Рост и дифферен-
цировка тканей организма, постоянно происходящие в детском воз-
расте с неизбежными отклонениями индивидуального характера,
заложенными в определенном генотипе, составляют тот общий фон,
который находит свое отражение в сниженной способности ребенка
к отграничению местного очага, каким является воспаление, и боль-
шей склонности его к распространению и превращению в генера-
лизованный процесс. Это положение подтверждают статистические
данные, согласно которым сепсис у детей встречается намного чаще,
чем у взрослых.
Кроме внутриутробного периода, периода новорожденности и
первых лет жизни, имеются еще два возрастных пика, когда воз-
можно особенно выраженное усиление указанной неспособности к
отграничению местного воспалительного процесса, — это отроческий
и пубертатный периоды. Как в том, так и в другом основную роль
в перестройке детского организма играют нервная, эндокринная и
иммунная системы.
308
Воспаление в отроческом периоде. В отроческом периоде (воз-
расте), который характеризуется сменой молочных зубов на посто-
янные, общей соматической перестройкой, выражающейся в преоб-
ладании ростового параметра над показателем массы тела ребенка,
указанные изменения воспалительной реакции не так выражены,
как в пубертатном периоде. Однако, очевидно, не случайно в этот
период учащаются аллергические реакции на некоторые раздражи-
тели, чаще в виде ГНТ и ГЗТ, и относительно чаще встречаются
бронхиальная астма, крапивница, отек Квинке, кардит инфекцион-
но-аллергической природы, ревматический артрит аутоиммунного
генеза и другие заболевания такого же генеза, которые до этого у
детей, как правило, не наблюдаются.
Воспаление в пубертатном периоде. В пубертатном периоде
наблюдается выраженная перестройка всех регулирующих систем
организма, в первую очередь эндокринной, вегетативной, нервной
и иммунной. Эта перестройка, сопровождающаяся активацией дея-
тельности указанных систем, неизбежно отражается на реактивности
при любом воздействии патогенного агента и, следовательно, на
таком сложном реактивном процессе, каким является воспаление.'
Если, кроме того, учесть как многообразие особенностей генетиче-
ского характера, так и значение средовых факторов, то легко пред-
ставить, какие сдвиги в системах регуляции могут происходить в
этом возрастном периоде. Как уже отмечалось, общей особенностью
периода детства является сниженная способность к отграничению
воспалительного очага, поэтому вполне понятно, что на фоне зна-
чительных сдвигов в регуляторных системах, наблюдающихся в
пубертатном периоде, эта особенность течения воспаления может
проявляться чаще, чем в другие периоды детства. В качестве ил-
люстрации приводим следующее наблюдение.
Мальчик 14 лет поступил в Детскую клиническую больницу № 1 Москвы в тяжелом
состоянии на 2-й день болезни. Из анамнеза известно, что признаки полового созревания
появились у него с 13,5 лет. Был практически здоров, однако в последние 1,5 года
часто отмечался насморк с гнойным отделяемым. За 2 дня до поступления в больницу
усилились выделения из носа, появилась субфебрильная температура. Внезапно общее
состояние резко ухудшилось, в связи с чем он был направлен в больницу. При
поступлении состояние тяжелое, температура тела гектическая, в легких обильные
влажные хрипы, лейкоцитоз со сдвигом влево, высокая СОЭ. Состояние не улучшалось,
несмотря на проводимую терапию, потерял сознание. Через 12 ч после поступления
в больницу наступила смерть. Клинический диагноз: острая респираторная инфекция;
двусторонняя очаговая пневмония.
На вскрытии: труп мальчика с наличием вторичных половых признаков. При
вертикальном распиле черепа в области околоносовых пазух (передних и задних
решетчатых, основной, лобной) гнойное содержимое. На твердой мозговой оболочке
основания черепа гнойные наложения; мягкая мозговая оболочка отечна, полнокровна,
в области основания мозга мутная. Вещество мозга набухшее, полнокровное. В легких,
преимущественно субплеврально, мно ественные мелкие зеленовато-желтые очажки
размером 2 х 1,5 мм, окруженные геморрагическим венчиком; на остальном протяже-
нии ткань легких отечная, полнокровная. Единичные очажки такого же вида обнару-
жены в корковом веществе почек. Селезенка увеличена в 1,5 раза, дает обильный
«>скоб пульпы. Тимус с жировыми дольками, без изменений Бронхолегочные лим-
фатические узлы увеличены, полнокровны. В мазках гнойного содержимого околоно- :
с°вых пазух и оболочек мозга — колонии стафилококка.
309
Патологоанатомический диагноз: стафилококковая септикопиемия: гнойный си-
нусит с преимущественным поражением решетчатых, основной и лобной пазух; гной-
ный пахимениигит основания черепа, начинающийся гнойный лептоменингит; мно-
жественные метастатические абсцессы в легких, единичные в корковом веществе почек;
острая миелоидная гиперплазия селезенки, бронхолегочных лимфатических узлов;
отек и набухание вещества головного мозга; дистрофия паренхиматозных органов;
возрастная жировая трансформация тимуеа.
В приведенном наблюдении скоропостижная смерть мальчика в
период полового созревания не является случайностью. В. В. Серов
также наблюдал развитие септикопиемии у мальчика пубертатного
возраста, больного гнойным синуситом, послужившим источником
сепсиса. В прозекторской практике далеко не редко встречаются
случаи образования других септических очагов у детей пубертатного
возраста, что, по нашему мнению, свидетельствует о наличии дисба-
ланса в регулирующих системах организма, которые в этом возрасте
функционируют с особым напряжением. Этот дисбаланс неизбежно
влияет на течение местного воспалительного процесса и может явиться
неблагоприятным фоновым состоянием, препятствующим отграниче-
нию воспалительного очага с его генерализацией и развитием сепсиса.
Следует также отметить, что для пубертатного периода харак-
терны заболевания инфекционно-аллергической природы или ауто-
иммунного генеза, такие как ревматизм, возникающий, как правило,
на фоне хронического тонзиллита, системная красная волчанка,
ревматоидный артрит, дерматомиозит, склеродермия. В любом ру-
ководстве по педиатрии можно найти указание на то, что все
переделенные заболевания наблюдаются преимущественно в пу-
бертатном или, реже, в отроческом возрасте [Ивановская Т. Е.,
Леонова Л. В., 1989]. Мы считаем, что изменения реактивности, на
фоне которых развиваются указанные заболевания, безусловно, за-
кономерны и свидетельствуют о значении в их возникновении дис-
баланса регулирующих систем, отмечающегося в пубертатном пе-
риоде и обусловливающего определенное предрасполагающее фоно-
вое состояние. На это же'указывает и тот факт, что инфекционный
эндокардит в его классическом проявлении наблюдается в основном
у детей пубертатного возраста.
Необходимо отметить, что среди грудных детей и новрожденных
в последние годы стали наблюдаться случаи возникновения инфек-
ционного эндокардита, связанного с катетеризацией подключичных
вен в условиях сепсиса, с атипичной локализацией в области правого
предсердно-желудочкового клапана.
Из представленных выше данных о характере воспаления в
пубертатном периоде следует, что особенности течения воспаления
в этом периоде зависят от глубокой перестройки тесно взаимосвя-
занных регулирующих систем организма. Дисбаланс этих систем
может стать неблагоприятным фоном, на котором воспалительный
очаг теряет способность к отграничению или становится источником
искажения реактивности организма, следствием чего являются за-
болевания инфекционно-аллергического, аллергического или ауто-
иммунного генеза.
310
Приведенные нами сведения будут неполными, если не указать
на значение некоторых этиологических факторов, способствующих
возникновению дисбаланса регулирующих систем ребенка. Как по-
казывают данные J. Schaller (1980, 1983), развитие некоторых ин-
фекционно-аллергических и аутоиммунных заболеваний, особенно
типа ревматоидного артрита, у детей тесно связано с определенными
антигенами гистосовместимости. Это указывает на особенности ге-
нетического характера, имеющие значение в течении и возникно-
вении отмеченных нами заболеваний (см. главу 7). Наследственные
факторы, безусловно, играют важную роль в обеспечении струк-
турно-функционального профиля регулирующих систем определен-
ного субъекта. В современных экологических условиях нельзя иск-
лючить также неблагоприятное воздействие внешней среды, особенно
выраженное в критические периоды детства, к которым относится
пубертатный период.
Подводя итог представленным выше данным о воспалительной
реакции у детей разного возраста, следует еще раз подчеркнуть,
что, кроме ее местных особенностей, отмечающихся во внутриут-
робном, постнатальном периодах и в раннем детском возрасте, вы-
ражающихся в преобладании альтеративного и продуктивного ком-
понентов воспаления, весь период детства, начиная от новорожден-
носги и кончая пубертатным возрастом, характеризуется одной
общей особенностью — более выраженной склонностью воспали-
тельного очага к потере способности к отграничению по сравнению
с таковым у взрослых. В связи с этим в исходе воспаления как
местного процесса у детей чаще, чем у взрослых, его репарация не
возникает, а, наоборот, превращается в источник либо генерализации
с развитием сепсиса, либо развития инфекционно-аллергических и
аутоиммунных болезней. Эта особенность проявляется не только у
плода и новорожденного, но также в отроческом и пубертатном
периодах, что зависит от степени сбалансированности регулирующих
систем организма — нервной, эндокринной и иммунной. Об этом
же свидетельствует преимущественное развитие в указанные воз-
растные периоды, в первую очередь в пубертатном, таких заболе-
ваний, как инфекционный эндокардит, ревматизм, ревматоидный
артрит, системная красная волчанка, склеродермия и др. Дисбаланс
регулирующих систем чрезвычайно вариабелен, что в свою очередь
зависит от генетического статуса индивидуума, а также от влияний
факторов окружающей среды, что необходимо иметь в виду при
общей оценке значения возрастного фактора для характера течения
и исхода воспаления.
8.2. ВОСПАЛЕНИЕ В ПОЖИЛОМ И СТАРЧЕСКОМ
ВОЗРАСТЕ
Увеличение продолжительности жизни и числа пожилых и старых
людей в современном обществе, особенности течения в этом возрасте
Различных заболеваний, в том числе воспалительных, характери-
311
зующихся скрытой или стертой клинической картиной, тяжелыми
осложнениями и высокой летальностью, обусловливают необходи-
мость более глубокого изучения вопросов старческой патологии.
В соответствии с рекомендациями Европейского бюро ВОЗ (1963)
пожилой возраст — от 60 до 74 лет, старческий — от 75 до 89 лет,
долгожителями считают людей старше 90 лет. Такое деление весьма
условно, поскольку расплывчаты сами понятия биологического воз-
раста, физиологического и преждевременного старения, старости.
8.2.1. Система гомеостаза и старение
Старение приводит к неуклонному снижению всех функций орга-
низма, что в значительной степени ограничивает его способность
адаптироваться к изменяющимся условиям существования. Сущность
функциональных сдвигов в старости, даже при сохранении физио-
логических констант, сводится к снижению или ослаблению гомео-
статических механизмов вследствие снижения лабильности структур
организма человека. Это касается психоэмоциональной сферы (па-
мять, воля, внимание), рефлекторной деятельности, репродукции,
иммунной реактивности, тонуса и тургора тканей и т. п. Изменения
связаны со снижением метаболизма прежде всего биоэнергетики и
белково-синтетических процессов.
Наблюдаемые в старости функциональные отклонения связаны
с атрофическими, дистрофическими и склеротическими изменениями
внутренних органов, что соответствует нашим представлениям о
возрастной инволюции. Вместе с тем по морфологическим, биохи-
мическим и иммунохимическим критериям изменения в клетках,
обусловленные старостью, нельзя отличить от таковых, вызванных
болезнями, наблюдаемыми в старости [Давыдовский И. В., 1966 ].
Гомеостаз в старости становится другим в результате изменения
многих обеспечивающих его систем, главным образом иммунной,
нервной, эндокринной и сосудистой, а также системы соединительной
ткани, в которой и возникает воспалительная реакция. Инволютив-
ные изменения, характеризующиеся снижением неспецифической
резистентности и иммунной недостаточностью, обнаружены во всех
звеньях неспецифической защиты и иммунитета. При этом инди-
видуальная вариабельность снижения иммунитета генетически де-
терминирована.
Снижение противоинфекционной защиты в пожилом и старче-
ском возрасте относится прежде всего к механизмам неспецифиче-
ской резистентности организма и в значительной мере связано с
системой ПЯЛ. Определенную роль в нарушении антимикробной
защиты играет нейтропения, обусловленная атрофическими и скле-
ротическими изменениями в костном мозге и относительным умень-
шением гемопоэтической ткани как инволютивного, так и неинво-
лютивного генеза [ШвабР., Векслер М., 1987]. Выявлено угне-
тение миграционной способности ПЯЛ, связанное с недостаточной
опсонизацией объектов фагоцитоза в стареющем организме
312
[Makinodan T., 1977]. Возрастные изменения системы ПЯЛ прояв-
ляются также в угнетении их фагоцитарной и бактерицидной ак-
тивности, обусловленной приобретенной недостаточностью фермен-
тных систем этих клеток [Бутенко Г. М., Войтенко В. П., 1983]. Те
же причины определяют и недостаточность системы мононуклеарных
фагоцитов: снижение фагоцитарной активности макрофагов отме-
чено у Людей пожилого и особенно старческого возраста [Бутен-
ко Г. М., Войтенко В. П., 1983; Makinodan Т., 1977].
8.2.1.1. Иммунная система
Снижение реакций гуморального иммунитета при старении харак-
теризуется уменьшением количества антителопродуцирующих кле-
ток и циркулирующих антител при первичном или вторичном им-
мунном ответе, причем первичный иммунный ответ подвергается
наибольшим возрастным изменениям. Слабая реакция на антиген-
ную стимуляцию в пожилом и старческом возрасте связана либо с
уменьшением способности продуцировать антитела, либо со сниже-
нием чувствительности В-лимфоцитов к небольшим дозам антигена
[Blankwater М. J., 1978; Weksler М. Е., 1978]. В старческом возрасте
обнаружена гиперглобулинемия. Эта парадоксальная, на первый
взгляд, реакция связана с избыточной продукцией иммунных гло-
булинов за счет тех клонов клеток, в которых в наибольшей степени
нарушена выработка антител [Haaijman I. et al., 1977]. Вместе с
тем в развитии патологии, наблюдающейся в старости, отмечена
возрастающая роль циркулирующих иммунных комплексов, пред-
посылкой для образования которых является длительная перси-
стенция в организме вирусных или бактериальных антигенов
[Menedith P.I., Walford R.L., 1979].
У людей пожилого и старческого возраста наиболее выраженные
изменения обнаружены в клеточном звене иммунитета. С увеличе-
нием возраста отмечаются уменьшение абсолютного и относитель-
ного количества Т-лимфоцитов и нарушение соотношения между
их субпопуляциями [Батори Г. и др., 1982; Бутенко Г. М. и др.,
1986; Jensen Т. L. et al., 1986], уменьшение количества клеток,
способных реагировать с митогенами [Segall., 1986], снижение их
пролиферативной активности и цитотоксичности естественных кил-
леров [Чекнев С. Б., Ковальчук Л. В., 1987; Jensen Т. L. et al., 1986 ],
а также уменьшение потенциальной возможности Т-лимфоцитов к
последующей дифференцировке в иммунные регуляторные и кил-
лерные клетки. Это приводит не только к «потере» соответствующих
иммунных реакций, но и к выходу многих из них из-под регуля-
торного контроля (например, поликлональная активация В-лимфо-
цитов с появлением клонов, продуцирующих низкоаффинные и
аутореактивные антитела) [YamakidoM. et al., 1983].
Особое значение в клеточных иммунных реакциях приобретают
нарушения рецепции интерлейкинов как внутрисистемных медиа-
торов, обеспечивающих клеточное взаимодействие. Для лимфоцитов,
полученных от старых доноров, характерно снижение способности
313
связывать интерлейкины. Это снижение обусловлено как уменьше-
нием их продукции, особенно ИЛ-2, так и угнетением экспрессии
ИЛ-2-рецепторов с возможным ослаблением их аффинности [Ро-
бинсон М. В. и др., 1986; Yamakido М. et al., 1983; Traill К. N. et
al., 1985]. Именно с этими факторами можно связать нарушения
межклеточных взаимодействий и пролиферации лимфоцитов в кле-
точном иммунном ответе у людей старших возрастных групп.
Важную роль в ослаблении контроля и регуляции иммунного
ответа при старении играют инволютивные изменения тимуса, ко-
торые характеризуются прогрессирующей атрофией и липоматозом.
Характерные возрастные изменения возникают и в других органах
иммуногенеза. Так, в селезенке выявлены редукция периартериаль-
ных лимфоидных муфт, их плазматизация и нарастание инфильт-
рации синусов макрофагами и гранулоцитами. В лимфатических
узлах с возрастом уменьшаются толщина коркового слоя и количе-
ство лимфоидных фолликулов, содержащих реактивные центры.
В ответ на антигенную стимуляцию реактивные центры увеличи-
ваются незначительно или вовсе не изменяются [Сапин М. Р. и др.,
1978]. С увеличением возраста все большее количество лимфати-
ческих узлов оказывается в той или иной степени защищенными
жировой клетчаткой или фиброзной тканью.' В миндалинах, черве-
образном отростке, групповых лимфоидных фолликулах также от-
мечена редукция лимфоидной ткани, увеличивающаяся с возрастом.
Отмеченные при старении морфофункциональные изменения не-
специфической защиты и различных звеньев иммунитета объясняют
в значительной мере особенности воспалительной реакции у людей
пожилого и старческого возраста. Речь идет об особенностях вос-
паления в условиях иммунного дефицита у стариков.
8.2.1.2. Нервная система
На течение воспалительных процессов в пожилом и старческом
возрасте влияют также изменения, развивающиеся при старении в
нервной системе. Эти изменения затрагивают центральные и пери-
ферические нейроны, проводники, синапсы и рецепторный аппарат,
проявляются ослаблением регуляции функциональной активности,
вазомоторных реакций и, что особенно важно в условиях воспаления,
трофики внутренних органов. Снижение функциональной активно-
сти нервной системы, ограничивающей адаптивные возможности
организма, проявляется во всех звеньях ее разных отделов и ха-
рактеризуется преобладанием инволютивных изменений над ком-
пенсаторными.
Хорошо известны заболевания ЦНС, встречающиеся лишь у лиц
пожилого и старческого возраста: дисциркуляторные энцефалопатии,
сенильная и пресенильная деменция (болезнь Альцгеймера), стар-
ческий паркинсонизм, параноидные состояния позднего возраста и
др., в основе которых лежат атрофия, дистрофия и некроз нейронов
коры больших полушарий и подкорковых структур головного мозга.
В патогенезе этих заболеваний важную роль играет несоответствие
314
между потребностью ткани мозга в кислороде и его доставкой.
Однако важно и другое: в клинической картине дисциркуляторных
энцефалопатий и сенильной деменции наряду с расстройствами
психики выражены проявления нейрогенной атрофии (нейродистро-
фии) внутренних органов, аналогичные таковым при их денервации.
Более отчетливо расстройства корковой регуляции трофики внут-
ренних органов выражены при очаговых повреждениях головного
мозга, обусловленных атеросклерозом или артериальной гипертен-
зией.
Схожие состояния могут возникать у пожилых и старых людей
при поражениях спинного мозга, вызванных остеохондрозом, стар-
ческими дископатиями, нарушением кровообращения. При этом в
большей степени повреждаются нейроны и проводящие пути сег-
ментов, в которые поступает меньше крови, что сопровождается
плегиями и параличами конечностей с нарушением чувствительно-
сти, расстройствами функций органов малого таза.
При морфологическом исследовании нейронов головного и спин-
ного мозга, интрамуральных ганглиев А. С. Ступина и соавт. (1983)
обнаружили деструктивные изменения клеток с формированием
аутофагических вакуолей и остаточных телец в сочетании с гипер-
трофией и гиперплазией сохранившихся органелл. Однако выражен-
ность деструктивных изменений имела гетерогенный характер и
определялась локализацией нейронов. У пожилых и старых людей
нередко можно обнаружить выраженные склеротические изменения
вегетативных ганглиев с истончением волокон, атрофией и липо-
фусцинозом клеток Догеля.
У старых животных обнаружено снижение возбудимости шей-
ных, поясничных и паравертебральных ганглиев, тонической им-
пульсации в пре- и постганглионарных волокнах [Фролькис В. В.,
1981 ]. Данные о снижении функциональной активности этих об-
разований согласуются с результатами морфологических исследо-
ваний.
Среди инволютивных изменений вегетативной нервной системы
важное значение имеют повреждения клеток и волокон интраму-
ральных ганглиев. В адренергических волокнах и варикозных тер-
миналях с возрастом снижается концентрация катехоламинов и
увеличивается содержание моноаминоксидазы. В холинергических
волокнах повышается активность ацетилхолинэстеразы. Можно
предположить, что подобные изменения возникают при старении в
интрамуральном нервном аппарате и других внутренних органов.
При старении наблюдаются значительные изменения и в синап-
сах. У старых животных обнаружено уменьшение количества аксо-
дендритических и аксосоматических синапсов, синаптических пу-
зырьков и площади «активных» зон. В синаптических щелях были
выявлены отростки глиальных клеток [Хмельницкий О. К., Ступи-
на А. С., 1989].
Инволютивные изменения нейронов и волокон различных отделов
нервной системы затрудняют высвобождение нейромедиаторов и
трофогенов из нервных образований, становятся причиной дезин-
315
теграции и угнетения регуляторной функции нервной системы. За-
медление или блокада аксотока приводит к трофическим наруше-
ниям органов и тканей с развитием в них атрофии, дистрофии и
склероза. Нарушение афферентной импульсации на фоне сниженной
трофики и склероза тканей, деструкции рецепторного аппарата в
значительной мере искажает информацию,'поступающую в цент-
ральные отделы нервной системы. Вместе с тем ослабленная акти-
вация структур мозга часто не полностью реализуется в соответст-
вующие периферические эффекты. Все это вместе взятое приводит
к снижению адаптивных возможностей организма, органов и тканей,
определяет выраженность альтеративных и вялость репаративных
процессов в очаге воспаления.
8.2.1.3. Эндокринная система
Одним из важнейших факторов нарушения гомеостаза в пожилом
и старческом возрасте является нарушение механизмов гормональ-
ной регуляции обмена веществ. Развивающаяся при старении поли-
гормональная недостаточность обусловлена комплексом сопряжен-
ных изменений нервной системы, эндокринных желез и тканей
внутренних органов. Она характеризуется ослаблением регулятор-
ных влияний ЦНС, снижением чувствительности гипоталамических
структур и клеток эндокринных желез к гуморальным и нервным
воздействиям, уменьшением секреции гормонов в сочетании со сни-
жением их биологической активности, разрушением рецепторов кле-
точных мембран и снижением рецепции клетками-мишенями гор-
мональных стимулов, а также ограничением метаболических воз-
можностей этих клеток [Фролькис В. В., 1981 ].
Морфологическим субстратом инволютивного снижения секре-
торной активности эндокринных органов являются развивающиеся
в них атрофические, дистрофические и склеротические процессы.
Наряду с ними в этих же органах при старении можно обнаружить
очаговую гиперплазию специализированных клеток, направленную
на поддержание достаточного уровня инкреции. Такова старческая
гиперплазия ацидофильных клеток аденогипофиза, коры надпочеч-
ников, фолликулярного эпителия щитовидной железы и других же-
лез, что подтверждено результатами электронно-микроскопических
исследований. При ультраструктурном анализе клеток различных
эндокринных желез, показано, что при старении в специализиро-
ванных клетках происходят изменения, которые характеризуют их
повышенное функциональное состояние, повреждение органелл и
адаптивную перестройку [Хмельницкий О. К., Ступина А. С., 1989].
Однако несовершенство этих компенсаторных механизмов проявля-
ется в низкой биологической активности вырабатываемых гормонов
(преобладание низкойодированных фракций тиреоидных гормонов,
В-цепи и проинсулина и т. п.) и отсутствии характерных клиниче-
ских эффектов. В некоторых эндокринных структурах с возрастом
увеличивается возможность образования из «промежуточных про-
дуктов» йнкрета амилоида. Таков, например, старческий амилоидоз
316
поджелудочной железы, ведущий к развитию старческого сахарного
диабета [Серов В. В., Зыкова JI. Д., 1987].
В клетках и тканях внутренних органов с возрастом угасает
обмен веществ и разрушаются поверхностные рецепторы клеток,
поэтому реакция клеток-мишеней на гормональные воздействия про-
грессивно снижается, сопровождаясь дальнейшим угнетением или
извращением метаболизма.
При эндокринных нарушениях гомеостаза у пожилых и старых
людей наиболее изучена роль тиреоидных гормонов, гормонов ги-
пофизарно-надпочечниково-гонадной системы, инсулина. Недоста-
точность функции щитовидной железы проявляется снижением ос-
новного и белкового обмена. Атрофия мозгового вещества надпо-
чечников обусловливает нарушение функций симпатоадреналовой
системы, снижая вазомоторные и адаптивные реакции организма.
Кроме того, уменьшение концентрации катехоламинов в крови при-
водит к снижению липолитической активности ферментов [Гац-
ко Г. Г. и др., 1985]. Низкий уровень стероидных гормонов коры
надпочечников и половых желез сопровождается слабой реакцией
организма на стрессовые раздражения, нарушением водно-электро-
литного баланса, гиперкоагуляцией, гиперлипидемией и активацией
свободнорадикального окисления липидов. Инсулиновая недостаточ-
ность характеризуется главным образом нарушением обмена угле-
водов и липидов с активацией глюконеогенеза, накоплением сво-
бодных жирных кислот и триглицеридов, усилением синтеза и уве-
личением накопления холестерина, повышенным образованием в
печени липопротеидов низкой и очень низкой плотности [Гацко Г. Г.
и др., 1985; Фролькис В. В., МурадянХ. К., 1988]. Эти вещества
являются негормональными антагонистами инсулина, в то же время
их накопление в организме в условиях дефицита антиоксидантов
сопровождается активацией свободнорадикального окисления липи-
дов, приводящего к дестабилизации и повреждению клеточных мем-
бран.
Таким образом, дискоординация гормональной регуляции в по-
жилом и старческом возрасте, нарушая гомеостатические механиз-
мы, сопровождается прогрессирующим угнетением и извращением
метаболизма клеток и тканей со снижением их способности адекватно
реагировать на повреждение. Изменение обмена веществ с развитием
микро- и макроангиопатий и активацией свободнорадикального окис-
ления липидов в значительной мере увеличивает выраженность
альтеративных изменений и вялость репаративных процессов при
воспалении.
8.2.1.4. Сосудистая система
Старение организма сопровождается уплотнением стенок и сужением
просвета артериальных сосудов различного калибра и капилляров,
которые могут быть обусловлены инволютивными изменениями,
артериальной гипертензией, атеросклерозом, диабетической макро-
и микроангиопатией, старческим амилоидозом и др.
Атеросклеротическое и амилоидное (системный старческий ами-
лоидоз) поражение аорты н ее магистральных ветвей определяет
снижение артериального кровотока в органах и развитие в них
тканевой гипоксии с редукцией микроциркуляторного русла и пе-
рестройкой интраорганных сосудов. Важную роль в развитии гипо-
ксии тканей играет хронический венозный застой, возникающий
при ослаблении сердечной деятельности, вызванной, как правило,
атеросклеротическим поражением венечных артерий сердца.
Снижение тканевого кровотока и связанная с ним гипоксия
органов в немалой степени зависят от развивающейся при старении
перестройки интрамурального сосудистого русла. Эти изменения
носят, вероятно, адаптивный характер и выражаются в появлении
сосудов замыкающего типа и перекалибровке мелких артерий с
последующим склерозом их стенок и сужением просвета, вплоть до
его полной облитерации. Еще одним фактором, обусловливающим
тканевую гипоксию, является гиалиноз артериол, возникающий при
некоторых хронических заболеваниях (гипертоническая болезнь, са-
харный диабет, иммунокомплексные болезни), сопровождающих ста-
рение.
Важную роль в развитии тканевой гипоксии играют нарушения в
системе микроциркуляции. Известно, что в пожилом и старческом воз-
расте снижены пролиферативная активность эндотелия и его компен-
саторная перестройка, затруднена регенерация спущенных эндотели-
альных клеток. При старении отмечены утолщение эндотелиальной
базальной мембраны, изменение ее физико-химических свойств с по-
явлением слоистости и хрупкости стенки кровеносного капилляра. Эти
изменения затрудняют транскапиллярный транспорт кислорода, жид-
кости и питательных веществ [Куприянов В. В. и др., 1986]. В нару-
шениях микроциркуляции немаловажное значение имеют старческий
системный амилоидоз, старческий изолированный амилоидоз аорты и
старческий амилоидоз предсердий с вовлечением в процесс проводя-
щей системы сердца [Серов В. В., Зыкова Л. Д., 1987 ].
Как видно из изложенного выше, выраженный и распространен-
ный характер гипоксии у пожилых и старых людей обусловлен как
инволютивными, так и различными патологическими процессами в
сердечно-сосудистой системе. Недостаточная оксигенация и низкий
уровень биоэнергетического обеспечения метаболизма вызывают ат-
рофические, дистрофические и склеротические изменения тканей,
снижают чувствительность клеток к нейрогуморальным воздействи-
ям. В условиях гипоксии и нарушенной сосудистой трофики тканей
у людей пожилого и старческого возраста воспаление имеет особый
характер.
8.2.1.5. Система соединительной ткани
Функциональная единица соединительной ткани (гистион) является
той средой, через которую транспортируются газы, вода, электро-
литы, поступают в клетку питательные вещества и выводятся про-
дукты метаболизма.
318
Все морфологические образования соединительной ткани функ-
ционируют как единое целое, при повреждении какого-либо ее
компонента нарушается взаимодействие структур всей системы как
между собой, так и с паренхиматозными клетками [Серов В. В.,
Шехтер А. Б., 1981 ]. В связи с этим состояние соединительной тка-
ни — «плацдарма» воспалительной реакции в значительной мере
определяет характер последней.
Возникающие .при старении изменения в иммунной системе,
нейроэндокринной регуляции, нарастающая брадитрофность тканей,
повреждение структур микроциркуляции и связанная с ними гипо-
ксия нарушают интегративное взаимодействие элементов соедини-
тельной ткани, снижают ее защитную, трофическую и репаративную
функции.
Эти изменения касаются в основном клеток соединительной
ткани как короткодистантных регуляторов обменных процессов
(например, важное значение при старении имеет значительное
уменьшение количества лаброцитов). С увеличением возраста вы-
раженные- изменения возникают также в основном веществе и
волокнистых структурах соединительной ткани. Помимо усиления
фибриллогенеза, обусловленного главным образом гипоксией и
уменьшением в какой-то мере в связи с этим количества кле-
точных элементов, важную роль играют биохимические изменения
коллагена соединительной ткани. В пожилом и старческом возрасте
увеличивается количество поперечных ковалентных связей между
полипептидными цепями коллагена, которые образуются при уча-
стии остатков лизиловой кислоты, в результате чего снижается
растворимость коллагена, происходят его накопление и склерози-
рование тканей. Вероятно, образование таких поперечных связей
отражает угнетение ферментативной активности клеток соедини-
тельной ткани, в частности коллагеназы и лизилоксидазы [Кану-
то М., 1982].
Накопление в тканях коллагеновых волокон сопровождается
уменьшением количества эластических волокон и основного меж-
клеточного вещества, нарушаются оптимальные соотношения про-
теогликанов и гликопротеидов. При этом отмечены повышенное
образование и накопление сульфатированных гликозаминогликанов,
уменьшение содержания гиалуроновых структур, с чем связывают
уменьшение проницаемости соединительной ткани, снижение ее
способности противодействовать распространению инфекционных
агентов и их токсинов, дезактивацию бактериальных ферментов,
ослабление защиты рецепторов клеточной поверхности, торможение
Репарации. Относительное увеличение содержания сульфатирован-
ных гликозаминогликанов сопровождается образованием ковалент-
ных связей последних с коллагеном, усилением связывания белков
плазмы и продуктов метаболизма клеток с последующим гиалинозом
и кальцинозом [Серов В. В., Шехтер А. Б., 1981 ]. При исследовании
ультраструктурной организации основного межклеточного вещества
соединительной ткани у старых животных выявлено превращение
характерных для протеогликанов сети тонких волоконцев и мелких
319
гранул в грубый хлопьевидный материал [Хмельницкий О. К., Сту-
пина А. С., 1989 ].
Изменения соединительной тк<Ьш при старении оказывают вы-
раженное влияние на развитие воспалительной реакции у пожилых
и старых людей.
8.2.2. Старение и воспаление
Воспаление в пожилом и старческом возрасте протекает на фоне
иммунного дефицита, нарушений нейрогуморальной регуляции тка-
невого обмена, гипоксии, дистрофических, атрофических и склеро-
тических изменений тканей.
Клинические особенности острых воспалительных заболеваний в
пожилом и старческом возрасте представлены слабовыраженным
лейкоцитозом, стертой или «неадекватной» температурной реакцией,
нередко ее отсутствием, скудостью вазомоторных проявлений. На
передний план MoiyT выступать признаки интоксикации, сердечно-
сосудистой, дыхательной или почечной недостаточности.
Вместе с тем при скудной клинической симптоматике нередко
резко выражен альтеративный (деструктивный) компонент воспа-
ления, вызывающий ранние и тяжелые осложнения. Пролифератив-
ная (репаративная) фаза воспаления выражена слабо и нередко
сохраняется в течение длительного периода времени.
Особенностью инфекционно-воспалительных заболеваний, раз-
вивающихся у лиц старших возрастных групп, является преобла-
дание эндогенной, главным образом оппортунистической грамотри-
цательной и неклостридиальной, анаэробной флоры. Ослаблению
толерантности стареющего организма к собственной микрофлоре в
немалой степени способствует снижение интенсивности обменных
процессов, в том числе и в органах иммунокомпетентной системы.
Определенную опасность в этом отношении представляют очаги
хронической инфекции. Так, острые холециститы у людей пожилого
и старческого возраста являются по существу обострением хрони-
ческого воспалительного процесса в стенке желчного пузыря, где
обнаруживают выраженные склеротические изменения, инфильтра-
цию лимфоцитами и плазматическими клетками, перекалибровку
сосудов. Как правило, воспалительный процесс быстро переходит в
гнойно-некротический и распространяется на подлежащие ткани с
развитием флегмоны или гангрены желчного пузыря (рис. 8.10).
При экстренном оперативном вмешательстве нередко выявляют пер-
форацию стенки желчного пузыря, перитонит или абсцессы в ок-
ружающей подкожной жировой клетчатке.
Еще одним примером, иллюстрирующим особенности воспаления
у пожилых и старых людей, является хронический колит. Даже
незначительные погрешности в диете больных вызывают ухудшение
кровообращения в системе брыжеечных артерий, что приводит к
обострению воспалительного процесса с формированием -обширных
язвенных дефектов. Такие язвы часто осложняются перфорациями
320
Рис. 8.10. Гнойно-некротический холецистит у женщины 70 лет: на границе
с некротизированной тканью виден участок мышечной оболочки желчного
пузыря, замещенный зрелой грануляционной тканью; в инфильтрате
преобладают лимфоциты и плазматические клетки. Окраска гематоксилином
и эозином, х 200.
кишечной стенки. Хронические перисигмоидиты, особенно при ди-
вертикуле кишки, у старых людей нередко обнаруживают на вскры-
тии. Они сопровождаются гипертрофией циркулярного слоя мышеч-
ной оболочки, выраженным и распространенным склерозом окру-
жающей подкожной жировой клетчатки (рис. 8.11), рубцовой
Деформацией стенки кишки со стенозом ее просвета и симулируют
злокачественные новоборазования. В старческом возрасте парапрок-
титы приобретают гнойно-некротический, а порой и гнилостно-не-
кротический характер и распространяются на обширные клетчаточ-
ные пространства.
Острый аппендицит у пожилых и старых людей составляет при-
мерно половину всех острых заболеваний органов брюшной полости
в этом возрасте. Воспалительный процесс характеризуется, как пра-
вило, быстрым распространением и развитием деструктивных форм
> 1-407 321
Рис. 8.11. Хронический перисигмоидит у мужчины 70 лет: выраженная
лимфоплазмоцитарная, макрофагальная инфильтрация мышечного слоя
кишки и окружающей глубоковолокнистой фиброзной ткани. Окраска
гематоксилином и эозином, х 80.
Рис. 8.12. Флегмонозно-гангренозный аппендицитг у мужчины 78 лет. в
подслизистом склерозированном слое червеобразшого отростка видны ар-
терии е резко склерозированными утолщенными стенками. Окраска гема
токсилином и эозином, х 250.
8.12) с перфорацией червеобразного отростка и перитонитом.
Однако нередко в таких случаях речь идет об обострении хрони-
ческого аппендицита.
у пожилых и старых людей часто встречаются хронические
воспалительные заболевания органов мочеполовой системы. У жен-
шин к развитию воспаления предрасполагают инволютивные изме-
нения мышц и связочного аппарата промежности и малого таза,
сопровождающиеся выпадением влагалища, матки, недостаточно-
стью сфинктеров мочевого пузыря. У мужчин развитие хронических
воспалительных процессов в уретре, мочевом пузыре и предстатель-
ной железе в значительной мере обусловлено ее гиперплазией,
приводящей в конечном счете к нарушению пассажа мочи, атонии
мочевого пузыря и формированию дивертикулов его стенки. Стар-
ческие кольпиты,, уретриты, циститы длительное время могут про-
текать латентно. При гистологическом исследовании этих органов
можно выявить склеротические, дистрофические, атрофические из-
менения всех структурных элементов их стенки с истончением или
десквамацией эпителиальной выстилки. На этом фоне определяются
воспалительная инфильтрация разной степени выраженности и ве-
нозное полнокровие. Иногда в слизистой оболочке можно обнаружить
микроабсцессы.
Острый пиелонефрит — весьма распространенное заболевание в
пожилом и старческом возрасте. Для него характерна склонность к
гнойному расплавлению ткани с образованием карбункулов почек
и развитием пионефроза. Нередко гнойно-некротическое воспаление
распространяется на паранефрий с образованием обширных флегмон
околопочечной клетчатки.
Особенность (флегмонозного воспаления мягких тканей у по-
жилых и старых людей также заключается в его гнойно-некро-
тическом характере и быстром распространении на соседние об-
ласти. Возникающие в старческом возрасте одонтогенные флегмоны
челюстно-лицевой области, распространяясь на соседние клетча-
точные пространства, сопровождаются гнойно-некротическими ми-
озитами и фасциитами (рис. 8.13), часто осложняются медиасти-
нитом, менинпггом, тромбозом вен лица и синусов твердой моз-
говой оболочки.
Нарушение репаративных процессов при воспалении в пожилом
и старческом возрасте можно проследить на течении пролежней и
Трофических язв.. Вследствие быстрого внедрения и распространения
инфекции, преобладания деструктивных процессов над репаратив-
ными острые язвы превращаются в хронические: развивается хро-
ническое гнойно-некротическое воспаление, сопровождающееся ин-
токсикацией, пры этом отмечается склонность к генерализации ин-
фекции.
Старение накладывает отпечаток и на течение гранулематозного
'’‘Специфического)» воспаления. Так, легочный туберкулез у пожилых
и ^аРЫх людей, являясь по существу выражением послепервичной
Фекции, характеризуется не только бронхолегочной, но и лим-
*елезистой генерализацией.
П*
323
Рис. 8.13. Одонтогенная флегмона подчелюстной области у женщины
69 лет. Гнойно-некротический фасциит, выраженная деструкция мышечных
клеток и коллагеновых волокон. Окраска гематоксилином и эозином, х 300.
Рис. 8.14. Хронический очаговый туберкулез почки; гнойный пиелонефрит
с формированием карбункула у мужчины 90 лет. На фоне банального
хронического воспаления и нефросклероза — специфическая грануляци-
онная ткань с гигантскими клетками Пирогова — Лангханса. Окраска
гематоксилином и эозином, х 200.
Среди внелегочных проявлений старческого туберкулеза особое
место занимает поражение почек. Туберкулез почек у пожилых и
старых людей имеет вялое хроническое течение, черты специфич-
ности грануляционной ткани стерты (рис. 8.14), гигантские клетки
Пирогова — Лангханса приобретают сходство с гигантскими клет-
ками типа инородных тел. Вокруг туберкулезных очагов и каверн
выявляют склеротические изменения и признаки неспецифического
воспаления [Струков А. И., Соловьева И. П., 1976]. При этом не-
редко преобладает неспецифический пиелонефрит, вплоть до обра-
зования карбункула почки.
Таким образом, для воспаления в старческом возрасте характерно
отсутствие параллелизма между его клиническими и морфологиче-
скими проявлениями: при стертости клинических признаков отме-
чаются деструктивно-некротические изменения ткани, нередко на
фоне ее атрофии и склероза. В связи с этим так опасно воспаление
в старческом возрасте, поскольку возникновение или обострение
воспалительного процесса в старости отражает декомпенсацию за-
щитно-приспособительных реакций организма [Давыдовский И. В.,
19661.
ГЛАВА 9
ХАРАКТЕР ВОСПАЛЕНИЯ В ЗАВИСИМОСТИ
ОТ ОСОБЕННОСТЕЙ ПРИЧИННОГО ФАКТОРА
9.1. БИОЛОГИЧЕСКИЕ АГЕНТЫ
Воспаление, вызванное биологическими агентами, представляет со-
бой основное проявление инфекционных болезней, роль которых в
Заболеваемости и смертности весьма высока. Среди различных био-
логических агентов, которыми могут быть многочисленные растения
и животные, относящиеся к разным типам и царствам, наибольшую
роль играют бактерии и вирусы. Особенности структуры и жизне-
деятельности возбудителей накладывают существенный отпечаток
на характер воспаления, возникающего при их внедрении в организм
человека.- Наиболее отчетливо отличия в проявлениях воспалитель-
ного процесса определяются при снижении реактивных возможностей
макроорганизма, в частности при нарушении иммунной системы.
Для оценки особенностей воспаления, связанных со свойствами
его возбудителя, в острой фазе болезни необходимо возможно полное
выявление в тканях возбудителей процесса и их взаимоотношений
с клетками (тканями) пораженного органа. При хроническом тече-
нии болезни или в ее исходе требуется изучение последствий такого
взаимоотношения. При определении давности инфекционного про-
цесса любой этиологии следует обращать внимание на очаговые
лимфоплазмоцитарные, инфильтраты в строме органов, умеренные
склероз, кальциноз и пролиферацию клеток мезенхимного проис-
хождения или глии, которые выявляются при длительном течении
брлезни или при повторном развитии за короткий срок инфекций,
j Для ориентировочного определения характера возбудителя исс-
ледование целесообразно начинать с изучения мазков-соскобов из
тех органов, где имеется инфекционный процесс. При таком исс-
ледовании можно разграничить возбудителей, относящихся к разным
типам, классам и семействам, а также установить в ряде случаев
их состояние. Кроме того, при этом выявляются особенности кле-
точной реакции, взаимоотношения между возбудителями и клетка-
ми, а также характерные для ряда инфекций изменения клеток.
Еще лучше особенности клеточной и тканевой реакций при
разных инфекционных процессах определяются при гистологиче-
ском исследовании. В острый период болезней, вызванных возбу-
дителями, относящимися к разным группам, наблюдается преоб-
ладание то альтеративного, то экссудативного компонентов воспа-
ления. При хроническом же течении происходит формирование
очагов продуктивного воспаления, нередко с образованием инфек-
326
ционных гранулем, несколько различающихся при разных инфек-
циях (см. ниже).
Естественно, что на основании результатов морфологического
изучения возможна лишь ориентировочная расшифровка этиологии
процесса, чаще в отношений класса, реже семейства возбудителя.
Окончательно этиологию инфекции можно установить по результа-
там комплексного обследования.
Достоверность данных патологоанатомического изучения инфек-
ционных болезней зависит, конечно, не только от объема и качества
лабораторных исследований. Важен учет всех сторон сложных вза-
имоотношений между возбудителями и макроорганизмом. При этом
необходимо помнить об особенностях ткани, в которой развивается
инфекционный процесс. Например, нельзя объяснять патогенез хро-
нической дизентерии сохранением шигелл в энтероцитах, резко
превышающим длительность существования самого энтероцита.
Очень распространенной является ошибка, основанная на связыва-
нии всех выявленных структурных изменений с агентом, обнару-
женным при посмертном исследовании.
Необходимо отметить, что морфологическое изучение инфекци-
онных болезней возможно и на архивных материалах. В частности,
при наличии парафиновых блоков сделанные с них срезы могут
быть окрашены любыми красителями для выявления агентов. При
некоторых инфекциях, особенно бактериальных, можно даже про-
вести иммунофлюоресцентную (ИФ) микроскопию. Через неогра-
ниченные сроки можно выполнить и гистологическое исследование
кусочков, взятых из музейных макропрепаратов, приготовленных с
сохранением окраски.
Приступая к описанию отдельных инфекционных болезней, мы
будем рассматривать их вначале как моноинфекции, несмотря на
то, что в настоящее время по материалам вскрытий выявляются,
как правило, сочетанные и смешанные инфекции [Цинзерлинг А. В.,
1991 ].
9.1.1. Особенности воспаления при инфекциях,
вызванных вирусами
Для выявления характерных черт воспалительного процесса при
заболеваниях, вызванных вирусами, наиболее целесообразно исполь-
зовать относительно простые методы с целью обнаружения вирусного
антигена с возможно точным определением его взаимоотношений с
клетками. При этом нужно иметь в виду, что антиген выявляется
лишь на определенных стадиях болезни, когда количество его мак-
симально.
Распространенным является метод прямой или непрямой ИФ-
микроскопии. В качестве объектов исследования можно использовать
мазки-соскобы из дыхательных путей, легких, головного мозга,
почек, печени и других органов, а также криостатные и даже
парафиновые (залитые по методике Санта-Мари) срезы. В последние
327
годы преимущественно за рубежом при ряде вирусных инфекций
стал распространяться способ выявления антигенов иммуноперокси-
дазным методом. Наибольшее число публикаций посвящено диа-
гностике герпеса. Следует, однако, отметить, что господствовавшие
вначале суждения об абсолютной надежности и простоте этого метода
стали позднее сменяться более осторожными оценками [Grandien М.,
Stenkvist-Olding Е., 1984]. Большие перспективы в повышении точ-
ности обоих методов связаны с использованием для приготовления
диагностических препаратов моноклональных сывороток.
В посмертной диагностике инфекций выделение вирусов имеет
умеренное значение, что объясняется прежде всего его трудоемко-
стью. Широкое использование вирусологических методов с диагно-
стической целью при большинстве инфекций представляется неоп-
равданным. Кроме того, в ряде случаев возможно выделение вируса
(например, простого герпеса или энтеровирусов) при отсутствии в
исследованном органе сколько-нибудь отчетливых структурных из-
менений. При оценке возможностей вирусологического исследования
необходимо учитывать термолабильность вирусов, которая сущест-
венно различается у разных вирусов.
Ценная для мор^юлога информация может быть получена и при
использовании методов (реакция иммунной конкуренции, иммунной
гемадсорбции и т. д.), направленных на выявление вирусных анти-
генов в жидкостях и тканях организма. Из других лабораторных
методов информативен серологический с определением уровня ан-
тител в реакциях связывания комплемента и непрямой гемагглю-
тинации. Для постановки этих реакций могут быть использованы,
кроме крови, цереброспинальная жидкость и околоплодные воды.
Результаты даже однократного посмертного исследования представ-
ляют ценность, в частности, для установления длительности болезни,
особенно при определении фракций и при сопоставлении с резуль-
татами ИФ-микроскопии и гистологического изучения.
Перспективными являются биохимические исследования, направ-
ленные на выявление изменений в качественном и количественном
составе ганглиозидов, составляющих основу вирусных рецепторов.
Так, при герпесе отмечается достоверное увеличение GDib-фракции
ганглиозидов [Индикова М. Г. и др., 1986].
Важным для морфолога является умение правильно проводить
цитологическое исследование мазков-соскобов, которые следует
брать параллельно с мазками-соскобами для ИФ-микроскопии.
Очень простой является окраска мазков метиленовым синим —
основным фуксином. При этом, помимо бактерий, грибов и неко-
торых других возбудителей, определяются фуксинофильные вклю-
чения (ФВ), представляющие собой возникшие под воздействием
вирусов участки альтерации клетки, в основном ее цитоплазмы.
Кроме того, в мазках выявляется характерный для заболеваний
этой группы гигантоклеточный метаморфоз.
Существенное значение имеет выявление особенностей струк-
турных изменений [Цинзерлинг А. В., 1977; Авцын А. П и др.,
1983]. При гистологическом исследовании даже без использования
328
вирусоскопически/ методик необходим также поиск вирусных вклю-
чений в пораженных клетках. Наиболее широко известны тельца
Бабеша—Негри при бешенстве и Пашена при оспе. Среди наиболее
распространенных в настоящее время инфекций включения легче
всего выявляются при заболеваниях, вызванных ДНК-вирусами.
Кроме вирусных включений, диагностическое значение при гисто-
логическом исследовании имеет гигантоклеточный метаморфоз самих
пораженных клеток.
Исключение составляют медленные инфекции, к которым относят
ряд своеобразных заболеваний [Ващенко М. А., Анисимова Ю. Н.,
1982]: подострый склерозирующий панэнцефалит, рассеянный скле-
роз, куру, болезнь Крейнцфельда—Якоби и вилюйскии энцефалит.
Медленные нейроинфекции выявляются и у животных (скрепи у
овец, контагиозная энцефалопатия у норок и др.). Все эти заболе-
вания характеризуются крайне медленным течением, иногда в те-
чение многих лет. Большинство исследователей рассматривают сей-
час эти болезни как вирусные, в частности, не вызывает сомнения
роль вируса кори при подостром склерозирующем панэнцефалите
[Гузов С. А., 1988 ]. В других случаях, например при куру и скрепи,
этиология стала очевидной лишь после успешного заражения экс-
периментальных животных тканью мозга, несмотря на невозмож-
ность выявить вирус при электронной микроскопии или получить
его репродукцию в культурах тканей. Необычные свойства возбу-
дителей этих болезней объясняют тем, что они являются прионами
[Prusiner S. В., 1982 ] и представляют собой способные к репродукции
белки без включения в их состав какой-либо нуклеиновой кислоты.
Попытки использовать для внутриклеточного выявления вирус-
ных частиц методы электронной микроскопии при большинстве
других инфекций оказались безуспешными. Видимо, это связано с
тем, что внутри клеток редко содержатся относительно легко оп-
ределяемые сформированные полные вирионы. Наиболее существен-
ный вклад вносит электронная микроскопия при исследовании кала
в случаях ротавирусной инфекции [Дроздов С. Г. и др., 1982], а
также при некоторых заболеваниях, вызванных ДНК-вирусами
[Stasney J., 1980].
9.1.1.1. РНК-вирусные инфекции
К этим инфекциям относятся заболевания, вызываемые вирусами
семейств Orthomyxoviridae, Paramyxoviridae, Picornaviridae,
Rabdoviridae, Togaviridae, Retroviridae.
9. J. J. J. 1. Заболевания, вызываемые вирусами семейств
Orthomyxoviridae и Paramyxoviridae
К этим инфекциям, помимо большей части респираторных вирусных,
относятся эпидемический паротит и корь. Заражение при всех этих
болезнях происходит воздушно-капельным путем от больных люйей.
Грипп, парагрипп и респираторно-синцитиальная (PC) инфек-
329
ция. Возбудителями этих заболеваний являются мелкие организмы
размерами 80—120 нм (вирус гриппа), 90—600 нм (вирус пара-
гриппа) и 90—120 нм (респираторно-синцитиальный вирус).
Репродукция вируса происходит прежде всего в эпителиальных
клетках органов дыхания и состоит из нескольких основных этапов.
Вначале осуществляется адсорбция вируса на оболочке восприим-
чивой клетки, видимо, за счет противоположных зарядов между
поверхностными структурами вируса и клетки. В начальном периоде
это взаимодействие обратимо. Следующим этапом является проник-
новение вируса или его нуклеиновой кислоты в клетку. При гриппе
это происходит благодаря ферменту нейраминидазе вируса. Возмож-
но, по мнению многих вирусологов, и активное поглощение клеткой
вируса (виропексис или пиноцитоз). Между проникновением вируса
в клетку и появлением в ней потомства в виде многих сотен
вирусных частиц может пройти всего лишь несколько десятков
минут. Быстрота репродукции вируса, поскольку она производится
клеткой хозяина на матрицах-вирусах, зависит от ритма исходного
обмена в клетках хозяина.
При патологоанатомическом исследовании первоначальные из-
менения заключаются в появлении в клетках эпителия вирусных
включений. Как уже указывалось, вирусы начинают выявляться в
тканях после скрытого периода, длительность которого в опытах с
гриппом [Мельникова В. Ф., Аксенов О. К., 1989] при ИФ-иссле-
довании составила 6 ч. В дальнейшем, после того, как агент на-
капливается в достаточном* количестве, он начинает выявляться и
при Световой микроскопии: его скопления имеют вид базофильных
гранул, располагающихся при РНК-вирусах в цитоплазме, а при
ДНК-вирусах — в ядре. Все вирусы лучше всего размножаются в
эпителии. Это касается в первую очередь эпителия трахеи и бронхов,
а также желез в подслизистой оболочке дыхательных путей и аль-
веолярном эпителии. В ответ на внедрение вируса уже через не-
сколько часов в клетке закономерно образуются цитоплазматические
и изредка внутриядерные ФВ (рис. 9.1, г). Количество этих вклю-
чений значительно варьирует в зависимости от стадии болезни.
Максимальное их число выявляется при затихании инфекционного
процесса.
Под влиянием жизнедеятельности вирусов, особенно респиратор-
ных, возникают гигантоклеточный метаморфоз клеток и специфи-
ческие разрастания эпителия, а также неспецифические дистрофи-
ческие изменения [Цинзерлинг А. В., 1977; Максимович Н. А., Го-
рин В. И., 1980]. При гриппе происходит гипертрофия пораженных
клеток с образованием крупных одноядерных клеток, что лучше
всего выявляется в альвеолоцитах (рис. 9.1, а, б). При кори воз-
никают многоядерные гигантские клетки. При парагриппе (рис. 9.1, в)
и PC-инфекции образуются разрастания эпителия, в основном мер-
цательного. Поскольку сходные изменения наблюдаются в заражен-
ных вирусами культурах тканей и не встречаются при бактериальных
и иных заболеваниях, их можно рассматривать как имеющие ди-
агностическое значение.
330
Рис. 9.1. Изменения в легких при инфекциях, вызванных РНК-вирусами,
а — в просветах альвеол много слу темных альвеолоцитов, подвергшихся гигантоклеточному
метаморфозу при гриппе А2. Окраска гематоксилином и эозином. * 600; б — специфическое
свечение антигена вируса гриппа А2 в мазке-соскобе, обработанном специфической сывороткой.
х 1350; в — подушкообразные разрастания эпителия бронха при парагриппе. Окраска гема-
токсилином и эозином, к 300; г — фуксинофильные включения (ФВ) в мазке-соскобе из
легкого при сочетанной респираторной вирусной инфекции. Окраска основным фуксином —
метиленовым синим. * 1350.
Наряду с этими возникают и неспецифйческие дистрофические
изменения эпителиальных клеток. В подавляющем большинстве слу-
чаев пораженный эпителий в дальнейшем частично слущивается.
Несмотря на имеющиеся высказывания о посмертном характере
такого слущивания, можно быть уверенным в том, что оно, во
всяком случае частично, является прижизненным. Даже если допу-
стить, что это слущивание происходит в агональном периоде, то и
тогда оно подготовлено инфекцией.
При локализации процесса в органах дыхания в просветах ды-
хательных путей и альвеол накапливается жидкость, богатая бел-
ками, к которой могут примешиваться не только описанные выше
клетки, но и отдельные макрофаги, эритроциты и нейтрофильные
лейкоциты, а также фибрин. Изменения дыхательных путей назы-
вают вирусным назофарингитом, ларингитом и трахеобронхитом.
Аналогичны им поражения респираторных отделов. Единственным
отличием является отсутствие примеси слизи в экссудате. Все это
дает основание рассматривать поражение легких как вирусную пнев-
монию. Конечно, допуская возможность возникновения вирусной
пневмонии, необходимо четко представлять себе, что этот процесс,
как правило, мелкоочаговый. После развития на фоне вирусного
поражения бактериальной пневмонии оно настолько «перекрывается»
последней, что может быть выявлено лишь при специальном ис-
следовании.
Следует остановиться на изменениях, которые при респираторных
вирусных инфекциях нередко трактуются как острая интерстици-
альная‘пневмония. М. А. Скворцов (1947, 1960) и A. Call (1985)
этим термином обозначали утолщение межальвеолярных перегоро-
док за счет гиперемии, пролиферации гистиоцитов, инфильтрации
лимфоцитами и плазмоцитами, накопления нейтрофильных лейко-
цитов и фибробластов, а также увеличения количества аргирофиль-
ных волокон. На препаратах, окрашенных гематоксилином и эози-
ном, подобные изменения действительно часто выявляются. Однако
при импрегнации срезов серебром по Футу можно видеть, что эти
участки с кажущимся утолщением межальвеолярных перегородок
на самом деле представляют собой несколько спавшихся или полу-
спавшихся альвеол, т. е. участок дистелектаза. Наблюдаются они
преимущественно у детей первых месяцев жизни прежде всего в
связи с недостаточным по сравнению со взрослыми развитием в их
легких эластических волокон. Наибольшее значение для формиро-
вания таких дистелектазов следует придавать уменьшению содер-.
жания в легких сурфактанта в результате недостаточного его синтеза
или избыточного разрушения. Сказанное, конечно, не означает, что
в легких не бывает воспалительных интерстициальных изменений.
Из первичного очага у новорожденных часто происходит пре-
имущественно гематогенная диссеминация вирусов. Преобладание
вирусемии очевидно, так как никаким другим способом вирусы из
легких не могут одновременно попасть в головной мозг, почки,
селезенку, печень и другие органы. Это подтверждает наличие
практически во всех органах поражения мелких кровеносных сосу-
332
дов. Лимфогенное распространение возможно, однако оно имеет
несравненно меньшее значение, что видно из сопоставления частоты
обнаружения антигенов вирусов в селезенке и разных лимфатиче-
ских узлах [Цинзерлинг А. В., Морской В. В., 1975]. Сложнее судить
о роли интраканаликулярного распространения вирусов, например,
из легких в кишку. Все же на основании совпадения частоты по-
ражения кишечника с частотой гематогенной генерализации в дру-
гих органах можно думать, что интраканаликулярное распростра-
нение вирусов не имеет существенного значения. Степень выражен-
ности генерализации значительно колеблется, что зависит прежде
всего от иммунного состояния больного.
При детальном исследовании внутренних органов, особенно у
детей первых месяцев жизни, удается обнаружить различные, иногда
тяжелые изменения, которые принципиально сходны с описанными
в органах дыхания [Цинзерлинг А. В., 1977]. Наряду с этим воз-
никают однотипные изменения при разных инфекциях. Они заклю-
чаются в расстройствах кровообращения с нарушением проницае-
мости кровеносных сосудов, развитием кровоизлияний и вслед за
этим дистрофических, а иногда и некротических изменений парен-
химы органов, что чаще всего объясняется токсическими воздейст-
виями вирусов или ДВС-синдромом.
Респираторные вирусы часто вызывают поражение последа [Цин-
зерлинг А В., Мельникова В. Ф., 1988 ]. Вслед за этим нередко
развивается внутриутробная генерализованная инфекция той же
этиологии с изменениями, аналогичными описанным выше.
Эпидемический паротит. Возбудителем является вирус паротита,
размеры его вириона 100—300 нм. Изменения в области первичного
очага, локализующегося в органах дыхания, не изучены. Лучше
известны проявления лимфогематогенной диссеминации вируса. Они
заключаются в развитии отека и лимфогистиоцитарной инфильтра-
ции, а иногда и кровоизлияний в соединительнотканной строме
слюнных желез, а также яичек, тимуса, щитовидной, поджелудоч-
ной, молочной желез и других органов.
Наиболее тяжелые изменения возникают в головном мозге. Их
проявлением может быть серозный менингит или, реже, менинго-
энцефалит. В цереброспинальной жидкости типично увеличение
цитоза до 1000» 10°/л в основном за счет лимфоцитарных и моно-
цитарных клеток. При ИФ-исследовании ликворного осадка показано
наличие антигена вируса паротита в клетках различного происхож-
дения, особенно дистрофически измененных [Патрик Л. А., 1985].
Наблюдается также умеренное увеличение количества белка (обычно
До 0,6—0,9 г/л). В ткани головного мозга выявляются лишь не-
большие лимфоидные периваскулярные инфильтраты, однако воз-
можны и более тяжелые изменения — периваскулярная демиели-
низация, кровоизлияния и т. д.
Корь. Возбудителем этого заболевания является вирус кори с
размерами вириона 120—250 нм. В пораженных участках легкого
после инфицирования вирусом кори возникает воспалительный про-
цесс, который имеет в основном серозно-макрофагальный характер,
333
здесь же образуются многоядерные гигантские клетки из эпителия,
наиболее полно описанные М. А. Скворцовым (1960). Макроскопи-
чески в это время выявляются катаральный конъюнктивит, фарин-
гит, ларинготрахеобронхит, в легких обнаруживаются, как .правило,
небольшие пневмонические очаги красного цвета.
Вскоре происходит в основном гематогенная диссеминация ви-
руса. Во многих органах возникают гиперплазия ретикулярных кле-
ток и гигантоклеточный метаморфоз пораженных клеток, прежде
всего эпителиальных, что многократно отмечалось, в частности, при
изучении мазков из носа, глотки и оперативно удаленных органов,
в первую очередь червеобразного отростка по поводу аппендицита
[Шройт И. Г., 1961; Finkelday W., 1931, 1932; Whalen Т. V. et al.,
1980]. Необходимо, однако, отметить, что гигантские клетки выяв-
ляются лишь на ранних фазах болезни.
Одновременно развивается специфичное для кори поражение
слизистых оболочек — энантема (пятна Бельского—Филатова—Коп-
лика). В этих участках определяются полнокровие, очаговый отек
.с вакуолизацией клеток эпителия и небольшие лимфогистиоцитар-
ные инфильтраты. Макроскопически энантема вначале имеет вид
мелких очажков красного цвета. Вскоре центральные участки в
результате слущивания поверхностных слоев эпителия становятся
беловатыми. Позднее появляется экзантема — крупнопятнистая па-
пулезная сыпь вначале за ушами, затем на лице, шее, туловище,'
наконец, на конечностях, больше на разгибательных поверхностях.
Наиболее тяжелыми, хотя и редкими, проявлениями генерали-
зации болезни являются поражения ЦНС, отмечающиеся примерно
у 0,1% заболевших. В результате вирусологических и электронно-
микроскопических исследований [Feldman L. et al., 1972; Roos R.
et al., 1981 ] доказано, что вирус кори проникает в нервные клетки,
в которых при световой микроскопии выявляется в виде эозино-
фильных включений. Существенное значение в патогенезе коревых
энцефалитов принято отводить инфекционно-аллергическим меха-
низмам. В настоящее время общепризнана роль коревого вируса в
этиологии подострого склерозирующего панэнцефалита. Возможно,
что вирусы кори имеют значение и для возникновения рассеянного
склероза. Вирус кори может вызвать также внутриутробное пора-
жение зародыша.
9. J. 1.1.2. Заболевания, вызываемые вирусами семейства
Picornaviridae
При этих заболеваниях (полиомиелит, инфекции Коксаки и ECHO,
а также гепатит А), вызываемых вирусами с диаметром вирионов
22—30 нм, наибольшее значение имеет энтеральный путь заражения,
хотя возможны другие пути, в частности воздушно-капельный.
Полиомиелит. Первоначальное размножение вируса полиомие-
лита чаще всего происходит в ротоглотке или кишке. Морфологи-
чески эта стадия болезни не изучена. В дальнейшем происходит
гематогенная и лимфогенная диссеминация вируса, при этом при-
334
близительно в 1 % случаев возникают тяжелые изменения нервной
системы.
Топография поражений нервной системы может быть весьма
различной, наиболее постоянно поражаются двигательные клетки
передних рогов спинного мозга. Пораженные клетки набухают, про-
исходит растворение тигроидных глыбок и пикноз ядер. После гибели
таких клеток в этих местах формируются нейронофагические узелки,
проходящие в своем развитии ряд стадий. В первые два дня вокруг
пораженных клеток появляются скопления нейтрофильных лейко-
цитов. Затем происходит очаговая реакция микро-, олигодендро- и
астроцитарной глии. Клетки глии, выполняющие функции макро-
фагов, фагоцитируют продукты распада. Процесс заканчивается руб-
цеванием.
Помимо изменения нервных клеток, в острой фазе болезни от-
мечаются нарушение проницаемости стенок кровеносных сосудов,
плазморрагии и диапедезные кровоизлияния. Достаточно законо-
мерно возникают изменения и в мозговых оболочках: развиваются
острое воспаление с небольшим отеком и полнокровием оболочек,
незначительная и кратковременная инфильтрация нейтрофильными
лейкоцитами, а позднее — более выраженная инфильтрация лим-
фоидн ми элементами.
В эксперименте Б. А. Ерманом и соавт. (1984) показано, что при
полиомиелите в нейронах вначале подавляется синтез белков. В это
время морфологически отмечаются дистрофические изменения гра-
нулярной эндоплазматической сети и вакуолизация цитоплазмы. Во
II фазе наблюдается внутриклеточная репродукция вируса, что со-
провождается нарастанием альтеративных изменений и увеличением
нетипичных для нервных клеток РНК-содержащих гранул в мито-
хондриях. В III фазе патологического процесса (после выхода вируса)
в клетке возникают некротические изменения. В некоторых клетках
перед гибелью обнаруживаются скопления лизосом и липидов, что,
по-видимому, связано с патологическими регенераторными процес-
сами.
Инфекции Коксаки и ECHO. Клинико-морфологические прояв-
ления этих инфекций многообразны, но наибольшее значение все
же имеет серозный менингоэнцефалит. По своим клиническим и
лабораторным проявлениям он очень незначительно отличается от
серозных менингитов другой вирусной этиологии. Морфологически
в мягкой мозговой оболочке головного и спинного мозга обнаружи-
ваются отек, гиперемия и преимущественно лимфоцитарно-моно-
цитарная инфильтрация. Аналогичная инфильтрация может выяв-
ляться и в сосудистых сплетениях. В случаях менингоэнцефалита
в веществе мозга, кроме того, определяются диапедезные кровоиз-
лияния, нерезко выраженная лимфомакрофагальная инфильтрация
и очаговая пролиферация глии. В отдельных наблюдениях возможна
гибель части нервных клеток, в которых нередко имеются эозино-
и пиронинофильные включения, эндотелия кровеносных сосудов,
дезорганизация белого вещества.
I. Rose и соавт. (1987) считают, что для инфекции, вызванной
335
вирусом Коксаки В, наиболее типично сочетание энцефалита, на-
поминающего по морфологическим проявлениям полиомиелит, с
интерстициальным миокардитом. Патогенез заболевания частично
связан с непосредственным воздействием на миокард вируса Коксаки
(особенно В), который нередко удается обнаружить при ИФ-иссле-
довании. Большое значение имеют и иммунопатологические меха-
низмы. Для инфекции Коксаки А миокардит нехарактерен [Rose I.
et al., 1987].
Очень важным диагностическим признаком являются изменения
диафрагмы, мышц шеи, верхних и нижних конечностей [Максимо-
вич Н. А. и Суптель Е. А., 1972]. Значительно реже в литературе
приводятся описания связанного с Коксаки-инфекцией гепатита.
Респираторная форма инфекций Коксаки и ECHO протекает
обычно сравнительно легко. Морфологические изменения в органах
дыхания мало изучены. По нашим данным, при этих заболеваниях
наряду с изменениями, общими для всех острых респираторных
инфекций, в просвете альвеол выявляются крупные слущенные
клетки. В таких клетках чаще содержится два или более светлых,
нередко сегментированных ядра. I. Rose и соавт. (1987) отмечают
нередкое развитие, в частности при инфекции ECHO, геморраги-
ческой пневмонии.
В последнее время стали привлекать к себе внимание эпидеми-
ческие вспышки острых кератоконъюнктивитов, в частности вызван-
ных энтеровирусом 70 [Королева Г. А. и др., 1984].
Орисывается также, особенно при инфекции ECHO, кратковре-
менная экзантема различного характера. Возможно, кроме того,
поражение верхних отделов пищеварительного тракта, преимуще-
ственно глотки (герпангина) с развитием папул, превращающихся
потом в везикулы, которые затем изъязвляются.
Воспалительные изменения при энтеровирусных инфекциях мо-
гут возникнуть в последе и во внутренних органах зародыша
[Batcup J. et al., 1985].
9.1.1.1.3. Заболевания, вызываемые вирусами семейства
Rabdoviridae
Среди заболеваний, вызванных вирусами данного семейства, наи-
большее значение имеет бешенство.
Бешенство. Вирус бешенства (диаметр вириона 80—200 нм)
передается, как правило, через укус или ослюяение больным жи-
вотным. Наиболее типичные проявления болезни возникают в ЦНС.
В первую очередь это касается изменений неравных клеток серого
вещества, особенно стволовой части головного мозга (продолговатый
мозг, область водопровода мозга, стенки III желудочка).
В пораженных нервных клетках выявляются специфические для
бешенства включения — тельца Бабеша—Негри, имеющие округ-
лую, иногда угловато-треугольную форму и размеры 1—27*4—
10 мкм. Эти тельца не содержат ни РНК, ни ДЯК и, по-видимому,
формируются в результате взаимодействия вируса с пораженными
336
клетками. Но при электронно-микроскопическом исследовании ви-
русных частиц в них обнаружить не удается. Нервные клетки
частично подвергаются альтеративным изменениям, вокруг таких
клеток и реже вокруг кровеносных сосудов постепенно образуются
небольшие разрастания клеток глии («узелки бешенства»). Наряду
с этим в головном мозге выявляются расстройства кровообращения
и отек. Вокруг резко расширенных кровеносных сосудов могут со-
держаться довольно густые, преимущественно лимфоидные, инфиль-
траты.
Принципиально сходные изменения возникают в спинном мозге,
а также в вегетативной нервной системе.
Макроскопические изменения нервной системы скудны. Отмеча-
ются лишь умеренное напряжение твердой мозговой оболочки, пол-
нокровие и отечность мягкой мозговой оболочки, иногда здесь же
имеются кровоизлияния. Ткань головного мозга, особенно серое
вещество, дряблая, отечная, полнокровная, иногда с кровоизлияни-
ями.
9.1.1.1.4. Заболевания, вызываемые вирусами семейства
Togaviridae
К этому семейству относится значительное число патогенных для
человека вирусов с диаметром вириона 40—70 нм. Они вызывают
такие заболевания, как краснуха, арбовирусные энцефалиты и ге-
моррагические лихорадки.
Краснуха. Заражение вирусом краснухи чаще воздушно-капель-
ное. Большое значение имеет трансплацентарное инфицирование,
особенно для возникновения врожденных пороков развития.
Структурные изменения в области первичного очага, локализу-
ющегося в органах дыхания, практически неизвестны. В дальнейшем
происходит генерализация инфекции. Ее наиболее тяжелое прояв-
ление — поражение ЦНС. Выделяют менингеальную, менингоми-
елитическую, энцефалитическую и энцефаломиелитическую формы
[Дадиомова М. А., 1986]. В имеющихся морфологических описаниях
отмечаются отек мозга, точечные кровоизлияния и периваскулярная
лимфоплазмоцитарная инфильтрация. Отдельные авторы сообщают
о перивенозной демиелинизации. Возможно также поражение эн-
дотелия кровеносных сосудов, ядра клеток которого зачастую на-
бухшие, с неровными контурами.
Описаны поражения и других органов, в том числе червеобразного
отростка [Loubet A. et al., 1982]. В коже наблюдается продуктивный
дерматит с периваскулярными лимфогистиоцитарными инфильтра-
тами, гиперкератозом и геморрагиями в дерме.
В плаценте возникают очаговые альтеративные изменения. Опи-
сан пикноз ядер синцитиотрофобласта со скоплением вокруг рас-
падающихся клеток материнских лейкоцитов. Наблюдается также
набухание клеток мезенхимы и эндотелия. Местами в венах пу-
повины и аллантоиса выявляются мелкие участки с некрозом
эндотелия.
337
При внутриутробной краснухе Т. Ф. Косой (1979) наблюдала
продуктивно-некротический энцефалит, продуктивный лептоменин-
гит, некрозы с формированием кист и кальцификатами, продуктив-
ный васкулит и мелкие очаги пролиферации глии преимущественно
в белом веществе. Возможно развитие продуктивно-некротического
эндофтальмита, а в легких отмечается интерстициальная продук-
тивная реакция с гигантоклеточным метаморфозом альвеолоцитов.
Нередко описывается пролиферация эндотелия сосудов. Возникают
и изменения в коже, аналогичные описанным выше.
Арбовирусы вызывают энцефалиты и энцефаломиелиты, к ко-
торым относятся клещевой весенне-летний энцефалит, американские
лошадиные энцефаломиелиты, американский энцефалит Сан-Луи,
австралийский энцефалит и др. Большинству этих энцефалитов
свойственны природная очаговость наличие в естественных условиях
резервуаров (млекопитающие и птицы) и характерных переносчиков
вирусов (клещи, комары).
При клещевом энцефалите входными воротами являются крове-
носные сосуды в поверхностных слоях кожи, где создается депо
вируса. С током крови он проникает в печень, селезенку, легкие
и мозг, где также размножается, после чего повторно поступает в
кровь. Помимо гематогенного, возможны лимфогенный и перинев-
ральный пути распространения вируса. Отмечается особая тропность
его к двигательным центрам головного мозга.
В головном мозге выявляется диффузный, широко распростра-
ненный менингоэнцефалит с преимущественным поражением серого
вещества. При электронно-микроскопическом исследовании [Ер-
ман Б. А. и др., 1984] вирусные частицы локализуются преимуще-
ственно в нервных клетках, особенно на мембранах эндоплазмати-
ческой сети. Возникающий процесс характеризуется воспалительной
реакцией экссудативно-пролиферативного типа и дистрофически-не-
кротическими изменениями нейронов. Резко выражен отек ткани
мозга, увеличено количество олигодендроцитов. Выявляются тяже-
лые изменения сосудов, в них определяются стазы, тромбоз, гомо-
генизация и даже некроз стенок. Закономерно обнаруживаются пе-
риваскулярные инфильтраты, состоящие из лимфоцитов, моноцитов,
гистиоцитов, плазмоцитов, а также диапедезные кровоизлияния.
Отмечается диффузная и очаговая пролиферация микроглии и ас-
троцитов, частично подвергающихся деструктивным изменениям.
При длительном течении инфекции наблюдаются фиброз оболо-
чек, глиофиброз, дистрофические изменения нервных клеток, спон-
гиозная дегенерация, циркуляторные изменения, очаги некроза при
отсутствии признаков воспаления.
Макроскопически мозг и его оболочки при клещевом энцефалит
резко гиперемированы, отечны, мозговое вещество умеренно дряблое.
На разрезе в ткани мозга обнаруживаются множественные точечные
кровоизлияния, особенно в области базальных ганглиев и серого
вещества ствола мозга.
Геморрагические лихорадки — природно-очаговые заболевания,
вызываемые разными вирусами, большую часть которых относят к
338
арбовирусам. Резервуаром возбудителей инфекции являются в пер-
вую очередь грызуны. Заражение человека происходит в результате
укуса инфицированным кровососущим насекомым (комаром, кле-
щом) , реже при контакте с больными животными или их экскретами.
Основные клинико-анатомические проявления обусловлены уни-
версальным капилляротоксикозом с поражением различных органов.
Необходимо отметить, что лихорадки, вызванные одними и теми
же арбовирусами, могут существенно различаться по своим прояв-
лениям в зависимости от- иммунного состояния человека. Это осо-
бенно отчетливо видно при лихорадке Денге — природно-очаговом
заболевании (Юго-Восточная Азия), вызываемом арбовирусами
группы В и передаваемом комарами. У лиц с обычной чувствитель-
ностью, в частности европейцев, наблюдаются двухфазная лихорад-
ка, головная боль, боли в суставах и мышцах, зудящая уртикарная
и макулопапулезная сыпь. У коренного населения, обладающего
повышенной чувствительностью, заболевание протекает с весьма
высокой лихорадкой, выраженным геморрагическим синдромом и
нередким развитием шока.
Особое место занимает геморрагическая лихорадка с.почечным
синдромом (геморрагический нефрозонефрит), наиболее полно опи-
санная В. Г. Чудаковым (1952, 1963). Основное проявление болез-
ни — поражение почек с резким полнокровием и обширными кро-
воизлияниями. Выявляются также альтеративные изменения нефро-
телия, а в просветах канальцев обнаруживаются цилиндры, прежде
всего гиалиновые. Отмечается отек межуточной ткани с альтера-
тивными изменениями ее клеток. В результате сдавления канальцев
нарушается отток мочи. Морфологически это проявляется резким
расширением канальцев в проксимальных участках, а также капсул
клубочков. В клубочках видны очаговые альтеративные изменения
с гомогенизацией сосудистых петель. Позднее выявляется картина
хронического интерстициального нефрита.
Макроскопически почки слегка увеличенные, дряблые. Корковое
вещество постепенно расширяется и становится желтоватым или
розовато-серым. Отмечаются также резкое полнокровие и обширные
кровоизлияния.
9.1.1.1.5. Заболевания, вызываемые вирусами семейства
Retroviridae
Среди заболеваний, вызываемых вирусами этого семейства, наи-
большее значение для человека имеет ВИЧ-инфекция, являющаяся
основной причиной развития синдрома приобретенного иммуноде-
фицита (СПИД).
ВИЧ-инфекция. Заражение вирусом иммунодефицита человека
(диаметр вириона 80—100 нм) происходит преимущественно поло-
вым путем, а также при введении инфицированной крови. Для
этого заболевания наиболее характерны проявления генерализован-
ной инфекции, напоминающей другие генерализованные РНК-ин-
фекции, однако с преимущественным поражением лимфоидной си-
339
Рис. 9.2. Изменения лимфоидных органов при СПИДе.
а — гиперплазия эндотелиоцитов в синусах лимфатического узла, в полостях синусов —
большое число крупных, преимущественно одноядерных клеток. Окраска гематоксилином и
эозином. * 300; б — синус лимфатического узла с крупными, преимущественно одноядерными,
клетками, их цитоплазма однородно окрашивается при ШИК-реакции. х 1350; в — небольшой
островок атрофической ткани тимуса с обызвествленным тимическим тельцем. Окраска гема-
токсилином и эозином, х 135.
стемы [Покровский В. В. и др., 1987; Авцын А. А. и др., 1990;
Казанцева И. А., Пермяков Н. К., 1990; Васильева Г. Г. и др., 1990].
На относительно ранних стадиях болезни в лимфатических узлах
при светооптической микроскопии выявляются широкие гермина-
тивные центры, клетки которых нередко разрушаются. В большин-
стве работ [Biberfeld Р. et al., 1987; Tenner-Racz К. et al., 1988]
отмечается нарушение функциональной активности лимфоцитов, в
частности снижение активности 5-нуклеотидазы в фолликулах и
распад дендритных клеток. В ряде работ подчеркивается, что ВИЧ
находится именно в дендритных клетках [Lobeck Н. et al., 1987].
При использовании моноклональных сывороток в клетках гермина-
тивных центров можно выявить вирусные включения [Racz Р.,
1988 ]. Наряду с этим происходит расширение синусов с гиперплазией
и-последующим отторжением их эндотелия (рис. 9.2, а, б). Синусы
заполняются крупными клетками со светлыми ядрами, одним или
изредка несколькими. Цитоплазма этих клеток широкая, довольно
интенсивно окрашивается при ШИК-реакции. При электронной мик-
роскопии в лимфоцитах и эндотелии отмечаются анастомозирующие
трубчатые структуры, а также толстостенные цилиндрические струк-
туры и палочки [Allegra S. et al., 1984]. Принципиально сходные
изменения обнаруживаются в селезенке и тимусе. Возможны изме-
нения альвеолоцитов, а также нефротелия почек, клеток печени и
ЦНС, напоминающие описанные выше.
На поздних стадиях ВИЧ-инфекции ранее увеличенные лимфа-
тические узлы, селезенка, тимус и лимфоидная ткань пищевари-
тельного тракта резко уменьшаются в объеме прежде всего за счет
тимусзависимых зон. Иногда лимфоидная ткань исчезает почти
полностью. В тимусе видны в основном лишь ретикулоэпителиальные
клетки и отдельные, в основном обызвествленные, тимические тель-
ца (рис. 9.2, в).
На фоне ВИЧ-инфекции, как и любого другого вторичного или
первичного иммунодефицита, часто возникают различные инфек-
ционные болезни (герпес, цитомегалия, пневмоцистоз и др.), нередко
называемые СПИД-ассоциированными. Характерно также развитие
некоторых опухолей, особенно саркомы Капоши.
9.1.1.2. ДНК-вирусные инфекции
К ним относятся заболевания, вызываемые вирусами семейств
Adenoviridae, Herpesviridae и Poxviridae.
9.1.1.2.1. Заболевания, вызываемые вирусами семейства
Adenoviridae
Наибольшее значение среди них принадлежит аденовирусной ин-
фекции. Аденовирусная инфекция. Размножение аденовирусов (ди-
аметр вирионов 70—90 нм) и пути инфицирования сходны с тако-
выми при заболеваниях, вызываемых другими респираторными ви-
русами.
341
Рис. 9.3. Изменения органов при инфекциях, вызванных ДНК-вирусами.
а — очаг пневмонии, вызванной аденовирусом, С гипертрофией и гиперхроматозом альвеоло-
цитов; выраженный мелкоглыбчатый распад клеток экссудата. Окраска азуром и эозином. *600;
б — гигантская клетка в альвеоле при аденовирусной инфекции. Видно характерное просветление
между внутриядерным вирусным включением и сохранившейся частью ядра клетки. Окраска
гематоксилином и эозином. * 900; в — гигантская клетка в альвеоле при простом герпесе С
ядром однородного строения. Окраска гематоксилином и эозином, х 1350; г — гигантоклеточный
метаморфоз эпителия выводного протока слюнной железы при цитомегалии. Окраска гематок-
силином и эозином, х 600.
Гистологически выявляются более отчетливые поражения, чем
при других ОРВИ. Ядра клеток эпителия дыхательных путей не-
равномерно окрашиваются, некоторые из них становятся более ба-
зофильными, увеличиваются в размерах за счет образования в ядре
богатого ДНК включения округлой формы. Во многих эпителиальных
клетках обнаруживаются также ФВ. В трахеальных и бронхиальных
железах отмечаются аналогичные изменения эпителия. В просвете
бронхов содержится серозный экссудат с примесью макрофагов и
единичных лейкоцитов. В более поздних стадиях процесса в пора-
женных участках эпителий и экссудат подвергаются мелкоглыбча-
тому распаду.
Сходные изменения наблюдаются и в альвеОлоцитах (рис. 9.3,
а, б). Они значительно увеличиваются в размерах, преимущественно
за счет ядра, в котором выявляется вирусное включение, вначале
окси-, затем базофильное. Такие гигантские одноядерные клетки в
дальнейшем отторгаются в просвет альвеол. Наряду с ними в аль-
веолах на ранних стадиях процесса обнаруживаются белковый экс-
судат (имеет вид капелек, хлопьев или нитей), немного эритроцитов,
а также макрофагов и отдельных нейтрофильных лейкоцитов. Поз
днее экссудат некротизируется, принимая мелкоглыбчатый вид, как
и в бронхах. У части детей в легких образуются гиалиновые мем-
браны.
У большинства умерших определяются также изменения кро-
веносных сосудов. Просветы их расширены, стенки нередко отеч-
ны, разволокнены, иногда имеются тромбы. Обычно возникают
дистелектазы, выраженные интенсивнее, чем при других
ОРВИ.
Макроскопически отмечается катаральный ларинготрахеоброн-
хит. В легких обнаруживаются красные или темно-красные, изредка
серо-красные западающие очаги небольших размеров с гладкой влаж-
ной поверхностью разреза. Они располагаются чаще в задних от-
делах. Одновременно, преимущественно в передних отделах легких,
определяется острая эмфизема.
Генерализация аденовирусной инфекции возможна в любом воз-
расте, но чаще наблюдается у детей. Изменения локализуются в
тех же органах, что и при других ОРВИ. Относительно чаще раз-
вивается конъюнктивит. Среди структурных изменений, выявляемых
при гистологическом исследовании вне органов дыхания (кишка,
почка, печень, головной мозг и др., в том числе послед), наибольший
интерес представляет размножение вируса в клетках, преимущест-
венно эпителиальных, с последующим превращением их в гигантские
одноядерные гиперхромные клетки. В этих же органах отмечаются
неспецифические расстройства кровообращения, дистрофические,
некротические и воспалительные изменения.
Как и другие респираторные вирусы, аденовирусы могут вызвать
внутриутробное поражение зародыша.
343
9.1.1.2.2. Заболевания, вызываемые вирусами семейства
Herpesviridae
Наибольшее значение среди них имеют болезни, вызываемые ви-
русами простого герпеса, цитомегалии и ветряной оспы.
Простой герпес (герпетическая инфекция). Это заболевание
вызывают вирусы простого герпеса (диаметр их вириона 100—
200 нм), которые размножаются внутриклеточно, преимущественно
в эпителии. Изменения пораженных клеток сходны с возникающими
при аденовирусной инфекции, но при герпесе они имеют меньшие
размеры.
Наибольшее значение в патологоанатомической практике имеет
внутриутробный герпес. В остром периоде болезни во многих ор-
ганах обнаруживаются однотипные изменения клеток преимущест-
венно эпителиального происхождения, характеризующиеся увели-
чением в размерах пораженных клетЪк и их ядер, фрагментацией
хроматина, краевым расположением его глыбок в- ядре, просветле-
нием центральной части ядра с наличием крупного базофильного
или эозинофильного включения, а также мелкоглыбчатым распадом
клеток. При наиболее выраженных альтеративных изменениях от-
мечается гибель отдельных клеток или их групп с формированием
очагов некроза. Клеточная воспалительная реакция вокруг участков
альтерации, как правило, отсутствует. Помимо этого, выявляются
расстройства кровообращения. При большей давности заболевания
обнаруживаются признаки регенерации.
Поражения при внутриутробном герпесе чаще всего выявляются
в печени, где возникает острый гепатит с гигантоклеточным мета-
морфозом как гепатоцитов, так и купферовских клеток (звездчатых
ретикулоэндотелиоцитов). Иногда могут быть обнаружены разра-
стания соединительной ткани. В этом случае поражение имеет ха-
рактер хронического гепатита с исходом в мелкоузловой цирроз.
Макроскопически печень несколько увеличена, дрябловата, на
разрезе пестрого вида, с наличием мелких, иногда сливающихся
серовато-желтых очагов.
Часто наблюдается поражение легких, которое заключается в
проявлении очаговой пневмонии (см. рис. 9.3). При наибольшей
тяжести процесса возникают распространенные очаги коагуляцион-
ного некроза.
Нередко поражается головной мозг. При этом на ранних стадиях
развития процесса выявляется набухание отдельных нейронов и
глиальных клеток, в ядрах которых определяются крупные базо-
фильные включения. Кроме того, обнаруживаются признаки суб-
эпендимарного глиоза различной степени выраженности. При боль-
шей длительности процесса в случае его прогрессирования возникает
некротический менингоэнцефалит.
Сходные изменения выявляются в надпочечниках, почках, пи-
щеварительном тракте, особенно пищеводе, и глазах. Сведения о
поражениях кожи в подавляющем большинстве работ отсутствуют.
Лишь в отдельных из них [Georgescu L. et al., 1981] описаны
344
внутриэпителиальные пузыри с акантолизом, слущиванием повер-
хностных слоев эпидермиса и наличием характерных внутриядерных
включений в эпителиальных клетках.
До инфицирования плода, естественно, происходит поражение
последа. При его исследовании в подобных наблюдениях выявляются
изменения всех трех оболочек плаценты и сосудов пуповины.
У детей старшего возраста и взрослых описан герпес, приобре-
тенный в постнатальном периоде в результате заражения различ-
ными путями.
При аэрозольном инфицировании возникает поражение органов
дыхания. В легких развивается массивная бронхопневмония с ге-
моррагиями, наличием в альвеолах белкового экссудата, содержа-
щего увеличенные в размерах альвеолоциты с гиперхромными яд-
рами, а также мононуклеары и клеточный детрит.
Приводятся сведения о существенной роли вируса простого гер-
песа в возникновении гепатитов. Структурные изменения печени
могут соответствовать острому альтеративному гепатиту без пери-
фокальной клеточной реакции, описанному у новорожденных, или
иметь хроническое течение с сохранением структур долек или их
перестройкой и скудной воспалительной инфильтрацией в порталь-
ном тракте (персистирующий гепатит).
Среди локальных форм герпеса большое значение имеет также
поражение нервной системы. Наиболее типичными структурными
изменениями являются очаги, располагающиеся в теменной и ви-
сочной долях, или гораздо реже в затылочной доле и мосту мозга.
В ядрах пораженных нейронов происходит маргинация хроматина,
реже определяются крупные включения. Вокруг очагов некроза
могут быть обширные кровоизлияния, перифокальные и периваску-
лярные мононуклеарные воспалительные инфильтраты, а также
скопления макрофагов.
Цитомегалия. Вирус цитомегалии (диаметр вириона до 100 нм)
может передаваться различными путями, среди которых существен-
ное значение имеет внутриутробное инфицирование. При любом
пути инфицирования размножение вируса происходит в клетках,
как правило, эпителиального происхождения [Seifert G., Oehme I.,
1957], в частности даже эндометрия [Kleinmann D. et al., 1984].
В результате этого в ядре появляются включения, они вначале
оксифильны, позднее становятся базофильными. Вокруг этих вклю-
чений имеется зона просветления вещества ядра. Возникают также
более мелкие цитоплазматические включения диаметром до 3 мкм.
Результаты гистохимического исследования таких клеток приводятся
П. А. Самохиным (1987). Необходимо подчеркнуть, что этот харак-
терный для цитомегалии гигантоклеточный метаморфоз (см.
рис. 9.3, г) определяется не сразу после начала болезни. В даль-
нейшем цитомегалические клетки подвергаются альтеративным из-
менениям и отторгаются. Наибольшей степени выраженности такой
метаморфоз достигает на фоне иммунодефицитных состояний.
Достаточно закономерными являются интерстициальные измене-
ния — очаговые лимфогистиоцитарные или лимфоплазмоцитарные
345
инфильтраты с примесью эритро- й миелобластов. Причина возник-
новения этих инфильтратов трактуется по-разному. Скорее всего
их следует рассматривать в качестве местного проявления иммунных
процессов.
Наибольшее практическое значение имеет цитомегалия у детей.
У них она распознается преимущественно в возрасте 1—6 мес.
Характерные цитомегалические изменения могут выявляться во мно-
гих органах, но наиболее закономерным все же является поражение
слюнных желез (цитомегалический сиаладенит). По частоте воз-
никновения на первом месте после слюнных желез стоят органы
дыхания, далее пищеварительный тракт, почки и еще реже другие
органы [Самохин П. А., 1987 ].
Макроскопические изменения при цитомегалии малохарактерны.
Ветряная оспа. Заражение вызывают вирусы Varicella herpc
zoster (диаметр вириона 200 нм), как правило, воздушно-капельны
путем, поэтому первичный очаг обычно располагается в органа
дыхания. Вирус размножается в эпителии слизистой оболочки дь
хательных путей и альвеолярном эпителии. Часть эпителиальны
клеток гипертрофируется, иногда образуются гигантские клетки,
дыхательных путях возникают умеренно выраженное ката рал ьнс.
воспаление, может наблюдаться и очаговая пневмония с серозно-
макрофагальным экссудатом. В центре этих очагов нередко равви-
ваются некротические изменения. Макроскопически очаги такой
пневмонии серовато-красного цвета, округлой формы. В дальнейшем
происходит генерализация инфекции с развитием очагов воспаления,
иногда во многих органах [Ивановская Т. Е„ 1960; Nakano S. et
al., 1965].
Наиболее типичными являются изменения кожи. Вначале по-
ражаются клетки шиповатого слоя эпидермиса, возможны образо-
вание гигантских многоядерных клеток и баллонная дистрофия.
Наблюдается и внеклеточный отек, при котором клетки теряют
связь между собой. В результате в эпидермисе образуются вези-
кулы — полости неправильной формы, различного размера, со-
держащие серозную жидкость, в которой лежат отдельные поги-
бающие клетки эпителия и иногда лейкоциты. Дно такого пу-
зырька образовано базальным слоем эпидермиса. Воспалительная
клеточная реакция в дерме практически отсутствует, лишь изредка
имеются небольшие лимфогистиоцитарные инфильтраты. Макро-
скопически экзантема при ветряной оспе весьма полиморфна. Осо-
бенно- типичны везикулы диаметром несколько миллиметров, ок-
руженные зоной гиперемии. Наиболее часто сыпь локализуется
на волосистой части головы.
Экзантеме нередко предшествует развитие энантемы на слизистой
оболочке рта, пищеварительного и мочеполового трактов, которая
имеет принципиально такое же строение, как и экзантема.
В случаях с наиболее тяжелой генерализацией, обычно у резко
ослабленных детей, сходные по структуре очаги воспаления возни-
кают и в других органах, особенно в печени [Талалаев А. Г., 1974;
Milauskas J., Webber В., 1984 [.
346
Наряду с аэрозольным заражением возможно и внутриутробное
инфицирование, о чем свидетельствует рождение детей с генерали-
зованной ветряной оспой.
9.1.1.2.3. Заболевания, вызываемые вирусами семейства
Poxviridae
Среди этих заболеваний наибольшее значение имеет натуральная
оспа.
Натуральная оспа. Заражение вирусом натуральной оспы (ви-
рион размерами 240—269*150 нм) происходит от больного человека
различными путями, чаще воздушно-капельным. В органах дыхания
возникают катаральное воспаление дыхательных путей и очаговая
пневмония с макрофагально-лейкоцитарно-фибринозным экссуда-
том. Закономерно отмечается гипертрофия клеток альвеолярного
эпителия, ядра которых становятся крупными и гиперхромными.
Дальнейшая генерализация инфекции ведет к образованию очагов
воспаления во многих органах и тканях. Наиболее типичными среди
них являются поражения кожи. Процесс начинается в дерме, где
отмечаются резкое очаговое полнокровие и отек, одновременно по-
являются небольшие лимфогистиоцитарные периваскулярные ин-
фильтраты. Почти одновременно происходят отек, набухание и про-
лиферация клеток базального слоя эпидермиса. Прогрессирующий,
преимущественно внутриклеточный отек ведет к баллонной дист-
рофии эпителия. В клетках обнаруживаются включения (тельца
Гварнери), представляющие собой уплотнения цитоплазмы в местах
скоплений вируса. Пузырьки увеличиваются в размерах и сливаются.
В дальнейшем центральные участки очага обычно некротизируются.
Кроме того, происходит выпотевание лейкоцитов, иногда в значи-
тельном количестве.
Макроскопически на ранних стадиях болезни экзантема имеет
вид папул диаметром чаще 3—4 мм. В дальнейшем в центре очага
появляется везикула. После накопления в пузырьке гноя поражение
кожи обозначают как пустулу. Развитие некроза ведет к возник-
новению типичного пупкообразного западения в центре. Такая сыпь
может раполагаться на голове, шее, руках, груди, спине, животе,
реже на ногах и изредка на ладонях и подошвах. При наиболее
тяжелом течении болезни в экссудате появляется большое количе-
ство эритроцитов.
В основном у вакцинированных людей возможно легкое течение
болезни (вариолоид) с развитием лишь немногочисленной папулез-
но-везикулярной сыпи на голове и реже на туловище.
Очаги воспаления иногда возникают также в слизистой оболочке
полости рта, пищевода, желудка, кишечника и влагалища. Довольно
часто поражаются яички, в которых развивается острый некроти-
ческий орхит. Нередко происходит поражение лимфоидной системы.
В паренхиматозных органах обычно описывают лишь тяжелые ди-
строфические изменения.
347
9.1.1.3. Заболевания, вызываемые другими вирусами
Вирусный гепатит. Этим термином принято обозначать не все ви-
русные поражения печени, а лишь вызванные несколькими гепа-
тотропными вирусами (вирусы гепатита А, В, дельта и «ни А ни
В»), Вирус гепатита А классифицируют как Enterovirus, основным
путем заражения считается энтеральный — преимущественно через
загрязненную фекалиями воду. Вирус гепатита В относят к группе-
Hepardnavirus, заражение при нем чаще парентеральное («шприце-
вой гепатит»). Вирус гепатита «ни А ни В» может передаваться
обоими путями. Многочисленные попытки выявить достоверные от-
личия в структурных изменениях в зависимости от этиологий ге-
патита остаются безуспешными.
Местные изменения печени при остром гепатите складываются
из альтеративных, экссудативнх и пролиферативных [Логинов А. С.,
Аруин Л. И., 1985; Серов В. В., Лапиш К.,. 1989]. Прежде всего
возникает мезенхимальная реакция, заключающаяся в пролифера-
ции звездчатых ретикулоэндотелиоцитов с последующим превраще-
нием их в макрофаги. Это наиболее типично для гепатита В. В стро-
ме местами выявляются небольшие лимфогистиоцитарные инфиль-
траты. - В дальнейшем наблюдаются явления преимущественно
баллонной дистрофии гепатоцитов. Гликоген в гепатоцитах вначале
сохраняется. Постепенно дистрофические изменения усиливаются,
далее развиваются некротические изменения (рис. 9.4, а).
В случае прогрессирования болезни поражение печени становится
все более тяжелым и захватывает практически весь орган. Проис-
ходит дискомплексация печеночных балок: образующие их гепато-
циты разъединяются и располагаются поодиночке или небольшими
группами. Характерен коагуляционный некроз гепатоцитов, а также
звездчатых ретикулоэндотелиоцитов. Наиболее типичным принято
считать коагуляционный некроз всей цитоплазмы (тельца Каун-
сильмена), реже — парциальный некроз цитоплазмы. Для диффе-
ренциальной диагностики вирусного гепатита, в частности В, весьма
полезно выявление HBs-антигена. О его наличии можно судить
также по результатам некоторых окрасок, например орсеином по
шМсата (рис. 9.4, б). Типичными считаются так называемые мос-
товидные некрозы, охватывающие комплекс клеток между цент-
ральной веной и портальным трактом.
Одновременно в перипортальных прослойках образуются неболь-
' ‘Дше инфильтраты из лимфоцитов с примесью гистиоцитов, единич-
ных плазмоцитов и зернистых лейкоцитов. Выраженность инфиль-
трации коррелирует со степенью некротических изменений. Харак-
терно также появление в гепатоцитах и макрофагах липофусцина.
Возможна имбибиция гепатоцитов желчными пигментами, нередко
выявляются стазы желчи с образованием желчных тромбов.
На 2—3-й неделе болезни определяются признаки регенерации:
появляются гепатоциты с ядрами разной величины, часто гипер-
хромными, иногда в них видны митозы, имеются двухъядерные
клетки.
348
Рис. 9.4. Изменения печени при гепатите.
а — выраженные дистрофические изменения гепатоцитов при гепатите В; образование
безъядерного тельца из клетки Купфера. Окраска гематоксилином и эозином, х 1350; б —
окрашивание гепатоцитов, содержащих HBsAg. Окраска по Ши ката. * 600.
Макроскопически печень при описанном остром течении гепатита
несколько увеличена, с закругленным краем и гладкой поверхно-
стью, слегка дрябловата, обычного цвета, хотя преимущественно
под капсулой имеется неравномерное кровенаполнение.
При особенно тяжелом злокачественном течении гепатита воз-
никает мультилобулярный некроз паренхимы печени. Макроскопи-
чески печень, особенно ее левая доля, после развития некротических
изменений уменьшается в размерах, становится дряблой, с морщи-
нистой капсулой и острым краем. На разрезе орган вначале желтого
Цвета, в основном за счет пропитывания некротизированной ткани
желчными пигментами. По мере рассасывания некротизированной
ткани печени на желтом фоне возникает крапчатость ярко-красного
Цвета, обусловленная расширением кровеносных сосудов, позднее
определяются обширные поля темно-красного цвета.
Нередко гепатит принимает хроническое течение. В настоящее
время хронический гепатит принято подразделять на хронический
персистирующий и хронический активный гепатит. Эти две формы
сравнительно редко переходят друг в друга.
Как особый морфологический вариант заболевания выделяют
гигантоклеточный гепатит. Он характеризуется появлением много-
ядерных клеток, по размеру в десятки раз превышающих обычный
гепатоцит. В их цитоплазме, как и в менее измененных гепатоцит*ах,
349
содержатся многочисленные включения, гликоген и мелкие зерна
желчных пигментов. Кроме того, наблюдаются дискомплексация
печеночных балок и холестазы, пролиферация холангиол с лимфо-
гистиоцитарной инфильтрацией вокруг них. Такого рода изменения,
как правило, наблюдаются у новорожденных [Тер-Григорова Е. Н.,
1967]. Некоторые исследователи склоняются к мнению, что гиган-
токлеточная реакция гепатоцитов связана с особенностями реактив-
ности макроорганизма. В пользу этого свидетельствуют и наши
данные о развитии гигантоклеточного процесса в печени при гепатите
В у ребенка 12 лет [Цинзерлинг А. В. и др., 1984]. В отдельных
изученных наблюдениях такого гепатита у детей раннего возраста
нам удавалось выявить орцеинположительные включения, что также
говорит об этиологической роли вируса гепатита В. В имеющихся
единичных описаниях гигантоклеточного гепатита у взрослых ука-
зывается на признаки нарушения иммунной регуляции [Thijs J. et
al., 1985].
Вирусные гастроэнтериты. Характер воспалительных изменений
при этой группе заболеваний, вызванных ротавирусами, вирусами
группы Норуволк, астровирусами, коронавирусами и другими, ма-
лоизвестен, хотя в развитых странах их рассматривают как наиболее
частые кишечные инфекции [Rockstroh Т., 1984].
Патологическая анатомия несколько лучше изучена при рота-
вирусной инфекции [Новикова А. В. и др., 1989], возбудителя ко
торой (диаметр вириона 60—80 нм) относят к семейству Reoviridae
В этом случае возникает острый энтерит или энтероколит, иногда
диффузный, с деформацией (чаще укорочением) ворсинок. Клетки
последних приобретают кубовидную форму, в строме ворсинок от-
мечаются полнокровие, отек и лимфоидная инфильтрация. В эпи-
телиальном слое выявляются многочисленные лимфоциты. При элек-
тронной микроскопии в просвете кишки, а также в эпителии, в том
числе в бокаловидных клетках и в фагоцитах собственной пластинки,
описывают вирусные частицы характерной формы в виде колеса.
9.1.2. Особенности воспаления при инфекциях,
вызываемых бактериями
Для получения четких данных о характере бактериального воспа-
лительного процесса необходимо использовать полноценные способы
исследования. При морфологическом исследовании важно проведение
бактериоскопии как в срезах пораженной ткани, так и в мазках с
поверхности или разреза органа. Учитывая преобладание в настоящее
время грамотрицательной микрофлоры, основными используемыми
красителями должны быть азур или метиленовый синий в сочетании
с фоновыми красителями. Окраска анилиновым фиолетовым по Гра-
му, как и ее многочисленные модификации, является только до-
полнительной. Серебрение по Левадити или иным способом также
имеет меньшее значение. Оценивая результаты бактериоскопических
методик, следует не забывать о том, что тинкториальные свойства
350
микроорганизмов непостоянны. Даже такой микроорганизм, как ми-
кобактерия туберкулеза, кислотоустойчив не на всех стадиях своего
развития. При бактериоскопическом исследовании нельзя определить
вид микроорганизмов. Можно, и то во многих случаях без полной
уверенности, определить только их семейство и изредка род.
В связи со сказанным ведущее значение в точной этиологической
диагностике принадлежит бактериологическому исследованию. Мож-
но отметить, что количество видов посмертно выделяемых микробов
не зависит от сроков вскрытия [Paakko Р. et al., 1986].
Обязательным условием для верной интерпретации полученных
результатов является не только правильный стерильный забор ма-
териала, но и проведение исследования с использованием достаточ-
ного набора питательных сред. В противном случае многие микробы,
в первую очередь анаэробные, а из аэробных особенно пневмококки,
практически не высеваются. Это приводит к ошибочному суждению,
например, об отсутствии в настоящее время пневмококковых пнев-
моний [Парусов В. Н., 1981]. Наконец, при проведении подробного
типирования выделенных культур вместо доминирующих в ответах
многих бактериологических лабораторий «нетипируемых кишечных
палочек» обнаруживаются возбудители из родов Serratia, Aerobacter
и др.
Возможны выявление бактерий и их идентификация с помощью
люминесцирующих сывороток по прямому или непрямому методу
Кунса, иммунопероксидазной метки и электронной микроскопии.
При ряде бактериальных инфекций, например сальмонеллезе и ста-
филококковой инфекции, для диагностики их длительно текущих
форм информативно серологическое исследование взятой посмертно
крови в реакциях связывания комплемента (РСК) или непрямой
гемагглютинации (РИГА).
Подавляющее большинство бактерий может вызывать патологи-
ческий процесс у человека, причем практически в любых органах.
Степень распространенности и тяжести этих процессов обусловлена,
с одной стороны, патогенностью и другими свойствами бактерий, и
с другой — состоянием макроорганизма во время заболевания, а
также особенностями того органа, в котором развивается патологи-
ческий процесс.
Наиболее характерной чертой любой бактериальной инфекции
является размножение возбудителя вне клеток, причем чаще всего
в полостях (альвеол и дыхательных путей, пищеварительного тракта,
серозных и др.). Возможно размножение бактерий в интерстици-
альной ткани и изредка в клетках, но неполноценных в результате
наследственных ферментопатий, например при синдроме Чедиака—
Хигаси [Clawson С. et al., 1979], или повреждения токсинами бак-
терий и вирусами.
Динамика течения воспалительного процесса при развитии бак-
териальной инфекции и роль при этом различий в характере воз-
будителей особенно хорошо прослежены при пневмониях [Цинзер-
линг В. Д., Цинзерлинг А. В., 1963 ]. Воспалительный процесс при
любой бактериальной пневмонии протекает принципиально одина-
351
ково. Процесс начинается в респираторных бронхиолах и альвео-
лярных ходах. Отмечается полнокровие стенок тех структурных
образований легкого, в полостях которых размножаются бактерии.
Вскоре сюда поступает серозный экссудат. К нему примешивается
все возрастающее количество нейтрофильных лейкоцитов, а при
выпотевании в полости альвеол плазмы крови, богатой грубодис-
персными белками, образуется и фибрин. Если пневмония закан-
чивается выздоровлением, то первым его признаком является ис-
чезновение возбудителей. В дальнейшем происходит рассасывание
экссудата — сначала серозной жидкости, а затем и клеток. Лейко-
циты распадаются, частью фагоцитируются макрофагами, частью
выводятся с мокротой или по лимфатическим путям. Фибрин рас-
сасывается в основном макрофагами, хотя некоторую роль могут
сыграть и протеолитические ферменты лейкоцитов. В этой фазе
болезни в местах воспаления выявляется лишь умеренное число
макрофагов. В дальнейшем эти клетки удаляются из легких так
же, как и остальные составные части экссудата.
При относительно длительном течении заболевания в строме
органов закономерно выявляются лимфогистиоцитарные плазмоци-
тарные инфильтраты разной степени интенсивности. Они могут
рассматриваться как местная иммуноморфологическая реакция.
Большое влияние на морфологические проявления болезнц ока-
зывает образование бактериями токсинов. Если возбудитель не об-
ладает сильно действующими на макроорганизм экзотоксинами, воз-
никает так называемый расплывной тип патологического процесса.
Такого характера пневмонии возникают в ответ, например, на внед-
рение пневмококков и клебсиелл. Для всех этих пневмоний харак-
терно отсутствие омертвения ткани в местах расположения микро-
организмов. Встречающиеся иногда некрозы имеют сосудистое про-
исхождение.
Противоположным типом являются пневмонии, вызванные ста-
филококками, стрептококками и некоторыми другими бактериями.
В этом случае в результате резкого токсического действия происходит
некротизация клеток экссудата и даже самой легочной ткани. Кроме
того, резко усиливается проницаемость кровеносных сосудов. В ре-
у/льтате образуются токсические периферические зоны с фибриноз-
ным и серозным выпотом в альвеолах.
Макроскопически очаги бактериальной пневмонии легко обна-
руживаются. Их вид зависит от характера экссудата, последний же
’ определяется особенностями как макроорганизма, так и возбудителя
процесса.
Весьма существенным является вопрос о том, ограничивается ли
поражение при острых бактериальных пневмониях одними органами
дыхания или заболевание протекает с генерализацией. В доанти-
бактериальный период, помимо воспаления больших серозных по-
лостей, нередко возникали гнойные менингиты, артриты, эндокар-
диты и др. В последние годы, как правило, не удается выявить
генерализацию бактериальной инфекции. Исключением является
лишь развитие у детей сепсиса или гнойного менингита.
352
При других локализациях инфекционных процессов воспаление
имеет принципиально те же черты, зависящие как от особенностей
бактерий — его возбудителей, так и от иммунологического состояния
организма больного. В наибольшей степени различаются по своим
проявлениям заболевания с поражением пищеварительного тракта.
При острых бактериальных кишечных инфекциях размножение
возбудителей происходит, как правило, в просвете пищеварительного
тракта. Воспалительные изменения в стенке органа возникают в
результате как ‘прямого воздействия бактерий и их токсинов на
слизистую оболочку органа, так и влияния всасывающихся токсинов.
Возникают альтеративные, преимущественно дистрофические,
изменения эпителия, который в дальнейшем слущивается. В строме
слизистой оболочки и в меньшей мере в более глубоких слоях стенок
отмечается нарушение проницаемости сосудов, в первую очередь
микроциркуляторного русла. Это сопровождается отеком окружаю-
щих тканей, накоплением серозной жидкости в подэпителиальном
пространстве и последующим поступлением ее в просвет пищева-
рительного тракта, что приводит к разжижению его содержимого.
Наряду с этим в стенке органа обычно наблюдается незначительная
лейкоцитарная инфильтрация. Степень выраженности этих измене-
ний варьирует.
При инфекциях, вызванных гноеродными бактериями (например,
стафилококком), альтеративные изменения слизистой оболочки вы-
ражены сильнее и имеют другой характер, поскольку происходят
грубые деструктивные изменения с изъязвлениями и лейкоцитар-
но-фибринозными наложениями на внутренней поверхности органа.
При этом лейкоцитарная инфильтрация более глубоких слоев стенки
нередко весьма значительна.
Наряду с этими проявлениями воспаления обнаруживаются ме-
стные иммуноморфологические изменения: помимо гиперплазии
лимфоидного аппарата увеличивается число свободно расположен-
ных очаговых скоплений лимфоцитов, а также плазмоцитов. Мак-
симальная выраженность этих изменений наблюдается при затиха-
нии патологического процесса.
Довольно часто отмечается интраканаликулярное распростране-
ние возбудителей из органов пищеварительного тракта (обычно
вместе с другой, непатогенной, флорой кишки) как вверх и далее
по дыхательным путям в легкие, так и по желчевыводящим путям
и по протоку поджелудочной железы. Принципиально возможно
также гематогенное и лимфогенное распространение, однако оно,
как правило, не имеет серьезного значения. Несколько большую
роль генерализация по этим путям играет при сальмонеллезах. При
кишечных инфекциях, сопровождающихся деструктивными измене-
ниями, возможно развитие кишечного сепсиса.
Таким образом, проявления бактериальных инфекционных за-
болеваний складываются из повреждения, обусловленного прямым
воздействием самих бактерий или их токсинов, и проявлений за-
щитных реакций макроорганизма, среди которых особенно большую
Роль играет лейкоцитарная. Наряду с этим обнаруживаются местные
12—407
353
и общие проявления тех иммунологических 'процессов, которые
возникают в течение болезни. Максимальная степень выраженности
всех этих изменений отмечается в области первичного очага. Однако
они могут возникать и за его пределами при генерализации инфек
ции, что наблюдается преимущественно у детей раннего возраста,
а также на фоне иммунодефицитных состояний.
9.1.2.1. Заболевания, вызываемые грамположительными кокками
К ним относятся инфекции, возбудителями которых являются кокки
семейств Micrococcaceae и Streptococcaceae.
9.1.2.1.1. Заболевания, вызываемые кокками семейства
Micrococcaceae
Среди этих инфекций наибольшее значение имеет стафилококковая.
Стафилококковая инфекция. Инфицирование стафилококками —
довольно крупными микроорганизмами (их поперечник 0,5—1,5
мкм) — происходит в основном из внешней среды различными
путями, которыми и определяется расположение первичного очага.
Наиболее типичной чертой стафилококковой инфекции при любой
локализации поражения является гнойное воспаление.
Стафилококковое поражение органов дыхания вызывает от-
четливые изменения, особенно в респираторных отделах легких.
В самой острой стадии болезни в области скоплений стафилококков
обнаруживается серозной или серозно-геморрагический экссудат, к
которому примешиваются вначале единичные, а затем все возра-
стающие в числе лейкоциты.
В дальнейшем очаги воспаления нередко приобретают типичную
зональность строения. В центральных участках пневмонических оча-
гов содержится много стафилококков (рис. 9.5, а). В области их скоп-
лений наблюдаются выраженные в разной степени альтеративные из-
менения. Чаще всего некрозу подвергаются лишь отдельные клетки
экссудата вблизи скоплений микроорганизмов. В других случаях не-
кротические изменения выражены значительно сильнее, они захваты-
вают не только эти клетки, но и межальвеолярные перегородки и стен-
ки бронхов. В окружности участка некроза образуется разной ширины
вал из зернистых лейкоцитов, которые фагоцитируют стафилококки.
В самих периферических участках пневмонического очага нередко
Дальвеолы выполнены преимущественно фибринозным и серозным экс-
судатом. Характерно отсутствие здесь бактерий. Благодаря этим пе-
риферическим зонам процесс как бы ограничивается, и его распрост-
ранение по легкому происходит в основном бронхогенно.
Макроскопически в легких видны мелкие, часто множественные,
иногда сливающиеся вместе очаги абсцедирующей пневмоний. Они
красного или темно-красного цвета с небольшими серовато-желтыми
участками в центре. При наиболее тяжелом течении болезни могут
обнаруживаться довольно крупные очаги некроза, располагающиеся
подплеврально, обычно в задних отделах легких.
354
Рис. 9.5. Изменения внутренних органов при инфекциях, вызванных
грамположительными бактериями.
а ~~ мелкие очаги абсцедирующей стафилококковой пневмонии, видны скопления стафилококков.
Окраска азуром и эозином. х 135; б — фиброзно-гнойный стафилококковый колит, осложнивший
Дизентерию. Окраска анилиновым фиолетовым по методу Грама—Вейгерта. * 135; в —
некротическая стрептококковая пневмония с фибринозным выпотом по периферии. Окраска
аНилиновым фиолетовым по методу Грама—Вейгерта. * 135; г — скопления стрептококков в
некротизированной ткани при флегмоне шеи. Окраска анилиновым фиолетовым по методу
ГРама—Вейгерта. к |350.
12*
У некоторых умерших выявляется буллезная эмфизема. Раз-
витие ее объясняется деструкцией бронхов с образованием кла-
панного механизма, в результате которого в межуточную ткань
поступает воздух, постепенно распространяющийся в передние от-
делы легких.
При менее выраженных стафилококковых поражениях легких
некротические и перифокальные токсические изменения выражены
слабее и могут даже отсутствовать.
Нередко наблюдается плеврит. Чаще всего он возникает в ре-
зультате прорыва абсцесса легкого в плевральную полость, где раз-
вивается гнойное или фибринозно-гнойное воспаление; наряду с
экссудатом в полости плевры содержится воздух. Плевра в месте
прорыва гнойника на участке до 2—3 мм некротизирована, а вокруг
отечна и инфильтрирована лейкоцитами.
При стафилококковом поражении пищеварительного
тракта выделяют разные формы. Наиболее отчетливые воспали-
тельные изменения определяются при энтероколите стафилококко-
вой этиологии, возникающем как осложнение предшествующих бак-
териальных или вирусных поражений пищеварительного тракта (рис.
,9.5, б). Чаще оно наблюдается вследствие массивного применения
антибиотиков, подавляющих обычную кишечную микрофлору и со-
здающих условия для дисбактериоза. Максимально поражается тол-
стая кишка.
Альтеративным изменениям могут подвергнуться не только эн-
тероциты, но и собственная пластинка слизистой оболочки и под-
слизистая основа. На границе некротических участков выявляются
отек, полнокровие, стазы, кровоизлияния и подчас интенсивная
инфильтрация нейтрофильными лейкоцитами. В более глубоко рас-
положенных слоях кишечной стенки, а также вне дефектов слизистой
оболочки выявляются полнокровие, отек, кровоизлияния, а также
тромбоз. В участках с некротическими изменениями в острой фазе
болезни имеется скопление большого числа стафилококков. Часть
этих микроорганизмов фагоцитирована нейтрофильными лейкоци-
тами.
Макроскопически кишечник несколько расширен, содержит зе-
леновато-желтую жидкость с комочками слизи, иногда с прожилками
крови. Слизистая оболочка полнокровна, набухшая, большей частью
неравномерно, местами очень резко. Обычно на ней видны серые
отрубевидные налеты и изредка более массивные фибринозно-гной-
ные пленчатые наложения. Солитарные и групповые лимфатические
фолликулы увеличены в размерах, набухшие.
В случае затихания процесса происходит регенерация, однако
обычно без восстановления тех структур, в частности вор-
синок, которые были разрушены в результате альтеративного про-
цесса.
Стафилококковые поражения могут возникать и почти во всех
других органах, где развивается процесс, принципиально сходный
по морфогенезу с описанным выше.
356
9,1.2.1.2. Заболевания, вызываемые кокками семейства
Streptococcaceae
К этим болезням относятся собственно стрептококковая (стрепто-
коккоз) и пневмококковая инфекции. Инфицирование может про-
исходить любыми путями.
Стрептококковая инфекция. Возбудителями являются мелкие
кокки (диаметром менее 2 мкм) — Streptococcus pyogenes — стреп-
тококки, ранее называвшиеся гемолитическими. В тканях они лежат
поодиночке или короткими цепочками. Длинных цепочек, харак-
терных при культивировании на искусственных средах, как правило,
не бывает.
При стрептококковой инфекции возможны воспалительные из-
менения разного характера, наиболее типичным до настоящего вре-
мени является выраженный альтератйвный процесс [Цинзер-
линг А. В., Иоакимова К. Г., 1987].
Наиболее тяжелые изменения развиваются при скарлатине.
Первичный очаг локализуется обычно в зеве и значительно реже
в других органах и тканях, прежде всего в коже.
Стрептококки после инфицирования чаще всего поселяются нй
слизистой оболочке носоглотки, преимущественно на миндалинах,
где они начинают размножиться в глубине одной или нескольких
крипт. Под влиянием их токсинов происходит некроз эпителия
крипт, а затем и лимфатической ткани органа. Вокруг очага некроза
отмечаются полнокровие, отек, а затем и лейкоцитарная реакция
с образованием зоны демаркационного воспаления. На поверхности
миндалины нередко выпадает фибрин. В случае распространения
инфекционного процесса на окружающие ткани возникает загло-
точный абсцесс.
Макроскопически миндалины увеличены, набухшие, ярко-крас-
ного цвета, с белыми или желтыми точками в устьях крипт, а
иногда с рыхлыми пленчатыми наложениями фибрина. Из-за пара-
литического состояния мелких кровеносных сосудов мягкое небо и
носоглотка резко полнокровны.
•Стрептококки и их токсины распространяются по организму
больного. Особенно часто происходит лимфогенное распространение
бактерий, прежде всего в регионарные лимфатические узлы. В даль-
нейшем в них развивается воспалительный процесс с преобладанием
альтеративного компонента. Воспалительный процесс может перейти
за пределы узлов на жировую клетчатку и мышцы шеи. Позднее
наступает й гематогенная диссеминация. Нередко наблюдается ин-
траканаликулярное распространение стрептококков. При их попа-
дании в носоглотку и нос поражается не только слизистая оболочка,
но и подлежащие ткани, в том числе решетчатая кость. Иногда
наблюдается генерализация инфекции по слуховой трубе в среднее
ухо. Реже описывается диссеминация стрептококков по пищевари-
тельному тракту.
Наряду с этим происходит распространение по организму боль-
ного токсинов стрептококков, что особенно выражено в первые 3 сут.
357
Наиболее важным для диагностики проявлением токсемии служит
сыпь (заболевание только в этом случае называют скарлатиной).
При гистологическом исследовании в коже выявляются очаговые
полнокровие, отек, а также кровоизлияния, позднее образуются
небольшие периваскулярные, в основном лимфогистиоцитарные, ин-
фильтраты. Макроскопически сыпь ярко-красного цвета, мелкото-
чечная, появляется сначала на коже шеи, далее распространяется
на грудь, спину, захватывает наконец в типичных случаях всё тело,
кроме носогубного треугольника.
На 3—4-й неделе от начала болезни у некоторых больных на-
ступает второй период скарлатины: появляются те же изменения,
что и в начале заболевания, однако они выражены слабее и не
сопровождаются токсическим симптомокомплексом. Этот повторный
воспалительный процесс вызывает у человека с повышенной чув-
ствительностью к стрептококкам своеобразные тяжелые аллергиче-
ские поражения, среди которых наиболее характерным является
гломерулонефрит. Стрептококков в почках в этой стадии процесса
нет, однако в них обнаруживаются иммунные комплексы, содержа-
щие антиген стрептококка [Серов В. В. и др., 1983].
Сходные проявления могут наблюдаться и при генерализованной
стрептококковой инфекции без сыпи. От этой формы имеются пе-
реходные варианты к легкому местному стрептококковому процессу.
Стрептококковая инфекция может протекать также без генера-
лизации или с небольшой диссеминацией стрептококков, в частности,
пру стрептококковой пневмонии. Наиболее тяжелой ее формой яв-
ляются очаговые некротические поражения легких (рис. 9.5, в).
При микроскопическом исследовании в омертвевшей ткани легкого
обнаруживается огромное количество стрептококков. По периферии
участков некроза располагаются зоны легочной ткани, содержащей
фибринозный выпот и далее от центра серозный экссудат. В этих
зонах стрептококки отсутствуют.
Чаще рассмотренного варианта встречаются стрептококковые
пневмонии, отличающиеся меньшей степенью некротизации ткани
и более выраженным поражением бронхов, которое в некоторых
случаях преобладает.
Возможны локализованные очаги воспаления во многих других
органах, в том числе в ЦНС, особенно в мягкой мозговой оболочке.
Все они протекают принципиально одинаково, с развитием вначале
серозного, затем серозно-геморрагического, а позднее гнойного вос-
паления, нередко с выраженным альтеративным компонентом.
Некоторые существенные отличия наблюдаются при поражениях
кожи. Возможно развитие острого, преимущественно серозного или
серозно-геморрагического воспаления в дерме, в подкожной клет-
чатке и слизистых оболочках — рожа. При этом отмечаются резкая
гиперемия и периваскулярная, реже диффузная инфильтрация кожи
нейтрофильными лейкоцитами и лимфоцитами. Выраженное пора-
жение лимфатических сосудов сопровождается лимфогенным рас-
пространением стрептококков. В ряде случаев эпидермис расслаи-
вается и образуются пузыри, заполненные серозным экссудатом.
358
Макроскопически очаг воспаления ярко-красного цвета, ткань его
уплотнена, края приподняты над окружающей кожей или слизистой
оболочкой и резко отграничены от нее. На этом фоне возможно
развитие флегмоны (рис. 9.5, г) или абсцесса.
Пневмококковая инфекция. Возбудителем является Streptococcus
pneumoniae — пневмококки. Эти относительно крупные кокки (их
поперечник 0,5—1,25 мкм) часто'обладают капсулой и располага-
ются попарно (диплококки), однако в тканях это свойство выражено
значительно слабее, чем при культивировании на искусственных
средах. Инфицирование может происходить разными путями, наи-
большее распространение имеет воздушно-капельный. Пневмококки
могут вызвать поражение многих органов, все же наибольшее зна-
чение имеют пневмония и менингит.
При наиболее тяжелом течении пневмония носит долевой
характер. По представлениям В. Д. Цинзерлинга (1939), подтверж-
денным на современном материале, начальные изменения заклю-
чаются в резком нарушении проницаемости кровеносных сосудов в
тех местах, где происходит размножение пневмококка. В результате
возникает небольшой очаг серозного воспаления, локализующийся
в задних или заднебоковых отделах легких. Серозная жидкость с
размножающимися в ней пневмококками быстро проникает через
отверстия в межальвеолярных перегородках в соседние альвеолы,
захватывая значительную часть легкого. Конечно, такое распрост-
ранение процесса возможно лишь у взрослых или детей старшего
возраста, поскольку у детей раннего возраста этому препятствуют
широкие межсегментарные прослойки. В дальнейшем наблюдается
все возрастающее выхождение нейтрофильных лейкоцитов, нередко
сочетающееся с выпадением фибрина. Экссудат постепенно запол-
няет весь просвет альвеол, причем тот, который они имеют при
вдохе. Межальвеолярные перегородки становятся малокровными и
кажутся истонченными. Пневмококки постепенно фагоцитируются
лейкоцитами.
В период выздоровления пневмококки перестают обнаруживаться,
серозная жидкость рассасывается, экссудат из-за распада лейкоцитов
в сочетании с накоплением макрофагов становится лейкоцитарно-
макрофагальным, а затем макрофагальным. Одновременно, в основ-
ном, с помощью макрофагов, рассасывается фибрин. В дальнейшем
удаляются и макрофаги.
Иногда, причем в разные сроки после начала крупозной пнев-
монии, в экссудате бывает много эритроцитов. Геморрагический
характер процесса в этом случае объясняется повышенной прони-
цаемостью сосудов, обусловленной другими заболеваниями (напри-
мер, гриппом, респираторным микоплазмозом) или состояниями
(прежде всего гиповитаминозом С).
Макроскопически очень характерен вид пораженных легких. Из-
мененная доля легкого (иногда несколько долей) почти на всем
протяжении резко увеличена и равномерно уплотнена. Вокруг уча-
стка уплотнения довольно часто определяется зона отека тестоватой
консистенции, и только в самых передних отделах видна воздухо-
359
содержащая ткань. Вид поверхности разреза может быть различным
в зависимости от состава экссудата.
Пневмококки нередко распространяются преимущественно лим-
фогенно в плевру — возникает фибринозно-гнойный или гнойный
плеврит. Возможна диссеминация пневмококков и за пределы груд-
ной клетки.
Изменения органов дыхания при очаговой пневмококковой пнев-
монии принципиально сходны с описанными выше, хотя и выражены
значительно слабее. Такие пневмонии чаще всего развиваются в
задненижних отделах легких и лишь затем распространяются кпе-
реди.
Из других форм пневмококковой инфекции наибольшее значение,
особенно у детей, имеет менингоэнцефалит. В первые часы забо-
левания выявляются очаговые скопления частью фагоцитированных
пневмококков и малоизмененных нейтрофильных лейкоцитов. На-
чиная со вторых суток инфильтрация мозговых оболочек становится
более густой и лейкоцитарно-макрофагальной. Наряду с этим вы-
являются фибриновые тромбы в сосудах, а в дальнейшем гнойный
васкулит во всех отделах головного мозга. Иногда отмечается переход
гнойного воспаления с мозговых оболочек на само вещество органа.
Эпендима мозговых желудочков с выраженными дистрофическими
изменениями частично слущена, нередко вблизи нее имеются лей-
коцитарные инфильтраты. Практически во всех случаях у детей
выявляется также инфильтрация сосудистых сплетений.
Макроскопически мягкая мозговая оболочка утолщена и мутно-
вата* преимущественно на конвекситальной поверхности. В глубине
борозд определяются зеленоватые массы в отличие от гнойных ме-
нингитов другой этиологии, при которых они желтоватые. Головной
мозг уплотнен, со сглаженными извилинами. Мозговые желудочки
чаще несколько расширены, реже щелевидной формы. Их эпендима
мутновата и шероховата. На сосудистых сплетениях обычно имеются
гноевидные наложения. Ликвор в ранние сроки заболевания жел-
товатый, позднее зеленоватый. При прогредиентном течении болезни
выявляются внутренняя и наружная гидроцефалия, явления кис-
тозного арахноидита.
9.1.2.2. Заболевания, вызываемые грамотрицательными кокками
К ним относятся в основном болезни, возбудителями которых яв-
ляются кокки семейства Neisseriaceae.
9.1.2.2.1. Заболевания, вызываемые кокками семейства
Neisseriaceae
Эти мелкие кокки (их диаметр 0,6—1 мкм) могут располагаться
попарно и иметь капсулу, но в тканях такое свойство выражено
значительно слабее, чем при культивировании в искусственных
средах. Кокки, относящиеся к семейству Neisseriaceae, вызывают
менингококковую инфекцию и гонорею.
360
Менингококковая инфекция. Возбудителями являются Neisseria
meningitidis — менингококки. Заражение происходит преимущест-
венно аэрозольным путем. По классификации В. И. Покровского и
др. (1976), принято различать локализованные (менингококковое
носительство и острый назофарингит) и генерализованные формы.
Среди последних наиболее тяжелой является менингококкцемия,
для которой характерны умеренно выраженные воспалительные из-
менения и резко преобладающие в клинико-морфологических про-
явлениях расстройства кровообращения.
При микроскопическом исследовании типично выявление в тка-
нях (чаще в мягкой мозговой оболочке, несколько реже в сердце,
печени, почках, коже и изредка в тимусе и легких) небольших
скоплений менингококков, окруженных умеренными рыхлыми ней-
трофильно-лимфоцитарными инфильтратами. Отчетливая преиму-
щественно нейтрофильная инфильтрация мягкой мозговой оболочки
в единичных случаях наблюдается уже в 1-е сутки от начала
заболевания, наряду с этим она может отсутствовать при гибели
детей на 3—5-е сутки. В части наблюдений удается выявить довольно
значительные скопления менингококков почти без воспалительной
реакции.
Макроскопически воспалительные изменения, за исключением
умеренного утолщения и помутнения мягкой мозговой оболочки,
не определяются.
Обязательным компонентом при менингококкемии являются при-
знаки ДВС-синдрома. Большое диагностическое значение имеет
сыпь. При минимальной степени ее интенсивности обнаруживается
полнокровие небольших венул с набуханием эндотелия. При большей
тяжести процесса определяются экстравазаты и умеренная лимфо-
лейкоцитарная инфильтрация преимущественно стенок кровеносных
сосудов. В просветах сосудов определяются тромбы. Бактериальные
микротромбы наблюдаются исключительно редко. Кроме того, вы-
являются диффузное пропитывание кровью всех слоев кожи и уча-
стки некроза.
Макроскопически в коже первоначально имеются мелкие розе-
олезные и розеолезно-папулезные элементы сыпи. В последующем
они увеличиваются в размерах, становятся геморрагическими, не-
редко приобретают звездчатую форму. В центре сливных элементов
выявляются желтоватые участки некроза. Наиболее типична лока-
лизация сыпи на ягодицах, задней поверхности бедер и голеней.
Другим проявлением тромбогеморрагического синдрома служит
поражение надпочечников. В них, как правило, выявляются тоталь-
ные или субтотальные кровоизлияния с последующим некрозом
ткани органа. Кровоизлияния нередко возникают в слизистых обо-
лочках пищеварительного тракта, трахеи и мочевого пузыря. Прак-
тически во всех случаях удается выявить выраженную в различной
степени инфильтрацию лаброцитами и эозинофилами ткани многих
органов. Для менингококковой инфекции типичны также поражения
почек, в частности мембранозный гломерулит.
При гнойном менингококковом менингите (менингоэнцефалите)
361
воспалительный процесс в настоящее время протекает так же, как
это описывалось М. А. Скворцовым (1960). При микроскопическом
исследовании определяется постепенно нарастающая инфильтрация
мягкой мозговой оболочки преимущественно нейтрофильными лей-
коцитами с примесью лимфоцитов, моноцитов и небольшого числа
эозинофилов. Максимально густые инфильтраты выявляются в стен-
ках кровеносных сосудов и вокруг них. В просветах сосудов обычно
определяются скопления нейтрофильных лейкоцитов и мелкие тром-
бы. Аналогичные, хотя и значительно менее выраженные изменения
отмечаются и в стенках мозговых желудочков. В веществе мозга
воспалительные изменения обычно определяются в виде гнойных
васкулитов. Кроме того, выявляются выраженные ишемические и
дистрофические изменения нервных и глиальных клеток.
Макроскопически воспалительный процесс, развивающийся в
мозговых оболочках, носит вначале серозно-гнойный или даже се-
розный характер. Со 2—3-х суток экссудат становится гнойным и
скапливается преимущественно в виде желтовато-серых масс в бо-
роздах вокруг вен. Гнойная инфильтрация может первоначально
располагаться как на базальной, так и (хотя несколько реже) на
конвекситальной поверхности. В отдельных случаях весь мозг покрыт
сплошным слоем желтоватых, реже желтовато-зеленоватых гнойных
масс. Экссудат, заполняющий подпаутинное пространство и пропи-
тывающий мягкую оболочку, в первые дни болезни жидкий. С
5—6-х суток он превращается в мягкую эластичную фибринозно-
гндйную массу. С продолговатого мозга экссудат может непосред-
ственно переходить на оболочки спинного мозга, а также черепных
и спинномозговых нервов. Изменения спинного мозга непостоянны
и выражены умереннее. В веществе головного мозга могут обнару-
живаться только отек и набухание. В отдельных случаях в просвете
желудочков определяются гноевидные массы, а выстилающая их
эпендима отечная, мутная. Сосудистые сплетения покрыты серова-
то-желтыми гнойными массами или содержат отдельные участки
такого же характера.
При длительном течении заболевания постепенно происходят
лизис клеток и рассасывание экссудата. Количество грануляций, а
в последующем и соединительной ткани в отличие от пневмокок-
кового поражения невелико. В поздние сроки заболевания преиму-
щественно вокруг желудочков отмечается пролиферация глии. Про-
исходит также увеличение периваскулярных лимфоплазмоцитарных
инфильтратов.
Гонорея. Заражение вызывают гонококки (Neisseria gonorrheae).
Оно происходит преимущественно половым путем. Наиболее часто
поражается слизистая оболочка уретры, шейки матки, а также
конъюнктивы. Многослойный плоский эпителий слизистой оболочки
влагалища или переходный мочевого пузыря является барьером,
предохраняющим от проникновения гонококков в глубину слизистой
оболочки. Гонококки распространяются преимущественно по протя-
жению, внедряются между эпителиальными клетками и проникают
в субэпителиальную соединительную ткань, откуда попадают в лим-
362
фатические щели и сосуды. При распаде гонококков высвобождается
значительное количество токсина, который, проникая в кровяное
русло, вызывает ряд общих явлений.
Морфологические проявления поражения гонореей различных
органов в основном одинаковы. В слизистой оболочке прежде всего
обнаруживаются проникновение между клетками эпителия полимор-
фно-ядерных лейкоцитов и выраженные дистрофические изменения
эпителия. Происходят вакуолизация цитоплазмы, кариопикноз и
другие процессы вплоть до некроза отдельных клеток. В дальнейшем
наблюдается пролиферация эпителия, иногда с появлением много-
ядерных структур.
В субэпителиальной ткани отмечаются гиперемия, отек, образо-
вание воспалительных инфильтратов. В острой фазе наиболее ти-
пична диффузная, преимущественно нейтрофильная инфильтрация,
более густая вокруг кровеносных сосудов. В просвете желез обна-
руживаются слущенный эпителий и нейтрофильные лейкоциты. При
длительном течении воспалительного процесса клеточные инфиль-
траты становятся очаговыми, в них начинают резко преобладать
лимфоидные и плазматические клетки, типична также значительная
примесь эозинофилов.
Возможен переход острой гонореи в хроническую. Воспалитель-
ные инфильтраты в этом случае постепенно замещаются соедини-
тельной тканью, и процесс заканчивается рубцеванием.
9.1.2.3. Заболевания, вызываемые грамотрицательными
палочками
Это весьма частые заболевания, многие из которых являются внут-
рибольничными (госпитальными) инфекциями. Их возбудители —
бактерии размерами 1—3*0,4—0,7 мкм — относятся к семействам
Enterobacteriaceae, Vibrionaceae, Pseudomonadaceae, Spirochaetaceae,
Legionellaceae и Spirillaceae.
9.1.2.3.1. Заболевания, вызываемые палочками семейства
Enterobacteriaceae
Бактерии этого семейства вызывают многочисленные инфекции,
преимущественно кишечные (сальмонеллезы, включая брюшной тиф
и паратифы; дизентерия; кишечная колиинфекция и др.). Эти воз-
будители могут передаваться различными путями, но основным
является энтеральный.
Брюшной тиф. Основные структурные изменения, вызываемые
Salmonella typhi abdominalis, наблюдаются в тонкой кишке. Наряду
с ними обычно возникают, хотя и слабее выраженные, изменения
толстой кишки.
В I стадии болезни (стадия мозговидного набухания) в кишечнике
развиваются катаральное воспаление и изменения лимфоидного ап-
парата. В последнем при гистологическом исследовании обнаружи-
ваются характерные тифозные узелки; Они состоят в основном из
363
крупных мононуклеарных «тифозных» клеток со светлым ядром
округлой или овальной формы. Образование этих клеток часто
связывают с размножением в них сальмонелл, однако даже при
целенаправленном гистобактериоскопическом исследовании сальмо-
неллы в таких клетках обычно не обнаруживаются.
Макроскопически поражения особенно отчетливо- определяются
на протяжении 1—1,5 м терминального отдела подвздошной кишки
и достигают максимума у самого илеоцекального клапана (бауги-
ниева заслонка). Слизистая оболочка пораженных отделов умеренно
полнокровна. В просвете кишки содержатся полужидкие или каши-
цеобразные массы с небольшой примесью слизи. Групповые и со-
литарные фолликулы, брыжеечные лимфатические узлы заметно
увеличены в размерах, сочные, красноватого цвета.
В случае затихания воспалительного процесса тифозные клетки
исчезают, а катаральное воспаление стихает. Такой исход болезни
наблюдается значительно чаще, чем это принято думать.
В других случаях брюшного тифа происходит дальнейшее про-
грессирование болезни с развитием чаще всего на 2—3-й неделе
некротических изменений лимфатического аппарата кишки. Процесс
в регионарных лимфатических узлах и в селезенке претерпевает
ту же эволюцию: от формирования тифозных гранулем до их распада.
В некротических массах всегда содержится большое количество раз-
нообразной микрофлоры, в том числе грамположительных кокков.
Роль этих бактерий в возникновении данного процесса остается
неявной. По-видимому, их значение недооценивается. В кровеносных
сосудах вблизи некротизированной бляшки нередко выявляется
тромбоз мелких кровеносных сосудов.
Макроскопически изъязвления вначале обнаруживаются в повер-
хностных участках групповых фолликулов. Некротизированные уча-
стки грязно-серые, а в случае пропитывания желчными пигмента-
ми — коричневато-зеленые.
В конце 2-й или в начале 3-й недели происходит постепенное
отторжение некротизированных масс (стадия образования язв) и
образуются изъязвления, очертания которых повторяют форму лим-
фатических фолликулов. Края свежих язв имеют форму валика и
нависают над неровным дном, на котором видны остатки некроти-
зированной ткани.
На 3—4-й неделе заболевания изъязвления становятся неглубо-
кими, с низкими краями, некротические массы уже отсутствуют
(стадия чистых язв). Начиная с 4-й недели заболевания все более
выражены процессы регенерации (стадия заживления).
Селезенка при брюшном тифе, как правило, увеличена. При
микроскопическом исследовании в ней наблюдается выраженная
гиперплазия ретикулярных клеток с образованием тифозных узел-
ков. Печень также несколько увеличена. В ней, помимо тифозных
узелков, выявляется белковая и жировая дистрофия. В костном
мозге наблюдается пролиферация ретикулоцитов, иногда видны
мелкие очажки некроза. Описаны проявления генерализации в
других органах, в частности серозный или серозно-гнойный ме-
364
нингит и даже менингоэнцефалит. Характерно развитие очагов
некроза в мышечной ткани, особенно в прямых мышцах живота
и приводящих мышцах бедер, а также в дифрагме; здесь же
могут возникать кровоизлияния. На 2-й неделе болезни выявляется
экзантема, имеющая характер розеол.
Паратиф. , При паратифах, вызываемых сальмонеллами много-
численных видов, воспалительные изменения могут быть идентич-
ными таковым при брюшном тифе (брюшнотифозная форма). На-
ряду с этим выделяют интестинальную (токсическую) и септическую
формы.
При интестинальной форме слизистая оболочка желудка и ки-
шечника, особенно тонких кишок, отечна, полнокровна, с мелкими
кровоизлияниями и небольшими поверхностными изъязвлениями.
Изредка на ней имеются нежные пленчатые наложения. В случае
особенно большой выраженности сосудистых расстройств воспаление
может принять геморрагический характер. Серозная оболочка ки-
шечника в участках с максимальными изменениями полнокровная,
с мелкими кровоизлияниями и иногда нежными пленчатыми нало-
жениями.
Макроскопически желудок и кишечник расширены, иногда па?
ралитически. В их просвете содержатся зеленоватые полужидкие
массы с примесью слизи и резким гнилостным запахом. *:
Лимфатический аппарат пораженной кишки, так же как лим?
фатические узлы брыжейки, гиперплазирован, однако в меньшей
степени, чем при типичном брюшном тифе.
Толстые кишки макроскопически изменены обычно значительно
слабее, но иногда именно в них происходят максимальные измене-
ния.
При септической форме изменения кишечника сходны с опи-
санными. Отличием является возникновение очагов генерализации,
в том числе в головном мозге.
Дизентерия. При неосложненной дизентерии, вызванной шигел-
лами (Shigella) разных видов, в желудке и кишечнике выявляются
прежде всего изменения поверхностного эпителия. Они выражаются
в некотором уплощении клеток, чаще на вершинах ворсинок, со-
четающемся с выраженными дистрофическими изменениями. По-
следние заключаются в деформации и изменении тинкториальных
свойств ядер, разрыхлении цитоплазмы и расширении межклеточных
пространств. Исчерченная каемка истончена или даже разрушена.
Постоянно наблюдается выраженная в разной степени инфильтрация
эпителиального слоя лимфоцитами, а также плазмоцитами и изредка
немногочисленными нейтрофильными и эозинофильными лейкоци-
тами. Иногда можно отметить частичное отслоение эпителия от
базальной мембраны с образованием полостей, в которых содержится
небольшое количество серозной жидкости с примесью отдельных
лейкоцитов и лимфоцитов. В дальнейшем происходит отторжение
поврежденных клеток эпителия, иногда целыми пластами. Число
бокаловидных энтероцитов как в тонкой, так и в толстой кишках
обычно увеличивается.
365
При электронно-микроскопическом исследовании биоптатов тон-
кой кишки у взрослых А. Ф. Блюгер и соавт. (1973), Л. А. Терентьева
(1978) отмечают дезорганизацию ультраструктур энтероцитов. Для
энтероцитов ворсинок наиболее характерно наличие многочисленных
включений и лизосом, содержащих гетерогенный материал неоди-
наковой электронной плотности в виде фрагментов мембран, дез-
организованных в различной степени миелиновых осмиофильных
зерен, напоминающих ауд-офагосомы. Встречается цитолиз отдель-
ных энтероцитов.
В собственной пластинке слизистой оболочки отмечаются полно-
кровие, неодинаково выраженное в разных участках, а также отек.
Эндотелий кровеносных капилляров нередко набухший. Постоянно об-
наруживаются инфильтраты из лимфоцитов и плазмоцитов, нередко
видны очаговые скопления нейтрофильных и эозинофильных лейко-
цитов, иногда выявляются кровоизлияния, как правило, точечные.
Лимфатические синусы в центрах ворсинок могут быть расширены.
Все эти процессы сопровождаются существенным изменением
формы и размеров ворсинок, многие их которых становятся шире,
приобретают неправильную форму в связи со срастанием в апи-
кальных или боковых частях. Крипты тонкой и толстой кишок
также неправильной формы.
В просвете кишки в первые дни болезни содержатся полужидкие
или кашицеобразные массы с примесью слизи и иногда с прожилками
крови. Кишка местами несколько растянута, в других участках
спазмирована. Слизистая оболочка набухшая, неравномерно полно-
кровная, покрыта крупными хлопьями слизи или более равномерно
распределенным и менее вязким содержимым (рис. 9.6, а). Под ним
в ряде случаев обнаруживаются мелкие кровоизлияния и редко —
поверхностные изъязвления на вершинах складок. Лимфатические
узлы брыжейки увеличены в размерах, красноватого цвета. Все
изменения носят очаговый характер.
В период затихания оспалительного процесса уменьшаются ка-
таральные изменения и нарастает лимфоплазмоцитарная инфильт-
рация стромы слизистой оболочки, а также подслизистой основы.
М. П. Синельникова и соавт. (1977) указывают, что в составе таких
инфильтратов много клеток, продуцирующих иммуноглобулины. От-
дельные лимфоидные клетки или небольшие группы их могут вы-
являться и в эпителиальном слое.
В последние годы широко обсуждается вопрос о месте размно-
жения шигелл. Если раньше было общепринято, что шигеллы раз-
множаются в просвете кишечника, то в 50—60-е годы ряд иссле-
дователей обратили внимание на то, что они могут располагаться
в цитоплазме клеток эпителия (рис. 9.6, б, в). В связи с этим даже
высказано предположение, что внутриклеточное размножение ши-
гелл является главным механизмом патогенеза дизентерии, чем она
якобы принципиально отличается от остальных острых кишечных
инфекций [Войно-Ясенецкий М. В., 1966]. Многочисленные после-
дующие исследования подтвердили возможность попадания шигелл
в энтероциты, но как незакономерное явление.
366
Рис. 9.6. Изменения внутренних органов, вызванных грамотрицательными
бактериями (дизентерия).
а — катаральный колит при дизентерии с выраженной гиперсекрецией слизи. В просвете
крипты видны бледноокрашеиные бактерии. Окраска азуром и эозином. х 600; б — при
дизентерии в цитоплазме одного из энтероцитов ближе к его поверхности содержится несколько
бактерий. Окраска азуром и эозином. * 1350; — шигеллы Флекснера в содержимом просвета
кишки. Обработка среза специфической л юм и нес пирующей сывороткой. * 1100.
Весьма существенное значение для развития структурных изме-
нений кишечника и вслед за этим клинических проявлений болезни
имеет присоединение к поражениям, вызванным шигеллами, ин-
367
фекционных процессов другой, чаще стафилококковой или микоти-
ческой, этиологии. Именно в этом случае возникает некротическое,
язвенное или дифтеритическое воспаление.
Диссеминация шигелл из пищеварительного тракта происходит
редко и в основном интраканаликулярно. Признается, хотя и в
меньшем объеме, возможность лимфогенной диссеминации. Резуль-
таты экспериментального исследования Е. А. Суптель и Н. А. Мак-
симович (1977, 1978) показали, что при дизентерии в самые ранние
сроки возможно, кроме того, кратковременное гематогенное распро-
странение шигелл.
Основные изменения вне кишечника обусловливаются воздейст-
вием токсинов, а также потерей жидкостей.
Кишечная колиинфекция и другие эшерихиозы. Структурные
изменения возникают под воздействием патогенных видов эшери-
хий — Escherichia (0111, 0119, 055 и др.). При этом в разных
отделах пищеварительного тракта они однотипны, од-
нако степень их выраженности различна: они максимальны в тонкой
кишке, где наблюдаются изменения прежде всего эпителия. Его
клетки набухают, кутикула становится неразличимой. Щелочная
фосфомоноэстераза в покровном эпителии высокоактивна, но в ки-
шечных криптах нередко не выявляется [Тихонова Н. М., 1964].
В ранних фазах болезни в эпителии отмечается значительное уве-
личение числа фигур митозов. Клетки эпителия претерпевают ди-
строфические изменения, которые в острой фазе болезни нередко
заканчиваются десквамацией отдельных энтероцитов или целых их
пластов. О прижизненное™ этого явления бесспорно свидетельствует
обнаруживаемая иногда регенерация эпителия.
При электронно-микроскопическом исследовании, по данным
А. Ф. Блюгера и соавт. (1973), определяется очаговая деформация
микроворсинок в отдельных энтероцитах тонкой кишки. В цитоп-
лазме этих клеток отмечаются незначительные изменения.
Собственная пластинка слизистой оболочки несколько утолщена
из-за полнокровия и умеренного очагового отека. В ней происходит
также некоторое увеличение числа гистиоцитов и лимфоцитов, а
также плазмоцитов и эозинофильных лейкоцитов. Кроме того, здесь
появляются небольшие скопления нейтрофильных лейкоцитов.
Ворсинки тонкой кишки становятся более короткими и приоб-
ретают неправильную форму, из-за чего слизистая оболочка подчас
напоминает слизистую оболочку толстой кишки.
В подслизистой основе определяются очаговые полнокровие, отек,
стазы в капиллярах и венах. Отмечается умеренная очаговая про-
лиферация гистаоцитов и фибробластов, увеличивается количество
волокон, прежде всего коллагеновых.
Лимфатический аппарат кишки в острой фазе болезни гипер-
плазирован. В центрах фолликулов виден мелкоглыбчатый распад
ретикулоцитов, а также лимфоцитов.
Все э™ изменения возникают в. основном под воздействием
токсинов патогенных эшерихий, размножающихся в просвете ки-
шечника и на его внутренней поверхности. Наряду с этам (в иск-
368
лючительно редких случаях) эшерихии выявляются также в цито-
плазме энтероцитов.
В первые дни болезни желудок и особенно тонкая кишка рас-
тянуты водянистым содержимым с беловатыми или зеленоватыми
хлопьями и изредка с небольшой примесью измененной бурой крови.
Толстая кишка не расширена, в ее полости имеется немного масс,
сходных с описанными выше, или немного обычного содержимого.
Стенка кишки может быть не изменена, но чаще удается отметить
неравномерное полнокровие и мелкие кровоизлияния в слизистой
оболочке, особенно вокруг групповых и солитарных лимфатических
фолликулов.
В случаях кишечной колиинфекции, вызванной энтероинвазив-
|ными эшерихиями, в частности 0124, болезнь по клиническим
[проявлениям близка к дизентерии. В изученных наблюдениях нам
[не удалось обнаружить принципиальных различий с колиинфекци-
'ями другой этиологии. Однако в эксперименте с этими эшерихиями
в S-форме в отличие от опытов с заражением другими эшерихиями
удалось получить энтерит, напоминавший шигеллезный [Цинзер-
лингА. В. и др., 1977].
Если эшерихии вырабатывают веротоксин, процесс клинически
может приобрести характер геморрагического колита [Kelly J. et al.,
1987]. Однако гистологические изменения, выявленные при иссле-
довании биоптатов толстой кишки этих больных, не коррелируют
с клиническими проявлениями болезни.
Несравненно более тяжелыми становятся морфологические из-
менения пищеварительного тракта при наслоении на кишечную
колиинфекцию других инфекционных процессов, в частности, вы-
званных стафилококками и Candida. В этом случае возникает фиб-
ринозно-некротический или язвенный энтерит (энтероколит).
Диссеминация эшерихий из пищеварительного тракта происходит
преимущественно интраканаликулярно, в частности, в легкие. Воз-
можно также лимфо- и гематогенное и\ распространение.
Остальные изменения, возникающие, в частности, у детей, обус-
ловлены в первую очередь потерей жидкости или токсикозом.
Наиболее подробные сведения о структурных изменениях, вы-
званных эшерихиями вне пищеварительного тракта, приводятся в
отношении органов дыхания [Шастина Г. В., 1966 ]. На
самых ранних стадиях развития имеется лишь массивное обсеме-
нение органов дыхания эшерихиями. В трахее и бронхах наблю-
дается нарушение связи между клетками эпителия и в ряде слу-
чаев слущивание его. Примерно в 1/д случаев в цитоплазме
отдельных клеток эпителия обнаруживаются единичные эшерихии.
В бронхах, а нередко и в альвеолах видны отдельные клетки или
пласты спущенного цилиндрического, а иногда плоского эпителия,
а также растительные частицы. Позднее в места расположения
микроорганизмов постепенно выпотевает серозный экссудат с при-
месью макрофагов и зернистых лейкоцитов. В дальнейшем в легких
преобладает сравнительно однородный лейкоцитарный экссудат с
единичными макрофагами. Некротизации ни клеток экссудата, ни
369
Рис. 9.7. Изменения внутренних органов, вызванных грамотрицательными
бактериями (клебсиеллез и иерсиниоз).
а — в альвеолах легких при клебсиеллезе содержатся лейкоциты и значительное число
бледноокрашеиных палочек. Окраска гематоксилином и эозином, х 900; б — долевая пневмония
при клебсиеллезе с инфарктом, отграниченным лейкоцитарным валом. Окраска гематоксилином
и эозином. Натуральная величина; в — резко увеличенный брыжеечный лимфатический узел
с абсцессами при псевдотуберкулезе. Окраска гематоксилином и эозином. * 4; г — иереи ни и
8 просвете червеобразного отростка и в цитоплазме слущенных энтероцитов. Окраска азуром
и эозином, х 1350.
Клебсиеллы (Klebsiella ozaenae) вызывают озену (зловонный на-
сморк). Заболевание характеризуется резким истончением слизистой
оболочки носа С плоскоклеточной ее метаплазией, распространяю-
щейся на железы, резким уменьшением числа бокаловидных клеток
[Abdel-Latif S. М. et al., 1987 ]. Происходит также утолщение ба-
зальной мембраны, возникают лимфоплазмоцитарные инфильтраты,
развивается слизисто-гнойное воспаление.
Клебсиелл разных видов нередко выделяют из содержимого киш-
ки [Sitka U., 1976; Deb М. et al., 1980]. Однако роль их в возник-
новении поражений кишечника остается не вполне ясной.
К той же трибе Klebsiellae относятся роды Entrobacter, Serratia
и Hafnia. В настоящее время имеются публикации о выделении
этих бактерий при пневмониях, энтероколитах и сепсисе в ос-
новном у ослабленных больных. Однако отдельные морфологиче-
ские исследования [Андреева Т. В., 1983; Goldstein J. D. et al.,
1982] еще не позволяют дать полную характеристику структурных
изменений.
Иерсиниозы. Среди заболеваний, вызываемых иерсиниями
(Yersinia), наибольшее значение имеют чума и кишечный иерси-
ниоз.
Заражение Yersinia pestis происходит различными путями, чаще
от диких грызунов через кровососущих насекомых. Патологическая
анатомия чумы изучена достаточно полно и описана во многих
работах. В соответствии с данными Г. С. Кулеша (1911) и Д. П. Ки-
шенского и др. (1912) в коже в области внедрения иерсиний у части
боЛьных образуется небольшой участок воспаления с серозно-гемор-
рагическим экссудатом в центре и лейкоцитарно-макрофагальной
реакцией вокруг. Макроскопически такой очаг имеет характер пу-
стулы или карбункула.
Вскоре после возникновения первичного очага наступает лим-
фогенная диссеминация возбудителя. Однако гораздо чаще она про-
исходит без образования первичного очага во входных воротах.
В регионарных лимфатических узлах развивается тяжелое острое
геморрагическое воспаление с выраженным альтеративным компо-
нентом. Вначале отмечается лишь очень незначительная примесь
лейкоцитов и макрофагов. Воспалительный процесс обычно распро-
страняется за пределы лимфатического узла. Пораженные лимфа-
тические узлы сливаются, образуя конгломераты поперечником 5
см и более. Лимфатические узлы, а также прилежащие к ним ткани
дряблые, темно-красного цвета. Ткани, расположенные ближе к
периферии, отечны, желеобразной консистенции. При прогрессиро-
вании болезни поражаются другие лимфатические узлы по току
лимфы, где возникает принципиально такой же процесс.
Параллельно с лимфогенной генерализацией на этой стадии бо-
лезни происходит и гематогенная диссеминация. Селезенка у таких
больных имеет все черты, типичные для сепсиса. В ее ткани со-
держатся многочисленные иерсинии.
Довольно часто поражаются легкие, где развивается геморраги-
ческая пневмония. При прогрессировании воспалительного процесса
374
по протяжению возникает его связь с бронхами. С этого момента
становятся возможными бронхогенное распространение процесса и
выделение возбудителя в окружающую среду. От таких больных
могут заражаться другие люди, уже воздушно-капельным путем.
Макроскопически очаги чумной пневмонии имеют различные
размеры — от нескольких сантиметров в поперечнике до долевых
поражений. На ранних стадиях ее развития легкие в пораженных
участках увеличены в объеме, на разрезе темно-красного цвета,
с гладкой поверхностью, с которой стекает красная жидкость.
В более поздних стадиях заболевания легкие приобретают серо-
красный цвет.
Кишечный иерсиниоз. Основным путем поступления возбудителя
является пищевой, а источником вобудителей — грызуны, домашние
животные и птицы. При вызванном Yersinia pseudotuberculosis иер-
синиозе (псевдотуберкулезе) возбудитель, по-видимому, после раз-:
множения в кишке проникает в ее слизистую оболочку, преиму-
щественно в области илеоцекального угла. При световой и ИФ-мик-
роскопии нам удавалось обнаружить иерсинии иногда в большом
количестве — до 40—50 в поле зрения [Полоцкий В. Ю. и др.,
1985]. Они имелись как в просвете > кишки, в частности червеоб-
разного отростка, так и в его стенке (рис. 97, г).
В местах локализации возбудителя возникают достаточно харак-
терные изменения — альтеративные, экссудативные, преимущест-
венно лейкоцитарные, и продуктивные [Агеев А. К., Королюк А. М.,
1973; Авцын А. П., Жаворонков А. А., 1978; Исачкова Л. М. и др.,
1988 ]. Обнаруживаются небольшие изъязвления слизистой оболочки
и гиперплазия лимфоидных фолликулов. Герминативные центры
последних увеличиваются в размерах, в них видны многочисленные
митозы, нередко отмечается также пылевидный, реже глыбчатый,
распад лимфоцитов. Обычно наблюдается эпителиоидная трансфор-
мация ретикулоцитов герминативных центров фолликулов и гисти-
оцитов собственной пластинки слизистой оболочки. В центре части
таких эпителиоидных гранулем выявляются скопления большей ча-
стью распадающихся нейтрофильных лейкоцитов.
Еще более закономерно поражение регионарных лимфатических
узлов, чаще всего брыжеечных, в правой подвздошной области
(рис. 9.7, в). Лимфатические узлы увеличены в 10—30 раз, в них
возникают принципиально те же изменения, что и в стенке кишки,
хотя и выраженные значительно интенсивнее. У части детей (пре-
имущественно с более длительным течением болезни) среди эпите-
лиоидных клеток могут быть выявлены гигантские клетки типа
Лангханса.
Наряду с лимфогенной диссеминацией возбудителя возможно и.
гематогенное его распространение с образованием очагов генерали-
зации, имеющих строение, сходное с описанным выше.
Иерсиниоз, вызванный Yersinia enterocolitica, сходен по клини-
ко-морфологическим проявлениям с псевдотуберкулезом [Гус-
ман Б. jC., 1981; Тимофеева Г. А., Цинзерлинг А. В., 1983]. Иногда
Указывается на более тяжелое его течение.
375
9.1.2.3.2. Заболевания, вызываемые палочками семейства
Vibrionaceae
Среди этих инфекций наибольшее значение имеет холера.
Холера. Возбудителями холеры являются Vibrio cholerae (раз-
личают биотипы V. cholerae, V. eltor и др.>. Это изогнутые палочки,
имеющие нередко форму запятой и один полярно расположенный
жгутик; их размеры 1,5—3*0,5 мкм. Заражение происходит энте-
ральным путем.
Патологическая анатомия холеры описана многократно [Движ-
ков П. П., 1964; Брумштейн М. С., Ядрова И. К., 1971; Покров-
ский В. И. и др., 1978 ],. В острой первоначальной фазе болезни
происходит бурное размножение холерного вибриона в верхних от-
делах пищеварительного тракта, где можно обнаружить огромные
его скопления на поверхности слизистой оболочки.
При микроскопическом исследовании в случае тяжелого течения
болезни в стенке тонкой кишки, а также желудка преобладают
резко выраженные отек и полнокровие, видны также мелкие кро-
воизлияния. При более легком течении эти явления выражены
слабее, в строме слизистой оболочки выявляются значительные скоп-
ления клеток, среди которых преобладают лимфо- и плазмоциты.
Закономерно возникают дистрофические изменения эпителия.
Нередко на большом протяжении происходит его слущивание, что
в значительной мере объясняется отеком подлежащих тканей и
обусловлено воздействием токсинов из просвета пищеварительного
тракта. Аналогичные изменения возникают и в толстой кишке,
однако они выражены нерезко.
Макроскопические изменения пищеварительного тракта в наи-
более тяжелых случаях весьма характерны. Просвет кишечника,
особенно тонкой кишки, резко расширен, переполнен бесцветной
или розоватой жидкостью, иногда слегка окрашенной желчью. Эта
жидкость напоминает по своему виду рисовый отвар. Стенка кишки,
в частности ее слизистая оболочка, отечна, с красными пятнами и
гиперсекрецией. Описывается также водянистый характер желчи в
желчном пузыре вследствие тех же нарушений, что и в кишечнике.
Выраженной диссеминации холерных вибрионов за пределы ор-
ганов пищеварения, по-вкцимому, не происходит. Отмечается в
основном лишь бактериемяя. Возможно также попадание возбуди-
теля в легкие интраканаликулярным путем. Значительно более вы-
ражены изменения, обусловленные резким нарушением обмена,
главным образом водного. Они заключаются прежде всего в обез-
воживании.
Острый период холеры может закончиться смертельным исходом,
выздоровлением, и, наконец, иногда развивается картина холерного
тифоида. Можно полагать, что холерный тифоид не стадия болезни,
обусловленная сенсибилизацией, как предполагали раньше, а про-
явление осложнения этой болезни в результате присоединения вто-
ричной, в основном бактериальной микрофлоры, особенно стафило-
кокков. В это время основные изменения развиваются уже в толстой
376
кишке, где возникает фибринозное воспаление слизистой оболочки.
В дальнейшем могут образоваться язвы.
При холере возможны и другие осложнения. В частности, на-
блюдается поражение почек в виде некротического нефроза, а также
гломерулонефрита, сопровождающихся уремией.
9.1.2.3.3. Заболевания, вызываемые палочками семейства
Pseudomonadaceae
Палочки этого семейства имеют прямую или изогнутую форму,
иногда нитевидные, их размер обычно 1,5—4*0,5—1 мкм. Среди
заболеваний, вызванных этими возбудителями, наибольшее значение
имеют псевдомоноз, сап и мелиоидоз.
Псевдомоноз (синегнойная инфекция). Возбудителем является
Pseudomonas aeruginosa, который может поступать в организм че-
ловека различными путями. Наибольшее значение это заболевание
имеет как госпитальная инфекция.
Патологическая анатомия псевдомоноза описана многими иссле-
дователями. Наиболее полные сведения приводятся А. А. Балябиным
(1969) и И. Н. Красногорским (1989).
При псевдомонозе легких на ранних этапах заболе-
вания в просветах альвеол и дистальных отделов воздухоносных
путей выявляются резкое полнокровие межуточной ткани, накоп-
ление лейкоцитов в капиллярах; в альвеолах содержится немного
серозной жидкости со значительной примесью эритроцитов и с
единичными лейкоцитами.
В более поздние сроки процесс характеризуется появлением круп-
ных очагов некроза легочной паренхимы с массивными скоплениями
возбудителя в некротизированных тканях. Деструктивным измене-
ниям в этих местах подвергаются также сосуды и бронхи. Клеточная
реакция выражена слабо, хотя в некротических массах нередко
содержатся фрагментированные ядра лейкоцитов, а также немно-
гочисленные лимфоциты и моноциты.! Очаги некроза окружены
зоной кровоизлияний, сосуды здесь расширены, в просветах альвеол
содержится серозно-лейкоцитарный экссудат с многочисленными
бактериями. Далее к периферии в альвеолах видны макрофаги,
лейкоциты, а также микробы, часть из которых фагоцитирована, в
некоторых случаях в альвеолах может быть обнаружен фибрин.
При сопоставлении характера структурных изменений, вызван-
ных Pseudomonas разных сероваров, с помощью ИФ-микроскопии
и иммунопероксидазного метода отчетливых различий обнаружить
не удается [Красногорский И. Н., 1989]. Тяжесть вызываемых из-
менений в значительной степени зависит от спектра не связанных
прямо с Серова ром факторов патогенности микробов (плазмокоагу-
лазы, протеазы, липазы и др.), что показано на модели острой
синегнойной пневмонии [Цинзерлинг В. Ф., Мороз А. Ф., 1984].
В соответствии с описанными гистологическими изменениями
макроскопические проявления болезни можно разделить на два ва-
рианта: 1) нечеткие геморрагические уплотнения, иногда с серова-
377
то-желтыми участками некротизированной паренхимы в центре;
2) более плотные, темно-серые или коричневые некротические уча-
стки с умеренно приподнятыми краями, окруженные узким ободком
темно-красного цвета. От очагов пневмонии может исходить запах
триметиламина, напоминающий запах жасмина.
Псевдомоноз пищеварительного тракта на-
блюдается довольно часто у детей, особенно новорожденных, или у
лиц, ослабленных предшествующими заболеваниями. Микроскопи-
чески в желудке наблюдаются полнокровие слизистой оболочки и
гиперсекреция слизи. В просвете тонкой кишки содержится серо-
зно-лейкоцитарный экссудат со значительной примесью слущенных
вакуолизированных энтероцитов, имеются скопления возбудителя.
Вершины ворсинок лишены эпителиальной выстилки. На поверх-
ности подвздошной кишки к экссудату местами примешивается фиб-
рин. Строма слизистой оболочки полнокровна, отечна, инфильтри-
рована лейкоцитами, а также лимфоцитами и гистиоцитами. Вокруг
отдельных мелких сосудов видны диапедезные кровоизлияния.
В подслизистой основе наблюдаются значительные расстройства кро-
вообращения, главным образом в виде полнокровия и отека.
На поверхности слизистой оболочки толстой кишки наряду с
экссудатом, сходным с описанным выше, определяются пленки,
состоящие из фибрина, распадающихся лейкоцитов, пластов слу-
щенных энтероцитов, слизи, а также бесструктурных белковых масс.
Желудок пустой или содержит немного мутной жидкости. Сли-
зистая оболочка его набухшая, синюшно-красная, с немногочислен-
ными точечными кровоизлияниями. Просвет тонкой кишки расши-
рен, переполнен зеленоватой или кровянистой жидкостью с комоч-
ками слизи. Ее слизистая оболочка, особенно в дистальных отделах
подвздошной кишки и преимущественно на вершинах складок, тем-
но-красного цвета. В участках с максимальными изменениями видны
нежные пленчатые наложения. В просвете толстых кишок содержатся
грязно-зеленые полужидкие массы и обрывки пленок фибрина с
гнилостным запахом. В этих отделах пищеварительного тракта более
выражено и поражение стенки органа.
В настоящее время псевдомоноз часто является причиной сеп-
сиса [Смольянников А. В., Саркисов Д. С.,. 1982 ]. Сепсис разви-
вается как у взрослых, так и у детей, в основном при выраженном
угнетении общих механизмов антимикробной защиты. При микро-
скопическом исследовании в первичных септических очагах наблю-
дается преимущественно альтеративное воспаление с большими скоп-
лениями возбудителя в этих участках и слабо выраженной лейко-
цитарной инфильтрацией по периферии. Весьма характерно
выявление тяжелых расстройств микроциркуляции и дистрофиче-
ских изменений внутренних органов. Стенки части мелких вен,
артерий и капилляров некротизированы, содержат скопления псев-
домонас. Септические метастазы. представлены очагами некроза,
имеющими иногда форму инфаркта.
Сап. При этом заболевании, вызываемом Pseudomonas mallei,
заражение происходит от однокопытных домашних животных. В об-
378
ласти первичного очага, локализующегося чаще всего в коже, воз-
никают своеобразные узлы. Их центральные участки, в которых
содержится большое число возбудителей, заняты скоплениями не-
редко распадающихся лейкоцитов. По окружности происходит раз-
множение гистиоцитов, принимающих вид эпителиоидных клеток.
Гигантские клетки не образуются. По мере распада клеток в центре
очага появляется полость, заполненная гноевидными массами с куч-
ками бактерий. Если очаг располагается в дерме, возможно его
вскрытие с последующим образованием язвы. Макроскопически эти
язвы имеют кратерообразную форму с неровными краями. На их
поверхности, как и в невскрывшихся очагах, содержатся тягучие
гноевидные массы.
В дальнейшем развиваются лимфангиит, лимфаденит и тром-
бофлебит, возможна и гематогенная диссеминация псевдомонас.
В ряде случаев сап принимает хроническое течение. Процесс
протекает медленнее, с более интенсивным продуктивным воспале-
нием и наличием повсеместно эпителиоидных клеток. Нагноение и
распад клеток выражены слабее. Отмечается также образование
рубцов, нередко звездчатой формы.
Мелиоидоз. Возбудителем является Pseudomonas pseudomallei,
заражение происходит разными путями — от грызунов, а также
домашних животных.
У умерших в ранние сроки болезни определяются мелкие, иногда
точечные кровоизлияния в коже, серозных и слизистых оболочках,
а также дистрофические изменения и полнокровие паренхиматозных
органов. В легких, печени и селезенке обнаруживаются мелкие
очажки, состоящие из нейтрофильных лейкоцитов, гистиоцитов,
эпителиоидных клеток и лимфоцитов. Особенностью этих очагов
является тенденция к быстрой некротизации и абсцедированию.
С наибольшим постоянством выявляются абсцессы в легких, где
они могут достигать в поперечнике нескольких сантиметров. При
субплевральном расположении абсцессов возможно развитие фиб-
ринозно-гнойного плеврита.
При благоприятном преморбидном состоянии организма течение
инфекции относительно доброкачественное и процесс ограничивается
поражением только легких.
9.1.2.3.4. Заболевания, вызываемые палочками семейства
Spirochaetaceae
Наибольшее значение среди них имеют сифилис, лептоспироз, а
также боррелиозы и фрамбезия. Условно к этой группе болезней
отнесена также гангрена легких.
Сифилис. Заболевание вызывает бледная трепонема (Treponema
pallidum) размерами 5—20*0,1—0,5 мкм. Заражение происходит
преимущественно половым путем.
В месте проникновения возбудителя в слизистую оболочку эпите-
лий приподнят скопившимся под ним серозным выпотом и отторгается,
а в краях и дне язвы развивается специфическое продуктивное воспа-
379
ление с новообразованием сосудов. В наиболее поверхностных участ-
ках имеется густая инфильтрация ткани лимфо- и плазмоцитами с
незначительной примесью нейтрофильных лейкоцитов, глубже ин-
фильтрат того же состава располагается более рыхло, в основном пе-
риваскулярно и периневрально. Характерны также панваскулиты. Эти
изменения обозначают как первичный период.
Макроскопически поражение (твердая язва, или шанкр) имеет
вид красного пятнышка, превращающегося в папулу, а затем в
язвочку диаметром до 1—2 см округлой формы, со скудным отде-
ляемым и гладким, плотным дном. Этот процесс сопровождается
увеличением регионарных лимфатических узлов.
При генерализации инфекции (вторичный период) в коже обна-
руживается разрыхление эпителия; подлежащие ткани отечны, пол-
нокровны. Характерны распространенные периваскулярные лимфо-
плазмоцитарные инфильтраты, нередко с примесью гигантских мно-
гоядерных клеток. Поражаются также многие внутренние органы.
Позднее, в среднем через 3—4 года, процесс приобретает другой
характер (третичный период). Наиболее типичным является обра-
зование гумм — гранулем, состоящих из лимфоцитов, макрофагов
и плазмоцитов, а также эпителиоидных и гигантских многоядерных
клеток. Число последних^ за исключением гумм, локализующихся
в коже, сравнительно невелико. В гуммах описывается большое
число кровеносных Сосудов с воспалительными изменениями в стен-
ке. Макроскопически гуммы имеют вид опухолевидных образований
неправильно-округлой формы, желтовато-серого или серовато-розо-
вого цвета. Типичен также диффузный сифилитический склероз
печени, поджелудочной железы, легких, надпочечников и яичек.
Висцеральный сифилис часто проявляется поражением кровенос-
ных сосудов, особенно аорты. При микроскопическом исследовании
в среднем слое стенки аорты и в ее адвентиции выявляется лим-
фоплазмоцитарная инфильтрация, чаще периваскулярная по ходу
vasa vasorum. Это сопровождается ичезновением эластических во-
локон и гладкомышечных клеток и замещением их рубцовой тканью.
Макроскопически, в основном в грудном отделе аорты, определяется
морщинистость ее интимы. Здесь же избирательно возникают вы-
раженные вторичные атеросклеротические изменения.
В еще более позднем периоде сифилиса возможно развитие про-
грессивного паралича и спинной сухотки. В первом случае преоб-
ладает поражение головного мозга, во втором — спинного. Они
заключаются в первую очередь в распространенных атрофических
изменениях ткани органа. Нервные клетки вакуолизируются, ядра
их становятся пикнотичными, в цитоплазме накапливается большое
количество липофусцина. Встречаются также мелкие очаги некроза
с глиальной реакцией вокруг.
Воспалительные изменения, сходные с приобретенным сифили-
сом, возникают и при врожденном, проявления которого зависят
прежде всего от давности заболевания, включая и то время, которое
сифилис развивался вПутриутробно’.
Фрамбезия. Заболевание вызывается Treponema partenue. Зараже-
380
ние происходит контактным (не половым) путем от больных людей,
фрамбезия начинается, с образования в коже гранулемы, отека и ин-
фильтрации дермы лейкоцитами и макрофагами. В эпидермисе над
гранулемой наблюдаются воспалительные разрастания, а также ваку-
ольная дистрофия и мелкие участки некроза со значительным коли-
чеством возбудителей. Макроскопически эти очаги имеют характер
папулы или папилломы, позднее может развиться папилломатоз.
Через 3—12 нед после появления первичного очага наступает
генерализация инфекции с развитием очагов в других участках
кожи, в слизистых оболочках, а также в суставах и костях. Про-
явления ранней фрамбезии обычно заживают через 3—6 мес.
Поздняя фрамбезия возникает через месяцы или годы после
начала болезни. Описываются поражения тех же органов. При ги-
стологическом исследовании в дерме имеются инфильтраты из плаз-
моцитов, а также фибробластов, эпителиоидных и гигантских клеток.
В эпидермисе определяются гиперкератоз и воспалительные разра-
стания. Макроскопически выявляются нередко изъязвляющиеся узлы
в коже и подкожной клетчатке, особенно в области суставов, а
также в верхних дыхательных путях и в костях. Заживление их
протекает с образованием грубых рубцов.
Лептоспирозы. Возбудителем лептоспирозов являются лептоспи-
ры (Leptospira interrogans) — палочки в форме спирали размером
6—200,1 мкм. Основной резервуар возбудителей инфекции — гры-
зуны. Лептоспиры внедряются в организм через кожу, слизистые
оболочки без образования первичного очага в воротах инфекции и
проникают в лимфатическую систему.. Позднее возникает лепто-
спиремия, что обычно сопровождается диссеминированным внутри-
сосудистым свертыванием. Одновременно резко усиливается прони-
цаемость сосудов и появляются кровоизлияния.
В дальнейшем лептоспиры попадают в почки, а также в печень,
надпочечники и другие органы и, по-видимому, размножаются в
них. Поражение печени наиболее типично. В ней выявляются ди-
скомплексация печеночных балок, дистрофические изменения гепа-
тоцитов, отмечается неравномерная величина этих клеток и их
ядер, появляются многоядерные клетки. Происходит также гипер-
трофия звездчатых ретикулоэндотелиоцитов с фагоцитозом ими
эритроцитов и лейкоцитов. У животных возникают некрозы печени.
Закономерно поражаются также почки, в которых наблюдаются
альтеративные изменения нефрона вплоть до зернистого распада
нефротелия. В межуточной ткани возникают лимфогистиоцитарные
инфильтраты с примесью нейтрофильных лейкоцитов. В неравно-
мерно расширенных просветах канальцев содержатся белковые мас-
сы, эритроциты, цилиндры, слущенные клетки нефротелия. Клу-
бочки обычно не изменены.
Возможно развитие очагов воспаления, а также кровоизлияний
и в других органах, в том числе в ЦНС. Особенно характерны
альтеративное воспаление и кровоизлияния в скелетных мышцах,
в первую очередь икроножных, где при ИФ-исследовании можно
выявить листерии [Sheldon W. Н., 1953].
381
Макроскопические изменения малохарактерны. Они заключаются
в основном в проявлениях геморрагического диатеза и в желтухе с
красноватым или коричневатым оттенком.
Боррелиозы. Возбудители этой группы заболеваний — Borrelia —
палочки спиралевидной формы размерами 3—20*0,2—0,5 мкм, пе-
редаются вшами и клещами. Основными представителями боррели-
озов являются эпидемический и клещевой возвратный тифы, а также
болезнь округа Лайм.
При эпидемическом возвратном тифе возбудитель (Borrelia
recurrentis) локализуется в кровеносных сосудах разных органов и
пульпе селезенки [Войно-Ясенецкий М. В., 1964 ], где они в основном
размножаются. Это достаточно закономерно сопровождается, по-ви-
димому, за счет действия эндотоксинов, повреждением сосудов.
Морфологически проявляется, по данным С. С. Вайля (1922), ли-
пидозом эндотелия. Повреждение сосудов осложняется кровоизлия-
ниями различных размеров, одновременно происходит умеренное
поступление боррелий в периваскулярные ткани различных органов.
Во многих органах отмечается активация клеток системы мононук-
леарных фагоцитов, лейкоцитарная же реакция выражена незначи-
тельно.
Боррелии фагоцитируются макрофагами и в меньшей мере ней-
трофильными гранулоцитами. Судя по тому, что бактерии в этом
случае как бы скомканы и разрушены, фагоцитоз является завер-
шенным. Однако одновременно или вслед за этим разрушаются и
сами клетки. В результате образуются милиарные очажки некроза.
Иногда, в частности в печени, описывают и мелкие гранулемы.
Макроскопически обычно отмечаются желтуха и гиперплазия
селезенки. Она довольно хрупкая, серовато-красного или темно-
красного цвета с мелкими желтоватыми очажками и иногда инфар-
ктами, пульпа дает умеренный соскоб. В других внутренних органах
наряду с кровоизлияниями дистрофические изменения разной сте-
пени.
Эндемический возвратный тиф сходен по своим проявлениям с
эпидемическим возвратным тифом. Принято считать типичным на-
копление боррелий в сосудах, особенно мягкой мозговой оболочки,
и капиллярах мозга. В веществе и желудочках мозга имеются
кровоизлияния. В костном мозге обнаруживаются множественные
кровоизлияния и значительное число мегакариоцитов с дегенера-
тивными ядрами. В других внутренних органах обычно описывают
лишь умеренные расстройства кровообращения и дистрофические
изменения.
Болезнь округа Лайм вызывает Borrelia burgdorjeri. Возможно
поражение кожи, системы мононуклеарных фагоцитов, сердечно-со-
судистой, костно-суставной системы и ЦНС [Duray Р. et al., 1986].
Возбудители обычно находятся вне клеток. В патогенезе болезни,
кроме прямого воздействия возбудителей, придают значение эндо-
токсинам, иммунным комплексам, антителам против миелина и
интерлейкину. При исследовании лимфоидной реакции выявляется
большое число незрелых В-лимфоцитов, лаброцитов и макрофагов.
382
Делается попытка выделить стадии болезни, напоминающие стадии
сифилиса [Baranton G., 1988 ]. Описана возможность поражения по-
следа и плода [MacDonald А., 1988 ].
В последние годы появились описания тяжелого энцефаломие-
лита, вызванного спирохетами, которые были отнесены к боррелиям
[Matschke Н. et al., 1989].
Гангрена легкого характеризуется распадом ткани органа в ре-
зультате действия гнилостных бактерий, среди которых большую
роль играет спирохета типа зубной. Под воздействием этих бактерий
органические вещества подвергаются расщеплению с образованием
пептонов, биогенных аминов, фенола, скатола и других токсических
веществ [Браунштейн А. Е., 1949]. Главным предрасполагающим
фактором развития гангрены является изменение реактивности ор-
ганизма, связанное прежде всего с гиповитаминозом С.
При микроскопическом исследовании на начальных стадиях про-
цесса выявляется зернистый распад ткани. Постепенно исчезает
аргирофильный каркас, еще позднее разрушаются и эластические
волокна. Эти участки постепенно переходят в отечную ткань. При
менее бурном прогрессировании процесса можно видеть вал из лей-
коцитов и макрофагов. В очаге поражения, по описанию В. Д. Цин-
зерлинга (1913, 1928), содержится огромное количество микробов;
среди них преобладают спирохеты, наибольшее количество которых
располагается в периферических участках очага некроза и в окру-
жающей его отечной ткани. На втором месте стоит веретенообразная
палочка, скапливающаяся преимущественно на границе некроза.
В области распада ткани к этим микроорганизмам присоединяются
разнообразные другие микробы. Распространение процесса зависит
от активного внедрения спирохет в ткани, особенно легко они
внедряются в плотные соединительнотканные прослойки, стенки
артерий и т. д.
Макроскопически в типичных случях гангрены легкого обна-
руживается обычно одиночный крупный очаг. Характерные изме-
нения заключаются в распаде ткани, приобретающей бурый или
зеленоватый оттенок. Очаг поражения издает резкий тошнотворный
запах. В дальнейшем на этом месте образуется полость, содер-
жащая буровато-черные или зеленоватые клочьевидные распада-
ющиеся массы.
Размножение спирохет и такое распространение их по тканям
возможны лишь при отсутствии нормальной воспалительной, в ча-
стности лейкоцитарной, реакции. При усилении воспалительного
процесса прогрессирование гангрены прекращается. Особенно де-
тально стадии затихания при гангрене легких описаны М. В. Рога-
чевым (1985).
Поражения, аналогичные гангрене легкого, возможны и в других
органах.
Описываются также спирохетозы кишечника, особенно его ди-
стальных отделов. Спирохеты располагаются на поверхности сли-
зистой оболочки, не пенетрируют ее, в месте контактов имеется
Электронно-плотное вещество. Воспалительные изменения иногда не
383
выявляются, в других же случаях описывают воспалительную ин-
фильтрацию собственной пластинки слизистой оболочки, эрозии и
регенерацию эпителия крипт [Willen R. et al., 1985].
9. J.2.3.5. Заболевания, вызываемые палочками семейства
Legionellaceae
Легионеллез. Возбудителями являются Legionella (в первую очередь
L. pneumophila) — палочки размером 2—3 (до 50)х0,5—0,7 мкм.
Возбудитель может существовать во внешней среде и поступать в
организм человека с пылью, водой, кондиционированным воздухом,
о чем свидетельствуют результаты американских эпидемиологиче-
ских исследований, подробно проанализированных С. В. Прозоров-
ским и соавт. (1984).
Среди легионеллезов выделяют несколько вариантов по особен-
ностям течения. Наибольшее значение имеет болезнь легионеров,
представляющая собой тяжелую пневмонию, нередко приводящую
к смертельному исходу. Эта форма легионеллеза наиболее изучена
[BlackonJ. et al., 1978; 1979; Evans С. Р., Winn W. С., 1981;
Helms С. M. et al., 1981]. Поражаются респираторные отделы лег-
ких. В альвеолах накапливается экссудат, содержащий фибрин,
серозную жидкость, нейтрофильные лейкоциты и макрофаги, при-
месь эритроцитов. Имеются также гиалиновые мембраны, свиде-
тельствующие о резком нарушении проницаемости сосудов. В цен-
тральных участках таких очагов значительно преобладают лей-
коциты, которые подвергаются весьма типичному для этого
заболевания распаду с кариорексисом. Часто наблюдается тромбоз
мелких кровеносных сосудов, в первую очередь вен, что способствует
развитию относительно крупных зон некроза. Наряду с этим пора-
жаются дистальные отделы дыхательных путей.
Во всех участках очагов воспаления описывают наличие легио-
нелл, лежащих как свободно, так и в макрофагах и лейкоцитах.
Наибольшее их число содержится в участках с выраженными аль-
теративными изменениями лейкоцитов. Среди серозного и серозно-
геморрагического экссудата по периферии очагов возбудители вы-
являются реже.
Макроскопически пневмония имеет характер очаговой или до-
левой. Поверхность разреза легкого серовато-красная или сероватая,
с ржавым оттенком, нередко с абсцедированием. Очень часто раз-
вивается серозный или серозно-фибринозный плеврит.
Возможна диссеминация легионелл. При лимфогенном их распро-
странении поражаются регионарные лимфатические узлы. Они увели-
чиваются в размерах, их синусы расширяются, содержат большое чис-
ло бактерий. Герминативные центры не увеличены. В этих узлах воз-
никают некротические изменения. Возможна и гематогенная
генерализация с поражением кожи в виде макулопапулезной сыпи,
эндокардитом, миокардитом, пиелонефритом, абсцессами в разных ор-
ганах. Описывают поражения почек, имеющие характер шоковой поч-
ки. Отмечается также выраженная гиперплазия селезенки.
384
9.1.2.3.6. Заболевания, вызываемые палочками семейства
Spirillaceae
Среди этих заболеваний наибольшее значение имеет геликобакте-
риоз (кампилобактериоз).
Геликобактериоз. Его возбудитель Helicobacter pylory — палочка
размерами 0,8*0,2—0,8 мкм — выделяется у значительной части
больных диареей. Наиболее частое и достоверное проявление гели-
кобактериоза — гастроэнтерит или энтероколит. Имеются также
клинико-лабораторные наблюдения аппендицита, холецистита, ме-
зентериального лимфаденита и септицемии данной этиологии.
Патологическая анатомия геликобактериоза изучена недостаточ-
но. Имеющиеся работы основаны преимущественно на результатах
исследования биоптатов желудка и двенадцатиперстной кишки [Ару-
ин'Л. И., 1990; Bayerdorffer Е. et al., 1986; Rauws Е. A. J. et al.,
1987; Andersen L. P. et al., 1987]. Геликобактерии часто выявляются
на слизистой оболочке желудка (в желудочной слизи, вблизи по-
верхностного эпителия), число этих бактерий коррелирует с содер-
жанием лейкоцитов в слизистой оболочке. Указывается на их почти
постоянное наличие при гастрите и дуодените, особенно активном.
Отмечается также большая степень выраженности метаплазии и
атрофии слизистой оболочки в антральном отделе желудка
[Karttunen Т. et al., 1987]. Эти изменения могут сочетаться с дуо-
денитом с выраженной инфильтрацией эпителиального слоя лейко-
цитами [Wyatt J. I. et al., 1987]. С большой частотой геликобактерии
выявляются при язвах желудка и двенадцатиперстной кишки
[Lamouliatte Н. et al., 1987].
В биоптатах ободочной кишки [Van Spreeuwel Y. Р. et al., 1985]
геликобактерии удавалось обнаружить с большой частотой в глико-
каликсе и цитоплазме поверхностного эпителия. Из структурных
изменений на ранней стадии болезни описаны инфильтрация по-
верхностного эпителия слизистой оболочки кишки нейтрофильными
лейкоцитами, участки изъязвления, отек и диффузная инфильтрация
собственной пластинки лимфоцитами и плазмоцитами с примесью
гранулоцитов и макрофагов. Позднее происходят регенерация эпи-
телия и гиперплазия лимфатических фолликулов. В стадии выздо-
ровления отмечается лишь незначительная лимфоплазмоцитарная
инфильтрация. Макроскопические изменения, выявленные при эн-
доскопии, нехарактерны.
9.1.2.3.7. Заболевания, вызываемые палочками с неясным
положением в систематике
К этим инфекциям относятся коклюш, гемофилез, бруцеллез и
туляремия.
Коклюш. Заражение Bordetella pertussis (возбудителем коклю-
ша) — палочкой размером 0,5—1 х. 0,2—0,3 мм — происходит аэро-
зольным путем. Бордетеллы размножаются, по данным А. П. Тара-
совой (1958), в основном на слизистой оболочке дыхательных путей.
13—407
385
Эпителий подвергается дистрофическим изменениям и слущивается,
выявляются признаки катарального воспаления. Просветы бронхов
содержат серозный экссудат с небольшой примесью лейкоцитов и
макрофагов. В экссудате находятся лежащие свободно или фагоци-
тированные бордетеллы. При накоплении палочек в цитоплазме
фагоцитов они некротизируются. В стенках бронхов обычно опре-
деляются небольшие лимфоидные инфильтраты. Иногда происходит
бронхогенное распространение воспалительного процесса на респи-
раторные отделы. В этих случаях возникают мелкие очаги пневмо-
нии. В участках с прогрессирующими изменениями в альвеолах
содержится серозно-макрофагально-лейкоцитарный или серозно-
лейкоцитарный экссудат, в котором имеется много преимущественно
свободно лежащих бордетелл. При затихании процесса обнаружи-
ваются очажки с остаточными изменениями. Альвеолы содержат
глыбки белка, окруженные макрофагами.
Наряду с описанными проявлениями болезни обнаруживаются
распространенные функциональные изменения. В передних и ниж-
некраевых отделах легких отмечается резко выраженная острая
эмфизема. В задних же отделах участки эмфиземы чередуются с
участками дистелектазов. Изменения воздушности сочетаются с ос-
трыми расстройствами кровообращения.
Макроскопически отмечается умеренное полнокровие дыхатель-
ных путей с необильными полужидкими наложениями на слизистой
оболочке. Легкие вздуты, в переднем их крае нередко определяется
буллезная эмфизема. В задних отделах легкие серо-красные, часто
с точечными кровоизлияниями. На разрезе здесь видны отдельные
выступающие мелкие серые или серо-красные очаги уплотнения и
более многочисленные западающие темно-красные участки.
В других органах, в том числе в головном мозге, выявляются
расстройства кровообращения, местами с плазмо- и геморрагиями.
Гемофилез. Среди палочек Haemophilus наибольшее значение
имеет Haemophilus influenzae (палочка Афанасьева — Пфейфера) —
мелкая палочка размерами 1—2x0,3—0,5 мкм.
Поражения, вызванные этой палочкой, могут локализоваться в
разных органах, относительно чаще в легких, в основном у детей.
Процесс начинается с возникновения участков воспаления с серо-
зным или серозно-лейкоцитарным экссудатом, в котором содержится
довольно большое число гемофильных палочек. На более поздних
стадиях развития процесса центральные участки очагов заняты пре-
имущественно лейкоцитарным экссудатом; палочек здесь нет. По
периферии фокусов имеется обычно узкая зона серозного воспаления
со значительным количеством свободно лежащих палочек. Далее,
по направлению к центру, в альвеолах все в большем количестве
появляются лейкоциты, фагоцитирующие микроорганизмы. Некроза
легочной ткани при этой форме пневмонии не наблюдается.
Макроскопическая картина пневмонии данной этиологии мало-
характерна. Это небольшие очаги серого или серовато-красного цве-
та, располагающиеся преимущественно в задних отделах легких.
Наряду с пневмонией гемофильные палочки могут вызывать и
386
иные поражения, в частности гнойный менингит или менингоэнце-
фалит с мало'характерными проявлениями.
Остальные виды гемофильных палочек вызывают другие забо-
левания: Haemophilus DG dycreyi — мягкий шанкр, Haemophilus
conjunctivalis — конъюнктивит.
Бруцеллез. Заражение палочками рода Brucella, размеры которых
составляют 0,6—1,5*0,5—0,7 мкм, происходит от больных домашних
животных преимущественно энтеральным путем.
По данным П. П. Очкура (1951), Т. Davion и соавт. (1987), бру-
целлы проникают в организм человека через слизистые оболочки
или реже кожу. В месте их внедрения существенных изменений не
отмечается. Заболевание развивается после лимфогенной, а позднее
и гематогенной генерализации инфекции. В местах размножения
бруцелл (в печени, лимфоидных и других органах) возникают уча-
стки некроза, вокруг которых формируются бруцеллезные грануле-
мы — гранулемы Банга. Они образованы эпителиоидными клетками,
гистиоцитами, лимфоцитами, плазмоцитами и эозинофильными лей-
коцитами. В тех же органах обнаруживаются очаговые скопления
клеток типа эпителиоидных, среди которых встречаются многоядер-
ные клетки.
Макроскопически пораженные лимфатические узлы сочные, об-
разуют не связанные с кожей пакеты, на разрезе в них видны
желто-серые участки некроза. Увеличены в размерах селезенка и
печень, которая при длительном течении болезни приобретает вид
цирротической (наблюдаются асцит и желтуха).
Помимо этого, часто разивается воспаление мужских (орхиты,
эпидидимиты) и женских половых органов, нередко возникают и
плацентиты. Типичными являются поражения костей и суставов:
гранулематозные, реже гнойные остеопериоститы, артриты крупных
суставов и остеомиелиты с серозно-фибринозным или гнойным экс-
судатом. Характерным проявлением бруцеллеза считается также
поражение сердечно-сосудистой системы в виде тромбоваскулитов,
миокардита, 'перикардита и эндокардита.
При длительном течении заболевания отмечается поражение
ЦНС в, виде распространенной периваскулярной инфильтрации и
гранулем преимущественно в коре больших полушарий.
Туляремия. Заражение Francisella tularensis — полиморфной
палочкой размерами 0,3—0,5 мкм — происходит, как правило, при
контакте с дикими грызунами или через кровососущих насекомых.
Возбудитель проникает через кожу или слизистые оболочки глаз,
дыхательных путей или пищеварительного тракта.
В области входных ворот возникают, хотя и непостоянно, вос-
палительные изменения. В этих участках, особенно в очагах лимфо-
и гематогенной генерализации, в типичных случаях образуются
туляремийные гранулемы, состоящие из участка некроза, окружен-
ного эпителиоидными и лимфоидными клетками. Обычно имеются
также гигантские многоядерные клетки типа Лангханса и нередко
нейтрофильные лейкоциты. Характерны пикноз и рексис ядер кле-
ток.
13*
387
Макроскопически в коже в месте внедрения возбудителя обра-
зуется папула или пустула, как правило, изъязвляющаяся. Язвы
имеют неровные края и сероватое дно, покрытое некротическими
массами.
При легочной форме туляремии в альвеолах обнаруживается
серозный или серозно-фибринозный экссудат со значительной при-
месью лимфоидных клеток, спущенных эпителиоцитов, немного-
численных нейтрофилов и эритроцитов. Характерны также мас-
сивные перибронхиальные и периваскулярные лимфоидные ин-
фильтраты.
Макроскопически отмечается катаральное воспаление гортани,
трахеи и крупных бронхов, в дальнейшем возможно развитие фиб-
ринозного, серозно-фибринозного или геморрагического плеврита.
Могут также возникать поражения, напоминающие милиарный ту-
беркулез. Нередко наблюдаются тяжелые расстройства микроцир-
куляции с возникновением геморрагических инфарктов.
В редких- случаях при заражении алиментарным путем образу-
ются эрозии и острые язвы в пищеварительном тракте. Обнаружи-
ваются также значительное увеличение лимфатических фолликулов,
особенно групповых, и кровоизлияния в них.
Из первичного очага закономерно происходит лимфогенное рас-
пространение возбудителей. В результате этого развивается регио-
нарный лимфаденит. Возможна также генерализованная лимфаде-
нопатия. Наряду с лимфогенным наблюдается гематогенное рас-
пространение возбудителей. У таких больных на бледной с
землисто-серым или желтушным оттенком коже видна сыпь, частью
геморрагическая. Во внутренних органах, особенно в печени, воз-
можно развитие милиарных и более крупных очагов. Селезенка
приобретает вид септической, на разрезе в ней выявляются некро-
тические очаги округлой или неправильной формы. Наконец, воз-
можно резкое преобладание в клинико-морфологических проявле-
ниях болезни поражения одного органа, например, крупноочаговое
поражение печени, которое расценивают как туляремийный гепатит
[OrtegoT. J. et al., 1986].
9.1.2.4. Заболевания, вызываемые грамположительными
палочками
К числу этих инфекций относятся болезни, вызванные палочками
семейств Mycobacteriaceae, Bacillaceae и некоторых других, а также
кори неформными бактериями.
9.1.2.4.1. Заболевания, вызываемые палочками семейства
Mycobacteriaceae
К этим инфекциям относятся туберкулез, лепра и некоторые другие.
Их возбудители (микобактерии) — палочки размерами 1—10 * 0,2—
0,6 мкм, кислого- и спиртоустойчивые на некоторых стадиях раз-
вития. Заражение, как правило, происходит от больных различными
388
Рис. 9.8. Изменения внутренних органов При туберкулезе.
а — множественные мелкие некротические очаги в печени. Окраска гематоксилином и эозином,
х 135; б — центральные участки гранулемы представлены некротическими массами., окружены
специфической грануляционной тканью с характерной многоядерной гигантской клеткой. Окраска
гематоксилином и эозином. * 135.
путями: для туберкулеза основным из них является воздушно-ка-
пельный.
Туберкулез. Возбудитель — Mycobacterium tuberculosis — при
первичном инфицировании вызывает воспалительный процесс, ло-
кализующийся, как правило, в легких. Его обозначают как первич-
ный очаг (аффект). Вначале возникает альвеолит с накоплением в
альвеолах экссудата с нейтрофильными гранулоцитами и макрофа-
гами, подвергающегося некрозу (рис. 9.8, а). В дальнейшем экссу-
дативные изменения сменяются продуктивными — формированием
туберкулезной гранулемы (рис. 9.8, б). Основным элементом гра-
нулемы являются эпителиоидные клетки, располагающиеся часто-
колом вокруг некроза в центре бугорка. Между ними и кнаружи
от этого частокола в бугорке находятся лимфоциты. Характерно
также присутствие гигантских многоядерных клеток — Пирогова —
Лангханса. Однако сходные клетки встречаются и при другой па-
тологии, в частности при микозах. Соотношение разных клеточных
элементов в бугорках неодинаково.
Диагноз туберкулеза становится более определенным, если уда-
ется обнаружить микобактерии. Их больше всего в участках казе-
озного некроза. В цитоплазме клеток Пирогова — Лангханса ми-
кобактерии обнаруживаются лишь изредка [Huebschmann Р., 1928,
1956].
389
При благоприятном течении процесс заканчивается рубцеванием
или инкапсуляцией и обызвествлением некротических масс, воз-
можна и оссификация.
Достаточно закономерно аналогичный процесс возникает в ре-
гионарных лимфатических узлах, правда, необходимо отметить, что
проявления воспалительного процесса MOiyr протекать не синхронно.
Принципиально сходный процесс может возникнуть и при другой
локализации первичного очага.
Прогрессирование туберкулеза происходит вследствие увеличения
размеров первичного очага, а также в результате лимфогенной или
гематогенной генерализации инфекции. Рост первичного аффекта
осуществляется благодаря возникновению перифокальных измене-
ний, подвергающихся казеозному некрозу. Если в воспалительный
процесс вовлекаются бронхи, некротические массы выделяются с
мокротой или аспирируются в другие участки легких. Следствием
аспирации может быть образование ацинозных или более крупных
очагов казеозной пневмонии. На месте же обширных участков не-
кротизированной ткани легкого образуется первичная легочная ка-
верна.
Наиболее разнообразные изменения возникают при гематогенной
и лимфогенной генерализациях, нередко сочетающихся друг с дру-
гом. При лимфогенной генерализации процесс распространяется из
регионарных лимфатических узлов в корне легкого до лимфатиче-
ских узлов шеи или брюшной полости. Наиболее частой формой
гематогенного туберкулеза является острый милиарный туберкулез.
Ой носит продуктивный характер. В легких проявляется формиро-
ванием просовидных бугорков, расположенных в интерстициальной
ткани. Бугорки имеются также в селезенке, печени, мозговых обо-
лочках и других органах.
Если генерализация инфекции приводит к формированию пре-
имущественно внелегочных поражений, возникает органный тубер-
кулез: костно-суставной, мочеполовой, эндокринный, других органов
(кожи, глаз, серозных оболочек, нервной системы).
Возможно развитие вторичного туберкулеза. Это результат либо
обострения ранее существовавшего процесса в области первичного
комплекса или внелегочных очагов в том случае, если там сохра-
нились возбудители хотя бы с ослабленной вирулентностью [Стру-
ков А. И., Соловьева И. П., 1986], либо экзогенного повторного ин-
фицирования больного (образование реинфекта).
На самой ранней стадии развития вторичный туберкулез пред-
ставляет собой очаговую пневмонию, которая может рассосаться,
организоваться или прогрессировать, подвергаясь при этом творо-
жистому некрозу. Все эти изменения принципиально сходны с опи-
санными при первичном туберкулезе, за исключением лишь того,
что при вторичном туберкулезе отсутствует лймфогенная и гема-
тогенная генерализация.
Наиболее тяжелой формой вторичного туберкулеза является фиб-
розно-кавернозный туберкулез легких, возникающий в случае раз-
растания вокруг каверны туберкулезной грануляционной ткани, ко-
390
торая постепенно превращается в рубцовую ткань. Тяжисгые раз-
растания соединительной ткани появляются и в окружающей каверну
легочной ткани. Прогрессирование вторичного кавернозного тубер-
кулеза в основном интраканаликулярное и сопровождается пораже-
нием не только бронхов и других отделов легких, но и трахеи,
гортани, зева. Возможно также спутогенное инфицирование кишеч-
ника с образованием язв, преимущественно в дистальных отделах
подвздошной кишки.
У беременных женщин, страдающих прогрессирующим туберку-
лезом, возможно развитие специфического плацентита и вслед за
этим поражение зародыша.
Процесс весьма сходный по своим морфологическим проявлениям
с туберкулезом, возможен и при вакцинации против него. В этом
случае очаговое воспаление может возникнуть не только в коже в
месте введения вакцины, но и в других участках, чаще всего в
регионарных лимфатических узлах.
Лепра. Очаги поражения, вызванные Mycobacterium leprae, ло-
кализуются в коже, слизистых оболочках, особенно в проксимальных
отделах дыхательных путей и пищеварительного тракта, а также
во внутренних органах.
Выделяют несколько форм лепры, в первую очередь лепрома-
тозную. При гистологическом исследовании в очагах воспаления
выявляется значительное число микобактерии, которые нередко ло-
кализуются вокруг мелких сосудов, а в коже и вокруг ее придатков.
Здесь же образуются специфические гранулемы — лепромы. Они
состоят в основном из клеток типа эпителиоидных, а также мно-
гоядерных, которые называют клетками Вирхова. В этих клетках
обнаруживаются микобактерии и многочисленные вакуоли, содер-
жащие липиды разного характера.
Типичны изменения сосудов, особенно мелких. При легком по-
ражении отмечается лишь гиперплазия эндотелия, при более тяже-
лых проявлениях возможен фибриноидный некроз стенки (медии),
сопровождающийся тромбозом и завершающийся рубцеванием
[Ravisse Р., RollierR., 1986]. Характерно также поражение нервов:
выявляются участки, в которых искажена их архитектоника, что
завершается некрозом и формированием гранулем. В дальнейшем
периневрий может приобретать вид чешуи лука [Ravisse Р.,
Rollier R., 1986].
Макроскопически особенно характерен вид кожи. На лице, во-
лосистой части головы, шее, туловище и конечностях видны эле-
менты разного характера. Это прежде всего выступающие узловид-
ные образования; имеются также желтоватые пятна, представляю-
щие собой лепрозные инфильтраты, и лишенные волос и пигмента
учатки рубцевания. Принципиально сходные изменения обнаружи-
ваются в слизистых оболочках. При развитии этого процесса в носу
возможно разрушение носовой перегородки. Лепромы выявляются
также в печени, легких, лимфатических узлах, особенно шейных
и паховых, яичках, костях и других органах.
Наряду с описанной формой лепры возможно развитие заболе-
391
вания, очаги поражения при котором, в частности в коже, весьма
напоминают туберкулезные. Это послужило основанием для выде-
ления туберкулоидной формы лепры. Микобактерии при этой форме
не обнаруживаются или их мало. Одиако с помощью пероксидазного
метода исследования антиген микобактерий может выявляться почти
закономерно, причем в половине наблюдений — в плазмоцитах
[Barros U. et al., 1987 J. В очагах поражения, особенно в период
затихания, содержится много лимфоцитов. Во внутренних органах
не определяется изменений, напоминающих туберкулез; имеются
лишь лимфогистиоцитарные инфильтраты с единичными эпителио-
идными клетками, а также довольно много гемосидерина.
Патогенными для человека могут быть и другие микобактерии.
Это относится, в частности, к Mycobacterium marinum. Поражения
этой этиологии описаны, например, Е. N. Beckman и соавт. (1985).
Они возникают, как правило, после травмы рук рыболовным крюч-
ком. При гистологическом исследовании операционного материала
выявляются гипертрофия и гиперплазия клеток, выстилающих си-
новиальные влагалища, на внутренней поверхности имеются нало-
жения фибрина. В пораженных участках обнаруживаются также
инфильтраты из нейтрофильных лейкоцитов, лимфоцитов, гистио-
цитов и плазмоцитов. Имеются четко отграниченные гранулемы без
участков казеозного некроза, образованные в основном эпителио-
идными клетками с небольшой примесью гигантских клеток типа
Лангерганса (белый отростчатый эпидермоцит) или инородных тел.
Л1.2.4.2. Заболевания, вызываемые коринеформными
бактериями
К этим инфекциям относятся дифтерия и листериоз.
Дифтерия. Возбудителем является Corynebacterium diphteriae
(размеры ее 1—5*0,5 мкм). Заражение происходит от больных
людей или бактерионосителей в основном воздушно-капельным пу-
тем. После инфицирования человека бактерии поселяются чаще
всего на слизистой оболочке верхних отделов дыхательных путей
и пищеварительного тракта. При легком течении болезни наблю-
дается катаральное воспаление. Чаще под воздействием токсина
повреждается слизистая оболочка — возникает некроз поверхност-
ных ее слоев. Одновременно происходит местное паралитическое
расширение кровеносных сосудов, сопровождающееся замедлением
тока крови и резким повышением порозности сосудов. В этом случае
к экссудату примешивается большое количество грубодисперсных
белков, и воспаление становится фибринозным (рис. 9.9). Помимо
фибрина, в экссудате имеется немного лейкоцитов, макрофагов и
иногда довольно значительное число эритроцитов. При гипертокси^
ческой форме дифтерии процесс иногда принимает геморрагический
характер.
Макроскопически на фоне умеренной гиперемии определяется
беловатая или желтоватая пленка толщиной около 1 мм, большей
частью плотно соединенная с подлежащими тканями. При этой
392
Рис. 9.9. Фибринозная пленка на внутренней поверхности гортани при
дифтерии. Окраска гематоксилином и эозином, к 5.
форме дифтерии наиболее выражены токсические изменения. При
выздоровлении происходит либо расплавление пленки под действием
протеолитических ферментов, либо её отторжение в результате де-
маркационного воспаления с образованием изъязвления.
Параллельно с дифтерией зева или самостоятельно может раз-
виться поражение гортани, трахеи и бронхов. Пленка в этом случае
легко отделяется от стенки дыхательных путей.
Помимо рассмотренной наиболее частой локализации местного
воспалительного процесса, возможно его развитие в носу, глазах,
Ушах, на коже (в области ран) и на слизистых оболочках половых
органов.
Лимфо- и гематогенное распространение возбудителя при диф-
терии не имеет существенного значения. Несколько большую роль
Может играть интраканаликулярная диссеминация. Таким способом
коринобактерии могут распространяться из зева в носоглотку, по
Дыхательным путям в легкие и т. д. Во всех участках возможно
возникновение воспаления принципиально такого же характера.
393
Значительно более тяжелые и распространенные изменения воз-
никают в связи с воздействием токсинов при их всасывании из
очага инфекции. К ним относятся прежде всего изменения регио-
нарных лимфатических узлов. Они значительно увеличиваются в
размерах вследствие резкого полнокровия и кровоизлияний. Обычно
возникают и участки некроза в центрах фолликулов. Нередко раз-
вивается отек слизистой оболочки и подслизистой основы зева и
глотки, а также клетчатки мышц шеи. Наряду с этим выявляются
клеточные инфильтраты и очаговый некроз мышц. При значитель-
ном токсикозе возникают многочисленные кровоизлияния. Нередко
отмечается тромбоз сосудов.
Большое значение имеет поражение нервной системы,
особенно периферической. Наиболее характерно избирательное по-
ражение нервных волокон [Вишневская О. П., 1940]. Типичен пе-
риаксональный характер дистрофических и некротических измене-
ний, заключающихся в распаде миелина. Реакция со стороны клеток
оболочек и изменения осевых цилиндров незначительны.
Существенную роль при дифтерии играет поражение с е р д е ч-
но-сосудистой системы. На ранних стадиях болезни от-
мечается парез кровеносных сосудов. В артериолах, а также в
стенках артерий может выявляться фибриноидный некроз. В мио-
карде вначале определяются альтеративные изменения в виде ли-
зиса, вакуолизации или глыбчатого распада мышечных волокон,
сочетающиеся с липидозом. На 2—3-й неделе болезни, помимо
этдго, выявляется острый интерстициальный миокардит, при котором
наблюдается очаговая инфильтрация межмышечных соединитель-
нотканных прослоек гистиоцитами и лимфоцитами с примесью плаз-
моцитов, нейтрофильных, а также эозинофильных лейкоцитов. Мак-
роскопически мышца сердца дряблая, сероватого или желтоватого
цвета. В расширенных полостях сердца, а также в крупных сосудах,
особенно в венах, нередко образуются тромбы.
Существенные изменения возникают в параганглиях и надпо-
чечниках, где отмечаются резкие расстройства кровообращения, не-
редко с кровоизлияниями, некроз части клеток коры. Возможно
развитие токсических изменений и в других органах.
Листериоз. Заражение Listeria monocytogenes — кокковидной
палочкой размерами 0,5—2 х 0,3—0,5 мкм — может произойти как
от больных людей, так и от многих домашних животных. Морфогенез
листериоза у взрослых больных малоизвестен.
Лучше изучен внутриутробный листериоз. По имеющимся до-
вольно многочисленным данным [Бродский Г. В., 1961; Klatt Е. С.,
1986], наиболее типичны мелкие очажки воспаления, в центре
которых среди в основном распадающихся лейкоцитов выявляется
большое число частью фагоцитированных листерий. В дальнейшем
число лейкоцитов увеличивается, а в наружных участках такого
очажка обнаруживается примесь фибрина. В более поздних стадиях
процесса по периферии очажка, а также в ряде случаев, вероятно,
и первично, возникают небольшие разрастания грануляционной тка-
ни, состоящей преимущественно из гистиоцитов. В дальнейшем эта
394
ткань может полностью заместить участок некроза. В грануляци-
онной ткани листерий практически нет. Нередко очажки связаны
с мелкими кровеносными сосудами, где отмечаются явления ангиита
и периангиита.
Макроскопически листериомы имеют характер мелких (милиар-
ных) желтоватых или сероватых очажков, иногда сливающихся
между собой. Довольно часто эти очажки имеют красную каемку.
Листериомы легче всего мотут быть выявлены в печени. В этом
случае процесс принято называть гранулематозным сепсисом.
Реже наблюдается заражение плода инфицированными около-
плодными водами. При их аспирации или проглатывании поража-
ются легкие или пищеварительный тракт: развивается воспаление
с альтеративным компонентом и очаговыми гранулематозными из-
менениями. Иногда на коже обнаруживается папулезная с красным
ободком или розеолезная сыпь.
Воспаление с принципиально сходными проявлениями описано
в последе. N. Sudan и соавт. (1982) различают микроабсцессы ворсин,
быстрое размножение листерий в амнионе без лейкоцитарной ин-
фильтрации и крупные очаги казеозного характера.
В отдельных наблюдениях листериоза у взрослых чаще всего
описывают поражение ЦНС. Так, Т. М. Преображенская (1986) на-
блюдала острый генерализованный гистиоцитарный гранулематоз,
а также деструктивный энцефалит в паравентрикулярных зонах
головного мозга и в мозжечке.
9.1.2.4.3. Заболевания, вызываемые палочками семейства
Bacillaceae
К числу важнейших для человека заболеваний, вызванных образу-
ющими эндоспоры возбудителями данного семейства, относятся кло-
стридиозы (анаэробная гангрена, столбняк, ботулизм и сибирская
язва). Палочки рода Clostridium имеют размеры 1,2—7*0,3—2,2
мкм, грамположительны (в поздних стадиях развития могут не
окрашиваться по Граму).
Анаэробная гангрена. Возбудителями, как правило, являются
клостридии нескольких видов. Бурное размножение клостридий,
значительно опережающее развитие всех остальных бактерий, про-
исходит, как правило, лишь при наличии определенных условий,
прежде всего местных, в виде выраженных нарушений кровообра-
щения и обширного размозжения ткани.
Патологическая анатомия анаэробной гангрены подробно рас-
смотрена в ряде исследований, выполненных как после первой, так
и второй мировых войн. Наиболее крупные обобщающие отечест-
венные исследования принад лежат А. В. Смольянникову (1950, 1964)
и А. Н. Чистовичу (1951). На основании их материалов процесс в
местах размножения клостридий начинается с выраженных сосуди-
Стых изменений, которые заключаются в стазе капилляров, спазме
артерий и расширении вен. Происходят гемолиз эритроцитов и
анутрисосудистое свертывание крови. Далее возникает и быстро
395
прогрессирует серозное или серозно-геморрагическое воспаление.
Появляющиеся вначале нейтрофильные лейкоциты быстро распада-
ются. Лишь при затихании процесса, например при успешном ан-
тибактериальном лечении, лейкоциты накапливаются в значитель-
ном количестве.
Вскоре развиваются некротические изменения, захватывающие
вначале межуточную ткань, а затем и паренхиму органа. В резуль-
тате ферментативного расщепления некротизированных тканей воз-
можно газообразование, при значительной выраженности которого
заболевание приобретает название «газовая гангрена». Соотношения
степени выраженности альтерации, отека и газообразования могут
существенно различаться. На основании экспериментальных иссле-
дований высказывалось мнение, что это определяется видом клост-
ридий. Так, для Clostridium perfringens особенно характерно газо-
образование, для Clostridium oedamatiens — отек и Clostridium
histoliticum — расплавление мышц. Однако на секционном матери-
але такую закономерность проследить не удается.
Макроскопически вид раны, осложненной анаэробной гангреной,
характерен. Края ее отечны, синюшны, наблюдаются студневидный
отек клетчатки, выбухание ее и бледных, частью распадающихся
мышц из раны. При наличии пузырьков газа выявляется крепитация.
Отмечают также желтушность кожи.
Клостридии могут распространяться лимфо- и гематогенно. Од-
нако большинство исследователей считают это нетипичным, по-
лагая, что диссеминация происходит в основном в агональном
периоде.
Большинство описанных случаев клостридиоза связано с ране-
ниями, однако возможно развитие его и при других обстоятельствах.
Клостридии могут явиться причиной некротического колита у но-
ворожденных [Fanaroff A. A. et al., 1979]. Клостридиозы могут быть
осложнениями оперативных вмешательств и механических травм
на фоне малокровия мягких тканей и в условиях вторичного им-
мунодефицита [Агеев А. К. и др., 1984].
Оценивая этиологию анаэробной гангрены, необходимо помнить
о том, что анаэробные инфекции могут быть вызваны не только
клостридиями, но и рядом других микроорганизмов [Балябин А. А.
и др., 1983; Bakker D., 1985; Kozianka J. et al., 1987].
Столбняк. Инфицирование Clostridium tetani происходит в ре-
зультате попадания спор в поврежденные участки кожи или сли-
зистых оболочек. Клостридии размножаются в области входных
ворот, однако развивающийся здесь инфекционный процесс детально
не описан.
У умерших‘от столбняка описаны [АвцынА. П., 1951; Надда-
чина Т. А., 1964] прежде всего структурные изменения мышц, яв-
ляющиеся последствием судорог, и связанных с этим расстройств
кровообращения. Они максимально выражены вблизи сухожилий и
в участках перегибов мышц через кости. На начальных стадиях
отмечаются базофилия мышечных подокон, распад их на фрагменты,
пикноз, а в дальнейшем пролиферация ядер. При большой степени
396
выраженности процесса происходят разрывы мышечных волокон,
сопровождающиеся кровоизлияниями.
В ЦНС развиваются очаговые альтеративные изменения разной
степени выраженности. Во внутренних органах описаны в основном
расстройства кровообращения.
Важно отметить, что при столбняке не происходит гиперплазии
селезенки, что подтверждает токсический характер процесса.
Ботулизм. Возбудитель — Clostridium botulinum — широко рас-
пространен в природе. Наибольшее значение для развития заболе-
вания имеет размножение клостридий в пищевых продуктах, осо-
бенно консервах, с накоплением токсинов.
Хотя патологическая анатомия ботулизма изучена недостаточно,
имеющиеся исследования, в частности А. П. Авцына и Л. М. Поповой
(1964), позволяют говорить о расстройствах кровообращения, прежде
всего в ЦНС, преимущественно в стволе головного мозга. Отмечается
паретическое состояние капилляров и мелких вен с альтеративными
изменениями их стенок, гемолизом эритроцитов и мелкими диапе-
дезными кровоизлияниями. Наряду с этим возникают альтеративные
изменения нервной ткани, особенно нервных узлов и волокон III
пары черепных нервов, а также стволов блуждающего и симпати-
ческого нервов. Кроме того, отмечается лимфоидная инфильтрация
мягкой мозговой оболочки, преимущественно в области выхода че-
репных нервов из мозгового ствола, а также сосудов этой же части
головного мозга. Описана также, хотя и слабо выраженная, про-
грессивная реакция микро- и олигодендроглии.. Наряду с этим име-
ются ясно выраженные инфильтрация и пролиферация в гассеровом,
коленчатом и межпозвоночном узлах и лимфогистиоцитарные ин-
фильтраты с пцимесью отдельных нейтрофильных лейкоцитов в
стволах глазодвигательных, блуждающих и в меньшей мере лицевых
нервов.
Принципиально такие же изменения, в частности кровеносной
системы, отмечаются и во внутренних органах, правда, значительно
слабее выраженные.
Сибирская язва. Заражение человека возбудителем этого ант-
ропозооноза — грубой палочкой размерами 3—5x1—1,2 мкм (Bacillus
anthracis) — происходит разными путями, чаще всего через кожу.
В области входных ворот наблюдаются бурное размножение бацилл
и возникновение очага серозно-геморрагического воспаления с вы-
раженными альтеративными изменениями. Этот процесс условно
называют карбункулом, несмотря на отсутствие гнойного воспале-
ния. На верхушке такого очага в ранних стадиях болезни выявляется
пузырек с серозно-геморрагическим содержимым, а позднее — плот-
ная черно-бурая корочка. Кожа и подкожная клетчатка вокруг
карбункула на значительном протяжении отечны, пропитаны серо-
зно-геморрагической жидкостью с примесью нейтрофильных лейко-
цитов и фибрина.
При более редком энтеральном заражении принципиально такого
же характера процесс возникает в пищеварительном тракте, пре-
имущественно в дистальных отделах тонкой или в слепой кишке.
397
Изредка возможно аэрогенное заражение пылью, содержащей
бациллы или их споры. В этом случае первичный очаг имеет характер
серозно-геморрагической пневмонии с участками некроза.
Независимо от локализации первичного очага часто происходит
лимфо-, а затем и гематогенная диссеминация возбудителя с бурным
размножением его почти повсеместно. Возникает сибиреязвенный
сепсис, при котором наблюдаются изменения многих органов. Преж-
де всего поражается селезенка: она увеличена, дряблая, темно-крас-
ного цвета. Нередко развивается менингит или менингоэнцефалит
с геморрагическим экссудатом.
9.1.2.4.4. Заболевания, вызываемые палочками других
семейств
Актиномикоз. Возбудителями являются бактерии семейства Actino-
mycetaceae, широко распространенные в природе. В тканях актино-
мицеты обычно состоят из тесно переплетенных нитей толщиной
0,4—0,7 мкм с боковыми ответвлениями. По периферии нити кол-
бовидно вздуты. Такие скопления бактерий называются друзами.
Внедрение возбудителя происходит обычно в местах с поврежденной
слизистой оболочкой.
Уже в первые часы возникает лейкоцитарная реакция, происходит
фагоцитоз бактерий. Однако значительная часть лейкоцитов поги-
бает, подвергается деструкции и та ткань, в которой развивается
процесс. В результате этого формируются гнойники. По окружности
гнойника развивается грануляционная ткань пестрого состава с пре-
обладанием гистиоцитов. Имеются также ксантомные клетки, лей-
коциты (в том числе эозинофильные), лимфоциты, плазмоциты и
фибробласты, формирующие капсулу гнойника. Могут выявляться
и гигантские клетки.
Макроскопические изменения на ранних стадиях болезни мало-
типичны. После развития продуктивного воспаления выявляются
характерные узлы плотной светлой ткани с многочисленными не-
большими гнойниками. В содержимом последних могут быть обна-
ружены друзы, напоминающие по виду и на ощупь песчинки. Такие
очаги возникают в полости рта, других отделах пищеварительного
тракта, органах дыхания и наружных женских половых органах.
Нокардиоз. Заражение бактериями семейства Nocardiaceae, име-
ющими вид кокковидных (размером 0,8—1,5 мкм) или нитевидных
образований, чаще всего происходит воздушно-капельным путем;
инфицирования от больных людей, по-видимому, не происходит.
Возникают лейкоцитарная реакция, затем некротические изме-
нения, и формируются абсцессы разных размеров. В последующем
образуется богатая лимфоцитами, плазмоцитами и ксантомными
клетками грануляционная ткань. Наличие гигантских клеток мало-
характерно.
Процесс чаще всего развивается в легких, наблюдается и эндо-
бронхиальное поражение [HenkleJ. О., Vijaychandran N. S., 1986].
Возможна лимфогенная и гематогенная диссеминация бактерий, в
398
том числе в печень [Piens М. A. et al., 1985 ] и головной мозг.
Нередко образуются свищи, при поражении шейных лимфатических
узлов они сообщаются с внешней средой.
9.1.2.5. Заболевания, вызываемые микроорганизмами семейства
Rickettsiaceae
Риккетсии представляют собой грамотрицательные плеоформные
(палочковидные или кокковидные) микроорганизмы размерами 0,8—
2,0 * 0,3—0,6 мкм. Они паразитируют в организме человека и жи-
вотных, в том числе членистоногих. К числу заболеваний, вызы-
ваемых риккетсиями, относится ряд лихорадок, прежде всего сыпной
тиф.
.Сыпной тиф. Возбудитель — Rickettsia prowazekii — проникает
в организм человека при раздавливании на коже инфицированной
вши или при втирании ее фекалий при расчесывании мест укуса.
Патологической анатомии сыпного тифа посвящено большое чис-
ло исследований, выполненных в прошлые годы. - Особенно полные
данные были получены И. В. Давыдовским (1921, 1922) и А. П. Ав-
цыным (1942, 1952, 1964). Наиболее характерные - изменения вы-
являются со стороны мелких артерий и капилляров. Наряду с ги-
перемией возникает тромбоваскулит с набуханием и последующей
десквамацией эндотелия, а также образованием тромбоза. Отмеча-
ется нарушение проницаемости, а в дальнейшем — деструктивные
изменения в стенках сосудов. Происходят пролиферация клеток
адвентиции и формирование периваскулярных инфильтратов. Такие
очаговые изменения обозначаются термином «сыпнотифозная гра-
нулема». Наиболее важное диагностическое значение имеет обра-
зование гранулем в продолговатом мозге, в частности в области
нижних олив.
Аналогичные изменения могут возникать во многих органах,
наибольшее значение имеют поражения миокарда, почек и яичек.
В этих органах наряду с васкулитами выявляются очаговые лим-
фогистиоцитарно-плазмоцитарные инфильтраты, иногда с неболь-
шой примесью нейтрофильных гранулоцитов. Принципиально сход-
ные изменения выявляются в селезенке. В более поздних стадиях
болезни возможно развитие секторальных или циркулярных де-
структивных изменений в относительно крупных кровеносных со-
судах, которые сопровождаются плазморрагиями и иногда кровоиз-
лияниями.
Макроскопически обнаруживается экзантема — вначале розеолы,
а позднее петехии. Существенное диагностическое значение имеет
наличие мелкоточечной конъюнктивальной сыпи, выраженной в
наибольшей степени на переходных складках [Авцын А. П., 1942].
Кроме того, макроскопически могут быть обнаружены конвекси-
тальный серозный менингит, полнокровие головногр мозга и внут-
ренних органов, гиперплазия селезенки. Характерно также увели-
чение почек, нередко с типичной полосчатостью коркового вещества.
Прочие риккетсиозы. Помимо сыпного тифа, существует ряд
399
других риккетсиозов. Среди них наибольшее значение имеют не-
сколько в основном эндемических заболеваний.
Пятнистая лихорадка Скалистых гор. Возбудителем болезни
являются Rickettsia rickettsii и sibirica и другие, переносчиком —
иксодовые клещи. Ее проявления, достаточно полно описанные
S. В. Wolbach (1918, 1922), R. D. Lilli и соавт. (1941), сходны с
рассмотренными при сыпном тифе. Однако они отличаются большей
тяжестью поражения сосудов, причем не только мелких, но и более
крупных. Последнее может привести к грубым нарушениям крово-
обращения и некрозам, в том числе в головном мозге.
Марсельская лихорадка. Возбудителем болезни является Ricket-
tsia conori, переносчиком — иксодовые клещи. Морфологически
наиболее характерно образование в месте укуса клеща первичного
очага в виде возвышающегося над поверхностью кожи струпа темного
цвета. Процесс сопровождается регионарным лимфаденитом и поли-
морфной сыпью, более крупной, чем при сыпном тифе.
Лихорадку Цуцугамуши вызывают Rickettsia tsutsugamushi, пере-
даваемые личинками краснотелковых клещей. Заболевание по своим
структурным проявлениям сходно с сыпным тифом [Allen А. С.,
Spitz S., 1945]. Описаны выраженный первичный очаг, а также
очаговые некрозы в лимфатических узлах. Степень альтеративных
изменений сосудов и их тромбоза меньшая, реже встречаются и
гранулемы в головном мозге.
Окопная лихорадка. Возбудителем является Rochalimaea quintans,
переносится вшами. Патологическая анатомия практически не изу-
чена. Первичный очаг и регионарный лимфаденит отсутствуют.
Сыпь, имеющая вид единичных розеол, непостоянна.
Ку-лихорадка — природно-очаговое заболевание, вызывается
Coxiella burned, передается воздушно-капельным, алиментарным
или контактным путями. Наиболее важное проявление этого забо-
левания — рассеянная мелкоочаговая пневмония с «моноцитарным»
клеточным составом и широкой перифокальной зоной отека
[Meldolesi G., 1950]. Заболевание может сопровождаться генерали-
зацией. Описана возможность поражения разных отделов нервной
системы.
9.1.3. Особенности воспаления при инфекциях,
вызываемых другими микроорганизмами
9.1.3.1. Заболевания, вызываемые микроорганизмами семейства
Mycoplasmatoceae
Микоплазмы — полиморфные грамотрицательные хорошо окраши-
вающиеся при ШИК-реакции микроорганизмы диаметром 2—200 нм
и более, ограниченные трехслойной мембраной. Для человека на-
ибольшее значение имеют Mycoplasma pneumoniae, М. hominis и
Ureaplasma urealiticum. Заражение происходит от больных людей
различными путями. Одним из наиболее важных является воздуШ'
но-капельный с последующим развитием респираторного микоплаз-
моза, что наиболее типично для М. pneumoniae. Половым путем
передаются преимущественно М. hominis и U. urealiticum, что со-
провождается развитием микоплазмоза мочеполовых органов. Воз-
можно трансплацентарное инфицирование.
Структурные проявления при заболеваниях, вызванных разными
микоплазмами, существенно не отличаются друг от друга. Это об-
стоятельство удалось выяснить не только при сопоставлении разных
заболеваний человека, но и при разносторонних экспериментальных
исследованиях с использованием для заражения многих видов ми-
коплазм [Козлюк А. С., 1982].
Респираторный микоплазмоз. На основании исследований
А. В. Цинзерлинга (1972), Б. С. Гусман и соавт. (1975), М. С. Бай-
жомартова и соавт. (1988) можно считать, что для респираторного
микоплазмоза наиболее типичен своеобразный вид альвеолярного
эпителия во многих участках легких (рис. 9.10, а, б). Б цитоплазме
клеток, а иногда и в их ядрах обнаруживается агент в виде то
отдельных, то многочисленных мелких телец. Особенно характерным
является то, что эти тельца обычно окружены четко очерченными
просветлениями цитоплазмы. Такие клетки значительно увеличены
в размерах. На более ранних стадиях процесса они сохраняют связь
со стенкой альвеол, позднее же слущиваются. Принципиально ана-
логичным, хотя и слабее выраженным изменениям подвергается и
часть клеток мерцательного эпителия. При тяжелом течении болезни
в просветах альвеол, а также бронхов обнаруживаются серозная
жидкость, единичные или многочисленные эритроциты, макрофаги,
а иногда и небольшое количество зернистых лейкоцитов. У детей
раннего возраста имеются также гиалиновые мембраны. Межальве-
олярные перегородки полнокровны. Нередко определяется умеренно
выраженный дистелектаз.
В небольших участках легких может быть обнаружено утол-
щение межальвеолярных перегородок с появлением здесь ограни-
ченных, преимущественно периваскулярных, скоплений клеток, в
том числе плазмоцитов. Кровеносные сосуды легких полнокровны,
стенки их нередко отечны. Часто отмечается также набухание
эндотелия.
Макроскопически в дыхательных путях отмечается незначитель-
ное полнокровие слизистой оболочки. В просвете трахеи и чаще
бронхов имеется немного вязкой слизи сероватого, иногда розового
или красного цвета. Легкие, преимущественно в задних отделах,
умеренно уплотнены, темно-красного цвета.
У большинства умерших детей обнаруживаются изменения мно-
гих внутренних органов (рис. 9.10, в). Они имеют принципиально
тот же характер, что и при внутриутробном микоплазмозе, при
котором их обнаружение еще более закономерно.
Внутриутробный микоплазмоз. Как и при респираторном ми-
коплазмозе, наиболее характерной чертой является размножение
микоплазм в клетках эпителия, претерпевающих в этом случае
изменения, аналогичные описанным выше [Цинзерлинг А. В., Ву-
401
Рис. 9.10. Изменения внутренних органов при микоплазмозе.
а — десквамативная пневмония с гиалиновыми мембранами. Окраска гематоксилином и эозином.
*135; б — в мазке-соскобе видны увеличенные в размерах альвеолоциты с вакуолизированной
цитоплазмой, содержащей микоплазмы. Окраска основным фуксином и метиленовым синим.
*1350; в — вакуолизация иефроцитов, в части из них и в просвете канальца видны микоплазмы.
ШИК-реакиия. *1350.
402
ду Г. А., 1986]. Наибольшие отличия заключаются в характере
внелегочных изменений.
В цитоплазме некоторых гепатоцитов и звездчатых ретикулоэн-
дотелиоцитов удается выявить микоплазмы. Пораженные клетки
подвергаются дистрофическим изменениям. В гепатоцитах законо-
мерно обнаруживаются вакуоли, не содержащие ни жира, ни гли-
когена. Наряду с этим определяются дискомплексация печеночных
балок, застойное полнокровие и расширение вокругсинусоидных
пространств. Закономерно расширение желчных капилляров с на-
коплением в них желчи.
В почках выявляются своеобразные изменения эпителия преиму-
щественно дистальных отделов нефрона, где прежде всего наблю-
дается размножение микоплазм. Возникает постепенно нарастающая
вакуольная дистрофия нефротелия. В дальнейшем развиваются и
некротические изменения. В просветах канальцев нак пливаются
белковые массы, появляются отдельные нейтрофильные лейкоциты
и иногда многочисленные эритроциты, встречаются гиалиновые и
зернистые цилиндры. При продолжительном течении болезни вы-
является регенерация эпителия канальцев. Почечные тельца нередко
увеличены в размерах, их петли набухшие, неравномерно полно-
кровные. Мезангиальный остов расширен за счет накопления в нем
ШИК-позитивного материала и очаговой пролиферации клеток.
В капсулах почечных телец накапливаются белковая жидкость, от-
дельные десквамированные клетки эпителия капсулы и иногда еди-
ничные эритроциты.
Отчетливых макроскопических изменений печени и почек не
определяется.
В головном мозге отмечаются полнокровие мягкой мозговой обо-
лочки, увеличение в ней числа клеток макрофагального ряда. В ва-
куолизированной цитоплазме многих из них содержатся микоплаз-
мы. Часть нейронов коры, а также узлов основания бледно ок-
рашиваются и подвергаются характерному для микоплазмоза
метаморфозу. Однако глиальной реакции нет. Эпендимоциты не-
редко неправильно ориентированы, в цитоплазме некоторых из них
находят возбудители.
Макроскопически выявляются отечность и полнокровие мягкой
мозговой оболочки, дрябловатость вещества головного мозга, не-
большие кровоизлияния.
Изменения кишечника, по данным Г. В. Шастиной (1986, 1988),
заключаются прежде всего в поражении эпителия, сходном с опи-
санным в легких. Те же изменения могут претерпевать эндотели-
оциты и ганглиозные клетки интрамуральных узлов вегетативной
нервной системы.
Принципиально аналогичный метаформоз может быть выявлен
и в других органах и тканях, в том числе сердечно-сосудистой
системы (Варясин В. В., Шастина Г. В., 1983]. Этими авторами опи-
саны характерные для микоплазмоза изменения с наличием мико-
плазм в кардиомиоцитах и эндотелии эндокарда. Наряду с этим
Имеются и неспецифические процессы в виде нарушения микроцир-
403
куляции и альтсративных изменений кардиомиоцитов. При дли-
тельном течении болезни или в случае ее сочетания с другими
инфекционными заболеваниями наблюдается дезорганизация соеди-
нительной ткани эндокарда и миокарда в виде мукоидного и фиб-
риноидного набухания, возникают периваскулярные лимфогистио-
цитарные инфильтраты и продуктивный васкулит.
При исследовании лимфоидной системы у детей Е. Д. Поповой
(1985) выявлена гиперплазия ретикулоэпителия тимуса, ретикуляр-
ных клеток селезенки и лимфатических узлов, эндотелия их синусов,
а также кровеносных сосудов тех же органов. В пораженных клетках
содержатся микоплазмы. Эндотелий синусов лимфатических узлов
частично десквамирован. Наряду с этим имеются и неспецифические
изменения, заключающиеся прежде всего в акцидентальной инво-
люции разной степени выраженности.
Рассматривая внутриутробный микоплазмоз, нельзя не остано-
виться на проявлениях микоплазменного плацентита. Эти измене-
ния, описанные особенно подробно В. Ф. Мельниковой и соавт.
(1984), заключаются прежде всего в своеобразной трансформации
клеток органа, аналогичной описанной выше. В базальной пластинке
видны оптически пустые децидуальные клетки, иногда участки не-
кроза и очаговая лимфоцитарно-нейтрофильная инфильтрация. Эн-
дотелий сосудов набухает и слущивается, что сочетается с сужением
и даже облитерацией просвета сосудов. В ворсинчатом хорионе
такого рода трансформация клеток происходит в трофобласте. Син-
цитиотрофобласт становится пышным, ядра в нем частично распо-
лагаются в несколько рядов. Цитоплазма цитотрофобласта имеет
пенистый вид. В строме ворсин появляются клетки со светлой ва-
куолизированной цитоплазмой. Здесь же имеется нерезко выражен-
ная инфильтрация лимфоцитами с примесью плазмоцитов и нейт-
рофилов. В амнионе выявляется очаговая пролиферация амниоцитов
с вакуолизацией их цитоплазмы. В экстраплацентарных оболочках
и интервиллезном пространстве обнаруживаются очаговые скопления
лимфоцитов, плазмоцитов и нейтрофилов.
Урогенитальный микоплазмоз. Патологическая анатомия его,
несмотря на большую распространенность заболевания, изучена ма-
ло. Имеющиеся немногочисленные наблюдения позволяют думать
о процессе, похожем по структурным проявлениям на описанный в
других органах.
9.1.3.2. Заболевания, вызываемые микроорганизмами семейства
Chlamydiaceae
Хламидии — своеобразные грамотрицательные хорошо окрашиваю-
щиеся при ШИК-реакции микроорганизмы, обладающие клеточной
оболочкой. Различают более мелкие элементарные (инфекционные)
тельца (частицы) диаметром около 300 нм и более крупные ини-
циальные (ретикулярные), или Гальберштедтера—Провачека, диа-
метром до 1200 нм.
Возбудителями этого семейства может быть вызван ряд заболе-
404
ваний человека, животных и растений. Инфицирование человека
хламидиями происходит различными путями: половым (при уроге-
нитальных заболеваниях), воздушно-капельным (при респираторной
инфекции — орнитозе) и контактным или через мух (при трахоме).
Урогенитальный хламидиоз. Его патологическая анатомия мало
известна, имеются лишь отдельные работы, посвященные исследо-
ванию эпителия шейки матки [Borges de R. Y. et al., 1984; Shiina Y.,
1985]. Клетки плоского эпителия с хламидиями располагаются груп-
пами по 4—6, хроматин в них распределен причудливо, грубые его
нагромождения чередуются с просветлениями, цитоплазма клетки
слегка вакуолизирована. В части наблюдений хламидии выявляются
в виде внутриклеточных элементарных телец. Позднее они стано-
вятся более крупными и менее плотными и располагаются внутри
крупной вакуоли вблизи ядра.
Особая форма урогенитального хламидиоза — венерическая лим-
фогранулема [Alegrant С. D., 1956; Alacoque В. et al., 1984]. Ее
возбудителем являются хламидии, как правило, сероваров LI, L2,
L3 Chl. trachomatis. Первичный очаг в этом случае представляет
собой небольшую папулу (пузырек или язвочку), локализующуюся
в уретре, а у женщин — в различных участках наружных половых
органов. Через несколько месяцев развивается поражение, чаще
одностороннее, лимфатических узлов, располагающихся над или под
паховой складкой. Оно наблюдается чаще у мужчин. Иногда у
женщин в области влагалища и промежности образуются множест-
венные кандиломы с хроническим течением [Alacoque В. et al.,
1984]. У гомосексуалистов возникает проктит с последующими руб-
| цовыми. изменениями.
Внутриутробный хламидиоз. Заражение плода (ребенка) может
произойти как анте-, так и интранатально. Более распространена
вторая точка зрения [ОриелДж. Д., Риджуей Дж. Л„ 1984]. По
данным А. В. Цинзерлинга (1989)..структурные изменения при внут-
| риутробном хламидиозе напоминают поражения при микоплазмозе.
Размеры пораженных клеток, преимущественно альвеолоцитов, не-
I сколько меньшие. Изменения цитоплазмы клеток выражены также
слабее. Наличие сходных клеток при внутриутробной пневмонии
той же этиологии описано А. М. Савичевой и соавт. (1983).
Внутриутробный хламидиоз теоретически должен сочетаться с
плацентитами той же этиологии. Однако о возможности поражения
хламидиями плаценты человека с выявлением в ней при ИФ-исс-
I ледовании агента имеются лишь краткие упоминания [Naprstkova J.,
1987].
Респираторный хламидиоз (орнитоз, пситтакоз). Обобщая ранее
выполненные работы, И. И. Терских (1979) пишет, что в легких
возникают очаги, отграниченные от нормальных тканей органа,
иногда отмечается и долевое поражение. Альвеолы содержат серо-
зный и фибринозный экссудат с примесью моноцитов, макрофагов
и слущенных альвеолоцитов. В альвеолоцитах и клетках синусов
бронхиальных лимфатических узлов, а такж^ в экссудате видны
скопления элементарных частиц.
405
Имеются исследования, в котооых описывается диссеминация
возбудителя. Этот процесс может сопровождаться клинико-морфо-
логическими проявлениями [Walton К. W., 1954; Yow Е. N. et al.,
1959; Myhre Е. В., Mordh Р. А., 1981J. В печени основное значение
имеет гиперплазия, а также десквамация звездчатых ретикулоэн-
дотелиоцитов. В их пенистой цитоплазме нередко выявляется воз-
будитель в виде мелких телец. Обнаруживаются также альтератив-
ные изменения в части гепатоцитов и лимфоидные инфильтраты в
перипортальных прослойках. В почках отмечается расширение ка-
нальцев, содержащих богатую белками жидкость с примесью эрит-
роцитов. В головном мозге чаще всего описывают мононуклеарную
инфильтрацию мягкой мозговой оболочки с наличием в менинго-
цитах возбудителя. При хламидиозе возможно также развитие по-
ражения сердца в виде миокардита с лимфоидными инфильтратами
в межуточной ткани, а иногда и альтеративными изменениями
кардиомиоцитов.
Возможность поражения разных органов при диссеминации хла-
мидий подтверждается в эксперименте.
Хламидиоз глаз. Принято выделять две формы этого заболевания:
трахому, вызываемую сероварами А—С Chlamidia trachomatis, и
паратрахому, возбудителями которой являются серовары Д—К («ге-
нитальные штаммы»).
При микроскопическом исследовании выявляются прежде всего
типичные изменения клеток эпителия. Изменения эти, приводимые
в фонографиях, например А. А. Шаткина (1985), принципиально
аналогичны выявляемым при исследовании внутренних органов
[Цинзерлинг А. В., 1989]. Наряду с этцм отмечается кратковремен-
ная нейтрофильно-гистиоцитарная реакция [Хорошилова-Масло-
ва И. П., 1975; Завьялова Н. Н., 1975]. При хроническом, но еще
не завершенном процессе в торзоконъюнктивальной ткани под эпи-
телиальным слоем описывают довольно густые инфильтраты, состо-
ящие из лимфоцитов, плазмоцитов, гистиоцитов и фибробластов.
Здесь же происходят разрастания эпителия, иногда с образованием
в этих участках кист со слизистым содержимым. Наблюдается ин-
фильтративная или узелковая лимфобластическая реакция. Далее
отмечается рубцевание, которое может закончиться грубой дефор-
мацией век.
Макроскопически вначале возникает острый или подострый конъ-
юнктивит с диффузной гиперемией, отеком и инфильтрацией конъ-
юнктивы. Затем образуются лимфоидные фолликулы на верхней и
нижней складках конъюнктивы, максимально выраженные в области
верхнего века. Позднее наблюдается папиллярная гиперплазия эпи-
телия конъюнктивы и возникает «пятнистый» кератит с образованием
в роговице кровеносных сосудов.
Паратрахома протекает легче трахомы [Хорошилова-Масло-
ва И. П., 1975]. Возникает слизисто-гнойный конъюнктивит, поз-
днее образуются множественные лимфоидные фолликулы, распола-
гающиеся преимущественно на нижнем веке. Нередко выявляется
лимфаденит с поражением околоушных лимфатических узлов, а
иногда и признаки инфекционного процесса в верхних дыхательных
путях.
Фелиноз (болезнь «кошачьих царапин»). Его возбудитель, как
принято считать, является хламидией [Терских И. И., 1979]. Однако
имеются работы, в которых высказывается мнение, что возбудителем
фелиноза служат другие полиморфные бактерии [Gerber М. A. et
al., 1985; Hadfield Т. L. et al., 1985; Korbi S. et al., 1986].
У части больных в области входных ворот образуется первичный
очаг, представляющий собой папулу (пустулу, язвочку). Основные
изменения возникают в регионарных лимфатических узлах, где
происходит наиболее интенсивное размножение возбудителя. При
гистологическом исследовании характерно обнаружение узелков, со-
стоящих из ретикулярных клеток, в центре которых имеются скоп-
ления нейтрофильных лейкоцитов. Возможно появление многоядер-
ных гигантских клеток, напоминающих клетки Штернберга. Иногда
происходит генерализация инфекции с развитием гранулематозных
изменений в легких, головном мозге, брыжейке, печени, костях и
гениталиях.
9.1.3.3. Заболевания, вызываемые грибами
Известны сотни грибов, которые могут вызвать заболевание человека
[Muller Е., Loffler W., 1982]. Роль их особенно возрастает на фоне
иммунодефицита, в частности при ВИЧ-инфекции. Иногда заболе-
вание вызывают несколько грибов одновременно, и только сероло-
гическое исследование позволяет выделить ведущий процесс [Vincent
М. et al., 1984; LiptonS. et al., 1984]. Заражение всеми ими экзо-
генное и происходит различными путями. Заболевание развивается
сразу лишь при очень массивном инфицировании. Значительно чаще
микоз вызывают грибы, которые подчас весьма значительное время
являлись сапрофитами и существовали на коже или слизистых
оболочках, не вызывая сколько-нибудь выраженного патологического
процесса. Микоз в этом случае развивается лишь после ослабления
макроорганизма интеркуррентным заболеванием или другими при-
чинами.
В зависимости от локализации наиболее частых поражений ми-
козы принято разделять на две основные группы: 1) дерматомикозы
с поражением только кожи и ее дериватов и 2) глубокие (висце-
ральные, системные) микозы, при которых патологический процесс
развивается преимущественно во внутренних органах.
Весьма важным для диагностики микозов является обнаружение на
относительно поздних стадиях болезни характерных для большинства
микозов гранулем [Хмельницкий О. К., 1973; Salfelder К., 1986].
Классификация грибов, имеющих значение в патологии человека,
неустоявшаяся. В настоящее время у ряда несовершенных грибов
(класс Deuteromycetes) выявлены половые формы, на основании
него последние под другим названием рассматриваются в классе
Ascomycetes. В связи с этим иногда оба эти- класса объединяют,
“асть патогенных для человека грибов не классифицируется.
407
Заболевания, вызываемые грибами класса Deuteromycetes. Воз-
будители этих микозов имеют в тканях округлую или овальную
форму, обычно отмечается почкование, с помощью которого грибы
размножаются. Мицелием они не обладают, правда, у грибов рода
Candida образуется псевдомицелий. Молодые формы грибов интен-
сивно окрашиваются анилиновым фиолетовым, зрелые или отмира-
ющие грибы становятся грамотрицательными, причем вначале толь-
ко частично. Оболочка (капсула) дольше остается грамположитель-
ной. Все грибы хорошо окрашиваются с помощью ШИК-реакции,
наиболее интенсивно воспринимают краситель молодые клетки и
оболочки. Общим для всех микозов данной группы является реакция
микроорганизма: вначале выявляется альтеративное или экссуда-
тивное воспаление, которое в дальнейшем сменяется продуктивным
с образованием многоядерных гигантских клеток.
Среди этих микозов наибольшее значение имеет кандидоз.
Кандидоз. Попавшие в организм человека грибы рода Candida
(диаметр их клеток 2—5 мкм) могут длительное время сапрофити-
ровать, что чаще всего наблюдается на слизистых оболочках, вы-
стланных многослойным плоским эпителием, в поверхностных слоях
которого грибы и размножаются. Частота развития грибов именно
в этих участках объясняется гликогенофилией гриба [Хмельницкий
О. К., 1973; Быков В. Л., 1986 J.
При прогрессировании кандидоза слизистой оболочки полости
рта грибы, разрушая ее поверхностные слои, постепенно прорастают
до4 подслизистой основы и даже глубже. Воспалительная реакция
вначале слабо выражена или вовсе отсутствует. Лишь при глубоком
проникновении грибов определяется умеренная лейкоцитарная, а
также лимфомакрофагальная реакция.
Макроскопически поражение имеет вид беловатых или буроватых
наложений толщиной 1—2 мм, большей частью легко снимающихся
с поверхности слизистой оболочки.
В результате гематогенного или интраканаликулярного распро-
странения грибы попадают в другие органы, в первую очередь в
расположенные дистальнее участки пищеварительного тракта и лег-
кие. Процесс в пищеводе, желудке и кишке протекает принципи-
ально аналогично описанному выше. Однако чаще, особенно в тол-
стой кишке, возможно образование язвенных дефектов. Здесь, в
подлежащих тканях, выявляются более выраженные, чем в полости
рта и пищеводе, лимфолейкоцитарные инфильтраты.
В. легких грибы размножаются в просвете бронхов и альвеол, в
редких случаях может происходить прорастание стенки бронха.
В местах локализации грибов накапливаются лейкоциты, а также
серозная жидкость и макрофаги. Через несколько недель в случае
прогрессирования болезни в легких начинают развиваться очаговые
разрастания грануляционной ткани, богатой эпителиоидными, лим-
фоидными и гигантскими многоядерными клетками. В их цитоплазме
при ШИК-реакции могут выявляться остатки гриба в виде участков
красного цвета со стертыми контурами.
Макроскопически в острой стадии болезни выявляются катараль-
408
ный бронхит и пневмония с небольшими безвоздушными очагами
сероватого или красновато-серого цвета. В поздних стадиях видны
небольшие участки сероватой плотной грануляционной ткани.
Возможно также развитие первичного кандидоза органов выде-
ления. В этом случае вначале возникает уретрит, позднее цистит
и даже пиелонефрит.
При гематогенной диссеминации кандид развиваются очаговые
поражения в одном или нескольких органах (почки, головной мозг,
костный мозг и др.). В метастатических очагах на ранних стадиях
развития видны лишь скопления размножающихся грибов, практи-
чески без какой-либо реакции. Такие очаги чаще всего выявляются
у детей, умерших в раннем неонатальном периоде, причем нередко
без сколько-нибудь отчетливого первичного очага [Хмельниц-
кий О. К., Белянин В. Л., 1981 ]. Позднее в метастатических очагах
вокруг кандид обнаруживаются небольшие скопления лейкоцитов,
нередко распадающихся. В дальнейшем появляются лимфоциты и
макрофаги, возможно также формирование грануляционной ткани,
строение которой описано выше.
Описаны случаи внутриутробного кандидоза с развитием на 16-й
и 19-й неделе гестационного возраста в легких зародыша грануле-
матозного процесса [Hood I. С. et al., 1985].
При экспериментальном воспроизведении кандидоза процесс
принципиально аналогичен возникающему при спонтанном канди-
дозе у человека [Цинзерлинг А. В., 1964 ], хотя и имеются некоторые
количественные отличия в зависимости от вида животного [Белянин
В. Л., Каримов А. Л., 1987]. Важным является то, что возникающий
при этом процесс качественно идентичен при введении живых па-
тогенных культур кандид разных видов и тех же убитых культур
[Цинзерлинг А. В., 1964]. Эпителиоидную реакцию удалось полу-
чить и в ответ на введение в ткани животного полисахаридов и
липидов кандида. Принципиально весьма существенна также явная
зависимость степени выраженности воспалительной реакции от осо-
бенностей иммунного состояния животного. В частности, удалось
показать, что у иммунизированных кроликов воспалительный про-
цесс при кандидозе развивается вначале более интенсивно, однако
быстрее отграничивается. Далее было выявлено, что в результате
появления антител на 3—4-е сутки наступает обострение воспали-
тельного процесса вокруг уже инкапсулированного участка воспа-
ления в области расположения введенных в начале опыта убитых
клеток кандида. В опытах in vitro удалось показать, что при внесении
кандид во взвесь нейтрофильных лейкоцитов человека происходит
их незавершенный фагоцитоз. В других опытах было доказано тор-
мозящее влияние на размножение грибов распада лейкоцитэв.
Глубокие микозы. Среди глубоких микозов различают также
геотрихоз, криптококкоз, бластомикоз и гистоплазмоз.
Геотрихоз. Возбудителем является Geotrichum (размер его 5—10х
*2—5 мкм). Для этого микоза характерно гнойное воспаление с
последующим развитием грануляционной ткани, сходной с описан-
ной при кандидозе. Возможны разные формы геотрихоза, в том
409
числе с поражением кожи, верхних отделов пищеварительного трак-
та, а также дыхательных путей и легких. Возможна генерализация
инфекции.
Криптококкоз вызывается Cryptococcus neoformans (поперечник
его 5—12 мкм и более; зрелые формы обладают желатинозной кап-
сулой толщиной до 3,5 мкм). По описанию О. К. Хмельницкого
(1973), острые формы заболевания в виде серозно-фибринозного
или гнойного воспаления обнаруживаются редко. Несколько чаще
в тканях выявляются большие скопления криптококков с минималь-
ной ответной реакцией в виде незначительных, преимущественно
гистиоцитарных, инфильтратов. Макроскопически такие очаги име-
ют достаточно характерный вид, поскольку обладают желатинозной
(студневидной) консистенцией. Позднее по окружности очага воз-
можно развитие гранулематозного процесса с отчетливой эпители-
оидно-клеточной реакцией и примесью гигантских многоядерных
клеток.
Бластомикоз Гилькриста (североамериканский бластомикоз)
вызывается Zymonema (Blastomyces) dennatitoidis (поперечник его
8—10 мкм), обладает двухконтурной оболочкой, содержащей хитин.
В местах локализации грибов происходит накопление ПЯЛ, нередко
вскоре распадающихся, и лимфоцитов. Эти изменения сочетаются
с хроническим воспалением с гигантоклеточной реакцией. При вис-
церальной форме процесс чаще всего возникает в легких, которые
макроскопически могут напоминать рак или туберкулез.
Гистоплазмоз. Его возбудителем является Histoplasma сар-
sufalum, имеющий в ткани поперечник 1—5 мкм, отмечается его
почкование. В тех случаях, когда в ткань, например легких, попадает
большое количество гистоплазм, возникает серозная, геморрагиче-
ская или десквамативная очаговая пневмония (при неблагоприятном
течении с некрозами в центре). Наблюдается лимфогенная, а в
дальнейшем и гематогенная диссеминация гриба. При затихании
процесса происходит инкапсуляция с выраженным обызвествлением.
В хронической стадии возможно развитие каверн с трехслойной
стенкой, имеющей некротический, грануляционный и фибропласти-
ческий слои [Goodwin R. A. et al., 1976 ]. По мнению тех же авторов,
тканевый ответ возникает, скорее, не на сам возбудитель, а на
растворимый антиген. При умеренном количестве гистоплазм с са-
мого начала преобладает макрофагальная реакция, затем формиру-
ется бугорок, состоящий из эпителиоидных, а также гигантских
клеток и зоны лимфоцитов и фибробластов вокруг. В центре такого
очага нередко наблюдается коагуляционный некроз, в дальнейшем
сюда могут мигрировать лейкоциты.
Возможны и другие глубокие микозы — кокцидиомикоз, пара-
кокцидиоидомикоз, споротрихоз, хромомикоз, мадуромикоз. При
этих заболеваниях также наблюдается сходная с описанными выше
микозами динамика воспалительного процесса: вначале преобладают
некротическая и обычно умеренная лейкоцитарная реакция, а поз-
днее — более выраженное продуктивное воспаление с образованием
гранулем.
410
Заболевания, вызываемые грибами класса Ascomycetes. Излюб-
ленная локализация поражений — органы дыхания и полость рта.
Это объясняется в первую очередь тем, что основной путь инфи-
цирования — аэрогенный (с пылью). При размножении грибы вы-
зывают альтеративное, а затем серозно-гнойное воспаление. Обра-
щает на себя внимание, что лейкоциты быстро подвергаются мел-
коглыбчатому распаду. Вслед за острой фазой воспаления наступает
образование грануляционной ткани с большим числом гигантских
многоядерных клеток типа клеток инородных тел, а также клеток
с пенистой (содержащей липиды) цитоплазмой. В еще большей
степени, чем рассмотренные выше, эти грибы могут прорастать в
ткани, в том числе в кровеносные сосуды, что вызывает тромбоз и
может сопровождаться распространением возбудителей гематоген-
ным путем в другие органы. Наибольшее значение среди микозов,
вызываемых грибами класса Ascomycetes, имеет аспергиллез.
Аспергиллез. Возбудитель — Aspergillus, в тканях он имеет вид
равномерно септированных нитей (гифов) толщиной 1,5—5 мкм,
которые могут дихотомически делиться под острым углом. Струк-
турные изменения идентичны описанным выше. Возможны пораже-
ния кожи, особенно лица и наружного слухового прохода, слизистых
оболочек носа и околоносовых пазух. Наряду с этим описаны вис-
церальные формы аспергиллеза. В качестве особого варианта выде-
ляют аспергиллему — шарообразное разрастание гриба замазкооб-
разной плотности.
Заболевания, вызываемые грибами класса Phycomycetes. Воз-
будителями является ряд грибов, в том числе Мисог.
Мукороз (фикомикоз). Гифы этого гриба имеют толщину 3—
20 мкм, несептированные, могут дихотомически делиться, чаще под
тупым углом. Гриб окрашивается гематоксилином, грамотрицателен.
Заражение преимущественно аэрогенное.
В участках поражения возникают выраженное альтеративное
воспаление и серозно-лейкоцитарная реакция. Грибы часто прора-
стают кровеносные сосуды, что приводит к тромбозу и может со-
провождаться инфарктами. В поздних стадиях наблюдается разра-
стание грануляционной ткани с немногочисленными многоядерными
гигантскими клетками инородных тел. Наибольшее значение имеет
бронхолегочный мукороз, который нередко протекает как изолиро-
ванное поражение, несмотря на прорастание грибами кровеносных
сосудов. При первичных поражениях полости носа, глотки и неба
возможно чаще гематогенное распространение процесса в полость
черепа с последующим развитием поражений головного мозга и его
оболочек. Описан также мукороз пищеварительного тракта.
9.1.3.4. Заболевания, вызываемые простейшими
Ряд микроорганизмов из числа многочисленных одноклеточных жи-
вотных, относимых к простейшим (Protozoa), способен вызвать за-
болевания человека. Протозойные инфекции наиболее широко рас-
пространены на территориях с жарким климатом, все же некоторые
411
из них могут систематически (например, токсоплазмоз, пневмо-
цистоз, трихомоноз и лямблиоз) или эпизодически (например,
малярия и амебиаз) встречаться почти в любых климатических
условиях.
Сложные циклы развития простейших на практике исключают
возможность их выделения с целью диагностики болезней этой
группы. Основная роль в посмертном распознавании заболеваний,
вызываемых простейшими, принадлежит гистологическому исследо-
ванию, позволяющему при использовании адекватных методов, ос-
нованных в первую очередь на применении ШИК-реакции, доста-
точно достоверно выявлять возбудителей. Это имеет особенно важное
значение, поскольку воспалительные изменения при протозоонозах
малохарактерны. На ранних этапах их развития отмечаются уме-
ренно выраженные альтеративные изменения и незначительные на-
рушения кровообращения. Выраженная лейкоцитарная реакция от-
сутствует, она выявляется, как правило, лишь в случаях одновре-
менного развития и бактериального процесса. Более характерна
макрофагальная реакция с фагоцитозом макрофагами возбудителей.
В более поздних стадиях болезни отмечается продуктивное воспа-
ление и далее образование грануляционной ткани. При хроническом
течении болезни возможна иммуноморфологическая реакция, пре-
имущественно местная.
Следует отметить, что морфологическое исследование может быть
успешным и при прижизненной диагностике протозоонозов, напри-
мер в случае исследования биоптатов при токсоплазмозе [Argyle J.
et al., 1983; Cohen С., TrapuckdS., 1984].
Классификация простейших, патогенных для человека, не явля-
ется в полной мере устоявшейся, а часть возбудителей (пневмоци-
сты) остается вообще неклассифицированной.
Токсоплазмоз. Возбудитель — облигатный внутриклеточный па-
разит Toxoplasma gondii. Размер его эндозоита (тахизоита), имею-
щего форму полумесяца, 4—7 х 2—4 мкм, а цистозоита, располага-
ющегося в цистах, — 50—200 мкм. Окончательным хозяином яв-
ляются кошки и другие животные того же семейства. Заражение
человека происходит алиментарным или трансплацентарным путем.
Внутриутробный (врожденный) токсоплазмоз изучен наиболее
полно [Ивановская Т. Е., Сорокин А. Ф., 1974; Rose I., 1975]. В ран-
них стадиях развития процесс характеризуется генерализованными
проявлениями. В это время во всех пораженных органах в местах
нахождения токсоплазм образуются мелкие участки некроза. Здесь
же в межуточной ткани видны инфильтраты, состоящие из лимфо-
цитов, гистиоцитов, а также плазмоцитов, нейтрофильных и эози-
нофильных лейкоцитов. Чаще всего описывают поражение печени —
интерстициальный гепатит с участками некроза и выраженной пе-
рипортальной инфильтрацией, сменяющейся позднее фиброзом. На-
ряду с этим выявляется экстрамедуллярное кроветворение. Селе-
зенка гиперплазирована, возможна умеренная инфильтрация ее
эозинофильными лейкоцитами. В миокарде, органах дыхания, над-
почечниках и реже в других внутренних органах обнаруживаются
412
мелкие участки некроза и выраженная инфильтрация межуточной
ткани. Сходные очаговые изменения возникают в головном мозге
и глазах, однако в этот период болезни они не играют ведущей
роли. Типична экзантема, имеющая характер розеолезной или ма-
кулезно-папулезной сыпи.
В более поздних стадиях внутриутробного токсоплазмоза —
через несколько месяцев или лет после рождения — значительно
преобладает поражение головного мозга. В это время в веществе
мозга обнаруживаются токсоплазмозы, возникают дистрофические,
а затем первичные некротические изменения. Экссудативная ре-
акция, особенно лейкоцитарная, выражена очень слабо. Вместо
нее наблюдается макрофагальная реакция, макрофаги фагоцити-
руют возбудителей и продукты распада некротизированной ткани
головного мозга. В кровеносных сосудах отмечаются стаз, набу-
хание эндотелия, разрастание клеток адвентиции и нередко тром-
боз. В результате поражения сосудов развивается вторичный оча-
говый асептический колликвационный некроз ткани головного
мозга. Очаги некроза располагаются асимметрично, преимуще-
ственно в коре больших полушарий и в субэпендимарной зоне
боковых желудочков. Их размеры и число могут значительно
варьировать. При наибольшей тяжести процесса очаги сливаются
в сплошные желтоватые полосы, идущие вдоль извилин мозговой
коры. Сосудистые сплетения и мозговые оболочки нередко утол-
щены, белесоватого или желтоватого цвета.
В дальнейшем на месте некротизированной ткани образуются
кисты. Особенно часто они располагаются на границе между серым
и белым веществом больших полушарий. Параллельно с этим про-
исходит обызвествление, хотя, конечно, оно ие является специфич-
ным для токсоплазмоза. В этой же стадии токсоплазмоза могут
выявляться и изменения глаз (хориоретинит).
Иногда возможны поражения кожи. По описанию М. Binazzi
(1986), на туловище могут образовываться поверхностные и глубокие
периваскулярные инфильтраты, состоящие в основном из лимфоци-
тов и гистиоцитов, а также макрофагов, плазмоцитов и эозинофилов.
Кроме того, отмечаются кровоизлияния и иногда аллергические
васкулиты. Возможна также кальцификация, иногда диффузная,
поверхностных слоев кожи. Макроскопически очаги имеют характер
папулогеморрагических, папулонодулярных, инфильтративно-не-
кротических элементов.
При токсоплазмозе наблюдается также поражение плаценты.
I- Rose (1975), А. П. Самойлов (1976), S. Krusche и соавт. (1984)
описывают гибель эпителиального покрова части ворсин, которые
в этих местах оказываются покрытыми фибрином. В отдельных
Участках эпителиальный покров истончен, в других — гипертро-
фирован и гиперплазирован. В строме содержатся инфильтраты из
лимфоцитов, плазмоцитов и гистиоцитов. В амниотической оболочке
выявляются токсоплазмы. Описаны также васкулиты и участки
некроза с последующей петрификацией.
При постнатальном токсоплазмозе структурные изменения
413
изучены значительно хуже, чем при внутриутробном. Несмотря на
то что основным путем инфицирования при токсоплазмозе является
алиментарный, поражение пищеварительного тракта у человека,
видимо, не исследовано. Наиболее постоянно описываются измене-
ния лимфатических узлов, причем не только брыжеечных, но и
заднешейных, углочелюстных, подмышечных и паховых [Казан-
цев А. П., Попова Н. И., 1980]. Они увеличиваются в размерах за
счет гиперплазии, нередко имеются очаговые разрастания описанного
выше клеточного состава с примесью гигантских многоядерных кле-
ток. Расплавления, нагноения или спаяния лимфатических узлов
друг с другом без наслоения гноеродных бактерий не происходит.
Селезенка поражается реже, все же иногда происходит ее умеренная
гиперплазия.
Довольно характерно поражение печени. Оно заключается в ее
увеличении, иногда большом [Weitberg А. В. et al., 1979]. Возникает
межуточный гепатит с холестазами, мелкими очагами некроза и
милиарными гранулемами того же характера. Возможно также из-
менение желчевыводящих путей.
Типично поражение мышц, прежде всего икроножных, бедра и
нижней половины спины. В толще пораженной мышцы обнаружи-
ваются уплотнения, нередко веретенообразной формы — участки
межуточного продуктивного миозита. Выявляются очаговые некрозы
мышцы.
Аналогичного характера инфильтраты имеются в строме легких,
по^чек и других органов. Из клеток эпителия легких могут развиваться
гигантские многоядерные клетки. Возможно, как правило, на фоне им-
мунодефицита, развитие энцефалита [Post М. et al., 1983].
Малярия. Возбудителями являются простейшие рода Plasmodium,
передаваемые комарами рода Anopheles. Патологическая анатомия
малярии изучена очень многими исследователями, одними из наи-
более полных являются работы М. В. Войно-Ясенецкого (1950, 1964,
.1987).
При трех- и четырехдневной малярии основное повреждение
обусловлено разрушением эритроцитов внедрившимся в них плаз-
модием. Размеры последнего несколько различаются на разных ста-
диях развития (размеры эритроцитарного мерозоита 1—1,5 мкм,
кольцевидного трозоита — 1—2 мкм, полу взрослого трофозоита —
4—5 мкм). При разрушении эритроцитов в кровь поступает мелко-
зернистый темный, почти черный пигмент — гемомеланин, обра-
зовавшийся в результате жизнедеятельности плазмодия. Одновре-
менно развивается анемия. В селезенке, в основном в ее красной
пульпе, печени, костном мозге, плазмодии захватываются макро-
фагами, а изредка и лейкоцитами, и погибают. Органы, в которых
накапливается гемомеланин, приобретают темно-серую окраску. На-
ряду с этим происходит значительная гиперплазия этих органов,
особенно селезенки, из-за увеличения числа клеточных элементов
пульпы, а также полнокровия. В остром периоде болезни селезенка
рыхлая, легко травмируется. Позже орган приобретает мясистую
плотность.
414
При тропической малярии имеются определенные отличия, обус-
ловленные тем, что плазмодии вторую половину своего цикла раз-
вития проводят в сосудах микроциркуляторного русла многих ор-
ганов и тканей. Они скапливаются также в синусах селезенки и
костном мозге. В местах скопления дозревающих плазмодиев появ-
ляется много фагоцитов, среди них вначале преобладают нейтро-
фильные лейкоциты. Более постоянны макрофаги, поглощающие
как продукты распада, оставшиеся после гибели эритроцитов, так
и пораженные эритроциты и плазмодии. В этих сосудах происходит
внутрисосудистое свертывание крови с образованием тромбов. При
поражении сосудов головного мозга, клинически протекающем с
явлениями комы, число эритроцитов с плазмодием в 3 раза больше,
чем в сосудах того же органа у больных малярией без поражения
головного мозга [Macpherson G. G. et al., 1985]. Наряду с этим
выявляются диффузные дистрофические изменения нейронов и мел-
кие периваскулярные кровоизлияния и участки некроза. В дальней-
шем вокруг них возникает глиальная реакция. Такого рода очажки
обозначают термином «гранулема Дюрка». Сходные дистрофические
и сосудистые изменения возникают также и во внутренних органах.
Макроскопически при гибели больных в состоянии комы отме-
чается характерная дымчатая окраска светлых органов.
Лейшманиоз. Возбудителями лейшманиоза являются несколько
видов простейшего Leischmania. В организме человека они имеют
округлую форму (их поперечник 2—4 мкм), передаются москитами.
В месте проникновения, обычно на лице или конечностях, лейш-
мании размножаются, а вслед за этим возникают реактивные из-
менения, в том числе, хотя и умеренные, лейкоцитарная и макро-
фагальная реакции. Если в лейкоцитах фагоцитоз завершенный, то
в макрофагах происходит размножение возбудителя. В дальнейшем
в этом участке формируется первичный очаг с преимущественно
продуктивным воспалением, имеющий макроскопически вид папулы,
узелка или пигментированного пятнышка. Лейшманиозы могут про-
текать в двух основных вариантах — висцеральном и кожном.
При висцеральном лейшманиозе основные структурные измене-
ния обусловлены размножением лейшманий в клетках главным
образом макрофагальной системы. Происходят резкая пролиферация
ретикулярных клеток и превращение их в свободно лежащие мак-
рофаги. Значительное накопление в цитоплазме макрофагов возбу-
дителей сопровождается гибелью клетки и выходом лейшманий в
ткань или кровоток. Закономерно поражение селезенки, печени и
костного мозга.
В селезенке обычная структура становится плохо различимой в
Результате замещения лимфоидной ткани крупными ретикулоцита-
ми. В цитоплазме многих из них содержатся лейшманий. В красной
пульпе выявляются эритрофаги и клетки с гемосидерином, отмеча-
ется также умеренный миелоз. Кроме того, обнаруживаются мно-
гочисленные плазмоциты и фуксинофильные тельца. Эндотелий си-
нусов обычно набухший. В пульпе встречаются кровоизлияния,
скопления нейтрофильных лейкоцитов, могут наблюдаться и ише-
415
мические инфаркты. Макроскопически селезенка уплотнена, масса
ее увеличена в несколько раз. Ткань органа темно-красная или
синюшная, реже пестрая.
В печени отмечается резкая гипертрофия звездчатых ретикуло-
эндотелиоцитов, многие из них, особенно на периферии долек,
содержат большое число лейшманий. Некоторые из них располага-
ются свободно в просветах синусоидов и капилляров. В гепатоцитах
выявляются дистрофические изменения. Макроскопически печень
несколько увеличена, рисунок ее строения смазан.
Принципиально сходный инфекционный процесс отмечается и в
большинстве других органов и тканей.
В дерме могут возникать очаговые довольно распространенные
разрастания грануляционной ткани, богатой гистиоцитами, лимфо-
цитами, плазмоцитами и крупными макрофагами, цитоплазма ко-
торых содержит большое число лейшманий. Эти изменения сочета-
ются с дискератозом или атрофией эпвдермиса, а также потерей
им пигмента.
При кожном лейшманиозе преобладает поражение кожи, прин-
ципиально аналогичное описанному выше. В современных исследо-
ваниях А. V. Magalhaes и соавт. (1986) показано, что антиген лей-
шманий постоянно обнаруживается на мембранах макрофагов, а
иммуноглобулин, особенно G, выявляемый в биоптатах кожи и
слизистых оболочек, находится в цитоплазме плазмоцитов.
Лямблиоз. Возбудителем является простейшее Lamblia intestinalis
размерами 9—13 мкм, обладающее 4 парами жгутиков. Заражение
происходит преимущественно алиментарным путем. Возбудители
размножаются в кишечнике и, по-видимому, в желчевыводящих
путях. Клинически принято выделять кишечную и печеночную фор-
мы лямблиоза. Вместе с тем лямблии нередко обнаруживаются в
содержимом кишечника у практически здоровых людей.
Характер структурных изменений в стенке кишечника изучали
преимущественно на материале биопсий [Judd R. et al., 1983; Martino
di L. et al., 1984; Garcia La Osa et al., 1987]. При этом описаны
изменения, которые рассматриваются как энтероколит или колит с
умеренной лимфогистиоцитарной инфильтрацией слизистой оболоч-
ки и дистрофическими и изредка даже деструктивными изменениями
эпителиальных клеток. Лямблии, как правило, в значительных ко-
личествах располагаются в просвете кишечника. По данным неко-
торых авторов [Ланда А. Л., Илинич В. К., 1973 ], в двенадцатипер
стной кишке они в 53,5% наблюдений проникают в глубь слизистой
оболочки. В слизистой-оболочке желчного пузыря наблюдаются отек,
десквамация эпителия и фибринозные наложения. Считают, что в
ткани печени возможно формирование мелких абсцессов с после-
дующим развитием цирроза.
Трихомоноз. Возбудителями являются Trichomonas нескольких
видов размерами 7—30 мкм. Наибольшее значение в патологии че-
ловека имеет Trichomonas vaginalis. Заражение происходит почти
исключительно половым путем. У женщин могут возникать вульвит,
вестибулит, бартолинит, кольпит, цервицит, уретрит, цистит и пи-
416
елит, а также поражения матки и придатков, у мужчин — уретрит,
везикулит, цистит, пиелит. Характер морфологических изменений
изучен недостаточно. Обычно [Клименко Б. В., 1987] приводят све-
дения о неспецифических воспалительных изменениях слизистой
оболочки уретры у мужчин и влагалища у женщин в виде дегене-
рации и десквамации эпителия с последующей его пролиферацией
и метаплазией. Отмечаются также гиперемия, отек и лимфогисти-
оцитарная инфильтрация, которые особенно выражены вокруг желез.
При хроническом течении инфекции более отчетливым становится
пролиферативный компонент. Возбудитель в первые часы после
инфицирования находится на поверхности эпителиальных клеток,
затем проникает в пространство между поврежденными эпителио-
цитами и, по-видимому, может вызывать образование эрозий и язв.
Амебиаз. Возбудителем является Entamoeba histolytica, ее раз-
меры в ткани 20—35 мкм. Заражение происходит энтеральным путем
и только цистами. Эта амеба может быть обнаружена в просвете
кишки и без структурных изменений органа. Патологическая ана-
томия амебиаза изучена достаточно полно [Криницкий Ш. И., 1911;
Константинов Г. С., Блохин А. В., 1988].
Благодаря способности амебы выделять во внешнюю среду про-
теолитические ферменты, в частности трипсин и пепсин, в случае
приближения к стенке кишки она вызывает повреждение ее эпи-
телия, что обеспечивает проникновение в подслизистую основу.
Дальнейшее распространение простейшего определяется выделени-
ем фактора проникновения, включающего гиалуронидазу. Имеются
и другие ферменты, оказывающие цитотоксическое влияние и
определяющие отрицательный Лейкотаксис. В эксперименте опи-
сано также поглощение амебой эпителиоцитов [Tsutsumi V. et al.,
1986].
В местах внедрения амебы образуются изъязвления различных
размеров. Дно их покрыто бесструктурным детритом, здесь же оп-
ределяются кровяные пигменты, видно много бактерий. Глубже
располагается слой некротизированной ткани органа, она эозино-
фильна, с участками базофилии, обусловленной мелкодисперсным
распадом ядер. Лейкоциты здесь почти полностью отсутствуют. Аме-
бы выявляются в основном в глубоких слоях некроза. Максимальное
их количество обнаруживается на границе участка некроза с со-
хранившимися тканями органа, а также в последних. Клеточная
реакция в основном мононуклеарная, незначительная. Описано про-
никновение амеб в стенку и просвет кровеносных сосудов, в части
таких сосудов возникает тромбоз. В регионарных лимфатических
Узлах выявляются гистиоцитоз синусов и расширение паракорти-
кальной зоны. Простейших здесь, как правило, нет.
Макроскопически слизистая оболочка кишки неравномерно пол-
нокровна, с участками кровоизлияний. Складки ее утолщены, на
них выявляются язвы разных размеров, иногда они сливаются
вместе. Толщина кишечной стенки в краях язвы — 1,2—1,5 см,
а несколько отступя от них — 0,5—0,8 см. Язвы приподняты над
поверхностью слизистой оболочки, при остром процессе они ок-
,4—407 ’ 417
ружены красным венчиком. При разрезе стенки кишки видно
что язвенный дефект распространяется под сохранившуюся сли-
зистую оболочку.
У значительной части лиц отмечается гематогенное распростра-
нение амеб по воротной вене с поражением печени, преимущественно
ее правой доли, где возникают одиночные или множественные очаги
некроза, которые условно называют абсцессами. Процесс имеет тот
же характер, что и в кишке.
Макроскопически содержимое абсцессов желеобразной консистен-
ции, светло-желтого цвета, по периферии имеется геморрагический
венчик. В дальнейшем вокруг этого очага формируется соедини-
тельнотканная капсула.
Изредка отмечается распространение амеб по большому кругу
кровообращения. Возможно также развитие генитального амебиаза
rVeliath A. J. et al., 1987].
Балантидиаз. Возбудителем является Balantidium coli, размер ее
50—90 мкм. Патологическая анатомия балантидиаза изучена непол-
но. Судя по имеющимся наблюдениям [Войно-Ясенецкий М. В.,
1964; Jaffe R., 1919], поражения пищеварительного тракта при этом
заболевании напоминают наблюдающиеся при амебиазе. Патологи-
ческий процесс при балантидиазе чаще возникает в толстых отделах
кишечника. Наиболее типичным является некротический характер
процесса практически при отсутствии лейкоцитарной реакции. Ба-
лантидии располагаются преимущественно на границе между этим
некрозом и сохранившимися тканями органа, а также в последних.
4ktro возбудитель обнаруживается за пределами язвы как в криптах,
так и в слизистой оболочке. Балантидии можно выявить также в
кровеносных и лимфатических сосудах кишки. Макроскопически
описаны язвенные дефекты разной величины и формы с подрытыми,
неровными, нередко утолщенными краями. На их дне располагаются
рыхлые, иногда полужидкие некротические массы, цвет которых
варьирует от серовато-зеленоватого до темно-бурого. Проявления
генерализации не описаны.
Криптоспоридиоз. Возбудителем является Cryptosporidium. Его
развитие протекает по схеме однохозяинного цикла кокцидий, для-
щегося около 5 сут и завершающегося выделением с фекалиями
ооцист диаметром 4—5 мкм [Бейер Т. В., 1989]. Они интенсивно
окрашиваются по Цилю—Нильсену. После попадания ооцисты в
пищеварительный тракт ее оболочка разрушается, при этом высво-
бождаются подвижные спорозоиты размерами 5—5,6 х 0,8— 1 мкм,
которые достигают зоны микроворсинок энтероцитов. Здесь и про-
исходит дальнейшее развитие паразита, проходящего стадии трофо-
зоита и меронта.
Поражаются преимущественно терминальные участки подвздош-
ной кишки. Ворсинки претерпевают различные изменения — оТ
набухания до атрофии, могут слипаться. В стенке кишки появляются
рыхлые инфильтраты из макрофагов, нейтрофильных и эозинофиль-
ных лейкоцитов. В просвете же кишки накапливается водянистая
жидкость со зловонным запахом.
418
Рис. 9.11. Пневмоцистоз. В альвеолах содержатся многочисленные пнев-
моцисты, имеющие пенистый вид и напоминающие на этой стадии фибрин.
В межальвеолярных перегородках видны лимфоплазмоцитарные инфильт-
раты. ШИК-реакция. х 300.
У животных наряду с поражением кишки описаны изменения и
в других органах.
Пневмоцистоз. Возбудителем является Pneumocystis carinii (по-
перечник его 2—3 мкм). Заражение происходит воздушно-капель-
ным путем в основном от больных людей.
При микроскопическом исследовании выявляются весьма харак-
терные изменения [Нагаи К. и др., 1982; Ammich О., 1938; Jirovec О.,
Vanek J., 1952, 1954, 1956; Watts J. С., Chandler F. W., 1985]. В ос-
трой фазе болезни на поверхности слизистой оболочки мелких брон-
хов обнаруживают пневмоцисты, хорошо окрашивающиеся при
ШИК-реакции. Здесь же можно видеть единичные макрофаги, ци-
топлазма которых изобилует пневмоцистами. Они могут обнаружи-
ваться и в цитоплазме клеток бронхиального эпителия.
Значительно более типично выявление в альвеолах и в меньшей
мере в просветах альвеолярных ходов интенсивно окрашивающихся
при ШИК-реакции грамположительных скоплений пневмоцист, име-
ющих вид пенистых белковых масс (рис. 9.11). На электронограммах
°ни представляют собой тонкостенные образования — цисты, в
которых выявляются дочерние формы. Эти пенистые массы, окра-
шивающиеся интенсивно реактивом Шиффа и слабо по Граму—
оейгерту, специфичны для пневмоцистоза, однако их требуется
дифференцировать с фибрином. Помимо этого содержимого, в аль-
веолах обнаруживаются единичные лейкоциты и макрофаги. В более
14*
419
поздних стадиях болезни описанные массы как бы съеживаются —
становятся более грубыми и располагаются преимущественно в цен-
тральной части альвеол. Вокруг появляются макрофаги, рассасыва-
ющие эти массы.
В участках легких с острыми изменениями имеются очаговые
ателектазы, чередующиеся с эмфизематозно расширенными альве-
олами. В межуточной ткани в области очагов пневмоцистоза с более
старыми по времени возникновения изменениями видны густые
скопления плазмоцитов, а также макрофагов, лимфоцитов и от-
дельных нейтрофильных лейкоцитов. Далее происходит фиброзиро-
вание межальвеолярных перегородок.
Макроскопически легкие при пневмоцистозе могут иметь харак-
терный вид. Так, J. Vanek, О. Irovec (1954, 1956) и О. Irovec (1954,
1959) считают типичными необычно большие размеры неспадаю-
щихся легких резиновой плотности. Их ткань, особенно в задних
отделах, безвоздушна, на разрезе гладкая, темного серо-фиолетового
или серо-красного цвета.
Заболевание ограничивается поражением легких, генерализации
процесса обычно не бывает.
9.1.3.5. Заболевания, вызываемые гельминтами
Гельминтозы представляют собой весьма распространенные болезни.
Всего известно около 250 видов гельминтов, паразитирующих в
организме человека, причем большей частью в пищеварительном
тракте. Гельминтозы особенно широко распространены в тропиче-
ских странах, однако некоторые из них часто встречаются и в
странах с умеренным климатом. Важнейшие гельминты, поражаю-
щие человека, относятся к классам Trematoda (сосальщики), Cestoda
(ленточные черви) и Nematoda (круглые черви). Яйца и личинки
гельминтов выделяются во внешнюю среду, где они вызревают и
становятся инвазионными. Они могут развиваться как с участием
промежуточных хозяев (биогельминты), так и без смены хозяев
(геогельминты).
Патологическая анатомия гельминтозов во многом определяется
местом существования гельминтов и их личинок. При их развитии
в просвете кишечника, что типично для ряда ленточных и круглых
червей, местные структурные изменения выражены незначительно,
и в клинико-анатомических проявлениях болезни преобладают ал-
лергические реакции, а также дистрофические изменения, прежде
всего печени. Определенное значение имеет и механический фактор,
проявляющийся в давлении паразита на окружающие ткани, в
затруднении прохождения пищевых масс, закрытии или сужении
просвета органов, особенно с небольшим диаметром (протоки боль-
ших пищеварительных желез, червеобразный отросток и т. д.). В тех
же случаях, когда происходит развитие самого паразита или его
личинки, в тканях отмечается, кроме того, отчетливая местная
воспалительная, преимущественно продуктивная, реакция.
420
9.1.3.5.1. Заболевания, вызываемые гельминтами класса
Trematoda
Среди трематодозов наибольшее значение в патологии человека
имеют описторхоз, фасциолезы и шистосоматоз.
Описторхоз. Возбудителем является Opistorchis (двуустка)
felineus (кошачья) и viverrini (беличья), его размеры 4—13 х I —
3,5 мм. Окончательные хозяева — человек, а также кошки, собаки
и другие животные. Промежуточный хозяин — пресноводные мол-
люски, дополнительные хозяева — рыбы семейства карповых. За-
ражение человека происходит при приеме в пищу сырой или тер-
мически плохо обработанной рыбы.
Основные изменения у человека, наиболее полно изученные
Н. А. Зубовым (1973), происходят в печени, особенно в желчевы-
водящих путях, поджелудочной железе, а также в пищеварительном
тракте.
В печени двуустка локализуется в основном в желчных протоках,
что сопровождается нарушением оттока желчи и развитием распро-
страненного продуктивного холангита с наличием гистиоцитарно-
лимфоцитарно-плазмоцитарных инфильтратов с примесью эозино-
фильных лейкоцитов, а также выраженного аденоматоза. Ширина
протоков большей частью неравномерная, возможно даже возник-
новение холангоэктазов. На более поздних стадиях болезни проис-
ходит постепенное созревание соединительной ткани и развиваются
фиброз стенок протоков всех калибров и коллагенизация перипор-
тальной соединительной ткани. Эти изменения нередко сочетаются
со склерозом ветвей печеночной артерии и атрофией паренхимы
печени. В дальнейшем иногда развивается цирроз смешанного типа.
Изменения сходного характера наблюдаются в протоках поджелу-
дочной железы. В желудке и кишке (преимущественно в прокси-
мальных отделах) возникает в основном поверхностный воспали-
тельный процесс, иногда с мелкими изъязвлениями.
На фоне описанных поражений нередко развивается вторичная
бактериальная инфекция и воспаление становится гнойным.
Распространение двуустки в другие органы, видимо, не имеет
существенного значения. Изменения, возникающие там, принято
рассматривать как аллергические. Необходимо отметить, что на
фоне описторхоза возможно более частое, чем обычно, развитие
рака печени.
Фасциолезы. Возбудителями являются два вида двуусток рода
Fasciola hepatica (печеночная) размерами 20—30 * 8—12 мм и
8’gantica (гигантская) размерами 33—70 * 5—12 мм. В яйцах гель-
минтов, выделившихся с калом окончательных хозяев (человека,
Домашних животных и грызунов) во внешнюю среду, формируются
зародыши (мирацидии). Они выходят в воду и проникают в про-
межуточного хозяина — пресноводного моллюска, в котором про-
ходит стадия бесполового размножения личинки. Зрелые хвостатые
Дичинки (церкарии) поступают из моллюска в воду и инцистируются
на поверхности воды или на водных растениях. Заражение оконча-
421
тельного хозяина происходит при питье воды или употреблении в
пищу растений водоемов.
У окончательных хозяев трематоды локализуются преимущест-
венно во вне- и внутрипеченочных желчных протоках и в желчном
пузыре, где возникают холангит и холецистит. Одновременно на-
рушается отток желчи. На этот процесс нередко наслаивается вто-
ричная бактериальная инфекция. Возможно, хотя и значительно
реже, развитие также глоточного фасциолеза с отеком глотки, гор-
тани и слизистой оболочки носа. Иногда поражаются легкие, что
сопровождается лихорадкой и кровохарканьем, а также другие ор-
ганы и т^аци.
Возбудителем клонорхоза является Clonorchis sinensis (двуустка
китайская). Морфологические изменения при клонорхозе сходны с
проявлениями заболеваний, вызванных другими двуустками.
Шистосоматоз. Возбудители — раздельнополые трематоды рода
Schistosoma. Их размеры различаются у разных видов, составляя у
самца 4—15 х 1 мм и у самки до 20 * 0,25 мм. Окончательным хо-
зяином в основном, является человек. Яйца выделяются им во внеш-
нюю среду с фекалиями; при попадании в воду из них вылупляются
личинки (мирацидии), проникающие затем в пресноводных моллю-
сков, в которых происходит их бесполое размножение и образуются
хвостатые формы (церкарии). Последние внедряются в организм
человека в основном через кожу, а также через слизистые оболочки,
чаще всего при купании.
, Выделяют несколько форм шистосоматоза. Возбудителем мочепо-
лового шистосоматоза является Schistosoma haematobium, которая
локализуется прежде всего в венах — воротной, брыжеечных и моче-
вого пузыря. В ранней стадии болезни наблюдаются папулезная сыпь,
крапивница и эозинофилия. Позднее выявляются кровоизлияния, изъ-
язвления и полипозные разрастания на слизистой оболочке мочевого
пузыря. Мочеиспускание становится болезненным, к моче примеши-
ваются капли крови, вначале лишь в конце мочеиспускания, позднее
на всем его протяжении. У женщин часто развивается сходное пора-
жение влагалища с полипозными разрастаниями его слизистой обо-
лочки. Процесс может переходить на окружающие органы, в частности
матку. При распространении возбудителя за пределы указанных ор-
ганов возможно поражение кишечника, легких, кожи, конъюнктивы
глаз и головного мозга. На фоне этого заболевания чаще обычного воз-
никает рак мочевого пузыря.
Возбудителем кишечного шистосоматоза служит Schistosoma
mansoni. Основная локализация процесса — вены брыжейки. Самка
откладывает яйца в мелких кровеносных сосудах дистальных отделов
пищеварительного тракта, откуда они выделяются в просвет кишки.
В проявлениях болезни преобладает поражение кишечника. При
ректороманоскопии описаны гиперемия и набухлость слизистой обо-
лочки прямой и сигмовидной кишки, кровоизлияния, изъязвления
и папилломатозные разрастания. Стул учащенный, со слизью и
кровью. В пораженных сосудах разной локализации возникает гра-
нулематозный артериит [Wiinschmann D., Ribas Е., 1989].
Наряду с кишечной выделяют гепатоинтестинальную и гепа-
тоспленическую формы шистосоматоза. Возможен также занос яиц
гельминта в легкие, почки, головной мозг и другие органы, где
возникают поражения, иногда массивные [Мамонтов П. Н., 1985].
В этом случае, например в мозговой оболочке, веществе головного
мозга и глазу, выявляются яйца шистосом. Ткань вокруг них не-
кротизируется, далее к периферии обнаруживаются лимфоплазмо-
цитарно-эозинофильные инфильтраты и даже гранулематозная ре-
акция [Pittella J. Е. Н., Orefice F., 1985].
Выделяют .также японский шистосоматоз — возбудитель
Schistosoma japonicum. Заболевание по своим проявлениям напоми-
нает кишечный шистосоматоз. Отличием являются более частое
поражение ЦНС с развитием диффузного энцефалита и/или ме-
нингита, иногда параличи и парезы. Чаще возникает фиброз печени
с портальной гипертензией [Bouree Р., Thulliez Ph., 1983].
Возможно также развитие шистосоматозных дерматитов, вызван-
ных личинками (церкариями) разных видов шистосом, проникающих
в кожу человека из воды. В этом случае они не достигают в
организме человека половой зрелости. В момент внедрения церкария
ощущается колющая боль в коже, затем возникает зуд, появляются
пятна, иногда диффузная эритема и крапивница. Позднее образу-
ются зудящие папулы и везикулы.
Изредка описывается развитие внутриутробного шистосоматоза.
9.1.3.5.2. Заболевания, вызываемые гельминтами
класса Cestoda
У человека эти заболевания (цестодозы) вызывается рядом гель-
минтов, общим для которых является уплощенное лентовидное тело
(с резким колебанием длины от 1 см до нескольких метров) и
наличие, как правило, гермафродитизма.
Возбудители тениидозов — Taenia solium (цепень свиной), Taenia
rhynchus saginatus (цепень бычий) и ряд других. Возможны две
группы поражений человека: взрослыми глистами (кишечные тени-
идозы) и их личинками (цистицеркоз).
Кишечный тениидоз развивается при употреблении в пищу мяса
промежуточных хозяев (крупного рогатого скота, свиней и т. д.)<
содержащего жизнеспособные личинки (финны). Животные же ин-
фицируются при проглатывании онкосфер при поедании загрязнен-
ной травы или слизывании (поедании) экскрементов человека. Про-
явления заболевания — нарушения питания больного и местное,
преимущественно механическое, нарушение прохождения пищевого
комка с развитием иногда непроходимости кишечника.
Термином цистицеркоз обозначают хроническое, длящееся го-
дами поражение человека личиночной стадией Taenia solium. Ци-
стицерк (финна) представляет собой пузырек овоидной формы с
полупрозрачными стенками и ввернутой внутрь головкой сколекса.
Диаметр цистицерка обычно 5—15 мм. Стенка пузырька трехслой-
На«: внутренний (ретикулярный) слой беден клетками, средний
423
(паренхиматозный) богат клетками чаще звездообразной формы,
наружный слой представляет собой гомогенную кутикулу, образу-
ющую при свободном расположении цистицерка, например в же-
лудочках мозга, весьма характерные волнообразные (фестончатые)
выступы.
Вокруг цистицерка возникает умеренная воспалительная реакция
с преобладанием разрастаний грануляционной, а позднее фиброзной
ткани. Кнаружи от нее отмечается выраженная в разной степени
(чаще незначительная) лимфоплазмоцитарная инфильтрация. При
отмирании цистицерка усиливается местная воспалительная реак-
ция, появляются гигантские многоядерные клетки. Наряду с этим
повышается общая аллергическая реакция. Погибший паразит чаще
всего обызвествляется.
При цистицеркозе возможно поражение многих органов: голо-
вного и спинного мозга, нередко с картиной психических расстройств
или опухоли, глаз, мышц, кожи и подкожной клетчатки, реже
внутренних органов и костей.
Эхинококкоз. Возбудитель — Echinococcus granulosus. Оконча-
тельным хозяином являются собаки и другие близкие к ним живо-
тные, у которых эхинококк — мелкая цестода, паразитирующая в
кишечнике.
Заболевание человека, а также травоядных животных (проме-
жуточных хозяев) вызывает личиночная стадия. Заражение проис-
ходит чаще всего от собак, на шерсти которых, а также в полости
рта могут иметься онкосферы эхинококка.
* Личиночная стадия эхинококка имеет вид пузырей, поражаю-
щих чаще всего печень, реже — легкие, головной мозг и другие
органы. Так, например, F. X. Roux и соавт. (1985) отмечают, что
в 60% поражается печень, в 30% — легкие и в .1—2%, причем
в основном у детей, — нервная система. Увеличение размеров
этих пузырей происходит постепенно и очень медленно — на
протяжении многих месяцев. Возможен прорыв такого узла в
соседние органы и ткани.
. Выделяют два варианта эхинококкоза у человека. Более частым
является однокамерный ( гидатиозный), его возбудитель —
Echinococcus granulosus. Полость такого пузыря может достигать в
поперечнике 10 см и более, она содержит жидкость и свободно
плавающие в ней или прикрепленные к стенке дочерние пузыри.
На внутренней поверхности материнского пузыря видно также боль-
шое число так называемых выводковых капсул, содержащих по
несколько головок. Дочерние пузыри в свою очередь содержат пузыри
третьего порядка (внучатые) и массу выводковых капсул. Пузырь
в целом окружен фиброзной капсулой с незначительной лимфоги-
стиоцитарной инфильтрацией.
Реже встречается многокамерный (альвеолярный) эхинококкоз
(альвеококкоз), вызываемый Alveococcus multilocularis. Он характе-
ризуется тем, что дочерние и внучатые пузыри образуются не в
полости материнского пузыря, а вне его, скапливаясь между сГ°
кутикулой и фиброзной капсулой. В связи с этим пузырьки сдавлены,
424
[имеют неправильную форму и почти не содержат жидкости. Мак-
роскопически такой узел имеет ячеистое строение.
Эхинококк оказывает на человека механическое (местное), ток-
сическое и аллергическое воздействие.
Гименолепидозы. Основным представителем является гельмин-
тоз, вызванный Hymenolepis папа — карликовым цепнем размерами
15—30 х 0,5—0,7 мм. Окончательный и. промежуточный хозяин —
человек. Личинки (цистоцеркоиды) развиваются в ворсинках тонкой
кишки, через 6—7 сут они превращаются во взрослую особь, и после
деструкции ворсинки выходят в просвет кишки, прикрепляясь к ее
стенке присосками и крючками. В кишке возникает умеренный
воспалительный процесс, кроме того, у больного отмечаются явления
интоксикации.
Дифиллоботриозы. Основной представитель этих глистов —
Diphyllobothrium latum (широкий лентец). У человека, являющегося
окончательным хозяином, длина его достигает нескольких метров.
Заражение происходит через пресноводных рыб (дополнительный
хозяин), в свою очередь заражающихся при поедании циклопов
(разных видов рачков), поглотивших яйца глиста. Проявления за-
болевания сходны с отмеченными выше при тениидозах.
Спорагнозы. Изредка, при некоторых дифиллоботриозах, воз-
можно развитие спорагнозов, т. е. поражений человека личиночными
стадиями с развитием их в подкожной клетчатке, межмышечной
соединительной ткани, а также в глазах.
9.1.3.5.3. Заболевания, вызываемые гельминтами класса
Nematoda
У человека эти заболевания (нематодозы) могут быть вызваны рядом
круглых червей: трихинеллами, аскаридами, власоглавом и др.
Трихинеллез. Возбудитель — Trichinella spiralis (трихинелла) —
еле видим невооруженным глазом. Паразитирует в кишечнике
многих животных, особенно свиней. В отдельных случаях, в том
числе у человека, возможна массивная инвазия половозрелых три-
хинелл через слизистую оболочку пищеварительного тракта [Анич-
ков Н. М. и др., 1987]. Обычно же в стенку кишки проникают
лишь откладываемые живородящей самкой личинки трихинелл.
Затем они разносятся током лимфы и крови по организму жи-
вотного. Однако развиваются они лишь в поперечнополосатых
мышцах, где и растут, вызывая альтеративные изменения и отек
мышцы. По описанию М. Baudrimont и соавт. (1989), личинки
располагаются в аморфных эозинофильных массах, среди которых
Имеются миогенные клетки с пузырькообразным ядром. Вокруг
додержатся инфильтраты из моноцитов и Т8-лимфоцитов и от-
дельных многоядерных клеток. В дальнейшем личинки инкапсу-
лируются, превращаясь в «мышечные трихинеллы». При приеме
в пищу такого мяса происходит заражение следующего хозяина.
Часть трихинелл погибает и обызвествляется. Гибель трихинелл
сопровождается аллергическими реакциями и клиническими про-
425
явлениями, напоминающими разные инфекционные заболевания
в том числе грипп.
Аскаридоз. Заражение возбудителем Ascaris lumbricoides, отно-
сящимся к семейству Ascaridae, происходит в результате проглаты-
вания с пищей яиц, содержащих подвижную личинку. В тонкой
кишке личинка вылупляется, проникает в стенку кишки и далее в
венозные сосуды. Током крови она заносится в легкие, где возможно
возникновение очаговых кровоизлияний и мелких участков воспа-
ления. Этот процесс сопровождается эозинофилией и кожными ал-
лергическими проявлениями. Из легких личинка удаляется по брон-
хам под воздействием мерцательного эпителия, в дальнейшем вновь
заглатывается. После повторного попадания в кишечник она раз-
вивается до половозрелой стадии с длительностью жизни на этом
этапе 8—13 мес. Среди проявлений болезни на этой ее стадии
преобладают изменения, обусловленные токсическими и местными
воздействиями;
Трихоцефалез. Возбудитель — Trichocephalus trichiurus (власог-
лав) — вылупляется из проглоченных инвазионных яиц в пищева-
рительном тракте, прежде всего в тонкой кишке, иногда описывается
его проникновение в ворсинки. Возможны нарушение кровообраще-
ния, частично рефлекторное, дискинезии, в том числе в желчных
путях. Наблюдаются и острые воспалительные изменения, однако
они обусловлены в основном присоединением вторичной бактери-
альной флоры.
Энтеробиоз. Возбудитель — Enterobius vermicularis (острица) —
паразитирует в дистальных отделах тонкой и толстой кишки, при-
сасываясь к слизистой оболочке. Длительность жизни острицы 3—
4 нед. Оплодотворенная самка теряет способность удерживаться на
слизистой оболочке и перемещается в дистальные отделы кишки,
где возможен ее активный выход из анального отверстия с отложе-
нием яиц на коже. Местно под воздействием остриц возникает
умеренное повреждение слизистой оболочки, в том числе червеоб-
разного отростка, на которое может наслаиваться вторичная бакте-
риальная флора. Изредка описывается распространение остриц за
пределы кишки, например в печень, с развитием участка некроза,
окруженного лимфоплазмоцитарно-эозинофильным инфильтратом
[Mondou Е. N., Gnepp D., 1989 ].
Дракункулез (ришта). Возбудитель — Dracunculus medinensis —
попадает в организм человека при заглатывании с питьевой водой
промежуточного хозяина — циклопа (веслоногий рачок). Развитие
взрослого возбудителя происходит в подкожной клетчатке оконча-
тельного хозяина, обычно человека. Здесь он достигает больших
размеров*, тело самки имеет длину десятки сантиметров при ширине
0,5—1 мм. Ко времени откладки личинок самка приближается к
коже, где образуется выпячивание, превращающееся в пузырь ди-
аметром 2—7 см. Через несколько дней он лопается, при этом
обнажаются конечные участки возбудителя. При контакте с водой
ткани последнего лопаются и подвижные личинки поступают в воду,
где захватываются циклопами. Наряду с местным воспалением,
426
вызванным не только самим гельминтом, но и вторичной бактери-
альной флорой, отмечается аллергическая реакция, в частности
крапивница с зудом и эритема, выраженная максимально в период
перед вскрытием пузыря.
9.1.4. Сочетанные инфекции
Сочетанные и смешанные инфекции являются серьезной проблемой,
обусловленной в значительной мере возможностью развития внут-
рибольничных (госпитальных) инфекций в результате суперинфи-
цирования как условно-патогенными бактериями из окружающей
среды, так и различными возбудителями от других больных и ме-
дицинского персонала. Термины «смешанная инфекция» и «соче-
танная инфекция» чаще всего рассматриваются как синонимы для
обозначения инфекционной болезни, вызванной двумя и более воз-
будителями. При таком отношении к этим двум понятиям объеди-
няются принципиально отличающиеся друг от друга варианты воз-
никновения сложных по этиологии инфекционных процессов. Пер-
вым из них является вариант, при котором заболевание вызвано
одновременно двумя и более возбудителями. При втором варианте
происходит последовательное развитие двух и более инфекционных
болезней, причем их максимальные проявления могут наблюдаться
как в одном, так и в разных органах. В связи с этим представляется
более логичным разграничить указанные понятия и использовать
термин «смешанные инфекции» для заболевания, вызванного одно-
временно несколькими возбудителями, оставив для второго варианта
термин «сочетанные инфекции».
При изучении материалов вскрытий детских стационаров Санкт-
Петербурга за последние несколько лет выявляется большая частота
сочетанных и смешанных инфекций с наличием самых различных
по этиологии и локализации процессов [Цинзерлинг А. В., 1980,
1986 ]. Существует прямая зависимость между полнотой посмертного
морфологического и лабораторного обследований и частотой диаг-
ностирования сочетанных и смешанных инфекций. В тех прозекту-
рах, где обследование проводится наиболее полно, моноинфекций
практически не обнаруживается.
Изучавшиеся, хотя и менее многочисленные, наблюдения из
прозектур больниц для взрослых позволяют утверждать, что у взрос-
лых больных положение не отличается сколько-нибудь от отмечен-
ного выше.
Среди возбудителей выявляются разные вирусы, в частности
респираторные, семейства Herpesviridae, бактерии преимущественно
семейства Enterobacteriaceae, микоплазмы, грибы, в основном рода
Candida, и простейшие (токсоплазмы и пневмоцисты). После того
как появились соответствующие диагностические возможности, часто
стали выявляться и хламидии. Какой-либо’достоверной общей за-
кономерности в этих сочетаниях нет. Частота участия отдельных
возбудителей в возникновении заболеваний зависит в первую очередь
427
от эпидемиологической ситуации. При этом имеет значение как
положение в городе, что особенно отчетливо выявляется при ин-
фекциях, вызванных респираторными вирусами, так и в данной
больнице и даже ее отделении. Последнее определялось прежде
всего при инфекциях, вызванных условно-патогенными бактериями
(стафилококки, псевдомонас и др.).
Весьма высокая частота сочетанных инфекций требует обсужде-
ния причин, которые способствуют или препятствуют возникновению
второго (третьего и т. д.) по времени развития заболевания. Можно
представить себе несколько вариантов взаимоотношений сочетаю-
щихся инфекций: 1) эти заболевания не оказывают друг на друга
существенного влияния; 2) каждая инфекция способствует развитию
другой, сочетающейся с ней, в результате повреждения самой ткани
или защитных механизмов, в первую очередь местных, органа или
синергизма микроорганизмов; 3) одна инфекция затрудняет развитие
и прогрессирование другой в результате стимуляции защитных ме-
ханизмов, например интерфероногенеза, или антагонизма микроор-
ганизмов.
Изученные материалы позволяют считать, что все перечисленные
варианты взаимоотношений разных инфекционных процессов встре-
чаются в практике. Эти фактические материалы, бесспорно, свиде-
тельствуют также о разнообразных изменениях, возникающих при
сочетанных инфекциях. Их важность особенно отчетливо выявляется
при респираторных воспалительных заболеваниях — ларинготра-
хеобронхитах и пневмониях разной этиологии. Среди таких инфек-
ций обычно обнаруживались одна, две и более вирусные респира-
торные инфекции, диагностированные суммарно у 78,5% умерших
детей. Одновременно в легких имелись очаги воспаления, вызванные
разными бактериями (у 69,4%), нередко определялись респиратор-
ный микоплазмоз (у 15,2%) и реже поражения другой этиологии.
Можно отметить, что тяжесть заболевания у разных детей, умерших
при наличии сочетанных респираторных инфекций, определялась
частично вирусными поражениями, частично бактериальными пнев-
мониями, особенно клебсиеллезом и псевдомонозом. Последние
обычно развивались незадолго до смерти, причем на фоне умеренно
выраженных вирусных поражений. Изредка в проявлениях болезни
доминировали иные инфекции.
Какими могут быть взаимоотношения разных респираторных
инфекций между собой? Прежде всего бесспорное значение имеет
первичное повреждение слизистой оболочки дыхательных путей ре-
спираторными вирусами, что закономерно приводит к нарушению
дренажной функции бронхиального дерева и создает предпосылки
для попадания в респираторные отделы легких бактерий. Кроме
того, ряд респираторных вирусов, особенно гриппа, оказывает им-
мунодепрессивное действие. Возможны и другие варианты влияния
одной инфекции на другую.
Так, например, при экспериментальном исследовании [Мельни-
кова В. Ф., Аксенов О. А., 1989], предпринятом с целью изучения
взаимного влияния гриппозной и стафилококковой респираторных
428
инфекций, удалось выявить существенные различия в зависимости
от того, когда вводился второй возбудитель по отношению к первому.
Это объясняется изменением состояния макроорганизма под воздей-
ствием первого заболевания. Наиболее отчетливо это выявлялось
при введении вируса гриппа на фоне уже развившегося стафило-
коккового поражения. При этом в первые дни болезни грипп про-
текал несравненно легче, чем в контроле, что объяснялось действием
интерферона, образовавшегося в ответ на развитие первоначальной
бактериальной инфекции. Введение же стафилококков на фоне грип-
позного процесса приводило к утяжелению поражения, соответст-
вовавшего тому процессу, который возникал при одновременном
заражении обоими возбудителями.
О более тяжелом течении сочетанной респираторной инфекции
свидетельствуют и опыты с заражением белых мышей вирусами
гриппа и парагриппа [Шастина Г. В., Конева Н. А., 1972]. При
заражении обоими вирусами в некоторые сроки выявлено большее
содержание в легких вируса гриппа, чем при введении только вируса
гриппа или вируса гриппа с культуральной жидкостью. Процесс
становился все более тяжелым, в том числе более выраженными
были структурные изменения легких.
Аналогичная ситуация отмечается при тонзиллитах. Нам уда
лось выявить закономерно частое сочетание фарингеальной (тон-
зиллогенной) стрептококковой инфекции, в том числе скарлатины,
с предшествующей ОРВИ [Цинзерлинг А. В., Иоакимова К. Г.,
1987]. Изучение поражения миндалин при дифтерии позволило
выяснить, что и здесь существенное значение имеют сочетанные
инфекции [Цинзерлинг А. В. и др., 1980]. При пересмотре архивных
материалов секционных наблюдений токсической дифтерии с окра-
ской заново срезов миндалин и при изучении отдельных наблюдений
этого заболевания, появившихся в самое последнее время, оказалось,
что коринебактерии располагаются в основном на поверхности фиб-
ринозной пленки. Наряду с этим в половине наблюдений в глубине
миндалин отмечались выраженные альтеративные изменения, вы-
званные стрептококками (Streptococcus pyogenes, ранее называв-
шийся гемолитическим), большие скопления которых располагались
в этих участках. Часть их была фагоцитирована нейтрофильными
лейкоцитами.
Обобщение текущих секционных материалов при кишечных ин-
фекциях дало возможность установить, что более чем в половине
наблюдений процесс вызывает одновременно несколько агентов. Не-
сколько инфекционных процессов разной этиологии в органах пи-
щеварения одного и того же ребенка развиваются частью парал-
лельно при одновременном инфицировании, в большинстве же слу-
чаев последовательно при суперинфицировании, иногда даже
близкими видами микроорганизмов.
Особенно сложными и малоизвестными являются сочетанные
поражения пищеварительного тракта, вызванные вирусами или ми-
коплазмами при генерализованном течении респираторных инфек-
ций и бактериями. Г. В. Шастиной (1986, 1988) удалось показать
429
возможность выявления при этой патологии в одном и том же срезе
процессов, вызванных разными вирусами, протекающих с гиганток-
леточным метаморфозом различного характера. При этом степень
выраженности вирусного энтероколита в случае его развития на
фоне бактериального или микотического поражения была меньшей.
Под влиянием наслаивающейся вторичной инфекции в ряде слу-
чаев возникает обострение первоначального заболевания. Следует,
однако, иметь в виду, что обострение энтероколита может быть
кажущимся. На самом деле клинические проявления целиком объ-
ясняются вторичным поражением пищеварительного тракта [Тимо-
феева Г. А., Цинзерлинг А. В., 1983]. Так, при исследовании хро-
нической и затяжной дизентерии у детей с использованием наряду
с другими клинико-лабораторными методами аспирационных био-
псий толстой кишки удалось доказать, что усиление клинических
проявлений кишечной дисфункции при этих формах дизентерии
было часто связано с наслоением ОРВИ с генерализацией.
Наряду со сложным по этиологии поражением кишки на значи-
тельном ее протяжении возможно преимущественное развитие вос-
паления на ограниченном ее участке — в червеобразном отростке
[Цинзерлинг А. В. и др., 1982, 1985 ]. При этом показано, что в
подавляющем большинстве случаев аппендицита как у детей, так
и у взрослых бактериальному процессу, проявлением которого слу-
жит гнойное воспаление органа (флегмонозный аппендицит), пред-
шествует поражение, вызванное вирусами (в наших наблюдениях
респираторными), создававшими условия для внедрения в стенку
органа бактерий.
Отчетливое влияние на проявления инфекционного процесса в
случае сочетанного поражения отмечается в печени. В частности,
при исследовании текущих патологоанатомических материалов
В. А. Цинзерлингом выявлялось закономерное утяжеление прояв-
лений гепатита, вызванного вирусом гепатита В, в случае наслоения
на него респираторной вирусной инфекции.
При углубленном изучении подавляющего большинства матери-
алов вскрытий при нейроинфекциях, наблюдавшихся за последние
десятилетия в Санкт-Петербурге [Цинзерлинг В. А. и др., 1985,
1987; Цинзерлинг В. А., 1988], выявлена закономерно высокая ча-
стота сочетания менингококкового, пневмококкового и других бак-
териальных менингитов и менингоэнцефалитов с предшествующими
вирусными поражениями того же органа как проявления генерали-
зации респираторных вирусных или герпетических инфекций. При
этом сочетанная вирусно-бактериальная, например гриппозно-ме-
нингококковая, инфекция протекала значительно тяжелее менин-
гококковой, что послужило основанием для включения в комплекс
ранней терапии менингококковой инфекции противогриппозного
гамма-глобулина [Дадиомова М. А. и др., 1978].
При исследовании процессов д и с с е м и н а ц и и и генерали-
зации было выявлено, что они протекают различно при моно- и
сочетанных инфекциях. Наиболее отчетливо это было показано
Г. В. Шастиной (1988), которая обнаружила, что в кишку из органов
430
дыхания происходила диссеминация лишь одного из 2—3 вирусов,
вызвавших там патологический процесс. Относительно низкая час-
тота поражения кишки несколькими вирусами объясняется прежде
всего сроками развития разных ОРВИ, в частности, тем, что про-
явления генерализации в кишке второй по времени возникновения
инфекции могли еще не развиться, или тем, что первое поражение
находится уже в стадии обратного развития. Наряду с этим опре-
деленное значение имеет и интерференция. О последнем свидетель-
ствовала относительная стабильность частоты генерализации адено-
вирусной инфекции при моно- и сочетанных инфекциях, в то время
как при РНК-инфекции отмечалось снижение частоты генерализа-
ции при микстинфекции. Эти различия можно объяснить тем, что
РНК-вирусы являются высокоактивными индукторами интерферона.
ДНК-вирусы, склонные к персистенции, индуцируют его значитель-
но’ хуже.
При специальном изучении взаимоотношений бактериального,
преимущественно стафилококкового, чаще пупочного сепсиса с ос-
трыми респираторными инфекциями (вирусными и микоплазмоза)
выявлено явное влияние последних на развитие и обострение сепсиса
[Цинзерлинг А. В. и др., 1982]. Полученные данные позволили
связать это влияние ОРВИ с рядом местных и общих воздействий.
Среди местных причин существенное значение имело прямое по-
вреждение кровеносных сосудов вирусами и микоплазмами, что
сопровождалось развитием характерных структурных изменений эн-
дотелия и повышенной проницаемостью сосудов. Наряду с этим
существенное значение имеет иммунодепрессивное действие ОРВИ,
особенно типичное для гриппа.
Высокая частота сочетанных инфекций выявлена нами также
при исследовании плацентитов [Цинзерлинг А. В., Мельникова
В. Ф., 1988 ] и внутриутробных инфекций [Цинзерлинг А. В., 1980,
1986]. То же отмечается на текущем материале при исследовании
совместно с Г.' В. Шастиной и Н. Г. Глуховец мазков из уретры
и канала шейки матки женщин с воспалительными забо-
леваниями гениталий и неблагоприятным акушерским анамнезом.
Аналогичные результаты получены при начатом совместно с
А. Д. Сапаргалиевой исследовании уретритов и простатитов у
мужчин с хроническими урологическими заболеваниями.
Наконец, существенное значение могут иметь сочетанные ин-
фекции и для развития инфекционно-аллергических заболеваний —
гломерулонефритов, миокардитов и васкулитов. Эти процессы обыч-
но связывают лишь со стрептококковой инфекцией. Нами они на-
блюдались и при исключении стрептококковой инфекции в случае
повторного перенесения за короткий срок ОРВИ [Цинзерлинг А. В.,
1977; Валькович Э. И., 1978; Варясин В. В., Шастина Г. В., 1983].
Правда, эти инфекционно-аллергические поражения были выражены
Умереннее, чем те, которые описываются как осложнение стрепто-
кокковой инфекции.
Таким образом, результаты разносторонних исследований раз-
личных секционных, биопсийных и экспериментальных материалов,
431
а также последа свидетельствуют о большой частоте и вариабель-
ности сочетанных инфекций. Последнее в значительной мере обус-
ловливается сложными взаимоотношениями, возникающими между
сочетающимися инфекциями, поскольку лишь в относительно редких
случаях происходит параллельное развитие нескольких процессов.
Наиболее часто отмечается существенное влияние первой инфекции
на вторую, поскольку она создает благоприятные условия для раз-
вития второй, прежде всего в результате повреждения местных
защитных механизмов. В наибольшей степени это выражено в ор-
ганах дыхания и головном мозге.
Существенное значение имеют изменения иммунитета, в том
числе местная иммунная перестройка, что наиболее отчетливо вы-
является в легких и кишке. Это заставляет обращать значительно
большее внимание, чем это обычно делается, на лимфогистиоци-
тарно-плазмоцитарные инфильтраты в строме органов. С лимфо-
макрофагальными сдвигами, происшедшими в ходе первой инфек-
ции, в значительной мере связано интерферонообразование, влияние
которого на вторую инфекцию очевидно.
Наряду с местными иммунными процессами большое значение
имеют процессы, происходящие при инфекционных заболеваниях в
лимфоидной системе в целом. Это наиболее отчетливо выражено
при прямом поражении лимфоидной системы при ВИЧ-инфекции,
однако определяется, хотя и в значительно меньшей степени, и при
других заболеваниях, например гриппе. Возникающее в этом случае
нарушение иммунитета влечет за собой несравненно более тяжелое
течение других инфекций с тенденцией к генерализации и развитию
сепсиса. Следует, конечно, не забывать и о возможном иммунодеп-
рессивном действии лекарственных препаратов, использовавшихся
для лечения первой инфекции или других заболеваний.
На изученных материалах воздействие одной инфекции на дру-
гую осуществлялось, как правило, в результате изменения состояния
макроорганизма, что, естественно, не исключает влияния, которое
мотут оказывать непосредственно друг на друга разные микроорга-
низмы. Это заключается, например, в возможности образования
вирусно-бактериальных, например гриппозно-стафилококковых,
комплексов при пневмониях данной этиологии [Эссель А. Е. и др.,
1978; Максимович Н. А. и др., 1985]. Такие комплексы могут быть
обнаружены и при поражении других органов. Например, их удалось
найти, правда, с очень небольшой частотой, при исследовании ви-
русно-бактериальных энтероколитов [Шастина Г. В., 1988].
9.2. ПЫЛИ, ДРУГИЕ АЭРОЗОЛИ
И ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ
В связи с научно-техническим прогрессом, углублением процессов
урбанизации в настоящее время среди этиологических факторов
воспаления особое значение приобретают аэрозоли — дисперсные
системы, состоящие из жидких и твердых частиц, взвешенных в
газовой среде, обычно в воздухе. К аэрозолям относят пыли, дымы,
туман, смог.
Пыли — аэрозоли, состоящие из взвешенных в воздухе частиц
диаметром 0,1 —100 мкм; дымы состоят из частиц диаметром
1—100 нм. С аэрозолями соприкасаются прежде всего органы
дыхания, кожа и слизистая оболочка глаз. Результат такого со-
прикосновения определяется формой и размерами частиц, их кон-
центрацией в газовой среде, химической активностью и способ-
ностью вызывать в организме иммунные реакции. В зависимости
от перечисленных характеристик частицы, составляющие аэрозоли,
могут вызывать механические, токсические и иммунологические
повреждения.
9.2.1. Механические повреждения
Механические повреждения появляются в большинстве случаев при
воздействии химически инертных пылей и проявляются прежде всего
на слизистых оболочках верхних дыхательных путей и глаз. Важную
роль при этом играют размеры частиц, так как более крупные из
них задерживаются на поверхности слизистых оболочек и не про-
никают в глубь органа. В органах дыхания такие частицы осаждаются
на слизистой оболочке крупных бронхов, а затем за счет функции
ресничек мерцательного эпителия выводятся наружу (ресничковый
клиренс). Форма частиц также имеет большое значение: твердые
частицы с острыми краями являются более интенсивными раздра-
жителями, чем мелкие, мягкие и округлые. Однако при длитель-
ном контакте даже с мелкими инертными пылевыми частицами,
например волокнами хлопка (хлопковая пыль на прядильных
фабриках), развиваются конъюнктивит, ринит и бронхит (крупные
бронхи).
Бронхит обусловлен повреждением преимущественно поверхно-
стного эпителия слизистой оболочки бронхов. При этом нарушается
ресничковый клиренс, а также меняется количество и качество
слизи, вырабатываемой в бронхах, что приводит к уменьшению
резистентности слизистой оболочки бронхиального дерева, к инфек-
ции и нарушению стерильности респираторного тракта [Есипо-
ва И. К., 1975]. Морфологически острый катаральный бронхит ха-
рактеризуется гиперсекрецией желез и увеличением количества бо-
каловидных клеток, гиперемией и отеком всех слоев стенок бронхов.
Изменяется состав слизи, она разжижается, теряет свойственную
ей в норме базофилию, в ней уменьшается содержание кислых
гликозаминогликанов и ШИК-положительных веществ. Устья брон-
хиальных желез резко расширяются, з просвете бронхов накапли-
вается слизь с примесью лейкоцитов и пластами десквамированных
клеток эпителия. Лейкоцитов в слизи больше, чем в инфильтрате,
пронизывающем разные слои стенок бронхов. Слизистая оболочка
может быть изъязвлена, но язвы поверхностные и быстро эпители-
зируются. Воспалительная инфильтрация наиболее выражена в сли-
433
зистой оболочке, в инфильтрате преобладают нейтрофильные лей-
коциты и макрофаги. Катарально-гнойный бронхит имеет анало-
гичную картину, но в инфильтрате и особенно в секрете, растяги-
вающем просвет желез бронхов, преобладают нейтрофилы. При
хроническом катаральном и катарально-гнойном бронхите наряду с
описанными изменениями отмечаются склероз и гиалиноз подсли-
зистого слоя, гипертрофия и гиперэластоз гладких мышц, последние
часто образуют пучки неравномерной толщины, расслаивающиеся
рубцовой тканью. Воспалительный инфильтрат содержит преиму-
щественно лимфоциты, плазмоциты и макрофаги [Есипова И. К.,
1976].
Кожные покровы при воздействии инертной пыли страдают в
меньшей степени, чем бронхи, но и в условиях повышенной по-
тливости и мацерации кожи возможно ее воспаление.
9.2.2. Токсические повреждения
При анализе действия частиц аэрозолей, обладающих токсическими
свойствами, нужно учитывать их размеры. Крупные частицы из
дыхательных путей выводятся быстро, тогда как мелкие проникают
глубоко в просвет альвеол, а затем и во внутреннюю среду органа.
R. J. Richards, С. С. Curtis (1984) выделяют 3 типа реакций легочной
паренхимы при проникновении частиц пыли: 1) первичные реакции
на альвеолярной поверхности, включающие изменения свободной
популяции клеток, сурфактанта и поверхностных альвеолярных бел-
ков; 2) реакцию интерстициальных клеток легкого, вызывающую
фиброгенез; 3) фиброз. По структуре очага хронического воспаления,
возникающего в ответ на проникновение в организм пыли,
А. И. Струков и О. Я. Кауфман (1989) выделяют: 1) хронический
диффузный макрофагальный инфильтрат; 2) зрелую макрофагаль-
ную гранулему с гигантскими многоядерными клетками и без них;
3) эпителиоидно-клеточные гранулемы, чаще саркоидного типа (рис.
9.12, 9.13). Следует отметить, что не только химический состав и
размеры частиц, но и способ получения последних отражаются на
характере вызываемого ими воспаления. Так, ацетатная окись бе-
риллия вызывает гранулематозное воспаление, а окись бериллия,
полученная при температуре 1200°С, и металлическая бериллиевая
пыль такого воспаления не вызывают [Литвинов Н. Н., Казен-
шев В. Ф., 1982].
Как пример воспаления, вызванного аэрозолем с токсическими
свойствами, можно назвать реакцию на мелкодисперсную пыль,
содержащую двуокись кремния. Все виды пылей кремния и его
соединений при ингаляции в легкие вызывают силикоз. Кремний
действует как инородное тело, вызывающее аккумуляцию вокруг
себя макрофагов, пытающихся его фагоцитировать. Однако кремний
обладает цитотоксичностью, по-видимому, специфичной для мак-
рофагов. Факторами, определяющими цитотоксичность, являются
структура, форма, размеры и концентрация частиц.
434
Рис. 9.12. Хроническое воспаление, вызванное пылью. Альвеолит. Окраска
гематоксилином и эозином.
а — диффузный макрофагальный инфильтрат в виде «мурального» альвеолита. х 120; б —
макрофагальный инфильтрат в виде «люминарного» альвеолита, к 75.
Рис. 9.13. Хроническое воспале-
ние, вызванное пылью. Эпители-
оидно-клеточная гранулема сар-
коидного типа. « 50.
Давно было известно, что не все кремниевые соединения об-
ладают цитотоксичностью. Исследования I. G. King и соавт. (1953)
показали, что кристаллический кремний, введенный интратрахе-
ально кроликам, вызывает образование силикотических гранулем
с фиброзом, а при применении образцов аморфного кремния фиб-
роза не возникает. Фиброгенность коррелирует с основной кри-
сталлической структурой двуокиси кремния, обнаруженной в при-
роде и представляющей собой тетраэдр с атомом кремния в центре
и 4 атомами кислорода вокруг [Alisson А., 1979]. Некоторые
нететраэдрные кристаллы кремния нефиброгенны, в то же время
встречаются аморфные соединения кремния с основной тетраэдрной
структурой, обладающие цитотоксичностью и фиброгенной актив-
ностью. Размер также важен: мелкие частицы (размером от 0,5
до 5 мкм) легче всего проникают в альвеолы, крупные — задер-
живаются на уровне трахеобронхиального дерева; частицы менее
1 мкм наиболее фиброгенны.
Макрофагальная цитотоксичность коррелирует с последующим
фиброзом. Попав в цитоплазму макрофагов, частицы кремния вы-
зывают повреждение внутриклеточных органелл, в первую очередь
лизосом и митохондрий. Разрушенные макрофаги выделяют лизо-
сомальные ферменты и другие биологически активные продукты,
часть из которых обладает фиброгенным действием. Кроме того,
установлено, что Т-лимфоциты играют большую роль в кинетике
фибробластических реакций, выделяя фактор, стимулирующий фиб-
робласты. Хотя прямых доказательств аберраций клеточного имму-
нитета при силикозе не получено, показано, что кремний обладает
адъювантным действием, стимулирует Т-лимфоциты и подавляет
В-клетки [Тернер-Уорвик М., 1984; Stankus R. Р. et al., 1980; Reed
Ch. Е., de Shazo R., 1982]. В исследованиях с использованием
тимидиновой метки установлено, что в процессах фиброгенеза уча-
ствуют не только макрофаги, но и, по-видимому, ПЯЛ [Adam-
son I. Y. R., Bowden D. N., 1984].
При силикозе, поражающем в первую очередь легкие, различают
узелковую и диффузно-склеротическую формы [Движков П. П.,
1962].
При узелковой форме узелки (силикотические гранулемы) имеют
размеры от субмилиарного до милиарного. Зрелые узелки образованы
концентрически или вихреобразно расположенными пучками гиа-
линизированной фиброзной ткани. Иногда в таких узелках возможен
некроз вследствие нарушения кровоснабжения [Движков П. П.,
1962].
При изучении динамики формирования узелков, как отметил
,П. П. Движков (1962), в ответ на попадание кварцевой пыли в
просвет альвеол наблюдаются внутриальвеолярный выход макрофа-
гов и фагоцитоз ими пылевых частиц. Образующиеся пылевые клет-
ки формируют компактные клеточные скопления, причем на 10—
20-е сутки в таких скоплениях начинается склероз. Таким образом,
зрелые макрофагальные гранулемы превращаются вначале в кле-
точно-фиброзные гранулемы, а затем в фиброзные узелки.
436
Диффузно-склеротическая форма силикоза легких характеризу-
ется диффузным разрастанием фиброзной ткани, нарушением струк-
туры легочной паренхимы и формированием в конечном итоге мик-
рокистозного легкого.
Пары металлов и металлические частицы (цинка,
кадмия, кобальта, титана, вольфрама, алюминия), а также их сплавы
и некоторые соединения этих металлов вызывают интерстициальные
поражения легких — пневмониты, диффузный интерстициальный
фиброз легких [Движков П. П., 1962; Davison A. G. et al., 1983;
Humiczewska М. et al., 1983]. При вдыхании пыли, содержащей
частицы кобальта [патологоанатомические наблюдения П. П. Движ-
кова (1962) ], на фоне пневмосклероза определяются скопления сло-
истых телец с положительной реакцией на железо, а также гигант-
ские многоядерные клетки типа инородных тел с мелкими частицами
в цитоплазме. При силикозе и других поражениях легких, вызванных
неорганическими пылями, возникают гранулемы типа зрелых мак-
рофагальных гранулем, что свидетельствует об отсутствии или не-
значительном участии в процессе клеточно-опосредованных иммун-
ных механизмов. В то же время A. Hartmann и соавт. (1982) опи-
сывают две клинические формы заболеваний органов дыхания у
работающих со сплавами твердых металлов — пневмониты и брон-
хиальную астму. Отмечается, что основной компонент этих спла-
вов — кобальт — обладает не только цитотоксическим, но и ал-
лергическим действием, которое A. G. Davison и соавт. (1983) объ-
ясняют чрезвычайно легкой растворимостью ионов кобальта в
биологических жидкостях.
Большой интерес представляют изменения в легких при попа-
дании в просвет бронхиол и альвеол пылевых частиц сульфида
кадмия. При этом, как было нами показано, развиваются по-
вреждение пневмоцитарной выстилки с гиперпродукцией пневмо-
цитами II типа сурфактанта, миграция в зону воспаления макро-
фагов, поглощение ими частиц сульфида кадмия и фрагментов
поврежденного сурфактанта, активация макрофагов, а также в фи-
нале диффузный интерстициальный склероз (рис. 9.14).
Р. D. Meyer и соавт. (1981) описали три наблюдения професси-
онального заболевания легких у точильщиков инструментов, арми-
рованных карбидом вольфрама. Выявлен интерстициальный фиброз,
главным образом перибронхиальный, сопровождающийся «десква-
мативным» альвеолитом.
При вдыхании пыли и паров металлического алюминия и его
соединений в легких возникают диффузные фиброзные изменения,
локализующиеся перибронхиально и периваскулярно [Движ-
ков П. П., 1962]. В то же время, по данным этого автора, внут-
Ритрахеальное введение крысам 50 мг чистого металлического алю-
миния приводит к образованию.в легких милиарных эпителиоидных
Узелков с последующим их склерозированием. G. Ungvary и соавт.
П982) отмечают, что при введении порошка силиката алюминия
крысам в очагах накопления этого вещества различаются два типа
клеток: в центре — темные, а по периферии — светлые с вакуо-
437
Рис. 9.14. Изменения
легких крыс при введе-
нии частиц сульфида
кадмия.
а — в просвете альвеол —
экссудат из гематогенных эле-
ментов, фрагментов разрушен-
ного тубулярного миелина и
осьмиофильных телец, 2-е сут-
ки после введения сульфида
кадмия, х 6000; б — деструкция
сурфактанта с отторжением его
в просвет альвеол, 2-е сутки
эксперимента, * 16 000;
Рис. 9.14. Продолже-
ние.
в — фагоцитоз частиц сульфи-
да кадмия и поврежденного сур-
фактанта. Фрагмент макрофага
с фаголиэосомой, 7-е сутки экс-
перимента. х 16 000.
лизированной цитоплазмой. В клетках обоих типов, но больше в
темных, содержатся слоистые тельца с чередованием электронно-
плотных и электронно-светлых зон.
Приведенные данные свидетельствуют о том, что в основе дей-
ствия аэрозолей, содержащих твердые или жидкие частицы с ток-
сическими свойствами, лежит способность таких частиц повреждать
элементы аэрогематического барьера и влиять на активность мак-
рофагов в альвеолярных структурах. Указанные механизмы обус-
ловливают пролонгированный характер воспаления, развитие дис-
регенераторных изменений, включение в процесс макрофагов с их
регуляторным влиянием на процессы склерозирования.
Близки по характеру вызываемых воспалительных реакций к
перечисленным аэрозолям с токсическими свойствами частиц пары
отравляющих веществ кожно-нарывного и удуша-
ющего действия. Детальная характеристика воспаления при
воздействии этих веществ дана С. С. Вайлем (1932). Важно отметить,
что эти и другие сходные с ними аэрозоли обладают выраженным
повреждающим действием на биологические структуры. В зависи-
мости от его интенсивности некробиотические изменения слизистых
оболочек и кожных покровов могут быть более или менее глубокими.
При этом развиваются воспаление с выраженным альтеративным
компонентом (фибринозно-некротический ринит, трахеит, бронхит,
пневмонит) или острое серозное воспаление (образование пузырей
на коже), острый токсический отек легких. Сходные изменения
Могут возникать при токсичных промышленных выбросах или в
Условиях экологической катастрофы.
439
У вдыхавших пыль окиси марганца описаны химические пнев-
монии. Пары ртути и углекислого никеля также могут вызывать
химические пневмонии и пневмониты, при этом возможны переход
острых форм в хронические и легочный фиброз. Более частой при-
чиной химических пневмоний являются промышленные газы —
двуокись азота, двуокись серы, хлор, аммиак [Yamamoto Ich.,
Takahashi М., 1984]. Двуокись азота, образующаяся при распаде
силоса, может вызывать острый отек легких, хронический пневмони
или бронхиолит.
В коже и конъюнктиве при проникновении в них неорганических
пылей развиваются гранулематозные изменения. Они могут возни-
кать не только вследствие контакта с пылью в процессе професси-
ональной деятельности, но и, например, при введении средств,
адсорбированных на алюминии. Так, N. A. Fawcet, N. Р. Smith (1984)
описали у 3 больных формирование на месте вакцинации против
дифтерии, столбняка и коклюша узелков, образованных лимфоци-
тами, макрофагами, плазматическими и многоядерными гигантскими
клетками.
Соединения бериллия (в первую очередь силикат бериллия) обус-
ловливают реакции, резко отличающиеся от тех, которые вызваны
другими неорганическими пылями. S. Schonherr и I. Pevny (1985)
оценивают бериллий и его соли как высокопотенциальный аллерген
или фотоаллерген.
Болезнь, вызываемая бериллием, имеет две формы [Тернер-
Уорвик М., 1984]: острый преходящий отек легких и хронический
прогрессирующий гранулематозный процесс, сходный с саркоидо-
зом, но не тождественный ему. В работах D. Fraiman и Н. L. Hardy
(.1971), описавших 130 случаев бериллиоза отмечаются более
разнообразные поражения — бронхит, пневмонит, диффузный ин-
терстициальный пневмонит с гранулематозным компонентом, гра-
нулемы саркоидного типа (рис. 9.15, а).- В 64% случаев обнару-
жены внутриклеточные кальцифицированные включения (так на-
зываемые конхоидальные тельца), которые по виду незначительно
отличаются от саркоидных телец Шаумана (рис. 9.15, б). Кон-
хоидальные тельца выявлены как в случаях с пневмонитом, так
и в случаях с мелкими, плохо сформированными гранулемами и
с хорошо сформированными гранулемами саркоидного типа. Кроме
того, S. Schouherr, I. Pevny (1985) указывают на кожные прояв-
ления бериллиоза в виде язв.
I. Sterner и М. Eisenbud (1951) предположили, что бериллий,
попадая в организм, связывается с белками, образуя комплексный
антиген. При этом, по данным авторов, в иммунном воспалении
играют роль иммунопатологические реакции по типу гиперчувст-
вительности как немедленного, так и замедленного типа. В даль-
нейшем было установлено, что бериллию присущи свойства гаптена:
растворимые и нерастворимые соединения бериллия, соединяясь с
белками организма, способны индуцировать ГЗТ [Алексеева О. Г.,
1965; Nishimura М., 1966; Chiappino G. et al., 1968; Reeves A. L. et
al., 1970]. Кроме того, установлено [Васильева Е. В., Орлова А. А.,
440
Рис. 9.15. Изменения легких при бериллиозе и экзогенном аллергическом
альвеоли.'е. Окраска гематоксилином и эозином.
• — эпителиоидно-клеточная гранулема при бериллиозе. х 100; б — конхоидальные тельца в
ткани легких при бериллиозе. *400; в — мелкие эпителиоидно-клеточные гранулемы при
экзогенном аллергическом альвеолите. Трансбронхиальные биоптаты. * 75; г — экзогенный
аллергический альвеолит, интраальвеолярные «выросты*. Трансбронхиальный биоптат. х 100.
1976], что бериллий влияет на структуру и спектр белков, синте-
зируемых клетками, и это способствует включению аутоиммунных
механизмов и появлению антител к антигенам, свойственным здо-
ровым (неповрежденным) тканям и характерным патологически не
измененным структурам. По заключению Е. В. Васильевой и
А. А. Орловой (1976)j для воспалительной реакции при бериллиозе
характерны также аутоиммунные механизмы.
Морфогенез бериллиозных поражений, особенно легких, деталь-
но изучен у экспериментальных животных и в клинике. Воспро-
изведение гранулематозных форм поражения у животных зависит
от дозы соединений бериллия. Так, I. Storeer и М. Eisenbud (1951)
при введении больших доз бериллия получили пневмонит. Оте-
чественные исследователи [Движков П. П., Федорова В. И., 1962;
Потапова И. Н., 1968; Васильева Е. В., 1969] обнаружили грану-
лематоз после интратрахеального введения крысам небольших доз
окиси бериллия (2—2,5 мг). А. Поликар (1950) получил грануле-
матоз легких у крыс в ответ на введение им окиси бериллия и
наблюдал адсорбцию белков на попавших в организм частицах
соединений бериллия.
В зависимости от структуры попадающих в организм соединений
бериллия могут преобладать гранулематозные или диффузные (типа
пневмонита) повреждения легких. Согласно данным И. Н. Потаповой
(1967, 1972), при грану ематозном поражении легких можно раз-
личить 2 периода. Первый период охватывает первый месяц после
введения соединения бериллия, когда преобладает общетоксическое
и Иммунопатологическое его действие. Самая ранняя токсическая
реакция на поступление соединения бериллия в легкое протекает
в клетках легочной альвеолы (они повреждаются) и микроцирку-
ляторном русле альвеолярных септ, в котором нарушена проница-
емость [Потапова И. Н., Селезнева Н. И., 1967]. При этом форми-
руются бериллиево-белковые комплексы, вокруг которых скаплива-
ются мононуклеары; в таких создающихся гранулемах макрофаги
(гистиоциты) могут размножаться. По мнению И. Н. Потаповой
(1972), для этих гранулем характерен полиморфный клеточный
состав: наличие наряду с макрофагами и их производными (эпите-
лиоидными клетками) эозинофилов и лимфоцитов. В ранние сроки
(1 нед) обнаруживается также пневмонит с отеком и лейкоцитарной
инфильтрацией альвеолярных септ, а также элементами деструкции
последних вплоть до некроза. К концу 7-х суток начинается склероз
гранулемы, на 2-й неделе — выраженный фагоцитоз бериллиевых
частиц гигантскими многоядерными клетками. В последующие 2—3
нед гигантские многоядерные клетки гибнут, освобождая продук ы
распада с бериллиевыми частицами. С этого периода начинается
вторая стадия процесса с выраженными склеротическими измене-
ниями в легких, формированием вторичных милиарных и субми-
лиарных гранулем, которые склерозируются и превращаются в кле-
точно-пылевые узелки.
В настоящее время показано, что некоторые соединения
циркония (лактат циркония) также способны вызывать форми-
442
рование эпителиоидно-клеточных гранулем [Epstein W. L., 1980].
Довольно детально этот вопрос изучен М. [soda и соавт. (1983),
которые вводили внутрикожно мышам лактат или сульфат циркония.
Первое из этих соединений вызывало образование зрелых гранулем
на 3-й неделе после введения, второе — на 6-й неделе. Гистохи-
мической меткой созревания гранулемы и образования эпителиоид-
ных клеток служит нарастание активности галактозидазы.
9.2.3. Иммунопатологические повреждения
В последнее время отмечают резкое возрастание аллергических гра-
нулематозных диссеминированных поражений легких, вызванных
органическими пылями и аэрозолями. В Международной классифи-
кации болезней (1979) эти заболевания выделены в рубрику «Эк-
зогенный аллергический альвеолит» (ЭАА).
Основные виды антигенов, обусловливающих развитие ЭАА, от-
носятся к различным грибам (термофильные актиномицеты, плес-
невые грибы), а также пылям и аэрозолям, содержащим белки птиц,
рыб, шерсти животных. Нельзя исключить и совместного действия
антигенов грибов и органических пылей, как это было показано
S. Н. Zaidi и соавт. (1983) на примере экспериментального багас-
соза — болезни, вызываемой заплесневелой пылью сахарного тро-
стника. Авторы интратрахеально вводили животным отдельно пыль
отжатого сахарного тростника или в комбинации с термофильными
актиномицетами, а контрольной группе животных — только акти-
номицеты. Оказалось, что типичная картина поражения легких при
багассозе развивается лишь при комбинированном введении пыли
и грибов.
Клинически наиболее актуальными для наших широт формами
ЭАА являются так называемые болезнь любителей птиц и работников
птицефабрик и легкое фермера [Ерохин В. В. и др., 1986]. Легкое
фермера — это ЭАА, вызываемый пылью заплесневелого сена или
соломы, в которой содержатся Aspergillus fumigatus, Aspergillus
umbrosus, Thermoactinomyces vulgaris, Microspora faeni. Заболевание
описано во всех странах мира [Brien О., Dean G., 1982; Fran К. А.,
1985; Reijula Kari, 1985].
Согласно данным К. Бергмана (1985) и Ch. Е. Reed, R. de Shazo
(1982), иммунологические механизмы при ЭАА включают появление
преципитирующих антител с иммунокомплексными механизмами
типа Артюса. Однако, по данным клинических испытаний, показана
возможность участия при ЭАА и клеточно-опосредованных иммун-
ных реакций [Reed Ch. Е., de Shazo R., 1982]. При эксперимен-
тальных ЭАА участие клеточно-опосредованных механизмов обус-
ловлено самой формой моделирования — использованием предва-
рительной иммунизации антигеном в полном адъюванте Фрейнда.
О. О. Орехов и соавт. (1985) также показали наличие при экспе-
риментальных формах ЭАА как иммунокомплексных, так и кле-
точно-опосредованных механизмов.
443
Гистологическая картина поражения легких при ЭЛА, по данным
О. Kawahami и соавт. (1983), X. Эккерта и К. Бергмана (1984),
включает несколько стадий. В острой стадии преобладает картина
интерстициальной пневмонии. В подострой стадии образуются эпи-
телиоидно-клеточные гранулемы, что сочетается с воспалительными
инфильтратами из лимфоидных и плазматических клеток. В хро-
нической стадии на первый план выступают фиброзные изменения
органа.-Авторы выявили в гигантских клетках.двоякопреломляющие
кристаллические инородные тела и тельца Шауманна, которые рас-
полагаются и внеклеточно.
В. В. Ерохина и соавт. (1986) выделяют 3 стадии ЭАА: 1-я —
острая начальная стадия, 2-я — подострая стадия и 3-я — хрони-
ческая стадия. В острой стадии ЭАА обнаруживается альвеоли г,
при этом в септальном инфильтрате преобладают лимфоциты и
плазматические клетки. Электронно-микроскопически отмечаются
отек альвеолярных септ, повреждение пневмоцитов, особенно I типа.
В подострой стадии ЭАА начинается формирование гранулем, ко-
торые состоят из «гистиоцитов», эпителиоидных клеток, гигантских
клеток типа инородных тел. Основное отличие этих гранулем от
саркоидных заключается в нечетком их отграничении от окружа-
ющих тканей. В гранулеме выявляются кристаллические структуры
и конхоидальные тельца. В этот период отмечается увеличение
относительного числа макрофагов. В хронической стадии преобладает
фиброз с формированием сотового легкого.
<По данным О. Kawanami и соавт. (1983), морфологические из-
менения при ЭАА включают следующие признаки: 1) альвеолит,
2) гранулемы, 3) внутриальвеолярные выросты (buds), 4) интер-
стициальный фиброз, 5) сопутствующие изменения. Альвеолит об-
наруживается у всех пациентов. При этом в инфильтрате преобла-
дают лимфоциты, составляющие большую часть септального ин-
фильтрата, плазматические клетки, моноциты и макрофаги.
Гранулемы выявлены у х/з больных ЭАА. Они были небольшими
и «рыхло организованными», что подтверждают и материалы
О. О. Орехова (1986). В гранулемах преобладают гигантские мно-
гоядерные клетки, в основном типа Пирогова—Лангханса, а также
эпителиоидные клетки, макрофаги и лимфоциты; казеозный некроз
и перифокальный фиброз отсутствуют. Гранулемы располагаются
внутриальвеолярно и по соседству с бронхами или артериями (рис.
9.15, в). Внутриклеточные выросты (рис. 9.15, г) образованы мак-
рофагами, лимфоцитами, миофибробластами. На поверхности вы-
ростов иногда обнаруживаются пневмоциты, а в строме — колла-
геновые волокна и материал, который (по плотности) отнесен к
протеогликанам.
При электронно-микроскопическом изучении гранулем и внут-
риальвеолярных выростов подтверждено преимущественное участие
в их образовании гигантских многоядерных, эпителиоидных клеток
и макрофагов, причем эпителиоидные клетки напоминают по струк-
туре клетки саркоидной гранулемы.
Аллергический альвеолит с формированием гранулем возникает
444
как при внутритрахеальном, так и при внутривенном (гематогенном)
поступлении антигена [Орехов О. О., 1986]. В последнем случае
особенно выражены иммунопатологические механизмы (типа фено-
мена Артюса) и васкулиты, что не характерно для типичных форм
ЭАА.
Наряду с органическими пылями аллергические поражения лег-
ких могут вызывать и многие лекарственные препараты. При этом
некоторые из этих препаратов (например, блеомицин) обладают
прямым токсическим действием и способны быть аллергенами. По-
этому во многих случаях поражений легких или других органов,
вызванных лекарствами и сопровождающихся гранулематозными
воспалительными изменениями, используется термин «токсико-ал-
лергические поражения». Вместе с гранулематозным воспалением
при аллергическом альвеолите, связанном с приемом лекарства,
могут выявляться очаговые эозинофильные инфильтраты и эозино-
филия периферической крови [Bedrossian С. W. М., 1982]. По дан-
ным С. W. М. Bedrossian (1982), причиной «пневмоний гиперчувст-
вительности» могут быть сульфаниламиды, пенициллин, пронтозил,
нитрофурантоин, толсеран, сульфосалазин, метотрексат, прокарбо-
зин, сарбамазепин, имипрамин, салицилаты, натрий кромолин (кро-
молин натрия), метилфенидат, дантролен, хлорфапиридин, гидра-
лазин, мекамиламин, салицилазосульфапиридин и др. О. О. Орехов
(1986) наблюдал гранулематозный пневмонит у лиц, которые в
течение длительного времени бесконтрольно принимали антибиотики
и сульфаниламиды. Возникновение гранулематозных поражений лег-
ких в результате применения лекарственных средств, а также ме-
ханизмы его нуждаются в дальнейшем изучении. По-видимому,
возможны сходные гранулематозные поражения печени и почек —
токсико-аллергические гранулематозные гепатиты, нефриты.
9.3. ИЗЛУЧЕНИЯ
В классической электродинамике под излучением понимают обра-
зование электромагнитных волн ускоренно движущимися заряжен-
ными частицами или переменными токами. В зависимости от час-
тоты, а также способа излучения и его регистрации различают
несколько видов электромагнитных волн: радиоволны, оптическое
излучение, рентгеновское и гамма-излучение. О тепловом (темпе-
ратурном) излучении говорят в тех случаях, когда электромагнитное
излучение испускается веществом и возникает за счет его внутренней
энергии. Вынужденное (индуцированное) излучение вещества про-
исходит под действием внешнего (вынуждающего) действия на него
электромагнитной волны. На основе этого эффекта созданы лазеры
(оптические квантовые генераторы, работающие в оптическом ди-
апазоне) и мазеры (диапазон ультракоротких радиоволн).
Биологические эффекты излучений обнаружены давно, их на-
блюдали и описывали многие исследователи, а врачи использовали
в лечении болезней воспалительной природы. Диапазон работ рас-
445
ширялся по мере развития, с одной стороны, физики излучений и
техники, а с другой — представлений о воспалении. Интерес к
биологическому действию как ионизирующих, так и неионизирую-
щих электромагнитных излучений нарастает в связи с расширением
сферы применения устройств, использующих эти излучения. Нео-
бозримое число работ посвящено физическим, химическим и био-
логическим процессам, происходящим при взаимодействии излуче-
ний с биологическими объектами и составляющими их элементами.
Биологическое действие излучений обстоятельно рассмотрено в мо-
нографиях [Петров И. Р.,. 1970; Гуськова А. К., Байсоголов Г. Д.,
1971; Толгская М. С., Гордон Э. В., 1971; Африканова Л. А., 1975;
Давыдов Б. И. и др., 1984; Бардычев М. С., Цыб А. Ф., 1985] и
многочисленных статьях. Морфологические особенности воспаления
в облученных объектах показаны в руководстве [Пономарьков В. И.,
1962 ], монографиях [Краевский Н. А., 1957; Африканова Л. А.,
1975; Иванов А. Е. и др., 1981 ], обзорных статьях [Краевский Н. А.,
Иванов А. Е., 1963].
Анализируя публикации прошлых и последних лет по влиянию
излучений на воспаление, следует обратить внимание на несколько
обстоятельств общего характера. Во-первых, многие закономерно-
сти биологического действия электромагнитных излучений уста-
новлены в экспериментах на животных, а потому существует
проблема их экстраполяции на человека. Во-вторых, многие ранее
полученные факты следует воспринимать критически по ряду при-
чин, в частности из-за неточностей дозиметрии, которая до сих
пор не всегда достоверна. В-третьих, проблема качественной и
количественной оценки реакции биологических объектов на излу-
чения сложна, поскольку зависит от многих факторов, каждый
из которых учесть бывает трудно. Поэтому в каждом случае
необходим многофакторный анализ.
9.3.1. Влияние рентгеновского излучения
на воспаление
Влияние рентгеновского излучения на воспаление, по-видимому,
исторически изучено первым. Установленное еще в прошлом веке
противовоспалительное действие рентгеновских лучей побудило к
проведению большого количества экспериментов для установления
механизмов явления и определения сущности изменений. Вклад
отечественных морфологов в изучение этой проблемы еще на заре
становления радиобиологии подробно рассмотрен В. И. Пономарько-
вым (1962).
В. Г. Гаршин (1938), подводя итоги многолетних исследовании
влияния рентгеновского излучения на течение воспалительного про-
цесса, подчеркивал противоречия, которые выявились во взглядах
разных авторов. Они касались не только количественной стороны
характеристики воспаления (уменьшение — увеличение, торможе-
ние — ускорение), но и изменения качества воспалительной реакции-
446
В. Г. Гаршин и его сотрудники показали, что, во-первых, сущность
действия рентгеновского излучения на воспаление как в больших,
так и в малых дозах одинакова и, во-вторых, наблюдается качест-
венное отличие воспалительного процесса, протекающего под дей-
ствием облучения, от воспаления в обычных условиях. Отклонения
в качестве воспалительного процесса как совокупности многих ре-
акций выражаются в изменении реакций клеток гематогенного про-
исхождения (исчезновение лейкоцитов и лимфоцитов, торможение
образования гигантских клеток) и соединительной ткани (извраще-
ние развития фибробластов, продукция коллагена с иными свойст-
вами, качественное изменение предсуществующих волокон, фиброз
грануляционной ткани). Следует напомнить, что В. Г. Гаршин рас-
сматривал воспаление как общебиологическое явление, слагающееся
из повреждения и реакции на него, в том числе и эпителиальной
ткани.
Выполненные в последующие годы работы подтвердили, что ме-
стное действие рентгеновского излучения на воспалительный процесс
определяется величиной поглощенной дозы, ее распределением во
времени, фазой воспаления, на которую приходится момент облу-
чения. В небольших дозах излучение ускоряет, а в больших —
угнетает течение воспаления; подобным же подавляющим влиянием
обладает и предварительное облучение [Захарьевская М. А., 1938;
Пономарьков В. И., 1962].
На заре развития рентгенотерапии рентгеновское излучение ис-
пользовали для лечения многих острых и хронических воспалитель-
ных заболеваний — абсцессов, фурункулов, гидраденита, панариция,
лимфаденитов, туберкулеза, пневмоний и др. В настоящее время
ионизирующие излучения редко применяют с лечебной целью при
воспалительных заболеваниях, и если используют, то в небольших
дозах. Поэтому морфологические особенности воспаления под вли-
янием излучений сейчас исследуют чаще всего как сопутствующие
лучевой терапии опухолей, реже их регистрируют как ошибки ди-
агностики и терапии. Приведем такой пример, касающийся тубер-
кулеза.
Больная Д., 57 лет, в течение нескольких лет лечилась в районной больнице по
победу хронической пневмонии средней доли правого легкого. С жалобами на общую
слабость, кровохарканье и с подозрением на рак была направлена в клинику. После
i рентгенологического и бронхоскопического исследований установлен диагноз рака
легкого. Больной проведена лучевая терапия в дозе 36,5 Гр, которая не принесла
эффекта. Смерть наступила от профузного легочного кровотечения.
На вскрытии: в дыхательных путях жидкая кровь, просвет правого среднедолевого
бронха значительно сужен за счет сдавления конгломератом увеличенных лимфати-
ческих узлов. Стенка бронха диффузно утолщена, отечна, желтоватого цвета. Ткань
легких воздушна, за исключением плотной, сморщенной средней доли. На разрезе ее
ткань серовато-коричневого цвета с мелкими желтовато-серыми участками диаметром
0,5 см. При гистологическом исследовании (рис. 9.16) обнаруживаются очаги
некроза, сливающиеся туберкулезные бугорки с гигантскими клетками Пирогова—
[Лангханса. Туберкулезный процесс захватывает и разрушает стенку бронха, лимфа-
тические узлы, а также ветвь легочной артерии. В верхней доле правого легкого на
Фоне эмфиземы встречаются единичные туберкулезные бугорки с разнообразными
тигантскими многоядерными клетками н фнбропластической реакцией.
447
Рис. 9.16. Морфология туберкулеза легких после лучевой терапии. Окраска
гематоксилином и эозином, х 240.
а — очаг казеозного некроза, окруженный массивной фиброзной капсулой; б -- сливающиеся
гранулемы с фибропластической реакцией.
Таким образом, непоказанная, а потому и неэффективная лучевая терапия, видимо,
усугубила процесс распада тканей в крупных очагах (следствием которого явилась
аррозня легочной артерии), а в небольших гранулемах способствовала склерозу. Многие
гигантские клетки имели строение не клеток Пирогова—Лангханса, а клеток инород-
ных тел.
Встречающиеся в опухоли и по ее периферии очаги воспаления
часто изменяются под влиянием облучения (рис. 9.17). Сдвиги в
иммунном воспалении при действии ионизирующего излучения за-
ключаются прежде всего в уменьшении числа клеток лейкоцитар-
ного, лимфоцитарного и гистиоцитарного ряда. В эксперименте мож-
но проследить не только уменьшение, но даже и полное прекращение
реакции трансплантационного иммунитета при общем однократном
облучении мышей в дозах 5—8 Гр (рис. 9.18).
Воспалительный процесс изменяет в свою очередь течение лу-
чевых повреждений, что было подробно исследовано Л. А. Африка-
новой (1975). У животных на коже после облучения в дозе 5365 Р
через 2 нед возникают язвы, которые через 25—30 сут эпителизи-
руются и примерно через 3 мес у некоторых особей рубцуются.
Если облучению предшествует введение в подкожную клетчатку
скипидара в подсолнечном масле, то-морфология язвы кожи изме-
няется. Облучение непосредственно вслед за введением скипидара
вызывает значительный отек кожи, первичная лучевая язва разви-
вается уже в конце 2-й недели после облучения, некротические
изменения возникают не только в дерме, но и в подкожной клетчатке
448
Рис. 9.17. Рак гортани. Морфология окружающих тканей до и после
лучевой терапии. Окраска гематоксилином и эозином, х 240.
а выраженное воспаление с реактивным ростом эпителия (до облучения); б — в облученной
Ткани небольшое число лимфоцитов и плазмоцитов^ атрофия железистого эпителия, фиброз.
,s—407
Рис. 9.18. Морфология иммунной реакции в почке мыши на опухолевый
трансплантат. Окраска по методу Ван-Гизона. х 240.
а — инфильтрация трансплантата лейкоцитами, лимфоцитами и гистиоцитами у необлу-
ченных животных; б — отсутствие воспалительной реакции, развитие грануляционной ткани
у облученных животных.
и мышцах. У всех животных процесс завершается глубоким рубце-
ванием. Если облучение проводилось на 4-е сутки после введения
скипидара, то в острый период наблюдается массивный отек кожи,
затем более быстрое образование первичной лучевой язвы, активная
краевая эпителизация и полное рубцевание к 70-м суткам экспе-
римента. У этих животных, несмотря на более тяжелое и глубокое
поражение, восстановительный период сокращается, а рубец отли-
чается хорошей васкуляризацией и компактным расположением фиб-
робластов. У животных, облученных на 20-е сутки после введения
скипидара, различия обнаружены только в фазе восстановления,
которая отличается более интенсивно идущими процессами эпите-
лизации язв и завершается образованием рубца к 4-му месяцу
опыта. Следовательно, воспалительный процесс положительно вли-
яет на эффективность и качество репаративной фазы острой лучевой
язвы кожи'.
Лучевые язвы кожи и подлежащих тканей в клинической прак-
тике встречаются чаще всего в разные сроки после лучевой терапии
злокачественных опухолей. Изъязвление начинается на месте зт-
450
Рис. 9.19. Лучевая язва кожи. Окраска гематоксилином и эозином, х 240.
а — край язвы с массивным отложением фибрина и единичными лейкоцитами; б — глубокие
слои язвы с очаговыми инфильтратами из лимфоцитов и гистиоцитов и пучками грубых
коллагеновых волокон.
Рис. 9.20. Лучевой некроз стенки сонной артерии с инфильтрацией
деикоцитами (а) и без воспалительной реакции (б). Окраска гематоксилином
и эозином, х 240.
15*
451
рофического или гипертрофического дерматита, затем распростра-
няется по периферии и в глубину. Особенностью таких поздних
лучевых язв является торпидное течение с вялой воспалительной
реакцией, затягивающейся на месяцы и годы. Удлиняются все фазы
воспаления, отторжение некротизированной ткани происходит ,яло,
развитие грануляционной ткани и эпителизация также бывают вы-
ражены слабо и продолжаются годами [Бардычев М. С., Цыб А. Ф.(
1985]. Гистологическое исследование лучевых язв показывает на-
личие в них воспаления разной формы и степени выраженности
даже в пределах одной ^звы (рис. 9.19). Отклонения процессов
воспаления от «стандартных» форм выражаются в повышении (или,
наоборот, понижении) сосудистой проницаемости, в сдвигах кле-
точных реакций, в сроках образования соединительной ткани и ее
качества (рис. 9.20). В этих условиях происходят нарушение ауто-
регуляторных механизмов заживления язв и образование «порочного
круга», формирование новой патологической самоподдерживающейся
системы с другими связями между повреждением, воспалением и
репарацией [Шехтер А. И. и др., 1984].
Анализ накопленных данных свидетельствует о том, что изме-
нение воспаления под влиянием ионизирующих излучений патоге-
нетически связано в первую очередь с их прямым местным действием
как на очаг воспаления, так и на окружающие его ткани. Облучение
вызывает изменение клеток гематогенного, сосудистого и стромаль-
ного происхождения, волокнистых структур, микроциркуляторного
русла. Возникновение на месте лучевых повреждений раковых опу-
холей свидетельствует о вовлечении в процесс, и эпителиальной
ткани, т. е. подтверждает взаимосвязь эпителия и соединительной
ткани. Вместе с тем на течение воспаления оказывают влияние
общие опосредованные патогенетические факторы, связанные с со-
стоянием иммунной и эндокринной систем, систем комплемента и
калликреин-кининов, неспецифических факторов защиты. Уже мно-
го лет назад эффект действия рентгеновского излучения объясняли
повышением общей иммунобиологической реакции организма после
облучения инфекционного очага [Могильницкий Б. Н. и др., 1936]
и бактерицидных свойств тканей, вовлеченных в воспаление [Ры-
жих А. Н., 1947]. На основании изучения феноменов Артюса и
Шварцмана пришли к выводу, что между иммунобиологическим
состоянием организма и реакцией ткани на воздействие рентгено-
вского излучения существует зависимость, которая выражается в
более раннем выявлении аллергического состояния, что, вероятно,
связано с повышенной общей ранимостью сенсибилизированного
организма к действию различных раздражителей [Самцов В. А.,
Городецкий А. А., 1936]. В конечном итоге соотношение местных
и общих, прямых и опосредованных факторов определяет характер
воспаления. Особенно отчетливо это доказано при изучении осо-
бенностей воспаления при общем облучении организма, в частности
при лучевой болезни.
452
9.3.2. Воспаление при лучевой болезни
Клинические наблюдения больных острой лучевой болезнью, вы-
званной взрывами атомных бомб в Японии или несчастными слу-
чаями в мирное время, показали значимость развития инфекционных
осложнений в исходе болезни [Гуськова А. К., Байсоголов Г. Д.,
1971 ]. Однако уже при первых патологоанатомических исследова-
ниях обнаружились большие трудности в попытках дифференциро-
вать собственно лучевые повреждения и возникающий инфекцион-
ный процесс. Трудности усугубляются еще и тем, что сам характер
тканевых реакций, наблюдаемых при инфекционных процессах,
претерпевает существенные изменения. Анализ результатов вскры-
тий умерших от лучевой болезни и многочисленные эксперимен-
тальные данные позволяют составить определенное представление
об особенностях воспалительной реакции в облученном организме.
В отечественной литературе классические описания принадлежат
Н. А. Краевскому и его соавт. [Краевский Н. А., 1957; Пономарьков
В. И., 1962; Иванов А. Е., Куршакова Н. Н., Шиходыров, 1981],
материалами которых мы воспользовались.
Во-первых, показано, что воспалительная реакция после облу-
чения извращается не всегда, а только при определенной дозе
поглощенной энергии, близкой к минимально абсолютно смертель-
ной. Так, при облучении кроликов в дозе 600 Р (пороговая доза)
наблюдается как измененная, так и обычная воспалительная ре-
акция. Если доза снижается (400 Р и менее), то на месте внут-
рикожного введения кишечной палочки возникает обычная картина
гнойного воспаления. При облучении в дозе 800 Р и более вос-
паление носит некротически-геморрагический характер. Очаг вос-
паления в центре представлен фибриноидным некрозом с обилием
микробов, а по периферии — умеренной клеточной инфильтрацией
лимфоцитами, нейтрофильными палочкоядерными гранулоцитами
и гистиоцитами.
Во-вторых, установлено, что воспалительные изменения возни-
кают при лучевой болезни не сразу, а спустя известное время после
облучения в зависимости от тяжести лучевого поражения. При
облучении в пределах минимальных смертельных доз чем раньше
после облучения возникает очаг воспаления, тем он в морфологи-
ческом отношении ближе к типичной воспалительной реакции. Такая
же реакция наблюдается в начале выздоровления и в более поздние
сроки. Наоборот, наибольшие отклонения от типичной картины
воспаления наступают на высоте лучевой болезни.
В-третьих, показано, что инфекционные осложнения лучевой
болезни имеют довольно определенную локализацию, в частности
встречаются в полости рта, кишечника и органах дыхания. Пнев-
мония как одно из наиболее частых осложнений болезни отличается
большим своеобразием [Базан О. И., 1961; Иванов А. Е. и др.,
1981]. Как правило, она возникает на фоне собственно лучевых
изменений легочной ткани, представлена серозно-геморрагическим
или фибринозно-геморрагическим воспалением с экссудатом, бедным
453
клетками, медленно подвергается рассасыванию или организации.
Морфологические проявления пневмонии весьма разнообразны, по-
скольку они обусловлены множеством внешних и внутренних фак-
торов.
В-четвертых, развитие инфекционн х осложнений при острой
лучевой болезни происходит по типу аутоинфекции в условиях
резкого угнетения кроветворения, падения иммунологической реак-
тивности организма, глубоких местных изменений метаболизма тка-
ней и клеток, нарушения процессов регенерации.
Изучение последствий взрыва атомных бомб, а также аварий на
АЭС выявило большое число комбинированных радиационных по-
ражений — радиационно-термических, радиационно-механических
и др. Установлено, что при комбинированных поражениях часто
возникают токсико-инфекционные осложнения с развитием гнойной
и анаэробной инфекций [Хромов Б. М., 1959]. Возникающие в этих
условиях инфекционные процессы не только отягощают течение
лучевой болезни, но и становятся непосредственной причиной смерти
от сепсиса. Многочисленные опыты на животных разных видов
выявили нарушения механизмов антитоксической и противоинфек-
ционной резистентности организма, что сказывается на качествен-
ных и количественных закономерностях развития местной воспали-
тельной реакции.
Морфологические особенности воспаления при хронической лу-
чевой болезни исследованы менее полно. Как известно, эти формы
лучевой болезни отличаются постепенным развитием и длител!ным
волнообразным течением, отражающим сочетание медленно нара-
стающих эффектов повреждения с признаками восстановительных
процессов и приспособительными реакциями. Только при тяжелых
степенях поражения вследствие ослабления иммунитета возможны
инфекционно-септические осложнения [Гуськова А. К., Байсого-
лов Г. Д., 1971 ]. Показано, что по окончании острой фазы вирусного
гриппа у мышей, предварительно многократно подвергавшихся воз-
действию малых доз рентгеновского излучения, развиваются очаги
пролиферации бронхиального эпителия в альвеолы. Возникновение
пролифератов и развивающийся затем склероз тесно связаны с
изменениями острого периода течения гриппа у облученных живо-
тных в виде геморрагий, отека, гнойных бронхитов, ателектазов
[Эмайкина В. П., 1964 ].
9.3.3. Оптическое излучение и воспаление
Энергия оптического излучения, включая инфракрасное, видимое
и ультрафиолетовое, широко используется в медицинских целях.
Поглощенная часть энергии преобразуется главным образом в теп-
лоту, повышая температуру облучаемого тела или его участка. Для
местных облучений при острых и хронических воспалительных про*
цессах уже давно применяют светолечебные лампы (соллюкс, лампы
Минина, инфракрасного облучения и т. д.). В последние десятилетия
в медицинской практике все шире применяют лазерное излучение,
которое получают с помощью нескольких типов установок различ-
ного целевого назначения. Так называемый световой скальпель со-
здает узкую зону асептического коагуляционного некроза с мини-
мальными деструктивными изменениями окружающих тканей, ко-
торая замещается тонким васкуляризованным рубцом. Указывают,
что в лазерной ране не развивается значительной воспалительной
лейкоцитарной реакции, не возникает вторичных некрозов, связан-
ных с образованием массивной лейколимфоцитарной инфильтрации
в окружающих тканях [Галанкин В. Н. и др., 1979; Пархомен-
ко Ю. Г. и др., 1979; Пархоменко Ю. Г., 1983; Галанкин В. Н.,
Боцманов К. В., 1984; Соловьев В. А., 1985].
Течение воспалительной реакции под влиянием лазерного излу-
чения изучено недостаточно. Отдельные клинико-морфологические
наблюдения и немногочисленные экспериментальные исследования
свидетельствуют о положительном лечебном действии расфокусиро-
ванного лазера. Облучение ран у крыс инфракрасным лазером вы-
зывает повышение проницаемости сосудов, увеличение количества
эритроцитов, нейтрофильных палочкоядерных гранулоцитов и лим-
фоцитов, усиление обменных процессов, но не меняет физиологи-
ческой последовательности процессов заживления [Архангель-
ский А. В. и др., 1980].
Морфологическое исследование биоптатов пораженных тканей
при гнойных заболеваниях и гнойных ран мягких тканей после
некрэктомии с помощью углекислотного лазера выявило их очище-
ние, стимуляцию регенераторных процессов и сокращение сроков
лечения больных [Елисеенко В. И. и др., 1984, 1987]. Механизм
ускоренной репарации авторы связывают с термическим воздейст-
вием лазерного излучения, приводящим к обезвоживанию, уплот-
нению коагуляционных тканей, стерилизации раневой поверхности,
резкому уменьшению сосудистой проницаемости. Отсутствие мик-
робного обсеменения ведет к значительному снижению лейкоцитар-
ной реакции и интенсивности всех компонентов экссудативного
воспаления. Последнее обусловлено отсутствием выброса медиаторов
воспаления, в частности кининов, снижением активности тканевых
и отсутствием бактериальных гиалуронидаз. Наличие в грануляци-
онной ткани мононуклеарных клеток и лимфоидно-клеточных ин-
фильтратов свидетельствует о нарастании иммунологических реак-
ций в организме.
Экспериментально установлена значимость микробного фактора
в развитии лейкоцитарной инфильтрации при заживлении лазерной
Раны, определены роль и место химической модификации ткани
под действием луча лазера в возникновении указанного явления
1Галанкин В. Н., Боцманов К. В., 1984]. Отмечено, что нейтрофиль-
ные палочкоядерные гранулоциты появляются в ране не столько в
Связи с необходимостью расплавления, сколько в результате обра-
зования в раневом содержимом хемотаксических факторов, обус-
ловленных наличием микроорганизмов, СЗа- и С5а-компонентов
, Комплемента, клеточных продуктов, липидов и других факторов.
455
Отсутствие хемотаксических веществ делает некротические ткани
«непривлекательными» для лейкоцитов, но макрофаги способны оты-
скивать и резорбировать находящиеся в ткани даже биологически
инертные объекты.
Лазерное излучение стимулирует заживление ран и посредством
стимуляции роста микрососудов, не оказывая существенного влияния
на скорость их дифференцировки. Источником образования микро-
сосудов служат кровеносные капилляры недеформированной соеди-
нительной ткани, окружающей рану [Барковский В. С„ 1983 ].
В пределах рациональных параметров лазерного облучения макси-
мальный стимулирующий эффект достигается при минимальном
термическом повреждении. Выраженное (вплоть до частичного обуг-
ливания) термическое повреждение тканей при излучении большей
мощности все же обеспечивает более предпочтительные условия для
заживления ран вторичным натяжением, чем те, которые имели
место без воздействия лазера [Елисеенко В. И. и др., 1987].
Таким образом, морфологические отличия лазерных ран заклю-
чаются в сокращении сроков второй фазы воспаления (снижение
или подавление реакции микроциркуляторного русла и экссудации)
и ускорении третьей фазы воспаления (пролиферация клеток мак-
рофагального и фибробластического ряда) с восстановлением ткани
или образованием рубца. Первая фаза воспаления (повреждение
тканей и клеток) по времени и тяжести зависит от мощности,
фокусировки излучения и других факторов.
9.3.4. Влияние электромагнитного излучения
на воспаление
Как известно, волны разной полосы частот подводят к облучаемым
участкам тела человека методами дарсонвализации и диатермии,
индуктотермии и микроволновой терапии. Волны дециметрового
диапазона проникают через кожу без существенных потерь и по-
глощаются глубоко расположенными органами и тканями, что со-
здает благоприятные условия для физиотерапии при многих воспа-
лительных заболеваниях.
В связи с развитием радиосвязи, телевидения, радиолокации,
космонавтики и других отраслей науки и техники усиливается общее
воздействие на человека радиоволн разных диапазонов и различной
интенсивности. Биофизика их взаимодействия с биологическими
объектами, разнообразные эффекты, изменения органов и тканей
описаны сравнительно полно [Толгская М. С., Гордон 3. В., 1971;
Петров И. Р., 1979; Давыдов Б. И. и др., 1984].
Биологические эффекты являются результатом поглощения энер-
гии электромагнитных волн. С одной стороны, это непосредственное
действие физического фактора через теплообразование, а с другой —
опосредованное влияние через различные физиологические системы.
Процессы теплообразования при разных условиях воздействия и в
различных объектах происходят неодинаково. Электромагнитные из-
456
лучения малой мощности миллиметрового диапазона не вызывают
нагрева тканей, и их действие на организм носит информационный
характер. В конечном итоге осуществляются вазомоторные реакции
с расширением сосудов микроциркуляторного русла, повышением
их тонуса, усилением циркуляции крови и лимфы, улучшением
трофики, стимуляцией тканевого обмена. Лечебный эффект отме-
чается при сравнительно большой интенсивности облучения и оп-
ределяется как местным тепловым эффектом, так и влиянием на
нервные, гормональные и иммунные механизмы всего организма.
Систематических морфологических исследований особенностей вос-
паления при этом не проводилось. Поскольку патогенез изменений
связан с явлениями перегрева, то по аналогии следует ожидать
сходства морфогенеза воспаления при разных видах теплообмена.
. В литературе имеются материалы исследований изменений им-
мунологической реактивности организма, свойств микроорганизмов,
вирусов и простейших при воздействии электромагнитных излучений
диапазона радиочастот. Отмечено отчетливое отягощение течения
инфекционного и инфекционно-токсического процесса в экспери-
менте под влиянием высокоинтенсивного излучения. При длительном
воздействии низкоинтенсивного излучения также выявлены более
тяжелое течение и большая частота инфекционных заболеваний
[Петров И. Р., 1971 ].
9.4. ОЖОГИ
Тяжелые ожоги кожи, занимающие значительную площадь (свыше
10—15%) поверхности тела, вызывают в организме пострадавшего
ряд сложных патологических процессов, которые в своей совокуп-
ности характеризуют развитие ожоговой болезни. Последняя изучена
во многих аспектах достаточно подробно. В патогенезе ожоговой
болезни сплелись воедино нарушения иммунологического, гормо-
нального статуса, сложные обменные изменения, явления токсикоза,
инфекционные и многие другие процессы, которые и обусловливают
своеобразие течения воспалительного процесса.
Для понимания особенностей воспаления при ожогах необходимо кратко охарак-
теризовать некоторую специфичность патогенеза ожоговой болезни. Ожоговой болезни
свойственно выраженное снижение ряда иммунных показателей и развитие вторичной
иммунной недостаточности. С. М. Вишневская и соавт. (1986) показали, что ожоговая
травма у больных с обширными и глубокими ожогами кожи сопровождается выра-
женной депрессией Т- и В-систем иммунитета за счет понижения содержания в крови
преимущественно Т-лимфоцитов, в меньшей степени В-лимфоцитов. причем наблю-
далась прямая корреляция между тяжестью ожога и степенью депрессии. Уточняя эти
Данные, О. М. Захаренко (1986) отметила, что при этом наблюдаются различные
варианты вторичного иммунодефицита, характеризующиеся снижением показателей
как клеточного, так и гуморального иммунитета — снижением содержания в крови
активированных В-лимфоцитов, уменьшением уровня общих и активированных
г-лимфоцитов и резким повышением уровня Т-лимфоцитов-депрессоров. При этом
одновременно резко понижается активность Т-лимфоцитов-супрессоров, отражающая
снижение иммунологической реактивности в целом. Все эти изменения протекают на
Фоне резкого снижения и неспецифических факторов защиты [Портнов Ф. Г. и др..
457
1986] и кратковременной активации некоторых факторов гуморального иммунитета,
в частности лимфотоксичности (тест Bertrams). О. М. Алиев (1986) показал опреде-
ленную фазность изменений некоторых факторов клеточного иммунитета. Так, в
первые 1—2 дня ожогового шока показатели иммунологической активности в боль-
шинстве наблюдений мало изменены. Снижение уровня таких показателей, как общие
и активированные Т-лимфоциты, В-лимфоциты, возникает лишь на 3—4-е сутки
болезни. Этот процесс наблюдается преимущественно при глубоких (III—IV степени)
ожогах (свыше 15% поверхности тела), в то времч как при ожогах менее 15%
поверхности тела и поверхностных ожогах эти показатели снижены незначительно.
Снижение активности указанных факторов в первые дни шока следует расценивать
как крайне неблагоприятный прогностический признак. В этом, в частности, прояв-
ляется в дальнейшем так называемое следовое действие шока, на фоне которого
особенно тяжело протекают разнообразные инфекционные процессы, осложняющие
ожоговую болезнь.
При ожоговой болезни происходят выраженное снижение активности лизоцима,
комплемента, а также угнетение фагоцитарной активности [Алиев О. М., 1986]. По
данным А. Е. Минкиной и соавт. (1986), при ожоговой травме, сопровождающейся
воспалением, отсутствует активная выработка лимфокина, нарушена связь между
сенсибилизированными лимфоцитами и иммуноэффекторными клетками. При этом
отсутствует реакций нейтрофильных лейкоцитов на бактериалыные антигены, что
свидетельствует о нарушении распознавания лейкоцитами бактериальных антигенов.
У пострадавших имеются серьезные нарушения и других видов иммунного ответа, в
частности реакции ГЗТ. Включение этой реакции наблюдается, как правило, при
внутриклеточном паразитировании микроорганизмов, связанном с неполноценностью
и незавершенностью фагоцитоза. В условиях ожоговой травмы отмечается угнетение
этой реакции на все основные бактериальные антигены; почти полностью она отсут-
ствует у больных с осложненной ожоговой болезнью, когда развиваются пневмонии,
сепсис, ожоговое истощение [Минкина А. Е. и др., 1986].
Характерно развитие при ожогах выраженной аутоиммунизащии. В крови у по-
страдавших появляется большое количество циркулирующих иммунных комплексов,
обладающих цитотоксическим действием, и IgE [Елагина Г. А. и др.., 1986], количество
которого увеличивается нередко в 3—7 раз по сравнению с нормо>й.
Своеобразие воспалительного процесса наблюдается во всех его
фазах — альтеративной, экссудативной и пролиферативной. Наи-
более ярко проявляется воспаление в ожоговых раках, в которых
всегда развивается местный инфекционный процесс вследствие об-
лигатного обсеменения раны условно-патогенной микрофлорой [Сар-
кисов Д. С. и др., 1981 ].
’ Воспалительный процесс при ожоговой травме начинается не-
посредственно после возникновения очага первичного поражения,
каковым является некроз кожи, слизистых оболочек и подлежащих
мягких тканей, возникший после действия повреждающего агента
(термического, химического и т. д.). Исследования Н.. И. Кочетыгова
(1973) показали, что непосредственно после действия повреждаю-
щего агента возникает зона так называемого первичного некроза,
обусловленного инактивацией окислительно-восстановительных фер-
ментов и гибелью клеточных белков и липйдов [Sewitt S., 1957]. В
дальнейшем под этой зоной формируется зона вторичного некроза,
обусловленная обычно выраженными микроциркуляггорными изме-
нениями в зоне паранекроза. В связи с распадом некрютизированных
тканей выделяются протеолитические ферменты, развивается ацидоз
вначале только в области раны, где активируется кинишовая система,
что ведет к резкому повышению проницаемости стешок кровеносных
капилляров. Сосудистая проницаемость повышается! также в связи
458
с рёзким увеличением содержания в зоне ожога гистамина, лейко-
токсина, пептонов [Вихриев Б. С., Бурмистров В. М., 1981, 1985].
Уже к концу первых суток происходит обсеменение зоны некроза
разнообразной микрофлорой с последующей вегетацией ее в струпе.
Действие микробных экзо- и эндотоксинов способствует усилению
указанных выше процессов. В этот же период наблюдается активация
гипоталамо-гипофизарно-надпочечниковой системы, стимулирую-
щей секрецию катехоламинов. Таким образом, уже в первые часы
после ожога создаются все условия для развития в области ожоговой
раны воспалительного процесса.
Особенности воспалительного процесса в значительной степени
определяются глубиной и характером поражения. При ожогах I—II
степени, при которых объем некроза незначителен, воспаление носит
преимущественно характер серозного и обычно не сопровождается
последующим нагноением раны. Затем закономерны процессы ре-
генерации. Для ожогов III—IV степени характерна иная последо-
вательность раневого процесса: некроз тканей в момент ожога и
вторичное углубление раны —> реактивный травматический отек
в тканях под зоной некроза —> гнойное демаркационное воспале-
ние —> инфекционный процесс в ожоговой ране —> раневая ре-
парация (рис. 9.21). Одним из наиболее ранних проявлений воспа-
ления в ожоговой ране является демаркационное воспаление. Оно
характеризуется формированием по границе с некротизированными
тканями демаркационного вала, состоящего из нейтрофильных лей-
коцитов, которые функционально высокоактивны. Цитоплазма их
богата гликогеном и липидами, отличается высокой активностью
щелочной фосфатазы и оксидазной активностью [Музыкант Л. И.,
Каем Р. И., 1978, 1983]. Среди нейтрофилов демаркационного вала
в отличие от нейтрофильных лейкоцитов, инфильтрирующих струп,
мало разрушенных клеток. Время формирования демаркационного
вала увеличивается по мере возрастания степени ожога. При ожогах
III—IV степени формирование демаркационного вала заканчивается
обычно к концу первого — середине второго месяца после травмы,
наступает отграничение некроза. Сосудистый компонент воспаления
в ране характеризуется развитием застойного полнокровия капил-
ляров и венул, капилляростаза, микротромбоза, экссудативный ком-
понент — выпотеванием экссудата, богатого глобулинами, эмигра-
цией нейтрофильных лейкоцитов, фибрина, эритроцитов. Лишь к
моменту завершения формирования демаркационного вала в ране
под ним появляются макрофаги, что свидетельствует о торможении
макрофагальной реакции при ожогах. Это можно объяснить в оп-
ределенной мере высокой бактериальной обсемененносгью ожоговой
раны [Кузин М. И. и др., 1981]. Еще J. Rotta и В. Bednar (1963),
В- Неушег и соавт. (1978) продемонстрировали в культуре тканей
тормозящее влияние бактериальных токсинов стрептококка и ста-
филококка на миграцию макрофагов и токсическое воздействие их
на клетку. I. Yoshida и соавт. (1975) показали аналогичное тормо-
зящее действие токсинов грамотрицательных микроорганизмов на
клетку. Не случайно поэтому, изучая макрофаги ожоговой раны и
459
I I
Рис. 9.21. Начальный этап формирования воспалительного процесса в
ожоговой ране. Окраска гематоксилином и эозином.
а — инвазия микрофлоры толще ожогового струпе. к 120; б — формирование множественных
демаркационных валиков (демаркационное воспаление) толще некротической ткани связи
с наличием вторичного некроза зоне ♦скрытого поражения*. * 100.
лимфатических узлов у обожженных экспериментальных животных,
Б. В. Втюрин и соавт. (1981, 1984, 1985) обнаружили выраженные
ультраструктурные изменения в макрофагах и угнетение их фаго-
цитарной активности.
Определенные особенности и гетерогенность нейтрофильных лей-
коцитов удалось изучить, используя метод электронной радиоавтог-
рафии. Д. С. Саркисов и соавт. (1988) показали различие нейтро-
фильных лейкоцитов крови и ожоговой раны в динамике заживления
раны. Нейтрофильные лейкоциты крови отличались низким уровнем
синтеза РНК, так как находились в состоянии покоя. Нередко синтез
РНК в них можно уловить лишь биохимически [Cline М., 1966].
При стимуляции лейкоцитов объектами фагоцитоза или же анти-
генным материалом ожогового струпа отмечаются повышение уровня
синтеза РНК в клетке и увеличение числа синтезирующих клеток.
Нейтрофильные лейкоциты ожоговой раны являются активирован-
ными клетками, на что указывают их морфологические особенно-
сти — многочисленные фагосомы в цитоплазме, большое количество
псевдоподий, ускоренное их «срабатывание», разрушение, а также
резко повышенный (по сравнению с активированными нейтрофиль-
ными лейкоцитами крови) синтез РНК в цитоплазме, способность
к адгезии. Эти клетки содержат в своих фагосомах детрит чаще,
чем бактерии. Нейтрофильные лейкоциты in vitro поглощают бак-
460
терии слабее и синтезируют белок значительно медленнее, чем
нейтрофилы крови. Значительную часть нейтрофилов раны составг
ляют клетки с грубыми нарушениями структуры. В таких клетках
особенно четко проявляется реципрокность синтеза РНК и белка
(чем сильнее выражен синтез РНК, тем слабее синтезируется белок).
Отмечается отсутствие прямой связи уровня синтеза РНК в нейт-
рофиле с фагоцитозом ими бактерий. В лейкоцитах, фагоцитирую-
щих бактерии, напротив, синтез РНК выражен слабее [Паль-
цын А. А., 1987].
Интенсивность фагоцитоза при ожоговой болезни, как считают
большинство исследователей, снижена [Победина В. Г., 1973;
Alexander J. М. et al., 1971; Howard J. Т., Simmonds В. В., 1974],
преобладает незавершенный фагоцитоз в связи с усиленной при
ожогах селекцией микрофлоры и повышенной вирулентностью мик-
роорганизмов [Втюрин Б. В. и др., 1985]. Наиболее выражены эти
процессы при сепсисе, часто осложняющем ожоговую болезнь.
Д. С. Саркисов, В. А. Пальцын, И. И. Колкер (1983), изучая погло-
тительную функцию лейкоцитов, показали, что у больных с сепсисом
при тяжелых ожогах кожи поглотительная способность нейтрофиль-
ных лейкоцитов «флюктуирует» [Alexander J. W. et al., 1971 ], со-
провождаясь временными снижениями фагоцитарного индекса (до
19%) и фагоцитарного числа (до 1,8%) при соответствующих ве-
личинах у здоровых людей 68±8% и 4,2±0,5%. По-видимому, от
продолжительности снижения фагоцитарной активности зависит ис-
ход инфекционных процессов. При изучении поглотительной и пе-
реваривающей способности нейтрофильных лейкоцитов крови у по-
страдавших эти же авторы установили, что сыворотка обожженных
больных в культуре не дает бактериостатического эффекта в отсут-
ствие нейтрофильного лейкоцита (как и сыворотка здоровых доно-
ров). Это противоречит широко распространенному мнению о бак-
терицидных свойствах сыворотки крови. Нейтрофильные лейкоциты
крови обожженных больных в отсутствие сыворотки крови этих
больных (в отличие от нейтрофилов доноров) не убивают микро-
организмы как интра-, так и экстрацеллюлярно. При добавлении
же сыворотки обожженных в культуру клеток способность нейтро-
фильных лейкоцитов к интра- и экстрацеллюлярному лизису бак-
терий значительно возрастает и превосходит даже таковую у здо-
ровых людей: фагоцитарный индекс у доноров — 18,5±5%, у боль-
ных — 64±13% [Саркисов Д. С. и др., 19.88].
Из этих данных можно сделать два вывода. Первый вывод: в
Цитоплазме нейтрофильных лейкоцитов обожженных больных по-
давлены антибактериальные факторы (killed-факторы), что обус-
ловливает феномен незавершенного фагоцитоза. Второй вывод: в
сыворотке крови обожженных содержатся мощные стимуляторы
фагоцитоза, которые пока не идентифицированы. Не исключено,
что ими могут быть некоторые продукты распада раны и нару-
шенного обмена — гликопрртеиды, олигопептиды, лизосомальные
гидролазы и клеточные протеолитические ферменты [Камаев
М. ф_, Ващук В. В., 1976; Ремизова М. И., Кочетыгов Н. И.,
461
r11
Рис. 9.22. Морфология воспалительного процесса в ожоговой ране при
инфицировании ее грамположительными бактериями. Окраска гематокси-
лином и эозином.
а — скопление кокковой флоры в дне раны. «400; б — микроабсцесс на фоне гнойного
воспаления в дне раны, х 160.
1976; Федоров Н. А., 1978; Лившиц Р. И., 1986 J. Возможно также,
что в их роли выступает и бактериальный фактор. Высокая об-
семененность ожоговой раны, обусловливающая Интенсивную ре-
зорбцию продуктов бактериального происхождения, способствует
выработке антител к комплексным антигенам типа ткань + бак-
териальный антиген.
В значительной степени характер воспаления в ожоговой ране
связан с особенностями инфекционного агента, вегетирующего в
ожоговом струпе, а после его отторжения — в ране. В ожоговой
ране вегетируют разнообразные микробные ассоциации, периоди-
чески сменяющие друг друга. В тех случаях, когда в составе
ассоциации преобладает стафилококк, обладающий мощным пио-
генным действием, в ране развиваются выраженное гнойное вос-
паление, глубокая лейкоцитарная инфильтрация грануляционной
ткани, формируются абсцессы (рис. 9.22). При преобладании в
ране грамотрицательных палочковидных микроорганизмов, харак-
теризующихся преимущественно некротическим действием, отме-
чают скопление большого количества фибрина, очаги некроза и
вначале угнетение лейкоцитарной реакции (рис. 9.23). При про-
рыве «грануляционного барьера» в ожоговой ране в тканях, ле-
жащих под грануляциями, образуются гнойные (стафилококк) или
462
Рис. 9.23. Морфология воспалительного процесса в ожоговой ране, инфи-
цированной ассоциациями грамотрицательных бактерий.
— гнойно-некротический процесс в подкожной ткани. Окраска гематоксилином и эозином.
* 200; б — палочковидное микробное тело в толще коллагеновых волокон зоны некроза.
Интенсивное включение 3Н-уридина в цитоплазме микроорганизма. Электронно-радиоавтогра-
фмческое исследование, х 32 000.
некротические (грамотрицательные бактерии) васкулиты, лимфан-
гиты и лимфадениты, свидетельствующие о генерализации инфек-
ции.
Фаза очищения ожоговой раны и последующее гранулирование,
463
организация и эпидермизация отражают заключительный этап вос-
палительного процесса, его пролиферативную фазу.
Фаза очищения ожоговой раны наступает позже по сравнению
с обычной (хирургической) раной, что связано, как уже указывалось
выше, с замедлением формирования демаркационного вала, тормо-
жением лизиса струпа, запаздыванием макрофагальной реакции.
Последнее обстоятельство, по-видимому, связано со значительным
количеством разрушенных лейкоцитов, выделением ими фактора,
тормозящего миграцию макрофагов. Грануляционная ткань поэтому
формируется неравномерно, преимущественно под участками оттор-
жения струпа, а также непосредственно под струпом. Особенно
велико микробное обсеменение при сепсисе у обожженных. Элект-
ронно-радиоавтографическое исследование [Саркисов Д. С. и др.,
1986, 1987 J показало, что при инвазии микроорганизмов в рану
происходит их селекция, повышаются вирулентность и патогенность.
Одновременно меняется характер лейкоцитарной реакции: среди
лейкоцитов грануляционной ткани много разрушенных, мало мак-
рофагов и много лимфоцитов.
Течение этих процессов в значительной степени связано с осо-
бенностями лечения ожогов. В лечении тяжелых ожогов применяют
традиционный «закрытый» метод с использованием масляных повя-
зок и современный комбинированный, который включает как важ-
нейшую составную часть «открытый» метод с применением камер
абактериальной управляемой среды.
.При традиционном «закрытом» методе лечения в ране зона не-
кроза представлена обычно толстым разлагающимся струпом, бога-
тым разнообразной микрофлорой, содержание которой достигает
10e'Vr струпа. Струп обильно инфильтрирован нейтрофильными
лейкоцитами, многие из которых разрушены, что способствует ли-
зису струпа, благодаря выделению лейкоцитарных протеаз, лизосо-
мальных ферментов. Формирование грануляций, как уже указыва-
лось выше, значительно запаздывает вследствие позднего очищения
раны от струпа. Они появляются лишь на 25—ЗО-е сутки после
начала лечения, причем в виде небольших островков. Количество
капилляров в них значительно меньше, чем в «чистых» хирурги-
ческих ранах. Среди клеток грануляций преобладают «круглокле-
точные элементы»; макрофагальная реакция и пролиферация фиб-
робластов угнетены (рис. 9.24, а). Грануляции отечны, инфильтри-
рованы значительным количеством нейтрофильных лейкоцитов,
многие из них распадающиеся (рис. 9.24, б). В грануляционной
ткани часто происходят кровоизлияния в ее толщу, некроз капил-
ляров, что обусловливает неоднородность самих грануляций. Для
фибробластов грануляций характерна гиперпродукция коллагена,
следствием чего нередко является ранний их склероз. При этом
обычно нарушается процесс эпителизации. Характерно также на-
личие в грануляциях большого количества лимфо- и плазмоцитов.
Подобное развитие грануляций ведет к тому, что репаративные
процессы в ране и заживление ее затягиваются нередко до 100 сут,
так как продлеваются сроки некрэктомии и аутопластики в связи
464
Рис. 9.24. Морфология воспалительного процесса в ожоговой ране при
лечении «закрытым» способом.
а — в. инфильтрате наряду с нейтрофильными лейкоцитами много круглоклеточных элементов.
Окраска гематоксилином и эозином. * 400; б — в пищеварительных вакуолях нейтрофильного
лейкоцита располагаются неизмененные коккоподобные микробные тельца. Включения ’’Н-ури-
Дина в цитоплазме микроорганизмов свидетельствуют об их жизнеспособности и незавершенном
фагоцитозе. Электронно-радиоавтографическое исследование, х 32 000.
с тем, что развивающиеся в ране грануляции малопригодны для
приживления аутотрансплантатов.
В отличие от «закрытого» при «открытом» методе лечения ожогов
465
Рис. 9.25. Морфология воспалительного процесса в ожоговой ране при
лечении «открытым» способом в управляемой абактериальной среде. Окраска
гематоксилином и эозином.
а — поверхностное обсеменение ожогового струпа микроорганизмами, х 460; б-в грануля-
ционной ткаии — большое количество фибробластов и кровеносных капилляров, в строме —
единичные нейтрофильные лейкоциты («чистые» грануляции). *240.
быстро образуется сухой тонкий струп, в котором вегетация мик-
рофлоры и инвазия ее обычно угнетены (рис. 9.25, а). Количество
микрофлоры в ране уже на 5—7-е сутки лечения .резко снижено:
поверхностно вегетирующая флора составляет до 10 на 1 см2 раны,
а флора в глубине раны — по 102 на 1 г ткани. Значительно
уменьшается содержание микрофлоры, ведущей в развитии раневой
инфекции, — стафилококка и синегнойной палочки. Полностью
ликвидируется обсеменение кишечной палочкой, протеем, энтеро-
бактериями, стрептококком. На 5—10-е сутки после хирургической
или химической некрэктомии в области раны начинается формиро-
вание грануляционной ткани, содержащей многочисленные капил-
ляры. В ней преобладают активные макрофаги, нейтрофильные лей-
коциты, а плазмоциты единичны (рис. 9.25, б). Характерно отсут-
ствие отека грануляционной ткани и тенденции к раннему ее
склерозу, что типично для «естественного» заживления ожоговой
раны. Даже на 15—20-е сутки грануляции остаются относительно
свежими и содержат большое количество капилляров, что обеспе-
чивает хорошее приживление аутолоскутов. Важной особенностью
является равномерное созревание грануляций, обусловленное отсут-
ствием в ране фокусов нагноения.
Таким образом, для воспалительных процессов при ожогах кожи
характерен ряд особенностей. Они развиваются на фоне вторичной им-
466
мунологической недостаточности, токсикоза продуктами распада ожо-
говой раны и выраженных нарушений обмена, характеризующихся
преобладанием катаболических процессов, гипоксии, выраженных
микроциркуляторных нарушений и дистрофических процессов в клет-
ках паренхиматозных органов. Для воспаления характерно наличие в
очаге массивного некроза и распространенного инфекционного процес-
са. Всё фазы воспаления заметно сдвинуты: альтеративная фаза про-
лонгирована за счет прогрессирующих некроза и нагноения, фаза очи-
щения раны замедлена в связи с угнетением макрофагальной реакции
и фагоцитарной функции лейкоцитов. В эту фазу остаются выражен-
ной «перегрузочная блокада» нейтрофильных лейкоцитов продуктами
распада раны и клеточного детрита, быстрое их «срабатывание». Ха-
рактерно также торможение пролиферативного компонента воспале-
ния, в частности развития капилляров и фибробластов грануляцион-
ной ткани, что придает течению воспалительного процесса некоторые
черты подострого или хронического воспаления, в связи с гиперпро-
дукцией коллагена и ранним неравномерным склерозом. Это, как из-
вестно, свойственно хроническому воспалению в ранах [Аничков Н. Н.
и др., 1951 ]. Торможение пролиферативного компонента воспаления
тесно связано с торможением репаративных процессов, свойственных
ожоговой болезни.
Воспалительные процессы, развивающиеся при ожогах в других
органах и тканях (пневмонии, острые гастроэнтериты, восходящий
воспалительный процесс в почках и печени и т. д.), в целом под-
чиняются тем же закономерностям, которые характеризуют воспа-
ление в ожоговой ране. Однако имеется и ряд патогенетических
особенностей.
Значительная часть воспалительных процессов во многих органах
связана с утратой тканями их барьерной функции. Так, при ожогах
дыхательных путей в связи с утратой функции мерцательного эпи-
телия бронхов наблюдаются нисходящий гнойный трахеобронхит и
«первичная» пневмония, нередко аспирационного типа. Нарушение
свойств эпителия желчных и мочевыводящих путей нередко ведет
к развитию восходящего цистопиелита, гнойного нефрита, холангита.
Наличие длительной бактериемии, свойственной ожоговой бо-
лезни, в сочетании с дистрофическими нарушениями всех элементов
гистогематических барьеров и явлениями незавершенного фагоци-
тоза лейкоцитами и макрофагами обусловливает феномен интра-
целлюлярной микробной инвазии и явления эндоцитобиоза [Втю-
рин Б. В. и др., 1985]. С этим связаны пролонгированный характер
инфекционных процессов при ожогах, а также частое развитие при
них сепсиса. Фактор транзиторной бактериемии и микробного об-
семенения органов играет немаловажную роль в развитии воспали-
тельных процессов в органах и тканях [Каем Р. И., 1966].
Отличительной особенностью ожоговой болезни является обост-
рение ранее существовавших подострых и хронических воспалитель-
ных заболеваний, особенно у лиц пожилого возраста. У тяжело-
обожженных часты обострения хронического бронхита, пневмонии,
Миокардита, гепатита и т. д.
467
ГЛАВА 10
ХАРАКТЕР ВОСПАЛЕНИЯ В ЗАВИСИМОСТИ
ОТ СТРУКТУРНО-ФУНКЦИОНАЛЬНЫХ
ОСОБЕННОСТЕЙ ОРГАНОВ И ТКАНЕЙ
В главе показано своеобразие воспалительной реакции в зависимости
от структурно-функционалыных особенностей легких, желудка, ки-
шечника, брюшины, печени, почек, сердца, сосудов, мышц, суставов,
костей, ЦНС, кожи.
10.1. ЛЕГКИЕ
Воспаление в легких развивается чаще в бронхах, чем в респира-
торном отделе, поскольку первые представляют открытую среду для
повреждающих факторов внешней среды. Но, несмотря на много-
численные защитные механизмы, инфекционные и другие агенты
проникают в бронхиолы, альвеолы, вызывая бронхопневмонию. По-
следняя при этом носит очаговый характер и до слияния по величине
соответствует пораженному калибру бронхов, подразделяясь на сег-
ментарную, субсегментарнуво, дольковую, ацинозную. Гематогенное
поражение альвеолярной паренхимы развивается реже, в частности
метастатическим путем и преимущественно в верхних отделах лег-
ких, нося очаговый характер, и часто в субплевральных отделах.
Двусторонний, лобарный или тотальный характер носят развиваю-
щиеся гематогенно пневмонии при системных, нередко аутоиммун-
ных заболеваниях, когда базальные мембраны альвеол поражаются
антителами или иммунными комплексами.
Воспаление в легких, как и в других органах, развивается на
базе микроциркуляторного русла, из которого проникают нейтро-
фильные палочкоядерные гранулоциты, «запускающие» воспаление,
где локализуются лаброцйты, поддерживающие процесс, выделяя
активные биологические амины. Надо иметь в виду, что в легком
есть участки, где микроциркуляторное русло развито слабо, прак-
тически отсутствует, где нет скоплений лаброцитов или их мало.
Это плотные фиброзные прослойки, окружающие крупные бронхи
первых порядков, адвентиция всех ветвей легочной артерии до
разветвления на артериолы, а также прослойки, подразделяющие
анатомические единицы легких, особенно в верхних отделах; далее
они сливаются с плеврой. Здесь проходят лимфатические коллек-
торы, вены, заложены лимфатические.фолликулы — часть иммунной
системы легких. Соединительная ткань представлена компактно рас-
положенными пучками коллагеновых волокон, единичными эласти-
ческими волокнами. Из клеточных элементов преобладают фибро-
468
бласты, мало гистиоцитов, миофибробластов. В связи с отсутствием
развитого микроциркуляторного русла клеточные воспалительные
инфильтраты здесь развиваются слабо или отсутствуют. Однако
• вследствие проникновения в лимфу из соседних воспалительных
очагов протеолитических ферментов происходит растворение, как
бы «расчесывание» коллагеновых фибрилл, между которыми скап-
ливается лимфа. Эти изменения наблюдаются и при гемодинами-
чески обусловленном отеке легких и нередко. рентгенологически
ошибочно принимаются за интерстициальную пневмонию. Исклю-
чением служит вовлечение этих прослоек в нагноительный процесс,
когда почкующиеся капилляры грануляций проникают в них или
расплавляются под действием ферментов нейтрофилов.
В легком обильно развита микроциркуляторная сеть в альвео-
лярной ткани, всей толще мелких бронхов, внутренней и средней
оболочках крупных бронхов. Строма здесь рыхлая, преобладают
ретикулярные и тонкие коллагеновые волокна. Именно эти струк-
туры являются основной базой воспалительных реакций легкого.
10.1.1. Бронхит
Следует выделять воспаление: 1) проксимальных крупных и средних
бронхов и 2) дистальных мелких бронхов и бронхиол. Это подраз-
деление оправдано дифференцированной клинической картиной [Чу-
чалин А. Г., 1986] и рядом анатомических особенностей: наличием
«адвентиции» в проксимальных отделах бронхов и особой защитной
I системой их слизистой оболочки в виде мукоцилиарного аппарата,
мощной системой бронхоассоциированной лимфоидной ткани в виде
фолликулов (БАЛТ), крупными лимфатическими коллекторами в
' адвентиции. Благодаря этим структурам, обеспечивающим высокий
бронхолимфатический клиренс, и иммунным реакциям в крупных
бронхах воспаление проявляется менее ярко, чем в мелких, и чаще
в виде эндомезобронхита, а не панбронхита [Струков А. И., Кодо-
I лова И. М., 1970].
Первым при воспалении бронхов реагирует мукоцилиарный ап-
парат, представленный взаимодействием ресничек цилиарного эпи-
телия, с секретом бокаловидных клеток эпителиальной выстилки и
г белково-слизистых желез. Реснички совершают до 1500 колебаний
в минуту. Каждое колебание происходит в две фазы — эффективную
и возврата в спокойное состояние. Подсчитано, что попавшие в
бронхи инородные частицы благодаря движению ресничек контак-
тируют в норме с одной клеткой не более */10 с, что затрудняет
Развитие инфекции [Шварцман Я. С., Хазесон Л. Б., 1978]. При
воспалительной гиперемии бронхов нарушается вязкость секрета,
так как нарастает количество бокаловидных клеток, выделяющих
более вязкий секрет, чем железы. Реснички при этом обволакиваются
слизью (рис. 10.1), замедляют свою работу вследствие возросшего
сопротивления и подвергаются деформации (их органеллы слипа-
йся, частично теряются). Иногда в основе воспаления бронха лежит
469
Рис. 10.1. Серозно-
гнойный бронхит. Вяз-
кая слизь покрывает
цилиндрический эпи-
телий, много нейтро-
фильных лейкоцитов.
Окраска гематоксили-
ном и эозином, х 200.
первичная недостаточная работа ресничек, связанная с отсутствием
их специфических органелл (микротрубочки, динеиновые ручки,
урадиарные спицы и др.), например при синдроме Картагенера,
когда обусловленные этим бронхоэктазы сочетаются с обратным
расположением органов [Березовский В. А. и др., 1979]. Серозно-
слизистый секрет желез обладает протеолитической активностью,
под его влиянием расщепляются белковые молекулы микроорганиз-
мов, улучшается реология слизи, но при воспалении эта функция
может подавляться. Изменение реологии слизи и подавление фун-
кции ресничек вызывает дым сигарет [Danielle R. Р., 1980], что
объясняет предрасположенность курящих к бронхиту.
Помимо мукоцилиарного механизма, частицы диаметром более
5 мкм' удаляются макрофагами, всегда присутствующими в сли-
зистой оболочке и подслизистой основе бронхов, и далее транс-
портируются в лимфатические пути и лимфатические узлы. За-
сорение последних пылью затрудняет этот транспорт. В секрете
крупных бронхов содержится IgA вместе с гликопротеином, кото-
рый предохраняет его от протеаз. Его концентрация в секрете
бронхов превышает сывороточную [Чернух А. М. и др., 1974;
Чучалин А. Г., 1986; Burnett D. et al., 1987]. Именно IgA в
основном поддерживают бактерицидное состояние крупных брон-
хов, не соединяясь с комплементом. В базальной мембране бронхов
сосудов содержится IgG, причем соотношение IgA и IgG в норме
470
равно от 3:1 до 8:1 [Шварцман Я. С., Хазесон Л. Б., 1978].
При повреждении эпителия бронхов количество иммуноглобулинов
уменьшается, изменяется их соотношение в пользу IgG [Непом-
нящих Г. И. и др., 1986; Кононов А. В. и др., 1988 [.
Иммунная защита бронхов обеспечивается бронхоассоциирован-
ной лимфоидной тканью (БАЛТ), которую впервые описали в 1973 г.
J. Bienenstock и соавт. Эта система состоит из лимфатических фол-
ликулов, расположенных под базальной мембраной эпителия, осо-
бенно вблизи протоков желез, а в мелких бронхах — из менее
дифференцированных скоплений лимфоцитов. Над фолликулами
эпителий уплощен, лишен ворсинок, но имеет микровиллы. При
растровой электронной микроскопии эти овальные поля хорошо
выделяются среди ресничек. Как показали J. Bienenstock и соавт.
(1973), лимфатический аппарат бронхов не отличается от такового
в кишечнике. В системе БАЛТ Т-лимфоциты преобладают над
В-лимфоцитами, обнаруживаются так называемые нулевые лимфоци-
ты, функция которых недостаточно выявлена. Иммунная активность
БАЛТ во многом зависит от соотношения Т-хелперов и Т-супрес-
соров, уменьшение первых и увеличение субпопуляции незрелых
лимфоцитов характеризует иммунную недостаточность [Сильвест-
ров В. П. и др., 1986]. В норме в стенках бронхов человека мак-
рофаги составляют 60—88%, лимфоциты — 11—30%, из них
Т-лимфоциты — 20—26%, В-лимфоциты — 11—28% [Danielle R. Р.,
1980].
При гиперергических реакциях количество лимфоцитов резко
увеличивается. По степени развития лимфоидной ткани и выработки
иммуноглобулинов ряд авторов рассматривают легкое как один из
важнейших периферических органов иммунной системы [Авер-
бах М. М., 1980; Чучалин А. Г., 1986].
Подавление защитных механизмов бронхов — мукоцилиарного,
иммунного и лимфатического клиренса — разными факторами
способствует прогрессированию бронхита. Большую роль при этом
играет курение, способствуя проникновению микрофлоры в дис-
тальные отделы бронхов, которые в норме стерильны. Генетически
зависимый дефицит IgA в системе лимфоэпителиального аппарата
может сопровождаться рецидивированием бронхита, пневмонии и
одновременным поражением пищеварительного тракта, печени
[Чучалин А. Г., Шимкович Б. И., 1980]. Инфицированию бронхов
способствует запыление, которое, «загружая» макрофаги, нарушает
лимфогенный клиренс, а также газы, особенно NH3, формальдегид
и чистый Ог, вызывая альтерацию эпителия. Слизистая оболочка
бронхов отвечает воспалением на кислородное голодание, напри-
мер, в условиях высокогорья [Жаворонков А. А., Ростовщи-
ков А. С., 1984].
Из микробной флоры наибольшую роль в развитии бронхита
играют вирусно-микробные ассоциации, пневмококки, условно-па-
тогенная флора при нарушении бронхиального и лимфатического
клиренса.
471
10.1.1.1. Воспаление крупных бронхов
Острый бронхит. Воспаление крупных бронхов чаще всего протекает
как катаральное или катарально-гнойное, реже деструктивное, со-
провождающееся гнойным расплавлением или фибринозно-некроти-
ческим язвенным процессом. Последний более характерен не для
диффузных первичных форм, а для очагового поражения бронхов,
дренирующих абсцессы, каверны. При катаральных и гнойно-ката-
ральных формах изменения происходят чаще всего в мукоцилиарном
аппарате. Количество бокаловидных клеток увеличивается. В норме
они относятся к реснитчатому эпителию как 1 :5, при воспалении
вытесняют реснитчатые клетки, ворсинки их деформируются. Объем
желез увеличивается за счет растяжения их секретом, воспалитель-
ной инфильтрацией. Увеличиваются индексы Рид (соотношение ди-
аметра желез и толщи стенки) и Стерлинга—Родмана (отношение
слизистой оболочки и подслизистой основы ко всей толще стенки
бронха). Базальная мембрана набухает, слизистая оболочка утол-
щается за счет полнокровия, отека. Их инфильтрация клеточными
элементами мало отличается от находящихся здесь в норме лим-
фогистиоцитарных скоплений, осуществляющих бронхогенный кли-
ренс. Однако присоединение ПЯЛ меняет картину. Следует учиты-
вать количество лейкоцитов, так как гиперсекреция, описанная
выше, может отражать не сам бронхит [Бобков А. Г., 1978]. Она
может быть вызвана изменением температуры, влажности среды,
гемодинамическими нарушениями при заболеваниях сердца. При
отсутствии нагноения адвентиция крупных бронхов не подвергается
инфильтрации, и поэтому воспаление крупных бронхов чаще про-
текает как эндомезобронхит, а не панбронхит.
Хронический бронхит. Существуют разные классификации хро-
нического бронхита [Струков А. И., Кодолова И. М., 1970; Есипо-
ва И. К., 1976; Непомнящих Г. И., 1979], но все авторы этих клас-
сификаций отличают катарально-гнойные и катаральные формы от
деструктивных, называя их склерозирующими, деформирующими,
гранулирующими. Мы считаем, что следует выделять: 1) первичные
диффузные (иногда неравномерно выраженные) двусторонние (си-
стемные) бронхиты и 2) вторичные бронхиты с поражением отдель-
ных бронхов, дренирующих абсцессы или каверны. Вторые по срав-
нению с первыми протекают тяжелее.
Принципиальными отличиями хронического бронхита от острого
являются склероз слизистой оболочки, перестройка мышечных пла-
стов, где чередуются атрофия, гипертрофия, иногда жировая дист-
рофия, разрывы, скручивание эластических волокон, часто пред-
ставленных комками; атрофия эпителия желез с их кистовидным
расширением; метаплазия цилиндрического эпителия в многослой-
ный плоский (признаки метаплазии на ультраструктурном уровне
выражаются в появлении полигональных клеток с длинными отро-
стками, обилием фибриллярных структур). Некоторые авторы ука-
зывают на возможность прямой метаплазии, т. е. развития плоского
эпителия не из стволовых базальных клеток, а из дифференциро-
472
Рис. 10.2. Воспаление долевого бронха. Биоптат. Дистрофия покровного
эпителия, реснитчатый аппарат поврежден. На поверхности клеток —
цитоплазматические выросты. *4600 (по Г. И. Непомнящих).
ванных [Lugo М., Putong Р., 1984], как ранее считал Р. Вирхов.
По данным В. Г. Гаршина, о метаплазии можно говорить лишь после
исчезновения воспалительных инфильтратов в подлежащей ткани,
так как в расцвете воспаления она может отражать временную
раздифференцировку пролиферирующих стволовых клеток.
При хроническом воспалении клеточные инфильтраты внутрен-
него и среднего слоя, строма желез изобилуют плазмоцитами, лим-
фоцитами, макрофагами. Адвентиции может быть гиалинизированд.
Такие бронхиты носят название катарально-фиброзных или фиб-
розных, они могут быть деформирующими, сопровождаться брон-
хоэктазами. При очаговых формах воспаления бронхов, дренирую-
473
щих каверны или абсцессы, преобладают гранулирующие формы с
уничтожением предшествующих структур, вовлечением адвентиция.
При очаговых формах чаще, чем при диффузных, в слизистой
оболочке возникают полипы. При туберкулезе фиброз бронхов раз-
вивается на фоне специфических туберкулезных изменений (или
параспецифических), обусловленных ограниченным выпячиванием
стенок в зоне казеозного лимфаденита, нодулобронхиальными сви-
щами, рубцовым стенозированием просвета, редко встречающимся
при неспецифических формах бронхита [Непомнящих Г. И., 1979].
Ультраструктурные изменения бронхов подробно изучены. От-
мечены признаки дистрофии эпителия (рис. 10.2) с появлением в
его клетках вторичных лизосом, фаголизосом, набуханием клеток,
утолщением и вместе с тем расширением межклеточных щелей,
куда проникает большее, чем в норме, количество лимфоцитов.
Утолщается весь базальный слой, а в самой базальной мембране
появляются дефекты. В секрете желез и бокаловидных клеток на-
растает продукция муцинов, что затрудняет действие ресничек эпи-
телия. В них происходит аутолиз надьядерной зоны. Развивается
склероз на фоне усиливающейся инфильтрации внутренних и сред-
них слоев лимфогистиоцитарными элементами, плазмоцитами, ПЯЛ.
Эти изменения способствуют деформации бронхов как за счет ре-
тенции слизи, так и ослабления тонуса стенок бронхов, вследствие
чего развиваются преимущественно цилиндрические бронхоэктазы.
При хроническом воспалении отдельных бронхов, дренирующих
абсцессы или каверны, деформация на фоне деструкции выражена
еще* сильнее: она возникает по типу бронхоэктатических каверн;
развивается полипоз слизистой оболочки, в процесс вовлекается
адвентиция, бронхит имеет характер панбронхита.
Иммунное воспаление крупных бронхов наблюдается при брон-
хиальной астме. Типичны эозинофильная инфильтрация стенок
бронхов, резкое утолщение базальной мембраны, онкоцитарная диф-
ференцировка эпителия желез. Другой особой формой является так
называемый лимфоматоидный бронхит с вовлечением не только
крупных, но и мелких бронхов: крупные лимфатические фолликулы
с многочисленными зародышевыми центрами сплошным кольцом
окружают бронхи [Liebow А. А., 1973].
10.1.1.2. Воспаление мелких бронхов и бронхиол
В мелких бронхах и бронхиолах нет или очень мало желез, хрящевые
пластинки мелкие, имеют вид распорок в участках деления мелких
бронхов. В бронхиолах эпителий кубический, нет также бокаловид-
ных клеток, но есть безворсинчатые клетки Клара, секретирующие
сурфактант, функция которых не до конца выяснена. Как видно,
мукоцилиарный аппарат в этих бронхах отсутствует. Вместе с тем
сильно развиты мышечная оболочка, доходящая до респираторных
бронхиол 3-го порядка, и эластические волокна, заложенные в
строме с богатым микроциркуляторным руслом. Деление на слои
не выражено. Структура БАЛТ упрощена, вместо лимфоидных фол-
474
Рис. 10.3. Панбронхит (мелкий бронхит) с переходом воспаления на
альвеолярную паренхиму. Окраска гематоксилином и эозином. * 120.
ликулов имеются малодифференцированные образования — агрегаты
лимфоидных клеток. В слизистой оболочке меняется соотношение
IgA/IgG в пользу последних. Лимфатические пути в виде капилляров
следуют до респираторных бронхиол 3-го порядка. Особенности стро-
мы, богатой мышечно-эластическими элементами, обеспечивают
большой диапазон изменения просвета бронхов; спазм их является
одним из приспособлений при внедрении раздражающих газов и
пыли. В тонусе мышц играет роль активный обмен простагландинов .
в легком [Сильвестров В. П. и др., 1986; Чучалин А. Г., 1986].
Отсутствие деления стенки мелких бронхов и бронхиол на слои и
хорошо выраженная микроциркуляторная система объясняют раз-
витие при воспалении панбронхита. В случае изъязвления слизистой
оболочки (адвентиция отсутствует) воспаление легко переходит на
окружающую альвеолярную ткань, развивается перифокальная
бронхопневмония (рис. 10.3).
Воспалительные процессы в любом участке бронхиального дерева
могут осложняться обтурационным синдромом. Он характеризуется
обтурационными ателектазами, очаговой эмфиземой, бронхоэктаза-
ми [Есипова И. К., Евсегнеева М. В., 1982].
Ателектазы чередуются с очагами вздутия легких (эмфиземы)
вследствие нескольких причин: усиленного прохождения воздуха в
свободные бронхи при закупорке или спазме одного из бронхов в
зонах их разветвлений; ослабления мышечно-эластического каркаса,
что сопровождается расширением витков этого каркаса и устьев
Расположенных между ними альвеол с последующим уплощением
их; деструкции эластики, которая возникает под влиянием измене-
475
ния соотношения многочисленных ферментов, вырабатываемых лег-
ким, нарастанием протеаз, в чем большую роль играют макрофаги,
ПЯЛ, особенно у злоупотребляющих курением. Чередование си-
нюшных западающих участков ателектаза и вздутых светлых полей
придает легкому пестрый вид, особенно характерный для вирусных
бронхопневмоний. Среди бронхоэктазов при обтурационном синд-
роме, помимо цилиндрических, мешотчатых, веретенообразных, це-
лесообразно выделять, руководствуясь патогенезом, ретенционные
и деструктивные. У первых сохраняется выстилка и их эпителий
не имеет резких повреждений, они граничат с воздушной тканью;
вторые характеризуются деструкцией стенок, перифокальной пнев-
монией, склерозом [Есипова И. К., 1976].
10.1.2. Пневмония
Пневмония — воспаление альвеолярной паренхимы, последних ге-
нераций респираторных бронхиол, несущих в стенках альвеолы.
В ее развитии, помимо недостаточно бронхолимфатического кли-
ренса, играет роль повреждение собственных защитных систем аль-
веолярной паренхимы. Сюда относятся альвеолярные макрофаги,
альвеолоциты 1-го и 2-го порядка. Последние не только вырабаты-
вают «антиателектатическую пленку», но и активно участвуют в
разных видах обмена веществ [Bend J. R. et al., 1986]. Сурфактан-
тная система включает не только эту «пленку», но и производящие
ее альвеолоциты 2-го порядка, щеточные альвеолоциты и макрофаги,
резорбирующие избыток сурфактанта [Романова Л. К., 1983; Бир-
кун А. А., Нестеров Е. Н., Кобозев Г. В., 1981 ]. При недостатке
последних развивается, в частности, альвеолярный липопрОтеиноз
(скопление в альвеолах эозинофильной белковой массы и кристал-
лов), который следует дифференцировать с пневмонией, несмотря
на возможную реакцию альвеолярного интерстиция. Белковая часть
сурфактанта обладает антигенными свойствами, но содержит имму-
ноглобулины, как и базальная мембрана альвеол. Повреждение сур-
фактантной системы при воспалении характеризуется развитием
ателектазов или дистелектазов и скоплением альвеолярных макро-
фагов.
Альвеолярные макрофаги относятся к общей мононуклеарной
фагоцитарной системе, находятся на поверхности альвеолярной вы-
стилки, в просвете воздухоносных путей. Альвеолярные макрофаги
характеризуются высоким цитоплазматическим ядерным отношени-
ем, богато развитыми органеллами, обилием первичных лизосом и
фагосом. В лизосомоподобных структурах содержится ряд гидроли-
тических ферментов и белковых продуктов, в частности проста-
гландинов. В секрете макрофагов есть интерферон, фракции комп-
лемента, лизоцим, гликозиды и особые ферменты, играющие роль
в инактивации аминов, что свидетельствует об их активном участии
наряду с ПЯЛ в воспалительном процессе [Ерохин В. В., 1987 ]•
Секреторная и фагоцитарная функции макрофагов чередуются.
Альвеолярные макрофаги характеризуются бактерицидным дси-
476
ствием, но не способны переваривать микобактерии туберкулеза,
бруцеллы, грибы. В них осуществляется эндоцитобиоз, что приводит
к образованию специфических многоядерных клеток: гигантских
клеток Пирогова—Лангханса при туберкулезе, клеток типа инород-
ных тел при микозах и т. д. Деятельность альвеолярных макрофагов
связана с Т-лимфоцитами, наличием хемотаксического фактора.
Дефицит последнего может способствовать рецидиву пневмонии,
развитию гранулематозных процессов. Функция этих клеток подав-
ляется дымом сигарет, некоторыми лекарствами. Помимо функции
зашиты, альвеолярные макрофаги участвуют в обмене, особенно
липидном, и легко превращаются в пенистые клетки, характерные
для эндогенной или экзогенной липидной пневмонии. Кроме того,
макрофаги участвуют в развитии пневмосклероза, вырабатывая фак-
тор роста фибробластов, фибронектин [Есипова И. К., 1989].
Исходя из морфологических особенностей выделяют экссуда-
тивную и интерстициальную пневмонии. Они могут быть вызваны
возбудителями инфекций, запылением, аэрозолями, лекарственны-
ми средствами, в их развитии часто играют роль иммунные ме-
ханизмы.
10.1.2.1. Экссудативная пневмония
Как показали экспериментальные исследования [Чернух А. М. и
др., 1974; Ерохин В. В., 1987], экссудативная пневмония начинается
с повреждения эндотелия капилляров стенок альвеол. Повышение
проницаемости сосудов способствует экссудации, набуханию основ-
ного вещества стенок альвеол. Выход экссудата в просвет альвеол
некоторое время удерживается альвеолоцитами 1-го порядка, отро-
стки которых соединены десмосомами. Дистрофия последних опре-
деляет переход воспаления стенок альвеол в экссудативную пнев-
монию.
Стенки альвеол утолщаются за счет полнокровия, собственно
экссудации, скопления ПЯЛ и макрофагов, которые могут лежать
пластами вдоль стенок и в просвете, симулируя «десквамативную»
пневмонию [Ерохин В. В., 1987]. Просветы альвеол суживаются
вследствие утолщения стенок, а также дистелектаза, обусловлен-
ного повреждением сурфактанта, местами растягиваются экссуда-
том. В развитии ателектазов принимает участие спазм бронхиол,
так как воспаление охватывает ацинусы целиком. Все это создает
пестроту, менее выраженную при долевой пневмококковой (кру-
позной) плевропневмонии, поскольку при ней имеет значение
ингаляционный механизм с проникновением возбудителя прямо в
респираторный отдел, щадя мелкие и средние бронхи, но вовлекая
респираторные, иногда терминальные бронхиолы. При атипических
формах пневмонии могут вовлекаться и крупные бронхи. Если
они заполняются экссудатом, бронхиальное дыхание исчезает (в
связи с этим возможны диагностические ошибки). Такую пнев-
монию называют массивной, хотя это и не отражает распростра-
ненность процесса.
477
Большое значение в развитии экссудативной пневмонии имеют
ПЯЛ. Нарушение проницаемости мембран их лизосом проявляется
накоплением кислой фосфатазы в очагах воспаления. Выявление ее
в виде гранул свидетельствует о внутриклеточном расположении, а
в виде диффузных скоплений — о поражении клеточных мембран
[Ященко JI. В., 1977]. Регрессия ПЯЛ приводит к аутолизу окру-
жающей ткани, сопровождаемому новой мобилизацией этих клеток,
пневмония прогрессирует. Подобные изменения возникают при вве-
дении стерильной нити в дыхательные пути (по модели Н. Н. Анич-
кова и М. А. Захарьевской), что способствует включению защитных
механизмов бронхов, активации аутофлоры. При дополнительной
иммунизации в эксперименте процесс становится более интенсив-
ным, особенно на 17-е сутки, когда в альвеолярных перегородках
обнаруживаются иммунные комплексы, а в лимфоцитах — IgG.
Вместе с тем появляются компенсаторные процессы: высокая степень
выявления ДНК и РНК, гиперплазия БАЛТ, лимфоидная инфиль-
трация всех слоев бронхов, регенерация альвеолоцитов 2-го типа.
Последняя на световом уровне определяется как выстилка кубиче-
ским эпителием, и часто принимается ошибочно за пролиферацию
бронхиол, если альвеолы имеют щелевидные контуры. В стенках
альвеол нарастает количество фибробластов, при течении процесса
более месяца развивается выраженный пневмосклероз.
Патологическая анатомия пневмоний зависит в основном от
характера возбудителя и иммунного ответа, который может быть
модулирован многими неспецифическими факторами: алкогол з-
мо14, сахарным диабетом, курением, состоянием сердечно-сосуди-
стой системы и факторами среды (температура, влажность, запы-
ление) .
Значение возбудителя в развитии экссудативной пневмонии хо-
рошо изучено (см. главу 9). При бациллярных формах в очагах
воспаления отмечается завершенный фагоцитоз со скоплением ПЯЛ
и выпотом фибрина, по периферии — зона серозного воспаления
или отека. При кокковых пневмониях в центре очага выявляется
некроз (часто расплавление), а по периферии — фибринозный или
серозный экссудат. Нагноительные процессы в легких развиваются
чаще при иммунодефиците Сг, Сз, С§ компонентов комплемента
[Чучалин А. Г. и др., 1980].
Развитие атипичных пневмоний не укладывается в классическую
схему. Они возникают большей частью на фоне вторичных имму-
нодефицитных состояний. Это клебсиеллезная, микоплазменная,
пневмоцистная пневмонии, болезнь легионеров.
Аутоинфекция условно-патогенной флорой вызывает при нару-
шении бронхиальной проводимости аспирационную пневмонию,
часто ихорозного характера, если участвуют анаэробы полости
рта, например при аспирации рвотных масс. Близка к ней гипо-
статическая пневмония, где нарушен бронхолимфогенный клиренс
в задненижних отделах легких. Она протекает на фоне полно-
кровия.
478
10.1*2.2. Интерстициальная пневмония
К интерстициальным пневмониям относят ряд неоднородных легоч-
ных поражений разного генеза [Струков А. И., Пауков В. С., Оре-
хов О. О., 1984].
Вирусные пневмонии. Наряду с разрушением сурфактантной
системы (вирусы паразитируют в альвеолоцитах и макрофагах) при
этих пневмониях развиваются дистелектазы, отек, пролиферация
эпителия бронхов, альвеол. Выражена воспалительная реакция аль-
веолярного интерстиция, которую необходимо дифференцировать с
кажущимся увеличением клеток в стенках альвеол при ателектазе
(подробнее см. главу 9).
Гранулематозное воспаление легких. Оно может быть вызвано
инертными частицами без иммуноглобулинов, но чаще, даже при
пылевом загрязнении, включает развитие иммунных реакций, так
же как при туберкулезе, микозах, сифилисе, глистных инвазиях.
При «переваривании» макрофагами возбудителей с восковидной обо-
лочкой образуются эпителиоидные клетки (например, при туберку-
лезе или шистосомозе). Некоторые авторы считают, что эпителио-
идные клетки всегда отражают иммунное воспаление [Струков А. И.,
Кауфман О. Я., 1989].
Среди интерстициальных пневмоний могут быть выделены от-
носительно специфичные «иммунные пневмонии» [Се-
ров В. В., 1975; Струков А. И., Пауков В. С., Орехов О. О., 1984;
Чучалин А. Г., 1986 ]. К ним следует отнести экзогенный аллерги-
ческий альвеолит и идиопатический фиброзирующий альвеолит (под-
робнее см. главу 9).
Экзогенный аллергический альвеолит. Это заболевание харак-
теризуется инфильтрацией респираторных бронхиол и окружающих
их альвеол лимфогистиоцитарными элементами в ответ на отло-
жение на базальной мембране стенок бронхиол иммунных комп-
лексов. Возникает в ответ на раздражение антигенами грибов
сена.
Идиопатический фиброзирующий альвеолит — частое ауто-
иммунное поражение легких при ревматических болезнях. Разви-
вается как двусторонняя интерстициальная пневмония. Стенки
альвеол инфильтрированы лимфоцитами, макрофагами, иногда
плазматическими клетками, в зависимости от преобладания реак-
ции ГЗТ или ГНТ в ответ на отложение в базальной мембране
альвеол антител или иммунных комплексов. Чисто антительный
механизм характерен для синдрома Гудпасчера, при котором про-
дуктивная интерстициальная пневмония без выраженного фиброза
[сочетается с экстракапиллярным продуктивным гломерулонефри-
том. При значительном участии цитолитических фракций комп-
лемента возникает некроз эпителия, тогда присоединяется фибри-
нозный выпот (гибель альвеолоцитов 1-го типа) и к нарастающему
Фиброзу перегородок альвеол присоединяется карнификация. При
некрозе эпителия бронхиол образуются гиалиновые мембраны. Та-
кое сочетание дает быстро прогрессирующий легочный фиброз,
479
Рис. 10.4. Аэрогематический барьер при пневмосклерозе. Склероз и ги-
перэластоз основного вещества. * 12 000.
известный как синдром Хаммена—Рича. При реакциях ГНТ с
участием цитолитических фракций комплемента, активации фак-
тора Хагемана иммунная реакция легких может выразиться в
синдроме Вегенера — васкулитах с тромбозами обеих систем со-
судов легких, развитием ишемических, геморрагических инфарктов
наряду с гигантоклеточной пневмонией. Обычно синдром протекает
с поражением верхних дыхательных путей и гломерулонефритом,
но может характеризоваться только поражением легких [Spen-
cer Н., 1974]. Существует так называемая некротическая пнев-
мония без васкулитов, она протекает по типу феномена Артюса
и получена в эксперименте путем иммунизации IgE, адъювантом
Фрейнда [Zavala D. С. et al., 1975].
О воспалительных процессах легких дают представление брон-
хоальвеолярные смывы [Чучалин А. Г., Шмушкович Б. И., 1980;
Кокосов А. Н. и др., 1988; Копьева Т.Н., Амосова О. М., 1989],
в которых оцениваются соотношения клеточных элементов, тип
иммуноглобулинов, ферментов, в частности протеаз и их ингиби-
торов.
В исходе любого затяжного воспаления легких, бронхита или
пневмонии возникает разрастание соединительной ткани — пнев-
москлероз (рис. 10.4). Следует различать: 1) лимфогенный склероз
фиброзных прослоек, не выходящий за их пределы, в виде круп'
нопетлистой сетки, подчеркивающей рисунок сосудов, границ сег-
480
Рис. 10.5. Утолщение фиброзной стромы (сетчатый пневмосклероз). Вверху
справа — фиброзная строма без капилляров. Импрегнация серебром по
Гомори. х 400.
ментов, особенно в верхних долях; 2) очаговый склероз в участках
воспаления или ателектазов, в основе развития которых лежат
карнификация, гранулематоз, интерстициальная пневмония. Пнев-
москлероз сопровождается утолщением аэрогематического барьера
за счет его склероза и гиперэластоза (рис. 10.5). Ателектаз может
подвергаться склерозу без воспаления в результате вызванного им
нарушения лимфотока, сближения фиброзных прослоек, но ате-
лектатические поля рубцуются быстрее при сочетании с воспале-
нием. Сам по себе ателектаз, еще до склероза, втягивает участки
легкого, а если переходит в фиброателектаз, обезображивает его,
т- е. вызывает пневмоцирроз.
16—407
481
10.2. ЖЕЛУДОК, КИШЕЧНИК, БРЮШИНА
Воспалительные изменения могут развиваться во всех слоях стенки
желудка и кишечника, но наибольшее клиническое значение имеет
воспаление слизистой оболочки.
Слизистая оболочка пищеварительного тракта обладает рядом
особенностей, определяющих своеобразие развивающихся в ней вос-
палительных изменений. Эти особенности касаются как ее «парен-
химы» (железы и поверхностный эпителий), так и стромы (собст-
венная пластинка).
Для эпителия пищеварительного тракта характерно активное
клеточное обновление (физиологическая регенерация). Так, повер-
хностный эпителий желудка полностью обновляется за 4—6 сут,
тонкой кишки — за 3 сут, толстой — за 4—5 сут. Каждую минуту
с поверхности желудка отторгается около полумиллиона клеток
[Croft D. N., 1977] и с поверхности тонкой кишки — 20—50 млн
или 287 млрд клеток в сутки [Croft D. N., Cotton Р. В., 1973] и
ровно столько же приходит им на смену. Источником всех эпите-
лиоцитов, невзирая на их структурные и функциональные особен-
ности, являются недифференцированные (стволовые) клетки, рас-
положенные в строго локализованных генеративных, или «старто-
вых», зонах. В желудке эти зоны занимают область шеек желез, в
кишечнике — дно крипт. Из этих участков клетки перемещаются
в функциональные зоны, подвергаясь при этом дифференциации, а
заусм отторгаются в просвет. Постоянство структуры слизистой обо-
лочки обеспечивает строгая синхронизация всех фаз клеточного
обновления: пролиферации, миграции, дифференциации и экстру-
зии.
Альтеративные изменения эпителия, возникающие при воспале-
нии, приводят к компенсаторному усилению пролиферации и миг-
рации. В результате этого на месте зрелого специализированного
эпителия оказываются не полностью дифференцированные клетки.
Длительное действие повреждающего фактора приводит к значи-
тельным структурным изменениям слизистой оболочки, сущность
которых сводится к нарушению фаз клеточного обновления и за-
мещению специализированных эпителиоцитов не полностью диф-
ференцированными. Это и является морфологическим субстратом
нарушения функции органа. Из особенностей морфогенеза струк-
турных нарушений слизистой оболочки вытекает и возможность
«обратного развития» с восстановлением структуры и функции ор-
гана после устранения повреждающего фактора.
Собственная пластинка (строма) слизистой оболочки всегда со-
держит элементы лимфоидной ткани. Лимфоидная ткань пищева-
рительного тракта в функциональном отношении считается иден-
тичной лимфоидной ткани лимфатических узлов и селезенки
[Шварцман Я. С., Хазенсон Л. Б., 1978; Helmke К., 1978]. Она за-
нимает 25% массы слизистой оболочки [Douglas А. Р., Weltman
А. Р., 1975]. На протяжении 1 м тонкой кишки содержится около
10ш клеток, секретирующих иммуноглобулины [Brangizaeg R- et
482
al., 1988]. В состав лимфоидной ткани пищеварительного тракта
входят межэпителиальные лимфоциты, лимфоциты и плазматиче-
ские клетки собственной пластинки, а также лимфоидные узелки
(фолликулы).
Большинство межэпителиальных лимфоцитов относится к Т-
клеткам-супрессорам, они первыми из всех иммунокомпетентных
клеток встречаются с различными антигенами, находящимися в
просвете пищеварительного канала. Больше всего межэпителиаль-
ных лимфоцитов в тонкой кишке — от 100 до 300 на 1000 эпите-
лиоцитов [Лившиц Е. Г., Медне Т. А., 1979; Ferguson А., 1977], в
желудке их значительно меньше — 52—59% [Аруин Л. И., Шата-
лова О. Л., 1981]. Р. Brandizaeg и соавт. (1988) считают, что меж-
эпителиальные лимфоциты (Т-супрессоры) ответственны за так на-
зываемую оральную толерантность, они контролируют иммунную
реактивность слизистой оболочки. Как известно, реакции гиперчув-
ствительности развиваются в пищеварительном тракте реже, чем в
респираторном. Не исключено, что одна из причин этого — различие
в содержании межэпителиальных супрессоров и хелперов. Среди
межэпителиальных лимфоцитов кишечника на долю Т-8 (супрес-
соров) приходится 84—87%, на долю Т-4 (хелперов) — 13—
16%. В эпителии слизистой оболочки носа Т-8 составляют 32%, а
Т-4 — 68% [Brandizaeg Р. et al., 1988]. По-видимому, межэпите-
лиальные лимфоциты блокируют местную реакцию гиперчувстви-
тельности, возникающую при взаимодействии антигена с IgG, что
могло бы привести к повреждению ткани.
Межэпителиальные лимфоциты могут участвовать и в регуляции
пролиферации эпителия [Аруин Л. И., Шаталова О. Л., 1981; Баба-
ева А. Г., 1985]. Установлена даже возможность переноса гиперпла-
стического гастрита мышам с помощью эффекторных Т-лимфоцитов
[Prehn L. М., 1986]. Интактные лимфоидные клетки влияют на
пролиферацию и дифференциацию кишечного эпителия как в норме
[Соболева И. Н. и др., 1987], так и при целиакии [Marsh М. N.,
1982] и при болезни Крона [Pallone F. et al., 1983].
В собственной пластинке слизистой оболочки желудка и кишеч-
ника преобладают В-лимфоциты и плазматические клетки, почти
90% которых синтезируют IgA [Шварцман Я. С., Хазенсон Л. Б.,
1978]. Вырабатываемые иммуноцитами димерный IgA и пента мер-
ный IgM избирательно транспортируются с помощью секреторного
компонента через эпителиоциты. Секреторный IgA при взаимодей-
ствии с антигенами не присоединяет комплемент и поэтому не
повреждает ткани, он препятствует прикреплению микроорганизмов
и других антигенов к эпителию. Источником плазматических клеток
слизистой оболочки считаются лимфатические фолликулы [Hamas-
himaW., 1976].
*0.2.1. Желудок
Воспаление желудка (гастрит) может быть острым и хроническим.
16*
483
10.2.1.1. Острый гастрит
Острый гастрит характеризуется отеком, полнокровием, полиморф-
но-ядерной инфильтрацией слизистой оболочки, а также вакуоли-
зацией поверхностного эпителия слизистой оболочки и мелкими
некрозами. Наиболее тяжелой формой острого гастрита является
флегмонозный гастрит. При этом поражается преимущестенно под-
слизистая основа, она подвергается почти полной деструкции и
лейкоцитарной инфильтрации, которая распространяется на слизи-
стую оболочку и мышечный слой. При микотическом гастрите об-
наруживаются множественные изъязвления и микроабсцессы сли-
зистой оболочки, в которых удается выявить большое количество
мицелиев.
10.2.1.2. Хронический гастрит
Хронический гастрит — одно из наиболее распространенных забо-
леваний человека. Для него характерно сочетание воспалительных
и дисрегенераторных изменений, обусловливающих структурную пе-
рестройку и последующие нарушения функции желудка.
При хроническом гастрите могут преобладать признаки интер-
стициального воспаления и почти не вовлекаться в процесс парен-
химатозные элементы слизистой оболочки (поверхностный гастрит —
рис. 10.6). При другой морфологической форме на первое место
выдвигаются поражения паренхимы в виде дисрегенераторных из-
менений эпителия, что может быть исходом воспаления (атрофи-
ческий гастрит).
Поверхностный гастрит. Типична инфильтрация собственной
пластинки слизистой оболочки плазматическими клетками (рис.
10.7), большинство которых вырабатывает IgA, и лимфоцитами. По
мнению Р. Nicdobitck (1985), инфильтрация слизистой оболочки
желудка может расцениваться как проявление патологии только
при сочетании со структурными изменениями желез и с наруше-
ниями секреции. В поверхностном эпителии видны признаки пре-
обладания стадий экскреции над стадией накопления секрета, а
также белковой дистрофии. Встречаются и не полностью диффе-
ренцированные эпителиоциты.
При обострении хронического гастрита в инфильтрате появляются
нейтрофильные ПЯЛ, расположенные обычно под эпителием и про-
никающие в него. При пищевых аллергиях, медикаментозных по-
ражениях и при глистной инвазии наблюдается инфильтрация эози-
нофильными лейкоцитами, диффузно распространяющимися по всей
толще слизистой оболочки.
В зависимости от интенсивности воспалительной инфильтрации
различают легкую, умеренную и выраженную формы поверхностного
гастрита. В диагностике поверхностного гастрита, особенно легкой
и умеренной его форм, следует учитывать, что инфильтрация соб-
ственной пластинки слизистой оболочки имеется и в норме. Правда.
484
Рис. 10.6. Поверхностный гастрит. Обильная мононуклеарная инфильтрация
собственной пластинки слизистой оболочки. Окраска гематоксилином и
эозином, х 112.
Рис. 10.7. Поверхностный гастрит: в инфильтрате собственной пластинки
преобладают плазматические клетки, много межэпителиальных лимфоцитов
Окраска гематоксилином и эозином. * 630.
это относится к антральному отделу, в фундальном отделе инфиль-
трация весьма незначительна.
В 1988 г. J. Hoot и соавт. выделили «новую» форму гастрита,
названного ими лимфоцитарным. При этой форме имеется выра-
женная инфильтрация поверхностного и ямочного эпителия малыми
и средними лимфоцитами, окруженными светлым ободком. Меж-
эпителиальные лимфоциты встречаются при всех формах гастрита
[Аруин Л. И., Шаталова О. Л., 1981 ], но при лимфоцитарном гас-
трите их особенно много (около 30 на 100 эпителиоцитов), и ин-
фильтрируют они преимущественно фундальную слизистую оболоч-
ку. В то же время лимфоцитарная инфильтрация собственной пла-
стинки весьма умеренная. Все это отличает лимфоцитарный гастрит
от «обычного» поверхностного, при котором поражается преимуще-
ственно пилороантральный отдел, а лимфоцитарная инфильтрация
собственной пластинки выражена больше, чем эпителия.
Прогноз поверхностного гастрита благоприятный. Обычно изме-
нения слизистой оболочки сохраняются без заметной динамики на
протяжении многих лет, но могут подвергаться как обратному раз-
витию, так и прогрессировать в атрофический гастрит. Следует
отметить, что больных поверхностным гастритом значительно боль-
ше, чем атрофическим, что можно рассматривать как свидетельство
редкой трансформации одной формы гастрита в другую.
Прогрессирование гастрита зависит от особенностей строения
слизистой оболочки желудка. Так, в антральном отделе гастрит
разбивается в более молодом возрасте, в фундальном отделе он
возникает позже и продолжает прогрессировать у пожилых людей
[Siurala М., 1985].
Атрофический гастрит. Для него характерно замещение специ-
ализированных клеток не полностью дифференцированными. Он
бывает диффузным и мультифокальным [Correa Р., 1988 ].
Слизистая оболочка желудка при атрофическом гастрите может
быть истончена, но это не обязательный его признак. Главное, что
определяет его функциональное значение, — это уменьшение ко-
личества специализированных клеток. На этом основании к атро-
фическому гастриту следует отнести и так называемый гастрит с
поражением желез, который, по мнению ряда авторов [Масе-
вич Ц. Г., 1967; Аруин Л. И., 1975], занимает промежуточное по-
ложение между поверхностным и атрофическим гастритом. Основ-
ным признаком такого гастрита считается «мукоидизация» неатро-
фированных фундальных желез, т. е. появление в их составе вместо
париетальных и главных клеток их не полностью дифференциро-
ванных предшественников. Из-за того что количество специализи-
рованных клеток уменьшено, правильнее говорить об атрофическом
гастрите, несмотря на то что количество и глубина желез не умень-
шаются.
При хроническом гастрите значительно (до 163% вместо 51 /о
в норме) возрастают содержание межэпителиальных лимфоцитов и
плазмоклеточная инфильтрация собственной пластинки, количество
лимфоцитов остается при этом в пределах нормы. Увеличивается
486
Рис. 10.8. Аутоиммунный гастрит (тип А). Антитела к париетальным
клеткам. Иммунофлюоресцентйая микроскопия с сывороткой больного,
х 1000.
и число клеток, вырабатывающих иммуноглобулины всех классов,
но особенно IgA [Аруин Л. И., Шаталова О. Л., 1981]. Правда по
данным А. В. Кононова и соавт. (1988), тяжелые дистрофические
изменения поверхностного эпителия при атрофическом гастрите со-
провождаются утратой способности к синтезу IgA. Это не противо-
речит усилению инфильтрации слизистой оболочки IgA-плазмоци-
тами. Как показали электронно-микроскопические исследования
этих авторов, такие клетки являются не столько продуцентами
иммуноглобулинов, сколько их депо.
При хроническом гастрите значительно возрастает и содержание
IgG-плазмоцитов, особенно в базальных отделах слизистой оболочки.
Как известно, IgG обеспечивают так называемую вторую линию
защиты. Поэтому увеличение числа IgG-клеток может рассматри-
ваться как реакция адаптации. Однако в связи с тем что IgG-ан-
титела являются комплементактивированными, они могут не только
задерживать проникновение антигена, но и увеличивать проница-
емость эпителия для макромолекул. Подобный механизм может
участвовать в поддержании хронического воспаления слизистой обо-
лочки и атрофии желез [Valens К. et al., 1986]. Увеличение числа
IgG-продуцирующих клеток может свидетельствовать о дефектах
ауторегуляции местного иммунитета. Подобные картины А. И. Стру-
ков (1981) расценивал как выражение иммунного воспаления.
Деление хронического гастрита на поверхностный и атрофиче-
ский характеризует лишь.структурные особенности слизистой обо-
487
Рис. 10.9. Пилорические рселикобактеры на поверхности слизистой оболочки.
Окраска по методу Гимзы. * 1000.
лочки. Патогенетически выделяют два типа хронического гастри-
та»— А и В.
'Хронический гастрит типа А встречается сравнительно редко,
его находят менее чем у 1% населения, но у 16% больных пер-
нициозной анемией [Strickland R. G., Mackay J.R., 1973; Mie-
derer S. E., 1979]. Для гастрита типа А характерна атрофия фун-
дальных желез с резкой ахлоргидрией. В то же время слизистая
оболочка антрального отдела почти не изменена. Постоянно наблю-
даются гиперплазия гастринпродуцирующих клеток и гипергастри-
немия. Характерным признаком гастрита типа А является наличие
у 85—90% больных антител против париетальных клеток (рис.
10.8), а у 25—50% и против внутреннего фактора [Owen D. А.,
1979]. Поэтому гастрит типа А рассматривается как аутоиммунный.
Введенная экспериментальным животным сыворотка таких больных
вызывает атрофию слизистой оболочки [Inada М., Glass G., 1975].
Аутоантитела могут иметь патогенетическое значение, так как они
нарушают дифференциацию железистого эпителия [Glass G. В.,
1977]. Однако на биопсийном материале цитотоксический эффект
аутоантител установить не удалось [Салупере В. П., Карнер Ю. К-,
1972].
Ряд исследователей находили при гастрите А больше,чем при
других типах гастрита, IgG-содержащих клеток [Camilleri J. Р. et
al., 1973], другие не смогли подтвердить этого [van Spreewel J. et
al., 1986].
Хронический гастрит типа В характеризуется поражением ан-
трального отдела, где может развиваться как поверхностное воспа-
488
лснис, так и атрофический гастрит. Собственная пластинка инфиль-
трирована плазматическими клетками, содержащими IgA, IgM и
IgG. Воспаление может распространяться в оральном направлении
на зону фундальных желез.
В отличие от гастрита типа А при гастрите типа В антитела
против париетальных клеток не выявляются. Этиология его неиз-
вестна. В последние годы появилось много работ, в которых обсуж-
дается этиологическое значение пилорических хеликобактеров [Ло-
гинов А. С. и др., 1987]. Установлены тесная связь между наличием
хеликобактеров (рис. 10.9) и активным хроническим гастритом,
развитие гастрита при случайном или намеренном (на добровольцах)
заражении здоровых людей.
Особой формой хронического гастрита считается рефлюкс-гаст-
рит, обусловленный действием щелочного содержимого кишечника
на слизистую оболочку желудка. Для него характерны удлинение
ямок, принимающих извитой штопорообразный вид, и атрофия же-
лез. Поверхностный и ямочный эпителий уплощен, клеточное об-
новление в нем резко усилено. Собственная пластинка отечна, обиль-
но инфильтрирована плазматическими клетками и лимфоцитами со
значительной примесью нейтрофильных лейкоцитов. Здесь же видны
группы гладкомышечных клеток, фибробласты и коллагеновые во-
локна. В отличие от хронического гастрита типа В при рефлюкс-
гастрите нет обсеменения слизистой оболочки пилорическим хели-
кобактером.
10.2.2. Кишечник
Воспаление различных отделов кишечника лежит в основе большой
группы заболеваний. Это не только энтерит и колит, но и целиакия,
болезнь Уиппла, болезнь Крона, неспецифический язвенный колит,
поражение кишечника при многих инфекциях, среди которых особое
место занимает ВИЧ-инфекция.
Ю.2.2.1. Острые энтерит и колит
Острые энтерит и колит вызывают различные микроорганизмы,
вирусы, грибы и простейшие. Встречается также энтерит алимен-
тарного и аллергического происхождения. Морфологически острые
энтерит и колит проявляются катаральным, фибринозным, крупоз-
ным (дифтеритическим) или гнойным воспалением. При всех формах
воспаления наблюдаются гиперплазия и ретикуломакрофагальная
трансформация лимфатического аппарата кишки.
Ю.2.2.2. Хронические энтерит и колит
Следует отметить, что в современной зарубежной литературе тер-
мины «хронический энтерит», «хронический колит» применяются
значительно реже, чем в отечественной. К хроническому энтериту
489
Рис. 10.10. Целиакия. Резкая атрофия ворсинок, удлинение крипт. Окраска
гематоксилином и эозином, х 100.
и хроническому колиту относят лишь достаточно четкие клинико-
морфологические понятия.
Хронический энтерит и хронический колит могут быть бактери-
альными (туберкулез), протозойными (лямблиоз, балантидиаз).
Наибольшее клиническое значение имеют хронический энтерит и
хронический колит неизвестной этиологии, к которым относят бо-
лезнь Крона, язвенный колит, эозинофильный энтерит, идиопати-
ческии язвенный энтерит, диффузную узелковую гиперплазию вос-
палительн й фибриноидный полип и др. [Remmele W., 1984]. В ли-
тературе последних лет термином «хронические неспецифические
заболевания кишечника» обозначают только болезнь Крона и яз-
венный колит.
Клиническую картину хронического энтерита имеют многие эн-
теропатии. Более того, часть из них, например целиакия, и мор-
фологически вполне соответствует представлениям о хроническом
воспалении тонкой кишки. Это свидетельствует об условности по-
нятий «энтерит» как воспалительное заболевание и «энтеропатия»
как ферментная недостаточность.
Целиакия (нетропическая спру, глутеновая энтеропатия). За-
болевание обусловлено генетически детерминированной предраспо-
ложенностью к выработке иммунных реакций типа реакции «транс-
плантат против хозяина». Считается, что иммунокомпетентные клет-
ки тонкой кишки (макрофаги или В-лимфоциты) таких больных
под влиянием фракций глютена воспринимаются Т-лимфоцитами
кишечника как чужеродные лимфоидные клетки. Они не элимини-
490
руются, наступает их автономная пролиферация, и развивается
местная реакция «трансплантат против хозяина» [Neld G. Н., 1981 ].
В крови большинства больных целиакией находят антитела против
фракции глютена — глиадина [Savilathi Е. et al., 1983]. Установлено
также, что у больных целиакией В-лимфоциты обладают значи-
тельно большим числом рецепторов глиадина, чем у здоровых
[Vercasalo М. А., 1982 ], что ведет к выработке антиглютеновых
антител.
Еще сравнительно недавно была широко распространена концеп-
ция о том, что целиакия является ферментопатией. Считалось, что
из-за дефицита пептидаз происходит неполное расщепление глютена,
что и ведет к токсическому повреждению эпителия. Однако оказа-
лось, что ферментная недостаточность не причина, а следствие
повреждений э ителия, что было доказано у больных, лечившихся
аглютеновой диетой [Pena A. S., Mearin М. L., 1986].
У всех больных целиакией имеется выраженная атрофия ворсинок
слизистой оболочки. Они резко укорочены, часто представляют собой
лишь небольшие широкие выступы, придающие поверхности сли-
зистой оболочки на гистологических срезах своеобразный волнистый
вид; крипты, напротив, значительно удлинены (рис. 10.10). Эпите-
лий, выстилающий ворсинки, уплощен, базофильный, концентрация
РНК в нем значительно увеличена, за счет чего свойственный
неизмененной тонкой кишке градиент РНК почти не отмечается.
Эпи елиальныи пласт обильно инфильтрирован лимфоцитами, по-
давляющее большинство которых располагается над базальной мем-
браной на уровне ядер энтероцитов. Большинство этих межэпите-
лиальных лимфоцитов — это Т-лимфоциты, цитотоксические суп-
рессоры и хелперы-индуцеры. Соотношение между этими двумя
типами Т-лимфоцитов в норме составляет 6,9:1, у больных целиа-
кией оно возрастает до 12,3:1. После лечения аглютеновой диетой
уменьшается инфильтрация эпителия, а соотношение между типами
Т-клеток становится почти таким же, как в норме. Введение глютена
вызывает быстрое (в течение нескольких часов) нарастание ин-
фильтрации эпителия, укорочение ворсинок и углубление крипт.
На этом основании А. Е. Freedman и соавт. (1987) считают, что
Т-лимфоциты принимают участие в патогенезе целиакии. Количе-
ство бокаловидных энтероцитов значительно уменьшено. Они встре-
чаются только в глубине крипт.
Собственная пластинка слизистой оболочки обильно инфильтри-
рована плазматическими клетками. Почти равномерно увеличено
количество клеток, секретирующих все виды иммуноглобулинов,
особенно много IgM-плазмоцитов [van Sprrenwel I. et al., 1986].
Лимфоцитов в собственной пластинке значительно меньше, чем в
норме. Среди них встречаются трансформированные лимфоциты с
крупными ядрами, хорошо развитой эндоплазматической сетью и
малым числом цитоплазматических органелл [Guix М. et al., 1979 ].
Содержание Т-лимфоцитов в собственной пластинке в отличие от
эпителия в пределах нормы [Freedman А.Е., 1987].
Результаты гистологического, гистохимического и радиоавтогра-
491
фического исследования свидетельствуют о глубоких нарушениях
процессов регенерации в тонкой кишке. Резкое удлинение крипт —
генеративной зоны слизистой оболочки кишки — характеризует
своеобразие атрофии у таких больных, которую можно обозначить
как гиперрегенераторную.
Нарушение абсорбции при целиакии обусловлено не только
уменьшением всасывающей поверхности тонкой кички из-за резко
выраженной атрофии ворсинок, но и замещением зрелых энтеро-
цитов мало ифференцированными. Длительное лечение аглютеновой
диетой приводит к значительному улучшению общего состояния
больных и нормализации процессов всасывания. Однако повторная
биопсия даже при строгом соблюдении диеты показывает восста-
новление нормального строения слизистой оболочки только у части
пациентов. У остальных ворсинки остаются атрофичными, но высота
эпителия отчетливо увеличивается во всех случаях. В нем появляется
щеточная каемка, восстанавливается градиент РНК, снижается ин-
декс метки 3Н-тимидином [Аруин Л. И. и др., 1983].
Оценка регенераторных потенций слизистой оболочки имеет пер-
востепенное значение для прогнозирования успеха лечения. Он воз-
можен только у тех больных, у которых высок пул пролифериру-
ющих энтероцитов. В этих случаях удается добиться даже восста-
новления ворсинок. Если же скорость клеточного обновления
находится на уровне «нормы», возможностей для восстановления
становится меньше.
4У больных с пищевой аллергией собственная пластинка ин-
фильтрирована плазматическими клетками, среди которых много
IgE-клеток, и эозинофилами. Интересно, что исключение из пищи
аллергена приводит к нормализации слизистой оболочки, однако
инфильтрация IgE-клетками сохраняется [van Spreewel J. et al.,
1986].
Болезнь Уиппла. Наиболее характерным признаком этого редкого
заболевания является наличие крупных своеобразных ШИК-поло-
жительных макрофагов, обильно инфильтрирующих собственную
пластинку слизистой оболочки (такие же макрофаги имеются в
брыжеечных лимфатических узлах, синовиальной жидкости, печени,
мозговых оболочках). В полутонких срезах, окрашенных толуиди-
новым синим, и при электронно-микроскопическом исследовании в
слизистой оболочке кишки (рис.' 10.11) и в лимфатических узлах
обнаруживаются бациллы, тип которых до настоящего времени ус-
тановить не удалось.
Обычно при микроскопическом исследовании можно отметить
небольшое укорочение, утолщение, а местами и деформацию вор-
синок. Энтероциты несколько расширены, с отчетливо исчерченной
каемкой, дающей положительную ШИК-реакцию. Собственная пла-
стинка ворсинок диффузно ифильтрирована крупными клетками со
слабоэозинофильной и пиронинофильной пенистой цитоплазмой, да-
ющей резко положительную ШИК-реакцию. В собственной пла-
стинке слизистой оболочки в ворсинках и между криптами распо-
лагаются полости различных размеров, часть их имеет эндотели-
492
Рис. 10.11. Болезнь Уиппла. Бациллы в межклеточном пространстве и
макрофагах, х 12 000.
альную выстилку. Содержимое этих полостей окрашивается осмием,
жировым красным О и другими красителями, выявляющими липиды.
Диагностика болезни Уиппла, в которой решающую роль играет
энтеробиопсия, имеет очень большое клиническое значение: свое-
временно начатая антибиотикотерапия приводит к значительному
улучшению состояния больных. При дифференциальной диагностике
болезни Уиппла следует иметь в виду, что сходная макрофагальная
инфильтрация наблюдается при микобактериальных инфекциях у
больных ВИЧ-инфекцией.
Болезнь Крона (гранулематозный энтерит и энтероколит). Бо-
лезнь Крона характеризуется утолщением стенки кишки, глубокими
щелевидными язвами; слизистая оболочка имеет вид булыжной
мостовой. У 25% больных в острой фазе болезни Крона и у 60—70%
в хронической фазе обнаруживаются мелкие саркоидоподобные .гра-
нулемы. Особенно часто они встречаются в анальной области, где
их находят в 36 раз чаще, чем в тонкой кишке, в 6 раз чаще, чем
в ободочной, и в 2 раза чаще, чем в прямой [Remmele W., 1984].
Характерным признаком болезни Крона считается наличие оча-
говых скоплений лимфоидных клеток во всех слоях кишки, а также
трансмуральных щелевидных язв, окруженных воспалительным ин-
фильтратом, который больше выражен в подслизистой основе, чем
в слизистой оболочке. Встречаются также ангииты, лимфангиэктазии
и участки пилорической метаплазии слизистой оболочки. В пора-
женных участках повышено содержание Т-лимфоцитов. Соотноше-
493
ние между Т-хелперами и Т-супрессорами не зависит от активности
процесса и от лечения, что ставит под сомнение патогенетическую
роль Т-лимфоцитов в развитии болезни Крона.
Неспецифический язвенный колит. В 36—39% случаев поражает
всю ободочную кишку, в 25—28% — ее левую половину, в 7—
18% — прямую и сигмовидную, в 7—9% колит бывает сегментар-
ным, в 9—11% правосторонний колит сочетается с илеитом [Otto Н.
et al., 1976; Roth J. L., 1976]. Макроскопически находят эрозии и
плоские язвы, полиповидные изменения слизистой оболочки.
При микроскопическом исследовании выявляется лейкоцитарная
инфильтрация дна язв, крипт-абсцессы в сохранившейся слизистой
оболочке (они встречаются почти у 70% больных), уменьшение
числа бокаловидных клеток (это важный признак в дифференци-
альной диагностике с болезнью Крона). Слизистая оболочка и под-
слизистая основа обильно инфильтрированы лимфоцитами, макро-
фагами и плазматическими клетками с высоким содержанием всех
иммуноглобулинов. При этом инфильтрация (в отличие от болезни
Крона) интенсивнее в слизистой оболочке, чем в подслизистой
основе. Значительная примесь эозинофильных лейкоцитов свиде-
тельствует о протрагированном, сравнительно благоприятном тече-
нии заболевания [Willoughby С. Р. et al., 1979].
В фазе ремиссии наступает регенерация эпителия, уменьшается
воспалительная инфильтрация. Слизистая оболочка подвергается
атрофии с метапластическим образованием клеток Панета в криптах
и гиперплазией лимфатических узелков. Нередко при язвенном
колите развивается дисплазия эпителия. Тяжелая дисплазия счита-
ется истинным предраком, и выявление ее служит показанием к
превентивной колэктомии [Remmele W., 1984].
Следует отметить, что при остром инфекционном колите в вос-
палительном инфильтрате слизистой оболочки преобладают IgA- и
IgM-клетки, количество IgG-клеток не изменяется. В то же время
у больных с активным хроническим воспалением при болезни Крона
и язвенном колите заметно увеличено содержание IgG-, а также
IgA-клеток. Наряду с этим у больных с болезнью Крона особенно
много IgM-плазмоцитов. Этот показатель используется для диффе-
ренциальной диагностики болезни Крона и язвенного колита
[Spreenwell J. Р. et al., 1986].
Синдром приобретенного иммунодефицита (ВИЧ-инфекция).
Пищеварительный тракт вовлекается при всех формах ВИЧ-инфек-
ции (см. главу 9). В тонкой кишке нередко встречается микобак-
териоз, для которого характерна инфильтрация собственной пла-
стинки ШИК-положительными макрофагами такого же вида, как
при болезни Уиппла. В отличие от нее макрофаги содержат огромное
количество кислотоустойчивых бацилл. При цитомегаловирусном
поражении иногда выявляются типичные включения в эпителии.
Много таких включений находят в фибробластах, миоцитах и эн-
дотелиоцитах.
В ободочной кишке отмечено резкое уменьшение содержания
лимфоцитов в фолликулах. На этом фоне развиваются картины
494
цитомегаловирусного, микобактериального, герпетического и крип-
тоспоридиозного колита разной степени выраженности. Лейкоцитар-
ная реакция при этом выражена слабо. У больных СПИДом гомо-
сексуалистов часто развивается воспаление слизистой оболочки пря-
мой кишки, которое может быть вызвано большим количеством
возбудителей. В слизистой оболочке кишечника заметно снижено
(на 50—90%) содержание плазматических клеток, секретирующих
IgA. В то же время возрастает количество IgM-плазмоцитов [Kotler
D. Р. et al., 1987]. Дефект IgA важен для понимания патогенеза
инфекционных поражений кишечника при СПИДе, так как в этих
условиях облегчается проникновение возбудителей в слизистую обо-
лочку.
10.2.3. Брюшина
Уникальные свойства брюшины обусловлены ее анатомическими
особенностями и определяются своеобразием строения и функции
мезотелия, волокнистого каркаса, межклеточного вещества, а также
гемо- и лимфомикроциркуляторного русла. На 1 мм2 брюшины
располагается до 75 тыс. кровеносных капилляров. Во многих уча-
стках ее имеются две сети лимфатических капилляров, которые
неодинаково взаимодействуют с системой гемомикроциркуляции.
Особую роль в резорбции жидкости из брюшной полости играют
терминальные лимфатические лакуны брюшины диафрагмы, кото-
рые через стоматы — щелевидные субмикроскопические отверстия —
сообщаются с брюшной полостью [Барон М. А., 1949; Кауфман О. Я.,
Ростовщиков А. С., 1987]. Стоматы открываются при повышении
внутрибрюшинного давления в связи с накоплением жидкости в
брюшной полости [Tsilibary Е. С., Wissig S. L., 1983]. Через стоматы
проникают не только жидкость, но и сравнительно крупные частицы,
в том числе клетки. Важно подчеркнуть, что различные области
брюшины имеют некоторые анатомо-функциональные особенности,
что находит отражение в клинической картине местного, распрост-
раненного или разлитого перитонита.
Функционально-морфологическими особенностями брюшины объ-
ясняется ее огромная всасывательная способность. Брюшина способна
«перекачивать» в сутки до 70 л жидкости [Шалимов А. А. и др.,
1981 ].
Ю.2.3.1. Перитонит
Перитонит может быть первичным (при проникновении в брюшную
полость бактерий гематогенным или лимфогенным путем, а также
через маточные трубы) и вторичным (при распространении инфек-
ции из органов чаще брюшной полости). Этиологически различают
бактериальный и абактериальный (асептический) перитонит, а по
течению — острый, подострый, вялотекущий и хронический. В за-
висимости от поражения анатомических областей брюшной полости
495
перитонит бывает местным (если поражена одна область), распро-
страненным (при поражении нескольких областей) и разлитым (при
поражении всей брюшины).
Причины острого разлитого перитонита чрезвычайно разнообраз-
ны, однако наиболее часто он является следствием перфоративного
аппендицита и опухолей толстой кишки, сопровождающихся ее
перфорацией [Пауков В. С., Петров В. И., 1983; Глумов В. Я. и др.,
1987; Струков А. И., Пауков В. С., 1987]. Мор<]юлогической специ-
фики, обусловленной причиной перитонита, обнаружить не удается,
но отчетливо выявляются особенности, связанные с длительностью
течения перитонита. Поэтому можно проследить динамику измене-
ний брюшины и внутренних органов в зависимости от стадии за-
болевания. Следует отметить, что еще до развития острого перито-
нита в крови больных острым аппендицитом, опухолями кишечника,
другими воспалительными заболеваниями пищеварительного тракта
отмечается умеренно выраженный вторичный иммунодефицит, обус-
ловленный угнетением Т-звена иммунитета.
Патомор<]юлогия перитонита изучена на биопсийном, секцион-
ном и экспериментальном материале. Наибольшее значение имеет
острый разлитой перитонит, смертность от которого составляет
10—67% [Кузин М. И., 1986; Глумов В. Я. и др., 1987; Delaitre
В. et al., 1988]. При этом заболевании состояние больных и
неблагоприятное течение связаны не только с резкими наруше-
ниями функции легких, сердца, печени, почек, но и с наличием
вторичных нарушений иммунного гомеостаза. Ведущим патогене-
тическим фактором является прогрессирующая интоксикация, свя-
занная с особыми условиями, в которых развивается заболевание:
при нарушении целостности полых органов в брюшную полость
вместе с микробами-сапрофитами попадают пищевые массы, фер-
менты, кислоты или щелочи.
Можно выделить 4 морфологических типа перитонита: серозно-
фибринозный, гнойно-фибринозный, гнойно-фибринозный с выра-
женным некротическим компонентом, гнойно-продуктивный. Сле-
дует иметь в виду, что при исследовании материалов вскрытий
умерших от перитонита, которым при жизни была произведена
операция, воспалительные изменения брюшины обычно представ-
лены не очень ярко из-за послеоперационной санации брюшной
полости. В таких случаях брюшина может быть без каких-либо
наложений, тусклой, несколько клейкой. Аналогичная картина на-
блюдается при так называемом сухом перитоните или «остром пе-
ритонеальном сепсисе».
В патогенезе острого перитонита выделяют 3 стадии: реактивную,
токсическую и терминальную [Симонян К. С., 1971 ].
При разлитом перитоните морфологические изменения быстро
нарастают и коррелируют со стадией процесса. В реактивной стадии
перитонита следует выделять две фазы — раннюю (до 12 ч) и
позднюю (свыше 12 ч). В ранней фазе обычно наблюдается серо-
зно-фибринозный перитонит. Брюшина тусклая, гиперемированная,
с умеренным количеством фибринозных наложений. Обнаруживается
496
отек брюшины, особенно глубокого слоя эластических и коллагено-
вых волокон, где нередко наблюдаются очаговые кровоизлияния,
отдельные ПЯЛ. Мезотелиоциты округляются в связи с сокращением
их сократительных элементов, большинство из них слущивается
(рис. 10.12, а). В обнаруженных участках базальной мембраны
брюшины фиксируются IgG и комплемент, что способствует накоп-
лению вблизи нее ПЯЛ.
Значительно страдает микроциркуляторное русло брюшины. На-
растают его гиперемия, набухание и отек эндотелия и базальной
мембраны сосудов. Происходит очаговая деструкция цитомембран
и цитоплазмы эндотелиоцитов, уменьшается количество пиноцитоз-
ных везикул в них, чему способствует и нарастающая деструкция
цитоскелета эндотелиальных клеток. В поздней фазе реактивной
стадии, кроме того, отмечается сокращение эндотелиоцитов с обра-
зованием межэндотелиальных щелей, что в определенной степени
компенсирует снижение пиноцитоза, способствуя сбросу жидкости,
так как при этом быстро выравнивается градиент концентрации
между просветом сосуда и периваскулярным пространством. Обра-
зование межэндотелиальных щелей обеспечивает и эмиграцию из
сосудов форменных элементов крови: резко возрастает проницае-
мость микроциркуляторного русла. В результате этого в брюшине
появляются кровоизлияния, скопления мелкогранулярных белковых
масс. Вместе с тем в капиллярах и венулах наблюдаются стазы
крови, эритроцитарные агрегаты и тромбы (рис. 10.12, б), а также
краевое стояние ПЯЛ, их эмиграция из сосудов и расположение
периваскулярно в виде муфт. По существу развиваются флебиты,
артериолы при этом обычно спазмированы. Широко раскрываются
лимфатические стоматы брюшины. Вместе с тем в брюшине мало
ПЯЛ, причем к концу 1-х суток заболевания в ней наблюдаются
в основном дегранулированные ПЯЛ. В части из них виден фагоцитоз
бактерий и продуктов распада тканей. Изредка встречаются «гнойные
тельца».
Активность функции ПЯЛ, характер инфильтрации ими брюши-
ны в динамике острого разлитого перитонита разнообразны [Ерма-
кова Н. Г., 1988 ]. В поздней фазе реактивной стадии в брюшине
обнаруживаются единичные макрофаги, иногда фагоцитирующие
бактерии. В мазках-отпечатках с брюшины содержится 94% ПЯЛ
их фагоцитарный индекс составляет 50% при значительном коли-
честве микроорганизмов (свыше 100 в поле зрения), 4% моноцитов,
2% лимфоцитов.
Иммунодефицит при остром разлитом перитоните независимо от
стадии процесса характеризуется отчетливым снижением содержания
в крови Т- и Т-хелперных (Тх) лимфоцитов, относительным уве-
личением количества Т-супрессорно-цитотоксических (Тсц) и В-
лимфоцитов, а также снижением отношения Тх — Тсц. В реактивной
стадии в мезентериальных лимфатических узлах происходят гипер-
плазия коркового вещества и паракортикальной зоны, увеличение
количества и размеров лимфоидных фолликулов. В Т-зависимой
зоне в основном расположены Тх, почти в 2 раза меньше Тсц-лим-
497
Рис. 10.12. Серозно-
фибринозный перитонит
(реактивная стадия),
а — на поверхности брюши-
ны — сохранившиеся округ-
лые мезотелноциты, брюшина
умеренно инфильтрирована
полиморфно-ядерными лейко-
цитами. Окраска гематоксили-
ном и эозином, к 120.
фоцитов. Первичные лимфоидные фолликулы и мантийная зона
вторичных фолликулов состоят в основном из В-лимфоцитов и
небольшого количества Тх-клеток. Иммунологическое исследование
распределения лимфоцитов в суспензии из лимфатических узлов
больных подтверждает наличие двух фаз реактивной стадии острого
разлитого перитонита — фазы активации периферических органов
иммуногенеза и фазы угнетения иммунного ответа [Шлопов Б. В.,
1990].
После операции, произведенной в реактивной стадии острого
разлитого перитонита, иммунодефицит прогрессирует в течение при-
мерно 3 сут, что связано, по-видимому, с повреждением иммунной
системы экзо- и эндотоксинами, а также с угнетающим влиянием
на нее наркоза и самого оперативного вмешательства. Вторичный
иммунодефицит исчезает чаще на 14-е сутки после операции.
Токсическая стадия острого разлитого перитонита развивается у
больных на 2-е сутки заболевания. Экссудат приобретает гнойно-фиб-
ринозный характер. На поверхности брюшины очень мало мезотели-
оцитов, нередко выявляются эритроциты и капли жира. Иногда в ба-
зальной мембране брюшины обнаруживается фиксация IgG, изредка
в сочетании с Сз. Меняются тинкторйальные свойства коллагеновых
волокон. В глубоком решетчато-коллагеново-эластическом слое брю-
498
Рис. 10.12. Продол-
жение.
6 — тромбоз мелкой вены брю-
шины. В просвете вены — гра-
нулярные массы, тромбоциты,
выщелоченные эритроциты.
Эндотелноциты резко сокра-
щены, под ними — скопления
фибрина. * 4000.
шины появляются свертки фибрина, капли жира, отмечаются крово-
излияния, умеренная инфильтрация ПЯЛ и макрофагами, которая бо-
лее выражена вокруг сосудов (рис. 10.13, а). Сохраняется резкая ка-
пиллярная и венозная гиперемия. В просветах капилляров и венул
много стазов и микротромбов, а в венах — агрегаты из измененных
эритроцитов, трансформирующихся в агглютинаты. Выражен эритро-
диапедез. Количество тромбоцитов снижается, часть из них разруше-
на. Не исключено, что такие изменения отражают морфологию «коа-
гулопатии потребления», характерную для ДВС. Выражены краевое
стояние и эмиграция ПЯЛ. Нарастают дистрофические и деструктив-
ные изменения эндотелиоцитов. Количество пиноцитозных везикул в
них снижается до 5-—10 на клетку. Между резко сокращенными эндо-
телиальн ми клетками образуются широкие щели. Под эндотелием
часто наблюдается незначительное количество фибрина. В базальных
мембр шах микрососудов фиксируются иммуноглобулины, в основном
IgG и IgM, иногда Сз. Фиксация иммуноглобулинов отмечается и на
поверхности эмигрирующих ПЯЛ. Гистогематический барьер разру-
шается, что усиливает сосудистую проницаемость и процессы экссу-
дации. Вместе с тем повреждение стенок сосудов, активация кининовой
системы и фактора Хагемана способствуют развитию внутрисосуди-
стой коагуляции.
499
Рис. 10.13. Гнойно-фибринозный перитонит (токсическая стадия).
а — брюшина отечная, мезотел иониты набухшие; базальная мембрана местами разрушена,
около нее внутри просвета — фибрин, снаружи — скопления полиморфно-ядерных лейкоцитов,
х 4000; б — большое количество микроорганизмов на поверхности брюшины, х 2500.
По мере развития заболевания в брюшине нарастает лейкоци-
тарная инфильтрация, многие ПЯЛ фагоцитируют микроорганизмы.
Вместе с тем много ПЯЛ, в цитоплазме которых мало гранул, очаги
цитолиза и хроматолиза, картина незавершенного фагоцитоза. При
этом в целом увеличивается количество микроорганизмов в экссудате
и на поверхности брюшины (рис. 10.13, б). В экссудате и инфиль-
трате обычно встречаются макрофаги, которые при благоприятном
течении перитонита на 3—4-е сутки заболевания формируют от-
граничительный вал в толще брюшины.
После хирургической санации брюшной полости происходит ин-
тенсивное выселение макрофагов на поверхность брюшины. Они
фагоцитируют погибшие ПЯЛ, детрит, отмечаются явления фиб-
роклазии. В инфильтрате встречаются ПЯЛ, лаброциты, лимфоциты.
Снижение количества или отсутствие макрофагов в инфильтрате
500
является неблагоприятным прогностическим признаком и наблюда-
ется при нарастании интоксикации и прогрессировании заболевания.
При исследовании мазков-отпечатков с поверхности брюшины от-
мечается снижение по сравнению с реактивной стадией количества
ПЯЛ до 81% и фагоцитарного индекса до 28%; количество моно-
цитов и лимфоцитов возрастает на 2% и достигает 12% и 7%
соответственно.
Через сутки после операции у больных, поступивших в токси-
ческой стадии, при благоприятном течении заболевания общее ко-
личество лимфоцитов в крови достоверно снижается почти в 1/2
раза, особенно за счет Тх- и Тсц-лимфоцитов. Уменьшается соот-
ношение лимфоцитов Тх- и Тсц-, отчетливо снижается и количество
В-лимфоцитов. Иммунодефицит нарастает в течение 3 сут после
операции, затем стабилизируется, и после 7-х суток начинает по-
вышаться количество иммунокомпетентных клеток. Иммунодефицит
ликвидируется примерно через 20—25 сут после операции. В этой
стадии перитонита в брыжеечных лимфатических узлах обычно
несколько стерт рисунок, еще больше, чем в реактивной стадии,
уменьшаются размеры коркового вещества, паракортикальной зоны
и лимфоидных фолликулов. В лимфатических узлах резко снижается
количество Тх-клеток. При иммунологическом исследовании отме-
чается прогрессирующее снижение содержания Тх- и Тсц-лимфо-
цитов.
При развитии осложнений и неблагоприятном послеоперацион-
ном течении процесса в крови прогрессивно снижаются все попу-
ляции и субпопуляции лимфоцитов, однако процентное содержание
Тсц- и В-клеток в противоположность их абсолютному количеству
нарастает. Значительно уменьшается соотношение Тх- и Тсц-лим-
фоцитов, что нарушает кооперативные взаимодействия как между
субпопуляциями Т-лимфоцитов, так и между Т-лимфоцитами и
другими лимфоидными клетками.
Таким образом, для токсической стадии острого разлитого пе-
ритонита характерны гнойно-фибринозный экссудат, усиление лей-
коцитарно-макрофагальной инфильтрации брюшины, нарастание
интоксикации, прогрессирующее нарушение микроциркуляции, уси-
ление вторичного иммунодефицита, нарастание количества микро-
организмов в брюшине и экссудате при некотором снижении фаго-
цитарной функции ПЯЛ и макрофагов, коррелирующем с небла-
гоприятным течением заболевания.
В терминальной стадии острого разлитого перитонита у больных
отмечаются выраженная интоксикация и декомпенсированный ме-
таболический ацидоз. При лапаротомии в брюшной полости опре-
деляется иногда до 2 л гнойно-фибринозного экссудата, покрываю-
щего брюшину в области диафрагмы, желудка, вздутые петли ки-
шечника и скапливающегося в различных участках брюшной
полости. Брюшина тусклая, местами грязно-багрового цвета, сосуды
ее резко гиперемированы. В экссудате, на поверхности брюшины,
лишенной мезотелиоцитов, и во всех других ее слоях выявляется
большое количество разнообразных микроорганизмов. В толще брю-
501
Рис. 10.14. Острый раз-
литой перитонит' (тер-
минальная стадия),
а — в отечной брюшине —
скопление мелкогранулярных
масс, фибрина, много гнойных
телец и свободно лежащих
микроорганизмов. Картина
гнойно-фибринозного перито-
нита с выраженным некроти-
ческим компонентом. * 12 000.
шины видны и грубозернистые азурофильные массы, фибрин; кол-
лагеновые волокна набухшие, фрагментированы. Во всех слоях брю-
шины видны очаговые инфильтраты из ПЯЛ, много гнойных телец,
эритроцитов, лаброцитов, лимфоцитов, незначительное количество
макрофагов (рис. 10.14, а). Отчетливо снижается фагоцитарная
активность ПЯЛ и макрофагов: в их цитоплазме почти нет микроб-
ных тел, хотя рядом имеются скопления бактерий. В мазках-отпе-
чатках с брюшины количество ПЯЛ снижается до 66%, а их фа-
гоцитарный индекс — до 14%; количество моноцитов возрастает
до 28%, а число лимфоцитов снижается до 6%. Изменения сосудов
выражены очень резко: отчетливо видны эмиграция из сосудов ПЯЛ,
инфильтрация ими периваскулярной ткани. Наблюдается картина
гнойного тромбофлебита и тромбоартериита. В микролимфоцирку-
ляторных сосудах встречаются ПЯЛ и эритроциты.
После операций, произведенных в терминальной стадии острого
разлитого перитонита при благоприятном течении процесса, у боль-
ных отмечается резко выраженная иммунодепрессия. Количество
Т-, Тх и Тсц-лимфоцитов достоверно снижается на 3-и сутки после
операции более чем в 2 раза, В-лимфоцитов — почти в 2 раза по
502
Рис. 10.14. Продол-
жение.
б — гнойно-продуктивное вос-
паление брюшины через 6 сут
после операции по поводу
гнойно-фибринозного перито-
нита. Окраска гематоксилином
и эозином, х 180.
сравнению с их дооперационным уровнем. Тенденция к увеличению
количества лимфоцитов появляется лишь через 7 сут после операции,
однако полного восстановления не происходит даже на 21-е сутки.
Соотношение Тх—Тсц-клеток постепенно увеличивается пропорци-
онально длительности послеоперационного периода. В брыжеечных
лимфатических узлах отмечаются гипоплазия Т-зависимых зон и
уменьшение площади первичных и вторичных лимфоидных фолли-
кулов и их количества, причем большинство из последних не имеет
светлых центров. Продолжает снижаться количество Тх-лимфоцитов
в корковом веществе. Количество В-лимфоцитов в мозговом веществе
несколько уменьшается. В суспензии из лимфатических узлов по
сравнению с токсической стадией болезни достоверно снижается
содержание общей популяции Т-клеток и их субпопуляций, а со-
держание В-лимфоцитов увеличивается. Соотношение Тх—Тсц-кле-
ток резко падает при прогрессировании перитонита, что коррелирует
с тяжестью течения заболевания. Иммунологические изменения кор-
релируют с морфологическими изменениями лимфатических узлов
и свидетельствуют о продолжающемся угнетении иммунной функ-
ции.
503
При присоединении осложнений или при неблагоприятном исходе
заболевания независимо от стадии, в которой был оперирован боль-
ной, в крови отмечается снижение всех популяций и субпопуляций
лимфоцитов, однако процентное содержание Тсц- и В-клеток в
противоположность их абсолютному количеству обычно нарастает.
Значительно уменьшается соотношение Тх- и Тсц-лимфоцитов, что
нарушает кооперативные взаимодействия как между субпопуляци-
ями Т-звена иммунитета, так и между Т-лимфоцитами и другими
лимфоидными клетками.
Таким образом, морфология терминальной стадии острого раз-
литого перитонита характеризуется гнойно-фибринозным воспале-
нием брюшины с выраженным некротическим компонентом, гной-
ными тромбофлебитами и тромбартериитами микрососудов брюши-
ны, тяжелым вторичным иммунодефицитом, отчетливым снижением
фагоцитарной активности ПЯЛ и макрофагов.
При длительно текущем местном перитоните часто наблюдается
гнойно-продуктивное воспаление брюшины (рис. 10.14, б). Ана-
логичная картина возникает и при разлитом перитоните после
хирургического лечения и санации брюшной полости. Однако в
этом случае гнойный компонент быстро исчезает и в брюшине
преобладают процессы репарации. При этой форме перитонита в
инфильтрате брюшины, который носит диффузный и диффузно-
очаговый характер, наряду с ПЯЛ особенно много лимфоцитов,
макрофагов и фибробластов. Между листками брюшины образуются
спцйки.
10.3. ПЕЧЕНЬ
Особенности воспаления в печени определяются прежде всего этио-
логическими факторами, однако структурно-функциональные осо-
бенности органа не менее важны для характеристики воспалительной
реакции.
Своеобразие строения печени определяется прежде всего особым
ее положением. Печень — это барьер между пищеварительным
трактом и остальными системами организма. Вопрос о том, что
считать структурно-функциональной единицей печени, решается
неоднозначно [Gerber М. A., ThungS. N., 1987]. Чаще пользуются
более удобным понятием — «печеночная долька», так как ее ус-
ловные границы могут быть легко определены. В центре гексаго-
нальной печеночной дольки расположена выносящая центральная
вена, а в ее углах — портальные тракты. Гепатоциты образуют
балки, которые радиарно расходятся от центральной вены. Внутри
печеночной балки, состоящей из двух гепатоцитов, располагаются
желчные капилляры. Между балками находятся синусоиды, не име-
ющие базальной мембраны и ограниченные синусоидальными клет-
ками — эндотелиоцитами, звездчатыми ретикулоэндотелиоцитами,
липоцитами и Pit-клетками.
В печеночной дольке различают центральную, промежуточную
504
и перипортальные ее части. Однако считается, что понятию струк-
турно-функциональной единицы печени более соответствует пече-
ночный ацинус [Rappoport А., 1982 ], в котором различают 3 зоны:
I — вокруг портального тракта, III — примыкает к центральным
венам, II — располагается между II и III зонами. Ацинус — трех-
мерная структура. Кровоток в ней формируется из терминальных
воротных венул и терминальных печеночных артериол портальных
трактов (I зона), которые впадают в синусоиды. Из синусоидов
кровь попадает в терминальные печеночные венулы периферии аци-
нусов (III зона). Как видно, кровоснабжение в разных отделах
ацинуса неоднозначно, что отражается на метаболической активно-
сти гепатоцитов. Зоны ацинуса и части гексагональной печеночной
дольки совпадают не полностью, и это надо учитывать.
Гепатоциты разделяют на темные и светлые. Темные гепатоциты
локализуются преимущественно в перипортальной трети печеночной
дольки, но могут встречаться в промежуточной и даже центральной
зонах. Большинство светлых гепатоцитов располагается в централь-
ной зоне дольки и лишь единичные — в перипортальной [Бекето-
ва Т. П., 1982]. Темные и светлые гепатоциты имеют различную
ультраструктуру и выполняют разные функции. Темные гепатоциты
по сравнению со светлыми имеют более развитую зернистую ци-
топлазматическую сеть, в них больше митохондрий, свободных ри-
босом, полисом и гликогена, лучше развит пластинчатый комплекс
[Шкурупий В. А., 1973; Miller D. et al., 1978]. Высокая активность
ферментов глюконеогенеза, дыхательных ферментов позволяет счи-
тать, что функция гепатоцитов периферических отделов дольки
связана с синтезом белков плазмы [Секамова С. М., Бекетова Т. П.,
1989]. В светлых гепатоцитах печеночной дольки хорошо развита
не зернистая, а гладкая цитоплазматическая сеть, они содержат
много микротелец, мелкие удлиненные митохондрии [Шкуру-
пий В. А., 1973; Inestrosa N. et al., 1979]. В них высока активность
ферментов липидного обмена, синтеза желчи, метаболизма ксено-
биотиков [Фактор В. М. и др., 1979]. Основная функция гепатоцитов
центральной зоны печеночной дольки — детоксикационная.
Гепатоциты находятся в кооперативных связях с синусоидаль-
ными клетками, не только «защищающих» печеночные клетки,
но и обеспечивающих выполнение их многообразных функций.
Нарушение этих кооперативных связей составляет сущность
многих патологических процессов в печени, в том числе и вос-
паления.
В основе выделения групп воспалительных заболеваний печени
лежит структурный принцип. Воспалительный процесс, локализу-
ющийся преимущественно в паренхиме и строме печени, называют
гепатитом, в желчных протоках — холангитом и холангиолитом.
Характеристика этих воспалительных процессов складывается из
повреждения, воспалительной инфильтрации, трансформации кле-
ток, завершающейся фиброзом. Особенности этих компонентов вос-
палительной реакции в печени зависят от этиологии процесса и
Механизма развития [Серов В. В., Лапиш К., 1989].
505
10.3.1. Гепатит
Гепатит относится к наиболее частым заболеваниям печени, имеет
ключевое значение в развитии цирроза этого органа. Поэтому особое
внимание уделяют изучению морфологических признаков гепатитов,
позволяющих определить прогноз заболевания.
10.3.1.1. Повреждение — неотъемлемый компонент гепатита
Ведущим видом повреждения при гепатите является некроз гепа-
тоцитов, механизмы развития которого различны. Выделяют пят-
нистые, ступенчатые, мостовидные (сливающиеся) и массивные не-
крозы [Bianchi L., 1986 ].
Пятнистые некрозы. Они могут быть цитолитическими (коллик-
вационными), ацидофильными (коагуляционными) или в виде апоп-
тоза.
Цитолитические некрозы — результат чрезмерной гидропии
гепатоцита. Поражаются, как правило, мелкие группы печеночных
клеток центральной (перивенулярной) зоны. Такие некрозы ти-
пичны для острого вирусного гепатита с пятнистыми некрозами.
В связи с тем что цитолитические некрозы развиваются чрезвы-
чайно быстро и в короткий срок приводят к лизису клетки, их
редко наблюдают в биопсийном материале. Стигмами таких не-
крозов служат очаговые скопления лимфоцитов и макрофагов в
центрах печеночных долек. Исследования in vitro и верификация
субпопуляций лимфоцитов показали, что цитолитические некрозы
лучше коррелируют с Т-клеточной цитотоксичностью [Edde-
leston A. L. W. Е. et al., 1985]. Реакцйя Т-клеток нередко связана
с экспрессией HBcAg или HBsAg в гепатоцитах. Цитолитические
некрозы могут быть вызваны также алкоголем и лекарствами
(рис. 10.15).
В отличие от цитолиза ацидофильный некроз является следствием
чрезмерной потери гепатоцитом воды, вероятно, из-за повреждения
мембран. Такие как бы мумифицированные гепатоциты с ацидо-
фильной цитоплазмой и пикнотичным ядром выталкиваются из
печеночной балки и могут поглощаться фагоцитами. Ацидофильные
тельца называют тельцами Каунсилмена. Они описаны в печени
при желтой лихорадке, вирусном гепатите.
Апоптоз рассматривается как физиологический путь заверше-
ния жизненного цикла клетки без повреждения ее мембраны, но
может быть пусковым моментом повреждения. При этом цитоп-
лазма отдельных гепатоцитов или групп клеток конденсируется,
хроматин становится глыбчатым. Распад цитоплазмы ведет к фор-
мированию ацидофильных апоптотических телец. В отличие от
других типов пятнистых некрозов апоптотические тельца часто не
окружены клетками воспалительного инфильтрата. Это объясняют
тем, что при апоптозе не освобождаются биологически активные
вещества. Ацидофильные тельца без клеточной реакции часто
наблюдаются при вирусном гепатите С. Они являются, очевидно,
506
Рис. 10.15. Алкогольный гепатит. Пятнистые некрозы гепатоцитов внутри
дольки. Окраска гематоксилином и эозином. * 250.
апоптотическими, однако значение апоптоза при вирусном гепатите
остается неясным.
Ступенчатые некрозы впервые описаны Н. Popper и соавт. (1965)
как иммунологический тип некроза. Они служат проявлением по-
степенной воспалительной деструкции мелких групп гепатоцитов
перипортальной ограничивающей пластинки. Определяется тесная
связь ступенчатых некрозов с мононуклеарными клетками воспа-
лительного инфильтрата. Взаимодействие лимфоцитов, макрофагов
и гепатоцитов с развитием периполеза и эмпериполеза является
наиболее важным признаком ступенчатых некрозов. Плазматические
клетки и нейтрофилы в зонах, прилежащих к ступенчатым некрозам,
не часты и диагностического значения не имеют. В зонах ступен-
чатых некрозов гепатоциты выглядят по-разному: набухшие, фраг-
ментированные, с формированием апоптотических телец; сохранные
гепатоциты формируют розетки (рис. 10.16). В патогенезе ступен-
чатых некрозов ведущее значение придают антителозависимому
клеточному цитолизу. Обсуждается значение в развитии ступенча-
тых некрозов ряда аутоантигенов — печеночно-специфического бел-
ка и антигена печеночных мембран, однако их прямая патогенность
остается недоказанной. Ступенчатые некрозы следует отличать от
перипортальных некрозов, редко встречающихся при вирусном ге-
патите А. Различия состоят в том, что в зонах перипортальных
некрозов при вирусном гепатите А преобладают плазматические
клетки, а не лимфоциты, некрозы гепатоцитов литического типа,
периполез лимфоцитов не наблюдается.
507
Рис. 10.16. Вирусный гепатит. Ступенчатые некрозы гепатоцитов. Окраска
гематоксилином и эозином. * 250.
Мостовидные (сливающиеся) некрозы. Среди мостовидных не-
крозов в зависимости от топографии разделяют центроцентральные,
центропортальные и портопортальные.
Центроцентральные некрозы, литические по своей природе,
захватывают периферическую часть ацинуса (III зону) от одной
центральной вены до центральной вены соседней дольки. Такие
некрозы не нарушают печеночной микроциркуляции, могут быстро
организовываться, если не сочетаются со ступенчатыми некрозами.
Центропортальные некрозы также литические по своей природе.
Они занимают пространство от центральной вены до портального
тракта. Этот тип мостовидного некроза рассекает печеночный аци-
нус, создает условия для развития портокавальных шунтов. В его
исходе развиваются портокавальные септы с шунтирующими сосу-
дами. Сохранившиеся жизнеспособные гепатоциты, персистирующие
в некротической зоне, рассматриваются как проявление неэффек-
тивной элиминации антигенов вируса или компонентов клеточных
мембран, т. е. нарушенного иммунного ответа. Эти островки сохра-
нившихся гепатоцитов могут стать источником узловой регенерации.
Патогенез центроцентральных и центропортальных некрозов оста-
ется неясным. Предполагается, что для их развития имеет значение
активация системы комплемента при наличии циркулирующих эн-
дотоксинов, а также недостаточность функции звездчатых ретику-
лоэндотелиоцитов.
Портопортальные некрозы тесно связаны со ступенчатыми, рас-
пространяются они от одного портального тракта до другого вдоль
508
I зоны ацинуса. Наиболее характерны они для тяжелого хронического
активного гепатита. Показано, что иммуносупрессивная терапия
может вести к уменьшению воспалительной активности в порто-
портальных мостах, при этом развивается перилобулярный фиброз,
не нарушающий печеночной микроциркуляции.
Массивные некрозы. Эти некрозы более распространенные, чём
мостовидные, и захватывают гепатоциты всей дольки (панлобуляр-
ные) или даже несколько печеночных додек. Тркие некрозы особенно
часто встречаются при вирусном гепатите В с дельта-суперинфек-
цией,, реже их наблюдают при инфекционном мононуклеозе, цито-
мегаловирусной инфекции, лекарственном гепатите. В исходе мас-
сивных некрозов развивается коллапс стромы.
Массивные некрозы печени могут быть воспроизведены в экспе-
рименте на основе механизмов феномена Шварцмана [Mori W. et
al., 1986]. Повторное введение эндотоксина (через 24 ч) в общий
желчный проток или в воротную вену вызывало у кроликов развитие
центролобулярных и панлобулярных некрозов с выраженными ге-
моррагиями в пограничной зоне. В синусоидах и ветвях воротной
вены определялись фибриновые тромбы. На фоне беременности и
приема стероидов такие некрозы развиваются при однократном вве-
дении эндотоксина в общий желчный проток. Провокацию реакции
Шварцмана в печени удалось вызвать и вирусными агентами. Вве-
дение кроликам частиц аденовирусов и HBsAg, полученных от
человека, на фоне предварительного введения эндотоксина модели-
ровало некрозы печени. Эти же вирусные агенты при инъекции в
общий желчный проток вызывали массивные некрозы печени у
кроликов на фоне беременности. Фибриновые тромбы у экспери-
ментальных животных наблюдали не только в печени, но и в других
органах. Эти эксперименты показали, что фульминантный гепатит
человека весьма сходен с проявлениями реакции Шварцмана.
Массивные некрозы лежат в основе такой клинической формы,
как фульминантный гепатит. Заболевание может иметь острое и
подострое течение [Mori W. et al., 1986]. Острый фульминантный
гепатит заканчивается обычно смертью в сроки от 2 до 10 дней.
При аутопсии находят резко уменьшенную, со сморщенной повер-
хностью печень. Масса ее менее 800 г, передний край заострен, на
разрезе видны темно-красные участки с коричневатыми очагами,
напоминает ткань селезенки. Гистологически выявляют некрозы
гепатоцитов, главным образом центролобулярные, но могут наблю-
даться и панлобулярные. Иногда поражена капсула печени. В цен-
тральных венах нередко обнаруживаются воспаление, тромбоз. При
выздоровлении исходом панлобулярных некрозов является замеще-
ние их рубцовой соединительной тканью, однако пространственные
взаимоотношения портальных трактов не изменяются. Прогресси-
рование в цирроз наблюдалось только при персистенции вируса
гепатита в печени [Mori W. et al., 1986].
Подострый фульминантный гепатит также протекает чаще
Фатально, но смерть наступает в более отдаленные сроки. Печень
на аутопсии уменьшена в разменах на 1/з—*/г от нормы. Повер-
509
хность неравномерная, край закруглен. На разрезе орган желто-зе-
леного цвета с красноватыми участками. Гистологически инициаль-
ные некрозы локализуются в ограничивающей пластинке, рециди-
вирование заболевания сопровождается развитием панлобулярных
или центролобулярных некрозов. Наряду с этим обнаруживаются
очаги нерегулярной гипертрофии, регенерации, формируются лож-
ные дольки. Эта форма гепатита, обычно вирусной этиологии, в
течение короткого промежутка времени ведет к формированию цир-
роза печени.
Оценка некротических изменений гепатоцитов при гепатите
крайне важна. Об этом свидетельствует тот факт, что клинические
проявления гепатита коррелируют с выраженностью некротического
компонента. В основу морфологической классификации острого ви-
русного гепатита положен именно этот принцип: различают острый
вирусный гепатит с пятнистыми, ступенчатыми, мостовидными и
массивными некрозами.
10.3.1.2. Особенности воспалительного инфильтрата
при гепатите
Характер воспалительного инфильтрата при гепатите зависит от
многих факторов — этиологии, механизма развития, локализации
и типа некроза. Важно, что особенности клеточного состава воспа-
лительного инфильтрата позволяют судить и о прогнозе гепатита.
Состав клеток воспалительного инфильтрата имеет значение для
установления этиологии первичного гепатита, характера его течения.
Так, при вирусном гепатите преобладают лимфоциты, макрофаги,
плазматические клетки (рис. 10.17). При остром вирусном гепатите
с пятнистыми некрозами в стадии разгара заболевания соотношение
лимфоцитов и макрофагов примерно одинаково, в более поздней
стадии становится больше макрофагов по сравнению с лимфоцитами.
Преобладание макрофагов в инфильтрате при остром вирусном ге-
патите служит показателем выздоровления. С другой стороны, при
хронических формах вирусного гепатита основным компонентом
воспалительного инфильтрата являются лимфоциты. Поэтому если
при остром вирусном гепатите процесс растягивается во времени и
в инфильтрате продолжают преобладать лимфоциты, то это является
показателем хронизации воспаления.
Преобладание нейтрофильных лейкоцитов в воспалительном ин-
фильтрате связывают с образованием лейкотаксических субстанций
(алкогольный гиалин, желчь, лейкотриены, простагландины). Ста-
новится понятной эта особенность воспалительного инфильтрата при
алкогольном [Серов В. В., Лебедев С. П., 1988] и холестатическом
гепатите. Преобладание нейтрофилов в инфильтрате имеет важное
значение в оценке остроты алкогольного гепатита (рис. 10.18): такой
инфильтрат характерен для стадии разгара заболевания. При сти-
хании признаков активности острого алкогольного гепатита преоб-
ладающими становятся макрофаги и лимфоциты [Серов В. В., Ла-
пиш К., 1989]. Редко нейтрофилы появляются при остром вирусном
510
Рис. 10.17. Вирусный гепатит. Лимфомакрофагальный воспалительный
инфильтрат. Окраска гематоксилином и эозином. >< 250.
<
гепатите с мостовидными некрозами, особенно когда они сочетаются
с пролиферацией дуктул.
Большое число эозинофилов в воспалительном инфильтрате ха-
рактерно для токсико-аллергического лекарственного гепатита, в
основе которого лежат реакции гиперчувствительности. Однако не-
редко воспалительный инфильтрат не имеет характерных особен-
ностей, что можно видеть при так называемом неспецифическом
реактивном гепатите. Иногда ведущим в морфологической картине
такого вторичного гепатита является гранулематозное воспаление и
гепатит называют гранулематозным [Серов В. В и др., 1985]. Раз-
личают макрофагальные и эпителиоидно-клеточные гранулемы
[Altman Н., 1980]. В клетках макрофагальных гранулем может быть
выявлен фагоцитированный материал (липиды, продукты распада
клеток, эритроциты, пигменты). В эпителиоидно-клеточных грану-
лемах довольно часто встречаются гигантские клетки, фагоцитиро-
ванный материал в них обычно не выявляется. С помощью повторных
биопсий печени прослежена динамика формирования гранулем. Вна-
чале появляются очаговые скопления звездчатых ретикулоэндоте-
лиоцитов и моноцитарных фагоцитов, затем формируется эпители-
оидно-клеточная гранулема с единичными гигантскими клетками,
постепенно превращающаяся в смешанную сложную гранулему.
В смешанной гранулеме появляются различные клетки-спутники
(лимфоциты, нейтрофилы, эозинофилы), которые могут придавать
гранулеме некоторые характерные черты.
Гранулемы могут обнаруживаться в портальных трактах и внутри
511
Рис. 10.18. Алкогольный гепатит: преобладание в воспалительном инфиль-
трате нейтрофилов. Окраска гематоксилином и эозином, * 250.
дол,ек. Гранулематозное воспаление может сочетаться с выраженным
диффузным воспалением или протекать без такового [Popper Н.,
1986]. Гранулематоз, сочетающийся с диффузным воспалением, на-
иболее ярко представлен при туберкулезе, бруцеллезе, Ку-лихорад-
ке, цитомегалии, реже — при саркоидозе, лекарственном воздей-
ствии. Гранулематоз без выраженного диффузного воспаления опи-
сан в печени при саркоидозе, первичном билиарном циррозе,
шистосомозе. Этиологию гранулематозного гепатита удается уста-
новить не всегда. Микробиологические исследования, бактериоско-
пия довольно редко (около 50%) дают положительные результаты
даже при явном туберкулезе. Наблюдаемые при СПИДе гранулемы,
состоящие обычно из ШИК-положительных макрофагов, связаны с
Mycobacterium intercellularis. f
Преимущественная локализация воспалительного инфильтрата
позволяет различать портальный, перипортальный и лобулярный
гепатит [Popper Н., 1986 ]. При портальном гепатите воспали-
тельный инфильтрат локализуется главным -образом в портальных
трактах. Ои представлен преимущественно лимфоцитами, моноци-
тами, иногда ШИК-положительными макрофагами и единичными
эозинофилами. Портальные тракты расширены, но пограничная пла-
стинка перипортальной паренхимы остается интактной. Портальная
воспалительная инфильтрация может наблюдаться у взрослых при
отсутствии заболевания печени, может быть проявлением неспеци-
фического реактивного гепатита или первичного гепатита в неак-
тивной. стадии.
512
Ярким примером портального гепатита является хронический
персистирующий гепатит вирусной или иной этиологии. При пор-
тальном гепатите в трактах могут образовываться лимфоидные
фолликулы с зародышевыми центрами. Наличие таких лимфоид-
ных фолликулов заставляет предполагать гепатит С или дельта-
гепатит.
При перипортальном гепатите воспалительный инфильтрат
проникает в пограничную пластинку, вызывает ее деструкцию с
развитием ступенчатых некрозов. Среди клеток инфильтрата пре-
обладают лимфоциты, которые тесно контактируют с гепатоцитами,
но могут встречаться также моноциты, плазматические клетки и
даже эозинофилы. Такое перипортальное воспаление со ступенча-
тыми некрозами характерно для хронического активного гепатита.
В отличие от этого при остром вирусном гепатите клетки инфиль-
трата портальных трактов могут распространяться на перипорталь-
ную паренхиму, не вызывая ее некроза.
При лобулярном гепатите, который связывают только с вирусной
этиологией, воспалительный лимфомакрофагальный инфильтрат
располагается внутри дольки вокруг пятнистых некрозов; портальные
тракты при этом мало изменены. Считают, что такой гепатит может
иметь как острое, так и хроническое течение.
Особое место занимает так называемый аутоиммунный гепатит,
выделение которого обосновано с патогенетических и клинических
позиций. За последние годы совершенствовались серологические те-
сты его диагностики, среди которых наиболее важными стали ги-
пергаммаглобулинемия, обнаружение в сыворотке антител к ДНК,
антигена мембран гепатоцитов, растворимого печеночного антигена
[Dienes Н. Р., 1988 ]. Установлено, что аутоиммунный гепатит в
инициальной фазе может иметь характер хронического персисти-
рующего. Ранее считалось, что гистологически для него характерны
ступенчатые некрозы гепатоцитов и инфильтрат из плазматических
клеток. Однако в последующем оба эти признака стали рассматри-
ваться как нехарактерные [Dienes Н. Р., 1988 ]: ступенчатые некрозы
наблюдаются при хроническом активном гепатите любой этиологии,
а плазматические клетки типичны для вирусного гепатита А. Как
видно, патогномоничные гистологические признаки аутоиммунного
гепати а отсутствуют. Дифференциальный диагноз особенно труден
с гепатитом С, специфические маркеры которого также отсутствуют.
Для аутоиммунного гепатита относительно характерным можно счи-
тать поражение портальных трактов и перипортальных зон, лим-
фоцитарный инфильтрат с. отдельными плазматическими клетками,
который может образовывать лимфоидные фолликулы. На границе
с паренхимой в портальных трактах, где находят дендритические
Ретикулярные клетки, обнаруживают только лимфоциты, которые
проникают в синусоиды в виде дорожки. Перипортально развиваются
Рипоцеллюлярные коллапсы паренхимы, которые напоминают сту-
пенчатые некрозы. Зоны коллапса могут распространяться в глубь
паренхимы и даже занимать всю дольку в поздней стадии гепатита.
Сохранившиеся островки гепатоцитов претерпевают микроацинар-
ную трансформацию: крупные набухшие гепатоциты группируются
вокруг расширенных желчных канальцев. Преобладает гидропиче-
ская дистрофия гепатоцитов, ацидофильные некрозы редки. По-
вреждение клеток опосредовано цитотоксическим эффектом лимфо-
цитов. В зонах коллапса в результате некроза гепатоцитов в отличие
от вирусного гепатита в звездчатых ретикулоэндотелиоцитах отсут-
ствует цероид, обнаруживается незначительное число клеток ин-
фильтрата. Все эти изменения находят только при «цветущем»
аутоиммунном гепатите, но не при персистирующей его форме,
которая наблюдается у 15% больных (переход в персистирующую
форму возможен при лечении стероидами). При отмене стероидов
вновь развивается активный гепатит.
В патогенезе аутоиммунного гепатита играют роль, вероятно,
два основных механизма: антительный цитолиз и антителозависимый
клеточный цитолиз. Показано, что определенные компоненты мем-
бран гепатоцитов имеют антигенйые свойства. К таким компонентам
относят антиген мембран гепатоцитов и печеночный специфический
протеин. К ним в крови у больных аутоиммунным гепатитом об-
наружены циркулирующие антитела [Meyer zum Biischenfelde К. Н„
Manns М., 1984]. В эксперименте моноклональные антитела к пе-
ченочному специфическому протеину фиксируются на плазмолемме
гепатоцитов и вызывают их повреждение. Развивается морфологи-
ческая картина, сходная с таковой при аутоиммунном гепатите
человека [Poralla Т. et al., 1987]. Значение антителозависимого
клеточного цитолиза в развитии заболевания подтверждено в экс-
периментах in vitro и in vivo. Показано, что в лимфоцитарном
инфильтрате преобладает популяция СД-8-положительных супрес-
соров — цитотоксических лимфоцитов [Dienes Н. Р., 1988]. Не ис-
ключают также роли в развитии аутоиммунного гепатита экспрессии
на гепатоцитах антигенов HLA I класса [Poralla Т. et al., 1988].
10.3.1.3. Признаки хронизации воспаления печени.
Фиброз как исход гепатита
Вопрос о морфологических различиях острого и хронического гепа-
тита сложен. Характер некротических изменений и воспалительного
инфильтрата зависит главным образом от этиологического фактора,
а не от особенностей течения гепатита. Важно также учитывать,
что фиброз внутридольковой и портальной стромы может быть пред-
существующим, связанным с ранее перенесенными заболеваниями.
Становится понятным, что ведущим критерием различия острого и
хронического гепатита является временной фактор: к острому от-
носят гепатит, продолжающийся менее 6 мес, к хроническому —
гепатит, продолжающийся более 6 мес.
Важное значение имеет поиск гистологических признаков, сви-
детельствующих о хронизации острого гепатита: преобладание в
портальном и перипортальном воспалительном инфильтрате лим-
фоцитов отсутствие пигментированных макрофагов, ступенчатые
некрозы, их сочетание с центропортальными мостовидными некро-
514
зами, формирование лимфоидных фолликулов в портальных трак-
тах, резко выраженная плазмоклеточная инфильтрация портальных
трактов и внутридольковой стромы, поражение желчных ходов,
наличие матово-стекловидных гепатоцитов и HBsAg в ткани печени.
В исходе некротических изменений и воспалительной инфильт-
рации при гепатите развивается фиброз, который при хроническом
гепатите становится его проявлением. Различают внутридольковый
и портальный фиброз.
Внутридольковый фиброз — результат коллапса предсуществу-
ющей стромы и новообразования соединительной ткани. Ведущее
значение в коллагеногенезе внутри дольки придают липоцитам
(клеткам Ито) синусоидов. Механизм портального фиброза не от-
личается от такового в других органах. Различают несколько вари-
антов, внутридолькового фиброза, которые иногда приобретают свой-
ственные для определенного этиологического воздействия черты
[Popper Н., 1986 ]. Перицеллюлярный фиброз, характеризующийся
появлением коллагеновых волокон в перисинусоидальных простран-
ствах, часто наблюдается при воздействии на печень лекарств,
этанола, различных метаболитов (например, при сахарном диабете).
Своеобразный внутридольковый фиброз в виде «куриной лапы» опи-
сан при алкоголизме. Перивенозный (перивенулярный) фиброз, про-
являющийся разрастанием фиброзной ткани вокруг центральных
вен, нередко наблюдается также при алкогольном повреждении
печени.
Портальный и перипортальный фиброз может быть пассивным
и активным. Пассивный фиброз обычно возникает в исходе пор-
тального и перипортального воспаления. В отличие от этого активный
фиброз характеризуется внедрением прослоек соединительной ткани
(септ) от портальных трактов в дольку. В этих радиально идущих
септах воспалительный инфильтрат скудный, но определяются со-
суды, пролиферирующие желчные ходы. Такие картины часты при
неспецифическом реактивном гепатите. В результате пассивного и
активного перипортального фиброза формируются септы (септаль-
ный фиброз), которые могут соединять портальные тракты и цен-
тральные вены, нарушая печеночную микроциркуляцию — сеп-
тальный фиброз.
Ю.3.2. Холангиты, холангиолиты
Воспалительный процесс в желчных ходах может локализоваться
преимущественно в мелких или крупных желчных протоках [Lud-
wig J., 1988]. Воспаление мелких желчных протоков чаще связано
с иммунологическими нарушениями, крупных желчных протоков —
с механическим препятствием оттоку желчи по внепеченочным жел-
чным путям. Промежуточное положение занимает первичный скле-
розирующий холангит, при котором, вероятно, в связи с иммуно-
логическими нарушениями могут быть поражены мелкие или круп-
ные желчные протоки или те и другие одновременно.
17*
515
10.3.2.1. Воспаление преимущественно мелких
желчных протоков
К этой группе холангитов относят первичный билиарный цирроз,
реакцию отторжения трансплантата печени, болезнь «трансплантат
против хозяина», холангит при саркоидозе, приеме лекарственных
средств.
При первичном билиарном циррозе воспалительная деструкция
холангиол проходит ряд стадий. Общепринято выделять 4 стадии
первичного билиарного цирроза печени [Rubin Е. et al., 1965]. Пер-
вая стадия характеризуется деструкцией желчных ходов, хрониче-
ским негнойным воспалением портальных трактов с образованием
нередко эпителиоидно-клеточных гранулем (рис. 10.19); процесс
преобладает в септальных и междольковых желчных протоках. Во
II стадии наблюдается пролиферация желчных протоков, воспали-
тельный инфильтрат распространяется из портальных трактов в
пограничную пластинку и вызывает ее деструкцию. В III стадии
происходят склероз портальных трактов, частичная регрессия вос-
палительных изменений. Для IV (цирротической) стадии характерны
редукция дуктул, уменьшение их количества в склерозированных
портальных трактах.
Накоплено достаточно фактов, подтверждающих значение ауто-
иммунизации в деструкции холангиол при первичном билиарном
циррозе [Mac Sween R. N. et al., 1981]. Полагают, что иммунные
реакции направлены против антигенов желчных протоков. О зна-
чении иммунных нарушений при первичном билиарном циррозе
свидетельствуют нередкие его сочетания с синдромом Шегрена,
аутоиммунным тиреоидитом, ревматоидным артритом [Попо-
ва И. В. и др., 1988 [. Участие клеточных иммунных механизмов
в развитии первичного билиарного цирроза подтверждается мно-
гими фактами. Во-первых, развитием гранулематоза, сходного с
таковым при тех болезнях, при которых участие иммунных ме-
ханизмов убедительно доказано (микобактериальные, грибковые
инфекции). Во-вторых, развитием при первичном билиарном цир-
розе реакции гиперчувствительности замедленного типа к антигену
желчного эпителия и печеночно-специфическому антигену.
В-третьих, развитием цитотоксичности лимфоцитов к аутологич-
ным клеткам печени у большинства больных, причем эта цито-
токсичность наиболее выражена в стадии разгара заболевания. На
участие реакций гуморального иммунитета в деструкции дуктул
указывают поликлоновая гипергаммаглобулинемия (особенно по-
вышен уровень IgM), циркуляция в сыворотке различных ауто-
логичных антител (к гладким мышцам, ядрам, желчным каналь-
цам, мембранам гепатоцитов, митохондриям, а также ревматоид-
ный фактор), иммунных комплексов, наличие депозитов IgG и
Сз вблизи желчных канальцев (особенно в ранней стадии забо-
левания). Среди факторов, определяющих развитие аутоиммуни-
зации при первичном билиарном циррозе, допускаются вирУсЫ
гепатита, лекарственные средства.
516
г
Рис. 10.19. Первичный билиарный цирроз печени: деструкция холангиол,
гранулематозное воспаление в портальном тракте. Окраска гематоксилином
и эозином, х 250
Реакция отторжения трансплантата печени стала изучаться
в последнее время особенно интенсивно в связи с появлением центров
ортотопической трансплантации этого органа. Показано, что холан-
гит является одним из наиболее существенных проявлений такой
реакции [Snover D. С. et al., 1987 ]. Его выраженность (при отсут-
ствии инфекционных осложнений) позволяет прогнозировать выжи-
ваемость трансплантата. Морфологически обнаруживают негнойный
холангит в инфильтрате вокруг желчных ходов преобладают лим-
фоциты (хелперы, Супрессоры — цитотоксические Т-клетки), мак-
рофаги, иногда единичные плазматические клетки. Деструкция жел-
чных ходов не выражена, базальная мембрана интактна. В порталь-
ных трактах может появляться инфильтрат из нейтрофилов и
эозинофилов. Часто обнаруживают повреждение иммуноцитами эн-
дотелия портальных и терминальных печеночных вен. Нередко по-
ражены и артерии (артериит), иногда развивается своеобразная
ксантоматозная артериопатия.
Болезнь «трансплантат против хозяина» наблюдается у 45—
70% реципиентов после аллогенной трансплантации костного мозга.
Развивающийся холангит морфологически сходен с наблюдаемым
при реакции отторжения печеночного трансплантата [Snover D. С.
et al., 1984].
Воспалительная деструкция мелких желчных ходов возможна
при саркоидозе. Морфологическая картина может напоминать пер-
вичный билиарный цирроз, однако гранулематоз более выражен и
517
является ведущим в картине воспаления. У таких больных часто
наблюдаются хронический внутрипеченочный холестаз, положитель-
ная реакция Квейта, а антимитохондриальные антитела не обнару-
живаются. В развитии заболевания придают значение нарушенному
иммунному ответу, о чем свидетельствует часто развивающаяся при
саркоидозе поликлоновая гипергаммаглобулинемия. In vitro в куль-
туре лимфоцитов больных саркоидозом снижены показатели реакции
бласттрансформации в ответ на фитогемагглютинин.
Деструктивный холангит, индуцированный лекарствами, сходен
с таковым при первичном билиарном циррозе. Полагают, что вос-
палительные изменения холангиол связаны с идиосинкразией к
лекарственным препаратам [Ludwig J., 1988].
При первичном склерозирующем холангите, как уже упомина-
лось, могут поражаться как внутрипеченочные, так и внепеченочные
желчные протоки. Холангит имеет хроническое течение с тенденцией
к склерозу стенок желчных протоков, вплоть до полной их обли-
терации. В инфильтрате преобладают лимфоциты и макрофаги.
Заболевание прогрессирует и переходит в цирроз печени. В цирро-
тической стадии первичный склерозирующий холангит морфологи-
чески трудно отличим от первичного билиарного цирроза печени.
Однако для первичного склерозирующего холангита более харак-
терны холангиэктазии желчных протоков крупного и среднего ка-
либра, сочетающиеся с облитерацией холангиол. Наиболее вероятен
аутоиммунный генез заболевания. В крови у больных обнаруживают
циркулирующие иммунные комплексы. Уровень иммуноглобулинов
и иммунных комплексов повышен и в желчи. Среди факторов
аутоиммунизации при первичном склерозирующем холангите об-
суждаются реовирусы 3-го типа [Siddiqui Н. М. et al., 1988]. Забо-
левание преобладает у мужчин, иногда носит семейный характер.
10.3.2.2. Воспаление внепеченочных желчных протоков
Склерозирующий холангит с поражением крупных протоков опи-
сывают при первичном склерозирующем холангите, при внутриар-
териальном лечении флоксиуридином, СПИДе. Однако наиболее
часто воспаление крупных желчных протоков связано с их меха-
нической обструкцией — стриктурой, опухолью, камнями. Восхо-
дящий холангит может развиться как осложнение после операций
на желчевыводящих путях. С увеличением продолжительности хо-
лестаза нарастает воспалительный процесс, в инфильтрате преоб-
ладают нейтрофилы. Постепенно воспаление распространяется на
перидуктальную ткань, мелкие протоки, паренхиму печени.
10.4. ПОЧКИ
Воспаление в ткани почек локализуется в клубочках или в строме,
причем характер воспалительной реакции определяется не только
особенностью ее причины и механизма развития, но и своеобразием
функционирования упомянутых структур.
518
10.4.1. Гломерулонефрит
Значение структурно-функциональных особенностей почечной тка-
ни, в частности ее клубочков, в развитии воспаления наиболее ярко
представлено при гломерулонефрите ( гломерулите). Механизм его
развития в подавляющем большинстве случаев связан с иммунными
реакциями. Исследования, проведенные в этом направлении, позво-
лили получить огромное количество фактов, убеждающих в прича-
стности структурных элементов клубочков к разыгрывающейся в
них иммунной реакции [Серов В, В., 1988].
10.4.1.1. Структурные основы иммунных гломерулярных реакций
К иммунным гломерулярным реакциям причастны как структуры
почечных клубочков (неклеточные и клеточные), так и компоненты
иммунной реакции (иммунные комплексы, антитела, комплемент,
клетки-эффекторы), причем при развитии самой реакции происходит
взаимодействие структур почечных клубочков с клетками иммунной
системы.
Основной неклеточной структурой почечного клубочка
и гломерулярного фильтра, на которой разыгрываются имммунные
реакции при гломерулонефрите, является гломерулярная ба-,
зальная мембрана (ГБМ). Ее высокая функциональная спо-
собность обусловлена наличием специализированных структурных
белков, количество и распределение которых меняется с возрастом
и при различных заболеваниях. В состав ГБМ входят несколько
специфических белков, которые объединяются в высокоорганизо-
ванный матрикс. Это прежде всего коллаген IV типа, ламинин и
две формы гепарансульфатпротеогликанов (ГСПГ), которые обра-
зуют «рабочую сеть», соединяющуюся с клетками и другими ком-
понентами матрикса, включая коллаген V типа, энтактин, ВМ-40,
нефритогенозид, фибронектин [Dziadek М. et al., 1985; Abrahamson
D. R., 1986]. Если с коллагеновыми белками связано структуриро-
вание ГБМ, то с неколлагеновыми гликопротеинами — ламинином,
энтактином и фибронектином — адгезия клеток на базальной мем-
бране. Протеогликаны ГБМ совместно с сиалопротеинами подоцитов
и в меньшей мере эндотелия обеспечивают отрицательный заряд
базальной мембраны (lamina гага externa - lamina densa - lamina
rara interna), который является основным барьером для анионных
и нейтральных макромолекул [Melvin Т., Michael A. F., 1986].
С ГБМ тесно связан мезангиальный матрикс, основ-
ными компонентами которого, как и ГБМ, являются коллаген IV
и V типов, ламинин и фибронектин. В отличие от ГБМ мезан-
гиальный матрикс не содержит энтактин и другие «мелкие» гли-
копротеины, вместе ГСПГ присутствует хондроитинсульфатпроте-
огликаны — ХСПГ [Melvin Т., Michael A. F., 1986]; кроме того,
выявляется форма ламинина, не встречающаяся в ГБМ. В фун-
кциональном отношении мезангиальный матрикс, образуя систему
каналов, выполняет роль «мусоропровода» для анионных и нейт-
519
ральных макромолекул, микроорганизмов и т. д. [Latta Н., Fligiel S
1985].
Биосинтез и метаболизм ГБМ и мезангиального матрикса связан
с клетками клубочкового фильтра и мезангия. Синтез ГБМ в по-
стнатальном периоде осуществляется только подоцитами. На их
поверхности найдены эпителиальный антиген почечных канальцев,
гликопротеин щеточной каймы (gp 330) и подоксалин. Вопрос об
антигене в настоящее время решен в пользу эндогенной природы
гликопротеина, который включается в состав рецепторов, осущест-
вляющих эндоцитоз в подоцитах [Kerjaschki D. et al., 1986]. gp 330
локализован в углублениях плазматической мембраны ножек под-
оцитов и в структурах синтеза этих клеток [эндоплазматическая
сеть и пластинчатый комплекс (Гольджи) ]. Подоксалин — основной
сиалопротеин клубочка — обеспечивает отрицательный заряд ГБМ
и локализован в основании ножек подоцитов и на поверхности
самих клеток, обращенной к базальной мембране.
Утилизация основных компонентов ГБМ осуществляется, по-ви-
димому, эндотелием. На его поверхности и внутри пор найдено
небольшое количество ГСПГ, отличных от ГСПГ базальной мемб-
раны, и подоксалина, находящегося на поверхности, обращенной
внутрь капилляра [Kerjaschki D. et al., 1986]. Не исключается и
роль мезангиальных клеток в утилизации деградирующих компо-
нентов ГБМ [Серов В. В., 1983].
Основной клеточной структурой почечного клубочка, причастной
к иммунной реакции, является мезангиальная клетка. Различают
три типа этих клеток: гладкомышечного типа, которые преобладают
в мезангии; костномозгового происхождения, относящиеся к системе
мононуклеарных фагоцитов; транзитные типа моноцитов, попада-
ющие в клубочек из циркулирующей крови [Kashgarian М., 1985].
Синтез всех компонентов мезангиального матрикса и их утилизация
осуществляются мезангиальными клетками гладкомышечного типа.
Мезангиальные клетки костномозгового происхождения осуществ-
ляют в основном функцию фагоцитоза различных макромолекул, в
том числе циркулирующих иммунных комплексов, контролируют
синтетическую деятельность мезангиальных клеток гладкомышеч-
ного типа [Striker G. Е., Striker L.J., 1985]. Среди мезангиальных
клеток выявлены la-положительные, антигенпредставляющие клет-
ки, в роли которых могут выступать как костномозговые мезанги-
альные клетки, так и транзиторные моноциты [Shigematsu Н.,
Yano А., 1986].
Изменения ГБМ при гломерулонефрите в значительной мере
связаны с нарушениями биосинтеза или метаболизма ее компонен-
тов, гиперпродукцией мезангиального матрикса или снижением ско-
рости обменных процессов. Так, при мезангиопролиферативных фор-
мах гломерулонефрита накопление, коллагена IV типа и фибронек-
тина наблюдается в мезангии, при мезангиокапиллярном
гломерулонефрите ламинин мезангиального матрикса в связи с ин-
терпозицией появляется в отдельных участках ' ГБМ [Koide Н.»
Horikoshi S., 1985; Hara М. et al., 1986]. С этими нарушениями
520
биосинтетических процессов связывают истончение ГБМ и перси-
стирующую гематурию. Показано, что при мезангиопролифератив-
ном гломерулонефрите фибронектин чаще обнаруживается в мезан-
гии, а при мембранопролиферативном и мембранозном гломеруло-
нефрите — в мезангии и ГБМ [Ikeya М. et al., 1985].
Не менее интересны исследования по выявлению анионных сайтов
ГБМ, выполненные с помощью катионизированных агентов (руте-
ниевый красный, полиэтиленэймин, коллоидное железо, катиони-
зированный ферритин). По местоположению они оказались иден-
тичными протеогликанам и располагались в норме с интервалом
60 нм. Исследования показали, что при разных морфологических
формах гломерулонефрита характер распределения анионных сайтов
и структурных белков клубочкового фильтра различен, что пред-
определяет в значительной степени и особенности изменения фун-
кциональных способностей почек. Например, при эндокапиллярном
пролиферативном гломерулонефрите изменяется распределение ани-
онных сайтов в lamina гага externa и interna и в местах непосред-
ственного контакта нейтрофилов с ГБМ [Okada К. et al.. 1986].
Нейтрализация анионных сайтов повышает проницаемость ГБМ,
что ведет к протеинурии [Rohrbach R., 1986]. Происходит повреж-
дение сиалопротеиновых анионных сайтов и карбоксильных групп,
слой ГСПГ изменяется мало, хотя нельзя исключить фокальных
дефектов ГБМ [Furness Р. N. et al., 1986 ].
Таким образом, кооперативная работа внеклеточных (ГБМ, ме-
зангиальный матрикс) и клеточных (подоцит, мезангиальная клетка,
эндотелиоцит) структур клубочка, определяющая в норме морфо-
биохимический и функциональный гомеостаз гломерулярного филь-
тра, при гломерулонефрите нарушается, что ведет к изменению и
перераспределению структурных белков и полисахаридов клубочков.
Эти изменения могут быть как следствием развивающейся в гло-
мерулах иммунной реакции, связанной чаще с циркулирующими
иммунными комплексами, так и причиной ее возникновения при
формировании иммунных комплексов за счет антигенов структурных
компонентов клубочков.
Структурные компоненты иммунологической реакции, иммуно-
компетентные клетки. В подавляющем большинстве случаев разви-
тие гломерулонефрита связано с повреждением клубочков иммун-
ными комплексами, как циркулирующими в крови, так и
образованными локально за счет структурного антигена клубочков
и циркулирующих в крови антител. Ведущая роль в фиксации
Циркулирующих иммунных комплексов в клубочках принадлежит
электростатическим силам. Лишенные Fc-фрагментов иммунные
комплексы распределяются в клубочке в зависимости от заряда:
катионные — в ГБМ, нейтральные и анионные — в мезангии
[Caulin-Glaser Т. et al., 1985]. На ранних стадиях депозиты цир-
кулирующих иммунных комплексов образуются за счет эндогенных
катионных белков, освобождающихся из тромбоцитов и нейтрофилов
под действием фактора, активирующего тромбоциты (ФАТ) IgE-
сенсибилизированных базофилов. Причем катионизированные анти-
521
гены обладают более высокой аффинностью к рецепторам Т-клеток,
понижают активность Т-супрессоров и активируют Т-хелперы. Та-
кие антигены быстрее и эффективнее распознаются антигенпред-
ставляющими клетками и/или Т-хелперами [Muckerheide A. et al.,
1987]. Способность катионизированных комплексов образовывать
депозиты, в том числе и в почечных клубочках, значительно выше,
чем у самих катионизированных антигенов [Mannick М. et al., 1987],
что связано не только с характером заряда, но и размером макро-
молекул.
Оседающие в клубочках циркулирующие иммунные комплексы
взаимодействуют с протеогликанами мембраны, в их субэндотели-
альной или мезангиальной фиксации безусловна роль Fc-рецепторов
эндотелиоцитов и мезангиоцитов. Однако эффекторная функция
Fc-рецепторов, вероятно, не так уж велика, так как основная масса
циркулирующих иммунных комплексов, фиксированная на эритро-
цитах с помощью CRI-рецептора, захватывается или расщепляется
мононуклеарными фагоцитами печени и селезенки [Hebert L. А.,
Cosio F. G., 1987]. Вместе с тем при дефекте Fc-рецепторов моно-
нуклеарных фагоцитов количество циркулирующих иммунных ком-
плексов возрастает, и они могут оседать в мезангии и ГБМ
[Roccatello D. et al., 1985].
Значение иммунных комплексов, возникающих in situ, не менее
важно, чем циркулирующих комплексов. Их образование при гло-
мерулонефрите некоторые исследователи считают ведущим [Cau-
ser W. G., 1986], так как в роли антигенов в этом случае могут
выступать не только структурные компоненты самого клубочка (gp
330, структурные белки ГБМ, мембранные антигены эндотелия,
мезангиоцитов, подоцитов), но и фиксированные негломерулярные
антигены. Образующиеся in situ депозиты иммунных комплексов
могут располагаться субэндотелиально, субэпителиально и в мезан-
гии. Субэндотелиальные и мезангиальные депозиты формируются
in situ в результате захвата крупных макромолекул мезангием;
задержкой в ГБМ больших поликатионных антигенов, биохимиче-
ского сродства антигенов с гликопротеинами базальной мембраны,
взаимодействия с ревматоидным фактором, антиидиопатическими
антителами и рядом других факторов [GouserW. G., 1986].
Образующиеся иммунные комплексы активируют различные гу-
моральные и клеточные медиаторные системы и эфф кторные клет-
ки — ПЯЛ, макрофаги, тромбоциты, с которыми связано повреж-
дение почечных клубочков. Характер повреждения клубочка зависит
от места и механизма образования в нем иммунного комплекса, а
также биологических свойств его компонентов — антигена, антитела,
комплемента [Серов В. В. и др., 1983]. Субэпителиальные иммунные
комплексы, образованные in situ, вызывают повреждение подоцитов,
которые активируют терминальные компоненты комплемента (С5В-
С9), так называемый мембраноатакующий комплекс (МАК), по-
вреждающий ГБМ. Субэндотелиальные и мезангиальные иммунные
комплексы, также образованные in situ, вызывают внутрисосудистую
активацию комплемента, образование С5а, являющегося хемоатт-
522
рактантом для ПЯЛ, и повреждение ГБМ эффекторными клетками.
В свою очередь сама система комплемента может играть важную
роль в иммунном повреждении клубочковых структур при гломе-
рулонефрите. Например, СЗ-компонент комплемента обеспечивает
транспорт иммунных комплексов эритроцитами, участие в фагоци-
тозе, солюбилизацию иммунных комплексов.
Считают, что рецепторы, прежде всего CRI подоцитов, участвуют
в их защите от действия активированного комплемента, вероятно,
путем солюбилизации субэпителиальных депозитов иммунных ком-
плексов. Следует подчеркнуть, что биологически активные вещества,
активирующие систему комплемента, могут стимулировать выделе-
ние и других медиаторов, повреждающих ГБМ, — ФАТ, метаболиты
арахидоновой кислоты, свободные радикалы кислорода [Воусе N. W.,
Holdsworth S. R., 1986].
Активация комплемента и эффекторных клеток иммунными ком-
плексами — это конечные этапы патогенеза гломерулонефрита, на
ранних же его этапах основную роль играют иммунорегуляторные
нарушения, прежде всего в звене клеточного иммунитета [Matsumo
К. etal., 1986; McCluskey R. Т., Bhan А. К., 1986]. Экспериментально
показано, что клеточно-опосредованный иммунный ответ в почечных
гломерулах может проявлять себя различно: 1) антителонезависимой
цитотоксичностью, обусловленной Т-супрессорами; 2) антителоза-
висимой цитотоксичностью с участием киллеров, в том числе есте-
ственных; 3) гиперчувствительностью замедленного типа при взаи-
модействии Т-хелперов с мононуклеарными фагоцитами; 4) естест-
венной киллерной активностью.
О причастности клеточно-опосредованного иммунного ответа к
развитию гломерулонефрита свидетельствуют и данные по опре-
делению при нем в ткани почки Т-лимфоцитов. Оказалось, что
в интактном клубочке процент Т-лимфоцитов и моноцитов неве-
лик, в интерстиции почки он значительно выше [Eddy A. A. et
al., 1986]. При «непролиферативных формах» гломерулонефрита
(минимальные изменения, ФСГГ, мембранозная нефропатия) число
лейкоцитов в клубочках практически не изменяется, но в интер-
стиции почки значительно возрастает число Т-лимфоцитов; при
пролиферативных формах гломерулонефрита (интракапиллярном
постинфекционном, экстракапиллярном, мезангиопролиферативном
и мезангиокапиллярном) число клеток в клубочках значительно
увеличивается за счет моноцитов и нейтрофилов, но не Т-лим-
фоцитов; однако в интерстиции почки резко нарастает число
Т-лимфоцитов.
Взаимодействие клеток почечного клубочка и клеток иммунной
системы. Этот вопрос наиболее интересен в плане изучения мор-
фогенеза гломерулонефрита, причем можно говорить лишь о первых
шагах в этом направлении.
Уже говорилось о том, что среди мезангиальных клеток суще-
ствуют антигенпредставляющие клетки, которые имеют костно-
мозговое происхождение. Мезангиальные клетки костномозгового
происхождения, кроме того, синтезируют ингибиторы нейтральных
523
протеаз, они активно фагоцитируют и экспрессируют на своей
поверхности Fc- и СЗЬ-рецепторы, la-, CALLA- и общий лейко-
цитарный антиген, что свидетельствует об их активной роли в
иммунных реакциях [Striker G. Е., Striker L.J., 1985]. Велика роль
в иммунной реакции и подоцитов, которые, помимо синтеза всех
компонентов ГБМ, экспрессируют антигены, общие с клетками
кроветворной системы, в частности CALLA- и CRI-рецептор
[Striker G. Е., Striker L. J., 1985 ].
Подоциты в норме секретируют гепариноподобное вещество, ин-
гибирующее пролиферацию мезангиоцитов [Carpenter С. В., 1986].
При гломерулонефрите эта связь, естественно, нарушается, чем
можно, вероятно, объяснить мезангиальную пролиферацию. Изве-
стно, что поражение подоцитов ведет к образованию МАК, с чем
связывают развитие сегментарного склероза клубочков.
При гломерулонефрите появляются новые кооперации клубоч-
ковых и иммунокомпетентных клеток. В почечном клубочке на-
блюдается аккумуляция моноцитов. Активированные моноциты син-
тезируют и выделяют интерлейкин-1, который вызывает пролифе-
рацию мезангиальных клеток, синтез ими простагландинов и
тромбоксанов, освобождение собственного интерлейкина-1 и нейт-
ральных протеаз, вызывающих деградацию мезангиального матрикса
[McCarthy R. Т. et al., 1986]. Интерлейкин-1, с одной стороны,
активирует Т-лимфоциты и стимулирует иммунные реакции, с дру-
гой — вызывает освобождение гистамина из базофилов и лаброцитов,
индуцируя воспалительную реакцию. Клетки мезангия, эндотелий,
активированные макрофаги и моноциты выделяют ФАТ и хемотак-
сические факторы, вовлекая в воспалительные реакции тромбоциты
и ПЯЛ — источники катионных белков, литических ферментов,
радикалов свободного кислорода и эндоперекисей, которые в комп-
лексе повреждают ГБМ и мембраны клеток клубочка [Johnson R. J.
et al., 1987 ]. Макрофаги и нейтрофилы, экспрессирующие на своей
поверхности рецепторы к ламинину, могут взаимодействовать не-
посредственно с ГБМ и повреждать ее, так как гистамин, вызывая
сокращение эндотелия, способствует «обнажению» отдельных уча-
стков ГБМ. Кроме того, следует помнить, что макрофаги и тром-
боциты являются основным источником факторов роста, стимули-
рующих пролиферацию гломерулярных клеток.
Мезангиальные, эндотелиальные клетки и подоциты секретируют
метаболиты арахидоновой кислоты (простагландины, лейкотриены,
тромбоксаны), которые регулируют тонус этих клеток, почечный
кровоток и иммунные реакции. Простагландины Ei и 1г,- например,
замедляют пролиферацию Т-лимфоцитов, уменьшают количество
циркулирующих иммунных комплексов за счет подавления синтеза
антител. Лейкотриен В4 усиливает пролиферацию Т-хелперов, экс-
прессию СЗЬ-рецептора и является модулятором продукции моно-
кинов и лимфокинов. В условиях измененного почечного кровотока
макрофаги экспрессируют прокоагулянтные тканевые факторы, ко-
торые запускают механизмы свертывания крови, что ведет к выпа-
дению фибрина.
524
По-видимому, клетки почечного клубочка, взаимодействуя между
собой и с эффекторными клетками крови, определяют кинетику
иммуновоспалительной реакции при гломерулонефрите.
10.4.1.2. Морфологическая и иммуногистохимическая
характеристика гломерулонефрита
В зависимости от характера течения различают острый, подострый
и хронический гломерулонефрит. Морфология каждого из них имеет
свои особенности.
Острый гломерулонефрит, который обычно вызывается нефри-
тогенным стрептококком (постстрепто окковый, бактериальный гло-
мерулонефрит), а патогенез связан с циркулирующими иммунными
комплексами, содержащими IgG и Сз, может протекать 10—12 мес.
В первые дни заболевания выражены диффузные изменения —
гиперемия клубочков, к которой довольно быстро присоединяется
инфильтрация мезангия и капиллярных петель нейтрофилами. Она
связана с лейкотаксическим свойством ранних компонентов комп-
лемента (Сз—С5), входящих в иммунные комплексы. Вскоре появ-
ляется пролиферация эндотелиальных и особенно мезангиальных
клеток, а экссудативная реакция убывает.
При преобладании в клубочках нейтрофилов говорят об экс-
судативной фазе острого гломерулонефрита. Иногда в полости
капсулы клубочков скапливается геморрагический экссудат, что ха-
рактерно для геморрагической формы острого нефрита [Серов В. В.,
Варшавский В. А., 1977}. При сочетании пролиферации клеток клу-
бочка с лейкоцитарной инфильтрацией речь идет об экссуда-
тивно-пролиферативной фазе (рис. 10.20), а при преоб-
ладании пролиферации эндотелиоцитов и особенно мезангиоцитов —
о пролиферативной фазе острого гломерулонефрита.
Пролиферация клеток клубочка, особенно мезангиоцитов, сви-
детельствует о репаративных процессах. Со временем она умень-
шается, но может оставаться довольно долго, особенно в осевой
части сосудистого пучка. Эти изменения могут персистировать в
течение нескольких лет [Kincaid-Smith Р., 1975; James J. А., 1976].
В таких случаях иногда появляются фиброэпителиальные полулуния
и синехии в полости капсулы. Подобные изменения, выявляющиеся
спустя более года после нефритической атаки, позволяют говорить
об остром затянувшемся гломерулонефрите, который может транс-
формироваться в хронический. Такая трансформация наблюдается
редко, обычно острый гломерулонефрит заканчивается обратимостью
характерных для него изменений и выздоровлением больных.
Почки при остром гломерулонефрите несколько увеличены,
набухшие. Пирамиды темно-красные, корковое вещество серова-
то-коричневого цвета с мелким красным крапом на поверхности
и разрезе или с сероватыми полупрозрачными точками («пест-
рая почка»). Иногда (смерть в первые дни болезни) почки
кажутся макроскопически совершенно не измененными, и лишь
гистологически выявляется острый диффузный гломерулонефрит.
525
Рис. 10.20. Острый бактериальный гломерулонефрит, экссудативно-проли-
феративная фаза (биоптат почки).
а — гистологическая картина. Импрегнация серебром полутонкого среза. *200; б — гранулярное
свечение иммунных комплексов, содержащих IgG, на базальной мембране гломерулярного
фильтра. Прямой метод Кунса, *400; в — субэпителиальные иммунные комплексы в виде
горбов (указаны стрелками). х24 000.
Рис. 10.21. Подострый, экстракапиллярный продуктивный гломерулонефрит,
синдром Гудпасчера (биоптат почки).
а — гистологическая картина. Окраска полутонкого среза метиленовым синим — азуром
И-фуксином. *200; б — лннейное и комковатое свечение IgG на базальной мембране
гломерулярного фильтра. Прямой метод Кунса. *300.
Подострый гломерулонефрит развивается в связи с поражением
клубочков почек как циркулирующими иммунными комплексами,
так и антителами, что типично для синдрома Гудпасчера. Для
иммунокомплексного поражения клубочков характерно обычно гра-
нулярное или комковатое свечение IgG и Сз [Thoenes W., 1976;
Wihitworth J. A. et al., 1976], для антительного поражения — ли-
нейное свечение IgG — рис. 10.21,6 [Heptinstall R. Н., 1974].
Подострый гломерулонефрит скоротечен (быстро прогрессирую-
щий гломерулонефрит), рано наступает почечная недостаточность
(злокачественный гломерулонефрит).
Гистологически характерны экстракапиллярные продуктивные
изменения клубочков — экстракапиллярный продуктивный гломе-
рулонефрит. В результате пролиферации эпителия капсулы (не-
фротелия), подоцитов и макрофагов появляются полулунные обра-
зования («полулуния»), сначала эпителиальные (рис. 10.21, а), а
затем фиброэпителиальные. Капиллярные петли подвергаются не-
крозу, в просвете их образуются фибриновые тромбы. Массы фибрина
обнаруживаются также в полости капсулы, куда они. поступают
через микроперфорации капиллярных мембран, и в полулуниях
[Rosen S., 1975]. Со скоплениями фибрина в полости капсулы клу-
бочков и в полулуниях связано быстрое превращение их в фибро-
эпителиальные, а затем в фиброзные спайки или гиалиновые поля.
Изменения клубочков сочетаются с выраженной дистрофией нефро-
цитов, отеком и инфильтрацией стромы почек. Рано наступают
склероз и гиалиноз клубочков, атрофия канальцев и фиброз стромы
поЧек (тубулоинтерстициальный компонент нефрита).
Почки при подостром гломерулонефрите увеличены, дряблые,
корковое вещество широкое, набухшее, желто-серое, тусклое, с
красным крапом и хорошо отграничено от темно-красного мозгового
вещества почки («большая пестрая почка») либо красное и сливается
с полнокровными пирамидами («большая красная почка»).
Хронический гломерулонефрит представлен группой мезангиаль-
ного нефрита, которая объединяет формы (варианты), близкие по
морфогенезу, а также фибропластич'еским (склерозирующим) гло-
мерулонефритом.
Возникновение мезангиального гломерулонефрита связано с от-
ложением иммунных комплексов в мезангии и под эпителием ка-
пилляров клубочка и реакций прежде всего мезангия на эти отло-
жения [Серов В. В. и др., 19831. На основании клинико-лаборатор-
ных данных и результатов морфологического исследования,
включающего светооптическое, иммуногистохимическое и электрон-
но-микроскопическое, в этой группе выделяются относительно ста-
бильные варианты. Их общими морфологическими признаками слу-
жат расширение мезангия сосудистого пучка клубочка, пролифера-
ция мезангиальных клеток, накопление мезангиального матрикса.
Изменения стенок капилляров связаны не только с отложением
иммуноглобулинов под эндотелием, но и с интерпозицией мезангия
[Arakawa М., Kimmelstiel Р., 1969], которая представлена выселе-
нием отростков мезангиальных клеток и вещества мезангиального
528
Рис. 10.22. Хронический мезангиопролиферативный гломерулонефрит (био-
птат почки).
а — гистологическая картина. Окраска полутонкого среза метиленовым синим — азуром
И-фуксином. *200; б — пролиферация мезангиоцитов. *12 000.
матрикса на периферию капиллярных петель, что создает светооп-
тический феномен двухконтурности или расщепления базальных
мембран капилляров клубочка. Для мезангиальных форм хрониче-
ского гломерулонефрита очень характерно вовлечение в процесс,
помимо клубочков, других структурных элементов почечной тка-
ни — канальцев, стромы, сосудов. В связи с этим говорят о тубу-
лярном, тубулоинтерстициальном (ТИК) и тубулоинтерстициально-
сосудистом компонентах хронического гломерулонефрита.
По характеру и выраженности изменений мезангия и стенок
капилляров мезангиальный гломерулонефрит подразделяют на три
основных варианта (формы) — мезангиопролиферативный, мезан-
гиокапиллярный и лобулярный [Серов В. В. и др., 1983].,
Для мезангиопролиферативного гломерулонефрита характерно
расширение мезангия, связанное прежде всего с пролиферацией
мезангиальных клеток. Она сопровождается очаговым накоплением
мезангиального матрикса, очаговым утолщением и удвоением ба-
зальных мембран в участках капиллярной стенки, прилежащих к
мезангию. Расширение мезангия в результате гиперплазии мезан-
529
гиальных клеток и накопления мембраноподобного вещества ведет
к расширению осевой части сосудистого пучка, укрупнению сосу-
дистых долек (рис. 10.22, а). Диффузная интракапиллярная проли-
ферация клеток дополняется фибропластическими изменениями:
клубочки приобретают лапчатый вид, нередко между капиллярами
и капсулой появляются синехии.
Иммуногистохимически в стенках капилляров и в мезангии
определяют отложения IgG, IgA, Сз-компонента комплемента. Эти
отложения комковатые или очагово-линейные. При электронно-
микроскопическом исследовании отложения электронно-плотного
материала находят в мезангии и под эндотелием, мезангиальные
клетки активны, их количество увеличено (рис. 10.22, б). Изме-
нения эндотелия и подоцитов не имеют каких-либо характерных
черт.
В последнее время получены данные о клинико-морфологической
гетерогенности мезангиопролиферативного гломерулонефрита. Так,
Б. И. Шулутко (1983) выделяет, руководствуясь особенностями те-
чения этой формы нефрита, два его типа — прогрессирующий и
непрогрессирующий (по типу персистирующего). Показано, что мор-
фологические особенности вариантов мезангиопролиферативного
гломерулонефрита определяются прежде всего характером иммуно-
глобулина, содержащегося в гломерулярных иммунных комплексах
[Серов В. В., Варшавский В. А., Гасанов А. Б., 1990; Гасанов А. Б.,
1990]. Первый вариант — это IgA-мезангиопролиферативный гло-
мерулонефрит. Для него клинически характерны повышение уровня
сывороточного IgA — преимущественно латентная и гематурическая
формы нефрита. Морфологически обнаруживаются преобладание в
гломерулярных иммунных комплексах также IgA, чаще в сочетании
с Сз, очаговое расширение мезангия за счет выраженной пролифе-
рации мезангиальных клеток и накопления мезангиального матрик-
са, преобладание в мезангии фагоцитирующих мезангиальных кле-
ток, при этом фибропластическая трансформация клубочков отсут-
ствует, а тубулоинтерстициальный компонент (ТИК) незначителен.
Для второго варианта — IgM-мезангиопролиферативного гломеру-
лонефрита — клинически характерны гипер-М-иммуноглобулине-
мия, нефротическая форма с доброкачественным течением. Морфо-
логически выявляются гломерулярные отложения IgM, чаще в со-
четании с Сз, диффузная слабая пролиферация мезангиальных
клеток и умеренное накопление мезангиального матрикса, наличие
в равном количестве фагоцитирующих и синтезирующих мезанги-
альных клеток; фибропластическая трансформация клубочков и
ТИК отсутствуют. Третий вариант — мезангиопролиферативный
гломерулонефрит с IgG-депозитами или без них (т. е. «иммуноне-
гативный» мезангиопролиферативный гломерулонефрит). Клиниче-
ски для него типичны гипер-С-иммуноглобулинемия, гипертониче-
ская и смешанная формы нефрита. Морфологически при этом ва-
рианте в гломерулах иммунных комплексов, содержащих IgG и Сз,
имеются отложения либо эти комплексы отсутствуют, мезангии
расширен за счет увеличения мезангиального матрикса и умеренной
530
Рис. 10.23. Хронический мезангиокапиллярный гломерулонефрит (биоптат
почки).
а — гистологическая картина. Окраска полугонкого среза метиленовым синнм — азуром
П-фукснном. *300; б — интерпозиция мезангия, отростки пролиферирующих мезангиоцитов
(указаны стрелками) отслаивают эндотелий от базальной мембраны капилляра. х 12 000.
пролиферации преимущественно синтезирующих и «фиброзирую-
щих» мезангиальных клеток, отмечается фибропластическая транс-
формация клубочков и ТИК. Каждый вариант мезангиопролифера-
тйвного гломерулонефрита, отличающийся особенностями патогене-
за, клиники и морфологии, является относительно самостоятельным,
531
поэтому можно говорить о мезангиопролиферативном гломеруло-
нефрите как о групповом понятии. Выделение клинико-морфологи-
ческих вариантов мезангиопролиферативнрго гломерулонефрита по-
зволяет понять разнообразие его клинических проявлений и характер
течения, а также разный прогноз. Среди вариантов мезангиопро-
лиферативного гломерулонефрита прогностически наименее благо-
получен третий вариант, более благополучны первый и второй ва-
рианты.
Мезангиокапиллярный (мембранопролиферативный) гломеруло-
нефрит — одна из форм (вариантов) мезангиального, при котором
в связи с выраженной пролиферацией и интерпозицией мезанги-
альных клеток наблюдаются неравномерное диффузное утолщение
стенок капилляров, двухконтурность их базальных мембран (рис.
10.23, а, б), что служит важным диагностическим признаком этого
варианта гломерулонефрита [Серов В. В. и др., 1983; Rotter W.,
1985; Jackson Е. С. et al., 1987 ]. В процесс вовлекаются все клубочки,
они увеличены, сосудистый пучок имеет дольчатое строение, про-
светы капилляров сужены, в них иногда обнаруживаются ПЯЛ;
встречаются полулуния, синехии сосудистых долек с капсулой клу-
бочка.
При иммуногистохимическом исследовании в капиллярах клу-
бочка находят отложения IgG и Сз, иногда IgM и IgA, фибрин.
Могут определяться только Сз или другие компоненты комплемента
[Шулутко В. И., 1983; Habib R. et al., 1975]. Иммуноглобулины и
комплемент распределены в виде гирлянд или лент по периферии
капилляров, иногда имеют вид гранул [Серов В. В. и др., 1983;
Goldman М., 1988].
В зарубежной литературе на основании электронно-микроскопи-
ческого исследования выделено три типа мезангиокапиллярного,
(мембранопролиферативного) гломерулонефрита.
Первый — мембранопролиферативный гломерулонефрит с суб-
эндотелиальными отложениями электронно-плотного материала им-
мунных комплексов [Habib R. et al., 1975; Рябов С. И., 1984;
Jackson Е. С., 1987]. С отложениями иммунных комплексов под
эндотелием в таких случаях сочетаются гиперплазия и интерпозиция
мезангия, обусловливающие феномен двухконтурности базальных
мембран капилляров; собственно базальная мембрана капилляров
клубочка при этом не изменена.
Второй тип — мембранопролиферативный гломерулонефрит с
плотными отложениями, или «болезнь плотных отложений», «бо-
лезнь плотных мембран», впервые описанная J. Berger и Р. Galle
(1963). Отложения электронно-плотного материала обнаруживают
внутри резко утолщенной lamina densa базальной мембраны капил-
ляров; они занимают всю толщину lamina densa и прослеживаются
на большом протяжении базальной мембраны всех капилляров. Ги-
перплазия мезангиальных клеток не так выражена, интерпозиция
мезангия обнаруживается не столь постоянно, но часто развивается
пролиферация клеток капсулы клубочка с формированием фибро-
эпителиальных полулуний [Spargo В. et al., 1980].
532
Третий тип [Churg J., Sobin L., 1982; Jackson E. C., 1987] напо-
минает мембранозную нефропатйю тем, что пролиферация мезан-
гиальных клеток невелика и при серебрении срезов в отдельных
сегментах встречаются характерные «шипики». Однако электронно-
микроскопически обнаруживают участки замещения базальной мем-
браны материалом, не воспринимающим серебро при импрегнации
ультратонких срезов.
Клинически все три типа мембранопролиферативного гломеру-
лонефрита идентичны.
Лобулярный гломерулонефрит рассматривают и как разновид-
ность мезангиокапиллярного [Zollinger R., Mihatsch М., 1978]. Для
него характерно расширение мезангия в центральных отделах со-
судистых долек клубочка, что определяет его долчатый рисунок на
светооптическом уровне. В связи с пролиферацией мезангиальных
клеток и выраженным увеличением мезангиального матрикса в цен-
тре долек происходят смещение капиллярных петель к периферии
долек, сдавление и сужение просвета капилляров, что определяет
ранний гиалиноз центра сосудистых долек. Иммуногистохимически
и электронно-микроскопически в мезангии и под эндотелием ка-
пилляров обнаруживаются отложения иммунных комплексов.
При разных вариантах мезангиального гломерулонефрита обя-
зательны изменения эпителия канальцев — гиалиново-капельная
или вакуольная дистрофия. При мезангиопролиферативном гломе-
рулонефрите чаще отмечают субатрофию эпителия канальцев, при
мезангиокапиллярном и лобулярном — атрофию самих канальцев,
их базальная мембрана утолщается и со временем исчезает. Строма
коркового и мозгового вещества почек при мезангиальном гломеру-
лонефрите отечна, с очагами склероза. При всех вариантах мезан-
гиального нефрита склероз стромы сопровождается очаговой лим-
фогистиоцитарной инфильтрацией. В сосудах отмечаются явления
плазморрагии, утолщение интимы и склеротические проявления в
случаях, когда заболевание сопровождается артериальной гипертен-
зией.
Почки при мезангиальном гломерулонефрите, если судить об их
состоянии по удаленному перед трансплантацией органу, обычно
плотные, бледные, в корковом веществе определяются желтые пятна,
артерии хорошо контурированы [Heptinstall R., 1974].
Фибропластический (склерозирующий) гломерулонефрит завер-
шает эволюцию большинства форм нефрита присоединением фиб-
ропластического компонента: склероза капиллярных петель клубоч-
ка, синехий сосудистых долек с капсулой, фиброэпителиальных
полулуний, утолщенной базальной мембраны капилляров и капсулы
клубочка.
Склероз капиллярных петель клубочка обусловлен прогрессиру-
ющим накоплением в мезангии и за его пределами (интерпозиция
мезангия) мембраноподобного вещества мезангиального матрикса,
синтезируемого мезангиальными клетками, что приводит к сдавле-
нию, облитерации и коллапсу капилляров. В случае разрывов стенок
капилляров мембраноподобное вещество появляется в полости кап-
533
сулы. Образование фиброэпителиальных полулуний усиливает кол-
лапс сосудов клубочка и способствует развитию его гиалиноза. Ги-
алиноз сосудов клубочка вызван также «организацией» массивных
отложений иммунных комплексов. При гиалинозе клубочка его
клеточные элементы, как правило, атрофируются и погибают.
В начале фибропластической трансформации клубочков с по-
мощью светооптической и электронной микроскопии, а также им-
муногистохимических методов удается выявить признаки, свойст-
венные исходной форме гломерулонефрита, но со временем фиб-
ропластическая трансформация нивелирует эти признаки.
Фибропластические изменения клубочков сопровождаются дист-
рофией и субатрофией нефроцитов проксимальных и дистальных
канальцев, их атрофией и коллапсом; на месте канальцев разра-
стается соединительная ткань. Характерны лимфогистиоцитарные
инфильтраты в строме почки, склероз интерстиция не только кор-
кового, но и мозгового вещества, периваскулярный склероз. Эти
изменения, как уже говорилось, являются тубулоинтерстициальным
компонентом гломерулонефрита (ТИК), который в значительной
мере определяет скорость эволюции гломерулонефрита во вторичное
сморщивание почек. Тубулоинтерстициальный компонент гломеру-
лонефрита может дополняться и тубулоинтерстициальным нефритом
[Серов В. В. и др., 1985 ], который в таких случаях имеет единый
с гломерулонефритом патогенез. В развитии ТИК определенную
роль играет склероз (гиалиноз) артериол и мелких артерий, который
связан не столько с самим гломерулонефритом, сколько с почечной
артериальной гипертензией.
К хроническому гломерулонефриту причисляют также, не имея
на то должных оснований [Серов В. В., 1987], так называемые
минимальные изменения (липоидный нефроз), мембранозную (эпи-
мембранозную) нефропатию и фокальный сегментарный гломеру-
лярный гиалиноз (ФСГГ). При каждом из этих видов гломерулярных
поражений воспалительные изменения клубочков отсутствуют. В ос-
нове минимальных изменений лежит редукция малых отростков
подоцитов как проявление врожденного дефекта подоцитов
[Bader Р. I. et al., 1974] или базальной мембраны [Brenner В. М.
et al., 1978] гломерулярного фильтра. При мембранозной нефропа-
тии, сопровождающейся трансформацией базальной мембраны в
склероз и гиалиноз в результате «организации» иммунных комп-
лексов, воспалительная реакция отсутствует в результате дефицита
Fc-рецепторов макрофагов и мезангиальных клеток [Berthoux F. С.
et al., 1984 ]. ФСГГ, как следует из самого названия этого поражения
клубочков, представлен не воспалением, а дистрофией гломеруляр-
ных структур.
Как видно, в групповом понятии «гломерулонефрит» должны
остаться лишь те заболевания, морфологической основой которых
является воспаление гломерул, составляющее сущность морфологи-
ческих форм (типов) гломерулонефрита: пролиферативного эндока-
пиллярного, пролиферативного экстракапиллярного, мезангиопроли-
феративного, мезангиокапиллярного (мембранопролиферативного) и
534
склерозирующего (фибропластического). Каждая из этих форм мо-
жет отражать особенности этиологии (наличие инфекта), патогенеза
(характер иммунопатологического процесса), морфологии (вид и
распространенность воспаления в клубочках), клинические прояв-
ления (выраженность почечных и внепочечных симптомов) гломе-
рулонефрита, его течения (острое, подострое, хроническое) и про-
гноза.
10.4.2. Тубулоинтерстициальный нефрит
Тубулоинтерстициальный нефрит (ТИН) представляет собой гете-
рогенную группу заболеваний, имеющих разные этиологию и па-
тогенез и характеризующихся преимущественным поражением ин-
терстиция и канальцев почек; возможны вторичные изменения клу-
бочков. Наибольший интерес для понимания роли структурно-
функциональных особенностей тубулостромальных отношений по-
чечной ткани в развитии этого своеобразного варианта межуточного
нефрита имеет ТИН, развитие которого связано с иммунными ме-
ханизмами, т. е. иммунологически обусловленный, или иммунный
тубулоинтерстициальный, нефрит (ИТИН).
10.4.2.1. Структурные основы иммуновоспалительных
интерстициальных реакций в почках
Соединительная ткань в различных слоях почки развита неодина-
ково, да и «качество» ее различно. С этим связаны неоднозначные
потенциальные возможности как самой соединительной ткани, так
и лимфатической системы различных слоев почки, которая является
вторым звеном почечной реабсорбции и определяет в значительной
мере метаболизм почечной ткани, состояние ее тубулярного аппарата
[Серов В. В., 1983 ]. В пограничном слое соединительная ткань, пред-
ставленная в основном ретикулярными волокнами, развита лучше
всего. Этот слой более богат лимфатическими дренажами, форми-
рующими сложную систему с высокими функциональными возмож-
ностями. В корковом веществе стромы немного, она представлена
в основном ретикулярными волокнами и «своими», «корковыми»,
фибробластами и гистиоцитами. Лимфатические капилляры окуты-
вают клубочки и канальцы и переходят в анастомозирующие сети,
сопровождающие междольковые артерии. В мозговом веществе со-
единительной ткани также немного; она очень рыхлая и способна
легко «набухать», так как богата кислыми гликозаминогликанами
(гиалуроновые структуры преобладают над хондроитинсульфатами).
Лимфатическая система пирамид развита слабо, представлена лим-
фатическими капиллярами лишь в артериовенозных пучках и крайне
лабильна. Интерстициальные клетки ткани пирамид продуцируют
простагландины, влияющие на обмен электролитов и воды путем
включения в работу противоточного умножителя почки, с чем свя-
зана исключительно большая гидрофильность стромы пирамид.
535
Функциональная специфика соединительной ткани почек объяс-
няет избирательную ранимость стромы как коркового, так и особенно
мозгового вещества при различных патологических процессах, осо-
бенно при воспалении.
Следует иметь в виду также особенность кровообращения в
почках, представленную наличием двух структурно и функциональ-
но разных кругов кровообращения (большого кортикального и малого
юкстамедуллярного). Этой особенностью объясняется развитие при
ряде воздействий на почки ишемии или застойного полнокровия
коры или пирамид, что ведет к гипоксии и повреждению как не-
фроцитов, так и-их базальных мембран.
Особенность соединительной ткани коркового и мозгового веще-
ства почки определяет своеобразие тубулостромальных (точнее ту-
буломембранных) отношений, учитывая, что базальная мембрана
перитубулярных капилляров на значительном протяжении является
и мембраной нефроцитов. С этой особенностью тубуломембранных
отношений связана содружественная тубулоинтерстициальная (или
интерстициально-тубулярная) реакция на многие воздействия, вклю-
чая компоненты -иммунной реакции — антитела, комплемент, им-
мунные комплексы, клетки-эффекторы.
Для понимания ИТИН важны результаты исследований, пока-
завшие, что антитела к тубулярной базальной мембране могут пе-
рекрестно реагировать с базальной мембраной капилляров клубочков
[Lehman D. Н. et al., 1974], что при гломерулонефрите возможно
появление антител не только к базальным мембранам канальцев,
но й*к щеточной каемке нефроцитов [Edington Т. Е., 1967], причем
эти антитела могут перекрестно реагировать с антителами к тубу-
лярной базальной мембране.
10.4.2.2. Патогенетическая и иммуноморфологическая
характеристика иммунного тубулоинтерстициального
нефрита
Исходя из особенностей патогенеза (преобладание того или иного
иммунопатологического механизма) выделяют три вида ИТИН
[McCluskey, 1979; Cotran R. S., 1983]: иммунокомплексный, обус-
ловленный воздействием антител или реакцией ГЗТ. Развитие
ИТИН связывают как с экзогенными (инфекция; лекарственные
средства, особенно антибиотики, анальгетики и цитостатики; иони-
зирующее излучение), так и эндогенными (метаболические нару-
шения, дисциркуляторные расстройства, аутоиммунизация, паране-
оплазия, наследственные нарушения) факторами.
^Иммунокомплексный ТИН, чаще вторичный, встречается при
гломерулонефрите, системной красной волчанке, реакции отторже-
ния почечного трансплантата. 1ИИ, обусловленный воздействием
антител, может быть идиопатическим или чаще лекарственным; в
ряде случаев он встречается при синдроме Гудпасчера и в транс-
плантате почки. ТИН как проявление ГЗТ находят обычно при
инфекционном гранулематозе (туберкулез, токсоплазмоз, брюшной
536
тиф и др.); он может быть и проявлением .трансплантационного
иммунитета.
Иммуноморфологическая характеристика ИТИН
различна при остром и хроническом его течении.
Острый ИТИН. Он обычно лекарственный, развивается чаще на
5—7-е сутки после приема лекарств и существует несколько недель
[Heptinstall R. Н., 1976; Cotran R. S., 1983]. Иммуноморфологиче-
ские изменения независимо от этиологии однотипны и складываются
из трех стадий, которые являются вместе с тем и формами нефрита
[Серов В. В. и др., 1983; Zollinger Н. U., Mihatsch, 1978; Cotran R. S.,
1983]: отечной, клеточной и тубулонекротической.
В отечной стадии, которая встречается наиболее часто, преоб-
ладает «серозный отек» почечного интерстиция, клеточная инфиль-
трация (лимфоциты, плазмоциты, нейтрофилы) незначительна.
В прямых сосудах, как правило, находят активированные лимфо-
циты. Тубулярная базальная мембрана разрыхлена; нефроциты в
состоянии дистрофии, некробиоза, изредка субатрофии. Вслед за
отечной следует клеточная стадия ИТИН, при которой проявления
иммунного повреждения тубулярной базальной мембраны выражены
наиболее ярко. Эту стадию находят в 3 раза реже отечной, что
свидетельствует об обратимости последней в большинстве случаев.
Для клеточной стадии типична выраженная клеточная инфильтра-
ция интерстиция почки, особенно вокруг полнокровных сосудов
кортико-медуллярной зоны. Инфильтрат чаще представлен лимфо-
цитами, макрофагами и гистиоцитами (лимфогистиоцитарный ва-
риант), реже — преимущественно плазмобластами и плазмоцитами
(плазмоцитарный вариант) или эозинофилами (эозинофильный ва-
риант); редко в интерстиции появляются гранулемы из макрофагов,
эпителиоидных клеток, лимфоцитов и плазмоцитов (гранулематоз-
ный вариант). Клетки инфильтрата повреждают тубулярную ба-
зальную мембрану, но не разрушают нефроциты, в которых находят
дистрофические или некробиотические изменения. Тубулонекроти-
ческая стадия ИТИН — финальйая. Она встречается не более чем
в 5% случаев ИТИН, что свидетельствует о частой обратимости и
клеточной стадии нефрита. Основной признак этой стадии — раз-
рушение нефроцитов клеточным воспалительным инфильтратом
(рис. 10.24, а, б). Инфильтрат, состоящий в основном из лимфоцитов,
макрофагов, плазмоцитов и нейтрофилов, «выходит» из кортико-
медуллярной зоны и распространяется в корковое вещество почки,
преодолевая тубулярную базальную мембрану, проникая между не-
фроцитами и разрушая их. При этом можно видеть тесные контакты
клеток инфильтрата с нефроцитами, а иногда и проникновение
клеток-эффекторов в цитоплазму эпителия канальцев. Со временем
эффекторные клетки инфильтрата вытесняются фибробластами, уве-
личивается количество коллагеновых волокон, замещающих погиб-
шие и атрофированные канальцы, — развивается фиброз почки.
Иммуногистохимически острый ИТИН гетерогенен, что связано
с разными иммунными механизмами его развития [Серов В. В. и
др., 1983; Cotran R. S., 1983]. При иммунокомплексном ИТИН на
537
Рис. 10.24. Острый иммунный тубулоинтерстициальный нефрит.
а — гистологическая картина. Окраска гематоксилином и эозином. *200; б — разрушение
канальцев клетками стромального инфильтрата — лимфоцитами и макрофагами. Электроно-
грамма. *8000.
базальной мембране канальцев находят гранулярные отложения IgG
и Сз, иногда IgA и IgM или только Сз [Lehman D. Н. et al., 1976].
Иммунные комплексы выявляются электронно-микроскопически в
виде плотных депозитов в (на) тубулярной базальной мембране. При
ИТИН антительного генеза отложения IgG и Сз на тубулярной
базальной мембране имеют не гранулярный, а линейный характер
538
Рис. 10.25. Тубулоинтерстициальный нефрит. Очаговое линейное свечение
в тубулярной базальной мембране. Прямой метод Кунса. *350.
(рис. 10.25); электронно-микроскопически находят деструктивные
изменения мембраны. ИТИН как выражение реакции ГЗТ пред-
ставлен агрессией лимфоцитов и макрофагов в отношении тубуляр-
ной базальной мембраны и нефроцитов, реже гранулематозом, при-
чем морфологические проявления этого вида гиперчувствительности
встречаются не ранее чем через 1 нед от начала заболевания.
Хронический ИТИН. Основная роль в его развитии принадлежит,
по-видимому, клеточным иммунным реакциям. В пользу этого сви-
детельствует преобладание в воспалительном инфильтрате Т-лим-
фоцитов и макрофагов — эффекторных клеток ГЗТ, киллерное
действие лимфоцитов в отношении тубулярной базальной мембраны
и нефроцитов, отсутствие иммуноглобулинов и компонентов комп-
лемента на (в) базальной мембране канальцев при иммунолюминес-
центном исследовании [Серов В. В. и др., 1983; McCluskey R. Т. et
al., 1976; Cotran R. S., 1983]. На это указывает и гранулематоз при
хроническом течении ИТИН, встречающийся как при инфекцион-
ных (туберкулез, токсоплазмоз и др.), так и при аутоиммунных
(ревматоидный артрит) заболеваниях.
При гистологическом исследовании находят не только лимфоги-
стиоцитарный инфильтрат, окутывающий тубулы и проникающий
в их межклеточные пространства, резко выраженную дистрофию и
некробиоз нефроцитов, но и регенерацию эпителия канальцев, их
атрофию, перидуктальный и периваскулярный склероз ткани кор-
кового вещества и кортико-медуллярной зоны. Финалом хрониче-
ского ИТИН могут стать нефросклероз и хроническая почечная
недостаточность.
539
Таким образом, своеобразие воспалительной реакции как при
гломерулонефрите, так и варианте межуточного нефрита — ИТИН
связаны не только с характером первичного фактора и механизма
развития, но и со структурно-функциональными особенностями по-
чечной ткани, в частности гломерул и интерстиция почек.
10.5. СЕРДЦЕ
Особенности воспаления в сердце зависят от строения тканей, об-
разующих эпикард, миокард и эндокард.
Эндокард состоит из 4 слоев, 3 из которых представляют собой
различные сочетания коллагеновых и эластических волокон, и 1
слой состоит из гладких мышц, причем наружный слой покрыт
эндотелиальными клетками. Эндокард по строению близок сосуди-
стой стенке, что и обусловливает особенности развивающегося в
нем воспаления. Здесь наиболее часто возникает фибринозное либо
гранулематозное воспаление.
Миокард состоит из поперечнополосатой мышечной ткани и со-
единительнотканного каркаса. При его воспалении мышечные во-
локна подвергаются дистрофии, некробиозу и некрозу, в то время
как воспалительный инфильтрат располагается в основном в интер-
сти иальной ткани или в области очага некроза кардиомиоцитов.
В миокарде обычно возникает серозное, иногда гнойное воспаление
в вуде абсцессов, а также гранулематозное воспаление.
Эпикард представляет собой серозную оболочку и включает ме-
зотелий, базальную мембрану и различные комбинации эластиче-
ских и коллагеновых волокон. Возникающий в нем воспалительный
процесс несет все признаки, характерные для воспаления серозных
оболочек, в которых обычно развивается фибринозное или гнойно-
фибринозное воспаление; редко встречается гранулематозное вос-
паление.
Сочетание разнородных тканей в стенке сердца объясняет раз-
витие нередко изолированного поражения одного из его слоев —
эндокарда, миокарда или перикардита, хотя при определенных ус-
ловиях в воспалительный процесс могут вовлекаться одновременно
эндокард и миокард (кардит) или все оболочки сердца (панкардит).
Однако и при этом сохраняются особенности, обусловленные свое-
образием структуры оболочек сердца.
10.5.1. Эндокардит
Наиболее часто поражается эндокард клапанов сердца, значительно
реже возникает воспаление периетального эндокарда и эндокарда,
выстилающего сухожильные хорды. Однако нередко встречается со-
четание воспаления этих отделов сердца. На основании этиологи-
ческих и клинико-морфологических признаков можно выделить сле-
дующие виды эндокардита: инфекционный (бактериальны , септи-
540
ческий) острый, подострый или хронический (затяжной) эндокардит;
неинфекционный тромбоэндокардит; ревматический эндокардит; па-
риетальный фибропластический эозинофильный эндокардит Лефф-
лера.
Инфекционный (бактериальный, септический) эндокардит пред-
ставляет собой обычно определенную форму сепсиса. Воспаление
локализуется чаще в клапанах сердца, значительно реже — в
париетальном эндокарде. Известно, что он может развиваться как
на неизмененных (первичный инфекционный эндокардит), так и на
склерозированных клапанах (вторичный инфекционный эндокар-
дит).
В 60—80% случаев инфекционный эндокардит вызывают стреп-
тококки, энтерококк, в 30% — стафилококки, а также грамотри-
цательные микроорганизмы, патогенные грибы и риккетсии [Davi-
es М. J., 1980; Geraci J.E., Wilson W. R., 1982]. В крови примерно
10—30% больных инфекционным эндокардитом не находят возбу-
дителей инфекции [Серов В. В. и др., 1981 ].
До сих пор нет ответа на вопрос, почему проникший в организм
возбудитель внедряется именно в клапаны сердца, где вызывает
очаг воспаления. Существуют лишь различные предположения. Со-
гласно одной из наиболее распространенных гипотез [Durack D.,
1975; CarrizosaJ. et al., 1978], инфекционному эндокардиту всегда
предшествует неинфекционный эндокардит, при котором в резуль-
тате травмы и слущивания эндотелия на эндокарде клапана обра-
зуется стерильный тромб. Если в этих условиях развивается бак-
териемия, то в тромботические массы внедряются бактерии и вы-
зывают воспаление в клапане. Не исключено, что при этом тромб
защищает бактерии от фагоцитирующего действия лейкоцитов и
бактерицидного действия плазмы крови. Однако в настоящее время
большинство исследователей рассматривают инфекционный эндо-
кардит как иммунокомплексную болезнь с недостаточностью системы
моноцитарных фагоцитов, которая может быть врожденной или
связанной с гиперпродукцией иммунных комплексов, синтезом гу-
моральных ингибиторов фагоцитоза, длительным приемом лекарств
[Сура В. В. и др., 1980; Серов В. В., 1981 ]. Чаще эта ситуация
определяет подострое или хроническое течение инфекционного эн-
докардита.
По характеру течения выделяют 3 формы инфекционного эндо-
кардита: острый, подострый и хронический (затяжной).
Острый инфекционный эндокардит возникает обычно на интак-
тных клапанах сердца в связи со стафилококковой септикопиемией.
На эндокарде клапанов появляются язвенные или язвенно-полипоз-
ные изменения, быстро формирующие порок клапанов. Вначале по
краям створок митрального (иногда аортального) клапана появля-
ются мелкие гранулярные образования величиной от нескольких
миллиметров до сантиметра и более, желтого или темно-коричневого
Цвета. Под ними обнаруживаются язвенные дефекты клапанов, ко-
торые увеличиваются и, распространяясь, мшут переходить на су-
хожильные хорды и пристеночный эндокард (полипозно-язвенный
541
Рис. 10.26. Морфология различных вариантов эндокардита. Окраска гема-
токсилином и эозином. *125.
а — острый м»«фекиионный эндежлрднт: клапан нтъяивлгн, иыраже»«й воспалительная инфмль-
трания н отложение фибрина, видны колонии микроорганизмов
эндокардит). Часто изъязвление створок клапанов приводит к по-
явлению их аневризм, в 50% всех смертных случаев обнаруживается
перфорация створок клапана.
При микроскопическом исследовании на некротизированной по-
верхности клапана часто видны колонии микроорганизмов, тромбо-
тические массы из фибрина и тромбоцитов, причем в более глубоких
слоях изъязвленного клапана больше фибрина, а на поверхности
клапана — тромбоцитов (рис. 10.26, а). Ткань клапана набухшая,
пронизана фибрином, инфильтрирована ПЯЛ (иногда они могут
отсутствовать). Характерны опасные осложнения, быстро ведущие
к смерти, — отрыв части клапанов, сухожильных хорд, тромбобак-
тсриальиыс эмболии с формированием септических инфарктов.
При затихании процесса тромботические массы подвергаются
организации, колонии микробов обычно петрифицируются, створки
клапана сморщиваются и деформируются.
Подострый инфекционный эндокардит, который в последнее
время встречается довольно редко, развивается нс только на неиз-
мененных, но и на склерозированных клапанах сердца. При этом
чаще поражается аортальный, реже — митральный клапан. Обычно
это полипозно-язвенный эндокардит. В отличие от острого инфек-
ционного эндокардита для подострой формы характерно развитие в
язвенных дефектах клапанов под тромботическими наложениями
грануляционной ткани. Вокруг очагов некроза, образующихся в
клапанном, пристеночном эндокарде и в трабекулах, выявляются
мононуклеарныс инфильтраты в виде палисадов.
542
Рис. 10.26. Продолжение.
6 — затяжной инфекционный эндокардит: створке клагана — рубцующиеся очаам некроза
* свежне тромбатические массы, выражена воспалительная инфильтрация; Я — реимлтнческнй
•юапрагно 6о(х,д:я>члт1эй эндокардит: на склерозированной створке клапана видны соежие трзы-
**пнчсские наложения.
Хронический (затяжной) инфекционный (септический) эндо-
кардит в большинстве случаев (85%) развивается на склерозиро-
ванных и деформированных клапанах (приобретенные или врож-
543
денные пороки сердца). В 15% случаев возникает жа неизмененных
клапанах — «болезнь Черногубова». По данным В. В. Серова и соавт.
(1982), затяжной инфекционный эндокардит составляет 45% от всех
инфекционных эндокардитов. Отмечается рост первичного затяжного
инфекционного эндокардита, чаще у лиц молодого возраста. Изо-
лированное поражение клапанов встречается в 73%, случаев, из них
в 53% поражается аортальный клапан, в 3 раза реже (16%) —
митральный клапан (обычно при сепсисе инъекционного происхож-
дения у наркоманов или как осложнение, связанжос с внутрисер-
дечной катетеризацией), сочетанное поражение мштрального и аор-
тального клапанов отмечается в 27%, поражение трсхстворчатого
клапана — в 19% случаев (Серов В. В. и др., 1982 J.
Первичный затяжной септический эндокардит морфологически
отличается от вторичного, так как процесс, развивающийся при
последнем, накладывается на предшествующие измгенения клапанов
склеротического характера. В целом же динамика этой формы эн-
докардита как бы повторяет морфогенез острого яг подострого ин-
фекционного эндокардита, приобретая при этом, однако, некоторые
морфологические особенности. Так, для него характерны язвенные
дефекты створок клапанов, сухожильных хорд, иногда пристеночного
эндокарда. На участках изъязвления образуются массивные кроша-
щиеся тромботические наложения. Вокруг очагов некроза с коло-
ниями микроорганизмов появляются лим^югистиоц.итарныс инфиль-
траты, иногда гигантские клетки. Грануляционная ткань под тром-
ботиуескими наложениями, созревая, деформирует' клапан, тромбо-
тические массы подвергаются организации, что также ведет к де-
формации клапана. Так как для болезни характерно хроническое
рецидивирующее течение, в клапане можно видеть одновременно
организованные и свежие тромботические массы, я также рубцую-
щиеся и свежие участки некроза и изъязвлений (рис. 10.26, б).
Помимо этого в сухожильных хордах и в париетальном эндокарде
можно найти очаги набухания и дезорганизации соединительной
ткани, лимфомакрофагальную инфильтрацию, иногда небольшие
тромботические наложения на неизмененном эндокарде.
Осложнения затяжного септического эндокардита и причины
смерти больных тс же, что и при подостром инфекционном эндо-
кардите. Необходимо отметить, что нередко довольно трудно диф-
ференцировать подострый септический и затяжном эндокардит.
Неинфекционный тромбоэндокардит (абактериальный тромбо-
эндокардит, минимальный эндокардит, дегенеративный бородавча-
тый эндокардит, марантический или терминальный эндокардит, не-
бактериальные тромботические вегетации и др.> развивается нс
только у резко ослабленных больных и при старческом маразме,
но и при эндогенных и экзогенных интоксикациях (уремия, отрав-
ление некоторыми ядами и др.). Он характеризуется образованием
на эндокарде клапанов, в основном левого желудочка сердца, сте-
рильных тромботических наложений, как это имеет место при бо-
родавчатом или полипозном эндокардите. Однако воспаление эндо"
карда как таковое практически отсутствует или представлено не-
544
большими скоплениями моноцитов, макрофагов и фибробластов под
тромботическими наложениями по краю створок митрального или
аортального, значительно реже трехстворчатого клапанов. Поэтому
нсинфекционный тромбоэндокардит — проблема нс воспаления, а
скорее нарушения реологических свойств крови. Как видно, термин
«нсинфекционный эндокардит» среди эндокардитов имеет лишь ис-
торическое значение.
Ревматический эндокардит — одно из самых ярких проявлений
ревматизма, в основе которого лежит системная дезорганизация
соединительной ткани, связанная с воздействием ^-гемолитического
стрептококка группы А и выраженными иммунными нарушениями.
При ревматическом эндокардите воспалительные изменения воз-
никают на клапанах сердца, сухожильных хордах и в париетальном
эндокарде. Наиболее часто поражается митральный клапан, несколь-
ко реже — аортальный, очень редко — трехстворчатый. В 30%
случаев наблюдается сочетание поражения митрального и аорталь-
ного клапанов или комбинация их поражения с воспалением эндо-
карда других локализаций. Изолированное поражение клапанов пра-
вой половины сердца является исключительной редкостью. Воспа-
ление может распространяться на сухожильные хорды и присте-
ночный эндокард, особенно предсердий, в связи с чем различают
клапанный, хордальный и пристеночный эндокардит.
А. И. Абрикосов (1947) выделил 4 формы ревматического эндо-
кардита: диффузный, острый бородавчатый, возвратно-бородавчатый
и фибропластический. Суть происходящих при этом процессов была
раскрыта А. И. Струковым и его сотрудниками (1963, 1974).
В основе диффузного (или простого) эндокардита лежит муко-
идное, а затем фибриноидное набухание соединительной ткани ство-
рок клапанов и фиброзных капец, но без поражения эндотелия
(вальвулит Талалаева). Поэтому при этой форме эндокардита на
поверхности клапана нс выпадает фибрин и нс образуются тром-
ботические бородавки. Однако дезорганизация соединительной ткани
клапанов сопровождается клеточной реакцией с тенденцией к об-
разованию гранулем из гистиоцитов и макрофагов, которые имеют
характерное строение, особенно при пристеночном эндокардите
(ашофф-талалаевские гранулемы). Изменения соединительной ткани
клапанов больше выражены со стороны той его поверхности, которая
испытывает большее давление крови.
В острой стадии заболевания при диффузном эндокардите клапан
изменен незначительно: его створки несколько утолщаются по линии
замыкания, становятся полупрозрачными.
Исход этих изменений может быть различным. Если лечение
ревматизма проведено успешно в тот период, когда в эндокарде
имело место лишь мукоидное набухание соединительной ткани, то
возможно обратное развитие изменений без каких-либо последствий.
Если же этого нс произошло, нарастают фибриноидные изменения
соединительной ткани клапанов, заканчивающиеся гиалинозом и
Утолщением их створок, но без выраженной деформации самих
клапанов. В тех случаях, когда резко выражена клеточная реакция
U 407
545
с наличием большого количества фибробластов, развиваются склероз
и деформация створок клапанов, укорочение, утолщение и сращение
сухожильных хорд, что более характерно для фибропластического
эндокардита, приводящего к формированию ревматического порока
сердца.
Острый бородавчатый эндокардит развивается в тех случаях,
когда дезорганизация соединительной ткани клапана особенно вы-
ражена в субэндотелиальных слоях и ведет к повреждению и слу-
щиванию эндотелия. В этих участках выпадают тромботические
массы и развивается острый бородавчатый эндокардит. На поверх-
ности клапана, обращенной к току крови, образуются мелкие, по-
лупрозрачные, светло-коричневые или серые бугорки (бородавки),
состоящие из фибрина, тромбоцитов и других элементов крови.
Обычно они располагаются в один ряд по замыкающему краю
клапана, нередко также вблизи фиброзного кольца, иногда по всей
поверхности створки. Они могут быстро увеличиваться в размерах,
образуя конгломераты, вегетации в виде гроздьев, сосочков, гирлянд
(острый полипозный эндокардит).
При микроскопическом исследовании створки клапана выглядят
набухшими, в ткани их обнаруживается фибрин. Инфильтраты со-
стоят из макрофагов, гистиоцитов, лимфоцитов, а также грануло-
цитов. Гранулемы Ашоффа—Талалаева в эндокарде клапанов встре-
чаются редко. Если ремиссия ревматизма наступает, когда имеются
лишь небольшие фибринозные наложения, их организация приводит
к умеренному фиброзному утолщению створок, при организации
массйвных фибринозных наложений развивается выраженный скле-
роз и гиалиноз створок, формируется порок сердца.
О возвратно-бородавчатом эндокардите говорят в тех случаях,
когда изменения, характерные для острого бородавчатого эндокар-
дита, развиваются при ревматической атаке в створках порочных,
склерозированных клапанов (рис. 10.26, в). При этом в тромботи-
ческие массы могут выпадать соли кальция, происходит васкуля-
ризация клапана. В соединительной ткани клапана наблюдается
замена типов коллагена, коллагеновые волокна фрагментируются,
наступающий гиалиноз способствует выпадению солей кальция.
Фибропластический эндокардит при ревматизме может быть
финалом каждого из описанных типов эндокардита при выраженной
и быстрой фибропластической реакции. В таких случаях склероз
преобладает над затухающей клеточной реакцией.
Эндокардит при других ревматических болезнях. Например,
при системной красной волчанке примерно в 50% случаев возникает
так называемый атипический небактериальный бородавчатый эн-
докардит (эндокардит Либмана—Сакса). Поражены обычно створки
митрального клапана, но иногда и клапаны правых отделов сердца.
Особенность эндокардита заключается в том, что на обеих повер-
хностях клапана или у основания створок (но нс по замыкающему
краю) образуются сначала мелкие, прочно связанные с клапаном
плоские гранулярные тромботические образования, которые быстро
превращаются в широкие и плоские вегетации. Они могут распо-
546
лататься и на эндокарде желудочков, а также сухожильных нитей.
В очагах повреждения обнаруживаются фибриноидный некроз ткани
клапана и характерные для системной красной волчанки гематок-
силиновые тельца в виде базофильных масс, а также инфильтраты
из гистиоцитов, лимфоцитов, плазматических клеток. Организация
тромботических наложений приводит к развитию порока митраль-
ного и аортального клапанов. Если при эндокардите Либмана—Сакса
в тромботические наложения попадают бактерии, то возможно раз-
витие вторичного бактериального язвенною эндокардита.
Париетальный фибропластический эозинофильный эндокардит
(фибропластический париетальный эндокардит с эозинофилией,
эндокардит Леффлера) характеризуется тем, что при нем сочета-
ются абсолютная эозинофилия крови и поражение париетального
эндокарда с последующим развитием выраженного его фиброза и
утолщения, сужение камер сердца. Заболевание заканчивается сер-
дечной недостаточностью. По существу правильнее говорить об эн-
домиокардитс, так как практически всегда в процесс вовлекаются
миокард, его субэндокардиальные отделы. Этиология заболевания
неизвестна. Морфологически в патогенезе этого эндокардита
Е. J. Olsen (1973) выделяет 3 стадии: острую (некротическую),
тромботическую и стадию фиброза.
Острая (некротическая) стадия продолжается 5—6
нед, характеризуется отчетливыми воспалительными изменениями
париетального эндокарда, обычно обоих желудочков сердца, но боль-
ше левого, особенно в области верхушки. На париетальном эндокарде
появляются тромботические наложения. Воспаление распространя-
ется на субэндокардиальные отделы миокарда, где возникают очаги
некроза. В воспалительном инфильтрате много эозинофилов, но
присутствуют также лимфоциты, плазматические клетки, ПЯЛ. Раз-
вивается эндартернит или панартсриит ветвей венечных артерий
сердца (те же изменения находят в сосудах кожи и внутренних
органов).
В тромботической стадии полости желудочков сердца
обычно несколько сужены, может быть небольшая эксцентрическая
гипертрофия миокарда. На париетальном эндокарде левого желу-
дочка, особенно в области верхушки, располагаются организующиеся
тромбы различной величины. Такие же тромбы выявляются в правом
желудочке по ходу приносящего тракта. При микроскопическом
исследовании обнаруживаются фиброзирование и утолщение эндо-
карда обоих желудочков, на котором видны организующиеся плоские
тромбы. Между утолщенным эндокардом и миокардом имеется зона
грануляций, богатая сосудами, эозинофилами, лимфоцитами и плаз-
матическими клетками. Часть мышечных волокон гипертрофируется,
часть атрофируется. На месте очагов некроза развивается сетчатый
или очаговый склероз, особенно в субэндокардиальном и среднем
слоях миокарда. Псриваскулярно разрастается молодая соединитель-
ная ткань.
В стадии фиброза камеры сердца сужены, париетальный
эндокард желудочков белесоватый, плотный, особенно по ходу при-
18»
547
носящих трактов и в области верхушки сердца. Нередко отмечается
выраженный фиброз папиллярных мышц и сухожильных хорд (осо-
бенно задней створки митрального клапана), в результате чего
может возникнуть порок сердца. Иногда развивается и порок аор-
тального клапана. При микроскопическом исследовании обнаружи-
ваются выраженный склероз и утолщение эндокарда, распростра-
няющиеся в виде пальцевидных рубцов на субэндокардиальные и
средние слои миокарда. В склерозированных участках и в эндокарде
отмечают незначительную лимфогистиоцитарную инфильтрацию с
наличием отдельных эозинофильных гранулоцитов. Наблюдается
также склероз сосудов с остаточными явлениями воспаления в их
стенках. Эта стадия лиффлеровского эндокардита гистологически не
отличается от описанного Н. Davis в 1948 г. эндомиокардиального
фиброза жителей Южной Африки. Большинство специалистов по-
лагают, что эндомиокардиальный фиброз Дейвиса и париетальный
фибропластический эозинофильный эндокардит Леффлера — одно
заболевание.
10.5.2. Миокардит
Миокардит различного происхождения встречается в 5% всех вскры-
тий, хотя неярко выраженные воспалительные изменения в миокарде
выявляются довольно часто при многих заболеваниях, особенно
инфекционных. Напротив, тяжелый, приводящий к смерти миокар-
дит‘развивается относительно редко. В большинстве случаев мио-
кардит успешно излечивается, причем в миокарде может не остаться
даже следов перенесенного воспаления.
Иногда миокардит может быть проявлением реакции гиперчув-
ствительности или физико-химических (в том числе токсических)
повреждений миокарда, они могут быть осложнением различных
лечебных мероприятий, интоксикаций, отравлений. Считают также,
что иногда миокардит в конечной стадии может переходить в за-
стойную (конгестивную) или гипертрофическую, обычно рестрик-
тивную, кардиомиопатию [Joshi V. V. et al., 1988; McAllester et al.,
1986].
Общепринятой классификации миокардита не существует, хотя
имеется немало попыток классифицировать различные варианты
воспаления миокарда. Предлаг ется делить миокардиты на неспе-
цифические, гранулематозные и гигантоклеточные; идиопатические
и сопутствующие и т. д. Мы полагаем, что в основе классификации
миокардитов должен лежать прежде всего нозологический принцип.
Поэтому следует выделять первичный (идиопатический миокардит
Абрамова—Фидлера) и вторичный миокардиты. Существует несколь-
ко этиологических групп вторичных миокардитов: группа инфекци-
онного миокардита (вирусный, бактериальный, паразитарный, гриб-
ковый); группа инфекционно-аллергического миокардита и группа
токсического миокардита. Разумеется, эта классификация в доста-
точной степени условна.
548
10.5.2.1. Идиопатический миокардит Абрамова—Фидлера
В тех случаях, когда не удается определить основное заболевание,
при котором развился миокардит, говорят об идиопатическом мио-
кардите Абрамова—Фидлера. При этом обсуждается возможная эти-
ологическая роль вирусной инфекции и лекарственных средств, а
также аллергических механизмов, тем более что около */4 больны
миокардитом Абрамова—Фидлера страдают также миозитом, ми-
астенией, некоторыми формами тимом. Встречаются диффузные и
очаговые, гранулематозные формы этого миокардита. Он может
протекать остро, с быстро наступающим смертельным исходом, но
имеются и латентные формы течения болезни [Davies М. J. et al.,
1975]. Воспалительный инфильтрат состоит из лимфоцитов, плаз-
моцитов, отдельных гранулоцитов, а также гигантских клеток, ко-
торые иногда напоминают клетки Пирогова—Лангханса (рис.
10.27, а); однако многие авторы полагают, что эти клетки имеют
миогенное происхождение. В центре инфильтратов образуются очаги
некроза с последующим рубцеванием, что приводит к выраженному
кардиосклерозу.
10.5.2.2. Инфекционный миокардит
Чаще всего встречается вирусный миокардит. Он обусловлен от-
четливой кардиотропностью определенных вирусов, особенно пикор-
навирусов. В процесс нередко вовлекается перикард. Такой миопе-
рикардит обычно является следствием вирусного поражения верхних
дыхательных путей. Спектр вирусов, вызывающих воспалительный
процесс в миокарде, довольно широк, однако наиболее часто обна-
руживаются Коксаки- и ЭКХО-вирусы, а также вирусы гриппа и
краснухи. Вирусный миокардит может возникать при вирусном ге-
патите, инфекционном мононуклеозе, кори, полиомиелите, пситта-
козе и др.
Патогенез вирусного миокардита рассматривается в рамках им-
мунологических реакций [Egeers Н. J., Biiltmann В. D., 1981 ]. Кар-
диотропные вирусы вызывают лизис кардиомиоцитов. При этом
появляются антивирусные и комплементактивирующие антитела
(IgM, IgG). В капсиде вируса содержится гликопротеин, имеющий
молекулярное сходство с гликопротеидами сарколеммы кардиомио-
цитов. Т-хелперные лимфоциты сенсибилизируют Т-цитотоксиче-
ские лимфоциты, которые разрушают инфицированные вирусом кар-
диомиоциты. При этом стимулируются естественные клетки-киллеры
(механизм этого процесса неизвестен). В ответ на разрушение кар-
диомиоцитов, индуцированное вирусом, развивается иммунная ре-
акция, приводящая к деструкции мышечных клеток сердца, причем
уже после того, как организм. очистится от вирусов. Переход же
вирусного миокардита в рестриктивную кардиомиопатию связывают
с уменьшением активности .Т-лимфоцитов-супрессоров [Eggers Н. J.,
Biiltmann В. D., 1981 ], однако этот вопрос еще мало изучен.
В первом триместре беременности миокардит наиболее часто
549
Рис. 10.27. Морфология первичного и вторичного инфекционного миокар-
дита. Окраска гематоксилином и эозином.
а — идиопатический миокардит: очаговый воспалительный полиморфно-клеточный инфильтрат
с гигантскими клетками. *500; б — вирусный миокардит: очаги некроза кард ио миоцитов,
вокруг них — лимфоплазмоцитарная и моноцитарная инфильтрация, отек интерстициальном
ткани, х 100; в — миокардит Шагаса: очаги некроза миокарда с выраженной лимфомакрофа-
гальной инфильтрацией. *250.
связан с краснухой. При этом в субэндокардиальных слоях миокарда
возникают ареактивные некрозы. В последнем триместре беремен-
ности миокардит у плодов чаще связан с Коксаки-инфекцией, и в
большинстве случаев именно этим обусловлен фиброэластоз эндо-
карда у новорожденных [Woodruff J. Е., 1980]. При вирусном мио-
кардите у новорожденных обнаруживаются очаги некроза миофиб-
рилл, вокруг которых формируется вначале гранулематозная реак-
ция, быстро сменяющаяся очаговым гистиолимфоцитарным
инфильтратом. Затем в этих участках развивается грануляционная
ткань, а в некротизированные кардиомиоциты откладываются соли
кальция.
У взрослых вирусный миокардит обычно поражает заднюю стенку
предсердий, перегородку сердца и его верхушку. Иногда воспаление
возникает изолированно в области предсердно-желудочкового (ат-
риовентрикулярного) узла, тогда миокардит протекает с выражен-
ными нарушениями ритма сердца. В ранней стадии заболевания
развивается гиперэозинофилия отдельных групп мышечных волокон,
в интерстиции появляется серозный экссудат с небольшим количе-
ством ПЯЛ. Затем происходит глыбчатый распад мышечных волокон
и образуются очаги коагуляционного некроза, вокруг них нарастает
лимфоплазмоцитарная и моноцитарная инфильтрация (рис.
10.27, б). Нередко присоединяется серозный или серозно-фибриноз-
ный перикардит. В дальнейшем очаги некрозов замещаются соеди-
нительной тканью, возникают выраженный кардиосклероз и ком-
пенсаторная гипертрофия миокарда. Бактериальный миокардит
встречается несколько реже, чем вирусный. Он возникает наиболее
часто благодаря воздействию на миокард бактерий, возможен и как
проявление аллергических реакций, связанных с инфекционным
заболеванием. Обычно миокардит развивается через 2—3 нед после
начала тонзиллита, туберкулеза легких, скарлатины, сальмонеллез-
нои менингококковой или других инфекций.
Различные типы миокардитов имеют достаточно характерную
топографию поражений миокарда.
Наиболее яркую морфологию находят при гнойном миокардите,
который возникает при септикопиемии.В миокарде выявляются
множественные абсцессы, окруженные красным венчиком. В абс-
цессах обычно обнаруживаются стафилококки или стрептококки,
изредка — патогенные грибы. Если абсцессы расположены субэн-
докардиально, может возникнуть абсцесс на внутренней поверхности
сердца; если гнойник располагается в субэпикардиальных слоях,
возможен гнойный перикардит.
Туберкулезный миокардит чаще развивается при генерализован-
ном милиарном туберкулезе. В миокарде появляются многочислен-
ные туберкулезные гранулемы. Крупные туберкулезные бугорки
встречаются чрезвычайно редко, в основном они появляются в ми-
окарде при туберкулезном перикардите или медиастините.
Паразитарный миокардит. При протозойных заболеваниях ми-
окард также может вовлекаться в процесс, особенно при токсоплаз-
мозе либо при болезни Шагаса. Toxoplasma gondii во всем мире
551
широко распространена среди домашних животных и иногда может
поражать человека, вызывая миокардит. Чаще он возникает у людей,
страдающих СПИДом. Паразит проникает в кардиомиоциты, раз-
множается в иих, образуя псевдоцисты, в результате чего мышечные
клетки разрушаются. Вокруг некротизированных мышечных волокон
располагаются инфильтраты из лимфоцитов, эозинофилов, ПЯЛ и
других гранулоцитов. В 50% случаев токсоплазменный миокардит
приводит к остановке сердца. При соответствующей терапии ток-
соплазма может погибать и возникает очаговый кардиосклероз.
Шагаса миокардит, или южноамериканская эндемическая бо-
лезнь Шагаса. Возбудитель болезни Tripanosoma cruzi chagas рас-
пространен в Южной и Средней Америке, включая южные штаты
Северной Америки. Поэтому ВОЗ считает это заболевание одним
из наиболее тяжелых эндемических страданий южноамериканского
континента.
Попавший в кровоток возбудитель проникает в клетки гладкой
и поперечнополосатой мускулатуры, в том числе в кардиомиоциты,
и разрушает их. В ранней фазе, продолжающейся 1—3 нед, наблю-
даются очаговые некрозы миокарда, окруженные лимфомакрофа-
гальным инфильтратом с небольшим количеством эозинофилов и
плазматических клеток (рис. 10.27, в). Иногда в кардиомиоците
можно увидеть паразита в псевдоцисте. Воспаление возникает в
основном в межжелудочковой перегородке и в левом желудочке,
миокард которого становится дряблым, его полость растягивается.
Иногда (примерно через месяц после начала заболевания) в области
верхушки сердца может возникнуть аневризма. После острой фазы
обычно наступает латентный период, который длится 10—20 лет,
но при этом воспалительный процесс в миокарде не прекращается.
При хроническом миокардите происходит организация очагов не-
кроза с образованием множественных мелких рубцов с незначи-
тельной клеточной инфильтрацией. Развивается умеренная гипер-
трофия миокарда. Характерно вовлечение в процесс не только мы-
шечной ткани, но и нервных клеток сердечных ганглиев, что
приводит к тяжелым нарушениям ритма сердца. При этом в суб-
эпикардиальных слоях нередко видны воспалительные инфильтраты
по ходу шванновских оболочек нервов.
Помимо указанных паразитов, очень редко в миокард могут
попадать трихины и вызывать интерстициальный эозинофильный
миокардит. Еще реже в сердце обнаруживается эхинококк. Его
цисты могут свободно лежать в полости перикарда или внедряться
в кардиомиоциты, особенно ушка предсердий. В миокарде возникает
характерное для этого паразита продуктивное воспаление.
10.5.2.3. Инфекционно-аллергический миокардит
Ведущим звеном патогенеза этого миокардита является длительный
контакт с возбудителями, в результате чего в организме развивается
реакция клеточной гиперчувствительности. Это способствует борьбе
с возбудителями и их токсинами, но одновременно страдают и
552
Рис. 10.28. Морфология инфекционно-аллергического миокардита. Окраска
гематоксилином и эозином.
а — ревматический миокардит: «цветущая* гранулема Ашоффа — Талалаева. х 250; б —
гигантоклеточный миокардит при генерализованном саркоидозе, х 125.
собственные ткани, в том числе миокард [Grouls V. et al., 1979].
При некоторых заболеваниях, таких как затяжной септический
эндокардит, первичный туберкулез, бруцеллез, язвенный колит,
ревматизм, такой механизм патогенеза миокардита практически не
вызывает сомнений. При других заболеваниях — генерализованном
саркоидозе, гигантоклеточном артериите, гранулематозе Вегенера и
некоторых других — этот механизм можно лишь предполагать.
Изменения развиваются преимущественно в правых отделах сер-
дца, его верхушке и в межжелудочковой перегородке. Здесь в строме
миокарда, преимущественно периваскулярно, имеется серозный экс-
судат, а также очаговые некробиотические и некротические изме-
нения миофибрилл, диффузные и очаговые лимфоплазмоцитарные
инфильтраты, иногда (при некоторых ревматических заболеваниях,
туберкулезе, саркоидозе и др.) инфильтраты могут принимать гра-
нулематозный характер.
Среди инфекционно7аллергических миокардитов наиболее часто
встречается ревматический миокардит. Различают 3 формы ревма-
тического миокардита: узелковый продуктивный (гранулематоз-
ный), диффузный межуточный экссудативный, очаговый межуточ-
ный экссудативный.
Гранулематозный миокардит в ранних стадиях ревматизма ха-
рактеризуется образованием в интерстициальной и периваскулярной
соединительной ткани «цветущих» ашофф-талалаевских гранулем,
состоящих из крупных макрофагов (рис. 10.28, а). Гранулемы об-
наруживаются в миокарде всех отделов сердца, но особенно часто
в задней стенке левого желудочка, папиллярных мышцах, в левом
предсердии и его ушке, а также в межжелудочковой перегородке.
В мышечных клетках рядом с гранулемами отмечаются некробио-
тические изменения, заканчивающиеся лизисом кардиомиоцитов.
При хроническом течении ревматизма гранулемы Ашоффа —
Талалаева встречаются значительно реже, чаще видны рубчики в
связи с их склерозированием. В миокарде отмечаются выраженный
диффузный кардиосклероз, периваскулярный склероз с дистрофи-
ческими и некробиотическими изменениями мышечных волокон.
Гипертрофия миокарда связана в основном со сформировавшимся
ревматическим пороком сердца.
Диффузный межуточный экссудативный миокардит наблюдается
в основном у детей (он описан М. А. Скворцовым). Для этой формы
миокардита характерны отек интерстициальной ткани и ее диф-
фузная лимфогистиоцитарная и нейтрофильно-эозинофильная ин-
фильтрация; гранулемы почти не встречаются, кардиомиоциты в
состоянии резко выраженной белковой дистрофии. Миокард дряблый,
полости сердца растянуты, сократительная способность миокарда
ослаблена. Процесс заканчивается диффузным кардиосклерозом.
Очаговый межуточный экссудативный миокардит возможен при
латентном течении ревматизма. Он характеризуется очаговой лим-
фогистиоцитарной инфильтрацией интерстиция с наличием в экс-
судате отдельных ПЯЛ. Гранулемы Ашоффа — Талалаева почти
не встречаются, в связи с чем этот миокардит называют также
554
неспецифическим. В кардиомиоцитах отмечаются дистрофические
и некробиотические изменения.
При генерализованном саркоидозе, гигантоклеточном артериите,
гранулематозе Вегенера, при некоторых видах тимом [Sekiguchi М. J.
et al., 1980] встречается, хотя и относительно редко, так называемый
гигантоклеточный миокардит. В миокарде, преимущественно левой
половины сердца и в межжелудочковой перегородке, обнаружива-
ются гранулемы, образованные гигантскими клетками саркоидного
типа. Размеры сердца увеличены, полости его расширены, особенно
левого желудочка; нередко наблюдается фиброз эндокарда по ходу
приносящего тракта. При микроскопическом исследовании выявля-
ются гипертрофированные и атрофированные мышечные волокна.
В кардиомиоцитах имеются перинуклеарные вакуоли, просветление
саркоплазмы. Находят как сетчатый кардиосклероз, так и крупные
рубцы (рис. 10.28, б). В рубцах и в несклерозированном миокарде
обнаруживаются отдельные гранулемы из лимфоцитов, гистиоцитов,
а также гигантских клеток типа Пирогова — Лангханса. Вокруг
гранулем можно наблюдать глыбчатый распад мышечных волокон
и незначительную гистиоцитарную инфильтрацию [Silvermann К. J.
et al., 1977].
10.5.2.4. Токсический миокардит
Токсический миокардит — большая группа воспалительных забо-
леваний миокарда. Наибольшее клиническое значение имеют диф-
терийный и лекарственный миокардиты.
Дифтерийный (ицфекционно-токсический) миокардит возника-
ет при дифтерии, а чаще при противодифтерийной вакцинации.
В настоящее время показано, что дифтерийный токсин, имея сход-
ную молекулярную структуру с цитохромом С, замещает его в
цикле Кребса. Это нарушает окислительное фосфорилирование,
транспорт длинноцепочечных жирных кислот, а также рибосомаль-
ный синтез протеинов в митохондриях кардиомиоцитов [Stru-
kov A. I., Paukov V. S., 1972; DickM. R. et al., 1982]. В результате
развиваются выраженная жировая дистрофия и распад кардиомио-
цитов, особенно правого желудочка сердца. Морфологически наблю-
даются очаговая эозинофилия и коагуляционный некроз мышечных
волокон (восковидная дегенерация), в интерстиции, преимущест-
венно периваскулярно, появляются серозный экссудат и небольшие
очаговые лимфоплазмоцитарные инфильтраты (рис. 10.29). Вслед-
ствие некроза миофибрилл происходит коллапс стромы, миокард
частично теряет свойства функционального синцития, что может
составлять один из компонентов патогенеза острой сердечной недо-
статочности (обычно на 2-й неделе заболевания). Очаги некроза
подвергаются организации, и развивается сетчатый (не грубый)
кардиосклероз. Сходная картина наблюдается в миокарде при га-
зовой гангрене и бактериальной дизентерии. Рубцы в миокарде
могут подвергаться гиалинозу, что приводит к тяжелому постдиф-
терийному кардиосклерозу.
555
Рис. 10.29. Дифтерийный (инфекционно-токсический) миокардит. Очаговая
эозинофилия и распад кардиомиоцитов, незначительная периваскулярная
лимфоплазмоцитарная инфильтрация. Окраска гематоксилином й эозином,
х 125.
Лекарственный (эозинофильный, или «гиперчувствительный»)
миокардит возникает при передозировке некоторых лекарств или ин-
дивидуальной их непереносимости. Такими лекарственными средства-
ми являются отдельные антибиотики, противовоспалительные, противо-
эпилептические препараты, антидепрессанты и др. В основе воспаления
миокарда лежит реакция гиперчувствительности замедленного типа. Ми-
окардит развивается преимущественно в левых Отделах сердца и в меж-
желудочков и перегородке. Мышца сердца дряблая, на глинистом фоне
видны многочисленные желтовато-красноватые пятна.
При гистологическом исследовании наблюдается поражение пре-
имущественно субэндокардиального слоя миокарда, в котором име-
ются множественные очаги миоцитолиза. В интерстиции отмечается
диффузная лимфоплазмоцитарная инфильтрация, в инфильтрате
особенно много эозинофильных гранулоцитов, в мелких интраму-
ральных сосудах — признаки «гиперчувствительного» васкулита.
Иногда в воспалительный процесс вовлекаются перикард и парие-
тальный эндокард. Далеко не всегда в таких случаях удается связать
такой панкардит с повышенной чувствительностью к лекарственным
средствам, хотя, как правило, у таких больных имеются бронхи-
альная астма, аллергия на пищевые продукты и т. д. В таких
ситуациях очень затруднен дифференциальный диагноз эозинофиль-
ного миокардита с париетально-фибропластическим эозинофильным
эндокардитом Леффлера.
556
После излечения больных от лекарственного миокардита, осо-
бенно протекающего с перикардитом и эндокардитом, в миокарде
остаются множественные тонкие рубцы, наблюдаются париетальный
фиброз эндокарда и фиброз перикарда, констриктивный перикардит.
Считают, что такие изменения мышцы сердца могут трансформи-
роваться в рестриктивную кардиомиопатию.
10.5.3. Перикардит
Перикардит может быть самостоятельным заболеванием, но значи-
тельно чаще он служит проявлением других заболеваний или их
осложнением, особенно заболеваний органов средостения, легких и
сердца. Перикардит встречается в 4—6% случаев всех вскрытий, а
по клиническим данным его частота колеблется от 0,5% до 1%
[Olsen Е. G. J., 1980; Schneider W., Kaltenbach М., 1982].
Первичный изолированный перикардит, или идиопатический
перикардит, составляет 7—33% всех перикардитов [Scholmerich Р.
et.al., 1980]. Он может протекать остро или хронически с рециди-
вированием. Этиология заболевания неизвестна, в качестве возмож-
ных его причин обсуждаются вирусная инфекция и реакция гипер-
чувствительности.
Морфологически обнаруживается серозный или серозно-фибри-
нозный, иногда геморрагический перикардит. В зависимости от ста-
дии болезни при микроскопическом исследовании отмечаются отек
обоих листков перикарда, их гиперемия,.в полости перикарда име-
ется фибринозный экссудат, который постепенно организуется. Воз-
можно кровотечение из новообразованных капилляров, и экссудат
при этом становится геморрагическим. В листках перикарда —
лимфоплазмоцитарная и макрофагальная инфильтрация. При вы-
здоровлении в большинстве случаев экссудат рассасывается, обли-
терация полости перикарда наступает крайне редко.
Вторичные перикардиты. Неспецифический бактериальный пе-
рикардит наиболее часто развивается при септикопиемии. Бактерии
могут проникать в полость перикарда гематогенным, лимфогенным
или контактным путем. Обычно перикардит вызывают стафилокок-
ки, пневмококки, стрептококки, кишечная палочка, грамотрица-
тельные бактерии. При неспецифическом бактериальном перикар-
дите возникает гнойное или гнойно-фибринозное воспаление. Состав
экссудата зависит от вида возбудителя и длительности процесса.
Вначале в экссудате-очень много гранулоцитов и фибрина, позднее
появляются лимфоциты, начинается склерозирование листков пе-
рикарда и организация экссудата. Гнойный перикардит почти всегда
заканчивается облитерацией полости перикарда.
Туберкулезный перикардит обычно наблюдается у лиц пожилого
возраста, среди других перикардитов он составляет 7—10%
[Olsen Е. G. J., 1980]. Заболевание возникает при распространении
микобактерии туберкулеза из легких гематогенным или лимфоген-
ным путем, но чаще при туберкулезе медиастинальных лимфати-
557
ческих узлов. В патогенезе этого перикардита выделяют 3 стадии.
Вначале развивается фибринозный перикардит («сухая стадия»),
который не подвергается обратному развитию. Затем наступает
«влажная стадия», при которой в полости перикарда появляется
серозно-фибринозный выпот (до 3 л) с большим количеством лим-
фоцитов. Листки перикарда утолщаются, на них обнаруживаются
туберкулезные бугорки. В абсорбционно-констриктивной стадии вы-
пот резорбируется. В г/з случаев полость перикарда облитерируется,
его листки склерозируются, утолщаются, в них выявляются тубер-
кулезные очаги.
Среди других перикардитов следует упомянуть вирусный пери-
кардит, вызываемый Коксаки-вирусом групп А или В, вирусом
полиомиелита, ЭКХО-вирусами, а также вирусами гриппа, инфек-
ционного мононуклеоза и др. Морфологически — это серозно-фиб-
ринозный перикардит. При ревматизме развивается серозно-фибри-
нозный или фибринозный перикардит. В листках перикарда могут
обнаруживаться гранулемы Ашоффа — Талалаева. Уремический
перикардит наблюдается у 9% больных, страдающих уремией. Мор-
фологически — это обычно фибринозный или фибринозно-геморра-
гический перикардит.
10.6. СОСУДЫ
Характер воспаления, развивающегося в сосудах, во многом опре-
делйется структурными особенностями сосудистой стенки. Как из-
вестно, она включает эндотелиальную выстилку, базальный слой,
эластические мембраны, коллагеновые волокна, межуточную суб-
станцию, гладкие мышечные клетки, адвентициальную соединитель-
ную ткань, систему vasa vasorum, перицитарные клеточные элемен-
ты. Эндотелий представляет собой огромное рецепторное поле для
связывания циркулирующих в крови иммуноглобулинов, компле-
мента. Эндотелиальные клетки могут выступать в роли мишени для
цитотоксических антител и цитотоксических Т-лимфоцитов. По-
вреждение эндотелия сопровождается выбросом коагулирующих фак-
торов, «запускающих» свертывающую систему крови, в результате
чего развивается тромбоз, что проявляется картиной тромбоэндова-
скулита. Нарушение целостности базального слоя и эластического
барьера способствует проникновению внутрь стенки из просвета
сосуда иммунных комплексов, компонентов плазмы, фибрина, фор-
менных элементов крови. В исходе развиваются отек сосудистой
ткани, плазморрагия вплоть до фибриноида, лейкоцитарная реак-
ция — формируется картина экссудативного воспаления. Деструк-
ция клеточных и неклеточных элементов сосудистой стенки вслед-
ствие токсического воздействия комплемента, цитокинов, лизосом-
ных ферментов, перекисных радикалов сопровождается альтератив-
ными процессами и некротическими изменениями, в том числе
фибриноидным некрозом, что проявляется деструктивными формами
васкулита. Пролиферация эндотелиальных клеток, перицитов, кле-
558
ток адвентициального слоя, инфильтрация сосудистой стенки моно-
нуклеарными клетками являются выражением пролиферативного
воспаления. Инициативным звеном в возникновении воспаления
могут быть vasa vasorum, откуда процесс переходит на другие слои
стенки.
Воспалительный процесс, развивающийся в стенках сосудов, име-
ет широкий спектр морфофункциональных и клинических прояв-
лений, что связано как со сложностью структурно-функциональн й
организации сосудистой системы, так и с разнообразием патогене-
тических механизмов, лежащих в основе этого процесса. Воспаление,,
протекающее в ткани сосудов, принято обозначать терминами «ва-
скулит» или «ангиит».
10.6.1. Васкулит
Васкулиты систематизируют и группируют исходя из разных кри-
териев — этиологических, патогенетических, анатомических, пато-
морфологических, клинических, на основе которых предложены мно-
гочисленные классификации [Зербино Д. Д., 1977; Семенкова Е. Н.,
1989; Ярыгин Н. Е. и др., 1990; LieJ. Т., 1988; Moore Р. М., 1989,
и др. ]. В зависимости от анатомической принадлежности и калибра
вовлеченного в воспалительный процесс сосуда васкулит подразде-
ляют на артериит, аортит, флебит, капиллярит, артериолит, венулит,
лимфангит. Васкулиты могут быть системными, когда имеется рас-
пространенное поражение каких-то звеньев сосудистого русла, и
локальными (региональными), когда воспаление сосудов ограничи-
вается определенной областью в пределах органа или ткани. В кли-
нической и исследовательской работе удобна предложенная В. В. Се-
ровым и Е. А. Коган (1982) классификационная схема васкулитов,
учитывающая их этиологию, патогенез, нозологическую принадлеж-
ность, характер распространенности воспалительной реакции, мор-
фологический тип поражения сосуда, локализацию процесса и кли-
ническую картину заболевания. Согласно этой классификации ва-
скулиты подразделяются на первичные и вторичные.
При первичных васкулитах воспаление развивается как само-
стоятельный патологический процесс, что выражается своеобразны-
ми проявлениями конкретных нозологических форм и синдромов.
К ним. относятся узелковый периартериит (болезнь Куссмауля —
Майера), болезни Такаясу, Бехчета, Кавасаки, Хортона, Черджа —
Строе, Винивартера — Бисвангера, гранулематоз Вегенера, гемор-
рагическая пурпура Шенлейна — Геноха, ревматическая полими-
алгия, синдромы Мошковича, Гудпасчера, гиперсенситивный васку-
лит, лимфоматоидный гранулематоз Либова, тромбангиит Бюргера
и др. [Семенкова Е. Н., 1989; Moore Р. М., 1989]. Вторичные вас-
кулиты возникают при вовлечении сосудов в воспалительный про-
цесс по ходу развития какого-либо заболевания. К ним относятся
васкулиты при инфекционных болезнях, паразитарных инвазиях,
интоксикациях, опухолях, коллагеновых болезнях, лекарственной
и сывороточной болезни и др.
559
Воспалительный процесс, развивающийся на уровне сосудов мик-
роциркуляторного русла, также может возникать первично в струк-
турных элементах терминального сосудистого русла. Тогда речь идет
о васкулите в элементах системы микроциркуляции, обозначаемом
соответственно калибру пораженного сосуда как капиллярит, арте-
риолит или венулит. Воспаление в периваскулярной ткани носит в
этих условиях вторичный характер, переходя на окружающую ткань
со стороны сосудов. Однако возможна ситуация, когда в предсуще-
ствующем очаге воспаления микрососуды вовлечены в процесс опос-
редованно. Можно ли говорить в этих случаях о васкулите (капил-
лярите, артериолите, венулите) — вопрос дискуссионный, неодно-
значно решаемый разными исследователями (например, когда речь
идет о поражении сосудов в очаге пневмонии).
По течению васкулиты подразделяют на острые, подострые и
хронические. Некоторые авторы выделяют рецидивирующие васку-
литы, хотя Д. Д. Зербино (1977) предлагает относить их к подострым
формам.
При всем многообразии подходов к систематизации васкулитов
для патологоанатомов наибольший интерес представляет группиров-
ка их по механизмам развития, а также по характеру структурных
проявлений, т. е. по патогенетичекому и патоморфологическому
принципам. В преобладающем большинстве случаев механизмы раз-
вития васкулитов бывают связаны с иммунопатологическими про-
цессами, реже они реализуются за счет прямого повреждающего
воздействия на сосуды химических субстанций, токсинов, микробных
и вирусных факторов [Семенкова Е. Н., 1989; Lie J. Т., 19881. В ка-
честве примера такого влияния можно привести артерииты (коро-
нариты, аортиты), вызванные хроническим токсическим воздейст-
вием на сосуды соединений тяжелых металлов, в первую очередь
свинца [Зербино Д. Д., 1977].
10.6.1.1. Патогенез
Иммунопатологические процессы, лежащие в основе развития по-
давляющего большинства васкулитов, принято подразделять, соглас-
но современной классификации реакций гиперчувствительности [Се-
ров В. В., 1990]. При всем многообразии реакций гиперчувствитель-
ности одни из них связаны с проявлениями гуморального иммунитета
(антителами или иммунными комплексами), т. е. с ГНТ, другие —
с проявлениями клеточного иммунитета (лимфоцитами, макрофа-
гами), т. е. с ГЗТ.
Васкулит, в основе которого лежат реакции ГНТ, можно разде-
лить по механизмам развития на антительный и иммунокомплек-
сный.
При антительном васкулите цитотоксические антитела взаи-
модействуют с компонентами сосудистой стенки, производя повреж-
дающий эффект. Обычно это аутоантитела, но могут быть также
и антитела, выработанные на внешние антигены и перекрестно
560
реагирующие со структурными элементами стенки сосудов. Приме-
ром антительного васкулита может служить болезнь Бюргера (об-
литерирующий тромбангиит), при которой имеет место выработка
антител к эластическим мембранам [Семенкова Е. Н., 1989].
Наиболее распространенной формой антительного васкулита яв-
ляется васкулит, вызванный антителами к эндотелиальным клеткам.
У 86% больных системными васкулитами обнаруживаются в крови
цитотоксические комплементфиксирующие антиэндотелиальные ан-
титела [Brasile L. et al., 1989]. Эти антитела способны реагировать
не только с эндотелиальными клетками, но и с моноцитами. По-
скольку они не реагируют с Т- и В-лимфоцитами, они не направлены
против антигенов системы HLA. Их антигенная направленность
сопряжена с антигенами, экспрессируемыми эндотелиоцитами: АВН,
МНС (major histocompatibility complex), тканевые антигены, тром-
боцитарные антигены.
Ярким примером антительного васкулита с антиэндотелиальной
направленностью может служить болезнь Кавасаки, протекающая
в форме острого заболевания у детей [Moore Р. М., 1989']. Гисто-
логически обнаруживают панваскулит с некрозом эндотелия, осаж-
дением в сосудистой стенке иммуноглобулинов, мононуклеарнои
клеточной инфильтрацией. Поражаются сосуды среднего и мелкого
калибра. В сыворотке больных выявляют цитотоксические компле-
ментсвязывающие антитела класса IgG, IgM, специфически реаги-
рующие с культивируемыми эндотелиальными клетками, экспрес-
сирующими поверхностный антиген Н4/Н18. Эти антитела способны
также реагировать с гладкими мышечными клетками и фибробла-
стами. Антиэндотелиальные антитела выявлены у группы больных
ревматоидным и волчаночным васкулитом [Heurkens А. Н. et al.,
1989]. Они относятся к классу IgG, способны реагировать с фиб-
робластами и не связываются с другими антигенами (ядерными,
групп крови и др.). При этом в крови больных отсутствуют цир-
кулирующие иммунные комплексы.
К категории антительных васкулитов с антиэндотелиальной на-
правленностью, по-видимому, следует отнести и трансплантацион-
ный васкулит при реакции отторжения, так как именно поверхно-
стные белки эндотелиальных клеток выполняют роль транспланта-
ционных иммуногенов [Brasile L. et al., 1989].
С эндотелием могут перекрестно реагировать антитела к разным
антигенам. Много внимания в последнее время уделяется антифос-
фолипидным антителам, особенно их разновидности — антителам
к кардиолипину. Появление этих антител отмечают при ряде форм
системных васкулитов, в частности при кожной форме узелкового
периартериита, артериите Такаясу, пурпуре Шенлейна — Геноха,
синдроме Бех.чета, лейкоцитокластическом васкулите [Зербино Д. Д.
и др., 1990; Degitz К. et al., 1989; Katayama I. et al., 1989]. Эти
антитела вступают в реакцию с антигенами фосфолипидов сверты-
вающей системы, в частности с факторами свертывания тромбоцитов,
с мембранами эндотелиальных клеток, вызывая формирование тром-
бов [Degitz К. et al., 1989], хотя in vitro антифосфолипидные ан-
561
титела проявляют антикоагулянтные свойства [Alarcon-Segovia D. et
al., 1989].
Важным шагом к раскрытию механизмов и в диагностике большой
группы системных васкулитов антительного генеза было обнаруже-
ние в крови больных аутоантител к цитоплазме нейтрофилов или,
как их по другому называют, аутоантител к внеядерным антигенам
нейтрофилов. Эти антитела впервые были обнаружены в 1985 г.
Е. J. Van der Woude и соавт. у больных гранулематозом Вегенера
и расценены как специфический маркер этого заболевания. Позже
было установлено, что данные антитела характерны не только для
гранулематоза Вегенера, но и для других форм системных васку-
литов, в частности для синдрома Черджа — Строе, болезни Кавасаки,
микроскопического варианта периартериита, лейкоцитокластическо-
го васкулита [Jennette J. S. et al., 1989; Lie J. T. et al., 1988]. Ан-
титела к цитоплазме нейтрофилов дают перекрестную реакцию с
антигенными детерминантами эндотелиальных клеток, относятся к
классам иммуноглобулинов G, М и А, но наиболее характерны IgM
[Lockwood С. М., 1989]. Их выявляют иммунофлюоресцентным или
иммунопероксидным методом, используя в качестве антигена мазки
лейкоцитов здоровых людей. Появление этих антител у больных
системными васкулитами нередко сочетается с развитием некроти-
зирующего или экстракапиллярного пролиферативного гломеруло-
нефрита [Lennette J. С. et al., 1989], а также с поражением легких,
сопровождающимся легочными геморрагиями [Jayne D. R. et al.,
1989].
Перекрестные антительные реакции описаны также при васку-
лите,‘сопровождающем развитие волосато-клеточного лейкоза, так
как и в волосковых лейкозных, и в эндотелиальных клетках содер-
жатся общие антигены [Conn D. L., 1989].
Вторым механизмом, по которому реализуются реакции ГНТ,
приводящие к васкулиту, является иммунокомплексный механизм,
связанный с фиксацией в стенке сосудов комплексов антиген —
антитело — комплемент. Примерами иммунокомплексных васкули-
тов служат васкулит при ревматоидном артрите, системной красной
волчанке, гломерулонефрите, при различных инфекциях, сыворо-
точной болезни; природной моделью такого васкулита является але-
утская болезнь норок [Moore Р. М., 1989]. В стенках сосудов могут
осаждаться циркулирующие в крови иммунные комплексы либо
возможно формирование иммунных комплексов непосредственно в
сосудистой стенке. Условиями осаждения циркулирующих иммунных
комплексов являются повышение сосудистой проницаемости, вы-
званное вазоактивными аминами и инициируемое IgE, а также
избыток антигена в составе комплекса, что наблюдается при про-
дукции низких титров антител. К факторам, локализующим им-
мунные комплексы в сосудистой стенке, относят гемодинамические
условия, заряд сосудистой ткани (например, отрицательный заряд
гломерулярной базальной мембраны), особенности строения сосуда
[Moore Р. М., 1989]. Под последним подразумевают, например, тип
структуры эндотелия. Так, фенестрированный эндотелий клубочков
562
Рис. 10.30. Иммуно-
флюоресценция IgG в
стенке венулы кожи
при системной крас-
ной волчанке. Прямой
метод Кунса, х 600.
почки способен легко «захватывать» крупные молекулы, и при
экспериментальной иммунокомплексной болезни комплексы анти-
ген — антитело долго выявляются в стенке гломерулярных капил-
ляров после их исчезновения из стенок других сосудов.
Примерами иммунных комплексов могут служить криоглобули-
ны, ревматоидный фактор, в которых роль антигена выполняют
иммуноглобулины классов G. Среди разных антигенов, входящих в
состав иммунных комплексов при васкулитах, в последнее время
большое внимание уделяется поверхностному антигену вируса ге-
патита B-HBsAg, выявленному, например, у одной трети больных
узелковым периартериитом [Семенкова Е. Н., 1989; LieJ. Т., 1988;
Moore Р. М., 1989]. Установлена также этиологическая роль в раз-
витии васкулитов вирусов гепатита А, Т-клеточной лимфомы 1 или
3, парвовируса, лимфотропного вируса, цитомегаловируса, вируса
герпеса [Conn D. L., 1989]. Последние два вируса способны внед-
ряться в сосудистую стенку, вызывая развитие реакции антиген —
антитело на месте.
Примером васкулита, при котором образование иммунных ком-
плексов происходит in situ в тканях, является реакция Артюса.
В последние годы получены данные, что при системной красной
волчанке антиген ядерной ДНК, циркулирующий в крови больных,
первоначально фиксируется в стенке сосудов, в частности в гломе-
рулярной базальной мембране, а затем антинуклеарные антитела,
реагируя с ним, формируют иммунные комплексы in situ [Mo-
ore Р. V„ 1989].
Важным патогенетическим звеном в развитии васкулита, обус-
ловленного ГНТ, является активация комплементарной
системы с высвобождением хемотаксических факторов, ведущих
к аттракции ПЯЛ. Присутствие комплемента, так же как и имму-
ноглобулинов, в составе иммунных комплексов удается визуализи-
563
ровать иммуногистохимическими методами (рис. 10.30), а также с
помощью иммунной электронной микроскопии. Так, на ультраструк-
турном уровне с помощью поликлональных антител в биоптатах
кожи больных иммунокомплексным васкулитом показано осаждение
комплементсодержащих комплексов на люминальной поверхности
мембран эндотелиоцитов и на инфильтрирующих стенку сосуда ПЯЛ
[Boom В. W. et al., 1989]. Лейкоцитарная реакция сопровождается
высвобождением из лейкоцитов медиаторов воспаления — катионных
лизосомных белков, гидролаз, перекисных радикалов, приводящих
к выраженной деструкции ткани. Высвобождение медиаторов из
нейтрофилов стимулируется ФАТ, рецепторы к которому содержатся
на поверхности нейтрофилов [Warren J. S. et al., 1989]. Существенна
также роль тромбоцитов в качестве источника гистамина и серото-
нина.
При преобладании в генезе васкулита реакций ГЗТ раз-
витие воспаления определяется главным образом специфическим
взаимодействием Т-лимфоцитов с сосудистыми, в первую очередь
эндотелиальными, антигенами. Ведущую роль при этом играют
Т-лимфоциты подтипа CD, которые, как установлено на примере
васкулита сетчатки при симпатической офтальмии, доминируют в
составе клеточного инфильтрата, в то время как число клеток
подтипа CD8 и В-лимфоцйтов незначительно [Chan С. et al., 1986].
Среди многочисленных антигенов, экспрессируемых эндотелио-
цитами (МНС, HLA, ABH, Н4/Н18, антиген фактора VIII и др.),
в индукции реакций ГЗТ особое значение придается антигенам
класса. I HLA (DR, DP, DQ), экспрессия которых индуцируется
медиаторами Т-клеток — лимфокинами, интерфероном [Brasile L.
et al., 1989; Chan С. et al., 1987; Moore P. M., 1989]. Эти антигены
стимулируют ^пролиферацию Т-клеток и реагируют с Т-хелперами,
что ведет к высвобождению медиаторов ГЗТ (интерферон, интер-
лейкины, ФНО), повреждению эндотелия с выделением из него
тромбопластина, простациклина, ФАТ.
Клиническим выражением участия медиаторов ГЗТ в развитии
васкулитов служит повышение их содержания в сыворотке больных.
Так, при болезни Кавасаки в сыворотке резко возрастает концен-
трация ФНО [Lang В. A. et al., 1989], при болезни Черджа — Строе,
узелковом периартериите — ИЛ-2 и «-интерферона [Grau G. Е. et
al., 1989].
Большую роль среди эндотелиальных антигенов играет антиген
фактора VIII (фактора Виллебранда), идентификация которого в
плазме крови больных при ряде системных васкулитов (узелковый
периартериит, системная красная волчанка, нейроваскулит и др.)
считается диагностическим критерием сосудистых поражений
{Lie J. Т„ 1988; Moore Р. М., 1989].
С эндотелиальными антигенами, по-видимому, в значительной
мере связана органная специфичность локализации васкулитов, так
как именно эндотелиоциты содержат органоспецифические антиге-
ны. Например, эндотелиальные клетки сосудов головного мозга кры-
сы, помимо общих для эндотелия антигенов (МЕ-2, АСЕ), обладают
564
антигенами, специфичными для клеток головного мозга (Thy-1,
ВАТ, МВБ) [Moore Р. М., 1989 ].
Имеются экспериментальные данные, согласно которым развитие
мононуклеарно-клеточного (пролиферативного) васкулита (т. е. ва-
скулита в условиях ГЗТ) у мышей С57В1/6 связано с экспрессией
аутосомного мутантного гена лимфопролиферации 1рг, что сопро-
вождается накоплением в селезенке и лимфатических узлах Т-лим-
фоцитов Thy-1, CD4, CD8, В 220 [Cerny A. et al., 1989].
Следует заметить, что определяющие развитие васкулитов ре-
акции ГНТ и ГЗТ обычно не происходят изолированно, а тесно
взаимосвязаны и один тип реакции трансформируется в другой.
Поэтому правильнее говорить лишь о преобрадании той или иной
реакции в генезе васкулита. Так, при феномене Артюса можно
считать, что преобладает ГНТ, а при феномене Овари — ГЗТ, хотя
при том и другом феномене происходит смена реакций [Серов В. В.
и др., 1970; Серов В. В., 1990; Ярыгин Н. Е. и др., 1980]. Смена
фаз ГНТ и ГЗТ отмечена при гранулематозе Вегенера [Van der
Woude F. J. et al., 1989], болезни Кавасаки [Lie J. T., 1988].
10.6.1.2. Морфологическая характеристика
Следует подчеркнуть справедливость утверждения J. Т. Lie (1988),
что в диагностике васкулита окончательное заключение почти всегда
возможно лишь после гистологического подтверждения диагноза с
помощью биопсии. Морфологические проявления васкулита соот-
ветствуют в основном известным фазам воспалительного процесса.
В зависимости от преобладания той или иной фазы воспаления
выделяют деструктивную, экссудативную, пролиферативную формы
васкулита и их смешанные варианты. Особо выделяют гранулема-
тозный васкулит. В случае вовлечения в воспалительный процесс
внутренней оболочки сосуда с деструкцией эндотелия и присоеди-
нением тромбоза речь идет о тромбоваскулите. По распространен-
ности воспаления в стенке сосуда выделяют эндо-, мезо-, пери- и
панваскулит.
Примером деструктивного васкулита, развивающегося на уров-
не сосудов микроциркуляции, может служить лейкоцитокластиче-
ский васкулит, при котором деструкция стенок микрососудов со-
провождается формированием фибриноидного некроза и лейкоци-
тарной реакцией с распадом нейтрофильных лейкоцитов и
образованием ядерных осколков. Эта форма васкулита встречается
при различных токсических поражениях, гиперергических состоя-
ниях, инфекциях, в частности она выявлена в коже при ВИЧ-ин-
фекции [Chren М.-М. et al., 1989]. Путем повторных биопсий кожи
удалось проследить эволюцию лейкоцитокластического васкулита в
пролиферативный [Zax R. Н. et al., 1990]. Примером деструктивного
васкулита на уровне крупных сосудов может служить узелковый
периартериит, при котором развивается фибриноидный некроз внут-
ренней и средней оболочек артерий с пролиферативной клеточной
565
Рис. 10.31. Деструктивно-пролиферативный васкулит при узелковом пе-
риартерите (фрагмент артерии мелкого калибра). Фибриноидный некроз
интимы и средней оболочки, клеточная реакция в адвентиции. Окраска
гематоксилином и эозином, х 400 (препарат Т. Н. Копьевой).
реак!гией в адвентиции, поэтому его правильнее обозначать как
деструктивно-пролиферативный васкулит (рис. 10.31).
Экссудативный васкулит характеризуется преобладанием при-
знаков повышенной сосудистой проницаемости, отеком стенки со-
суда, плазморрагией, отложением в стенке сосудов нейтральных
мукополисахаридов, выявляемых при ШИК-реакции, образованием
фибриноида, выходом форменных элементов крови в стенку и за
пределы сосуда. Дискуссионным представляется вопрос о морфоло-
гической верификации экссудативного капилляра, если не выражены
другие компоненты воспаления, так как в этом случае критерии
капиллярита в основном совпадают с признаками обычной плаз-
моррагии. В какой-то мере здесь могут помочь ультраструктурные
критерии (которые тоже не абсолютны): отек и набухание клеток
эндотелия, резкое усиление пиноцитоза, утолщение базального слоя
(рис. 10.32).
Продуктивный васкулит характеризуется преобладанием проли-
ферации клеточных элементов сосудистой стенки (эндотелиоцитов,
перицитов, адвентициальных гистиоцитов) и инфильтрацией ее мо-
нонуклеарными клеточными элементами гематогенного происхож-
дения — макрофагами, лимфоцитами. В сосудах микроциркулятор-
ного русла наблюдается формирование клеточных тяжей, в которых
не определяются сосудистые просветы (рис. 10.33). При сочетании
этих изменений с периваскулярной клеточной инфильтрацией ка-
пилляры бывают практически неразличимы в составе инфильтрата
566
Рис. 10.32. Экссудативный капиллярит кожи при системной красной
волчанке: резкое набухание эндотелиоцитов, сужение просвета капилляра,
усиление пиноцитарной активности, неравномерное утолщение базальной
мембраны, х 32 000.
Рис. 10.33. Пролиферативный капиллярит кожи при системной красной
волчанке: капилляры имеют вид клеточных тяжей. Окраска гематоксилином
и эозином. * 280.
Рис. 10.34. Пролиферативный капиллярит кожи при системной красной
волчанке с периваскулярной лимфогистиоцитарной инфильтрацией. Окраска
гематоксилином и эозином, х 400.
Рис. 10.35. Высокая активность кислой фосфатазы в пролиферирующих
по ходу сосудов клетках при продуктивном васкулите. Кожа больной
системной красной волчанкой. Реакция Гомори. х 160.
(рис. 10.34). Подобного типа васкулиты составляют основу меж-
уточного воспаления, наблюдае ого, например, в органах больных
диффузными болезнями соединительной ткани («коллагеновыми за-
болеваниями»). В пролиферирующих по ходу сосудов клетках высока
метаболическая активность, о чем свидетельствуют, в частности,
ферментогистохимические реакции на окислительно-восстановитель-
ные и гидролитические ферменты (рис. 10.35).
Морфологические варианты васкулита отражают в значительной
мере иммунопатологические механизмы, лежащие в основе их раз-
вития. Так, деструктивные и экссудативные формы васкулита с
фибриноидным некрозом, лейкоцитарной реакцией являются выра-
жением реакций ГНТ, а пр имущественно продуктивные формы —
реакций ГЗТ. Иммунопатологическая природа васкулитов расшиф-
ровывается благодаря иммуногистохимической идентификации мар-
керов реакций ГНТ, ГЗТ (антигенов, антител, комплемента). Так,
при иммунокомплексных васкулитах в стенках сосудов иммуноги-
стохимически идентифицируют иммуноглобулины и комплемент, а
электронно-микроскопически — эквиваленты иммунных комплексов
в виде электронно-плотных депозитов. Следует иметь в виду, что
иммунные комплексы, согласно экспериментальным данным, уда-
ляются из сосудистой стенки благодаря фагоцитозу нейтрофилами
уже через 24—48 ч после их осаждения [Moore Р. М., 1989].
В качестве примера иммуногистохимической идентификации мар-
керов ГЗТ можно привести выявление сосудов сетчатки, инфильт-
рированных Т-лимфоцитами [Chan С. et al., 1987], или перокси-
дазными методами — антигена Н4/18 при экспериментальной ре-
акции ГЗТ [CktranR. С., RoberJ. S., 1988].
10.7. МЫШЦЫ
Распространенность, течение и исход воспалительных реакций в
мышцах во многом определяются сложной организацией паренхимы
мышечной ткани и особенностями архитектоники стромального ком-
понента.
В отличие от клеток паренхимы других органов и тканей ске-
летное мышечное волокно представлет собой многоядерный симп-
ласт, что, по-видимому, связано с большими размерами волокна и
высоким уровнем пластической потребности при нагрузках. Так,
восстановление ультраструктур мышечных волокон после больших
физических нагрузок сопровождается активацией ядер и структур
белкового синтеза одновременно во многих околоядерных зонах в
виде гиперплазии рибо- и полисом, пластинчатого комплекса, эле-
ментов шероховатой эндоплазматической сети как проявления внут-
риклеточной регенерации.
Мышечное волокно окружено двойной мембраной — плазмати-
ческой и базальной. Уникальной особенностью скелетных мышечных
волокон является наличие между мембранами сарколеммы клеток-
сателлитов. Являясь камбиальными клетками (потенциальными мио-
569
бластами), клетки-сателлиты играют огромную роль в регенератор-
ных процессах. По данным Moss Leblond С. Р. (1971), за счет кле-
ток-сателлитов пополняется пул собственных ядер мышечного во-
локна после повреждения. Активация их находится, по-видимому,
под контролем ядерно-цитоплазматических отношений мышечного
волокна. При необратимом повреждении волокон клетки-сателлиты
служат источником новых волокон.
Каждое мышечное волокно имеет индивидуальную иннервацию:
терминали двигательного аксона и специализированная, холиноре-
цепторная, зона сарколеммы образуют нервно-мышечное соедине-
ние. При некоторых видах патологии аксомышечных синапсов вос-
палительный процесс локализуется преимущественно вокруг этих
зон. Именно с патологией холинорецепторов сарколеммы связано
нарушение нервно-мышечного проведения возбуждения при миасте-
нии, при этом признаки иммунного воспаления в виде лимфоги-
стиоцитарных инфильтратов выявляются вблизи нервно-мышечных
соединений, в структурах которых определяются IgG и Сз-
Следует отметить еще одну особенность скелетной мышцы: она
состоит из мышечных волокон различных типов (красных и белых),
что связано с иннервацией их разными мотонейронами (соответст-
венно медленными и быстрыми). Избирательное вовлечение в па-
тологический процесс того или другого типа волокон имеет прак-
тическое значение в дифференциальной диагностике некоторых мы-
шечных заболеваний^
Стромальный компонент скелетных мышц представлен анасто-
мозирующей системой соединительной ткани — пери- и эндомизием
с широкой сетью сосудов и нервов. Подобная организация интер-
стиция и взаимоотношение ее с паренхимой обеспечивают полно-
ценное функционирование мышцы в целом, поддерживая необхо-
димый уровень гомеостаза. Однако при различного рода поврежде-
ниях и заболеваниях мышц строма служит плацдармом воспали-
тельных и репаративных процессов, а тесная анатомическая связь
различных ее отделов обусловливает диффузный характер экссуда-
тивного воспаления. Так, при флегмонах мышц различной этиоло-
гии, в частности при пиомиозите, гнойное расплавление скелетных
мышц, вызванное золотистым стафилококком или /?-гемолитическим
стрептококком, быстро распространяется по интерстициальным про-
странствам и может охватывать обширные участки скелетной мус-
кулатуры [Свистанюк И. У. и др., 1985; Рындин В. Д. и др., 1988;
MinorR. L., 1988]. К инфильтрату главным образом из лимфоцитов
в начале воспаления присоединяется массивная инвазия ПЯЛ, мы-
шечные волокна подвергаются некрозу. Вовлечение всех компонен-
тов соединительнотканной стромы и мышечных волокон в воспали-
тельный процесс наблюдается также и при эозинофильном фасциите;
лишь в части случаев воспаление ограничивается глубокой фасциеи
мышц или эпимизием [Huand К., Chen X., 1987 ].
Мышечная ткань характеризуется чрезвычайно развитой сосу-
дистой системой, причем в эндомизии вокруг каждого мышечного
волокна на поперечном срезе определяется до 3—4 капилляров-
570
Повышение проницаемости капилляров при некоторых видах пато-
логии мышц обусловливает быстрое развитие подфасциального отека
и вторичного гипоксического повреждения мышечных волокон и
сосудов. Например, значительная экссудация после восстановления
кровотока в длительно ишемизированных мышцах конечностей при
компрессии их после удаления тромбоэмболов или снятия жгута
вызывает сильнейшую гидратацию мышц со сдавлением мышечных
волокон и увеличением размеров ишемического некроза. В сосудах
микроциркуляторного русла отмечается резкое полнокровие, обна-
руживаются микротромбы, десквамация эндотелия с обширными
периваскулярными кровоизлияниями. Таким образом создаются не-
благоприятные условия для фагоцитоза некротического детрита и
регенерации мышц [Секамова С. М., 1987].
10.7.1. МИОЗИТ
В группу воспалительных миопатий S. Carpenter и G. Kaspati (1984)
объединили миозиты, развивающиеся при различных повреждениях
и заболеваниях (при наличии клеток воспалительного инфильтрата):
бактериальные и паразитарные миозиты, полимиозит, дерматомио-
зит, миозиты при ревматических болезнях, вирусный миозит, эози-
нофильный фасцит и др.
Для всех видов миозита характерно развитие дистрофических
изменений^ очагового или тотального некроза мышечных волокон
с воспалительной реакцией, поражением сосудов и соединительной
ткани. В скелетных мышцах могут развиваться коагуляционный и
колликвационный некроз. Последний чаще наблюдается при ишемии
мышц в виде так называемого дискоидного некроза с выраженной
картиной поперечной исчерченности, обусловленной лизисом изо-
тропных дисков вследствие высокой активности протеаз в зоне Z-
дисков. Локализация воспалительного инфильтрата, особенно в ос-
трой фазе миозита, зависит от первичного вовлечения в процесс
различных структур мышечной ткани.
При полимиозите, например, с самого начала заболевания раз-
вивается некроз мышечных волокон, и воспалительный процесс
развертывается в основном в эндомизии (вокруг волокон). В ин-
фильтрате много В- и Т-лимфоцитов, причем среди последних пре-
обладают Тв , по-видимому, с цитотоксическим эффектом в отно-
шении мышечных волокон; наличие В- и Т -лимфоцитов свиде-
тельствует в пользу присоединения гуморального механизма
мышечного некроза. Для дерматомиозита характерно первичное по-
ражение сосудов микроциркуляции, воспалительная реакция отме-
чается периваскулярно. При этом высокий процент В-лимфоцитов
и высокое отношение т4+/Т8+ свидетельствуют о преобладании гу-
морального механизма ангиопатии и повреждения соединительной
ткани при дерматомиозите [Arahata К., Engel A. G., 1984]. При
оссифицирующем миозите выявляются очаги пролиферации мио-
фибробластов и гигантских клеток вблизи зон остеоида. При пара-
571
Рис. 10.36. Дерматомио-
зит. Перифасцикулярная
атрофия и склероз мы-
шечных волокон, редук-
ция капилляров. Проник-
новение лимфогистио-
цитарного инфильтрата
из перимизия в эндоми-
зий. Полутонкий срез.
Окраска толуидиновым
синим, х 150.
Рис. 10.37. Миозит. Не-
кроз мышечного волокна.
Макрофаг (МФ) и пол-
иморфно-ядерный лейко-
цит (ПЯЛ) среди мышеч-
ного детрита. Вдоль ба-
зальных мембран (БМ)—
клетки-сателлиты (КС) в
различных стадиях транс-
формации. х 6500.
зитарных миозитах (трихинеллез, цистицеркоз, токсоплазмоз и др.)
очаги хронического продуктивного воспаления в эндомизии могут
обнаруживаться вокруг мышечных волокон, пораженных личинками
паразитов.
Характер и выраженность воспалительных реакций в мышцах
обусловлены прежде всего основным заболеванием, но даже при
одной и той же нозологической форме можно обнаружить зависи-
мость характера и локализации воспалительного процесса от струк-
турно-функциональной характеристики мышц. Так, особенности
анатомо-физиологических взаимоотношений соединительнотканного
и собственно мышечного компонентов растущего организма в соче-
тании с другими факторами могут определять при дерматомиозите
у детей преимущественно перифасцикулярное поражение сосудов и
мышечных волокон [Comola М. et al., 1987 ]: преобладают некроз и
редукция капилляров перимизия с обширными периваскулярными
лимфогистиоцитарными инфильтратами, которые как бы наползают
из перимизиальной соединительной ткани в эндомизий, в процесс
вовлекаются артериолы и даже септальные артерии. В связи с
прогрессирующей ишемией на уровне микрососудов в исходе вос-
палительного процесса резко выражены перифасцикулярная атрофия
и склероз мышц (рис. 10,36). Для дерматомиозита у взрослых также
характерна редукция капиллярного русла, однако не столь выражена
избирательная локализация повреждения: перифасцикулярная ат-
рофия наблюдается редко, чаще отдельные атрофированные волокна
или их группы и очаги инфильтратов располагаются внутри пучка.
Структурно-функциональные особенности волокон склетной мы-
шечной ткани, очевидно, обусловливают и особенности фагоцитоза
при миозите. При некрозе мышечных волокон плазматическая мем-
брана, как правило, разрушается, в то время как базальная мембрана
остается интактной. В эксперименте обычно через 6—8 ч или позже
макрофаги пенетрируют базальную мембрану и осуществляют ре-
зорбцию некротического детрита внутри сарколеммного футляра.
При очаговых повреждениях мышечного волокна можно наблюдать
несколько участков фагоцитоза среди сохранных миофибрилл: Ха-
рактерно, что фагоцитоз детрита сопровождается активацией кле-
ток-сателлитов. Не исключено, что при некрозе удаляется ингиби-
рующий фактор, продуцирующийся в мышечном волокне и конт-
ролирующий структурно-функциональное состояние потенциальных
миобластов. Известно также, что макрофаги вырабатывают факторы
роста, поэтому можно ожидать, что стимулирующий сигнал для
клеток-сателлитов исходит от фагоцитов. Нередко в одном сарко-
леммном футляре одновременно можно видеть остатки детрита,
нередко с петрификатами, макрофаги в различных фазах фагоцитоза
и клетки-сателлиты (рис. 10.37). При этом отличить макрофаги
можно лишь при реакции на кислую фосфатазу — в самом мышечном
волокне кислая реакция не определяется. Большую помощь в этом
могут оказать результаты электронно-микроскопического исследо-
вания. Обычно скопления макрофагов располагаются в центре во-
локон, а по периферии их вдоль сохранившихся базальных мембран
573
определяются уплощенные недифференцированные клетки-сателли-
ты, которые после митотического деления образуют новые популяции
миобластов [Schmal Р. Н. et al., 1985] и растут «в обход детрита».
Нередко одновременно можно наблюдать различные стадии их диф-
ференцировки — от миобластов до мышечных трубок с образованием
собственных базальных мембран (через неделю после некроза). Ста-
рая базальная мембрана играет важную роль в процессах регене-
рации: постсинаптический участок ее способствует врастанию нерва
в базальную мембрану нового волокна [Carlson В. М., Fanlkner J. А.,
1983]. Прогрессирующее увеличение количества клеток-сателлитов
отмечается при дистрофии Дюшенна, а уменьшение их числа —
при неонатальной центронуклеарной миопатии. От пролиферативной
активности клеток-сателлитов во многом зависят характер и исход
воспалительных процессов в мышцах. При благоприятных для ре-
генерации условиях уже на 7—10-е сутки после некроза выявляются
зрелые молодые волокна.
10.8. СУСТАВЫ
Острые и хронические артриты являются постоянным «спутником»
инфекционных болезней, а также системных заболеваний соедини-
тельной ткани. Это связано прежде всего со структурно-функцио-
нальными особенностями синовиальной оболочки, адаптированной
к быстрому обмену воды и растворимых веществ. Хорошо развитая
поверхностная и глубокая капиллярная сеть синовиальной оболочки
содержит значительное количество фенестр в базальной мембране
и не отделена от поверхностного слоя и полости сустава базальной
мембраной. Кроме того, капилляры образуют гломерулы, подобные
тем, которые имеются в почечных клубочках, хороидальных спле-
тениях и др.
10.8.1. Артрит
Основные морфологические изменения при синовите складываются
из повреждения или утолщения синовиального пласта, а также
клеточной инфильтрации покровного и поверхностного стромального
слоев (рис. 10.38). Гистологические особенности синовита зависят
от патогенетических механизмов заболевания. При инфекционных
артритах изменения в синовиальном пласте обычно незначительные,
воспалительный инфильтрат представлен нейтрофилами, лимфоци-
тами и макрофагами. Для артритов, сопровождающих ревматические
заболевания, активно текущему синовиту свойственны выраженные
пролиферативные или деструктивные изменения синовиального пла-
ста и преимущественно лимфомакрофагальный характер воспали-
тельного инфильтрата.
Важное место в развитии воспалительной реакции в суставе
принадлежит покровному слою, 20—30% клеток которого (синовио-
574
Рис. 10.38. Ревматоидный синовит (фрагмент гиперплазированной ворсин-
ки): утолщение синовиального пласта, гипертрофия синовиоцитов, диф-
фузный воспалительный инфильтрат из лимфоцитов, плазмоцитов и гис-
тиоцитов в субпокровном слое. Окраска гематоксилином и эозином, х 200.
циты типа А) имеют костномозговое происхождение и являются
макрофагами. В нормальной синовиальной оболочке синовиоциты
типа А располагаются очагово, не активированы; они удаляют про-
дукты распада из синовиальной жидкости. При синовитах, харак-
терных для ревматических заболеваний, синовиоциты типа А со-
ставляют 80—100% клеток, они активно участвуют в разрушении
тканей суставов [Henderson В. et al., 1988 J. При артритах класси-
ческие макрофаги и дендритические клетки обнаруживаются в раз-
ных отделах синовиальной среды суставов [Dejkstra С. D. et al.,
1987]. Макрофаги и моноциты, секретирующие ферменты и ради-
калы кислорода, выявляются в синовиальном пласте и синовиальной
жидкости; при этом моноциты синовиальной жидкости «притягива-
ются» к поверхности суставного хряща. Дендритические клетки
определяются в субпокровном слое в виде небольших перивенуляр-
ных скоплений совместно с Т-хелперами-индукторами.
Хронический синовит при ревматических заболеваниях рассмат-
ривается как проявление нарушенной местной иммунорегуляции.
Об этом свидетельствует наличие избыточного количества активи-
рованных Т-лимфоцитов, преимущественно хелперов-индукторов
(CD4+), и макрофагов с фенотипом дендритических клеток (RFD1+)
как в синовиальной оболочке, так и в синовиальной жидкости
[Stamenkovic I. et al., 1988]. Дендритические клетки, представляя
575
антиген, активируют определенный клон Т-Л1имфоцитов. В очаге
хронического воспаления показана прямая кор]реляция выраженно-
сти воспалительного мононуклеарного инфилыграта и избыточного
синтеза коллагена [Salisbury А. К. et al., 1987]].
Различия иммунопатологических реакций п|ри отдельных ревма-
тических заболеваниях отражаются на морфологической
картине синовитов. Характерными особеннюстями ревматоид-
ного синовита являются значительная гиперплазия и гипертрофия
синовиоцитов, мезенхимоидная трансформация! клеток субпокров-
ного слоя, поликлональная пролиферация В-лимфоцитов, развитие
грануляционной ткани [Павлова В. Н. и др., 1'988]. Выявлена кле-
точная гетерогенность воспалительного инфильтрата разных участ-
ков синовиальной оболочки. В одних очагах шреобладают Т-лим-
фоциты, в других — Т- и В-лимфоциты, в третьих — дендритические
клетки. В-лимфоциты в ревматоидной синовиальной оболочке ак-
тивированы. С помощью plug-фотометрии показгано увеличение син-
теза иммуноглобулина одной плазматической клеткой [Fritz F.,
1986]. Вырабатывающиеся антитела образуют иммунные комплексы
с другими молекулами антител и антигенов. Фагоцитоз иммунных
комплексов нейтрофилами синовиальной среды суставов приводит
к активации различных систем: медиаторных, коагуляции, кинино-
вой, комплементарной, фибринолитической. Пюликлональную про-
лиферацию В-лимфоцитов с гипергаммаглобулшнемией и образова-
нием аутоантител при ревматоидном артрите связывают с недоста-
точностью супрессорно-индукторной субпопулящии Т-лимфоцитов.
Морфологической основой развития грануляционной ткани считают
фибрин. Организация фибринозного экссудата и созревание грану-
ляционной ткани ведут к образованию фибрюзных спаек между
суставными поверхностями вплоть до полной облитерации полости
сустава (фиброзный анкилоз).
При остром волчаночном синовите преобладает экссудативно-
некротическая реакция с ядерной патологией и скудным воспали-
тельным инфильтратом, что связано с характерной для системной
красной волчанки антинуклеарной направленностью антител. Общим
признаком волчаночного и склеродермическоп» синовитов является
поражение капилляров с деструкцией эндотелия,, резким утолщением
базальной мембраны и редукцией капиллярной сети. Для ранней
стадии склеродермического синовита, кроме того, характерен дис-
семинированный капилляротромбоз, при подостром и хроническом
течении заболевания преобладают процессы штрофии, склероза и
гиалиноза [Русакова М. С. и др., 1981 ].
Гистологическая картина псориатического (синовита в виде по-
верхностной локализации воспалительного прощесса, лейкопедеза и
примеси нейтрофилов в инфильтрате, ангиогенеза с высокой актив-
ностью щелочной фосфатазы в эндотелии кашилляров во многом
совпадает с характером кожных тканевых изменений при псориазе
[Копьева Т. Н и др., 1985].
Особое место в характеристике артрита занимают изменения
г и ал инового хряща суставов, который, как известно, не
576
Рис. 10.39. Системная склеродермия. Клеточный синовиальный паннус,
разрушающий поверхность суставного хряща, видны очаги погибших
хондроцитов; низкое содержание гликозаминогликанов в. промежуточной
зоне. Окраска сафранином О. * 160.
содержит кровеносных и лимфатических сосудов. Разрушение хряща
при воспалении обусловлено кооперирующимся действием различ-
ных типов клеток, которые или секретируют катаболические фер-
менты, или регулируют выработку и освобождение их другими
клетками [Вулли Д. Е., 1988]. В этот процесс вовлечены как клетки
воспалительного инфильтрата, так и хондроциты. Наиболее выра-
женное разрушение суставного хряща с развитием узур, очаговых
деструктивных и пролиферативных изменений хондроцитов отме-
чается в участках синовиального (рис. 10.39) и костномозгового
паннусов.
Синовиальный паннус представляет собой хронический гипер-
трофический синовит перихондральной части синовиальной оболоч-
ки, распространяющийся над хрящом и проникающий в его матрикс.
Чаще всего паннус встречается при ревматоидном и псориатическом
артритах, реже — при системной склеродермии. Поверхностная
часть синовиального паннуса сохраняет структуру синовиальной
оболочки и содержит синовиоциты и субпокровный слой. Около
80% синовиоцитов ревматоидного паннуса экспрессируют фенотип
дендритических клеток (RFD 1) и зрелых макрофагов (RFD 7),
которые редко встречаются в нормальной синовиальной оболочке
[Saliabury А. К. et al., 1987]. В субпокровном слое определяются
большое количество капилляров, венул и артериол, а также пери-
васкулярный инфильтрат из Т-лимфоцитов хелперно-индукторного
типа и большого количества макрофагов, экспрессирующих главным
19—407
577
Рис. 10.40. Ревматоидный артрит. Костно-мозговой паннус в убхондральной
зоне эпифиза кости; скопление остеокластов. Пластинчатая кость почти
не содержит линий склеивания, количество остеоцитов уменьшено. Окраска
гематоксилином и эозином, к 100.
образом антиген дендритических клеток. Примыкающий к субпок-
ровному поверхностный стромальный слой содержит мало клеток,
которые экспрессируют антиген фенотипов дендритических клеток,
зрелых классических макрофагов и моноцитов.
В непосредственном соединении суставного хряща и паннуса
выделяют два типа участков: клеточный (без сосудов и в сочетании
с пролиферирующими сосудами) и фиброзный [Вулли Д. Е., 1988].
Участки клеточного паннуса содержат фибробластоподобные и
макрофагоподобные клетки, ПЯЛ, лаброциты и плазматические
клетки. Фибробластоподобные клетки имеют вытянутое ядро и ци-
топлазму, богатую гранулярной эндоплазматической сетью; в мак-
рофагоподобных клетках выявляются лизосомы, митохондрии и боль-
шое количество цитоплазматических вакуолей. С помощью моно-
клональных антител показано, что большинство макрофагоподобных
клеток клеточного паннуса экспрессируют фенотип зрелых макро-
фагов [Salisbury А. К. et al., 1987]. Электронно-микроскопически в
макрофагах и полинуклеарах обнаружены фрагменты коллагеновых
волокон. Клеточный паннус содержит значительное количество со-
судов, он обладает слабым деструктивным действием и разрушает
уже некротизированные хондроциты, поврежденный матрикс, раз-
рушенные костные балки субхондральной кости.
В фиброзном паннусе определяется небольшое количество фиб-
робластов и макрофагов, расположенных среди толстых пучков кол-
578
лагеновых волокон. Характерной особенностью его является поля-
ризация клеток. Поверхность их, обращенная к паннусу, гладкая
и богата мелкими везикулами. Противоположная сторона, направ-
ленная к хрящу, имеет цитоплазматические выросты. В клетках
находят фрагменты коллагена на разных стадиях переваривания:
одни с хорошо выраженной поперечной исчерченностью, другие —
окруженные мембраноподобным материалом.
Характерной особенностью костномозгового паннуса (рис. 10.40)
является наличие в нем хондрокластов, остеокластов, многоядерных
клеток с зазубренной поверхностью, обращенной к хрящевой ткани.
Цитоплазма их содержит многочисленные везикулы, лизосомальные
тельца, фагоцитированные коллагеновые волокна [Bromley М. et al.,
1985]. В хряще вблизи паннуса определяются большое количество
пустых лакун, некротизированные хондроциты. Встречаются также
очаги пролиферирующих хондроцитарных клонов.
В процессе разрушения хряща различные типы клеток выделяют
разные ферменты [Вулли Д. Е., 1988]. Синовиоциты вырабатывают
ряд металлопротеиназ, нейтрофилы — сериновые протеиназы, мно-
гоядерные хондрокласты, возможно, секретируют лизосомные фер-
менты типа катепсинов. Каждый фермент действует лишь на оп-
ределенные субстраты в строго определенных условиях среды. Два
основных структурных компонента внеклеточного матрикса сустав-
ного хряща — протеогликаны и коллагеновые волокна — разруша-
ются специфическими ферментами. Для протеогликанов наиболее
важными являются протеогликаназа, эластаза нейтрофилов и про-
теиназа лаброцитов. Лизис коллагена осуществляется главным об-
разом коллагеназой. Другие ферменты (эластаза и катепсин) об-
легчают действие коллагеназы, ускоряя распад коллагена. Как по-
казали ультраструктурные и иммуногистохимические исследования,
разрушение коллагена in vivo — локальный процесс, ограниченный
микроокружением клеток.
При ревматоидном артрите в местах эрозий хряща и особенно
на стыке хряща и паннуса иммуногистохимически находят увели-
ченное количество коллагеназы. Коллагеназа обычно сосредоточи-
вается в перицеллюлярных пространствах отдельных клеток или
небольших групп их и не имеет тенденции к диффузному распре-
делению. В разрушении суставного хряща участвуют также гумо-
ральные иммунные реакции. Об этом свидетельствует прежде всего
наличие в его матриксе иммунных комплексов.
Характер поражения кости при артритах связан с особенностями
регуляции функции клеток, образующих и резорбирующих кость.
Регуляция клеточного обмена осуществляется взаимодействием ме-
стных (цитокины, факторы роста, простагландины) и системных
(кальцитонин, паратиреоидный гормон, витамин D) факторов. При
воспалении баланс между резорбцией и образованием кости нару-
шается в сторону резорбции. Местная потеря кости вокруг очага
воспаления рассматривается как следствие клеточных взаимодейст-
вий остеокластов и прилежащих «воспалительных» клеток. Остеок-
ласты, мобильные многоядерные клетки костномозгового происхож-
19*
579
дения, образуются путем слияния моноцитов под влиянием цито-
кинов, простагландинов, витамина D и гормона паращитовидной
железы [Marks S. С., PopoffS. W., 1988]. . •
Резорбция кости с помощью остеокластов представляет собой
уникальный образец разрушения соединительной ткани на ограни-
ченном пространстве с помощью так называемой полувакуоли. По-
следняя представляет собой обращенную к кости активированную
сторону остеокласта с микроворсинками, а также прилежащий ко-
стный матрикс. С помощью электронной микроскопии и микрофиль-
мирования показано, что именно в пределах этой полувакуоли
остеокласты секретируют лизосомальные ферменты, ионы водорода
и протоны. Ионы водорода и протоны создают кислое окружение,
благодаря которому соли кальция растворяются, ферменты фраг-
ментирует и растворяют органические компоненты (коллаген и
протеогликаны) костного матрикса, способствуют их эндоцитозу и
дальнейшему внутриклеточному перевариванию. Благодаря непре-
рывному движению остеокластов ферменты и переваривающий суб-
страт кости смешиваются. Рядом с остеокластами находятся лим-
фоциты и макрофаги. Параллельно деструкции отмечается репара-
ция костной ткани. В очаги резорбированной кости мигрируют
остеобласт , которые формируют новую кость. Новообразованная
кость отличается от предшествующих пластинчатых образцов более
крупными округлой формы остеоцитами и грубыми коллагеновыми
волокнами. Полагают, что остеобласты используют сохранившиеся
предсуществующие коллагеновые волокна для ремодуляции кости.
При "завершении процесса определяется пластинчатая кость с не-
правильными контурами коры, педжетоидными структурами, бес-
порядочным слиянием цементных линий.
Повреждение кости при артритах наиболее выражено в области
костно-хрящевых соединений, где развивается костномозговой пан-
нус (см. рис. 10.40). В субхондральной костной пластинке находят
множественные эрозии, местами полное разрушение ее. Особенно
резко изменения выражены в межфаланговых, метакарпофаланго-
вых, коленных и голеностопных суставах. Между остатками кости
определяется грануляционная и фиброзная ткань с очагами фибри-
ноидного некроза и лимфоплазмоцитарной инфильтрацией. Посто-
янным признаком является периостальное новообразование кости с
формированием остеофитов [Worlock Р. et al., 1988].
10.9. КОЖА
Воспаление в коже вызывают различные как экзогенные, так и
эндогенные повреждающие факторы. К первым относятся биологи-
ческие (вирусы, грибы, животные паразиты), физические (лучевая
энергия, высокая или низкая температура), химические (скипидар,
кротоновое масло и др.) факторы, ко вторым — продукты азотистого
обмена, распада опухолей, эффекторные клетки иммунной системы,
медиаторы, иммунные комплексы и др.
580
Воспалительный очаг в коже может быть небольшим, ограни-
ченным или занимать большие площади, иногда весь кожный покров
(эритродермия). Кожа постоянно вовлекается в процесс и при си-
стемных заболеваниях.
10.9.1. Морфологические виды воспаления
Воспаление в' коже, как и в других тканях, всегда развивается на
территории гистиона — структурно-функциональной единицы сое-
динительной ткани и складывается из последовательно развиваю-
щихся фаз — альтерации, экссудации и пролиферации. Альтера-
тивный компонент может быть представлен фибриноидными изме-
нениями соединительной ткани, как, например, при аллергических
васкулитах, ревматических болезнях; при этом особенно поражаются
сосуды субэпидермальных отделов кожи. Усиливают альтеративные
изменения в очаге воспаления процессы, связанные с образованием
тромба, что наблюдается при васкулитах кожи, протекающих с
некротическим компонентом (аллергический васкулит кожи Руите-
ра, узелковый некротический васкулит Вертера — Дюмлинга).
Преобладание экссудативного компонента при воспалительных
процессах в коже обусловлено резко выраженной реакцией микро-
циркуляторного русла с образованием большого количества экссу-
дата. Характер последнего различный в зависимости от степени
повреждения стенок посткапиллярных венул, а также от интенсив-
ности действия медиаторов.
Серозное воспаление встречается в коже наиболее часто при
остром дерматите, экземе, вирусных поражениях кожи (герпетиче-
ская инфекция). При этом в эпидермисе развивается межклеточный
отек (спонгиоз) с образованием спонгиотических пузырьков и пу-
зырей (рис. 10.41). Спонгиоз может сопровождаться внутриклеточ-
ным отеком, приводящим к ретикулярной дистрофии эпидермиса,
характеризующейся сильным отеком эпидермоцитов с разрывом их
оболочек, в результате чего образуется многокамерный пузырь.
Ретикулярная дистрофия часто сочетается с баллонной, при которой
наблюдается разрушение межклеточных мостиков и клетки свободно
плавают в серозном экссудате. По локализации пузыри подразделяют
на внутри- и субэпидермальные. Внутридермальные в свою очередь
могут быть субкорнеальными и супрабазальными. По патогенети-
ческим критериям различают пузыри, образующиеся в результате
первичной деструкции клеток (вирусные), спонгиоза, и акантоли-
тические пузыри (рис. 10.42), а также пузыри в результате по-
вреждения дермоэпидермальных связей (рис. 10.43). Как считает
К. Bork (1980), интра- и субкорнеальные пузыри наблюдаются при
воздействии бактерий, дерматофитов и УФО-излучения, спонгиоти-
ческие — вызывают многочисленные контакты с аллергенами, ток-
сическими субстанциями, бактериями, грйбами и УФО-излучением,
акантолитические — проявляются в связи с воздействием вирусов,
бактерий, действием высоких температур, а субэпидермальные —
581
Рис. 10.41. Спонгиотический пузырек при острой экземе с деструкцией
клеток эпидермиса, х 75.
Рис. 10.42. Акантолитический надбазальный пузырь при болезни Дарье.х 75-
Рис. 10.43. Внутри- и субэпидермальные пузыри при болезни Дюринга, х 75.
образуются при воздействии лекарственных препаратов, высоких и
низких температур, УФО-излучения, ионизирующего излучения,
вакуума, иприта.
Гнойное воспаление в коже протекает как остро, так и хрони-
чески. Основным элементом при остром гнойном воспалении явля-
ется пустула — полостной элемент, заполненный гранулоцитами и
распадающимися клетками. Располагается она в зависимости от
возбудителя субкорнеально (как при обыкновенном импетиго) либо
в более глубоких отделах эпидермиса, захватывая и сосочковый
слой дермы (эктима). Пустулы, связанные с волосяными фоллику-
лами, наблюдаются при фолликулитах, а связанные с сальными
железами — при обычных угрях. Разновидностью гнойничка может
служить пустула Когоя — многокамерная пустула, локализующаяся
в верхней части эпидермиса; характеризуется наличием сетки из
остатков оболочек погибших эпидермоцитов, заполненной нейтро-
фильными гранулоцитами (рис. 10.44). Эпидермис в состоянии акан-
тоза с явлениями межклеточного отека. Пустула Когоя встречается
при пустулезном псориазе, болезни Рейтера, акродерматите Аллопо,
герпетиформном импетиго, гонорейном кератозе и кандидозе.
К хроническому гнойному воспалению в коже относятся пиодер-
мии — длительно текущие заболевания, обусловленные нарушением
механизма формирования воспалительной реакции организма на
гноеродную инфекцию, что связано с нарушением клеточного им-
мунитета, фагоцитарной и бактерицидной функций нейтрофильных
гранулоцитов [Пауков В. С., Кауфман О. Я., 1983]. А. И. Лесницкий
583
Рис. 10.44. Подроговая спонгиоформная пустула Когоя при субкорнеальном
пустулезе. х 75.
(1980), изучая механизм воспалительной реакции у больных пио-
дермиями, установил, что наиболее выраженные нарушения притока
клеток в очаги антигенного раздражения связаны с ослаблением
реактивности больных и в первую очередь с угнетением клеточного
иммунитета.
Геморрагическое воспаление возникает, кроме сибирской язвы,
наиболее часто при васкулитах кожи, особенно при таких разно-
видностях, как геморрагический васкулит Шенлейна — Геноха,
геморрагический васкулит Мишера и узелковый некротический ва-
скулит Вертера — Дюмлинга. При всех формах васкулита на коже
всегда наблюдаются геморрагические пятна — петехии и экхимозы.
Гистологически эти геморрагические васкулиты характеризуются
поражением мелких сосудов типа фибриноидного некроза, который
часто обнаруживаемся и в окружающей сосуды соединительной тка-
ни. Иногда стенки сосудов полностью некротизированы, периваску-
лярный инфильтрат содержит в основном нейтрофильные грануло-
циты с примесью эозинофилов. Характерен кариорексис нейтро-
фильных гранулоцитов с образованием ядерной «пыли» (лейкокла-
зия). На фоне выраженного отека и фибриноидных изменений кол-
лагеновой субстанции дермы видны обширные кровоизлияния. По-
добные изменения приводят к некротическим изменениям в коже
с образованием язв, покрытых геморрагическими корочками.
Продуктивное (пролиферативное) воспаление, как и в других
тканях, характеризуется преобладанием в очаге воспаления клеточ-
ных элементов как гематогенного, так и гистиогенного происхож-
584
дения. Инфильтраты могут иметь различное строение в зависимости
от характера возбудителя и реактивности организма. Они могут
быть лимфоцитарными, гистиоцитарными, эпителиоидно-клеточны-
ми, но чаще все эти виды клеток присутствуют одновременно (сме-
шанные инфильтраты).
Продуктивное воспаление в коже сопровождается не только про-
лиферацией клеток дермы, но и эпидермиса, что может приводить
к образованию папилломатозных образований или полипов. Послед-
ние встречаются при многих дерматозах, например при веррукозной
форме красного плоского лишая, псориазиформном сифилисе, а
также при лихенификации, которая развивается на почве хрониче-
ского воспаления. Последняя характеризуется утолщением кожи в
результате акантоза и гиперкератоза, а также фиброза в дерме, где
располагаются небольшие воспалительные инфильтраты. При имп-
регнации серебром среди клеток инфильтрата можно видеть значи-
тельное количество шванновских клеток, особенно при нейродер-
мите.
Одной из форм проявления продуктивного воспаления в коже
является образование вегетаций, что наблюдается при таких забо-
леваниях, как болезнь Дарье, бородавчатые формы туберкулеза,
вегетирующая форма пузйрчатки. Вегетации представляют собой
разрастание эпидермиса и сосочков дермы в папулах, характеризу-
ющееся акантозом с удлинением эпидермальных выростов, глубоко
погружающихся в дерму. При болезни Дарье и вегетирующей пу-
зырчатке в акантотичном эпидермисе, кроме того, имеются пузыри,
в просвете которых можно видеть акантолитические клетки и эози-
нофилы. Удлиненные сосочки дермы могут быть при этом инфиль-
трированы воспалительными элементами или фиброзно изменены.
Подобные виды продуктивного воспаления, как правило, имеют
хроническое течение и могут длиться неопределенно долго, пока не
исчезнет возбудитель или раздражающий агент. Они чаще всего
связаны с наличием в тканях ГЗТ к белковым компонентам (фиб-
риногену) или инфекционным агентам (например, к туберкулезной
палочке, возбудителю бластомикоза).
Воспалительный процесс в коже завершается, особенно при за-
мещении глубоких ее дефектов, образованием рубцов. Последние
могут быть поверхностными атрофическими и глубокими втянутыми,
спаянными с подлежащей тканью, или, напротив, выступающими
гипертрофическими.
10.9.2. Воспалительные заболевания кожи
В патогенезе заболеваний кожи широко представлена аллергия.
Аллергодерматозы очень трудно классифицировать, так как в ал-
лергических реакциях принимают участие все структуры кожи, что
иногда не дает возможности идентифицировать различные формы
заболевания. Э. Райка (1966) классифицирует все аллергодерматозы
по видам гиперчувствительности немедленного или замедленного
585
типов, хотя это требует уточнения, так как при большинстве де-
рматозов имеется смешанный тип реакции.
Характерным примером ГНТ является крапивница, представля-
ющая собой анафилактическую реакцию кожи на различные био-
логически активные вещества эндогенного или экзогенного проис-
хождения. Различают острую и хроническую крапивницу. Острая
крапивница характеризуется резко выраженным отеком дермы, осо-
бенно в ее верхней трети, разрыхлением пучков коллагеновых во-
локон, расширением кровеносных сосудов и небольшой периваску-
лярной инфильтрацией, главным образом лимфоцитами. Часто как
внутри сосудов, так и в окружающей ткани обнаруживаются эози-
нофильные гранулоциты. В эпидермисе отмечаются спонгиоз и внут-
риклеточный отек различной степени. Острый отек кожи развивается
при этом в результате ангиогенных воздействий на тканевые базо-
филы, сенсибилизированные специфическими IgE-антигенами. При
некоторых формах крапивницы имеет место прямое воздействие
различных антигенов (атибиотики, сульфаниламиды и др.).
D. Schreiber и соавт. (1986) выделяют среди аллергодерматозов
аллерготоксическую сыпь. Она, как правило, симметричная, по-
является на коже конечностей, лица, туловища в ответ на воз-
действие различных аллергенов (лекарственных препаратов, воз-
будителей инфекций и др.); может быть локализованной и гене-
рализованной. Воспалительный процесс при этом развивается в
области сосудистого сплетения, где наблюдается расширение со-
судов, часто с явлениями стаза, сопровождающееся повышением
проницаемости и резким отеком сосочков дермы. Вокруг сосудов
располагаются инфильтраты смешанного характера. При более глу-
боких поражениях стенок сосудов в дерме обнаруживаются кро-
воизлияния, отмечается образование пузырей и некроз эпидермиса.
Если воспалительный процесс захватывает более глубокие отделы
дермы на границе с подкожной клетчаткой, то D. Schreiber и
соавт. рассматривают его как кожно-васкулярную интолерантную
реакцию. Примером аллерготоксической сыпи может служить ал-
лергический поверхностный васкулит кожи Руитера (лейкокла-
стический васкулит), представляющий собой системную анафи-
лактическую пурпуру, как и васкулит Шенлейна — Геноха.
Гистологически в области локализации иммунных комплексов
наблюдаются фибриноидный некроз стенок сосудов, инфильтра-
ция их распадающимися нейтрофильными гранулоцитами с об-
разованием ядерной «пыли». Иммунные комплексы при элек-
тронно-микроскопическом исследовании выглядят как электрон-
но-плотные депозиты в местах поражения стенок сосудов, и
иммунохимически в них определяются иммуноглобулины и ком-
племент [Gower R.G., 1977].
К токсико-аллергическим заболеваниям относится и многофор-
мная экссудативная эритема, представляющая собой полиэтиоло-
гический синдром гиперсенсибилизации, развивающийся большей
частью в результате действия лекарственных препаратов и возбу-
дителей инфекции. Различают 3 типа поражения: дермальный, сме-
586
шанный дермоэпидермальный и эпидермальный. Первый тип ха-
рактеризуется наличием периваскулярных мононуклеарных инфиль-
тратов с примесью нейтрофильных и эозинофильных гранулоцитов,
резким отеком тканей вплоть до образования субэпидермальных
пузырей. Дермоэпидермальный тип протекает с наличием, кроме
субэпидермальных инфильтратов смешанного характера, некробио-
тических изменений эпидермоцитов и гидропической дистрофии ба-
зальных клеток. При эпидермальном типе в дерме отмечается лишь
небольшая инфильтрация вокруг сосудов, а в эпидермисе уже в
ранних стадиях наблюдаются некробиотические изменения эпидер-
моцитов, в результате чего пораженные клетки сливаются в сплош-
ную массу.
К тяжелым токсико-аллергическим заболеваниям относится ос-
трый токсический некролиз, характеризующийся появлением на
коже эритематозных и буллезных элементов, быстро вскрывающихся
и распространяющихся по периферии с образованием обширных
ожогоподобных, резко болезненных поверхностей. При гистологи-
ческом исследовании обнаруживают некробиотические изменения в
эпидермисе типа некролиза, сопровождающегося баллонной дистро-
фией клеток. В области дефектов верхние слои эпидермиса некро-
тизированы.
К локализованным формам аллерготоксической сыпи относится
фиксированная эритема, развивающаяся после приема некоторых
лекарственных препаратов в одних и тех же местах в виде одиночных
или множественных пятен, иногда с образованием пузырей в центре.
Гистологические изменения при этом виде эритемы напоминают
таковые при многоформной эритеме, а при распространении про-
цесса — синдром Лайелла.
К лекарственной аллергической сыпи относятся также бромодер-
ма и йододерма. Бромистые угри наиболее часто встречаются на
лице, спине и конечностях. Иногда возникает туберозная вегети-
рующая бромодерма, при которой резко выражены акантоз, гипер-
кератоз, папилломатоз, нередко с явлениями псевдоэпителиоматоз-
ной гиперплазии и наличием внутриэпидермальных абсцессов.
В дерме обычно наблюдается диффузная инфильтрация смешанного
характера, иногда с образованием абсцессов.
К аллергическому воспалению кожи типа ГЗТ относятся экзе-
матозная реакция и группа экзем. Экзематозная реакция является
одной из наиболее часто встречающихся среди различных дермато-
зов. Это интолерантная реакция на различные раздражители как
экзогенного, так и эндогенного характера, вызывающие повреждение
эпидермиса [Schreiber D., 1986]. Локализованные очажки повреж-
денного эпидермиса приводят к локальному увеличению осмотиче-
ского давления, сопровождающемуся усилением движения жидкости
из дермы в эпидермис, что ведет к образованию в нем крупных
пузырей (см. рис. 10.41), а при движении ее к поверхности — к
образованию «колодцев» (рис. 10.45). В основе экзематозной реакции
лежат иммунные нарушения, аналогичные таковым при аллергиче-
ском контактном дерматите. Большей частью эта реакция является
587
Рис. 10.45. Акантоз, спонгиоз с образованием в верхних отделах «колодцев»
при острой экземе, х 250.
следствием реакции антиген — антитело. Морфологическая картина
в коже при экзематозной реакции, независимо от ее разновидности,
боле!Ь или менее однотипна, видоизменяясь лишь в зависимости от
остроты процесса.
При острой экзематозной реакции динамика процесса харак-
теризуется несколькими следующими друг за другом клинико-мор-
фологическими фазами: 1) эритематозной, проявляющейся покрас-
нением кожи, а гистологически характеризующейся отеком верхней
половины дермы, ограниченными лимфоцитарными инфильтратами
и расширением капилляров сосочков; 2) папулезной, наиболее ти-
пичный для этой реакции, характеризующейся появленйем спонги-
оза и акантоза, отечными изменениями как эпидермиса, так и
дермы с образованием очажков паракератоза и небольших пузырь-
ков; 3) везикулезной, сопровождающейся появлением пузырьков в
эпидермисе, заполненных серозным содержимым; 4) пустулезной,
развивающейся при инфицировании, что приводит к превращению
пузырьков в пустулы. В эпидермисе при этом имеется выраженный
экзоцитоз, в дерме в периваскулярных инфильтратах появляется
значительное количество эозинофильных гранулоцитов. Заканчива-
ется этот процесс образованием корок, что связано с высыханием
серозного экссудата на поверхности эпидермиса. В дальнейшем корки
отторгаются с последующей эпителизацией очагов поражения.
Электронно-микроскопически в остром периоде этой реакции в
коже выявляется внутриклеточный отек с образованием в цито-
плазме эпидермоцитов вакуолей различных размеров, располагаю-
щихся преимущественно вокруг ядра [Цветкова Г. М. и др., 1966;
589
Jones R., 1983 ]. Последние также находятся в различных стадиях
«отечной» дистрофии. Тонофиламенты гомогенные; митохондрии,
эндоплазматическая сеть и пластинчатый аппарат не определяются.
Глыбки кератогиалина в зернистом слое не видны, что свидетель-
ствует о резкой гипоксии эпидермальных клеток. Дермоэпидермаль-
ная зона характеризуется в области плотной пластинки разрыхле-
нием с появлением отверстий, через которые из дермы в эпидермис
проникают клетки экссудата. В сосудах сосочкового слоя дермы
отмечается увеличение объема эндотелиоцитов, наблюдается экс-
травазация эритроцитов.
Хроническая экзематозная реакция может развиваться под вли-
янием постоянного воздействия раздражителя в течение длительного
времени. В дерме при этом отечность выражена меньше, инфиль-
траты большей частью периваскулярного характера, состоят, как
правило, из гистиоцитов, в эпидермисе же отмечаются акантоз и
массивный гиперкератоз, иногда — паракератоз. Электронно-мик-
роскопически в эпидермоцитах определяется большое количество
рибосом, много крупных митохондрий, хотя в некоторых из них
имеются дистрофические изменения.
R. Jones (1983), изучая различные фазы экзематозной реакции,
показал, что ранние изменения всегда начинаются с сосудистого
аппарата дермы, что сопровождается резким отеком сосочков дермы,
из которых отечная жидкость элиминируется в эпидермис через
дермоэпидермальную мембрану. Затем появляется межклеточный
отек эпидермиса и наступает вакуолизация эпидермоцитов, приво-
дящие к образованию пузырьков. В настоящее время в этом суще-
ственную роль отводят гуморальным факторам. Так, В. А. Лосева
(1981), проводя количественное изучение иммунокомпетентных кле-
ток периферической крови (Т- и В-лимфоцитов), показала, что у
больных различными формами экземы содержание Т-лимфоцитов
несколько увеличено. При изучении инфильтрата оказалось, что
его основу составляют иммунные лимфоциты и дегранулированные
базофилы, среди которых имеются макрофаги, что указывает на
реакцию ГЗТ.
Гранулематозное («специфическое») воспаление отражает особое
состояние иммунитета, характеризующееся несостоятельностью мо-
нонуклеарных фагоцитов по отношению к возбудителю, который
персистирует в пораженных тканях. О. Reyes-Flores (1986) приводит
классификацию гранулематозного воспаления в коже в зависимости
от иммунного статуса организма. Все виды гранулематозного вос-
паления он делит на иммунокомпетентное, гранулематозное воспа-
ление с неустойчивым иммунитетом и иммунодефицитное. К им-
мунокомпетентным гранулемам автор относит туберкулез, туберку-
лоидную форму лепры и сифилис, к инфекционным гранулемам с
неустойчивым иммунитетом — пограничную форму лепры, туляре-
мию, фелиноз (болезнь кошачьих царапин), венерическую лимфо-
гранулему и риносклерому, к иммунодефицитным — лепроматозную
форму лепры. Таким же образом О. Reyes-Flores (1986) подразделяет
гранулематозное воспаление при грибах, относя к иммунокомпетен
589
тным гранулемам хромомикоз, с неустойчивым иммунитетом —
кандидоз, североамериканский бластомикоз,' кокцидиоидоз, гисто-
плазмоз, актиномикоз, мицетому и к иммунодефицитным — сис-
темный паракокцидиоидомикоз. К паразитарным иммунокомпетен-
тным гранулемам он относит американский мукокутанный лейш-
маниоз, к иммунодефицитным — диффузный кожный лейшманиоз.
Туберкулез кожи возникает гематогенно, клинически проявляется
сыпью, которая в зависимости от степени казеозного некроза варь-
ирует от пятен до язвенных поражений. Гематогенные поражения
кожи при туберкулезе внутренних органов проявляются в виде
индуративной эритемы Базена, милиарного диссеминированного ту-
беркулеза кожи, «колликвативного» туберкулеза и др. При таких
формах, как туберкулезная волчанка, бородавчатый туберкулез ко-
жи, некроз почти не выявляется. При милиарных формах туберку-
леза кожи (петехии, пятна, папулы) специфической реакции в очаге
воспаления не отмечается.
При туберкулезе кожи (как и других органов) наблюдаются
признаки различных видов иммунного ответа, включая циркулиру-
ющие антитела, ГЗТ-гранулематозную чувствительность. Туберку-
лезная гранулема, чаще наблюдаемая при туберкулезной волчанке,
состоит из эпителиоидных клеток, небольшого количества клеток
Пирогова — Лангханса, окруженных валом из Т-лимфоцитов. Стро-
му гранулемы составляют аргирофильные волокна, а в центре ее,
как правило, имеется казеозный некроз.
Сифилис относится к иммунокомпетентному гранулематозному
воспалению с образованием гранулем в позднем вторичном и тре-
тичном периодах. В развитии воспалительного процесса при сифи-
лисе наблюдаются тканевые реакции следующих видов: продуктив-
но-инфильтративная, когда инфильтрат состоит из лимфоидных,
плазматических и эпителиоидных клеток с наличием продуктивного
васкулита (твердый шанкр); продуктивно-некротическая (бугорок)
и экссудативно-некротическая, наблюдающаяся при врожденном си-
филисе. В очаге воспаления при сифилисе в отличие от туберкулеза
больше вовлекаются в процесс кровеносные сосуды в виде артериитов
и флебитов. При позднем вторичном сифилисе в дерме наблюдается
диффузный воспалительный инфильтрат преимущественно из лим-
фоцитов с тенденцией к формированию гранулемы с гигантскими
клетками типа Пирогова — Лангханса. В третьем (гуммозном)
периоде в коже развиваются характерные для этого заболевания
гранулемы, состоящие в центре из очага казеозного некроза, окру-
женного лимфоцитами, плазмоцитами и эпителиоидными клетками
с примесью гигантских клеток типа Пирогова — Лангханса.
Лепра, как и туберкулез, характеризуется комплексом различных
клинико-морфологических проявлений, связанных с нарушением на
различных уровнях клеточного и гуморального иммунитетов. Раз-
личные формы лепры характеризуются различной резистентностью
организма по отношению к возбудителю. Так, туберкулоидная форма
лепры, для которой типичны туберкулоидного типа гранулемы, ха-
рактеризуется высокой резистентностью организма по отношению
590
к возбудителю, лепроматозная форма — низкой, а промежуточная
форма имеет признаки как первой, так и второй форм.
Туберкулоидная форма лепры характеризуется образованием гра-
нулем, которые формируются из высокодифференцированных мо-
нонуклеаров (эпителиоидных клеток) в момент максимума гипер-
сенсибилизации, располагающихся в виде плотных гранулем, окру-
женных валом из лимфоцитов, которые могут находиться и внутри
гранулемы. Последние являются Т-хелперами (ОКТ4), а окружа-
ющие очаг — Т-супрессорами (ОКТ8) [Joihman-Jahr М., 1982].
Гранулематозная реакция может захватывать весь эпидермис, а
также различные структуры дермы — мышцы, поднимающие волос,
потовые железы и нервы. При окраске по Цилю — Нильсену
микобактерии не выявляются либо в небольшом количестве нахо-
дятся в нервах и мышцах кожи. При неустойчивом иммунитете
развивается пограничная форма лепры, которая характеризуется
макрофагальной реакцией дермы, но .местами можно наблюдать и
эпителиоидные клетки с различной степенью дифференцировки.
Гигантские клетки, как правило, отсутствуют, выявляется умеренное
количество микобактерий лепры.
При иммунодефицитных состояниях, как уже было указано,
развивается лепроматозная форма лепры, характеризующаяся на-
личием специфических инфильтратов, состоящих главным образом
из макрофагов, обнаруживающих различную степень липодистро-
фии. Лимфоцитов среди последних немного, их число соответствует
степени развития очага воспаления, большей частью они находятся
в нервах и придатках кожи. В активном периоде лепроматоза мак-
рофаги образуют отдельные очажки, показывающие умеренную ва-
куолизацию, превращающиеся затем в крупные пенистые клетки
(лепрозные клетки), содержащие большое количество микобактерий
в виде глобул ей.
К иммунокомпетентным гранулемам при грибковых поражениях
кожи относят хромомикоз, вызывающийся различными типами хро-
момицет. При кожных формах этого заболевания эпидермис под-
вергается акантозу, иногда с картиной псевдоэпителиоматозной ги-
перплазии. В дерме образуются гранулемы из эпителиоидных клеток,
плазмоцитов, гигантских клеток типа инородных тел, нейтрофиль-
ных гранулоцитов, которые формируют микроабсцессы. В центре
последних могут наблюдаться некробиоз и наличие хромомицет
(рис. 10.46). При подкожных формах хромомикоза имеются нейт-
рофильные абсцессы с гранулематозной реакцией вокруг.
Кандидоз является примером гранулематозного воспаления с не-
устойчивым иммунитетом. Острая поверхностная, а также системная
его формы сопровождаются свежими изменениями кожи, грануле-
матозом с различной интенсивности неспецифической воспалитель-
ной реакцией, с наличием возбудителя в виде спор и ветвящихся
гифов. Хронический кандидоз кожи и слизистых оболочек сопро-
вождается акантозом, папилломатозом, гиперкератозом с везикуля-
цией. В дерме имеются инфильтраты из лимфоидных и плазмати-
ческих клеток, макрофагов, эпителиоидных и гигантских клеток с
591
Рис. 10.46. Хромомикоз: эпителиоидно-клеточные гранулемы с микроабс-
цессами в центре, х 75.
наличием нейтрофильных гранулоцитов. Подобные изменения могут
наблюдаться и в подкожной жировой клетчатке.
К этой же группе относится и североамериканский бластомикоз,
вызываемый Blastomyces dermatitidis. Он является системным забо-
леванием, а изменения в коже, как правило, вторичны и представ-
ляются в виде хронических язвенных и язвенно-вегетирующих оча-
гов поражения. Гистологически при этом наблюдаются акантоз,
папилломатоз, иногда с явлениями псевдоэпителиоматозной гипер-
плазии. В дерме нейтрофильные гранулоциты формируют микроаб-
сцессы, вокруг которых наблюдается макрофагальная реакция с
большим количеством гигантских клеток. Нейтрофильные грануло-
циты мигрируют в эпидермис, нередко образуя здесь микроабсцессы,
в которых локализуется возбудитель.
Кокцидиоидомикоз, вызываемый Coccidioides imitis, характери-
зуется поражением кожи и регионарных лимфатических узлов. Из-
менения кожи напоминают узловатую эритему без образования
гранулем. Грануляционное воспаление имеет место в лимфатических
узлах, бляшках, узлах и подкожных поражениях, где обнаруживают
гранулемы, состоящие из эпителиоидных, гигантских и мононукле-
арных элементов, среди которых отмечаются нейтрофильные гра-
нулоциты с тенденцией к образованию микроабсцессов. Местами
имеются участки некроза. Возбудитель локализуется как внутри,
так и вне клеток.
Среди паразитарных гранулем с иммунокомпетентной реакцией
можно выделить американский мукокутанный лейшманиоз, вызы-
592
ваемый Leishmania braziliensis. Гистологические изменения в коже
различны в зависимости от клинической картины: язва, узел, бляшка
и т. д. В эпидермисе отмечается выраженный акантоз, иногда с
псевдоэпителиоматозной гиперплазией. В дерме в ранних стадиях
может наблюдаться неспецифическая воспалительная реакция, при
которой инфильтраты состоят из недифференцированных макрофа-
гов, лимфоцитов, плазматических клеток с небольшим количеством
эозинофильных и нейтрофильных гранулоцитов. В более старых
очагах макрофаги дифференцируются в эпителиоидные клетки, фор-
мируя гранулемы, окруженные лимфоцитами и плазматическими
клетками. Гранулема может инвазировать и подкожную клетчатку.
Лейшманий находятся внутриклеточно, и их число варьирует в
зависимости от интенсивности процесса. Они часто располагаются
вблизи язв.
Диффузный кожный лейшманиоз относят к иммунодефицитным
гранулемам. Гистологически эта форма лейшманиоза напоминает
лепроматозную форму лепры. Образуется плотный инфильтрат из
вакуолизированных макрофагов, содержащих множество паразитов,
которые видны даже при окраске гематоксилином и эозином. Однако
в отличие от лепры в вакуолизированных клетках жир отсутствует.
В этих очагах среди вакуолизированных макрофагов, содержащих
много паразитов, имеются макрофаги с различной степенью диф-
ференцировки и большое число лимфоидных элементов. Эпидермис
атрофичен благодаря давлению плотным инфильтратом.
ЛИТЕРАТУРА
К главе I
Абрикосов А. И. Основы общей патологической анатомии. — М.—Л.: «Медгиз»,
1933. — 394 с.
Абрикосов А. И. Основы общей патологической анатомии. — 9-е испр. изд. — М.:
Медгиз, 1949. — 499 с.’
Аничков Н. Н. Ретикулоэндотелиальная система и тканевой обмен в свете гистофи
энологических исследований//Арх. пат. — 1937. — Т. 3, вып. 6. — С. 20—30.
Вайль С. С., Шейнина Л. Б. Сравнительная морфология так называемого «физиоло-
гического» и «патологического» воспаления слизистой желудка//Тр. Всерос. конф,
патол. — М.—Л., 1935. — С. 68—81.
(Virchow R.) Вирхов Р. Целлюлярная патология как учение о физиологической и
патологической гистологии. — СПБ, 1871. — 388 с.
(GalenusC.) Гален К. О назначении частей человеческого тела. — М.: Медицина,
1971. — 553 с.
(Hippokrates) Гиппократ. Избранные книги: Пер. с греч. — М.: Биомедгиз, 1936. —
736 с.
Головин Д И. Очерки сравнительной патологии воспаления. — Кишинев: Картя
молдовеняскэ, 1961. — 46 с.
Давыдовский И. В. Воспаление//БМЭ. — 1-е изд. — 1928. — Т. 5. — С. 626—641.
Давыдовский И. В. Н. И. Пирогов как патолог//Труды Пироговских чтений. — М.:
Медицина, 1986. — Т. 1. — С. 34.
' Зильбер Л. А. И. И. Мечников и учение об иммунитете//Научное наследство. —
М.—Л.. 1948. — Т. 1. — С. 482—519.
(CohnheitnJ.) КонгеймЮ. Общая патология. — СПБ, 1878. — 698 с.
(Menkin V.) МенкинВ. Динамика воспаления. — М.: Медгиз, 1948. — 100 с.
Мечников И. И. Страницы воспоминаний. — М.: Изд-во АН СССР, 1946. — 278 с.
Мечников И. Й. Невосприимчивость в инфекционных болезнях. — М.: Медгиз,
1947. — 698 с.
Мечников И. И. Современное состояние вопроса об иммунитете и инфекционных
болезнях//Научное наследство. — М.—Л., 1948. — Т. 1. — С. 520.
Мечников И. И. Речь нобелевского лауреата//Научное наследство. — М.—Л., 1948. —
Т. 1. — С. 536.
Мечников И. И. Этюды оптимизма. — М.: Наука, 1966. — 289 с.
Пальцын А. А. Новые данные о функциональной морфологии полиморфноядерного
лейкоцита//Актуальные вопросы хирургии. — М., 1985. — С. 161—166.
Пигаревский В. Е. Зернистые лейкоциты и их свойства. — М.: Медицина, 1978. —
127 с.
Пигаревский В. Е О секреторной активности полиморфноядерных лейкоцитов//Арх.
патол. — 1982. — Вып. 5. — С. 3—12.
Пирогов П. И. Собрание сочинений. — М.: Медгиз, 1961. — Т. 6. — С. 19.
Подвысои/сий В. В. Основы общей и экспериментальной патологии. — СПБ, 1899. —
741 с.
Рёссле Р. Сущность и проявления острого воспаления//Новое в медицине. — Сборник
№ 6. — Киев, 1925. — С- 78—105.
(Ribbert Н.) Рибберт Г. Учебник общей патологии и общей патологической анатомии:
Пер. с нем. — Киев: Изд. студ.-медиков, 1905. — 521 с.
Саркисов Д С. О влиянии нарушений морфологии и функции головного мозга на
течение и исходы экспериментальной пневмонии. .— Л.: Изд. ВМА им. С. М-
Кирова, 1956. — 70 с.
594
Саркисов Д. С., Пальцын А. А., ЧервонскаяН. В. и др. Влияние сыворотки на внутри-
и внеклеточную бактерицидную способность нейтрофилов//Лрх. патол. —
1988. — Вып. 7. — С. 17—23.
Серов В. В. Воспаление, иммунитет, гиперчувствительность//Арх. патол. — 1983. —
Вып. 11. — С. 3—14.
Серов В. В., ШехтерА. Б. Соединительная ткань. — М.: Медицина, 1981.
Струков А. И. Воспаление//Общая патология человека. Ред. А. И. Струков, В. В.
Серов, Д. С. Саркисов. — М.: Медицина, 1982. — С. 271—328.
(Horst А.) Хорст А. Молекулярные основы патогенеза болезней: Пер. с польск. —
М.: Медицина, 1982. — 454 с.
(Celsus А) Цельс А. О медицине. — М.: Медгиз, 1959. — 499 с.
Цинзерлинг Ё. Д., Цинзерлинг А. В. Патологическая анатомия острых пневмоний раз-
ной этиологии. — Л.: Медгиз, 1963. — 175 с.
Чернух А. М. Воспаление. — М.: Медицина, 1979. — 448 с.
Klebanoff S. J., Clark R. A. The neutrophil: function and clinical disorders. Amsterdam:
North-Holland, 1978. — 810 p.
MbvatH.S. (Мовэт Г. 3.) Воспаление, иммунитет и гиперчувствительность: Пер. с
англ. — М.: Медицина, 1975. —г 560 с.
Schade Н. Physikalische Chemie in dec inneren Medlzin. Dresden—Leipzig: Stelnkopff,
1923. — 605 S.
van FurthR. Identification of mononuclear phagocytes: overviw and dlfinlctionZZMethods
for tudying mononuclear phagocytes. — New York etc., 1981.
Weissmann G., Smolen J. E., Korchak H. M. Release of inflammatory mediators from
stimulated neutrophilsZZN. Engl. J. Med. — 1980. — V. 303. — P. 27—34.
Wright D. G., Gallin J. I. Secretory responses of human neutrophils: Exocytosls of specific
(secontary) granules by human neutrophils during adherence in vitro and during
exudation in vivoZZJ. Immunol. — 1979. — V. 123. — P. 285—294.
Wright D. G. The neutrophil as a secretory organ of host defenseZZAdvances tn host
defence mechanisms. — New York, 1982. — V. 1. — P. 75—110.
К главе 2
Галанкин В. II. Об особенностях взаимодействия системы полиморфноядерного лей-
коцита с бактериальными arewraMnZZApx. патол. — 1984. — Вып. 11. — С.
80—86. •
Галанкин В. Н. О взаимоотношении приспособления и болезни в фило- и онтогене-
seZZApx. пат. 1988. — Вып. 16. — С. 73—76.
Гусейнов А. 3. Динамика заживления гнойных ран под влиянием иммуноре!улиру-
ющих npenapaTOeZZApx. пат. — 1988. — Вып. 9. — С. 28—34.
Даабуль С., Королева С. А., Дорохова Е А., Ермакова Н. С. Особенности течения абс-
цессов в условиях воздействия на систему фагоцитирующих MOHOiiyiuieapoBZZApx.
пат. — 1988. — Вып. 7. — С. 45—51.
Давыдовский И. В., Общая патология человека. — М., 1961. — С. 301—357.
Давыдовский И. В. Проблемы причинности в медицине. — М., 1962.
Ермакова Н. Г. Хемотаксис лейкоцитов периферической крови у больных разлитым
гнойным nepwtOHHTOMZZApx. пат. — 1988. — Вып. 1. — С. 59—64.
Крапчев А. К Сравнительное изучение ультраструктуры энтероцитов и микрососудов
тонкого кишечника у безмикробных и обычных морских свинок при заражении
их Е. co!l-055ZZnaT. физиол. — 1981. — № 3. — С. 35—42.
Мечников И. И. Лекции о сравнительной патологии воспаления. — М.: Медгиз, 1947.
Пауков В. С. Роль нейтрофилов и макрофагов в локализации гноеродной инфек-
wmZZApx. пат. — 1986. — Вып. 3. — С. 30—38.
Пауков В. С., Орехова Е. В. Изменения мышечной оболочки и межмышечного нер-
вного сплетения при экспериментальном перитоните крыс//Арх. пат. — 1990. —
Вып. 9. — С. 56—62.
Пауков В. С., Петров В. И. Острый разлитой перитонит как проблема воспале-
ния/ZApx. пат. — 1983. — Вып. 11.' — С. 66—74.
Саркисов Д. С. Очерки истории общей патологии. — М.: Медицина, 1988.
Серов В. В., ШехтерА. Б. Соединительная ткань. — М.: Медицина, 1981.
595
Струков А. И. Новые аспекты учения о воспалении (иммунное воспаление)//Арх.
пат. — 1981. — Вып. 1. — С. 3—12.
Струков А. И., БегларянА.Г. Коллагеновые болезни. — М.: Медицина, 1963.
Струков А. И., Серов В. В. Патологическая анатомия. — М.: Медицина, 1985.
Чернух А. М. Воспаление. — М.: Медицина, 1979.
ШлоповБ.В., Пауков В. С. Морфология лимфатических узлов при вторичном им-
мунодефиците, обусловленном острым разлитым перитонитом//Арх. пат. —
1991. — Вып. 7. — С. 66—70.
Bekemeier Н., Hirschelmann R. Systemische Modulation der Entziindung//Z. kiin. Med. —
1987. — Bd 42, N 10. — S. 839—846.
Brailsfords., LunecJ., Winyard P., Blake D. R. A possible roie for ferritin during
infiammation//Free Radical Res. Commun. — 1985. — V. 1, N2. — P, 101—109.
Cavagnaro J. Molecular basis for the bidirectional modulation of the neuroendocrine and
the immune systems//J. Immunol. — 1986. — V. 2. (Basel). — P. 303—322.
Chipens G., Vegners R., Levina N., Rosenthal C. Polarins: A novel group of immunological
active peptides//Immunol. Res- — 1986(1987). — V. 5, N 4. — P. 314—327.
Cornaglia-Ferraris P. Sensory neuropeptides (substance P) and 4— 11 SP enhance human
neutrophils chemiluminescence; the role of L-arginine//Int. J. Immunopharmacol. —
1986. — V. 8, N 4. — P. 463—468.
De Blasi A., FratelliM., WieloszM., LipartitiM. Regulation of beta adrenergic receptors
on rat mononuclear leukocytes by stress receptor redistribution and down-regulation
are altered with aging//J. Pharmacol. exp. Ther. — 1987. — V. 240, N 1 . — P.
228—233.
Foreman J. C. Neuropeptides and the pathogenesis of aliergy//Allergy. — 1987. — V.
42, N 1. — P. 1 — 11.
Ganz T. Extracellular release of antimicrobial defensins by human polymorphonuclear
leukocytes/Zlnfect. and Immun. — 1987. — V. 55, N 3. — P. 568—571.
GlibeticM. D., BaumannH. Influence of chronic inflammation of the level of mRNA for
acute-phase reactants in the mouse liver//J. Immunol. — 1986. — V. 137, -N 5. —
P. 1616—1622.
Hartung'H.-P., Wolters К, ToykaK. V. Substance P: binding properties and studies on
cellular responses in guinea pig macrophages//!. Immunol. — 1986. — V. 136,
N 10. — P. 3856—3863.
Payan D. G., McGillis J. P., GoetzlE.J,. Neuroimmunology//Adv. Immunol. (Orlando). —
1986. — V. 39. — P. 299—323.
RuffM.R., WahlS.M., PertC.B. Substance P receptor-mediated chemotaxis of human
monocytesZ/Peptides. — 1985. — V. 6, Suppl. N 2. — P. 107—111.
К главе 3
Адо А. Д. Общая аллергология. — М.: Медицина, 1978. — 463 с.
Беклемишев Н. Д. Иммунопатология и иммунорегуляция (при инфекциях, инвазиях
и аллергиях). — М.: Медицина, 1986. — 256 с.
Герасимов А. М., Фурцева Л. Н. Биохимическая диагностика в травматологии и ор-
топедии. — М.: Медицина, 1986. — 235 с.
Давыдовский И. В. Общая патология человека. — М.: Медицина, 1969. — 610 с.
Демуров Е. А., Игнатова В. А. Метаболические и нейрогормональные механизмы
ишемических повреждений миокарда//Итоги науки и техники. Серия: Физиол-
человека и животных. — М., 1985. — Т. 30.
Епифанов О. И., Терских В. В., Полуновский В. А. Регуляторные механизмы проли-
ферации клеток//Итоги науки и техники. Серия: Общие проблемы физико-хи-
мической 6иологии/М., 1988. — Т. 10.
Киреева Е. Г., Струкова С. М. Молекулярные механизмы инактивации тромбина при-
родными и синтетическими ингибиторами//Успехи совр. биол. — 1987. — Т.
103. — С. 371—389.
Кудряшов Б. А. Молекулярная основа триггерного механизма возбуждения противо-
свертывающей системы в организме//Вестн. Моск, ун-та, сер. биология. —
1986. — № 2. — С. 3—15.
596
Кудряшов Б. А., Струкова С. М. Значение молекулярных особенностей тромбина во
взаимодействии с рецепторными структурами в организме//Успехи совр. биол. —
1984. — Т. 97. — С. 193—209.
Кузик Б. И., Васильев Н. В., Цыденов Н. И. Иммуногенез, гемостаз и неспецифическая
резистентность организма. — М.: Медицина, 1989. — 320 с.
Кульберг А. Я. Регуляция иммунного ответа. — М.: Медицина, 1986. — 224 с.
МенкинВ. (Menkin W.). Динамика воспаления: Пер. с англ. — М.: Медгиз, 1948 —
100 с.
МусилЯ. (MusilJ-). Основы биохимии патологических процессов: Пер. с чешек. —
М.: Медицина, 1965. — 314 с.
Ошват П. (Osvath Р.). Аллергические и иммунологические болезни детского возраста:
Пер. с венгер. — Будапешт. — 1983. — 249 с.
Панченко Л. Ф„ Герасимов А. М., Антоненков В. Д. Роль пероксисом в патологии
клетки. — М.: Медицина, 1981. — 208 с.
Пауков В. С., Петров В. И. Острый перитонит как проблема воспаления//Арх. пат. —
1983. — № 14. — С. 66—74.
Саркисов Д. С. Очерки истории общей патологии. — М.: Медицина, 1988. — 336 с.
Серейская А. А., Струкова С. М. Особенности действия тромбина на высокомолеку-
лярные субстраты//ДАН СССР. — 1985. — Т. 282. — С. 481—484.
Струков А. И. Микроциркуляция и воспаление//Архив патол. — 1983. — № 8. —
С. 73—76.
Струков А. И., Струкова С. М. Тромбоз//Там же. — С. 297—370.
Струков А. И., Пауков В. С., Кауфман О. Я. — В кн.: Общая патология человека.
Руководство/Под ред. А. И. Струкова, В. В. Серова, Д. С. Саркисова. — М.:- Ме-
дицина, 1989. — С. 3—74.
Струков С. М. Структурно-функциональные особенности тромбина//Биохимия жи-
вотных и человека. — 1982. — Киев, Наукова думка. — Вып. 6. — С. 26—37.
Струкова С. М., Серейская А. А., Осадчук Т. А. Структурные основы специфичности
тромбина//Успехи совр. биол. — 1988. — Т. 107. — С. 41—54.
Умаров Б. А., Шапиро Ф. Б., Хлгатян С. В., Струкова С. М. Включение ^-гепари-
на в тучные клетки крысы и выделение его в кровеносные сосуды//Бюлл. экспер.
биол. мед. — 1989. — Т. 58. № 12. — С. 648—651.
Хаитов Р.М., Атауллаханов Р. И. Мембранозависимые медиаторы, регулирующие
метаболизм, пролиферацию и дифференцировку иммуноцитов. Итоги науки и
техники. Серия «Иммунология». — Т. 9. Медиаторы иммунной системы. — М.:
Медицина, 1981.
Хорст A. (Horst А.). Молекулярные основы патогенеза болезней. — М.: Медицина,
1982. — 454 с.
Чернух А. М., Александров П. Н., Алексеев О. В. Микроциркуляция. — М.: Медицина,
1984. — 426 с.
Austen К F. Tissue mast cells in immediate hypersensitivity//Hosp. Pract. — 1982. —
V. 17. — P. 98—108.
Bar-Shavit R., HruskaKA., Kahn A. J., Wilner G. D. Hormone-like activity of human
thrombin//Ann. N. Y. Acad. Sci. USA. — 1986a. — V. 485. — P. 335—348.
Berrettini M., Lammle B., Griffin J. H. Initiation of coagulation and reguiationships between
intrinsic and extrinsic coagulation pathways//Thrombosis and Haemostasis. Eds.
Verstraete M. et al. Leuven Univ. Leuven. — 1987. — P. 473—495.
Bevilacqua M. P., GimbroneM.A. Inducible endothelial functions in inflammation and
coaguIation/ZSeminars Thromb. Hemost. — 1987. — V. 13. — P. 425—433.
Boogaets M. A., Vermylen J., Deckmyn H. et aL Enkephalins modify granulocyte-endothelial
interactions by stimulating prostacyclin production//Thromb. Haemost. — 1983. —
V. 50. — P. 572—575.
BraquetP., TouquiL., ShenT. S. et aL Perspectives in platelet-activating factor re-
search//Pharmacol. Rev. — 1987. — V. 39. — P. 97—145.
Buchanan M. R. Mechanisms of pathogenesis of arterial thrombosis//Seminars Thromb.
Hemost. — 1988. — V. 14. — P. 33-40.
Bussolino F., Camussi G., Breviario F. et aL Endothelial cells and inflammation: the roie
of platelet-activating factor, interleukin L tumor necrosis factor and circulating
neutrophilsZ/Platelet-activating factor and cell immunology/Ed. Braquet P. — Karger
Basel. — 1988. — P. 135—143.
597
Cannistra S. A., VellengaE., GroshekP. et aL Human granulocyte-monocyte colony-
stimulating factor and IL3 stimulate monocyte cytotoxlclty//Biood. — 1988. — V.
71. — P. 672—676.
Carrel R. W., Chrlstey P. B., BoswellD. R. Serplns: antithrombin and other inhibitors of
coagulation and fibrinolysisZ/Thrombosis and Haemostasis. Eds Verstraete M. et al. —
Leuven Univ. Press. Leuven. — 1987. — P. 1—15.
Cosio F. G. Human fibronectin Is an opsonin for IgG antibodycoated sheep erythrocytes//!.
Lab. Clin. Med. — 1984. — V. 103. — P. 613—619.
Del Maestro R. F. et aL Пит. по A. M. Герасимову, Л. H. Фурцевой//Биохимическая
диагностика в травматологии и ортопедии. — М.: Медицина, 1986. — 235 с.
Doolittle R. F. Fibrinogen and fibrin//Ann. Rev. Biochem. — 1984. — V. 53. — P.
191—229.
Duband J. L, Rocher S., Chen W. et aL Cell adhesion and migration of the early vertebrate
embryo//!. Cell. Biol. — 1986. — V. 102. — P. 160—178.
DuffG. M., Durum S. K. The pyrogenic and m trogenic actions of interleukin — 1 are
related//Nature. — 1983. — V. 304. — P. 449—451.
Esmon С. T. The regulation of natural anticoagulant pathways/ZScience. — 1987. — V.
225. — P. 1348—1352.
Eantone J. C., Ward P. A. Role of oxygen-derived free radicals and metabolites in leukicyte-
dependent inflammatory reactions//Am. I. Pathol. — 1982. — V. 104(3). — P.
397—418.
Fox J. E. B. The platelets cytoskeleton/ZThrombosis and Haemostasis. Eds Verstraete M.
et al. — Leuven Univ. Press. Leuven. — 1987. — P. 175—225.
Freeman B. A., CrapoJ.D. Biology of disease: Free radicals and tissue injury//Lab.
Invest. — 1982. — V. 47(5). — P. 412—426.
Garcia J. G. N., Azghani A., Callahan K. S., Johnson A. R. Effect of PAF on leukocyte
endothelial cell interactions/ZThromb Res. — 1988. — V. 51. — P. 83—96.
GirtnaJ. P., Meyer D., Verweij C. L, SixmaJ. J. Structure function relationship of human
von Willebrand factor//Blood. — 1987. — V. 70. — P. 605—611.
GreebergerJ. et aL Цит. по КульбергА. Я. Регуляция иммунного ответа. — М.:
Медицина, 1986. — 224 с.
Groer M.W., Shekleton М. Е. Basic pathophysiology. A conceptual approach/Second
ed. — The С. V. Mosby Company. St. Louis—Toronto—London. — 1983. — 641 p.
Gustafson E. J., Colman R. W. Interaction of PMNs (Polymorphonuclear cells with contact
activation factors//Seminars Thronb. Hemost. — 1987. — V. 13. — P. 95—104.
HayJ.B., MovatH.Z. Hyperemia, Stasis and Increase in vascular Permeability: New
Methods for Their Quntitation//Cutt. Top. in Pathol. — 1979. — V. 68. — P.
33—45.
HeltianuC., Simionescu M., SimionescuN. Histamine receptors of the microvasculsr
endothelium revealed in situ with a histamine-ferritine conjugate: Characteristic high-
affinity binding sites in venules//!. Cell Biol. — 1982. — V. 93. — P. 357—364.
Hurley J. V. Acute Infiammation/2nd ed. — Baltimore; Williams & Wilkins Co. — 1983. —
157 p.
JanoffA., CarpH. Proteases, antiproteasesand oxidants: Pathways of tissue injury during
infiammation/Eds. G. Majno, R. S. CotranZ/Current Topics in inflammation and
Infection. — Baltimore: Williams & Wilkins Co. — 1982. — P. 62—82.
KaneW.R., Davie E W. Blood coagulation factor V and VIII//Blood. — 1988. — V.
71. — P. 539—555.
LeeC. W. et aL Generation and metabolism of Сб-sulfodipeptide leukotrienes in IgE
dependent reactions: Mast cell heterogeneity//In Piper P. (ed): Proc. Symp. on
Leukotrienes and other Lipooxygenase Products. — London: lohn Wiley & Sons.,
1983.
Levin E., MarzeC., Anderson J. et al. Thrombin stimulates tissue plasminogen activator
release from cultured human endothelial cells//!. Ciin. Invest. — 1984. — V. 74. —
P. 1988—1995.
Libby P. The active roles of cells of the blood vessel wail in health and disease//Moiec.
Aspects Med. — 1987. — V. 9. — P. 499—567.
LiuC.-S., Chang J.-Y. The heparin binding site of human antithrombin III//!. Biol.
Chem. — 1987- — V. 262. — P. 17356—17361.
Marcus A. J. Eicosanoids: transcellular metabolism//Inflammation: Basic principles and
clinical correlates/Eds. Gallin !. I. et al. — N. Y.: Raven Press, 1988. — P. 129—137.
598
McGuire E. A., Tolleffsen D. M. Activation of heparin cofactor II by fibroblasts and vascular
smooth muscle ceils//J. Biol. Chem. — 1987. — V. 262. — P. 169—175.
Metcalf D. Granulocyte-macrophage colony-stimulating factors//Control of animal cell
proliferaton. V. II. Eds. A. L. Boynton, H. L. Leffert. — Acad. Press, 1987. — P.
109—131.
Moncada S., Palmer R. M. J., Higgs E. A. The discovery of nitric oxide as the endogenous
nitrovasodilator/ZHypertenslon. — 1988. — V. 12. — P. 365—372.
Moore K. E, EsmonC. T., EsmonN. E Tumor necrosis factor leads to the internalization
and degradation of thrombomodulin from the surface of bovine aortic andothelial cells
in cuiture/ZBlood. — 1989. — V. 73. — P. 159—165.
Movat H. The Inflammatory reaction//Amsterdam—New York—Oxford—Elsevier. —
1985. — 365 p.
Movat H.Z., Cybulsky M. I., Colditzl.G. et al Acute inflammation in gram-negative
Infection: endotoxin, interleukin I, tumor necros factor, and neutrophils/ZFed. Proc. —
1987. — V. 46. — P. 97—104.
Milller-Berghaus G. Septicemia and the vessel wall/ZThrombosis and Haemostasis/Eds.
_ Verstraete M. et al. — Leuven Univ. Press. Leuven. — 1987. — P. 619—671.
Milller-Esterl W. Novel functions of the kininogensZ/Seminars Thromtc Hemost. — 1987. —
V. 13. — P. 115—126.
Nachman R. E, Silverstein R. E, Asch A. S. Thrombospondin: cell biology of an adhesive
glycoprotein//Thrombosis and Haemostasis. Eds. Verstrete M. et al. — Leuven Univ.
Press. — 1987. — P. 81—91.
NawrothP. P., Handley D. A., EsmonG.T. et al Interleikln induces and otheliai cell
procoagulant while suppessia cell-surface anticoagulant activity//Proc. Natl. Acad.
USA. — 1986. — V. 83. .— P. 3460—3464.
NawrothP. P., Stern D. M. et al Endothelial cell procoagulant properties and the host
response/ZSeminars in Thromb. Hemost. — 1987. -=• V. 13. — P. 391—397.
NemersonY., Repke D. Tissue factor accelerates the activation of coagulation factor
VII//Thromb. Res. — 1985. — V. 40. — P. 351—358.
OmingE, Hammarstrom S., SamuelssonB. Leukotriene D: A slow reacting substance
from rat basophilic leukemia cellZ/Proc. nat. Acad. Sci. U.S.A. — 1980. — V.
77(4). — P. 2014—2017.
Palmblad J., Malmsten С. E, Uden A. M. et aL Leukotriene B4 Is a potent and stereospecific
stimulator of neutrophil chemotaxic and adherenceZ/Blood. — 1981. — V. 58(3). —
P. 658—661.
Perez H.-D., Weksler В. B., Goldstein!. M. Generation of Chemotaxic Lipid from
arachidonic acid by exposure to a superoxide generation systemZ/Inflammation. —
1980. — V. 4(3). — P. 313—328.
Pinckard N. The «new» chemical mediators of inflammation//In: G. Majno and R. S. Cotran
(eds). — Current Topics in Inflammation and Infection. — Baltimore: Williams &
Wilkins Co. — 1982. — P. 38—54.
PloplisV.A., Edgington T. S., Fair D. S. et al Initiation of the extrinsic pathway of
coagulation//.!. Biol. Chem. — 1987. — V. 262. — P. 9503—9508.
Pratt C. W., Church F. C., PizzoS. V. In vivo catabolism of heparin cofactor II and its
complex with thrombin//Arch. Biochem. Biophys. — 1988. — V. 262. — P. Ill —117.
RaoE V. M., Rapaport S. I., Bajaj S. P. Activation of Human Factor VII in tne initiation
of tissue factor-dependent coagulation/ZBlood. — 1986. — V. 68. — P. 685—691.
Rocklin R. E. et aL Mediators of immunity: Lymphokines and monokines//Adv. Immunol. —
1980. — V. 29. — P. 56.
Rodgers G. M., Shuman M. A. Congenital thrombotic disorders/ZAmer. J. Hemat. —
1986. — V. 21. — P. 419—430.
Rosenberg R. D., Bauer K. A. Thrombosis in inherited deficiences of antithrombin protein
C and protein S//Hum. Pathol. — 1987. — V. 18. — P. 253—262.
Rosing J., ZwaaalR. F. A., TansG. Formation of meizothrombin as intermediate in factor
Xa-catalyzed prothrombin activation//!. Biol. Chem. — 1986. — V. 271. — P.
4224—4230.
SanbergA. E Complement/In: !. Oppenhein et al. (eds.)//Cellular Functions In Immunity
and Inflammation. — Amsterdam. — Elsevier/North-Holland. — 1981. — P. 373—395.
Stern D., NawrothP., Handley D., KisielW. An andothelian al cell-dependent pathway
of coagulation//Proc. nat. Acad. Sci. USA. — 1985. — V. 82. — P. 2523—2527.
599
StiefT. W., Aab A., HeimburgerN. et al Oxidative Inactivation of purified human
antiplasmin, AI III and CI-inhibitor//Thromb. Res. — 1.988. — V. 49. — P. 581—589.
Straight D. L., YakoiL., MckeeP.. ShydermanR. Binding of Macroglobulin-thrombin
compleves and methylamine treated macroglobulin to human blood mono-
cytes//Biochem. — 1988. — V. 27. — P. 2885—2890.
Strickland D. K, Kessler С. M. Biochemical and functional properties of pC and pS//Clin.
Chem. Acta. — 1987. — V. 170. — P. 1—24.
Toy J. I. The rewiew interferons//Clln. exp. Immunol. — 1983. — V. 54. — P. 1—13.
TracyP. B., Mann К G. et aL A model for assembly of coagulation factor complexes on
cell surfaces: prothrombin activation on pletelets/ZBlochemistry of platelets/Eds. Phillips
D. R. et ai. — Acad. Press. — 1986. — P. 295—318.
Tuszynski G. P., Rothman V., MurphyaA. et aL Thrombospondin promotes cell-substratum
adhesion//Science. — 1987. — V. 236. — P. 1570—1573.
Van IwaardenF., BoumaB.N. Role of high moiecular weight kininogen in contact
activation//Semlnars Thromb. Hemost. — 1987. — V. 13. — P. 15—24.
Yamada К M., Akiyama S. K, Hasegawa T. et aL Resent advances research on Fibronectin
and other cell adgesive proteins//!. Cell Blochem. — 1985. — V. 28. — P. 79—97.
Weiss W., Drazen J. M., Coles N. Bronchoconstrictor effects of Leukotrience C In human
subjects//Science. — 1982. — V. 216. — P. 196—198.
Wachtfogel Y., ZervoP., Colman R. W.//Thromb. Res. — 1986. — Suppl. VI. — P. 56.
Zimmerman G. A., Whatley R. E., McIntyre T. M., Prescott S. M. Production of platelet
activating factor, a biologically active lipid, by vascular endothelial ceils//Am. Rev.
Respir. Dis. — 1987. — V. 136. — P. 204—207.
К главе 4
Беклемишев H. Д. Иммунология и иммунорегуляция. — М.: Медицина, 1986. —
256 с.
БоброЛ. П. Фибробласты и их значение в тканевых 0еакциях//Арх. пат. — 1990. —
Вып. 12.
Вылков И. Г. (Вълков Ив.) Патология лимфатических узлов: Пер. с болг. — София:
Медицина и физкультура, 1980.
Гаврильчак А. В. Ультраструктурная характеристика перитонеальных макрофагов,
стимулированных коллагепом//Соедипительная ткань в норме и патологии. —
Новосибирск, 1980. — Т. 1. — С. 30—32.
Даабулъ С., Королева С. А., Дорохова Е. И. и др. Особенности течения абсцессов в
условиях воздействия на систему фагоцитирующих мононуклеаров//Арх. пат. —
1988. — № 7. — С. 45—48.
КэйА. (КауАВ). Роль эозинофилов в физиологических и патологических процес-
сах//Последние достижения в клинической иммунологии: Пер. с англ. — М.,
1983. — С. 159—200.
Линднер Д. П., Коган Э.М. Регуляторы тканевого гомеостаза и их место в ряду
биологических регуляторов//Арх. пат. — 1976. — № 8. — С. 3—14.
Маянский А. Н., Маянский Д. Н. Очерки о нейтрофиле и макрофаге. — Новосибирск:
Наука, 1983. — 255 с.
Маянский Д. Н. Клетки Купфера и система мононуклеарных фагоцитов. — Новоси-
бирск: Паука, 1981. — 168 с.
Пальцын А. А., Бадикова А. К, Червонская Н. В. и др. Радиоавтографическое выяв-
ление интрацеллюлярного и экстрацеллюлярного бактерицидного действия ней-
трофилов//Бюлл. экспер. биол. — 1988. — № 11. — С. 621—623.
Пальцын А. А., Червонская Н. В., Бадикова А. К, УчанеишвилиЭ. К. Электронно-ра-
диоавтографическое выявление интра- и экстрацеллюлярного бактерицидного
действия полиморфноядерных лейкоцитов//Бюлл. экспер. биол. — 1987. —
№ 11. — С. 637—638.
Паркер Ч. В. (Parker Ch. W.). Медиаторы: высвобождение и функции//Иммуноло-
гия. — М.: Мир, 1989. — Т. 3. — С. 185—206.
Пауков В. С. Роль нейтрофилов и макрофагов в локализации гноеродной инфек-
ции//Арх. пат. — 1986. — № 3. — С. 30—38.
ПерсинаИ. С. Клетка Лангерганса — структура, функция, роль в патологии//Арх.
пат. — 1985. — № 2. — С. 86—93.
600
Петров Р. В. Иммунология и иммуногенетука. — М.: Медицина, 1976.
Петров Р. В., Хаитов Р. М., МанькоВ.М., Михайлова А. А. Контроль и регуляция
иммунного ответа. — Л.: Медицина, 1981.
Пигаревский В. Е. Зернистые лейкоциты и их свойства. — М.: Медицина, 1978. —
302 с.
ПолУ. (PaulE.). Иммунология: Пер. с англ. — М.: Мир, 1987. — Т. 1, 2.
Саркисов Д. С., Пальцын А. А., Втюрин Б. В. Электронно-микроскопическая радио-
автография клетки. — М.: Медицина, 1980.
Саркисов Д С., Пальцын А. А., Колокольчикова Е. Г. и др. Электронно-радиоавтогра-
фическое изучение инфицированной раны человека//Арх. пат. — 1984а. —
№ 9. — С. 16—24.
Саркисов Д. С., Пальцын А. А., Колокольчикова Е. Г. и др. Синтез РНК в полимор-
фноядерных лейкоцитах гнойной раны//Бюлл. экспер. биол. — 19846. —
№ 10. — С. 499—502.
Саркисов Д С., Пальцын А. А., КолкерИ. И. и др. Синтез РНК при активации ней-
трофила//Арх. пат. — 1986. — № 12. — С. 6—13.
Сидоренко С. П., ГлузманДФ., Уманский Ю. А. Поверхностный фенотип и цито-
'химические особенности Т-лимфоцитов в норме и при злокачественных лим-
фопролиферативных заболеваниях//Иммунология. — 1982. — № 1. — С. 49—53.
Смирнов А. В. Специфические эффекты и возможные механизмы действия экзоген-
ных РНК//Успехи совр. биол. — 1988. — Т. 106, № 1(4). — С. 20—36.
Струков А. И., Пауков В. С., Кауфман О. Я. Воспаление//Общая патология челове-
ка. — М.: Медицина, 1990. — С. 3—73.
Тернер-Уорвик М. (Turner-Warwick М.) Иммунология легких: Пер. с англ. — М.:
Медицина, 1982. — 336 с.
Тищенко Л. М., Гусева С. А. Механизмы нарушения фагоцитарной функции нейтро-
филов при остром миелобластном лейкозе//Гематол. и трансфузиол. — 1986. —
№ 1. — С. 16—19.
Учанешивили Э. К Особенности синтеза РНК и белка в сегментоядерных нейтро-
фильных гранулоцитах раны//Бюлл. экспер. биол. — 1987. — № 2. — С.
202—205.
ФрейдлинИ.С. Система мононуклеарных фагоцитов. — М.: Медицина, 1984. —
272 с.
Фриденштейн А. Я., Лурия Е. А. Клеточные основы кроветворного микроокруже-
ния. — М.: Медицина, 1979. — 216 с.
Фриденштейн А. Я., МанькоВ.М., Колобов А. В., Перцев Н. В. Стромальная и Т-
клеточная регуляция кроветворных стволовых клеток//Иммунология. — 1985. —
№ 2. — С. 91—93.
Чередеев А. Н., Ковальчук Л. В. Итоги науки и техники//Иммунология/Под ред.
Р. В. Петрова. — М.: ВИНИТИ, 1989. — Т. 19.
Шахламов В. А., Гайдар Ю. А. Иммуноморфология групповых лимфатических фол-
ликулов//Арх. патол. анат. — 1984. — Т. 87. — Вып. 12. — С. 87—97.
Шехтер А. Б., Берченко Г. Н. Грануляционная ткань: воспаление и регенера-
ция//Арх. пат. — 1984. — Вып. 2. — С. 20—28.
Шехтер А. Б., Дворникова О. Г., Гаврильчак А. В. Сравнительная характеристика
макрофагов грануляционной ткани, перитонеальных и легочных макрофагов
(фагоцитарные и секреторные клетки)//Изучение репаративных процессов и
методов их коррекции. — М.: I ММИ им. И. М. Сеченова, 1985. — С. 31—35.
Шехтер А. Б. Репаративная регенерация и дисрегенерация (роль межклеточных
взаимодействий)//Современные проблемы регенерации. — Йошкар-Ола, 1987. —
С. 48—63.
Шехтер А. Б., Гаврильчак А. В., Дворникова О. Г. Структурно-функциональная ге-
терогенность макрофагов и их роль в патологических процессах//Морфологиче-
ские основы изучения и преподавания морфогенеза тканей и органов в адаптивных
процессах. — Иркутск, 1987. — С. 184—186.
Шехтер А. Б., Дворникова О. Г., Гаврильчак А. В. Ультраструктура секреторных и
фагоцитарных макрофагов при воспалении, регенерации и склерозе//Ультра-
структурные основы патологии органов и тканей. — Тбилиси, 1989. — С.
292—294.
Шехтер А. Б. Склеротические процессы//Общая патология человека. — М.: Меди-
цина, 1990. — Т. 2. — С. 124—150.
601
Adams D. О. The biology of the granulomas//Pathology of gr,ranulomas/Ed. by H. L.
loachim. — New York, 1983. — P. 1 — 19.
Adams D. O., HamiltonT. A. Phagocitlc Ceils: Cytotoxic: Activities of Macro-
phages//Inflammation: Basic Principles and clinical correlatees/Eds. by J. I. Gaiiin et
al. — New York, 1988. — P. 471—492.
Ackermans S. J., Kephart G., Habermann T. et aL Localization of f eosinophil granule major
basic protein in human basophiis//J. exp. Med. — 1983. — V. 158, N 3. — P.
946—961.
Ackerman S. J., LoegeringD. A., VelgeP. et al. Distinctive cationnic proteins of the human
eosinophil granule major basic protein, eosinophii cationic । protein, and eosinophil-
derived neurotoxin//.). Immunoi. — 1983. — V. 131, N 6. — P. 2977—2982.
Amenta P. S., Gay S., Vaheri A. The extracellular matrix is a integgrated unit: uitrastructural
localization of collagen types, fibronectin and laminin//Coii. Relat. Res. — 1986. —
V. 6, N2. — P. 125—152.
Anderson R, JooneG. Inhibition of polymorphonuclear leukocyte imotiiity by benoxaprafen
reiated to activation of cellular oxidative metaboiism//Int. J. Immunopharmac. —
1984. — V. 6, N 4. — P. 269—274.
Andrews P., Babior B. Phosphorylation of cytosoiic proteins by resBting and activated human
neutrophils//Blood. — 1984. — V. 64, N 4. — P. 883—8900.
AustynJ. M. Migration patterns of dendritic ieukocytes//Res. Inmmunoi. — 1989. — V.
140, N 9. — P. 898—902.
Assem E. S„ Azizan A. N., Cowie A. G. Kidney mast ceiis, IgE andd release of inflammatory
mediators capoble of altering renal haemodynamics//Arch. Alieergy a. Appi. Immunoi. —
1987. — V. 84, N 2. — P. 212—126.
Beeken W. L, Northwood I., Beliveau J. et al. Eosinophiis of huiiman colonic mucose: C3b
and Fc receptor expression and phagocytic capabiiities//Clin. Irlmmunol. Immunopath. —
1987. — V. 43, -N 3. — P. 289—300.
BenvenisteJ., PretolaniM. PAF-acether (piatelet-activatingg factor): its role in
inflammation//Adv. Inflam. Res. — 1986. — V. 10. — P. 77—19.
Besedovsky H., Rey A., Sorkin E. Immunoregulation by neeuroendocrine mecha-
nism//Neuroimmunology/Ed. by Beham, F. Spreafico — N.-.-Y.: Raven Press, 1984.
— V. J2. — P. 445—450.
BienenstockJ., OtsukaH., DolovichJ. et al. Growth and differentiation of mast ceils and
basophils//Progr. Immunoi. VI: 6th Int. Congr. Immunoi., 11986. — Orlando e. a.,
1986. — P. 851—860.
Braathen L. R., Bjercke S., Thorsby E. The antigen-presentinng function of human
Langerhans ceils//Immunobioiogy. — 1984. — V. 168, N 3—-5. — P. 30i—312.
Buys]., WeverR., RuitenbergE. Trichiella spiralis in vitro. M4yeloperoxidase in more
efficient than eosinophii peroxidase in the vitro Keliing of newbiborn larvae of Trichineiia
spiralis//Immunoiogy. — 1984. — V. 51, N 3. — P. 601—6607.
Capron M., Nogueira-QueirozJ., Papin J. et al. Interactions bdetween eosinophils and
antibodies: in vivo protective role against rat schistosomiasis//C£eii immunoi. — 1984. —
V. 83, N 1. — P. 60—72.
Carr J. (КаррЯ). Макрофаги. — M.: Медицина, 1978. — 1877 с.
CastorC. W. Regulation of connectiv tissue metabolism//Artritis annd aliied conditions/Eds.
D. Melarty et al. — Filadelphia: Lea a. Febinger, 1989. — - P. 256—272.
Chakravarty N., Nielsen E. Regeneration of mast cells after hisisuraine secretion//Adv.
Histamine Res. Proc. Int. Histamine Symp. Okayama, 26—277 July, 1981. — Oxford
e. a., 1982. — P. 47—56.
Chaturvedi U. C., Rizvi N., Mathur A. Antigen presentation//Cunrr. Sci. — i987. — V.
56, N 12. — P. 561—568.
Choi К L, ClamanG.N. Mast ceils, fibroblasts and fibrosis//Imaimun. Res. — i987- —
V. 6, N 3. — P. 145—152.
Church M. K, Lowman M. A., ReesP. H. et aL Plenary lecture, MMast ceiis, neuropeptides
and inflammation//Agents and Actions. —•. 1989. — V. 27, bN 1. — P. 8—16.
Cohen S. Eosinophils in ceii-mediated immunity//Immunobioi. EEosinophii. Proc. I Int.
Symp. Fukuoka, 27—28 No. 1981. — New York e. a., 19833. — P. 3—10.
Colins T., RoberJ. Gimbrone M. A. Cultured human endotheliaiai cells express platelet-
derived growth factor A-chain//Am. J. Pathoi. — 1987. — 1 V. 126. — P 7—12.
Colvin R. B. Fibronectin in wound heaiing//Fibronectin/Ed. by D. I. Mosher. — San Diege:
Acad. Press, 1989. — P. 213—254.
602
Daems W. T. Peritoneal macrophages//Reticuloendothelial system a comprehensive triatise.
Voi. 1. Morphology/Eds. by J. Carr, W. Daems. — New York, i 980.
DaleM., Muid R. E., Wilson H. K. The effect of inhibitors of macromolecular synthesis
on neutrophii-mediated antibody-dependent celiuiar cytotoxicity: exacerbation by
mitomycin C//Int. J. Immunopharmacol. — 1984. — V. 6, N 4. — P. 279—285.
DallegriF., Patrone E, FrumentoG. et aL Phagocytosis-dependent neutrophii-mediated
extracellular cytotoxicity against different target celis//Acta Haemat. — i984. — V.
71. N 6. — P. 371—375.
DavenasE., Beauvais F., Amaral. et aL Human basophil degranuiation triggered by very
dilute antiserum against IgE//Nature. — 1988. — V. 333, N 6176. — P. 816—818.
De Week A. Lymphokines and other immunoactive soluble cellular products: prospects for
the future//Lymphokines and thymic hormones: their potential utilization in cancer
therapeutics/Eds. by A. Goldstein, M. Chirigos. — N. Y.: Raven Press, 1981. — P.
1-13.
Di CorletoP. E., Bowen Pope D. F. Cultured endothelial ceils produce a platelet-derived
growth factor-like protein//Proc. nat. Acad. Sci. USA. — 1983. — V. 80. — P.
1919—1923.
Diegelman R. E, Cohen I. K, Kaplan A. M. The role of macrophages in wound repair: a
review//Plast. reconstr. Surg. — 1980. — V. 68. — P. 107—113.
Diegelmann R., Cohen/., Kaplan A. Effect of macrophages on fibroblast DNA synthesis
and proliferation//Proc. Soc. exp. Biol. (N. Y.). — 1982. — V. 169, N 4. — P.
445—451.
Diegelman R. F., Lindbland W., Cohen I. К Fibrogenic processes during tissue
repair//Coiiagen/Ed. M. Nlmni. — Florida: CPC Press, 1988. — P. 114—138.
Druvefors P., Norrby K. Molecular aspects of mast-celi-mediated mitogenesis in
fibroblasts and mesothelial cells in sltu//Virch. Arch. — 1988. — Bd B55,
N 3. — S. 187—192.
Dunn C. J., Elliott G., OostveenJ. et aL Development of prolonged eosinophil rich
inflammatory leukocyte Infiltration In the guinea-pig asthmatic responce to aibumin in
halation//Amer. Rev. resp. Dis. — 1988. — V. 137, N 3. — P. 541—547.
Dvorak A., Schleimer R., Lichtenstien I. Morphologic mast celi cycles//Cell Immunol. —
1987. — V. 105, N 1. — P. 199—204.
Enerback L., Norrby К The mast ceils//Ceii Kinel. Inflammatory React. — Berlin etc.,
1989. — C. 169—204.
Ehrlich P. (1887) Цит. no HirschJ. G., Hirsch В. I. Paul Ehrlich and the discovery of
the eosinophil//The Eosinophil//Eds. by A. Mahmond, K. F. Austen. — N. Y.. i980. —
P. 3—25.
Ferrante A., MocattaT. Human neutrophiis require activation by mononuclear leukocyte
conditioned medium to kiii the pathogenic free-living amoeba, Naegieria fowieri//Ciin.
Exp. Immunol. — 1984. — V. 56, N 3. — P. 559—566.
Fossum S. Dendritic leukocytes, features of their in vivo physioiogy//Res. Immunol. —
1989. — V. 140, N 9. — P. 883—991.
Gabbiani G. The myofibroblast: a key ceil for wound healing and fibrocontractive
diseases//Progr. din. biol. Res. — 1981. — V. 54. — P. 183—194.
Galli S. J., Dvorak A. M., Dvorak H. F. Basophils and mast cells: Morphologic insights into
their bioiogi, secretory pattersm, and function//Progr. Allergy. — 1984. — V. 34. —
P. 1—141.
Ganwerky Ch., Golda D. W. Development of blood monocytes and alveoiar macro-
phage//Basic and Clinical Aspects of Granulomatous Diseases/Eds. D. E. Boros, T.
Yoshida. — Eisevier North Holland a. New York, 1980. — P. 35—48.
Gordon S. Macrophage neutral protiinase and lysosomal hydrolases — roie in tissue
destruction//Idem. — P. 119-131.
GrinnelF. Cell-collagen lnteractlons//Structural and contract'd proteins/Ed. L. W.
Cunningham. — N. Y.: Acad. Press, 1982. — Part A. — P. 499—509.
Griffin F. M., Mullinax P. J. Augmentation of macrophage complement receptor function
in vivo//J. Exp. Med. — 1981. — V. 154. — P. 291—302.
FormD.M., Auerbach R. PGER and angiogenesis//Proc. Soc. exp. Bioi. (N. Y.). —
1983. — V. 172. — P. 214—221.
Heimark R. L., Twardzik D. R., Schwartz S. M. Inhibition of endotheiiai regeneration by
type-beta transforming growth factor from piateiets//Sclence. — 1986. — V. 233. —
P. 1078—1080.
603
Hiroshima M., HirotsuY., MayashiM. Natural mediators of eosinophil chemotaxis in
inflammation//Immunobiol. Eosinophii. Proc. 1 Int. Symp., Fukuoka, 27—28 No.
i98i. — New York, e. a., 1983. — P. 213—226.
Holgate S., Chirch M. Mast ceiis heterogeneity and its ciinicai implications//Allergologie. —
1989. — V. 12, N 9. — P. 109—H3.
HuntT.K, Banda M. J., Silver A. Cell interaction in post-traumatic fibrosis//Fibrosis. —
London: Pitman, 1985. — P. 127—149.
Hunter J. A. The Langerhans ceil: from gold to giitter//Clin. Exp. Dermatol. — 1983. —
V. 8, N 6. — P. 569—592.
JanossyG. Human lymphocyte subjects: their tissue distribution//Progr. Immunoi. J. —
Tokyo e. a., i984. — P. 1089—HOi.
Jaffe E. Endotheiial cellsZ/Inflamation basic principles and clinical correlates/Ed. J.
Gallin. — N. Y.: Raven Press, 1988. — P. 559—575.
KaulT.W., FadenH., Baker R., OgraP. Virus-induced complement activation and
neutrophii-mediated cytotoxicity against respiratory syncytial virus//Ciin. exp.
Immunoi. — 1984. — V. 46, N 3. — P. 501—508.
Kay A. B. Eosinophils as effector cells in immunity and hypersensitivity disorders//Ciin.
exp. Immunol. — 1985. — V. 62, N 1. — P. i —12.
KazuraJ., Mahmoud A. Protective role of eosinophils: The Schistosome egg granu-
loma//Immunobioi. Eosinophil. Proc, i Int. Symp. Fukuoka, 27—28 No. 1981 (New
York), 1983. — P. 363—394.
Knight S.C., KrejaJ., MalkovskyM. et al. The role of dendritic ceils in the intribition
of immune responses to contact sensitizers//Cell Immunol. — 1985. — V. 94, N 2. —
P. 427—434.
Korec S. The role of granulocytes in host defense against tumors//Natural cell-mediated
immunity against tumors/Ed- R. B. Herberman. — N. Y.: Acad. Press, 1980. — P.
1301—1307.
Kunn Ch. Macrophages and the turnover of connective tissue in the lung//Ceii. Bioi. Lung.
Proc. 5th Course Int. Sch. Thorac. Med. Erices, i—6 March i98l. — New York,
London, i982. — P. 227—289.
Kuhn К The coiiagen family-variations in the molecuiar and supermoiecular
structure//Connective tissue: biologicai and ciinicai aspects//Ed. K. Kuhn. — Basei:
Karger, 1986. — P. 29—69.
Leblond С. P., Laurie G. W. Morphological features on connective tissues//Connective tissue:
biological and ciinicai aspects/Ed. K. Kuhn. — Basei: Karger, 1986. — P. i—28.
LenziH., Mednis A., DesseinA. Activation of human eosinophiis by monokines and
lymphokines//Ceii Immunol. — i985. — V. 94, N 2. — P. 333—341.
LescoS., Lorentzen R.. Ts’o P. Roie of superoxide in deoxyribonucleic acid strand
scission//Biochemistry. — i980. — V. 19, N 13. — P. 3023—3028.
Levi-Schaffer E, Austen К, KatzH. et al. T-cell-derived factors and fibroblast-derived
factors regulate the growth and differentiation of mast cells//Progr. Immunoi. VI: 6th
Int. Congr. Immunoi. — Orlando e. a., 1986. — P. 840—850.
Lindner J. Biochemical and morphological basic of wound heaiing//Med. Welt. Stuttg. —
1983. — Bd 24. — S. 897—911.
LobbR., SasseJ., SilvianR. Purification and characterization of endothelial cell growth
factors//!. Bioi. Chem. — 1986. — V. 261. — P. 1924—1928.
Marc hi F, Leblond С. P. Radioautographic characterization of successive compartments
along pathway of collagen precursors in foot-pad fibroblasts//Cell. Biol. — 1984. —
V. 98. — P. 1705—1709.
Martin J. B. Neuroendocrine regulation of the immune response//Neuroimmunoiogy/Ed.
by P. Beham, F. Spreafico. — N. Y.: Raven Press, i984. — V. i2. — P. 433—444.
Miller J. M. Collagen types: structure, distribution and function//Coiiagen/Ed. by M. E.
Nimni. — Florida: CRC Press, 1988. — V. 1. — P. i40—157.
Misosses P., Cavender D. E., ZiffM. Productions of interieikin I by human endotheiiai
celis//J. Immunoi. — i986. — V. 136. —P. 2486—2491.
Montes G. S., Junquera L. C. Histochemical localization of collagen and of proteoglycans
in tissues//Coilagen/Ed. M. Nimni. — Fiorida: CRC Press, i988. — V. 2. — P-
41—78.
Muller-Hermeiink H. The Human thymus. Histophysiology and Pathology. — Berlin:
Springer-Verlag, 1986. — 275 p.
Nemetschek-Gansler H., Meinel A., Nemetschek T. Uber Vorkommen und Bedeutung extra-
604
und intracellular periodisch fllamentar Assoziate//Virch. Arch. Abt A. Path. Anat. —
1988. — V. 375. — P. 185—196.
NibberingP. H., Leijh P. C. J., van FurtR Quantitative immunochemical characterization
of mononuclear phagocytes. 1. Monoblast, promonocytes, monocytes, peritoneal and
aiveolar macrophages//Cell Immunol. — 1987. — V. 105. — P. 374—385.
Nielsen E., Clausen/., Bytzer P. Membrane retrieval in non-exocytic and exocytic rat
peritoneal mast ceiis//Exp. Celi. Res. — 1981. — V. 135, N 2. — P. 291—298.
Nieuwenhuis P., Opstelten D. Functional Anatomy of Germinal Centers//Ciin. Immunoi. •
Immunopath. — 1984. — V. 31, N I. — P. 421—425.
NimniM. E., Harkness R. D. Moiecuiar structures and functions of coliagen//Coiiagen/Ed.
M.E. Nimni. — Florida: CRC Press, 1988. — V. i. — P.i—78.
Okai Y. Macrophage-activating factors in extracellular matrix of human embruo fibroblast
ceil line//Zooi. Sci. — 1986. — V. 3, N 4. — P. 621—626.
ParwareschM. R., Horny H. P., Lennert К Tissue mast ceiis in heaith and disease//Path.
Res. Pract. — 1985. — V. 179. — P. 439—46i.
PimentaP., De Souza W. Uitrastructure and cytochemistry of the ceil surface of
eosinophiis//J. Submicr. Cytol. — 1982..— V. i4, N 2. — P. 227—237.
Pinehard R. N., Ludwig J. C., McManus L. M. Piateiet-activating factors//Infiamation:
basic principles and clinical correlates/Ed. J. Gallin. — N. Y.: Raven Press, 1988. —
P. 139—167.
Podleski W. Autoreactive eosinophils associated with spontaneous autocytotoxicity in
bronchial asthma//Agents and Action. — 1988. — V. i—2. — P. 20—25.
PoitevinB., Davenas E, BenvenisteJ. In vitro immunoiigicai degranuiation of human
basophils is modulated by lung histamine and Apis meiiifice//Brit. J. clin. Pharmacol. —
1988. — V. 25, N 4. — P. 439—444.
PopovA. Uitrastructural changes in the size of mast ceii granules and in the granuiar
matrix during an experimental anaphylactic shock/ZAnat. Anz. — 1988. — N 1 —5. —
P. 267—273.
Postlethwaite A. E., Kang A. H. Fibrobiast//Infiamation basic principles and clinical
correiates/Ed. J. Gaiiin. — N. Y.: Raven Press, i988. — P. 577—597.
PretolaniM., VargaftigB. Roie du PAF-acether dans ies reactions infiammatoires et
aiiergiques//M/S. Med. sci. — 1987. — V. 3, N 9. — P. 508—514.
Proud D., Siekierski E., Bailey G. Identification of human lung mast celi kininogenase as
tryptase and relevance of triptase kininogenase activity//Biochem. Pharmacoi. —
1988. — V. 37, N 8. — P. 1473—1488.
Rand T., Colley D. Lymphokine-mediated regulation of murine eosinophiis//Immunobioi.
Eosinophii. Proc. 1 Int. Symp., Fukuoka, 27—28 No. 1981. — New York e. a.,
1983. — P. 13—26.
Rand J. Intravital microscopic studies on acute mast cell-dependent inflammation//Acta
physiol, scand. — 1989. — V. 135, Suppi. N 576. — P. 1 —58.
Reichert R., JerabekK., Gallatin W. et aL Ontogeny of lymphocyte homing receptor
expression in the mouse thymus//J. Immunoi. — 1986. — V. 136, N iO. — P.
3535—3542.
Rigby P. J., Papadimitrion J. M. Cytoskeietal control of nuckear arrangementin Langerhans
muitinucieate giant ceils//J. Pathol. — 1984. — V. 143, N I. — P. i7—29.
Romani N., Schuler G. Structural and functional relationships between epidermai Langerhans
ceiis and dendritic ceiis//Res. Immunoi. — i989. — V. 140, N 9. — P. 895—898.
Roos D. The metaboiic response to phagocytosis//The ceii bioiogy of infiammation/Ed.
G. Weissmann. — New York, 1980. — P. 337—385.
Roske A. K., Lipsky P. E. Monocytes and Macrophages//Textbook of Reumatoiogy/Ed. W.
N. Keiioy, E. D. Harris, W. Saunders. — Phiiadeiphia, 1989. — P..346—366.
Rothschild A. M., Gomes E. L., Gousalves R P. Non-histamine releasing activities of rat
mast ceiis//Adv. Histamine Res. Proc. Int. Histamine Symp., Okayama, 26—27 July
1981. — Oxford, 1982. — P. 57—68.
Rouse R., Reichert R., Gallatin W. et al. Localization of iymphocyte subpopuiations in
peripheral lymphoid Organs/ZCIin. Immunoi. Immunopath. — 1984. — V. 31, N 1. —
P. 64—68.
RyterA., Chastellier Ch. Phagocyte-pathogenic microbe interactions//Int. Rev. Cytoi. —
1983. — V. 85. — P. 287—327.
Sage H. Coilagen synthesis by endothelial ceiis in culture//Biologe of endothelial ceils/Ed.
E. A. Jaffe. — Boston, 1984. — P. 161 — i77.
605
SaviilJ., Dransfield I., HoggN. et al. Vironectin receptor mediated phagocytosis of ceiis
undergoing apoptosis//Nature. — 1990. — V. 343, N'6254. — P. 170—173.
Schaffner Th., Kellner H., Hess M. et al. Macrophage functions in antimicrobial
defense//Klin Wochenschr. — 1982. — V. 60, N 14. — P. 720—726.
Schweigerer K, Neufeld G., Gospadoriwicz D. Capiiiary endothelial cells express basic
fibroblast growth factor//Nature. — 1987. — V. 325. — P. 257—259.
Shekhter А. В. (Шехтер А. Б.) Connective tissue as an integral system (role of ceii-ceii
and cell-matrix interactions)//Connect. Tiss. Res. — i986. — V. 15. — P. 23—31.
Sitaganian R. P. Mast cells and basophiis//Infiamma >n: Basic Principles and Clinical
Correlates/Eds. J. Gallin et al. — New York, 1988. — P. 513—54i.
Snyde'rman R., PikeM. C. Structure and function of monocytes and macrophages//Arthritis
and aiiied conditions/Ed. D. McCarty. — N. Y.: Lea a. Febiger, 1989. — P. 306—335.
Sorensen L. S., Mullarkey M. E, Bean M. et cd. Prapagation and characterization of human
blood basophils//Int. Arch. Allergy. — 1988. — V. 86, N 3. — P. 267—280.
Steinnian R. M. Dentritic ceiis: clinical aspects//Res. Immunol. — 1989. — V. 140, N
9. — P. 911—918.
Stoic V. Formation of ingibitor of aminoacid incorporation into protein in the phagocytosing
.human polymorphonuclear leukocytes//Exp. Hematol. — 1981. — V. 9, N 7. — P.
745—753.
Stricklin G. P., Hibbs M. S. Biochemistry a physiology of mammalian coilage-
nase//Collagen/Ed. M. E. Nimni. — Florida: CRC Press, 1988. — V. 1. — P.
188—205.
SuttorpN., Simon L. Lung cell oxidant injury. Enhancement of polymorphonuclear
leukocyte-mediated cytotoxicity in iung ceils exposed to sustained in vitro hyperoxia//J.
Ciin. Invest. — 1982. — V. 70, N 2. — P. 342—350.
Ten Cate A. R., Freeman E. Collagen remodelling by fibroblasts in wound repair//Anat.
Rec. — 1974. — V. 179, N 4. — P. 543—556.
Thome К, Free J., Franks D. et al. The mechanism of Fc-mediated interaction of eosynophils
with immobilized immune complex//!. Cell Sci. — i982. — V. 56. — P. 357—369.
Tracey D. Macrophages-mediated injury//Reticuloendothei. System: Compr. Treatise. Voi.
4. Immunopathol. — New York — London, 1983. — P. 77—lOi.
TrelstadiR. L., Birk D. E. The Fibroblast in morphogenesis and Fibrosis: ceil topography
and Surface related functions//Fibrosis. — London: Pitman, i985. — P. 4—i9.
Vnkelles J. C. Fc receptor of mouse macrophage//Mononuciear Phagocyts: Functional
Aspects/Ed. R. van Furth. — Martinus Nijhoff, i980.
Vadas M. Activation of eosinophils and regulation of eosinophilia//lmmunobiol. Eosinophil.
Proc. 1 Int. Symp., Fukuoka, 27—28 No., 1981. — New York, 1983. — P. 77—94.
van Furth R. Cells of the mononuclear phagocyte system: nomenclature in. terms sites and
conditions//Mononuclear Phagocytes. Functional Aspects/Ed. by R. van Furth. —
Boston, 1980. — P. 1—30.
van Furth R. Monocyte production during infiammation//Comp. Immunol., MicrobioL a.
Infect Diseases. — 1985. — V. 8, N 2. — P. 205—211.
van Furth R. Phagocytic Ceils: Development and distribution of Mononuclear Phagocytes
in Normal Steady State and Inflammation//Inflammation: Basic Principles and Clinical
Correlates/Ed. by J. 1. Gailin et ai. — New York, 1988. — P. 281—291.
van Furth R. Origin and turnover of monocytes and macrophages//Ceil Kinetik Inflammatory
Reaction. — Berlin, 1989. — P. 125—150.
van Overveld F. J., Terpstra G. K, BruijnzeelP. et al. The isolation of human lung mast
cells by afFinity chromatography//Scand. J. Immunoi. — 1988. — V. 27, N 1. — P-
i—6.
, VelW., Namavar F., Verweij A. et at Killing capacity of human polymorphonuclear
leukocytes in aerobic and anaerobic conditions//!. Med. Microbiol. — 1984. — V.
18, N2. — P. 167—172.
VengaP., Dahl R., Fredens К et aL Epithelial injury by human eosinophils//Amer. Rev.
Respir. Disease. — 1988. — V. 138, N 6. — Pt. 2. — P. 54—57.
Wahl S. M. Inflammaty cell regulation of cohnectiv tissue metaboiism//Connective tissue:
biological and clinical aspects/Ed. K. Kuhn. — Basel: Karger, 1986. — P. 404—429.
Wasserman S. I. Mast Cells and Eosinophils//Textbook of Rheumatology/Eds. W. Keiley
et al. — New York. 1989. — P. 367—379.
Weiss S. J., PeppinG., Ortiz X. et al. Oxidative autoactivation of latent coiiagenase by
human neutrophiis//Science. — i985. — V. 227, N 4688. — P. 747—749.
606
Weitberg A. В., Wetzman S. A., Destrempeg M. et al. Stimulated human phagocytes produce
cytogenetic changes in cutured mammalian ceils//N. Engi. J. Med. — 1983. — V.
308, N 1. — P. 26—30.
Weitzman S. A., Stossel T. P. Effects of oxygen radicai scavengers and antioxidants on
phagocyte-induced mutagenesis//.!. Immunol. — 1982. — V. 128, N 6. — P. 2770—
2772.
Weitzman S. A., Weitberg A. B., Clare E. P., Stossel T. P Phagocytes as carcinogenes:
malignant transformation produced by human neutrophils//Science. — 1985. — V.
227, N4691. — P. 1231—1233.
Williams G. T., Williams J. Granulomatous Inflammation: a review//!. Clin. Pathol. —
1983. — V. 36. — P. 723—733.
Woodbury R. G., TrongH.L, NeurathH. Structure and function of mast cell prote-
ases//Acta histochem. et cytochem. — 1987. — V. 20, N 2. — P. 261—269.
Wright D. G. The neutrophil as a secretory organ of host defense//Advances in host
defense mechanisms. — New York, 1982. — V. 1. — P. 75—110.
К главе 5
Абрикосов А. И. Морфологические проявления аллергических реакций у человека. —
Сов. клиника, 1933. — № 19. — С. 109—112.
Абрикосов А. И. Аллергия и вопросы патологии. — М.: Изд-во АН СССР, 1963. —
С. 16—43.
Зотиков Е. А. Антигенные системы человека и гомеостаз. — М., 1982.
Ивановская Т. Е. Болезни иммунной системы. — В кн.: Патологическая анатомия
болезней плода и ребенка. — М.: Медицина, 1981, гл. X. — С. 67—90.
Ивановская Т. Е. Иммунная система и ее связь с характером инфекционного процесса
у детей. — Арх. пат. — 1983. — Вып. 7. — С. 3—13.
Ивановская Т. Е. Значение иммунодефицитных состояний в патологии человека. —
Арх. пат. — 1983. — Вып. 11. — С. 75—82.
ИвановскаяТ. Е., ГуревичП. С. и др. Некоторые наследственные иммунодефициты,
сцепленные с Х-хромосомой. — Арх. пат. — 1986. — Вып. 5. — С. 53—59.
Ивановская Т. Е., Катасонова Л. П. Структура тимуса, иммунный статус и патоло-
гический процесс. — Арх. пат. — 1986. — Вып. 1. — С. 3—9.
Йегер Л. Клиническая иммунология и аллергия: Пер. с нем. — Т. 2—3. — М., 1990.
Лесков В. П., Халатян Н. А., Гущин И. С. Структура и функции рецептора для Fc-
фрагмента IgG // Иммунология. — 1981. — № i. — С. 17—26.
Лямперт И. М. Иммунологические механизмы, имеющие значение при возникнове-
нии аутоиммунного процесса // Вести. АМН СССР. — 1988. — № 5. — С.
12—20.
Матвеева Л. А. Диагностика иммунологической недостаточности у детей с заболе-
ваниями легких // Педиатрия. — 1988. — № 10. — С. 39—43.
Маянский А. И., Маянский Д. И. Очерки о нейтрофиле и макрофаге. Новосибирск,
1983.
Медуницин Н. В. Участие IA-антигенов в иммунных реакциях // Иммунология. —
1982. — № 4. — С. 19—26.
Морфологическая диагностика заболеваний печени // Под ред. В. В. Серова, К.
Лапиша. — М.: Медицина, 1989.
Насонов ЕЛ., Сура В. В. Взаимосвязь аутоиммунной и иммунокомплексной патоло-
гии: современное состояние проблемы // Тер. арх. — 1984. — № 10. — С.
4—10.
Общая патология человека / Под ред. А. И. Струкова, В. В. Серова, Д. С. Саркисо-
ва. — 2-е изд. — М.: Медицина, 1990. — Т. 2.
Петров Р. В. Иммунология. — М.: Медицина, 1982.
Петров Р. В., Орадовская И. В. Эпидемиология иммунодефицитов. ВНИИМИ. Серия:
Мед. генетика и иммунология. М., 1988. — Вып. 3.
Пигаревский В. Е. Зернистые лейкоциты и их свойства. — М.: Медицина, 1978.
Саркисов Д. С. Очерки истории общей патологии. — М.: Медицина, 1988.
Серов В. В. Воспаление, иммунитет и гиперчувствительность // Арх. пат. — 1983. —
Вып. 11. — С. 3—14.
607
Серов В. В. Перспективные направления патологоанатомических исследований //
Лрх. пат. — i486. — Вып. 3. — С. 20—29.
Серов В. В., Шехтер А. Б. Соединительная ткань. — М.: Медицина, 1981.
Серов В. В., Зайратьянц О. В. Лутоиммунизация и аутоиммунные болезни // Арх.
пат. — 1922. — Вып. 3. — С. 5—11.
Струков А. И. Некоторые современные аспекты в учении о воспалении // Арх.
пат. — 1972. — Вып. 4. — С. 9—18.
Струков А. И. Механизмы иммунного воспаления // Вести. АМН СССР. — 1979. —
№ 11. — С. 76—84.
Струков А. И., Кауфман О. Я. Гранулематозное воспаление и гранулематозные бо-
лезни. — М.: Медицина, 1989.
Сура В. В., Насонов Е. Л., Борисов И. А., Тимофеева Е. Б. Клинико-патогенетические
закономерности развития болезней иммунных комплексов // Тер. арх. — 1980. —
№ 12. — С.'3—10.
Чередеев А. Н., Ковальчук Л. В. Клеточные и молекулярные аспекты иммунных про-
цессов // ВИНИТИ (Сер.: Иммунология). — 1989. — Т. 19.
Чернух А. М. Воспаление. — М.: Медицина, 1979.
Чернушенко Е. Ф., КогосоваЛ.С. Механизмы формирования и биологическая роль
аутоиммунизации. — В кн.: Аутоиммунные процессы и их роль в клинике
внутренних болезней. — Киев: Здоров’я, 1985. — С. 3—18.
Яковцева А. Ф. Значение патоморфологического исследования последа в перинато-
логии // Арх. пат. — 1988. — Вып. 5. — С. 87—92.
Ярыгин Н. Е., Насонова В. А., Потехина Р. Н. Системные аллергические васкули-
ты.— М.: Медицина, 1980.
Albrecht W., Kurth R. HJV-Infektionen in Kindes-alter. Soziai-padiatrie. — i987. — Bd
9. — N 9. — S. 600—603.
AmorB., Dougados M., Mery Ch. et al. Nonathymuiin in rheumatoid arthritis // Ann.
Rheum. Dis. — i987. — V. 46. — N 7. — P. 549—554.
BiggemanB., NeuenE., Wechsler W. et al. Nevrological manifestations in three german
children with AIDS// Neuropediatrics. — 1987. — V. 18. — N 2. — P. 22—106.
Boyd ₽;, Oberhuber Y.„ Hala K, Wick G. Obese strain chicieus with spontaneous autoimmune
thyroiditis have a deficiency in thymic nurce ceils // J. Immunol. — 1984. — V.
132. — N 2. — P. 718—724.
BultmannB., Wildfeuer A., HaferkampO. Die septiche Granulomatose. Pathogenese und
Differential diagnose // Zbl. allg. Path. path. Anat. — 1981. — Bd 125. — N 3. —
S. 232.
Cantani A. Les erworbene Immunoorganel syndrom (AIDS) im kindesalter // Derzeitiger
Sand. Mschr. Kinderheilk. — 1987. — Bd 135. — N 9. — S. 610—6i4.
Carlson H. Endocrinology. — N. Y., 1983.
Cohen M., Rubinstein A., Li J. et al. Thymus hypoplasia associated with isotretinoin
embryopathy. — Amer. J. Dis. Child. — 1987. — V. 144. — N 3. — P. 263—266.
Cottier H. Pathogenese. — Benin, i980.
Cumming I. Proc, of the VI. Intern. Congress of Endocrinology. Neiburne (Australia),
1980.
Drachman D. Myasthenia Gravis: bioiogy and Treatment. — N. Y., 1987.
Eipstein-Knesch S. et al. Desimineted Sporotchrix shenckii infection with artritis in a
patients with acquireed immunodeficiency Syndrome// J. Rheumatol. — i985. — V.
12. — P. 805—808.
Fudelberg H., Stites D., Caldwell J., Wells J. Basic and ciinivai immunology. Los-Atlas
(LMP), 1980.
van Gaudecker P. The development of the human thymus microenvironment. In: The
Human thymus /Ed. by Muller-Hermelink H. — Benin etc., 1986. — P. i—43.
GellP., Coombs R. Clinical aspects of immunology. — 3rd. ed. — Oxford, 1975.
Lesgold BelmanA., Diamond G., Dickson D. et aL Pediatric acquired immunodeficiency
syndrome. Necrologis syndromes. — Amer. J. Dis. Child. — 1988. — V. 142. —
N 1. — P. 29—35.
Mayjcay I. The nature of autoimmune disease. — In: Autoimmunity and autoimmune
diseases /Ed. by Evered D., WheianJ. Chicjester etc., 1987. — P. 177—i93.
MarionR., WizniaA., HutchenR. et al. Fetai AIDS Syndrom Score // Amer. J. Dis.
Child., 1987. — V. 141. — N 4. — P. 429—431.
608
MovatH. Inflammation, immunity and hypersensitivity. New York, 1971.
Miiller-Hermelink H. The Human thymus. — Beriin, 1986.
Nezelof Ch. Pathology of the Thymus in ImmunnodeBciency Status. The Human Thymus.
Editor Miiller-Hermellnk H. Springer-Verlag. Beriin, Heidelberg, New York, Toklo,
1986. — P. 151—178.
PanayiC. S. Lymphocyte studies in rhevmatoid arthritis // Scand. J. Rheum., 1982. —
V. 11, Suppi. — P. 133—137.
QaziQ., Sheikh T., Fikrig S. et al. Lack of evidence for craniofacial dysmorphism in
perinatal human immunodeficiency virus infection // J. Pediat. — 1988. — V. 112. —
N I. — P. 7—11.
Robbins S., AngellM., Kumar V. Basic Pathology. — Philadelphia, I98i.
Rossie R Uber die Merkmale der Entziindung im aliergischen organismus // Verh. Dtsch.
path. Ges. — 1914. — Bd 17. — S. 281—285.
Schatz H., DomiachD. Autoimmunity in thyroid disorders. — N.Y., i984.
SellS. Immunopathoiogy (Teaching monograph). — Amer. J. Path. — 1978. — V. 90. —
P. 211—288.
SellS. Immunology, immunopathoiogy and immunity. — N.Y., 1980.
Sonnichsen N., Apostoloff B. Autoimmunkiankheiten. Fischer Veriag, Jena, 1987.
SteihmE., Fulgini V. Immunologic disorders in infants and children. Philadelphia, 1980.
Svejgaard A., MozlingN., Platz P. et aL Ciinicai implications of associations between HLA
and disease. — In: Ciinicai Immunology and Allergology. — Amsterdam, 1981. —
P. 121—128.
TerragnaA., De Maria A. L’infezione de MJV in eta pediatrica. — Minerva pediat. —
1987. — V. 39. — N 21. — P. 915—923.
TsujiK. HLA and immune response mechanism. — Dokkyo J. med. Sci. — 1981. — V.
8. — P. 1—9.
WiedmannK H., BergP. A. Autoimmunophanomene bei gastrointestinaien Erkran Kungen
und Leberkrankheiten. Therapiewoche, 1981. — Bd 31. — S. 6419—6426.
Williams R S. Immune complexes in ciinicai and experimental medicine. — Boston, 1980.
К главе б
Блинова Е. Н. К экспериментальному обоснованию патогенеза нейрогенных артро-
патий. — В кн.: Нарушение механизмов регуляции и их коррекция. — Т. 1. —
М„ 1989. — С. 9.
Быков К М. Кора головного мозга и внутренние органы. Избранные произведения,-—
Л. — М.: Изд-во АН СССР, 1954.
Глебов Р. Н., Крыжановский Г. Н. функциональная биохимия синапсов. — М.: Ме-
дицина, 1978. — С. 328.
Гращенков Н. И. Гипоталамус, его роль в физиологии и патологии. — М.: Наука,
1964. — С. 368.
Давыдовский И._ В. Общая патология человека. — М.: Медицина, 1969. — С. 6ii.
Данилова Л. Я., Потоцкая И. И., КолесоваН. А. и др. Роль свободно-радикального
окисления в патогенезе нейродистрофического процесса в мышцах и возможность
его коррекции. — В кн.: Нарушения механизмов регуляции и их коррекция. —
Т. 1. — М., 1989. — С. 119.
Зайко И. И., ЗаярнаяЛ.П., Михнев В. А. и др. Особенности метаболизма денерви-
рованных тканей и их реакции на гормональные влияния. — В кн.: Нарушения
механизмов регуляции и их коррекция. — М., 1989. — С. 2i.
Каменская М. М. Развитие представлений о иейросекреции. Пептидергические ней-
роны. Итоги науки и техники. Физиология человека и животных. — Т. 34. —
М., 1988. Нейропептиды в синаптической передаче. — С. 14—22.
Князев Г. Г., Князева Г. Б.. Никифоров А. Ф. Микроциркуляторное нарушение при
деафферентации глаза. — Патол. физиол. — 1990. — № 1. — С. 32—34.
Крыжановский Г. Н. Общая патофизиология нервной системы..— Патол. физиол. —
1989. — № 2. — С. 63—71.
Лазуркина Н. Н. Хемилюминесцентный анализ феномена Орбели — Гинецинского. —
В кн.: Нарушение механизмов регуляции и их коррекция. — Т. 1. — М„ 1989. —
С. 32.
20—407
609
Павлов И. П. Труды по физиологии кровообращени К иннервации сердца (1898). —
М.: Медгиз, 1954. — С. 201—202.
Саркисов Д. С. Проблема взаимоотношения структуры и функции в ее историческом
аспекте. — В кн: Структурные основы адаптации и компенсации нарушенных
функций / Под ред. Д. С. Саркисова. — М.: Медицина, 1987. — С. 9—20.
Саркисов Д. С., Туманов В. П. Приспособительные и компенсаторные процессы. —
В кн.: Общая патология человека. 2-е изд. / Под ред. А. И. Струкова, В. В. Серова,
Д. С. Саркисова. — Т. 2. — М.: Медицина, 1990. — С. 199—322.
Сперанский А. Д. Избранные труды. — М.: Медгиз, 1955.
Струков А. И., Пауков В. С., Кауфман О. Я. Воспаление. — В кн.: Общая патология
человека. — 2-е изд. / Под ред. А. И. Струкова, В. В. Серова, Д. С. Саркисова. —
М.: Медицина. — Т. 2. — 1990. — С. 3—73.
Сукманский О. И., Бахвала Ю. П., КлопацкийГ. А. и др. Исследование трофических
расстройств в слизистой оболочке рта при нарушении тригеминальной иннерва-
ции. — В кн.: Нарушение механизмов рефляции и их коррекция. — Т. 1. —
М., 1989. — С. 59.
Хитрое Н. К, Пауков В. С. Адаптация сердца к гипоксии. — М.: Медицина, 1991.
Чернух А. М. Воспаление (очерки патологии и экспериментальной терапии). М.:
Медицина, 1979. — С. 448.
Шухов В. С- Боль: механизмы формирования, исследование в клинике. — В кн.:
Медицина и здравоохранение. Серия: Невропатология и психиатрия. Обзорная
информация. — Вып. 1. НПО: Союзмединформ. — М., 1990.
ChallE, Szolcsanyi I., LembeckE. Antidromie vasodilatation and neurogenic inflammation.
Sateiiite Symp. of the 29 th. Int. Congr. of Physiological Sciences. Newcastle. Australia,
1983. Acad. Kiado. — Budapest, 1984. — 353 p.
Dowling I. Autonomic measures and behavioral induces of pain sensitivity. — Pain, 1983. —
V. 16. — N 2. — P. 193—200.
Fields П. L., BasbaumA. I. Endogenous pain control mechanisms. Textbook of Pain. —
Edinburgh: Churchiil Livingstone, 1985. — P. 142—152.
Hunts. P., Rossi I. Peptide and non-peptide-containing unmyelinated primary affevents:
the parallel processing of nociceptive information. Nociception and Pain. — London:
Rof Soc., 1985. — P. 65—72.
Del Maestro F. Цит. no Герасимову A. M. и Фурцевой Л. H. Биохимическая диагно-
стика в травматологии и ортопедии. — М.: Медицина, 1986. — 235 с.
Magendie М. Del influence de la cinquieme paire de nerfs sur la nutrition et les fonctions
de L’ocii. J. Physiol. (Paris), 1824. — T. 4. — P. 176.
Nielsh V. Цит. no Chall L., Szolcsangi I., Lembeck E. Antidromie vasodilation and
neurogenic inflammation. Satellite Symp. of the 2th Int. Congr. of Physiological
Sciences. Newcastle. Australia, 1983. Acad, Kiado. Budapest, 1984. — 353 p.
К главе 7
Зотиков E. А., Кутьина P.M., Сидельникова С. М. Сенсибилизация больных иерси-
ниозной артропатией к HLA-B27 антигену // Ревматология. — 1985. — № 3. —
С. 56—58.
Медуницын Н. В. Антигены II класса главного комплекса гистосовместимости как
универсальные рецепторы и носители антигенов (гипотеза) // Иммунология. —
1986. — № 4. — С. 85—87.
Amaldil., Reith W., BerteC. et al. Induction of HLA class II genes by IFN-y is
transcriptional and requires a trans-action protein // J. Immunoi. — 1989. — V.
142. — P. 999—1004.
Ballardini G., Mirakian R., Bianchi F. B. et al. Aberrant expression of HLA-DR antigens
on bibeduct epithelium in primary biliary cirrhosis: relevance to pathogenesis //
Lancet. — 1984. — V. 2. — P. 1009—1013.
Basham T. Y., Nickoloff B. J., Merigan T. C. et al. Recombinant gamma interferon
differentially regulates class II antigen expression and biosynthesis on cultured normal
human keratinocytes Hi. Interferon Res. — 1985. V. 5. — P. 23—32.
610
Beutler В., CeramiA. Cachectin: more than a tumor necrosis factor // N. Engl. J. Med. —
1987. — V. 316. — P. 379—385.
Bjerke S., Gaudernack G. Dendric cells and monocytes as accessory cells In T-cell responses
In man. II fraction antigen-presented cells // Scand. J. Immuntol. — 1985. — V.
21. — P. 501—508.
Вlustone J. A., Matis L. A. TCR у cells-mlnor redundant T cell subset or specialized
Immune system component // J. Immunol. — 1989. — V. 142. — P. 1785—1788.
Bottazzo G. F., Path M. R. C., Dean В. M. et aL In situ characterization of autoimmune
phenomena and expression of HLA molecules In the pancreas in diabetic insulitis //
New Engl. K. Med. — 1985. — V. 313. — P. 353—359.
Bottazzo G. F., Pujol-Borrell R., Hanqfusa T. et aL Role aberrant HLA-DR expression
and antigen presentation in Induction autoimmunity // Lancet. — 1983. — V. 2. —
P. 1115—1119.
BurrlneO.R., Kefford R. F., Gilmore/., Milstein C. Stimulation of HLA-A, В, C by
IFN-a. The derivation of Molt 4 variants and the differential expression of HLA-
A, В, C subsets// EMBO J. — 1985. V. 4. — P. 2855—2860.
Christophers E, Schubert C., Schroder/. M. Psorias // Triangle. Sandoz. J. Med. —
1987. — V. 26. — P. 167—175.
Collins T., Lappierre L. A., Fiers W. et al. Recombinant human tumor necrosis factor
Increases in RNA levels and surface expression HLA-A, В antigens In vascular
endothelial ceiis and dermal Fibroblasts in vitro //Proc. Nat. Acad. Sci. USA. —
1986. — V. 83. — P. 446—450.
CordobaS. R., Marshall P., Rubinstein P. Molecular characterization by high resolution
isoelectric focusing of the products encoded by the II class MHC // J. Immunol. —
1989. — V. 142. — P. 836—841.
Durum S. K., Schmidt /. A., Oppenheim /. /. Interleukin I: an immunological perspective
// Ann. Rev. Immunol. — 1985. — V. 3. — P. 263—387.
GeczyA. F., Alexander K., Bashir H.V. et cd. HLA-B27, Klebsiella and ankylosing
spondilitis: Biological and chemical studies // Immunol. Rev. — 1983. — V. 70. —
P. 23—50.
Girdlstone /., Milstein C. Differential expression and interferon response of HLA class I
genes in thymocyte lines and response of HLA class I genes in thymocyte iines and
response variants // Eur. J. Immunol. — 1988. — V. 18. — P. 139—143.
Grumer F. C., Fendly В. M., FishL. et al. Monoclonal antibody (B27M2) subdividing
HLA-B27 human // Immunology. — 1982. — V. 5. — P. 61—72.
Hakem R., Bouteiller P. L., Barad M. IFN-mediated differential regulation of the expression
of HLA-B7 and HLA-A3 class I genes // J. Immunol. — 1989. — V. 142. — P.
297—305.
Hanafusa T., Pujol Borrell R., Chiovato L. et al. Aberrant expression of HLA antigen on
thyrocytes in Graves disease: releavance to autoimmunity // Lancet. — 1983. — V.
2. — P. 1111—1115.
Hayashi H., Ennis P. D., ArigaH. et al. HLA-B51 and HLA-B52 differ by only two
aminoacids which are in the Helical region on the ai domain // J. Immunol. — 1989.
V. 142. — P. 307—310.
/ensenius /. C. Williams A. F. The T-lympocyte antigen-receptor-paradigm lost //
Nature. — 1982. — V. 300. — P. 583—588.
/ewell D. P., Lowes /. R. Aetiology and pathogenesis of ulcerative colitis and Crohn’s
disease // Sandoz J. Med. Sci. Triangle. — 1987. — V. 27. — P. 137—141.
KohaseM., /1enriksen-Destefano D., May L. T. et aL Induction of /^-interferon by tumor
necrosis factor: a homeostatic mechanism in controi of ceii proliferation // Cell. —
1986. — V. 45. — P. 659—666.
UbbyP., Ordovas/.M; Auger K. R. et al. Endotoxin and tumor necrosis factor induce
interleukin I gene expression in adult human vascular endothelial cells // Amer. J.
Path. — 1986. — V. 124. — P. 179—185.
Lipton /. M. Genetic restriction in the suppression of erythropoiesis and the role of la-like
antigens in progenitor differentiation // Progr. Clin. Biol. Res. — 1985. — V. 184. —
P. 425—443.
Lopez de Castro /. A., Strominger LA. et al. Structure of crossreactive human
histocompalitolity antigens HLA-A28 and HIA-A2: possible implications for the
generation of HLA polymorphism //Proc. Nat. Acad. Sci. US. — 1982. — Vol. 79. —
P. 3813—3817.
20*
611
Lunger T. A., Kock A., Danner M. Characterization of immunoregulatory cytokines produced
by epidermal ceils // Scand. J. Immunol. — 1985. — V. 21. — P. 455—462.
NanerothP. P., Bank I., Handley D. et al. Tumor necrotic factor cachectin interacts with
endothelial cell receptors to induce release of interleukin I // J. exp. Med. — 1986. —
V. 163. — P. 1363—1368.
Nawroth P. P., Stern D. M. Modification of endothelial cell hemostatic properties by tumor
necrosis factor // J. exp. Med. — 1986. — V. 163. — P. 740—745.
OrrH. T., Lopez de Castro J. A., Parham P. et al. Comparison of amino and sequences
of two human histocompatibiiity antigens HLA-A2 and HLA-B7; location of putative
ailoantigenic sltez // Proc. nat. Acad. Sci USA. — 1979. V. 76. — P. 4395—4399.
Paegelow I., Werner H., Vietinghoff G. The production of lnterleukin-1 induced by an
acute non-specific inflammation in mice// Agents a. Actions. — 1988. — V. 23. —
P. 79—81.
Pober J. S., Bevilacqua M. P., Mendrick D. L. et al. Two distinct monokines interieukin I
and tumor necrosis factor, each independently induce biosynthesis and transient
expression on the same antigen on the surface of cultured human vascular endothelial
celis // J. Immunol. — 1986. — V. 136. — P. 1680—1687.
Schlosstein L, TerasakiP.L, Bluestone R. et aL High association of an HLA antigen
W27 with ankylosing spondylitis //New Engl. J. Med. — 1973. — V. 288. — P.
704—706.
Schmid D. S. The human МНС-restricted cellular response to herpes simplex vinis type
I is mediated by CD4+, CD8+ T cells and restricted to the DR region of the MHC
complex // J. Immunol. — 1988. — V. 140. — P. 3610—3615.
Sheehy M., SondelP., BachM.L. et al. HLA-D typing a rapid assay using primed
lymphocytes // Science. — 1975. — V. 188. — P. 1308—1311.
Snary D., Barnstable C., Bodwer W. F. et al. Human la antigenspurificatlon and molecular
structure // Cold. Spring. Harber Sump. Quant. Biol. — 1977. — V. 41. — P.
379—386.
Stetler D., Das H., NunbergJ. H. et al. Isolation of a cDNA clone for the human HLA-DR
antigen a chain by using a synthetic oligonucleotide as a hybridization probe // Proc,
nat. Acad. Sci. USA. — 1982. — V. 79. — P. 5965—5970.
Svejgaard A., Platz P., Ryder L. HLA and disease // Immunol. Rev. — 1983. — V. 70. —
P. 193—218.
Takematsu IL, Suzuki R., Tagami H. et al. Interieukin-I-like activity in horny layer extracts:
decreased activity in seaie extracts of psoriasis and sterile pustular dermatoses//
Dermatology. — 1986. — V. 172. — P. 236—240.
Torok-Storb B., Hansen H. A. Modification of in vitro BFU-E growth by normal la positive
T-ceii in restricted by HLA-DR // Nature. — 1982. — V. 298. — P. 473—474.
Torpey D. J., Lindsley M. D., Rinaldo C. R. HLA restricted iysis of herpes simplex vims —
induced monocytes and macrophages mediated by CD4+ and CD8+ T-lymphocytes
// J. Immunol. — 1989. — V. 142. — P. 1325—1332.
TschachlerE., GrohV., Popovic M. et al. Epidermal Langerhans ceii — a target for
HTLV-III/LAV infection // J. invest. Derm. — 1987. — V. 88. — P. 233—237.
Vinci G., Vernant M.. NakazawaM. et aL In vitro innibition normal human hematopoiesis
by marrow CD3 , CD8+, HLA-DR*, HNK+, lymphocytes// Blood. — 1988. — V.
72. — P. 1616—1621.
Warner S. T. G., Libby P. Human vascular smooth muscle cells. Target for and source of
tumor necrosis factor // J. Immunol. — 1989. — V. 142. — P. 100—109.
Wernet P. Human la-type alloantigens:method of detection, aspects of chemistry and
biology markers for disease states // Transplant. Rev. — 1976. — V. 30. — P-
271—298.
Wolff K, StinglG. Cellular interaction and skin: the epidermis as a immune organ //
Sandoz J. Med. Sci. Triangle. — 1987. — V. 27. — P. 139—153.
Zinkernagel R. M„ Doherty P.C. Restriction of in vitro T ceil mediated cytotoxicity in
lymphocytic choriomeningitis a singeneic or semi-allogenic system // Nature. —
1974. — V. 248 — P. 701—702.
612
К главе 8
Афанасьева В. М., Покровская Л. Я., Леонова Л. В. Анализ сепсиса у детей по сек-
ционным данным прозектуры ДКБ № 1 за 1943—1975 гт. // Арх. пат. — 1976. —
Вып. 10. — С. 12—18.
Батори Г., Береги Э., Петрани Г. Изменение субпопуляций лимфоцитов при старении
// В сб.: Вопросы геронтологии. — Киев. — 1982. — Вып. 4. — С. 19—27.
Бутенко Г. М., Войтенко В. П. Генетические и иммунологические механизмы воз-
растной патологии. — Киев: Здоровье, 1983. — 144 с.
Бутенко Г. М., Андрианова Л. Ф., Зайченко А. П. и др. Изменение субпопуляций
Т-лимфоцитов у людей при старении, определяемое с помощью моноклональных
антител // Иммунология. — 1986. — № 2. — С. 81—82.
Вельтищев Ю. Е, Ермолаев М. В., Ананенко А. А. Обмен веществ у детей. — М.:
Медицина, 1983. — 462 с.
ГацкоГ. Г., Жукова А. С., ЧайкоЛ. Д. Жировая ткань при старении. — Минск: Наука
и техника, 1985. — 184 с.
Гуревич П. С., Барсуков В. С. Иммунологические аспекты сепсиса у детей раннего
возраста // Арх. пат. — 1982. — Вып. 3. — С. 74.
Давыдовский И. В. Геронтология. —М.: Медицина, 1961. — 300 с.
Ивановская Т. Е. Особенности общих патологических процессов у детей // В кн.:
Патологическая анатомия болезней детского возраста/Ред. Т. Е. Ивановская,
А. В. Цинзерлинг. — М.: Медицина, 1976. — С. 6—11.
Ивановская Т. Е. Пренатальные инфекции // В кн.: Патологическая анатомия бо-
лезней плода и ребенка: Руководство/ Ред. Т; Е. Ивановская, Б. С. Гусман. —
М.: Медицина, 1981. — Т. 2. — С. 10—15.
КапугоМ. Биохимия старения. — М.: Мир, 1982. — 296 с.
Когой Т. Ф. Патологическая анатомия рубеолярной эмбриофетопатии // Арх. пат. —
1979. Вып. 4. — С. 62—64.
Лазюк Г. И. Общие данные о патологических процессах пренатального периода И
В кн.: Патологическая анатомия болезней плода и ребенка: Руководство / Ред.
Т. Е. Ивановская, Б. С. Гусман. — М.: Медицина, 1981. — Т. 1. — С. 5—9.
Лещинская Е. В., Келли Е. И., Мартыненко И. Н'. и др. Клиника и морфология острых
некротических энцефалитов у детей // Педиатрия. — 1985. — № 11. — С.
14—19.
Нейрогуморальная регуляция и двигательная активность при старении / Ред. А. С.
Дмитриев. — Минск: Наука и техника, 1984. — 200 с.
Патологическая анатомия болезней плода и ребенка: Руководство, 2-е изд. / Ред.
Т. Е. Ивановская, Л. Н. Леонова. — М: Медицина, 1989. — 384 с.
Робинсон М. В., Топоркова Л. Б., ТруфакинВ.А. Морфология и метаболизм лимфо-
цитов. — Новосибирск: Наука, 1986. — 128 с.
Сапин М. Р., Юрина Н. А., Этинген Л. Е. Лимфатический узел. — М.: Медицина,
1978. — 272 с.
СеровВ. В., Шехтер А. Б. Соединительная ткань. — М.: Медицина, 1981. — 312 с.
Серов В. В., Зыкова Л. Д. Старческий амилоидоз И Тер. арх. — 1987. — № 8. —
С. 14—20.
Скворцов М. А. Пупочный сепсис //В кн.: Руководство по патологической анатомии
/ Ред. М. А. Скворцов. — М., 1960. — Т. 3. — С. 425—437.
Сосудистый эндотелий / Ред. В. В. Куприянов, И. И. Бобрин, Я. К. Карачаков. —
Киев: Здоровье, 1986. — 248 с.
Струков А. И., Соловьева И. П. Морфология туберкулеза в современных условиях. —
М.: Медицина, 1976. — 256 с.
Струков А. И., Пауков В. С., Кауфман О. Я. Воспаление // В кн.: Общая патология
человека: Руководство. 2-е изд. / Ред. А. И. Струков, В. В. Серов, Д. С. Сарки-
сов. — М.: Медицина, 1990. — Т. 2. — С. 3—73.
Ступина А. С., Межиборская Н. А., Квитницкая-Рыжова Т. Ю. Ультраструктура ней-
рона при старении // В сб.: Геронтология и гериатрия. Нервная система и
старение. — Киев, 1983. — С. 28—33.
ТерновскийС. Д. Хирургия детского возраста. — М.: Медгиз, 1953. — С. 90—93.
Фролькис В. В. Старение. Нейрогуморальные механизмы. — Киев: Наукова думка,
1981. — 320 с.
613
Фролькис В. В., Мурадян X. К. Экспериментальные пути продления жизни. — Л.:
Наука, 1988. — 248 с.
Хмельницкий О. К., Ступина А. С. Функциональная морфология эндокринной сис-
темы при атеросклерозе и старении. — Л.: Медицина, 1989. — 248 с.
Цеттериипрем Р., Бенют Р., Эриксон М. Сепсис новорожденных: частота, этиология
и патогенез // Педиатрия. — 1988. — № 2. — С. 36—40.
ЧекневС. В., 'КовальчукЛ. В. Возрастные особенности активности естественных кил-
леров у здоровых доноров //В кн.: Вопросы геронтологии. Иммунитет и старе-
ние. — Киев, 1987. — С. 79—83.
ШвабР., Векслер М. Старение и иммунитет // В кн.: Вопросы геронтологии. Им-
мунитет и старение. — Киев, 1987. — С. 19—27.
Blankwater М. J. Ageing and the hutnarai immune respons in mice. — Rijswijk, Inst. Exp:
Gerontology, '1978. — 201 p.
Francois P., Gugot A., JeonD. et al. Complications de la varicelle en fonction duterrain.
Apropos de 103 observations // Pediatrie. — 1985. — V. 40, N 2. — P. 99—106.
Haaijman I., Shutt H. R., Himans W. Immunoglobulincontaining cells in different limphoid
organs CBA mouse during in lifespan // Immunology. — 1977. — V. 32, N 4. —
P. 427—434.
lensenT. L., HallgrenH. M., YasminerW. G. et al. Do immature T-cells accumulate in
advanced ege? // Meeh. Ageing Develop. — 1986. — V. 33, N 3. — P-237—245.
Kreutner A. Listeriosis. Prine. Med. Then prognancy. — New York — London, 1985. —
P. 467—469.
Makinodan 7. // In: The Handbock of the Biology of Ageing С. E. Finch and L. Hayflink
Eds. — Reinhoid, New York, 1977. — P. 379—408.
Meredith P. I., Walford R. L. Autoimmunity histocompatibility and ageing // Meeh. Ageing.
Develop. — 1979. — V. 9, N 1—2. — P. 61—77.
Norska-BorowkaJ., Godula-Stuglik U., GajewskaJ. Wpiyw perinataluych czynnikowza-
grozenia nu wyniki ieczenia posocznic u noworodkow // Pediat. Pol. — 1983. — V.
58, N 1. — S. 47—55.
Potter E, Craig G. Pathology of the Fetus and the Infant. Third Edition. — London,
1976. — P. 121—149.
Schaller J. The rheumatic disorder // In: Immunologie disorder in infants and children,
2ed / Ed. E. Stiehm, V. Fulginiti. — Philadelphia, 1980. — 518 p.
Schaller J. Paucirticular arthritis of childhood // Ann. Pediat. — 1983. — V. 30, N
8. — P. 557—563.
Segal J. Stadies on the age-related decline in the respons of lymphoid cells to mitogens
measurement of conconavalin A binding and stimulation of coicium and sugar uptake
in thymocytes from rats of varying ages // Meeh. Ageing Develop. — i986. — V.
33. — P. 295—303.
Traill К N., Schonitzer D., /urgensG. et al. Age relation changes in lymphocytes subset
proportions, surface differentiation antigen densiti and plasma membrane fluiditi:
application of the Euriige Senicur Protocol admission criteria // Meeh. Ageing
Develop. — 1985. — V. 33. — P. 39—66.
Waller P., BlotP., IvanoffB. The placental lesions in congenital suphilis // Virchows
Arch. Abt. Path. Abat. — 1982. — Vol. 397, N 3. — P. 313—326.
Weksler M. E. The influence of immune function on iifespan. // Buii. New-York Acad.
Med. — 1978. — V. 54. — P. 964—969.
YamakidoM., Takaishi M., Onari К et al. Roie of regulatory T ceil in age-related increase
of mitogen-induced IgG production in vitro by hyman lymphocytes // Hiroshima J.
Med. Sci. — 1983.' — V. 32, N 2. — P. 199—206.
К главе 9
Авцын А. П., ШройтИ. Г., ЕрманБ. А. Своеобразие воспалительных процессов при
вирусных инфекциях // Вести. АМН СССР. — 1983. — № 11. — С. 3—10.
Агеев А. К, БалябинА.А., Вяземский Л. И. и др. Сравнительная клинико-морфоло-
гическая характеристика анаэробных инфекций мирного времени // Арх. пат. —
1984. — № 1. — С. 57—63.
614
Алиев О. М. Некоторые аспекты иммунологической резистентности у больных с ожо-
говым шоком. — В кн.: III Всесоюзная конференция по проблеме: Современные
средства скорой помощи и методы лечения ожогов 11—12 декабря 1986 г..
Москва. М., 1986. — С. 209—211.
Андреева Т. В. Изменения в легких и плевре при инфицировании Serratia marcescens
// Арх. пат. — 1983. — № 5. — С. 64—66.
Архангельский А. В., Астафьева О. Г., Исупов И. В. Влияние инфракрасного лазера
на морфоэнзимологию и кислородный баланс раны в эксперименте // Арх.
пат. — 1980. — № 6. — С. 19—23.
Африканова Л. А. Острая лучевая травма кожи. — М.: Медицина, 1975. — 190 с.
Байжомартов М. С-, Прозоровский С. В., Царевский Л. П. Этиопатогенез и ускорен-
ная лабораторная диагностика микоплазменной пневмонии. — Алма-Ата: Казах-
стан, 1988. — 163 с.
Балябин А. А., Кочеровец В. И., Столбовой А. В. Неклостридиальные анаэробные ин-
фекции мягких тканей // Арх. пат. — 1983. — № 3. — С. 12—18.
Бардычев М. С., Цыб А. Ф. Местные лучевые повреждения. — М.: Медицина, 1985. —
240 с.
Барковский В. С. Влияние лазерного облучения на процесс васкуляризации ткани
после ее повреждения // Арх. пат. — 1983. — № 8. — С. 72—76.
Белянин В. Л., Керимов А. X. Видовые особенности экспериментальных кацдидозных
поражений легких // Бюлл. экспер. биол. и мед. — 1987. — Т. 103. — № 2. —
С. 224—226.
Быков В. Л. Патогенез и морфологические особенности кандидозного кольпита / /
Арх. пат. — 1986. — № 5. — С. 59—63.
Варясин В. В., Шастина Г. В. Изменения сердца при некоторых острых респиратор-
ных инфекциях у детей // Арх. пат. — 1983. — № 10. — С. 21—26.
Вишневская С. М., Панова Ю. М. Т- и В-лимфоциты у больных с ожоговой трав-
мой. — В кн.: III Всесоюзная конференция по проблеме «Современные средства
скорой помощи и методы лечения ожогов» 11—12 декабря 1986 г., Москва. —
М., 1986. — С. 194—196.
Вихриев Б. С., Бурмистров В. М. Ожоги. Изд. 1-е. — Л.: Медицина, 1981. —
163 с.
Вихриев Б. С., Бурмистров В. М. Ожоги. — Изд. 2-е. — Л.: Медицина. — 1986. —
271 с.
Войно-ЯсенецкийМ. В. Сведения и гипотезы о патогенезе малярии // Арх. пат. —
1987. — № 9. — С. 3—9.
Втюрин Б. В., Каем Р. И., Туманов В. П. Ультраструктурный анализ взаимоотноше-
ний микробов и клеток гистогематических барьеров при тяжелых ожогах кожи
// Вести, дерматол. и веперол. — 1981. — №6. — С. 18—23.
Втюрин Б. В., Каем Р. И. Ультраструктурное исследование клеток лимфатических
узлов при экспериментальной ожоговой травме // Бюлл. экспер. биол. и мед. —
1984. — № 4. — С. 506—508.
Втюрин Б. В., Каем Р. И. Ультраструктурные основы инфекционного процесса в
развитии ожогов кожи и раннего сепсиса // Вести, дерматол. и веперол. —
1985. — № 8. — С. 20—27.
Галанкин В. Н., БоцмановK.B.Q путях заживления ран, нанесенных углекислотным
лазером // Арх. пат. — 1984. — № 9. — С. 48—56.
Гаршин В. Г. О качественных изменениях воспалительных реакций под влиянием
рентгеновых лучей // Вести, рентгенол. и радиол. — 1938. — Т. 20.'— С. 292—
294.
Гуревич П С., Гусман Б. С., Еремеева А. С. и др. Бактериальные инфекции. — В кн.:
Патологическая анатомия болезней плода и ребенка. Руководство (ред. Т. Е. Ива-
новская, Б. С. Гусман). — Т. 2. — М.: Медицина, 1981. — С. 208—242.
Гусман Б. С. Кишечные иерсипиозы. В кн.: Патологическая анатомия болезней плода
и ребенка (Ред. Т. Е. Ивановская, Б. С. Гусман). — Т. 2. — М.: Медицина,
1981. — С. 229—234.
Гуськова А. К., Байсоголов Г. Д. Лучевая болезнь человека. — М.: Медицина, 1971. —
383 с.
Давыдов Б. И., Тихончук В. С., Антипов В. В. Биологическое действие, нормирование
и защита от электромагнитных излучений. — М.: Энергоатомиздат, 1984. —
176 с.
615
Дадиомова М. А. Энцефалиты при экзантемных инфекциях. — В кн.: Острые ней-
роинфекции у детей. Руководство для врачей (Ред. А. П. Зинченко). — Л.:
Медицина. 1986. — С. 158—170.
Диагностика, клиника, лечение и профилактика криптоспородиоза / Ред. Т. В.
Бейер и др. — Л.: ЛенНИИ эпидемиологии и микробиологии им. Пастера, 1987.
Дроздов С. Г., Покровский В. И., ШекаянЛ. А., Машилов В. П. Ротавирусный гаст-
роэнтерит. — М.: Медицина, 1982. — 158 с.
Елагина Г. А., Лагнилава М. Г., Гордеев В. Ф. Изменение уровня циркулирующих
иммунных комплексов и иммуноглобулина Е в крови ожоговых больных при
открытом и повязочном методах лечения. В кн.: III Всесоюзн. конф. «Современные
средства скорой помощи и методы лечения ожогов». 11 —12 декабря 1986 г.
Москва. — М.: Медицина, 1986. — С. 203—204.
Елисеенко В. И., Скабелкин О. К, Брехов Е. И, Морфология гнойной раны при ле-
чении углекислым лазером И Арх. пат. — 1984. — № 9. — С. 56—61.
Елисеенко В. И., СкобелкинО. К, Брехов Е. И. и др. Особенности микроциркуляции
и ангиогенеза при заживлении экспериментальных гнойных ран, обработанных
расфокусированным лучом углекислого лазера // Арх. пат. — 1987. — № 11. —
С. 50—54.
ЕрманБ. А., Шестопалова Н. М., Бочаров А. Ф и др. Ультраструктурная патология
нейровирусных инфекций. — Новосибирск: Наука, 1984- — 101 с.
Ерохин В. В., Уварова О. А., ГедыминЛ.Е. и др. Морфофункциональное состояние
легких при экзогенном аллергическом альвеолите // Арх. пат. — 1986. — № 7. —
С. 64—68.
Захаренко О. М. Диагностика и лечение вторичных иммунодефицитов у больных
ожоговой болезнью. — В кн.: III Всесоюз. конф. «Современные средства скорой
помощи и методы лечения ожогов», 11 —12 декабря 1986 г., Москва. — М.:
Медицина, 1986. — С. 198—200.
Захарьевская М. А. О действии рентгеновых лучей на гнойное воспаление // Вести,
рентгенол. и радиол. — 1988. — Т. 19. — С. 359—368.
Иванов А. К., Куршакова Н. И., Шиходыров В. В. Патологическая анатомия лучевой
болезни. — М.: Медицина, 1981. — 303 с.
Индикова^М. Г., Цинзерлинг В. А., Карпова О. Б. Патологическая анатомия герпети-
ческих поражений головного мозга у детей // Арх. пат. — 1986. — № 7. —
С. 47—54.
ИсачковаЛ. М., Жаворонков А. А., Антоненко Ф. Ф., Тимченко Н. ф. Патоморфо-
логия кишечника и регионарного лимфатического аппарата при псевдотуберкулезе
// Арх. пат. — 1988. — № 9. — С. 22—28.
Казанцев А. П., Попова Н. И. Внутриутробные инфекционные заболевания детей и
их профилактика. — Л.: Медицина, 1980. — 150 с.
Клименко Б. В. Трихомониаз. — Л.: Медицина, 1987. — 159 с.
Константинов Г. С., Блохин А. В. О морфологии амебиаза // Арх. пат. — 1988. —
№ 4. — С. 44—50.
Кочетыгов Н. И. Ожоговая болезнь. — Л., 1973. — 211 с.
Краевский Н. А., Иванов А. Е. Воспаление и проникающее ионизирующее излучение
// Арх. пат. — 1963. — № 8. — С. 3—14.
Кузин М. И., Колкер И. И., Сологуб В. К. Инфекция у обожженных // Клин. мед. —
1981. — № 3. — С. 93—98.
Лещинская Е В. Острый энцефалит, вызванный вирусом обычного вируса герпеса. —
В кн.: Острые нейроинфекции у детей. Руководство для врачей (ред. А. П.
Зинченко). — Л.: Медицина, 1986. — С. 138—152.
Литвинов Н. Н., Казенашев В. Ф. Особенности морфологической реакции легких
животных при воздействии различными соединениями бериллия // Гиг. труда. —
1982. — № 2. — С. 86—93.
Логинов А. С., Аруин Л. И. Клиническая морфология печени. — М.: Медицина,
1985. — 239 с.
Максимович Н. А., Горин В. И. Патологическая анатомия острых респираторных за-
болеваний и их значение в детской летальности // Арх. пат. — 1980. — № 7. —
С. 20—24.
Максимович Н. А., СуптельЕ. А., Юрчак В. Ф. Значение метода ФА в диагностике,
прогнозе и профилактике пневмоний у детей // Значение биопсии в педиатрии,
морфология болезней перинатального периода и детских инфекционных болезней:
616
Тез. докл. Ill Всесоюзн. научн. конф. дет. патологоанатомов. — Харьков, 1985. —
С. 224—225.
Мамонтов П. Н. Кишечный шистосомоз с массивным поражением легких // Арх.
пат. — 1985. — № 6. — С. 72—73.
Мельникова В, Ф., Аксенов О. А. Взаимное влияние экспериментальных гриппозной
и стафилококковой инфекций // VIII Всесоюзный съезд патологоанатомов. Тби-
лиси, 17—20 октября 1989 г. — М., 1989. — С. 62—64.
Мельникова В. Ф„ Шастина Г. В., Михайлова Л. Е. О микоплазменном плацентите
// Арх. пат. — 1984. — № 3. — С. 59—65.
Минкина А. Е., Панова Ю. М., Морозове. С. Прогнозирование инфекционных ос-
ложнений у больных с ожоговой травмой по данным реакции ГЗТ. — В кн.:
III Всесоюзн. конф. «Современные средства скорой помощи и методы лечения
ожогов», 11—12 декабря 1986 г., Москва. — М.-, Медицина, 1986. — С. 194—196.
Музыкант Л. И., Каем Р. И., Бадикова А. К, Богатова И. П. Сравнительное морфо-
логическое изучение динамики заживления ожоговых ран при различных методах
лечения // Арх. пат. — 1984. — № 3. — С. 52—59.
НагаиК, КаматаУ., ТатескаТ. Пневмоцистоз легких // Арх. пат. — 1982. —
№ 8. — С. 55—62.
Новикова А. В., Смирнова Е. А., Шебекова В. М. и др. Патологоанатомические изме-
нения при ротавирусном гастроэнтерите у детей // Арх. пат. — 1989. — № 6. —
С. 75—80.
ОреховО. О., Ермакова Н. Г., Салтыков Б. Б. Иммунопатологические реакции при
некоторых кспериментальных формах интерстициальных заболеваний легких. —
В кн.: Изучение репаративных процессов и методов их коррекции. Тез. докл. —
М., 1985. — С. 95—98.
Ориэл Дж. Д, Риджуэй Дж. Л. Хламидиоз: Пер. с англ. — М.: Медицина, 1984. —
191 с.
Пальцын А. А., Червонская Н. В., Бадикова А. К и др. Электронно-радиоавтографи-
ческое выявление бактерицидного действия полиморфноядерных лейкоцитов //
Бюлл. экспер. биол. — 1987. — № 11. — С. 637—638.
Парусов В. Н. Патологическая анатомия, патогенез и экспериментальная терапия
тяжелых форм гриппа. — Л.: Медицина. — 1981. — 192 с.
Петров И. О. (ред.). Влияние СВЧ-излучений на организм человека и животных. —
Л.: Медицина, 1970. — 230 с.
Покровский В. И., Малеев В. В., Шалыгина Н. Б. Патогенез и патологическая анато-
мия холеры. — В кн.: Холера (Ред. В. И. Покровский и В. В. Малеев). — Л.:
Медицина, 1978. — С. 9—30, 98—105.
Покровский В. В., Яркина 3. К, Покровский В. И. и др. Синдром приобретенного им-
мунодефицита и генерализованная лимфаденопатия у лиц, серопозитивных к
вирусу HLV // Тер. арх. — 1987. — № 7. — С. 35—39.
Портнов В. Г., Дронов Н. Е., Ремез И. М. Динамика иммунологических показателей
в процессе электроаэрозольтерапии ожоговых ран в эксперименте. — В кн.: III
Всесоюзн. конф. «Современные средства скорой помощи и методы лечения ожо-
гов», 11—12 декабря 1986 г., Москва. — М.: Медицина, 1986. — С. 207—209.
Преображенская Т. М. Нервно-септическая форма листериоза у мужчины 19 лет //
Арх. пат. — 1986. — № 1. — С. 65—69.
Прозоровский С. В., Покровский В. И., ТартаковскийИ. С. Болезнь легионеров. —
М.: Медицина, 1982. — 206 с.
Простой герпес (этиология, диагностика, клинико-анатомические проявления) / Ред.
А. В. Цинзерлинг. — Л.: Медицина, 1968. — 128 с.
Савичева А. М., Калашникова Е. П., ПоляковаГ. П. Внутриутробная пневмония, вы-
званная хламидиями // Акушерство, 1983. — № 1. — С. 46—48.
Самохин П. А. Цитомегаловирусная инфекция у детей (клинико-морфологические
аспекты). — М.: Медицина, 1987. — 159 с.
Саркисов Д. С., Каем Р. И., Втюрин Б. В., Туманове. П. Морфологические измене-
ния при ожоговой болезни и их значение в ее патогенезе // Хирургия. —
1980. — № 3. — С. 8—13.
Саркисов Д. С., Пальцын А. А., КолкерИ.И., Червонская Н. В. Некоторые законо-
мерности взаимоотношения лейкоцитов крови и микробов в инфекционном про-
цессе // Арх. пат. — 1983. — № 11. — С. 51—58.
Саркисов Д. С., Колокольчикова Е. Г., КолкерИ.И. и др. Морфологические и мик-
617
робиологические исследования бактериальной обсемененшости ожоговой раны и
механизма проникновения микробов в кровяное русло. — В кн.: III Всесоюзн.
конф. «Современные средства скорой помощи и методы! лечения обожженных»,
11—12 декабря 1986 г., Москва. — М.: Медицина, 198(6. — С. 48—50.
Саркисов Д. С. Электронно-радиоаутографическое исследование бактериальной ин-
вазии у тяжелообожженных // Арх. пат. — 1987. — NS 8. — С. 35—41.
Саркисов Д. С. Влияние сыворотки крови на внутри- и внекл<еточную бактерицидную
активность нейтрофилов // Арх. пат. — 1988. — № 7.. — С. 23—27.
Серов В. В., Варшавский В. А., Куприянова Л. А. Иммунопатология почек. — М.:
Медицина, 1983. — 174 с.
Серов В. В., Лапши К. (ред.). Морфологическая диагностика заболеваний печени. —
М.: Медицина, 1989. — 336 с.
Смольянников А. С. Анаэробная гангрена: Многотомное руководство по патологиче-
ской анатомии. — Т. 9. — М.: Медицина, 1964. — С. 365—385.
Смольянников А. В., Саркисов Д. С. Современное состояние проблемы патогенеза сеп-
сиса // Арх. пат. — 1982. — № 3. — С. 3—13.
Струков А. И., Кауфман О. Я. Гранулематозное воспаление и гранулематозные бо-
лезни. — М.: Медицина, 1989. — 179 с.
Струков А. И., Соловьевой. П. Морфология туберкулеза в современных условиях. —
М.: Медицина, 1986. — 232 с.
Тимофеева Г. А., Цинзерлинг А. В. Острые кишечные инфекции у детей. — Л.:
Медицина, 1983. — 309 с.
Толгская М. С., Гордон 3. В. Морфофизиологические измёнеыия при действии элек-
тромагнитных волн радиочастот. М.:'Медицина, 1971. — 134 с.
Хмельницкий О. К Гистологическая диагностика поверхностных и глубоких мико-
зов. — Л.: Медицина, 1973. — 239 с.
Хмельницкий О. К, Белянин В. Л. О кандидозе новорожденных // Арх. пат. —
1981. — № 5. — С. 21—25.
Цинзерлинг А. В. Этиология и патологическая анатомия острых респираторных ин-
фекций. — Л.: Медицина, 1977. — 160 с.
Цинзерлинг А. В. Современные аспекты инфекционной патологии у детей и плодов
//‘Арх. пат. — 1986. — № 9. — С. 7—13.
Цинзерлинг А. В. Сочетанные и смешанные инфекции в патологии человека // Арх.
пат. — 1991. — № 9.
Цинзерлинг А. В. Хламидиозы (диагностика, роль в патологии человека) // Арх.
пат. — 1989. — № 1. — С. 3—9.
Цинзерлинг А. В., АброянН. А., Комарова Д. В., Быков В. Л. (0 некоторых критериях
для морфологической диагностики СПИДа на секционном материале // Арх.
пат. — 1990. — № 11. — С. 46—51.
Цинзерлинг А. В., Богданова А. В., Загорская Н. К и др. Особенности проявлений
бронхолегочной патологии и гепатита В у детей с гипопаммаглобулинемией //
Арх. пат. — 1984. — № 3. — С. 65—69.
Цинзерлинг В. Ф., МорозА. Ф. Сравнительная оценка патологического процесса на
модели острой экспериментальной пневмонии крыс, обусловленной штаммами
Pseudomonas aeruginosa различного происхождения // Журн. микробиол. —
1984. — № 12. — С. 68—72.
Цинзерлинг А. В., Вуду Г. А. Внутриутробный микоплазмоз — Кишинев: Штиинца,
1986. — 190 с.
Цинзерлинг А. В., ИоакимоваКГ. Стрептококковая инфекция (формы и морфоло-
гические проявления) // Арх. пат. — 1987. — № 5. — С. 3—И.
Цинзерлинг А. В., Мельникова В. Ф. Инфекционные плацентиты, их влияние на плод
и развитие ребенка // Арх. пат. — 1988. — № 5. — С. 70—79.
Цинзерлинг В. А., Мурина Е. А., Аксенов О. А. и др. Некоторые вопросы патогенеза
и патоморфологии вирусно-бактериальных ассоциаций у детей, умерших от
менингококковой инфекции // Арх. пат. — 1985. — № 8. — С. 26—32.
Цинзерлинг В. А., Сорокина М. Н., ВолковаМ. О и др. Патологическая анатомия и
некоторые вопросы патогенеза пневмококковых менингоэнцефалитов у детей //
Арх. пат. — 1987. — № 4- — С. 38—45.
Цинзерлинг А. В., СиземовА.Н„ Мясникова Т. И и др. Миндалины при дифтерии
и носительстве коринебактерий дифтерии // Арх. пат. — 1980. — № 8. — С.
75—80.
618
Цинзерлинг А. В., Офенгейм М. Л., Ильенко В. И. О влиянии вирусных респиратор-
ных инфекций на возникновение и течение бактериального сепсиса // Арх.
пат. — 1982. — № 3. — С. 54—59.
Цинзерлинг А. В., Шастина Г. В., Выдумкина С. Л. и др. Вирусные поражения чер-
веобразного отростка // Арх. пат. — 1982. — № 11. — С. 17—24.
Цинзерлинг А. В., Шастина Г. В., Выдумкина С. П. О взаимоотношениях острых ви-
русных инфекций и аппендицита у детей // Педиатрия. — 1985. — № 11. —
С. 26—30.
Шастина Г. В. Поражение кишечника при острых респираторных вирусных и ми-
коплазменных инфекциях // Арх. пат. — 1986. — № 12. — С. 22—29.
Adamson I. У. R., Bowden D. Н. Role of polymorphonuclear leukocytes in siiica-induced
pulmonary fibrosis // Amer. J. Path. — 1984. — V. 117. — Bl. — P. 37—43.
Alacoque B„ Cloppet J., Dumontel C. et al. Hictological, immunofluorescent and
uitrastructural features of lymphogranuloma venereum: a case report // Brit. J. Vener.
Dis. — 1985. — V. 60 — P. 390—395.
Allegro S. R., ChaoT., Pella J. A. Acquired immune deficiency syndrome (AIDS). Light
Microscopic, uitrastructural and immunocytochemical studies of one case // J.
Submicrosc. Cytol. — 1984. — V. 16, N. 3. — P. 561—568.
Andersen L. P., Hoick S-, PovlsenC.O. et aL Campyiobacter pyloridis in peptic ucler
disease. I. Gastric and duodenal infection cused by C. pyloridis: Histopathologic and
Microbioiogic Findings // Scand. J. Gastroenterol. — 1987. — V. 22. — P. 219—224.
Argyle J. C., Schumann G. B., Kjeldsberg C. R. et al. Identification of a toxopiasma cyst
by fine-needle aspiration // Amer. J. clin Path. — 1983. — V. 80. — P. 256—258.
Azadeh C., SamadA., Ardehali S. Histological spectrum of cutaneous leishmaniasis due
to Leishmania tropica // Trans, roy. Soc. trap. Med. — 1985. — V. 79, N 5. —
P. 631—636.
Bakker D. J. Pure and mixed aerobic and anaerobic soft tissue infections // Hyperbaric
Oxygen Rev. — 1985. — V. 6. — P. 65—96.
Baranton G. Maiadie de Lyme, une terminoiogie recente pour un complexe- pathologique
oublie // Sem. Hop. Paris. — 1988. — V. 64, N 14. — P. 1005—Ю10.
Barros U., ShettyV.P., Antia N.H. Demonstration of Mycobacterium leprae antigen in
nerves of tuberculoid leprosy // Acta neuropath. — 1987. — V. 73, N 4. — P.
387—392.
Batcup J., Holt P., Hambling M. H. et al. Placental and fetai pathology in Coxsakie virus
A9 infection // Histopathology. — 1985. — V. 9. — P. i227—1235.
Bayerdorffer E., Hochter W., Schwarzkopf-Steinhauser G. et al. Bioptic microbiology in
the differential diagnosis of enterocolitis // Endoscopy. — 1986. — V. i8. — P.
177—181.
Biberfield P., Portwit A., Bergstrom A. L. et aL Pathogenic Mechanisms in the Development
of Hiv Limphodenopathy // Path. Res. Pract. — 1987. — V. 182. — P. 467.
BinazziM. Profile of Cutaneous Toxoplasmosis // Internal. Journal of Dermatology. —
1986. — V. 25. P. 357—363.
Borges de R. /., Carmona O., Machado H. etal. Chlamydial infection in Papanicolou-stained
Cervical Smears // Acta cytol. — 1984. — V. 28. — N 4. — P. 47i—476.
Cohen C.. Trapuckd S. Toxoplasma cyst with toxoplasmic lymphodenitis // Hum. Pathol. —
1984. — V. 15. — P. 396—397.
DavionT., DelamarreJ.. Sallebert S. et aL Brucellome hepatique (Necrose caseeuse
brucellienne hepatique pseudotumorale). Etude d’un cas et revue de la litterature //
Gastroenterol. Ciin. Bioi. — 1987. — V. il. — P. 424—428.
Dorfman S., Salazar F. G. De, Guillermo B. L. Balantidiasis apendicuiar. Aportacion de
dos casos // Res. esp. enferm. apar. digest. — 1984. — V. 65, N 2. — P. 167—170.
Epstein W. L. Foreing body granulomas /7 Basic and clinical aspects of granulomatous
diseases // Ed. Boros D. L., Yochida T. — New York, 1980. — P. 133—148.
Faris M. R., Perry J. J., Westermeir Th. G. Rectal syphilis mimicking hystiocytic iymphoma
// Amer. J. iin >ath. — 1983. — V. 80. — P. 719—721.
FawcettH. A., SmithN.P. Injection — site, gtanuloma due to aluminum // Arch.
Dermatol. — 1984. — V. 120, N 10. — P. 13i8—1322.
KattrunenT., NiemelaS., LehtolaJ. et al. Campylobacteriike organisms and gasritis:
histopathology, bile reflux and gastric fluid composition // Scand. J. Gastroenterol. —
1987. — V. 22. — P. 478—486.
619
Kawanami О., Basset F., Barrios R et al. Hypersensitivity pneumonitis in man. Light- and
electron-mictoscopic studies of 18 lung biopsies // Amer. J. Path. — 1983. — V.
110. — N 3. — P. 275—289.
Kelly J. К, PaiC.H., JadusinghLH. et aL The histopathology of rectosigmoid biopsies
from adults with bloody diarrhea due to verotoxin-producing Escherichia coli //
Amer. J. clin. Path. — 1987. — V. 88. — P. 78—82.
KlattE.C., PavlovaZ., TebergA.J. et aL Epidemic perinatal listeriosis at autopsy //
Hum. Pathol. — 1986. — V. 17. — P. 1278—1281.
Kleinmann D., Sarov I., Insler V. Infection of endomatrial cells with human cytomegalovirus
// Gynec. Obstet. Invest. 1984. — V. 17. — P. 89—95.
KorbiS., Toccanier M.- F., LeyvrazG. et al. Use of silver staining (Dieterle’s stain) in
the diagnosis of cat scratch disease // Histopathology. — 1986. — V. 10. — P.
1015—1021.
KoziankaJ., KozuschekW., EdelmannM. Dec Gasbrandeine «wenig bekannte» Infektion
mit hoher Mortalitat // Therapiewoche. — 1987 . — V. 37. — S. 4271 —
4292.
Krusche S., Vogel M., Schmidt R et al. Plazentautersuchung. Eine mogliche Hilfe bei dec
Friihdiagnose einer connatalen Toxoplasmose // Padiat. — Prax. — 1984. — V.
29. — S. 649—653.
Lamouliatte H., Megraud F., De Mascarel A. etaL «Campylobacter pyloridis» and epigastric
pain: endoscopic, histological, and bacteriological correlations // Gastroenterol, clin.
biol. — 1987. — V. 11. — P. 212—216.
Lipton S. A., Hickey W. F., Morris J. H. Candidal infection in the central nervous system
// Am. J. Med. — 1984. — V, 76. — P. 101 — 108.
LobeckH., Sanders К, Kretschmer R. et al. Immunohistochemical Detection of HiV —
Specific Antigens in Tissue of Patients with AIDS // Path. Res. Pract. — 1987. —
V. 182. — P. 520.
Macpherson G. G., WarrellM. J., White N. J. et al. Human cerebral malaria. A quantitative
ultrastructural analysis of parasitized erythocyte sequestration //Amer. J. Path. —
1985. — V. 119. — P. 385—401.
Magalhaes A. V., Moraes M. A., RaickA.N. et al. Histopatologia da leishmaniose
tegujnentar рог Leishmania braziliensis. 2. Resposta humoral tissular // Rev. Inst,
med. trop. Sao Paulo. — 1986. — V. 28. — P. 293—299.
Martino di L, Ecuba P., de Campora E. et aL Colite assosclata a giardlasi. Descrizione
di due casi// Minerva pediat. — 1984. — V.36. — P.635—638.
Miliauskas J. R., Webber B. L. Disseminated varicelie at autopsy in children with cancer
. // Cancer. — 1984. — V.53. — P.1518—1525.
Naprstkova J. Chlamydia Trachomatis in Pathological Pregnancy (Poster) // Path. Res.
Pract. — 1987. — V.182. — P.532.
Nielsen J., Sf/ndergaard G. Campylobacter-colitis med lysmikroskopisk pavisning af bacterien
i colondiopsler // Igeskr. Iaeger. — 1988. — V.150. — G10—Gil.
Gaafar H. A., El Assi M. N. Skin affection in rhinoscleroma //Acta Otolaryngol. —
1988. — V.105. — P.494—499.
Garcia La Osa I. C., Dehesa E. A., Gonzales P.T. etaL Algunas aspectas morfofunctionales
de ia mucosa del intestino deiagado en nines con diarreas cronicas por giardiasis//
Rev. Cub. Med. Trop.— 1987. — V.39. — P.93—99.
Gerber M. A., Sedgwick A., Mac Alister T. J. et aL The aetiological agent of cat scratch
disease // Lancet. — 1985. — V.l, N 8440. — P. 1236—1239.
Grandien M., Stenkvist-Olding E. Rapid diagnosis of viral infections in the central nervous
system // Scand. J. Infect. Dis. — 1984. — V.l6. — P.l—9.
Guarda L. A., Luna M. A., Smith J. L. et aL Acquired immune deficiency syndrome.
Postmortem findings //Amer. J. clin. Path. — 1984. — V.81. — P.549—557.
Hadfield T. L., Maluty R H., Van Dellen A. et aL Electron Micriscopy of Bacillus causing
Cat-Scratch Disease // J. Inf. Dis. — 1985. — V.l2, P.643—646.
Henkle J. O., Vijayachandran N. S. Endobronchial pulmonary nocardiosis // JAMA. —
1986. — V.256. — P.1331—1332.
Hood I. C„ Browning D., Sa de D. J. et aL Fetal Inflammatory response In second trimester
candidal chorioamniomitis //Early Hum. Dev.— 1985. — V.ll. — P.l—iO.
loashiin H. L, Lerner Ch. W., Tapper M. L. The lymphoid lesions associated with the
acquired immunod ficiency syndrome //Amer. J. Surg. Path. — 1983. — V.7. —
P.543—553.
620
Judd R-, Deckelbaum R. J., Weizman Z. et aL Giardiasis in childhood: poor clinical and
histological correlations // Isr. J. Med. Sco. — 1983. — V.19. — P.818—823.
Okuno T., Sana A., Deguchi T. et aL Pathology of acute Hepatitis В // Am. J. Clin.
Path. — 1984. — V.81. — P.162—170.
Ortego T. J., Hutchins L. E, Rice J. D. et aL Tularemic hepatitis presenting as obstructive
jaundice // Gastroenterology. — 1986. — V.91. — P.461—463.
Paakko P., Nurmi T., Sarkioja T. et aL Postmortem bacterial culture of bronchial mucus
and heart blood in hospital and non-hospital autopsies. Effects of morque time and
length of hospitalization // Zbl. Bakteriol. — 1986. — Bd 182. — S.360—371.
Piens M. Ay Garin C.. Richard-Lenoble D. etaL Premier cas du phycomycose sous-coutanee
observee an Gabon et traitee avec succes par ketoconazole // Bull. Soc. Path. Exot.
Filiales. — 1985. — V.78. — P.170—178.
Phillips D., Swenson Ch., Schachter J. Ultrastructure of Chlamydia trachomatic infection
of the mouse oviduct // J. Ultrastruct. Res. — 1984. — V.88. — P.244—256.
Post M. J. D., Chan V, Hensley G. T. et aL Toxoplasma encephalitis in Haitian adults
with acquired Immunodefeclency syndrome. A clinlcal-pathologic-CT correlation //
Дшег. J. Roentgenol. — 1983. — V.140. — P.861—868.
Racz P. Molecular, biologic, immunohistochemical, and ultrastructural aspects of lymphatic
spread of the human immunodeficiency virus // Lymphology. — 1988. — V.21. —
P.28—35.
Rauws E. A. J., Langenberg W., Houthoff H. J. et aL Histologische, kulturelle sowie
atemanalytische Nachweiserfahren und Therapie einer Campylobacter—pylori—
Basiedlung des Magens//Z. Gastroenterol. — 1987. — V.25. — Suppl. 4. — S.24—26.
Ravisse P., Rollier R. Reflexions sur 1'histopathologie de la lepre. Etude sur plus de 2300
biopsies // Bull. soc. path. exor. — 1986. — V.79. — P.172—179.
Reichert С. M., O'Leary T. J., Levens D. L et aL Autopsy pathology in the AIDS// Clin.
J. Path. — 1983. — V.l 12. — P.357—383.
Rose I., Mohnike D., Burkhardt R. Pathomorphologie von todlich verlaufenden
Enteroviruserkrankungen // Padiat. u. Grenzgeb. — 1987. — Bd 26. — S.49—51.
Salfelder K. Histopathology of deep mycoses //Zbl. Bakteriol., Mikrobiol. und Hyg. —
1986. — Bd 262. — 15S.
Schbnherr S., Pevny I. Berylliumallergie // Arbeitsmed.. Sozialmed., Praventivmed. —
1985. — V.20. — N 12. — P.281—286.
Shiina Y. Cytomorphologic and Immunocytochemical studies of chlamydial Infections in
cervical smears //Acta cytol. — 1985. — V.29. — P.683—691.
Stjennberg U., Silseth Ch., Ritiand St. Granulomatous hepatitis In Yersinia enterocoh ica
infection // Hepato-Gastroenterol. — 1987. — V.34. — P.56—57.
Tenner-Racz K. Human Immunodeficiency virus-associated changes in germinal centers of
lymph nodes and relevance to impaired В-cell function // Lymphology. — 1988. —
V.21. — P.36—43.
Thijs J. C., Bosnia A., Heuzen-Longmans S. S. et aL Postinfantile giant cell hepatitis in
a patient with multiple autoimmune features // Am. J. Gastroenterol. — 1985. —
V.80. — P.294—297.
Thurnbeer U., Nowak A., Michel M. et aL Septische Melioidose nach Aufenthalt im
indischen Subkontinent H Schweiz, med. Wschr. — 1988. — V.118. — S.558—564.
Tsutsumi V., Martinez-Palomo A., Anaya-Velazquez F. Intestinal invasive amebiasis:
ultrastructure of the early stages during the development of mucosal ulcerations // J.
Electron. Microscop. — 1986. — V.3. — Suppl. 4. — P. 3557—3558.
Van Spreeuwel J. P., Duursma G. C., Meijer C. J. L M. et aL Campylobacter colitis:
histological. Immunochemical and ultrastructural finding // Gut. — 1985. — V.26. —
P.945—951.
Veliath A. J., Bansal R-, Sankaran V. et aL Genital amebiasis// Int. J. Gynaec. Obstet. —
1987. — V.2. — P.249—256.
Vincent M., Guinet R-, Piens M. A. et aL Mucormycose pulmonaire. A propos d’un cas
confirmation serologique// Rev. malad. resp. — 1984. — V.l. — P.241—244.
Watts J. C., Chandler F. W. Pneumocystis carinii pneumonitis. The nature and diagnostic
significance of the methenamin silver-positive «intracystic bodies» //Amer. J. Surg.
Path. — 1985. — V.9. — P. 744—751.
Widen R., Carlen B., .Crons edt J. et al Intestinal spirochaetosis of the colon diagnosed
with colono-ileoscopy and multiple biopsies // Endoscopy. — 1985. — V.l7. —
P.86—88.
621 .
Wyatt J. I., Rathbone B. J., Dixon M. F. et aL Campylobacter pyloridis and acid induced
gastric metaplasia in the pathogenesis of duodenitis // I. clin. Path. — 1987. —
V.40. — P.841—848.
К главе 10
Авербах M. М. Иммунологические аспекты легочной патологин. — М.: Медицина,
1980. — 300 с.
Аруин Л. И. Морфологическое исследование материала гастробиопснй: Методические
рекомендации. — М.: М3 СССР, 1975.
Аруин Л. И., Шаталова О. Л. Межэпителиальные лимфоциты слизистой оболочки
желудка при язвенной болезни // Арх. пат. — 1981. — № 8. — С. 11—17.
Аруин Л. И., Смотрова И. А., Екисенина Н. И. Состояние процессов регенерации
слизистой оболочки тонкой кишки при целиакии И Арх. пат. — 1983. — № 8. —
С. 54—60.
Бабаева А. Г. Регенерация и система иммунитета. — М.: Медицина, 1985.
Березовский М. Е., Албац Е. И., Клембовский А. И., Сергеев В. М. Структура аль-
веолярной стенки при обструктивных ателектазах легких у детей И Арх. пат. —
1979. — № 2. — С. 25—31.
Биркун А. А., Нестеров Е. Н., Кобозев Г. В. Сурфактант легких. — Киев: Здоров'я,
1981. — 160 с.
Бобков А. Г. Некоторые общие вопросы патоморфологии и патогенеза неспецифи-
ческих заболеваний легких // Руководство по пульмонологии / Под ред. Н. В.
Путова, Г. Б. Федосеева. — Л.: Медицина, 1978. — 504 с.
Большакова Г. М. Морфология экземы по данным электронной микроскопии //
Всеросс. съезд дермато-венерологов: Тез. докл. — Казань, 1966. — С. 92—94.
Вулли Д. Е (Wolley D. Е.). Роль коллагеновых ферментов и деструкция суставов //
Ревматология. 1— 1988. — № 3. — С. 70—74.
Глумов В. Н., Пермяков А. В., Кирьянов КА., Иванова Г. С. Анализ летальности
больных острым перитонитом по данным вскрытия // Арх. пат. — 1987. — Вып.
11.*-*- С. 54—59.
Ермакова Н. Г. Хемотаксис лейкоцитов периферической крови у больных разлитым
гнойным перитонитом И Арх. пат. — 1988. — Вып. 1. — С. 59—64.
Ерохин В. В. Функциональная морфология легких. — М.: Медицина, 1987. — 272 с.
Есипова И. К Патологическая анатомия легких. — М.: Медициг а, 1976. — 181 с.
Есипова И. К Пневмосклероз // Арх. пат. — 1989. — № 3. — С. 79—84.
Есипова И. К, Евстегнеева М. В. Ателектаз легких И Сов. мед. — 1982. — № 8. —
С. 68—73.
Жаворонков А. А., Ростовщиков А. С. Патоморфология дисадаптивпых изменений
нижних дыхательных путей в высокогорье // Акт. вопр. совр. гистопатол. —
М., 1984. — С. 7—8.
Зербино Д. Д. Васкулиты и ангиопатии. — Киев: Здоров’я, 1977. — 104 с.
Зербино Д. Д, Лукасевич Л. Л., Билынская О. А. Синдром антифосфолипидных ан-
тител: патогенез н клинико-морфологические проявления // Арх. пат. — 1990. —
Вып. 4. — С. 65—69.
Кауфман О. II., Ростовщиков А. С. Функциональная морфология брюшины человека
и некоторых животных // Острый разлитой перитонит / Под ред. А. И. Струкова
и др. — М.: Медицина, 1987. — С. 5—30.
Кокосов А. II., Степанова Н. Г., Александрова Н. И. Клинико-цитологические осо-
бенности бронхов при хроническом бронхите // Клин. мед. — 1988. — № 3. —
С. 24—27.
Кононов А. В., Непомнящих Г. И., Зиновьев А. С. и др. Морфогенез хронических
воспалительных заболеваний дыхательной и пищеварительной систем И Бюлл.
Сиб. отд. АМН СССР. — 1988. — № 1. — С. 75—82.
Копьева Т. II., Амосова О. М. Полиморфноядерные лейкоциты. Роль в развитии
острых и хронических воспалений легких // Тер. арх. — 1987. — № 3. — С.
142—144.
Копьева Т. II., Агабабова Э. Р., Макарова О. В. и др. Морфология псориатического
артрита // Арх. пат. — 1985. — Т. 47. — Вып. 6. — С. 36—44.
622
Кузин М. И., Шкроб О. С., Сорокина М. И. Лечение разлитого гнойного перитонита
в терминальной стадии // Всес. съезд хирургов: Тез. докл. — Ташкент, 1986. —
С. 45—46.
Лившиц Е Г., Медне Т. А. Синдром мальабсорбции в педиатрической практике. —
Рига, 1979.
Масевич Ц. Г. Аспирационная биопсия слизистых оболочек желудка, двенадцати-
перстной и тощей кишки. — Л.: Медицина, 1967.
Непомнящих Г. И. Патологическая анатомия и ультраструктура бронхов при хрони-
ческом воспалении легких. — Новосибирск: Наука, 1979. — 246 с.
Непомнящих Г. И., Кононов А. В., Непомнящих Л. М. Иммуногистохимическая и
ультраструктурная характеристика слизистой оболочки бронхов при хроническом
воспалении // Бюлл. экспер. биол. — 1986. — № 3. — С. 359—367.
Павлова В. Н., Копьева Т. Н., Слуцкий Л. И., Павлов Г. Г. Хрящ. — М.: Медицина.
1988. — 320 с.
Пауков В. С., Петров В. И. Острый перитонит как проблема воспаления И Арх.
пат. — 1983. — Вып.П. — С. 66—74.
Пауков В. С., Кранчев А. К, Кауфман О. Я. Изменения паренхимы легких в ранние
сроки бактериальной токсемии и острого разлитого перитонита в эксперименте
// Арх. пат. — 1987. — Вып. 9. — С. 25—32.
Попова И. В., Попов М. С., Секамова С. М. О морфогенезе первичного билиарного
цирроза печени И Арх. пат. — 1988. — Вып. 2. — С. 19—24.
Рапопорт Я. Л. Некоторые вопросы патологии пересаженного сердца. Патология
интеграции // Кардиология. — 1971. — Т. 11, № 10. — С. 17—25.
Рапопо т Я. Л. Патология миокардита И Клин. мед. — 1978. — Т. 56, № 6. —
С. 7—16.
Романова Л. К Особенности ультраструктурной организации сурфактантной системы
легкого в норме и при действии некоторых патологич ских фактов И Вести.
АМН СССР. — 1983. — № 11. — С. 44—53.
Русакова М. С., Яковлева Г. И., Мульдияров П. Я. и др. Морфологические изменения
синовиальной оболочки коленного сустава в ранней стадии системной склеро-
дермии. // Вопр. ревм. — 1981. — № 4. — С. 28—31.
Рындин В. Д., Фурман В. Н., Анчия Э. П., Октавио Ф. Тропический пиомиозит,
некротический фасциит, гангрема Фурнье // Вести, хир. — 1988. — Т. 140,
№ 5. — С. 48—52.
Рябов С. С. Хронический гломерулонефрит // Клин. мед. — 1984. — № 1. — С.
24—30.
Салу пере В. П., Карнер JO. К И Ультраструктура обкладочных клеток желудка при
атрофическом гастрите И Арх. пат. — 1972. — С. 20—25.
Свистонюк И. У., Свистонюк А. В., Букения П. М. Пиомиозит // Клип. хир. —
1985. — № 1. — С. 67—68.
Секамова С. М. Морфология и некоторые вопросы патогенеза синдрома длительного
раздавливания // Арх. пат. — 1987. — Вып. 2. — С. 3—12.
Секамова С. М., Б кетова Т. П. Ф нкциональная морфология печени И Морфоло-
гическая диагностика заболеваний печени / Под ред. В. В. Серова, К. Лапиша. —
М.: Медицина, 1989. — С. 8—37.
Семенкова Е. Н. Современные проблемы системных васкулитов И Клин. мед. —
1989. — № 4. — С. 18—24..
Серов В. В. Иммунологический аспект пневмоний. Патологическая анатомия пнев-
моний. — Ташкент, 1975. — С. 3—5.
Серов В. В. Иммунокомплексная болезнь II Арх. пат. — 1981. — № 5. — С. 3—9.
Серов В. В. Функциональная морфология почек II Клиническая нефрология / Под
ред. Е. М. Тареева. — М.: Медицина, 1983. — Т. 1. — С. 9—33.
Серов В. В. Что называть гломерулонефритом: спорные вопросы классификации И
Арх. пат. — 1987. — Вып. 1. — С. 67—75.
Серов В. В. Иммунопатология / / Общая патология человека (Руководство для врачей)
I Под ред. А. И. Струкова, В. В. Серова, Д. С. Саркисова. — 2-е изд. — М.:
Медицина, 1990. — Т. 2. — С. 74—107-
Серов В. В., Лапши К Морфологическая диагностика заболеваний печени. — М.:
Медицина, 1989. — 336 с.
Серов В. В., Лебедев С. П. Клиническая морфология висцерального алкоголизма //
Вести. АМН СССР. — 1988. — № 3. — С. 48—53.
623
Серов В. В., Коган Е. А. Васкулиты // Руководство по кардиологии. Структура и
функция сердечно-сосудистой системы в норме и прн патологии / Под ред.
р. И.‘ Чазова: — М.: Медицина, 1982. — Т. 1. — С. 628—656.
Серое В. В., Шехтер А. Б. Соединительная ткаиь. — М., 1981. — 310 с.
Серое В. В., Пальцев М. А., Пеанов А. А. Перспективы иммуноморфологического
изучения гломерулонефрита И Арх. пат. — 1988. — Вып. 9. — С. 86—91.
Серов В. В., Буткевич О. М., Чумаков А. М. и др. Клинико-морфологический анализ
септического (инфекционного) эндокардита // Арх. пат. — 1982. — Т. 44,
№ 3. — С. 27—33.
Серов В. В., Варшавский А. В., Гасанов А. Б. Клинико-морфологические варианты
мезангиопролиферативного гломерулонефрита И Тер. арх. — 1990. — № 6. —
С. 22—27.
Серов В. В., Варшавский В. А., Куприянова Л. А. Иммунопатология почек. — М.:
Медицина, 1983.
Серов В. В., Дрозд Т. Н., Лебедев С. П. и др. Гранулематозный гепатит // Арх.
пат. — 1985. — Вып. 2. — С. 23—29.
Сильвестров В. П., Караулов А. В., Марциновский В. Ю. и др. О новых подходах к
диагностике хронического бронхита. Взаимосвязь функциональных и иммунных
нарушений И Тер. арх. — 1986. — № 6. — С. 84—93.
Струков А. И. Новые аспекты учения о воспалении (иммунное воспаление) // Арх.
пат. — 1981. — № 1. — С. 3—12.
Струков А. И., Кодолова И. М. Хронические неспецифические заболевания легких. —
М.: Медицина, 1970. — 255 с.
Струков А. И., Кауфман О. Я. Гранулематозное воспаление и гранулематозные
болезни. — М.: Медицина, 1989.
Струков А. И., Пауков В. С. Острый перитонит как проблема воспаления // Острый
разлитой перитонит / Под ред. А. И. Струкова и др. — М.: Медицина. 1987. —
288 с.
Струков А. И., Пауков В. С., Кауфман О. Я. Воспаление // Общая патология че-
ловека. — 2-е изд. — М., 1990. — Т. 2. — С. 3—73.
Струков А. И., Пауков В. С., Орехов О. О. Морфология, патогенез, классификация
интсфстициальпых заболеваний легких // Арх. пат. — 1984. — № 7. — С.
3—14.
Чучалин А. Г., Копылов И. Д., Даниляк И. Г., Дидковский П. А. Современная трактовка
хронических неспецифических заболеваний легких // Клин. мед. — 1980. —
№ 2. — С. 11 — 14.
Чучалин А. Г., Шмушкович Б. И. Пути диагностики и дифференцированной терапии
иммунодефицитных состояний у больных с патологией органов дыхания // Тер.
арх. — 1980. — № 3. — С. 139—147.
Чучалин А. Г. Актуальные проблемы современной пульмонологии И Тер. арх. —
1986. — № 6. — С. 15—20.
Шалимов А. А., Шапошников В. И., Пинчук М. П. Острый перитонит. — Киев:
Здоров’я, 1981.
Шварцман Я. С., Хазенсон Л. Б. Местный иммунитет. — Л.: Медицина, 1978.
Шудутко Б. И. Патология почек. — М.: Медицина, 1983.
Ярыгин П. Е., Насонова В. А., Потехина Р. Н. Системные аллергические васкули-
ты. — М.: Медицина, 1980. — 328 с.
Ященко Л. В. Изменения фагоцитирующих, лимфоидных элементов при обострении
пневмонии И Бюлл. экспер. биол. — 1977. — № 5. — С. 620—622.
Abrahamson D. R. Recent studies on the structure and pathology of basement membranes
// J. Path. — 1986. — V.l49. — N4. — P.257—278.
Alarcon-Segovia D., Cardiel M. H., Reyes E. Antiphospholipid arterial vasculopathy //
J. Rheumatol. — 1989. — V.l6, N6. — P.762—767.
Alderson M., Speers D., Emslie К et aL Acute haematogenous osteomyelitis and septic
arthritis — a single disease. A hypothesis based upon the presence of transphyseal
blood vessels 11 J. Bone Jt. Surg. (Br.). — 1986. — V. 68, N 2. — P.268—274-
Altman H. Die granuldmatosen Reactioncn dec Leber // Verh. dtsch. Ges. Path. —
1980. — Bd 64. — S.152—177.
Arahata K, Engel A. G. Monoclonal antibody analysis of mononuclear ceiis in myopathies.
I. Quantitation pf subsets according to diagnosis and sites of accumulation and
624
demonstration and counts of muscle fibers invaded by T-celis // Ann. Neurol. —
1984. — V.16. — P.193—208.
Bend J. R-, Serabjit-Singh С. I. Comparative biochemistry of the lungs: importance of
cellular heterogenlty 11 B. G. A. Schriften. — 1986. — N 4. — P.61—93.
Berthoux F. C., Laurent B.. Le Petit J. C. et aL Immunogenetics and immunopathology
of human primary membranous glomerulonephritis // Clin. Nephrol. — 1984. —
V.22. — P.15—20.
Bianchi L. Necroinflammatory liver disease // Seminars In liver disease. — 1986. — V.6,
N 3. — P.185—198.
Bienenstock J. Bronchus associated lymphoid tissue and the source of immunoglobulon-
containing ceiis In the mucosa // Environm. Health Prespect. — 1980. — V.35. —
P.39—42.
Bienenstock J., Befus A. D. Review mucosal Immunology// J. Immunol. — 1980. —
N 41. — P.249—270.
Boom B. W., Mommaas M., Doha M. R., Vermeer B.-J. Complement-mediated endothelial
cell damage in immune complex vasculitis of the skin: uitrastructural localization of
the membrane attack complex// J. Invest. Dermatol. — 1989. — V.93, Suppl. N 2. —
P.68S—72S.
Bork К Pathophysiologic der Blasenbildung // Dermatologia in Praxis und Klinik /Hrsg.
G. W. Korting.-Stuttgart, New York, 1980. — Bd 1. — S.8.49—8.60.
Brandisaeg P., Sieliad L. M., Thraue P. S. et aL Lymphoepithelial interactions in the
mucosal immune system // Gut. — 1988. — V.29. — P.1116—1130.
Brasile L., Kremer J. M., Clarke J. L., Cerilli J. Indentiflcation of an autoantibody to
vascular endothelial cell-specific antigens in patients with systemic vasculitis// Amer.
J. Med. — 1989. — V.‘87, N 1. — P.74—80.
Bromley M., Bertfield H., Evanson J. M. et aL Bidirectional erosion od certilage in the
rheumatoid knee joint // Ann. Rheum. Dis. — 1985. — V.44, N 10. — P.676—681.
Burnett D., Crocker J., Stockley R. A. Cells containing IgA subclass in bronchi of subjects
with and without chronic obstructive lung disease//J. Clin. Path. — 1987. — N 40. —
P.1217—1220.
Canlin-Glaser T., Emancipator S. H., Gallo G. R-, Lamm M. E. Chargerelated deposition
of immune complexes in the glomerular basement membrane is independent of Fc-effector
function // Am. J. Path. — 1985. — V.U9, N 2. — P.288—293.
Carpenter С. B. Primary renal disease and the major histocompatibility complex (IILA)//
Clin. Immunol. Allergy. — 1986. — V.6, N 2. — P.383—394.
Carpenter S., Karpati G. Pathology of skeletal Muscle. — New York: Churchill Livingstone
Inc., 1984.
Cerny A., Kimoto M., Hugin A. W. et al. Anti-IgM treatment of C57B1/6—ipr/lpr mice:
depletion of В celle reduces Ipr geneinduced limphoproliferation and mononuclear
cell vasculitis// Clin. exp. Immunol. — 1989. — V.77, N 1. — P.124—129.
Chan C., Nussenblatt R., Fujikawa L. et aL Sympathetic ophthalmia: immunopathologic
Findings // Ophthalmology. — 1986. — V.93. — P.690—695.
Chan C., Wetzig R., Palestine A. et aL Immunohistopathology of occular sarcoidosis //
Arch. Ophthalmol. — 1987. — V.105. — P.1398—1402.
Chren M.-M., Silverman R. A., Sorensen R. IL, Elmets C. A. Leukocytoclastic vasculitis
in a patient with human immunodeficiency virus // J. Amer. Acad. Dermatol. —
1989. — V.21, N5, Pt.2. — P.1161—1164.
Cotnola M., Johnson M. A, Howel D., Brunsdon C. Spatial distribution of muscle necrosis
in biopsies from patients with inflammatory muscle disorders // J. Neurol. Sci. —
1987. — V.82, N 1—3. — P.229—244.
Conn D. L. Update on systemic necrotizing vasculitis // Mayo Clin. Proc. — 1989. —
V.64. N 5. — P.535—543.
Correa P. Chronic gastritis: a dinlco-pathological classiflcation//Am. J. Gastroenterol. —
1988. — V.83. — P.504—509.
Cotran R. S. Tubulo-intersticial nephropaties. — New York — London, 1983. — 381 p.
Cotran R. S., Pober J. S. Endothelial activation. Its role In Inflammatory and immune
reactions // Endothelial Celi Biology in Health and Disease /Eds. N. Simonescu, M.
Simonescu. — New York, London: Plenum Press, 1988. — P.335—347.
\J Couser W. G. In situ formation of immune complexes and the role of complement activation
in glomerunephrltis // Clinics in Immunol. Allergy. — 1986. — V.6, N 2. — P.287—306.
Danielle R. P. Immune defenses of the lung // Pulmonary diseases and disorders /Ed.
625
A. P. Fischman. — N. Y., St. Lois, London, Sydney. Tokio: M. C. Grav-Hill Book
Company, 1980. — P.624—633.
Davies M. J. Pathology of cardias valver. — London—Boston: Butterworths, 1980.
Degitz K, Kind P., Lakomer H. J., Goerz G. Livedo racemose bei Nachweis von Anti-
Phospholipld-Antikorpern// Hautarzt. — 1989. — Jg. 40, H.7. — S.437—440.
Delaitre B., AttalUa A., Chihnaoni M. Ulceros gastroduodenoux perforas traltement par
dialys peritoneale // Press med. — 1988. — V.17, N 25. — P.1297—1300.
Dienes H. P. Autoimmune hepatitis — new aspects of histopathology, fine structure and
immunohistology H7JA. allg. Path. path.Anat. — 1988. — Bd 134. — S.143—152.
Dykstra C. D., Dopp E. A., Vogels I. M. et aL Macrophages and dendritic celis In
antigen — induced arthritis // Scand. J. Immunol. — 1987. — V.26, N5. —
P.513—523.
Dorr W., Mattfeldt T. Endokarditis-pathologische-anatomisch Gesehen // Dtsch. Arztbl. —
1986. — V.83. — S.37—46.
Dunnil M. Pulmonary pathology. — Edinburgh, 1980.
Eddeleston A. L. Immunology of chronic active hepatitis // Quart. J. Med. — 1985. —
V.55, N218. — P.191—198.
Eggers H.J., Biiltmann B. D. Virus und Herz // Verh. Dtsch. Ges. Path. — 1981. —
V.65. — S.127.
Ferguson A. Intraepithelial lymphocytes of the small Intestine // Gut. — 1977. — V.l8. —
P.921—937.
Freedman A. R., Macartny J. C., Nelujer J. M., Ciclitira P. J. Timing of T-lymphocytes
induced by gluten Into small intestine in coeliac disease 111. Clin. Path. — 1987. —
V.40. — P.741—745.
Fritz P., Mischlinski A., Gran A. et aL In situ evaluation of immunoglobulin synthesis of
synovial plasms celis in rheumatoid artritis and osteoarthritis by plug photometry //
Pathol. Res. Pract. — 1986. — V.181, N 2. — P.243—248.
Furness P. N., Turner D. R., Cotton R. E. Basement membrane charge In human glomerular
disease // J. Path. — 1986. — V.150, N 2. — P.267—278.
Glass G.B.J. Immunology of atrophic gastritis // N. St. J. Med. — 1977- — V.ll. —
P.1697—1706.
Goldman M. Autoimmune gfom rulonephntis: new concepts and therapeutic perspectives
II Rev. Med. Brux. — 1988. — Now. Spec. — P.71—78.
Grau G. E., Roux-Lombard P., Gysler C. et aL Serum cytokine changes in systemic
vasculitis // Immunology. — 1989. — V.68, N 2. — P.196—198.
Guix M., Skinner J. M., Whitehead R. Morphometric electron and light mlcrospoce analysis
of lymphoid cells in соёПас disease //J. Gastroenterol. — 1979. — V.l 4. —
P.261—265.
Hamashima V. Immunohistopathology. — Stuttgart, 1976.
Hara M., Mase D., Inaba S. et aL Immunohistochemical localization of glomerular basement
membrane antigens in various renal diseases // Virchows Arch.(A). — 1986. —
•V.408. N 4. — P.403—420.
Hebert L. A., Cosio F. G. The erythrocyte-immune complex glomerulonephritis connection
in man // Kidnes Int. — 1987. — V.31, N4. — P.877—885.
Helmke К Immunologische Aspekte bei entziindlichen Erkrankungen des Intestinaltraktes
// Immun. und Infekt. — 1978. — Bd 1. — S.15—27.
Henderson B., Revell P. A., Edwards J. C. Synovial lining cell hyperplasia in rheumatoid
arthritis: dogma and fact // Ann. Rheum. Dis. — 1988. — V.47, N 4. — P.348—349.
Heurkens A. H. M., I Hemstr a P. S;, Lajeber G. Y. M. et al. Anti-endothelial cell antibodies
in patients with rheumatoid arthritis complicated by vasculitis // Clin. exp. Immunol. —
1989. — V.78, N 1. — P.7—12.
Hoot J., Hamichi L., Walletz L, Mainnguet P. Lymphocytic gastritis: a newley described
entity// Gut. — 1988. — V.29. — P.1258—1264.
Huang К W., Chen X. H. Pathology of eosinophilic fasciitis and Its relation to polymyositis
// Can. J. Neurol. Sci. — 1987. — V.l4, N 4. — P.632—637.
Okeya M., Nagase M., Honda N. Intraglomerular distribution of fibronectin In primary
glomerular disease // Clin. Nephrol. — 1985. — V.24, N 2. — P.53—59.
Jackson E. C., McAdam A. J., Strife C. F. Differences between mambranoproliferative
glomerulonephritis typus I and III in clinical presentation // Amer. J. Kidney Des. —
1987. — V.9, N2. — P.115—120.
Jayne D. R. W., Jones S. J., Severn A. et aL Severe pulmonary hemorrhage and systemic
626
vasculitis In association with circulating antineutrophil cytoplasma antibodies of IgM
class only // Clin. Nephrol. — 1989. — V.32, N 3. — P.101—106.
Jennette J. C., Wilkman A S., Falk R J. Anti-neutrophil cytoplasmic autoantibody-
associated glomerulonephritis and vasculitis// Amer. J. Path. — 1989. — V.l35. —
N 5. — P.921—930.
Johnson R. J., Conser W. G., Ohi E. V. et aL New mechanism for glomerular injury.
Myeloperoxidase-hydrogen peroxide-halide system // J. Clin. Invest. — 1987. —
V.79, N5. — P.l379—1387.
Katayama I., Masuzawa M., Nishioka K, Nishiyama S. Anticardiolipin antibody in
Henoch-Schonleln purpura and related vascular disorders // Arch. Dermatol. Res. —
1989. — V.281, N 4. — P.296—298.
Kerjaschki D., Sawada H., Farquhar M. G. Immunoelectron microscopy In kidney research:
some contribution and limitations ll Kidney Int. — 1986. — V.30, N 2. — P.229—245.
Kotler D. P., Scholes J. V., Tierney A R. Intestinal plasma cell alteration In acquired
immunodeficiency syndrom // Digestive Disease and Science. — 1987. — V.32. —
P.129—138.
Lang B. A, Silverman E. D., Laxer R M., Lau A S. Spontaneous tumor necrosis factor
production in Kawasaki disease // J. Pediat. — 1989. — V.l 15, N 6. — P.939—943.
Lie J. T. Classification and immunodiagnoisis of vasculitis: a new solution or promises
unfulfilled? J. Rheumatol. — 1988. — V.15, N5. — P.728—732.
Lockwood С. M. Autoimmune responses in systemic vasculitis //Amer. J. Nephrol. —
1989. — V.9, Suppl. 1. — P.30—32.
Ludwig J. Ethiology of biliary cirrhosis: diagnostic features and a new classification //Zbl.
allg. Pathol, path. Anat. — 1988. — Bd 134, N 2. — S.132—141.
Mac Sween R., Sand Hand G. P., Whaley К The morphology and’immunology or primere
biliary cirrhosis // Frontiers in liver disease /Eds. P. D. Berk, T. C. Chalmers. —
New York, 1981. — P.255—268.
Mannich M., Gauthier V. J., Stapleton S. A., Agodoa L. V. C. Immune complexes with
cationic antibodies deposit In glomeruli more effectively than cationic antibodies alone
// J. Immunol. — 1987. — V.138, N 12. — P.4209—4217.
Marcs S. C., Popoff S. N. Bone cell biology: the regulation of development, structure and
function In the skeleton // Am. J. Anat. — 1988. — V.183, N 1. — P.l—44.
Matsumoto К, Okano K, Hatano M. Defective in vitro T cell colony formation in patients
with membranous nephropathy // Nephron. — 1986. — V.42, N 1. — P.91—92.
McCarthy E. P., Hsu A., Got Y. M., Ooi B. S. Modulation of mouse mesangial cell
proliferation by macrophage products // Immunology. — 1985. — V.56, N 4. —
P.695—700.
McCluskey R. T., В han A. К Cell-mediated immunity In renal disease // Human Path. —
1986. — V.17, N 2..— P.146—153.
Melvin T., Michael A. F. New insights into the pathogenesis of minimal change disease
// Clin. Immunol. Allergy. — 1986. — V.6, N 2. — P.331—352.
Meyer Zum Biischenfelde K.-H., Manus M. Mechanismus of autoimmune liver disease //
Semin. Liver Dis. — 1984. — V.4, N 1. — P.26—35.
Minor R. L, Baum S., Schulze-Delrieu К S. Pyomyositis in a patient with progressive
systemic sclerosis. Case report and review of the literature // Arch. Intern. Med. —
1988. — V.148, N6. — P.1453—1455.
Moore P. M. Ymmune mechanisms in the primary and secondary vasculitis // J. Neurol.
Sci. — 1989. — V.93, N 2—3. — P.129—145.
Mori W., Shiga I., Irie II. Shwartzman reaction as a pathogenetic mechanism in fulminant
hepatitis // Semin. Liver Dis. — 1968. — V.6, N 3. — P.267—276.
Muckerheide A., Apple R. J., Pesce A J., Michal J. G. Cationization of protein antigens.
I. Alteration of Immunogenic properties //J. Immunol. — 1987. — V.138, N 3. —
P.833—837.
Neild G.H. Coeliac disease // Lancet. — 1981. — V.l. — P.812—812.
Norden C. N. Lessons learned from animal models of osteomyelitis //Rev. Infect. Dis. —
1988. — V.10, N 1. — P.103—110.
Okada K, Kawakami K, Miyao M., Oite T. Ultrastructural alterations of glomerular
anionic sites in idiopathic membranous glomerulonephritis // Clin. Nephrol. — 1986. —
V.26, N 1. — P.7—14.
Olsen E.G.J. The pathology of the heart, 2ed. — London: Macmilan, 1980.
Otto II. F., Wanke M., Zeitlhofer J. Darm und Peritoneum // Spezielle pathologische
627
Anatomle// Hrsg. W. Doerr. G. Seifert. F. Uehlinger. — Berlin: Springer. 1976. —
Bd 2. — T.2.
Popper H. General pathology of the liven light microscopic aspects serving diagnosis and
interpretation Ц Semin. Liver Dis. — 1986. — V.6, № 3. — P.175—184.
Popper H., Paronetto F., Schaffner F. Immune processes in the pathogenesis of liver
disease П Ann. N. Y. Acad. Sci. — 1965. — V.124. № 30. — P.781—799.
Poralla T., Ramadori G., Dienes H. P. et aL Liver cell demage caused by monoclonal
antibody against an organ-specific membrane antigen in vivo and in vitro //J.
Hepatol. — 1984. — V.4, N 3. — P.373—380.
Rappaport A. M. Physioanatomic considerations // Diseasis of the liver /Eds. L. Schiff,
E. R. Schiff. — Philadelphia, Toronto: J. B. Lippincoft Company, 1982. — 1681 p.
Remmele W. Jejunum und Ileum // Pathologic / Hrsg. W. Remmele. — Berlin: Springer,
1984. — Bd 2. — S.251—322.
Reyes-Flores О. H Int. J. Dermatol. — 1986. — V.25, № 3. — P.158—165.
Rohrbach R. Reduced content and abnormal distribution of anionic sites (arid proteoglycans)
in the diabetic glomerular basement membrane // Virchows Arch. (A). — 1986. —
V.51, N 2. — P.127—136.
Rubin E, Schaffner F., Popper H. Primary biliary cirrhosis // Am. J. Path. — 1965. —
V.46, N 3. — P.387—407.
Salisbury A. JC, Duke O., Paulter E W. Macrophage-like- cells of the pannus area in
rheumatoid arthritis joints 11 Scand. J. Rheumatol. — 1987. — V.16, N 4. —
P.263—272.
Savilathi E., Viander M., Perkkio M. et aL IgA antigliadin antibodies // Lancet. —
1983. — V.l. — P.320—322.
Schmalbruch P. IL, Oksche A., Vollrath L. Skeletal Muscle. — Berlin, Heidelberg. New
York, Tokyo: Springer-Verlag, 1985. — 440 p.
Schneider W., Kaltenbach M. Perimyokarditis // Dtsch Arztbl. — 1982. — V.79. —
S.33—44.
Scholmerich P., Theile U., Hoppe B. Acute Pericarditis 11 Dtsch. Arztbl. — 1980. —
V.78. — S.369—380.
Schreiber D. Haut 11 Spezielle Pathologie /Hrsg. D. Schreiber. — Jena, 1968. — T.l. —
S.540-«-j631.
Siddiqui IL M., Waghdikar U. E, D'Costa G. F. Primary sclerosing cholangitis // Indian
J. Path. Microbiol. — 1988. — V.l69, N 2. — P.60—63.
Silvestri F., Bussani R., Cosatti C., Giarelli L. Acute complication during infective
endocarditis at autopsy// 17th Int. Congr. Int. Acad. Path, and 8th World Congr.
Acad, and Environ. Path.//Dublin, 1988. — Book Abstr. — P.175.
Snover D. C., Freese D. K., Sharp II. E et aL Liver allograft rejection. An analysis of
the use of biopsy in determining outcome of rejection // Am. J. Surg. Path. —
1987. — V.U, N 1. — P.1 — 10.
Snover D. C., Weisdorf S. A., Ramsay N. K. et aL Hepatic groft versus host disease: a
study of the predictive value of liver biopsy in diagnosis II Hepatology. — 1984. —
V.4, N 1. — P. 123—130.
van Spreeuwel J., Lindeman J., Meijer C. Quantitative analysis of immunoglobulin
containing cells in gastrointestinal pathology // Int. Aead. Cytol. — 1986. — V.8. —
P.314—320.
Stainenkovic I., Sreyagno M., Wright K. et aL Clonal dominance among T-lymphocyte
infiltrates In arthritis // Proc. Nat. Acad. Sci. USA. — 1988. — V.85, N 4. —
P.1179—1183.
Striker G. E., Striker E J. Glomerular ceii culture // Lab. Investig. — 1985. — V.53,
N 1. — P.122—131.
Tsilibary E. C., Wisslg S. E Lymphatic absorption from peritoneal cavity: regulation of
patency of mesothelial stomate II Microvasc. Res. — 1983. — V.25, N 1. — P.22—39.
Valens X., Brandtzaeg P., Elgjo K., Stave R. Quantitative distribution of immunoglobulin
producing cells in gastric mucosa // Gut. — 1986. — V.27. — P.505—515.
Van der Woude F. J., Doha M. R., Van Es E A. The current status of neutrophil
cytoplasmic antibodies // Clin. exp. Immunol. — 1989. — V.78, N 2. — P.143—148.
Vercasalo M. A. Adherence of gliadin fractions of limphocytes in coeliacs disease //
Lancet. — 1982. — V.l. — P.1384—1386.
Warren J. S-, Mander D. M., Johnson K. J., Ward P. A. Evidence for the role of platelet
628
activating factor in immune complex vasculitis Hi. Clin. Invest. — 1989. — V.83.
N 2. — P.669—678.
Willoughby C. P-, Pins J., Truelove S. C. Tissue eosinophils in ulcerative colitis // Scand.
J. Gastroenterol. — 1979. — V.l4. — P.395—399.
Warlock P., Slack R-, Harvey L., Mawhinney R An experimental model of port-traumatic
osteomyelitis in rabbits// Brit. 3. exp. Path. — 1988. — V.69, N 2. — P.235—244.
Zax R. H., Hodge S. J., Callen J. P. Cutaneous leukocytoclastic vasculitis: serial
histopathologic evaluation demonstrates the dynamic nature of the Infiltrate //Arch.
Dermatol. — 1990. — V.126, N 1. — P.69—72.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Абсцесс 187
Актиномикоз 398
Аллергодерматозы 585
— аллерготоксическая сыпь 586
— крапивница 586
Альвеолит аллергический экзогенный 479
— фиброзирующий идиопатический 479
Альтерация см. Повреждение
Амебиаз 417
Апоптоз 506
Анти медиаторы воспаления 97
— — понятие 97
Арилсульфатаза 148
Артрит 574
Аскаридоз 426
Аспергиллез 411
Аутоиммунизация, сущность и механизм раз-
вития 241
Аэрозоли 432
Балантидиаз 418
Биогенные амины 83
— — гистамин 83
— — серотонин 84
Биохимия воспаления 39
Бластомикоз Гилькриста 410
— северноамериканский 592
Болезнь (и) аутоиммунные, принципы клас-
сификации 246
— — морфология 248
— «кошачьих царапин* см. Фелиноз
— Крона 493
— округа Лайм 382
— «трансплантат против хозяина* 517
— Уиппла 492
— Шагаса южноамериканская эндемическая
552
Боррелиозы 382
Ботулизм 397
Бромодерма 587
Бронхит 469
— острый 472
— хронический 472
Бронхоассоциироваиная лимфоидная ткань
(БАТЛ) 471
Бруцеллез 387
Брюшина 482; 495
Васкулит(ы) 559
— вторичные 559
— деструктивный 565
— кожи Руитера поверхностный аллергиче-
ский 586
— лейкокластический см. Аллергический по-
верхностный васкулит кожи Руитера
— морфологическая характеристика 565
— патогенез 560
— первичные 559
— продуктивный 566
— экссудативный 566
ВИЧ-инфекция см. Синдром приобретенного
иммунодефицита
В-лимфоциты 151
— система 158
Влияния нервно-трофические, значение 268
— — механизмы 268
— — на разных уровнях нервной системы
271
Воспаление 74
— анти медиаторы 97
— биохимия 39
— бронхиол 474
— бронхов крупных 472
— — мелких 474
— геморрагическое 189
— гнилостное 189
— гнойное 186
легких 479
— гуморальше гомеостатические системы 52
— гранулематозное 192
— интерстициальное диффузное 191
— и аутоиммунизация 241
— — возраст 297
— — иммунитет 219
— — иммунодефицитные состояния 250
— — нервная трофика 262
— — нервно-трофическая функция 275
— — оптическое излучение 454
— особенности при инфекциях, вызываемых
другими микроорганизмами 400
— — реакции гиперчувствительности 225
— — фибринолиз 77
— и хо роз ное см. Воспаление гнилостное
— катаральное 189
— — пролиферативное см. Воспаление кожи
продуктивное
— медиаторы 79, 81
— — классификация 81
— — основные группы 83
— — характеристика 83
— место в биологии и медицине 30
— морфология 100
— — эффекторные клетки 100
— особенности при инфекциях, вызываемых
бактериями 350
— продуктивное 190
— — интерстициальное 191
— при лучевой болезни 453
— серозное 184
— стадии 176
— сущность 30
— участие факторов свертывания крови 78
— фибринозное 184
— физиология 39
— 4»рмы 183
— экссудативное 184
Гангрена анаэробная 395
— легкого 383
Гастрит атрофический 484
— острый 484
— поверхностный 484
— хронический 484
— — типа А 488
В 488
Гастроэнтериты вирусные 350
Геликобактериоз 385
Гемофилез 386
Геотрихоз 409
Гепатит 506
630
— аутоиммушый 513
— вирусный 348
— — фульминантный острый 509
— — — подострый 509
— лобулярный 513
— пери портальный 512
— портальный 513
Герпес внутриутробный 344
— приобретенный в постнатальном периоде
345
— простой 344
Гидроперекиси липидов 90
Гименолепидозы 425
Гиперчувствительность замедленного типа
(ГЗТ) 226; 227
— немедленного типа (ГНТ) 226; 227
Гистоплазмоз 410
Гломерулонефрит 519
— лобулярный 533
— мезангиокапиллярный 532
— мезангиопролиферативный 529
— мембранопролиферативный см. Гломеру-
лонефрит мезангиокапиллярный
— острый 525
— — затянувшийся 525
— подострый 528
— продуктивный экстракап иллярный 528
— склерозирующий см. Гломерулонефрит
фибропластический
— фибропластический 533
— характеристика иммуногистохимическая
525
---морфологическая 522
— хронический 528
Гомеостаз, активация тромбоцитарного звена
52
Гонорея 362
Гранулематоз 239
Гранулоциты ацидофильные см. Гранулоциты
эозинофильные
базофильные 137
— эозинофильные 137
Дизентерия 365
Дисрегснерация 213
Дифиллоботриозы 425
Дифтерив 392
D-клетки 151
Дракункулез 426
Желудок 482, 483
Заболевания воспалительные респираторные
428
— вызываемые бактериями коринеформными
392
— — вирусами семейства Herpesviridae 344
— — — — Poxvitidae 347
— — — другими 348
— — гельминтами 420
— — — класса Cestoda 423
— — — — Nematoda 425
— — — — Trema tod а 421
— — грибами 407
— — — класса Ascomycetes 411
--------— Deuteromycetes 408
— — — — Phy соту се tee 411
— — кокками грамотрицательными 360
— грам положительны ми 354
— — — семейства Micrococcaceae 354
-----------Neisseriaceae 360
— —------Streptococcaceae 357
— — микроорганизмами семейства Clamydiaceae
404
— Mycoplasmatoceae 400
----— — Rickettsiaceae 399
— — палочками грамотрицательными 363
— — — грам положительным и 388
— — — семейств (a) Bacillaceae 395
-----------Других 398
— Enterobacteriaceae 363
— — — — Legionellaceae 384
-----------Mycobacteriaceae 388
— —------Pseudomonadaceac 377
— —------Spirillacea 385
— — — — Spirochaetaceae 379
--------— Vibrionaceae 376
--------с неясным положением в система-
тике 385
----простейшими 411
— инфекционно-аллергические 431
— токсико-аллергические 586
— - — многоформная экссудативная эритема
586
— — острый токсический некролиз 587
Излучения 445
— оптическое и воспаление 454
— рентгеновское, влияние иа воспаление 446
— электромагнитное, влияние на воспаление
456
Иерсиниоз (ы) 374
— кишечный 375
Инфекция (и) внутриутробные 431
— герпетическая см. Герпес простой
— кищечные 429
— менингококковая 361
— пневмококковая 359
— синегнойная см. Псевдомоноз
— смешанные 427
— сочетанные 427
— стафилококковая 354
— стрептококковая 357
Йодерма 587
Кандидоз 408; 591
Кислородные радикалы 90
Кишечник 482; 489
Клебсисллезы 370; 428
К-клетки 151
— Лангерганса 126
— микроглиальные i 26
— тучные 137
Клеточная рецепция 222
Кожа 580
— виды воспаления 581
-----— аллергическое 585
-----— геморрагическое 584
----- — гнойное 583
-----— гранулематозное 589
-----------иммунодефицитное 589
-----------— — с неустойчивым иммунитетом
589
— — — продуктивное 584
— — — серозное 581
— воспалительные заболевания 585
Коклюш 385
Кокцидиоидомикоз 410; 592
Колит острый 489
631
— хронический 489
Коллаген, синтез, секреция, фибриллогенез
и катаболизм 170
Коллагенобласты 166
Коли инфекция кишечная 368
Колониестимулирующий фактор (КСФ) 146
Криптококкоз 410
Криптоспоридиоз 418
Ку-лихорадка 400
Лаброциты 137
— базофильные 137
— слизистых оболочек 139
— соединительной ткани 139
Легионеллез 384
Лейкоциты полиморфно-ядерные 100
Лейшманиоз 415
— американский мукокутанный 592
— висцеральный 415
— кожный 416
-----диффузный 593
Лепра 391; 590
— форма лепроматозная 391
-----туберкулоидная 391; 392; 591
Лептоспирозы 381
Лимфокины 148
Лимфоциты 151
— особые типы 162
Листериоз 394
Лихорадка марсельская 400
— пятнистая Скалистых гор 400
— окопная 400
— Цуцугамуши 400
Лямблиоз 416
Мадуромикоз 410
Макрофаги 115
— в очагах воспаления 126
— — — — острого 126
—-------— хронического 126
— как клетки секреторные 134
— — — фагоцитарные 134
— костного мозга 123
— легочные 121
— лимфатических узлов 123
— печени 122
— разновидности 120
— селезенки 123
— соединительной ткани (гистиоциты) 120
— эпидермальные 126
Малярия 414
— трехдневная 414
— тропическая 415
— четырехдневная 414
Медиаторы взаимодействия в динамике вос-
паления 95
— воспаления 221
— лейкоцитов полиморфно-ядерных 92
— лимфоцитов 92
— моноцитов 92
Мелиоидоз 379
Менингит менингококковый гнойный 361
Меиингококкемия 361
Миозит 571
Миокардит 548
Механизм (ы) нервно-трофических влияний
268
— ограничения тромбообразования 71
зависимый от эндотелия 72
— — — нарушение при воспалении 71
— положительных обратных связей между
клетками крови 70
— —* — — — гуморальными и клеточными
медиаторами воспаления 70
— — —-------эндотелия 70
Микозы глубокие 409
Микоплазмоз внутриутробный 401
— респираторный 401
Миокардит гигантоклеточный 555
— гиперчувствительиый см. Миокардит ле-
карственный
— гнойный 551
— дифтерийный 555
— идиопатический Абрамова—Фидлера 549
— интерстициальный эозинофильный 552
— инфекционно-аллергический 552
— инфекционно-токсический см. Миокардит
дифтерийный
— инфекционный 549
— лекарственный 556
— паразитарный 551
— ревматический 554
— токсический 555
— Шагаса 552
— эозинофильный см. Миокардит лекарст-
венный
Миофибробласты 167
Монокины 148
Мукороз 411
Мышцы 569
Насморк зловонный см. Озена
Нейроинфекции 430
Некроз(ы) ацидофильные 506
— массивные 507
— мостовидные 508
— — портопортальные 508
— — центропортальные 508
— — центроцентральные 508
— пятнистые 506
— ступенчатые 507
— цитолитические 506
Нервная трофика и межклеточное взаимо-
действие 266
— — расстройства 273
Нефрит тубулоинтерстициальный 535
— — иммунный острый 537
— — — хронический 539
— — —• характеристика иммуноморфологи-
ческая 536
— — —* — патогенетическая 536
N К-клетки 151
Нокардиоз 398
Ожоги 457
Озена 371
Q-клетки 151
Описторхоэ 421
Органы лимфоидные периферические 152
— центральные 152
Орнитоз см. Хламидиоз респираторный
Оспа натуральная 347
Острица 426
Паратиф 365
Пары веществ отравляющих де иста и я кож-
но-нарывного 439
— * — удушающего 439
Паннус костномозговой 579
синовиальный 577
632
Паракокцидиом икоз 410
Перикардит (ы) 557
— бактериальный неспецифический 557
— вирусный 558
— вторичные 557
— идиопатический см. Перикардит изолиро-
ванный первичный
— изолированный первичный 557
— туберкулезный 557
— уремический 558
Перитонит 495
Печень 504
Плазменные полипептиды и белки 83
— — гемостаза 86
— — кининов 85
— — фибринолиза 86
— — фрагменты комплемента 88
Плацентиты 431
Пневмония (и) 359; 476
— вирусные 479
— интерстициальная 479
— экссудативная 477
Пнеамоцистоз 419
Повреждение (я) 221
— иммунопатологические 443
— механические 433
— токсические 434
Поздние хемотаксические факторы (ПХФ)
148
Полиморфно-аде рные лейкоциты (ПЯЛ) 100
— — базофилы 100
— — нейтрофилы 100
— — эозинофилы 100
Препараты лекарственные 432
Производные арахидоновой кислоты 88
— — — лейкотриены 90
— — — простагландины 88
— — — хемотаксические липиды 90
Проницаемость стенок микрососудов 43
Простатиты 431
Протеоз 370
Процессы аутоиммунные, морфология 248
Псевдомоноз 377
Пыли 432
Разрастания гиперпластические см. Разра-
стания гиперрегенероторные
— гм пер регенераторные 199
Реакция (и) аиафилаксические 227
— — немедленные 227
— воспалительно-репаративная как стерео-
типный процесс 201
— иммунокомплексные 231
— инактивации 231
— нейтрализации 231
— отторжения трансплантации печени 517
— цитотоксические 229
— ; экзематозная 587
— — острая 588
— — хроническая 589
Регенерация 200
Рефлюкс-гастрит 489
Риккетсии 399
Риккетсиозы прочие 399
Сап 378
Саркоидоз 517
Сердце 540
Свертывание крови, активация 62
— — контактная фаза 77
---- факторы 62—66
Североамериканский бластомикоз 592
Силикоз 434
Сицдром приобретенного иммунодефицита
494
Синовит волчаночный острый 576
— псориатический 576
— ревматоидный 576
— склеродерм и чески й 576
Сибирская язва 397
Система В-лимфоцитов 158
— лимфоцитов, межклеточные взаимодейст-
вия 163
— Т-лимфоцитов 154
— Т4-лимфоцитов 157
— Т8-лимфоцитов 157
Сифилис 379, 590
Скарлатина 357
Соединительная ткань, ауторегуляция 200
Сосуды 558
— изменение диаметра 39
— — перфузии кровью и лимфой 39
— реакция в очаге воспаления 39
Спорагнозы 425
Спирохетозы кишечника 383
Споротрихоз 410
Спру некротическая 490
Стадия(и) альтерации 176
— воспаление 176
— продуктивная 182
— пролиферативная см. Стадия продуктив-
ная
— экссудации 178
Столбняк 396
Суставы 574
Сыпь аллергическая лекарственная 587
— — — бромодерма 587
— — — йодерма 587
Сыпь аллерготоксическая 586
— — аллергический поверхностный васку-
лит кожи Руитера 586
---фиксированная эритема 587
Тениндоз кишечный 423
Тиф брюшной 363
— возвратный эндемический 382
— — эпидемический 382
— сыпной 399
Ткань грануляционная 209
— лимфоидная бронхоассоциированная 471
— соединительная, ауторегуляция 200
Т-лимфоциты 151
— система 154
Т4-л имфоциты 152
— система 157
Т8-лимфоциты 152
— система 157
Токсоплазмоз 412
— Внутриутробный 412
— врожденный см. Токсоплазмоз внутриут-
робный
— постнатальный 413
Тонзиллиты 429
Трахома 406
Трихинеллез 425
Трихинеллы 425
Трихомоноз 416
Трихоцефалез 426
Тромбин 67
— действие противовоспалительное 67
Тромбообраэоваиие, активация 62
633
Тромбо эндо кард ит нсинфекционный 544
Т-супрессоры 156
Туберкулез 389
— аторижый 390
— гематогенный 390
— кожи 590
Туляремия 387
Т-киллеры 156
Т-супрессоры 156
Т-хелперы 156
Уретриты 431
Фактор(ы) колониестимулирующий 146
— - свертывания 62—66
— хемотаксические поздние 148
Фасциолезы 421
Фелиноз 407
Фибробласты 164
— зрелые 166
— малодиффереицированные 165
— структурно-функциональные типы 165
— юные 166
Фиброз внутридольковый 515
— как исход гепатита 514
— пери портальный 515
— портальный 515
— - септальный 515
Фиброциты 167
Физиология воспаления 39
Фикомикоз см. Мукороз
Флегмона 188
Форменные элементы крови, эмиграция из
сосудистого русла 49
Формы воспаления 183
— — смешанные 190
Фрамбезия 380 *•
Хламидиоз внутриутробный 405
— глаз 406
— респираторный 405
— урогенитальный 405
Холангиолиты 515 -
Холангит(ы) 515
— индуцированный лекарствами 518
— пераичный склерозирующий 518
Холера 376
Хромомикоз 410; 591
Целиакия 490
Цепень бычий 423
— карликовый 425
— свиной 423
Цестозы 423
Цирроз билиарный пераичный 516
Цистицеркоз 423
Цитотоксичность, опосредованная антителами
229
— — комплементом 229
Шистосоматоэ 422
— кишечный 422
— мочеполовой 422
— японский 423
Экзематозная реакция 587
— — острая 588
— — хроническая 589
Экссудация, механизмы 43
Эмпиема 188
Эндокардит 540
— бактериальный см. Эндокардит' инфекци-
онный
— инфекционный 541
— — подострый 543
— — хронический 543
— Леффлера см. Эндокардит париетальный
фибропластический эозинофильный
— Либмана—Сакса см. Эндокардит небак-
териальный атипический бородавчатый
— париетальный фибробластический с эози-
нофилией 547
—-------эозинофильный 547
— небактериальный атипический бородавча-
тый 546
— при других реаматичсских болезнях 546
— ревматический 545
— — возвратно-бородавчатый 546
---диффузный 545
— - — острый бородавчатый 546
— — фибропластический 546
— септический см. Эндокардит инфекцион-
ный
— — затяжной см. Эндокардит хронический
инфекционным
Энтерит острый 489
— хронический 489
Эитеробиоз 426
Энтеропатия глутеновая 490
Эритема фиксированная 587
Эффекторные клетки воспаления 100
— — — гранулоциты эозинофильные 137
— — — лаброциты базофильные 137
— — — лимфоциты 151
— — — макрофаги 115
— — — фибробласты 164
— — — полиморфно-ядерные лейкоциты
100
Эхинококкоз 424
— альвеолярный см. Эхинококкоз многока-
мерный
— гудатидозный см. Эхинококкрз однокамер-
ный
— многокамерный 424
— однокамерный 424
634
ОГЛАВЛЕНИЕ
Предисловие ............................................................ 3
Глава 1. История учения о воспалении. — Д. С. Саркисов, В. В. Серов. 7
Глава 2. Сущность воспаления, его место в биологии и медицине. —
В. С. Пауков, В. В. Серов................................... 30
2.1. Воспаление как защитно-приспособительная реакция ......... 30
2.2. Воспаление как категория общей патологии.................. 32
2.3. «Местное» и «общее» в воспалении ......................... 35
Глава 3. Физиология и биохимия воспаления.............................. 39
3.1. Реакция сосудов в очаге воспаления. — Н. К. Хитрое..... 39
3.1.1. Изменения диаметра сосудов и перфузии их кровью и
лимфой..................................................... 39
3.1.2. Проницаемость стенок микрососудов и механизмы экс-
судации ................................................... 43
3.1.3. Эмиграция форменных элементов крови из сосудистого
русла ..................................................... 49
3.2. Гуморальные гомеостатические системы при воспалении. —
С. М. Струкова............................................. 52
3.2.1. Активация тромбоцитарного звена гемостаза........... 52
3.2.2. Активация свертывания крови и тромбообразования . . 62
3.2.3. Противовоспалительное действие тромбина............. 67
3.2.4. Механизмы ограничения тромбообразования и их нару-
шения при воспалении ..................................... 71
3.2.5. Контактная фаза свертывания крови. Фибринолиз и
воспаление........................................... 77
3.3. Медиаторы воспаления. — Н. К. Хитров...................... 81
3.3.1. Классификация медиаторов воспаления........... 81
3.3.2. Характеристика основных групп медиаторов воспаления 83
3.3.3. Взаимодействие медиаторов в динамике воспаления . . 95
3.3.4. Понятие об антимедиаторах воспаления ............... 97
Глава 4. Морфология воспаления 100
4.1. Эффекторные клетки воспаления ........................... 100
4.1.1. Полиморфно-ядерные лейкоциты. — А. А. Пальцын . . 100
4.1.2. Макрофаги. — О. Я. Кауфман, А. Б. Шехтер .......... 115
4.1.2.1. Разновидности макрофагов .................. 120
4.1.2.2. Макрофаги в очагах острого и хронического
воспаления.......................................... 126
4.1.2.3. Макрофаги как фагоцитарные и секреторные
клетки.............................................. 134
635
4.1.3. Лаброцйты, базофильные н эозинофильные грану лоциты-
О. Я. Кауфман........................................................ 137
4.1.3.1. Тучные клетки и базофильные грану лоци 137
4.1.3.2. Эозинофильные (ацидофильные) гранулогы 146
4.1.4. Лимфоциты. — О. В. Зайратьянц................... 151
4.1.4.1. Центральные и периферические лимфоиде
органы............................................ 152
4.1.4.2. Система Т-лимфоцитов.................... 154
4.1.4.3. Система В-лимфоцитов.................... 158
4.1.4.4. Особые типы лимфоцитов.................. 162
4.1.4.5. Межклеточные взаимодействия в системе м-
фоцитов . . . .......................... 163
4.1.5. Фибробласты. — А. Б. Шехтер...................... 164
4.1.5.1. Структурно-функциональные типы фиброб.
стов.............................................. 165
4.1.5.2. Синтез, секреция, фибриллогенез и катабо-
лизм коллагена.................................... 170
4.1.5.3. Фибробласт как ре1уляторная клетка, учасз
в межклеточном взаимодействии..................... 173
4.2. Стадии воспаления. — В. С. Пауков, О. Я. Кауфман ... 176
4.2.1. Стадия альтерации........ ....................... 176
4.2.2. Стадия экссудации................................ 178
4.2.3. Продуктивная (пролиферативная) стадия ........... 182
4.3. Формы воспаления....................................... 183
4.3.1. Экссудативное воспаление................ 184
4.3.2. Продуктивное воспаление.......................... 190
, 4.3.2.1. Интерстициальное диффузное воспаление 191
4.3.2.2. Гранулематозное воспаление ......... 192
4.3.2.3. Воспалительные гиперпластические
(гиперрегенераториые) разрастания .... 199
4.4. Воспаление и регенерация. — А. Б. Шехтер, В. В. Серов 200
4.4.1. Ауторе1уляция соединительной ткани............... 200
4.4.2. Воспалительно-репаративная реакция как стереотипй
процесс..................-.............................. 201
4.4.3. Грануляционная ткань — продукт воспалительно-р«-
ративного процесса...................................... 209
4.4.4. Дисрегенерация как результат нарушения и извран
ния кинетики воспалительно-репаративной реакцю . 213
Глава 5. Иммунологические и иммунопатологические аспекты восп
ления. — В. В. Серов..................................... 219
5.1. Воспаление и иммунитет ................................ 219
5.2. Реакции гиперчувствительности и воспаление............. 225
5.2.1. Анафилактические реакции......................... 227
5.2.2. Цитотоксические реакции.......................... 229
5.2.3. Иммунокомплексные реакции........................ 231
5.2.4. Гранулематоз..................................... 239
5.3. Аутоиммунизация и воспаление. — В. В. Серов, О. В. За( 241
ратьянц ..................................................
5-3.1. Сущность и механизм развития аутоиммунизации 241
5.3.2. Принципы классификации аутоиммунных болезней . 246
5.3.3. Морфология аутоиммунных процессов и болезней 248
636
5.3.4. Воспаление как возможная причина аутоиммунного
процесса .................................................. 249
5.4. Иммунодефицитные состояния и воспаление. — Т. Е. Иванов-
ская .......................................................... 250
5.4.1. Особенности воспалительной реакции у детей с врож-
денными иммунодефицитными синдромами....................... 252
Глава 6. Нервная трофика и воспаление. — Н. К. Хитров ................. 262
6.1. Некоторые исторические аспекты изучения нервной трофики
в норме и при патологии........................................ 262
6.2. Современные представления о нервнотрофической функции . 266
6.2.1. Межклеточное взаимодействие и нервная трофика . . . 266
6.2.2. Значение нервнотрофических влияний и их механизмы 268
6.2.3. Нервнотрофические влияния на разных уровнях нерв-
ной системы................................................ 271
6.3. Расстройства нервной трофики.............................. 273
6.4. Нервнотрофическая функция и воспаление ................... 275
* 6.4.1. Нервнотрофические влияния и альтеративные процессы
при воспалении....................................... 277
6.4.2. Нервнотрофические влияния и сосудисто-экссудатив-
ные изменения в процессе развития воспаления .... 281
6.4.3. Нервнотрофические влияния и пролиферация при вос-
палении ............................................. 283
Глава 7. Система HLA и воспаление. — Е. Н. Зотиков................. 287
Глава 8. Возраст и воспаление ..................................... 297
8.1. Особенности воспалительной реакции у зародыша и детей
разного возраста. — Т. Е. Ивановская........................... 297
8.1.1. Воспаление у зародыша человека ..................... 298
8.1.2. Воспаление у новорожденных и детей грудного возраста 305
8.1.3. Воспаление у детей в отроческом и пубертатном перио-
дах ....................................................... 308
8.2. Воспаление в пожилом и старческом возрасте. — К. А. Рогов 311
8.2.1. Система гомеостаза и старение....................... 312
8.2.1.1. Иммунная система ........................... 313
8.2.1.2. Нервная система ............................ 314
8.2.1.3. Эндокринная система ........................ 316
8.2.1.4. Сосудистая система.......................... 317
8.2.1.5. Система соединительной ткани .............» 31g
8.2.2. Старение и воспаление............................... 320
Глава 9. Характер воспаления в зависимости от особенностей причин-
ного фактора........................................................... 326
9.1. Биологические агенты. — А. В. Цинзерлинг.................. 326
9.1.1. Особенности воспаления при инфекциях, вызванных ви-
русами ......................................... 327
9.1.1.1. РНК-вирусные инфекции....................... 329
9.1.1.1.1. Заболевания, вызываемые вирусами
семейств Orthomyxoviridae и Paramy-
xoviridae ................................... 329
9.1.1.1.2. Заболевания, вызываемые вирусами
семейства Picornaviridae..................... 334
637
9.1.1.1.3. Заболевания, вызываемые вирусами
семейства Rabdoviridae......................... 336
9.1.1.1.4. Заболевания, вызываемые вирусами
семейства Togavlridae ......................... 337
9.1.1.1.5. Заболевания, вызываемые вирусами
семейства Retroviridae......................... 339
9.1.1.2. ДНК-вирусные инфекции......................... 341
9.1.1.2.1. Заболевания, вызываемые вирусами
семейства Adenovlridae......................... 341
9.1.1.2.2. Заболевания, вызываемые вирусами
семейства Herpesviridae ...................... 344
9.1.1.2.3. Заболевания, вызываемые вирусами
семейства Poxviridae......................... 347
9.1,1.3. Заболевания, вызываемые другими вирусами . 348
9.1.2. Особенности воспаления при инфекциях, вызываемых
бактериями................................................. 350
9.1.2.1. Заболевания, вызываемые грамположительны-
ми коккамн............................................. 354
9.1.2.1.1. Заболевания, вызываемые кокками се-
мейства Micrococcaceae......................... 354
9.1.2.1.2. Заболевания, вызываемые кокками се-
мейства Streptococcaceae....................... 357
9.1.2.2. Заболевания, вызываемые грамотрицательными
кокками................................................ 360
9.1.2.2.1. Заболевания, вызываемые кокками се-
мейства Neisseriaceae.......................... 360
€ 9.1.2.3. Заболевания, вызываемые грамотрицательными
палочками ................................................ 363
9.1.2.3.1. Заболевания, вызываемые палочками
семейства Enterobacteriaceae ......... 363
9.1.2.3.2. Заболевания, вызываемые палочками
семейства Vibrionaceae......................... 376
9.1.2.3.3. Заболевания, вызываемые палочками
семейства Pseudomonadaceae................... 377
9.1.2.3.4. Заболевания, вызываемые палочками
семейства Splrochaetaccae...................... 379
9.1.2.3.5. Заболевания, вызываемые палочками
семейства Legionellaceae....................... 384
9.1.2.3.6. Заболевания, вызываемые палочками
семейства SpiriUaceae.......................... 385
9.1.2.3.7. Заболевания, вызываемые палочками
с неясным положением в систематике 385
9.1.2.4. Заболевания, вызываемые грамположительны-
ми палочками ................................. . . . 388
9.1.2.4.1. Заболевания, вызываемые палочками
семейства Mycobacteriaceae................... 388
9.1.2.4.2. Заболевания, вызываемые коринефор-
мными бактериями............................... 392
9.1.2.4.3. Заболевания, вызываемые палочками
семейства ВасШасеае............................ 395
9.1.2.4.4. Заболевания, вызываемые палочками
других семейста................................ 398
638
9.1.2.5. Заболевания, вызываемые микроорганизмами
семейства Ricketts! сеае............................. 399
9.1.3. Особенности воспаления при инфекциях, вызываемых
другими микроорганизмами................................... 400
9.1.3.1. Заболевания, вызываемые микроорганизмами
семейства Mycoplasmatoceae.................... 400
9.1.3.2. Заболевания, вызываемые микроорганизмами
семейства Chlamydiaceae....................... 404
9.1.3.3. Заболевания, вызываемые грибами ............ 407
9.113.4. Заболевания, вызываемые простейшими .... 411
9.1.3.5. Заболевания, вызываемые гельминтами .'.... 420
9.1.3.5.1. Заболевания, вызываемые гельминта-
ми класса Trematoda.................... 421
9.1.3.5.2. Заболевания, вызываемые гельминта-
ми класса Cestoda ............................ 423
9.1.3.5.3. Заболевания, вызываемые гельминта-
ми класса Nematoda............................ 425
9.1.4. Сочетанные инфекции................................. 427
9.2. Пыли, другие аэрозоли и лекарственные препараты. —
О. О. Орехов................................................... 432
9.2.1. Механические повреждения............................ 433
9.2.2. Токсические повреждения............................. 434
9.2.3. Иммунопатологические повреждения ................... 443
9.3. Излучения. — Е. Ф. Лушников .............................. 445
9.3.1. Влияние рентгеновского излучения на воспаление . . . 446
9.3.2. Воспаление при лучевой болезни ..................... 453
9.3.3. Оптическое излучение и воспаление .................. 454
9.3.4. Влияние электромагнитного излучения на воспаление 456
9.4. Ожоги. — Р. И. Каем ...................................... 457
Глава 10. Характер воспаления в зависимости от структурно-функцио-
нальных. особенностей органов и тканей ................................ 468
10.1. Легкие. — И. К. Есипова, Ю. Г. Алексеевских.............. 468
10.1.1. Бронхит .......................................... 469
10.1.1.1. Воспаление крупных бронхов............... 472
10.1.1.2. Воспаление мелких бронхов и бронхиол . . 474
10.1.2. Пневмония......................................... 476
10.1.2.1. Экссудативная пневмония.................. 477
10.1.2.2. Интерстициальная пневмония .............. 479
10.2. Желудок, кишечник, брюшина............................... 482
10.2.1. Желудок. — Л. И. Аруин............................ 483
10.2.1.1. Острый гастрит........................... 484
10.2.1.2. Хронический гастрит...................... 484
10.2.2. Кишечник. — Л. И. Аруин........................... 489
10.2.2.1. Острые энтерит и колит .................. 489
10.2.2.2. Хронические энтерит и колит.............. 489
10.2.3. Брюшина. — В. С. Пауков........................... 495
10.2.3.1. Перитонит................................ 495
10.3. Печень. — В. В. Серов.................................. 504
10.3.1. Гепатит........................................... 506
10.3.1.1. Повреждение — неотъемлемый компонент
гепатита........................................... 506
639
10.3.1.2. Особенности воспалительного инфильтрата
при гепатите..................................... 510
10.3.1.3. Признаки хронизации воспаления печени.
Фиброз как исход гепатита............... 514
10.3.2. Холангиты, холангиолиты ........................... 515
10.3.2.1. Воспаление преимущественно мелких желч-
ных протоков .................................... 516
10.3.2.2. Воспаление внепеченочных желчных прото-
ков ............................................. 518
10.4. Почки. — В. В. Серов ..............:..................... 518
10.4.1. Гломерулонефрит ................................... 519
10.4.1.1. Структурные основы иммунных гломеруляр-
ных реакций ....................................... 519
10.4.1.2. Морфологическая и иммуногистохимическая
характеристика гломерулонефрита ................... 525
10.4.2. Тубулоинтерстициальный нефрит...................... 535
10.4.2.1. Структурные основы иммуиовоспалительных
интерстициальных реакций в почках............... 535
10.4.2.2. Патогенетическая и иммуноморфологическая
характеристика иммунного тубулоинтерстици-
ального нефрита ................................... 536
„ 10.5. Сердце. — В. С. Пауков.................................. 540
10.5.1 . Эндокардит...................................... 540
10.5.2 . Миокардит......................................' 548
10.5.2.1 . Идиопатический миокардит Абрамова—Фид-
лера .............................................. 549
10.5.2.2 . Инфекционный миокардит .................. 549
10.5.2.3 . Инфекционно-аллергический миокардит . . . 552
10.5.2.4 . Токсический миокардит.................... 555
10.5.3 . Перикардит...................................... 557
10.6. Сосуды. — Л. В. Кактурский .............................. 558
10.6.1. Васкулит........................................... 559
10.6.1.1. Патогенез................................. 560
,10.6.1.2. Морфологическая характеристика ..*..... 565
10.7. Мышцы. — С. М. Секамова, Г. Н. Копьева................... 569
10.7.1. Миозит............................................. 571
10.8. Суставы. — С. М. Секамова, Т. Н. Копьева................. 574
} 10.8.1. Артрит............................................ 574
10.9. Кожа. — Г. М. Цветкова................................... 580
10.9.1. Морфологические виды воспаления ................. 581
10.9.2. Воспалительные заболевания кожи .-..................585
Литература ................:........................................... 594
Предметный указатель ................................................ 630