Автор: Елинов Н.П. Заикина Н.А. Калошин В.Г. Марюхта Ю.Б. Соколова И.П.
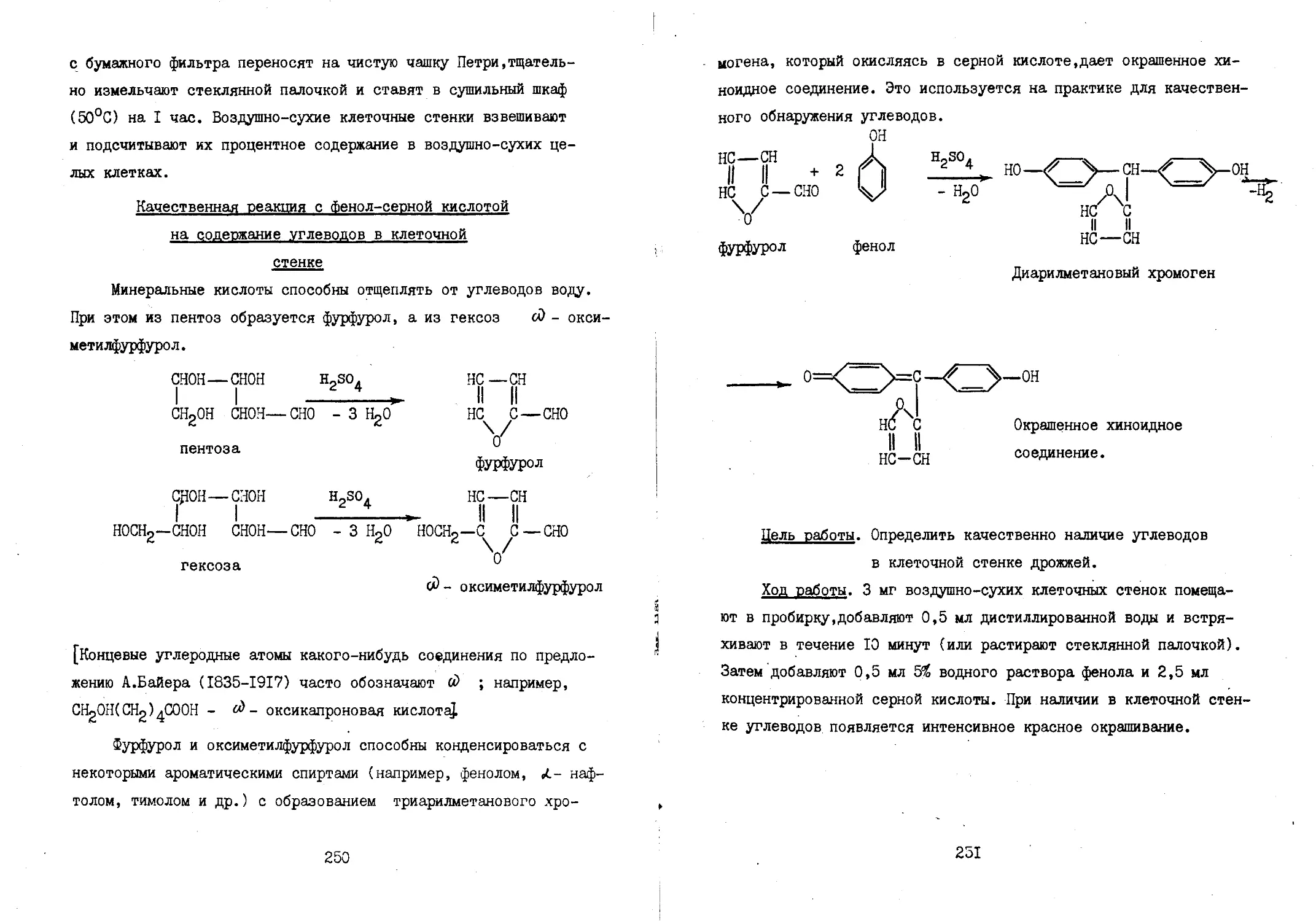
Теги: биология микробиология
Год: 1982
Текст
МИНИСТЕРСТВО МЕДИЦИНСКОЙ ПРОМЫШЛЕННОСТИ
ЛЕНИНГРАДСКИЙ ХИМИКО-ФАРМАЦЕВТИЧЕСКИЙ ИНСТИТУТ
Кафедра микробиологии
"УТВЕРЖДАЮ "
Заместитель министра
Медицинской промышленности СССР
Н.Ф. ДАНИЛИН
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПО МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИМ ОСНОВАМ МИКРОБИОЛОГИИ
ДЛЯ СТУДЕНТОВ ХИМИКО-ТЕХНОЛОГИЧЕСКОГО ФАКУЛЬТЕТА
, B.wik—» • " ' 1 11,1
Бимнс.а*
Ленихгрял ИХ y*-W4
Ленинград, 1982 г.
Методические рекомендации по молекулярно-
генетическим основам микробиологии для
студентов химико-технологического факультета
436 стр.,ЛХФИ,1982г.
АННОТАЦИЯ.
Методические рекомендации по молекулярно - генетическим
основам микробиологии предназначены для студентов химико-
технологического факультета,специализирующихся в области
химии и технологии различных продуктов микробного синтеза и,
прежде всего,лекарственных веществ.(специальность0809).
В составлени методичесикх рекомендаций по молекулярно -
генетическим основам микробиологии принимали участие
Н.П.БЛИНОВ,Н.А.ЗАЙКИНА,В.Г.КАЛОШИН.О.B.MAPDXTA,И.П.СОКОЛОВА.
М-М4 75 Подписано к печати 25.03. 82. Заказ //£3.
Тираж 300, формат бумаги 60x64 I/I6, 27,25 печ. л.
Ротапринт тип. № 2 "Ленуприздата"
I92I04, Ленинград, Литейный пр. дом № 55
Цена 3 руб.
СОДЕРЖАНИЕ
Введение .................................................. 4
I. Организация и оборудование лаборатории для молекулярно-
. 6
102
174
209
222
235
238
248
.281
.285
генетических исследований микроорганизмов.
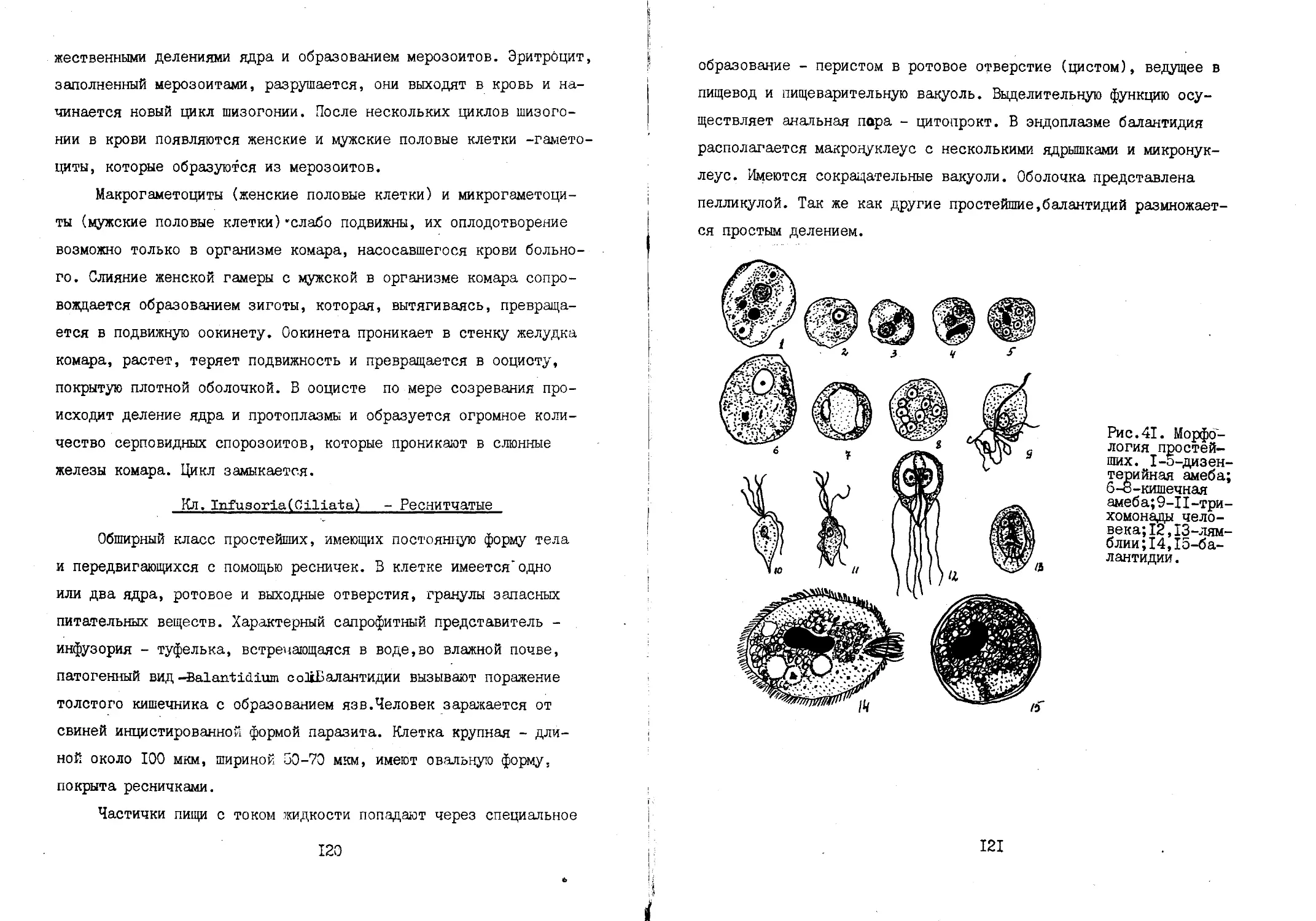
2. Морфология микроорганизмов .........................
3. Методы стерилизации ..............................
4. Питательные среды и способы их приготовления.
5. Методы выделения чистых культур микроорганизмов .
6. Измерение микробной клетки. Методы микрометрии.
/^рИзмерение бактериальной массы и числа микробных кле-
ток. Изучение фаз роста микроорганизмов..................
8. Молекулярный состав микробной клетки .....
9. Изучение влияния на рост микроорганизмов источников
углерода,азота,витаминов и микроэлементов.
10. Ферментативная активность микроорганизмов.
Роль микроорганизмов в круговороте углерода и азота
в природе. ... .....................................
Бактериофагия. ...................................
Изменчивость микроорганизмов......................
II.
12.
13.
294
312
, . . 316
14. Микрофлора тела человека и окружающей его среды. . . 328
15. Изучение патогенности и вирулентности микробов. . . 365
16. Молекулярно-генетические основы иммунитета. Оценка
иммунного состояния макроорганизма в эксперименте. . 371
17. Изучение влияния некоторых химиотерапевтических ве-
; ществ на микроорганизмы...............................396
18. Определение микробной обсемененности неинъекционных
лекарственных форм........................................404
19. Определение стерильности инъекционных лекарственных
препаратов.............................................. 417
Приложение......................................... 425
ВВЕДЕНИЕ
Методические рекомендации для выполнения лабораторных работ
по курсу "Молекулярно-генетические основы микробиологии" сос-
тавлены в соответствии с утвержденной программой. Названная
дисциплина по специальности 0809 предусмотрена учебным планом,
утвервденным заместителем Министра'высшего и среднего специаль-
ного образования СССР проф.Н.С.Егоровым 27 сентября 1974 г.
Она преподается студентам Ш курса химико-технологического фа-
культета Ленинградского химико-фармацевтического института
(ЛХФИ) в течение двух семестров. Курс "Молекулярно-генетические
основы микробиологии и микологии" является оригинальным, вклю-
чает материалы, касающиеся морфологии и биохимии микробов, ис-
пользующихся в целом ряде биопроизводств. Существующие учебни-
ки и практические руководства не отражают всех вопросов, затра-
гиваемых в этом курсе. Настоящие методические указания разрабо-
таны по темам, соответствующим лабораторным работам. Лаборатор-
ный практикум (90 часов) включает необходима: материал для ус-
воения современных знаний о представителях основных групп мик-
роорганизмов: простейших животных организмах,грибах,бактериях
и вирусах. Мы сочли целесообразным выделить в самостоятельный
раздел (1.3) соответствующие методы и аппаратурное оформление
исследований микроорганизмов. Отдельные методы отработаны ав-
торами и били предложены студентам, которые апробировали их в
течение 1976-1980 гг(см.раздел 8). Разрушение микробных клеток
студенты осуществляют на оригинальном дезинтеграторе, разрабо-
танном на нашей кафедре. Он удобен для получения клеточных
стенок и некоторых других органелл соответствующих микроорга-
низмов.
4
Учитывая профиль подготовки молодых специалистов в ЛХФИ
(инженеры химики-технологи и, в том числе, по биосинтезу мно-
гих вторичных метаболитов:антибиотиков, полисахаридов,витами-
нов и др.), в методических рекомендациях основное внимание
уделено методике проведения лабораторных занятий по строению
и физиологической активности микроорганизмов-продуцентов био-
логически активных веществ. Вместе с тем студенты знакомятся
с санитарно-показательными микроорганизмами, возбудителями
инфекционных заболеваний, некоторыми вопросами иммунологии и
иммунохимии и методами оценки действия на микробы различных
химиотерепевтических веществ.
В "Рекомендации" включены разделы, касающиеся определе-
ния микробной обсемененности неинъекционных лекарств, т.к.-
это отвечает требованиям вышестоящих организаций, контроли-
рующих производство лекарственных веществ и готовых лекарст-
венных форм.
Методические рекомендации составлены проф.Н.А.Заикиной
(разделы 2,5,6,7,9-13,15-17), ст.научн.сотр.,к.б.н. В.Г.Кало-
шиным (разделы 1,3,8), доцентом Ю.Б.Марюхта (разделы 2,4,8,
18,19) и ассистентом, к.б.н.И.П.Соколовой (разделы 2 и 14).
Зав.кафедрой микробиологии ЛХФИ
з.д.н. РСФСР, проф.Н.П.Елинов
I. ОРГАНИЗАЦИЯ И ОБОРУДОВАНИЕ ЛАБОРАТОРИИ ДЛЯ МОЛЕКУЛЯР- ~
НО-ГЕНЕТИЧЕСКИХ ИССЛЕДОВАНИЙ МИКРООРГАНИЗМОВ
I.I. ОРГАНИЗАЦИЯ И ОБОРУДОВАНИЕ МИКРОБИОЛОГИЧЕСКОЙ ЛАБО- * -
РАТОРИИ
Вопросы для подготовки по теме.
I. Назначение микробиологической лаборатории.
2. Организация микробиологической лаборатории. Оснащение
рабочего, места микробиолога.
3. Методы,используемые для изучения микроорганизмов. <
Лаборатории, изучающие микроорганизмы,по своему назначению
подразделяются на следующие:
I .Клинико-диагностические (медицинские и ветеринарные).
2 .Санитарно-эпидемиологические.
3 .Гигиенические.
4 .Ведомственные (при мясокомбинатах,молочных,хлебных и
пивоваренных заводах,водонасосных станциях,станциях за-
щиты растений, предприятиях медицинской промышленности и
др.). t
5 .Лаборатории по контролю бактериологических препаратов.
6 .Учебные микробиологические лаборатории.
Круг вопросов, которыми занимаются микробиологические лабо-
ратории, определяются их назначением. Например,самыми важными
разделами клинико-диагностических лабораторий являются: микро-
биологическая диагностика инфекционных заболеваний людей или
животных,научная разработка новых методов лабораторной диаг-
ностики. t
Санитарно-эпидемиологические лаборатории выполняют исследо-
вания диагностического и профилактического характера,обследуя
6
' организованные коллективы и отдельных лиц на носительство пато-
генных бактерий кишечной группы и возбудителя дифтерии.
Гигиенические лаборатории занимаются исследованиями на бак-
териальную загрязненность объектов внешней среды: воздуха,воды,
почвы,продуктев питания и т.д.
Ведомственные лаборатории занимаются контролем выпускаемой
продукции на бактериальную загрязненность,разработкой методов
обеззараживания пищевых продуктев,воды и кормовых средств от
болезнетворных микробов; изучением и подбором наиболее эффектив-
ных штаммов микроорганизмов,используемых в соответствующей отрас-
ли микробиологической промышленности.
Лаборатории по контролю бактериологических препаратов осу-
ществляют контроль вакцин,сывороток и других бактериологических
препаратов на их пригодность (безвредность,эффективность и т.д.).
Микробиологические лаборатории могут заниматься изучением
роли отдельных видов микроорганизмов в биохимических превраще-
ниях веществ в природе,в создании структуры почвы,в почвенном
питании растений.
Несмотря на различие микробиологических лабораторий по наз-
начению, основные методы,используемые в них для изучения мик-
роорганизмов, являются общими. К этим методам относятся:
Микроскопический. при котором в специально изготовленных
препаратах (мазок,раздавленная капля и др.) под микроскопом
изучают форму,размеры,строение,отношение к окраске,подвижность,
органеллы микроорганизмов и включения в микробной клетке.*
Микробиологический. который предусматривает посев микробов
на питательные среды,изолирование их отдельных видов друг от
друга и изучение характера роста чистых культур на плотных и
и жидких питательных средах.
Биохимический. позволяющий определить принадлежность выде-
ленного микроба к тому или иному роду и виду по его ферментатив-
ной активности и химическому составу или выяснить роль микроор-
ганизма, которую он играет в круговороте веществ в природе.
Серологический, основанный на идентификации микроорганизмов
и определении их видовой и типовой принадлежности по антигенной
структуре с помощью антител,содержащихся в иммунных сыворотках.
Биологический, позволяющий отделить патогенные для людей,
животных и растений микробы от сапрофитных (он осуществляется пу-
тем заражения восприимчивых экспериментальных животных или рас-
тений выделенным микроорганизмом).
Общность основных методов исследования в микробиологических
лабораториях определяет некоторые требования к организации этих
лабораторий и правилам работы в них.
Помещение,отведенное под микробиологическую лабораторию,
должно быть изолировано от других производственных и жилых объек-
тов или размещаться в отдельной секции здания.
В состав микробиологической лаборатории обычно входят сле-
дующие подразделения:
I. Лабораторная комната для выполнения микробиологических
исследований.
2. Автоклавная (стерилизационная), в которой стерилизуют
питательные среды,обеззараживают отработанный материал,
зараженную посуду.
3. Моечная,оборудованная для мытья посуды.
4. Препараторская,приспособленная для подготовки лабора-
8
торной посуды,растворов красителей и хранения питатель-
ных сред и культур,
5. Терлостатная комната,имеющая термостаты разных-форм и
размеров,отрегулированные на разные температуры, в них
выращивают культуры на питательных средах.
6. Бокс-комната,используемая для пересевов культур микро-
организмов и проведения научно-исследовательской работы,
которая требует стерильных условий; бокс должен быть ос-
теклен,стекла хорошо промазаны,чтобы не проникал из
окружающей среды воздух,а вместе с ним и микроорганиз-
мы; в боксе устанавливают бактерицидные лампы (БУФ-15
или БУФ-30).
7. Виварий - помещение,предназначенное для содержания ла-
бораторных животных (белых мышей,белых крыс,морских
свинок,кроликов и др.),
8. Материальная комната для хранения запаса реактивов, по-
суды, аппаратуры и хозяйственного инвентаря.
Лабораторная комната должна выходить окнами на север,а
естественное освещение ее должно быть не менее НО лк.
Все помещения лаборатории должны быть высотой не менее 3 м,
обеспечены вентиляцией,водопроводом,канализацией,электроэнергией
и по возможности газом.
Стены микробиологической лаборатории окрашиваются в светлые
тона на всю высоту масляной краской,чтобы их можно было легко
мыть. Полы покрывают линолеумом.
Лабораторные столы имеют подводку электроэнергии к каждому
рабочему месту и, если в учреждении имеется газ,то на каждом
рабочем месте устанавливают газовую горелку,заменяющую спиртовку.
9
Поверхность столов покрывают пластиком, линолеумом или
стеклом, что облегчает их дезинфекцию.
В учебных лабораториях за каждым студентом закрепляют пос-
тоянное отдельное рабочее место площадью 110x70 см. На рабочем
месте размещают: микроскоп, осветитель, набор наиболее ходовых
красок и реактивов для окраски препаратов, бактериологические
иглу, петлю и лопаточку (рис.1), шпатели (рис.2),
а б в г д
Рис.1. Игла(а);
петля(б,в,г);б,
в-петля приготов
лена неправильно;
г-петля приготов-
лена правильно;д-
лопаточка.
Рис.2. Шпатели Дри-
гальского.
Рис.З. Отрезки трубок(а,б)пасте-
ровская пипетка(в);пипетка Ру(г).
градуированные пипетки, отрезки стеклянных трубок, пастеров-
ские пипетки и пипетки Ру (рис.З),предметные стекла и пинцеты
(рис.4),покровные стёкла, ванночку с мостиком для приготовле-
ния и окраски мазков, промывалку с водопроводной водой (рис.5),
сосуд с дезинфицирующей жидкостью [l% раствор хлорамина, З^раст-
10
вор фенола или растворы поверхностно-активных веществ(пальмита-
та натрия, додецилсульфата натрия, лаурилсульфоната натрия)], ва-
ту в стеклянном сосуде, фланелевую салфетку, карандаш по стеклу,
иммерсионное масло, песочные часы, фильтровальную бумагу,спички.
Стол микробиолога должен быть всегда чистым, а необходимые для
работы предметы аккуратно разложены на виду у работающего. На
столе не должно быть ничего лишнего, загромождающего стол и ме-
шающего работе.
Рис.4. Предметные стёк-
ла и пинцеты.
Рис.5. Ванночка с
мостиком и промы-
валка с водопровод-
ной водой.
II
1.2. ПРАВИЛА РАБОТЫ С РАЗЛИЧНЫМИ ГРУППАМИ МИКРООРГАНИЗМОВ.
ТРЕБОВАНИЯ ТЕХНИКИ БЕЗОПАСНОСТИ
Вопросы для подготовки по теме
I. Правила техники безопасности в микробиологической лаборато-
рии
2. Порядок работы с различными группами микроорганизмов. Хране-
ние, учет, передача культур.
Работники микробиологических лабораторий и студенты на
практических занятиях постоянно должны помнить, что они имеют
дело с микроорганизмами, которые могут быть вредными для здоровья
человека . Кроме того, при посеве сапрофитных микроорганизмов
из окружающей среды случайно может быть высеян и патогенный
вид. При неосторожном обращении с микробным материалом работа-
ющий может заразиться сам или стать источником распространения
патогенного микроба. Поэтому при работе в микробиологической
лаборатории необходимо соблюдать следующие правила безопасности:
I. Заходить и работать в микробиологической лаборатории
только в белом халате и головном уборе (косынка или ша-
почка).
2. Не вносить посторонних вещей.
3. Работать на одном и том же месте и пользоваться закреп-
ленным оборудованием.
4. Соблюдать чистоту и опрятность при работе, работать си-
дя. После окончания работы тщательно вымыть руки с мы-
лом.
5. В помещении лаборатории не принимать пищу и воду, не ку-
рить, не допускать излишних разговоров и ненужных пере-
ходов.
12
Зак. 1183.
6. Использованные пипетки, предметные и покровные стёкла,
шпатели, ватные томпоны и т.п. помещают в сосуд с дезин-
фицирующей жидкостью. Пинцеты,бактериологические петли,
иглы и лопаточки прожигают в пламени спиртовки.
7. Все использованные материалы, трупы животных, отработан-
ные культуры и т.д. сдавать для обезвреживания в авток-
лавную.
8. Стол, одежду, обувь и другие предметы, случайно загряз-
ненные исследуемым материалом или культурой микробов
(разбилась пробирка, упала капля) подвергают немедленной
дезинфекции в присутствии преподавателя.
9. После окончания работы, поставить в термостат засеянные
чашки, пробирки и пр. Культуры.микробов и остатки иссле-
дуемого материала сдать старшему лаборанту, а рабочее
место привести в порядок и сдать дежурному по группе. Де-
журный сдает лабораторную комнату старшему лаборанту и
преподавателю.
Порядок работы с различными группами,
микроорганизмов.
Все виды микробов в соответствии со степенью опасности за-
ражения для работающих с ними лиц, учетом клиники вызываемых за-
болеваний, а также наличием определенных приемов труда и техни-
ки безопасности при работе, подразделяются на следующие пять
групп:
Группа I. Возбудитель чумы.
Группа II.Возбудители холеры, натуральной оспы, бруцеллеза,
13
туляремии,сибирской язвы,сапа,мелиоидоза, эпи-
демического сыпного тифа, эпидемических энцефали-
тов, геморрагических лихорадок,желтой лихорадки,
лихорадки Ку, лихорадки цуцугамуши, лихорадки
Скалистых гор, орнитозов, гистоплазмоза, кокци-
диозов, токсин ботулиновый.
Группа Ш, Возбудители бактерийных (брюшной тиф,дизентерия,
дифтерия,туберкулез и др.), вирусных (бешенство, it
полиомиелит, корь,грипп и др.), риккетсиозных
(болезнь Брилля, клещевые тифы и*др.),простейших
(малярия,лейшманиоз, возвратный тиф, сифилис и
др.),грибковых ,бластомикоз, дерма-
томикозы и др.), инфекционных заболеваний, выде-
ленных в самостоятельные нозологические формы.
Группа 1У. Возбудители тбксикоинфекций и острых бактериаль-
ных отравлений (сальмонеллы,стафилококки,вибрионы,
клостридии и др.), септицемий и пневмоний (стафи-
лококки и стрептококки, синегнойная палочка и др.).
Группа У, Облигатная непатогенная микрофлора,населяющая
слизистые и кожные покровы человека, а также мик-
роорганизмы - показатели санитарного состояния
внешней среда (эшерихии, энтерококки, перфрингенс
и др.).
Представленная схема распределения микробов по группам оп-
ределяет режим работы,порядок хранения и ввдачи микроорганизмов
различных групп.
Работу с культурами микроорганизмов I и П группы можно про-
водить только с разрешения Центральной режимной комиссии Глав-
VB t I
14
ного управления карантинных инфекций Министерства здравоохране-
ния СССР или Главного санитарно-эпидемиологического управления
Министерства здравоохранения союзной республики в специально
оборудованных лабораторных помещениях, работа которых регламен-
тируется действующими инструкциями по режиму работы с материа-
лом, зараженным или подозрительным на зараженность возбудителя-
ми чумы, холеры, сибирской язвы, туляремии и бруцеллеза.
Работа с микробами, отнесенными в № группу, проводится в
соответствии с правилами устройства, техники безопасности, про-
изводственной санитарии и личной гигиены при работе в лаборато-
риях санитарно-эпидемиологических учреждений.
Работа с микроорганизмами 1У и У групп требует соблюдения
обычного режима работы бактериологической лаборатории, обеспе-
чивающего надежную защиту персонала лаборатории от внутрилабо-
раторных заражений в процессе исследований и надлежащее обезза-
раживание материала, исключающее возможность распространения
инфекции за пределы лаборатории.
Культуры всех групп микроорганизмов хранят в пробирках на
плотных питательных средах или в ампулах в лиофилизированном
состоянии. На пробирки и ампулы с культурами наклеивают этикет-
ки с номером штамма по инвентарной книге, названием возбудителя
и датой пересева.
Культуры хранят в холодильниках или сейфах. Холодильники
и несгораемые шкафы с культурами 1,11,111 групп ho окончании ра-
бочего дня закрывают на ключ, пломбируют или опечатывают сур-
гучной печатью.
Культуры микробов 1-У групп, выделяемые при диагностичес-
ких исследованиях и находящиеся в работе в бактериологической
15
лаборатории, подлежат обязательной регистрации в журналах с про-
нумерованными страницами, прошнурованных и скрепленных сургучной
печатью учреждения.
Министерством здравоохранения СССР для лабораторий, работа-
ющих с живыми культурами микробов, утверждены следующие журналы
учета:
I. Журнал регистрации материалов (культур), поступивших
для исследования.
2. Журнал учета выделенных культур и их уничтожения.
3. Журнал, ведение которого предусмотрено для лабораторий,
работающих с возбудителями I и II групп, отражает дви-
жение микробных культур и материалов подозрительных на
зараженность.
Микробные культуры,отнесенные к I и II группам, и заражен-
ные ими животные, учитываются по каждому виду возбудителя отдель-
но, микробы Ш и 1У групп - суммарно по каждому роду микроорга-
низмов. Микробы У группы специальному учету не подлежат. Регист-
рация их ведется в рабочих журналах и дневниках.
Существует определенный порядок передачи микробных культур.
Из лаборатории в лабораторию в пределах одного учреждения музей-
ные культуры микробов Ш-У групп передаются по письменному разре-
шению заведующего музеем культур микроорганизмов, возбудители
I-II групп - с разрешения руководителя учреждения. В пределах од-
ной и той же лаборатории штаммы микробных культур могут быть пе-
реданы по письменному разрешению заведующего лабораторией.
Для выдачи культур за пределы лаборатории необходимо офици-
альное требование за подписью руководителя учреждения, скреплен-
ное гербовой печатью.
16
Зак. 1183.
Разрешение на выдачу микроорганизмов I-У групп дает руково-
дитель учреждения. Культуры микробов I и II групп выдаются лишь
в те учреждения, которые имеют разрешение Министерства здраво-
охранения СССР на работу с этими микроорганизмами.
Учреждения, запрашивающие культуры возбудителей IB группы,
одновременно с требованием должны представить заключение мест-
ной (районной, городской) санитарно-эпидемиологической станции
о наличии условий для работы с микробами этой группы.
Культуры микроорганизмов I-У групп в высушенном виде (в
ампулах) или в пробирках на плотных питательных средах при вы-
даче завертываются в лигнин или гигроскопическую вату и поме-
щаются в металлический ( для культур Ш-У групп - можно пластмас-
совый), плотно закрывающийся, опечатываемый пенал.
Микробные культуры I и II групп пересылают по специальной
связи. При этом пенал с отправляемыми культурами укладывают в
деревянный прочный ящик, обшивают его материалом, пломбируют
или опечатывают сургучной печатью. На адресной стороне посылки
прикрепляется особый ярлык с отметкой "Опасно".Не открывать во
время пересылки".
Культуры возбудителя чумы пересылаются в сопровождении 2
лиц, одним из которых должен быть врач.
Культуры микроорганизмов, отнесенные в Ш группу, пересы-
лаются обычной почтовой посылкой в такой же упаковке, как куль-
тура I и II групп, или выдаются через нарочного по предъявлении
им официального требования, доверенности и паспорта.
17
1.3. МЕТОДЫ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИХ ИССЛЕДОВАНИЙ МИКРО-
ОРГАНИЗМОВ И НЕОБХОДИМОЕ ОБОРУДОВАНИЕ
Вопросы для подготовки по теме.
I. Биологический светлопольный микроскоп. Устройство и пра-
вила работы с ним.
2. Микроскопия в темном поле,фазово-контрастная микроско-
пия , интерференционная , по ляриз ационная , флуоресцентная
/люминесцентная/ микроскопия.
3. Электронный микроскоп: принцип устройства,назначение.
4. Дезинтеграция микроорганизмов. Цели и методы.
5. Методы центрифугирования.
6. Фотоэлектроколориметр и спектрофотометр: устройство и
назначение.
7. Хроматографические методы исследования.
8. Электрофорез. Принцип метода,назначение,оборудование.
Микроскопы - устройство и правила
работы е ними
В микробиологии изучают организмы,большинство из которых
нельзя рассмотреть невооруженным глазом,поэтому для установле-
ния их формы,размеров,строения и пр. используют микроскоп
(от греческих слов micros - малый, scopeo - смотрю) - слож-
ный оптический или электронно-оптический прибор,предназначен-
ный для исследования очень малых объектов,имеющих размеры от
микрометров ( I мкм = 10“^мм) до нанометров (1нм=10“^мм).
ТВ
Устройство светлопольного микроскопа’ и осветителя
Наиболее распостраненными в настоящее время моделями сов-
ременного биологического микроскопа, позволяющего наблюдать
объекты в проходящем свете, являются микроскопы типаМБИ-1,
МБР-I (рис.6) и МБР-IA. Микроскоп имеет механическую и оптичес-
кую части.
Рис.б. Микроскоп МБР-I. 1-подковооб-
разное основание микроскопа;2-пред-
метный столик;3-винты для перемеще-
ния предметного столика;4-клеммы,при-
жимающие препарат;5-конденсор ^-крон-
штейн конденсора;7-винт укрепляющий
конденсор в гильзе;8-рукоятка переме-
щения конденсора;9-рукбятка ирисовой
диафрагмы конденсора; 10-зеркало;II-
тубусодержатель; 12-рукоятка маномет-
рического винта;13-рукоятка микрометри-
ческого винта;14-револьвер;I5-ооъекти-
вы;1б-наклонныйЬуоус;17-винт для креп-
ления тубуса; 18-окуляр.
19
Механическая часть микроскопа МБР-I включает штатив с прд -
метным столиком и тубус. Предметный столик может перемещаться
*
в горизонтальной плоскости на 8мм с помощью двух винтов, находя-
щихся справа и слева. Это дает возможность привести любую точку
препарата в центр поля зрения. На поверхности столика имеются
две клеммы, зажимающие препарат. Под предметным столиком на
штативе укреплен кронштейн конденсора, который может переме-
щаться в пределах 20мм специальным винтом, расположенным справа.
Конденсор крепится в гильзе винтом, находящимся с передней сто-
роны кольца кронштейна. Верхняя часть штатива -тубусодержатель
-имеет форму дуги и может перемещаться с помощью механизма,
смонтированного в основании штатива. Этот механизм приводится
в действие вращением макрометрического и микрометрического вин-
тов, предназначенных для грубой и тонкой фокусировки препарата.
При вращении этих винтов по часовой стрелке тубусодержатель мик-
роскопа опускается, при вращении против часовой стрелки подни-
мается. Один оборот микрометрического винта соответствует пере-
мещению тубуса на 0,1 мм. В верхней части тубусодержателя нахо-
дится вращающийся вокруг своей оси револьвер, в отверстия кото-
рого ввинчиваются объективы и гнездо для крепления наклонного
или прямого тубуса. Наклонный тубус можно повернуть вокруг верти-
кальной оси в любое удобное положение и закрепить винтом. Внут-
ри наклонного тубуса в нижней его части помещена призма (см.ни-
же). В верхний конец тубуса вставляется окуляр.
Оптическая часть микроскопа. Состоит из осветительного ап-
парата, объектива и окуляра. Осветительный аппарат состоит из
зеркала и конденсора и является существенной частью оптической
системы микроскопа. Регулируемое зеркало укреплено у основания
штатива и имеет две стороны:вогнутую и плоскую. Вогнутое зерка-
20
ло собирает и концентрирует в плоскости препарата пучок параллель-
ных лучей, идущих от источника света, поэтому им пользуются толь-
ко в тех случаях, когда работают без конденсора т.е. с очень ма-
лыми увеличениями. При работе с конденсором, который расчитан на
использование параллельных лучей следует пользоваться только плос-
кой стороной зеркала. Конденсор, укрепленный непосредственно над
зеркалом, состоит из нескольких линз и предназначен для собирания
параллельных лучей света, идущих* от источника и отраженных плос-
ким зеркалом, в одной точке - фокусе, который должен находиться
в плоскости препарата. На рис.7 показан ход лучей от источника
света к исследуемому объекту. Под конденсором имеются ирисовая
диафрагма и откидная оправа для светофильтра. Ирисовая диафрагма
служит для задержания излишних лучей Света и позволяет при необ-
ходимости уменьшить апертуру (см.ниже) конденсора.
Объектив представляет наиболее
важную часть микроскопа, он
состоит из системы линз, зак-
люченных в металическую опра-
ву, одно из обозначений, име-
ющихся на оправе, соответст-
вует степени увеличения объек-
тива. Б микроскопе МБР-I ис-
пользуются объективы дающие
увеличения в 8,40 и 90раз.
Самой главной линзой объек-
тива является передняя (фрон-
тальная) . Увеличение объекти-
ва зависит от фокусного рассто-
Рис.7. Схема хода лучей
от источника света к
объекту. 1-лучи света;
2-зеркало; 3-конденсор;
4-предметный столик мик-
роскопа; 5-предметное
стекло; 6-объект.
21
яния фронтальной линзы и, следовательно, от ее кривизны. Чем
больше кривизна фронтальной линзы, тем короче фокусное расстоя-
ние и тем больше увеличение объектива. Это обстоятельство необ-
ходимо учитывать в практической работе: чем больше увеличение
дает объектив, тем ниже следует опускать его над плоскостью
препарата. Другие линзы объектива, а их может быть 10 и больше,
расположены выше фронтальной. Они имеют различную кривизну по-
верхности и изготовлены из стекол разных оптических свойств.
Эти линзы называются коррекционными и предназначены не для уве-
личения, а для получения более четкого изображения. Как извест-
но, изображение, получаемое при помощи линз, обладает рядом не-
достатков - аберраций. Наиболее существенные - сферическая и
хроматическая аберрации. Первая состоит в том, что каждая точка
объекта имеет вид кружочка, а не точки,т.е. изображение полу-
чается не резким и размытым. Второй дефект состоит в том, что
получаемое изображение, в результате разложения видимого света
на его составляющие с различными длинами волн, приобретает ок-
раску, 'которую не имеет. Объективы, у которых сферическая и хро-
матическая аберрации скорректированы неполностью, называются
ахроматами. Они содержат до шести линз и дают изображение наибо-
лее резкое в центре. Края поля зрения часто бывают окрашены в
разные цвета спектра. Ахроматы широко распостранены вследст-
вии своей простоты и дешевизны. Микроскоп МБР-I снабжен ахрома-
тическими объективами. Более совершенные объективы - апохрома-
ты - могут состоять из 10, а иногда из 12 линз. Хроматическая
погрешность в них почти в 10 раз меньше, чем у ахроматов. Кро-
ме того, в них достигнута более равномерная резкость изображе-
ния. Это более дорогие объективы. На их оправе имеется обозна-
22
чение "АПОХР".
Планахроматы полностью устраняют искривление поля зрения,
вплоть до краев. Эти объективы целесообразно применять при мик-
рофотографировании .
Окуляр - содержит линзы: глазную -верхнюю и собирательную -
нижнюю. Общее увеличение окуляра повышается с уменьшением фокус-
ного расстояния линз, его составляющих, поэтому более сильные
окуляры будут короткими, а более слабые - длинными. Окуляры мо-
гут давать увеличение в 5,7,10,12,15 и 20 раз, что указано на
их оправе (например, I5X). Специальные, так называемые компен-
сационные окуляры, употребляются только с апохроматами. Они
сконструированы таким образом, что дают хроматическую ошибку,
обратную остаточному хроматизму апохромата и потому ее компен-
сирующую. В результате получается правильно коррегированное изоб-
ражение объекта. На оправе компенсационных окуляров имеется обоз-
начение "КОМП". Объектив и окуляр дают изображение объекта, уве-
личенное в той или иной степени. Общий принцип образования изоб-
ражения во всех современных световых микроскопах показан на
рис.8. Объектив 0 дает в плоскости Z действительное переверну-
'тое изображение А*объекта А. Точка Z находится в фокусе окуляра
Е, так что наблюдатель видит увеличенное мнимое изображение А',
в плоскости X. Последняя обычно находится в 25 см от глаза,т.е.
на расстоянии, наиболее удобном для ближнего зрения. В микрос-
копе МБР-I, имеющем наклонный тубус, между объективом и окуля-
ром помещена призма, которая изменяет ход лучей и направляет оп-
тическую часть наклонно под углом 45° к горизонтальной плоскости.
Увеличение, которое дает микроскоп, определяется произведе-
нием увеличения объектива на увеличение окуляра. Так, например,
23
используя окуляр I5X и объектив 90Х, можно получить увеличение
изображения в 1350 раз.
Рис.8. Схема образования изображения в
световом микроскопе. A-объект; 0-объек-
тив; Е-окуляр; А'-изображение объекта А.
Однако общее увеличение еще не характеризует всех возможностей
микроскопа. Увеличенное изображение может оказаться как четким,
так и нечетким. Отчетливость получаемого изображения определя-
ется разрешающей способностью микроскопа. Под последней пони-
мают минимальное расстояние между двумя точками,когда они еще не
сливаются в одну. Таким образом,чем больше разрешающая способ-
ность микроскопа тем меньшей величины объект можно увидеть.
Разрешающая способность невооруженного глаза составляет 200 мкм,
т.е. 0,2 мм.
Величина разрешающей способности микроскопа зависит от длины
волны используемого света и суммы числовых апертур объектива и
конденсора: d- — -----, где d -минимальное расстояние между
двумя точками: 1 2
Aj - числовая апертура объектива;
А2 - числовая апертура конденсора;
X - длина волны используемого света.
24
Числовая апертура определяется произведением синуса полови-
ны ( и ) отверстного угла ( Л ) на показатель преломления ( п )
среды,граничащей с линзой (рис.9): А» Sin u-n . Иными словами,
числовая апертура - это "охват" линзы, она характеризуется коли-
чеством лучей,попадающих в линзу.
Рис.9. Схема хода лучей
при разной величине угла.
А-объект; 0- объектив;
л-отверстный угол;
и -половина отверстного
угла.
Рис.10. Влияние иммер-
сионного масла на ход
лучей в микроскопе.
I-объектив; 2-предмет-
ное стекло;3-объект;
4-иммерсионное масло;
5-лучи света;6-фрон-
тальная линза объекти-
ва.
Используя объективы с большей апертурой и освещая препа-
рат светом с более короткой длиной волны,можно увидеть более
мелкие объекты (вплоть до крупных вирусов) или различить в
клетке более тонкие структуры.
Числовая апертура любой линзы,граничащей с воздухом,не
может быть больше I, так как показатель преломления воздуха ра-
вен I, а утоли (см.рис.9) не может быть больше 90°(т.е.
sin u<1 ). Практически в микроскопе МБР-I объектив 40Х имеет
апертуру,равную 0,65,а конденсор - апертуру около I. Тогда макси-
мальное разрешение микроскопа,т.е. наименьшая видимая структура
будет при использовании,например,объектива 40Х и зеленого света с
25
длиной волны 550 нм (0,55 мкм):
0,65+1
Повысить разрешающую способность можно двумя путями: либо
освещая объект еще более короткими лучами света, например,ульт-
рафиолетовыми, либо увеличивая показатель преломления среды,гра-
ничащей с линзой, с тем, чтобы приблизить его к показателю пре- I
ломления стекла, на котором находится объект &1,5).
СТ cKJld
Последнее весьма часто применяют на практике: между фронтальной
линзой объектива и исследуемым объектом помещают каплю так на-
зываемого иммерсионного масла, имеющего пг»1,5 (иммергирование
объектива, рис.10) (immersion - погружение).
Величина числовой апертуры каждого объектива указывается ;
на его оправе. Сухие системы МБР-I - 8Х и 40Х - имеют апертуру I
0,20 и 0,65 соответственно. Объективы,имеющие апертуру 1,25,на-
зываются иммерсионными и обозначаются "МИ" (маслинная иммерсия).
На оправе этих объективов имеется черное кольцо.
Иммергировать объектив можно не только маслом, но и другими
жидкостями, имеющими показатель преломления больший, чем показа- ,
тель преломления воздуха, например,водой (п =1,3), глицерином
(п=1,4). Для каждой из этих жидкостей выпускаются специальные ;
объективы.
В связи с выше изложенными данными можно говорить о двух
основных качествах микроскопа: увеличении и разрешении. Разре-
шение определяет отчетливость получаемого изображения, а увели-
чение-это получение изображения, увеличенного в той или иной
степени. Повышение, степени увеличения с помощью более сильного |
окуляра не улучшает разрешения, так как окуляр не может изме-
26
нить качества получаемого изображения; последнее зависит только
от объектива. Поэтому лучше использовать объектив с большим уве-
личением и окуляр с меньшим увеличением, чем наоборот. Разреша-
ющую способность, напротив, легко ухудшить, не меняя увеличения.
Предположим, что в оптическую систему, изображенную на рис. 9,
не внесено никаких изменений, за исключением уменьшения величи-
ны диафрагмы конденсора. Тогда угол и , под которым свет попада-
ет в объектив (пунктир), уменьшится и следовательно, уменьшится
числовая апертура объектива. В результате разрешающая способность
понизится, т.е. ухудшится качество изображения; однако увеличе-
ние останется прежним, так как ни объектив, ни окуляр не менялись.
Осветитель составляет неотъемлемую часть микроскопа, так
как в настоящее время в исследовательской микроскопии применяется
исключительно электрический свет. Во многих современных микроско-
пах (МБИ-2,МБИ-6 и др.) осветительный аппарат вместе с источни-
ком света вмонтирован в основание микроскопа. Микроскоп МБР-I не
имеет такого устройства, поэтому для искусственного освещения
применяют специальные осветители. Наиболее часто используемый
осветитель ОИ-19 (рис.II) имеет низковольтную лампу накаливания
(8в,20 вт) с короткой толстой нитью. Лампу включают в сеть че-
рез понижающий трансформатор, в корпусе которого имеется реос-
тат с рукояткой, регулирующей накал лампы. Патрон с лампочкой
может свободно передвигаться в корпусе осветителя, который ук-
репляется на нужной высоте в специальном штативе. Перед лампой
в корпусе осветителя помещен двухлинзовый конденсор с ирисовой
диафрагмой и гнездо для светофильтра. Осветитель устанавливают
перед микроскопом на соединительной планке, обеспечивающей не-
обходимое удаление его от микроскопа.
27
Рис.II. Осветитель ОИ-19 е микроскопом.
I-штатив осветителя; 2-корпус осветителя;
3-патрон с лампочкой; 4-рукоятка ирисовой
диафрагмы; 5-светофильтр; 6-трансформатор;
7-рукоятка реостата; 8-выключатель; 9-со-
единительная планка.
Правила работы с биологическим
микроскопом
Обращение с микроскопом требует навыков, поэтому, приступая
к работе с ним, необходимо усвоить основные правила пользования
микроскопом.
I. Перемещая микроскоп, его держат одной рукой за тубусо-
держатель, а другой - поддерживают за подковообразное
основание микроскопа.
2. На рабочем столе микроскоп помещают тубусодержателем к
себе, на расстоянии 3-5 см от края стола. Перед началом
28
работы следует осторожно мягкой сухой тканью удалить
пыль с механических и оптических частей микроскопа, не
касаясь пальцами линз.
З. На предметный столик помещают исследуемый препарат и
закрепляют его клеммами.
^Устанавливают правильное освещение поля зрения микрос-
копа. Используют либо критическое освещение либо освеще-
ние Кёллера.
а) . В критическом освещении может быть использован свет
настольной лампы или свет осветителя при максималь-
ном накале лампы и полностью открытой диафрагме.
Смотря в окуляр, лучи света от источника зеркалом
направляют в объектив. Свет источника фокусируется
так, чтобы объект освещался конусом света. На практи-
ке это означает, что положение конденсора относитель-
но объекта регулируется таким образом, что пятно ос-
вещающего света должно быть по возможности наимень-
шим, если смотреть невооруженным глазом, и возможно
более ярким, если смотреть через окуляр и объектив
сфокусированный на объекте. Настройку освещения про-
изводят с объективом 8Х. При правильной установке осве-
щения поле зрения микроскопа имеет форму круга,хоро-
шо и равномерно освещенного. При смене объективов
следует регулировать интенсивность освещения рассмат-
риваемого объекта. Желаемую степень освещенности по-
лучают, опуская или поднимая конденсор. При просмот-
ре препарата с объективом 8Х, конденсор опускают,
при переходе на объектив 40Х конденсор несколько под-
29
нимают, а при работе с объективом 90Х конденсор под-
нимают до предела или почти до предела. Критическое
освещение используют очень широко; оно обязательно
требует наличия перед источником рассеивающего экра-
на (например, матового стекла), чтобы избежать полу-
чения на объекте изображения нити накаливания источ-
ника света. Этот метод приводит к излишним затратам
света, однако он очень прост.
б) . Освещение Кёллера более интенсивно и допускает более
точный контроль. В освещении используется осветитель
типа ОИ-19 (с линзой и ирисовой диафрагмой). Линза
осветителя дает изображение в том случае когда источ-
ник (нить накаливания) находится в фокусной плоскос-
ти конденсора, в действительной фокусной точке. Все
лучи света после конденсора являются параллельным
пучком. Они проходят через объект под различными уг-
лами, которые возрастают с увеличением расстояния то-
чек источника от оптической оси. Таким образом, объект
освещается набором пучков, составляющих светойлконус .
(В действительности это не конус, так как нить нака-
ливания лампы не круглая. Однако размер и положение
ирисовой диафрагмы осветителя позволяет использовать
в качестве источника только малую часть нити лампы).
Конденсор.можно отрегулировать таким образом, что
изображение нити осветителя будет находиться в плос-
кости рассматриваемого объекта. Этого достигают
уменьшением диафрагмы осветителя и фокусированием
её на объекте с помощью конденсора. При этом полу-
30
чается освещение такое же, как и линзы осветителя.
Практически освещение по Кёллеру выполняется следу-
ющим образом.
Устанавливают объектив 8Х. Поднимают конденсор
вверх до упора. Открывают полностью диафрагму кон-
денсора. Отодвигают матовое стекло. Устанавливают
плоское зеркало. Закрывают диафрагму осветителя, ос-
тавив только небольшое отверстие.
Включают осветитель. Пользуясь реостатом( регу-
лируют яркость света таким образом, чтобы нить лам-
пы давала слабый накал. Корпусу осветителя придают
такое положение, при котором свет падал бы'в центр
зеркала.
Кладут на зеркало микроскопа кружок белой бу-
маги и фокусируют на него изображение витка нити
лампы осветителя. Это достигается передвижением пат-
рона лампы осветителя.
Глядя в окуляр и слегка вращая зеркало, ловят
в поле зрения изображение краев диафрагмы осветите-
ля, которое имеет вид светлого пятна с нечеткими кра-
ями. Величина пятна зависит от степени раскрытия
диафрагмы и положения объектива.
При таком освещении фокусируют препарат (объек-
тив 8Х). Слегка опуская конденсор фокусируют в плос-
кости препарата изображение краев диафрагмы осветите-
ля т.е. получают изображение светлого пятна с чётко
очерченными краями.
С помощью зеркала переводят полученное яркое
31
пятно в центр поля зрения. Если все сделано правиль-
но, то это светлое пятно,видимое одновременно с пре-
паратом, будет равномерно освещено. В случае, когда пятно
освещено неравномерно,нужно добиться его равномерного
освещения, слегка поворачивая корпус осветителя.
Открывают диафрагму осветителя так,чтобы светлое
пятно заняло все поле зрения.
Устанавливают объектив 40Х и фокусируют препарат.
Яркость освещения регулируют только изменением
накала лампы осветителя или применением светофильтров.
Положение зеркала, конденсора и диафрагмы осветителя
больше не изменяют (независимо от того, с каким объек-
тивом работают)? Диафрагмой конденсора можно пользо-
ваться только для изменения контрастности изображения.
5. Сначала препарат рассматривают с объективом 8Х, а затем
переходят к большим увеличениям.
Необходимо помнить, что чем меньше увеличение дает объек-
тив тем больше при установке препарата на фокус будет сво-
бодное рабочее расстояние (расстояние между объективом
и препаратом). При работе с объективом 8Х расстояние между
препаратом и объективом около 9 мм, с объективом 40Х -
0,6 мм и с объективом 90Х - около 0,15 мм. Тубус микрос-
копа необходимо опускать вниз с помощью макрометричес-
кого винта осторожно, наблюдая за объективом сбоку и
приблизить его к препарату (не касаясь его) на расстоя-
ние меньше рабочего. Затем,гладя в окуляр,тем же винтом,
медленно вращая его против часовой стрелки, поднимают
32
тубус до тех пор, пока в поле зрения не появится изоб-
ражение изучаемого объекта. После этого вращением мик-
рометрического винта фокусируют объектив так, чтобы
изображение предмета было четким. Микрометрический винт
можно вращать не более, чем на пол-оборота в ту или
другую сторону. При работе с иммерсионным объективом
(увеличение 90Х) на препарат предварительно наносят
каплю кедрового масла и, глядя сбоку, микрометрическим
винтом опускают осторожно тубус микроскопа так, чтобы
кончик объектива погрузился в каплю масла. Затем, гля-
дя в окуляр, тем же винтом очень медленно поднимают ту-
бус до тех пор, пока не увидят изображение. Точную на-
водку объектива на фокус производят микрометрическим
винтом.
6. Препарат рассматривают в нескольких местах, передвигая
предметный столик боковыми винтами. При изучении препа-
рата следует все время медленно (в пределах пол-оборота)
вращать микровинт по часовой стрелке или против нее, что-
бы просмотреть предмет во всей толще и установить на фо-
кус то один, то другой участок препарата.
Перед переходом от одного объектива к другому место пре-
парата, где расположен изучаемый объект, следует поста-
вить точно в центр поля зрения и только после этого по-
вернуть"револьвер" с объективом.
7. Во время микроскопирования необходимо держать оба глаза
открытыми и пользоваться ими попеременно.
8. После окончания работы следует снять препарат с предмет-
ного столика, опустить конденсор, поставить под тубус
33
объектив 8Х, удалить мягкой тканью иммерсионное масло с
фронтальной линзы объектива 90Х и убрать микроскоп в фут-
ляр или накрыть его полиэтиленовым колпаком.
Микроскопия в темном поле
Микроскопия в темном поле основана на освещении объекта
косыми лучами света. Эти лучи, не попадая в объектив, остаются
невидимыми для глаза, поэтому поле зрения выглядит совершенно
черным. Если препарат содержит какие-то частицы, например, мик-
роорганизмы, то косые лучи, проходя через такой препарат, в
значительной степени отражаются от поверхности этих частиц и
настолько уклоняются от своего первоначального направления, что
попадают в объектив. При этом наблюдатель видит на черном фоне
интенсивно светящиеся объекты, даже если их диаметр в 10 раз
меньше, чем разрешающая способность объектива. Такое освещение
препарата достигается применением специального конденсора (рис.12)
которым заменяют обычный конденсор микроскопа. Темнопольный
конденсор имеет затемненную среднюю часть, поэтому центральные
лучи света, идущие от зеркала (или осветителя) вверх,задержи-
ваются. В плоскость препарата попадают только боковые лучи, от-
раженные от зеркальных поверхностей, расположенных внутри кон-
денсора. На рис. 13 показан ход лучей в конденсоре темного по-
ля. Из приведенной схемы видно, что эффект темного поля может
быть получен только в том случае, когда апертура конденсора нес-
колько больше апертуры объектива. Обычно разница должна состав-
лять 0,2-0,4 единицы. В противном случае часть боковых лучей
попадает в объектив, что вызовет снижение контраста и общее за-
туманивание картины. Поэтому рекомендуется вести наблюдение в
34
темном поле е иммергированным конденсором, имеющим апертуру
около 1,2 и сухими системами с числовой апертурой 0,65 - 0,85.
Рис.12. Конденсор тем-
ного поля 0И-13.
Рис.13. Схема хода
лучей в конденсоре
темного поля. 1-лин-
за конденсора;2-чёр-
ная пластинка,задер-
живающая центральные
лучи;3-объектив.
Если используется объектив с большей апертурой, то для получе-
ния четкого изображения объектив необходимо диафрагмировать,т.е.
снизить его апертуру. С этой целью в объектив, извлеченный из
револьвера, вводят специальную вставную диафрагму, которая вхо-
дит в комплект выпускаемых темнопольных конденсеров. Еще более
удобнее пользоваться объективами, снабженными ирисовой диафраг-
мой, расположенной между линзами. Изменяя диаметр раскрытия ди-
афрагмы вращением специального кольца, имеющегося на оправе,
можно менять числовую апертуру объектива. Все конденсоры тем-
ного поля имеют очень маленькое рабочее расстояние ,поэтому
они расчитаны на применение предметных стекол, толщина которых
не превышает 1,2 мм. В противном случае точка пересечения высо-
коапертурных лучей (фокус конденсора) окажется в толще предмет-
ного стекла, а не в плоскости препарата, и наблюдатель ничего
35
не увидит.
Для темнопольной микроскопии требуется более мощный источник
света, чем для микроскопии в светлом поле, так как темнопольный
конденсор пропускает лишь незначительную часть поступающего в
него светового потока. Поэтому приобретает особое значение пра-
вильная установка света, максимальное его использование и осо-
бенно тщательная центрировка. Работая с тёмнопольным конденсо-
ром, следует обращать внимание также на толщину препарата и тол-
щину используемых стекол. Чем толще препарат и чем больше в нем
посторонних частиц, преломляющих свет (пылинки,пузырьки воздуха
и т.п.), тем менее контрастным получается изображение,так как
каждая частица, отражая лучи, освещает поле зрения. При соблю-
дении всех условий получают ослепительно яркие объекты на интен-
сивно черном фоне. Величина этих объектов может измеряться со-
тыми долями микрона, т.е. разрешающая способность в случае ис-
пользования темнопольного конденсора приблизительно в 10 раз
больше, чем при светлопольной микроскопии. .
Таким образом, микроскопия в темном поле позволяет увидеть
объекты, лежащие за пределами видимости обычного микроскопа.
Необходимо отметить, что при наблюдении объектов в темном поле
различают только их контуры (особенно это относится к очень
мелким объектам), что не дает возможности судить об их внутрен-
нем строении.
В темном поле лучше всего наблюдать живые культуры микро-
организмов в препарате "раздавленная капля". Препарат готовят
на тонком предметном стекле (не толще 1,2 мм), предварительно
тщательно очищенным. Препарат помещают на столик микроскопа и
фокусируют с объективом 8Х. После этого приступают к замене
светлопольного конденсора на темнопольный и центрировке света,
для чего последовательно выполняют следующие операции:
I. Вынимают светлопольный конденсор и окуляр, вывинчивают
один из объективов. Револьвер микроскопа МБИ-1 имеет одно сво-
бодное от объективов отверстие, закрытое специальной заглушкой,
так что можно воспользоваться этим отверстием, вывинтив заглуш-
ку.
2. Закрыв диафрагму осветителя, фокусируют изображение ни-
ти лампы на зеркале, прикрытом кружком белой бумаги (как при
установке света по Кёллеру). Предварительно необходимо с помо-
щью реостата уменьшить яркость света.
3. Открывают диафрагму осветителя. Помещают на верхний
конец тубуса микроскопа (на место' окуляра) матовое стекло и,
слегка поворачивая зеркало, добиваются равномерного освещения
поля. После этого зеркало перемещать нельзя.
4. Вставляют окуляр, устанавливают объектив 8Х и осторож-
но, не задевая зеркала, устанавливают темнопольный конденсор.
Последний устанавливают таким образом, чтобы белый винт был
обращен в сторону штатива микроскопа, а два регулировочных
винта - в сторону осветителя. Надевают на регулировочные вин-
ты ключи.
5. Препарат сдвигают в сторону, на верхнюю линзу конден-
сора наносят каплю иммерсионного масла и несколько опустив кон-
денсор снова устанавливают препарат, закрепив его клеммами.
б. Поднимают конденсор вверх до соприкосновения маслянной
капли с предметным стеклом. Калля должна равномерно заполнить
пространство между линзой конденсора и предметным стеклом и не
содержать пузырьков воздуха. В противном случае операцию сле-
37
дует повторить, увеличив масляную каплю.
7. Отключают реостат осветителя.т.е. получают максимальное
освещение.
8. Глядя в окуляр, центрируют конденсор. Для этого с по-
мощью регулировочных винтов приводят точно в центр поля зрения
изображение светлого кольца с темным пятном в середине (или
только светлого пятна).
9. Слегка поднимая или опуская конденсор, устанавливают
его в таком положении, чтобы в световой картине исчезло темное
пятно и в поле зрения осталось только замкнутое светлое пятно.
10. Ставят объектив 40Х и фокусируют препарат.
Фазово-контрастная микроскопия
Большинство препаратов живых микроорганизмов слабо контра-
стны, т.е. клетки мало отличаются по окраске и прозрачности от
окружающей среды. Это объясняется тем, что лучи света, проходя-
щие через клетки, почти не отличимы от лучей, проходящих через
окружающую среду. Между тем, световая волна испытывает опреде-
ленные изменения: проходя через участки препарата, имеющие боль-
ший, чем у окружающей среды показатель преломления, световая
волна меняет фазу - выходит из более плотной области с некото-
рым отставанием по фазе относительно соседних волн. Такие пре-
параты называются "фазовыми". Но, как известно, глаз человека
не в состоянии заметить различный по фазе, а выявляет только
различия в длине волны (цвета) и в амплитуде (контрастность).
Действительно, неокрашенные живые объекты хорошо видны только
в том случае, когда они в достаточной мере непрозрачны, в так
называемых "амплитудных".контрастных препаратах,где часть энер-
38
гии света, проходящего через более плотные участки, поглощается.
Выходящая из такого участка волна имеет меньшую амплитуду, и это
место воспринимается глазом наблюдателя как более темное. Прев-
ратить "фазовый" (неконтрастный) препарат в "амплитудный" (конт-
рактный) можно либо окрашивая бактерии, либо снижая апертуру
конденсора (прикрывая диафрагму). Последнее нежелательно,так как
уменьшает разрешающую способность микроскопа. Фазово-контрастное
устройство позволяет оптическим путем превращать различия по фа-
зе в изменение амплитуды, в результате чего живые прозрачные
объекты становятся контрастными, хорошо видимыми глазом. При этом
разрешающая способность микроскопа не снижается.
Оптическая система, используемая для получения фазового
контраста (рис.14),состоит из фазовой пластинки, имеющей фор-
му кольца, и специальной кольцевой диафрагмы.
Рис.14. Схема хода лучей при
использовании фазово-контраст-
ного устройства.1-кольцевая
ди афрагма;2-конденсор;3-объект;
4-ооъектив;5-фазовая пластинка.
39
Фазовая пластинка представляет собой круг напыления из солей
редких металлов на одну из линз объектива. Эта пластинка обес-
печивает изменение фазы проходящей волны света на 1/4 Л ,что
приводит к превращению фазовых различий в амплитудные. Кольце-
вая диафрагма представляет собой непроницаемую для света плас-
тинку, в которой имеется прозрачная щель в виде кольца. Помещен-
ная под конденсором кольцевая диафрагма пропускает в плоскость
препарата лишь кольцо света. Для получения фазового эффекта t
необходимо точное совмещение фазового кольца с проекцией коль-
цевой диафрагмы.
Устройство^применяемое для наблюдения методом фазового конт-
раста (рис.15), представляет собой приставку к микроскопу (в
настоящее время наиболее широко применяется модель НФ-4),
состоящую из вспомогательного микроскопа,специальных фазовых
объективов и конденсора с набором кольцевых диафрагм каждая из
которых соответствует фазовой пластинке определенного объектива.
Кольцевые диафрагмы установлены в револьверном диске под кон-
денсором и поворотом диска могут легко меняться,причем в окне
крышки диска появляется цифра,соответствующая увеличению
применяемого объектива. Кроме того, в револьверном диске име-
ется свободное отверстие - "нулевая диафрагма"для тех случаев,
когда ковденсор необходимо использовать для наблюдений обычным
способом. Конденсор снабжен двумя винтами для центрировки коль-
цевой диафрагмы относительно фазового кольца объектива. Все фа-
зовые объективы имеют на оправе обозначение "Ф" (на импортных
объективах встречается обозначение " Ph"). Ими можно пользоваться
и для обычной микроскопии,но из-за наличия фазового кольца они
дают изображение пониженного качества.
40
Рис.15. Фазовоконтрастное устройство КФ-4.
1-конденсор; 2-револьверный диск с набором
кольцевых диафрагм; 3-центрировочные вин-
ты; 4-вспомогательный микроскоп; 5-набор
фазовых объективов.
Методика исследования живых культур микроорганизмов с фа-
зовоконтрастным устройством сводится к следующему:
I. Удаляют из микроскопа обычный конденсор и на его месте
устанавливают фазово-контрастный. Диск револьвера конденсора
поворачивают таким образом, чтобы в окошке стояла цифра "О".
Ирисовая диафрагма конденсора должна быть открыта.
2. Заменяют объектив 40Х на фазовый объектив 40ХФ.
3. На предметный столик помещают препарат "раздавленная
капля". Устанавливают свет по Кёллеру, пользуясь объективом 6Х.
4. Устанавливают объектив 40ХФ.
б. Заменяют окуляр на вспомогательный микроскоп и,переме-
щая тубус последнего, добиваются четкой фокусировки фазовой
41
пластинки объектива. Она имеет вид темного кольца.
6. Поворотом диска револьвера, включают кольцевую диафраг-
му^ соответствующую объективу 40 ХФ. Теперь при наблюдении во
вспомогательный микроскоп видно не только фазовое кольцо, но и
светлое кольцо - щель диафрагмы.
7. Пользуясь центрировочными винтами конденсора, перемеща-
ют кольцевую диафрагму так, чтобы она совместилась с фазовым
кольцом ( рис. 16). Если ширина темного кольца (фазовой плас-
тинки) больше, чем ширина светлого кольца (щель диафрагмы), то
необходимо, чтобы светлое кольцо вписалось в контур темного
кольца концентрично.
8. Вынимают вспомогательный
фокусируют препарат.
9. При микроскопировании
с другими объективами устанав-
ливают соответствующие кольце-
вые диафрагмы и каждый раз про-
веряют центрировку, пользуясь
микроскоп, вставляют окуляр и
Рис.16. Центрировка
кольцевой диафрагмы
и фазовой пластинки:
A-неправильное поло-
жение; Б-правильное
положение.
вспомогательным микроскопом.
Интерференционная микроскопия
Как и фазово-контрастная микроскопия, интерференционная
микроскопия основана на возможности преобразования различия
фаз в различия интенсивностей. Наиболее эффективная система
(система Дайсена) состоит из сложного комплекса посеребренных
42
поверхностей и рефлекторов, который делит свет, выходящий от
объекта, на части, одна из которых проходит через окружающую
среду и сдвигающую фазовую пластинку. При последующей рекомби-
нации с остальной частью света,которая не подвергалась сдвигу
по фазе,происходит интерференция. При этом сдвиги по фазе,обус-
ловленные различиями показателей преломления и (или) толщин
участков объекта,преобразуются в различия интенсивностей. При
использовании белого света эти участки будут иметь различную
окраску, тогда как в монохроматическом свете будет наблюдаться
только различие интенсивностей. Интерференционный микроскоп очень
сложен по устройству.Он позволяет получать контрастное изображе-
ние объекта без ореола в отличие от фазово-контрастной микроско-
пии.Причем, с помощью этого микроскопа можно увидеть мелкие дета-
ли, которые не доступны для фазового метода.Кроме того,интерференци
онный микроскоп позволяет проводить количественные измерения, в
отличие от фазово-контрастного микроскопа. Например’,можно изме-
рить разность длин оптического пути между частицей и окружающей
средой.Поскольку длина пути определяется показателем преломления
и толщиной, то можно измерить один из этих параметров,если другой
известен.Более того,можно определить концентрацию известного ве-
щества,если известны показатель преломления и удельный инкремент
рефракции (изменение показателя преломления на единицу количества
растворенного вещества).Так, если и пр - показатели прелом-
ления белка и растворителя соответственно, то
- Пр
где 4- - удельный инкремент рефракции, а С - концентрация в грам-
мах на 100 мл.Поскольку hy и «С - мало изменяются в зависимос-
ти от типа белка,то пользуясь этим соотношением, можно ориен-
43
тировочно определить концентрацию белка внутри клетки.
Поляризационная микроскопия.
В поляризационной микроскопии используют плоскополяризован-
ный свет, получаемый при пропускании света через поляризатор
(например, поляроид или призму Николя).
Структуры, состоящие из вытянутых молекул, расположенных
параллельно, или дисков, расположенных в виде стопки, при введе-
нии в среду с показателем преломления, отличающимся от показате-
ля преломления частиц структуры, обнаруживают способность к дву-
лучепреломлению. Это означает, что структура будет пропускать
плоскополяризованный свет только в том случае, когда плоскость
поляризации параллельна длинным осям частиц. Это остается в силе
даже тогда, когда частицы не обладают собственным двулучепрелом-
лением, т.е. если частицы с равной вероятностью пропускают поля-
ризованный свет, падающий под любым углом.
В поляризационном микроскопе поляризатор распологается меж-
ду источником света и конденсором. Кроме того, в микроскопе име-
ются вращающийся столик или держатель образца, анализатор, нахо-
дящийся между объективом и окуляром, который можно установить
так, чтобы его ось была перпендикулярна оси поляризатора (гово-
рят, что в этом случае поляризатор и анализатор скрещены),и ком-
пенсатор (рис. 17). Когда поляризатор и анализатор скрещены, а
объект отсутствует или является изотропным (не имеет преиму-
щественной оси преломления поляризованного света), поле выгля-
дит равномерно темным. Если же присутствует объект, обладающий
двулучепреломлением, причем он расположен так, что его ось на-
ходится под углом к плоскости поляризации, отличным от 0° или
44
90°, он будет разделять поляризованный свет на два компонента
- параллельный и перпендикулярный относительно, плоскости ана-
лизатора (рис.16).
Поляризованный свет
Рис.17. Оптическая схема поляриза-
ционного микроскопа. 1-источник
света; 2-линза поля; 3-поляриза-
тор; 4-конденсор; 5-образец; 6-
вращающийся столик;‘7-объектив;
6-компенсатор; 9-вращающийся анали-
затор; 10-окуляр.
падает на обаект
с Ьеулучепреломлением
Указанный компонент
попадает
в анализатор ( — - »),
который пропускает
компонент, параллельный
направлению анализатора
Рис. 18. А--разделение
поляризованного све-
та объектом с двулу-
чепреломлением. ь-
вид объекта с двулу-
чепреломлением, рас-
положенного вдоль по-
ляризатора, вдоль ана-
лизатора й под углом
450к каждому из них.
Б
I
45
Следовательно,часть света будет проходить через анализатор, в ре-
зультате чего появляется яркое изображение объекта на темном фо-
не. При вращении объекта яркость его изображения будет изменяться,
достигая максимума при угле 45° относительно поляризатора и анали-
затора; если же объект находится на одной линии с любым из них, то
его изображение становится невидимым (для этих целей и предусмотрен
вращающийся столик).На рис. 18 изображена стержнеобразная струк-
тура, проявляющая свойство двулучепреломления и ориентированная
таким образом,что продольная ось находится под углом 45°к скре-
щенным поляризатору и анализатору. Яркость будет максимальной,
если структура состоит из вытянутых параллельных молекул и уложен-
ных стопкой дисков,поскольку в этом случае ось и плоскость дисков
перпендикулярны. С помощью компенсатора можно различить параллель-
ное ("положительное") и перпендикулярное ("отрицательное") двулу-
чепреломление. Объект проявляет свойство двулучепреломления в
том случае, когда показатель преломления света,поляризованного
параллельно оси,отличаетсй -от показателя света,поляризованного
в перпендикулярном направлении. Для положительного двулучепре-
ломления параллельное направление имеет меныпий показатель прелом-
ления, поэтому свет в этом направлении движется быстрее, чем в
перпендикулярном. Если уравнять скорости параллельного и перпен-
дикулярного компонентов, то общее значение двулучепреломления
будет равно нулю,а объект станет невидимым. Вращение компенсаяо-
ра позволяет индентифицировать знак двулучепреломления по поло-
жению компенсатора, в котором наблюдается максимальная и мини-
мальная яркость.
Поляризационная микроскопия позволяет за относительно ко-
роткое время получать информацию о молекулярной архитектуре
46
клеток. Например,с помощью поляризационного микроскопа можно
выявлять структуры^ содержащие ориентированные молекулы.Причем,
знак двулучепреломления свидетельствует о том, как эти компонен-
ты ориентированы. Кроме того поляризационная микроскопия дает
возможность идентифицировать спиральные структуры и наблюдать
объекты, невидимые при применении других методов (например,
митотическое веретено).
Флуоресцентная (люминесцентная) микроскопия.
Флуоресценция - свечение микроскопических объектов,которое
может быть выявлено с помощью увеличивающих оптических приборов.
Метод этот очень чувствителен,поскольку для любого флуоресцирую-
щего вещества интенсивность флуоресценции пропорциональна интен-
сивности падающего света.
Свечение объектов может быть собственное (без предваритель-
ного окралмвания) и наведенное (в результате обработки образца
красителем). При действии на объект невидимыми ультрафиолетовы-
ми или сине-фиолетовыми лучами с короткой длиной волн возбуждает
ся люминесценция с более длинной световой волной,видимой гла-
зом человека. Это свойство и положено в основу люминесцентной
микроскопии.
Главная проблема во флуоресцентной микроскопии состоит в
отделении флуоресценции от падающего света. Для этого во флу-
оресцентном микроскопе используются оптические фильтры (рис.19).
Фильтр,который пропускает в спектре флуоресценции только свет
с длиной волны,соответствующей возбуждению,помещают между ис-
точником света и конденсором. Другой фильтр,пропускающий свет
с длиной волны,соответствующей флуоресценции, но не возбужда-
ющей свет, помещают между объективом и глазом наблюдателя. Та-
ким образом в отсутствие флуоресцентного объекта в глаз не бу-
дет попадать свет и поле будет черным. Если же объект флуорес-
цирует, то он будет контрастно выделяться на окружающем фоне.
Для анализа слабой флуоресценции необходимо использовать пок-
ровные стекла, предметные стекла и линзы из нефлуоресцирующего
стекла, поскольку любой из этих элементов может подсвечивать
поле фона в достаточной степени.
В люминесцентной микроскопии большое значение имеет вторич-
ная лпонесценцня, которая появляется после обработки исследу-
емых объектов специальными красителями (флуорохромами), облада-
ющими способностью светиться под действием длинных ультрафио-
летовых и коротких сине-фиолетовых лучей. Флуорохромы могут
быть синтетические и естественные; они применяются в больших раз-
ведениях (порядка 0,0001-0,00001^). Наиболее часто применяются
следующие флуорохромы: акридин оранжевый, аурамин, корифосфин,
флуоресцин, уранин, родамин, риванол, акрихин, тиофлавин и др.
В люминесцентном микроскопе можно'исследовать живые прозрачные
и непрозрачные объекты. Они видны цветными, более крупными и
контрастными.
Рис.19. Оптическая схе-
ма флуоресцентного мик-
роскопа. I-источник све-
та; 2-фильтр (отделяет
X * А,); 3-конденсор;
4-объектив; 5-фильтр(от-
деляет Л|).
48
С помощью флуоресцентной микроскопии можно увидеть компонен-
ты,которые трудно увидеть при применении других методов,лока-
лизовать вещество путем специфического связывания и опреде-
лить ориентацию с помощью поляризационной флуоресценции.
Электронная микроскопия.
В электронной микроскопии пучок света заменен потоком элект-
ронов. Длина волны электронных лучей во много раз короче длины
световых лучей,что позволяет получить большее увеличение и рас-
сматривать объекты,невидимые в световом микроскопе. Электронные
микроскопы бывают разных систем. Наибольшее распостранение по-
лучили микроскопы просвечивающего типа. По разрешающей способ-
ности их делят на три класса: к первому классу относят микроско-
пы с разрешением равным 100-150 нм, ко второму классу - микрос-
копы с разрешающей способностью 200-300 нм и к третьему микроскопы
с разрешением равным 500-1500 нм. В настоящее время имеются мик-
роскопы с разрешающей способностью менее 100 нм. Отечественный
универсальный микроскоп ЭМВ-150 имеет разрешающую способность
50 нм,а Японские НИ-ПЕ (фирма Hitachi ) и JEM -100В (фирма
JEOL ) соответственно 15 и 20 нм (рис.20).
В электронном микроскопе линзами являются электрические
или магнитные поля соответствующей конфигурации. Источником
электронов служит катод,представляющий собой тонкую вольфрамо-
вую нить,закрепленную в специальном держателе пушки. Движение
электронов осуществляется по направлению к аноду,который укреп-
лен в верхней части конденсорной линзы,за конденсорной линзой
размещена камера объекта,она вместе с объективной линзой пред-
ставляет одно целое.Затем электроны проходят через промежуточ-
ную линзу и попадают на экран,где и получается изображение
(рис.21). Движение электронов происходит в вакууме,так как
49
при столкновении с молекулами газа они отклоняются от первона-
чального направления,что ведет к ухудшению изображения,а иног-
да и к полному исчезновению его. При наличии даже небольшого
количества воздуха вольфрам на
катоде окисляется и выходит из
строя.
Рис.20. Схема устройства
электронного просвечивающе-
го микроскопа JEM-IOOB.
I-электронная пушка;2-ваку-
умный клапан шлюза пушки;
3-1-я конденсорная линза;
4-2-я конденсорная линза;
5-стигматор 2-ой конденсор-
ной линзы;о-система откло-
нения пучка;7-держатель об-
разца;8-стигматор объектив-
ной линзы;9-объективная
линза;IO-1-я промежуточная
линза;II-2-я промежуточная
линза;12-проекционная линза:
13-датчик фотоэкспонометра;
14-фотокамера;15-флуоресци-
рующий экран;16-бинокуляр;
17-механизм селекторной
диафрагмы;18-механизм апер-
турной диафрагмы;19-устрой-
ство защиты образца от заг-
рязнения;20-магазин для дер-
жателей образцов;21-компен-
сатор смещения пучка;22-руч-
ки юстировки.
Вот почему создание хорошего вакуума является обязатель-
ным условием нормальной работы электронного микроскопа.
Объекты,исследуемые в электронном микроскопе,должны быть
50
прозрачными для электронов и в то же время обладать достаточной
прочностью. Исследуемый материал наносят на тонкие пленки-подлож-
ки, которые крепятся на опорной сетке, имеющей от 4 до 10 ячеек
на I мм^.
Рис.21. Схема хода лучей в электронном
микроскопе. I-электронная пушка; 2-кон-
денсорная линза; 3-предмет; 4-объектив-
ная линза; 5-промежуточное изображение;
6-проекционная линза; 7-окончательное
изображение.
Пленки-подложки готовят из раствора коллодия в амилацетате
или других веществ.
Для увеличения контрастности рассматриваемых объектов их
напыляют .обычно хромом, металл при этом помещают под колпак и
нагревают в вакууме до высокой температуры, в результате чего
он испаряется. Чем мельче предполагаемый объект, тем меньше
должен быть угол наклона препарата по отношению к напылителю.
Напыленный материал на сетке помещают в патрон, закрепля-
ют обоймой, а затем переносят в камеру объекта микроскопа и рас-
сматривают.
51
Суцествуют электронные микроскопы,способные давать трехмер-
ное изображение объекта.
Техника микроскопических исследований с каждым годом совер-
шенствуется, что позволяет проводить изучение микробиологических
объектов в естественных условиях обитания.
Дезинтеграпия микроорганизмов. Устройство
баллистического дезинтегратора и правила
работы на нем.
Первым и наиболее важным этапом при получении микробных
субструктур является дезинтеграция микроорганизмов. Различают
химические,ферментативные,биологические,физические и механи-
ческие методы дезинтеграции.
Химические и ферментативные методы заключаются в обработ-
ке биомассы клеток различными химическими агентами или фермен-
тами, соответственно.
В биологических методах для разрушения клеток используют
бактериофаг. Из-за своей узкой специфичности этот метод редко
находит применение на практике.
Такие воздействия на клетки, как: I) осмотический шок,
2)температура, 3)попеременное замораживание и оттаивание,
4)высокое давление, 5)декомпрессия, 6) ультразвуковые волны,
7)электроимпульсный разряд, составляют группу физических мето-
дов дезинтеграции.
К механическим методам разрушения клеток относятся расти-
рание, перемешивание, встряхивание клеток с абразивными матери-
алами и без них.
52
Механические методы дезинтеграции, в которых для разрушения
микроорганизмов в суспензии используется интенсивное движение
мелких частиц (стеклянных, пластмассовых и пр,).называют баллис-
тическими.
На кафедре микробиологии ЛХФИ разработан и создан баллисти-
ческий дезинтегратор непрерывного действия, общий вид которого
показан на рис.22, а разрез по оси и вид в плане на рис.23.
Рис.22. Дезинтегратор для микроорганизмов.
Дезинтегратор для микроорганизмов непрерывного действия
предназначен для разрушения микроорганизмов с целью получения
клеточных органелл (митохондрий, ядер, мембран, рибосом и др.),
биополимеров (белков,ферментов, липидов, нуклеиновых кислот,
полисахаридов), а также других ценных компонентов клетки (вита-
минов, гормонов, антибиотиков). Кроме того дезинтегратор может
быть использован для ускорения экстракции различных веществ из
53
микробных клеток; сверхтонкого измельчения, гомогенизации, эмуль-
гирования органических и биологических материалов в жидких сре-
дах.
Дезинтегратор для микроорганизмов (рис.23) состоит из гер-
метического цилиндрического корпуса I,рабочей камеры 2 (внутрен-
ние размеры: диаметр - 131 мм, высота - 51 мм) с мелющими телами
( рабочая камера 2 и корпус I выполнены как одно целое - в виде
одной детали),крышки 3,фланца 4,расположенных в рабочей камере
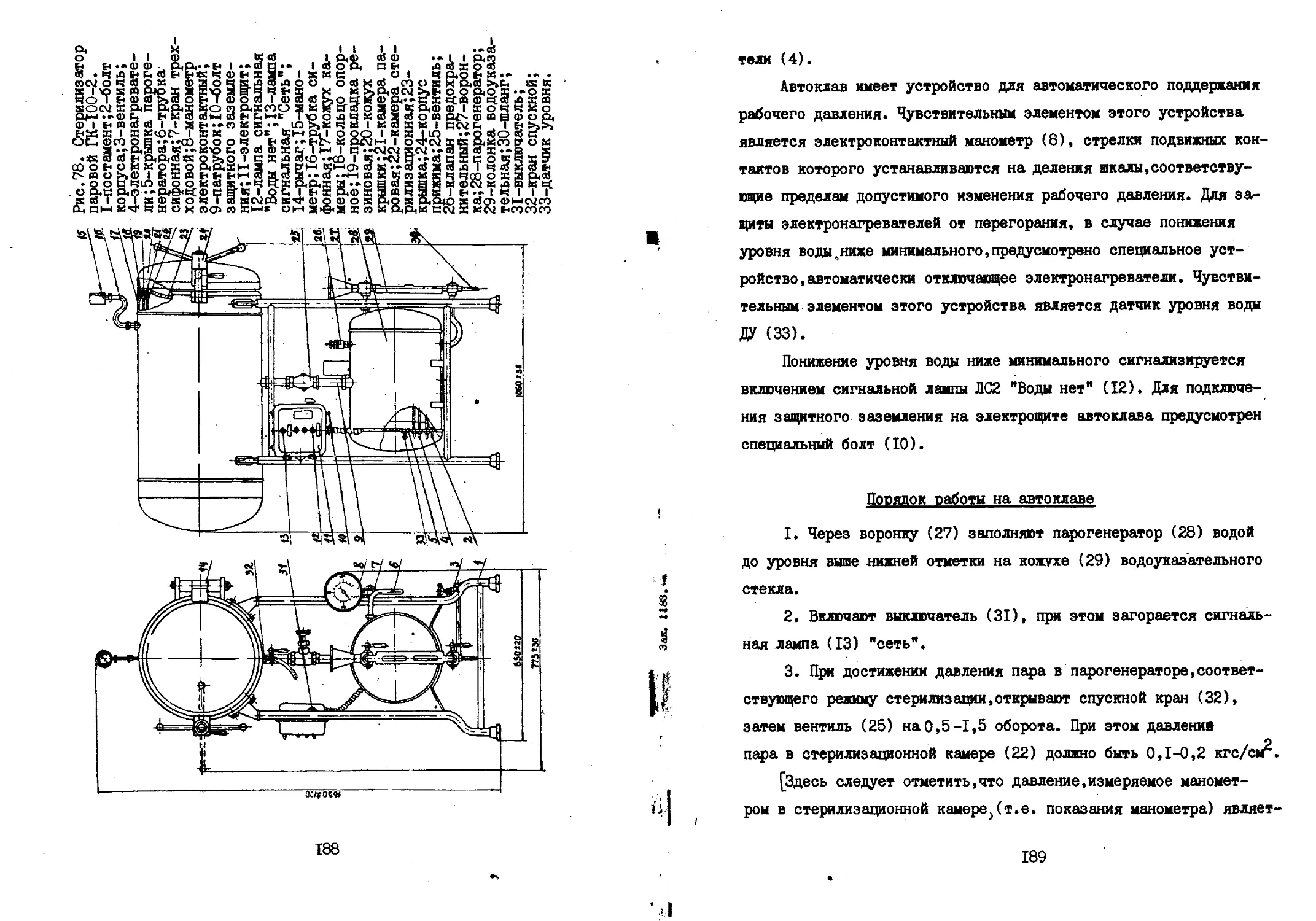
на приводном валу 5 рабочего цилиндрического диска 6 (размеры:
диаметр - ИЗ мм, высота - 34 мм), сепарирующего колеса 7 (с ра-
диально расположенными лопатками сверху, угол между двумя сосед-
ними лопатками равен 15°) и сепарирующей втулки 8. Рабочий диск 6,
сепарирующее колесо 7 и сепарирующая втулка 8 крепятся на валу 5
прижимной круглой гайкой 9. Между диском б и гайкой 9 имеется
фрикционная прокладка 10 и шайба II. На конце вала 5 навинчена
круглая гайка 12, с конической внутренней поверхностью по краю.
Кроме того на валу 5 закреплено разгрузочное колесо 13 шпонкой 14.
Лопатки разгрузочного колеса расположены радиально сверху и снизу;
угол между двумя соседними лопатками равен 45°. Вал 5 свободно
вращается в подшипниках 15, впресованных во фланец 4. Фиксирующая
втулка 16 и муфта 17, закрепленная на валу штифтом 18, предохра-
няют вал от продольных смещений.
Нижний подшипник 15 закрыт прижимной крышкой 19, которая к
фланцу 4 крепится винтами 20. Крышка 3 выполнена в виде кольца,
внутренняя часть которого представлена четырьмя вертикальными
цилиндрическими поверхностями,между которыми образуются горизон-
тальные кольцевые выступы. На горизонтальном кольцевом выступе
мещцу первой и второй цилиндрическими поверхностями (считая
внутренние вертикальные цилиндрические поверхности от верха
54
крышки) установлена массивная шайба 21. Между шайбой и цилиндри-
ческим выступом крышки имеется прокладка 22. В крышке выполнен
выходной цилиндрический канал 23, продольная ось которого гори-
зонтальна, а наиболее удаленная от этой оси образующая цилиндри-
ческой поверхности канала направлена по касательной к третьей
внутренней вертикальной цилиндрической поверхности крышки. Вы-
ходной канал заканчивается разгрузочным штуцером 24, прикреп-
ленным к крышке дезинтегратора. К горизонтальному кольцевому
выступу крышки между третьей и четвертой внутренними вертикаль-
ными цилиндрическими поверхностями прикреплен вкладыш 25 винта-
ми 26. Вертикальная цилиндрическая часть вкладыша 25 входит в
паз, выполненный в виде кольца, в лопатках сепарирующего коле-
са 7.
Сепарирующее колесо 7, сепарирующая втулка 8 и вкладыш 25
предназначены для сепарации жидкой фазы от мелющих тел. Сепара-
ция осуществляется за счет лопаток сепарирующего колеса 7,отбра-
сывающих при вращении колеса мелющие тела к периферии, а также
за счет минимальных зазоров (0,1-0,15 мм) между внутренней
вертикальной цилиндрической поверхностью кольцевого паза сепа-
рирующего колеса 7, внутренней вертикальной 'цилиндрической по-
верхностью вкладыша 25 и кромкой конической поверхности сепари-
рующей втулки 8.
Разгрузочное колесо 13 совместно с горизонтальными поверх-
ностями шайбы 21 и вкладыша 25 и выходным каналом 23 представ-
ляют устройство, подобное центробежному насосу.
3 крышке дезинтегратора имеется загрузочный патрубок 27,
который закрывается длинной пробкой 28 и завинчивается крыш-
кой 29. Пробка 28 заполняет все пространство загрузочного пат-
55
42
12
35
30
36
a
и
22
fa J
33
39
Вид A
Рис.23. Дезинтегратор
для микроорганизмов
(разрез по оси и вид
в плане). I-корпус;
2-рабочая камера;
3-крышка;4-фланец;
5-вал;6-рабочий диск;
7-сепарирующее колесо;
8-сепарирующая втулка;
9-прижимная гайка;
10-прокладка;11-шайба;
12-круглая гайка с внут-
ренней конической по-
верхностью по краю;
13-разгрузочное колесо;
14-шпонка; 15-подшипник;
16-фиксирующая втулка;
17-муфта;18-штифт;
19-прижимная крышка;
20-винты;21-массивная
шайб а;22-прокладка;
23-выходнои канал;
24-разгрузочный штуцер;
. 25-вкдадыш;26-винты;
ЕМ i 27-загрузочныЙ патру-
бок;28-пробка;29-крыш-
ка:30-втулка;31-гайка;
32прокладка;33-крышка;34-входной штуцер;35-накидная круглая
гайка с внешней конической поверхностью;Зб-прокладка;37-шай-
ба;38-контргайка;39-прокладка;40-станина;41-откидные болты;
42-гайки-барашки;43-шайбы.
56
рубка и тем самым уменьшает нерабочее пространство рабочей ка-
меры 2.
В круглое отверстие днища корпуса I вставлена втулка 30,
имеющая внешнюю и внутреннюю резьбу. На внешнюю резьбу втулки
навинчивается гайка 31,плотно прижимающая втулку к днищу корпуса.
Между втулкой и днищем имеется прокладка 32. Сверху на втулку
надета крышка 33,закрывающая сверления во втулке,которые пред-
назначены для сборки данного узла дезинтегратора. Во внутреннюю
часть втулки 30 ввинчен входной штуцер 34,на верхний конец кото-
рого навинчена до упора накидная круглая гайка 35 с левой резьбой,
имеющая одинаковые диаметр и конусность по внешней поверхности с
гайкой 12, навинченной на конец вала 5.
Входной штуцер 34 при вращении вправо или влево может пере-
мещаться вдоль своей оси вверх или вниз,поднимая или опуская на-
кидную гайку 35. Для обеспечения герметичности в резьбовом соеди-
нении между входным штуцером 34 и втулкой 30 имеется прокладка 36,
шайба 37 и контрогайка. В крышке 3 имеются кольцевые пазы, в ко-
торые на небольшую глубину входят вертикальные цилиндрические
части рабочей камеры 2 и корпуса I. В эти пазы вставлены проклад-
ки 39. Корпус с камерой установлен в станину 40 с откидными бол-
тами 41,гайками-барашками 42 и шайбами 43. Крышка 3 плотно при-
жимается к корпусу и рабочей камере откидными болтами 41,стя-
гивающими станину 40 и фланец 4.
При плотном прижатии крышки 3 к корпусу и рабочей камере 2,
между их вертикальными цилиндрическими поверхностями образуется
герметическое пространство,в которое через штуцер 44,располо-
женный в нижней части корпуса,подается охлаждающий агент (вода
или рассол). Через такой же штуцер располо-
57
женный диаметрально противоположно в верхней части корпуса,ох-
лаждающий агент отводится.
На трубке фланца 4, в которую впрессованы подшипники 15,
закреплена платформа (рис.23 не показана) для установки на ней
электродвигателя.
Эксплуатация дезинтегратора.
После сборки дезинтегратора вращением входного штуцера 34
накидную гайку 35 поднять вверх до упора. Затем вращением вход-
ного штуцера в обратную сторону (учитывая,что шаг резьбы штуце-
ра равен I мм) установить зазор 0,3-0,5 мм между коническими
поверхностями гаек 12 и 35. В таком положении входной штуцер 34
зафиксировать контрогайкой 38. При этом на входе в рабочую камеру
обеспечивается сепарация мелющих тел от жидкой фазы. Проверить
вручную вращение вала дезинтегратора и соединенной с ним муфтой
вала электродвигателя (вращение должно быть свободным и плав-
ным). На входной штуцер 34 надеть резиновый или селиконовый
шланг и перекрыть его зажимом на расстоянии минимальном к входу
штуцера. На разгрузочный штуцер 24 надеть резиновый или селико-
новый шланг,перекрытый зажимом.
Через загрузочный патрубок 27 в рабочую камеру 2 загрузить
необходимое количество мелющих тел (350 г стеклянных шариков
диаметром 0,6-0,8 мм) и затем суспензию микроорганизмов. Рабо-
чую камеру 2 заполнять суспензией до тех пор пока не появятся
первые капли жидкости из разгрузочного штуцера 24 (около 150 мл).
После этого загрузочный патрубок 27 закрыть пробкой 28 и завин-
тить крышкой 29. Через штуцер 44 по резиновому шлангу подать
охлаждающий агент в герметическое пространство между цилиндри-
58
ческими поверхностями корпуса I и рабочей камеры 2.
Далее процесс дезинтеграции микроорганизмов можно выполнять
в одном из трех режимов: периодическом, циркуляционном и непре-
рывном.
Правила работы в периодическом режиме.
I. Со шланга, надетого на разгрузочный штуцер 24,снять зажим и
конец шланга поместить в сосуд с дезинфицирующим раствором.
2. Включить электродвигатель дезинтегратора. При этом происхо-
дит разрушение загруженной суспензии микроорганизмов (время
разрушения устанавливается опытным путем, оно зависит от
разрушаемого объекта и преследуемой цели).
3. По окончании дезинтеграции выключить электродвигатель.
4. Снять с разгрузочного штуцера 24 шланг и поместить его в со-
суд с дезинфицирующим раствором.
5. Слить разрушенную суспензию в приемный сосуд через входной
штуцер 34, сняв зажим со шланга,надетого на этот штуцер.
6. Снять с входного штуцера 34 шланг и поместить его в сосуд
с дезинфицирующим раствором.
7. На штуцеры 24 и 34 надеть другие шланги, перекрытые зажима-
ми.
8. Отвинтить крышку 29 и открыть загрузочный патрубок 27.
9. Через загрузочный патрубок 27 в рабочую камеру 2 залить
дезинфицирующий раствор, закрыть патрубок пробкой 28, завин-
тить крышкой 29 и оставить на 1-2 часа.
10. Снять со шлангов зажимы и через входной штуцер 34 слить дез-
инфицирующий раствор.
Ц.Шяанг, надетый на входной штуцер 34,подсоединить к водопро-
59
водному крану.
12. Конец шланга,надетого на разгрузочный штуцер 24,опустить в
раковину и снять с этого шланга зажим.
13. Приоткрыть водопроводный кран, сразу же включить электро-
двигатель дезинтегратора и промывать рабочую камеру проточ-
ной водой в течение 5 минут.
14. Закрыть водопроводный кран, выключить электродвигатель.
15. Снять с водопроводного крана шланг и конец его опустить в
раковину, при этом с рабочей камеры сольются остатки про-
мывной воды.
16. Шланги,надетые на входной штуцер 34 и разгрузочный штуцер
24,перекрыть зажимами.
17. Конец Шланга, надетого на разгрузочный штуцер 24, опустить
в сосуд с дезинфицирующим раствором.
После этого дезинтегратор готов к следующей операции.
Правила работы в циркуляционном режиме.
I. Загрузить в дезинтегратор суспензию микроорганизмов как
было указано ранее.
2. Шланг,надетый на входной штуцер 34,соединить с напорной
склянкой, содержащей суспензию микроорганизмов (или с на-
сосом, подающим суспензию в рабочую камеру 2 дезинтеграто-
ра).
3. Конец шланга, надетого на разгрузочный штуцер 24,поместить
в напорную склянку с суснензией микроорганизмов и снять с
этого шланга зажим.
4. Снять зажим со шланга,надетого на входной штуцер 34, и сра-
зу же вклвчмть электродвигатель дезинтегратора (если для
60
подачи суспензии в рабочую камеру 2 используется насос,то
его включить после включения двигателя дезинтегратора), при
этом происходит циркуляция суспензии через рабочую камеру 2
(время циркуляции суспензии зависит от ее объема,разрушаемо-
го объекта и поставленной цели).
5. По окончании дезинтеграции перекрыть зажимом шланг, надетый
на входной штуцер 34 (если для подачи суспензии использо-
вался насос, то предварительно выключить его).
6. Конец шланга,надетого на разгрузочный штуцер 24,опустить в
склянку с дезинфицирующим раствором.
7. Выключить электродвигатель дезинтегратора.
8. Отсоединить от напорной склянки (или от подающего суспен-
зию насоса) шланг, надетый на входной штуцер 34,и конец его
поместить в приемный сосуд для слива суспензии из рабочей
камеры.
9. Снять с разгрузочного штуцера 24 шланг и поместить его в
сосуд с дезинфицирующим раствором.
10. Снять зажим со шланга,надетого на входной штуцер 34,и слить
суспензию из рабочей камеры в приемный сосуд.
II. Все дальнейшие операции выполнять как было указано ранее.
Правила работы в непрерывном режиме.
I. Загрузить в дезинтегратор суспензию микроорганизмов,как
было указано ранее,
2. Шланг, надетый на входной штуцер 34,соединить с напорной
склянкой, содержащей суспензию микроорганизмов (или с насо-
сом подающим суспензию в рабочую камеру из склянки).
3. Конец шланга, надетого на разгрузочный штуцер 24,поместить
в приемный сосуд и снять с этого шланга зажим.
61
4. Включить двигатель дезинтегратора и работать в течение то-
го времени, которое необходимо для получения нужной степе-
ни разрушения микробных клеток (например,для разрушения
практически всех клеток суспензии дрожжей Sacoharomyces
cerevlsiae , содержащей 12% биомассы по сухому остатку,
требуется 6 мин).
5. Не выключая двигателя дезинтегратора, снять зажим со
шланга,надетого на входной штуцер 34 (если для подачи
суспензии в рабочую камеру 2 используется насос, то вклю-
чить его); скорость протока суспензии микроорганизмов через
рабочую камеру устанавливают экспериментально в зависимос-
ти от разрушаемого объекта и поставленной цели (например,
при пропускании через дезинтегратор суспензии дрожжей
Saccharomyces cerevlsiae , содержащей 12% биомассы по
сухому остатку, со скоростью 80-100 мл/мин на выходе по-
лучается гомогенизат практически без целых клеток).
6. После пропускания через дезинтегратор всего объема суспен-
зии перекрыть зажимом шланг,надетый на входной штуцер 34
(если для подачи суспензии использовался насос, то пред-
варительно выключить его).
7. Конец шланга, надетого на разгрузочный штуцер 24,опустить
в склянку с дезинфицирующим раствором.
8. Выключить электродвигатель дезинтегратора.
9. Отсоединить от напорной склянки (или от подающего суспен-
зию насоса) шланг,надетый на входной штуцер 34,и конец его
поместить в приемный сосуд для слива суспензии из рабочей
камер!.
10. Снять с разгрузочного штуцера 24 шланг и поместить его в
62
сосуд с дезинфицирующим раствором.
II. Снять зажим со шланга,надетого на входной штуцер 34,и слить
суспензию из рабочей камеры в приемный сосуд.
12. Все дальнейшие операции выполнять как было указано ранее.
Техника безопасности.
Запрещается.
I. Включать электродвигатель дезинтегратора^не проверив вращение
его вала вручную.
2. Работать на дезинтеграторе более 15 минут в отсутствие цир-
куляции или протока суспензии через него.
3. Работать на дезинтеграторе без подачи в него охлаждающего
агента (воды или рассола).
4. Включать насос, подающий в рабочую камеру суспензию, без
включенного электродвигателя дезинтегратора или выключать
дезинтегратор при работающем насосе.
5. Работать на дезинтеграторе с суспензиями^содержащими твер-
дые частицы размером более 0,05 мм.
Методы центрифугирования. Оборудование и применение.
Центрифугирование используется в лабораториях вместо фильт-
рования, когда необходимо без потерь отделить малые количест-
ва вещества или если осадок забивает поры фильтра. Обычно в ла-
бораториях используются для препаративной работы седиментацион-
ные центрифуги с числом оборотов 2000-9000 в минуту.
На рис.24 изображена малогабаритная настольная центрифуга
ЦПН-2. Она состоит из основания, на котором смонтированы корпус
63
и электродвигатель. На ось
электродвигателя надет угло-
вой ротор. Суспензию поме-
щают в центрифужные стакан-
чики (пластмассовые или
стеклянные) и тарируют их
до равного веса на центри-
фужных весах (рис.25) пе-
реливанием содержимого из
одного стаканчика в другой.
Затем вставляют стаканчики
в гнезда ротора, закрывают
центрифугу крышкой и вклю-
чают электродвигатель. При
работе центрифуги на частоте
вращения 3000,4000,5000,6000
об/мин ручку переключателя
частоты вращения устанавлива-
ют на 2 ступени выше требу-
емой частоты вращения.
Рис.25. Центрифужные весы.
яян *Я»Е
64
I
По окончании центрифугирования, после остановки вращения ротора
центрифужные стаканчики вынимают и жидкий супернатант сливают с
осадка. Нельзя работать со стеклянными пробирками на частоте вра-
щения свыше 4000 об/мин, с удельным весом центрифугируемой
жидкости более 1,5 г/см^.
С помощью соответствующих вариантов метода центрифугирова-
ния можно получить данные о молекулярной массе,плотности и фор-
ме макромолекул, обнаружить изменения этих параметров, причем
любой них можно затем использовать в качестве основы разде-
ления компонентов смеси как для аналитических, так и для препа-
ративных целей. При этом используют высокоскоростные центрифуги,
называемые ультрацентрифугами (ускорение достигает 500000g
при скорости вращения 70000 об/мин).
Если частица находится в поле центробежной силы,образую-
щейся при вращении ротора с угловой скоростью ,на неё бу-
дет действовать центробежная сила « md)2r ,где m -масса
частицы, т - расстояние до центра вращения. Если частица нахо-
дится не в вакууме а в растворе,молекулы растворителя будут вы-
тесняться при движении частиццИх сопротивление вытеснению состав-
ляет выталкивающую силу,направленную против центробежной силы.
Фактор плавучести понижает общую силу действующую на макромолеку-
лу,на величину массы вытесненного растворителя,умноженной на
й>гт ;эта масса равна объему частицы,умноженному на плотность
растворителя fi . Объем частицы равен шг ,где ▼- пар-
циальный удельный объем частицы (увеличение объема,вызываемое
прибавлением к раствору единицы массы растворяемого вещества).
Откуда выталкивающая сила равна <Ляй/
Частицы и молекулы растворителя не могут двигаться относи-
65
тельно друг друга без заметного трения. Сила трения,направлен-
ная против движения частиц и молекул растворителя,пропорциональ-
на разнице между скоростями частиц и молекул растворителя и вы-
ражается значением fv ,где £ - коэффициент трения, а
v - скорость относительно ячейки центрифуги,содержащей раствор.
Так как скорость постоянна при общей силе,равной нулю,то
эта скорость частицы равна:
Из уравнения (I) следует (при равенстве всех прочих факто-
ров):
I. Более массивная частица (или молекула) будет стремиться
двигаться быстрее,чем менее массивная.
2. Более плотная частица (т.е. обладающая малым парциаль-
ным удельным объемом) движется быстрее,чем менее плот-
ная.
3. Чем больше плотность раствора,тем медленнее будут дви-
гаться в нем частицы.
4. Чем больше коэффициент трения,тем медленнее движение
частиц.
Эти четыре положения составляют основные правила седимента-
ции и приложимы ко всем частицам независимо, от того являются
ли они крупными структурами,макромолекулами или небольшими мо-
лекулами.
Поскольку скорость молекулы пропорциональна величине поля
центробежной силы (т.е. «Яг ),обычно седиментационные свойства
рассматриваются в зависимости от величины скорости,деленной
на центробежное ускорение:
з= -2— = ш. (1- у А ) (2)
«Я г £
66
где в- коэффициент седиментации.
Коэффициент седиментации измеряют в единицах Сведберга ( s );
I единица Сведберга равна КГ^с. Численное значение в зависит
от молекулярной массы и формы частиц и является величиной, ха-
рактерной для данной молекулы или надмолекулярной структуры.
Например,коэффициент седиментации лизоцима равен 2,153 ;
каталаза имеет коэффициент седиментации 11,35 s ; субъединицы
рибосом бактерий от 30 до 50 s , а субъединицы рибосом эукари-
отов - от 40 до 60 S .
Определение з является непосредственной задачей в боль-
шинстве экспериментов по скоростной седиментации, а решение
её осуществляется на аналитической центрифуге (рис.26). При-
бор снабжен оптической системой,позволяющей определять распре-
деление концентраций в любой момент времени в течение всего
измерения.
Рис.26. Схема аналитичес-
кой ультрацентрифуги.
I-мотор;2-ротор;3-брони-
рованная камера;4-зерка-
ло; 5-камерная линза;
6-путь света;7-держатель
фотопленки;8-панель конт-
роля скорости:9-контроль
температуры;10-источник
света;II-вакуумный насос;
12-охлаждение.
Ротор находится в бронированной охлаждаемой камере в вакууме
и подвешивается на струне,соединенной с ведущим валом мотора.
В наконечнике ротора имеется термисторный датчик температуры.
67
Электрический контакт термистора с контрольным устройством
осуществляется через контакт с ртутью, с которой соприкасается
наконечник ротора. Камера с ротором оборудована верхней и ниж-
ней линзами. Нижняя линза служит коллиматором, через неё в ана-
литическую ячейку попадают параллельные лучи. Верхняя линза и
камерная линза фокусируют проходящий свет на фотопленку, на
которой регистрируется распределение концентрации образца в
ячейке центрифуги. Аналитическая ячейка (рис.27) емкость кото-
рой,как правило, равна I см , имеет секториальную форму. На
торцах аналитической ячейки имеются окошки с кварцевыми стек-
лами. Для уравновешивания аналитической ячейки в ротор встав-
ляется балансировочная ячейка, которая представляет собой ме-
талический блок с прецизионной системой. В ней имеются также
два индексных отверстия, находящиеся на строго определенном
расстоянии от оси вращения, с помощью которых определяют соот-
ветствующие расстояния в аналитической ячейке. Оптические сис-
темы аналитических ультрацентрифуг
позволяют наблюдать за седимента-
цией частиц в течение всего пери-
ода центрифугирования.Через за-
данные промежутки времени седи-
ментирующий материал можно фотог-
рафировать. При фракционирова-
нии белков и ДНК за седимента-
цией наблюдают по поглощению в
ультрафиолете, а в тех случаях,
когда исследуемые растворы име-
ют разные коэффициенты прелом-
Центробежная
сила
Рис.27. Аналитическая
ячейка.I-односектор-
ная ячейка;2-двусектор-
ная ячейка;3-верх ячей-
ки ;4-воздух;5-мениск;
б-растворитель;7-грани-
ца; 8-раствор;9-дно
ячейки.
68
ления с помощью шлирен-систены или интерференционной системы
Рэлея.Два последних метода основаны на том, что при прохождении
света через прозрачный раствор состоящий из зон с различной
плотностью, на границе зон происходит преломление света. При
седиментации между зонами с тяжелыми и легкими частицами обра-
зуется граница, которая действует как преломляющая линза; при
этом на фотопластинке, использующейся в качестве детектора,
появляется пик. В ходе седиментации происходит перемещение
границы, а следовательно и пика, по скорости передвижения ко-
торого можно судить о скорости седиментации материала (рис.28)
Направление свАшмааацаи
Рис.28. Различные стадии
седиментации макромоле-
кул (седиментограммы по-
лучают с помощью шлирен-
системы,позволяющей опре-
делить коэффициент прелом-
ления раствора в любой
точке ячейки в разные про-
межутки времени. По мере
движения макромолекул к
дну ячейки в ходе седимен-
тации высота пика уменьша-
ется, а ширина его за счет
диффузии образца увеличива-
ете^.
Определив коэффициент седиментации и коэффициент диффузии
макромолекулы можно вычислить молекулярную массу по уравнению
Сведберга:
М = ___RT
D (I-vp)
(3)
гдей - газовая постоянная, Т-абсолютная температура,v -парци-
альный удельный объем макромолекулы, j> -плотность раствора,
з - коэффициент седиментации; М-молекулярная масса,D -коэффи-
циент диффузии. Коэффициент диффузии макромолекул обычно изме-
69
ряют путем создания границы между буфером и раствором макромо-
лекул с известной концентрацией с последующим наблюдением рас-
ширения этой границы во времени.
Аналитическое ультрацентрифугирование широко применяют
для оценки чистоты препаратов ДНК, вирусов,белков,полисахари-
дов. В большинстве случаев о гомогенности препарата можно су-
дить по характеру границы седиментации, используя метод опре-
деления скорости седиментации: гомогенный препарат обычно да-
ет одну резкоочерченную границу. Присутствующие в препарате при-
меси проявляются в виде дополнительного пика или плеча; они
обуславливают ассиметрию основного пика.
Еще одна область применения аналитического ультрацентри-
фугирования - исследование конформационных изменений макромоле-
кул. Молекула ДНК, например, может быть одно - или двухцепо- .
чечной, линейной или кольцевой. Под действием различных соеди-
нений (таких,например,как органические растворители) или при
повышенных температурах ДОК претерпевает ряд обратимых и необ-
ратимых конформационных изменений*, которые можно установить
по изменению скорости седиментации образца. Чем компактнее мо-
лекулы, тем меньше её коэффициент трения в растворе и наоборот:
чем менее она компактна, тем больше коэффициент и, следователь-
но, тем медленнее будет она седиментировать. Таким образом, раз-
личия в скорости седиментации образца до и после различных воз-
действий на него позволяет обнаруживать конформационные измене-
ния, происходящие в макромолекулах.
На рис.29 приведена схема препаративной ультрацентрифуги.
Этот прибор более прост, чем аналитический.
В препаративной ультрацентрифуге нет оптической системы
70
и используется угловой ротор или ротор с подвесными стаканами.
Рис. 29. Схема препаративной ультрацентрифуги.
I - бронированная камера; 2-ротор;3-мотор;4-конт-
рольная панель; 5-отодвигающийся люк^-охлажде-
ние; 7-вакуумный насос.
Стенки пробирок в препаративных роторах параллельны в отличие
от ячейки секториальной формы в аналитических ультрацентрифугах.
В препаративной ультрацентрифуге осуществляется фракционирова-
ние содержимого центрифужной ячейки. Если центрифугирование про-
водится для получения осадка,то после остановки вращения ротора
пробирку вынимают и супернатант сливают с осадка.
Название "препаративная центрифуга" употребляют не совсем
правильно,так как, помимо использования для получения и очист-
ки различных макромолекул и клеточных органелл они почти столь
же часто используются для количественного анализа смесей (т.е.
как аналитический прибор).
Фотоэлектроколориметрические методы исследования.
Фотоэлектроколориметрические методы находят широкое при-
менение для количественных определений различных веществ. Они
71
основаны на свойстве растворов веществ поглощать часть световой
энергии. Фотоколориметрические методы характеризуются большой чув
ствительностью (до 0,01 мкг/мл) и потому дают возможность опре-
делять весьма малые количества вещества в растворе. Однако эти
методы можно использовать только в том случае,если окрашенное
соединение достаточно устойчиво,а реакция его образования спе-
цифична.
Отечественная промышленность выпускает несколько моделей
фотоэлектроколориметров. Принципиальная оптическая схема
(рис.30) у них одинакова.
Рис.30. Оптическая схема фотоэлектроко-
лориметра. I-источник света; 2-призма;
3-зеркала;4-кювета; 5-раздвижные диаф-
рагмы; 6-фотоэлемент.
Световой пучок от источника света (I) падает на призму (2),
которая делит его на два пучка - левый и правый. Отразившись
от зеркала (3) и пройдя через линзы,пучки света идут парал-.
лельно,проходят через кюветы (4) и попадают на фотоэлемен-
ты (б). Последние соединены с гальванометром. При равенстве
интенсивностей световых пучков,падающих на фотоэлементы ст-
релка гальванометра не отклоняется. Если же на пути одного
72
из параллельно падающих лучей помещена кювета с раствором,пог-
лощающим или рассеивающим свет, то интенсивность света,прошед-
шего через неё, становится меньше интенсивности света прошед-
шего через кювету с растворителем, и стрелка гальванометра от-
клоняется. Для выравнивания интенсивностей световых потоков в.
правом и левом барабанах имеются раздвижные диафрагмы (5).
Правый световой поток - измерительный, левый - компенсацион-
ный.
Порядок работы на фотоэлектроколориметре ФЭК-56М (рис.31)
сводится к следующему:
I. Прибор включают в сеть через блок питания, перекрыва-
ют световые пучки шторкой (2) и оставляют прибор на
15-20 минут для обеспечения стабильного режима лампы.
2. Устанавливают "электрический нуль" прибора, для чего
рукояткой, расположенной на левой панели ниже компен-
сационного барабана, ставят стрелку микроамперметра
(б) на "0".
3. Рукояткой,расположенной на левой панели за компенса-
ционным барабаном,в световой пучок включают необходи-
мый для работы светофильтр.
4- Открывают крышку прибора (I) и в левом световом пучке
на все время измерения устанавливают кювету с раствори-
телем. В правый пучок света помещают кювету с исследу-
емым раствором. Кюветы должны быть установлены в кюве-
тодержателях на одинаковом расстоянии от входного от-
верстия и быть обращены к источнику света одной и той
же гранью. Рабочие грани кюветы перед измерением про-
тирают мягкой тканью или фильтровальной бумагой. Ка-
73
саться пальцами граней ниже уровня жидкости нельзя!
5. Открывают шторку.
6. Индекс правого барабана (4) устанавливают по шкале оп-
тической плотности (красной) на нуль, что соответству-
ет индексу 100 по черной шкале светопропускания. Вра-
щением левого барабана добиваются установки стрелки
микроамперметра на "0".
7. Поворотом рукоятки (3) в правом пучке кювету с раство-
ром заменяют кюветой с растворителем; при этом стрелка
микроамперметра смещается.
8. Вращением правого измерительного барабана (4) добиваются
нулевого положения стрелки и отсчитывают величину опти-
ческой плотности исследуемого раствора.
Рис.31. Общий вид фотоэлектро-
колориметра ФЭК-обМ: I-крышка
прибора;2-рукоятка шторки;
3-рукоятка для перемещения кю-
вет; 4-измерительный барабан;
5-компенсационный барабан;
6-микро амперметр.
Концентрацию веществ в растворе определяют в такой после-
довательности: выбирают светофильтр, затем кювету, строят калиб-
ровочную кривую для данного вещества, измеряют оптическую плот-
ность исследуемого раствора и определяют концентрацию вещества
по калибровочной кривой.
При выборе светофильтра, если максимум поглощения раствора
не известен из справочной литературы, поступают следующим обра-
74
зон. Измеряют оптическую плотность исследуемого раствора, ис-
пользуя все имеющиеся светофильтры. Строят кривую зависимости
оптической плотности от длины волны. Для этого на оси абсцисс
откладывают длины волн,соответствующие максимуму светопропуска-
ния светофильтров, а на оси ординат - значения оптической плот-
ности. Тот светофильтр,при котором значение оптической плотности
будет наибольшим,более других пригоден для измерения оптической
плотности данного раствора.
Кювету выбирают с таким расчетом,чтобы с одной и той же
кюветой и одним и тем же светофильтром можно было измерить ве-
личины оптической плотности серии растворов. К каждому фото-
электроколориметру прикладывается два набора кювет с расстоя-
нием мещду рабочими гранями 1;3;5;10;20;30;50 мм. Чем интенсив-
нее окрашен раствор,тем меньше должно быть рабочее расстояние
между гранями кювет и наоборот. Выбирают кювету с таким рас-
стоянием между рабочими гранями,чтобы наиболее часто встреча-
ющаяся рабочая концентрация раствора давала показания прибора
в пределах 0,3-1,0.
Для построения калибровочной кривой готовят серию раство-
ров, каждый из которых содержит определенную концентрацию ис-
следуемого вещества, и измеряют оптическую плотность этих раст-
воров, используя выбранный светофильтр и кювету. По получен-
ным данным на миллиметровой бумаге строят график,откладывая
на оси ординат показания ФЭК ( D ), а на оси абсцисс - соответ-
ствующую концентрацию в растворе. Если величина D раствора
пропорциональна его концентрации,кривая имеет вид прямой,про-
ходящей через начало координат.
Для определения концентрации вещества исследуемого раст-
75
вора измеряют оптическую плотность этого раствора, находят на
оси ординат точку, соответствующую данному значению D ; Через
неё проводят линию, параллельную оси абсцисс, до пересечения
с калибровочной линией, и из точки пересечения на ось абсцисс
опускают перпендикуляр. По точке пересечения определяют кон-
центрацию вещества в анализируемом растворе.
Абсорбционная спектроскопия.
Аппаратура и применение.
Молекулы поглощают свет. Длины волн,при которых происходит
поглощение, и степень поглощения зависят от структуры и от окру
жения молекулы,поэтому абсорбционная спектроскопия является по-
лезным методом для характеристики молекул различного размера.
Световая волна состоит из взаимно перпендикулярных электри-
ческого и магнитных полей, амплитуды которых по мере распостра-
нения в пространстве изменяются по синусоиде.
Энергия волны Е равна
E=-V-=M . (I)
гдеЬ- постоянная планка; с-скорость света; л-длина волны;
у-частота.
Когда волна сталкивается с молекулой, она может либо рас-
сеиваться (т.е. изменяется направление её распостранения), ли-
бо поглощаться (т.е. её энергия передается молекуле). Относи-
тельная вероятность протекания того или иного процесса является
свойством той молекулы, с которой произошло столкновение. Если
произошло поглощение электромагнитной энергии света, о молеку-
ле говорят, что она возбуждена или перешла в возбужденное сос-
76
тояние. Молекула или часть молекулы,которая может быть возбуж-
дена посредством поглощения света в видимой и ближней УФ-облас-
ти, называется хромофором. Обычно энергия возбуждения превращает-
ся в тепло (кинетическую энергию) в результате столкновения
возбужденной молекулы с другой молекулой (например, молекулой
растворителя). Некоторые молекулы вновь излучают энергию
(например, при флуоресценции). В обоих случаях интенсивность
света, прошедшего через молекулу,содержащую набор хромофоров,
меньше интенсивности падающего света.
Возбужденная молекула обладает набором дискретных кванто-
вых энергетических состояний,описываемых законами квантовой
механики. Эти состояния называются энергетическими уровнями
молекулы. Главные энергетические уровни определяются возможным
пространственным распределением электронов и называются электрон-
ными энергетическими уровнями; на них накладываются колебатель-
ные уровни,которые указывают на различные типы колебаний молеку-
лы (например, растягивание и изменение углов различных кова-
лентных связей). Самый низкий электронный уровень называется
основным состоянием (здесь не имеются в виду еще более
.близко расположенные уровни, называемые вращательными,так как
они не очень важны в абсорбционной спектроскопии), а все
другие возбужденными. Поглощение энергии происходит с наиболь-
шей вероятностью только в том случае, если количество погло-
щенной энергии соответствует разности энергий квантовых состо-
яний. Это можно выразить,констатируя,что свет с длиной вол-
ны J. поглощается только тогда, когда
. h • с
А ю
77
где Ej - энергетический уровень молекулы до поглощения, a Eg -
энергетический уровень достигаемый в результате поглощения.
Изменение энергетического состояния при испускании или пог-
лощении кванта называется переходом. Упрощенно переход между
электронными энергетическими уровнями соответствует энергии,
необходимой для перемещения электрона с одной орбиты на другую.
Зависимость вероятности поглощения от длины волны называется
спектром поглощения. Задача абсорбционной спектроскопии состоит
в накоплении и анализе данных по поглощению. Если бы все
переходы происходили только между самыми низкими колебательны-
ми уровнями основного состояния и первого возбужденного сос-
тояния,тогда спектр поглощения состоял бы из узких,дискрет-
ных линий. Однако,поскольку возможны переходы с основного сос-
тояния на любой колебательный и вращательный уровни первого
возбувденного состояния,а линии имеют конечную ширину,то
спектр проявляется в виде относительно плавной кривой (рис.32).
Рис.32. Сравнение спектров двух
биологических молекул: флавин-
мононуклеотида (а) и фикоциана
(б). Спектры можно использовать
для идентификации соединения.
Для большинства молекул длины волн,соответствующие переходам
между основным состоянием и любым колебательным уровнем перво-
го возбужденного состояния,лежат в ультрафиолетовой и видимой
78
области спектра. Возможны также низкие по энергии перехода между
колебательными уровнями в пределах одного электронного уровня.
Эти переходы получаются в результате поглощения излучения в
инфракрасной области.
Вероятность перехода при одной длине волны характеризуется
коэффициентом молярной экстинкции поглощающего вещества. Если свет
интенсивности 1о проходит через раствор с толщиной слоя б
и концентрацией с, интенсивность проведшего света I подчиняется
закону Ламберта-Бера:
I » т 10 “ £dc ,т.е. lg(-i-)—edc или ig-^c€dc (3)
° Io 1
где е - коэффициент молярной экстинкции поглощающего вещества
при длине волны Л ; с - молярная концентрация раствора;
d - оптический путь, или толщина образца в см.
г
Величинуig —2 в литературе называют поглощением (А),экс-
тинкцией (Е) или оптической плотностью ( D ). Отношение интенсив-
ностей прошедшего и падающего света ( i/i0) называется пропуска-
нием (Т).
Пропускание (Т) обычно измеряется в процентах и меняется
от 0 до 100%. Экстинкция - величина безразмерная и изменяется от
О до о° . Поскольку коэффициент молярной экстинкции, как пра-
вило, довольно большой, используют другую величину - поглощение
света образцом толщиной в I см,содержащим однопроцентный раст-
вор исследуемого вещества Е^. Закон Ламберта-Бэра применим
не для всех систем. Во-первых,при поглощении света образец мо-'
жет ионизироваться, а при высоких концентрациях - полимеризо-
ваться. Иногда образец при облучении коагулирует, образуя мут-
ную суспензию. Эти эффекты увеличивают или уменьшают экстинк-
цию.
79
Измерение поглощения осуществляют с помощью спектрофотомет-
ра. Несмотря на различия в конструкции принципиальная схема всех
спектрофотометров одинакова. Они состоят из источника света,мо-
нохроматора (для выделения определенной длины волны), прозрач-
ной кюветы, куда помещается образец, детектора света и измери-
тельного прибора или самописца для регистрации выходного сигна-
ла детектора. (рис.33).
в
Рис.33. Схематическое устройство спектрофото-
метра.
Свет от лампы I проходит через монохроматор 2 для выделения
пучка света с определенной длиной волны. Образец 3 и раствори-
тель 4 содержатся в двух кюветах,помещенных в держатель кювет5.
Свет проходит через кювету и падает на фотоэлемент б, выходной
сигнал которого регистрируется измерительным прибором 7. Держа-
тель кюветы находится на направляющих 8, так что каждая кюве-
та может быть независимо помещена в пучок лучей.
Ход работы обычно следующий: измеряют при одной длине
волны интенсивность света,проходящего через растворитель (ко-
торый может быть буфером), затем следует измерение интенсивнос-
ти' света, проходящего через раствор изучаемого вещества, в
том же растворителе. Далее фиксируется изменение в интенсив-
ности света, по’которому можно судить о поглощении света раст-
80
зоренным веществом. На практике прибор настраивают таким обра-
зом, чтобы он показывал нулевое поглощение при прохождении све-
та через растворитель. Осуществив такую настройку, можно сни-
мать показания, соответствующие непосредственно поглощению об-
разца. Для получения спектра эта операция повторяется при мно-
гих длинах волн. Некоторые приборы,называемые автоматическими
двухлучевыми регистрирующими спектрофотометрами, позволяют
осуществлять развертку длин волн и одновременно измерять погло-
щение образца и растворителя (которые находятся в различных кю-
ветах) и фиксировать с помощью электронного оборудования сум-
мированный поток излучений. При этом самописец на бумажной
ленте вычерчивает спектр. «
Абсорбционная спектроскопия в видимой и УФ -областях спект-
ра находит широкое применение в биохимических исследованиях.
Она может быть использована для измерения концентрации веществ
в растворе, исследования химических реакций, идентификации ве-
ществ и определения некоторых структурных параметров макромо-
лекул (например, переход спираль-клубок в двухцепочной ДНК
и белках, спектрофотометрическое титрование белков, ассоци-
ация белка, связывание с белками малых молекул и др.).
Метод распределительной хроматографии на
бумаге.
В зависимости от физико-химических факторов, определяющих
основной механизм процесса, методы хроматографического анализа
делятся на четыре основных вида: адсорбционные, распределитель-
ные, ионнообменные и осадочные.
Для разделения смеси веществ часто применяют метод распре-
81
делительной хроматографии. Он основан на различной степени
распределения компонентов смеси между двумя несмешивающшися
жидкими фазами (неподвижной,чаще всего, водной фазой и подвиж-
ной фазой органического растворителя).
Органический растворитель , насыщенный водой, проходя че-
рез полоску фильтровальной бумаги, увлекает за собой вещества,
раствор которых был нанесен на бумагу. Вода при этом связывает-
ся волокном бумаги. Различные вещества передвигаются по бумаге
с неодинаковой скоростью, Скорость перемещения компонентов сме-
си зависит от многих факторов: строения молекул веществ, их спо-
собности легко растворяться в органическом растворителе или в
воде, избирательной адсорбции на бумаге, типа бумаги, условия
проведения анализа и т.д. Чем лучше растворяется данный компо-
нент 'смеси в органическом растворителе, тем больший путь он
пройдет с ним по бумаге, и наоборот.
Хроматографирование на бумаге проводят восходящим и нисхо-
дящим способами (рис.34). И в том и другом случае растворитель
наливают на дно герметичной камеры для насыщения атмосферы па-
рами растворителя, и лишь затем помещают в камеру бумагу. При
восходящей хроматографии бумажную полосу подвешивают таким об-
разом, чтобы нижний конец полосы бумаги был погружен в раство-
ритель. По мере движения растворителя под действием капилярных
сил вертикально вверх происходит разделение .^веществ. При нисхо-
дящей хроматографии верхний конец бумажной полосы с образцом,
нанесенным недалеко от кромки бумаги, закрепляют в лотке, на-
ходящемся в верхней части камеры, а нижний конец бумаги спус-
кают вниз так, чтобы он не соприкасался с налитым на дно каме-
ры растворителем. Перед началом хроматографирования лоток за-
82
полняют растворителем. Под действием капилярных сил и сил тя-
жести растворитель начинает двигаться вниз по бумажной полосе,
в результате чего и происходит разделение.
Рис.34. Восходящая (а) и нисходя-
щая (б) хроматография на бумаге.
1-крышка;2-держатель;3-зажим;
4-бумага; 5-стеклянная камера;
б-место нанесения пробы;7-раст-
воритель; 8-стеклянная палочка;
9-лоток с растворителем.
Из-за простоты первый вид хроматографии применяется чаще,
однако скорость движения растворителя при нисходящей хроматог-
рафии гораздо выше, чем при восходящей.
Качество бумаги оказывает большое влияние на разделение
анализируемых веществ. В СССР выпускается 3 сорта хроматогра-
фических бумаг - быстрая, средняя,медленная. Эти бумаги разли-
чаются по плотности, а следовательно, по скорости движения
растворителя.
Бумага может быть загрязнена катионами металлов или ами-
нокислотами. Поэтому при использовании её не только для разде-
ления, но и последующей элюции и определения количества ве-
ществ хроматографическую бумагу рекомендуется промывать. Чаще
всего для этой цели используют 0,10-0,15^-ый раствор 8-оксихи-
нолина в системе Н-бутанол-уксусная кислота-вода в соотношении
40:5:25.Листы бумаги погружают на 20-30 минут в кювету с этим
раствором, затем вынимают и подсушивают на воздухе, образовав-
шийся комплекс 8-оксихинолина с катионами вымывают из бумаги
83
этим же растворителем, но без 8-оксихинолина. Промывание прово-
дят в хроматографической камере нисходящим током растворителя
до полного удаления темноокрашенных оксихинолятов, на что тре-
буется 36-48 часов. Промытую бумагу высушивают в вытяжном шка-
ФУ-
Можно промывать бумагу 1%-ным раствором НС1 или 2М раство-
ром СН3СООН, а затем дистиллированной водой до отрицательной
реакции на ион С1~ или до нейтральной реакции промывных вод.
Из бумаги вырезают хроматограмму по фигурному трафарету
(рис.35). Длина хроматограммы зависит от высоты банки (в сред-
нем она составляет 400 мм). Затем на хроматограмме простым ка-
рандашам проводят линию старта.
Рис.35. Фигурная хроматограмма,применяемая для
лучшего разделения веществ (размеры указаны в
мм).
84
Для хроматограмм с восходящим током растворителя она должна
быть расположена на расстоянии 30-35 мм, а для хроматограмм
с нисходящим током растворителя - на расстоянии 80-90 мм от
края бумаги.
Количество наносимого на хроматограмму вещества должно
быть достаточным для его обнаружения, но не слишком большим,
так как это мешает разделению веществ. Удобно, когда объем про-
бы составляет 0,01-0,02 мл. Для обнаружения многих веществ дос-
таточно нанести их на хроматограмму в количестве 50-500мкг.
Пробы чаще всего наносят градуированными микропипетками на 0,1—
0,2 мл, у которых оттянут кончик или специальными пипетками на
5,10,20 и 25 мкл, отградуированными весовым методом.
Обычно раствор анализируемого образца наносят в одну и ту
же точку на стартовой линии несколько раз. Перед каждым после-
дующим нанесением бумагу подсушивают током воздуха. Таким же
образом на соседние полоски хроматограммы наносят растворы сви-
детелей, т.е. соединений определенного состава.
Подвижная фаза растворителя,применяемая для разделения ве-
ществ методом бумажной хроматографии, содержит, как правило,ор-
ганический растворитель,насыщенный водой. В этой фазе’ могут
быть и другие компоненты, например, кислота (реже основание)
Кислота (или основание) переводит компоненты разделяемой сме-
си в подходящую для хроматографирования ионную форму.
Для приготовления подвижной фазы компоненты хроматогра-
фической смеси наливают в делительную воронку и тщательно пе-
ремешивают. Если все они полностью смешиваются, то смесь мож-
но использовать сразу же после приготовления в качестве под-
вижного растворителя. В противном случае смеси дают расслоиться.
85
Верхний слой используют как подвижный растворитель, а нижний -
для насыщения хроматографической камеры при нисходящем токе
растворителя. При разделении веществ восходящим током раство-
рителя подвижную фазу, насыщенную неподвижной, наливают на
дно камеры. Полоску бумаги с нанесенными свидетелями и анали-
зируемой смесью погружают нижним концом в растворитель на
глубину 10-15 мм. Верхний конец бумажной полосы закрепляют
так, чтобы бумага свободно свисала вниз, не касаясь дна и сте-
нок камеры. Бумагу крепят к стеклянным палочкам, закрепленным
в верхней части камеры, специальными прищепками или прошивают
верхний крнец бумаги ниткой и подвешивают хроматограмму, зак-
репив концы ниток на наружной стороне камеры пластилином.
При разделении веществ нисходящим током растворителя хро-
матографическую бумагу вставляют в сухую лодочку. Предваритель-
но нижний конец бумаги загибают по линии, проведенной простым
карандашом на расстоянии 10-15 мм. Чтобы бумага не выскользну-
ла из лодочки при прохождении растворителя, ее закрепляют стек-
лянной пластинкой или палочкой. Пластинку или палочку помеща-
ют в лодочку внутрь изгиба бумаги. Только после этого в кюве-
ту через воронку наливают подвижную фазу растворителя, насы-
щенную неподвижной. Неподвижную фазу наливают на дно камеры
(или наливают в химический стакан и ставят на дно камеры).
Продолжительность' однократного пропускания растворителя через
хроматограмму различна. Она зависит от состава растворителя,
температуры, сорта бумаги. В ряде случаев для лучшего разделе-
ния веществ растворитель пропускают 2-3 раза. Перед повторным
пропусанием хроматограмму высушивают.
После последнего пропускания хроматограмму вынимают из
86
камеры, отмечают простым карандашом линию фронта растворителя,
а затем высушивают. Вещества анализируемой смеси обнаруживают
на хроматограмме (проявляют) по-разному.Например,чтобы обнару-
жить вещества,поглощающие ультрафиолетовые лучи или обладающие
способностью люминесцировать, хроматограммы просматривают, ис-
пользуя ультрахемоскоп. Выявленные пятна обводят простым каран-
дашом. Чаще же используют проявители,образующие с анализируемы-
ми веществами окрашенные соединения. В этом случае хроматограм-
му опрыскивают проявителем из пульверизатора или проводят через
раствор проявителя, предварительно налитый в кювету. Затем хро-
матограмму высушивают, выявленные пятна обводят простым каран-
дашом. В ряде случаев для развития максимальной окраски хрома-
тограмму выдерживают определенное время при повышенной темпера-
туре.
Приготовление растворителей, заполнение хроматографической
камеры, высушивание и проявление хроматограмм проводят в вытяж-
ном шкафу.
После проявления хроматограмм определяют подвижность обна-
руженных компонентов анализируемой смеси и свидетелей. Подвиж-
ность характеризуют коэффициентом , который представляет со-
бой отношение величины смещения зоны вещества к величине смеще-
ния фронта растворителя на хроматограмме.
где, а - расстояние от линии старта (места нанесения вещества
на хроматограмме) до середины пятна данного вещества
на хроматограмме после проявления;
Ъ - расстояние от линии старта до линии фронта растворите-
ля на той же хроматограмме.
87
Каждое вещество имеет определенное значение коэффициента Rf,
которое может меняться в зависимости от вида применяемой бумаги,
растворителя,количества разделяемых веществ,температуры,pH сре-
ды и других факторов.Значение Rf для данного компонента анали-
зируемой смеси является величиной,постоянной только в строго оп-
ределенных условиях.Поэтому при идентификации веществ по величи-
не Rj, сравнивают Rf исследуемого соединения и Rf свидете-
ля, нанесенного на хроматограмму одновременно с анализируемой
смесью. Однако, одинаковая величина^ свидетеля и исследуемого ве-
щества в одной системе растворителя еще не достаточна для оконча-
тельной идентификации. Необходимо сравнить величину Rf свидете-
ля и исследуемого соединения в разных системах растворителя, а
так же дополнить хроматографические данные специфическими ка -
чественными реакциями.
Метод гель-хроматографии. Оборудование и применение.
Метод гель-проникающей хроматографии предназначен для раз-
деления молекул различающихся по размерам. Он может быть исполь-
зован для решения проблем как аналитического,так и препаратив-
ного характера.
Разделение молекул происходит наиболее эффективно при ис-
пользовании гранулированного геля, который представляет собой
слой мелких гранул,имеющих поры. В настоящее время химическая
промышленность выпускает гели-сефадексы,молселекты,биогели-Р
и др. Характеристику различных марок гелей можно найти в спра-
вочнике А.А.Лурье "Сорбенты и хроматографические носители",
Москва,издательство "Химия",1972. Обычно гель характеризуется
величиной предела эксклюзии (т.е. величиной молекулярной массы
88
самых крупных молекул, еще способных проникать в поры гранул),
диапозоном фракционирования веществ по молекулярной массе, пог-
лощением воды (мл/г), удельным объемом в колонке (см^/г), време-
нем полного набухания и зернениемС меш или мкм).
В ситовом анализе часто используют ситовую шкалу с характе-
ристикой сита в мешах.(меш-число отверстий на I погонный дюйм
сита). В основу этой шкалы положено сито 200 меш с отверстиями
размером 0,074 мм и диаметром проволоки 0,056 мм. Ширина отвер-
стия в каждом последующем сите увеличивается по сравнению с
предшествующим ситом в 1,19 раза, а площадь отверстия - в 1,41
раза. Так в последующем сите,после сита взятого за основу,ши-
рина отверстия будет 0,088 мм. На одном погонном дюйме такого
сита число отверстий равно 170. Это и есть характеристика сита
- 170 меш. При характеристике крупности зерен в мешах имеется
в виду, что зерна с указанным числом меш проходят через сито,
характеризующееся тем же числом меш.
Для гель-хроматографии наиболее часто используют сефадексы-
гранулированные поперечносшитые декстраны (полисахариды). В ра-
бочем состоянии сефадексы уравновешены необходимыми буферными
растворами (рабочая область рН-2?10). При пропускании смеси ве-
ществ через слой гранулированного геля, находящегося в стеклян-
ной колонке, молекулы, имеющие размер больше, чем размер пор
гранул геля, проходят через колонку с сефадексом без проникно-
вения внутрь частиц геля, и элюируемый объем (т.е. объем буфера,
который вымывает эти молекулы с колонки) равен свободному объе-
му (незанятому частицами геля объему колонки).
Молекулы,имеющие размер меньше, чем размер пор геля, бу-
дут проходить через зерна геля по этим порам. Такие молекулы
89
диффундируют внутрь частиц геля, но опять-таки различные молеку-
лы проникают в частицы в разной степени,в зависимости от своих
размеров. Таким образом,чем меньше размеры молекул, тем медлен-
нее они передвигаются по колонке. Сечение колонки, проницаемое
для наиболее мелких молекул,наибольшее и поэтому движение их
наиболее медленное (элюируемый объем таких веществ будет наиболь-
шим по отношению к свободному объему колонки). Таким образом
происходит фракционирование веществ по молекулярным массам.
На основании характеристик различных гелей для каждого кон-
кретного случая можно выбрать тот или иной тип геля. Если необ-
ходимым требованиям одновременно удовлетворяют несколько гелей,
то целесообразно выбирать гель с наименьшей величиной поглоще-
ния воды, т.е. с наибольшим числом поперечных связей.
Перед заполнением колонки гель должен полностью набухнуть.
Для этого навеску геля выдерживают в воде или лучше в слабом
солевом растворе. В результате электростатического притяжения
отдельные частицы геля могут слипаться; в растворах электроли-
тов этого не происходит. Если не-дать гелю предварительно на-
бухнуть, то окончательное набухание произойдет после внесения
его в колонку, что значительно снизит скорость протекания раст-
ворителя из-за слишком плотной набивки колонки.
Стеклянная хроматографическая колонка должна быть устроена
таким образом, чтобы неподвижная фаза уходила до самого ее дна,
т.е. чтобы "мертвое пространство" у основания колонки было мини-
мальным; в противном случае уже разделившиеся молекулы будут
скапливаться на дне и перемешиваться. Для этого в основание ко-
лонок впаивают, например, пористую стеклянную пластинку, на кото-
рую помещают съемную сетку из нейлона или шёлка, а затем нано-
90
сят неподвижную фазу. Другой более простой способ состоит в том,
что на дно колонки кладут тампон из стекловолокна, капроновых
или шёлковых ниток, а затем тонкий ровный слой кварцевого песка.
Колонку заполняют кашицеобразной суспензией геля в подходящем
растворителе. При этом верхний слой суспензии перемешивают, а
стенки колонки слегка постукивают, что способствует удалению
попавших в колонку пузырьков воздуха и равномерному ее заполне-
нию. Заполнение осуществляют до требуемой высоты столба геля,
а затем открывают кран и пропускают растворитель. (Установле-
но, что для эффективного разделения частиц методом гель-прони-
кающей хроматографии соотношение высоты столба геля и его ди-
аметра лежит в пределах 10:1 - 20:1). Необходимо следить за
тем, чтобы заполненная колонка не высыхала; для этого над на-
полнителем должен всегда находиться слой растворителя. Чтобы
уменьшить взмучивание верхнего слоя наполнителя при внесении в
колонку образца, над ним обычно помещают кружок фильтровальной
бумаги или прокладку из нейлона или шёлка.
Для нанесения образца избыток растворителя отсасывают из
верхней части колонки пипеткой, а остатку дают впитаться в на-
полнитель. Затем при помощи пипетки осторожно наносят образец
и также дают ему впитаться; остатки образца смывают со стенок
колонки небольшой порцией растворителя. После этого колонку
заполняют свежим растворителем, создавая слой в 5-10 см, и со-
единяют с резервуаром, который находится над колонкой и содер-
жит большой объем растворителя, что позволяет поддерживать нуж-
ный слой растворителя в колонке.
Рекомендуется вносить образец в возможно малом объеме раст-
ворителя. Это позволяет сосредоточить разделяемые частицы в уз-
91
кой полосе уже в самом начале разделения.
Скорость протекания элюирующего раствора через колонку в
ходе разделения должна быть постоянной. Элюируемый с колонки
раствор (элюат) собирают в виде небольших фракций, каждая из
которых составляет 2-5% общего объема колонки. Фракции собира-
ют в пробирки. Каждое соединение обычно распределено по нес-
кольким пробиркам. Существует целый ряд автоматических коллек-
торов фракций, с помощью которых можно собирать определенные
объемы элюата в автоматически сменяющие друг друга пробирки
(рис.36).
Рис.36. Установка для
гель-проникающей хро-
матографии.
92
Гель-проникающая хроматография находит широкое применение
в биохимических исследованиях. Она используется в основном для
очистки высокомолекулярных биологических соединений. С помощью
соответствующих гелей проводят разделение и очистку вирусов,
белков,ферментов,гормонов,антител,нуклеиновых кислот и полиса-
харидов. Методом проникающей хроматографии можно разделять
смеси низкомолекулярных соединений, отделять аминокислоты от
пептидов, моносахара от полисахаридов, фракционировать пептиды,
олигосахариды и олигонуклеотиды, образующиеся в результате час-
тичного гидролиза белков,полисахаридов и нуклеиновых кислот^
соответственно.
Гель-хроматографию можно использовать для определения моле-
кулярных масс биологических соединений. Прокалибровав колонку
с помощью веществ (чаще всего белков), размеры молекул которых
известны, и сопоставив кривую элюции неизвестного вещества с
калибровочной кривой, можно определить молекулярные массы не-
известных компонентов системы. Однако следует помнить, что фрак-
ционирование веществ по молекулярной массе при гель-хроматогра-
фии зависит не только от величины молекул, но и от их,формы и
химического строения. Поэтому размеры молекул, определенные с
помощью этого метода, весьма приблизительны и требуют всегда
уточнения с помощью других методов.
Растворы высокомолекулярных соединений можно концентриро-
вать путем добавления к ним сухого сефадекса G-25 (лучше круп-
нозернистого). Набухающий гель поглощает воду и низкомолекуляр-
ные соединения, а вещества с большим молекулярным весом остают-
ся в растворе. Спустя 10 мин. гель удаляют центрифугированием;
при этом pH' и ионная сила раствора остаются неизменными.
93
Наконец, с помощью колонки, заполненной сефадексом G-25,
можно проводить обессоливание растворов высокомолекулярных со-
единений. Фракции высокомолекулярных соединений элюируются со
свободным объемом колонки, в то время как фракции, содержащие
низкомолекулярные соединения, распределяются между подвижной и
неподвижной фазами и поэтому движутся с меньшей скоростью.
Метод электрофореза на бумаге. Оборудование и приме-
нение.
Электрофорезом называется направленное движение дисперсных
заряженных частиц в дисперсионной среде в постоянном электричес-
ком поле к противоположно заряженному электроду.
Основу аппарата для электрофореза (рис.37) составляет ванна
из силикатного или органического стекла, в которую помещены две
кюветы (анодная и катодная) с электродами, приспособления для
размещения и закрепления полосок хроматографической бумаги. При-
меняются платиновые или угольные электроды. Сущность метода
заключается в том, что оба конца ленты хроматографической бума-
ги, смоченные буфером, опускают в катодную и анодную кюветы и
исследуемый раствор наносят на бумагу в виде точки или полосы
из нескольких капель, аппарат закрывают крышкой, чтобы препятст-
вовать испарению тонкого слоя буферного раствора, затем на элек-
троды, вмонтированные в кюветы, подают электрическое напряжение.
Индивидуальные вещества, находящиеся в исследуемом растворе, на-
несенном на хроматографическую бумагу, начинают при этом двига-
ться в различном направлении и с различной скоростью в зависи-
мости от их заряда, молекулярной массы, формы молекул.
В конечном итоге происходит распределение веществ на полос-
94
ке бумаги. Местоположение их обнаруживают обработкой специально
подобранными проявителями.
Рис.37. Аппарат для электрофореза на бумаге.
I-ванна из толстого стекла; 2-стеклянная
крышка, пришлифованная к ванне^-электрод-
ные кюветы (свободно вынимаются)^-продоль-
ная перегородка,разделяющая кювету пополам;
5-угольные электроды;6-бумажные полосы,кон-
цы их опускаются во внутреннее отделение
кюветы;7-съемные пластинки, на которых укреп-
ляются электроды (присоединяются к ванне при
помощи двух пружинок);8-рамка,на которой укрепля-
ются и натягиваются бумажные полосы;9-лабиринт
для укрепления бумажных полос; 10-пружины для
натягивания бумажных полос;II-подставка для
ванны; 12-уровень на подставке;13-установочные
винты.
В настоящее время кроме описанного выше низковольтного
(напряжение 100-500 В) горизонтального электрофореза на бумаге
находят широкое применение такие методы как: электрофорез на
ацетате целлюлозы; в тонких слоях с использованием кремния,
кизельгура, окиси алюминия или целлюлозы; с применением агаро-
вых крахмальных,полиакриламидных и других гелей; вертикальный
электрофорез; непрерывный (проточный) электрофорез; диск-электро-
форез; высоковольтный (500-I0000B) и иммунноэлектрофорез.
Подробно указанные методы описаны в специальных руководст-
вах.
Используя правильно выбранный метод электрофореза, можно
95
производить анализ и выделение препаратов не только индивидуаль-
ных биополимеров, но и клеток, клеточных органелл,вирусов, а
также низкомолекулярных соединений, как аминокислоты,моносаха-
риды, пурины, пиримидины и т.д.
Электрофорез дает возможность разделения ряда веществ, ко-
торые нельзя или очень трудно разделись иным путем.
Термостат, магнитная мешалка с подогревом,
торсионные весы. Назначение и устройство.
а) Термостат предназначен для' достижения и длительного под-
держания внутри рабочей камеры стабильной температуры, необхо-
димой при микробиологических исследованиях.
На рис.38 изображен общий вид электрического суховоздушного
термостата повышенной точности.
Рис.38. Общий вид
термостата ТС-80М.
1-нога опорная;
2-дверь наружная;
3-дверь внутренняя;
4-блок электромон-
тажный; 5-кнопка вк-
лючения подсвета;
6-термометр ^-заг-
лушка; 8-полка;9-
электронагреватель;
10-шаиба стопорная;
I1-шайба;12-гайка;
13-болт;14-колодка
клемная;15-датчик
температуры;16-про-
вод питания и зазем-
ления; 17-корпус сре-
дний; 18-рабочая ка-
мера; 19-корпус тер-
мостата.
96
Термостат представляет собой конструкцию бескаркасного ти-
па. Все узлы размещены и укреплены на корпусе термостата.
Рабочая камера, заключенная в среднюю камеру, выполнена из
листов полированной латуни.
Пространство между рабочей и средней камерами обогревается-
электронагревателями,расположенными в данной части средней каме-
ры.
Промежуток между наружным корпусом и средней камерой запол-
нен теплоизоляционным материалом. В термостате имеется две две-
ри - внутренняя и наружная. Внутренняя дверь застеклена, что
позволяет осуществлять периодический контроль за ходом исследо-
вания без значительного изменения температурного режима в рабо-
чей камере.
Уплотнители и запоры на внутренней и наружной дверях обес-
печивают плотный прижим к корпусу. Наружная дверь открывается
поворотом ручки против часовой стрелки.
Электромагнитный блок осуществляет автоматическое терморе-
гулирование .Для создания устойчивой работы полупроводникового
усилителя некоторые элементы электроблока защищены электромаг-
нитным экраном.
Диапазон регулируемых температур в рабочей камере термос-
тата находится в пределах от 28 до 55°С.
б Магнитная мешалка с подогревом (рис.39) предназначена
для перемешивания и, в случае необходимости,нагрева жидкости.
Электродвигатель мешалки вращает постоянный магнит,кото-
рый находится под нагревательной плиткой. Вращающееся магнит-
ное поле магнита приводит в движение мешалку, помещенную в ста-
кан и представляющую собой железный стержень,покрытый инертным
97
материалом"(полиэтиленом,тефлоном и др). Магнитную мешалку мож-
но использовать для перемешивания жидкостей в закрытых сосудах
(например, в колбе после стерилизации; питательной среды).
Рис.39. Магнитная мешалка с подогревом. 1-гнездо для штати-
ва;2-штатив;3-рифленная гайка;4-держатели стакана;5-электри-
ческий шнур;6-стеклянный стакан;7-нагревательная плитка;
8-ножка;9-выключатель;10-контрольная лампа;II-рукоятка регу-
лировки числа оборотов;12-выключатель нагревательной плитки;
13-контрольная лампа нагревательной плитки;14-штепсель для
подключения регулятора температуры;15-съемный кольцевой ко-
жух.
в) Торсионные весы (рис.40) предназначены для быстрого и
точного взвешивания тел массой до 250 мг.
Механизм весов смонтирован на металической плите (I) и
прикрыт корпусом (2). Плита опирается на приклепленную к ней
подпору и два регулировочных винта (3).служащих для установки
. весов по уровню(4). Чашка (или крючок для подвешивания взвеши-
98
ваемой массы) (5) находится на конце подвижного рычага и предох-
ранена стеклянным ограждением (6).Это ограждение предохраняет
взвешиваемую массу от влияния внешней среды во время процессаа
взвешивания (оно крепится на петлях и может открываться при по-
мещении взвешиваемой массы на чашку). С правой стороны корпуса.
Рис.40. Торсионные весы.I-металлическая
плита;2-корпус;3-регулировочные винты;
4-уровень;5-чашка или крючок для подве-
шивания взвешиваемой массы;6-стеклянное
ограждение чашки;7-регулировочная голов-
ка;8-головка, вращающая барабан со шка-
лой; 9-блокирующая головка.
находится регулировочная головка (7) предназначенная для под-
вода неподвижной стрелки на нулевое деление шкалы. С'левой сто-
роны корпуса находится головка (8) используемая во время взве-
шивания. Эта головка вращает барабан со шкалой, на которой от-
считываются измеряемые величины. С правой стороны корпуса вни-
зу, находится головка (9).позволяющая блокировать подвижный
рычаг в случае длительного простоя весов или во время их тран-
спортировки .
Перед взвешиванием производят отблокирование весов; для
99
этого головку (9) поворачивают на 180° устанавливая красную точ-
ку головки на ”0" (отблокировано). Буква "Z " обозначает положе-
ние "заблокировано".
Затем вращают левой головкой (8) шкалу до тех пор, пока
подвижная стрелка не займет положение на красной черте,опреде-
ляющей равновесие рычага. Правой головкой (7) наводят неподвиж-
ную стрелку на нулевое деление шкалы.
Открывают стеклянное ограждение (6) и предмет приготовлен-
ный к взвешиванию помещают на чашку, или подвешивают на крючке.
После этого закрывают ограждение и левую головку (8) вращают ле-
вой рукой влево (от себя) до тех пор, пока подвижная стрелка не
достигнет красной черты равновесия. Вращение головки вызывает
вращение подвижной шкалы. Величину массы, взвешиваемого предме-
та, отсчитывают на подвижной шкале в том месте, на которое указы-
вает неподвижная стрелка. После отсчета результата шкалу уста-
навливают при помощи головки (8) в исходное положение (нулевое).
Затем снимают с чашки (или с крючка) взвешенный предмет и закры-
вает ограждение.
•100
Литература
I. Б о у э н Т. Введение в ультрацентрифугирование. М.,"Мир",
1973.
2. В а ш к о в В.И. Антимикробные средства и методы дезинфекции.
М.,"Медицина",1977.
3. Е ж о в Г.И. Руководство к практическим занятиям по сельско-
хозяйственной микробиологии. М.,"Высшая школа",1974.
1. Лебедева М.Н. Руководство к практическим занятиям по ме-
дицинской микробиологии. М.."Медицина",1973.
5. М е т о д ы практической биохимии (редакторы Уильямс Б.,
Уилсон К.) . М.,"Мир",1978.
6. Пи м е н о в а М.Н., Гречушкина Н.Н., Азова
Л.Г. Руководство к практическим занятиям по микробиологии.
М.."Издательство московского университета",1971.
7. Практикум по микробиологии (под редакцией проф.
Егорова Н.С.), М.."Издательство московского университета",
1976.
8. Руководство к лабораторным занятиям по биологи-
ческой химии (под редакцией проф. Березова Т.Т.) М.,"Медици-
на", 1976.
9. Филиппович Ю.Б. .Егорова Т.А. .Севастья-
нова Г.А. Практикум по общей биохимии.М.."Просвещение",
1975.
10. Ф рай фельдер Д. Физическая биохимия. М., "Мир", I960.
II. Ш а п и р о Д.К. Практикум по биологической химии.Минск.
"Вышэйшая школа",1976.
12. Э кспериментальная микробиология (под редак-
цией проф.Бырдарева С.В.).София,"Медицина и физкультура?1965.
101
2. МОРФОЛОГИЯ МИКРООРГАНИЗМОВ
2.1. ТЕХНИКА ПОДГОТОВКИ МИКРООРГАНИЗМОВ ДЛЯ
НАБЛЮДЕНИЯ В ЖИВОМ И УБИТОМ СОСТОЯНИИ.
МЕТОДЫ ОКРАСКИ.
Вопросы для. подготовки по теме
I. Техника приготовления препаратов "раздавленная","висячая"
капли и их микроскопия.
2. Техника приготовления фиксированных мазков. Цель и методы
фиксации.
3. Простые методы окраски микробов.
4. Сложные методы окраски микроорганизмов:
I) Метод Грамм. Техника и механизм.
2) Методы Циля-Нильсена, Ожешки и их использование для выяв-
ления спор.
3) Метод Романовского-Гимза.
4) Выявление капсул с помощью метода Бурри-Гинса.
' 5) Окраска жгутиков.
•Морфологию микроорганизмов изучают с помощью микроскопии
их в неокрашенном или окрашенном виде.
Для приготовления микробиологических препаратов использу-
ют бактериологическую петлю, крючок, иглу или пипетки. Для ра-
боты с культурами бактерий и дрожжей используют петли, реже
иглы и пипетки. Культуры грибов берут с помощью крючка.
Бактериологическую петлю (иглу,крючок) перед взятием мик-
роорганизмов необходимо простерилизовать. Для этого проволоку
прокаливают до красного каления в пламени спиртовки или газо-
вой горелки,одновременно обжигая примыкающую к петле часть дер-
102
жателя. При прокаливании петлю (иглу,крючок) держат в пламени
вертикально, а затем горизонтально. Сразу же после стерилизации
петлю,иглу или крючок можно использовать для взятия микробной
массы. В том случае, если микробная культура выращена в пробир-
ке или колбе на плотной питательной среде, сосуд берут в левую,
руку таким образом, чтобы поверхность с ростом культуры была
обращена вверх. Простерилизованную петлю держат в. правой руке,
как карандаш; не выпуская петли мизинцем и безымянным пальцем
правой руки вынимают пробку из сосуда, края его обжигают в пла-
мени горелки (спиртовки) и в сосуд вводят прокаленную петлю;
пробку от сосуда при этом держат мизинцем правой руки. Чтобы
микробные клетки не погибли от соприкосновения с горячим метал-
лом, петлю охлаждают, прикасаясь к внутренней поверхности сосу-
да или к питательной среде, свободной от клеток микроорганизмов,
и только после этого захватывают небольшое количество микробной
массы. После этого сосуд закрывают,снова обжигая его края в пла-
мени горелки. После приготовления микробиологического препарата
петлю (крючок ,иглу) прожигают в пламени и ставят в специальный
стакан.
Если микробная культура выращена на жидкой питательной сре-
де, то для ее извлечения пользуются петлей или стерильной пипет-
кой. 3 последнем случае пипетку вынимают из бумаги или пенала,
в которых стерилизуют пипетки и , соблюдая описанные выше меры
предосторожности, вводят в сосуд с культурой; при этом следует
особенно внимательно следить за положением пробирки или колбы,
держа их в слегка наклонном положении, чтобы жидкость,содержа-
щая микробы, не вылилась. После взятия культуры пипетку сразу же
переносят в стакан с дезинфицирующим раствором, не касаясь ею
103,
окружающих предметов.
Техника приготовления препаратов "раздавленная"
и "висячая" капли. I
Для изучения микроорганизмов в живом неокрашенном состоянии
используют препараты "раздавленная" и "висячая" капли.
Предметные стекла, необходимые для этих препаратов,должны
быть чистыми и обезжиренными. Для обезжиривания стёкла помещают
в сосуд с притертой пробкой в смесь Никифорова (этанол:серный
эфир 1:1). Из обезжиривающего раствора стекла извлекают пинце-
том. Чистые сухие стекла непосредственно перед работой можно
обезжирить следующим образом: рабочую поверхность стекла нате-
реть мылом, которое затем удалить тканью.
,В том случае, если микробная культура выращена на плотной
питательной среде, на обезжиренное стекло наносят каплю физиоло-
гического раствора и в него вносят петлёй,соблюдая все описан-
ные выше приемы, небольшое количество клеток микроорганизмов.
Затем на каплю накладывают покровное стекло таким образом, что-
бы между покровным стеклом и предметным не было пузырьков возду-
ха. Кроме того, жидкость не должна выступать за края покровного
стекла, избыток жидкости удаляют фильтровальной бумагой.
Если микробы выращены на жидкой питательной среде, то для
приготовления препарата используют пастеровскую пипетку, с по-
мощью которой берут небольшую каплю культуры и наносят ее на
предметное стекло. В том случае, когда необходимо приготовить
препарат из культуры грибов, пользуются крючком, а вместо фи-
зиологического раствора на предметное стекло наносят каплю раз-
веденной уксусной кислоты или смеси этилового спирта с глицери-
Зак. 1183
104
ном, в которую и помещают кусочек мицелия гриба.
Препарат "висячая капля" готовят аналогичным образом, но
каплю культуры наносят на покровное стекло, а затем его накла-
дывают каплей вниз на предметное стекло с лункой посередине,
края которой смазаны вазелином. Предметное стекло слегка при- ч
жимают . к покровному, при этом получается герметически зак-
рытая камера, в которой капля долго не высыхает.
Препараты живых клеток микроорганизмов просматривают,
используя вначале малый объектив (х8 или х10), а затем микрос-
копируют с более сильным объективом (х40) при опущенном конден-
соре и прикрытой диафрагме, т.к. неокрашенные клетки лучше вид-
ны не в проходящем, а в отраженном свете. Для просмотра прижиз-
ненных препаратов часто используют фазовоконтрастную и темно-
польную микроскопию. В препаратах "раздавленная" и "висячая"
капли хорошо видны сравнительно крупные объекты, такие как гри-
бы, дрожжи, простейшие, кроме того отчетливо выявляется движе-
ние микробов, однако увидеть органы движения - жгутики можно,
только окрасив их с помощью специальных методов.
Приготовление препаратов фиксированных клеток
Простые и сложные методы окраски микроорганизмов.
Для количественного учета, изучения морфологии и особенно
деталей строения микробных клеток (выявления спор,капсул,орга-
ноидов, включений и т.д.) необходимо зафиксировать и окрасить
их. С^этой целью готовят мазок, начиная с обезжиривания чисто-
го предметного стекла, как это описано выше. На обезжиренное
стекло наносят небольшую каплю физиологического раствора или
воды и в нее вносят с помощью петли, соблюдая правила асептики,
105
исследуемый микробный материал, который распределяют на поверх-
ности площадью приблизительно 2,0 см^ тонким слоем. Если микро-
организмы выращены на жидкой питательной среде, микробную куль-
туру берут петлей и наносят на обезжиренное стекло (без воды).
После этого мазок высушивают на воздухе и фиксируют. В про-
цессе фиксации микробные клетки погибают, этим достигается бе-
зопасность работы с ними, что особенно важно при исследовании
патогенных микроорганизмов. Убитые клетки значительно лучше
воспринимают красители, чем живые. Кроме того, в фиксированном
мазке клетки приклепляются к стеклу и не смываются при после-
дующей обработке.
Методы фиксации подразделяют на физические и химические.
Физический метод - фиксация в пламени горелки или спиртовки в
течении нескольких секунд - мазком вверх. Эту операцию проводят
очень быстро после полного высушивания мазка, не перегревая его,
т.к. при перегревании могут произойти грубые изменения структур-
ных элементов клетки.
Химические методы фиксации более мягкие по сравнению с фик-
сацией в пламени. В качестве фиксаторов применяют жидкие раст-
ворители, при этом мазок для фиксации погружается в жидкость на
определенное время или фиксатор наливают на мазок. Химическую
фиксацию ведут:
I) этанолом (96%) 10-15 минут;
2) ацетоном - 5 минут;
3) смесью Никифорова (этиловый спирт:серный эфир - 1:1) -
10-15 минут;
4) метанолом - 3 минуты;
5) в парах осмиевой кислоты - несколько секунд;
106
6) формалином - несколько секунд;
После фиксации мазок можно окрашивать.
Окраску микробиологического мазка производят простыми или
сложными методами. Простые методы - обработка мазка каким-нибудь
одним красителем. При этом прокрашивается вся клетка, ее форма.
и размеры становятся хорошо видны. Для окраски микробов исполь-
зуют красители анилинового ряда, они могут быть основными и кис-
лыми, если красящий ион (хромофор) - катион, то краситель обла-
дает основными свойствами, если хромофор - анион, то краситель
- кислый. Кислые красители -эритрозин,кислый фуксин,эозин. Ос-
новные красители - генциан -виолет, кристалл-виолет, метилено-
вый синий, основной фуксин. Основные красители более интенсивно
связываются кислыми компонентами клетки. Для окраски микроорга-
низмов преимущественно’ используют основные красители. Из сухих
красителей,продающихся в виде порошков, готовят насыщенные спир-
товые растворы, а из них - водноспиртовые, которые и служат для
окрашивания микробных клеток (см. Приложение). Фиксированный ма-
зок опрашивают, наливая краситель на поверхность мазка на опре-
деленное время. Окраску мазка основным фуксином ведут в течение
2 минут, метиленовым синим - 5-7 минут. Затем мазок промывают
водой до тех пор, пока струи воды, стекающие с мазка, не станут
бесцветными, высушивают с помощью фильтровальной бумаги и микрос-
копируют в иммерсионной^системе. Если мазок правильно окрашен и
промыт, поле зрения совершенно прозрачно, а клетки интенсивно
окрашены.
Сложные методы окраски микроорганизмов применяются для изу-
чения структуры клетки и дифференциации одних микробов от других.
Они отличаются от простых прежде всего тем, что фиксированный
107
мазок подвергается воздействию нескольких красителей и других
химических веществ.
Окраска по методу Грама в модификации Синева
Дифференцированный метод окраски бактерий был предложен
Грамом в 1884 году. Этот метод очень важен,т.к.большинство мик-
робов подразделяется по отношению к окраске по Граму на грам-
положительные (грампозитивные или окрашивающиеся по Граму) и
грамотрицательные (грамнегативные или не окрашивающиеся по
Грацу). Отношение к окраске по Граму является отличительным
признаком микроорганизмов и учитывается в определении микроба.
Техника окраски
- Для окраски по методу Грама в модификации Синева подго-
тавливают бумажки, пропитанные генциан-или кристаллвиолетом.
Для этого полоски фильтровальной бумаги пропитывают 1% спирто-
вым раствором красителя и высушивают (см. Приложение).
- На фиксированный мазок накладывают бумажки,пропитанные
краской, заливают небольшим количеством воды, краситель быстро
диффундирует и окрашивает мазок. Окраску ведут 2 минуты.
- Генциан-виолетовую бумажку удаляют пинцетом. Не промывая
препарата водой, сливают краску и наносят раствор Люголя на
30-60 секунд до почернения препарата.
- Сливают раствор Люголя, не промывая водой, погружают пре-
парат в 96^ этанол на 20-30 секунд. Обесцвечивание спиртом произ-
водят до отхождения фиолетовых струй краски.
- Препарат тщательно промывают водой для удаления спирта.
- Окрашивают мазок водным фуксином 2 минуты.
106
- Промывают мазок водой до тех пор пока струи воды не станут
бесцветными.
- Высушивают препарат фильтровальной бумагой и микроскопи-
руют его в иммерсионной системе.
/ Грамположительные микроорганизмы окрашиваются в сине-фио-
летовый цвет; грамотрицательные в светло-красный. /
Механизм окраски по Граму. По современным представлениям,
основанным на изучении физико-химического состава и структуры
клетки,отношение к окраске по Граму обусловлено составом клеточ-
ной стенкиi микробов. У грамположительных бактерий муреин,состав-
ляющий каркас клеточной стенки,многослоен и содержит полимер уг-
леводной природы - тейхоевые кислоты. Таким образом, в клеточной
стенке грамположительных микробов количественно преобладают поли-
меры полисахаридной природы, связанные с белками.
Муреиновый каркас грамотрицательных бактерий однослоен, кро-
ме того,клеточная стенка этих микробов содержит относительно бо-
льшое количество липидов в. виде липопротеидов,фосфолипидов и ли-
пополисахаридов.
При окраске по Граму в клетках на уровне плазмолеммы идет
образование комплекса генициан-виолет + йод. Этот комплекс не-
растворим в воде и слабо растворим в спирте. При обработке эта-
нолом он проходит через клеточную стенку грамотрицательных мик-
робов, вымывается из клеток, последние становятся бесцветными
и докрашиваются фуксином,приобретая красный цвет. Клеточная
стенка грамположительных микробов, благодаря присутствию боль-
шого .количества полисахаридов не пропускает комплекса "генциан
-виолет + йод" и грампозитивные микробы остаются -сине-фиолето-
вого цвета. Способность окрашиваться или не окрашиваться по
109
Граму - достаточно постоянный видовой признак микроорганизма,
однако следует обращать внимание на возраст микробной культуры.
Так,например,известно,что некоторые спорообразующие бактерии
будучи грамположительными в молодых культурах (после 20-24 ча-
сов выращивания в термостате) с возрастом неодинаково интенсивно
окрашиваются по Граму. Поэтому рекомендуется окрашивать по Гра-
му молодые (односуточные) культуры микроорганизмов для изучения
их морфологии и других целей.
Для того,чтобы проконтролировать правильность окраски по
Граму исследуемого микроба,на одном предметном стекле делают
три мазка,по краям мазки культур п известным отношением и окрас-
ке,например Esch, coll - грамотрицательныё бактерии и _>&с.
mesentericus - грамположительные бациллы, а в центре мазок ис-
следуемого микроба. Мазки должны быть приготовлены одинаково,
т.е. иметь одну и ту же толщину,размер и т.д.,окраску следует
вести одновременно. В том случае,если тест-микробы окрасились при
этих условиях правильно.можно считать верной окраску исследуемой
культуры.
Окраска по методу Циля-Нильсена
Этот метод применяется для выявления спор и окрашивания
кислотоупорных микроорганизмов.
Техника окраски:
- Фиксированный мазок покрывают фильтровальной бумажкой и
наливают карболовый фуксин Циля.Затем,держа препарат пинцетом,
мазок подогревают до появления паров над пламенем горелки.
Добавляют новую порцию красителя и повторяют манипуляцию в те-
чении 3-S минут.
- Снимают бумажку пинцетом и после охлаждения предметного
ПО
стекла до комнатной температуры тщательно промывают мазок водой.
- Обесцвечивают мазок 5% HgSO^, опуская его на 20-30 секунд
в стаканчик с кислотой,затем препарат тщательно промывают водой.
- Окрашивают водно-спиртовым раствором метиленового синего
в течении 5 минут,промывают водой,высушивают,осторожно накла-
дывая фильтровальную бумагу, и микроскопируют с помощью иммер-
сионной системы.
Споры бактерий,окрашенные по методу Циля-Нильсена,выгля-
дят рубиново-красными,вегетативные клетки - голубыми.Бактериаль-
ная спора имеет высококонцентрированную протоплазму и окружена
плотной многослойной оболочкой,содержащей липиды и дипиколинат
кальция. Карболовая кислота (фенол),входящая в состав фуксина
Циля,является гидролизующим агентом,размягчающим оболочку споры.
Размягчению способствует также повышенная температура. Фуксин,
проникший в спору и окрасивший ее протоплазму,прочно удерживает-
ся ею и не обесцвечивается серной кислотой, протоплазма же веге-
тативных клеток обесцвечивается кислотой и докрашивается мети-
леновой синью.
Устойчивость некоторых микроорганизмов к кислотам связана
с наличием в их клеточной стенке липидов и восковых веществ.По
методу Циля-Нильсена кислотоупорные микроорганизмы (например,
микобактерии туберкулеза) окрашиваются в красный цвет и не обес-
цвечиваются кислотой.
Метод Ожешки также служит для выявления спор.
I). Приготавливают мазок и высушивают его.
2) . Не фиксируя,наливают на мазок 0,5^ раствор
соляной кислоты,которая служит в качестве протравы. Подогревают
т-2 минуты до появления паров и сливают кислоту.
3) . Мазок промывают водой,просушивают,фиксируют
III
в пламени спиртовки.
4) Накладывают на мазок фильтровальную бумажку и
окрашивают при подогревании фуксином Циля около 3-х минут., как
указано выше.
5) Обесцвечивают препарат б^Н^ЗО^.
6) Промывают водой.
7) Окрашивают метиленовым синим 5 минут.
8) Промывают водой, высушивают и микроскопируют
в иммерсионной системе. Споры, прочно адсорбировавшие фуксин,
красного цвета, вегетативные клетки - голубые.
Окраска по Романовскому-Гимза
Метод Романовского-Гимза широко применяется в микробиологии
для выявления деталей строения клетки, кроме того он является
одним из основных при изучении морфологии простейших,спирохет и
риккетсий.
Краситель Романовского-Гимза представляет собой смесь азура-
(органическая краска, получаемая из метиленового синего), эози-
на и метиленового синего. В растворе краска имеет сине-фиолето-
вый цвет, продается в готовом виде. Непосредственно перед окрас-
кой мазка приготавливают рабочий раствор краски, состоящий из
10 мл дистиллированной воды (pH-7,0) и 10 капель краски. Фикси-
рованный мазок опускают в стаканчик с рабочим раствором красите-
ля или в кювету с краской мазком вниз на I час. Через час краску
сливают,- препарат промывают водой до тех пор, пока струи воды
не станут прозрачными, высушивают на воздухе и микроскопируют в
иммерсионной системе.
112’
Методы выявления капсул микробов
Многие микроорганизмы имеют капсулу,которая окружает мик-
робную клётку в виде слизистого слоя. Капсулы могут быть различ-
ной величины и химического состава. Чаще всего они состоят из
высокомолекулярных полисахаридов, реже в их состав входят белки,
функция капсулы прежде всего защитная.
Капсулы не окрашиваются красителями при обычных методах
окраски. Для их выявления используют так называемые негативные
методы, при которых с помощью определенных веществ (тушь,2% раст-
вор колларгола и др.), не адсорбирующихся микробными клетками,
создается темный фон, на котором отчетливо видны яркие неокра-
шенные тела микробов.
Метод Б упри
На край обезжиренного предметного стекла наносят капельку
туши, а рядом с ней каплю воды,в которую вносят петлей микроб-
ную культуру. Затем обе капли быстро и тщательно перемешивают
и из смешанной капли делают мазок ребром другого предметного
стекла, как это показано на схеме. /х
Затем мазок тщательно высушивают на воздухе и микроскопи-
руют с иммерсионной системой. На темном фоне клетки,окруженные
капсулой, видны как ярко освещенные тельца.Этот способ применя-
ют и для выявления безкапсульных микробов: например спирохет,
микробов зубного налета человека и др.
ИЗ
Метод Бурри-Гинса
Мазок приготавливают по методу Бурри,фиксируют над пламе-
нем или смесью Никифорова, затем окрашивают фуксином Циля(раз-
ведецным водой в соотношении 1:3), наливая краситель нгЬоверх-
ность мазка на 2 минуты,осторожно промнвают водой, чтобы смыть
остатки краски, но не удалить слой туши, высушивают на воздухе
и микроскопируют в иммерсионной системе. Бактериальные клетки
красного цвета, окруженные бесцветными капсулами, хорошо видны
на темном фоне.
Модифицированный метод Бурри-Гинса
На край предметного стекла помещают i.jlhuo разбавленного
(1:1) водой карболового фуксина Циля, в которую вносят петлей
исследуемую культуру. Через 2-3 минуты к ней добавляют каплю
туши, разведенной водой (1:1), тщательно перемешивают и готовят
препарат по схеме, представленной выше. Мазок полностью высуши-
вают на воздухе и .микроскопируют в иммерсионной системе. Клетки
окрашиваются в красный цвет, капсулы бесцветные, тушь создает
темный фон.
Окраска жгутиков
Многие микроорганизмы имеют специальные органы движения-
жгутики, длина которых достигает 20 мкм, диаметр 10-20 нм.
Окраска жгутиков очень трудоемкая операция, т.к. жгутики
легко отрываются и повреждаются.
Для приготовления препарата можно пользоваться как пред-
метными так и покровными стеклами. Они должны быть обработаны
хромовой смесью, промыты и обезжирены!; хранят стекла в смеси
Никифорова (этиловый спирт : эфир - 1:1).
114
Исследуемая бактериальная культура должна быть молодой
(16-20 часов роста в термостате).Культуру,выращенную на МПА,
заливают I мл стерильной воды, и для приготовления мазка берут
небольшую капельку взвеси.
Окраска жгутиков по ЛеДкЬлеру •
За 1-2 суток до употребления готовят протраву. следующего
состава: I мл насыщенного спиртового раствора основного фукси-
на, 10 мл 20^5 водного раствора танина, 5,5 мл насыщенного на
холоду водного раствора сернокислого закисного аммиачного желе-
за. Перед употреблением фильтруют. Капельку взвеси переносят
на предметное или покровное стекло,не размазывая ее петлей и
дают высохнуть. Затем обрабатывают мазок протравой при комнат-
ной температуре 20 минут. Мазок тщательно промывают водой,вы-
сушивают на воздухе и докрашивают фуксином Циля 3-4 минуты при х
легком подогревании (без отхождения паров). Промывают препарат
водой,высушивают и микроскопируют в иммерсионной системе.
2.2. МОРФОЛОГИЯ ПРОСТЕЙШИХ.
Вопросы для подготовки по теме
I. Морфология протозойных микроорганизмов.
2. Принцип классификации простейших.
3. Особенности основных представителей простейших;классов
споровиков.жгутиковых,саркодовых.реснитчатых.
Простейшие (Protozoa ) - микроскопические одноклеточные
животные организмы (эукариоты).
Простейшие весьма разнообразны по форме,величине и стро-
ению клетки (рис.41). Размеры их колеблются в зависимости от
115
вида от нескольких мкм до 2 см. Большинство простейших значитель-
но крупнее бактерий ( 100 мкм), по сравнению с последними они
достаточно сложно организованы, их клетка имеет оформленное ядро,
в цитоплазме можно обнаружить целый ряд дифференцированных орга-
ноидов, характерных для низших животных. Оболочка простейших по
строению и химическому составу отличается от клеточной стенки
бактерий и грибов. Характерной ее особенностью является наличие
хитина.
В настоящее время известно более I5Q00 видов простейших,
большинство ведет сапрофитный образ жизни, обитая в воде и почве,
но среди них известны и патогенные виды, вызывающие заболевания
у человека и животных.
Протоплазма простейших делится на два слоя - наружный,
называемый эктоплазмой и внутренний, который имеет сложное стро-
ение и содержит'вакуоли, включения и т.д. - эндоплазму.Митохонд-
рии простейших хорошо развиты и находятся в эндоплазме.
Ядро простейших может иметь различную форму - овальную,
шаровидную, удлиненную, неправильную. У некоторых видов имеется
два ядра - макронуклеус и микронуклеус.
Оболочка Protozoa может быть плотной двухслойной, содер-
жащей большое количество хитина, в таком случае она называется
кутикулой; другие виды имеют гибкую оболочку, выполняющую роль
полупроницаемой мембраны; у некоторых простейших практически
нет оболочки, ее заменяет эктоплазма.
Размножение простейших осуществляется простым делением и
половым путем (в основном конъюгацией). В неблагоприятных усло-
виях существования многие простейшие образуют покоящиеся форш
со сниженным обменом веществ и прочной оболочкой - цисты.
Классификация простейших основана на способе передвижения,
По
связанном с наличием специальных органов: жгутиков,ресничек,лож-
но ножек (псевдоподий).
Кл. Sarcodina _ Корненожки или Саркодовые
Передвигаются с помощью выростов протоплазмы,.постоянно
меняющих направление.- ложноножек или псевдоподий.
Представителями являются различные амебы.
Клетка амеб имеет сложное строение, в ней находятся ваку-
оли: пищеварительная, сократительная, выделительная. Амебы
имеют оформленное ядро и ядрышко. Протоплазма амеб находится
в постоянном движении, выполняя функцию циркуляторной системы.
Оболочка амеб представлена тонкой пелликулой, а у некото-
рых отсутствует.
Амебы, ведущие сапрофитный образ жизни, обитают в воде и
почвр. В объектах внешней среды их можно обнаружить, пригото-
вив и промикроскопировав прижизненные препараты из образцов
воды или почвы, желательно сразу же после их взятия. В препа-
ратах "раздавленная" и особенно "висячая" капля хорошо видны
сравнительно крупные,активно передвигающиеся.клетки этих прос-
тейших. Но для более детального изучения необходимо получить
чистые культуры простейших, для этого используют специальные
питательные среды, которые должны быть благоприятны для бак-
терий, которыми питаются корненожки.
В кишечнике человека и животных обитают непатогенная
кишечная амеба (But. coll ) и дизентерийная амеба (Ent.histolytica).
Эти микроорганизмы выявляют в испражнениях, при этом исследу-
ют прижизненные препараты только что выделенных фикалий на
подогретом предметном стекле , т.к. вегетативные клетки амеб
II?
быстро погибают от охлаждения. Дифференциацию сапрофитной ки-
шечной амебы от дизентерийной ведут в мазках;окрашенных для
выявления ядра (см.раздел 3.4). Ядро у дизентерийной амебы име-
ет тонкий слой хроматина у оболочки и небольшое ядрышко в цент-
ре, в эндоплазме четко видны эритроциты, у®пг.со1лдро имеет
широкий слой хроматина, в эндоплазме видны бактерии. Амебы об-
разуют цисты, окруженные плотной оболочкой и хорошо сохраняю-
щиеся во внешней.среде, в отличие от вегетативных клеток. За-
ражение амебной дизентерией осуществляется цистами.
Кд. Flagellata- Жгутиковые
К этому классу относятся многочисленные простейшие, кото-
рые имеют овальную, веретенообразную или грушевидную форму,
передвигающиеся с помощью одного или нескольких жгутиков, рас-
положенных на одном конце тела. Их можно обнаружить в сточных
водах, в прудах, во влажной почве. Многие представители этого
класса являются патогенными для человека и животных.
Lamblia intestinales патогенна' для человека, вызывает лям-
блиоз - заболевание, сопровождающееся поражением кишечника и
печени.
Лямблии имеют характерную грушевидную форму с двумя
симметрично расположенными ядрами и четырьмя парами жгутиков,
очень подвижны.
Заражение человека осуществляется цистами, которые обра-
зуются' в кишечнике и выходят с испражнениями. Цисты имеют плот-
ную двухслойную хитиновую оболочку и хорошо сохраняются во внеш-
ней среде. Выявить лямблии можно в прижизненных препаратах из
испражнений (цисты) и желчи (вегетативные клетки).
ПЬ
Возбудителями трихомоноза являются различные виды рода
Trichomona^в частности ,Tr .vaginalis , вызывающий воспалитель-
ный процесс мочеполовой системы. Обнаруживаются в моче больных.
Жгутиковые вызывают также африканскую сонную болезнь,кото-
рую переносят мухи це-це (trypanosoma gambiens^; токсоплазмозы
( Toxoplasma gondii ) и лейшманиозы ( Leishmania tropica,
L. donovani ), практически не встречающиеся на территории
СССР.
Кл, Sporozoq, -Споровики
К этому классу относятся возбудители малярии,разные виды
малярийных плазмодиев (Plasmodium vivax,Pl.malarias,Pl.ovale),
Малярия относится к заболеваниям,переносимым членистоногими -
комарами рода Anopheles .
Жизненный цикл малярийного плазмодия состоит из 2-х частей:
бесполое размножение (шизогония) проходит в организме человека,
а половое - в организме комара.
Комар при укусе заносит в кровь человека паразита в форме
спорозоита, в организме человека спорозоиты короткое время
размножаются в печени (так называемая экзоэритроцитарная ста-
дия) . Вскоре паразит проникает в эритроциты и в них начинается
активное их размножение,которое получило название шизогонии.
Цикл шизогонии начинается с образования мерозоита,который
при соответствующей окраске может выглядеть в эритроците в ви-
де кольца. Молодой шизонт растет,размеры его увеличиваются,
тело принимает амебную форму, появляются псевдоподии.шизонт
становится подвижным. Постепенно шизонт заполняет весь эритро-
цит, начинается стадия меруляции,которая сопровождается мно-
119
жественными делениями ядра и образованием мерозоитов. Эритроцит,
заполненный мерозоитами, разрушается, они выходят в кровь и на-
чинается новый цикл шизогонии. После нескольких циклов шизого-
нии в крови появляются женские и мужские половые клетки -гамето-
циты, которые образуются из мерозоитов.
Макрогаметоциты (женские половые клетки) и микрогаметоци-
ты (мужские половые клетки)-слабо подвижны, их оплодотворение
возможно только в организме комара, насосавшегося крови больно-
го. Слияние женской гамеры с мужской в организме комара сопро-
вождается образованием зиготы, которая, вытягиваясь, превраща-
ется в подвижную оокинету. Оокинета проникает в стенку желудка
комара, растет, теряет подвижность и превращается в ооцисту,
покрытую плотной оболочкой. В ооцисте по мере созревания про-
исходит деление ядра и протоплазмы и образуется огромное коли-
чество серповидных спорозоитов, которые проникают в слюнные
железы комара. Цикл замыкается.
Кл. Infusoria(Ciliata) - Реснитчатые
Обширный класс простейших, имеющих постоянную форму тела
и передвигающихся с помощью ресничек. В клетке имеется’одно
или два ядра, ротовое и выходные отверстия, гранулы запасных
питательных веществ. Характерный сапрофитный представитель -
инфузория - туфелька, встречающаяся в воде,во влажной почве,
патогенный вид-Balantidium соЗкБалантидии вызывают поражение
толстого кишечника с образованием язв.Человек заражается от
свиней инцистированной формой паразита. Клетка крупная - дли-
ной около 100 мкм, шириной 50-70 мкм, имеют овальную форму,
покрыта ресничками.
Частички пищи с током жидкости попадают через специальное
120
образование - перистом в ротовое отверстие (цистом), ведущее в
пищевод и пищеварительную вакуоль. Выделительную функцию осу-
ществляет анальная пара - цитопрокт. В эндоплазме балантидия
располагается макронуклеус с несколькими ядрышками и микронук-
леус. Имеются сокращательные вакуоли. Оболочка представлена
пелликулой. Так же как другие простейшие,балантидий размножает-
ся простым делением.
Рис.41. Морфо-
логия простей-
ших. I-5-диэен-
терийная амеба;
6-8-кишечная
амеба;9-П-три-
хомонады чело-
века; 12,13-лям-
блии; 14,15-ба-
лантидии .
121
2.3. МОРФОЛОГИЯ ГРИБОВ
Вопросы для подготовки по теме
I. Особенности строения грибов
2. Мицелий и его видоизменения
3. Способы размножения грибов
4. Классификация грибов
5. Особенности морфогенеза грибов из классов аскомицетов,
базидиомицетов и зигомицетов.
б. Местоположение аспергиллов и пенициллов в классифика-
ции грибов
7. Культурально-морфологические особенности несовершен-
ных грибов
Мицелий и его видоизменения
Грибы являются эукариотами,имеют довольно сложную по срав-
нению с бактериями клеточную организацию и большое разнообра-
зие строения и формы у различных представителей этой большой
группы организмов. При этом можно отметить ряд особенностей,
свойственных огромному большинству их. Наиболее общим является
строение вегетативных органов, называемых мицелием или грибни-
цей. Мицелий состоит из системы тонких около 5 мкм в диаметре,'
ветвящихся нитей или гиф , которые отчасти проникают внутрь
субстрата, отчасти стелятся по его поверхности. У низших гри-
бов гифы обычно не имеют перегородок, весь мицелий является
одной сильно разветвленной многоядерной клеткой. Такой мицелий
называется несептированным или нечленистым. У всех.высших гри-
бов и некоторых низших в гифах мицелия расположены поперечггые
перегородки или септы,делящие их на отдельные клетки, одноядер-
122
ные или многоядерные. Такой мицелий называется членистым,много-
клетным или септированным.
Микроскопическое строение мицелия довольно разнообразно и
зависит от функции, которую выполняет та или иная его часть
(рис.42).
Столоны служат главным образом для расгйстранения мицелия
по субстрату, это гифы, обычно толстые, слабо разветвленные,
обладающие энергичным ростом.
Ризоиды служат для прикрепления мицелия к субстрату, при-
чем не обязательно имеющему значение для питания гриба, напри-
мер^. стеклу. Имеют вид пучка коротких разветвленных нитей.
Анастомозы - это срастания гиф мицелия, которые служат для
сообщения между клетками, при большом их развитии мицелий при-
обретает характерный сетчатый вид. Развитие анастомозов наблю-
дается у различных грибов с септированным мицелием. В некото-
рых случаях через них совершается перемещение клеточного ядра
из одной клетки в другую и таким образом гаплоидный мицелий пе-
реходит в диплоидный или дикариотический. Однако чаще анастомозы
развиваются у грибов просто при недостатке питания.
Пряжки характерны для базидиомицетов, являются важным так-
сономическим признаком. Это небольшие клетки, развивающиеся у
поперечной перегородки гифы и служащие для сообщения между дву-
мя соседними клетками мицелия. Пряжки развиваются на диплоид-
ном мицелии и служат аппаратом, посредством которого происхо-
дит передача ядра из одной клетки в другую. Иногда пряжки про-
растают, образуя боковые ветви.
Гаустории характерны для паразитирующих грибов.Это специ-
альные ветви,которые внедряются в полость клетки растения, на
X
123
котором развивается гриб, и воспринимают из нее питательные ве-
щества.
Тяжи - это образования,сложенные из небольшого количества
параллельно идущих гиф, которые или склеиваются между собой
ослизненными ободочками,или вступают в более прочное соедине-
ние посредством многочисленных анастомозов. Более массивные тя-
жи с темноокрашенными наружными частями имеют сходство с корня-
ми высших растений и называются ризоморфами. Тяжи и ризоморфы
могут достигать нескольких миллиметров толщины и нескольких мет-
ров длины. Их назначение состоит в том, что они способствуют ве-
гетативному распространению гриба, через них может происходить
передвижение питательных веществ к плодовым телам базидиомице-
тов из мицелия. Наконец, ризоморфы, защищенные плотной корой,
могут служить для сохранения гриба при неблагоприятных условиях.
Склероции представляют собой тела плотной консистенции,об-
i
разованные в результате плотного переплетения и анастомозов гиф.
По размерам склероции бывают от десятых долей миллиметра до 30
см в диаметре и 20 кг веса /у некоторых тропических грибов/.
Они очень бедны водой/5-10%/, содержат большое количество запас-
ных питательных вейцеств, особенно жира. В таком состоянии они
могут долгое время сохраняться, а в благоприятных условиях про-
растать, развивая мицелий или плодовое тело. Склероции распрост-
ранены у всех групп высших грибов, например,; у аскомицетов ха-
рактерно их образование у спорыньи piaviceps purpurep. Они обра-
зуются свободно на мицелии, у паразитарных грибов - часто
внутри пораженного растения, иногда мумифицируют целые органы.
Почкующийся мицелий отличается от обычного гифенного ми-
целия тем, что его клетки размножаются не обычным делением, а
124
почкованием.В некоторых случаях он остается очень коротким,т.к.
все время распадается на отдельные клетки, но иногда достигает
больших размеров и ветвится. Наиболее типично почкование у
дрожжей, у других грибов оно наблюдается только в специальных
условиях, например, при недостатке кислорода и питательных' ве-
ществ у Mucor racemosus.
Оидии образуются в результате, того,что на гифах мицелия,
начиная от концов их, появляются частые перегородки, по ним
мицелий распадается на отдельные клетки большей частью овальной
формы. При подходящих условиях оидии прорастают в мицелий.
Артроспоры образуются путем сегментации и последующего рас-
пада гиф.
Хламидоспоры часто образуются при неблагоприятных условиях
роста, когда содержимое гиф стягивается в отдельные места и оде-
вается собственной толстой оболочкой. После разрушения остав-
шихся пустыми частей гиф они освобождаются и могут прорастать
в новый мицелий. Если клетки типа хламидоспор отличаются неопре-
деленностью и разнообразием своей 'формы, их называют геммами.
Они встречаются как у низших,так и у высших грибов, например,
у Aureobasidium pullulans.
Зигомицеты (класс Zygomycetes )
Зигомицеты - это низшие грибы, образующие обильный хорошо
развитый мицелий. Споры бесполого размножения у них обычно эн-
догенного происхоадения,т.е. образуются внутри особых вместилищ-
спорангиев. Только у немногих из них встречаются экзогенные спо-
ры, которые образуются на поверхности производящих их органов
/конидиеносцев/ и называются конидиями. Спорангии образуются
125
1
Рис.42. Видоизменения мицелия.
I- Rhizopus - столоны со спорангиеносцами
на них и ризоидами; 2- анастомозы мицелия;
3-развитие пряжки; 4- почкующиеся дрожжи;
5-Вис от - почкующийся мицелий; 6-образова-
ние оидий; 7- хламидоспоры Mucor racer.iosus.
125
на особых спорангиеносцах, которые являются по происхождению
ответвлениями мицелия, но отличаются от -него своей большой тол-
щиной, ограниченным ростом, характером ветвления /или полным
отсутствием ветвления/. На их концах только в воздушной среде
образуются спорангии, отделяющиеся от спорангиеносца перегород-
кой. Перегородка идет обычно не прямо поперек, а изгибается ку-
полообразно, очерчивая так называемую колонку, представляющую
как бы продолжение спорангиеносца, вдающееся в полость споран-
гия. Споры освобождаются после разрыва оболочки спорангия. У
некоторых видов зигомицетов нижняя часть оболочки спорангия
сохраняет большую прочность и остается в виде воротника /апо-
сЬизы/у основания колонки, /рис.43/.
У целого ряда зигомицетов вместо спорангиев, содержащих
значительное количество спор в каждом, развиваются на сильно
разветвленных спороносцах отдельные конидии. Некоторые виды
имеют мелкие спорангии /спорангиоли/, содержащие небольшое ко-
личество спор /не больше 10/ в каждом. У ряда грибов на повер-
хности вздутого на конце спорангиеносца развиваются экзогенные
споры. Нередко у одного и того же гриба наряду с экзогенным спо-
роношением можно обнаружить и обычный спорангий, /рис.44/.
У зигомицетов половой процесс, называемый зигогамией, зак-
лючается в слиянии двух большей частью многоядерных клеток -га-
метангиев. Они образуются на концах особых коротких ветвей мй-
целия /популяционных ветвей/ и большей частью совершенно одина-
ковы по величине и строению /изогамия/,хотя иногда наблюдается
и некоторые различия /зачатки гетерогамии/. Гаметангии содер-
жат большое количество ядер,которые в процессе оплодотворения
сливаются, у некоторых видов до одного ядра. Результатом поло-
12^ '
вого процесса является зигота или зигоспора, имеющая характер
покоящейся споры. Она образуется на месте слияния гаметангиев.
Зигота прорастает только после периода покоя, образуя или мице-
лий или чаще зародышевый спорангий /рис.45/.
РИс.44. Blakeslea
Trispora : a-нормаль-
ный спорангий^ - экзоген-
ные спорангии; 2-споранги-
еносец llhanmidium
со спорангием и спорангио-
лями (по Л.И.Курсанову),
126
Рис.45. Половой процесс зигомицетов. I-.Rhizopus
nigricans -изогамная копуляция;2- Absidia
spinosa -гетерогамная копуляцмя;3- liucor -
прорастание зигоспоры образованием зародышевого
спорангияСпо Л.Н.Курсанову).
Аскомицеты (Класс Ascomycetes )
Сумчатые грибы (аскомицеты) - один из крупнейших классов
грибов. В нем более 3000С видов, что составляет приблизительно
30% всех известных видов грибов. Организмы, входящие в этот
класс, чрезвычайно разнообразны по строению. Имеются сумчатые
грибы с хорошо выраженным многоклеточным мицелием и грибы, у ко-
торых типичный мицелий отсутствует - дрожжи. Но все эти многооб-
разные формы связаны общим происхождением и имеют ряд общих черт,
на основании которых они объединяются в этот класс.
Основной признак аскомицетов - образование в результате по-
лового процесса сумок (или асков) - одноклеточных структур, со-
держащих чаще всего 8 аскоспор. Сумки образуются или непосредст-
венно из зиготы (у низших аскомицетов), или из развивающихся из
зиготы аскогенных гиф. 3 сумке происходит слияние ядер зиготы,
а затем мейотическое деление диплоидного ядра и образование гап-
лоидных аскоспор. Форма аскоспор очень разнообразна - от шаро-
видных или эллипсоидальных до нитевидных. Форма сумок округлая,
овальная или цилиндрическая.
У низших аскомицетов (голосумчатых) сумки образуются непос-
редственно на мицелии, а у высших (покрытосумчатых) в специаль-
ных вместилищах - плодовых телах.
Подкласс голосумчатых или протоаскомицетов
Подкласс голосумчатых грибов относительно небольшой. В не-
го входят грибы, у которых отсутствуют плодовые тела и сумки раз-
виваются в виде одиночных клеток или слоем непосредственно на
мицелии. В этот подкласс входят дрожжи, типичным представителем
которых является семейство *Saccharomycetaceae .Эти организ-
мы в большинстве случаев одноклеточные и размножаются делением -
Shisosaccharomyces , а род Saccharomycodes имеет ,
промежуточный тип размножения (рис.45).
Рис.46. Дрожжи. 1-почкование;
2-почкующееся деление;3-сумки
со спорами;4-деление;Р-псевдо-
мицелии.
Дрожжи в культурах на плотных' питательных средах растут
в виде колоний разного цвета, формы и консистенции. /1а жидких
питательных средах образуют помутнение, пленки и осадки. ;
("летка дрожжей имеет все основные структуры, характерные
130 '
для грибов.
Форма дрожжевой клетки зависит от способа вегетативного
размножения. При почковании возникают круглые, яйцевидные и
овальные клетки. Почки у многих видов дрожжей возникают неупо-
рядоченно по одной или по две и более одновременно. В резуль-
тате почкования без отделения клеток у некоторых дрожжей воз-
никают структуры примитивного или хорошо развитого ложного
мицелия.
При почкующемся делении клетки приобретают грушевидную,
веретеновидную или лимоновидную форму.
После деления клетки чаще остаются одиночными, имеют вы-
тянутую или слегка овальную форму.
Подкласс покрытосумчатых или эуаскомицетов
Подкласс эуаскомицетов содержит организмы, у которых сум-
ки образуются в настоящих плодовых телах различной формы.
Конидиальное спороношение аскомицетов развивается в пери-
од вегетации грибов и служит для их массового расселения. У
некоторых аскомицетов конидиальное спороношение редко, у дру-
гих оно преобладает в цикле развития. В отдельных группах это-
го класса наблюдается редукция полового процесса и сумчатая ста-
дия образуется редко. Очень часто ее трудно обнаружить в приро-
де и получить в искусственной культуре грибов. Поэтому многие
аскомицеты как в природе, так и в коллекциях культур мы чаще
встречаем в их конидиальной стадии. Например, у грибов рода
lenicillium и Aspergillus клейстотеций удается обнаружить
у немногих видов ( Peniqillium Ihonii,Aspergillus nidulans ) ф
Поэтому в ряде руководств часть грибов этих родов включена
в группу дейтеромицетов, или несовершенных грибов.
IBI
Грибы рода PenMiiiium. имеют бесцветный, многоклеточный,
ветвящийся мицелий. Для них характерно конидиальное спороноше-
ние в виде кисточки различной степени сложности (отсюда его си-
ноним "кистевик"). На основании строения кисточки и культураль-
но-морфологических признаков в пределах рода установлены сек-
ции, подсекции и серии. Различают следующие основные типы стро-
ения кисточек: (рис.47).
I. Одномутовчатый (моновертиттиллятный)
От мицелия отходит септированный конидиеносёц, на конце которо-
го мутовчато (кисточкой) расположен один ряд клеток, называемых
стеригмами. Каждая стеригма несет- на конце цепочку клеток, кото-
рые называются конидиями.
2. Двумутовчаты“ (бивертициллятный).
На конце конидиеносца клетки расположены в два ряда, причем на
132
клетках первого ряда обычно находится несколько клеток второго
ряда. Клетки первого ряда называются метулами, а клетки второго
ряда, несущие конидии, - стеригмами.
3. Многомутовчатый (поливертициллятный) тип отличается от
двумутовчатого тем, что метулы расположены в свою очередь на
клетках, которые отходят непосредственно от конидиеносца и на-
зываются веточками. Таким образом, имеется 3 ряда клеток: ве-
точки, метулы и стеригмы (рис.48).
4. Несимметричный. Кисточки состоят из двух или трех рядов
элементов, но нижний ряд часто редуцирован до двух клеток: цент-
ральной и боковой.
У некоторых видов конидиеносцы соединены в пучки, называ-
емые коремиями. Имеются виды, которые образуют склероции.
Грибы рода Aspergillus имеют, как и пенйциллы, многоклеточ-
ный, ветвящийся мицелий. Конидиеносцы отходят вверх от особых
ктеток мицелия - опорных клеток. Верхняя часть конидиеносца взду-
вается, образуя пузырь, который называют конидиальной головкой.
Конидиальная головка у большинства округлая, у отдельных видов
в различной степени вытянутая (рис.49). На головке находятся сте-
ригмы, расположенные в один или два ряда. Стеригмы на головке
располагаются радиально по всей поверхности или в верхней ее
части. От стеригм отходят цепочки конидий (рис.50).
Рис.49. Типы конидиальных головок, а-булаво-
видная;б-куполообразная;в-овальная;г-круглая.
Рис.50. Конидиальное стро-
ение аспергилла. 1-опорная
клетка; 2-конидиеносец;
3-конидиальная головка;
4-стеригмы первого ряда;
5-стеригмы второго ряда;
б-цепочка конидий.
134
По мере созревания конидии отваливаются, переносятся на новые
места и при благоприятных условиях прорастают, образуя мицелий.
При помощи конидий, т.е. бесполым путем,размножается большинст-
во аспергиллов. Однако некоторые их них имеют и высшее спороно-
шение, т.е. половое. Сумчатая стадия известна у Aspergillus
glaucus , Aspergillus fumigatus , Aspergillus nidulaus
и некоторых других.
Плодовые тела аскомицетов
Различают следующие типы плодовых тел:
I. Клейстотеций или клейстокарпий - округлые полностью
замкнутые плодовые тела, содержащие сумки со спорами. Сумки в
клейстотециях располагаются в беспорядке. Созревшие аскоспоры
освобождаются из клейстотеция в результате его разрыва под дав-
лением набухающих сумок. Образование клейстотециив характерно
для пенициллов и аспергиллов (рис.51,1).
2. Перитеции - полузамкнутые плодовые тела, большей частью
округлые или кувшиновидные, с узким отверстием на вершине. Со
дна перитеция пучком или слоем поднимаются сумки, обычно була-
вовидные или цилиндрические. При набухании сумок в перитеции
создается давление и они поочередно выталкиваются к отверстию
перитеция и выбрасывают аскоспоры. Образование перитециев ха-
рактерно для грибов - паразитов растений - мучнисто-росяных гри-
бов и для хетомиевых грибов, сапрофитов, обитающих преимущест-
венно на растительных остатках(рис.51,2).
3. Апотеции - широко открытые при созревании плодовые те-
ла, обычно блюдцевидные, дисковидные или чашевидные. На их вер-
хней стороне располагается слой сумок, называемый гимением.
135
Расположение сумок широко открытым гимением дает возможность
одновременного выбрасывания аскоспор из многих сумок в виде "вз-
рыва" или "залпа".
Апотеций - наиболее совершенный тип плодового тела аскоми-
цетов, обеспечивающий максимальную продукцию аскоспор.
Примером грибов, образующих апотеции, могут быть пецици-
евые грибы. Плодовые тела пецицевых - апотеции типичного ст-
роения, от очень мелких, не превышающих в диаметре I мм, до
крупных, размером около 10 см. Их окраска разнообразна, от ярко
оранжевой или красной у одних, до коричневой или черной у дру-
гих. Большинство пецицевых известно только в сумчатой стадии,
хотя у некоторых присуиствуют конидиальное спороношения. Пеци-
цевые, как правило, сапрофиты, лишь немногие из них могут пара-
зитировать на растениях (рис.51,3).
Рис.51. Плодовые тела аскомицетов. I-клейстотеций; 2-перитеций;
3-апотеций.
Таким образом, класс аскомицетов очень многочисленный и
разнообразный по своим представителям. Многие организмы этого
класса имеют экономическое значение как продуценты антибиотиков,
136
алкалоидов, ростовых веществ (гиббереллинов), витаминов,фермен-
тов, белка. Наконец, многие аскомицеты широко используются сей-
час в качестве объектов генетических и биохимических исследова-
ний.
Базидиомицеты (Класс Basidiomycetes).
Этот класс высших грибов включает более 20 тысяч видов.
Наиболее известные представители базидиомицетов - шляпочные гри-
бы (пластинчатые и трубчатые). Мицелий этих грибов развивается
в почве и при благоприятных условиях может распространяться на
много метров, а на нем в разных местах образуются плодовые тела.
Плодовое тело состоит из плотно упакованных гиф, нижняя сторона
шляпки плодового тела содержит множество пластинок (у пластинча-
тых грибов) или трубочек (у трубчатых), в которых находятся ты-
сячи базидий. При созревании гриба базидиоспоры, находящиеся на
базидии, попадают в почву и прорастают.
Рис.52. Разрез шляпочного гриба,
показаны подземный вегетативный
мицелий и плодовое тело.У созрев-
шего плодового тела(слева) из плас-
тинок на нижней стороне шляпки ос-
вобождается и рассеивается ветром
большое количество базидиоспор.Сп-
рава показано второе,незрелое пло-
довое тело, только что появившееся
на поверхности почвы.
137
Т.к. изолированные базидиоспоры гаплоидны,то они, прорастая, да-
ют начало гаплоидному мицелию, который является стерильным,т.е.
неспособным к плодоношению. Однако, гаплоидный мицелий базиди-
омицетов существует непродолжительно и тем или иным путем пере-
ходит в дикариотическую фазу. Дикариотческий мицелий характери-
зуется тем, что в нем ядра сближены попарно, но не сливаются,У
гомоталличных (таллус-вегетативный мицелий) базидиомицетов пе-
реход от гаплоидной к дикариотической стадии осуществляется в
пределах одного мицелия переходом ядра из одной клетки в другую
через анастомозы между гифами.
У гетероталличных базидиомицетов происходит слияние раз-
личных, но совместимых по половым типам("+" и "-") мицелиев..
Дикариотический мицелий может длительное время расти вегетатив-
но, слияние ядер дикариона, т.е. образование диплоидного ядра
происходит только в процессе формирования базидий.
Рис.53. Последователям- стадии формирования бази -
дий' и отделения базидиоспор.Т-двуядерная зигота;
2-слияние ядер;3-4-деление ядер;5-образование ба-
зидиоспор;5-7- отделение базидиоспор.
Слияние ядер в базидии сопровождается мейозом с образова-
нием 4-х гаплоидных ядер, предназначенных для включения в ба-
зидиоспоры (рис.53). Т.о. цикл развития базидиального гриба
замыкается (рис.54).
138
хована.
Дикариотическая стадия в развитии-базидиомицетов преобладает,
что отличает их от аскомицетов, для которых характерна преиму-
щественно гаплоидная стадия. Характерной особенностью мицелия
базидиомицетов является наличие пряжек.
По строению базидии подразделяются на одноклеточные холо-
базидии и многоклеточные фрагмобазидии
< Z
Рис.55. Базидии:1-колобазидии; 2-фрагмобазидии.
Плодовые тела у сравнительно низко организованных базиди-
омицетов представляют собой плоское сплетение гиф, на верхней
поверхности которого находятся базидии (например,грибы рода
Lierulius).
У более высоко организованных представителей плодовые те-
139
..а, сохраняя плоскую форму, отчасти приподнимаются от субстрата,
базидии формируются на нижней поверхности. Дальнейший шаг эволю-
ции - грибы-трутовики, которые имеют копытообразные плодовые те-
ла, боком приросшие к субстрату и базидии на нижней стороне. На-
ивысший тип развития представляют собой прямо стоящие плодовые
тела шляпных грибов, у которых базидии образуются на нижней сто-
роне шляпки.
Базидиомицеты, ведущие паразитический образ жизни, представ-
лены головневыми и ржавчинными грибами.
Головневые грибы (пор. Ustilaginalesi) паразитируют на различ-
ных злаках, кукурузе и других растениях, вызывая заболевание, на-
зываемое головней.
Ржавчинные грибы (пор. Ureainales ) - облигатные паразиты
на семенных растениях или папоротниках, поражающие листья и мо-
лодые побеги.
Несовершенные грибы ( Deuteromycetes )
Это большая обособленная группа многоклеточных (высших)
микроскопических грибов, у которых репродуктивное размножение
происходит только в виде бесполого (гаплоидного) конидиального
спороношения. Конидиальное размножение у несовершенных грибов
осуществляется с помощью спор (конидий), распологающихся на бо-
лее или менее дифференцированных ответвлениях мицелия - кониди-
еносцах. Морфологически группа дейтеромицетов очень разнообраз-
на, общим свойством ее представителей является отсутствие у них
репродуктивного полового пути размножения, сопровождающегося
возникновением специальных половых структур. Морфологически мно-
гие несовершенные грибы близки аскомицетам и базидиомицетам.
140
Так, например, в эту группу относят пенициллин аспергиллы, не
образующие плодовых тел.
Вегетативное размножение у дейтеромицетов осуществляется
с помощью - обрывков, кусочков мицелия, склероциев, шнуров, а
также посредством так называемых вегетативных спор (хламидо-
спор, оидий, гемм, бластоспор и артроспор), возникающих непос-
редственно из гиф мицелия.
Систематика несовершенных грибов основана на характере
конидиального спороношения. Конидии (экзоспоры) у дейтеромице-
тов могут быть самой разнообразной формы: неокрашенные и окра-
шенные, одноклеточные, двуклеточные, многоклеточные, сетчатые.
Существуют микроконидии и макроконидии, иногда те и другие
встречаются в пределах одного вида (рис.56).
Рис.56 Строение и форма
конидий дейтеромицетов.
Конидиеносцы несовершенных грибов также чрезвычайно разно-
образны, они могут быть различной длины, неразветвленные и вет-
вящиеся по монолодиальному, симподиаиьному и дихотомическому ти-
пу (рис.5^).
Ill
У многих групп дейтеромицетов конидиеносцы образуют скопления. -
коремии, ложа и пикниды (рис.58).
Коремией называют пучок тесно сближенных и спаянных (скле-
енных) вдоль конидиеносцев, отшнуровывающих каждый на своей вер-
хушке конидии.
Ложе состоит из плотного сплетения гиф, на поверхности ко-
торого тесным слоем располагаются конидиеносцы, большей частью
короткие и неветвящиеся. На верхней свободной поверхности своего
слоя они отделяют большей частью одиночные конидии.
Пикнидв представляет собой округлое образование, одетое об-
щей оболочкой с узким отверстием наверху. От оболочки внутрь по
радиусам отходят расположенные тесным слоем короткие конидиенос-
цы.
Рис.57. Типы ветвления конидиеносцев. I-монопод,иальный; 2-ко-
лос; 3-мутовка; 4-зонтик; 5-головка; 6-дихотомическиЦ; 7-сим-
подиальный(улиточный); 8-симподиальный; 9-дихазиальный; 10-
ридипидиальный.
142
Рис.58. I-коремии: 2-ложе; 3-пикнида
(по Л.Н.лурсанову).
I
тов.
На рис.59 и 60 показаны разные представители дейтеромице-
Рис.59. Несовершенные грибы (по Ы.А.Литвинову). I- Lacrosporium
(а-конидиеносцы,б,в-конидии);2-Stemphylium ;3- Alternaria;
4- Fusarium '> 5- Trycliothecium ; G-Cephalodiplosporium
7- Aureobasidium pullulans.
144
z
Рис.60. Несовершенные грибы. I-Byalostachybotrys ;
2- Trichoderma : а,б - общий вид конидиеносца,
в,д - детальное строение конидиеносца, фиалид,кони-
дий (по М.А.Литвинову).
145
2.4, МОРФОЛОГИЯ БАКТЕРИЙ
Вопросы для подготовки по теме
I .Характеристика основных форм бактерий, их микро- и
макроморфология.
2 .Процесс спорообразования у бактерий. Морфолого-физи-
ологические особенности бацилл.
3 .Способы передвижения прокариотических организмов.
Жгутики, их строение и расположение.
Бактерии по форме делятся на несколько групп: шарообраз-
ные - кокки, палочковидные - собственно бактерии и бациллы и
извитые - вибрионы, спириллы и спирохеты (рис.61).
Кокки - бактерии шаровидной формы, размер их в диаметре
1-2 мкм. Чаще всего они имеют округлую или овальную форму, но
могут быть ланцетовидные (пневмококки) и бобовидные (гоно- и
менингококки).
Кокки, так же как остальные бактерии, размножаются прос-
тым делением. В том случае, когда клетки после деления расхо-
дятся и располагаются отдельно, их называют микрококками.Если
после деления клетки не расходятся и располагаются по две, об-
разуются так называемые диплококки.Примером таких бактерий мо-
гут быть пневмококки, гонококки и менингококки.
Если кокки делятся в одной плоскости и, не расходясь после
деления, образуют цепочку, их называют стрептококками.Например,
Streptococcus lactis , Streptococcus haemolyticus.
Если деление клеток идет в двух взаимно перпендикулярных плос-
костях и"кокки располагаются по четыре клетки, их называют
тетракокками (бактерии рода Graffkya ).
146
pH, т.к. от этого зависят результаты окрашивания.
3. Для окрашивания предметное стекло помещают на стеклян-
ные палочки в раствор красителя, налитый в плоскую кювету или
чашку Петри. Продолжительность окрашивания 20 мин.
4. Промывают препарат дистиллированной водой до тех пор,
пока струи воды не станут прозрачными.и после просушивания мик-
роскопируют в иммерсионной системе. При этом ядра и ядерные
элементы имеют красно-фиолетовый цвет, а протоплазма - светло-
розовый.
Митохондрии и их выявление
Б протоплазме эукариотических микроорганизмов, так же как
в клетках растений и животных структурами, выполняющими энерге-
тические функции, являются митохондрии. Основной процесс, иду-
щий в митохондриях - окислительное фосфорилирование. Митохонд-
рии - крупные органоиды, имеющие сложное строение. Они состоят
из внешней и внутренней мембран, крист и матрикса. У прокариот
митохондрий, как таковых, нет, функции их выполняют цитоплазма-
тическая мембрана и мезосомы. Мезосомы - выросты внутреннего
слоя цитоплазматической мембраны.
Митохондрии обладают способностью избирательно адсорбиро-
вать краситель янус зеленый. На этом основан метод их выявле-
ния. Приготавливают взвесь клеток исследуемого микроорганизма
в воде или физиологическом растворе и добавляют несколько ка-
пель януса зеленого (в препарате "раздавленная капля"). Через
несколько минут при микроскопии можно наблюдать в клетках об-
ласти яркого сине-зеленого окрашивания. Фиксация януса зелено-
го митохондриями происходит в интервале pH от 3,3 до 6,4.
165
Цитохимические реакции на включения в микробной
клетке
В протоплазме микробных клеток кроме органоидов и ядерной
субстанции имеется целый ряд включений. Включения могут быть
неорганической и органической природы: сера,кальций,оксалаты,
"гранулы волютина,жир,гликоген,гранулеза и др.
Волютин в клетках микробов чаще всего содержится в виде
зерен диаметром около 0,3 мкм, иногда волютин находится в дис-
персном состоянии. У дрожжей и грибов волютин находится в ваку-
олях, у бактерий - в цитоплазме. Химическая природа волютина
может быть различной, но основное вещество - полиметафосфаты,
которые могут быть соединены с РНК и белком,иногда в зернах
волютина находят и липиды. Волютин имеет большое значение для
клеток как резерв фосфора. Он может расходоваться клеткой в
процессе деления, по-видимому, как энергетический материал,т.к.
полиметафосфаты содержат макроэргические' связи.
Для волютина характерно явление метахромазии: на этом осно-
вана окраска его метиленовым синим:фиксированный мазок окрашива-
ют метиленовым синим в течение 3-5 минут, краситель сливают,пре-
парат промывают,просушивают и микроскопируют в иммерсионной сис-
теме; зерна волютина выглядят красновато-фиолетовыми на фоне го-
лубой протоплазмы.
Волютин растворяется в слабых кислотах и щелочах,но после
окраски становится кислотоустойчивым, на этом свойстве основан
метод окраски Омелянского:фиксированный мазок окрашивают в те-
чение 30 сек. фуксином Циля,затем обесцвечивают 1% Н^О^ 30 сек.
и после промывания водой,высушивают и микроскопируют с иммерси-
ей. Зерна волютина - ярко красные,протоплазма - голубая.
168
Волютин встречается в клетках многих бактерий и большинст-
ва дрожжей и грибов.
Для окраски волютина используют молодые культуры; в клет-
ках ДрожжейСопсПаа mycoderma < бактерий Spirillum volutans,
Azotobacter chroococcum метахроматические зерна встречаются ча-
ще и в большем количестве,чем у других микроорганизмов. Эти
микробы можно использовать при выявлении волютина.
Гликоген - запасное питательное вещество, он представляет
собой полимер глюкозы,содержащий 1-4 и 1-6 связи между мо-
номерными звеньями. Этот полисахарид накапливается в клетках
при нормальном и избыточном питании и расходуется в случае не-
достаточного количества источника углерода в среде. Включения
гликогена чаще всего обнаруживаются в клетках дрожжей (напри-
мер, рода Saccharomyces ),и спорообразующих бактерий (Bacillus
subtilis,Clostridium pasteurianum). Гликоген может находиться
в клетках в виде "глыбок" и в растворенном виде, выявляют его
с помощью микрохимической реакции с концентрированным раство-
ром Люголя. На обезжиренное предметное стекло наносят каплю мик-
робной взвеси и добавляют каплю раствора Люголя. Препарат закры-
вают покровным стеклом ("раздавленная капля") и микроскопируют
в сухой системе микроскопа (объектив х8 и х40).Гликоген в виде
"глыбок" или диффузно распределенной в цитоплазме - красно-бу-
рого цвета. Кроме того,можно приготовить мазок исследуемой куль-
туры,зафиксировать его смесью Никифорова и обработать концентри-
рованным раствором Люголя - 2 минуты.Раствор Люголя сливают,пре-
парат промывают водой и микроскопируют в иммерсионной системе.
Гранулеза - крахмалоподобный неразветвленный полисахарид,
который также может содержаться в клетках микробов в виде гра-
169
нул. Некоторые бациллы образует гр.*нулёзу в период спорообразо-
<
вания (например, маслянокислые бактерии poflaGranulobacter ).
Выявляют включения гранулезы с помощью раствора Люголя; так же
как гликоген, с йодом гранулеза дает серо-синее окрашивание.
Жировые включения или липидные гранулы в клетках микро-
организмов могут быть представлены нейтральными жирами и поли-
оксимасляной кислотой. Накопление жировых включений определяет-
ся соотношением источников углерода и азота в среде.. Так поли-
оксимасляная кислота может образовываться из углеродсодержащих
соединений в отсутствие азота.
Жировые гранулы характерны для клеток бацилл, дрожжей, нит-
чатых грибов, особенно в период старения. У микобактерий тубер-
кулеза, липиды составляют БО'» сухого веса. Накопление нейтраль-
ных жиров в клетках характерно для эукариот, а поли-jj-оксимас-
ляная кислота откладывается в цитоплазме прокариотических мик-
роорганизмов.
Коэффициент преломления жиров и гранул, состоящих из нейт-
ральных жиров, отличаются от такового протоплазмы, поэтому в
препарате "раздавленная капля" жир виден в клетках в виде блес-
тящих ярких капелек. Препарат необходимо рассматривать в затем-
ненном поле зрения, опустив конденсор и закрыв диафрагму (объек-
тив х40). В качестве тест-культуры можно использовать 4-5 су-
точную культуру дрожжей Trichosporon pullulans.
Гранулы, состоящие из поли-р-оксимасляной кислоты, выявляют с
помощью специального растворимого в жире красителя - Судана III.
Непосредственно перед окраской приготавливают рабочий раствор
красителя, состоящий из 0,1 г Судана Ш и 20 мл 95^ этанола.
На обезжиренном предметном стекле в капле воды готовят суспен-
ITO
зию клеток исследуемой культуры и в нее вносят каплю красителя,
закрывают покровным стеклом и микроскопируют (объектив х40).
Цитоплазма клеток бесцветная или розоватая,капли жира окрашены
в красно-оранжевый цвет.
2.7. ПОЛУЧЕНИЕ СФЕРОПЛАСТОВ И ПРОТОПЛАСТОВ
Вопросы для подготовки по теме
I. Протопласты и сферопласты,их свойства.
2. Микоплазмы и L -формы бактерий.
3. Методы получения протопластов и сферопластов.
Если у микробных клеток полностью удалить клеточную стенку,
образуются особые структуры,называемые протопластами. Если кле-
точная стенка разрушена частично, или нарушен ее синтез,то гово-
рят об образовании сферопласта. У сферопластов можно обнару-
жить материал клеточной стенки (мурамовую и диаминопимелино-
вую кислоты), сферопласты в отличие от протопластов чувст-
вительны к фагам,присутствие материала клеточной стенки можно
обнаружить также и серологическими методами. При микроскопирова-
нии сферопласты и протопласты выглядят одинаково, как круп-
ные сферические образования. Протопласты и сферопласты грам-
положительных микробов при окраске по Граму становятся грамнега-
тивными.
Для.разрушения клеточной стенки обычно используют лизоцим
(фермент - мураминидазу).пищеварительный сок яблочной улитки
\о/”л±цпредставляющий собой сложный комплекс ферментов,
и некоторые микробные ферменты, например, эндо- р - (1-3)
глюканазу. Кроме того, протопласты можно получить с помощью
174
пенициллина, который нарушает процесс синтеза элементов клеточ-
ной стенки микробов.
Пенициллин действует только на молодую культуру микроорга-
низмов, у которых происходит синтез структурных элементов клет-
ки.
Обычно при применении лизоцима и пенициллина из грамполо-
жительных микроорганизмов образуются протопласты, а из грамот-
рицательных - сферопласты, т.к. в оболочке грамотрицательных
микробов значительно меньше мурамовой кислоты, на которую спе-
цифически воздействуют эти вещества. Протопласты и сферопласты
имеют цитоплазматическую мембрану.У протопластов сохраняются
такие процессы как рост,синтез белка, дыхание, но они не спо-
собны к делению, т.к. не синтезируют компонентов клеточной
стенки. Протопласты очень неустойчивые структуры, они чувстви-
тельны к осмотическому давлению, механическим воздействиям,
аэрации и т.д. Сферопласты, в отличии от протопластов, иногда
способны к синтезу утраченных элементов клеточной стенки, так
называемой регенерации или реверсии.
Цель работы: получить сферопласты Proteus vulgaris.
Материалы: культура р.vulgaris на МПА; питательные среды-
МПБ, среда с пенициллином в пробирках по 5 мл (смГПриложение”),
изотоническая среда - МПБ с 5% сахарозы; краска метиленовая
синяя 1:40.
Постановка опыта. Приготовить взвесь культуры в МПБ по
500 млн стандарту. Выращивать 5 час при 37°С. Микроскопировать,
приготовив мазок и окрасив его по Граму, обратить внимание на
особенности морфологии бактерии (грамотрицательная палочка).
Внести Т мл 5-часовой бульонной культуры в среду с пеницилли-
172
ном, выращивать 18 час при 37°С. Микроскопировать полученный
материал в препарате "раздавленная капля", окрасив препарат ме
тиленовой синью (смешать каплю культуры с каплей красителя).
Сферопласты круглой формы, значительно крупнее нормальных кле-
ток протея, синего цвета, т.к. они из-за отсутствия клеточной
стенки лучше воспринимают краситель.
Посеять сферопласты на изотоническую среду, выращивать
18 час при 37°С. Наблюдать реверсию сферопластов в нормальные
клетки, окрасив мазок по Граму.
Литература
I. Ел и н о в Н.П. Общие закономерности строения и развития
микробов продуцентов биологически активных веществ. Л.,1977
2. Кашкин П.Н. , Е‘л и н о в Н.П., К а ш к и н К.П. Мик-
робиология. 1970.
3. М о т а в к и наИ.С. .Артемкин В.Д. Атлас по микро-
биологии и вирусологии. М.,1976.
4. СтейниерР., ЭдельбергЭ., Ингрэм Дж.
Мир микробов. М.,1979, т.1,2,3.
5. Ш л е ге л ь Г. Общая микробиология. 1972.
т73
3. МЕТОДЫ СТЕРИЛИЗАЦИИ
Вопросы для подготовки по теме.
I. Понятие об асептике,антисептике,дезинфекции и сте-
рилизации.
2. Методы стерилизации. Оборудование,режимы и объекты {
стерилизации фламбированием,горячим воздухом,кипячением, те-
кучим паром.
3. Принцип дробной стерилизации,тиндализация. j
4. Стерилизация паром под давлением. Устройство автоклава,
порядок работы на нем, режимы и объекты стерилизации. Методы i
контроля работы автоклава. Требования техники безопасности.
5. Особенности пастеризации.
6. Стерилизация фильтрованием. Бактериальные фильтры.
7. Химическая и физико-химическая стерилизация.
8. Стерилизация облучением. Оборудование и объекты
стерилизации.
Большое значение в микробиологии имеют методы уничтожения,
устранения и подавления роста микроорганизмов.
Процесс полного уничтожения в объекте всех жизнеспособных
форм патогенных и непатогенных микроорганизмов и их спор назы- S
вают стерилизацией. t
а
Уничтожение в объекте или окружающей среде возбудителей
инфекционных заболеваний (патогенных микроорганизмов) назы-
вают дезинфекцией. Она направлена на прерывание передачи ин-
фекционных заболеваний. Дезинфекцию обычно осуществляют с по-
мощью химических соединений, например, карболовой кислоты (фе-
нола), формалина,хлора,йода,сулемы и других веществ. Иногда
I
174
процесс дезинфекции может привести к стерилизации объекта.
В медицинской и микробиологической практике широко приме-
няется термин антисептика (septikus - гнилостный), под которым
подразумевается использование химических веществ, убивающих или
подавляющих рост болезнетворных и других микробов, находящихся
в контакте с макроорганизмом. В качестве таких веществ Н.И.Пиро-
гов (1865) применял хлорную воду,азотнокислое серебро,йод,
а Д.Листер (1867) фенол. В настоящее время для этих целей использу-
ют много других соединений: поверхностно-активные вещества,йодо-
форм и др. Такие вещества называют антисептиками. Они не облада-
ют специфичностью действия и эффективны против бактерий, вирусов,
грибов и протозойных организмов.
В 1897 г. Э.Бергман ввел в практику хирургии асептику.
В точном переводе это слово означает отсутствие патогенных
микроорганизмов, но в настоящее время термин асептика применя-
ется для обозначения комплекса мероприятий,направленных на
то, чтобы не допустить появления каких-либо нежелательных
микроорганизмов, например, на операционном поле, в микробиоло-
гическом боксе или в цехе,выпускающем стерильные лекарствен-
ные формы. Работа микробиологов и хирургов проводится с приме-
нением методов асептики. Обычно созданию асептических условий
работы предшествует дезинфекция помещения, стерилизация исполь-
зуемых инструментов и материалов.
Метопы стеоилизапии.
Их можно подразделить на три группы: физические,химические
и физико-химические.
К физическим способам стерилизации относятся: стерилизация
175
высокой температурой,ультрафиолетовыми лучами, радиоактивными
излучениями,ультразвуком, "холодная" стерилизация фильтровани-
ем через специальные бактериальные фильтр!.
Одним из самых надежных и наиболее распространенных ме-
тодов физической стерилизации является стерилизался высокой
температурой. Она проводится прокаливанием предметов на пламе-
ни горелки (фламбирование), кипячением, сухим жаром (горячим
воздухом) «парой под давлением и текучим паром.
Прокаливание на пламени - самый быстрый и надежный способ сте-
рилизации благодаря высокой температуре пламени горелки.
На рис. 71 приведено примерное распределение температур в раз-
личных частях пламени.
Рис.71. Схема пламени газо-
вой горелки. A-область пла-
мени, в которой горение не
происходит (смесь газа с
воздухом);В-область восстано-
вительного пламени (сгорание
газа происходит неполностьв-
недостаток кислорода;содер-
жатся раскаленные углеродис-
тые продукты распада молекул
газ а);0-область окислитель-
ного пламени (полное сгора-
ние -.избыток кислорода);
1-300°C; 2-350%: 3^20%:п
4-1540%; 5-1560®С; 6-I550°C;
7-I54O°C4
176
Этим методом стерилизуют бактериологические петли,пинцеты,
предметные стекла и некоторые мелкие инструменты (иглы,крючки,
лопаточки).
Для стерилизации обрабатываемый предмет несколько раз про-
водят через пламя горелки. При прокаливании происходит сгорание
микробов и их спор. Следует,однако,иметь в виду,что прокали-
вание режущих инструментов приводит к их порче, а стеклянные
предметы часто лопаются или плавятся, что ограничивает возмож-
ность этого метода.
Стерилизация сухим жаром (или горячим воздухом) проводится
в специальных печах Пастера (рис.72) или сушильных шкафах
(рис.73). Печь Пастера представляет собой металлический ящик
с двойными стенками, с хорошей асбестовой или стекловатной теп-
лоизоляцией, электрообогревателем и терморегулятором.
Сушильный шкаф состоит из кор-
пуса с подставкой I,рабочей ка-
меры 15,двери 5,блока управле-
ния 20 и терморегулятора 21.
Корпус с подставкой выполнены
из тонкослойного металла и
служат для размещения всех ос-
новных узлов и деталей шкафа.
В верхней части корпуса уста-
новлен контрольный термометр
Рис.72. Печь Пастера. 4,защищенный оправой 3. В
основании оправы имеются от-
верстия для вентиляции,перек-
рываемые поворотным кольцом 2.
177
На передней стенке подставки расположены индикатор 7,тумблер 9,
предохранители 8, ручка 10. Здесь же (на передней стенке) нане-
сена шкала,служащая для ориентировки при настройке шкафа на
нужную температуру.
Рис.73. Шкаф сушильный электрический круглый.
1-корпус с подставкой; 2-кольцо вентиляционное;3-оправа
термометра; 4-термометр; 5-дверь; 6-защелка; 7-индикатор;
8-предохранитель; 9-тумблер; 10-ручка; II-вилка штепсель-
ная; 12-провод; 13-вата стеклянная; 14-трубка нижняя;
15-камера рабочая; 16-17 - ящики;18-полка; 19- экран;
20-блок управления; 21-терморегулятор; 22-дно подставки;
23-дно; 24-нагревательные элементы; a-место установки
пломбы.
В процессе работы при отрегулированном терморегуляторе
можно установить,какой отметке шкалы соответствует та или
иная температура в рабочей камере.
Индикатор 7 сигнализирует о работе шкафа: он включается
при его нагреве и отключается при охлаждении.
178
Рабочая камера представляет собой цилиндрический сосуд, вы-
полненный из тонколистового металла с плоским дном. Внутри каме-
ры, на специальных направляющих уголках расположены: полка 18 и
два ящика с перегородками нижний 16 и верхний 17, в которые по-
мещаются для сушки посуда и инструменты. Камера обогревается ос-
новным нагревательным элементом 24,намотанным по наружной по-
верхности камеры на изолирующей прокладке из асбестовой бумаги.
На задней стенке камер!,расположен дополнительный нагрева-
тельный элемент для нагрева датчика терморегулятора. Благодаря
последовательному соединению,основной и дополнительный нагре-
вательный элементы находятся в одном токовом режиме,что необ-
ходимо для синхронизации обогрева датчика и камеры.
Действие механической части терморегулятора основано на
использовании различия коэффициентов линейного расширения двух
металлов - алюминия и стали. Регулируемая температура сушильно-
го шкафа от 40° до 200°С.
Он может быть использован для стерилизации стеклянных, ме-
таллических и фарфоровых предметов (флаконы,колбы,цилиндры,
инструменты,ступки и др.) предварительно завернутых в бумагу
для сохранения стерильности после стерилизации. Кроме того в
сушильном шкафу можно стерилизовать термостойкие порошкообраз-
ные лекарственные вещества (тальк,белая глина,окись цинка и др.)
а также минеральные и растительные масла,жиры, ланолин, вазе-
лин, воск.
Режимы стерилизации некоторых объектов в сушильном шкафу
приведены в таблице I.
179
Таблица I.
Режимы стерилизации в сушильном шкафу
Объекты стерилизации
Стеклянные,ме- таллические и фарфоровые предметы Термостойкие порошко- образные лекарствен- ные вещества Минеральные и расти- тельные масла,жиры, ланолин,вазелин,воск
темпера- время тураиС мин. вес об- темпера- время разца тураиС мин. вес об- темпера- время разца тураиС мин.
180° 20 до 25 180° 30 200° до 100 180° 30
200° 10 26-100 180° 40 200° 20 101-500 180° 40 200° 20
101-200 180° 60 200° 30' -
Кипячение - простейший способ стерилизации игл,шприцев,
хирургических инструментов. Для этого можно применять подходя-
щей формы и размеров кастрюлю,подожив на ее дно слой ваты
или марли. Гораздо удобнее пользоваться специальным стерилиза-
тором для инструментов- (рис.74), который состоит из прямоуголь-
ного металлического корпуса,металлической сетки и крышки. Наг-
рев осуществляется газом или электричеством.
Стерилизуемые предметы кладут на сетку,опускают ее в ки-
пящую воду корпуса и закрывают стерилизатор крышкой. Стерили-
зацию проводят в течение 20-30 минут. После окончания стерили-
зации выключают нагрев стерилизатора. Вынимают сетку с инстру-
180
ментами из корпуса, вода при этом стекает, а предметы на сетке
быстро высыхают; после чего они готовы к работе.
Рис.74. Стерилизатор для
инструментов. 1-корпус;
2-сетка; 3-крышка; 4-га-
зовая горелка.
Добавление к воде 1-2% соды значительно повышает стерилизу-
ющее действие кипячения и устраняет жесткость воды, что пре-
дохраняет металлические предметы от ржавчины после кипячения.
Этот метод не обеспечивает полной стерилизации, так как споры
некоторых бацилл выдерживают кипячение в течение нескольких
часов.
Стерилизация текучим паром применяется в тех случаях, ког-
да стерилизуемый материал изменяется при температуре выше 100°С.
Текучим паром стерилизуют растворы,являющиеся хорошей пи-
тательной средой для микроорганизмов (они могут содержать бел-
ки ,углеводы,молоко,витамины и т.д.).
Для стерилизации текучим паром используют автоклав (описание
см. ниже) с незакрепленной крышкой и открытым паровыпускным
краном или специальный аппарат Коха (рис.75).
Аппарат Коха представляет собой металлический цилиндр на
181
дно которого наливается вода; над водой на специальные выступы
цилиндрического корпуса кладутся сетки,на которые устанавлива-
ется стерилизуемый материал. Сверху аппарат закрывается крыш-
кой с отверстиями через которые пар свободно выходит наружу.
Рис.75. Аппарат Коха.
I-металлический корпус;
2-теплоизоляция;3-водо-
указательная колонка;
4-металлическая сетка;
5-крышка;6-газовая го-
релка (нагрев может быть
и электрический).,
Внешняя поверхность цилиндра покрыта теплоизолирующим матери-
алом. Однократное нагревание стерилизуемого материала прово-
дится при 100°С 30-60 мин, считая с момента начала кипения
воды. При этом погибают только вегетативные формы микробов,а
споровые сохраняют жизнеспособность. Для уничтожения споровых
форм прибегают к дробной стерилизации, применяющейся в двух
разновидностях:
I) Нагревают стерилизуемый материал текучим паром в аппа-
рате Коха или автоклаве при Ю0°С 3 раза по 30 мин через каж-
162
j- дые 24 часа с выдерживанием стерилизуемых объектов между стери-
лизациями при температуре 18-37°.
2) Нагревают стерилизуемый материал в специальных водяных
терморегулируемых банях (рис.76) при 60-65°С 5 раз по 60 минут
или 70-80°С 3 раза через каждые 24 часа, с выдерживанием стери-
лизуемых объектов между стерилизациями при температуре 18-37°С.
За это время споровые формы микробов прорастают и превращаются
F в вегетативные,которые погибают при повторных прогревах.
8
Л
JJ
т
Рис.76. Водяная тер-
морегулируемая баня.
I-ванна;2-корпус;
3-крышка; 4-контакт-
ный термометр;5-конт--
рольный угловой тер-
мометро-литая станина;
7-выключатель сети;
8-сигнальная лампа.
Такой вид дробной стерилизации называют тиндализалией
и применяют ее к объектам,содержащим вещества,легко разруша-
ющиеся и денатурирующиеся при температуре Ю0°С (питатель-
ные среды,содержащие белки,витамины,некоторые глазные
капли и т.д.).
183
Недостаток дробной стерилизации - возможность образования
спор вегетативными клетками,образовавшимися из проросших спор.
Водяная баня (рис.76) , в которой можно проводить дробную
стерилизацию, представляет собой резервуар для вода, оборудо-
ванный электронагревательным элементом и регулятором темпера-
туры.
Ванна, в которую заливается вода и помещаются колбы или
пробирки,выполнена из нержавеющей стали и заключена в прямо-
угольный металлический кожух,образующий вместе с ней корпус
аппарата. Для уменьшения тепловых потерь между кожухом и ван-
ной проложена губчатая резина.
Контактный термометр,при помощи,, которого устанавливается
и поддерживается заданная температура,помещен в специальную,
закрытую кожухом трубу, сообщающуюся с ванной.
Контроль температуры воды в ванне производится угловым
ртутным термометром со шкалой от 0°С до Ю0°С, защищенным оп-
равой. Оправа и термометр закрепляются в горизонтальном поло-
жении на передней стенке кожуха. Сверху ванна закрывается
крышкой. Для уплотнения на крышке и корпусе имеются резиновые
прокладки.Крышка также как и корпус,имеет теплоизоляцию из
губчатой резины. Вода сливается из ванны через кран,оканчивающий-
ся штуцером. Выходное отверстие в ванне прикрыто фильтроваль-
ной сеткой.
Корпус аппарата четырьмя болтами прикрепляется к литой
станине, в ней же находится шасси, на котором смонтированы
трансформатор,селеновый выпрямитель и два реле. На передней
наклонной стенке станины находится выключатель сети и сигналь-
ная лампа.
1Ь4
Пастеризация - однократное прогревание материала в течение
I часа при температуре 67-70° или 5-10. мин при температуре
75-80°0. После прогревания материал быстро охлаждают до Ю°С и
сохраняют при такой температуре. Этот метод направлен на
уничтожение только вегетативных форм,преимущественно патоген-
ных, микробов. Споровые же формы и многие сапрофитные микроор-
ганизмы сохраняются. Этим методом обрабатывают молоко,вино,пиво
и другие продукты. При пастеризации полностью сохраняются витами-
ны и вкусовые качества продуктов. Пастеризованные продукты дли-
тельному хранению не подлежат.
Стерилизация паром под давлением
Стерилизация насыщенным паром под давлением - наиболее на-
дежный и чаще всего применяемый способ стерилизации. Он основан
на нагревании материала насыщенным водяным паром при давлении
выше атмосферного. Известно,что температура пара возрастает при
повышении давления (табл.2).
оак.-iidd
Таблица 2.
Температура насыщенного пара при различных давлениях
Давление Температура °C
Нормальное Добавочное
атм н/м^Сили Па) х Ю5 атм н/м^Сили Па) х I05
1.0 1,01325 — — 100
1.0 1,01325 0,5 0,50662 112
1.0 1,01325 1,0 1,01325 121
1.0 1,01325 1,5 1,61987 127
1,0 1,01325 2,0 2,02650 134
185
Совместное действие высокой температуры и пара обеспечива-
ет особую эффективность данного способа. При этом погибают как
вегетативные клетки, так и споры микроорганизмов. Стерилизацию
паром под давлением проводят в специальных приборах - автокла-
вах. Автоклавы бывают различной конструкции (рис.77), но прин-
ципиальное их устройство следующее (рис.78). Это металлический
двухстенный котел, способный выдерживать высокое давление. Внут-
ренняя часть котла является стерилизационной.камерой (22), в ко-
торую помещают подлежащие стерилизации материалы и инструменты.
Стерилизационная камера находится внутри паровой камеры (21).
ПароЬая камера имеет опорное кольцо (18), в пазу которого поме-
щена резиновая прокладка (19).спускной кран >32) для выпуска
воздуха в начале нагрева стерилизатора и выпуска пара по окон-
чании стерилизации; манометр (15) с соединительной муфтой и си-
фонной трубкой (16). К опорному кольцу (18) приварена петля, к
которой на шарнире приклеплена крышка (23). Диаметрально проти-
воположно приварена еще одна петля для шарнирного крепления
винта корпуса,прижима (24),которым прижимается крышка (23) к
опорному кольцу (18), создавая с помощью резиновой прокладки
(19) необходимую герметичность паровой камеры (21).
Пар поступает в паровую камеру (21) из парогенератора (28)
по патрубку (9). В процессе работы автоклава образующийся кон-
денсат через этот же патрубок сливается в парогенератор (28).
Для прекращения поступления пара из парогенератора в паровую
камеру по окончании стерилизации на патрубке установлен вентиль
(25). Камера крепится на постаменте (1),где в нижней части
его находится парогенератор, имеющий водоуказательную колонку
(29) с воронкой (27) для залива воды в парогенератор,электро-
186
контактный манометр (8) с трехходовым краном (7) и сифонной
трубкой (6), предохранительный клапан (26).
Рис.77. Автоклавы. А-вертикальный.
Б-горизонтаяьный.
В крышку парогенератора вмонтированы электронагреватели
(4). Снизу парогенератор имеет патрубок с вентилем (3) для
питания водой непосредственно от водопровода. Для уменьшения
тепловых потерь и защиты обслуживающего персонала от ожогов
паровая камера и парогенератор снабжены кожухами. На цифер-
блате манометра (15) черезотметку 2 кгс/см^, соответствующую
максимальному давлению,допускаемому в стерилизаторе,прове-
дена красная черта. Предохранительный клапан (26) отрегулиро-
ван на давление пара 2 + 0,2 кгс/см^. Включение автоклава осу-
ществляется нажатием кнопки выключателя (31),при этом загора-
ется сигнальная лампа ЛИ "сеть" (13). При наличии достаточно-
го количества воды в парогенераторе включаются электронагрева-
187
•I
188
тели (4).
Автоклав имеет устройство для автоматического поддержания
рабочего давления. Чувствительным элементом этого устройства
является электроконтактный манометр (8), стрелки подвижных кон-
тактов которого устанавливаются на деления шкалы,соответству-
ющие пределам допустимого изменения рабочего давления. Для за-
щиты электронагревателей от перегорания, в случае понижения
уровня вода,ниже минимального,предусмотрено специальное уст-
ройство , автоматически отключающее электронагреватели. Чувстви-
тельным элементом этого устройства является датчик уровня воды
ДУ (33).
Понижение уровня воды ниже минимального сигнализируется
включением сигнальной лампы ЛС2 "Воды нет" (12). Для подключе-
ния защитного заземления на электрощите автоклава предусмотрен
специальный болт (10).
Порядок работы на автоклаве
I. Через воронку (27) заполняют парогенератор (28) водой
до уровня выше нижней отметки на кожухе (29) водоукаэательного
стекла.
2. Включают выключатель (31), при этом загорается сигналь-
ная лампа (13) "сеть".
3. При достижении давления пара в парогенераторе,соответ-
ствующего режиму стерилизации,открывают спускной кран (32),
затем вентиль (25) на 0,5-1,5 оборота. При этом давление
пара в стерилизационной камере (22) должно быть 0,1-0,2 кгс/см^.
[Здесь следует отметить,что давление,измеряемое маномет-
ром в стерилизационной камере}(т.е. показания манометра) являет-
189
ся дополнительным к нормальному и выражается в технических ат-
мосферах (ат или кгс/см^). Техническая атмосфера несколько от-
личается от физической, в связи с чем в дальнейшем при указа-
нии режимов стерилизации дополнительные давления и соответст-
вующие им температуры будут численно отличаться от данных, при-
веденных в таблице 2J.
Появление через отверстие крана непрерывной струи пара
считать началом продувки (вытеснение воздуха . из стерилизаци-
онной камеры и стерилизационных коробок),которая продолжается
в течение 15 мин. Необходимо,чтобы из автоклава был удален
весь воздух,так как губительное действие насыщенного перегре-
того пара на бактерии значительно сильнее, чем его смеси с воз-
духом. Это связано с тем,что при одном и том же давлении тем-
пература чистого пара выше температур! смеси пара и воздуха.
4. По окончании продувки закрывают кран (32), открывают
полностью вентиль (25) и доводят давление в стерилизационной
камере, до показания,соответствующего режиму стерилизации.
5. При достижении заданного рабочего давления, которое
совпадает с первым автоматическим отключением электронагрева-
телей, отмечают время начала стерилизации.
Режимы стерилизации насыщенным паром под давлением, реко-
мендуемые общей статьей "Стерилизация", подготовленной для
XI изд. Государственной Фармакопеи СССР следующие: II9-I2I0
(дополнительное давление X»0-1,1 ат) в течение 8-15 минут, в
некоторых случаях до 120 минут или при 110°(дополнительное
давление 0,5 ат) в течение 30-60 минут.
6. По окончании времени стерилизации закрывают вентиль
(25).выключают электронагреватели и выпускают пар из паровой
190
камеры через спускной кран (32) в атмосферу или сосуд с водой
в течение 15 мин. Так можно поступить только в том случае, ког-
да среди стерилизуемых объектов нет водных растворов. Если сте-
рилизации подвергали растворы, жидкие питательные среды, то
кран (32) открывать нельзя до тех пор пока давление в паровой
камере не упадет до 0. Преждевременное открывание крана недо-
пустимо, так как перегретые среды при резком снижении давления
сразу же бурно закипают, смачивают и даже иногда выталкивают
ватные пробки. Это может нарушить впоследствии стерильность
материала.
7. После того как давление в паровой камере (21) по ма-
нометру (15) упадет до 0 и из шланга спускного крана прекратит-
ся парение, открывают крышку камеры автоклава и приступают к
выгрузке стерилизуемого материала.
8. При проведении последующих стерилизаций необходимо
иметь в виду:
а) если уровень воды выше нижней отметки уровня на кожу-
хе водоуказательного стекла, то воду в парогенератор можно не
добавлять;
б) если уровень воды ниже нижней отметки, то следует до-
бавить воды.
Стеклянные, металлические и фарфоровые предметы стерили-
зуют в автоклаве при II9-I2T0 (дополнительное давление 1,0-1,I
ат) в течение 20-40 минут; перевязочные материалы (вата,алиг-
нин, марля), лигатурный шелк, белье, фильтровальную бумагу,
корковые и резиновые пробки, пергамент, изделия из резины, цел-
люлозы, древесины стерилизуют при H9-I2I0 ''дополнительное дав-
ление I,0-1,1 ат) в течение 20-30 минут; минеральные, расти-
19 Т
тельные масла, жиры стерилизуют в автоклаве при тех же условиях
в течение 120 минут в герметически закрытых сосудах. Раствор!
для инъекций, глазные капли,дистиллированную воду и воду для
инъекций стерилизуют насыщенным паром при 119-121° ( дополни-
тельное давление I,0-1,1 ат), при П0°(дополнительное давление
0,5 ат) или текучим паром при 100°(см. таблицу 3).
Таблица 3.
Режимы стерилизации в автоклаве.
Объем образца в мл Температура Время в минутах
до 100 119-121° 100° или 110° 8 30
101-500 119-121° 100° или 110° 8-12 45
501-1000 119-121° 100° или 110° 12-15 60
Для контроля действия автоклава пользуются различными ве-
ществами, имеющими определенную точку плавления,например,бензо-
нафтолом - температура плавления 110°;антипирином - 113°;резор-
цином и серой - 119° и бензойной кислотой - 120°. Пр! испыта-
нии в стеклянную трубочку,длиной 5-6 см,запаянную с одного кон-
ца, насыпают одно из перечисленных выше веществ,прибавляют немно-
го сухой анилиновой краски (фуксин,сафранин,бриллиантгрюн и др.)
и трубочку запаивают. Трубочку с порошком помещают в автоклав
между стерилизуемыми предметами. Если температура в автоклаве
достаточна,вещество расплавится и ярко окрасится в цвет,соответ-
ствующий взятой краске.
Контроль работы автоклава можно осуществлять и с помощью
192
бактериологических тестов. Биотесты изготавливаются бактериоло-
гическими лабораториями СЭС или лабораториями дезинфицирующих
станций из образцов почвы, содержащей споры сапрофитов, выдер-
живающие в течение 3-5 мин. воздействие пара с температурой
120°С. Не менее трех образцов почвы, завернутых в пергаментную,
а затем в фильтровальную бумагу, вместе с максимальным термо-
метром закладывают в коробки со стерилизуемым материалом. Вне
I коробок в верхнюю и нижнюю части стерилизационной камеры кла-
дут еще две биопробы. По окончании работы автоклава пробы зем-
ли вместе с контрольными (непрогретыми) образцами направляют
в бактериологическую лабораторию СЭС на исследование. При соб-
людении правил асептики каждую пробу засевают в 20 мл пита-
тельной среды, (мясо-пептонный сахарный бульон и полужидкий
мясо-пептонный агар). При посеве наружную обертку развертыва-
ют, стерильными ножницами срезают угол пакета и содержащуюся
в нем землю высыпают над пламенем горелки в пробирки с пита-
тельными средами. Посевы инкубируют в термостате 7 суток при
37°С. При появлении микробного роста из первичного посева про-
изводят высев на мясо-пептонный агар для выявления споровой
микрофлоры. Рост вегетативной формы (сарцины,кокки) расцени-
вается как загрязнение питательной среды в момент посева вс-
ледствие нарушения правил асептики. При наличии в питательных
средах роста спорообразующих микроорганизмов бактериологичес-
| кий контроль повторяют и производят проверку технического
состояния автоклава.
В приложении >1 "Наставлений и нормативных материалов
по аптечному делу" (Выпуск 1У,1979,М) приведены правила рабо-
ты на паровых стерилизаторах (автоклавах).
193
Отметим из них лишь те, которые являются дополнением к
правилам работы на автоклаве, изложенным ранее.
- Установка, эксплуатация и содержание автоклавов должны
осуществляться в строгом соответствии с требованиями Инструк-
ции по их эксплуатации, приложенной заводом изготовителем
и Правил техники безопасности при работе на автоклавах^утвер-
жденных президиумом ЦК профсоюзов медицинских работников и
Министерством здравоохранения СССР 30 марта Т971г.
- Обслуживание автоклавов поручается только лицам, достиг-
нувшим 18-летнего возраста, прошедшим предварительно медицинс-
кий осмотр, курсовоеfобучение, аттестацию в квалификационной
комиссии и инструктаж по безопасному обслуживанию автоклавов.
- Перед началом работы необходимо проверить состояние ав-
токлава и контрольно-измерительных приборов. При обнаружении
неисправностей (трещина в водоуказательном стекле,крышке или
корпусе автоклава, разрыв прокладки, смещение стрелки наномет-
ра й нуля и т'.д.) стерилизовать в автоклаве запрещается. Сот-
рудник, работающий с автоклавом, обязан немедленно сообщить
об этом управляющему аптекой или ответственному за эксплуата-
цию автоклавов, чтобы принять меры и устранить выявленные не-
достатки .
- При стерилизации в автоклаве текучим паром стрелки
контактного манометра целесообразно установить на 0,1 ати,
чтобы иметь возможность по звуковому сигналу отключения авток-
лава (щелканье) контролировать начало кипения воды в парогене-
раторе .
- Если требуется просушить вспомогательный простерилизо-
ванный материал (вату,фильтровальную бумагу и другие предметы^
194
поглощающие влагу), необходимо после выпуска пара и конденсата
из стерилизационной камеры, не открывай крышки автоклава, пус-
тить в действие водоструйный насос. Для этого сначала открыва-
ют у водоструйного насоса вентиль на трубе для подачи водопро-
водной воды, а затем вентиль (32) для отсасывания воздуха.
Сушить следует при вакууме не менее - 0,5 ати (кгс/см^)
4-10 мин.
- После окончания просушивания необходимо сначала закрыть
вентиль для отсасывания воздуха, а затем вентиль для подачи
воды из водопровода, открыть вентиль, соединяющий стерилиза-
ционную камеру с атмосферой и выгрузить просушенный материал.
- Заполнять воздухом стерилизационную камеру после просу-
шивания материала следует через фильтр со стерильной ватой.
Стерилизация фильтрованием
Стерилизация фильтрованием применяется в тех случаях, ког-
да субстраты не выдерживают нагревания, в частности для сред,
содержащих белки, для сывороток, некоторых антибиотиков, вита-
минов, летучих веществ, например, некоторых углеводородов.
Способ заключается в фильтровании жидкости через специальные
фильтры, имеющие мелкопористые перегородки и поэтому задержи-
вающие клетки микроорганизмов. Причем здесь имеет место не
только механическая задержка, но и адсорбция микроорганизмов
на стенках (поверхностях); ограничивающих поры, вследствие того,
что большинство микроорганизмов в водных суспензиях несет на
своей поверхности отрицательный заряд, а фильтры изготавлива-
ются из положительно заряженных материалов.
Как правило, бактериальные фильтры пропускают вирусы и
195
бактериофаг.
В настоящее время для стерилизации наиболее широко исполь-
зуются два типа фильтров: мембранные фильтры и фильтры Зейтца.
Мембранные фильтры готовят из коллодия, ацетата целлюлозы
и других материалов. Они представляют собой диски, напоминаю-
щие бумажные, толщиной около 0,1 мм. Диаметр мембранных фильт-
ров может быть разным. Отечественная промышленность выпускает
мембранные фильтры диаметром 35 мм. В зависимости от размеров
пор они обозначаются № 1,2,3,4,5 (см. таблицу 4).
Таблица 4.
Характеристика мембранных фильтров
Номер фильтра Средний диаметр пор, мкм
I 0,35
2 0,5
3 0,7
4, 0,9
5 1,2
Фильтры Зейтца - это плотные диски, изготовленные из смеси
асбеста с целлюлозой. Отечественные асбестовые фильтры обознача-
ются марками Ф^ и Стерилизующими являются фильтры марки ОФ.
Помятые асбестовые пластинки, а также пластинки с надломами и
трещинами для работы непригодны. Приборы для стерилизации фильт-
рованием изображены на рис. 79.
Кроме того, для стерилизации применяются фильтры, изготов-
ленные из каолина с примесью кварцевого песка ("свечи" Шамбер-
лана), из инфузорной земли ("свечи" Бер£ефельда,рис.8о)и из
других материалов.
Г96
Рис.79. Прибор* для стерили-
зации фильтрованием А-со
стеклянным держателем; Б-с
металлическим держателем.
Рис.80. Свеча
Беркефельда.
Фильтры с обозначением L наиболее пористые. Они про-
пускают все бактерии. Свечи l^bls и ъ2 задерживают клетки толь-
ко крупных бактерий. Свечи задерживают споры столбняка и
палочку дифтерии. Затем в порядке уменьшения размеров пор све-
чи обозначаются оть5 до ь13. Свечи, предназначенные, главным
образом, для фильтрации воды, обозначаются Р и В , причем,
по своей пористости свечи F соответствуют , а свечи В - L?
Форма свеч Шамберлана может быть разной. Свечи Беркефельда
имеют обозначения w , и и v , что соответствует диаметрам
3-4, 5-7 и 8-12 мкм.
Работа с бактериальными фильтрами осуществляется следую-
щим образом. Фильтр должен быть закреплен в специальном держа-
теле, который вставлен в приемник фильтрата. Обычно приемником
является колба Бунзена. Для мембранных фильтров имеются много-
численные держатели, приспособленные для фильтрования различ-
197
ных объемов жидкостей. Есть, например, держатель, изготовлен-
ный целиком из стекла, в котором в качестве опоры фильтра ис-
пользуется крупнопористый стеклянный диск. Есть металлические
держатели. Держатели для фильтров Зейтца изготавливает в боль-
шинстве случаев из нержавеющей стали. Асбестовая пластинка
крепко зажимается винтами между верхней (цилиндр без дна) и
нижней (воронкообразный тубус) частями держателя (рис.79).
Опорой для асбестового диска служит сетка или пористая плас-
тинка из нержавеющей стали. Трубка фильтра, по которой стека-
ет фильтрат, через резиновую пробку проходит в колбу Бунзена.
Свечи Шамберлана вставляют непосредственно в резиновую пробку.
Перед употреблением фильтры, их держатели и приемник фильтра-
та должны быть простерилизованы. Мембранные фильтры можно сте-
рилизовать, поместив их в дистиллированную воду, автоклавиро-
ванием при дополнительном давлении I ат 15 минут или длитель-
ным кипячением. Сосуд с фильтрами должен быть закрыт ватной
пробкой. Держатель вместе с резиновой пробкой заворачивают в
бумагу и автоклавируют при дополнительном давлении I ат 20-30
мин. Прибор собирают в асептических условиях непосредственно
перед работой. Стерилизация мембранных фильтров вместе с дер-
жателем не рекомендуется, так как может привести к их повреж-
дению.
Фильтры Зейтца автоклавируют в собранном виде. Свечи сте-
рилизуют в автоклаве вместе с резиновой пробкой. Перед стерили-
зацией их заворачивают в бумагу и хранят в таком виде до упот-
ребления. Колбу Бунзена закрывают ватной пробкой. В отводную
трубку, которая будет присоединена к вакуумному насосу, встав-
ляют ватный тампон, и в таком виде приемник стерилизуют. Не-
196
посредственно перед работой ватную пробку колбы Бунзена быстро
заменяют держателем с фильтпой, а отводной конец колбы соединя-
ют с предохранительной склянкой, находящейся перед насосом (рис.
81) Тампон из отводного конца не вынимают, чтобы сохранить сте-
рильность приемника. Разливку профильтрованных сред производят
в стерильных условиях в заранее простерилизовакную посуду. Так
же как и при термической стерилизации, разлитые среды 2-3 суток
выдерживают при 30°С. Если в них обнаружится рост микроорганиз-
мов, среды готовят заново.
Мембранные и асбестовые фильтры расчитаны на одноразовое
использование. Свечи после использования сначала промывают дис-
Рис.81. Фильтро-
вальный прибор
со свечой Шамоер-
лана.
тиллированной водой, прокачивая ее в направлении, обратном фильт-
рованию. Затем свечи заливают на ночь концентрированной серной
кислотой, содержащей небольшое количество нитрата натрия и хлор-
нокислого калия (КСЮ^). На следующий день их многократно про- •
199
мывают дистиллированной водой, а затем кипятят в воде для уда-
ления растворенного воздуха. Свечи не следует мыть смесью дву-
хромовокислого калия с серной кислотой, так как хромат адсор-
бируется на фильтре, что может привести к повреждению фильтра
и испортить фильтрат. Нельзя обрабатывать свечи концентрирован-
ными растворами щелочей, так как это может увеличить размеры
пор. Для очистки свечей от посторонних частиц органического
происхождения их можно прокаливать в муфельной печи.
Следует учитывать, что состав жидкостей, прошедших через
бактериальные фильтры, может меняться вследствие адсорбции на
фильтрах ряда веществ, таких, как, например, некоторые жирные
кислоты, белки, полисахариды и др. В результате среды могут
оказаться непригодными для культиворования данных микроорга-
низмов. Возможность и степень адсорбции веществ на фильтре оп-
ределяется химической природой фильтра, размерами его пор, вре-
менем фильтрования.
Химическая и физико-химическая
стерилизация. Газовая стерилизация
Химическая стерилизация основана на губительном действии
химических веществ на микроорганизмы. Она применяется для об-
работки вакцин,сывороток и других биопрепаратов, консервируемых
различными антисептиками (хлороформ,хинозол, мертиолат,фенол,
трикрезол и др.).
К химической стерилизации относится также газовая стери-
лизация. Исследования последних десятилетий позволили устано-
вить способность некоторых газов убивать споры. К этим так
называемым стерилизующим газам относятся формальдегид, окись
200
этилена ир-пропио лактон. Применявшиеся прежде хлор и серный
ангидрид, оказывают сильное разрушающее действие и слишком ток-
сичны, для того, чтобы ими можно было широко пользоваться. Пре-
имущество газов как стерилизующих веществ состоит в том, что
их применение не требует нагревания, кроме того, их можно при-
менять для стерилизации больших объемов, например, помещений
и т.д. Однако, они действуют лишь на открытые поверхности и
должны применяться в определенных условиях температуры и влаж-
ности.
Формальдегид является очень раздражающим газом. Если фор-
мальдегид применять без соблюдения особых предосторожностей, то
он полимеризуется с образованием паральдегида, оседающего в ви-
де белой пленки на всех поверхностях. Поэтому его не следует
применять в помещениях, где имеется ценное оборудование. Макси-
мальный эффект получают при относительной влажности 70% и тем-
пературе около 22°. Пары формальдегида плохо проникают в шерстя-
ные ткани. Теперь формальдегид применяют значительно реже, чем
раньше.
При стерилизации пищевых продуктов, лекарственных препара-
тов и различных приборов, а также в лабораторной практике оп-
равдало себя применение окиси этилена » которая
убивает как вегетативные клетки так и споры, но действует толь-
ко в том случае, если подвергаемые стерилизации материалы со-
держат 5-15% влаги. Окись этилена применяется в газовой смеси
с бромистым этилом, азотом или двуокисью углерода. На долю
окиси этилена при этом приходится от 2 до 50%. Стерилизацию
материалов проводят в герметических сосудах, например, авток-
лавах, или специальных контейнерах. Для стерилизации нестойких
20Г
. 1 '
органических жидкостей, например, бактериологических культу-
ральных сред, окись этилена можно применять в жидком состоянии.
Для этого среду„смешивают с окисью этилена (до 1%) при темпера-
туре 10°. После нескольких часов контакта окись этилена удаля-
ют путем кратковременной инкубации при 37°.
Для стерилизации термолабильных веществ в растворах часто
используют также -пропиолактон:
СН9-----С = 0
12 I
СН2-----о
Он значительно активнее окиси этилена, но обладает по некото-
рым данным, довольно сильным канцерогенным действием и вызыва-
ет некоторые другие побочные физиологические эффекты, р-Пропио-
лактон прибавляют к готовой питательной среде в количестве 0,2%
и оставляют на 2 часа при 37°. При хранении питательной среды
в течении ночи, р-пропиолактон полностью разлагается и улету-
чивается. Углеводы при этом не затрагиваются, р-Пропиолактон
применяют для стерилизации вакцин, различных трансплантантов
тканей и других нестойких биологических материалов.
Применительно к производственным условиям перспективным
становится аэрозольный метод стерилизации. Этод метод предус-
матривает применение препаратов для деконтаминации ( contaminatio
- загрязнение, заражение) воздуха в виде мелкодисперсных аэро-
золей и крупнодисперсных - для стерилизации поверхностей.
Для деконтаминации используют-трех-и шестипроцентные вод-
ные растворы перекиси водорода. Первый расчитан на уничтожение
вегетативной микрофлоры при ежедневной уборке цехов, второй -
на уничтожение спор и должен применяться при генеральных убор-
202
:ах помещений.
Полная деконтаминация всех поверхностей,размещенных в
трех плоскостях (на полу,стенах и потолке), обсемененных зо-
лотистым стафилококком,достигается при распылении 3^-ного раст-
вора перекиси водорода в количестве 100 мл/м^, гибель спор
антракоида (Вас. anthracoides ) наблюдается при использовании
6^-ного раствора перекиси водорода в дозе 300 мл/м^.
К Физико-химическим методам стерилизации относятся те
методы, в которых физическое и химическое воздействие на микро-
организмы используется совместно. Например, в проекте общей
статьи "Стерилизация" для XI издания Государственной Фармакопеи
СССР для обеспложивания некоторых растворов предлагается добав-
ление к ним 0,5^ фенола или 0,3^ трикрезола, а также насыщенно-
го раствора хлорбутанолгидрата с последующим нагреванием их до
80° и ввдержкой в таких условиях не менее 30 минут.
Инъекционные растворы таким методом стерилизовать нельзя.
Стерилизация облучением.
Ультрафиолетовые лучи ртутно-кварцевой лампы широко исполь
зуются для обезвреживания воздуха лечебных учреждений,многолюд-
ных цехов завода.
Действие этих лучей обеспечивает также асептичность посе-
вов и пересевов больших объемов материала на заводах бродиль-
ной промышленности при производстве антибиотиков и т.д. Можно
использовать ультрафиолетовые лучи для стерилизации прозрачных
растворов некоторых термолабильных веществ (белков,витаминов,
антибиотиков и др.).помещенных в сосуды, выполненные из квар-
203
цевого стекла. Причем сосуды необходимо при этом периодически
встряхивать, так как ультрафиолетовое излучение обладает очень
малой проникающей способностью (слой воды, например, ультрафи-
олетовые лучи способны "пробить" толщиной всего лишь в несколь-
ко десятков микрон). Гарантии полного уничтожения всех микро-
организмов в стерилизуемой ультрафиолетовым облучением жидкос-
ти нет.
Отечественной промышленностью выпускаются бактерицидные
лампы БУФ-Т5 и БУФ-30, а также 0БП-300 (облучатель бактериоцид-
ннй потолочный). Длина волны, излучаемая этими лампами, равна
260 нм (.ммк) и является наиболее губительной для микроорганиз-
мов. Это связано с тем, что пуриновые и пиримидиновые основания,
входящие в состав ДНК и РНК, обладают максимумом поглощения
именно при длине волны 260 нм. Облучение ультрафиолетом вызыва-
ет образование ковалентных связей между остатками тимина в це-
пях ДНК. Этот процесс димеризации тимина частично или полностью
подавляет репликацию ДНК.
Более губительным по сравнению с ультрафиолетовыми лучами
является действие на микроорганизмы таких излучений как альфа-
-частицы,протоны, дейтроны,электроны и позитроны, а также рентге-
новское и гамма-излучения. Антимикробное действие указанных
ионизирующих излучений связано с количеством энергии, которое
поглощается клеткой. Поглощенная доза отличается от дозы из-
лучения, падающей на излучаемый объект •'экспозиционная доза).
Единицей экспозиционной дозы рентгеновского и гамма-излучения
является кулон на килограмм (к/кг) и определяется как экспо-
зиционная доза, при которой сопряженная корпускулярная эмиссия
на килограмм сухого атмосферного воздуха производит в воздухе
204
Зак. 1183
ионы несущие заряд в I кулон электричества каждого знака. Вне-
системной единицей экспозиционной дозы является рентген (р) -
такое количество рентгеновского или гамма-излучения,которое
9 Я
вызывает образование 2,1*10 пар ионов в I см сухого воздуха
при температуре 0° и давлении 760 мм рт.ст. (р=2,57976*10“^
к/кг).
Единицей поглощенной дозы является джоуль на килограмм.
Эта единица оценивается следующим образом: "Джоуль на килог-
рамм - поглощенная доза излучения,измеренная энергией в один
джоуль любого вида ионизирующего излучения,переданной массе
в один килограмм облученного вещества". ГОСТ 8843-63 допускает
использование внесистемной единицы поглощенной дозы излучения -
-рад. Один рад соответствует поглощению 100 эрг/г и равен 10
дж/кг. В воздухе 1р=0,88 рад. Кроме единиц дозы джоуль на
килограмм,рад и рентген в практике используется еще единица
Бэр - биологический эквивалент рада.Бэр - единица дозы любого
вида ионизирующего излучения в биологической ткани,которая соз-
дает тот же биологический эффект,что и доза в I рад рентгенов-
ского или гамма-излучения. В зависимости от того, как- рас-
, ходуется энергия того или иного вида излучения при взаимодейст-
виях с веществом,как распределяются в веществе ионы при различ-
ных видах и энергиях излучения, но при одной и той же дозе.биоло-
AV гическое действие различных излучений будет разным. Если условно
а' - принять биологическую эффективность гамма-излучения за единицу,
то для альфа-частиц она будет равна 10, для медленных нейтронов
- 5, для быстрых - 20.
Бактерицидный эффект ионизирующих излучений связан с обра-
зованием свободных радикалов,с активацией молекул цитоплаз-
295;.
мы и ядра клетки, с косвенным действием излучений на вещество,
с которым они взаимодействуют. Все эти механизмы приводят в ко-
нечном итоге к глубоким изменениям клеток, к разрушению и гибе-
ли микроорганизмов.
Использование новых материалов и упаковочных средств, но-
вых синтезированных препаратов, не выдерживающих ни химических,
ни термических способов обработки, делает лучевую стерилизацию
важным видом стерилизации в различных отраслях медицинской про-
мышленности. Основные качества, характеризующие лучевую стери-
лизацию: возможность обработки термолабильных препаратов и ма-
териалов; обработка объектов различного объема в упаковке из
бумаги, стекла, пластмассы; возможность включения лучевой сте-
рилизации в непрерывный, производственный процесс; стерилизация
готовой продукции в уже упакованном виде.
Метод радиостерилизации должен удовлетворять двум требо-
ваниям: во-первых, облучение должно оказывать на микроорганиз-
мы бактерицидное действие , во-вторых, радиостерилизация не
должна изменять качеств и свойств обрабатываемых объектов. С
помощью ионизирующих излучений стерилизуют перевязочные мате-
риалы, хирургические инструменты, некоторые лекарственные пре-
параты, в том числе антибиотики и гормоны, биологические ткани
и т.д.
Ионизирующие излучения используют также при производстве
вакцин и стерилизации токсинов. Особенно перспективен метод
лучевой стерилизации различных изделий одноразового пользова-
ния, изготовляемых из пластмасс, например, систем службы кро-
ви и шприцев.
• Выбор дозы радиационного облучения зависит от объекта,под-
206
РОГТ •Я9С
лежащего стерилизации, его инициальной контаминации и необходи-
мой степени надежности стерилизации. Для большинства объектов
выбрана доза облучения равная 2-4 Мрад (1Мрад или I мегорад
равен Г0ь рад).
. Для стерилизации используют радиационные установки трёх
типов: изотопные, в которых применяют в качестве источника
гамма-излучения Со^, ускорители электронов и источники из-
лучения, связанные с атомными реакторами. Радиационная стерили-
зация пока остается экономически более дорогой по сравнению с
другими видами стерилизации из-за необходимости значительных
капитальных затрат на строительство специальных радиационных
установок и закупку радиактивных источников, стоимость которых
остается пока очень высокой. Однако, -как показали экономичес-
кие расчеты некоторых зарубежных фирм, эти затраты могут быть
полностью окуплены в течение первых 1-2 лет эксплуатации уста-
новок. Эти расчеты оказались справедливыми при использовании
не только радиоактивных изотопов в качестве источника излуче-
ния, но и ускорителей. Несмотря на более высокую стоимость сте-
рилизации радиационной обработкой, отказаться от метода стери-
лизации облучением нельзя, он остается единственной возможностью
для стерилизации множества изделий и препаратов, не выдержива-
ющих обработки теплом и химическими веществами.
Обработка ультразвуком как метод стерилизации применяется
крайне редко из-за своей малой эффективности. Некоторые иссле-
дователи пытались использовать ультразвук для приготовления
вакцин, обеспложивания лекарственных препаратов и т.п.
2.07
Литература
Башков В.И. Антимикробные средства и методы дезинфекции.
М.,"Медицина",1977.
Ежов Г.И. Руководство к практическим занятиям по сельскохо-
зяйственной микробиологии. М.,"Высшая школа", 1974.
Лебедева М.Н. Руководство к практическим занятиям по
медицинской микробиологии. М.."Медицина",1973.
Обеспечение стерильности процесса биосинтеза и полу-
чение стерильных лекарственных препаратов. (Материалы Всесоюз-
ного совещания, г.Пенза, II-I2 апреля 1978).
Пименова М.Н. .Гречушкина Н.Н., А з о в а Л.Г.
Руководство к практическим занятиям по микробиологии. М.,
"Издательство.Московского университета",1971.
П р и к а з по Министерству здравоохранения СССР и Министерст-
ву медицинской промышленности № 376/207 от 19 апреля 1974
"0 введении в действие единых" методических правил в области
радиационной стерилизации медицинской продукции".
Туманян М.А.. К а у ш а некий Д.А. Радиационная
стерилизация. М.."Медицина",1974.
Фармакопейная статья. Стерилизация (проект).
Издание официальное. Министерство здравоохранения СССР.
Наставления и нормативные материалы по аптечному
делу. Выпуск 1У, М., 1979.
203
4. ПИТАТЕЛЬНЫЕ СРЕДЫ И СПОСОБЫ ИХ
ПРИГОТОВЛЕНИЯ
Вопросы для подготовки по теме:
I. Типы питания микроорганизмов.
2. Вещества, необходимые для роста и размножения
микроорганизмов.
3. Назначение питательных сред.
4. Классификация питательных сред по их составу и
назначению.
5. Стерилизация питательных сред.
6. Требования, предъявляемые к питательным средам.
Питательные среды необходимы для получения чистых культур
микробов, изучения их морфологии, получения ценных метаболитов,
а также для сохранения самих микробов.
Состав питательной среды должен соответствовать поставлен-
ной задаче исследования. Для нормального развития микроорганиз-
мов и осуществления конструктивных и энергетических процессов
среда должна содержать все необходимые вещества - источники уг-
лерода, азота, макро- и микроэлементы, витамины.
Другими факторами, обеспечивающими возможность развития
микроорганизмов на питательной среде, является влажность, тем-
пература, аэрация.
По типу питания микроорганизмы подразделяют на аутотрофы,
которые способны синтезировать углеродные соединения из угле-
кислоты, и гетеротрофы, не обладающие таким свойством и требу-
ющие присутствия органических источников углерода.
Аутотрофные микроорганизмы усваивают COg из воздуха и рас-
209
тут на средах без углерода. Примером последних могут служить
среды С.Н.Виноградского.
Число органических соединений углерода, используемых ге-
теротрофами очень велико. Углеводы - это наиболее доступные ис-
точники углерода. Моносахариды, особенно глюкоза, многоатомные
спирты, органические кислоты являются хорошими источниками уг-
лерода, Однако использование органических кислот вызывает сни-
жение {Л в культуре, что может неблагоприятно сказаться на рос-
те организма, кроме того, некоторые органические кислоты (напри-
мер, лимонная и винная) являются активными хелатными агентами,
а недостаток ионов металла может отрицательно влиять на рост
бактерий. Использование же других групп органических соедине-
ний углерода более ограничено, т.к. они способны усваиваться
небольшим числом микроорганизмов. Например, ароматические соеди-
нения используются псевдомонадами.
Потребности микробов в источниках азота также весьма раз-
нообразны. Хорошими источниками азота для бактерий являются
пептон, .смеси аминокислот. Из минеральных веществ бактерии
предпочтительно используют ион аммония (МН4+), а грибы и водо-
росли - нитраты (нОд ). Многие микробы-паразиты размножаются
только в присутствии нативного белка (например, на средах с
сывороткой, кровью). Напротив, микробы, фиксирующие молекуляр-
ный азот, не требуют его присутствия в питательной среде (сре-
да си5и для культивирования азотобактеров).
Потребности в других элементах удовлетворяются чаще всего
минеральными солями: uaCi , KHgP04, MgS 04, FeS04 и др.
Хотя известно очень много питательных сред для культивиро-
вания микроорганизмов (более 2000), число ингредиентов, входя-
210
щих в их состав, относительно невелико.
Микроэлементе, выполняющие роль кофакторов в химических
процессах клетки, необходимые в ничтожно малых количествах,
поступают в питательную среду с пептоном, неорганическими со-
лями и водой. Источниками факторов роста являются прибавляемые
к питательной среде продукты растительного и животного проис-
хождения, содержащие в своем составе никотиновую, пантотеновую,
парааминобензойную кислоты, витамины А/В,С и др. Но существу-
ют микроорганизмы, нуждающиеся в определенном факторе роста
(ауксотрофы). В этом случае такое вещество специально до-
бавляют в среду. Например, для культивирования СогупвЪас-terium
diphtherias в среду следует добавлять пантотеновую кислоту,
а для молочнокислых микроорганизмов ч биотин.
Питательные вещества могут усваиваться микробами при опре-
деленной реакции питательной среды
Различные микроорганизмы имеют свою оптимальную зону рп,
в пределах которой они могут расти. Бактерии "предпочитают"
среды со значением pH, близким к нейтральному или слабощелочно-
му. Исключение составляют уксуснокислые бактерии и некоторые
серные бактерии, для которых благоприятной является среда с
pH 4-5. Грибы и дрожжи растут при слабо кислой реакции среды
(pH 4-6).
Требования к питательным веществам и другим условиям рос*
та у различных видов микробов неодинаковы и этим исключается
возможность создания универсальной питательной среды.
По составу среды подразделяются на естественные, искусст-
венные и синтетические.
Естественными питательными средами являются те, которые
211
представляют собой натуральный продукт животного или раститель-
ного происхождения - молоко, яйца, овощи, животные ткани, желчь,
сыворотка крови. Естественные или натуральные среды используют-
ся для накопления биомассы, а некоторые - для диагностических
целей (молоко).
Искусственные среды - это среда, приготовленные по опреде-
ленным рецептам из различных настоев или отваров животного или
растительного происхождения с добавлением неорганических солей,
углеводов и азотистых веществ. Эти среда широко используются
для культивирования микроорганизмов.
Синтетические среда - это среда, в состав которых входят
определенные химические соединения в точно указанных концентра-
циях. Синтетические среда удобны для исследования обмена ве-
ществ микроорганизмов. Они учитывают потребности микроба во
всех необходимых источниках питания, включая витамины. Многие
бактерии нуждаются в большом числе факторов роста и для них
синтетические среда имеют очень сложный состав (молочнокислые
микроорганизмы).
По физическому состоянию среда бывают жидкие, плотные и
сыпучие.
Жидкие среда чаще применяют для изучения физиолого-биохи-
мических особенностей микробов, для накопления биомассы и про-
дуктов обмена.
Полужидкие среда обычно используют для хранения культур.
Плотные среда - для выделения микроорганизмов, изучения
морфологии колоний, диагностических целей, количественного уче-
та, определения анатагонистических свойств и ряда других целей.
Сыпучие среда обычно используют для хранения посевного
212
материала, культур продуцентов в микробиологической и медицин-
ской промышленности. К ним относят разваренное пшено, кварце-
вый песок, пропитанный питательным раствором.
В качестве уплотнителей можно использовать целый ряд ве-
ществ, таких как крахмальный гель, метилцеллюлозу, силикагель,
желатин, агар-агар. Но в настоящее время обычно используют толь-
ко агар-агар,реже желатин и силикагель.
Агар-агар - полисахарид, выделенный из морских водорослей.
Он обладает рядом полезных свойств, в частности способен обра-
зовывать в воде гели, плавящиеся при Ю0°С и затвердевающие
при 45°С и ниже, не используется микробами в качестве питатель-
ного субстрата. Несколько циклов плавления и затвердевания в
слабокислых, нейтральных и щелочных средах не влияют на способ-
ность агара образовывать гель, благодаря чему агаровые среды
можно несколько раз стерилизовать. Агар-агар к средам добавля-
ют в количестве 0,5% для полужидкой среды, и в количестве 1,5-
2% для плотной среды. При добавлении агар-агара в среды строго
определенного состава для генетических экспериментов и изучения
факторов роста, уплотнитель очищают многократным промыванием
агара дистиллированной водой при комнатной температуре. Агар-
агар помещают в двойной марлевый мешок и промывают в течение
2-х дней проточной водой, затем в течение суток промывают
дистиллированной водой, меняя воду 3-5 раз. Промытый агар рас-
кладывают тонким слоем и сушат на воздухе или в сушильном шка-
фу при 40-50°.
Желатин - белок, получаемый из кожи, костей и хрящей жи-
вотных. Он способен плавиться при температуре 25°С. Эта темпе-
ратура обычно ниже температуры инкубации микроорганизмов. Кро-
2ТЗ
ме того, желатин разжижается протеолитическими ферментами мик-
роорганизмов, повторная стерилизация сред с желатином при pH
ниже 6,0 и выше 7,3 не рекомендуется, так как он при этом теряет
способность образовывать гель. Поэтому желатин в настоящее вре-
мя используют лишь для специальных целей - для выявления про-
теолитической активности микроорганизмов, а так же для получе-
ния "гигантских" и глубинных колоний дрожжей.
Силикагель (кремнекислый гель ) - двуокись кремния Si 0g.
Его используют как твердую основу для синтетических сред строго
определенного состава, т.к. он является веществом неорганичес-
кой природы. Существует несколько методов приготовления геля.
Один из методов заключается в том, что золь готовят путем про-
пускания 10% (вес/объем) раствора силиката натрия через колон-
ку катионообменника и получают прозрачный, бесцветный золь, со-
держащий 3% (вес/объм) Si 0g . Он стабилен в течение 1-3 недель
и выдерживает автоклавирование при 2 ат в течение Т5 мин. К сте-
рильному золю из раствора силиката натрия добавляют жидкую пи-
тательную среду, содержащую электролиты. Золь берут в таком
количестве, чтобы конечная концентрацияSiOg была приблизительно
1,5% (вес/объе?-). Для образования геля смесь выдерживают при
комнатной температуре в течение 1-2 часов.
Сухие питательные среды
Медицинская промышленность выпускает сухие питательные
среды. Применение этих сред имеет большое практическое значение,
т.к. они стандартные, их просто хранить и легко транспортиро-
вать.
Сухие питательные среды представляют собой гигроскопичес-
214
кие порошки без комков с влажностью до 10%. Их следует хранить
герметически закрытыми и по возможности в темноте. Эти среды
должны хорошо растворяться в дистиллированной воде при комнат-
ной температуре. В виде сухих питательных сред выпускают основ-
ные, элективные и дифференциальные среды.
По назначению среды подразделяют на обычные, специальные,
элективные, дифференциально-диагностические.
• Обычные среды используют для культивирования большинства
микроорганизмов, это мясопептонный бульон (МПБ), мясо-пептонный
агар (МПА), сусло жидкое, сусло-агар.
Специальные среды используют для выделения и культивирова-
ния определенных групп или видов микроорганизмов. Например,
МПБ с глюкозой для культивирования стрептококков, среда Чапека
- для грибов.
Элективные среды используют при выделении определенного
вида микроба из мест его естественного обитания или для полу-
чения накопительных культур. Сопутствующие микроорганизмы или
совсем не растут на таких средах, или развитие их сильно задер-
живается. Такие среды используют при выделении определенного
вида микроба из мест естественного обитания или для получения
накопительных культур. С этой целью к основной питательной
среде добавляют различные красители (метиленовый синий, брил-
лиантовый зеленый и др.), антибиотики или соли, которые задер-
живают рост чувствительных к ним микробов. Например, среда
Левина, которая представляет собой МПА с добавлением эозина,
лактозы, и метиленового синего. Метиленовая синь задер-
живает рост грамположительных микробов, на этой среде развива-
ются только энтеробактерии.
210
Дифференциально-диагностические среды применяют для изу-
чения биохимических свойств и для отличия (дифференцировки) од-
ного вида микроба от другого по характеру их ферментативной ак-
тивности. Состав этих сред подбирают с таким расчетом, чтобы
четко выявить наиболее характерные свойства определенного вида.
Например, для выделения патогенных бактерий из кишечника приме-
няют среды, которые позволяют их дифференцировать от постоянных
обитателей кишечника - микробов, разлагающих лактозу. Такой
средой является среда Эндо, в состав которой входит лактоза.
Пользуясь этой средой, по цвету колоний можно отличить микроор-
ганизмы, обладающие способностью сбраживать лактозу, от микро-
организмов, не обладающих этим свойством. Основными компонен-
тами среды Эндо является МПА, лактоза и основной фуксин, обес-
цвеченный сульфитом. Исходная питательная среда окрашена в ро-
зовый цвет. При сбраживании лактозы образуется ацетальдегид,
который реагирует с сульфитом и окрашивает колонии в ярко-крас-
ный цвет. Поэтому кишечная палочка, которая сбраживает лактозу,
при росте на этой среде образует красные колонии с металличес-
ким блеском, а сальмонеллы и шигеллы бесцветные, так как они
не сбраживают лактозу.
Стерилизация сред
Все питательные среды, независимо от их назначения, разли-
вают в стерильную посуду и стерилизуют. Большинство сред стери-
лизуют автоклавированием, но при различных режимах, в зависи-
мости от их состава. Среды, предназначенные для стерилизации
в автоклаве, наливают не выше .1/2 высоты посуды и закрывают ват-
ными пробками. Пробки должны быть не слишком плотными, так как
2Т6
в противном случае они будут затруднять проникновение пара че-
рез пробку в сосуд при стерилизации, а в дальнейшем - снабжение
микробов воздухом при культивировании.
Режимы стерилизации зависят от состава сред. Субстраты,
содержащие вещества, не выдерживающие нагревание 120° (2ат.),
стерилизуют при 1,5 ат 15 мин. (молоко, дрожжевая вода, среды
с желатином) и 20 мин. при 1,5 ат. Среды, содержащие сахара и
витамины, пивное сусло стерилизуют при 1,5 ат 20-30 мин., а
МПБ и МПА автоклавируют при 2 ат 30 мин.
При выборе режима стерилизации необходимо учитывать pH
среды. В случае кислой реакции среды может произойти гидролиз
полимеров, входящих в состав среды. При pH ниже 6 пептонизиру-
ется желатин и среда не застывает.
При щелочной реакции среды выпадают при стерилизации соли
железа, карамелизируются сахара. В некоторых случаях, чтобы
избежать этих явлений, часто такие вещества-стерилизуют отдель-
но при нейтральном значении pH и стерильно добавляют в просте-
рилизованные среды. Некоторые среды, содержащие белок, витами-
ны и т.п. стерилизуют с помощью бактериальных фильтров и ультра
фиолетового облучения в кварцевой посуде.
Для контроля стерильности простерилизованные среды помеща-
ют в термостат при 37°С на 5 суток. Жидкие среды должны оста-
ваться прозрачными, а на поверхности и в толще плотных питатель
ных сред не должны расти микробы.
Кроме контроля стерильности производят химический контроль
готовых сред, который заключается в том, что в нескольких об-
разцах . каждой серии определяют pH (потенциометрически).количест
во общего и аминного азота, пептона и хлоридов.
217
Схема режимов стерилизации сред
Среды Режим степилизании
аппарат темпе- ратура давле- ние время
Т. Простые автоклав 120° 2 ат 20 минут
2. С углеводами,мо- автоклав Т09° 1,5 ат т5 минут
локом,желатином или автоклав с незакрытой ТОО0 'теку- 30-60 мин. 3 дня под-
крышкой,или аппарат Коха чий пар) ряд (дроб- ная стери- лизация)
3. Белковые сыворо- 80-85° I час, 3
точные и яичные (с уплотнением) аппарат Коха ИЛИ 95° дня подряд I час од- ; нократно
4. Белковые (без уп- лотнения) водяная баня 58° , I час, 3-4 дня подряд
Существует так же биологический контроль сред. В этом слу-
чае несколько образцов среды засевают лабораторной культурой
того микроба, для которого приготовлена среда, и изучают харак-
тер его роста. Только после того, как среды выдержали контроль,
их можно использовать по назначению.
Всякая питательная среда должна удовлетворять следующим
требованиям:
Т. Содержать все необходимые для роста и размножения мик-
роба источники азота, углерода, водорода, неорганические соли,
218
факторы роста.
2. Быть влажной, так как микробы могут развиваться лишь в
присутствии воды.
3. Иметь соответствующую реакцию pH. Чтобы во время роста
микробов продукты их жизнедеятельности не изменяли оптимальное
значение pH, среды должны обладать буферностью, т.е. содержать
вещества, способные нейтрализовать кислые или щелочные продук-
ты обмена.
4. Быть стерильной. Режим стерилизации зависит от состава
среды.
5. Среды должны быть изотоничными для микробной клетки,
т.е. осмотическое давление в среде должно быть'таким же, как
внутри клетки.
6. Среды должны обладать определенным окислительно-вос-
становительным потенциалом, гН2. Для анаэробных микроорганиз-
мов rHg не выше 5, а для аэробных - не ниже ТО.
7. Среды должны быть по возможности унифицированными в от-
ношении основных компонентов среды, т.е. содержание суммарного
азота аминогрупп, аминокислот и низших полипептидов, должно
составлять 60-120 мг%, общего азота 250-300 мг%, хлоридов (в
пересчете на^аСМ 0,5-0,8%, пептона 1,0%.
Цель работы - приготовить питательные среды и проверить
их пригодность для культивирования микро-
организмов.
Материалы: мясная вода, llaCl, пептон, агар-агар, папОд,
8^004-7Н20, 2е0047Н20, KH2P04,KCl .сахароза.
Приготовление сред
Мясо-пептонный бульон <МПБ). К ТОО мл мясной воды прибавить
219
I. г пептона и 0,5 rN аС1 . Смесь кипятить ДО-15 минут при поме-
шивании. К полученному бульону добавить по каплямН /20 р-рИеОН
до значения pH 7,4 и снова кипятить 30 мин до выпадения осадка.
Отфильтровать через бумажный фильтр, долить водой до первона-
чального объема, разлить в стерильные пробирки по 3 мл и сте-
рилизовать в автоклаве 30 мин при 2 ат. После стерилизации pH
среды снижается до 7,2.
Мясо-пептонный агар (МПА). К готовому МПБ добавить 2% измель-
ченного агар-агара и оставить для набухания на 30 мин. Получен-
ную смесь кипятить при помешивании до полного растворения агара.
Горячий МПА фильтруют через ватно-марлевый фильтр, разливают
по 5 мл в стерйльные пробирки и стерилизуют в автоклаве 30 мин
при 2 ат. После стерилизации горячие пробирки уложить в наклон-
ном положении (под углом 20°) и дать застыть.
Среда Чапека. Налить в мерный стакан приблизительно 50 мл дис-
тиллированной воды и добавить 0,2 г какОд, 0,1 г KgHPO^, 0,05
г MgS04-7H20,' 0,001 r*FeSO4, 3 г сахарозы и 2 агар-агара и оста-
вить для набухания на 30 мин. Довести' водой до 100 мл. Получен-
ную смесь кипятить при помешивании до полного растворения ага-
ра. Горячую среду фильтровать через ватно-марлевый фильтр, раз-
лить по 5 мл в стерильные пробирки и стерилизовать в автоклаве
30 мин при 1,5 ат. После стерилизации горячие пробирки уложить
в наклонном положении (под углом 20°) и дати застыть.
Проверка стерильности питательных
сред -
Для проверки стерильности помещают 10% пробирок со стериль-
ной средой в термостат npif 37°С и 24°С. Наблюдение ведут в те-
220
чение недели. Если ни одна из пробирок не помутнеет и ни в од-
ной пробирке не появится рост микроорганизмов, то среды счита-
ют стерильными.
Проверка пригодности сред для культивирования
микроорганизмов
а) проверка пригодности мясо-пептонного агара.
Взять 2 пробирки со стерильным МПБ и 2 пробирки со стериль-
ным МПА, засеять их культурой Staphylococcus aureus и поместить
в термостат на 24 часа при t =37°. Через 24 часа отметить ре-
зультаты посева. На жидкой среде должна быть равномерная мут-
ность, а на плотной сплошной рост. Сделать из посевов мазки,
окрасить по Граму и промикроскопировать. Если среда пригодна,
то должна быть характерная картина роста стафилококка.
б) проверка пригодности среды Чапека
Взять 2 пробирки со стерильной средой Чапека,•засеять куль-
турой Aspergillus сlavatus,поместить в термостат на 7 дней при
24°. Через неделю на среде должен вырасти гриб с зеленоватым
пигментом и при микроскопировании дать типичную морфологичес-
кую картину (булавовидная головка с одним рядом стеригм по
всей поверхности).
Литература
ЛабинскаяА.С. Микробиология с техникой микробиологи-
ческих исследований. М., "Медицина", 1978.
Практикум по микробиологии. Под ред. Н.С.Егорова. М.,
Т976.
221
5. МЕТОДЫ ВЫДЕЛЕНИЯ ЧИСТЫХ КУЛЬТУР МИКРООРГАНИЗМОВ
Вопросы для подготовки по теме
I. Понятие о культуре и чистой культуре микроорга-
низмов. Колонии микроорганизмов.
2. Популяция, клон, штамм.
3. Значение чистых культур в микробиологической
практике.
Культуры микроорганизмов - это популяции клеток, выросших
на стерильной питательной среде. Популяции могут состоять из
разных видов микробов и тогда культуры называются смешанными.
Если популяция содержит лишь один вид микроба, культура назы-
вается чистой. Чистую культуру выделяют путем получения потомст-
ва одной клетки. Культура может расти в виде отдельных колоний
на плотной питательной среде. При густом посеве колонии дают
сливной рост на плотной среде. Колония микроорганизмов - это
сообщество клеток одного вида, возникшее из одной или несколь-
ких особей как правило на плотной питательной среде. Колонии
грибов могут возникать и на жидких питательных средах. Поддер-
живать чистые культуры можно на плотных и жидких питательных
средах.
Чтобы получить из смешанной культуры чистую, прибегают к
методу накопительной культуры, т.е. культуры, обогащенной не-
обходимым видом микроба. Накопительные культуры получают, соз-
давая элективные условия для их выращивания, т.е. условия,
обеспечивающие преимущественное развитие определенной группы
или вида микроорганизмов. При создании элективных условий
учитывают особенности физиологии и обмена веществ микробов,
222
их требования к источникам питания, отношение к pH среды, аэра-
ции, температуре, способность к образованию эндоспор и др.
Элективные условия не всегда оптимальны для роста учитываемой
группы микроорганизмов, но все же они лучше переносятся ими,
чем сопутствующими формами.
Выделение чистых культур аэробных микроорганизмов
Методы выделения чистых культур микробов можно подразде-
лить на две основные группы: а) методы,основанные на принципе
механического разделения микробов; б) методы, основанные на
биологических особенностях микроорганизмов.
Методы механического разделения микробов.
I. Метод последовательных разведений по Пастеру. Берут
ряд пробирок с жидкой питательной средой, в первую вносят ис-
следуемый материал, далее, перенося из пробирки в пробирку оп-
ределенный объем жидкости, получают ряд серийных разведений.
При этом в первых пробирках будет содержаться большое коли-
чество микробных клеток, а в одной из последних теоретически
может находиться одна клетка. Создав условия для роста и размно-
жения микробов в этой пробирке можно получить чистую культуру.
В других же пробирках будет расти смесь микробов. Этот метод
в чистом виде в настоящее время почти не применяется.
2. Метод Коха. Берут 6-10 пробирок с 9 мл стерильного
расплавленного и охлажденного до 50° агара. I мл исследуемого
материала вносят в первую пробирку, хорошо перемешивают, за-
тем I мл из первой пробирки переносят во вторую и т.д., т.е.
готовят ряд последовательных разведений. Затем агар из проби-
223
рок выливают в стерильные чашки Петри, которые после застыва-
ния агара помещают в термостат с соответствующей температурой.
Каждая живая клетка, попавшая в агар,начнет размножаться и об-
разует колонию. В чашках, содержащих большое количество бакте-
рий, будет наблюдаться обильный рост, колонии будут сливаться,
и чистую культуру получить на таких чашках трудно. В последу-
ющих разведениях будут образовываться отдельные колонии, из
которых легко выделить чистую культуру.
3. Рассев шпателем по Дригальскому. Берут 3 чашки Петри
с питательной средой. На первую петлей или пипеткой наносят
каплю исследуемого материала и растирают шпателем по всей по-
верхности питательного агара. Затем шпатель переносят на дру-
гую чашку и втирают оставшихся на шпателе микробов в поверх-
ность питательной среды. Далее шпатель переносят на третью
чашку и аналогичным образом производят посев. На первой чашке
вырастет максимальное количество колоний, на третьей - на-
именьшее. В зависимости от содержания микробных клеток в ис-
следуемом материале на одной из чашек разовьются отдельные
колонии, пригодные для выделения чистой культуры микроорганиз-
ма.
4. Рассев петлей. Метод принципиально не отличается от
предыдущего, но более экономичен. Берут одну чашку Петри с
питательным агаром и делят ее на 4 сектора, проводя разгра-
ничительные линии на внешней стороне дна чашки. Отжатую петлю
исследуемого материала вносят в первый сектор и проводят этой
петлей параллельные линии по всему сектору на расстоянии одна
от другой около 5 мм. Этой же петлей, не изменяя ее положения
224
по отношению к агару, проводят такие же линии на других секто-
рах чашки. В том месте, где на агар попало большое количество
микробных клеток,рост микроорганизмов будет в виде сплошного
штриха. На секторах, куда попало небольшое количество клеток,
разовьются отдельные колонии.
5. Метод фильтрации основан на пропускании исследуемого
материала через специальные фильтры с определенным диаметром
пор и разделении содержащихся микроорганизмов по величине.
Этот метод применяется главным образом для очистки вирусов от
бактерий.
6. Метод получения одноклеточной культуры- с помощью мик-
романипулятора. Все описанные выше методы не гарантируют полу-
чения чистой культуры как потомства одной бактериальной клетки,
поскольку колонии, развивающиеся из одной, двух или более близ-
ко расположенных клеток практически неразличимы. Для получения
чистой культуры рассев следует повторить несколько раз для выяв-
ления возможного загрязнения.. Однако существуют методы, позво-
ляющие получить потомство одной единственной бактериальной
клетки. Один из них - предусматривает использование микромани-
пулятора. Это прибор, с помощью которого под контролем глаза
через микроскоп можно захватить одну микробную клетку и пере-
нести ее'в питательную среду.
7. Выделение одноклеточной культуры в висячей капле яв-
ляется другим методом, позволяющим получить потомство одной
микробной клетки. Для этого на покровное стекло с помощью сте-
рильного чертежного пера наносят несколько капель суспензии
225
микробных клеток в питательной среде. Диаметр капли около I мм.
Концентрацию клеток подбирают таким образом, чтобы в некоторых
каплях содержалась одна микробная клетка. Покровное стекло с
нанесенными каплями используют для приготовления препарата "ви-
сячая капля". Чтобы жидкость не высохла, на дно лунки помещают
каплю воды а края покровного стекла смазывают вазелином. Под
микроскопом находят и отмечают на рисунке капли, содержащие
одну клетку. Создают условия для роста микробной культуры. При
необходимости поддерживать температуру выше комнатной исполь-
зуют специальный нагревательный столик, который помещается на ..
предметный столик микроскопа. Под микроскопом наблюдают разви-
тие микроколонии из одной клетки. Когда колония разовьется,
ее осторожно переносят с помощью узкой полоски стерильной
фильтровальной бумаги в питательную среду.
Методы выделения «истых культур по биологическим
свойствам
I. Метод Шукевича заключается-в посеве исследуемого
материала в конденсационную воду косого агара. При размножении
подвижные формы микробов из конденсационной воды распространяют-
ся на агар, как бы вползают на его поверхность. Отсевая верхние
края культуры в конденсационную воду свежескошенного агара и
повторяя это несколько раз, можно получить чистую культуру.
2. Метод прогревания исследуемого материала позволяет от-
делить спорообразующие бациллы от неспоровых форм. Прогревают
на водяной бане при 80° 10-15 мин. При этом погибают вегетатив-
ные формы, а споры остаются невредимыми и при посеве на соот-
ветствующую питательную среду прорастают.
226
3. Бактериостатический метод основан на различном действии
некоторых химических веществ и антибиотиков на микроорганизмы.
Определенные вещества угнетают рост одних микробов и не оказы-
вают влияния на другие. Например, небольшие концентрации пени-
циллина задерживают рост грамположительных микробов и не вли-
яют на грамотрицательные. Смесь пенициллина и стрептомицина
позволяет освободить грибы и дрожжи от бактериальной флоры.
5% раствор серной кислоты быстро убивает большинство микроор-
ганизмов, а туберкулезная палочка выживает в этих условиях и
дает рост.
4. Метод обогащения предусматривает посев исследуемого
материала на элективные питательные среды, способствующие рос-
ту определенного вида микроба. Все другие виды или совсем не
растут на такой среде, или их развитие идет настолько медленно,
что они подавляются ростом того микроба, для которого создана
элективная среда . (Примеря использования этого метода приведе-
ны в разделе 14).
5. Метод заражения лабораторных животных или растений
применяется в целях выделения и идентификации патогенных мик-
робов и отделения их от сапрофитной флоры. Для заражения
/то,
подбирают наиболее восприимчивые к предлагаемому возбудителю
инфекции виды животных или сорта растений. После появления у
зараженных организмов признаков заболевания производят посев
их органов и тканей на питательные среды. При выделении и
изучении облигатных паразитов этот метод является основным и
единственным (см. также раздел 15).
227
Цель работы: выделить чистые культуры из смеси микроорга-
низмов методом рассева петлей.
Материалы: культуры микроорганизмов: взвесь с концентра-
цией микробных клеток 50 млн/мл, содержащая
смесь культур: St.aureus, B.coli; St.aureus,
Вас.subtilis; Serratia marcescens, Вас.
subtilis и-т.п., чашки Петри и пробир-
ки с МПА.
Делают препараты окрашенных по Граму клеток, чтобы убе-
диться, что взвесь содержит смесь микроорганизмов. Рассевают
взвесь на чашке, как это указано выше. Инкубируют 5-7 дней
при 37°С. Наблюдают результаты посева. Описывают отдельные ко-
лонии, обращая внимание на их отличительные особенности: окрас-
ку, форму, размер, консистенцию и т.д. Из отдельных колоний го-
товят окрашенные по Граму препараты, чтобы убедиться, что коло-
нии содержат чистую культуру микроорганизмов. Отсевают микроор-
ганизмы из тех же колоний, из которых брали материал для микрос- ,
копирования, на пробирки с МПА. Выращивают при 37° 24 часа. Сно-
ва готовят препараты, окрашенные по Граму, чтобы проверить чис-
тоту полученной культуры.
$
Культивирование и выделение чистых культур анаэробов ,
Л
Для культивирования анаэробов необходимо понизить окисли-
тельно-восстановительный потенциал ( rHg) среды, создать усло-
вия анаэробиоза, т.е. пониженного- содержания кислорода в среде
и окружающем ее пространстве. Это достигается применением фи-
зических, химических и биологических методов.
Физические методы основаны на выращивании микроорганиз- ,
228
мов в безвоздушной среде, что достигается:
I. Посевом в среды, содержащие редуцирующие и легко окисля-
емые вещества.
2. Посевом микробов в глубину плотных питательных сред.
3. Механическим удалением воздуха из сосудов, в которых
выращивают анаэробные микроорганизмы.
4. Заменой воздуха в сосудах каким-либо индифферентным га-
зом.
Посев в среды с редуцирующими веществами. В качестве реду-
цирующих веществ обычно используют кусочки (около 0,5г) живот-
ных или растительных тканей (печень, мозг,почки,селезенка,
кровь,картофель, вата). Эти ткани, связывают растворенный в сре-
де кислород и адсорбируют бактерий.
Чтобы уменьшить содержание кислорода в питательной среде,
ее перед посевом кипятят 10-15 мин, а затем быстро охлаждают
и заливают сверху небольшим количеством стерильного вазелино-
вого масла. Высота слоя масла в пробирке около I см.
В качестве легко окисляемых веществ используют глюкозу,
лактозу и муравьинокислый натрий.
Лучшей жидкой питательной средой с редуцирующими вещества-
ми является среда Китт-Тароцци. Она содержит концентрированный
мясо-пептонный бульон с 0,5-1% глюкозы, 0,15% агара и кусочки
свежевареных тканей животных (печень). Сверху среду заливают
вазелиновым маслом. Эта среда используется с успехом для накоп-
ления анаэробов при первичном посеве из исследуемого материала
и для поддержания роста выделенной чистой культуры анаэробов.
Посев микробов в глубину плотных сред производится по
229
способу Виньяль-Вейона.
Способ Виньяль-Вейона состоит в механической защите посе-
вов от кислорода воздуха. Берут стеклянную трубку длиной 30 см
и диаметром 3-6 мм. Один конец трубки вытягивают в капилляр в
виде пастеровской пипетки, а у другого конца делают перетяжку.'
В оставшийся широкий конец трубки вставляют ватную пробку. В
пробирки с расплавленным и охлажденным до 50° агаром засевают
исследуемый материал. Затем насасывают агар в стерильные вей-
оновские трубки. Капиллярный конец трубки запаивают в пламени
горелки и трубки помещают в термостат. Выращивание в таких
трубках надежно защищает среду от атмосферного воздуха. Соз-
даются благоприятные условия для роста самых строгих анаэробов.
Для выделения изолированной колонии из трубки ее, соблюдая
правила асептики, надрезают напильником на уровне колонии, ло-
мают, а колонию захватывают стерильной петлей и переносят в
пробирку с питательной средой для дальнейшего выращивания и
изучения в чистом виде.
Удаление воздуха производится путем его механического
откачивания из специальных приборов - анаэростатов, в которые
помещают чашки с посевом анаэробов. Анаэростат (рис.82) пред-
ставляет собой толстостенный металлический цилиндр с хорошо
притертой крышкой (с резиновой прокладкой), снабженный отводя-
щим краном и вакууметром. Внутри находится этажерка или ведер-
ко для размещения чашек ’Петри или пробирок с посевами. После
размещения чашек воздух из анаэростата удаляют с помощью
вакуумного насоса. Отрицательное давление доводят до 0,5-0,8
атм, после чего кран перекрывают, отъединяют анаэростат от
насоса и переносят в термостат при 37°.
230
Рис.82. Микроанаэростат
Рис.83. Стеклянный вакуум-
ный эксикатор
Замена воздуха индифферентным газом (азотом,водородом,
аргоном, углекислым газом) может производиться в тех же анаэ-
ростатах или эксикаторах (рис.83) путем вытеснения его газом
из баллона.
Химические методы основаны на поглощении кислорода воз-
духа в герметически закрытом сосуде (анаэростат,эксикатор)
такими веществами, как пирогаллол или гидросульфит натрия
(1ш2з2о4) которые в щелочной среде способны поглощать большое
количество кислорода.
При создании анаэробных условий следят за тем, чтобы в
окружающей культуру среде содержалось некоторое количество
углекислоты, которая необходима многим микроорганизмам. Нап-
ример, пирогаллол рекомендуется растворять только в растворе
231
соды, но не в едких щелочах, чтобы не происходило поглощение
со2.
Сосуд с восстановителем помещают в анаэростат рядом с чаш-
ками или пробирками с посевами. При использовании вакуумного '
эксикатора, реактивы, отнимающие кислород, можно поместить на
дно эксикатора.
»«г3204 1:‘г32°з 1',“2S°4
Биологические методы основаны на совместном выращивании
на одной чашке анаэробов с жадно поглощающими кислород аэро-
бами. Для этого из застывшей агаровой пластинки по диаметру
чашки вырезают стерильным скальпелем полоску агара шириной око-
ло I см. Получается два агаровых полудиска в одной чаше. На
одну сторону агаровой пластинки засевают аэроб, например, часто
используют St.aureus или. 3orratia загсеscens.
На другую сторону засевают анаэроб. Края чашки заклеивают плас-
тилином или заливают расплавленным парафином и помещают в тер-
мостат. При наличии подходящих условий в чашке начнут размно-
жаться аэробы. После того, как весь кислород в чашке будет ими
использован, начнется рост анаэробов (на 3-4 сутки). В целях
сокращения воздушного пространства в чашке питательную среду
наливают возможно более толстым слоем.
Комбинированный метод основан на сочетании физических,
химических и биологических методов создания анаэробиоза.
Цель работы: выделить из почвы чистую культуру анаэробных
микроорганизмов по способу Виньяль-Вейона.
Материалы: образца почвы, трубки Виньяль-Вейона,МПА.
232
Приготавливают взвесь почвы. Для этого I г образца почвы
помещают в колбу емкостью 250 мл, содержащую 100 мл стерильной
воды. Встряхивают на качалке 15 мин, дают отстояться 5 мин,
чтобы осели крупные частицы. Получают таким образом разведение
почвы 1:100. Разбавляют взвесь еще в 10;100 и 1000 раз, внося
последовательно по I мл взвеси в пробирки с 9 мл стерильного
физиологического раствора.
В пробирки с 10 мл расплавленного и охлажденного до 50°
о л
МПА засевают по 0,1 мл взвеси, разведенной до 1:10 , 1:10^ и
1:10^, быстро перемешивают и засасывают в стерильные трубки
Виньяль-Вейона. Выращивают 24 часа при 37°. Под лупой или при
малом увеличении микроскопа просматривают и описывают выросшие
колонии. Пересевают микроорганизмы из- отдельных колоний на
среду Китт-Тароцци, как это описано выше, выращивают при 37°. .
Затем изучают подвижность микроорганизмов в препарате "раздав-
ленная капля". Наблюдают особенности клеток в мазках, окрашен-
ных по Граму и Цилю-Нильсену. Результаты опыта вносят в таблицу.
Некоторые морфологические особенности анаэробных микроор-
ганизмов почвы
Разведение суспензии почвы № | Форма колонии'колонии Подвижность клеток Окраска по Гра- му Наличие спор Рисунок
1:1000 I
и т.д. • • •
233
Литер ату р а
Большой практикум по микробиологии. Под ред. Г.Л.Селибе-
ра. М., 1962.
Ежов Г.И. Руководство к практическим занятиям по сельскохо-
зяйственной микробиологии. М.,1974.
М е й н е л л Дж..МейнеллЭ. Экспериментальная микро-
биология. М., 1967. ।
Пяткин К.Д. Микробиология с вирусологией и иммунологией.
М.» 1971.
234
6. ИЗМЕРЕНИЕ МИКРОБНЫХ КЛЕТОК. МЕТОДЫ МИКРОМЕТРИИ.
Размеры клеток микроорганизмов определяют под микроскопом
с помощью окулярной линейки (микрометра) или окулярного винтово-
го микрометра. У кокков измеряют диаметр, у других форм - дли-
ну и ширину клетки. Результаты измерений выражают в микрометрах
,(мкм). Для измерения лучше использовать живые, а не фиксирован-
ные клетки, т.к. фиксация и окраска может несколько изменять их
размеры. Если клетки подвижны, препарат слегка подогревают или
к капле исследуемой суспензии добавляют каплю 0,1% водного раст-
вора агар-агара.
В окуляр микроскопа вставляют окулярную линейку. На столик
микроскопа кладут препарат, фокусируют объект и определяют,
скольким делениям линейки соответствует длина и ширина клетки
при данном увеличении микроскопа. Чтобы результат был достовер-
ным, измеряют не менее 10-20 клеток.
Размеры клеток ............. при увеличении микроскопа......
в делениях окулярной линейки в мкм
Длина ; Ширина Длина Ширина
1
Однако делениями окулярного микрометра нельзя непосредст-
венно измерить клетку, т.к. деления линейки просматривают толь-
ко через верхнюю линзу окуляра, а клетки - через объектив и оку-
ляр. Поэтому необходимо определить цену деления окулярного мик-
рометра для данного увеличения микроскопа и выразить ее в мкм.
Это делают с помощью объективного микрометра. Объективный микро-
235
метр представляет собой нанесенную на стекло линейку длиной 1мм,
которая разделена точно на 100 частей,так что одно деление её
соответствует 0,01 мм или 10 мкм.
Для определения цены деления окулярной линейки на столик
микроскопа вместо препарата помещают объективный микрометр и
вначале при малом увеличении фокусируют изображение линейки.
Затем перемещают её в центр поля и меняют объектив на тот,при
котором измеряли клетки. Перемещая столик микроскопа и поворачи-
вая окуляр,устанавливают микрометры так,чтобы их шкалы были па-
раллельны и одна перекрывала другую. Совмещают одно из делений
шкалы микрометров и находят их следующее совмещение. Устанавлива-
ют, какую часть деления объективного микрометра составляет одно
деление окулярной линейки и умножают полученное число на 10.Та-
ким образом получают цену деления окулярного микрометра в микро-
метрах для данного увеличения микроскопа. Например,(рис.84),в 4
деления объективного микрометра,т.е. в 40 мкм,укладывается 13
делений окулярного микрометра,следовательно,одно деление окуляр -
ного микрометра при данном увеличении микроскопа соответствует
3,08 мкм.
Точные размеры клеток можно определить,используя винтовой
окулярный микрометр (рис.85).который закрепляют на тубусе микрос-
копа, предварительно выцув окуляр. В окуляре винтового микрометра
имеется неподвижная шкала с ценой деления I мм и подвижная стек-
лянная пластинка с перекрестием. Пластинка связана с микрометри-
ческим винтом-барабаном и перемещается вместе с перекрестием от
его вращения. Цену деления барабана для каждого объектива опре-
деляют также с помощью объективного микрометра. Для изме-
рения клетки вращением винта - барабана подводят
236
- - 10rw.
Рис.85. Винтовой окуляр-
ный микрометр: I-корпус;
2-отсчетный барабан,3-
окуляр с диоптрийной на-
водкой; 4-винт для креп-
ления на тубусе микрос-
копа^- вид под микрос-
копом.
Рис.84. Определение цены
деления окулярного микро-
метра: 1-деление объектив-
ного микрометра; 2-деление
окулярного микрометра.
перекрестие к концу клетки и отмечают деление на барабане. За-
тем, вращая барабан, перемещают перекрестие к концу клетки и
отмечают вновь деление на барабане. Определяют, скольким деле-
ниям винта-барабана соответствует размер клетки и умножают по-
лученное значение на цену деления барабана при данном увеличе-
нии микроскопа.
Лите.ратура
Большой практикум по микробиологии. Под ред. Г.Л.Селибера.
М.,1962.
Ежов Г.И. Руководство к практическим'занятиям по сельскохо-
зяйственной микробиологии. М.,1974.
М е й н е л л „с , 14 е й н е л л Э. Экспериментальная микро-
биология. М.,1967.
Пяткин К.Д. Микробиология с вирусологией и иммунологией.
М., 1971.
237
7. ИЗМЕРЕНИЕ БАКТЕРИАЛЬНОЙ МАССЫ И ЧИСЛА МИКРОБНЫХ
КЛЕТОК. ИЗУЧЕНИЕ ФАЗ РОСТА МИКРООРГАНИЗМОВ.
Вопросы для подготовки по теме
I. Фазы роста бактерий,дрожжей и грибов.
2. Кривые роста и их различие при оценке роста однокле-
точных и нитчатых организмов.
3. Число бактерий и бактериальная масса.
При росте культуры масса и число бактерий изменяются отно-
сительно независимо друг от друга. В лаг-фазе масса бактериальной
культуры увеличивается без изменения числа клеток. Напротив, в
конце фазы экспоненциального размножения, когда величина клеток
уменьшается, изменяется в основном их число. Отношение массы к
числу бактерий изменяется также и при изменении питательной сре-
ды экспоненциально растущей культуры. Отношение массы к числу
клеток возрастает особенно сильно при наличии поврежденных
клеток, которые иногда увеличиваются в размерах без последующе-
го деления.
Поэтому при измерении роста культуры бактерий массу и чис-
ло микроорганизмов следует определять независимо друг от друга.
Измерение бактериальной массы
Величину биомассы определяют по ее сухому весу или с по-
мощью химических анализов.
Определение сухого веса. Ii образцу культуры добавляют
формалин до конечной концентрации I*.. Смесь переносят в зара-
нее взвешенную пробирку и центрифугируют. Осевшие клетки про-
мывают сначала Э,с5* раствором /аСб в растворе формалина,
а затем 0,05* раствором ХаС£ или дистиллированной водой. Оса-
док сушат при 105° в сушильном шкафу до постоянного веса.
Химические анализы. 0 величине бактериальной массы часто
судят по результатам определения бактериального азота или белка.
Во многих случаях это верно,но если существенная часть азота
клеток содержится в структуре, образование которой не зависит
от роста цитоплазмы (например, капсулы бацилл, состоящие из
полиглутаминовой кислоты), следует пользоваться другими мето-
дами. В подобных случаях можно определять ДНК или фосфор, со-
держащиеся в клетках микроорганизмов.
Светорассеяние. Количество света, рассеиваемого суспензи-
ей бактерий, пропорционально либо их концентрации (выраженной
в единицах массы или числом клеток), либо средней длине бакте-
рии. Общее количество рассеянного света пропорционально отно-
шению размера частицы к длине волны падающего света. Отсюда
следует, что: а) при данной длине волны падающего света рас-
сеяние тем больше, чем крупнее микроорганизмы, и б) для мик-
робов дачного размера светорассеяние тем больше, чем меньше
длина волны падающего света. Светорассеяние, вызываемое микро-
бами в питательном бульоне, наиболее удобно измерять При 650
ммк, т.к. при этой длине волны оптическая плотность бульона
минимальна. Для измерений используют фотоэлектроколориметр или
спектрофотометр.
"а практике доя определения концентрации бактерий давно
используется простой субъективный метод, основанный на визу-
альном сравнении мутности исследуемой бактериальной суспен-
зии со стандартами мутности. Такими стандартами служат пробир-
ки, содержащие различные суспензии, например,сернокислого ба-
239
рия или мелкоизмельченного стекла в воде, для сравнения про-
бирки с анализируемой и стандартной суспензиями ставят рядом на
фоне белой карточки, на которую нанесены черные линии, распо-
лагая их так, чтобы на них падал свет,, лучше дневной. Опалес-
ценцию анализируемой суспензии можно оценить с точностью поряд-
ка 10% от стандартной.
Определение общего числа клеток
Для определения общего числа клеток обычно используют
счетные камеры, иногда применяют и другие методы, например,
подсчет клеток в окрашенных мазках или измерение светорассея-
ния.
Счетные камеры. Подсчет в камерах возможен только для
клеток, имеющих достаточно крупные размеры, позволяющие при
микроскопировании применять оптические системы со сравнитель-
но малым увеличением, он удобен для подсчета клеток дрожжей и
крупных бактерий.
Счетная камера (Горяева, Тома) имеет вид толстого предмет-
ного стекла с углублением. На дно камеры нанесена сетка, разде-
ленная на ряд больших квадратов, часть которых разделена на 13
малых квадратов площадью Т/ОО^м^. Глубина камеры составляет
0,1 мм, таким образом, объем малого квадрата 1/4000 ммд.
Каплю суспензии бактерий помещают в камеру и накрывают
толстым покровным стеклом. При необходимости суспензию разво-
дят, чтобы в большом квадрате было не более 50 клеток. Для
того, чтобы убедиться в полноте заполнения камеры и, следо-
вательно, в соответствии расчетного значения объема камеры дей-
ствительному объему находящейся в ней суспензии, покровное
стекло следует несколько раз сместить в противоположные сторо-
ны. Образование колец Ньютона свидетельствует о правильном за-
полнении камеры. Прежде, чем перейти к подсчету, надо дать
микробам осесть. Подвижные или патогенные формы следует пред-
варительно убить нагреванием или с помощью формалина.
Чтобы результат подсчета был достоверен, в одной пробе
должно быть сосчитано не менее 600 клеток. Поскольку точность
определения зависит от того, насколько плотно покровное стекло
прилегает к поверхности камеры, следует установку стекла повто-
рить несколько раз, например, четыре, каждый раз подсчитывая
по 150 клеток.
Рекомендуется подсчитывать клетки в 10 больших квадратах
при каждом заполнении камеры, далее вычислить среднее число
клеток в одном большом квадрате (а) и рассчитать концентрацию
клеток в суспензии по формуле
з;_а-1000 -4000 t ъ
К
где х- число клеток в I мл суспензии
а- число клеток в одном большом квадрате
Ь - разведение.
Подсчет клеток в окрашенных мазках . Пользуясь микропипет-
кой, наносят на предметное стекло каплю известного объема, нап-
ример, 0,01 мл, и размазывают её так, чтобы она заняла площадь
около I см^. Мазок фиксируют, окрашивают, после чего производят
подсчет. Общее число микроорганизмов, содержащихся в 0,01 мл,
равно числу клеток, видимых в поле зрения микроскопа, деленно-
му на площадь поля зрения, выраженную в квадратных сантиметрах.
241
Площадь поля зрения определяют методом микрометрии (см. раздел
"Измерение клеток").
Подсчет микробных клеток в агаровых пленках . Равные объе-
мы взвеси культуры и расплавленного агар-агара, содержащего не-
большое количество туши, смешивают при 45°. Затем 0,005 мл сме-
си наносят микропипрткой на предметное стекло, нагретое до 45°.
Препарат накрывают покровным стеклом и оставляют при комнатной
температуре до застывания агара. В результате получают пленку
толщиной 10-20 мкм. Подсчет клеток производят с помощью фазово-
контрастного микроскопа, снабженного объективом с масляной
иммерсией. Величину площади, на которой локализуются учтенные
особи, определяют методом микрометрии, а толщину пленки - по
иониусу тонкой регулировки, фокусируя микроскоп на частицах
туши, лежащих на предметном стекле и непосредственно под пок-
ровным стеклом.
Подсчет живых микроорганизмов
Жизнеспособными клетками считают микроорганизмы, способ-
ные образовывать макроскопические колонии на питательном ага- -
ре или вызывать видимое помутнение при подсчете методом разве-
дений. Величины, получаемые при подсчете живых микроорганизмов,
нельзя считать абсолютными, т.к. они часто зависят от условий
эксперимента (например, от питательной среды) и от состояния
микроорганизма.
Существует два основных, метода подсчета живых организмов:
I. Метод подсчета колоний и 2.Метод серийных разведений. Более
точные результаты дает первый метод.
Подсчет колоний. Различные методы подсчета колоний разли-
242 '
чаются в основном по способу выращивания отдельных, поддающих-
ся учету колоний. Наиболее простой способ состоит в том, что
посевной материал равномерно распределяют по поверхности хоро-
шо высушенного питательного агара. При другом способе посевной
материал сначала смешивают с расплавленным агаром и разливают
в пустые чашки, или на поверхность застывшего питательного ага-
ра в чашке, или равномерно распределяют по стенкам пробирки.
Чтобы получить отдельные колонии, бактериальные суспензии
приходится, как правило, разводить. Для этого удобнее всего,
пользуясь некоторым постоянным коэффициентом разведения, полу-
чить серию разведений, концентрации которых образуют геометри-
ческую прогрессию. Например, в пробирки наливают по 9 мл физиоло-
гического раствора. В первую пробирку вносят I мл исходной
суспензии, перемешивают, берут из нее I мл и вносят в следую-
щую пробирку и т.д., получая разведения 1:10,10 и т.д. При
приготовлении разведений вегетативных клеток бактерий для каж*
дого разведения следует использовать отдельную пипетку. Пре-
небрежение этой предосторожностью может привести к получению
ошибочного результата, в результате чего часть их остается в
пипетке и попадает в одно из последующих разведений. Суспен-
зии спор ведут себя противоположным образом: при использова-
нии вымытых кислотой пипеток на их стенках остается слой раст-
ворителя, совершенно не содержащего спор.
Метод серийных разведений. Готовят серийные разведения
таким же образом, как для подсчета колоний. Материалом, взя-
тым из приготовленных-разведений, засевают определенное чис-
ло пробирок, содержащих питательную среду. После инкубации
243
все пробирки, засеянные неразбавленным материалом, окажутся
мутными, а пробирки, засеянные материалом в малых концентра-
циях - прозрачными. В ряду, где посев был произведен матери-
алом промежуточной концентрации, часть пробирок окажется
мутной, а часть прозрачной. Соотношение тех и других проби-
рок зависит от числа живых клеток в исходной культуре. ДЛя
определения наиболее вероятного количества клеток в единице
объема используют методы вариационной статистики (таблица
Мак-Креди). Составляют числовую характеристику, которая
включает три цифры. Первая цифра показывает число пробирок в
том последнем разведении, при высеве из которого во всех
засеянных пробирках отмечен рост. Две следующие.цифры обозна-
чают число пробирок, в которых отмечен рост микроорганизмов
при засеве их из двух последующих разведений. Затем по табли-
це находят наиболее вероятное число микроорганизмов, соответ-
ствующее данному значению числовой характеристики. Количество '
микробных клеток в I да исходного субстрата соответствует это-
му числу, умноженному на то разведение, которое было взято для
получения первой цифры числовой характеристики. Например,
Разведение исходной суспензии 0 1:10 1:100 1:1000 1:10003
Число засеянных пробирок 4 4 4 4 4
Число пробирок,в которых обнаружен рост 4 4 3 I 0
Числовая характеристика 431
Наиболее вероятное число микробных клеток 16,5
Наиболее вероятное число клеток в I мл(1г)субстрата(лГ) 165
244
Для определения доверительного интервала используют коэф-
фициент ш, величина которого зависит от коэффициента разведе-
ния (К) условия значимости (Р) и числа засеянных пробирок ( п).
Значение коэффициента ш при К=10 и Pq gg в зависимости от
числа засеянных пробирок дано в таблице.
Доверительный интервал вычисляют, используя формулу:
Значение коэффициентаm при К=10 и Pg gg в зависимости от
числа засеянных пробирок
Число засеянных
пробирок I 2 3 4 5 & ... 10
Коэффициентш 14,456,61 4,683,803,302,98 2,32
Следовательно, доверительный интервал количества клеток
Т65
лежит в пределах от g-jj до 165’3,8, т.е. в I мл субстрата ко-
личество клеток может быть от 43,4 до 627,0.
Чтобы получить достоверные результаты при использовании
этого метода, необходимо соблюдать особую тщательность и ак-
куратность во время приготовления разведений и посева.
Изучение фаз роста микроорганизмов
Цель работы: изучить динамику роста популяции дрожжей
на жидкой питательной среде, построить кривую роста.
Материалы: среда Чапека с добавлением 5^ сусла в пробир-
ках по 5 мл (на одну культуру 6 пробирок), или в качалочных
колбах Спо одной колбе на каждую культуру). Камеры Горяева,
нефелометры.
Лосев. Готовят взвесь дрожжевой культуры в физиологичес-
ком растворе. Подсчитывают ее концентрацию, которая должна
245
составлять около 5 млн клеток в I мл. Взвесью засевают пита-
тельную среду, внося 0,1 объема микробной суспензии на I объем
питательной среды.
Выращивание. на качалках при 28°. Отбор проб через 2 ча-
са, 4, 6, 8, 24 и 48 часов.
Учет результатов. В каждой пробе определяют число дрожже-
вых клеток путем подсчета в камере или нефелометрически. Исполь-
зуя полулогарифмическую шкалу, строят кривую роста микробной
популяции. Оценивают продолжительность каждой фазы роста культу-
ры. Вычисляют константу скорости роста и время генерации (для
логарифмической фазы роста) по формуле:
К=_1йЫеЫ tlg2 °" где К 0- начальная концентрация клеток;
G к N - конечная концентрация клеток; t - время выращивания;
G - время генерации, т.е. время, требующееся для одного цикла деления.
К- константа скорости деления или число клеточных делений за
I час.
Например,
до 5-10®,
81£ 2 .
• а время генерации составляет
I =2,4 часа.
0,416
если за 8 часов число клеток в I мл возрастет от 5-10°
тогда
---- = 0.416
24С
Литер ату р а
Ашмарин И.П., Вороб ьева А.А. Статистические ме-
тоды в микробиологических исследованиях. Л.,1962.
Большой практикум по микробиологии. Под ред. Г.Л.Селибе-
ра. М., 1962.
Елино в Н.П. Общие закономерности строения и развития мик-
робов-продуцентов биологически активных веществ. Л.,1977.
Ежов Г.И. Руководство к практическим занятиям по сельскохо-
зяйственной микробиологии. М., 1974.
Практикум по микробиологии. Под ред. Н.С.Егорова. М.,
1976.
247
8. МОЛЕКУЛЯРНЫЙ СОСТАВ МИКРОБНОЙ КЛЕТКИ
8.1. ДЕЗИНТЕГРАЦИЯ МИКРОБНЫХ КЛЕТОК
ПОЛУЧЕНИЕ КЛЕТОЧНЫХ СТЕНОК МИКРООРГАНИЗМОВ.
ИЗУЧЕНИЕ ИХ УГЛЕВОДНОГО СОСТАВА.
Вопросы для подготовки по теме
I. Получение клеточных стенок микроорганизмов.
2. Качественные реакции на углеводы.
3. Количественное определение редуцирующих веществ
в клеточной стенке.
4. Определение моносахаридного состава клеточной
стенки методом распределительной хроматографии на бумаге.
5. Получение полисахаридных препаратов из клеточных
стенок микроорганизмов.
6. Гель-хроматография полисахаридных препаратов.
Материалы, необходимые для лабораторных работ по разделу 8/.
Дезинтегратор для микроорганизмов, центрифуга (К-23, ЦЛН-2,
или ЦЛС-3, центрифужные стаканы, хроматографическая камера,
хроматографическая бумага, трафарет для вырезания хроматографи-
ческой бумаги, фотоэлектроколориметр, сушильный шкаф, водяная
баня, весы (аналитические, торсионные, чашечные, для центрифуж-
ных пробирок), химические стаканы, колбы, мерные стаканы, мер-
ные колбы разные, конические воронки >2 и 4; пробирки химичес-
кие, пипетки разные, стеклянные палочки, резиновые груши, фильт-
ровальная бумага, ацетон, конц. HgSO^, 5Х водный раствор фенола.
Получение клеточных стенок микроорганизмов
Цель работы . Познакомиться с методами дезинтеграции мик-
роорганизмов на дезинтеграторе баллистического типа; изолировать
248
клеточные стенки дрожжевых клеток из гомогенизата после разру-
шения клеток.
Ход работы: Навеску воздушно-сухих дрожжевых клеток (Юг)
помещают в 200 мл стакан. Заливают в стакан 160 мл дистиллиро-
ванной воды и, перемешивая стеклянной палочкой, готовят однород-
ную суспензию микробных клеток. Полученную суспензию дрожжевых
клеток загружают в дезинтегратор и подвергают разрушению в пе-
риодическом режиме, как было указано ранее.
После 5-7 минут работы дезинтегратора двигатель выключают
и через штуцер (27) (рис.23) бактериальной петлей отбирают про-
бу для проверки полноты разрушения клеток (делают мазок и окра-
шивают по Граму). При наличии в поле зрения целых клеток опера-
цию повторяют.
При 100%-ом разрушении клеток (т.е. в поле зрения нет ни
одной клетки, окрашенной по Граму положительно) суспензию сли-
вают в тот же стакан, из которого загружали, предварительно
его вымыв. Затем суспензию разливают по центрифужным стаканам
приблизительно по 60 мл, тщательно уравновешивают на весах и
производят центрифугирование при 3000 об/мин в течение 15 мин.
Надосадочную жидкость сливают, а осадок в центрифужных стака-
нах промывают 40 мл (в каждом стакане) дистиллированной воды,
перемешивая содержимое в течение 5 минут стеклянной палочкой,
и снова центрифугируют при тех же условиях. Надосадочную (про-
мывную ) воду сливаот, а осадок в центрифужных стаканах обра-
батывают ацетоном, перемешивая стеклянной палочкой, и перено-
сят на коническую воронку с бумажным фильтром. Воронка встав-
лена в колбу на 200 мл. На воронке осадок промывается ацето-
ном до тех пор пока не станет рассыпчатым. После этого осадок
249
с бумажного фильтра переносят на чистую чашку Петри,тщатель-
но измельчают стеклянной палочкой и ставят в сушильный шкаф
(50°0) на I час. Воздушно-сухие клеточные стенки взвешивают
и подсчитывают их процентное содержание в воздушно-сухих це-
лых клетках.
Качественная реакция с фенол-серной кислотой
на содержание углеводов в клеточной
стенке
Минеральные кислоты способны отщеплять от углеводов воду.
При этом из пентоз образуется фурфурол, а из гексоз <х) - окси-
метилфурфурол.
СНОП—СНОП Н„30
СН20Н СНОП—СПО - 3 HgO
пентоза
фон—слои h2so4
Н0СН2—СНОН СНОН—ОНО - 3 Н20
гексоза
НС—сн
фурфурол
НС—сн
II II
носн2—с с—сно
\/
С*)- оксиметилфурфурол
[Концевые углеродные атомы какого-нибудь соединения по предло-
жению А.Байера (I835-I9I7) часто обозначают ft) ; например,
Ct^0H(CH2)4C00H - - оксикапроновая кислота^
Фурфурол и оксиметилфурфурол способны конденсироваться с
некоторыми ароматическими спиртами (например, фенолом, Z- наф-
толом, тимолом и др.) с образованием триарилметанового хро-
250
могена, который окисляясь в серной кислоте,дает окрашенное хи-
ноидное соединение. Это используется на практике для качествен-
ного обнаружения углеводов.
ОН
фурфурол фенол
Диарилметановый хромоген
Цель работы. Определить качественно наличие углеводов
в клеточной стенке дрожжей.
Ход работы. 3 мг воздушно-сухих клеточных стенок помеща-
ют в пробирку,добавляют 0,5 мл дистиллированной воды и встря-
хивают в течение 10 минут (или растирают стеклянной палочкой).
Затем добавляют 0,5 мл 5% водного раствора фенола и 2,5 мл
концентрированной серной кислоты. При наличии в клеточной стен-
ке углеводов появляется интенсивное красное окрашивание.
251
Определение редуцирующих веществ в клеточной
стенке после гидролиза 2 Н серной кислотой
а) Метод Хагедорна-Иенсена.
Метод основан на окислении восстанавливающих групп саха-
ров железосинеродистым калием (феррицианидом калия) в щелочной
среде и на йодометрическом определении его избытка. Определение
производят в присутствии соли цинка, которая осаждает образовав-
шийся железистосинеродистый калий (ферроцианид калия) и способ-
ствует тем самым количественному ходу реакции:
Н'-^О
I. 2К3Ре(СТ)б + (СН0Н)4 + 2 КОН
феррицианид CHgOH
калия глюкоза
ОН О
cz
(СНОН)4 + HgO +K3?e(Cir)g (избыток)
сн2он
глюконовая
кислота
2.
3.
2K4Pe(CN)6 +
ферроцианид
калия
2K4Pe(CN)6 + 3ZnSO4 —— K2Zn3|Pe(CH)6J 2 + 3K2SO4
нерастворимая комплексная
тройная соль
2K3Fe(CH)6 + 2KI — —2К4?е(СЯТ)б + 12
.Зак. 1)63
’4. I, + 2Na„So0, ------------- 2KaI + Na9S.Ofi
d d d J d 4 о
гипосульфит натрия
тетратионат
натрия
252
Цель работы; Определять количество редуцирующих веществ
в клеточной стенке дрожжей с использованием
йодометрического титрования.
Материалы. Микробюретка на 2 мл, специальные пробирки
диаметром 29 мм и высотой 105 мм - 4, ампула на 10 мл; мерная
колба на 50 мл; 0,005 Н раствор железосинеродистого калия,
2,5% раствор иодида калия в растворе сульфата цинка с хлоридом
натрия ( 10 г znso^ + 50 г HaCI и доводят до 200 мл дистиллиро-
ванной водой). Раствор йодида калия готовят перед самым употреб-
лением; 0,005Н раствор серноватйстокислого натрия^а252Оу 5Н2О )
3% раствор уксусной кислоты, 1% раствор крахмала, 2 Н серная
кислота.
Ход работы. Навеску клеточных стенок (5 мг) помещают в ампу-
лу на 10 мл, приливают 0,5 мл 2 Н серной кислоты. Ампулу запаива-
ют на пламени спиртовки и ставят на кипящую водяную баню на 4 ча-
са. После гидролиза содержимое ампулы количественно переносят в
50 мл мерную колбу,промывая ампулу 3-4 раза дистиллированной во-
дой. Нейтрализуют содержимое мерной колбы I Н Каон и доводят
дистиллированной водой до метки. Из мерной колбы берут две па-
раллельные пробы по I мл и помещают в специальные пробирки.
Для контрольного опыта в такие же пробирки приливают по I мл
дистиллированной воды. Во все пробирки добавляют по 2 мл 0,005 Н
железосинеродистого калия и ставят в кипящую водяную баню точ-
но на 15 минут. После нагревания все пробы быстро охлаждают до
комнатной температуры , добавляют в каждую 3 мл 2^5% раствора
йодида калия в растворе сернокислого цинка и хлористого натрия,
2 мл уксусной кислоты и 2-3 капли 1% раствора крахмала. Затем
пробы титруют 0,005 Н раствором серноватистокислого натрия из
253
микробюретки. Добавлять все реактивы следует перед самым титро-
ванием. Количество редуцирующих веществ определяют по таблице 5,
исходя из количества серноватистокислого натрия,пошедшего на
титрование.
Пример расчета содержания редуцирующих веществ в процентах
в исследуемом препарате: предположим на титрование пробы пошло
1,51 мл (средняя величина) 0,005 Н раствора серноватистокислого
натрия, что соответствует по таблице 0,086 мг глюкозы, и на t
титрование контрольной пробы - 1,95 мл (тоже средняя величина
от двух контрольных проб), что соответствует 0,008 мг глюкозы.
Тогда истинное количество глюкозы в I мл пробы будет 0,086-0,008=
=0,078 мг. Отсюда процент редуцирующих веществ (X) в исследу-
емом препарате: ~где 5 мг - исходная
я
навеска материала.
б) йетод с применением 2,3,5 - трифенилтетразолий хлорида.
Метод основан на способности бесцветной соли трифенил-
тетразолий хлорида восстанавливатыдцо окрашенного нераствори-
мого трифенилформазана по уравнению реакции:
и--V----ph +2Н N—ин—рь
Ph—J -------->- ph-----+ НИ
\ц=Н------ph --Ph
СГ
2,3,5 -трифенилтетразолий трифелилформазан
хлорид
Трифенилформазан растворяясь в органических растворителях?
окрашивает их в вишнево-красный цвет.
Цель работы. Определить количество редуцирующих сахаров
254
Св
р
s
Таблица для определения содержания глюкозы по Хагедорну-Иенсену
CQ
со
о
LO СО 1~। Ф Г4- Ю СО Н Ф Г-
COCOCOWCQWWWHH
о о о о о о о . о о
HCQlOCOOW^^^W
сО^СЧООЕ^ЮСОЫО
ЫЬНМкнОООООО
oooooooooo
ооооооооооооо
о
OCOHOOOHW^OCQOWin^^HCOLOa)
^^NOCOtO^NOCOOlOCOHO>0<O^NO
cocococowc^wwwhhmhhoooooo
оооооооооооооооооооо
cnNC\2C\JCW'£CQOCWr''^HC0LQI>O
СМОСО'О^С\2003Г"ЮСОНФСО^^С\2Н
COCONWWNNHHHHHOOOOOO
оооооооооооооооооооо
О 03 ю ю ю со
^''TWOCOCWNO
СОСООСОС\2С\2С\2С\2СЧ
ооооооооо
ОСЧ^’ОФНГЭЮГ4^^
ОЕ>1ЛС0й-1ОС0О’^02М
ЫМЫМЫЫООООО
ООООООООООО
ООГ'-'ОСМО£чСО№НСОЮСООС\2^ЮаЗН^
гоясхгосОФ’^^оо^юсосхгософЗ'сон
COCOCOCOWWWWC^HHHHHHOOOOO
***<£>
оооооооооооооооооооо
ООО
о о О о
О ООООООООООО
О о О О О О ООО О ООООООООООО
I I
Л F Ч
tc ft«=? Св s
О >а!
02 СО Ю <о
о apoPl
255
в клеточных стенках дрожжей фотоколориметрически на основе реак-
ции с трифенилтетразолием.
Материалы. 0,3%-ный водный раствор хлористого 2,3,5-три-
фенилтетразолия; 2 Н раствор едкого натрия, 2,1 Н уксусная кис-
лота, 2 Н серная кислота, этанол.
Ход работы. Навеску клеточных стенок (5 мг) гидролизуют
в 0,5 мл 2 Н н2304 в запаянной ампуле в течение 4 часов на
кипящей водяной бане. Гидролизат количественно переносят в мер-
ную колбу на 50 мл,нейтрализуют 2 Н NaOH и доводят объем дистил-
лированной водой до метки.
Из мерной колбы на 50 мл переносят 2 мл раствора гидролиза-
та в мерную колбу на 25 мл (параллельно ставят контрольный опыт
с 2 мл дистиллированной воды), добавляют I мл 0,3%-ного водного
раствора трифенилтетразолия и I мл 2 Н раствора едкого натрия.
Олесь нагревают 3 минуты на кипящей водяной бане, немедленно
подкисляют I мл 2,1 Н уксусной кислотой,охлаждают и разбавляют
раствор этанолом до объема 25 мл. При этом появляется красная
окраска с максимумом поглощения при 485 нм.
Измерив поглощение исследуемого образца на фотоэлектроко-
лориметре (светофильтр > 4 - сине-зеленый), находят количество
редуцирующих сахаров по предварительно построенной калибровоч-
ной кривой по глюкозе.
Определение аминосахаров в клеточной стенке
микроорганизмов
Конденсация гексозамина с ацетилацетоном в щелочной среде
дает 3 или 4 хромогена, которые затем конденсируются в кис-
лом растворе с р-диметиламинобензальдегидом, образуя окрашен-
256
ные соединения.
Один из наиболее важных хромогенов, видимо, образуется по
реакции:
I 3
Н ОН ОН Н .0 со
сн2он—£ —с-с—£ —с^ + сн2 ИаОН г
ОН Н Н ин2 н со
сн3
р-глюкозамин ацетилацетон
он он сн—с—со—сн.
I I II II
с—С—С С—СНо
I A
нн нн
+ 2 Н20
3-ацетил- 2 -метил - 5 -тетрагидробутилпиррол
(хромоген)
Цель работы. Определить в клеточных стенках дрожжей коли-
чество аминосахаров с использованием реактива Эрлиха.
Материалы. Ампула на 10 мл, химически стойкие резиновые
пробки № 14 - 2,4% ацетилацетон (свежеперегнанный) в Т,5 Н раст-
воре Ha2COj (реактив готовят перед самым употреблением),
б Н НИ , реактив Эрлиха[2,б7% (вес к объему) р-диметиламино-
бензальдегид в смеси (1:1) 95% этанола и концентрированной HC1J.
Ход работы. Навеску клеточных стенок (10 мг) гидролизуют
в I мл б Н ни в запаянной ампуле в течение 8 часов на кипя-
щей водяной бане.Гидролизат количественно переносят в мерную кол-
257
бу на ТОО мл, нейтрализуют TH КаОН и доводят объем дистиллиро-
ванной водой до метки. В пробирку наливают I мл раствора гидро-
лизата, а в качестве контрольной пробы берут пробирку с I мл
дистиллированной воды, добавляют I мл ацетилацетового реактива.
Пробирку закрывают химически стойкой пробкой, встряхивают и
нагревают на кипящей водяной бане в течение 30 минут. Охлаж-
дают пробирку до комнатной температуры, добавляют I мл реакти-
ва Эрлиха (пробирку встряхивают) и оставляют стоять в течение
25 минут. Затем замеряют экстинкцию в контрольной и опытной
пробах на фотоэлектроколориметре при зеленом светофильтре (в
контрольной кювете дистиллированная вода). Содержание аминоса-
харов в пробе находят по стандартной кривой, построенной по
хлоргидрату глюкозамина.
Определение моносахаридов в клеточной стенке
микроорганизмов методом распределительной
хроматографии на бумаге.
Метод основан на различней степени распределения моноса-
харидов между двумя несмешивающимися жидкими фазами (неподвиж-
ной водной фазой и подвижной фазой органического растворителя).
Органический растворитель (например, П-бутанол, насыщен-
ный водой), проходя через полоску фильтровальной бумаги,увле-
кает за собой сахара, раствор которых был нанесен на бумагу.
Различные сахара передвигаются по бумаге с неодинаковей
скоростью. .
После распределения на хроматограмме сахара проявляют
проявителем, например, аниличфталатом.
При этом на бумаге появляются пятна различной окраски в
результате реакции конденсации с' образованием хромогенов и
Зое
последующего их окисления:
конден-
сация
Ф + Н2О
Диаминодифенилметановый
хромоген
окрашенное соединение
где Ф - фталевая кислота
r - остаток сахара
Альдопентозы дают яркую вишнево-нсрасную окраску, альдогек-
созы - неяркую красно-коричневую.
Анилинфталат более чувствителен к альдозам,чем к кетозам.
Цель работы.' Определить количественно и качественно моно-
сахаридный состав клеточных стенок дрожжей методом распредели-
тельной хроматографии на бумаге.
Материалы. Эмалированная кювета,ампула на 10 мл,микропи-
петки на 0,1 мл - 3, 2 Н НС1 , порошок ВаСОд, универсальная
индикаторная бумага; система растворителей - бутанол:этанол:ам-
миак:вода (в соотношении 40:10:1:49,используется верхний слой),
проявитель - анилингидрофталат (0,75 мл свежеперегнанного ани-
лина + 1,66 г фталевой кислоты + 100 мл водонасыщенного бута-
нола) .ледяная уксусная кислота. Свидетели I (смесь равных
объемов 4^ растворов арабинозы,глюкозы,ксилозы и рибозы);
свидетели П (смесь равных объемов 4% растворов галактозы,ман-
259
нозы, фруктозы, фукозы). При таком приготовлении свидетелей I и
II содержание каждого сахара в смеси составляет 1%.
Ход работы. Навеску клеточных стенок (5 мг) гидролизуют
в 0,5 мл 2Н НС1 в запаянной ампуле в течение 4 часов на кипя-
щей водяной бане. Затем гидролизат клеточных стенок разводят
в ампуле в два раза дистиллированной водой и нейтрализуют по-
рошком ВаСОд. Ампулу ставят в центрифужную пластмассовую про-
бирку и центрифугируют ТО мин при 3000 об/мин. После центрифу-
гирования надосадочную жидкость наносят на хроматограмму в
количестве 0,02 мл. На соседние полоски хроматограммы наносят
углеводы - свидетели I и П по 0,0Т мл. Затем хроматограмму
помещают на сутки в хроматографическую банку так, чтобы ее
кончики были погружены в систему растворителей - бутанол:эта-
нол: аммиак: вода приблизительно на 10 мм. По истечении суток
хроматограмму высушивают и снова помещают в хроматографичес-
кую банку (процедуру повторяют трижды). После трехкратного
прохождения хроматограммы системой растворителей ее высушива-
ют, смачивают проявителем, снова высушивают и проявляют в су-
шильном шкафу в течение 5-ТО минут при ТОО-ТО50. После этого
по свидетелям определяют, какие моносахара входят в состав
углеводных полимеров клеточных стенок. Затем вырезают пятна
выявленных моносахаридов и элюируют 3 мл ледяной уксусной
кислоты в пробирках в течение ТО мин. на кипящей водяной ба-
не. Экстинкцию элюатов замеряют на фотоэлектроколориметре про-
тив элюата полоски пустой хроматограммы (такого же размера
как и вырезанная проба), обработанной анилингидрофталатом,
при синем светофильтре в кювете с рабочей длиной 5 мм. Коли-
чество моносахаров в элюате определяют по стандартным кривым,
260
а затем пересчитывают на процентное содержание в воздушно-сухой
клеточной стенке.
Получение полисахаридного препарата
из клеточных стенок микроорганизмов
Извлечение полисахаридных препаратов из клеточной стенки
имеет в своей основе два процесса:
Т) Разрушение структуры клеточной стенки;
2) Экстракцию полисахаридных препаратов клеточной стенки
последующим осаждением их спиртом или ацетоном.
Для разрушения структуры клеточной стенки могут быть ис-
Ряльзованы различные химические агенты. В литературе описано
/гишенение для этой цели воды, глицерина, диэтиленгликоля,
- нафтола, трихлоруксусной кислоты, фенола, детергентов'*
.сбавленных (0,1 Н) растворов минеральных кислот, растворов
' Аточей и др.
В большинстве случаев процесс разрушения структуры кле-
точной стенки сопровождается экстракцией полисахаридных пре-
паратов т.е. переходом их в водный раствор разрушающего хими-
ческого агента.
При этом, чем жестче обработка клеточных стенок, тем глуб-
же разрушение их структуры и тем выше выход полисахаридного
препарата.
Так при экстракции из клеточных стенок дрожжей полисаха-
ридных препаратов водой при 20°C выход последних составляет
%. Обработка же дрожжевых клеточных стенок 3%-ным водным
раствором каОП при 20'J0 позволяет достигнуть выхода полисаха-
ридов 15-23’*.^
В данной работе с целью получения высокого выхода поли-
сахаридного препарата использован один из наиболее жестких ме-
тодов - обработка клеточных стенок 3^-ным водным раствором
ЙаОН при ТОО°С.
Цель работы. Получить полисахаридные препараты из клеток
и клеточных структур.
Материалы. Магнитная мешалка с подогревом, часовое стекло,
диаметром 70 мм, 3% водный раствор КаОН, ледяная уксусная кис-
лота, спирт этиловый, эфир серный.
Ход работы. Навеску клеточных стенок 0,5 г помещают в 50
мл химический стакан, приливают 15 мл 3% НаОН и перемешивают
магнитной мешалкой с обогревом в течение Т часа при 9Э-ЮЭ°С.
Содержимое стакана переносят в полиэтиленовые центрифужные
стаканы и уравновешивают на весах.'Центрифугируют при 5000об/мин
в течение 15 мин. Затем надосадочную жидкость осторожно слива-
ют в Т50 мл химический стакан, а осадок клеточных стенок про-
мывают Т5 мл дистиллированной водой, снова центрифугируют при
тех же условиях. Промывную воду приливают к щелочному экстрак-
ту в Т50 мл стакан. Экстракт и промывные воды нейтрализуют ле-
дяной уксусной кислотой. Полисахаридный препарат осаждают из
экстракта добавлением 4-х объемов этилового спирта. Выпавший
осадок переносят на коническую воронку с бумажным фильтром,
промывают на воронке 3 раза спиртом по 10 мл и 2 раза эфиром
по ТО мл, переносят на часовое стекло и сушат при температуре
40° I час. Полученный препарат взвешивают и расчитывают его
выход в процентах от.биомассы воздушно-сухих клеточных стенок.
Делают реакцию с фенол-серной кислотой для выявления в
препарате углеводов.
Гель-хроматография полисахаридного препарата.
Цель работы. Освоить метод гель-хроматографии для анали-
тических и препаративных целей.
Материалы. Хроматографическая колонка (с внутренним ди-
аметром 8 мм, высотой 200 мм), штатив для хроматографической
колонки,коллектор для отбора фракций с колонки,напорная
склянка на 200 мл, сефадекс G -200 в I/I5 М фосфатном буфере
(рН=6,б), I/I5 М фосфатный буфер, 5^ водный раствор фенола,
концентрированная H^so^.
Ход работы. Хроматографическую колонку заполняют сефадек-
сом G-200, набухшим (в течение трех суток) в I/I5 М фосфат-
ном буфере. Дают возможность гелю осесть (над гелем должно ос-
таться около 3 мл буфера). Колонку с-гелем промывают,пропуская
через нее из напорной склянки I/I5 М фосфатный буфер (промывку
ведут до тех пор,пока во взятой пробе не будет отрицательная
реакция с фенолсерной кислотой).
Навеску полисахаридного препарата (3 мг) растворяют в 0,3-
0,5 мл I/I5 М фосфатного буфера,рН=6,6. После растворения по-
лисахарида раствор центрифугируют при 5000 об/мин в течение
20 минут. Жидкость отсасывают пастеровской пипеткой и осторож-
но наслаивают на поверхность геля. Для этого предварительно
избыток буфера пастеровской пипеткой удаляют из колонки почти
полностью, остатку дают впитаться в гель и в один прием осто-
рожно наносят пипеткой раствор полисахаридного препарата на
поверхность геля. После того как раствор впитается, поверх-
ность геля заливают буфером из пипетки (3 мл) и начинают пода-
вать буфер (элюирующую жидкость) из напорной склянки, в этот
же момент начинают отбор фракций.Фракции собирают по 0,5 мл в
263
40 пробирок. С каждой пробой ставят реакцию с фенолсерной кис-
лотой. Для-этого в каждую пробирку добавляют 0,5 мл 5% фенола и
2,5 мл концентрированной серной кислоты.После охлаждения проби-
рок до комнатной температуры замеряют экстинкцию на фотоэлект-
роколориметре при синем «светофильтре и кюветой с рабочей длиной
5 мм.
Строят кривую зависимости поглощения света от вышедшего с
колонки объема элюата,откладывая по оси абсцисс вышедшие с ко-
лонки объемы. По построенной кривой определяют число фракций
в полисахаридном препарате, различающиеся по молекулярной
массе.
8.2. ВЫДЕЛЕНИЕ ГЛИКО-ПРОТЕИНОВОГО КОМПЛЕКСА ИЗ
ДРОЖЖЕЙ И ЕГО АНАЛИЗ.
Вопросы для подготовки по теме
I. Получение глико-протеинового комплекса из дрожжей.
2. Качественные реакции на белки.
3. Определение аминокислотного состава глико-протеино-
вого комплекса.
4. Электрофоретический анализ полисахаридов,белков
и глико-протеинов.
Получение глико-протеинового комплекса из дрожжей
Цель работы. Изолировать глико-протеиновый комплекс из
дрожжевых клеток и изучить его состав.
Ход работы. Навеску воздушно-сухих дрожжевых клеток (Юг)
помещают в 200 мл стакан,заливают 160 мл дистиллированной во-
ды и, перемешивая стеклянной палочкой,готовят однородную сус-
пензию микроорганизмов. Затем суспензию дрожжей подвергают раз
рушению в дезинтеграторе по методике,описанной ранее (см.По-
264
лучение клеточных стенок). После дезинтеграции суспензию разли-
вают в центрифужные пробирки, уравновешивают их на.весах и цен-
трифугируют при 5000 об/мин в течение 20 минут. Надосадочную
жидкость осторожно сливают в химический стакан на 500 мл и при-
бавляют к ней 3 объема 96/ этанола, перемешивают стеклянной па-
лочкой и оставляют на I час в холодильнике. После формирования
осадка гликопротеинового комплекса (в данном случае получается
гликопротеиновый комплекс с примесями других биополимеров, не
подвергающийся дальнейшей очистке). Надосадочную жидкость сли-
вают. Осадок переносят в чистую чашку Петри и высушивают в су-
шильном шкафу при 40°С в течение I часа.
Качественное определение углеводного компонента
в гликопротеиновом комплексе (реакция Подобедова-
Молиша).
Химизм реакции аналогичен реакции с фенол-серной кислотой.
Материалы. Т0/-ный спиртовый раствор ^-нафтола.
. Ход работы. Берут 3 мг гликопротеинового комплекса и по-
мацают в пробирку с Т мл дистиллированной воды. Встряхивая или
растирая стеклянной палочкой, добиваются наиболее полного раст-
ворения комплекса. Затем к раствору прибавляют 2 капли 10/
спиртового раствора «С- нафтола и 3 мл концентрированной HgS'O.j
'осторожно по стенке пробирки, чтобы кислота не смешивалась с,
жидкостью, а опускалась па дно). Реакция положительная если
ta границе жидкостей образуется кольцо фиолетового цвета.
Качественное определение протеинового компонента
в гликопротеиновом комплексе (биуретовая реакция)
Эту реакцию дают все белки, а также продукты их неполного
гидролиза - пептоны,пептиды,содержащие не менее двух пептидных
связей. Группа,образующая пептидную связь <—со—нн—),в ще-
лочной среде присутствует в своей таутомерной енольной форме:
О Н ----— он
II I -— I
— С — N— —С = н—
При избытке щелочи происходит диссоциация -ОН группы,появ-
ляется отрицательный заряд,с помощью которого кислород взаимо-
действует с медью,возникает солеобразная связь;кроме того,
медь образует дополнительные координационные связи с атомами
азота,участвующими в пептидной связи,путем использования их
неподеленных электронных пар. Возникающий таким образом комп-
лекс очень стабилен. Цвет комплекса фиолетовый с красным или си-
ним оттенком.
Такую же реакцию дают с солями меди в щелочной среде
биурет (HHg—со—нн—со—нн2),оксамид ( н^т—со—со—ин2)
гистидин нс^ J сн2—сн соон
V / ТТН
+ГО ?Н2 2 ?Н2
треонин (ciiy-CHOH-cii—соон),серин ( но —сн2—сн—соон) и
аспарагин Н2н — с —сн2—сн — соон
о нн2
Таким образом,реакция не является строго специфичной для
полипептидных цепей.
Материалы.10% водный раствор НаОН ,1% водный раствор СиЗОд
Ход работы.Взвешивают 3 мг гликопротеинового комплекса
266
и растворяют в I мл дистиллированной воды в пробирке.Затем до-
бавляют I мл 10% раствора НаОН и 2 капли раствора CuSO^
Взбалтывают. При наличии в пробе протеинового компонента появ-
ляется фиолетовое окрашивание.
Определение аминокислотного состава гликопротеинового
комплекса методом распределительной хроматографии на
бумаге
Механизм разделения аминокислот методом распределительной
хроматографии на бумаге аналогичен хроматографическому методу
анализа углеводов,о котором говорилось ранее.
Химизм же реакции обнаружения аминокислот на хроматограм-
ме сводится к следующему.
При нагревании нингидрина с аминокислотами последние
окисляются и распадаются,образуя двуокись углерода,аммиак и
соответствующий альдегид:
1ТН2 о о
Л-аминокислота окисленный альдегид восстановлен-
нингидрин ный нингидрин
Восстановленный нингидрин конденсируется с аммиаком и
окисленной молекулой нингидрина,образуя краситель типа мурек-
сида фиолетово-синего цвета:
окрашенный продукт
конденсации
267
Следует иметь в виду, что аммиак и js-аланин также дают
положительную нингидриновую реакцию. Чувствительность нингид-
риновой реакции может быть повышена добавлением аскорбиновой
кислоты.
Материалы. Ампула на 10 мл,микропипетка на 0,1 мл,эмали-
рованная ванночка,универсальная индикаторная бумага,6Н ни ,
10% изопропиловый спирт,система растворителей - Н-бутанол:ук-
сусная кислота:вода - 4:1:5; свидетель I (смесь: цистина,лизи-
на, аспарагиновой кислоты,глутаминовой кислоты,тирозина,фенил-
аланина. - 0,1 М раствор в 10% изопропиловом спирте,подкислен-
ном соляной кислотой),свидетель И (смесь: оерина,треонина,
пролина,метионина,лейцина - 0,1 М раствор в 10% изопропиловом
спирте,подкисленном соляной кислотой ), свидетель Ш (смесь:
аргинина,глицина, «с-аланина,валина - 0,1 М раствор в 10%
изопропиловом спирте,подкисленном соляной кислотой), 0,5%
раствор нингидрина в ацетоне.
Ход работы. Навеску гликопротеинового комплекса (20 мг)
гидролизуют 6Н НИ (5 мл) в запаянной ампуле на кипящей бане
в течение 20 часов. По окончании процесса гидролиза содержимое
ампулы переносят в химический стакан на 100 мл и упаривают
на водяной бане. Упаренный гидролизат растворяют в 5 мл теплой
дистиллированной воды,фильтруют через бумажный фильтр и вновь
упаривают. Такую процедуру продолжают до тех пор,пока реакция
гидролизата не станет нейтральной (pH определяют, используя
универсальную индикаторную бумажку). Затем осадок хлоргидра-
тов аминокислот растворяют в I мл 10% изопропилового спирта и
наносят микропипеткой 0,02 мл полученного раствора на подготов-
268
ленную хроматограмму. Параллельно на соседние полоски хроматог-
раммы наносят свидетели 1,П и Ш по 0,02 мл.
Нанесенные капли высушивают на воздухе и хроматограмму
помещают в хроматографическую камеру,погрузив ее кончики на
Ю мм в систему растворителей; верхний конец хроматограммы зак-
репляют на перекладине. Камеру плотно закрывают и оставляют на
18-20 часов при комнатной температуре для распределения смеси
аминокислот. Затем хроматограмму вынимают из камеры,высушивают
на воздухе в вытяжном шкафу и снова помещают в хроматографи-
ческую камеру в систему растворителей на 18-20 часов. Эту
процедуру повторяют трижды.
После трехкратного пропускания растворителей хроматограмму
высушивают и проявляют - для этого смачивают ее в эмалированной
ванночке 0,5^ раствором нингидрина в ацетоне,высушивают под
тягой и выдерживают в сушильном шкафу при 75-80° в течение
15 минут.
Полученные окрашенные пятна сравнивают с пятнами,которые
дали свидетели и определяют качественно аминокислотный состав
гликопротеинового комплекса.
Электрофоретический анализ полисахаридов.
белков и гликопротеинов.
Материалы. Аппарат для электрофореза, эмалированная кю-
вета,микропипетка на 0,2 мл,60^ водный ацетон, 1% водный
раствор йодной кислоты,фуксинсерная кислота (которую готовят
растворением I г основного фуксина в I л дистиллированной воды
при 60°С, добавлением 6 г метабисульфита калия и 10 мл концен-
269
триров'анной НС1 , выдержкой реактива в холодильнике в течение
суток; в случае недостаточного обесцвечивания реактива, его об-
рабатывают 3 г активированного угля и фильтруют через бумажный
фильтр).раствор метабисульфита калия (8 г в I литре воды),
концентрированная соляная кислота,раствор бромфенолового сине-
го (который готовят растворением 0,5 г растворимого бромфеноло-
вого синего, 10 г сулемы и 50 мл уксусной кислоты в I л дистил-
лированной воды), 0,5^ раствор уксусной кислоты,боратный бу-
фер (рН=9,30).
Ход работы. Взвешивают 10 мг исследуемого препарата и раст-
воряют в I мл дистиллированной воды (в случае плохой раствори-
мости в воде препарат растворяют в боратном буфере) в пробирке.
На расстоянии 20 см от катодного края на одну полоску хрома-
тографической бумаги микропипеткой наносят 0,1 мл раствора пре-
парата на другую 0,3 мл. (нанесение раствора выполнять тонким
штрихом,перпендикулярным к полоске). Обе полоски помещают в
прибор для электрофореза. Электрофорез проводят в боратном бу-
фере (рН=9,3) при разности потенциалов 300 В в течение 3-х ча-
сов.
Нейтральные полисахариды могут давать комплексы с борат-
ным буфером и приобретать таким образом заряд,который будет
вызывать движение молекул в электрическом поле.
По окончании процесса элекрофореза бумажные полоски
высушивают на воздухе, а затем фиксируют в сушильном шкафу
при 115° в течение 20 минут.
Первую фореграмму окрашивают фуксинсерной кислотой на выяв-
ление полисахаридов, вторую - бромфеноловым синим на выявление
белка.
270
а) Окраска на выявление полисахаридов.
I. Первую фореграмму обрабатывают в эмалированной кювете
60^ водным ацетоном в течение 10 минут.
2. Высушивают на воздухе.
3. Обрабатывают Г& водным раствором йодной кислоты в течение
45 минут.
4. Промывают 3 раза дистиллированной водой.
5. Обрабатывают в течение 10 минут фуксинсерной кислотой.
6. Обрабатывают 3-4 раза раствором метабисульфита калия
по нескольку секунд (к раствору метабисульфита перед употреб-
лением добавляют концентрированную соляную кислоту из расчета
12 мл на I л).
7. Фореграмму погружают на 10 минут в 60% водный раствор
ацетона и высушивают на воздухе.
Фракции,содержащие полисахарид, на полоске бумаги окраши-
ваются в красно-фиолетовый цвет.
б) Окраска на выявление белка.
I. Вторую фореграмму обрабатывают раствором бромфенолового
синего в течение 30 минут.
2. Обрабатывают 3-4 раза 0,5^ уксусной кислотой по 15 ми-
нут каж/'ьтй раз и высушивают на воздухе.
Фракции,содержащие протеины,окрашиваются на полоске бу-
маги в светло-зеленый или синий цвет.
Делают заключение о количестве полисахаридных и белковых
фракций.
лсли имеются полосы,окрашенные в красно-фиолетовый цвет
на первой форепрайме, в светло-зеленый цвет на второй фореграм-
271
ме и одинаково удаленные от линии старта, то можно сделать
предварительное заключение, что эти полосы соответствуют фрак-
циям, являющимися гликопротеинами.
8.3. ПОЛУЧЕНИЕ ДНК И ИССЛЕДОВАНИЕ ЕЕ СВОЙСТВ.
Вопросы для подготовки по теме
I. Химический состав и строение ДНК.
2. Топология и функции ДНК у микроорганизмов.
3. Характеристика препаратов ДНК.
4. Методы выделения ДНК из микробной клетки.
Нуклеиновым кислотам принадлежит ведущая роль в осущест-
влении специфического биосинтеза макромолекул, обеспечении про-
цессов морфогенеза и передачи наследственной информации.
Молекулы ДНК построены из четырех основных мононуклеотид-
ных единиц, ковалентно связанных между собой с помощью фосфо-
эфирных мостиков, соединяющих 3 положение одного мононуклеоти-
да с 5;-положением его соседа. В состав ДНК входят азотистые
основания: аденин,гуанин,тимин и цитозин.
Как правило, каждая молекула ДНК имеет одинаковый качест-
венный состав. Однако конфигурация молекул разных ДНК может
значительно различаться.
По структуре она представляет собой линейный полинуклео-
тид, состоящий из двух нитей. Каждая из этих нитей удерживается
одна возле другой водородными связями и вся двухцепочечная ст-
руктура закручена в правую спираль.
Препараты ДНК, выделенные из разных организмов, различают-
ся по молекулярной массе, соотношению и последовательности мо-
272
нонуклеотидных единиц.
У прокариот, содержащих только одну хромосому, практичес-
ки вся ДНК присутствует в виде одной макромолекулы с молекуляр-
Q
ной массой более 2-10 . У эукариот, содержащих несколько хромо-
сом, имеется много молекул ДНК так же с большой молекулярной
массой.
Нуклеотидный состав ДНК у различных видов различен, а у
организма данного вида он не зависит от его возраста, условий
питания и внешней среды. ДНК близких видов имеют сходный нук-
леотидный состав, тогда как эволюционно отдаленные организмы,
как правило, заметно отличаются один от другого по этому призна-
ку.
Для изучения природы и свойств нуклеиновой кислоты необхо-
димо ее выделить, по возможности в нативном неизменном состо-
янии. Но это трудно сделать,т.к. крупные молекулы нуклеиновых
кислот прочно связаны с другими химическими компонентами клет-
ки, особенно с белками, а кроме того в клетке всегда есть ак-
тивные нуклеазы, заключенные преимущественно в лизосомах и пе-
реходящие в свободное состояние при гомогенизации тканей. Та-
ким образом, при выделении нуклеиновых кислот необходимо осо-
бое внимание уделять инактивации нуклеаз,полноте гомогенизации
и очистке препарата от белков, полисахаридов,полифосфатов.
В настоящее время существует несколько методов выделения
ДНК. Для разрушения клеток используют механические методы
(дезинтеграция), химические (с помощью детергентов^ферментные
(с помощью лизоцима). Для экстракции ДНК применяют фенол, пер-
хлорат натрия, солевые растворы. В полученных препаратах ДНК
определяют содержание примесей (белков,полисахаридов,полифос-
272
фатов и др.), а такхже исследуют степень ее полимерности и на-
тивности, для этого измеряют вязкость, гиперхромный эффект и
коэффициент седиментации препарата.
I. Кислотно-основные свойства ДНК.
ДНК - это довольно сильная многоосновная кислота, полностью
ионизованная при любом значении pH выше 4. Фосфатные группы,
расположенные на периферии двойной спирали, полностью доступны
для воды. Они прочно связывают двухвалентные катионы, как Са
иМ^+ , а такхже поликатионные амины - спермин и спермидин.
ДНК прочно связывается с гистонами - основными серпами, входя-
щими в состав хромосом эукариотических клеток. Пары оснований
наиболее устойчивы при значении рН=4-П. За пределами этого
интервала значений pH двухцепочечная спираль ДНК постепенно
теряет устойчивость и раскручивается.
2.Вязкость
Визкозиметрические методы используют для исследования
процессов денатурации молекулы ДНК. Для работы следует брать
растворы очень низкой концентрации, т.к. в процессе диффузии
молекулы ДНК увлекают с собой большой объем раствора, в не-
сколько раз превышающий собственный объем молекулы; поэтому
раствор ДНК может рассматриваться как "идеальный" только при
очень низких концентрациях.
3, Седиментационные свойства.
Константа седиментации служит для определения молекуляр-
ной массы. Коэффициент седиментации и молекулярную массу ДНК
можно определить, используя обычные методы ультрацентрифугиро-
274
вания. Коэффициенты седиментации исследуемых препаратов ДНК час-
то определяют, сравнивая скорости седиментации анализируемого
препарата ДНК и препарата ДНК с заранее известным коэффициентом
седиментации. По ширине равновесной полосы ДНК в градиенте CsCL
можно судить о ее молекулярной массе.
4. Денатурация ДНК
При определенных условиях двухцепочечная ДНК может раскру-
чиваться с образованием неупорядоченных клубков. Такой струк-
турный переход происходит: I) при экстремальных значениях pH;
2) при нагревании; 3) при уменьшении диэлектрической постоян-
ной водной среды в результате добавления спиртов, кетонов и т.д.;
4) при обработке амидами карбоновых кислот, мочевиной и други-
ми аналогичными веществами. Такой процесс перехода "спираль-
клубок" был назван денатурацией.
Денатурация ДНК сопровождается резкими изменениями ее фи-
зических свойств: I) уменьшается вязкость; 2) возрастает погло-
щение света при 260 нм; 3) увеличивается отрицательный угол
вращения плоскости поляризации. Из всех физических свойств
удобнее всего использовать в качестве критерия денатурации ДНК
возрастание поглощения света при 260 нм, называемое гиперхром-
ным эффектом.
Известно, что в ультрафиолетовой области спектра ДНК погло-
щает у/ф лучи с максимумом при 260 нм приблизительно на 40^
меньше, чем смесь нуклеотидов, характерная для данного образца
ДНК. При денатурации ДНК водородные связи, стабилизирующие азо-
тистые основания в определенном положении, разрушаются, что
приводит к увеличению поглощения в ультрафиолетовой области
275
спектра, равному при максимальном нарушении структуры ДНК 40%
по сравнению с ее нативными образцами.
Таким образом, величина поглощения ( ер ) на I моль фосфо-
ра ДНК при стандартной ширине кюветы (I см) может служить од-
ним из критериев нативности ДНК. Нативные образцы ДНК имеют
Ер=6200 - 6600. Более высокие значения Ер характеризуют дена-
турационные сдвиги в структуре ДНК.
Цель работы - выделить ДНК бактериальной клетки, доказать
ее идентичность и оценить степень чистоты и нативности.
Материалы. Культуру в.с oil выращивают на чашках Петри с
МПА. 48 часов приt=37°. Биомассу собирают стерильным шпателем.
Для исследования требуется не менее 4 г сырой биомассы.
Реактивы: I) 0,1 млаСхв 0,014 м растворе цитрата К а -
500 мл;
2) 2 MllaCl- 100 мл; '
3) 0,2 МлаС 1- ТО мл;
4) Хлороформ - изоамиловый спирт (24:Т по объему)
- 20 мл;
5) 96% и 70% этанол по 50 мл;
6) 30%лаОН - 5 мл;
7) 1% сульфат меди - 2 мл.
8) дифениламиновый реактив (реактив Дише): I г
дифениламина растворяют в 100 мл ледяной
уксусной кислоты. К раствору добавляют 2,75 г
концентрированной серной кислоты (с плотно-
стьюД>0=1,836,);
У) 0,4% КаОН - 10 мл
276
Разрушение биомассы и выделение ДНК
Бактериальную массу залить раствором 0,1 М NaCl +0,014 М
цитрат Na (30 мл раствора на I г биомассы), тщательно переме-
шать и центрифугировать в стеклянных центрифужных стаканах на
холоду 20 мин. при 3000 об/мин. Стаканы тщательно уравнове-
сить! Надосадочную жидкость слить, а биомассу промыть дважды.
Промытую биомассу перенести в химический стакан суспенди-
ровать в 2 М иаС1 (1:5 по объему) и разрушать в дезинтеграторе
10 мин. Разрушенную биомассу слить в стеклянный химический ста-
кан и перемешивать магнитной мешалкой в течение 50 мин на холо-
ду. При этом происходит экстракция дезоксирибонуклеопротеиново-
го комплекса из разрушенных клеток. Полученную массу центрифу-
гировать в стеклянных центрифужных стаканах 20 мин при 3000
об/мин на холоду. Надосадочную жидкость слить и наслоить на
нее 2 объема охлажденного 96% этанола. При этом в осадок выпа-
дает ДНП.
Депротеинизация и осаждение ДНК
Жидкость с осадка слить декантацией, осадок растворить в
0,1 М naCi+0,014 М цитрата ка (1:2 по объему). На полученный
раствор наслоить 2 объема охлажденного 96 % этанола. Жидкость
с полученного осадка слить и повторно растворить осадок в сме-
си 0,1 М иаС1и 0,014 М цитрата Na (1:1 по объему), добавить
равный объем смеси хлороформ-изоамиловыи спирт. Смесь встряхи-
вать в течение 30 мин в колбе с притертой пробкой. Полученную
суспензию центрифугировать в стеклянных стаканах на холоду
при ЗОООоб/мин. В результате центрифугирования образуется 3
слоя: верхний - водносолевой, содержащий нуклеиновые кислоты;
277
средний - белок и нижний - хлороформ. Верхний слой осторожно
отсосать пастеровской пипеткой в колбу с притертой пробкой и
снова добавить хлороформ - изоамиловый спирт и всю операцию
повторить. Депротеинизацию проводят 2-3 раза, пока на границе
двух фаз не останется белка. После последней депротеинизации
нуклеиновую кислоту осаждают из верхнего водносолевого раство-
ра наслаиванием двух объемов этанола. При помешивании двух
слоев стеклянной палочкой ДНК наматывается на палочку в виде
нитевидного осадка и легко отделяется. Полученную ДНК промыть
в небольшом количестве (3-5 мл) 70% этанола. Половину осадка
растворить Bi мл J,2 М NaUl . Раствор и вторую половину осадка
использовать для изучения ДНК.
Характеристика препарата ДНК
а) качественная реакция на ДНК
К I мл 0,4% раствора приливают равный объем дифениламино-
вого реактива. Осадок, выпадающий вначале, растворяют в после-
дующих порциях реактива, после чего его нагревают в течение
т5-23 мин в кипящей водяной бане. Появляется синее окрашивание
в результате взаимодействия дифениламина с дезоксирибозой или
ДНК.
б) оценка чистоты препарата
Чистоту выделенного препарата определяют по спектральной
кривой поглощения в ультрафиолетовой области спектра по величи-
нам отношений Egg-r.Eggg и ^бО^бО’ Для препарата ДНК эти по-
казатели должны быть в пределах 2,х-2,4.
Раствор ДНК налить в кювету спектрометра и измерить плот-
ность при длине волны 230,260,260 нм. Насчитать отношения
*260: *230 и ^бО^бО-
278
в) определение примеси белка.
Для качественного определения белка используют биуретовую
реакцию. К 0,5 мл раствора ДНК прибавить Т мл SO1? раствора ыаОН,
тщательно перемешать и добавить 2-3 капли 1% раствора сульфата
меди. Хорошо перемешать. При наличии белка развивается красно-
фиолетовое окрашивание. (Химизм реакции описан в теме 8.2.)
г) количественное определение ДНК (по Дише).
К I мл раствора ДНК прилить двойной объем реактива Дише,
нагреть 10 мин на кипящей водяной бане, затем охладить. Жид-
кость окрашивается в синий или сине-фиолетовый цвет. Измерить
поглощение раствора в фотоэлектроколориметре с красным свето-
фильтром против контроля (реактив Диш₽).
с
Содержание ДНК в исследуемом растворе расчитывают по ка-
либровочной кривой, составленной по стандартному раствору нат-
риевой соли дезоксирибонуклеиновой кислоты с известным содержа-
нием фосфора (9,89-10,0^ в пересчете на чистую ДНК).
Механизм реакции заключается в образовании оксилевулиново-
го альдегида и конденсации последнего с дифениламином,с образо-
ванием окрашенного соединения.
3
* Оформление результатов
% содержание ДНК ^260 Е230 *260 *280
<1
279
Литература
Дроздов Н.С., Матеранская Н.П. Практикум по
биологической химии. М.» "Высшая школа", 1970.
ДроздовА.И. Методы выделения антигенов из патогенных
грибов (методическое пособие). Ленинградский государственный
ордена Ленина институт усовершенствования врачей им.С.М.Киро-
ва, 1971.
К а р р е р П. Курс органической химии. Л.,"Госхимиздат",Т960.
ЛенинджерА. Биохимия. М.,1976.
Методика количественной бумажной хроматографии сахаров,
органических кислот и аминокислот у растений. М., Л.."Издатель-
ство академии наук СССР", 1962.
Методы химии углеводов (под редакцией член-корр. АНСССР
Кочеткова Н.К.). М., "Мир",Т967.
Практикум по химии углеводов (под редакцией член-корр.
АНСССР Жданова Ю.А.). М.,"Высшая школа", 1973.
П р а к т и иум по биохимии (под редакцией Мешковой Н.П. и
Северина С.Е.) . М.,1979.
Руководствок лабораторным занятиям по биологической
химии (под редакцией проф. Березова Т.Т.). М.."Медицина",1976.
ФизерЛ.,ФизерМ. Органическая химия I и П т. М.,
"Химия", 1966.
Филиппович Ю.Б. .Егорова Т.А., Севастья-
н о в а Г.А. Практикум по общей биохимии. М.."Просвещение",1975.
Шапиро Д.К. Практикум по биологической химии. Минск,
"Вышэйшая школа", Т97С.-
Экспериментальная микробиология (под редакцией
проф. Бырдарова С.В.)София,"Медицина и физкультура" ,1965.
280
9. ИЗУЧЕНИЕ ВЛИЯНИЯ НА РОСТ МИКРООРГАНИЗМОВ ИСТОЧНИКОВ
УГЛЕРОДА, АЗОТА, ВИТАМИНОВ И МИКРОЭЛЕМЕНТОВ
Вопросы для подготовки по теме
1. Питание микроорганизмов.
2. Способы питания в зависимости от источника углерода
и энергии. Автотрофы и гетеротрофы, фототрофы и хемотрофы.
3. Типы питательных веществ (источники углерода,азота,
серы,фосфора, витамины, микроэлементы).
Для изучения способности микроорганизма усваивать опреде-
ленное вещество удобно использовать метод ауксанограмм, осно-
ванный на том, что испытуемое вещество вносят в синтетическую
питательную среду, лишенную определенных источников питания.
Например, изучая усвоение источников азота, используют среду,
не содержащую азота, и т.д. Сравнивают интенсивность роста
микроорганизма на контрольной среде и на среде, содержащей
изучаемое вещество.
Цель работы: изучить способность дрожжей усваивать различ-
ные источники углерода, азота, витамины и микроэлементы.
Материалы.
а) Среда для ауксанограммы углеводов (г/л):(ин4)230д - 5,0,
КН^РО^ - 1,0, М^ S 0^ ТН^О - 0,5, промытый агар - 20.
б) Среда для ауксанограммы источников азота (г/л): глюко-
за - 20, KHgPO^ - 1,5, - 0,25, промытый агар - 20.
Агар промывают вначале в проточной водопроводной воде I сутки,
затем I сутки в дистиллированной воде, меняя ее не менее 4 раз,
чтобы избежать примесей, которые могут искажать результаты
опытов.
281
в) Среда для изучения усвоения витаминов и микроэлементов
(г/л): (NH4)ZSO4- 5,0, КН2Р04 - 1,0, 5 0^ ТН20 - 0,5, глюко-
за - 20 в пробирках по 5 мл.
г) Суточная культура дрожжей ( Saccharomyces cerevisiae,
Candida utilis. Из нее готовят взвесь с концентрацией
100000 клеток в I мл.
д) 10^ растворы испытуемых веществ: глюкоза, сахароза,маль-
тоза, лактоза, крахмал, ксилоза, маннит, лимонная кислота, ами-
нокислоты, пептон, мочевина, (01-1д)230д, 1.г ai02 и т.д.
Растворы витаминов Bp В2, Bg, С в концентрации 0,05 мг/мл.
Растворы микроэлементов ЗпЗОд ,..ji30z, , Созо^ в концентрации 5мг/мл
Все растворы стерилизуют кипячением в течении ТО минут перед
опытом.
е) диски из фильтровальной бумаги диаметром ТО мм, стери-
лизуют в автоклаве в чашках Петри.
Ж) стерильные чашки Петри, пипетки,пинцеты, трафарет для
укладки дисков (рис.86).
Рис.86. Схема укладки
дисков для ауксанограммы.
Постановка опыта
т. Ауксанограмма источников углерода и азота. Взвесь куль-
туры дрожжей вносят в расплавленный и охлажденный до 50° пита-
тельный агар из расчета I мл взвеси на ТО мл среды. Разливают
в чашки Петри по 20 мл. Диски из фильтровальной бумаги смачи-
вают растворами испытуемых веществ. Подсушивают 15 мин в тер-
мостате при 37°. Используя трафарет, раскладывают диски на чаш-
ки с соответствующей питательной средой. На кавдую чашку укла-
дывают по 6 дисков. Чашки инкубируют при 24° в течение 4-5
дней, ежедневно отмечая результаты опыта. Об усвоении опреде-
ленного вещества судят по появлению видимого роста вокруг дис-
ка. Результаты наблюдений вносят в таблицу.
2. Изучение влияния витаминов и микроэлементов на рост
культуры. В пробирки с жидкой питательной средой вносят по 0,1
мл раствора изучаемого вещества и по 0,1 мл взвеси дрожжевой
культуры. Для каждого вещества используют по 2 параллельных
пробирки. Две пробирки оставляют в качестве контрольных: их
засевают, не внося никаких добавочных компонентов. Пробирки вы-
держивают в термостате 5-7 дней. Интенсивность роста культуры
на всех средах оценивают нефелометрически или путем подсчета
клеток в камере Горяева. Результат вносят в таблицу.
Ауксанограмма источников углерода и азота
Наименование | Источники углерода j Источники азота
культуры i----------------------!----------------------
дрожжей :глюкоза и т.д. ; мочевина и т.д.
283
+ наличие- зоны роста вокруг диска
- отсутствие зоны роста вокруг диска
Влияние витаминов и микроэлементов на рост дрожжей
Наименование культуры Испытуемое вещество । Интенсивность роста
I пробирка I 2 пробирка среднее
Вт
%
и т.д. i
контроль 1
Литер а.т ура
Е л и н о в Н.П. Патогенные дрожжеподобные организмы. М.,1964.
Тимаков В.Д. Микробиология. М., 1973.
ШлегельГ. Общая микробиология. М., 1972.
ZB4
10. ФЕРМЕНТАТИВНАЯ АКТИВНОСТЬ МИКРООРГАНИЗМОВ
Программа подготовки по теме
I. Ферменты как биологические катализаторы
2. Классификация ферментов
3. Методы определения активности ферментов
4. Влияние на скорость ферментативной реакции темпера-
туры, pH, активаторов и ингибиторов
5. Микробные пигменты как компоненты ферментативных
реакций
6. Свечение у микроорганизмов как ферментативный про-
цесс
Получение ферментных препаратов
Микроорганизмы являются богатейшим источником различных
ферментных препаратов, в том числе производящихся в промышлен-
ном масштабе. Ввиду того, что ферменты являются белками и легко
подвергаются денатурации, все операции по их выделению и очист-
ке следует вести в мягких условиях, при пониженной температуре,
применяя высокоочищенные реактивы. В связи с тем, что выделе-
ние индивидуальных ферментов чрезвычайно сложно, часто работу
ведут с частично очищенными ферментными препаратами. Источни-•
ком экзоферментов микроорганизмов может служить культуральная
£
жидкость, освобоженная от клеток фильтрацией или центрифуги-
рованием; источником эндоферментов - микробные клетки, которые
в целях консервации обезвоживают. Обезвоживание используют теп-
ловое или водоотнимающими реактивами (ацетоновые порошки). Обез-
воживание способствует повышению проницаемости клеточной стен-
ки, что необходимо для извлечения эндофермента. Для этой же
285
цели применяют механическую дезинтеграцию живых или высушенных
-клеток, повторное замораживание и оттаивание и автолиз.
Для выделения ферментов из культуральной жидкости или из
клеточных экстрактов используют осаждение с помощью высалива-
ния сульфатом аммония, или органическими растворителями. Для
получения чистых препаратов используют такие эффективные ме-
тоды, как электрофорез, гель-хроматографию, ионообменную хро-
матографию и др. I
Получение препарата сахаразы
(уЗ-D- фруктофуранозид-фруктогидролаза, КФ 3.2.1.26)
Материалы. Дрожжи пекарские, кварцевый песок, жидкость
Фелинга, 5% раствор сахарозы, ацетон.
Влажные дрожжи тщательно растирают в течение 15 мин в
ступке с кварцевым песком. Растертую массу наносят тонким сло-
ем на <|текло и высушивают в токе сухого воздуха. Высушенные
дрожжи растирают в порошок. Для извлечения сахаразы к полу-
ченному порошку приливают небольшими порциями воду из расчета
ТО мл на Т г сухой массы. Воду добавляют при постоянном пере-
вешивании, полученную массу вновь растирают в ступке и центри-
фугируют при 3000 об/мин, или фильтруют через бумажный склад- ;
чатый фильтр. К полученному фильтрату добавляют пятикратный ,
объем охлажденного ацетона, образовавшийся осадок отделяют
центрифугированием при 3000 об/мин, высушивают при 37° и рас-
тирают в порошок. Полученный препарат длительно сохраняется. !
В качестве антисептика к нему можно добавить кристаллик ти-
мола, завернутый в фильтровальную бумагу.
Для проверки активности сахаразы готовят 0,01% водный
раствор полученного препарата и наливают по 0,5 мл в две про-
286
бирки. В одной из них фермент инактивируют кипячением в теченир ,
3 мин, затем пробирку охлаждают. В обе пробирки добавляют по
3 мл 5^ раствора сахарозы и ввдерживают при 40° 10-15 мин. За-
тем в пробирки добавляют по 2 мл жидкости Фелинга, перемешива-
ют и нагревают до начала кипения. В пробирке с активным фермен-
том появляется красный осадок окиси меди (I), что указывает на
присутствие восстанавливающих ионы меди глюкозы и фруктозы,
образующихся из невосстанавливающего её дисахарида - сахарозы.
В контрольной пробирке окиси меди не образуется.
Получение препарата амилазы из плесневых грибов.
Материалы. Среда Чапека, культура xspercillus ni^er ,
образующая амилазу.
Культивирование при 25-28° 5-6 дней.
Получение фермента. Грибную массу отделяют фильтрованием ,
высушивают в тонком слое на поверхности стекла при 37° . Воз-
душно-сухую массу растирают в фарфоровой ступке с кварцевым
песком. 2 г полученного порошка смешивают с 50 мл воды при 37°,
тщательно размешивают и настаивают в течение 2 час при этой
же температуре, затем отфильтровывают. В фильтрате содержится
комплекс грибных амилаз.
Определение активности фермента.
Смешивают I мл полученного фильтрата с 2 мл 1% раствора
крахмала. Каплю смеси с помощью стеклянной палочки помещают
на фарфоровую пластинку. К ней добавляют каплю раствора Люго-
ля. Наблюдают интенсивно синее окрашивание. Пробирку помещают
в водяную баню при 40° и через каждые 2 мин повторяют взятие
проб. По мере расщепления крахмала пробы с йодом будут окраши-
ваться в различные цвета вследствие образования декстринов
287
разной степени сложности. Амилаза, присутствующая в крахмале,
дает синее окрашивание с йодом (м.м. до 500000), амилодекстри-
ны - сине-фиолетовое (м.м. около 10000), эритродекстрины -
красно-бурое (м.м. 4000-6000). Декстрины, имеющие низкий моле-
кулярный вес , не окрашиваются йодом.
Результаты вносят в таблицу.
Гидролиз крахмала грибной амилазой
.Время гидролиза . Окрашивание пробы Продукты гидролиза
0 2 мин и т.д. синее ; —
Качественное опведелевде ферментов
Каталаза. Это фермент, катализирующий разложение перекиси
водорода на воду и кислород. Каталаза содержится у аэробов и
факультативных анаэробов, не содержится у облигатных анаэробов.
Обнаружить каталазу можно по пузырькам кислорода, которые начи-
нают выделяться сразу же после смешивания микробных клеток с 1%
раствором HgOg. На предметное стекло помещают каплю перекиси
водорода и суспензируют в ней петлю микробной культуры, выра-
щенной на плотной среде. Отмечают, какой из изучаемых микроор-
ганизмов образует каталазу.
Глутамат-аминотрансфераза. Этот фермент катализирует пере-
аминирование глутаминовой кислоты с пировиноградной кислотой с
образованием аланина:
Н00С-СН2-СН2-СН-С00Н + СН3СС00Н СН3СНС00Н + Н00С-СН2-СН2-СС00Н
J*TH2 о о
глутаминовая к-та пировиноград- аланин <А-кетоглутаровая
ная к-та • к-та
268
Материалы» Оборудование и реактивы, необходимые для хрома-
тографического анализа аминокислот, 1% растворы глутаминовой и
пировиноградной кислот, нейтрализованные кристаллическим гидро-
карбонатом натрия, 2£ уксусная кислота. Источником фермента
служит густая суспензия микробных клеток. Для ее получения мик-
роорганизм выращивают на соответствующей питательной среде,
клетки собирают, промывают физиологическим раствором при центри-
фугировании, затем добавляют к осадку в центрифужных пробирках
равный объем физиологического раствора и тщательно перемешива-
ют.
Ход определения. В две пробирки берут по 0,5 мл растворов
глутаминовой и пировиноградной кислот и вносят по I мл свежей
микробной взвеси. Одну (контрольную) пробу сразу же прогрева-
ют на кипящей водяной бане 1-2 мин. Затем обе пробирки остав-
ляют при 37° на 2 часа. После инкубации в каждую пробирку до-
бавляют по 0,25 мл уксусной кислоты и фильтруют. На полоски
хроматографической бумаги наносят по 0,01-0,02 мл фильтрата.
В качестве свидетелей используют глутаминовую кислоту и аланин.
Проявление хроматограммы ведут в течение 24 час, затем её су-
шат и окрашивают раствором нингидрина. Отмечают убыль глута-
миновой кислоты в опыте по сравнению с контролем и появление
аланина.
Диффузионный метод определения Ферментов
Этот метод является экспрессным и может быть использован
для поиска активных продуцентов ферментов в природных популя-
циях микроорганизмов.
Принцип метода. Горячий (80-90°С) 3% раствор агар-агара
смешивают с равным объемом раствора субстрата, перемешивают и
289
разливают в чашки Петре. После застывания агара в нем делают
лунки, в которые вносят раствор фермента. В качестве последне-
го обычно используют культуральную жидкость испытуемого микро-
организма. Чашки выдерживают 18 час при 37°, затем выявляют
и измеряют зоны превращенного субстрата.
Амилаза
Субстрат: 1,6% раствор крахмала кипятят 3 мин при переме-
шивании. Полученный раствор смешивают с равным объемом ацетат-
ного буфера pH 5,0 содержащего УаС£/ 0,4 м буфер и 0,4 м раст-
вор jTaGt в равных объемах/.
Окрашивание раствором Люголя I мин.
Об активности фермента судят по образованию неокрашенной
зоны вокруг лунки за счет гидролиза крахмала.
Протеаза
Субстраты:
а) Казеин по Гаммерстену. Готовят 1% раствор на I/I5 м
фосфатном буфере pH 7,6, нагревая на кипящей водяной бане
10 мин при перемешивании. В качестве консерванта добавляют
фенол до конечной концентрации 0,2%.
Окрашивание 1% раствором амидового черного на 7% растворе
уксусной кислоты 5-7 мин. Об активности фермента судят по об-
разованию зоны просветления вокруг лунки.
б) Гемоглобин. Раствор, содержащий 10 мл 22% гемоглобина,
8 мл I н ХаОН, 82 мл воды и 36 г мочевины выдерживают при 25°
60 мин. Затем в него вносят 10 мл I м раствора KHgPO^, 4 г
мочевины и доводят объем до 220 мл. Перед работой раствор сме-
шивают с равным объемом фосфатного буфера 0,2 м, pH 7,6.
290
Окрашивание не требуется, об активности фермента судят по
зоне измененного гемоглобина.
Дипаза
Оубстрат: 0,2 м фосфатный буфер {Я 7,6 смешивают с равным
объемом горячего агар-агара, добавляют 0,1% подсолнечного мас-
ла, перемешивают I мин в гомогенизаторе и разливают в чашки.
Об активности фермента судят по образованию зоны просвет-
ления вокруг лунки за счет гидролиза масла.
Влияние на Ферменты температуры. pH, активаторов и инги-
биторов.
I. Влияние температуры на активность амилазы микроорганиз-
мов.
Материалы. Препарат амилазы Л3р.nicer или Вас* subtills.
Концентрацию раствора ферментов предварительно подбирают таким
образом, чтобы в,условиях опыта полный гидролиз крахмала про-
ходил в течение T0-I2 мин. Раствор крахмала 0,5%; раствор Люго-
ля; фарфоровая пластинка; стеклянные палочки; пробирки; пипетки;
водяная баня; ацетатный буферный раствор 0,1 н pH 5,0.
Ход работы. В четыре пробирки налить по I мл буферного
раствора и по 0,5 мл раствора крахмала. Одну пробирку поста-
вить в водяную баню при 60°, вторую - при 40°, 3-ю при комнат-
ной температуре и 4-ю - в ледяную воду. Через 10 мин, когда
содержимое пробирок примет заданную температуру, во все пробир-
ки вносят по 0,5 мл раствора фермента, перемешивают и оставля-
ют в тех же условиях. Наблюдение за ходом гидролиза крахмала
ведут по реакции с йодом. Для этого наносят на фарфоровую плас-
тинку несколько капель раствора Люголя и смешивают их с каплями
291
гидролизуемой смеси из каждой пробирки, беря пробы через 1,2,4,
6,8,10 и 12 мин. Результаты наблюдений вносят в таблицу. Дела-
ют вывод о величине температурного оптимума для микробной ами-
лазы.
Влияние температуры на скорость гидролиза крахмала
амилазой
Температура Реакция с иодом по истечении времени (в мин)
12 4 6 8 10 12
60°
40°
20°
0°
2. Влияние pH на активность амилазы микроорганизмов
Материалы. Буферные растворы 0,1 н ацетатные, pH 3,0 и 5,0
и фосфатные pH 6,0; 7,0 и 8,0. Остальное то же, что в предыду-
щем разделе.
Ход работы. В 5 пробирок вносят буферные растворы по I мл,
и по 0,5 мл раствора крахмала и фермента. Содержимое пробирок
перемешивают и помещают в водяную баню при 40°. Отбирают пробы
из каждой пробирки с помощью стеклянной палочки через каящые
2 мин и по окрашиванию с йодом судят о степени расщепления
крахмала. Продолжают наблюдения до тех пор, пока не исчезнет
синяя окраска. Полученные результаты выражают графически: по
оси абсцисс наносят значение pH, а по оси ординат - время рас-
щепления крахмала при соответствующем значении pH. Делают вы-
вод об оптимуме pH для данного фермента
292
3. Действие активаторов и ингибиторов на микробную амилазу.
Материалы. 1% растворы СаС^-бН20 и СкЗО^б^О остальное
то же, что в первом разделе.
Ход работы. В три пробирки внести по I мл буферного раство-
ра pH 5,0 по 0,5 мл раствора амилазы. Затем в пробирку I доба-.
вить 0,5 мл раствора CaClg-GHgO, в пробирку 2 - 0,5 мл СиЗО^’
5Н20 и в пробирку 3 - 0,5 мл воды (контроль). Далее во все про-
бирки внести по 0,5 мл раствора крахмала, поставить пробирки в
термостат при 40° и наблюдать ход гидролиза крахмала по реакции
с йодом, отбирая пробы каждые 2 мин. Результаты опыта вносят в
таблицу. Делают вывод о влиянии активатора и ингибитора на ско-
рость ферментативной реакции.
Влияние CaCtfg'OHgO и Си504*5Н20 на скорость ферментатив-
ного гидролиза крахмала
Эффектор Реакция с йодом по истечении времени (в мин)
Т 2 4 6 8 10 12 14 Тб
сасе2-бн2о
См504‘5Н20
вода
Литература
Диксон М.,Уэбб Э. Ферменты. М., 1966.
ЛенинджерА. Биохимия. М.,1974.
Мосолов В.В. Протеолитические ферменты. М.,1971.
Практикум по биохимии. Под ред. Н.П.Мешковой и С.Е.Се-
верина. М. ,1979.
293
II. РОЛЬ МИКРООРГАНИЗМОВ В КРУГОВОРОТЕ УГЛЕРОДА И АЗОТА
В ПРИРОДЕ.
II.I. МИКРОБЫ, РАЗЛАГАЩИЕ КЛЕТЧАТКУ И ПЕКТИНОВЫЕ ВЕЩЕСТВА
Вопросы для подготовки по теме
I. Роль микробов в круговороте углерода в природе
2. Микробы, разлагающие клетчатку в аэробных условиях
3. Микробы, разлагающие клетчатку в анаэробных условиях
4. Разложение пектиновых веществ с помощью микроорга-
низмов в аэробных и анаэробных условиях.
Целлюлоза и пектиновые вещества являются основными состав-
ляющими частями растительных тканей, синтез которых превосхо-
дит синтез всех прочих природных соединений. Поэтому микробы,
разлагающие данные соединения,играют исключительно важную роль
в круговороте углерода, а кроме того имеют важное хозяйственное
значение.
Микробы, разрушающие клетчатку в аэробных условиях.
В аэробных условиях целлюлозу гидролизуют миксобактерии,
некоторые представители неспоровых и споровых бактерий, актино-
мицеты и грибы. Ведущая роль принадлежит миксобактериям. Клет-
ки миксобактерий-это мелкие, слегка изогнутые, часто с заост-
ренными концами палочки, имеющие очень тонкую оболочку и сла-
бее окрашивающиеся, чем другие бактерии. Обладают скользящим
движением, которое возможно только на плотном субстрате. Пред-
полагают, что их движение связано с неравномерным выделением
слизи всей поверхностью клетки. У некоторых обнаружены жгутики.
Многие миксобактерии имеют сложный цикл развития, который с'осто
ит в том, что с возрастом палочки превращаются в утолщенные,
294
довольно крупные покоящиеся клетки - микроцисты, которые бывают
собраны в группы (цисты), включающие несколько десятков клеток,
погруженных в слизь. Скопления цист образуют ложные плодовые
тела, часто видимые невооруженным глазом.
Миксобактерии, разрушающие клетчатку, представлены в основ-
ном родами Gytophaga, Sporocytophaga, Sorangium.
На поверхности материалов, содержащих клетчатку, миксобактерии
растут в виде слизистых налетов, бесцветных, желтых, оранжевых
или красных. Клетки миксобактерий тесно прилегают к фибриллам
клетчатки и осуществляют ее гидролиз только при непосредствен-
ном контакте с ней.
Кроме миксобактерий в почвах часто встречаются разлагающие
клетчатку виды рода Cellyibrio . Это изогнутые подвижные клетки
с одним жгутиком, не образующие эндоспор. И х колонии бесцвет-
ны или окрашены в желто-зеленые тона.
К использованию клетчатки в аэробных условиях способны не-
которые ВИДЫ родов Acliromobacter, Pseudomonas, Bacillus,
а также актиномицеты И грибы родов Trichoderma, Chaetomium,
Fusarium, Aspergillus, Botrytis etc.
Материалы. Среда Гетчинсона. Вырезают из фильтровальной
бумаги кружки такого диаметра, чтобы они свободно помещались
в чашке Петри. Стерилизуют в чашках Петри при I атм.
Посевной материал и техника посева. Почвенную взвесь раз-
водят 1:10 и 1:100, вносят по 0,1 мл в стерильные чашки Петри,
куда затем наливают по 2-3 мл среды Гетчинсона и помещают
диск из фильтровальной бумаги. Каждый посев делают в пятикрат-
ной повторности.
Условия культивирования. Чашки помещают во влажную камеру
295
и выдерживаю» 12-14 суток при 28-30°.
Учет результатов. Подсчитывают количество колоний, вырос-
ших на фильтрах в чашках Петри. Рассчитывают наиболее вероятное
число микроорганизмов в I г образца почвы при Pq gg
Определение количества микроорганизмов в I г (I мл) исход-
ного субстрата.
Наиболее вероятное количество микроорганизмов, содержащееся
в I г (I мл) исходного субстрата при уровне вероятности 95%
(Ро gg) вычисляют по формуле:
где - среднее число колоний, выросшее при высеве данного
разведенця; <5^-=+—- среднее квадратичное отклонение; Z
- критерий t при Pq gs; 2 6^ - доверительный интервал; К- разве-
дение, nd которого произведен посев; V - объем суспензии, взя-
тый для досева, мл;Хх - общее количество подсчитанных коло-
ний при высеве данного разведения; п - число повторностей.
Результаты записывают в виде таблицы.
Численность колоний, выросших на фильтровальной бумаге,
и расчет наиболее вероятного количества микроорганизмов,
разрушающих клетчатку, в I г почвы
I
Разведение Повторность
опыта
Кол-во колоний на чашках X ^х
Кол-во мик-
роорганизмов
в I г почвы
ПРИ Р0.95
1:10 ?
О
4
1:100 I
О
296
Сравнивают доверительные интервалы, полученные на основа-
нии подсчета результатов высева из разных разведений, и делают
вывод, какой результат следует считать наиболее достоверным.
Описывают колонии микробов на фильтрах. Готовят препараты фик-
.сированных окрашенных клеток из этих колоний. Для этого мате-
риал отбирают из наиболее разрушенных и ослизненных участков
фильтра. Все наблюдения вносят в таблицу.
Характер колоний и морфология клеток микроорганизмов,
выросших на фильтрах, пропитанных средой Гетчинсона
№ колонии Признаки колонии Вид культуры под микроско- скопом (с.рисунком)
диаметр цвет 1 1 । । слизь сте- пень разру- шения клет- чатки вегета- тивные клетки микро- цисты цисты
I и т.д.
г---------------------------------------------------------
Бактерии, разрушающие клетчатку в анаэробных условиях
В анаэробных условиях клетчатку разлагают мезофильные
или термофильные виды родов Clostridium u Bacillus.
Типичный представитель мезофильных бактерий, разлагающих цел-
люлозу при 30-40° - CT.omelanskii . К термофильным бактериям
относятся, например, CI. thermocellum и Вас. cellulosa-
dissolvens. Оптимальной для их развития является температура
60-65°. При 30-40° они не растут.
Анаэробы, разлагающие клетчатку, распространены в почве,
навозе, компостах, илах, сточных водах.
Материалы. Среда для мезофилов (г/л):[УН^Я0^ 1,0, KgHPO^
297
- 1,0, McjSO^'THgO - 0,5,ZaCI - следы, вода водопроводная.
Среда для термофилов (г/л): пептон 5,0,(УНч)<г///>^- 1,5, KHgP04
и КзНР04 - по 0,5 , M^J04 - 0,4, ZaCI - 0,1,ЛМ^и FeSO* _
следы. Вода водопроводная.
Среды разливают в пробирки по 10 мл, добавляют мел - око-
ло 0,1 г для мезофилов и 0,2 г для термофилов и вносят полоски
фильтровальной бумаги 50x5 мм.
Посевной материал - почвенная взвесь, разведенная 1:10 -
1:1000. Объем посевного материала - 0,2 мл.
Условия культивирования для мезофилов 30° в течение 18-20
суток, для термофилов - 60° в течение 10-14 суток.
Учет результатов.
Основным признаком развития бактерий, разлагающих клетчат-
ку, является характерное изменение клетчатки: обычно фильтро-
вальная бумага слегка желтеет, покрывается слизью и постепенно
превращается в рыхлую массу, состоящую из отдельных волокон.
Кроме того наблюдается помутнение среды и выделение газа.
Готовят препараты для микроскопирования, "раздавленная
капля" и окрашенные по Циль-Нильсену. Материал отбирают вместе
с волокнами целлюлозы из тех пробирок, гдн наблюдали наиболее
интенсивное разложение бумаги. Оценивают морфологическое раз-
нообразие клеток в накопительных культурах, обращают внимание
на подвижность бактерий, наличие спор1 и тип спорообразования.
Все результаты наблюдений вносят в таблицу.
Характеристика бактерий, разрушающих клетчатку в анаэробных
условиях
Температура Разведение Разрушение культивирования клетчатки Помутнение Газовы- среды деление Вид под микроско- пом! с рис)
30° 1:10 и т.д. 60° 1:10 и т.д.
298
I Микробы, разлагающие пектиновые вещества
В аэробных условиях пектин разлагается бактериями и гриба-
ми. Способностью разлагать пектин обладает большинство фитопа-
тогенных бактерий. В анаэробных условиях пектиновые вещества
разрушают представители спорообразующих бактерий: Clostridium,
acetobutylicum, Cl.felsineum, Cl.thermocellum.
Характерным признаком этих микроорганизмов является способность
накапливать гранулезу, которая выявляется по темно-бурому или
фиолетовому окрашиванию с йодом.
Пектиноразлагающие микроорганизмы находят практическое
применение при обработке прядильных культур (льна,конопли,
джута и др.).
Материалы. Снопики из стеблей льна или крапивы (пригодны
только зеленые стебли) помещают в пробирки. Чтобы снопик не
всплывал, к нему привязывают стеклянную трубочку. Заливают 20-
30 - кратным количеством водопроводной водыС на 2/3 высоты про-
бирки).
Культивирование 15-20 дней при 37°.
Учет результатов.
0 пектиновом брожении судят по разрушению растительной
ткани. При разрушении пектиновых веществ лубяные волокна лег-
ко отделяются друг от друга и от древесной части растения. От-
мечается характерный запах масляной кислоты, образующейся в
данном процессе.
Микроскопирование.
Готовят препараты " раздавленная капля", окрашенный по
Циль-Нильсену и раствором Люголя. Отмечают подвижность клеток,
наличие гранулезы, характер спорообразования.
299
CI. acetobutyiicui® период спорообразования имеет вид длинных
барабанных палочек с прерывистым расположением гранулезы.
CI. felsineum имеет вид короткой сигарообразной палочки
с концевой или приконцевой спорой.
II.2. РОЛЬ МИКРОБОВ^ В КРУГОВОРОТЕ АЗОТА В ПРИРОДЕ
Вопросы для подготовки по теме
I. Круговорот азота в природе
2. Аммонифицирующие бактерии
3. Нитрифицирующие бактерии
4. Денитрифицирующие бактерии
5. Азотфиксирующие микроорганизмы
Круговорот азота на земле и перевод его в доступные для
растений соединения осуществляется благодаря жизнедеятель- а
•
ности микроорганизмов.
8
г
Атмосферный азот
300
Аммонифицирующие бактерии
Аммонификацией называются процессы распада белка и других
органических соединений азота с образованием аммиака. К аммони-
фикации способны многие виды спорообразующих и неспорообразу-
ющих бактерий, различные актиномицеты и мицелиальные грибы,
ведущие этот процесс в аэробных, анаэробных условиях и при
ограниченном притоке кислорода. Характерными продуктами распа-
да помимо аммиака являются сероводород, меркаптаны, индол, ска-
тол, придающие характерный запах гниющим субстратам.
Индол образуется при разложении аминокислоты триптофана.
Его обнаруживают с помощью индикаторных бумажек, пропитанных
насыщенным водным раствором щавелевой кислоты. В присутствии
индола щавелевая кислота краснеет.
При расщеплении микроорганизмами белков, в состав которых
входят серосодержащие аминокислоты (цистин, цистеин, метионин),
образуется сероводород. Он может образоваться также и в резуль-
тате восстановления солей серной,сернистой и серноватистой
кислот. Для обнаружения сероводорода пользуются индикаторной
бумажкой, пропитанной насыщенным водным раствором уксуснокис-
лого свинца, который в присутствии сероводорода чернеет.
Аммиак является конечным продуктом разложения белка. Его
присутствие определяют по изменению цвета красной лакмусовой
бумажки, которая синеет при щелочном pH.
— Выявление аммонификаторов и определение их численности
осуществляют высевом анализируемой пробы в МПБ и на поверх-
ность агаризованной среды, состоящей из смеси МПБ и сусла
(1:1). Посев предварительно пастеризованного материала позво-
ляет определить в нем содержание спорообразующих микроорга-
30 т
низмов.
Выявление и учет численности аммонифицирующих бактерий
высевом в МПБ
В МПБ развиваются различные виды родов Pseudomonas, Рго-
teus vulgaris, Escherichia coli
, спорообразующие микро-
организмы (Вас. subtilis, Bac.cereus var.mycoides,B.mesentericus).
Факультативно-анаэробные бактерии растут у поверхности и в глу-
бине субстрата, образуя помутнение, хлопья, осадки. Аэробы
предпочтительно развиваются в виде пленки (Baejnessntericus ).
Материалы. МПБ разливают в 23 пробирки по 5 мл, стерилизу-
ют при I атм. В чашки Петри помещают индикаторные бумажки на
аммиак, Н<Ди индол, стерилизуют при 0,5 атм.
R тт
Посевной материал - взвесь почвы, разведенная 1:10-1:10 .
Засевают каждое разведение в 3-кратной повторности в объеме
Т мл. Две пробирки оставляют стерильными в качестве контроля,
После посева между горлышком и пробкой каждой пробирки укреп-
ляют полоски индикаторных бумажек (рис.87)
Рис. 87. Почернение индикаторной
бумаги, пропитанной ацетатом свинца,
в результате выделения Н? Sмикроор-
ганизмами.
Условия культивирования - 5-7 суток при 28-30°.
302
Учет результатов
О развитии аммонифицирующих бактерий судят по помутнению
среды, образованию в ней хлопьев и (или) осадка, наличию плен-
ки на поверхности и по изменению индикаторных бумажек. Резуль-
таты наблюдений отмечают в таблице. Рассчитывают вероятное ко-
личество аммонифицирующих бактерий в I г исходного субстрата
и доверительный интервал (см. выше).
Признаки развития аммонифицирующих бактерий в МПБ
Разведение Повторность Помутнение Хлопья Осадок Выделение
среды /Н3 индола
1:Ю5 I
и т.д. 2
3
Микроскопировании. Готовят препараты "раздавленная капля"
и окрашенные по Граму и Циль-Нильсену из пленки, глубины куль-
туры и осадка. Зарисовывают микроскопическую картину, отмеча-
ют подвижность, наличие или отсутствие спор.
Выявление и учет численности спор аэробных бактерий
Материалы. Среда состоит из смеси равных объемов МПБ и
жидкого сусла с 3% агар-агара. Посевной материал- почва, раз-
веденная 1:100, 1:1000, 1:10000. Перед посевом суспензию пас-
теризуют (80° 10 мин), чтобы убить вегетативные клетки и оста-
вить жизнеспособными только споры.
Посев в чашки Петри по 0,1 мл газоном. Выращивают 3-5 су-
ток при 28-30°.
303
Учет результатов.
Описывают колонии выросших бактерий. Из различных колоний
готовят препарат "раздавленная капля" и просматривают его с
фазово-контрастным устройством, используя объективы 40хФ и 90хФ.
Все наблюдения вносят в таблицу. Подсчитывают число спор во
взятом образце почвы.
Особенности морфологии спорообразующих бактерий
Особенности № колонии
морфологии I 2 3
Признаки колонии Форма Диаметр Блеск Прозрачность Цвет Поверхность Край Консистенция -
Особенности клеток Микроскопи- ческая кар- тина (рису- нок) Подвижность Наличие спор Расположение спор в клетках
Нитрифицирующие бактерии
Нитрификацией называют окисление аммиака до азотной кис-
лоты, в процессе которого микроорганизмы получают энергию для
своей жизнедеятельности. Микроорганизмы, осуществляющие этот
процесс, относятся к хемолитотрофам и являются облигатными
аэробами.
Нитрификация протекает в две стадии. Первую - окисление
аммиака до нитритов - осуществляют представители немногочис-
304
Зак. И83
ленной группы нитрозных бактерий, относящихся к родам Nitroso-
monas, Nitrosocystis, Hitrosococcus, Nitrosobolus, Nitrosospira.
Все эти микроорганизмы сходны между собой в физиолого-биохими-
ческом отношении, но отличаются по морфологическим признакам
и структура клеток. Представители рода Nitrosomonas не образу-
ют спор, мелкие эллипсовидные клетки. В жидкой культуре они
проходят в зависимости от условий несколько фаз развития. Ос-
новных фаз две: подвижная и зооглейная. Зооглеи состоят из
неподвижных клеток.
Вторая стадия нитрификации связана с окислением азотистой
кислоты до азотной. Основные возбудители этого процесса -Nit-
robacter winogradski, N.agilis, Nitrospina gracilis, Nitrococ-
cus mobilis.
Клетки Nitrobacter отличаются полиморфностью: в культурах
бывают округлые, палочковидные, бобовидные и грушевидные фор-
мы, подвижные и неподвижные. В неблагоприятных условиях может
образовывать зооглеи. Образование зооглей считают характерным
признаком poflaNitrocystis. JJitrocpina gracilis - прямая
тонкая палочка 0,3-0,4 х 2,7-6,5 мкм, иногда образует.сферичес-
кие формы, неподвижная. Nitrococcus mobilis имеет округлые
клетки 1,5 мкм в диаметре, имеет один-два жгутика.
Возбудители нитрификации не используют органические ве-
щества и строго специализированы в отношении окисляемых суб-
стратов - аммиака и нитритов.
Материалы. Среда Виноградского. Среду разливают в кони-
ческие колбы на 50 мл по 15 мл среда в каждую. Высота слоя
з колбах должна быть 1-1,5 см. В каждую колбу вносят на кончи-
ке шпателя небольшое количество мела.
305
р
Посевной материал - почвенная суспензия в разведениях 1:10
I:io3, 1;Ю® по I мл в каждую колбу. Одну колбу оставля-
ют стерильной для контроля на реактивы.
Условия культивирования - 2-3 недели при 28-30°.
Учет результатов.
0 развитии тарификаторов судят по появлению в среде нит-
ритов и нитратов. Для этого проводят соответствующие качествен-
ные реакции. Пробы делают на белой керамической пластинке.
Реакция на II 0g- с реактивом Грисса основана на образова-
нии в кислой среде в присутствии нитритов и ароматических ами-
нов (сульфаниловой кислоты и<Х-нафтиламина) азосоединения, ок-
рашенного в красно- розовый цвет. Для выполнения реакции к кап-
ле реактива Грисса добавляют каплю культуры. Появление красно-
го окрашивания свидетельствует о присутствии нитритов.
H30.S<O>'wk HS0r<Q>V=,V
сульфаниловая к-та 00
ot - нафтиламин
оС- нафтиламин L Д 1
красно-розовое соединение
Реакция на П Од . Несколько кристаллов дифениламина раст-
воряют в капле концентрированной серной кислоты и к смеси до-
306
бавляют каплю исследуемой жидкости. При наличии нитратов возни-
кает интенсивно-синее окрашивание.
Предварительно проделывают контрольные реакции со стериль-
ной средой. Результаты отмечают в таблице.
Показатели роста нитрифицирующих бактерий на среде
Виноградского
Присутствие Разведение
1:102 1:Ю3 1:Ю4 1:Ю5
Нитритов
Нитратов
Зак. 1183
Микроскопирование. Готовят препараты "раздавленная капля"
и фиксированных окрашенных клеток. Для этого используют куль-
туру, где отмечен лучший рост. Материал отбирают так, чтобы
в препарат попали частицы мела, т.к. около них может быть
больше нитрифицирующих бактерий, чем в окружающей среде. Опи-
сывают и зарисовывают особенности обнаруженных клеток (форму,
подвижность, наличие зооглейных образований).
Денитрифипирующие бактерии
Денитрификацией называют микробиологический процесс вос-
становления нитратов до молекулярного азота с одновременным
(сопряженным) окислением до COg и HgO органических веществ.
Конечным акцептором водорода является ХО3-. Денитрификация мо-
жет проходить в аэробных условиях, но особенно интенсивно про-
«Л
текает процесс без доступа кислорода. Денитрификаторы широко
распространены в природе. Большинство из них относится к ро-
307
Дам Pseudomonas, Achromobacter, Liicrococcus,
но есть и представители бацилл (B.Bidieniformis
Все они - хемоорганогетеротрофы, факультативные анаэробы. В аэ-
робных условиях при окислении органического вещества они исполь-
зуют в качестве конечного акцептора водорода главным образом
кислород воздуха.
Некоторые денитрификаторы используют нитраты главным обра-
зом или исключительно в энергетическом обмене, но не как источ-
ник азота для конструктивных целей, т.е. не могут восстанавли-
вать нитраты до аммония. Поэтому в среду добавляют пептон, ас-
парагин или соль аммония.
Материалы. Среда Гильтея в пробирках с поплавками.
Посев из разведений 1:10^-1:10^ в трех-четырехкратной
повторности. Объем посевного материала I мл. Суспензии вносят
на дно пробирок. Среду в одной пробирке оставляют стерильней
для контроля.
Условия культивирования: 7-10 суток при 28-30°.
Учет результатов.
0 развитии денитрификаторов судят по образованию газа,
исчезновению из среды нитратов (р-ция с дифениламином), под-
щелочению и помутнению среды. PH определяют универсальным ин-
дикатором. Все показатели сравнивают с данными стерильной
среды и вносят в таблицу. Рассчитывают вероятное количество
аммонифицирующих бактерий в Т г исходного субстрата и дове-
рительный интервал.
Микроскопирование. Из глубины культуры, в которой наблю-
дались наиболее характерные изменения среды, отбирают матери-
ал, готовят препараты "раздавленная капля" и окрашенный по
308
Граму. Обращают внимание на форму клеток, их сочетания, подвиж-
ность. Микроскопическую картину зарисовывают.
Показатели роста денитрифицирующих бактерий на среде Гиль-
тея
Разведение Повторность Газообра- зование Наличие И°3~ Hi Помутнение
Г. ТО4 I
И т.д. 2
3
Стерильная среда
Азотфиксирующие микроорганизмы
Азотфиксация - это способность организмов усваивать молеку-
лярный азот и строить из него все азотсодержащие соединения
клетки. Этим свойством обладают многие микроорганизмы, обита-
ющие в почве и в водоемах: различные виды родов Azotobe.cter,
Clostridium, Pseudomonas, Aerobacter , Bacillus,
некоторые микобактерии, актиномицеты, грибы, сине-зеленые водо-
росли и др. Кроме того азотфиксация характерна для клубеньковых
бактерий рода Ahisobium , живущих в симбиозе с бобовыми рас-
тениями.
Выявление азотфиксаторов рода Azotobacter________.
Виды этого рода различаются между собой характером роста
на плотных средах, размерами и формой клеток и некоторыми фи-
зиологическими особенностями. Характерным признаком для боль-
шинства из них является образование слизистых колоний, окра-
309
шенных в темно-бурый или желтовато-зеленоватый цвет. Моло-
дые клетки подвижны, старые утрачивают жгутики и покрываются
слизистой капсулой.
Материалы. Среду ‘Эшби разливают в пробирки, туда же поме-
щают полоски фильтровальной бумаги так, чтобы край полоски был
выше уровня жидкости. Стерилизуют в автоклаве при 0,5 ат.
Посевной материал - комочки почвы.
Условия культивирования - 5-7 суток при 28-30°.
Учет результатов.
0 развитии азотобактера судят по появлению характерных
слизистых колоний на полоске фильтровальной бумаги. Описывают
и зарисовывают особенности обнаруженных клеток ( форму,под-
вижность, наличие капсулы, соединения клеток).
Выявление азотфиксаторов из рода CTostridimi
Бактерии этого рода в молодых культурах - подвижные па-
лочки, одиночные или соединены в короткие цепочки из 2-3 кле-
ток. В старых культурах большинство клеток неподвижны. При
спорообразовании клетки утолщаются в середине или в конце.
Наиболее активный азотфиксатор из этой группы микроорганиз-
мов CI. paBteurianura - облигатный анаэроб, хемоорганогете-
ротроф. Молекулярный азот усваивается ими при дефиците
азотсодержащих соединений в среде.
Материалы. Среда Виноградского (г): глюкоза -
- 1,0, Мез O^’THgO - 0,5, l.raCI,l'eSC4, МсЗ 0^ - следы,
СаСОд - 20,0. Разливают по ТО мл в пробирки, стерилизуют.
Посевной материал - пастеризованная почва.
Условия культивирования - 7-Т0 суток при 28-30°.
зто
Учет результатов.
Наиболее существенные признаки развития клостридий в сре-
де Виноградского - характерный запах масляной кислоты, выделе-
ние газа, образование пены и наличие в накопительной культуре
содержащих гранулезу клостридиальных форм клеток. Пробы отби-
рают со дна пробирок вместе с мелом. Описывают и зарисовыва-
ют особенности обнаруженных микроорганизмов.
Литература
Большой практикум по микробиологии. Под ред.Г.Л.Селибера.
М., 1962.
Елино вН.П. Полезная и вредная деятельность микроорганиз-
мов. М., 1970.
Практикум по микробиологии. Под ред. Н.С.Егорова. М.,
1974.
311
12. БАКТЕРИОФАГИЯ
Вопросы для подготовки по теме
I. Общая характеристика фагов: морфология, распростра-
нение, жизненный цикл.
2. Вирулентные и умеренные фаги. Лизогенные культуры.
3. Специфичность фагов.
4. Выделение фагов и методы их количественной оценки.
Бактериофаги - это вирусы, паразитирующие на прокариотах
(бактериях , синезеленых водорослях и актиномицетах). Фаги об-
наруживают по их литическому действию на соответствующие микро-
организмы, причем это действие специфично, т.е. каждый фаг на-
иболее активно действует на определенный вид бактерий или на
группу родственных видов. Лизирующее действие фага выражается
в полном просветлении бульонной культуры или в образовании на
засеянных плотных средах прозрачных участков среди газона куль-
туры на поверхности среды ("стерильные" пятна).
Применение бактериофага для фагодиагностики инфекций
С при дизентерии, брюшном тифе, холере и т.п.). При этом не
требуется выделения культуры возбудителя инфекции, а доказа-
тельством ее присутствия в исследуемом материале служит реак-
ция нарастания титра фага. Метод применяется при исследовании
воды, почвы, выделений больного. Материал, подлежащий исследо-
ванию, засевают на бульон и помещают в термостат при 37°.
На следующий день бульон фильтруют через фильтр Зейтца. При-
сутствие фага в фильтрате определяется по его лизирующему дей-
ствию на соответствующую культуру. Количество бактериофага в
фильтрате оценивают методом титрования.
ЗТ2
Применение бактериофага для фаготипирования микробной
культуры.
Для этого используют стандартные коллекции фагов. Для
фаготипирования нужна чистая культура микроорганизма. Её засе-
вают газоном на чашку Петри, через 5-10 мин после посева нано-
сят капли фага. Через 24 часа роста в термостате отмечают зоны
лизиса культуры под действием фага, интенсивность лизиса и по-
явление вторичного роста культуры. Фаготипирование особенно
часто используют для установления эпидемиологических связей при
стафилококковых инфекциях.
Применение бактериофага для фаготерапии и фагопрофилактики
Для этих целей используют бактериофаг, активный в отноше-
нии возбудителей таких заболеваний, как дизентерия, холера,
стафилококковые и стрептококковые инфекции. Фаг производят в
массовых количествах, его активность определяют методом титро-
вания.
Титрование бактериофага. Титрование бактериофага произво-
дится на культурах бактерий в жидких и твердых средах.
На жидких средах (титрование по Аппельману). Приготавли-
вают ряд пробирок с 4,5 мл МПБ. В первую пробирку вносят 0,5
мл исследуемого фага. Перемешивают и переносят в следующую про-
бирку 0,5. мл и т.д., получая серию разведений фага с уменьше-
нием его концентрации в каждой пробирке в ТО раз. После того
во все пробирки вносят по 0,1 мл суточной бульонной культуры
соответствующих бактерий. Пробирки помещают в термостат при
37° на сутки, после чего определяют титр фага по тому послед-
нему разведению его, которое дало лизис бактерий.
На твердых средах. Чашки Петри с МПА засевают газоном су-
зтз
точной культурой соответствующих бактерий. Спустя 5-10 мин пос-
ле посева на кавдую чашку наносят капли предварительно разве-
денного бактериофага. Разведения делают, как и в предыдущем
методе. На каждую чашку наносят несколько капель одного разве-
дения фага. Чашки выдерживают 18 часов при 37°, затем оценива-
ют результаты посева. На чашках с большой концентрацией фага
по следу капли роста культуры нет или имеются отдельные коло-
нии с изъеденными краями или центром. В последующих чашках
отмечается большее или меньшее в зависимости от разведения фа-
га количество "стерильных" пятен. Титр фага определяется его
последним разведением, давшим лизис культуры.
Определение специфичности действия бактериофага.
Культуры бактерий засевают газоном на чашки Петри. На них
через 5-10 мин после посева наносят капли испытуемого бакте-
риофага. Специфичность фага оценивают по его способности обра-
зовывать "стерильные" пятна на чашке с определенной микробной
культурой.
Цель работы: исследовать техническую воду на присутствие
бактериофага; исследовать воздух на присутствие актинофага.
Материалы:
Бульонные 18-часовые культуры St.aureus, s.coli, Bac.sub-
tilis, rseudoraonas aeruginosa .
Культуры актиномицетов на агаре Чапека:-‘ict.iTaaiae, „.ct.
strepto-uycini, Act .{.lobisporus, -,ct.aureo-'aciens
Пробирки c 8 мл МПБ, чашки Петри с агаром Чапека.
Исследование воды.
Качественная проба на присутствие фага.
В пробирки с МПБ засевают по I мл исследуемой воды и по
314
0,1 мл бульонной культуры одного из микроорганизмов. В КОНТ
рольные пробирки засевают только бактерии. Инкубируют 18 часов
при 37°С. Если бульон в опытных пробирках остается прозрачным,
а в контрольных мутным, то это является доказательством нали-
чия фага. Часто бульон в опытной пробирке после просветления
становится мутным вследствие размножения фагоустойчивых клеток.
Титрование бактериофага делают, как указано выше, исполь-
зуя в качестве тест-культуры специфичный для фага микроорганизм.
Исследование воздуха
Чашки Петри засевают культурами актиномицетов газоном.
Открытие чашки со свежеприготовленным посевом оставляют откры-
тыми на 30 мин, затем закрывают и инкубируют в термостате 24-48
час. Наличие в воздухе фага обнаруживают по появлению на повер-
хности газона отдельных стерильных пятен.
Литература
Лебедева М.Н. Руководство к практическим занятиям по
медицинской микробиологии. М.,1973.
Пяткин К.Д. Микробиология с вирусологией и иммунологией.
М., 1971.
Синюшина М.Н., Самсонова М.Н.Руководство к прак-
тическим занятиям по медицинской микробиологии. М.,1974.
Тимаков В.Д. Микробиология. М., Т973.
ЗТ5
13. ГЕНЕТИЧЕСКАЯ ИЗМЕНЧИВОСТЬ МИКРООРГАНИЗМОВ
Вопросы для подготовки по теме
I. Ядерный аппарат у прокариотов и эукариотов
2. Мутации спонтанные и индуцированные. Мутагены.
3. Фенотип и генотип.
4. Рекомбинация у микроорганизмов (трансформация,
трансдукция, конъюгация).
Получение и идентификация ауксотрофных мутантов E.coli.
Термин "биохимические мутанты" используют для обозначени.
мутантов с измененными потребностями в определенных факторах
роста или мутантов с измененными, легко распознаваемыми биохи-
мическими процессами (например, способность сбраживать какой-
либо сахар, синтезировать аминокислоты, азотистые основания,
витамины). Среди биохимических мутантов наиболее изучены аук-
сотрофные мутанты.
Ауксотрофным называют мутант, требующий дополнительные
факторы для своего роста, в которых не нуждается дикий штамм -
прототроф. Выделять ауксотрофные мутанты из популяции протот-
рофов довольно сложно, поэтому прибегают к различным методам,
позволяющим увеличить относительное количество ауксотрофных
мутантов в популяции.
Один из широко применяемых в этих целях методов - так на-
зываемый полуселективный метод, основан на действии пеницилли-
на, который в больших концентрациях действует не только на
грамположительные, но и грамотрицательные бактерии. Пенициллин
вызывает гибель растущих бактерий, но не оказывает влияния на
клетки с подавленным метаболизмом. Поэтому если смесь ауксот-
ЗТб
рофных и прототрофных клеток поместить в среду, дефицитную по
тем или иным питательным веществам и содержащую летальную дозу
пенициллина, то прототрофы погибнут, как только начнут размно-
жаться, жизнеспособными останутся только ауксотрофы, которые
не смогут расти в этих условиях.
Цель работы - получение и идентификация ауксотрофных му-
тантов E.coli К-12 под действием нитрита натрия.
Материалы.
Питательные среды. Полноценная среда - бульон и агар
Хоттингера, содержащий 0,2^ глюкозы. Минимальная среда - сре-
да Гловера (в г/л дистиллированной воды): IIН^СТ -3,0; IlH^Oj -
l,0;iiagso4- 2,0; KgHP04 - 3,0; KH2P04 - 1,0; LlgS04'7H20 - 0,1,
глюкозы - 2,0. Селективные среды. Для приготовления селектив-
ных сред в минимальную среду Гловера вносят необходимые соеди-
нения в следующих количествах (мг/л): аминокислоты - 100, ви-
тамины - 10, азотистые основания и нуклеозиды - 20. Растворы
этих веществ и глюкозы готовят на дистиллированной воде и сте-
рилизуют пропусканием через бактериальный фильтр.
Посевной материал. Взвесь 16-часовой культуры E.coli ,
содержащая 2 млрд клеток в Т мл.
Постановка опыта. Суспензию клеток исходного штамма обра-
батывают нитритом натрия и выращивают на полноценной среде для
фенотипического проявления мутаций. Затем клетки для истощения
эндогенных веществ переносят в минимальную среду, где клетки
обрабатывают пенициллином. Чтобы определить содержание жизне-
способных клеток, проводят посев на агаризованную полноценную
среду из следующих вариантов суспензий:
Т. Исходной, не обработанной мутагеном.
ЗТ7
2. Обработанной нитритом натрия.
3. После подращивания на полноценной среде
4. Обработанной пенициллином.
Из каждого варианта отсеивают по ТОО колоний на плотную
полноценную и минимальную среды. Для всех вариантов определяют
мутагенный эффект, а также летальный эффект мутагена для 2-го
варианта сравнительно с I-ым и летальный эффект пенициллина
для 4-го варианта в сравнении с 3-им. Идентификацию ауксотроф-
ных мутантов, полученных из рассева второй пробы, проводят на
среде Гловера с добавкой комбинаций различных питательных ве-
ществ.
Обработка бактериальных клеток нитритом натрия. К 0,5 мл
суспензии клеток добавляют 0,5 мл 0,03 М нитрита натрия и вы-
держивают 30 мин при 37°. Затем для прекращения действия нитри-
та к суспензии добавляют 8 мл фосфатного буфера с pH 7,0. При
этом pH мутаген неактивен. Затем клетки отмывают 2 раза при
центрифугировании й фосфатном буфере pH 7,0 и осадок ресуспен-
дируют в 0,5 мл того же буфера. Контролем служит 0,5 мл необра-
ботанной взвеси клеток.
Для изучения летального и мутагенного действия нитрита
натрия контрольную и обработанную мутагеном суспензии высева-
ют на поверхность плотной полноценной среды в чашках Петри.
Предварительно суспензию разбавляют: контрольную в ТОО раз,а
обработанную мутагеном в 1000 раз. Засевают по 0,1 мл на чашку,
noj6 чашек на контроль и опыт. Выращивание при 37° 24 часа.
0,05 мл обработанной мутагеном разведенной суспензии пе-
реносят микропипеткой в пробирку с 5 мл полноценной среды. Про-
бирку ставят на качалку при 37° на 18-20 часов.
318
Обработка клеток пенициллином.
Культуру, выросшую в пробирке с 5 мл бульона, центрифуги-
руют, клетки отмывают фосфатным буфером pH 7,0 и ресуспензиру-
ют в исходном объеме того же буфера. После этого для истощения
эндогенных запасов питательных веществ вклетках 0,05 мл такой
суспензии переносят в пробирку с 5 мл минимальной среды и ста-
вят на качалку при температуре 37° на 3 часа. Из оставшейся
7
суспензии делают разведения до 10 и из двух последних разве-
цений по 0,1 мл в трех повторностях для-определения эффекта под-
ацивания высевают в чашки с полноценной средой. Через 3 часа
в пробирку, находившуюся на качалке, вносят I мл раствора пе-
нициллина (100000 ед/мл), оставляют на качалке еще на 2 часа,
затем суспензию центрифугируют, клетки отмывают фосфатным бу-
фером pH 7,0 и ресуспензируют в 5 мл этого же буфера. После
„__4
этого делают разведения до ТО и два последних разведения
по 0,1 мл в трех повторностях высевают на чашки с полноценной
питательной средой. Чашки оставляют при 37° на 24 часа.
Определение летального действия нитрита натрия.
Просматривают все чашки с выросшими колониями. В каждом
варианте выбирают одно наиболее удачное разведение и подсчиты-
вают число живых клеток в I мл суспензии. Результаты вносят в
таблицу.
Определение летального эффекта нитрита натрия и пенициллина
Вариант опыта Разведение Количество ко- лоний на чашке Кол-во живых клеток в 1мл Выживаемость в %
Т 2 3 4 100 100
319
По результатам подсчетов определяют летальный эффект.
Для определения процентного содержания ауксотрофов ТОО ко-
лоний каждого из вариантов опыта проверяют на способность к
росту на минимальной среде. Для этого каждую из ТОО колоний вы-
севают штрихом на две чашки: с минимальным и полноценным ага-
ром. Колонии ауксотрофов выявляют по отсутствию роста на мини-
мальной среде.
Для этой же цели можно воспользоваться методом реплик,
который позволяет перенести на чашку сразу большое количество
колоний.
Метод реплик заключается в переносе или отпечатке бак-
териальных колоний, развившихся на чашке с твердой питательной
средой на другие чашки, при этом точно фиксируют место каждой
колонии на первой чашке с питательной средой. Отпечатки дела-
ют с помощью лоскута стерильного бархата, натянутого на цилин-
дрическую деревянную или металлическую подставку, диаметром
немного меньше диаметра чашки Петри, на которой нужно сделать
отпечаток. Приготовленную таким образом "печать" слегка прижи-
мают к колониям, выросшим на исходной чашке, и делают с нее
отпечаток, причем каждая ворсинка бархата становится как бы
иглой для переноса бактерий. Затем ворсистый лоскут с отпе-
чатанными на нем колониями бактерий осторожно прижимают к по-
верхности питательного агара, разлитого в чашки Петри (в нашем
опыте одна чашка с полноценной питательной средой, а другая
- с минимальной). Чашка с полноценной средой служит в качест-
ве контроля полноты переноса колоний с исходной чашки на ана-
логичную питательную среду. На минимальном агаре будут образо-
вывать колонии только клетки-прототрофы. Отсутствие определен-
320
ной колонии на минимальном агаре показывает, что соответству-
ющая колония на полноценной питательной среде состоит из аук-
сотрофньк мутантов.
Определение содержания ауксотрофных мутантов в разных
вариантах опыта. Идентификация ауксотрофов.
Через 24 часа просматривают чашки и определяют долю аук-
сотрофов в каждом из четырех вариантов опыта. Результаты вносят
в таблицу.
Определение количества ауксотрофных мутантов Е.соП в раз- ных вариантах опыта
Вариант опыта Общее количество колоний км»—мм—хм—ма—аимма Кол-во ауксотрофных колоний
абсолютное % к общему числу коло- ний
I 2
3
4
Для идентификации ауксотрофов из второго варианта опыта
отбирают ТО колоний, которые высевают штрихами на чашки Петри
с минимальной средой, содержащей различные комбинации ростовых
веществ (всего таких комбинаций 12). Таким образом, каждый му-
тант высевают на Т2 чашек, содержащих перечисленные комбинации
веществ 1'см. таблицу).На каждую чашку по секторам высевают
ТО идентифицируемых мутантов. Через 48 часов просматривают чаш-
ки. Специфические потребности ввделенных мутантов определяют
следующим образом: если мутант растет только при добавлении к
среде двух каких-либо комбинаций веществ, то он нуждается в
метаболите, общем для этих групп. Не исключено, что выделен-
32Т
ные ауксотрофы могут быть дефектны не по одному, а по несколь-
ким метаболитам.
Комбинации ростовых веществ, используемых для идентифика-
ции ауксотрофов
Комби- I нации 2 3 4 5 6
7 аденин биотин фенилаланин аланин аргинин лейцин
8 гипоксантин фолиевая к-та серин цистеин орнитин глицин
9 цитозин пантотен. к-та трипто- фан треонин аспара- гин . к-та изолейцин
10 гуанин пиридоксин тирозин тиосуль- фат Уа - пролин гистидин
11 ТИМИН тиамин ПАБК метионин глута- лизин мин.к-та
12 урацил рибофлавин никотин. холин инозит валин
к-та
Летальное и мутагенное действие ультрафиолетовых
лучей (УФЛ) на клетки дрожжевых организмов
Наибольший летальный и мутагенный эффект УФЛ наблюдается
при длине волны 260 нм, поскольку это максимум поглощения
УФЛ ДНК. При изучении зависимости выживаемости бактериальных
клеток от дозы УФЛ следует учитывать ряд факторов, влияющих
на интенсивность облучения. Прежде всего это густота облучае-
мой суспензии. УФЛ интенсивно поглощаются клетками, поэтому
при большой густоте облучаемой суспензии клетки экранируют друг
друга. Это обстоятельство не играет существенной роли при кон-
центрациях суспензии, не превышающих I-T0® клеток/мл. При не-
обходимости использования более густой суспензии ее необходи-
322
мо непрерывно перемешивать во время облучения.
Выживаемость клеток зависит и от состава среды, использу-
емой для суспензирования. Лучше проводить облучение в буферных
растворах. Питательный бульон поглощает УФЛ сильнее, чем бу-
ферные растворы, поэтому получаемая клетками доза УФЛ уменьша-
ется. Но при облучении бульона образуются токсичные органичес-
кие перекиси, увеличивающие летальный эффект УФЛ.
Наконец, летальный эффект УФЛ зависит от физиологического
состояния клеток, в первую очередь от возраста культуры. В ста-
дии экспоненциального роста клетки более чувствительны к УФЛ,
чем в стационарной фазе.
Цель работы - получение под действием УФЛ мутантов дрож-
жевых организмов и определение мутагенного и летального дейст-
вия УФЛ. Оценка мутагенного действия проводится по выявлению
морфологических мутантов, т.е. по количеству морфологически
измененных колоний у облученной культуры по сравнению с исход-
ной.
Материалы.
Питательная среда - сусло-агар.
Тест культура - клоновая культура одного из видов дрожжей
Sao-Jiaroi^’ces cerevisiae, Sporobolorayces species, Aureobasi-
dium oullulaiis. Культуру выращивают в
течение 48 часов на сусло-агаре и готовят взвесь на физиоло-
гическом растворе с концентрацией 50 млн клеток/мл.
Постановка опыта. Проводят облучение дрожжевых клеток
разными дозами УФЛ, часть суспензии оставляют необлученной
(контроль). Из обработанной и контрольной суспензии высевают
пробы на сусло-агар. По числу выросших колоний определяют ко-
323
личество жизнеспособных клеток в I мл облученной и контрольной
суспензии. О мутагенном действии УФЛ судят по соотношению (%)
числа иффологически измененных колоний в контроле и облученных
пробах.
Облучение. Суспензию дрожжевых клеток облучают УФЛ, источ-
ником которых служит лампа БУФ-15. Используется доза 1300 и
2600 эрг/мм^. Облучение проводят в открытых чашках Петри, ди-
аметр которых I00-II0 мм. В чашку наливают по 4 мл суспензии.
Во время облучения суспензию непрерывно перемешивают магнитной
мешалкой. 4 мл необлученной суспензии служит контролем.
Для определения количества жизнеспособных клеток в I мл
взвеси облученных и необлученных клеток отбирают пробы и де-
лают разведения 1:100,1:1000 и 1:10000. Из двух последних раз-
ведений делают высевы по 0,1 мл на чашки с сусло-агаром. Взвесь
равномерно распределяют по поверхности питательной среды шпа-
телем.
Обработку облученной суспензии и рассев ее на чашки сле-
дует проводить при свете красного фонаря, т.к. при обычном све-
те происходит фотореактивация облученных клеток.
Определение эффекта УФЛ на клетки.
Засеянные чашки выдерживают при 24° 4-5 суток. Подсчитыва-
ют общее число колоний«на чашках и количество морфологически
измененных колоний. Результаты вносят в таблицы. Определяют
выживаемость клеток в зависимости от дозы облучения и количест-
во морфологических мутантов.
<24
Летальное действие УФЛ на клетки .........
Доза облучения Кол-во колоний на чашке при разведении Кол-во жизне- Выживае-
способных клен ТОК в I мл - - мость %
1:1000 Г. 10000
Контроль 1300 эрг/мм^ : 2600 эрг/мм^ ТОО
Зак. 1183
Мутагенное действие УФЛ на клетки ...............
Доза облучения Общее число просмотренных колоний на чашках Кол-во мор- Измен- фологически чивость измененных % колоний 1
Контроль 1300 эрг/мм^ 2600 эрг/мм^
Трансформация у бактерий
Трансформация - это процесс гибридизации бактерий, при
котором перенос информации осуществляется путем передачи ДНК,
экстрагированной из клетки донора, в клетку реципиента без
каких-либо посредников. Процесс трансформации подразделяют
на 5 фаз:
I. Обратимая фаза контакта ДНК с клеткой-реципиентом.
Здесь ДНК еще можно удалить путем отмывания клеток или инак-
тивировать ферментом ДНК-азой.
2. Необратимая фаза проникновения ДНК в клетку-реципиент.
Здесь ДНК донора уже не чувствительна к ДНК-азе.
3. Фаза спаривания ДНК донора с ДНК реципиента.
325
4. Фаза интеграции ДНК донора с ДНК реципиента.
5. Фаза репликации ДНК,интегрированной в хромосоме реци-
пиента. Развивается трансформированный клон.
В последних трех фазах ДНК донора также нечувствительна
к ДНК-азе.
Путем трансформации можно передать различные признаки:
устойчивость к лекарственным препаратам, способность синтези-
ровать ферменты или полисахариды, зависимость от определенных
факторов роста и т.д.
Цель работы - получить путем трансформации штамм Вас.
subtilis , устойчивый к стрептомицину.
Материалы.
Питательная среда. Мясо-пептонный бульон с 0,Й глюкозы
и элективная среда - мясо-пептонный агар с глюкозы, содер-
жащий ТОО ед/мл стрептомицина.
Реципиент - клоновая культура Bac^ubtiiis , чувствитель-
ная к стрептомицину ( str.3 ).
Донор - стрептомицинорезистентный штамм Вас. subtilis ,
из которого выделяют ДНК обычным способом ( strr ). Её раство-
ряют в 0,01 м трис-буфере в концентрации I мкг/мл. ДНК -аза.
Раствор готовят на 0,5 м Mg Cig с концентрацией фермента 0,1
мг/мл.
Постановка опыта. Культуру реципиента выращивают в тече-
ние 18 часов на сахарном МПБ. К I мл бульонной культуры добав-
ляют 0,1 мл раствора ДНК донора и инкубируют при встряхива-
нии в течение I часа при 37°. Затем делают высев 0,Т мл на
элективную среду для опенки эффективности трансформации. Од-
новременно на эту же среду делают следующие контрольные посе-
323
вы по 0,1 мл на чашки Петри:
I. Исходная культура реципиента без обработки донорной ДНК
2. Раствор ДНК для проверки его стерильности
3. Контроль на инактивацию трансформирующей активности ДНК.
Для этого смешивают 0,1 мл раствора ДНК и 0,1 мл раствора
ДНК-азы, инкубируют при 37° 30 мин, затем добавляют I мл куль-
туры реципиента, инкубируют I час при 37° и делают высев.
4. Контроль для доказательства того, что на определенных
стадиях трансформации ДНК донора нечувствительна к ДНК-азе.
Для этого к 0,1 мл культуры реципиента, обработанной ДНК, пос-
ле 1-часовой инкубации добавляют 0,1 мл раствора ДНК-азы, вы-
держивают 30 мин при 37° и делают высев.
Засеянные чашки инкубируют 24 часа при 37°, затем регист-
рируют появление стрептомицинорезистентных колоний на электив-
ной среде.
Литера ту р а
АлиханянС.И. Селекция промышленных микроорганизмов.
М., 1968.
Б р а у н В. Генетика бактерий. М., 1968.
Блинов Н.П. Общие закономерности строения и раз вития, мик-
робов-продуцентов биологически активных веществ. М.,1977.
Захаров И.А., Квитко Н.В. Генетика микроорганизмов.
Л., 1967.
327
14. МИКРОФЛОРА ТЕЛА ЧЕЛОВЕКА 'И ОКРУЖАЮЩЕЙ ЕГО СРЕДЫ.
14.I. НОРМАЛЬНАЯ МИКРОФЛОРА ТЕЛА ЧЕЛОВЕКА И ЕЁ ЗНАЧЕНИЕ.
Вопросы для подготовки по теме
I. Микрофлора наружных покровов тела человека.
2. Микробы полости рта и дыхательных путей.
3. Микрофлора желудочно-кишечного тракта.
4. Значение нормальной микрофлоры человеческого тела.
Организм человека, начиная с первых часов жизни, постоянно
соприкасается с внешней средой и заселяется микробами. Многие
сапрофитные микроорганизмы в процессе эволюции приспособились
к жизни в макроорганизме и вступили с ним в симбиотические
взаимоотношения. На поверхности тела человека обитают стафило-
кокки, микрококки, стрептококки, дрожжи, грибы, некоторые грам-
положительные и грамотрицательные палочки. В качестве источни-
ка питательных веществ они могут использовать выделения саль-
ных и потовых желез. Общее количество микробов на поверхности
ТО
кожи может достигать 1*10 . Некоторые из микроорганизмов, на-
селяющих кожные покровы, относятся к условно-патогенным и при
несоблюдении гигиенических правил или ослаблении организма
( охлаждении, перегреве, нарушении режима питания,сна и т.д.)
могут активизироваться и вызвать заболевание, например, пио-
дермию, фурункулезы и т.д.
Микрофлора полости рта особенно•многочисленна и разнооб-
разна, т.к. здесь влажность,температура, обилие питательных
веществ, pH - благоприятствуют развитию микробов.
В течение жизни микрофлора полости рта значительно меня-
ется, в раннем детском возрасте преобладают молочнокислые бак-
326
I
менение некоторых лекарственных препаратов, обладающих антимик-
робными свойствами (антибиотики, сульфаниламиды), может сдви-
гать сложившееся соотношение между группами микроорганизмов
и приводить к дисбактериозу. Результатом дисбактериозов явля-
ется, например, кандидоз - заболевание, вызываемое грибами
рода Candida
Для изучения нормальной микрофлоры человеческого тела ис-
пользуют метод непосредственной микроскопии, например, мазков
зубного налета, со слизистой носа, миндалин и т.д.
С этой целью берут с помощью стерильных щепочек зубной
налет и стерильных тампонов слизь из носа и зева и делают маз-
ки на обезжиренном предметном стекле. Мазки фиксируют, окра-
шивают по методу Грама и микроскопируют в иммерсионной систе-
ме. Микробы зубного налета представлены на рис. 88.
Зак. 1183
Рис.88. Микрофлора зубного
налета.
I- Leptotrix ; 2- Вас .шах.
buccalis ; 3- Spirochaeta
buccalis; 4- Spirochaeta
dentiujn^; 5- Diplostrepto-
соссий 6-Pneumococcus; 7- Вас
fusiforme•
В мазках co слизистой носовой полости и зева чаще всего
обнаруживаются стрептококки, стафилококки, диплококки.
Цель работы: изучить микрофлору кожных покровов, полости
рта и носоглотки человека.
ЗЗТ
Материалы: стери^кые тампоны для взятия мазков с кожи и
слизистых, стерильные деревянные палочки для взятия соскобов с
зубов, чашки Петри с МПА, МПА с глюкозой и кровяным агаром.
Ход работы.
I. Взять с помощью стерильных палочек налет с зубов и с
помощью тампонов - слизь из носа, из зева. Сделать мазки на
обезжиренном предметном стекле, окрасить по Граму, микроскопи-
ровать в иммерсионной системе, описать и зарисовать микроорга-
низмы.
2. Взятый таким же образом материал засеять на чашки
Петри с МПА, кровяным и сахарным агаром. Выращивать при 37°
24 часа. Описать характер выросших колоний, сделать мазки из
отдельных колоний, окрасить их по Граму. На МПА обычно вырас-
тает колонии непатогенных стафилококков и стрептококков, на
сахарном и Кровяном агаре развиваются условнопатогенные и па-
тогенные кокки, которые более требовательны к питательным сре-
дам; на кровяном агаре они дают зоны гемолиза (разрушения эрит-
роцитов) .
3. Сделать посев "отпечатков" пальпев на чашках с МПА,
прикасаясь пальцами к поверхности питательной среды. Через
24 часа роста при 37°С на чашках можно обнаружить рост много-
численных микроорганизмов. Сделать мазки из отдельных колоний,
окрасить их по Граму. В мазках можно выявить стафилококки,
грамположительные, реже грамотрицательные палочки, дрожжи. За-
рисовать и описать наблюдаемые объекты. Для получения чистой
культуры материал из отдельных колоний пересеять на скошенный
МПА в пробирках.
332
14.2. МИКРОМОРА ПОЧВЫ.
САНИТАРНО-БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ ПОЧВЫ.
Вопросы для подготовки по теме:
I. Качественный и количественный состав микрофлоры
почвы.
2. Микробное число почвы и его определение.
I 3. Санитарно-показательные микроорганизмы почвы. Опре-
деление коли-титра и перфрингенс-титра почвы.
Почвв является естественной средой обитания многочисленных
микроорганизмов. Среди них подавляющее большинство является сап-
рофитами, участвующими в таких важнейших процессах круговорота
веществ в природе, как круговорот углерода,азота,фосфора,серы.
Таким образом, .по качественному составу микрофлора почвы чрезвы-
чайно разнообразна: в ней находятся гнилостные, нитрифицирующие,
денитрифицирующие,азотфиксирующие,разлагающие клетчатку микроор-
ганизмы,серо- и железобактерии, актиномицеты,микроскопические
грибы,водоросли.простейшие.
Для количественной характеристики микрофлоры почвы введено g
понятие микробного числа. Микробное число почвы - общёе коли- j
чество микроорганизмов,содержащихся в I г почвы. *
Количество микроорганизмов в почве зависит от состава поч-
вы, географических, геологических уеловий,от времени года и интен-
сивности загрязнения почвы человеком и животными. Наибольшее ко-
личество микроорганизмов находится в перегнойном слое почвы,так
называемом гумусе. Гумус - органический компонент почвы, в кото-
ром содержатся остатки животных и растительных организмов и
интенсивно идут процессы разложения последних. Гумус
во многом определяет плодородие почвы. Наибольшее количество
1183
333
микроорганизмов содержится на глубине ТО-25 см, микробное чис-
ло почвы здесь может достигать десятков и сотен миллионов. По
мере увеличения глубины количество микроорганизмов постепенно
снижается. Однако в глубинные слои почвы микроорганизмы могут
заноситься с водой, некоторые группы микробов участвуют в фор-
мировании и разложении горных пород, залегающих на больших глу-
бинах.
Условно-патогенные и патогенные микроорганизмы попадают
в почву с выделениями человека и животных.
Первый этап оценки санитарно-бактериологического состояния
почвы включает определение общего числа микроорганизмов (микроб-
ного числа).
Пробы почвы для анализа отбирают следующим образом: из
ямы, вырытой до нужной глубины, берут небольшое количество поч-
вы стерильным шпателем и помещают в стерильную колбу или сте-
рильный полиэтиленовый пакет. Кроме того, можно использовать
бур Некрасова - пустотелое сверло со специальной камерой для
проб почвы, которую стерилизуют перед использованием (рис.89).
Пробы почвы доставляются в лабораторию не позже, чем через 2
часа после их взятия; допускается хранение их в холодильнике
не дольше 24 часов, затем необходимо производить микробиологи-
ческое исследование.
В связи с тем, что микроорганизмы в почве могут распреде-
ляться неравномерно, для более полной характеристики микрофло-
ры необходимо брать не менее Т0-Т5 проб из различных участков
исследуемой территории.
Прежде чем производить посев почвы для определения микроб-
ного числа её измельчают и просевают через стерильное сито с
334
гчейками диаметром до 3 мм. Затем навески почвы (поЮ г) расти-
рают пестиком в стерильной ступке с добавлением небольшого ко-
личества физиологического раствора. Затем приготавливают ТСУ?
суспензию подготовленной таким образом почвы в стерильных кол-
бах и встряхивают на шуттельаппарате (качалке) 10-15 минут, пос-
ле чего без отстаивания готовят несколько десятикратных разве-
дений почвы (1:1000,1:10000,1:100000, Т:1000000) для последу-
ющего посева. Для посева почвы можно использовать два метода:
Рис.89. Почвенный бур
Некрасова. I-головка с
рукоятко й;2-осно вная
.штанга; 3-шпонка;4-муф-
та; 5-крышка; б-допол-
нительная штанга;7-ко-
робка; 8-нож;9-бур в
собранном виде.
при глубинном посеве I мл соответствующего разведения почвен-
ной суспензии вносят в пустую стерильную чашку Петри и залива-
ют т0 мл расплавленного и охлажденного до 45° мясопептонного
агара или сусло-агара; среду перемешивают, осторожно вращая
чашку Петри в горизонтальной плоскости.
После застывания среды чашки с сусло-агаром помещают в
335
термостат при 24° (для роста дрожжевой и грибной микрофлоры),
чашки с МПА при 37° (для роста бактериальной флоры). При поверх
ностном методе посева сеют 0,1 мл соответствующего разведения
суспензии шпателем по поверхности плотной питательной среды
(МПА или сусло-агара). Посевы инкубируют 48 часов, после чего
подсчитывают количество выросших колоний для каждого разведе-
ния почвы, а затем вычисляют средний показатель микробного чис-
ла почвы в пересчете на I грамм.
Определение микробного числа почвы дает представление об
общей численности, в основном, сапрофитных микроорганизмов, ко-
торые растут на МПА и сусле-агаре, если же необходимо выделить
определенные группы микробов (например, азотфиксирующие, разла-
гающие клетчатку, продуцирующие антибиотики, нитрифицирующие,
некоторые патогенные и т.д.) используют специальные среды и ме-
тоды посева (см.раздел II).
Для характеристики санитарного состояния почвы особое зна-
чение имеет выявление фекального загрязнения.
Люди и теплокровные животные являются основными резерву-
арами и источниками распространения инфекционных заболеваний.
Основными путями выделения патогенных микробов в окружа-
ющую среду являются фекальный и воздушно-капельный..
Обнаружение в почве патогенных микроорганизмов крайне
затруднительно из-за того, что их количество может быть очень
мало, некоторые из них быстро погибают и методы определения
возбудителей инфекционных заболеваний длительны и трудоемки.
Поэтому для оценки загрязнения почвы фекалиями человека или
животных, в которых могут находиться патогенные микробы, под-
ходят непрямым путем, обнаруживая таких нормальных представи-
телей микрофлоры кишечника, как Escherichia coli и
Clostridium perfringens,которые признаны санитарно-показательны-
ми~дщя~почвы. ~Обнаружение их, особенно в больших количествах,
служит свидетельством санитарного неблагополучия и потенциаль-
ной опасности почвы. Микроорганизмы, включенные в группу сани-
тарно-показательных, должны отвечать следующим требованиям:
I. они должны постоянно содержаться в выделениях человека
и определенных теплокровных животный;
2. у них не должно быть других природных резервуаров или
естественных мест обитания;
3. после выделения в окружающую среду, они должны сохра-
нять жизнеспособность в течение определенных сроков,
близких к срокам выживания некоторых патогенных бакте-
рий, выводимых из организма теми же путями;
4. они не должны сколько-нибудь интенсивно размножаться
во внешней среде, т.е. их количество должно оставаться
постоянным определенный период времени после попадания
в окружающую среду;
5. они должны легко обнаруживаться современными микробио-
логическими методами и поддаваться количественному оп-
ределению;
б. они должны быть достаточно типичными, чтобы их диффе-
ренциация была облегчена и изменчивость в природных
условиях была неширокой.
Санитарно-показательное значение кишечной палочки (Esch,
coli) определяется прежде всего тем, что, являясь нормаль-
ным обитателем кишечника человека и животных, она находится
там в огромных количествах (в I г испражнений человека содер-
337
т
О Q
жится до ТО-ТО жизнеспособных кишечных палочек), кроме того её
сроки выживания во внешней среде близки к срокам сохранения
возбудителей кишечных инфекций (брюшного тифа, дизентерии, пи-
щевых токсикоинфекций). Так же как эти микроорганизмы,E.coli в
почве и воде, как правило, не размножаются и постепенно погиба-
ют. Для определения кишечной палочки в почве, воде и других
объектах разработаны специальные среды и методы, с помощью ко-
торых её легко обнаружить и отделить от других групп микроорга-
низмов.
Для количественной характеристики содержания кишечной па-
лочки в почве введено понятие коли-титра. Коли-титр почвы - то
наименьшее количество почвы, выраженное в граммах, в котором об-
наруживается одна жизнеспособная кишечная палочка.
Для определения коли-титра почвы используют элективные пи-
тательные среды, содержащие желчь и генпиан-виолет, подавляющие
рост многочисленных бактерий, населяющих почву, но не препят-
ствующие росту кишечной палочки. Наиболее употребительной яв-
ляется жидкая среда Кесслера, которая кроме вышеназванных ком-
понентов содержит пептон и лактозу, сбраживаемую E.coli ; для
улавливания образовавшегося газа служат поплавки.
Описываемый метод определения коли-титра называется мето-
дом бродильной пробы. Первый этап - посев ТО мл почвенной сус-
пензии (в разведении 1:10), что соответствует Т г почвы, в кол-
бы с 50 мл среды Кесслера, а Т мл суспензии (О,Т г почвы) и по
I мл дальнейших десятикратных разведений суспензии - в пробир-
ки с 5 мл среды. Посевы инкубируют в термостате при 43°, так
как при этой температуре большинство микроорганизмов, в отли-
чие от кишечной палочки, не развивается.
33»
После суточной инкубации отбирают так называемые положи-
теяьные посевы, в которых наблюдается обильное газообразование
и диффузный рост, эти признаки характерны для развития E.coli •
ферментирующей лактозу с образованием газа, скапливающегося
в поплавке (запаянной с одной стороны трубке, помещенной в сре-
ду). Из отобранных посевов делают высевы на дифференциально-
диагностическую среду Эндо , инкубируют при 37° 24 часа, обна-
руживают характерные для E.coli темнокрасные колонии с металли-
ческим блеском, производят микроскопию и при наличии в мазках
мелких грамотрицательных палочек делают вывод о присутствии
E.coli . При необходимости делают высев на глюкозопептонную
среду (ГПС) с поплавком, т.е. производят постановку так называ-
емой вторичной, бродильной пробы.
Предельное разведение почвенной суспензии, в которой об-
наружено наличие кишечной палочки (по бродильным пробам и мор-
фологии) указывает на титр кишечной палочки, т.е. на интенсив-
ность фекального загрязнения данной пробы почвы.
Анаэробные споровые бактерии - Clostr.perfringens так
же как E.coli содержатся в кишечнике человека и животных, од-
нако их количество значительно ниже содержания последних. Бла-
годаря способности образовывать споры эти микроорганизмы имеют
значительно большую устойчивость во внешней среде и поэтому мо-
гут служить показателями давнего фекального загрязнения и, кро-
,ме того, характеризовать степень возможного инфицирования поч-
вы патогенными спорообразующими анаэробами.
Перфрингенс-титр почвы - то наименьшее ее количество, вы-
раженное в граммах, в котором содержится одна жизнеспособная
клетка Cl.perfringens
339
Для определения Clostr.perfringens в почве «используют
железо-сульфитный агар (среду Вильсон-Блера). Эта плотная сре-
да содержит глюкозу, сульфит натрия CHa2SOj ), хлорное железо
(Ре2С1^ (см. Приложение). Посев почвы производят из тех же раз-
ведений почвенной суспензии, что и для определения коли-титра,
для того, чтобы неспоросные бактерии не росли на этой среде,
суспензию прогревают при 80° 10-15 минут./Посев производят сле-
дующим образом: из соответствующих разведений берут стерильной
пипеткой по I мл суспензии и вносят в пробирку с расплавленной
средой Вильсон-Блера. Равномерно распределяют посеянный мате-
риал и помещают в термостат при 37-43°.
Если в пробе почвы присутствует 01.perfringens наблюдается
характерное изменение среды в течение 3-18 часов.*В результате
роста на среде Вильсон-Егера этот микроорганизм восстанавливает
сульфит натрия до сернистого натрия ( Ha2s ), который взаимо-
действуя с хлорным железом образует сульфид железа( РеЗ ), ок-
рашивающий колонииC'l.perfring^ черный цвет. Кроме того, за
счет ферментации глюкозы образуются газы, разрывающие среду.
Перфрингенс-титр определяется максимальным разведением почвен-
ной суспензии, при посеве которого развиваются колонии.
В некоторых случаях, кроме среды Вильсон-Блера, использу- •
ют молочные среды (среду Тукаева). На этой среде Cl.perfringens
энергично сбраживает лактозу,молоко быстро сворачивается (в
течение 3-4 часов), образующийся газ разрывает сгустки казеина
и вытесняет их в верхнюю часть пробирки. Наличие 01.perfringens
на средах Вильсон-Блера и Тукаева подтверждается микроскопичес-
ки. В мазках, окрашенных по Граму, бациллы имеют вид крупных
грамположительных палочек с как бы обрубленными концами, кото-
34»
рые могут располагаться цепочками.
В том случае, если Cl.perfriagens вместе с почвой попадает
в глубокую раневую поверхность, она может вызвать тяжелов инфек-
ционное заболевание - газовую гангрену.
Оценка санитарного состояния почвы по коли-титру и перф-
рингенс-титру дана в таблицеб.
Таблица 6
Санитарно-бактериологическая оценка почвы по коли-титру
и перфрингенс-титру.
Исследуемая почва Титр E.coli (г) Титр Clostr.perfringens (г.)
Сильно загрязненная до 0,001 до 0,0001
Умеренно загрязненная 0,0Т-0,001 0,001-0,0001
Слабо загрязненная Т,0-0,от 0,01-0,001
Чистая выше 1,0 Выше 0,1
Цель работы: определить микробное число почвы, установить
ее коли-титр и перфрингенс-титр.
Материалы: образцы почвы, технические весы, стерильные
ступки и пестики, стерильный физиологический раствор, колбы,
пипетки, пробирки и чашки Петри, МПА, среда Эндо, среда Вильсон-
Блера в пробирках высоким столбиком, среда Кесслера в колбах
по К мл и в пробирках по 5 мл с поплавками, среда Тукаева.
Ход работы: Приготовить суспензию почвы, как это указано
34Т
выше. Сделать разведения суспензии в физиологическом растворе
1:10^, 1:10^, 1:10®, 1:10®. Десятикратные разведения получают,
добавляя I мл суспензии к 9 мл физиологического раствора в про-
бирке и тщательно перемешивая полученную взвесь. По I мл каж-
дого разведения внести в пустую чашку Петри и залить 10 мл
расплавленного и охлажденного до 45°С МПА, осторожно перемешать.
Инкубировать при 22°С 48 часов. В тех чашках, где позволяет гус-
тота посева, подсчитать выросшие колонии и определить микробное
число, учитывая взятое разведение.
2. Посеять 10 мл почвенной суспензии 1:10 в колбы с 50 мл
среды Кесслера, а I мл этой же суспензии и по I мл последующих
ее разведений- в пробирки с 5 мл среды. Выращивать 24 часа при
43°С. Отобрать пробирки и колбы с обильным ростом и газообразо-
ванием, сделать высевы на среду Эндо в чашки Петри, выращивать
при 37°С 24 часа, отметить характерные для кишечной палочки
темнокрасные колонии с металлическим блеском. Из типичных коло-
ний сделать мазки, окрасить их по Граму, при наличии в мазках
мелких грамотрицательных палочек можно сделать вывод о присут-
ствии E.coTi . Учитывая последнее.разведение, в котором обнару-
жен рост кишечной палочки, определить коли-титр данного образца
почвы.
3. Прогреть взвесь почвы при 80° 15 минут. По^Д, мл разве-
денной почвенной взвеси внести в пробирки с расплавленной и ох-
лажденной до 45°С средой Вильсон-Блера. Выращивать при 43°С в
течение 18 часов. Наблюдать образование характерных для ciostr.
perfringens черных колоний. Учитывая разведение почвенной сус-
пензии, определить перфрингенс-титр образца.
4. По I мл разведенной прогретой при 80°С почвенной взвеси
342
посеять в пробирки со средой Тукаева.Выращивать при 43°С 18 ча-
сов. Наблюдать характерное изменение среды (см. выше). Опреде-
лить перфрингенс-титр данного образца почвы.
14.3. МИКРОФЛОРА ВОДЫ. САНИТАРНО-БАКТЕРИОЛОГИЧЕСКОЕ
исследование вода.
Вопросы для подготовки по теме:
I. Общая характеристика микрофлоры воды.
2. Санитарно-бактериологический анализ воды
а) определение микробного числа воды;
б) определение коли-титра и коли-индекса.
Вода, так же как почва, является средой обитания многих
микроорганизмов. Их видовой состав чрезвычайно разнообразен и
широко варьирует как по вертикали, так и по горизонтали (по ме-
ре удаления от берега). Среди микробов, населяющих придонные
слои воды озер, рек, морей встречаются аммонификаторы, нитрифи-
каторы, бактерии, разлагающие клетчатку, железобактерии, серо-
бактерии. Особенно много в воде синезеленых водорослей (циано-
бактерий), простейших, сапрофитных спирохет.. Микроорганизмы
воды участвуют в важных процессах круговорота углерода, азота,
железа, серы на Земле. Вода родников, глубоких скважин, арте-
зианских колодцев чрезвычайно бедна микроорганизмами, так как
она многократно фильтруется через песчаные и глинистые слои
почвы.
Вода морей и океанов заселена микробами, приспособившими-
ся к высокой концентрации соли (галофильные бактерии) и хоро-
шо переносящими давление и низкие температуры на больших глуби-
343
нах. В морях встречаются и люминисцентные бактерии, вызывающие
так называемое "свечение" воды.
Пресная вода прибрежных зон рек, озер часто используется
для питья, технологических и других целей, поэтому особенно
важно исследовать качественный и количественный состав микро-
флоры этой воды. Чем больше вода загрязнена органическими со-
единениями, тем больше микробов она содержит, особенно много
их вблизи населенных пунктов, где непосредственно в воду зачас-
тую спускаются канализационные стоки, фекальные воды, стоки про-
мышленных предприятий. Благодаря деятельности сапрофитной мик-
рофлоры воды в ней идет достаточно быстро разложение органичес-
ких веществ, причем разные группы микроорганизмов, например,
аэробы и анаэробы, развиваясь последовательно или одновремен-
но, проводят минерализацию.
Учитывая процессы самоочищения воды, в открытых водоемах
условно различают три зоны: I. полисапробная - зона сильного
загрязнения, вода которой содержит значительное количество ор-
ганических веществ. Микрофлора очень обильна и представлена, в
основном, гнилостными и вызывающими брожение микроорганизмами;
много кишечных бактерий. В I мл воды этой зоны может содержать-
ся несколько миллионов бактериальных клеток.
2. мезосапробная - зона умеренного загрязнения,где завершаются
процессы разложения и протекает минерализация органических ве-
ществ. Микрофлора разнообразна, но преобладают микроорганизмы,
ведущие процессы окисления с участием кислорода. Встречаются
нитрифицирующие микроорганизмы; количество микробов в Т мл -
до 100 тысяч.
3. олигосапробная - зона чистой воды - в ней органических соеди-
344
нений практически нет, процессы минерализации заканчиваются,
много представителей нормальной водной микрофлоры, например, же-
лезо- и серобактерии, количество микробов в I мл не превышает
I 000 клеток.
Даже сильно загрязненная посторонней микрофлорой вода пос-
тепенно очищается, благодаря следующим процессам: разбавление
загрязненных вод более чистыми, механическое осаждение микроб-
ных клеток, гибель микробов под влиянием антибиотических ве-
ществ, выделяемых грибами и водорослями, и антагонизма между
отдельными микробными видами в ассоциациях, пожирания бактерий
простейшими и т.д. Однако, эти процессы идут достаточно медлен-
но и в том случае, если вода значительно загрязнена фекальными
стоками, она может стать источником некоторых инфекционных забо-
леваний. Так, например, через воду могут передаваться холера,
брюшной тиф, дизентерия,туляремия, эпидемический гепатит, поли-
омиелит и т.д.
Для характеристики воды при её санитарно-бактериологичес-
ком анализе определяют микробное число и содержание санитарно-
показательных микроорганизмов.
.Микробноечисло воды -это общее количество микроорганиз-
мов, содержащееся в I мл воды.
Для взятия проб воды используют колбы емкостью 0,5-1 л,
закрытые ватно-марлевыми пробками, которые стерилизуют при
ТбО°С 1-1,5 часа, упакованными в специальнеебумажные мешки.
Поверхностные пробы воды из открытых водоемов берут с глубины
Ю-Т5 см от поверхности и не менее T0-I5 см от дна с помощью
специальных приборов батометров (рис.90).
При санитарно-микробиологическом исследовании водопровод-
345
ной воды пробы берут из уличных водоразборов и кранов внутрен-
них водопроводов. Краны обжигают, затем полностью открывают и
спускают воду в течение 10 минут, а затем отбирают пробы воды
с соблюдением требований асептики, не смачивая пробки, в коли-
честве не менее 0,5 л. Если вода подвергалась хлорированию, то
её собирают в колбы, содержащие 2 мл 1,5^ стерильного раствора
гипосульфита.
Рис.90. Батометр - прибор для взятия
проб воды.
Посев воды осуществляется следующим образом: берут I мл
воды стерильной пипеткой и вносят в пустую стерильную чашку
Петри, после чего чашку заливают 10-12 мл расплавленного мясо-
пептонного агара (t-45°) и тщательно перемешивают. После засты-
вания агара посевы инкубируют при 37° - 24 часа. Обычно из од-
ной пробы воды засевают несколько параллельных чашек и не толь-
ко на МПА, но и на сусло-агар, для выявления роста дрожжевой
и грибной флоры, в этом случае посевы инкубируют 46-72 часа
при 24°С.
Подсчитав общее количество колоний, выросших на чашках
34»
после посева I мл воды и принимая, что из одной микробной клет-
ки развивается одна колония, вычисляют микробное число воды.
В качестве санитарно-показательных микроорганизмов для во-
ды выбраны микробы, постоянно присутствующие в кишечнике чело-
века и теплокровных животных, нахождение которых в воде свиде-
тельствует о фекальном загрязнении ее. К ним относятся E.coli ,
энтерококки и Cl.perfringens
Многочисленными исследованиями было установлено, что из
этих микроорганизмов только сроки выживания кишечной палочки
совпадают со сроками сохранения в воде большинства патогенных
бактерий, кишечной группы (например, родов Salmonella,Shigella)
поэтому чаще всего для выявления фекального загрязнения воды
определяют именно E.coli . Для количественной характеристики
содержания кишечной палочки в воде предложены два показателя:
коли-титр и коли-индекс.
Коли-титр - наименьший объем воды, выраженный в мл, в ко-
тором обнаруживается хотя бы одна жизнеспособная кишечная па-
лочка. Таким образом, чем выше коли-титр, тем меньше фекальная
загрязненность воды.
Коди-индекс - это количество особей кишечной палочки, на-
ходящихся в I литре воды. Коли-титр и коли-индекс связаны между
собой обратной зависимостью.
Для определения коли-титра воды чаще всего используют
двухфазный бродильный метод. Первый этап заключается в посеве
исследуемой воды на глюкозо-пептонную среду Эйкмана. Среда
Эйкмана приготавливается в двух концентрациях: разведенная, в
которой содержится Т°а пептона, 0,4^IiaCl и 0,5% глюкозы, и
концентрированная с содержанием тех же компонентов, но в деся-
347
тикратно увеличенном количестве. Разведенную среду Эйкмана
разливают в пробирки с поплавками по 10 мл в каждую. Она слу-
жит для посева малых объемов воды ( I мл и менее).
Концентрированную среду Эйкмана разливают в пробирки с
поплавками по I мл и в колбы по 10 мл. В эти пробирки и колбы
сеют по 10 мл и ТОО мл воды соответственно и, таким образом,
концентрация питательных веществ в среде становится такой же
как в случае применения разбавленной среды Эйкмана для посева
малых объемов воды.
Для посева водопроводной воды берут пробы объемом не менее
500 мл, как описано выше, и вносят 10 объемов по ТО мл в пробир-
ки и 2 объема по ТОО мл в колбы с концентрированной средой
Эйкмана.
Для исследования загрязненной и технической воды засевают
в разведенную среду Эйкмана по 4 объема воды 1,0; 0,1; 0,01;
0,00Т мл и 10,0; 1,0; 0,1; 0,01 мл, соответственно. Объемы
менее Т,0 мл получают путем разведения: в пробирку с 9 мл сте-
рильной воды вносят I мл исследуемой воды и тщательно переме-
шивают, затем из этой пробирки переносят I мл в следующую про-
бирку с 9^мл стерильной воды и так до тех пор, пока не будет
получено нужное разведение. Из пробирок с разведенной водой бе-
рут по Т мл для посева. Посевы инкубируют при 43°С - 24 часа,
после чего из всех проб, вне зависимости от того, наблюдается
ли в них диффузный рост и газообразование, производят пересев на
дифференциально-диагностическую среду - розоловый дифференци-
альный агар (РДА) уколом и в конденсационную жидкость.
РДА - плотная питательная среда на основе М.ТА с добавле-
нием 5^ желчи, Г? лактозы, 0,глюкозы и индикатора - розоло-
34S
Зак. 1183
вой кислоты; при pH 7,0; 7,2 после стерилизации среда имеет ро-
зоватый цвет. Кишечная палочка на РДА вызывает пожелтение сре-
ды, вспенивание конденсащюнной вода и разрывы агара. Наличие
Е. col подтверждается, кроме того, микроскопически, в том
случае, если в мазках после окраски по Граму видны грамотрица-
тельные мелкие палочки, результат анализа считается положитель-
ным.
На основании многочисленных исследований были составлены
специальные таблицы, по которым определяют коли-титр по количест-
ву так называемых положительных объемов. В случае ориентиро-
вочного анализа (после роста на среде Эйкмана) положительными
считается пробы, в которых обнаруживается диффузное помутнение
и обильное газообразование, окончательный результат, получают
после подтверждения наличия E.coli на РДА (табл.7,8,9).
Коли-индекс вода определяют с использованием мембранных
фильтров. Для этого исследуемую воду фильтруют через стериль-
ные фильтры из нитроцеллюлозы, так называемые мембранные фильт-
ры № 3, используя аппараты Зейтца. При анализе водопроводной
воды пропускают от 300 до 500 мл воды, а загрязненную воду пе-
ред фильтрацией разводят. По окончании фильтрации снимают верх-
нюю часть прибора, стерильным пинцетом захватывают фильтр и по-
мещают его на поверхность дифференциально-диагностической сре-
ды Эндо. На этой среде колонии E.coli. , как правило, темнокрас-
ные с металлическим оттенком, однако некоторые штаммы кишечной
палочки, не ферментирующие лактозу, образуют бесцветные колонии.
В этом случае делают пересев на глюкозопептонную среду. Подсчи-
тав количество выросших колоний, характерных для кишечной па-
лочки, и зная количество профильтрованной воды, подсчитывают
34В
коли-индекс. Во всех случаях наличие в колониях E.coJ- подтверж-
дают микроскопически и только при обнаружении грамотрицательных
неспорообразующих мелких палочек результат анализа считают поло-
жительным.
Для водопроводной воды Москвы и Ленинграда коли-титр дол-
жен быть не менее 500, коли-индекс - 2, для крупных городов
коли-титр должен быть не менее 333, коли-индекс - 3, вода откры-
тых водоемов, используемая для питья, должна иметь коли-титр
ПО, коли-индекс - 9.
По особым показаниям для воды могут быть определены титр
энтерококка и Cl.perfringens . Обнаружение энтерококка свиде-
тельствует о свежем фекальном загрязнении, a Cl.perfringens
о давнем загрязнении воды фекалиями.
Для изучения микрофлоры почвы и воды применяют также "ка-
пилярную" микроскопию, методы которой разработаны, в основном,
Б.Ф.Перфильевым. Сущность этих методов состоит в том, что в
почву или водоемы помещают микрокапилляры со строго прямоуголь-
ным сечением, сравнимым по размерам с микробной клеткой. После
заполнения, их микроскопируют с помощью специального приспособле-
ния в обычном световом микроскопе.
Цель работы: определить микробное число, коли-титр и коли-
индекс водопроводной, технической и дистиллированной воды.
Материалы: пробы воды, взятой для исследования, МПА, сре-
да Эндо,среда Эйкмана,концентрированная и разведенная (см.выше),
розоловый дифференциальный агар (в пробирках высоким столби-
ком с небольшим скосом), фильтры Зейтца с мембранными фильтра-
ми.
35*
Таблица 7
Оценка водопроводной воды и воды грунтовых
колодцев по коли-титру и коли-индексу.
Общий объем взятой для анализа воды 300 мл
(2 объема по ТОО мл и 10 объемов по 10 мл)
Количество положи- Количество положительных объемов по 100 мл
тельных объемов -------------------------------------------------
по 10 мл 0 I 2
коли- коли- коли- коли- коли- коли-
индекс титр индекс титр индекс титр
Зак. 1183
0 Менее 3 БолееЗЗЗ 4 250 II 91
I 3 333 8 125 18 56
2 7 143 13 77 27 37
3 II 91 18 56 38 26
4 14 71 24 42 52 19
5 18 56 зо 33 70 14
6 22 45 36 28 92 II
7 27 37 43 23 120 8
8 31 32 51 20 161 6
9 36 28 60 17 230 4
10 40 25 69 14 Более 230 4
351
Таблица 8
Ориентировочный анализ технической воды по коли-титру
и коли-индексу.
Объемы воды, взятые для анализа: 10,0; 1,0; 0,1; 0,01 мл.
10,0 1,0 0,1 0,01 Коли-индекс Коли-титр
- - - - Менее 90 Более IT,I
- - - + 90 II,I
- - 4- - 90 II,I
- + - - 95 10,5
- - + + 180 5,6
- 4- - 4- 190 5,3
- + + - 220 4,6
+ - - - 230 4,3
- + + + 280 3,6
+ - - 4- 920 ' 1,7
+ - 4* - 940 1,0
+ - 4- 1800 0,6
+ 4- - - 2300 0,4
+ + - 4- 9600 0,1
+ + + - 23800 0,04
+ + 4- + Более 23800 Менее 0,04
Примечание:
"+" - "положительные" по наличию кишечной палочки объе-
мы (объяснение в тексте)
- "отрицательные"объемы
352
Таблица 9
Ориентировочный анализ загрязненной воды по коли-титру
и коли-индексу.
Объемы воды, взятые для анализа : 1,0; 0,1; 0,01;0,001 мл
1.0 0,1 0,01 0,001 Коли-индекс Коли-титр
- - - - Менее 900 Более I,II
- - + 4- 900 1,11
- - + - 900 1,11
- + - - 950 1,05
- - 4- 4- 1800 0,56
- + 4- 1900 0,53
- + 4- - 2200 0,46
4- - - - 2300 0,43
- + + 4- 2800 0,36
4- - - 4- 9200 0,11
+ - + 4- Т9400 0,10
4- - 4- 4- 18000 0,06
+ . 4- - - 23000 0,04
+ 4- - 4- 96000 0,01
+ + 4- - 238000 0,004
+ 4- 4- 4- Более 238000 Менее 0,004
Примечание:
"+" - "положительные" по наличию кишечной палочки объемы
(объяснения в тексте)
- "отрицательные" по наличию кишечной палочки объемы.
353
Ход работы.
I. Внести I мл воды в пустую стерильную чашку Петри и за-
лить 10 мл расплавленного и охлажденного до 45°С МПА, тщатель-
но перемешать. Инкубировать при 37°С 24 часа, подсчитать общее
число колоний и определить микробное число данного образца воды
2. Определить коли-титр данного образца воды, применяя
двухэтапный бродильный метод. Внести исследуемую воду в среду
Эйкмана, как это указано выше, выращивать при 43°С 24 часа.
Затем из всех проб сделать высевы на розоловый агар уколом в
агар и штрихом по его поверхности. Выращивать при 37°С 24 часа.
Наблюдать изменение среды (см.выше). Сделать мазки, окрасить их
по Граму. Сделать выводы о количестве положительных и отрица-
тельных проб. По таблице 7 и 8 определить коли-титр и коли-ин-
декс исследованного образца воды.
3. Определение коли-индекса методом фильтрации. Профильт-
ровать 500 мл исследуемой воды через мембранный фильтр. После
этого фильтр поместить на поверхность среды Эндо в чашку Петри.
Выращивать при 37°С 24 часа. Подсчитать количество колоний, ха-
рактерных для кишечной палочки. Промикроскопировать окрашенные
по Граму мазки из этих колоний, чтобы подтвердить правильность
сделанного вывода. Определить коли-индекс и рассчитать коли-
титр.
Сравнить результаты, полученные двумя методами.
354
Зак. 1183
14 .4. МИКРОФЛОРА ВОЗДУХА. САНИТАРНО-БАКТЕРИОЛОГИЧЕСКОЕ
ИССЛЕДОВАНИЕ ВОЗДУХА.
Вопросы для подготовки по теме.
I. Характеристика микрофлоры воздуха.
2. Микробное число воздуха и его определение.
3. Санитарно-показательные микроорганизмы воздуха и
их выявление.
Воздух- среда неблагоприятная для жизнедеятельности мик-
роорганизмов; попадают микробы в воздух из почвы, воды, орга-
низма человека и животных и, не находя в воздухе питательных
веществ, постепенно отмирают под действием солнечной радиации,
высыхания,смены температуры и других, факторов.
Количество микроорганизмов в воздухе и их качественный
состав колеблются в значительных пределах, в зависимости от
метеорологических условий,расстояния от поверхности земли, на-
личия населенных пунктов и т.д. Наибольшее количество микроор-
ганизмов содержит воздух больших городов с интенсивным уличным
движением,меньше всего микробов в воздухе лесов,гор, но по ме-
ре подъема вверх воздух становится все более чистым даже над
крупными промышленными городами. В воздухе закрытых помещений
содержится значительное количество микроорганизмов,особенно
при большом скоплении людей.
Микробы в воздухе находятся на частичках пыли или влаги
в виде аэрозолей. Аэрозолем называют коллоидную систему, сос-
тоящую из газообразной среды, например, воздуха, в которой
содержатся в состоянии распыления мельчайшие частицы твердого
вещества или капельки жидкости. На поверхности частиц находит-
ся слой адсорбированного воздуха, наличие газовой среды предох-
355
раняет частицы от смачивания.
Устойчивость дисперсной фазы аэрозоля зависит от величины
частиц, их поверхностной энергии и электрического заряда. В ки-
нетике микробного аэрозоля схематически различают 3 фазы:
I. Крупноядерная фаза.частицы которой имеют диаметр более
0,1 мм и сравнительно быстро оседают, длительность их пребы-
вания в воздухе несколько секунд;
2. Мелкоядерная Фаза, размер частиц менее 0,1 мм; эти
мелкие капельки благодаря большой удельной поверхности и мало-
му весу длительно удерживаются в воздухе, образуя достаточно
устойчивую коллоидную систему, микроорганизмы в ней защищены
слоем влаги;
3. Фаза бактериальной пыли. Капли крупноядерной и мелко-
ядерной фазы аэрозоля, постепенно оседая и высыхая, могут
превращаться в так называемую бактериальную пыль, размер час-
тиц которой от I мкм до 100 мкм, частицы бактериальной пыли
долго находятся в воздухе во взвешенном состоянии и могут
проникать в верхние дыхательные пути и легкие человека.
. В воздухе в естественных условиях встречается до ТОО ви-
дов различных микроорганизмов, большинство из которых представ-
лено сапрофитами.
К наиболее часто находимым в открытом воздухе микробам
относятся различные кокки, спорообразующие палочки в виде
спор (Bacillut aesenterictis ,3сс.subtHid, Зас .negateгiua ),
неспорообразующие пигментные бактерии (зеггоЛП ncrcesceiic ).,
многочисленные споры грибов из родов renicilliua,..spersillus,;..uc<
дрожжи и дрожжеподобные грибы. Наиболее устойчивы к неблагоп-
риятным факторам, действующим в атмосфере, пигментные микроор-
356
Зак. 1183
ганизмы, относящиеся к различным систематическим группам.
В воздух, особенно закрытых помещений, от человека и живот-
ных могут попадать условно-патогенные и патогенные микроорганиз-
мы: стафилококки, стрептококки, пневмококки, дифтерийные и ту-
беркулезные палочки, вирусы гриппа, ветряной оспы, кори, паро-
тита и др. Особенно много микроорганизмов попадает в воздух
при кашле, чихании, разговоре; даже совершенно здоровый чело-
век при каждом акте чихания ввделяет в окружающую среду прибли-
зительно 10 000 - 20 000 микроорганизмов. В распространении
многих инфекционных заболеваний так называемых аэрогенных, нап-
ример, гриппа, ветряной оспы и до., большое значение имеет
воздушно-капельный путь передачи. В тех случаях, когда высыха-
ние капель слюны или мокроты приводит, к образованию капельных
ядрышек, в которых микробы защищены белковой пленкой, последние
могут сохраняться жизнеспособными длительное время. Так, диф-
терийные палочки сохраняются сутки, гемолитические стрептококки
до 2-х суток, туберкулезные микробактерии до 18 суток. Для
профилактики инфекций, для контроля воздуха цехов предприятий
медицинской промышленности, учреждений здравоохранения и других
целей широко используется санитарно-бактериологическое исследова-
ние воздуха. Оно включает определение общего числа микроорганиз-
О
мов в I 1Г (1000 л) воздуха, т.е. микробного числа воздуха и
санитарно-показательных микробов.
Методы микробиологического исследования воздуха подразде-
ляют на седиментационные и фильтрационные.
Разновидностью седиментационного метода является метод
ударной струи воздуха. Наиболее простым является седимента-
ционный метод Коха: стерильные чашки Петри с М11А открывают в
357
местах отбора проб воздуха и выдерживают в течение определенно-’
го времени (чаще всего от 5 минут до 30 минут), после чего зак-
рывают и помещают в термостат при 37° на 24 часа, а затем остав-
ляют на сутки при комнатной температуре. Микроорганизмы, содер-
жащиеся на частицах аэрозоля оседают на питательную среду и об-
разуют на ней колонии. По количеству выросших колоний подсчиты-
вают микробное число воздуха, пользуясь правилом Омелянского, в
соответствии с которым считают, что на поверхность питательной
среды площадью 100 см^ в течение 5 минут оседает столько микро-
организмов, сколько их содержится в 3 л воздуха. Зная количест-
во выросших колоний и время экспозиции, вычисляют количество мик-
робов, содержащихся в I 1? (1000 л) воздуха.
Метод Коха при своей простоте и удобстве имеет ряд недос-
татков: прежде всего, на агар оседают лишь сравнительно круп-
ные частицы аэрозоля, частицы фазы бактериальной пыли могут
длительное время находиться в воздухе во взвешенном состоянии,
не осаждаясь, кроме того на процесс седиментации оказывают вли-
яние направление и сила токов воздуха. Посев методом Коха не
дает представления о численности в воздухе риккетсий и вирусов.
Более совершенными являются методы инструментального ис-
следования воздушной микрофлоры с помощью аппаратов Кротова и
импакторов (рис.91,92,93). Прибор Кротова представляет собой
цилиндрической формы корпус, закрываемый сверху съемной крыш-
кой, под которой на вращающемся диске устанавливается чашка
Петри с МПА, внутри цилиндра помещается электрический мотор,
последний, вращаясь со скоростью 4-5 тысяч оборотов в минуту,
обеспечивает просасывание воздуха через плексигласовую крышку,
имеющую клиновидную щель или отверстия. В результате турбу-
358
лентного потока воздуха внутри цилиндра вращается диск с чашкой
Петри, что обеспечивает равномерное распределение микрофлоры по
всей поверхности питательной среды, причем активно засасывается
аэрозольные частицы всех трех фаз. Пользуясь ротаметром, кото-
рый предназначен для определения количества засасываемого воз-
духа, через прибор пропускают от 50 до 200 литров воздуха. Пос-
ле взятия проб чашки закрывают и помещают в термостат при 37°
на 24 часа, а затем на 24 часа при комнатной температуре. Под-
считав количество выросших колоний и зная объем пропущенного воз-
духа, легко вычислить микробное число.
• W
Рис.91. Схема прибора
Кротова. 1-цилиндричес-
кий корпус;2-основание
корпуса;3-электромотор;
4-центробежный вентиля-
тор; 5-восьмилопастная
крыльчатка;6-диск;7-пру-
жина; 8-чашка Петри;
9-крышка прибора;10-на,-
кидные замки;11-диски
из плексигласа;12-кли-
новидная щель;13-разрез-
ное кольцо;14-штуцер с
диафрагмой;15-выводная
трубка.
Рис.92. Прибор Кротова
(общий вид).
359
Рис.93. Схема четырех-
каскадного импактора
Мея (см.описание в
тексте).
Импакторы - приборы, снабженные трубками с коническими соп-
лами - каскадами, через которые просасывается воздух. Перед
узким концом каждого сопла помещают приемные пластинки, пред-
ставляющие собой предметные стекла, смазанные глицерином с фи-
зиологическим раствором. Воздух просачивается через трубки с
соплами, ударяется о приемные пластинки, микроорганизмы оседа-
ют на них. После отбора воздуха предметные стекла вынимают из
импакторов и исследуют осевшие микробы либо с помощью микроско-
пии, либо производят смыв со стекла физиологическим раствором,
из которого затем делают высевы на питательные среды.
Фильтрационные методы исследования воздуха основаны на
фильтрации или аспирации (просасывании) его через специальные
фильтры, жидкости, порошки и т.-д., адсорбирующие микрофлору.
Фильтры, применяемые для анализа воздуха, могут быть не-
растворимыми - ватные, бумажные, мембранные, миллипоры, и раст-
воримыми - глицерино-желатиновые, из альгината натрия,сахарной
359
пудры.
Фильтровальная пластинка из соответствующего материала
помещается в аппарат Зейтца и с помощью вакуум насоса через
фильтр просасывают определенное количество воздуха. Затем
фильтровальную пластинку извлекают, погружают в физиологичес-
кий раствор и встряхивают, микроорганизмы десорбируются в
раствор и из него делают количественные высевы на питательные
среды. Если в качестве фильтров используют растворимые матери-
алы, то после просасывания воздуха их растворяют в стерильном
физиологическом растворе.
Воздух можно просасывать через стерильную жидкость (воду,
физиологический раствор, мясопептонный бульон и т.д.), поль-
зуясь прибором Дьяконова (рис.94)
Рис.94. Прибор Дьяконова.
Этот прибор состоит из стеклянного цилиндра емкостью
10Э-200 мл, в герметически закрытую пробку которого вставлена
две стеклянные трубки, длинная приводящая трубка заканчивает-
331
ся у самого дна, а отводящая (короткая) непосредственно под
пробкой. При исследовании воздуха в прибор заливают 10-20 мл
воды, помещают стеклянные бусы и стерилизуют. После стерилиза-
ции отводящую трубку соединяют с вакуум-насосом, к которому
присоединен реометр для измерения объема воздуха, проходящего
через прибор, и просасывают воздух в количестве 100-200 литров.
После отключения прибора берут I мл воды, через которую фильт-
ровался воздух, вносят в пустую стерильную чашку Петри и зали-
вают 15 мл расплавленного МПА (+ 45°). Чашки с посевами инку-
бируют в термостате при 37° 1-2 суток, а затем подсчитывают ко-
личество выросших колоний и, зная объем профильтрованного воз-
духа, вычисляют микробное число.
В воздухе закрытых помещений, так же как и в воде и почве
определяют наличие санитарно-показательных микроорганизмов.
Ими признаны streptococcus viridans ,(зеленящий стрептококк)
(тип Л. ), Str.haemolyticus ( гемолитический стрептококки
Staphylococcus aureus , обладающий гемолитическими свойства-
ми. Наличие этих микробов в воздухе свидетельствует об обсеме-
ненности его микрофлорой верхних дыхательных путей человека.
Количество санитарно-показательных микроорганизмов, содержа-
О
щееся в I и (1000 литров) воздуха, называется стрептококковым
индексом.
Для выявления санитарно-показательных микробов воздуха
используются все описанные выше методы, но посев производится
на элективные и дифференциально-диагностические среды, позво-
ляющие быстро обнаружить эти бактерии и отделить их от других
представителей воздушной микрофлоры. К таким средам относится
кровяной агар, на котором гемолитические стафилококки и стреп-
362
тококки дают зону гемолиза (разрушения эритроцитов).желточно-
солевой агар и др.
Результаты оценки воздуха в жилых помещениях зимой и ле-
том представлены в таблице 10.
Таблица 10
Критерий для санитарной оценки воздуха жилых помещений
Q
(число микроорганизмов в I м воздуха)
Оценка воздуха Летний период Зимний период
всего зеленящего и микро- гемолитического орга- стрептококков низмов всего зеленящего и микро- гемолитическо- орга- го стрептокок- низмов ков
Чистый 1500 16 4500 36
Загрязненный.... 2500 36 7000 124
Цель работы: определить микробное число воздуха и содер-
жание санитарно-показательных микроорганизмов.
Материалы: чашки Петри с МПА, сусло-агаром и кровяным ага-
ром, аппарат Кротова.
Ход работы. I. Определить микробное число методом Коха:
чашки Петри с МПА, кровяным агаром и сусло-агаром оставить
открытыми в разных частях лаборатории на 5 мин. Закрыть чашки
и поместить их в термостат при 37°С на 46 часов. Подсчитать
число выросших колоний, определить микробное число воздуха
(см.выше).
2. Определить микробное число и количество санитарно-пока-
зательных микроорганизмов с помощью аппарата Кротова. Исполь-
зовать чашки с МПА, кровяным агаром и сусло-агаром. Для каждой
363
чашки пропустить по 200 л воздуха со скоростью 20-30 л/мин.
После взятия проб чашки закрыть и поместить в термостат при
37° на 48 часов. Подсчитать выросшие колонии, промикроскопиро-
вать их, приготовив мазки и окрасив их по Граму. Отметить на-
личие зон гемолиза на кровяном агаре.
Сравнить результаты, полученные двумя методами. Дать
оценку чистоты воздуха. Результаты оформить в виде таблицы.
Санитарная оценка воздуха
Среда Число колоний на чашке при определении
методом Коха в аппарате Кротова
МПА
кровяной агар
сусло-агар
Микробное число
Число зеленящего и
гемолитического
стрептококков
Литература
Лабинская А. С. Микробиология с техникой микробиологи-
ческих исследований. М.,1972.
Перети Л.Г. Значение нормальной микрофлоры для организма чело-
века. Медгиз.,1955.
Пяткин К.Д., Кривошеин В.С. Микробиология.'»!. ,1960.
Санитарная микробиология. Под ред. Г. П. Калины и Г.Н.Чис-
.товича. М.,1969.
Теп В. И. Санитарная микробиология. 1958.
Тимаков В.Д. Микробиология. М.,1973. .
364
15. ИЗУЧЕНИЕ ПАТОГЕННОСТИ И ВИРУЛЕНТНОСТИ МИКРОБОВ
Вопросы для подготовки по теме
I. Болезнетворные микробы. Факторы патогенности.
2. Патогенность и вирулентность.
3. Инфекция, инфекционный процесс, инфекционная болезнь.
4. Цели и методы заражения экспериментальных животных.
Болезнетворные (патогенные) микробы - это микроорганизмы,
способные вызывать заболевания у человека,животных и растений.
Патогенными могут быть бактерии, вирусы, грибы, простейшие.
Таким образом, патогенность - это потенциальная способность
определенных видов микроорганизмов вызывать инфекционный про-
цесс. Вирулентность - это степень патогенности данного штамма,
показатель качественного индивидуального признака патогенного
микроорганизма. Вирулентность изменяется под влиянием естест-
венных условий. Её можно повысить пассажами через восприимчи-
вых животных или путем генетических рекомбинаций. Её можно и
ослабить путем воздействия различных факторов: иммунных сыворо-
ток,прогревания, антибиотиков, антисептиков,пересевом на опре-
деленные питательные среды.
Для характеристики вирулентности микробов служат такие
показ атеж, как Din, LDC . . Dim - это минимальная
5о
смертельная доза, т.е. наименьшее количество микробных клеток,
вызывающее гибель зараженных животных. Для ее установления
разжчные кожчества микробов вводят восприимчивым животным,
причем способ введения (под кожу, внутрибрюшинно и т.п.) уста-
новлен заранее . это кожчество микробных клеток, введе-
ние которого вызывает гибель 50% зараженных животных. Эта доза
365
вычисляется обычно статистическим путем.
Дозы, определяющие вирулентность, зависят не только от ви-
да и штамма микроорганизма, но и от вида и возраста подопытно-
го животного, а также от способа заражения. Поэтому для полу-
чения сравнимых результатов исследования проводят на животных
одного вида, пола и веса. При работе с бактериями используют
16-24 -часовую культуру, т.к. в более старых культурах много
погибших клеток.
Помимо определения патогенности и вирулентности микроор-
ганизмов, лабораторных животных используют для выделения микро-
бов из исследуемого материала, особенно в тех случаях, когда
возбудитель не может быть обнаружен методом посева, например,
при вирусных заболеваниях, риккетсиозах и т.д.; для выделения
чистой культуры патогенного микроба из материала, загрязненно-
го другими микроорганизмами; для изучения действия микробных
токсинов (определение Dim токсина, определение дермонекроти-
ческого действия и т.д.); для экспериментального воспроизведе-
ния некоторых инфекций. Последнее часто используют для изучения
эффективности антибиотиков, химиотерапевтических и иммунобиоло-
гических препаратов. При выборе вида лабораторного животного
необходимо учитывать степень его восприимчивости к изучаемой
инфекпди.
Виды лабораторных животных. Для экспериментального зара-
жения чаще всего используют белых мышей, крыс, морских свинок
и кроликов. Для некоторых специальных исследований служат
обезьяны,кошки,собаки,лошади,крупный и мелкий рогатый скот,
дикие животные (хомяки,суслики,дикие крысы,полевки), а также
птицу: куры, куриные эмбрионы, голуби и т.д.
Збб
Содержание лабораторных животных. Животные содержатся в
специальных условиях в особых помещениях - вивариях. Каждый вид
сивотных содержат отдельно в клетках или банках. Виварий должен
(меть ряд отделений: для содержания зараженных животных, для
содержания здоровых животных, помещение, предназначенное для
вскрытий животных, кухню. Уход за животными заключается в их
правильном и полноценном кормлении (нормы рационального питания
для каждого вида животных разработаны и утверждены Министерст-
вом здравоохранения СССР), уборке помещения вивария, наблюдении
за общим состоянием животных.
Перед опытом животных взвешивают, маркируют, при проведе-
нии некоторых опытов термометрируют.
Эксперимантальное заражение животных. При манипуляциях с
животными производят их иммобилизацию или с помощью специальных
приспособлений,или фиксируя мелких животных руками, работая с
помощником или без него.
Инструменты,предназначенные для работы с животными, стери-
лизуют кипячением.
Существуют следующие способы заражения: подкожный, внутри-
кожный , накожный,внутримышечный,внутрибрюшинный,внутривенный ,
пероральный (через’рот), интраназальный (через нос в дыхатель-
ный тракт), введение в глаз, введение в центральную нервную
систему и' т.д. При внутрикожном или накожном заражении шерсть
на месте заражения удаляют выстриганием, выщипыванием или
депилированием.
Максимальное количество материала, вводимого животному,
зависит от вида животного и способа введения (см.таблицу).
1
Схема введения инфицированного материала животным
(по Ф.К.Черкес, 1974).
Вид Средний Кол-во вводимого материала (в мл)
животного вес жи- ----------------------------------------------
вотного подкож- внут- внут- внут- перо- интра- интра-
в г но рикож-римы- рибрю-раль- назаль-окуляр-
но шечно шинно но но но
Кролики 3000-4000 доЗО 0,1 5-8 до20 до5 до4 0,2-0,4
Морские свинки 100-400 до15 1,0 3-5 10-12 1-2 до4 0,2-0,4
Крысы 150-200 ДО 10 1,0 2-3 3-5 до2 доЗ 0,1-0,2
Мыши 18-25 до! 0,1 0,5 до2 0,5-1,0 1,0 0,1-0,2
Вскрытие и микробиологическое исследование погибших живот-
ных.
При экспериментальном заражении вскрытие животного после
его гибели, характер изменений и результат бактериологического
исследования внутренних органов позволяют выяснить причину смер-
ти животного, пути распространения микробов в организме и место
их локализации.
Вскрытие следует производить непосредственно после гибели
животного, чтобы избежать проникновения микроорганизмов из
кишечника в кровь и другие органы. При отсутствии такой воз-
можности трупы сохраняют на холоду.
Вскрытие производят на специальном столе в отдельной ком-
нате. На столе должно находиться все необходимое для вскрытия
и бактериологического исследования секционного материала: дос-
ка или кювета, залитая парафином, для фиксации животного, га-
зовая горелка или спиртовка, сосуд со спиртом и ватой на дне,
368
в котором находятся простерилизованные инструменты (ножницы,
скальпель, хирургический и анатомический пинцеты и пр.), сте-
рильные ватные тампоны, бактериологическая петля, стерильные
пастеровские пипетки, предметные стекла, чашки Петри, пробирки
с питательными средами. Выбор сред зависит от вида микроорга-
низма, который считают причиной гибели животного.
Все наблюдения, сделанные во время вскрытия, протоколиру-
I ют. Отмечают вид животного, номер, время и место заражения,
материал, применяемый для заражения, время гибели, обнаружен-
ные изменения и т.д.
Во время вскрытия надо следить за тем, чтобы жидкость и
кусочки тканей и органов не попали на стол. После каждой мани-
пуляции инструменты промывают водой или спиртом и прожигают.
Вскрытие состоит из следующих этапов:
I. Фиксация животного.
2. Осмотр наружных покровов.
3. Вскрытие и исследование грудной полости.
4. Вскрытие и исследование брюшной полости.
Отмечают цвет, величину и консистенцию каждого органа.
Из..измененных органов (или из всех, в зависимости от цели
эксперимента) делают высев на питательные среды, мазки и
мазки- отпечатки. Для посева прижженную поверхность органа над-
резают стерильным скальпелем, из глубины органа вырезают малень-
кий кусочек, часть его помещают в питательную среду, а из дру-
гой делают мазки-отпечатки, прикладывая срезанную часть к
стеклу, и мазки. Обязательно делают посев крови из сердца.
Для этого прижигают раскаленным скальпелем верхушку сердца и
стерильной пастеровской пипеткой прокалывают прожженный учас-
363
ток, кровь при этом поднимается в капилляр. Кровь из капилляра
выдувают в питательные среды и делают из нее мазки.
После окончания вскрытия производят тщательную уборку ра-
бочего места. Труп животного сжигают или автоклавируют. Инстру-
мент стерилизуют кипячением или автоклавируют. Доску или кюве-
ту протирают спиртом и прожигают или заливают на сутки дезин-
фицирующим раствором. Мазки фиксируют в пламени или жидким
фиксатором, окрашивают и изучают.
Литература
Л е б е д е в а М.Н. Руководство к практическим занятиям по
медицинской микробиологии. М.,1974.
Пяткин К.Д., Кривошеин Ю.С. Микробиология. М._,
I960.
Синюшина М.Н., Самсонова М.Н. Руководство к прак-
тическим занятиям по медицинской микробиологии. М.,1974.
Тимаков В.Д. Микробиология. М.,1973.
ГЗ. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ ОСНОВЫ ИММУНИТЕТА.
ОЦЕНКА ИММУННОГО СОСТОЯНИЯ МАКРООРГАНИЗМА В
ЭКСПЕРИМЕНТЕ.
Вопросы для подготовки по теме.
I. Общее понятие об иммунитете.
2. Типы , виды и формы иммунитета.
3. Антигены и антитела.
4. Реакции иммунитета и их практическое использование.
5. Вакцины,сыворотки, иммуноглобулины.
6. Аллергия немедленного и замедленного типов. Аллергены.
Иммунитет - это система защиты макроорганизма от генети-
чески чужеродной информации. Эта система включает разнообраз-
ные формы, в соответствии с которыми различают тканевый, гумо-
ральный и функциональный иммунитет.
Тканевый иммунитет - это форма невосприимчивости, связан-
ная с фагоцитозом, барьерными функциями кожи, слизистых оболо-
чек, лимфатических узлов и других тканей и органов. Фагоцитоз
выражается в явлении захватывания и переваривания фагоцитами
посторонних частиц, в том числе микробов. Фагоциты - это осо-
бая группа лейкоцитов, как подвижных, циркулирующих в крови и
тканях, (лимфатических узлах, селезенке), так и неподвижных,
располагающихся в этих же тканях и в эндотелии кровеносных со-
судов. Кожа в нормальном неповрежденном состоянии является не
только защитным механическим барьером, но и бактерицидным фак-
тором. Слизистые оболочки также убивают и обезвреживают многие
микроорганизмы, выделяя лизоцим, и с помощью мерцательного эпи-
телия, удаляющего посторонние частицы и клетки. Лимфатические
узлы захватывают и обезвреживают микробов, Проникших через ко-
371
ну и слизистые оболочки. В них развивается воспаление, в зоне
которого скапливаются лейкоциты, образуя защитный вал, препят-
ствующий распространению микробов.
Гуморальный иммунитет - эволюционно более поздняя, чем
тканевый, форма защиты, присущая позвоночным. Она связана с
бактерицидными свойствами крови. В плазме крови имеются неспе-
цифические защитные вещества, обезвреживающие микробов (компле-
мент, лизины, интерферон), а также специфические антитела, ко-
торые образуются в ответ на введение антигена.
Функциональный иммунитет направлен на восстановление на-
рушенных в процессе болезни функций макроорганизма. Например,
повышается артериальное давление, что компенсирует потерю то-
нуса артериол, возникающую при многих болезнях. Усиливается
выделительная функция кишечника, почек, верхних дыхательных
путей. Повышенная температура тела активизирует метаболизм лей-
коцитов и уничтожение ими микробов; на многих возбудителей ин-
фекционных заболеваний повышение температуры тела действует
неблагоприятно. К функциональному иммунитету относят и защитно-
адаптационные механизмы, получившие название стресса. Они свя-
заны с действием желез внутренней секреции и выделением ими
некоторых гормонов.
Антигены - это вещества, которые при введении в организм
человека или животного вызывают образование антител и которые
специфически реагируют с антителами. Есть вещества, которые не
индуцируют образование антител, но реагируют с ними. Они на-
зываются неполными антигенами или гаптенами. Антигенами могут
быть разнообразные по своей структуре и происхождению вещества.
Чаще всего это белки, например, микробные токсины, раститель-
372
1183
ные яды, яды змей, ферменты и т.д. Антигенами могут быть также
полисахариды и комплексные вещества ( липополисахариды, липо-
протеины, гликолипиды). Антиген должен быть чужеродным для им-
мунизируемого животного, в ответ на введение белков генетичес-
ки идентичного организма антитела вырабатываться не будут. Вто-
рое необходимое условие для проявления антигенной активности
вещества - достаточно большой размер молекулы и достаточно слож-
ная ее структура, чтобы ее "заметила" иммунная система макроор-
ганизма.
Антигены могут поступать в организм различными путями.
Наиболее эффективный способ иммунизации - парэнтерапьное вве-
дение (внутривенно, внутрибрюшинно, накожно, внутрикожно,
внутримышечно, в слизистые оболочки),, поскольку в желудочно-
кишечном тракте молекулы антигена обычно перевариваются и те-
ряют свою нативную структуру. Однако некоторые антигены вводят
перорально, например, при иммунизации против полиомиэлита,
против некоторых кишечных инфекций.
Всем естественным антигенам присущи свойства химической,
генетической, структурной и функциональной специфичности. Ан-
тигены, например, белки, принадлежащие разным видам животных,
растений, микробов, вирусов, могут быть дифференцированы с по-
мощью иммунологических реакций. Специфичность антигенов связа-
на с наличием в их молекуле особых структур, так называемых
детерминан!т . Если в молекулах разных антигенов имеются одина-
ковые детерминанты, их удается выявить в серологических реак-
циях. Тогда говорят об антигенном родстве организмов. Помимо
одинаковых детерминант разные виды имеют разные антигены, ко-
торые обусловливают их антигенное различие, выявляемое в имму-
373
нологических реакциях. Таким образом, серологические реакции
позволяют выявить сходство и различие в структуре макромолекул,
которое не всегда удается обнаружить химическими методами. На-
личие общих антигенов отражает эволюционный процесс развития
видов, их генетические связи.
Антитела - это специфические белки, образующиеся в орга-
низме при введении антигенов и обладающие способностью вступать
с ними в специфическую связь. Антигены, связанные с антитела-
ми, обезвреживаются иммунными системами макроорганизма и уда-
ляются из него. Особое значение имеет способность антител.соеди-
няться со специфической молекулой антигена, "узнавать" даже са-
мые тонкие различия в их структуре, например, не только замену
одной аминокислоты на другую, но даже замену стереоизомеров
органических соединений. Специфичность антител связана с раз-
личием в их химическом строении, т.е. в аминокислотной пос-
ледовательности полипептидных цепей, составляющих их структуру.
Помимо различий антитела имеют и общие черты в своем строении.
Антитела - это белки плазмы крови, которые относятся к иммуно-
глобулинам. Общая схема их строения показана на рис. 95.
легкая цепь
-------------1-----г-------- соон
3 тяжелые
га 5 цепи
-------------------г------1-------с ООН
S
s легкая цепь
вариабельная постоянная область
область
Рис.95. Схема строения иммуноглобулинов.
374
Молекула иммуноглобулина состоит из двух легких ( L) и двух тя-
желых (Н) полипептидных цепей, соединенных дисульфидными мости-
ками. Каждая цепь имеет постоянную и вариабельную область.Пос-
тоянная область содержит почти одинаковые полипептидные цепи,
тогда как аминокислотная последовательность вариабельной об-
ласти разная у разных антител. Вероятно, вариабельная область
имеет отношение к специфичности антител, хотя доказательств
этого предположения еще не получено.
Для иммуноглобулинов характерна их гетерогенность, не
имеющая отношения к их специфичности. Она связана с существо-
ванием разных типов Н и Lцепей. Так, у человека имеется 2 типа
легких цепей (X и Л ) и 5 классов тяжелых цепей: у,
Класс тяжелой цепи определяет класс иммуноглобулина. Основными
классами иммуноглобулинов у человека являются IgG, IgA, IgM.
Кроме того имеются минорные классы IgD и IgE /Классы имму-
ноглобулинов включают подклассы, различающиеся по расположению
и количеству дисульфидных связей между цепями. У человека из-
вестно 4 подкласса в классе IgG и по два подкласса в классах IgA
И IgLl .
Реакции иммунитета.
Реакции иммунитета, т.е. реакции взаимодействия антигена
и соответствующего ему (специфического) антитела, благодаря
высокой специфичности и чувствительности, нашли широкое примене-
ние при диагностике инфекционных заболеваний и в научных меди-
ко-биологических исследованиях.
В зависимости от состояния антигена и особенностей среды ,
в которой взаимодействуют антигены и антитела, различают реак-
цию агглютинации, преципитации, лизиса, связывания комплемента,
375
нейтрализации и др.
Серологическими реакциями пользуются в двух основных слу-
чаях:
I) для выявления антител в сыворотке больного,т.е. для
серодиагностики инфекционного заболевания
2) для определения вида или типа антигена, например, мик-
роба для его идентификации. При этом неизвестный компонент
определяют по известному. Например, для обнаружения антител
в сыворотке больного берут известную лабораторную культуру
микроба. Если сыворотка реагирует с определенным антигеном,
значит в ней имеются соответствующие антитела и можно думать,
что данный микроб является возбудителем болезни у обследуемого
больного.
Если следует узнать,какой микроб выделен, нужно его испы-
тать в реакции с известной иммунной сывороткой. Положительный
результат реакции свидетельствует о том, что выделенный микроб
идентичен тому, которым иммунизировали животное для получения
данной иммунной сыворотки.
Реакции агглютинации.
Агглютинация - это склеивание и выпадение в осадок микро-
бов или других клеток под действием антител в присутствии со-
лей (физиологического раствора). Для реакции необходимы следу-
ющие компоненты:
I. Антитело (агглютинин) находится в сыворотке больного
человека или иммунного животного.
2. Антиген - взвесь убитых или живых микробов или других
клеток.
3. Физиологический раствор - 0,9^ раствор jfeZ7, приготов-
Зак. 1183.
ленный на дистиллированной воде.
I. Сыворотки.
а) Сыворотка больного. Для получения сыворотки кровь берут
чаще всего из вены и собирают в стерильную пробирку. Её остав-
ляют на час при комнатной температуре, или при 37° на 30 мин.
Образовавшийся сгусток отделяют от стенок пробирки стеклянной
палочкой, затем пробирку оставляют в холодильнике на ночь для
лучшего отделения сыворотки. Сыворотку после этого отсасывают
и при необходимости освобождают от форменных элементов крови
центрифугиро в ани ем.
б) Иммунные диагностические сыворотки содержат антитела
к тому антигену, которым произведена иммунизация. Обычно их
готовят в производственных условиях. Получают чаще всего из
крови кроликов или лошадей, которым предварительно многократно
был введен соответствующий антиген. В качестве антигена для
иммунизации применяют взвесь живых или убитых микробов, экст-
ракты клеток и тканей, эритроциты и т.п.
2. Антигены. Для приготовления взвеси испытуемого микроба
микробную массу, выросшую на питательном агаре, смывают физи-
ологическим раствором и доводят концентрацию микробных клеток
приблизительно до 3 млрд в I мл. Полученная взвесь должна быть
гомогенной.
Иногда используют взвесь убитых микробов, так называемые
диагностикумы, приготовленные в производственных условиях.
Постановка реакции агглютинации. Существует два основных
метода проведения реакции агглютинации: реакция на стекле и
развернутая реакция (в пробирках).
377
Реакция агглютинации на стекле. На обезжиренное предметное
стекло наносят две капли сыворотки и каплю физиологического
раствора. В одну из капель сыворотки и в каплю физиологического
раствора петлей вносят культуру испытуемого микроба и тщагель-
но размешивают. Нельзя при этом переносить культуру из капли
с сывороткой в каплю с физиологическим раствором, которая яв-
ляется контролем антигена. Капля сыворотки, в которую не внесе-
на культура, является контролем сыворотки. Реакция протекает
при комнатной температуре в течение 1-3 мин. Если контроль сы-
воротки остается прозрачным, в контроле антигена наблюдается
равномерная муть, а в капле, где культура смешана с сывороткой,
появляются хлопья агглютината, результат реакции считают поло-
жительным.
Развернутая реакция агглютинации. Готовят нужное количест-
во пробирок одинакового диаметра, высоты и конфигурации дна. Го-
товят последовательные, чаще всего двукратные, разведения сыво-
ротки. В реакции агглютинации сыворотку больного обычно разво-
дят в соотношении от 1:50 до 1:1600, а иммунную диагностическую
сыворотку до титра или до половины титра (титр сыворотки ука-
зан на этикетке). В каждой пробирке должен содержаться I мл
сыворотки в соответствующем разведении. Б качестве контроля
сыворотки используют сыворотку в максимальной концентрации. 3
эту пробирку антиген не вносят. Б качестве контроля антигена
используют пробирку, содержащую I мл физиологического раство-
ра и -антиген. Антиген (диагностикум или свежеприготовленную
взвесь микробов) вносят во все пробирки кроме пробирки контро-
ля сыворотки в объеме 0,1 мл (2 капли). 3 пробирках при этом
должна появиться небольшая равномерная муть. Зробирки тща-
3^6
тельно встряхивают и помещают в термостат при 37°. Через 18-20
часов учитывают результат. Учет реакции агглютинации можно про-
изводить только при безукоризненных результатах в контроле: рав-
номерной мути в контроле антигена и полной прозрачности в конт-
роле сыворотки.
Учет реакции производят невооруженным глазом, с помощью
лупы или в агглютиноскопе.
При положительном результате реакции в пробирках появля-
ются хлопья склеившихся клеток, которые оседают на дно проби-
рок. Жидкость над осадком при этом просветляется. При встряхи-
вании осадка (агглютината) видны хлопья, плавающие в игранной
жидкости (сравнить с равномерно мутным контролем антигена).
Интенсивность реакции выражается" следующим образом:
++++ все клетки находятся в осадке, жидкость совершенно
прозрачна. Результат резко положительный.
+++ осадок меньше, нет полного просветления жидкости.
Результат положительный.
++ осадок еще меньше, жидкость мутнее. Результат сла-
боположительный .
+ на дне пробирки незначительный осадок, жидкость
мутная. Сомнительный результат реакции.
отсутствие осадка, жидкость равномерно мутная, как
в контроле антигена. Отрицательный результат.
Реакция непрямой гемагглютинации (РИГА).
При этой реакции происходит агглютинация эритроцитов, на
которых адсорбирован антиген, например, полисахарид микроба,
под влиянием специфических к нему антител. 3 качестве антигена
применяют взвесь эритроцитов барана или кур с адсорбированным
на них соответствующим антигеном (эритроцитарный диагностику!*).
Испытуемую сыворотку прогревают 30 мин при температуре 56° для
инактивации имеющегося в сыворотке комплемента, присутствие ко-
торого может исказить результаты реакции. В пробирки или в углуб-
ления специальных гемагглютинационных досок наливают по 0,5 мл
сыворотки, разведенной от 1:10 до 1:1280, и по 0,25 мл диагнос-
тикума. Пробирки помещают в термостат на 2 часа, а затем сутки
выдерживают при комнатной температуре.
Контролем служит взвесь эритроцитов с заведомо иммунной и I
нормальной сыворотками. В первом случае должна произойти агглю-
тинация, во втором ее не должно быть. Контролем антигена служит
взвесь нормальных эритроцитов, к которым добавлена испытуемая
сыворотка. В данном случае агглютинации не будет.
Если при помощи РИГА определяют неизвестный антиген, то
эритроциты насыщают заведомо известными антителами.
Имеются модификации этой реакции, в которых вместо эритро-
цитов используют какой-либо другой нейтральный носитель анти-
гена или антитела, например, частицы латекса или коллодия и т.п.
Реакция преципитации.
Реакцию преципитации ставят в тех случаях, когда в качестве
антигена пользуются растворенными веществами: лизатами, экстрак-
тами, гаптенами и т.п. При взаимодействии такого антигена с ан-
тителом в присутствии солей образуется преципитат в виде мутно-
го кольца или осадка.
Реакцию преципитации обычно применяют для определения анти-
гена при диагностике ряда инфекционных болезней (сибирской язвы,
менингита, пневмонии,дизентерии); в судебной медицине - для оп-
ределения видовой принадлежности крови и т.д.; при санитарно-
гигиенических исследованиях - при установлении фальсификации
383
продуктов; с её помощью также определяют филогенетическое родст-
во животных, растений и микрс^зганизмов.
Для проведения реакции преципитации необходимы следующие
компоненты:
I. Антиген. В качестве антигена используют полные антигены
или гаптены микроорганизмов или высших организмов, т.е. раство-
ры веществ белковой,полисахаридной, липополисахаридной или гли-
копротеидной природы.
2. Антитело - иммунная сыворотка, содержащая антитела в
высоком титре. Титр преципитирующей сыворотки устанавливают по
наибольшему разведению антигена, с которым она дает реакцию.
Это разведение в зависимости от природы антигена может коле-
баться от 1:10000' до 1:10000030 и выше. Сыворотку обычно при-
меняют неразведенной или в разведении 1:5-1:10.
3. Физиологический раствор.
Все компоненты должны быть совершенно прозрачными.
Постановка реакции. Основными методами проведения реакции
преципитации являются реакция кольцепреципитации и реакция пре-
ципитации в геле.
Реакция кольцепреципитации. Реакцию проводят в специальных
пробирках диаметром 0,4-0,5 см и высотой 7-8 см. В пробирку
вносят 0,2 мл иммунной сыворотки, на сыворотку осторожно насла-
ивают такой же объем антигена, чтобы не произошло смешивания
ингредиентов. При положительном результате на границе антигена
и антитела образуется белое кольцо - преципитат. Учет реакции
производят после выдержки в течение 5-30 мин при 37°. Иногда
пробирки оставляют еще на ночь в холодильнике.
Контролем антигена служит его раствор, смешанный с физиоло-
гическим раствором; контроль сыворотки - сыворотка с физраство-
ром, В случае необходимости контроля специфичности иммунной сы-
воротки её смешивают с заведомо гомологичным и гетерологичным
антигеном, В первом случае реакция должна быть положительной.
Реакция преципитации в геле. Особенность этой реакции в
том, что взаимодействие антигена с антителом происходит в полу-
твердой среде - геле, чаще всего агаровом; иногда используют
крахмальный гель, полиакриламидный и т.п. Это позволяет четко
разграничить друг от друга преципитаты, образованные различны-
ми системами антиген-антитело, которые благодаря неодинаковой
скорости диффузии и неодинаковой концентрации встречаются и
образуют преципитат в разных участках геля. Поэтому этот метод
носит название иммунодиффузии. Часто иммунодиффузию комбинируют
с электрофорезом в геле. Иммуноэлектрофорез является весьма
ценным методом в иммунологии и иммунохимии.
Иммунодиффузия. В качестве примера можно рассмотреть
двойную диффузию по Ухтерлони, т.к. этот метод нашел наиболее
широкое распространение. Реакцию проводят в чашках Петри или
на предметных стеклах (микрометод). Дно чашки должно быть со-
вершенно ровным, на стекле не должно быть царапин. На дно ча-
шек предварительно наливают 1% раствор агара в воде, после чего
их высушивают в термостате. Это делают для того, чтобы реаген-
ты из лунок не проникали под слой агара. Затем на чашку выли-
вают расплавленный 1,5% агар, растворённый в физиологическом
растворе или в буфере при pH 7,2. Слой агара должен быть толщи-
ной около 3 мм и одинаковой толщины, для чего чашки ставят на
строго горизонтальную поверхность. После того, как агар засты-
нет, в нем проделывают лунки специальными резцами или обычным
362
лабораторным сверлом,используя трафарет, чтобы расстояние между
лунками было всегда одинаковым (рис.96). В лунки вносят раство-
ры антигена и иммунную сыворотку. Жидкость должна заполнить
лунки, но не вытекать из них. Чашки помещают во влажную камеру,
чтобы предотвратить высыхание агара, и выдерживают при комнат-
ной температуре. Четкие линии преципитации обычно получают че-
рез 3-7 дней в зависимости от свойств антигена и антитела и их
концентрации. При двойной диффузии антигены и антитела диффун-
дируют навстречу друг другу в агаре. Они встречаются между дву-
мя лунками и преципитируют в различных местах в зависимости от
концентрации реагентов и скорости диффузии. Обычно каждая пара
антиген-антитело образует одну полосу преципитации. Число полос
преципитации показывает число таких пар, содержащихся в данной
системе. Однако некоторые пары могут остаться необнаруженными
вследствие неподходящего соотношения концентраций, недостаточ-
ного количества реагирующих веществ, накладывания одной линии
на другую и т.д. Чтобы установить наиболее благоприятные соот-
ношения концентраций антигена и антител, те и другие можно брать
в опыт в разных разведениях.
ООО
о о
о ооооо©о
00900000
Б
ооооо
• о • о •
ооооо
Рис.96. Различные схемы иммунодиффузии. А. Расположение
лунок в чашке. Диаметр лунок 5 мм,расстояние между кра-
ями лунок о мм. Иммунную сыворотку наливают в центральную
яунку. Б. Расположение яунок на предметном стекле.диаметр
лунок 2 мм.Расстояние между краями лунок 2,5 мм.Иммунную
сыворотку наливают в зачерненные на рисунке резервуары.
ЗоЗ
Чувствительность иммунодиффузионного метода сравнительно
невелика (таблица II).
Таблица II.
Сравнительная чувствительность серологических реакций
Метод Наименьшее количество оп- ределяемого азота антител (в мкг)
Кольцепреципитация 3-5
Иммунодиффузия 5-10
Агглютинация 0,05-1,0
Непрямая гемагглютинация 0,1 - 0,2
Связывание комплемента 0,1
Иммуноэлектрофорез.
Принцип метода заключается в том, что при иммуноэлектро-
форезе исследуемый антиген сначала фракционируют электрофоре-
тически, а затем полученные фракции анализируют на той же
пленке геля методом двойной диффузии при помощи антисыворотки,
внесенной в траншею, которая расположена параллельно направле-
нию электрофоретического разделения.
Электрофорез. Электрофорезом называют движение коллоидных
частиц или макромолекул в растворе под действием внешнего электри-
ческого поля. Такое движение коллоидных частиц возможно, когда
они несут электрический заряд. Электрический заряд частиц или
макромолекул может возникнуть двумя путями: или вследствие ад-
сорбции ионов низкомолекулярных веществ на поверхности коллоид-
ной частицы, или вследствие электролитической диссоциации ионо-
генных групп макромолекулы. Во внешнем электрическом поле дви-
жутся не только коллоидные частицы или макромолекулы, но и ионы
низкомолекулярных веществ. Это явление в отличие от электрофо-
реза называют ионофорезом.
Направление, в котором частицы передвигаются в электричес-
ком поле, зависит от их электрического заряда. Отрицательно за-
ряженные частицы будут двигаться к аноду, а положительно заря-
женные - к катоду. Знак заряда частицы (макромолекулы) зависит
от pH среды. Это обстоятельство имеет особое значение для цвит-
терионов (например, растворов белков).
Различие в скорости движения макромолекул под действием
электрического поля, позволяет проводить их пространственное
разделение. Для того,чтобы фиксировать полученные при электро-
форезе зоны, его проводят в подходящем инертном носителе, про-
питанном буферным раствором. Для целей иммуноэлектрофореза на-
иболее удобными являются гели (агаровый,крахмальный и др.).
Условия электрофореза (состав буфера, напряжение тока,си-
лу тока, сечение пластинки геля и т.д.) выбирают в зависимости
от свойств анализируемого вещества. Например, при электрофоре-
зе белков сыворотки используют вероналовый буфер {Л 8,6, ионная
сила буфера 0,05, напряжение на электродах’200 в, сила тока ТО-
12 мА на I см^ сечения агаровой пластинки, градиент напряжения
2,5 в/см. При соблюдении этих условий белки разделяются за
4-4,5 часов.
Иммунопреципитация. После электрофоретического разделения
на определенном расстоянии от лунки, куда был внесен исследу-
емый антиген, прорезают траншеи для иммунной сыворотки. Рассто-
яние между лункой и траншеями зависит от концентрации антигена
и титра сыворотки. Для каждой конкретной системы условия опыта
385
подбираются индивидуально. После внесения иммунной сыворотки в
траншеи пластинку ставят на несколько дней в герметически закры-
тую влажную камеру. По существу реакция преципитации при имму-
ноэлектрофорезе не отличается от двойной диффузии в агаре и под-
чиняется тем же закономерностям. Первые дуги преципитации появ-
ляются уже через 24 часа, максимальное количество преципитатных
дуг обнаруживается через 3-7 дней.
Иммунная
сыворотка
поливалентная
Исследуемая смесь антигенов
Иммунная сыворотка
моновалентная
. Рис.97. Иммуноэлектрофорез. Схема постановки опыта.
Для идентификации антигенов используют различные приемы,
например, моновалентные сыворотки, т.е. иммунные сыворотки, со-
держащие антитела против определенного антигена, содержащегося
в смеси (рис.97).
Реакция связывания комплемента (РСК).
Реакция связывания комплемента относится к сложным сероло-
гическим реакциям: в ней участвует комплемент и две системы
антиген-антитело. Первая система, как и в описанных ранее реак-
циях иммунитета, является специфической. Вторая система сос-
тоит из эритроцитов барана и соответствующей им гемолитической
сыворотки. Она называется гемолитической системой и является
индикатором образования комплекса антиген-антитело (первой сис-
ЗС'-О
ИР?
темы) с комплементом.
В присутствии комплемента в гемолитической системе происхо-
дит лизис эритроцитов. Если комплемент связан специфической сис-
темой, гемолиза не будет.
РСК, благодаря высокой чувствительности и специфичности,
нашла широкое применение при серодиагностике ряда инфекционных
болезней и для идентификации антигенов. Особенно широко РСК
применяется при диагностике сифилиса (реакция Вассермана) и
других спирохетозов, риккетсиозов, вирусных инфекций и т.д.
Реакция связывания комплемента протекает в две фазы. В пер-
вой - специфической - взаимодействуют антиген, антитело и комп-
лемент. Если антиген соответствует антителу, они соединяются и
образуют комплекс, который связывает комплемент. Образовавшееся
соединение внешне не проявляется. О его образовании узнают с
помощью индикатора, которым является гемолитическая система,
участвующая во второй, индикаторной,фазе реакции.
Гемолитическая система состоит из эритроцитов барана и
соответствующей гемолитической сыворотки. Гемолитическая сыво-
ротка, реагируя с эритроцитами, делает их чувствительными (сен-
сибилизирует) к действию комплемента, в присутствии которого
эритроциты разрушаются (лизируются). Если лизиса нет, значит
комплемент связан первой системой и, следовательно, антиген в
ней соответствует антителу. Отсутствие гемолиза регистрируют
как положительный ответ. Если в испытуемой системе антиген не
соответствует антителу, иммунный комплекс не образуется и комп-
лемент остается свободным. Свободный комплемент участвует во
второй системе, вызывая гемолиз эритроцитов, результат РСК
387
при этом отрицательный.
Ввиду сложности РСК все компоненты, участвующие в ней, долж-
ны быть предварительно оттитрованы и использованы в реакции в оп-
ределенных количествах и в равных объемах. Обычно каждый из них
берут в объеме 0,5 или 0,2 мл.
Ингредиенты реакции.
Гемолитическая сыворотка. Её получают обычно в производст-
венных условиях, иммунизируя животных (кроликов) эритроцитами
барана. После того как у животных выработается достаточное коли-
чество антител к эритроцитам, у них берут кровь для получения
иммунной сыворотки. Сыворотку прогревают при 56° 30 мин, чтобы
инактивировать содержащийся в ней комплемент и титруют, т.е. оп-
ределяют активность. Титром гемолизина является то наибольшее
разведение сыворотки, при котором происходит полное растворение
3^ взвеси эритроцитов барана в присутствии комплемента.
Эритроциты барана. Кровь у барана берут из яремной вены.
Её собирают в стерильную банку со стеклянными бусами и энергич-
но встряхивают в течение 10-15 мин(дефибринируют). Эритроциты
отмывают от плазмы физиологическим раствором при центрифугирова-
нии (2000 об/мин 10 мин). Операцию повторяют трижды. Прозрачную
надосадочную жидкость отсасывают, а из осадка готовят взвесь на
физиологическом растворе в концентрации 3%.
Комплемент. Это неспецифический многокомпонентный белок,
содержащийся в свежей сыворотке человека и теплокровных живот-
ных. Больше всего комплемента в сыворотке морской свинки. Ее
обычно используют в качестве источника комплемента в реакциях
иммунитета. Непосредственно перед опытом комплемент титруют.
386
Титром комплемента называется его наименьшее количество, в при-
сутствии которого гемолитическая сыворотка растворяет М взвесь
эритроцитов барана при 37° в течение часа.
Антиген. Антигеном в РСК обычно используется экстракт кле-
ток или их определенная фракция. В качестве антигена может быть
использован и гаптен. Реже используют взвесь микроба.
Антитело. Сыворотка больного, или иммунная сыворотка, или
иммунный гамма-глобулин. Сыворотку перед опытом прогревают для
инактивации содержащегося в ней комплемента.
Проведение опыта.
При постановке РСК важна последовательность добавления
компонентов реакции. Вначале в пробирки вносят сыворотку в оп-
ределенном разведении, затем антиген и комплемент в рабочей до-
зе. Опыт сопровождают контролями всех ингредиентов: сыворотки,
антигена, комплемента и гемолитической системы. Пробирки встря-
хивают и инкубируют при 37° I час или 18 час в холодильнике при
4°. За это время при наличии специфического комплекса происхо-
дит связывание комплемента. Далее во все пробирки вносят гемо-
литическую систему, т.е. смесь взвеси эритроцитов и гемолити-
ческой сывортки. Вторая фаза реакции проходит при 37°. Резуль-
таты опыта отмечают после того, как становятся прозрачными про-
бирки контроля антигена, сыворотки и комплемента. В контроле
гемолитической системы не должно быть гемолиза, т.к. в этой
пробирке комплемент полностью отсутствует.
Схема постановки РСК
Ингредиенты Опыт Контроль
сыворотки антигена гемосистемн комплемента
I фаза: Сыворотка 0,5 0,5 — — —
Антиген 0,5 - 0,5 -
Комплемент 0,5 0,5 0,5 0,5
Физ.р-р - 0,5 0,5 1,5 1.0
Инкубация при 37° I час или при 4° 13 часов
II фаза: гемолитическая система по 1,0 мл
Инкубация при 37° 30-60 мин до полного лизиса в контроле ан-
тигена, сыворотки и комплемента
Результат + - - + —
или
+ нет гемолиза; - гемолиз.
Цель работы: определить специфичность и титр антител в сы-
воротке методом реакции агглютинации; оценить количество анти-
генных фракций в глико-протеиновом комплексе, выделенном из
микробных клеток, методом иммунодиффузии.
Материалы: суточные культуры на агаре: st.aureus, в.coll,
Candida albicans.
0,Г£ растворы глико-протеиновых комплексов, выделенных из этих
же микроорганизмов (см.раздел 8.2); иммунные сыворотки, содер-
жащие антитела против этих же микроорганизмов.
Определение специфичности сыворотки методом реакции агглю-
тинации на стекле.(см.выше). В качестве антигена используют
390
взвесь того микроорганизма, в отношении которого специфична дан-
ная сыворотка. Результаты опытов вносят в таблицы.
Специфичность сыворотки №... при испытании методом
реакции агглютинации на стекле
Антиген St.aureus E.coli С.albicans
Результат реакции
I
Титр антител в сыворотке № ... с антигеном~.........................
- Разведение 1:50 1:100 ... 1:1600 Контроль Контроль
сыворотки сыворотки антигена
Интенсивность ++++ и т.д. — —
реакции
Исследование глико-протеинового комплекса методом
иммунодиффузии.
Используют метод диффузии на предметном стекле. В централь-
ную лунку пастеровской пипеткой вносят неразбавленную иммунную
сыворотку, в лунки по периферии - растворы антигенов. После
экспозиции отмечают и зарисовывают зоны преципитации. Оценива-
ют специфичность метода и количество антигенных фракций в пре-
парате .
Аллергия и аллергические пробы
Аллергия - это измененная реактивность организма под вли-
янием микробов, продуктов их распада или обмена, токсинов, лека-
рственных препаратов и других веществ. Вещества, которые вызы-
вают аллергию, называются аллергенами. Аллергические реакции
используют для диагностики некоторых инфекционных заболеваний
(туляремия, бруцеллез, туберкулез,микозы), для определения чувст-
391
вительности больного к определенным лекарственным препаратам
и т.д.
При диагностике инфекционных заболеваний в качестве аллер-
генов используют вакцины, фильтраты культуральных жидкостей,
полисахаридные гаптены, водные и другие извлечения из клеток
возбудителей. Аллергены обычно вводят в насечки на кожу (реак-
ция Пирке) или внутрикожно (по Манту). При положительной реак-
ции на месте нанесения аллергена наблюдается покраснение и при-
пухлость.
Аллергические пробы с туберкулином. Организм больного ту-
беркулезом обладает повышенной чувствительностью на введение
малых доз аллергена (туберкулина) и отвечает на него воспали-
тельной реакцией, тогда как при отсутствии инфекционного про-
цесса организм нечувствителен к туберкулезу. Положительная ал-
лергическая реакция появляется и в ответ на вакцинацию в целях
профилактики заболевания и свидетельствует о наличии инфекци-
онного иммунитета. В качестве аллергена используют туберкулин,
представляющий собой фильтрат бульонной культуры туберкулез-
ных бактерий, или очищенный протеиновый препарат туберкулина.
Реакция Пирке - наиболее часто применяемая кожная проба.
На сгибательную поверхность предплечья наносят I каплю тубер-
кулина, а на несколько сантиметров ниже - каплю 0,51 раствора
карболовой кислоты в физиологическом раствбре с 51 глицерина
(контроль). Затем делают поверхностные царапины на коже -
сначала в контрольной капле, а затем на месте с каплей туберку-
лина. При положительной реакции на месте нанесения туберкулина
через 48 часов отмечается образование красноватой папулы, кото-
рая быстро увеличивается в ширину. В контрольной царапине реак-
392
ция отсутствует.
Реакция Манту - внутрикожная проба. 0,05 мл туберкулина в
разведении 1:5000 вводят внутрикожно (не подкожно!) через тон-
кую иглу из специального туберкулинового шприца с делениями,
соответствующими сотым долям миллиметра.
Приготовление вакцины
Вакцинами называют препараты, употребляемые для иммуниза-
ции (вакцинации) людей или животных с целью создания у них актив-
ного иммунитета. Вакцина содержит антиген возбудителя той ин-
фекции, против которой предпринимается вакцинация. Антигенами
могут быть бактериальные клетки, убитые нагреванием или хими-
ческими веществами (формалином,спиртом,ацетоном). Они называются
корпускулярными вакцинами. Антигенами могут быть также актив-
ные фракции микробных клеток, извлеченные различными способами
(химические вакцины). В качестве антигенов для профилактики
токсинемических инфекций используют анатоксины - токсины,
лишенные своих ядовитых свойств, но сохранившие антигенность.
Для перевода токсина в анатоксин часто используют формалин,
который добавляют к токсину в концентрации 0,3-0,4% и выдержи-
вают при 37-40° 18-30 дней д<у полного обезвреживания.
Приготовление бактериальной вакцины состоит из нескольких
этапов: отбор штаммов и выращивание бактерий, приготовление
суспензии и убивание (если необходимо) микробов, установление
нужной концентрации микробных клеток в вакцине, разливка и
укупорка. Все этапы работы сопровождаются контрольными иссле-
дованиями: проверка чистоты культуры (мазки), проверка стериль-
ности при приготовлении убитой вакцины (посев), проверка без-
вредности путем введения лабораторным животным и проверка им-
393
муногенной эффективности.
Цель работы: приготовить вакцину для иммунизации кроликов.
Материалы: суточные агаровые культуры at.aureus, E.coli,
Candida albicans. Пробирки co средами: МПА,МПБ,
сусло-агар,сусло жидкое, среда Китт-Тароцпи. Бактериальные
стандарты, водяная баня.
Проверить чистоту культуры, сделав мазок и окрасив его по
Граму. Приготовить 10 мл взвеси клеток в физиологическом раство-
ре с содержанием клеток !• млрд/мл, используя бактериальный стан-
дарт. Прогреть клетки на водяной бане при 70°С I час. Проверить
стерильность прогретой вакцины. Для этого посеять по 0,2 мл
вакцины в пробирки со средами (см.выше). Посевы на сусле остав-
ляют на 7 дней при 24°С, остальные - при 37°С, после чего оце-
нивают стерильность вакцины.
Фагоцитоз.
Фагоцитозом называется поглощение клетками каких-либо час-
тиц. Фагоцитоз может завершиться перевариванием захваченных
частиц (завершенный фагоцитоз) или ограничится только их зах-
ватом (незавершенный фагоцитоз). Клетками-фагоцитами являются
лейкоциты, а также (фиксированные клетки ретикуло-эндотелиаль-
ной системы. Фагоцитоз микробных клеток является защитным при-
способлением макроорганизма, направленным на борьбу с инфекци-
онным заболеванием.
Для изучения фагоцитоза мышам вводят в брюшную полость
2-3 мл стерильного мясо-пептонного бульона. Через 2-3 часа
после этого в брюшной полости животных скапливается эксудат,
содержаний большое количество лейкоцитов. Чышам вводят внутри-
брюшинно I мл густой (10 млрд/мл) суспензии микробных клеток.
Через 5,10,30 и 60 минут берут пробы эксудата с помощью пасте-
ровской пипетки, делают мазки на обезжиренном стекле, высушива-
ют на воздухе, фиксируют смесью Никифорова и окрашивают по Ро-
мановскому-Гимза. Под микроскопом производят подсчет в несколь-
ких полях зрения количества лейкоцитов и поглощенных ими микро-
бов. Частное от деления количества микробов на число лейкоци-
тов является фагоцитарным показателем. Фагоцитарный показатель
подсчитывают в динамике. Если фагоцитарный показатель со вре-
менем убывает, это свидетельствует о том, что фагоциты перева-
ривают поглощенные ими микробные клетки (завершенный фагоцитоз)
Если фагоцитарный показатель с течением времени не изменяется
или возрастает, это свидетельствует о незавершенном фагоцитозе.
Результаты опыта заносят в таблицу.
Фагоцитоз клеток ................
Время Кол-во лейкоцитов Кол-во микробных Фагоцитарный по-
(мин) клеток казатель
5
10
'30
60
Литература
БойдУ. Основы иммунологии. М., 1969.
Введение в иммуногенетику. М., 1975.
К э б о т Е., М е й е р М. Экспериментальная иммунохимия.М.,1968.
Пяткин К.Д., Кривошеин Ю.С. Микробиология. М.,1980.
395
17. ИЗУЧЕНИЕ ВЛИЯНИЯ НЕКОТОРЫХ ХИМИОТЕРАПЕВТИЧЕСКИХ
ВЕЩЕСТВ НА МИКРООРГАНИЗМЫ
Вопросы для подготовки по теме
I. Этиотропность и оргаиотропность химиотерапевтичес-
ких препаратов. Химиотерапевтический индекс.
2. Основные группы химиотерапевтических веществ и ме-
ханизмы их действия на микроорганизмы.
3. Естественная и приобретенная устойчивость микробов
к лекарственным веществам.
4. Пути преодоления резистентности микробов к лекарст-
венным веществам.
Химиотерапевтическими'называются препараты, которые изби-
рательно действуют на возбудителя инфекционного заболевания, не
причиняя ущерба макроорганизму. Биологической активностью пре-
парата называют его способность убивать или тормозить рост и
развитие микроорганизмов. В связи с этим различают бактерицид-
ное и бактериостатическое действие веществ. В отношении проти-
вогрибковых препаратов говорят о фунгистатической и фунгицид-
ной активности.
Для количественного выражения биологической активности
произвольно введено понятие единицы действия (ВД). ЕД- это ак-
тивность строго определенного весового количества вещества,
принятого за эталон. Для большинства антибиотиков и других
веществ, химический состав и строение которых не установлены,
единицей действия является минимальное количество вещества,
угнетающее рост определенного микроба в стандартных условиях
эксперимента.
Антибиотик может быть в культуральной жидкос'ти в виде хи-
396
мически чистого вещества или в различных лекарственных формах.
В каждом случае необходим правильный выбор методов определения
активности. В качестве тест-культуры обычно используют непато-
генный или условно патогенный микроорганизм, проявляющий наиболь-
шую чувствительность к данному веществу.
Для оценки спектра действия антибиотика применяют различ
ные организмы, в том числе и патогенные.
Все штаммы, используемые для определения активности анти-
биотиков, хранят в определенных условиях и постоянно контроли-
руют по их морфолого-физиологическим свойствам.
В качестве питательной среды, пригодной для большинства
тест-культур, используют МВБ и МПА. Для дрожжей и грибов в эти
среды вносят Г? глюкозы. При определении активности методом
диффузии в агар используют голодный агар для базисного слоя.
Его состав: агар-агар - 1,5-2,0 г, фосфатный буфер с pH 8,8-7,О
- ТОО мл.
Определение активности антибиотиков методом серийных
разведений
Серийный метод титрования может быть выполнен в разных
объемах среды (от I до 10 мл). Эксперименты выполняются в асеп-
тических условиях при использовании стерильных пипеток для каж-
дого ингредиента реакции. Титрование можно проводить в плотных
л жидких средах.
При титровании в жидких средах в ряд пробирок наливают
питательную среду в строго определенном объеме. Количество про-
бирок определяется количеством разведений препарата, которое
необходимо взять в опыт. В первую пробирку вносят определенное
количество раствора антибиотика, перемешивают, затем опреде-
397
ленный объем смеси из первой пробирки переносят во вторую, пере-
мешивают и переносят то же количество смеси из второй в третью
и т.д. Из последней пробирки, содержащей антибиотик, такой же
объем смеси выливают прочь, чтобы во всех пробирках объем жид-
кости был одинаков. Две пробирки, не содержащие антибиотика,
являются контрольными. После этого во все пробирки, содержащие
серийно разведенный антибиотики в одну контрольную пробирку
вносят одинаковое количество взвеси тест-культуры. Вторая конт-
рольная пробирка содержит только питательную среду. Штатив с
пробирками встряхивают и ставят в термостат при 37° на 18-20
часов.
Кратность разведения антибиотика обычно выбирают равной
двум, для этого в каждую пробирку наливают, например, по I мл
бульона, в первую пробирку вносят I мл раствора антибиотика и
переносят из пробирки в пробирку по I мл смеси. При этом точ-
ность определения активности препарата составляет + 50 л. Точ-
ность определения можно повысить путем дополнительных разве-
дений антибиотика,например, используя кратности 1:1,1; 1:1,15;
1:1,20 и т.д.
Взвесь тест-микроба готовят на физиологическом (0,85е*)
растворе -VaCI при обязательном сравнении со стандартами мутнос-
ти. При титровании антибактериальных антибиотиков микробная
нагрузка обычно составляет 1000 микробных клеток на I мл раст-
вора антибиотика в питательном бульоне. Этого достигают следу-
ющим образом. Готовят взвесь тест микроба по стандарту 10 ед.
мутности, что составляет I млрд микробных тел в I мл. Из этой
взвеси берут 0,1 мл и вносят в 9,9 мл-физиологического раство-
ра, получая таким образом разведение в 100 раз. Полученную
396
взвесь таким же образом разводят еще в 100 раз, достигая кон-
центрации микробных тел 100000 в I мл. Эту взвесь разводят в 10
раз, внося I мл её в 9 мл физиологического раствора. Получен-
ную взвесь вносят в пробирки с серийно разведенным антибиоти-
ком по 0,1 мл на I мл питательного бульона.
Метод серийных разведений в плотных средах отличается тем
преимуществом, что микробы-загрязнители легко выявляются и по
существу не изменяют общих результатов титрования, тогда как
на жидких средах весь опыт может оказаться безрезультатным из-
за попадания в пробирки хотя бы единичных клеток посторонних
устойчивых микроорганизмов. Этот метод используют также при
работе с микроорганизмами, которые не растут на обычных жидких
средах, например, туберкулезная палочка, которую выращивают на
среде, содержащей свернутую сыворотку.
Вначале готовят ряд серийных разведений антибиотика, а
затем вносят по I мл каждого разведения в пробирку, содержащую
4 мл расплавленной и охлажденной до 45-50° агаризованной среды.
Затем пробирки скашивают до застывания агара, а на поверхность
плотной среды петлей засевают взвесь тест-микроба.
Для выявления бактерицидного действия препарата делают вы-
сев на МПА из всех пробирок, где визуально не отмечен рост мик-
роорганизма. Для стойких антимикробных веществ, которые абсор-
бируются на микробных клетках и препятствуют их росту даже в
свежей питательной среде, применяют соответствующие нейтрали-
I заторы. Результаты опыта вносят в таблицу.
4
м
Зак. 1183
Определение активности антибиотика методом серийных
разведений
Тест-культура Разведение антибиотика Контроль Контроль пи-
культуры тательной
среды
БСД 44-
БОД. 4+
4+- - отчетливый рост микроорганизма
- - отсутствие роста
БСД- бактериостатическое действие
БОД- бактерицидное действие
Определение активности антибиотиков методом дисИузии в
агар
Этот метод точнее, чем метод серийных разведений, поэтому
он чаще используется на практике.
Материалы: чашки Петри (лучше со шлифованным дном), гори-
зонтальный столик из зеркального.стекла с ватерпасом, цилиндри-
ки из нержавеющей стали с размерами: высота" 8 мм, наружный ди-
аметр 8 мм, внутренний диаметр б мм, голодный агар для базис-
ного слоя, питательный агар, тест-микроб и антибиотик. При ис-
пользовании стандартных чашек Петри со шлифованным дном исполь-
зование базисного слоя агара необязательно.
Ход опыта. Голодный агар разливают по 15 мл в чашки Петри,
размещенные на горизонтальном столике. После застывания агара
чашки подсушивают в термостате, затем в каждую чашку наливают
по 5 мл питательного агара, смешанного с тест-культурой. Коли-
чество последней берут из расчета 20 млн клеток на I мл среды.
400
Перед внесением культуры в агар, его необходимо охладить до 45-
50°. Вместо цилиндров можно использовать лунки, которые делают в
агаре с помощью специального приспособления.После застывания
второго слоя агара на его поверхность наносят по трафарету 6
цилиндров на каждую чашку. В 3 из них через один вносят по 0,1
мл стандартного раствора (контроль). После этого чашки помеща-
ют в термостат при 37° на 16-18 часов. По истечении этого вре-
мени цилиндры удаляют с чашки, а размеры зон задержки роста
тест-микроба измеряют с помощью крон-циркуля или с помощью оп-
тического светового фонаря. Среднеарифметическая величина ди-
аметра зон не должна иметь отклонения более чем ± I мм.
Расчет активности антибиотика по размеру зон задержки
может быть произведен на основании расчетных таблиц В.С.Дмит-
риевой (Государственная фармакопея, X издание), или по стан-;
дартным кривым. Стандартные кривые строят на полулогарифмичес-
кой сетке, откладывая по оси абсцисс диаметры зон задержки
роста тест-микроба, а по оси ординат - величины логарифмов
концентрации антибиотика в растворах от 0,1 до 10 ЕД/мл.Для
этого и служат стандартные растворы препарата.
Ошибка диффузионного метода составляет ± 5-15^.
Определение чувствительности микробов к антибиотикам
методом дисков.
Проверка чувствительности микробов к антибиотикам необхо-
дима прежде всего для оценки эффективности антибиотиков в кли-
нических условиях. Клинический материал или выделенную чистую
культуру засевают на поверхность питательного агара сплошным
газоном. Затем стерильным пинцетом накладывают на агар бумаж-
401
ные диски, пропитанные раствором определенного антибиотика.
Чашки ставят в термостат при 37° на 16-18 часов, после чего от-
мечают результаты. При наличии чувствительной флоры к антиби-
отику вокруг соответствующих дисков будет зона отсутствия рос-
та микробов.
Соотношение чувствительности микробов к антибиотикам и
диаметра зон их угнетения
Степень чувствительности Размер диаметра зоны угнетения (мм)
Высокочувствительный . 26 и более
Чувствительный 15-25 .
Малочувствительный П-14
Устойчивый 10 или отсутствие зоны угнете- ния
Ускоренный метод определения чувствительности микроба к
антибиотику.
Б чашку Петри наливают 15 мл питательного агара. После
застывания агара на него наносят смесь 4 мл такого же агара,
I лл взвеси тест-культуры, приготовленной по стандарту I млрд
клеток в I мл, и I мл 0,2^ водного раствора 2,6-дихлорфенол-
индофенола (pH 7,2-7,3). Вместо культуры можно использовать
клинический материал. Затем на застывший агар ярко-синего цве-
та наносят диски, пропитанные антибиотиками, и чашки ставят
в термостат при 37°. Через 2-4 часа учитывают результаты по
диаметру синих зон отсутствия роста. Резистентные к антиби-
отику микробы восстанавливают краситель, обесцвечивая его ‘
или трансформируя в желтый цвет.
402
Данный краситель задерживает рост стафилококков, поэтому
при работе с этим микроорганизмом раствор индикатора наливают
на поверхность чашки в количестве 2-3 мл уже после выдержива-
ния чашки с дисками в термостате. Избыток индикатора сливают
через 5-7 минут и учитывают результаты.
Литература
Пашкин П.Н., Блинов И. П., Безбородов А.М.,
Цыганов В.А. Антибиотики. М., 1970.
Молекулярные основы действия антибиотиков. М.,1975.
Й
Е8П
18. ОПРЕДЕЛЕНИЕ МИКРОБНОЙ ОБСЕМЕНЕННОСТИ НЕИНЪЕКЦИОННЫХ
ЛЕКАРСТВЕННЫХ ФОРМ
Вопросы для подготовки по теме:
I. Опасности микробного загрязнения лекарственных
веществ.
2. Источники микробного загрязнения неинъекционных ле-
карственных форм.
3. Бактериостатическое и бактерицидное действие лекарст-
венных веществ.
4. Чувствительность микроорганизмов к лекарственным ве-
ществам.
5. Меры предупреждения микробной загрязненности лекар-
ственных форм.
Лекарственные вещества, которые применяют как инъекцион-
ные растворы, выпускаются стерильными. Неинъекционные лекарст-
венные вещества, как правило, в разной степени загрязнены мик-
роорганизмами. Микробы различных групп обнаруживаются как в
препаратах синтетического происхождения, так и в природных.
Источниками загрязнения лекарственных форм может быть сырье,
воздух, аппаратура, руки и одежда работающих. Обсемененность
лекарственных средств микроорганизмами из рода Salmonella,
Pseudomonas, Proteus и др. может явиться причиной тяже-
лых заболеваний.
Кроме того, располагая набором различных ферментов, мик-
роорганизмы способны использовать соединения, входящие в состав
лекарственных средств,и в значительной степени изменять их
физические и химические свойства. Размножение микроорганизмов
может привести к снижению активности препарата или к полной
404
Зак. 1183
его инактивации, а иногда и к превращению действующего вещест-
ва в токсический продукт. В связи с этим существуют определен-
ные нормы, допускающие наличие микроорганизмов в лекарственных
веществах.
Микробную обсемененность препаратов выражают количеством
клеток микроорганизмов в I г сухого препарата или в I мл раст-
вора. При определении микробной обсемененности следует учиты-
вать, что лекарственное вещество может обладать антимикробным
действием. Это действие бывает бактериостатическим (задержива-
ющим развитие микроба), бактерицидным (губительно действующим
на микробы). Сами же микроорганизмы по отношению к лекарствен-
ному веществу могут быть чувствительными или устойчивыми.
Все это усложняет методику определения микробной обсе-
мененности и требует индивидуального подхода к конкретной
лекарственной форме.
Имеются определенные требования ВОЗ и фармакопеи, огра-
ничивающие микробную обсемененность неиньекционных препаратов.
Нестерильные лекарственные формы Для приема per os не должны
содержать патогенной и условно патогенной микрофлоры.Число
сапрофитных бактерий не должно превышать 1000 клеток, а пато-
генных грибов 100 клеток в I г препарата.
для достижения высокого качества продукции несводима
высокая культура производства и строгий санитарно-бактериоло-
гический контроль за состоянием сырья, воздуха помещений, обо-
рудования, одежды и рук работающих. Такой контроль дает возмож-
ность своевременно выявить причину бактериальной обсемененнос-
ти лекарственной (формы и позволяет наметить пути к их устране-
нию.
'105
I
Цель работы.
I. Определить бактериостатическое и бактерицидное действие
лекарственных веществ.
2. Определить микробную загрязненность лекарственного ве-
щества,не обладающего бактерицидным действием.
3. Определить микробную загрязненность лекарственного ве-
щества, обладающего бактерицидным действием (антибиотики).
Материалы.
От каждой серии препарата (независимо от ее объема) отби-
рают пробу не менее,чем 50 г или 50 мл, состоящую из 10 рав-
ных проб, взятых не менее, чем из 10 разных упаковок. Для одно-
го анализа берут образец в 10 г или 10 'мл,взятых из 10 разных
упаковок. При повторении анализа взять образец в 20 г или 20 мл.
Среды: МПА (в ч.Петри 4 шт);ср.Сабуро (в ч.Петри 4шт).лактозный
бульон для накопления микробов рода Escherichia (2 колбы по
100 мл); ср.Киллиана для накопления микробов рода Salmonella ,
Shigella (2 колбы по 400 мл); ср.Эндо (в ч.Петри 4 шт) для
определения кишечной палочки; ср.Плоскирева и Левина (в ч.Петри
2 шт.) для определения микробов рода Salmonella,Shigella ;
ср.Гисса с углеводами (лактозой,глюкозой,маннитом) для опреде-
ления биохимической активности микробов рода Escherichia,
Salmonella И Shigella; накопительная среда для Pseudomonas
aeruginosa и стафилококков; солевой агар с маннитом для опре-
деления патогенных стафилококков; среда для определения Pseu-
domonas aeruginosa.
При испытании на микробную загрязненность лекарственных
форм определяют:
I. Количество сапрофитных бактерий.
406
1183
2 .Количество дрожжевых грибов.
3 .Количество плесневых грибов.
4 .Наличие бактерий рода Proteus.
5 .Наличие бактерий рода Escherichia.
6 .Наличие бактерий родов Salmonella,Shigella.
7 .Наличие патогенных микробов рода Staphylococcus.
8 .Наличие Pseudomonas aeruginosa.
Определение антимикробного действия лекарственных средств.
Чтобы избежать неправильных результатов, обусловленных
антимикробным действием, которым может обладать испытуемый
препарат, при изучении его микробной загрязненности необходимо
предварительно определить антимикробные свойства препарата на
всех используемых для изучения питательных средах.
Для этого к препарату в разведении 1:10 добавить взвесь
тест-организма из расчета 2000 микробных клеток на I г (мл)
препарата. Для приготовления микробной взвеси используют 24-
часовые культуры бактерий и 72-часовую Candida albicans.
Раствор, суспензию или эмульсию препарата, зараженные каждым
микроорганизмом, вносят по 0,2 мл в чашки Петри и по 10 мл -
в накопительные среды для культур Pseudomonas aeruginosa,
Staphylococcus.
Препарат в разведении 1:10 и 1:100, зараженный Bas.cereus
высевают на МПА, в разведении 1:5 и 1:10, зараженный Candida
albicans - на чашки Петри со ср.Сабуро. Препарат в разведении
1:10, зараженный Proteus vulgaris , высевают на скошенный
агар по Еукевичу, E.coli - на лактозный бульон,St.aureus
и Ps.aeruginosa - на накопительную среду с последующим вы-
севом на соответствующие дифференциальные среды.
407
Контролем служат высевы тест-организмов без препарата на
аналогичные среды. Если по сравнению с контролем рост тест-ор-
ганизма на питательной среде угнетается более, чем на
(подсчитывают количество микробов на чашках), то отмечают бак-
териостатическое (фунгистатическое) действие препарата и пре-
парат в этом разведении не исследуется в отношении данного
микроорганизма.
Определение бактериальной обремененности лекарственных
средств
10 г или 100 мл препарата разводят стерильно 0,1 М фосфат-
ным буфером pH 7,0. Приготавливают 3 разведения 1:5,1:10 и 1:100,
Для этого в мерных стерильных колбах 10 г или 10 мл препарата
разводят стерильным 0,1 М фосфатным буфером pH 7,0 до 50 мл
(1:5), 25 мл полученной суспензии разводят до 50 мл (1:10) и
затем I мл последнего разведения - до 10 мл (1:100). При разве-
дении мягких лекарственных форм приготавливают эмульсию препа-
рата. С этой целью 10 г препарата,10 г твин-80 и 80 мл 0,1М
фосфатного буфера pH 7,0 вносят в колбу со стеклянными бусами
(разведение 1:10). Твин-80 и буферный раствор перед употребле-
нием нагревают до 40-45°. Колбу встряхивают 5 мин на водяной
бане при 40-45° до получения гомогенной эмульсии. I мл эмуль-
сии разводят до id мл 0,1М фосфатным буфером (разведение 1:100).
I. Определение количества сапрофитных бактерий
По I мл раствора 1:10 и 1:100 вносят в чашки Петри и за-
ливают МПА (по 2 чашки на каждое разведение) и по 0,2 мл раст-
вора 1:10 и 1:100 засевают шпателем на чашки Петри с МПА (по
2 чашки на каждое разведение).
408
Схема посева препарата для определения его антимикробного
. агар с манни
Ps.aeruginosa. г
том
2. Определение количества плесневых и дрожжевых грибов
По I мл разведения 1:5 и 1:10 вносят в чашки Петри и зали-
вают средой Сабуро (по 2 чашки на каждое разведение)и по 0,2 мл
разведения 1:5 и 1:10 засевают шпателем в чашки Петри со средой
Сабуро.
3. Определение микроорганизмов рода Proteus
По 0,5 мл разведения 1:10 вносят в 2 пробирки свежескошен-
ного МПА (посев по Щукевичу). Через 24-48 час делают пересев в
2 пробирки со средой для Proteus.
4. Определение бактерий родов Escherichia.Salmonella.Shigella.
По 10 мл разведения 1:10 вносят в 100 мл лактозного буль-
она и в 100 мл среды Киллиана. Через 24 часа инкубирования
при 37° делают сплошной посев шпателем по 0,2 мл: с лактозного
бульона на чашки Петри со средой Эндо (2 чашки) и со средой
Киллиана на чашки Петри со средой Плоскирева и Левина(по 2 чаш-
ки), инкубируют 24 часа при 37°.
5. Определение патогенных стафилококков и Ps.aeru?inosa.
10 мл разведения 1:10 засевают в 100 мл накопительной сре-
ды,через 24 часа инкубирования при 37° делают высев по 0,2 мл
сплошным посевом шпателем на чашки Петри с солевым агаром с
маннитом (2чашки) и на чашки Петри со средой для определения
Рз.aeruginosa (2чашки).
Учет результатов
I. Определение общего количества бактерий,плесневых и
дрожжевых грибов.
Подсчет колоний бактерий производят на чашках Петри с
410
МПА через 48 часов инкубирования при 37°, колонии грибов под-
считывают на ч.Петри со ср.Сабуро через 5 суток инкубирования
при 20-22°.
Подсчет колоний микроорганизмов производят по формуле:
а _ ,
X =~2— Ъ
где х - количество бактерий плесневых грибов4 дрожжевых гри-
бов' в I г (мл) препарата
а - среднее количество микроорганизмов на чашках Петри
ъ - показатель разведения препарата
2. Бактерии рода Proteus определяют через 24 часа
инкубирования на специальной среде по изменению цвета среды
из желтого в красный.
3. Бактерии рода Escherichia на среде Эндо образуют
круглые красные колонии. Колонии микроскопируют ; окраска
мазков по Граму), отсевают на пробирки с МПА. При наличии в
мазке грамотрицательных палочек их высевают на пестрый ряд
с лактозой, глюкозой, маннитом,сахарозой, бульон с мочевиной,
на бульон для обнаружения индола.
Культуры рода Escherichia ферментируют лактозу, глюко-
зу с образованием кислоты и газа, не расщепляют мочевину, обра-
зуют индол.
На средах Плоскирева и Левина бактерии родов Salmonella
и Shigella образуют мелкие круглые прозрачные бесцветные
колонии. Колонии микроскопируют ( окраска мазков по Граму),
при наличии в мазке грамотрицательных палочек их отсевают в
пробирки с МПА, затем высевают на среды с лактозой, глюкозой,
маннитом,сахарозой,бульон с мочевиной, бульон для обнаружения
индола.
411
Культур* рода Salmonella сбраживают глюкозу и маннит с
образованием или без образования газа, не сбраживают лактозу,
сахарозу, мочевину, не образуют индола.
Культуры рода Shxigeiia разлагают глюкозу без обра-
зования газа, не разлагают лактозу, не расщепляют мочевину;
некоторые представители рода могут разлагать сахарозу и давать
индол.
Особенности грамотрицательных бактерий
Микроорганизм рода Лакто- за Глюко- за Ман- нит Саха- роза бульон с моче- виной индол среда Эндо
Escherichia кг кг - - - Ярко- красные колонии
Salmonella - к(г) к (г) - - - розовые колонии
Shigella к - (к) - - розовые колонии
4. Патогенные стафилококки на солевом агаре с маннитом
при инкубировании 36-48 часов при 37° образуют колонии, окружен-
ные желтыми зонами. При микроскопии обнаруживают грамположи-
тельные кокки, которые пересевают на МПБ, инкубируют при 37°
16-24 часа и изучают их плазмокоагулирующие свойства. Для это-
го 8 мл свежеполученной крови человека или кролика смешивают
с 2 мл 5% раствора цитрата натрия, тщательно перемешивают и
центрифугируют. Полученную плазму разводят 1:4 0,9% раствором
хлорида натрия и разливают по 0,5 мл в стерильные пробирки.
В каждую пробирку вносят по 2 капли бульонной культуры ис-
412
и
следуемых микроорганизмов и инкубируют при 37°. Результаты учи-
: тывают через 1-24 часа.
Патогенные стафилококки коагулируют плазму и разлагают
маннит. Результаты оформляют в виде таблицы.
Микробная обсемененность лекарства .............
1 Jr Наличие микрофлоры Результат
i r Количество колоний бактерий на МПА при
разведении препарата 1:10 цифра
1:100 цифра
: 2. Количество колоний дрожжевых грибов на
i 1 ср.Сабуро при разведении препарата цифра
1:10 цифра
' 3. Количество колоний плесневых грибов на
ср.Сабуро при разведении препарата цифра
! • 1:10 цифра
'•] 4. ; 1 Наличие бактерий рода Proteus ^покрасне-
: * ние среды с мочевиной) есть-нет
5. Наличие Ps.aeruginosa ('позеленение среды' есть-нет
6. Наличие патогенных стафилококков ('желтые
колонии с желтым орелом, положительная
реакция плазмокоагуляции) есть-нет
7. Наличие бактерий рода Escherichia есть-нет
; 8. Наличие бактерий родов Salmonella,Shigella есть-нет
413
Определение микробной загрязненности лекарственных
веществ, обладающих бактерицидным действием, включая
антибиотики
Растворы для анализа
I л 0,5% раствора антибиотика или 10% суспензии из табле-
ток, содержащих антибиотик. Суспензию из таблеток приготавли-
вают путем их растирания в стерильных фарфоровых ступках.
Для феноксиметилпенициллина, ампициллина тригидрата, тет-
рациклина, олеандомицина фосфата растворителем является I/I5M
фосфатный буфер pH 7,8-8,0, для оксациллина и диклоксациллина
- 0,9% раствор NaCI . Критерием для выбора растворителя являет-
ся скорость растворения препарата и отсутствие антимикробных
свойств у самого растворителя.
Питательные среды. МПА, среда Сабуро, среда Эндо,кровяной
агар. Стерильные среды разливают в чашки Петри.
Ход анализа
Раствор антибиотика немедленно после приготовления фильт-
руют через 4 мембранных фильтра по 250 мл раствора через каж-
дый фильтр. После фильтрации фильтры отмывают от антибиотика
пятью порциями растворителя по 100 мл. Фильтры помещают в чаш-
ки Петри на следующие среды:
а) для определения общего количества микроорганизмов на
МПА. В МПА добавляют пенициллиназу для феноксиметилпенициллина
и ампициллина тригидрата - 100 ёд/мл среды, для оксациллина и
диклоксациллина - 1000 ед/мл среды, для тетрациклина - MgSO^-
7HgO из расчета 0,11 мл 2М раствора на I мл среды. Посевы ин-
кубируют при 37° в течение 3 суток.
б) для определения общего числа плесневых и дрожжевых гри-
414
бов - на среду Сабуро. Инактивацию производят только пеницилли-
назой. Инкубируют при 24° в течение 5 суток.
в) для определения кишечной группы - на среду Эндо, в аре-
нду добавляют инактиваторы, как и в МПА. Инкубируют при 37°
трое суток; бактерии рода Escherichia на среде Эндо обра-
зуют красные колонии, в отличие от родов Salmonella,Shigella,
которые дают розовые колонии.
г) для обнаружения патогенных стафилококков - на кровяной
агар, куда так<ке добавляют инактиваторы, как и в МПА. Инкуби-
руют при 37° 3 суток. На кровяном агаре патогенные стафилокок-
ки вокруг колоний дают зону гемолиза.
Суспензии из таблеток антибиотиков высевают непосредствен-
но по 0,2 мл на поверхность агаризованных сред сплошным посе-
вом шпателем, используя параллельно 3 чашки Петри.
Учет результатов
Для определения обсемененности растворов антибиотика
подсчитывают количество колоний на фильтре и пересчитывают на
I г препарата по формуле
X =4а • ь , где
а- количество колоний микроорганизмов на фильтре
ъ- показатель разведения
При подсчете обсемененности таблеток расчет ведут по
формуле
X = -~Ь
3 , где
а - среднее количество колоний на чашке Петри
ъ - показатель разведения.
Результат оформляют в виде таблицы.
415
Микробная обсемененность лекарственных препаратов
Кол-во микроорганизмов на I г препарата
Препарат бакте- рий плесне- вых грибов дрожже- вые гри- бы патоген- ные ста- филокок- ки бакте- рии рода jSsche richia грамотрица- тельные бак- терии, не сбраживаю- щие лактозу (на ср.Эндо)
416
19. ОПРЕДЕЛЕНИЕ СТЕРИЛЬНОСТИ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ,
ИСПОЛЬЗУЕМЫХ ДЛЯ ИНЪЕКЦИЙ
Вопросы для подготовки по теме:
I. Источники загрязнения лекарственных веществ
2. Проверка стерильности
3. Пирогенность, ее источники.
4. Методы исследования стерильности.
Все основные группы микроорганизмов могут быть загрязните-
лями биопроизводства. В производстве антибиотиков, плазмозаме-
нителей крови (декстран), отдельных витаминов ( Bg.Bjg) сущест-
венная роль споровых бактерий, попадающих в ферментеры с заг-
рязненным воздухом. Как правило, в этих случаях имеет место
негерметичность аппаратуры или попадание В* ферментеры нестериль-
ного наружного воздуха из-за его плохой очистки.
Грамотрипательные бактерии группы Escherichia и
PsQvda..or_:?.s могут попасть в ферментеры с нестерильной во-
дой.
Дрожжевые организмы могут быть в культуральной жидкости
вследствие недостаточной стерилизации питательной среды, содер-
жащей кукурузный экстракт.
Нередко продукт может быть стерильным , но содержать про-
дукты жизнедеятельности микроорганизмов, которые могут явиться
причиной пирогенности препарата. Пирогены (комплексно связан-
ные белки,жиры,углеводы,тейхоевые кислоты й т.д.) проходят
через бактериальные фильтры, устойчивы к нагреванию и многим
другим факторам внешней среды.
Пирогены вызывают ряд изменений в макроорганизме,харак-
теризуемый повышением температуры, вазомоторными расстройствв-
4Т7
ми и т.д. , поэтому стерильный продукт должен быть свободным
от пирогенных веществ.
Все препараты, выпускаемые для инъекций, должны быть сте-
рильными. Стерильность препаратов достигается соблюдением са-
нитарных условий изготовления и режима стерилизации лекарст-
венных препаратов для инъекций, установленных Гос.фармакопеей
СССР или ТУ.
Испытания на стерильность производят в боксах со строгим
соблюдением требуемого режима стерильности в работе. Бокс дол-
жен быть специально подготовлен.
Подготовка бокса: помещение бокса моют горячей водой с мы-
лом и обрабатывают дезйнфицирующими растворами по очереди: нап-
ример - 0,5^ раствором цетазола, 5% раствором формалина, 3^
раствором перекиси водорода с моющим порошком "Прогресс" или
"Сульфанол". Для полного обеспложивания в боксе включают бак-
терицидные лампы не менее чем за 2 часа до начала работы. Воз-
дух в боксе должен регулярно проверяться на бактериальную об-
семененность. Для этого чашки Петри с МПА и средой Сабуро ос-
тавляют открытыми на 15 мин, затем закрывают и выдерживают в
термостате при 37° 48 часов. Допустимым считается рост не бо-
лее 5 колоний на чашке с МПА, большее количество колоний яв-
ляется признаком~высокой обсёмененности бокса. Плесневых и дрож-
жевых грибов не должно быть вообще на ч.Петри со ср.Сабуро.
Работа в боксе производится в специально предназначенных
стерильных халатах и бельтинговых тапочках, которые заверты-
вают в пергаментную бумагу и стерилизуют в автоклаве в течение
30 мин при 2 ат.
4Т6
Цель работы
I. Определить стерильность инъекционных препаратов
Материалы:
От каждой серии препарата (антибиотика) в 10000 флаконов
берут 3 флакона и дополнительно по I флакону от каждых после-
дующих 10 000 флаконов.
При определении стерильности полиглюкина и ферроглюкина
берут по 6 флаконов от каждой загрузки автоклава и 3 флакона от
100 флаконов, выпущенной серии.
Питательные среды: тиогликолевая среда во флаконах по 20
мл (15 флаконов на препарат), сахарный бульон с 0,Й глюкозы
pH 7,2-7,5 во флаконах по 50 мл (5 флаконов на препарат) и по
10 мл в пробирках (4 пробирки на препарат); МПА рН7,2-7,4 про-
бирки (2 пробирки на препарат), жидкая среда Сабуро в пробир-
ках по 10 мл и В мл (по 5 пробирок на препарат).
Все среды после стерилизации выдерживают в течение 5 суток
в термостате при 37°, а среды Сабуро при 24° для проверки их
стерильности. Используемые среды должны иметь паспорт и быть
проверены на интенсивность роста в них тест-микробов.
Ход анализа
I. Определение стерильности антибиотиков.
Методы определения стерильности различных антибиотиков раз-
личаются мало; небольшие изменения касаются количества антиби-
отиков, которые высевают в среду, и способа инактивации. Для
инактивации используют чаще пенициллиназу или 0,33% стерильный
раствор гидроксиламина. Предварительно в тиогликолевую среду
добавляют стерильно раствор пенициллиназы из расчета, что I ед
пенициллиназы инактивирует 60 ед пенициллина. Среды с пеницил-
419
линазой выдерживают 48-72 часа в термостате при 37° для провер-
ки их стерильности.
Для посева содержимое каждого флакона растворяют в стериль-
ной дистиллированной воде. Препарат высевают в 15 пробирок с
тиогликолевой средой и 5 пробирок Спо 5 мл) со средой Сабуро
по 0,2 мл, создавая концентрацию антибиотика 2500 единиц.
Засеянные среды выдерживают в термостате при двух разных
температурах: при 37° - 10 пробирок с тиогликолевой средой,
при 24° - 5 пробирок с тиогликолевой средой и 5 пробирок со сре-
дой Сабуро.
Пробы выдерживают в течение 5 суток при ежедневном прос-
мотре. С целью проверки инактивации пенициллина одну из проби-
рок с тиогликолевой средой одновременно засевают 18-часовой
культурой Staphylocoo-cus aureus 209-р из расчета 250 мик-
робных клеток на I мл среды и выдерживают так-же при 37° в те-
чение 5 суток. Эта пробирка должна через 18 часов обязательно
стать мутной.
При проросте питательной среды посевы повторяют из удвоен-
ного количества образцов на двойном количестве сред, при нали-
чии пророста хотя бы в единичных пробирках препарат считают
нестерильным.
Учет результатов
Среды Количество проросших пробирок
Тиогликолевая Тиогликолевая + .Л
Сабуро
420
2. Определение стерильности полиглюкина и фер^оглюкина
Полиглюкин представляет собой раствор среднемолекулярной
фракции частично гидрализованного декстрана в изотоничес-
ком растворе хлорида натрия.
Ферроглюкин - это раствор декстрана, к которому методом
комплексирования присоединен атом железа.
Флаконы с препаратом до посева выдерживают 3 суток в тер-
мостате при 37° для выявления споровых форм микроорганизмов,
которые в течение этого времени переходят в вегетативные. Из
каждого флакона для выявления аэробов производят высев по 2 мл
в 5 флаконов с сахарным бульоном и по 0,5 мл в 3 пробирки со
средой Китт-Таропци. Для выявления плесневых грибов и дрожжей
производят высев по 0,5 мл в 4 пробирки с жидкой средой Сабуро.
Засеянные среды выдерживают в термостате при двух разных тем-
пературах.
При 37° - 3 флакона с сахарным бульоном ,
4 пробирки с МПА,
3 пробирки со средой Китт-Таропци
При 24° - 2 флакона с сахарным бульоном ,
4 пробирки со средой Сабуро.
Пробы выдерживает в течение 8 суток при ежедневном прос-
мотре. Для контроля пригодности питательной среды один из
флаконов с сахарным бульоном одновременно засевают 18-часо-
вой культурой st.aureus 209-р, внося во флакон I каплю
I млн взвеси и выдерживают в термостате при 37° в течение
6 суток.
При проросте питательных сре д опыт повторяют из удвоенного
количества образцов на двойном количестве сред.
421
Учет результатов
Среды Количество проросших пробирок
Сахарный бульон Мясо-пептонный агар Китт-Тароцци .Сабуро
3. Определение стерильности химико-фармацевтических пре-
паратов, не обладающих бактериостатическим действием.
Препарат засевают по 0,5 мл в 5 пробирок с сахарным буль-
оном по 0,2 мл в 3 пробирки с МПА, для выявления анаэробов про-
изводят высев по 0,5 мл в 3 пробирки со средой Китт-Тароцци, а
для выявления плесневых и дрожжевых грибов производят высев по
0,5 мл в 3 пробирки со средой Сабуро.
Засеянные среды выдерживают при двух разных температурах
При 37° - 3 пробирки с сахарным бульоном
3 пробирки с МПА
3 пробирки со средой Китт-Тароцци
При 24° - 2 пробирки с сахарным бульоном
3 пробирки со средой Сабуро.
Посевы выдерживают 7 суток при ежедневном просмотре. При
проросте сред опыт повторяется из удвоенного количества образ-
цов на двойном количестве сред.
Масляные препараты перец посевом эмульгируют в стерильном
физиологическом растворе с бусами (в колбочке 5 мл 0,9^ xiaCl
и 2-3 бусинки1*. Препарат вносят стерильно в количестве I мл
и встряхивают 3-5 мин, а затем уке высевают на питательные
422
среды.
Учет результатов
Среды Количество проросших пробирок
Сахарный бульон МПА Китт-Тароцци
Сабуро।
4. Определение стерильности препаратов, обладающих
бактериостатическим действием.
Препарат высевают по 5 мл в колбы с 200 мл сахарного буль-
она и выдергивают 3 суток.
После этого делают высевы так же, как и препарата не обла-
дающего бактериостатическим действием (п.З)
5. Определение стерильности препаратов, обладающих
бактерицидным действием.
Раствор препарата пропускают через 2 мембранных фильтра,
по 10 мл через каждый фильтр. После фильтрации фильтры отмыва-
ют от препарата 3 порциями стерильного физиологического раст-
вора по 100 мл. Фильтры помещают в ч. Петри на следующие сре-
ды.
а1 для определения бактерий на МПА
б) для определения плесневых и дрожжевых грибов на
среду Сабуро.
Наблюдение за посевом ведут в течение 7 суток. На фильт-
рах не должно вырасти никаких колоний микроорганизмов. В слу-
чае пророста опыт повторяют из удвоенного количества образцов
423
и на двойном количестве сред.
Литература
Государственная Фармакопея. Изд. 10.М.,1968,
стр.954.
Приказ Мин. здравоохранения СССР, Мин. мед.промышленнос-
ти, Мин. мясной и молочной промышленности СССР. JP944 (486)207.
ТО. ТО.1974
Зек. 1183
<124
ПРИЛОЖЕНИЕ
Питательные среды
Лактозный бульон.
Пептон 5 г, лактоза - 5 г, мясная вода до 1000 мл, pH после
стерилизации 6,7. Стерилизуют при 2 ат 15 мин.
Среда Киллиана.
К 100 мл МПБ (pH 6,7-6,9) перед употреблением добавляют I мл
0,К водного раствора бриллиантового зеленого.
Среда Эндо, (готовится непосредственно перед употреблением).
К 100 мл МПА (pH 7,6) при температуре 70°С стерильно добав-
ляют 5 мл 20^ раствора лактозы и смесь 0,5 мл насыщенного раство-
ра основного фуксина с 1,25 мл свежеприготовленного 10^ раствора
су.ль'с натрия.
Среды Гисса с углеводами
Пептон - 10 г, isaCl - 5 г, углевод - 10 г, реактив Андреде -
10 мл, вода дистиллированная до 1000 мл, pH после стерилизации
7,2-7,4, стерилизуют 15 мин при 2 ат. Углеводы - лактоза, глюко-
за или маннит.
Реактив Андреде.
0,5 г кислого фуксина растворяют в 100 мл дистиллированной
воды, прибавляют 16,4 мл In раствора ПаОП, стерилизуют 5 мин
при 100° и хранят в темном месте во флаконе с притертой пробкой.
Приготовленный реактив должен иметь соломенно-желтый цвет.
Накопительная среда для 1:: ;i;;. > .о-p, у а Досона...
Дрожжевой экстракт - 5 г, казеиновый гидролизат (кислотный)
- 20 г, л - 5 г, пептон - 10 г, глюкоза - 2 г, К^ПЦ
2,5 г, вода дистиллированная до 1000 мл. Среду стерилизуют 15мин
425
при 2 ат.
Солевой агар с маннитом.
Пептон - 10 г, NaCl - 75 г, Д-маннит - 10 г, феноловый крас- (
ный - 0,025 г, агар-агар - 20 г, мясо-пептонный бульон до 1000 мл,
pH после стерилизации 7,4.
Феноловый красный внести в виде 0,1% раствора в 20 И> спирте
(25 мл на 1000 мл среды). Среду стерилизуют 15 мин при 2 ат.
Т
Среда для определения___Ряяпапшппяя аетиР1тиЬяа
Пептон - 20 г, глицерин - 10 г, К2НРО4 - 1,о г, MgSO4.7H2o
-1,5 г, агар-агар - а.0 г, pH после стерилизации 7,2. Стерилизу-
ют 15 мин при 2 ат.
Среда Сабуро
Пептон - 10 г, глюкоза - 40 г, агар-агар - 20 г, дистилли-
рованная вода до 1000 мл. Стерилизуют 15 мин при 2 ат.
Кровяной агар.
К расплавленному и охлажденному до 45°С МПА (2% агар-агара)
стерильно добавляют 5-10% дефибринированной стерильно взятой
крови лошади, кролика или барана.
Среда Девина.
К 100 мл расплавленного МПА (pH 7,2-7,4) добавляют 2 мл 0,5%
водного раствора метиленового синего , 1,5 мл 2% раствора эозина
желтого, 2 г лактозы и 0,2 г двуосновного фосфата калия. Раство-
ры красок готовят на дистиллированной воде, стерилизуют паром в
течение I часа. Лактозу и двуосновной фосфат калия перед добавле-
нием к агару растворяют в небольшом количестве стерильной дис-
тиллированной воды и кипятят в пробирке. После добавления всех |
ингредиентов среда имеет красно-фиолетовый цвет.
426
Среда Китта-Тароппи.
Печень животного нарезают кусочками 1-1,5 г,прибавляют трой-
ное количество МПБ и кипятят 30 мин. Бульон отфильтровывают, пе-
чень промывают под краном на сите. Отфильтрованный бульон разли-
вают по 7-10 мл в пробирки и кладут в них по 2-3 кусочка отмы-
той печени. Пробирки стерилизуют в автоклаве 30 мин при I ат.
После посева пробирки заливают стерильным вазелиновым маслом
(слой масла 0,5 см).
Среда Тукаева.
К 1%-ой пептонной воде добавляют 5-6% обезжиренного молока.
Стерилизуют дробно при 100° 3 дня по 60 минут.
Тиогликолевая среда.
Панкреатический гидролизат казеина (в пересчете на сухой
остаток) - 15 г, дрожжевой экстракт (10%) (в пересчете на сухой
остаток) - 5 г, ВаС1 - 5 г, глюкоза - 5 г, цистин -0,75 г,
тиогликолевая кислота - 0,3 мл, раствор резазурина натрия I:1ббО
свежеприготовленного - I мл (допускается приготовление среды
без раствора резазурина натрия), агар-агар - 0,75, вода дистил-
лированная до 1000 мл, PW среды после стерилизации 7,0-7,2.
Смешивают все составные части среды за исключением глюко-
зы и тиогликолевой кислоты. Цистин предварительно растворяют в
небольшом количестве дистиллированной воды при добавлении 10-20%
раствора едкого натра до его полного растворения. Среду после
добавления агар-агара расплавляют текучим паром, затем добавля-
ют тиогликолевую кислоту и глюкозу и фильтруют через бумажный
фильтр. Разливают по 20 мл в пробирки и стерилизуют при 120° в
течение 20 мин.
427
Розолово-дифференциальный агар.
К I л мясо-пептонного бульона добавляют 10 г агара, 50 мл
желчи, 10 г лактозы и 0,5 г глюкозы, устанавливают pH 7,4-7,б,
добавляют 2 мл 1% спиртового раствора бромтимолблау и 2 мл
3% спиртового раствора розоловой кислоты. Среду разливают в
пробирки, стерилизуют в автоклаве в течение 20 минут при
III0 - 112°, скашивают так, чтобы получился высокий столбик и
скошенная поверхность. Приготовленная среда до употребления име-
ет красновато-коричневый цвет. При росте на ней кишечной па-
лочки среда становится желтой. Образование газа в среде опреде-
ляют по вспениванию конденсационной жидкости и разрыву столбика
среды.
Среда Вильсон-Блера.
100 мл мясо-пептонного агара с 1% глюкозы растапливают
в водяной бане и добавляют 10 мл 20^ раствора сульфиХа натрия
и I мл 8£ раствора хлористого железа. Оба раствора готовят на
стерильной дистиллированной воде и кипятят. Среду разливают в
пробирки по 7 мл и используют в расплавленном виде при 45°для
посева исследуемого материала на выделение анаэробов.
Среда Кесслера.
Пептон - 10 г, желчь - 50 мл, вода дистиллированная -1000мл.
Смесь перечисленных ингредиентов кипятят 20-30 минут, фильт-
руют через вату, добавляют 10 г лактозы и доводят объем до I л,
устанавливают pH 7,4-7,6, добавляют 4 мл 1% водного раствора
генцианвиолета. Среду разливают в пробирки с поплавками по 5 мл
и стерилизуют при 1,5 ат 15 минут. Среда имеет фиолетовый цвет.
428
Глюкозо-пептонная среда Эйкмана
а) Концентрированная среда Эйкмана.
В I л воды растворяют 100 г пептона, 50 г хлористого натрия,
смесь нагревают до кипения, фильтруют, прибавляют 100 г глюкозы,
устанавливают pH 7,4-7,6 , разливают по 1и мл в колбы или склян-
ки емкостью 250 мл с поплавками и по I мл в пробирки с поплавка-
ми. Стерилизуют текучим паром (t -100°) дробно в течение I часа
через 24 часа три раза. После стерилизации поплавки должны быть
полностью заполнены средой.
б) Разведенная среда Эйкмана. В I л воды растворяют 10 г
пептона, 5 г хлористого натрия, нагревают до кипения, добавля-
ют 10 г глюкозы, устанавливают pH 7,4-7,б, разливают по пробиркам
с поплавками, стерилизуют текучим паром.'
Желточно-солевой агар.
Для приготовления желточно-солевого агара готовят мясо-пеп-
тонный агар (pH 7,2-7,4) с содержанием 10^ поваренной соли.
После розлива во флаконы по 100-200 мл стерилизуют в автоклаве
в течение 20 минут при температуре 120°. Перед употреблением
растапливают, охлаждают до 45°-50° и добавляют 20^ (по объему)
стерильной желточной взвеси (Тжелток куриного яйца на 150-200мл
стерильного физиологического раствора). Среду быстро перемеши-
вают и разливают в чашки Петри.
Специальная среда для получения сферопластов и протопластов.
В МПБ вносят 5^ сахарозы, 0,02^ сульфата магния и ЮООед/мл
пенициллина. Используют сразу после приготовления.
Бульон на переваре Хоттингера.
Говяжье мясо освобождают от костей,жира,сухожилий,нарезают
мелкими кусочками, заливают водой (I кг мяса на 2 л воды) и ки-
429
пятят 15-20 ммн. Мясо пропускают через мясорубку, заливают полу-
ченной мясной водой и сливают в бутыль с таким расчетом, чтобы
1/3 бутыли оставалась свободной. К горлышку бутыли подбирают хо-
рошо пригнанную резиновую пробку. Смесь подщелачивают 20% раство-
ром питьевой соды до pH 7,8-8,0 и прибавляют 0,5% панкреатина
(можно и больше, в зависимости от его активности).
Через 1-2 часа после добавления фермента проверяют реакцию
перевара и подщелачивают его повторно до pH 7,4-7,5. Если сдви-
га pH не произошло, то добавляют еще фермент.
Содержимое бутыли тщательно перемешивают, добавляют хлоро-
форм из расчета 10-30 мл на каждый литр перевара. Бутыль плот-
но закрывают резиновой пробкой и ставят в термостат на 37°С
на 7-10 суток. Первые сутки содержимое бутыли перемешивают каж-
дые 1-2 часа, а в последующие дни - по нескольяу раз в день.
При стоянии в термостате мясо ферментируется, превращаясь
в однородный осадок, а жидкость становится прозрачной соломен-
но-желтого цвета. Об окончании переваривания судят на основа-
нии качественной реакции на триптофан.
По окончании гидролиза перевар фильтруют через бумажный
фильтр, разливают в колбы, стерилизуют 30 мин при 120°С.
Реакция на триптофан.
К 3 мл фильтрованного перевара добавляют 3-4 капли бром-
ной воды. При наличии ^триптофана жидкость принимает розово-
фиолетовый цвет.
Среда Гетчинсона (г): кноз -2,5, к2нро4 - 1,0, HgS04.7H20
- 0,3, СаС12.бН20, NaCl по 0,1, РеС13 -0,01, во-
да водопроводная - до 1000 мл. PH 7,2-7,3 (по бромтимоловому
430
синему). Стерилизуют при 2. ат .
Среда Чапека (г): сахароза - 30, ВаИОз -2,0, кн2р04о
UgSO4.!?H2aO,5, КС1 -0,5, вода водопроводная до 1000 мл.
Среда Виноградского (г):(1Ш4)2304 -2,0, -1,0,
MgS04.7H20 - 0,5, PeSO4 -0,4, JJaCl -2,0, вода водопроводная
до 1000 мл.
Среда Гильтея (г): цитратКа или К трехзамещенный - 5,0,
*д‘°3-2,0, аспарагин - 1,0,КН2ро4" 2.0, -2,0,
СаС12.бн2о - 0,2, 1?еС1з - следы, вода водопроводная -
I л. Проверяют значение pH с помощью бромтимолового синего, при
необходимости доводят до 6,8-7,2 сухой содой . Среду разливают
в пробирки высоким столбиком. Предварительно в каждую пробирку
помещают поплавок. Стерилизация при т,5 ат ..
Среда Эшби (г): маннит или глюкоза - 2O,K2in.’O4 -0»2,ugSO4.7H2O
-0,2,i;aCl-0,2,к2зо4 -0,1, мел -5, вода водопроводная до 1000мл.
Бромная вода.
К 100 мл дистиллированной воды добавляют 3,5 мл чистого бро-
иа для получения насыщенного раствора. Раствор хранят в склянке
темного стекла в темноте.
Красители и индикаторы.
Бумага, пропитанная раствором уксуснокислого свинца.
Нарезают полоски фильтровальной бумаги, погружают их на
5-10 мин в 5% раствор уксуснокислого свинца, высушивают на воз-
духе и стерилизуют в чашке Петри автоклавированием при I,5 гт .
Реактив Грисса.
I. раствор сульфаниловой кислоты: 0,5 г сульфаниловой кис-
лоты растворяют в 30 мл ледяной уксусной кислоты. Добавляют
431
100 мл дистиллированной воды и фильтруют. Раствор устойчив в
течении месяца.
2. Раствор с<.-нафтиламина: 0,1 г о(-нафтиламина растворяют
в 100 мл кипящей дистиллированной воды. Остужают и добавляют
30 мл ледяной уксусной кислоты. Раствор фильтруют и хранят не
более недели.
Непосредственно перед употреблением смешивают равные объемы
реактивов. 1
4 Приготовление красящих бумажек для окраски по методу Грама
в модификации Синева.
Для приготовления красящих бумажек пользуются стандартной
фильтровальной бумагой, которую предварительно гютштич л на
пригодность. Для этого отрезают полоску бумаги и погружают в
спиртовой раствор краски, затем высушивают на воздухе. Хорошая
бумага окрашивается равномерно, без пятен. Затем от нее отреза-
ют небольшой кусок и кладут на стекло с несколькими каплями
воды. Пригодная для окраски бумага сразу пропитывается водой
и через несколько секунд отдает и краску, вследствие чего во-
да вокруг становится интенсивно окрашенной в соответствующий
цвет. Если этого не происходит, бумага для приготовления кра-
сящих бумажек непригодна.
Краску, предназначенную для пропитывания бумаги, наливают
в лоток или кювету. Бумагу нарезают в виде полосок шириной
2-2,5 см и длиной 30-50 см. Полоску погружают на несколько се-
кунд в окраску так, чтобы смачивались обе ее поверхности. Ок-
рашенные полосы вынимают пинцетом, дают краскj стечь и подве-
шивают для высушивания. Бумагу сушат на воздухе при комнатной
температуре или в термостате при 37°С. Высушенные полоски бу-
432
маги разрезают на кусочки размером 2x2 или 2x4,5 см.
Прописи раствора красителя для приготовления бумаги:
Генциан- или кристалвиолет I г
Спирт этиловый 90% 100 мл
Глицерин 5 мл
J Фуксин -насыщенный спиртовой раствор.
Основной фуксин 8-9 г
Спирт этиловый 100 мл
Д Фуксин -спиртово-водный раствор.
I мл насыщенного спиртового раствора фуксина разбавляют
10 мл дистиллированной воды.
•4 Карболовый фуксин Циля
Основной фуксин в порошке
Карболовая кислота кристаллическая
Глицерин
Спирт этиловый 96%
Вода дистиллированная
I г
5 г
0,5 мг
10 мл
100 мл
Способы приготовления:
1.1г основного кристаллического фуксина Циля растирают в
фарфоровой ступке с 5 г кристаллической карболовой кислоты и
несколькими каплями глицерина. Во время растирания небольшими
порциями прибавляют спирт. После тщательного растирания прили-
вают при постоянном помешивании 100 мл дистиллированной воды.
Раствор краски фильтруют через влажный бумажный фильтр. Фуксин
Циля хранят во флаконе темного стекла с притертой пробкой.
П. К 10 мл насыщенного спиртового раствора основного фукси-
на приливают 90 мл 5% карболовой кислоты (карболовую кислоту
433
вливают в краску). Смесь в течение нескольких минут энергично
встряхивают, фильтруют через бумажный фильтр и переливают в
склянку темного стекла с притертой пробкой.
Тушь для окраски препаратов по Бурри.
Тушь черная 5 мл
Дистиллированная вода 15 мл
К одному объему черной туши прибавляют 3 объема дистиллиро-
ванной воды. Разведенную тушь наливают в центрифужную пробирку
и центрифугируют 15-20 минут при 2000-3000 об/мин для осаждения
крупных частиц туши. После центрифугирования пробирку быстро
перевертывают, сливая надосадочный слой туши, и стерилизуют в
автоклаве при 1,5 ат в течение 30 минут.
v! Раствор Люголя.
Кристаллический йод I г
Йодистый калий 2 г
Дистиллированная вода 300 ил
Йодистый калий растворяют в 5-10 мл дистиллированной воды,
затем прибавляют кристаллический йод, оставляют на. несколько
часов до полного растворения йода и после этого приливают ос-
тальное количество воды.
J Метиленовая синь - наснценный спиртовой раствор:
метиленовая синь 8-9 г
спирт этиловый 96% 100 мл
Д Метиленовая синь - спирто-водный раствор
I мл насыщенного спиртового раствора метиленовой сини разбав-
ляют 30 мл дистиллированной воды.
434
Краска Романовского-Гимзы.
Краска Романовского-Гимзы представляет собой смесь красите-
лей: азура (органическая краска,получаемая из метиленовой сини),
эозина и метиленовой сини. В растворенном виде краска имеет си-
не-фиолетовый цвет. Выпускается промышленностью и продается в
готовом- виде.
Буферные растворы
I. Ацетатный буфер
Уксусно-кислый натрий - уксусная кислота (0,2 М).
Уксусно-кислый натрий-З^О, м.в.=136,09;
' 0,2М = 27,22 г/100 мл.
pH 18°С 0,2 И уксуснокислой натрий (мл) 0,2 М уксусная кислота (мл)
3,6 0,75 9,25
3,8 1.20 8,80
4,0 1,80 8,20
4,2 2,65 7,35
4,4 3,70 6,30
4,6 4,90 5,10
4,8 5,90 4,10
5,0 7,00 3,00
5,2 7,90 2,10
5,4 8,60 1,40
5,6 9,10 0,90
5,8 9,40 0,60
435
2. Вероналовый буфер pH 8,6 для фракционирования белков.
29,43 г вероналнатрия и 19,43 г ацетата натрия ( NaOOCCH^).зн2О
растворяют приблизительно в I л дистиллированной воды, затем
добавляют 180 мл I н НС1 . Доливают, водой до 3 л.
3. Фосфатный буфер
Буферная смесь: ИааНРО^т) - КаНгЮд (2) (0,1М)
PH 0,2М (1.) (мл) 0.2М(2) (мл)
5,8 8,0 92,0 разбавляя до 200 мл
6,0 12,3 87,7 разбавляя до 200 мл
6,2 18,5 81,5 разбавляя до 200 мл
6,4 26,5 73,5 разбавляя до 200 мл
6,6 37,5 62,5 разбавляя до 200 мл
6,8 49,0 51,0 разбавляя до 200 мл
7,0 61,0 39,0 разбавляя до 200 мл
7,2 72,0 28,0 разбавляя до 200 мл
7,4 81,0 19,0 разбавляя до 200.мл
7,8 87,0 13,0 разбавляя до 200 мл
7,8 91,5 8,5 разбавляя до 200 мл
8,0 94,7 5,3 разбавляя до 200 мл
436