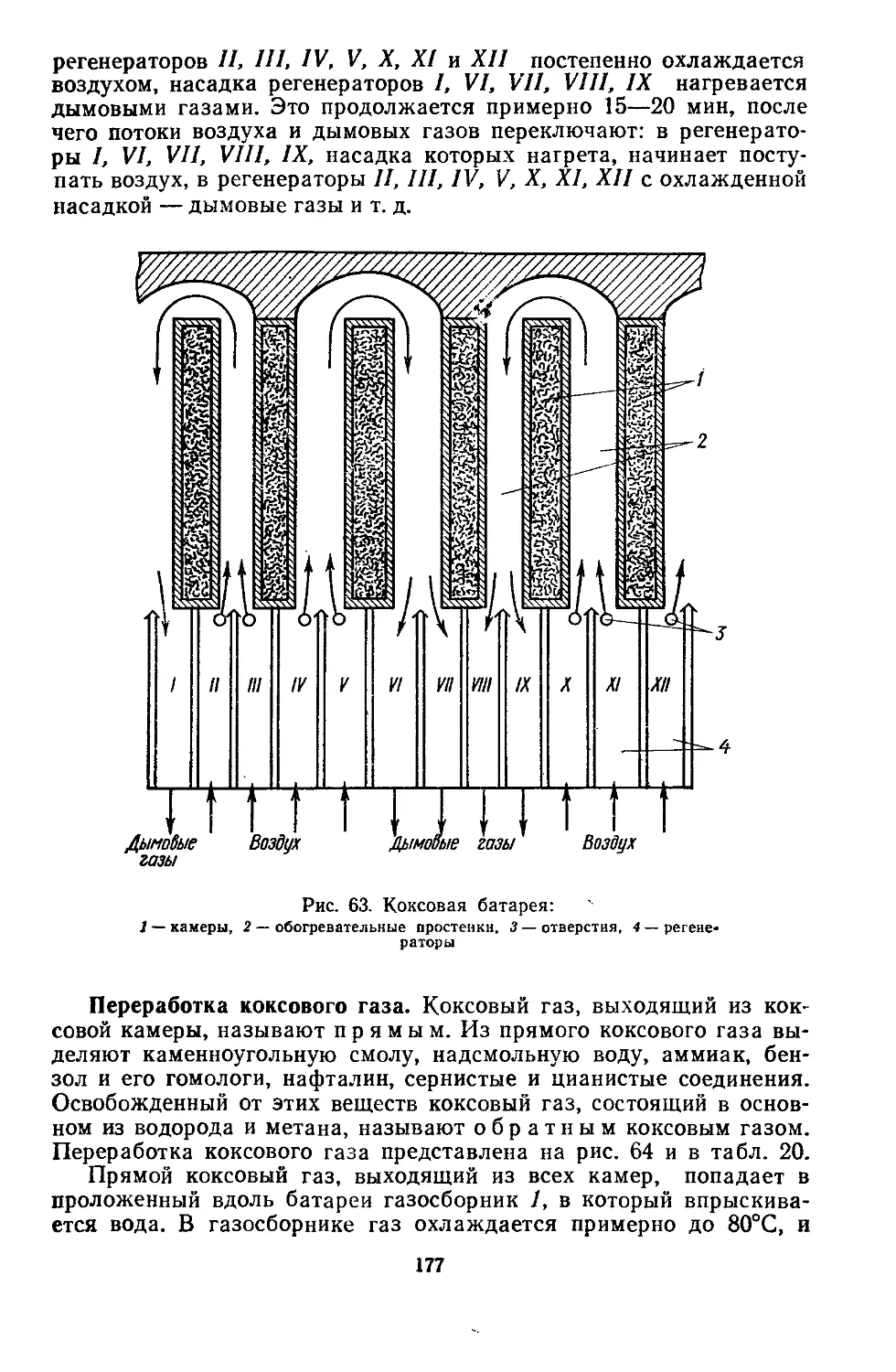
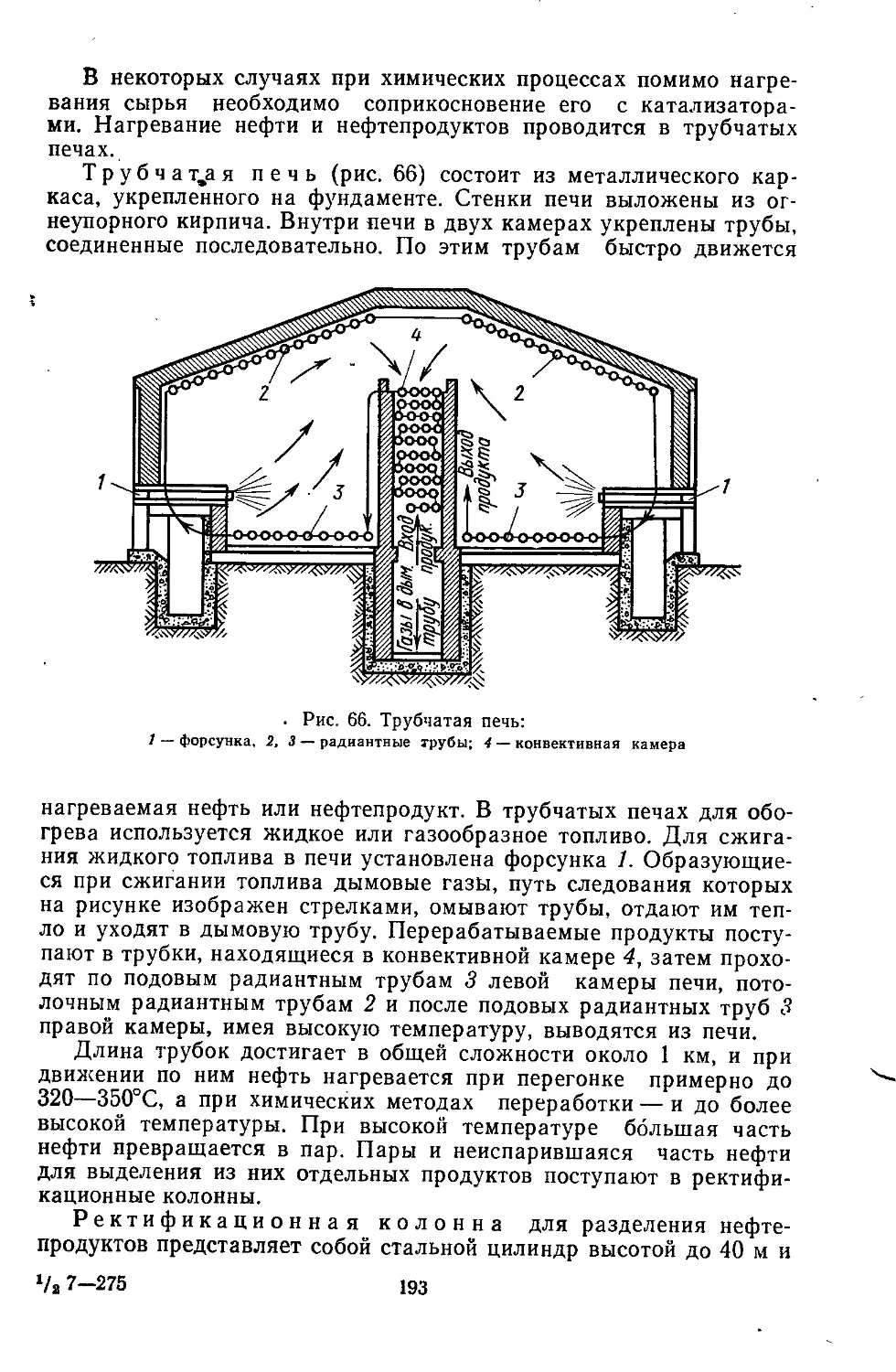
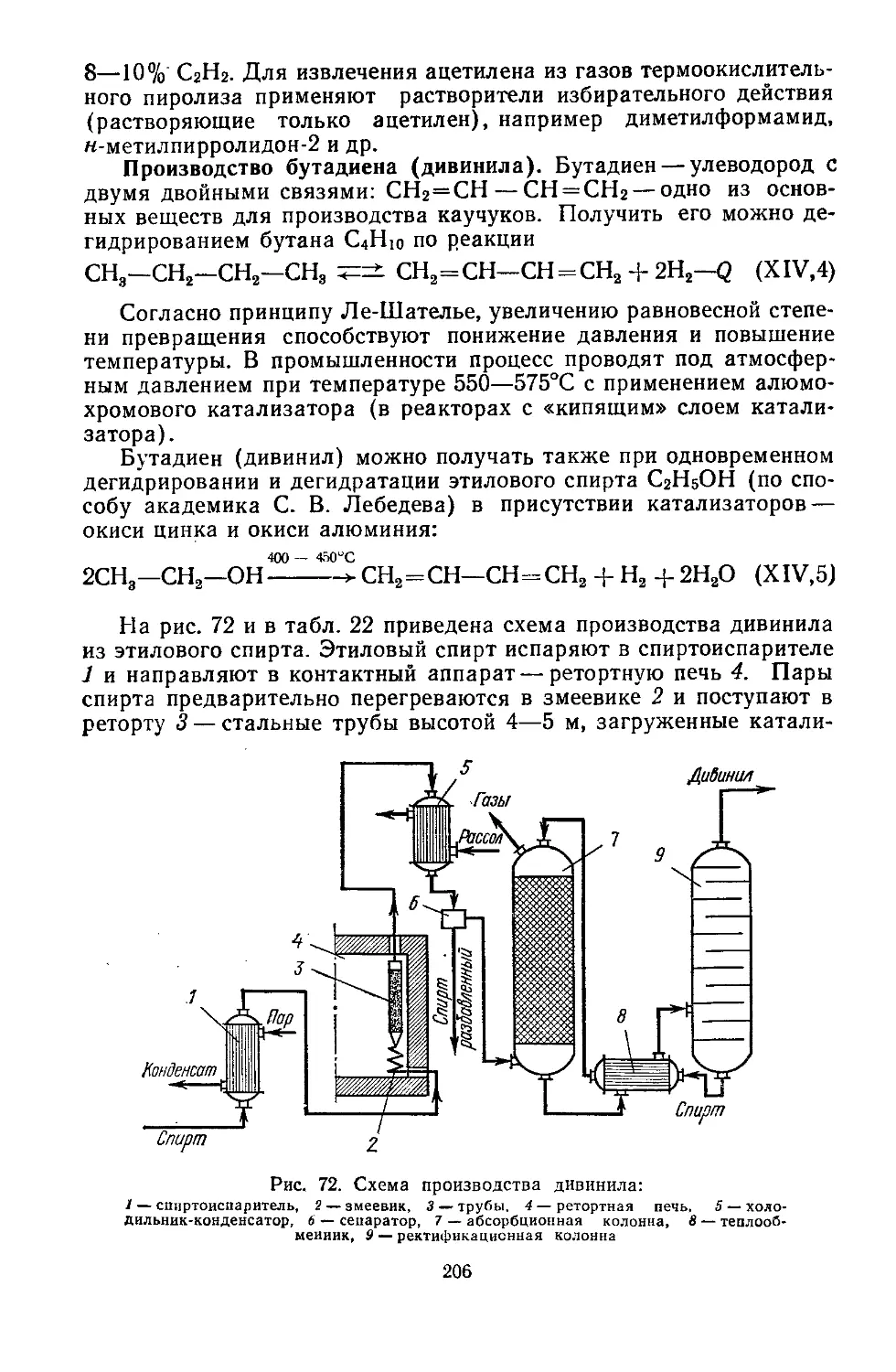
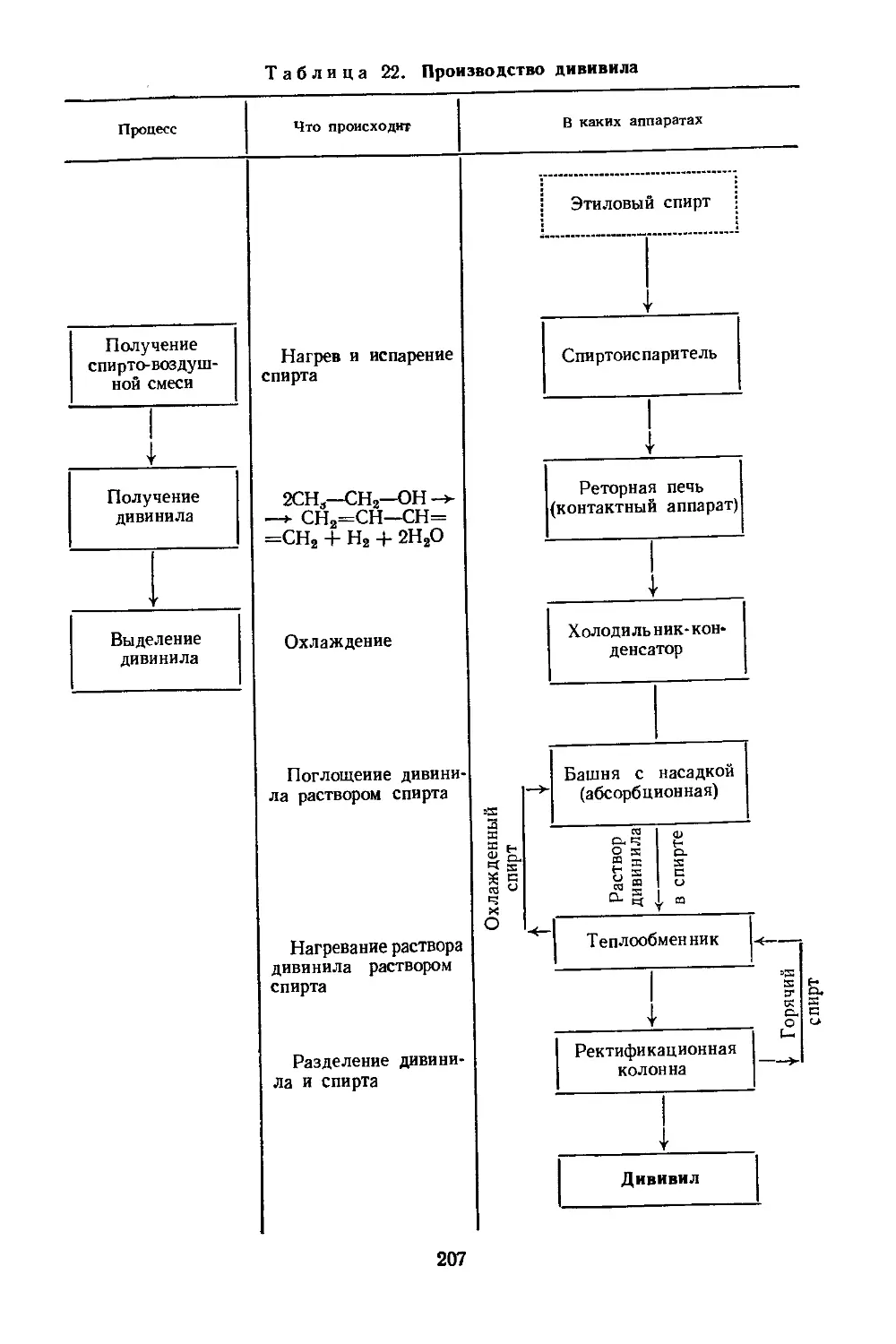
Текст
И. Э. Фурмер, В. Н. Зайцев
ОБЩАЯ
ХИМИЧЕСКАЯ
ТЕХНОЛОГИЯ
ИЗДАНИЕ ВТОРОЕ
ПЕРЕРАБОТАННОЕ И ДОПОЛНЕННОЕ
Утверждено
Ученым советом
при Государственном комитете
Совета Министров СССР
по профессионально-
техническому образованию
в качестве учебного пособия
для профессионально-
технических училищ
W'H » НН и м ч в с
... Б гьлиетвкА
Москва
«Высшая школа»
1978
ББК 24
Ф95
Отзывы и замечания проснм присылать по адресу: 103051, Москва,
К-51, Неглинная ул., 29/14, издательство свисшая школа».
Фурмер И. Э., Зайцев В. Н.
Ф95 Общая химическая технология: Учеб, пособие для проф.
техн, училищ.— 2-е изд., перераб. и доп. — М.: Высш, школа,
1978. — 264 с., ил.
В пер. 55 к.
Приводятся основные закономерности химико-технологических процессов, типы
реакционных аппаратов. Подробно рассматривается технология неорганических и ор-
ганических веществ, полимеров. Для каждого химического продукта приводятся
краткие сведения о его свойствах и народнохозяйственном значении, сырье, физико-
химические основы процесса, аппаратурное оформление, наиболее типичные техно-
логические схемы, перспективы развития производства.
Пособие предназначено для учащихся средних профессионально-технических
училищ я может быть использовано при подготовке рабочих на производстве.
ф 31401-422
052(01)—78
ББК 24
54
Изабелла Эммануиловна Фурмер
Владимир Николаевич Зайцев
ОБЩАЯ ХИМИЧЕСКАЯ
ТЕХНОЛОГИЯ
Редактор И. Ф. Гуревич. Художник В. П. Бабикова. Художественный редактор
Т. А. Дурасова. Технический редактор Т. А. Новикова. Корректор С. К. Марченко
ИБ № 1404
Изд. № ППМ-476 Сдано я набор 30.03.78. Подп. в печать 28.07.78. Т.-10184
Формат 60X9tf/lfc Бум. тип. № 2. Гарнитура литературная. Печать высокая. Объем
16,5 усл. печ. л. 17,32 уч.-изд. л. Тпраж 25 000 зкз. Зак. № 275. Цена 55 коп.
Издательство «Высшая школа»,
Москва, К-51, Неглннная ул., д. 29/14
Ярославский полиграфкомбинат Союзполиграфпрома при Государственном комитете
Совета Министров СССР по делам издательств, полиграфии и книжной торговли,
150014. Ярославль, ул. Свободы, 97.
© Издательство «Высшая школа», 1974
© Издательство «Высшая школа», 1978, с изменениями
ВВЕДЕНИЕ
«Широко распространяет химия руки свои в дела человеческие.
Куда ни посмотрим, везде обращаются перед очами нашими успехи
ее прилежания». Эти слова были сказаны нашим великим соотече-
ственником М. В. Ломоносовым более двухсот лет назад. В наше
время они справедливы еще больше, чем во времена М. В. Ломоно-
сова, так как именно в последние годы химия все глубже проникает
во все области промышленности, сельского хозяйства и быта.
В машиностроении значительное распространение получили
пластические массы, резины, лакокрасочные покрытия. Достижения
в области техники были бы невозможны без искусственных мате-
риалов, которые поставляет химическая промышленность. Химиче-
ские материалы внедрены в отрасль, которая была отгорожена ка-
менной стеной от синтетических материалов. Эта отрасль — строи-
тельство.
Велико значение химической продукции для интенсификации
сельского хозяйства. Удобрения дают растениям питательные эле-
менты, ядохимикаты защищают растения от вредителей и болезней.
Ткани, одежда, обувь, трикотажные изделия, искусственные ме-
ха, кожа, хозяйственные и культурно-бытовые товары, предметы
домашнего обихода — все это дает химическая промышленность.
Здравоохранение — один из потребителей химических продук-
тов: лекарств, витаминов, материалов для хирургии и т. д. — могу-
чих средств в борьбе за здоровье человека.
Внедрение химии в различные отрасли настолько широко и пло-
дотворно, что без роста химической промышленности не может бы-
стро развиваться современное хозяйство.
До Великой Октябрьской социалистической революции химиче-
ская промышленность нашей страны была отсталой. Большинство
химических продуктов ввозили из других стран. Мощная химиче-
ская промышленность была создана в Советском Союзе после Ве-
ликой Октябрьской социалистической революции. Ее развитию у
нас в стране придается большое значение, что отражено в Програм-
ме КПСС: «Одна из крупнейших задач — всемерное развитие хи-
мической промышленности, полное использование во всех отраслях
народного хозяйства достижений современной химии, в огромной
степени расширяющей возможности роста народного богатства, вы-
3
пуска новых, более совершенных и дешевых средств производства и
предметов народного потребления»
В постановлении ЦК КПСС от 31 января 1977 года «О 60-й го-
довщине Великой Октябрьской социалистической революции» ска-
зано, что социализм обеспечил невиданные в истории темпы прог-
ресса всех сторон жизни общества. «Социализм создал неограни-
ченные возможности для развития науки, поставил ее на службу
народу... Советская наука вышла на самые передовые рубежи по
ряду направлений математики и механики, квантовой электроники
и физики твердого тела, ядерной энергетики, химии и биологии...»1 2.
Национальный доход страны увеличился по сравнению с доре-
волюционным уровнем в 65 раз. «Ныне за два с половиной дня про-
мышленность производит столько же продукции, сколько ее про-
изводилось за весь 1913 год»3.
В постановлении подчеркиваются преимущества социалистиче-
ской плановой системы хозяйства: «В Советском Союзе произво-
дится больше, чем в любом другом государстве, чугуна, стали, неф-
ти, марганцевой и хромовой руды, угля, кокса, цемента... минераль-
ных удобрений и многих других видов продукции»4.
В соответствии с решениями партии и правительства химическая
промышленность развивается более быстрыми темпами, чем дру-
гие отрасли народного хозяйства. Так, в Основных направлениях
развития народного хозяйства СССР на 1976—1980 годы, принятых
на XXV съезде КПСС, предусмотрено увеличение производства про-
мышленной продукции за пятилетие на 35—39%. Производство
продукции химической и нефтехимической промышленности долж-
но быть увеличено на 60—65%. В 1980 г. предусмотрено довести
выпуск минеральных удобрений до 143 млн. т, увеличить выпуск
синтетических смол и пластических масс в 1,9—2,1 раза, синтетиче-
ского каучука в 1,4—1,6 раза, обеспечить производство 1450—
1500 тыс. т химических волокон 5.
Научной основой выполнения огромной программы ускоренного
развития советской химической промышленности является техноло-
гия— наука о методах и средствах массовой переработки сырья в
предметы потребления и средства производства.
Технология подразделяется на механическую и химическую.
Механическая технология изучает такие процессы пе-
реработки сырья, при которых, как правило, не изменяются состав
и внутреннее строение исходного вещества. Например, из древесины
изготавливают мебель, из металлов — машины и аппараты, из
хлопка, льна, шерсти — пряжу, а затем ткани.
Химическая технология предусматривает химическую
переработку сырья, при которой получаемые продукты по своему
1 Программа Коммунистической партии Советского Союза. М., Политиздат,
1971, с. 70.
2 О 60-й годовщине Великой Октябрьской социалистической революции. М.,
Политиздат, 1977. с. 8.
8 Там же, с. 6.
4 Там же, с. 7
5 Материалы XXV съезда КПСС. М., Политиздат, 1976, с. 175, 181, 182.
4
составу, строению и свойствам не похожи на исходные материалы.
Так, из природного газа в результате его химической переработки
получают пластические массы, синтетические каучуки, синтетиче-
ские волокна; из древесины — волокна, уксусную кислоту, метило-
вый спирт; из каменного угля — красители, фармацевтические пре-
параты и другие продукты.
Вместе с тем провести четкую границу между механической и
химической технологией в ряде случаев затруднительно, поскольку
изменение формы и внешнего вида материалов может иногда сопро-
вождаться химическими реакциями. И, наоборот, химическим про-
цессам, приводящим к изменению состава вещества, сопутствуют
процессы механические.
Современные химические предприятия представляют собой про-
мышленные комплексы, на которых осуществляются сложные про-
цессы. Для их обслуживания необходимы рабочие высокой квали-
фикации.
В настоящее время количество продуктов, производимых хими-
ческой и родственными отраслями промышленности, достигает де-
сятков тысяч, и ознакомить учащихся с производством каждого из
них не представляется возможным. Поэтому прежде всего необхо-
димо дать учащимся сведения о закономерностях, присущих хими-
ческим процессам, и об использовании этих закономерностей для
практической реализации этих процессов.
В связи с этим особое значение для подготовки кадров рабочих
приобретает курс общей химической технологии. В данном учеб-
ном пособии авторы излагают основы теории химических процессов
в доступной для учащихся профессионально-технических училищ
форме и показывают их применение на конкретных примерах про-
изводства важнейших химических продуктов.
Глава I
ТЕХНИКО-ЭКОНОМИЧЕСКИЕ ПОКАЗАТЕЛИ
ХИМИКО-ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ
Цель химической технологии — провести процесс как можно вы-
годнее, наиболее полно превратить исходное сырье в продукты ре-
акции, получить максимальное количество продукта из взятого
сырья, повысить выработку продукта в реакторе в единицу време-
ни, т. е. увеличить скорость переработки сырья. При этом старают-
ся получить продукт высокого качества и свести к минимуму все
виды затрат при его производстве.
Для анализа хода процесса и определения его эффективности
существуют технико-экономические показатели про-
цесса.
Чтобы охарактеризовать всякий процесс, прежде всего нужно
знать, как полно используется сырье, насколько глубоко протекает
его химическое превращение. Это можно установить, если сопоста-
вить количество вещества, вступившего в реакцию, с исходным ко-
личеством его. Например, протекает простая необратимая реакция
типа
А----> В. (1,1)
Допустим, что Ga0 — исходное количество вещества А (в начале
процесса), a Ga— количество вещества А после проведения процес-
са. Необходимо установить, насколько полно прошло химическое
превращение вещества А. Для этого количество прореагировавше-
го вещества А, равное величине GA„ -Ga, относят к его первона-
чальному количеству GAo .Полученная величина дает долю вещест-
ва А, подвергшуюся химическому превращению. Ее обозначают че-
рез хА и называют степенью превращения:
, °*-°*
Л «л.
(1.2)
Таким образом, степень превращения — это отношение количе-
ства вещества, вступившего в реакцию, к его исходному количест-
ву. Чем больше степень превращения Ха, тем большая часть исход-
ного сырья вступила в реакцию, тем полнее прошел процесс хими-
ческого превращения.
6
(1,3)
Об эффективности проведения процесса судят также и по друго-
му показателю — выходу продукта. Выход продукта — отно-
шение количества полученного продукта к максимально возможно-
му. Для реакции А—>-В выход Фв равен:
ф = °в =
В Чанс °Л0
где Gb — количество вещества В, полученное практически по реак-
ции; Овыакс —максимальное количество вещества В, которое мож-
но получить в данном процессе.
Максимальное количество продукта, которое можно получить
из данного количества сырья, рассчитывается по уравнению реак-
ции с учетом содержания в сырье реагента, подлежащего превраще-
нию. Это можно показать на примере получения извести (окиси
кальция СаО) разложением углекислого кальция СаСОз, содержа-
щегося в известняке, по реакции
СаСО3 = СаО 4- СО2
Требуется определить, какое максимальное количество СаО
можно получить из 100 кг известняка, если в нем содержится 90%
СаСОз.
Сначала рассчитывают, сколько углекислого кальция содержит-
ся в 100 кг известняка:
100 • 90
--------- 90 кг.
100
Далее по уравнению реакции определяют, что из 90 кг СаСОз
можно получить СаО:
90 • 56 cn ,
-----— 50,4 кг,
100
где 100 и 56 — молекулярные массы СаСОз и СаО соответственно.
Таким образом, из 100 кг известняка можно максимально полу-
чить 50,4 кг СаО.
Для сложных реакций, когда с одним и тем же исходным веще-
ством могут происходить несколько химических превращений и по-
лучаться различные продукты реакции, оценивать ход процесса
только по степени превращения недостаточно. Степень превращения
может быть высокой, т. е. большая часть исходных продуктов всту-
пит в химическую реакцию, но не всегда это превращение приведет
к образованию нужных нам (целевых) продуктов. Наряду с целе-
выми может образовываться и ряд ненужных (побочных) продук-
тов. Чем больше образуется целевых и меньше побочных продук-
тов, тем эффективнее протекает процесс. Для характеристики та-
ких сложных процессов и установления доли целевых продуктов в
общем количестве полученных продуктов пользуются величиной
селективности.
7
Селективность — это отношение количества целевого продукта к
общему количеству полученных продуктов.
Так, если в процессе протекают параллельные реакции
Л -> В; А -> D (1,4)
и целевым является продукт В, а побочным — D, количество кото-
рых соответственно выражено через GB и GD, то селективность фв
равна
Так как общее количество полученных продуктов равно коли-
честву прореагировавшего вещества А:
а, + ^ = ал.-сл- ('.б)
селективность можно рассматривать как отношение количества по-
лученного целевого продукта В к количеству превращенного реа-
гента А:
Ниже приводится пример расчета степени превращения, выхо-
да и селективности для процесса, где протекает сложная реакция.
Пример. Для получения формальдегида НСНО проводят
окисление метилового спирта СНзОН на серебряном катализаторе:
СН3ОН + 0,5 О2 = НСНО + Н2О (1,8)
Кроме этой основной реакции протекает ряд побочных, в ре-
зультате которых образуются муравьиная кислота НСООН, окись
углерода СО, углекислый газ СО2, метан СН4 и другие продукты.
Предположим, на окисление подали 3,2 кмоль метилового спир-
та. Из них образовалось 1,8 кмоль формальдегида, 0,8 кмоль по-
бочных продуктов (суммарно) и остались неокисленными 0,6 кмоль
метилового спирта.
Необходимо найти степень превращения метилового спир-
та хсн он, выход формальдегида Фнсн0 и селективность процесса
по формальдегиду фнсно-
Решение. 1. Степень превращения. Для определения ко-
личества прореагировавшего спирта нужно от его начального ко-
личества G(CHjOH)o = 3,2 кмоль вычесть оставшееся после реакции
Gch.oh —0,6 кмоль. Тогда
_ G(ch3oh)„ — gch3oh _ 3,2 — 0,6 _
лсн3он — п — ГТ — u,oi.
и(СН30Н)« °’2
2. Выход формальдегида. Максимальное количество
формальдегида будет получено, если весь метиловый спирт превра-
тится в НСНО. Из реакции (I, 8) видно, что из одной молекулы
спирта образуется одна молекула формальдегида. Поэтому макси-
8
мально возможное количество формальдегида будет GHCHO
= 3,2 кмоль. Фактически же получено GHCHO = 1,8 кмоль. Тогда
Снсно
нсно ~ Онгно
НСНОмакс
1,8
3?2
= 0,56.
3. Селективность по формальдегиду. Общее коли-
чество полученных продуктов равно сумме количества формальде-
гида Ghcho =1,8 кмоль и побочных продуктов GnO6 = 0,8 кмоль.
Тогда
ф о = = __= 0,69.
^нсно Т" ^поб 1,8 +0,8
Помимо степени превращения, выхода и селективности для харак-
теристики процесса используют и ряд других величин.
Показателем, характеризующим эффективность работы машин,
аппаратов, цехов и заводов, служит производительность —
количество выработанного продукта или переработанного сырья в
единицу времени. Производительность может измеряться в кило-
граммах в час (кг/ч), в тоннах в сутки (т/сут) или в кубических
метрах в сутки (м3/сут). Максимально возможная производитель-
ность называется мощностью. Мощность измеряется в тех же
единицах, что и производительность.
Показателем работы аппарата или установок, в которых проте-
кают одни и те же химические процессы, служит так называемая
интенсивность. Интенсивность — это производительность, от-
несенная к какой-либо величине, характеризующей размеры аппа-
рата (к объему его или сечению). Интенсивность может измеряться,
например, количеством килограммов продукта, получаемого в тече-
ние часа с единицы объема аппарата (кг/ч-м3), или количеством
тонн продукта, полученного в сутки с единицы сечения аппарата
(т/сут-м2).
Однако для полной характеристики процесса недостаточно при-
веденных выше показателей. Химико-технологический процесс счи-
тается совершенным, если он является и экономически эффектив-
ным. Оценку экономической эффективности производства проводят
по нескольким показателям, из которых наиболее важным являет-
ся себестоимость продукции.
Фабрично-заводская себестоимость — это затраты
предприятия в денежном выражении, непосредственно связанные
с производством продукта. Сумма затрат на изготовление продук-
та и затрат на его сбыт — это полная себестоимость про-
дукта.
Ниже показано, из^аких основных статей затрат складывается
фабрично-заводская себестоимость продукции.
1. Чтобы получить какой-нибудь продукт, необходимо иметь
сырье. Поэтому первой статьей затрат является стоимость
сырья и основных материалов, непосредственно участ-
вующих в химических процессах производства.
9
2. Чтобы сырье превратить в продукт, требуется определенное
количество энергии. Топливо и энергия для технологических
целей — вторая статья расходов, входящих в себестоимость про-
дукта.
3. Для осуществления химических превращений необходимы
место и аппаратура. На строительство промышленных зданий и со-
оружений, обеспечение их оборудованием (основных производствен-
ных фондов) тратятся определенные средства. В процессе эксплуа-
тации производственные фонды постепенно изнашиваются. Возме-
щение их износа осуществляется за счет постепенного переноса их
стоимости на производимый продукт в течение соответствующего
срока службы основных производственных фондов. Затраты на воз-
мещение износа этих фондов, называемые амортизационны-
ми отчислениями (амортизацией), — третья статья за-
трат на производство продукции.
4. В себестоимость продукта включается также заработная
плата основных производственных рабочих, т. е.
рабочих, непосредственно обслуживающих химические аппараты.
5. Следующей статьей затрат, входящих в себестоимость про-
дукта, являются цеховые расходы, т. е. затраты на содержа-
ние и текущий ремонт основных производственных фондов (в том
числе заработная плата вспомогательных и ремонтных рабочих, а
также заработная плата административно-хозяйственного персона-
ла цеха, расходы на охрану труда и технику безопасности).
6. Общезаводские расходы — затраты, связанные с ре-
монтом общезаводских зданий и с управлением заводом.
Из себестоимости основного продукта обычно вычитается стои-
мость побочных продуктов, получаемых из того же сырья. Соотно-
шение затрат по статьям себестоимости различно для отдельных хи-
мических производств. Однако в большинстве случаев основные за-
траты приходятся на сырье — по химической промышленности они
составляют в среднем 60—70%, на топливо и энергию приходится
около 10%. Заработная плата в себестоимости химической продук-
ции составляет около 4%, а амортизация — 3—4%.
Из приведенных данных следует, что себестоимость продукции
химической промышленности прежде всего зависит от стоимости и
полноты использования сырья и от стоимости и расхода топлива и
энергии. Следовательно, экономное использование сырья, топлива
и энергии — основное условие снижения себестоимости продукции.
Количество сырья и энергии, затраченное на производство еди-
ницы получаемой продукции, называют расходными коэффи-
циентами и выражают соответственно для сырья в тоннах на
тонну (т/т), кубических метрах на тонну (м3/т), для энергии — в ки-
ловатт-часах на тонну (кВт-ч/т) и т. п.
Например, известно, что для производства 5 т серной кислоты
расходуется 4,5 т сырья (серного колчедана). Тогда расходный ко-
эффициент по сырью будет равен 4,5: 5=0,9 т серного колчедана
на 1 т серной кислоты.
10
Контрольные вопросы
1. Какие основные технико-экономические показатели используют для опре-
деления эффективности проведения технологического процесса?
2. Какой величиной характеризуют полноту превращения исходных веществ?
3. Достаточно ли при проведении сложной реакции знать степень превраще-
ния исходного реагента, чтобы судить об эффективности прохождения процесса?
4. Из каких основных статей складывается себестоимость продукции хими-
ческой промышленности?
Глава П
СЫРЬЕ И ЭНЕРГЕТИКА ХИМИЧЕСКОЙ ПРОМЫШЛЕННОСТИ
§ 1. Сырье химической промышленности
Сырьем называют природные материалы, используемые в
производстве промышленных продуктов. Полупродукты — это
материалы, которые получены в результате промышленной перера-
ботки сырья на данном предприятии и используются в качестве ис-
ходных материалов для производства какого-либо продукта. О т-
ходами называются побочные продукты, которые не находят при-
менения на данном производстве, но могут служить сырьем при
производстве некоторых химических продуктов.
Сырье — неотъемлемый элемент любого химико-технологическо-
го процесса, во многом определяющий его технику и экономику.
Окружающая нас природа служит неисчерпаемой кладовой, из
которой химическая промышленность получает сырье. По мере раз-
вития науки и техники все новые и новые полезные ископаемые ис-
пользуются для производства химических продуктов, появляются
новые виды сырья, расширяется сырьевая база промышленности.
На химических заводах перерабатывают самое разнообразное
сырье. Химия использует кристаллы поваренной соли при получе-
нии искусственной кожи и трикотажного белья, фармацевтических
препаратов и электроизоляционных материалов. Из угля химики
производят детали сложнейших машин, красители, предметы широ-
кого потребления. Эластичный каучук, твердые пластические мас-
сы, прочное и красивое волокно, удобрения, лаки, растворители, ле-
карства, моющие средства —- таков далеко не полный перечень про-
дуктов, получаемых из нефти и природных газов. С Кольского
полуострова на химические заводы для производства удобрений
привозят светло-серый камень — апатитовую руду, названную «кам-
нем плодородия». Из этой руды кроме удобрений получают соду,
алюминий для авиационной промышленности, цемент для строи-
тельства. Песок в руках химиков превращается в стекло, цемент,
смазки и пленки, выдерживающие высокую температуру, а воз-
дух— в удобрения, трикотажные изделия, красители.
Виды сырья. Трудно перечислить все исходные материалы, ко-
торые перерабатываются на химических предприятиях. Однако, не-
смотря на широкое разнообразие, сырье химической промышлен-
ности можно классифицировать по происхождению на мине-
ральное, растительное и животное, по агрегатному состоя*
11
нию — на твердое, жидкое и газообразное, по составу — на не-
органическое и органическое.
Минеральное сырье — это добываемые из земных недр полез-
ные ископаемые, которые при данном уровне техники могут быть
экономически эффективно использованы в народном хозяйстве.
Обычно минеральное сырье делят на три вида: рудное, нерудное и
горючее.
Рудным минеральным сырьем называют горные поро-
ды, из которых могут быть экономически выгодно получены метал-
лы. При переработке некоторых видов рудного сырья наряду с ме-
таллами производят и химические продукты. Например, одновре-
менно с медью, цинком, никелем производят серную кислоту.
Нерудное минеральное сырье — это горные породы,
используемые в производстве химических, строительных и других
неметаллических материалов и не являющиеся источником получе-
ния металлов. Сюда относится сырье, содержащее серу, фосфори-
ты, апатиты, калийные соли, поваренная соль, песок, гравий, глины
и т. д. Эти виды сырья служат источником получения разнообраз-
ных химических продуктов. Некоторые примеры использования не-
рудного сырья приведены на схемах 1 и 2.
Схема 1. Использование поваренной соли
покрытия
Схема 2. Использование сырья, содержащего серу
12
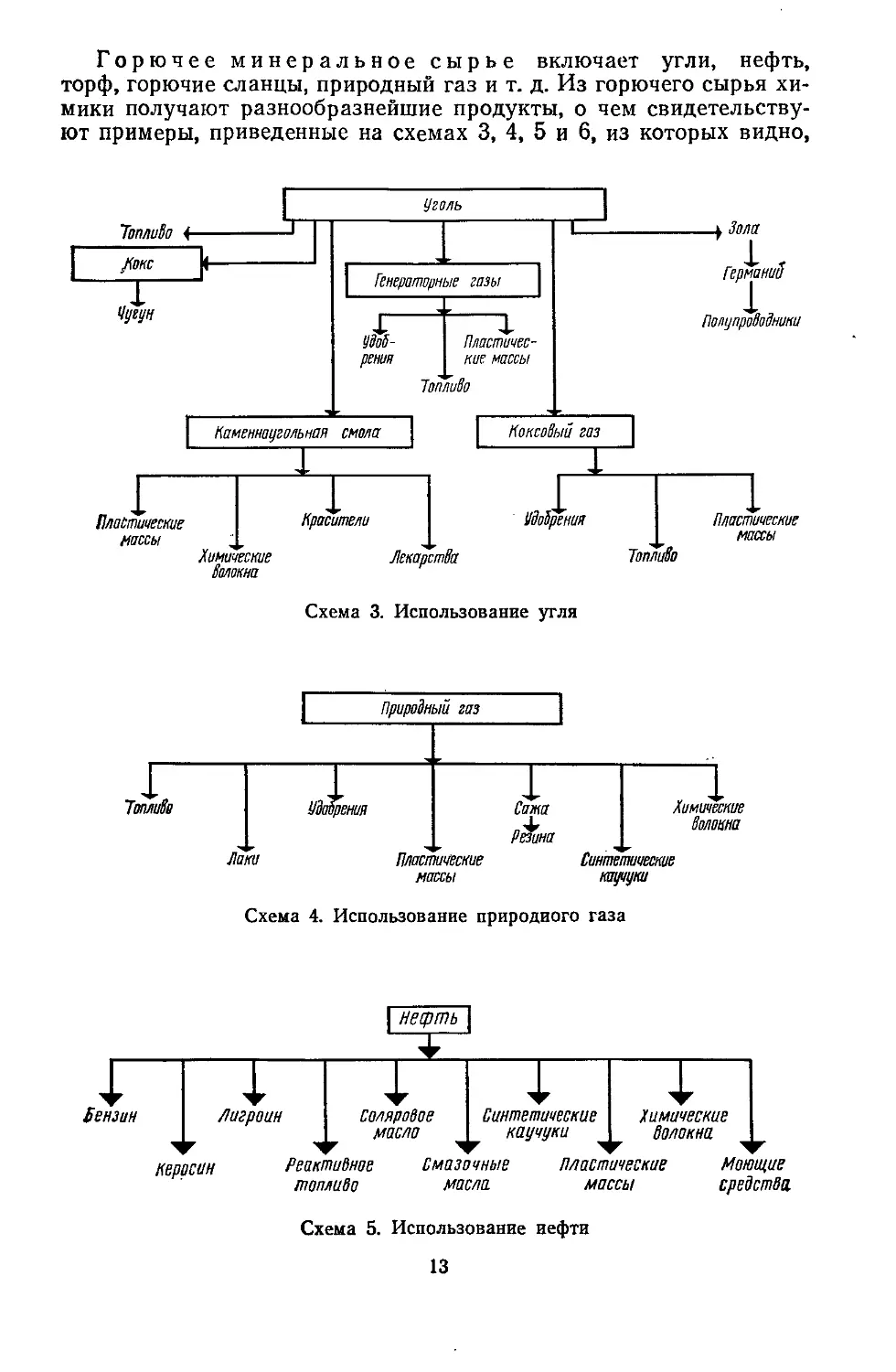
Горючее минеральное сырье включает угли, нефть,
торф, горючие сланцы, природный газ и т. д. Из горючего сырья хи-
мики получают разнообразнейшие продукты, о чем свидетельству-
ют примеры, приведенные на схемах 3, 4, 5 и 6, из которых видно,
Схема 3. Использование угля
Природный газ
7тЛ
Лаки
Удобрения
Пластические
массы
Сажа
Резина
Химические
волокна
Синтетические
каучуки
Схема 4. Использование природного газа
Пензин
Лигроин
керосин
| нефть |
соляровое Синтетические Химические
масло каучуки волокна
Реактивное Смазочные пластические Моющие
топливо масла массы средства.
Схема 5. Использование нефти
13
Древесина
Схема 6. Использование древесины
что нефть, уголь, газы для химиков — это не только источники по-
лучения тепла, но и источники огромных материальных ценностей.
Каменный и другие угли дают нам красители,' лекарственные
препараты, красивые и изящные изделия из химических волокон,
разнообразные изделия из пластических масс, полупроводниковые
материалы для транзисторных радиоприемников, телевизоров,
удобрения. В качестве сырья широко используются угли Донбасса,
Кузбасса, Караганды, Подмосковья.
Одно из самых ценных веществ, которым одарила нас приро-
да,— это нефть. Трудно сейчас представить себе нашу жизнь без
самолетов, автомобилей, тракторов, комбайнов, топливо для кото-
рых получают из нефти. Нефть — это еще и сырье для получения
волокон, синтетических каучуков, пластических масс, моющих
средств. Не напрасно нефть называют «черным золотом», ее запасы
расположены на Кавказе, в Башкирии, Татарии. В последнее вре-
мя открыты нефтяные месторождения в Сибири.
На тысячи километров протянулись по Советскому Союзу газо-
проводы, по которым со Средней Волги, Украины, Бухары, Север-
ного Кавказа на химические предприятия поступает для переработ-
ки природный газ. Из газа получают удобрения, пластические мас-
сы, лаки, химические волокна и т. д.
В различных районах Советского Союза добывают минеральное
сырье. Трудами советских ученых В. И. Вернадского, Н. С. Курна-
кова, А. Е. Ферсмана, И. М. Губкина и других разработаны основы
разведки, добычи и переработки различных видов сырья. С имена-
ми этих ученых связаны разведка и разработка месторождений
апатитов на Кольском полуострове, калийных солей на Урале в
районе Соликамска, нефтей Баку, Грозного, Башкирии.
В настоящее время Советский Союз занимает первое место в
мире по разведанным запасам фосфоритов, апатитов, ка-
лийных солей, поваренной соли и других видов сырья. Эти запасы
14
непрерывно возрастают благодаря плодотворной работе советских
геологов, продолжающих славные традиции своих учителей.
Растительное сырье и животное сырье по своему назначению де-
лится на пищевое и техническое. К пищевому сырью относят-
ся продукты сельского, лесного и рыбного хозяйства, которые ис-
пользуются для пищевых целей (картофель, сахарная свекла,
хлебные злаки, пищевые жиры и т. п.). Химическая и другие отрас-
ли промышленности используют техническое раститель-
ное и животное сырье, которое непригодно для пищевых
целей и может быть переработано в продукты или материалы бы-
тового или промышленного потребления. К этому виду сырья отно-
сятся хлопок, древесина, солома, лен, конопля, кожа, шерсть, пуш-
нина, китовый и тресковый жир, кости животных и т. д. Примером
использования растительного сырья является древесина (см. схе-
му 6).
Сырьем для химической промышленности, кроме минерального,
растительного и животного, служат воздух и вода.
Воздух — сырье практически неисчерпаемое. Больше всего в воз-
духе азота — около 78%, кислорода — около 21%, остальное со-
ставляют так называемые благородные газы — аргон, неон, крип-
тон, ксенон и гелий. Все составные части воздуха нашли примене-
ние в народном хозяйстве. Как видно из схемы 7, из воздуха
получают самые различные продукты и материалы — от лекарств,
выпускаемых в количествах, исчисляемых граммами и килограмма-
ми, до миллионов тонн удобрений.
Схема 7. Использование аоздуха
Вода не только служит источником непосредственного получе-
ния водорода и кислорода, но и участвует в целом ряде химических
процессов, вступая в различные химические реакции. Так, ее ис-
пользуют для производства серной, азотной и других кислот, щело-
15
чей и т. п. В ряде случаев воду применяют для растворения твер-
дых, жидких и газообразных веществ. На химических предприяти-
ях вода служит также для нагревания и охлаждения реагирующих
веществ.
Потребление воды химическим предприятием огромно и на
больших комбинатах измеряется миллионами кубометров в
сутки.
Использование сырья. Химическое сырье весьма разнообразно,
и запасы его велики. Вместе с тем распространение отдельных эле-
ментов в земной коре чрезвычайно неравномерно. Около половины
веса земной коры составляет кислород и 26% —кремний. Далее по
степени распространенности следуют алюминий (7,45%) и железо
(4,2%). Девять элементов — кислород, кремний, алюминий, желе-
зо, кальций, натрий, магний, калий и водород — составляют око-
ло 98% веса земной коры, а все остальные элементы — лишь 1,9%.
Такой важнейший для жизни элемент, как углерод, составляет
лишь 0,35% веса земной коры, а 76 элементов, включая широко
применяемые свинец, ртуть и мышьяк, — 0,06%. Из этого следует,
что наши обычные представления о распространенности отдельных
элементов не соответствуют действительности.
Химическая промышленность Советского Союза в настоящее
время использует более 80 элементов. Как видно из предыдущего,
запасы отдельных элементов невелики, и поэтому несоответствие
между запасами и потреблением некоторых элементов выдвигает
проблему бережного и рационального использования сырья. В со-
циалистической промышленности сырьевые ресурсы расходуются
бережно и планомерно. Мы ставим перед собой следующие основ-
ные задачи в области экономного использования сырья: изыскание
и применение дешевого сырья, комплексное использование сырья,
регенерация сырья, использование отходов, применение концентри-
рованного сырья, замена пищевого сырья непищевым.
Изыскание и применение дешевого сырья. Преж-
де всего необходимо стремиться использовать местное сырье, т. е.
то, которое находится у места его потребления и не требует даль-
них перевозок. В ряде случаев в качестве исходного сырья для про-
изводства одного из продуктов используют отходы производства
какого-то другого продукта.
Применение легко добываемого и дешевого сырья является по-
казателем экономической эффективности технологического процес-
са. Например, долгое время считали, что основным видом топлива и
сырья для химической промышленности Советского Союза является
уголь. Однако транспортировка нефти и газов по трубопроводам
удобнее и дешевле, чем перевозка угля по железной дороге. Нефть
и газы сгорают без остатка, в то время как после сжигания угля ос-
таются горы золы (шлака), да и тепла при горении нефти и газов
выделяется больше, чем при горении угля. Однако это не означает,
что в химической переработке уголь вытесняется нефтью и газом.
Вопрос о применении того или иного вида топлива для произ-
водства химических продуктов следует решать применительно к от-
16
дельным районам страны. Несомненно, что в районах, богатых
нефтью и газом, они должны служить основным химическим сырь-
ем; там же, где имеются дешевые угли, например в некоторых райо-
нах Сибири, следует максимально использовать уголь.
По мере развития техники понятие «сырье» изменяется — рас-
ширяются возможности использования отходов и полупродуктов
производства и нередко вчерашние отходы становятся сегодня цен-
ным промышленным сырьем.
Комплексное использование сырья. Эта задача оз-
начает использование всех основных частей сырья для производст-
ва различных продуктов или материалов. При комплексном исполь-
зовании сырья нет отходов производства — все, что содержится в
сырье, используется. Примерами комплексного использования
сырья могут служить переработка нефти, угля, природного газа, по-
варенной соли, серосодержащих руд, фосфоритов и апатитов, дре-
весины (см. схемы 1—7). Примеры, приведенные на этих схемах,
не исчерпывают возможностей комплексной переработки сырья,
они лишь показывают, что из одного вида сырья можно получить
большое количество продуктов, и это, несомненно, приводит к их
удешевлению.
Комплексное использование сырья имеет большое значение еще
и потому, что дает возможность сократить расход сырья. Так, про-
изводство удобрений из природного газа позволяет одновременно
кбез дополнительных затрат сырья получать каучук, уксусную
.кислоту, пластические массы, химические волокна и другие про-
дукты.
Комплексная переработка сырья благодаря большой экономиче-
ской целесообразности имеет огромное народнохозяйственное зна-
чение и приобретает все более широкое распространение в нашей
социалистической промышленности.
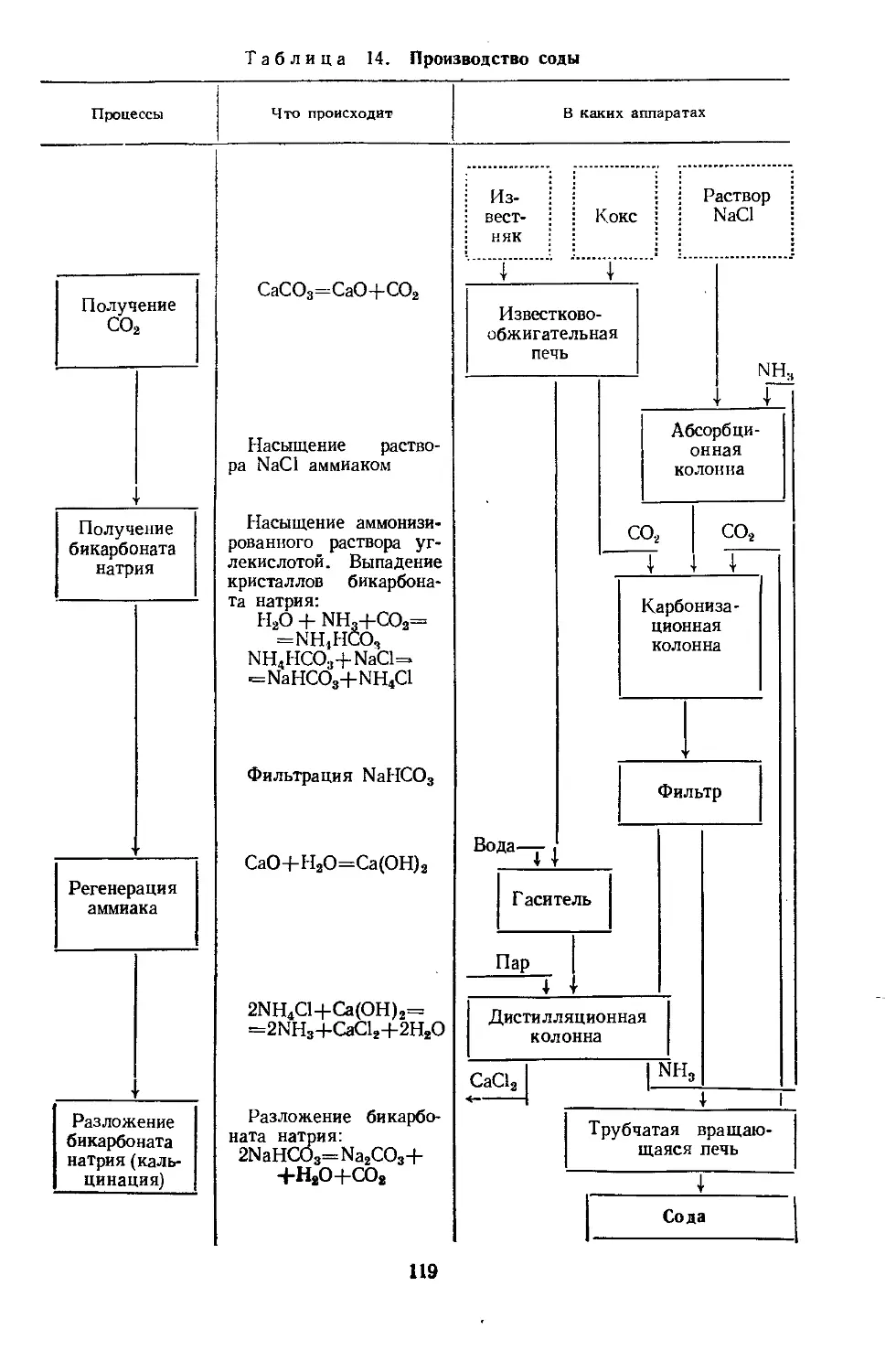
Регенерация сырья. Перевод прореагировавших веществ
в их первоначальное состояние для повторного использования на-
зывается регенерацией сырья. Например, при взаимодействии раст-
вора поваренной соли с аммиаком и двуокисью углерода образуют-
ся осадок бикарбоната натрия NaHCOs, применяемый затем для
производства соды, и раствор хлористого аммония NH4C1 — реак-
ция (II, 1). Если этот раствор обработать при нагревании известко-
вым молоком по реакции (II, 2), то выделится аммиак, который
повторно используют для проведения реакции (II, 1):
।
NaCl + СО2 + NH3 + Н2О = NaHCO3 + NH4C1
I .
(П.1)
2 NH4C1 + Ca (OH)2 = CaCl2 + NH3 + H2O (11,2)
Реакция (II, 2) описывает процесс рф'Ий№ацшг^ммиа1ки. was
1 яЙйиея я/о
17 | венав-твхвячявяаа v
|. ЕИБЛИаГНКА '
Использование отходов. Несмотря на широкое раз-
витие комплексной переработки сырья, до настоящего времени на
некоторых химических производствах остается значительное коли-
чество отходов, не находящих потребления. Они выводятся с пред-
приятия и, как правило, отравляют водоемы, заражают почву и
воздух, загромождают заводские и расположенные вблизи заводов
территории. Например, на содовых заводах вырабатывается боль-
шое количество жидких отходов, содержащих растворенные соли
(в частности, СаСЬ) и твердые частицы. Около содовых заводов,
в котлованах, куда спускают эти растворы, образуются так назы-
ваемые «белые моря», которые загрязняют территорию, а находя-
щиеся в них растворы впитываются в окружающую почву и дела-
ют ее неплодородной.
В Советском Союзе установлены нормы допустимого содержа-
ния веществ в отходящих промышленных газах и сточных водах.
Для обезвреживания отходов химических предприятий строят спе-
циальные очистные сооружения. Задача химиков заключается не
только в обезвреживании отходов, но и в использовании заключен-
ных в них ценных веществ. Так, некоторые отходы могут быть ис-
пользованы в качестве удобрений. Колчеданный огарок — отход
сернокислотного производства, внесенный в почву, значительно
увеличивает урожай ячменя. В качестве удобрений применяют
шлаки, получаемые при производстве стали, шлаки медеплавиль-
ных заводов, пыль цементных заводов и т. д.
Применение концентрированного сырья. Следует
стремиться применять сырье, в котором велико содержание (кон-
центрация) тех или иных веществ. Использование такого сырья
удешевляет и упрощает его переработку, а также позволяет полу-
чать продукты высокого качества. К сожалению, потребляемое в
химической промышленности сырье не всегда является концентри-
рованным, и поэтому, прежде чем оно подвергнется переработке,
его «обогащают» на обогатительных фабриках или же в течение са-
мого процесса получения из него продуктов.
Замена пищевого сырья непищевым. До недавне-
го времени многие химические продукты и материалы вырабатыва-
ли из пищевого сырья, на что расходовались миллионы тонн зерна,
картофеля, растительного масла, животных жиров. Например, для
производства синтетического каучука необходим этиловый спирт,
для получения 1 т которого нужно переработать около 10—11 т кар-
тофеля или 4 т зерна.
Приведенный пример показывает, что химическая промышлен-
ность отнимает огромные количества пищевых продуктов. В связи
с этим понятно, как важна и необходима замена в химической и
других отраслях промышленности пищевых продуктов непищевы-
ми. Стоимость продуктов, полученных из непищевого сырья, ниже,
чем продуктов из пищевого сырья. В производстве каучуков, кра-
сителей, лаков, лекарственных веществ, многих пластических масс
и ряда других материалов растительное и животное пищевое сырье
в основном уже вытеснено синтетическим.
18
Сейчас на очереди стоит задача получения из непищевого сырья
основных продуктов питания — крахмала и сахара, а также искус-
ственное получение составных частей источника жизни — белка.
§ 2. Подготовка сырья к переработке
Одним из важнейших приемов подготовки сырья к переработке
является его обогащение.
Обогащением называется обработка сырья с целью отде-
ления полезной его части от неполезной, так называемой пустой по-
роды, а при необходимости и для разделения отдельных веществ.
В результате обогащения вместо сырья, содержащего малые коли-
чества полезных веществ, получают концентрированное сырье.
Применение концентрированного сырья позволяет сделать более
совершенным процесс его переработки, так как с повышением кон-
центрации полезного компонента в сырье возрастает скорость его
химического превращения, упрощается переработка сырья, умень-
шается расход энергии. Кроме того, обогащая сырье на месте до-
бычи, получают экономию транспортных расходов на перевозку его
к месту потребления, потому что в обогащенном сырье содержится
значительно меньше ненужных (неиспользуемых) компонентов, чем
в необогащенном. И, наконец, обогащение позволяет перерабаты-
вать в промышленности бедные по содержанию полезного компо-
нента виды сырья, которые без предварительного концентрирования
не поддаются переработке. Это особенно важно, если учесть, что
запасы концентрированного сырья в природе постепенно истощают-
ся. Все это обусловило широкое применение обогащения сырья в
нашей стране и строительство обогатительных фабрик в местах до-
бычи сырья.
Обогащению подвергают твердые материалы — разнообразные
горные породы, жидкие материалы — растворы, а также газы, при-
чем методы обогащения тех и других различны. Однако все они ос-
нованы на разнице физических, химических или физико-химических
свойств компонентов сырья.
Твердый материал (например, горная порода), обогащенный
полезной составной частью, называют концентратом, а отхо-
ды, содержащие пустую породу. — хвостами. Твердое мине-
ральное сырье, как правило, не представляет собой какой-либо ми-
нерал в чистом виде. Чаще всего в его состав входят различные
минералы.
Полезная составная часть сырья и пустая порода отличаются по
физическим, физико-химическим или химическим свойствам: плот-
ности, твердости, растворимости, смачиваемости отдельными жид-
костями, температуре плавления и т. д. Разницей в этих свойствах
и определяется разделение сложного минерального сырья на кон-
центрат и хвосты.
Если полезный минерал и пустая порода, входящие в состав
сырья, обладают различной прочностью (твердостью), т. е. различ-
19
ной способностью разрушаться (рассыпаться) при ударе, то сырье
предварительно измельчают. При этом менее прочные минералы,
входящие в состав сырья, дробятся на более мелкие зерна и крис-
таллы, чем более прочные минералы. Измельченное сырье просеива-
ют через сита (грохота) с различной величиной отверстий. Круп-
ные куски остаются на сите, мелкие проходят сквозь отверстия в
нем. В зависимости от числа сит и величины отверстий в них сырье
можно разделить на ряд частей (фракций). На каждом сите оста-
ются частицы определенной величины и, следовательно, различной
твердости. Поэтому с каждого сита получают фракцию, обогащен-
ную тем или иным минералом.
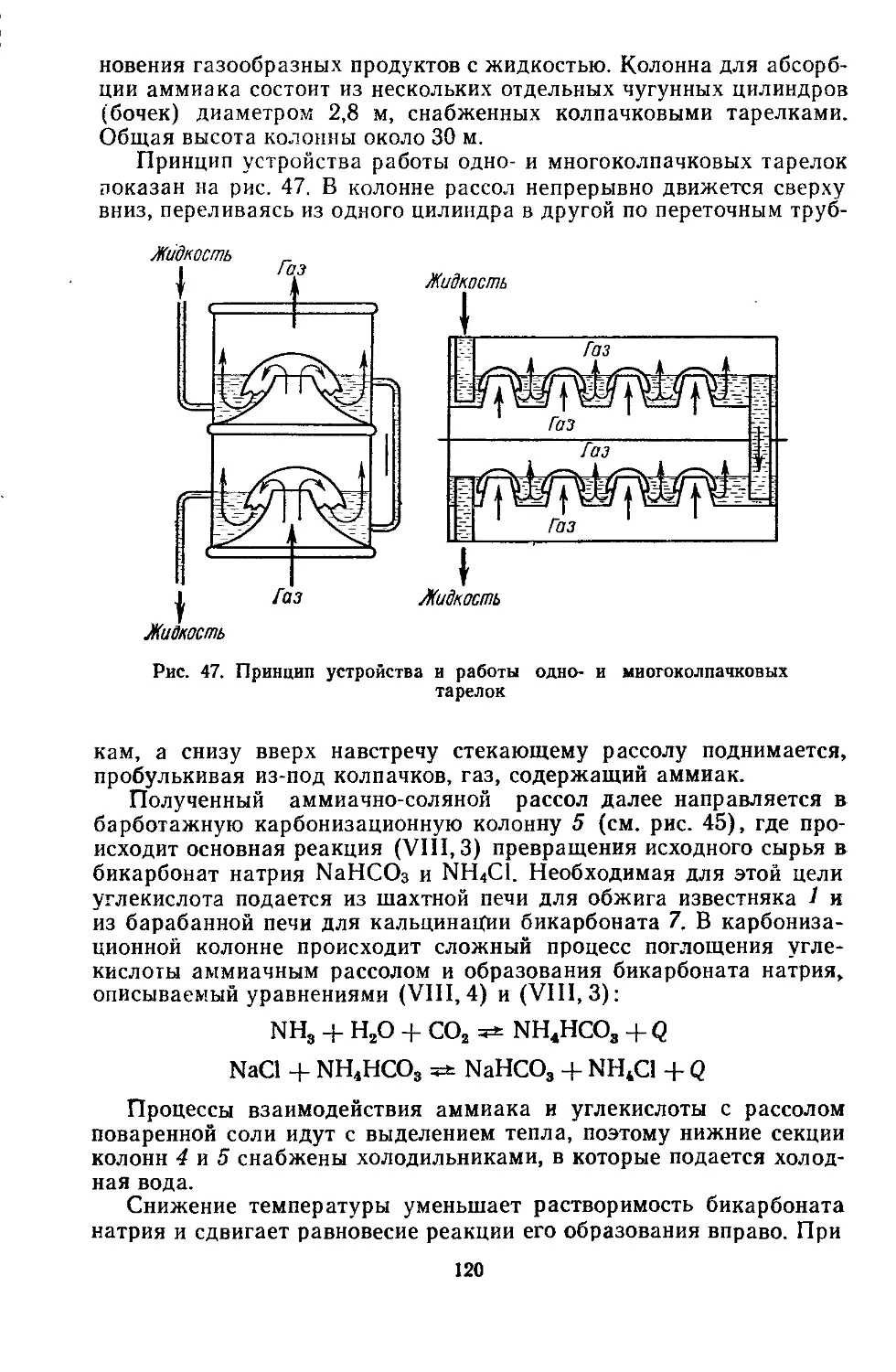
Рис. I. Принципиальная схема мокрого гравита-
ционного обогащении:
I, II, III — осадительные камеры; 1, 2, 3 — бункера
Для обогащения сырья пользуются разной скоростью падения
частиц в зависимости от их плотности и крупности в потоке жидкос-
ти или газа. На этом свойстве основан метод гравитацион-
ного обогащения. На рис. 1 показана схема мокрого гравита-
ционного обогащения, при котором осаждение твердых частиц про-
изводят в потоке жидкости (чаще всего воды). Измельченное сырье
в баке с мешалкой смешивается с водой и в виде пульпы (взвеси
твердого измельченного материала в жидкости) направляется в
осадительные камеры (корыта) /, //, III с конусообразными дни-
щами (бункерами), через которые проходит последовательно.
Для оседания наиболее крупных и тяжелых частиц требуется
наименьшее время, поэтому они оседают в камере /. Средняя фрак-
ция оседает в камере II и легкая (мелкозернистая) — в камере III.
Для разделения можно применять аппараты с одной, двумя, тре-
мя и большим числом камер, в зависимости от того, на сколько
фракций необходимо разделить материал. Фракции через отверстия
выводят из бункеров 1, 2 и 3.
Сухое гравитационное обогащение основано на том же принци-
пе, что и мокрое, но отличается от него тем, что твердые частицы
оседают не в потоке жидкости, а в потоке газа (чаще всего — воз-
20
духа). На рис. 2 показана схема аппарата для разделения воз-
душного сепаратора центробежного типа. Он представляет собой
цилиндр 5, снабженный конусом 6 (внешний цилиндр и конус).
В основном цилиндре концентрически расположен второй цилиндр 2
с конусом 1. Во внутренний цилиндр через крышку сепаратора вхо-
дят тарелка 3 и крыльчатка вентилятора 4, приводимые во враща-
тельное движение электродвигателем, расположенным над крыш-
кой сепаратора. При вращении тарелки и крыльчатки вентилятора
внутри сепаратора образуются воздушные потоки (показанные на
Измельченный
Рис. 2. Воздушный сепаратор
центробежного типа:
I — внутренний конус, 2 — внутрен-
ний цилиндр , 3— тарелка, 4 —
крыльчатка вентилятора, 5 —внеш-
ний цилиндр, 6 — внешний конус
Рис. 3. Электромагнитный сепаратор:
1 — транспортер, 2 — барабан, 3 — электро-
магнит, 4, 5 — бункера
схеме стрелками). Измельченный материал, поданный на тарелку,
при ее вращении разбрасывается по сечению внутреннего цилиндра.
Мелкие частицы увлекаются воздушным потоком, создаваемым
крыльчаткой вентилятора, и попадают в пространство между внеш-
ним и внутренним цилиндрами, где, ударяясь о стенки (теряя
скорость движения), опускаются вниз и выводятся из внешнего ко-
нуса 6 в виде тонко измельченной фракции. Крупные частицы пре-
одолевают сопротивление воздушного потока и падают вниз внут-
реннего конуса 1, откуда они выводятся.
Электромагнитное разделение (сепарацию)
применяют в тех случаях, когда сырье состоит из магнитовосприим-
чивых материалов (способных притягиваться к полюсу магнита) и
немагнитных (не притягивающихся к магниту). Таким образом
21
можно отделять магнитный железняк, хромистый железняк (маг-
нитные материалы) от пустой породы (немагнитной части сырья).
На рис. 3 показана принципиальная схема электромагнитного сепа-
ратора. Измельченный материал подается на ленточный транспор-
тер 1, который имеет барабан 2 с установленным внутри электро-
магнитом 3. Когда лента транспортера соприкасается с поверх-
ностью вращающегося барабана, частицы материала, не обладаю-
щие магнитной восприимчивостью, не притягиваются к магниту и
потому ссыпаются с ленты в бункер 4. Частицы же магнитного ма-
териала притягиваются магнитом и как бы прилипают к поверх-
ности ленты. Частицы продолжают двигаться таким образом до тех
пор, пока лента не пройдет область действия магнита. Лишь после
этого они отрываются от поверхности ленты и ссыпаются в бун-
кер 5.
Электростатической сепарацией разделяют мате-
риалы с различной электропроводностью. Обогащение осуществля-
ется так же, как и при электромагнитном способе. Разница заклю-
чается в том, что в электростатическом сепараторе барабан снаб-
жен вместо магнита отрицательно заряженным электродом. Части-
ны материалов, обладающие высокой электропроводностью, попа-
дая при движении ленты в поле действия отрицательного электро*
да, заряжаются одноименным отрицательным зарядом и потому от-
талкиваются от ленты и ссыпаются в бункер, поставленный на не-
котором расстоянии от барабана. Частицы, не обладающие элект-
ропроводностью (диэлектрики), не способны заряжаться от элект-
рода и потому не отталкиваются от ленты и ссыпаются в бункер,
расположенный ближе к барабану.
Электростатической сепарацией можно отделять, например, сер-
ный и медный колчедан, свинцовый блеск, золото, серебро (вещест-
ва с хорошей электропроводностью) от известняка, гипса, песка (не
проводящих ток).
Широко распространен флотационный метод обогаще-
ния сырья, основанный на различней смачиваемости жидкостью
(чаще всего водой) зерен отдельных минералов. Если поместить,
как показано на рис. 4, на поверхности жидкости тонко измельчен-
ные частицы несмачиваемого (гидрофобного) минерала А и смачи-
ваемого (гидрофильного) Б, то гидрофобная частица будет как бы
выталкиваться из жидкости, оставаясь окруженной воздушной
пленкой, а гидрофильная частица быстро обволакивается пленкой
жидкости. Поэтому, если предназначенное для флотации сырье
предварительно измельчить до пылевидного состояния, затем взму-
тить его в воде (создать пульпу или суспензию) и через получен-
ную суспензию пропустить в виде мелких пузырьков воздух, то
частицы минералов с несмачивающейся поверхностью будут прили-
пать к пузырькам воздуха и увлекаться ими к поверхности воды
(всплывать), образуя на поверхности пену.
Гидрофильные, смачивающиеся водой частицы в отличие от
гидрофобных легко обволакиваются жидкостью и потому не при-
липают к пузырькам воздуха, а остаются в жидкости во взвешен-
22
ном состоянии. С течением времени эти частицы оседают на дно
флотационного аппарата.
В производственных условиях суспензия тонко измельченной
горной породы (величина зерен не более 0,2 мм) подается во фло-
тационную машину. Применяют машины двух типов: с механиче-
ским перемешиванием пульпы при одновременной подаче воздуха
Рис. 4. Принцип разделения частиц
несмачиваемого и смачиваемого мате-
риалов:
А — несмачнваемый (гидрофобный) мине-
рал, 5 — смачиваемый (гидрофильный)
минерал
Воздух
Рис. 5. Флотационная машина с воздушным
перемешиванием:
1 — камера, 2— перегородки, 3— трубка, желоб,
5 — коллектор
и с воздушным перемеши-
ванием. На рис. 5 схема-
тически показан попереч-
ный разрез флотационной
машины с воздушным пе-
ремешиванием пульпы.
Внутри корытообразного
резервуара — камеры 1
имеются вертикально ус-
тановленные перегород-
ки 2, между которыми
расположены трубки 3.
По этим трубкам из кол-
лектора 5 под давлением
в камеру 1 подается воз-
дух. Воздух перемешивает
водную взвесь, и пузырь-
ки его увлекают за собой
частицы гидрофобного ми-
нерала, всплывающего на
поверхность жидкости.
Одновременно воздух соз-
дает циркуляцию суспен-
зии в камере (на рисунке
показано стрелками).
Для лучшего удержа-
ния на поверхности жид-
кости всплывших частиц
гидрофобного минерала в
суспензию добавляют не-
большое количество веще-
ства, образующего пену,—
пенообразов а тел я.
В качестве пенообразователей применяют сосновое масло, древес-
ный деготь, некоторые фракции каменноугольной смолы и др. Пе-
на, состоящая из пузырьков воздуха с прилипшими к ним частица-
ми минералов, с поверхности жидкости попадает через борт камеры
в желоб 4, откуда ее направляют в сосуды, где она разрушается
(пузырьки лопаются). На дне сосудов остаются увлеченные пузырь-
ками газа несмачивающиеся частицы. Полученный таким образом
осадок минеральной части, извлеченной из руды в концентрирован-
ном виде, называется флотационным концентратом.
Частицы гидрофильного минерала опускаются на дно камеры и
23
собираются там в виде осадка, который носит название флота-
ционных хвостов.
Природной флотируемостью, т. е. плохой смачиваемостью во-
дой, обладают сравнительно немногие природные минералы. К ним
относятся самородная сера, графит, озокерит и др. Большинство
минералов хорошо смачивается водой, и для их выделения флота-
цией в суспензию необходимо вводить специальные реагенты, пони-
жающие их смачиваемость. Эти реагенты получили название со-
бирателей или коллекторов. Собирателями являются
олеиновая кислота, нафтеновые кислоты и другие органические ве-
щества. Собиратели покрывают поверхность частиц гидрофильных
минералов гидрофобной пленкой, которая обеспечивает их всплы-
вание.
В некоторых случаях бывает необходимо затруднить всплыва-
ние отдельных минералов. Для этого в суспензию вводят вещества,
получившие название подавителей или депрессоров.
В качестве подавителей применяют щелочи, соли щелочных метал-
лов: цианистые, кремнекислые, сернокислые и др. С помощью этих
веществ повышают гидрофильность поверхности минералов и тем
самым затрудняют их всплывание.
Пенообразователи, коллекторы, депрессоры называются фло-
тационными реагентами.
Применение флотационных реагентов позволяет обогащать са-
мые разнообразные горные породы. Расход флотореагентов при
этом незначителен (100 г на 1 т породы). Флотация получила самое
широкое распространение как промышленный метод обогащения
сырья в крупных масштабах.
Термическое обогащение основано на различной плав-
кости материалов, входящих в смесь. Так, серу, имеющую низкую
температуру плавления (119°С) по сравнению с пустой породой
серной руды (т. пл. свыше 1000°С), выплавляют из руды в жидком
виде.
Химические способы обогащения весьма разнооб-
разны: избирательное растворение, разложение химическими реа-
гентами, обжиг и др.
Жидкости обогащают (концентрируют) следующими методами.'
выпариванием растворителя, добавлением к раствору полезного
компонента (донасыщение), выделением из раствора примесей в
осадок или переводом их в газообразное состояние (испарение при-
месей — десорбция).
Для обогащения газовых смесей также используют различие в
свойствах газов, входящих в смесь. Известно, что любой газ при
определенных условиях можно превратить в жидкость. Причем для
каждого газа существует определенная температура, при которой
он сжижается (температура конденсации, или, что то же самое, тем-
пература кипения). На различии температур конденсации газов ос-
нован метод последовательной (фракционной) кон-
денсации. Этим методом, например, разделяют коксовый газ,
состоящий из водорода, азота, окиси углерода СО, метана СН«,
24
этилена С2Н4. Все эти газы превращаются в жидкость при разных
температурах, т. е. они обладают различной температурой конден-
сации (°C):
Этилен .......—103 Азот < ...........—195,7
Метан.........ниже—161 Водород .........—252,6
Окись углерода . . —191,7
Сначала газ охлаждают до температуры более низкой, чем темпе-
ратура конденсации этилена, но более высокой, чем температура
конденсации метана. При этом из всех газов только этилен превра-
щается в жидкость, остальные компоненты остаются в газообраз-
ном состоянии. Жидкий этилен отделяют, а оставшуюся газовую
смесь охлаждают теперь уже до температуры, меньшей температуры
конденсации метана, но большей температуры конденсации окиси
углерода. Метан при этом переходит в жидкость и выделяется из
смеси. С оставшейся газовой смесью поступают аналогичным обра-
зом. Так, постепенно охлаждая смесь, можно разделить ее на от-
дельные газы.
На разности температур кипения различных веществ основан и
другой способ обогащения газов и жидкостей — ректификация.
Этим методом разделяют воздух на азот и кислород. Воздух состо-
ит в основном из кислорода (20,95%) и азота (78,09%). Жидкий
кислород кипит при температуре минус 182,95°С, а жидкий азот —
при более низкой температуре — минус 195,8°С.
Для разделения воздуха, т. е. для получения чистых кислорода
и азота, воздух предварительно охлаждают и переводят в жидкое
состояние. Затем эту жидкую смесь частично испаряют. Так как
азот кипит при более низкой температуре, чем кислород, то он ис-
паряется легче, и в парах над жидкостью его будет больше, чем в
жидкости. Пары над жидкостью обогащаются азотом, а жидкость
обедняется им и, следовательно, обогащается кислородом. Если от-
делить пары от жидкости, то произойдет частичное разделение воз-
духа, так как в парах больше азота, а в жидкости больше кислоро-
да, чем в воздухе. Многократно повторяя описанную операцию,
можно добиться практически полного разделения воздуха на азот
и кислород.
В основе ректификации и лежит именно такое многократное час-
тичное испарение жидкости в сочетании с конденсацией пара. (Бо-
лее детально процессы ректификации рассмотрены в главах, по-
священных отдельным производствам.)
На способности жидких растворителей избирательно поглощать
тот или иной газ из газовой смеси основан абсорбционный метод
разделения газовых смесей. Газовую смесь пропускают через жид-
кий растворитель (абсорбент). Растворитель подбирают так, чтобы
в нем растворялся только тот газ, который хотят выделить. Затем
растворитель с поглощенным газом направляют на следующую опе-
рацию (десорбцию), где из растворителя выделяют поглощенный
газ в концентрированном виде.
Для поглощения смесей можно применять не только жидкий, но
25
и твердый материал, поглощающий отдельные газы из смеси. Такой
процесс называют адсорбцией. Адсорбированные (поглощен-
ные) газы десорбируют (удаляют) с поверхности адсорбента (твер-
дого материала).
Абсорбционно-деборбционные и адсорбционно-десорбционные
методы разделения жидких и газовых смесей очень широко приме-
няют в химической промышленности.
§ 3. Вода в химической промышленности
Вода в химической промышленности имеет исключительно ши-
рокое и разнообразное применение. В ряде производств она служит
сырьем и реагентом (получение серной кислоты H2SO4, азотной кис-
лоты HNO3, соды №2СОз, едкого натра NaOH и едкого кали КОН,
водорода; процессы гидролиза и гидратации).
Во многих производствах воду используют как растворитель
твердых, жидких и газообразных веществ, для получения водных
взвесей твердых веществ — суспензий, пульпы (например, при гра-
витационном и флотационном обогащении). Вода необходима для
промывки твердых и газообразных материалов от загрязнений.
Широко используют воду и как теплоноситель — для охлажде-
ния и нагревания тел или веществ, участвующих в реакции. Для ох-
лаждения и нагревания водой и паром реагирующих масс применя-
ют разнообразные холодильники и нагреватели.
Основным источником, удовлетворяющим технические и быто-
вые потребности в воде, являются природные воды. Природ-
ные воды подразделяются на атмосферные — воды атмосферных
осадков; поверхностные — воды рек, озер и морей; подземные — ко-
лодезные, ключевые, артезианские, минеральные.
В природных водах содержатся взвешенные грубодисперсные и
коллоидные частицы органического и неорганического происхожде-
ния (песок, глина и т. п.). В ней растворены газы и соли — бикарбо-
наты, сульфаты, хлориды, нитраты кальция, магния, калия. В во-
де могут находиться различные бактерии, грибки и другие микро-
организмы.
Присутствие в воде грубодисперсных частичек, газов, солей, ор-
ганических веществ и микроорганизмов может вредно влиять на от-
дельные реакции, вызывать коррозию аппаратуры, способствовать
образованию накипей, стать причиной засорения трубопроводов и
аппаратов, вспенивания воды в котлах и аппаратах, ухудшения про-
цессов флотации и т. п. Поэтому к воде, употребляемой и в техни-
ке и в быту, предъявляются определенные требования в отношении
содержания механических примесей, растворенных солей, газов.
Характеристика воды. Качество воды определяется ее физиче-
скими и химическими характеристиками. Основные показатели ка-
чества воды: жесткость, общее солесодержание, окисляемость, про-
зрачность, цвет, запах, реакция.
Жесткость — это свойство воды, обусловленное присутстви-
26
ем в ней растворимых солей кальция и магния. Различают жест-
кость временную и постоянную.
Временная жесткость вызвана присутствием в воде растворимых
кислых углекислых солей кальция и магния Са(НСОз)г и
М§(НСОз)г — бикарбонатов. При кипячении воды соли эти разла-
гаются, из раствора выпадает осадок — СаСОз (карбонат кальция):
Са (НСО3)2 = СаСОз + Н2О + СО2 (11,3)
Постоянная жесткость определяется присутствием хлористых и
сернокислых солей кальция и магния. При кипячении воды эти со-
ли не удаляются.
Жесткая вода создает большие трудности в работе. При кипяче-
нии жесткой воды из углекислых солей кальция и магния образует-
ся нерастворимый осадок карбонатов кальция или основной соли
магния. Осадок этот отлагается на внутренней поверхности труб
паровых котлов в виде накипи. Накипь ухудшает передачу тепла
через стенки труб, происходит их перегрев и преждевременный из-
нос. Поэтому соли, вызывающие жесткость, должны быть удалены
из воды.
Общее солесодержание характеризует наличие в воде
минеральных и органических примесей.
Окисляемость — это свойство воды, обусловленное присут-
ствием в ней органических веществ. От их содержания зависит при-
годность воды для питья, возможность длительного хранения и при-
менения для технических целей. J
Прозрачность воды измеряется толщиной слоя воды, че-
рез который можно различить визуально или при помощи фотоэле-
мента изображение креста или определенного шрифта.
Реакция воды — это ее кислотность или щелочность, обычно
характеризуемая величиной pH. pH — отрицательный десятичный
логарифм концентрации ионов водорода [Н+] в растворе, который
может принимать значения от 1 до 14. Для нейтрального раствора
значение pH составляет 7, с повышением кислотности раствора оно
уменьшается, с увеличением щелочности — возрастает.
Воды в зависимости от назначения условно подразделяют на
промышленные и питьевые.
Питьевые воды должны быть в первую очередь освобожде-
ны от бактерий: к ним предъявляются особые требования в отно-
шении вкуса, цвета, запаха.
Промышленные воды не должны содержать большого ко-
личества растворенных солей. Максимально допустимая концентра-
ция растворенных солей устанавливается соответствующим
ГОСТом в зависимости от производства, на котором используется
вода. Например, для воды, применяемой в производстве синтетиче-
ских волокон, установлены следующие нормы: содержание взве-
шенных частиц не более 20—40 мг на 1 л, общее количество со-
лей— не более 1,0—1,5 мг/л. Вода для паровых котлов должна
быть свободна также от углекислого газа и кислорода, вызывающих
коррозию труб.
27
Водоподготовка. В зависимости от требований проводится про-
цесс водоподготовки, состоящий из нескольких операций. Важней-
шие из них: очистка от взвешенных примесей, умягчение (устране-
ние жесткости), обессоливание, дегазация (удаление растворенных
газов) и обезвреживание (удаление органических примесей и мик-
роорганизмов) .
От взвешенных примесей воду очищают отстаиванием
или фильтрацией — обычно через слой песка и гравия. Примеси
органических веществ находятся в воде в виде чрезвычайно мелких
трудноудаляемых частичек, образующих устойчивые системы, на-
зываемые коллоидными. Для удаления из коллоидных систем
частичек к ним добавляют специальные вещества — ко а гуля н-
т ы. Они способствуют слипанию мелких частиц в более или менее
крупные. Образуются хлопья, которые выпадают в осадок. Для
осаждения органических примесей из воды в качестве коагулянта
применяют сернокислый алюминий. Выпавший осадок затем от-
фильтровывают, при этом удаляется и часть бактерий, содержа-
щихся в воде.
Умягчение воды — один из важнейших процессов водопод-
готовки. Различают физические, химические и физико-химические
способы умягчения воды. К физическим способам относит-
ся кипячение воды, при котором удаляются соли временной жест-
кости. При химическом способе понижения жесткости воды
добиваются тем, что переводят растворимые соли кальция и маг-
ния в нерастворимые, превращающиеся в осадок, который затем
отфильтровывают. Для перевода солей кальция и магния в осадок
в воду добавляют различные химические реагенты. При обработке
воды известковым молоком Са(ОН)г или раствором каусти-
ка NaOH удаляются соли временной жесткости. Например:
Са (НСО3)а + Са (ОН)2 = 2 СаСО3 + 2 Н2О (11,4)
осадок
При действии на воду содой ИагСОз устраняются соли постоян-
ной жесткости:
СаС12 + Na2CO3 = СаСО3 + 2 NaCl (11,5)
осадок
Обычно применяют комбинированный известково-содо-
вый способ умягчения воды, при котором воду сначала обраба-
тывают известью, а потом содой. При этом устраняется временная
и постоянная жесткость, так как все соли кальция и магния пере-
ходят в нерастворимый осадок в виде карбоната кальция СаСОз и
гидроокиси магния Mg (ОН) г-
Для умягчения воды применяют также фосфат натрия Na3PO4,
который переводит соли кальция и магния из раствора в нераство-
римый осадок фосфатов кальция и магния (устраняется временная
и постоянная жесткость):
3 Са (НСО3)2 4- 2 NagPO, = Са3 (РО4)а + 6 NaH С03 (11,6)
осадок
28
3 MgCl2 + 2 Na3PO4 = Mg3 (PO4)2 + 6 NaCl (11,7)
осадок
К физико-химическим способам умягчения и обессоливания во-
ды относятся ионообменные способы. Они основаны на
свойстве некоторых труднорастворимых веществ —ионитов обмени-
вать свои ионы на ионы солей, растворенных в воде. Например, ио-
нит алюмосиликат состава Na2O-А12Оз-25Ю2-«Н2О содержит ак-
тивные ионы натрия, способные переходить в раствор. В обмен на
эти ионы из раствора могут поглощаться ионы кальция или магния,
т. е. вода очищается от этих ионов:
Na2O • А12О3 2 SiO2 • п Н2О + СаС12
=rtCaO • А12О3 • 2 SiO2 • п Н2О + 2 NaCl (11,8)
Дегазацию воды, т. е. удаление растворенных в ней вред-
ных газов — сероводорода, сернистого ангидрида, углекислого газа
и др., способных корродировать аппаратуру, осуществляют, проду-
вая воду воздухом. Растворенные газы переходят из воды в воздух
и вместе с ним удаляются. Этот процесс называют также аэриро-
ванием.
Большой народнохозяйственной задачей является очистка
сточных промышленных вод. Сточные воды многих хими-
ческих предприятий содержат загрязнения в виде кислот, щелочей,
солей, всевозможных органических веществ, часто ядовитых для
растительных и животных организмов. Сбрасывать такие воды в
прилегающие к заводу водоемы недопустимо.
Способы обезвреживания сточных вод:
физико-химические — аэрация, адсорбция, испарение с
выделением примесей в осадок;
химические — осаждение примесей различными реагентами
с последующим отстаиванием и фильтрацией осадков;
биологические — главным образом для очистки сточных вод
населенных пунктов с помощью некоторых микроорганизмов, на-
пример хлопьевидных колоний бактерий и низших организмов, со-
держащихся в активном иле. Органические примеси в результате
жизнедеятельности микроорганизмов превращаются в углекислый
газ, нитраты, воду и окислы.
Потребление воды на больших химических комбинатах измеря-
ется миллионами кубометров, поэтому во многих производствах от-
работанная вода, например вытекающая из холодильников, вновь
используется в производстве. Такая вода называется оборотной.
Оборотную воду охлаждают в специальных водоемах (прудах),
иногда предварительно разбрызгивая ее, или подают сверху в де-
ревянную башню с насадкой из решеток и реек. Стекая вниз по на-
садке, вода охлаждается движущимся навстречу холодным возду-
хом. Такие башни называют градирнями.
29
§ 4. Энергетика химической промышленности
Химические производства потребляют значительные количества
энергии. Энергия затрачивается не только на проведение химиче-
ских реакций, но также на транспортировку материалов, дробление
и измельчение твердых веществ, фильтрацию, сжатие газов и др.
В фабрично-заводской стоимости химической продукции затраты
энергии составляют около 10%, что свидетельствует о высокой
энергоемкости химических производств.
Виды энергии. В химической промышленности применяются
электрическая, тепловая, химическая, световая, внутриядерная
энергия и вторичные энергетические ресурсы.
Электрическая энергия необходима для разложения
под действием электрического тока растворов и расплавов (элект-
рохимические процессы), нагревания реакционных смесей до высо-
кой температуры (электротермические процессы), превращения ее
в механическую энергию, используемую для транспортировки ма-
териалов, дробления, сжатия газов и т. д.
Тепловую энергию применяют для нагрева, сушки, выпар-
ки, дистилляции и т. д.
Химическая энергия используется в гальванических эле-
ментах и аккумуляторах, где она преобразуется в электрическую
энергию.
Световая энергия необходима для осуществления процес-
сов, протекающих под действием света (фотохимических).
Внутриядерной энергией пользуются для проведения
реакций под действием радиоактивных излучений.
Вторичные энергетические ресурсы — энергетиче-
ские отходы или побочные продукты производства, имеющие высо-
кую температуру, используют для нужд предприятий и тем самым
сокращают потери энергии в окружающую среду.
Источники энергии. Для производства химических продуктов в
качестве источников энергии используют уголь, нефть, горючие
сланцы, природные газы, энергию гидро- и атомных электростан-
ций. Источники энергии различаются по энергетической ценности.
Под энергетической ценностью понимают количество
энергии (в киловатт-часах), которое может быть получено при сжи-
гании 1 кг или 1 м3 топлива. Энергетическая ценность (кВт-ч/кг)
некоторых видов топлива приведена ниже:
Каменный уголь .......................... 8,0
Кокс .................................... 7,2
Торф .................................... 4,0
Коксовый газ ............................ 4,8
Природный газ, кВт-ч/м® ...................10,6
Целесообразность применения отдельных источников энергии
определяется не только их энергетической ценностью, но также за-
пасами их в природе, географическим положением, доступностью
и некоторыми другими факторами.
30
Рациональное использование энергии. Химическая промышлен-
ность потребляет большие количества энергии, и это во многом оп-
ределяет стоимость получаемых продуктов. Одна из важнейших
проблем — экономное расходование энергии. Оценкой, или крите-
рием, рационального использования энергии служит коэффициент
использования энергии, под которым понимают отношение коли-
чества энергии, которое теоретически требуется затратить на полу-
чение единицы продукта, к количеству практически затраченной
энергии.
На химических предприятиях из всех видов энергии больше все-
го потребляется тепловой. Степень ее использования характеризу-
ется тепловым коэффициентом полезного действия, который равен
отношению количества тепла, используемого на осуществление ос-
новных химических реакций, к общему количеству затраченного
тепла.
Во многих производствах этот коэффициент невысок. Так, в про-
цессе обжига известняка, при котором при 900°С протекает реакция
СаСО3 = СаО + СОа (11,7)
коэффициент использования тепловой энергии составляет око-
ло 65%. При этом 25% тепла теряется с продуктами, выходящими
из аппарата (СаО и СОг), и 10% —в окружающую среду. Вследст-
вие этого перед химическими предприятиями ставится задача ис-
пользования тепла выходящих из реакционных аппаратов газов,
жидкостей и твердых тел (регенерация тепла) и энергии сжатых
газов и жидкостей (регенерация энергии).
Тепло отходящих нагретых газов используют чаще всего для
предварительного нагревания материалов, поступающих в реакци-
онные аппараты, или для получения пара, необходимого в произ-
водстве. Для этой цели служат теплообменники, называемые реку-
ператорами и регенераторами тепла, и котлы-утилизаторы.
Рекуператор (рис. 6) — обычно цилиндрический аппарат2,
внутри кцторого помещены плиты 1 с развальцованными в них
трубами. Горячие газы, выходящие из реакционного аппарата, про-
ходят, например, по трубкам 3 рекуператора; холодные газы, кото-
рые должны быть поданы в реакционный аппарат, движутся в меж-
трубном пространстве. В результате теплообмена через стенки тру-
бок проходит охлаждение горячих газов и нагрев холодных.
Регенератор — периодически действующая камера, запол-
ненная насадкой (рис. 7). Вначале через камеру 1 пропускают го-
рячие газы, выходящие из реакционного аппарата. Газы соприкаса-
ются с насадкой 2, отдают ей тепло и охлаждаются; насадка при
этом нагревается. Затем прекращают подачу горячих реакционных
газов и через горячую насадку начинают пропускать холодные га-
зы, которые далее должны поступать в реактор. Холодные газы от-
бирают тепло от насадки и нагреваются; насадка при этом охлаж-
дается. Затем через охлажденную насадку продувают горячие га-
зы и т. д.
31
Для создания непрерывного процесса устанавливают по крайней
мере два регенератора. В этом случае, когда одна камера работает
на нагревание насадки, т. е. через нее пропускают горячие газы, в
другой камере пропускают холодный газ, т. е. насадка отдает тепло
холодному газу. Через некоторый промежуток времени происходит
автоматическое переключение потоков газов.
Охлажденные газы
Рис. 6. Рекуператор:
I — плиты, 2 —• корпус аппарата, 3
трубки
Рис. 7. Регенератор:
1 — камера, 2 — насадка
Регенераторы, как правило, применяются для использования
тепла газов, имеющих очень высокую температуру — порядка 700—
800°С и выше. Для использования тепла газов и жидкостей с более
низкой температурой обычно устанавливают рекуператоры.
Котлы-утилизаторы применяют в том случае, когда тепло
отходящих газов используют для получения пара. На рис. 8 изоб-
ражена одна из конструкций котла-утилизатора. Горячие газы дви-
жутся по трубам 4, находящимся в корпусе котла 3. Вода поступа-
ет в межтрубное пространство котла через штуцер 5. Полученный
пар выводится через влагоотделитель 2 и вентиль 1.
Тепло отходящих газов иногда применяют для нагревания воз-
духа или воды, идущих на отопление заводских зданий и для дру-
гих целей (горячая вода для душевых, парникового хозяйства
и др.).
Энергию сжатых газов или жидкостей, выходящих из реакцион-
ных аппаратов, используют для приведения во вращение колес га-
32
зовых и водяных турбин, смонтированных на одном валу с насосом
и электродвигателем, и тем самым уменьшают расход электриче-
ской энергии, которой питают электродвигатель.
Рис. 8. Котел-утилизатор:
2— вентиль, 2 — влагоотделитель, 3 — корпус котла, 4 — трубы. 5 — штуцер
В настоящее время широко используются тепло отходящих га-
зов, энергия сжатых газов или жидкостей — так называемых вто-
ричных энергетических ресурсов, что позволяет значительно повы-
сить энергетические коэффициенты полезного действия. Подобные
процессы реализованы в энерготехнологических схемах производ-
ства (см. с. 70).
Контрольные вопросы
1. На какие группы подразделяют сырье для химической промышленности?
2. Почему необходимо обогащать сырье?
3. Назовите методы обогащения твердых горных пород.
4. На каком принципе основано гравитационное обогащение?
5. Какой принцип положен в основу электромагнитного обогащения?
6. Какие минералы называются гидрофобными и какие гидрофильными?
7. На каком явлении основан метод обогащения флотацией?
8. Приведите пример комплексного использования сырья.
9. Какую воду называют жесткой и каким образом понижают жесткость
воды?
10. Какие виды энергии используют в химической промышленности?
И. Какую задачу выполняют рекуператоры, регенераторы тепла и котлы-
утилизаторы?
2—275 33
Глава III
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИКО-
ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ
§ 5. Понятие о химико-технологическом процессе
Всякий химико-технологический процесс должен отвечать опре-
деленным требованиям. Прежде всего химико-технологический про-
цесс стремятся проводить в таких условиях, которые позволяют по-
лучить максимальный выход продукта, — т. е. наибольшее количест-
во продукта из взятого количества сырья. Очень важно, чтобы
условия проведения процесса обеспечивали высокую скорость его
протекания. Чем выше скорость процесса, тем больше исходных ве-
ществ можно переработать в аппарате в продукты за один час, т. е.
с повышением скорости процесса увеличивается производительность
аппаратуры. И, наконец, не менее важно, чтобы получаемый про-
дукт был дешевым и обладал высоким качеством.
Для удовлетворения перечисленных выше требований процесс
необходимо проводить в оптимальных условиях.
Оптимальные условия ведения процесса — это наиболее выгод-
ное сочетание основных показателей процесса (температуры, дав-
ления, концентрации исходных реагентов и т д.), позволяющее по-
лучить наибольший выход продукта с большой скоростью и снизить
расходы сырья, энергии, топлива, затраты на строительство и экс-
плуатацию аппаратуры, затраты труда на производство продукта.
В оптимальных условиях должны быть проведены все стадии тех-
нологического процесса. Выбрать оптимальные условия невозмож-
но без знания основных закономерностей, которым подчиняются хи-
мико-технологические процессы.
Для проведения химической реакции необходимо, чтобы исход-
ные вещества пришли в соприкосновение друг с другом. Поэтому
химическое превращение складывается из ряда связанных между
собой элементарных процессов: подвода реагентов в зону реакции,
химических реакций и отвода полученных продуктов из зоны ре-
акции. Например, для осуществления процесса сжигания угля в
кислороде воздуха необходимо, чтобы молекулы кислорода имели
возможность подойти из пространства, заполненного воздухом, к
поверхности твердых частичек. Там при взаимодействии с углеро-
дом (основной составляющей частью угля) происходит химическая
реакция окисления:
С+О2 = СО2 (III,1)
Образовавшийся углекислый газ СО2 удаляется с поверхности
твердой частички угля (рис. 9).
Если воздух вокруг твердой частички угля неподвижен, то под-
вод кислорода к ней и отвод углекислого газа могут осуществлять-
ся только за счет беспорядочного движения молекул газа, т. е. по-
34
средством молекулярной диффузии. В движущейся среде.
когда воздух потоком перемещается вокруг частичек угля, перенос
вещества (Oj и СО2) осуществляется не только молекулярной диф-
фузией, но и самой средой в направлении ее движения, т. е. кон-
Рис. 9. Схема сжига-
ния угля а воздухе
векцией. При интенсивном перемешивании реагирующих ве-
ществ конвективный перенос называют также турбулентной
диффузией.
Многие химические процессы являются многофазными, т. е. со-
стоящими одновременно из нескольких фаз.
части системы, одинаковые по составу, физи-
ческим и химическим свойствам и ограничен-
ные от других частей системы поверхностью
раздела. Участвующие в реакции вещества мо-
гут находиться в следующих фазах: твердой —
Т, газовой — Г или жидкой — Ж.
Примером многофазного процесса служит
приведенный выше процесс окисления угля ки-
слородом воздуха. В этом процессе имеются
две фазы: газовая (Г) и твердая (Т). В газо-
вой фазе находятся один из исходных реаген-
тов — кислород и продукт реакции — углекис-
лый газ, а в твердой фазе второй реагент —
углерод. Примером двухфазного процесса с
участием газа и жидкости (Г—Ж) является процесс поглощения
серного ангидрида SO3 водой:
Фаза — однородные
SO3 + Н2О = H2SO4
г ж
(Ш,2)
Есть процессы, в которых имеются все три фазы: твердая, жид-
кая и газообразная. В многофазных процессах подвод реагентов в
зону реакции и отвод продуктов из зоны реакции связаны с пере-
носом вещества из одной фазы в другую. Так, в последнем примере
химическая реакция поглощения серного ангидрида водой может
осуществиться лишь при условии, что SO3 из газовой фазы перей-
дет в жидкую, а затем уже вступит в реакцию. Такие процессы пе-
рехода вещества из одной фазы в другую называются массопе-
р е д а ч е й.
§ 6. Классификация химических реакции
Особо важное место в химической технологии занимает изучение
самой существенной стадии химико-технологического процесса—
химических превращений. Химические реакции, протекающие в про-
мышленных процессах, весьма разнообразны. Их классифицируют
по различным признакам.
По условиям проведения реакции подразделяются на: 1) изо-
термические, протекающие при постоянной температуре, и н е-
изотермические, при которых температура процесса непосто-
янна; 2) протекающие при постоянном или перем ен-
2* 35
ном объеме (давлении); 3) адиабатические (без под-
вода тепла извне или отвода тепла в окружающую среду) и
неадиабатические (когда имеется теплообмен с окружающей
средой).
По фазовому состоянию реагентов реакции делят на гомоген-
ные (однородные) и гетерогенные (неоднородные). В гомо-
генных реакциях все взаимодействующие вещества находятся в од-
ной фазе — газовой (Г), жидкой (Ж) или твердой (Т). Примером
гомогенной реакции, протекающей в газовой фазе, является окис-
ление окиси азота NO кислородом;
2NO + O2 = 2NO2 (Ш.З)
Г Г г
Исходные вещества и продукты реакции — газы. Гомогенный
процесс, в котором действуют жидкие вещества, например раствор
щелочи NaOH и соляная кислота НС1, называют процессом, проте-
кающим в жидкой фазе:
NaOH + НС1 = NaCl 4-Н2О (III,4)
ЖЖ ж
В гетерогенных процессах реагенты, принимающие участие в
реакции, находятся в разных фазах. В реакционном объеме имеют-
ся одновременно две или более фаз. Так, в двухфазных системах в
химическом взаимодействии могут находиться вещества в следу-
ющем физическом состоянии: газ — жидкость (Г — Ж), газ — твер-
дое (Г — Т), жидкость — твердое (Ж — Т), жидкость — жидкость
(Ж — Ж) — при условии, что жидкости не смешиваются, твер-
дое— твердое (Т—Т). Во всех гетерогенных процессах имеется
граница раздела фаз. В качестве примера гетерогенного процесса с
участием газовой и твердой фаз (Г —Т) можно привести описанное
выше сжигание угля:
С + О2=СО2 (III,1)
Г Г г
Поглощение серного ангидрида водой — пример системы Г—Ж.
SO3 4-Н2О = H2SO4 (II 1,5)
Г Ж Ж
Реакция между серной кислотой H2SO4 и окисью меди СиО является
примером гетерогенной системы Ж —Т:
H2SO4 4- CuO = CuSO4 4- Н2О (III,6)
По механизму реакции делят на простые, параллельные
и последовательные (кон секутивны е). Все эти реак-
ции могут быть обратимыми и необратимыми. Простая
необратимая реакция характеризуется тем, что по мере ее протека-
ния исходное вещество полностью превращается в продукт реакции
36
и концентрация исходного реагента уменьшается от ее начального
значения до нуля. Примером необратимой реакции является сжига-
ние серы:
S + O2->SO2 (111,7)
Эта реакция будет протекать до тех пор, пока вся сера не израсхо-
дуется и не превратится в сернистый газ SO2. Необратимость этой
реакции обозначается стрелкой, направленной в одну сторону.
Обратимые реакции отличаются от необратимых тем, что полу-
чаемые в результате реакции продукты способны вновь превра-
щаться в исходные вещества. Например, при реакции водорода Н2
с парами иода 12 образуется газообразный продукт — иодистый во-
дород HI:
H2+I2=Pt2HI (111,8)
Полностью превратить иод и водород в иодистый водород не удает-
ся, так как часть полученного йодистого водорода вновь разлагает-
ся с образованием исходных реагентов — иода и водорода. В таких
случаях говорят, что реакция протекает как в прямом, так и в
обратном направлении, т. е. является обратимой. Обратимость та-
ких реакций показывают в уравнении обратными стрелками. Так
как при проведении обратимых реакций нельзя полностью превра-
тить исходные вещества в продукты, то в реакторе одновременно
присутствуют и продукты реакции, и исходные вещества.
При параллельных реакциях с одними и теми же ис-
ходными веществами происходит несколько различных превраще-
ний с образованием разных продуктов. Например, при взаимодей-
ствии газообразного аммиака с кислородом может протекать одно-
временно несколько реакций с образованием различных продук-
тов — окиси азота NO, закиси азота N2O и азота N2:
4NH3 + 5O2 = 4NO + 6H2O (III,9а)
4 NH3 + 4О2 = 2 N2O + 6 Н2О (Ш,9б)
4 NH3 + ЗО2 = 2N2 + 6 Н2О (Ш,9в)
При последовательных реакциях исходное вещест-
во не сразу превращается в конечный продукт: сначала из него
получается промежуточное вещество, которое затем превращается
в конечный продукт. Например, при окислении серного колчедана
кислородом в конечном счете получают сернистый газ SO2 и окись
железа Fe2O3:
4FeS2 +11O2 = 8SO2+2FeaO3 (III, 10)
Но эти продукты получаются не сразу, а через промежуточную ста-
дию. Сначала серный колчедан разлагается при высокой темпера-
туре на сернистое железо FeS и серу S:
FeS2 = FeS-|-S (111,10а)
37
И только после этого сернистое железо и сера окисляются кислоро-
дом с образованием конечных продуктов — SO2 и Ре2Оз.
При разработке химико-технологического процесса необходимо
получить ответы на два вопроса:
1. Какое максимальное количество продукта можно получить
из данного сырья?
2. Сколько времени потребуется для осуществления химическо-
го превращения, или, другими словами, как быстро протекает про-
цесс, какова его скорость?
Ответ на первый вопрос дает учение о химическом равновесии—
статике процесса, ответ на второй вопрос — учение о скоростях хи-
мических процессов, называемое химической кинетикой. Изучение
равновесия и кинетики процесса имеет исключительное значение
для химической технологии. Наряду с такими общими закономер-
ностями, как закон сохранения массы и закон сохранения энергии,
оно позволяет выбрать наилучший технологический режим, т. е.
наиболее выгодное сочетание основных величин (параметров режи-
ма), влияющих на выход, качество продукта и скорость его полу-
чения. Для большинства процессов основными параметрами режи-
ма являются температура, давление, применение катализатора,
концентрация взаимодействующих веществ.
§ 7. Равновесие в технологических процессах
Большинство промышленных химических реакций обратимо.
Процесс химического превращения в таких случаях происходит в
двух направлениях. Примером обратимого процесса служит широко
применяемая в промышленности для получения водорода реакция
взаимодействия окиси углерода СО с водяными парами (конверсия
окиси углерода):
СО + Н2Опар Н2 + СО2 (III,11)
По прямой реакции (слева направо) исходные вещества (окись
углерода и вода) превращаются в продукты реакции (водород и
двуокись углерода). Полученные продукты начинают взаимодей-
ствовать между собой, вновь образуя исходные вещества, т. е. идет
обратная (справа налево) реакция. Обе реакции происходят одно-
временно.
В начале процесса концентрация исходных веществ — СО и Н2О
велика и поэтому значительна скорость прямой реакции. Но по ме-
ре протекания процесса окись углерода и водяные пары расходуют-
ся, концентрация их уменьшается и прямая реакция постепенно
замедляется. Одновременно увеличивается количество полученных
продуктов (водорода и углекислого газа), растет их концентрация,
а потому повышается и скорость обратной реакции. Наконец, на-
ступает такой момент, когда скорости прямой и обратной реакций
становятся равными. Такое состояние реагирующей системы назы-
вается химическим равновесием.
38
Поскольку в обратимых процессах практически не происходит
полного превращения исходных реагентов в продукты реакции, то
после наступления равновесия в системе присутствуют одновремен-
но и исходные вещества, и продукты реакции (СО, НгО, СО2, Н2),
причем при равновесии устанавливаются определенные значения
концентраций СО, Н2О, СО2 и Н2, которые больше не меняются. Они
остаются постоянными не потому, что прекратились химические
превращения, а потому, что процессы, протекающие по прямой ре-
акции, уравновешиваются протеканием обратной реакции. Сколько
молекул СО и Н2О вступит в реакцию за определенное время (пря-
мая реакция), столько же их образуется за это же время в резуль-
тате взаимодействия СО2 и Н2 (обратная реакция).
Константа равновесия. Определенное соотношение между содер-
жанием веществ СО, Н2О, Н2 и СО2 в равновесной системе будет
оставаться постоянным до тех пор, пока не произойдет изменения
внешних условий (например, температуры).
Отношение произведения концентраций продуктов реакции к
произведению концентраций исходных веществ в момент равнове-
сия называют константой равновесия реакции. Концентрации ис-
ходных веществ и продуктов реакции должны быть взяты при этом
в степенях, равных коэффициентам при данных веществах в урав-
нении реакции.
Так, для приведенной реакции (III, 11) константа равновесия
/Ср записывается в виде
ц = СНг • Ссо,
Р Ссо • сняо
где Сц2 , Ссо„Ссо, Сц2о — концентрации Н2, СО2, СО и Н2О соот-
ветственно в момент равновесия.
Величину константы равновесия используют для расчета равно-
весия обратимых процессов.
Выход продуктов, достигаемый при равновесии, называется
равновесным. Он является максимальным для данных условий
(температуры, давления, концентрации исходных веществ). Сколь-
ко бы времени ни вели процесс после наступления равновесия, по-
лучить выход больше, чем равновесный, невозможно. Повысить его
можно, если сместить равновесие реакции вправо, изменив внешние
условия проведения процесса. Поэтому важно знать, как влияют
различные технологические показатели (температура, давление,
концентрация реагирующих веществ) на равновесие химических
реакций.
Влияние различных факторов на равновесие обратимых реакций.
Принцип Ле-Шателье. Влияние температуры, давления и концент-
раций реагирующих веществ на равновесие в гомогенных и гетеро-
генных процессах определяется открытым в 1884 г. Ле-Шателье
принципом, который формулируется так: если на систему, находя-
щуюся в состоянии равновесия, воздействовать извне, изменяя ка-
кую-либо из величин, определяющих состояние равновесия, то рав-
39
новесие смещается таким образом, чтобы ослабить эффект воздей-
ствия.
К важнейшим факторам, оказывающим влияние на сдвиг рав-
новесия обратимой реакции, относятся температура, давление, кон-
центрация участвующих в реакции веществ.
Влияние температуры. Для установления влияния температуры
на сдвиг равновесия обратимой реакции необходимо знать, являет-
ся ли данная реакция экзотермической (протекающей слева напра-
во с выделением тепла+Q) или эндотермической (идущей слева
направо с поглощением тепла —Q).
К обратимым экзотермическим реакциям отно-
сится рассмотренная конверсия окиси углерода водяным паром:
СО + Н2Опар Н2 + со2 + Q (III, 11)
Если после наступления равновесия в такой системе изменить
температуру, например понизить ее, то, согласно принципу Ле-Ша-
телье, в системе должны произойти изменения, компенсирующие
снижение температуры и приводящие к ее повышению. Следова-
тельно, должна пройти та реакция, в результате которой выделяет-
ся тепло, т. е. новые порции СО и Н2О превратятся в СО2 и Н2. Рав-
новесие реакции смещается при этом в правую сторону и равновес-
ный выход продуктов увеличивается.
Если же при протекании экзотермической реакции повысить тем-
пературу, то равновесие сдвинется влево и равновесный выход про-
дуктов реакции снизится.
Для обратимой эндотермической реакции, на-
оборот, снижение температуры приводит к смещению равновесия
влево и уменьшению равновесного выхода продукта, а увеличение
температуры — к сдвигу равновесия вправо.
Влияние давления. Если обратимая реакция протекает с измене-
нием объема, то помимо температуры на состояние равновесия такой
реакции влияет давление. Например, обратимая реакция синтеза
аммиака протекает в газовой фазе слева направо с уменьшени-
ем объема:
N24-3H2^2NH3 (111,12)
В этом случае из четырех молекул исходных веществ получаются
две молекулы конечного продукта. При увеличении давления в та-
кой системе, находящейся в состоянии равновесия, по принципу
Ле-Шателье должны произойти изменения, приводящие к пониже-
нию давления или, что то же самое, к уменьшению числа молекул
в газовой смеси. Таким процессом является прямая реакция. Поэто-
му определенные количества азота и водорода дополнительно прев-
ращаются в аммиак, равновесие сдвигается в правую сторону и
выход аммиака повышается. При понижении же давления в реак-
ции, идущей с уменьшением объема, равновесие смещается влево.
Для реакций, идущих с увеличением объема, наоборот,
при уменьшении давления выход продукта растет, а при увеличении
40
давления — падает. Примером такой реакции может служить взаи-
модействие метана СН4 с водяными парами (конверсия метана):
СН4 + Н2Опар 3 Н2 + СО2 (111,13)
Влияние концентрации реагирующих веществ. Выход конечного
продукта можно увеличить, изменяя концентрации участвующих в
реакции веществ. Если, например, после установления равновесия
реакции конверсии окиси углерода
СО + Н2Опар Н2 + СО2 (111,11)
повысить концентрацию исходных реагентов (СО или водяных па-
ров), то по принципу Ле-Шателье должны произойти процессы,
снижающие концентрацию этих реагентов, т. е. должна пройти реак-
ция между СО и НаО. Равновесие при этом сдвигается вправо и
выход продукта повышается. Обычно не повышают концентрацию
всех исходных реагентов, а берут в избытке более дешевый реагент.
Для нашего примера таким реагентом является вода, поэтому и
берут избыток водяных паров. Сдвинуть равновесие можно не толь-
ко увеличением концентрации исходных вешеств, но и уменьшением
концентрации продуктов реакции. Это осуществляется выводом
продуктов из реакционной системы.
В химической технологии обратимые процессы широко распрост-
ранены. Выбирая условия проведения таких процессов, нужно в пер-
вую очередь руководствоваться требованием смещения равновесия
в сторону образования продукта реакции. При этом следует учиты-
вать, что для повышения равновесного выхода необходимо:
1) снижать температуру для экзотермической реакции;
2) повышать температуру для эндотермической реакции;
3) повышать давление в реакциях, протекающих с уменьшением
объема;
4) понижать давление в реакциях, идущих с увеличением объема;
5) повышать концентрацию исходных реагентов;
6) снижать концентрацию продуктов реакции.
Необходимо также учитывать, что для смещения равновесия сле-
дует (когда это возможно) менять одновременно несколько показа-
телей, приводящих к увеличению выхода продукта, например тем-
пературу, давление и концентрации веществ.
Перечисленные выше положения позволяют установить диапа-
зон условий, при которых возможен высокий равновесный выход
продукта. Но для практического осуществления процесса знания
этих условий недостаточно, так как необходимо не только получить
большой выход продукта, но и обеспечить высокую скорость про-
цесса, поскольку от нее в значительной степени зависит производи-
тельность аппаратуры.
§ 8. Скорость химико-технологических процессов
В современном производстве при его громадных масштабах, ис-
пользовании дорогой и сложной аппаратуры и машин повышение
скоростей реакции имеет особенно важное значение.
41
4 ’ •'
Часто при условиях, обеспечивающих высокий выход продукта,
мала скорость реакции, или наоборот. Поэтому окончательный вы-
бор условий можно сделать только после изучения кинетики про-
цесса. Кинетика позволяет установить, какова скорость взаимо-
действия исходных веществ и от чего она зависит. Учитывая кине-
тику процесса, можно выбрать такие условия, при которых реак-
ция будет протекать не только с высоким выходом продукта, но и
с большой скоростью.
Показателем скорости химической реакции служит количество
исходных веществ, вступающих в реакцию в единицу времени. На-
пример, о скорости процесса окисления сернистого ангидрида SO2 в
серный SO3 кислородом:
2SO2 + O2 =f± 2SO3 (Ш, 14)
можно судить по тому, как быстро уменьшается количество SO2 в
реакционном объеме. Если оно уменьшается быстро, говорят, что
скорость реакции большая; если же концентрация SO2 меняется
медленно, говорят, что реакция протекает с малой скоростью. Ско-
рость реакции можно установить и по тому, как быстро растет
концентрация конечных продуктов (в данном случае SO3).
Скорость химического процесса — это изменение концентрации
одного из реагирующих веществ или продуктов реакции в единицу
времени в единице объема реакционной массы.
Химико-технологические процессы в большинстве случаев свя-
заны со сложными реакциями. Скорость таких процессов зависит не
только от скорости основной реакции, но и от скорости побочных
реакций, а для гетерогенных процессов также от скорости подвода
исходных веществ в зону реакции и скорости отвода продуктов из
зоны реакции.
Скорости отдельных реакций различаются чрезвычайно сильно.
Известны реакции, протекающие очень быстро. Например, окисле-
ние аммиака на платиновом катализаторе практически полностью
заканчивается в течение десятитысячной доли секунды, реакция
нейтрализации заканчивается за несколько секунд. Другие же реак-
ции, например окисление железа, идут медленно.
Влияние различных факторов на скорость химической реакции.
Скорость химической реакции зависит прежде всего от природы
реагирующих веществ, т. е. от их физических и химических свойств.
Кроме того, на скорость реакции существенно влияют следующие
факторы: концентрация взаимодействующих веществ, температура,
давление, катализатор, степень перемешивания веществ.
Влияние концентрации взаимодействующих веществ. Как извест-
но, молекулы взаимодействующих веществ движутся с различной
скоростью в реакционном пространстве. Чтобы произошла химиче-
ская реакция, молекулы различных веществ должны столкнуться
друг с другом. Например, для проведения реакции получения йодис-
того водорода HI из водорода и паров иода
Н2 + 12 = 2Н1 (II 1,8)
42
необходимо, чтобы молекула иода столкнулась с молекулой водоро-
да. Число столкновений молекул иода с молекулами водорода зави-
сит от числа этих молекул, находящихся в объеме. Чем больше реа-
гирующих частичек находится в единице объема, тем больше
вероятность их столкновения, а следовательно, и скорость реакции.
Поэтому скорость химической реакции пропорциональна концен-
трациям веществ, участвующих в реакции.
Скорость получения йодистого водорода по приведенной реакции
(гН1) пропорциональна концентрации водорода СН; и концентрации
иода
rHi = ‘ Ц/ (III, 15)
Величина kc, в этом уравнении скорости является константой
скорости реакции и зависит от природы реагирующих ве-
ществ и условий проведения реакции.
В общем случае для необратимой реакции
nA + тВ -> pR (111,16)
уравнение скорости (кинетическое уравнение) записывается так:
(Ш.17)
где rR — скорость реакции; СА и Св — концентрации исходных ве-
ществ А и В; и, т — стехиометрические коэффициенты (коэффици-
енты в уравнении реакции).
Влияние давления. Концентрация вещества, находящегося в га-
зообразном состоянии, увеличивается с повышением давления. По-
этому для реакций, протекающих с участием газообразных веществ,
увеличение давления (равнозначное увеличению концентрации)
приводит к повышению скорости реакции.
При проведении химической реакции следует учитывать, что в
начале процесса, когда концентрация реагирующих веществ высо-
кая, скорость реакции большая. По мере прохождения реакции кон-
центрации продуктов реакции увеличиваются, а концентрации ис-
ходных веществ уменьшаются, и поэтому скорость реакции стано-
вится очень малой. Следовательно, для полного превращения исход-
ных реагентов в продукт требуется затратить значительное время,
что вызовет снижение производительности аппаратуры. Поэтому
не всегда целесообразно добиваться полного превращения исход-
ного реагента в продукт, чтобы не снижать тем самым производи-
тельность аппаратуры.
По этой же причине в случае обратимых реакций выход продукта
не доводят до равновесного.
Влияние температуры. Известно, что не все столкновения моле-
кул приводят к химическому превращению. В реакцию вступают
только активные молекулы, которые имеют более высокую скорость
движения, а поэтому обладают и более высокой энергией по сравне-
нию с остальными молекулами в системе. При нагревании реак-
ционной смеси увеличивается число активных молекул, обладающих
43
необходимой для вступления в реакцию энергией. Поэтому с повы-
шением температуры резко возрастает скорость химической реак-
ции. Повышение температуры на 10° увеличивает скорость химиче-
ской реакции в 2—4 раза.
Влияние температуры на скорость реакции учитывается в кинети-
ческом уравнении через константу скорости. Последняя увеличива-
ется с ростом температуры, поэтому растет и скорость реакции.
Для сложных реакций увеличение температуры не только повы-
шает их скорость, но и меняет ход процесса. Это можно показать
на примере параллельной реакции:
fec,
А---> В, (III,18а)
kc,
А --> D. (111,186)
Константа скорости первой реакции kCt, второй — kc, • Кинетиче-
ское уравнение для первой реакции
(Ш,19а)
для второй
r2 = feCjC4. (111,196)
С повышением температуры увеличиваются kc, и kp„ и поэтому уве-
личивается скорость обеих реакций. Но константы скорости могут
увеличиться не в одинаковой степени. Например, fee, увеличивается
больше, чем kc„ тогда первая реакция ускоряется с ростом темпе-
ратуры больше, чем вторая. Это приведет к тому, что при повышении
температуры выход продукта В (за определенный период времени)
возрастет больше, чем выход продукта D. Изменится соотношение
между содержанием конечных продуктов В и О, или, что то же
самое, избирательность, или селективность, процесса. Это необхо-
димо учитывать, когда стремятся повысить выход того или иного
продукта в сложной реакции.
Влияние катализатора. Ускорить химическую реакцию можно и
применением особых веществ, называемых катализаторами
или контактами. Многие химические реакции не могут быть
практически осуществлены без применения катализатора. Ускоряя
реакцию, сам катализатор не входит в состав конечного продукта и
остается в реакционной среде без изменения.
Катализаторы могут не только ускорять химическую реакцию,
но и направлять ход реакции. Например, из окиси углеродд СО и
водорода Нг в зависимости от примененного катализатора можно
получить различные вещества: углеводороды, спирты.
Скорость гетерогенных процессов. Гетерогенные процессы по
сравнению с гомогенными имеют ряд особенностей. Для примера
рассмотрим процесс поглощения сернистого ангидрида SO2 водой,
протекающий в гетерогенной системе газ — жидкость:
SO2 + Н2О H2SO3 (111,20)
Г Ж ж
44
' Газ,
содержащий- SO.
SOz
; Вова -
Рис; 10. Схема проте-
кания процесса в ге-
терогенной системе
Г—Ж (поглощение
она станет равной кон- сернистого ангидри-
да водой)
На рис. 10 условно показан этот процесс. Сернистый ангидрид,
находящийся в газовой фазе, должен перейти в жидкость, и только
тогда может пройти его химическое взаимодействие с водой. Чем
больше поверхность соприкосновения реагирующих фаз, тем боль-
ше молекул SO2 перейдет в жидкость и тем быстрее будет идти хи-
мическое превращение. Следовательно, скорость гетерогенных про-
цессов в сильной степени зависит от величины поверхности сопри-
косновения фаз, и в уравнение скорости гетерогенной реакции обя-
зательно входит значение этой поверхности — F.
Как уже говорилось, для проведения химичес*
кой реакции сернистый ангидрид SO2 должен пе-
рейти в жидкость. Но осуществиться это может
лишь при определенных условиях и вот по какой
причине. При переходе в жидкую фазу сернистый
ангидрид образует с водой сернистую кислоту.
Эта реакция обратимая. Поэтому сернистая кис-
лота будет вновь разлагаться с образованием
SO2 и воды и над поверхностью жидкой фазы ус5'
танавливается определенная концентрация сер-
нистого газа, называемая равновесной кон*
центрацией SO2 — Ср-Величина ее зависит
от концентрации сернистой кислоты в жидкости-.
В процессе поглощения SO2 и превращения его
в сернистую кислоту ее концентрация в жидкости
повышается, и поэтому увеличивается и равновес-
ная концентрация SO2 над жидкостью. Может на-
ступить момент; когда
центрации SO2 во всем объеме газовой фазы —
действующей концентрации SO2 — Сд.
Процесс перехода SO2 из газовой фазы в жидкую прекратится, что
приведет к прекращению дальнейшего химического превращения.
Таким образом, при проведении гетерогенного процесса очень
важно знать, какова разница между действующей концентрацией
вещества в газовой фазе и его равновесной концентрацией на гра-
нице раздела фаз. Разность этих концентраций обозначают АС и
называют движущей силой процес с а:
АС = СД — Ср. (111,21)
Чем выше движущая сила гетерогенного процесса, тем больше
и его скорость. Когда равновесная концентрация становится равной
действующей, движущая сила равна нулю, переход вещества из
газовой фазы в жидкую прекращается и наступает равновесие.
С учетом сказанного*выше можно записать уравнение скорости
для гетерогенного процесса:
rA = kFAC. (Ш,22)
Величина k — коэффициент массопередачи — харак-
теризует (подобно константе скорости для гомогенных процессов)
скорость течения процесса. Но коэффициент массопередачи — более
45
сложная величина, зависящая не только от химических свойств ре-
агирующих веществ, но и от физических свойств, от скоростей пото-
ков реагентов, степени перемешивания и других факторов.
Рассмотрение кинетики процесса позволяет сделать важный
практический вывод, что для повышения скорости реакции необхо-
димо:
1) увеличивать начальные концентрации реагирующих веществ
(давление для реакций, идущих в газовой фазе);
2) повышать температуру;
3) применять катализатор;
4) увеличивать поверхность соприкосновения между вещества-
ми, находящимися в разных фазах.
Все перечисленные меры приводят к повышению наиболее важ-
ного показателя, характеризующего совершенство процесса'—ин-
тенсивности химического аппарата. Чем выше скорость химического
превращения, тем выше интенсивность аппарата. Поэтому все фак-
торы, ускоряющие химические процессы, приводят к повышению их
интенсивности.
§ 9. Выбор оптимального технологического режима
Изучив, как влияют статика и кинетика процесса на выбор усло-
вий его проведения, можно найти самый целесообразный с техноло-
гической точки зрения (оптимальный) режим. Вот как выбирают с
учетом статики и кинетики оптимальную температуру процесса.
Необратимая реакция. Равновесие таких реакций практически
полностью смещено в сторону образования продуктов реакции.
С повышением температуры растет скорость реакции. Поэтому при
проведении необратимых реакций температура
должна быть максимально допустимой. Повышение
температуры ограничивается неустойчивостью материала, из ко-
торого сделан аппарат, либо разложением продуктов реакции и
сырья при высоких температурах.
Обратимая эндотермическая реакция. С повышением темпера-
туры растут равновесный выход продукта и скорость реакции. По-
этому обратимые эндотермические реакции следу-
ет проводить при максимально возможной темпе-
ратуре.
Обратимая экзотермическая реакция. С повышением темпера-
туры растет скорость превращения, но снижается равновесный вы-
ход. Поэтому необходимо вести процесс в таком интервале темпе-
ратур, когда и выход и скорость удовлетворительны. На практике
обратимую экзотермическую реакцию начинают
вести при высокой температуре и в ходе процес-
са температуру снижают. Большая температура в начале
процесса обеспечивает высокую скорость процесса. При этом прев-
ращается основное количество исходных реагентов. Снижение тем-
пературы в конце процесса хотя и приводит к уменьшению скорости
46
реакции, зато позволяет по условиям равновесия получить большой
выход продукта.
Однако на практике не всегда соблюдается тот технологический
режим, который предписывает теория. Большое значение имеет эко-
номическая целесообразность процесса. Важно не только получить
большой выход продукта при большой скорости процесса, но и за-
тратить минимум средств на получение единицы продукции, т. е. до-
биваться уменьшения удельных расходов сырья, вспомогательных
материалов, энергии. Выбранный с учетом этих требований техно-
логический режим можно считать экономически рациональным.
§ 10. Гетерогенные системы
Гетерогенные процессы разнообразны: в них могут участвовать
газы и жидкости (пример таких процессов абсорбция, десорбция,
испарение, конденсация, ректификация), газы и твердые тела (ад-
сорбция, десорбция), жидкость и твердые тела (растворение, крис-
таллизация) и др.
При всем разнообразии гетерогенных процессов им присущ ряд
общих признаков: все они протекают либо на поверхности соприкос-
новения веществ, находящихся в различных агрегатных состояниях
(на границе раздела фаз), либо в объеме одной фазы, т. е. всегда
связаны с переходом вещества из одной фазы (передающей) в дру-
гую (воспринимающую) через поверхность раздела фаз. Общим для
всех гетерогенных процессов является также то, что для осущест-
вления таких процессов необходимо, чтобы концентрация вещества
в передающей фазе была больше равновесной концентрации этого
вещества над воспринимающей фазой, т. е. существовала движущая
сила процесса.
Из уравнения скорости гетерогенных процессов
r=fe-F-AC (111,22)
видно, что для ускорения таких процессов необходимо увеличивать
поверхность соприкосновения веществ (Г), находящихся в разных
фазах, повышать движущую силу процесса (АС) и коэффициент
массопередачи (fe).
Для увеличения (развития) поверхности со-
прикосновения веществ (F), находящихся в разных фазах,
проводят измельчение (диспергирование) взаимодействующих фаз.
Способы развития поверхности контакта фаз зависят от вида гете-
рогенной системы: Г — Ж, Г — Т, Ж — Т, Ж — Ж, Т — Т, а также
от условий проведения процесса: применяемых давлений, темпера-
тур, катализаторов и т. п. Как правило, увеличивают поверхность
более тяжелой фазы — твердой в системах Г — Т, Ж — Т и жидкой
в системах Г — Ж. Вспомним пример с горением угля в воздухе.
Большой кусок угля горит на воздухе сравнительно медленно. Если
увеличить поверхность соприкосновения угля с воздухом, расколов
кусок угля на мелкие кусочки, то горение значительно ускорится.
Увеличения поверхности контакта фаз возможно также достигнуть
подбором определенной конструкции аппарата.
47
Для увеличения движущей силы процесса ДС,
равной разности между действующей концентрацией вещества в
передающей фазе Ся и равновесной концентрацией этого вещества
над воспринимающей фазой Ср, повышают действующую концентра-
цию вещества и стараются снизить равновесную.
Для увеличения Сд можно применять концентрированное сырье
(для чего в промышленности проводят обогащение сырья), а если
реакция идет с участием газовой фазы, то увеличивать давление, что
равнозначно повышению концентрации вещества в газовой фазе.
Так, уголь горит в чистом кислороде гораздо быстрее, чем на возду-
хе, который содержит только 21 % кислорода.
Для уменьшения Ср нужно знать, как влияет температура на
равновесие, и соответствующим образом ее менять (понижать при
экзотермических и повышать при эндотермических реакциях). Мож-
но также для снижения Ср выводить продукты реакции из реакци-
онного объема. Вывод продуктов реакции осуществляется конден-
сацией, избирательной абсорбцией или адсорбцией из газовых сме-
сей, осаждением, испарением или адсорбцией из жидких смесей.
И, наконец, для ускорения гетерогенного процесса необходимо
увеличить коэффициент массопередачи k. Он ха-
рактеризует скорость перехода вещества из одной фазы в другую, и
поэтому от него зависит скорость гетерогенного процесса. Для уве-
личения коэффициента массопередачи k необходимо знать, какие
факторы на него влияют.
Коэффициент массопередачи — сложная величина, зависящая
как от химических свойств реагирующих веществ, так и от их физи-
ческих свойств, условий проведения процесса, а в ряде случаев от
конструкции аппарата. Понять эту зависимость поможет еще одна
общая черта всех гетерогенных процессов: любой гетерогенный
процесс является сложным, состоящим из ряда элементарных ста-
дий. При горении угля в воздухе углерод реагирует с молекулами
кислорода, находящимися непосредственно у поверхности угля.
Здесь образуется углекислый газ; уголь горит только в том случае,
если кислород непрерывно поступает из воздуха к его поверхности,
а углекислый газ, наоборот, перемещается в газовую фазу. Таким
образом, любой гетерогенный процесс всегда включает по крайней
мере три последовательно осуществляющиеся элементарные стадии:
1) подвод реагентов к поверхности раздела фаз (диффузия ис-
ходных реагентов);
2) химическую реакцию;
3) отвод продуктов реакции от поверхности раздела фаз (диф-
фузия продуктов).
Оказывается, скорости этих процессов могут быть неодинаковы-
ми. Тогда скорость всего процесса будет зависеть от скорости самой
медленной стадии, тормозиться ею, лимитироваться. Самой медлен-
ной может быть любая из перечисленных стадий, и от этого зависит
характер протекания всего процессса. Если медленней всего идет
химическая реакция, то как бы быстро ни осуществлялся подвод
реагентов и отвод продуктов реакции, общая скорость процесса бу-
дет не больше, чем скорость химического превращения.
48
О процессе, где самой медленной является скорость химической
реакции, говорят, что он протекает вкинетической области.
В таком процессе коэффициент массопередачи k зависит только от
скорости реакции и не зависит от скорости диффузии. Поэтому для
интенсификации процесса, протекающего в кинетической области,
необходимо ускорять химическую реакцию. Это приведет к увеличе-
нию коэффициента массопередачи, а следовательно, и общей ско-
рости процесса. Для повышения скорости химической реакции в
этом случае увеличивают температуру, концентрацию реагирующих
веществ, применяют катализаторы и т. д.
О процессе, в котором из трех элементарных стадий гетероген-
ного процесса наиболее медленно протекает диффузия, говорят, что
он происходит вдиффузионной области. Как бы быстро ни
протекала реакция, но если подвод реагентов осуществляется мед-
ленно, то и общая скорость процесса будет мала. Коэффициент мас-
сопередачи в этом случае зависит от скорости диффузии реагентов.
Для повышения общей скорости процесса, протекающего в диффу-
зионной области, необходимо принимать меры к ускорению диф-
фузии— повышать скорости потоков взаимодействующих фаз,
увеличивать перемешивание реагентов, менять условия, влияющие
на вязкость, плотность и другие физические свойства среды, от ко-
торых зависит скорость диффузии.
Когда скорости химической реакции и диффузии приблизительно
равны, говорят, что процесс протекает в переходной области.
Для ускорения такого процесса необходимо повышать и скорость
химической реакции, и скорость диффузии.
Как видно, в зависимости от области протекания гетерогенного
процесса применяют различные средства для его ускорения. При
определении области, в которой протекает процесс, следует иметь
в виду, что скорость химической реакции резко возрастает с увели-
чением температуры, в то время как на скорость диффузии темпе-
ратура не оказывает существенного влияния.
Для определения области протекания процесса его проводят при
различных все возрастающих температурах. При этом общая ско-
рость процесса может либо увеличиваться, либо оставаться практи-
чески постоянной. Повышение общей скорости процесса при повы-
шении температуры происходит только для процесса, протекающего
в кинетической области, за счет увеличения скорости самой медлен-
ной его стадии — химической реакции. Если же с увеличением тем-
пературы общая скорость процесса практически не увеличивается,
то это значит, что она зависит не от скорости химической реакции,
а от скорости диффузии (на скорость диффузии температура почти
не влияет) — процесс идет в диффузионной области.
Таким образом, для увеличения скорости гетерогенных процес-
сов необходимо:
1) увеличивать поверхность соприкосновения фаз (независимо
от области протекания процесса);
2) увеличивать движущую силу процесса (независимо от облас-
ти его протекания) , для чего:
49
Рис. 11. Реактор фильт-
рующего, или стационар-
ного, слоя:
t — решетка, 2 — слой твер-
дых частиц
а) повышать действующую концентрацию вещества в передаю-
щей фазе (давление в газовой фазе);
б) принимать меры к снижению равновесной концентрации ве-
щества в воспринимающей фазе;
3) увеличивать коэффициент массопередачи, для чего:
а) при протекании процесса в кинетической области применять
средства, увеличивающие скорость химической реакции — повышать
температуру, концентрации реагирующих
веществ, применять катализаторы и т. д.;
б) при протекании процесса в диффузи-
онной области принимать меры к увеличе- .
нию диффузии — повышать скорость пото-
ков взаимодействующих фаз, увеличивать
перемешивание и т. д.
Аппаратурное оформление гетерогенных
процессов. Конструкция реакторов, приме-
няемых для проведения гетерогенных про-
цессов, должна обеспечивать создание боль-
шой поверхности контакта между вещест-
вами, находящимися в различных агрегат-
ных состояниях. Необходимо также доби-
ваться усиленного перемешивания реаген-
тов, что приводит к обновлению поверхно-
сти контакта фаз и улучшению условий
диффузии.
Реакторы, в которых происходит обработка систем Г — Т и Ж —
Т, можно разделить на четыре группы.
Аппараты фильтрующего, или стационарного,
слоя (рис. 11). На решетке 1 покоится неподвижный слой твердых
частиц 2, через который пропускается поток газа или жидкости.
Аппараты этого типа отличаются простотой конструкции, однако в
них отсутствует обновление поверхности соприкосновения фаз, нель-
зя использовать твердый материал высокой степени измельчения и
большие скорости газового потока, так как это повышает расход
энергии на подачу газа или жидкости через слой твердого материа-
ла. В аппаратах с фильтрующим слоем затруднен отвод или подвод
тепла, необходимого для проведения реакции.
Аппараты с мешалками (рис. 12). На рис. 12, а приве-
дена схема аппарата с мешалкой для систем Ж — Т. В ряде случаев
несколько таких аппаратов соединены последовательно, образуя
каскад реакторов. На рис. 12, б представлена схема одного из аппа-
ратов для обработки систем Г — Т. Он представляет собой верти-
кальный цилиндр 1, внутри которого находятся горизонтальные сво-
ды 3. В центре аппарата установлен вал 4. На валу горизонтально
расположены гребки 5 с насаженными на них лопатками (зубьями).
Во время работы вал с гребками врашается и не только перемеши-
вает твердый материал, находящийся на сводах, но и перемещает
его с верхнего свода на нижний через отверстия в сводах 6. Газ по-
дается снизу и движется противотоком по отношению к твердому
50
материалу. Получаемые газообразные продукты реакции выводятся
из аппарата сверху, твердые — снизу. Такого типа аппараты приме-
Рис. 12. Реакторы с мешалкой:
а — для системы Ж—Т, б — для системы Г—Т; /— цилиндр, 2 —
мешалка. 3 — своды, 4 — вал, 5 — гребки, 6 — отверстия в сводах
няются, например, в сернокислотной промышленности для обжига
колчедана (механические печи).
В аппаратах с мешалками обеспечивается непрерывное обновле-
ние поверхности контакта фаз, ко-
торое ускоряет диффузионные про-
цессы. Вместе с тем данные аппара-
ты, особенно для системы Г—Т,
сложны по устройству и не обеспе-
чивают высокой степени превраще-
ния исходного сырья.
Аппараты, в которых про-
исходит взаимодействие
фаз в потоке (рис. 13). Аппара-
ты для системы Г—Т представляют
собой полые камеры, в которые че-
рез пневматические сопла подводит-
ся газообразный реагент, распыляю-
щий тонкоизмельченный твердый
материал. В потоке между газом и
твердым материалом протекает хи-
мическое взаимодействие. Отделе-
ние твердых продуктов от газооб-
Твердый
материал
Рис. 13. Реактор для взаимодейст-
вия фаз в потоке для системы Г—Г
разных происходит под действием
силы тяжести. Аппараты этого типа
отличаются простотой конструкции.
Благодаря развитию поверхности
51
соприкосновения фаз реакция в потоке протекает с большой ско-
ростью, что обусловливает высокую интенсивность реактора. Су-
щественным недостатком этих аппаратов является унос твердых
частиц газовым потоком, что приводит к загрязнению газообраз-
ных продуктов реакции и потере твердых.
Аппараты «кипящего», или псевдоожиженного,
слоя (рис. 14). В этих аппаратах образуется «кипящий» слой при
пропускании газа или жидкости снизу вверх через слой твердого
материала с такой скоростью, при которой частицы взвешиваются,
плавают и пульсируют в потоке газа или жидкости, но не покидают
пределов взвешенного слоя. Твердый материал непрерывно пода-
Рис. 14. Реактор «кипящего» слоя
Рис. 15. Башня с насадкой
ется на решетку, под которую поступает воздух со скоростью, обес-
печивающей переход частиц в состояние псевдоожижения. Темпера-
тура «кипящего» слоя постоянна, при этом в слое можно регулиро-
вать температуру, устанавливая внутри него теплообменники.
Применение псевдоожиженного слоя особенно перспективно для
процессов, скорость которых определяется диффузионным сопро-
тивлением в газовой фазе. Эти сопротивления в условиях псевдо-
ожижения уменьшаются в десятки, а иногда и в сотни раз, что
соответственно увеличивает скорость процесса.
Аппараты, в которых процессы протекают в системах Г — Ж,
делятся на четыре группы.
Поверхностные и пленочные абсорберы — аппа-
раты, в которых газ проходит над поверхностью неподвижной или
медленно текущей жидкости: зеркало жидкости служит поверхно-
стью массообмена. В пленочных абсорберах газ и жидкость сопри-
касаются на поверхности пленки, стекающей по вертикальной по-
верхности, представляющей собой трубу или пластины.
52
Насадочные аппараты (рис. 15)—колонны, загружен-
ные насадкой различной формы. Жидкость подается на насадку
сверху и стекает вниз по насадке, образуя на ее поверхности пленку
жидкости. Газ обычно подается в башню или колонну снизу про-
тивотоком к стекающей жидкости. Соприкосновение газа с жидко-
стью происходит на смоченной поверхности насадки.
Рис. 16. Барботажные колонны — ситчатая (а) и колпачко-
вая (б):
/ — ситчатая тарелка (решетка), 2—переливная трубка, 3— колпач-
ковая тарелка, 4—колпачок
Барботажные аппараты — колонны, где газ соприка-
сается с жидкостью при пробулькивании (барботаже) пузырьков
газа через слой жидкости. Для лучшего разбивания потока газа
на мелкие пузырьки в аппарат вводят ситчатые полки (решетки)
(рис. 16, а) или колпачковые тарелки (рис. 16, б).
Аппараты с распылением или разбрызгива-
нием жидкости в объеме (потоке) газа, в которых
обеспечивается развитие поверхности контакта фаз (рис. 17).
53
В системах Ж—Ж (несмешивающиеся жидкости) поверхность
контакта фаз развивается в результате диспергирования на капли
одной жидкой фазы в другой в распылителях, насадочных, тарель-
чатых или других типах аппаратов.
В системах Т—Т применяется перемешивание при помощи ме-
ханических и пневматических мешалок и вращающихся барабанов.
Вращающийся полый барабан (рис. 18) установлен под небольшим
углом. Барабан при помощи насажен-
ного на него зубчатого колеса приво-
дится во вращение от привода. Сырье
поступает в барабан через питатель.
При вращении барабана материал пе-
ремещается к разгрузочному отвер-
стию. Аппарат обогревается дымовыми
газами, движущимися противотоком
реагентам или омывающими его сна-
ружи.
Жидкость
Рис. 17. Башня с разбрызгива-
нием жидкости
Рис. 18. Вращающийся барабан:
1 — питатель, 2 — зубчатое колесо, 3 — барабан
§ 11. Каталитические процессы
Многие реакции протекают очень медленно. Однако их можно
ускорить введением катализаторов — веществ, присутствия
которых достаточно для того, чтобы реакция протекала с высокой
скоростью. При этом катализаторы остаются неизменными.
Процессы, скорость которых увеличивают с помощью катализа-
торов, называются каталитическими. Каталитические про-
цессы нашли чрезвычайно широкое распространение в промышлен-
ной практике — в настоящее время около 90% промышленных про-
54
цессов каталитические. Сюда относятся производства водорода,
аммиака, феноло-формальдегидных смол и многие другие.
Следует отметить, что катализаторы используюся главным об-
разом для ускорения реакций. Процесс, в котором катализаторы
используются для ускорения реакций, называется положи-
тельным катализом. Имеются случаи применения катализа-
торов для замедления процессов (например, окислительных) —та-
кой катализ называется отрицательным.
Процесс, в котором катализатор и реагенты находятся в одном
агрегатном состоянии, например реагенты и катализатор жидкие
или газообразные, называют гомогенным каталитиче-
ским. В случае, когда реагенты и катализатор — в различном аг-
регатном состоянии, например реагенты газообразные, а катализа-
тор твердый или же реагенты газообразные, а катализатор жид-
кий, речь идет о гетерогенном катализе.
Различные катализаторы ускоряют один и тот же процесс в раз-
ной степени. Мера ускоряющего действия катализатора по отно-
шению к данной реакции называется активностью катализатора.
Следовательно, чем выше активность катализатора, тем в большей
степени он увеличивает скорость реакции, и поэтому реакции в при-
сутствии катализатора могут быть проведены с большой скоростью
при низких температурах.
Минимальная температура, при которой в присутствии данного
катализатора процесс протекает с достаточной скоростью для его
промышленного применения, называется температурой за-
жигания катализатора.
Как указывалось выше, катализаторы остаются неизменными
после реакции, т. е. их свойства и состав не меняются. Практиче-
ски, в реальных условиях, катализатор в процессе работы посте-
пенно'теряет способность ускорять реакции. Другими словами, ак-
тивность катализаторов снижается и даже возможна полная поте-
ря активности — катализатор дезактивируется. Дезактива-
ция катализаторов вызывается его «отравлением» некоторыми
веществами, которые присутствуют в реагентах, вступающих во вза-
имодействие. Такие вещества называются контактными яда-
ми. Следовательно, для того чтобы катализатор работал
длительное время, необходима тщательная очистка реагентов от
контактных ядов.
Гомогенно-каталитические процессы. Гомогенно-каталитический
процесс схематически можно представить следующим образом.
Пусть в газовой фазе должна пройти реакция между веществами
А и В с образованием продукта АВ:
А А-В = АВ. (111,23)
»
Для ускорения реакции ее ведут в присутствии катализатора К,
благодаря которому процесс пойдет по другому пути, а именно ве-
щество А взаимодействует с катализатором К:
А + К. = АК. (Ш.24)
55
При этом образуется соединение АК, которое в свою очередь всту-
пает в реакцию с В:
АК + В = АВ + К. (111,25)
Таким образом, путь реакции изменился: по реакции (III, 24) об-
разовалось промежуточное соединение АК, по реакции (III, 25) —
вещество АВ и в результате катализатор оказался неизменным.
Скорость реакций (III, 24) и (III, 25) значительно выше скорости
реакции (III, 23), и потому благодаря присутствию катализатора
вещество АВ образуется с высокой скоростью.
Скорость гомогенно-каталитического процесса возрастает с уве-
личением активности катализатора, повышением температуры, кон-
центрации реагирующих веществ и катализатора; иногда она рас-
тет при перемешивании реагентов.
Гетерогенно-каталитические процессы. Гетерогенно-каталити-
ческие процессы нашли широкое применение в промышленности.
Наибольшее распространение получили процессы с использованием
твердых катализаторов для проведения реакций между газообраз-
ными веществами — водорода с азотом с образованием аммиака,
двуокиси серы с кислородом с получением трехокиси серы и мно-
гие другие.
В присутствии твердых катализаторов процесс протекает сле-
дующим образом: сначала реагенты диффундируют к поверхности
катализатора, затем они проникают в поры катализатора и осажда-
ются— адсорбируются на его поверхности. На поверхности катали-
затора протекает реакция между реагентами. Образовавшиеся
продукты реакции диффундируют через поры катализатора к его
поверхности и с поверхности катализатора в окружающий его объ-
ем. Скорости отдельных стадий такого процесса различны. Анало-
гично тому как это делалось для гетерогенного некаталитического
процесса (см. с. 49), необходимо рассмотреть и определить наибо-
лее медленную стадию гетерогенного каталитического процесса,
от которой зависит его общая скорость (лимитирующую стадию).
Если наиболее медленной стадией оказывается стадия диффузии,
то это значит, что процесс протекает в диффузионной обла-
сти. Такой процесс можно ускорить, если увеличить скорость диф-
фузии. Для этого целесообразно перемешивать реагенты, что при-
ведет к ускорению диффузии, или приготовить катализатор с боль-
шими порами для облегчения проникновения газов внутрь частицы
катализатора.
Если же скорость процесса определяется скоростью химической
реакции, т. е. процесс протекает в кинетической области,
для его интенсификации следует повысить температуру и концент-
рацию реагирующих веществ.
В случае, когда наиболее медленная стадия — адсорбция, целе-
сообразно увеличить концентрацию реагентов и пористость катали-
затора.
Показатели процесса. Для обеспечения полноты протекания ре-
акции необходимо, чтобы реагирующие вещества достаточно долго
56
соприкасались с катализатором. Это характеризуется временем
соприкосновения (временем контактирова-
ния). Длительность соприкосновения с катализатором определя-
ется объемной скоростью, которая показывает, какое коли-
чество объемов газа в кубических метрах (при температуре 0°С и
давлении 760 мм рт. ст.) проходит в течение 1 ч через 1 м3 катали-
затора.
Чем более полно проходит реакция на катализаторе, тем выше
производительность, или и
лизатора, под которой понимают
граммах, получаемое с 1 м3 ката-
лизатора в течение 1 ч. В про-
мышленной практике всегда не-
обходимо вести процесс так, что-
бы производительность катализа-
тора была возможно выше.
нтенсивность, к а т а -
количество продукта в кило-
рат:
катализатор, 2 — полка, 3 — тепло-
обменники
Продукты
реакции
Реагенты
Рис. 19. Емкостный
контактный аппарат:
1 — решетка, 2 — слой
катализатора
Промышленные катализаторы. Большей частью это смеси, назы-
ваемые контактными массами. В состав контактных масс
входят вещества — собственно катализаторы, носители и промо-
торы.
Катализаторы — это окислы металлов: железа, алюминия,
кобальта и др.; железо, медь и другие металлы, некоторые соли;
хлорная ртуть, алюмосиликаты и другие вещества.
Носители — пемза, асбест, каолин, уголь и другие высоко-
пористые вещества, которые увеличивают пористость катализато-
ра, делают его прочным и снижают его стоимость.
Промоторы повышают активность катализатора. К ним ОТ-
57
носятся, например, окислы калия, кальция, алюминия и некоторые
другие вещества.
Аппаратурное оформление гетерогенно-каталитических процес-
сов. Для осуществления гетерогенно-каталитических процессов ис-
пользуют различного типа реакторы, называемые контактными
аппаратами.
Емкостные аппараты — металлические, цилиндриче-
ские (рис. 19), имеют решетку 1, на которой находится слой ката-
лизатора 2. Газы проходят через контактный аппарат снизу вверх,
как показано на рисунке, или же сверху вниз. Аппараты такого типа
отличаются простотой, их применяют, например, в нефтеперераба-
тывающей промышленности.
Полочные контактные аппараты (рис. 20) и^еют
ряд полок 2, на которых покоится катализатор 1. Между полками
находятся теплообменники 3. Обычно эти аппараты используются
для проведения реакций, протекающих с выделением тепла
(экзотермических). Реакционные газы, прежде чем попасть
на катализатор, находящийся на верхней полке, проходят
последовательно через межтрубное прост-
ранство теплообменников 3 и нагрева-
ются. На верхней полке протекает экзотер-
мическая реакция, и температура газа по-
вышается. Далее горячие газы попадают в
трубки теплообменника 3, где они охлажда-
Продукты реакции
Рис. 21. Трубчатый контактный ап-
парат:
/ — трубки с катализатором, 2 — меж-
трубное пространство
Рис. 22. Контактный аппа-
рат с «кипящим» слоем ка-
тализатора:
1 — катализатор, 2— полки, 3 —
змеевики
58
Катализатор
Реагенты
Про^кты
реакции
Рис. 23. Схема рабо-
ты контактного аппа-
рата с движущимся
катализатором:
1 — контактный аппа-
рат, 2 — генератор
ются, так как в его межтрубном пространстве движутся более хо-
лодные газы. Газовая смесь из трубок теплообменника поступает
в следующий слой катализатора и затем для охлаждения в следую-
щий теплообменник. Пройдя последовательно все слои катализато-
ра и теплообменники, она выводится из реактора. Таким образом
поддерживается определенная температура в каждом слое контакт-
ной массы и используется тепло реакции для нагрева газов, идущих
на катализ. Аппараты этого типа используют при окислении дву-
окиси серы в трехокись, синтезе аммиака из
азота и водорода и во многих других процессах.
Трубчатые контактные аппара-
ты (рис. 21) по конструкции аналогичны
трубчатым теплообменникам. В трубках 1, по
которым проходят реакционные газы, находит-
ся катализатор. Если реакция идет с поглоще-
нием тепла, то в межтрубное пространство 2
подают греющие газы для поддержания в труб-
ках необходимой температуры.
Трубчатые контактные аппараты использу-
ются в азотной и других отраслях промышлен-
ности.
Аппараты с «кипящим» слоем
катализатора (рис. 22) имеют ряд по-
лок 2, на которые загружают мелкозернистый
катализатор 1. Снизу в реактор с большой
скоростью подают газообразные реагенты, ко-
торые, проходя через катализатор, приводят
его в состояние «кипения» — частицы поднима-
ются и перемешиваются. Слой по внешнему
виду напоминает кипящую жидкость. В каж-
дом слое «кипящего» катализатора протекает
ная смесь выводится из аппарата сверху. Отвод тепла реакции или
подвод необходимого для реакции тепла может быть осуществлен
с помощью змеевиков 3, погруженных в слой катализатора.
Аппараты этого типа отличаются простотой конструкции и вы-
сокой производительностью. Они используются в сернокислотной,
нефтеперерабатывающей и других отраслях промышленности.
Аппараты с движущимся катализатором
(рис. 23) используют в тех случаях, когда катализатор в процессе
работы быстро теряет активность и его необходимо регенериро-
вать для восстановления его каталитических свойств. Реактор со-
стоит из двух частей. Сверху располагается контактный аппарат 1,
снизу — регенератор 2. Катализатор поступает в контактный аппа-
рат сверху и непрерывно перемещается сверху вниз. Противоточно
ему движутся реагенты.
Продукты реакции выводятся из аппарата сверху. Из контакт-
ного аппарата дезактивированный катализатор попадает в регене-
ратор 2, где он также движется сверху вниз. Катализатор, актив-
. Реакцион-
59
ность которого в регенераторе восстановлена, подается вновь, на
верх контактного аппарата.
Контактные аппараты этого типа нашли применение в процес-
сах переработки нефти и нефтепродуктов. 9
§ 12. Высокотемпературные процессы
В химической технологии существует много процессов, для ко-
торых основным способом увеличения скорости реакций и смещения
равновесия является повышение температуры. Их проводят при
высокой температуре и поэтому называют высокотемпера-
турными.
Это могут быть экзотермические процессы, которые приходится
проводить при относительно большой температуре для поддержа-
ния высокой скорости химического превращения. Но в основном
это эндотермические процессы, для которых повышение темпера-
туры является чрезвычайно эффективным и незаменимым средст-
вом, так как одновременно увеличивает как скорость процесса, так
и выход продукта.
В промышленности при высоких температурах проводят много-
численные реакции, требующие для своего осуществления большого
количества тепла. Это могут быть реакции термической диссоциа-
ции и расщепления молекул, например разложение карбоната каль-
ция на окись кальция и углекислый газ, или отщепления молекул
воды от гидроокиси алюминия при получении корунда.
К высокотемпературным процессам относят также получение
различных металлов из их окислов, например чугуна, стали, цвет-
ных металлов.
При высоких температурах проводят и многочисленные процес-
сы переработки топлив, как твердых, так и жидких, — коксование
угля, крекинг (расщепление) жидких нефтепродуктов или газов.
Высокие температуры являются иногда единственным средством
осуществления процессов между несколькими твердыми вещест-
вами. Повышение температуры в этих случаях позволяет изменить
фазовое состояние реагирующих веществ, т. е. перевести твердые
вещества в расплав, создать условия для хорошего перемешивания
реакционной смеси в аппаратах, увеличить скорость процесса.
С описанными явлениями мы встречаемся, например, при про-
изводстве стекла, получении многих металлов, когда при высокой
температуре происходит полное расплавление твердых реагентов, а
также при производстве керамики и вяжущих веществ, когда осу-
ществляется спекание и сплавление продуктов.
Высокотемпературные процессы осуществляются в различных
аппаратах — печах, контактных аппаратах, котлах, автоклавах и
др., но основными аппаратами для их проведения являются про-
мышленные печи.
Пр омышленная печь — аппарат, в котором вырабатыва-
ется тепло, необходимое для проведения высокотемпературного
процесса. Применяемые в промышленности печи исключительно
60
разнообразны. Однако во всех печах тепловую энергию получают
одним из трех следующих способов: при сжигании топлива (твер-
дого, жидкого и газообразного), из электрической энергии или за
счет тепла самой химической реакции, происходящей в аппарате.
Отличаются печи и по способу нагрева.
В печах прямого нагрева источник тепловой энергии,
или горячий газ, соприкасается с нагреваемыми материалами либо
тепловая энергия выделяется
Рис. 24. Шахтная печь:
1 — стальной кожух, 2 — футеров-
ка, 3 — загрузочная коробка с за-
твором, 4 — обрабатываемый ма-
териал
в самих материалах.
В печах косвенного на-
грева источник тепловой энергии
и нагреваемый материал разделены
стенкой, через которую происходит
передача тепла.
С учетом названных отличитель-
ных признаков ниже описывается
устройство наиболее часто встре-
чающихся промышленных печей.
Печи, где необходимая высокая
температура достигается за счет
тепла происходящей реакции, есте-
ственно, могут быть использованы
Рис. 25. Электрическая печь со-
противления косвенного нагрева:
1 — стальной кожух, 2—огнеупорная
футеровка, 3 — сопротивление (уголь-
ный стержень), 4 — нагреваемый ма-
териал
только в том случае, если в печи происходят экзотермические про-
цессы с большим тепловыделением. Это, например, печи для обжи-
га колчедана или других сернистых руд (описание конструкции пе-
чей см. на с. 78).
Топливные печи, в которых для создания высокой температуры
сжигается разнообразное топливо, имеют различную конструкцию.
Часто используют барабанные вращающиеся печи (для
получения цемента, разложения бикарбоната натрия в производст-
ве соды), где нагрев производится горячими газами, соприкасаю-
щимися с реагентами (см. с. 164). Для обжига огнеупоров при-
меняют туннельные печи (с. 159), где обогрев осуществля-
ется при сжигании газообразного топлива.
Широкое распространение получили шахтные печи для вы-
плавки чугуна, обжига известняка, обжига сульфидных руд
61
(рис. 24). Рабочее пространство такой печи образует высокую шах-
ту круглого или прямоугольного сечения. В шахту печи сверху за-
гружается кусковой обжигаемый материал вместе с твердым топли-
вом (шихта). Шихта медленно перемещается вниз. В нижнюю
часть печи подаются газы, которые движутся вверх навстречу твер-
дому материалу и реагируют с ним.
Шахтные печи, как и барабанные и туннельные, относятся к пе-
чам прямого нагрева, однако высокая температура создается здесь
не горячими газами, а за счет сжигания топлива (кокса), входящего
в состав шихты. При окислении кокса выделяется большое коли-
чество тепла, необходимое для проведения процесса.
Рис. 26. Электрическая печь сопро-
тивления прямого нагрева:
1 — стальной кожух, 2 — огнеупорная
футеровка, 3 — электроды, 4 — обжи-
гаемый материал
Рис. 27. Электрическая дуговая
печь косвенного нагрева:
1 — кожух печи, 2 — футеровка, 3 —
электроды, 4 — дуга, 5 — уровень рас-
плавленного металла
Из топливных печей косвенного нагрева широко применяются
трубчатые печи для переработки жидких топлив — нефти и нефте-
продуктов, а также коксовые печи для переработки твердых топ-
лив. В трубчатых печах тепло, полученное в результате сжигания
топлива, передается через стенки металлических трубок, по кото-
рым перемещаются перерабатываемые продукты. Конструкция
этих печей подробно описывается на с. 193.
В коксовых печах тепло передается через стенки камеры, в ко-
торую загружено твердое топливо, подлежащее переработке (см.
с. 176).
В электрических печах тепловая энергия вырабатывает-
ся из электрической. Наиболее часто применяются электрические
печи сопротивления и дуговые.
В печах сопротивления тепло вырабатывается при про-
хождении электрического тока через сопротивление. При этом в
печах косвенного нагрева (рис. 25) таким сопротивлением может
служить металлическая проволока или лента, а также стержни из
электропроводного материала. Выделяющаяся при прохождении
по ним тока тепловая энергия передается нагреваемому материалу.
В печах сопротивления прямого нагрева (рис. 26) проводником
тока служит сам нагреваемый материал, обладающий большим со-
62
противлением. При пропускании тока тепло выделяется в самом ма-
териале.
В дуговых печах тепловая энергия образуется путем соз-
дания электрической дуги при пропускании электрического тока.
При этом в печах косвенного нагрева (рис. 27) дуга создается меж-
ду двумя электродами, и материал нагревается за счет тепла излу-
чения дуги. В печах же прямого нагрева электрическая дуга обра-
зуется между электродами в слое нагреваемого материала.
§ 13. Материальные и энергетические балансы
Для количественной оценки и анализа процессов, для сравнения
отдельных способов производства, а также выбора реакционных и
других аппаратов проводятся технологические расчеты. Составля-
ются материальные и энергетические балансы, которые отражают
количественные изменения, происходящие в процессе, и позволяют
определить его характеристики: расход сырья и энергии, количест-
во получаемых отходов, качество производимых продуктов, основ-
ные размеры аппаратуры, транспортные устройства и т. п.
Материальный баланс основан на законе сохранения массы. Для
технологического процесса это означает, что масса веществ, по-
ступивших на технологическую операцию, т. е. приход GnpaXj ра-
вен массе полученных веществ, т. е. расходу Gpacx:
Gnpax ~ Gpacx • (111,26)
Материальный баланс составляют по уравнению суммарной реак-
ции с учетом параллельных и побочных реакций.
В производственной практике приходится иметь дело не с чисты-
ми веществами, а с сырьем сложного состава, поэтому сравнивают
(балансируют) по данным анализов массу основных компонентов
и примесей с массой основного получаемого продукта, побочных
продуктов и отходов производства.
Большей частью определяют массу вещества отдельно для твер-
дой, жидкой и газовой фаз. Таким образом, уравнение материаль-
ного баланса имеет вид
GT+G»+Gr = G;+G;+G;, (шд?)
где GT, Gm, Gr — соответственно масса поступивших твердых, жид-
ких и газообразных материалов; G', G’*, G'r — массы продуктов
производства.
В практических расчетах не всегда присутствуют все три фазы,
может быть несколько веществ в какой-либо одной фазе, и тогда
уравнение (III, 27) соответственно упрощается или усложняется.
Материальный баланс составляют из расчета расхода сырья и
получения побочных продуктов на единицу основного продукта
(кг/т, кг/моль) или относят к единице времени (час, сутки, месяц).
Ниже показан порядок составления материального баланса на
примере процесса обжига серного колчедана. Серный колчедан, по-
63
лезнои составляющей частью которого является двусернистое желе-
зо FeS2, окисляется в печи обжига кислородом воздуха по урав-
нению
4 FeS2 + 11 О2 = 2 Fe2O3 + 8 SO2 + Q (111,28)
Для составления материального баланса необходимо учесть ко-
личество всех веществ, подаваемых в печь обжига (статьи прихо-
да), а также выходящих из нее (статьи расхода), и внести в табли-
цу. Статьями прихода в рассматриваемом процессе являются кол-
чедан, воздух, а также влага, всегда присутствующая в них.
Статьи расхода — огарок, получающийся по реакции и содер-
жащий в основном Fe2O3, а также печной газ — газовая смесь, со-
стоящая из SO2, SO3, О2, N2, паров воды (табл. 1).
Таблица 1. Материальный баланс печи обжига колчедана
(производительность 20 т/ч H2SO4)
Приход Количество Расход Количество
кг м3 кг м3
Колчедан Влага с колчеданом 18 020 560 — Огарок Обжиговый газ: so2 13 560 13 780 4 700
Воздух сухой 70 250 54 400 SO, 940 260
Влага с воздухом 510 634 azo м N 0 6 360 53 700 1060 4 440 42 920 1 320
Всего . . 89 400 55 034 Всего . . . 89 400 53 600
Для расчета всех этих величин необходимо знать стехиометри-
ческое уравнение, описывающее реакцию, производительность ус-
тановки, состав перерабатываемых продуктов, а также полноту ис-
пользования исходного сырья. На основе таких данных составлен
материальный баланс, приведенный в таблице. Все величины рас-
считаны на 1 ч работы печи, т. е. баланс составлен на единицу вре-
мени.
Энергетический баланс составляют на основе закона
сохранения энергии. Для химико-технологических процессов боль-
шей частью составляют тепловой баланс, применительно к.
которому закон сохранения энергии формулируется следующим об-
разом: количество тепла, поступившего на технологическую опера-
цию, т. е. приход тепла Qnpnx, равно расходу его Qpacx в той же
операции:
Qnpax = Qpacx- (III.29)
Тепловой баланс составляют на основании данных материально-
го баланса, тепловых эффектов химических реакций и физических
64
превращений, протекающих в аппарате, с учетом подвода тепла
извне и отвода его с продуктами реакции и через стенки аппарата.
Отсюда уравнение теплового баланса:
QT+Qr+Qi«+Qp+Q<t>+Qii=Q T + Qr+Q ж +QP4-Qф+<2п (Ш>30)
где QT, Q», Qr — тепло, вносимое с поступающими в аппарат
твердыми, жидкими и газообразными продуктами; Q Q' —
тепло выходящих продуктов; Qp, Qp — тепло соответственно экзо-
и эндотермических реакций; фф, (?ф— тепло физических процессов,
соответственно протекающих с выделением и поглощением тепла;
Qn — тепло, подаваемое извне; Q'n — потери тепла в окружающую
среду и отвод его через холодильники, помещенные внутри аппа-
рата.
Контрольные вопросы
1. Каким основным требованиям должен удовлетворять любой химико-тех-
нологнческий процесс?
2. Какие условия ведения процесса называют оптимальными?
3. Из каких основных стадий складывается химико-технологнческнй процесс?
4. По каким признакам классифицируют химические реакции? Какие основ-
ные типы химических реакций вам известны? Приведите примеры.
5. Какие процессы называются обратимыми и необратимыми? Приведите
примеры.
6. Какие системы называются гомогенными? Гетерогенными? Приведите при-
меры двух гомогенных и двух гетерогенных реакций, о которых не упоминалось
в тексте.
7. Для каких процессов применим принцип Ле-Шателье?
8. Какие факторы влияют на положение равновесия?
9. Как влияет температура на обратимые экзотермические и эндотермические
процессы?
10. Как влияет давление на равновесие обратимого процесса, протекающего
в газовой фазе с уменьшением объема?
11. Как влияет концентрация исходных веществ иа смещение равновесия?
12. От каких основных факторов зависит скорость химического процесса?
13. Объясните, почему получение аммиака в промышленности проводят при
относительно высокой температуре (около 550°С), хотя синтез аммиака из азота
и водорода является экзотермической реакцией.
14. Реакция между водородом и хлором с образованием хлористого водо-
рода протекает следующим образом:
^2(г) ^2(г) 2НС1(г) -f- 185 кДж
Какие три вывода можно сделать из этого уравнения реакции?
15. Каким образом можно сместить равновесие обратимых экзотермических
реакций синтеза аммиака и конверсии окиси водорода?
16. Почему при проведении в промышленности реакции между твердым веще-
ством и газом или жидкостью стремятся создать большую поверхность твердого
вещества?
17. Как увеличивается поверхность соприкосновения фаз в гетерогенных си-
стемах Г—Т, Ж—Т, Г-Ж?
18. Из каких стадий состоит гетерогенный процесс?
19. Как увеличить скорость гетерогенного процесса, протекающего в кинети-
ческой области? В диффузионной?
20. Какой температурный режим является нанлучшнм при проведении обра-
тимых экзотермических реакций? Обратимых эндотермических? Необратимых
реакций?
3—275
65
21. Каково назначение катализатора?
22. Что понимают под «отравлением» катализатора?
23. Рассмотрите реакцию
4НС1 + O2(r) 2HtO(r) + 2С12(г, + 113 кДж
Какое влияние иа равновесную концентрацию Clz будут оказывать:
а) повышение температуры в реакционном сосуде;.
б) уменьшение общего давления;
в) увеличение концентрации О2?
Ответ обоснуйте.
Глава IV
ТИПОВЫЕ МЕТОДЫ ОРГАНИЗАЦИИ
ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ
Химическая промышленность производит тысячи разнообраз-
ных продуктов, обладающих различными свойствами и применяе-
мых во многих отраслях хозяйства.
Несмотря на многообразие химических продуктов, условий про-
ведения процессов, применяемых реакционных и нереакционных
аппаратов, химико-технологические процессы имеют общие законо-
мерности, позволяющие определять необходимые условия их про-
ведения. Общность имеется и в организации процессов.
Технологические схемы. Производство химических продуктов,
как правило, включает ряд физических и химических процессов:
подготовку сырья к переработке, транспортировку реагирующих ве-
ществ (перемещение их из аппарата в аппарат), проведение хими-
ческих реакций, разделение полученных продуктов, их хранение и
упаковку и т. д. Последовательное описание и графическое изобра-
жение всех стадий переработки исходных веществ в продукты про-
изводства и аппаратов, применяемых для этой цели, называется
технологической схемой производства.
При всей сложности химико-технологических процессов и схем
можно выделить типовые, наиболее часто встречающиеся в произ-
водственных условиях.
Как правило, химико-технологический процесс складывается из
трех стадий: подготовки сырья, химических превращений и выде-
ления целевых продуктов (схема 8).
[Ыочные продукты
Сырье Химические L_J Разделение Целевой
иооютоока превращения продукт! продут
ЦепреВращенное
сырье
Схема 8. Схема с открытой цепью
Подготовка сырья. Требования, предъявляемые к сырью,
зависят от вида химического производства. В одних случаях удоб-
но перерабатывать сырье в твердом виде, в других — в виде раство-
66
ра, расплава или газа. Для одних химико-технологических опера-
ций целесообразнее перерабатывать твердое сырье в виде мелких,
для других — в виде крупных кусков. Часто химическая переработ-
ка сырья становится возможной лишь после повышения концентра-
ции полезного компонента в нем (концентрирования сырья).
Первая стадия химико-технологических процессов — подготовка
сырья решает задачу доведения его до такого состояния, при кото-
ром состав сырья и свойства будут отвечать требованиям данного
производства, обеспечивать высокую скорость химических превра-
щений. Для многих видов сырья предъявляемые к нему требова-
ния закреплены государственными общесоюзными стандартами
(ГОСТами) или техническими условиями (ТУ).
Подготовка сырья включает операции измельчения, концентри-
рования, сушки, удаления пыли из газов и т.п. Те или иные опера-
ции подготовки сырья применяют в зависимости от конкретных тре-
бований последующего этапа — стадии химических превращений.
Химические превращения. На этой стадии компоненты
сырья вступают между собой в химическое взаимодействие, в ре-
зультате которого происходит образование новых веществ.
Основные закономерности химических процессов, рассмотрен-
ные ранее (см. с. 46), позволяют определить условия, обеспечиваю-
щие высокую интенсивность их протекания.
В большинстве случаев в результате химических превращений
не удается получить чистый продукт. Он может быть смешан с ча-
стично непрореагировавшим сырьем; если по реакции получается
не один продукт, а несколько, то целевой (нужный нам) продукт
будет смешан с рядом побочных продуктов, которые в данном про-
цессе не используются. Поэтому целевой продукт необходимо выде-
лить из смеси продуктов.
Выделение пелевых продуктов осуществляется
ректификацией, абсорбцией, адсорбцией, кристаллизацией, выпа-
риванием и т. п.
Ректификацией можно разделять однородные смеси, со-
стоящие из жидкостей, кипящих при разных температурах. Если,
например, нагреть и частично испарить жидкость, состоящую из
этилового спирта и воды, то спирт будет легче испаряться, чем во-
да, так как он кипит при более низкой температуре. Поэтому спир-
та в парах будет больше, чем в исходной жидкой смеси. Если эти
пары отделить, снова охладить и превратить в жидкость (сконден-
сировать), то содержание спирта в ней также будет больше, чем в
исходной смеси. При повторении тех же операций (испарения и
конденсации) с обогащенной спиртом жидкостью можно получить
продукт с еще большим содержанием спирта. Именно такой про-
цесс и происходит при ректификации, когда в ректификационной
колонне при подогреве жидкости многократно повторяются частич-
ное испарение смеси и конденсация паров.
Абсорбция — поглощение газа жидкостью — применяется
для разделения газовых смесей, в состав которых входят газы, по-
разному поглощающиеся жидкостью. Процесс связан с переходом
3*
67
вещества из газовой фазы в жидкую. Его осуществляют в абсорб-
ционных колоннах, где газовую смесь приводят в соприкосновение
с жидкостью. Жидкость подбирают таким образом, чтобы она по-
глощала только те газы, которые нужно выделить из смесн. Осталь-
ные газы, не способные поглощаться выбранной жидкостью, уда-
ляются из колонны. Например, если требуется удалить углекислый
газ из газовой смеси азота с водородом, смесь пропускают через
колонну, в которую подают воду. В воде растворяется только угле-
кислый газ н из колонны выходит очищенная от углекислого газа
смесь, состоящая нз азота н водорода.
Процесс, при котором для разделения газовых или жидких сме-
сей используют не жидкий, а твердый поглотитель, называют ад-
сорбцией. Этот процесс разделения характеризуется переходом
вещества из газовой или жидкой фазы в твердую.
Кристаллизацией можно выделить вещество из раствора
или расплава в твердом виде. Подбирают такие условия, при ко-
торых снижается растворимость вещества, вследствие чего оно из
жидкой фазы выделяется в виде кристаллов.
При выпаривании разделение веществ происходит за счет
перехода одного вещества из жидкости в паровую фазу. Из схемы
8 (с. 66) следует, что сырье и получаемые продукты последователь-
но проходят через все этапы переработки. Для проведения каждо-
го этапа могут быть необходимы несколько аппаратов. Например,
при подготовке сырья нужны транспортеры для его перемещения,
дробилка, приводимая в действие от электрического мотора, сита
для разделения измельченного сырья на фракции с различными
размерами кусков н т. д.
Таким образом, при организации технологического процесса в
соответствии со схемой 8 обрабатываемые материалы проходят по-
следовательно все аппараты каждого этапа схемы, переходя из од-
ного аппарата в другой и пребывая в каждом из них лишь один
раз. Такая технологическая схема называется схемой с откры-
той цепью.
Для многих процессов за один проход исходных реагентов через
реакционный аппарат нельзя достигнуть высокой степени их пре-
вращения. Примером может служить обратимая экзотермическая
реакция: когда такую реакцию вынуждены проводить при повышен-
ной температуре, получают неполное превращение сырья в продук-
ты реакции.
Поэтому для повышения степени превращения исходных ве-
ществ организуют производство по циклической (циркуля-
ционной) схеме (схема 9). После прохождения реагентов
Схема 9. Циклическая схема
68
через аппараты стадии химических превращений отделяют полу-
ченный продукт от непревратившегося сырья. Это сырье смешива-
ют с вновь поступающим и возвращают для повторной химической
обработки.
Схемы, где на повторную переработку подается все непрореаги-
ровавшее сырье, называются схемами с полной рециркуляцией.
В схемах с частичной рециркуляцией в реактор возвращается лишь
часть непрореагировавшего сырья.
Циклические схемы производства широко применяются для
синтеза аммиака, метанола и других соединений. Установки, рабо-
тающие по циклической схеме, более компактны, они включают
меньше аппаратов, обеспечивают большую полноту переработки
исходных веществ в продукты по сравнению со схемами с открытой
цепью. Циркуляцию применяют и в тех случаях, когда хотят воз-
вратить в процесс какое-нибудь вспомогательное вещество, выде-
ляющееся в конце процесса и используемое на начальных стадиях
процесса, например аммиак в содовом производстве (см. с. 121).
В химической промышленности широко применяют циркуляцию
воды, водяных паров или холодильных растворов, когда они высту-
пают в роли переносчиков тепла. Это особенно интересно в случае
проведения процессов при высоких температурах и давлениях,
осуществление которых связано со значительными расходами
энергии.
Вместе с тем источниками тепла могут служить химические ре-
акции, протекающие с выделением тепла. Представим себе, что
протекает экзотермическая реакция например
N2-t-3H2^2NH3+Q. Для обеспечения большой скорости реакции
требуется высокая температура, например для получения аммиака
температура 500°С. Достигнуть столь, высокой температуры без
подвода тепла в реактор извне можно, если реагенты поступят в
него предварительно нагретыми. Что же можно использовать в ка-
честве теплоносителя? Для нагрева реакционных газов могут слу-
жить горячие продукты реакции. В данном случае, как и в других,
процесс складывается из известных уже этапов: подготовки сырья,
химических превращений и разделения продуктов. На стадии под-
готовки сырье нагревается продуктами, выходящими из реактора.
На схеме 10 представлен такой процесс: сырье поступает для под-
готовки в теплообменник (рекуператор), откуда в нагретом состоя-
нии направляется на стадию химических превращений, протекаю-
Подочные продукты
Схема 10. Схема с автотермическим химическим превращением.
69
щих с выделением тепла. Продукты реакции отдают тепло в тепло-
обменнике и направляются на разделение. Таким образом, химиче-
ская реакция протекает при высокой температуре без затраты тепла
извне. Такие процессы называются автотермичными.
Тепло реакции может быть применено не только для нагрева,
но и для производства в котлах-утилизаторах пара, энергия кото-
рого может быть использована. Так, приведенная выше реакция
синтеза аммиака протекает с уменьшением объема. Следовательно,
исходя из принципа Ле-Шателье ее нужно проводить при высоких
давлениях. В этом случае тепло реакционных газов рекуперируют
не только для нагрева поступающих продуктов, но и для получения
пара. Подобная схема, называемая энерготехнологичес-
кой, изображена ниже (схема 11).
Турбина
Схема 11. Энерготехнологическая схема
Стадия подготовки состоит из двух этапов — сжатия газов и их
нагрева. Сжатые и нагретые газы поступают на стадию химическо-
го превращения, после которого они проходят через котел-утилиза-
тор и теплообменник. В котле-утилизаторе вода превращается в
пар. Последний попадает на лопатки турбины, находящейся на од-
ном валу с турбокомпрессором, сжимающим поступающую на син-
тез реакционную смесь. Продукты реакции после котла-утилиза-
тора проходят через теплообменник, отдают свое тепло сжатым
газам и направляются на разделение. Подобное построение схемы
не только позволяет значительно увеличить энергетический коэф-
фициент полезного действия, но в ряде случаев получать необходи-
мую в производстве дополнительную энергию. Энерготехнологиче-
ские схемы в настоящее время реализованы в промышленности, в
частности, при получении аммиака, серной кислоты и других про-
дуктов. Они показали высокую эффективность и получают все
большее распространение в промышленной практике.
Как указывалось, технологическая схема включает ряд аппара-
тов, через которые проходят обрабатываемые материалы. Эти ап-
параты работают периодически или непрерывно, они могут быть
соединены между собой параллельно или последовательно.
70
В гетерогенных процессах потоки реагирующих фаз могут иметь
различное направление.
Периодические и непрерывные процессы. Технологические про-
цессы на всех стадиях химического производства по характеру вве-
дения исходных материалов в аппарат и вывода из него продуктов
подразделяются на периодические и непрерывные.
Периодическими называют такие процессы, при которых
в аппарат сразу загружают определенное количество исходных ве-
ществ, после чего в течение заданного времени происходит их об-
работка, по завершении которой аппарат разгружают. Затем снова
повторяют все три операции: загрузку, обработку сырья, выгрузку
и т. д.
В периодических процессах при загрузке исходных веществ н
выгрузке продукта аппарат не работает (простаивает), т. е. время
работы аппарата используется нерационально. Кроме того, пере-
рывы в работе аппарата часто сопровождаются большими непроиз-
водительными потерями тепла или других видов энергии. При пе-
риодических процессах трудно обеспечить получение продуктов
одинакового качества, эти процессы сложно механизировать и ав-
томатизировать.
Но иногда выгодно проводить процесс периодически, например
при небольшой производительности установки. В таких условиях
периодический процесс отличается лучшими экономическими пока-
зателями по сравнению с непрерывными процессами.
Непрерывными называют такие процессы, при которых
одновременно и непрерывно осуществляются следующие операции:
поступление исходных веществ в аппарат, их обработка и вывод
продуктов. При непрерывных процессах нет непроизводительной
траты времени на остановку аппарата, загрузку сырья и выгрузку
продуктов. Некоторые процессы протекают непрерывно не только
круглые сутки, но и месяцы, а иногда и годы. Поэтому непрерыв-
ные процессы по сравнению с периодическими в большинстве слу-
чаев экономически более выгодны и высокопроизводительны: они
позволяют получить высокий выход и однородное качество продук-
тов, их легче механизировать и автоматизировать, они обеспечи-
вают непрерывность и постоянство условий протекания процесса.
Этими преимуществами непрерывных процессов объясняется
то, что в современной передовой технике периодические процессы
заменяются непрерывными.
Параллельные и последовательные соединения. В ряде случаев
та или иная операция в технологических процессах может осущест-
вляться одновременно в одном или нескольких аппаратах. В зави-
симости от распределения перерабатываемых материалов разли-
чают параллельные и последовательные соединения аппаратов
между собой. Например, для переработки большого количества
сырья необходим аппарат такого большого объема, что установка
его будет затруднена: в нем трудно будет обеспечить необходимый
режим работы, например температуру, степень смешения реаген-
тов, равномерную их подачу по сечению аппарата и т. д. В этом
71
случае целесообразна установка нескольких аппаратов, общий
объем которых равен объему одного большого. Аппараты могут
быть соединены параллельно (см. схему 12, а) йТПГ по^ёдовател*ь-
но2_(схёмаГ12, б).ДПри параллельном соединении поток
\роодукты
Сырье
Реактор
ф Реактор
0)
Реактор
Продукты
Схема 12. Способы соедииеиия аппаратов
непрерывно поступающего сырья разделяется и в каждый из ап-
паратов поступает только часть его. Если высота аппаратов оди-
накова, т. е. одинаково в них время пребывания сырья, достигается
и одинаковая степень превращения. Из каждого аппарата выводят-
ся продукты переработки, которые далее объединяются в один
общий поток. При последовательном соединении ре-
акторов перерабатываемое сырье проходит один за другим все
аппараты. В каждом аппарате происходит переработка сырья и по
мере его движения увеличивается степень превращения. В резуль-
тате на выходе из последнего аппарата достигается степень пре-
вращения такая же, какая была бы получена в единичном реакто-
реДдлина которого равна суммарной длине реакторов, соединенных
последовательно. .
Направление потоковАНепрерывные гетерогенные процессы под-
разделяют в зависимости от характера перемещения взаимодейст-
вующих фаз на прямоточные и противоточные.
В прямоточных процессах (рис. 28, а) взаимодействую-
щие фазы движутся в одном направлении. Таким образом, в аппа-
рат обе фазы поступают с высокой концентрацией содержащихся в
них реагентов. Вместе с тем на выходе из аппарата концентрация
реагирующих веществ становится небольшой. Поэтому на входе в
аппарат достигается большая скорость процесса, но по мере про-
хождения потоков через аппарат она резко снижается и на выходе
из аппарата становится незначительной. Средняя скорость пре-
вращения при прямоточной подаче реагирующих веществ относи-
тельно невысокая.
72
Газ
Жидкость
Газ
С
Твердое
Жидкость
Твердое
При противотоке (рис. 28, б) на входе и выходе из аппара-
та свежий реагент, находящийся в одной фазе, встречается с отра-
ботанным реагентом, содержащимся в другой фазе. Это приводит
к тому, что на входе в аппарат и на выходе из него движущая сила
процесса оказывается примерно одинаковой и нет такого резкого
изменения скорости процесса, как при прямотоке. Средняя скорость
противоточного процесса выше,
чем прямоточного. Противо-
точные процессы обеспечивают
большую полноту взаимодейст-
вия реагирующих веществ, поэ-
тому при организации техноло-
гических процессов стремятся
обеспечить взаимодействие фаз
гетерогенной системы по прин-
ципу противотока.|
Противотоком осуществля-
ют многочисленные процессы
абсорбции, встречающиеся в
различных производствах, ког-
да в поглотительные башни
сверху подается жидкость, а
снизу навстречу ей движутся
поглощаемые газы. Обжиг
твердых материалов, а также
сушку во вращающихся труб-
чатых печах, обогреваемых то-
почными газами, проводят в
основном по принципу противо-
тока.
Прямоточные процессы
применяют главным образом в
тех случаях, когда из-за специ-
фики взаимодействия реаги-
рующих веществ невозможно использовать противоток, например
при сушке аммиачной селитры нагретым воздухом. При сушке
аммиачной селитры по принципу противотока нагретый воздух
встречался бы с уже высушенной и нагретой аммиачной селитрой,
выходящей из аппарата. Это привело бы к разложению части се-
литры и увеличению потерь продукта.
Жидкость
Рис. 28. Схема направления потоков:
а — прямоток, б — противоток
Глава V
ПРОИЗВОДСТВО СЕРНОЙ кислоты
§ 14. Свойства и применение серной кислоты
Серная кислота — один из важнейших продуктов химической
промышленности. Безводная сериая кислота, или моногидрат,—
это маслянистая жидкость, более тяжелая, чем вода. Плотность
73
серной кислоты (масса 1 мл ее при 0°С) равна 1,84 г/см3; в этих же
условиях плотность воды составляет 1 г/см3.
Серная кислота отличается высокой химической активностью —
очень легко вступает в химические реакции. Она энергично реаги-
рует с металлами, вытесняет другие кислоты из их солей, очень
жадно соединяется с водой. Дерево, другие растения, а также жи-
вые ткани быстро разрушаются серной кислотой и при этом чер-
неют. Работающие с серной кислотой должны соблюдать особую
осторожность.
Высокая химическая активность серной кислоты дает возмож-
ность получать из нее или с ее помощью другие вещества.
Серную кислоту используют буквально во всех отраслях хими-
ческой промышленности. Она служит одним из главных химиче-
ских продуктов, определяющих развитие химической промышлен-
ности,— недаром называют ее «хлебом химии». В химической
промышленности серную кислоту используют для производства
удобрений — суперфосфата, сульфата аммония, аммофоса и др.
В СССР около половины вырабатываемой кислоты расходуется на
производство удобрений.
Серная кислота необходима для получения красителей, пласти-
ческих масс, химических волокон, фармацевтических препаратов.
Значительные количества серной кислоты расходуются при получе-
нии нефтепродуктов — жидких топлив, смазочных масел.
Потребление серной кислоты не исчерпывается химической про-
мышленностью. Выделение металлов из руд в металлургии, трав-
ление металлов на машиностроительных заводах, обработка волок-
на и тканей разбавленными растворами серной кислоты перед кра-
шением на текстильных фабриках, получение крахмала, патоки и
спирта на предприятиях пищевой промышленности — вот неполный
перечень областей использования серной кислоты в различных от-
раслях промышленности. Серная кислота имеет большое значение
и для оборонной промышленности — ее применяют при производ-
стве взрывчатых веществ и порохов (схема 13).
50,
Взрывчатые
Вещества
Очистка
нефтепродуктов
Пластические
массы
Эфиры и
'Металлургия
Минеральные
пигменты
Сернокислые соли
V.tfe,a,lntPtudp
Сульфат
аммония
Фосфорная
и другие
кислоты
Cynepipoctpam
Схема 13. Области применения серной кислоты
Большая нужда в серной кислоте определила масштабы ее про-
изводства. Мировое производство серной кислоты составляет
74
Таблица 2. Сорта серной кислоты
Кислота Содержание, масс. %
H.SO. so,
Контактная: техническая «... 92,5
техническая улуч- шенная «•••««' 92,5—94
Олеум 81,5 18,5
Башенная 75,0 —
около 100 млн. т в год. По масштабам производства серной кисло-
ты СССР занимает второе место в мире.
Серная кислота, исполь-
зуемая в промышленности,
называется технической.
Она представляет собой
растворы серной кислоты в
воде. Содержание (концент-
рация) серной кислоты в
этих растворах может быть
различной: так, башенная
кислота содержит 75—
78% H2SO4 и 22—25% Н2О.
Вырабатываемая в больших
количествах контактная
кислота — более концентрированная и чистая, чем башенная,—
в ней 92,5% H2SO4 и 7,5% Н2О. Значительное использование полу-
чили также растворы серного ангидрида (SO3) в серной кислоте,
называемые олеумом. В олеуме содержится 18—20% SO3, ос-
тальное— H2SO4. В табл. 2 приведена характеристика сортов сер-
ной кислоты, вырабатываемой в промышленности.
§ 15. Сырье для производства серной кислоты
Процесс получения серной кислоты протекает по двум реак-
циям:
2 SO2-|-О2 = 2 SO3 (V.1)
SO3+H2O = H2SO4 (V.2)
Реакция (V, 1) описывает окисление сернистого ангидрида, в ре-
зультате чего получается серный ангидрид. Вторая реакция (V, 2)
показывает взаимодействие серного ангидрида и воды с получени-
ем серной кислоты. Из уравнений (V, 1) и (V, 2) следует, что для
получения серной кислоты необходимы кислород, получаемый из
воздуха, вода и сернистый ангидрид.
Следовательно, первым сырьевым материалом для производст-
ва серной кислоты является воздух, вторым — вода, третьим — сер-
нистый ангидрид. Откуда же берут сернистый ангидрид? Сырьем
для получения сернистого ангидрида, а следовательно, и серной ки-
слоты служит сера или материалы, в состав которых входит сера.
Сера — твердое желтое вещество, имеющее температуру плавле-
ния 113°С и кипящее при 444,6°С. Сера встречается в природе в так
называемых серных рудах, в которых она смешана с другими ве-
ществами. При нагревании серной руды сера, расплавляясь, вы-
текает из нее. На этом принципе основан один из методов извле-
чения ее из серных руд.
Богатые залежи серы расположены на Украине, в Средней Азии.
Развитие процессов получения серы из отходящих газов увеличи-
75
вает значение серы для отечественной сернокислотной промышлен-
ности.
Серный колчедан — желтовато-серый с блестящими вкрапле-
ниями камень. В состав колчедана входит минерал пирит FeS2. Со-
держание серы в колчедане колеблется от 35 до 50%, а железа —
от 30 до 43%. Остальное составляют примеси — соединения меди,
цинка, свинпа, мышьяка, селена и др.
Советский Союз располагает мощными месторождениями сер-
ного колчедана на Урале и на Кавказе. Добытый на рудниках этих
месторождений колчедан в виде кусков различной величины достав-
ляют на химические заводы. Такой колчедан называют рядовым.
Помимо этого, серный колчедан может быть получен из медных
руд, идущих на производство меди и имеющих в своем составе
FeS2. При переработке медной руды на специальных предприяти-
ях— обогатительных фабриках получают продукт, в котором содер-
жится много меди (медный концентрат), и отход (флотационные
хвосты), богатый серным колчеданом. Медный концентрат посту-
пает на медеплавильные заводы, а отход производства — флотаци-
онные хвосты, являющиеся важнейшим сырьем для производства
серной кислоты, — на химические заводы. Таким образом, мы ви-
дим, что медные руды используются комплексно.
Газы металлургических печей, в которых перерабатывают ру-
ды меди, цинка и других цветных металлов, содержат сернистый
ангидрид. Эти газы, выходя из печей, загрязняют атмосферный воз-
дух, губят растительность и вредно отражаются на здоровье людей.
Из этих газов может быть получена сера по реакциям:
2 H2S 4- О2 = S2 + 2Н2О (V.3)
2 CS2 + 2SO2 = 3S2 4- 2СО3 (V,4)
4 СО 4- 2 SO2 = S2 4- 4CO2 (V,5)
Использование отходящих газов цветной металлургии имеет
большое народнохозяйственное значение, так как позволяет одно-
временно решить две задачи — получение серной кислоты без за-
трат колчедана или серы и обезвреживание атмосферы.
Сероводород извлекают из газов, получаемых при химической
переработке углей и нефти. Его окисляют кислородом воздуха до
сернистого ангидрида:
2 H,S 4- ЗО2 = 2 SO2 4- 2 Н2О (V.6)
или до элементарной серы:
2 H,S + О2 = 2S + 2 Н2О (V.7)
Полученные при этом SO2 или серу используют для производства
серной кислоты.
76
§ 16. Производство сернистого газа
Переработка серы. Для получения сернистого газа серу сжигают
в воздухе. При этом происходит реакция
S + О2 = SO2 (V.8)
Сжигание серы проводят в простых по устройству печах и получа-
ют сернистый газ, не загрязненный вредными примесями.
Печь для сжигания серы (рис. 29) представляет собой стальной
цилиндр 2, футерованный огнеупорным кирпичом 3. Расплавленная
сера подается воздухом через форсунку 1 в печь. Для лучшего сме-
шения продуктов внутри печи имеются перегородки 4. При высокой
температуре в печи сера загорается — образуется факел горящей
Жидкая
сера
1
J
Газ
Воздух для горения
серы
Рис. 29. Печь для сжигания серы:
1 — форсунка, 2— стальной горизонтальный цилиндр,
3 — футеровка из огнеупорного кирпича, 4 — перегородки
серы. Горение серы происходит во всем объеме печи и заканчива-
ется в камерах, образованных перегородками 4, куда подается до-
полнительное количество воздуха. Из этих камер выводится горя-
чий печной газ, содержащий сернистый ангидрид.
Переработка серного колчедана. Этот процесс описывается ре-
акцией
4 FeS2 + 11 О2 = 2 Fe2O3 + 8 SO2 + 3324 кДж (V.9)
При взаимодействии FeS2 с кислородом воздуха, как видно из
реакции (V, 9), выделяется значительное количество тепла, в ре-
зультате чего температура в печи, в которой проводится процесс,
повышается до 700—800°С. Продуктами обжига колчедана являют-
ся обжиговый, или печной, газ, который содержит примерно 8—10%
SO2, около 10—11% кислорода, а остальное азот, поступивший в
печь с воздухом, и колчеданный огарок — красно-коричневый про-
дукт, в основном состоящий из окиси железа.
Обжиг колчедана протекает интенсивно при высоких температу-
рах, так как при этом увеличивается скорость реакции. Обжиг кол-
чедана — это гетерогенный процесс, и поэтому для его интенсифи-
кации необходимо иметь возможно большую поверхность соприкос-
новения между частицами колчедана и воздуха. Этого достигают
77
измельчением колчедана и его перемешиванием в воздушном пото-
ке в процессе обжига.
Измельчение колчедана, если он поступает на завод в виде круп-
ных кусков, сначала производится в щековых дробилках
(рис. 30, а). Дробилка имеет две плиты, или «щеки», из которых од-
на 1 неподвижная, а вторая 5 — подвижная. Колчедан подается в
пространство между плитами. Подвижная щека, подвешенная на
стальном валу 3, периодически приближается к неподвижной и раз-
давливает колчедан, находящийся между ними. После щековой
дробилки куски колчедана еще относительно велики, и он поступа-
Рис. 30. Схема процесса из-
мельчения колчедана:
а — в щековых дробилках, б —
в валковых дробилках; 1 — не-
подвижная щека, 2 — колчедан,
3 — стальной вал, 4 — маховое
колесо, 5 — подвижная щека.
6 — валки
Рис. 31. Печь «кипящего» слоя:
1 — камера, 2 —решетка
ет для окончательного измельчения в валковую дробилку
(рис. 30, б), в которой куски материала раздавливаются между
двумя вращающимися навстречу друг другу стальными цилиндра-
ми (валками^.
Обжиг колчедана производится в печах различной конструкции
при температуре около 800°С. Наибольшее распространение полу-
чили печи «кипящего» слоя.
Печь «кипящего» слоя КС (рис. 31) представляет собой полую
вертикальную камеру 1, в нижней части которой находится решет-
ка 2 (наподобие колосниковой). На решетку непрерывно поступа-
ет мелкораздробленный колчедан, а под решетку вдувается воздух.
Воздух проходит через отверстия решетки с большой скоростью,
поднимает и перемешивает находящийся на решетке колчедан.
78
Слой колчедана напоминает по внешнему виду кипящую жидкость
(откуда и название — печь «кипящего» слоя). Температура в печи
около 800°С. Сверху из печи отводится обжиговый газ, а через пе-
реточную трубу — огарок. В печи «кипящего» слоя можно обжигать
100 т колчедана в сутки.
Газ, выходящий из обжиговых печей, уносит мелкие частицы
огарка. Чтобы не загрязнить получаемую в дальнейшем кислоту и
не засорять аппаратуру, обжиговый газ очищают от пыли.
Очистка обжигового
газа от пыли. Наиболее
успешно этот процесс
осуществляется в элект-
рофильтрах, принцип дей-
ствия которых представ-
лен на рис. 32. Электро-
фильтр питается постоян-
ным током высокого на-
пряжения 60000—70000
В. В поле постоянного то-
ка такого напряжения
пылинки получают отри-
цательный электрический
заряд и движутся к поло-
жительно заряженному
электроду, разряжаются
на нем и падают. Очищен-
ный от пыли обжиговый
газ содержит около 9%
SOo, 9—10% О2 и около
80% N2.
Огарок. Образующийся при обжиге колчедана огарок содержит
до 50% Fe. На 1 т серной кислоты получается около 0.6 т огарка.
Таким образом, количество огарка составляет миллионы тонн в год
и он может быть использован для производства чугуна. Однако
удаляемый из обжиговых печей огарок непригоден непосредственно
для доменного процесса — он очень мелкий и содержание в нем
цветных металлов превышает нормы, допустимые для доменного
процесса. Поэтому перед тем как передать огарок на доменную
плавку, его подвергают предварительной обработке. Огарок может
быть также использован в производстве цемента, для получения
минеральных красок и др.
II
Рис. 32. Электрофильтр
§ 17. Переработка сернистого газа в серную кислоту
Производство серной кислоты из сернистого газа заключается
во взаимодействии сернистого газа и кислорода, содержащихся в
обжиговом газе (реакция V, 1). В результате этого процесса обра-
зуется серный ангидрид SO3, который затем поглощается водой с
получением серной кислоты (реакция V, 2).
79
Первая реакция в обычных условиях протекает крайне медлен-
но. В зависимости от способа окисления SO2 в SO3 серную кислоту
получают двумя способами.
Нитрозный способ. Нитрозный способ производства серной кис-
лоты предусматривает использование для окисления сернистого ан>-
гидрида окислов азота. Этот процесс протекает по следующим ре-
акциям;
I
so2 +NO2 =SO3 + NO (V,10)
SO3 + H2O= H2SO4 (V,ll)
1 NO + 0,5 O2 = NO2 (V.12)
Реакция (V, 10) описывает окисление двуокисью азота сернистого
ангидрида до серного, который затем по реакции (V, 11) поглоща-
ется водой, н образуется серная кислота.
Окись азота, получаемая по реакции (V, 10), окисляется кисло-
родом, содержащимся в печном газе, до двуокиси азота (реакция
V, 12), используемой для окисления SO2 в SO3 по реакции (V, 10).
Таким образом, окислы азота теоретически в процессе не расходу-
ются.
Уравнения (V, 10) и (V> 12) описывают процессы протекающие
в газовой фазе. Как показали исследования, большая часть SO2
окисляется в жидкой фазе. Этот процесс протекает через ряд ста-»
дий. Сначала окислы абсорбируются (поглощаются) серной ки-
слотой:
/ОН
2 H2SO4 + NO + NO2 = 2 SO2 + H2O (V, 13)
\no2
нитрозилсерная
кислота
Образовавшаяся нитрозилсерная кислота находится в серной
кислоте в растворенном состоянии. Раствор нитрозилсерной кисло-
ты в серной называется нитрозой. Далее нитрозилсерная кисло-
та взаимодействует с водой — этот процесс называют денитра-
цией:
/ОН
SO2 + Н2О = H2SO4 4- HNO2 (V,14)
^NO,
Сернистый ангидрид, находящийся в печном газе, реагирует с
водой с образованием сернистой кислоты:
SO2 + Н2О = H2SO3 (V.15)
которая затем окисляется азотистой кислотой, образовавшейся по
80
реакции (VI, 14), и получается серная кислота:
H2SOs + 2 HNO2 = HZSO4 + 2 NO + H2O (V, 16)
Рис. 33. Башня с насадкой:
1 — стальной кожух, 2— футеровка, 3 —решетка,
4 — насадка
Концентрация получаемой серной кислоты 75%. Окись азота по ре-
акции (V, 12) окисляется кислородом печного газа до двуокиси азо-
та, которая используется для получения нитрозы по реакции
(V, 13).
Таким образом, теоретически окислы азота не расходуются.
Практически происходит некоторая потеря окислов азота с отходя-
щими газами, которая ком-
пенсируется введением в си-
стему азотной кислоты. От-
ходящие газы нитрозных си-
стем, окрашенные окислами
азота в коричневый цвет
(так называемый «лисий
хвост»), загрязняют и отрав-
ляют атмосферу.
Схематически нитрозный
способ получения серной ки-
слоты изображен в табл. 3.
Реакции (V, 13) — (V, 16)
осуществляют в башнях с
насадкой. Поэтому установ-
ки, работающие по нитроз-
ному методу, часто называв
ют башенными, а получае-
мую в них 75%-ную кисло-
ту — башенной.
Башни^с насадкой широ-
ко распространены в хими-
ческой, ^топливной, метал-
лургической и других отрас-
лях промышленности. Это
цилиндрические аппараты
(рис. 33) диаметром 2—6 и
высотой 16—20 м, имеющие
крышкой.
В сернокислотном производстве башня имеет стальной кожух 1.
Серная кислота разрушает металл кожуха, и поэтому изнутри баш-
ня выложена кислотоупорными плитками 2. Снизу башни имеется
решетка 3 из кислотоупорного материала, на которую загружена
насадка 4, представляющая собой керамические цилиндрики —
кольца Рашига. Как видно из рисунка, газ подается снизу, жид-
кость сверху, т. е. они движутся противотоком. Кислота отбирается
из башни снизу, а газ выводится сверху.
Контактный способ. Этот способ производства серной кислоты
описывается двумя показанными ранее реакциями:
снизу днище и закрытые сверху
81
2 S02 + 02 = 2 S03 (V,l)
S03 4- H20 = H2SO4 (V,2)
Окисление сернистого ангид-
рида в серный в обычных услови-
ях не происходит, так как эта ре-
акция протекает с очень малой
скоростью. Для ее ускорения ис-
пользуют ванадиевый катализа-
тор, содержащий пятиокись вана-
дия V2O5. Иногда катализаторы
называют «контактами». Отсюда
и метод называют контактным ме-
тодом производства серной кисло-
ты.
Катализатор работает дли-
тельное время без замены его
свежим при условии очистки об-
жигового газа не только от пыли,
но и от вредных примесей, таких,
как Аз20з, SeO2, паров воды, ко-
торые попадают в него из колче-
дана при обжиге.
Очистка обжигового газа
(рис. 34) начинается с удаления
пыли в электрофильтре. Затем
газ поступает в промывные баш-
ни 1, 2, которые орошаются раз-
бавленной серной кислотой. Кис-
лота охлаждает газ и растворяет
соединения мышьяка и селена, ча-
стично освобождая от них газ.
При промывке газа разбавленной
серной кислотой образуется ту-
манообразная серная кислота, со-
держащая АзгОз. Если частицы
тумана попадут на катализатор,
то они «отравят» его и катализа-
тор выйдет из строя. Поэтому ча-
стицы тумана удаляют в так на-
зываемом «мокром» электро-
фильтре 3, принцип действия ко-
торого такой же, как и у электро-
фильтра для осаждения пыли —
частицы тумана в поле высокого
напряжения ионизируются и раз-
ряжаются на электроде. Пройдя
«мокрый» электрофильтр, газ ос-
вобождается от водяных паров в
82
Таблица 3. Производство серной кислоты иитрозиым способом
насадочной башне 4, орошаемой концентрированной серной кисло-
той. Эта башня называется сушильной. После нее газ передается
через теплообменник 6 в контактный аппарат 7 для окисления
SO2 в SO3.
Окисление SO2 в SO3 представляет собой обратимую реакцию,
83
протекающую с выделением тепла:
2SOa -fc О2 2SO3 + 190 кДж (V, 17)
Рис. 35. Контактный аппарат:
1 — катализатор, 2 — полка, 3 — теплообменники
Как известно, в этом случае, для того чтобы сдвинуть равновесие
реакции слева направо, целесообразно проводить процесс при низ-
ких температурах. Однако при низких температурах реакция будет
протекать с очень малой скоростью и поэтому степень превращения
SO2 в SO3 окажется очень небольшой. Исходя из этого находят
такую температуру, при которой скорость реакции будет высокой
и достаточно высокой
окажется степень превраще-
ния сернистого ангидрида в
серный. Такая температура
называется оптимальной;
для реакции (V, 17) она со-
ответствует примерно 440—
450°С. Нагревают газ до
этой температуры в трубча-
том теплообменнике.
Поскольку реакция (V,
17) обратима, начинают про-
цесс при высокой температу-
ре для обеспечения высокой
скорости и постепенно сни-
жают ее для сдвига равнове-
сия в сторону образования
трехокиси серы. Этому спо-
собствует специальное
оформление конструкции
контактного аппарата.
Контактный аппарат
(рис. 35) имеет полки 2, на
которые насыпан катализа-
тор 1. Между полками с ка-
тализаторами находятся
трубчатые теплообменники
3. Газ поступает в аппарат
снизу и последовательно
проходит через межтрубное
пространство теплообменни-
ков, где нагревается до
450°С в результате теплооб-
мена с газами, прошедшими
через катализатор. При температуре 450°С газ поступает в первый
слой контактной массы. Здесь протекает реакция образования
SO3 (V, 17), при которой происходит выделение тепла, и темпера-
тура газа повышается.
Газ, выходящий из первого слоя контактной массы 1, попадает
в трубки верхнего теплообменника 3, где он охлаждается идущим
84
Таблица 4. Производство серной кислоты контактным способом
Процесс | Что происходит В каких аппаратах
Подготовка газа
-
Окисление сернистого ангидрида
4
Поглощение
серного
ангидрида
водой
Удаление пыли из
i газа
Охлаждение газа и
удаление вредных при-
месей
Нагревание газа
2 SO2 + О2 = 2 SOs
Охлаждение газов
SO2 + Н2О = H2SO4
Охлаждение кислоты
85
на контактирование газом, находящимся в межтрубном простран-
стве. После этого газ проходит во второй слой контактной массы 1,
в ротором происходит реакция (V, 17), вновь нагревается, затем от-
дает тепло во втором теплообменнике и т. д. Таким образом созда-
ется необходимый температурный режим окисления сернистого
ангидрида.
В настоящее время строятся контактные аппараты высокой мощ-
ности— производительностью 1000—1200 т H2SO4 в сутки.
Для получения серной кислоты необходимо поглотить серный
ангидрид водой (реакция V, 2) или серной кислотой. Для этого го-
рячий газ, выходящий из контактного аппарата с температурой око-
ло 450°С, охлаждается в трубчатом холодильнике 8 (см. рис. 34) и
поступает в абсорберы 9, 10, орошаемые серной кислотой. Из баш-
ни вытекает либо концентрированная (контактная) кислота, либо
олеум, получающийся в результате растворения серного ангидри-
да в серной кислоте.
Схематически контактный метод получения серной кислоты
представлен в табл. 4.
Можно сравнить способы получения серной кислоты, рассмот-
рев показатели нитрозного и контактного способов получения сер-
ной кислоты, которые приведены в табл. 5.
Таблица 5. Сравнение нитрозного и контактного способов
производства серной кислоты
Показатель Нитрозный способ Контактный способ
Концентрация кислоты, масс. % Примеси Расход энергии, кВт ч/т . . . Стоимость 1 т, руб. ..... 75 Соединения мышьяка, । окислы азота 30—40 21—100 92,5—94 Олеум, 18,5—20 SOs 60—100 29—60
Из табл. 5 следует, что при контактном процессе получается ки-
слота более концентрированная и чистая, но более дорогая, чем
при нитрозном способе. Контактная кислота используется при по-
лучении химических волокон, пластических масс, красителей, эти-
лового спирта и др. Башенная кислота применяется главным обра-
зом там, где не требуется кислота высокой концентрации, например
при производстве удобрений.
§ 18. Концентрирование серной кислоты
Для большинства производств, потребляющих серную кислоту,
требуется концентрированная кислота. Перевозка на дальние рас-
стояния слабой кислоты, например башенной, невыгодна, так как
такая кислота содержит только 75% полезного вещества, осталь-
ные 25% составляет вода. Такую кислоту, как правило, стремятся
86
использовать на том предприятии, где ее производят, или подвер-
гают концентрированию.
Концентрирование, проводимое для удаления воды, содержа-
щейся в кислоте, осуществляется путем нагревания слабой серной
кислоты, в результате которого происходит испарение воды и ки-
слота концентрируется. Источником тепла обычно служат горячие
топочные газы, получаемые при сжигании угля, мазута, природно-
го газа. Аппарат для концентрирования кислоты называется кон-
центратором.
Рис. 36. Барабанный концентратор:
/ — горизонтальный барабан, 2 — футеровка (андезит), 3 — труба, 4 — перегородки
Барабанный концентратор, получивший наибольшее распрост-
ранение в промышленности (рис. 36), представляет собой горизон-
тальный стальной барабан 1, футерованный кислотоупорным ма-
териалом (андезитом) 2. Внутри цилиндр разделен перегородками
4 на три камеры. Топочные газы поступают по трубе 3 в камеру 1
и из нее последовательно проходят камеры II и III. Слабая кисло-
та подается в камеру III и движется противотоком к топочным га-
зам через камеры II и I. Поскольку трубы, по которым проходят
газы, погружены в кислоту, происходит барботаж (пробулькива-
ние) их через кислоту. Газы отдают тепло кислоте, и она концент-
рируется до 92—93%.
§ 19. Материалы для изготовления аппаратуры
в сернокислотном производстве
При выборе материалов для изготовления аппаратуры в серно-
кислотном производстве следует учитывать их стойкость к разру-
шению (коррозии) серной кислотой и образующимися газообраз-
ными продуктами, а также устойчивость при высокой температуре.
Почти все аппараты в производстве серной кислоты изготавлива-
ют из стали и чугуна и в большинстве случаев футеруют кислото-
87
упорными материалами—керамикой, природными кислотоупорами,
например, андезитом, каменным литьем, кислотоупорным бето-
ном, органическими кислотоупорными покрытиями — пластически-
ми массами (фаолитом, винипластом, полиизобутиленом и др.).
§ 20. Хранение и транспортирование серной кислоты
На складе серную кислоту хранят в стальных баках, размещен-
ных в здании или под навесом, предохраняющим верхнюю часть
баков от атмосферных осадков. На дальние расстояния серную ки-
слоту перевозят в железнодорожных цистернах грузоподъемностью
до 60 т. При отправке небольших партий серной кислоты пользуют-
ся автоцистернами, контейнерами, стальными бочками емкостью
до 0,2—1 т или стеклянными бутылями емкостью 30—45 л, которые
помещают в корзины или обрешетки. Промежуток между бутылью
и обрешеткой заполняют соломой или древесной стружкой.
§ 21. Перспективы развития производства серной кислоты
В нашей стране развернулось огромное строительство новых
сернокислотных заводов. Намечаемые по плану масштабы произ-
водства серной кислоты таковы, что прежние мощности аппаратов
не в состоянии обеспечить их. Поэтому встал вопрос о разработке
новых, более упрощенных технологических схем производства и
конструкций аппаратов большой мощности и интенсивности (на-
пример, контактных аппаратов производительностью 1200 т кисло-
ты в сутки и более).
Серьезной задачей является максимальная механизация и ав-
томатизация производства. Сернокислотные заводы должны быть
полностью автоматизированы. Следует усовершенствовать контакт-
ную массу для сернокислотной промышленности. Необходимо сни-
зить температуру ее работы, повысить ее прочность. Представляет
интерес использование газа, содержащего высокий процент SO2,
что позволит интенсифицировать процесс.
Немаловажное значение имеет создание герметичной сернокис-
лотной аппаратуры и устранение выбросов вредных для здоровья
газов в атмосферу помещения и на территорию завода. Отходящие
(выхлопные) газы должны быть максимально освобождены от SO2,
окислов азота и тумана серной кислоты.
Большим народнохозяйственным вопросом является очистка от
SO2 дымовых газов ТЭЦ, работающих на угле с повышенным со-
держанием серы, и использование SO2 для получения серной кисло-
ты. Это необходимо не только для улучшения санитарно-гигиени-
ческих условий труда и жизни в промышленных районах, но и для
устранения повышенной коррозии металлов на предприятиях, рас-
положенных в прилегающих к ТЭЦ районах. Важно также исполь-
зовать огарок •сернокислотных заводов в качестве сырья для полу-
чения некоторых металлов, в том числе драгоценных.
88
Контрольные вопросы
1. Назовите области применения серной кислоты.
2. Из какого сырья получают серную кислоту?
3. Напишите реакцию окисления FeSj.
4. Начертите схему печи для обжига колчедана.
5. Как производится очистка обжигового газа от пыли?
6. Какие реакции протекают при башенном способе производства серной
кислоты?
7. По схеме, помещенной в учебнике, опишите нитрозный способ получения
серной кислоты.
8. В чем заключается процесс очистки обжигового газа при контактном спо-
собе производства серной кислоты?
9. Перечислите факторы, влияющие на степень превращения SO» в SO3.
10. Начертите схему контактного аппарата.
Глава VI
ПРОИЗВОДСТВО АММИАКА
§ 22. Соединения азота и их значение
для народного хозяйства
Понятие о свободном и связанном азоте. Азот в переводе с гре-
ческого языка означает «не поддерживающий жизнь». Называют
его еще и «безжизненным газом». Он получил такие названия по-
тому, что при обычных условиях не вступает в химические реакции
ни с металлами, ни с металлоидами. Вместе с тем это название
весьма условно, потому что азот входит в состав белков, образует
важнейшие питательные вещества и, таким образом, играет очень
важную роль в живой природе нашей планеты и жизни людей.
С этой точки зрения правильнее было бы называть азот «источни-
ком жизни». Однако азот входит в состав взрывчатых веществ и в
этом случае он, действительно, «не поддерживающий жизнь».
Газообразный (атмосферный), или свободный, азот, находя-
щийся в воздухе, сам по себе имеет ограниченное практическое зна-
чение. Его используют в смеси с аргоном для наполнения электри-
ческих ламп; в лабораториях и на заводах свободный азот приме-
няют для создания инертной среды при проведении химических ре-
акций.
Огромное значение имеют органические и неорганические соеди-
нения, в состав которых входит так называемый связанный азот.
Азот в природе находится в постоянном круговороте. Первым
этапом является связывание азота воздуха в соединения — фикса-
ция атмосферного азота. Она может проходить двумя путями. Пер-
вый путь заключается в том, что свободный азот воздуха при раз-
рядах атмосферного электричества, т. е. при грозовых разрядах,
соединяется с кислородом воздуха. Образовавшиеся при этом окис-
лы азота дают с атмосферными осадками азотную и азотистую
кислоты, которые попадают в почву, где превращаются в азотно-
кислые и азотистокислые соли. Второй путь — фиксация атмосфер-
89
ного азота происходит благодаря деятельности в почве особых фик-
сирующих бактерий. Обычно растения не усваивают, не поглощают
азот из воздуха. Некоторые же бобовые — клевер красный, кле-
вер шведский, люцерна, люпин и др. — имеют на своих корнях клу-
беньки, наполненные бактериями. Эти бактерии, или микроорганиз-
мы, попадают в растения из почвы; они-то и фиксируют, собирают
атмосферный азот. Помимо клубеньковых бактерий, азот воздуха
связывается бактериями, свободно живущими в почве, — азотобак-
териями.
Соединения азота, находящиеся в почве в виде растворов, по-
глощаются корнями растений, а затем благодаря целому ряду слож-
ных биохимических процессов образуют азотсодержащие органиче-
ские соединения — белки. Поскольку растения служат продуктом
питания животных и человека, их белковые вещества служат ис-
точником образования животных белков. При гниении умерших
животных и растений белковые вещества распадаются, причем ко-
нечным продуктом распада являются аммиак и свободный азот.
Большая часть аммиачного азота в почве под действием нитрофи-
цирующих бактерий при воздействии кислорода воздуха переходит
в соли азотной кислоты. Последние растворяются в воде, поглоща-
ются корнями растений, превращаются в белок и т. д.
Помимо этого, распад белковых веществ в почве происходит под
действием так называемых денитрофицирующих бактерий с обра-
зованием свободного азота. Затем свободный азот вновь фиксиру-
ется и т. д.
Применение связанного азота. В почвах содержание соединений
азота, которые могут усваиваться растениями, очень мало, и поэто-
му основным источником азотного питания растений является азот
воздуха. Как уже указывалось, в природе имеются два пути свя-
зывания атмосферного азота и пополнения ресурсов азота почвы —
электрический разряд и способность некоторых бактерий связывать
азот. Однако этого недостаточно. Поэтому возникла практическая
задача обеспечения растений азотным питанием для увеличения
урожайности сельскохозяйственных культур путем внесения в
почву соединений, содержащих азот, — азотных удобрений.
Мощное развитие у нас в стране производства синтетических
материалов (полимеров) неразрывно связано с потреблением азот-
содержащих продуктов. Промышленности пластических масс тре-
буются соединения азота для изготовления аминопластов, прозрач-
ного органического стекла, целлулоида и других материалов. Свя-
занный азот используется для получения синтетических волокон —
капрона, нейлона, некоторых синтетических каучуков, лакокрасоч-
ных покрытий. Значительное количество азотных соединений необ-
ходимо для производства анилиновых красителей и других химиче-
ских продуктов.
Связанный азот помимо биологического и промышленного име-
ет большое оборонное значение, так как входит в состав многочис-
ленных взрывчатых веществ и порохов.
Основная масса технического связанного азота в СССР идет на
90
производство удобрений, пластических масс, синтетических волокон
и других продуктов и материалов, необходимых для повышения
благосостояния советского народа.
Простейшими и важнейшими исходными продуктами для произ-
водства азотных соединений служат аммиак и азотная кислота.
Высокая реакционная способность аммиака и азотной кислоты
обусловили возможность использования их для производства азот-
содержащих продуктов — азотных удобрений, пластических масс,
химических волокон, анилиновых красителей и т. д. (схема 14).
Схема 14. Области использования азота
§ 23. Способы фиксации атмосферного азота
Природные источники связанного азота. Наиболее старыми ис-
точниками технического связанного азота были навоз, гуано (мине-
рализованный птичий помет), натриевая селитра (NaNO3). Место-
рождения натриевой селитры имеются в ряде стран, в том числе и в
СССР. Но промышленное значение могут иметь только залежи ее
в Чили (Южная Америка), запас которых составляет около
8 млрд. т. Отсюда название селитры — «чилийская». Месторожде-
ния калиевой селитры KNO3 находятся в Индии.
Природным источником связанного азота является также твер-
дое топливо — ископаемые угли, при переработке которых получа-
ется аммиак.
Несмотря на развитие процессов переработки углей, количества
получаемого при этом аммиака вместе с чилийской и калиевой се-
литрами совершенно недостаточно для удовлетворения спроса сель-
ского хозяйства и промышленности на азотные соединения. Науч-
ная мысль обратилась к окружающему нас воздуху как к источнику
азота. Воздух — действительно неисчерпаемый источник азота,
в воздухе азота в миллионы раз больше, чем требуется для успеш-
ного ведения сельского хозяйства и развития промышленности.
91
Великий наш соотечественник Д. И. Менделеев первым выдви-
нул перед наукой задачу фиксации атмосферного азота. В 1869 г. он
писал: «Одну из задач прикладной химии составляет отыскание
технически выгодного способа получения из азота воздуха его сое-
динений, заключающих ассимилируемый азот... Будущность сель-
ского хозяйства много зависит от открытия подобного способа» *.
Методы фиксации азота. К началу XX в. разработка методов
фиксации атмосферного азота была поставлена как важнейшая на-
учно-техническая задача. Решение ее затруднялось тем, что азот
инертен — он трудно вступает в химические реакции. Нужно было
найти пути, которые бы заста-
вили азот воздуха соединяться
с другими элементами.
Дуговой метод фиксации
атмосферного азота был пер-
вым процессом (1902—
1903 гг.), при котором азот и
кислород окружающей нас ат-
Рис. 37. Схема дугового метода фик- мосферы взаимодействовали
сации азота: при температуре 2000—2500°С.
/ — электрод, 2 — дуга В этом случае в промышлен-
ном масштабе воспроизводился
процесс, протекающий при грозовом разряде. В электрической печи
(рис. 37) находятся электроды 1, по которым протекает ток высоко-
го напряжения. Так как электроды помещены на некотором рас-
стоянии, то между ними образуется электрическая дуга 2, в которой
температура достигает 2000—2500°С. Сквозь дугу продувается воз-
дух, и при высокой температуре в пламени дуги азот и кислород воз-
духа реагируют между собой:
N24-O2 = 2NO (VI,1)
с образованием бесцветного газа — окиси азота. Таким образом,
свободный азот воздуха становится связанным с кислородом в
окись азота, которая далее перерабатывается в азотную кислоту.
Существенным недостатком этого процесса является чрезвычай-
но высокий расход электрической энергии — 60—70 тыс. кВт-ч на
тонну связанного азота. Этим объясняется то, что после разработки
других, более экономичных методов фиксации атмосферного азота
дуговой способ быстро утратил свое значение.
Цианамидный метод фиксации азота вошел в практику в 1905—
1910 гг. Он заключается в том, что азот воздуха в электрической пе-
чи при 1000—1100°С реагирует с карбидом кальция по реакции
СаСг + Na = CaCN2 + С (VI,2)
Образовавшийся цианамид кальция может быть использован в ка-
честве азотного удобрения либо переработан в аммиак и азотную
кислоту.
1 Менделеев Д. И. Сочинения, т. XIII. М., Изд-во АН СССР, 1949, с. 362.
92
Расход энергии и в этом методе довольно высок — около 10 тыс.
кВт-ч на тонну связанного азота. Исходя из этого проводились ра-
боты по изысканию более экономичного способа фиксации атмос-
ферного азота.
Синтез аммиака из элементов (азота и водорода) был разрабо-
тан в 1913 г. в Германии. Он оказался значительно выгоднее дуго-
вого и цианамидного, быстро вытеснил их и стал господствующим
способом фиксации атмосферного азота во всех странах мира.
Образование аммиака из элементов протекает по реакции
3H24-N2 = 2NH3 (VI,3)
Аммиак — бесцветный газ с очень резким, характерным запа-
хом. Аммиак при охлаждении сжижается, хорошо растворяется в
воде, легко вступает в реакции, давая аммонийные соли и другие
соединения. Раствор аммиака в воде называют аммиачной водой
или нашатырным спиртом. При вдыхании небольших количеств ам-
миака происходит раздражение верхних дыхательных путей, боль-
шие количества вызывают удушье, приступы кашля, головокруже-
ние и судороги.
Как видно из уравнения (VI, 3), сырьем для этого процесса слу-
жат водород и азот, причем последний получают из воздуха.
§ 24. Получение азота из воздуха
Воздух представляет собой сложную смесь газов. Ниже приве-
ден состав воздуха (содержание газов дано в об. %):
Азота .................78,09
Кислорода..............20,95
Аргона ..................0,93
Углекислого газа ... 0,03
Гелия
Неона
Кри птона
Ксенона
0,00046
0,0016
0,00011
0,000008
Из приведенных данных очевидно, что основную массу воздуха
составляют азот и кислород (99,04%).
Получение азота из воздуха заключается в отделении его от
кислорода и других газов. Этот процесс основан на разнице в тем-
пературах кипения азота и кислорода — азот при атмосферном дав-
лении кипит при температуре— 196°С, а кислород при— 183°С, т. е.
азот имеет более низкую температуру кипения, чем кислород.
При обычных условиях воздух — это бесцветный газ. Но если
воздух подвергнуть «глубокому охлаждению», т. е. охладить его до
очень низкой температуры, а именно до —192°С, то он превраща-
ется в бесцветную жидкость. Если жидкий воздух нагревать, то из
него будет испаряться азот, а кислород останется в виде жидкости.
Этот процесс называется ректификацией воздуха. Таким образом
из воздуха производят азот, необходимый для синтеза аммиака.
93
Получающийся при этом кислород в больших количествах приме-
няется в металлургической, химической и других отраслях промыш-
ленности.
§ 25. Получение водорода
Водород редко встречается в природе. Его производят несколь-
кими методами: электролизом воды, конверсией окиси углерода,
конверсией метана, разделением коксового газа. Выбор метода оп-
ределяется экономикой процесса — стоимостью получаемого водо-
рода, так как получение смеси азота и водорода — наиболее доро-
гостоящая часть производства аммиака.
Электролиз воды заключается в следующем: если электроды по-
грузить в воду и пропускать постоянный ток, вода будет разлагать-
ся на водород и кислород, при этом водород выделяется на катоде
(отрицательно заряженном электроде), а кислород — на аноде (по-
ложительно заряженном электроде). Этот процесс дает возмож-
ность получать водород и кислород высокой степени чистоты. Вме-
сте с тем он связан с высоким расходом электрической энергии, и
поэтому его можно применять при наличии дешевой электроэнер-
гии. С целью получения водорода для синтеза аммиака этот про-
цесс применяется мало.
Конверсия окиси углерода основана на том, что при пропускании
окиси углерода с водяным паром при температуре 250—525°С через
катализатор происходит реакция
СО Н2О СО2 + Н2 + 20 кДж (VI ,4)
в результате которой получаются водород и двуокись углерода.
Далее газ очищается от двуокиси углерода, и таким образом полу-
чается водород, идущий для синтеза аммиака.
Используемая в процессе конверсии окись углерода содержится
в генераторных газах, получаемых при переработке твердых топ-
лив — большей частью углей (см. с. 181). Следовательно, сырьем
для получения водорода по этому методу служат водяной пар и
уголь.
Конверсия метана. Выше уже говорилось о том, что более эко-
номичным топливом, чем угли, являются природные газы (см. с. 16).
Поэтому использование их для получения водорода и технологиче-
ских газов для синтеза аммиака, метанола представляет несомнен-
ный интерес. В природных газах содержится до 98% метана. Про-
цесс переработки их на водород заключается в получении водоро-
да из метана с помощью водяного пара и кислорода. Этот процесс,
получивший название конверсии метана, описывается следующими
реакциями:
СН4 + Н2О СО + ЗН2 — 203 кДж (VI,5)
СН4 + V8Oa СО + 2Нг + 36 кДж (VI,6)
94
Далее получающаяся окись углерода конвертируется в водород
по реакции (VI, 4). Поскольку реакция (VI, 5) обратима и протека-
ет с поглощением тепла, для сдвига равновесия конверсия метана
проводится при высокой температуре — порядка 1400°С (высоко-
температурная конверсия). В присутствии катализатора процесс
осуществляется при температуре 800—900°С (каталитическая кон-
версия). В качестве катализатора применяется никель, нанесенный
на окись алюминия или окись магния. Никелевый катализатор чув-
ствителен к примеси соединений серы в газе.
Рис. 38. Схема каталитической конверсии метана:
5 — парогазосмесители, 2 — трубчатый контактный аппарат (трубчатый
конвертор метана), 3—контактный аппарат емкостного типа (шахтный
конвертор метана), 4—котел-утилизатор, 5 — парогазосмеситель, 6 — по-
лочный контактный аппарат (конвертор окиси углерода)
Источником тепла могут служить горячие дымовые газы, полу-
чаемые при сжигании природного газа. В этом случае при катали-
тической конверсии используется трубчатый контактный аппарат 2
(рис. 38), в трубках которого находится никелевый катализатор, а
по межтрубному пространству проходят горячие дымовые газы.
Тепло, необходимое для конверсии СН4 водяным паром, может
быть получено по реакции (VI, 6). В этом случае для конверсии
применяют смесь природного газа с воздухом или кислородом.
На рис. 38 изображена схема переработки природного газа. При-
родный газ, очищенный предварительно от сернистых соединений,
смешивается в парогазосмесителе 1 с водяным паром. Полученная
парогазовая смесь (соотношение пар : газ = 2,5 : 1) направляется в
трубчатый контактный аппарат 2— первую ступень конверсии ме-
тана. В конверторе при температуре 700°С конвертируется около
70% метана. Из трубчатого контактного аппарата газ подается в
95
контактный аппарат емкостного типа 3 — вторую ступень конвер-
сии метана. В этот конвертор вводится воздух, необходимый для
осуществления экзотермической реакции (VI, 6). Температура в
конверторе поддерживается на уровне примерно 850°С. Воздух в
конвертор второй ступени подают в таком количестве, чтобы после
того как содержащийся в нем кислород вступит в реакцию с ме-
таном, соотношение азота и водорода в смеси было 1 :3 (такое со-
отношение необходимо для синтеза аммиака).
Горячий газ из конвертора второй ступени поступает в котел-
утилизатор 4, где тепло используется для превращения воды в пар.
Из котла-утилизатора газ направляется в парогазосмеситель 5, ку-
да подается водяной пар, необходимый для конверсии окиси угле-
рода по реакции (VI, 4), и оттуда в конвертор окиси углерода 6.
В конвертор 6 для снижения температуры при проведении обрати-
мой экзотермической реакции (VI, 4) вводят конденсат. Затем газ
охлаждается и подается на очистку.
Несомненная экономическая эффективность применения природ-
ных газов для производства аммиака обусловила их использова-
ние на большинстве азотно-туковых комбинатов СССР. Помимо
природного газа для синтеза аммиака используют другие газы, со-
держащие метан, — попутные, коксовый, газы нефтепереработки.
Таблица 6. Состав коксового газа
и температура кипения компонентов
Компоненты Содержа- ние, % Температура кипения, °C
Н, 55—59 —252,6
N2 5-6 —195,7
со 5—7 —191,7
со2 1—3 —79,9
сн4 23—28 —161
Высшие угле- 2—3 От—40
водороды до—103
О2 0,3—0,8 —183
Разделение коксового га-
за. Процесс разделения кок-
сового газа для получения
из него водорода нашел зна-
чительное распространение.
Коксовый газ получают в
процессе нагрева угля без
доступа воздуха (см. с. 174)
при температуре 800—
1050°С. Состав коксового га-
за и температура кипения
входящих в него компонен-
тов при атмосферном давле-
нии приведены в табл. 6.
Из таблицы следует, что
все компоненты коксового
газа, за исключением водорода, имеют температуру кипения выше
—252,6°С. Таким образом, если охладить коксовый газ до темпера<
туры, более высокой чем —252,6°С, например до —200°С, то все
компоненты газа перейдут в жидкое состояние, а водород останет>
ся в газообразном. Это и положено в основу получения водорода из
коксового газа.
§ 26. Очистка газов
Для синтеза аммиака необходима возможно более полная очист-
ка азотно-водородной смеси от кислород- и серосодержащих соеди-
нений, которые являются каталитическими ядами. Газ после конвер-
96
сии метана кроме водорода и азота содержит приблизительно 30%
СО2, 0,3—4% СО, 0,5% СН4, 0,5% Аг, следы H2S.
Промышленные методы очистки газов весьма разнообразны.
Обычно их разделяют на три основные группы: 1) очистка при по-
мощи жидких поглотителей (абсорбентов); 2) очистка при помощи
твердых поглотителей (адсорбентов) или катализаторов (сухой ме-
тод) ; 3) очистка вымораживанием, т. е. перевод примесей в жидкое
или твердое состояние.
Очистку газа от двуокиси углерода в промышленности обычно
осуществляют первым методом — при помощи жидких поглотите-
лей. В качестве абсорбентов применяют воду, растворы моноэтано-
ламина, горячий раствор поташа и др.
Водная очистка основана на том, что в воде двуокись углерода
хорошо растворяется. Конвертированный газ под давлением 25—
30 кгс/см2 поступает в нижнюю часть насадочной башни, орошае-
мую водой. Промытый газ выводится из верхней части башни. Вы-
текающая из башни вода подается на турбину, где ее давление сни-
жается, и из нее выделяется поглощенная углекислота. Вода вновь
поступает на орошение абсорбционных башен.
Этаноламиновая очистка осуществляется водными растворами
моно-или диэтаноламинов: (СН2 CH2OH)NH2 и (CH2CH2OH)2NH.
Обозначим СН2СН2ОН через R. Тогда формулу моноэтаноламина
запишем в виде RNH2 и покажем основные реакции, протекающие
при очистке газов:
очистка от СО2: 2RNH2 + Н2О + СО2 (RHNH2)2 СО8 (VI,7)
очистка от H2S : 2 RH2 J- H2S (RHNH2)2S (VI,8)
Образовавшиеся при поглощении CO2 и H2S карбонат и сульфид
амина относительно легко разлагаются при регенерации раствора,
которая заключается в нагревании его до 120°С с выделением СО2 и
H2S. Раствор моноэтаноламина после регенерации вновь направ-
ляется на орошение абсорберов.
Для освобождения газа от окиси углерода в ряде случаев его
промывают при давлении до 300 кгс/см2 и температуре 0—30°С ам-
миачным раствором уксуснокислой меди:
[Си (NH3)2] СН3СОО + СО + NH3 [Си (NH3)3 СО] СН3СОО (VI,9)
Регенерируют раствор нагреванием и снижением давления.
После очистки азотно-водородной смеси жидкими поглотителя-
ми в ней остаются небольшие количества СО и СО2 (до 1%), кото-
рые могут отравлять катализатор.
Метанирование, или гидрирование, позволяет освободиться от
остатков СО и СО2 в газе. Газ поступает на никелевый катализатор,
на котором при 200—400°С протекают реакции.
СО + ЗН2 = СН4 + Н2О (VI, 10)
СО2 + 4Н2 = СН4 + 2 Н2О (VI, 11)
4-275
97
Образующийся при этом метан не снижает активность катализато-
ра синтеза аммиака.
§ 27. Синтез аммиака
Теоретические основы синтеза аммиака. Синтез аммиака — один
из наиболее совершенных химико-технологических процессов. Как
указывалось, он описывается реакцией взаимодействия азота с во-
дородом:
N2 + ЗНг NH3 + 92 кДж (VI,12)
Эта реакция обратима. Она протекает с уменьшением объема (из
четырех объемов азотно-водородной смеси получается два объема
аммиака) и выделением тепла. Следовательно, основываясь на
принципе Ле-Шателье, для того чтобы сдвинуть равновесие реак-
ции (IV, 12) в сторону образования аммиака, необходимо прово-
дить процесс при высоких давлениях и низких температурах, высо-
кой концентрации азота и водорода в газе, поступающем на син-
тез (табл.7).
Таблица 7. Равновесное содержание аммиака в синтез-газе Из табл. 7 следует, что чем выше давление и ниже темпе- ратура, тем выше концентра- ция аммиака в синтез-газе. Ис- ходя из этого все промышлен- ные установки синтеза аммиа- ка работают при давлениях, ис- числяемых сотнями атмосфер.
Темпера- тура, ЪС Свдержание NH3 (%) при различном давлении (кгс/смг)
100 300 1000
200 89,94 98,29 Что касается температуры, то
300 __ 70,96 92,55 при низких температурах ско-
400 25,12 47,00 79,82 рость реакции настолько мала.
500 10,61 26,44 31,43 что реакция практически не
600 4,52 13,77 12,83 протекает. Поэтому для того чтобы реакция проходила с выгодной для промышленности
скоростью, необходимо повышение температуры. Оптимальной тем-
пературой, при которой будут достаточно высокими скорость реак-
ции и степень превращения азотно-водородной смеси в аммиак, ока-
залась температура около 500°С. Но и этого недостаточно для про-
ведения процесса с большой скоростью. В этом случае, как и в ряде
других (например, при окислении двуокиси серы), ускорить реак-
цию можно с помощью катализатора — железа в виде губчатых ку-
сочков или таблеток с добавками окислов алюминия и калия для
придания высокой и стабильной активности.
Скорость синтеза аммиака зависит также от объемной скорости
газа (количество газа в куб. метрах, проходящего через 1 м3 ката-
лизатора за 1 ч, т. е. м3/м3-ч). В табл. 8 приведены данные о влия-
нии объемной скорости на концентрацию аммиака в синтез-газе при
давлении 300 кгс/см2.
98
Из табл. 8 следует, что при
увеличении объемной скорости
или, что то же самое, уменьше-
нии времени соприкосновения
частиц газа с катализатором
происходит снижение концент-
рации аммиака в газе. Однако
очень важно то, что это сниже-
ние не пропорционально увели-
чению объемной скорости. На-
пример, при увеличении объем-
ной скорости от 15 000 до
45 000 м3/'м3 • ч, т. е. в три ра
температуре 450°С снижается от
Таблица 8. Концентрация аммиака
в синтез-газе в зависимости от объемной
скорости
Объемная скорость, м8/м3-ч Содержание NH3(%) при раз- личных температурах (°C)
450 475 500
15 000 19,6 21,6 23,0
30 000 14,6 17,7 18,2
45 000 12,7 15,2 16,5
за, концентрация аммиака при
19,6 до 12,7%, т. е. всего на 6,9%.
Следовательно, при увеличении объемной скорости количество ам-
миака, образовавшегося на единицу объема катализатора, должно
возрастать. Действительно, в первом случае количество NH3, полу-
ченного с 1 м3 катализатора в час, составит 15 000-0,196=2850 м3,
во втором — 45 000-0,127=5715 м3. Таким образом, увеличение объ-
емной скорости от 15 000 до 45000 м3/м3-ч привело к удвоению ин-
тенсивности катализатора. Отсюда следует вывод о целесообразно-
сти работы контактных аппаратов при высоких объемных скоростях.
В современных установках для синтеза аммиака объемная ско-
рость достигает 30000 м3/м3-ч. При более высоких объемных ско-
ростях, когда через катализатор проходит большее количество газа,
может не хватить тепла, выделяющегося по реакции (VI, 12), для
поддержания температуры синтеза около 500°С. Помимо этого с
ростом объемной скорости увеличивается расход энергии на пере-
качку газа и расход металла в связи с увеличением размеров аппа-
ратуры.
Однако даже при указанных выше условиях синтеза: высоких
температуре, давлении, объемной скорости, наличии катализато-
ра— не весь азот и водород вступают в реакцию. В газовой смеси,
выходящей из реакционного (контактного) аппарата, содержится
всего 18—20% аммиака, а остальное — непрореагировавшая азотно-
водородная смесь. Возник вопрос: как использовать не вошедшую
в реакцию азотно-водородную смесь? Поступают следующим обра-
зом: газовую смесь охлаждают, при этот аммиак сжижается, а
смесь азота и водорода вновь заставляют пройти через тот же кон-
тактный аппарат, т. е. проводят процесс по циклической схеме.
Практическая реализация синтеза аммиака потребовала огром-
ного напряжения сил и совместных усилий работников науки и тех-
ники. Нужно было решить ряд сложнейших вопросов, связанных
с использованием высоких температур и давлений, изысканием ак-
тивных и дешевых катализаторов, созданием новых видов химиче-
ской аппаратуры. Эти задачи были успешно решены учеными и не
только послужили основой для создания азотной промышленно-
сти, но и дали толчок для развития других отраслей химического
производства. Опыт азотной промышленности был использован для
4*
99
создания процессов производства спиртов, органических кислот,
синтетического горючего и других продуктов.
До настоящего времени промышленный синтез аммиака остает-
ся одним из передовых процессов химической технологии. Именно
здесь работают агрегаты высокой единичной мощности, позволяю-
щие в одном контактном аппарате (колонне синтеза) производить
1360 т аммиака в сутки. При этом технологический процесс реали-
зуется по энерготехнологическим схемам, которые позволяют за
счет использования тепла химических реакций проводить процесс
без потребления электрической энергии извне (см. с. 70).
Промышленные способы синтеза аммиака. Промышленные уста-
новки синтеза аммиака работают при различных давлениях. В за-
висимости от используемого давления различают системы низкого
(100 кгс/см2), среднего (200—550 кгс/см2) и высокого давления
(600—1000 кгс/см2).
На всех установках образующийся при синтезе аммиак выделя-
ют охлаждением газа. При этом газообразный аммиак переходит
в жидкое состояние. Температура, до которой нужно охладить газ
для сжижения аммиака, зависит от давления. Чем ниже давление,
тем более низкая температура требуется для выделения аммиака.
Например, при давлении 1000 кгс/см2 можно ограничиться охлаж-
дением газа до 40°С, а при 100 кгс/см2 необходима весьма низкая
температура — около — 60°С. Применение высоких давлений поз-
воляет ускорить реакцию, уменьшить размеры аппаратуры. Таким
образом, применение высоких давлений имеет ряд преимуществ.
Однако с повышением давления увеличивается расход энергии
на сжатие газа и быстрее изнашивается аппаратура.
Исходя из этого наибольшее распространение получили уста-
новки среднего давления, на которых эффективно осуществляется
процесс выделения аммиака, достигается высокая скорость синтеза.
Поэтому далее будет рассмотрена лишь схема синтеза аммиака при
среднем давлении.
Рис. 39. Схема синтеза аммиака:
1 — колонна синтеза аммиака, 2 — водяной конденсатор. 3 — сепаратор, 4 — циркуляцион-
ный насос, 5 — фильтр, 6 — конденсационная колонна, 7 — испаритель
100
Принципиальная схема синтеза аммиака при среднем давлении
приведена на рис. 39. Из колонны синтеза 1 газовая смесь, содер-
жащая аммиак и непрореагировавшие азот и водород, выходит с
температурой 200°С и поступает в водяной конденсатор 2, где часть
аммиака конденсируется и выделяется в сепараторе 3.
Далее азотно-водородная смесь с остатком аммиака поступает
в циркуляционный насос 4, при помощи которого осуществляется
циркуляция газа в установке синтеза. Перед фильтром 5 к циркуля-
ционному газу добавляется свежая сжатая азотно-водородная смесь.
Смесь свежего и циркуляционного газа в фильтре 5 освобожда-
ется от смазочного масла, которое может отравлять катализатор, и
подается в систему вторичной конденсации аммиака, состоящую
из конденсационной колонны 6 и испари-
теля жидкого аммиака 7. В конденсаци-
онной колонне 6 газ охлаждается в рас-
положенном в верхней части колонны
теплообменнике и затем направляется в
в испаритель 7. В нем азотно-водородная
смесь еще охлаждается испаряющимся
жидким аммиаком и поступает в нижнюю
часть колонны 6, служащей сепаратором.
После отделения аммиака азотно-во-
дородная смесь охлаждает в теплообмен-
нике поступающий в конденсационную
колонну газ. Из конденсационной колон-
ны азотно-водородная смесь направляет-
ся в колонну синтеза 1. Таким образом
осуществляется циркуляция газовой сме-
си через один и тот же контактный аппа-
рат. Она позволяет эффективно использо-
вать азотно-водородную смесь.
При синтезе аммиака под более высо-
ким давлением — от 450 кгс/см2 и выше
отпадает необходимость во вторичной
конденсации аммиака, поскольку в этом
случае при охлаждении водой в результа-
те конденсации в газе остается немного
аммиака.
Колонна синтеза аммиака — основной
аппарат в процессе производства аммиа-
ка. Он представляет собой сложное кон-
структивное сооружение, работающее при
высокой температуре и высоком давле-
нии. Много усилий было затрачено на
разработку конструкции промышленного
аппарата. Немало вариантов было откло-
нено, прежде чем ученые остановились
на современной конструкции колонны
синтеза аммиака.
Рис. 40. Колонна синтеза
аммиака:
/ — толстостенный цилиндр,
теплообменник, 3 — катализа»
торная коробка, 4 — централь-
ная труба, 5 — электроподогре»
ватель. 6 — катализатор 7 —
теплообменные трубки
101
Процессы
Получение
азотно-водо-
родной смеси
I
Таблица. 9. Производство аммиака
Что происходит
Конверсия метана:
сна+н2о=со+зн2
СН4+0,5О2=СО+2Н2
Конверсия окиси
углерода:
со+н2о=со2+н2
Промывка синтез-
газа раствором моно-
этанола ми на:
2RNH2+H2O+CO2=
=(RHNH2)2CO3
Каталитическое гид-
рирование
СО2+4Н2=СН4-|-2Н2О
со+зн2=сн,+н2о
О2+2Н2=2Н2О
N2-J-3H2=2NH3
Сжижение аммиака
Разделение аммиака
и циркуляционного
газа
В каких аппаратах
: Природ- : : ный газ : : ВОДЯ- : : НОЙ : i пар : Воз- : : ДУХ :
1 1 4
102
Корпус колонны синтеза (рис. 40) выполняется из стали высокой
прочности в виде толстостенного цилиндра 1 высотой 12—20 м и
диаметром около 1000—1400 мм. Сверху и снизу колонна плотно
закрыта крышками. Внутри колонны располагаются теплообмен-
ник 2 и катализаторная коробка 3, в которую загружен катали-
затор.
Смесь азота с водородом, имеющая температуру 20—30°С, по-
ступает в колонну сверху, опускается по кольцевому пространству
между стенками колонны и катализаторной коробкой и снизу вхо-
дит в теплообменник 2. В теплообменнике в пространстве между
трубками газ поднимается и нагревается за счет тепла прореаги-
ровавших газов, которые движутся вниз внутри трубок теплооб-
менника. Из теплообменника подогретый газ по центральной тру-
бе 4, в которой расположен электроподогреватель 5, включаемый
при пуске колонны, поступает в катализаторную коробку 3. Для то-
го чтобы поддерживать на катализаторе 6 необходимую темпера-
туру и не допускать его перегрева, в слой катализатора погружены
двойные теплообменные трубки 7. Вначале газ проходит по узкой
внутренней трубке сверху вниз и затем поднимается по кольцевому
пространству между узкой и широкой трубками. При этом он отво-
дит тепло, выделяющееся на катализаторе при взаимодействии азо-
та с водородом, сам нагревается и поступает на катализатор.
За счет тепла реакции синтеза температура повышается примерно
до 500°С. Прореагировавшие газы с катализатора направляются в
трубки теплообменника 2, где их тепло используется для подогрева
свежего газа, и выводятся из колонны синтеза аммиака.
Основные этапы производства аммиака из природного газа пред-
ставлены в табл. 9.
§ 28. Сорта аммиака, его транспортировка и хранение
Согласно ГОСТ 6221—70, жидкий синтетический аммиак выпу-
скается двух сортов. Он должен удовлетворять требованиям, при-
веденным в табл. 10.
Таблица 10. Сорта синтетического аммиака
Сорт Содержание
аммиака, % воды, % смазочного масла, мг/л железа, мг/л
1-й Не менее99,9 Не более 0,1 Не более 10 Не более 2
2-й » » 99,6 » » 0,4 » » 35 —
Жидкий аммиак хранится под давлением 16 кгс/см2 на складах
в танках и цилиндрических сосудах емкостью от 50 до 100 м3.
Перевозят жидкий аммиак в железнодорожных цистернах, авто-
103
мобильных цистернах и стальных баллонах. Аммиачные цистерны
окрашены в белый цвет и имеют на боковой поверхности желтую
полосу с надписями «Жидкий аммиак», «Газ — ядовито». Аммиач-
ные баллоны окрашиваются в желтый цвет с черной надписью «Ам-
миак». Баллоны, заполненные аммиаком, запрещается хранить на
солнце и устанавливать вблизи источников тепла.
Контрольные вопросы
1. Назовите природные источники свободного азота (несвязанного) и связан-
ного в химические соединения.
2. Каковы преимущества синтеза аммиака в сравнении с другими методами
получения азотных соединений из азота воздуха?
3. На каком явлении основано разделение воздуха?
4. Назовите основные промышленные методы получения водорода.
5. При каких условиях протекает процесс конверсии окиси углерода?
6. Как проводится конверсия метана? Какой контактный аппарат использу-
ют при этом?
7. От каких примесей очищается конвертированный газ?
8. Как получают водород из коксового газа?
9. Как влияют давление и температура на процесс синтеза аммиака?
10. Почему при синтезе аммиака принята циклическая схема производства?
Начертите схему.
11. Как устроена колонна для синтеза аммиака?
12. Для каких целей используется синтетический аммиак?
Глава VII
ПРОИЗВОДСТВО АЗОТНОЙ кислоты
§ 29. Свойства и сорта азотной кислоты
Азотная кислота — одна из важнейших минеральных кислот.
Безводная азотная кислота HNO3 представляет собой тяжелую бес-
цветную жидкость плотностью 1,52 г/см3 (при 15°С), дымящую на
воздухе. Она замерзает при — 47°С и кипит при 86°С. Кипение
кислоты сопровождается частичным ее разложением с выделением
двуокиси азота. Выделяющаяся двуокись азота, растворяясь в
кислоте, окрашивает ее в желтый или красный (в зависимости от
количества NO2) цвет. При упаривании разбавленной азотной кис-
лоты содержание ее в растворе повышается до 68,4%.
Азотная кислота — сильный окислитель. Концентрированная
азотная кислота превращает большую часть металлов в соответст-
вующие окислы и нитраты. На поверхности некоторых металлов,
например Al, Fe, Сг, при взаимодействии с азотной кислотой обра-
зуется слой окислов, стойких к ее действию.
Многие органические вещества при действии HNO3 разрушают-
ся, а некоторые из них при соприкосновении с концентрированной
кислотой могут воспламеняться.
Концентрированная азотная кислота при взаимодействии с цик-
лическими органическими соединениями замещает в них атомы
104
водорода на нитрогруппу. С органическими соединениями, содержа-
щими гидроксильную группу, HNO3 образует эфиры.
Азотная кислота находит широкое применение как в химиче-
ской промышленности, так и в других отраслях народного хозяй-
ства. По объему производства она занимает второе место после сер-
ной кислоты. Большая часть азотной кислоты расходуется на про-
изводство удобрений, взрывчатых веществ, ракетного топлива.
Кроме того, ее применяют при производстве серной кислоты (ни-
трозный способ), синтетических красителей, пластмасс, синтетиче-
ских волокон и т. п.
В связи с интенсивным развитием производства минеральных
удобрений и синтетических материалов в СССР значительно увели-
чиваются мощности по производству азотной кислоты.
Промышленностью выпускаются три сорта разбавленной (сла-
бой) и два сорта концентрированной азотной кислоты (табл. 11).
Таблица 11. Сорта азотной кислоты
Азотная кислота Содержание HNO3, масс. % Азотная кислота Содержание HNO3, масс. %
Слабая Сорт: 1-й 55 Концентриро- ванная Сорт: высший 98,5
2-й 47 1-й 98
3-й 45 2-й 97
§ 30. Получение слабой азотной кислоты
Примерно до 20-х годов нынешнего столетия азотную кислоту
получали из чилийской селитры при взаимодействии ее с серной
кислотой:
NaNO3 -J- H2SO4 = HNO3 + NaHSO4 (VII,1)
Разложение селитры серной кислотой проводили в чугунных ре-
тортах, обогреваемых топочными газами. Выделяющиеся при этом
пары азотной кислоты конденсировали в холодильнике. При ис-
пользовании 95—97%-ной серной кислоты и 96%-ной селитры уда-
валось получить 96—98%-ную азотную кислоту.
Успехи в области синтеза аммиака из элементов сделали амми-
ак основным источником получения азотной кислоты.
Первая установка по производству азотной кислоты из аммиака
была пущена в Германии в 1909 г. Однако из-за несовершенства
технологии эта установка, как и другие, построенные вслед за ней,
оказалась нерентабельной.
В 1914—1916 гг. у нас в стране инженер И. И. Андреев с сотруд-
никами детально исследовали этот процесс. Результаты исследо-
вания оказались настолько плодотворными, что на их основании
105
в 1916 г. в Юзовке (ныне г. Донецк) был сооружен первый в Рос-
сии завод по производству азотной кислоты.
Переработка аммиака в азотную кислоту начинается с его окис-
ления кислородом воздуха по реакции
4 NH3 + 5О2 = 4 NO + 6 Н2О + 910 кДж (VII,2)
Окись азота, получающаяся в этом процессе, представляет собой
бесцветный газ, который легко окисляется до двуокиси азота:
2NO + О2 = 2 NO2 + 124 кДж (VII,3)
Двуокись азота NO2 — бурый, тяжелый, удушливый газ, при рас-
творении в воде дает азотную кислоту:
3 NOa + Н2О = 2 HNO3 4- NO 4- 137 кДж (VII,4)
Как видно, процесс получения азотной кислоты протекает через
ряд последовательных стадий. Реакция (VII, 2) описывает первую
стадию — окисление аммиака. Образующиеся при этом газы, в со-
став которых входит окись азота, называют нитрозными газами.
Вторая стадия описывается реакциями (VII, 3) и (VII, 4) — пере-
работка нитрозных газов в азотную кислоту.
Окисление аммиака. Процесс протекает с достаточной скоростью
только при высоких температурах. При этом наряду с реакцией
(VII, 2) идут и другие:
4 NH3 4- 4О2 = 2N2O 4- 6 Н2О 4- 1108 кДж (VII,5)
4 NH3 4- ЗО2 = 2N2 4- 6 Н2О 4- 1273 кДж (VII,6)
В результате реакций (VII, 5) и (VII, 6) из аммиака образуют-
ся закись азота и азот вместо необходимой окиси азота. Следова-
тельно, нужно создать такие условия процесса, при которых основ-
ная (целевая) реакция (VII, 2) протекала бы со значительно
большей скоростью, чем (VII, 5) и (VII,6). Для этого процесс прово-
дят при температуре около 800°С. Более высокая температура вы-
зывает разложение аммиака до азота и образовавшейся по реакции
(VII, 2) окиси азота — до азота и кислорода. Однако даже при этих
условиях необходимо присутствие катализатора. Без него процесс
не идет в нужном направлении.
Для окисления аммиака используют дорогой катализатор —
платину в сплаве с родием и палладием. До настоящего времени
этот катализатор не превзойден более дешевыми, которые оказа-
лись менее активными и устойчивыми. Платиновые катализаторы
изготавливаются в виде сеток из очень тонкой проволоки — диамет-
ром 0,06—0,09 мм. На 1 см2 сетки 1024 отверстий, через которые
проходит аммиачно-воздушная смесь.
Направление процесса в сторону реакции (VII, 2) зависит также
от времени соприкосновения аммиачно-воздушной смеси с катали-
затором (так называемое время контактирования). Наиболее вы-
годным оказалось время контактирования 0,0001—0,0002 с. При
меньшем времени соприкосновения газа с катализатором, т. е. при
106
большей скорости газового потока, аммиак не успевает окислиться
и выход окиси азота уменьшается. При большем времени контакти-
рования протекают побочные реакции, что в свою очередь приводит
к уменьшению выхода NO.
Применение давления в процессе окисления аммиака способст-
вует увеличению скорости реакции, но одновременно приводит к
увеличению потерь платины.
По реакции (VII, 2) на 4 молекулы аммиака необходимо расхо-
довать 5 молекул кислорода, т. е. на 1 моль NH3—1,25 моль Ог.
Рис. 41. Пределы взры-
ваемости аммиачно-воз-
душных смесей (темпе-
ратура 18°С)
Нитрозные газы
Рис. 42. Контактный ап-
парат для окисления ам-
миака:
/ — корпус, 2 — катализа-
тор, 3 — поролитовые труб-
ки
Чтобы увеличить скорость окисления, на 1 моль аммиака берут
1,7—2 моль кислорода, что соответствует примерно 10—12%-ной
концентрации аммиака в аммиачно-воздушной смеси. При этом тот
кислород, который не вступил в реакцию (VII, 2), используется при
переработке нитрозных газов для окисления окиси азота до дву-
окиси по реакции (VII, 3).
При составлении аммиачно-воздушных смесей следует учиты-
вать, что эти смеси при определенном содержании в них аммиака
взрывчаты. Как видно из рис. 41, область взрывоопасных концент-
раций аммиака при 18°С соответствует примерно 16—28%. В про-
изводственных условиях работают с аммиачно-воздушными смеся-
ми, содержание аммиака в которых находится за пределами взры-
воопасных концентраций.
Присутствие в аммиачно-воздушной смеси некоторых примесей
приводит к отравлению катализатора. К таким примесям относят-
107
ся фосфористый водород, соединения серы, пыль, ржавчина, пары
смазочного масла. Во избежание попадания их на катализатор воз-
дух подводится к цеху по заборной трубе, установленной вне заво-
да, и тщательно очищается. Перед катализатором внутри контакт-
ного аппарата для освобождения газа от взвешенных примесей
устанавливаются пористые — поролитовые (керамические) трубки,
через поры которых происходит фильтрация газа.
Контактный аппарат для окисления аммиака (рис. 42) состоит
из корпуса 1 цилиндрической формы, в котором закреплен катали-
затор-пакет платино-родиевых сеток 2 и поролитовые трубки 3.
Аммиачно-воздушная смесь подается в аппарат снизу, фильтрует-
ся через поры трубок 3 и последовательно проходит все сетки. Нит-
розные газы, содержащие NO, отводятся из аппарата сверху.
На установках, работающих под атмосферным давлением, в пакет
обычно входят 3—4 сетки, при повышенном давлении — 12—
20 сеток.
Переработка нитрозных газов в азотную кислоту. Реакции
(VII, 3) и (VII, 4) протекают в одном и том же реакционном аппа-
рате. Образовавшаяся по реакции (VII, 4) окись азота вновь окис-
ляется до NO2, которая поглощается водой (реакция VII, 4), и т. д.
Реакция (VII, 3)—самая медленная среди всех реакций, которые
протекают при переработке нитрозных газов; следовательно, от
нее зависит общая скорость процесса. Исходя из этого необходимо
определить условия, при которых будет интенсивно протекать окис-
ление NO в NO2, и таким образом обеспечить высокую скорость
переработки нитрозных газов.
Окисление NO в NO2 происходит с уменьшением объема. По
принципу Ле-Шателье, для сдвига равновесия реакции слева напра-
во необходимо повышение давления. Повышение давления приво-
дит не только к сдвигу равновесия этой реакции, но и к ее ускорению.
Поэтому на установках, работающих при давлении около 10 кгс/см2,
окись азота практически полностью окислена в NO2.
Реакция (VII, 3) идет с выделением тепла, поэтому для сдвига
равновесия следует проводить процесс при низкой температуре. По-
вышение температуры, как известно, увеличивает скорость боль-
шинства реакций. Однако реакция окисления NO в NO2 составляет
редкое исключение — скорость ее растет с понижением температу-
ры. Следовательно, для сдвига равновесия реакции (VII, 3) н для
ее ускорения целесообразно проводить процесс при низких темпе-
ратурах.
Абсорбция (поглощение) двуокиси азота водой — конечная ста-
дия производства азотной кислоты. По мере протекания абсорбции
концентрация азотной кислоты возрастает. Этот процесс так же,
как и окисление NO, требует понижения температуры и повышения
давления.
При переработке нитрозных газов, если процесс проводится при
атмосферном давлении, получают азотную кислоту концентрацией
48—50%. Повышение давления до 10 кгс/см2 позволяет получать
азотную кислоту концентрацией 60—62% и выше.
108
Схемы производства разбавленной азотной кислоты. В зависимо-
сти от применяемого давления установки производства разбавлен-
ной азотной кислоты классифицируют на: 1) работающие под атмо-
сферным давлением; 2) работающие под повышенным давлением;
3) комбинированные, в которых окисление аммиака осуществляет-
ся под атмосферным давлением, а окисление NO и абсорбция NO2
водой — под повышенным.
Схема производства слабой азотной кислоты под атмосферным
Давлением приведена на рис. 43. Очищенные воздух и аммиак посту-
пают в смеситель 1 в таком соотношении, чтобы получилась воздуш-
Рис. 43. Схема производства слабой азотной кислоты под атмос-
ферным давлением:
1 — смеситель, 2 — контактный аппарат, 3 — котел-утилизатор, 4 — холодиль-
ник, 5 — башни кислотной абсорбции, 6 — окислительная башня, 7 — башии
щелочной абсорбции, 8 — холодильники, 9 —насосы
но-аммиачная смесь с содержанием 10—12% NH3. Из смесителя 1
смесь направляется в контактный аппарат 2, в котором помещены
платино-родиевые сетки.
Температура нитрозных газов на выходе из контактного аппара-
та поддерживается около 800°С. Степень окисления аммиака до
окиси азота составляет примерно 97—98%. В котле-утилизаторе 3
температура газов снижается до 250°С. Затем газы охлаждают до
30°С водой в кожухотрубном холодильнике 4, при этом происходит
частичная конденсация водяных паров и окисление окиси азота до
двуокиси. Поэтому в холодильнике частично образуется слабая
азотная кислота, которую направляют на орошение башен 5. Аб-
сорбционное отделение включает башни водной (называемой также
кислотной) абсорбции 5, окислительную башню 6 и башню щелоч-
ной абсорбции 7. Газы, выходящие из холодильника, последователь-
но движутся через башни. Обычно для водной абсорбции ставят
шесть — восемь последовательно соединенных башен, а для щелоч-
ной — две.
109
Необходимая для поглощения NO2 вода подается в последнюю
по ходу газов башню 5. Образующаяся кислота перекачивается по-
следовательно через все башни при помощи насосов 9. Продукция—
50%-ная азотная кислота выводится из первой по ходу газа башни.
В башнях водной абсорбции 5 перерабатывается в азотную кислоту
примерно 92% окислов азота. За башнями водной абсорбции уста-
навливается окислительная башня б, пройдя которую нитрозные
газы поступают на абсорбцию раствором соды (щелочная абсорб-
ция) в башне 7. При этом протекает следующая реакция:
2NO2 + Na2CO3 -> NaNO3 + NaNO2 + CO2 (VII,7)
Полученный раствор, содержащий азотнокислый натрий (нитрат
натрия) и азотистокислый натрий (нитрит натрия), обрабатывают
50%-ной азотной кислотой, в результате чего выделяются окислы
азота и образуется нитрат натрия по реакции
3NaNO2 + 2HNO3 -> 3 NaNO3 + 2NO + H2O (VI1,8)
Выделяющуюся окись азота возвращают в процесс на окисление
и абсорбцию водой. Раствор, содержащий азотнокислый натрий,
упаривают и из него кристаллизуют NaNO2 (натриевая селитра),
которую используют как удобрение.
Схема производства разбавленной азотной кислоты под повы-
шенным давлением (до 8—10 кгс/см2) в принципе не отличается
от производства ее под атмосферным давлением. Однако установ-
ки, работающие под повышенным давлением, обладают рядом пре-
имуществ: степень переработки окислов азота в азотную кислоту
повышается до 98—99%, а концентрация получаемой азотной кис-
лоты— до 60—62%; отпадает необходимость в щелочной абсорб-
ции; уменьшаются капитальные затраты на постройку установки
и расход специальной стали на изготовление аппаратов, так как
объем абсорбционных колонн в десятки раз меньше, чем в системах,
работающих под атмосферным давлением. Вместе с тем применение
давления связано с увеличением потерь катализатора и расхода
энергии, что является недостатком этих установок.
Производство азотной кислоты на комбинированных установ-
ках позволяет использовать достоинства обеих предыдущих схем.
Проведение окисления аммиака при атмосферном давлении дает
возможность снизить потери платины по сравнению с теми, которые
неизбежны на установках повышенного давления. В то же время
переработка нитрозных газов под давлением позволяет получать
60—62%-ную кислоту, устраняет необходимость щелочной очистки,
способствует снижению капитальных затрат, дает возможность
уменьшить размеры аппаратов. На установках этого типа абсорб-
цию окислов азота проводят при давлении 3—9 кгс/см2. К недостат-
кам комбинированных установок следует отнести то, что сжатию
перед абсорбцией подвергают очень агрессивные нитрозные газы.
Принцип работы комбинированных установок приведен в табл, 12,
ПО
В настоящее время в промышленную практику все шире внедряют-
ся агрегаты высокой мощности, производящие 700—1200 т/сут
100%-ной азотной кислоты. На некоторых установках окисление
аммиака производится под давлением 3,5—4 кгс/см2, а абсорбция
окислов азота — под давлением 10 кгс/см2 и выше. Тепло, выделяю-
щееся при окислении аммиака, и тепло окисления NO в NO2 исполь-
зуется для получения электроэнергии, необходимой для сжатия воз-
духа и нитрозных газов до указанных выше давлений.
Таблица 12, Производство слабой азотной кислоты
Процессы
Что проивходит
В каких аппаратах
4NH л+5О2=
=4NO-t-6H2O
2NO+O2«=2NO2
3NO24-H2O=
=2HNO3+NO
Современные установки высокой мощности, так же как и ком-
бинированные, гарантируют низкие капитальные затраты, но наря-
ду с этим значительное сокращение расхода энергии по сравнению
с другими системами. Сравнение показателей работы различных
установок приведено в табл. 13.
111
Таблица 13. Сравнение методов производства азотной кислоты
Показатели Расходные коэффициенты иа 1 т HNO3 для установок
атмосферного давления повышенного давления, Р = 7—9 кгс/см2 комбинирован- ные, Р—3,5 кгс/см8 в абсорбционной части высокой мощно- сти , Р = 3.5 — — 4 кгс/см2; окис- ление аммиака, Р = 10 кгс/см2 в абсорбционной части
Аммиак, т Платиновый катализатор, г Электроэнер- гия, кВт-ч 0,287—0,290 0,045—0,049 115 0,290—0,295 0,155—0,170 360—380 0,287—0,290 0,045—0,049 230—260 0,280—0,282 0,09—0,100 8
Данные табл. 13 подтверждают, что системы повышенного дав-
ления, работающие при меньших капитальных затратах, по сравне-
нию с установками атмосферного давления требуют повышенных
эксплуатационных расходов (электроэнергия, платина).
Содержание окислов азота в газах, выходящих из абсорбцион-
ных колонн, составляет 0,05—0,1%. Поскольку окислы азота отрав-
ляют воздушный бассейн, необходима специальная, так называемая
«санитарная очистка» газов. Она заключается в том, что газы на-
гревают до 380—480°С, смешивают с природным газом и направля-
ют в реактор, где на катализаторе (палладированная окись алю-
миния и активная окись алюминия) происходит восстановление
окислов азота до элементарного азота. В результате содержание
окислов азота снижается до 0,004—0,006% и газы через 100-метро-
вую трубу выбрасываются в атмосферу.
§ 31. Получение концентрированной азотной кислоты
Для отдельных производств требуется не разбавленная азотная
кислота, а концентрированная с содержанием HNO3 выше 96%.
Азотную кислоту такой концентрации можно получить концентриро-
ванием разбавленной азотной кислоты или методом прямого син-
теза.
Концентрирование разбавленной азотной кислоты. Для получе-
ния концентрированной азотной кислоты разбавленную HNO3 упа-
ривают в присутствии серной кислоты, которая отнимает воду.
На рис. 44 показана принципиальная схема установки для кон-
центрирования разбавленной азотной кислоты. Концентрированная
серная кислота поступает в колонну 3 на одну из верхних тарелок.
Несколько ниже в колонну подается разбавленная азотная кисло-
та, содержащая около 50% HNO3. Часть ее испаряют, пропуская
через испаритель 4. Пары азотной кислоты с незначительным содер-
жанием паров воды и окислов азота, образовавшихся в резуль-
тате разложения азотной кислоты, направляют из колонны 3 в
конденсатор 2, где азотная кислота конденсируется, а окислы азота
идут на улавливание. Часть окислов азота растворяется в азотной
112
кислоте, поэтому из конденсатора 2 она возвращается на верхние
тарелки колонны, где продувается выходящими из колонны парами
азотной кислоты н затем отводится как продукция в холодильник 1.
Отработанная разбавленная серная кислота (70%-ная) вытекает
снизу колонны и поступа-
ет без охлаждения на упа-
ривание.
Прямей синтез азотной
кислоты. Этот метод пре-
дусматривает непосред-
ственное получение кон-
центрированной азотной
кислоты из нитрозных га-
зов окисления аммиака.
При этом исключаются
процессы получения сла-
бой азотной кислоты, ее
концентрирования, упари-
вания серной кислоты.
Процесс заключается в
том, что окись азота, со-
держащаяся в нитрозных
газах, окисляется, получа-
ется NO2, которая при ох-
лаждении примерно до
—8°С переходит в жидкое
состояние с образованием
N2O4. Прямой синтез азот-
ной кислоты из жидкой
N2O4 протекает при взаи-
модействии ее с водой и
fhSO*
Рис. 44. Установка для получения концентриро-
ванной азотной кислоты:
/ — холодильник, 2 — конденсатор, 3— колонна,
4 — испаритель
кислородом:
2 П2О4ЖИДК + 2 Н2О + О2 = 4 HNO3 (VI 1,9)
Эту реакцию осуществляют при давлении 50 кгс/см2 и температуре
около 75°С.
§ 32. Хранение и транспортировка азотной кислоты
Слабую азотную кислоту (45—60%-ную) хранят на складе в
резервуарах из нержавеющей стали. Небольшие количества разбав-
ленной азотной кислоты перевозят в стеклянных бутылях, которые
упаковывают в корзины или деревянную обрешетку с обкладкой
стружкой или соломой, пропитанными огнестойкими веществами.
Большие количества разбавленной азотной кислоты перевозят в же-
лезнодорожных цистернах из нержавеющей стали.
Концентрированную кислоту хранят в резервуарах и перевозят
в железнодорожных цистернах из алюминия.
113
Контрольные вопросы
1. Перечислите основных потребителей азотной кислоты.
2. Напвшите реакции, протекающие при окислении аммиака.
3. Начертите схему контактного аппарата.
4. Как влияют температура и давление на реакцию окисления окиси азота
в двуокись?
5. По рис. 43 опишите схему получения слабой азотиой кислоты.
6. Каковы достоинства и недостатки получения азотиой кислоты под давле-
нием?
7. Какие способы получения концентрированной азотной кислоты вам из-
вестны?
Глава VIII
ПРОИЗВОДСТВО КАЛЬЦИНИРОВАННОЙ соды
§ 33. Значение соды для народного хозяйства
В промышленности и в быту под названием «сода» известно
несколько продуктов: кальцинированная сода — безводный угле-
кислый натрий Na2CO3 (слово «кальцинированный» образовано от
латинского и обозначает прокаленный, безводный); двууглекислая
сода — бикарбонат натрия NaHCOa, часто называемая также пить-
евой содой; кристаллическая сода NasCOs'lOHjO и ЫагСОз-НгО;
каустическая сода, или едкий натр, NaOH.
Большое значение для химической промышленности и других
отраслей народного хозяйства имеет кальцинированная сода. Она
широко применяется в производстве мыла, стекла, в металлурги-
ческой, нефтяной, лакокрасочной, текстильной, кожевенной, цел-
люлозно-бумажной, пищевой промышленности, для получения мно-
гих солей натрия, при очистке воды и т. п. (схема 15).
Схема 15. Области применения соды
Двууглекислая питье-
вая сода применяется в
пищевой, кондитерской,
химико - фармацевтичес-
кой промышленности, в
медицине. Кристалличе-
ская сода находит приме-
нение преимущественно в
текстильной промышлен-
ности.
До конца XVIII в.
пользовались только природной содой. В природе сода встречается
в твердом виде в небольших залежах, в виде раствора — в воде не-
которых содовых озер и щелочных минеральных источников. В Со-
ветском Союзе имеются содовые озера в Кулундинской степи, За-
падной Сибири, около г. Читы.
В конце XVIII в., когда недостаток в соде и ее высокая стои-
мость начали задерживать развитие ряда отраслей промышленно-
114
сти, в частности стекольной, встал вопрос о разработке методов
получения искусственной (синтетической) соды.
В настоящее время в СССР почти во всех отраслях потребляется
синтетическая кальцинированная сода. Состав и требования к каль-
цинированной соде определяются ГОСТ 5100—64, в соответствии
с которым содержание Иа2СОз должно быть не менее 99%.
Первый способ получения искусственной соды, осуществленный
в промышленности в 1891 г., был предложен французским врачом
и химиком Лебланом. По этому способу соду производили из суль-
фата натрия Na2SO4, известняка — углекислого кальция СаСОз и
угля. Сульфат натрия получали из твердой поваренной соли при
действии на нее серной кислотой:
2NaClH2SO4 = Na2SO4-J-2HC1 (VIII, 1)
Затем сульфат натрия сплавляли с известняком и углем при высо-
кой температуре в печах и получали содовый плав:
Na2SO4 + СаСО3 + 2С = Na2CO3 + CaS + 2СО2 (VIII,2)
Полученный плав обрабатывали водой (выщелачивали). В ре-
зультате выщелачивания получали раствор соды. Его выпаривали
и выделяли кристаллы соды. После прокаливания их получали
готовый продукт.
Хотя способ Леблана был в свое время величайшим достижени-
ем техники, он имел недостатки. Кальцинированная сода, получен-
ная этим способом, была дорогой и низкого качества, кроме того,
было громоздким аппаратурное оформление процесса. Это обусло-
вило поиски более экономичного способа получения соды.
С середины XIX в. с появлением более совершенного — аммиач-
ного способа (способ Сольве) способ Леблана утратил свое значе-
ние. В настоящее время во всех странах, в том числе и в СССР,
аммиачный способ получения соды является основным методом про-
изводства кальцинированной соды.
§ 34. Аммиачный способ получения кальцинированной соды
Сырьем для производства кальцинированной соды аммиачным
способом служит поваренная соль NaCl в виде насыщенного вод-
ного раствора (рассола) и известняк, или мел, СаСО3. В качестве
вспомогательного вещества применяют аммиак (отсюда название
способа).
Сразу превратить NaCl в соду Na2CO3 невозможно, так как в
хлористом натрии нельзя заместить непосредственно ион сильной
соляной кислоты на ион слабой угольной кислоты. Поэтому соду по-
лучают через промежуточное соединение.
Поваренная соль перерабатывается на соду путем реакции обме-
на, происходящей в водном растворе между двумя солями. Как
известно, при этом образуются две новые соли. Эта реакция может
служить удобным способом получения солей, если одна из образую-
115
щихся солей мало растворима в воде и может быть выделена из
раствора в виде твердого осадка.
Сода Na2CO3 хорошо растворима в воде. Подобрать продукты
так, чтобы вторая образующаяся соль была нерастворима, доволь-
но трудно. Поэтому получение соды ведут не прямым путем, а через
бикарбонат натрия NaHCO3, который в отличие от углекислого
натрия Na2CO3 относительно мало растворим в воде. Его раство-
римость еще более понижается в присутствии NaCl.
Для получения бикарбоната натрия проводят обменную реак-
цию между поваренной солью, находящейся в растворе, и раство-
римой кислой углекислой солью аммония (бикарбонатом аммония):
NaCl + NH4HCO3 NaHCO3 + NH4C1 (VIII,3)
осадок раствор
Углекислый аммоний не изготовляется отдельно, а получается
во время самого процесса насыщением соляного раствора сначала
аммиаком (аммонизация раствора), а потом углекислым газом
(карбонизация раствора). Это сложный процесс, который суммар-
но может быть представлен уравнением,
NН3 + Н2О + СО2 NН4НСО3 (VII1,4)
Реакция получения бикарбоната натрия (VIII,3) обратима, поэ-
тому она не доходит до конца. Невозможно всю поваренную соль
превратить в бикарбонат. Процент превращения поваренной соли
в бикарбонат зависит от температуры и концентрации реагирую-
щих веществ и составляет в заводских условиях 70—75%.
Полученный бикарбонат натрия имеет малую растворимость и
поэтому выделяется из раствора в кристаллическом виде. Кристал-
лы NaHCO3 отделяют от раствора фильтрацией. Полученный би-
карбонат натрия превращают прокаливанием при высокой темпе-
ратуре в карбонат:
2 NaHCO3 --= Na;,CO3 4- СО2 + Н2О (VIII,5)
Этот процесс называется кальцинацией.
Таким образом, для получения кальцинированной соды необхо-
димо осуществить следующие операции: получить бикарбонат нат-
рия путем насыщения раствора поваренной соли аммиаком и угле-
кислым газом, полученный кристаллический бикарбонат натрия
отделить от раствора и перевести нагреванием в карбонат.
Получение бикарбоната и карбоната натрия является основным
процессом в содовом производстве. Наряду с ним проводят и ряд
вспомогательных процессов, к которым относятся получение аммиа-
ка и углекислого газа, необходимых для превращения раствора
поваренной соли в соду.
Углекислый газ получают обжигом известняка или мела:
СаСО3 = СаО + СО2 (VIII, 6)
(В этом процессе кроме СО2 получают обожженную известь СаО,
которая также находит применение в содовом производстве.) Вы-
делившийся углекислый газ направляют на карбонизацию соля-
116
кого раствора. Для карбонизации применяют, кроме того, углекис-
лый газ, выделившийся при кальцинации.
Аммиак получают обработкой раствора хлористого аммония
NH4C1. Хлористый аммоний образуется при получении бикарбоната
натрия по реакции (VIII, 3) и остается в растворе после отделения
кристаллического бикарбоната натрия. Раствор нагревают с извест-
ковым молоком (гашеной известью Са(ОН)2, смешанной с водой).
Хлористый аммоний разрушается, и из раствора выделяется сво-
бодный аммиак:
2 NH4C1 + Са (ОН)2= 2 NH3 + СаС12 + 2 Н 2О (VI 11,7)
Необходимую для этой реакции гашеную известь получают при
действии на обожженную известь СаО (продукт обжига известня-
ка) водой:
СаО + Н2О = Са (ОН)2 (VI 11,8)
При разложении хлористого аммония (VIII, 7) выделяется ам-
миак, который был затрачен при получении бикарбоната натрия и
превратился в NH4C1 по реакции (VIII, 3). Как известно, такие
процессы, когда использованный реагент выделяют в перво-
начальном виде, называются регенерацией (восстановлением). По-
лученный регенерацией аммиак вновь направляется на насыщение
соляного раствора (аммонизацию), т. е. аммиак совершает в про-
изводстве цикл — он вступает в реакцию с поваренной солью, угле-
кислым газом и водой, давая при этом хлористый аммоний (реакции
(VIII,3), (VIII,4)), а затем выделяется при разрушении хлористого
аммония, чтобы снова вступить в реакцию. Поэтому количество
аммиака во время всего процесса производства должно оставаться
постоянным. Однако вследствие несовершенства аппаратуры и дру-
Раствор
Рис. 45. Схема производства кальцинированной соды:
/-известково-обжигательная печь, 2 — гаситель, 3 — дистилляционная колонна,
4 — абсорбционная колонна, 5 — карбонизационная колонна, 6 — вакуум-фильтр,
7 — барабанная печь
117
гих причин незначительная часть аммиака теряется. Эта потеря
компенсируется добавлением свежего аммиака.
Все описанные выше операции, сведенные вместе, представлены
в табл. 14. На рис. 45 показана принципиальная схема производ-
ства кальцинированной соды по аммиачному способу.
Для получения соды используют рассол поваренной соли кон-
центрацией 300 г/л, полученный в естественных условиях подзем-
ным выщелачиванием залежей поваренной соли. Для этого в буро-
Рис. 46. СхемЭ подземного растворе-
ния соли
вую скважину вставляют две
трубы одна в другую (рис. 46).
Через внутреннюю трубу вво-
дят под давлением воду, кото-
рая растворяет соль в недрах
земли. Полученный рассол вы-
давливается водой по внешней
трубе на поверхность земли,со-
бирается в резервуары и по
трубопроводу передается на за-
вод.
В естественном рассоле по-
мимо NaCl обычно содержатся
соли кальция и магния. При
аммонизации и карбонизации
рассола в результате взаимо-
действия этих примесей с NH3
и СО2 будут выпадать осадки,
что приведет к загрязнению ап-
паратов и нарушению нормаль-
ного хода процесса. Поэтому
рассол предварительно очища-
ют от примесей: осаждают их,
добавив к рассолу строго опре-
деленное количество реакти-
вов — суспензии соды в очи-
щенном рассоле и известкового
молока. Этот способ очистки
называется содово-известко-
вым. Выпавшие при этом осад-
ки гидрата окиси магния
Mg (ОН) 2 и карбоната кальция СаСОз отделяются в отстойнике.
Очищенный и осветленный рассол поваренной соли направляют
в абсорбционную колонну 4 (см. рис. 45), которая служит для на-
сыщения рассола аммиаком (абсорбция), поступающим из дистил-
ляционной колонны 3. Абсорбционная колонна (абсорбер) пред-
ставляет собой колонну барботажного типа. Так называют колон-
ны, в которых происходит процесс поглощения газов жидкостью при
пробулькивании (барботировании) пузырьков газа через слой жид-
кости. При этом применяют различные устройства, разбивающие
струю на мелкие пузырьки и увеличивающие поверхность соприкос-
118
Таблица 14. Производство соды
Процессы
Что происходит
В каких аппаратах
СаСО3=СаО+СО2
Насыщение раство-
ра NaCl аммиаком
Насыщение аммонизи-
рованного раствора уг-
лекислотой. Выпадение
кристаллов бикарбона-
та натрия:
Н2О + nh,+co2=
=nh,hco3
NH4HCO3+NaCl=
=NaIICO3+NH4Cl
Фильтрация NaHCO3
CaO+H2O=Ca(OH)2
2NH4Cl+Ca(OH)2=
=2NH3+CaCl2+2H2O
Разложение бикарбо-
ната натрия:
2NaHCO3=Na2CO3+
+Н2О+СО2
119
новения газообразных продуктов с жидкостью. Колонна для абсорб-
ции аммиака состоит из нескольких отдельных чугунных цилиндров
(бочек) диаметром 2,8 м, снабженных колпачковыми тарелками.
Общая высота колонны около 30 м.
Принцип устройства работы одно- и многоколпачковых тарелок
показан на рис. 47. В колонне рассол непрерывно движется сверху
вниз, переливаясь из одного цилиндра в другой по переточным труб-
Рис. 47. Принцип устройства и работы одно- и миогоколпачковых
тарелок
кам, а снизу вверх навстречу стекающему рассолу поднимается,
пробулькивая из-под колпачков, газ, содержащий аммиак.
Полученный аммиачно-соляной рассол далее направляется в
барботажную карбонизационную колонну 5 (см. рис. 45), где про-
исходит основная реакция (VIII, 3) превращения исходного сырья в
бикарбонат натрия NaHCCb и NH4C1. Необходимая для этой цели
углекислота подается из шахтной печи для обжига известняка 1 и
из барабанной печи для кальцинации бикарбоната 7. В карбониза-
ционной колонне происходит сложный процесс поглощения угле-
кислоты аммиачным рассолом и образования бикарбоната натрия,
описываемый уравнениями (VIII, 4) и (VIII, 3):
NH3 + Н2О + СО2 NH4HCO„ + Q
NaCl + NH4HCO3 NaHCO3 + NH4C1 + Q
Процессы взаимодействия аммиака и углекислоты с рассолом
поваренной соли идут с выделением тепла, поэтому нижние секции
колонн 4 и 5 снабжены холодильниками, в которые подается холод-
ная вода.
Снижение температуры уменьшает растворимость бикарбоната
натрия и сдвигает равновесие реакции его образования вправо. При
120
этом удается превратить в NaHCOs 70—75% поваренной соли. Об-
разовавшийся в карбонизационной колонне 5 бикарбонат натрия,
как малорастворимый в условиях протекания процесса, находится
в виде мелких кристаллов во взвешенном состоянии в растворе хло-
ристого аммония.
Карбонизационная колонна 5 работает по тому же принципу,
что и абсорбер 4. Только в отличие от абсорбционных колонн, где
применяют многоколпачковые тарелки, карбонизационная колон-
на снабжена одноколпачковыми тарелками. Это вызвано тем, что
в карбонизационной колонне выделяется осадок NaHCO3, который
может забивать колпачки небольшого сечения.
Полученные в карбонизационной колонне кристаллы бикарбо-
ната натрия отделяют от раствора на барабанном вакуум-филь-
тре 6. Фильтрат, полученный с вакуум-фильтра (фильтровая жид-
кость), подается в барботажную дистилляционную колонну 3, на-
зываемую дистиллером, для выделения (регенерации) аммиака из
хлористого аммония. С этой целью фильтровую жидкость обраба-
тывают известковым молоком:
2 NH4C1 + Са (ОН)2 = 2 NHS + СаС12 + 2 Н2О
Для улучшения отгонки аммиака в дистиляционную колонну 3
снизу подается пар. Регенерированный аммиак после охлаждения
подается в нижнюю часть колонны 4.
При производстве соды аммиачным методом аммиак теорети-
чески не должен расходоваться. Однако практически полностью воз-
вратить его в процесс не удается. Поэтому потери аммиака вос-
полняются добавлением его в виде аммиачной воды в дистиллер 3
или в виде газообразного аммиака по пути от дистиллера к абсор-
беру 4.
Отделенные от раствора хлористого аммония кристаллы бикар-
боната натрия промывают водой на вакуум-фильтре 6 для окон-
чательного удаления фильтровой жидкости из бикарбоната и на-
правляют на кальцинацию в печь 7, которая представляет собой
стальной барабан, снаружи обогреваемый топочными газами и вра-
щающийся со скоростью 5 об/мин.
Для получения углекислоты и обожженной извести служит из-
вестково-обжигательная печь шахтного типа 1. Разложение извест-
няка на углекислоту СО2 и обожженную известь СаО идет с затра-
той тепла (процесс эндотермический). Поэтому сверху в печь одно-
временно с известняком подают уголь или кокс, а снизу — воздух.
За счет тепла горения твердого топлива в шахтной печи развивает-
ся нужная для разложения известняка температура (1100—1200°С).
Газ известково-обжигательных печей, содержащий около 40%
углекислоты, после промывки водой направляют в карбонизацион-
ную колонну 5. Полученную в печи 1 обожженную известь гасят во-
дой в гасителе — вращающемся барабане 2. Приготовленное в ап-
парате с мешалкой известковое молоко концентрации 270—308 г/л
после фильтрования крупных частиц взвесей подается для выделе-
ния аммиака из фильтровой жидкости в дистиллер 3.
121
Из дистилляционной колонны 3 выводится оставшийся после
выделения аммиака раствор хлористого кальция СаС12, содержащий
NaCl. Это отход содового производства. Его направляют в шламо-
вые бассейны, так называемые «белые моря», расположенные за
пределами завода. Этот отход до настоящего времени не нашел еще
применения, и вопрос о его использовании нуждается в разрешении.
§ 35. Получение бикарбоната натрия
Двууглекислая сода (бикарбонат натрия МаНСОз — питьевая
сода) применяется в пищевой промышленности, медицине и т. д.
К ней предъявляют высокие требования в отношении чистоты. Го-
товится двууглекислая сода главным образом из промежуточного
продукта содового производства — сырого бикарбоната натрия, по-
лучаемого в вакуум-фильтрах. Сырой бикарбонат размешивают в
воде, при этом получают взвесь — пульпу (бикарбонат трудно рас*
творим в воде). Через пульпу пропускают водяной пар, под дейст-
вием которого происходит разложение бикарбоната:
2 NaHCO3 = Na2CO3 + СО2 + Н2О (VI11,9)
Полученный таким образом раствор соды подвергают карбони-
зации:
Na2CO3 + СО2 + Н2О = 2 NaHCO3 (VIII, 10)
Образующийся чистый бикарбонат натрия отфильтровывают,
сушат, упаковывают в тару в сухих помещениях. Он должен содер-
жать не менее 98,5% NaHCOa, не более 1,0—1,2% Na2COs, 0,05%
NaCl и 1,0% Н2О, не содержать мышьяка, солей аммония и тяже-
лых металлов.
§ 36. Основные направления развития содового производства
Развитие производства и потребления кальцинированной соды
в нашей стране будет возрастать с каждым годом, что, несомнен-
но, приведет к изменениям как в технологическом процессе, так и
в его аппаратурном оформлении. Несмотря на то что аммиачный
способ получения насчитывает свыше ста лет промышленного при-
менения, он до настоящего времени остается несовершенным в сво*
ей основе: низкий коэффициент использования сырья как по натрию,
так и по углекислому газу. Хлор, содержащийся в исходной поварен-
ной соли, и известь теряются почти полностью в виде отхода — хло-
ристого кальция.
Развитие содовой промышленности в нашей стране идет по пу-
ти совершенствования технологических процессов, интенсификации
работы аппаратуры, механизации трудоемких процессов, автомати-
зации отдельных стадий и производства в целом. Принимаются ме-
ры к использованию отходов содового производства — хлористого
кальция и мелких фракций мела и известняка. Ставится вопрос о
получении соды из природного сернокислого натрия — мирабилита
122
с одновременным получением сульфата аммония, используемого в
качестве удобрения. Предполагается получать соду без регенерации
аммиака из раствора NH4C1, выделяя хлористый аммоний из рас-
твора и используя его как удобрение. Заслуживает внимания при-
менение вместо хлористого натрия сильвинита KCl-NaCl, что позво-
лит получать соду и азотнокалийное удобрение KCI + NH4CI.
Контрольные вопросы
1. Назовите виды соды и основных ее потребителей.
2. Объясните, почему нельзя получить соду из раствора поваренной соли
простым обменом с углекислотой?
3. Объясните, какое значение имеет регенерация аммиака из растворов хло-
ристого аммонии? Что такое известковое молоко, как его получают?
4. Назовите источники углекислого газа, используемого для карбонизации
рассола.
5. При термическом разложении известняка выделяется 100%-ный углекис-
лый газ. Почему же из известково-обжигательной печи выходит газ с содержани-
ем только 38—40% СО2?
6. Какой метод увеличения поверхности соприкосновения в реагирующей
системе Г—Ж принят в производстве соды?
7. Назовите основные аппараты производства кальцинированной соды амми-
ачным способом.
8. Какие недостатки имеет аммиачный способ производства кальцинирован-
ной соды?
9. Как получают чистую двууглекислую соду?
Глава IX
ПРОИЗВОДСТВО ЕДКОГО НАТРА,
ХЛОРА И СОЛЯНОЙ КИСЛОТЫ
Едкий натр (NaOH), хлор и соляная кислота HCI широко ис-
пользуются в ряде отраслей промышленности.
Едкий натр — сильная щелочь, называемая в быту каустической
содой, применяется в мыловарении, в производстве глинозема —
полупродукта для получения металлического алюминия, в лакокра-
сочной, нефтеперерабатывающей промышленности, в производстве
искусственного шелка, в промышленности органического синтеза и
других отраслях народного хозяйства. •
Хлор — при атмосферном давлении и обычной температуре тя-
желый газ желто-зеленого цвета с удушливым запахом, кипит при
температуре —33,6°С и замерзает при —101,5°С. Он потребляется
при получении органических хлорпроизводных, для изготовления
пластических масс, синтетических каучуков, химических волокон,
растворителей, инсектицидов (средства борьбы с вредителями сель-
ского хозяйства), в производстве соляной кислоты, гипохлоритов
натрия и кальция — NaClO, Са (СЮ) 2, хлоратов — NaClOa и др.,
в металлургии, нефтяной промышленности, для обеззараживания
питьевой и сточных вод, в медицине и санитарии, пиротехнике.
Соляная кислота представляет собой водный раствор хлористого
водорода НС1. В товарной соляной кислоте содержится 27,5 — 31%
123
HCI. Эта кислота нашла применение в производстве неорганиче-
ских солей (цинка, бария и др.), цветной металлургии, гидролизе
крахмала и ряде других производств. Выпускают техническую соля-
ную кислоту 1-го и 2-го сортов и синтетическую. Содержание НС1 в
технической кислоте должно быть не менее 27,5%> в синтетиче-
ской —31 % (ГОСТ 1382—69 и ГОСТ 857—69).
Хлористый водород — бесцветный газ, имеющий температуру
плавления—П4,2°С и температуру кипения — 85°С. При раство-
пении хлористого водорода в воде образуется соляная кислота.
Хлористый водород применяется для получения органических хлор-
производных — винилхлорида, хлористого этила и др.
При работе с хлором, хлористым водородом, соляной кислотой и
едким натром необходимо строго соблюдать правила техники без-
опасности. Вдыхание хлора вызывает резкий кашель и удушье, вос-
паление слизистых оболочек дыхательных путей, отек легких, а в
дальнейшем образование в легких воспалительных очагов.
Хлористый водород даже при незначительном содержании его в
воздухе вызывает раздражение в носу и гортани, покалывание в
груди, хрипоту и удушье. При хроническом отравлении малыми его
концентрациями особенно страдают зубы, эмаль которых быстро
разрушается.
Отравления соляной кислотой весьма сходны с отравлениями
хлором.
§ 37. Химические способы получения едкого натра
К химическим способам получения едкого натра относятся из-
вестковый и ферритный.
Известковый способ получения едкого натра заключается во
взаимодействии раствора соды с известковым молоком при темпе-
ратуре около 80°С. Этот процесс называется каустификацией; он
описывается реакцией
Na2CO3 + Са (ОН)2 = 2NaOH + СаСО3 (IX, 1>
раствор осадок
По реакции (IX, 1) получается раствор едкого натра и осадок
карбоната кальция. Карбонат кальция отделяется от раствора, ко-
торый упаривается до получения расплавленного продукта, содер-
жащего около 92% NaOH. Расплавленный NaOH разливают в же-
лезные барабаны, где он застывает.
Ферритный способ описывается двумя реакциями:
I
Na2CO3 + Fe2O8 = Na2O • FezO3 + CO2
феррит натрия
NaaO • FeaO3 + H20 = 2 NaOH 4- Fe2O3
раствор »сад«к
(IX,2>
(IX,3)
124
Реакция (IX, 2) показывает процесс спекания кальцинированной
соды с окисью железа при температуре 1100—1200°С. При этом об-
разуется спек-—феррит натрия и выделяется двуокись углерода.
Далее спек обрабатывают (выщелачивают) водой по реакции
(IX,3); получается раствор едкого натра и осадок Fe2O3, который
после отделения его от раствора возвращается в процесс. Раствор
содержит около 400 г/л NaOH. Его упаривают до получения про-
дукта, содержащего около 92% NaOH.
Химические методы получения едкого натра имеют существен-
ные недостатки: расходуется большое количество топлива, получае-
мый едкий натр загрязнен примесями, обслуживание аппаратов
трудоемко и др. В настоящее время эти методы почти полностью
вытеснены электрохимическим способом производства.
§ 38. Электрохимический способ получения хлора,
едкого натра и водорода
Понятие об электролизе и электрохимических процессах. Элек-
трохимическими процессами называют химические процессы, про-
текающие в водных растворах или расплавах под действием по-
стоянного электрического тока.
Растворы и расплавы солей, растворы кислот и щелочей, назы-
ваемые электролитами, относятся к проводникам второго рода, в
которых перенос электрического тока осуществляется ионами.
(В проводниках первого рода, например металлах, ток переносится
электронами.) При прохождении электрического тока через элек-
тролит на электродах происходит разряд ионов и выделяются соот-
ветствующие вещества. Этот процесс называется электролизом.
Аппарат, в котором осуществляется электролиз, называется элек-
тролизером или электролитической ванной.
Электролиз получил значительное распространение в химиче-
ской и других отраслях промышленности. Он используется для по-
крытия металлических изделий каким-либо металлом. Такие покры-
тия называются гальваническими. Они необходимы для защиты
металлов от коррозии, для увеличения прочности изделий и т. п.
Электролиз используется для получения ряда химических про-
дуктов— хлора, водорода, кислорода, щелочей и др. Следует отме-
тить, что путем электролиза получают химические продукты высо-
кой степени чистоты, в ряде случаев недостижимой при химических
методах их производства. Легкие металлы, такие, как магний, алю-
миний, и тяжелые металлы — медь, цинк, никель, свинец и др. в
промышленной практике производят электрохимическим путем. Та-
ким образом, ассортимент продуктов, получаемых электролизом,
чрезвычайно велик.
К недостаткам электрохимических процессов следует отнести
высокий расход энергии при электролизе, что увеличивает стоимость
получаемых продуктов. В связи с этим проведение электрохимиче-
ских процессов целесообразно только на базе дешевой электриче-
ской энергии. Советский Союз располагает мощными электрически'
125
ми станциями, которые обеспечивают электрохимические установки
дешевой энергией. В связи с этим у нас в стране имеется прочная
основа для развития электрохимических процессов.
Выдающаяся роль в развитии электрохимических процессов
принадлежит Фарадею, который сформулировал ее основные за-
коны.
Первый закон Фарадея говорит о том, что количество вещества,
выделяющегося на электроде, прямо пропорционально количеству
электричества, проходящего через электролит. Количество электри-
чества равно произведению силы тока на время и измеряется ам-
пер-часами. Если силу тока обозначить через I, а время через т, то
количество электричества Q будет
Q = h. (IX,4)
Например, если через электролит проходит ток силой 10 А в те-
чение 1 ч, то это значит, что количество электричества равно
10 А-ч. Если сила тока равна 100 А, а время электролиза состав-
ляло 0,1 ч, то количество электричества будет также равно 10 А-ч.
Следовательно, в первом и втором случаях проходит одинаковое
количество электричества. В соответствии с первым законом Фара-
дея в первом и втором случаях выделится одно и то же количество
вещества. Если же через электролит будет проходить ток силой
100 А в течение 2 ч, то количество электричества составит 200 А-ч
и на электродах выделится в 20 раз больше вещества, чем в первом
и втором случаях.
Второй закон Фарадея заключается в том, что при прохождении
одного и того же количества электричества через растворы различ-
ных электролитов количество веществ, выделившихся на электро-
дах, пропорционально грамм-эквивалентам этих веществ.
Грамм-эквивалент равен отношению атомного веса вещества к
г г 107 88
его валентности. Так, грамм-эквивалент серебра : —р— = 107,88 г;
„ 63,57 „. __
двухвалентной меди: —-— =31,78 г; шестивалентного хрома:
= 8,66 г.
6
Следовательно, по второму закону Фарадея, если через электро-
лит, содержащий AgNO3, CuSO4 и Н2Сг2О7, пропустить одинаковое
количество электричества, то выделившиеся количества серебра,
меди и хрома будут находиться в отношении 107,88:31,78:8,66.
Для того чтобы выделить 1 г-экв вещества, требуется затратить
теоретически 96 500 Кл. Эта величина называется числом Фа-
радея. Так как 1 Кл равен количеству электричества, проходящего в
1 с при силе тока 1 А, то 96 500 Кл составят 96500:3600=26,8А-ч
(3600 — количество секунд в 1ч). Следовательно, за 26,8 А-ч
будет выделяться 1 г-экв вещества.
В течение 1 А-ч выделится вещества в 26,8 раз меньше, т. е.
1 г-экв: 26,8. Эта величина называется электрохимическим эквива-
лентом. Например, грамм-эквивалент для хлора равен 35,46 г, для
126
едкого натра 40,0 г, для водорода 1,008 г. Соответственно электро-
химический эквивалент для хлора 35,46:26,8= 1,323 г, для водорода
1,008 : 26,8=0,0376 г, для едкого натра 40 : 26,8= 1,4926 г.
Практически на электродах выделяется меньшее количество ве-
ществ, чем следует из законов Фарадея. Это объясняется тем, что
помимо основного процесса, приводящего к выделению на электро-
дах необходимых (целевых) продуктов, протекают процессы, обу-
словливающие выделение побочных продуктов. Оценить эффектив-
ность электрохимического процесса позволяет так называемый вы-
ход по току Т).
Выход по току — отношение количества выделившегося на
электроде вещества (Опр) к теоретически возможному количеству
(GT), рассчитанному по законам Фарадея. Обычно выход по току т)
выражается в процентах:
tj = -g-- 100% . (IX,5)
Например, через раствор соли никеля пропускали ток силой 100 А
в течение 0,5 ч. При этом образовалось 50 г никеля. Требуется
определить выход по току. Атомный вес никеля 58,7; валентность 2.
В соответствии с законами Фарадея за 1 А-ч должно было выде-
литься
58’7 = 1,095 г.
2 • 26,8
Так как через раствор пропущено тока 100-0,5=50 А-ч, то всего
должно было бы выделиться 1,095-50 = 54,75 г. Следовательно, вы-
ход по току составит
71 = -52-. 100 = 91,3% .
1 54,75
При электролизе, как указывалось помимо основного процесса,
на который затрачивают электрическую энергию, протекает ряд
побочных, связанных также с затратами энергии. Практические
затраты энергии на электролиз будут тем меньше, чем ниже напря-
жение на электролизере и чем выше выход по току. Мерой эффек-
тивности использования энергии при электролизе служит коэф-
фициент использования энергии (ц), который равен от-
ношению количества энергии, теоретически необходимой для выде-
ления единицы продукта (Ц7Т), к действительно затраченной
р. = • 100% , (IX,6)
»*пр
ИЛИ
" и = (IX,6а)
*пр
где Ут — теоретическое напряжение на электролизере, В; Vnp —
практическое напряжение на электролизере, В; ц — выход по току.
127
На практике всегда стремятся иметь как можно больший коэф-
фициент использования энергии. Для этого создают условия, при
которых напряжение на ванне (Ущ>) невелико, а выход по току (г|)
большой.
Сырье. Для производства хлора, едкого натра, водорода исполь-
зуют раствор поваренной соли, который подвергают электролизу.
Поваренная соль встречается в природе в виде подземных залежей
каменной соли, в водах озер и морей и в виде естественных рассо-
лов или растворов. Залежи каменной соли в СССР находятся в
Рис. 48. Ванна с фильтрующей
диафрагмой:
1 — цилиндрический сосуд, 2 — ас-
бестовая диафрагма, 3 — железный
катод, 4 — графитовый аиод, 5 —
анодное пространство, 6 — катод-
ное пространство
Донбассе, на Урале, в Сибири, Закав-
казье и других районах. Богаты солью
у нас в стране озера Эльтон и Баскун-
чак.
В летнее время происходит испаре-
ние воды с поверхности озер, и пова-
ренная соль выпадает в виде кристал-
лов. Такая соль называется самосадоч-
ной. В морской воде содержится до
35 г/л хлористого натрия. В местах с
жарким климатом, где происходит ин-
тенсивное испарение воды, образуются
концентрированные растворы хлорис-
того натрия, из которых он кристалли-
зуется. В недрах земли, в пластах соли
протекают подземные воды, которые
растворяют NaCl и образуют подзем-
ные рассолы, выходящие через буровые
скважины на поверхность.
Электролиз растворов хлористого
натрия. Этот процесс осуществляют в
ваннах с фильтрующей диафрагмой и
железным катодом и в ваннах с ртут-
ным катодом.
Ванна с фильтрующей диа-
фрагмой, схема работы которой изображена на рис. 4$, пред-
ставляет собой цилиндрический сосуд /, внутри которого находится
асбестовая диафрагма 2, железный катод 3 в виде сетки и графи-
товый анод 4.
В водном растворе хлористый натрий диссоциирован на ионы
Na+ и С1-. Вода, хотя слабо, но также диссоциирована на ионы Н+
и ОН-. При пропускании постоянного электрического тока на ано-
де происходит разряд ионов хлора и образуются молекулы газооб-
разного хлора:
2С1- — 2е = С12
На катоде разряжаются ионы водорода:
2Н+ 4- 2е = Н2
(IX,7)
(IX,8)
и выделяется водород.
128
Ионы гидроксила и натрия образуют едкий натр:
Na+ + ОН- = NaOH (IX,9)
Предварительно очищенный от ионов кальция и магния насыщен-
ный раствор хлористого натрия (около 310 г/л) подается в анодное
пространство 5 ванны, где при прохождении электрического тока
при температуре около 80°С происходит выделение хлора на аноде.
Раствор хлористого натрия фильтруется через диафрагму 2, водо-
род выделяется на катоде и выводится из катодного пространства 6.
Образовавшийся NaOH вместе с неразложившейся поваренной
солью стекает на дно катодного пространства и выводится из ван-
ны. Состав этого раствора, называемого электролитическим щело-
ком, примерно следующий: NaOH—ПО—120 г/л, NaCl—170—
180 /гл.
Для увеличения нагрузки на ванну (силы питающего тока) и
повышения ее производительности стремятся в данном объеме ван-
ны получить возможно более развитую поверхность катода и диаф-
рагмы и полнее использовать поверхность анода. Это приводит к
усложнению формы катода. С усложнением конфигурации катода
становится затруднительным нанесение на него асбестового карто-
на. В этом случае наносят диафрагму насасыванием ее иа сложную
поверхность катода из суспензии (взвеси) асбестового волокна в
соляном растворе. Такого типа ванны называют ваннами с осаж-
денной диафрагмой. В СССР созданы ванны с осажденной диаф-
рагмой БГК-13 и БГК-17, показатели работы которых приведены
в табл. 15.
Таблица 15. Показатели работы ванн с осажденной диафрагмой
Показатель Тип ванна
БГК-13 БГК-17
Нагрузка, А Напряжение, В Выход по току, % Расход энергии на 1 т NaOH, кВт-ч Концентрация щелока NaOH, г/л 5000 3,35 93,5 2370—2400 120 20 000—30 000 3,35—3,40 94—96 2350—2400 135—140
Ванны с ртутным (жидким) к а т о д о м состоят из двух
частей — электролизера и разлагателя, соединенных друг с другом
(рис. 49). Электролизер 1 представляет собой длинный закрытый
ящик. В него опущены графитовые аиоды 2, катодом служит
ртуть 3, которая течет по слегка наклонному дну ванны. Раствор
хлористого натрия концентрацией 310—315 г/л NaCl непрерывно
подается в электролизер. При прохождении постоянного тока на
анодах выделяется хлор по реакции (IX,7), на катоде происходит
разряд ионов натрия
Na‘h + « = Na (IX, 10)
5-275 129
который реагирует с ртутью, и образуется амальгама натрия:
Na+ + nHg = NaHgn (IX, 11)
амальгама натрия
Из электролизера непрерывно выводятся обедненный раствор
(в нем содержится около 270 г/л NaCl) и амальгама натрия, кото-
рая поступает в разлагатель 4, где она обрабатывается водой. При
этом протекает реакция
NaHgn + Н2О = NaOH + 0,5 Н2 + n Hg (IX, 12)
Рис. 49. Ванна с ртутным катодом:
1 — электролизер, 2 — графитовые аноды, 3 — ртутный катод, 4 — разлага*
тель, 5 — насос
Как видно из реакции (IX, 12), в разлагателе происходит образова-
ние раствора едкого натра и водорода. Выделившуюся ртуть с по-
мощью насоса 5 возвращают в электролизер. Таким образом, ртуть
находится в замкнутом цикле (электролизер — разлагатель — элек-
тролизер).
Обедненный раствор хлористого натрия насыщают NaCl и вновь
возвращают на электролиз.
Ванны с ртутным катодом работают при напряжении около
4,5 В, нагрузка на ванну достигает 200 000 А, температура электро-
лита 70—80°С. Выход по току составляет 94—96%. Концентрация
щелочи на выходе из разлагателя 450—500 г/л, расход энергии на
1 т NaOH 3100—3200 кВт-ч.
Преимущества ванны с ртутным катодом — высокая концентра-
ция получаемой щелочи, что уменьшает расход топлива на ее упа-
ривание, и высокая степень чистоты получаемой щелочи. Недостат-
ке
ками этих ванн по сравнению с ваннами с фильтрующей диафраг-
мой являются повышенный расход энегии на единицу продукции:
значительные капитальные затраты на строительство ванн, необхо-
димость в установках большого количества ртути; вредные условия
труда из-за проникновения паров ртути в атмосферу рабочих поме-
щений и др.
Несмотря ва недостатки ванн с ртутным катодом, применение их
возрастает. Это объясняется тем, что отдельные производства, как,
например, производство искусственного шелка, требуют чистой ще-
лочи, не содержашей хлоридов. Такую щелочь можно получить
только в ваннах с ртутным катодом.
Растворы щелочи, получаемые из ванн с фильтрующей диаф-
рагмой и из разлагателей ванн с ртутным катодом, подвергают упа-
риванию вначале в вакуум-выпарных аппаратах, а затем в котлах
до концентрации NaOH 92—94%. В случае концентрирования ще-
локов из ванн с фильтрующей диафрагмой, которые содержат не
только NaOH, но и NaCl, при их упаривании происходит кристалли-
зация хлористого натрия. Однако полностью удалить NaCl не уда-
ется, н поэтому едкий натр содержит в качестве примеси 2—3%
NaCl. Хлористый натрий, который выделяется при упаривании ще-
локов, возвращают на электролиз (табл. 16 и 17).
Хлор, полученный при электролизе, насыщен водяными парами.
Его в ряде случаев перерабатывают в жидкий хлор. Сначала ох-
лаждают, и из него конденсируется влага. Затем для окончатель-
ной осушки его подают в башни, орошаемые концентрированной
серной кислотой, которая поглощает влагу, содержащуюся в хлоре.
Хлор переводят в жидкость при сжатии до 3—6 кгс/см2 и охлажде-
нии до — 25°С.
Жидкий хлор хранят и перевозят в стальных баллонах, бочках
или цистернах емкостью до 50 т.
§ 39. Получение соляной кислоты
Соляную кислоту получают в две стадии—сначала производят
хлористый водород, а затем поглощают (абсорбируют) его водой.
Получение хлористого водорода. Процесс может быть осущест-
влен тремя методами: сульфатным, синтезом из элементов и хлори-
рованием органических соединений.
Сульфатный метод получения хлористого водорода заключается
в разложении поваренной соли концентрированной серной кислотой
(92—93% H2SO4) по реакции
2 NaCl + HaSO, = Na2SO9 + 2 HCI (IX. 13)
При этом получается твердый сульфат натрия и газообразный хло-
ристый водород. Реакцию проводят при 500—550°С в муфельных
печах, обогреваемых снаружи горячими дымовыми газами.
Газ, выходящий из печи, содержит около 35% хлористого водо-
рода. Он загрязнен соединениями мышьяка, парами серной кисло-
ты и другими примесями. При поглощении хлористого водорода во-
5*
131
Таблица 16. Электролиз растворов NaCl в вайнах с фильтрующей
(осажденной) диафрагмой
Лроаэссы
Что происходит
В каких аппаратах
Раствор NaCl
(рассол)
Очистка рассола от
ионов кальция и магния
М§(НСО3!)22}+пСа(ОН)2=
_ 2СаСб3 | 4-2НаО
~ 2СаСО, ф +
+ Mg(OH)2 | + 2НаО
мЭ}+^С°з=
_ СаСО31 +Na2SO4
- MgCO3 | +2NaCl
2H+ 4- 2e == H,
2СГ — 2e = Cl2
Na+ + OH~=NaOH
Выпарка щелока и
кристаллизация NaCl
Дальнейшее концен-
трирование раствора ще-
лочи
Са(ОН)2, Na2CO3 |
4 4
дой эти примеси переходят в раствор и загрязняют получаемую со-
ляную кислоту, концентрация которой составляет 27—28% НС1.
Таким образом, при сульфатном методе трудно обеспечить по-
лучение чистой кислоты. В этом процессе расходуется серная кисло-
та, которую целесообразно использовать для производства других
132
Таблица 17. Электролиз раствора NaCl в вайнах с ртутным катодом
Процессы
Что происходит
В каких аппаратах
Подготовка рассола
Очистка рассола от
ионов кальция и магния:
Са(НСО3)2 1_с(2аЮН) _
MgfHCO^j /+са(ОН)2 -
2СаСО3 | +2Н2О
СаСО3 | +Mg(OH)2 |
+ 2Н2О
мй} + ^С°з =
СаСО31 +Na«SO4
"MgCO3 4 +2NaCl
: Раствор
i NaCl
i (рассол)
4
Са(ОН)2, Na,CO-,
I
Электролиз
раствора NaCl
Na+ -f- e= Na
Na -f- nHg •= NaHg„
2C1" — 2e = Cl2
I
NaHg„ + H2O =NaOH +
+ 0,5Ha -f- n Hg
Выпарка раствора
NaOH
Дальнейшее концент-
рирование раствора ще-
лочи
4
133
продуктов, например удобрений. Помимо этого, к недостаткам спо-
соба нужно отнести расходование топлива на нагрев реагентов.
Этот способ может представлять интерес для получения сульфата
натрия. Однако в связи с открытием месторождений природного
сульфата он утратил свое значение.
Синтез хлористого водорода из хлора и водорода, получаемых
при электролизе раствора поваренной соли, протекает по реакции
С12 + Н2 = 2 НС1 + Q (IX,14)
вплоть до взрыва.
2
Хлор
Рис. 50. Печь для синте-
за хлористого водорода:
I — корпус, 2 — асбестовая
крышка. 3 — патрубок. 4 —
смотровое отверстие, 5 —
горелка
Эта реакция не идет при обычных температурах и в темноте. При
нагревании и на свету она протекает с очень большой скоростью,
~ яшение температуры до 2300—2400°С проис-
ходит за счет тепла, выделяющегося при вза-
имодействии хлора с водородом. Обычно с
целью полного использования хлора берется
5—10%-ный избыток водорода по сравне-
нию с тем, которое требуется по реакции
(IX, 14).
Синтез хлористого водорода осуществля-
ется в печах (рис. 50), которые просты по
устройству. Печь имеет стальной корпус 1.
Нижняя часть корпуса печи футерована ог-
неупорным кирпичом. На дне печи располо-
жена горелка 5, представляющая собой две
трубы, вставленные одна в другую. По внут-
ренней трубе подается в печь хлор, по на-
ружной — водород. Хлористый водород вы-
ходит из печи сверху через патрубок 3. Для
наблюдения за горением водорода в хлоре
печь снабжена смотровыми отверстиями 4.
Сверху печь закрыта асбестовой крышкой 2,
которая вылетает в случае взрыва, что пре-
дохраняет печь от разрушения.
Синтез хлористого водорода из элемен-
тов имеет ряд преимуществ перед сульфатным методом его произ-
водства. Прежде всего к ним относятся высокая концентрация хло-
ристого водорода в газах (до 90%), выходящих из печи, и отсутст-
вие в них примесей. Это позволяет получать кислоту более высокой
концентрации и степени чистоты, чем при сульфатном способе, — в
данном случае производят кислоту, содержащую 31 % HCI. Преиму-
ществом способа является и то, что отпадает необходимость расхо-
дования серной кислоты и топлива. Достоинства синтеза хлористо-
го водорода обусловили широкое использование этого способа.
Хлорирование органических соединений применяют для получе-
ния различных хлорпроизводных на предприятиях органического
синтеза. Этот процесс можно проиллюстрировать реакцией хлори-
рования бензола:
C6He + С12 = СвН5С1 + HCI (IX, 15)
бензол хлорбензол
134
Хлористый водород, образующийся в качестве побочного про-
дукта, используют для получения соляной кислоты.
Абсорбция хлористого водорода водой. Процесс сопровождается
выделением тепла, и поэтому при растворении хлористого водорода
в воде происходит повышение температуры. Вместе с тем чем выше
температура, тем меньше может раствориться хлористого водорода,
так как растворимость его с повышением температуры падает. От-
сюда можно сделать вывод о том, что абсорбцию хлористого водо-
рода следует проводить при возможно более низких температурах.
Поэтому раньше для получения более концентрированной кислоты
стремились интенсивно отводить тепло из поглотительных аппара-
тов. Для этого необходимо было передавать как можно больше
тепла от поглотителя в окружающую среду. Этого достигали увели-
чением поверхности теплоотдачи поглотителей и числа поглотите-
лей, обслуживающих одну установку. Число поглотителей в этом
случае достигало 30—40, что усложняло и удорожало установку.
Советский инженер А. М. Гаспарян доказал, что при достаточно
высокой концентрации хлористого водорода в газах тепло растворе-
ния НС1, если его не отводить в окружающую среду, будет расхо-
доваться на испарение воды из раствора, и концентрация получае-
мой кислоты будет постепенно увеличиваться. Следовательно,
отпадает необходимость в развитии поверхности теплоотдачи в ок-
ружающую среду, а это приводит к значительному уменьшению
габаритов абсорбционной установки. Абсорбер, предложенный
А. М. Гаспаряном, представляет собой колонну с насадкой. Колон-
на изготавливается из кислотоупорных материалов — керамики,
кварца, пластических масс (винипласта, фаолита). Сверху колонна
орошается водой, снизу в нее поступает хлористый водород. Соля-
ная кислота концентрацией 31% НС1, образующаяся в колонне,
выводится из нее снизу.
Соляная кислота поступает потребителям в стеклянных буты-
лях, установленных в корзинах и обложенных стружкой. В больших
количествах ее перевозят в специальных (гуммированных внутри)
стальных цистернах, баках и других емкостях.
Контрольные вопросы
1. Назовите основные области потребления едкого натра, хлора и соляной
кислоты.
2. Что такое выход по току и коэффициент использования энергии?
3. Какие процессы протекают на аноде и на катоде при электролизе раство-
ров хлористого натрия в ваннах с диафрагмой? В ваннах с ртутным катодом?
4. Назовите преимущества и недостатки электролизеров с диафрагмой и с
ртутным катодом.
5. Как получается жидкий хлор?
6. Каковы преимущества способа получения хлористого водорода синтезом
из хлора и водорода?
7. В чем сущность предложенного А. М. Гаспаряном способа абсорбции хло-
ристого водорода?
135
Глава X
ПРОИЗВОДСТВО МИНЕРАЛЬНЫХ УДОБРЕНИИ
И ЯДОХИМИКАТОВ
Построение коммунистического общества в нашей стране нераз-
рывно связано с созданием высокопродуктивного сельского хозяй-
ства. Только при условии высокоразвитого сельского хозяйства
могут быть в полной мере удовлетворены потребности народа в
продуктах питания. Ответственная роль в этом деле принадлежит
химической промышленности, которая сейчас становится решаю-
щей силой в создании высоких и устойчивых урожаев и повышении
продуктивности животноводства. Имеется в виду всестороннее вне-
дрение химии в сельское хозяйство — применение удобрений, хими-
ческих средств борьбы с сорняками (гербицидов), препаратов для
борьбы с вредителями и болезнями растений (инсектофунгисидов),
стимуляторов роста и т. д.
Выдающаяся роль химии в борьбе за получение высоких урожа-
ев нашла отражение в Программе Коммунистической партии Совет-
ского Союза, которая предусматривает осуществление всесторон-
ней химизации сельского хозяйства, полное удовлетворение его
потребностей в минеральных удобрениях и других химических сред-
ствах воздействия на продуктивность сельского хозяйства. Особое
внимание в решениях партии и правительства уделяется производ-
ству минеральных удобрений.
Удобрения — это вещества, содержащие элементы, необходимые
для питания растений, и вносимые в почву с целью получения высо-
ких и устойчивых урожаев. В состав растений входит около вось-
мидесяти химических элементов. Основную массу растений сос-
тавляют углерод, кислород, водород. Жизненно важными элемента-
ми являются азот, фосфор, калий, кальций, магний, сера, железо,
бор, марганец, медь, цинк и др.
Источниками веществ, необходимых для питания растений, слу-
жат окружающая растения атмосфера и почва, в которой они
произрастают.
Углерод в виде углекислоты и кислород растения извлекают
из воздуха. Небольшие количества углекислоты воспринимаются
корневой системой растений из почвы. Водород растения получают
с атмосферными осадками и влагой, имеющейся в почве. Азот рас-
тения получают из почвы через корневую систему в виде растворов
азотнокислых солей, мочевины, аммиака и др. Как было указано
(с. 89), некоторое количество азота растения получают в результа-
те процессов фиксации азота атмосферы. Однако эти естественные
процессы не обеспечивают потребности растений в азоте, и поэтому
он должен вноситься в почву с удобрениями. Фосфор растения мо-
гут получать из почвы в виде растворимых фосфорнокислых солей.
Но содержание этих солей в почве невелико, и поэтому фосфор
растения получают главным образом благодаря внесению в почву
удобрений. Калий также вносится в почву с удобрениями. Бор, сера,
136
медь, кобальт и некоторые другие элементы в небольших количе-
ствах необходимы для развития растений. Эти элементы называют
в сельскохозяйственной практике микроэлементами, а содер-
жащие их удобрения — микроудобрениями.
Количество химических
элементов, вносимых с удоб-
рениями на 1 га посевной
площади, колеблется при-
мерно в следующих преде-
лах: азота 30—120 кг, фос-
фора (в пересчете на фос-
форный ангидрид Р2О5) 40—
120 кг, калия (в пересчете на
окись калия К2О) 40—200 кг.
Результаты, получаемые при
применении удобрений, по-
казаны в табл. 18.
Результаты использова-
ния удобрений иллюстриру-
ются также схемой 16.
Таблица 18. Примерный прирост
урожая при внесении в почву азота,
фосфора, калия
Сельскохозяйственны е
культуры
Сахарная свекла . .
Картофель . . . .
Хлопок-сырец . .
Лен-волокно . . .
Озимая пшеница
(зерно).............
В тоннах на тонну
внесенного
N P2OS KSO
100 70
120 80
20 25
40
60
2
1,5
4
Схема 16. Урожайность некоторых культур без использования удоб-
рений и при внесении азотных удобрений (ц/га)
В дореволюционной России имелись лишь полукустарные произ-
водства фосфоритной муки и суперфосфата; азотные и калийные
удобрения не производились. В годы первой мировой войны произ-
водство удобрений почти прекратилось. После Великой Октябрь-
ской социалистической революции, буквально с первых шагов
Советской власти, в стране проявляется забота о создании мощного
производства удобрений. В трудные для страны первые послерево-
люционные годы организуется отраслевой Научный институт удоб-
рений (ныне НИУИФ — Научный институт удобрений и инсекто-
фунгисидов), широким фронтом ведутся геологические поиски
сырья для производства удобрений, начинается проектирование и
строительство предприятий, выпускающих удобрения. В результате
137
в 1928 г. выпуск удобрений составил 135 000 т. Для того времени
это было большим достижением советской науки и техники.
Быстрорастущая потребность сельского хозяйства в удобрениях
обусловила дальнейшее развитие этой отрасли химической про-
мышленности. В 1975 г. в СССР было выработано 90 млн. т удоб-
ренийВ 1980 г. по решениям XXV съезда КПСС производство
удобрений планируется довести до 143 млн. т1 2. Учитывая большое
многообразие почвенно-климатических условий Советского Союза,
в стране увеличивается не только количество выпускаемых удобре-
ний, но и ассортимент удобрений. При этом ставится задача выпус-
ка удобрений только высокого качества.
§ 40. Классификация удобрений
Удобрения классифицируются по происхождению, агрохимиче-
скому значению, составу и количеству входящих в них питательных
элементов.
По происхождению удобрения подразделяются на естественные
и искусственные. Естественные удобрения — это природные вещест-
ва, не подвергнутые переработке: навоз, зола растений, так называ-
емые агрономические руды (фосфориты и апатиты). Естественные
удобрения в больших количествах используются в сельском хозяй-
стве, однако питательные элементы иногда находятся в них не в
том количестве и не в тех сочетаниях, как это необходимо для уве-
личения урожайности.
Процесс усвоения питательных элементов растениями заключа-
ется в растворении удобрений в почвенных водах и поглощении
полученных растворов корневой системой растений. Таким образом,
необходимым условием для усвоения питательных элементов рас-
тениями является растворимость удобрений. В агрономических
рудах — апатите и фосфорите содержится значительное количество
фосфора, но эти руды нерастворимы в воде и поэтому находящийся
в них фосфор чрезвычайно медленно усваивается растениями, т. е.
фосфор находится в «неусвояемой» или «трудноусвояемой» форме.
Недостатки, присущие естественным удобрениям, а также необхо-
димость увеличения количества удобрений выдвигают задачу все-
мерного развития процессов синтеза искусственных удобрений.
Искусственные удобрения, получаемые переработкой природных
материалов, могут содержать высокий процент питательных эле-
ментов в различном их соотношении.
По происхождению удобрения можно также подразделять на
минеральные, органические, органо-минеральные и бактериальные.
К минеральным удобрениям, в значительных количествах вы-
рабатываемым на химических предприятиях, относятся главным
образом неорганические соли, из органических соединений — кар-
бамил (мочевина). Органические удобрения содержат пита-
1 Материалы XXV съезда КПСС. М., Политиздат, 1976, с. 137.
2 Там же, с. 181.
138
тельные элементы, входящие в состав органических соединений.
Органо-минеральные удобрения — смесь органических и ми-
неральных удобрений. Бактериальные удобрения содержат
культуры бактерий, которые способствуют накоплению в почве ус-
вояемых форм питательных элементов.
По агрохимическому значению удобрения делятся на прямые и
косвенные. Прямые удобрения содержат питательные элементы,
например азот, фосфор, калий, которые усваиваются растениями,
т. е. прямые удобрения являются пищей для растений. Косвен-
ные удобрения вносят в почву для улучшения ее физических,
химических и биологических свойств. В качестве косвенных удоб-
рений используют известняк, доломит, гипс и др.
По составу, т. е. по видам питательных элементов, прямые удоб-
рения подразделяются на азотные, фосфорные, калийные, магние-
вые и др. В отдельную группу входят микроудобрения.
По количеству питательных элементов удобрения подразделяют-
ся на простые, или односторонние, и комплексные, или многосто-
ронние.
Простые, или односторонние, удобрения содержат толь-
ко один питательный элемент — азот, фосфор или калий. Например,
суперфосфат содержит монокальцийфосфат Са(Н2РО4)2, т. е. в нем
имеется только один питательный элемент—фосфор, и он пред-
ставляет собой простое фосфорное удобрение. Аммиачная селитра
NH4NO3, в которой из питательных элементов содержится только
азот, относится к простым азотным удобрениям. КС1 содержит пита-
тельный элемент калий и является простым калийным удобрением.
Комплексные, или многосторонние, удобрения содер-
жат несколько питательных элементов в различных сочетаниях.
Например, удобрение аммофос [NH4H2PO4 + (NH^HPOJ содер-
жит два питательных элемента — азот и фосфор, калийная селитра
KNO3 — калий и азот, а нитрофоска, представляющая собой смесь
солей [NH4NO3+NH4H2PO4 + СаНРО4 • 2Н2О + КС1 + CaSO4 • 2Н2О],
имеет в своем составе азот, фосфор и калий.
Различают сложные и смешанные многосторонние удобрения.
Смешанные удобрения получают механическим смешением од-
носторонних удобрений; к ним относится, например, нитрофоска.
Сложные удобрения образуются в результате химических реак-
ций. Так, калийную селитру получают реакцией обменного разло-
жения NaNOs и КС1.
По содержанию питательных элементов в удобрениях их также
подразделяют на концентрированные и неконцентри-
рованные, или ординарные. Обычно количество азота в
удобрениях выражается в процентах азота N, количество фосфо-
ра— в пересчете на процент фосфорного ангидрида Р2О5, калия —
в пересчете на процент окиси калия КгО. Концентрация питатель-
ных элементов во многом определяет качество удобрений. Чем
выше концентрация питательных веществ и меньше балласта, тем
ценнее удобрение. Применение концентрированных удобрений поз-
воляет сократить расходы на перевозку удобрений от заводов до
139
колхозов и совхозов, на тару и хранение удобрений, а также на вне-
сение удобрений в почву. В связи с этим перед промышленностью
ставится задача увеличения выпуска концентрированных удо-
брений.
Помимо высокой концентрации питательных веществ качество
удобрений определяется их физическими свойствами. Удобрения
должны быть сухими, рассыпчатыми, удобными для рассева меха-
ническими сеялками. Они не должны слеживаться в глыбы или
крупные комки. Частицы удобрений должны быть не слишком
крупными, чтобы растениям было легче извлекать из них питатель-
ные вещества, но и не слишком мелкими, иначе они будут разно-
ситься ветром, распыляться при транспортировке. В связи с этим
выпускают гранулированные удобрения — в виде шариков диамет-
ром 2—4 мм.
Показателем качества удобрений является способность их впи-
тывать влагу — гигроскопичность. Гигроскопичность удобрений оп-
ределяет условия их транспортировки, хранения, характер тары.
§ 41. Фосфорные удобрения
Сырье. Фосфорсодержащие соединения в больших количествах
дает природа в виде так называемых фосфатных руд, или природ-
ных фосфатов, — апатитов и фосфоритов. Крупнейшее месторожде-
ние апатитов, расположенное в Хибинах на Кольском полуострове,
не имеет себе равных в мире. Честь открытия этого месторождения
принадлежит академику А. Е. Ферсману. Мощные месторождения
фосфоритов находятся в Казахстане (месторождение Кара-Тау),
на Урале, Украине, в Подмосковье.
В состав фосфоритов и апатитов входит трикальцийфосфат
Са3(РО4)2 и фторапатит Ca5F(PO4)3; эти соединения служат источ-
ником получения фосфора, необходимого для растений.
Примеси, находящиеся в фосфорных рудах, значительно снижа-
ют в них концентрацию Р2О5. Некоторые примеси оказывают вред-
ное влияние на переработку руд и качество получаемых из них
удобрений. Особенно нежелательны примеси окислов железа и
алюминия (Fe2O3, А12О3) и солей угольной кислоты — карбонатов.
Чтобы повысить концентрацию фосфатов кальция в рудах и сни-
зить в них количество вредных примесей, природные фосфаты под-
вергаются обогащению.
При измельчении фосфоритов получают фосфоритную муку, ко-
торую используют в качестве фосфорного удобрения. Однако соеди-
нения Са3(РО4)2 и CasF(PO4)3 малорастворимы в почвенных водах,
и поэтому фосфор, содержащийся в фосфоритной муке, очень мало
и медленно усваивается растениями. Таким образом, фосфоритная
мука является трудноусваиваемым удобрением и при тонком помо-
ле оказывается эффективной только на кислых подзолистых
почвах.
К растворимым фосфорсодержащим соединениям относятся
монокальцийфосфат Са(Н2РО4)2 и дикальцийфосфат СаНРО4. Мо-
140
нокальцийфосфат хорошо растворим в воде и потому хорошо усва-
ивается растениями; содержащие его удобрения называют водора-
створимыми. Дикальцийфосфат в воде нерастворим, но растворим
в почвенных кислотах и потому усваивается растениями на кислых
почвах. Критерием растворимости удобрений, содержащих СаНРО4,
служит растворимость их в аммиачном растворе лимоннокислого
аммония или в 2 %-ном растворе лимонной кислоты. Такого типа
удобрения называют цитратнорастворимыми или лимоннораствори-
мыми. Удобрения водорастворимые, цитратнорастворимые и лимон-
норастворимые представляют собой усвояемые фосфорные удоб-
рения.
Процесс получения искусственных фосфорных удобрений заклю-
чается в переводе трудноусвояемого растениями фосфора, содер-
жащегося в фосфатных рудах, в растворимую, усвояемую форму.
Одновременно с этим стремятся к получению фосфорных удобрений
с возможно большей концентрацией фосфора.
Современные методы переработки фосфатных руд в искусствен-
ные удобрения можно разделить на следующие группы:
1. Разложение природных фосфатов кислотами (серной, азот-
ной, фосфорной, реже соляной). При этом получаются главным
образом водорастворимые удобрения — суперфосфат, двойной су-
перфосфат.
2. Гидротермическая переработка природных фосфатов — обра-
ботка водяным паром с получением цитратнорастворимых или ли-
моннорастворимых, так называемых обесфторенных фосфатов.
3. Разложение природных фосфатов путем спекания или сплав-
ления их при высокой температуре с солями натрия, калия, магния
и щелочноземельных металлов. В результате получаются цитрат-
но- или лимоннорастворимые удобрения — термофосфаты, плавле-
ные фосфаты.
Основные и самые распространенные фосфорные удобрения в
настоящее время — суперфосфат и двойной суперфосфат.
Производство фосфорной кислоты. Фосфорную кислоту, необхо-
димую для получения ряда удобрений, в частности двойного супер-
фосфата, производят из фосфоритов или апатитов экстракционным
и электротермическим способами.
Экстракционный способ получения фосфорной кислоты
заключается в разложении природных фосфатов кислотами, боль-
шей частью серной, по реакции
Са3 (РО4)2 + 3 H2SO4 + 6 Н2О = 2 Н3РО4 + 3 (CaSO4 • 2 Н2О) (X, 1)
Фосфорную кислоту (раствор) отфильтровывают от осадка
(гипса). Осадок промывают водой для более полного удаления
фосфорной кислоты. Однако и после промывки часть фосфорных
соединений остается в гипсе, поэтому он получил название фосфо-
гипса.
Установка для получения экстракционной фосфорной кислоты
включает сравнительно простые аппараты. Основными являются
экстракторы (чаны с мешалкой) и вакуум-фильтры. Экстракцион-
141
ная фосфорная кислота содержит не более 36% Н3РО4. Для про-
изводства двойного суперфосфата и других удобрений экстракцион-
ную фосфорную кислоту в отдельных случаях упаривают до кон-
центрации 50—75% в барабанных барботажных концентраторах,
принципиально мало отличающихся по своему устройству и дейст-
вию от концентраторов, применяемых при упаривании серной кис-
лоты.
Электротермический способ получения фосфорной
кислоты заключается в восстановлении в электрических печах при
температуре около 1500°С фосфора, содержащегося в природных
фосфатах, углеродом в присутствии кремнезема:
Cas (РО4)2 + 5С + n SiO2 = Р2 + 3 [СаО • п SiO2J 4- 5 СО (Х,2)
При этом фосфор получается в парообразном состоянии. Этот
процесс иногда называют электровозгонкой. При окислении (сжи-
гании) паров фосфора, выходящих из печи, или расплавленного
фосфора получается фосфорный ангидрид:
2Р2 + 50, = 2 P2OS (Х,3)
Далее фосфорный ангидрид взаимодействует с водой. Сначала
образуется метафосфорная кислота
Р2О6 + Н2О 2 НРО3 (Х,4)
которая при охлаждении и наличии избытка воды гидратируется
(присоединяет воду) с получением термической фосфорной кислоты
Н3РО4, отличающейся высокой чистотой и концентрацией — до
80—95%. Она пригодна для получения ряда солей фосфорной кис-
лоты и синтеза органических соединений. При дешевой электро-
энергии термическую фосфорную кислоту целесообразно применять
для производства концентрированных удобрений (двойного супер-
фосфата, преципитата, аммофоса и др.).
Производство простого суперфосфата. Это светло-серый, порош-
кообразный продукт, в состав которого входит монокальцийфосфат
Са(Н2РО4)2.
Сырьем для производства суперфосфата служат природные фос-
фаты— фосфориты и аппатиты и башенная серная кислота. Между
ними протекает следующая реакция:
Са3 (РО4)2 + 2 H,SO4 4- п НгО = Са (Н2РО4)2 • Н2О +
•4-2 [CaSO4 • 2 Н2О[ (Х,5)
По реакции (X, 5) получается твердая смесь монокальцийфос-
фата с гипсом, которая и называется простым суперфосфа-
том или просто суперфосфатом. Наряду с этим в суперфос-
фате находятся примеси соединений железа, алюминия, кремния и
других элементов, перешедших в него из сырья.
Взаимодействие природных фосфатов с серной кислотой требу-
ет длительного времени. Весь процесс производства суперфосфата
разбивается на ряд стадий: 1) измельчение природных фосфатов;
142
(башенная, концентрацией
Ц20 75%-наяН^ Фосфоритная
Суперфосфат
на склад
Рис. 51. Схема производства
простого суперфосфата:
1 — дозатор-смеситель, 2 — весы,
3 — смеситель, 4 —• камера созре-
вания
2) смешение природных фосфатов с серной кислотой; 3) «созрева-
ние» суперфосфата, в течение которого протекает реакция (X, 5);
4) измельчение, или «вырезывание», суперфосфата; 5) «дозрева-
ние» суперфосфата на складе — завершение взаимодействия
Са3(РО4)2 с серной кислотой.
На рис. 51 показана принципиальная схема производства про-
стого суперфосфата. Серная кислота
75%) непрерывно поступает в дозатор-
смеситель /, где разбавляется водой до
концентрации 68%, и затем подается в
камерный смеситель 3. Дозировку фос-
форитной или апатитовой муки, посту-
пающей из хранилища в производство,
осуществляют при помощи автомати-
ческих весов 2. Смешивают фосфатную
муку с серной кислотой в смесителе 3
непрерывного действия. Полученную в
смесителе пульпу направляют в камеру
«созревания» непрерывного действия 4,
где пульпа «схватывается» (затверде-
вает), «созревает», затем подвергается
вырезке и подается на склад.
Смеситель непрерывного действия
(рис. 52) представляет собой две или
три сообщающиеся камеры 4 с быстро-
вращающимися мешалками 2 и пере-
ливной коробкой 3. Фосфорит или апа-
тит и серная кислота подаются в сме-
ситель через входное отверстие (шту-
цер) 1 в крышке аппарата. Время пре-
бывания образующейся пульпы в сме-
сителе невелико — всего 5—6 мин, и
реакция (X, 5) между фосфатом и сер-
ной кислотой здесь только начинается. Пульпа перемешается в те-
чение указанного времени по всей длине смесителя, через перелив-
ную коробку 3 выходит из него и подается в суперфосфатную ка-
меру.
Суперфосфатная камера, в которой протекает реакция (X, 5),
представлена на рис. 53. В ней продолжается начавшаяся в смеси-
теле реакция разложения фосфата серной кислотой, происходит
схватывание, затвердевание реакционной массы с образованием по-
ристого куска суперфосфата и его измельчение. Процесс взаимодей-
ствия фосфата с серной кислотой очень медленный, и для достаточ-
но полного его протекания реагирующие вещества должны нахо-
диться в суперфосфатной камере около 1,5—2 ч.
Суперфосфатная камера непрерывного действия представляет
собой вертикальный железобетонный цилиндр 6 со стальным кожу-
хом и бетонным днищем. Цилиндр 6 медленно (один оборот за 1,5—
2 ч) вращается вокруг внутренней неподвижной чугунной трубы /,
143
установленной на фундаменте и прочно соединенной с неподвиж-
ным щитом 8. Внутри камеры помещен вращающийся цилиндр 3 с
ножами — так называемая карусель для измельчения (вырезыва-
Рис. 52. Смеситель непрерывного действия:
7-—штуцер, 2 —мешалка, 3— переливная коробка, 4 —ка-
меры
ния) суперфосфата. Карусель вращается в направлении, противо-
положном вращению цилиндра 6. Суперфосфатная пульпа из сме-
Рис. 53. Суперфосфатная камера непре-
рывного действия:
/ — чугунная труба, 2 —роликовая опора,
3 — цилиндр, с ножами (карусель), 4 — крыш-
ка камеры, 5 — смеситель, б — железобетон-
ный цилиндр, 7 — транспортер, 8 — неподвиж-
ный щит
сителя 5 через отверстие в кры-
шке камеры 4 возле неподвиж-
ного щита 8 поступает в коль-
цевое пространство между
стенками железобетонного ци-
линдра 6 и трубой 1. Загру-
женная пульпа перемещается
вместе с вращающимся корпу-
сом камеры. Скорость враще-
ния камеры такова, что за вре-
мя ее полного оборота происхо-
дит «созревание» суперфосфа-
та, он затвердевает. «Созрев-
ший» к концу оборота камеры
суперфосфат срезается ножами
карусели 3 и падает через цен-
тральную трубу 1 на транспор-
тер, который передает его на
склад. Камера диаметром 7 м
производит 50 т суперфосфата
в час.
Склад в производстве су-
перфосфата — не только хра-
нилище, но и технологический
цех. Дело в том, что реакция
между фосфатом и серной кис-
лотой в суперфосфатной каме-
144
ре не завершается. Для ее окончания необходимо от 6 до 20 суток.
Этот процесс «дозревания» суперфосфата заканчивается при хра-
нении его на складе. Содержание Р2О5 в суперфосфате, получен-
ном из апатитового концентрата, составляет около 20%.
При производстве суперфосфата в нем остается некоторое коли-
чество непрореагировавшей кислоты, которая ухудшает качество
суперфосфата. Чтобы избавиться от избытка кислоты, ее нейтрали-
зуют добавкой к суперфосфату костяной муки или извести. Иногда
нейтрализацию производят аммиаком, и тогда получают аммонизи-
рованный суперфосфат, содержащий кроме фосфора азот.
Обычный измельченный суперфосфат способен комковаться и
слеживаться, что затрудняет его рассеивание на полях с помощью
сеялок. Помимо этого, частицы порошкообразного суперфосфата
быстро растворяются в воде при внесении его в почву и уходят в
глубинные слои почвы. Таким образом, корневая система растений
не успевает извлечь из удобрения большую часть водорастворимого
монокальцийфосфата. Эти недостатки суперфосфата устраняются
при его гранулировании. Для этого суперфосфат смачивают водой
и пропускают через наклонный обогреваемый вращающийся бара-
бан. При вращении барабана суперфосфат скатывается в шарики—
гранулы .и получается гранулированный суперфосфат.
Как указывалось, в природных фосфатах содержатся примеси
Fe2O3 и А120з. Эти соединения при разложении фосфатов серной
кислотой образуют сульфаты железа и алюминия, которые вступа-
ют во взаимодействие с Са(Н2РО4)2 и переводят фосфор в соедине-
ния, не растворяющиеся в воде. Этот процесс, называемый ретро-
градацией суперфосфата, приводит к снижению концент-
рации усвояемого фосфора в продукте. Поэтому стремятся
использовать для производства суперфосфата сырье с малым содер-
жанием Ре20з и А120з.
Простой суперфосфат представляет собой неконцентрированное
водорастворимое удобрение. Низкая концентрация в нем Р2О5 обус-
ловлена тем, что при разложении природных фосфатов серной кис-
лотой [см. реакцию (X, 5)] наряду с монокальцийфосфатом обра-
зуется гипс (CaSO4-2H2O), который является балластом, снижаю-
щим концентрацию Р2О5 в продукте. Следовательно, для
увеличения концентрации P2Os в суперфосфате нужно подобрать
такую кислоту, чтобы при разложении ею природных фосфатов по-
лучался только монокальцийфосфат Са(Н2РО4)2 и не получалось
других кальциевых солей.
Производство двойного суперфосфата. Для получения двойного
суперфосфата, содержащего (помимо примесей, перешедших в него
из сырья) только Са(Н2РО4)2, разлагают природные фосфаты фос-
форной кислотой:
Са3 (РО4)2 + 4 Н3РО4 + п Н2О = 3 [Са (Н2РО4)2 • Н2О] (Х,6)
Двойной суперфосфат — концентрированное удобрение, содер-
жащее 42—48% P2Os; производство этого удобрения у нас в стране
непрерывно возрастает.
145
Технологические процессы производства двойного суперфосфата
и простого суперфосфата аналогичны. Так же, как и простой супер-
фосфат, двойной суперфосфат подвергают гранулированию и аммо-
низации.
В процессах разложения фосфатного сырья, например апатитов
Са5р(РО4)з, кислотами (производства фосфорной кислоты, просто-
го и двойного суперфосфатов) происходит выделение газов, содер-
жащих фтористые соединения — HF, SiF4. Они обрабатываются
водой, при этом образуется кремнефтористоводородная кислота
H2SiF6, которую перерабатывают в Na2SiF6, NaF и (NH^SiFe.
Производство преципитата СаНРО4 2Н2О. Процесс заключает-
ся в нейтрализации фосфорной кислоты известняком, а затем изве-
стковым молоком:
3 Н3РО4 4- 2СаСО3 = СаНРО4 • 2Н2О + Са (Н2РО4)2 + 2СО2 (Х.7)
Са (H2POJ2 + Са (ОН)2 = 2 СаНРО4 • 2 Н2О (Х.8)
Образовавшийся осадок преципитата отфильтровывают от раство-
ра и сушат. Это удобрение содержит 42% Р2О3 в цитратнораство-
римой форме. Сравнительно высокая стоимость единицы Р2О5 в
преципитате ограничивает его производство.
Производство термофосфатов и плавленых фосфатов. Природ-
ные фосфаты переводят в усвояемое растениями состояние спека-
нием при 1200°С со щелочами, в результате которого получаются
так называемые термофосфаты. Сплавлением фосфатов с си-
ликатами получают плавленые фосфаты. Термофосфаты и плав-
леные фосфаты содержат 20—30% Р2О3 в лимоннорастворимой
усвояемой растениями форме и применяются на кислых почвах.
Удобрением, близким по составу к плавленым фосфатам, явля-
ется томасшлак, получаемый при выплавке стали из чугуна с повы-
шенным содержанием фосфора. Томасшлак содержит до 20% Р2О5
в лимоннорастворимой форме.
§ 42. Азотные удобрения
Азотные удобрения синтезируют из азотной или серной кислоты,
аммиака, двуокиси углерода, гидрата окиси кальция и т. д. Все
азотные удобрения хорошо растворяются в воде и усваиваются
растениями.
Азотные удобрения подразделяются на аммиачные, нитратные,
аммиачно-нитратные и амидные. Аммиачные удобрения содержат
азот в форме катиона NH4+ (сульфат аммония (NH4)2SO4), нитрат-
ные— в форме аниона NO3_ (нитрат кальция Са(1ЧОз)2 или нитрат
натрия NaNO3), аммиачно-нитратные — в форме катиона NH4+ и
аниона NO3- (нитрат аммония, или аммиачная селитра NH4NO3),
амидные — в форме группы NH2 (карбамид CO(NH2)2)-
Промышленность выпускает следующие азотные удобрения: ам-
миачную селитру, карбамид или мочевину, сульфат аммония,
нитрат натрия.
146
Производство аммиачной селитры. Нитрат аммония, или амми-
ачная селитра,— концентрированное азотное удобрение, содержа-
щее около 35% азота. Это наиболее распространенное азотное
удобрение в СССР, используемое практически на любых почвах и
под любые культуры. Помимо сельского хозяйства аммиачную се-
литру применяют для производства некоторых взрывчатых веществ.
Наряду с достоинствами аммиачная селитра как удобрение
обладает существенными недостатками. При хранении и транспор-
Рис. 54. Аппарат ИТН:
1 — корпус аппарата, 2 —
внутренний цилиндр, 3 —
кольцевое пространство. 4 —
труба
Рис. 55. Грануляционная баш-
ня:
Z — вращающаяся корзина, 2 —
грануляционная башия, 3 — тран-
спортер
тировке она распыляется на воздухе или слеживается в крупные
агрегаты. В результате вместо рассыпчатого продукта, который
легко вносится в почву, получаются крупные куски или блоки се-
литры, требующие специального измельчения. Взрывчатость и огне-
опасность аммиачной селитры усложняют ее производство и при-
менение.
В соответствии с ГОСТ 2—65 в СССР выпускаются два сорта
аммиачной селитры: сорт А — кристаллическая, или чешуйчатая, со-
держащая не менее 34,8% N и не более 0,5% Н2О, и сорт Б — гра-
нулированная с содержанием азота 34,2% и влажностью не более
0,4%.
Получают аммиачную селитру из аммиака и азотной кислоты
по реакции
NH3 + HNO3 = NH4NO3 (Х,9)
которая протекает с интенсивным выделением тепла.
Для производства аммиачной селитры обычно используют син-
тетический аммиак и слабую (50—55%-ную) азотную кислоту. При
нейтрализации слабой азотной кислоты аммиаком получается ра-
створ, содержащий около 50% нитрата аммония. За счет выделяю-
147
щегося при реакции нейтрализации тепла из этого раствора испа-
ряется вода и в результате получается более концентрированный —
80%-ный раствор аммиачной селитры. Использование тепла
нейтрализации в производстве аммиачной селитры представляет
известные трудности. Чтобы реализовать это тепло, устанавливают
специальные аппараты — нейтрализаторы ИТН (аппараты с ис-
пользованием тепла нейтрализации).
Аппарат ИТН (рис. 54) представляет собой сосуд цилиндриче-
ской формы 1 из нержавеющей стали, внутри которого располага-
ется второй сосуд 2. В цилиндр 2 непрерывно вводятся азотная
кислота и аммиак, и в нем протекает реакция нейтрализации (X, 9).
Раствор аммиачной селитры, получаемый в цилиндре 2, поступаете
кольцевое пространство 3 между внешним и внутренним цилиндра-
ми аппарата ИТН. Тепло, образующееся в цилиндре 2 при реакции
нейтрализации, через стенки цилиндра передается раствору, нахо-
дящемуся в кольцевом пространстве, и этот раствор упаривается.
Пары воды выводятся из кольцевого пространства 3 сверху. Упа-
ренный раствор селитры удаляется из аппарата через трубки 4, за-
тем к нему добавляют дополнительное количество аммиака для
полной нейтрализации, и он выпаривается до получения горячего
плава аммиачной селитры, содержащего 98—99%' NH4NO3.
При охлаждении плава могут быть получены кристаллы аммиач-
ной селитры.
Для уменьшения слеживаемости аммиачную селитру «припуд-
ривают» тонкоизмельченным известняком, фосфоритной мукой,
гипсом, каолином. Эти добавки как бы прослаивают кристаллы се-
литры и предотвращают их сцепление.
Наиболее эффективный способ улучшения свойств аммиачной
селитры — ее гранулирование, т. е. получение селитры в виде шари-
ков диаметром 2—3 мм. Гранулирование аммиачной селитры осу-
ществляется в полых железобетонных грануляционных башнях
высотой 30—35 м (рис. 55). Сверху башни находится дырчатая,
вращающаяся корзина 1, в которую подается горячий плав амми-
ачной селитры. При вращении корзины плав разбрызгивается че-
рез отверстия корзины, а снизу навстречу ему движется холодный
воздух. Капли падающего плава застывают при соприкосновении
с холодным воздухом и падают в виде гранул на транспортер 3,
передающий продукт на сушку и упаковку.
Производство карбамида (мочевины). Карбамид, или мочевина,
(МН2)гСО — наиболее ценное азотное удобрение, которое содер-
жит около 46% азота, а также углерод, легко усваиваемые расте-
ниями. Мочевина более эффективна, чем аммиачная селитра, еще
и потому, что при внесении азота в почву в виде мочевины прирост
урожая будет выше, чем при внесении того же количества азота в
виде аммиачной селитры. Карбамид — не только удобрение, его
также применяют в животноводстве в качестве добавки к кормам.
Помимо сельского хозяйства карбамид широко используют для
производства пластических масс — из него вырабатывают мочеви-
но-формальдегидные, или карбамидные, смолы, а также лаки, от-
148
личающиеся прочностью, тепло- и светостойкостью, и клеи, нечув-
ствительные к влаге. В фармацевтической промышленности на ос-
нове карбамида получают болеутоляющие и снотворные средства.
Важное значение карбамида для развития сельского хозяйства
и промышленности требует увеличения масштабов его производ-
ства.
Карбамид получают из жидкого аммиака и газообразной угле-
кислоты. Процесс получения карбамида весьма сложен. Для того
чтобы прошла реакция
NH3 + СО2 = (NH2)2 СО + Н2О (X, 10)
необходимо давление около 200 кгс/см2 и температура около 200°С.
Этот синтез протекает в толстостенной колонне.
Принципиальная схема колонны синтеза моче-
вины представлена на рис. 56. Внутри колонны 2
имеется цилиндр 1. Жидкий аммиак насосом по-
дается в кольцевое пространство между корпусом
и внутренним цилиндром и затем поступает в ци-
линдр 1. Снизу в цилиндр 1 входит углеки-
слота. Аммиак и углекислота взаимодействуют
друг с другом с образованием плава, в котором
кроме карбамида присутствуют другие продукты,
образующиеся из аммиака и углекислоты, а так-
же непрореагировавший аммиак и углекислота.
Плав выводится из колонны сверху, и затем из
него выделяется карбамид. Карбамид выдается
потребителям в кристаллическом виде либо его
гранулируют подобно аммиачной селитре.
Сульфат аммония — белый кристаллический
продукт. Получают его в результате нейтрализа-
ции серной кислоты газообразным аммиаком:
Рис. 56. Колонна
синтеза мочевины:
1 — внутренний ци-
линдр, 2 —колонна
H2SO4 + 2 NH3 = (NH4)2 SO4
(Х,11)
Для производства сульфата аммония используют башенную серную
кислоту и аммиак, содержащийся в коксовом газе, получаемом при
коксовании углей (см. с. 178).
Сульфат аммония — неконцентрированное азотное удобрение,
в нем содержится всего 20—21% азота. Кроме того, недостаток
сульфата аммония заключается в том, что при внесении его в поч-
ву присутствующий в нем ион SO42- подкисляет почву. Однако
сульфат аммония имеет преимущества перед другими удобрения-
ми — он не слеживается при хранении, не впитывает влагу, не ог-
неопасен.
Нитрат натрия, или чилийская селитра. Нитрат натрия отно-
сится к неконцентрированным удобрениям, содержание азота в
нем составляет около 16%. Нитрат натрия производят из раствора
соды или едкого натра и окислов азота, содержащихся в отходя-
щих газах азотнокислотных установок (см. с. НО). Таким образом,
это удобрение получают из отходов производства азотной кислоты
149
и поэтому, несмотря на низкую концентрацию в нем азота, пред-
ставляется целесообразным его производство. При этом одновре-
менно решаются две задачи: во-первых, получение удобрения и,
во-вторых, обезвреживание газов, удаляемых в атмосферу на азот-
но-туковых комбинатах.
Жидкие азотные удобрения. К жидким азотным удобрениям
относятся либо растворы аммиака в воде (аммиачная вода), либо
растворы, содержащие кроме аммиака аммиачную селитру или
мочевину. Это концентрированные азотные удобрения, вносимые в
почву с помощью специальных машин, подобных машинам для
поливки улиц. Использование жидких удобрений на полях показа-
ло их высокую эффективность; например, средний прирост урожая
при внесении 200 кг аммиачной воды на гектар составил для яро-
вой пшеницы 6,4 ц, кукурузы— 152 ц, сахарной свеклы — 37 ц.
§ 43. Калийные удобрения
Калийные удобрения, так же как азотные и фосфорные, имеют
большое значение для интенсификации сельского хозяйства.
В качестве калийных удобрений очень давно начали использо-
вать золу растений, содержащую карбонат калия (поташ К2СО3).
Этот источник калия ие мог удовлетворить потребностей сельского
хозяйства в калии. Получение калийных удобрений стало возмож-
ным с середины XIX в., когда были открыты месторождения ка-
лийных солей. Впервые товарный хлористый калий появился в
1861 г., и с тех пор производство калийных солей превратилось
в важнейшую отрасль химической промышленности. В настоящее
время около 90% добываемых калийных солей используется в ка-
честве калийных удобрений, а остальное количество применяется
для получения других химических продуктов.
Советский Союз обладает мощными месторождениями калий-
ных солей. Среди них первое место принадлежит Верхнекамскому
(на Урале) месторождению, запасы которого исчисляются миллиар-
дами тонн. Богатые месторождения калийных солей имеются в Бе-
лоруссии, на Украине, в Казахстане и Туркмении.
В природе калий входит в состав нескольких минералов: в на-
шей стране больше всего сильвинита и карналлита.
Сильвинит представляет собой смесь, содержащую около
30% хлористого калия и 70% хлористого натрия. Карналлит
(КС1-MgCl2-6Н2О) кроме хлористого калия содержит хлористый
магний.
В качестве удобрений используют природные калийные соли
(чаще всего молотый сильвинит) и продукты их переработки. При-
родные калийные соли (сырье) содержат от 15 до 22% калия в пе-
ресчете на К2О. Для производства калийных удобрений необходи-
мо выделить хлористый калий из минералов, в состав которых он
входит.
Переработка сильвинита. Этот процесс заключается в разделе-
нии содержащихся в нем хлористого калия и хлористого натрия.
150
Один из методов получения хлористого калия из сильвинита осно-
ван на том, что растворимость хлористого калия в горячей воде
выше, чем в холодной, т. е. чем выше температура воды, тем больше
хлористого калия можно растворить в ней. Растворимость же хло-
ристого натрия с повышением температуры изменяется очень мало,
и потому в горячей и холодной воде растворяются примерно оди-
наковые количества поваренной соли. Следовательно, если в горя-
чей воде растворить измельченный сильвинит, то в раствор перей-
дут и хлористый калий и хлористый натрий. При охлаждении та-
кого раствора, насыщенного при высокой температуре двумя
солями, будет кристаллизоваться только хлористый калий, так как
с понижением температуры растворимость его уменьшается. Хло-
ристый натрий, растворимость которого почти не зависит от темпе-
ратуры, останется в растворе. Кристаллы хлористого калия отде-
ляются от раствора. Раствор, полученный после отделения кри-
сталлов КС1 (маточный раствор), используется для растворения
новых порций сильвинита.
На практике обработку молотого сильвинита при температуре
около 100°С осуществляют не водой, а маточным раствором, содер-
жащим хлористый натрий и немного хлористого калия (схема 17).
Сильвинит
Маточный
раствор
Растворение
при too’С
Отделение
хлористого
натрия
4 Нераство^ившийся
Охлаждение
до 20-т
Нагревание
дот’С
Отделение
хлористого
калия
4 Кристаллы
" nCl
Маточный раствор
Схема 17. Переработка сильвинита
При этом, поскольку раствор уже насыщен хлористым натрием, из
сильвинита переходит в раствор хлористый калий и почти не раст-
воряется хлористый натрий. Горячий раствор хлористого калия
отделяется фильтрованием от нерастворившегося хлористого нат-
рия, а затем охлаждается до 20—30°С. При охлаждении раствора
происходит кристаллизация хлористого калия, а хлористый натрий
остается в растворе. Кристаллы хлористого калия отделяют от
раствора, сушат и упаковывают. Маточный раствор, полученный
151
после отделения хлористого калия, нагревают и направляют вновь
на обработку сильвинита.
Разработан метод выделения хлористого калия из сильвинита —
флотация. Флотацию сильвинита проводят в растворе, насы-
щенном хлористым калием и хлористым натрием. Хлористый ка-
лий, смачиваемость которого ниже смачиваемости хлористого
натрия, уходит с пеной, а хлористый натрий падает на дио аппара-
та. В результате разделения сильвинита описанным методом полу-
чают технический хлористый калий.
Технический хлористый калий как удобрение имеет ограничен-
ное применение. Он используется для изготовления комплексных
удобрений, в частности служит исходным продуктом для производ-
ства калийной селитры, калийно-аммиачной селитры, нитрофоски
и других удобрений.
§ 44. Комплексные удобрения
Комплексные удобрения могут быть сложными и сме-
шанными, их выпускают, как правило, в гранулированном виде;
эти удобрения относятся к концентрированным удобрениям, так
как содержат одновременно несколько питательных веществ
(в сумме 50—70% N, Р2О5 и К2О). Помимо азота, фосфора и калия
такие удобрения могут содержать микроэлементы. Благодаря
ценным качествам комплексных удобрений применение их в сель-
ском хозяйстве обеспечивает значительное снижение трудовых
затрат. Так, экономия при внесении комплексных удобрений в поч-
ву по сравнению с затратами труда на внесение такого же коли-
чества простых (односторонних) удобрений составляет 0,3 челове-
ко-дня на 1 га. Экономия, получаемая при одновременном внесе-
нии в почву нескольких питательных элементов, и повышение их
концентрации в удобрениях способствовали развитию производства
комплексных удобрений. В СССР производство таких удобрений
было впервые организовано в 30-х годах. В настоящее время у нас
в стране выпускается большое количество различных сортов (или
марок) комплексных удобрений, отличающихся содержанием и со-
отношением питательных элементов.
Чтобы сокращенно обозначить состав удобрений, указывают
содержание в нем питательных веществ цифрами, отделенными
друг от друга знаками тире. При этом первая цифра обозначает
процентное содержание азота, вторая — фосфорного ангидрида,
третья—окиси калия. Например, если комплексное удобрение со-
держит 10% N, 15% Р2О5 и 10% КгО, его можно обозначить 10—
15—10; если оно содержит только 10% N и 15% Р2О5, то его обозна-
чают 10—15—0.
Производство сложных удобрений. Аммофос содержит два
питательных элемента — азот и фосфор. Он состоит преимущест-
венно из моноаммонийфосфата NH4H2PO4 (80—90%) и диаммо-
нийфосфата (NH4)2HPO4 (10—20%). Аммофос — удобрение кон-
152
центрированное, содержащее около 10—13% N и 47—50% Р2О5 в
водорастворимом состоянии.
Аммофос получают нейтрализацией фосфорной кислоты, чаще
всего экстракционной, аммиаком по реакциям
Н3РО4 + NH3 = NH4H2PO4 (X, 12)
NH4H2PO4 + NH3 = (NH4)2 HPO4 (X, 13)
В установках производства гранулированного аммофоса исполь-
зуется неупаренная фосфорная кислота с содержанием около 25%
Р2О5. Фосфорная кислота нейтрализуется аммиаком в последова-
тельно расположенных реакторах. Температура пульпы не превы-
шает 90°С, и потери аммиака невелики. Пульпу сушат в распыли-
тельной сушилке топочными газами. Высушенный порошкообраз-
ный продукт гранулируют, подсушивают и сортируют.
Нитрофоска — удобрение, содержащее три питательных
элемента: фосфор, азот и калий в виде дикальцийфосфата CaHPCU,
аммиачной селитры, фосфатов аммония и солей калия. Состав
нитрофоски (в %): 124-20 N; 104-14 Р2О5; 104-21 КгО в цитратно-
растворимой и водорастворимой формах.
Нитрофоску получают на основе продуктов разложения при-
родных фосфатов 47—55%-ной азотной кислотой:
Са3 (РО4)2 + 6HNO3 = 2 Н3РО4 + ЗСа (NO3)2 (X, 14)
Получаемый при разложении раствор (вытяжка) содержит
фосфорную кислоту и нитрат кальция, который при переработке
остается в удобрении и резко ухудшает качество продукта. Следо-
вательно, вытекает необходимость удаления Са(МОз)2 из раствора.
Один из способов удаления нитрата кальция из раствора — вымо-
раживание. Для этого раствор охлаждают до температуры
—5, —10°С. При охлаждении происходит кристаллизация
Са(МОз)2-4НгО, кристаллы отделяют от раствора. Маточный рас-
твор, содержащий в основном фосфорную кислоту и растворенный
Са (NO3)2, подвергают аммонизации. Процесс аммонизации проте-
кает по реакции
Са (NO3)2 + 2 Н3РО4 + 3NH3 + Н2О = СаНРО4 +
+ NH4H2PO4 4- 2 NH4NO3 (X, 15)
Полученную таким образом пульпу упаривают, добавляют к ней
КС1 и гранулируют.
Производство смешанных удобрений. Процесс заключается в
смешении простых удобрений или простых и сложных удобрений.
Для производства смесей используют NaNOs, (NH4)2SO4i, мочеви-
ну, аммонизированный суперфосфат и NH4NO3. Чтобы смешанное
удобрение было высокого качества, вводимые в смесь компоненты
должны быть сухими, иметь близкую по величине плотность, при-
мерно одинаковый размер частиц, при смешении компонентов не
153
должно происходить химических реакций, приводящих к потере
питательных элементов.
В смешанных удобрениях по сравнению со сложными соотно-
шения между питательными элементами могут быть значительно
более разнообразными.
§ 45. Микроудобрения
Микроудобрения наряду с обычными азотными, фосфор-
ными и калийными имеют большое значение для повышения уро-
жайности и улучшения качества сельскохозяйственной продукции.
Микроудобрения содержат бор, медь, марганец, цинк, молибден и
некоторые другие элементы, требующиеся для растений в малых
количествах (микроэлементы). Известен ряд почв, на которых ра-
стения не могут развиваться без микроудобрений,— растения «за-
болевают» и урожай получается плохим.
При недостатке микроэлементов в почве не только снижается
урожай, но и получается продукция с недостаточным содержанием
микроэлементов. Использование ее для питания человека и живот-
ных может вызвать ряд заболеваний.
Микроудобрения вносят в почву в очень небольших количест-
вах. Достаточно 0,5—1,5 кг на 1 га для того, чтобы повысить уро-
жай и качество получаемых продуктов.
Борные удобрения — в качестве этого типа удобрений мо-
гут быть использованы борная кислота Н3ВО3, бура КагВ^О?, бо-
рат магния Mg(BOs)2, борный суперфосфат.
Медные удобрения вносят в почву в твердом виде и в
виде растворов солей меди. К медным удобрениям относится мед-
ный купорос CuSOi. Это высокоэффективное, но пока дорогое
удобрение. Вместо него можно использовать отходы производства
серной кислоты — колчеданный огарок, низкосортные медные руды
и др.
Марганцевые удобрения — преимущественно марган-
цевые шламы — отход переработки марганцевых руд.
Цинковые удобрения — сульфат и другие соли цинка.
Молибденовыми удобрениями служат молибдаты
аммония и натрия (NH4)2MoO4, Na2MoO4, суперфосфат, содержа-
щий молибден (молибденизированный суперфосфат), трехокись
молибдена МоОз.
§ 46. Ядохимикаты
Химическая защита растений от вредителей, болезней, сорняков
имеет исключительно важное значение. Потери от вредителей и
болезней растений в некоторых странах составляют от 10 до 80%
урожая. Тяжелым трудом является прополка растений от сорняков.
Весьма эффективна борьба с вредителями, болезнями и сор-
154
ной растительностью при помощи ядохимикатов. Применение
ядохимикатов имеет огромное народнохозяйственное значение: оно
способствует повышению урожайности, сохранению запасов и уве-
личению производительности труда в сельском хозяйстве. Ядохи-
микатами являются органические и неорганические вещества, в
состав которых входят соединения мышьяка, фтора, хлора, серы,
фосфора, ртути, меди и др.
Ядохимикаты должны обладать возможно большей ядовитостью
для насекомых и грибковых организмов, но быть безвредными
для человека и животных. По назначению ядохимикаты делятся
на инсектициды — средства борьбы с насекомыми, фунгициды —
средства борьбы с грибковыми заболеваниями растений, гербици-
ды— средства для уничтожения сорной или нежелательной расти-
тельности, дефолианты — средства для удаления листьев хлопчат-
ника, свеклы и других культур перед уборкой их машинами.
Инсектициды действуют либо через пищеварительные ор-
ганы насекомых, либо оказывают действие, попадая на поверх-
ность их тела, либо впитываются в соки растений и делают их ядо-
витыми для насекомых. Инсектициды применяют в виде порошков
(дустов) для опыления, в виде растворов для опрыскивания или
дымов для окуривания растений с помощью машин или сельскохо-
зяйственной авиации.
В качестве инсектицидов используются соединения
мышьяка: NaAsO2, Ca(AsO2)2, Ca3(AsO4)2, Na3AsO4,
Си(СНзСОО)2-ЗСи(АзО2)2; соединения, в состав которых входит
хлор: ДДТ (дихлордифенилтрихлорэтан СС13СН (СбН4С1)г), гекса-
хлоран С6Н6С1б; соединения фосфора: тиофос (C2H5O)2PSOC6H4NO2
и др.
Фунгициды применяются для опрыскивания, опыливания и
окуривания растений и семян. Наиболее известными фунгицидами
являются медный купорос, молотая сера, бордосская жидкость —
смесь раствора медного купороса и известкового молока, сулема
HgCl2, гранозан, или препарат НИУИФ-2, содержащий этилмер-
курхлорид C2H5HgCl, и др.
Г ербициды могут использоваться для уничтожения всей ра-
стительности при подготовке участков к пахоте (гербициды сплош-
ного действия) или при прополке (гербициды избирательного дей-
ствия). В качестве гербицидов нашли применение растворы медного
купороса, раствор железного купороса FeSO4, порошок цианамида
кальция CaCN2, производные феноксиуксусной кислоты
С6Н5ОСН2СООН.
Дефолиантами являются цианамид кальция, пентахлорфе-
нолят натрия CeClsONa.
Помимо указанных сельскохозяйственных ядохимикатов для по-
вышения урожайности используют препараты для протрав-
ки семянс целью их дезинфекции, антисептики — вещества,
предохраняющие продукты растительного и животного происхожде-
ния от порчи микроорганизмами, зооциды— средства для унич-
тожения грызунов и других вредных животных.
155
Контрольные вопросы
1. Какие элементы имеют наибольшее значение для жизнедеятельности рас-
тений?
2. Какими элементами обедняется почва при выращивании урожая сельско-
хозяйственных культур?
3. Что называют минеральными удобрениями и как их классифицируют?
4. Какие преимущества имеют концентрированные и комплексные удобрения?
5. Назовите важнейшие месторождения природных минералов, содержащих
соединения фосфора и калия.
6. Какие способы получения фосфорной кислоты вам известны?
7. С какой целью фосфорит и апатит обрабатывают серной или фосфорной
кислотой? Что называют простым и двойным суперфосфатом?
8. Начертите схему работы суперфосфатной камеры.
9. Что называют термофосфатом, плавленым фосфатом, томасшлаком?
10. Какие свойства аммиачной селитры затрудняют ее хранение н примене-
ние как удобрения?
11. Почему нейтрализатор в производстве аммиачной селитры назван аппа-
ратом ИТН?
12. Какое применение в сельском хозяйстве и в промышленности получил
карбамид (мочевина)? Напишите реакцию его получения.
13. В чем заключается переработка сильвинита?
14. Какие комплексные удобрения вам известны?
15. Какие элементы вносят в почву с микроудобреннями?
16. Приведите классификацию ядохимикатов.
Глава XI
ТЕХНОЛОГИЯ СИЛИКАТОВ
Изделия силикатной промышленности в большинстве случаев
содержат силикаты, алюмосиликаты или другие соли кремневой
кислоты. Их получают путем термической или термохимической
переработки силикатного сырья.
Промышленность силикатов включает три основные отрасли:
производство керамики, вяжущих веществ и
стекла. Эти отрасли выпускают разнообразные материалы и
изделия, имеющие огромное значение для народного хозяйства.
Различные строительные материалы (кирпич, черепица, облицовоч-
ные плиты, огнеупоры), химически стойкие материалы, электро-,
тепло- и звукоизоляционные материалы, технические и хозяйствен-
ные изделия из фарфора и фаянса, листовое стекло, изделия из сте-
кла для электро-, радио-, телевизионной и оптической промышлен-
ности, химическую и хозяйственную посуду, кварцевое стекло, хру-
сталь, растворимое стекло, стекловолокно, пеностекло, разнообраз-
ные вяжущие вещества, цемент и строительные детали из него,
кислотоупорные вяжущие материалы — все это продукты силикат-
ной промышленности, без которых невозможна жизнь современно-
го человека.
К силикатной промышленности относится также производство
химически стойких материалов литьем расплавленных горных по-
род (диабаза, базальта) и металлургических шлаков. В последнее
время, сочетая этот метод со специальной термической обработкой,
изготовляют стеклокерамику.
156
§ 47. Керамика
Керамикой называют изделия, изготовленные из смесей, в
которых основным материалом является глина. Изделия получают
формованием или отливкой. Отформованное изделие сушат и об-
жигают до спекания.
В зависимости от исходного материала и назначения керамику
подразделяют на следующие основные группы: 1) строитель-
ная — к ней относятся строительный кирпич и блоки из него, кро-
вельная черепица, дренажные трубы и т. п.; 2) облицовоч-
ная — кирпич, плитки, изразцы, предназначенные для наружной
отделки зданий; 3) огнеупорная — изделия из огнеупоров,
сохраняющие свои механические свойства при температуре выше
1000°С и предназначенные для изготовления и футеровки печей, то-
пок и других аппаратов, работающих в условиях высокотемпера-
турного нагрева; 4) тонкая — изделия главным образом из
фарфоровой и фаянсовой глины (хозяйственная и химическая посу-
да, художественные и декоративные изделия, раковины и умываль-
ники, изделия для электротехники);5) специальная — изде-
лия для радио- и авиапромышленности, приборостроения и т. д.
По характеру излома — черепка керамику подразделяют на
пористую (впитывающую влагу) и соспекшимся череп-
ком (дает блестящий раковистый излом, не впитывающий влагу).
Сырьем для изготовления керамики служат различные по со-
ставу природные глины. Основным минералом, входящим в состав
глин, является каолинит А12Оз-25Ю2-2Н2О. В чистом виде каоли-
нит встречается редко. Обычно в глинах в различных соотношени-
ях содержатся алюмосиликаты, окислы железа, кальция, магния,
щелочных металлов.
Важнейшее свойство глины — пластичность. Глина с определен-
ным количеством воды образует пластичную массу, которой может
быть придана любая форма, сохраняемая после прекращения внеш-
него воздействия. Различают жирные глины, поглощающие много
воды (высокопластичные), и тощие (малопластичные). Жирные
глины хорошо формуются, но изделия из них дают при сушке и
обжиге трещины и большую усадку (уменьшение размеров изде-
лия). Тощие глины плохо формуются, но при обжиге дают малую
усадку, и изделие из них при этом не деформируется. Чтобы полу-
чить массы с определенной пластичностью, смешивают жирные и
тощие глины в определенных соотношениях или к жирной глине до-
бавляют отощающие вещества, чаще всего кварц, песок.
Изготовление керамических изделий. Изготовление керамиче-
ских изделий состоит из следующих стадий: 1) подготовки сырья,
2) приготовления керамической массы, 3) формования изделий,
4) сушки, 5) обжига, 6) нанесения рисунка и глазури на изделия.
Подготовка сырья включает обогащение, дробление,
тонкий помол и смешение компонентов смеси. Цель подготовки и
смешения исходных материалов — получение однородной массы.
Приготовление керамической массы заключает-
157
ся в смешении сырья с некоторым количеством воды до получения
массы определенной консистенции. Приготовление массы осущест-
вляется в шнеках-смесителях, смесительных бегунах, мешалках.
Полученный в смесителях замес поступает на формование изделий.
Формование изделий производится одним из следующих
способов, отличающихся по содержанию воды в замесе: сухим (3—
7% воды); полусухим (7—16% воды); пластичным (16—32%
воды).
Формование изделий ведется в механических и гидравлических
прессах. При пластичном способе формования применяют главным
образом шнековые прессы (рис. 57). В рабочем цилиндре пресса
Рис. 57. Шнековый пресс:
/ — материал, 2 — воронка, 3 — шнек, 4 — мундштук
вращается шнек 3. Керамическая масса загружается в цилиндр при
помощи вальцового питателя, перемещается шнеком справа налево
и выдавливается через отверстие определенной формы (мунд-
штук) 4. Так формуются простые и пустотелые кирпичи, трубы
и т. д.
Тонкую и специальную керамику часто формуют специальным
методом литья жидкой массы (называемой шликером), содержащей
30—35% воды, в гипсовые сосуды и формы, впитывающие воду.
Частицы суспензии оседают на стенках формы, образуя отформо-
ванное изделие. Для изготовления некоторых керамических изде-
лий применяют формование на гончарном круге, а иногда и ручное
формование.
Сушку отформованных керамических изделий проводят в ес-
тественных условиях воздухом или чаще дымовыми газами в су-
шилках различных типов: камерных, подовых, туннельных.
Обжи: — наиболее ответственная стадия производства кера-
мических изделий, завершающая технологический процесс. При
обжиге происходят сложные физические и химические процессы:
удаление механической и гигроскопической влаги, удаление хими-
чески связанной, гидратной воды и собственно обжиг, при котором
керамическая масса изделий приобретает твердый черепок. Для
этих процессов необходим определенный температурный режим,
158
зависящий от вида материала и изделия. Отклонение от темпера-
турного режима приводит к образованию трещин, короблению и
сплавлению готовых изделий. Так, обыкновенный строительный
кирпич обжигают при 1050— 1100°С, огнеупорные изделия —при
1350—1650°С, кислотоупорную керамику — при 1250—1350°С.
Обжиг керамических изделий осуществляют в печах периоди-
ческого или непрерывного действия.
Значительное распространение получили туннельные печи не-
прерывного действия. Такая печь (рис. 58) представляет собой
длинный канал 3 (до 160 м), имеющий внутри рельсовый путь, по
которому движутся плотно сомкнутые вагонетки-платформы 1 с из-
делиями для обжига. Печь имеет три зоны: подогрева, обжига и
охлаждения керамических изделий. Вначале вагонетки входят в
зону подогрева, где из изделий удаляются влага и гидратная вода
за счет тепла топочных газов, отходящих из зоны обжига. Затем
вагонетки входят в зону обжига, расположенную в середине тун-
нельной печи, и из зоны обжига поступают в зону охлаждения, где
обожженные изделия остывают, нагревая поступающий в эту зону
холодный воздух. Нагретый воздух по каналам 2 подается в зону
обжига для горения газообразного топлива, поступающего через
горелки 4. Температура в зоне обжига поддерживается в пределах
1100— 1500°С.
В туннельных печах загрузка и выгрузка изделий механизиро-
вана, подачу на горение газообразного топлива и воздуха регули-
руют автоматически. Использование тепла отходящих из зоны об-
жига топочных газов для подогрева поступающих в печь изделий
и тепла обожженных изделий для подогрева холодного воздуха, по-
ступающего в зону обжига, значительно снижает расходы топлива.
С развитием высокотемпературных процессов в металлургии, хи-
мической промышленности и энергетике все большее применение
159
получает огнеупорная керамика. К огнеупорным материа-
лам предъявляется ряд требований. Они должны обладать: высокой
огнеупорностью, т. е. существенно не изменять своих механических
свойств при действии высоких температур; химической устойчиво-
стью, т. е. не взаимодействовать с агрессивной средой, с кислыми
или основными расплавленными шлаками, горячими газами н т. д.;
термической устойчивостью, т. е. выдерживать многократные коле-
бания температуры в широких пределах.
Применяют в основном следующие три группы огнеупорных ма-
териалов: кремнекислые, хорошо противостоящие кислым шлакам
(поэтому они названы кислыми огнеупорами); алюмосиликатные,
выдерживающие слабокислую и нейтральную среду; магнезитовые,
применяемые для основной и нейтральной сред.
Из кремнекислых огнеупоров наибольшее примене-
ние получили динасовые, содержащие не менее 93% SiO2. Динасо-
вые огнеупоры используют при кладке и футеровке металлургиче-
ских и коксовых печей, футеровке туннельных керамических печей.
Температура размягчения динасовых изделий (огнеупорность) ко-
леблется в пределах 1670—1730°С.
Из алюмосиликатных огнеупоров широкое распростра-
нение получил шамот, содержащий 50—60% SiO2 и 30—45% А120з.
Шамотные огнеупорные изделия пригодны для слабокислых и нейт-
ральных сред, но плохо сопротивляются действию основных шла-
ков. Огнеупорность шамотных изделий колеблется в пределах
1580—1770°С.
Магнезитовые огнеупоры содержат не менее 85% MgO,
они проявляют высокую устойчивость к действию основных шла-
ков, но плохо сопротивляются колебаниям температуры, огнеупор-
ность их выше 2000°С. Магнезитовые огнеупоры применяют для
кладки металлургических печей.
Из керамических материалов с большой химической устойчиво-
стью изготовляют всевозможные аппараты и детали для коммуни-
каций химических заводов: реторты, баллоны, трубопроводы, зме-
евики, облицовочные плиты и т. д.
§ 48. Вяжущие вещества
Минеральные вяжущие вещества представляют собой порошко-
образные продукты, обычно сложного состава, которые при смеши-
вании с водой, а в некоторых случаях с водными растворами солей
дают пластичную массу (тесто), превращающуюся через некоторое
время в твердое тело — искусственный камень. Этот переход из
пластичного состояния в твердое называется схватыванием.
Твердение вяжущих веществ связано с протеканием физико-хими-
ческих процессов, которые приводят к образованию новых веществ
и новой структуры.
Благодаря способности твердеть вяжущие вещества широко
применяются в строительном деле для связывания (цементирова-
ния) кирпичей, плит, блоков и других строительных деталей.
160
Вяжущие вещества по назначению и свойствам подразделяются
на воздушные, гидравлические и кислотоупорные. Воздушные вя-
жущие вещества затвердевают и сохраняют прочность только на
воздухе, гидравлические — на воздухе и в воде, кислотоупорные —
после твердения устойчивы к действию минеральных кислот.
Воздушные вяжущие вещества. К воздушным вяжущим вещест-
вам относятся воздушная известь, гипсовые и магнезиальные вя-
жущие материалы.
Воздушную известь получают обжигом известняка. При
этом протекает эндотермическая реакция разложения известняка:
СаСО3 = СаО + СО2 — Q (XI, 1 )
Обжиг известняка производится в известково-обжигательных
печах. Различают следующие виды строительной воздушной изве-
сти: 1) негашеную комовую известь-кипелку, состоящую главным
образом из СаО и представляющую собой пористые куски белого
или серого цвета; 2) негашеную молотую известь — измельченную
Комовую известь; 3) пушонку — тонкий порошок, состоящий в ос-
новном из Са(ОН)2 и получаемый гашением комовой извести по
реакции
СаО + Н2О = Са (ОН)2 + Q (X1,2>
(содержание влаги в пушонке не более 5%); 4) известковое тесто —
пластичную массу, состоящую в основном из Са(ОН)2 и получае-
мую гашением комовой извести с применением избытка воды.
Для предотвращения растрескивания в процессе твердения из-
вести к ее смеси с водой (замесу) добавляют песок. Процесс твер-
дения замеса воздушной извести объясняется испарением механи-
чески связанной воды, кристаллизацией гидрата окиси кальция
Са(ОН)2 и его карбонизацией — поглощением СО2, содержащейся
в воздухе, по реакции
Са (ОН)2 + СО2 = СаСО3 + Н2О (X 1,3)
Образующийся при этом СаСО3 связывает зерна песка.
Воздушную известь применяют для каменной кладки, в штука-
турных работах, в производстве кирпича, блоков, плит, в качестве
вяжущего материала.
Гипсовые вяжущие вещества получают из природного
гипса CaSO4-2H2O или из природного ангидрита — безводного сер-
нокислого кальция CaSO4 путем их обжига. В зависимости от тем-
пературы обжига получают различные продукты: строительный,
или полуводный, гипс CaSO4-0,5H2O (температура обжига 120—
200°С), гипсовоангидритный цемент — безводный сернокислый
кальций CaSOj, (температура обжига 500—700°С) или другие про-
дукты.
Процесс твердения гипса при замешивании его с водой объясня-
ется образованием вновь из полуводного сульфата кальция двух-
водного:
CaSO4 • 0,5Н2О + 1,5 Н2О = CaSO4 + 2 Н2О + Q (XI,4)
6—275
161
Гипсовоангидритный цемент применяется с добавкой 1,5% од-
ной из солей — NaHSOt, NagSO^ NH4CI, FeSO*, являющихся ката-
лизаторами в процессе его твердения. Без катализатора безводный
CaSO* не будет вяжущим веществом. Прибавление катализатора
создает условия для гидратации (присоединения воды) и кристал-
лизации CaSO^, в результате чего происходит твердение.
Гипс применяется для штукатурных работ, для формовки орна-
ментов, статуй, для получения искусственного мрамора и плит, для
изготовления перегородок в строительстве. Гипсовоангидритный це-
мент применяют для изготовления полов, лестничных площадок,
пустотелых камней.
К магнезиальным вяжущим веществам относят-
ся каустический магнезит MgO и каустический доломит, содержа-
щий наряду с MgO неразложившийся СаСОз и небольшое коли-
чество СаО. Их получают обжигом магнезита MgCO3 или доломита
СаСОз-MgCOs в шахтных или вращающихся печах при 800—
850°С.
Обожженный материал измельчают в шаровой мельнице и затво-
ряют в отличие от других вяжущих веществ не водой, а раствором
хлористого магния, так как при затворении водой образуется мед-
ленно схватывающийся материал малой прочности. Полученный та-
ким образом магнезиальный цемент хорошо связывает добавлен-
ный к нему наполнитель. Из магнезиального цемента изготовляют
жернова, лестничные ступени, фибролит — спрессованные в виде
плит и связанные цементом древесные стружки (их применяют в
строительстве для изготовления перегородок), ксилолит — матери-
ал, представляющий собой древесные опилки, асбест, тальк и др.,
связанные цементом (применяют для изготовления плит полов,
подоконников и т. д.).
Гидравлические вяжущие вещества. К ним относят гидравли-
ческую известь, портландцемент, глиноземистый цемент и вяжущие
вещества, содержащие гидравлические добавки.
Портландцемент — важнейший гидравлический вяжущий
материал, получивший широкое применение в строительстве. Он
обладает большой механической прочностью, стойкостью на воз-
духе и под водой, морозостойкостью.
В состав портландцемента входят образованные из окислов
минералы, важнейшие из которых трехкальциевый силикат ЗСаО-
-SiOz (37—60%), двухкальциевый силикат 2CaO-SiO2 (15—37%),
трехкальциевый алюминат ЗСаО-А^Оз (7—15%), четырехкальцие-
вый алюмоферрит 4СаО-А1гОз-Ре2Оз (10—18%) и окись магния.
Исходные материалы для получения портландцемента берутся в та-
ком соотношении, чтобы при обжиге их образовались именно эти
минералы.
Сырьем для производства портландцемента служат природные
известковые мергели (смесь глины со значительным количеством
карбонатов кальция и магния) или искусственные смеси материа-
лов, содержащие известь и глину; последнюю можно заменить
доменным шлаком, трепелом и др.
162
При изготовлении портландцемента исходные материалы тонко
измельчают, точно дозируют, замешивают с тем или иным коли-
чеством воды (в зависимости от способа подготовки сырья) и под-
вергают обжигу до спекания (температура 1400—1450°С), при этом
получают спек, называемый клинкером. Тонко измельченный
клинкер и представляет собой готовый продукт. Часто в процессе
измельчения клинкера к нему примешивают гидравлические до-
бавки.
Таким образом, в производстве портландцемента можно выде-
лить основные стадии: 1) подготовку сырья и получение полу-
фабриката—клинкера; 2) помол клинкера с добавками, обеспе-
чивающими определенные свойства портландцемента; 3) его скла-
дирование и упаковку.
Сырье готовят к обжигу двумя способами — мокрым и сухим.
В соответствии с этим и способы производства портландцемента
подразделяют на мокрый и сухой.
При мокром способе исходное сырье измельчают в вод-
ной среде, в результате получают сметанообразную массу, называе-
мую шламом и содержащую 35—40% воды. Полученный шлам
поступает в обжиговую печь.
При сухом способе сырье высушивают, тонко измельча-
ют и смешивают. Полученная сырьевая мука немного увлажня-
ется и поступает на обжиг.
Мокрый способ обеспечивает хорошее перемешивание материа-
лов, уменьшает их распыление, но при этом увеличивается расход
топлива на обжиг, поскольку необходимо испарить значительное
количество воды из шлама.
Обжиг сырьевой смеси производят в барабанных вращающих-
ся печах, отапливаемых пылевидным топливом (угольной пылью),
газообразным топливом или мазутом, сжигаемым внутри печи.
На рис. 59 показано производство цементного клинкера. Барабан-
ная печь 2 длиной до 200 м и более вращается со скоростью 1,0—
1,5 об/мин. Печь поставлена с небольшим углом наклона так, что-
бы обжигаемый материал перемещался в печи. Шлам подается пи-
тателем 1 в приподнятую часть печи и выгружается из печи в виде
спекшегося материала — клинкера. Топочные газы движутся про-
тивотоком по отношению к сырьевой смеси. Вначале по ходу смеси
происходит испарение воды из шлама, затем протекают процессы
разложения гидратов (дегидратация) и известняка (декарбониза-
ция) с образованием СаО и, наконец, взаимодействие СаО с други-
ми окислами, в результате чего образуются минералы, входящие в
состав клинкера.
Таким образом, в печи можно различить три зоны: 1) сушку и
подогрев, 2) кальцинацию (900—1200°С) и 3) спекание (1300—
1450°С). Для охлаждения клинкера служит холодильник — вра-
щающийся барабан 3, в котором клинкер охлаждается холодным
воздухом. Нагретый при охлаждении клинкера воздух идет в печь
на горение топлива. Охлажденный клинкер вылеживается на скла-
де в течение 10—15 суток, где он перелопачивается при помощи
6*
163
грейферного крана, после чего поступает на тонкий размол в труб-
ные цементные мельнины. Хранят готовый цемент в железобетон-
ных силосах—хранилищах. Цемент отправляют потребителю без
тары (навалом) в авто- или железнодорожных цементовозах или
в таре — бумажных многослойных мешках.
Схватывание и твердение портландцемен-
т а — сложный физико-химический процесс. Содержащиеся в це-
менге силикаты, алюминаты и ферриты при замешивании с водой
подвергаются процессам гидратации (присоединения воды) и ги-
дролизу с образованием высокопрочных кристаллов. Реакция гид-
Исходное^ сырье
Рис. 59. Вращающаяся печь:
1 — питатель, 2 —печь, 3 •— холодильник
ратации характеризуется тем, что происходит присоединение воды
без распада основного вещества, например:
2 СаО • SiO2 4- п Н2О = 2 СаО SiO2 • п Н2О (X 1,5)
При реакции гидролиза присоединение воды сопровождается рас-
падом основного вещества, например:
3 СаО • SiO2 4- т Н2О = 2 СаО • SiO2 • п Н2О 4- Са (ОН)2 (XI,6)
Обычно для придания цементам тех или иных свойств и для их
удешевления при размоле клинкера вводят различные добавки, по-
лучая таким образом смешанные цементы. Чаще всего к портланд-
цементу примешивают 20—50% так называемых гидравличес-
ких добавок. Гидравлическими добавками называют природ-
ные или искусственно полученные вещества, содержащие активную
SiO2, которая с СаО дает твердеющие в воде силикаты. К естествен-
ным гидравлическим добавкам относят пористые вулканические
породы — пемзу, туфы, осадочные породы — трепел и др.; к искус-
ственным — прокаленные глины, кислые и основные доменные шла-
ки и другие промышленные отходы.
Требования к портландцементу определяются областями его
применения. Одним из важнейших качеств, характеризующих порт-
164
ландцемент, является прочность. В соответствии с ГОСТ 970—61
портландцемент делится по прочности на марки: 200, 300, 400, 500,
600, что означает предел прочности на сжатие (в кгс/см2) после
твердения в течение 28 суток.
Начало схватывания портландцемента должно наступать не ра-
нее чем через 45 мин, конец схватывания — не позднее чем через
12 ч с момента затворения.
Портландцемент применяют главным образом для бетонных и
железобетонных конструкций в наземных и подводных сооружени-
ях. Этот цемент широко используется для изготовления различных
сборных железобетонных деталей, асбоцементных материалов и
ряда других строительных изделий.
Бетоны. Бетон— искусственный камень, получаемый при за-
твердевании затворенной водой смеси цемента, песка и заполните-
ля. Бетоны широко используются для различных сооружений.
Вобыкновеиных бетонах заполнителем служат песок и
гравий или шебень.
Легкие бетоны имеют пористые заполнители: туф, пемзу,
шлаки и др. Применяются в виде камней, крупных блоков и пане-
лей в основном для изготовления стен зданий.
В огнеупорных бетонах в качестве заполнителей ис-
пользуются хромистый железняк, шамот и др. Они обладают высо-
кой термоустойчивостью и применяются для футеровки печей, кот-
лов и т. п.
Железобетон — это бетой, армированный сталью, железом
(каркасы, трубы, стальные пруты и пр.). Из железобетона сооружа-
ют трубы высотой 30—40 м и более, фермы для покрытия больших
пролетов, колонны для цехов, фундаментные и другие балки, изго-
товляют различные изделия для крупноблочного жилищного строи-
тельства.
Кислотоупорные вяжущие вещества. Эти вещества подразделя-
ют иа кислотоупорные цементы и замазки. Кислотоупорный цемент
готовят без обжига. Для этого берут кислотоупорные природные
минералы (андезит, диабаз, кварц) и тонко измельчают их вместе
с кремнефтористым натрием NajSiFe. Полученный порошок заме-
шивают с растворимым стеклом — водным раствором силиката
натрия или калия (Na^O, KaOJ-nSiOj. Замес быстро схватывается
и твердеет в результате взаимодействия жидкого стекла с кремне-
фтористым натрием. Кислотоупорные цементы применяют для фу-
теровки химических аппаратов (сборников, башен, реакторов и др.).
Кислотоупорные замазки готовят иа основе кислотоупорного цемен-
та и применяют при монтаже химической аппаратуры.
§ 49. Производство стекла
Стекло представляет собой аморфное вещество. Аморфные ве-
щества в отличие от кристаллических не обладают правильным за-
кономерным расположением частиц, атомов, ионов, молекул, из
которых они состоят. Кристаллические же тела построены из крис-
165
таллов, где частицы расположены в строго определенном порядке.
Аморфные тела не имеют определенной температуры плавления.
Поэтому стекло при повышении температуры постепенно размягча-
ется, вплоть до образования расплава.
Стекло обладает ценными оптическими свойствами (прозрачно-
стью, однородностью). В состав стекла входят окислы: SiC>2, СаО,
Na2O, К2О, MgO и др. Эти окислы образуют в стекле различные
соединения. Двуокись кремния SiC>2 обладает свойством соединять-
ся с другими окислами в любом соотношении молекул. Различают
одно-, двух-, трех- и многокомпонентные стекла в зависимости от
количества входящих в их состав окислов. Например, однокомпо-
нентное — содержащее только SiC>2 (кварцевое стекло); двухкомпо-
нентное — /иЗЮг-лНагО (растворимое стекло); трехкомпонент-
ное— /nSiO2-nCaO-pNa2O (известково-натриевое стекло); много-
компонентное— содержащее окислы SiO2, Na2O, СаО, MgO, А120з
и др.
Наиболее распространенное стекло — трехкомпонентное имеет
следующий состав: Na2O-CaO-6SiO2. От вида и количественного
соотношения окислов зависят свойства стекла. Так, кислотные окис-
лы придают стеклу высокую термическую, химическую и механиче-
скую стойкость. Окислы щелочных металлов понижают вязкость и
температуру плавления стекла, а также уменьшает его твердость,
ухудшают термические и химическое свойства. Окислы щелочнозе-
мельных металлов придают стеклу требуемую вязкость.
Качество и область применения стекла определяются его меха-
ническими, термическими, оптическими, электрическими свойства-
ми и химической стойкостью. В зависимости от свойств и области
применения стекло подразделяют на строительное и архитектурное,
техническое, тарное, химико-лабораторное, бытовое, художествен-
ное и оптическое.
Сырье. Сырьевые материалы, применяемые в стеклоделии, де-
лятся на главные и вспомогательные. Главными материала-
ми, которые называются также стеклорбразователями,
являются кварцевый песок БЮг, сода Ыа2СОз, поташ К2СО3, суль-
фат натрия Na2SO4, известняк, или мел, СаСО3, магнезит MgCO3,
доломит CaCO3-MgCO3, барит BaSO4, каолин А12Оз-251О2-2Н2О,
борная кислота Н3ВО3, бура Na2B40y, свинцовый сурик РЬ3О4, свин-
цовый глет РЬО, стеклянный бой и отходы других производств,
например доменные шлаки.
Вспомогательными материалами называются ве-
щества, применяемые для изменения свойств стекломассы в нуж-
ном направлении. К ним относятся красители, глушители
(вещества, делающие стекло непрозрачным — матовым), обес-
цвечиватели (вещества, устраняющие желтизну стекла),
осветлители (вещества, удаляющие из стекломассы газовые
включения) и др.
Подготовка сырья включает ряд операций: промывку и сушку
кварцевого песка, дробление и размол материалов, дозировку ис-
ходных материалов, приготовление шихты (тщательное смешива-
166
ние). Полученную шихту направляют на варку в стекловаренную
печь.
Варка стекла. Это сложный физико-химический процесс, прохо-
дящий при высокой температуре. Схематически процесс варки стек-
ла из шихты, содержащей SiO2, Na2CO3 и СаСОз, можно предста-
вить следующим образом. При нагревании шихты в стекловаренной
печи вначале происходит удаление влаги, затем при температуре
около 400°С начинается реакция между содой и двуокисью крем-
ния с выделением СО2 и образованием силиката натрия по реакции
Na2CO3 + SiO2 Na2SiO3 + СО2 — Q (XI,7)
При повышении температуры этот процесс ускоряется и одно-
временно (при температуре 620°С) происходит образование из из-
вестняка и соды двойной соли по уравнению
СаСО3 +Na2CO3 Na2Ca (СО3)2 (XI,8)
Образовавшаяся двойная соль кальция и натрия угольной кис-
лоты также взаимодействует с SiO2 по реакции
Na2Ca (COS)2 + 2 SiO2 -> CaSiOs + Na2SiO3 + 2 CO2 — Q (X 1,9)
Процесс образования силикатов натрия и кальция (и других
силикатов, если в шихте имеются щелочные или щелочноземельные
окислы) заканчивается при температуре около 1000°С, при этом
реагирующая масса спекается. При этих условиях в массе содер-
жатся зерна избыточного несвязанного (свободного) SiO2. Эта ста-
дия варки стекла называется стадией силикатообразова-
н и я. При дальнейшем повышении температуры примерно до
1200°С происходит растворение избыточных зерен кварца (SiO2) в
щелочном силикатном расплаве, масса переходит в жидкое состоя-
ние, становится более однородной (но еще не полностью) и содер-
жит большое количество газообразных включений (в виде пузырь-
ков). Этот период называется стадией образования стек-
ломассы, он протекает медленно и требует много времени.
Для придания однородности стекломассе и удаления из нее пу-
зырьков газов ее нагревают в стекловаренной печи до 1450—1500°С,
при этом стекломасса становится более жидкой (вязкость ее умень-
шается), что способствует выделению из нее газовых включений
(дегазация) и увеличению прозрачности (осветление). Добавление
некоторых веществ, называемых осветлителями, ускоряет процесс
осветления. При выделении газов происходит перемешивание стек-
ломассы, в результате чего она становится однородной (гомоген-
ной) . Эта стадия варки называется дегазацией и гомогени-
зацией стекломассы.
Вязкость стекломассы после выделения из нее газов при 1450°С
слишком мала для того, чтобы формовать из нее изделия. Для уве-
личения вязкости стекломассу охлаждают до температуры 1050—
1250°С, при которой из нее изготавливают изделия. Эта стадия
создания рабочей вязкости понижением температуры стекломассы
называется с т у д к о й.
167
Применяют стекловаренные печи двух типов: ванные — непре-
рывного действия и горшковые — периодического действия.
Ванные печи непрерывного действия широко применяют
для получения больших количеств стекломассы и изготовления из
нее изделий широкого потребления (оконное стекло, банки, бутыл-
ки и т. п.). Ванная печь состоит из двух частей — варочной для при-
готовления стекломассы, куда поступает шихта и оборотный стек-
лянный бой, и выработочной, куда перетекает стекломасса из ва-
рочной части и где подвергается студке для придания ей рабочей
Рис. 60. Ванная печь для варки стекла:
1, 5—регенераторы, 2, 4 — горелки, 3— варочная часть печи
вязкости. Варочная и выработочная части печи соединены прото-
ком для стекломассы. Из выработочной части стекломасса посту-
пает в машины на переработку в листовое стекло или другие стек-
лоизделия.
На рис. 60 схематически показано устройство ванной печи для
варки стекла. Шихта и стеклянный оборотный бой, поступающие в
варочную часть печи 3, нагреваются топочными газами, получен-
ными от сжигания газообразного топлива в горелках 2 и 4. Тепло
газов передается шихте как путем непосредственного соприкосно-
вения их с поверхностью шихты, так и излучением тепла раскален-
ными сводами печи. Расплавленная стекломасса перетекает из ва-
рочной части печи в зону охлаждения и выработки. Варочная печь
имеет регенераторы тепла 1 и 5, представляющие собой камеры,
заполненные огнеупорным кирпичом. В две камеры (например, 5)
подают горячие отходящие газы, и насадка камер нагревается; в
других (левых) камерах 1 идет отдача тепла нагретой насадкой
газу и воздуху, поступающим к горелкам. Через определенное вре-
168
мя происходит переключение камер, т. е. в камеры регенератора с
насадкой, охлажденной газом и воздухом, подаются горячие отхо-
дящие топочные газы, и они начинают работать на нагрев насадки,
а камеры с нагретой насадкой — на подогрев газа и воздуха. Пе-
риодическое переключение хода топочных газов в камерах осуще-
ствляется с помощью автоматов. На 1 м2 поверхности варочной
части ванны печи получают 0,5—2 т стекольной массы в сутки.
Горшковые печи служат для приготовления небольших ко-
личеств стекломассы и применяются главным образом для произ-
водства дорогих сортов стекла — оптического, хрустального и ху-
дожественного. Приготовленную к варке шихту загружают в гор-
шок, изготовленный из огнеупорного материала. Затем горшок
вносят в печь, где при обогреве топочными газами происходит вар-
ка стекла.
Изготовление стеклянных изделий. Изделия из расплавленной
стекломассы изготавливают различными методами: вытягиванием,
выдуванием, прессованием, прокаткой.
Вытягивание применяют для изготовления листового стек-
ла, труб, стержней и т. п. Для этой цели используют машины-авто-
маты (рис. 61). На поверхности расплавленного стекла (в рабочей
части печи) установлена шамотная лодочка 3 с щелью вдоль всей
длины. При погружении лодочки в расплав стекла через щель начи-
нает выдавливаться стекломасса. Выработка листового стекла
происходит следующим образом. Вначале к щели лодочки подво-
дится конец ленты из какого-либо материала, выдерживающего
высокую температуру, например из листового асбеста. Если смо-
чить нижний край ленты расплавленной стекломассой, выходящей
из щели лодочки, а затем двигать ленту вверх с помощью валков
2, расположенных в шахте 1, то она потянет за собой пленку стек-
ломассы. По ходу ленты устанавливают холодильники, пройдя
которые пленка стекломассы охлаждается, затвердевает, образуя
ленту листового стекла, ширина которой зависит от длины щели в
лодочке. Далее этот процесс вытягивания становится непрерывным.
От вытягиваемой ленты стекла на верхней рабочей площадке отре-
зают листы определенного размера, которые затем упаковывают.
Выдуванием изготовляют химико-лабораторную и тарную
посуду. Изделия выдуваются машинным способом, или при помощи
специальной стеклодувной трубки с резиновым баллоном на конце
для нагнетания воздуха газодувкой, или автоматически действую-
щими машинами.
Прессование применяют для производства толстостенных
полых или массивных изделий из стекла. Определенная порция
стекломассы подается в автоматический пресс, где горячей стекло-
массе придается форма изделия.
Прокатку применяют для выработки толстостенного листо-
вого и узорчатого стекла. Струя стекломассы проходит между дву-
мя вращающимися вальцами, охлаждаемыми внутри водой.
Все стеклоизделия после формовки, как правило, подвергают
отжигу, необходимость которого объясняется следующим. Жид-
169
кое стекло, переходя в твердое состояние, уменьшается в объеме.
Затвердевание стекла начинается с поверхности изделия и посте-
пенно распространяется внутрь массы стекла, пока вся она не пере-
ходит в твердое состояние. Неодновременное застывание заформо-
Рис. 61. Машина для выработки оконного стекла:
1 — шахта, 2 — валки, 3 — лодочка
ванного стекла во всей массе приводит к возникновению в стекло-
изделиях больших напряжений, понижающих их механическую и
термическую устойчивость. Отжигом стекла устраняют эти напря-
жения. Для этого стеклоизделие вновь нагревают до температуры,
170
близкой к температуре размягчения его поверхностного слоя, и с
появлении пластичности стекла внутренние силы, обусловливаю-
щие напряжение в стеклоизделии, устраняются.
Из обычного стекла можно получать специальные стекла.
Триплекс, или безосколочное стекло, представляет
собой два листа обычного силикатного стекла, склеенных прослой-
кой или пленкой прозрачного эластичного органического полимера
(поливинилацетата, полибутироля и др.). Триплекс изготовляют
прессованием в автоклаве трехслойного комплекта при определен-
ном температурном режиме.
Закаленное небьющееся стекло получают в резуль-
тате специальной термической обработки листового стекла — за-
калки в электропечах с последующей обдувкой воздухом. Закален-
ное стекло во много раз превосходит обычное по механической
прочности и термической устойчивости.
Пеностекло получают добавлением в шихту веществ, разла-
гающихся при плавлении шихты с выделением газов. При застыва-
нии вспененной стекломассы образуется пеностекло (пористое стек-
ло) — легкий строительный материал, обладающий малой тепло-
проводностью и звукопроницаемостью.
Плавленые горные породы и природные кислотоупоры. Плавле-
ный природный кварц, или кварцевое стекло, — высокоогнеупорный
материал, выдерживающий резкие колебания температуры. Полу-
чают его из горного хрусталя плавлением в индукционных элект-
рических печах или плавлением чистого кварцевого песка в печах
сопротивления.
Каменное литье — изделия из некоторых плавленых гор-
ных пород, главным образом базальта и диабаза. Такие горные по-
роды содержат до 50%SiO2. Изделия из них обладают высокой
химической стойкостью и стойкостью к истиранию. Из каменного
литья изготовляют плитки для футеровки химической аппаратуры,
шары для шаровых и трубчатых мельниц. Производство каменного
литья сводится к плавке кусковой горной породы, отливке изделий
и их термической обработке.
Кроме изделий из плавленых пород для футеровки аппаратуры
и изготовления отдельных деталей в химической промышленности
применяются природные кислотоупорные материалы: андезит, беш-
таунит.
Ситаллы. Это новые силикатные материалы, обладающие высо-
кой термической, коррозионной стойкостью и механической прочно-
стью. Ситаллы получают из стекла полной или частичной его крис-
таллизацией, т. е. переведением стекла в кристаллическое состоя-
ние, при котором отдельные частицы, входящие в кристаллы, рас-
полагаются в пространстве в строго определенном порядке.
Сырьем для производства ситаллов служат горные породы, ме-
таллургические и топливные шлаки, отходы стекольного производ-
ства. Кристаллизация стекла в производстве ситаллов осуществля-
ется из расплавленной стекломассы определенного химического
состава, в которой для создания центров кристаллизации присутст-
171
вуют катализаторы. В результате получаются продукты кристалли-
ческого строения (до 95% кристаллической фазы).
Ситаллы имеют высокую температуру размягчения — 900—
1000°С, высокую прочность, устойчивы к воздействию щелочей, всех
кислот, кроме плавиковой. По многим механическим свойствам си-
таллы превосходят сталь и имеют коэффициент термического рас-
ширения, близкий к нулю. Такие материалы устойчивы к действию
смеси азотной и серной кислот при температурах до 300°С и выдер-
живают резкие колебания температур (до 1000°С). Благодаря этим
ценным свойствам ситаллы могут широко использоваться в маши-
ностроении, приборостроении, строительстве.
Контрольные вопросы
1. Каково значение силикатной промышленности для народного хозяйства?
2. Что является сырьем для производства силикатных материалов и изделий?
3. Какие процессы лежат в основе получения керамических изделий?
4. Как классифицируются вяжущие вещестиа?
Б. Какие процессы происходит в цементной печи при производстве портланд-
цемента?
6. Перечислите виды бетонов.
7. Назовите методы получения стекломассы и изготовления изделий из нее.
8- Как изготовить листовое стекло?
9. Назовите различные виды стекла.
10. Какими ценными свойствами обладают ситаллы и где они применяются?
Глава XII
ТЕХНОЛОГИЯ ТВЕРДОГО ТОПЛИВА
Понятие <топливо> в нашем сознании связано с горением. Но
топливо —не только источник получения тепла, это сырье химиче-
ской промышленности, из которого получают каучук и ткани, дета-
ли самолетов и предметы широкого потребления, удобрения и кра-
сители. Топливом называют существующие в природе или искус-
ственно изготовленные вещества, являющиеся источником тепловой
энергии и сырьем для химической промышленности. Мировые запа-
сы топлив грандиозны. Так, по данным академика А. Е. Ферсмана,
на долю бурых углей приходится 2100 млрд, т, каменных углей —
3200 млрд, т, антрацита — 600 млрд. т. Ежегодная мировая добыча
всех видов углей составляет более миллиарда тонн. Кроме угля в
земных недрах имеются горючие сланцы, нефть и газы.
Недра Советского Союза — богатейшая кладовая, хранящая са-
мые разнообразные топлива. В СССР в 1977 г. добыча углей соста-
вила 722 млн. т, нефти, включая газовый конденсат, — 546 млн. т,
газа — 346 млрд. ма. К 1980 г. добыча угля должна быть доведена
до 790—810 млн. т, нефти, включая газовый конденсат, — до 620—
640 млн. т, газа — до 400—435 млрд, м3 *.
‘ Материалы XXV съезда КПСС. М., Политиздат, 1976, с. 137, 177—179.
172
Большое значение имеет переработка растительного топлива —
древесины. Ресурсы этого вида топлива в СССР огромны — в лесах
Советского Союза примерно 400 млрд, м3 древесины.
Все виды топлива используются в качестве сырья для химиче-
ской промышленности.
§ 50. Классификация и состав топлив
Все топлива можно разделить по агрегатному состоя-
нию на твердые, жидкие и газообразные, а по происхожде-
нию на естественные и искусственные.
Естественные топлива: твер ды е— угли, древесина, сланцы,
торф; жидкие — нефть; газообразные — природные и попут-
ные газы.
Искусственные топлива получают главным образом при перера-
ботке естественных топлив. Твердые искусственные топлива —
кокс, полукокс, древесный уголь; жидкие — бензин, керосин, лиг-
роин и др.; газообразные — генераторные газы, коксовый газ,
газы переработки нефти и др.
Несмотря на большое разнообразие видов топлива, в химиче-
ских методах их переработки имеется много общего. Характерно,
что в большинстве случаев переработка топлив протекает при очень
высоких температурах. Процессы, проходящие при высоких темпе-
ратурах, называют пирогенетическими. (По-гречески слово
«пиро» означает огонь, «генос» — рождение.)
Имеются процессы переработки топлив, проходящие и при низ-
ких температурах. В этом случае топлива обрабатывают кислота-
ми, щелочами или какими-то другими реагентами. Такой метод по-
лучил особенно широкое распространение при переработке древе-
сины для производства целлюлозы, этилового спирта и других про-
дуктов. Несмотря на общность методов переработки топлив,
количество и состав продуктов, получаемых из различных топлив,
различны.
В этой главе рассматриваются процессы переработки твердых
топлив.
§ 51. Состав твердых топлив
Ископаемые твердые топлива образовались из растений, неког-
да покрывавших Землю. Процессы превращения растений в иско-
паемые горючие вещества протекали в течение миллионов лет. Из
растений образовывался торф, который со временем превратился
в бурый уголь, а последний затем в каменный уголь. В этом про-
цессе углеобразования изменялся состав топлив, причем увеличива-
лось содержание в них углерода и уменьшалось содержание водо-
рода и кислорода. Поэтому, как видно из табл. 19, наиболее богаты
углеродом «старые» по возрасту топлива — антрацит, каменный
уголь и меньше всего углерода в «молодых» топливах — древесине
и торфе.
173
Таблица 19. Состав органической массы топлива (%)
Вид топлива Углерод Водород Кислород Азот
Древесина 44 6 59 1
Торф 59 6 33 2
Бурый уголь 70 5,5 24 1
Каменный уголь 82 5 12 1
Антрацит 95 2 3 Следы
В табл. 19 представлен состав органической, или горю-
чей, массы топлива — той части топлива, которая при горении дает
тепло. Элементы, входящие в состав органической массы топли-
ва, связаны между собой и образуют органические соединения. По-
мимо этого, в топливе имеется негорючая часть, или бал-
ласт, не дающий тепла при сжигании топлива. Негорючую часть
топлива составляют влага и зола; количество золы в топливе колеб-
лется, например в углях от 2 до 30%, количество влаги—от 1 до
50%. Чем меньше зольность и влажность топлива, тем выше его ка-
чество.
Угли — один из основных видов топлива — служат источником
получения искусственного топлива и химического сырья. Существу-
ют следующие основные методы переработки углей: коксование,
полукоксование и газификация.
§ 52. Коксование углей
Коксование углей заключается в нагревании углей без доступа
воздуха при температуре 900—1100°С. В результате коксования по-
лучают твердый продукт — кокс, жидкие продукты — каменно-
угольную смолу, сырой бензол, надсмольную воду, газообразный
продукт — коксовый газ.
Кокс — матово-черный твердый пористый материал. Его ис-
пользуют главным образом в металлургии, а также для газифика-
ции, в производстве карбида кальция и других продуктов.
Каменноугольная смола — вязкий, более тяжелый, чем
вода, черно-бурый продукт со специфическим запахом, содержа-
щий около 300 разнообразных веществ. Из каменноугольной смолы
извлекают бензол, толуол, ксилолы, фенол, крезолы, пиридин, наф-
талин, антрацен и другие вещества, необходимые для производства
пластических масс, химических волокон и т. д.
Сырой бензол — так называется получаемая при коксова-
нии смесь, состоящая из сероуглерода, бензола, толуола, ксилолов
и других веществ.
Надсмольная вода представляет собой слабый водный
раствор аммиака и аммонийных солей. Аммиак может быть выде-
лен из надсмольной воды и применен для производства удобрений.
Коксовый газ — смесь, содержащая водород, метан, эти-
174
лен, окись углерода, азот и другие вещества. При сжигании коксо-
вого газа можно получить тепло, однако вещества, содержащиеся
в нем, могут служить сырьем для химических синтезов и потому
использование коксового газа в качестве источника тепла нерацио-
нально.
Коксование — одно из старейших химических производств,
оно существует уже более 200 лет. Этот процесс возник в Англии в
1735 г. в связи с необходимостью найти замену древесному углю в
доменном процессе при производстве чугуна. До середины XIX. в.
коксование проводилось с единственной целью — производство кок-
са для металлургии. Пары каменноугольной смолы, сырого бензо-
ла, коксовый газ, аммиак выбрасывали в атмосферу или сжигали в
печах.
Со второй половины XIX в. положение коренным образом изме-
нилось. Поворотным пунктом послужили синтез Митчерлихом нит-
робензола из бензола и получение в России Н. Н. Зининым анили-
на из нитробензола. Эти открытия легли в основу создания анили-
нокрасочной промышленности, а затем фармацевтической и
промышленности взрывчатых веществ. Для этих отраслей понадо-
бились бензол, толуол, фенолы, крезолы, нафталин, антрацен и
другие продукты, содержащиеся в каменноугольной смоле и сыром
бензоле. С этого момента каменноугольная смола и сырой бензол
превратились из отходов производства в основные и важнейшие
продукты. Почти на всех заводах начали строить установки, на ко-
торых улавливались каменноугольная смола и сырой бензол. Та-
ким образом, были созданы единые коксохимические производства,
производящие наряду с коксом бензол, ксилол, нафталин, антрацен,
фенолы и другие продукты.
Сырье. Сырьем для коксования служат коксующиеся угли (мар-
ки К), которые при высокой температуре хорошо спекаются, давая
прочный и пористый кокс. Однако в промышленной практике со-
ставляется смесь — шихта, в которую вводятся угли и других ма-
рок. Шихтовка позволяет расширить сырьевую базу коксохимиче-
ской промышленности и помимо качественного кокса производить
большие количества смолы, сырого бензола и коксового газа.
Из одной тонны сухого угля в среднем получается 700—800 кг
кокса, 25—50 кг каменноугольной смолы и 300—350 м3 газа, со-
держащего около 3 кг аммиака и до 10 кг сырого бензола.
Коксование. Для осуществления этого процесса служат коксо-
вые батареи, состоящие из ряда камер, в которых уголь в отсут-
ствие воздуха нагревается до 900—1100°С.
В этих условиях из угля выделяются пары каменноугольной смо-
лы, сырого бензола, воды и коксовый газ. Парообразные и газооб-
разные продукты непрерывно выводятся из печи, и к концу периода
коксования, продолжающегося 14—15 ч, в печи остается кокс в ви-
де пористого, спекшегося «пирога». Поскольку процесс проводится
при очень высокой температуре, стенки камер выкладываются из
материалов, выдерживающих высокие температуры. Такими мате-
риалами являются огнеупорные кирпичи — динас или шамот.
175
Коксовая камера представляет собой длинный и узкий
канал прямоугольного сечения (рис. 62). Передняя 2 и задняя 5
стенки печи съемные н в момент загрузки плотно закрыты. В своде
камеры имеются загрузочные люки 3, которые открываются прн
загрузке камеры углем и закрыты в период коксования. Образую-
щиеся в процессе коксования газообразные и парообразные про-
дукты выводятся из камеры через стояки 4 в газосборники. По окон-
чании коксования специальным механизмом снимаются торцевые
стенки 2 и 5 и коксовый «пирог» массой 15—16 т выталкивается из
камеры коксовыталкивателем 1. При выдаче кокса «пирог» рас-
Горячие газы, обогре-
вающие камеры снаружи
Рис. 62. Коксовая камера:
1 — коксовыталкиватель, 2 — передняя стенка, 3 — загрузочные люки,
4 — стояк, 5 — задняя стенка
сыпается и куски раскаленного докрасна кокса падают в подводи-
мый к камере вагон, в котором они затем быстро охлаждаются во-
дой во избежание сгорания кокса.
Коксовая батарея включает обычно более 60 камер, ра-
ботающих параллельно. Часть батареи изображена на рис. 63.
Между камерами 1 образуются каналы — обогревательные про-
стенки 2, по которым движутся горячие дымовые газы (на рисунке
их путь показан стрелками), отдающие свое тепло через стенки ка-
мер коксуемому углю.
Дымовые или топочные газы получают прн сжигании газообраз-
ного топлива — доменного, коксового или генераторного газа. Кок-
совая батарея оборудована регенераторами 4, расположенными под
коксовыми камерами. В регенераторах тепло газов, выходящих из
обогревательных простенков, используется для подогрева воздуха,
необходимого для горения газообразного топлива, которое поступа-
ет через отверстия 3. В регенераторы II, III, IV, V, X, XI, XII, насад-
ка которых нагрета, подается воздух. Воздух в них нагревается и ис-
пользуется для горения газов, подаваемых через отверстия 3. Ды-
мовые газы проходят по обогревательным простенкам, нагревают
стенки коксовых камер, насадку регенераторов I, VI, VII, VIII, IX и
уходят в дымовую трубу. Таким образом, в данном случае насадка
176
регенераторов II, III, IV, V, X, XI и XII постепенно охлаждается
воздухом, насадка регенераторов I, VI, VII, VIII, IX нагревается
дымовыми газами. Это продолжается примерно 15—20 мин, после
чего потоки воздуха и дымовых газов переключают: в регенерато-
ры I, VI, VII, VIII, IX, насадка которых нагрета, начинает посту-
пать воздух, в регенераторы II, 111, IV, V, X, XI, XII с охлажденной
насадкой — дымовые газы и т. д.
Рис. 63. Коксовая батарея:
1 — камеры, 2 — обогревательные простенки, 3 — отверстия, 4 — регене-
раторы
Переработка коксового газа. Коксовый газ, выходящий из кок-
совой камеры, называют прямым. Из прямого коксового газа вы-
деляют каменноугольную смолу, надсмольную воду, аммиак, бен-
зол и его гомологи, нафталин, сернистые и цианистые соединения.
Освобожденный от этих веществ коксовый газ, состоящий в основ-
ном из водорода и метана, называют обратным коксовым газом.
Переработка коксового газа представлена на рис. 64 и в табл. 20.
Прямой коксовый газ, выходящий из всех камер, попадает в
проложенный вдоль батареи газосборник 1, в который впрыскива-
ется вода. В газосборнике газ охлаждается примерно до 80°С, и
177
из него частично конденсируется смола. Одновременно в газосбор-
нике удаляются твердые частицы угля. В результате последующего
охлаждения газа в холодильнике 2 до 20—30°С происходит кон-
денсация паров смолы и воды. Присутствующий в газе аммиак час-
тично растворяется в конденсирующейся воде с получением над-
смольной воды. Смола и надсмольная вода из холодильников сте-
кают в сборник 3, где разделяются по плотности. Смола, как более
тяжелая, скапливается на две сборника. Смола, присутствующая
в газе, частично превращается в туман, который не оседает при
Поглотительное
масло
Рис. 64. Переработка прямого коксового газа:
/ — газосборник, 2 — холодильник, 3 — сборник, 4 — электрофильтр» 5 — турбогазо-
дувка, 6 — подогреватель, 7 — сатуратор, 8 — башня с насадкой^ 9 — бензольные
скрубберы
конденсации смолы в холодильниках. Смоляной туман удаляют из
коксового газа осаждением его в электрофильтре 4, работающем
при напряжении 60 000—70 000 В. Для транспортировки газа пос-
ле электрофильтров установлен эксгаустер (турбогазодувка) 5.
В надсмольной воде происходит лишь частичное растворение со-
держащегося в коксовом газе аммиака. Улавливание аммиака, ос-
тающегося в газе после холодильников, производится в сатурато-
ре 7 башенной серной кислотой, которая взаимодействует с аммиа-
ком с образованием кристаллов сульфата аммония:
NH3 + H2SO4 = (NH^SOi (XII, 1)
Процесс поглощения аммиака серной кислотой гетерогенный —
система газ — жидкость. Поэтому для его ускорения стремятся уве-
личить поверхность соприкосновения взаимодействующих фаз. Для
этого в сатураторе имеется барботер — труба с зазубринами, по-
груженная в жидкость. Газ проходит по трубе сверху вниз, пробуль-
кивает (барботирует) через жидкость и сверху выводится из аппа-
рата. Для увеличения скорости реакции (XII, 1) газ до поступле-
ния в сатуратор нагревают паром в трубчатом подогревателе 6.
Образовавшиеся в сатураторе кристаллы сульфата аммония
178
Таблица 20. Переработка прямого коксового газа
170
вместе с раствором выводятся из сатуратора, отделяются на цент-
рифугах и используются как азотное удобрение.
Освобожденный от аммиака коксовый газ направляется на
улавливание сырого бензола. Наибольшее распространение полу-
чило улавливание сырого бензола абсорбцией его поглотительными
маслами при 20—25°С в скрубберах (башнях с насадкой) 9. В ка-
честве поглотителей используется каменноугольное масло (фракция
перегонки каменноугольной смолы, кипящей при 230—300°С). Газ,
поступающий в бензольные скрубберы, предварительно охлаждается
водой в башне с насадкой 8. Из скрубберов 9 выходит раствор сы-
рого бензола в поглотительном масле. Поскольку7 сырой бензол
имеет температуру кипения, значительно более низкую, чем погло-
тительное масло, его отгоняют из поглотительного масла, которое
затем вновь подается на орошение скрубберов.
Из скрубберов уходит обратный коксовый газ, который
далее подвергают очистке от сероводорода и других серосодержа-
щих соединений. Обратный газ содержит: водорода 54—59%, ме-
тана 23—28%, окиси углерода 5—7%, тяжелых углеводородов
2—3%, азота 3—5%, двуокиси углерода 1,5—2,5%, кислорода 0,3—
0,8%- Теплотворная способность его 16750—17200 кДж/м3. Из него
выделяют водород, который используют для синтеза аммиака.
Из каменноугольной смолы и сырого бензола в настоящее вре-
мя извлекают около шестидесяти продуктов. Для этого используют
либо нагревание, при котором некоторые продукты улетучиваются,
а затем улавливаются, либо охлаждение, при котором происходит
кристаллизация отдельных веществ.
При таком процессе переработки из 1 т угля можно получить
(в кг):
Бензола ...........3,5
Толуола .... 1,5
Сольвент-нафты . 0,9
Ксилолов .... 0,7
Фенола ..... 0,07
Крезолов .... 0,10
Пиридина .... 0,02
Нафталина .... 2,0
Хинолина .... 0,01
Антрацена ... 0,15
Карбазола .... 0,02
Все эти продукты используются как сырье для химических про-
изводств.
На первый взгляд может показаться, что количество химиче-
ских продуктов, образующихся при коксовании углей, невелико. Ес-
ли же учесть масштабы коксования, то окажется, что при перера-
ботке углей получают тысячи тонн бензола, толуола, нафталина и
других веществ. Несмотря на то что некоторые из этих продуктов
получают из нефти, каменноугольная смола и сырой бензол все же
останутся важнейшими поставщиками ароматических углеводоро-
дов для химической промышленности.
После выделения из каменноугольной смолы указанных про-
дуктов остается каменноугольный пек — черная, блестящая,
размягчающаяся при нагревании масса, используемая в дорожном
строительстве, при изготовлении электродов и др.
180
§ 53. Газификация топлива
Газификация топлива — один из распространенных процессов
переработки топлива, в результате которого из твердого топлива
получаются газы, представляющие собой беззольное транспорта-
бельное топливо и сырье для химических синтезов.
Газификация проводится большей частью в аппаратах — газо-
генераторах, и получаемые газы называются генераторными.
Чтобы загруженное в генератор топливо превратить в газ, через
него продувают воздух или водяной пар. При этом кислород, со-
держащийся в воздухе, или водяной пар взаимодействует с угле-
родом топлива и образуется окись углерода. При продувании через
топливо воздуха протекает реакция
2C + O2^2CO + Q (XII,2)
При этом образуется так называемый воздушный генера-
торный газ. В реакцию (XII, 2) с углеродом топлива вступает
лишь кислород, содержащийся в воздухе, азот воздуха с углеро-
дом топлива не взаимодействует и остается неизменным. Поэтому
в воздушном генераторном газе содержится теоретически только
34,7 об. % окиси углерода и 65,3 об. % азота. Такой воздушный ге-
нераторный газ называется идеальным воздушным га-
зом. Практически вследствие протекания других, кроме (XII, 2),
реакций количество окиси углерода в нем составляет 30—32%.
В случае подачи в генератор водяного пара образуется водя-
ной генераторный газ по реакции
С + Н2О СО +Н2— Q (XII,3)
Из реакции (XII, 3) следует, что теоретически в идеальном во-
дяном газе должны содержаться в одинаковых количествах СО и
Нг, т. е. в таком газе должно находиться 50 об. % окиси углерода
и 50 об. % водорода. Практически же состав несколько отличается
от идеального.
Если в газогенератор поступает смесь пара с воздухом или пара
с кислородом, то одновременно протекают реакции (XII, 2) и
(XII, 3) и образуются в первом случае паровоздушный или
полу водяной и во втором — парокислородный газы. Их
состав зависит от соотношения между паром и воздухом или паром
и кислородом в дутье.
Одним из показателей качества генераторных газов является ко-
личество тепла, получаемого при сжигании одного кубического мет-
ра газа, называемое теплотворной способностью и вы-
ражаемое, например, в кДж/м3.
Состав и теплотворная способность некоторых промышленных
генераторных газов приведены в табл. 21.
181
Таблица 21. Состав генераторных газов
Вид газа Дутье Состав газа Теплотворная способность, кДж/м’
окись угле- рода СО водород Н, двуокись углерода СО* азот другие газы
Воздушный Воздух 32 43 4,2 59 1 4 600
Водяной Водяной пар 39 50 5 5 1 10 500
Полуводяной Водяной пар+воз- дух 35 36 5 23 1 8 400
Табл. 21 показывает, что все генераторные газы обладают отно-
сительно высокой теплотворной способностью и в них содержатся
окись углерода и водород, которые служат исходным сырьем для
получения аммиака, спиртов, органических кислот и т. д. Таким
образом, генераторные газы являются источником получения теп-
ловой энергии и сырьем химической промышленности.
Чтобы получить возможно большее содержание СО и Н2 в ге-
нераторных газах, необходимо проводить процесс газификации при
таких условиях, чтобы равновесие реакций (XII, 2) и (XII, 3) было
возможно больше сдвинуто в правую сторону и чтобы они протека-
ли с возможно большей скоростью.
Равновесие этих реакций зависит от температуры и давле-
ния, и их влияние определяется принципом Ле-Шателье. Так, для
увеличения степени газификации при экзотермической реакции
(XII, 2) необходимы низкие температуры, при эндотермической
(XII, 3) — высокие. Увеличение давления по принципу Ле-Шателье
сдвигает вправо равновесие реакций, протекающих с уменьшением
объема. Поскольку обе реакции (XII, 2) и (XII, 3) идут с увеличе-
нием объема, проведение их под давлением нецелесообразно.
К и н е т и ка, т. е. скорость газификации, в огромной степени
определяет результат процесса. Процесс газификации твердого топ-
лива гетерогенный — происходит взаимодействие твердого вещест-
ва с газом. Поэтому на скорость его оказывают влияние скорость
химических реакций (XII, 2) и (XII, 3), скорость диффузии кисло-
рода или водяного пара из потока газа, обтекающего твердую час-
тицу, к его поверхности и величина поверхности контакта взаимо-
действующих фаз.
Чтобы реакции газификации проходили с высокой скоростью,
обычно их проводят при высокой температуре — около 1000°С. При
этой температуре скорость реакций очень велика, и потому важным
фактором, определяющим (лимитирующим) общую скорость гази-
фикации, является скорость диффузии реагентов. Следовательно,
этот процесс протекает в диффузионной области и основным путем
его интенсификации является увеличение скорости газового потока.
Значительно интенсифицируется этот процесс при измельчении топ-
182
лива, так кай при этом увеличивается поверхность взаимодействую-
щих фаз.
Образующиеся по реакции (XII, 3) СО и Н2 могут вступать в
реакции, ведущие к образованию метана. Например:
C + 2H2^CH4 + Q (XII,4)
СО 4- ЗН2 СН4 + Н2О + Q (XII,5)
Эти реакции протекают с уменьшением объема, и потому для
сдвига равновесия в сторону образования метана целесообразно
применение давления.
Газификация под давлением около 25 кгс/см2 дает возможность
получать генераторный газ, богатый метаном. Поскольку метан
обладает высокой теплотворной спо-
собностью, в этом случае образуется
генераторный газ, при сжигании ко-
торого выделяется большое коли-
чество тепла — около 16 000 кДж из
одного кубического метра газа. Од-
нако генераторы, работающие под
давлением, дороги в изготовлении
и обслуживании.
Основным аппаратом процесса
газификации является газогене-
ратор (рис. 65). Это вертикальный
цилиндрический аппарат. Цилиндр
состоит из стального кожуха 1, из-
нутри футерованного огнеупорным
кирпичом 2, так как пройесс газифи-
кации протекает при высокой темпе-
ратуре— около 1000—1100°С. Стен-
,ки газогенератора опущены в золь-
ную чашу 8, которая залита водой и
медленно вращается. Вместе с золь-
ной чашей вращается и колоснико-
вая решетка 9, через которую снизу
Рис. 65. Газогенератор:
1 — стальной кожух, 2 — футеровка,
3 — загрузочная коробка, 4 — конус
затвора, 5 — зона подсушки, 6 — зона
газификации, 7— зола, 8 — зольная
чаша, 9 — колосниковая решетка
в генератор подается дутье — воз-
дух. Топливо поступает периодичес-
ки через загрузочную коробку 3 при
опущенном конусе затвора 4 и по-
степенно двигается вниз — происхо-
дит противоточное движение фаз.
Сначала топливо подсушивается поднимающимися газами в зоне
подсушки 5, а затем окисляется [реакция (XII,2)] в зоне газифи-
кации 6. Образующийся генераторный газ выводится сверху. Остаю-
щаяся после газификации топлива зола 7 падает в зольную чашу 8
и выводится из аппарата.
Газификация в «кипящем» слое топлива проводится
в генераторе, конструкция которого аналогична конструкции печи
для обжига колчедана в «кипящем» слое (см. с. 52).
183
На решетку такого генератора подается мелкозернистое топли-
во (развитая поверхность контакта фаз), а под решетку с большой
скоростью подводится дутье. Образующийся газ выводится сверху.
Генераторы такого типа высокоинтенсивны и позволяют газифици-
ровать мелкозернистое топливо, непригодное для генераторов филь-
трующего слоя. Недостаток генераторов «кипящего» слоя заключа-
ется в значительном уносе угольной пыли и золы с газом, для улав-
ливания которых необходимы специальные устройства.
§ 54. Переработка древесины
Переработка древесины — один из наиболее старых химико-тех-
нологических процессов. Еще древние египтяне получали из древе-
сины древесный уголь, необходимый для выделения металлов из
руд. В наше время переработка древесины превратилась в само-
стоятельную отрасль — лесохимическую промышленность.
Химический состав древесины очень сложен и неодинаков у раз-
личных пород дерева. Поэтому при переработке разнообразных
хвойных и лиственных пород получают различные продукты. Основ-
ные вещества, составляющие растительную ткань,— это целлюлоза
(клетчатка), гемицеллюлоза и лигнин. Минеральные вещества об-
разуют золу.
Целлюлоза (СбНюОз),, имеет волокнистое строение, она не-
растворима в воде и органических растворителях. При действии ми-
неральных кислот целлюлоза растворяется. Содержание целлюлозы
в сухой древесине составляет от 30 до 50%, в хлопке — более 90%.
Гемицеллюлозы состоят из пентозанов (С5Н3О4)п, гексоза-
нов (CeHioOsJn, которые менее стойки, чем целлюлоза, и легче рас-
творяются кислотами. В сухой древесине содержится 24—30% ге-
мицеллюлозы.
Лигнина в древесине содержится 25—30%. Строение лигнина
еще окончательно не установлено.
Из древесины выделяют смолы, из которых получают канифоль
и скипидар, а также дубильные и некоторые другие вещества.
Существуют две группы процессов переработки древесины: пи-
рогенетический (пиролиз или сухая перегонка древесины) и хими-
ческие (обработка древесины растворами слабых кислот или ще-
лочей при относительно низких температурах).
Сухая перегонка древесины — процесс, аналогичный коксованию
углей. Древесину нагревают без доступа воздуха до 400—470°С.
В результате, так же как и при коксовании, получаются твердые,
жидкие и газообразные продукты. Однако состав этих продуктов и
их количество иные, чем при коксовании углей.
При сухой перегонке древесины получают твердый продукт —
древесный уголь, жидкие — надсмольную или подсмольную воду и
смолу и, наконец, газы.
Древесный уголь, выход которого составляет около 32—
38% от веса перерабатываемой древесины, находит важное техни-
ческое применение. Его используют вместо кокса для выплавки вы-
184
сококачественного чугуна, так как в нем не содержится таких вред-
ных для чугуна примесей, как сера и фосфор. Из древесного угля
изготовляют электроды для электрических печей и электролизеров,
активированные угли для противогазов и для очистки газов от вред-
ных примесей.
Надсмольная вода содержит метиловый спирт СНзОН,
уксусную кислоту СН3СООН, ацетон (СНз)гСО, фурфурол
(С5Н4О)2 и другие вещества, которые выделяют из нее и применя-
ют для синтеза химических продуктов.
Следует отметить, что в связи с развитием химической промыш-
ленности спрос на уксусную кислоту и метиловый спирт возрос на-
столько сильно, что лесохимическая промышленность уже не в со-
стоянии его удовлетворить. В связи с этим разработаны и получили
широкое распространение синтетические способы производства этих
продуктов (см. с. 216, 209).
Смола представляет собой продукт, из которого получают фло-
тационные реагенты, необходимые при обогащении руд; масла для
пропитки древесины; креозот — продукт, обладающий сильным ан-
тимикробным действием.
Газы сухой перегонки древесины используются как топливо.
Помимо пирогенетического способа переработки древесины получи-
ли распространение чисто химические, проводимые при относитель-
но небольших температурах. Этими способами в результате обра-
ботки древесины химическими реагентами получают, например,
целлюлозу, этиловый спирт и другие продукты.
Получение целлюлозы. Целлюлоза (прессованная целлюлоза по-
хожа на необработанный картон) необходима для выработки ис-
кусственных волокон, например вискозного волокна, бумаги, цел-
лулоида — первой промышленности пластической массы, целлофа-
на, кинопленки, пороха. Из 1 м3 древесины можно получить около
170—200 кг целлюлозы и из нее примерно 1500 м шелковой ткани.
Целлюлозу большей частью изготовляют из древесины, так как
стоимость хлопка выше стоимости древесины.
Производство целлюлозы заключается в выделении ее из древе-
сины — другими словами, отделении ее от гемицеллюлоз и лигнина.
Для этого измельченную древесину — древесную щепу обрабатыва-
ют какими-либо реагентами, например растворами, которые рас-
творяют гемицеллюлозы и лигнин, а целлюлозу оставляют неизме-
ненной. Для растворения гемицеллюлоз и лигнина используют рас-
творы слабых кислот или щелочей. В зависимости от этого различа-
ют два основных метода производства целлюлозы: 1) сульфитный
(кислотный) и 2) сульфатный (щелочной).
Сульфитный метод заключается в том, что древесную
щепу обрабатывают при температуре до 135—145°С под давлением
5—7 кгс/см2 в течение 10—15 ч слабокислым раствором бисульфи-
та кальция Ca(HSO3)2, содержащим растворенный сернистый ан-
гидрид SO2. В этом процессе (процесс варки) целлюлоза остается
почти неизмененной, а гемицеллюлозы и лигнин переходят в рас-
твор. Затем целлюлозу отделяют от раствора, называемого суль-
185
фитным щелоком, освобождают от неразлсжившейся древе-
сины и других включений, промывают водой, сушат, прессуют и
передают потребителям.
При получении целлюлозы по этому способу на 1 т целлюлозы
получается около 10—12 т сульфитных щелоков. Использование
этих щелоков имеет огромное народнохозяйственное значение, так
как спускаемые в реки и другие водоемы, они не только загряз-
няют их, но и приносят огромный ущерб рыбному хозяйству. При
переработке этих щелоков можно получать этиловый спирт С2Н5ОН,
дубильные экстракты, связующие материалы для песчаных литей-
ных форм и т. д.
Сульфатный способ заключается в том, что для разложе-
ния древесины используют раствор, содержащий едкий натр. Вар-
ку целлюлозы в этом растворе ведут при 165—175°С, давлении 8—
10 кгс/см2 в течение 3,5—8 ч. Как и при сульфитном методе, лигиин
и гемицеллюлозы переходят в раствор, целлюлоза отделяется от
него, очищается, сушится и прессуется. В отличие от сульфитного
метода щелока, получаемые при щелочном методе, возвращаются
обратно в процесс (регенерируются). Для этого к ним добавляют
порошкообразный Na2SO4 (отсюда и название метода — сульфат-
ный) и смесь прокаливают. При прокаливании и последующей об-
работке прокаленного продукта известковым молоком Са(ОН)2 об-
разуется едкий натр, который и возвращается в процесс получения
целлюлозы.
Гидролиз древесины. Переработка древесины, при которой из-
мельченная древесина обрабатывается слабыми кислотами, назы-
вается гидролизом древесины. Это очень перспективный
метод. При обработке древесных опилок или щепы 0,3—0,5%-ным
раствором серной кислоты при 170—180°С и давлении 7—•
10 кгс/см2 гемицеллюлозы и целлюлоза гидролизуются, т. е. при-
соединяют воду, и превращаются в сахара (осахаривание):
+ нго
(С6Н10Н5)п-----> пС6Н12О6 (XII,6)
глюкоза
Оставшийся после такой обработки лигнин отделяется от раствора
сахаров и используется, например, в качестве наполнителя в про-
изводстве полимерных материалов — пластических масс, каучука.
Раствор сахаров нейтрализуется известковым молоком и на-
правляется в бродильные чаны, где протекает биохимический син-
тез этилового спирта:
СвН12О6 2 С2Н5ОН 4- 2СО2 (XII,7)
Помимо этилового спирта, идущего на производство каучука,
при гидролизе древесины получают пищевую глюкозу и фурфурол,
идущий в производство пластических масс, а также дрожжи, со-
держащие белки и витамины, представляющие собой ценный корм
для животных, птиц, рыбы. Из 1 т древесины получают 150—180 л
95%-ного этилового спирта, 30—40 кг дрожжей, 4—7 кг фурфурола.
186
Контрольные вопросы
1. Как можно классифицировать топлива? Из чего состоят твердые топлива?
2. В чем заключается процесс коксования? Какие при этом получают про-
дукты?
3. По рис. 62 объясните работу коксовой камеры.
4. Начертите схему переработки коксового газа.
5. Какой процесс называют газификацией?
6. Начертите схему газогенератора.
7. Напишите реакции, протекающие при газификации топлива воздухом, во-
дяным паром (при атмосферном давлении и под давлением).
8. Назовите основные составные части древесины.
9. В чем заключается сухая перегонка древесины? Какие продукты при этом
получаются?
10. На каком свойстве целлюлозы основано ее выделение из древесины?
Глава XIII
ПЕРЕРАБОТКА ЖИДКИХ ТОПЛИВ
(НЕФТИ И НЕФТЕПРОДУКТОВ)
Использование нефти известно с глубокой древности. В русских
летописях XVI в. имеется упоминание о том, что во время царство-
вания Бориса Годунова из Ухты в Москву была привезена «горя-
чая вода густа». До второй половины XIX в. нефть использовали
в качестве топлива — ее сжигали в топках. Со второй половины
XIX столетия начинается строительство установок, на которых из
нефти выделяют керосин, применявшийся для освещения. Более
легкий, чем керосин, продукт — бензин выбрасывали или сжигали.
Развитие машиностроения потребовало значительных количеств
смазочных масел, которые наряду с керосином начинают получать
из нефти. Но все же и в это время бензин не использовался.
С начала XX в. бурно развивается автомобильный, а затем и
авиационный транспорт, для которых становится необходимым бен-
зин. Происходит «углубление» процессов переработки нефти — бен-
зин становится одним из основных продуктов нефтепереработки, и
одновременно с ним получают другие продукты — лигроин, керо-
син, смазочные масла и т. д. При этом керосин утрачивает свое зна-
чение как осветительное средство, так как его вытесняет электриче-
ство. В наше время керосин применяется в реактивной авиации, для
двигателей тракторов и тепловозов. В связи с появлением новой
техники назрела необходимость в различных смазочных маслах и
других нефтепродуктах.
Примерно с 30-х годов нынешнего столетия из нефти наряду с
различными видами топлива и смазочных масел начинают произво-
дить продукты, необходимые для химической промышленности:
этилен, пропилен, бутаны, бутилены, фенол, бензол и т. д. Нефте-
переработка превращается в сложнейшую отрасль индустрии —
промышленность нефтехимического синтеза. За-
воды нефтехимического синтеза — это предприятия, оснащенные
современным оборудованием с высокой степенью автоматизации,
187
на которых из нефти получают различные виды топлив, а также
сырье для производства пластических масс, синтетических каучу-
ков, химических волокон, моющих средств и т. д.
СССР занимает первое место в мире по запасам нефти. Помимо
давно известных нефтеносных районов — Апшеронского полуост-
рова (Азербайджанская ССР), Грозного, Майкопа (Северный Кав-
каз) открыто много новых месторождений. Для добычи и перера-
ботки нефти большое значение имеют Башкирская АССР, Татар-
ская АССР и Куйбышевская область. Нефть найдена и с восточной
стороны Уральского хребта, который при своем геологическом об-
разовании, по-видимому, как бы рассек на две половины огромный
нефтеносный бассейн. В 1980 г. добыча нефти должна быть доведе-
на до 640 млн. т, из них свыше 300 млн. т будет добыто в Западной
Сибири.
§ 55. Состав и свойства нефти
Нефть — маслянистая жидкость, более легкая, чем вода, имею-
щая окраску от светло-желтой до темно-коричневой и почти черной.
Нефть состоит в основном из углерода (85—86%) и водорода (12—
14%), которые связаны между собой в разнообразные химические
соединения — углеводороды. Помимо углеводородов в нефтях в не-
больших количествах содержатся вещества, содержащие кислород,
азот, серу и механические примеси.
Углеводородная часть нефтей состоит из парафиновых (пре-
дельных) СпН2п+2, нафтеновых (циклические углеводороды с общей
формулой СпНгп) и ароматических углеводородов. Непредельные
углеводороды СпНгп, как правило, в нефтях отсутствуют, но содер-
жатся в продуктах их переработки.
Парафиновые углеводороды от СН4 до С4Ню — газо-
образные. Они присутствуют в нефтях в растворенном состоянии.
При добыче нефти, когда давление нефти снижается, они выделя-
ются из нее в виде попутных газов. Жидкие парафиновые углево-
дороды от C5Hi2 до С16Н34 составляют основную массу жидкой
части нефтей и жидких фракций, получаемых при ее переработке.
Твердые парафиновые углеводороды от CieH34 и выше растворены
в нефти и могут быть выделены из нее. Нафтеновые углеводороды
представлены в нефтях главным образом производными циклопен-
тана
Н2С----СНа
Н2С СН2
188
и циклогексана
Н2С
Н2С
СН2
СН2
Ароматические углеводороды содержатся в нефтях в относительно
небольших количествах в виде бензола и его гомологов — толуола,
ксилолов.
В зависимости от преимущественного содержания в нефтях уг-
леводородов различных классов они подразделяются на парафи-
нистые (бакинские, эмбинские), нафтено-парафиновые,
(грозненские, суроханские), нафтено-ароматические
(майкопские), парафино-нафтено-ароматические (не-
которые майкопские).
Неуглеводородная часть нефтей состоит из сернистых, кисло-
родных и азотистых соединений.
По содержанию серы нефти делятся на малосернистые
(кавказские) с содержанием серы до 0,5% и многосернистые,
в которых серы содержится более 0,5% • Например, в башкирских
нефтях содержание серы достигает 4%.
Кислородные соединения — это нафтеновые кислоты, фенолы,
смолистые вещества. Последние придают нефти темную окраску,
разлагаются и коксуются при нагревании.
Минеральные примеси — это механические примеси, вода, ми-
неральные соли, зола.
Механические примеси — это твердые частицы песка, глины,
выносимые из недр земли потоком добываемой нефти. Вода в неф-
ти находится в двух видах: отделяемая от нефти при отстаивании
и в виде стойких эмульсий, которые могут быть разрушены толь-
ко специальными методами. Минеральные соли, например хло-
ристые кальций и магний, растворены в воде, содержащейся в неф-
ти. Зола составляет в нефти сотые и даже тысячные доли
процента.
Состав нефти определяет ее физические свойства, в частности
цвет, плотность, температуры, при которых она воспламеняется и
застывает, и др.
Цвет нефти изменяется от светло-желтого до темно-коричневого.
Плотность большинства нефтей при 20°С 0,83—0,97 г/см3. Вязкость
нефтей неодинакова и сильно уменьшается с повышением темпера-
туры. Температура застывания колеблется в широких пределах —
от 10 до —20°С. Она характеризует условия, при которых нефть
теряет текучесть. Теплота сгорания нефти 39 800—44 000 кДж/кг.
189
§ 56. Продукты переработки нефти
При переработке нефти получают следующие продукты: топли-
ва жидкие и газообразные, растворители, смазочные масла, конси-
стентные смазки, твердые и полутвердые смеси углеводородов
(парафины, церезин, вазелин и т. д.), нефтяные битумы и пеки, неф-
тяные кислоты и их производные (мылонафты, сульфокислоты, жир-
ные кислоты и пр.), индивидуальные углеводороды (газообразные
и жидкие — этилен, пропилен, метан, бензол, толуол, ксилол), яв-
ляющиеся сырьем для химической промышленности.
Нефтяные жидкие топлива подразделяются на моторные бензи-
ны, тракторное топливо, дизельное топливо, котельное топливо,топ-
ливо для реактивных и турбореактивных двигателей.
Жидкие топлива потребляются в огромном количестве,
особенно моторные бензины, которые применяются в поршневых
карбюраторных двигателях с зажиганием от искры. Моторное
топливо не должно содержать сернистых соединений, органиче-
ских кислот и других веществ, которые вызывают коррозию метал-
лов, применяемых для изготовления двигателей и тары. Они долж-
ны быть стабильны при хранении.
Бензины имеют определенный фракционный состав, характе-
ризующий начало и окончание кипения фракций, получаемых при
разгонке бензинов в интервале температур 25—200°С. Давление
насыщенных паров бензина, т. е. давление паров, которое может
быть над жидким бензином при определенных условиях, не долж-
но быть выше установленного предела.
Важная характеристика бензинов — их антидетонационные
свойства, или детонационная стойкость.
Бензин в настоящее время используется для автомобильных
двигателей и для двигателей винтомоторных самолетов (карбюра-
торных двигателей). При работе такого двигателя горючая смесь
паров бензина с воздухом поступает в цилиндр двигателя, сжима-
ется в нем поршнем и поджигается от запальной свечи (искры).
Внутри цилиндра продукты, образовавшиеся при горении паров бен-
зина, расширяются и двигают поршень; движение поршня переда-
ется в ходовую часть машины. Чем сильнее сжимается смесь в ци-
линдре двигателя или, как говорят, чем выше степень ее сжатия,
тем экономичнее двигатель. Что же ограничивает увеличение сте-
пени сжатия? Дело в том, что при увеличении степени сжатия на-
ступает такой момент, когда вместо спокойного горения смеси на-
ступает резкое увеличение скорости распространения пламени в
цилиндре двигателя. Этот процесс, подобный взрыву, называется
детонацией; он сопровождается резким стуком в цилиндре,по-
явлением черного дыма на выхлопе машины. Все это приводит к
повышению расхода топлива, снижению мощности двигателя и
преждевременному его износу.
Склонность бензинов к детонации характеризуется октано-
вым числом. Чем выше октановое число бензина, тем меньше
склонность его к детонации, т. е. лучше качество. Октановое чис-
190
ло — величина условная. Изооктан (2,2,4-триметилпентан) проявля-
ет малую склонность к горению с детонацией, и для него принято
октановое число, равное 100; октановое число «-гептана, чрезвы-
чайно склонного к детонации, принято считать за 0. Октановое чис-
ло смеси изооктана с «-гептаном в зависимости от содержания в
ней (в %) изооктана будет изменяться от 0 до 100. Октановое чис-
ло смеси принимают равным содержанию в ней изооктана. Напри-
мер, если смесь состоит из 70% изооктана и 30% «-гептана, то ее
октановое число равно 70. Для определения октанового числа бен-
зина сравнивают в определенных условиях детонационные свойства
его и смесей изооктана с «-гептаном. Бензин будет иметь октано-
вое число, соответствующее содержанию изооктана в смеси, у кото-
рой одинаковые с ним детонационные свойства. Например, октано-
вое число автомобильных бензинов 78 означает, что он обладает
теми же детонационными свойствами, что и смесь, состоящая из
78% изооктана и 22% «-гептана.
Выпускают авиационные бензины с октановым числом 100 и
выше. Чем выше октановое число авиационного бензина, тем мень-
ше его потребуется при полете, и, следовательно, можно увеличить
полезную нагрузку самолета. Октановое число моторного топлива
повышается с увеличением содержания в нем изопарафинов и аро-
матических соединений.
Для повышения октанового числа моторного топлива применя-
ют смесь бензина с высокооктановыми компонентами — изоокта-
ном, изопентаном, этилбензолом и др. — или добавляют к бензину
антидетонаторы. В качестве антидетонатора применяют тетраэтил-
свинец Pb(C2Hs)4 в смеси с бромистым этилом и монохлорнафта-
лином (этиловая жидкость).
Тракторное топливо — обычно керосин; качество его ха-
рактеризуется теми же показателями, что и качество бензинов.
Дизельное топливо — керосин, газойль, соляровый ди-
стиллят; используется для поршневых двигателей внутреннего сго-
рания.
Котельное топливо — мазут и другие нефтяные остатки.
Топливо для реактивных двигателей представля-
ет собой фракцию керосина, используемую для воздушно-реактив-
ных двигателей.
К газообразным нефтяным топливам относятся
попутные газы и газы, получаемые при переработке нефти и нефте-
продуктов.
Смазочные масла разделяют на следующие группы в за-
висимости от области их применения: индустриальные — веретен-
ное, машинное и др.; для двигателей внутреннего сгорания — авто-
тракторное (автолы), авиационные масла и др.; трансмиссионные;
турбинные; компрессорные; для паровых машин — цилиндровые;
масла специального назначения. Качество масел характеризуется
смазывающей способностью, вязкостью, температурами застыва-
ния и вспышки, плотностью, содержанием воды, кислотностью, кок-
суемостью, зольностью, стабильностью.
191
§ 57. Переработка нефти
Переработка нефти — весьма сложный процесс, которому пред-
шествует специальная ее подготовка.
Подготовка нефти- Необходимость подготовки нефти к перера-
ботке объясняется следующими причинами. Фонтаны нефти, выхо-
дящие из скважины, увлекают за собой песок, глину, воду и дру-
гие вещества, встречающиеся на их пути. В нефти имеются раство-
ренные газы, вода, соли. Все это должно быть удалено из нефти,
так как их присутствие приводит к нарушению технологических
процессов переработки нефти.
Подготовка нефти к переработке начинается на нефтяных про-
мыслах. Нефть из скважин поступает по трубам в ловушки (тра-
пы), в которых происходит отделение растворенных газов (попут-
ных газов), и затем попадает в отстойники. На дне отстойников
оседают песок и другие твердые примеси, а также скапливается
вода, так как она тяжелее нефти. Из отстойников нефть поступает
в резервуары, из которых по трубопроводам или в цистернах ее до-
ставляют на нефтеперерабатывающие заводы.
На заводах производится окончательное обезвоживание нефти,
удаление из нее растворенных солей, механических примесей, и
лишь после этого нефть поступает на переработку.
Методы переработки нефти и основные аппараты. Методы пере-
работки нефтц можно разделить на две группы: физические и хи-
мические.
Физические методы переработки нефти основаны на ис-
пользовании различий в физических свойствах веществ, входящих
в состав нефти. Например, одни из них затвердевают или кристал-
лизуются при более высоких, другие при более низких температу-
рах, одни растворяются в каких-либо растворителях лучше, чем
другие, и т. д. Если нагревать нефть, то по мере повышения темпе-
ратуры из нее будут испаряться различные продукты. Сначала из
нефти будут улетучиваться те продукты, которые закипают и ис-
паряются при более низких температурах, чем те, которые кипят
при более высоких температурах. Такой процесс называется пе-
регонкой нефти, и среди физических методов он получил наи-
большее распространение. Химические реакции при физических
методах переработки нефти не протекают.
Химические методы переработки основаны на том, что
под влиянием температуры, давления, катализаторов углеводоро-
ды, содержащиеся в нефти и нефтепродуктах, претерпевают глу-
бочайшие химические превращения. В этих процессах протекает
множество химических реакций, в результате которых образуются
новые соединения, новые продукты.
Таким образом, природа физических и химических процессов
принципиально разная, однако в практическом их осуществлении
есть сходство: эти процессы складываются из двух основных опера-
ций — нагревания перерабатываемого сырья до высокой тем-
пературы и разделения получающихся продуктов.
192
В некоторых случаях при химических процессах помимо нагре-
вания сырья необходимо соприкосновение его с катализатора-
ми. Нагревание нефти и нефтепродуктов проводится в трубчатых
печах.
Трубчатка я печь (рис. 66) состоит из металлического кар-
каса, укрепленного на фундаменте. Стенки печи выложены из ог-
неупорного кирпича. Внутри печи в двух камерах укреплены трубы,
соединенные последовательно. По этим трубам быстро движется
. Рис. 66. Трубчатая печь:
/ — форсунка. 2, 3 — радиантные трубы; 4 — конвективная камера
нагреваемая нефть или нефтепродукт. В трубчатых печах для обо-
грева используется жидкое или газообразное топливо. Для сжига-
ния жидкого топлива в печи установлена форсунка 1. Образующие-
ся при сжигании топлива дымовые газы, путь следования которых
на рисунке изображен стрелками, омывают трубы, отдают им теп-
ло и уходят в дымовую трубу. Перерабатываемые продукты посту-
пают в трубки, находящиеся в конвективной камере 4, затем прохо-
дят по подовым радиантным трубам 3 левой камеры печи, пото-
лочным радиантным трубам 2 и после подовых радиантных труб 3
правой камеры, имея высокую температуру, выводятся из печи.
Длина трубок достигает в общей сложности около 1 км, и при
движении по ним нефть нагревается при перегонке примерно до
320—350°С, а при химических методах переработки — и до более
высокой температуры. При высокой температуре большая часть
нефти превращается в пар. Пары и неиспарившаяся часть нефти
для выделения из них отдельных продуктов поступают в ректифи-
кационные колонны.
Ректификационная колонна для разделения нефте-
продуктов представляет собой стальной цилиндр высотой до 40 м и
х/а 7-275 193
диаметром до 3,5—4 м. Внутри колонны установлено несколько де-
сятков горизонтальных полок, или тарелок. Одна из конструкций
тарелок ректификационной колонны изображена на рис. 67. На этой
тарелке в центре колонны имеется направленная вверх трубка
(патрубок) 1, закрытая сверху колпаком 3 с зазубринами. Через
патрубки и колпаки проходят пары нефти, поднимающиеся в ко-
лонне снизу вверх. Сверху колонна орошается холодной жидко-
стью, например бензином, и через имеющиеся на тарелке перелив-
ные трубы (сливные стака-
ны) 2 жидкость перетекает с
тарелки на тарелку. Благо-
даря тому что сливные ста-
каны возвышаются над уров-
нем тарелки, на ней всегда
есть слой жидкости, через
который пробулькивают
(барботируют) поднимаю-
щиеся вверх пары. Имеются
и другие конструкции ректи-
фикационных колонн, одна-
ко принцип их действия не
отличается от изображенно-
го на рис. 67.
Смесь паров и жидкость,
выходящая из трубчатой пе-
чи, поступают в нижнюю
часть колонны. Пары подни-
маются вверх и, так как тем-
пература по высоте колонны
Жидкость
Рис. 67. Тарелки ректификационной
колонны:
/ — патрубки, 2— переливные трубы, 3 —
барботажные колпаки
понижается, двигаясь с тарелки на тарелку, постепенно конденси-
руются, отдавая свое тепло стекающей жидкости. За счет этого теп-
ла из жидкости испаряются наиболее легкокипящие продукты. Та-
ким образом, жидкость, стекающая с тарелки на тарелку, обогаща-
ется более высоко кипящими продуктами, а пары, наоборот, — лег-
кокипящпми.
Перегонка нефти. Как уже отмечалось, перегонка — один из
распространенных методов переработки нефти. Процесс перегонки
нефти схематически изображен на рис. 68. Нефть, подаваемая в
трубчатую печь 1, сначала проходит через теплообменники 3, в
которых она подогревается до 180°С выходящими из ректификаци-
онной колонны 2 бензином и мазутом. В трубчатой печи происхо-
дит дальнейший нагрев нефти до 320—350°С, и при этом образуется
смесь паров и жидкости, которая подается в ректификационную ко-
лонну 2. Снизу в колонну вводится пар, и в ней происходит разде-
ление нефти на фракции, или дистилляты, которые отбираются по
высоте колонны.
Сверху из колонны выводятся пары бензина, которые сначала
охлаждаются нефтью в- теплообменнике 3, а затем водой в холо-
дильнике 4. При охлаждении пары бензина конденсируются, пре-
194
вращаются в жидкий бензин, который частично идет в хранилище,
а частично подается на орошение колонны. Выход бензина при
перегонке нефти составляет от 3 до 15% веса перерабатываемой
нефти. Остальные продукты перегонки нефти — лигроин, керосин,
соляровое масло — выводятся из колонны, охлаждаются в холо-
дильниках (на рисунке не показаны) и перекачиваются в хранили-
ща. Снизу колонны отбирается самый тяжелый продукт — мазут,
тепло которого используется в теплообменнике 3 для нагрева нефти.
Мазут — это не конечный продукт перегонки нефти. На уста-
новке, совершенно аналогичной изображенной на рис. 68, но рабо-
Вода
у1* Бензин
Нефть
Бензин
СоляроВое масло
Мазут
Нефть
Бензин на орошение
Лигроин
Керосин
Рис. 68. Схема перегонки нефти:
/ — трубчатая печь, 2— ректификационная колонна, 3 — теплообмен-
ники, 4 — холодильник
тающей под разрежением, можно проводить разгонку мазута на
фракции, получая смазочные масла, необходимые для смазки тру-
щихся частей машин и механизмов. Остаток после разгонки мазу-
та называется гудроном; его используют, например, в дорожном
строительстве.
Мазут часто называют котельным топливом, потому что его
сжигают в топках паровых котлов и различных печей. Однако-это
не единственное его применение. Как уже говорилось, мазут ис-
пользуется для получения смазочных масел; кроме того, при хими-
ческой переработке из мазута получают бензин, а также газооб-
разные углеводороды, служащие сырьем химического синтеза.
Крекинг нефти и нефтепродуктов. Слово «крекинг» произошло
от английского глагола «to crack», что означает раскалывать, рас-
щеплять. Крекинг нефти и нефтепродуктов относится к химическим
методам переработки.
В 1876 г. Д. И. Менделеев обнаружил, что при перегонке нефти
помимо обычных фракций — бензиновой, лигроиновой и т. д., по-
лучаются другие жидкие, а также газообразные продукты, что мог-
’/.7*
195
ло быть результатом протекавших при высоких температурах хи-
мических реакций. Этот факт заинтересовал ученого, и он написал:
«Должно разработать сведения о действии жара на тяжелые мас-
ла нефти». Таким образом, Д. И. Менделеев впервые поставил за-
дачу исследования химических процессов, протекающих при воз-
действии высокой температуры на нефть и продукты ее перера-
ботки.
Почти одновременно с Д. И. Менделеевым талантливый рус-
ский химик-технолог А. А. Летний установил, что при температуре
выше 300°С остатки после перегонки нефти частично разлагаются
с образованием бензина, керосина и газообразных углеводородов,
а при температурах выше 500°С ему удалось получить из нефти
бензол, толуол, ксилол. Эти процессы были результатом химических
реакций расщепления, или крекирования, углеводородов, содержа-
щихся в продуктах, исследованных А. А. Летним.
В 1891 г. русский инженер В. Г. Шухов предложил схему и кон-
структивное оформление промышленной установки крекинг-процес-
са. Выдающееся изобретение В. Г. Шухова, как и многие другие
русские изобретения, не было реализовано в царской России. Про-
мышленное оформление крекинга началось лишь в США в 1920 г.,
а затем и у нас в стране. В 1931 г. в Баку сооружена крекинг-уста-
новка системы Шухова-Капелюшникова, вслед за ней развертыва-
ется строительство и создаются многочисленные установки по хи-
мической переработке нефти.
Крекинг по сравнению с перегонкой обладает рядом преиму-
ществ. Так, выход бензина при крекинге составляет 40—50 и даже
70% от веса сырья, в то время как при перегонке нефти—лишь 3—
15%. С другой стороны, при крекинге наряду с бензином получа-
ются газообразные углеводороды, служащие сырьем химической
промышленности. Некоторые процессы крекинга дают возможность
получать для химической промышленности не только газообразное
сырье, но и жидкие ароматические углеводороды — бензол, ксилол
и др. «Гибкость» процессов крекинга, т. е. возможность получения
больших количеств бензина и других химическйх продуктов, сдела-
ли в течение короткого времени крекинг одним из основных мето-
дов переработки нефти и нефтепродуктов.
Сырьем для крекинга служат обычно не только нефть, но и
фракции, получаемые при перегонке нефти.
Бензин и другие продукты получаются в результате превраще-
ний, которые претерпевают углеводороды, содержащиеся в исход-
ном сырье. Эти превращения заключаются в том, что при высоких
температурах происходит расщепление (крекинг) углеводородов с
высокой молекулярной массой, в результате чего образуются угле-
водороды с меньшей молекулярной массой, которые и входят в со-
став получаемых бензина и газов. Хотя крекинг — процесс весьма
сложный, все же можно установить некоторые закономерности в
поведении отдельных групп углеводородов при высоких темпера-
турах.
Парафиновые (предельные) углеводороды
196
(CnH2n+2) могут подвергаться реакциям разрыва цепей. В общем
виде это можно изобразить реакцией
Cn H2n+2 Ст Н2т+2 + Ст Н2т — Q (XIII, 1)
предельный предельный непредельный
углеводород углеводород углеводород
Например:
С8Н18 С4Н10 + С4Н8 — Q (XI11,1 а)
октан бутан бутилен
Помимо разрыва цепей может происходить дегидрирование (от-
щепление водорода) парафиновых углеводородов, что в общем ви-
де представлено реакцией
C„H2n+2 =₽* ст Н2т н- Н2 — Q (XIII,2)
предельный непредельный
углеводород углеводород
Например:
С4Н10 С4Н8 + Н2-Q (XIII,2а)
Как видно из уравнений (XIII, 1) и (XIII, 1а), при расщеплении
предельных углеводородов образуется один предельный углеводо-
род, более легкий, чем исходный, и один непредельный. По уравне-
ниям (XIII, 2) и (XIII, 2а) образуются водород и непредельный
углеводород.
Нафтеновые углеводороды (СпН2п) дегидрируются с
образованием ароматических углеводородов, например при дегид-
рировании циклогексана получается бензол:
сн
СН2
Н2С СН2
у \
НС сн
I I ~Q
НС сн
(XIII,3)
циклогексан
бензол
Ароматические углеводороды могут расщепляться с
отрывом боковой цепи. При этом образуются простые ароматичес-
кие и непредельные углеводороды, например из этилбензола полу-
чаются бензол и этилен:
С—СН2СН,
А **
HCz/ сн
НС сн
\ /
сн
этилбензол
сн
сн
+ c2h4-q
(XIII,4)
бензол этилен
8—275
197
Непредельные углеводороды (СпНгп), получающиеся
при крекинге, вступают в реакции друг с другом и исходными про-
дуктами. При этом образуются ароматические и другие сложные
углеводороды.
Реакции (XIII,1) (XIII,2), (XIII,3) и (XIII,4) — обратимые эн-
дотермические, поэтому исходя из принципа Ле-Шателье для сдви-
га равновесия в сторону образования продуктов более легких, чем
исходные, необходимы высокие температуры. Следовательно, повы-
шение температуры снижает прочность углеводородов. При нагре-
вании в первую очередь расщепляются углеводороды с длинными
цепями. Повышение температуры приводит к сдвигу места разрыва
цепи от середины к краю, т. е. происходит увеличение выхода газо-
образных продуктов.
Скорость превращения отдельных групп углеводоров различ-
ная: разложение парафиновых углеводородов происходит с наи-
большей скоростью, затем следуют нафтеновые и наименьшая ско-
рость расщепления у ароматических углеводородов. Поэтому при
нагревании в первую очередь крекируются парафиновые углеводоро-
ды, затем нафтеновые и в последнюю очередь ароматические, что
приводит к накоплению их в продуктах крекинга.
Реакции (XIII, 1), (XIII, 2), (XIII, 3) и (XIII, 4) протекают с
увеличением объема. Следовательно, повышение давления сдвигает
равновесие этих реакций справа налево и в результате образуются
тяжелые углеводороды.
Крекинг, протекающий только под влиянием высокой температу-
ры, называется термическим крекингом; если же наряду с
высокой температурой используются катализаторы, крекинг назы-
вают каталитическим. Сырьем крекинга обычно служат фрак-
ции перегонки нефти — от лигроина до мазута включительно.
Термический крекинг. Термический крекинг осуществляется на
установках хотя и более сложных, чем трубчатые установки для
перегонки нефти, но все же сходных с ними: нагрев перерабатывае-
мого сырья производится в трубчатых печах, а разделение полу-
ченных продуктов — в ректификационных колоннах. Однако усло-
вия крекинга отличаются от условий перегонки нефти. Термический
крекинг большей частью проводится при температуре 470—540°С и
давлении до 40—60 кгс/см2. При этих условиях реакции расщепле-
ния происходят в жидкой и паровой фазах. Такой крекинг называ-
ется жидкофазным. Если крекинг осуществляется при темпера-
туре 550сС и давлении около 2—5 кгс/см2, реакции протекают в па-
ровой фазе. Такой процесс называется парофазным.
Выход бензина составляет 30—35%, газов — 10—15%, крекинг-
остатка, используемого в качестве котельного топлива,— 50—55%
от веса сырья. Бензины термического крекинга имеют октановые
числа более высокие, чем некоторые бензины перегонки нефти,—
60—70 единиц, но они менее стабильны, чем бензины перегонки неф-
ти, т. е. качество их в процессе хранения ухудшается.
Один из процессов термического крекинга — так называемый
пиролиз — проводится при температуре 670—720°С и атмосфер-
198
ном давлении. В результате пиролиза бензины не получаются, а
производятся большие количества газов и смола, содержащая бен-
зол, толуол, ксилол и другое сырье для химического синтеза.
Каталитический крекинг. Этот вид крекинга получил большое
распространение. Обычно он проводится при температуре 450—
500°С и атмосферном давлении в присутствии катализаторов. Наи-
более эффективными оказались алюмосиликатные катализаторы —
твердые, пористые тела, состоящие в основном из окиси алюминия
AI2O3. На этих катализаторах выход бензина достигает 70% от ве-
са крекируемого сырья. Бензины каталитического крекинга имеют
высокие октановые числа — 78—82 единицы и не изменяют своих
свойств при хранении. Наряду с бензином при каталитическом кре-
кинге получаются газы, содержащие углеводороды, выход их сос-
тавляет 12—15% от веса сырья.
Таким образом, каталитический крекинг дает возможность по-
лучения больших количеств бензинов хорошего качества и наряду
с ними значительных количеств газов. Однако каталитический кре-
кинг имеет существенный недостаток — катализатор очень быстро
выходит из строя, или, как говорят, теряет активность. Потеря ка-
тализатором активности объясняется тем, что в процессе крекинга
на его поверхности откладывается кокс. Чтобы вернуть катализато-
ру активность, нужно удалить кокс с его поверхности. Этот процесс,
называемый регенерацией катализатора, заключается в
том, что кокс выжигают при пропускании воздуха через катализа-
тор при температуре 550—600°С. Следовательно, процесс каталити-
ческого крекинга включает чередование рабочего процесса, когда
через катализатор проходит крекируемое сырье, и процесса регене-
рации катализатора — продувки воздухом.
Каталитический крекинг обычно реализуется в контактных ап-
паратах непрерывного действия, состоящих из двух частей — реак-
тора и регенератора. В реакторе происходит расщепление углево-
дородов на катализаторе, что приводит к падению его активности.
В регенераторе при продувке воздухом активность катализатора
восстанавливается. Катализатор непрерывно циркулирует между
реактором и регенератором.
Крекинг в «кипящем» слое катализатора, получив-
ший наибольшее распространение, представлен на схеме, на которой
реактор и регенератор конструктивно объединены в одном аппара-
те (рис. 69). В верхней части расположен реактор 6, а в нижней —
регенератор 9, соединенные между собой катализаторопроводами 3
и 4. Сырье, выходящее из трубчатой печи, засасывает регенериро-
ванный катализатор из цилиндрического колодца 2 и по трубе пос-
тупает на решетку 7 реактора. Продукты крекинга освобождаются
от частиц катализатора в циклоне 5 и идут на разделение. Отрабо-
танный катализатор по трубе 4 опускается в регенератор, в котором
под решетку 1 для выжигания кокса вдувается воздух. Дымовые
газы, образовавшиеся в результате горения, после очистки в цикло-
нах 8 выводятся из аппарата в паровой котел, а регенерированный
катализатор вновь возвращается в реактор.
8*
199
Крекинг с движущимся к а т а л из а то р о м также пре-
дусматривает циркуляцию катализатора между реактором и реге-
нератором. Сырье, нагретое в трубчатой печи 1 (рис. 70), подается
в реактор 3, куда сверху из бункера 4 поступает регенерированный
катализатор. Продукты, полученные при крекинге, выводятся из
реактора сверху и идут на разделение. Отработанный катализатор
выводится из контактного аппарата
снизу и попадает в регенератор 2, где
с поверхности катализатора выжигает-
ся кокс; продукты горения уходят из
регенератора. Регенерированный ката-
лизатор подается из нижней части ре-
генератора через пневмоподъемник 5
Рис. 69. Контактный аппарат с
«кипящим» слоем катализатора:
1, 7 — решетки, 2 — цилиндричес-
кий колодец, 3, 4 — катализаторо-
проводы, 5, 5 —циклоны, б — реак-
тор, 9 — регенератор
Сырье
Рнс. 70. Контактный аппарат с
движущимся катализатором:
1 — трубчатая печь, 2 — регенера-
тор, 3 — реактор, 4 —бункер, 5 —
пневмоподъемник
при помощи сжатого воздуха, нагнетаемого воздуходувкой, в бун-
кер 4.
Риформинг. Риформингом называется один из видов крекинга,
отличающийся от обычного крекинга используемым сырьем. При
риформинге в качестве сырья используют низкооктановые бензины,
или лигроины, из которых получают либо высокооктановые бензины,
либо сырье для химической промышленности. Этот процесс дает
возможность, с одной стороны, увеличить октановое число бензинов
200
перегонки нефти, термического и каталитического крекинга, с дру-
гой — получить сырье для химической промышленности. ч
Наибольшее распространение получили процессы каталитичес-
кого риформинга, например платформинг. В этом процессе ка-
тализатором служит платина, нанесенная на поверхность окиси
алюминия. Если платформинг проводится при температуре 480—
510°С и давлении от 15 до 30 кгс/см2, то в результате получают
сырье — бензол, толуол, ксилол. Если же подобный процесс ведется
при давлении около 50 кгс/см2, то производятся высокооктановые
бензины, имеющие октановое число без этиловой жидкости около
98, а с добавкой этиловой жидкости — выше 100 единиц.
При каталитическом риформинге наряду с жидкими продуктами
получают газы, используемые для синтеза аммиака, метилового
спирта и других соединений. Выход газов при каталитическом ри-
форминге— до 15% от веса сырья.
§ 58. Очистка нефтепродуктов
Очистка — завершающая стадия производства моторных топлив
и смазочных масел. Она необходима потому, что получаемые при
перегонке и крекинге продукты содержат непредельные, реакцион-
носпособные углеводороды, сернистые и азотистые соединения, ко-
торые вызывают нестабильность их свойств, появление темного
цвета, неприятного запаха, нагара в цилиндрах двигателей и т. д.
Существуют химические и физико-химические методы очистки неф-
тепродуктов.
К химическим методам принадлежит очистка серной кислотой
и обработка водородом — гидроочистка, к физико-химическим ме-
тодам — адсорбционные и абсорбционные способы очистки.
Сернокислотная очистка заключается в смешении про-
дукта с небольшим количеством 90—93% ной серной кислоты при
обычной температуре. В результате химических реакций получает-
ся очищенный продукт и так называемый кислый гудрон, в который
и переходят нежелательные примеси. Кислый гудрон — отход про-
изводства— может быть использован для получения серной кисло-
ты. Сернокислотная очистка — громоздкий процесс, связанный с
образованием отходов, требующий большого количества реаген-
тов, и г. д.
В последнее время получил распространение метод гидри-
рования, или гидроочистка. В присутствии алюмо-кобальто-
молибденового катализатора при температуре 380—420°С, давлении
от 35 до 40 кгс/см2 водород взаимодействует с сернистыми, азотис-
тыми и кислородсодержащими соединениями, образуя легко устра-
няемые сероводород, аммиак и воду. Одновременно происходит гид-
рирование ненасыщенных соединений, что повышает стабильность
продукта. Гидроочистка позволяет использовать высокосернистые
нефти для получения нефтепродуктов.
Адсорбционный метод очистки основан на адсорбции
(поглощении твердым веществом) вредных примесей, содержащихся
201
в нефтепродуктах. В качестве адсорбента (твердого поглотителя)
используют главным образом природные глины. Глины вводят в
нефтепродукт, взмучивают, а затем отделяют от нефтепродукта ли-
бо фильтруют нефтепродукты через глины.
Абсорбционные методы очистки заключаются в изби-
рательной (селективной) способности некоторых жидкостей раство-
рять вредные вещества, содержащиеся в нефтепродуктах. Для этой
цели применяют нитробензол, фурфурол, жидкий сернистый ангид-
рид, дихлорэтиловый эфир и др. Получают очищенный продукт вы-
сокого качества.
§ 59. Переработка газов
Советский Союз располагает неисчислимыми запасами горючих
естественных газов. В одних случаях это газы, находящиеся в тол-
ще осадочных пород,— природные газы, в других — раство-
ренные в нефти газы, вместе с нею выходящие на поверхность,—
попутные газы.
Помимо природных и попутных газов в больших количествах
вырабатываются газы на нефтеперерабатывающих и коксохимичес-
ких заводах, газогенераторных станциях и т. д. Газы — не только
самое дешевое и удобное топливо, но в то же время ценное сырье
для химической промышленности. В природных и попутных газах
содержатся углеводороды — метан СН4, этан СгН6, пропан СзН8,
бутан С4Н10, а в газах нефтепереработки и коксовом — кроме того,
этилен С2Н4, пропилен С3Н6, бутилены С4Н8. В генераторных газах
находятся окись углерода и водород. Вещества, содержащиеся в
этих газах, являются сырьем для получения удобрений, пластичес-
ких масс, химических волокон, синтетических каучуков, раствори-
телей, моющих средств и т. д. Чтобы получать эти продукты, газы
необходимо переработать. Методы переработки газов можно раз-
бить на три группы:
1) прямое использование веществ, входящих в состав газов, при-
соединением к ним кислорода (окисление), хлора (хлорирование),
воды (гидратация), водорода (гидрирование), отнятием водорода
(дегидрирование), присоединением к молекулам групп СН3, С2Н5
и др. (алкилирование), изменением структуры молекул (изомери-
зация), соединением многих простых молекул в сложные (полиме-
ризация) и т. д.;
2) крекинг углеводородов, входящих в состав газов, для полу-
чения непредельных углеводородов (олефинов);
3) конверсия — взаимодействие с водяным паром для получения
окиси углерода и водорода.
В результате этих процессов из газов можно получать самые раз-
нообразные продукты. Следует отметить большой экономический
эффект использования газов. Например, для получения 1 т этило-
вого спирта из 9,6 т картофеля понадобится затратить 200 чел-ч, а
из 0.8 т этилена — всего 10 чел-ч.
Газовое сырье имеет большое значение для химической промыш-
202
ленности. Его использование привело к созданию новых технологи-
ческих процессов, аппаратуры, схем, позволило удешевить стои-
мость ряда химических продуктов.
Контрольные вопросы
1. Назовите основные типы и состав нефтей.
2. Как устроены трубчатые печи?
3. Для чего служит ректификационная колонна, как она устроена?
4. Какие продукты получают при переработке нефти?
5. Что такое октановое число бензина?
6, Какой процесс называют перегонкой нефти? Начертите его схему.
7. Каковы преимущества химических методов переработки нефти и нефте-
продуктов по сравнению с перегонкой нефти?
8. Напишите основные реакции, протекающие при крекинге.
9. По рис. 69 и 70 объясните работу контактных аппаратов.
10. С какой целью и каким образом производят очистку нефтепродуктов?
Глава XIV
ТЕХНОЛОГИЯ ОСНОВНОГО ОРГАНИЧЕСКОГО СИНТЕЗА
§ 60. Продукты и сырье основного органического синтеза
Промышленность основного (тяжелого) органического синтеза
занимается производством важнейших органических веществ, кото-
рые являются исходными материалами (промежуточными продук-
тами) для получения более сложных органических соединений или
самостоятельно применяются в народном хозяйстве.
Продуктами основного органического синтеза служат относи-
тельно простые по строению органические вещества: углеводороды,
спирты (метиловый, этиловый), альдегиды и кетоны (формальде-
гид, уксусный альдегид, ацетон), хлорпроизводные (дихлорэтан,
хлористый винил), карбоновые кислоты (муравьиная, уксусная) и
их производные (сложные эфиры, уксусный ангидрид), диеновые
углеводороды и их производные (бутадиен, хлоропрен) и др.
Продукты основного органического синтеза применяются в про-
изводстве пластмасс и смол, синтетического каучука и химических
волокон, органических красителей и лакокрасочных материалов,
фармацевтических продуктов и фотоматериалов; их используют
для получения средств защиты растений, растворителей и моющих
веществ, смазочных материалов и флотореагентов, различных вспо-
могательных материалов для ряда отраслей народного хозяйства.
В начальный период развития промышленности органического
синтеза для получения органических соединений применяли глав-
ным образом растительное и животное сырье (древесину для полу-
чения уксусной кислоты, метилового спирта; сахаристые вещества
для производства этилового спирта и т. п.), а также продукты пере-
работки каменноугольной смолы (бензол, толуол и др.). Позднее в
качестве сырья стали применять карбид кальция СаСг (для полу-
чения ацетилена С2Н2) и генераторные газы, содержащие окись уг-
203
лерода — одно из важнейших исходных веществ органического
синтеза.
В настоящее время многочисленные продукты основного орга-
нического синтеза производят из углеводородных газов. Важней-
шим сырьем в современной промышленности основного органиче-
ского синтеза являются парафиновые углеводороды (метан и его
гомологи), олефины (этилен, пропилен, н-бутилен, изо-бутилен),
диолефины (дивинил, изопрен), ацетиленовые углеводороды (аце-
тилен), ароматические соединения (бензол, толуол, нафталин).
Неисчерпаемым источником углеводородов служат нефть, природ-
ные газы и продукты их переработки.
В производстве продуктов основного органического синтеза хи-
мические превращения во многих случаях проводятся в одну
стадию.
Множество реакций, используемых при синтезах, может быть
сведено к нескольким, наиболее часто встречающимся типам реак-
ций. Это окисление и восстановление, дегидрирование (отщепление
водорода) и гидрирование (присоединение водорода), гидратация
(присоединение воды), сульфирование (введение сульфогруппы —
SO3H), нитрование (введение нитрогруппы — NO2), полимеризация
(соединение одинаковых молекул в одну), изомеризация (измене-
ние строения молекул без изменения их состава). Ниже приводятся
примеры производственных процессов, основанные на определенной
типовой реакции.
§ 61. Дегидрирование углеводородов
При дегидрировании происходит разрыв связи между ато-
мами углерода и водорода в молекуле углеводорода и отщепление
водорода от молекулы органического соединения. Обычно этот
процесс проходит при высокой температуре. Но при такой темпера-
туре возможно размыкание связи между двумя атомами углерода,
т. е. расщепление углеводорода (крекинг). Чтобы провести преиму-
щественно дегидрирование углеводорода, а не его крекинг, применя-
ют ряд технологических приемов: повышают температуру, снижают
давление, подбирают определенное время пребывания реагентов в
реакторе, вводят селективные катализаторы. Катализаторы не мо-
гут полностью подавить реакции расщепления углеводородов, но
зато они во много раз повышают скорость реакции дегидрирова-
ния. Это позволяет провести процесс дегидрирования за столь ко-
роткое время, что реакция расщепления не успевает пройти.
Производство ацетилена крекингом метана. Ацетилен С2Н2 —
бесцветный газ со слабым своеобразным запахом представляет со-
бой ненасыщенное соединение с тройной связью: HCsCH. Он легко
вступает в самые различные химические реакции и образует много-
численные производные, являющиеся исходными веществами для
получения важных химических продуктов: синтетических каучуков,
смол, пластмасс и др. Так, из ацетилена получают ацетальдегид,
перерабатываемый в уксусную кислоту, этиловый спирт, бутадиен,
204
этилацетат, хлористый винил, винилацетат, хлоропрен и др. Ацети-
лен применяют для получения высокой температуры, необходимой
для резки и сварки металлов (автогенная сварка). При горении
ацетилена в смеси с кислородом можно получить пламя с температу-
рой до 3200°С.
Получают ацетилен обработкой при высокой температуре (до
1500°С) метановых углеводородов (метана, этана, а также смеси
углеводородов, находящихся в природном газе). При этом происхо-
дит дегидрирование предельных углеводородов и они превращаются
в ацетилен:
2СН4 > НС = СН + ЗН2 — Q
(XIV, I)
С2Нв----> НС= CH + 2Н2 — Q
(XIV,2)
Повышение температуры и понижение давления увеличивают вы-
ход ацетилена. Для создания высокой температуры часть метана
сжигают в печи (окисляют кислородом):
СН4 + 0,5 О2 СО + 2Н2 4- Q
(XIV,3)
За счет выделяющегося тепла в печи поддерживается высокая
температура (1400—1500°С). При этой температуре несгоревшая
часть метана разлагается с образованием ацетилена. Описанный
процесс называют термоокисли-
тельным пиролизом метана.
На рис. 71 приведена упрощенная
схема печи термоокислительного пиро-
лиза метана. Подогретые метан и кис-
лород вводят в верхнюю часть печи 1,
где они смешиваются. У нижнего края
футерованной части печи установлена
плита 2 из огнеупорного материала с
большим количеством отверстий. Ме-
та нокислородная смесь проходит через
отверстия, и под плитой происходит
превращение метана. Для получения
большого выхода ацетилена и предот-
вращения полного разложения метана
с выделением углерода газы должны
находиться в зоне высоких температур
очень малое время. Поэтому ниже пли-
ты 2 впрыскивается вода, которая при
соприкосновении с продуктами реак-
ции резко снижает их температуру.
Из-за неполного превращения мета-
на и протекания побочных реакций на
выходе из печи получают сложную га-
зовую смесь, состоящую из С2Н2, Н2,
СО, СОг, НгО и содержащую примерно
02
Горячая бода
и сажа
Рис. 71. Печь термоокислитель-
ного пиролиза метана:
1 — печь, 2 — плита
205
8—10% С2Н2. Для извлечения ацетилена из газов термоокислитель-
ного пиролиза применяют растворители избирательного действия
(растворяющие только ацетилен), например диметилформамид,
н-метилпирролидон-2 и др.
Производство бутадиена (дивинила). Бутадиен — улеводород с
двумя двойными связями: СН2=СН — СН = СН2 — одно из основ-
ных веществ для производства каучуков. Получить его можно де-
гидрированием бутана С4Ню по реакции
СН3—СН2—СН2—СН3 СН2=CH—СН=СН2 + 2Н2—Q (XIV,4)
Согласно принципу Ле-Шателье, увеличению равновесной степе-
ни превращения способствуют понижение давления и повышение
температуры. В промышленности процесс проводят под атмосфер-
ным давлением при температуре 550—575°С с применением алюмо-
хромового катализатора (в реакторах с «кипящим» слоем катали-
затора).
Бутадиен (дивинил) можно получать также при одновременном
дегидрировании и дегидратации этилового спирта C2HsOH (по спо-
собу академика С. В. Лебедева) в присутствии катализаторов —
окиси цинка и окиси алюминия:
400 — 450“С
2СН3—СН2—ОН--------> СН2=СН—СН=СН2 + Н2 + 2Н2О (XIV,5)
На рис. 72 и в табл. 22 приведена схема производства дивинила
из этилового спирта. Этиловый спирт испаряют в спиртоиспарителе
J и направляют в контактный аппарат — ретортную печь 4. Пары
спирта предварительно перегреваются в змеевике 2 и поступают в
реторту 3 — стальные трубы высотой 4—5 м, загруженные катали-
Рис. 72. Схема производства дивинила:
J — спиртоиспаритель, 2 —змеевик, 3 —-трубы, 4 — ретортная печь, 5 —холо-
дильник-конденсатор, 6 — сепаратор, 7 —- абсорбционная колонна, 8 — теплооб-
менник, 9 — ректификационная колонна
206
Процесс
Что происходит
В каких аппаратах
Таблица 22. Производство дививила
Нагрев и испарение
спирта
2СН,—СН2—ОН->
—сн2=сн—сн=
=СН2 + Н2 + 2Н2О
Охлаждение
Поглощение дивини-
ла раствором спирта
Нагревание раствора
дивинила раствором
спирта
Разделение дивини-
ла и спирта
спирт
207
затором. Реторты расположены у раскаленных стенок печи 4,
обогреваемых при сжигании топлива. Полученный в печн дивинил
выделяют из газовой смеси охлаждением и абсорбцией. Выходящую
из печи 4 газовую смесь охлаждают в холодильнике-конденсаторе 5
и после отделения в сепараторе 6 непрореагировавшего спирта на-
правляют в абсорбционную колонну 7, заполненную керамической
насадкой из колец. Для поглощения дивинила колонна орошается
охлажденным этиловым спиртом.
Полученный раствор бутадиена в этиловом спирте после подо-
грева в теплообменнике 8 поступает на ректификацию в тарельча-
тую колонну 9, где разделяется на бутадиен (верх колонны) и
спирт (низ колонны). Спирт, выходящий из нижней части колон-
ны 9, охлаждается в теплообменнике 8, отдавая свое тепло раство-
ру, поступающему на ректификацию, и вновь направляется на
орошение абсорбционной колонны 7 для улавливания дивинила.
Производство стирола (винилбензола или фенилэтилена). Сти-
рол
СН=СН2 —важный исходный продукт для получения кау-
чуков и пластических масс. Стирол получают при дегидрировании
этилбензола:
Рис. 73. Схема производства стирола:
t — контактный аппарат, 2 — перегреватель, 3 — испаритель, 4 — котел-
утилизатор, 6 — конденсатор, в — отстойник
208
Дегидрирование этилбензола в промышленности проводят при
560—600°С в присутствии катализатора (окислы железа, цинка,
магния и др.) в реакторах двух типов — трубчатых и шахтных. На
рис. 73 и в табл. 23 приведена схема получения стирола. Водяные
пары, полученные из воды в котле-утилизаторе 4, смешивают с
этилбензолом и пропускают через испаритель 3 и перегреватель 2,
где они нагреваются до температуры 530°С и поступают в реактор
(контактный аппарат) 1.
Тепло, необходимое для проведения эндотермической реакции
дегидрирования, подводится с перегретым водяным паром. Горячие
газы, выходящие из контактного аппарата /, проходят последова-
тельно перегреватель 2, испаритель 3 и котел-утилизатор 4, где от-
дают свое тепло реагентам, поступающим в реактор 1. Из котла-
утилизатора 4 охлажденные газы поступают в конденсатор 5, где
конденсируются вода и углеводороды, содержащие стирол. В от-
стойнике 6 конденсат, содержащий стирол, отделяется от воды.
Несконденсировавшиеся газы используются в качестве топлива.
Регенерацию катализатора проводят при продувке его воздухом.
§ 62. Процессы гидрирования
Многие производства основного органического синтеза основа-
ны на процессе гидрирования. Гидрирование — присоединение
водорода к углеродсодержащим веществам с выделением или без
выделения воды. Реакции гидрирования экзотермические, идут
только в присутствии катализаторов и часто при значительном дав-
лении водорода.
Из процессов гидрирования особенно большое значение имеет
взаимодействие окиси углерода с водородом. Окись углерода с во-
дородом может давать различные соединения: метиловый спирт,
муравьиный альдегид, углеводороды и другие в зависимости от ус-
ловий проведения процесса. При гидрировании окиси углерода ши-
роко применяют катализаторы, обладающие избирательными свой-
ствами, т. е. ускоряющие одну из возможных реакций между окисью
углерода и водородом. В качестве катализаторов используют метал-
лы: железо, никель, кобальт, медь и окислы магния, алюминия, то-
рия и др. Подбирая определенные катализаторы, температуру,
давление, объемное соотношение между окисью углерода и водоро-
дом, можно направить реакций по желательному пути и получить
тот или иной продукт.
Синтез метилового спирта (метанола). Метиловый спирт СНзОН
представляет собой бесцветную прозрачную ядовитую жидкость со
слабым запахом, смешивающуюся с водой в любых соотношениях.
Температура кипения метилового спирта 64,7°С, плавления — 95°С,
плотность 0,796 г/см3. Раньше метиловый спирт получали только
путем сухой перегонки древесины (древесный спирт). С развитием
химической технологии (главным образом органической) потреб-
ление метилового спирта сильно возросло. Его применяют в качест-
ве растворителя, добавки к моторному топливу и как сырье для
209
Таблица 23. Производство стирола
210
получения химических продуктов — формальдегида и метилового
эфира, акриловой кислоты, необходимых для производства пласти-
ческих масс, антидетонационных смесей, лаков, красителей.
В настоящее время основное количество метилового спирта про-
изводят методом синтеза из окиси углерода и водорода. Производ-
ство синтетического метилового спирта относится к крупнотоннаж-
ным (производящим большое количество продукта) производствам
основного органического синтеза. Основная реакция в синтезе
метилового спирта:
СО + 2Н2 СН3ОН + Q (XIV,7)
Наряду с этой основной реакцией может протекать ряд побоч-
ных.
Чтобы повысить выход целевого продукта (метанола), применя-
ют цинк-хромовый катализатор селективного действия. Такой ка-
тализатор значительно повышает скорость протекания основной
реакции (XVI, 7) и не ускоряет или ускоряет в небольшой степени
побочные реакции. Поэтому протекание побочных реакций подав-
ляется.
Реакция получения метанола обратимая, экзотермическая, идет
в сторону образования метилового спирта с большим уменьшением
объема. Следовательно, равновесие реакции будет смещаться в
сторону образования метилового спирта при повышении давления и
при понижении температуры. Вместе с тем при обычных темпера-
турах синтез метанола протекает крайне медленно. Поэтому для его
ускорения процесс проводят при высоких температурах (около
400°С).
Для смещения равновесия в сторону образования метанола про-
цесс проводят с избытком водорода против стехиометрического (при
соотношении СО : Нг, равном 1 : 4) и при давлении около 250 кгс/см2.
Синтез метанола осуществляют при высоких объемных скоростях
газа (10000—35000 м3/м3-ч), что позволяет повысить интенсивность
катализатора.
Применение довольно высокой температуры (400°С), необходи-
мой для обеспечения большой скорости процесса, неблагоприятно
сказывается на положении равновесия реакции. Поэтому концент-
рация метилового спирта в газах на выходе из контактного аппара-
та за один проход газовой смеси через слой катализатора состав-
ляет лишь 5—20%. Непрореагировавшие газы после отделения ме-
тилового спирта возвращаются в процесс, г. е. для синтеза метанола
применяется циклическая схема производства.
Из приведенных физико-химических условий синтеза метило-
вого спирта видно, что производство этого продукта имеет большое
сходство с синтезом аммиака. Это сходство видно также и при со-
поставлении технологических схем получения этих продуктов.
На рис. 74 и в табл. 24 показана схема синтеза метилового спир-<
та из окиси углерода и водорода. Очищенный от примесей синтез-
газ в компрессоре 1 сжимается до 250 кгс/см2 и поступает в смеси-
тель 2, где смешивается с циркулирующим газом, подаваемым ком-
211
этилацетата, взрывчатых веществ, синтетического волокна и других
продуктов органического синтеза.
Раньше этиловый спирт получали только биохимическим спосо-
бом— путем сбраживания при помощи микроорганизмов различ-
ных сахаристых веществ, содержащихся в пищевом сырье — карто-
феле и зерне. При этом приходилось расходовать значительные
количества ценных пищевых продуктов. Большое народнохозяйст-
венное значение приобрели способы получения этилового спирта из
непищевого сырья и особенно производство синтетического этило-
вого спирта гидратацией этилена.
Присоединение воды к этилену осуществляется двумя метода-
ми — прямым и косвенным.
Косвенная гидратация проводится в две стадии с учас-
тием серной кислоты и образованием промежуточных продуктов.
Прямая гидратация этилена — более совершенный про-
цесс, при котором происходит непосредственное присоединение во-
ды к этилену в присутствии катализатора. Гидратация проводится
в паровой и жидкой фазах по реакции
СН2=СН2 + Н2О СН3—СН2—ОН + Q (XIV,8)
Согласно принципу Ле-Шателье, выход спирта увеличивается
при понижении температуры и повышении давления. Однако для
увеличения скорости реакции ее проводят при температуре 280—
300°С. Процесс ведут под давлением 70 кгс/см2 в присутствии ката-
лизатора. В парофазном процессе применяют в качестве катализа-
тора фосфорную кислоту, нанесенную на силикагель или синтети-
ческий алюмосиликат.
На рис. 75 и в табл. 25 показана принципиальная схема произ-
водства этилового спирта каталитической гидратацией этилена в
паровой фазе. Этилен, сжатый компрессором до 70—80 кгс/см2,
Рис. 75. Принципиальная схема производства эти-
лового спирта:
1 — теплообменник, 2 — трубчатая печь, 3 — контакт*
ныд аппарат. 4 — сборник
214
Таблица 25. Производство этилового спирта
Процессы
Что происходит
В каких аппаратах
Сжатие этиле-
на
Нагрев парога-
зовой смеси
СН,=СН2+Н2О^
^СН3—СН2—ОН
Разделение
спирта и цирку-
ляционного газа
215
вместе с водой или перегретым паром высокого давления (70 кгс/см2)
подают в трубчатый теплообменник 1, где эта смесь подогревается
горячими газами, выходящими из реактора — контактного аппара-
та 3. Подогретая смесь проходит трубчатую печь 2, на выходе из
которой температура достигает 280°С, и с этой температурой посту-
пает в загруженный катализатором контактный аппарат 3, где про-
исходит реакция гидратации этилена. Из контактного аппарата 3
горячая паро-газовая смесь, содержащая этиловый спирт, попадает
в теплообменник 1. Сконденсировавшиеся пары воды и этилового
спирта отделяются в сборнике 4. Полученный водный раствор эти-
лового спирта-сырца (содержащего 15—16% С2Н5ОН) направляют
из сборника 4 на ректификацию.
Газы, оставшиеся после отделения в сборнике 4 спирта-сырца,
содержат большое количество этилена, так как условия проведения
процесса гидратации не позволяют получить за один проход паро-
газовой смеси через контактный аппарат степень превращения бо-
лее 4—5%. Поэтому прямую гидратацию этилена проводят по цик-
лической (циркуляционной) схеме. Непрореагировавшие газы —
этилен и примеси (циркуляционный газ) возвращают циркуляцион-
ным насосом обратно в процесс, добавляя их к свежей исходной
смеси, поступающей на реакцию. Применение циркуляционной схе-
мы позволяет повысить степень превращения этилена в этиловый
спирт до 95%.
§ 64. Процессы окисления
Метод окисления углеводородов и других органических соедине-
ний получил значительное распространение в современном промыш-
ленном органическом синтезе. Этим методом получают спирты, фе-
нолы, альдегиды, кетоны, органические кислоты и другие соедине-
ния. Окисление проводится большей частью воздухом, в некоторых
случаях кислородом, озоном, водяным паром в присутствии катали-
заторов — металлов, их окислов и солей.
Производство уксусной кислоты. Уксусная кислота СН3СООН —
одна из самых важных органических кислот. Ее роль в развитии
многих отраслей народного хозяйства огромна. Она применяется
в текстильной промышленности при крашении тканей, для получе-
ния красок, приготовления сложных эфиров, консервирования и
приготовления эссенций в пищевой и кондитерской промышленнос-
ти, в производстве ацетилцеллюлозы, ацетатного шелка, раствори-
телей, пластических масс, лаков, уксусного ангидрида, ацетона, кау«
чука и т. д.
Безводная уксусная кислота застывает в виде бесцветных крис-
таллов при 16,6°С, температура ее кипения 118,1°С, плотность при
20°С 1,049 г/см3. Она смешивается с водой и многими органическими
жидкостями.
С древнейших времен уксусную кислоту получали в небольших
количествах в виде разбавленного водного раствора (уксуса) путем
брожения содержащих этиловый спирт жидкостей (вина, пива и
216
т. д.) в присутствии особых бактерий, называемых уксусными.
В значительных количествах получается уксусная кислота при су-
хой перегонке дерева.
Однако рост потребности в уксусной кислоте, вызванный разви-
тием производства ацетатного волокна и лаков, многих производств
тонкого органического синтеза и т. п., вызвал необходимость про-
изводства синтетической уксусной кислоты.
В настоящее время важнейшим способом получения уксусной
кислоты является окисление уксусного альдегида (ацетальдегида).
Процесс окисления протекает при действии кислорода в две стадии:
сначала ацетальдегид окисляется с образованием нестойкого про-
межуточного продукта —надуксусной кислоты:
° /О
CH3-(Z + О2 —CH3-(Z +Q (XIV,9)
\Н \О —ОН
надуксусная кислота
Надуксусная кислота, будучи сильным окислителем, вступает во
взаимодействие с ацетальдегидом и превращает его в уксусную
кислоту:
О О ,0
СН3—СН3—Сл -----------------> 2СН3—+Q (XIV, 10)
\о—ОН \н \он
Обе реакции протекают с выделением тепла. Во избежание на-
копления надуксусной кислоты, обладающей способностью разла-
гаться со взрывом на атомарный кислород и уксусную кислоту,
необходимо вести процесс так, чтобы надуксусная кислота не на-
капливалась в реакционной смеси, а возможно быстрее превраща-
лась в уксусную. С этой целью процесс окисления обычно ведут,
применяя не чистый ацетальдегид, а его разбавленный раствор в
уксусной кислоте. Кроме того, ускорению превращения надуксус-
ной кислоты в уксусную способствует применение катализатора —
раствора уксуснокислого марганца Мп(СНзСОО)2 в уксусной
кислоте.
Окисление ацетальдегида проводят в жидкой фазе при темпера-
туре 60—70°С. Принципиальная схема получения уксусной кисло-
ты жидкофазным окислением ацетальдегида представлена на
рис. 76 и в табл. 26.
Основным аппаратом служит окислительная колонна барботаж-
ного типа 2. В нее вводятся растворы ацетальдегида и катализатора
в уксусной кислоте, которые приготовляются в смесителях 1. Прямо-
током с окисляемой жидкостью в колонну вводится воздух (или
кислород). Для отвода тепла экзотермической реакции окисления
и поддержания нужной температуры в колонне установлены ох-
лаждающие водяные змеевики, по которым протекает вода (на ри-
сунке не показаны). Тщательное регулирование температуры очень
важно, так как уменьшение ее ниже 60—70°С приводит к накопле*
217
нию надуксусной кислоты, а повышение — к усилению побочных
реакций.
Газы, выходящие из окислительной колонны 2, содержат пары
уксусной кислоты и ацетальдегида, конденсирующиеся в конденса-
торе 3, охлаждаемом рассолом. Конденсат после сепаратора 4 воз-
вращается в колонну 2, а газы выводятся в атмосферу. Уксусная
кислота, выводимая из колонны, разделяется на два потока: мень-
ший из них идет на приготовление растворов ацетальдегида и ката-
Рис. 76. Схема производства уксусной кислоты:
1 — смесители, 2 — окислительная колонна. 3 —конден-
сатор, 4 — сепаратор
лизатора, больший поступает на ректификацию, проводимую для
отделения от уксусной кислоты примесей и повышения ее концент-
рации. Ректификацию повторяют дважды, после чего получают
97,5—98,5%-ный раствор уксусной кислоты.
Получение формальдегида. Еще одним важным производством,
основанным на способе каталитического окисления, является полу-
чение такого ценного продукта, как формальдегид.
/°
Формальдегид НС^ , или альдегид муравьиной кисло-
\н
ты, при обыкновенной температуре представляет собой газообраз-
ный продукт с резким специфическим запахом. Температура кипе-
ния его —2ГС, плавления —92°С. Растворы формальдегида с водой,
содержащие 33—40% формальдегида, называют формалином. Фор-
мальдегид обладает большой реакционной способностью, что и обу-
словило широкое применение его в качестве сырья для синтеза мно-
218
Таблица 26. Производство уксусной кислоты
Процессы
Что происходит
В каких аппаратах
Получение рас-
твора ацетальде-
гида в уксусной
кислоте
Получение рас-
твора катализато-
ра в уксусной
кислоте
Окисление аце-
тальдегида
ZO
2СН3—С" +О2->
ХН
/Р
2СН3С^
Охлаждение и
конденсация па-
ров уксусной кис-
лоты и ацеталь-
дегида
Разделение кон-
денсата и газов
Отделение от
примесей и кон-
центрирование ук-
сусной кислоты
219
гих органических соединений: искусственных смол и пластмасс, уро-
тропина, гликолевой кислоты и др. Формальдегид ядовит. Водный
раствор его — формалин применяется в качестве протравителя се-
мян, для дезинфекции овощехранилищ, парников.
Для получения формальдегида подвергают каталитическому
окислению метиловый спирт (метанол):
/°
СН2ОН + 0,5 О2--> Н— О" + Н2О + Q (XIV, 11)
\н
Пары метилового спирта окисляются кислородом воздуха при тем-
пературе 500—700°С в присутствии катализатора — серебра, нане-
сенного на пемзу.
На рис. 77 и в табл. 27 представлена схема производства фор-
мальдегида окислением метилового спирта. Метиловый спирт посту-
пает в нижнюю часть аппарата 1 — спиртоиспаритель. Туда же по-
дается необходимый для процесса окисления воздух, который про-
булькивает через слой метилового спирта. В спиртоиспарителе при
помощи горячей воды, проходящей по змеевикам, поддерживается
температура 40—50°С. Метанол испаряется и с барботирующим че-
рез него воздухом образует спирто-воздушную смесь. Она поступа-
ет в верхнюю часть аппарата 1 — спиртоперегреватель, где нагре-
вается до 110°С. С такой температурой смесь поступает в контакт-
ный аппарат 2, где в слое серебряного катализатора при 650—700°С
образуется формальдегид.
Окисление проводят автотермично. Температурный режим в слое
катализатора регулируют изменением количества и температуры
Рис. 77. Схема производства формальдегида:
1 — испаритель и перегреватель спирта. 2 — контактный аппарат, 3, 5 —
холодильники. 4 — тарельчатый абсорбер
220
Таблица 27. Производство формальдегида
В каких аппаратах
Процессы Что происходит
Подготовка сырья
Нагрев метило- вого спирта и по- лучение спирто- воздушной смеси Нагрев спирто- воздушной смеси снэон + + 0,50,- ХН
Получение формальдегида
Охлаждение га-
зовой смеси
Выделение
формальдегида
Поглощение во-
дой формальдеги-
да
: Метиловый спирт
i
Воздух Спиртоиспаритель
Спиртоперегреватель
Контактный аппарат
I
I
Холодильник
1
Вода ———* Поглотительная башня (тарельчатый абсорбер) Газы
1
Раствор
формальдегида
(формалин)
221
спирто-воздушной смеси, подаваемой в аппарат, и воды, посту-
пающей в трубки, находящиеся в слое.
Ниже слоя катализатора контактный аппарат представляет со-
бой холодильник, где горячий контактный газ проходит по трубам,
охлаждаемым водой. Затем эта вода используется в нижней части
аппарата 1 (спиртоиспарителе) для создания необходимой темпера-
туры при испарении метилового спирта. Газ, выходящий из контакт-
ного аппарата 2, содержит не только формальдегид, но и азот, а так-
же примеси СОг, СО, СН4, СН3ОН. Поэтому газ, пройдя еще один
холодильник 3, где он охлаждается водой, поступает с температу-
рой 60°С в поглотительную башню (тарельчатый абсорбер) 4, где
формальдегид поглощается водой. Для отвода тепла абсорбционная
колонна 4 снабжена внутренним холодильником 5. Из нижней части
колонны 4 выводится готовая продукция — 33—40%-ный раст-
вор формальдегида в воде (формалин). Он содержит 10—12% ме-
тилового спирта. Эта примесь является желательной, так как она
препятствует полимеризации формальдегида в процессе его хра-
нения.
§ 65. Галогенирование углеводородов
Среди процессов галогенирования широкое распространение по-
лучили процессы хлорирования углеводородов. Ценные свойства по-
лученных продуктов и доступность элементарного хлора, необходи-
мого для их получения, способствовали развитию производства
хлорорганических соединений.
Хлор в углеводородах может замещать водородные атомы или
присоединяться по месту ненасыщенных связей между атомами
углерода. Для хлорирования можно использовать не только хлор,
но и хлорсодержащие соединения.
Большой практический интерес представляет процесс хлориро-
вания углеводородов хлористым водородом—так называемое гид-
рохлорирование. Хлорирование углеводородов проводится в
паровой и в жидкой фазах различными способами: при нагревании
(термическое хлорирование), в присутствии катализаторов (ката-
литическое хлорирование), при специальном освещении реагирую-
щих компонентов (фотохимическое хлорирование).
Хлористый винил (винилхлорид) СНг = СНС1 — важнейшее
сырье для получения полимеров, необходимых в производстве пла-
стических масс и синтетических волокон. Винилхлорид получают
гидрохлорированием ацетилена:
СН=СН + НС1 > СН2=СНС1 (XIV, 12)
винилхлорид
В промышленности гидрохлорирование ацетилена проводят в
жидкой или газовой фазе. Последний способ более перспективен,
так как для его осуществления требуется более простая аппаратура
и процесс может быть легко автоматизирован.
222
Гидрохлорирование ацетилена в газовой фазе (рис. 78, табл.
28) производится при 170°С. Смесь хлористого водорода и ацети-
лена из смесителя 1 поступает в трубчатый контактный аппарат 2,
трубки которого заполнены катализатором — хлорной ртутью, нане-
сенной на активированный уголь. Тепло реакции отводится хо-
лодным минеральным маслом, циркулирующим в межтрубном про-
странстве реактора. Газы, выходящие из контактного аппарата 2
Раствор НС!
Рис. 78. Схема производства хлористого винила:
1 — смеситель, 2 — контактный аппарат, 3 — скрубберы, 4 — аппарат для
сушки, 5 — конденсатор
и содержащие 93% хлористого винила и 5% хлористого водорода,
поступают в скрубберы 3, где они сначала промываются водой для
удаления хлористого водорода, а затем нейтрализуются щелочью.
В аппарате 4 хлористый винил осушается твердой щелочью. Далее
винилхлорид конденсируется в конденсаторе 5, охлаждаемом рассо-
лом, после чего направляется на ректификацию для отделения при-
месей.
Широко распространено хлорирование ароматических соедине-
ний. При хлорировании бензола в присутствии катализатора полу-
чают хлорбензол, который применяется как полупродукт в про-
изводстве синтетических красителей, фенола, инсектицида ДДТ,
как растворитель некоторых эфиров целлюлозы и других полиме-
ров.
Фторхлорзамещенные углеводороды предельного и не-
предельного ряда используют для получения пластических масс —
фторопластов. При взаимодействии хлороформа с фтористым водо-
родом образуется дифторхлорметан:
СНС13 4- 2HF-->- CHF2C1 + 2НС1 (XIV, 13)
223
Таблица 28. Производство хлористого винила
Процесс Что происходит В каких аппаратах
Смешение исход- ных реагентов СН==СН+НС1 -> -*СН2 = СНС1 Промывка водой от НС1 Нейтрализация со- ляной кислоты Сушка твердой щелочью Охлаждение газов и конденсация хло- ристого винила Отделение хлорис- того винила от при- месей
! Хлористый : 1 Ацетилен I i водород : : Ацетилен !
4 i
Подготовка сырья Смеситель
1
1
Получение хлорис- того винила Трубчатый контактный аппарат
I
Выделение хло- ристого винила 4
Вода Скруббер
Раствор Скруббер - —>
щелочи
1
Аппарат для сушки
1
Холодильник- конденсатор
1 I
Ректифика цион - ная колонна
Очистка хлорис- того винила
1
Хлористый винил
Пиролиз дифторхлорметана при 650°С в отсутствие катализато-
ра приводит к образованию тетрафторэтилена, из которого получа-
ют фторопласт-4 (тефлон):
2 CHF2C1 » CF2=CF2 + 2 НС1 (XIV, 14)
650°С
224
§ 66. Другие методы получения продуктов
основного органического синтеза
Наряду с описанными выше в органическом синтезе широко при-
меняется и ряд других методов: изомеризация, алкилирование,
сульфирование, нитрование углеводородов и др.
Изомеризация —изменение строения молекул углеводоро-
дов без изменения их молекулярного веса и состава; этот метод
применяется для получения углеводородов с разветвленной цепью,
которые, например, используются для повышения антидетонацион-
ной стойкости моторных топлив. Так, изопентан
снзч
сн—сн2—сн3
сн/
получаемый изомеризацией н-пентана СНз—(СН2)з—СНз, имеет ок-
тановое число 105,7, в то время как н-пентан обладает октановым
числом 88,7.
Алкирование — введение алкильной группы в молекулу ор-
ганического соединения. Алкилирование углеводородов жирного ря-
да заключается во взаимодействии олефинов с пзо-парафином. Алки-
лирование углеводородов жирного ряда используют для получения
высокооктановых добавок к моторным топливам.
Сульфирование — замещение водородных атомов исход-
ных углеводородов сульфогруппой — SO3H проводят с применением
олеума, концентрированной серной кислоты, реже серного ангидри-
да, бисульфатов, бисульфитов. Сульфирование применяют при по-
лучении таких важных продуктов, как бензолсульфокислота, фенол
и др.
Нитрование — замещение водородных атомов в углеводоро-
де на нитрогруппу — NO2 применяют для получения нитробензола.
Контрольные вопросы
1. Какое значение имеет основной органический синтез для химической про-
мышленности?
2. Назовите важнейшие продукты промышленности основного органического
синтеза.
3. Какие виды сырья применяют в промышленности органического синтеза?
4. Назовите важнейшие типы реакции, наиболее часто применяющиеся в
промышленности основного органического синтеза.
5. Назовите известные вам производства, где используется метод дегидри-
рования углеводородов.
6. На чем основано получение бутадиена по способу академика С. В. Ле-
бедева?
7. Для чего применяется метиловый спирт?
8. Какие условия необходимы для успешного осуществления синтеза мети-
лового спирта?
9. Что общего между процессами получения аммиака и метанола?
10. Что делают для того, чтобы подавить побочные реакции при синтезе
метанола?
225
И. Какими методами можно получить этиловый спирт из этилена?
12. Для каких основных производств применяется этиловый спирт?
13. Назовите известные вам производства, основанные иа реакциях окисления.
14. Напишите реакции получения уксусной кислоты из ацетальдегида.
15. Для чего применяется уксусная кислота?
16. Как получают формальдегид и где его применяют?
17. Назовите некоторые продукты, получаемые методом галогенирования
углеводородов.
Глава XV
ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ
§ 67. Общие сведения о высокомолекулярных соединениях
Вся окружающая нас живая и неживая природа построена из
молекул, которые в свою очередь состоят из атомов. Атомы, соеди-
няясь между собой в различных соотношениях, образуют молекулы,
которые отличаются друг от друга размерами, строением, химичес-
ким составом и свойствами.
Вещества, построенные из небольшого числа атомов, называют-
ся низкомолекулярными. Их молекулярный вес не превыша-
ет нескольких сотен единиц. Низкомолекулярными веществами яв-
ляются соли, кислоты, щелочи, спирты и другие соединения.
В то же время многие вещества состоят из гигантских молекул,
в состав которых входят тысячи, десятки и сотни тысяч атомов. Та-
кие молекулы называют макромолекулами; их молекуляр-
ный вес достигает сотен и даже тысяч единиц. Например, молеку-
лярный вес молекул, входящих в состав натурального каучука, сос-
тавляет 136 000—340 000.
Соединения, построенные из макромолекул, называют высо-
комолекулярными или полимерами.
Полимеры по происхождению подразделяют на природные и син-
тетические.
К природным, т. е. естественным, полимерам относятся цел-
люлоза, входящая в состав древесины, хлопка и других растений;
белки, входящие в состав живых организмов; натуральный каучук
и др.
Синтетические полимеры получают искусственно, путем
химического синтеза; они входят в состав пластических масс, синте-
тических каучуков, химических волокон, лаков.
Состав и свойства полимеров. Молекулы полимеров представ-
ляют собой длинные цепи, в которых чередуются одинаковые зве-
нья. Если обозначить эти звенья буквой А, то молекулу полимера
можно представить так:
—А—А—А—А—А—А— (XV, 1)
В синтетических полимерах эти звенья являются остатками мо-
лекул исходных соединений, состоящих всего из нескольких ато-
мов. Эти исходные соединения называются мономерами. На-
226
пример, этилен СН2СНг— мономер для получения высокомолеку-
лярного соединения, называемого полиэтиленом. При образовании
полимера у молекул этилена двойная связь между атомами угле-
рода раскрывается, и за счет образующихся свободных валентно-
стей углерода большое число получившихся из мономера звеньев
соединяется друг с другом. Схематически это можно представить
следующим образом:
НН НН НННННН
II II I I I I I I ,YV
С=С---> —С—С—----> —С—С—С—С—С—С— (XV,2)
нн нА AhAAiIh
мономер образовавшееся звено звено звено
(этилен) звено полиэтилен
На схеме показано только три звена в составе полимера, факти-
чески количество их в полиэтилене от 1000 до 10 000, а молекуляр-
ный вес такого полимера колеблется от 28 000 до 280 000.
Из приведенной схемы видно, что как
в мономере, так и в полимере на один
атом углерода приходятся два атома во-
дорода, т. е. элементарный состав получа-
емого полимера одинаков с мономером.
С изменением числа связанных между
собой молекул мономера происходит из-
менение свойств получаемых полимеров.
Так, полиэтилен по мере увеличения мо-
лекулярного веса становится более вяз-
ким, затем пастообразным и, наконец,
твердым. Свойства полимеров зависят
также от химического состава мономеров,
формы цепей молекул и их строения
(структуры полимера).
В макромолекуле линейной стру-
ктуры элементарные звенья образуют
нитевидную молекулу, т. е. каждое звено
связано только с двумя соседними звень-
ями (рис. 79, а). Нитевидные (линейные)
макромолекулы могут быть расположены
в полимере параллельно друг другу (рис.
79, б) или переплетаться без химической
связи отдельных макромолекул (рис. 79,
в). Они могут быть изогнутыми, сверну-
тыми в клубок (рис. 79, г, б). Макромоле-
кулы линейной структуры характерны для
полиэтилена, полипропилена, целлюлозы,
полиэфиров, полиамидов и многих других
высокомолекулярных соединений, широко
используемых для получения волокон,
ооооооооооооооооооооосю
а)
б)
Рис. 79. Структуры макро-
молекул
227
пленок, пластмасс, резины. Эти полимерные материалы, как прави-
ло, прочны, эластичны, способны растворяться и плавиться при на-
гревании.
Макромолекулы разветвленной структуры имеют бо-
ковые ответвления от основной цепи (рис. 79, е). Полимеры с раз-
ветвленной структурой молекул растворяются и плавятся труднее,
чем линейные.
Макромолекулы с сетчатой структурой построены следу-
ющим образом: длинные цепи молекул связаны друг с другом корот-
кими цепями в трех измерениях, что на рисунке изобразить трудно.
Обычно такую структуру полимерных молекул изображают в виде
соединенных между собой линейно построенных больших молекул
(рис. 79, ж). При этом всегда имеется в виду, что линейные моле-
кулы химически связаны с молекулами, расположенными над пло-
скостью и за плоскостью бумаги. Такую структуру молекул назы-
вают также пространственной или трехмерной. Чем
больше число «мостиков» в такой макромолекуле, тем менее элас-
тичен полимер и у него в значительной степени проявляются свой-
ства твердого тела.
Структура цепей полимерных молекул может быть различной.
В одних случаях образуются полимерные молекулы, у которых эле-
ментарные звенья имеют различное пространственное расположение
боковых групп, в других — строго регулярное пространственное
расположение. Полимеры со строго регулярной структурой моле-
кул называются изотактическими. Такого типа полимеры об-
ладают высокой твердостью и теплостойкостью.
Молекулы полимеров могут состоять не из одинаковых звеньев,
как это показано в уравнении (XV, 1). Они могут быть получены
из разных мономеров, например А и Б. Тогда макромолекулу изоб-
ражают так:
—А—Б—А—Б—А—Б—А-Б—А—Б— (XV,3)
Такие высокомолекулярные соединения называются сополиме-
рами. Они совмещают в себе характерные свойства полимеров,
полученных из каждого компонента в отдельности. Таким образом
удается придавать полимерам некоторые специфические свойства,
например получать каучуки с повышенной бензо- и маслостойко-
стью, химической стойкостью и т. д.
Представляют интерес так называемые привитые сополи-
меры. Цепи их молекул построены по следующей схеме:
_А—А—А—А—А—А—А— (XV,4)
Б Б
I I
228
Такой полимер можно сравнить с плодовым деревом, к которо-
му привит другой сорт плодового дерева. В результате подобной
«прививки» получают плоды, сочетающие в себе наиболее ценные
качества обоих сортов. В привитом сополимере один полимер при-
вит к «стволу» другого полимера. Полученный «гибрид» обладает
свойствами исходных веществ. Таким образом удается получать по-
лимеры, сочетающие, например, высокие электроизоляционные
свойства с огнестойкостью и устойчивостью к бензину и маслам.
Макромолекулы могут быть построены из «блоков» сравни-
тельно невысокого молекулярного веса, полученных из различных
мономеров. Схема такого б л о к-с ополи мера имеет вид
-А—А—А—А—Б—Б—Б—А—А—А—А—Б-Б—Б— (XV,5)
Блок-сополимеры также сочетают в себе свойства исходных поли-
меров.
До сих пор элементарные звенья в макромолекуле обозначали
условно А и Б. Из уравнения (XV,2) видно, что в основе органиче-
ских полимеров лежит углерод, атомы которого соединились между
собой, образуя «скелет» молекулы, обрамленный атомами водоро-
да. Вместо атомов водорода могут быть группы атомов, в которых
наряду с атомами углерода присутствуют атомы других элементов.
Если скелет молекул полимеров построен из атомов углерода,
их называют карбоцепными. Существуют молекулы, в скелете
которых атомы углерода периодически чередуются с атомами дру-
гих элементов, например:
—N -C-C-C-C-C-C-C-N-C-C-C-C-C-C-C-N— (XV,6)
Такие полимеры называют гетероцепными.
Поведение полимеров при нагревании зависит от структуры мо-
лекул. Линейные и разветвленные полимеры при нагревании раз-
мягчаются, при последующем охлаждении переходят в твердое
состояние. Такие полимеры называются термопластичными.
Полимеры, молекулы которых имеют пространственную структуру,
не плавятся при нагревании; их называют термореактивными.
Температура перехода полимера из твердого состояния в элас-
тичное (или наоборот) называется температурой стеклова-
ния, температура перехода в текучее состояние — температу-
рой текучести.
Полимеры могут быть или полностью аморфными веществами—
аморфные полиме ры, или веществами, содержащими крис-
таллические и аморфные области, — кристаллические поли-
меры. По видам деформаций, которые возникают в полимерах
под влиянием внешних условий при комнатной температуре, их
подразделяют на т в е р д ы е полимеры, эластичные поли-
меры, или эластомеры, и текучие полимеры.
Таким образом, изменяя величину получаемой макромолекулы,
ее молекулярный вес и форму, составляя макромолекулу из раз-
личных исходных мономеров, прививая к одной макромолекуле це-
почку полимера из звеньев, образованных другим мономером, мож-
но в широкой степени изменять физические и Химические свойства
229
полимеров, получать их с заранее обусловленными свойствами, из-
менять их физическое состояние, делать жидкими, твердыми, пла-
стичными и эластичными.
Полимеры обладают малой плотностью (самые легкие пласти-
ческие массы в 800 раз легче стали), высокой механической проч-
ностью (превышает прочность дерева, стекла, керамики), высокими
термо-, звуко- и электроизоляционными свойствами, высокой хими-
ческой стойкостью, прекрасными оптическими свойствами, они спо-
собны поглощать и гасить вибрации, образовывать чрезвычайно
тонкие пленки и волокна, они легко поддаются обработке и перера-
ботке в изделия.
Ценные свойства полимеров обусловили их широкое использо-
вание в различных отраслях народного хозяйства: в машинострое-
нии, строительстве, автомобильной, авиационной, атомной, косми-
ческой и других отраслях техники, для изготовления тканей, искус-
ственной кожи, предметов домашнего обихода, в медицине.
Производство полимерных материалов у нас в стране развивает-
ся очень быстрыми темпами. Так, с 1976 по 1980 г. предусмотрено
увеличение выпуска синтетических смол и пластических масс в
1,9—2,1 раза, синтетического каучука в 1,4—1,6 раза. Производство
химических волокон в 1980 г. должно составить 1450—1500 тыс. т.1.
§ 68. Способы синтеза полимеров
Полимеры могут быть получены методами полимеризации и по-
ликонденсации.
Полимеризация. Метод полимеризации заключается в том, что
молекулы мономеров под воздействием нагревания, катализаторов,
у-лучей, света, инициаторов соединяются между собой в молеку-
лы больших размеров. При этом образуются макромолекулы ли-
нейной, разветвленной, сетчатой структуры, молекулы сополимеров,
привитых сополимеров.
Скорость полимеризации и молекулярный вес полимера зависят
от температуры, давления, активности катализатора и т. д.
Существуют следующие способы полимеризации: в массе (блоч-
ный способ), в эмульсиях, в растворе и так называемая суспензион-
ная полимеризация.
Полимеризация в массе происходит в аппарате (авто-
клаве), куда подается исходный мономер с катализатором или ини-
циатором— веществом, которое вступает в реакцию с мономером
и ускоряет полимеризацию. В начале полимеризации реагирующую
массу подогревают, затем подогрев прекращают, так как полимери-
зация сопровождается выделением тепла. Для поддержания опреде-
ленной температуры в аппарате в процессе полимеризации иногда
прибегают к охлаждению реагирующей массы. По окончании поли-
меризации из аппарата извлекают сплошную массу полимера в виде
блока. Процесс полимеризации может быть как периодическим,
так и непрерывным. При.полимеризации в массе трудно обеспечить
1 Материалы XXV съезда КПСС. М., Политиздат, 1976, с. 182.
230
одинаковую температуру во всей реагирующей массе, поэтому по-
лучаемый полимер состоит из макромолекул, имеющих различную
степень полимеризации. Этим методом получают полистирол, поли-
меры метакриловой кислоты, бутадиеновый каучук и др.
Эмульсионный способ полимеризации заключается
в том, что мономер смешивается с инициатором и эмульгатором и
превращается при помощи мешалок в мельчайшие капельки, взве-
шенные в другой жидкости, чаще всего в воде. (Эмульгаторы —
вещества, препятствующие слиянию капель жидкости.) Полученные
эмульсии нагревают до температуры, при которой происходит поли-
меризация мономера. При этом тепло, выделяемое в процессе поли-
меризации, отводится легко и образующийся полимер более одно-
роден, чем полученный блочным методом. Недостаток способа
заключается в трудности отделения эмульгатора от поли-
мера. Этим способом получают сополимеры бутадиена, винилаце-
тата, акрилонитрила и др.
Полимеризация в растворе осуществляется в раство-
рителе, смешивающемся с мономером и растворяющем образующий-
ся полимер. Из полученного раствора полимер выделяют испаре-
нием растворителя или осаждением. Полимеризацию проводят так-
же в растворителе, растворяющем мономер, но не растворяющем
полимер. В данном случае полимер выпадает в осадок, который
отфильтровывают. По этому способу получают поливинилацетат,
полибутилакрилат и др.
Суспензионный способ предусматривает измельчение
(диспергирование) мономера в виде капель в плохорастворяющей
среде, обычно в воде. Полимеризация протекает в каждой капле
мономера. Образующийся полимер в виде твердых частиц, не раст-
воряющихся в воде, осаждается и отделяется от жидкости фильтро-
ванием.
Поликонденсация. Метод заключается в том, что соединение меж-
ду собой молекул мономеров происходит при реакции между ними,
идущей с выделением побочных продуктов. Например, обозначим
молекулу одного из реагирующих веществ через а—А—а, а вторую
б—Б—б. Схема реакции между ними может быть представлена
следующим образом:
' а—А— —а ч- б— —Б—б —► а—А—Б—б
I
соединение
а— б
(XV,7)
По уравнению (XV, 7) из реагирующих молекул образовалась
молекула вещества а — А — Б — б и при этом выделилось вещество
а — б. Молекула вещества а — А — Б — б может дальше вступать
в реакцию с мономерами. Благодаря присоединению новых-молекул
мономера растет полимерная цепь. При этом присоединение каж-
дой новой молекулы сопровождается выделением вещества а — б.
231
В результате по химическому составу полимерные молекулы не-
сколько отличаются от исходных мономеров.
В процессе поликонденсации получаются полимеры, имеющие
линейную, а также сетчатую структуру.
Процесс поликонденсации экзотермический, и поэтому, исходя
из принципа Ле-Шателье, для сдвига равновесия слева направо
необходимо проводить процесс при низкой температуре. Однако для
увеличения скорости процесса нужно повысить температуру. Поэто-
му для увеличения скорости поликонденсации вначале процесс про-
водят при повышенной температуре, а затем ее постепенно снижают
для сдвига равновесия реакции и тем самым получают продукт
с более высоким молекулярным весом.
Поликонденсацию осуществляют как в присутствии катализа-
тора, так и без него. Ее проводят в расплаве, растворе и на границе
раздела двух фаз.
Поликонденсация в расплаве осуществляется при вы-
сокой температуре (220—280°С) в реакторе в атмосфере инертного
газа. Таким образом обеспечивают высокую скорость процесса и
удаление низкомолекулярных продуктов.
При поликонденсации в р а створ е мономеры раство-
рены в растворителе — реакция протекает с небольшой скоростью,
не обеспечивается удаление низкомолекулярных продуктов. Этот
способ не используется в промышленности.
Поликонденсация на границе раздела фаз за-
ключается в том, что имеются две несмешивающиеся жидкости,
в каждой из которых растворены исходные мономеры. Реакция по-
ликонденсации мгновенно протекает на границе раздела фаз с об-
разованием пленки полимеров. Таким образом, продукты реакции
выводятся из сферы реакции, что способствует протеканию реак-
ции с высокой скоростью. При удалении пленки поверхность разде-
ла фаз освобождается и реакция продолжается.
Контрольные вопросы
1. Какие соединения называют высокомолекулярными?
2. Изобразите молекулы с линейной, разветвленной и сетчатой структурой.
Каковы их свойства?
3. Изобразите схематически молекулы различных типов сополимеров.
4. Что такое карбоцепные и гетероцепиые полимеры?
5. Какие способы синтеза полимеров вам известны?
6. В чем заключаются процессы блочной, эмульсионной, в растворе и суспен-
зионной полимеризации?
7. Какие существуют способы поликонденсации?
8. Чем отличаются термопластичные полимеры от термореактивиых?
Глава XVI
ТЕХНОЛОГИЯ ПЛАСТИЧЕСКИХ МАСС
Пластические массы, или пластмассы, — это группа
материалов, состоящих полностью или частично из полимеров и об-
ладающих на некоторой стадии переработки пластичностью.
Пластичность — способность тела к пластической дефор-
232
мации, которая заключается в изменении формы тела под влиянием
внешних механических усилий без нарушения связи между части-
цами. При этом новая форма сохраняется после прекращения внеш-
них воздействий.
Пластмассы обладают самыми разнообразными свойствами.
Механическая прочность отдельных видов пластмасс превышает
прочность дерева, металла и керамики, в то же время они значи-
тельно легче этих материалов. Пластические массы могут быть не
только твердыми, но и эластичными, как каучук, они отличаются
высокими диэлектрическими свойствами и без труда подвергаются
переработке в готовые изделия самых различных и сложных форм:
легко прессуются, отливаются, шлифуются, полируются, вытягива-
ются в нити и пленки.
Эти замечательные качества пластических масс обеспечили им
широчайшее распространение в технике при изготовлении деталей
машин, приборов, в производстве летательных аппаратов, автомо-
билей, вагонов, судов и т. п., в медицине, быту и сельском хозяйстве.
Трудно назвать отрасль народного хозяйства, в которой бы не на-
шли применения пластические массы.
Однако пластмассы имеют .низкую теплостойкость, подвержены
«старению». Большинство из них может работать при температу-
рах до 150°С и только некоторые — до 300°С. Старение пластиче-
ских масс — процесс, при котором под влиянием различных факто-
ров (окисления, облучения и т. п.) изменяются состав и структура
макромолекул.
Некоторые пластические массы состоят только из полимера —
простые пластмассы, другие представляют собой компози-
цию, в которой помимо полимера присутствуют наполнители, пла-
стификаторы, красители, отвердители, стабилизаторы—напол-
ненные пластмассы. Основой всякой пластмассы являются
высокомолекулярные полимерные вещества, связывающие воедино
все компоненты композиции. Эти полимеры называются связую-
щими.
Наполнители — вещества непластичные. Это могут быть
тонко измельченные твердые материалы — древесная мука, гипс,
каолин, сажа, графит, тальк и др., волокнистые — хлопок, текстиль-
ные очесы, асбестовое волокно, бумага, хлопчатобумажные ткани,
стеклянные волокна и т. д. Наполнители улучшают механические и
химические свойства пластмасс, например повышают теплостой-
кость, прочность, негорючесть, водостойкость, электроизоляционные
свойства, улучшают внешний вид и т. п. Поскольку в качестве на-
полнителей используют дешевые вещества, введение их в компози-
цию снижает стоимость готовых изделий.
Пластификаторы — вещества, главным образом жидкости,
добавление которых в композицию облегчает переход смеси в пла-
стическое состояние, а следовательно, улучшает процесс формова-
ния изделий из пластических масс. В качестве пластификаторов ис-
пользуют камфару, касторовое масло, дибутилфталат и другие ве-
щества.
9—275
233
Красители вводят в смеси для придания изделиям опреде-
ленной окраски.
Отвердители добавляют в смесь для изменения структуры
полимеров — превращения линейных молекул в пространственные
и тем самым получения нерастворимой и твердой массы.
Стабилизаторы — вещества, способствующие сохранению
первоначальных свойств полимеров и предотвращающие изменение
их свойств со временем.
Пластические массы в зависимости от химической природы и
способа синтеза полимеров делятся на четыре группы:
1. Пластмассы на основе высокомолекулярных соединений, по-
лученных цепной полимеризацией. К ним относятся пластмассы на
основе полимеров этилена, винилового спирта и их производных.
2. Пластмассы на основе высокомолекулярных соединений, по-
лученных поликонденсацией. К этой группе относятся пластмассы
на основе феноло-альдегидных (фенопласты), амино-формальде-
гидных смол (аминопласты) и др.
3. Пластмассы, содержащие природные полимеры. К ним отно-
сятся простые и сложные эфиры целлюлозы (целлулоид, этролы),
белковые вещества (галлалит) и др.
4. Пластмассы на основе природных и нефтяных асфальтов,
а также на основе смол.
Кроме того, в промышленности получают пластмассы смешан-
ного типа, которые содержат смолы различных классов; при этом
получают материалы, обладающие разнообразными свойствами.
В зависимости от типа полимеров, входящих в состав пластиче-
ских масс, различают термопластичные пластмассы (термопласты)
и термореактивные пластмассы. Выше (с. 229) говорилось о раз-
личии между ними.
§ 69. Пластические массы на основе полимеризационных смол
Полимеризационные смолы — полиэтилен, полистирол, поливи-
нилхлорид, полиметилметакрилат и другие относятся к термоплас-
там.
Получение полиэтилена. Получение одного из наиболее распро-
страненных видов полимеризационных пластмасс основано на реак-
ции полимеризации газообразного продукта этилена Н2С=СН2, в
результате которой получается соединение
Н Н Н Н Н Н
I I I I I I
—С—С—С—С— с—с—
н н н н А н
Цепочка полиэтилена состоит из большого количества звеньев
—СН2—СН2—, и потому формулу полиэтилена можно записать
в виде (—СН2—СН2—)п.
234
Полимеризацию этилена проводят при высоком, среднем или
низком давлении. Процесс полимеризации этилена при высоком
давлении — 1000—3000 кгс/см2, чаще 1500 кгс/см2, температу-
ре 220—280°С и в присутствии небольших количеств кислорода осу-
ществляют на установках, принципиальная схема одной из которых
изображена на рис. 80 и в табл. 29. Очищенный газообразный
этилен с добавкой небольшого количества кислорода (катализа-
Рис. 80. Схема получения полиэтилена:
1 — компрессор, 2 —- маслоотделитель. 5 — реактор, 4 — сепаратор,
6 — приемник, 6 — ловушка
тора) вместе с непрореагировавшим этиленом сжимают в компрес-
соре / до 1500 кгс/см2. Из компрессора этилен направляется в мас-
лоотделитель 2, где он освобождается от смазочного масла, попа-
дающего в сжатый этилен в компрессоре. Далее этилен поступает
в реактор 3, где происходит его полимеризация. Температура в
верхней части реактора поддерживается около Ю0°С, в нижней—
около 200°С.
Реактор представляет собой систему наклонно расположенных
толстостенных труб с внутренним диаметром до 25 мм и длиной до
300 м. Степень полимеризации (степень превращения) этилена за
один проход через реактор составляет 10—12%. После реактора 3
полученный полиэтилен и непрореагировавший этилен проходят
сепаратор 4, где отделяется полиэтилен, который собирается в при-
емнике 5. После снижения давления от полиэтилена отделяют не-
прореагировавший этилен, который направляют через ловушку 6
на промывку и затем подают в компрессор 1. При многократной
9* 235
Таблица 29. Получение полиэтилена
Процессы Что происходит В каких аппаратах
Сжатие этилена
Освобождение от
смазочного масла
п (Н2С = СН2) —
- (—СН2 —СН2—)„
Разделение поли-
этилена и циркуля-
ционного газа
циркуляции этилена степень его превращения в полиэтилен дости-
гает 95—97%. Таким образом, в данном случае применена цикли-
ческая схема производства. Полиэтилен из приемника 5 и ловуш-
ки 6 подвергают стабилизации и, если необходимо, окрашивают,
гранулируют и затем перерабатывают в изделия.
Полиэтилен высокого давления отличается низкой плотностью.
Полимеризация этилена при среднем давлении 30—
70 кгс/см2 проводится в присутстви катализатора (Сг20з,
СгО3 и др.). Этилен растворяют в бензине, и при соприкосновении
с катализатором при температуре ПО—140°С происходит полиме-
ризация этилена. По окончании реакции полимер отделяют от бен-
зина, промывают, сушат и гранулируют.
Полимеризацию этилена при низком давлении — 2—
6 кгс/см2, так же как и полимеризацию при среднем давлении, про-
водят в растворе, например бензина, при температуре в реакторе
60—80°С и в присутствии катализатора. В качестве катализатора
236
используют смесь триэтилалюминия (С2Нз)зА1 с четыреххлористым
титаном TiCl4. Полиэтилен после отделения от бензина промывают
спиртом, сушат и гранулируют.
Полиэтилен отличается высокой химической стойкостью и хоро-
шими диэлектрическими свойствами. Он широко применяется для
изготовления труб, кранов, шестерней, аккумуляторных баков, ка-
бельных изделий, деталей радио-, телевизионных и телеграфных
установок, бытовой посуды, пленок, синтетического волокна и др.
Следует отметить, что полиэтилен, полученный при низком давле-
нии, более теплостоек, более стоек к действию органических кислот
и растворителей, но менее эластичен и труднее перерабатывается
в изделия, чем полиэтилен высокого давления.
Получение поливинилхлорида. Поливинилхлорид — полимер,
состоящий из элементарных звеньев —СН2—СНС1—:
Н Н Н Н Н Н
—С—С—С—С—С—С— ,
I I I I I I
Н С1 Н С1 Н С1
Отсюда формула поливинилхлорида: (—СН2— СНС1—)п.
Сырьем для производства поливинилхлорида служит хлористый
винил СН2=СНС1, являющийся при обычных условиях газом.
Полимеризацию хлористого винила обычно проводят в водной
эмульсии, получаемой при его смешении с водой при температуре
35—70°С и давлении 5—8 кгс/см2, в присутствии эмульгатора — же-
латины и инициатора — перекиси бензоила. После завершения по-
лимеризации реакционную массу переводят в аппарат для отгонки
непрореагировавшего хлористого винила, который затем очищают и
возвращают на полимеризацию. Образовавшийся поливинилхлорид
отделяют от воды на центрифуге и сушат.
Поливинилхлорид может быть получен в виде твердого хрупко-
го вещества — винипласта и в виде эластичного материала — пла-
стиката.
Винипласт получают из чистой смолы со стабилизатором
(амины, окислы металлов). Он обладает высокой прочностью, хо-
рошо поддается механической обработке, хорошо сваривается, хи-
мически стоек. Однако винипласт растворяется в азотной кислоте
и в ароматических и хлорированных углеводородах.
Пластикат получают при смешивании поливинилхлорида
с пластификатором (эфиры фосфорной и фталевой кислот). Его ис-
пользуют для футеровки и уплотнения химической аппаратуры, из-
готовления заменителей кожи, шлангов, линолеума, клеенки, транс-
портерных лент, предметов бытового обихода и т. д.
Получение фторопластов. Фторопласты превосходят по хими-
ческой стойкости все известные материалы, в том числе золото и
платину. Фторопласты получают полимеризацией четырехфтористо-
го этилена CF2=CF2 или трифторхлорэтилена CF2 = CFC1.
237
В первом случае получают соединение
F F F F F F
I I I I I I
—С— С— С—с—с—с—
I 1 1 1 1 д
F F F F F F
называемое фторопластом-4, которое имеет формулу (—CF2—
CF2-)n.
При полимеризации трифторхлорэтилена образуется соединение
F F F F F F
-С—С—С—С—С—С—
I I I I I I
F Cl F Cl F С1
имеющее формулу (—CF2—CFC1—)п и называемое фторопластом-3.
Помимо высокой химической стойкости фторопласты обладают
хорошими электроизоляционными свойствами, выдерживают темпе-
ратуру от —190 до +200°С. Их можно кратковременно употреблять
даже при 300—400°С. Они являются ценнейшим материалом для из-
готовления деталей аппаратуры, прокладок, листов, пленок, труб,
стержней и других изделий, работающих при повышенной темпера-
туре в сильно агрессивной среде. Однако следует отметить трудность
переработки фторопластов в изделия.
Получение полистирола. Полистирол получают из стирола СН2=
СН — С6Н5 (фенилэтилена). В результате полимеризации получают
соединение
н н н н н н
—с—с—с—с—с—с—
II II II
Н CeH5 Н СвН5 н С6Н5
формула которого / —СН2—СН— \
I
\ CeHs Д
Полимеризацию проводят лаковым, эмульсионным и блочным
методами.
На рис. 81 ив табл. 30 показан процесс непрерывной
блочной полимеризации. При этом получают так назы-
ваемый блочный полистирол. Очищенный стирол подает-
ся в реакторы 2 с мешалками. В этих реакторах находятся змееви-
ки (на чертеже не показаны), по которым проходит горячая вода.
В реакторах при температуре около 80°С начинается полимериза-
ция стирола. Из реакторов жидкая смесь полистирола и непрореа-
гировавшего стирола поступает в верхнюю часть полимеризацион-
ной колонны 3 для окончательной полимеризации, которая прово-
238
Эмульсиог
мер (—СН2—
Полимети.
для остеклен!
потому назва
ло — очень тв
ется действии
работке, легк
остекления сг
аппаратуры, v.
изделий. Спос
летовые лучи
На основе
полиизобутил
Полипрс
прочность И б'
лен. Он у сто г
органических
сти,различны
П ол и из о
дится в атмосфере азота. Колонна состоит из шести секций, причем в
каждой секции поддерживается строго определенная температура
от 100 до 200°С, что достигается обогревом при помощи пара, пода-
ваемого в паровую рубашку 4, и электрическим обогревом нижней
части колонны 3. По мере движения стирола сверху вниз колонны
заканчивается его полимеризация. При этом стирол частично испа-
ряется, его пары поступают в холодильник 1, где он конденсирует-
ся, и возвращается снова в процесс.
хорошо смеши
чески г
туры' .орро:
г ол и фо{
низких TeMnef
действию мно1
кие диэлектри
твердый и со:
используют д.
скольжения, т]
Рис. 81. Схема получения полистирола:
/ •— холодильник, 2 — реакторы, 3 — полимеризационная колон*
на, 4 — паровая рубашка, 5 — шнек-пресс, 6 — рольганг
§ 70. Пласта»
Не менее в
ные поликонд<
бамидиые и д|
ции термореак
Феноло-
ские масс!
фенола CeHsO
Расплавленный полистирол, выходящий из колонны, поступает
в обогреваемый шнек-пресс 5, откуда в виде вязкой непрерывной
струи выходит на охлаждаемый водой или воздухом рольганг 6,
здесь он затвердевает и после охлаждения передается на переработ-
ку. Реакторы и полимеризационная колонна изготовляются из алю-
миния или эмалированной стали.
При полимеризации полистирола в эмульсии получают эмуль-
сионный полистирол.
Блочный полистирол широко применяется в радиотехнике, элек-
тронике и других отраслях в качестве электроизоляционного мате-
риала. Из него изготавливают детали машин, облицовочные плиты,
пленку, предметы бытового потребления.
239
Процесс
ного раствора формальдегида (формалина) с большим количест-
вом фенола, добавлении кислоты (катализатор) и нагревании будет
протекать реакция
ОН
С
ОН
С
HCZ/
QH + О + HiC
сн
Получение
тирол^
НС
СН н-с-н
НС
сн
сн
сн
он
он
он
с
н
с
н
с
н
НС^'
С---С--+Н2О
с—с—с
С—с—с
I
НС.. /СН
н нс
сн н НС
сн н
Обработка г
стиролг
СН
сн
сн
По этой реакции образуется новолачная смола. Эта смола
термопластична, так
Если же смешать
присутствии щелочи
зольная смола:
как ее молекулы имеют линейное строение,
большие количества формалина с фенолом в
(катализатор) и нагреть, то получится р е-
он
он
он
Э М у Л Ь
зуемый не
для получе!
Получек
ризации пр
большее ра
полимеризг
= ССН3СО
НС;
НС1.
С------С------С;
|С—с—с.
||С—
сн
НС1
Сн
НС
Сн
н—с—н
н—с—н
Н—С—н
НС
СН
НС
сн
НС
СН
с—
С—с—с1
С-----С------Счч
он
он
он
с
с
с
с
н
н
н
Н
с
с
с
с
н
н
н
Н
с
с
с
с
242
Молекулы этой смолы имеют пространственную структуру, и по-
тому смола термореактивна.
Аппаратурное оформление процессов получения новолачных и
резольных смол мало отличается друг от друга (рис. 82). В реак-
тор 1 с мешалкой загружают фенол, формалин и катализатор.
Смесь перемешивают и нагревают до 70—75°С подачей пара в ру-
башку реактора. После этого нагрев прекращают. За счет тепла
реакции температура повышается до 90°С. Для устранения даль-
Рис. 82. Схема получения поликонденсационной смолы:
/ — реактор, 2— холодильник-конденсатор, <3 — вакуум-прием-
ник, 4 — противень
нейшего повышения температуры в рубашку реактора подают хо-
лодную воду. Пары воды, выходящие из реактора 1, охлаждаются в
холодильнике-конденсаторе 2, и конденсат возвращается в реактор.
В реакторе образуется смесь, состоящая из воды, непрореагировав-
ших фенола и формальдегида и образовавшейся смолы. Для полу-
чения сухой феноло-формальдегидной смолы в реакторе создают
разрежение и в рубашку реактора подают для обогрева пар. Полу-
чаемый в аппарате 2 конденсат собирают в вакуум-приемнике 3.
Приготовленную смолу выпускают из реактора в противень 4, где
ее охлаждают и затем направляют на склад.
На рис. 82 показан периодический процесс получения феноло-
формальдегидной смолы. В настоящее время реализована непре-
рывная поликонденсация фенола с формальдегидом, осуществляе-
мая аналогично непрерывному получению стирола.
Феноло-формальдегидные смолы используют без наполните-
лей— литые пластмассы, с наполнителями порошкообразных и во-
243
локнистых веществ, в качестве связующего в слоистых пласти-
ках, в виде клеев и лаков, для изготовления поропластов. В качест-
ве наполнителей используют древесную муку, асбест, тальк, каолин,
магнезию и др. При применении в качестве наполнителя асбеста
получают фаолит — химически стойкий материал, используемый для
изготовления химической аппаратуры.
Пластические массы на основе феноло-формальдегидных смол
обладают высокой прочностью, химической стойкостью, электроизо-
ляционными свойствами. Их применяют для изготовления деталей
радиотехнической аппаратуры, деталей, работающих при повышен-
ной температуре и в агрессивных средах.
Аминопласты получают конденсацией карбамида (мочеви-
ны) (NH2)2CO с формальдегидом. Аминопласты термореактивны,
их используют с различными наполнителями для изготовления
предметов широкого потребления, электроизоляционных изделий,
строительно-облицовочных материалов.
Полиэфирные смолы получают поликонденсацией мно-
гоосновных кислот с многоатомными спиртами. Их используют для
изготовления электроизоляционных композиций, лаков и эмалей.
Поликарбонаты — полиэфиры угольной кислоты получают,
например, из фосгена СОСЬ и дифенилолпропана HOCeHj —
— С(СНз)2 — CeHjOH в щелочной среде. Образующийся поликар-
бонат— твердое прозрачное вещество — применяется для изготов-
ления электроизоляционных деталей, радиодеталей, нагревательных
приборов и др.
Полиэпоксидные смолы получают на основе соединений,
I I
содержащих эпоксидную (окисную) группу ^х исполь-
зуют для получения деталей и узлов электрических устройств,
покрытий, клеев.
Кремнийорганические соединения—полиорганоси-
локсаны представляют собой высокомолекулярные соединения,
структура цепей которых образована кремнием и кислородом, при
этом кремний связан с органическими радикалами:
₽ /? Я
' - •. —Si—О—Si—О—Si— • • •
/? /?
где /? — СН3, С2Н5 и др. Кремнийорганические соединения получа-
ют жидкими различной вязкости и твердыми с макромолекулами
линейной и трехмерной структуры. Они отличаются разнообразием
свойств, что объясняется изменением и различным сочетанием
радикалов, входящих в их состав, а также размерами получаемых
макромолекул.
244
Кремнийорганические соединения выдерживают значительное
нагревание — они могут длительно использоваться при температу-
ре 200°С и кратковременно при температуре 500°С и выше. Они
стойки в воде, мало изменяют вязкость при изменении температу-
ры. Многие из них имеют хорошие диэлектрические свойства, т. е.
являются надежными изоляторами. Это обусловило широкое при-
менение их в различных отраслях промышленности в качестве
смазочных масел, клеев, лаковых покрытий, прокладок, жаростой-
ких эмалей.
Слоистые пластики получают при пропитке тканей раст-
ворами синтетических смол.
Пропиткой хлопчатобумажной ткани раствором феноло-фор-
мальдегидной смолы с последующим горячим прессованием полу-
чают текстолит, отличающийся повышенной водостойкостью
и значительной прочностью. Его используют для изготовления дета-
лей машин.
Более прочен, чем текстолит, другой слоистый пластик — стек-
лотекстолит. Его изготовляют из стеклянной ткани, пропитан-
ной феноло-формальдегидными, полиэпоксидными, кремнийоргани-
ческими смолами. Значительный интерес представляет стеклотек-
столит, полученный из стеклянной ткани, пропитанной
кремнийорганическими соединениями. Он может выдержать высо-
котемпературную нагрузку без изменения внешней формы.
Стеклопластики применяются в автомобилестроении, самолето-
строении, для изготовления деталей машин, лодок, их используют
в качестве электроизоляционных материалов и т. д.
§ 71. Эфиры целлюлозы и пластические массы на их основе
Целлюлоза (C6Hi0O5)n — это природное бесцветное, неплав-
кое и нерастворимое вещество, входящее в состав клеток древеси-
ны, хлопка и других растений.
Целлюлоза по своей химической природе является высокомоле-
кулярным спиртом — ее молекулы содержат гидроксильную группу.
Целлюлоза вступает в реакцию с различными веществами; при ее
взаимодействии с кислотами происходит образование эфиров цел-
люлозы. Так, в результате обработки ее смесью азотной и серной
кислот азотная кислота соединяется с молекулами целлюлозы,
образуя азотнокислый эфир, который называют нитроцеллю-
лозой. При реакции между целлюлозой и уксусной кислотой или
ее ангидридом (ацетангидридом) получается эфир уксусной кисло-
ты— ацетилцеллюлоза. Из эфиров целлюлозы нельзя непо-
средственно получить пластические массы, так как они недостаточ-
но термопластичны. Для придания пластичности их смешивают с
пластификаторами, например с камфарой.
Нитроцеллюлоза при растворении ее в спиртовом растворе кам-
фары и последующем удалении спирта образует пластическую мас-
су целлулоид. Целлулоид при нагревании становится пластич-
ным, поддается обработке, легко окрашивается. Изделия из
245
целлулоида отличаются легкостью, приятным внешним видом. Из
целлулоида изготовляют галантерейные изделия, игрушки и т. п.
Ацетилцеллюлоза применяется для производства пластмасс,
шелка, лаков, негорючих кино- и фотопленок.
§ 72. Изготовление изделий из пластмасс
Методы переработки пластмасс основаны на свойствах полиме-
ров приобретать пластичность и текучесть при воздействии на них
температуры и давления и сохранять затем в обычных условиях
приданную им форму.
Рис. 83. Схема прямого прессования:
а — форма открыта, б — форма закрыта; / — пуансон,
2— направляющие стержни, 3 — полимер, 4 — матрица,
6 — изделие
Пластмассы в зависимости от поведения их при нагревании де-
лят на термореактивные и термопластичные, поэтому принадлеж-
ность к одной из этих групп определяет и методы их переработки.
Например, при переработке термопластов материал сохраняет
плавкость в готовом изделии и может быть переработан повторно
в отличие от термореактивных материалов, у которых при пере-
работке под влиянием температуры и давления происходят хими-
ческие процессы, в результате которых получаемое изделие стано-
вится неплавким и нерастворимым.
Основные способы переработки пластических масс в изделия:
прямое прессование, литье под давлением, экструзия, формование
из листа, изготовление изделий намоткой, сварка и механическая
обработка.
Прямое прессование (рис. 83) применяется в основном
при переработке термореактивных смол. При этом способе полимер
(в виде порошка или таблеток) 3 помещают в оформляющую по-
лость нижней части пресс-формы — матрицу 4 и нагревают с помо-
щью пара или электричества. Материал при этом расплавляется и
под давлением пуансона 1 заполняет ее рабочую часть. После осты-
вания форму раскрывают и вынимают изделие.
Прямое прессование изделий из термопластичных смол приме-
няется редко, так как при этом полученное изделие нужно выдер-
246
живать в форме до полного его охлаждения, что увеличивает
длительность процесса.
Литье под давлением применяют при переработке в из-
делия термопластичных материалов — полиэтилена, полистирола
и др. Порошкообразный или гранулированный материал 5 (рис. 84)
подают в загрузочную воронку 4, из которой он поступает в обогре-
ваемую камеру 3. В ней он остается пластичным и приобретает
Рис. 84. Литьевая машина:
а — форма открыта, б — форма закрыта; 1 —- подвижная
плита формы, 2 — неподвижная плита формы (матри-
ца), 3— обогреваемая камера, 4 —воронка, 5 — матери-
ал, б — плунжер, 7 — изделие, 8 — сопло
способность течь под давлением. В этой камере перемещается плун-
жер 6, приводимый в движение от мотора. При движении плунжера
вперед размягченный материал через сопло попадает в холодную
форму, где он затвердевает. После выдавливания материала плун-
жер отходит назад, и при этом из загрузочной воронки в камеру
поступает новая порция порошкообразного материала. Далее плун-
жер перемещается вперед и т. д. Такой способ позволяет быстро
осуществлять все операции и не требует охлаждения формы.
Метод выдавливания, или экструзия, позволяет изго-
товлять из полимерных материалов листы, пленки, стержни, трубы
и т. п. Такие изделия можно получать только при непрерывном про-
цессе формования, что и достигается при помощи специальных
машин— экструдеров (рис. 85). Экструдеры имеют загрузоч-
ную воронку 2, через которую подается порошкообразный матери-
ал 3, цилиндрическую камеру- 4, внутри которой вращается близко
прилегающий к стенкам камеры шнек 5.
При вращении шнека 5 материал вначале поступает в обогре-
ваемую зону камеры, где он становится пластичным, а затем про-
247
Давливается через оформляющую головку — мундштук экструдера 1.
Форма оформляющей головки экструдера определяет профиль по-
лучаемого изделия. При выходе из головки экструдера изделие
быстро охлаждают. Этот метод позволяет также наносить пласт-
массы на проволоку и другие изделия.
Рис. 85. Экструдер:
/ — мундштук, 2— воронка, 3— материал, 4— камера,
5 — шнек
Формование из листа применяется при переработке тер-
мопластичных материалов и получении из них изделий сложной
формы, с большой поверхностью и малой толщиной стенок.
Рис. 86. Схема штамповки из
листа:
/ — листовой материал, 2 — пуан-
сон, 3 — матрица
На рис. 86 показана схема штам-
повки из листа. Из листа 1 готовит-
ся заготовка, которая нагревается
до высокоэластичного состояния, за-
тем она закрепляется на матрице 3
штампа, установленного на непо-
движной плите пресса. После этого
иа нее воздействуют пуансоном 2.
Выдержка заготовки между матри-
цей и паунсоном осуществляется до
тех пор, пока она не охладится и не
зафиксируется приданная форма.
Сварку пластмасс приме-
няют для соединения деталей, полу-
ченных из термопластичных матери-
алов. Нагрев соединяемых деталей осуществляют газовыми тепло-
носителями, теплом трения, токами высокой частоты и ультразву-
ком. Выбор способа сварки (температуры нагрева, времени вы-
держки) зависит от свойств материала, подлежащего сварке, фор-
мы, назначения и условий эксплуатации изделия.
Механической обработке подвергают все виды пласт-
масс. Ее осуществляют на обычных деревообрабатывающих, метал-
лорежущих, специальных станках и вручную.
Контрольные вопросы
1. Какие материалы называют пластическими массами?
2. Каков состав простых и наполненных пластмасс?
3. Приведите схемы полимеризации этилена, стирола.
248
4. Напишите формулы полимеризационных смол и назовите области приме-
нения пластических масс на их основе.
5. Напишите реакции получения новолачной и резольной смол. Каковы их
свойства?
6. Изобразите схему процесса получения феноло-формальдегидной смолы.
7. Какие поликонденсационные смолы ры знаете, каковы их свойства?
8. Какие соединения называют кремнийорганическими? Приведите их общую
формулу.
9. Какие эфиры целлюлозы используют для производства пластических масс
и пленок?
10. По рис. 83—86 объясните способы изготовления изделий из пластиче-
ских масс.
Глава XVII
ПРОИЗВОДСТВО ХИМИЧЕСКИХ волокон
Волокнами называют тонкие, прочные, гибкие, нитеобразные
тела, имеющие очень малые размеры поперечного сечения.
С давних времен люди носят одежду из естественных (природ-
ных) текстильных волокон— шерсти, шелка, льна, хлопка. Ассор-
тимент текстильных материалов значительно расширился, когда
три-четыре десятилетия назад были созданы процессы получения
волокон химическим путем. Эти волокна назвали химическими.
Существует два типа химических волокон — искусственные и синте-
тические.
Искусственные волокна изготавливают из природных
высокомолекулярных соединений — целлюлозы, казеина и др.,
синтетические волокна — из высокомолекулярных соедине-
ний, полученных синтезом из мономеров.
Разработка способов получения химических волокон открыла
безграничные возможности создания волокон, превосходящих при-
родные волокна по своим свойствам и отвечающих разнообразным
требованиям. Эти волокна прочнее, легче природных, не смачива-
ются водой, не подвержены гниению, действию плесени, некоторые
из них отличаются химической стойкостью.
Производство химических волокон позволяет применять механи-
зацию и автоматизацию технологических процессов. Себестоимость
химических волокон, как правило, ниже себестоимости естествен-
ных.
§ 73. Процессы получения волокон
В методах получения различных волокон много общего. Процесс
складывается из четырех этапов: 1) получения исходного материа-
ла, 2) приготовления прядильной массы, 3) формования волокна,
4) отделки волокна.
Получение исходного материала может быть осу-
ществлено не из любого полимера, а только из такого, молекулы
249
которого обладают строгой линейной и малоразветвленной струк-
турой.
Приготовление прядильной массы для формования
волокна различно для различных исходных материалов-Для полу-
чения искусственных волокон на основе эфиров целлюлозы их раст-
воряют в 5—6%-ном растворе едкого натра и таким образом полу-
чают прядильный раствор. Прядильную массу для изготовления
синтетических волокон готовят растворением или расплавлением
полимера.
Рис. 87. Фильера
Рис. 88. Формование волокна
из раствора полимера:
/ — насос, 2 — фильтр, 3 — стеклян-
• ная трубка, 4 — бобина, 5 — филье-
ра, 6 — осадительная ванна
Формование волокна, или прядение, заключается в
вытягивании нити из раствора или расплава полимера. С этой целью
раствор или расплав продавливают через очень маленькие отвер-
стия — фильеры (рис. 87). Тонкие струйки раствора или расплава,
выходящие через отверстия фильеры, обрабатывают химическими
реагентами или охлаждают, в результате чего они твердеют и пре-
вращаются в нити.
Фильеры устанавливают на прядильной машине. Каждая маши-
на снабжена 60—100 фильерами. Существуют два способа формо-
вания волокна — мокрый и сухой.
Мокрый способ используется в случае прядения волокна из
раствора (рис. 88). Прядильный раствор, подаваемый прядильным
насосом /, проходит фильтр 2, стеклянную трубку 3, продавливает-
ся через отверстие фильеры 5 и попадает в раствор, находящийся
в осадительной ванне 6. Выдавливаемые через фильеры струйки
прядильного раствора реагируют с раствором осадительной ванны
250
6 с образованием нитей волокна, которые наматываются на боби-
ну 4. Мокрый способ используют для изготовления искусственных
волокон — вискозного, медно-аммиачного и иногда синтетических
волокон.
Рис. 89. Сухое формование во-
локна из раствора или распла-
ва полимера:
/ — головка, 2 — фильера, 3 — шах-
та прядильной машины, 4—пучок
волокон, 5 — нить, 6 — бобина
Крошка
полимера
Рис. 90. Формование волокна
из расплава:
/ — решетка, 2 — насос, 3 — филье-
ра, 4 — пучок волокон, 5 — шахта
прядильной машины, 6 —• нить, 7 —
бобина
Сухой способ применяется в случае прядения волокна из
раствора или из расплава полимера. При сухом формовании волок-
на из раствора (рис. 89) нагретый раствор полимера проходит
через прядильную головку 1 и фильеру 2 и попадает в виде тонких
струек в шахту прядильной машины 3, в которую подается нагретый
воздух. Снаружи шахта обогревается горячей водой, и таким обра-
зом в шахте поддерживается температура порядка 80°С. При этой
температуре происходит испарение растворителя, и струйки пря-
дильного раствора, затвердевая, образуют пучок волокон 4, которые
в нижней части шахты соединяются вместе в нить 5 и наматывают-
251
ся на бобину 6. Сухой способ применяют для получения искусствен-
ных волокон, например ацетатного, а также некоторых синтетиче-
ских волокон.
При формовании волокна из расплава (рис. 90) смолу в виде
крошки подают на обогреваемую решетку 1, где она расплавляется.
Затем расплав насосом 2 продавливается через фильеру 3. Пучок
волокон 4 попадает в шахту 5, где он охлаждается воздухом. Во-
локна в шахте 5 затвердевают, собираются в нить 6 и наматывают-
ся на бобину 7. Сухой способ используют для формования синте-
тических волокон — капрона, нейлона и др.
Отделка волокна включает удаление загрязнений, сушку,в
случае необходимости его отбеливание и окраску. Как правило, все
волокна подвергают обработке жиросодержащими растворами для
облегчения их переработки в процессах ткачества, вязания и др.
§74. Производство искусственных волокон
Производство вискозного волокна. Сырьем для этого процесса
служит целлюлоза. Первая стадия процесса заключается в полу-
чении прядильного раствора. Для этого целлюлозу прежде всего
обрабатывают 18—20%-ным раствором едкого натра-. При этом
протекает реакция образования щелочной целлюлозы:
(C6H10O5)n + nNaOH = (СвН10О5 . NaOH)n
целлюлоза щелочная целлюлоза
Щелочную целлюлозу отжимают от раствора щелочи, выдержи-
вают 12—24 ч при 20—22°С и обрабатывают сероуглеродом CS2.
При этом происходит образование ксантогената целлюлозы:
(С6Н10О5 NaOH)n + nCS2 =
+ nH2O
ксантогенат
целлюлозы
Ксантогенат целлюлозы растворяют в 4—7 %-ном растворе едко-
го натра при 25—30°С и получают прядильный раствор, из которого
примеси отделяют фильтрованием. Раствор некоторое время выдер-
живают и передают на формование вискозного волокна.
Формование вискозного волокна производится мокрым спосо-
бом. Прядильный раствор проходит через отверстия фильеры, по-
груженные в осадительные ванны с водным раствором серной кис-
лоты, сульфата натрия и сульфата цинка. Струйки ксантогената
целлюлозы из отверстий фильеры попадают в ванну, и при этом
происходит коагуляция (свертывание) и разложение ксантогената
целлюлозы с образованием вискозного волокна. Волокно в самой
ванне или после выхода из нее вытягивают и наматывают на
бобины.
252
Вискозное волокно устойчиво к действию органических раство-
рителей, выдерживает температуру 100—120°С. Недостаток вискоз-
ного волокна заключается в значительной потере прочности в мок-
ром состоянии и малой стойкости в щелочах.
Производство ацетатного волокна. Апетатное волокно формуют
сухим методом из растворов ацетилцеллюлозы в смеси ацетона со
спиртом. Раствор продавливается через отверстия фильеры в
шахту формовочной машины, в которую подают воздух с темпера-
турой 55—70°С.
Ацетатное волокно обладает большой эластичностью и меньше
теряет прочность в мокром состоянии, чем вискозное. Ацетатное
волокно — хороший электроизолятор.
§ 75. Производство синтетических волокон
Синтетические волокна обладают самыми разнообразными свой-
ствами. Одни из них легко растворяются в воде, другие не погло-
щают влагу и не набухают. Они имеют высокую прочность, химиче-
ческую стойкость, не поддаются действию микроорганизмов.
В настоящее время число синтетических волокон, выпускаемых
промышленностью, непрерывно возрастает. Большую группу синте-
тических волокон представляют полиамидные волокна — капрон,
нейлон, энант.
Волокно капрон получают из смолы капрон, которую про-
изводят из капролактама. Превращение капролактама в смолу —
полимеризация производится в автоклаве при температуре 250°С и
давлении около 15 кгс/см2 в среде азота. Расплавленная смола вы-
давливаетя из автоклава азотом в виде узкой ленты, которая затем
застывает и подвергается дроблению. Крошка, получаемая при
дроблении, промывается водой, сушится и поступает на формова-
ние волокна. Формуют волокно капрон сухим способом из расплава.
Волокно вытягивают, промывают и сушат.
Волокно капрон обладает высокой устойчивостью к истиранию
и прочностью, эластичностью, устойчивостью к действию щелочей.
Из волокна капрон изготавливают ткани для одежды, технические
ткани (фильтровальные, корды и Др.), трикотажные изделия,
электроизоляционные материалы и др.
Волокно нейлон получают из смолы нейлон, синтезируе-
мой поликонденсацией адипиновой кислоты НООС—(СН2)б—
—СООН с гексаметилендиамином H2N (CH2)6NH2. Прядение волок-
на нейлон производится из расплава сухим способом. Нейлон
отличается от капрона более высокой температурой плавления.
Физико-химические показатели и области применения нейлона ана-
логичны показателям и областям применения капрона.
Волок ноэнант получают из смолы энант, которую синтезиру-
ют поликонденсацией аминоэнантовой кислоты H2N(CH2)6 СООН.
Формуют волокно сухим способом из расплава. Волокно энант
253
не уступает капрону, а по ряду свойств превосходит его. Оно обла-
дает большей свето- и термостойкостью, чем волокно капрон. При-
менение его аналогично волокну капрон.
Волокно лавсан относится к полиэфирным волокнам. Его
изготовляют из смолы лавсан, получаемой.поликонденсацией диме-
тилового эфира терефталевой кислоты Н3СООС(С6Н4)СООСНз с
этиленгликолем НОСН2СН2ОН.
Волокно лавсан формуют из расплава сухим способом. Это во-
локно по теплопроводности аналогично шерсти, не боится влаги,
обладает высоким сопротивлением к вытягиванию, по своей термо-
стойкости превосходит большинство синтетических волокон.
Волокно лавсан используют для изготовления тканей, трико-
тажных изделий, для производства фильтров, кордных и электро-
изоляционных материалов, транспортерных лент и др.
Волокно хлорин — поливинилхлоридное волокно получа-
ют из смолы хлорин — хлорированного поливинилхлорида.
Формуют волокно из растворов сухим и мокрым способами.
Сухое формование производится из раствора смолы в смеси ацето-
на с бензолом, мокрое — из раствора в диметилформамиде и тетра-
гидрофуране. Для снижения вязкости растворов их продавливают
через фильеры при повышенной температуре. Волокно хлорин,
отличающееся высокой химической стойкостью, используют для
изготовления фильтровальных тканей и других материалов для
химической промышленности, изготовления рыболовных снастей
и др.
Волокно нитрон — полиакриловое волокно формуют из по-
лимеров, получаемых на основе акрилонитрила СНг—CHCN или
его сополимеров. Формование волокна осуществляют сухим и мок-
рым способами.
Нитрон устойчив к окислителям, теплу (до 120—130°С), свету,
не теряет прочности во влажной среде, не подвергается гниению,
но имеет низкую гигроскопичность и сравнительно плохо окраши-
вается. Пряжу из полиакриловых волокон применяют для изготов-
ления трикотажных изделий, фильтровальных, обивочных и других
тканей, парусов, канатов и т. п.
Замечательные свойства химических волокон, возможность по-
лучения с заранее заданными свойствами обусловили бурное
развитие их производства. Во многих случаях химические волокна
пришли на смену природным — хлопку, льну, шелку, шерсти и др.
По. темпам развития производство химических волокон опережает
производство естественных.
Контрольные вопросы
1. Какие волокна называют искусственными? Синтетическими?
2. Какое сырье используется для получения искусственных и синтетических
волокон?
3. Что понимают под сухим и мокрым формованием волокна из раствора?
4. В чем заключается процесс получения вискозного волокна?
5. Какие синтетические волокна вам известны? Каковы их свойства?
254
Глава XVIII
ТЕХНОЛОГИЯ КАУЧУКА И РЕЗИНЫ
Каучук — это эластичные высокомолекулярные соединения,
которые изменяют форму под влиянием внешних сил и принимают
начальную форму, если действие этих сил устранено. Способность
каучуков изменять форму объясняется тем, что макромолекулы
каучука находятся в свернутом состоянии, в виде спиралей. При
растяжении они в значительной мере распрямляются, а при снятии
растягивающей нагрузки вновь самопроизвольно свертываются.
Каучуки известны давно. Долгое время не удавалось использо-
вать их замечательные свойства — способность значительно удли-
няться при растяжении и сокращаться при сжатии, эластичность,
гибкость. Это объяснялось тем, что изделия из каучука быстро
теряли форму и большинство своих ценных качеств. Только с от-
крытием способа вулканизации каучуков, позволившего получать
из каучука резину, в которой эластичность и упругость каучуков
сочетаются с хорошей механической прочностью, теплостойкостью
и хладостойкостью, эти продукты начали широко использовать во
многих областях промышленности.
В чем состоит процесс вулканизации? Как указывалось выше,
молекулы каучука представляют собой спирали, способные расши-
ряться и сжиматься под действием внешних усилий. В то же время
силы взаимодействия между отдельными полимерными цепями
каучука очень малы и молекулы обладают способностью сдвигать-
ся относительно друг друга, особенно при нагревании. Задача вул-
канизации заключается в том, чтобы скрепить молекулы и тем са-
мым устранить их подвижность. Вулканизирующим агентом служит
сера. Она соединяет цепи макромолекул каучука, образуя между
ними «мостики». Например, при вулканизации каучука, макромо-
лекулы которого имеют линейную структуру:
сн3 сн3
I I
—СН2—С=СН—СН2—СН2—С= СН—Со-
образуются макромолекулы сетчатой структуры с серными «мости-
ками» между макромолекулами:
СНз ' СНз
—СН2—с—СН—СН2—СН2— С—СН-СН,—
I I
S S
I I
—СН2—С—СН—СН2—СН2—С—СН—СН2—
I I
СН3 CHS
255
Вулканизированный каучук в сочетании с наполнителями, на*
пример сажей, называется резиной; она обладает механической
прочностью, устойчивостью к нагреванию, действию растворителей
и других реагентов.
Резина широко используется для изготовления автомобильных
и авиационных шин, приводных ремней, транспортерных лент,
гибких шлангов, деталей машин, электроизоляционных материалов,
резиновых тканей, обуви, предметов санитарии и гигиены и т. п.
Каучуки подразделяются на натуральные и синтетиче-
с к и е.
§ 76. Натуральный каучук
Натуральный каучук (НК) — природное высокомолеку-
лярное вещество растительного происхождения. Его можно полу-
чать из довольно большого числа растений — каучуконосов, среди
которых основное промышленное значение имеет бразильская гевея.
В настоящее время натуральный каучук в основном добывается
на плантациях, расположенных на островах Юго-Восточной Азии.
Натуральный каучук добывают следующим образом: на коре
гевеи делают надрез — подсочку; из надреза вытекает млечный
сок — латекс, в котором содержится 20—35% каучукового вещест-
ва. Это вещество представляет собой высокомолекулярный полимер
изопрена СН2=С—СН=СН2. Таким образом, макромолекула
СН3
натурального каучука состоит из элементарных звеньев:
/ —СН2-С=СН—СН2—
\ сн3
Для выделения каучука к латексу добавляют уксусную или
муравьиную кислоту. При этом частицы каучука (глобулы) свер-
тываются — происходит коагуляция и выделение его в виде
рыхлого объемистого сгустка. Каучук отфильтровывают, промыва-
ют водой и пропускают через валки с рифленой поверхностью.
Резина из натурального каучука обладает высокой механиче-
ской прочностью и эластичностью в широком интервале температур.
§ 77. Синтетические каучуки
Возрастающий спрос на каучук и зависимость многих государств
от стран, производящих натуральный каучук, поставили перед
учеными всего мира задачу получения синтетического кау-
чука (СК). Длительное время попытки ученых синтезировать
каучук были безуспешными.
Подлинной родиной синтетических каучуков является Совет-
ский Союз, где в 1928 г. академик С. В. Лебедев получил полиме-
ризацией бутадиена (дивинила) бутадиеновый каучук. В 1932 г.
256
был осуществлен пуск завода синтетического каучука, работавшего
по методу С. В. Лебедева.
Бутадиеновый каучук (СКВ), как указывалось, получа-
ют полимеризацией бутадиена.
Бутадиен СНг=СН—СН = СН2 в начале развития производства
каучука получали из этилового спирта, который производили из
пищевых продуктов — зерна, картофеля и др. В настоящее время
этиловый спирт синтезируют из этилена (см. с. 214).
Представляет значительный интерес производство бутадиена
дегидрированием бутана (см. с. 206), содержащегося, как и этилен,
в продуктах переработки нефти и природного газа. Таким образом,
основным сырьем для получения СКВ являются нефть и природные
газы.
Бутадиеновый каучук получают в автоклаве периодического
действия (рис. 91), закрытом крышкой 3, в который через штуцер 2
загружают жидкий или газообразный бутадиен. Полимеризация
происходит в массе при температуре 30—40°С и давлении 9—
10 кгс/см2 в присутствии катализатора — стержней металлического
натрия. В рубашку 1 автоклава в начале процесса подают пар для
ускорения полимеризации, а затем воду для отвода тепла, выделя-
ющегося при реакции. По окончании полимеризации давление в
автоклаве снижают. При этом удаляются непрореагировавший бу-
2 3
Рис. 91. Автоклав:
i _ рубашка, 2 — штуцер, 3 — крышка
257
тадиен и другие газообразные продукты. Каучук в виде блока вы-
гружают из аппарата в атмосфере азота.
Резина, изготовленная из бутадиенового каучука, уступает по
прочности, эластичности и износоустойчивости резине, полученной
из натурального каучука. СКВ используют для изготовления авто-
мобильных шин, обуви, резинотканых изделий и др.
Бутадиенстирольный каучук (СКС, Буна-S и др.) по-
лучают совместной полимеризацией бутадиена со стиролом.
Каучук состоит из макромолекул:
/—СН2-СН=СН—СН2—СН2-СН— X
\ С6Н5 / п
Полимеризацию осуществляют эмульсионным методом при тем-
пературе от 5 до 50°С. Вначале бутадиен и стирол смешивают с во-
дой и эмульгатором (канифольное мыло и др.) и проводят предва-
рительное эмульгирование. Эмульсия вместе с раствором инициато-
ра (гидроперекись изопропилбензола) проходит последовательно
через батарею полимеризаторов, состоящую из 12 аппаратов. Поли-
меризатор— стальной аппарат емкостью 12—20 м3 с мешалками,
футерованный изнутри. За время прохождения эмульсией батареи
полимеризаторов примерно 60% исходных мономеров превращает-
ся в полимеры. Таким образом получают латекс, из которого отде-
ляют непрореагировавшие мономеры и другие примеси. Затем к
латексу добавляют коагулянты (поваренную соль NaCl или хлори-
стый кальций СаС1г, серную кислоту H2SO4 или уксусную кислоту
СН3СООН), в присутствии которых каучук свертывается — коагу-
лирует. Его отделяют из раствора, промывают, сушат, формуют в
виде лент и свертывают в рулоны. Чтобы каучук не склеивался в
рулоне, ленты каучука припудривают тальком.
Бутадиенстирольный каучук применяют для изготовления шин,
транспортерных лент. Некоторые сорта СКС по морозостойкости
близки натуральному каучуку, поэтому их используют для получе-
ния морозостойких резиновых изделий.
Бутадиеннитрильный каучук (СКН, Буна-N)—сопо-
лимеры бутадиена и нитрила акриловой кислоты (CH2=CHCN),
имеющие формулу
/ —СН2—СН=СН—СН2—СН2—СН— X
Сополимеризация осуществляется в водной эмульсии.
Эти каучуки отличаются высокой масло- и бензостойкостью. Их
используют для изготовления бензо- и маслостойких рукавов, про-
кладок и других изделий, необходимых в нефтяной, авиационной и
других отраслях промышленности.
258
Изопреновый каучук (СКИ)
/ —СН2—С=СН—СН2—
v сн3 jn
получают полимеризацией изопрена при температуре 30—40°С в
присутствии катализатора (лития или комплексных металлоорга-
нических соединений). По своей структуре синтетический изопрено-
вый каучук близок к натуральному, поэтому по многим свойствам
он приближается к натуральному.
Хлоропреновый каучук представляет собой полимер
хлоропрена. Его формула / —СН2—С=СН—СН2—\ . Хлоропрен
Cl
n
получают из винилацетилена.
Полимеризацию хлоропрена осуществляют преимущественно
эмульсионным методом при температуре около 40°С. В качестве
эмульгатора используют канифольное мыло и др.
Хлоропреновый каучук негорюч, устойчив к действию химичес-
ких реагентов и масел. Он обладает повышенной тепло- и светостой-
костью. Недостатком хлоропренового каучука является понижен-
ная морозоустойчивость.
Хлоропреновый каучук не вулканизуется серой, и поэтому для
превращения его в резину, т. е. получения макромолекул сетчатой
структуры, используют окислы цинка, ртути и других металлов.
Этот каучук применяют в кабельной промышленности в качестве
антикоррозийного покрытия, для изготовления клеев.
Макромолекулы кремни йор га н ических каучуков (си-
локсановых) состоят из характерных для кремнийорганических по-
лимеров цепочек:
R
R
—Si—O—Si—O—
R R
Отличительной особенностью кремнийорганических каучуков
является высокая термостойкость и эластичность. Кремнийоргани-
ческие каучуки не изменяют своих свойств в интервале температур
от —60 до +300°С, водостойки, обладают электроизоляционными
свойствами, не растворяются в масЛе, бензине и других раствори-
телях.
Кремнийорганические каучуки используют для изготовления
жароупорных прокладок, клапанов, мембран, в качестве электро-
изоляторов и других изделий, работающих в условиях высоких и
низких температур.
Фторкаучуки получают из фторпроизводных этилена. Наи-
большее применение нашли каучуки, получаемые сополимеризаци-
ей трифторхлорэтилена CF2 = CFC1 с винилиденфторидом CF2 = CH2.
259
Фторкаучуки отличают высокие термо- и химическая стойкость,
механическая прочность. В связи с высокой стоимостью фторкаучу-
ки производят в ограниченных количествах.
Синтетические латексы обычно содержат 20—33% кау-
чука. Их используют для пропитки шинного корда, ряда техниче-
ских изделий, пропитки и покрытия бумаги, в кожевенном произ-
водстве и т. д.
§ 78. Производство резины и резиновых изделий
Изготовление резиновых изделий. Процесс состоит из трех ос-
новных стадий: приготовления сырой резиновой смеси, формования
изделий и их вулканизации. В состав резиновых смесей входят по-
мимо каучука, являющегося основой смеси, другие органические и
неорганические вещества, называемые ингредиентами. Под-
бор и количество ингредиентов в смеси зависят от качества исход-
ного каучука и требуемых свойств получаемых резиновых изделий.
Обычно в состав сырой резиновой смеси входят следующие ве-
щества: каучук, вулканизатор (сера и др.), ускорители вулканиза-
ции (дифенилгуанидин и др.), пластификаторы, или мягчители
(жирные кислоты, вазелин, сосновая смола, парафин и др.), проти-
востарители (фенолы, фенил-0-нафтиламин и др.), наполнители
(сажа, двуокись кремния SiOg, цинковые белила ZnO, каолин
и др.), красители.
Основное условие получения высококачественных резиновых
изделий — приготовление резиновой смеси с равномерным распре-
делением в ней всех ингредиентов. Для большей пластичности и
лучшего смешивания каучука с ингредиентами его предварительно
разогревают. При приготовлении резиновой смеси необходимо со-
блюдать определенные условия (температуру, механические воз-
действия и пр.), при которых не происходило бы изменения макро-
молекул каучука и разложения компонентов смеси.
Смешение проводят чаще всего в высокопроизводительных
закрытых смесителях, представляющих собой камеру, в которой
навстречу друг другу вращаются с разными скоростями два ротора
(вала или барабана) овальной или трехгранной формы, снабжен-
ные гребнями. Камеры и роторы имеют устройство для охлажде-
ния— отвода тепла, выделяющегося при пластификации каучука.
Для смешения резиновой смеси применяют также вальцы
(рис. 92), валки 1, 3 которых вращаются с разной скоростью. Во из-
бежание преждевременной вулканизации серу вводят в конце сме-
шения.
Приготовленную резиновую смесь формуют, пропуская через
валки-каландры в виде непрерывной ленты равномерной толщины,
разрезаемой затем на листы. Из сформованной в листы резиновой
смеси вырубают или раскраивают детали и заготовки резиновых
изделий. Дальнейшая переработка деталей и заготовок в изделия
зависит от их формы, назначения и условий эксплуатации.
260
ч
Кроме того, для формования резиновой смеси используют
шприц-машины, в которых резиновую смесь продавливают через
отверстия, разнообразные по форме и размерам их сечения. Так де-
лают резиновые трубки, шланги.
Вулканизация — конечная стадия изготовления резиновых
изделий. Вулканизацию каучука можно проводить при обычной
температуре (холодная вулканизация) или при нагрева-
нии (горячая вулканизация). Холодная вулканизация
происходит под действием 2—3%-ных растворов полухлористой се-
ры в течение 1—3 мин. Холодную вулканизацию применяют только
для изготовления тонкостенных изде-
лий из резиновой смеси. Она связана с
потерями растворителя и вредными ус-
ловиями труда. Поэтому преимущест-
венное распространение получила го-
рячая вулканизация при температуре
125—160°С с применением в качестве
вулканизатора серы. Горячую вулкани-
зацию проводят в прессах или вулка-
низационных котлах — автоклавах в
атмосфере горячего воздуха или насы-
щенного водяного пара.
Классификация резин. По назначе-
нию резины подразделяются на следу-
ющие группы:
1) резины общего назначения, эксплуатируемые при температу-
ре от —50 до+150°С (шины, обувь, ремни, амортизаторы и др.);
2) теплостойкие резины, применяемые при длительной работе
при температуре выше 150°С (детали самолетов, машин, электро-
двигателей и т. п.);
3) морозостойкие резины, устойчивые при работе изделий в ус-
ловиях Крайнего Севера, Антарктиды и на больших высотах;
4) химически стойкие резины, устойчивые к озону, кислороду,
кислотам, щелочам, растворам солей и т. д.;
5) маслостсйкие резины, устойчивые в бензине, керосине, нефти;
6) газонаполненные резины, применяемые как теплоизоляцион-
ный материал;
7) резины, стойкие к действию радиации и применяемые для
изготовления деталей рентгеновских аппаратов и т. п.;
8) диэлектрические резины, используемые для изоляции кабе-
ля и других целей.
Развитие производства каучука и резины. Объем производства
резины и каучука определяется прежде всего потребностями авто-
транспорта и авиастроения. Применение каучука и резины в других
отраслях промышленности, на транспорте, в сельском хозяйстве и
в быту неуклонно расширяется. Увеличивается не только количест-
во, но и ассортимент каучуков и резин, предназначенных для рабо-
ты в самых разнообразных условиях.
261
I
Применение новых видов сырья для получения мономеров и со- I
вершенствование методов их полимеризации — одна из задач, стоя- I
щих перед резиновой промышленностью.
Контрольные вопросы
1. Какие высокомолекулярные соединения называют каучуками?
2. Какое строение обычно имеют макромолекулы каучуков? I
3. Что представляет собой натуральный каучук и как его получают? |
4. Какой синтетический каучук впервые стали получать в нашей стране по
методу С. В. Лебедева?
5. Какой каучук получают сополимеризацией мономеров? (
6. Как получают хлоропрен?
7. Что представляет собой изопреновый каучук и какими свойствами он
обладает?
8. Какой процесс называют вулканизацией каучука и с какой целью он
проводится?
9. Назовите основные ингредиенты резиновой смеси.
10. Какие стадии процесса изготовления резиновых изделий вы знаете?
ОГЛАВЛЕНИЕ
Введение........................................................................... J
Глава I. Технико-экономические показатели химико-технологических
процессов....................................................... 6
Глава II. Сырье и энергетика химической промышленности............. 11
§ 1. Сырье химической промышленности............ И
§ 2. Подготовка сырья к переработке........... 19
§ 3. Вода в химической промышленности......... 26
§ 4. Энергетика химической промышленности. 30
Глава III. Основные закономерности химико-технологических процессов 34
§ 5. Понятие о хнмнко-технологнческом процессе................... 34
§ 6. Классификация химических реакций............................. 35
§ 7. Равновесие в технологических процессах....................... 38
§ 8. Скорость химнко-технологических процессов.................... 41
§ 9. Выбор оптимального технологического режима.................. 46
§ 10. Гетерогенные системы........................................ 47
§ 11. Каталитические процессы..................................... 54
§ 12. Высокотемпературные процессы................................ 60
§ 13. Материальные и энергетические балансы....................... 63
Глава IV. Типовые методы организации технологических процессов . . 66
Глава V. Производство серной кислоты.................................. 73
§ 14. Свойства и применение серной кислоты........................ 73
§ 15. Сырье для производства серной кислоты....................... 75
§ 16. Производство сернистого газа................................ 77
§ 17. Переработка сернистого газа в серную кислоту................ 79
§ 18. Концентрирование серной кислоты............................. 86
§ |9 . Материалы для изготовления аппаратуры в сернокислотном про-
изводстве ........................................................ 87
§ 20. Хранение н транспортирование серной кислоты................. 88
§ 21. Перспективы развития производства серной кислоты .... 88
Глава VI. Производство аммиака........................................ 89
§ 22. Соединения азота н их значение для народного хозяйства . . 89
§ 23. Способы фиксации атмосферного азота ........................ 91
§ 24. Получение азота нз воздуха.................................. 93
§ 25. Получение водорода..................... ;.................. 94
§ 26. Очистка газов............................................... 96
§ 27. Синтез аммиака.............................................. 98
§ 28. Сорта аммиака, его транспортировка и хранение...............103
Глава VII. Производство азотной кислоты...............................104
§ 29. Свойства и сорта азотной кислоты............................104
§ 30. Получение слабой азотной кислоты........................... 105
§ 31. Получение концентрированной азотной кислоты................ 112
§ 32. Хранение н транспортировка азотной кислоты................. 113
Глава VIII. Производство кальцинированной соды....................... 114
§ 33. Значение соды для народного хозяйства.......................114
§ 34. Аммиачный способ получения кальцинированной соды .... 115
§ 35. Получение бикарбоната натрия............................... 122
§ 36. Основные направления развития содового производства . . . 122
Глава IX. Производство едкого натра, хлора и соляной кислоты . . 123
1 § 37. Химические способы получения едкого натра...................124
§ 38. Электрохимический способ получения хлора, едкого натра и во-
дорода ...................................................... 125
§ 39. Получение соляной кислоты.................................. 131
263
Глава X. Производство минеральных удобрений и ядохимикатов . .
§ 40. Классификация удобрений..................................
§ 41. Фосфорные удобрения......................................
§ 42. Азотные удобрения........................................
§ 43. Калийные удобрения.......................................
§ 44. Комплексные удобрения....................................
§ 45. Микроудобрення ..........................................
§ 46. Ядохимикаты .............................................
Глава XI. Технология силикатов.....................................
§ 47. Керамика.................................................
§ 48. Вяжущие вещества.........................................
§ 49. Производство стекла......................................
Глава XII. Технология твердого топлива.............................
§ 50. Классификация и состав топлив..........................
§ 51. Состав твердых топлив....................................
§ 52. Коксование углей.........................................
§ 53. Газификация топлива......................................
§ 54. Переработка древесины....................................
Глава XIII. Переработка жидких топлив (нефти и нефтепродуктов)
§ 55. Состав и свойства нефти..................................
§ 56. Продукты переработки нефти...............................
§ 57. Переработка нефти........................................
§ 58. Очистка нефтепродуктов...................................
§ 59. Переработка газов........................................
Глава XIV. Технология основного органического синтеза..............
§ 60. Продукты н сырье основного органического синтеза.........
§ 61. Дегидрирование углеводородов.............................
§ 62. Процессы гидрирования....................................
§ 63. Гидратация углеводородов.................................
§ 64. Процессы окисления.......................................
§ 65. Галогенирование углеводородов ...........................
§ 66. Другие методы получения продуктов основного органического
синтеза.........................................................
Глава XV. Высокомолекулярные соединения............................
§ 67. Общие сведения о высокомолекулярных соединениях ....
§ 68. Способы синтеза полимеров................................
Глава XVI. Технология пластических масс............................
§ 69. Пластические массы на основе полимеризационных смол . . .
§ 70. Пластические массы на основе поликонденсациоиных смол . .
§ 71. Эфиры целлюлозы и пластические массы на их основе . . .
§ 72. Изготовление изделий из пластмасс........................
Глава XVII. Производство химических волокон........................
§ 73. Процессы получения волокон...............................
§ 74. Производство искусственных волокон.......................
§ 75. Производство синтетических волокон.......................
Глава XVIII. Технология каучука и резины...........................
§ 76. Натуральный каучук.......................................
§ 77. Синтетические каучуки....................................
§ 78. Производство резины и резиновых изделий .................
136
138
140
146
150
152
154
154
156
157
160
165
172
173
173
174
181
184
187
188
190
192
201
202
203
203
204
209
212
216
222
225
226
226
230
232
234
241
245
24г
249
249
252
253
255
256
256
260