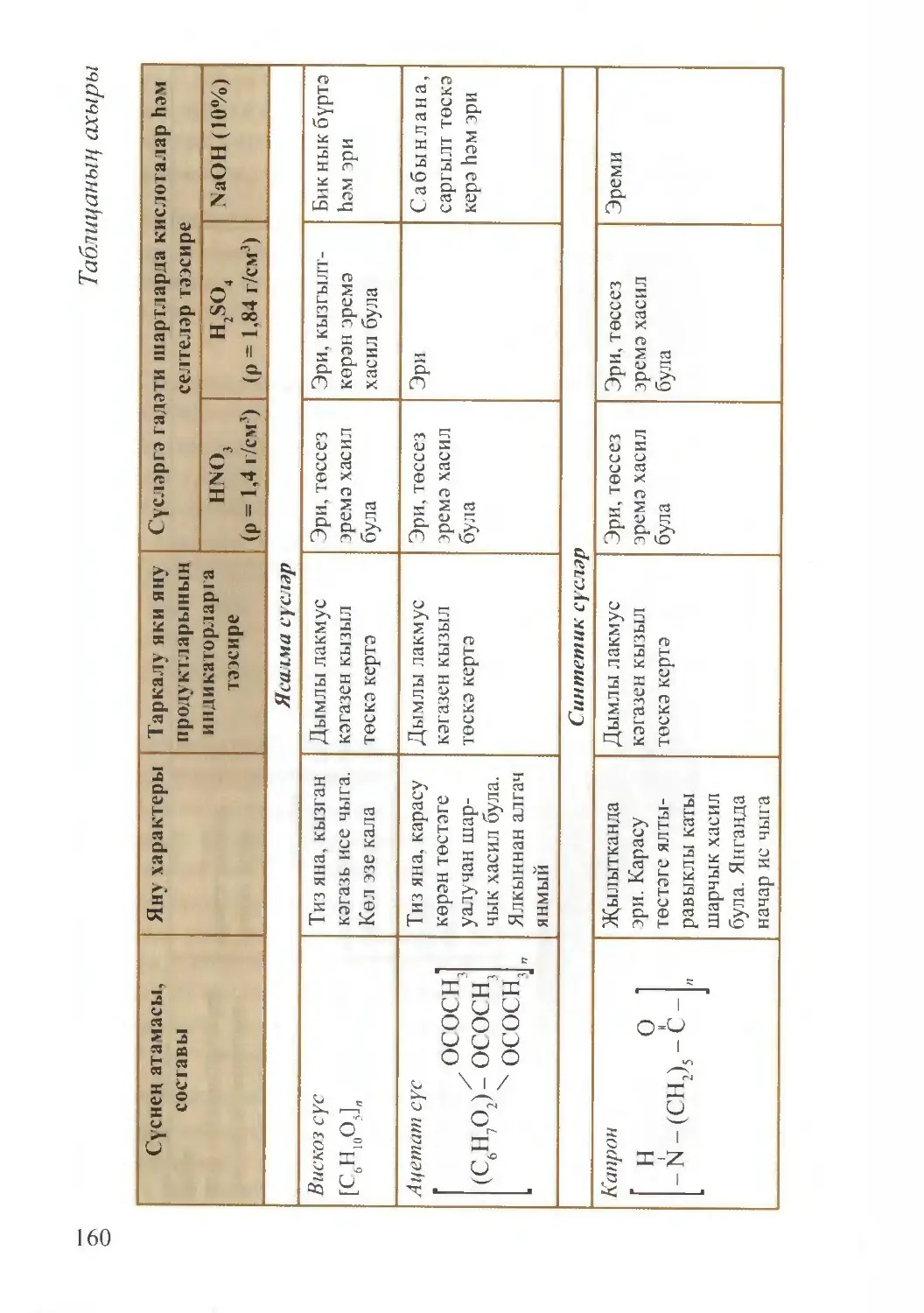
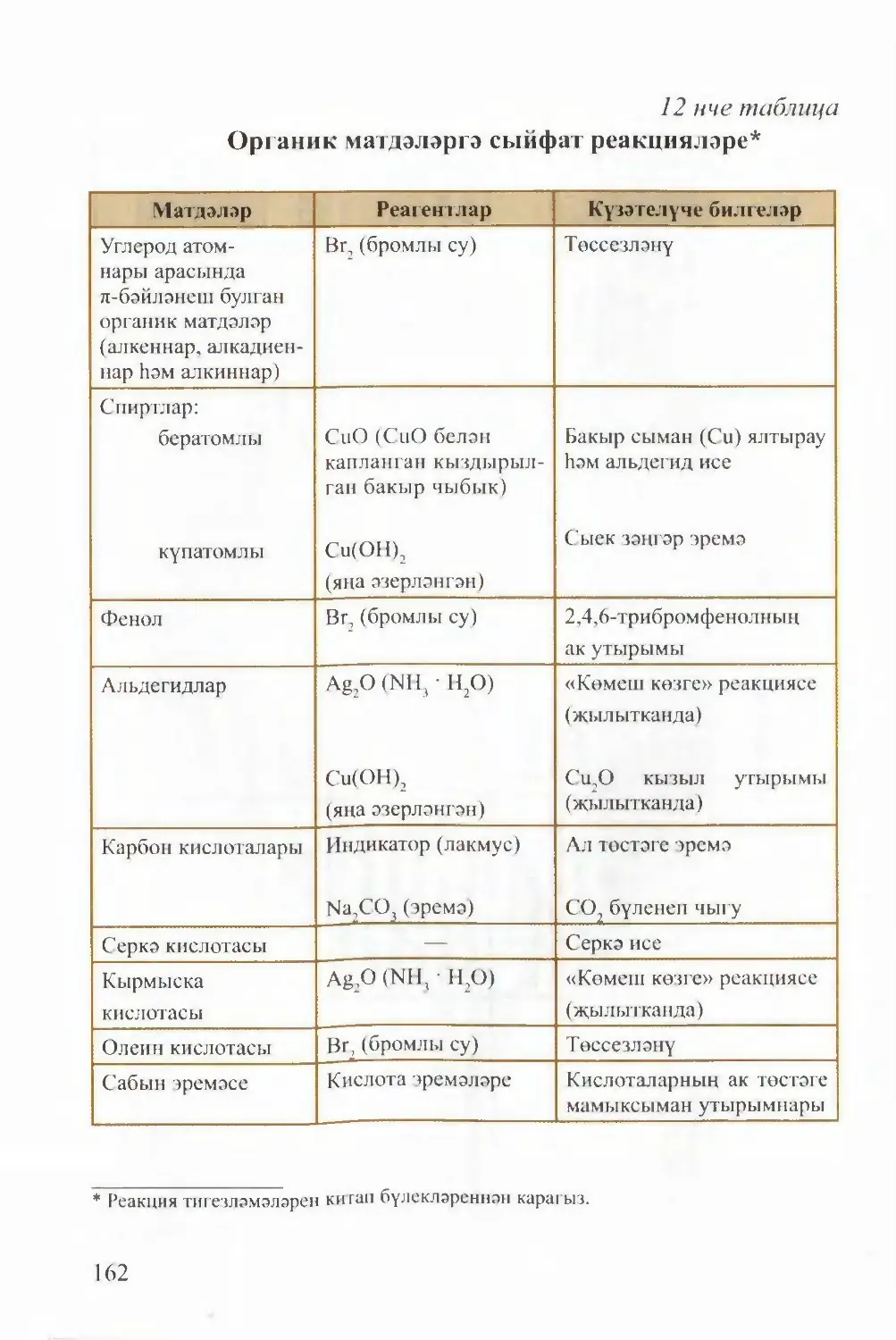
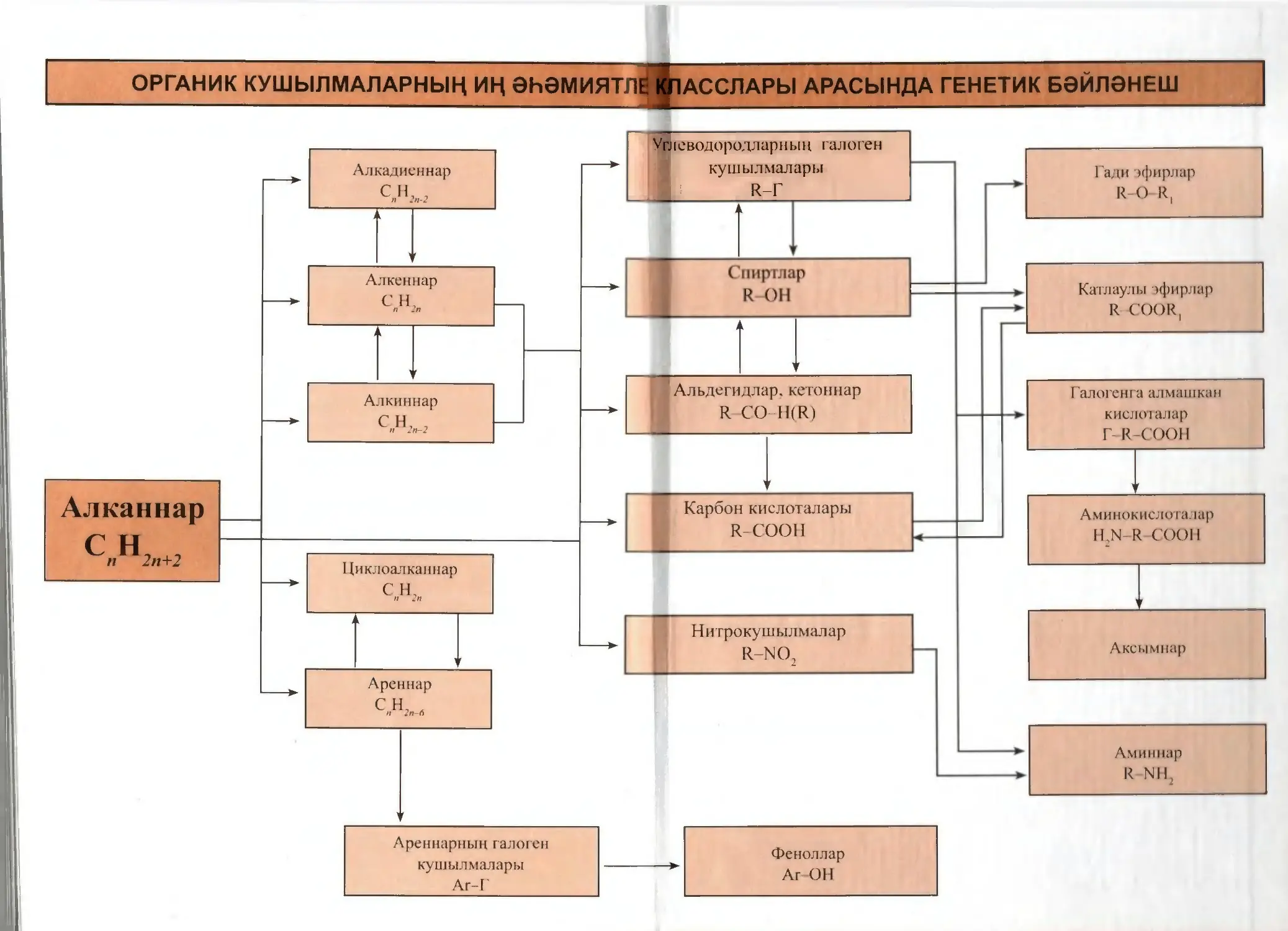
Текст
И.И. НОВОШИНСКИЙ
Н.С. НОВОШИНСКАЯ
БАЗА ДӘРӘҖӘСЕ
УГЛЕВОДОРОДЛАР
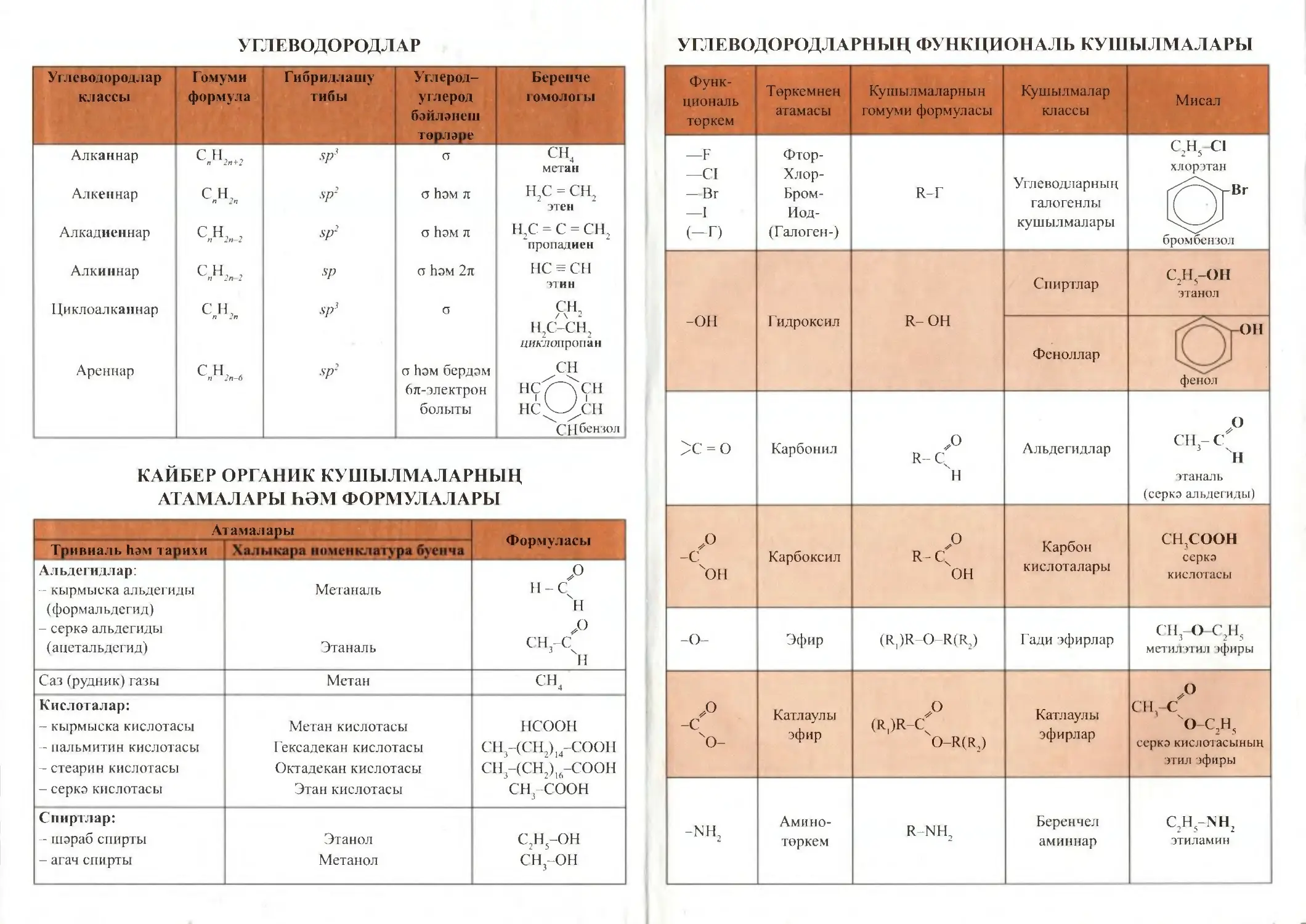
Углеводородлар
классы
Гомуми
формула
Гибридлашу
тибы
Углерод-
углерод
бәйләнеш
төрләре
Беренче
гомологы
Алканнар
сн, +,
п 2п+2
Sp3
O
CH4
метан
Алкеннар
C н,
п 2п
Sp2
<5 ҺӘМ Tt
H2C = CH2
этен
Алкадиеннар
СН, ,
п 2п-2
Sp2
а һәм тг
H2C = C = CH2
"пропадиен
Алкиннар
СН, ,
п 2п-2
Sp
о һәм 2л
HC-CH
этин
Циклоалканнар
с н,
п 2п
Sp3
O
сн,
H2C-CH2
циклопропан
Ареннар
с н,_
п 2п-6
Sp2
о һәм бердәм
6л-электрон
болыты
CH
нс/~\сн
нс<_у,сн
CH бензол
КАЙБЕР ОРГАНИК КУШЫЛМАЛАРНЫҢ
АТАМАЛАРЫ ҺӘМ ФОРМУЛАЛАРЫ
Атамалары
Формуласы
Тривиаль һәм тарихи
Халыкара номенклатура буенча
Альдегидлар:
- кырмыска альдегиды
(формальдегид)
- серкә альдегиды
(ацетальдегид)
Метаналь
Этаналь
P
H-C
4H
P
CH3-C4
H
Саз (рудник) газы
Метан
CH4
Кислоталар:
- кырмыска кислотасы
- пальмитин кислотасы
- стеарин кислотасы
- серкә кислотасы
Метан кислотасы
Гексадекан кислотасы
Октадекан кислотасы
Этан кислотасы
HCOOH
CH3-(CH2)14-COOH
CH-(CH2)14-COOH
CH3-COOH
Спиртлар:
- шәраб спирты
- агач спирты
Этанол
Метанол
C2H5-OH
CH-OH
УГЛЕВОДОРОДЛАРНЫҢ ФУНКЦИОНАЛЬ КУШЫЛМАЛАРЫ
Функ¬
циональ
төркем
Төркемнең
атамасы
Кушылмаларның
гомуми формуласы
Кушылмалар
классы
Мисал
-F
-CI
-Br
—I
(-D
Фтор-
Хлор-
Бром-
Иод-
(Галоген-)
R-Г
Углеводларның
галогенлы
кушылмалары
C2H5-Cl
хлорэтан
бромбензол
-OH
Гидроксил
R-OH
Спиртлар
C2H-OH
этанол
Феноллар
фенол
үОН
>с = о
Карбонил
=C O
Альдегидлар
P
CH3-C
этаналь
(серкә альдегиды)
-C0
"он
Карбоксил
ОЛС
Я
Карбон
кислоталары
CH3COOH
серкә
кислотасы
-O-
Эфир
(R1)R-O-R(R2)
Гади эфирлар
CH3-O-C2H5
метилэтил эфиры
I
ZfX
? °
Катлаулы
эфир
.°
(R1)R-Cx
O-R(R2)
Катлаулы
эфирлар
P
CH3-C
xO-C2H5
серкә кислотасының
этил эфиры
-NH2
Амино-
төркем
R-NH2
Беренчел
аминнар
C2H-NH2
этиламин
И. И. Новошинский
H. С. Новошинская
ОРГАНИК
Ж1ЖЯ
11
сыйныф
БАЗА ДӘРӘҖӘСЕ
Гомуми белем бирү учреждениеләре өчен дәреслек
Россия Федераци
һәм фән министрлыгы тар
н
анган
Тәрҗемә Татарстан Pecny
һәм фән министрлыгы тарафы
Москва
L «Русское слово»
i,B 2008
Казан
«Хәтер»
2009
ББК 24.1я721
Н74
Новошинский И.И., Новошинская Н.С.
Н74 Органик химия. 11 иче сыйныф. Гомуми белем бирү
учреждениеләре өчен д-лек: База дәрәҗәсе / [ И.И. Новошинский, Н.С.
Новошинская]. - 2 нче басма,- M.: ҖЧҖ «Русское слово - PC», 2008.
ISBN 978-5-9932-0074-3
Русчадан И.Д. Низамов тәрҗ. - ҖЧҖ «Татарстан Республикасы «Хәтер»
нәшрияты», 2009. - 168 б.
ISBN 978-5-94113-311-6
«Органик химия» дәреслеге урта (тулы) гомуми белем бирү стандартына
нигезләнә.
Курсның нигезенә органик кушылмаларны функциональ төркемнәр буенча
классификацияләү салынган. Фактик материалны сайлап алуда иң беренче чират¬
та органик матдәләрнең сәнәгатьтә, авыл хуҗалыгында, медицинада, көнкүрештә
булган практик әһәмияте күздә тотыла.
Дәреслек профиль мәктәпләрдә профиль булмаган класслар өчен (атнага бер
сәгать) һәм гомуми белем бирү мәктәпләре өчен (атнага ике сәгать) кирәк булган
материалны үз эченә ала. Химия дәресләре атнага ике сәгать булганда, укучылар
төп текстны гына түгел, ә уң яктан өзек сызык белән аерып күрсәтелгән текстны
да үзләштерәләр.
IV бүлектә атнага бер һәм ике сәгать булганда өйрәнелә торган, ләкин чыгары¬
лыш укучыларын әзерләгәндә таләп ителми торган материал китерелә.
ББК 24.1я721
Оригинал-макетган басарага кул куелды 29.12.09. Форматы 60x90 V16.
Офсет кәгазе. «Таймс» гарнитурасы. Офсет басма. Басма табагы 10,5.
Тиражы 1150 д. Заказ 0-69
«Идел-Пресс» полиграфия-нәшрият комплексы ААҖ.
420066, Казан, Декабристлар ур., 2.
ISBN 978-5-9932-0074-3
ISBN 978-5-94113-311-6
© ООО «ТИД «Русское слово - PC», 2007, 2008
Все права защищены
© Татарчага тәрҗемә, «Хәтер», 2009
Барлык хокуклар сакланган
Дәреслек белән ничек эшләргә
Сезгә тәкъдим ителә торган дәреслектәге органик химия курсы
8-9 һәм аеруча 10 нчы сыйныфта гомуми һәм неорганик химияне
өйрәнгәндә алган белемнәрегезгә нигезләнеп төзелгән. Органик хими¬
яне өйрәнү өчен атом төзелеше һәм химик бәйләнешләрнең табигате,
химик процесслар үтешенең төп закончалыклары һ.б. турында заман¬
ча күзаллауларны белү зарур.
Курсның нигезенә органик кушылмаларның функциональ төркемнәр
буенча классификациясе салынган. Иң элек төрле типтагы углево¬
дородлар, аннары углеводородларның функциональ кушылмалары
тикшерелә. Мондый тәртиптә язу функциональ төркемнәрне органик
матдәләрнең үзлеген күрсәтүче төп фактор итеп аерып күрсәтергә
ярдәм итә. Фактик материалны сайлап алуда иң беренче чиратта ор¬
ганик матдәләрнең сәнәгатьтә, авыл хуҗалыгында, медицинада,
көнкүрештә булган практик әһәмияте күздә тотыла. Органик кушыл¬
малар класслары арасында һәм шулай ук табигатьтәге барлык органик
һәм неорганик матдәләр арасында булган генетик бәйлелеккә аеруча
зур игътибар бирелә.
Дәреслектән файдаланганда, китапта аерып алып күрсәтелгән
фәнни терминнарга, формулировкаларга, гомумиләштерүләргә игъти¬
бар итегез.
Схемаларны, таблицаларны, рәсемнәрне һәм аларның аңлатмаларын
игътибарсыз калдырмагыз. Алар текстны аңлауны җиңеләйтәләр, аны
ачыклыйлар яисә тулыландыралар.
Кирәкле теманы эзләгәндә, эчтәлеккә мөрәҗәгать итегез, ә
төшенчәләр һәм терминнарны, матдә һәм реакция атамаларын китап
ахырында бирелгән алфавит тәртибендә төзелгән предмет күрсәткече
ярдәмендә табарга мөмкин.
Параграфлар ахырында төрледән-төрле сораулар, биремнәр һәм
мәсьәләләр бирелгән, аларны үтәү сезгә үзләштерелгән белемнәрне
тикшерергә һәм материалны тагын да тулырак аңларга булышлык итәр.
Йолдызчык (*) белән күрсәтелгән биремнәрнең җаваплары дәреслек
ахырында бирелгән.
3
Шартлы билгеләр
! Химия фәне атнага ике сәгать булганда өйрәнелә торган материал.
Аеруча зур игътибар сорала торган материал.
Мәсьәлә чишү, бирем эшләү үрнәге.
Лаборатор тәҗрибә.
Дүрт җавап арасыннан бер дөресен сайлап алу белән
башкарыла торган тест биреме.
4
ОРГАНИК ХИМИЯГӘ КЕРЕШ
U
ОРГАНИК ХИМИЯ ПРЕДМЕТЫ. ОРГАНИК КУШЫЛМАЛАР
ҺӘМ АЛАРНЫҢ РЕАКЦИЯЛӘРЕ ҮЗЕНЧӘЛЕКЛӘРЕ
Органик матдәләр кеше тормышында бик зур әһәмияткә ия. Бо¬
рынгы заманнардан ук кешеләр крахмал, майлар, төрле сумала кебек
матдәләрне киң кулланганнар, шәраб әзерләгәннәр, шикәр камышын¬
нан шикәр, әчегән шәрабтан серкә, ә үсемлекләрдән эфир матдәләр
һәм буягычлар таба белгәннәр. Барлык бу матдәләр дә үсемлек яки
хайваннардан килеп чыгышлы булган.
Хәзерге вакытта безне әйләндереп алган органик матдәләрнең саны
күп тапкыр артты. Аларның берләре - углеводлар, майлар, аксымнар
һ.б. - табигый матдәләр. Алар бик зур роль уйныйлар, чөнки Җирдәге
тормыш аларның әверелешләренә бәйле. Калганнарын - синтетик юу
чараларын һәм сүсләрне, пластмассалар һәм каучукларны, уңышны
арттыручы матдәләрне һ.б. синтетик юл белән табалар. Барлык бу
матдәләр безнең тормышка шуның кадәр тыгыз килеп кергән, без инде
алардан башка яшәүне күз алдына да китерә алмыйбыз.
Органик матдәләрнең төп үзенчәлекләре - аларның барысында да
углерод булуда. Шулай итеп, углеродның барлык кушылмалары да
(углерод оксидлары, карбон кислотасы һәм аның тозлары, металл
карбидларыннан кала) органик матдәләргә керә. Аларның төзелешен,
табу юлларын, үзлекләрен, практик куллану юлларын органик химия
өйрәнә дә инде.
Органик химия - углерод кушылмалары турындагы фән.
«Органик» атамасы бу матдәләргә XIX гасыр башында бирелгән.
Элек бу матдәләр тере организмнарда гына барлыкка килә ала дип
исәпләгәннәр. Ләкин XIX гасыр уртасына инде иң гади органик
матдәләр неорганик матдәләрдән табыла. 1824 елда немец хими¬
гы Ф.Велер тарихта иң беренче булып неорганик матдәдән органик
матдә - кузгалак кислотасын синтезлый, ә 1828 елда ул мочевина таба
(кеше һәм хайваннар организмында аксымнар таркалу продукты). Ве¬
лер моның турыда шул вакытның атаклы галимнәренең берсе - швед
5
химигы Й.Берцелиуска болай дип яза: «Мин башка әйтми булдыра
алмыйм, һәм сезгә җиткерергә тиешмен, мин мочевинаны эт, кеше
ярдәменнән башка һәм гомумән нинди дә булса тереклек иясе катна¬
шыннан башка таба алам...»
Велер тәҗрибәләре органик синтезга нигез сала. 1842 елда рус
галиме Н.Н.Зинин анилин таба, аны элек табигый буяу - индигодан
таба торган булганнар. 1845 елда немец химигы А.Кольбе серкә кис¬
лотасы синтезлый, 1854 елда француз галиме М.Бертло ясалма юл
белән майлар таба (ацетиленны табучы да ул), 1861 елда рус химигы
А.М.Бутлеров шикәрле матдә синтезлый.
Органик кушылмаларны неорганик матдәләрдән синтезлау бу
матдәләр арасында кискен чик булмавын күрсәтә. Биология курсын¬
дагы «углеродның табигатьтә әйләнеше» темасыннан белгәнегезчә,
неорганик матдәләрдән органик матдәләр барлыкка килә, соңгылары
исә неорганик матдәләргә әверелергә мөмкин. Димәк, табигатьтә
барлык матдәләр дә бер-берсе белән бәйләнгән һәм бербөтен.
Ләкин органик кушылмалар берничә үзенчәлеккә ия (1 нче табл.), һәм
бу үзенчәлекләр аларны неорганик матдәләрдән аера. Бу үзенчәлекләр
органик химияне химия фәненең аерым өлкәсе итеп бүлеп өйрәнергә
сәбәп булып тора.
1 нче таблица
Неорганик һәм органик матдәләрне чагыштыру
Неорганик матдәләр
Opi aHHK матдәләр
Барлык неорганик матдәләр соста¬
вына да кергән бер генә химик эле¬
мент та юк.
Барлык органик матдәләрнең состав
өлеше булып углерод тора.
Неорганик матдәләр ясалуда Перио¬
дик системаның барлык элементла¬
ры да диярлек катнаша. Мәсәлән,
балчык һәм су, чәй содасы һәм аш
тозы, сульфидлар һәм нитратлар һ.б.
төрле элемент атомнарыннан тора.
Органик матдәләр ясалуда углерод¬
тан башка аз сандагы элементлар кат¬
наша. Аларның составына һәрвакыт
диярлек водород, еш кына кислород
һәм азот, сирәгрәк күкерт, фосфор,
галогеннар керә. Мәсәлән, күп кенә
органик матдәләр ике генә элемент¬
тан - углерод һәм водородтан гына
торалар (метан, пропан, парафин
һ.б.), калганнары өч элементтан —
углерод, водород һәм кислородтан
торалар (спиртлар, органик кислота¬
лар, углеводлар, майлар һ.б.).
6
Неорганик матдәләр
Органик матдәләр
Неорганик матдәләр саны меңнәр
белән исәпләнелә (барлыгы 500 мең
тирәсе билгеле).
Органик кушылмалар саны берничә
миллион (15 млн нан артык).
Молекулалары кислород, күкерт,
фосфор, кремний яки азотның
бертөрле атомнарының озын булма¬
ган (2-8 атом) чылбырыннан ясал¬
ган неорганик матдәләр саны аз.
Органик матдәләрнең күптөрлелек
сәбәпләренең берсе - углерод
атомнарының бер-берсе белән ку¬
шылып чикләнмәгән озынлыктагы
һәм төрле төзелештәге (туры, тармак¬
ланган, циклик) чылбырлар хасил
итә алуы.
Күпчелек неорганик матдәләр ион¬
лы яисә поляр ковалент бәйләнеш
ярдәмендә ясалганнар. Шуңа күрә
неорганик матдәләр күбесенчә мо¬
лекуляр булмаган төзелешкә ия,
каты һәм югары температурада гына
эрүчән булалар, электролитларга
керәләр.
Органик кушылмаларның моле¬
кулаларында углерод атомнары
белән бүтән элементлар арасында
бәйләнеш ковалент һәм аз поляр,
углерод атомнары арасында поляр
түгел. Шуңа күрә күпчелек органик
матдәләр молекуляр төзелешле, һәм
алар түбән температурада эрүчән
газлар, сыеклыклар, каты матдәләр
булалар, алар электролит булмаган
матдәләргә керәләр.
Күпчелек неорганик матдәләр яну-
чан түгел (һавада янмыйлар).
Күпчелек органик матдәләр янучан
(һавада яналар).
Неорганик матдәләр тере булмаган
табигатьнең төп материаллары бу¬
лып торалар.
Органик кушылмалар - үсемлек һәм
хайван организмнары (тере табигать)
өчен төп төзелеш материаллары.
Органик кушылмаларның реакцияләре һәм неорганик матдәләр
реакцияләре бер үк төрле законнарга буйсыналар, ләкин кайбер
үзенчәлекләре бар:
• неорганик матдәләр реакцияләре күп очракта — тиз, кайчакта
мизгел эчендә уза;
• органик кушылма реакцияләренә зур булмаган тизлек хас, аны
арттыру өчен температураны, кайчак басымны арттырырга, ка¬
тализатор өстәргә кирәк. Шуңа күрә органик матдәләр катнашын¬
да баручы реакция тигезләмәләренә, кагыйдә буларак, аларның үтү
шартларын язалар;
• органик матдәләр тәэсир итешкәндә еш кына өстәмә реакцияләр
дә бара, шуңа күрә күрсәтеләгән продуктның чыгышы күп вакыт зур
булмый (кайчак 50 % тан ким).
7
Органик матдәләр катнашында баручы реакцияләрне дә, неорганик
матдәләр катнашында баручы реакцияләр кебек, бер үк төрле билгеләр
ярдәмендә классификациялиләр, ләкин кайбер очракларда специфик
атамалар кулланалар. Мәсәлән, таркалу реакциясен аерып алу реак¬
циясе дип әйтәләр һ.б.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Табигый һәм синтетик органик матдәләргә мисаллар китерегез.
2. Органик матдәләрнең үзенчәлекләрен неорганик матдәләр белән
чагыштырып санап чыгыгыз.
Q 3. Неорганик матдәләрдән аермалы буларак органик матдәләр:
а) һавадан авыррак;
б) барысы да диярлек яна;
в) яктыда таркалалар;
г) суда яхшы эриләр.
4. Химик реакция тигезләмәләрен төгәлләгез һәм электрон баланс
методы ярдәмендә коэффициентлар куегыз. Кайсы реакция бер үк
вакытта оксидлашу-кайтарылу, эндотермик, гомоген һәм таркалу
реакциясе булып тора:
а)СО + О —в)С,Н +О,
б)н2о А; г)CuO+ H2 -4.
Органик матдә катнашында барган реакцияне күрсәтегез.
5*. 3 моль метан янганда барлыкка килгән углерод (IV) оксидының
массасын исәпләгез.
|2
ОРГАНИК КУШЫЛМАЛАР ТӨЗЕЛЕШЕ ТЕОРИЯСЕ
ТЕОРИЯ БАРЛЫККА КИЛҮНЕҢ АЛШАРТЛАРЫ
XIX гасыр уртасына органик химиядә гаять зур эксперименталь
материал җыелган була. Ләкин һәр табылган яңа матдәне калган¬
нарына бәйсез рәвештә тикшерәләр, галимнәр аңлата алмаган күп
кенә фактлар була. Мәсәлән, ни өчен углерод шуның кадәр күп ку¬
8
шылмалар барлыкка китерә (белгәнегезчә, органик матдәләр неорга-
ник матдәләрдән күпкә артык)? Ни өчен сыйфат һәм микъдар соста¬
вы ягыннан бертөрле булган матдәләрнең үзлекләре төрле? Мәсәлән,
глюкоза һәм фруктозаның составы бертөрле C6HpO6, ә үзлекләре төрле.
Органик кушылмаларда углеродның валентлыгы ачык билгеле булмый,
чөнки күбесенең микъдар составы углеродның валентлыгына туры
килмәгән кебек тоела: C2H6, C3H8, C2H4, C2H2 һ. б.
Шул ук вакытта үсеп баручы сәнәгать һәм сәүдә табигать бирә алмый
торган матдәләр табуны таләп итә. Текстиль сәнәгатенә - буяулар, меди¬
цинага дару препаратлары кирәк була, авыл хуҗалыгы продукцияләре
эшкәртү методларын камилләштерү сорала һ.б. Ләкин органик матдәләр
синтезлау өчен яңа методларны үстерүгә практик мәсьәләләрне теоре¬
тик дәлилләүнең җитәрлек дәрәҗәдә булмавы комачаулый.
Бу вакытка инде кайбер мөһим ачышлар ясала: инглиз химигы
Э.Франклэнд элементларның валентлыгы турында төшенчә кертә, не¬
мец галимнәре Ф.Кекуле һәм А.Кольбе углеродның органик кушылма¬
ларда дүрт валентлы булуын дәлиллиләр, шотланд эзләнүчесе А.Купер
һәм немец химигы Ф.Кекуле, бер-берсенә бәйсез рәвештә, углерод
атомнарының бер-берсе белән чылбыр ясап кушыла алуларын ачык¬
лыйлар.
Әмма болар аерым фактлар, идеяләр генә була. Ә фәнгә экспери¬
мент һәм күзәтү нәтиҗәләрен аңлатучы гына түгел, яңа синтезларны
алдан әйтүче теория дә кирәк була. Мондый теорияне, үзенең элгәр
хезмәттәшләренең эшләренә таянып, атаклы рус химигы Александр
Михайлович Бутлеров иҗат итә.
Александр Михайлович Бутлеров
(1828-1886)
Pyc химигы, Казан һәм Петербург университет¬
ларының профессоры, Россия Фәннәр академия¬
сенең академигы, органик химиянең нигезен
тәшкил иткән химик төзелеш теориясен иҗат итүче,
безнең илдә иң зур химик-органиклар мәктәбен
оештыручы. А.М.Бутлеров, үзенең химик төзелеш
теориясенә нигезләнеп, «Органик химияне тулы-
сынча өйрәнүгә кереш» дигән фән тарихында бе¬
ренче кулланманы яза. Галим күп кенә органик кушылмаларның изоме-
риясен алдан әйтә һәм өйрәнә, полимерлашу реакциясен тикшерә, зур
молекулалы кушылмалар синтезын нигезли. Күп кенә органик кушылма¬
лар синтезлый.
9
ОРГАНИК КУШЫЛМАЛАРНЫҢ ХИМИК ТӨЗЕЛЕШ
ТЕОРИЯСЕНЕҢ ТӨП КАГЫЙДӘЛӘРЕ
А.М.Бутлеров үзе иҗат иткән теориянең төп кагыйдәләрен 1861 елда
бәян итә. Заманча төшенчәләр һәм терминнарны кулланып, органик
кушылмаларның химик төзелеш теориясе асылын берничә кагыйдә
рәвешендә чагылдырырга була.
1. Органик матдә молекулаларында атомнар бер-берсе белән ва-
лентлыкларына тиңдәш рәвештә билгеле бер эзлеклелектә химик
бәйләнешләр ярдәмендә тоташканнар. Углерод органик кушылмалар¬
да нәрвакыт дүрт валентлы.
Молекулада атомнарның тоташу тәртибен А.М.Бутлеров химик
төзелеш дип атаган.
Органик кушылма молекуласының химик төзелешен шушы матдә
өчен бердәнбер булган структур формула (җәелгән яки кыскартыл¬
ган) ярдәмендә күрсәтәләр. Җәелгән формулада сызыклар ярдәмендә
барлык бәйләнешләрне дә (ягъни сызыклар саны атомнарның валент-
лыгына туры килә), ә кыскартылганында углерод атомнары арасында¬
гы бәйләнешләрне генә тамгалыйлар.
Мәсәлән, пропан C3H8 молекуласында атомнар түбәндәге тәртиптә
бәйләнгән:
HHH
I I I
H-C-C-C-H
I I I
HHH CH3-CH2-CH3
җәелгән структур кыскартылган структур
формула формула
Водород һәм углерод атомнары бер молекулага бәйләнгәннәр, водо¬
род атомнарының валентлыгы - бергә, углерод атомнарыныкы дүрткә
тигез. Өч углерод атомы бер-берсе белән C-C бәйләнешләре ярдәмендә
бәйләнгән.
Углерод атомнарының бер-берсе белән чылбыр ясап тоташа
алуы - органик кушылмалар күптөрлелегенең бер сәбәбе.
Кайчак электрон формулалар белән файдаланалар, белгәнегезчә,
аларда ковалент бәйләнешне шартлыча нокталар ярдәмендә тамга¬
лыйлар. Электрон формула шулай ук молекулада атомнарның тоташу
тәртибен күрсәтә:
10
HHH
н : с: с : с : н
н н н
пропан молекуласының
электрон формуласы
Шуны истә тотарга кирәк: молекуланың структур һәм электрон
формулалары атомнарның тоташу эзлеклеген генә чагылдыра, ә
атомнарның пространствода ничек урнашуын күрсәтми. Шуңа күрә,
пропанның структур формуласын ничек кенә сурәтләсәк тә:
CH3-CH-CH3 яки CH3-CH2,
CH3
бу бер үк молекула формуласы була, чөнки атомнарның тоташу тәртибе
үзгәрми.
2. Органик кушылмаларның үзлекләре (физик һәм химик) аларның
сыйфат һәм микъдар составына гына түгел, ә молекулада атомнар¬
ның урнашу тәртибенә дә, ягъни молекуланың химик төзелешенә дә
бәйле.
Шулай итеп, бер үк составлы (бертөрле молекуляр формула
белән тасвирлана торган) һәм бер үк моляр массалы матдәләр төрле
үзлекләргә ия булырга мөмкин. Мәсәлән, C4Hl0 составына ике матдә
туры килә - бутан (молекуласында ике ян углерод атомы бар) һәм изо¬
бутан (молекуласында өч ян углерод атомы бар):
сн-сн-сн-сн, CH-CH-CH
3 2 2 3 ц 4 IOj 3
бутан
(/ . = -0,5°С)
v каин '
CH3
изобутан
(/ =-11,7 °C)
v каин '
Молекулалары бертөрле сыйфат һәм микъдар составына (ягъни
бертөрле молекуляр формулага) ия, ләкин химик төзелеше төрле һәм
шуңа күрә төрле физик һәм химик үзлекләргә ия булган матдәләрне изо¬
мерлар дип атыйлар.
Изомерлар булу күренеше изомерия (грекчадан isos - бертөрле, охшаш
һәм meros - өлеш, кисәк) дип атала.
Бутан һәм изобутан - изомерлар, чөнки алар бертөрле молекуляр фор¬
мула C4Hio белән тасвирланалар, ләкин структур формулалары төрле.
11
Молекуляр формулалары бертөрле, ләкин төзелешләре төрле бул¬
ган кушылмаларның үзлекләре аерылганга күрә, органик химиядә
ешрак структур формулалардан файдаланалар. Өстенлек кыскартыл¬
ган структур формулаларга бирелә, чөнки алар артык зур түгел һәм
шул ук вакытта молекуладагы атомнарның бәйләнеш тәртибе турында
күзаллау тудыра.
Изомерия — органик матдәләр күптөрлелегенең тагын бер сәбәбе.
Неорганик химиядән аермалы буларак, бу күренеш органик химиядә
бик киң таралган.
3. Кушылмаларның химик үзлекләре молекуланы хасил итүче атом¬
нар яки атомнар төркеменең бер-берсенә тәэсир итешүенә бәйле.
Турыдан-туры бәйләнгән атомнарның бер-берсенә йогынтысы ае¬
руча нык сизелә. Бу атомнарның төрле электр тискәрелеге исәбенә мо¬
лекулада электрон тыгызлыкның кабат бүленүе, бәйләнеш ныклыгына
тәэсир итүче бәйләнеш полярлыгының артуы яки кимүе белән аңлатыла.
Мәсәлән, сульфид кислотасының - көчсез, ә хлорид кислотасы көчле
булуы билгеле. Кислоталарның төрле көче Н-Э бәйләнешләренең по¬
лярлыгы төрле булу белән аңлатыла, бу полярлык атомнарның төрле
электр тискәрелеге белән тасвирланырга мөмкин. H-Cl бәйләнеше
H-S бәйләнешеннән аермалы буларак, күбрәк поляр (атомнарның
электртискәрелеге аермасы 0,73 кә тигез, ә H-S ныкы — 0,5), уртак
электрон пары хлор атомына күбрәк авышкан, шуңа күрә мондый
бәйләнеш буенча диссоциация җиңелрәк бара. Органик кушылмалар¬
да да атомнарның бер-берсенә тәэсир итешүен конкрет мисалларда без
алдарак карап үтәрбез.
ХИМИК ТӨЗЕЛЕШ ТЕОРИЯСЕНЕҢ ӘҺӘМИЯТЕ
А.М.Бутлеров тарафыннан иҗат ителгән химик төзелеш теориясе
биргән мөмкинлекләр:
• бик күп фактик материалны гомумиләштерү һәм системалашты¬
ру. Бу органик химиядә чәчәк аткан хаоска тәртип урнаштырырга
ярдәм итә. 1835 елда Ф.Велер Й.Берцелиуска булган хатында юкка
гына болай дип язмаган: «Органик химия хәзер һәркемне дә акылдан
яздырырга мөмкин, ул миңа керергә батырчылык җитмәгән һәм чы¬
гып булмаслык гаҗәеп әйберләрдән, очсыз-кырыйсыз куе чытырман¬
нан торган куе урманны хәтерләтә»;
• яңа матдәләр барлыгын, аларның үзлекләрен һәм табу юлларын
12
алдан әйтү. Бу органик синтезның бик тиз үсешенә булышлык итә,
хәзер аның ярдәмендә төрледән-төрле органик матдәләр: дару пре¬
паратлары, буяулар, ясалма сүсләр һ.б. табалар. Органик синтез
продукциясеннән башка халык хуҗалыгының бер генә тармагы да
яши алмый.
А.М.Бутлеровның заманча күзаллаулар белән тулыландырылган
теориясе бүген дә органик химиядә фундамент булып кала бирә.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
Q 1. Органик кушылмадагы элемент атомнарының валентлыгын табу
өчен нәрсә белергә кирәк:
а) кушылманың сыйфат составын;
б) кушылманың микъдар составын;
в) кушылманың сыйфат һәм микъдар составын;
г) кушылманың сыйфат, микъдар составын һәм молекуласының
химик төзелешен.
Санап үтелгән факторларның кайсысы А.М.Бутлеров теориясе
иҗат ителгәнче билгеле булмаган?
2. Молекуляр формуласы C6H14 булган матдәнең структур форму¬
лаларын (җәелгән һәм кыскартылган) төзегез.
3. Кушылма формулалары буенча углерод атомнарының валентлы¬
гын һәм оксидлашу дәрәҗәләрен билгеләгез һәм аларны углерод
атомнары оксидлашу дәрәҗәсе үсү тәртибендә урнаштырыгыз:
CO,, CH2Cl2, CH3OH, C2H6.
13
ХИМИК ФОРМУЛАЛАРНЫ ЧЫГАРУ
Матдәнең молекуляр формуласын берничә ысул белән чыгарырга
була:
1) матдәнең чагыштырма тыгызлыгы һәм элементларның масса
өлешләре буенча;
2) матдәнең чагыштырма тыгызлыгы һәм яну продуктларының
массасы (күләме яисә матдә микъдары) буенча (бу ысулны янучан
матдәләргә карата кулланырга була).
13
МАТДӘ ФОРМУЛАСЫН АНЫҢ ЧАГЫШТЫРМА ТЫГЫЗЛЫГЫ
ҺӘМ ЭЛЕМЕНТЛАРНЫҢ МАССА ӨЛЕШЛӘРЕ БУЕНЧА ЧЫГАРУ
Мондый типтагы мәсьәләләр чишүне түбәндәге эзлеклелектә алып
барырга була:
1. Водород яки һава буенча чагыштырма тыгызлыкка нигезләнеп
матдәнең моляр массасын исәпләргә:
А/(газ) = 2£>|Н(газ);
Л/(газ) = 29£>һам(газ).
2. 1 моль матдәнең массасын исәпләргә.
3. Элементларның билгеле булган масса өлешләренә нигезләнеп
1 моль матдәдәге һәр элементның атомнар массасын исәпләргә:
/ң(Э) = ш(Э) • И матдә) = ш(Э) • 1 моль • М(матдә)
4. 1 моль матдәдәге элемент атомнарының матдә микъдарын
билгеләргә:
НЭ)
у(Э) = -^-
’ М(Э)
5. Матдәнең молекуляр формуласын язарга.
1 нче мәсьәлә. Углеродның масса өлеше 82,75%, водо¬
родныкы 17,25% булган матдәнең формуласын табыгыз.
Бу матдә парларының водород буенча тыгызлыгы 29 га
тигез.
Бирелгән:
W(C) = 82,75%
HH)= 17,25%
D (C H ) = 29
Н2 v х у'
Табарга: C H
Чишү
1. Матдәнең моляр массасын исәплибез:
M(CH) = 2DH2(CH);
M(CxH ) = 2 г/моль ■ 29 = 58 г/моль.
2. 1 моль матдәнең массасын исәплибез:
HCrH,) = AY(CvHv) • V(CvIlv);
HC Н ) = 58 г/моль = 58 г.
14
3. 1 моль матдәдәге углерод һәм водородның массаларын табабыз:
w(C) = W(C) • W(CxHy); w(C) = 0,8275 • 58 г = 48 г;
w(H) = да(Н) • w(C Hy); w(H) = 0,1725 • 58 г = 10 г.
4. 1 моль матдәдәге углерод һәм водород атомнарының матдә микъ¬
дарын табабыз:
w(C) 48 г
V(C)'MQ; V(C) ■ - 4 “°”ь;
w(H) Юг
v(H) = ; v(H) = —— = 10 моль.
M(H) 1 г/моль
5. Матдәнең молекуляр формуласын язабыз. Моның өчен углерод
һәм водород атомнары матдә микъдарының нисбәтен табабыз:
v(C): v(H) = 4 : 10 => матдә формуласы C4H10 - бутан.
Җавап: матдәнең формуласы C4H10.
МАТДӘ ФОРМУЛАСЫН АНЫҢ ЧАГЫШТЫРМА ТЫГЫЗЛЫГЫ
ҺӘМ ЯНУ ПРОДУКТЛАРЫНЫҢ МАССАСЫ (КҮЛӘМЕ ЯИСӘ
МАТДӘ МИКЪДАРЫ) БУЕНЧА ЧЫГАРУ
Бу типтагы мәсьәлә шартларында яндырыла торган матдәнең мас¬
сасы, аның водород яки һава буенча чагыштырма тыгызлыгы һәм яну
продуктларының массасы, күләме яки матдә микъдары күрсәтелә.
Мәсьәләне чишү өчен түбәндәге алгоритмны кулланырга була:
1. Чагыштырма тыгызлыгы буенча матдәнең моляр массасын
исәпләргә.
2. Углерод (IV) оксиды һәм углерод атомнарының матдә микъдарын
исәпләргә:
W(CO7)
-Дсог) '
3. Cy һәм водород атомнарының матдә микъдарын исәпләргә:
V(H7O) = ’’ ■ V(H) = 2v(H О).
2 M(H2O)
15
4. Яну продуктларындагы һәм башлангыч матдәдәге углерод һәм во¬
дород массаларын табарга:
w(C) = V(C) ■ M(C); w(H) = V(H) • M(H).
5. Углерод һәм водород массаларының суммасын табарга.
Әгәр дә аларның суммасы матдә массасына тигез икән, димәк, бу
матдә - углеводород.
Әгәр дә углерод һәм водород массалары суммасы матдә массасыннан
кимрәк икән, димәк, аның составына өченче элемент - кислород керә.
Бу очракта аның массасын һәм матдә микъдарын исәпләргә кирәк.
6. Углерод, водород һәм, әгәр дә матдәдә кислород булса, матдә
микъдарларының нисбәтен табарга.
7. Матдәнең иң гади формуласын язарга, аның ярдәмендә матдәнең
моляр массасын исәпләргә һәм мәсьәлә шарты буенча исәпләнгән мо¬
ляр масса белән чагыштырырга (1 нче пункт).
Әгәр дә иң гади формула ярдәмендә исәпләнгән моляр масса мәсьәлә
шарты буенча бирелгәненнән кимрәк икән, ул чакта матдәнең молеку¬
ляр массасын чыгару өчен чын молекуляр массаны иң гади форму¬
ла ярдәмендә исәпләнгән моляр массага бүләргә кирәк. Аннары чын
моляр масса иң гади формулага туры килүче моляр массадан ничә
тапкыр зуррак булса, иң гади формуладагы индексларны шул тапкыр
арттырырга кирәк.
2 нче мәсьәлә. 0,57 г органик матдәне артыгы белән
алынган кислород катнашында яндырганда 1,76 г угле¬
род (IV) оксиды һәм 0,81 г су барлыкка килгән. Әгәр дә
бу матдә парларының һава буенча чагыштырма тыгыз¬
лыгы 3,931 гә тигез булса, аның молекуляр формуласын
чыгарыгыз.
Бирелгән:
W(Maiyio) = 0,57 г
w(CO,)= 1,76 г
W(H1O) = 0,81 г
Чаза (МЭТДЭ) = 3’93 1
Табарга: матдә
формуласын
Чишү
1. Матдәнең моляр массасын исәплибез:
А/( матдә) = 29DhaBa (матдә);
А7( матдә) = 29 г/моль • 3,931 = 114 г/моль.
2. Углерод (IV) оксиды һәм углерод
атомнарының матдә микъдарын исәплибез:
16
от(СО,) 1,76 г
V(CO2) = . „гп ү ’ v(C02) = TT^ =0,04 моль;
v 27 Af(CO2) 44 г/моль
v(C) = V(CO2) = 0,04 моль.
3. Cy һәм водород атомнарының матдә микъдарын исәплибез:
от(Н,О) 0,81 г
v(H О) = ; v(H.O) = —— = 0,045 моль;
1 2 7 Af(H2O) 2 18 г/моль
v(H) = 2v(H2O); v(H) = 2 • 0,045 моль = 0,09 моль.
4. Башлангыч матдәдәге углерод һәм водородның массаларын бил¬
гелибез:
от(С) = V(C) • Af(C);
от(С) = 0,04 моль • 12 г/моль = 0,48 г;
от(Н) = V(H) • Af(H);
от(Н) = 0,09 моль • 1 г/моль = 0,09 г.
5. Углерод һәм водород массалары суммасын исәплибез:
от(С) + W(H) = 0,48 г + 0,09 г = 0,57 г.
Углерод һәм водородның суммар массасы башлангыч матдәнең мас¬
сасына туры килә, димәк, аның составында кислород юк, бу - углево¬
дород.
6. Углерод һәм водород атомнары матдә микъдарының нисбәтен та¬
бабыз:
v(C): V(H) = 0,04 : 0,09 = 4:9.
7. Матдәнең иң гади формуласын табабыз һәм аның буенча молеку¬
ляр массасын исәплибез.
Матдәнең иң гади формуласы C4H9;
Af(C4H9) = 57 г/моль (чыныннан кимрәк).
8. Матдәнең молекуляр формуласын билгелибез.
от(С H ) 114 г
vfcA) = ИСҖ) = = 2 => <СА). => с,н„.
Җавап: матдәнең молекуляр формуласы CgH18.
17
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1*. Углеродның масса өлеше 80% булган углеводородның молеку¬
ляр формуласын табыгыз. Аның парларының водород буенча ча¬
гыштырма тыгызлыгы 15 кә тигез.
2*. Матдәдәге углеродның масса өлеше — 45,86%, хлорныкы —
45,22%, ә калганы водород. Бу матдәнең һава буенча чагыштырма
тыгызлыгы 2,707 гә тигез. Матдәнең молекуляр формуласын чы¬
гарыгыз.
3*. 4,3 г органик матдәне яндырганда 13,2 г углерод (IV) оксиды
һәм 6,3 г су табалар. Әгәр дә бу матдә парларының водород буенча
чагыштырма тыгызлыгы 43 кә тигез булса, аның молекуляр фор¬
муласын табыгыз.
4*. 6 г органик матдәне яндырганда 13,2 г углерод (IV) оксиды һәм
7,2 г су барлыкка килгән. Әгәр дә бу матдә парларының һава буен¬
ча чагыштырма тыгызлыгы 2,069 га тигез булса, аның молекуляр
формуласын билгеләгез.
18
I. УГЛЕВОДОРОДЛАР
Органик матдәләрнең аерым вәкилләре белән танышуны углеводо¬
родлардан башларбыз. 9 нчы сыйныф химия курсыннан белгәнегезчә,
углеводородлар - сыйфат составы ягыннан иң гади органик кушылма,
аларның молекулалары углерод һәм водород атомнарыннан гына тора.
Углерод атомнары арасындагы бәйләнеш үзенчәлекләренә бәйле
рәвештә углеводородларны чикле һәм чиксезләргә бүләләр.
I бүлек. Чикле углеводородлар
Чикле углеводородлар - молекулаларындагы барлык углерод атом¬
нары да үзара берле (а) бәйләнеш белән бәйләнгән углеводородлар.
Барлык чикле углеводородларның да халыкара (систематик) номен¬
клатурадагы гомуми атамасы - алканнар.
И
АЛKAHНАРНЫҢ ГОМОЛОГИИ РӘТЕ,
НОМЕНКЛАТУРАСЫ ҺӘМ ИЗОМЕРИЯСЕ
АЛКАННАРНЫҢ ГОМОЛОГИИ РӘТЕ
Алканнарның иң гади вәкиле - метан CH4.
Метан молекуласының төзелешен электрон һәм структур формула¬
лар ярдәмендә чагылдырып була:
H
н : с : н
н
H
|а
H-C-H
|О
H
Чикле углеводородларга шулай ук этан C2H6, пропан C3Hft, һ.б. керә.
Углеводородларның составын тикшергәндә, сез бу рәтнең һәр киләсе
әгъзасы үткәненнән CH2 төркеменә аерылганын күрәсез.
Төзелешләре һәм химик үзлекләре белән охшаш, ләкин молекула соста¬
вы буенча бер-берсеннән бер яки берничә CH2 төркеменә аерылучы
матдәләр гомологлар дип аталалар-.
19
CH3- CH3 CH3- CH2- CH3
гомологлар
Чагыштырма молекуляр массалары үсү тәртибендә урнашкан
гомологлар гомологик рәт барлыкка китерә. CH2 төркемен гомо-
логик аерма дип атыйлар. Алканнарның гомологик рәтендәге бар¬
лык кушылмаларның составы түбәндәге гомуми формула белән
күрсәтелә: _
C H7 +7, п > 1
п 2п+27 —
Бу формулада п - углерод атомнары саны. Мәсәлән, п = 7 булганда
ал канның составы C7H1, - гептан.
7 Io
Чикле углеводородларның беренче дүрт вәкиле тарихи килеп чы¬
гышлы атамага ия (2 нче табл.). Калган чикле углеводородларның
атамалары грек һәм латин саннарына -ан кушымчасы кушып ясала:
пентан, гексан һ. б.
2 нче таблица
Чикле углеводородларның һәм аларның алкил радикалларының
гомологик рәте
Углеводо¬
родный
атамасы
Алканның
молекуляр
формуласы
С.н~,
Мөмкин
булган
изомерлар
саны
Радикалның
молекуляр
формуласы
-сн2я+;
Радикалның
атамасы
Метан
CH4
—
-CH3
Метил
Этан
C2H6
—
-C7H3
Этил
Пропа//
C4Hk
—
-C3H7
Пропил
Бутан
C4H10
2
-C4H9
Бутил
Пентан
C5H12
3
-C5H11
Пентил
Гексан
C6H14
5
-C9H13
Гексил
Гептан
C7H16
9
-C7H15
Гептил
Октан
C8H18
18
-C8H17
Октил
Нонан
C9H70
35
-C9H19
Нонил
Декан
C10H22
75
-C10H21
Децил
Эйкозан
C20H42
366319
-C20H41
Эйкозил
20
Алкан молекуласыннан бер водород атомын аерып алганда, углево¬
дород радикалы (R) барлыкка килә; аның атамасы тиңдәшле углеводо¬
род атамасындагы -ан кушымчасын -ил га алмаштыру белән ясала:
CH4 =>-CH3 C2H6 =>-C2H5 һ.б.
метал метол этан этал
Радикаллар составын -СпН2я+/ гомуми формуласы белән күрсәтәләр
(2 нче табл.).
АЛКАННАР ИЗОМЕРИЯСЕ
Алканнарга структур изомерия — углерод скелеты (углерод чыл¬
быры) изомериясе хас. Алканнарның гомологик рәтендәге беренче өч
әгъзаның изомеры юк. Метан, этан һәм пропан молекулаларында угле¬
род атомнарының бәйләнеш тәртибе бер генә төрле булырга мөмкин:
H HH HHH
I Il Ill
H-C-H H-C-C-H H-C-C-C-H
I Il Ill
H HH HHH
Мондый углерод чылбырын тармакланмаган (нормаль) дип атый¬
лар. Калган алкан молекулаларында, бутаннан C4H10 башлап, углерод
чылбыры тармакланмаган да, тармакланган да булырга мөмкин. Тар¬
макланган чылбырда ян углерод атомнары икедән артык һәм барысы
да бер-бер артлы урнашмаган:
CH3-CH2-CH2-CH3
бутан
тармакланмаган чылбыр
сн,
— CH1-CH-CHs
изобутан
тармакланган чылбыр
Изобутан һәм бутан - изомерлар. Аларның сыйфат һәм микъ¬
дар составы бер үк, ләкин углерод скелетының төзелеше төрле. Бу
изомерларның үзлекләре дә төрле (3 нче табл.).
3 нче таблица
Изомер буганнарның физик үзлекләре
Изомер
Формулалары
Температура, "С
Агреат
халәте
молекуляр
структур
эрү
кайнау
Бутан
C4H10
CH3-CH2-CH2-CH3
-138
-0,5
Газ
Изобутан
C4Hl0
CH1-CH-CH,
3 I 3
CH3
-159,6
-11,7
Газ
21
Әгәр C4H10 формуласына ике генә изомер туры килсә, C5H12 состав¬
лы углеводородта алар инде өч, ә C7H16 составлыда - тугыз. Соста¬
вы C10H22 формуласы белән чагылдырылган углеводородлар саны 75.
Димәк, углеводород молекуласындагы углерод атомнары саны арту
нәтиҗәсендә изомерлар саны тиз үсә (2 нче табл.).
АЛКАННАРНЫҢ НОМЕНКЛАТУРАСЫ
Тармакланган чылбырлы углеводородка атама бирү өчен төп һәм ян
чылбырны табарга кирәк. Төп чылбыр күбрәк сандагы бер-бер артлы
тоташкан углерод атомнарыннан тора, ул - иң озыны. Аның белән
берничә ян чылбыр - радикаллар тоташырга мөмкин.
Тармакланган чылбырлы алканга
атама төзү алгоритмы
1. Иң озын углеводород чылбырын сайлап алырга һәм андагы
углерод атомнарын номерлап чыгарга. Номерлауны радикал (алмаш-
тыргыч) якынрак урнашкан баштан башлыйлар. Әгәр дә радикаллар
берничә икән, радикаллар белән бәйләнгән углерод атомнары мини¬
маль номерлар алырлык итеп номерлыйлар, ягъни атамадагы цифрлар
суммасы иң кечкенә булырга тиеш.
2. Радикалларга алфавит тәртибендә атама бирергә (метил, про¬
пил, этил).
3. һәр радикал атамасы алдында аның белән бәйләнгән углерод
атомының номерын күрсәтергә.
4. Әгәр дә бер үк углерод атомы ике бертөрле радикал белән
бәйләнгән булса, бу углерод атомын күрсәтүче цифрны ике тапкыр ка¬
батларга кирәк.
5. Бертөрле радикаллар санын санлы алкушымчалар ярдәмендә
күрсәтергә (ди- - ике, три- - өч, тетра- - дүрт).
Атамадагы барлык цифрларны да сүзләрдән - сызыкчалар, ә бер-
берсеннән өтер белән аералар.
6. Номерланган чылбырдагы углерод атомнары санына карап угле¬
водородка атама бирергә.
1 нче бирем. Төзелеше түбәндәгечә булган алкайны си¬
стематик номенклатура буенча атарга:
CH3
CH-CH-CH-CH-CH,
3I I 3
CH, CH7
3 I 2
CH - CH
22
Чишү
Иң озын чылбырны сайлап алыйк һәм андагы углерод атомнарын
номерлап чыгыйк. Бу очракта номерлауны сул яктан башларга кирәк,
чөнки сул якта иң кырыйдагы радикал икенче углерод атомы белән
бәйләнгән, ә уң якта - дүртенче белән:
п__._сн^_
CH1-CH-CH-CH-1CH,
3 — I 1 5l I 3
CH1 1CH, I
3 I 61 2 1T -
, CH2 - CH3
Алканның атамасын төзик. Аның молекуласында төп чылбырга
кермәгән өч метил радикалы бар, берсе - икенче, берсе - өченче һәм
тагын берсе дүртенче углерод атомында. Шулай итеп, алканның ата¬
масы 2,3,4-триметилгептан.
2 нче бирем. Төзелеше түбәндәгечә булган алканны си¬
стематик номенклатура буенча атарга:
CH3
CH1-CH-CH1-C-CH1
3I 2I 3
CH CH
Чишү
Иң озын чылбырны сайлыйк һәм углерод атомнарын номерлыйк.
Номерлауны уң яктан башларга кирәк. Бу очракта атамадагы цифрлар
минималь булалар: 2, 2 һәм 4. (Сул яктан номерлаганда - 2,4 һәм 4.)
CH1
rCH1-CH - CH1- C - CH11
CH3 CH3
Димәк, бу матдә 2,2,4-триметилпентан.
Молекулада углерод атомнары эзлеклелеге белән аерылучы
изомерларның структур формулаларын төзергә өйрәнү мөһим. Моны
ничек эшләргә икәнен карап үтик.
23
Изомерларның структур формулаларын төзү алгоритмы
1. Бирелгән углерод атомнары санына карап нормаль төзелешле
углеводородның структур формуласын төзергә.
2. Чылбырны акрынлап кыскарта барырга (һәр тапкыр бер углерод
атомына) һәм бер яки берничә радикалның барлык күчереп куярга
мөмкин булган урыннарын эзләргә.
3 нче бирем. C5H12 составлы барлык изомерларның фор¬
муласын төзергә һәм матдәләрне систематик номенкла¬
тура буенча атарга.
Чишү
1. Нормаль төзелешле углеводород формуласын төзик:
CH3-CH2-CH2-CH2-CH3 (1)
пентан
2. Чылбырны бер углерод атомына кыскартыйк һәм -CH3 радикалын
тәңгәл кушылма барлыкка килмәслек итеп күчергәлик (күрсәтмәлелек
өчен углерод атомнары янындагы водород атомнарын төшереп калды¬
рырга да була):
C V с-C-C-C * C C-C-C CH3-CH-CH9-CH, (2)
I Д 1 2 3
I 1 C (ЗН 2-метилбутан
3. Углерод чылбырын тагын бер углерод атомына кыскартыйк (бар¬
лыгы ике C атомына) һәм ике -CH3 радикалының мөмкин булган
күчереп кую урынын эзлик:
CH3
CH3-C-CH3 (3)
CH3 2,2-диметилпропан
Углерод чылбырын бүтәнчә кыскарту мөмкин түгел, шулай ук
ике -CH3 радикалы урынына бер -C2H5 не дә алып булмый. Ни өчен
икәнен уйлагыз. Шулай итеп, C5H12 составлы барлык изомерларның
структур формулалары төзелде (алар өч).
24
Углерод чылбырын ирекле боргалаулар яңа изомерлар
барлыкка китерми. Шулай
CH-CH-CH9-CH9-CH, һәм CH-CH9
3 2 2 2 3 3 I 2
CH2-CH2
CH3
формулалары бертөрле кушылма - нормаль төзелешле
пентанга туры килә.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Молекуласында 4 углерод атомы булган алкайның молекуляр
һәм структур формулаларын төзегез. Бу алканның ике гомологы
формулаларын китерегез (озынрак һәм кыскарак углерод чылбы¬
рыннан торган). Бу углеводородларны атагыз.
Q 2*. Түбәндәге формулалар белән билгеләнгән матдәләрнең саны:
CH3-CH2-CH2-CH2-CH3
ZCH3
CH3-C-CH3
4CH3
a) 2; 6)3; в) 1;
CH3-CH2
CH2
CH2-CH3
CH3-CH-CH2-CH3,
CH3
г) 4.
3. Түбәндәге углеводородларны атагыз, гомологларының һәм
изомерларының формулаларын күрсәтегез:
a) CH3
CH-C-CH9
3 I 3
CH3
б) CH3
CH3-CH-CH3
в) CH1-CH-CH9
3I I2
CH3 CH3
г) I 3
CH1- C-CH9-CH1
3I 2 3
CH3
Q 4*. Кайсы матдәнең 200 г ында матдә микъдары күбрәк:
a) NO; б) CH4; в) HCl; г) C2H6.
25
5*. 65% метан, 15% этан һәм 5% водородтан, шулай ук башка ян¬
маудан матдәләрдән торган 100 л газ катнашмасы янганда сарыф
ителгән кислород күләмен исәпләп чыгарыгыз.
6*. Углеродның масса өлеше 82,75% булган углеводородның мо¬
лекуляр формуласын билгеләгез. Углеводородның тыгызлыгы
2,59 г/л (н.ш.). Мөмкин булган изомерларның структур формула¬
ларын төзегез һәм аларга атама бирегез.
£5
МЕТАН МОЛЕКУЛАСЫНЫҢ
ЭЛЕКТРОН ҺӘМ ПРОСТРАНСТВОЛЫ ТӨЗЕЛЕШЕ
Метанның электрон һәм структур формулалары молекуланың про-
странстводагы төзелешен күрсәтми. Аны күзаллау өчен метан молеку¬
ласында бәйләнешләр барлыкка килүне карап үтик. Белгәнегезчә, угле¬
род атомында тәэсирләнгән халәттә дүрт парлашмаган электрон бар
(2л12/?3) һәм метан молекуласында углерод 5/?3-гибридлашу халәтендә
була. Дүрт бертөрле гибрид орбитальләре бер-берсенә 109,5° лы поч¬
мак ясап урнашканнар һәм уртасында углерод атомы төше урнашкан
тетраэдр түбәләренә юнәлгәннәр. Болай урнашканда, орбитальләр
бер-берсеннән максималь ераклаша (1а рәс.).
1 нче рәсем. Метан молекуласында химик бәйләнешләрнең барлыкка килүе:
a - углерод атомының дүрт л/Р-гибрид орбитале һәм водород атомнарының дүрт
l.v-орбитале; б - метанның тетраэдрик молекуласы; в - метан молекуласындагы C-H
бәйләнешләренең тетраэдрик юнәлеше
26
C-H ковалент бәйләнешләрнең ясалуы углерод атомының дүрт
у/?3-гибрид орбитале һәм 4 водород атомының 1 .s-орбитальләре арала¬
шу исәбенә барлыкка килә (16 рәс.).
Барлыкка килгән метан молекуласында водород атомнарының
төшләре тетраэдр түбәләрендә урнашкан, водород һәм углерод
атомнарының төшләре арасындагы ара (C-H бәйләнеш озынлыгы)
бертөрле һәм 0,109 нм га тигез, C-H бәйләнешләре арасындагы ва-
лентлык почмагы 109,5° ка тигез (Ie рәс.). Метан молекуласындагы
барлык бәйләнешләр дә орбитальләрнең атом төшләрен тоташты¬
ручы сызык буенча аралашуы исәбенә барлыкка килә. Белгәнегезчә,
мондый бәйләнеш төрен а-бәйләнеш дип атыйлар.
Метан һәм бүтән органик кушылмалар молекулаларының простран-
стволы төзелешен ачык күзаллау өчен, шарчыбыклы һәм масштаблы
модельләр кулланалар (2 нче рәс.).
Шарчыбыклы модельләрне атомнар дип уйланылган шарлардан һәм
алар арасындагы химик бәйләнешне алмаштыручы чыбыклардан ясый¬
лар. Алар молекуладагы атомнарның пространстводагы урнашуын ачык
итеп чагылдыралар, тоташу эзлеклеген күрсәтәләр, ләкин атомнарның
чагыштырмача үлчәмнәре һәм төшара ерак¬
лык турында күзаллау бирмиләр. Чын мо¬
лекулада атомнар модельдәге шарлар кебек
бер-берсеннән алай ук ерак урнашмаганнар,
алар тыгыз тупланганнар.
Дөресрәк күзаллауны масштаблы модель¬
ләр бирә, аларның атомнарны сурәтләүче
детальләре чын үлчәмнәргә карата билгеле
бер масштабта ясалган. Мондый модельләр
органик матдә молекуласын (күләмен һәм
өлешләренең чагыштырма үлчәмнәрен) күз
алдына китерергә ярдәм итә.
Алканнарның калган кушылмалары элек¬
трон һәм пространстволы төзелеше белән
метан молекуласы төзелешенә охшаш.
Шулай итеп, чикле углеводородларда:
• углерод атомнары л/?’-гибридлашу халә¬
тендә була;
• углерод атомнарындагы барлык бәйлә¬
нешләр дә тетраэдр түбәләренә юнәлгән;
• барлык углерод атомнары да бер-берсенә
берле (о) бәйләнеш белән бәйләнгән.
2 нче рәсем. Метан моле¬
куласының модельләре: а -
шарчыбыклы; 6 - масштаблы
27
Әйтелгәннәрдән чыгып алканнарга тулырак билгеләмә бирергә
була.
Алканнар - гомуми формуласы CjH2jj2, молекулаларында барлык
углерод атомнары да хр!-гибридлашу халәтендә булган һәм бер-берсе
белән о-бәйләнешләр белән генә бәйләнгән углеводородлар.
<Х 1 нче лаборатор эш (өйдә эшләнә)
® УГЛЕВОДОРОД ҺӘМ АЛАРНЫҢ ГАЛОГЕН
КУШЫЛМАЛАРЫ МОЛЕКУЛАЛАРЫНЫҢ
МОДЕЛЬЛӘРЕН ЯСАУ
Пластилин һәм агач яки металл чыбык кулланып, молекулаларның
модельләрен ясагыз.
1. Метан молекуласының шарчыбыклы моделе. Бер төстәге
пластилиннан бер үлчәмдәге дүрт шар әзерләгез (водород атомнарын
алыштыра), ә бүтән төстәге пластилиннан диаметры алдагыларыннан
1,5 тапкыр зуррак булган бер шар (углерод атомын алыштыра) ясагыз.
Зуррак үлчәмдәге шар өстенә дүрт нокта тамгалагыз һәм бу урыннар¬
га бер-берсенә 109° почмак ясап чыбыклар кадагыз. Чыбыкларның
буш очларына дүрт шар беркетегез. Күзаллау яки җеп ярдәмендә «во¬
дород атомнарын» бер-берсе белән тоташтырыгыз. Нинди геометрик
фигураның сурәте килеп чыкты? Мондый ике модель ясагыз.
2. Метан молекуласының масштаблы моделе. Бер метан
молекуласының шарчыбыклы моделеннән чыбыкларны алыгыз.
Бәйләнеш юнәлешен истә тотып, «углерод атомына» дүрт «водород
атомын» беркетегез, шарлар берникадәр сытылырлар, һәм бу тоташу
атом орбитальләренең аралашуын күрсәтер. Шарчыбыклы модель
белән масштаблы модельне чагыштырыгыз. Метан молекуласының
пространстволы төзелеше үзгәрдеме? Кайсы модель аның төзелешенә
төгәлрәк туры килә?
3. Бромметан молекуласы моделе. Метан молекуласының шарчы¬
быклы моделеннән бер «водород атомын» алыгыз. Аның урынына
бүтән төстәге шар беркетегез (бром атомын алыштыра, бром атомының
диаметры углерод атомыннан зуррак). Ни өчен модельләрне ясау өчен
төрле үлчәмдәге шарлар кирәк булуын аңлатыгыз.
Углеводород һәм аның галоген кушылмасы молекуласының моде¬
лен ясаганда А.М.Бутлеров теориясенең нинди кагыйдәләренә таян¬
ганыгызны билгеләп үтегез.
28
1 СОРАУЛАР ҺӘМ БИРЕМНӘР
Q 1. Кайсы молекула атомнары 5/?3-гибридлашу халәтендә:
a) HCl; б) BeCl2; в) C3Hg; г) AlCl3.
2. H2O, CH3Cl, CO2, C3Hg, HClO4 молекулаларында электрон
парларның авышуын (структур формулаларда уклар ярдәмендә)
күрсәтегез.
3. Аммиак һәм метан молекулаларында химик бәйләнеш тибын
билгеләгез, аларның электрон формулаларын төзегез һәм атом
орбитальләренең аралашу схемасын сурәтләгез. Төзелеше буенча
алар нәрсә белән аерыла һәм кайсы молекула поляр түгел?
Q 4*. Углеводородтагы углеродның масса өлеше 83,3%. Бу матдә
парларының водород буенча чагыштырма тыгызлыгы 36 га тигез.
Углеводородның молекуляр формуласы:
a) C4Hg; б) C4Hl0; в) C5H10; г) C5H12.
§6
АЛКАННАРНЫҢ ҮЗЛЕКЛӘРЕ ҺӘМ АЛАРНЫ КУЛЛАНУ
AJlKAHHAPHbIH, ФИЗИК ҮЗЛЕКЛӘРЕ
Чикле углеводородлар табигатьтә киң таралганнар. Аларны табуда
төп чыганаклар булып нефть, табигый һәм иярчен газлар тора.
Чикле углеводородларның физик үзлекләре, бүтән органик кушыл¬
маларныкы кебек, аларның составы һәм төзелеше белән билгеләнә.
Алканнар, күп кенә органик матдәләр кебек, каты халәттә молекуляр
төзелешкә һәм молекуляр кристаллик рәшәткәгә ия.
Гомологик рәтнең беренче дүрт әгъзасы (CH4 - C4H10) - гадәти шарт¬
ларда төссез һәм иссез газлар. Пентаннан алып пентадеканга кадәрге
тармакланмаган углеводородлар (C5H12 - C15H32) - төссез сыеклык¬
лар; C16H34 тән башлап - тотып карауга майлы сыман ак төстәге каты
матдәләр. Түбән төзелешле сыек алканнарга «бензин» исе хас. Югары
температурада кайнаучы һәм каты алканнарның исе юк. Чылбырдагы
углерод атомнары саны арткан саен, алканнарның кайнау һәм эрү тем¬
пературалары арта.
29
Чикле углеводородлар - поляр булмаган кушылмалар. Шуңа күрә
алар суда (поляр эреткеч) бөтенләй эремиләр. Әгәр дә суга сыек угле¬
водородлар катнашмасы булган бензин яки керосин салсак, ике кат¬
лам барлыкка килә: өстә - углеводород, аста - су катламы. Ләкин
углеводородлар бензол, тетрахлорметан һ.б. поляр булмаган органик
эреткечләрдә яхшы эриләр. (Охшаш охшашта эри дигән кагыйдәне
искә төшерегез.)
Сыек углеводородлар бер-берсе белән җиңел кушылалар, шулай ук
алар каты углеводородларны да җиңел эретәләр. Аларның бу үзлеген
предметлар өслеген пычрактан чистарту өчен кулланалар. Мәсәлән,
керосин яки бензин ярдәмендә минераль майдан (сыек алканнар һәм
башка кушылмалар катнашмасы) һәм битумнан (каты алканнар һәм
бүтән углеводородлар катнашмасы) арыналар.
АЧКАННАРНЫҢ ХИМИК ҮЗЛЕКЛӘРЕ
Органик кушылмаларның химик үзлекләре молекулаларының соста¬
вы һәм төзелешенә, химик бәйләнешләрнең табигатенә бәйле. Алкан
молекулаларында барлык атомнар да үзара ныклы берле бәйләнешләр
(о-бәйләнеш) белән бәйләнгәннәр. Атомнарны бер-берсе белән
бәйләүгә сарыф ителмәгән углерод атомнарының валентлыгы водород
атомнары белән тулысынча туендырылган, шуңа күрә алканнарны чикле,
ягъни туендырылган углеводородлар дип атыйлар. Алар чыдам ку¬
шылмалар һәм гадәти шартларда аларның активлыгы аз. Шул сәбәпле
аларны парафиннар дип йөртәләр (лат. parum affinis - якынлыгы аз).
C-H һәм C-C бәйләнешләренең полярлыгы аз яки нульгә тиң, шуңа
күрә алканнар яктылык, температура яки катализатор тәэсирендә ба¬
ручы реакцияләргә генә керәләр. Бу реакцияләр C-H бәйләнешләре
яисә углерод атомнары чылбыры (C-C бәйләнешләре) өзелү белән ба¬
рырга мөмкин. Алканнарга күбесенчә водород атомнары алмаштыру
реакцияләре хас, алар C-H бәйләнеше өзелү белән баралар.
Чикле углеводородларның химик үзлекләрен метан мисалында ка¬
рап үтик.
Алмаштыру реакциясе
Алкан молекуласындагы водород атомнарын галоген (хлор яки
бром) атомнарына алмаштыру һәм галоген кушылмалар хасил булу
реакциясе галогенлау реакциясе дип атала.
30
Бу реакция яктылык тәэсирендә яки югары температурада үтә.
Мәсәлән, метан белән хлор катнашмасы булган савытны тонык кояш
нурлары астына куйсаң (көчле яктыда шартлау мөмкин), метан белән
тәэсир итешү нәтиҗәсендә, әкренләп хлорның саргылт-яшел төсе
кимүен күзәтергә була:
H H
H-C-H+ Cl-Cl ► H-C-Cl+ HCl
IL J I
H H
хлорметан
Хлор артык булганда, ул бер-бер артлы барлык водород атомнарын
да алмаштыра:
H H
Н-С-[Н + С1}С1 Н-С-С1 + НС1
Cl Ci
дихлорметан
Cl , Cl
I I* т hv I
Н-С-Н + С1-С1 > Н-С-С1 + НС1
IL J I
Cl Cl
трихлорметан (хлороформ)
Cl и Cl
I г — — п nv I
Cl - C-[H +Cl]-Cl > С1-С-С1 + НС1
IL--J I
Cl Cl
тетрахлорметан
(дүртхлорлы углерод)
Реакция нәтиҗәсендә метанның хлор кушылмалары катнашмасы
барлыкка килә. Хлор белән реакцияне — хлорлау, бром белән реак¬
цияне бромлау дип йөртәләр.
Аналогик рәвештә бүтән алканнар да хлор белән реакциягә
керә. Галогенлау реакциясе яктылыкта яки югары температурада
гына үткәнгә күрә, алканнар гадәти температурада бромлы суны
төссезләндермиләр.
Алканнарны галогенлау сәнәгати әһәмияткә ия. Мәсәлән, метаннан
дихлорметан CH2Cl2, трихлорметан (хлороформ) CHCl3, тетрахлорме¬
тан CCl4 (дүртхлорлы углерод, көнкүрештә аны «тапларны чыгаручы
31
сыеклык» дип атыйлар) кебек органик эреткечләр табалар. Алканнар-
ны галогенлап шулай ук фреоннар табалар, алар салкынлык ясаучы
(хладагент) буларак суыткыч җайланмаларында һәм кондиционерлар¬
да кулланыла.
Оксидлашу реакцияләре
Алканнарның аеруча әһәмиятле реакциясе булып яну тора. Аларны
табигый газ, бензин, керосин, соляр майлары, мазут рәвешендә ян¬
дыру җылылык һәм яктылык бирә, шулай ук күпчелек машиналарны
хәрәкәткә китерә.
Углеводородлар гадәти температурада һава кислороды белән
реакциягә кермиләр, бу реакцияне кабызып җибәреп, яисә электр бу¬
шануы биреп башларга була. Көндәлек тормыштан белгәнегезчә, ме¬
тан (көнкүреш газының төп составы) янып китсен өчен, аны кабызып
җибәрергә кирәк. Кислород артыгы белән алынганда, метан төссез ди¬
ярлек ялкын белән яна һәм углерод (IV) оксиды, су хасил итә, энергия
бүленеп чыга:
СН4(г.) + 2О2(г.) -> CO2 (г.) + 2Н2О (г.) + 880 кДж
артыгы
белән алынган
Әгәр дә бер күләм метаннан һәм ике күләм кислородтан (тигезләмәне
кара) торган катнашманы әзерләп, аны яндырып җибәрсәң, яки аның
аша электр очкыннары үткәрсәң, каты шартлау күзәтелә. Метанның
һава белән катнашмасы ташкүмер шахталарында, завод котельныйла-
рында, торак йортларда җыелырга мөмкин. Еш кына бу авария яки
бәхетсезлек очракларына сәбәп була.
Калган газсыман, сыек, каты углеводородларның да яну реакция¬
се аналогик рәвештә үтә. Шуңа күрә бензин, керосин һ.б. шундый
сыеклыклар белән сак эш итәргә кирәк, чөнки гадәти температурада
ук һавада шырпы ялкыныннан, очкыннан җиңел кабынып китәргә
җитәрлек углеводород парлары бар. Бу шартлау белән үтүче янгын
китереп чыгарырга мөмкин. Мондый сыеклыкларны ачык савытларда
сакларга ярамый.
Кислород ким итеп алынганда углеводород тулысынча янып бетми
һәм агулы газ - углерод (II) оксиды барлыкка килә яисә саф углерод
бүленеп чыга:
2СН + 30, —>2СО + 4НО
4 2 2
ким итеп
алынган
32
CH. + О, -> C + 2H,0
4 2 2
ким итеп
алынган
Бу вакытта горелка ялкыны сары төс ала.
Белгәнегезчә, ис (сөрем) газы гемоглобин (канның кызыл пиг¬
менты) белән кислородка караганда ныграк бәйләнә, шуңа күрә кан
үзенең төп функциясен - организмда кислород күчерүне югалта.
Автомобильләрнең төтен газында һәрвакыт күпмедер микъдарда (1 %
чамасы) углерод (II) оксиды бар.
Алканнарның термик әверелешләре
500 oC тан югары температурада алкан молекулалары водород һәм
кечерәк молекуляр массалы углеводород барлыкка китереп таркала¬
лар. Бу реакцияләрдә C-H һәм C-C бәйләнешләре өзелә.
Таркалу, һава кертмичә нык җылытканда (1000 oC тан югары), чикле
углеводородлар тулысынча углерод һәм водородка таркалалар, ягъни
C-H һәм C-C бәйләнешләре өзелә. Бу реакцияне пиролиз дип атый¬
лар. Аны водород һәм корым алу өчен кулланалар:
/ >iooo °с С + 2Н C2H6 7 >100°°С > 2С+ЗН
Крекинг. Алканнарның крекингы (ингл. cracking - таркалу,
бүлгәләнү) күбесенчә C-C бәйләнешләре өзелү һәм азрак сандагы
углерод атомы булган алкан һәм алкен катнашмалары барлыкка килү
белән бара. Крекинг вакытында молекула үзәгенә якынрак урнашкан
C-C бәйләнешләренең өзелү ихтималы зуррак була, мәсәлән:
г' II 600 °C II . р ri
С9Н20 > С4Н10 + ЧН10
алкан алкен
C9H20 600°с-> C5H12+C4H8
алкан алкен
Крекинг нәтиҗәсендә һәрвакыт продуктлар катнашмасы барлыкка
килә. Мәсәлән, нефть продуктлары (мазут, соляр майлары) крекингы
молекулалары кечерәк үлчәмле углеводородлар катнашмасы - бензин
алырга мөмкинлек бирә.
Дегидрирлау. Бу алкан молекуласыннан молекуляр водород аерып
алу реакциясе. Ул катализатор катнашында (ешрак хром (III) оксиды)
300-350 oC та үтә һәм күбесенчә алкеннар барлыкка килү белән бара:
33
I I t, Cr,O.
H-C-C-H —* CH2=CH2+H2
EhZhZ
Изомерлашу. Бу тармакланмаган төзелешле алканның үзенең тар¬
макланган изомерына әверелеше. Ул җылытканда һәм катализатор бу¬
ларак алюминий оксиды катнашында бара:
Г, Al,О,
CH3-CH2-CH2-CH2-CH3 CH3-CH-CH2-CH3
пентан
CH3
2-метилбутан
Изомерлашу реакциясенә молекулаларында кимендә дүрт углерод
атомы булган алканнар керә.
Metah конверсиясе
Конверсия (лат. Conversio - үзгәреш, әверелеш) процессы югары
температурада (800 - 900 °C) һәм никель катализаторы катнашында
уза. Бу шартларда метан су белән реагирлаша:
сн4+н2о —,,N1 > СО + ЗН,
Синтез-газ дип аталучы углерод (II) оксиды һәм водород катнаш¬
масы барлыкка килә. Синтез-газ - кыйммәтле химик чимал, аны күп
төрле органик кушылмалар табу өчен, ә катнашмадан аерып чыга тор¬
ган водородны аммиак җитештерүдә кулланалар.
AJIKAHHAPHbI КУЛЛАНУ
Метан - табигый газның иң әһәмиятле состав өлеше, чикле углево¬
дородлар арасыннан иң күп кулланыш таба. Белгәнегезчә, метан янган¬
да күп җылылык аерылып чыга (32 нче биттәге реакция тигезләмәсен
кара), шуңа күрә табигый газны сәнәгатьтә һәм көнкүрештә энергия
алу өчен киң кулланалар.
Көнкүрештә метан белән эш иткәндә сак булырга кирәк, чөнки
ул нава белән шартлаучан катнашма хасил итә. Иң зур шартлау
бер күләм метан белән ун күләм һава кушылганда килеп чыга. Башка
төрле күләм катнашмаларында шулай ук шартлау күзәтелә, тик көче
генә азрак була.
34
3 нче рәсем. Метанны куллану: 1 — резина; 2 — типографик буяулар; 3 -
метанол; 4 — эреткечләр; 5 хладогентлар; 6 — синтетик бензин; 7 — во¬
дород, аммиак, азотлы ашламалар табу өчен; 8 — эчке янулы двигательләр
өчен ягулык; 9 — сәнәгать һәм көнкүреш газы сыйфатында
Метанның исе булмаганлыктан, табигый газга аз гына күләмдә
көчле ис бирүче кушылма кушалар, бу газ торбасыннан саркып чыгу¬
чы газны табарга ярдәм итә.
Водород, ацетилен, фреоннар, метил спирты, кырмыска кислотасы,
синтетик каучуклар һәм башка матдәләр табу өчен дә башлангыч чи¬
мал итеп метан кулланалар (3 нче рәс.).
Пропанның бутан белән катнашмасын (пропан-бутан катнашмасы)
ягулык буларак табигый газ кертелмәгән торак пунктларда куллана¬
лар. Бу катнашманы сыекландырылган халәттә баллоннарда транс-
портлыйлар.
Углерод атомы саны җидедән артык булган сыек углеводород кат¬
нашмаларын мотор ягулыгы (бензин, керосин, дизель ягулыгы) һәм
эреткеч буларак кулланалар.
Парафин һәм вазелин кебек чикле углеводородлар катнашмалары да
киң кулланыш таба. Парафин - каты углеводородлар катнашмасыннан
торучы каты ак масса (эрү температурасы 50-54 °C). Ул медицина¬
да җылылык процедураларында, шәм ясау өчен кулланыла, аны төрү
кәгазьләренә сеңдерәләр һ.б. Вазелин - сыек һәм каты углеводородлар
катнашмасы - медицинада мазьлар ясаганда, парфюмериядә косметик
35
матдәләр җитештергәндә кулланыла. Югарырак температурада (60-
80 °C) эрүче углеводородлар катнашмасы табигатьтә озокерит (тау
балавызы) минералы халәтендә очрый. Аны җылытып дәвалау проце¬
дураларында кулланалар. 10-20 углерод атомыннан торучы ачканнар¬
дан, микробиологик юл белән эшкәртеп, терлек азыгы итеп кулланыла
торган аксым массасы алалар.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Шахтада метан барлыкка килүне органолептик, ягъни ис, тәм
һәм башка билгеләр ярдәмендә белеп буламы? Ни өчен?
Q 2. Кайсы җыелмадагы барлык матдәләр дә бензолда эри?
a) H2S, CaCl2, C6H14, Br2; в) I2, C6H14, C7H16, Br2;
б) I2, HCl, C5H12, K2S; г) CaCl2, H2S, CgHlg, Cl2.
3. Этан белән реакциягә керүче матдәләрнең формулаларын сайлап
алыгыз: Br2, HBr, O2, NaOH, H2O. Реакция тигезләмәләрен төзегез,
реакция үтү шартларын күрсәтегез һәм барлыкка килгән продукт¬
ларны атагыз.
4*. Углеродның масса өлеше 84,21% булган углеводородның мо¬
лекуляр формуласын исәпләп чыгарыгыз. Водород буенча матдә
парларының тыгызлыгы 57. Шундый составлы өч изомерның
структур формуласын төзегез һәм аларны атагыз.
5 . Схемадагы әверелешләргә нигезләнеп реакция тигезләмәләрен
төзегез:
а)СН x^cO1-cH(hcO1)1
X2-^ H2O^NaOH
б ) CH4-> C ->CH4 — CH Br
7 4 4 3
Реакция үтү шартларын күрсәтегез һәм X1, X2, X3 матдәләрен ата¬
гыз.
6*. Күләме буенча 95% метаннан, 3% углерод (IV) оксидыннан
һәм 2% азоттан торучы 1 м3 табигый газны яндырганда аерылып
чыккан җылылык күләмен исәпләгез. Метан яну реакциясенең
җылылык эффекты 880 кДж/моль.
36
Il бүлек. Чиксез углеводородлар
Чиксез углеводородлар — молекулаларында углерод атомнары ара¬
сында берле бәйләнеш белән беррәттән икеле яисә өчле бәйләнеш бул¬
ган углеводородлар.
Чиксез углеводородлар молекулаларында водород атомнары саны
тиңдәшле алканнарныкына караганда азрак, шуңа күрә чиксез углево¬
дородларны туендырылмаган дип йөртәләр.
Молекулалары водород атомнары белән туенуга бәйле рәвештә чик¬
сез углеводородларны этилен (алкен), диен (алкадиен), ацетилен (ал¬
кин) һ.б. төрләргә бүләләр.
LZ
АЛКЕННАР. ГОМОЛОГИК РӘТ,
НОМЕНКЛАТУРА ҺӘМ ИЗОМЕРИЯ.
ЭТИЛЕН МОЛЕКУЛАСЫНЫҢ ТӨЗЕЛЕШЕ
АЛКЕННАРНЫҢ ГОМОЛОГИК РӘТЕ
Алкеннар - молекулаларында углерод атомнары арасында бер ике¬
ле бәйләнеш (C-C) булган чиксез углеводородлар.
Бу углеводородларның гомологик
рәтендә беренче әгъзасы булып
этилен тора:
H H
H H
C2H4 .’с::с;
CH2= CH2 C = C
H* 'н
H H
молекуляр формуласы электрон формуласы
структур формулалары
Шуңа күрә алкеннарны этилен углеводородлары дип тә атыйлар.
Систематик номенклатура буенча этилен углеводородларының атама¬
лары тиңдәшле алкан атамаларындагы -ан кушымчасын -ен кушым¬
часына алмаштырып ясала. Систематик номенклатура белән беррәттән
этилен углеводородларының тривиаль атамаларын да кулланалар,
аларның кушымчасы -илен (4 нче табл.).
Тривиаль (тарихи барлыкка килгән) - органик кушылмаларның гадәттә табигый
чыганагын яисә берәр үзлеген аңлатучы очраклы атамалары.
37
4 нче таблица
Алкан һәм алкен составларын чагыштыру
Алкан
Алкен
Молекуляр
формула
Атамасы
Молекуляр
формула
Атамасы
систематик номен¬
клатура буенча
тривиаль
CH4
Метан
-
-
-
C2H6
Этан
C2H4
Этен
Этилен
C3H11
Пропан
C3H6
Пропен
Пропилен
C4H10
Бутан
C4H8
Бутен
Бутилен
Алкан һәм алкеннарның алда китерелгән молекуляр формулаларын
чагыштырудан килеп чыкканча:
• алкеннарның гомологик рәтендә бер әгъза икенчесеннән (алканнар
рәтендәге кебек) гомологик аерма - CH2 төркеменә аерыла;
• һәр этилен углеводороды тиңдәш алканнан ике водород атомына
аерыла. Димәк, этилен углеводородларының гомуми формуласы
C H2 ,
п 2п7
АЛКЕННАР ИЗОМЕРИЯСЕ ҺӘМ НОМЕНКЛАТУРАСЫ
Алкеннарга, алканнарга кебек үк, структур изомерия хас. Ләкин
алкеннарның изомерлар саны алканнарныкыннан күпкә артык. Бу ал¬
кеннарга углерод скелет изомериясеннән тыш башка төр изомерия дә
хас булуга бәйле.
• Углерод скелеты изомериясе (C4H8 дән башлап):
ГС4Н?
L I-8J
4 3 2 1 * 1 2 3
CH3 - CH2 - CH=CH2 CH2= C - CH3
CH3
бутен-1 2-метилпропен
38
• Молекулада икеле бәйләнеш торышы изомериясе (C4Hg дән башлап):
C4H8
CH = CH-CH2- CHf
бутен-1
CH3-CH = CH-CH3
бутен-2
Алкен атамасын төзү алгоритмы
1. Төп чылбыр итеп икеле бәйләнеш булган һәм иң күп алмаштыр-
гычлар (радикаллар) белән бәйләнгән иң озын чылбырны сайлап
алырга.
2. Икеле бәйләнешкә якын баштан башлап чылбырдагы углерод
атомнарын номерлап чыгарга. Әгәр дә ул уртада икән, номерлауны ра¬
дикал (алмаштыргыч) якынрак баштан башлыйлар.
3. Радикаллар белән бәйләнгән углерод атомнарының номерларын
күрсәтергә һәм радикалларга алфавит тәртибендә атама бирергә.
4. Төп чылбырга атама бирергә.
5. Алкен атамасыннан соң цифр белән икеле бәйләнеш ясаучы угле¬
род атомының номерын күрсәтергә.
Мәсәлән:
CH3
S 4 Jl
CH3-CH2-C =
CH3
2l 1
C-CH3
2,3-диметилпентен-2
CH3
1 21 3 4 5 6
CH4-C-CH = CH-CH4-CH,
3I 2 3
CH3
2,2-диметилгексен-З
ЭТИЛЕН МОЛЕКУЛАСЫНЫҢ ЭЛЕКТРОН ҺӘМ
ПРОСТРАНСТВОЛЫ ТӨЗЕЛЕШЕ
Этилен молекуласының пространстводагы төзелешен карап үтик.
Этилен һәм башка алкен молекулаларында икеле бәйләнеш хасил
итүче углерод атомнары 5/г-гибридлашу халәтендә булалар. Бу ва¬
кытта углерод атомының тәэсирләнгән халәттә дүрт орбиталеннән бер
2s- һәм ике 2р-орбитальләре гибридлашуга дучар булалар. Нәтиҗәдә
бертөрле өч д/Агибрид орбитале барлыкка килә, алар, бер-берсенә
39
4 нче рәсем. Этилен молекуласында а-бәйләнешләр барлыкка килүе: а- углерод атомының
өч лр2-гибрид орбитале һәм бер гибридлашмаган 2р-орбитале; б - «т-бәйләнешләр яса¬
луы; в - этилен молекуласында о-бәйләнешләрнең урнашу схемасы
120° почмак ясап, бер яссылыкта урнашалар. Гибридлашмаган бер
2р-орбитале шушы яссылыкка перпендикуляр юнәлә (4а рәс.).
Этилен молекуласы ясалганда, углерод атомнарының лр2-гибрид
орбитальләре бер C-C о-бәйләнеш һәм дүрт C-H о-бәйләнеш барлык¬
ка китерәләр (46 рәс.). C-C һәм C-H бәйләнешләре бер яссылыкта
бер-берсенә карата 120° лы почмак ясап урнашалар. Шулай итеп, эти¬
лен молекуласында биш о-бәйләнеш бар (4в рәс.).
Бер углерод атомының гибридлашмаган 2р-орбитале икенче угле¬
род атомының 2р-орбитале белән аралаша. Аларның ян аралашуы
нәтиҗәсендә о-бәйләнешләр яссылыгының өстендә һәм астында та¬
гын бер бәйләнеш барлыкка килә. Мондый бәйләнеш, белгәнегезчә,
л-бәйләнеш дип атала, л-бәйләнеш яссылыгы о-бәйләнеш яссылыгы¬
на перпендикуляр урнаша (5 нче рәс.). Димәк, этилен молекуласында
икеле бәйләнеш C=C бер о-бәйләнеш һәм бер л-бәйләнеш белән ясал¬
ган.
5 нче рәсем. Этилен молекуласында л-бәйләнешенең ясалуы: а - гибридлашмаган
2р-орбитальләренең ян аралашуы; б - л-бәйләнеш яссылыгының урнашуы
40
6 нчы рәсем. Этилен молекуласы модельләре: а - шарчыбыклы, б масштаблы
6 нчы рәсемдә этилен молекуласы модельләре күрсәтелгән.
5 нче таблицада C-C һәм C=C бәйләнешләренең микъдари характе¬
ристикалары бирелгән:
5 нче таблица
C-C һәм C=C бәйләнешләренең микъдари характеристикалары
Бәйләнеш
Бәйләнеш озынлыгы, нм
Бәйләнеш энергиясе, кДж/моль
C-C
0,154
352
C = C
0,134
587
5 нче таблицадагы мәгълүматларны чагыштырудан күренгәнчә,
C=C икеле бәйләнеше C-C бәйләнешләреннән кыскарак һәм
гомумән ныграк та. Ләкин энергиясе 235 кДж/моль булган (587-
352) л-бәйләнешнең ныклыгы о-бәйләнеш ныклыгыннан кимрәк
(352 кДж/ моль). Моның ике сәбәбе бар:
а) р-орбитальләренең ян аралашуы (л-бәйләнеш) орбитальләрнең
бәйләнеш линиясе буйлап аралашуына караганда (о-бәйләнеш) кимрәк
дәрәҗәдә була;
б) л-бәйләнешне ясаучы электроннар бәйләнгән атом төшләреннән
ерактарак урнаша һәм алар белән кимрәк тотылып торалар.
Шуңа күрә алкеннар алканнарга караганда химик яктан активрак,
нэм алкен молекуласында бик көчле реакцион үзәк булып п-бәйләнеш
тора.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Алкеннарның гомологик рәтендәге бишенче әгъза мисалында
а) углерод скелеты; б) икеле бәйләнеш торышы белән аерылып
торган ике изомерның структур формуласын төзегез.
Барлык матдәләрне дә атагыз.
41
2. Түбәндәге формулалары бирелгән углеводородларны система¬
тик номенклатура буенча атагыз, гомологлары һәм изомерлары
формулаларын күрсәтегез.
a) CH2= - CH3
CH3
в)СН -C = C-CH3
3II 3
CH3 CH3
CH3
б) CH3-C = CH
CH3 CH3
г) CH3 - C - CH = CH2
CH3
Q 3. Пропен молекуласында о-бәйләнешләр саны:
а) 5; б) 8;
в) 12; г) 9 га тигез.
4.2,3- диметилбутен-1 молекуласының электрон һәм структур фор¬
мулаларын төзегез, углерод атомнарының валентлыгын һәм оксид¬
лашу дәрәҗәсен билгеләгез.
5*. Түбәндәге термохимик тигезләмә буенча 201,6 л (н.ш.) этилен ян¬
ганда бүленеп чыга торган җылылык күләмен исәпләп чыгарыгыз:
C2H4(E) + ЗО2(г.) = 2СО2 (г.) + 2Н2О(г.) +1400 кДж
6*.Углеродның углеводородтагы масса өлеше 85,7%. Бу матдә
парларының водород буенча чагыштырма тыгызлыгы 21 гә тигез.
Матдәнең формуласын табыгыз һәм аны атагыз.
§8
АЛКЕННАРНЫ ТАБУ,
АЛАРНЫҢ ҮЗЛЕКЛӘРЕ ҺӘМ КУЛЛАНУ
АЛКЕННАРНЫ ТАБУ
Чикле углеводородлардан аермалы буларак, алкеннар табигатьтә
сирәк очрыйлар, бу аларның химик активлыгы зур булу белән аңлатыла.
Алкеннарны табу өчен башлангыч матдәләр булып чикле углеводород¬
лар һәм аларның кушылмалары тора. Алкеннарны сәнәгатьтә табу
ысулларын карап үтик.
42
Алканнарны дегидрирлау.
t. Cr О
CH3-CH3 —► CH2= CH2+ H2
этан
этилен
Алканнарның термик крекингы. Белгәнегезчә, нефть составына
керүче алканнарны җылытканда кечерәк молекуляр массалы алкан
һәм алкен катнашмалары барлыкка килә. Мәсәлән, бутан крекингы
этан һәм этилен катнашмасын бирә:
C4H10 С2нб+с2н4
7 нче рәсем. Этилен табу: а- эти¬
ленның бромлы су белән тәэсир
итешүе; б - тәҗрибәгә кадәр
бромлы су салынган пробирка
Лаборатор шартларда алкеннарны
аерып алу реакцияләре ярдәмендә таба¬
лар. Бу реакцияләрдә күрше торучы ике
углерод атомыннан ике атом яки атомнар
төркеме аерыла, ә углерод атомнары ара¬
сында икеле бәйләнеш барлыкка килә.
Спиртларныңдегидратлашуы.Дегмд-
ратлашу реакциясе - су молекулалары ае¬
рылу процессы - спиртларны куертылган
сульфат кислотасы (суны тартып алучы
матдә) белән 140 oC тан югары темпера¬
турада җылытканда бара (7 нче рәс.):
CH-CH,
этил спирты
H2SO4 (куерт.), / > 140 oC
CH2= CH2+H2O
этилен
АЛКЕННАРНЫҢ ФИЗИК ҮЗЛЕКЛӘРЕ
Физик үзлекләре ягыннан алкеннар алканнарга якын, чөнки
аларның молекулалары шулай ук поляр түгел. Алканнарның гомоло-
гик рәтендәге кебек үк, алкеннарның беренче кушылмалары - этен,
пропен һәм бутен - гадәти шартларда газлар, C5H10 - C16H32 - төссез
сыеклыклар, югары алкеннар - каты матдәләр. Алканнар кебек үк,
алкеннар суда эремиләр, ләкин органик эреткечләрдә яхшы эриләр.
Алкеннарның кайнау һәм эрү температуралары закончалыклы рәвештә
углерод чылбыры үсү белән арта.
43
АЛКЕННАРНЫҢ ХИМИК ҮЗЛЕКЛӘРЕ
Алканнардан аермалы буларак, алкеннар - химик яктан актив
матдәләр, бу аларның молекулаларында икеле бәйләнеш булу белән
аңлатыла. Углерод атомнары арасында икеле бәйләнешнең бер¬
се (л-бәйләнеш) нык түгел һәм җиңел өзелә, шуңа күрә реакцияләр
гадәттә икеле бәйләнеш урыны буенча үтәләр. Алкеннарга кушылу һәм
полимерлашу реакцияләре хас. Алар л-бәйләнеш өзелү һәм о-бәйләнеш
хасил булу белән баралар.
Алкеннарның химик үзлекләрен этилен мисалында карап үтик.
Кушылу реакцияләре
Алкеннар гади матдәләрне дә (галогеннар, водород), катлаулы
матдәләрне дә (галогенводородлар, су) җиңел кушалар.
Галогенлау. Бу алкеннарга галоген кушу реакциясе. Мәсәлән, әгәр
дә бромлы су яисә бромның органик эреткечләрдәге эремәсе аша
гадәти шартларда этилен үткәрсәк, бромның төсе тиз юкка чыга
(7 нче рәс. кара), бу бромның реакциягә кереп, төссез авыр сыеклык
1,2-дибромэтан хасил итүе белән аңлатыла.
СН, = СН, + Br, -»CH-CH,
2 2 2 I2I2
этен Br Br
1,2-дибромэтан
Бром эремәсенең төссезләнүе - органик кушылмалардагы углерод
атомнары арасындагы л-бәйләнешкә сыйфат реакциясе.
Гидрирлау. Гидрирлау реакциясе - алкеннарга водород кушу реак¬
циясе. Бу реакция нәтиҗәсендә углерод атомнары водород атомнары
белән тулысынча туендырыла һәм чикле углеводородлар барлыкка
килә. Гидрирлау реакциясе югары басымда, уртача җылытканда, ме¬
талл катализаторлар (Pt, Pd яки Ni) катнашында бара:
„ t, р, Ni
CH2 = CH2 + H2 — - > CH3 - CH3
этен этан
Югарырак температурада, шул ук катализаторлар катнашында де-
гидрирлау процессы да узарга мөмкин:
„ /, р, Ni
CH2 = CH2 — > CH = CH + H2
Гидрогалогенлау. Гидрогалогенлау реакциясе - галогенводородлар
кушылып, галогеналканнар хасил булу реакциясе:
CH2 = CH2 + HBr -> CH3- CH2Br
этен бромэтан
44
Гидратлау. Гидратлау реакциясе — су кушу реакциясе. Ул
җылытканда, сульфат яисә фосфат кислотасы катнашында бара, бу ва¬
кытта спирт барлыкка килә:
t, н,so
CH2 = CH2+H-ОН —2 4 > CH3-CH2OH
этен этил спирты
Этиленга су кушып, сәнәгатьтә этил спирты табалар.
Полимерлашу реакциясе. Кушылу реакцияләренә алкеннарның
полимерлашу реакцияләрен дә кертергә була.
Полимерлашу — икеле яки өчле бәйләнешләр өзелү хисабына,
һәм өстәмә продуктлар аерылып чыкмыйча, башлангыч матдәнең
бертөрле молекулалары (мономер) үзара бер-бер артлы тоташу про¬
цессы.
Алкеннарның полимерлашу процессы А.М.Бутлеров тарафыннан
ачылган.
Бу реакциянең продукты - макромолекуласы күп тапкыр кабатла¬
нып килүче элементар (структур) берәмлекләрдән (буыннардан) то¬
ручы полимер. Полимерлашу җылыту, югары басым, нурландыру, ка¬
тализатор яисә бүтән факторлар тәэсирендә килеп чыгарга мөмкин. Бу
реакцияне, гадиләштереп, кыскартылган схема рәвешендә язалар:
WCH1 = CH1 tAiatr- » [-CH1-CH-]
2 2 L 2 2 Jn
этилен (мономер) полиэтилен
Схеманың сул ягындагы w - реакциягә ничә этилен молекуласы
кергәнен күрсәтүче коэффициент, ә уң яктагы п - полиэтилен моле¬
куласында ничә -CH2-CH2- берәмлек (буын) бар икәнлеген күрсәтүче
индекс (w саны берничә меңгә җитәргә мөмкин). Бу санны полимерла¬
шу дәрәҗәсе дип йөртәләр.
Полиэтилен - җиңел, сыгылмалы, кислота һәм селтеләр тәэсиренә
чыдам. Аннан торбалар, савыт-сабалар ясыйлар, радио һәм телевизион
техникада изоляция материалы буларак, продуктлар, кием төрү өчен,
теплицалар каплау өчен (полиэтилен пленка 90% тан артык ультра¬
фиолет нурларын үткәрә), сугару каналлары һәм сулыклар төзегәндә
тышлагыч материал итеп кулланалар.
Оксидлашу реакцияләре
һавада алкеннар башка углеводородлар кебек үк яналар һәм углерод
(IV) оксиды белән су хасил итәләр:
C1H + 30,—2СО,+ 2Н.О
2 4 2 2 2
45
8 нче рәсем. Этилен кулланыла: I - пластмассалар; 2 - синтетик каучуклар; 3 - этил
спирты; 4 - эреткечләр; 5 - синтетик сүсләр; 6 - антифризлар; 7 - анестезия чаралары
табу өчен, 8 — яшелчә һәм жиләк-жимеш өлгертүне тизләтү өчен
Этилен кислород яисә һава белән шартлаучан катнашмалар бар¬
лыкка китерә.
AJlKEHHAPHbl КУЛЛАНУ
Химик активлыгы югары булганлыктан, алкеннарны ягулык итеп
кулланмыйлар, аларны сәнәгати органик синтезда башлангыч чимал
буларак куллану файдалырак. Этилен органик матдәләр табуда аеруча
киң кулланыла (8 нче рәс.).
? СОРАУЛАР ҺӘМ БИРЕМНӘР
O 1. Бирелгән матдәләрнең кайсысы һавадан авыр:
а) метан; б) этан; в) этилен; г) аммиак.
Q 2. Кайсы җыелмадагы барлык матдәләр белән дә этилен реакциягә
керә:
a) Br2, N2, О,; в) HCl, H2, CO,;
б) HCl, Cl2, O2; г) H2O, N2, KOH (эремә);
Бу җыелмадагы матдәләр белән этиленның реакция тигезләмәләрен
языгыз, реакция үтү шартларын күрсәтегез.
46
3. Схемадагы әверелешләргә нигезләнеп, реакция тигезләмәләрен
төзегез:
C, Hd-> C, HsOH C, Hd- CO, — CaCO, +Н;°С°2 » X
2425 24 2 3
Реакцияләрнең үтү шартларын билгеләгез. X матдәсен атагыз.
Q 4. Кыен кабынып китүче очучан сыеклык күп кенә органик
матдәләрне яхшы эретә, авыл хуҗалыгында саклау урыннарын за-
рарсызландыру өчен кулланыла. Бу матдә:
а) пропан; б) пропен; в) 1,2-дихлорэтан; г) этан.
5*. Этилен иң беренче булып Беккер (1860) тарафыннан сульфат
кислотасы һәм шәраб (этил) спирты катнашмасын җылытып та¬
былган. Этил спиртының масса өлеше 95% булган 500 см3 эремәдән
нинди күләмдәге этилен табарга мөмкин?
6*, Хирургик операция вакытында урынлы анестезия үткәрү өчен
5,6 л газ хәлендәге хлорэтан кирәк. Әгәр дә продуктның чыгы¬
шы 90% икән, күпме күләмдә этилен һәм хлороводород кирәк
икәнлеген исәпләп чыгарыгыз.
7*. Углеродның масса өлеше 85,7% булган углеводородның моле¬
куляр формуласын табыгыз, һава буенча чагыштырма тыгызлыгы
1,448 гә тигез.
§9
АЛКАДИЕННАР.
НАТУРАЛЬ ҺӘМ СИНТЕТИК КАУЧУКЛАР
АЛКАДИЕННАР СОСТАВЫ ҺӘМ НОМЕНКЛАТУРАСЫ
Бер генә түгел, ике икеле бәйләнеш булган углеводородлар да
билгеле. Углеводородта бер икеле бәйләнеш барлыкка килү водород
атомнары санын икегә киметкәнлектән (СпН,и - алкеннар), икенче
икеле бәйләнеш барлыкка килү водород атомнары санын тагын икегә
киметә.
Шулай итеп, алкадиеннарның гомуми формуласы:
47
Алкадиеннар (диен углеводородлары) - молекулаларында ике икеле
бәйләнеш булган һәм составлары CH2n2 (п > 3) гомуми формуласы
белән күрсәтелә торган чиксез углеводородлар.
Систематик номенклатура буенча диен углеводородларын этилен
углеводородларын атаган кебек атыйлар, ләкин -ен кушымчасы уры¬
нына -диен кушымчасын кулланалар. Мәсәлән:
12 3 4
CH2=CH-CH2-CH3 =>
бутен-1
12 3 4
CH2= CH-CH2=CH2
бутадиен-1,3 (дивинил)
Диен углеводородларыннан иң зур гамәли әһәмияткә бутадиен-1,3
(дивинил) һәм 2-метилбутадиен-1,3 (изопрен) ия. Алар синтетик кау¬
чук табу өчен чимал булып торалар.
АЛКАДИЕННАРНЫ ТАБУ
1932 елда академик С.В.Лебедев этил спиртыннан каталитик юл
белән дивинил табу ысулын эшли. Спирт парларын 400-500 oC та ка¬
тализатор өстеннән үткәргәндә, спирт молекуласыннан бер үк вакытта
су һәм водород молекулалары аерыла:
CH, - CH T H + H г CH - CH,
[6н “н] [ll“ OlJ
г, Al2O3
ZnO *
-+ CH2 =CH-CH = СН2+Н2О+Н2
бутадиен-1,3 (дивинил)
Сергей Васильевич Лебедев
(1874-1934)
Pyc химигы, академик. Төп эзләнүләре чиксез
кушылмаларның полимерлашуына, изомерлашуы-
на, гидрирлавына багышланган. Натрий тәэсирендә
бутадиен-1,3 не полимерлап синтетик каучук таба.
С.В.Лебедев җитәкчелегендә безнең илдә беренче
синтетик каучук заводы төзелгән.
Хәзерге вакытта алкадиеннарны табуда иң киң таралган ысул бу¬
лып нефть эшкәрткәндә барлыкка килгән газлардагы алканнарны де-
гидрирлау тора.
48
Бутадиен-1,3 бутанны дегидрирлап табыла. Моның өчен бутанны j
җылытылган катализатор өстеннән үткәрәләр: i
CH3-CH2-CH2-CH3 '' Cr,Oi > CH2 = CH - CH = CH2 + 2Н2
бутан бутадиен-1,3 I
Изопрен табу өчен 2-метилбутанны дегидрирлыйлар.
CH3-CH-CH-CH ■ лСгА> CH = C - CH = CH, + 2Н
3 i 2 3 2 J 2 2 I
CH3 CH3
2-метилбутан 2-метилбутадиен-1,3
АЛКАДИЕННАРНЫҢ ФИЗИК ҺӘМ ХИМИК ҮЗЛЕКЛӘРЕ
Дивинил - төссез, җиңел сыекланучан газ, ә изопрен 34,1 oC та кай¬
ный торган төссез сыеклык. Барлык диен углеводородлары да - чик¬
сез углеводородлар, шуңа күрә алар алкеннар кергән реакцияләргә
керәләр. Диен углеводородларының полимерлашу реакциясе иң зур
практик әһәмияткә ия. Бу реакция югары эластик һәм табигый каучук¬
ны хәтерләтүче полимер барлыкка китерә. Синтетик каучуклар табу -
бутадиен һәм изопрен куллануның төп өлкәсе.
НАТУРАЛЬ ҺӘМ СИНТЕТИК КАУЧУКЛАР
Натураль (табигый) каучук
XVI гасырда Көньяк Америкага килеп төшкән испаннар индеецлар
уйнаган шарларга игътибар итәләр. Бу шарлар индеецлар тарафыннан
Көньяк Америка агачы - гевея согыннан алынган, Европада билгеле
булмаган сыгылмалы һәм пластик матдәдән ясалган була. Индеецлар
бу матдәдән су үткәрми торган аяк киемнәре ясаганнар яки тукыманы
су сеңдермәсен өчен шуңа манганнар. Анда яшәүчеләр гевея согын
«каучу» дип атаганнар, шуннан каучук сүзе дә килеп чыккан.
Натураль каучук кайбер үсемлекләрнең согында (латекста) бар.
Күбрәк аны Бразилиядә үсә торган гевея согыннан табалар. Каучук
үзлекләрен тикшерүләр күрсәткәнчә, һава кертмичә җылытканда, ул
майсыман матдә - изопрен барлыкка китереп таркала. Ә изопрен по¬
лимерлашканда каучук барлыкка килә. Шуларга нигезләнеп, натураль
каучук макромолекулалары изопрен молекуласы калдыкларыннан тора
дигән нәтиҗә ясала.
49
Изопрен полимерлашу процессын түбәндәге схема ярдәмендә
күрсәтергә була:
CH3 CH3 H
MCH2 = C-CH = CH2 -> ,С = с'
-CH2 CH2-"
натураль каучук
Натураль каучук макромолекуласындагы барлык элементар
берәмлекләрнең метилен төркемнәре -CH2- икеле бәйләнештән бер
якта урнашкан. Молекула төзелешенең мондый үзенчәлеге натураль
каучукка ышкылуга чыдамлык һәм эластиклык - тышкы йөкләнеш
тәэсирендә сузылу һәм кыскару, ә йөкләнешне алганнан соң кире үз
формасын кайтара алу сәләте бирә.
Ләкин натураль каучук кыска температура интервалында гына эла¬
стик. 40 oC тан югары температурада ул йомшак һәм ябышучан, ә сал¬
кында - уалучан һәм каты.
Каучукны вулканлаштыру
Натураль каучукның сыйфатларын яхшырту өчен аны вулканлаш¬
тыралар. Моның өчен аны күкерт һәм башка катнашмалар (корым,
акбур, буяу һ.б.) белән бергә җылыталар. Вулканлаштыру процессын¬
да күкерт атомнары каучук молекуласындагы кайбер икеле бәйләнеш
өзелгән урыннарга кушылалар һәм молекулаларны бер-берсе белән
дисульфид күперчекләре аша «тегәләр» (9 нчы рәс.). Каучук вулкан-
лашуы продукты булып резина тора, ул каучуктан ныграк, ышкылуга
һәм температура үзгәрүгә чыдамлырак,
шулай ук органик эреткечләр тәэсиренә
дә тотрыклы.
Әгәр дә вулканлаштыруны резина
ясалуга киткәннән күбрәк күкерт кушып
үткәрсәң, дисульфид күперчекләр саны
артачак һәм материалның эластиклыгы
бетәчәк, ул катыланачак, һәм озак ва¬
кыт электр изоляторы итеп кулланыл¬
ган эбонит барлыкка киләчәк (хәзер
аны төрледән-төрле пластмассалар этеп
чыгарды).
9 нчы рәсем. Вулканлашты-
рылган каучукның төзелеш
схемасы
50
Натураль каучук (резина рәвешендә) автомобиль, самолет, мото¬
цикл, трактор, велосипед камералары һәм покрышкалары ясау өчен,
аяк киеме, уенчыклар һ.б. җитештерүдә кулланыла.
Синтетик каучуклар
Озак вакытлар буе кайбер илләрдә генә табыла торган натураль кау¬
чукны кулланганнар. XX гасыр башында сәнәгать җитештерүе, авто¬
мобиль төзү киң колач алу белән каучукка да ихтыяҗ арта. Бу галимнәр
алдында әлеге матдәне синтезлау мәсьәләсен куя. Синтетик каучукның
сәнәгати җитештерүен оештыруда безнең ил пионер була.
Үткән гасырның 30 нчы еллары башында С.В.Лебедев, бутадиен-1,3
не полимерлап, беренче тапкыр бутадиенлы синтетик каучук таба (10
нчы рәс.):
нСН = CH - CH = CH, -> [ -CH9 - CH = CH - CH,- ]
2 2 L 2 2 Jn
10 нчы рәсем. Бутадиен каучук табу схемасы:
a - этанолдан (С.В.Лебедев ысулы); б - бутаннан (заманча сәнәгати ысул)
Синтетик каучук һәм аннан алына торган резинаның үзлекләре
аларны синтезлау өчен кулланыла торган мономер төрләренә бәйле.
Мәсәлән, бутадиен каучуктан алынган резинаны киң кулланалар
(шина, кабель һәм чыбыкларның саклагыч катлаулары). Хлоропренны
полимерлап хлоропрен каучук табалар:
иСН =C-CH = CH /,кат> F-CH-C = CH-CH,-
2I 2 2I 2
Cl Cl
In
2-хлорбутадиен-1,3 (хлоропропен) хлоропропсн каучук
Аннан ясалган резина бензинга, майга, җылытуга чыдам һәм ян¬
мый.
51
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Бутадиенның тулысынча яну реакциясе тигезләмәсендә кисло¬
род формуласы алдындагы коэффициент ничәгә тигез:
а) 11; 6)10; в) 5; г) 13.
Q 2. Натураль каучук таркалуының төп продукты булып нәрсә тора:
а) бутан; б) пентен; в) дивинил; г) изопрен.
Аның полимерлашу процессының схемасын языгыз.
O 3. Каучук үзле эремә барлыкка китерә:
а) суда; в) сульфат кислотасында;
б) бензинда; г) селте эремәсендә.
Q 4. Каучукны күкерт һәм тутыргычлар белән җылыту процессының
атамасы:
а) полимерлашу; в) укмашу;
б) йомшарту; г) вулканлаштыру.
5*. Әгәр дә продукт чыгышы 75% икән, 162 г бутадиен-1,3 табу
өчен күпме күләмдәге этил спирты (р=0,8 г/см3) кирәк булуын
исәпләп чыгарыгыз.
6. Әверелешләр схемасына туры китереп, реакция тигезләмәләрен
языгыз:
пентан —у 2-метилбутан -> изопрен —> каучук.
Реакцияләрнең үтү шартларын күрсәтегез.
§10
АЛКИННАР
АЛКИННАРНЫҢ ГОМОЛОГИК РӘТЕ, НОМЕНКЛАТУРАСЫ ҺӘМ
ИЗОМЕРИЯСЕ
Алкиннар - углерод атомнары арасында бер өчле бәйләнеш булган
чиксез углеводородлар (C=C). Алкиннарның гомуми формуласы
52
Алкиннарның гомологик рәтен башлап җибәрүче - ацетилен:
C2H2 H: C-=C: H H-C = C-H CH = CH
молекуляр формула электрон формула структур формулалары
Шуңа күрә алкиннарны ацетилен углеводородлары дип тә
йөртәләр.
Систематик номенклатура буенча ацетилен углеводородларының
(алкиннар) атамаларын тиңдәшле алкан атамаларының -ан кушымча¬
сын -ин кушымчасына алмаштырып ясыйлар:
CH = CH CH3-C = CH CH3-C = C-CH3 һ.б.
этми пропин бутни-2
Тармакланган төзелешле ацетилен углеводородларының атамала¬
рын этилен углеводородларын атаганда кулланылган кагыйдәләр бу¬
енча төзиләр. Төп чылбырны өчле бәйләнеш керерлек итеп сайлыйлар
һәм номерлауны өчле бәйләнеш якынрак урнашкан баштан башлый¬
лар:
CH3
5 4| 3 2 1
CH3-C-C = C-CH3
CH3
4, 4-диметилпентин-2
Алкиннарга, алкеннарга кебек үк, структур изомерия төрләре хас.
• Углерод скелеты изомериясе (C5H8 тан башлап):
5 4 3 2 1 г — - 4 3 21
CH-CH1-CH-C = CH <- t H -> CH -CH-C = CH
3 2 2 в 5 о a 5
пентин-1 ь — J I
CH3 3-метилбутин-1
• Өчле бәйләнеш торышы изомериясе (C4H6 дан башлап):
CH, - CH2 - C = CH <- Гс“н? -> CH, - C = C - CH1
3 2 а 4 6| 3 3
бутин-1 ь — J бутин-2
АЦЕТИЛЕН МОЛЕКУЛАСЫНЫҢ
ЭЛЕКТРОН ҺӘМ ПРОСТРАНСТВОЛЫ ТӨЗЕЛЕШЕ
Ацетилен молекуласында углерод атомнары 5р-гибридлашу
халәтендә торалар. Бу очракта гибридлашуга бер 2s- һәм бер 2р-
орбитале бирелә. Хасил булган ике бертөрле 572-гибрид орбитальләре
бер-берсенә карата 180° почмак ясап урнашалар (бер турыда яталар).
53
Калган гибридлашмаган 2р-орбитальләре шул турыга һәм бер-берсенә
карата перпендикуляр урнашалар (Па рәс.).
11 нче рәсем. Ацетилен молекуласында о-бәйләнешләрнең барлыкка килүе:
a — углерод атомының ике др-гибридлы һәм гибридлашмаган ике 2р-орбитале;
б - о-бәйләнешләрнең ясалуы
Ацетилен молекуласы ясалганда, углерод атомнарының лр-гибридлы
орбитальләре C-C о-бәйләнеше һәм ике C-H о-бәйләнеше барлыкка
китерәләр. Шулай итеп, ацетилен молекуласында өч о-бәйләнеш бар
(116 рәс.).
Бер углерод атомының гибридлашмаган ике 2р-орбитале икенче
углерод атомының гибридлашмаган ике 2р-орбитале белән аралаша.
Аларның ян аралашу нәтиҗәсендә ике л-бәйләнеш ясала, һәм алар бер-
берсенә карата перпендикуляр яссылыкларда урнашалар (12 нче рәс.).
Димәк, ацетилен молекуласында углерод атомнары арасында бер сә¬
нәм ике л-бәйләнештән торучы өчле бәйләнеш бар. Углерод һәм водород
атомнары бер турыда урнашканга күрә, молекулага сызыкча төзелеш хас.
12 нче рәсем. Ацетилен молекуласында л-бәйләнешләрнең ясалуы:
a - 2р-орбитальләренең ян аралашуы;
б - л-бәйләнешләр яссылыкларының бер-берсенә карата урнашуы
54
Өченче бәйләнешнең барлыкка килүе углерод атомнарын тагын да
якынайта, шуңа күрә өчле бәйләнешнең C=C озынлыгы 0,120 нм га
тигез, бу берле бәйләнешнең дә, икеле бәйләнешнең дә озынлыкла-
рыннан кимрәк. Модельләрдә моны углерод атомнарын күрсәтүче шар¬
ларны тагын да кысыбрак күрсәтәләр (13 нче рәс.). Бәйләнешнең озын¬
лыгы кимү белән аның энергиясе дә арта, ул 828 кДж/мольгә тигез.
13 нче рәсем. Ацетилен молекуласы модельләре: a - шарчыбыклы, б- масштаблы
АЦЕТИЛЕН ТАБУ
Лабораториядә ацетиленны карбид ысулы белән табалар. Әгәр дә
кальций карбиды кисәкчекләрен сулы савытка салсаң, көчле итеп аце¬
тилен аерылып чыга башлый:
/C H1OH
Calm + I -> C7H J + Ca (ОН),
^1C HjOH
Сәнәгатьтә ацетиленны җитәрлек һәм арзан чимал - метаннан (та¬
бигый газның төп өлеше) табалар:
1500oC
2СН4 ► C2H2 + ЗН2
АЛКИННАРНЫҢ ФИЗИК ҺӘМ ХИМИК ҮЗЛЕКЛӘРЕ
Ацетилен углеводородларының гомологик рәтендә физик
үзлекләрнең (кайнау һәм эрү температуралары) төп үзгәрү закончалы¬
гы алкан һәм алкен рәтендәгеләргә охшаш.
Ацетилен углеводородларының химик үзлекләре аларның моле¬
куласында өчле бәйләнеш булу белән билгеләнә. Алкиннарга, алкен¬
нарга кебек үк, кушылу реакцияләре хас. Ләкин алкеннардан аермалы
буларак, алкиннарда кушылу реакциясе ике стадиядә үтәргә мөмкин.
Беренче стадиядә реагентның бер молекуласы кушыла һәм өчле
бәйләнеш икелегә әйләнә. Аннары икенче молекула кушыла.
Алкиннарның химик үзлекләрен ацетилен мисалында карап үтик.
55
Кушылу реакцияләре
Гидрирлау. Алкеннарны гидрирлау реакциясендә дә кулланыла тор¬
ган катализаторлар (Pt, Ni, Pd) катнашында җылытканда ацетиленга
бер-бер артлы водород молекулалары кушыла. Гидрирлауның беренче
стадиясендә — этилен, ә аннары этан барлыкка килә:
CH = CH + H2 tNi> CH2 = CH2
ацетилен этилен
CH2 = CH2+ H2 ^Nix CH3-CH3
этилен этан
Галогенлау. Алкиннарда, алкеннардагы кебек үк, углерод атомна¬
ры арасында тг-бәйләнешләр бар һәм шуңа күрә алар бромлы суны
төссезләндерәләр. Бу реакция ярдәмендә алкен һәм алкиннарны аерып
булмый:
CH = CH +Вг?> CHBr = CHBr +ВГ;» CHBr2 - CHBr2
этин 1,2-дибромэтен 1,1,2,2-тетрабромэтан
Гидрогалогенлау. Терекөмеш (II) тозлары һәм башка катализа¬
торлар катнашында үтә торган хлороводород кушу реакциясе зур
әһәмияткә ия. Ацетилен молекуласына хлороводород кушылганда газ
хәлендәге матдә - хлорэтен (винилхлорид, хлорвинил) барлыкка килә:
CH = CH + HCl '■ »g2 х CH2 = CHCl
хлорэтен
(винилхлорид,хлорвинил)
Аны поливинилхлорид (полихлорвинил) полимеры табу өчен кул¬
ланалар:
«си= CH^ Рсн-сн-
2 I 2 I
Cl Cl
— — п
винилхлорид поливинилхлорид
Поливинилхлорид (ПВХ) - хәзерге вакытта иң киң таралган
полимерларның берсе. Ул химик реагентлар тәэсиренә чыдам, тиз буя¬
ла. Аннан диэлектрик үзлекле, химик һәм механик яктан чыдам пласт¬
масса алалар, шулай ук ясалма күн, клеенка һ.б. ясыйлар.
Гидратлашу. Ацетиленның гидратлашу өчен, этиленнан аермалы
буларак, әче тирәлектән башка, катализатор - терекөмеш (II) тозлары
да кирәк. Реакция серкә альдегиды барлыкка килү белән уза:
t. Hg2+, Н’
CH = CH + HOH ► CH3 - C
4H
серкә альдегиды
56
Бу реакция рус химигы М.Г.Кучеров тарафыннан 1881 елда ачылган
һәм аның исеме белән Кучеров реакциясе дип атала.
Михаил Григорьевич Кучеров
(1850-1911)
Pyc химик-органигы. Төп фәнни эшләре ор¬
ганик синтезны үстерүгә карый. Дифенил һәм
аның кушылмаларын таба, бромвинилның аце¬
тиленга әверелү шартларын тикшерә. Ацетилен
углеводородларын каталитик гидратлап карбо¬
нил кушылмалар алу реакциясен, ацетиленның
терекөмеш тозлары катнашында серкә альдеги¬
дына әверелүен ача (Кучеров реакциясе). Ацети¬
лен углеводородларының гидратлашуын шулай ук магний, цинк, кадмий
тозлары катнашында да үткәреп булуын күрсәтә.
Оксидлашу реакциясе
һавада ацетилен якты ялкын белән корымланып яна, чөнки анда
углеродның масса өлеше зур. Әгәр дә ялкынга өстәмә кислород
өрдерсәң, ацетилен тулысынча корымсыз янып бетә:
2С2Н2+ SO2-MCO2 + 2Н2О
Ацетилен кислород тогында янганда, бик югары температура
(3000 0C тирәсе) барлыкка килә, шуңа күрә кислород-ацетиленлы ял¬
кынны автогенлы эретеп ябыштыруда һәм металл кискәндә куллана¬
лар. Ацетиленның нава яисә кислород белән катнашмасы шарт-
лаучан. Сыек ацетилен хәтта селкетүдән дә җиңел шартлый, шуңа
күрә аны баллоннарда - ацетондагы эремәсе сеңдерелгән, күзәнәкле
материаллар халәтендә күчереп йөртәләр.
АЦЕТИЛЕННЫ КУЛЛАНУ
Ацетилен башлангыч матдә буларак синтетик сүс, кайбер каучуклар,
поливинилхлорид пластмассалар һәм башка продуктлар тапканда кул¬
ланыла (14 нче рәс.). Ацетиленнан алына торган хлоркушылмалар -
яхшы эреткечләр. Шулай ук ацетиленны эретеп ябыштырганда һәм
металлар кискәндә кулланалар, чөнки аны яндырганда югары темпе¬
ратура барлыкка килә.
57
14 нче рәсем. Ацети¬
ленны куллану:
1 — металларны кисү
һәм ябыштыру өчен;
2 - ПВА клее; 3 — син¬
тетик сүсләр; 4 — кау¬
чуклар; 5 - эреткечләр;
6 — поливинилхлорид
табу өчен
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Составында а) 5 углерод атомы; б) 10 водород атомы булган
алкиннарның молекуляр формулаларын төзегез.
2. CsHx составлы барлык мөмкин булган алкиннарның структур
формулаларын языгыз, аларны атагыз.
Q 3. Бирелгән кайтма реакция тигезләмәләренең кайсысында басым¬
ны арттыру тигезләнешне бозмый:
а)2СН4(г.) C2H2(E)+ ЗН2(г.); в) C2H4 (г.) C2H2(E) + H2(E);
б) CH4 (г.) C (кап>1) + 2Н2(е); г) CO (г.) + H2O (г.) <=± CO2 (г.) + Н2(г.).
Q 4. Cy кайсы җыелмадагы һәр матдә белән дә реакциягә керә:
а) этен, пропан, кремний оксиды; в) бутен-1, бутан, пропин;
б) күкерт (VI) оксиды, этин, этен; г) натрий карбонаты, пропан, этин.
Бу җыелмадагы матдәләрнең су белән булган реакция
тигезләмәләрен языгыз һәм аларның үтү шартларын күрсәтегез.
5. Схемага туры китереп, реакция тигезләмәләрен төзегез:
х O
Ca -+ CaC2 -> C2H2-+ CH3-C'
H
реакцияләрнең үтү шартларын күрсәтегез һәм барлык матдәләргә
атама бирегез.
6*. Метан таркалганда матдә микъдары 15 моль булган ацетилен
табылган. Бүленеп чыккан водород күләмен исәпләгез (н.ш.).
7*. 270 г массалы кальций карбидын су белән эшкәртәләр. Барлык-1
ка килгән ацетиленны Кучеров реакциясе буенча гидратлаштыра-1
лар. Әгәр дә ацетиленның чыгышы 80% булса, барлыкка килгән |
серкә альдегидының массасын исәпләп чыгарыгыз. |
58
Ill бүлек. Циклик углеводородлар
Без молекулаларындагы углерод атомнары ачык чылбырларга
бәйләнгән углеводородларны карап үттек. Ләкин молекулаларында
углерод чылбырлары ябык цикл хасил итүче матдәләр дә билгеле.
Аларны циклик углеводородлар дип йөртәләр.
§11
ЦИКЛОАЛКАННАР (ЦИКЛОПАРАФИННАР)
ЦИКЛОАЛКАННАРНЫҢ СОСТАВЫ ҺӘМ НОМЕНКЛАТУРАСЫ
Циклоалканнар (циклопарафиннар) - чикле (туендырылган) ци¬
клик углеводородлар.
Составы буенча циклоалканнар тиңдәшле алканнардан ике водород
атомына аерыла. Бу атомнарның аерылып чыгуы исәбенә циклның йо¬
мылуы күзәтелә (15 нче рәс.):
H2C-Jl^Hj-CH2 H2 C - CH2
H2C-CH2 * H2C-CH2
бутан циклобутан
15 нче рәсем. Молекула модельләре: а - бутан; б - циклобутан
Димәк, циклоалканнарның гомуми формуласы этилен углеводород¬
ларыныкы кебек үк:
CH,, п > 3
п 2п7
Циклоалканнарның атамалары тиңдәшле алкан атамасына цикло-
алкушымчасы кушып ясала:
CH3 - CH2 - CH3
пропан
CH2
H2C-CH2
циклон iponan
59
ЦИКЛОАЛКАННАРНЫ ТАБУ ҺӘМ КУЛЛАНУ
Циклоалканнар кайбер нефть сортларының состав өлеше булып
тора, шуңа күрә сәнәгатьтә аларны нефтьтән аерып алалар.
Циклоалканнар табуның лаборатор ысулы - молекулаларында га¬
логен атомнары кимендә өч углерод атомы аша урнашкан дигалоге-
налканнарны металлар (магний яки цинк) белән җылыту:
хсн,|в7 *[ /СН2
H2C +Mg-Uh2C I +MgBr2
xCH2 -[в_г_ _[ xCH2
1,3-дибромпропан циклопропан
Циклоалканнардан иң зур әһәмияткә циклогексан ия, аны бүтән
углеводородлар табу өчен дә, эреткеч буларак та кулланалар. Цикло¬
пропан хирургиядә анестезия чарасы буларак кулланыла.
ФИЗИК ҺӘМ ХИМИК ҮЗЛЕКЛӘРЕ
Гадәти шартларда циклопропан, циклобутан - газсыман матдәләр;
циклопентан, циклогексан - сыеклыклар; югары циклоалканнар -
каты матдәләр. Алар суда бөтенләй эремиләр.
Биш-алты углерод атомы булган циклоалканнарның активлыгы
түбән, химик үзлекләре ягыннан алар чикле углеводородларга охшаш.
Аларга шулай ук алмашу реакцияләре хас. Бу реакцияләр алканнар
алмашу реакциясе кебек шартларда үтәләр. Мәсәлән, циклопентан як¬
тыда бром белән реакциягә керә:
H2C - CH1
I xCH2+ Br1
H2C - CH2 х
циклопентан
hv
—>
H2C-CH2x
I CH - Br + HBr
H2C-CH2 х
бромциклопентан
Циклоалканнар, алканнар кебек үк, дегидрирлашу реакцияләренә дә
керәләр. Мәсәлән, платина катализаторы катнашында циклогексанны
дегидрирлаганда бензол барлыкка килә:
C6H12 _Д, C6H6+ ЗН,
циклогексан бензол
Циклоалканнарга яну реакциясе хас:
С4Н8 + 6О2-> 4СО, + 4Н2О
циклобутан
60
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Схемадагы әвәрелешләргә туры китереп, реакция тигезләмәләрен
төзегез:
+Mg
1,6- дихлоргексан ► X —► CO2
X матдәсен атагыз.
2*. Углеродның масса өлеше 85,71% булган углеводородның мо¬
лекуляр формуласын табыгыз. Бу матдә парларының һава буенча
чагыштырма тыгызлыгы 1,93.
§12
АРОМАТИК УГЛЕВОДОРОДЛАР (АРЕННАР)
APEHHAPHbIH1 СОСТАВЫ ҺӘМ ТӨЗЕЛЕШЕ
Бу рәтнең беренче билгеле булган матдәләре хуш исле булганга
күрә, әлеге кушылмаларны ароматик дип атаганнар. Аларны табигый
хуш исле бальзамнардан яки бүтән матдәләрдән таба торган булган¬
нар. Органик химия үскән саен, төзелеше һәм үзлекләре белән аларга
охшаш матдәләр табыла, ләкин болары иссез яисә начар исле булалар.
Шуңа да карамастан бу углеводородларның тарихи атамасы сакланып
калган.
Ароматик углеводородларның үзлекләрен һәм
төзелешләрен тикшерү күрсәткәнчә, аларның мо¬
лекулаларында алты углерод атомыннан торучы
циклик группировка бар, аны бензол боҗрасы,
яки бензол төше дип атыйлар. Ароматик
углеводородларның иң гади вәкиле - бензол C6H6
(16 нчы рәс.). Хәзерге вакытта бензолның структур
формуласын эчендә түгәрәк булган алтыпочмаклык
аша (а) яки шартлыча углерод һәм водород атомна¬
рын язмыйча күрсәтәләр (б):
16 нчы рәсем. Бен¬
зол молекуласының
масштаблы моделе
а
бензолның структур формулалары
61
БЕНЗОЛ ТАБУ
Сәнәгатьтә ароматик углеводородлар табуда төп чимал булып
ташкүмер кокслаганда табыла торган ташкүмер сумаласы һәм нефть
тора. Бензолны синтетик юл белән дә табалар.
Ацетиленның тримеризациясе. Ацетиленны активлаштырылган
күмер өстеннән җылытып үткәргәндә бензол барлыкка килә:
^CH CH
нс сн с (акт.), / нс<-Ссн
Ill ► I ( ) I
HCk CH НС^<СН
CH CH
ацетилен бензол
Ачканнарны дегидрирлау. Молекуласында алты углерод атомын¬
нан да ким булмаган тармакланмаган чикле углеводородларны кызды¬
рылган катализатор өстеннән үткәргәндә, чылбыр йомыла, һәм водо¬
род аерылып чыга. Мәсәлән, гексаннан бензол табыла:
^CH
CHj-(CH1)4-CHj „
HC <^сн
CH
гексан бензол
Циклоалканнарны дегидрирлау. Циклогексанны катализатор
(Pt яки Pd) катнашында җылытканда, ул бензолга әверелә:
CH2 CH
H2C^ "CH2 Pt,,r нс^?сн +ЗНг
H2Ck кСН2 HC ^<СН
CH2 CH
циклогексан бензол
Бу юл белән бензол табу ысулы академик Н.Д.Зелинский тарафын¬
нан эшләнгән.
Николай Дмитриевич Зелинский
(1861-1953)
Pyc химик-органигы, академик. Фәнни тикшеренүләре
гетероцикллар химиясенә, органик катализга, аксымнар
һәм аминокислоталар химиясенә карый. Органик катализ
һәм нефть химиясенә нигез салучыларның берсе. Цикло-
62
гексаннан бензол табу методын эшли, күмерле противогаз уйлап таба.
СССР да иң беренче булып (1932) хлоропрен каучук табу эшләрен баш¬
лап җибәрә. СССР ФАнең Органик химия институтын (хәзер Зелинский
исемен йөртә) оештырып җибәрүчеләрнең берсе.
БЕНЗОЛНЫҢ ФИЗИК ҺӘМ ХИМИК ҮЗЛЕКЛӘРЕ
Гадәти шартларда бензол - тәмсез исле, төссез, очу чан һәм тиз ка-
бынучан сыеклык. Ул судан җиңелрәк (р = 0,88 г/см3) һәм аның белән
катнашмый, ләкин органик эреткечләрдә эрүчән һәм үзе дә күп кенә
матдәләрне яхшы эретә. Бензол 80,1 oC та кайный, суытканда кристал¬
лик ак матдә ясап җиңел ката. Бензол һәм аның парлары агулы. Аның
парларын систематик рәвештә сулау кан авыруы китереп чыгара.
Бензол составы ягыннан чиксез булса да, аңа кушылу реакцияләре
чиксез углеводородларга караганда азрак хас. Мәсәлән, ул бромлы су
белән реагирлашмый. Бензолга күбрәк алмаштыру реакцияләре хас,
өстәвенә алар чикле углеводородлар белән чагыштырганда җиңелрәк
баралар.
Алмаштыру реакцияләре
Галогенлау. Бензол хлор һәм бром белән реакциягә керә. Этилен¬
нан аермалы буларак, ул бромлы су белән реагирлашмый. Реакция үтү
өчен сыек бромның катализатор - сусыз тимер (III) бромиды катна¬
шында аз гына җылытканда тәэсир итүе кирәк; нәтиҗәдә авыр сые¬
клык - бромбензол барлыкка килә (17 нче рәс.):
^CH CH
HC FeBr HC-X'C-Br
I ( ) I +Br, „Ч I О I + HBr
HCXch HCXXH
CH CH
бромбензол
яки C H + Br F"Br’> C H Br+ HBr
6 6 2 до oC 6 5
17 нче рәсем. Бензолның бром белән тәэсир итешүе
Тимер тозы урынына тимер чүбе кулланырга була - бу вакытта ка¬
тализатор турыдан-туры реакция катнашмасында барлыкка килә. Бен¬
63
золны хлорлаганда хлор тимер (III) хлориды катнашында кулланыла.
Нитролаштыру. Бензолга куертылган нитрат һәм сульфат кислота¬
лары катнашмасы (нитролаштыручы катнашма) белән тәэсир итеп
аз гына җылытканда (50 °C), авыр саргылт төстәге миндаль исле сые¬
клык - нитробензол барлыкка килә:
^CH ^CH
HCL.1I 1 H2so4(KyePT.)^ НС<-хС -NO,
I ( ) I KtiHQLt NO 50 oC *" I ( ) I + H O
HC/CH \HC^-/CH
CH CH
яки C6H6 + HNO, C6HjNO1 + H1O
-NO2 атомнар төркемен нитротөркем дип атыйлар.
Кушылу реакцияләре
Кырысрак шартларда бензол кушылу реакцияләренә дә керергә
мөмкин.
Гидрирлау. Бензолның водород белән тәэсир итешүе алкеннарга
караганда югарырак температура һәм басым астында катализатор кат¬
нашында бара. Бензол циклогексанга әверелә:
/СН
НС^-^СИ Н,С C Н,
I C ) I + ЗН, ‘’Р- N' -I I2
НС<~7СН 2 Н,С CH2
CH ■ ""CK
циклогексан
яки CaHa+ЗН, САН„
OOZ O Iz
Хлорлау. Реакция бензол һәм хлор катнашмасын яктыртканда бара:
HC
HC
CH
CH һ
) I +ЗС12 —K
-^сн
CH
H^
сК|
H^ I
C
сП
H
H ^Cl
" C "
^H
С"с|
1 /Н
C
Cl
Cl
гексахлорциклогексан
hv
яки CaH + ЗС1, —► CaHaCIa
OO Z OOO
64
Гексахлорциклогексан - гексахлоран дип аталучы кристаллик матдә.
Инсектицид буларак аны озак вакыт авыл хуҗалыгы культуралары
корткычлары булып саналучы бөҗәкләр белән көрәшүдә кулланган¬
нар.
Чиксез углеводородлардан аермалы буларак, бензол су
һәм галогенводородларны кушмый, шулай ук бромлы
суны да төссезләндерми.
Оксидлашу реакциясе
Бензол һавада корымланып яна, ләкин кислород күп булганда ул ту-
лысынча янып бетә:
2С H + 150, 12СО, + 6Н,О
оо 2 2 2
БЕНЗОЛНЫ КУЛЛАНУ
Бензол - эреткеч һәм буяулар, дарулар, агулы химикатлар, фенол, ани¬
лин, стирол һәм башка органик матдәләр табу өчен чимал (18 нче рәс.).
18 нче рәс. Бензол һәм аның гомологларын куллану: 1 - корткыч бөҗәкләргә һәм
үсемлек авыруларына каршы торучы матдәләр; 2 - пластмассалар; 3 - бутадиен-
стирол каучук; 4 - шартлаткыч матдәләр; 5 - буяулар; 6 - дарулар; 7 - синтетик сүсләр
табу өчен; 8 - эреткеч буларак.
65
? СОРАУЛАР ҺӘМ БИРЕМНӘР
Q 1. Кайсы пардагы һәр матдә белән дә бензол реакциягә керә?
a) Br2 һәм HCl; в) H2O һәм Cl2;
б) KOH һәм H2; г) Br2 һәм H2. ‘
Бу реакцияләрнең тигезләмәләрен языгыз, аларның үтү шартларын
күрсәтегез, реакция продуктларын атагыз.
2. Схемага нигезләнеп, реакция тигезләмәләрен төзегез:
CHd -> C2H, -> CH -> C H Br
4 2 2 6 6 6 5
Реакция үтү шартларын күрсәтегез һәм матдәләрнең исемнәрен
атагыз.
3*. 112 л ацетиленнан табылган бензолның күләмен (р = 0,8 г/см3)
табыгыз (н.ш.).
4*. 19,5 см3 бензолны (р = 0,8 г/см3) гексахлоранга әверелдерүче
хлорны табу өчен кирәк булган марганец (IV) оксиды массасын
исәпләп чыгарыгыз.
5. Бензол һәм гексен-1 сыеклыклары бер-берсеннән нәрсә белән
аерыла? Реакция тигезләмәсен языгыз.
§_13
УГЛЕВОДОРОДЛАР АРАСЫНДА ГЕНЕТИК БӘЙЛӘНЕШ
Сез углеводородларның берничә классын өйрәндегез. Органик
кушылмалар арасында, неорганик кушылмалар арасында булган ке¬
бек, генетик бәйләнеш бар: бер класс матдәләреннән икенче класс
матдәләрен табып була (1 нче схема). Чикле углеводородлардан чиксез
углеводородлар, ацетиленнан (алкин) - бензол (арен) табалар; чиксез
углеводородлар чикле углеводородларга әвереләләр һ.б.
1 нче схема
Углеводород класслары арасында бер-берсенә күчеш
66
Сез шулай ук углеводородларны неоганик матдәләрдән табып бул¬
ганын беләсез. Мәсәлән, неорганик матдә, кальций карбиды су белән
реакциягә кереп, органик матдә - ацетилен хасил итә. Ацетиленнан Ку¬
черов реакциясе ярдәмендә серкә альдегиды табалар, ул тулы бер чыл¬
быр әверелешләрендә башлангыч матдә булып тора, һәм, киресенчә,
органик матдәләрне оксидлаштырганда - неорганик матдәләр: углерод
(IV) оксиды һәм су барлыкка килә. Димәк, табигатьтә барлык неорга¬
ник ьэм органик матдәләр арасында бердәмлек һәм генетик бәйләнеш
бар. Аңа без органик химияне өйрәнү барышында инанырбыз.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Углеводородлар мисалында органик кушылмаларның күп¬
төрлелек сәбәбен аңлатыгыз. 1 нче схемада уклар ярдәмендә
күрсәтелгән углеводород әверелешләрен сурәтләүче реакция
тигезләмәләрен языгыз.
2. Неорганик матдәләрдән углеводородлар табуны сурәтләүче ре¬
акция тигезләмәләрен языгыз.
3. Сез нинди изомерия төрләрен беләсез? Тиешле мисаллар ките¬
регез.
4. Схемадагы әверелешләргә туры китереп, реакция тигезләмәләрен
төзегез:
Jr CO1 —> CaCO3 —> CaO —> CaC,
с -* CH4
С,Н,-> CfcHfc-+CfcHl,
2 2 об о 12
§14
УГЛЕВОДОРОДЛАРНЫҢ ТАБИГЫЙ ЧЫГАНАКЛАРЫ
Углеводородлар табигатьтә киң таралганнар. Аларның төп чыганак-
лары булып нефть, табигый һәм иярчен нефть газлары, ташкүмер
тора.
ТАБИГЫЙ ҺӘМ ИЯРЧЕН НЕФТЬ ГАЗЛАРЫ
Табигый газ - төп өлеше метан (табылу урынына карап 75 тән 98%
ка кадәр), калган өлеше этан, пропан, бутан һәм аз гына катышма-
67
лар - азот, углерод (IV) оксиды, сероводород, су парлары булган газ
катнашмасы.
Табигый газның аерым табылу урыннары бар.
Табигый газ янганда, бик күп җылылык аерылып чыга, шуңа күрә
аның 90% ка кадәр өлешен ягулык буларак кулланалар (җылылык
электр станцияләрендә, сәнәгать предприятиеләрендә, көнкүрештә).
Калган 10% ы химик сәнәгатьтә чимал буларак кулланыла: аннан во¬
дород, ацетилен, корым, төрле пластмассалар, дарулар һәм башка про¬
дуктлар алалар.
Иярчен нефть газы - шулай ук табигый газ, ләкин ул нефть белән
бергә очрый - нефть өстендә урнашкан яки басым астында анда эрегән
була. Нефтьне өскә чыгарганда басым төшә һәм газның эрүчәнлеге
кими, нәтиҗәдә ул нефтьтән аерыла.
Иярчен газда метан азрак (30-50%), ләкин аның гомологлары - этан,
пропан, бутан һәм башка углеводородлар күбрәк. Өстәвенә анда таби¬
гый газда булган катышмалар да бар.
НЕФТЬНЕҢ ҮЗЛЕКЛӘРЕ ҺӘМ СОСТАВЫ
Нефть - сары яки ачык коңгырт төстән алып кара төскә кадәр,
үзенчәлекле исле майсыман сыеклык. Ул судан җиңелрәк һәм анда
бөтенләй эреми. Нефть - бүтән матдәләр катышкан углеводородлар
катнашмасы, шуңа күрә аңа билгеле бер кайнау температурасы хас
түгел.
Табылу урынына карап нефтьнең составы төрле. Мәсәлән, Баку
нефте - циклик углеводородларга бай (90% ка кадәр), Грозный
нефте - чикле углеводородларга, ә Урал нефте ароматик угле¬
водородларга бай. Ешрак катнаш составлы нефть очрый. Тыгызлыгы
ягыннан җиңел һәм авыр нефтьне аералар.
Нефтьнең күп өлеше (90%) төрле ягулык һәм майлагыч материал¬
лар җитештерүдә кулланыла. Шул ук вакытта нефть - химия сәнәгате
өчен кыйммәтле чимал. Нефтьтән алына торган матдәләрдән синтетик
каучуклар, пластмассалар, шартлагыч матдәләр, дару препаратлары,
синтетик сүсләр һ.б. табалар. Шуңа күрә илнең икътисады башка фай¬
далы казылмаларга караганда нефтькә күбрәк бәйле дип әйтергә була.
Җир астыннан табыла торган нефтьне эшкәртелмәгән нефть дип
атыйлар. Аны бу халәттә кулланмыйлар, иң элек аны эшкәртәләр.
68
19 нчы рәсем. Нефть куа торган лаборатор җайланманың схемасы: 1 - нефть салын¬
ган колба; 2 - термометр; 3 — сулы суыткыч; 4 - алонж; 5 - кабул иткеч савыт
НЕФТЬНЕ ЭШКӘРТҮ
Нефтьне беренчел эшкәртү физик процессларга нигезләнгән.
Эшкәртелмәгән нефтьне газлардан, судан, механик катышмалардан
(ком, балчык, минераль тозлар һ.б.) чистарталар, аннары фракцияләп
кудыралар.
Кудыру (ректификация) - катнашмаларны аерым компонентлар¬
га яисә фракцияләргә аеру процессы, ул компонентларның төрле тем¬
пературада кайнавына нигезләнгән.
Нефть составында кайнау температуралары үзара якын булган угле¬
водородлар күп, шуңа күрә куган вакытта (19 нчы рәс.) индивидуаль
углеводородлар түгел, ә кайнау температуралары билгеле бер интер¬
валда булган фракцияләр алалар.
Нефть эшкәртү заводларында нефть продуктларын берничә
фракциягә бүләләр.
Газ фракциясе (кайнау температурасы 40 oC ка кадәр) CH4 - C4IIl0
составлы нормаль һәм тармакланган алканнардан тора. Элек бу газлар¬
ны факел ысулы белән яндырганнар. Хәзерге вакытта аларны тотып
калырга һәм ягулык яки химик чимал итеп кулланырга тырышалар.
Бензин фракциясе (кайнау температурасы 40-200 °C) C5Hp - C11H24
составлы углеводородлардан тора. Аны кабат куганда авиация һәм ав¬
томобиль бензиннары алалар (70-120 0C).
Лигроин фракциясе (авыр бензин, кайнау температурасы 150-250 °C)
C8Hlg-C14H30 составлы углеводородлардан тора, аны тракторлар, тепло¬
возлар, йөк автомобильләре өчен ягулык итеп кулланалар.
Керосин фракциясе (кайнау температурасы 180-300 °C) үз эченә
69
Cj2H26 — Cj8H3g составлы углеводородларны ала. Аны реактив самолет¬
ларда, ракеталарда ягулык итеп кулланалар.
Газойль (кайнау температурасы 270-350 0C) дизель ягулыгы була¬
рак кулланыла һәм зур масштабларда крекинглаштырыла.
Ачык төсле нефть продуктлары дип аталучы шушы әйтелгән
фракцияләрне куганнан соң караңгы куе сыеклык - мазут кала. Аны
ягулык буларак котельный җайланмаларында кулланалар, ләкин төп
өлешен түбән басымда (вакуумда) кудыралар (ректификациялиләр). Бу
шартларда мазуттан соляр майлары (аннан дизель ягулыгы һәм майлау
матдәләре), вазелин (косметик чаралар һәм дарулар ясаганда кулланы¬
ла), парафин (шәм ясау, медицинада) алалар. Мазутны куганнан соң
гудрон кала, аны юл төзелеше өчен материал (асфальт) җитештергәндә
кулланалар.
Нефтьне куу 20% тан да күп булмаган бензин фракциясе бирә.
Бензинның күләме генә түгел, аның сыйфаты да әһәмиятле. Бензинның
шактый югары детонация (франц, detoner - шартлау) ныклыгы булыр¬
га тиеш, ул бензин составына керүче углеводород молекулаларының
төзелешенә бәйле.
Тармакланмаган төзелешле чикле углеводородларның детонация
ныклыгы иң кечкенә. Тармакланган төзелешле чикле углеводородлар,
шулай ук чиксез һәм ароматик углеводородлар детонациягә чыдамлы-
рак.
Бензинның детонация ныклыгын микъдари яктан октан саны
ярдәмендә билгелиләр. Бу сан зуррак булган саен, бензинның дето¬
нация ныклыгы да зуррак. Җиңел детонацияли торган гептанның
Ch3-CH2-CH2-CH2-CH2-CH2-CH3 детонация ныклыгы 0 дип, ә
детонациягә чыдам изооктанныкы
сн,
(2,2,4-триметилпентан) CH3- C-CH2-CH- CH3 100 дип алынган (20 нче рәс.).
CH3 CH3
20 нче рәсем. Молекула модельләре: а — гептан; б - изооктан
70
Бензинның октан санын табу өчен аны гептан һәм изооктаннан тору¬
чы эталон катнашма белән чагыштыралар. Эталон катнашмадагы октан
саны андагы изооктанның масса өлешенә тигез. Әгәр дә бензинның
октан саны 92 гә тигез икән, ул бу бензин 92% изооктан һәм 8% геп-
таннан торучы эталон катнашма кебек үк детонация үзлекләренә ия
дигәнне аңлата.
Фракцияләп куып табылган бензин составында тармакланмаган
төзелешле углеводородлар күп, шуңа күрә аның октан саны түбән
(50 - 60). Автомобиль һәм авиация транспорты үсеше белән бергә юга¬
рырак октан санлы бензинны өстәмә рәвештә җитештерү ихтыяҗы арт¬
ты. Югары сыйфатлы бензин фракцияләренең чыгышын арттыру өчен
нефть продуктларын химик юл белән эшкәртү ысуллары эшләнелгән.
Нефтьне икенчел эшкәртү химик процессларга нигезләнгән.
Икенчел эшкәртү өчен башлангыч чимал буларак югары температу¬
рада кайнаучы нефть фракцияләре тора: керосин, газойль, мазут.
Нефть продуктларының крекингы. Бу — нефтьне химик эшкәртү
ысулларының берсе. Сәнәгати крекинг 1891 елда рус инженеры
В.Г.Шухов тарафыннан тәкъдим ителгән. Белгәнегезчә (§6 ны кара),
крекингның асылы - зур углеводород молекулаларының кечерәкләргә
таркалуда.
Хәзерге вакытта каталитик крекинг бик киң таралган. Ул углево¬
дород молекулаларының бүлгәләнүе белән генә түгел, ә аларның тар¬
макланган төзелешле углеводородлар хасил итеп, изомерлашуы белән
дә бара:
си ^xar- C H + C H
V16 П34 > vS11Ie vSrlIft
гексадекан октан октен
октан 2,2,4-триметилпентан
(изооктан)
Каталитик крекинг вакытында шулай ук аз гына күләмдә арома-
тик углеводородлар да барлыкка килә. Шуңа күрә каталитик крекинг
белән табылган бензин фракцияләп куып табылган бензинга караган¬
да күбрәк детонация ныклыгына ия (октан саны 90 тирәсе).
71
Димәк, крекинг процессы бензин чыгышын арттырып кына калмый
(эшкәртелгән нефтькә карата исәпләгәндә 65-75% ка кадәр), шулай
ук югарырак октан санлы бензин алуга да китерә.
Нефть продуктларының пиролизы. Бу процесс нефть продукт¬
ларын 650-800 oC ка кадәр җылытканда бара. Мондый шартларда
реакциянең төп продуктлары булып газ хәлендәге чиксез (этилен, аце¬
тилен) һәм ароматик (бензол, толуол) углеводородлар тора.
Шулай итеп, нефть-ягулык кына түгел, күп кенә органик матдәләр
җитештерү өчен чимал да.
Нефть табу һәм эшкәртү масштаблары үскән саен, әйләнә-тирә
мохитне нефть һәм аның продуктлары белән пычранудан саклау
әһәмияте арта. Нефть белән пычрану бигрәк тә сулыклар өчен куркы¬
ныч. Пычрану чыганаклары төрле булырга мөмкин - күчергән вакытта
нефтьнең агып чыгуы (мәсәлән, танкерлар авариягә очраганда), нефть
продуктларының предприятиеләрнең ташландык суларына эләгүе һ.б.
Җиңел нефть продуктлары, су өстенә таралып, юка катлам барлыкка
китерәләр һәм газ алмашуын кыенлаштыралар. Авыр майлар (мазут)
сулыкларның төбенә утырып, андагы фаунаның агулануына китерәләр.
Сулыкларның нефть продуктларыннан пычрануын киметү өчен, ике
кат төптән һәм камилләштерелгән корпус конструкциясеннән торган
танкерлар ясыйлар, нефть эшкәртүче заводларда чистарту корылмала¬
ры ясыйлар һ.б.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Иярчен нефть газы табигый газдан нәрсә белән аерыла?
2. Иң әһәмиятле нефть продуктларын атагыз һәм аларның а) химик
составлары буенча нәрсә белән аерылуларын; б) куллану өлкәләрен
күрсәтегез.
3. Нефтьне фракцияләп кудыру процессы крекингтан нәрсә белән J
аерыла? I
72
II. УГЛЕВОДОРОДЛАРНЫҢ
ФУНКЦИОНАЛЬ КУШЫЛМАЛАРЫ
Углеводородлардагы водород атомнары функциональ төркем дип
аталучы атомнарга яки атомнар төркеменә алмаштырылырга мөмкин.
Функциональ төркем - билгеле бер органик кушылмалар классына
хас химик үзлекләрне билгеләүче атом яисә атомнар төркеме.
Андый алмаштыргычлар булып галоген атомнары һәм кислород,
азот, углерод кергән атомнар төркеме торырга мөмкин. Мәсәлән:
-OH
гидроксил төркем
(спиртларда)
-COOH
карбоксил төркем
(карбон кислоталарында)
-NH2
аминотөркем
(аминнарда)
Кайсы да булса функциональ төркемнең булуы матдәнең билгеле
бер органик кушылмалар классына керүен билгели.
Шулай, мәсәлән, CH3OH, C2H5OH, C3H7OH кушылмалары спиртлар
классына керәләр һәм алар бертөрле үзлекләргә ия, чөнки аларның ба¬
рысында да гидроксил -OH төркеме бар.
Күп кенә реакцияләрдә функциональ төркемнәр генә катнаша, ә
углеводород радикаллары (R) продукт молекулаларына үзгәрмичә
күчәләр, мәсәлән:
C7H, -ГОН + H- Br C7H Br + H7O
2 5 j 2 5 2
IV бүлек. Спиртлар. Феноллар. Аминнар
Составына углерод һәм водород белән беррәттән кислород һәм азот
кергән күп кенә органик матдәләр билгеле. Без бу бүлектә углеводо¬
род радикалы табигатенә карап спиртларга һәм фенолларга бүленүче
углеводородларның гидроксил кушылмаларын һәм шулай ук азот
кергән матдәләр - аминнарны карап үтәрбез.
73
§15
ЧИКЛЕ БЕРАТОМЛЫ СПИРТЛАР
СПИРТЛАРНЫҢ ГОМОЛОГИК РӘТЕ ҺӘМ НОМЕНКЛАТУРАСЫ
Чикле бератомлы спиртлар - молекулаларында бер водород ато¬
мы гидроксил төркемгә алмаштырылган чикле углеводородларның
кушылмалары.
Бу рәт матдәләренең гомуми формуласы
C H, .,OH , п >11 яки I r-oh|
п 2п+1 7 —
R - чикле радикал СН2п+1
Систематик номенклатура буенча спирт атамасын тиңдәшле угле¬
водород атамасына ол кушымчасы ялгап ясыйлар. Сан белән гидрок¬
сил төркем бәйләнгән углерод атомы номерын күрсәтәләр. Углерод
чылбырын номерлауны гидроксил группа якынрак урнашкан баштан
башлыйлар.
Спиртларның тривиаль атамасы углеводород радикал атамасына
«спирты» сүзе өстәп ясала.
Мәсәлән:
CH4 —> CH3 - OH C2H6 => CH3 - CH2 - OH
метан метанол этан этанол
(метил спирты) (этил спирты)
Чикле бератомлы спиртлар, бер әгъзасы икенчесеннән гомологик
аермага -CH2 төркеменә аерылып, гомологик рәт хасил итәләр.
ИЗОМЕРИЯ
Чикле бератомлы спиртларга структур изомерия хас.
• Углерод скелеты изомериясе (C4H9OH тан башлап):
CH3
4 3 2 1 3 21 1
CH3 - CH2 - CH2 - CH2 - OH CH3 -CH- CH2 - OH
бутанол-1 2-метилпропанол-1
• -OH функциональ төркеме торышы изомериясе (C3H7OH тан баш¬
лап):
3 2 1
3 2 1
CH3 - CH2 - CH2
CH3 -CH- CH3
OH
OH
пропанол-1
пропанол-2
74
СПИРТ МОЛЕКУЛАЛАРЫНЫҢ ТӨЗЕЛЕШЕ
Спирт молекуласында углерод һәм водород белән чагыштырганда
электртискәрлеге югарырак булган кислород атомы булу электроннар
тыгызлыгы аның ягына авышуына китерә. Нәтиҗәдә кислород ато¬
мы өлешчә тискәре корылма, ә углерод һәм водород атомнары өлешчә
уңай корылма алалар:
H H
I I 6 6*
Н-С-С->О«-Н
I I
H H
Шуңа күрә спирт молекулаларында C-O һәм O-H ковалент
бәйләнешләре поляр, өстәвенә O-H бәйләнешенең полярлыгы C-O
бәйләнешенең полярлыгыннан күбрәк, чөнки кислород һәм водород
электртискәрелек билгеләренең аермасы зур.
Электроннар тыгызлыгы авышу исәбенә гидроксил төркемдәге
водород атомы углеводород составына керүче водород атомнары
белән чагыштырганда хәрәкәтчәнрәк. Бу спиртларда аз гына кисло¬
та үзлекләре барлыкка килүгә китерә һәм алмашу реакцияләренә керү
мөмкинлеге бирә.
Шулай итеп, спирт молекулаларының төзелеше органик
кушылмаларның химик төзелеше теориясендәге атомнарның үзара
тәэсир итешү турындагы тәгълиматны ачык сурәтли.
Спиртларны су молекуласындагы бер водород атомы углеводород ра¬
дикалына алмашып ясалган продукт дип күзалларга була (21 нче рәс.).
21 нче рәсем. Метил спирты молекуласының тезелеше
ФИЗИК ҮЗЛЕКЛӘРЕ
CH3OH тан башлап C11H23OH ка кадәр булган чикле бератомлы спирт¬
лар - сыеклыклар, ә иң югарылары - каты матдәләр. Метанол, этанол
һәм пропанол-1 гә специфик алкоголь исе хас, калган сыек спиртлар
буылдыргыч начар исле. Югары төзелешле спиртларның исе юк.
75
Спиртларның физик үзлекләрен молекуляр массалары якын булган
углеводородларның үзлекләре белән чагыштыру күп кенә аермалык
күрсәтә. Углеводородлардан аермалы буларак, спиртлар:
• газ хәлендәге матдәләр түгел, хәтта гомологик рәтнең беренче
әгъзасы метанол да - сыеклык;
• эрү һәм кайнау температуралары югарырак;
• суда эрергә мөмкиннәр, түбән спиртлар (метанол, этанол, пропа¬
нол) суда чикләнмәгәнчә эриләр.
Спиртларның үзлелекләре аларның составында поляр гидроксил
төркем булу һәм спирт молекулаларының водород бәйләнешләре ясый
алуы белән билгеләнә. Гидроксил төркемнең водород атомында өлешчә
уңай корылма бар, шуңа күрә ул бүтән молекуладагы бүленмәгән
электрон пары булган кислород атомы белән тәэсир итешергә мөмкин.
Бу вакытта молекулара бәйләнеш ясала, белгәнегезчә, аны водород
бәйләнеше дип атыйлар:
6 а* я я* <5- <5*
..O-H ...'р-н .../Э-Н ...
RRR
Водород бәйләнешләре ясалу нәтиҗәсендә спирт молекулалары
ассоциацияләшә (берләшә) һәм бу аларның углеводородларга караган¬
да югарырак температурада кайнавын аңлата, чөнки бу бәйләнешләрне
өзү өчен өстәмә энергия сарыф ителә. Шуңа күрә, газ хәлендәге угле¬
водородлардан аермалы буларак, алар молекуляр массалары белән
якын яисә тигез булган спиртлар сыеклык халәтендә булалар.
Водород бәйләнешләре спирт молекулалары арасында гына түгел, ә
спирт һәм су молекулалары арасында да ясала:
<5 <5- я* й- я*
..уО-Н ...^р-Н .../О-Н ...
RHR
Шуңа күрә түбән спиртлар су белән теләсә нинди чагыштырма¬
да кушылалар. Углерод атомнары саны арту белән, спиртларның
суда эрүчәнлеге кими, бу поляр булмаган радикалның тәэсир итүенә
бәйле.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. 2-метилбутанол-2; 2,3,4-триметилпентанол-2 нең структур фор¬
мулаларын төзегез.
76
2*. C4H9OH формуласына туры килүче изомер спиртлар саны:
а) 3; 6)4; в) 2; г) 1.
3. Углеродның масса өлеше — 68,2%, кислородныкы — 18,2%,
водородныкы 13,6% булган органик кушылманың һава буенча
чагыштырма тыгызлыгы 3,04 кә тигез. Матдәнең молекуляр фор¬
муласын табыгыз, мөмкин булган изомерларның формулаларын
төзегез һәм аларны систематик номенклатура буенча атагыз.
§16
ЧИКЛЕ БЕРАТОМЛЫ СПИРТЛАРНЫҢ
ХИМИК ҮЗЛЕКЛӘРЕ
Спиртларның химик үзлекләре составларында -OH функцио¬
наль төркеме булуына һәм C-O бәйләнешенең полярлыгына бәйле,
шуңа күрә аларга O-H һәм C-O бәйләнешләре өзелү белән баручы
реакцияләр хас.
Спиртлар - электролит булмаган матдәләр. Аларда ачык чагылыш¬
лы кислота яки нигез үзлекләре юк, индикаторның төсен үзгәртмиләр.
O-H БӘЙЛӘНЕШЕ ӨЗЕЛҮ БЕЛӘН БАРУЧЫ РЕАКЦИЯЛӘР
Көчсез кислота үзлекләре. Спиртлар селтеле һәм селтеле-җир ме-
таллары белән реагирлашалар һәм тозлар -алкоголятлар хасил итәләр.
Мәсәлән, этил спирты натрий белән тәэсир итешкәндә, натрий этила¬
ты барлыкка килә, ул ак төстәге каты матдә:
2С2Н5ОН + 2Na -> 2C2H5ONa + HJ
Этерификация реакциясе. Этерификация реакциясе - спиртлар¬
ның, органик һәм неорганик кислоталар белән тәэсир итешеп, кат¬
лаулы эфирлар хасил итүе. Бу реакция катализатор - көчле неорга¬
ник кислоталар катнашында бара һәм кайтма реакция булып тора.
Мәсәлән, этил спирты серкә кислотасы белән тәэсир итешкәндә, серкә
кислотасының этил эфиры (этилацетат) барлыкка килә:
//Q
x^H-Th1-O-C2 H5 н^(куерт)-/±. сн _ /
I i 2 5 3 \
L ■* xO- C2H5
этилацетат
+ H2O
77
C-O БӘЙЛӘНЕШЕ ӨЗЕЛҮ БЕЛӘН БАРУЧЫ РЕАКЦИЯЛӘР
Көчсез нигез үзлекләре. Спиртлар галогенводородлар белән тәэсир
итешәләр. Мәсәлән, әгәр дә колбага этил спирты белән куертылган
сульфат кислотасының катнашмасын салып, аңа калий яки натрий
бромиды өстәсәк (бромводород барлыкка килсен өчен), ә аннары бер
башы боз һәм сулы кабул итү колбасына төшерелгән һава суыткычлы
бөке белән каплап, катнашманы җылытсак, кабул иткечкә майсыман
авыр сыеклык килүен күрергә була (22 нче рәс.). Реакция продукты -
галогеналкан:
С, H5-!(ЭН + H "* Br <=> C7 H Br+ H7O
“ “ бромэтан
Бу реакция кайтма.
22 нче рәсем. Этил спиртыннан бромэтан табу
Дегидратлашу реакцияләре. Спиртны куертылган сульфат кисло¬
тасы (суны тартып алучы матдә) белән җылытканда су молекулала¬
ры аерылып чыга. Реакция шартларына карап дегидратлашу молекула
эчендә һәм молекулара үтәргә мөмкин.
Молекулара дегидратлашу - ике спирт молекуласыннан су молеку¬
ласы аерылып чыгу. Реакция катнашманы 140 0C ка кадәр җылытканда
бара. Спиртның молекулара дегидратлашу нәтиҗәсендә гади эфир
барлыкка килә:
Г T Н,80,(куерт.)
C2H5-L0H+ H J O - C2H5 ^140t > C2H5 -O- C2H5 + H2O
диэтил эфиры
Гади эфир молекулалары бер-берсе белән кислород атомы аша то¬
ташкан ике углеводород радикалыннан (бертөрле яки төрле) тора. Ди-
78
этил эфиры - иң әһәмиятле гади эфирларның берсе, ул бик тиз янып
китүчән, суда аз эри торган, җиңел очучан 0кайнау = 36 °C), үзенчәлекле
исле сыеклык.
Диэтил эфиры - хирургия практикасында авыртуны басу өчен кул¬
ланылган иң беренче наркоз матдәләренең берсе. Иң беренчеләрдән
булып бу матдәне хирургик операцияләрдә гомум наркоз өчен
Н.И.Пирогов куллана башлый. Хәзерге вакытта бүтән төрле наркоз
матдәләре күп. Диэтил эфирын эреткеч сыйфатында төтенсез дары
тапканда кулланалар.
Молекула эчендә үтүче дегидратлашу — бер спирт молекуласыннан
су молекуласының аерылып чыгу. Бу реакция катнашманы 140 oC тан
югарырак җылытканда бара. Реакция продукты - алкен:
CH - CH, _H2SO/KyePT)>> сн = сн + Н,0
’дң' />140С 2 2 2
Оксидлашу реакцияләре
Яну (тулысынча оксидлашу). Спиртлар һавада зәңгәрсу ялкын
белән күп җылылык бүлеп чыгарып яналар:
C2H5- OH + 30,-> 2СО2+ ЗН2О +1374 кДж
Тулы булмаган оксидлашу. Спиртлар катализатор (мәсәлән, ба¬
кыр) катнашында һава кислороды белән, шулай ук натрий дихроматы,
калий перманганаты яки башка оксидлаштыргычлар ярдәмендә оксид¬
лашалар. Бу очракта бер үк вакытта O-H бәйләнеше һәм гидроксил
төркем белән бәйләнгән углерод атомындагы C-H бәйләнеше озелә.
Шулай итеп, этил спирты натрий дихроматы белән әче тирәлектә
тәэсир итешкәндә Cr,О, ионнарының кызгылт-сары төсе юкка чыга
һәм Cr3+ ионнарының зәңгәрсу-яшел төсе барлыкка килә:
[н” ! P
CH4- C - 0~j H + [О] Na2Cr2°r н' » CH4-Cz +н,о
3 I |_ _ Л 3 \ 2
H H
ацетальдегид
Төс үзгәрү бик аз күләмдә дә спирт эзләрен табып белергә ярдәм
итә. Бу үзлеккә нигезләнеп, кайбер илләрдә натрий дихроматлы торба
ярдәмендә автотранспорт йөртүчеләрнең хәлен тикшерәләр. Әгәр дә
79
торбага һава өрдергәндә кызыл төс зәңгәрсу-яшел төскә үзгәрә икән,
димәк, өреп чыгара торган һавада этанол һәм аның оксидлашу про¬
дуктлары бар.
Спиртларга сыйфат реакциясе. Бакыр (11) оксиды (кара төстә)
белән капланган бакыр чыбыкны кыздырып этанолга төшергәндә ул
ялтырый башлый, һәм ацетальдегидның специфик исе чыга:
, //°
C2H5OH+ CuO —CH3-C +Cu+ H2O
xH
2 иче лаборатор тәҗрибә
БАКЫР (II) ОКСИДЫ ЯРДӘМЕНДӘ СПИРТЛАРНЫҢ
ОКСИДЛАШУЫ
Пробиркага 1 см’ тирәсе этил спирты салыгыз. Бакыр чыбыкның
чистартылган бер очыннан спираль ясагыз, ә икенче очын бөкегә
беркетегез. Бөкедән тотып, спиральне спиртовка ялкынында кызды¬
рыгыз. Kapa төстәге бакыр (II) оксиды белән капланган кыздырыл¬
ган спиральне этаноллы пробиркага төшерегез. Нәрсә күзәтәсез?
Барлыкка килгән продуктның исенә игътибар итегез һәм реакция
тигезләмәсен төзегез.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
Q 1. Этанол кайсы җыелмадагы һәр матдә белән дә реагирлаша?
a) HBr, Cu, CH3COOH; в) Ca, CH3COOH, CuO;
б) Br2, H2O, NaOH; г) C2H6, HNO3, Ag.
Этанолның бу җыелмадагы матдәләр белән реакция тигезләмәлә¬
рен языгыз.
2. Әверелешләр схемасына туры китереп, реакция тигезләмәләрен
төзегез:
CH4 C2H2 C2H4 C2H5OH
80
Q 3. C2H5OH T HBr «=* C2H5Br T H2O T Q реакциясе тигезләнешенә
нәрсә тәэсир итми:
а) температура күтәрелү;
б) HBr концентрациясе кимү;
в) басым арту;
г) H2O концентрациясе арту.
4*. 13,8 г этанолны бакыр (II) оксиды ярдәмендә оксидлаштырган-]
да 9,24 г альдегид табылган. Реакция продукты чыгышын процент-1
ларда исәпләгез. 1
§17
ЧИКЛЕ БЕРАТОМЛЫ СПИРТЛАРНЫ
ТАБУ ҺӘМ КУЛЛАНУ
СПИРТЛАР ТАБУНЫҢ ГОМУМИ ЫСУЛЛАРЫ
Спиртлар чиста хәлдә табигатьтә бөтенләй очрамыйлар, шуңа күрә
аларны күбесенчә синтетик юл белән табалар.
Алкеннарны гидратлау. Бу спиртларны сәнәгати табу юлларының
иң әһәмиятлеләренең берсе. Мәсәлән, этил спиртын катализатор итеп
алынган фосфор кислотасы катнашында 300 0C тирәсе температурада
һәм 7-8 МПа басым астында табалар:
H POd
CH, = CH, + Н,0 ’ 4 » CH, - CH2OH
л- Z Z JvU C*, U J Z
Галогеналканнарны гидролизлау. Лабораториядә спиртларны
галогеналканнар белән селтенең судагы эремәсен җылытып табарга
була, бу вакытта галоген атомы -OH төркеменә алмаша:
C2H5ClTNaOH > C2H5OHTNaCl
МЕТАНОЛ ҺӘМ ЭТАНОЛ ТАБУНЫҢ СПЕЦИФИК ЫСУЛЛАРЫ
Метанол. Метанолны (метил спирты) озак вакытлар агач пироли¬
зы (коры куу) продуктларыннан бүлеп чыгарганнар, шуннан аңа агач
спирты дигән атама да биргәннәр.
81
Хәзерге вакытта аны синтетик юл белән табалар: углерод (II) окси-J
дына водород белән тәэсир итәләр (синтез-газдан). Реакция катнашма-1
ны катализатор катнашында (цинк һәм бакыр оксидлары катнашмасы) 1
югары басымда 7-10 МПа һәм 220-300 oC ка кадәр җылытканда бара: J
t, р, кат. I
СО + 2Н2 * CH3OH I
Метанол җиңел табылганга һәм арзан булганга күрә киң кулланыла.
Аны буяулар, дару матдәләре ясаганда, пластмассалар табу өчен чи¬
мал булган формальдегид җитештергәндә, шулай ук эреткеч буларак
кулланалар.
Метанолның мотор ягулыгы буларак кулланыла алынуының
киләчәге бар, чөнки аны бензинга кушу янучан катнашманың октан
санын арттыра һәм төтен белән бергә бүленеп чыккан агулы матдәләр
күләмен киметә.
Метанол бик агулы: 5-10 см3 спирт сукыраюга һәм организмның
көчле агулануына илтә, ә 30 см3 үлемгә китерергә мөмкин.
Этанол. Элекке вакытлардан ук этил (шәраб) спиртын спирт¬
лы әчетү юлы белән тапканнар. Виноград һәм башка җиләк-җимеш
соклары составында глюкоза C6H12O6 бар, ул беркүзәнәкле организм¬
нар - чүпрәләр эшләп чыгара торган ферментлар тәэсирендә спиртлы
әчетелүгә дучар ителә:
C6H12O6 ФеРментлаР» 2С H5OH + 2СО t
O IZ O Zj Z1
Бу процесс шәраб ясаганда бара.
Этанол җитештерү өчен бәрәңге һәм ашлык бөртегендә булган
крахмал һәм клетчатка (целлюлоза) кулланыла. Әмма аларны башта
глюкозага әверелдерәләр, аннары гына спиртлы әчетүгә кертәләр.
Этанол медикаментлар, ислемай һәм одеколоннар, лаклар, буяу¬
лар табу өчен башлангыч материал буларак кулланыла. Медицинада
этанол дару препаратларын эреткеч буларак, дезинфекцияләүче һәм
компресслау чарасы буларак, экстракт һәм төнәтмәләр әзерләү өчен
кулланыла. Кайбер илләрдә аны эчке янулы двигательләрдә экологик
яктан чиста ягулык буларак кулланалар.
Спирт күп күләмдә төрле спиртлы эчемлекләр ясауда кулланыла.
Белергә һәм онытмаска кирәк, этанол - агулы наркотик матдә.
Алкоголь эчемлекләрне куллану сиземләүне начарландыра, баш мие
һәм мускул системасы функцияләрен киметә, реакцияне әкренәйтә,
хәрәкәт координациясен боза. Әгәр дә исерек хәлдәге кешегә тиз ара¬
82
да карар кабул итәргә һәм аларны төгәл үтәргә туры килсә, мәсәлән,
автомобиль йөрткәндә, мондый халәт бигрәк тә куркыныч. Спирт¬
лы эчемлекләрне еш кулланганда, аңа күнегү, һаләкәтле мавыгу һәм
каты авыру - алкоголизм барлыкка килә. Этанол бавырда ферментлар
тәэсирендә ацетальдегидка кадәр таркала. Ацетальдегид - бик агу¬
лы матдә, ул баш әйләнүе һәм косу белән бара торган авыр агулану
китереп чыгара. Алкоголь эчемлекләрне систематик рәвештә куллану
бавырның зәгыйфьләнүенә (нәтиҗәдә цирроз барлыкка килә), гомер
озынлыгы кимүгә, шәхеснең деградациясенә, кимчелекле балалар туу
ихтималын арттыруга илтә.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1*. 5,6 л (н.ш.) этилен су белән тәэсир итешкәндә барлыкка килгән
спирт массасын исәпләгез.
2*. Әгәр дә продуктның чыгышы 80% булса, 276 г этил спирты |
табу өчен кирәк булган глюкозаның массасын табыгыз. i
§18
КҮПАТОМЛЫ СПИРТЛАР
СОСТАВЫ ҺӘМ ТӨЗЕЛЕШЕ
Күпатомлы спиртлар - молекулаларында төрле углерод атом¬
нары белән бәйләнгән берничә гидроксил төркем булган углеводород
кушылмалары.
Күпатомлы спиртларның иң әһәмиятле кушылмалары булып ике
атомлы спирт - этиленгликоль һәм өч атомлы спирт - глицерин тора:
CH2OH
CH2OH
CH2-OH
CH-OH
CH2-OH
Алар төссез, татлырак тәмле куе сыеклыклар, су белән теләсә нин¬
ди катнашмада кушылалар. Глицерин бик гигроскопик. Этиленгли¬
коль - гаять агулы матдә.
83
ХИМИК ҮЗЛЕКЛӘРЕ
Химик яктан этиленгликоль һәм глицерин бератомлы спиртларга
охшаш, ләкин реакцияләрдә бер яки барлык гидроксил төркемнәре дә
катнашырга мөмкин. Мәсәлән, күпатомлы спиртлар, актив металлар
белән реагирлашып, тозлар - гликолятлар яисә глицератлар барлыкка
китерәләр:
CH2-OH CH-O-Na
I +2Na-> I +H2T
CH2-OH CH2-O-Na
этиленгликоль натрий этиленгликоляты
Күпатомлы спиртлар, бератомлы спиртлар кебек, неорганик һәм
органик кислоталар белән тәэсир итешеп, катлаулы эфирлар хасил
итәләр. Глицеринның нитрат кислотасы белән тәэсир итешүе зур
сәнәгати әһәмияткә ия, аның нәтиҗәсендә нитроглицерин исеме белән
билгеле булган глицерин тринитраты барлыкка килә:
CH-OH CH-O-NO9
CH - OH + ЗНО - NO2 » CH - O - NO2 + ЗН2О
CH2-OH 6h2-o-no2
глицерин нитроглицерин
Нитроглицерин - шартлагыч матдә (аз гына селкетүдән дә шартлый).
Практик кулланышта аны агач онына яки агач чүбенә сеңдерәләр һәм
эшләгәндә, саклаганда, транспортлаганда куркынычсызрак булган
динамит табалар. Динамитны швед инженер-химигы А.Нобель уй¬
лап тапкан. А.Нобель үз байлыгының бер өлешен фәндә атаклы каза¬
нышларга ирешкән өчен, шулай ук тынычлык саклау эшчәнлеге өчен
премияләр бирүне васыять иткән. Нитроглицерин аз гына күләмдә
йөрәк-кан тамырларын киңәйтә, шуңа күрә аның 1% спирттагы
эремәсен медицинада кулланалар.
Этиленгликоль һәм глицерин шулай ук специфик химик үзлекләргә
дә ия. Молекулада гидроксил төркемнәр саны арту спиртларда кислота
үзлекләрен арттыра, бу этиленгликольнең һәм глицеринның актив ме¬
таллар белән генә түгел, ә авыр металл гидроксидлары белән дә тәэсир
итешүендә күренә. Әгәр дә яңа әзерләнгән бакыр (II) гидроксидының
селтедәге эремәсенә глицерин яки этиленгликоль салсаң, зәңгәр төстәге
Cu(OH)2 утырымы эри һәм үтә күренмәле зәңгәрсу төстәге бакыр (II)
глицераты яки гликоляты барлыкка килә. Бу күпатомлы спиртларга
сыйфат реакциясе.
Кислота үзлекләре артуына карамастан, этиленгликоль һәм глице¬
рин индикатор төсен үзгәртмиләр.
84
КУЛЛАНЫЛЫШЫ
Этиленгликоль синтетик сүс - лавсан һәм антифризлар - кыш көне
автомобиль һәм авиация моторларында кулланыла торган катмаучан
сыеклыклар ясауда кулланыла.
Глицеринның гигроскопиклыгына нигезләнеп, аны парфюмерия
һәм медицинада (тирене йомшарта торган мазьлар, кремнар ясау
очен), күн җитештергәндә (күнне кибүдән саклау өчен), текстиль
сәнәгатендә (тукымаларга йомшаклык һәм эластиклык бирү өчен),
полиграфиядә (буяуларны кибүдән саклау өчен) кулланалар. Глицерин
нитроглицерин һәм пластмассалар табу өчен, азык сәнәгатендә (кон¬
дитер эшләнмәләр, ликерлар, салкын эчемлекләр ясау өчен), шулай ук
җитештерүнең бүтән өлкәләрендә файдаланыла.
ЪЗ нче лаборатор тәҗрибә
ГЛИЦЕРИННЫҢ ҮЗЛЕКЛӘРЕ
1. Пробиркага 1 см3 глицерин салыгыз, шуның кадәр үк су өстәгез
һәм селкетегез. Аннары 2-3 тапкыр күбрәк су өстәгез. Пробиркада¬
гы катнашманы болгатыгыз. Глицеринның суда эрүчәнлеге турында
нәтиҗә ясагыз.
2. Пробиркага 1-2 см3 натрий гидроксиды эремәсе салыгыз һәм
берничә тамчы бакыр (II) сульфаты эремәсе өстәгез. Бу реакциянең
молекуляр һәм кыскартылган ион-молекуляр тигезләмәләрен язы¬
гыз.
Барлыкка килгән утырымга аз гына глицерин өстәгез һәм катнаш¬
маны пыяла таякчык ярдәмендә болгатыгыз. Нинди үзгәрешләр бул¬
ганын билгеләгез. Нәтиҗә ясагыз.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Калий глицераты табу реакциясе тигезләмәсен языгыз.
2. Ике пробиркага этил спирты һәм этиленгликоль салынган. Бу
матдәләрне ничек аерып булуын күрсәтегез.
85
§19
ФЕНОЛЛАР
Феноллар — молекулаларында гидроксил төркемнәре бен¬
зол боҗрасы белән турыдан-туры тоташкан ароматик
углеводородларның кушылмалары.
23 нче рәсем. Фе¬
нол молекуласының
моделе
Бу класс органик кушылмаларның иң гади
вәкиле - фенол C6H5OH (23 нче рос.).
ФИЗИК ҺӘМ ХИМИК ҮЗЛЕКЛӘРЕ
Фенол - төссез, кристаллик, җиңел эрүчән
(Zipy = 43 °C, Zicaiiiiay = 182 °C), үзенчәлекле исле матдә,
һавада ул оксид лаша һәм ал төскә керә. Гадәти темпе¬
ратурада суда начар эри, антисептик матдә булып тора.
Фенол - агулы матдә, тиредә пешүләр барлык¬
ка китерә.
Фенолның химик үзлекләре аның молекуласын¬
да бер-берсенә тәэсир итүче гидроксил төркем һәм
бензол боҗрасы булуга бәйле.
Гидроксил төркем катнашындагы реакцияләр
Фенол кислота үзлекләрен күрсәтә. Ул, спиртлар кебек үк, актив ме¬
таллар белән тәэсир итешеп, тозлар - фенолятлар хасил итә:
ZCaH5OH + 2Na -> 2CJWNa + HJ
O 3 0 3 Z1
натрий феноляты
Ләкин, спиртлардан аермалы буларак, фенол:
• су эремәсендә кислота тибында диссоциацияләшә:
OH
CaH5OH <=* CaH5O + H+
O 3 O 3
фенолят-ион
Фенолның тарихи атамасы - карбол кислотасы шушы үзлек белән
аңлатыла;
• селте эремәләре белән реагирлаша (нейтральләшү реакциясе):
C6H5OH + NaOH -> C6H5ONa + H2O
CaH5OH + OH CaH5O + Н,0
о 3 о 3 Z
86
Ләкин фенолның кислота үзлекләре бик көчсез, шуңа күрә карбонат
кислотасы кебек көчсез кислота да фенолны аның тозлары эремәсеннән
этеп чыгара:
C6H ONa + H7O + CO7 -> C6H OH + NaHCO,
Oj L Zoj J
Спиртларның һәм фенолларның кислота үзлекләрендәге аерма
радикалның гидроксил төркемгә тәэсире белән аңлатыла. Бензолның
радикалы фенил -C6H5 гидроксил төркемендәге водород атомының
хәрәкәтчәнлеген арттыра, ә алкан радикаллары (метил -CH3,
этил -C2H5) аны киметә, шуңа күрә фенолда кислота үзлекләре спирт¬
ларга караганда күбрәк чагыла.
Бензол боҗрасы катнашындагы реакцияләр
Фенол алмашу реакцияләренә бензолга караганда җиңелрәк керә,
гидроксил төркем алмаштыргычларны 2, 4, 6 торышларга юнәлтә.
Бу органик кушылмаларның химик төзелеш теориясендәге молеку¬
лаларда атомнарның бер-берсенә тәэсир итешү тезисын раслый.
Бензолдан аермалы буларак, фенол бромлы су белән бүлмә темпе¬
ратурасында катализаторсыз ак төстәге утырым 2,4,6-трибромфе-
нол хасил итеп реагирлаша:
OH OH
rAi ВгүЧгВг
Kjj +ЗВг2 -» KJJ 1 + ЗНВг
Бу реакция сыйфат реакциясе һәм фенолны танып белү өчен кул¬
ланыла.
ТАБУ ҺӘМ КУЛЛАНУ
Фенолны ташкүмер сумаласыннан бүлеп чыгаралар. Ләкин фенолга
ихтыяҗ гаять зур булганлыктан, бу чыганак кына җитми. Шуңа күрә
фенолны ясалма юл белән табу ысуллары уйлап табылган. Мәсәлән,
хлорбензолның селтеле гидролизы аны натрий гидроксиды эремәсе
белән басым астында җылытканда бара:
C6Hc-CH-NaOH ► C6Hc-OH-I-NaCl
Oj Oj
Фенол һәм аның кушылмалары - агулы матдәләр, алар кеше, хай¬
ван һәм үсемлек организмнары өчен куркыныч. Сулыкларга фенолның
87
аз гына күләме эләгү дә ашарга яраклы балыкның тәме үзгәрүгә
китерә. Фенол табу һәм эшкәртү белән бәйле җитештерүдә агулы
матдәләрнең әйләнә-тирәгә чыгуыннан саклый торган җиһазлар кул¬
ланалар.
Фенол - нефть химиясенең иң әһәмиятле продуктларының берсе.
Аны синтетик сүс һәм буяулар, юу матдәләре һәм үсемлекләрне сак¬
лау чаралары, дару препаратлары, шартлагыч матдәләр һәм фенол¬
формальдегид сумалалары табуда кулланалар. Масса өлеше 3-5%
булган фенол эремәсе медицинада антисептик буларак, биналарны,
хирургик инструментлар һ.б. дезинфекцияләү өчен файдаланыла.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Әверелешләр схемасына туры китереп, реакция тигезләмәләрен |
төзегез:
кальций карбиды —» ацетилен —> бензол —> хлорбензол —» фенол. ।
Реакция үтү шартларын күрсәтегез.
2. Өч пробиркада этанол, фенол, этиленгликоль эремәләре
бирелгән. Нинди реактивлар ярдәмендә аларны танып булуын
күрсәтегез. Тиңдәшле реакция тигезләмәләрен языгыз.
3*. 4,7 г фенолга натрий гидроксиды эремәсе белән тәэсир итеп
табып була торган натрий феноляты массасын исәпләгез.
§20
АМИННАР
СОСТАВЫ ҺӘМ ТӨЗЕЛЕШЕ
Аминнар - молекуласында бер, ике яки өч
водород атомы углеводород радикалларына
алмаштырылган аммиак кушылмалары (24
нче рәс.).
Аммиак молекуласында алмашкан водо¬
род атомнары санына карап беренчел, икен¬
чел һәм өченчел аминнарны аералар:
24 нче рәсем. Метиламин
молекуласының моделе
88
CH3 - NH2
метиламин
(беренчел амин)
CH3-NH-C2H5
метилэтиламин
(икенчел амин)
9нз
CH3-N- CH3
триметиламин
(өченчел амин)
Без чикле рәттәге беренчел аминнарны гына карап үтәрбез.
Чикле рәттәге беренчел аминнарның функциональ төркеме булып
аминотөркем -NH2 тора. Аларның гомуми формуласы
C H7 . ,NH , п > 1
п 2n+l Lj
Беренчел аминнарның атамасын углеводород радикаллары атама¬
сына -амин кушымчасы кушып ясыйлар:
C2H5 - NH2 C3H7 - NH2
этилаиии пропилоиии
Амин молекулалары төзелеше аммиак молекуласы төзелешенә
охшаш:
H-N-H R-N-H
I I
H H
Аларның молекулаларындагы азот атомында бүленмәгән электрон
пары бар, ул аммиакның да, аминнарның да нигез үзлеген билгели.
Димәк, аминнар — органик нигезләр, аммиакның органик аналоглары
булалар.
ФИЗИК ҺӘМ ХИМИК ҮЗЛЕКЛӘРЕ
Түбән аминнар - газсыман, аммиак исле, суда яхшы эрүчән матдәләр.
Алардан соң аз гына сасы балык исе килгән сыеклыклар тора. Югары
аминнар - каты, суда эреми торган, иссез матдәләр.
Аминнарның химик үзлекләре аларның молекулаларында
аминотөркем булуга бәйле һәм шуңа күрә алар аммиакның химик
үзлекләренә охшаш. Азот атомындагы бүленмәгән электрон пары
(-NH2) водород ионының буш орбитале (DH+) белән донор-акцептор
механизмы буенча тәэсир итешергә сәләтле, шуңа күрә аминнар, ам¬
миак кебек үк, нигез үзлекләрен күрсәтәләр.
Cy белән тәэсир итешүе. Аммиак шикелле үк, аминнар да суда
эрегәндә судагы водород ионын кушалар. Нәтиҗәдә эремәдә гидрок¬
сид ионнар туплана һәм ул селтелеге әйләнә (лакмус — зәңгәр төс,
фенолфталеин кура җиләге төсен ала):
CH3-NH2+ DH I : OH <=> [CH3NH3] OH [CH3NH3]+ + OH
донор акцептор мстиламмоний ионы
89
Ләкин аминнарның судагы эремәсе аммиакка караганда көчлерәк
нигез үзлекләренә ия. Бу аларның молекула составы төрлелеге белән
аңлатыла. Әгәр дә аммиак молекуласында азот атомына водород атом¬
нарыннан гына электроннар авыша икән, амин молекуласында азот
атомына электроннар углеводород радикалларыннан да авыша:
Л
*
H : N : H
H —> N«—H
t
R:N:H
R —> N <— H
T
H
H
H
I
H
аммиак
амин
Нәтиҗәдә амин молекуласындагы азот атомында өлешчә тискәре
корылма аммиак молекуласындагыга караганда күбрәк, шуңа күрә ул
судагы водород ионын да көчлерәк тарта. Ә бу эремәдә көчлерәк нигез
үзлекләре барлыкка килүгә илтә.
Кислоталар белән тәэсир итешүе (нейтральләшү реакциясе).
Нигезләр кебек, аминнар да кислоталар белән тоз хасил итеп реагир-
лашалар:
H
CH3-Sl:
метиламин
(нигез)
+ DHkCl ->
\ 1
акцептор
хлорид
кислотасы
H
CH-N-H
3 I
H
Cl
метиламмоний хлориды
(тоз)
BkhCH3-NH2 + HCl-> [CH3 - NH J Cl
Амин тозлары (аммоний тозлары кебек үк) - кристаллик, молекуляр
төзелешле булмаган, суда яхшы эрүчән матдәләр. Алар су эремәләрендә
көчле электролит тибында диссоциацияләшәләр:
[CH3 - NHJCl = [CH3 - NHJ+ + Cl
Көчлерәк нигез буларак, селтеләр аминнарны (аммиакны кебек)
тозларыннан этеп чыгаралар:
[CH3 - NH JCl + NaOH -♦ CH3NH2 + NaCl + H2O
көчле көчсез
нигез нигез
[CH3 - NHJ+ + OH — CH3NH2 + H2O
Яну. Аминнар, аммиактан аермалы буларак, һавада яналар (амми¬
ак кислородта гына яна). Бу вакытта углерод (IV) оксиды, азот һәм су
барлыкка килә:
4CH3NH, + 90, -> 4СО,+ 2N2 + IOH2O
90
ТАБУ ҺӘМ КУЛЛАНУ
Аминнар табуның күп ысуллары билгеле, шуларның берсе - галоге- J
калканнардагы галоген атомын аминотөркемгә алмаштыру. Бу вакыт-1
та бүленеп чыга торган галогенводород артып киткән аммиак белән,
бәйләнә:
CH.fl ThT-NH +NH1 —► CH NH +NH Cl
Түбән аминнар дару матдәләре һәм полимер материаллар тапканда
кулланыла. Югары аминнарны кайбер металларның коррозиясе инги¬
биторы буларак кулланалар.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
O 1. Хлорид кислотасы кайсы җыелмадагы һәр матдә белән дә реа-
гирлаша:
a) C, NHp C1H5NH2; в) NH3, C2H5NH2, CH3COONa;
б) CH3NH2, NO, C2H5OH; г) C2H6, CH3OH, CH3NH1.
Бу җыелма матдәләре өчен реакция тигезләмәләрен языгыз.
Q 2*. 19,6 л метиламин янганда барлыкка килгән азотның күләме
күпме (л., н.ш.):
а) 10,2; 6)9,8; в) 10; г) 9,6.
3. Башлангыч матдә итеп метан бирелгән булса, метиламин табу
реакциясе тигезләмәләрен языгыз.
4. Әверелешләр схемасына туры китереп, реакция тигезләмәләрен
языгыз:
CaC -> C1H1 -> C1H, -> C1HsBr -> C1HsNH1 +H2S°4» X
2 22 24 25 252
Реакцияләрнең бару шартларын күрсәтегез һәм барлык матдәләрне
дә атагыз.
5*. Әгәр дә 14,6 г матдә янганда 17,92 л углерод (IV) оксиды,
2,24 л азот һәм 19,8 г су барлыкка килүе билгеле булса, бу органик
матдәнең формуласын чыгарыгыз. Матдә парларының тыгызлыгы
гелий буенча 18,25 кә тигез. Газларның күләме нормаль шартларда
исәпләнгән.
91
V бүлек. Альдегидлар. Карбон кислоталары
һәм аларның кушылмалары
§21
АЛЬДЕГИДЛАРНЫҢ НОМЕНКЛАТУРАСЫ
ҺӘМ МОЛЕКУЛАЛАРЫ ТӨЗЕЛЕШЕ
АЛЬДЕГИДЛАРНЫҢ СОСТАВЫ ҺӘМ НОМЕНКЛАТУРАСЫ
Альдегидлар - молекулаларында функцио¬
наль альдегид төркеме -C^ углеводород ра-
H
дикалы белән кушылган органик кушылмалар.
Альдегидларның гомуми формуласы
R-C
H
Искәрмә булып иң гади альдегид - формаль¬
дегид тора, аның молекуласында радикал уры¬
нын бер водород атомы алган (25 нче рәс.):
.0
H-C
xH
25 нче рәсем, а - мета¬
наль; б - этаналь моле¬
кулалары модельләре
xC=O атомнар төркеме карбонил төркеме дип атала.
Без чикле альдегидларны карап үтәрбез. Чикле альдегидларның го¬
муми формуласы ____________
CnHCx ,л>0
п Zn-rl \ II
Il
Систематик номенклатура буенча альдегидларның атамасын
тиңдәшле алканнар атамасына -аль кушымчасы кушып ясыйлар. Шу¬
лай ук альдегидларның тривиаль атамаларын да киң кулланалар, алар
альдегидлар оксидлашкан вакытта хасил булучы кислота атамаларын¬
нан ясала.
CH3- сно оксидлащу> СНз _ COOH
серкә альдегиды серкә кислотасы
92
CH4
метан
ХО
=> H-C
xH
метаналь
(кырмыска альдегиды,
формальдегид)
^O
C7 H => CH, - C
2 6 3 -H
этан этаналь
(серкә альдегиды,
ацетальдегид)
Альдегид төркеме һәрвакыт углерод чылбырының башында
тора, шуңа күрә альдегидларга углерод скелеты изомериясе генә
хас (C3H7CHO дан башлап). Тармакланган скелет булган очракта
төп чылбырны аның эчендә альдегид төркем булырлык итеп сай¬
лыйлар; исәпне функциональ төркемнең углерод атомыннан баш¬
лыйлар.
4 3 2 1 .0 3 2 1
CH3 - CH2 -CH2-C CH3 -CH-Cx
хн ён3 хн
бутаналь 2-метилпропаналь
КАРБОНИЛ ТӨРКЕМЕНЕҢ ТӨЗЕЛЕШЕ
Карбонил төркемендә углерод атомы кислород атомы белән C=O ике¬
ле бәйләнеше белән бәйләнгән (бер о-бәйләнеш һәм бер я-бәйләнеш).
Үзенең табигате буенча ул C=C икеле бәйләнешенә охшаш. Этилен
углеводородларындагы икеле бәйләнештән аермалы буларак, карбонил
төркемендә л-бәйләнешенең электрон тыгызлыгы электртискәрелеге
тагын да югарырак булган кислород атомына авыша. Нәтиҗәдә кис¬
лород атомында - тискәре, ә углерод атомында өлешчә уңай корылма
барлыкка килә.
8’ 8
/C=O )с=сС
поляр бәйләнеш поляр булмаган бәйләнеш
C=O бәйләнешенең полярлыгы карбонил кушылмаларның күпчелек
физик һәм химик үзлекләрен билгели.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Түбәндә формулалары бирелгән кушылмаларны атагыз, гомолог
һәм изомерларның формулаларын күрсәтегез.
a) CH3 - CH7 -CH- С*° б) CH, - CH7 - CH7 - CH7- С^°
I-H 3 -н
CH3
93
CH3 Х/о
в) сн, - d - сн - сл
3I 2 ■.
CH3 H
CH3
г) ^CH-CH2-CH2-CH2-Cx
сн/ xH
2*. Күләме 33,6 л (н.ш.) булган формальдегидны 200 см3 суда
эреткәннәр. Формальдегидның эремәдәге масса өлешен (% да)
исәпләгез.
§22
АЛЬДЕГИДЛАРНЫ ТАБУ, КУЛЛАНУ
ҺӘМ АЛАРНЫҢ ҮЗЛЕКЛӘРЕ
ТАБУ
Альдегидларны спиртларны оксидлаштырып табалар. Мәсәлән,
сәнәгатьтә формальдегидны кыздырылган бакыр яки көмеш челтәрле
реактор аша метил спирты парлары белән һава катнашмасы җибәреп
табалар.
2СН3ОН + O2 —2НСНО + 2Н2О
Һава
ФИЗИК ҺӘМ ХИМИК ҮЗЛЕКЛӘРЕ
Иң гади альдегид - кырмыска альдегиды - гадәти шартларда газ
халәтендә, калганнары - сыеклыклар яки каты матдәләр. Формальде¬
гид һәм ацетальдегид суда яхшы эрүчән.
Молекуляр масса арту белән альдегидларның суда эрүчәнлекләре
кими. Барлык альдегидлар да үзенчәлекле исле. 8-12 углерод атом¬
лы альдегидлар хуш исле. Аларны азык-төлек сәнәгатендә һәм
парфюмериядә куллану шул үзлеккә нигезләнгән.
Альдегидлар, кагыйдә буларак, күз һәм сулыш юлларының лайла¬
лы тышчасын ялкынсындыралар, нерв системасына начар тәэсир
итәләр.
Молекулаларында карбонил төркеме булу сәбәпле, альдегидлар -
химик актив кушылмалар.
Альдегидларга кушылу, оксидлашу һәм полимерлашу реакцияләре хас.
94
Кушылу реакцияләре
Күпчелек кушылу реакцияләре арасыннан без гидрирлауреакциясен
карап үтәрбез. Альдегидлар катализатор катнашында водород белән
тәэсир итешкәндә спиртлар барлыкка килә.
O
сн3-с* * х +H2
xH
этаналь
CH3-CH2OH
этанол
Оксидлашу реакцияләре
Яну (тулысынча оксидлашу), һавада альдегидлар углерод (IV) ок¬
сиды һәм су хасил итеп яналар.
HCHO + O2 CO2 + H2O
Тулы булмаган оксидлашу. Альдегидларга кайтару үзлекләре хас.
Алар спиртларга караганда җиңелрәк оксидлашалар. Ал арга көчле
оксидлаштыручылар (һава кислороды, бераз кислота өстәлгән калий
перманганаты KMnO4 яки калий дихроматы K7Cr2O7 эремәсе) гына
түгел, ә бәлки көчсез оксидлаштыручылар да (көмеш оксидының ам¬
миактагы эремәсе яки бакыр (II) гидроксиды) тәэсир итә. Бу очраклар¬
да тиңдәшле карбон кислоталары хасил була.
Көмеш оксидының аммиактагы эремәсенә кырмыска яки серкә аль¬
дегиды эремәсе салып, кушылманы әкрен генә җылытсаң, пробирка
стеналарында көзге сыман өслек ясап металлик көмеш утыра. Шуңа
күрә бу реакция «көмеш көзге» реакциясе исемен алган, ул альдегид¬
ларга сыйфат реакциясе булып тора. Бу реакциянең тигезләмәсен еш
кына гадиләштерелгән рәвештә язалар*:
^O ^O
R-C +Ag2O NHi-H2O R-C +2 AgJ,
xH xOH
альдегид карбон кислотасы
Альдегидлар бакыр (II) гидроксиды белән дә оксидлашалар. Яңа
гына әзерләнгән бакыр (II) гидроксидын альдегид эремәсе белән
җылытканда башта бакыр (I) гидроксидының сары утырымы хасил
була, аннары ул кызыл төстәге бакыр (I) оксиды барлыкка китереп
таркала:
* Бу процессны төгәлрәк итеп түбәндәге тигезләмә күрсәтә:
R-C + 2[Ag,(NHi)JOH -» R-C + 2 Ag J + 3NH3f + H2O
xH xONH4
95
R-C +2Cu(0H), -Л- R-C + 2CuOH| +H2O
хн 4OH /ар\
альдегид карбон / V
кислотасы г 'Я
Cu2Ol H2O
КЫЗЫЛ
Бу реакция, «көмеш көзге» реакциясе кебек үк, альдегидларга сый¬
фат реакциясе булып тора.
Полимерлашу реакцияләре
Бу реакцияләр түбән альдегидларга хас. Формальдегидның по¬
лимерлашу реакциясе зур әһәмияткә ия. Сәнәгать шартларында аны
катализатор катнашында үткәрәләр һәм полимерлашу дәрәҗәсе IOOO
булган полимер - полиформальдегид табалар.
Hx
п C = O [-CH -O-]
Hx
Аны сүсләр, пленкалар һәм башка әйберләр эшләп чыгару өчен кул¬
ланалар.
Формальдегидның полимерлашуы (мәсәлән, этиленныкы шикелле
үк) л-бәйләнеш өзелү исәбенә бара.
КУЛЛАНУ
Карбонил кушылмалар арасыннан формальдегид һәм ацетальдегид
иң зур кулланышка ия.
Формальдегидның судагы эремәсе - формалинны - анатомик пре¬
паратлар саклау (консервлау), авыл хуҗалыгында ярма һәм яшелчә
саклагычларын дезинфекцияләү, орлыкларны авыруларга һәм корт¬
кычларга каршы агулау, күн эшкәртү өчен кулланалар.
Әмма формальдегидның төп өлеше полиформальдегид, фенол¬
формальдегид сумала кебек синтетик материаллар җитештерүгә бара,
ә алардан инде электротехник әйберләр, төрле детальләр, көнкүреш
кирәк-яраклары эшләп чыгаралар.
Ацетальдегид сәнәгати органик синтезда киң кулланыш таба. Ул
серкә кислотасы һәм аның кушылмалары, синтетик сумалалар һәм
башка кушылмалар табу өчен чимал булып тора.
96
4 нче лаборатор тәҗрибә
* ФОРМАЛЬДЕГИДНЫҢ БАКЫР (II) ГИДРОКСИДЫ
БЕЛӘН ОКСИДЛАШУЫ
Пробиркага 2-3 см3 10% лы селте эремәсе салыгыз һәм шуңа
3-4 тамчы 2% лы бакыр (II) сульфаты эремәсе өстәгез. Яңа гына
әзерләнгән бакыр (II) гидроксидына 1-2 см3 формальдегид эремәсе
агызыгыз һәм реакция катнашмасын җылытыгыз.
Пробиркада бара торган барлык үзгәрешләрне дә билгеләгез.
Тиңдәшле реакция тигезләмәләрен төзегез.
Алмашу реакциясе өчен молекуляр һәм кыскартылган ион-
молекуляр тигезләмәләрен языгыз.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Органик матдәләрнең структур формулаларын кулланып,
әверелешләр схемасына туры килгән реакция тигезләмәләрен
төзегез: этилен —> этанол —> ацетальдегид —> серкә кислотасы.
Реакцияләрнең бару шартларын күрсәтегез.
2*. 0,5 г ацетальдегид артыгы белән алынган көмеш оксидының
аммиактагы эремәсе белән оксидлашканда 2,16 г көмеш бар¬
лыкка килгән. Реакция продуктының чыгышын (процентларда)
исәпләгез.
3. Реакция барышында түбәндәге продуктлар хасил булуы билгеле
булса, реакциягә нинди матдәләр керүен һәм нинди шартларда ба¬
руын күрсәтегез:
а) ЗСО, +ЗН2О; в) 2СН3СООН + Cu2O + Н,О;
б) HCOOH + 2Ag; г) CH3- CH2OH.
4*. 2 моль метанолны оксидлаштырып, табылган мстанальне
200 г суда эреткәннәр. Барлыкка килгән эремәдә мстанальнең мас¬
са өлешен (%) исәпләгез.
97
§J23
КАРБОН КИСЛОТАЛАРЫ
ҺӘМ АЛАРНЫҢ КУШЫЛМАЛАРЫ
Карбон кислоталары - составында карбоксил функциональ
төркеме -COOH (карбоксил) булган углеводород кушылмалары.
Карбон кислоталарының гомуми формуласы
R-C
xOH
Карбоксил төркеме үзендә гидроксил һәм карбонил төркемнәрен
берләштерә.
S 0> карбонил
<- С/ => карбоксил
v гидроксил
Углеводород радикалының табигате буенча кислоталар:
• чикле (алканнар кушылмалары)
CH3-CH2-COOH
пропан кислотасы
• чиксезгә (алкеннар һәм башка туендырылмаган углеводородлар ку¬
шылмалары)
CH2 =CH- COOH
пропен кислотасы
булалар.
Радикалдагы углерод атомнары саны буенча аларны:
• түбән (10 углерод атомына кадәр)
• югары (10 углерод атомыннан югарырак) кислоталарга аералар.
ЧИКЛЕ БЕР НИГЕЗЛЕ КАРБОН КИСЛОТАЛАРЫНЫҢ СОСТАВЫ,
НОМЕНКЛАТУРАСЫ ҺӘМ ИЗОМЕРИЯСЕ
Чикле бер нигезле карбон кислоталары — молекулалары соста¬
вында бер водород атомы карбоксил төркеменә алмаштырылган ал¬
каннар кушылмалары.
Бу матдәләр рәтенең гомуми формуласы
C H7 COOH, и > Ol
п 2п+1 1 — I
98
Искәрмә булып кырмыска кислотасы тора, аның молекуласында
карбоксил төркеме углеводород радикалы белән түгел, ә водород ато¬
мы белән бәйләнгән: H-COOH.
Систематик номенклатура буенча кислота атамасын аңа тиңдәш
алкан атамасына «кислотасы» сүзен кушып ясыйлар.
Әмма ешрак тарихи (тривиаль) атамалар кулланыла, алар
кислоталарның табигатьтәге чыганакларына бәйләнгән.
6 нчы таблица
Иң киң таралган чикле бернигезле карбон кислоталары
Кислота фор-
муласы
Кислота атамасы
Кайнау
температурасы, oC
систематик
тривиаль
H-COOH
Метан кислотасы
Кырмыска кислотасы
100,7
CH3-COOH
Этан кислотасы
Серкә кислотасы
118,1
C2H5-COOH
Пропан кислотасы
Пропион кислотасы
141,1
C3H7-COOH
Бутан кислотасы
Май кислотасы
163,9
CdH0-COOH
Пентан кислотасы
Валериан кислотасы
187,0
C5H11-COOH
Гексан кислотасы
Капрон кислотасы
205,3
C15H39-COOH
Гексадскан кислотасы
Пальмитин кислотасы
271,5
CiaH33-COOH
Гептадекан кислотасы
Mapi apnH кислотасы
277,0
C17H35-COOH
Октадскан кислотасы
Стеарин кислотасы
287,0
Бер нигезле карбон кислоталарына, альдегидлардагы кебек үк,
структур изомерия - углерод скелеты изомериясе (C3H7COOH тан
башлап) хас.
сн, - CH7 - CH7 - соон ,Jc3H7CoohV сн3 - сн - соон
L _ J dHi
бутан (май) кислотасы 2-метилпропан
(изомай) кислотасы
КАРБОКСИЛ ТӨРКЕМЕНЕҢ ТӨЗЕЛЕШЕ
Карбоксил төркеме составына керүче карбонил >С = O һәм гидрок¬
сил (-ОН) төркемнәре бер-берсе белән тәэсир итешәләр.
8^0
R-C
/ОН
99
Карбонил төркеменең тәэсире. Карбонил төркеменең углерод ато- J
мы өлешчә уңай корылма йөртә һәм гидроксил төркеменең кислород i
атомы электроннарын үзенә тарта. Электрон тыгызлыгы авышу арка- ।
сында O-H бәйләнеше полярлыгы шулкадәр арта, хәтта водород ато- J
мы Ht ионы булып аерылып чыгарга мөмкин. Шуңа күрә карбон кис-«
лотолары — спиртларга караганда көчлерәк кислоталар.
C2H5OH CH3COOH ;
этанол этан кислотасы I
а = 3,16 -IO-7 % а= 1,36% ‘
Гидроксил төркеменең тәэсире. Электроннарның гидроксил '
төркеменнән карбонил төркеменә авышуы углерод атомында уңай J
корылманы өлешчә киметә, шуңа күрә кислоталардагы карбонил ।
төркеме, альдегидлардан аермалы буларак, кушылу реакцияләренә J
керү сәләтен югалта. Димәк, кислоталарга >С = O икеле бәйләнеш бу- J
енча кушылу реакцияләре хас түгел.
ФИЗИК ҺӘМ ХИМИК ҮЗЛЕКЛӘРЕ
Чикле бер нигезле карбон кислоталар гомологик рәтенең түбәнге
вәкилләре - кискен исле сыеклыклар, су белән теләсә нинди чагыш¬
тырмада кушылалар. Чагыштырма молекуляр массасы арткан саен,
кислоталарның суда эрүчәнлеге кими, ә кайнау температурасы арта
(6 нчы табл.). Югары кислоталар - иссез каты матдәләр, суда
эремиләр.
Карбоксил төркеме булу сәбәпле, чикле бер нигезле карбон кислота¬
лары - химик актив кушылмалар. Аларга O-H һәм C-O бәйләнешләре
өзелү белән баручы реакцияләр, шулай ук а-углерод атомы янындагы
водород атомын алмаштыру реакцияләре хас.
O-H БӘЙЛӘНЕШЕ ӨЗЕЛҮ БЕЛӘН БАРУЧЫ РЕАКЦИЯЛӘР
Карбон кислоталары үзлекләре буенча көчсез минерал кислоталарга
охшаш.
Кислоталар диссоциациясе. Cy эремәсендә карбон кислотала¬
ры, водород катионы һәм кислота калдыгы анионы ясап, кайтма
диссоциацияләшәл әр:
CH3COOH <=t CH3COO +H+
ацетат-ион
Карбон кислоталары - көчсез электролитлар (кырмыска кислота¬
IOO
сы уртача көчле). Диссоциация процессының тигезләнеше нык сулга
авышкан. Шуңа да карамастан аларның эремәләре индикаторлар төсен
үзгәртә, әче тәмгә ия, электр тогын үткәрә, тозлар хасил итә.
Тозлар ясалуы. Карбон кислоталары, неорганик кислоталар кебек,
түбәндәге реакцияләргә керәләр:
• электрохимик көчәнешләр рәтендә водородтан алда торган метал¬
лар белән:
2НСООН + Mg -> (HCOO)2Mg + H21
магний формиаты
2НСООН + Mg -> 2НСОО + Mg2+ + H2 f
• нигезләр белән (нейтральләшү реакциясе)
C2H5COOH + NaOH -> C2H5COONa+ H2O
натрий пропионаты
C2H5COOH+ OH -> C2H5COO + H2O
• нигез һәм амфотер оксидлары белән:
2СН3СООН + MgO -> (CH3COO)2Mg+ H2O
магний ацетаты
2СН3СООН + MgO 2СН3СОО + Mg2+ + H2O
2СН3СООН + ZnO -> (CH3COO)2 Zn + H2O
цинк ацетаты
2СН2СООН + ZnO -> 2СН3СОО +Zn2+ + H2O
• көчсезрәк һәм очучан кислоталардан ясалган тозлар белән:
- неорганик тозлар белән
2СН3СООН + Na2CO3 -» 2CH3COONa + H2O + CO2 J
2СН3СООН + CO22СН3СОО +H2O + CO2 T
- органик тозлар белән
CH3COOH + C17H35COONa -> CH3COONa + C17H35COOH
натрий стеараты
CH3COOH + C17H35COO" -> CH3COO + C17H35COOH
Карбон кислоталары көчсез булганга күрә, аларның тозлары су
эремәсендә җиңел гидролизлашалар.
K CH3COO + H2O CH3COOH + KOH
көчле көчсез
нигез кислота
KOH CH3COOH
катионы анионы
rCH3COO Th1OH «=+ CH3COOH + OH
L. —3— _ — J 3
IOl
Көчле неорганик кислоталар карбон кислоталарын аларның тозла¬
рыннан этеп чыгаралар:
2CH3COONa + H2SO4-+ 2СН3СООН + Na2SO4
CH3COO + H+ -» CH3COOH
Ацетатларның көчле кислоталар белән тәэсир итешүе ацетат-ионга
CH3COO сыйфат реакциясе булып тора. Аның билгесе - серкә кисло¬
тасы исе барлыкка килү.
C-O БӘЙЛӘНЕШЕ ӨЗЕЛҮ БЕЛӘН БАРУЧЫ РЕАКЦИЯЛӘР
Карбон кислоталары молекулаларында -OH төркеме башка алмаш-
тыргычларга алмаштырылганда, кислотаның функциональ кушылма¬
лары, мәсәлән, катлаулы эфирлар барлыкка килә.
Катлаулы эфирлар — гидроксил төркемен -OR калдыгына
алмаштыру продукты. Алар органик кислоталарны спиртлар белән
куертылган сульфат кислотасы катнашында җылытканда хасил була
(сезгә билгеле булган этерификация реакциясе):
O
CH - C* + O - CH3
3 г* — — 3
Joh_н J
H2SO4 (куерт.), t
O
CH3-C* +H2O
4O-CH3
метилацетат
(серкә кислотасының
метил эфиры)
Углеводород радикалы катнашындагы реакцияләр
Карбон кислоталары молекулаларында углеводород радикаллары
булу сәбәпле, алар башка үзлекләргә дә ия.
Яну. Карбон кислоталары кислородта углерод (IV) оксиды һәм су
хасил итеп тулысынча янып бетәләр.
CH3COOH+ 20, -+ 2СО2 + 2Н,О
26 нчы рәсем. Хлорсеркә кис-
лотасының молекула моделе
Галогеннар белән тәэсир итешү. Кар¬
бонил төркеме күршесе булган углерод ато¬
мы (а-атом) янындагы водород атомнары,
галоген атомнарына алмашынып, а-галоген-
карбон кислоталары барлыкка китерергә
сәләтле. Мәсәлән, хлорны кызыл фосфор
катнашында кайнап торган серкә кислота¬
сы аша уздырганда, хлорсеркә кислотасы
дигән кристаллик матдә хасил була.
102
CH, - COOH + Cl CH, - COOH + HCl
_ I ~ ■■■■■■I., I 2
[H Cj Cl
хлорсеркә кислотасы
КЫРМЫСКА КИСЛОТАСЫНЫҢ ТӨЗЕЛЕШ
ҺӘМ ҮЗЛЕК ҮЗЕНЧӘЛЕКЛӘРЕ
Кырмыска кислотасы молекуласында карбок¬
сил төркеме углеводород радикалы белән түгел,
ә водород атомы белән бәйләнгән (27 нче рәс.),
шулай итеп, аның молекуласында карбоксил
төркеме белән бергә альдегид төркеме дә бар:
I" """ ■■■ "I I" нав||> aI
I <° I I +° I
HyC HOIC
L JohJ L JhJ
карбоксил төркеме альдегид төркеме
Шуңа күрә кырмыска кислотасы чикле бернигезле карбон кислота¬
ларына хас гомуми үзлекләргә генә түгел, ә үзенчәлекле үзлекләргә дә
ия.
Мәсәлән, альдегидлар шикелле үк, ул көчле кайтаргыч үзлекләре
күрсәтә һәм углерод (IV) оксидына чаклы җиңел оксидлаша. Ул
«көмеш көзге» реакциясен бирә.
HCOOH+ Ag2O '-niV hP*. 2Ag 1 + H2O + CO2 $
27 нче рәсем. Кырмыска
кислотасының молекула
моделе
5 нче лаборатор тәҗрибә
* СЕРКӘ ҺӘМ ХЛОРИД КИСЛОТАЛАРЫ ҮЗЛЕКЛӘРЕН
ЧАГЫШТЫРУ
Дүрт пробиркага да 1-2 см3 серкә кислотасы эремәсе салы¬
гыз. Беренче пробиркага 1-2 тамчы лакмус тамызыгыз (инди¬
катор төсен билгеләгез), аннары кислотаны селте эремәсе белән
нейтральләштерегез. Икенче пробиркага - бераз гына магний поро¬
шогы, өченчесенә - магний оксиды, ә дүртенчесенә натрий карбона¬
ты кушыгыз.
Шундый ук тәҗрибәләрне хлорид кислотасы белән дә үткәрегез.
Тәҗрибә нәтиҗәләрен чагыштырыгыз һәм йомгак ясагыз.
103
Үткәрелгән реакцияләрнең молекуляр, тулы һәм кыскартылган ион-
молекуляр тигезләмәләрен төзегез. Ион-молекуляр тигезләмәләрдә
хлорид һәм серкә кислоталарының төрлечә язылу сәбәбен
аңлатыгыз.
Эш нәтиҗәләрен 7 нче таблицага тутырыгыз.
7 нче таблица
Хлорид һәм серкә кислоталарының химик үзлекләрен чагыштыру
Кислота үзлекләре
Хлорид кислота¬
сы (неорганик)
Серкә кислотасы
(органик)
1. Индикаторларга тәэсире (кис¬
лота молекулалары су эремәсендә
диссоциацияләшәләр)
2. Селтеләр белән тәэсир итешү
3. Металлар белән тәэсир итешү
4. Нигез оксидлары белән тәэсир
итешү
5. Көчсезрәк һәм очучан кислота
тозлары белән тәэсир итешү
? СОРАУЛАР ҺӘМ БИРЕМНӘР
Q 1. Эремәдәге серкә кислотасы кайсы җыелмадагы һәрбер матдә
белән дә реагирлаша:
a) NH3, FeO, NaHS; в) SiO2, KHSO4, (CuOH)2SO4;
б) Na2SO4, Mg(OH)2, Al; г) ZnO, CO, Fe.
Серкә кислотасының шул җыелма матдәләре белән реакцияләренең
молекуляр һәм кыскартылган ион-молекуляр тигезләмәләрен
төзегез.
2. Әверелеш схемасына туры килгән реакция тигезләмәләрен
төзегез.
C2H2 -> CH3CHO -> CH3COOH -> CH3COONa -> CH3COOH — H2
Реакцияләр бару шартларын күрсәтегез.
3*. 30 г серкә кислотасын нейтральләштерер өчен кирәк бул¬
ган 20% лы натрий гидроксиды эремәсе (р = 1,22 г/см3) күләмен
исәпләгез.
104
Q 4. Кайсы рәттә тозларның гидролизга бирешү сәләте арта бара:
a) C2H5ONa, CH3COONa, C6H5ONa;
б) CH3COONa, C2H5ONa, C6H5ONa;
в) C6H5ONa, C2H5ONa, CH3COONa;
г) CHjCOONa, C H ONa, C H ONa.
Шул рәт тозлары гидролизының молекуляр һәм кыскартылган ион-
молекуляр тигезләмәләрен төзегез.
5. Ничек итеп характерлы реакцияләр аша түбәндәге матдәләрне
танып белергә була: кырмыска кислотасы, натрий ацетаты һәм
серкә кислотасы? Танып белү эзлеклеген югалтмыйча, реакция
тигезләмәләрен языгыз.
§24
КАРБОН КИСЛОТАЛАРЫН ТАБУ ҺӘМ КУЛЛАНУ
Карбон кислоталары табигатьтә еш очрыйлар. Кырмыска кислотасы
чыршы ылысында бар, аны кырмыскалар да бүлеп чыгара. Кычыткан
яки медузага тигән урынның пешүе - кырмыска кислотасының ялкын -
сындыру тәэсире нәтиҗәсе. Валериан кислотасы - валериана тамыр¬
ларында, ә пропион кислотасы агач сумаласында бар. Шуңа да кара¬
мастан карбон кислоталарының табигать чыганакларыннан бүленеп
чыгуының практик әһәмияте юк. Карбон кислоталары табуның төп
чыганагы - органик синтез.
КИСЛОТАЛАР ТАБУНЫҢ ГОМУМИ ЫСУЛЛАРЫ
Спиртларны һәм альдегидларны оксидлаштыру. Оксидлашты¬
ручы итеп калий перманганаты һәм дихроматы, кислород һ.б. кулла¬
налар:
R - CH2 - OH + 2[О] -> R - COOH + H2O
спирт кислота
ХО zo
R-Cx + [OJ-R-C'
4H xOH
альдегид кислота
105
Алканнарны оксидлаштыру. Сәнәгатьтә алканнарны югары ба¬
сымда һәм температурада катализаторлар катнашында һава кислоро¬
ды белән оксидлаштыралар. Әйтик, серкә кислотасын бутанны оксид¬
лаштырып табалар:
2СН3 - CH2 4 CH2- CH3 + 5О2 ' г 4СН3СООН + 2Н,0
КАРБОН КИСЛОТАЛАРЫНЫҢ АЕРЫМ ВӘКИЛЛӘРЕ
Кырмыска кислотасы. Кырмыска кислотасын сәнәгатьтә табуның
үзенчәлекле ысулы - басым астында углерод (II) оксиды белән кыз¬
дырылган натрий гидроксидының тәэсир итү һәм шуннан соң табыл¬
ган натрий формиатын көчле кислота белән эшкәртү:
NaOH+ CO ► HCOONa
2HC00Na + H SOd -> Na7SOd+ 2НС00Н
Кырмыска кислотасы - төссез, үтә күренмәле кискен исле сыеклык,
суда яхшы эри. Тәнгә тигәндә пешү барлыкка китерә. Аның парла¬
рын иснәү сулыш юлларын ялкынсындыра.
Кырмыска кислотасын тукымалар буяганда, күн җитештергәндә
кулланалар. Ул бактерицид үзлекләргә ия. Кырмыска кислотасының
масса өлеше 1,25% булган спиртлы эремәсен медицинада «кырмыска
спирты» атамасы астында кулланалар.
Серкә кислотасы. Азык максатларында серкә кислотасын соста¬
вында спирт булган сыеклыкларны (шәраб, сыра) ферментатив әчетеп
(оксидлаштырып) табалар.
CH3 - CH2OH + O2 фермен-™^> CH3COOH + H2O
Серкә кислотасы (28 нче рәс.) - төссез, үтә күренмәле, үзенчәлекле
кискен исле сыеклык. +16,6 oC температурада сусыз серкә кислотасы
бозны хәтерләтеп кристаллик масса булып ката, шуңа күрә аны бозлы
серкә кислотасы дип атыйлар. Cy белән ул теләсә нинди чагыштырма-
28 нче рәсем. Серкә кислотасының
молекула моделе
да кушыла. Кислотаның судагы эремәсе
сатуга «аш серкәсе» (3-9% лы эремә)
һәм «серкә эссенциясе» (70-80% лы
эремә) исемендә чыгарыла. Бозлы һәм
куертылган серкә кислотасы тәнгә
тигәндә пешүләр барлыкка китерә.
Карбон кислоталары арасыннан
серкә кислотасы аеруча киң кулланы-
106
29 нчы рәсем. Серкә кислотасын куллану: 1 - ясалма сүс; 2 - тозлар; 3 - гербицид¬
лар; 4 - тукыма өчен буяулар; 5 - эреткечләр; 6 - пластмассалар; 7 - кинопленкалар;
8 - консервлар һәм азык тәмләткечләр; 9 - парфюмерия продукциясе ясау өчен
ла (29 нчы рәс.). Кислотаны һәм аның кушылмаларын ясалма сүсләр,
пластмассалар, янмый торган кинопленка, буягычлар һ.б. табу өчен
кулланалар. Серкә кислотасының тозларын тукымаларны буяганда
эретеп буягыч итеп кулланалар, алар сүстәге буягычны беркетергә бу¬
лыша. Серкә кислотасы шулай ук продуктларны консервлау өчен һәм
аш тәмләткеч итеп тә кулланыла. Серкә кислотасының кайбер катлау¬
лы эфирларын кондитер әйберләр җитештерүдә кулланалар.
Югары карбон кислоталары. Бу кислоталар радикаллары соста¬
вында углерод атомнары саны уннан артык. Шулар арасыннан пальми¬
тин (гексадекан) C15H31COOH һәм стеарин (октадекан) C17H35COOH
кислоталары аеруча зур әһәмияткә ия. Аларның молекулаларында¬
гы углеводород радикаллары о-бәйләнешләр белән тоташкан унбиш
һәм унҗиде углерод атомлы тармакланмаган чылбырдан тора (30 нчы
рәс.). Бу кислоталарның калдыклары каты майлар составына керә. Бу
кислоталарны парафинны каталитик оксидлаштырып яки майларны
гидролизлаштырып табалар. Хәзерге вакытта пальмитин һәм стеарин
кислоталарын иң беренче чиратта сабын җитештерү өчен, стеарин
шәмнәр җитештерүдә кирәкле стеарин ясау өчен кулланалар.
107
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Әверелешләр схемасына туры килгән реакция тигезләмәләрен
языгыз:
С,Н_—> С.Н. —> X1 ^CH COOH №£О; > X,
Z O Z 4 1 3 Z
Реакцияләрнең бару шартларын күрсәтегез һәм X1 һәм X2
матдәләренә атама бирегез.
2*. 500 см3 аш серкәсе (р - 1,007 г/см3) әзерләү өчен кирәк бул¬
ган серкә эссенциясенең (р = 1,07 г/см3) күләмен исәпләгез. Серкә
кислотасының эссенциядәге масса өлеше - 80%, аш серкәсендә
6% ка тигез.
3*. 11,2 л (н.ш.) углерод (II) оксиды натрий гидроксиды белән
тәэсир итешкәндә тоз хасил булган һәм шул тоздан кислота тап¬
каннар. Бу нинди кислота икәнен әйтегез һәм аның массасын са¬
нагыз.
4*. Реакция продуктының чыгышы 90% тәшкил итсә, 230 г эта¬
нолны оксидлаштырып табылган серкә кислотасының массасын
билгеләгез.
§25
КАРБОН КИСЛОТАЛАРЫНЫҢ КАТЛАУЛЫ ЭФИРЛАРЫ
СОСТАВЫ ҺӘМ НОМЕНКЛАТУРАСЫ
Карбон кислоталарының катлаулы эфирлары - органик кислота¬
лар спиртлар белән тәэсир итешкәндә хасил булган кушылмалар.
Карбон кислоталары һәм бератомлы спиртлар белән ясалган катлау¬
лы эфирларның гомуми формуласы:
R-C
4O-R,
яки
I R - COO - R^
108
Монда R һәм R1 - углеводород радикаллары,
бертөрле яки төрле булалар. Искәрмә булып
кырмыска кислотасы эфирлары тора
H-C х (31нчерәс.).
Катлаулы эфирларның атамалары аларның
молекулаларын төзүдә катнашкан кислота
һәм спирт атамаларыннан ясала:
O
H-Cx
х O - CH3
метилформиат,
яки кырмыска кислотасының метил эфиры яки
(метилкырмыска эфиры)
31 нче рәсем. Метилформиат-
ның молекула моделе
<0
CH1-C
3 xO-C2H5
этилацетат
серкә кислотасының этил эфиры
(этилсеркә эфиры)
ТАБИГАТЬТӘ ОЧРАВЫ ҺӘМ ТАБУ
Катлаулы эфирлар табигатьтә киң таралганнар. Чәчәкләр, җиләкләр,
җимешләрнең хуш исләре аларда теге яки бу катлаулы эфир булу белән
билгеләнә (8 нче табл.).
8 нче таблица
Катлаулы эфирларның исләре
Эфир
Исе
Май кислотасының этил эфиры
Ананас
Серкә кислотасының изоамил эфиры
Груша
Серкә кислотасының изобутил эфиры
Банан
Май кислотасының метил эфиры
Алма
Шуңа да карамастан җимеш эссенцияләре ясау өчен катлаулы эфир¬
ларны ясалма юл белән табалар: аларны җимешләрдән һәм чәчәкләрдән
бүлеп чыгару технологик яктан катлаулы. Лабораториядә аларны сезгә
билгеле булган этерификация реакциясе белән табалар. Мәсәлән, серкә
кислотасы һәм этанол катнашмасын аз микъдардагы сульфат кислотасы
катнашында җиңелчә җылытсаң, серкә кислотасы һәм этанолның кат¬
лаулы эфиры - этилацетатның тәмле исе барлыкка килә.
CHs - Clr T H10 - C2Hs Aso'
£»н_ J
/О
CH3 - C " + H2O
xO-C2H5
109
Этерификация реакциясе - кайтма реакция. Бу реакциянең
тигезләнешен катлаулы эфир ясалу ягына авыштыру өчен JIe Шателье
принцибы буенча реакция катнашмасыннан реакция продуктларының
берсен чыгарырга кирәк (эфирны кудырырга яки суны су йотучы
матдәләр белән бәйләргә). Сульфат кислотасы - бу реакциянең ката¬
лизаторы.
ФИЗИК ҺӘМ ХИМИК ҮЗЛЕКЛӘРЕ
Гади кислота һәм спиртларның катлаулы эфирлары - төссез очучан
сыеклыклар, суда аз эрүчән, тәмле исле, тиңдәш кислоталарга кара¬
ганда түбәнрәк температурада кайныйлар.
Югары кислота һәм бератомлы спиртларның катлаулы эфирлары -
балавыз сыман матдәләр, мәсәлән, бал корты балавызы.
Катлаулы эфирларга хас үзлек - гидролиз (су белән тәэсир итешү).
Бу реакция - этерификация реакциясенә капма-каршы процесс. Ул әче
тирәлектә дә, селтеле тирәлектә дә үтәргә мөмкин.
Әче гидролиз кайтма була, чөнки гидролиз вакытында хасил булу¬
чы кислота һәм спирт кабаттан катлаулы эфир барлыкка китереп реа-
гирлашалар:
CH3-C _ - - --TH"] OH
I0-cA
I» **
этилацетат
H+, /, гидролиз
< CH, — C
этерификация 3
xOH
+ C2H5OH
серкә кислотасы
Селтеле гидролиз (сабынлау) кайтма түгел, чөнки барлыкка килүче
кислота селте белән нейтральләшеп тозга әверелә, ә тоз спирт белән
реагирлашмый.
хо
CH3-C +NaOH -> CH3-Cf + C2H5OH
xO- C2H5 xO-Na
Эфирлар углерод (IV) һәм су хасил итеп җиңел янып бетәләр (ту-
лысынча оксидлашу).
CH3COOC2H5 + 50, -> 4СО2 + 4Н2О
КУЛЛАНУ
Хуш исле булганлыктан, катлаулы эфирларны салкын эчемлекләр
һәм җимеш сулары, кондитер әйберләре, ислемайлар һәм одеколоннар
IlO
әзерләү өчен кулланалар. Серкә кислотасының этил эфирын һәм кай¬
бер башка катлаулы эфирларны эреткечләр итеп файдаланалар. Кайбер
эфирларны медицинада (мәсәлән, салол дару препараты), пластмасса¬
лар җитештерүдә кулланалар.
А 6 нчы лаборатор тәҗрибә
W КАТЛАУЛЫ ЭФИР ТАБУ
Пробиркага 4-5 см3 этил спирты, серкә һәм сульфат кислотала¬
ры катнашмасын салыгыз, тигез кайнасын өчен, бераз гына елга
комы өстәгез. Пробирканы газүткәргеч көпшәле бөке белән ябыгыз,
көпшәнең бер очын салкын сулы җыйгыч пробиркага төшерегез (суга
берничә боз кисәге салыгыз). Җыйгыч-пробирканы мамык тампон
белән каплагыз. Катнашманы берничә минут эчендә челтәр аша сак
кына көчсез ялкында җылытыгыз (32 нче рәс.).
Сез нәрсә күзәтәсез? Җыйгыч пробиркадагы су өслегендә нинди
матдә җыелды?
Җылытуны тәмамлап, мамыкны алыгыз. Эфир исе сизеләме?
Реакция тигезләмәсен төзегез, реакцияне һәм аның продуктын ата¬
гыз.
нче рәсем. Этилацетат табу
Ill
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Әверелеш схемасына туры килгән реакция тигезләмәләрен
төзегез: кальций карбиды —» ацетилен —» ацетальдегид —> серкә
кислотасы —* метилацетат.
*Эфирның чыгышы 80% тәшкил итсә, 64 г кальций карбидыннан!
алынган метилацетат массасын исәпләгез.
2*. Метанолдан һәм 42 г серкә кислотасыннан табылган эфир мас¬
сасын санап чыгарыгыз.
3*. Этилацетатны сабынлаганда 34,5 г этанол тапканнар. Реакциягә
кергән катлаулы эфирның массасын билгеләгез.
§26
МАЙЛАР
СОСТАВЫ ҺӘМ ТӨЗЕЛЕШЕ
Катлаулы эфирлар арасында майлар аерым урын алып торалар,
аларның составын француз химигы Э.Шеврель билгеләгән. Майлар¬
ны селте катнашында су белән җылытканда, ул глицерин һәм төрле
карбон кислоталарын аерып алган. Аның ватандашы М.Бертло капма-
каршы процесс үткәрә - глицеринны югары карбон кислоталары белән
җылытып, май синтезлый.
Майларны анализлау һәм синтезлау соңында майлар - өч атомлы
спирт - глицеринның һәм югары карбон кислоталарының катлаулы
эфирлары дигән нәтиҗә ясарга мөмкинлек бирә.
CH2-O H
I
1
HO-C
1 xR
^O
CH2-O-C
I R
' Г •
CH-OH
I
+ Ho1-C* -4
J х R,
^o
► CH-O-C +зн,о
I
' Г ■
CH2 -qH
1
о
CH2-O-C
R2
майларның гомуми формуласы
112
Монда R, R1 һәм R2 - углеводород ра¬
дикаллары (төрле яки бертөрле булырга
мөмкиннәр), кагыйдә буларак, углерод
атомнарының саны күп (> 15). Кайбер
майларда түбән кислота калдыклары да
очрый, мәсәлән, ак майда май кислотасы
C3H7COOH составына керүче -C3H7 угле¬
водород радикаллары бар (33 нче рәс.).
Кислота калдыклары составына карап
каты һәм сыек майлар аералар. Каты
майлар - күбесенчә чикле, ә сыек май¬
лар - чиксез югары карбон кислоталары
эфирлары. Килеп чыгышы буенча май¬
ларны үсемлек һәм терлек майларына
бүләләр.
33 нче рәсем. Май кислотасының
глицерин эфиры молекуласы мо¬
деле
ФИЗИК ҮЗЛЕКЛӘРЕ
Күпчелек терлек (сыер, сарык һ.б.) майлары - каты матдәләр (балык
маеннан кала, ул сыек). Сыек майлар күбесенчә үсемлекләрдә очрый,
шуңа күрә аларны үсемлек (көнбагыш, кукуруз, мамык һ.б.) майлары
дип атыйлар. Каты үсемлек мае - кокос мае да билгеле (2 нче схема).
2 нче схема
Майларның составы һәм үзлекләре
113
Майлар судан җиңел һәм анда эремиләр, ләкин диэтил эфиры, бен¬
зин, хлороформ һ.б. кебек органик эреткечләрдә яхшы эриләр.
ХИМИК ҮЗЛЕКЛӘРЕ
Майларга, барлык башка катлаулы эфирларга кебек үк, гидролиз-
лашу реакциясе хас, ә составында чиксез карбон кислота калдыклары
булган үсемлек майлары туендырылмаган кушылмаларга хас барлык
реакцияләргә дә керәләр (кушылу, полимерлашу, оксидлашу).
Майлар гидролизы. Бу процессны техникада глицерин, карбон
кислоталары һәм сабын табу өчен кулланалар.
Глицерин һәм карбон кислоталарын табу өчен майны су белән бергә
автоклавта җылыталар (170 oC та һәм югары басымда):
СН.-О-СО- C17H,, CH, - OH
I 2 17 3. / n I 2
CH-O-CO-C17H,, +ЗН,0 СН-ОН + ЗС,7Н„СООН
17 35 2 J 17 35
CH2-O-CO-C17H35 CH2-OH к=сны
тристеарин глицерин
Майлар, мәсәлән, ак май, гадәти шартларда озак саклаганда өлешчә
гидролизлаша. Хасил булган май кислотасының CH3-CH2-CH2-COOh
микъдары күп булмаса да, ул ак майга тәмсез тәм һәм ис бирә. Бу про¬
цесс әчү дип атала.
Гидролизны селтеле тирәлектә (селте яки натрий карбонаты
эремәсендә) үткәргәндә карбон кислоталарының натрий тозлары - са¬
быннар бүленеп чыга. Шуңа күрә майларның селтеле гидролизын са¬
бынлау дип атыйлар.
CH2-O-CO-C17H35 CH2-OH
CH-O-CO-C17H,, + 3NaOH -> CH-OH + 3C17H„COONa
17 35 I 17 35
CHi-O-CO-CnHli CH2-OH
Бу процесс борынгы заманнардан бирле билгеле, ул вакытта сабын
табу өчен терлек майларын су һәм составында калий карбонаты бул¬
ган агач көле белән кайнатканнар.
Майларны гидрирлау (гидрогенлаштыру). Сабын һәм башка
матдәләр табу өчен күбесенчә каты майлардан файдаланалар. Әмма
ул кыйммәтле азык продукты. Терлек майларын экономияләү макса¬
ты белән составларына чиксез кислота калдыклары кергән үсемлек
майларын каты майларга әверелдерәләр. Аның өчен аларның гид-
рирлашуын (гидрогенлашуын) үткәрәләр. Җылытылган май белән
114
вакланган катализатор (никель) катнашмасы аша басым астында во¬
дород үткәрәләр. Ул углеводород радикалларындагы икеле бәйләнеш
(-CH=CH-) урыны буенча кушыла, һәм сыек май каты продуктка -
саломаска әверелә.
CH2-O-CO- C17H33 CH2-O-CO- C17H35
CH-O-CO-C17H33 +ЗН2 -2^4. CH-O-CO-C17H35
CH2-O-CO- C17H33 CH2-O-CO- C17H35
триолеин (сыек май) тристеарин (каты май)
МАЙЛАРНЫҢ ҺӘМ АЛАР НИГЕЗЕНДӘГЕ ПРОДУКТЛАРНЫҢ
АЗЫК КЫЙММӘТЕ
компонентларының ча-
гы пп ырма энергетик
кыйммәте:
a - аксымнар
6 майлар
в углеводлар
Майлар - азыкның әһәмиятле өлеше. Алар организмдагы энергиянең
бер чыганагы булып торалар. Организмга энергия даими температура¬
ны саклау өчен дә, эш башкару өчен дә кирәк. Шулкадәр үк аксым һәм
углевод оксидлашканга караганда майлар оксидлашканда энергия ике
тапкыр күбрәк бүленеп чыга (34 нче рәс.). 1 г май тулысынча оксид¬
лашканда уртача 38,9 кДж энергия бүленеп чыга.
Нормаль тормыш итү өчен кешегә көненә уртача 65-70 г май кирәк.
Моңа иттә, балыкта, сөт һәм сөт продуктларындагы, шулай ук кон¬
сервлардагы, икмәк һәм кондитер әйберләрендәге һ.б. кертеп, барлык
майлар да керә.
Майлар организмда резерв туклык¬
лы матдә булып торалар. Организмга
эләккәннән соң, алар, ашказаны асты бизе
һәм эчәклек соклары тәэсирендә гидролизла-
шып, глицерин һәм карбон кислоталары ха¬
сил итәләр. Гидролиз продуктлары эчәктәге
төксыман үсентеләр аша суырылалар һәм
алардан шул организмга хас майлар синтез¬
лана.
Моннан тыш майлар тире асты тукыма¬
ларында һәм эчке органнарны урап алган
тукымаларда җыела, шулай итеп алар сакла¬
гыч һәм җылылык тоткарлау функцияләрен
үтиләр.
Соңгы вакытта үсемлек майларының тер¬
лек майларына караганда организм тарафын¬
115
нан җиңелрәк үзләштерелүе, аларны кулланганда кандагы холестерин
дәрәҗәсе төшүе ачыкланды.
Майлардан маргарин һәм майонез кебек азык продуктларын таба¬
лар.
Маргарин - вак дисперслы эмульсия, аның составына каты май,
үсемлек мае, сөт, ароматизаторлар, витаминнар, шикәр, тоз, азык буя¬
гычлары керә. Составы һәм структурасы буенча маргарин ак майга
якынлаша. Аны икмәк пешерү, кулинар һәм кондитер сәнәгатьләрендә
кулланалар.
Майонез - шулай ук үсемлек маеның су, йомырка порошогы, коры
сөт, шикәр, серкә һәм тәмләткечләр белән вак дисперсияле эмульсия¬
се. Аны туклыклылыгын арттыру һәм тәмләтү өчен төрле кулинар
ашамлыкларга тәмләткеч итеп өстәү аппетитны арттыра һәм ашкай-
натуны яхшырта.
Маргарин һәм майонез җитештергәндә үзлекләре алдан билгеләнгән
киң ассортиментлы продуктлар табарга мөмкин. Бу төрле яшьтәге
кешеләргә дөрес туклану проблемасын, шулай ук диетик туклану про¬
блемасын чишәргә ярдәм итә.
7 иче лаборатор тәҗрибә
* МАЙЛАРНЫҢ ҮЗЛЕКЛӘРЕ
1. Майларның эрүчәнлеге
Өч пробиркага 1 см1 2 3 су, этил спирты, бензин салыгыз һәм аларга
якынча тигез итеп каты май кисәкләре яки 2-3 шәр тамчы үсемлек
мае өстәгез. Пробиркаларны болгатканда нинди үзгәрешләр булуын
күзәтегез. Майлар нинди сыеклыкта яхшырак эрегәнен билгеләгез.
Тукымадан май тапларын чыгарганда сез нинди эреткеч кулланыр¬
сыз?
2. Сыек майларның чиксез характеры
Бер пробиркага 1-2 см3 көнбагыш мае, икенчесенә каты терлек
мае салыгыз һәм май эрегәнче җылытыгыз, һәрбер пробиркага бе¬
раз гына бромлы су кушыгыз һәм катнашманы болгатыгыз. Кайсы
пробиркада бромлы су төссезләнгәнен билгеләгез. Ул нәрсә турында
сөйли? Реакция тигезләмәсен төзегез.
116
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Әверелеш схемасына туры килгән реакция тигезләмәләрен
төзегез.
трипальмитин —> глицерин —> триолеин —> тристеарин —♦ калий
стеараты.
Q 2. Стеарин кислотасын олеин кислотасыннан аеру өчен нәрсә кул¬
ланалар:
а) бромлы су;
б) бакыр (II) гидроксиды;
в) натрий карбонаты;
г) метанол.
3*. 132,6 г триолеинны гидрирлау өчен кирәк булган водород
күләмен (н.ш.) исәпләгез.
§27
САБЫННАР ҺӘМ СИНТЕТИК ЮУ ЧАРАЛАРЫ
Сабынның составы һәм үзлекләре. Са¬
быннар - югары чикле бернигезле карбон
кислоталарының натрий яки калий тозлары.
Калий тозлары - сыек сабыннар, ә натрий
тозлары - каты сабыннар. Калийлы сабыннар
суда яхшырак эрүчән, алар шампунь һәм кыры¬
ну кремнары составында бар. Натрийлы сабын¬
нар өлешчә генә эрүчән, аларны төрле формада¬
гы брикетлар рәвешендә чыгарыла торган кер
сабыны, исле сабын табу өчен кулланалар (35
нче рәс.). Исле сабын җитештергәндә тәмле исле
һәм буягыч матдәләр, антисептиклар кушалар.
35 нче рәсем. Сыек һәм
каты сабын
Табу. Әле күптән түгел генә сабын табу өчен майлар кулланган¬
нар. Моның өчен аларны селтеле гидролиз (сабынлау) процессына
керткәннәр.
Хәзерге вакытта сабынны синтетик кислоталарны нейтраль¬
ләштереп табалар.
117
C15H31COOH + KOH -> C15H31COOK + H2O
калий пальмитаты
(сыек сабын)
C15H31COOH + NaOH -> C15H31COONa + H2O
натрий пальмитаты
(каты сабын)
Сабын җитештерү өчен кирәк булган кислоталар күбесенчә нефть
парафиннарын оксидлаштырып табыла.
2СН+50 кэт- C 4С,,H11COOH+ ZH1O
пальмитин кислотасы
Сабынның җитешсезлекләре. Сабын көчле нигез һәм көчсез кис¬
лота тозы булганга күрә, аның суда эрүе гидролиз белән бара, барлык¬
ка килгән селтеле тирәлек күп кенә тукымаларга, бигрәк тә йонга,
ефәккә зыянлы тәэсир ясый.
C15H31COONa+ H2O C15H31COOH + NaOH
Jl1Too “ H1OH C1 H11COOH+ OH
Ij Jl j IjJI
Каты суда һәм диңгез суында сабынның чистарту үзлеге, эремәүчән
кальций яки магний тозлары (мамыксыман утырым) хасил булу
сәбәпле, кими (ул сабынланмый, күбекләнми).
ZC15H31COOK + CaCl2 -> (C15H31COO)2Ca 1 + 2КС1
ZC15H31COO + Ca2+ ->• (C15H31COO)2Ca 1
Шуңа күрә сабын урынына ешрак синтетик юу чаралары куллана¬
лар (СЮЧ).
Синтетик юу чаралары. Синтетик юу чара¬
ларының бер төркемен югары спиртларның
һәм сульфат кислотасының катлаулы
эфирларының тозлары алып тора. Гади са¬
быннан аермалы буларак, СЮЧ гидролизга
бирешмиләр, шуңа күрә аларның эремәләре
нейтраль. Алар чистарту үзлекләрен каты
суда, һәм хәтта диңгез суында да саклыйлар,
чөнки бу вакытта алар хасил иткән кальций
һәм магний тозлары эрүчән.
СЮЧ «Миф», «Астра», «Ариэль» һ.б.
исемдә киң таралган кер юу порошоклары 36 нче рэсем синтетик
составына керә. юу чарасы
118
СЮЧнын җитешсезлекләре. Синтетик юу чаралары тотрыклы
һәм кыен таркалалар, шунлыктан алар әйләнә-тирә мохитта җыелып,
аны пычратуга сәләтле. Шуңа күрә яңа юу чаралары җитештергәндә
аларның нәтиҗәлелеген генә түгел, ә бәлки биологик һәм химик тар¬
калуга сәләтен дә исәпкә алырга кирәк.
8 нче лаборатор тәҗрибә
ЮУ ЧАРАЛАРЫНЫҢ ҮЗЛЕКЛӘРЕ
1. Сабынның үзлекләре
Пробиркага 4-6 см3 дистиллят су салыгыз һәм кер сабыны
кисәкчекләрен (1 г) җылытып эретегез. Барлыкка килгән эремәне дүрт
пробиркага бүлегез.
Беренче пробиркага берничә тамчы фенолфталеин тамызыгыз.
Индикаторның төсен билгеләгез һәм сабын гидролизының кыскартыл¬
ган ион-молекуляр һәм молекуляр тигезләмәләрен төзегез.
Икенче пробиркага мамыксыман утырым барлыкка килгәнче хлорид
кислотасы салыгыз. Бу утырым нәрсәдән гыйбарәт? Реакциянең моле¬
куляр һәм кыскартылган ион-молекуляр тигезләмәләрен төзегез. Селте
өстәгәч мамыксыман утырым эриме? Күзәтүләрне аңлатыгыз. Сабын
юу үзлекләрен әче эремәдә саклыймы?
Өченче пробиркага кальций хлориды эремәсе салыгыз. Нәрсә
күзәтәсез? Реакциянең молекуляр һәм кыскартылган ион-молекуляр
тигезләмәләрен языгыз. Бу тәҗрибә сабынның нинди үзлекләрен
сурәтли?
2. Сабын һәм синтетик юу чараларының үзлекләрен чагыштыру
Берәр төрле синтетик югыч матдәнең дистиллят судагы 2-3 см'
эремәсен әзерләгез.
Ике пробиркага 4-5 см3 каты су (анда Ca2+ һәм Mg2' ионнары бар)
салыгыз. Пробирканың берсенә - тамчылап дүртенче пробиркада¬
гы (1 нче тәҗрибә) сабын эремәсен, икенчесенә синтетик юу чара¬
сы эремәсен кушыгыз, һәрбер кушылган тамчыдан соң пробирканы
селкегез.
Кайсы очракта тотрыклы күбек хасил булсын өчен күбрәк эремә
өстәргә туры килүен билгеләгез һәм СЮЧның өстенлеге !урында нәтиҗә
ясагыз. Аларның җитешсезлекләрен күрсәтегез.
119
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Сабын, натрий карбонаты һәм селте эремәләрен танып белү өчен
нәрсә кирәк:
а) хлорид кислотасы; в) кальций хлориды эремәсе;
б) бакыр (II) гидроксиды; г) фенолфталеин эремәсе.
2. Глицерин, сабын, формалин һәм этил спирты эремәләрен ничек
танып белергә? Тәҗрибәнең планын һәм реакция тигезләмәләрен
төзегез.
■
3*. 805 кг калийлы сабын табу өчен кирәк булган тристеарат мае- •
сасын исәпләгез. Реакция продуктының чыгышы 80% тәшкил итә. ■
I
120
III. ПОЛИФУНКЦИОНАЛЬ КУШЫЛМАЛАР
Сез молекулалары составында бер яки берничә бертөрле функцио¬
наль төркем булган күптөрле углеводород кушылмалары белән (спирт¬
лар, аминнар, альдегидлар, карбон кислоталары) таныштыгыз. Ләкин
органик матдәләр составына берьюлы берничә, төрле функциональ
төркем дә керергә мөмкин.
Андый кушылмаларның химик үзлекләре молекулалары составына
керүче функциональ төркемнәр белән билгеләнә. Мәсәлән, метан мо¬
лекуласындагы бер водород атомын гидроксил, ә икенчесен карбоксил
төркеменә алмаштырсаң, барлыкка килүче кушылма спиртларга да,
кислоталарга да хас булган үзлекләр күрсәтәчәк:
CH2-C
дн хон
Полифункциональ кушылмаларга углеводлар, аминокислоталар,
аксымнар керә.
Vl бүлек. Углеводлар
Углеводлар тере табигатьтә, бигрәк тә үсемлекләр дөньясында киң
таралган һәм безнең планетадагы органик матдәләрнең төп өлешен
тәшкил итәләр. Үсемлекләрнең коры массасының 80% ка кадәре угле¬
водлар өлешенә туры килә. Углеводларга төрле шикәрле матдәләр
(глюкоза, фруктоза, сахароза), крахмал, клетчатка керә. «Углеводлар»
сүзе - тарихи атама, ул әле бу кушылмаларның төзелеше билгеле бул¬
маган, ләкин составлары Cn(H2O)m (биредә п, т > 3) гомуми форму¬
ласына туры килүе ачыкланган көннәрдән бирле сакланган. Бу фор¬
муладан углеводлар углерод белән су - «угле-вод» кушылмасы була¬
рак икәне аңлашыла. Күпчелек углеводларның составы бу формулага
туры килә.
Углеводлар төзелеше буенча моносахаридларга, дисахаридларга
һәм полисахаридларга бүленәләр.
121
§28
МОНОСАХАРИДЛАР
Моносахаридлар — гидролизлашып гадирәк углеводларга таркала
алмый торган углеводлар.
Моносахаридлар арасыннан глюкоза һәм фруктоза аеруча тарал¬
ган.
ГЛЮКОЗА МОЛЕКУЛАСЫНЫҢ СОСТАВЫ ҺӘМ ТӨЗЕЛЕШЕ
Глюкоза (грек, glykys - баллы) - төссез кристаллик матдә, суда яхшы
эрүчән, тәме баллы. Ул виноград согы составында бар, шуңа күрә аны
виноград шикәре дип атыйлар, шулай ук ул өлгергән җиләк-җимеш
һәм бал составында да бар.
Глюкозаның составы C6H12O6 формуласы белән күрсәтелә, аның
төзелеше тәҗрибәләр ярдәмендә дәлилләнгән.
• Глюкоза кайтарылганда гексан хасил була. Бу молекуланың скелет
нигезендә тармакланмаган углерод чылбыры бар икәнлеген күрсәтә.
• Глюкозаның судагы эремәсе нейтраль (индикатор төсен үзгәртми),
ул тозлар ясамый. Димәк, глюкоза составында карбоксил төркеме
юк.
• Глюкоза «көмеш көзге» реакциясен бирә, ә ул глюкоза молекула¬
сында альдегид төркеме барлыгын дәлилли.
• Глюкозаның молекуласында биш серкә кислотасы калдыгы булган
катлаулы эфиры табылган, ә ул аның молекуласында биш гидроксил
төркеме барлыгын дәлилли.
Бу дәлилләр нигезендә глюкозаның химик төзелешен түбәндәге
формула белән күрсәтәләр:
6 5 4 3 2 1
CH2OH - CHOH - CHOH - CHOH - CHOH - C
хн
яки CH2OH - (CHOH)4 - <°
Шулай итеп, глюкоза - альдегидоспирт.
122
ГЛЮКОЗАНЫҢ ХИМИК ҮЗЛЕКЛӘРЕ
Глюкоза - бифункциональ кушылма (ике төр функциональ
төркемнән тора), аңа альдегид һәм күпатомлы спирт үзлекләре, шулай
ук үзенчәлекле үзлекләр хас.
Альдегид төркеме катнашындагы реакцияләр
Оксидлашу реакциясе. Глюкоза альдегид кебек кайтару
үзлекләренә ия һәм көмеш оксидының аммиактагы эремәсе белән реа-
гирлаша («көмеш көзге» реакциясе):
z NH • H O
CH2OH-(CHOH)4-C +Ag2O ——
глюкоза H
-» CH2OH - (CHOH)4 - C Х + 2Ag 1
глюкон кислотасы OH
Җылытканда глюкозаның яңа әзерләнгән бакыр (II) гидроксиды
белән оксидлашуы да югарыга охшаш рәвештә уза:
'°
CH2OH-(CHOH)4-C + 2Cu(OH)2 A
xH
-> CH2OH - (CHOH)4 -Cx + Cu2O i + 2Н2О
OH кызыл
Кальций глюконаты исемле дару препараты - глюкон кислотасы
тозы.
Кайтарылу реакциясе. Водород тәэсирендә һәм катализатор кат¬
нашында глюкозаның альдегид төркеме, алты атомлы спирт - сорбит
хасил итеп, спирт төркеменә кадәр кайтарыла:
^O
CH2OH - (CHOH)4 -C ' + H2 A CH2OH - (CHOH)4 - CH2OH
xH
Сорбит - сәнәгатьтә C витаминын синтезлау өчен башлангыч матдә,
ул шикәр диабеты белән авыручыларга шикәр алмаштыргычы булып
тора.
Гидроксил төркемнәре катнашындагы реакцияләр
Глюкоза, күпатомлы спиртлар (мәсәлән, глицерин) кебек, яңа
әзерләнгән бакыр (II) гидроксиды белән җылытмыйча (суыкта) сыек
123
зәңгәр төстәге кушылма хасил итеп реагирлаша. Бу реакцияне сидектә
шикәр барлыгын белү өчен кулланалар.
Шулай итеп, глюкоза составында ике төр функциональ төркем
барлыгын дәлилләү өчен ике сыйфат реакциясе үткәрергә мөмкин.
Тикшерелә торган эремәгә башта бакыр (Il) гидроксиды кушарга
кирәк. Сыек зәңгәр эремә барлыкка килүе гидроксил төркемнәр бар¬
лыгын дәлилли. Аннары катнашманы җылытырга һәм кызыл утырым
төшүе буенча альдегид төркеме барлыгын белергә кирәк.
Глюкозаның үзенчәлекле үзлекләре
Микроорганизмнар эшләп чыгарган биологик катализаторлар -
ферментлар тәэсирендә глюкоза молекулалары таркалуга бирешәләр.
Бу әчү реакциясе дип атала. Фермент табигате буенча спиртлы, сөт-
кислоталы, май-кислоталы һ.б. төрле әчүләрне аералар. Процессның
атамасы реакциянең азаккы продукты буенча билгеләнә. Әйтик, чүпрә
ферментлары тәэсирендә спиртлы әчү бара, ул шәраб эшләп чыгаруда,
сыра кайнатуда кулланыла:
CftH19Oft чүпрә ферментлары 2С H OH + 2СО,1
OlZO ZJ Z1
этил спирты
Сөт-кислоталы әчү сөт әчетү бактерияләре эшләп чыгарган фер¬
ментлар тәэсирендә үтә.
C H11Oa бактерия ферментлары 2СҢ -CH- COOH
о Iz о 3 I
OH
сөт кислотасы
Бу реакция әчетелгән сөт продуктлары (ачыган сөт, каймак, эрем¬
чек, сыр) җитештерү нигезендә ята. Сөт кислотасы шулай ук кәбестә
һәм кыярны әчетеп тозлаганда, мал-туар өчен яшел азык силослаганда
барлыкка килә. Бу очракта ул черү процессларын тоткарлаучы консер¬
вант ролен үти.
ГЛЮКОЗАНЫҢ БИОЛОГИК ӘҺӘМИЯТЕ ҺӘМ КУЛЛАНУ
Табигатьтә глюкоза кояш энергиясе тәэсирендә үтүче фотосинтез
процессында яшел үсемлекләрдә хасил була:
фотосинтез
6СО, + 6НО ► CftH11 Oft+ 60,1-2816 кДж
Z Z O Iz O Z1
124
Бу реакция барышында глюкоза Кояш энергиясен үзенә җыя, Кояш
энергиясе шулай итеп тере организмнар үзләштерерлек хәлгә күчә. Ел
саен фотосинтез нәтиҗәсендә Җирдәге һәр кешегә якынча 20 шәр т
туры килерлек итеп органик матдә барлыкка килә, шул ук вакытта
фотосинтез процессында 200 млрд т углерод (IV) оксиды үзләштерелә
һәм атмосферага якынча 145 млрд т ирекле кислород бүленеп чыга.
Tepe организмнарда глюкозаның күпчелек өлеше (якынча 70%) һава
кислороды белән оксидлаштырыла (фотосинтез процессына капма-
каршы реакция):
C6H12O6+ 60, сулыш > 6СО2 + 6Н2О + 2816 кДж
Реакция вакытында глюкоза ясалганда, тотылган кадәр микъдарда
энергия бүленеп чыга. Бу энергия организмның яшәү эшчәнлеге про¬
цессларын тәэмин итү өчен тотыла (мускуллар кыскаруы, матдәләр
синтезы һ.б.).
Глюкоза - энергия чыганагы гына түгел, ул әле тере организмнарга
кирәк булган башка күп кушылмалар (гликоген, майлар, аминокисло¬
талар) синтезы өчен башлангыч матдә дә.
Глюкоза - канның зарури компоненты, аның масса өлеше 0,08% тан
алып 0,11% ка кадәр үзгәрергә мөмкин. Кайбер чирләр вакытында,
мәсәлән, шикәр диабеты вакытында, глюкозаның кандагы микъдары
арта һәм аның артыгы сидек белән чыга. Глюкозаның сидектәге өлеше
бу вакытта 12% ка кадәр артырга мөмкин, ә гадәттә ул 0,1% була.
Глюкозаны медицинада яхшыртылган туклану чарасы һәм дару
матдәсе итеп, кондитер җитештерүендә (карамель, мармелад, прәннек
һ.б. эшләп чыгару) кулланалар, ул эчемлекләр составына керә. Глю¬
козаны көзгеләр, чыршы бизәгечләре (көмешләү) эшләп чыгару өчен,
шулай ук текстиль сәнәгатендә буяганда кулланалар.
Сәнәгатьтә глюкозаны крахмал һәм целлюлозаны гидролизлау юлы
белән табалар.
ФРУКТОЗА
Фруктоза (җимеш шикәре) глюкоза кебек үк C6H12O6 молекуляр
формулага ия, ләкин төзелеше белән аерыла:
CH,OH - CHOH - CHOH - CHOH -C- CH1OH
6 ‘
Шулай итеп, фруктоза глюкозаның структур изомеры булып тора.
Ул кристаллик матдә, суда яхшы эри, глюкозадан өч тапкыр баллырак.
125
Ирекле рәвештә җиләк-җимеш составында очрый. Бал - глюкоза һәм
фруктоза катнашмасы.
Күпатомлы спирт буларак фруктоза җылытусыз бакыр (II) гидрок¬
сиды белән сыек зәңгәр төс бирә.
Глюкозадан аермалы буларак, фруктоза көмеш оксидының амми¬
актагы эремәсе белән оксидлашмый («көмеш көзге» реакциясенә кер¬
ми).
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Ничек итеп бер реактив кына кулланып, глюкоза молекуласын¬
да ике төрле функциональ төркем барлыгын дәлилләргә? Тәҗрибә
үткәрү планын һәм реакция тигезләмәсен төзегез.
2. Глюкозаның яну реакциясе тигезләмәсен языгыз.
Q 3*. 200 г глюкоза сөт - кислоталы әчегәндә 160 г сөт кислотасы
тапканнар. Продуктның чыгышы (% ларда) күпмегә тигез?
а) 80; б) 50; в) 70; г) 90.
4*, 5 г глюкоза эремәсе спиртлы әчегәндә углерод (IV) оксиды
бүленеп чыккан. Аны кальций гидроксиды аша үткәргәннәр, һәм
0,5 г утырым төшкән. Глюкозаның эремәдәге масса өлешен (%)
исәпләгез.
§29
ДИСАХАРИДЛАР
Дисахаридлар - гидролизлаганда ике моносахарид молекуласы ха¬
сил итә торган углеводлар.
Алар табигатьтә киң таралганнар: күпчелек җиләк-җимеш һәм
яшелчә составларында бар. Сахароза дисахариды аеруча киң тарал¬
ган, аның молекуласы глюкоза һәм фруктоза калдыкларыннан тора.
Физик һәм химик үзлекләре. Сахароза - баллы тәмле кристал¬
лик матдә (глюкозага караганда баллырак), суда яхшы эрүчән (сал¬
кын суда - әкренрәк, кайнар суда - тиз). Җылытканда ул көрән төскә
126
керә, таркалып су бүлеп чыгара һәм аморф матдәләр катнашмасына -
карамельгә әверелә.
Сахароза молекулалары составында альдегид төркемнәре юк. Шуңа
күрә ул «көмеш көзге» реакциясенә керми һәм бакыр (П) гидроксидын
кайтармый. Сахароза күпатомлы спирт үзлекләрен күрсәтә. Шулай,
ул җылытусыз бакыр (II) гидроксиды белән тәэсир итешкәндә сыек
зәңгәр төсле эремә хасил була.
Сахарозага гидролиз реакциясе хас. Аны минераль кислота катна¬
шында җылытканда, глюкоза һәм фруктоза хасил була.
C12H22On + H2O н-' > C6H12O6+ C6H12O6
глюкоза фруктоза
Гидролиз процессында барлыкка килгән глюкозаны альдегид
төркеменең сыйфат реакцияләренең берсе белән табарга була. Мәсәлән,
әгәр табылган эремәне нейтральләштереп, яңа әзерләнгән бакыр (II)
гидроксиды белән җылытсаң, бакыр (I) оксидының кызыл утырымы
хасил була.
Tepe организмнарда сахарозаның гидролизлашуы ферментлар
тәэсирендә үтә. Мәсәлән, андый процесс чәчәк нектарын (сахаро¬
за эремәсен) глюкоза һәм фруктоза катанашмасы булган бал итеп
эшкәртүче бал кортлары организмында бара.
Табу һәм куллану. Сахароза - шикәрләр арасыннан иң таралга¬
ны. Ул яшел үсемлекләрнең барлык өлешләрендә дә бар. Сахарозага
бигрәк тә шикәр чөгендере (16-20%) һәм шикәр камышы (14-26%)
бай. Аны шул үсемлекләрдән алалар да инде, һәм шунлыктан чөгендер
яки камыш шикәре дип атыйлар. Аның төп өлешен азык сәнәгатендә
кулланалар. Сахароза - кешенең туклануында углеводларның төп чы¬
ганакларыннан берсе.
§30
ПОЛИСАХАРИДЛАР
Полисахаридлар - макромолекулалары йөзләгән һәм меңләгән мо¬
носахарид калдыкларыннан төзелгән табигый югары молекуляр ку¬
шылмалар.
Полисахаридлар арасыннан крахмал, гликоген (хайван крах¬
малы), клетчатка (целлюлоза) аеруча зур әһәмияткә ия. Бу
127
полисахаридларның барысы да бер-берсе белән төрлечә бәйләнештә
торучы глюкоза молекулалары калдыкларыннан тора. Аларның
төзелеше түбәндәге гомуми формула белән тасвирлана:
IC6Hl0O5I
Moho- Һәм дисахаридлардан аермалы буларак, полисахаридларның
тәме баллы түгел, алар суда эремиләр.
КРАХМАЛ
Төзелеше һәм үзлекләре
Крахмал сызыкча һәм тармакланган
макромолекулалардан тора (37 нче рәс.,
нокталар белән глюкоза молекулалары
калдыклары күрсәтелгән). Крахмал -
ак төстәге аморф порошок, салкын суда
эреми. Кайнар суда ул бүртә һәм колло¬
ид эремә - клейстер хасил итә.
Крахмал, сахароза кебек үк, «көмеш
көзге» реакциясен бирми һәм бакыр
(П) гидроксидын кайтармый.
Иод эремәсе белән тәэсир иткәндә,
крахмал зәңгәр төстәге кушылма хасил
итә - бу крахмалга сыйфат реакциясе.
37 нче рәсем. Крахмал макромо¬
лекулалары структурасы:
a - сызыкча;
6 - тармакланган
Крахмал гидролизга чагыштырмача җиңел бирелә:
[с.н„оа+ян,о —,.C6H11O6
Бу реакция сәнәгатьтә глюкоза табу нигезендә ята.
Табигатьтә очравы
Крахмал табигатьтә киңтаралган. Биология курсыннан белгәнегезчә,
крахмал - фотосинтез продуктларының берсе. Фотосинтез вакытын¬
да яшел үсемлекләрдә хасил булучы глюкозаның бер өлеше крахмалга
әверелә:
6СО2 + 6Н,О Фотосинте^> CH12O +60,
LL b IL о L t
ZiC6Hl2O6 ферментлар [C6H16OJii + ZiH2O
O IL O *■ O IU L
глюкоза крахмал
128
Гомуми рәвештә:
6лСО, + 5иН O [C6H10O5] + 6иО
2 2 L 6 10 5-*и 2
Резерв туклыклы матдә буларак, крахмал бүлбеләрдә, җимешләрдә,
үсемлек орлыкларында җыела. Әйтик, бәрәңге бүлбесендә - 24% ка
кадәр, бодай бөртекләрендә - 64% ка, дөгедә - 75% ка, кукурузда
70% ка кадәр крахмал бар.
Табу һәм куллану
Крахмалны бәрәңге бүлбесеннән яки кукуруздан һәм дөгедән таба¬
лар. Азык-төлек сәнәгатендә аны куерткыч һәм желе ясаучы чара итеп
кулланалар.
Кондитер җитештерүендә крахмалны патокага әверелдерәләр, ә па¬
токаны үз чиратында джемнар, мармелад, конфет һ.б. әзерләүдә кул¬
ланалар. Крахмалны гидролизлаштырып табылган глюкоза этанол,
сөт кислотасы һ.б. кыйммәтле продуктлар җитештерүгә бара. Крахмал
мазьлар һәм порошоклар өчен тутыргыч буларак һәм беркетү матдәсе
буларак та кулланыла.
Крахмалны юган керне крахмаллау өчен кулланалар. Кайнар үтүк
белән үтүкләгәндә крахмал өлешчә гидролизлаша һәм, тыгыз пленка
хасил итеп, тукымага ялтыравык бирә һәм аны пычранудан саклый.
Крахмалның биологик әһәмияте. Гликоген
Крахмал - кыйммәтле туклыклы матдә һәм сахароза белән беррәттән
кеше организмында углеводларның төп чыганагы булып тора. Ул
икмәк һәм бәрәңге, ярмалар, макарон һәм кондитер әйберләре составы¬
на керә. Организмда крахмал турыдан-туры үзләштерелми, башта ул
ферментлар тәэсирендә гидролизга бирелә. Бу процесс авыз куышлы¬
гында азыкны чәйнәгәндә үк селәгәй ферменты - птиалин тәэсирендә
башлана һәм ашкайнату трактында глюкоза хасил итеп тәмамлана.
Глюкозаның бер өлешен организм шунда ук үзләштерә, ә аның артыгы
гликогенга (хайван крахмалына) әверелә.
Гликоген - полисахарид. Аның макромолекулаларының төзелеше
крахмалның тармакланган макромолекулалары төзелешенә охшаш,
ләкин алар тагын да күбрәк тармакланган һәм зуррак чагыштырма мо¬
лекуляр массага ия. Гликоген бавырда һәм мускулларда туплана. Кеше
һәм хайван организмында ул резерв туклыклы матдә булып тора һәм
кирәк булган саен глюкозага кадәр гидролизлана.
129
ЦЕЛЛЮЛОЗА
Целлюлозаның төзелеше
Целлюлоза (клетчатка), крахмал ши¬
келле үк, табигый полимер. Бу матдәләр¬
нең молекуляр формулалары бертөрле
[C6H10OJn. Ләкин крахмал макромолеку¬
лаларыннан аермалы буларак целлюлоза
макромолекулалары:
• составында структур берәмлекләр
(глюкоза калдыклары) саны күбрәк;
38 нче рәсем. Табигый сүсләрдә
целлюлоза макромолекулала¬
рының юнәлеше
• сызыкча төзелешле генә булалар (җеп
сыман) (38 нче рәс.);
• үзара водород бәйләнешләре белән бәйләнгәннәр, ул бәйләнешләр
ясалуда глюкоза калдыкларының гидроксил төркемнәре катнаша һәм
алар целлюлозаның механик яктан югары тотрыклылыгын тәэмин
итәләр.
Физик ҺӘМ ХИМИК ҮЗЛЕКЛӘРЕ
Крахмал һәм целлюлоза макромолекулалары төзелешендәге аерма
аларның физик һәм химик үзлекләрендәге аермаларны билгели. Цел¬
люлоза - каты ак яки сары төстәге сүс сыман матдә, суда һәм гадәти
органик эреткечләрдә эреми.
Гидролиз. Крахмалдан аермалы буларак, целлюлозаның гидролизла-
шуы кырысрак шартларда үтә (сульфат кислотасы тәэсирендә озак
җылытканда). Гидролизлашуның азаккы продукты булып глюкоза
тора:
н+л
* "C6H12O6
[C6H10O5In+ "H2O
Бу реакцияне сәнәгатьтә кулланалар; табылган глюкозаны спиртка
кадәр әчетәләр.
Этерификация реакциясе. Целлюлоза макромолекуласында һәр
элементар берәмлек C6HioO5 составында өч гидроксил төркеме бар:
[C6H7O9(OH)J яки
u о 7 2V 'i-*n
/ОН
(C6H7O2)-OH
4OH
130
Шуңа күрә, күпатомлы спирт буларак, целлюлоза катлаулы эфир¬
лар хасил итә, алар арасыннан целлюлоза ацетатлары зур практик
әһәмияткә ия. Алар целлюлозаны сульфат кислотасы тәэсирендә серкә
кислотасы белән эшкәрткәндә барлыкка киләләр:
z O - CO - CH3
(C H7O,) -O-CO-CH3
4 OH
целлюлоза диацетаты
O-CO- CH3'
(CftH7O,)-O-CO-CH3
у о / Zz J
4 O-CO-CH3
целлюлоза триацетаты
Целлюлоза ацетатларын янмый торган фото- һәм кинопленка, лак¬
лар һәм башка материаллар җитештерүдә, шулай ук ясалма ацетат сүс
табуда кулланалар.
Таркалу. Үзагачны һавасыз җылытканда целлюлоза таркалуы бара,
һәм агач күмере, метан, метанол, серкә кислотасы, ацетон, су һәм баш¬
ка матдәләр хасил була.
Целлюлоза, крахмал кебек үк, «көмеш көзге» реакциясен бирми.
Целлюлозаның табигатьтә очравы, биологик әһәмияте, табу һәм куллану
Крахмалга караганда целлюлоза табигатьтә тагын да киңрәк та¬
ралган. Ул үсемлекләрнең төзелеш материалы булып тора һәм алар-
да күзәнәк тышчаларын ясый. Мамык, җитен, киндер сүсләренең төп
өлеше целлюлозадан тора. Үзагачта аның масса өлеше якынча 50%,
үләндә һәм яшел яфракларда 25% ка кадәр. Целлюлоза, крахмал кебек
үк, яшел үсемлекләрдә фотосинтез процессында хасил була. Күпчелек
хайваннар һәм кеше организмында целлюлозаны гидролизлаштыруга
сәләтле ферментлар юк, шуңа күрә целлюлоза, крахмал һәм гликоген¬
нан аермалы буларак, организм тарафыннан үзләштерелми һәм азык
продукты була алмый.
Сәнәгатьтә целлюлозаны үзагачтан бүлеп чыгаралар. Саф диярлек
целлюлоза үрнәкләре булып табигый мамыктан алына торган мамык
һәм фильтр кәгазе тора.
Целлюлозаны төзелештә, агач эшендә һәм ягулык итеп (үзагач) кул¬
ланалар. Сүс материаллары рәвешендә (җитен, киндер, мамык) ул ма¬
мык һәм җитен тукымалар җитештерүгә бара. Целлюлоза - кәгазь һәм
картон, ясалма ефәк һәм терлек азыгы табу өчен чимал, шулай ук ул
глюкоза һәм этил спирты чималы буларак зур әһәмияткә ия.
131
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Ни өчен составында крахмал булган продуктларны югары тем¬
пературада әзерлиләр (бәрәңге һәм ипи пешерү)?
2. а) крахмал һәм целлюлоза макромолекулалары төзелешендәге
охшашлыкны; б) бу макромолекулалар төзелешендәге аермаларны
күрсәтегез.
3. Сахарозага, крахмалга һәм целлюлозага хас гомуми химик
үзлекне күрсәтегез. Җавапны реакция тигезләмәләре белән
дәлилләгез.
4. Әверелеш схемасына туры килгән реакция тигезләмәләрен
төзегез:
12 3 4
крахмал —> глюкоза —> этанол —»углерод (IV) оксиды —»глюкоза.
* 243 г крахмал алынган булса, өченче стадиядә хасил булучы
углерод (IV) оксидының микъдарын табыгыз.
§31
ЯСАЛМА ҺӘМ СИНТЕТИК СҮСЛӘР
Сүсләрне сәнәгатьтә һәм көндәлек тормышта киң кулланалар. Ал ар¬
дан кием-салым, арканнар, көнкүреш кирәк-ярагы һ.б. җитештерәләр.
Сүсләрне табигый (натураль) һәм химик төрләргә бүләләр (3 нче
схема).
3 нче схема
Сүсләрнең классларга бүленеше
132
Табигый (натураль) сүсләр үсемлекләрдән яки хайваннардан алы¬
на. Сезгә мамык, җитен, ефәк һәм йон сүсләр билгеле. Үсемлекләрдән
килеп чыгышлылары - целлюлозадан, хайваннардан килеп чыгышлы-
лары аксымнардан тора.
Халык саны арту һәм техника үсеше белән бергә сүсләргә дә ихтыяҗ
арта бара, шуңа күрә химик сүсләр җитештерү ихтыяҗы туа.
Химик сүсләрне химик ысуллар белән арзан чималдан табалар
(үзагач, нефть, табигый газ). Натураль сүсләр җитештерүгә караганда
химик сүсләр табуга киткән чыгымнар күп тапкыр кимрәк. Кулланы¬
ла торган чималга карап химик сүсләр ясалма һәм синтетик төрләргә
бүленәләр.
Ясалма сүсләрне табигый полимерлардан (гадәттә целлюлозадан)
химик эшкәртү юлы белән табалар. Ацетат һәм вискоза сүсләр ясалма
сүсләр арасыннан аеруча зур әһәмияткә ия.
Сүс ясау өчен целлюлозаның барлык макромолекулаларын да [
бер-берсенә карата параллель урнаштырырга кирәк. Ацетат сүс ■
җитештергәндә, молекулаларны хәрәкәтчән итәр өчен, целлюлозаны J
ацетатка әверелдерәләр, ә аны үз чиратында дихлорметан һәм эта- •
нол катнашмасында эретәләр. Шулай итеп, ацетат сүс целлюлозаның ।
катлаулы эфиры булып тора. Хасил булучы куе эремәне күп тишек- [
ле металл япкычлар - фильералар аша этеп чыгаралар (39 нчы рәс.). ■
Фильерадан агып чыгучы эремәнең нечкә агымын җылытылган һава J
белән эшкәртәләр. Эреткеч парга әверелә барган саен, нечкә озын ■
җепселләр формалаша. Башка химик сүсләрне дә шулай итеп табалар. ]
Макромолекулаларның тәртипле урнашуы җепселләрнең һәм алардан ■
хасил булган җепләрнең ныклыгы артуына китерә.
Кайнар су
Җылытылган
һава
Кайнар су
Эреткеч парлары
белән һава
катмашмасы
о $ Җсп
Целлюлоза диацетаты эремәсе
39 нчы рәсем. Ацетат сүсне фор¬
малау схемасы:
I - жеп эрләү эшләпәсе;
2 - фильера;
3 - шахта;
4 хасил булучы сүсләр бәйләме
133
Ацетат сүс бөгәрләнми, матур ялтырый, шуңа аны трикотаж
әйберләр, тукымалар (күлмәклек, эчлек, декоратив, мебель тукымалар)
җитештерүдә кулланалар. Ацетат сүснең кимчелеге - ышкылуга аз чы¬
дамлык һәм өстәвенә әле ул дымны мамык сүскә караганда начаррак
сеңдерә.
Вискоза сүс - химик эшкәртелгән целлюлоза. Аннан юка тукымалар
һәм трикотаж әйберләр җитештерүгә бара торган ясалма ефәк, авто-
һәм авиашиналар покрышкаларындагы каркас хезмәтен үти торган
корд тукымасы табалар.
Синтетик сүсләрне синтетик полимерлардан табалар. Күпсанлы
синтетик сүсләр арасыннан капрон һәм лавсанны карап үтик.
Капрон сүснең мөһим үзлекләре - механик яктан ныклылык, ышкы¬
луга (бу күрсәткеч буенча ул барлык төр сүсләрдән дә өстен тора) һәм
күп тапкыр деформацияләнүгә (бөгелүләргә) чыдамлылык, югары эла¬
стиклылык. Капроннан бик юка җеп алырга була, озынлыгы 9 км булган
бу җепнең авырлыгы бары тик 1 г булачак. Сүс дымны үзенә сеңдерми
(гигроскопик түгел), шуңа күрә ул юеш хәлдә үзенең ныклыгын югалт¬
мый, юганнан соң тиз кибә һәм элекке күренешен ала. Ләкин ул кис¬
лоталар эремәсенә һәм температурага чыдамсыз (җылытканда аның
ныклыгы кими, ә 215 oC та сүс эри), шуңа күрә капрон кием-салымны
кайнар үтүк белән үтүкләргә ярамый.
Капрон сүсне үтә нык автомобиль һәм авиацион корд, парашют ту¬
кымалары, арканнар, конвейер ленталары, ясалма мех җитештерүдә
кулланалар.
Лавсан нигезендә өс киеме тукымалары һәм трикотаж, коверлар,
тышлау материаллары, тюль һ.б. ясыйлар. Лавсан дым тартучан бул¬
маганга күрә, тукымалар җитештергәндә аны башка сүсләр катнашын¬
да кулланалар: лавсан - әйберләрнең ныклыгын һәм тузмаучанлыгын,
ә башка сүсләр гигиена таләпләренә туры килүен тәэмин итә. Лавсан
(яки лавсан катнаш) тукымалар бөгәрләнми диярлек. Лавсаннан ясал¬
ган техник җепне шиналар корды, балыкчы җәтмәләре, арканнар,
җилкән тукымалары һ.б. җитештерү өчен кулланалар.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Ясалма сүсләр синтетик сүсләрдән нәрсә белән аерылалар? Ми¬
саллар китерегез.
2. а) Йон тукыма мамык тукымадан; б) табигый сүсләр химик
сүсләрдән нәрсә белән аерылып торганнарын күрсәтегез.
134
Vll бүлек. Аминокислоталар. Аксымнар
§32
АМИНОКИСЛОТАЛАР
СОСТАВЫ, НОМЕНКЛАТУРАСЫ ҺӘМ ИЗОМЕРИЯСЕ
Аминокислоталар - составында ике функциональ төркем -
аминотөркем -NH2 һәм карбоксил төркеме -COOH булган органик
кушылмалар.
Аларны радикалындагы бер водород атомы аминотөркемгә алмаш¬
тырылган карбон кислоталары кушылмалары итеп карарга була (40
нчы рәс.). Чагыштырып карагыз:
CH3 - COOH
серкә кислотасы
H2N - CH2 - COOH
аминосеркә кислотасы (глицин)
Аминокислоталар атамаларын тиң¬
дәшле карбон кислоталарының атама¬
ларына «амино-» сүз өлеше кушып һәм
аминотөркемнең урнашкан урынын
күрсәтеп ясыйлар. Карбоксил төркеме
белән бәйләнгән углерод атомын а
хәрефе белән, ә калганнарын |3, ү, 8, е хәрефләре белән билгелиләр.
Күпчелек аминокислоталар тривиаль атамаларга ия. Мәсәлән:
P о
CH4-CH-COOH
3 I
NH2
а-аиииопропион кислотасы (аланин)
Практикада ешрак аминокислоталарның тривиаль атамаларын кул¬
ланалар.
Аеруча зур әһәмияткә а-аминокислоталар ия, чөнки алар аксым мо¬
лекулалары төзүдә катнашалар. а-Аминокислоталар составын гомуми
формула белән күрсәтергә була:
R-CH-COOH
NH2
135
Аминокислоталарга структур изомерия хас.
• Углерод скелеты изомериясе (H1NC3H6COOH тан башлап):
ү P “
CH1-CH -CH7-COOH
NH2
Р-аминомай кислотасы
• Аминотөркем торышына бәйле
башлап):
P а
CH1-CH -COOH
3 NH2
а-аминопропион кислотасы
ФИЗИК ҺӘМ ХИМИК ҮЗЛЕКЛӘРЕ
CH3
р al
CH1-C- COOH
3 I
NH2
а-амино-а-метилпропион кислотасы
изомерия (H2NC2H4COOH тан
P а
CH7 - CH7 - COOH
I 2 2
NH2
Р-аминопропион кислотасы
Аминокислоталар - төссез кристаллик матдәләр, суда яхшы эриләр.
Күпчелек кислоталарның тәме баллы.
Аминокислота молекулалары составына капма-каршы характердагы
ике функциональ төркем керә. Аминотөркем - аминокислоталарның
селтеле, ә карбоксил төркеме кислоталы үзлекләрен билгели. Шулай
итеп, алюминий, цинк гидроксидлары кебек неорганик матдәләргә
охшаш рәвештә, аминокислоталар органик амфотер кушылмалар бу¬
лып торалар.
H2N-R- COOH
нигез үзлекләре кислота үзлекләре
(амин үзлекләре) (карбон кислоталары үзлекләре)
Карбоксил төркеме катнашындагы реакцияләр
Кислота үзлекләрен күрсәтеп, аминокислоталар актив металлар,
металл оксидлары һәм гидроксидлары, көчсез һәм очучан кислота
тозлары белән, шулай ук спиртлар белән (этерификация реакциясе)
тәэсир итешәләр. Мәсәлән:
2H2N - CH2 - COOH + Na2CO3 -> 2H2N - CH2 - COONa + H2O + CO2T
аминосеркә кислотасының
натрий тозы
Г — -I Н\
H2N-CH2-CO ОН + ЬГО-С2Н5 H2N-CH2-C +H2O
O - C2H5
аминосеркә кислотасының этил эфиры
136
Аминотөркем катнашындагы реакцияләр
Нигезләр буларак аминокислоталар кислоталар белән реагирлашалар:
. г*"' 6*8
Nh2-CH2-COOH-I-HCI -» [H3N-CH2-COOH]+C1-
аминосеркә кислотасының гидрохлориды
(хлороводород тозы)
Аминокислоталарның аерым үзлекләре
Аминокислота молекуласында ике функциональ төркем булуы яңа
үзлекләр барлыкка китерә. Шулай итеп, аминокислота молекулалары
бер-берсе белән реакциягә керә алалар. Ул вакытта бер молекуланың
карбоксил төркеме белән икенче молекуланың аминотөркеме тәэсир
итешә. Реакция вакытында су молекуласы аерылып чыга һәм пептид
хасил була. Ике аминокислота молекуласы тәэсир итешкәндә дипеп-
тид барлыкка килә.
^O
H2N-CH2 -C _ jJh! NH - CH2-COOH
[он J
I I
-+H2N-CH2-C + H2O
NH1CH1 COOH
L--J 2
пептид (амид)
төркеме
Хасил булган дипептид составында аминотөркем һәм карбоксил
төркеме бар, шуңа күрә ул, өченче молекула белән тәэсир итешеп,
трипептид барлыкка кителә ала һәм шулай дәвам итә. Нәтиҗәдә по¬
липептид хасил була. -C' атомнар төркемен - пептид яки амид
NH-
төркеме, ә андагы углерод һәм азот арасындагы бәйләнешне пептид
(амид) бәйләнеш дип йөртәләр.
АМИНОКИСЛОТАЛАРНЫ ТАБУ
Биологик яктан әһәмиятле (табигый) булган а-аминокислоталарны
аксымнарны гидролизлап табалар (§ 33 кара).
а-Аминокислоталар табуның синтетик ысулларының берсе - тиңдәш¬
ле а-галогенкарбон кислоталардагы галоген атомын аминотөркемгә
алмаштыру:
137
а a
CH1 -CH- COOH <н“1 NH, + NH1 -» CH, -CH- COOH + NH Cl
2 _ __ —J 2 3 3 I 4
JCl I NH2
a - аминопропион кислотасы (аланин)
АМИНОКИСЛОТАЛАРНЫҢ ӘҺӘМИЯТЕ ҺӘМ КУЛЛАНЫШЫ
a-Аминокислоталарның биологик әһәмиятен аларның үсемлек
һәм хайван аксымнарын төзүче структур берәмлекләр («кирпечләр»)
булуы билгели. Организмга азык белән бергә кереп, аксымнар
a-аминокислоталарга кадәр таркалалар, ә аларны организм үз аксым¬
нарын синтезлау өчен куллана. Шуңа бәйле рәвештә аминокислота¬
ларны алмаштырыла торган һәм алмаштырылмый торган төрләргә
бүләләр.
Алмаштырыла торган аминокислоталар организмда синтезлана¬
лар. Мондыйларга глицин, аланин, глутамин кислотасы, серин, аспа¬
рагин кислотасы һ.б. керә.
Алмаштырылмый торган аминокислоталар организмда синтез¬
ланмый һәм азык белән бергә генә керә. Бу лизин, валин, трипто¬
фан, лейцин һ.б. Аларның азыкта җитеп бетмәве организмның күп
функцияләре бозылуына китерә һәм, ашауның җитәрлек калорияле
булуына да карамастан, ул организмның үсеп туктавына, ябыгуына
сәбәп булырга мөмкин.
Мәсәлән, кукуруз аксымы зеинда лизин юк. Азык белән бу бер
аксымны гына ала алмаган хайваннар, күп ашатуга да карамастан,
авырлыкларын югалталар. Ә азыкта триптофанның булмавы авыр күз
чире - катарактага сәбәп булырга мөмкин.
Җитеп бетмәгән аминокислоталарны кеше ризыгына һәм терлек
азыгына өстәргә кирәк. Организм аларны ирекле хәлдә үзләштерә
ала. Аларның кечкенә дозалары да терлекләрнең үсүен тизләтергә һәм
азыкның чыгымын киметергә ярдәм итә.
Кайбер аминокислоталарны дәвалау матдәләре итеп кулланалар,
мәсәлән, глутамин кислотасы - нерв чирләре вакытында, гистидин
ашказаны җәрәхәте белән авырганда дәвалый.
Аминокислоталар азык сәнәгатендә дә кулланыш таба. Мәсәлән,
глутамин кислотасын консервларга һәм азык концентратларына тәмне
яхшырту өчен өстиләр.
138
? СОРАУЛАР ҺӘМ БИРЕМНӘР
Q 1. Кайсы кушылманың составы аминокислоталарга туры килә:
a) C5H11N; б) C5H12O2; в) C5H10O2; г) C5H11O2N.
2. C4H9O2N составлы изомер аминокислоталарның структур фор-1
мулаларын төзегез һәм аларны атагыз.
3. а-Аминпропион кислотасының амфотер булуын дәлилләгез
(кимендә өч реакция тигезләмәсе языгыз).
§33
АКСЫМНАР
СОСТАВЫ ҺӘМ ТӨЗЕЛЕШЕ
Аксымнар - бер-берсе белән пептид (амид) бәйләнешләр аша то¬
ташкан а-аминокислота калдыкларыннан төзелгән табигый югары
молекуляр кушылмалар.
R, R,, R2- а-аминокислота радикаллары
Аксымнар үтә югары чагыштырма молекуляр массага ия: берничә
дистәләгән меңнән алып йөзләгән меңгә һәм берничә миллионга кадәр
дә булырга мөмкин.
Барлык табигый аксымнар да биш химик элементтан төзелгән: угле¬
род, водород, кислород, азот һәм күкерт. Калган элементлар арасын¬
нан фосфор, сирәгрәк тимер очрый. Химик составы буенча аксымнар¬
ны ике төркемгә бүләләр:
• протеиннар (гади) - гидролизлашып а-аминокислоталар гына ха¬
сил итүче аксымнар;
• протеидлар (катлаулы) - гидролизлашып аминокислоталардан
тыш башка компонентлар да (полисахаридлар, ортофосфат кислота¬
сы калдыклары, металл катионнары һ.б.) хасил итүче аксымнар.
һәр аксымның шәхси һәм даими төзелеше була*. Аксым
* Материал гомуми белем бирү дәрәҗәсендә укытылырга тиеш (атнага 2 сәг.), ләкин
чыгарылыш укучыларының әзерлек таләпләренә керми.
139
41 нче рәсем. Аксымның беренчел структурасы
молекуласының беренчел, икенчел, өченчел һәм дүртенчел структу¬
раларын аералар.
Беренчел структура — сызыкча полипептид чылбырда аминокисло¬
та калдыкларының билгеле бер чиратлашу эзлеклелеге (41 нче рәс.).
Чылбырдагы аминокислота калдыкларының чиратлашу эзлеклелеге
бозылу аксым үзлекләрен кискен үзгәртә. Мәсәлән, әгәр дә 574 ами¬
нокислота калдыгыннан торган гемоглобин молекуласында глутамин
кислотасы белән валинның гына булса да үзара урнашуы үзгәрсә, кеше
каты авыру була.
Икенчел структура - полипептид чылбыр¬
ның пространстводагы формасы. Аның бер ва¬
рианты - а-спираль, аны цилиндр өстенлеген
урап алучы тасма итеп күзалларга була (42 нче
рәс.). а-Спиральнең тотрыклылыгы төп чыл¬
бырдагы NH-төркеменең водород атомнары
һәм СО-төркеменең кислород атомнары ара¬
сында барлыкка килүче водород бәйләнешләре
белән тәэмин ителә.
Өченчел структура - пространствода
спиральгә чорналган полипептид чылбыр ха¬
сил итүче конфигурация. Спиральсыман чыл¬
быр йомгак булып төрелергә сәләтле (43 нче
рәс.). Аксымнарның өченчел структурасы
хасил булуы функциональ төркемнәрнең бер-
берсе белән тәэсир итешүенә бәйле. Мәсәлән,
карбоксил һәм гидроксил төркемнәре арасын¬
да - катлаулы эфир күпере, күкерт атомнары
арасында дисульфид күпере барлыкка килә.
42 нче рәсем. Аксымның
икенчел (спираль сыман)
структурасы
43 нче рәсем. Аксымның
өченчел структурасы
140
Аксымның өченчел структурасы ясалуда зур әһәмиятне водород
бәйләнешләр дә уйный. Шул сәбәпле аксымның өченчел структурасы
тотрыклылана.
Дүртенчел структура — бер-берсе
белән тоташкан аксым макромолекулала¬
ры. Алар комплекс хасил итәләр (44 нче
рәс.). Мәсәлән, гемоглобин дүрт макромо¬
лекуладан торган комплекстан гыйбарәт.
Нәкъ менә шундый структуралы булганда
гына гемоглобин организмда кислород¬
ны үзенә кушарга һәм күчерергә сәләтле.
Дүртенчел структура барлык аксымнарга
да хас түгел.
■
■
■
■
44 нче рәсем. Аксымның
дүртенчел структурасы
Аксымның өченчел структурасы (һәм, әгәр дә булса, дүртенчел
структура) аның үзенчәлекле үзлекләрен, физиологик активлыгын
билгели. Бу структураның бозылуы аксымның үзенчәлекле үзлекләре
югалуга китерә, мәсәлән, ферментларның каталитик активлыгы юкка
чыга.
ФИЗИК ҺӘМ ХИМИК ҮЗЛЕКЛӘРЕ
Агрегат халәте буенча каты, сыек яки ярым сыек (койка сыман) ак¬
сымнарны аералар. Суда эрүчәнлеге буенча аксымнарны эрүчән һәм
эремәүчән төрләргә бүләләр. Аларның кайберләре, мәсәлән, тавык
йомыркасы аксымы, суда коллоид эремә барлыкка китерә.
Аксымнар составында күптөрле функциональ төркемнәр булганга
күрә, аларны билгеле бер кушылмалар классына кертеп булмый. Ак¬
сымнар - органик матдәләр яшәешенең иң югары формасы.
Аксым молекулалары составында аминотөркемнәр һәм карбоксил
төркемнәре бар, шунлыктан алар, аминокислоталар шикелле үк, ам-
фотер үзлекләргә ия һәм кислоталар белән дә, нигезләр белән дә тоз¬
лар хасил итәләр.
Гидролиз. Аксымнарны кислота яки селте эремәсе белән
җылытканда пептид бәйләнешләр урыны буенча гидролиз процессы
күзәтелә (беренчел структура җимерелә). Гидролизның азаккы про¬
дукты булып а-аминокислоталар тора:
141
HO-H HO-H HO-H
Il Il I
NH1-CH-C-N-CH-C-N-CH-C - ...->
2i и I I и I I и
R1 0 H R2 O H R3 O
— NH1 -CH- COOH + NH -CH- COOH + NH1 -CH- COOH +...
2I 2I 2I
R1 R1 R3
Кеше һәм хайван организмында аксымнар гидролизы йомшаграк
шартларда - ферментлар (пепсин, трипсин һ.б.) тәэсирендә үтә.
Денатурация. Денатурация - аксымнарның икенчел һәм өченчел
структуралары таркалып, беренчел структурасы гына сакланып калу
(45 нче рәс.). Ул физик яки химик факторлар тәэсирендә бара (60-100
oC ка кадәр җылыту, радиация, авыр металл тозлары, кислоталар,
селтеләр тәэсире). Денатура¬
ция, мәсәлән, ит һәм йомырка
пешергәндә күзәтелә.
Көчле җылытканда, аксым¬
нар янган канат исе чыгарып
очучан продуктларга тарка¬
лалар. Бу үзлеккә таянып ак¬
сымнарны табалар, сүсләрнең
(йон, натураль ефәк) аксым¬
45 нче рәсем. Аксымның денатурация
процессы схемасы
нардан тору-тормавын билгелиләр.
Сыйфат реакцияләре. Биурет реакциясе - пептид төркемгә
-NH-CO- сыйфат реакциясе. Селтеле тирәлектә бакыр (II) тозлары
тәэсирендә аксым эремәсе зәңгәрсу-шәмәхә төс ала:
аксым эремәсе + NaOH + CuSO4 —» шәмәхә төс
Ксантопротеин реакциясе - составында ароматик аминокислота
калдыклары булган аксымнарга реакция. Андый аксым нитрат кис¬
лотасы белән тәэсир итеп сары төс бирә (нитрат кислотасының бен¬
зол боҗралар белән тәэсир итү продукты). Бу реакцияне нитрат кис¬
лотасы белән саксыз эш иткәндә кул тиресендә күзәтергә була:
аксым эремәсе + HNO3 —♦ сары төс
142
БИОЛОГИК ӘҺӘМИЯТЕ
Аксым - тереклекне йөртүче. Организмга мөһим булган процесслар¬
ны оештыруда башка матдәләр дә катнаша, ләкин аларның берсе дә
аксымнар белән үзләренең функция күптөрлелеге белән сынаша ал¬
мый. Аларның иң әһәмиятлесе - аксымнарның каталитик функция¬
се. Башка матдәләр (майлар, углеводлар һ.б.) катнашында организмда
барган барлык диярлек реакцияләр дә табигате буенча аксымнар бул¬
ган ферментлар тәэсирендә үтә. Шуңа күрә, углеводлар һәм майлар
бер-берсен алмаштыра алган кебек, аксымнарны алар белән алмаш¬
тырып булмый.
Аксымнар шулай ук:
• күзәнәктә төзелеш материалы (алардан терәк, мускул, өске кат¬
лам тукымалары төзелгән);
• транспортлаучы чара (мәсәлән, кан аксымы гемоглобин тукы¬
маларга кислород җиткерә, ә тукымалардан углерод (IV) оксидын
ала);
• инфекцияләрдән саклагыч (кайсыбер үзенчәлекле аксымнар -
антитәнчекләр - вирусларны, бактерияләрне, ят күзәнәкләрне зарар-
сызландырырга сәләтле);
• энергия чыганагы (1 г аксым оксидлашканда уртача 18 кДж энер¬
гия бүленеп чыга, бу сан буенча аксымнар углеводлардан һәм май¬
лардан күпкә калыша) булып торалар.
Аксымнар алмашу процессларын көйлиләр (мәсәлән, инсу¬
лин глюкоза алмашуын көйли); хәрәкәтләнү функциясен үтиләр
(мәсәлән, миозин - мускуллар аксымы); ә аксым-рецепторлар күрше
күзәнәкләрдән яки әйләнә-тирәлектән керүче сигналларны кабул
итәләр һәм күчерәләр.
Димәк, организм аксымнар ярдәме белән хәрәкәтләнергә, үсәргә,
ризык үзләштерергә, үрчергә, тыштан тәэсир итүгә җавап бирергә һ.б.
сәләтле. Шуңа күрә аксымнар һәр организмның яшәү өчен кирәкле
һәм туклануының мөһим компоненты булып торалар. Сау-сәламәт
кешегә аксымдагы көндәлек норма 100 г нан да ким булмаска тиеш.
Организмны аксым белән ит, балык, йомырка, эремчек һәм кузаклы
культуралар тәэмин итә. Ризыкта аксымнарның җитмәве чирләр ките¬
реп чыгарырга мөмкин, ә озак вакыт аксымсыз тору тулысынча арык¬
лануга һәм үлемгә китерә.
143
9 нчы лаборатор тәҗрибә
АКСЫМНАРГА СЫЙФАТ РЕАКЦИЯЛӘРЕ
1. Биурет реакциясе
Пробиркага 2-3 см3 аксым эремәсе (суда эретелгән тавык
йомыркасының аксымы) һәм шулкадәр үк 10% натрий гидроксиды
эремәсе салыгыз, яхшылап болгатыгыз, ә аннары берничә тамчы ба¬
кыр (II) сульфаты эремәсе өстәгез. Аксымның нинди төскә буялуын
билгеләгез.
2. Ксантопротеин реакциясе
Пробиркага 2-3 см3 аксым эремәсе салыгыз һәм саклык белән
берничә тамчы нитрат кислотасы өстәгез, шуннан соң катнашманы
җылытыгыз. Хасил булган утырымның төсен билгеләгез. Бу реакция
белән аксымнарда кайсы аминокислота калдыкларын табарга мөмкин
булуын күрсәтегез.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
Q 1. Барлык аксымнарга да хас булган үзлек:
а) эрүчәнлек һәм оешу;
б) амфотерлык һәм денатурация;
в) гидролиз һәм тозларда эрүчәнлек;
г) очучанлык һәм яну.
2. Ни өчен аксымлы азыкны озак вакытка майлар һәм углеводлар¬
дан гына торган туклануга алмаштырырга ярамый?
3. Ни өчен тән тиресе аңа куертылган нитрат кислотасы тигәндә
сары төскә керә?
4. Азыкларда, йон һәм ефәк тукымаларда аксым барлыгын дәлилләү
ысулын тәкъдим итегез.
144
IV. БИОЛОГИК АКТИВ МАТДӘЛӘР*
§34
ФЕРМЕНТЛАР. ВИТАМИННАР
Ферментлар (энзимнар) - биологик катализаторлар ролен үтәүче
аксымнар.
Tepe организмнарда бара торган барлык диярлек биохимик
реакцияләр дә каталитик реакцияләргә керәләр. Бу организмнарның
энергия һәм төзү материалы чыганагы буларак химик яктан чагыш¬
тырмача тотрыклы матдәләр алуы белән аңлатыла. Күзәнәкләрдә яхшы
балансланган ике процесс үтә:
• азык аксымнарының, углеводларның һәм майларның таркалуы;
• барлыкка килгән төзү материалларыннан организмга кирәк булган
кушылмалар синтезлану.
Ике процесс та бер-берсеннән башка була алмый.
Органик матдәләрнең таркалуы да, синтезлашуы да күзәнәктә гадәти
шартларда үтә: югары булмаган температура, нормаль басым, сыегай¬
тылган эремәләр, нейтральгә якын булган тирәлек һ.б. Бу шартларда
биохимик реакцияләр кирәкле (еш кына бик зур) тизлектә үтсен өчен
катализаторлар кирәк, мондый катализаторлар ролен ферментлар үти.
Ферментлар, башка катализаторлар кебек үк, катализның гомуми за¬
кончалыкларына буйсыналар:
• реакция юнәлешен үзгәртмиләр;
• тигезләнешне авыштырмыйлар, ләкин аңа ирешүне генә тиз¬
ләтәләр;
• химик әверелеш вакытында тотылмыйлар;
• реакциянең активлаштыру энергиясен киметәләр.
Биологик булмаган катализаторлардан ферментлар югарырак ката¬
литик активлыгы һәм үзенчәлекле тәэсире белән аерылып торалар.
Аларның һәрберсе билгеле бер реакцияне яки билгеле бер реакцияләр
төркемен катализлый.
’Материал профильле мәктәпләрнең (атнага бер сәгать) профильле булмаган сый¬
ныфларында да, гомуми мәктәпләрдә дә (атнага ике сәгать) өйрәнелергә мөмкин,
ләкин чыгарылыш сыйныф укучыларының әзерлек дәрәҗәсе таләпләренә керми.
145
Ферментларга тышкы шартлар (температура, pH, тирәлек составы һ.б.)
үзгәрүгә югары сизгерлек хас. Алар организм температурасында актив.
Түбәнрәк температурада аларның эшчәнлеге түбәнәя. Каты җылытканда
ферментлар, аксым матдәләр буларак, оешалар (денатурацияләнәләр)
һәм активлыкларын югалталар. Каталитик тәэсирне алар билгеле бер
pH күрсәткечтә күрсәтәләр. Шулай итеп, ашказаны согындагы пепсин
көчле әче тирәлектә (pH = 1,7), ә селәгәй ферменты птиалин нейтральгә
якын булган тирәлектә (pH = 6,8) актив.
Ферментатив процессларны элек-электән азык-төлек һәм җиңел
сәнәгатьтә (сырлар, чәй, тәмәке әзерләп чыгару, күн эшкәртү һ.б.),
шәраб ясауда, сыра кайнатуда һәм җитештерүнең башка тармакларын¬
да кулланганнар. Ферментлар шулай ук ипи пешергәндә камырда ба¬
ручы процессларны да көйлиләр. Алар медицинада кайбер чирләрне
терелтүдә кулланылалар, мәсәлән, плазмин ферменты - тамырлар тром¬
бозын дәвалауда, пепсин - ашказаны чирләре вакытында, рибонуклеаза
кайбер вирус инфекцияләре белән көрәшүдә актив. Аларны куллануның
мөһим юнәлеше - агынты суларын микробиологик юл белән чистарту.
Организмның ихтыяҗы аксымнар, майлар, углеводлар һәм тозлар
белән генә чикләнмәгәне билгеле. Организмга әле микроскопик микъ¬
дарда витаминнар да кирәк.
1880 елда ук рус тикшерүчесе Н.И.Лунин тәҗрибә үткәргән була. Ул
тычканнарны ике читлеккә аерып утырта һәм бер читлектәгеләрен - та¬
бигый сөт белән, калганнарын исә табигый сөт составына керүче казеин,
май, сөт шикәре һәм тозлардан әзерләнгән ясалма сөт белән тукланды¬
ра. Беренче читлектә тычканнар үзләрен яхшы хис итәләр, икенчесендә
бер-бер артлы үләләр. Тәҗрибәдән шул ачыклана: табигый сөттә бик аз
микъдарда тормыш өчен кирәк булган ниндидер билгесез матдәләр бар.
Бу мәгълүматны күп галимнәр раслый. 1912 елда поляк галиме К.Функ
әлеге матдәләрне витаминнар (лат. vita - тормыш) дип, ә алар булмаган-
лыктан барлыкка килгән чирләрне авитаминоз дип атый.
Витаминнар - тере организмнарда тормыш өчен әһәмиятле био¬
химик һәм физиологик процессларны үткәрү өчен кирәк булган төрле
химик табигатьле түбән молекуляр органик кушылмалар.
Төп туклыклы матдәләр белән чагыштырганда витаминнар ор¬
ганизмга аз микъдарда кирәк. Кешегә көненә кирәк булган теге яки
бу витаминның микъдары миллиграммнарда яки хәтта миллиграмм
өлешләрендә үлчәнә. Ләкин организмда витаминнар булмаганда авита¬
миноз белән бәйле авыр чирләр барлыкка килә: цинга, рахит, тавык су¬
кырлыгы, полиневрит һ.б.
146
Күбрәк гиповитаминоз - витамин җитешмәүчәнлек таралган. Әгәр
дә сез ангина белән чирлисез, һаман саен арыйсыз, кәефегез начар, эш
сәләтегез түбән, иммунитетыгыз көчсез икән - димәк, сездә витамин¬
нар дефициты.
Кеше һәм терлек организмы кайбер витаминнарны бөтенләй синтез¬
ламый, ә калганнарын аз микъдарда синтезлый, шуңа күрә витамин¬
нар Һичшиксез азык белән әзер килеш керергә тиеш. Витаминнарның
башлангыч чыганагы булып үсемлекләр тора. Кеше витаминнарны
үсемлек азыгы белән яки тереклек иткәндә үзләренә үсемлек матери¬
алларындагы витаминнарны җыйган хайван продуктлары аша ала.
Кагыйдә буларак, витаминнар агулы түгел, ләкин аларны тәкъдим
ителгән нормадан берничә тапкыр күбрәк кабул итү агуланулар ките¬
реп чыгара, ул гипервитаминоз дип атала. Бу яктан бигрәк тә A һәм D
витаминнары куркыныч.
Гадәттә витаминнарны латин алфавиты хәрефләре белән билгелиләр:
A, B, C һ.б. - яки аларга биологик әһәмиятен күрсәтүче атамалар тагалар.
Шулай итеп, E витаминын токоферол дип атыйлар (грек, токос - бала
табу, феро - йөртүче), һәрбер витамин организмда катгый бер химик
әверелешне катализлаучы ферментлар эшчәнлегенә этәргеч булып тора.
Витаминнарны ике класска бүләләр: суда эрүчэн һәм майда эрүчэн
(9 нчытабл.).
9 нчы таблица
Мөһим витаминнар һәм аларның биологик тәэсире
Витамин
Биологик тәэсире
Cvda эрүчэн витаминнар
Аскорбин
кислотасы,
C витамины
Антиоксидант. Tepe күзәнәктә оксидлашу-
кайтарылу процессларын катализлаучы ферментлар
эшчәнлегенә этәргеч булып тора. Аның җитмәве
цинга чирен китереп чыгара.
Биотин, H витамины
Күзәнәкләрнең бүленүенә булышучы фермент¬
лар составына керә. Витаминның җитмәве үсүнең
әкренәюенә, тире катлавы зарарлануга, чәчләр кое¬
луына китерә.
Фолий кислотасы,
Bj2 витамины
Пурин һәм пиримидин нигезләре, нуклеин кислота¬
лары синтезлануында катнаша. Аның җитмәве үсү
тоткарлануы, анемия китереп чыгара.
Майда эрүчэн витаминнар
Ретинол, A витамины
Организмның үсүе һәм үсеше өчен кирәк, күрү про¬
цессында катнаша. Аның җитмәве сукырлыкка, ябы¬
гуга китерә.
Кальциферол,
D2 витамины
Үсүче организмда фосфор һәм кальций алмашын
көйләүче ферментлар активлыгына тәэсир итә. Аның
җитмәве рахит белән чирләүгә китерә.
147
Кеше организмы өчен барлык витаминнар да кирәк, ләкин
кешеләрнең сәламәтлеге өчен кирәклеге буенча аерым урынны C ви¬
тамины (аскорбин кислотасы) алып тора. Беренче чиратта бу вита¬
мин — антиоксидант һәм башка антиоксидантлар белән берлектә,
мәсәлән, E һәм A витаминнары белән, безнең организмны оксидант-
лардан - күзәнәкләрне җимерүче кушылмалардан саклый. Күп чирләр
вакытында C витаминының уңай тәэсире аның шушы үзлеге белән
аңлатыла.
C витаминының җитмәве цинга китереп чыгара. Элек бу чир теләсә
нинди шартларда башланган, чөнки кешеләр тулы кыйммәтле азык
ала алмаган, аларның рационына җиләк-җимеш, яшелчә, яшеллек
кермәгән. Цинга-диңгез сәяхәтчеләренең юлдашы, сугыш вакытында
һәм армиядә, тыныч халык арасында гадәти күренеш булган. C витами¬
ны коллаген - безнең организмда тоташтыргыч тукыма ясаучы аксым
синтезлау өчен кирәк. Бу тукыма тешләрне уртта тотып тора, орган¬
нарны бер-берсе белән бәйли, кан тамырларын ныгыта. C витамины
булган продуктларны кабул итүне туктатсаң, тиздән тешләр селкенә
башлый, теш урты кабара һәм каный, тән тиресе кибә һәм анда кан
сауган урыннар барлыкка килә.
Грипп эпидемиясе вакытында көненә 200-250 мг C витамины кабул
итү чирләү ихтималын киметә. Болардан тыш C витаминын өстәмә
кабул итүче кешеләргә йөрәк һәм онкология авырулары, гипертония
чире килеп чыгу куркынычы азрак яный.
Кеше организмы C витаминын синтезламый, шуңа күрә сезнең
өстәлегездә һәрвакыт C витаминының бердәнбер чыганагы булган
яшелчә, җиләк-җимеш, яшеллек булырга тиеш.
Кайбер продуктларда (яшелчә, җиләк-җимеш, сөт һ.б.) витамин¬
нар микъдары ел фасылына карап үзгәрә, ә калган продуктларда ул
бик аз (ак ипи, макарон) яки бөтенләй юк (маргарин, шикәр). Шуңа
күрә кышын һәм иртә язын азык-төлек продуктларын витаминларга
һәм витаминнар кабул итәргә кирәк. Витаминнарны терлекчелектә
терлекләрнең продуктлылыгын арттыру өчен дә кулланалар.
Сәнәгатьтә кайбер витаминнарны (A, B, C, PP һ.б.) ясалма юл белән
табалар, кайберләрен табигый чыганаклардан бүлеп чыгаралар: D2 һәм
A - балык маеннан, E - үсемлек маеннан, C гөлҗимеш җимешеннән
алына.
148
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Ферментларны һәм витаминнарны чагыштырыгыз.
2. Төшенчәләрне аңлатыгыз: гиповитаминоз, авитаминоз һәм ги-
первитаминоз.
§35
ГОРМОННАР. ДАРУ ПРЕПАРАТЛАРЫ
Гормоннар — эчке секрет бизләре тарафыннан бүленеп чыгып, кеше
һәм хайван организмының меним функцияләрен - матдәләр алмашы,
үсү, җенси үсеш, үрчү Һ.б. җайга салучы органик матдәләр.
Кайбер гормоннарны бөер өсте бизләре кабыгы һәм җенес бизләре
бүлеп чыгара. Алар организмның үсүен һәм аның картаю процессларын
җайга салалар, үрчү һәм тормыш эшчәнлегенең башка функцияләрен
тәэмин итәләр. Мәсәлән, кортизон - бөер өсте бизенең кабык катламы
эшләп чыгарган 20 гормонның берсе, углеводлар алмашын җайга сала,
күп авыр чирләрне (ревматизм, бронхиаль астма, ялкынсыну процес¬
сы, аллергик чирләр) дәвалауда кулланыла.
Башка гормоннарны ашказаны асты бизе (инсулин, глюкагон) һәм
гипофиз (соматотропин - үсү гормоны, окситоцин, тиреотропин)
эшләп чыгара. Инсулин углеводлар алмашын җайлый (кандагы шикәр
микъдарын), глюкагон канда шикәр концентрациясен арттыра. Бу гор¬
моннарны диабеттан (инсулин), калкансыман биз чирләреннән (ти¬
реотропин), сөт бүлеп чыгаруны арттыру өчен (пролактин) һәм бала
табуны тизләтер өчен (окситоцин) кулланалар.
Калкансыман биз гормоны тироксин барлык төр матдәләр
алмашының да көчен арттыра. Бөер өсте бизенең ми матдәсе бүлеп
чыгарган гормон адреналин кан басымын арттыра, йөрәк тибешенең
ритмын ешайта.
Витаминнар һәм ферментлар шикелле үк, гормоннар аз гына
концентрацияләрдә югары физиологик активлык күрсәтәләр.
Гормоннарның җитмәве һәм артык булуы авыр чирләр китереп чыга¬
ра. Гормональ көйләү үзәк нерв системасы контроле астында тора.
Витаминнардан аермалы буларак, гормоннар организмга читгән
149
кермиләр, шуңа күрә кешенең һәм хайваннарның теге яки бу гормонга
ихтыяҗы тиңдәшле бизнең нормаль эшчәнлеге бозылган чакта гына
барлыкка килә.
Гормоннарны хәзерге медицинада дару препаратлары буларак кул¬
ланалар, аларның күпчелеген ясалма юл белән табалар.
Дару матдәләре (препаратлары) - дәвалау һәм чирләрне булдыр¬
мау өчен кулланыла торган кушылмалар.
Дару чараларын әле борынгы заманнарда ук куллана башлаганнар.
Ул чакта кешеләр чирләрдән терелү өчен үсемлекләр (төнәтмә, кайнат¬
ма һ.б. рәвешендә), киптерелгән бөҗәкләр, хайван органнары куллан¬
ганнар. Фәнни белемнәр үсеше белән табигый чыганаклардан аерым,
кирәкле дәрәҗәдә чиста матдәләр табалар, аларның тәэсире даими,
ал арны билгеле бер дозага бүләргә була һәм кулланырга да уңайлы.
Шулай итеп киң кулланыла торган алкалоидлар, гормоннар, витамин¬
нар һ.б. табылган.
Хәзерге заман медицинасында табигый кушылмалар белән беррәт-
тән ясалма дару препаратларын да киң кулланалар. Беренче ясал¬
ма дару матдәләре XIX гасырның соңгы чирегендә барлыкка килә.
Мәсәлән, 1887 елда температураны төшерә торган матдә фенацетин,
1896 елда - пирамидон, XX гасыр башында - веронал һ.б. табыла.
Химик-органиклар медиклар, микробиологлар һәм фармацевтлар
белән бергә бик күп табигый матдәләр арасында тиңдәшләре булмаган
ясалма препаратлар табалар.
Бүген медицина бик күп төрле дару матдәләре белән эш итә (12
меңнән артык).
Дару матдәләрен гадәттә организмга тәэсир итү характеры буенча
классларга бүләләр. Бер төр препаратлар микробларга каршы тәэсиргә
ия (мәсәлән, сульфаниламид препаратлары: ак стрептоцид, норсульфа¬
зол, фталазол, сульфадимезин һ.б.) һәм ангинаны, үпкә ялкынсынуын,
скарлатинаны һ.б. йогышлы авыруларны дәвалый. Башкалары авырту¬
ны басарга ярдәм итә (аспирин, парацетамол, анальгин). Йөрәккә һәм
кан тамырларына тәэсир итүче дарулар да бар (нитроглицерин, ана-
прилин, дибазол). Антигистамин (аллергик чирләрне терелтү өчен),
шешләргә каршы (яман шеш авыруларын терелтү өчен) һәм психо-
фармакологик (кешенең психик хәленә тәэсир итүче) препаратлар та¬
былган.
150
Дару препаратларын шулай ук сәбәпчел һәм симптоматик төрләргә
бүләләр. Беренчеләре турыдан-туры чирнең сәбәбенә тәэсир итәләр
һәм аны бетерәләр, мәсәлән, акрихин малярия чирен китереп чыга¬
ручыга каршы тора, яки йөрәк препаратлары авыру йөрәк муску¬
лына нормаль көчен кайтара. Икенче төркем препаратлары чирнең
сәбәбен түгел, чир китереп чыгарган нормадан тайпылышларны гына
бетерәләр. Мәсәлән, аспирин температураны төшерә, яки пирамидон
невралгик авыртуны бетерә һ.б.
Дару препаратларының тәэсир итү характеры нинди генә булмасын,
организм өчен алар ят һәм агулы, шуңа күрә аларны дөрес дозалау
мөһим.
Дару препаратларының саны бик күп, без медицина практикасында
еш кулланыла торган сульфамид препаратларын карап үтәрбез.
Препаратны сайлап алу аның фармакологик үзенчәлекләренә, шу¬
лай ук чир китереп чыгаручының табигатенә һәм чирнең үтүенә бәйле.
Препаратның органнар һәм тукымалар буенча бүленүе, ашказаны-эчәк
тракты белән сеңдерелүе, организмнан чыгу юллары һәм тизлеге ту¬
рындагы мәгълүматлар зур әһәмияткә ия.
Шулай итеп, стрептоцид, норсульфазол, сульфадимезин, этазол һәм
сульфадиметоксин чагыштырмача җиңел сеңдерелүе, канда һәм ор¬
ганнарда бактериостатик тәэсир өчен кирәкле концентрациядә тиз ту¬
планулары билгеләнгән. Шуңа күрә бу препаратларны төрле йогышлы
авыруларны дәвалаганда кулланалар. Фталазол, фтазин кебек башка
препаратлар кыен сеңдереләләр, эчәклекләрдә зур концентрацияләрдә
озак вакыт сакланалар, шуңа күрә аларны башлыча йогышлы
ашказаны-эчәк авырулары вакытында кулланалар.
Сеңдерелү һәм организмнан бүленеп чыгу тизлеге даруның доза¬
сын һәм кабул итү ешлыгын билгели. Шулай итеп, сульфамид препа¬
ратлары, мәсәлән, сульфадиметоксин организмда озак вакытка тоткар¬
ланалар, шуңа күрә аларны көнгә бер тапкыр гына кабул итү дә җитә.
Тәэсир итүче матдәнең химик үзлекләре дару препаратларын кабул
итү вакытына бәйле: ашауга кадәр яки ашаудан соң.
Төрле чирләрне дәвалау практикасында микроорганизмнарның теге
яки бу препаратка карата ияләшү (яраклашу) күренеше билгеләнә.
Әкренләп яңа токым микроорганизмнар барлыкка килә, аларга карата
гадәти дарулар инде тәэсир итми һәм чир дәвалауга кыенрак бирешә.
Шуңа күрә химия-фармацевтика сәнәгате үсешенең бер юнәлеше бу¬
лып дару препаратларын яңарту тора.
151
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Гормоннарны витаминнар белән чагыштырыгыз.
2. Ашказаны даруы салолның төзелеше:
OH
Физик үзлекләрен тасвирлагыз һәм бу кушылма нинди химик
реакцияләргә керә алуын күрсәтегез.
152
ПРАКТИК ЭШЛӘР
ХИМИК ЛАБОРАТОРИЯДӘ ЭШЛӘГӘНДӘ
КУРКЫНЫЧСЫЗЛЫК КАГЫЙДӘЛӘРЕ
Органик химиядән эшләр үткәргәндә, алдан өйрәнгән барлык кур¬
кынычсызлык кагыйдәләрен дә үтәргә кирәк. Болардан тыш барлык
диярлек органик матдәләр дә янучан, ә аларның парлары шартлау
куркынычы китереп чыгаруын истә тотарга кирәк. Күпчелек орга¬
ник матдәләрнең исе бар. Начар исле һәм яшь агызучан матдәләрне
махсус билгеләнгән бөкеле пыяла савытта тотарга кирәк. Агулы һәм
начар исле матдәләрне канализациягә агызу катгый тыела, һава
пычрануы янаган барлык эшләр дә суыру шкафында гына үткәрелергә
тиеш.
Истә тотыгыз: органик матдәләр белән эксперименталь эш термик
һәм химик пешүләр куркынычы тудыра, шуңа күрә практик эшләргә
бирелгән күрсәтмәләрне төгәл үтәргә кирәк.
Термик пешүләр гадәттә тиз кабынучан матдәләр яки югары тем¬
пературага кадәр җылытылган әйберләр белән белмичә яки саксыз
эш итү нәтиҗәсе булып торалар. (Җылыткыч приборлар һәм кайнар
савыт-саба белән эш итү кагыйдәләрен кабатлагыз.) Тагын да зуррак
нәтиҗәләргә органик матдәләрнең ялкынланып янып китүе сәбәп була:
чөнки ул вакытта пешү белән беррәттән ялкынланып янып киткән
матдә белән агуланырга мөмкин, ә килеп чыккан янгын зур материаль
югалтулар китереп чыгара ала. Шуңа күрә һәр эшләүче кеше кулла¬
ныла торган матдәләрнең кайсысы тиз янып китүчән икәнен һәм алар
ялкынланып янып китмәсен өчен нинди чаралар күрергә кирәклеген
белергә тиеш. Лабораториядә генә түгел, ә бәлки көндәлек тормышта
да очрый торган киң таралган тиз янып китүчән матдәләр - диэтил
эфиры, гексан, бензол, метил һәм этил спиртлары, ацетон.
Тиз кабып китүчән сыеклык булган савыт һичшиксез бөке белән
ябылырга (бик тыгыз итеп түгел), кабынган газ горелкасы һәм спир¬
товкадан ерак урында торырга тиеш. Тиз янып китүчән сыеклыклар¬
ны раковинага, чиләкләргә, чүп савытларына һәм урналарга түгү
катгый тыела. Тиз янып китүчән сыеклык булган ачык савыт янында
электроприборларны ток астындагы клеммаларга тоташтыру тыела,
чөнки электр очкыныннан янгын килеп чыгуы бар.
153
1 нче эш
ОРГАНИК МАТДӘЛӘРНЕҢ СЫЙФАТ
СОСТАВЫН БИЛГЕЛӘҮ
1 нче тәҗрибә. Углеродны һәм водородны сыйфатлы билгеләү
Органик кушылмада углерод һәм водород барлыгын аның оксидла¬
шу продуктлары аша билгеләргә була.
1. Спиртовка яки парафин шәм яндырыгыз. Ялкын өстендә 2-3 с
әйләндерелгән хәлдә коры стакан тотып торыгыз. Стакан ни өчен пар¬
ланды?
2. Стаканны кальций гидроксиды эремәсе (известьле су) белән чы¬
латыгыз һәм тагын шул хәлдә үк ялкын өстендә тотып торыгыз. Ста¬
кан кырыйларында ак таплар хасил булуының сәбәбен аңлатыгыз.
Реакция тигезләмәләрен языгыз.
Үткәрелгән тәҗрибәләр нигезендә янып беткән матдәнең сыйфат сос¬
тавы турында нәтиҗә ясагыз. Парафин составында 18 углерод атомлы
алкан булуын исәпкә алып, парафинның яну реакциясе тигезләмәсен язы¬
гыз.
2 нче тәҗрибә. Хлорны сыйфатлы билгеләү
Органик кушылмаларда хлор булуын билгеләү бакыр хлоридлары¬
ның ялкынны яшел төскә кертүенә нигезләнгән. Бакыр хлоридлары
үз чиратында составында хлор булган органик матдәләрнең таркалу
һәм янып бетү продуктлары бакыр (II) оксиды белән тәэсир иткәндә
барлыкка киләләр.
1. Тәҗрибәне үткәрү өчен, бакыр чыбыкның бер башын боҗра итеп
бәгегез, ә икенче башын бөкегә беркетегез (46 нчы рәс.). Бөкедән то¬
тып, боҗраны ялкында төсе үзгәреп туктаганчы кыздырыгыз. Суын¬
ган боҗраны тикшерелүче матдәнең, мәсәлән, тетрахлорметан яки
составында хлор булган башка органик
кушылманың бер өлешенә төшерегез. Ан¬
нары боҗраны тагын спиртовка ялкынына
кертегез. Ялкынның яшел төскә буялуын
күзәтегез.
2. Укытучыдан билгесез органик матдә¬
ләр белән өч пробирка алыгыз. Аларның
кайсысында хлорлы органик матдә булуын
билгеләгез.
46 нчы рәсем. Органик
матдәдә хлорны сыйфат
ягыннан танып белү
154
2 нче эш
КАРБОН КИСЛОТАЛАРЫ ҺӘМ АЛАРНЫҢ ТОЗЛАРЫ
/ нче тәҗрибә. Серкә кислотасы табу
47 нче рәсемдә күрсәтелгәнчә,
штативка беркетелгән пробиркага
3-4 г натрий ацетаты салыгыз һәм
2-3 см3 сульфат кислотасы эремәсе
өстәгез. Пробирканы газүткәргеч
көпшәле бөке белән ябып, көпшәнең
башын буш пробиркага төшерегез.
Матдәләр катнашмасын җыйгыч про¬
биркада 1-2 см3 кислота җыелганчы
җылытыгыз.
Серкә кислотасының физик
үзлекләрен билгеләгез. Реакция
тигезләмәсен төзегез.
47 нче рәсем. Серкә кислотасын табу
2 нче тәҗрибә. Серкә кислотасы үзлекләре
Табылган серкә кислотасын яртылаш су белән сыегайтыгыз һәм
дүрт пробиркага бүлегез. Беренче пробиркага 1-2 тамчы лакмус
эремәсе салыгыз (индикаторның төсен билгеләгез), аннары кисло¬
таны селте эремәсе белән нейтральләштерегез. Икенче пробирка¬
га - бераз гына магний порошогы, өченчесенә - бакыр (II) оксиды, ә
дүртенчесенә натрий карбонаты өстәгез.
Үткәрелгән реакцияләрнең тулы һәм кыскартылган ион-молекуляр
тигезләмәләрен төзегез. Нәтиҗә ясагыз.
3 нче тәҗрибә. Натрий ацетатының гидролизы
Пробиркага 1-2 см3 дистиллят су салыгыз, аңа 1-2 тамчы фенол¬
фталеин эремәсе, ә аннары 1-2 натрий ацетаты кристаллары өстәгез.
Тоз тизрәк эресен өчен эремәне селкетегез.
Фенолфталеинның төсе үзгәрү буенча натрий ацетаты эремәсен¬
дәге тирәлек реакциясе турында нәтиҗә ясагыз.
Бу тоз гидролизының кыскартылган ион-молекуляр һәм молекуляр
тигезләмәләрен языгыз.
155
3 нче эш
УГЛЕВОДЛАР
I нче тәҗрибә. Глюкозаның бакыр (II) гидроксиды белән тәэсир
итешүе
1. Пробиркага 2 см3 натрий гидроксиды салыгыз һәм өч тамчыдан
да күп булмаган бакыр (II) сульфаты эремәсе өстәгез. Яңа әзерләнгән
бакыр (II) гидроксидына 1 см3 глюкоза өстәгез. Катнашманы селкетеп
алыгыз. Сез нәрсә күзәтәсез? Бу тәҗрибә нәрсә дәлилли? Шундый ук
реакциягә тагын нинди кушылмалар керә?
2. Пробирканы җылытыгыз. Сез нинди үзгәрешләр күзәтәсез? Алар
нәрсәне дәлиллиләр? Бакыр (II) гидроксиды белән җылытканда нинди
матдәләр үзләрен шулай ук тоталар?
Җылытканда глюкозаның бакыр (II) гидроксиды белән реагирлашу
тигезләмәсен төзегез. Глюкозаның төзелеше турында нәтиҗә ясагыз.
2 нче тәҗрибә. Крахмалга сыйфат реакциясе
1. 0,5-1 см3 крахмал клейстерына бер тамчы йодның спирттагы
эремәсен кушыгыз. Сез нәрсә күзәтәсез?
2. Табылган крахмал клейстеры белән йод катнашмасын җылытыгыз.
Нинди үзгәрешләр бара? Суытканда эремә элеккеге төсенә кайтамы?
Күзәтелгән күренешне аңлатыгыз.
3. Ипи кисәгенә һәм бәрәңге бүлбесе кисеменә берничә тамчы
йодның спирттагы эремәсен тамызыгыз. Сез нәрсә күзәтәсез?
3 нче тәҗрибә. Крахмал гидролизы
1. Пробиркада крахмал клейстерын яңа әзерләнгән бакыр (II) ги¬
дроксиды белән җылытыгыз. Бакыр (II) гидроксиды крахмал белән
кайтарыламы?
2. 2-3 см3 крахмал клейстерына 0,5 см3 сульфат кислотасы эремәсе
кушып, катнашманы болгата-болгата 2-3 минут кайнатыгыз. Пробир¬
каны суытыгыз һәм ике өлешкә бүлегез.
Беренче өлешкә 2-3 тамчы йод эремәсе кушыгыз. Зәңгәр төс бар¬
лыкка киләме?
Икенче өлешне гидролиз процессында глюкоза хасил булуын
дәлилләү өчен кулланыгыз.
Күзәтелүче күренешләрне аңлатыгыз һәм химик реакцияләрнең
тигезләмәләрен төзегез.
156
4 нче эш
ЭКСПЕРИМЕНТАЛЬ МӘСЬӘЛӘЛӘР ЧИШҮ
1 нче бирем, а) этил спирты; б) глицерин эремәсе; в) серкә кисло¬
тасы; г) натрий ацетаты эремәсе белән пробиркалар бирелгән. Химик
ысул белән күрсәтелгән һәр матдәне дә ачыклагыз.
2 нче бирем. Җитешкән җимешләрдә глюкоза барлыгын тәҗрибә
белән дәлилләгез.
3 нче бирем. Чи бәрәңгедә, ак ипидә, ярмаларда (дөге, манный ярма¬
сы) крахмал бар икәнен тәҗрибә юлы белән дәлилләгез.
4 нче бирем. Бал составына глюкоза һәм фруктоза керә. Бал
эремәсендә глюкоза барлыгын дәлилләгез.
5 нче бирем. Дүрт пробиркада крахмал, сахароза, глюкоза һәм
глицерин эремәләре бирелгән. Сыйфат реакцияләре аша матдәләрне
ачыклагыз.
6 нчы бирем. Ике пробиркада аксым һәм глюкоза эремәләре
бирелгән, өченчесендә - үсемлек мае. Химик ысул белән күрсәтелгән
һәр матдәне дә ачыклагыз.
7 нче бирем. Этанолдан чыгып, күрсәтелгән матдәләрнең берсен
табыгыз: а) катлаулы эфир; б) этилен; в) ацетальдегид. Хасил булган
матдәләрнең бар икәнлеген ничек билгеләвегезне күрсәтегез.
Химик реакция тигезләмәләрен төзегез, аларның үтү шартларын
күрсәтегез.
5 нче эш
СҮСЛӘР ҺӘМ ПОЛИМЕРЛАР
/ нче тәҗрибә. Синтетик сүсләрнең үзлекләрен өйрәнү
1. Капрон сүс үрнәген (капроннан булган әйберне) кыскыч белән то¬
тып, спиртовка ялкынына кертегез, аннары дымлы кызыл лакмус кә¬
газен газ чыгу юлына китерегез. Лакмус кәгазенең төсен билгеләгез.
2. Кечкенә капрон сүс кисәген фарфор савытка салып җылытыгыз.
Сүс эреп беткәч, аңа пыяла таяк белән кагылыгыз һәм аны кырыйга
алып, юка капрон җеп сузыгыз. Тәҗрибәне берничә тапкыр кабатла¬
гыз. Бу тәҗрибәдә полимерның нинди үзлеге күзәтелде?
3. Дүрт пробиркага капрон сүс кисәкләре салыгыз. Беренче про-
157
биркага - нитрат кислотасы, икенчесенә - сульфат кислотасы, өчен¬
чесенә - натрий гидроксиды, дүртенчесенә ацетон агызыгыз. Пробир¬
каларны сак кына селкетеп алыгыз. Сез нәрсә күзәтәсез?
Капронның төрле матдәләргә карата тәэсире турында нәтиҗә ясагыз.
2 нче тәҗрибә. Сүсләрне танып белү
Сезгә номерланган пакетларда сүс үрнәкләре бирелгән.
Кушымтаның 10 нчы таблицасында китерелгән мәгълүматларны кул¬
ланып, һәр пакетта нәрсә икәнен билгеләгез.
Сүсләрне анализлау эзлеклелеге
1. Сүсләрне танып белүне яндырып караудан башлагыз, аны берничә
тапкыр кабатлагыз. Шул вакытта:
а) яну нинди тизлек белән баруын күзәтегез;
б) яну продуктларының исен билгеләгез;
в) яну калдыгының характерын билгеләгез.
Бу тәҗрибә белән сез сүснең билгеле бер төркемгә керүен
билгеләрсез: целлюлоза, аксым, синтетик.
2. Яну яки таркалу продуктларының индикаторга тәэсирен
билгеләгез.
3. Сүснең кислоталарга, селтеләргә һәм ацетонга тәэсирен тикше¬
регез.
3 нче тәҗрибә. Полиэтиленның үзлекләре
1. Полиэтиленның (полиэтилен бөке, капкач һ.б.) физик үзлекләрен
тикшерегез: а) тышкы күренеше; б) тыгызлыгы (судан җиңелрәк яки
авыррак); в) органик эреткечләрнең тәэсире; г) җылытуга тәэсире.
Эретелмәне җеп итеп сузып буламы икәнен билгеләгез.
2. Полиэтиленның химик үзлекләрен тикшерегез: а) спиртовка ял¬
кынында үзен тотышы (янучанлык, ялкын төсе, янганда корым хасил
буламы, ялкыннан алгач януын дәвам итәме, яну продуктларының исе
бармы); б) кислота һәм селте эремәләренә карата чыдамлыгы.
Үткәрелгән тәҗрибәләр нигезендә полиэтиленның физик һәм химик
үзлекләре турында нәтиҗә ясагыз.
4 нче тәҗрибә. Полимерларны танып белү
Төрле номерлар сугылган пакетларда полимер үрнәкләре бирелгән.
Кушымтаның 11 нче таблицасында китерелгән мәгълүматларны кул¬
ланып, һәр пакетта нәрсә барлыгын билгеләгез.
158
КУШЫМТАЛАР
10 нчы таблица
Сүсләрне танып белү
Сүсләргә гадәти шартларда кислоталар һәм
селтеләр тәэсире
NaOH (10%)
Табигый (натураль) сүсләр
Бүртә, ләкин
эреми
Таркалалар
H1SOj
2 4
(р = 1,84 г/см3)
Эри
Таркалалар
S
” -У
о
X *“
Il
а.
Эри, төссез
эремә хасил
була
Бүртәләр һәм
сары төскә
керәләр
Таркалу яки яну
продуктларының
индикаторларга
тәэсире
Дымлы лакмус
кәгазен кызыл
төскә кертә
Дымлы лакмус
кәгазен кызыл
төскә кертә
Яну характеры
Тиз яна, кызган
кәгазь исе чыга.
Соры көл кала
Әкрен яна,
көйгән чәч
исе чыга. Kapa
төстәге уалучан
шарчык ясала,
уганда поро¬
шокка әверелә
Сүснен атамасы,
составы
Мамык сүс
(мамык тукыма)
[CaHhiO,]
L 6 10 5j/j
Йон, ефәк сүсләр
Аксымнардан торалар,
аксым молекулалары
пептид бәйләнешләр
-CO-NH- белән
бәйләнгән аминокис¬
лота калдыкларыннан
ясала
159
Таблицаның ахыры
Сүсләргә гадәти шартларда кислоталар һәм
селтеләр тәэсире
NaOH (10%)
U
I
Бик нык бүртә
һәм эри
Сабынлана,
саргылт төскә
керә һәм эри
Синтетик сүсләр
Эреми
H2SO4
(р = 1,84 г/см3)
Эри, кызгылт-
көрән эремә
хасил була
Эри
Эри, төссез
эремә хасил
була
S
O >-
Z ч
Я
Il
о.
S-Z
Эри, төссез
эремә хасил
була
Эри, төссез
эремә хасил
була
Эри, төссез
эремә хасил
була
Таркалу яки яну
продуктларының
индикаторларга
тәэсире
Дымлы лакмус
кәгазен кызыл
төскә кертә
Дымлы лакмус
кәгазен кызыл
төскә кертә
Дымлы лакмус
кәгазен кызыл
төскә кертә
Яну характеры
Тиз яна, кызган
кәгазь исе чыга.
Көл эзе кала
Тиз яна, карасу
көрән төстәге
уалучан шар¬
чык хасил була.
Ялкыннан алгач
янмый
Җылытканда
эри. Карасу
төстәге ялты¬
равыклы каты
шарчык хасил
була. Янганда
начар ис чыга
Сүснең атамасы,
составы
Вискоз сүс
uOlO 5-*л
Ацетат сүс
OCOCH3'
(C,H7O7) - OCOCH,
xOzZ-' 3
х OCOCH,
3 п
Капрон
H O '
[-N-(CH2)5-C-„
160
»
s
S
з-
г
Полимерларны танып белү
Таркалу яки яну
продуктларынын ин¬
дикаторларга яки баш¬
ка матдәләргә тәэсире
Бромлы суны
төссезләндерми
Дымлы лакмус кәгазен
кызыл төскә кептә.
AgNO3 эремәсе белән ак
утырым бирә
Таркалу продуктлары
тикшерелми
Яну характеры
Зәңгәр ялкын булып
яна, янган шәм исе та¬
рата. Ялкыннан алгач
та яна
Корымлы ялкын бу¬
лып яна, хлороводо¬
род бүлеп чыгара. Ял¬
кыннан алгач янмый
Кыен янып китә. Фе¬
нол исе чыга, ялкын¬
нан алгач әкренләп
сүнә
Җылытуга
тәэсире
Йомшара, эре-
телмәдән җеп итеп
сузып була
Тиз йомшара
Каты җылытканда
таркала
Тышкы
билгеләре
Үтә күренмәле,
эластик, тотып ка¬
рауга майлы
Чагыштырмача
җиңел, температу¬
раны киметкәндә
каты һәм уалу-
чанга әйләнә, төсе
төрлечә
Каты, уалучан.
Көрән төстән
алып карага кадәр
караңгы төстә
Полимернын
атамасы, составы
Полиэтилен
[-CH2-CH2-In
ид
п
Поливинилхлорид
-CH-CH- ■
' Cl
п
Фенол-формалъдег
сумаласы
OH
Н^^ү^Ъ
H
161
12 нче таблица
Органик матдәләргә сыйфат реакцияләре*
Матдәләр
Реагентлар
Күзәтелүче билгеләр
Углерод атом¬
нары арасында
л-бәйләнеш булган
органик матдәләр
(алкеннар, алкадиен-
нар һәм алкиннар)
Br2 (бромлы су)
Төссезләнү
Спиртлар:
бератомлы
күпатомлы
CuO (CuO белән
капланган кыздырыл¬
ган бакыр чыбык)
Cu(OH)2
(яна әзерләнгән)
Бакыр сыман (Cu) ялтырау
һәм альдегид исе
Сыек зәңгәр эремә
Фенол
Br2 (бромлы су)
2,4,6-трибромфенолның
ак утырымы
Альдегидлар
Ag2O (NH3 ■ H2O)
Cu(OH)2
(яңа әзерләнгән)
«Көмеш көзге» реакциясе
(җылытканда)
Cu2O кызыл утырымы
(җылытканда)
Карбон кислоталары
Индикатор (лакмус)
Na2CO3 (эремә)
Ал төстәге эремә
CO2 бүленеп чыгу
Серкә кислотасы
—
Серкә исе
Кырмыска
кислотасы
Ag2O (NH3 ■ H2O)
«Көмеш көзге» реакциясе
(җылытканда)
Олеин кислотасы
Br2 (бромлы су)
Төссезләнү
Сабын эремәсе
Кислота эремәләре
Кислоталарның ак төстәге
мамыксыман утырымнары
* Реакция тигезләмәләрен китап бүлекләреннән карагыз.
162
Таблицаның ахыры
Матдәләр
Реагентлар
Күзәтелүче билгеләр
Углеводлар:
глюкоза
Ag2O (NH3 H2O)
«Көмеш көзге» реакциясе
(җылытканда)
Cu(OH)2 (яңа әзерләнгән)
1. Суыкта сыек зәңгәр эремә
бирә.
2. Җылытканда Cu2O кызыл
утырымын бирә
фруктоза
Ag2O (NH3 • H2O)
Реагирлашмый
Cu(OH)2 (яңа әзерләнгән)
Сыек зәңгәр эремә, җылыт¬
канда үзгәрми
сахароза
Ag2O (NH3 • H2O)
Реагирлашмый
Кислота эремәсе
Гидролиз процессында ха¬
сил булучы глюкоза «көмеш
көзге» реакциясен бирә
(җылытканда)
крахмал
I2 (эремә)
Зәңгәр төс
•Аксым
Cu(OH)2 селтеле тирәлектә
Шәмәхә төс
HNO3 (эремә)
Сары төс
163
Җаваплар
§ 1. 5. 132 г.
§3. LC7Hft. 2. C1H7Cl. 3. CftHld. 4. C1HliO.
§ 4- 2.6 4.6. 5.160 л. 6. C4H1,
§ 5. 4. г.
§6. 4. C8H18. 6. 37321 кДж.
§7. 5. 12600 кДж. 6. C1H6.
§ 8. 5. 185 л. 6. C(C2H4) = 6,22 л, V (HCl) = 6,22 л. 7. C3H6.
§ 9. 5. 460 см3.
§ 10. 6. 1008 л. 7.148,5 г.
§П. 2. C4H8.
§ 12. 3. 162,5 см3. 4.52,2 г.
§15.2 .6. 3. C5H11OH.
§ 16. 4. 70%.
§17. 1.11,5 г. 2.675 г.
§ 19. 3. 5,8 г.
§ 20. 2. 6. 5. C4H9NH2.
§21. 2. 18,37%.
§ 22. 2. 88%. 4.23,1%
§23. 3. 81,97 см3.
§ 24. 2. 35,3 см3. 3. HCOOH - кырмыска кислотасы,
w(HCOOH)= 23 г. 4. 270 г.
§25. 1.59,2 г. 2.51,8 г. 3.66 г.
§26. 3. 10,08 л.
§ 27. 3. 927,1 кг.
§ 28. 3. а. 4. 9%.
§ 30. 4. 6 моль.
164
Атамалар күрсәткече
A
Глицерин 83
Аксымнар 139
Глюкоза 122
Аксымнарның денату-
Гомологлар 20
рациясе 142
Гомологик аерымлык 20
Алкадиеннар 49
Гомологик рәт 20
Алканнар 28
Гормоннар 149
Алкеннар 38
Гудрон 70
Алкиннар 54
д
Альдегидлар 92
Дару матдәләре 150
Аминотөркем 73, 89
Дегидрирлау 34
Аминокислоталар 135
Детонация ныклыгы 70
Аминнар 88
Дивинил 49
Ареннар 61
Дисахаридлар 126
Ароматик углеводо-
И
родлар 61
Изобутан 12
Ацетальдегид 93
Изомерия 12
Ацетилен 54
- структур 21
Ә
Изомерлар 12
Әчү 124
Изооктан 70
Б
Изопрен 49
Бензол 61
K
Бутадиен-1,3 50
Капрон 134
B
Карбон кислоталары 98
Вазелин 70
Катлаулы эфирлар 102
Витаминнар 145
Каучуклар 50
Вулканизация 51
- табигый
Г
- синтетик
Газойль 70
Керосин 69
Гидрирлау 45
Кислоталар
Гидрогалогенлау 46
-аминосеркә 135
Гидрогенлаштыру 114
- аскорбин 148
Гликоген 129
— бутан 99
- карбол 86
- кырмыска 99
- линол 115
-линолен 113
- май 99
- метан 99
- олеин 113
- пальмитин 113
- серкә 99
- сөт 124
- стеарин 113
-хлорсеркә 106
— этан 99
Клетчатка 130
Коллаген 148
Крахмал 128
Крекинг 71
Кудыру 69
Л
Лавсан 134
Лигроин 69
M
Мазут 70
Майлар 112
Майонез 116
Маргарин 116
Метан 19
Метаналь 93
Метанол 74
Моносахаридлар 122
165
H
Нефть 68
Нитробензол 64
Нитролаштыру 64
О
Озокерит 36
Октан саны 70
П
Парафин 70
Пептид 137
Пептид бәйләнеш 137
Пиролиз 72
Полимерлашу 46
Полисахаридлар 127
Поливинилхлорид 58
Полиэтилен 46
P
Реакция
- аерылу 44
- алмаштыру 31
- әчү 124
- биурет 142
- галогенлау 31
- гидратлау 46
- гидрогалогенлау 46
- гидрогенлау 114
- дегидрирлау 34
- дегидратлашу 78
- изомерлашу 34
- «көмеш көзге» 95
- ксантопротеин 142
- Кучеров 58
- нитролаштыру 64
- полимерлашу 46
— этерификация 77
Резина 51
Ректификация 69
C
Сабыннар 114
Сабынлау ПО
Саломас 115
Сахароза 126
Спирт(лар)
- агач 81
— күпатомлы 83
- метил 74
— чикле бератомлы 74
- шәраб 82
- этил 74
Сүс(ләр)
- ацетат 133
- вискоза 134
-табигый 133
— синтетик 134
- химик 133
- ясалма 133
T
Трихлорметан 32
Туендырылган углево¬
дородлар 31
Төркемнәр
- альдегид 92
- гидроксил 74
- карбоксил 98
- функциональ 73
У
Углеводород радика¬
лы 21
Углеводородлар
- ароматик 61
— диен 49
- туендырылган 31
- туендырылмаган 38
- чикле 19
- чиксез 38
Углеводлар 121
Үсемлек майлары 113
Ф
Фенол(лар) 86
Ферментлар 145
Формалин 96
Формальдегид 94
Фотосинтез 124
Фреоннар 35
Фруктоза 125
X
Хлороформ 32
H
Целлюлоза 130
Целлюлоза ацетаты 131
Циклоалканнар 59
Циклопарафиннар 59
Ч
Чикле углеводород¬
лар 19
Э
Эластиклык 51
Этаналь 92
Этанол 74
Этерификация 77
Этиленгликоль 83
Этин 54
Эфир(лар)
- гади 78
- диэтил 78
- катлаулы 102
166
Эчтәлек
Дәреслек белән ничек эшләргә 3
Органик химиягә кереш
§ 1. Органик химия предметы. Органик кушылмалар һәм аларның
реакцияләре үзенчәлекләре 5
§ 2. Органик кушылмалар төзелеше теориясе 8
§ 3. Химик формулаларны чыгару. 13
I. УГЛЕВОДОРОДЛАР
I бүлек. Чикле углеводородлар
§ 4. Алканнарның гомологик рәте, номенклатурасы һәм изомериясе 19
§ 5. Метан молекуласының электрон һәм пространстволы төзелеше 26
§ 6. Алканнарның үзлекләре һәм аларны куллану. 29
II бүлек. Чиксез углеводородлар
§ 7. Алкеннар. Гомологик рәт, номенклатура һәм изомериясе. Этилен
молекуласының төзелеше 37
§ 8. Алкеннарны табу, аларның үзлекләре һәм куллану. 42
§ 9. Алкадиеннар. Натураль һәм синтетик каучуклар 47
§ 10. Алкиннар 52
III бүлек. Циклик углеводородлар
§11. Циклоалканнар (циклопарафиннар) 59
§ 12. Ароматик углеводородлар (ареннар) 61
§ 13. Углеводородлар арасында генетик бәйләнеш 66
§ 14. Углеводородларның табигый чыганаклары 67
П. УГЛЕВОДОРОДЛАРНЫҢ ФУНКЦИОНАЛЬ КУШЫЛМАЛАРЫ
IV бүлек. Спиртлар. Феноллар. Аминнар
§ 15. Чикле бератомлы спиртлар 74
§ 16. Чикле бератомлы спиртларның химик үзлекләре 77
§ 17. Чикле бератомлы спиртларны табу һәм куллану. 81
§ 18. Күпатомлы спиртлар 83
§ 19. Феноллар 86
§ 20. Аминнар 88
167
V бүлек. Альдегидлар. Карбон кислоталары һәм аларның кушылмалары
§21. Альдегидларның номенклатурасы һәм молекулалары төзелеше 92
§ 22. Альдегидларны табу, куллану һәм аларның үзлекләре 94
§ 23. Карбон кислоталары һәм аларның кушылмалары 98
§ 24. Карбон кислоталарын табу һәм куллану. 105
§ 25. Карбон кислоталарының катлаулы эфирлары 108
§26. Майлар 112
§ 27. Сабыннар һәм синтетик юу чаралары 117
III. ПОЛИФУНКЦИОНАЛЬ КУШЫЛМАЛАР
VI бүлек. Углеводлар
§ 28. Моносахаридлар 122
§ 29. Дисахаридлар 126
§ 30. Полисахаридлар 127
§31. Ясалма һәм синтетик сүсләр 132
VII бүлек. Аминокислоталар. Аксымнар
§ 32. Аминокислоталар 135
§ 33. Аксымнар 139
IV. БИОЛОГИК АКТИВ МАТДӘЛӘР
§ 34. Ферментлар. Витаминнар 145
§ 35. Гормоннар. Дару препаратлары 149
Практик эшләр 153
Кушымталар 159
Җаваплар 164
Атамалар күрсәткече 165
168
ОРГАНИК КУШЫЛМАЛАРНЫҢ ИҢ ӘҺӘМИЯТЛЕ; КЛАССЛАРЫ АРАСЫНДА ГЕНЕТИК БӘЙЛӘНЕШ
Г1
Дәреслек химия буенча урта (тулы) гомуми белем бирү
стандартының база дәрәҗәсенә нигезләнеп иҗат ителгән.
Дәреслек профильле мәктәпләрнең профильсез сыйныфлары
өчен (атнага бер сәгать) һәм гомуми белем бирү мәктәпләре
өчен (атнага ике сәгать) кирәкле материалны үз эченә алган.
Россия Федерациясенең Мәгариф һәм фән министрлыгы
тарафыннан тәкъдим ителгән Федераль дәреслекләр
исемлегенә керә.