Текст
H C әхмәтов
НЕОРГАНИК
ХИМИЯ
8-9 НЕОРГАНИК ХИМИЯ
ХИМИК ЭЛЕМЕНТЛАРНЫҢ Д. И. Ml НДЕЛЕЕВ ПЕРИОДИК СИСТЕМАСЫ
Ht Рио
РЯДЫ
Г* в*
'У'
П Il
ы
э
JI E
IVf
E H
T
О о
ды
I
Il
Ill
IV
V
Vl
Vll
Vlll
1
1
H ’
ВОДОРОД
1.00794
(H)
2 Не
ГЕЛИЙ
4,00260
2
2
Li 3
литий
6,941
Be 4
БЕРИЛЛИИ
9,01218
5 В
БОР
10.81
6 C
УГЛЕРОД
12.011
7
14,004
N
АЗОТ
8 О
КИСЛОРОД
15,9994
9 F
ФТОР
18.998403
го Ne
HEOH
20,178
3
3
Na 11
НАТРИЙ
22,98977
Mg 12
МАГНИИ
24,305
13 Al
АЛЮМИНИИ
26,98154
14 Si
КРЕМНИИ
28,0855
15
30.Э7*
P
ОСФОР
76
» S
СЕРА
32,06
17 Cl
ХЛОР
35,453
18 Ar
АРГОН
39,948
И
4
К 9
КАЛИИ
39,0983
Ca 20
КАЛЬЦИИ
40.08
Sc 31
СКАНДИЙ
44.9559
Ti 23
ТИТАН
4 7,90
V
BAHA1I
23
«ни
J 50,9415
Cr 24
ХРОМ
51,996
Mn 25
МАРГАНЕЦ
54.9380
Fe 29
ЖЕЛЕЗО
55,847
Со 27
КОБАЛЬТ
58,9332
Ni 29
НИКЕЛЬ
58,70
5
29 Cu
МЕДЬ
63,546
30 Zn
ЦИНК
65 38
31 Ga
ГАЛЛИИ
69,72
32 Ge
ГЕРМАНИИ
72,5т1
33
M
74,9211
As
ншьяк
34 Se
СЕЛЕН
78,96
35 Br
БРОМ
79.904
38 Kr
КРИПТОН
83.80
R
6
Rb 37
РУБИДИИ
е 5.46 78
Sr 18
СТРОНЦИИ
87,62
Y 39
ИТТРИИ
88,9059
Zr 40
ЦИРКОНИИ
91,22
Nl
НИОБ1
> 11
$Й
92,9064
Mo 42
МОЛИБДЕН
95,94
Tc 43
ТЕХНЕЦИИ
98.9082
Ru 44
РУТЕНИЙ
101,07
Rh 45
РОДИИ
102,9055
Pd 46
ПАЛЛАДИИ
106,4
V/
7
Ag
СЕРЕБРО
107.8682
48 Cd
КАДМИИ
112,41
49 In
ИНДИИ
114,62
59 Sn
ОЛОВО
118,69
51
121,75
Sb
Сурьма
52 Те
ТЕЛЛУР
127,60
53
иод
126,9045
84 Xe
КСЕНОН
Ю130
4*
8
Cs 55
ЦЕЗИИ
132,9054
Ba 56
БАРИИ
137.33
57 71
La-Lu
*.
Hf 72
ГАФНИИ
178,49
Та
ТАИТ/
j 73
{п
I 180,9479
W 74
ВОЛЬФРАМ
183,85
Re 35
РЕНИИ
186,207
Os п
ОСМИЙ
190,2
Ir 77
ИРИДИИ
192,22
Pt 79
ПЛАТИНА
195,09
9
79 Au
золото
196.9665
90 Hg
РТУТЬ
200,59
91 Tl
ТАЛЛИИ
204,37
92 Pb
СВИНЕЦ
207,2
83
208,98
Bi
Ьисмут
г4
84 Po
полонии
[2091
93 At
АСТАТ
12101
“ Rn
РАДОН
(2221
7
10
Fr 97
ФРАНЦИИ
(223)
Ra 99
РАДИИ
226,0254
89 , 103
Ac -(Lr)
* *
Ku ,и
КУРЧАТОВИИ
(261)
Nj
ниль
( 105
1БОРИЙ
f 1261J
106
107
■ ' •
<3
ВЫСШИЕ
онсиды
ЛЕТУЧИЕ
ВОДОРОДНЫЕ
СОЕДИНЕНИЯ
RO2
RH4
5
R2O7 RO4
' з
RH2
RH
•
ЛАН Г А МОИ ДЫ
La 57
ЛАЙТАМ
138,9055
Ce 58
UtAMM
140,12
Pr 59
лразсодмм
140,90 77
Nd 60
HtOANM
144,24
Pm 61
прометии
[145]
Sm 62
САМАРИИ
150 4
Eu 63J
европии
151.9б|
Gd 64
Ir лдолмимм
^7,25
Tb 65
’WN M
158,9254
Dy *
ANC HPOlNIil
162,50
Но6’
гольмий
164,9304
Er 88
IPBNM
167,16
Tm69
ТУЛИИ
868,9342
Yb 70
MTTtPtMM
173,04
Lu л
лютщмй
174,967
AMTMHOKAbl
Ac 88
AMTMNNM
(ПТ)
Th 90
томим
232,0381
Pa •’
ПРОТАКТИНИИ
231.0359
и 92
ГРАИ
238,029
Np 93
MtnTrKMM
237,0482
Pu 94
ПЛГТОМММ
1<«4]
Am 9^
«ЛАСРМЦМИ Д.
(743Г
Cm 96
»;-С.РИИ
(2471
Bk 97
KtPMAMM
[2471
Cf 98
КАЛИФОРНИИ
(2511
Es *
яимштсйнмм
(2541
Fmw
««РММЙ
1571
Md10i
MlNAtntMMN
[2581
(No)102
MOltANM
(255)
(Lr)793
ЛОУРСМСШЙ
(1661
н. с. әхмәтов
НЕОРГАНИК
ХИМИЯ
ХИМИЯНЕ ТИРӘНТЕН ӨЙРӘНҮ
МӘКТӘПЛӘРЕНЕҢ 8—9 СЫЙНЫФ
УКУЧЫЛАРЫ ӨЧЕН УКУ ЯРДӘМЛЕГЕ
ИКЕ КИСӘКТӘ
Россия Федерациясе
Мәгариф министрлыгы тарафыннан
расланган
Тәрҗемә Татарстан Халык мәгарифе министрлыгы
тарафыннан расланган
КАЗАН «МӘГАРИФ» 1994
ББК 24.1я72
Ә 95
Ахметов H. С.
Неорганическая химия. Учеб, пособие для учащихся 8—9 кл.
шк. с углубл. изуч. химии. В 2-х ч.— 2-е изд.—M.: Просвеще¬
ние, 1990
Шартлы билгеләр:
А — күнегүләр
? — сораулар
■ — өйгә эшләр
Әхмәтов H. С.
Ә 95 Неорганик химия. Химияне тирәнтен өйрәнү мәктәплә¬
ренең 8—9 сыйныф укучылары өчен уку ярдәмлеге. 2 ки¬
сәктә / Русчадан Р. И. Хәлиуллин тәрҗ.— Казан: Мәгариф,
1994.— 423 б., рәс. белән.
ISBN 5-7761-128-Х
4306021500—030_
П ¥б0)3)-94-
БЗ 60—58—94/95
ББК 24.1я72
ISBN 5-7761-128-Х
© Издательство «Просвещение», 1989
© «Мәгариф» нәшрияты, тәрҗемә, 1994
I нче кисәк
БАШЛАНГЫЧ
ХИМИК ТӨШЕНЧӘЛӘР
§ 1. ХИМИЯ —МАТДӘЛӘР ҺӘМ АЛАРНЫҢ
ӘВЕРЕЛЕШЛӘРЕ ТУРЫНДАГЫ ФӘН
Бөек рус галиме Михаил Васильевич Ломоносов: «Химия
кешенең һәр эшенә киң колач җәеп керә бара»,— дип язган.
Бу сүзләр XVIII гасыр урталарында әйтелгән. Безнең көннәрдә
кешелек тормышында химиянең роле гаять зур дәрәҗәдә үсте.
Химия ярдәмендә табигый рудадан металлар эретеп алалар,
эретмәләр табалар. Нефтьтән бензин алалар, пластик массалар,
майлагыч материаллар, буяу матдәләре һәм кешегә кирәкле күп
кенә башка матдәләрне җитештерәләр.
Химия — матдәләр һәм аларның әверелешләре турындагы
фән ул.
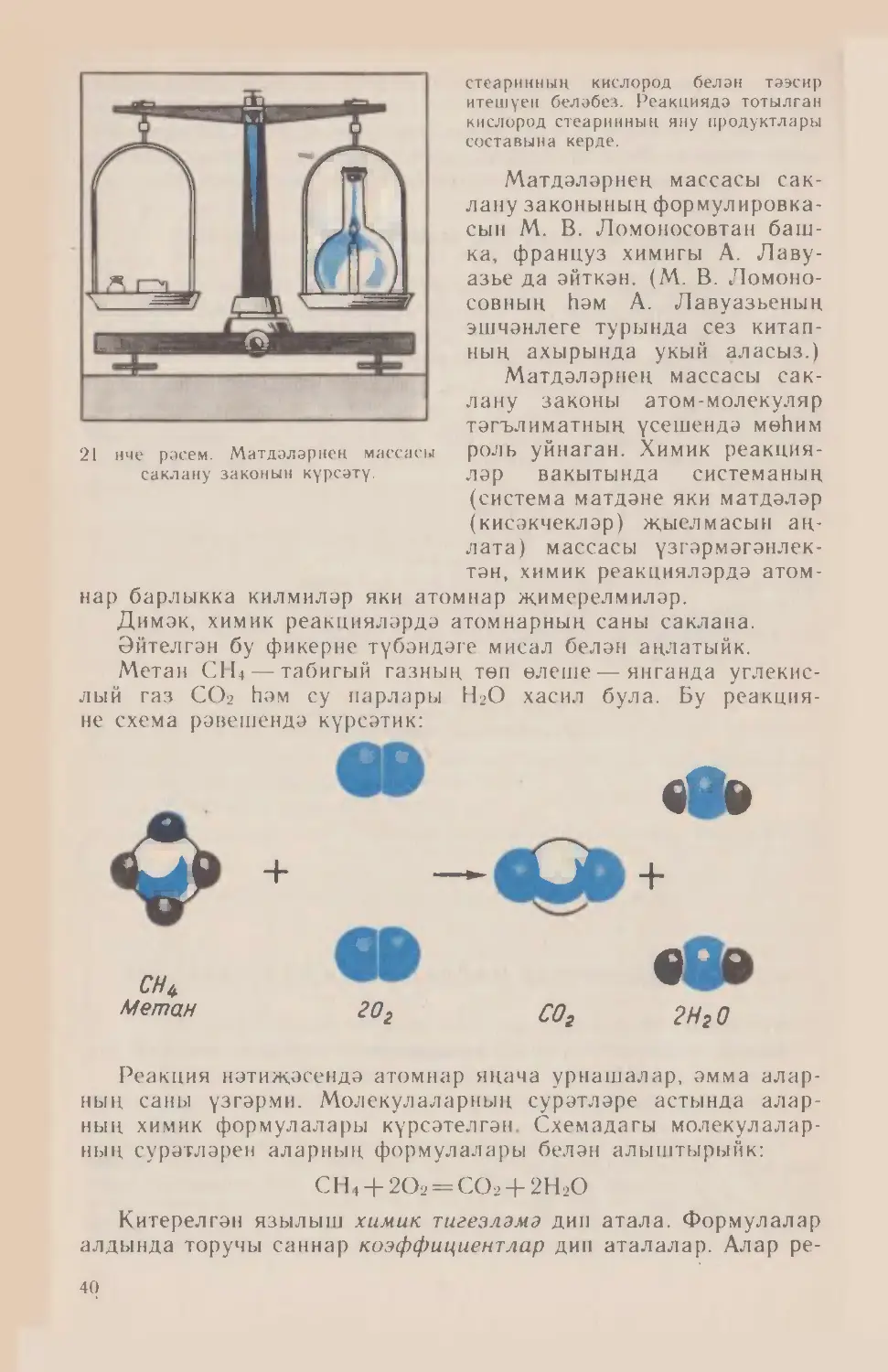
Матдәләрнең химик әверелешләрен башкарыйк. Тимер һәм
күкерт порошокларының катнашмасын хәзерлик. Бу катнашмага
магнит белән тәэсир иткәндә тимерне күкерттән аерып алу җи¬
ңел булыр. Шул катнашманы пробиркага салыйк һәм җиңелчә
генә җылытыйк. Катнашма уттай кыза, һәм аның төсе үзгәрә.
Суынганнан соң пробиркадагы матдәне ваклыйк. Инде хәзер
порошокка магнитны якын китерсәк, ул магнитка тартылмый.
Бу исә хасил булган порошокта металлик тимер юклыгын дә¬
лилли. Нәрсә булды соң? Тәҗрибә өчен без тимер һәм күкерт
алдык, ә нәтиҗәдә башка бер матдә — тимер сульфиды таптык.
Тимер сульфидының үзлекләре тимер һәм күкерт үзлекләреннән
аерылып торалар.
Бер матдәнең башка матдәләргә әверелеше химик реакция
дип атала.
Табигатьтә химик реакцияләр һәрвакыт булып тора. Химик
реакцияләр исәбенә җирдәге барлык тереклек ияләре яши. Та¬
бигать белеме курсыннан белгәнегезчә, яшел үсемлекләрдә уг¬
лекислый газ һәм суның органик матдәләргә әверелеше була
һәм кислород аерылып чыга. Киресенчә, сулау процессында ор¬
ганик матдәләр һәм кислород углекислый газга әвереләләр.
Углекислый газ шулай ук ташкүмер, табигый газ, нефть һәм
башка ягулык янганда да барлыкка килә.
Химияне табигать фәннәренә кертәләр, чөнки ул табигать
күренешләрен һәм объектларын өйрәнү белән шөгыльләнә. Без
химия фәне нигезләрен үзебезне әйләндереп алган дөньяны ях¬
шырак аңлау өчен өйрәнербез. Без химиянең төп законнарын
з
тикшерербез һәм химик әверелешләрнең ничек тормышка ашы¬
рылуын һәм аларның кеше файдасына ничек кулланылуын аң¬
ларга тырышырбыз.
Ел саен безнең илебездә миллионнарча тонна химия продук¬
циясе чыгарыла. Бу меңләгән химия производствосындагы һәм
фәнни-тикшеренү учреждениеләрендәге эшчеләр һәм галимнәр¬
нең тулы бер армиясенең фидакарь хезмәте нәтиҗәсе.
Сезнең белүегезчә, химия заводларында минераль ашла¬
малар, үсемлекләрне корткычлардан һәм чүп үләннәрдән химик
саклау матдәләре җитештерәләр. Аларны куллану кырларыбыз-
ның уңдырышлылыгын арттыра.
Химия файдалы казылмаларны космик корабльләр һәм раке¬
талар өчен кирәкле ягулыкка, төш ягулыгына, нык һәм кызуга
чыдам материалларга эшкәртүне тәэмин итә.
Химия продуктларыннан көнкүрештә киң файдаланалар. Без
ясалма сүсләрдән, ясалма күннән, пластмассалардан эшләнгән
әйберләрне кулланабыз, лаклардан һәм буяулардан, юу матдәлә¬
реннән файдаланабыз.
Төзелеш материаллары — кирпеч, цемент, бетон җитештерү
дә химик процессларга нигезләнгән.
Химия халык хуҗалыгының барлык тармакларына да үтеп
керә. Шуңа күрә киләчәктә сез кем генә булсагыз да — агро¬
номмы яисә төзүчеме, медицина хезмәткәреме яисә геологмы,
космонавтмы яисә хезмәт күрсәтү өлкәсе хезмәткәреме, метал¬
лургмы яисә электрон-хисаплау машинасын төзүчеме,— сезгә
химия буенча белемнәрне кулланырга туры киләчәк.
Химия — үсә торган фән. Үзен бу фәнгә хезмәт итүгә ба¬
гышлаган һәркем аның үсешенә, табигать серләрен ачуга, яңа,
табигатьтә булмаган материаллар һәм матдәләр булдыруга үзен¬
нән өлеш кертә ала.
Химияне — матдәләр һәм аларның әверелешләре турындагы
фәнне өйрәнүгә керешик.
Э 1. Химия нәрсәне өйрәнә?
2. Химик реакцияләр вакытында ни була?
д 3. а) Табигатьтәге; б) промышленностьтагы; в) көнкүрештәге химик реак¬
цияләргә нинди мисаллар китерә аласыз?
4. Физик күренешләр химик күренешләрдән (реакцияләрдән) нәрсә белән
аерыла?
5. Сез көнкүрештә куллана торган химия продуктларына мисаллар ки¬
терегез.
6. Түбәндә күрсәтелгән материалларның кайсылары табигатьтә очрый,
ә кайсылары ясалма юл белән табыла: а) пыяла; б) чуен; в) бетон;
г) аш тозы; д) капрон; е) алюминий; ж) табигый газ; з) корыч; и) пласт¬
масса?
7. Ничек уйлыйсыз; а) агрономга; б) металлургка; в) төзүчегә; г) врач¬
ка; д) космик корабльләр уйлап чыгаручыга; е) машиналар төзүчегә;
ж) химик чистарту хезмәткәренә; з) кулинарга; и) бакчачыга химия фәне
буенча нинди белемнәр кирәк?
8. Кушымтадан химия лабораториясендә эшләү һәм куркынычсызлык тех¬
никасы кагыйдәләрен укып чыгыгыз. Укып чыккан материал буенча кыска-
ча конспект төзегез.
4
1 нче лаборатор дәрес
МАТДӘЛӘР ҺӘМ АЛАРНЫҢ ҮЗЛЕКЛӘРЕ
Күзәтүләр, фактлар — фәннең нигезе. Аларның асылын аңлау
өчен күзәтә һәм үзеңнең күзәтүләреңә анализ ясый белү бик
мөһим. Химиянең нигезен матдәләрнең химик әверелешләре тәш¬
кил иткәнлектән, матдәләрнең үзлекләрен белү әһәмиятле. Бу
дәрестә сез кайбер матдәләр белән танышырсыз һәм аларның
үзлекләрен өйрәнерсез. Мәктәп химия лабораториясе шартларын¬
да матдәләрнең барлык үзлекләрен дә белеп бетереп булмый.
Моның өчен махсус тикшеренүләр кирәк; матдәләрнең күп кенә
үзлекләре турында белешмәлекләрдән белергә мөмкин. (Әдәбият
исемлеген китапның ахырыннан карагыз.)
Тәҗрибәләрне башкарганда химия лабораториясендә эшләү
һәм куркынычсызлык техникасы кагыйдәләрен үтәгез.
Укытучыдан бирем алыгыз һәм түбәндәге план буенча мат¬
дәләрнең үзлекләрен тасвирлагыз:
1. Бирелгән шартларда матдә нинди хәлдә — газсыманмы,
сыекмы, катымы?
2. Матдәнең төсе нинди? Аның ялтыравыгы бармы?
3. Матдәнең исе бармы?
4. Чагыштырма катылык шкаласы буенча матдәнең катылыгы
нинди?
5. Матдәдә пластиклык, уалучанлык, эластиклык чагыламы?
6. Матдә суда эриме? (Матдә бөртеген пробиркага салыгыз,
һәм 1—2 мл су өстәп, болгатыгыз. Матдәнең суда эрүчәнлеге
турында нәтиҗә ясагыз.)
7. Матдәнең эретелү температурасы һәм кайнау температу¬
расы нинди? (Бу мәгълүматларны белешмәлектән табыгыз.)
8. Матдәнең тыгызлыгы нинди? (Белешмәлектән табыгыз.)
Күзәтүләрнең нәтиҗәләрен укытучыга күрсәтегез.
? 1. Текстта бирелгән планнан файдаланып, а) суның; б) графитның (ка-
Д рандашның үзәге); в) тимернең үзлекләрен тасвирлагыз. Бу матдәләрне
куллану аларның нинди үзлекләренә нигезләнгән? Аларны кайларда кул¬
ланалар?
2. а) Пыяланың; б) резинаның; в) бетонның; г) бакырның; д) чуенның
кулланылышын аларның нинди үзлекләре билгели?
3. Ни өчен алюминий, магний, титан эретмәләрен «канатлы» дип атыйлар?
Сезгә таныш булган матдәләр, аларның үзлекләре, кулланылышы турында
хикәя төзегез.
2 нче лаборатор дәрес
ХИМИК РЕАКЦИЯЛӘРНЕҢ БИЛГЕЛӘРЕ
Бу дәрестә сезгә кайбер тәҗрибәләрне башкарырга һәм хи¬
мик реакцияләрнең узуын аларның тышкы билгеләре буенча
әйтергә мөмкин икәнлеге турында нәтиҗәләр ясарга кирәк бу¬
лачак.
5
Тәҗрибәләрне башкарганда химия лабораториясендә эшләү
һәм куркынычсызлык техникасы кагыйдәләрен үтәгез.
Үзегезнең күзәтүләрегезне лаборатор эшләр журналына язып
барыгыз. Бу сезгә башкарган тәҗрибәләр буенча нәтиҗәләр яса¬
ганда ярдәм итәр. Химияне өйрәнүнең бу этабында матдәләрнең
исемнәрен хәтердә калдыру мәҗбүри түгел.
1 нче тәҗрибә. Кальций карбонаты (акбур яки мәрмәр) ки¬
сәген пробиркага салыгыз һәм аңа тамчылап хлорид кислотасы
эремәсен өстәгез. Сез нәрсә күзәтәсез? Күзәтүләрегезне лабо¬
ратор эшләр журналына язып куегыз.
2 нче тәҗрибә. Пробиркага берничә тамчы тимер (III) хло¬
риды эремәсен тамызыгыз, ә аннары берничә тамчы аммоний
роданиды эремәсен салыгыз. Бу реакция барышында күзәтелгән
тышкы билгеләрне лаборатор эшләр журналына язып куегыз.
3 нче тәҗрибә. Берничә тамчы натрий сульфаты эремәсен
пробиркага салыгыз. Аннан соң берничә тамчы барий хлориды
эремәсен өстәгез. Сез нәрсә күзәтәсез? Күзәтүләрегезне лабо¬
ратор эшләр журналына язып куегыз.
4 нче тәҗрибә. Пробиркадагы берничә тамчы кургаш ацетаты
эремәсенә тамчылап калий иодиды эремәсен өстәгез. Сез нәрсә
күзәттегез, шуны лаборатор эшләр журналына язып куегыз.
Тәҗрибәләргә нигезләнеп нәтиҗә ясагыз, башкарылган реак¬
цияләр узганда нинди тышкы билгеләр күзәтелде?
■ 1. Кайсы очракларда сүз химик әверелеш турында, ә кайсыларында физик
▲ күренеш турында бара: а) табигый газны резина табу өчен кулланалар;
б) су парга әйләнә; в) эремәне фильтрлыйлар; г) металл касмак белән
каплана; д) пыяладан лаборатория савытлары эшләп чыгаралар; е) утта
ризык пешерәләр; ж) электр лампочкасында кыздырма кыл яктырта;
з) шәм яна?
2. Түбәндәге химик әверелешләрнең узуын нинди тышкы билгеләре буенча
әйтергә мөмкин: а) йомырка пешкәндә; б) сөт әчегәндә; в) фотоматериал¬
ларны ачыкландырганда (проявить иткәндә) һәм беркеткәндә (фиксаж¬
лаганда); г) тимер күгәргәндә; д) кәгазь искергәндә; е) резина искергәндә;
ж) шырпы янганда?
§ 2. ХИМИК ЭЛЕМЕНТ.
ЧАГЫШТЫРМА ATOM МАССАСЫ
Физика дәреслегеннән «Матдә төзелеше», «Молекулалар» дигән параграф¬
ларны кабатлагыз. Шуның белән бергә молекулаларның һәм кристалларның
ничек сурәтләнүләренә дә игътибар итегез.
Матдәләрнең атомнардан торуы сезгә билгеле инде. 1 нче
рәсемдә кайбер матдәләрнең молекулаларының модельләре күр¬
сәтелгән. Водород молекуласы ике водород атомыннан (1 нче рә¬
сем, а), ә кислород молекуласы ике кислород атомыннан (1 нче
рәсем, б) тора. Cy молекулалары (1 нче рәсем, в) һәм углекис¬
лый газ молекулалары (1 нче рәсем, г) исә өчәр атомнан тора¬
лар: су молекуласы — бер кислород атомыннан һәм ике водород
6
1 нче рәсем. Водород (а), кислород
(б), су (в), углекислый газ (г) моле¬
кулаларының. схема рәвешендә сурәт¬
ләнеше.
/
химик элементларның латинча
атомыннан, ә углекислый газ
молекуласы — бер углерод ато¬
мыннан һәм ике кислород ато¬
мыннан тора. Водород, кисло¬
род, углерод атомнары — атом¬
нарның төрле төрләре алар.
Атомнарның төрен химик
элемент дип атау кабул ител¬
гән. Хәзерге вакытта атомнар¬
ның 109 төре, ягъни 109 химик
элемент билгеле. Шулай ча¬
гыштырмача күп булмаган сан¬
дагы химик элементларның
атомнары төрлечә урнашудан,
соңгы мәгълүматлардан билге¬
ле булганча, алты миллион
матдә барлыкка килә.
Химик элементларны химик
билгеләр яки символлар белән
билгелиләр. Символлар рәве¬
шендә күпчелек очракларда
исемнәренең башлангыч хәрефләре кабул ителгән. Әйтик,
водород элементының латинча исеме гидрогениум (Hydroge¬
nium), һәм шуңа күрә аны H символы белән билгелиләр.
Кислород элементының латинча исеме оксигениум (Oxyge¬
nium), һәм аны O хәрефе белән билгелиләр. Углерод химик
элементының символы С, чөнки аның латинча исеме кар-
бонеум (Carboneum). Башка элементларның исемнәрен сез ку¬
шымтадан укый аласыз.
Химик элементлар «Химик элементларның Д. И. Менделеев
периодик системасы» дип аталган таблицада күрсәтелгән (1 нче
форзацны карагыз). Бу таблицадан сез химик элементларның
исемнәрен һәм символларын белә аласыз. Алга таба химик эле¬
ментлар турында төрле мәгълүматлар алу өчен сез аннан күп
тапкырлар файдаланырсыз әле. Сез җитәрлек кадәр белем туп¬
лагач, без химик элементларны классификацияләүгә һәм сис¬
темалаштыруга кагылышлы сорауларны тулырак итеп тикшерер¬
без.
Химик элементлар турындагы беренче күзаллауларны фәнгә
Р. Бойль керткән (XVII гасыр урталары). Матдәләрнең атом¬
нардан һәм молекулалардан торуы турындагы күзаллау атом-
молекуляр тәгълиматның нигезен тәшкил итә. Төрле илләрнең
галимнәре: Р. Бойль, М. В. Ломоносов, Дж. Дальтон, А. Авогад-
ро атом-молекуляр тәгълиматын тудыруда үзләреннән өлеш
керткәннәр. Бу галимнәрнең исемнәре белән сез дәреслек бит¬
ләрендә әле күп тапкырлар очрашырсыз (алар турында сез
дәреслек ахырыннан укый аласыз).
Химик элементларның һәркайсы билгеле бер, аның үзенә ге¬
нә хас үзлекләр җыелмасына ия булып тора. Элементның аеруча
7
2 нче рәсем. Хлор (а), хлороводород
(б), метан (в) молекулаларының схе¬
ма рәвешендә сурәтләнеше.
3 нче рәсем. Җир кабыгында химик
элементларның масса өлеше.
мөһим характеристикасы булып аның чагыштырма атом масса¬
сы Ar тора. (Ar билгесендә г индексы — «инглизчә relative яки
французча relatif сүзләренең беренче хәрефе, татарча «чагыш¬
тырма».)
Элементның чагыштырма атом массасы аның атомының мас¬
сасы углерод атомы массасының ' / м өлешеннән ничә тапкыр
зуррак булуын күрсәтә. (Чагыштырма атом массасының тагын
да төгәлрәк билгеләмәсе атом төзелеше теориясен өйрәнгәннән
соң биреләчәк.)
Ar= ™,
‘/12 ma (C) кг
монда
т — бирелгән элемент атомының массасы; ша(С)—углерод
атомының массасы.
Химик элементларның чагыштырма атом массаларының зур¬
лыклары химик элементларның Д. И. Менделеев периодик сис¬
темасында күрсәтелә. Шул таблицага карыйк. Водород химик
элементының чагыштырма атом массасы Ar(H) = 1,0079, ә кисло¬
род химик элементыныкы Ar (O) = 15,9994. Гадәттә исәпләүләр
өчен чагыштырма атом массаларының зурлыкларын түгәрәкләп
кулланалар. Мәсәлән, водород өчен 1 дип, кислород өчен 16 дип
алалар.
Чагыштырма атом массасы төшенчәсен химиягә Дж. Дальтон
керткән.
? 1. 2 нче рәсемдә: а) хлор; б) хлороводород; в) метан молекулаларының
модельләре күрсәтелгән. Молекулаларны тәшкил итүче атомнарның санын
билгеләгез. Бу матдәләрне хасил иткән химик элементларның исемнәрен
A атагыз.
2. а) Водород; б) кислород; в) су; г) углекислый газ молекулалары мо¬
дельләренең рәсемнәрен ясагыз һәм атомнарның сурәтләрен, 2 нче рәсем¬
дә күрсәтелгәнчә, химик символлары белән тамгалагыз.
8
3. Химик элементларның Д. И. Менделеев периодик системасында: а) водо¬
род; б) углерод; в) азот; г) кислород; д) күкерт; е) хлор химик элемент¬
ларын табыгыз. Аларның символларын языгыз һәм ничек укылуларын күр¬
сәтегез (кушымтаны карагыз).
4. 3 нче рәсемдә химик элементларның Җир кабыгында таралышы күрсә¬
телгән. Җир кабыгында нинди элементлар аеруча күп таралган?
5. Химик элементларның Д. И. Менделеев периодик системасыннан фай¬
даланып, C, N, O, F, Mg, Al, Si, S, Cu, Fe элементларының исемнәрен
һәм аларның чагыштырма атом массаларын язып алыгыз. Түгәрәкләп алын¬
ган чагыштырма атом массаларын китерегез һәм аларны кушымта табли¬
цасындагы мәгълүматлар белән чагыштырыгыз.
6. Чагыштырма атом массасы а) 24; б) 23 булган химик элементның
символы һәм исеме нинди?
7. Кайсы элементның: a) C яки В; б) K яки Na — чагыштырма атом
массасы зуррак? Бу элементларның исемнәрен языгыз.
§ 3. ХИМИК ФОРМУЛАЛАР.
ЧАГЫШТЫРМА МОЛЕКУЛЯР МАССА
Физика дәреслегеннән молекула массасы турында «Җисем массасы. Масса
берәмлекләре» дигән параграфны кабатлагыз.
Матдәнең составын химик формула рәвешендә химик эле¬
ментларның символлары ярдәмендә күрсәтү кабул ителгән. Атом¬
нар санын формулада индекс — символдан уңда
торган сан белән күрсәтәләр. Мәсәлән, водород
химик формуласын Нг дип, ә су молекуласыныкын
лар: ’ H2O
һәм аста языла
молекуласының
— Н2О дип яза-
H2
Водородның химик формуласы Нг «аш-ике» дип укыла һәм ул
водород молекуласы водород химик элементының ике атомыннан
торуын аңлата.
Суның химик формуласы НгО («аш-ике-о» дип укыла), су
молекуласында ике водород атомы һәм бер кислород атомы бу¬
луын күрсәтә.
Матдәнең мөһим характеристикасы булып, аның чагыштырма
молекуляр массасы Mr тора. Чагыштырма молекуляр масса бу
матдәнең молекула массасы углерод атомы массасының '/12 өле¬
шеннән ничә тапкыр авыррак булуын күрсәтә. (Чагыштырма
молекуляр массаның тагын да төгәлрәк билгеләмәсе атом тө¬
зелеше теориясен өйрәнгәннән соң биреләчәк.)
M г = - , монда
. /12 та (C) кг
т — бирелгән матдәнең молекула массасы; та (C)—углерод
атомының массасы.
9
ее а ф
4 нче рәсем. Иод (а), сероводород (б), аммиак (в) молекулаларының схема
рәвешендә сурәтләнеше.
Чагыштырма молекуляр массаны молекуланы хасил итүче
элементларның чагыштырма атом массалары буенча, индекслар¬
ны да исәпкә алып, ансат табарга була. Әйтик, водородның H2
чагыштырма молекуляр массасы:
Alr(H2)=2АГ(Н) =2-1 =2 тәшкил итә.
Суның H2O чагыштырма молекуляр массасы ике водород ато¬
мының һәм бер кислород атомының чагыштырма атом массалары
суммасына тигез:
Mr (H2O) =2Ar (H) +Ar (O) =2-1 + 16= 18
? 1. Молекулалары 1 нче һәм 2 нче рәсемнәрдә сурәтләнгән матдәләрнең
A химик формулаларын языгыз. Аларның чагыштырма молекуляр массаларын
исәпләп чыгарыгыз.
2. Модельләре 4 нче рәсемдә күрсәтелгән: а) йодның; б) сероводородның;
в) аммиакның чагыштырма молекуляр массаларын исәпләп чыгарыгыз.
3. а) Шикәрнең С12Н22О11; б) серкә кислотасының СНзСООН; в) метан¬
ның СНч (табигый газның төп состав өлеше) чагыштырма молекуляр мас¬
саларын исәпләп чыгарыгыз.
§ 4. АТОМНАР. МОЛЕКУЛАЛАР.
МОЛЕКУЛЯР КРИСТАЛЛАР
Физика дәреслегеннән «Каты җисемнәрнең, сыеклыкларның һәм газларның
молекуляр төзелешендәге аерымлыклар» дигән параграфларны кабатлагыз.
Атомнар, бер-берсе белән кушылып, молекулалар хасил итә¬
ләр. Молекулаларда атомнар саны төрлечә булуы ихтимал. Сез
беләсез инде, кислород молекуласы ике атомнан тора һәм аның
составы O2 формуласы белән күрсәтелә, су молекуласы өч атом-
10
5 нче рәсем. Углекислый газ молекулаларының каты (а) һәм газ (б) хәлендәге
матдәдә урнашулары.
нан тора, аның формуласы Н2О. Шикәр молекуласында кырык
биш атом бар — С12Н22О11. Молекуладагы атомнар саны шактый
күбрәк тә булуы мөмкин. Бер матдәнең молекулалары билгеле
бер составка ия булып торалар. Әйтик, елга, яңгыр, чишмә, диң¬
гез суларының молекулалары составы һәрвакытта да НгО фор¬
муласына туры килә.
Күмер, торф, нефть, ташкүмер, табигый газ янганда угле¬
кислый газ барлыкка килә. Янган матдәнең табигатенә карамас¬
тан, углекислый газ молекуласының составы бер үк — СОг. Төр¬
ле төрдәге ягулык янганда шулай ук су да хасил була; аның
молекулалары составы да бер үк—Н2О.
Матдәнең агрегат хәле үзгәргәндә аның молекулалары сос¬
тавы үзгәрмәвен сез физика курсыннан беләсез. Бары тик моле¬
кулаларның бер-берсенә карата урнашулары гына үзгәрә (5 нче
рәсем) . Каты җисем кристаллик төзелешкә ия (5 нче рәсем, а).
Бу очракта, матдәнең сыек һәм бигрәк тә газ хәлендәге торы¬
шыннан аермалы буларак (5 нче рәсем, б), аның молекулалары
ныклы бер тәртиптә урнашалар.
Молекулалардан торучы кристаллар молекуляр кристаллар
дип аталалар.
Кристалларда молекулалар үзара молекулаара тәэсир итешү
көчләре белән бәйләнгәннәр. Молекулалар арасындагы бәйлә¬
нешләр чагыштырмача түбән температурада да җиңел өзеләләр.
Шунлыктан молекулалардан торучы матдәләргә чагыштырмача
түбән кайнау һәм эретелү температуралары хас. Мондый матдә¬
ләрнең күбесе гадәттәге шартларда газлар (водород, кислород,
углекислый газ) яки сыеклыклар (су, спирт).
Әмма атомнар арасындагы бәйләнешләр, мәсәлән, су НгО мо¬
H
лекуласында, ни дәрәҗәдә ныклы соң? НгО молекулаларын җи¬
мерү өчен, су парларын бик югары температурага кадәр (2000 C
тан да югары) җылытырга кирәк. Димәк, H2O молекуласында
атомнар арасындагы бәйләнешләр гаять нык. Матдәдәге атомнар
арасындагы бәйләнешләрне химик бәйләнешләр дип атыйлар.
Составындагы атомнары химик бәйләнешләр ярдәмендә кушыл¬
ган матдәләрне химик кушылмалар дип атыйлар.
? 1. VII класслар өчен физика дәреслегендә бирелгән 24 нче рәсем буенча
A газ, сыек, каты хәлләрдә су молекулаларының бер-берсенә карата ничек
урнашуларын аңлатып бирегез. Физикада нинди җисемнәрне каты җисем¬
нәр дип атыйлар? Ни өчен суның агрегат хәле үзгәргәндә аның молеку¬
лаларының составы үзгәрми?
2. Азык-төлекне, аерым алганда туңдырманы, суыту өчен еш кына «коры
боз» дип йөртелә торган кристаллик СОг кулланалар. Гадәттәге темпера¬
турада «коры боз» кисәгенең чын-чыннан күз алдында юкка чыгуын ничек
аңлатырга? Җавап биргәндә 5 нче рәсемнән файдаланыгыз.
3. Углекислый газдан тыш, углерод белән кислородның, составы CO булган,
башка химик кушылмасы да билгеле. Ул агулы газ, аны «ис газы» дип
атыйлар. Ни өчен углекислый газ һәм ис газы үзләренең үзлекләре белән
аерылып торалар?
4. «Коры боз» гадәттәге температурада ук парга әйләнә, ә СОг молеку¬
ласы бар тик 2500 C тан да югары температурада гына таркала. Бу факт¬
ларга сез нинди аңлатма бирерсез?
§ 5. АТОМНАР. АТОМЛЫ КРИСТАЛЛАР
Ике матдәнең — «коры бозның» һәм кварцның үзлекләрен
чагыштырып карыйк. Бу матдәләр сезгә таныш. «Коры боз» —
каты хәлдәге углекислый газ CO2. Кварц SiO2 — елга комының
төп состав өлеше. Ә үзләренең физик үзлекләре белән бу мат¬
дәләр ни дәрәҗәдә кискен аерылып торалар! «Коры боз» гадәт¬
тәге температурада парга әйләнә, сыеклыкка әверелмичә, крис¬
талл халәтеннән газ хәленә күчә. Ә кварц исә авыр эретелүчән.
Газ ^үәленә күчерү өчен аны бик югары температурага кадәр
(2590 С) җылытырга кирәк. Ни өчен химик формулалары ох¬
шаш булган бу ике матдә үзлекләре буенча бик нык аерылып то¬
ра? Сәбәбе — аларның төзелешләре төрле булуда.
«Коры бозга» молекуляр кристаллар хас (5 нче рәсем).
Кварц кристалларында исә аерым молекулалар юк (6 нчы рә¬
сем). Кристалл бөтен барлыгы белән бер гигант молекуладан
тора сыман. 6 нчы рәсемне игътибар белән карагыз әле. SiO2
кристалында кремнийның һәр атомы химик бәйләнешләр ярдә¬
мендә кислородның дүрт атомы белән тоташкан. Ә кислородның
һәр атомы химик бәйләнешләр ярдәмендә ике кремний атомы
белән тоташкан. Кремний һәм кислород атомнарының бер-берсе-
нә карата урнашуларын бигрәк тә ачык итеп түбәндәге схема
ярдәмендә күзалларга мөмкин:
12
6 нчы рәсемдәге һәм схемадагы сызыклар химик бәйләнеш¬
ләрне аңлаталар. Кремний һәм кислород атомнары арасындагы
химик бәйләнешләр нык булганлыктан, алар кварцны бик югары
температурага кадәр җылытканда гына җимереләләр.
Кристаллик кварц мисалында атомлы кристалларның струк¬
турасы белән танышканнан соң, без түбәндәге нәтиҗәләрне
ясый алабыз. Атомлы кристаллның зурлыгына карап андагы
атомнарның саны да төрлечә була. Әмма зурлыгына һәм масса¬
сына карамастан, атомлы кристалларның структурасы бер үк бу¬
ла. Кечкенә генә ком бөртегенең дә, зур кристаллның да тө¬
зелеше бер үк.
Атомлы структурага ия булган матдәнең химик формуласы
кушылманы барлыкка китерүче элементларның атомнары са¬
нының чагыштырмасын күрсәтә. Кварц очрагында SiOa форму¬
ласы кварц кристалларында бер кремний атомына ике кислород
атомы туры килүен аңлата.
1. 7 нче рәсемдә алмазның структурасы күрсәтелгән. Анда һәр углерод
атомы химик бәйләнешләр ярдәмендә башка дүрт атом белән тоташкан.
Алмаз кристалларының төзелеше аларның зурлыгына бәйлеме? Алмаз¬
ның эретелү һәм кайнау температуралары турында сез нәрсә әйтә аласыз:
бу зурлыкларның кыйммәтләре югары булырмы, әллә түбән булырмы?
6 нчы рәсем. Кварц кристалының 7 нче рәсем. Алмазның структурасы,
структурасы.
13
2. Марляга төргән нафталин, озак вакытлар саклаганда, «юкка чыга».
Моның сәбәбе нәрсәдә? Нафталинның кристалы нинди төргә керә — мо¬
лекуляр кристаллмы яисә атомлы кристаллмы?
3. Пластилиннан: а) су молекуласының; б) алмаз кристалының шарлы-
таякчыклы модельләрен ясагыз.
4. а) Молекуланың; б) атомлы кристаллның химик формуласы нәрсәне
аңлата? Җавапны дәлилләү өчен конкрет матдәләргә мисаллар китерегез.
5. Ике генә элементтан — углеродтан һәм водородтан торып, бер үк төрле
химик формула белән күрсәтелүче күп сандагы органик матдәләр бил¬
геле. Ни өчен бу матдәләрнең үзлекләре төрле?
3 нче лаборатор дәрес
КРИСТАЛЛАРНЫ МИКРОСКОПТАН КҮЗӘТҮ
Кристаллар молекулалардан, атомнардан яки сез алга таба
танышачак башка кисәкчекләрдән тора. Кристаллны барлыкка
китерүче кисәкчекләрнең табигатенә бәйсез рәвештә, аның эчке
структурасы ныклы бер тәртипкә килгән була. Бу эш барышында
сез төрле матдәләрнең кристалларын табарсыз һәм аларның
формаларын күзәтерсез. Башлангыч һәм табыла торган матдә¬
ләрнең исемнәрен, шулай ук аларның формулаларын хәтердә
калдыру мәҗбүри түгел.
Эшне башкару алдыннан микроскоп белән эш итү кагыйдәлә¬
ре язылган инструкция белән танышыгыз.
1 нче тәҗрибә. Шикәр комы бөртеген предмет пыяласына ур¬
наштырыгыз һәм микроскоптан җентекләп карагыз. Сез нәрсә
күзәтәсез? Күзәтүләрегезне лаборатор эшләр журналына язып
куегыз.
2 нче тәҗрибә. Нәкъ шундый тәҗрибәне елга комы, аш тозы
һәм сезгә укытучы биргән башка матдәләрнең бөртекләре белән
8 нче рәсем. Сыегайтылган эремәләр¬
дән аерылып чыгучы MgNHiPOi-бНаО
кристаллары.
9 нчы рәсем. Куертылган эремәләр¬
дән аерылып чыгучы MgNHiPOi-бНзО
кристаллары.
14
үткәрегез. Күзәтүләрегезне ла¬
боратор эшләр журналына язып
барыгыз.
3 нче тәҗрибә. Предмет пыя¬
ласына бер тамчы магний хло¬
риды MgCl2 эремәсен тамы¬
зыгыз. Капилляр пипетка ярдә¬
мендә аңа бер тамчы аммоний
хлориды NFhCl эремәсен, ә ан¬
нары бер тамчы аммиакның
FKN куертылган эремәсен өстә¬
гез. Ниһаять, иң соңында эре¬
мәгә натрий гидрофосфаты
Na2HPO4-GH2O кристалын кер¬
тегез. Предмет пыяласын кай¬
нар сулы савыт капкачына ку¬
еп җылытыгыз һәм суыткан¬
нан соң аны саклык белән генә
микроскопның окуляры астына
куегыз. Сез, барлыкка килгән
MgNH4PCh-GH2O кристаллары,
10 нчы рәсем. CaSO4-2Н2О (гипс)
кристаллары.
магний аммоний фосфатының
призма (8 нче рәсем) яки вак
кристалларның кушылып үсүе сәбәпле, алты нурлы йолдыз фор¬
масында (9 нчы рәсем) булуларын күрерсез. Күзәтүләрегезне
лаборатор эшләр журналына язып куегыз. Кристалларның фор¬
маларын рәсемдә ясап күрсәтегез.
4 нче тәҗрибә. Кальций хлориды CaCl2 эремәсе тамчысын
предмет пыяласына тамызыгыз. Аннары сыегайтылган сульфат
кислотасы H2SO4 эремәсе тамчысын өстәгез һәм кайнар сулы
савыт өстенә куеп җиңелчә генә парга әйләндерегез. Микро¬
скоптан сез энә көлтәләрен — гипс CaSO4-2H2O кристалларын
күрерсез (10 нчы рәсем).
5 нче тәҗрибә. Кургаш ацетаты Pb(CH3COO)2 эремәсе тамчы¬
сын каплау пыяласына тамызыгыз. Аннары 1 тамчы сыегайтыл¬
ган сульфат кислотасы H2SO4 эремәсен өстәгез. Микроскоптан
нәрсә күзәтәсез? Күзәтүләрегезне лаборатор эшләр журналына
язып куегыз. Кристалларның формаларын рәсемдә ясап күрсә¬
тегез.
§ 6. ГАДИ МАТДӘЛӘР
Сез, мөгаен, игътибар иткәнсездер, химик кушылмаларны бер
химик элемент яисә берничә химик элемент барлыкка китерүе
мөмкин.
Бер химик элемент атомнарыннан хасил булган химик кушыл¬
ма гади матдә дип атала.
Сез нинди гади матдәләрне беләсез? Водород, кислород, ти¬
мер, азот, бакыр, күкерт — болар барысы да гади матдәләр.
15
Гади матдәләрнең исемнәре га¬
дәттә атомнары аларны бар¬
лыкка китергән химик элемент¬
ларның исемнәренә туры килә¬
ләр.
Үзлекләренә карап гади
матдәләрне металларга һәм не-
металларга бүләләр. Сезгә та¬
ныш булган металларны санап
чыгыгыз. Иң әүвәл аларның
нинди уртак үзлекләрен билге¬
ләп үтәргә була? Тимер, алю¬
миний, кургаш, аккургашның
тышкы күренешләре нинди бу¬
луын исегезгә төшерегез. Алар
металлик ялтыравыклы, бары¬
сы да диярлек көмешсыман
ак яки соры төстә. Металлар
электр тогын, җылылыкны ях¬
шы үткәрәләр, аларга пластик¬
лык хас. Металларның гомуми
үзлекләрен аларның эчке төзе¬
леше охшаш булу белән аңла¬
тырга мөмкин. Аларның атом¬
нары атомлы кристалларның
металлик кристаллар дип ата¬
ла торган аерым бер төрен бар¬
лыкка китерәләр. Металлик
кристалларда атомнар арасын¬
дагы химик бәйләнешләрнең
үзенчәлекләре турында сез ки¬
ләчәктә белерсез (38 нче пара¬
графны карагыз).
Сезгә шулай ук кайбер не-
металлар да таныш. Бу — кү¬
керт, фосфор, кислород, водо¬
род, азот. Неметалларның үз¬
лекләрендә, металлардагы бул¬
ган охшашлык кебек, уртаклык
юк. Гадәттәге шартларда водо¬
род — газ, ә күкерт — уалучан
каты матдә. Алмаз гаять каты,
әмма уалучан. Кислород — газ,
ә кремний — авыр эретелүчән
кристаллик матдә.
11 нче рәсем. Кайбер молекулаларның
һәм кристалларның схема рәвешендә
сурәтләнеше.
16
Каты хәлдә кайбер неметалларга атомлы кристаллар, ә баш¬
каларына — молекуляр кристаллар хас. Неметаллар практик як¬
тан электр тогын үткәрмиләр. Болар барысы да неметалларның
үзлекләре металларның үзлекләренә капма-каршы булуын рас¬
лый.
Гади матдәләрнең химик формулаларын ничек язарга? Моле¬
куляр төрдәге кушылмаларның химик формулалары молекула¬
ларның составын күрсәтүен сез беләсез инде, мәсәлән: Нг (водо¬
род), Ог (кислород), N2 (азот). Әгәр гади матдә атомлы крис¬
таллдан торса, аның химик формуласын ничек язарга? Мондый
матдәнең кристаллары бик күп һәм даими булмаган сандагы
атомнардан барлыкка килгәннәр бит. Андый гади матдәләрнең
химик формулаларын тиешле элементның символы ярдәмендә
язалар. Шулай итеп, тимернең химик формуласы Fe, алюминий¬
ныкы Al, кремнийныкы Si, бакырныкы Cu, алмазныкы С.
Химик элементларның Д. И. Менделеев периодик системасын¬
да неметалл гади матдәләрен барлыкка китерүче элементлар
таблицаның уң як өлешендә тупланганнар. II нче төсле рәсем¬
дәге таблицада неметаллик элементлар металлик элементлардан
бор (B) белән астатны (At) тоташтыручы диагональ сызык бе¬
лән аерып куелган.
? 1. 11 нче рәсемдә гади матдәләр молекулаларының сурәтләрен табыгыз
A һәм аларның химик формулаларын язып куегыз.
2. 1 нче күнегүдә китерелгән гади матдәләрнең кайсына каты хәлдә:
а) молекуляр кристаллар; б) атомлы кристаллар хас? Атомлы кристал¬
лардай торучы гади матдәләрнең химик формулаларын язып алыгыз.
§ 7. КАТЛАУЛЫ МАТДӘЛӘР
Төрле химик элементлардан хасил булган
химик кушылма катлаулы матдә дип атала.
Cy НгО, кварц SiOs, углекислый газ СОг,
аммиак H3N — катлаулы матдәләр. Бу матдә¬
ләрнең һәркайсын ике элемент барлыкка ки¬
тергән; шикәр С12Н22О11 өч элементтан хасил
булган.
Катлаулы матдәләрнең составын экспери¬
менталь тикшеренүләргә нигезләнеп ачыклый¬
лар. Суның составын билгеләү өчен тәҗрибә
үткәрик. 12 нче рәсемдә күрсәтелгән прибор¬
дагыча су аркылы электр тогын уздырыйк. Бу
очракта приборның көпшәләрендә газлар җые¬
лыр. Көпшәләрнең берсендә газның күләме
икенче көпшәдәгедән икеләтә күбрәк булуына
игътибар итегез.
12 нче рәсем. Суны электр тогы белән таркату приборы.
2 Г1-236
17
Азрак күләмдә җыелган газга пыскып торган чыраны керт¬
кәндә, чыра кабынып китә. Димәк, бу газ — кислород Ог- Икенче
газ, янып торган чыраны керткәндә, үзе кабынып китә. Бу газ —
водород Нг.
Шулай итеп, без су составына ике элемент — водород һәм
кислород керүен аңлатып бирдек. Хасил булган водородның кү¬
ләме кислород күләменнән ике тапкыр күбрәк. Шунлыктан су
молекуласында водород атомнары саны кислород атомнарыны-
кына караганда икеләтә артыграк дип фикер йөртергә мөмкин.
Ул чагында суның химик формуласы Н2О килеп чыга.
Бу формуланың дөреслеге суны башкача тикшерүдән алынган
мәгълүматларга тулысынча туры килә.
Шул рәвешчә, кушылманың формуласын химик анализга ни¬
гезләнеп чыгаралар. Аның асылы шуннан гыйбарәт: өйрәнелә
торган матдәне таркалуга дучар итәләр һәм барлыкка килгән
продуктларның сыйфат һәм микъдар составларын ачыклыйлар.
Анализ мәгълүматларын кулланып, исәпләүләр башкаралар. Ан¬
дый исәпләүләргә мисаллар белән сез соңрак танышырсыз.
Сезгә мәгълүм ки, төзелеше билгеле булганда матдәнең
составын белергә мөмкин. Әйтик, тикшеренүләрдән чыгып, цинк
оксиды кристалларының атомлы төзелешкә ия булулары ачык¬
ланган. Аның кристалында цинкның һәр атомы дүрт кислород
атомы белән чолгап алынган (13 нче рәсем).
Үз чиратында һәр кислород атомы дүрт цинк атомы белән
чолгап алынган:
Шулай итеп, цинкның бер атомына кислородның бер атомы
туры килә. Цинк оксидының химик формуласы ZnO.
Химик кушылмалар арасында неорганик һәм органик матдәләрне аералар.
Соңгыларына углерод кушылмаларының иң зур күпчелеген кертәләр. Калган
элементлар хасил иткән кушылмаларны, шулай ук углерод элементының бар¬
лык гади матдәләрен неорганик кушылмаларга кертәләр. Билгеле булган неор¬
ганик кушылмалар саны 500 мең чамасы. Алар Җир литосферасын (җир ка¬
быгын), гидросферасын (океаннар, диңгезләр, елгалар, бозлыклар) һәм атмо¬
сферасын барлыкка китерәләр.
? I. 1, 2, 4 һәм 11 нче рәсемнәрдә катлаулы матдәләрнең сурәтләрен та¬
быгыз. Аларның формулаларын төзегез. Бу матдәләрнең кайсылары моле-
A куляр төзелешкә ия, ә кайсыларына атомлы кристаллар хас? (Формула-
18
ларны төзегәндә элементларның сим¬
волларын матдәнең исемендә бу эле¬
ментларның әйтелеше тәртибендә
язалар. Рәсемнәрдә күрсәтелгән во¬
дород кушылмаларының формула¬
ларында водородның символы бе¬
ренче урында языла.)
2. Әгәр структурасы цинк оксиды
кристалының структурасы кебек үк
булса (13 нче рәсем), цинк сульфи¬
дының формуласын төзегез.
3. Хлороводород HCl молекуляр
төзелешкә ия, ә алюминий хлориды
AICla — атомлы челтәрдән торучы
кристаллик матдә. Бу матдәләрнең
кайсына югарырак эретелү темпера¬
турасы хас?
4. Ни өчен гади һәм катлаулы
матдәләрне химик кушылмалар дип
атыйлар? Фикерләрегезне гади һәм
катлаулы матдәләрнең төзелеш
схемалары белән раслагыз.
13 нче рәсем. Цинк оксиды кристалы¬
ның төзелеше.
5. Тимер оксиды кристаллары магний оксиды кристаллары кебек үк (11 нче
рәсемне карагыз) төзелгәннәр. Тимер оксидының химик формуласы нинди?
Җавапны дәлилләгез.
6. Химик анализ күкерт оксидында 1 күкерт S атомына 3 кислород O ато¬
мы туры килүен күрсәткән. Күкерт оксидының формуласын төзегез.
§ 8. МОЛЬ. МОЛЯР МАССА
а) Чагыштырма атом массасы; б) чагыштырма молекуляр масса төшен¬
чәләрен әйтеп бирегез.
Җисемнең озынлыгы метрларда, матдәнең массасы кило¬
граммнарда үлчәнүен сез беләсез инде. Ә матдәнең микъдарын
ничек үлчиләр соң? Матдәнең микъдарын үлчәү өчен махсус
берәмлек — моль кабул ителгән.
Моль — массасы 0,012 кг (12 г) булган углеродтагы атомнар
санынча кисәкчекләрдән (атомнардан, молекулалардан яки баш¬
калардан) торучы матдә микъдары.
Бу 1 моль тимердә, 1 моль бакырда, 1 моль күкерттә, 1 моль
углеродта атомнар саны бер үк дигән сүз. Бу 1 моль су, 1 моль
углекислый газ, 1 моль молекуляр водород бер үк сандагы
молекулалардан тора дигән сүз. һәр ике очракта да 1 мольдә
булган кисәкчекләр (атомнар, молекулалар) саны 1 моль угле¬
родтагы атомнар санына тигез.
Эксперименталь юл белән 1 моль матдәдә 6,02-IO23 кисәкчек
(атомнар, молекулалар һәм башкалар) булуы ачыкланган:
»т 6,02* IO23 г* no 1 о23 I
Na= —: = 6,02 • 102d моль 1
1 моль
(Va саны Авогадро саны дип атала (XIX гасырда яшәгән италь¬
ян галиме А. Авогадро исеме белән).
2* 19
Авогадро саны гаять зур сан. Аның никадәр зур булуын ачык
итеп күрсәтү өчен түбәндәге чагыштыруны китерик. Радиусы
14 см булган 6,02-IO23 шарны бергә җыйганда, аларның гомуми
күләме якынча бөтен безнең Җир планетасы биләп торган кү¬
ләмгә тиңләшер иде!
Ни өчен моль төшенчәсенә нигез итеп 12 г углеродтагы ки¬
сәкчекләр саны алынган? Бу шуның белән билгеләнәдер ки, чөн¬
ки чагыштырма атом массасы һәм чагыштырма молекуляр масса
берәмлеге итеп углерод атомы массасының 1/12 өлеше сайланган,
ә углеродның чагыштырма атом массасы 12 гә тигез.
Матдәнең массасы һәм аның микъдары арасындагы үзара
бәйләнешне чагылдыру өчен моляр масса төшенчәсе кертелгән.
Матдәнең моляр массасын M аның массасының т шул матдәнең
массасына туры килгән микъдарына v («ню» дип укыла) чагыш¬
тырмасыннан табалар:
Аны мольгә килограммнар (кг/моль) яки мольгә граммнар
(г/моль) белән күрсәтәләр.
Моляр массаның санча кыйммәте чагыштырма атом (молеку¬
ляр) массага тигез булуына төшенү кыен түгел. Мисалларны
тикшерик. Углеродның моляр массасы нинди? Ar = 12 булган¬
лыктан,
M (C) = 12 г =12 г/моль
' ' 1 моль '
Ә кислородның Ог моляр массасы күпме булыр? Alr(Oa) =
= 32. Алай булгач,
M (Ог) = , 32 г =32 г/моль
' ’ 1 моль '
Катлаулы матдәләрнең моляр массаларын аларны хасил итү¬
че химик элементларның моляр массаларыннан чыгып исәпләр¬
гә мөмкин. Әйтик, SiOa өчен:
Al(SiOa) = M(Si) 4~2М(О) = 28 г/моль + 2-16 г/моль = 60 г/моль
Моляр массаны белгәндә, матдәнең бирелгән массасына т
шул матдәнең нинди микъдары туры килүен исәпләп чыгару ан¬
сат. 180 г кварцка матдәнең күпме микъдары туры килүен бил¬
гелик:
Zn(SiOa)
V(SiO2) = M(Si02) , ул чагында
v(SiOa)= Г—=3 моль
' ' 60 г/моль
Шулай итеп, 180 г кварц —ул аның 3 моль матдә микъда¬
рына туры килүче массасы.
20
• 1. а) Суның; б) бакыр оксидының CuO; в) натрий хлоридының NaCl;
г) тимер сульфидының FeS моляр массаларын исәпләп чыгарыгыз.
2. Матдә микъдары 2 моль булган химик кушылмада ничә молекула бар?
3. Матдә микъдары: а) 2 моль; б) 4 моль тәшкил итсә, молекуляр азотта
Na ничә кисәкчек — атомнар һәм молекулалар бар?
4. Cy молекуласының массасы 2,99-10“ 6 кг. 1 моль микъдардагы суның
массасы күпмегә тигез?
5. Матдә микъдары 1 моль булган суда H2O ничәшәр H һәм O атомнары
бар?
18 г су үлчәп алыгыз. (Бу чама белән дүрт бал кашыгы.) 18 г суда ничә
молекула булыр?
4 нче лаборатор дәрес
ГАДИ МАТДӘЛӘРДӘН КАТЛАУЛЫ МАТДӘЛӘР ТАБУ
Матдәләрнең моляр массалары зурлыкларын, мәсәлән, бил¬
геле бер массалы матдәне табу өчен белергә кирәк. Безгә 11 г
тимер сульфиды FeS катлаулы матдәсен табарга (синтезларга)
кирәк булсын ди. Ул тимер Fe һәм күкерт S атомнарыннан
барлыкка килгәнлектән, аны тимер һәм күкерт гади матдәләре
үзара тәэсир итешкәндә табып була дип фараз итәргә мөмкин.
Дөрестән дә, бу реакция тормышка ашырырлык һәм сез аны кү¬
зәткән идегез инде. Хәзер сезгә аны мөстәкыйль рәвештә баш¬
карырга кирәк булачак. Әмма без элек гади матдәләрне нинди
микъдарларда алырга кирәклеген хәл итәргә тиеш. Формулага
караганда, 1 моль тимер сульфидында FeS 1 моль тимер Fe атом¬
нары һәм 1 моль күкерт S атомнары бар. Матдәләрнең моляр
массаларын китерик: M(FeS) =88 г/моль, M(Fe)=56 г/моль,
M(S) =32 г/моль. Димәк, 88 г FeS (1 моль-88 г/моль) табу
өчен 56 г Fe (1 моль-56 г/моль) һәм 32 г S (1 моль-32 г/моль)
алырга кирәк. Моннан 11 г FeS табу өчен 7 г Fe һәм 4 г S алыр¬
га кирәк булуын исәпләп чыгару кыен түгел.
Эшне башкару өчен сезгә: тимер һәм күкерт порошоклары,
пробирка, тоткыч, горелка (спиртовка), киле белән төйгеч, маг¬
нит, су салынган стакан кирәк булачак. Эшне башкару өчен ба¬
рысы да әзер булуын тикшерегез.
Эшне сез мондый эзлеклелектә үткәрәчәксез:
1. Күрсәтелгән массалы тимер сульфидын табу өчен кирәкле
тимернең һәм күкертнең массаларын исәпләп чыгарыгыз.
2. Тимернең һәм күкертнең исәпләп чыгарылган массаларын
үлчәп алыгыз.
3. Порошокларны бер бит кәгазь кисәгенә салып яхшылап
аралаштырыгыз.
4. Катнашманы пробиркага салыгыз. Горелканы (спиртовка¬
ны) кабызыгыз. Катнашма салынган пробирканы тоткычка кысты¬
рыгыз һәм горелка (спиртовка) ялкынында җиңелчә генә җылы¬
тыгыз. Катнашма кыза башлагач, җылытуны туктатыгыз. Кат¬
нашма кызудан туктагач, реакцияне тәмамланган дип исәпләргә
була.
21
5. Суынганнан соң барлыкка килгән продуктны пробиркадан
чыгарыгыз, килегә салып порошокка әверелгәнче ваклагыз. Ча¬
гыштырып карагыз, магнит кырында тимер сульфиды порошогы
һәм тимер белән күкерт порошоклары катнашмасы үзләрен ничек
тоталар. Шулай ук бу порошокларны сулы стаканга салганда ни
күзәтелүен дә чагыштырыгыз.
6. Күзәтелгән фактларга аңлатма бирегез.
? 1. 22 г тимер сульфиды табу өчен күпме күкерт һәм тимер алырга кирәк?
A 2. 12 г магнийны яндырганда барлыкка килүче магний оксидының массасы
күпме булыр?
3. Синтез өчен 65 г цинк һәм 16 г күкерт алынган булса, аның нәтиҗәсе
нинди булыр?
КАТЛАУЛЫ МАТДӘНЕҢ ФОРМУЛАСЫН ЧЫГАРУГА
КҮНЕГҮЛӘР
Матдәнең химик формуласын эксперименталь мәгълүматлар¬
дан чыгып ачыклыйлар. Кайбер мисалларны тикшерик.
1 нче мисал. Химик кушылманың 291 г массалы үрнәгендә
195 г цинк һәм 96 г күкерт бар. Бу кушылманың формуласы
нинди?
Бу сорауга җавап бирү өчен цинк матдә микъдарының күкерт
матдә микъдарына чагыштырмасын табарга кирәк. Матдә микъ¬
дарын
формуласы буенча табабыз.
Д. И. Менделеев периодик системасын кулланып, моляр мас¬
саларны билгелик: M(Zn)-65 г/моль һәм M(S) =32 г/моль.
Цинкның һәм күкертнең бирелгән үрнәктәге матдә микъдарларын
табабыз:
/•ух 195 г о 96 г о
V( Zn) = -т= =3 МОЛЬ; V(S) = -X7;—7 =3 моль
' ' 65 г/моль ' ' 32 г/моль
Табылган зурлыкларның чагыштырмалары
v(Zn) :v(S)=3 моль:3 моль=1 моль:1 моль
тәшкил итә. Димәк, цинкның 1 атомына күкертнең 1 атомы
туры килә.
Җавап. Кушылманың формуласы ZnS. Бу цинк сульфиды.
(Химик формулада беренче урында металл, ә аннары неметалл
символы языла.)
1 нче бирем. Химик анализ ниндидер бер кушылманың 160 г
массалы үрнәгендә 128 г бакыр һәм 32 г кислород барлыгын
күрсәткән. Кушылманың формуласы нинди?
2 нче бирем. Химик кушылманың 40,2 грамм массалы үрнә¬
гендә 26,8 г бакыр 13,4 г күкерт бар. Бу кушылманың форму¬
ласын китереп чыгарыгыз.
22
3 нче бирем. Ниндидер бер кушылманың 32,5 грамм массалы
үрнәгендә 21,3 г хлорга, ә калган масса тимергә туры килә.
Бу кушылманың формуласы нинди?
4 нче бирем. 33 г углекислый газда 9 г углерод бар, ә кал¬
ганы — кислород. Углекислый газның формуласын китереп чыга¬
рыгыз.
5 нче бирем. Түбәндәге мәгълүматлар буенча кварцның фор¬
муласын ачыклагыз: 30 г кварцта 14 г кремний һәм 16 г кисло¬
род бар.
Кварц һәм углекислый газның формулаларын чагыштырыгыз
(4 нче биремне карагыз). Кайсы очракта формула молекуланың
чынбарлыктагы составын, ә кайсы очракта беренче һәм икенче
элемент атомнарының чагыштырмаларын күрсәтә. Ни өчен, угле¬
кислый газдан аермалы буларак, кварц — авыр эретелүчән мат¬
дә?
2 нче мисал. Күкерт һәм кислородның һәркайсына 50% мас¬
са өлеше туры килсә, кушылманың формуласын китереп чыга¬
рырга.
Күкертнең һәм кислородның моляр массаларын билгелик.
Моның өчен Д. И. Менделеев периодик системасыннан файда¬
ланыйк: M(S) =32 г/моль; M(O) = 16 г/моль.
Мәсьәләнең шартыннан килеп чыкканча, 100 г күкерт окси¬
дында 50 г күкерт һәм 50 г кислород бар. Бу массаларның
күкерт һәм кислород матдәләренең нинди микъдарларына туры
килүен ачыклыйбыз:
v(S) = оо 50/ Г— — 1,5625 моль;
' ' 32 г/моль
V(O) = 50 г—=3,125 моль.
' ' 16 г/моль
Күкерт һәм кислородның мольләр чагыштырмасы
V (S) :v(O) = 1,5625:3,125 = 1:2
тәшкил итә.
Шулай итеп, күкерт оксидында күкерт һәм кислород атом¬
нарының сан чагыштырмасы 1:2 була.
Җавап. Кушылманың формуласы: SO2.
6 нчы бирем. Бакыр һәм кислород химик элементларының
масса өлешләре тиңдәшле рәвештә 0,8 һәм 0,2 булса, бакыр ку¬
шылмасының формуласын китереп чыгарыгыз.
7 нче бирем. Аммиакның составына 82,35% азот һәм 17,65%
водород керүе ачыкланган. Шул мәгълүматлар буенча кушыл¬
маның формуласын табыгыз. Җавапның дөреслеген аммиакның
чагыштырма молекуляр массасы зурлыгы буенча тикшерегез, ул
17 гә тигез.
8 нче бирем. Матдә составында 11,11% H һәм 88,89% O бар.
Нинди кушылма шундый составка ия булып тора?
9 нчы бирем. Күкертнең кислородлы кушылмаларының бер¬
сендә 40% S һәм 60% O бар. Бу кушылманың формуласы нинди?
23
КУШЫЛМАЛАРНЫҢ ФОРМУЛАЛАРЫН ТӨЗҮГӘ
КҮНЕГҮЛӘР
Үткән дәрестә сез эксперименталь мәгълүматлар нигезендә
кушылмаларның составларын билгеләдегез һәм аларның форму¬
лаларын китереп чыгардыгыз.
Кайбер химик кушылмаларның сез тапкан формулаларын
языйк: CuO1 СО2, SO3, НгО.
Бу матдәләрне икешәр элемент хасил иткән һәм бу элемент¬
ларның берсе кислород. Бер элемент матдә микъдарының икенче
элемент матдә микъдарына чагыштырмасына игътибар итегез.
CuO да 1 моль Cu атомнарына 1 моль O атомнары туры килә,
СОг дә 1 моль C атомнарына 2 моль O атомнары туры килә һ. б.
Күргәнебезчә, атомнарның мольләр саны чагыштырмасы бик
гади. Күрсәтелгән закончалык катлаулы матдәләрнең составын
ачыклаучы эксперименталь мәгълүматларда күзәтелә.
Бу закончалыктан чыгып, химик кушылмаларның формулала¬
рын химик анализ нәтиҗәләреннән файдаланмыйча да төзергә
мөмкин. Бары тик гади математик исәпләүләр башкарырга һәм
оксидлашу дәрәҗәсе турындагы белемнәрне кулланырга кирәк.
Оксидлашу дәрәҗәсе — кушылмадагы элементка бирелә тор¬
ган уңай яки тискәре сан ул. Әгәр кушылма ике элементтан
торса, аның берсенә уңай оксидлашу дәрәҗәсе, ә икенчесенә
тискәре оксидлашу дәрәҗәсе бирелә.
AmBn составлы кушылманы тикшерик. A элементының оксид¬
лашу дәрәҗәсе х, ә B элементының оксидлашу дәрәҗәсе у дип
х у
фараз итик. АтВлны язып куйыйк. Элементларның х һәм у ок¬
сидлашу дәрәҗәләре белән бу элементларның т һәм п индекс¬
лары арасындагы бәйлелек
in ти
тх-\- пу = О, тх— —пу, яки — = ү-
тигезләмәсе белән күрсәтелә.
Н2О формуласын тикшерик. Күпчелек кушылмаларда водо¬
родның оксидлашу дәрәҗәсе +1, ә кислородның оксидлашу дә¬
рәҗәсе —2. Cy формуласын гомуми Hn Qn рәвештә языйк. Бу
очракта X= 1, у= — 2, т — 2, п — 1, ягъни
т = _у_ . 2 _ _ ( — 2) 2 _ 2
п х ’ 1 1’1 1
Cy формуласында индекслар 2:1 чагыштырмасында була.
Кушылмаларда кайсы элемент уңай оксидлашу дәрәҗәсе,
ә кайсы элемент тискәре оксидлашу дәрәҗәсе күрсәтүен ничек
белергә соң? Химик элементларның түбәндә китерелгән рәтенә
карыйк. (Бу рәтне теоретик дәлилләү 37 нче параграфта тикше¬
релә) :
F O N Cl Br S P C H Si Al Mg Ca Na Cs
24
Ике элементтан торган кушылмаларда бу рәттә сулдарак
урнашкан химик элемент — тискәре оксидлашу дәрәҗәсенә, ә уң-
дарак урнашканы уңай оксидлашу дәрәҗәсенә ия була. Әйтик,
NF3 кушылмасында азот химик элементының уңай оксидлашу
дәрәҗәсе +3 кә, ә фторның тискәре оксидлашу дәрәҗәсе —1 гә
тигез. Күргәнебезчә, ике элементтан торган кушылманың фор¬
муласында башта уңай оксидлашу дәрәҗәле элементның симво¬
лы, ә аннары тискәре оксидлашу дәрәҗәле элементның символы
языла.
1 нче мисал. Күкертнең кислородлы кушылмасының форму¬
ласын төзергә. Бу кушылмада күкертнең оксидлашу дәрәҗәсе
х у
+ 4. Гомуми рәвештә кушылманың формуласы SmOn була. Га¬
дәттә кислородның оксидлашу дәрәҗәсе —2 гә тигез, ул чагында
х = 4, у— —2, /п = ?, п = ?
т у _ т ( — 2) 1
п х ’ п 4 2
Җавап. т=1, п = 2, ягъни күкертнең 1 атомына кислррод-
ның 2 атомы туры килә. Кушылманың формуласы SO2.
1 нче бирем. Углеродның оксидлашу дәрәҗәсе +4 булса,
углерод белән кислород кушылмасының формуласын төзегез.
2 нче бирем. Кремнийның оксидлашу дәрәҗәсе +4 булса,
кремний белән кислород кушылмасының формуласы нинди?
3 нче бирем. Алюминий Ң-З оксидлашу дәрәҗәсен күрсәтсә,
алюминий белән кислород кушылмасының составы нинди форму¬
ла белән билгеләнер?
2 нче мисал. CI2O7 кушылмасында хлорның оксидлашу дәрә¬
җәсен билгеләргә.
Хәтерегезгә төшерик, кислородның оксидлашу дәрәҗәсе —2
х у
гә тигез. CI2O7 яки ClmOn кушылмасы өчен: ш = 2, п = 7, у= —2,
х = ?
т
п
2 = 2х=14, х = 7
х 7 х
Җавап. Cl2O? дә хлорның оксидлашу дәрәҗәсе +7 гә ти¬
гез.
4 нче бирем. Түбәндәге кушылмаларда элементларның оксид¬
лашу дәрәҗәләре нинди: a) HCl; б) NaCl; в) CCU; г) H2S;
д) CuS; е) SO3; ж) HF; з) SFe?
5 нче бирем. Магнийга даими оксидлашу дәрәҗәсе хас.
MgO кушылмасында аның кыйммәтен билгеләгез. MgS та кү¬
кертнең оксидлашу дәрәҗәсе нинди?
6 нчы бирем, а) Фосфор белән кислород; б) фосфор белән
күкерт; в) фосфор белән фтор кушылмаларының формулаларын
языгыз һәм элементларның оксидлашу дәрәҗәләрен куеп чы¬
гыгыз. Бу кушылмаларда фосфорның оксидлашу дәрәҗәсе Ң-5
булуын исәпкә алыгыз.
25
Д. И. МЕНДЕЛЕЕВ ПЕРИОДИК СИСТЕМАСЫНДА УРНАШУЛАРЫНА
КАРАП ЭЛЕМЕНТЛАРНЫҢ ОКСИДЛАШУ ДӘРӘҖӘЛӘРЕН
БИЛГЕЛӘҮГӘ КҮНЕГҮЛӘР
Элементларның Д. И. Менделеев периодик системасыннан
файдаланып эш итик.
Химик элементларның Д. И. Менделеев периодик системасын
без сезнең белән җитәрлек белем туплагач өйрәнербез. Хәзергә
исә периодик система табигатьнең иң мөһим законнарыннан бер¬
се — периодик законның гәүдәләнеше булуын гына басым ясап
әйтик. Периодик законны Д. И. Менделеев химик элементлар¬
дан барлыкка килүче кушылмаларның составларына һәм үзлек¬
ләренә анализ ясау нигезендә ачкан. Игътибар итегез, периодик
системада химик элементның төгәл билгеле урыны бар: ул химик
элементларның билгеле бер вертикаль рәте — төркемгә һәм гори¬
зонталь рәте — периодка керә. Системада 8 төркем һәм 7 период.
Химик элемент кергән төркем һәм периодның номерлары элемент¬
ның системадагы үзенә бертөрле координатлары булып торалар
һәм алар буенча элементның күп кенә үзлекләре турында фи¬
кер йөртергә мөмкин.
Бу дәрестә без периодик системада урнашуларына карап
элементларның оксидлашу дәрәҗәләренең кыйммәтләрен ничек
билгеләргә икәнен тикшерербез. Элементлар, кагыйдә буларак,
төрле оксидлашу дәрәҗәләре күрсәтәләр. Мәсәлән, VII төркем
элементы хлорга 4-7, 4-5, +3, 4-1, —1 оксидлашу дәрәҗәләре
хас. Элементның югары уңай оксидлашу дәрәҗәсенең кыйммә¬
те үзе урнашкан төркем номерына санча тигез була. Элементның
түбән тискәре оксидлашу дәрәҗәсе шулай ук аның периодик сис¬
темада кайсы төркемдә урнашуына карап билгеләнә. Түбән ок¬
сидлашу дәрәҗәсен N —8 формуласыннан исәпләп чыгарырга
була (V —төркем номеры).
2 һәм 3 нче период элементларының мөмкин булган оксид¬
лашу дәрәҗәләре 1 нче таблицада күрсәтелгән.
Бу мәгълүматлардан күренгәнчә, кайбер элементлар тискә¬
ре оксидлашу дәрәҗәсе күрсәтәләр, ә башкалары күрсәтмиләр.
Моның сәбәпләрен сез химик элементларның үзлекләрен өйрә¬
нү барышында белерсез.
1 нче мисал. Күкертнең югары уңай һәм түбән тискәре ок¬
сидлашу дәрәҗәләре нинди?
Күкерт химик элементы периодик системаның VI төркемендә
урнашкан. Димәк, аның югары уңай оксидлашу дәрәҗәсе 4-6
булырга тиеш. N —8 формуласы буенча аның тискәре оксид¬
лашу дәрәҗәсе —2 гә тигез.
1 нче бирем, а) Хлорның; б) азотның; в) кислородның тис¬
кәре оксидлашу дәрәҗәләре нинди? Җавапны 1 нче таблица¬
дагы мәгълүматлар белән чагыштырыгыз.
26
1 нче таблиц а. Д. И. Менделеев периодик системасының
2 нче һәм 3 нче период элементларының оксидлашу
дәрәҗәләренең кайбер кыйммәтләре
2 нче период
Төркем
I
II
III
IV
V
VI
VII
Химик элемент
Югары уңай оксидлашу
дәрәҗәсе
Түбән тискәре оксидлашу
дәрәҗәсе
Li
+ 1
Be
+ 2
B
+3
C
+ 4
— 4
N
+ 5
-3
O
—2
F
— 1
3 нче период
Төркем
I
II
III
IV
V
VI
VII
Химик элемент
Югары уңай оксидлашу
дәрәҗәсе
Түбән тискәре оксидлашу
дәрәҗәсе
Na
+ 1
Mg
+ 2
Al
+ 3
Si
+ 4
— 4
P
+ 5
-3
S
+6
— 2
Cl
+ 7
— 1
2 нче мисал. Алюминий һәм кислород кушылмасының соста¬
вы нинди формула белән күрсәтелер? Элегрәк китерелгән рәттә
(24 нче бит) кислород алюминийдан сулдарак урнашкан. Ди¬
мәк, бу кушылмада алюминий уңай оксидлашу дәрәҗәсенә, ә
кислород тискәре оксидлашу дәрәҗәсенә ия булып торалар.
Алюминий химик элементы периодик системаның III төркеме¬
нә керә. Шунлыктан аның югары оксидлашу дәрәҗәсе +3 була.
Кислород — VI төркем элементы. Димәк, аның тискәре оксид¬
лашу дәрәҗәсе V—-8= —2 гә
X у
AlmOn; х —3, у= —2.
тут
Күренгәнчә, — = ——, — =
1 г ’ п х п
тигез. Кушылманың формуласы
( — 2) т _ 2
3 ’ п ~~ 3
Димәк, алюминийның Al һәр ике атомына 3 кислород O ато¬
мы туры килә.
Җавап. Кушылманың формуласы: Al2O3 — бу алюминий ок¬
сиды.
2 нче бирем, а) Магний белән хлор; б) магний белән күкерт;
в) магний белән кислород кушылмаларының формулаларын тө¬
зегез.
3 нче бирем. Күкертнең кислород белән һәм күкертнең водо¬
род белән кушылмалары бар. Кушылмаларның берсендә күкерт
27
югары уңай, ә икенчесендә түбән тискәре оксидлашу дәрәҗә¬
ләренә ия булса, бу кушылмаларның составлары нинди?
4 нче бирем. 3 нче период элементларының кислород белән
кушылмаларының формулаларын төзегез.
5 нче бирем. 1 нче таблица мәгълүматларын кулланып, V
төркем элементлары — азот һәм фосфорның кислород белән
кушылмаларының формулаларын төзегез.
§ 9. ИКЕ ЭЛЕМЕНТЛЫ КУШЫЛМАЛАР
Табигать белемен, ботаника, физика, биологияне өйрәнгән¬
дә сез күп сандагы химик кушылмаларны очраттыгыз. Мөгаен,
сез химик кушылмаларны ничек классификацияләүләре һәм
аларга ничек исем бирүләре турында уйлангансыздыр. Химик
элементларның һәм аларның кушылмаларының классификациясе
һәм номенклатурасы — фән өчен мөһим проблема. Бу проблема¬
ның ничек хәл ителүе белән сез химияне өйрәнү дәвамында
танышырсыз.
Сезгә химик кушылмаларның гади һәм катлаулы матдәләргә,
ә гади матдәләрнең — бер элементлы кушылмаларның — үз чира¬
тында металларга һәм неметалларга бүленүе билгеле.
Ике элемент кушылганда нинди типтагы кушылмалар барлык¬
ка килүен тикшерик. Ике элементтан торып, аның берсе кисло¬
род булган, сезгә таныш кушылмаларны языйк:
MgO, AI2O3, CO2, SiO2, Р2О5
Бу кушылмалар — оксидлар. Кислород химик элементының
латинча исеменнән — Oxygenium (оксигениум) алынган. Оксид¬
ларда кислород химик элементының оксидлашу дәрәҗәсе —2 бу¬
ла.
Оксидлашу дәрәҗәсе —2 булган күкертнең ике элементлы
кушылмаларын ничек атыйлар икән? Күкертнең латинча исеме
Sulfur (сульфур), ә аның кушылмалары сульфидлар дип атала¬
лар. Менә сульфидларга кайбер мисаллар:
MgS, Al2S3, CS2, SiS2, P2S5
Ә менә ике элементлы кушылмаларның тагын бер рәте:
MgCl2, AlCl3, CCl4, SiCl4, PCl5
Аларның составына оксидлашу дәрәҗәсе —1 булган хлор химик
элементы керә. Бу кушылмалар хлоридлар дип аталалар.
Фторидларга
MgF2, AlF3, CF4, SiF4, PF5
кушылмалары керә.
28
Бер үк элемент, төрле оксидлашу дәрәҗәләре күрсәтеп, бер¬
ничә оксид, берничә сульфид, берничә хлорид һ. б. барлыкка
китерүе мөмкин. Аларны аеру өчен, кушылманың исемен яз¬
ганда җәяләр эчендә элементның оксидлашу дәрәҗәсе күрсә¬
телә. Мәсәлән, тимернең оксидлары: FeO — тимер (II) оксиды,
РегОз — тимер (III) оксиды; хлоридлары: FeCb — тимер (II)
хлориды, FeCh — тимер (III) хлориды.
Дикъкать белән үзегезгә бирелгән оксидларның, сульфид¬
ларның һәм хлоридларның үрнәкләрен карагыз. Аларның тышкы
күренешләрен тасвирлагыз һәм 2 нче таблицаны тутырыгыз.
2 нче таблица. Кушылмаларга тасвирлама
Кушылманың
исеме
Кушылманың
составы
Агрегат
хәле
Төсе
Исе
Ике элементлы кушылмалар табигатьтә киң таралган. Алар
күп кенә файдалы казылмаларның, кара һәм төсле металл руда¬
ларының составларына керәләр. Әйтик, сезгә табигать белеме
курсыннан таныш булган магнитлы, кызыл, коңгырт тимерташ¬
ларның составын башлыча тимер оксидлары тәшкил итә. Бу ру¬
далардан чуен һәм корыч эретеп алалар.
Кургаш ялтыравыгы дип аталган рудада нигездә кургаш (II)
сульфиды PbS, ә цинк обманкасында — башлыча цинк (II) суль¬
фиды ZnS була. Руда булмаган файдалы казылма — таш тозы
(аш тозы) натрий хлориды NaCl була инде. Аны техникада
киң кулланалар (сода, хлор һ. б. табу). Аны көнкүрештә фай¬
далану сезгә яхшы таныш. Кремний (IV) оксиды S1O2 кварц
(елга) комының төп компоненты, ул пыяла, цемент, бетон җи¬
тештерүдә кулланыла.
• 1. Бер үк химик элемент хасил иткән оксидның һәм сульфидның состав¬
ларын чагыштырыгыз. Аларның составларындагы уртаклык нәрсәдә кү¬
ренә?
А 2. а) Углекислый газга СОг; б) ис газына CO химик исемнәр бирегез.
3. Элементларның оксидлашу дәрәҗәләрен күрсәтегез һәм кушылмаларга
исемнәр бирегез: CaClj, CaO1 CaFj, CaS, CajNj.
4. Алюминийның оксидлашу дәрәҗһсе -j-З булса, кушылмаларның фор¬
мулаларын языгыз: а) алюминий хлориды; б) алюминий фториды; в) алю¬
миний оксиды; г) алюминий сульфиды.
5. Кушылмаларның формулаларын төзегез: а) хлор (VII) оксиды; б) кү¬
керт (VI) оксиды; в) күкерт (IV) оксиды; г) фосфор (V) оксиды; д) фос¬
фор (III) оксиды.
6. Тимер (II) һәм тимер (III) нең: а) кислород белән; б) күкерт белән;
в) фтор белән; г) хлор белән кушылмаларының формулалары һәм исем¬
нәре нинди булыр?
29
КУШЫЛМАДА ЭЛЕМЕНТЛАРНЫҢ МАССА ӨЛЕШЛӘРЕН
БИЛГЕЛӘҮГӘ КҮНЕГҮЛӘР
Элементның масса өлеше аның массасының составына шул
элемент кергән матдә массасына чагыштырмасыннан табыла.
AB составлы матдә өчен A һәм B химик элементларының масса
өлешләрен w («омега» дип укыла)
_ "|(А| . „пп _ т<в>
т(АВ) ’ 'В) от(АВ)
чагыштырмаларыннан табалар.
1 нче мисал. Кремний белән кислородның 60 г кушылмасын¬
да 28 г кремний һәм 32 г кислород бар. Кушылмадагы элемент¬
ларның масса өлешләре күпме булыр?
W(Si) = =0,47 яки 47%
v ' 60 г
0)(0) = -1^=0,53 яки 53%
Җавап. Кремнийның масса өлеше 47%, кислородныкы —
53%.
2 нче мисал. Судагы элементларның масса өлешләрен исәп¬
ләп чыгарырга.
Суда 1 моль НгО молекулаларына 2 моль H атомнары һәм
1 моль O атомнары туры килә. Аларның моляр массалары:
M(HaO) = IS г/моль, M(H) = I г/моль, M(O) = 16 г/моль.
Моннан:
/ /—\ \ Af (O) 16 г/МОЛЬ п оло/
W (O) = .. ' Д. = ; =0,89 яки 89%
' ' Af(H2O) 18 г/моль
,u, 2Af(H) 2-1 г/моль < 1 о/
0)(Н) = ...„ = -T5—у =0,11 ЯКИ 11%
' ’ Af(H2O) 18 г/моль ’
Җавап. Суда водородның масса өлеше 11%, кислородны¬
кы — 89%.
1 нче бирем. Элементларның масса өлешләрен исәпләп чыга¬
рыгыз: а) кремний (IV) оксидында SiOa; б) углерод (IV) ок¬
сидында COa; в) хлороводородта HCI.
2 нче бирем. Глюкозаның CeHiaOe формуласы буенча аның
моляр массасын һәм аның составындагы элементларның масса
өлешләрен билгеләгез. (Глюкоза — шикәрләрнең бер төре, балда
һәм җиләк-җимешләрдә була. Ул тере организмга энергия чыга¬
нагы буларак кирәк һәм организмда җиңел үзләштерелә.)
3 нче мисал. Химик анализ цинк рудасындагы цинк сульфи¬
дының ZnS масса өлеше 38,8% булуын күрсәткән. 1 т шул ру¬
дадан ничә килограмм цинк табарга мөмкин булыр иде?
Мәсьәләнең шартыннан килеп чыкканча, 1 т рудада 388 кг
цинк сульфиды бар. M(ZnS) =97 г/моль, M(Zn) =65 г/моль.
Пропорция төзик:
зо
m(Zn) M(Zn)
m(ZnS) M(ZnS)
, моннан m(Zn) =
tn(ZnS) -M(Zn)
M(ZnS)
388 кг-65 г/моль
97 г/моль
= 260 кг
Җавап. 1 т рудадан теоретик карашка (производствода
югалтулар булмаса) 260 кг цинк табылыр иде.
3 нче бирем. Кадмий табигатьтә сульфид CdS рәвешендә
очрый. Әгәр рудада 49,2% CdS булса, бу руданың 1 тоннасын¬
нан теоретик карашка ничә килограмм кадмий табылыр иде?
4 нче бирем. Табигатьтә бакырның төрле составлы рудала¬
ры очрый. Рудаларның берсендә бакыр (I) сульфиды CU2S, ә
икенчесендә бакыр (I) оксиды СигО була. Әгәр рудаларда CuzS
һәм CU2O бер үк масса өлешләрендә очрасалар, бу рудаларның
кайсысы бакырга баерак булыр?
§ 10. МАТДӘЛӘРНЕҢ КАТНАШМАЛАРЫ. ЭРЕМӘЛӘР
Табигатьтә химик кушылмалар аерым хәлдә практик рәвештә
очрамыйлар. Алар бер-берсе белән катнашма хәлендә, судагы
эремәләр хәлендә булалар.
Барыннан да бигрәк катнашмалардагы аерым матдәләрне
тышкы күренешләренә карап танып булмый. Без һаваның азот,
кислород, углекислый газ һәм кайбер башка газлар катнашмасы
булуын күрмибез. Тышкы күренешләре буенча сөтнең төрле мат¬
дәләр катнашмасы икәнен, ә безнең тирә-юньдәге металл пред¬
метларның саф металлардай түгел, бәлки эретмәләрдән эшлән¬
гән булуларын белеп булмый. Тышкы күренешләре буенча шулай
ук суны һәм тозның, шикәрнең судагы эремәләрен дә аерырга
мөмкин түгел.
Химик кушылмалар төгәл билгеле үзлекләр белән характер¬
ланалар. Әйтик, суның кайнау температурасы (басым 101,3 кПа
булганда) IOOoC ка, ә эретелү температурасы OoC ка тигез.
Табигый чыганакларның суында (яңгыр, чишмә, диңгез сулары)
эрегән матдәләр була. Шуңа күрә төрле табигый суларның эре¬
телү һәм кайнау температуралары бер үк түгел, алар суда күп¬
ме һәм нинди матдәләр эрегән булуга бәйләнгән. Мәсәлән, океан
суының кату температурасы —1,9° C тәшкил итә.
Сезгә алюминийның пластик металл булуы билгеле. Ә узган
гасырда алюминийны чыбык итеп сузарга һәм юка табаклы итеп
җәяргә кыен дип уйлаганнар бит. Соңыннан билгеле булганча,
ул заманда саф металл белән түгел, ә катышмалардан пычран¬
ган металл белән эш иткәннәр икән. Элегрәк хромны, титанны
һәм вольфрамны уалучан металларга керткәннәр. Әмма аларны
катышмалары 10~5% тан да артмаган хәлдә табуга ирешкәч,
аларның пластик булулары беленгән. Бу мисалларның барысы да
кушылмаларның химик үзлекләрен ачыклау өчен аларны саф
хәлдә табарга кирәклеген раслый.
31
Химик кушылманы катнашмадан һәм эремәдән аерып алу
өчен төрле ысуллар кулланалар. Аларның барысы да матдә¬
ләрнең үзлекләре төрле булуга нигезләнгән. Әйтик, тимер маг¬
нитлану үзлекләре күрсәткәнлектән, ул андый үзлекләре булма¬
ган матдәләрдән ансат аерып алына.
Матдәләрне аларның тыгызлыклары төрле булудан файдала¬
нып та аерырга мөмкин. Ә тимер һәм күкерт порошокларын
аларның суда төрлечә чылануларына нигезләнеп аерырга була.
Бу катнашманы суга салганда тимер порошогы савыт төбенә
утыра, ә суда чыланмый торган күкерт порошогы өскә калкып
чыга.
Матдәләрнең кайнау температураларының төрлелегенә дис-
тиллирлау методы нигезләнгән. Бу ысул белән дистиллирланган
су, ягъни эрегән матдәләрдән арындырылган су табалар. Моның
өчен табигый суны парга әверелдерәләр. Парны суытып яңадан
суга әйләндерәләр. Суда эрегән матдәләрнең кайнау температу¬
ралары суныкыннан югарырак булганлыктан, алар парга әве¬
релмиләр. Дистиллирланган су табу белән сез лаборатор дәрес¬
тә танышырсыз.
Азык итеп кулланыла торган аш тозы табигатьтә табыла
торган аш тозына охшамаган. Табигый тоз көрән төстә, тәме ачы
була. Аны чистарту өчен яңадан кристаллаштыру методын кул¬
ланалар. Бу ысулның асылы шуннан гыйбарәт ки, табигый тозны
суга салалар. Аш тозы эри, балчык һәм башка катышмалар
утырымда калалар. Утырымны эремәдән аеру өчен аларны
фильтрлыйлар. Эремәдәге тозны аерып алу өчен эремәне парга
әйләндерәләр.
Фәнни тикшеренүләр өчен, техникада, көндәлек тормышта
кулланыла торган матдәләрнең сафлыгы төрле дәрәҗәдә булуы
ихтимал. Сез аш тозының чистартылу дәрәҗәсе белән аерылып
торучы төрле сортларын беләсез. Әйтик, табынга бирелә торган
тоз, яшелчәләр тозлау өчен тотыла торган тоздан, үзенең чиста¬
лыгы белән аерылып тора. Ә химик анализлар өчен кулланыла
торган аш тозының сафлык дәрәҗәсе табынга бирелә торган
тозныкына караганда да югарырак булырга тиеш.
Катышмалар матдәгә һәрвакытта да кирәксез үзлекләр генә
бирәләр дип уйларга кирәкми. Мәсәлән, алюминийның магнийлы,
кремнийлы эретмәләре саф алюминийның үзенә хас булмаган
ныклык һәм катылык белән аерылып торалар. Бу эретмәләрне
самолетлар төзү эшендә кулланалар.
Хәзерге вакытта аеруча саф матдәләр дип йөртелә торган матдәләрне та¬
балар. Алардагы катышмалар 10“6—10~9% тан да артмаска тиеш. Мондый
дәрәҗәдә саф булган матдәләрне табу өчен махсус ысуллар кулланалар. Аеруча
саф матдәләр атом энергетикасында, ярымүткәргечләр промышленностенда, пыяла
җепселләр оптикасында мөһим роль уйныйлар.
«Саф матдә» төшенчәсе үзе ниндидер үзгәрмәс бернәрсә булмавын әйтеп
үтәргә кирәк. Гасыр башларында 0,1% чит катышмасы булган матдәләрне саф
матдәләр дип санаганнар. Бүгенге көндә ис^ атом_Iji^M ярымүткәргечләр промыш¬
ленностьларында башка катышмалары 10 —10 % тан да артмаган матдәләр
32
таләп ителә. IO-10% катышманың бу¬
луы төп матдәнең 300 миллиард ато¬
мына катышманың бары тик 1 генә
атомы туры килүен күрсәтә!
Саф матдәне табуы гына түгел, ә
шул хәлдә саклавы да кыен. Җентек¬
ләп чистартылган һәм һавадан изоля¬
цияләнгән матдә космик нурлар тәэси¬
ренә дучар була һәм берникадәр ва¬
кыттан соң анда бөтенләй башка атом¬
нар барлыкка килә.
Матдәләрне чистарТу һәм
аларны химик кушылмалары¬
ның масса өлешләре төгәл
билгеләнгән чагыштырмаларда
булырлык итеп табу — химия
алдында торучы мөһим пробле¬
ма.
? 1. Сезгә матдәләрне чистартуның
һәм аеруның нинди ысуллары бил-
A геле? Алар нәрсәгә нигезләнгән?
Табигать белеме, химия, физика,
ботаника курсларыннан мисаллар
китерегез.
2. 14 иче рәсем буенча дистил-
лирланган су тапканда кудыру ку¬
бының эшләү принцибын аңлатып
14 нче рәсем. Кудыру кубы.
бирегез.
3. Селен үткәргечендә 99,999999% селен була. 1 г үрнәктә селен атомна¬
рының һәм катышма атомнарының саны күпме? Катышмаларның чагыш¬
тырма атом массасын селенның чагыштырма атом массасына тигез дип
кабул итегез.
5 нче лаборатор дәрес
СЫЕКЛЫКНЫ КУДЫРЫП ЧИСТАРТУ
Эшкә керешкәнче сорауларга җавап бирегез: 1. Нинди матдәләрне кудыру
(дистиллирлау) ысулы белән чистартып була? 2. Кудыруны нинди приборларда
башкаралар һәм аларның эшләү принцибы нинди?
Матдәләрне кудыру ысулы белән аеру (чистарту) приборы
(15 нче рәсем) колбадан, суыткычтан һәм приемниктан тора. Кол¬
бада катышмалардан чистартылырга тиешле сыеклыкны кайната¬
лар. Суыткыч берсе эченә икенчесе куелган ике көпшәдән тора.
Колбадагы сыеклыкны кайнатканда хасил булган парлар суыткыч¬
ның эчке көпшәсенә керә. Аның тышкы көпшәсе буйлап парларга
капма-каршы юнәлештә салкын су агып тора. Эчке көпшәдә
барлыкка килгән сыеклык приемникка агып төшә.
Сез водопровод суын кудырырсыз. Колбага аның '/з өлеше
күләмендә су салыгыз. Колбаны челтәргә куегыз һәм штатив¬
ка беркетегез. Колбаны термометр куелган бөке белән каплагыз.
15 нче рәсемдә күрсәтелгәнчә, колбаны бөке ярдәмендә суыткыч
3 П-236
зз
15 нче рәсем. Сыеклыкларны кудыру приборы.
белән тоташтырыгыз. Суыткычны штативка беркетегез. Суыт¬
кычның аскы тармагын резина көпшә ярдәмендә водопровод
кранына тоташтырыгыз. Өске тармакка резина көпшә кидертегез
һәм аның очын раковинага төшерегез. Аллонж астына приемник-
колбаны урнаштырыгыз. Газ горелкасы (спиртовка) ярдәмендә
колбаны җылыта башлагыз. Суыткычка бик көчле итмичә генә
су агынтысы җибәрегез (суыткычның һәрвакыт су белән тулган
булырга тиешлеген онытмагыз, югыйсә эчке көпшә шартларга
мөмкин). Суның 2/3 өлеше кайнап кимегәч, кудыруны туктатыгыз.
Водопровод суында һәм кудырылган суда катышмаларның
күпме булуын чагыштырыгыз. Моның өчен су тамчысын сәгать
пыяласына тамызыгыз һәм пыяланы махсус кыскыч белән тотып,
аны саклык белән генә горелка (спиртовка) ялкынында җылыты-
гыз. Водопровод суын һәм кудырылган суны парга әйләндерү
нәтиҗәләрен чагыштырыгыз.
6 нчы лаборатор дәрес
МАТДӘЛӘРНЕ ЯҢАДАН КРИСТАЛЛАШТЫРЫП АЕРУ
I. Яңадан кристаллаштыру методы белән нинди матдәләрне аерырга була?
2. Матдәләрне яңадан кристаллаштырып аеру буенча тәҗрибәнең эш барышын
тәкъдим итегез. 3. Юдыргычтан ничек файдаланалар (16 нчы рәсем)? 4. Фильтр¬
ны ничек ясыйлар (17 нче рәсем) һәм фильтрлауны ничек башкаралар (18 нче
рәсем)?
34
Бу эш барышында сез тех¬
ник аш тозын катышмалардан
чистартырсыз.
Эшне үтәгәндә сез түбәндә¬
ге операцияләрне башкарыр¬
сыз: матдәне эретү, эремәне
фильтрлау, эремәне парга әй¬
ләндерү, эремәдәге матдәне
кристаллаштыру.
Эшне башкару өчен 50 мл
сыешлы ике химик стакан, пыя¬
ла бүрәнкә һәм пыяла таяк¬
чык, юдыргыч, фарфор чашка,
штатив, челтәр һәм горелка
(спиртовка), фильтр ясау өчен
фильтр кәгазе кирәк булачак.
Химик стаканга '/з өлеше
күләмендә су салыгыз. Пыяла
таякчык белән болгатып торган
өстәгез. Тозны, өстәлгән өлеше
16 нчы рәсем. Юдыргычтан файдалану
алымы.
хәлдә аз-азлап техник аш тозын
эрүдән туктаганчы, өстәп торы¬
гыз.
Фильтр хәзерләгез (аның кырые бүрәнкә кырыена 0,5 см җит¬
ми калырлык булырга тиеш). Барлыкка килгән тоз эремәсен
фильтрлагыз. Моның өчен фильтрны воронка эченә куегыз һәм
ул бүрәнкә стеналарына тыгыз
орынып торсын өчен юдыргыч¬
тан су белән чылатыгыз (16
нчы рәсем). Фильтрлаганда бү¬
рәнкәнең очы стаканның эчке
стенасына тиеп торырга тиеш¬
леген онытмагыз. Фильтрлана
торган эремәне бүрәнкәгә ста¬
канның борыны белән орынып,
пыяла таякчык буйлап, өлеш¬
ләп салыгыз (18 нче рәсем).
Эремәнең чәчрәмәслек һәм
аның биеклеге фильтр кырыена
җитмәслек булырга тиешлеген
онытмагыз, югыйсә эремәнең
бүрәнкә белән фильтр арасын¬
нан үтүе мөмкин. Таякчык бе¬
лән фильтрга кагылмагыз — ул
бик тиз тишелеп чыга!
Фильтрланган эремәне
(фильтратны) парга әйләндерү
өчен фарфор чашкага бушаты¬
гыз. Эремә салынган чашканы
штатив боҗрасына утыртыгыз
17 нче рәсем. Фильтр ясау.
3*
35
18 иче рәсем. Фильтрлау.
19 нчы рәсем. Эремәне парга әйлән¬
дерү.
(19 нчы рәсем) һәм эремәне
җылытыгыз. Чашка стенала¬
рында кристаллар күренә баш¬
лагач эремәне җылытуны тук¬
татыгыз. Чашка суынганнан
соң бүленеп чыккан кристал-
ларны эремәдән аерыгыз.
Техник аш тозының һәм
яңадан кристаллаштырылган
аш тозының тышкы күренеш¬
ләрен чагыштырыгыз.
ЭРЕГӘН МАТДӘНЕҢ ЭРЕМӘДӘГЕ
МАССА ӨЛЕШЕН ТАБУГА
КҮНЕГҮЛӘР
Эремәдәге эрегән матдәнең
күпме булуын төрле ысуллар
белән күрсәтәләр.
Эрегән матдә массасының
эремәнең гомуми массасына
чагыштырмасы эрегән матдә¬
нең масса өлеше дип атала.
Масса өлешен берәмлек өлеш¬
ләрендә яки процентлар белән
күрсәтәләр.
I нче мисал. 450 г суда 50 г
натрий нитраты NaNOs эрет¬
кәннәр. Табылган эремәдәге
натрий нитратының масса өле¬
шен исәпләп чыгарырга.
Эремәнең гомуми массасы
500 г тәшкил итә. Тозның
масса өлешен табабыз:
«(NaNO,) = -0.1
яки 10%
Җавап. NaNOs ның эре¬
мәдәге масса өлеше 10%.
1 нче бирем. 250 мл суда
50 г тоз эреткәннәр. Хасил
булган эремәдә тозның масса
өлеше күпме булыр?
2 нче бирем. Эрегән КС1ның
масса өлеше 52% булырлык
итеп, 120 г массалы эремә хә¬
36
зерләү өчен күпме калий хлориды (граммнарда) һәм су (милли-
литрларда) кирәк?
3 нче бирем. Эрегән йодның масса өлеше 5% булырлык итеп,
50 г спиртлы эремә хәзерләү өчен күпме йод алырга кирәк?
4 нче бирем. Үсемлекләрнең, бигрәк тә җимеш агачлары һәм
виноград бакчаларының, авыруларына каршы көрәшү өчен ба¬
кыр купоросы эремәсе кулланыла. Гадәттә 1 чиләк суда (8 л ча¬
масы) 150 г тоз эретәләр. Хасил булган эремәдә тозның масса
өлеше нинди? 500 г шул эремәдә күпме тоз һәм су бар?
2 нче мисал. KCl ның масса өлеше 16% тәшкил итсә, 0,5 л
эремә хәзерләү өчен күпме KCl алырга кирәк? Бу эремәнең ты¬
гызлыгы 1,1 г/см3.
Хәзерләргә кирәк булган эремәнең массасын билгелик: т =
= V-p; 500 мл-1,1 г/мл = 550 г. Эремәдә калий хлоридының
масса өлеше 16% булганлыктан, тозның массасы
550 г-0,16 = 88 г
тәшкил итәр.
Җавап. Эремә хәзерләү өчен 88 г KCl алырга кирәк.
3 нче мисал. Натрий гидроксидының NaOH масса өлеше
40% булган 400 мл эремәгә (р= 1,44 г/мл) 150 мл су өстәгән¬
нәр. Табылган эремәдә натрий гидроксидының NaOH масса өле¬
шен билгеләргә.
400 мл башлангыч эремәнең массасын табыйк:
tn = V-p;
400 мл-1,44 г/мл = 576 г
576 г эремәдә натрий гидроксидының
40% булганлыктан, натрий гидроксидының
NaOH масса өлеше
NaOH массасы
576 г-0,4 = 230,4 г
тәшкил итә.
Өстәлгән суның массасы 150 граммга тигез, чөнки суның ты¬
гызлыгы 1,0 г/мл тәшкил итә. Шулай итеп, су өстәгәннән соң
эремәнең массасы
576 г+ 150 г = 726 г
була.
Табылган эремәдә натрий гидроксидының масса өлеше
w(NaOH) = ^-L =0,32 яки 32%
тәшкил итә.
Җавап. Табылган эремәдә натрий гидроксидының NaOH
масса өлеше 32% була.
5 нче бирем. Натрий хлоридының масса өлеше 12% булырлык
итеп эремә табу өчен (р= 1,086 г/мл), натрий хлоридының мас¬
37
са өлеше 8% (р= 1,056 г/мл) булган 450 г эремәгә ничә грамм
натрий хлориды өстәргә кирәк?
6 нчы бирем. Натрий хлоридының масса өлеше 20% булган
эремә хәзерләү өчен натрий хлоридының 26% лы 40 мл эремәсенә
(р= 1,197 г/мл) күпме су өстәргә кирәк?
7 нче бирем. Тозның масса өлеше 10% булган у (200, 300,
400) г эремә табу өчен ничә г (х) тоз алырга кирәк? Килеп
чыккан нәтиҗәләрне тигезләмә рәвешендә күрсәтегез һәм у =
= f(x) күренешендәге бәйлелекнең графигын төзегез.
8 нче бирем. Нинди билгеләре буенча матдәләрне эрүчән,
аз эрүчән һәм практик яктан эремәүчән матдәләргә бүләләр
(кушымтаны карагыз)? Аларны эрегән матдәнең масса өлешлә¬
рендә күрсәтегез.
Ашламаларның масса
ламаларның эремәсен
дыру өчен тотыгыз.
өлеше 2% булырлык итеп, бүлмә гөлләре өчен аш-
хәзерләгез. Эремәне бүлмә гөлләрен өстәмә туклан-
7 нче лаборатор дәрес
ЭРЕМӘ ХӘЗЕРЛӘҮ ҺӘМ АНЫҢ ТЫГЫЗЛЫГЫН ҮЛЧӘҮ
1. Эремәнең тыгызлыгын нинди прибор ярдәмендә үлчиләр? Аны куллану
нинди законга нигезләнгән? 2. Белешмәлектән тыгызлыгы: а) 1,06 г/мл;
б) 1,08 г/мл; в) 1,10 г/мл га тигез булган аш тозы эремәсендәге эрегән
матдәнең масса өлешен табыгыз. (Таблицалар әдәбият исемлегендә күрсәтелгән
белешмәлектә бар (кушымтаны карагыз).)
Бу дәрестә сезгә эрегән матдәнең масса өлеше билгеле булган
эремә хәзерләргә һәм аның тыгызлыгын үлчәргә кирәк булачак.
Элек сез исәпләүләр башкарырсыз һәм, аларны укытучыга күр¬
сәткәннән соң, тәҗрибәне башкарырга керешерсез. Эремәнең
тыгызлыгын ареометр ярдәмендә үлчәрсез.
20 нче рәсем. Аре¬
ометр.
Ареометр — сыеклыкларның тыгызлыгын
үлчәү приборы. Аны куллану Архимед зако¬
нына нигезләнгән. 20 нче рәсемнән күрен¬
гәнчә, ареометр аскы өлешендә йөк, ә өске
өлешендә бүлемнәр булган калкавычтан то¬
ра. Сыеклыкның тыгызлыгы ареометрның
шул сыеклыкка күмелү тирәнлеге буенча
билгеләнә. Эремә тыгызлыгының зурлыгы
буенча махсус таблицалардан эремәдә эре¬
гән матдәнең күпме булуын белергә мөмкин.
1. Эремәнең тыгызлыгын ареометр
ярдәмендә үлчәү
Укытучыдан тикшерелә торган эремәне
алыгыз һәм аны үлчәү цилиндрына салы¬
гыз. Эремәгә саклык белән генә ареометрны
төшерегез. Шкаланың күпме күрсәтүен
38
язып алыгыз. Күзәтү вакытында ареометр цилиндр стеналарына
тиеп тормаска тиеш. Ареометрны 1—2 см га күтәрә төшеп, аны яңа¬
дан эремәгә төшерегез һәм шкаланың күпме күрсәтүен тагын бер
кат билгеләгез. Эремәне кире шешәгә бушатыгыз. Ареометрны юы¬
гыз. Тыгызлыкны үлчәү нәтиҗәләрен укытучыга күрсәтегез.
2. Эремә хәзерләү һәм аның тыгызлыгын үлчәү
Тикшеренүләрне сез берничәшәр укучыдан торган группалар¬
га бүленеп башкарырсыз. Сезнең һәркайсыгызга аш тозының
бирелгән масса өлешләреннән берсенә: 5%, 10%, 15%, 20%,
25% эремә хәзерләргә кирәк булачак.
Аш тозын үлчәп алыгыз һәм стаканга салыгыз. Шунда ук
исәпләп табылган күләмдә су өстәгез. Стакандагы катнашманы
яхшылап болгатыгыз. Матдә эреп беткәннән соң, ареометр яр¬
дәмендә эремәнең тыгызлыгын билгеләгез. Эремәнең тыгызлык
зурлыгын һәм аңа күпме эрегән матдә туры килүен лаборатор
эшләр журналына язып куегыз.
Үзегезнең группа үткәргән тәҗрибәнең нәтиҗәләре буенча
килеп чыккан закончалыкны ачыклагыз һәм шул закончалыкка
туры китереп таблица төзегез (3 нче таблица).
Таблицадагы мәгълүматларны әдәбият исемлегендә күрсәтел¬
гән белешмәлекләрдәге белешмә мәгълүматлар белән чагышты¬
рыгыз. (Кушымтаны карагыз.)
3 нче таблица. Эремәнең тыгызлыгы һәм
эрегән матдәнең масса өлеше
Эремәнең тыгызлыгы, р
Эрегән матдәнең масса
өлеше (% белән)
§ 11. МАТДӘЛӘРНЕҢ МАССАСЫ САКЛАНУ ЗАКОНЫ
Матдәләрнең массасы саклану законы болай әйтелә:
Химик реакциягә кергән матдәләрнең массасы реакция нә¬
тиҗәсендә хасил булган матдәләрнең массасына тигез.
Законның бу әйтелешен М. В. Ломоносов тәкъдим иткән.
Тәҗрибә күрсәтеп алыйк. Бер тәлинкәсенә эченә стеарин шәм утыртылган,
бөке белән капланган колба куеп үлчәүне тигезлик (21 нче рәсем). Шәмне
кабызыйк һәм колбаны яңадан бөке белән каплыйк. Шәм берникадәр вакыт
яна, ә аннары яну туктала. Шәм янган вакытта үлчәүнең тигезләнеше сакла¬
на. Димәк, эчендә башлангыч матдәләр булган колбаның массасы эчендә реак¬
ция продуктлары булган колба массасына тигез. Без стеарин шәм янганда
39
21 нче рәсем. Матдәләрнең массасы
саклану законын күрсәтү.
стеаринның кислород белән тәэсир
итешүен беләбез. Реакциядә тотылган
кислород стеаринның яну продуктлары
составына керде.
Матдәләрнең массасы сак¬
лану законының формулировка¬
сын М. В. Ломоносовтан баш¬
ка, француз химигы А. Лаву¬
азье да әйткән. (М. В. Ломоно¬
совның һәм А. Лавуазьеның
эшчәнлеге турында сез китап¬
ның ахырында укый аласыз.)
Матдәләрнең массасы сак¬
лану законы атом-молекуляр
тәгълиматның үсешендә мөһим
роль уйнаган. Химик реакция¬
ләр вакытында системаның
(система матдәне яки матдәләр
(кисәкчекләр) җыелмасын аң¬
лата) массасы үзгәрмәгәнлек-
тән, химик реакцияләрдә атом¬
нар барлыкка килмиләр яки атомнар җимерелмиләр.
Димәк, химик реакцияләрдә атомнарның саны саклана.
Әйтелгән бу фикерне түбәндәге мисал белән аңлатыйк.
Метан CH4-табигый газның төп өлеше — янганда углекис¬
лый газ СО2 һәм су парлары НгО хасил була. Бу реакция¬
не схема рәвешендә күрсәтик:
CHi,
Метан
Реакция нәтиҗәсендә атомнар яңача урнашалар, әмма алар-
ның саны үзгәрми. Молекулаларның сурәтләре астында алар-
ның химик формулалары күрсәтелгән. Схемадагы молекулалар¬
ның сурәтләрен аларның формулалары белән алыштырыйк:
СН4 + 2О2 = СО2 + 2Н2О
Китерелгән язылыш химик, тигезләмә дип атала. Формулалар
алдында торучы саннар коэффициентлар дип аталалар. Алар ре-
40
акциягә кергән һәм реакция
нәтиҗәсендә хасил булган мат¬
дәләрнең микъдар чагыштыр¬
маларын аңлаталар.
Бу очракта реакция тигез¬
ләмәсеннән күренгәнчә, реак¬
циягә 1 моль CH4 һәм 2 моль
Ch керә. Реакция нәтиҗәсендә
1 моль CO2 һәм 2 моль НгО
барлыкка килә.
Химик тигезләмә башлангыч
матдәләрдә һәм продуктларда
бирелгән элемент атомнарының
мольләр саны, матдәләрнең
массасы саклану законы ниге¬
зендә, бер үк булуын күрсәтә:
CH4 + 202 = CO2 + 2Н2О
1 моль C 4 моль O 1 моль C 4 моль H
4 моль H 2 моль O 2 моль O
Реакция тигезләмәсенең сул
атомнары, 4 моль H атомнары,
22 нче рәсем. Суның водород һәм кис¬
лород атомнарыннан хасил булу схе¬
масы.
һәм уң якларында: 1 моль C
4 моль O атомнары язылган.
? 1. Химик реакциянең асылы нидән гыйбарәт? Җавапны дәлилләү өчен
22 нче рәсемдәге схемадан файдаланыгыз.
▲ 2. Лаборатор дәресләрнең берсендә сез тимернең күкерт белән реакциясен
башкарган идегез. Реакция тигезләмәсен төзегез. Әгәр: а) 56 г тимер һәм
32 г күкерт; б) 28 г тимер һәм 16 г күкерт; в) 112 г тимер һәм 61 г күкерт
реакциягә кергән булса, продуктның массасы күпме булыр?
3. 28 г тимер һәм 32 г күкертне җылытканда барлыкка килгән продуктның
массасы нинди булыр? Кайсы матдә — тимерме яки күкертме — кирәгеннән
артык алынган?
4. Цинк сульфидының формуласын төзегез. 65 г Zn һәм 32 г S реакциягә
керсә, күпме цинк сульфиды табылыр?
ХИМИК РЕАКЦИЯЛӘРНЕҢ ТИГЕЗЛӘМӘЛӘРЕН
ТӨЗҮГӘ КҮНЕГҮЛӘР
1. Химик реакцияләрнең тигезләмәләрен төзү нинди законга нигезләнгән?
Ул ничек әйтелә? 2. Химик реакция тигезләмәсендә коэффициентлар нәрсәне
аңлаталар?
Реакцияләрнең тигезләмәләре ничек төзелүен тикшерик.
1 нче мисал. Водород белән кислородның су хасил итү реак¬
циясенең тигезләмәсен төзергә.
Башта реакциянең схемасын төзибез:
H2 + O2--H2O
Бу схема водородның кислород белән су хасил итеп реагир-
лашуын аңлата.
Аннары сул һәм уң якларында һәр элемент атомнарының
мольләр санын билгеләрбез:
41
H2 + O2 H2O
2 моль H 2 моль О 2 моль H
1 моль О
Схема буенча башлангыч матдәләрдә — 2 моль H атомнары
һәм 2 моль O атомнары, ә продуктларда 2 моль H атомнары һәм
1 моль O атомнары бар. Кислород атомнарының мольләр саны,
ягъни матдә микъдары, схеманың сул һәм уң якларында бертөр¬
ле булсын өчен, H2O формуласы алдына 2 коэффициенты куярга
кирәк:
H2 + O2 -> 2Н2О
2 моль H 2 моль O 4 моль H
2 моль O
Хәзер схеманың уң ягында 4 моль водород атомнары, ә сул
ягында — 2 моль. Шуңа күрә H2 формуласы алдына 2 коэффи¬
циенты куярга кирәк:
2Н2 + O2 -> 2Н2О
4 моль H 2 моль O 4 моль H
2 моль O
Бу язылыш атомнарның саклану законына туры килә, һәм ук
урынына тигезлек билгесе куярга мөмкин — схема реакция тигез¬
ләмәсенә әверелде. Шулай итеп, водородның кислород белән су
хасил итү реакция тигезләмәсе мондый рәвештә языла:
2Н2 + О2 = 2Н2О
1 нче бирем. Горелканың төссез ялкынында җылытканда ба¬
кыр чыбык кара төстәге кунык белән каплана. Әгәр бакыр (II)
оксиды хасил булса, реакция тигезләмәсен төзегез.
2 нче бирем. Горелка ялкынына керткәндә алюминий пудрасы
яп-якты булып кабынып китә. Бу вакытта нинди продукт бар¬
лыкка килә? Реакция тигезләмәсен төзегез. Алюминийның ок¬
сидлашу дәрәҗәсен аның периодик системада урнашуына карап
ачыклагыз.
3 нче бирем. Көнкүрештә кулланылучы, баллоннарда күчереп
йөртелә торган газның төп состав өлеше булып пропан C3Hg то¬
ра. Пропанның тулысынча яну реакциясенең тигезләмәсен төзе¬
гез.
4 нче бирем. Бензинның төп компоненты — октан CgHis. Аның
тулысынча яну реакциясенең тигезләмәсен төзегез.
5 нче бирем. Түбәндәге реакция схемаларында коэффициент¬
лар куегыз:
а) Н2 + С12->НС1
б) CuO + H2->Си ~ГH2O
B) PbO+ C-^Pb+ CO
г) H2O+ SO3-^h2SO4
д) H2O+P2O5 -+I3PO4
е) CaO+ H2O-++(OH)2
ж) NaOH+ H2SO4^Na2SO4+ H2O
42
Реакцияләрнең схемалары реакцияләрнең тигезләмәләреннән
нәрсә белән аерылып торалар? Дәлилләнгән җавап бирегез.
6 нчы бирем. Гади матдәләрдән: а) күкерт (IV) оксидын;
б) калий хлоридын; в) алюминий фторидын; г) бакыр (II) хло¬
ридын табу реакцияләренең тигезләмәләрен төзегез. Фтор һәм
хлор молекулаларының ике атомлы булуларын күздә тотыгыз.
Продуктларның формулаларында элементларның оксидлашу дә¬
рәҗәләрен язып куегыз.
7 иче бирем, а) Алюминий белән күкерт; б) фосфор белән
кислород; в) фосфор белән хлор; г) углерод белән кислород
тәэсир итешкәндә нинди матдәләр хасил була? Реакцияләрнең
тигезләмәләрен төзегез, элементларның оксидлашу дәрәҗәләрен
куегыз һәм реакцияләр продуктларының исемнәрен атагыз.
РЕАКЦИЯЛӘРНЕҢ ТИГЕЗЛӘМӘЛӘРЕ БУЕНЧА ИСӘПЛӘҮЛӘРГӘ
КҮНЕГҮЛӘР
Химия производствосында һәм лабораториядә реакцияләрнең
тигезләмәләре буенча күрсәтелгән микъдардагы матдә табу өчен
нинди микъдарда башлангыч матдәләр алырга кирәк булуын
исәплиләр.
Кайбер мисалларны тикшерик.
1 нче мисал. Промышленностьта титанны металлотермия
ысулы белән табалар:
TiCl4 + 2Mg = Ti + 2MgCl2
Титан (IV) хлоридыннан 9,6 кг титан табу өчен күпме маг¬
ний алырга кирәк?
Реакция тигезләмәсе 1 кмоль титан табу өчен 2 кмоль маг¬
ний кирәк булуын күрсәтә.
M(Mg) =24 кг/моль, M(Ti) =48 кг/моль.
TiCl4+ 2Mg = 9Ti+ 2MgCl2
(2 кмоль-24 кг/моль I кмоль-48 кг/моль)
2 кмоль-24 кг/моль-9,6 кг „ „
X = j : = 9,6 кг
1 кмоль-48 кг/моль
Җавап. Реакция уздыру өчен 9,6 кг Mg алырга кирәк.
1 нче бирем. Лабораториядә кургаш оксидыннан PbO 414 г
кургаш табу өчен күпме күмер алырга кирәк? Реакция
РЬО + С = РЬ + СО
тигезләмәсе белән күрсәтелә.
2 нче бирем. Тимер (III) хлориды FeCb эремәсенә 0,24 моль
натрий гидроксиды NaOH булган эремә өстәгәннәр:
FeCI3 + 3NaOH = Fe(OH)3 + 3NaCl
43
Реакция нәтиҗәсендә нинди микъдарда тимер (III) гидроксиды
барлыкка килгән?
3 нче бирем. Бакыр табу өчен
CuO 4-H2 = Cu+ H2O
реакциясен кулланалар. 128 г бакыр табу өчен күпме бакыр (II)
оксиды алырга кирәк?
4 нче бирем. Тимер белән күкерт реакциягә кергәндә 44 г
тимер (II) сульфиды табылсын өчен, алына торган күкертнең
массасы күпме булырга тиеш?
§ 12. РЕАКЦИЯНЕҢ ҖЫЛЫЛЫК ЭФФЕКТЫ
1. Физика дәреслегеннән «Эчке энергия», «Ягулык энергиясе», «Ягулыкның
чагыштырма яну җылылыгы» дигән параграфларны кабатлагыз. 2. Ягулык ян¬
ганда нинди тышкы билгеләр күзәтелә? 3. Сез ничек уйлыйсыз, ни өчен химик
реакциянең билгеләренең берсе булып җылылык аерылып чыгу яки йотылу тора?
Химик реакция процессында химик бәйләнешләр өзелү һәм
яңа бәйләнешләр ясалу нәтиҗәсендә атомнар башкача урнаша¬
лар. Физика курсыннан белгәнегезчә, молекулаларда атомнарны
бер-берсеннән аеру өчен атомнарның үзара тартылу көчен җиңәр¬
гә, эш башкарырга, димәк энергия сарыф итәргә кирәк. Ә атом¬
нар молекулаларга кушылганда энергия, киресенчә, аерылып чы¬
га. Шуңа күрә теләсә нинди химик реакция энергия аерылып
чыгу яисә йотылу белән бара. Бу факт химик реакцияләрнең
мәҗбүри тышкы билгесе булып тора.
Химик реакция вакытында аерылып чыга яки йотыла торган
энергия микъдары реакциянең җылылык эффекты дип атала.
Энергия саклану законы буенча химик реакцияләр вакытын¬
да энергия төрле формаларда аерылып чыгарга яки йотылырга
мөмкин.
Күп микъдарда җылылык һәм яктылык аерылып чыгу белән
бара торган химик реакция яну дип атала.
Водород белән кислородның су хасил итү реакциясен тик¬
шерик:
2Н2 + О2 = 2Н2О
Системаның химик реакциягә кадәрге энергиясен Нбашл. (баш¬
лангыч) дип, ә реакциядән соңгысын //ахыр. (ахыргы) дип бил¬
гелик. Ул чагында реакциянең җылылык эффекты l\H («дельта-
аш» дип укыла; A символын гадәттә нинди дә булса зурлыкның үз¬
гәрүен билгеләү өчен кулланалар, мәсәлән: массаның үзгәрүе Am,
күләмнең үзгәрүе AV, температураның үзгәрүе AZ һ. б.) булыр:
^ахыр. Нбашл. ===
44
Системаның, энергиясе
2Нг(г}+02(г]
Энергияне югалту
АН<0
, гн2о(с)
Системаның, энергиясе
гн2(г)+о2(г)
Энергияне алу
&Н>0
2Н20(с]
23 нче рәсем. Энергия аерылып чыгу
белән бара торган реакциянең энерге¬
тик диаграммасы (системада энергия
микъдары кими).
24 нче рәсем. Энергия йотылу белән
бара торган реакциянең энергетик ди¬
аграммасы (системада энергия микъ¬
дары арта).
Реакциянең җылылык эффектын джоульләрдә күрсәтәләр.
Әгәр реакция нәтиҗәсендә энергия аерылып чыкса (система¬
ның энергиясе кими), ул чагында АЯ<0 дип исәпләү кабул
ителгән. Әгәр энергия йотыла икән инде (системаның энергиясе
арта), бу вакытта АЯ>0 була.
Белгәнебезчә, водород янганда җылылык аерылып чыга. Бу
процесс
2Н2 + О2 = 2Н2О, АЯ = —484 кДж
тигезләмәсе белән күрсәтелә.
Химик реакциянең җылылык эффекты күрсәтелгән язылышын
реакциянең термохимик тигезләмәсе дип атыйлар. Водород яну
реакциясендә энергия аерылып чыга, шунлыктан реакциянең
җылылык эффекты минус тамгасы белән күрсәтелгән. 23 нче
рәсемдә энергия аерылып чыгу белән бара торган реакция ва¬
кытында системаның энергиясе үзгәрү схемасы бирелгән.
Энергия саклану законы нигезендә, суны молекуляр водо¬
родка һәм кислородка таркату өчен, шундый ук микъдарда энер¬
гия тотарга кирәк (24 нче рәсем):
2Н2О = 2Н2Ң-О2, АЯ = 484 кДж
Бу вакытта җылылык эффектының тамгасы плюс була.
Җылылык аерылып чыгу белән бара торган реакцияләр эк-
зотермик реакцияләр дип, ә җылылык йотылу белән бара тор¬
ган реакцияләр эндотермик реакцияләр дип аталалар. (Грекча
экзо — «тышка», эндо — «эчкә», термо — «җылылык».)
45
? 1. Сезнең җылылык аерылып чыгу яки йотылу белән бара торган нинди
Д реакцияләр күзәткәнегез бар? Ни өчен химик реакция вакытында җылылык
аерылып чыкса, җылылык эффекты ДЖО һәм, киресенчә, җылылык йотыл¬
са, Л//>0 булуын аңлатып бирегез.
2. Водородның H2 яну җылылыгы 12,1-IO7 Дж/кг. Водородның яну җы¬
лылыгын мольгә килоджоульләрдә күрсәтегез. Водородның кислородта яну
реакциясенең термохимик тигезләмәсен төзегез.
3. Физика дәреслегеннән спиртның, агач күмеренең, табигый газның яну
җылылыкларын язып алыгыз. Яну җылылыкларын мольгә джоульләрдә
күрсәтегез. Спиртның моляр массасы 46 г/моль, агач күмеренеке —
12 г/моль чамасы, табигый газныкы — 16 г/моль чамасы.
4. а) Агач күмере (башлыча C тан тора); б) спирт C2H5OH; в) табигый
газ (төп состав өлеше — метан CH4) яну реакцияләренең термохимик ти¬
гезләмәләрен языгыз.
ТЕРМОХИМИК ТИГЕЗЛӘМӘЛӘР БУЕНЧА
ИСӘПЛӘҮЛӘРГӘ КҮНЕГҮЛӘР
Химик теге яки бу реакцияне тормышка ашыру өчен реак¬
циянең җылылык эффектын белергә тиеш. Реакциянең җылылык
аерылып чыгу яки йотылу белән баруына карап, аны уздыруның
шартларын билгелиләр.
1 нче мисал. Әгәр алюминий оксиды хасил булганда, 1 моль
алюминий оксидына 1582 кДж җылылык аерылып чыкса, алю¬
миний яну реакциясен термохимик тигезләмәсен төзегез.
Алюминий кислород белән реакциягә керә:
4А1 + ЗО2 = 2А12Оз
Җавап. Реакциянең җылылык эффекты 2 моль -1582 кДж/моль
= 3164 кДж. Реакция җылылык аерылып чыгу белән узган¬
лыктан, А/7<0, реакциянең термохимик тигезләмәсе
4А1 + ЗО2 = 2А12Оз, AW= -3164 кДж
рәвешендә була.
1 нче бирем. Күкерт белән кислородның күкерт (IV) оксиды
хасил итү реакциясенең термохимик тигезләмәсен төзегез. Бу ре¬
акциядә 1 моль күкерт (IV) оксидына исәпләгәндә 297 кДж
җылылык аерылып чыга.
2 нче бирем. Метан CH4 (табигый газның төп өлеше) янганда
1 моль СН4га исәпләгәндә 802 кДж җылылык аерылып чыга.
Cy һәм углекислый газ хасил булса, реакциянең термохимик
тигезләмәсен төзегез.
3 нче бирем. Тимер кислород белән тәэсир итешкәндә тимер
(III) оксиды барлыкка килгән. Реакциядә 1 моль оксидка исәп¬
ләгәндә 822 кДж җылылык аерылып чыгуны күздә тотып, термо¬
химик тигезләмә төзегез.
2 нче мисал. Водород белән кислород арасындагы реакция¬
нең билгеле булган җылылык эффекты буенча, 1 кг водородның
яну җылылыгын (Дж/кг) исәпләп чыгарырга:
2Н2 + О2 = 2Н2О, \Н= -484 кДж
46
2 моль водород һәм 1 моль кислород реакциягә кергәндә
484 кДж җылылык аерылып чыга. Af(H2) —2 г/моль:
2Н2 + О2 = 2Н2О, АЯ = — 484 кДж
2 моль-2 г/моль
2 моль-2 г/моль H2 янганда 484 кДж җылылык аерылып чыга,
1 кг (I-IO3 г) H2 янганда х аерылып чыга:
X = -484 кДж-Ь103..г = _ 121 . Ю3 кДж
2 моль-2 г/моль
Җавап. Водородның яну җылылыгы —121-IO6 Дж/кг =
= -1,21-IO8 Дж/кг.
4 нче бирем. 2 кг күмер янганда күпме җылылык аерылып
чыгар?
C+ O2 = CO2, АЯ = —393 кДж
5 нче бирем. 1 моль ис газы CO янганда күпме җылылык ае¬
рылып чыгар?
2СО + О2 = 2СО2> NH = —566 кДж
6 нчы бирем. Термохимик тигезләмәсе
2H3N = 3H2 + N2, АЯ=92 кДж булса,
5 моль аммиакны таркату өчен күпме җылылык сарыф итәргә
кирәк?
Гади матдәләрдән 1 моль аммиак барлыкка килү реакциясе¬
нең җылылык эффекты нинди?
НЕОРГАНИК МАТДӘЛӘРНЕҢ АЕРУЧА
ӘҺӘМИЯТЛЕ КЛАССЛАРЫ
§ 13. ТОЗЛАР
Физика дәреслегеннән «Электролитларнын, эремәләрендә электр тогы», «Атом
төзелеше» дигән параграфларны кабатлагыз.
Матдәләрнең гаять күп төрле булуын аңлау һәм аларның
үзлекләрен алдан әйтергә өйрәнү өчен, матдәләрнең классифи¬
кациясен белергә кирәк. Хайваннарны һәм үсемлекләрне клас¬
сификацияләү сезгә зоология һәм ботаника курсларын өйрәнгән¬
дә материалны системага салырга ничек ярдәм итүен хәтере¬
гезгә төшерегез. Бу бүлектә без неорганик матдәләрнең төп
классларын һәм аларның үзләренә генә хас үзенчәлекләрен тик¬
шерербез.
Химик кушылмаларның бер классы булып тозлар тора. Ти¬
пик тозларның берсе — сезгә яхшы таныш булган аш тозы —
натрий хлориды NaCL Бу матдәне тозлар классына нинди билге¬
ләре буенча кертәләр соң?
Тозлар кристаллик матдәләр булып торалар. Аларның крис-
таллары уңай корылмалы һәм тискәре корылмалы ионнардан
төзелгән. Натрий хлориды NaCl кристалларының структурасы
25 нче рәсемдә күрсәтелгән. Уңай корылган һәр натрий ионы
Na+ алты тискәре корылган хлор ионы Cl- белән чолгап алын¬
ган. Үз чиратында тискәре корылган һәр хлор ионы Cl~ алты
уңай корылган натрий ионы Na+ белән чолгап алынган. 1 моль
Na+ ионнарына 1 моль Cl- ионнары туры килә. Шунлыктан
кушылманың формуласы NaCl.
Капма-к.аршы корылмалы ионнар арасындагы бәйләнеш ион¬
лы бәйләнеш дип атала.
Ике элементтан торган ионлы кушылмаларда ионның корыл¬
масы элементның оксидлашу дәрәҗәсенә санча туры килә. Бу
очракта оксидлашу дәрәҗәсе мондый мәгънәгә ия: ул ионның
корылмасын характерлый. (Игътибар итегез, оксидлашу дәрә¬
җәсен күрсәткәндә аның тамгасын цифр алдына, ә корылманы
күрсәткәндә аның тамгасын цифрдан соң куялар.) Әйтик, NaCl
да натрийның оксидлашу дәрәҗәсе +1 һәм натрий ионының
корылмасы 1+, ә хлорның оксидлашу дәрәҗәсе —1 һәм хлор
ионының корылмасы 1—.
Ионлы кушылмаларга югары эретелү температуралары хас,
аларның эретелмәләре һәм судагы эремәләре электр тогын үткә¬
рәләр. Тозларга, ионлы кушылмалар буларак, бу үзлекләрнең
барысы да хас.
48
Сез физика дәресендә күзәткән
тәҗрибәне кабатлыйк. Дистиллирлан-
ган су салынган савытка күмер элек¬
тродларын төшерик һәм аларны электр
лампочкасы белән тоташтырып, чыл¬
бырга ток чыганагын ялгыйк (26 нчы
рәсем). Лампочка янмый. Димәк, чыл¬
бырда ток юк. Аннары суга бер чеметем
нинди дә булса тоз өстик, мәсәлән, нат¬
рий хлориды NaCl. Тоз эри, һәм лампоч¬
ка яна башлый.
Тоз эремәсе электр тогын
үткәрә. Бу тоз эремәсе элект¬
ролит икәнен күрсәтә: анда
электр тогын күчерүче кисәк¬
чекләр — ионнар бар.
Натрий хлориды NaCl эре¬
мәсендә, тозны эреткәндә эре¬
мәгә күчкән, Na+ һәм Cl- ион¬
нары шундый ионнар булып то¬
25 нче рәсем. Натрий хлориды крис-
талының структурасы.
ралар.
Ике элементтан торган кушылмалардан тозларга, мәсәлән,
кальций фториды СаЕг, калий хлориды KCl, натрий бромиды
NaBr һ. б. керәләр. Башка төрдәге тозлар белән сез § 19 та
танышырсыз.
1. Нинди матдәләр ионлы матдәләр дип аталалар?
2. Кристалларының структурасы натрий хлоридының, структурасына охшаш
булган: а) калий хлориды; б) натрий бромиды тозларының формулалары
нинди?
3. 27 нче рәсемдә кальций фторидының структурасы (кристаллик челтәре)
күрсәтелгән. Бу кушылманың формуласын китереп чыгарыгыз (§ 7 ны кара¬
гыз).
26 нчы рәсем. Эремәнең электр тогын
үткәрүчәнлеген тикшерү приборы.
27 нче рәсем. Кальций фторидының
структурасы.
4 П-236
49
4. Ни өчен тозларның судагы эремәләре электр тогын үткәрәләр? а) Барий
хлориды; б) натрий иодиды; в) калий хлориды тозларының эремәләрендә
нинди ионнар бар?
5. Гади матдәләрдән түбәндәге тозлар хасил булу реакцияләренең тигез¬
ләмәләрен төзегез: а) калий бромиды; б) калий хлориды; в) барий хлори¬
ды. Бу тозлар нинди ионнардан торалар?
6. Әгәр тоз: a) Na+ һәм I-; б) Ca2+ һәм С1~; в) Al3+ һәм F- ионнарыннан
торса, аның формуласы нинди булыр?
§ 14. ЭЛЕКТРОЛИТИК ДИССОЦИАЦИЯ
1. JIh өчен тозларның судагы эремәләре электр тогын үткәрәләр? 2. а) Ба¬
рий хлориды BaCh; б) кальций иодиды СаЬ тозлары эремәләрендә нинди ион¬
нар бар?
Аш тозы эремәсенең электр тогын үткәрүчәнлеген тикшерү
тәҗрибәсен башкарганда, сез тозның судагы эремәдә ионнарга
таркалуына ышандыгыз.
Эрегәндә матдәнең ионнарга таркалуын электролитик диссо¬
циация дип атыйлар.
Эремәдә натрий хлоридының электролитик диссоциациясен
NaCl = Na+-I-Cl-
тигезләмәсе белән күрсәтергә мөмкин.
Бу тигезләмә натрий хлоридының электролитик диссоциация
тигезләмәсе дип атала. Шул рәвешчә теләсә нинди тоз өчен,
мәсәлән, кальций хлориды өчен электролитик диссоциация ти¬
гезләмәсен язарга була:
CaCl2 = Ca2++2С1-
Электролитик диссоциация тигезләмәсен язганда, масса һәм
корылмалар саклану законы буенча, уңай корылмалар саны тис¬
кәре корылмалар санына тигез булуын исәпкә алырга кирәк.
Әйтик, кальций хлоридының электролитик диссоциациясе вакы¬
тында 1 моль кальций Ca2+ (2-¼ корылмалы) ионнарына 2 моль
Cl- (1— корылмалы) хлорид-ионнар туры килә.
Эремә аша электр тогы уздырганда уңай корылган ионнар
катодка таба, ә тискәре корылган ионнар анодка таба хәрәкәт
итәләр. Уңай корылмалы ионнар катионнар дип, ә тискәре корыл¬
малы ионнар анионнар дип аталалар. (Грекча ион — «баручы»; ка¬
тион— «катодка баручы»; анион — «анодка баручы».)
Биредә без электролитик диссоциациянең сәбәпләрен тикшер¬
мибез. Бу турыда соңрак белерсез. Тик шунысын гына әйтеп
үтик, диссоциация процессында су молекулалары ионнарны
чолгап алалар һәм ионнарның бер-берсеннән аерылуы өчен шарт¬
лар тудыралар.
Ә тозны аерып алганда ни була соң? Төрлечә корылган
катионнар һәм анионнар бер-берсенә тартылалар һәм тозның
кристалларын барлыкка китерәләр. Әйтик, калий хлориды эре¬
50
мәсеннән (парга әйләндергәндә) KCI кристаллары аерылып чы¬
га, ягъни ионнар арасында реакция бара:
K+H-Cr = KCl
Шулай итеп, суда эреткәндә тоз катионнарга һәм анионнар¬
га таркала, ә тозның эремәдән аерылып чыгуы катионнарның
һәм анионнарның кристалларга берләшүе исәбенә була.
Тозларның кристаллашу процесслары табигать шартларында
да, мәсәлән, суында тозлар эрегән күлләр кипкәндә, була.
? 1. Нинди процесс электролитик диссоциация дип атала? Эрегәндә тозлар-
нын ионнарга диссоциацияләшүен ничек дәлилләргә мөмкин?
A 2. 6 нчы лаборатор дәрестә сез аш тозын яңадан кристаллаштыруны баш¬
карган идегез. Тозны эретүне һәм кристаллаштыруны электролитик дис-
социациядән чыгып аңлатып бирегез. Электролитик диссоциация тигезләмә¬
сен языгыз.
3. Судагы эремәсендә: а) магний хлориды MgCh; б) барий бромиды ВаВга;
в) калий иодиды KI тозы нинди ионнарга таркала?
8 нче лаборатор дәрес
ОКСИДЛАР. ГАДИ МАТДӘЛӘРДӘН ОКСИДЛАР ХАСИЛ БУЛУ
Оксидлар — химик кушылмалар классларыннан берсе. Бел¬
гәнегезчә, оксидларны гади матдәләр — металлар һәм неметал-
лар — кислород белән тәэсир
итешкәндә, ягъни матдәләр кис¬
лород белән оксидлашканда
табарга мөмкин.
Бу эш барышында сезгә
кислород табарга һәм табыл¬
ган кислородта яки һава кисло¬
родында, оксидлар хасил итеп,
гади матдәләрне оксидлашты¬
рырга кирәк булачак.
1 нче тәҗрибә. Кислородны
табу һәм җыю. 28 нче рәсем
буенча прибор белән танышы¬
гыз. Андый прибор ярдәмендә
сез кислород табарсыз һәм аны
җыярсыз. Сезгә бирелгән при¬
борның детальләрен рәсем бу¬
енча барлагыз. Тимер кашык
һәм чыра әзерләп куегыз. Сез¬
гә калий перманганаты, агач
күмере, алюминий порошогы,
бакыр пластинка кирәк була¬
чак.
Пробиркага аның '/ь күлә¬
мендә калий перманганаты са¬
28 нче рәсем. Кислород табу һәм аны
җыю.
4
51
лыгыз. Пробирканы, 28 нче рәсемдә күрсәтелгәнчә, штативка бер¬
кетегез. Бөке астына мамык кисәге куеп калдырып, пробирканы,
газүткәргеч көпшәле бөке белән каплагыз. Көпшәнең очын ста¬
канга төшерегез.
Башта пробирканың бөтен җирен, ә аннан соң калий перман¬
ганаты салынган өлешен генә җылытыгыз. Реакциянең узуы
турында башлангыч матдәнең төсе үзгәрү буенча белеп була.
Реакция барышында горелканы (спиртовканы) таркалып өлгер¬
мәгән перманганат ягына таба күчерегез.
Стаканга кислород тулуны тикшерегез. Моның өчен вакыт-
вакыт стакан авызына көйрәп торган чыра китерегез. Ул кабы¬
нып китсә, җылытуны туктатыгыз. Кислородлы стаканны катыр¬
гы түгәрәк белән каплагыз.
2 нче тәҗрибә. Күмерне кислород белән оксидлаштыру. Агач
күмерен тимер кашыкка урнаштырыгыз, горелка (спиртовка)
ялкынында кыздырыгыз, ә аннары кислородлы стаканга кертегез.
Сез нәрсә күзәтәсез? Реакция тигезләмәсен төзегез.
Күмер янып беткәч, стаканга известьле су салыгыз һәм бол¬
гатыгыз. Утырым хасил булу нәрсәне аңлата? Табигать белеме
курсыннан сез углекислый газның — углерод (IV) оксидының
известьле су белән тәэсир итешүен беләсез.
3 нче тәҗрибә. Алюминийны кислород белән оксидлаштыру.
Горелка ялкынына шпатель очында гына алюминий порошогы
кертегез. Нәрсә күзәтәсез? Реакция нәтиҗәсендә нәрсә хасил
булды? Реакциянең тигезләмәсен төзегез.
4 нче тәҗрибә. Бакырны кислород белән оксидлаштыру. Го-
релканың (спиртовканың) яктырмый янган ялкынына бакыр
пластинканы кертегез. Бакыр пластинка өслегендә кара төстәге
матдә барлыкка килүенә игътибар итегез. Бу бакыр (II) оксиды.
Реакция тигезләмәсен төзегез.
? 1. Гади матдәләрдән: а) магний оксиды; б) кремний (IV) оксиды; в) фос¬
фор (V) оксиды табу реакцияләренең тигезләмәләрен языгыз.
A 2. Күкерт (IV) оксидының, хлор (VII) оксидының формулаларын языгыз.
3. Түбәндә оксидларның формулалары бирелгән:
Na2O, MgO, Al2O3, SiO2, P2O51 SO3, CI2O7
Металл оксидларын һәм неметалл оксидларын баганаларга аерып языгыз.
4. 13 нче рәсемдә цинк белән кислород кушылмасының структурасы күрсә¬
телгән. Бериллийның кислород белән кушылмасы шундый ук структурага
ия. Кислород атомнары бериллий атомы тирәсендә һәм бериллий атомнары
кислород атомы тирәсендә ничек урнашуның рәсемен ясагыз. Кушылма¬
ның химик формуласы һәм исеме нинди?
5. Кристалл структурасы натрий хлориды структурасына охшаш булса
(25 нче рәсем), тимер (II) белән кислород кушылмасының формуласы
нинди? Тимер атомнарының кислород атомнарына карата ничек урнашуын
рәсемдә ясап күрсәтегез. Бу кушылмага исем бирегез.
52
§ 15. КИСЛОТАЛАР
Неметаллар: а) кремний (IV); б) фосфор (V); в) күкерт (VI); г) хлор (VII)
оксидларының формулаларын языгыз.
Тәҗрибә үткәрик. Cy салынган стаканга фосфор (V) оксиды
Р2О5 өстик. Реакция җылылык аерылып чыгу белән уза — фос¬
фор (V) оксиды су белән тәэсир итешә:
ЗН2О + Р2О5 = 2НзРО4
Фосфат кислотасы Н3РО4 хасил була.
Күкерт (VI) оксиды SO3 су белән тәэсир итешкәндә суль¬
фат кислотасы H2SO4 барлыкка килә:
H2O+ SO3 = H2SO4
Кислоталар химик кушылмаларның аерым бер классын тәш¬
кил итәләр. Матдәләрнең кислоталар классына керүен нинди үз¬
лекләр билгели соң?
Тикшеренүләр кислоталарның эремәләре электр тогын узды¬
руны күрсәтә. Кислоталарның эремәләрендә нинди ионнар бу¬
ла икән? Кислоталарның электролитик диссоциациясе водород
катионнары H+ хасил булу белән бара дип фараз итәргә мөмкин.
Сульфат кислотасы өчен бу процесс
H2SO4 = 2H+ + SOl-
тигезләмәсе белән күрсәтелә.
Эремәдә водород ионнарының барлыгын белү өчен махсус
матдәләр — индикаторлар бар (латинча «indicator» — күрсәт¬
кеч). Индикаторлар, водород ионнары белән үзара тәэсир ите¬
шеп, төсләрен үзгәртәләр. Мәсәлән, шәмәхә төстәге лакмус ин¬
дикаторы эремәсе водород ионнары булганда кызыл төскә керә.
Кайбер кислоталарның эремәләрен индикатор ярдәмендә тик¬
шерик. Барлык эремәләрдә дә лакмус кызыл төскә керде. Бу
кислоталарның гомуми билгесен — аларның эремәләрендә водо¬
род ионнары булуны раслый.
Эремәдә бары тик водород катионнары гына хасил итеп һәм
башка катионнарны барлыкка китермичә диссоциацияләшә тор¬
ган матдәләр кислоталар дип аталалар.
Кислотаның анионын кислота калдыгы дип атыйлар.
Кислоталарның исемнәрен кислотаны хасил итүче неметалл
элементының латинча исеменнән төзиләр: H2SO4 — сульфат кис¬
лотасы, HNO3 — нитрат кислотасы, H3PO4 — фосфат кислотасы
һ. б.
Кислоталар табигатьтә бик күп таралган. Сез үзегезнең тор¬
мыш тәҗрибәгездән күп кенә азык продуктларының тәме әче
булуын беләсез. Бу продуктларның әче тәме аларда кислоталар
булуга бәйләнгән. Лимонга әче тәмне — лимон кислотасы, алма-
53
га — алма кислотасы, әчегән сөткә — сөт кислотасы бирә. Куз¬
галакның әче тәме аның яфракларында кузгалак кислотасы бу¬
лудан килә. Азык итеп кулланыла торган серкә — серкә кисло¬
тасының эремәсе ул.
? 1. Кислоталарга нинди матдәләр керәләр? Бирелгән эремәнең кислота
эремәсе икәнен ничек белергә була? g
▲ 2. Кислота калдыкларының составлары: a) AsO4-; б) TeOs"; в) SeOi-;
г) IOg- булса, тиешле кислоталарның формулаларын языгыз һәм аларның
исемнәрен атагыз.
3. а) Нитрат кислотасының HNO3; б) фосфат кислотасының H3PO4; в) кар¬
бонат кислотасының HjCO3 электролитик диссоциациясе тигезләмәләрен тө¬
зегез.
4. Тиешле оксидлардан: а) сульфат кислотасын; б) карбонат кислотасын;
в) нитрат кислотасын табу реакцияләренең тигезләмәләрен төзегез.
Индикаторларны беренче буларак Р. Бойль ачкан. Ул, миләүшә чәчәгенә
кислота тамчысы тамызганда, аның үз төсен үзгәртүен күргән. Төрле үсем¬
лекләр чәчәкләренең таҗ яфракларына яки үсемлекләрнең төсле яфрак¬
ларына кислотаның тәэсирен тикшерегез. Кислота сыйфатында серкәне,
алма согын, тозлы кәбестә суын, лимон кислотасы эремәсен, кефирны кул¬
ланыгыз.
§ 16. НЕМЕТАЛЛ. КИСЛОТА ОКСИДЫ.
КИСЛОТА
Неметаллга һәм аңа туры килүче оксидка һәм кислотага мисаллар ки¬
терегез.
Неметаллга оксид туры килүен сез беләсез. Күпчелек неме¬
талл оксидларына кислоталар туры килә, шуңа күрә аларны
кислота оксидлары дип атыйлар.
S * SO3 * H2SO4
Неметалл Кислота Кислота
оксиды
Барлык кислоталарны да тиешле оксидларны суда эретеп та¬
бып булмавын әйтеп үтәргә кирәк. Суда эреми торган оксидлар
бар. Аларга, мәсәлән, кремний оксиды SiO2 керә. Ул елга комы¬
ның состав өлеше, ә ком, белгәнегезчә, суда эреми. (Диңгез
дулкыннарының пляждагы комга килеп бәрелүләрен хәтере¬
гезгә төшерегез.) Әмма неметалл оксидларына кислоталар туры
килә: мәсәлән, кремний (IV) оксидына SiO2 — силикат кисло¬
тасы H4SiO4.
Түбәндә 2 нче һәм 3 нче период элементлары кислоталарының
формулалары күрсәтелгән:
54
2 нче период
Төркем
III
IV
V
VI
VII
Химик элемент
B
C
N
O
F
Оксидның фор¬
муласы
В2О3
CO2
N2O5
—
—
Кислотаның
формуласы
H3BO3
H2CO3
HNO3
—
—
Кислотаның исе¬
ме
Борат
Карбонат
Нитрат
—
—
Кислота калды¬
гының формула¬
сы
воГ
COi-
NO3-
—
—
Кислота калды-
Борат
Карбонат
Нитрат
—
—
гының исеме
3 нче
период
Төркем
IV
V
VI
VH
Химик элемент
Si
P
S
Cl
Оксидның форму¬
ласы
SiO2
P2O5
SO3
Cl2O7
Кислотаның фор¬
муласы
H4SiO4
H3PO4
H2SO4
HClO4
Кислотаның исеме
Силикат
Фосфат
Сульфат
Перхлорат
Кислота калдыгы¬
ның формуласы
SiOJ-
ро|-
soi-
Cio4-
Кислота калдыгы¬
ның исеме
Силикат
Фосфат
Сульфат
Перхлорат
яки
Хлорат
(VH)
Кислота калдыгының исемен элементның латинча исеменә
«ат» кушымчасы кушып төзиләр. Әйтик, SO4- ионын сульфат-
ион дип атыйлар (күкерт латинча — сульфур). Үзгәрүчән оксид¬
лашу дәрәҗәле элемент өчен кислота калдыгының исемендә шу¬
лай ук оксидлашу дәрәҗәсен дә күрсәтәләр, мәсәлән, ClO4- —
хлорат (VII)-HOH.
55
Без кислота калдыкларында кислород химик элементы булган
кислоталар белән таныштык. Бу кислоталарны шуңа күрә кисло¬
родлы кислоталар дип атыйлар. Әмма кислородсыз кислоталар
да бар. Кислота үзлекләрен, мәсәлән, водород катионы хасил
итеп диссоциацияләшүче, водородның ике элементтан торган
кушылмалары күрсәтәләр. Аларга HCI — хлороводород (хлорид)
кислотасы, H2S — сероводород кислотасы һ. б. керәләр.
Ирекле хәлдә кислоталар газсыман матдәләр (НС1, H2S),
сыеклыклар (H2SO4, HNO3) һәм каты матдәләр (Н3РО4, H4S1O4)
булып торалар. Күпчелек кислоталарга молекуляр төзелеш хас.
Э 1. Углерод химик элементыннан торучы гади матдәгә, аңа туры килүче
оксидка һәм кислотага характеристика бирегез. Түбәндәге әверелешләрнең
A реакция тигезләмәләрен төзегез: С-э-СОз-^НгСОз.
2. Түбәндәге күчешләр барышында башкарыла торган реакцияләрнең ти¬
гезләмәләрен языгыз: Р-^РгОз-«-НзРСЦ.
3. Хлор югары оксидлашу дәрәҗәсендә булганда НС1О< кислотасын бар¬
лыкка китерә. Аның исемен әйтегез. Бу кислотага хлорның нинди оксиды
туры килә?
4. a) SOl-; б) POl-; в) COi-; г) NOr ионнары ничек аталалар?
§ 17. МЕТАЛЛ. НИГЕЗ ОКСИДЫ. НИГЕЗ
1. а) Калий; б) барий катионнарының формулаларын языгыз. 2. Бу катион¬
нар OH- анионнары белән тәэсир итешкәндә нинди составлы кушылмалар хасил
була?
Сез неметалларның кислота оксидлары барлыкка китерүлә¬
рен, ә соңгыларына кислоталар туры килүен, ягъни түбәндәге
әверелешләр чылбырының мөмкин булуын белдегез:
Неметалл-»-Неметалл оксиды—«-Кислота
Мөгаен, металл шулай ук тиешле әверелешләрнең башлан¬
гычы була аладыр. Әйтик, кальций, кислород белән кушылып,
кальций оксиды хасил итә:
2Са + О2 = 2СаО
Кальций оксиды су белән үзара реакциягә керә. Cy салын¬
ган стаканга бераз гына кальций оксидының ак порошогын са¬
лыйк. Процессның узуын җылылык аерылып чыгу раслый.
Табылган эремәне тикшерик. Иң элек эремәнең электр тогын
үткәрүенә ышаныйк. Моның өчен сезгә таныш булган прибордан
файдаланыйк (26 нчы рәсем). Эремәгә, ток чыганагына тоташ¬
тырылган, электродларны төшерик. Чылбырдагы лампочка яна
башлый. Димәк, эремәдә ионнар бар. Тикшеренүләр эремәдә
кальций ионнары Ca2+ барлыгын күрсәтә.
Ә нинди анионнар бар соң эремәдә? Эремәне шәмәхә төстә¬
ге лакмус белән тикшерик. Лакмус зәңгәр төскә керде. Лакмус¬
56
ның зәңгәр төскә гидроксид-ионнар О1Г булганда керүе бил¬
геле.
Шулай итеп, кальций оксидының су белән тәэсир итешүе
нәтиҗәсендә эремәдә Ca2+ һәм OH- ионнары булуы беленә.
Эремәне парга әйләндергәндә Ca (OH)2 составлы матдә кристал-
лары аерылып чыга. Бу кушылма кальций гидроксиды дип атала.
Кальций оксидының су белән реакциягә керүен
CaOH-H2O = Ca(OH)2
тигезләмәсе белән күрсәтергә була.
Эремәдә кальций гидроксиды ионнарга таркала:
Ca (OH)2 = Ca2+-|-20Н~
Гидроксид-ионнар су белән натрий оксиды, магний оксиды,
барий оксиды һәм кайбер башка металларның оксидлары тәэсир
итешү нәтиҗәсендә дә хасил була.
Эремәдә бары тик гидроксид-анионнар гына хасил итеп һәм
башка анионнарны барлыкка китермичә диссоциацияләшә тор¬
ган матдәләр нигезләр дип аталалар.
Нигезләрнең исемнәрен металл исеменнән һәм гидроксид-ион-
нан төзиләр: мәсәлән, Ca(OH)2 — кальций гидроксиды.
Барлык металларның да оксидлары су белән тәэсир итешмә¬
вен, ләкин аларның һәркайсына нигез туры килүен аерып әйтергә
кирәк. Әйтик, суда эреми торган бакыр (II) оксидына CuO суда
эреми торган нигез — бакыр (II) гидроксиды Cu(OH)2 туры
килә. Нигезләргә туры килүче металл оксидларын нигез оксид¬
лары дип атыйлар.
Шулай итеп, металл, аның оксиды һәм гидроксиды арасында
шундый бәйләнеш бар:
Металл->Металл оксиды-оНигез
Әйтик, тикшерелгән әверелешләр чылбырын мондый схема рә¬
вешендә язарга мөмкин:
Са~>СаО—»-Са (OH) 2
Суда эри торган нигезләрне селтеләр дип атыйлар. Аларга,
мәсәлән, КОН —калий гидроксиды, Ba (OH)2 — барий гидрокси¬
ды һ. б. керәләр. Селтеләр ионлы кушылмалар булып торалар.
•* 1. Нигезләр классына нинди матдәләр һәм нинди характерлы үзлекләре
буенча берләшәләр? Бу матдәләргә мисаллар китерегез.
Л 2. Кушымтадагы таблицадан файдаланып: а) эрүчән; б) аз эрүчән; а) эре-
мәүчән нигезләрнең формулаларын китерегез.
3. Түбәндәге әверелешләрнең тигезләмәләрен языгыз:
Ва-о BaO-OBa(OH)2
4. а) Натрий гидроксидының; б) барий гидроксидының; в) калий гидрок-
сидының ионнарга диссоциацияләшү тигезләмәләрен языгыз.
57
§ 18. НЕЙТРАЛЬЛӘШҮ РЕАКЦИЯСЕ
Сез ничек уйлыйсыз, нигез белән кислота тәэсир итешкәндә нинди реакция
була? Бу сорауга җавап бирү өчен: а) нигезләрнең гомуми үзлекләрен; б) кисло¬
таларның гомуми үзлекләрен нинди ионнар билгеләвен хәтерегезгә төшерегез.
Натрий гидроксиды NaOH эремәсенә нитрат кислотасы HNO3
эремәсен өстик. Без күзгә күренерлек үзгәрешләрне күзәтмибез.
Әмма бу вакытта җылылык аерылып чыгуын белергә кыен түгел.
Димәк, реакция уза. Бу реакциянең асылы нидән гайбарәт?
Бу реакциянең асылын аңлату өчен түбәндәге тәҗрибәне
үткәрик. Селте — натрий гидроксиды NaOH эремәсенә шәмәхә
төстәге лакмус тамчысы өстик. Эремә зәңгәр төскә керә. Аннары
бюреткадан (29 нчы рәсем), лакмус яңадан шәмәхә төскә кер¬
гәнче, аз-азлап нитрат кислотасы HNO3 эремәсен тамызырбыз.
Эремәнең төсе үзгәргәч, эремәдә башка селте юк дигән сүз. Кис¬
лота да юк, югыйсә лакмус кызыл төскә керер иде. Шулай итеп,
реакция нәтиҗәсендә нигезне күрсәтүче билгеләр дә (ОН- ион¬
нары булу), кислотаны күрсәтүче билгеләр дә (H+ ионнары бу¬
лу) юкка чыкты.
Моннан килеп чыкканча, водород H+ ионнары белән гидрок-
сид-ионнар OH- арасында реакция булып узды:
H+H-OH- = HOH, яки H2O
Бу реакция вакытында су барлыкка килә һәм эремә нейтраль¬
ләшә.
Кислота белән нигез арасында су хасил итеп бара торган
реакция нейтральләшү реакциясе дип атала.
Нейтральләшү реакциясе нәтиҗәсендә шулай ук тоз да хасил
була.
Башкарылган нейтральләшү реакциясен
29 нчы рәсем. Нейтральләшү реакция¬
сен үткәрү өчен прибор.
NaOH + HNO3 = NaNO3-F H2O
тигезләмәсе ярдәмендә язып ку¬
ярга мөмкин. Эремәне парга әй¬
ләндергәндә натрий нитраты
NaNO3 тозының кристаллары
аерылып чыгар.
Ни өчен нейтральләшү ре¬
акциясен тормышка ашыру
мөмкин соң? Кислотагы H +
ионнары белән нигездәге OH-
ионнары кушылып су молекула¬
лары H2O хасил итәләр. Cy мо¬
лекулалары практик яктан ион¬
нарга таркалмыйлар. Саф су
практик яктан электр тогын үт¬
кәрми.
58
Кислоталар белән башка нигезләр дә, шул исәптән суда эре¬
ми торган нигезләр дә реакциягә керәләр.
Эремәүчән бакыр (II) гидроксидын Cu(OH)2 табыйк. Моның
өчен тоз эремәсенә, мәсәлән бакыр (II) хлориды CuCb эремә¬
сенә, селте — калий гидроксиды KOH эремәсе өстик. Бакыр (II)
гидроксидының Cu(OH) 2 зәңгәр утырымы төшә (аска юнәлтел-
гән ук| утырым хасил булуны, ә өскә юнәлтелгән ук f газ
барлыкка килүне күрсәтә):
Cu2++ 20Н-=Cu(OH)2I
Утырым өстендәге эремәне агызып алыйк һәм утырымга суль¬
фат кислотасы өстик. Нәтиҗәдә үтә күренмәле зәңгәр төстә
бакыр (II) сульфаты эремәсе барлыкка килә:
Cu (ОН) 2 + H2SO4 = CuSO4 + 2Н2О
? 1. Нейтральләшү реакциясенең асылы нидән гайбарәт? a) KOH һәм HzSO4;
6) NaOH һәм H3PO4; в) Ca(ОН) г һәм HNO3; г) Al(OH)3 һәм HzSO4 ара-
▲ сындагы нейтральләшү реакцияләренең тигезләмәләрен төзегез. Барлыкка
килүче тозларның исемнәрен атагыз. Эремәдә нинди ионнар булыр? Бу тоз¬
ларны эремәдән ничек аерып алырга мөмкин?
2. Түбәндәге тозларны табу өчен нинди кислоталар һәм нигезләр алырга
кирәк булыр: a) Fe(NO3)3; б) Fez(SO4)3; в) NaCl; г) Mg(NO3)Z? Реакция¬
ләрнең тигезләмәләрен языгыз, реакциядә катнашучы матдәләргә исемнәр
бирегез.
3. Кальций сульфатының CaSO4 а) нигез һәм кислота; б) металл оксиды
һәм неметалл оксиды; в) кальций оксиды һәм сульфат кислотасы; г) каль¬
ций гидроксиды һәм күкерт (VI) оксиды тәэсир итешкәндә хасил булу
реакцияләренең тигезләмәләрен төзегез.
4. Эрүчән тозларны азот кислотасы белән: а) кургаш (II) гидроксидын;
б) бакыр (II) гидроксидын; в) цинк гидроксидын; г) тимер (III) гидрокси¬
дын нейтральләштереп табу реакцияләренең тигезләмәләрен языгыз.
9 нчы лаборатор дәрес
КИСЛОТАЛАР ҺӘМ НИГЕЗЛӘР
1. Индикаторлар
Лабораторияләрдә төрле индикаторлардан файдаланалар. Бу
эшне башкарганда сез лакмус, метилоранж (метиловый оранже¬
вый), фенолфталеин кебек индикаторларны кулланырсыз. Сезгә
күрсәтелгән индикаторларның дистиллирланган судагы (нейт¬
раль тирәлек), кислота эремәсендәге (әче тирәлек) һәм селте
эремәсендәге (селтеле тирәлек) төсләрен чагыштырып карарга
кирәк булачак. Индикаторларны эремә рәвешендә яки индикатор
эремәсе сеңдереп киптерелгән индикатор кәгазе рәвешендә кул¬
ланалар.
Күзәтүләрнең нәтиҗәләрен 4 нче таблица рәвешендә язып
куегыз.
59
4 нче таблица. Кислота-нигез индикаторлары
һәм аларның төсләре
Индикатор
Индикаторның төсе
суда
кислота
эремәсендә
селте
эремәсендә
Лакмус
Метилоранж
Фенолфталеин
1 нче тәҗрибә. Дистиллирланган су салынган өч пробиркага
берәр тамчы лакмус, метилоранж һәм фенолфталеин тамызыгыз
(яки индикатор кәгазе төшерегез). Нейтраль тирәлектә индика¬
торларның төсләрен билгеләгез.
2 нче тәҗрибә. Кислота эремәсе салынган өч пробиркага
берәр тамчы күрсәтелгән индикаторларны тамызыгыз (яки ин¬
дикатор кәгазе төшерегез). Индикаторларның төсләрен билге¬
ләгез.
3 нче тәҗрибә. Өч пробиркага селте эремәсе салыгыз һәм
берәр тамчы бирелгән индикаторларны өстәгез (яки индикатор
кәгазе төшерегез). Селте эремәсендә индикаторларның төсләрен
билгеләгез.
2. Кислоталарны һәм селтеләрне билгеләү
Ике пробиркада кислота һәм селте эремәләре бирелгән. Сез¬
гә аларның кайсы пробиркада икәнен белергә кирәк булачак.
4 нче тәҗрибә, һәр пробиркадан 2—3 мл эремәне башка про¬
биркаларга агызып алыгыз, һәм кайсында — нигез, ә кайсында
кислота булуын билгеләгез. Моны сез ничек башкарырсыз?
3. Нейтральләшү реакциясе
5 нче тәҗрибә. Фарфор чашкага 5 мл нинди дә булса кисло¬
та эремәсе салыгыз. Бер тамчы лакмус өстәгез. Аннары тамчы¬
лап, пыяла таякчык белән болгаткан хәлдә, лакмус шәмәхә төскә
кергәнче, нинди дә булса селте эремәсе өстәгез. Башкарылган
реакциянең тигезләмәсен төзегез.
6 нчы тәҗрибә. Фарфор чашканы штатив боҗрасына урнаш¬
тырыгыз һәм эремәне горелка (спиртовка) ялкынында җылыты¬
гыз. Эремәне чашканың стеналарында тоз кристаллары күренгән¬
че парга әйләндерегез.
60
§ 19. КИСЛОРОДЛЫ КИСЛОТАЛАРНЫҢ. ТОЗЛАРЫ
1. а) Магний гидроксиды һәм сульфат кислотасы; б) калий гидроксиды
һам нитрат кислотасы арасындагы нейтральләшү реакцияләренең тигезләмәләрен
төзегез. 2. а) Магний сульфаты; б) калий нитраты тозлары нинди ионнардан
торалар?
Нигез кислота белән тәэсир итешә. Бу вакытта тоз хасил бу¬
ла. Шундый ук рәвешчә нигез оксиды кислота оксиды белән ре¬
акциягә керә. Мәсәлән, магний оксиды MgO күкерт (VI) оксиды
SOs белән үзара тәэсир итешә:
MgOH-SO3 = MgSO4
Нәтиҗәдә магний сульфаты тозы MgSO4 хасил була. Бу тозның
кристаллары уңай корылмалы магний ионнарыннан Mg2+ һәм
тискәре коралмалы сульфат-ионнардан SO4- торалар. Сульфат-
анион SO4- сульфат кислотасының НгБО4 кислота калдыгы бу¬
лып тора.
Сез, мөгаен, игътибар иткәнсездер, бу периодның югары ок¬
сидлашу дәрәҗәләрендәге элементлары барлыкка китергән кис¬
лота калдыкларының составы нәкъ шундый ук. 2 нче период эле¬
ментларына бер неметалл атомыннан һәм өч кислород атомыннан
(30 нчы рәсем, а) торучы кислота калдыклары характерлы:
BOi-, СОГ, NO3-.
Төзелешләре охшаш булган хәлдә алар үзләренең корылма¬
лары белән аерылып торалар.
3 нче периодның югары оксидлашу дәрәҗәсендәге элемент¬
ларның кислота калдыклары бер неметалл атомыннан һәм дүрт
кислород атомыннан (30 нчы рәсем, б) торалар: SiO4-, PO4-,
SOl-, ClO4-.
30 нчы рәсем. 2 нче (а) һәм 3 нче (б) периодлардагы неметалл элементлары
кислота калдыкларының схема рәвешендәге сурәтләнеше.
61
Ионнар корылмаларының зурлыклары белән аерылып тора¬
лар.
Судагы эремәләрендә тозлар металл катионнарына һәм кис¬
лота калдыклары анионнарына диссоциацияләшәләр. Мәсәлән:
K2SO4 = 2K+ + SO4_
NaNO3 = Na +4-NO3-
KCl = K+H-Cl-
Тозларның судагы эремәләрендә нинди кисәкчекләргә диссо-
циацияләшүләреннән чыгып, тозларга мондый билгеләмә бирер¬
гә мөмкин.
Тозлар — эремәдә металл катионнарына һәм кислота калдык¬
ларына таркала торган кушылмалар.
Тозлар табигатьтә бик күп таралган. Алар хайван һәм үсем¬
лек организмнарындагы матдәләр алмашу процессларында мө¬
һим роль уйныйлар. Тозлар тере организмнарның күзәнәк сыек¬
часында бар, алар сөяк, нерв, мускул Һ. б. тукымаларның состав¬
ларына керәләр. Кеше организмында тозлар 5,5% чамасы тәш¬
кил итәләр. Tepe организмнар тозларның даими рәвештә кереп
торуына мохтаҗ. Эчә торган суда тозлар булуын сез беләсез.
Халык хуҗалыгында да тозларның роле бик зур. Тозларны,
мәсәлән, күп кенә металларны, минераль ашламаларны, пыяла,
минераль буяулар, юу матдәләре һ. б. табу өчен кулланалар.
Күп кенә тозларны промышленностьта бик зур микъдарларда
табалар. Әйтик, ел саен берничә миллион тонна натрий карбо¬
наты— сода Na2CO3 җитештерәләр. Натрий карбонатын башлы¬
ча гади пыяла табу өчен кулланалар. Табигый кальций фосфа¬
тыннан Ca3(PO4)2 күпләп фосфорлы ашламалар һәм башка мат¬
дәләр җитештерәләр. Натрий силикаты эремәләрен җилемнәр
(силикат җилеме ярдәмендә катыргы әйберләрне ябыштыралар)
ясау өчен кулланалар. Бик зур микъдарларда калий хлоридын
KCl табалар. Ул калийлы ашлама һәм калийның башка кушыл¬
маларын җитештерү өчен башлангыч матдә буларак кулланыла.
Сезгә натрий хлориды NaCl яхшы таныш. Натрий хлориды —
химия промышленностеның күп санлы тармаклары өчен башлан¬
гыч чимал (сода, хлор һ. б. табу), әмма бу турыда алдагы курс¬
та сөйләнәчәк.
? 1. Составларына кислород һәм: а) 2 нче периодның неметалл элемент¬
лары; б) 3 нче периодның неметалл элементлары кергән тискәре корылма¬
лы катлаулы ионнарга мисаллар китерегез.
▲ 2. CaO-I-CO2 = CaCO3
реакциясе мисалында түбәндәге сораулар буенча фикер алышыгыз. Неме¬
талл оксиды белән металл оксиды үзара тәэсир итешкәндә нинди кушыл¬
ма хасил була? Бу реакциянең продукты нинди кисәкчекләрдән тора? Ул
неорганик кушылмаларның кайсы классына керә?
3. Кальций оксиды белән күкерт (Vl) оксиды арасындагы реакциянең тигез¬
ләмәсен языгыз. Хасил булган тозның исемен атагыз.
4. Түбәндәге тозларның электролитик диссоциацияләре тигезләмәләрен язы¬
гыз: а) магний сульфаты; б) натрий фосфаты; в) кальций хлориды; г) нат¬
рий карбонаты; д) кальций нитраты. 1 моль һәр тоз диссоциацияләшкән-
дә ничәшәр моль катионнар һәм анионнар барлыкка килә?
62
5. Эремәләрдә: a) K+ һәм Cl-; б) Al3+ һәм SO3-; в) Na+ һәм СЮГ;
г) Mg2+ һәм NOf; д) Ba2+ һәм Cl- ионнары булса, кристаллашканда
нинди тозлар барлыкка килер? Бу ионнардан тозлар хасил булу тигез¬
ләмәләрен төзегез. Тозларның исемнәрен атагыз.
6. Кайбер чирләрне дәвалаганда авырулар диңгез ванналары кабул итәләр.
Диңгез суында башлыча Na + , Mg5 + , Ca2+, Cl-, S0«-, Br-, I-, K+
ионнары бар. Диңгездән ерак урнашкан дәвалау йортларында диңгез суын
ясалма рәвештә хәзерлиләр. Диңгез суын хәзерләү өчен төче суда нинди
тозлар эретергә кирәк?
7. Безнең илдә нинди күлләр тоз табу өчен чыганак булуын сез география
курсыннан беләсез. Аларны атап чыгыгыз.
Я Минераль су шешәсендәге этикетка белән танышыгыз. Бу минераль суда
нинди ионнар бар?
§ 20. ИОНЛЫ РЕАКЦИЯЛӘР
Тозларның, кислоталарның һәм нигезләрнең суда эрүчәнлеге таблицасы бе¬
лән танышыгыз (кушымтаны карагыз), а) Суда эрүчән; б) суда аз эрүчән; в) су¬
да практик яктан эремәүчән тозларга мисаллар китерегез.
Ионлы реакцияне тормышка ашыруның билгеләреннән берсе
булып утырым төшү тора. Утырым, мәсәлән, реакция продуктла¬
рыннан берсе генә булса да суда эремәгән яки аз эрегән очрак¬
та, барлыкка килә. Еш кына утырым тозлар катнашкан реакция¬
ләрдә хасил була.
Натрий хлориды NaCl һәм көмеш нитраты AgNOa эремәлә¬
рен алыйк. Алар ионнарга диссоциацияләшәләр:
NaCI = Na+H-Cl-
AgNO3 = Ag+H-NOy
Аларның эремәләрен бергә кушканда ак утырым төшә. Реак¬
ция нәтиҗәсендә нинди матдәләр барлыкка килде?
Эремәләрне бергә кушкан моментта аларда Na+, Ag+, Cl-,
NOr ионнары бар иде. Эремәдә ионнар тәртипсез рәвештә хә¬
рәкәт итәләр һәм һәрвакыт бер-берсе белән бәрелешеп торалар:
Na+H-Cl-; Ag+H-NOr; Na+ + NOr; Ag+H-Cr
Бу бәрелешләрнең кайсысы ионнардан утырым хасил булуга,
ягъни суда эремәүчән тоз барлыкка килүгә китерә соң? Беренче
ике пар ионнары бәрелешкәндә баштагы тозлар хасил була,
әмма бу тозлар суда яхшы эриләр. Кушымтадагы таблицадан
күренгәнчә, натрий нитраты NaNO3 тозы да шулай ук яхшы
эрүчән. Димәк, утырым төшүгә китерерлек бары тик бер генә
ионнар җыелмасы кала,— бу Ag+ катионнары һәм СГ анионна¬
ры арасындагы реакция:
Ag+-FCl-=AgClI
Эремәләрдә ионнар арасында бара торган реакцияләр ионлы-
реакцияләр дип атала.
63
Реакция нәтиҗәсендә табылган көмеш хлориды AgCl утыры¬
мын фильтрлап аерып алганда, ә фильтратны парга әйләндер¬
гәндә, эремәдән натрий нитраты NaNOa тозының кристаллары
аерылып чыга. Шулай итеп, реакция нәтиҗәсендә ике тоз: берсе
эремәүчән — көмеш хлориды AgCl, икенчесе яхшы эрүчән — нат¬
рий нитраты NaNOa, хасил булды. Тикшерелгән тәҗрибәнең нә¬
тиҗәсен түбәндәге реакция тигезләмәсе белән күрсәтергә мөм¬
кин:
AgNO3H-NaCl = NaNO3-I-AgClI
Тигезләмәдән күренгәнчә, реакциядә тозлар арасында ионнар
алмашу була. Мондый реакцияләр алмашу реакцияләренә керә¬
ләр.
Ионнар арасындагы реакцияләр утырым, газ яки аз диссо-
циацияләшүче кушылма хасил булу ягына таба баралар. Барлык
бу очракларда да баштагы ионнар реакция сферасыннан чыгучы
продукт хасил итәләр.
Тозларның эрүе һәм аларның табигый сулардан аерылып
чыгуы Җирдә өзлексез булып тора. Табигатьтәге химик процесс¬
лар нәтиҗәсендә табигый суларда эрегән тозлар була. Чишмә¬
ләр, елгалар үз сулары белән диңгезләргә һәм океаннарга гаять
күп микъдарда эрегән тозлар алып киләләр. Мәсәлән, Иделнең
Каспий диңгезенә 50 млн. тонна чамасы эрегән тозлар чыгаруын
исәпләп белгәннәр. Диңгез суында тозлар (3,5%) елга суларын-
дагыга (0,01%) караганда чагыштыргысыз дәрәҗәдә күбрәк.
Ионлы реакцияләр нәтиҗәсендә диңгез суында барлыкка
килүче аз эрүчән тозлар өзлексез төпкә утыралар.
Җир тарихы дәвамында аның кабыгы күчешләре нәтиҗә¬
сендә диңгезләрнең урнашуы үзгәреп торган. Утырма токымнар¬
ның ятмалары күтәрелгән диңгез төбе өслегенә чыккан. Җир
кабыгының күчешләре вакытында шулай ук тозлы күлләр дә
барлыкка килгән. Аларның күбесе инде кибеп беткән, ә калган¬
нары әле һаман да бар: бу — Каспий һәм Арал диңгезләре,
Эльтон һәм Баскунчак күлләре. Суларында башлыча хлоридлар,
сульфатлар, карбонатлар тибындагы тозлар булган күлләр оч¬
рый. Суларында тозларның микъдары күп булганлыктан, мондый
күлләр химия промышленносте өчен мул чимал базасы булып
торалар.
? 1. Кайбер матдәләрнең суда эрүчәнлеге күрсәтелгән таблицадан файдала¬
нып (кушымтаны карагыз), түбәндә бирелгән тозларның кайсылары: а) эрү-
A чән; б) аз эрүчән яки эремәүчән булуларын билгеләгез: KCl, PbCl2, CaS,
AgCl, NaNO3, CaCO3.
2. а) Эрүчән; б) аз эрүчән; а) эремәүчән сульфатларның (VI) формула¬
ларын языгыз.
3. Түбәндәге ионнар үзара тәэсир итешкәндә нинди тозлар хасил була:
а)Ва2+ һәм SOl-; б) Na+ һәм CO3-; в) Ca2+ һәм SOl-; г) K+ һәм
NOY; д) Pb2+ һәм NOr? Бу тозларның кайсылары суда эрүчән, ә кайсыла¬
ры—эремәүчән (аз эрүчән)?
64
4. Бер эремәдә Ca2+ һәм Cl- ионнары, икенчесендә K+ һәм СОз~ ионнары
бар. Бу эремәләрдәге ионнар нинди тозларның электролитик диссоциация-
ләшүе нәтиҗәсендә хасил булганнар? Эремәләрне бергә кушканда нинди
тоз утырымга төшәр? Нинди тоз эремәдә калыр? Реакциянең тигезләмә¬
сен төзегез һәм аның асылын ионлы тигезләмәне язып аңлатыгыз.
РЕАКЦИЯЛӘРНЕҢ ИОНЛЫ ТИГЕЗЛӘМӘЛӘРЕН
ТӨЗҮГӘ КҮНЕГҮЛӘР
Ионнар арасындагы күп кенә реакцияләрнең аз эрүчән
(эремәүчән) матдә хасил булу ягына узуларын сез беләсез инде.
Матдәләрнең эрүчәнлеге турында мәгълүматлар булганда, эремә¬
дәге ионнар арасындагы реакция нәтиҗәсендә нинди матдәләр
барлыкка киләчәген алдан белү кыен түгел (кушымтаны ка¬
рагыз) .
1 нче мисал. Кальций карбонатын табу өчен нинди матдә¬
ләрнең эремәләрен алырга кирәк?
Кушымтадагы эрүчәнлек таблицасына карыйк. Кальций кар¬
бонаты СаСОз суда эреми. Аның ионнардан хасил булуын
Ca2+ +COi- = CaCO3;
тигезләмәсе белән күрсәтергә мөмкин.
Эремәдә шушы реакция узсын өчен нинди матдәләр алырга
кирәк? Ca2+ ионнары хасил итеп диссоциацияләшүче, кальций¬
ның теләсә нинди эрүчән кушылмасын алырга ярый. Эрүчәнлек
таблицасыннан күренгәнчә, ул кальций нитраты Ca(NO3)3, каль¬
ций хлориды CaCh булырга мөмкин.
CO3- ионнары белән тәэмин итүче буларак суда эрүчән те¬
ләсә кайсы карбонатны алырга ярый. Таблицага карыйк. Алар-
ның К2СО3, Na3CO3 булуы мөмкин.
Реакцияне үткәрү өчен K2CO3 һәм Ca (NO3) 2 алынса, каль¬
ций карбонаты барлыкка килүне
К2СО3 + Ca (NO3) 2 = CaCO3; + 2KNO3
тигезләмәсе белән күрсәтеп була. '
CaCO3 табу өчен Na3CO3 һәм CaCl3 эремәләре алынса, ул
чагында реакциянең тигезләмәсе мондый була:
Na2CO3 +CaCl2 = 2NaCl +CaCO3;
һәр ике очракта да процессның асылы:
Ca2++ СО!" = CaCO3;
ионлы тигезләмә белән күрсәтелер.
1 нче бирем, а) Кальций фосфаты; б) кургаш (II) сульфаты;
в) барий карбонаты табу өчен нинди тозларның эремәләрен
алырга кирәк? Биремдә күрсәтелгән тозларны табу реакцияләре¬
нең тигезләмәләрен төзегез һәм процессның асылын ионлы тигез¬
ләмәләрне язып аңлатыгыз.
5 п-236 65
2 нче бирем. Ионнар арасындагы реакцияләрне: a) Ca2+ +
+ SO2-->CaSO4|; б) Ba2+ + РОГ->Ва3 (PO4)2I
эремәдәге нинди тозлар китереп чыгара? Реакцияләрнең тигез¬
ләмәләрен языгыз.
3 нче бирем, а) Стронций карбонаты; б) барий силикаты;
в) кургаш (II) фосфаты тозлары хасил булу белән бара торган
өчәр алмашу реакциясенә мисаллар китерегез.
2 нче мисал. Натрий сульфаты һәм барий хлориды эремәлә¬
рен бергә кушканда нинди матдәләр хасил була?
Эрүчәнлек таблицасыннан күренгәнчә, бу тозларның икесе
дә суда эриләр. Эремәдә алар ионнар рәвешендә булалар:
Na2SO4 = 2Na++ SO4-
BaCl2 = Ba2++ 2СГ
Шулай итеп, бу эремәләрдә Na+ һәм Ba2+ катионнары һәм
SO4- һәм Cl- анионнары була. Эремәләрне бергә кушканда
бу ионнарның нинди җыелмасы эреми торган (аз эри торган)
кушылма ясалуга китерер? Эрүчәнлек таблицасыннан күренгән¬
чә, Na+ һәм Cl- ионнары җыелмасы эрүчән тозны бирә. Эремәү-
чән тоз Ba2+ һәм SO4- ионнары үзара тәэсир итешкәндә бар¬
лыкка килә:
Ba2+ + SO4- = BaSO4|
Реакция өчен натрий сульфаты һәм барий хлориды алынган¬
лыктан, реакциянең тигезләмәсе мондый булыр:
BaCl2+Na2SO4 = BaSO4I+ 2NaCl
Барлыкка килүче барий сульфаты утырымга төшә.
4 нче бирем. Түбәндәге тозларның эремәләрен бергә куш¬
канда нинди тозлар утырымга төшә: а) көмеш нитраты һәм
кальций хлориды; б) натрий сульфаты һәм кургаш (II) нитраты;
в) барий нитраты һәм калий сульфаты? Бу әверелешләрнең асы¬
лын күрсәткән реакция тигезләмәләрен төзегез. Нинди тозлар
эремәдә кала? Хасил булучы тозларның исемнәрен атагыз.
5 нче бирем. Аш тозын натрий сульфатыннан (VI) ничек
чистартырга?
10 нчы лаборатор дәрес
ИОНЛЫ РЕАКЦИЯЛӘР
Реакция вакытында эремәүчән (аз эрүчән) кушылма хасил
булуны теге яки бу ионның барлыгын белү өчен файдаланалар.
Әйтик, Ba2+ һәм SO4- ионнары үзара тәэсир итешкәндә BaSO4
утырымы хасил була. Шуңа күрә барийның эрүчән тозларын
эремәдә сульфат-ионнарның SO4 барлыгын белү өчен кулла¬
нырга мөмкин. Икенче төрле әйткәндә, барийның эрүчән тозлары
66
сульфат-ионнарга SO4- реактив булып торалар, ә эрүчән суль¬
фатлар үз чиратында Ba2+ ионнарына реактив булып тора.
1 нче тәҗрибә. Сульфат-ионнарның SO2- барлыгын белү.
Бер пробиркага — натрий сульфаты эремәсе, ә икенчесенә калий
сульфаты эремәсе салыгыз, һәр ике пробиркага да тамчылап
барий хлориды эремәсен өстәгез. Күзәтүләрегезне аңлатып бире¬
гез. Алынган тозларның электролитик диссоциациясе тигезләмә¬
ләрен һәм алмашу реакцияләренең тигезләмәләрен төзегез. Реак¬
цияләрнең ионлы тигезләмәләрен языгыз. Нинди кушылмалар
барий ионнарына Ba2+ реактив була ала? Ионнарның барлыгын
реактив ярдәмендә белүнең асылы нидән гыйбарәт?
2 нче тәҗрибә. Хлорид-ионнарның Cl~ барлыгын белү. Эрү-
чәнлек таблицасы буенча составларында хлорид-ион Cl- булган
нинди тозларның эремәүчән (аз эрүчән) икәнен ачыклагыз. Сез¬
гә бирелгән реактивлар ярдәмендә натрий хлориды эремәсендә
хлорид-ионнар барлыгын исбат итегез. Тозларның диссоциация¬
се, алмашу реакциясенең тигезләмәләрен һәм башкарылган реак¬
цияләрнең ионлы тигезләмәләрен төзегез.
3 нче тәҗрибә. Сульфат-ионнарның SO?- һәм хлорид-ионнар¬
ның Cl- барлыгын белү. Ике пробиркада калий хлориды һәм
магний сульфаты эремәләре бирелгән. Бер пробиркада калий
хлориды, ә икенчесендә магний сульфаты эремәләре булуын нин¬
ди реакцияләр ярдәмендә исбатларга мөмкин?
Беренче пробиркадагы эремәне ике пробиркага бүлеп салы¬
гыз. Аның берсенә кургаш (II) сульфаты эремәсе, ә икенчесе¬
нә — барий хлориды эремәсен өстәгез. Кайсы пробиркада утырым
төште? Беренче пробиркада кайсы тоз эремәсе: KCl яки MgSO4?
Икенче пробиркадагы эремәдә беренче пробиркада булмаган
анионның барлыгын тикшерегез. Моның өчен тикшерелә торган
эремәгә кургаш (II) нитраты эремәсен өстәгез. Күзәтүләрегезне
аңлатып бирегез.
Сез башкарган алмашу реакцияләренең тигезләмәләрен тө¬
зегез. Ионнар барлыгын белү реакцияләренең ионлы тигезләмә¬
ләрен төзегез.
«ЭРЕМӘЛӘРНЕҢ МОЛЯР КОНЦЕНТРАЦИЯСЕ»
ТЕМАСЫНА КАРАТА КҮНЕГҮЛӘР
Моляр концентрация эремәдәге матдә микъдарының эремә¬
нең күләменә чагыштырмасын күрсәтә:
V(X)
V
Эремәләр белән эш иткәндә аларның моляр концентрациясен
белү шуның белән уңайлы ки, ул эремәнең билгеле бер күләмен¬
дәге матдә микъдарын (мольләр санын) исәпкә алырга мөмкин¬
лек бирә. Реакциянең тигезләмәсеннән чыгып, реакцияне тор¬
мышка ашыру өчен эремәләрнең тиешле күләмнәрен ансат сай¬
лап алырга була.
C(X)
5
67
1 нче мисал, а) Натрий гидроксидының 1 л 1 моль/л моляр
концентрацияле эремәсен; б) натрий гидроксидының 0,5 л
2 моль/л моляр концентрацияле эремәсен; в) натрий гидрокси¬
дының 1 л 2 моль/л моляр концентрацияле эремәсен нейтраль¬
ләштерү өчен хлорид кислотасының HCl 1 моль/л моляр кон¬
центрацияле эремәсен нинди күләмдә алырга кирәк булыр?
Хлорид кислотасы һәм натрий гидроксиды арасындагы ней¬
тральләшү реакциясе
HCl + NaOH = NaCl + H2O
H+H-OH- = H2O
тигезләмәсе белән күрсәтелә.
Моннан килеп чыкканча, нейтральләштерү өчен: а) 1 л
1 моль/л моляр концентрацияле NaOH эремәсенә 1 л 1 моль/л
моляр концентрацияле хлорид кислотасы эремәсе; б) 0,5 л
2 моль/л моляр концентрацияле NaOH эремәсенә 1 л 1 моль/л
моляр концентрацияле хлорид кислотасы HCl эремәсе; в) 1 л
2 моль/л моляр концентрацияле NaOH эремәсенә 2 л 1 моль/л
моляр концентрацияле хлорид кислотасы HCl эремәсе кирәк.
1 нче бирем, а) 0,5 моль/л; б) 2 моль/л; в) 0,1 моль/л моляр
концентрацияле 2 л күләмендәге эремә хәзерләү өчен кирәкле
калий нитратының KNO3 массасын исәпләп чыгарыгыз.
2 нче бирем. 2 моль/л моляр концентрацияле 1 л сульфат
кислотасы эремәсе H2SO4 табу өчен ничә грамм күкерт (VI)
оксиды SO3 кирәк булыр?
3 нче бирем. 2 моль/л моляр концентрацияле 1 л фосфат
кислотасы Н3РО4 эремәсен нейтральләштерү өчен нинди күләм¬
дә 0,5 моль/л моляр концентрацияле калий гидроксиды KOH
эремәсе кирәк?
2 нче мисал. 1 моль/л моляр концентрацияле 1 л барий хло¬
риды BaCl2 эремәсен һәм 1 моль/л моляр концентрацияле 1 л
натрий сульфаты (VI) Na2SO4 эремәсен бергә кушканда барлык¬
ка килүче утырымның массасы күпме булыр?
Барий хлориды һәм натрий сульфаты (VI) эремәдә ионнар
рәвешендә булалар:
BaCl2 = Ba2+ + 2СГ
Na2SO4 = 2Na++ SO2-
Кушымтадагы эрүчәнлек таблицасы буенча утырым Ba2+ һәм
SO2- ионнары тәэсир итешкәндә хасил була:
Ba2+-I-SO24- = BaSO4;,
ә Na+ һәм Cl- ионнары тәэсир итешкәндә утырым барлыкка
килми.
1 моль/л моляр концентрацияле 1 л BaCl2 эремәсендә 1 моль
Ba2+ ионнары бар, 1 моль/л моляр концентрацияле 1 л Na2SO4
эремәсендә 1 моль SO4- ионнары бар. Димәк, бу эремәләрне бер¬
68
гә кушканда 1 моль BaSO4 хасил була. M(BaSO4) =233 г/моль.
Ул чагында 1 моль-233 г/моль BaSO4 = 233 г BaSO4.
Җавап. Бирелгән эремәләрне бергә кушканда 233 г барий
сульфаты BaSO4 утырымы барлыкка килә.
4 нче бирем. Бакыр (II) хлоридының моляр концентрациясе
C(CuCh) = 1моль/л булган 0,5 л эремәсен һәм калий гидрокси-
дының моляр концентрациясе C(KOH) = I моль/л булган 1 л
эремәсе белән бергә кушканда нинди кушылма утырымга төшәр
һәм аның массасы күпме булыр?
3 нче мисал. IOO г кальций карбонаты СаСОз табу өчен моляр
концентрацияләре 1 моль/л булган эремәләр нинди күләмдә ки¬
рәк булырлар?
Кальций карбонаты СаСОз
Ca2++ COi-= CaCO3I
реакциясе нәтиҗәсендә хасил була.
IOO г СаСОз ничә моль тәшкил итә? M(CaCOs) = IOO г/моль.
Шулай итеп, мәсьәләдә 1 моль CaCO3 табу турында сүз бара.
Аны табу өчен тоз эремәләрен шундый күләмнәрдә алырга ки¬
рәк ки, аларда 1 моль Ca2+ ионнары һәм 1 моль CO3- ионнары
булырга тиеш.
Җавап: Мәсәлән, 1 моль/л моляр концентрацияле 1 л CaCU
эремәсе һәм шундый ук концентрацияле 1 л NajCO3 эремәсе яки
1 моль/л моляр концентрацияле 1 л Ca(NO3)2 эремәсе һәм 1 л
1 моль/л моляр концентрацияле К2СО3 эремәсе алырга мөмкин.
5 нче бирем. 542 г кургаш (II) сульфаты PbSO4 табу өчен
1 моль/л моляр концентрацияле тоз эремәләрен нинди күләм¬
нәрдә алырга кирәк?
11 нче лаборатор дәрес
КҮРСӘТЕЛГӘН МОЛЯР КОНЦЕНТРАЦИЯЛЕ
ЭРЕМӘ ХӘЗЕРЛӘҮ
Каты матдәнең эремәсен хәзерләү
0,10 моль/л моляр концентрацияле 1 л күләмендә NaCl эремә¬
сен хәзерләргә кирәк булсын ди.
Шарт буенча 1 л эремәдә 0,10 моль NaCl бар. M (NaCl) =
= 58,5 г/моль. Шулай итеп, 1 л эремәдә:
0,1 моль/л-58,5 г/моль NaCl = 5,85 г NaCl
Эремәне хәзерләү схемасы 31 нче рәсемдә күрсәтелгән.
Эремә хәзерләү өчен 5,85 г NaCl алырга кирәк. Үлчәнгән
тозны 1 литр сыешлы үлчәү колбасына салырбыз. 100—150 мл су
өстәрбез. Барлык тоз эреп беткәннән соң, эремәне, колбаның
муенындагы боҗрасыман билгесенә кадәр су салып, 1 л күләменә
кадәр сыегайтырбыз.
69
31 нче рәсем. Каты матдәнең эремәсен
хәзерләү схемасы.
32 нче рәсем. Куертылган эремәне сые¬
гайтып эремә хәзерләү схемасы.
Куертылган эремәне сыегайтып
эремә хәзерләү
Әйтик, C(H2SO4) = IjO моль/л моляр концентрацияле эремә¬
дән C(H2SCh) =0,10 моль/л моляр концентрацияле 1 л H2SO4
эремәсен хәзерләргә кирәк булсын ди.
1,0 моль/л моляр концентрацияле эремәдән 0,10 моль H2SO4
алырга кирәк. H2SO4Hbm мондый матдә микъдары 1,0 моль/л мо¬
ляр концентрацияле 100 мл эремәдә булыр.
1 л сыешлы үлчәү колбасына 100—150 мл су салырбыз.
Исәпләп табылган күләмдәге эремәне пипетка белән алып үлчәү
колбасына бушатырбыз. Аннан соң эремәне, аның күләмен
1 литрга кадәр җиткереп, су белән сыегайтырбыз.
Эремә хәзерләүнең эш тәртибе 32 нче рәсемдә күрсәтелгән.
Хәзерләгән эремәләрне нейтральләшү
реакциясендә куллану
Кислота эремәсен (моляр концентрациясе билгеле) бюретка-
га салыгыз (33 нче рәсем). Пипетка ярдәмендә колбага 20 мл
селте эремәсе (моляр концентрациясе билгеле) салыгыз. Колба¬
га 1—2 тамчы кислота-нигез индикаторы өстәгез. Аннары бю-
70
реткадан колбага аз-азлап
кислота эремәсен агызыгыз.
Нейтральләшү реакциясенең
тулысынча тәмамлануын инди¬
каторның төсе үзгәрүдән белеп
була. Селтене нейтральләштерү
өчен ничә миллилитр кислота
эремәсе тотылуын билгеләгез.
Нейтральләшү тулысынча
узсын өчен, нейтральләшү ре¬
акциясенә киткән эремәләрнең
күләмнәре, тотылган эремәләр¬
нең моляр концентрацияләренә
туры килүен яки килмәвен
исәпләп чыгарыгыз.
§21. Оксидларның кислоталар
һәм нигезләр белән үзара
тәэсир итешүләре
Сез ничек уйлыйсыз, әгәр: а) ба¬
рий оксиды BaO сульфат кислотасы бе¬
лән; б) күкерт (VI) оксиды барий
гидроксиды Ba (ОН) г белән үзара ре¬
акциягә керсәләр, нинди продуктлар
барлыкка килер?
Нигез — кальций гидрокси¬
ды Ca (OH) 2 эремәсе аша угле¬
род (IV) оксиды СО2—кислота
оксидын уздырыйк. Эремәнең
болганчыклануы күзәтелә. Эре-
мәүчән тоз —кальций карбона¬
ты СаСОз хасил була:
33 нче рәсем. Нигез эремәсен кислота
эремәсе белән нейтральләштерүнең эш
тәртибе.
Ca(OH)2H-CO2 = CaCO3I+ H2O
Кислота оксиды нигез белән тоз һәм су хасил итеп реакциягә
керә. Әйтергә кирәк, тозда шул кислота оксидына туры килүче
кислотаның анионы була.
Сульфат кислотасы H2SO4 эремәсенә индикатор (метил¬
оранж) өстик. Аннары эремәгә аз-азлап, индикаторның төсе
үзгәргәнче, нигез оксиды — магний оксиды MgO өстәрбез. Инди¬
каторның төсе үзгәрү эремәдә башка кислота булмавын күрсә¬
тә, ягъни реакция булып уза:
MgO + H2SO4 = MgSO4 + H2O
Нигез оксиды кислота белән тоз һәм су хасил итеп реакциягә
керә.
71
Бик күп химик кушылмалар арасыннан без матдәләрнең тү¬
бәндәге классларын: гади матдәләрне (металлар һәм неметал-
лар), оксидларны (нигез оксидлары һәм кислота оксидлары), ни¬
гезләрне һәм кислоталарны аерып күрсәттек.
Алар арасында үзара бәйләнеш бар һәм бу бәйләнешне мон¬
дый схема белән күрсәтергә мөмкин:
Memann
I
Нигез оксиды
I
Нигез *■
T
0
3
л
A
P
«*— Неметалл
-•— Кислота оксиды
-<— Кислота
Схемадан күренгәнчә, капма-каршы үзлекле матдәләрнең ике
рәте бар (вертикаль буенча карагыз). Беренче рәт: металл —
нигез оксиды ■— нигез — металл элементына хас. Икенче рәт: не¬
металл — кислота оксиды — кислота — неметалл элементына хас.
Үзлекләрнең капма-каршы булуы матдәләрнең үзара тәэсир
итешүләрендә чагыла (горизонталь буенча карагыз): металлар
неметаллар белән; нигез оксидлары кислота оксидлары белән;
нигезләр кислоталар белән; нигез оксидлары кислоталар белән;
кислота оксидлары нигезләр белән реагирлашалар.
? 1. Түбәндәге әверелешләрне ничек башкарырга: а) барий-»-барий оксиды-*
барий гидроксиды—>-барий фосфаты; б) фосфор—,-фосфор (V) оксиды-»-
A фосфат кислотасы-»-барий фосфаты? Реакцияләрнең тигезләмәләрен языгыз.
2. Түбәндәге матдәләрнең электролитик диссоциация тигезләмәләрен язы¬
гыз: Н3РО4, NaOH, NaCl, MgS04, Ва(ОН>2, ВаСЬ, HNOa. Күрсәтелгән
кушылмаларның исемнәрен атагыз. Аларны химик кушылмаларның сезгә
билгеле булган классларына аерып языгыз.
3. Тимер (II) сульфатын сезгә таныш булган өч ысул белән табу реакция¬
ләренең тигезләмәләрен языгыз (параграф текстындагы схеманы карагыз).
4. Түбәндәге әверелешләрне ничек башкарырга: кремний—►кремний (IV)
оксиды-^барий силикаты? Реакцияләрнең тигезләмәләрен языгыз.
5. Кальций карбонаты табуның мөмкин булган өч ысулын тәкъдим итегез.
Бу реакцияләрнең тигезләмәләрен төзегез.
6. Параграфта бирелгән схема буенча химик кушылмалар арасындагы бәй¬
ләнешләрне карап чыгыгыз. Схемада күрсәтелгән әверелешләрне тигезлә¬
мәләр белән раслагыз.
12 нче лаборатор дәрес
МАТДӘЛӘРНЕҢ КЛАССЛАРЫ АРАСЫНДА ГЕНЕТИК БӘЙЛӘНЕШ
Бу дәрестә сезгә матдәләрнең классификациясе буенча булган
белемнәрегезне тәҗрибәләрне үткәрү һәм аңлату өчен кулланыр¬
га кирәк булачак. Биремне укып чыгыгыз. Тәҗрибәне үткәрү
планын төзегез, кирәкле реактивларны һәм җиһазларны сайлап
72
алыгыз, ә аннары тәҗрибәләрне башкаруга керешегез. Нәтиҗә¬
ләрне язып куегыз.
1 нче тәҗрибә. Сезгә бирелгән пробиркаларның кайсында
кислота эремәсе, ә кайсында селте эремәсе барлыгын танып бе¬
легез.
2 нче тәҗрибә. Түбәндәге химик әверелешләрне башкарыгыз:
а) Cu->Cuo->-CuCl2->Cu (OH)2->-CuSO4
б) С-^СО2->Н2СОз->СаСО3
§ 22. НЕОРГАНИК МАТДӘЛӘРНЕҢ
КЛАССИФИКАЦИЯСЕ
Сезгә таныш булган химик кушылмаларның классификация¬
сен түбәндәге схема рәвешендә күрсәтергә мөмкин:
Химик кушылмалар
f
Гади матдәләр
1
Катлаулы матдәләр
♦ т tilt
Металлар Неметаллар Оксидлар Нигезләр Кислоталар Тозлар
Нигез
оксид¬
лары
Il i i i
Кисло- Суда Суда Кис- Кис¬
та ок- эрү- эре- ло- ло-
сидла- чән — мәү- род- род-
ры сел- чән сыз лы
теләр
Бу схеманы без сораулар һәм җаваплар рәвешендә тикшерер¬
без. Элек сорауга җавап бирергә тырышыгыз, ә аннары, текстны
укып чыгып, җавабыгызның дөреслеген тикшерерсез.
1. Гади матдәләрне ничек классификациялиләр? Металлар-
ның нинди үзенчәлекле үзлекләре бар? Металлйрга һәм неме-
талларга мисаллар китерегез.
Бер элементтан торучы химик кушылмалар гади матдәләр
булалар. Аларга металлар һәм неметаллар керә. Металларга
металлик ялтыравык, пластиклык, электр үткәрүчәнлек хас. Не¬
металлар капма-каршы үзлекләрне күрсәтәләр. Металларга ми¬
саллар: бакыр, тимер, алюминий, натрий, калий, кальций, барий
һ. б. Неметалларга мисаллар: күкерт, кислород, водород, азот,
фосфор, графит һ. б.
2. Кислоталы-нигезле үзлекләре буенча оксидлар ничек бүле¬
нәләр? Җавапны исбатлау өчен реакцияләргә мисаллар китере¬
гез.
Металл элементларының оксидлары нигез үзлекләрен күрсә¬
тәләр. Бу аларның: а) кислота оксидлары белән; б) кислоталар
белән тәэсир итешүләрендә күренә:
а) CaO + CO2= СаСОз-—тоз хасил була
б) CaO + Н2СОз — СаСОз + H2O — тоз һәм су хасил була.
73
Неметалл элементларының оксидлары кислота үзлекләрен
күрсәтәләр һәм: а) нигез оксидлары белән; б) нигезләр белән
тәэсир итешәләр:
а) BaOH-SOs = BaSCh — тоз хасил була
б) SO3 +Ba (OH) 2 = BaSO4| + H2O— тоз һәм су хасил була.
3. Нигезләрнең характерлы үзлекләре нинди? Аларны нинди
элементлар барлыкка китерә?
Нигезләрне металл элементлары барлыкка китерә. Эремәдә
нигезләр металл катионнары һәм гидроксид-ионнар ОН" анион¬
нары хасил итеп диссоциацияләшәләр. Нигезләрнең гомуми бил¬
гесе — электролитик диссоциация вакытында гидроксид-ионнар
хасил булу:
Ca(OH)2 = Ca2++ 2ОН-
NaOH==Na+H-OH-
4. Нигезләрне ничек классификациялиләр? Аларны ничек та¬
балар?
Нигезләр суда эрүчән һәм суда эремәүчән булалар. Суда
эри торган нигезләрне селтеләр дип атыйлар. Аларны нигез ок¬
сидларына су белән тәэсир иткәндә табарга мөмкин:
BaOH-H2O = Ba(OH)2
Эреми торган нигезләр күпчелекне тәшкил итәләр. Аларны
металл катионнары белән гидроксид-ионнарның реакциясе ярдә¬
мендә табалар:
Cu2+H-20Н~ = Cu(OH)2I
Моның өчен металлның теләсә нинди суда эрүчән тозын
һәм теләсә кайсы селте эремәсен алырга кирәк:
CuC12 + 2KOH = Cu(OH) 2ф Н-2КС1
CuSO4 H-2NaOH = Cu (OH)2I+ Na2SO4
5. Нигезләргә нинди реакцияләр хас?
Нигезләр: а) кислоталар белән; б) кислота оксидлары бе¬
лән реагирлашалар.
6. Кислоталарның үзенчәлекле үзлекләре нинди? Аларны
нинди элементлар барлыкка китерә?
Кислоталарны барлыкка китерү неметалл элементларына ха¬
рактерлы. Эремәдә кислоталар водород катионнары H+ һәм кис¬
лота калдыгы анионнары хасил итеп диссоциацияләшәләр. Кис¬
лоталарның гомуми билгесе — электролитик диссоциация вакы¬
тында H+ катионнары хасил булу. Кислоталар кислородсыз һәм
кислородлы булырга мөмкин:
НС1 = Н+ + С1-
HNO3 = H++ NO3-
H2SO4 = 2H+ + SOl-
74
7. Кислоталарга нинди реакцияләр хас?
Кислоталар: а) нигезләр белән; б) нигез оксидлары белән
реагирлашалар.
8. Нейтральләшү реакциясенең асылы нидән гыйбарәт?
Нейтральләшү реакциясе водород катионнарының H+ һәм
гидроксид-анионнарның OH- су хасил итеп үзара тәэсир итешү-
ләреннән гыйбарәт:
H+ + OH =H2O
9. Нинди матдәләрне тозларга кертәләр?
Тозлар — ионлы челтәргә ия булган кристаллик матдәләр.
Аларга югары эретелү температурасы, уалучанлык хас. Судагы
эремәдә металл катионнарына һәм кислота калдыгы анионнары¬
на таркалалар:
NaCl = Na+ + Cl~
CuSO4 = Cu2++ SO4-
Тикшерелгән схема химик кушылмаларның һәм аларның бер-
берсенә әверелешләренең төрлелеген бары тик өлешчә генә ча¬
гылдыра. Химик кушылмаларның барлыкка килү һәм үзара әве¬
релү закончалыкларына периодик закон һәм химик элементлар¬
ның Д. И. Менделеев периодик системасы нигезендә төшенергә
мөмкин. Алдагы бүлектә без аларны өйрәнүгә күчәрбез.
? 1. а) Нигез һәм кислота; б) нигез оксиды һәм кислота оксиды; в) нигез
оксиды һәм кислота; г) нигез һәм кислота оксиды үзара тәэсир итешкәндә
▲ нинди продуктлар барлыкка килә? Җавапны дәлилләү өчен барий һәм уг¬
лерод (IV) кушылмалары катнашындагы реакцияләрнең тигезләмәләрен
языгыз.
2. Кальций фосфатын (V) дүрт ысул белән табу реакцияләренең тигез¬
ләмәләрен языгыз.
3. Цинк сульфатын: а) цинк оксидыннан; б) цинк гидроксидыннан табу
реакцияләренең тигезләмәләрен төзегез.
ПЕРИОДИК ЗАКОН ҺӘМ ХИМИК
ЭЛЕМЕНТЛАРНЫҢ Д. И. МЕНДЕЛЕЕВ
ПЕРИОДИК СИСТЕМАСЫ
§ 23. ПЕРИОДИК ЗАКОННЫҢ АЛТАРИХЫ
Сезгә билгеле булганча, периодик системада урнашуына ка¬
рап, химик элементка характеристика бирергә һәм, аеруча әһә-
миятлесе, аның үзлекләрен алдан әйтеп бирергә мөмкин. Әй¬
тик, химик элементның периодик системада урнашуына карап,
сез аның чагыштырма атом массасын, тәртип номерын тапкан
идегез; элементның мөмкин булган оксидлашу дәрәҗәләре һәм
аның кушылмаларының составы турында фараз иттегез.
Химик элементлар таблицасының шулкадәр тирән эчтәлеге
аның табигать законы — периодик законның график гәүдәләнеше
булып торуы белән аңлатыла. Периодик законны Дмитрий Ива¬
нович Менделеев 1869 елда ачкан. Бу ачыш хәзерге заман химия
фәне һәм башка табигать фәннәре өчен фәнни нигезгә әверелде.
Теләсә кайсы мөһим фәнни ачыш кебек үк, периодик закон¬
ның да үз алтарихы бар. Законны ачудан алда гадәттә фактлар¬
ны туплау, аларны өйрәнү һәм гомумиләштерү була. Химия
фәнендә дә нәкъ менә шулар күзәтелә.
Химик элементларның беренче классификациясе алар барлык¬
ка китергән гади матдәләрнең — металларның һәм неметаллар-
ның ачык чагылган капма-каршы үзлекләренә нигезләнгән була.
Сез металларны һәм неметалларны, мәсәлән, күкертнең һәм кальцийның үз¬
лекләрен чагыштырып карап, тасвирлый аласыз.
1. Металларга һәм неметалларга нинди физик үзлекләр хас?
2. Химик үзлекләре буенча: а) металл оксиды һәм неметалл оксиды; б) нигез
һәм кислота ничек аерылып торалар? Җавапны дәлилләү өчен нигез оксиды
белән кислота оксиды, нигез белән кислота арасындагы реакцияләрнең тигез¬
ләмәләрен языгыз.
3. Башлангычлары булып: а) металл; б) неметалл торган берничә кушылманы:
оксидны, нигезне яки кислотаны, тозны атагыз.
Соңрак үзлекләре белән охшаш элементларның төркемнәре
булуы беленгән. Аларны табигый төркемнәр дип атаганнар.
Әйтик, табигый төркемнәрнең берсенә литий Li, натрий Na
һәм калий K (ә соңрак — тагын рубидий Rb һәм цезий Cs)
берләштерелгән булган. Бу элементлардан барлыкка килгән гади
матдәләр — металлар. Алар металлик ялтыравыклы, йомшак,
пластик үзлекле, электр тогын һәм җылылыкны яхшы үткәрә¬
ләр. Барлык башка металлар белән чагыштырганда алар химик
активлыклары аеруча көчле булулары белән аерылып торалар.
Әйтик, натрий кисәген кискәндә кисем өслегендә аның ачык
76
металлик ялтыравыгын күрергә мөмкин. Әмма күз алдында ук
ул тоныклана. Натрийның һава кислороды белән тәэсир итешү
продуктлары барлыкка килә.
Бу элементларның бер типтагы кушылмаларының составы
һәм үзлекләре охшаш була. Әйтик, аларның оксидлары (ЫгО,
ИагО, К2О һ. б.) нигез үзлекләрен ачык күрсәтәләр. Аларга суда
эрүчән нигезләр — селтеләр туры килә (LiOH, NaOH, KOH һ. б.)
Бу металларны селтеле металлар дип атаганнар.
Ә менә үзлекләре белән бер-берсенә охшаш элементларның
башка бер төркеме: хлор Cl, бром Вг, иод I (соңрак бу төр¬
кемгә фторны F да керткәннәр). Алардан барлыкка килүче гади
матдәләр — типик неметаллар. Гадәттәге шартларда хлор —газ,
бром—-сыеклык, йод — тиз эретелүчән кристаллик матдә. Алар-
ны югары химик активлык аерып тора. Алар металлар белән
үзара тәэсир итешәләр һәм тозлар барлыкка китерәләр, мәсә¬
лән: NaCl, NaBr, NaI, MgCH, MgBf2, Mgb. Бу табигый төркем
элементларын галогеннар дип атаганнар (грекча «тоз тудыручы»
дигән сүз).
Галогеннарның бер типтагы кушылмаларының составлары
һәм үзлекләре охшаш була. Әйтик, аларның водородлы ку¬
шылмаларының судагы эремәләре (HF, HCl, HBr, HI)-кисло¬
талар.
Охшаш үзлекле элементларның табигый төркемнәре барлы¬
гын белү элементларны классификацияләүдә мөһим этап булган.
Әмма ул төп проблеманы—-үзлекләре охшаш һәм охшаш булма¬
ган барлык элементларны да табигый нигездә классификация¬
ләүне хәл итмәгән. Д. И. Менделеевка кадәр табигый төркем¬
нәрнең һәркайсы, башкаларына охшамаганлыктан, төркем бу¬
ларак аерым тикшерелгән. Мәсәлән, фосфор һәм күкерт, натрий
һәм магний кебек элементлар арасында үзара бәйләнешләр бар¬
лыгын күз алдына китерү кыен булган. Бигрәк тә хлор һәм нат¬
рий кебек үзлекләре ачыктан-ачык капма-каршы булган элемент¬
лар арасында бәйләнешләр эзләү фикере тумаган да. Бары
тик даһи галим генә, гаять күп санлы аерым фактларны тик¬
шереп, барлык элементларны да төзек бер системага берләште¬
рүче законны ачарга сәләтле булган.
? 1. Түбәндәге реакцияләрнең тигезләмәләрен языгыз:
Д Li-Li2O-Li^H
LiCIO4
2. Галогеннарның: а) алюминий; б) кальций; в) цинк; г) кремний белән
реакцияләренең тигезләмәләрен төзегез. Барлыкка килүче матдәләрнең
исемнәрен языгыз.
3. Селтеле-м;ир металлары дип аталган табигый төркемнәрнең берсенә
кальцийны, стронцийны һәм барийны керткәннәр. Аларның оксидларының
һәм гидроксидларының составы һәм химик табигате нинди?
77
§ 24. Д. И. МЕНДЕЛЕЕВ ТАРАФЫННАН
ПЕРИОДИК ЗАКОННЫ
ҺӘМ ХИМИК ЭЛЕМЕНТЛАРНЫҢ
ПЕРИОДИК СИСТЕМАСЫН АЧУ
Na, Mg, Al, Si, P, S, Cl рәтендәге элементлар өчен: а) югары оксидлашу
дәрәҗәсенең кыйммәтен; б) түбән (тискәре) оксидлашу дәрәҗәсенең кыйммә¬
тен; в) элементның югары оксидлашу дәрәҗәсендәге оксидының формуласын;
г) элементның түбән (тискәре) оксидлашу дәрәҗәсендәге водородлы кушыл¬
масының формуласын языгыз.
Үзенең элгәрләреннән аермалы буларак, Д. И. Менделеев үз¬
лекләре охшаш һәм охшаш булмаган барлык химик элементлар
арасында да табигый бәйләнешләр булырга тиешлегенә тирәнтен
ышанган. Аның эзләнүләренең максаты барлык элементларны
бер системага берләштерүче закончалыкны табудан гыйбарәт
булган. «Артык күп нәрсәләрне индивидуаль дип саныйлар. Бу
индивидуальлекләрне гомуми бер идея белән үзара бәйләү —
минем табигый системамның максаты менә шул»,— дип язган ул
периодик законга багышланган үзенең беренче эшләренең кара¬
ламасында.
Химик элементларны классификацияләү өчен нигез итеп
Д. И. Менделеев элементларның атом массаларын сайлап алган,
чөнки ул чагыштырма атом массасы химик элементның төп ха¬
рактеристикасы булып тора дип санаган. Ул элемент гади мат¬
дә хасил иткәндә дә, катлаулы матдә хасил иткәндә дә үзгәрми.
«Мин,—дигән Д. И. Менделеев үзенең улына,— иң баштан
ук атомның иң төп үзлеге, атом авырлыгы яки атомның массасы,
һәр элементның төп үзлекләрен билгеләргә тиешлегенә тирәнтен
ышанган идем. Барысын да чагыштырып карап, мин искиткеч
ачыклык белән периодик законны күрдем һәм аның әйберләрнең
иң тирән табигатенә туры килүенә тулы ышаныч алдым. Аның
яктыртуында минем алда фәннең бөтен бер яңа өлкәләре ачыл¬
ды. Мин аңа күңелемнән шундый инану белән ышандым ки, ан¬
дый ышаныч һәр нәтиҗәле эш өчен кирәкле дип саныйм... »
(Кедров Б. M., Д. И. Менделеев. Новые материалы по ис¬
тории открытия периодического закона.— М.— Л., 1950—139 б.)
Д. И. Менделеев периодик законны ачуга төрле табигый төр¬
кемнәрдәге элементларның үзлекләрен һәм чагыштырма атом
массаларын чагыштырып карау нәтиҗәсендә килгән. Ул чорда
алты шундый төркем — селтеле металлар, селтеле-җир металла-
ры (Ca, Ba, Sr), галогеннар, кислород төркеме, азот төркеме,
углерод төркеме билгеле булган. Д. И. Менделеев табигый төр¬
кемнәрне янәшәдәге һәр ике төркем элементларының чагыштыр¬
ма атом массаларының кыйммәтләре якын булырлык итеп ур¬
наштырган. Нәтиҗәдә ул элементларның хәзерге периодик систе¬
масының беренче үрнәге булган таблицаны төзүгә ирешкән. Соң¬
рак элементларның табигый төркемнәре — периодик таблицадагы
төркемнәрнең нигезен, ә чагыштырма атом массаларының кыйм¬
78
мәтләре акрынлап арту тәртибендә урнаштырылган элементлар¬
ның рәтләре таблицадагы периодларның нигезен тәшкил иткән¬
нәр.
Д. И. Менделеев иң беренче төзелгән таблицага өстәмәләр
керткән һәм, аны төзүне дәвам итеп, аңа ахыр чиктә ул заман¬
да билгеле булган барлык элементларны да кертеп бетергән.
Д. И. Менделеев төзегән таблицаның соңгы вариантларыннан
берсе үзенең формасы ягыннан безгә таныш булган хәзерге
таблицадан бик аз гына аерылып тора.
Элементларның табигый төркемнәрен таблицага берләштер¬
гәндә галимнең нинди закончалыкларны ачуын анализлап ка¬
рыйк. Моның өчен элементларның түбәндәге ике периодын, алар-
ның чагыштырма атом массаларын, кислородлы һәм водородлы
кушылмаларын алыйк:
Li
Be
B
C
N
O
F
7
9,4
11
12
14
16
19
Li2O
BeO
B2O3
CO2
N2O5
—
—
—
—
—
—
H3N
H2O
HF
Na
Mg
Al
Si
P
S
Cl
13
24
27
28
31
32
35,5
Na2O
MgO
Al2O3
SiO2
P2O5
SO3
Cl2O7
—
—
—
—
H3P
H2S
HCl
Чагыштырма атом массалары арту тәртибендә урнаштырыл¬
ган химик элементлар рәтендә түбәндәгеләр чагыла. Литийдан
Li фторга F таба химик элементларның үзлекләре акрынлап
үзгәрә бара. Әйтик, литий Li химик элементы металл гади мат¬
дәсе (селтеле металл), ә фтор F элементы неметалл гади мат¬
дәсе (галоген) хасил итә. Литий Li химик элементыннан фтор
F химик элементына күчкәндә кушылмаларның, аерым алганда
оксидларның һәм водородлы кушылмаларның, составлары үз¬
гәрү күзәтелә. Бу исә кушылмаларның үзлекләре үзгәрүгә дә ту¬
ры килә. Әйтик, оксидлар рәтендә нигез оксидыннан (LizO) кис¬
лота оксидына (N2O5) күчү күзәтелә.
Аннары үзлекләр үзгәрүдәге бу эзлеклелек кинәт кенә өзе¬
лә. (Хәзерге периодик таблицада фтор белән натрий, хлор белән
калий арасында урнашкан химик элементлар периодик законны
ачканнан соң гына билгеле булганнар.) Чираттагы элемент бу¬
лып, үзлекләре белән алдагы рәтнең беренче элементы — литийга
Li охшаган, натрий Na химик элементы килә. Алга таба элемент¬
ларның үзлекләре нәкъ литийдан фторга кадәр күчкәндәге эз-
леклелектә үзгәрә. Гади матдәләр рәтендә типик металлдан (сел¬
теле металл) типик неметаллга (галоген) күчеш б^ла. Кушылма¬
ларның составлары һәм үзлекләре үзгәрү, аерым алганда нигез
оксидыннан (NazO) кислота оксидына (ClzO7) күчү күзәтелә.
79
Бу закончалыклар күбрәк яки азрак дәрәҗәдә ачык булып
чагыштырма атом массалары арту тәртибендә урнаштырылган
барлык элементларның бөтен бер рәтендә күренә. Музыка теле
белән образлы итеп әйткәндә, химик элементларның рәте — ул
музыкаль әсәрнең формасы — рондо сыман. Анда да бит төп те¬
ма периодик рәвештә вариацияләрдә кабатлана.
Д. И. Менделеев болай дип язган: «Атом авырлыгы арткан
саен элементлар башта яңадан-яңа үзгәрүчән үзлекләргә ия бу¬
лалар, ә аннары бу үзлекләр, яңа периодта, моннан алда кил¬
гән рәттәге шикелле үк эзлеклелектә, кабатланалар. Шуңа күрә
дә периодиклык законын мондый рәвештә әйтергә була: элемент¬
ларның үзлекләре, ә шулай булгач алар хасил иткән гади һәм
катлаулы җисемнәрнең үзлекләре дә, аларның атом авырлыкла-
рыннан периодик бәйлелектә торалар». (Д. И. Менделеев. Ос¬
новы химии.— Л.— M., 1948 — 52 б.)
Шулай итеп, периодик законны ачу нәтиҗәсендә барлык эле¬
ментларның да үзара бәйләнештә булулары, бер законга буй¬
сынулары һәм бербөтен система тәшкил итүләре ачыкланган,
һәм ул бик хаклы рәвештә галим хөрмәтенә «Химик элемент¬
ларның Д. И. Менделеев периодик системасы» дип аталган.
? 1. Югары оксидлашу дәрәҗәсендә: а) НЭСҢ; б) Н6ЭО6; в) Н2ЭО4; г) Н2ЭО3;
Д д) Э(ОН)з составлы кушылманы хасил итүче элемент периодик системаның
кайсы төркеменә керә?
2. XIX гасырның 60 нчы елларында элементларның түбәндәге табигый төр¬
кемнәре билгеле булган:
F
Li
Mg
C
O
N
Cl
Na
Ca
Si
S
P
Br
K
Sr
—
Se
As
1
Rb
Ba
Sn
Te
Sb
Cs
Бу элементлар химик элементларның Д. И. Менделеев периодик системасы¬
ның кайсы төркемнәренә керәләр?
H Таблицадан үзләренең исемнәрен: а) ил исеменнән; б) планета исеменнән;
в) галим исеменнән алган элементларны табыгыз. Элементларны ачу тарихы
турындагы китаплардан файдаланып, бер-ике элемент турында чыгыш ясар¬
га хәзерләнегез.
§ 25. Д. И. МЕНДЕЛЕЕВНЫҢ ФӘННИ КАЗАНЫШЫ
Ачылган табигать законы, практикада һәм фәннең аннан
соңгы үсеше белән раслангач кына, фәнни әһәмияткә ия була.
Үзе ачкан законның дөреслегенә тирәнтен ышанган хәлдә,
Д. И. Менделеев аның фәндә тиешле урын алуы өчен күп көч
куйган. Ул беренче булып, таныш фактларны тикшерү һәм яңа¬
ларын алдан әйтеп бирү өчен законнан ничек файдаланырга
кирәклеген күрсәткән. Ул, аерым алганда, кайбер элементларның
чагыштырма атом массаларын төзәткән һәм ул вакытта әле
ачылмаган күп кенә элементларның барлыгын әйткән.
80
Әйтик, күпчелек галимнәр бериллийның чагыштырма атом
массасын 13,5 дип кабул иткәннәр. Әмма, барлык үзлекләрен
исәпкә алганда, бериллий периодик системада литий (чагыш¬
тырма атом массасы 7) белән бор (чагыштырма атом массасы
11) арасында урнашырга тиеш булган. Моннан Д. И. Менде¬
леев бериллийның чагыштырма атом массасы период буенча
аның күрше элементлары атом массаларының уртачасына, ягъ¬
ни якынча 9 га тигез булырга тиеш дигән нәтиҗә ясый.
Соңрак эксперименталь тикшеренүләр Д. И. Менделеев фи¬
керенең дөрес булуын раслаганнар.
Периодик системаны төзегәндә Д. И. Менделеев күп кенә шак¬
макларны буш калдырган. Ул чагында билгеле булган 63 элемент
арасында чагыштырма атом массаларының кыйммәтләре һәм
үзлекләренең җыелмасы буенча бу шакмакларга урнаштырыр-
лыклары табылмаган. Бу шакмакларны буш калдырып,
Д. И. Менделеев әлегә билгесез бу элементларның булырга
тиешлеген күрсәткән.
Д. И. Менделеев билгесез элементларның булырга тиешлеген
генә алдан әйтеп калмаган, ә бәлки аларның кайберләре өчен
үзлекләрен дә тулы итеп тасвирлап биргән. Д. И. Менделеев¬
ның алдан әйтүләре алга таба зур төгәллек белән расланган.
Түбәндә германий элементы турында Д. И. Менделеев алдан
әйтеп биргән һәм 15 елдан соң немец галиме К. Винклер экспе¬
рименталь рәвештә раслаган мәгълүматлар күрсәтелә:
Таблица 5. Германийның алдан әйтелгән һәм
эксперименталь рәвештә табылган үзлекләре
Германийның үзлекләре
Д. И. Менделеев алдан әйткән
үзлекләр (1871)
К. Винклер ачкан үзлекләр
(1886)
Чагыштырма атом массасы 72 гә якын
Авыр эретелә торган соры металл
Металлның тыгызлыгы 5,5 г/см3 ча¬
масы
Оксидының формуласы ЭОг
Оксидының тыгызлыгы 4,7 г/см3 ча¬
масы
Оксиды металлга шактый җиңел кай¬
тарыла торган булыр
ЭС14 хлориды — тыгызлыгы 1,9 г/см3
һәм кайнау температурасы 90° C
чамасы булган сыеклык булырга
тиеш
Чагыштырма атом массасы 72,6
Авыр эретелә торган соры металл
Металлның тыгызлыгы 5,35 г/см3
Оксидының формуласы GeO2
Оксидының тыгызлыгы 4,70 г/см3
GeO? оксиды водород агымында җы¬
лытканда металлга кайтарыла
Германий хлориды GeCl4- тыгызлы¬
гы 1,887 г/см3 һәм кайнау темпера¬
турасы 83° C булган сыеклык
Д. И. Менделеев билгесез элементларның үзлекләрен аларны
периодик системада чолгап алган элементлар үзлекләренең урта¬
часы буларак китереп чыгарган.
6 П-236
81
Әйтик, селенның сул һәм уң як күршеләре булып мышьяк һәм бром тора,
ә өске һәм аскы күршеләре — күкерт һәм теллур. Селенның чагыштырма атом
массасы бу элементларның чагыштырма атом массаларының уртача арифметик
зурлыгына тигез. Д. И. Менделеев методыннан файдаланып, күкертнең, теллур¬
ның, мышьякның һәм бромның чагыштырма атом массаларына нигезләнеп, се¬
ленның чагыштырма атом массасын исәпләп чыгарыйк:
. , Ar(S)H-Ar(Te)H-Ar(As)H-Ar(Br)
Ar (Se) = -
Ar (Se) = 32,06+127,60 + 74,92 + 79,90 = ?8 62
78,62 саны, ягъни селенның чагыштырма атом массасы кыйммәтенә якын
сан килеп чыга.
Бу элемент кушылмаларының, мәсәлән селен белән водород кушылмасының,
составларын да ачыкларга мөмкин. Мышьяк өчен водородлы кушылма HsAs,
ә бром өчен HBr билгеле. Димәк, селенның водородлы кушылмасының составы
HsSe формуласына туры килә.
Периодик закон өчен инерт газларны — гелийны He, неонны
Ne, аргонны Аг, криптонны Kr, ксенонны Xe ачу кыен сынау бул¬
ды. Бу газлар атмосфера составына керәләр (1% күләм өлеше).
Беренчеләрдән булып аргон аерып алынган, һава составында
аның булуы турындагы хәбәр галимнәрдә шаккатыргыч тәэсир
калдырган. Җентекләп өйрәнелгән дип саналган һавада билге¬
сез газ! Алга таба һавадан неонны, криптонны һәм ксенонны ае¬
рып алуга ирешкәннәр. Бу газларны тикшерү аларның молеку¬
лаларының берәр атомлы булуларын күрсәткән.
Ни өчен бу газларның барлыгы турында озак вакытлар бел¬
мәгәннәр соң? Сәбәбе аларның химик яктан инерт булуларыннан
гыйбарәт.
Инерт газларны ачу тарихы фәнни тикшеренүләр нәтиҗәләрендәге кечкенә
генә туры килмәүләргә дә игътибар итүнең никадәр мөһим икәнен күрсәтүче
үрнәк булып тора. 1892 елда инглиз галиме Д. Рэлей һавадан тапкан азотның
кушылмаларын таркатып табылган азоттан авыррак булуын сизгән, һавадан
аерып табылган 1 л азотның массасы 1,257 г, ә химик юл белән табылган
азотныкы — 1,251 г булган. Мондый туры килмәүнең сәбәбен ачыклаганда, һа¬
вадан табылган азотта ул чагында әле билгесез булган газ барлыгы беленгән.
Химик инертлыгы өчен аңа аргон («эшлексез» дигән мәгънәдә) исеме бир¬
гәннәр.
Аңлашыла ки, бу газларны хасил итүче яңа элементларның
периодик системадагы урыны турында сорау туган. Д. И. Менде¬
леев: «Периодик системаны ачканда (1869) кушылмаларның
нинди дә булса гадәти формаларына сәләтсез аргон һәм аның
аналоглары билгесез генә булмыйча, ә бәлки аларга охшаш
элементлар булуы мөмкин дип уйларга сәбәп тә юк иде. Хәзер,
аларда, селтеле металлар яки галоидлар (галогеннар) төркемен¬
дәге кебек үк, күп уртаклыклар булуы ап-ачык беленгәч, алар
бу соңгылары шикелле үк шулай үзара якыннар. Бу периодик
законның теоретик асылына үзенә күрә бер сынау булды. Бу
элементлар атом авырлыкларының зурлыклары буенча галоид¬
82
лар белән селтеле металлар арасында төгәл урын алдылар»,—
дип язган. (Me н деле в Д. И., Соч.—М.— Л., 1954,—Т. 24,—
147 б.) Шулай итеп, Д. И. Менделеев бу элементларны галоген¬
нар һәм селтеле металлар төркемнәренең арасына аерым бер
төркемгә урнаштырган, һәм периодик системаның периодлары
үзләренең логик төгәлләнеш рәвешләрен алганнар.
Д. И. Менделеев үзгәрткән чагыштырма атом массаларының
эксперименталь рәвештә расланулары, бигрәк тә үзлекләре ал¬
дан әйтелгән элементларны ачу, периодик законны гомуми тануга
китергән.
Ф. Энгельс Д. И. Менделеев тарафыннан периодик закон
ачуны һәм аның нигезендә билгесез элементларның барлыгын
алдан әйтеп бирүне фәнни батырлык дип атаган.
Фәннең хәзерге торышын белгән хәлдә, без Д. И. Менделеев
ачышының табигать серләрен танып белүдәге гаять зур роленә
тиешенчә бәя бирә алабыз. Периодик закон атом төзелешен өй¬
рәнүгә юл ачты. Периодик законга таянып, галимнәр билгеле үз¬
лекле матдәләр таба алдылар, элек билгесез булган химик эле¬
ментларны ачуга һәм яңаларын синтезлауга ирештеләр. Перио¬
дик закон галимнәргә Галәмдә, Кояш һәм йолдыз тирәнлекләрен-
дә элементларның барлыкка килүе һәм әверелешләре турында
гипотезалар корырга мөмкинлек ачты.
Практикадагы сынауны периодик закон уңыш белән җиңеп
чыкты! Периодик законның какшамас нык булуына тирәнтен
ышанычын Д. И. Менделеев үзе мондый сүзләр белән әйтеп
биргән: «Периодик законга юкка чыгу куркынычы янамый, килә¬
чәк аңа тулылану һәм камилләшү генә вәгъдә итә».
Периодик закон — табигатьнең объектив законы. Ул дөнья¬
ның материальлеген, аның берлеген, аның үсешен чагылдыра.
Барлык элементлар да үзара бәйләнештә булалар. Аларның
һәркайсының да үзлекләре очраклы түгел, ә уртак бер законга
буйсыналар.
Периодик законны ачу дөньяны өйрәнеп булуны һәм табигать
серләрен танып белү процессы чиксез булуны күрсәтә. Үз чира¬
тында периодик закон хәзерге вакытта үзе табигатьне танып
белү инструменты булып тора. Ул шактый дәрәҗәдә атом физи¬
касының, химиянең, геологиянең һәм астрономиянең, атом һәм
төш техникасының, химия технологиясенең, металлургиянең, ме¬
дицинаның һ. б. үсешен билгели.
Периодик закон табигать фәннәренең күп кенә өлкәләрен¬
дә фәнни алдан күрү өчен юл күрсәтүче маяк булып тора.
■J 1. Периодик системаның китерелгән фрагментында (84 нче бит) сызыклар
’ белән Д. И. Менделеев алдан әйткән элементларның урнашулары күрсәтел-
▲ гән. Бу нинди элементлар? Бу элементларның югары оксидлашу дәрәҗәлә¬
рендәге оксидларының составлары нинди?
2. Бериллий элементын периодик системада элеккеге (ялгыш) чагыштырма
атом массасы кыйммәте буенча урнаштырганда 2 нче период элементлары¬
ның үзлекләре закончалыклы үзгәрүдә нинди бозылулар күзәтелер?
6!
83
II төркем
III төркем
IV төркем
V төркем
VI төркем
Be
B
C
N
O
9,4
11
12
14
16
Mg
Al
Si
P
S
24
27,3
28
31
32
Ca
—
Ti
V
Cr
40
44
50?
51
52
Zn
—
—
As
Se
65
68
72
75
78
Sr
Y
Zr
Nb
Mo
87
88?
90
94
96
Cd
In
Sn
Sb
Te
112
113
118
122
128
§ 26. ДМИТРИЙ ИВАНОВИЧ МЕНДЕЛЕЕВ
Дмитрий Иванович Менделеев 1834 елда Тобольск шәһәрендә
туган. Тобольск гимназиясендә белем алганнан соң ул Петербург
педагогия институтына керә. Институтны ул алтын медаль белән
тәмамлый. Әле студент вакытында ук Д. И. Менделеев үзенең
беренче фәнни тикшеренүләрен бастырып чыгара.
Д. И. Менделеев фән һәм практиканың кайсы гына өлкәсендә
шөгыльләнмәсен, ул һәркайда катлаулы мәсьәләләрнең яңа чи¬
шелешләрен таба. Аның омтылышлары искиткеч күп төрле була.
Д. И. Менделеевның әдәби мирасы гаять бай — аның әсәрләре¬
нең тулы җыентыгы 26 том тәшкил итә!
Д. И. Менделеевның зур хезмәтләренә эремәләрнең химик
табигате, газларның торышы, ягулыкның яну җылылыгы өлкәлә¬
ренә караган тикшеренүләре керә. Дәртле патриот, Д. И. Мен¬
делеев үз эшчәнлегенең максаты итеп Ватанының чәчәк атуына,
аның икътисади һәм сәяси бәйсезлегенә даими булышлык итүне
саный. Аның күп кенә хезмәтләре промышленность һәм авыл
хуҗалыгының төрле проблемаларына багышланган була. «Фән
һәм промышленность — менә монда минем хыялларым»,— дип
язган Д. И. Менделеев. Д. И. Менделеев илнең табигый байлык¬
ларын һәрьяклап куллану һәм хуҗалыкны планлы итеп алып ба¬
ру өчен көрәшкә күп көч куя. Ул тау-руда казу эше, металлур¬
гия мәсьәләләре белән кызыксына, ягулыкны җир астында газга
әйләндерү проблемасы өстендә эшли, нефть чыгару эшен өйрә¬
нә. Д. И. Менделеев нефтькә күп сандагы төрле химик продукт¬
лар табу өчен кыйммәтле чимал буларак аеруча әһәмият бирә.
Д. И. Менделеев авыл хуҗалыгында химик ашламалар кул¬
лануның, коры районнарның җирләрен сугаруның, урманнар үс-
84
Дмитрий Иванович Менделеев
(1834—1907)
терү һәм аларны саклауның чын күңелдән бирелгән тарафдары
була.
Ул халык мәгарифен үстерү өчен көрәшче, хатын-кызларның
тигез хокуклылыгын кайнар яклаучы була һәм, прогрессив эш¬
лекле буларак, күп тапкырлар патша чиновникларына оппози¬
циядә тора. Студентлар чуалышы вакытында ул студентларны
яклап чыга һәм мәгариф министры белән низаг аркасында үзе
33 ел эшләгән, яраткан Петербург университетын ташлап китәргә
мәҗбүр була.
Д. И. Менделеев күп нәрсәләр белән кызыксынган һәм шө¬
гыльләнгән. Ул музыканы, сынлы сәнгатьне ярата, матур әдәбият
белән мавыга, ял сәгатьләрендә кул эше белән шөгыльләнә:
шкатулкалар ясый, китаплар төпли.
Аның халык хуҗалыгын индустриальләштерү һәм химияләш¬
терү, илнең табигый байлыкларыннан планлы рәвештә файдала¬
ну, фәннең һәм мәгърифәтнең үсеше турындагы тәкъдимнәре хә¬
зерге вакытта да актуаль булып калалар. Д. И. Менделеев:
«Кеше җәмгыять, дәүләт һәм бөтен кешелек мәнфәгатьләре өчен
никадәр күбрәк файдалы булса, ул шул дәрәҗәдә күбрәк ка¬
мил»,—дип язган.
Д. И. Менделеевка бөтен дөнья күләмендә дан китергән иҗа¬
ди эшчәнлекнең бөек нәтиҗәсе булып аның тарафыннан 1869
елда периодик законны һәм химик элементларның периодик сис¬
темасын ачу тора.
Үзенең «Д. И. Менделеев һәм аның периодик системасының
киләчәк өчен әһәмияте» исемле хезмәтендә атаклы рус галиме
революционер H. А. Морозов Д. И. Менделеевның даһилеге
турында мондый фикер әйткән: «һәр гениаль галимнең төп көче
безне чолгап алган күренешләрне дөрес аңлый һәм эмпирик рә¬
вештә тупланган фактларның котылгысыз кимчелекләре һәм ха¬
талары аркылы кыю атлап чыга белүендә. Даһилеге һәм хыялы
булмаган кеше бу ялгышлар һәм проблемалар алдында туктап
калыр һәм алар хакына дип башына килгән гүзәл идеяне кире
кагар; фантазиясе булып та даһилеге булмаган кеше бу хата¬
лардан башлангыч хакыйкать югалып калырлык үзенә бер төрле
теория барлыкка китерер, һәм бары тик саф, сабыр акыл гына
үз алдында яткан фактларны дөрес бәяләргә сәләтле».
Д. И. Менделеев Россия фәннәр академиясенең члены була.
Фәндәге күренекле хезмәтләре өчен Д. И. Менделеев күп кенә
чит ил фәннәр академияләренең: Америка, Ирландия, Рим, Бер¬
лин, Бельгия, Дания, Чехия, Краков һ. б. мактаулы члены итеп
сайлана. Ул күп кенә университетларның мактаулы докторы һәм
күп санлы фәнни җәмгыятьләрнең мактаулы члены була.
Д. И. Менделеев 1907 елда 73 яшендә үлә.
Д. И. Менделеев хөрмәтенә безнең илдә химия өлкәсендәге
күренекле хезмәтләр өчен алтын медаль булдырылган. Д. И. Мен¬
делеев исеме белән шәһәрләр, заводлар, уку йортлары, фәнни-
тикшеренү институтлары аталган. Галимнең исеме белән Татар¬
86
стан республикасының химия промышленносте үзәкләреннән бер¬
се булган Менделеевск шәһәре аталган. Элеккеге Бондюг посело¬
гы заводында Д. И. Менделеев төтенсез дарының үзе уйлап
тапкан бер төрен җитештерүне оештырган булган.
Д. И. Менделеев исеме Россия химия җәмгыятенә бирелгән.
Татарстан химия җәмгыяте дә Д. И. Менделеев исемен йөртә.
Бөек галим хөрмәтенә 101 нче химик элемент Md (менделевий)
аталган.
Д. И. Менделеевның тууына 100 еллык юбилее уңаеннан
«Правда» газетасының баш мәкаләсендә: «Безнең илебезгә, үз
вакытында Менделеев эшләгәнчә, аны гигант адымнар белән ал¬
га үстерүгә сәләтле үзебезнең бөек Менделеевларыбыз кирәк»,—
дип язылган иде.
§ 27. ATOM ТӨЗЕЛЕШЕ
Физика дәреслегеннән «Резерфорд тәҗрибәсе», «Атомның төш моделе»,
«Атом төзелеше» дигән параграфларны кабатлагыз.
Периодик закон һәм химик элементларның аңа нигезләнгән
периодик системасы озак вакытлар дәвамында фактларны гени-
аль рәвештә гомумиләштерү булып кына күренгән. Ни өчен
элементларның үзлекләре аларның чагыштырма атом массала¬
рыннан периодик бәйлелектә булуы аңлашылмаган. Периодлы-
лыкның сәбәбе үзе ачык булмаган. Галимнәр алдында период-
лылыкның физик мәгънәсен ачып бирү бурычы торган. Ә бу атом
төзелешен ачкач һәм аның төзелеш теориясен тудыргач кына
мөмкин булган.
Физика курсыннан сезгә атомның үзара тәэсир итешүче төш¬
тән һәм электроннардан торуы билгеле. Атом төше атомның
үзәгендә урнашкан. Атомның массасы һәм аның зурлыгы күз
алдына китерә алмаслык кечкенә; атомның массасы бары тик
IO-27 — 10~25 кг гына тәшкил итә.
Атомның радиусы исә чама белән 10”10 м тәшкил итә. Атом
төшенең радиусы тагын да кечерәк. Ул атомга караганда йөз
мең тапкырга кечкенәрәк, ягъни аның радиусы 10” м чамасы.
Әгәр атом Җир зурлыгына кадәр зурайтылса, аның төшенең ра¬
диусы бары тик 30 м гына булыр иде. Андый төш зур булмаган
футбол кырына да иркен сыяр иде.
Атом төшенең составына протоннар һәм нейтроннар керәләр.
Протон уңай корылмага ия. Аның корылмасы абсолют кыйммәте
белән электрон корылмасына тигез. Нейтронның корылмасы юк.
Протонның һәм нейтронның массалары бер үк диярлек һәм
электрон массасыннан якынча 1840 мәртәбә зуррак. Бу атомның
бөтен массасы практик яктан төштә тупланган дигән сүз. Хәзер
ни өчен химик элементларның бер-берләреннән чагыштырма атом
массалары белән аерылып торуларына төшенү җиңел. Аларның
атом төшләренең составлары төрле.
87
Атомның төше уңай корылмалы, чөнки аның составына уңай
корылган протоннар керә. Күп сандагы тикшеренүләр күрсәт¬
кәнчә, төштәге протоннар саны элементның периодик система¬
сындагы тәртип (атом) номерына (Z) санча тигез. Әйтик, кисло¬
род атомы төшендәге протоннар саны 8. Кислород элементының
атом номеры Z = 8. Хлорның атом номеры Z= 17, ягъни атом
төшендә 17 протон бар һәм төш корылмасы 17+ кә тигез.
Атом электронейтраль. Төшнең уңай корылмасы электроннар¬
ның суммар тискәре корылмасы белән компенсацияләнә. Элек¬
тронның корылмасы 1 —. Электроннарның саны төштәге протон¬
нар санына тигез. Атомдагы электроннар аның электрон сүрүен
тәшкил итәләр. Мисалларны тикшереп узыйк: кислородның атом
номеры Z = 8. Аның атомының төшендә 8 протон, ә электрон
сүрүендә —8 электрон. Хлорның атом номеры Z = 17. Димәк,
аның атомының электрон сүрүендә 17 электрон бар.
Химик элемент — төш корылмалары бертөрле булган атомнар
төре ул.
Химик элементның атом номерын элемент символыннан сул
якта аста язалар, мәсәлән: iH, вО, |?С1.
? 1. Протонның, нейтронның һәм электронның корылмасын тасвирлагыз. Бу
кисәкчекләр атомның кайсы өлеше составына керәләр?
▲ 2. Алюминий химик элементының атом номеры Z= 13. Аның атомының
төш корылмасы күпмегә тигез? Аның атомында ничә электрон бар?
3. Төш корылмасы 12-Т булса, магний атомында ничә электрон бар?
4. Элементларның Д. И. Менделеев периодик системасы буенча күкерт,
тимер, бакыр атомнарының төш кбрылмаларын һәм атомнардагы электрон¬
нар санын билгеләгез.
5. Химик элементларның Д. И. Менделеев периодик системасына нигезләнеп,
фтор һәм хлор атомнарында ничәшәр протон һәм электрон булуын билге¬
ләгез.
§ 28. ИЗОТОПЛАР
1. Атом төше нинди кисәкчекләрдән тора? 2. «Химик элемент» төшенчәсенең
әйтелеше ничек? 3. Нинди дүрт пар элемент периодик системада чагыштыр¬
ма атом массалары арту принцибында түгел, ә киресенчә, ягъни чагыштырма
атом массасы артыграк булган элемент чагыштырма атом массасы кимрәк
булган элементтан алда урнашкан?
Химик элементларны периодик системада урнаштырганда
Д. И. Менделеевка кайбер очракларда чагыштырма атом масса¬
лары арту принцибыннан тайпылырга туры килгән. Аерым алган¬
да, ул теллур элементын (чагыштырма атом массасы 128) йод
элементыннан (чагыштырма атом массасы 127) алда урнаштыр¬
ган. Болай урнаштырганда алар үзлекләре белән үзләренә ох¬
шаш элементлар кергән төркемнәргә эләккәннәр: теллур — VI
төркемгә, ә йод VII төркемгә кергән. Озак вакытлар дәвамында
мондый «бозулар» аңлашылмый калган. Әмма хәзер без элемент¬
ларның периодик системада урнашуы аларның атомнарының
88
төш корылмаларына бәйле булуын беләбез. Аерым алганда, йод¬
ның төш корылмасы (Z = 53 + ) теллурныкыннан (Z = 52+) зур¬
рак. Ләкин ни өчен теллурның чагыштырма атом массасы йод¬
ныкына караганда зуррак соң? Бик күп тикшеренүләр бу эле¬
ментның массалары белән аерылып торучы төрле атомнары бар¬
лыгын күрсәткән. Бу шул элемент атомнарының төрләре төшлә¬
рендәге нейтроннар саны буенча аерылып торулары белән аңла¬
тыла. Мисал итеп хлор элементының атом төрләрен тикшерик.
Бу атомнарның төшләрендәге протоннар саны бер үк һәм 17 гә
тигез, ул хлорның атом номерына туры килә. Ләкин хлор атом¬
нарының бер төрендә төшләрдә—18 нейтрон, ә икенчесендә
20 нейтрон була.
Элементның бер-берсеннән нейтроннар саны белән, димәк
төш массасы белән дә, аерылып торучы атом төрләре изотоплар
дип атала. (Грекча «изос» — бер һәм «топос» — урын дигән сүз¬
ләрдән алынган, изотоп — элементларның Д. И. Менделеев си¬
стемасында бер урын (шакмак) алып торучы.)
Изотопларны күрсәткәндә протоннарның һәм нейтроннарның
гомуми санын язу кабул ителгән, мәсәлән: хлор-35 яки 35Cl
(17р+, 18п°) һәм хлор-37 яки 37Cl (17р+, 20/1°).
Табигатьтә химик элемент гадәттә изотоплар катнашмасын¬
нан тора. Шуңа күрә элементның чагыштырма атом массасы
изотопларның табигатьтәге масса өлешләрен исәпкә алган хәл¬
дә, аларның чагыштырма атом массаларының кыйммәтләре бе¬
лән билгеләнә. Мәсәлән, табигый катнашмада хлор-35 изотобы¬
ның масса өлеше 75,53%, ә хлор-37 изотобыныкы — 24,47%.
Моннан хлор элементының чагыштырма атом массасы 35,453 кә
тигез булып килеп чыга. Элементларның периодик системасында
без шул кыйммәтне күрәбез дә инде. Углерод химик элементы
|2С(98,892%) Һәм 13C (1,108%) изотоплары катнашмасыннан то¬
ра. Углеродның чагыштырма атом массасы 12,011 тәшкил итә.
Монда без чагыштырма атом массасы һәм молекуляр масса
турындагы сорауларга (§ 2 не карагыз) әйләнеп кайта алабыз.
Хәзерге вакытта чагыштырма атом (молекуляр) масса берәмлеге
итеп углерод-12 атом массасының ’/12 өлеше алына. Матдә микъ¬
дарының берәмлеге итеп углерод-12 нең 0,012 кг дагы атомнар
саны кабул ителгән (§ 8 не карагыз).
Табигатьтә бер генә изотоп хәлендә очрый торган химик элементлар да бар
(бериллий, фтор, натрий, фосфор һ. б.). Әмма алар азчылыкны тәшкил итәләр.
Күп кенә химик элементларның икешәр, өчәр, дүртәр һәм аннан да күбрәк
изотоплары бар. Мәсәлән, кремний — кремний атомнарының өч төренең табигый
катнашмасы, тимер — дүрт изотоптан, аккургаш ун изотоптан тора һ. б.
Теллурның чагыштырма атом массасы йодның чагыштырма
атом массасыннан ни өчен артыграк -икәнлеге хәзер аңлашыла
инде. Иод бер изотоптан — йод-127 дән тора. Теллурның алты
изотобы бар; алар арасында иң авырлары — теллур-128 һәм тел¬
лур-130—күпчелекне (66% чамасы) тәшкил итәләр. Шунлыктан
89
теллурның чагыштырма атом массасы да йодныкына караганда
артыграк.
Бер элемент, изотопларының төш корылмалары бер үк бул¬
ганлыктан (электрон сүрүенең төзелеше бердәй), аларның химик
үзлекләре дә практик яктан бертөрле. Шулай булгач, химик үз¬
лекләр турында сүз барганда элементның, мәсәлән, хлорның изо¬
топлар составына игътибар итмәскә дә ярый.
Изотопларның тотрыклылары һәм тотрыксызлары (радиоак¬
тив булганнары) очрый. Радиоактив изотоплар үзләреннән-үзлә-
ре таркалуга дучар булалар. Әйтик, радий-226 изотобының тар¬
калуын
226т-> 222т~» I 4т т
eeRa—► seRn + aHe
схемасы белән күрсәтергә мөмкин.
Схемадан күренгәнчә, радийның (Z = 88) радиоактив тар¬
калуы нәтиҗәсендә ике башка элемент — радон (Z =86) һәм ге¬
лий (Z =2) барлыкка килә.
Радиоактив таркалу күренеше ачылганнан соң химик эле¬
ментларның мәңгелек һәм үзгәрми торган булмаулары, ә бер-бер¬
ләренә күчә алулары бәхәссез ачыкланды. Нәкъ менә шуның
бедән элементларның үзара бәйләнеше, аларның үзара якынлы¬
гы расланды.
Изотопларның яшәеш дәвамлылыгы гаять төрле — секундның
меңенче өлешләреннән алып күп мең миллион елларгача. Барлык
изотоплары да радиоактив булган элементлар бар. Аларга перио¬
дик системада висмуттан соң урнашкан элементлар керә. Хәзер¬
ге вакытта радиоактив изотопларны ясалма юл белән таба¬
лар, һәм алар барлык элементлар өчен дә билгеле.
Радиоактив изотопларны образлы рәвештә «тамгалы атом¬
нар» дип атыйлар. Чыннан да, аларның барлыгын радиоактив
нурланышны сизә торган махсус приборлар ярдәмендә бик ансат
белергә мөмкин. Тамгалы атомнарны фәндә һәм техникада киң
кулланалар. Мәсәлән, алар ярдәмендә үсемлек һәм хайван күзә¬
нәкләрендәге матдәләр алмашын тулысыңча күзәтергә була. Әй¬
тик, әгәр минераль ашламага радиоактив фосфор кушылмасы
өстәлгән булса, ул чагында бу элементның үсемлектә үткән
юлын күзәтергә һәм аның ничек итеп үзләштерелүен ачыкларга
мөмкин. Радиоактив элементларны азык һәм дарулар составына
кертү, кайсы органнарда нинди элементлар үзләштерелүен, алар¬
ның нинди өлеше организмнан чыгарылуын белергә, дару матдә¬
ләренең тәэсир итү механизмын ачыкларга мөмкинлек бирә.
Химик элементларның бер-берсенә әверелешен төш физикасы
өйрәнә. (Төш физикасы нигезләре белән сез физика курсында
танышырсыз. Ул чагында сезгә ни өчен изотопларның чагыш¬
тырма атом массаларының кыйммәтләре бөтен сан булмавы аң¬
лашылыр.) Матдәләрнең химик әверелешләре вакытында эле¬
ментлар үзгәрми, ә аларның атомнарының электрон сүрүләрендә
генә үзгәрешләр була.
90
1. Чагыштырма атом һәм молекуляр масса, моль төшенчәләренең форму¬
лировкаларын әйтегез.
Лк 2. Cl (75,53%) һәм Cl (24,47%) изотопларының табигый катнашмасы
булган хлорның чагыштырма атом массасын исәпләп чыгарыгыз. Cl изо¬
тобының чагыштырма атом массасы 34,964 кә, Cl изотобыныкы — 36,961 гә
тигез.
3. Аргон һәм калий химик элементлары
40Ar (99,60%), 38Ar (0,06%), 36Ar (0,34%)
41K (6,88%), 40K (0,02%), 39K (93,10%)
изотопларыннан торалар. Ни өчен аргонның чагыштырма атом массасы
калийның чагыштырма атом массасыннан артыграк? Нәрсәгә нигезләнеп,
Д. И. Менделеев чагыштырма атом массасы артыграк булган аргон эле¬
ментын периодик системада кимрәк чагыштырма атом массасына ия бул¬
ган калий элементыннан алда урнаштырган?
4 . 234U изотобының радиоактив таркалуы вакытында 230Th изотобы һәм
4He изотобы барлыкка килгән. Радиоактив таркалуның схемасын төзегез.
Изотопларны табу һәм куллану турында чыгыш ясарга хәзерләнегез.
§ 29. ЭЛЕКТРОННЫҢ АТОМДАГЫ ХӘРӘКӘТЕ
Физика дәреслегеннән «Электр кыры» дигән параграфны кабатлагыз.
Атомның төзелеше турындагы күзаллаулар катлаулы үсеш
юлы үткәннәр. Атом төзелеше теориясенең үсешендә атомның
планетар моделе бик мөһим роль уйнаган. Белгәнегезчә, бу мо¬
дель буенча атомда төш тирәсендә орбиталар буйлап электрон¬
нар әйләнәләр. Әмма бу модель химик элементларның күп кенә
үзлекләрен аңлатырга мөмкинлек бирми.
Атомның хәзерге моделе микроскопик зурлыктагы кисәкчек¬
ләр дөньясы — микродөнья турындагы күзаллауларга нигезләнә.
Микродөнья макродөнья законнарына буйсынмый. Әйтик, атомда
электронның хәрәкәтен күзәтү мөмкин түгел икән, чөнки аның
хәрәкәт траекториясе юк. Бары тик электронның төшкә карата
теге яки бу урында булу ихтималы турында гына сүз алып ба¬
рырга мөмкин.
Әйтелгәннәрне водород атомы мисалында аңлатыйк. Водород
химик элементының атом номеры Z=I. Атомда бер электрон
бар. Ниндидер ысул белән электронның төш
тирәсендәге торышын ачыклый һәм ул то¬
рышны нокта белән билгели алдык дип
уйлыйк. Бу тәҗрибәне бик күп мәртәбә, мә¬
сәлән, мең тапкыр кабатлый алдык ди. Ул
чагында без болытны хәтерләтүче күренеш¬
не күрербез. Шундый болытның сурәтләне¬
ше 34 нче рәсемдә күрсәтелгән. Нокталар
күбрәк урнашкан урында электрон ешрак
34 нче рәсем. Элек¬
трон болыты.
була. Электрон хәрәкәтенең мондый моделе
электрон болытын күзалларга мөмкинлек
бирә.
91
35 нче рәсем, s- һәм р-орбитальләр
нең формалары.
Тискәре корылмалы элек¬
троннар уңай корылмалы төш¬
кә тартылалар һәм шул ук ва¬
кытта бер-берсеннән этеләләр
(бер үсемдәге корылмалар бу¬
ларак) . Атомдагы электроннар
үзләренең энергияләре E белән
аерылып торалар. Эксперимен¬
таль мәгълүматлар бериш
электроннарның төшкә күбрәк,
ә икенчеләренең азрак тарты¬
луларын күрсәтәләр. Димәк,
бериш электроннар күбрәк ва¬
кыт дәвамында төшкә якынрак,
ә икеңчеләре төштән ераграк
булалар. Электрон хәрәкәт итә
торган пространство орбиталь
дип ат(ала.
Энергиягә бәйле рәвештә электрон болытлары (орбитальләр)
зурлыклары белән аерылып торалар. Билгеле, электрон төшкә
никадәр көчлерәк тартылса, аның болыты (орбитале) шулкадәр
кечерәк, әмма тыгызрак була.
Орбитальләр (электрон болытлары) зурлыклары белән генә
түгел, ә формалары белән дә аерылып торалар. Теоретик исәп¬
ләүләр орбитальләрнең шар, гантель һәм башка катлаулырак
формаларда була алуларын күрсәтәләр. Шар формасындагы ор¬
битальләрне s хәрефе белән, гантель формасындагыларын — р
хәрефе белән, катлаулырак формадагы орбитальләрне d, f, ...
хәрефләре белән билгелиләр. 35 нче рәсемдә s-һәм р-орбиталь-
ләр сурәтләнгән. Орбитальләрнең үзәкләре төшнең үзәгенә туры
килә.
? 1. Электронның атомдагы хәрәкәте моделен сез ничек күз алдына китерә¬
сез?
A 2. а) s-орбитальнең; б) р-орбитальнең формасы нинди? Координаталар
күчәре башлангычы итеп төш үзәген һәм орбитальләрнең үзәген алып,
аларның модельләрен сурәтләгез.
3. х, у, z күчәре буйлап өч р-орбитальнең урнашуын сурәтләгез.
4. Нинди көчләр исәбенә электроннар төшкә тартылалар һәм бер-берсен¬
нән этеләләр?
§ 30. АТОМНЫҢ ЭЛЕКТРОННАР СҮРҮЕ
Атомның электроннар сүрүендәге электроннар үзләренең
энергияләре белән аерылып торалар. Моны ачык итеп түбәндә¬
гечә күз алдына китерергә мөмкин. Энергияләре якын булган
электрон болытлары атомда электрон катлавын тәшкил итәләр.
Төшкә иң якын беренче катлау электроннары икенче катлау
электроннарыннан көчлерәк тартылалар. Өченче катлау элект-
92
3d
Зр Өченче катлау
3
Cl
0)
X
_ ?р Икенче катлаЧ
Беренче катлау
роннары исә, төшкә икенче
катлау электроннарына кара- <i
ганда, көчсезрәк тартылалар.
Электрон катлауларының
энергетик аермасын схема рә- —
вешендә күрсәтергә була (36 Зр Өченче катлау
нчы рәсем). Анда орбитальләр —3s
сызыклар ярдәмендә билгелән- *
гән. Схемада сызык никадәр d « НкеНЧӨ К(Л71ЛС1Ц
югарырак урнаштырылса, бу * —2s ’
орбитальнең электроны төш бе-
лән шулкадәр көчсезрәк бәй¬
ләнгән. _f Беренче катлау
Беренче катлау бер орби- -
тальдән гыйбарәт, аны Is дип
билгелиләр (ул шар форма- 36 нчы рәсем. Электрон катлаулары-
сында була). Икенче катлау ның схемасы.
ике типтагы орбитальдән тора:
аның берсе s-тибында (шар формасы) һәм өчесе р-тибын-
да (гантель формасы). Аларны орбитальләргә туры китереп,
2s һәм 2р дип билгелиләр. Өченче катлау тугыз орбиталь¬
дән гыйбарәт: аларның берсе 3s- (шар формасы), өчесе Зр-
(гантель формасы) һәм бишесе 3</-тибында. Аннан соңгы кат¬
лауларның структурасы турында сез соңрак белерсез. Катлау¬
дагы орбитальләрнең гомуми саны п2 гә тигез (п— катлау но¬
меры) .
Орбитальләрнең һәркайсында икешәр электрон булуы мөм¬
кин. Шулай итеп, катлаудагы электроннарның гомуми саны 2п2
тәшкил итә (монда п —катлау номеры).
Орбитальләрнең энергия дәрәҗәләре күрсәтелгән схема
электроннарның элемент атомнарындагы орбитальләрдә бүлене¬
шен ачыкларга ярдәм итә. Кайбер мисалларны тикшереп узыйк.
Водород атомының атом номеры Z=I, |Н, ягъни төш ко¬
рылмасы 1+, аның төше протоннан гыйбарәт. Шуңа күрә во¬
дород атомында бер электрон булырга тиеш. Төш белән ls-op-
биталендәге электрон аеруча нык бәйләнгән. Водород атомының
электрон конфигурациясе: Is'. Бу ls-орбитальдә бер электрон
барлыгын аңлата. Водород атомы моделен сурәтләргә дә мөм¬
кин. Ул II форзацта күрсәтелгән. Координаталар күчәренең баш¬
лангычы атом төшенең үзәгенә туры килә.
Ә литий атомының электроннар конфигурациясе нинди соң?
Химик элементларның Д. И. Менделеев периодик системасына
күз салыйк. Литийның тәртип номеры Z = 3, 3L1. Димәк, аның
атомында өч электрон бар. Ике электрон 1 s-орбиталендә, өченче
электрон 25-орбиталендә урнашкан. Литий атомының электрон¬
нар конфигурациясе: ls22s‘. II форзацта литий атомының моделе
күрсәтелгән.
Электроннарның орбитальләрдә бүленешен һәм аларның
энергияләре буенча аерымлыкларын схема рәвешендә сурәтлиләр
93
(36 нчы рәсем). Орбитальдәге һәр электронны ук белән, ә парлы
электроннарны төрле юнәлештәге ике ук белән билгеләргә киле¬
шик. Ул чагында водород iH һәм литий 3L1 атомнарының элек¬
троннар конфигурацияләрен мондый схемалар рәвешендә күрсә¬
тергә була:
Ei ,Hb'
13Li 1$1 2 * * 52Д
Бу схемаларны кулланып, химик элементларның Д. И. Менде¬
леев периодик системасының 1 иче һәм 2 нче периодларындагы
химик элементлар атомнарының электроннар конфигурацияләрен
төзергә мөмкин.
? 1. Гелий атомы электроннар конфигурациясенең схемасын сурәтләгез.
Кайсы атом зуррак — гелий атомымы яки водород атомымы? Атомнарның
A төш корылмаларындагы аерымлыкны исәпкә алыгыз. Водород һәм гелий
атомнарының зурлыкларындагы аерманы игътибарга алып, гелий атомы мо¬
деленең рәсемен ясагыз.
2. Алюминий 13AI атомының электроннар конфигурациясен ls22s22p63s23p'
формуласы белән күрсәтергә була. Электроннарның энергияләре буенча
бүленешен күрсәткән схеманы төзегез. Кайсы орбитальдәге электрон: a) 2s
яки 3s; б) 2р яки Зр — төшкә көчлерәк тартыла? Кайсы электрон болыты
кечерәк: 2s яки 3s?
3. Электрон болыты, орбиталь, электрон катлавы, атомның электроннар
конфигурациясе төшенчәләренә билгеләмәләр бирегез. Атом моделен тас¬
вирлаганда, аларны дөрес кулланыгыз.
4. Магний атомының электроннар конфигурациясен һәм аның схемасын
төзегез. Шул ук вакытта 2 нче күнегүдәге мәгълүматларны да исәпкә
алыгыз.
5. Атомда бер s- һәм өч р-орбитальләренең бер-берсенә карата урнашуларын
сез ничек күз алдына китерәсез? Рәсемдә координаталар күчәре башлангы¬
чы итеп атом төшенең үзәген санагыз.
§ 31. ПЕРИОДИК СИСТЕМА
ҺӘМ ATOM ТӨЗЕЛЕШЕ
1. Атом нинди кисәкчекләрдән тора? 2. Төш корылмасы һәм атомның элек¬
троннар сүрүендәге электроннар саны нәрсәгә бәйле? 3. а) Орбиталь; б) электрон
катлавы төшенчәләренә нинди мәгънә салынган? 4. Is, 2s, 2р, 3s, Зр, 3d орби¬
тальләренең чагыштырма энергияләрен чагылдырган схеманы күрсәтеп бирегез.
5. а) Орбитальдә; б) электрон катлавында (п) күпме максималь сандагы элект¬
роннар була ала? 6. Периодик системаның беренче өч периодындагы элемент¬
ларның атомнарында электроннарның орбитальләрдәге бүленешен күрсәткән схе¬
маларны төзегез. Бу периодлардагы элементларның атомнары төзелешендә пе¬
риодлылык чагыламы? Параграфта бирелгән материалны дикъкать белән укып
чыгыгыз һәм үзегезнең фараз итүләрегезне параграф тексты белән чагыштырып
карагыз.
94
Периодик законның асылын атом төзелеше турындагы күз¬
аллаулардан чыгып тикшерик. Белгәнегезчә, химик элемент —
төш корылмалары бертөрле булган атомнар төре. Төш корылма¬
сы элементның периодик системадагы тәртип номерына санча
тигез. Төш корылмасы атомның электроннар сүрүендәге элек¬
троннар санын һәм бу сүрүнең төзелешен, ә шулай булгач,
химик элементның үзлекләрен дә билгели. Хәзер инде периодик
законга мондый формулировка бирә алабыз:
Химик элементларның, ә шулай булгач, алар барлыкка китер¬
гән гади һәм катлаулы матдәләрнең дә, үзлекләре атомнарның
төш корылмаларына периодик бәйлелектә тора.
Элементларның периодик системасына күз салыйк һәм 1—3
нче периодлардагы элементлар атомнарының электроннар сүрү¬
ләре төзелешен тикшерик. Периодик системаның 1 нче периодын¬
дагы элементлар — водород һәм гелий — атомнарының электрон¬
нар сүрүләре төзелеше турында без фикер алыштык инде. Бу
элементларның беренче электрон катлавы тутырыла:
H Is* Ei2HeIs2
2 нче периодта урнашкан элементларның атомнарында икенче
электрон катлавы тутырыла. Беренче катлауда исә, гелий эле¬
ментының электроннар конфигурациясе саклана. Периодның бе¬
ренче ике элементында — литийда з1~Л һәм бериллийда 4Ве —
электроннар s-орбитальдә урнашалар:
f 4Ве Is*2s*
is
2Р
Литий Li һәм бериллий Be атомнарында электроннар белән
25-орбитале, ягъни тышкы электрон катлавы тутырыла. Атом¬
нарында тышкы электрон катлау электроннары s-орбиталендә ур¬
нашкан элементлар s-элементлар дип аталалар.
2 нче периодның алардан соңгы алты элементында 2р-орби-
тальләр тутырыла. Бу очракта бор 5В, углерод бС һәм азот 7N
атомнарының 2р-орбитальләрендә берәр электрон урнаша:
95
E 5B 1s*2$Z2p'
Кислород 8О, фтор gF, неон ioNe атомнарында исә, 2р-орби-
тальләрендә икенче электроннар да туплана:
Ei10Ne 1^22^2 IpB
Атомнарында тышкы катлау электроннары р-орбитальлэр-
дә урнашкан элементлар р-элементлар дип аталалар.
3 нче период элементларында электроннар өченче катлауны
тутыралар. Бу элементларның атомнарында беренче ике катлау
тәмамланган һәм аларга неон атомы конфигурациясе (ls22s22p )
хас. 3 нче период элементлары атомнарының тышкы катлау¬
ларындагы электроннар конфигурацияләрен китерик:
Атом номеры
Атомның тышкы
Na
11
Mg
12
Ai
13
Si
14
P
15
S
16
Cl
17
Ar
18
электрон катлавы
3s23p'
3s23p2
3s23p3
3s23p4
төзелеше
3s1
3s2
3s23p
3s23p
96
Күргәнебезчә, 3 нче период элементларының атомнарында
орбитальләрнең тутырылуы 2 нче период элементларының атом¬
нарындагы кебек үк эзлеклелектә була.
4 нче һәм аннан соңгы период элементларының атомнар¬
ында электрон сүрүләренең тутырылу закончалыкларын киләсе
параграфта тикшерербез. Ә хәзер шуны билгеләп үтик, һәр пе¬
риодның беренче ике элементы s-элемент була, һәр периодның
беренче элементыннан атомнарда яңа электрон катлавы туты¬
рыла башлый:
H Li Na K Rb Cs Fr
Is1 2s1 3s1 4s1 5s1 6s‘ 7s'
һәр период (беренчесеннән башка) алты p-элемент белән
тәмамлана. Период ахырында атомының тышкы катлавы элек¬
троннар конфигурациясе сигез электронны эченә ала торган
элемент урнаша:
Ne Ar Kr Xe Rn
2s22p6 3s23p6 4s24p6 5s25pb 6s26p6
Шулай итеп, төш корылмасы арту белән, s- һәм р-элемент-
лары атомнарының тышкы катлавында электроннар конфигура¬
циясенең периодик рәвештә кабатлануы күзәтелә.
? 1. Түбәндәге химик элементлар атомнарының электроннар копфигурация-
A ләрен языгыз: а) фосфор; б) кремний; в) хлор; г) кальций. Алар нинди
элементларга керәләр: s-элементларгамы яисә р-элементларгамы?
2. a) IV төркемнең р-элементлары; б) VII төркемнең р-элементлары сим¬
волларын, шулай ук аларның атомнарының тышкы электрон катлаулары
өчен электроннар конфигурацияләрен һәм энергетик схемаларың китерегез.
3. Кайсы элементның атомы зуррак: бериллийныкымы яки магнийныкымы?
Җавапны дәлилләгез.
4. Кайсы атомнан тышкы катлау электроннарын аерып алу җиңелрәк: ли¬
тийданмы яки калийданмы? Аңлатма бирегез.
5. Периодик законның Д. И. Менделеев тарафыннан әйтелгән һәм хәзерге
формулировкаларын чагыштырыгыз.
§ 32. Д. И. МЕНДЕЛЕЕВ ПЕРИОДИК СИСТЕМАСЫНЫҢ
СТРУКТУРАСЫ
1. Периодик системаның 1 нче һәм аннан соңгы периодларында ничәшәр
химик элемент бар? 2. Ни өчен 1 нче һәм 2 нче периодларда химик элемент¬
ларның саны төрле? 3. Атомның өченче электроннар катлавы ничә орбитальдән
гыйбарәт? Бу катлаудагы электроннарның максималь саны күпме булуы мөмкин?
Периодик системаның структурасы белән сез гомумән алган¬
да таныш инде. Периодик системада урнашуына карап химик
элементның үзлекләрен алдан әйтеп бирү өчен, системаның тө¬
зелешен җентекләбрәк өйрәнергә кирәк.
7 п-236
97
Периодик законны ачканнан соң узган 100 елдан артык ва¬
кыт эчендә периодик системаны аңлаешлы итеп күрсәтүнең бик
күп төрле вариантлары эшләнгән. Бигрәк тә таблица формасын-
дагылары, ә алардан — сигез шакмаклы (1 форзац) һәм унсигез
шакмаклы (II төсле рәсем) вариантлары киң таралган. Килә¬
чәктә без периодик системаның өйрәнелә торган материалны ба¬
рыннан да яхшырак ачыкларга мөмкинлек бирә торган вариан¬
тыннан файдаланырбыз.
Периодик системада җиде период бар. Беренче өч период
кечкенә периодлар дип, ә калганнары зур периодлар дип ата¬
лалар. Ни өчен периодлардагы элементларның саны төрле? Бу
сорауга сез зур периодлардагы химик элементларның атом тө¬
зелешләре белән танышканнан соң җавап бирә алырсыз.
4 нче период 18 элементтан тора (II төсле рәсемне карагыз).
Беренче ике элемент — s-элементлар (K, Ca), аларның атомна¬
рында тышкы электрон катлавы (4$-орбиталь) тутырыла. Соңгы
алты элемент — р-элементлар (Ga, Ge, As, Se, Br, Кг). Аларның
атомнарында шулай ук тышкы электрон катлавы (4р-орбиталь-
ләр) тутырыла. S- һәм р-элементлары арасында ун d-элементы
урнашкан. Аларның атомнарында тышкы катлаудан алдагы кат¬
лауның d-орбитальләре тутырыла (II төсле рәсемне карагыз).
Соңгы катлауда исә (45-орбиталендә) ике яки бер электрон
туплана. 4 нче периодның ун d-элементы атомнарында биш
Зd-opбитaльнeң тутырылуы болай була:
Sc Ti V Cr Mn Fe Co Ni Cu Zn
3rf'4s2 3rf24s2 3d34s2 3d5 * *4s' 3</'4s2 зЛ? 3d?4s2 3d84s2 3d'04s' 3d'°4s2
Хром атомының тышкы катлавында бары тик бер генә электрон бар.
Электрон бер катлаудан башкасына сикерә сыман: 4х-электроннарының берсе
тышкы катлаудан алдагы катлауга күчә. Бу барлык биш M-орбиталендә дә
берәр электрон урнашуга китерә:
3ds
Шул ук рәвешчә бакыр атомында 4х-электроннарының берсе тышкы кат¬
лаудан алдагы катлауга күчә һәм бу ЗЦ-орбитальләренең һәркайсында икешәр
электрон урнашуны тәэмин итә:
3d'0
5 нче период, 4 нче период кебек үк, 18 элементтан тора
(II төсле рәсемне карагыз). Анда шулай ук ике s-элемент
(Rb, Sr), ун d-элемент (Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd)
һәм алты p-элемент (In, Sn, Sb, Те, I, Хе) бар. s- һәм р-элемент-
98
ларның атомнарында соңгы катлау (5s- һәм 5р-орбитальләре),
ә d-элементларның атомнарында тышкы катлаудан алдагы кат¬
лау (4с/-орбитальләре) тутырыла.
6 нчы период 32 элементтан гыйбарәт. Анда, ике s-элемент¬
тан, ун d-элементтан һәм алты р-элементтан тыш, {^-элемент
(лантаноидлар) урнаша, f-элементларның атомнарында тыштан
өченче катлауда электроннар туплану дәвам иткәнлектән, элек¬
троннар 4/-орбитальләрне тутыралар, d- һәм /-орбитальләрендә
электроннарның туплану закончалыклары белән тагын да җен¬
текләбрәк II төсле рәсем буенча танышырсыз.
s-элементлар барлык периодларда да, р-элементлар 2 нче
һәм аннан соңгы периодларда, d-элементлар 4 нче һәм аннан
соңгы периодларда, ә /-элементлар 6 нчы һәм 7 нче периодлар¬
да бар.
Шулай итеп, периодларда элементлар санының төрле булуы
атомнардагы электрон катлауларының тутырылу закончалык¬
лары белән аңлатыла.
Периодик системадагы элементлар сигез төркемгә бү¬
ленәләр. һәр төркем элементларның төп һәм ян төркемчә¬
ләреннән тора. Төп төркемчәне, яки а төркемчәсен s- һәм
р-элементлар, ә ян төркемчәне, яки б төркемчәсен d-элементлар
тәшкил итәләр (II төсле рәсемне карагыз). Мәсәлән, элемент¬
ларның периодик системасындагы IV төркемне тикшереп үтик.
Бу төркемгә түбәндәге элементлар керә:
Төп төркемчә
(углерод төркемчәсе)
C...2s22p2
Si...3s23p2
Ge...4s24p2
Sn...5s25p2
Pb...6s26p2
Ян төркемчә
(титан төркемчәсе)
Ti...3d24s2
Zr...4d25s2
Hf...5d26s2
Ku...6d27s2
р-элементлар: углерод С, кремний Si, германий Ge, аккургаш
Sn һәм кургаш Pb — төп төркемчәне (а)—углерод төркемчәсен
тәшкил итәләр. Ян төркемчә (б) — титан төркемчәсе d-элемент¬
лардан гыйбарәт: титан Ti, цирконий Zr, гафний Hf һәм курча¬
товий Ku.
Барлык башка төркемнәрдән VIII төркем аерылып тора. Анда
төп төркемчәдән (гелий төркемчәсеннән) тыш, бер түгел, ә өч
ян төркемчә — тимер төркемчәсе, кобальт төркемчәсе, никель
төркемчәсе бар.
1 нче период элементлары — водород (Is) һәм гелий (Is2)
периодик системада үзенә бер төрле урын алып торалар. Гадәт¬
тә водородны VII яки I төркемгә, ә гелийны VIII төркемгә кер¬
тәләр.
Шулай итеп, Д. И. Менделеев периодик системасы элемент¬
ларның атомнардагы электронлы структураларга нигезләнгән
7*
99
табигый классификациясе булып тора. Химик элементлар атом¬
нарының төш корылмалары арткан саен, электрон сүрүләренең
төзелеше периодик рәвештә үзгәрә.
Белгәнегезчә, химик элементлар рәтендә атомнарның тыш¬
кы электрон катлавындагы электроннар конфигурациясе генә
кабатланып калмый, ә бәлки атомнарның электроннар сүрүе дә
катлаулана бара. Шуңа күрә атомнарындагы тышкы электрон
катлауларының төзелеше бертөрле булган элементларның үзлек¬
ләрендә охшашлыклар гына түгел, ә аерымлыклар да чагыла.
1. 6 нчы таблицаны дәфтәрегезгә күчереп языгыз һәм тутырыгыз.
6 нчы таблица. Атомнардагы орбитальләрнең
электроннар белән тутырылу тәртибе
Орбитальләрнең электроннар белән тутырылуы кайсы
элементтан башлана
Is
2s
2р
3s
Зр
3d
4s
4р
4d
5$
5р
5d
2. VlI төркем элементларының соңгы ике катлаулары өчен электроннар
конфигурацияләрен языгыз, а) Алар нинди элементларга керәләр: S-,
р- яки d-элементларга? б) Төп һәм ян төркемчә элементларын әйтеп бире¬
гез. в) Бу төркемчәләрдәге элементларның атом структураларының охшаш¬
лыгы һәм аерымлыгы нәрсәдән гыйбарәт? г) VII төркем элементларының
югары оксидлашу дәрәҗәләре нинди? д) Элементларның югары оксидлашу
дәрәҗәләренә туры килүче оксидларның формулаларын языгыз.
3. VI төркем элементлары нинди төркемчәләргә бүленәләр?
а) Бу элементларның югары оксидлашу дәрәҗәләре нинди?
б) Бу элементларның югары оксидлашу дәрәҗәләрендәге оксидларының
составлары нинди?
ЭЛЕМЕНТЛАРНЫҢ Д. И. МЕНДЕЛЕЕВ ПЕРИОДИК СИСТЕМАСЫНДА
УРНАШУЫНА КАРАП, ХИМИК ЭЛЕМЕНТНЫҢ
ATOM ТӨЗЕЛЕШЕН БИЛГЕЛӘҮГӘ КАРАТА КҮНЕГҮЛӘР
1 нче мисал. Фтор атомының тышкы катлавында ничә элект¬
рон бар? Фтор атомы электроннар сүрүендәге тышкы катлауның
электроннар конфигурациясен төзергә.
Фтор F элементы периодик системада VII төркемнең төп
төркемчәсендә урнашкан, ул p-элемент. Шуңа күрә фтор ато¬
мының тышкы катлавында җиде электрон бар. Фтор 2 нче пе¬
риод элементы булганлыктан, аның тышкы катлавы булып икенче
катлау тора. Ул вакытта атомның электроннар сүрүендәге тышкы
катлауның электроннар конфигурациясе мондый булыр: 2s22p5,
яки:
E
2/7
100
2$
1 нче бирем, а) Натрий; б) бериллий; в) кремний; г) угле¬
род атомнарының электроннар сүрүләрендәге тышкы катлаула¬
рында ничә электрон булыр?
2 нче мисал. Кислород атомының электроннар конфигурация¬
сен һәм электроннарның орбитальләргә бүленешенең энергетик
схемасын төзергә, атомның тышкы электрон катлавы төзелеше¬
нең моделен сурәтләргә.
Кислород элементы 8О 2 нче периодта урнашкан. Димәк,
аның электроннары электроннар сүрүенең беренче ике катлау¬
дагы орбитальләрендә тупланган. Кислород — VI төркемнең төп
төркемчәсе элементы; ул — p-элемент. Шулай булгач, аның тыш¬
кы катлавында алты электрон бар. Ул вакытта электроннар бү¬
ленешенең схемасы мондый рәвештә булыр:
Кислород атомының 8О электроннар конфигурациясе: ls2 32s22p4.
Электроннарның саны элементның атом номерына туры килә.
2s- һәм 2р-орбитальләренең бер-берсенә карата урнашуларын
сурәтлик. Координаталар күчәре башлангычы итеп атом төшенең
үзәген исәпләрбез:
2 нче бирем, а) Магний; б) алюминий атомнарының элек¬
троннар конфигурацияләрен билгеләгез. Электроннарның орби¬
тальләргә бүленешенең энергетик схемасын төзегез.
3 нче бирем, а) Азот; б) фосфор; в) хлор; г) күкерт атом¬
нарының электроннар конфигурациясен, электроннарның орби¬
тальләргә бүленешенең энергетик схемасын һәм тышкы катлау¬
лары төзелешенең модельләрен төзегез.
101
§ 33. ЭЛЕМЕНТЛАРНЫҢ ATOM НОМЕРЛАРЫ
ФУНКЦИЯЛӘРЕ БУЛАРАК ATOM РАДИУСЛАРЫ
1. Химик элементларның түбәндә китерелгән үзлекләренең кайсылары эле¬
ментларның атом номерларыннан периодик бәйлелектә үзгәрә: а) чагыштырма
атом массасы; б) атомның электроннар конфигурациясе; в) атом радиусы?
2. Ни өчен бер төркемчәдәге химик элементларның үзлекләре охшаш? Сез ничек
уйлыйсыз, бер төркемчәдәге химик элементларның үзлекләрендәге аерманың
сәбәбе нәрсәдә?
Сезгә билгеле булганча, бер төркемчәдәге элементларның
үзлекләрендәге охшашлыклар, аларның атомнарында бертөрле
санда валентлык электроннары булу белән аңлатыла. Ә төркем¬
чәдәге элементларның үзлекләрендәге аерымлыклар нәрсәгә бәй¬
ле соң? Мәсәлән, ни өчен углерод химик элементы кургаш химик
элементыннан аерылып тора?
Югыйсә, һәр ике элемент та Д. И. Менделеев периодик сис¬
темасының бер үк төркемчәсенә керәләр бит. Аларның атом¬
нарының тышкы электрон катлаулары бер үк төзелешкә ия бу¬
лып торалар:
Ләкин углерод атомында (2s22p2) тышкы катлау электроннары
икенче катлау орбитальләрендә, ә кургаш атомында (6s26p2) —
алтынчы катлау орбитальләрендә урнашканнар. Углерод һәм
кургаш атомнарының зурлыклары белән аерылып торуларын ча¬
маларга кыен түгел: кургаш атомының радиусы углерод атомы-
ныкыннан зуррак. Элементларның төркемчәләрендә атом номеры
арту белән атомнарның радиуслары зураю тенденциясе күзәтелә.
Элементларның атом номерларына бәйле рәвештә периодлар¬
да атомнарның радиуслары ничек үзгәрүен күзәтик. Моның
өчен 37 нче рәсемдә бирелгән мәгълүматлардан файдаланыйк.
Рәсемнән күренгәнчә, иң зур радиус — периодны башлап җибә¬
рүче элемент атомыныкы (H, Li, Na, K, Rb, Cs), ә иң кечкенә
радиус — периодны төгәлләүче элемент атомыныкы (He, Ne, Ar,
Kr, Xe, Rn). Бу, төш корылмасы арткан саен, сүрүдәге элек¬
троннарның да саны арту һәм аларның төшкә тартылулары көчәю
белән аңлатыла — атомнар кысылып тыгызлангандай булалар.
Шулай итеп, атомнарның зурлыклары төш корылмасы һәм
атомдагы электроннар сүрүенең төзелеше белән билгеләнә. Шуңа
күрә элементларның атом номерлары арту белән, атомнарның
радиуслары үзгәрүе ачык күренеп торган периодик характерда
102
37 нче рәсем. Элементларның атом номерлары функцияләре буларак атом
радиуслары.
була (37 нче рәсем). Төркемчәләрдә атомнарның зурлыклары
үсү тенденциясе, ә периодларда аларның кимү тенденциясе кү¬
зәтелә.
1. Түбәндә 1 төркемнең s-элементларының атомнары радиусларының кыйм¬
мәтләре бирелгән:
A Химик элемент Li Na K Rb Cs
Атомның радиусы, им 0,16 0,17 0,22 0,23 0,25
Шул мәгълүматлар нигезендә атомнар радиусларының химик элементлар¬
ның атом номерларына бәйлелек графигын төзегез.
2. Ни өчен бер периодның соңгы элементыннан аннан соң килгән период¬
ның беренче элементына күчкәндә атомнарның радиуслары бик кискен арта?
3. Кайсы химик элемент атомыннан электронны аерып алу җиңелрәк: ли¬
тийданмы яки натрийданмы? Җавапны дәлилләгез.
4. Атомнарының электроннар конфигурацияләре бер үк төрле булуга кара¬
мастан, углерод һәм кургаш химик элементлары үзлекләре белән бик нык
аерылып торалар. Сез ничек уйлыйсыз, моны ничек аңлатып була?
§ 34. ЭЛЕМЕНТЛАРНЫҢ ATOM НОМЕРЛАРЫ
ФУНКЦИЯЛӘРЕ БУЛАРАК АТОМНАРНЫҢ ИОНЛАШУ
ЭНЕРГИЯЛӘРЕ
1. Натрий атомыннан бер электронны аерып алганда барлыкка килгән ион¬
ның корылмасы нинди булыр? 2. Сез ничек уйлыйсыз, Li — Na — K-Rb — Cs
рәтендә тышкы катлаудагы электрон белән төш бәйләнешенең ныклыгы ничек
үзгәрер?
Химик элементның үзлекләрен аңлау өчен, аның атомында
электроннарның никадәр нык тотылып торуларын белергә кирәк.
Электрон белән төш бәйләнешенең ныклыгын атомның ионлашу
энергиясенең кыйммәте (/) белән бәялиләр. Атомның ионлашу
103
энергиясе — элемент атомыннан (Э) электронны аерып алу өчен
кирәк булган энергия микъдары ул:
Э + 1 = Э++ё
Ионлашу энергиясен мольгә джоульләрдә (яки кДж/моль)
күрсәтәләр.
Элементларның атом номерлары арту белән атомнарның ион¬
лашу энергияләре үзгәрү ачык чагылган периодик характерда
була. 38 нче рәсемнән күренгәнчә, периодларда төш корылмасы
арту белән, тулаем алганда, атомның ионлашу энергиясе дә арта.
Бу электрон белән төш бәйләнешенең ныгуын күрсәтә. Иң аз
ионлашу энергиясе периодны башлап җибәрүче элементларга
(H, Li, Na, K, Rb, Cs, Fr) хас. Иң күп ионлашу энергиясе
период ахырындагы элементларда (He, Ne, Ar, Kr, Xe, Rn) ча¬
гыла.
S- һәм р-элементларының төркемчәләрендә элементларның
атом номерлары арту белән атомнарның ионлашу энергияләре
кимү тенденциясе күзәтелә. Бу болай аңлатыла: тышкы катлау¬
ларда электроннар конфигурациясе бертөрле булганда, зуррак
радиуслы атомнан электронны аерып алу җиңелрәк. Зуррак
радиуслы атомда тышкы электрон төштән ераграк урнаша һәм
аның төш белән бәйләнеше көчсезрәк була.
Атомнарның ионлашу энергияләренең кыйммәтләрен өйрәнү
атомнардагы электрон сүрүләрнең катламлы төзелешкә ия бу¬
луларын раслый. Әйтик, натрий атомыннан (1 s22s22p63s‘) берен¬
че электронны аерып алу өчен кирәкле энергия (496 кДж/моль),
икенче электронны аерып алу өчен кирәк булган энергиядән
(4564 кДж/моль) шактый кимрәк. Беренче электрон (3s1) тышкы
катлаудан китә, ә икенче электрон (2р') тышкы катлаудан ал¬
дагы катлауныкы. Тышкы катлаудагы электронның төшкә тарты-
2500
Kr
Xe
Rn
500
0
He
* N0
2000
^1500
Iw
I
Na K Rb Cs
I 1 I I. —
10 20 30 40 50 60
Элементның, атом нотеры
38 нче рәсем. Элементларның атом номерлары функцияләре буларак атомнарның
ионлашу энергияләре.
104
луы аннан алдагы катлау электронныкына караганда шактый
көчсезрәк.
Неметалл атомнарыннан аермалы буларак, металл атомнары¬
ның ионлашу энергияләренең кыйммәтләре зур түгел.
1. Түбәндә I төркемнең s-элементлары атомнарының ионлашу энергиясе
кыйммәтләре бирелгән:
Химик элемент Li Na K Rb Cs
Атомның ионлашу
энергиясе, кДж/моль 520 496 419 403 376
Шул мәгълүматлар нигезендә, атомнарның ионлашу энергияләренең химик
элементларның атом номерларына бәйлелек графигын төзегез. Табылган
кәкрене § 33, 1 нче күнегүдә төзелгән кәкре белән чагыштырыгыз. Аңлат¬
малар бирегез.
2. Углерод атомыннан беренче, икенче, өченче, дүртенче һәм бишенче
электроннарны аерып алу өчен кирәк булган энергия түбәндә күрсәтелгән:
Ионлашу энергиясе, Һ Һ Һ Л Һ
кДж/моль 1086 2353 4619 6222 37827
Углерод атомының электроннар конфигурациясен языгыз һәм түбәндәге
сорауларга җавап бирегез: а) Ни өчен икенче электронны аерып алу өчен,
беренче электронны аерып алуга караганда, күбрәк энергия кирәк (/1</г),
ә өченче электронны аерып алу өчен икенче электронны аерып алуга кара¬
ганда күбрәк энергия кирәк (/г</з) һ. б.? б). Ни өчен /4 һәм /з кыйм¬
мәтләре арасында кискен сикереш күзәтелә?
3. K, Ca, Ba өчен электроннар конфигурацияләрен языгыз. Төш белән
кайсы электроннар көчсезрәк бәйләнгән? Атомнан бу электроннар аерылып
киткәндә барлыкка килгән ионнарның корылмалары нинди булыр?
13 нче лаборатор дәрес
3 НЧЕ ПЕРИОД ЭЛЕМЕНТЛАРЫНЫҢ ОКСИДЛАРЫ ҺӘМ
ГИДРОКСИДЛАРЫ
Бу эш барышында 3 нче период элементларының югары ок¬
сидлашу дәрәҗәләрендәге оксидларының һәм гидроксидларының
(«гидроксид» сүзе нигезләрне дә, кислородлы кислоталарны да
эченә ала) кислота-нигез үзлекләрен ачыкларга кирәк булачак.
Күзәтүләрдән чыгып, 3 нче период элементлары гидроксидлары¬
ның үзлекләре үзгәрүнең характеры аларның тәртип номерлары¬
на бәйле булуы турында нәтиҗә ясагыз.
1 нче тәҗрибә. Пробиркадагы натрий оксидына (натрий
оксиды урынына литий оксидын да алырга ярый) тамчылап
су өстәгез. Күзәтүләрегезне аңлатып бирегез. Кислота-нигез
индикаторы ярдәмендә барлыкка килгән эремә тирәлегенең ха¬
рактерын тикшерегез. Реакция тигезләмәсен төзегез, индикатор¬
ның төсе ничек үзгәрүне язып куегыз. Натрий оксиды нинди
оксидларга керә: кислота оксидларынамы, әллә нигез оксидлары¬
намы? Натрий гидроксидының кислота-нигез үзлекләре нинди?
2 нче тәҗрибә. Магний оксиды салынган пробиркага су өс¬
тәгез. Магний оксиды суда эриме? Катнашманы болгатыгыз. Ин¬
105
дикатор кәгазе ярдәмендә тирәлекнең характерын тикшерегез.
Реакция тигезләмәсен языгыз, индикаторның төсе ничек үзгә¬
рүен язып куегыз.
Аннары пробиркага тамчылап хлорид кислотасы өстәгез. Кү-
зәтүләрегезгә аңлатма бирегез. Реакцияләрнең тигезләмәләрен
языгыз.
Магний оксидының селте эремәсендә эрүчәнлеген тикшере¬
гез. Магний оксидының һәм магний гидроксидының кислота-ни-
гез үзлекләре нинди?
3 нче тәҗрибә. Алюминий оксидының суга мөнәсәбәтен тик¬
шерегез. Индикатор үзенең төсен үзгәртәме?
4 нче тәҗрибә. Лабораториядә булган реактивлардан фай¬
даланып, алюминий гидроксидын алмашу реакциясе ярдәмендә
табыгыз. (Тозларның һәм гидроксидларның эрүчәнлек таблица¬
сын кулланыгыз.) Селте эремәсен, утырым хасил булганчы, там¬
чылап өстәгез. Утырымның тышкы күренешенә игътибар итегез.
Утырымны ике өлешкә бүлегез. Утырымның бер өлешенә, ул
эреп беткәнче, хлорид кислотасы салыгыз. Күзәтүләрегезне аң¬
латып бирегез. Реакцияләрнең тигезләмәләрен языгыз.
Утырымның икенче өлешенә селте эремәсе өстәгез. Сез нәр¬
сә күзәтәсез? Алюминий гидроксидының селтегә ,мөнәсәбәте
нинди? Бу реакцияне сез §107 не өйрәнгәннән соң аңлатып бирә
алырсыз. Ни өчен алюминий гидроксидын алмашу реакция¬
се ярдәмендә тапканда, селте эремәсен кирәгеннән артык алмый¬
ча, тамчылап кына салырга кирәк?
5 нче тәҗрибә. Кремний (IV) оксиды салынган пробиркага
су өстәгез. Бу оксид суда эриме? Индикаторның төсе үзгәрәме?
Күзәтүләрегезне аңлатып бирегез.
6 нчы тәҗрибә. Силикат кислотасына селте эремәсе өстә¬
гез. Катнашманы җиңелчә генә җылытыгыз. Күзәтүләрегезне
аңлатып бирегез.
7 нче тәҗрибә. Пробиркадагы фосфор (V) оксидына, оксид
эреп беткәнче, тамчылап су өстәгез. Күзәтүләрегезгә аңлатма
бирегез. Эремә тирәлегенең характерын тикшерегез. Реакция ти¬
гезләмәсен төзегез; индикаторның төсе ничек үзгәрүен язып
куегыз.
? 1. Натрий оксиды, магний оксиды, алюминий оксиды, кремний (IV) оксиды,
▲ фосфор (V) оксиды рәтендә оксидларның су белән тәэсир итешү актив¬
лыгы ничек үзгәрә? Аларның эремәләре тирәлегенең характеры нинди?
2. Күкерт (VI) оксидының һәм хлор (VII) оксидының кислота-нигез үз¬
лекләре нинди? Бу оксидларның су белән реакцияләренең тигезләмәлә¬
рен төзегез.
3. 3 нче период элементларының югары оксидлашу дәрәҗәләрендәге гид-
роксидларының (туры килгәнчә нигезләренең яки кислоталарының) фор¬
мулаларын языгыз, а) I төркем элементы — натрийның; б) VII төркем
элементы — хлорның гидроксидлары нинди химик табигатькә ия?
4. Алюминий гидроксидының кислоталы-нигезле табигате турында сез
нәрсә әйтә аласыз?
106
§ 35. ЭЛЕМЕНТЛАРНЫҢ ПЕРИОДИК СИСТЕМАДА
УРНАШУЛАРЫ ҺӘМ АЛАРНЫҢ ОКСИДЛАРЫНЫҢ
ҺӘМ ГИДРОКСИДЛАРЫНЫҢ ҮЗЛЕКЛӘРЕ
13 нче лаборатор дәрестәге күзәтүләрегезнең нәтиҗәләрен лаборатор эш¬
ләр журналыннан карап чыгыгыз. Na — Cl рәтендә оксидларның һәм гидроксид-
ларның кислота-нигез үзлекләре ничек үзгәрә? Оксидларның һәм гидроксидлар-
ның кислота-нигез үзлекләрен эксперименталь рәвештә ничек ачыкларга?
3 нче период элементлары оксидларының һәм гидроксидла-
рының составлары һәм үзлекләре ничек үзгәрүен тикшерик
;(7 нче таблица). Периодта атомнарның электроннар конфигура¬
циясе закончалыклы рәвештә үзгәрә:
Na Mg Al Si P S Cl Ar
3s1 з/ 3s23p' 3s23p2 3s23p3 3s23p4 3s23p5 3s23p
Шуңа күрә элементларның югары оксидлашу дәрәҗәләренең
кыйммәтләре дә, димәк, элементларның югары оксидлашу дәрә¬
җәләрендәге оксидларының составлары да шулай ук законча¬
лыклы рәвештә үзгәрә:
Na Mg Al Si P S Cl Ar
Na2blO Mg+2O Al2+3O3 Si+4O2 Р2+5О5 S+6O3 С12+7О7 —
Бу оксидларның үзлекләрен тикшергәндә, моннан алдагы дә¬
рестә башкарылган тәҗрибәләрнең нәтиҗәләреннән файдала¬
нырбыз. Белгәнегезчә, натрий оксиды Na2O су белән актив реа-
гирлаша һәм бу вакытта суда эрүчән нигез — NaOH селтесе
барлыкка килә:
Na2O +H2O = 2NaOH
Na2O+ H2O = 2Na++2ОН“
Реакция күп микъдарда җылылык аерылып чыгу белән бара.
Ә магний гидроксиды Mg(OH)2 суда начар эри. Шуңа күрә
сез магний оксидының MgO суда эрүен күзәтә алмадыгыз. Әмма
индикатор ярдәмендә сез тирәлекнең селтеле булуын белдегез.
Димәк, MgO күпмедер микъдарда шулай да су белән реагир-
лаша:
MgO+ H2O = Mg (OH) 2
MgO + H2O = Mg2+ + 20Н-
Алюминий оксидына килгәндә исә, AI2O3 гадәттәге шартларда
су белән бөтенләй тәэсир итешми. Шулай итеп, Na2O — MgO —
AI2O3 рәтендә су белән тәэсир итешү активлыгы кими. Бу рәттә
оксидларның нигез билгеләре көчсезләнә бара.
Cy белән кремний оксиды да SiO2 тәэсир итешми. Әмма
аңа силикат кислотасы H4SiO4 туры килә.
Фосфор (V) оксиды P2O3 исә, су белән бик көчле рәвештә
тәэсир итешә:
107
ЗН2О + Р2О5 = 2НзРО4
Бу вакытта күп микъдарда җылылык аерылып чыга.
Cy белән тагын да активрак күкерт (VI) оксиды SO3:
H2O+ SO3 = H2SO4
яки
H2O + SO3 = 2Н++ SOl-
һәм хлор (VII) оксиды Cl2O? тәэсир итешә:
H2O +Cl2O7 = 2НС1О4
яки
H2O + Cl2O7 = 2Н+ +2С10Г
SiO2 — P2Os — SO3 — Cl2O7 рәтендә оксидларның кислота
билгеләре көчәя.
Шулай итеп, периодта бер элементтан икенчесенә күчкән¬
дә оксидларның нигез үзлекләре көчсезләнү һәм кислота үзлек¬
ләре көчәю күзәтелә:
Na2O MgO Al2O3 SiO2 P2Os SO3 Cl2O7
Оксидларның нигез үзлекләре көчсезләнү Оксидларның кислота үзлекләре көчәю
Шул рәвешчә үк периодлардагы элементларның югары ок¬
сидлашу дәрәҗәләренә туры килүче гидроксидларның үзлекләре
үзгәрү характерын да аңлатырга мөмкин:
Na Mg Al Si P S Cl
+ 1 +2 +3 +4 +5 +6 +7
NaOH Mg(OH)2 AI(OH)3 H4SiO4 H3PO4 H2SO4 HClO4
Гидроксидларның нигез үзлекләре көчсезләнү Гидроксидларның кислота үзлекләре көчәю
3 нче период элементлары оксидларының һәм гидроксидла-
рының үзлекләре үзгәрүдәге закончалыкларны тикшерүне төгәл¬
ләү өчен, сез башкарган тагын бер тәҗрибәне искә төшерик.
Сез алюминий гидроксидын тапкан идегез:
Al* 3+ + ЗОН- = Al(OH) + ,
мәсәлән, мондый алмашу реакциясе ярдәмендә:
Al2 (SO4) з + 6NaOH = 2А1 (OH) 3| + SNa2SO4
Табылган алюминий гидроксиды утырымының бер өлешенә
сез хлорид кислотасы, ә икенче өлешенә селте эремәсе салган иде¬
гез. һәр ике очракта да алюминий гидроксиды эри. Бу алюминий
гидроксидының Al(OH)3 кислота белән дә, нигез белән дә ре¬
акциягә керүен күрсәтә. Кислоталар белән дә, нигезләр белән
дә үзара тәэсир итешүче гидроксидлар амфотер гидроксидлар
дип аталалар. (Грекча амфотерлык «һәр ике яктан», «ике як-
108
лы», «ике төрле» дигән мәгънәләрне аңлата. А. Беляевның «Ке¬
ше — амфибия» исемле фантастик повестеның героен исегезгә
төшерегез: ул суда да, коры җирдә дә сулый ала, яки үпкә һәм
тире сулышына ия булган җир-су хайваннары классын, амфи¬
бияләрне хәтерләтә.)
Амфотер гидроксидларга туры килгән оксидлар да шулай
ук амфотер үзлекләр күрсәтәләр. Мәсәлән, алюминий оксиды
кайбер шартларда кислоталар белән дә, нигезләр белән дә тәэ¬
сир итешә.
Нәтиҗә ясыйк. Периодтагы элементлар рәтендә нигез ок¬
сидларының һәм нигезләрнең үзлекләре көчсезләнә һәм шул ук
юнәлештә аларның кислота үзлекләре көчәя. Нигез оксидларын¬
нан кислота оксидларына һәм тиешле гидроксидларга күчү пе¬
риодларда амфотер оксид һәм амфотер гидроксид аша була.
Мондый нәтиҗә химик элементлар периодик системасының 2 нче
һәм 3 нче периодлары өчен генә дөрес. Зур периодларның эле¬
ментлары өчен закончалыклар шактый катлаулырак. Алар ту¬
рында сез соңрак белерсез.
7 нче таблицада 2 нче һәм 3 нче периодлардагы элемент¬
лар оксидларының һәм гидроксидларының формулалары бирел¬
гән. Анда кушылмаларның кислота-нигез үзлекләре күрсәтелгән.
? 1. 2 нче период элементларының югары оксидлашу дәрәҗәләрендәге ок¬
сидларының кислота-нигез үзлекләрен характерлагыз. Җавапны дәлилләү
▲ өчен оксидларның су белән реакцияләренең тигезләмәләрен языгыз. Шуның
белән бергә бериллий оксидының (алюминий оксиды шикелле үк) суда
эремәвен исәпкә алыгыз.
2. Амфотер гидроксидларны алмашу реакциясе ярдәмендә тапканда, ни
өчен кирәгеннән артык селте эремәсе салырга ярамый?
3. Кальций оксидының Si(IV), P (V), S (VI), Cl (VII) гидроксидлары
белән реакцияләренең тигезләмәләрен төзегез.
4. Азот һәм фосфор периодик системаның бер үк төркемендә урнашканнар.
Әмма нитрат һәм фосфат кислоталарының структуралары төрле. Нитрат
кислотасы калдыгында азот атомы тирәсендә бары тик өч кислород атомы
гына, ә фосфат кислотасы калдыгында фосфор атомы тирәсендә дүрт кис¬
лород атомы урнашкан (30 нчы рәсем, а, б). Бу фактка сез нинди аң¬
латма бирә аласыз?
5. Теллурат кислотасы калдыгында
теллур атомын алты кислород ато¬
мы чолгап алган (39 нчы рәсем).
Теллурның оксидлашу дәрәҗәсе
+ 6 га тигез икәнен күздә тотып,
теллурат кислотасының формула¬
сын языгыз. Ни өчен кислота кал¬
дыгының һәм теллурат кислотасы¬
ның структуралары сульфат-ион
һәм сульфат кислотасы структура¬
ларыннан аерылып торалар?
39 нчы рәсем. ЭО? тибындагы ион¬
нарда атомнарның координациясе.
109
7 нче таблица. Элементларның периодик системада
урнашулары һәм аларнын югары оксидларының
һәм гидроксидларының үзлекләре
2 нче период
Төркем
I
II
III
IV
V
VI
VII
VIII
Химик
элемент
Атомның
тышкы
катлавын¬
дагы элек¬
троннары
Югары
оксидлашу
дәрәҗәсе
Нигез
оксиды
Амфотер
оксид
Кислота
оксиды
Гидроксид
— нигез
— амфотер
— кислота
Li
2s'
4-1
Li2O
LiOH
Be
2s2
4-2
BeO
Be(OH)2
В
2s22p‘
+ 3
B2O3
H2BO3
C
2s22p2
4-4
CO2
H2CO3
N
2s22p3
4-5
N2O5
HNO3
O
2s22p4
4-2
F
2s22p5
Ne
2s22p6
3 нче период
Төркем
I
II
III
IV
V
IV
VII
VIII
Химик
элемент
Na
Mg
Al
Si
P
S
Cl
Ar
Атомның
тышкы
катлавын¬
дагы элек¬
троннары
3s'
3s2
3s23p'
3s23p2
3s23p3
3s23p4
3s23p5
3s23p6
Югары
оксидлашу
дәрәҗәсе
4-1
4-2
4-3
4-4
+ 5
4-6
4-7
Нигез
оксиды
Амфотер
оксид
Кислота
оксиды
Гидроксид
— нигез
— амфотер
— кислота
Na2O
NaOH
MgO
Mg(OH)2
Al2O3
Al(OH)3
SiO2
H4SiO4
P2O5
H3PO4
SO3
H2SO4
Cl2O7
HCIO4
ХИМИК БӘЙЛӘНЕШ.
МАТДӘ ТӨЗЕЛЕШЕ
§ 36. АТОМНАРНЫҢ ҮЗАРА ТӘЭСИР ИТЕШҮЕ.
ХИМИК БӘЙЛӘНЕШ
1. Физика дәреслегеннән «Электр кыры» дигән параграфны кабатлагыз.
2. Атомда электронның төш тирәсендә булу ихтималлыгы һәм электрон болы¬
тының тыгызлыгы турындагы күзаллаулар үзара ничек бәйләнгәннәр? 3. а) Во¬
дород; б) кислород; в) су молекулаларының формулаларын языгыз.
Гадәттәге шартларда күпчелек химик элементларның атомна¬
ры, химик кушылмалар хасил итеп, үзара бәйләнешкә керәләр.
Ни өчен атомнар бер-берсе белән үзара тәэсир итешәләр? Атом¬
нар арасында химик бәйләнеш ничек барлыкка килә? Кушыл¬
маның составы нәрсәгә бәйле? Ни өчен химик кушылма молеку¬
лаларының составы һәрчакта да бер үк төрле? Мәсәлән, водо¬
род молекуларының составы һәрвакыт H2, кислородныкы — O2,
суныкы — Н2О.
Химик бәйләнешнең табигатен атомнардан водород молеку¬
ласы хасил булу мисалында тикшерик:
H-I-H = H2
Водородның ике атомы бер-берсеннән бик зур ераклыкта г
торалар һәм үзара тәэсир итешмиләр дип уйлыйк. Атомнар якын¬
лашканда, системаның потенциаль энергиясе ничек үзгәрер?
Якынлашканда, бер атомның төше белән икенчесенең электроны
арасында тартылу көчләре һәм шулай ук ике атомның төшләре
һәм электроннары арасында этелү көчләре тәэсир итә башлый¬
лар. Исәпләүләр билгеле бер ераклыктан башлап тартылу көч¬
ләренең этелү көчләреннән өстенлек алуларын күрсәтә. Ә атом¬
нар тагын да якынлашканда, киресенчә, этелү көчләре тартылу
көчләреннән өстенлек итә. Шуңа күрә, 40 нчы рәсемнән кү¬
ренгәнчә, системаның потенциаль энергиясе E водород атомнары
якынлашканда элек кими, ә аннары арта. Шулай итеп, E — f(r)
бәйлелеге минимумы булган кәкре белән күрсәтелә (40 нчы
рәсем). Әгәр төшләр арасындагы ераклык го икән, системаның
энергиясе минималь (Eo) була.
Тартылу көчләре этелү көчләренә тигезләшкәндә система иң
аз (минималь) энергиягә ия була. Бу системаның иң тотрыклы
халәтенә, ягъни молекула хасил булуга туры килә. Атомнардан
молекула барлыкка килгәндә гомуми закончалык күзәтелә: әгәр
системаның энергиясе минималь икән, аның халәте бигрәк тә
тотрыклы була.
IH
40 нчы рәсем. Потенциаль энергиянең
атомнар үзара төрле ераклыкта тәэсир
итешүгә бәйле рәвештә үзгәрүе.
Потенциаль энергия кәкре¬
сендә минимумның «тирәнлеге»
Нг молекуласы барлыкка кил¬
гәндә аерылып чыга торган
энергия микъдарын E0 харак¬
терлый.
Исәпләүләр күрсәткәнчә, Н2
молекуласында электроннар
вакытның күбрәк өлешендә
төшләр арасында булалар һәм
нәкъ шуның белән атомнар
арасындагы химик бәйләнешне
тәэмин итәләр.
Н2 молекуласында химик
бәйләнеш барлыкка килүне во¬
дород атомнарының электрон
болытлары аралашу схемасы
рәвешендә күрсәтергә мөмкин:
Аралашу нәтиҗәсендә бәйләүче ике электронлы болыт барлыкка
килә. Ул молекуладагы төшләр арасында электроннар тыгызлы¬
гының югарырак булуы белән характерлана, ягъни химик бәйлә¬
неш барлыкка килә.
Элемент атомының химик бәйләнешләр барлыкка китерә алу-
чанлыгы валентлык дип атала. Ә химик бәйләнеш хасил булуда
катнашучы электроннар валентлык электроннары дип аталалар.
Н2 молекуласында химик бәйләнеш ике атомның бер электронлы
болытлары аралашу исәбенә барлыкка килгән.
Атомнар арасында ике электрон ярдәмендә урнашкан химик
бәйләнеш ковалент бәйләнеш дип атала. (Валентлык (латинча
Valentia) «көч» сүзен аңлата. Ko— алкушымчасы «бергәләп кат-
нашу»ны аңлата.)
1. Ни өчен атомнар молекулаларга берләшәләр? Атомнардан водород мо-
A лекуласы хасил булу мисалында аңлатып бирегез.
2. а) Ике атомның s-электрон болытлары; б) бер атомның s-электрон бо¬
лыты һәм икенче атомның р-электрон болыты (х, у, z күчәрләренең теләсә
кайсысы буйлап) аралашу схемаларын төзегез.
3. Кислород атомының электроннар конфигурациясен һәм атомның тышкы
катлавындагы орбитальләрдә электроннар бүленешен языгыз. Водород атом¬
нары белән ковалент бәйләнешләр хасил итүдә кислород атомының ничә
электроны катнаша ала?
112
«ХИМИК БӘЙЛӘНЕШ ҺӘМ МОЛЕКУЛАЛАРНЫҢ ТӨЗЕЛЕШЕ»
ТЕМАСЫНА КАРАТА КҮНЕГҮЛӘР
Молекулаларның төзелешен төрле ысуллар ярдәмендә күрсә¬
тәләр. Атомнарның бер-берсенә карата ничек урнашуларын күр¬
сәтү өчен-шарлы-таякчыклы модельдән файдаланалар. Түбәндә
су молекуласы шарлы-таякчыклы модель рәвешендә күрсәтелгән:
Химиклар молекулаларны күбрәк структур формула рәвешен¬
дә күрсәтәләр, мәсәлән:
Биредә һәр символ атомның «каркасын» — аның төшен һәм
бәйләнешләр хасил итүдә катнашмаган электроннарны аңлата.
Сызыклар ковалент бәйләнешләрнең билгесе булып торалар.
Бу дәрестә без кайбер иң гади молекулаларда химик бәй¬
ләнешләр ясалуны һәм аларның структураларын ничек аңлатыр¬
га мөмкин икәнлеген тикшерербез.
1 нче мисал. Фторның молекуласы ике атомнан тора — F2.
Бу фактны ничек аңлатырга мөмкин?
Фтор — 2 нче периодның VII төркем p-элементы. Аның ато¬
мында 7 валентлык электроны бар. Тышкы катлавында 7 элек¬
трон.
Fh
-H- -H- +
15
Атомда бер парлашмаган электрон бар. Шуңа күрә бер атом¬
ның 2р-бер электронлы болыты һәм икенче атомның 2р-бер элек¬
тронлы болыты аралашуы исәбенә химик бәйләнеш хасил булуы
мөмкин:
8 п-236 1 13
Фтор молекуласының Fa структур формуласы:
F-F
1 нче бирем. Ни өчен хлор молекуласы ике атомнан тора?
Анда ковалент бәйләнеш нинди электроннар исәбенә хасил була?
2 нче мисал. Водород фториды HF молекуласы барлыкка
килүне ничек аңлатырга була?
HF молекуласы водород атомыннан һәм фтор атомыннан
барлыкка килгән. Водород атомында бер, ә фтор атомында җиде
валентлык электроннары бар:
E H Ij'
Химик бәйләнеш водород атомының 1 s-бер электронлы бо¬
лыты һәм фтор атомының 2р-бер электронлы болыты аралашуы
исәбенә барлыкка килә:
Шуңа күрә водород фториды молекуласының составы HF
формуласы белән күрсәтелә. Анда бер ковалент бәйләнеш бар:
H-F
2 нче бирем. Водород хлориды молекуласының составы нин¬
ди? Химик бәйләнеш хасил булуны аңлата торган схема төзегез.
Водород хлориды молекуласының структур формуласын языгыз.
3 нче мисал. Cy молекуласының составын һәм почмаклы тө¬
зелешен ничек аңлатырга була? Кислород һәм водород атомна¬
рының тышкы катлаулары өчен электроннар конфигурацияләрен
язабыз. Кислород — 2 нче периодның VI төркем р-элементы,
аның 6 валентлык электроны бар (2s22p4); водород атомының
1 валентлык электроны бар:
2j
114
Димәк, кислород атомы, кислород атомының 2р-бер элек¬
тронлы болытлары һәм ике водород атомының 1 s-бер электрон¬
лы болытлары аралашу исәбенә барлыкка килүче, ике ковалент
бәйләнеш хасил итә.
Шунлыктан су молекуласының составы Н2О. Химик бәйлә¬
нештә кислород атомының O ике р-электроны катнашканга күрә,
су молекуласы Н2О почмаклы формада була:
H-O
H
3 нче бирем. Күкерт һәм водород атомнарының төзелешен¬
нән чыгып, водород сульфиды молекуласының төзелешен һәм
составын аңлатып бирегез.
4 нче бирем. Сез диңгез, елга, яңгыр суларының, водород,
янучан газ (CIh) янганда барлыкка килгән суның молекулала¬
рына НгО составы хас икәнен беләсез. Аңлатып бирегез әле,
ни өчен бу матдәнең молекулалары, табылу ысулына карамастан,
бер үк элементар составка һәм бер үк төзелешкә ия булып
торалар?
5 нче бирем. Пластилиннан: а) фтор; б) хлор; в) водород
фториды; г) водород хлориды; д) су; е) водород сульфиды
молекулаларының шарлы-таякчыклы модельләрен ясагыз. Кис¬
лород һәм күкерт атомнарының, фтор һәм хлор атомнарының
зурлыклары төрле булуын исәпкә алыгыз (37 нче рәсем). Барлык
атомнар арасында иң кечкенәсе — водород атомы.
§ 37. ПОЛЯР ҺӘМ ПОЛЯР БУЛМАГАН БӘЙЛӘНЕШЛӘР.
ЭЛЕКТРОТИСКӘРЕЛЕК
Бериш элементларның атомнарында электроннар төшкә көч¬
лерәк, ә икенчеләрендә көчсезрәк тартылалар. Бу — кушылмада
бәйләүче электроннар болыты тыгызлыгының бүленешенә йогын¬
ты ясый. Әйтик, водород хлориды HCl молекуласында бәйләүче
электроннар болыты хлор атомына водород атомына караганда
көчлерәк тартыла. Шул сәбәпле хлор атомында тискәре корылма
«+«—
туплана, ә водород атомы уңай корылмага ия була HCl. Атом¬
нардагы корылмаларны 6 хәрефе белән («дельта» дип укыла)
тиешле тамганы куеп билгелиләр: 6-|- яки 6 — .
8'
115
Бәйләүче электроннар болыты атомнарның берсе ягына
авышканда, химик бәйләнешне поляр ковалент бәйләнеш дип
атыйлар. Ул төрле химик элементлардан хасил булган барлык
кушылмаларга да хас.
Атомның бәйләүче электроннар болытын үзенә тарту үзлеге
электротискәрелек (ЭТ) дип атала. Электротискәрелекләре буен¬
ча элементларны түбәндәгечә бер рәткә тезәргә мөмкин:
F>O>N>Cl>Br>S>P>C>H>Si>Al>Mg>Ca>
>Na>K>Cs
Бәйләүче электроннар болытын үзенә тарту үзлеге фторда
аеруча көчле, ә цезийда барыннан да азрак чагыла. Бер эле¬
ментның электротискәрелеге зуррак һәм икенчесенеке кечерәк
булган саен, химик бәйләнеш ныграк була. Әйтик, фторның
электротискәрелеге хлорныкыннан зуррак. Димәк, водород фто¬
ридындагы HF бәйләнеш водород хлоридындагы HCl бәйләнешкә
караганда күбрәк полярлашкан.
Кушылмадагы атомның корылма тамгасы (6-|- яки 6 —),
кагыйдә буларак, бу элементның оксидлашу дәрәҗәсенең тамга¬
сына туры килә. Мәсәлән, водород фторидында HF водород
б 4"
атомындагы корылма уңай (H), ә фтор атомындагысы — тискә¬
ре (F). HF да водородның оксидлашу дәрәҗәсе дә шулай
-ы -I
ук уңай (H)1 ә фторның оксидлашу дәрәҗәсе тискәре (F).
Гади матдәләрдә үзара бәйләнгән бер төрле атомнар ара¬
сында бәйләүче электроннар болытының тыгызлыгы симметрияле
рәвештә бүленә. Мондый химик бәйләнеш поляр булмаган кова¬
лент бәйләнеш дип атала.
Поляр булмаган ковалент бәйләнеш һәм ионлы бәйләнеш —
электроннар тыгызлыгы бүленешенең икесе ике чик очрагы. По¬
ляр булмаган бәйләнешкә бәйләүче ике электронлы болытның
бертөрле атомнар арасында тигез бүленеше туры килә. Киресен¬
чә, ионлы бәйләнеш очрагында бәйләүче электроннар болыты
практик яктан тулысынча бер генә атомныкы булып авыша. Күп¬
челек кушылмалардагы химик бәйләнешләр исә, бу бәйләнеш
төрләренең урталыгына якын торалар, ягъни аларда поляр кова¬
лент бәйләнеш хасил була. Үзенең характеры белән кайсы чик
очрагына якынрак булуына карап, бәйләнешне ионлы яки поляр
булмаган ковалент бәйләнеш итеп саныйлар.
? 1. Күрсәтелгән химик кушылмаларның кайсыларында поляр булмаган ко¬
валент бәйләнеш, ә кайсыларында поляр ковалент бәйләнеш: H2, CO2, SiOj,
NH3, O2, SO3, SO2, KCl, F2, AlF3, Al2O3, Р2О5, N2, HCl? Поляр бәйләнешле
A кушылмаларда атомнарның корылмаларын (6+ яки 6 — ) һәм элементлар¬
ның оксидлашу дәрәҗәләрен билгеләгез. Кушылмаларның исемнәрен атагыз.
2. a) Су; б) водород сульфиды молекулаларының структур формулаларында
атомнарның корылмаларын (6-F яки 6 —) һәм элементларның оксидлашу
дәрәҗәләрен күрсәтегез.
116
§ 38. ЭЛЕМЕНТЛАРНЫҢ ПЕРИОДИК СИСТЕМАДА
УРНАШУЛАРЫ ҺӘМ АЛАРНЫҢ ГАДИ МАТДӘЛӘРЕНЕҢ
СТРУКТУРАСЫ
1. а) Атомлы кристаллик челтәрдән; б) молекуляр кристаллик челтәрдән;
в) металлик кристаллар челтәреннән торган гади матдәләргә мисаллар китере¬
гез. 2. а) Молекуляр челтәрле; б) атом челтәрле кристалларда кисәкчекләр
нинди бәйләнешләр исәбенә тотылып торалар? 3. Молекулада химик бәйләнеш
ничек барлыкка килә?
Сез периодта I төркемнең s-элементыннан VIII төркемнең
р-элементына күчкәндә элементларның атомнарында электроннар
конфигурацияләре закончалыклы үзгәрүенә ышандыгыз инде.
Күрсәтеп үтелгән закончалык элементлар хасил иткән гади мат¬
дәләрнең структураларында һәм физик үзлекләрендә чагыламы
соң?
Сезгә каты хәлдә неметалларның молекуляр һәм атомлы
кристаллик челтәрләрдән, ә металларның металлик челтәрдән
торуы билгеле.
8 нче таблицадан күренгәнчә, 2 нче һәм аннан соңгы пери¬
одларның башында гади матдәләре металлик челтәрдән торучы
химик элементлар урнашкан. Аннары гади матдәләре атомлы
челтәрдән торучы элементлар килә һәм периодларны гади мат¬
дәләре молекуляр челтәрләрдән торучы элементлар тәмамлый.
Гади матдәләрнең кристаллик челтәрләренең һәр төрен карап
үтик.
8 нче таблица. Элементларның Д. И. Менделеев периодик системасында
урнашулары һәм аларның гади матдәләренең кристаллик челтәрләренең төрләре'
Период
Төркем
I
II
III
IV
V
VI
VII
VIII
1
2
Li
Be
B
C
N2
O2
H2
F2
He
Ne
3
Na
Mg
Al
Si
P4
S8
Cl2
Ar
4
K
Ca
Ga
Ge
As
Se
Br2
Kr
5
Rb
Sr
In
Sn
Sb
Te
I2
Xe
Кристаллик
челтәрләр¬
нең төрләре
Металлик
Атомлы
Молекуляр
' Калган элементларның (радоннан тыш) гади матдәләренә металлик чел¬
тәр хас.
Молекуляр кристаллик челтәрнең төеннәрендә молекула¬
лар урнашалар (5 нче, 41 нче рәсемнәрне карагыз). Молеку-
117
41 нче рәсем. Йодның кристаллар чел¬
тәре.
лалар арасында молекулаара
көчләр тәэсир итешәләр. Моле¬
кулада атомнар арасында ко-
валент бәйләнешне барлыкка
китергән электроннар кри¬
сталлда күчеп йөрмиләр. Шуңа
күрә молекуляр кристаллик
челтәрле матдәләр электр то¬
гын үткәрмиләр. Алар диэлек-
трикларга керәләр.
Атомлы кристаллик чел¬
тәрнең төеннәрендә ковалент
бәйләнешләр ярдәмендә бәй¬
ләнгән атомнар урнашалар.
Атомлы кристаллик челтәрле
типик матдәләрнең берсе — алмаз, ул углерод химик элементы
хасил иткән гади матдә. Углерод атомнарының дүрт валентлык
электроны һәм дүрт валентлык орбитале бар:
C 2$гIp2
Шуңа күрә углеродның һәр атомы дүрт ковалент бәйләнеш
хасил итә ала. Алмаз кристалында (7 нче рәсемне карагыз)
һәр атом дүрт күрше атом белән тоташкан. Барысы бергә «ги¬
гант молекула» — кристалл хасил итеп, бер-берсе белән шулай
теләсә күпме сандагы атомнар
берләшә ала. Күрше атомнар
арасындагы ковалент бәйлә¬
нешләр бик нык. Шунлыктан
гадәттәге шартларда алмаз
кристаллында электроннар кү¬
чеп йөрмиләр. Аның электр үт-
кәрүчәнлеге бик аз. Ул диэлек¬
трик булып тора.
Күпчелек химик элементлар
(75% чамасы) барлыкка ки¬
тергән гади матдәләр метал¬
лардай гыйбарәт. Аларга гому¬
ми физик үзлекләр хас. Бу ме-
талларда, металлик, бәйләнеш
42 нче рәсем. Натрийның кристаллик аталган, бертөрле ХИМИК
челтәре. бәйләнеш булуны күрсәтә.
118
Металлардагы химик бәйләнешнең табигате турында аларның
характерлы үзлекләренә карап фикер йөртергә мөмкин. Метал¬
ларга югары электр үткәрүчәнлек хас. Ә бу, электроннар металл
кисәгенең бөтен күләме буенча күчеп йөри алалар дигән сүз.
Гадәттәге шартларда металлар кристаллик матдәләр булып то¬
ралар (терекөмештән тыш). 42 нче рәсемдә натрийның крис¬
таллик челтәрендә атомнарның үзара ничек урнашулары күрсә¬
телгән. Рәсемнән күренгәнчә, натрийның һәр атомы күрше сигез
атом белән чолгап алынган. Сигез ковалент бәйләнеш барлыкка
килсен өчен атом сигез электрон «биреп торырга» тиеш булыр
иде. Ә бу мөмкин түгел, чөнки натрий атомында бер генә ва-
лентлык электроны (3s1) бар:
3/7
EiNa 3s*
Металларның химик бәйләнешенең табигатен һәм характерлы
үзлекләрен натрий мисалында түбәндәгечә аңлатып була. Крис¬
таллда күрше атомнарның валентлык орбитальләре (3s, Зр)
аралашалар, һәр атом бәйләнешкә дүрт валентлык орбитален
һәм бары тик бер генә валентлык электронын «биреп тора».
Димәк, кристаллда электроннар саны орбитальләр саныннан
шактый азрак. Шуңа күрә электроннар бер орбитальдән икенче
орбитальгә күчә алалар. Шулай итеп, электроннар металл крис-
талындагы барлык атомнар арасында бәйләнеш ясалуда катна¬
шалар.
Әйтелгәннәрдән түбәндәге нәтиҗәне ясарга мөмкин. Металл
гади матдәләрен, тышкы катлауларында валентлык электрон¬
нары саны, тышкы орбитальләрнең гомуми саны белән чагыш¬
тырганда, кагыйдә буларак, күп булмаган (1—3 электрон) эле¬
ментлар хасил итә. Моннан тыш, металл атомнары ионлашу
энергияләренең кыйммәтләре зур булмау белән характерланалар.
Валентлык электроннары атомда нык тотылып тормыйлар, шун¬
лыктан бөтен кристалл буйлап күчеп йөри алалар.
• 1. а) Күкерт молекуласында атомнар; б) кристаллда күкерт молекулалары
нинди бәйләнешләр исәбенә тотылып таралар?
A 2. Ни өчен кремний яки германий пластинка көчле итеп бәргәндә, кисәк¬
ләргә ватылып чәчелә, ә аккургаш яки кургаш пластинка бары тик дефор¬
мацияләнә генә? Кайсы очракта һәм ни өчен химик бәйләнешнең җиме¬
релүен аңлатып бирегез.
3. Углерод һәм кургаш атомнарындагы тышкы катлауларның электроннар
конфигурацияләрен чагыштырыгыз. Ни өчен углерод атомының ионлашу
энергиясе (1090 кДж/моль) кургаш атомының ионлашу энергиясеннән
(726 кДж/моль) артыграк? Ни өчен алмаз гади матдәсе—неметалл, ә
кургаш гади матдәсе — металл?
119
§ 39. ГАДИ МАТДӘЛӘРНЕҢ ОКСИДЛАШУ-КАЙТАРЫЛУ
ҮЗЛЕКЛӘРЕ
1. 6 нчы параграфны («Гади матдәләр») кабатлагыз. 2. а) Металларны ха¬
сил итүче; б) неметалларны хасил итүче элементлар периодик системада ничек
урнашканнар? 3. Гади матдәләрдән: а) бакыр (II) оксиды; б) алюминий хло¬
риды; в) күкерт (IV) оксиды; г) углерод (IV) оксиды хасил булу реакциялә¬
ренең тигезләмәләрен төзегез.
Типик металл натрий һәм типик неметалл хлор арасындагы
реакцияне үткәрик (43 нче рәсем). Хлорда җылытканда натрий
янып китә. Ул янганда ионлы кушылма — натрий хлориды тозы¬
ның кристалларыннан торган ак төтен хасил була (25 нче рә¬
сем).
2Na04-ClB = 2Na + 1Cl-'
Реакция барышында элементларның оксидлашу дәрәҗәләре
үзгәрде. Гади матдәләрдә элементларның — натрийның һәм
хлорның — оксидлашу дәрәҗәләре 0 гә тигез. Реакция нәтиҗә¬
сендә натрийның оксидлашу дәрәҗәсе +1 гә, ә хлорныкы —1 гә
кадәр үзгәрде.
Составына оксидлашу дәрәҗәсен үстерә торган элемент кер¬
гән матдәне кайтаручы дип атыйлар. Составына оксидлашу дә¬
рәҗәсен киметә торган элемент кергән матдәне оксидлаштыру¬
чы дип атыйлар. Элементларның оксидлашу дәрәҗәләре кимү
һәм үсү бер үк вакытта һәм
бер-берсенә бәйле рәвештә бу¬
ла. Шуңа күрә элементларның
оксидлашу дәрәҗәләре үзгәрү
белән бара торган реакцияләр¬
не оксидлашу-кайтарылу реак¬
цияләре дип атыйлар.
Оксидлашу-кайтарылу ре¬
акцияләрендә кайтаручы ок¬
сидлаша, оксидлаштыручы
кайтарыла. Без күзәткән тәҗ¬
рибәдә натрий — кайтаручы,
үзе оксидлаша; хлор — оксид¬
лаштыручы, ул кайтарыла:
0 0 +1—1
Na + Cl2 =2NaCl
Кайтаручы Оксидлаштыручы
оксидлаша кайтарыла
Күргәнебезчә, металл белән
неметалл үзара тәэсир итеш¬
кәндә металл кайтаручы ролен,
ә неметалл оксидлаштыручы
43 нче рәсем. Натрийның хлорда януы. ролен уйный.
120
Белгәнебезчә, металлар белән неметаллар арасында кискен
чик юк. Шуңа күрә оксидлашу-кайтарылу реакцияләре не¬
металлар арасында да, металлар арасында да узарга мөмкин. Бу
очракта кайтаручы ролен электротискәрелеге кимрәк булган
элемент барлыкка китергән гади матдә уйный. Мәсәлән, кисло¬
родта күмер янганда күмер — кайтаручы, ә кислород оксидлаш¬
тыручы булып тора:
0 0 +4-2
C О2 = C Ог
Кайтаручы Оксидлаштыручы
оксидлаша кайтарыла
Гади матдәнең оксидлаштыручы яки кайтаручы була алуы
турында аны барлыкка китергән химик элементның периодик
системада кайда урнашуына карап фикер йөртергә мөмкин. Әй¬
тик, I төркемнең s-элементы, химик яктан шул период элемент¬
лары барлыкка китергән башка металлар белән чагыштырганда
бик актив (кайтаручы буларак) металл хасил итә. 2 нче период¬
та бу литий Li, 3 нче периодта — натрий Na, 4 нче периодта —
калий K һ. б. Киресенчә, VII төркемнең p-элементы, химик як¬
тан, шул период элементлары барлыкка китергән, башка неме¬
таллар белән чагыштырганда, бик актив (оксидлаштыручы була¬
рак) неметалл хасил итә: бу фтор F2, хлор Cl2, бром Вгг һ. б.
□
• 1. Гади матдәләрдән: а) кальций хлоридын; б) цинк сульфидын; в) цезий
иодидын; г) күкерт (IV) оксидын; д) алюминий сульфидын; е) фосфор
▲ (V) оксидын; ж) калий фторидын табу реакцияләренең тигезләмәләрен
төзегез. Нинди гади матдәләр: а) кайтаручы; б) оксидлаштыручы ролен
уйныйлар? Реакцияләрнең башлангыч матдәләрендә һәм продуктларында
элементларның оксидлашу дәрәҗәләре ничек үзгәрүен күрсәтегез.
2. Бакыр (II) гидроксидын табу реакциясенең тигезләмәсен языгыз. Алма¬
шу реакцияләре вакытында элементларның оксидлашу дәрәҗәләре үзгә¬
рәме?
ОКСИДЛАШУ-КАЙТАРЫЛУ РЕАКЦИЯЛӘРЕНЕҢ
ТИГЕЗЛӘМӘЛӘРЕН ТӨЗҮГӘ КҮНЕГҮЛӘР
Оксидлашу-кайтарылу реакцияләренең тигезләмәләрен төзү
элементларның оксидлашу дәрәҗәләрен куллануга нигезләнгән.
Реакция нәтиҗәсендә бер элементның оксидлашу дәрәҗәсе арта,
ә икенчесенеке кими.
Оксидлаштыручы составына оксидлашу дәрәҗәсе кими тор¬
ган элемент керә. Кайтаручы составына исә, оксидлашу дәрә¬
җәсе арта торган элемент керә.
Бер элементның оксидлашу дәрәҗәсе арту һәм икенче эле¬
ментның оксидлашу дәрәҗәсе кимү бер үк вакытта була.
Әйтик, алюминий белән күкерт үзара тәэсир итешкәндә
0 0+3-2
AI-KS-^Al2S3
алюминийның оксидлашу дәрәҗәсе 3 берәмлеккә үсә:
0 +3
А1->А1 (3—0 = 3),
121
ә күкертнең оксидлашу дәрәҗәсе 2 берәмлеккә кими:
0 -2
S~> S (-2-0 = — 2)
Реакциянең тигезләмәсендә коэффициентларны кую өчен ок¬
сидлашу дәрәҗәләре үсүне һәм кимүне күрсәткән саннарның
уртак кабатлысын табарга кирәк:
Табылган коэффициентларны реакция тигезләмәсенә күчереп
язабыз:
2А1Ң-SS=Al2S3
1 нче бирем. Алюминий белән хлор реакциясенең тигезләмә¬
сен төзегез.
2 нче бирем. Магнийның кислородта яну реакциясенең ти¬
гезләмәсен төзегез.
2 нче мисал. Сероводородның кислородта януын
— 2 0 -f-4—2 —2
H2S + O2-> SO2H-H2O
схемасы белән күрсәтергә мөмкин. Реакция тигезләмәсен төзергә.
Тикшерелә торган процесс күкертнең һәм кислородның ок¬
сидлашу дәрәҗәләре үзгәрү белән бара:
— 2 4-4 0 -2
S -* S O^O
Күкертнең оксидлашу дәрәҗәсе 6 берәмлеккә арта:
4-(-2) = 6,
ә кислородның оксидлашу дәрәҗәсе 2 берәмлеккә кими:
-2-0= -2.
Димәк:
-2 4-4
S + S 2
O —2
0^0 6
— 2 O 4-4 —2
2S + 6O = 2S + 6O
яки
— 2 O 4-4 —2
2S + 3O2 = 2S + 6O
122
—2
Оксидлашу-кайтарылу реакциясе узсын өчен 2 моль S атом¬
нарына 3 моль O2 молекулалары туры килергә тиеш:
2H2S + ЗО2 = 2SO2 + 2Н2О
-2
3 моль O2 молекулаларыннан 6 моль O атомнары хасил була:
-2
4 моль O атомнары 2 моль SO2 молекулаларына һәм 2 моль
— 2
O атомнары 2 моль H2O молекуларына керә.
3 нче бирем. Лабораториядә водородны цинк белән хлорид
кислотасы тәэсир итешкәндә табалар. Бу реакция барышында
шулай ук цинк хлориды да хасил була. Бу реакциянең тигезлә¬
мәсен төзегез.
3 нче мисал. Кислородны бертолет тозын җылытканда тар¬
катып табу реакциясенең тигезләмәсен төзергә.
Реакциянең схемасы буенча:
+ 5-2 -I O
KClO3-KCl+ O2
хлорның һәм кислородның оксидлашу дәрәҗәләре үзгәрә:
+ 5 -I
Cl-Cl
2
O I
Г
O =
6
+ 5 —2 —1 O
2СЦ-6О = 2С1 + 6О
ЯКИ +5 —2 —1 O
2СЦ-6О = 2С1 + ЗО2
Реакция
2КС1Оз = 2КС1 + ЗО2
тигезләмәсе белән күрсәтелә.
4 нче бирем. Гади матдәләрдән сөрмә (III) хлориды хасил
булу реакциясенең тигезләмәсен төзегез.
5 нче бирем. Күкерт фторда янганда күкертнең югары ок¬
сидлашу дәрәҗәсендәге фториды барлыкка килә. Реакция тигез¬
ләмәсен языгыз.
6 нчы бирем. Күкерт (IV) оксидын SO2 күкерт (VI) окси¬
дына SO3 оксидлаштыру реакциясенең тигезләмәсен төзегез.
7 нче бирем. Сероводородның тулы булмаган яну реакциясе¬
нең тигезләмәсен төзегез:
H2S +O2-S+ H2O
8 нче бирем. 24,5 г бертолет тозы куертылган хлорид кисло¬
тасы белән тәэсир итешкәндә ничә моль хлор аерылып чыгар?
KClO3 +HCl-Cl2+ KCl+ H2O
ВОДОРОД
Сез химия фәненең кайбер мөһим теоретик положениеләре
белән таныштыгыз. Алардан химик элементларның һәм аларның
кушылмаларының үзлекләрен фараз итү һәм өйрәнү өчен файда¬
ланыйк* 1. Элементлар химиясен системалы рәвештә өйрәнүне во¬
дородны — химик элементларның Д. И. Менделеев периодик сис¬
темасындагы атом төзелеше иң гади булган элементны өйрәнү¬
дән башлыйк.
§ 40. ВОДОРОД.
ВОДОРОДНЫҢ ФИЗИК ҮЗЛЕКЛӘРЕ
Химик элементны өйрәнү өчен белешмәлектән файдаланып, водород атомы¬
ның төзелешен, ул барлыкка китергән гади матдәнең төзелешен һәм физик
үзлекләрен аңлатып бирергә тырышып карагыз.
Водородның атом номеры 1 гә тигез.
Аның атомының электрон конфигурациясе Is1.
Водород барлык башка элементлардан (гелийдан тыш) үзе¬
нең атомындагы валентлык электронының төштән иң кечкенә
' Химик элементны өйрәнү өчен белешмәлек
Сез химияне өйрәнү өчен төп инструмент булган периодик законнан фай¬
далана беләсез һәм периодик система структурасының закончалыклары белән
дә таныштыгыз. Шуңа күрә элементларны, аларның химик кушылмаларын өй¬
рәнгәндә сез күп нәрсәләрне китаптан укымыйча да сөйләп һәм алдан әйтеп
бирә алырсыз.
Элементны өйрәнгәндә һәрвакыт түбәндәгеләрне аңлатып бирергә тырышы¬
гыз:
1. Элементның периодик системада урнашуына карап, аның атом төзеле¬
шен (төш корылмасын, электроннар конфигурациясен), мөмкин булган оксид¬
лашу дәрәҗәләрен тасвирлагыз.
2. Атом структурасы буенча нәтиҗәләр ясагыз?
а) Гадәттәге шартларда элемент гади матдә молекуласы хасил итәме?
б) Каты хәлдә гади матдәнең кристаллик челтәре нинди (атомлы, металлик,
молекуляр)?
в) Бу гади матдәнең нинди физик үзлекләрен алдан әйтеп бирергә мөмкин
(металлик ялтыравык, электр үткәрүчәнлек, җылы үткәрүчәнлек, пластиклык
яки уалучанлык, җиңел яки авыр эретелүчәнлек)?
3. Элементның мөмкин булган оксидлашу дәрәҗәләреннән чыгып, билгелә¬
гез: гади матдә оксидлаштыручы булырмы яисә кайтаручымы?
4. Элементның периодик системада урнашуына карап һәм аның мөмкин
булган оксидлашу дәрәҗәләре буенча:
а) югары оксидының һәм гидроксидының формуласын;
б) оксидының һәм гидроксидының кислота-нигез үзлекләрен билгеләгез.
124
ераклыкта булуы белән (Is1) аерылып тора. H+ ионында элек¬
троннар юк һәм ул төш кисәкчәсе — протоннан гыйбарәт. Бо-
ларның барысы да водородның барлык башка элементлар белән
чагыштырганда үзенчәлекле булган үзлекләрен билгели.
Водород үзлекләре белән берникадәр I төркемнең s-элемент-
лары белән дә, VII төркемнең р-элементлары белән дә уртаклык
күрсәтә. Гадәттә водородны периодик системаның I яки VII
төркеменә урнаштыралар. Шуның белән бергә водород — үзен¬
чәлекле элемент аны таблицаның теге яки бу төркеменә урнаш¬
тыру шактый ук шартлы булып кала.
Атом төзелеше иң гади буларак, водород галәмдә аеруча
таралган элемент. Ул Кояш һәм күпчелек йолдызлар массасының
яртысы чамасын тәшкил итә. Водородның Җирдәге масса өлеше
0,15% тәшкил итә. Водород су, ташкүмер һәм соры күмер,
нефть, шулай ук үсемлек һәм хайван организмнары составына
керә.
Ирекле водородны беренче булып 1799 елда инглиз галиме Г. Кавендиш
тапкан һәм ул аны «янучан һава» дип атаган. А. Лавуазье суның составы кат¬
лаулы икәнлеген тулысынча ачыклаган, ә 1787 елда водородны химик элемент¬
ларга керткән һәм аңа «су тудыручы» мәгънәсен аңлатучы хәзерге Hydfogenium
исемен биргән.
Ирекле хәлдә водород ике атомнан торган молекула рәве¬
шендә була. Сезгә билгеле булганча, бу молекула атомнарның
s-электрон болытлары аралашу исәбенә хасил була.
Атомнардан H2 молекуласы ясалганда бик күп микъдарда
энергия (436 кДж/моль) аерылып чыга. H2 молекулаларын атом¬
нарга таркату өчен нәкъ шундый ук микъдарда энергия сарыф
итәргә кирәк. Димәк, Нг молекуласындагы химик бәйләнеш бик
нык. Нг молекулаларының атомнарга таркалуы сизелерлек дә¬
рәҗәдә 2000° C тан да югарырак температурада бара.
Водород атомнарының молекулалар хасил итеп тәэсир ите¬
шүенә, авыр эретелүчән металларны һәм эретмәләрне кисү һәм
эретеп ябыштыру өчен кулланыла торган, атом-водород горелка-
ларының эшләве нигезләнгән. Атом-водород горелкасы түбәндә¬
ге принцип нигезендә эшли. Молекуляр водород агынтысы электр
дугасы аркылы җибәрелә. Бу вакытта Нг молекулалары атом¬
нарга таркалалар. Аннары эретеп ябыштырыла торган металлар
өслегендә атомнар яңадан бергә кушылалар. Бу процесста ае¬
рылып чыга торган энергия металлар тарафыннан йотыла, һәм
алар бик югары температурага кадәр (3500° C тан да югары¬
рак) кызалар. Шулай итеп, металлар эретеп ябыштырылалар.
Водород молекуласының массасы бик кечкенә (водородның
чагыштырма молекуляр массасы Mr(H2) = 2) һәм ул бик тә хә¬
рәкәтчән. Аның эретелү температурасы ( —259,1° С) һәм кайнау
температурасы (— 252,6° С) бик түбән булу шуның белән аң¬
латыла. Гадәттәге шартларда водород — газ. Ул һавадан 14,5
тапкырга җиңелрәк. Водородның исе һәм тәме юк.
125
44 нче рәсем. Водород һавадан җиңел¬
рәк.
чәйлегенең кайсы өлкәләрендә
Водород һавадан җиңелрәк
булганлыктан, аны савытка ба¬
ры тик савытның төбен өскә
әйләндереп кенә җыеп була.
Үлчәүдә асты өскә әйләндереп
эленгән колбаны тигезлик (44
нче рәсем). Аның эчендәге һа¬
ваны водород белән этеп чыга¬
рыйк. Тигезлек югала. Водо¬
родлы колба эленгән тәлинкә
өскә күтәрелә. Димәк, водород
һавага караганда җиңелрәк.
Водород тутырылган сабын
куыклары өскә күтәреләләр
һәм түшәмгә җитәләр. (Уйлап
карагыз әле, водородның һава¬
га караганда бик күпкә җиңел
булу үзлеген кеше практик эш-
кулланырга мөмкин?)
Атмосфераның түбәндәге катлауларында водород ирекле хәл¬
дә практик яктан очрамый (~ 10~4%), ләкин 100 км биеклектә
атмосфера башлыча водородтан тора (сез ничек уйлыйсыз, ни
өчен атмосфераның түбәнге һәм югарыгы катлауларында водо¬
родның микъдары шулкадәр аерылып тора?) Кайчакта ирекле
хәлдәге водород башка газлар белән бергә вулканнар атылганда
һәм нефть тапканда бораулау скважиналарыннан чыга.
р 1. Водородның өч изотобы бар: 1H (протий), 2H (дейтерий, D), 3H (три¬
тий, Т). Бу изотопларның массалары үзара нинди бәйләнештә булырлар?
Водород изотоплары төшләренең составлары нинди?
2. Төрле изотоплардан хасил булган водород молекулаларының формулала¬
рын языгыз. Бу молекулаларның чагыштырма молекуляр массалары нин¬
ди?
3. Каты хәлдә водородның кристаллик челтәре нинди — атомлы челтәрме;
молекуляр челтәрме яки металлик челтәрме? Ни өчен гадәттәге шартларда
водород газсыман хәлдә була?
«ГАЗЛАРНЫҢ ЧАГЫШТЫРМА ТЫГЫЗЛЫГЫ»
ТЕМАСЫНА КАРАТА КҮНЕГҮЛӘР
Газның үзлекләрен өйрәнгәндә аның башка газларга яки газ¬
лар катнашмасына караганда җиңелрәкме яисә авырракмы икән¬
леген белү мөһим. Моны белү, газны кешенең практик эшчәнлеген-
дә куллану мөмкинлекләрен билгеләү өчен, аның атмосфераның
кайсы катлауларында туплануын аңлау өчен кирәк. Моны
белү газ җыела торган савытны ничек — төбе белән өскә әйлән¬
дерепме яки авызы белән өскә каратыпмы — урнаштырырга кирәк¬
леген хәл итү өчен дә кирәк.
126
Газның башка газ белән чагыштырганда җиңелрәкме яки
авырракмы икәнен белү өчен газның чагыштырма тыгызлыгы
кыйммәтен кулланалар.
Газның чагыштырма тыгызлыгы аның чагыштырма молекуляр
массасының чагыштыру өчен алынган газның чагыштырма моле¬
куляр массасына чагыштырмасыннан гыйбарәт:
Mr(A) _
Mr(B) '
монда Mr(A) һәм Mr(B) — A һәм B газларының чагыштырма мо¬
лекуляр массалары, ә D — A газының B газына карата чагыштыр¬
ма тыгызлыгы. Моннан
Mr(A) = DMr(B)
1 нче мисал. Кислородның водородка карата тыгызлыгын
исәпләргә.
Кислородның чагыштырма молекуляр массасы 32 гә, ә водо¬
родныкы — 2 гә тигез. Кислородның Ch водород Hs буенча ты¬
гызлыгы 32:2=16 була. Кислород водородка караганда 16 тап¬
кырга авыррак.
1 нче бирем. Углерод (IV) оксидының водородка карата ты¬
гызлыгын исәпләгез. Углекислый газ водородтан ничә тапкыр¬
га авыррак?
2 нче мисал. Водород буенча тыгызлыгы 32 гә тигез булса,
күкерт (IV) оксидының чагыштырма молекуляр массасын исәп¬
ләп чыгарырга.
Күкерт (IV) оксидының чагыштырма молекуляр массасы водо¬
родның чагыштырма молекуляр массасыннан (Mr(Hs) = 2) 32 тап¬
кырга зуррак булырга тиеш, ягъни ул 2-32 = 64 кә тигез.
2 нче бирем. Әгәр водород буенча тыгызлыгы 8 гә тигез
булса, газның чагыштырма молекуляр массасы күпме булыр?
Молекуласы углерод һәм водород атомнарыннан торуы билгеле
булса, газның формуласын китереп чыгарыгыз.
3 нче бирем. Әгәр водородка карата тыгызлыгы 8,5 тәшкил ит¬
сә, газның чагыштырма молекуляр массасын исәпләп чыгарыгыз.
Аның составында азотның масса өлеше 82,35%, ә водородныкы —
17,65% булса, газның формуласын билгеләгез.
Еш кына газның тыгызлыгын һавага карата күрсәтәләр, һава
газлар катнашмасы булганлыктан, һаваның бары тик уртача
чагыштырма молекуляр массасы турында гына сүз алып барырга
мөмкин; ул чама белән 29 га тигез.
3 нче мисал. Углерод (IV) оксидының тыгызлыгын һавага ка¬
рата исәпләп чыгарырга. Углекислый газны савытка һаваны этеп
чыгару ысулы белән җыеп булырмы?
Углерод (IV) оксидының чагыштырма молекуляр массасы
44 кә тигез. Ул чагында
O= | =1.52
127
Углекислый газ һавадан 1,52 тапкырга авыррак, шуңа күрә
аны савытка һаваны этеп чыгару ысулын кулланып тутырырга
мөмкин.
4 нче бирем, һава буенча һәм водород буенча: а) хлор (I)
оксидының; б) водород йодидының; в) йод парларының тыгыз¬
лыкларын исәпләп чыгарыгыз.
5 нче бирем, һавадан: а) водород сульфиды H2S; б) водород
хлориды HCl; в) аммиак H3N ничә тапкырга авыррак? Савытны
бу газларның һәркайсы белән тутырганда аны ничек тотарга ки¬
рәк: авызы белән өскә каратыпмы яисә төбен өскә әйләндерепме?
6 нчы бирем, һавага карата: а) водородның; б) гелийның;
в) кислородның тыгызлыкларын исәпләп чыгарыгыз. Бу газларны
савытка һаваны этеп чыгару ысулы белән җыеп буламы?
7 нче бирем. Фосфинның (фосфорның водород белән кушылма¬
сы) чагыштырма молекуляр массасын исәпләгез һәм химик фор¬
муласын китереп чыгарыгыз. Фосфин парларының водородка ка¬
рата тыгызлыгы 17 гә тигез.
8 нче бирем. Химик анализлау ярдәмендә газның составын¬
да 27,27% C һәм 72,73% O барлыгы ачыкланган, һава буенча
тыгызлыгы 1,52 гә тигез булса, газның формуласы нинди?
§ 41 ВОДОРОДНЫҢ ХИМИК ҮЗЛЕКЛӘРЕ
Водород химик элементының мөмкин булган оксидлашу дәрәҗәләрен тасвир¬
лагыз. Химик реакцияләрдә водород гади матдәсе нәрсә буларак катнаша: кай¬
таручымы яки оксидлаштыручымы?
Химик кушылмаларда водород + 1 һәм сирәгрәк — 1 оксид¬
лашу дәрәҗәләрен күрсәтә. Шулай итеп, гади матдә хәлендә
водород химик реакцияләрдә кайтаручы буларак та, оксидлаш¬
тыручы буларак та катнаша ала.
.0 +1
Н2->2Н
Кайтаручы
0 — I
Н2-+-2Н
Оксидлаштыручы
Кайтаручы буларак водород типик неметаллар белән, мәсә¬
лән, фтор, кислород, азот белән тәэсир итешә. Бу реакцияләрдә
тиешле булганча
HF
Водород
фториды
+1-2 +1-3
H2O H3N
Водород Водород
оксиды нитриды
барлыкка килә.
Водород атомының ионлашу энергиясе бик зур булганлыктан
(38 нче рәсемне карагыз), аның неметаллар белән химик бәйлә¬
неше ионлы түгел, ә поляр ковалент бәйләнеш була.
128
Водород ялкынын салкын
өслеккә юнәлткәндә (пыяла
пластинка, стакан, цилиндр өс¬
леге), парлар конденсацияләнү
сәбәпле, су тамчылары хасил
була (45 нче рәсем).
2Н2 + О2 = 2Н2О
о +1
Н2->2Н
0 -2
0^20
4
2
2
1
OO +1—2
2Н2 + О2 = 4Н + 2О
Водородның кислород белән
реакциясе күп микъдарда җы¬
лылык аерылып чыгу белән ба¬
ра. Водород төссез диярлек ял¬
кын белән яна. (Әгәр водород
45 нче рәсем. Водородның януы.
чыга торган көпшә пыяладан
эшләнгән булса, ялкын сары
төскә керә. Бу төсне ялкынга
пыяланың парга әйләнүче со¬
став өлешләре бирә.)
Китерелгән тәҗрибәдә водород Кипп аппаратыннан чыгып
торган саен акрынлап янды. Шул ук реакция башкача да узарга
мөмкин. Водород белән кислород катнашмасы аша электр очкы¬
ны уздырганда реакция практик яктан күз ачып йомганчы шарт¬
лап уза. Шуңа күрә водородның кислород яки һава белән кат¬
нашмасы шартлагыч катнашма дип атала.
Водородны, башка газларны яндыргандагы кебек үк, зур
саклык белән яндырырга кирәк. Водородның сафлыгын тикшерү
өчен, аны пробиркага җыялар һәм яндыралар. Водород саф булса,
ул тыныч кына үзенчәлекле «п-пах» тавышы чыгарып янып китә.
Әгәр пробиркада кислород катнашмасы булса, газ шартлап яна
башлый. Шартлагыч катнашманың пробиркада шартлавы кур¬
кыныч түгел, чөнки анда газ бик аз. Әгәр инде шартлау нинди
дә булса ябык савыт эчендә узса, савыт шартлап ярылырга
һәм пыяла кисәкләре сезне яраларга мөмкин.
Водород һәм кислород атомнары арасында H — O химик бәй¬
ләнеше бик нык. Шуңа күрә су молекулалары водород башка
элементларның күп кенә оксидлары белән тәэсир итешкәндә дә
хасил була. Атап әйткәндә, кайбер металларны, аларның оксид¬
ларыннан тапканда кайтаручы буларак водородны куллану шуңа
нигезләнгән. Бик саф бакырны, мәсәлән, шулай табалар:
9 П-2311
129
CuO -)- H 2 = Cu -j- H2O
+2 о
Cu-*Cu
1
1
о +1
Нг->2Н
+ 2 0 0 +1
Cu + H2 = Cu + 2H
Тиешле шартларда водород кислород белән генә түгел, бәлки
башка неметаллар (галогеннар, азот, күкерт) белән дә кушыла.
Бу реакцияләрдән аммиакны H3N синтезлау иң әһәмиятлесе
булып тора һәм аны җитештерү өчен промышленностьта та¬
была торган водородның күпчелек өлеше тотыла.
Электротискәрелекләре кимрәк булган элементлар белән
кушылмаларында водород тискәре — 1 оксидлашу дәрәҗәсен
күрсәтә. Шуңа күрә аеруча актив металлар белән тәэсир итеш¬
кәндә водород оксидлаштыручы булып тора. Мәсәлән, натрийны
водородта җылытканда натрий гидриды хасил була:
2Na + H2 = 2NaH
0 +1
Na->Na
2
Нг*2Н
1
0 0 +1 -I
2Na + H2 = 2Na + 2H
Селтеле металларның гидридлары ионлы кушылмалар булып
торалар, ягъни алар типик тозлар. Аларның кристаллары уңай
корылмалы селтеле металл ионнарыннан, мәсәлән Na+, һәм тис¬
кәре корылмалы водород ионнарыннан H- барлыкка килгән.
Шул рәвешчә, водород оксидлаштыручы үзлекләре күрсәтә һәм
металлар белән тоз хасил итә алуы белән галогеннарны хәтер¬
ләтә.
? 1. Теләсә нинди матдәнең кулланылыш өлкәләре аның үзлекләренә бәйле.
Водородны кеше эшчәнлегенең төрле өлкәләрендә куллану аның нинди
A үзлекләренә нигезләнгән икәнлеген әйтеп бирегез.
2. Түбәндәге кушылмаларда водородның оксидлашу дәрәҗәләре нинди:
CaFh, HI, НгТе, AIH3, HjS1 KH? Бу кушылмаларның исемнәрен атагыз.
3. Водородның: а) галогеннар; б) күкерт; в) барий; г) азот белән булган
реакцияләренең тигезләмәләрен языгыз. Барлыкка килүче матдәләрнең
исемнәрен атагыз.
4. Электр лампочкаларының кыздырма кылларын эшләүдә кулланыла тор¬
ган металл — вольфрамны аның оксидыннан WOs водород белән кайтарып
табалар. Вольфрамны табу реакциясенең тигезләмәсен языгыз.
5. Беренче тапкыр буларак водородны күпләп XVIII гасыр ахырларында
аэростатларны тутыру өчен таба башлаганнар. А. Лавуазье тәкъдиме
буенча водородны су парларын кызарганчы кызган тимер кисәкләре аша
уздырып тапканнар. Водородтан тыш, тигез микъдарларда тимер (III) ок¬
сиды һәм тимер (II) оксиды да хасил булуын күздә тотып, водородны шул
ысул белән тапканда бара торган реакцияләрнең тигезләмәләрен төзегез.
130
§ 42. ВОДОРОДНЫ ЯГУЛЫК БУЛАРАК КУЛЛАНУ.
ХИМИК РЕАКЦИЯЛӘРНЕҢ ЭНЕРГЕТИКАСЫ
XXH Олимпиада-80 көннәрендә Мәскәү урамнары буйлап марафон узы¬
шында катнашкан спортчыларны телевидение комментаторлары һәм спорт судья¬
лары водород-кислород катнашмасында эшли торган двигательле автомашина¬
ларда озата бардылар. Водород-кислород катнашмасын ягулык итеп куллану
нинди реакциягә нигезләнгән? Ни өчен мондый автомобильләрдән файдалануны
гадәти ягулыкта эшләүче автомобильләрдән яхшырак дип тапканнар?
Водородның яну җылылыгы (1 мольгә исәпләгәндә) нефть¬
некенә һәм нефть продуктларыныкына караганда өч тапкыр,
ташкүмернекеннән дүрт тапкыр чамасы артыграк.
Водородның кислородта яну реакциясе техникада кулланы¬
лыш таба. Водород ялкынында 2800° C ка кадәр җитә торган
югары температура исәбенә авыр эретелүчән металларны кисәргә
һәм эретеп ябыштырырга мөмкин. Моның өчен водород-кислород
горелкасыннан файдаланалар.
Сыек водородны ракета техникасында аеруча нәтиҗәле ре¬
актив ягулык итеп кулланалар. Водородны ракеталар өчен энер¬
гия чыганагы буларак куллану мөмкинлеген әле К. Э. Циолковский
ук алдан күргән.
Водородны «киләчәк ягулыгы» дип атыйлар. Хәзерге вакыт¬
та башлыча күмер, нефть, газ кебек чыганаклардан алына тор¬
ган энергияне тоту гаҗәп тиз арта бара. Әмма аларның запас¬
лары чиксез түгел һәм аларны куллану мохитнең пычрануына
китерә. Водородның запаслары исә чиксез күп (диңгез һәм оке¬
ан сулары, галәмдәге водород). Ягулык буларак, водород ян¬
ганда зарарлы продуктлар барлыкка китерми, чөнки ул янган¬
да су хасил була. Шуңа күрә водородны ягулык итеп куллану
мохитне саклау проблемасын хәл итәргә дә мөмкинлекләр ача¬
чак. Галимнәр, кайбер техник проблемалар хәл ителгәннән соң,
якындагы унъеллыкта водород ягулыкның төп төрләреннән берсе
булачак дип исәплиләр.
Бу хәл Бөек Ватан сугышының беренче, иң авыр елында камалышта калган
Ленинградта булган. Шәһәрне дошман самолетларыннан саклау өчен һавага
водород тутырылган аэростатларны күтәргәннәр. Аэростатларны күтәрү һәм
төшерүне лебедкалар ярдәмендә кулдан башкарырга туры килгән, чөнки двига¬
тельләр өчен бензин җитешмәгән. Блокадада калган шәһәрдә бензин икмәк
кебек үк әһәмиткә ия булган, һәм шул чагында автомобиль двигательләре
өчен ягулык итеп аэростатларда файдаланылганнан соң бушатылган водород¬
ны куллану буенча кыю идея туган. Сынаулар уңышлы үткән. Бу эчке янулы
двигательләрдә ягулык итеп водородны куллану буенча тарихта беренче уңышлы
тәҗрибә була.
Ни өчен водород кислородта янганда күп микъдарда җылы¬
лык аерылып чыга? Ни өчен бериш реакцияләрдә энергия аеры¬
лып чыга, ә башкаларында — йотыла?
Экзотермик реакцияләргә мисалларны сез үзегез дә китерә
аласыз (АЯ<0). Бу водородның, магнийның, үзагачның һәм
башка янучан матдәләрнең яну реакцияләре. Эндотермик реак-
9* 131
цияләргә (АЯ>0), мәсәлән, су аркылы электр тогы уздырганда
аның водородка һәм кислородка таркалу реакциясе керә.
Водородның кислородта яну реакциясенең термохимик тигез¬
ләмәсен языйк:
2Н2 + О2 = 2Н2О, \Н = —484 кДж
Ни өчен бу реакция вакытында җылылык аерылып чыга?
Реакцияне H2 молекулаларында водород атомнары арасындагы
бәйләнешләрнең һәм O2 молекулаларында кислород атомнары
арасындагы бәйләнешләрнең өзелүе һәм су H2O молекулаларын¬
да водород белән кислород атомнары арасында бәйләнешләр
ясалу нәтиҗәсе итеп санарга мөмкин. Исәпләүләр 2 моль H2 мо¬
лекулаларындагы бәйләнешләрне (2-435 кДж) һәм 1 моль O2
молекулаларындагы бәйләнешләрне (494 кДж) өзү өчен кирәкле
энергия 2 моль H2O молекулаларында водород белән кислород
атомнары арасында бәйләнешләр барлыкка килгәндә аерылып
чыккан (1848 кДж) энергиядән кимрәк булуын күрсәтәләр. Шу¬
ңа күрә дә водородның кислород белән реакциясе экзотермик
реакция була:
[870 кДжҢ-494 кДж] — 1848 кДж= —484 кДж
Шулай итеп, әгәр реакция продуктларындагы химик бәйлә¬
нешләр башлангыч матдәләрдәгедән ныграк булса, ул вакытта
реакция энергия аерылып чыгу белән бара.
Суны водород һәм кислород гади матдәләренә таркату реак¬
циясенең ни өчен эндотермик реакция (А//>0) булуын аңла¬
тып бирергә һәм исәпләүләр белән дәлилләргә тырышыгыз:
2Н2О + 2Н2+О2, А/7 = 484 кДж
Сез шундый нәтиҗәгә килерсез: әгәр башлангыч матдәләр¬
дәге химик бәйләнешләр продуктлардагыга караганда ныграк
булса, ул вакытта реакция җылылык йотылу белән бара.
Ә 1. Реакциянең җылылык эффекты дип нәрсә атала? Реакциянең энергия
аерылып чыгу яки энергия йотылу белән баруын ничек аңлатырга мөмкин?
д 2. Гади матдәләрдән су синтезлау реакциясенең җылылык эффекты һәм
суны гади матдәләргә таркату реакциясенең җылылык эффекты санча ти¬
гез, әмма аларның тамгалары капма-каршы булуының сәбәбен энергия
саклану законын кулланып аңлатып бирегез.
3. Водородның яну җылылыгы күпме? Аны мольгә килоджоульләрдә һәм
килограммга килоджоульләрдә күрсәтегез.
4. Реакцияләрнең җылылык эффектларын нәрсә өчен белергә кирәк?
132
РЕАГЕНТЛАРНЫҢ ҺӘМ РЕАКЦИЯ ПРОДУКТЛАРЫНЫҢ
ХИМИК БӘЙЛӘНЕШЛӘРЕ ЭНЕРГИЯЛӘРЕ БУЕНЧА
РЕАКЦИЯНЕҢ ҖЫЛЫЛЫК ЭФФЕКТЫН
ИСӘПЛӘҮГӘ КҮНЕГҮЛӘР
1 нче мисал. Химик бәйләнешләрнең энергиясе E6aiij, (Бәйлә¬
нешнең ныклыгын шул бәйләнешне өзү өчен кирәкле энергия
микъдары белән бәялиләр. Шунлыктан бәйләнешнең ныклыгын
бәяләгәндә «бәйләнеш энергиясе» дип әйтү кабул ителгән):
H-H N-N H-N
£бәйл, кДж/моль 435 945 390
тәшкил итсә,
3H2 + N2 = 2H3N
реакциясенең җылылык эффектын исәпләп чыгарырга.
3 моль H2 һәм 1 моль N2 молекулаларындагы бәйләнешләр¬
не өзү өчен
3 моль-435 кДж/моль+1 моль-945 кДж/моль = 2250 кДж
энергия кирәк.
һәр H3N молекуласында өчәр H — N бәйләнеш бар. Димәк,
2 моль H3N молекулаларында химик бәйләнешләр барлыкка
килгәндә
2 моль-3-390 кДж/моль = 2340 кДж
аерылып чыга.
Шулай итеп, реакциянең җылылык эффекты
A//= 2250 кДж — 2340 кДж= —90 кДж
тәшкил итә.
1 нче бирем. Химик бәйләнешләрнең энергиясе E6allj,.:
H-H Cl-Cl H-Cl
E6allj,., кДж/моль 435 243 432
булса, гади матдәләрдән водород хлориды барлыкка килү реак¬
циясенең җылылык эффектын исәпләп чыгарыгыз.
2 нче бирем. Водород, фтор һәм водород фториды молекула¬
ларында бәйләнешләр энергиясе E6aftlt.:
H-H F-F H-F
E6aftl,., кДж/моль 435 155 566
Гади матдәләрдән водород фториды барлыкка килү реакция¬
сенең җылылык эффектын исәпләп чыгарыгыз.
3 нче бирем. Әгәр химик бәйләнешләрнең энергияләре
S-S O-O S-O
E6aitlt., кДж/моль 273 494 530
булса, күкерт яну реакциясенең
SH-O2 = SO2
җылылык эффектын исәпләп чыгарыгыз.
133
§ 43. ВОДОРОДНЫ ТАБУ
Водородның нинди практик әһәмияте бар? Аны химия промышленностенда,
металлургиядә, энергетикада куллану өлкәләрен әйтеп бирегез. Водородны кул¬
лану аның нинди химик үзлекләренә нигезләнгән?
Табигатьтә очрамый торган (яки аз микъдарларда очрый
торган) гади матдәләрне аларның табигый кушылмаларын кай¬
тару яисә оксидлаштыру юлы белән табалар. Водород үзенең
күпчелек кушылмаларында уңай +1 оксидлашу дәрәҗәсен күр¬
сәтә. Димәк, бу очракта водородны табу аны кайтарудан гый¬
барәт.
+ 1 о
2Н+Н2
Лабораториядә водородны цинкның сыегайтылган хлорид
кислотасы яки сульфат кислотасы белән реакцияләре ярдәмендә
табалар:
Zn+ 2НС1 = ZnCl2+ H2)
Zn + H2SO4 = ZnSO4 + H2J
Сез кислоталарның һәм тозларның эремәдә ионнар рәвешен¬
дә булуларын беләсез:
HCl = H+-FCr
ZnCl2 = Zn2+ +2СГ
Цинкның хлорид һәм сульфат кислоталары белән реакция¬
ләренең ионлы тигезләмәләрен төзик:
Zn + 2H+4-2Cr = Zn2++2Cr+H2f
Zn + 2Н+ + SOl- = Zn2+ + SOl- + H2J
Реакция нәтиҗәсендә кислота калдыклары — Cl- һәм SO4-
анионнары үзгәрмәделәр. Димәк, цинк белән кислота реакция¬
сенең асылын
Zn+ 2Н+= Zn2++ H2f
тигезләмәсе белән күрсәтергә мөмкин.
Бу реакциядә цинк кайтаручы ролен уйный. Цинкның оксид¬
лашу дәрәҗәсенең үсүе аның атомнары тарафыннан электрон¬
нарны югалтып Zn2+ катионнары хасил итү исәбенә була:
Zn — 2е = Zn2+
Кайтаручы
Электроннарны водород катионнары үзләренә китереп ку¬
шалар. Бу водородның оксидлашу дәрәҗәсе кимүгә китерә. H +
ионнары оксидлаштыручы ролен уйныйлар:
2Н+ +2ё=Н2
Оксидлаштыручы
134
Шулай итеп, оксидлашу-кайтарылу реакцияләрендә элемент¬
ларның оксидлашу дәрәҗәләре үзгәрүнең сәбәпләреннән берсе
булып кайтаручы тарафыннан электроннарны югалту һәм оксид¬
лаштыручы тарафыннан электроннарны кабул итү тора.
Кислота эремәләреннән водород ионнарын кайтара алу үз¬
леге төрле металларда төрлечә чагыла.
Хлорид кислотасы салынган аерым дүрт пробиркага һәм сульфат кислотасы
салынган дүрт пробиркага магний Mg, цинк Zn, тимер Fe һәм бакыр Cu плас¬
тинкалар төшерик. Магний, цинк һәм тимер кислоталар белән реагирлашалар.
Бу вакытта водород аерылып чыгуына ышанырбыз. Кислоталарның магний
белән реакцияләре аеруча тиз, цинк белән — акрынрак, тимер белән тагын да
акрынрак уза. Бакыр төшерелгән пробиркаларда исә бернинди үзгәрешләр дә
күзәтелми. Бакыр кислоталардан водородны этеп чыгармый.
Кислоталардан водород ионнарын кайтара алуларына карап,
металларны аларның химик активлыклары кимү тәртибендә тү¬
бәндәгечә бер рәткә урнаштырырга мөмкин:
K Na Mg Al Zn Fe Ni Sn Pb (H2) Cu Hg Ag Pt Au
Водородны этеп чыгаралар Водородны этеп чыгармыйлар
Бу рәттә водородка кадәр урнаштырылган металлар водород
ионнарын кайтаралар — водородны кислота¬
лардан этеп чыгаралар. Ә активлык рәтендә
водородтан соң урнаштырылган металлар исә
водородны кислоталардан этеп чыгармыйлар.
Рәтнең башында иң актив металлар (К,
Na) урнаштырылган. Алар кислоталар белән
шартлап тәэсир итешәләр.
Аларның химик активлыгы шундый зур ки, алар водо¬
родны судан гадәттәге шартларда да этеп чыгаралар.
Натрийның суга тәэсирен тикшерик (46 нчы рәсем).
Cy салынган савытка берничә тамчы фенолфталеин өстик,
ә аннары саклык белән натрий кисәге төшерик (ярты
борчактан да кечерәк). Натрий су өслегендә бик тиз әй¬
ләнеп йөри, ул кечерәйгәннән-кечерәя бара. Реакция ва¬
кытында күп микъдарда җылылык аерылып чыга — хәтта
натрий эретелә.
Реакция тәмамланганнан соң пробиркада водород бу¬
луына ышанырбыз. Селте хасил булуын индикаторның төсе
үзгәрү күрсәтә: фенолфталеин кура җиләге төсенә керә.
Натрийның су белән реакциясе
2Na4-2H2O = 2Na+ + 2ОН“ + H2J
2Na + 2H2O = 2NaOH + H2t
тигезләмәсе белән күрсәтелә.
Магний су белән җылытканда (70° C тан югарырак)
тәэсир итешә:
Mg + H2O = MgO + Н2|
46 нчы рәсем. Нат¬
рийның су белән
үзара тәэсир ите¬
шүе.
135
Цинк бары тик җылытканда гына су парлары белән, тимер бик каты кыздыр¬
ганда гына (кызарып кызганчы) реагирлашалар.
Шулай итеп, металлның активлык рәтендә кайда урнашуын
белеп аның кислота һәм су белән реакциягә керә алуы яки ал¬
мавын һәм процессның ни дәрәҗәдә актив узачагын алдан әйтеп
бирергә була.
Водородны шулай ук гидридлардан, ягъни аның оксидлашу дәрәҗәсе —1
булган кушылмалардан да табарга мөмкин. Ул вакытта водородны табу оксид¬
лаштыру процессын тормышка ашыруга кайтып кала:
-1 о
2Н—H2
Әйтик, гидридлар су тәэсирендә таркалалар, мәсәлән:
NaH + H2O = NaOH + H2f
яки
H" +H2O = OH +H2J
Бу вакытта гидридның водороды (оксидлашу дәрәҗәсе —1) кайтаручы ро¬
лен, ә суның водороды (оксидлашу дәрәҗәсе +1) оксидлаштыручы ролен уйный:
-I о
H-H о
+io У H2
H-H J
Без водородны аның кушылмаларыннан табуның төрле ысул¬
ларын тикшердек. Инде билгеләп үтелгәнчә, лабораториядә во¬
дородны гадәттә цинкка сыегыйтылган хлорид яки сульфат кис¬
лотасы белән тәэсир итеп табалар. Бу реакция тыныч кына,
ләкин җитәрлек дәрәҗәдә актив уза. Шуңа күрә аны Кипп
аппаратында үткәрергә була.
Промышленностьта водородны судан һәм водородның таби¬
гый газдагы кушылмаларыннан табалар.
Водород табуның ысулларыннан берсе суны электр тогы бе¬
лән таркатуга нигезләнгән:
2Н2О = 2Н2 + О2
Водородны промышленностьта табуның башка ысуллары белән
сез 91 нче параграфта танышырсыз.
? 1. Водородны хлорид һәм сульфат кислоталары белән: а) магний; б) ти¬
мер (бу очракта Fe2+ ионнары барлыкка килә) тәэсир итешкәндә табу
реакцияләренең тигезләмәләрен языгыз.
“ 2. Ни өчен водородны кислоталардан тапканда селтеле металларны куллан¬
мыйлар?
3. Промышленностьта водород табу ысулларының берсе су парларын кыз¬
ган күмер аркылы уздыруга нигезләнгән. Водородтан тыш углерод (II)
оксиды да хасил булса, реакциянең тигезләмәсен языгыз.
4. Бакыр вагы белән цинк вагы катнашмасы бирелгән. Бакыр вагын химик
юл белән ничек аерып алырга? Реакциянең тигезләмәсен языгыз.
5. Водород һәм углерод (IV) оксиды катнашмасыннан водородны химик
ысул белән ничек аерып алырга?
136
14 нче лаборатор дәрес
ВОДОРОД ҺӘМ АНЫҢ ҮЗЛЕКЛӘРЕ
1 нче тәҗрибә. Водородны кислоталарга металлар белән тәэ¬
сир итеп табу. Пробиркадагы цинк грануласына 1—2 мл хлорид
кислотасы өстәгез. Берникадәр вакыт, пробиркадагы һава чыгып
беткәнче, көткәннән соң, янып торган шырпыны пробирка авы¬
зына китерегез. Күзәтүләрегезне аңлатып бирегез.
Газ аерылып чыгу тукталгач, берничә тамчы эремәне пыяла
пластинкага тамызыгыз да, пластинканы горелка ялкыны өстендә
тотып, эремәне парга әйләндерегез. Күзәтүләрегезне аңлатып би¬
регез.
Үткәрелгән реакцияләрнең тигезләмәләрен төзегез, аларның
асылын аңлатыгыз.
2 нче тәҗрибә. Металларның кислоталарга карата актив¬
лыкларын чагыштыру. Дүрт пробиркага берәр кисәк цинк, тимер,
бакыр һәм кургаш төшерегез. Пробиркаларга 1 әр мл сыегай¬
тылган сульфат кислотасы өстәгез. Әгәр кайсы да булса про¬
биркада реакция бармаса, пробирканы горелка ялкынында җи-
ңелчә җылытыгыз. Җылытуны саклык белән генә башкарырга
кирәк!
Кайсы пробиркаларда газ аерылып чыгуын күзәтегез. Аның
нинди газ икәнлеген танып белегез. Күзәтүләрегезне аңлатып
бирегез. Үткәрелгән тәҗрибәдән чыгып, алынган металларның
47 нче рәсем. Бакыр (II) оксидыннан водород белән бакырны кайтару приборы.
137
кислоталарга карата чагыштырма химик активлыклары турында
нинди нәтиҗәләр ясарга мөмкин? Реакцияләрнең тигезләмәләрен
төзегез.
3 нче тәҗрибә. Водородның кайтару үзлекләре. Сезгә водо¬
родның бакыр (II) оксиды белән реакциясен үткәрергә кирәк бу¬
лачак. Моның өчен 47 нче рәсемдә күрсәтелгән приборны кулла¬
нырсыз.
1. Приборны җыегыз. Коры көпшә эченә бакыр (II) оксиды
кисәкләре урнаштырыгыз, ә шешәгә цинк гранулалары салыгыз.
2. Шешәгә воронка аша хлорид кислотасы салыгыз.
3. Көпшәнең бакыр (II) оксиды салынган урынын горелка
(спиртовка) ялкынында җылытыгыз. Көпшә стеналарында һәм
пробиркада нәрсә күзәтәсез? Бакыр (II) оксиды белән нинди
үзгәрешләр була?
4. Реакциянең узуына ышанганнан соң җылытуны тукта¬
тыгыз.
Күзәтүләрегезне аңлатып бирегез. Реакцияләрнең тигез¬
ләмәләрен төзегез.
«ГАЗЛАРНЫҢ МОЛЯР КҮЛӘМЕ. ХИМИК РЕАКЦИЯЛӘР ВАКЫТЫНДА
ГАЗЛАРНЫҢ КҮЛӘМ ЧАГЫШТЫРМАЛАРЫ» ТЕМАСЫНА КАРАТА
КҮНЕГҮЛӘР
Газларны тикшереп өйрәнгәндә, аларны кулланганда, шулай
ук лабораториядә һәм промышленностьта тапканда, газларның
нинди күләм чагыштырмаларында реагирлашуларын һәм реак¬
ция нәтиҗәсендә хасил булуларын белү мөһим. Мондый исәпләү¬
ләр Авогадро законына нигезләнәләр: бер үк шартларда алын¬
ган төрле газларның тигез күләмнәрендә молекулалар саны бер¬
тигез була. Димәк, бер үк шартларда 1 моль микъдардагы
(6,02-IO23 молекула) теләсә нинди газның күләме бертигез була.
Бу күләмне моляр күләм дип атыйлар.
Газның моляр күләме Vm аның күләменең матдә микъдарына
чагыштырмасыннан табыла:
г—т
Газның моляр күләмен мольгә туры килгән литрларда (л/моль)
күрсәтәләр. Нормаль шартларда (н. ш.— OoC, 101, 325 кПа)
газның моляр күләме 22,4 л/мольгә тигез (48 нче рәсем).
1 нче мисал. Бакыр (II) оксидыннан 128 г бакырны кайтару
өчен кирәк булган водородның күләмен табарга (н.ш.).
CuO-I-H2=Cu-I-H2O
1 моль I моль
ти1^зләмәсе буенча 1 моль Cu табу өчен 1 моль H2 кирәк. Ба¬
кырның моляр массасы M(Cu) =64 г/моль тәшкил итә, водород¬
ның H2 моляр күләме Vm (H2) =22,4 л/мольгә тигез (н.ш.). Ти-
138
48 нче рәсем. Кайбер газларның моляр күләме һәм моляр массалары.
гезләмә буенча реакциягә водород V(Hs) =22,4 л/моль-1 моль =
= 22,4 л күләмендә керә. Бу вакытта m(Cu) = 64 г/мольХ
Xl моль = 64 г массалы бакыр хасил була:
х 128 г
CuOH-H2 = Cu + H2O
22,4 л 64 г
Пропорция төзик:
22,4 л:х л = 64 г: 128 г
Җавап. 128 г бакырны кайтару өчен 44,8 л (н.ш.) водород
кирәк.
1 нче бирем. 130 г цинк хлорид кислотасы белән реагир-
лашканда хасил булган водородның күләмен (н.ш.) исәпләп
чыгарыгыз.
2 нче бирем. 3 моль цинк сульфат кислотасы белән реакциягә
кергәндә нинди күләмдә (н.ш.) водород аерылып чыгар?
3 нче бирем. 18,4 кг массалы вольфрам табу өчен ничә
кг вольфрам (VI) оксиды һәм ничә л (н.ш.) водород алырга
кирәк булыр?
2 нче мисал. 20 л водород янганда нинди күләмдә кислород
тотыла (н.ш.)?
20 л х
2Н2 +О2 = 2Н2О
2 моль 1 моль
реакция тигезләмәсе буенча водород һәм кислород 2:1 күләм
чагыштырмаларында реагирлашалар. Ул вакытта болай язарга
мөмкин:
2 ; 1 = 20 л : х л; х=10л
139
Җавап. 20л водород янганда (н.ш.) 10 л кислород тотыла.
4 нче бирем. Cy парларын кызган күмер аша уздырганда
10 м3 углерод (II) оксиды хасил булса, нинди күләмдә (н.ш.)
водород барлыкка килгән? (§ 43, 3 нче күнегүне карагыз).
5 нче бирем. 10 м3 углерод (II) оксидын яндыру өчен нинди
күләмдә (н.ш.) кислород кирәк һәм бу вакытта барлыкка килү¬
че углерод (IV) оксидының күләме күпме булыр?
3 нче мисал. 67,2 (н. ш.) водород янганда нинди микъдарда
җылылык аерылып чыгар?
67,2 л х
2Н2 H-Ch = SH2O, АЯ= —484 кДж
44,8 л
тигезләмәсе буенча 2 моль Нг яки 22,4 л/моль-2 моль = 44,8 л Нг
янганда 484 кДж җылылык аерылып чыга. 67,2 л водород ян¬
ганда
-484 кДж-67,2 л
44,8 л
= —726 кДж
җылылык аерылып чыга.
Җавап. 67,2 л водород янганда (н. ш.) 726 кДж җылылык
аерылып чыга.
6 нчы бирем. S-I-O2 = SO2; АЯ= —300 кДж тигезләмәсе бу¬
енча исәпләп чыгарыгыз: 64 г массалы күкерт янганда күпме
җылылык аерылып чыга һәм бу вакытта нинди күләмдә (н. ш.)
күкерт (IV) оксиды хасил була?
ХИМИК ЭЛЕМЕНТЛАРНЫҢ
Д. И. МЕНДЕЛЕЕВ ПЕРИОДИК СИСТЕМАСЫНЫҢ
VII ТӨРКЕМ р-ЭЛ EMEHTJIAPbI
(ФТОР ТӨРКЕМЧӘСЕ)
§ 44. ФТОР ТӨРКЕМЧӘСЕНӘ ГОМУМИ
ХАРАКТЕРИСТИКА
I. Фтор төркемчәсенә нинди элементлар керә? 2. Аларның атомнарында
электрон сүрүләренең төзелеше нинди? 3. Аларның атомнарында электрон
сүрүләренең төзелешендәге охшашлыклар һәм аерымлыклар нидән гыйбарәт?
4. Төркемчәдә атом радиуслары һәм аларның ионлашу энергияләре үзгәрүдәге
тенденция нинди? 5. Галогеннарның молекула составы нинди? Аларның крис-
таллары нинди кисәкчекләрдән (атомнардан, молекулалардан, ионнардан)
төзелгән?
Сезгә билгеле булганча, VII төркемнең р-элементларына га¬
логеннар— фтор F, хлор Cl, бром Br, иод I һәм астат At (ас¬
тат— радиоактив элемент, аз өйрәнелгән; астатның барлыгын
Д. И. Менделеев алдан әйткән. Астат ясалма юл белән табыл¬
ган (1940); элементның исеме грекча астатос — «тотрыксыз»
сүзеннән алынган) керә.
Элементларның фтор төркемчәсенә керүе аларның атомна¬
рының тышкы электрон катлаулары бертөрле төзелештә икәнле¬
ген раслый — ns^np-.
F Cl Br I At
2s22p5 3s23p5 4s24/?5 5s25p5 6s26p5
Тышкы катлауларының '(өзелешендәге охшашлык галоген¬
нарның уртак үзлекләрен бйлгели. Галогеннарның үзлекләрен¬
дәге аерма аларның атомнарының зурлыклары төрле булу белән
аңлатыла.
49 нчы рәсемнән күренгәнчә, F — Cl — Br — I рәтендә атом¬
нарның радиуслары зурая, чөнки электроннар белән тутырыла
торган электрон катлауларының саны арта.
F — Cl — Br — I-At рәтендә атомнарның ионлашу энергия¬
ләре кимүне дә шулай ук аңлатырга мөмкин (50 нче рәсем).
Фтор төркемчәсе элементларының атомнарында тышкы кат¬
лау тәмамлануга якын:
49 нчы рәсем. Элементларның атом номерлары функцияләре буларак VII төркем¬
нең р-элементлары атомнарының радиуслары.
1800
I 1600
Z^oo
1000
CL D
• Br
Ii Ii I l—i I-J
9 17 35 531
Элементның, атом номеры
50 нче рәсем. Элементларның атом номерлары функцияләре буларак VII төр¬
кемнең р-элементлары атомнарының ионлашу энергияләре.
Шуңа күрә галогеннарның атомнарына бер электронны ките¬
реп кушу характерлы. Әйтик, галогеннарның атомнары ике атом¬
лы молекулаларга берләшәләр, мәсәлән (схемадагы нокталар
электроннарның символлары булып торалар):
•• •• м ••
:CI. + .Cl: SCl-Cl:
•• •• •• ••
Ковалент бәйләнеш ясалуда һәр атомнан берәр парлашмаган
р-электрон катнаша. Галогеннарның молекулаларында бәйләнеш
хасил булганда электрон болытларының аралашуы 51 нче рә¬
семдә сурәтләнгән. Шул рәвешчә галогеннарның атомнары
водород атомнары белән дә бәйләнешләр барлыкка китерәләр
(52 нче рәсем), мәсәлән:
142
51 нче рәсем. Хлор (а) һәм йод (б) молекулалары барлыкка килгәндә электрон
болытларының аралашуы.
H* + «CIS — H — CIS
•• ••
Галогеннарның атомнары электротискәрелекләре аеруча зур
булган башка элементларның атомнары белән дә ковалент бәй¬
ләнешләр хасил итәләр. Ә галогеннарның электротискәрелек¬
ләре аеруча кечкенә булган элементлар белән кушылмаларында
ионлы бәйләнеш урнаша. Натрий хлоридының NaCI төзелеше
нинди булуын исегезгә төшерегез әле (25 нче рәсемне карагыз).
Аның кристаллик челтәре Na+ һәм Cl- ионнарыннан тора.
Фтор төркемчәсе элементла¬
ры аеруча электротискәре эле¬
ментларга керәләр (кушымта¬
ны карагыз). Шуңа күрә алар-
га тискәре — 1 оксидлашу дә¬
рәҗәсе хас. Тискәре оксидлашу
дәрәҗәсеннән тыш, галогеннар
шулай ук уңай оксидлашу дә¬
рәҗәләрен дә күрсәтәләр.
(Фтор иң электротискәре эле¬
мент буларак бары тик — 1 'ок¬
сидлашу дәрәҗәсен генә күр¬
сәтә.) VII төркем элементлары
буларак, хлор, бром һәм йод
4-7 югары оксидлашу дәрәҗә¬
сен күрсәтәләр.
? 1. Галогеннарның атомнарында
тышкы электрон катлау орбиталь¬
ләренең урнашу модельләрен су¬
рәтләгез (II форзацны карагыз).
52 нче рәсем. Водород хлориды (а) һәм
водород иодиды (б) молекулалары
барлыкка килгәндә электрон болытла¬
рының аралашуы.
143
А 2. Атомнардан фтор молекуласы ясалганда электрон болытларының, ара¬
лашу схемасын языгыз.
3. Фтор һәм хлор CaFs, NaCl1 MgCls, KCl кушылмалары булган минерал¬
ларның составларына керәләр. Бу кушылмаларда галогеннарның оксид¬
лашу дәрәҗәләре нинди?
§ 45. ФТОР
Химик элементны өйрәнү өчен белешмәлек (§ 40 ны карагыз) буенча, андагы
сораулардан файдаланып, фторның үзлекләрен алдан әйтеп бирегез. Фтор ато¬
мының тышкы электрон катлавындагы орбитальләрнең урнашу моделен сурәт¬
ләгез (II форзацны карагыз). Академик А. Е. Ферсманның образлы әйтеме
буенча фтор «барысын да ашап бетерүче». Үзенең фтор дигән исемен ул грекча
«фторос» — җимерү, һәлакәт сүзеннән алган. Сез ничек уйлыйсыз, бу исемнәр
нәрсә белән аңлатыла?
Сезгә фтор атомының электроннар сүрүендәге тышкы кат¬
лауның төзелеше билгеле:
Zs
Фтор атомының ионлашу энергиясе бик зур булганлыктан,
химик реакцияләрдә F+ уңай ионнарының кушылмалары бар¬
лыкка килми. Киресенчә, фтор атомнары шактый җиңел генә
тискәре корылмалы ион F- торышына күчәләр.
Атомының тышкы электрон катлавы төзелешенә һәм иң зур
электротискәрелегенә туры килгәнчә, фтор —1 оксидлашу дә¬
рәҗәсен күрсәтә.
Табигатьтә фтор бары тик кушылмалар хәлендә генә очрый,
мәсәлән, составына кальций фториды СаРг кергән плавик шпа¬
ты, яки флюорит шундыйлардан санала. Кайбер металларның
фторидлары аз микъдарда табигый суларда була.
Фтор элементы тере организмнарда була; аерым алганда ул
теш эмале составына керә. Эчә торган суда фтор кушылмалары¬
ның булмавы аның организмда җитешмәвенә китерә, ә бу исә
теш авыруларын китереп чыгара. Фторның кирәгеннән тыш күп
булуы да зарарлы.
Гадәттәге шартларда фтор —яшел төстәге газ, иң актив не¬
металл. Юкка гына аны «барысын да ашап бетерүче» дип ата¬
мыйлар. Бу нәрсә белән аңлатыла соң?
Фтор молекуласында : FxFs химик бәйләнеш ике электрон
исәбенә ясала. Моннан тыш, молекуладагы һәр атомның бәйлә¬
нештә катнашмаган өчәр электрон парлары бар. Фтор атомнары
144
зур түгел, шунлыктан F2 молекуласындагы уртак булмаган пар¬
лы электроннар бер-берсеннән сизелерлек рәвештә этеләләр. Бу
J7 — F бәйләнешенең ныклыгы кимүгә һәм аның тотрыксыз бу¬
луына китерә. Киресенчә, башка элементлар белән кушылмала¬
рында фтор һәм тиешле элемент атомы арасындагы бәйләнеш га¬
дәттә бик нык була. (Әйтик, Fa молекуласындагы бәйләнешнең
энергиясе 159 кДж/мольгә, ә HF молекуласында — 565 кДж/
мольгә тигез.)
Шулай итеп, химик реакцияләр барышында фтор молекула¬
ларын таркатуга энергия, яңа бәйләнешләр ясалганда аерылып
чыккан энергиягә караганда шактый кимрәк тотыла. Фторның
химик активлыгы аеруча зур булуны шул билгели дә инде.
Фтор атмосферасында хәтта пыяла (пыяла мамыгы) һәм су ке¬
бек «тотрыклы» матдәләр дә яналар:
2H2O + 2F2 = 4HF + O2
Игътибар итегез: бу реакциядә яну продуктларының берсе —
кислород! Бу реакция фторның кислородка караганда активрак
оксидлаштыручы икәнлеген раслый:
-2 0
2О-*О2
0 -I
F2->2F
Турыдан-туры фтор бары тик гелий, неон һәм аргон белән
генә тәэсир итешми.
Кушылмаларда фторның оксидлашу дәрәҗәсе —1 булганлык¬
тан, аны ирекле хәлдә табу өчен түбәндәге процессны тормыш¬
ка ашырырга кирәк:
-10
2F->F2
Әмма бу процессны башка матдәләр ярдәмендә башкару чи¬
тен. Фтор — бик көчле оксидлаштыручы бит. Шуңа күрә дә
фторны аның кушылмаларын электр тогы белән таркатып таба¬
лар.
Ирекле фтордан аермалы буларак, аның күп кенә кушыл¬
малары химик яктан инертлыклары белән аерылып торалар. Әй¬
тик, аның углеродлы кушылмаларыннан кислоталар, селтеләр,
фторның үзенең һәм башка агрессив матдәләрнең тәэсиренә
чыдам пластмасса — фторопласт җитештерәләр.
Фторны ракета ягулыгын яхшы оксидлаштыручы матдә була¬
рак кулланалар. Фторның кайбер кушылмаларыннан медицинада
файдаланалар.
Водород фториды HF (фтороводород) — сыеклык. Аны ал¬
машу реакциясе ярдәмендә — кальций фторидына (флюоритка)
сульфат кислотасы белән тәэсир итеп табалар:
10 П-236
145
CaF2+ H2SO4 = CaSO4+ 2HF
Водород фториды суда чикләнмәгән микъдарда эри. Аның
судагы эремәсе — фтороводород (плавик) кислотасы. Плавик
кислотасының характерлы үзенчәлеге бар, ул пыяланың сос¬
тав өлеше булган кремний (IV) оксиды SiO2 белән тәэсир ите¬
шү сәбәпле, пыяланы ашый:
SiO2 + 4HF = SiF4I+2Н2О
Пыяланың өслеге тоныклана, үтә күренми торган була. Во¬
дород фторидын пыяла савытта табарга һәм сакларга ярамый.
Бу максатларда парафиннан, полиэтиленнан эшләнгән савытлар¬
дан файдаланалар.
Фтороводород кислотасы агулы, тирегә тигәндә авыр төзәлә
торган җәрәхәтләр китереп чыгара. Плавик кислотасы пыяланы
ашату өчен (төрле билгеләр, язулар төшерү өчен), металл ко¬
елмадагы комны SiO2 бетерү өчен кулланыла.
? 1. 3 нче период элементларының югары оксидлашу дәрәҗәләрендәге фто¬
ридларының формулаларын языгыз. Бу период элементының атомы тирә-
A сендә тотрыклы рәвештә фторның алты атомнан да артык координацияләнә
алмавын исәпкә алыгыз. 3 нче период элементлары фторидларының кай¬
сылары тозлар булып торалар? Аларның кайсылары тозларга кермиләр?
Бу фторидларны табу реакцияләренең тигезләмәләрен төзегез.
2. 5 нче период s- һәм р-элементларының югары оксидлашу дәрәҗәлә¬
рендәге фторидларын табу реакцияләренең тигезләмәләрен төзегез. 5 нче
период элементларының атомнары тирәсендә фторның җиде атомга кадәр
координацияләнүе мөмкин булуын исәпкә алыгыз.
3. Кальций фториды кристалының структурасын тасвирлагыз (27 нче рәсем¬
не карагыз). Ca2+ катионын ничә F- анионы һәм, киресенчә, F- анионын
ничә Ca2+ катионы чолгап алган. Бу кальций фторидының формуласына
туры киләме?
4. Бериллий фторидының структурасы кремний (IV) оксидының SiOa струк¬
турасы белән охшаш (6 нчы рәсемне карагыз). Бериллий фторидының
формуласы нинди?
5. Фторның кремний (IV) оксиды SiOa (пыяла мамыгы рәвешендә) белән
реакциясенең тигезләмәсен төзегез. Реакция продуктларының берсе булып
кремний (IV) фториды SiF4 барлыкка килүен күздә тотыгыз.
§ 46. ХЛОР
Химик элементны өйрәнү өчен белешмәлекнең 1-—3 нче сорауларына җа¬
вап бирегез (§ 40 ны карагыз) һәм хлорның үзлекләрен алдан әйтеп бирегез.
Хлор үзлекләре белән фторны бик нык хәтерләтә. Әмма хлор
атомы фторныкыннан зуррак. Бу аларның үзлекләрендәге аер¬
маны китереп чыгара. Үзенең электротискәрелеге ягыннан хлор
бары тик фтордан һәм кислородтан гына калыша. Шуңа күрә,
фтордан аермалы буларак, хлор тискәре оксидлашу дәрәҗәсен
дә, уңай оксидлашу дәрәҗәләрен дә күрсәтә ала:
146
Бәйләнешләр ясалуда катнашучы электроннар санынча, хлор¬
ның оксидлашу дәрәҗәләре — 1, +1, 4~3, 4-5 һәм 4-7 булырга
мөмкин.
Бәйләнешләр хасил булуда атомның барлык валентлык элек¬
троннары катнашканда, хлор югары 4-7 оксидлашу дәрәҗәсен
күрсәтә. Хлорга, барлык башка галогеннар кебек үк, —1 оксид¬
лашу дәрәҗәсе аеруча характерлы.
Химик активлыгы бик югары булганлыктан, хлор ирекле хәл¬
дә очрамый. Табигатьтә хлор хлоридлар, мәсәлән, NaCl, KCl
хәлендә була. Бигрәк тә натрий хлориды күп таралган. Ул
диңгез суларында күп була. Натрий хлоридын тозлы күлләрдән
һәм кипкән борынгы тоз күлләре урынында барлыкка килгән
тоз ятмаларыннан чыгаралар.
Гадәттәге шартларда гади матдә хәлендәге хлор — саргылт-
яшел төстәге газ (хлорның исеме грекча хлорос — «яшел» сү¬
зеннән килеп чыккан), аның молекулаларында CH икешәр атом
бар:
•• ••
XCI-CIt
•• —
Хлорга үзенчәлекле зәһәр ис хас. Хлорны күп микъдарда
сулау буылдыра һәм үлемгә дә китерүе мөмкин. Хлор белән эш
53 нче рәсем. Бакырның (а) һәм сөрмәнең (б) хлорда януы.
10*
147
иткәндә зур саклык күрсәтергә кирәк. (Хлор белән булган эш¬
ләрне газларны суыра торган махсус шкафта гына башкара¬
лар!) Хлорны эчә торган суны йогышсызландыру өчен кулла¬
налар, чөнки ул микроорганизмнарны үтерә.
Хлор суда шактый сизелерлек микъдарда эри. (Бүлмә
температурасында 1 күләм суда 2,3 күләм хлор эри). Хлорның
судагы эремәсен хлорлы су дип атыйлар. Анда хлорның төсе
һәм исе саклана.
Ирекле хлор — аеруча көчле оксидлаштыручыларның берсе.
Күп кенә металлар һәм неметаллар хлорда яналар. Әйтик, сез
натрийның хлор белән бик актив рәвештә тәэсир итешүен күзәт¬
кән идегез (43 нче рәсем).
Хлорның активлыгын тагын да ачыграк итеп күрсәтү өчен
берничә тәҗрибәне тикшереп узыйк (53 нче рәсем).
Хлор тутырылган банкага алдан җылытылган бакыр фольганы төшерик
(53 нче рәсем, а). Фольга бик нык кыза һәм янып бетә. Бакыр (II) хлориды¬
ның вак кына кисәкчекләреннән торган коңгырт төтен хасил була.
CuH-CI2 = CuCI2, ДЖО
0 +2
Cu-»-Cu
0 -1
Cl2-»-2С1
Хлор тутырылган банкага сөрмә порошогын сипкәндә «ут яңгыры» күзә¬
телә (53 нче рәсем, б). Реакция нәтиҗәсендә ак төтен— сөрмә (III) хлориды
барлыкка килә:
2Sb + 3Cl2 = 2SbCl3, Д//<0
0 +з
Sb->Sb
Cl2 — 2CI
Хлорны аның оксидлашу дәрәҗәсе —1 булган кушылмала¬
рыннан табалар:
-1 о
2С1—»-С12
Бу максатта төрле оксидлаштыручыларны яки электр тогын
кулланалар (электролиз уздыралар). Лабораториядә хлорны га¬
дәттә куертылган хлорид кислотасын марганец (IV) оксиды бе¬
лән оксидлаштырып табалар. Бу реакция җылыту шартларында
уза:
4НС1 +MnO2 = MnCl2 +Cl2+ 2Н2О
+ 4 +2
Mn=-Mn
-1 о
2С1->С12
Хлор кеше эшчәнлегенең төрле өлкәләрендә киң кулланылыш
таба (54 нче рәсем).
148
А
хлор органам татдәлөр
54 нче рәсем. Хлорны куллану.
Дәфтәрегезгә, 54 нче рәсемнән файдаланып, хлорның кулланылыш өлкә¬
ләрен язып алыгыз.
1. Эчә торган суны эшкәрткәндә 1 м3 суга 1,5 л чамасы хлор тотыла.
10 м3 су аша ничә моль (н. ш.) хлор уздырырга кирәк? Суны нинди мак¬
сатларда хлорлыйлар?
2. Хлорны куллануның мөһим өлкәсе булып, аны ак калай калдыкларыннан
аккургашны аерып алу өчен файдалану тора. (Ак калай башлыча кон¬
серв банкалары эшләү өчен тотыла, һәр консерв банкасының өслегендә
0,5 г чамасы аккургаш була). Бу ысул коры хлорның, тимергә кагылмыйча,
аккургаш белән сыек аккургаш (IV) хлориды хасил итүеннән гыйбарәт.
Ак калайдан 5 кг аккургашны аерып алу өчен чама белән нинди күләм¬
дә (н. ш.) хлор кирәк?
3. Хлорның һава буенча тыгызлыгын исәпләп чыгарыгыз. Хлорны савытка
һаваны этеп чыгару ысулы белән ничек тутырырга? Савытка хлорны суны
этеп чыгару ысулы белән тутырып буламы?
§ 47. ХЛОРИДЛАР
1. Гади матдәләрдән 3 нче период элементларының түбәндәге югары хло¬
ридларын табу реакцияләренең тигезләмәләрен төзегез: NaCl, MgCl21 AlCl3,
SiCl4, PCl5, SCL. 2. Бу хлоридларның кайсылары тозлар, ә кайсылары тозлар¬
га кермиләр? 3. Ни өчен күкерт атомы тирәсендә алты фтор атомы (SF5) һәм
бары тик дүрт кенә хлор атомы (SCL) тотрыклы булып координацияләнә ала?
Оксидлашу дәрәҗәсе —1 булган хлорның кушылмалары га¬
ять күп төрле. Әйтик, 3 нче период элементлары өчен түбән¬
дәге югары хлоридлар билгеле:
Na Mg Al Si P S
NaCl MgCl2 AlCl3 SiCl4 PCl5 SCl4
Металлармын, хлоридлары
Неметалларның хлоридлары
Электротискәрелекләре иң кечкенә булган элементларның
хлоридлары (NaCl, MgCl2) — авыр эретелүчән кристаллик мат¬
дәләр (тозлар). Электротискәрлекләре иң зур булган элементлар¬
ның хлоридлары (SiCl4, PCl5, SCl4) —гадәттәге шартларда газ¬
лар, сыеклыклар һәм җиңел эретелүчән каты матдәләр.
Аеруча әһәмиятле хлоридларның берсе булып водород хло¬
риды HCl тора. Ул төссез, буылдыра торган газ, һавадан аз гына
авыррак. Водород хлориды гади матдәләр үзара тәэсир итеш¬
кәндә хасил була:
Н2 + С12 = 2НС1, ЬН<0
Бу реакция водородның кислородта яну реакциясенә охшаш.
Яну күп микъдарда җылылык аерылып чыгу белән уза (ялкын¬
ның температурасы 2200° C ка җитә). Водородның хлор белән
катнашмасы, водород һәм кислород катнашмасы шикелле үк,
шартлаучан. Шартларга карап, хлорның һәм водородның үзара
тәэсир итешүе тыныч кына яки шартлап узарга мөмкин.
150
Газүткәргеч көпшәдән чыга торган водородны кабызыйк һәм көпшәне хлор
тутырылган цилиндрга кертик. Водород анда зәңгәрсу тонык ялкын белән яна.
Әмма шул ук реакция шартлап та узарга мөмкин. Водород белән хлорны калын
стеналы цилиндрда катнаштырыйк. Цилиндрның авызын катыргы кисәге белән
каплыйк. Цилиндр тирәсендә магний яндырганда колак тондырырлык шартлау
була. Катнашма аңа янып торган чыраны керткәндә дә шартлый. Шулай итеп,
реакция катнашманың яктылык энергиясен йотуы исәбенә дә, җылылыкны йо¬
туы исәбенә дә башлана.
Тикшеренүләр күрсәткәнчә, бу реакция түбәндәге рәвешчә
уза. Энергияне йоту исәбенә кайбер хлор молекулалары атом¬
нарга диссоциацияләшәләр: Ch = Cl Ң- Cl.
Барлыкка килгән хлор атомнары реакция башлануның ини¬
циаторлары ролен уйныйлар. Хлорның һәр атомы, HCl молекула¬
сы һәм H атомы хасил итеп, водород молекуласы белән реагир-
лаша:
Cl-I-H2 = HClH-H
Үз чиратында водород атомы, HCl молекуласы һәм Cl атомы ха¬
сил итеп, хлор молекуласы белән реагирлаша:
H + Cl2 = HCl + Cl һ. б.
Тулаем алганда, процесс эзлекле реакцияләр чылбырыннан
гыйбарәт:
Cl Ң-H2-^HCl + H
+
С12-*НС1 + С1
+
Н2->НС1Ң-Н
+
Cl2-^HCl-I-Cl
һ. б.
Мондый әверелешләр чылбыры йөзләрчә мең звеноны эченә
ала, ягъни хлорның таркалган бер молекуласы йөзләрчә мең
водород хлориды молекулалары хасил булуга китерә. (Ә әвере¬
лешләр чылбыры булмаса ике молекула барлыкка килер иде.)
Мондый реакцияләрне чылбырлы реакцияләр дип атыйлар. Бу
процесс практик яктан күз ачып йомганчы булып уза. Бу вакыт¬
та бик күп микъдарда җылылык аерылып чыга. Шунлыктан во¬
дород белән хлор катнашмасы аеруча шартлау куркынычлы!
Күрәсең, чылбырның өзелеп калуы
HH-Cl = HCl, ClH-Cl = Cl2, н + н = н2
реакцияләре тормышка ашса гына мөмкин буладыр.
Әмма мондый реакцияләрнең булу ихтималлыгы чиктән тыш
аз, чөнки атомнарның концентрациясе молекулалар концентра¬
циясенә караганда бик түбән.
Академик H. H. Семенов ачыклаганча, чылбырлы реакция¬
ләр бик тә таралган. Чылбырлы механизм нигезендә яну, шарт-
151
55 нче рәсем. Водород хлоридын ла¬
бораториядә табу.
56 нчы рәсем. Водород хлоридын суда
эретү.
лау (атап әйткәндә, шартлагыч катнашмаларның шартлавы)
процесслары булып уза.
Лабораториядә водород хлоридын натрий хлоридын куертыл¬
ган сульфат кислотасы белән бергә җылытып табалар (55 нче
рәсем).
2NaCl H-H2SO4 = Na2SO4 + 2HClt
куерт.
Водород хлориды һавадан авыррак булганга күрә, аны савыт¬
ка һаваны этеп чыгару ысулы белән җыярга мөмкин.
Водород хлориды суда бик яхшы эри: бүлмә температура¬
сында 1 күләм суда 450 күләмгә кадәр HCl эри.
Цилиндрның водород хлориды белән тулуын аның авызы өстендә томан
күренә башлауга карап беләләр. Бу һавадагы су парларында HCl эремәсе
тамчылары барлыкка килүне күрсәтә. Водород хлоридының эрүчәнлеген тагын
152
да ачыграк итеп 56 нчы рәсемдә сурәтләнгән приборда күзәтергә мөмкин. Тү¬
бәнге савытка зәңгәр лакмус өстәп төсе үзгәртелгән су салынган, ә югарыгы
савытка водород хлориды тутырылган. Резина көпшә аша һава өрдергәндә
югарыгы савыт эченә пыяла көпшә буйлап су керә. Берничә тамчы су эләгүгә,
югарыгы савыт эчендә фонтан ургыла башлый. Бу водород хлоридының HCI
суда яхшы эрүен раслый. Водород хлоридының беренче су тамчыларында эрүе
сәбәпле, югарыгы савытта газның сирәкләнүе була. Атмосфера һавасы басымы
астында су югарыгы савытка күтәрелә. Водород хлоридының суда эрүе нәти¬
җәсендә индикаторның төсе үзгәрүгә игътибар итегез. Ул кызыл төскә керә.
Водород хлоридының судагы эремәсе;— кислота; аны хлоро¬
водород кислотасы яки хлорид кислотасы дип атыйлар.
Хлоридлар буяулар, дару матдәләре буларак киң кулланы¬
лалар. Натрий хлориды — химия промышленносте өчен мөһим
чимал (хлор, селтеләр җитештерү).
? 1. Кушымта таблицасында күрсәтелгән хлоридларның кайсылары суда
аз эриләр яки практик яктан эремиләр? Аларны эремәләрдә уза торган ал-
Д машу реакцияләре ярдәмендә табуга мисаллар китерегез. Хлорид-ионнарга
С1“ нинди тоз реактив булып тора? (10 нчы лаборатор дәресне карагыз).
2. Хлор агымында 1,76 г бакыр һәм тимер ваклары катнашмасын яндыр¬
ганнар. Нәтиҗәдә 4,60 г хлоридлар катнашмасы табылган. Катнашмада
күпме бакыр һәм күпме тимер булган?
3. H2 + CI2 катнашмасын нурландырганда ни өчен атомнарга Нг моле¬
кулалары түгел, ә С1г молекулалары таркала?
Хлоридларның кулланылышы турында чыгыш ясарга әзерләнегез.
Химик элементны өйрәнү өчен белешмәлекнең 4 нче биремен башкарыгыз
(§ 40 ны карагыз).
§ 48. ХЛОРОВОДОРОД КИСЛОТАСЫ
1. Нинди матдәләрне кислоталар дип атыйлар? 2. Хлорид кислотасының
электролитик диссоциациясе тигезләмәсен языгыз. Типик кислоталарның берсе
буларак хлорид кислотасына нинди үзлекләр хас? 3. Цинк белән хлорид кисло¬
тасы реакциясенең асылы нидән гыйбарәт?
57 нче рәсемдә хлорид кислотасын промышленностьта җи¬
тештерү схемасы күрсәтелгән. Водород хлоридын синтез мичендә
гади матдәләрдән синтезлап табалар. Мичнең түбәнге өлешен¬
дә горелка урнаштырылган, анда водород белән хлор катнашма¬
сы яндырыла. Горелка үзәктәш итеп урнаштырылган ике труба¬
дан торучы конструкциядән гыйбарәт: эчке труба буйлап хлор,
ә трубалар арасындагы боҗрасыман ярык буйлап водород кер¬
телә.
Катнаштыру моментында яндырылган хлор һәм водород кат¬
нашмасы януын дәвам итә. Хасил булган водород хлориды йот¬
тыру башняларына җибәрелә. Беренче башняда водород хлори¬
ды сыегайтылган хлорид кислотасында эретелгәнлектән, куер¬
тылган хлорид кислотасы барлыкка килә. Беренче башняда йо¬
тылмый калган водород хлориды икенче башняда эри. Бу вакыт¬
та сыегайтылган хлорид кислотасы хасил була, бу кислотаны ан¬
нары водород хлоридын йоттыру өчен кулланалар.
153
Ы нче рәсем. Хлороводород һәм хлорид кислотасы җитештерү схемасы.
Куертылган хлорид кислотасы (НОның масса өлеше 40% ка
кадәр җитә) зәһәр исле була һәм һавада «төтенли». Бу кисло¬
тадан водород хлориды аерылып чыгу һәм аның һавадагы су
парлары белән тәэсир итешүе белән аңлатыла.
Хлорид кислотасының химик активлыгы бик зур. Ул актив¬
лык рәтендә водородка кадәр урнашкан металлар белән тәэ¬
сир итешә, мәсәлән:
Fe 4-2Н+= Fe2++ H2f
яки
Fe + 2НС1 = FeCl2+ H2f
Металларның күпчелек хлоридлары суда эриләр. Хлорид кис¬
лотасы барлык нигез оксидлары һәм гидроксидлары белән дияр¬
лек реагирлаша, мәсәлән:
яки
яки
FeO+ 2Н+ = Fe2+ + H2O
FeO + 2HCl = FeCl2 +H2O
Fe(OH) 2 + 2Н+ = Fe2++ 2Н2О
Fe(OH) 2 + 2HCl = FeCl2 + 2H2O
154
Бу очракларның һәркайсында металл ионнары хасил була.
Эремәдән тоз кристалларын аерып алырга мөмкин.
Хлорид кислотасы халык хуҗалыгында киң кулланыла. Атап
әйткәндә, аны металларның (цинкның, тимернең, марганецның)
хлоридларын табу өчен кулланалар. Хлорид кислотасы корыч¬
ның өслеген оксидлардан арындыру өчен кулланыла. Бу вакытта
металл үзе эремәсен өчен, кислотага металлны кислота тәэси¬
реннән ашалудан саклый торган, әмма оксидларның эрүенә ко¬
мачауламаучы махсус матдәләр (ингибиторлар) өстиләр.
Хлорид кислотасын зур пыяла шешәләрдә яки эчке өслеге
резина белән капланган металл (корыч) савытларда күчереп
йөртәләр. Ингибиторлар өстәлгән хлорид кислотасын корыч цис¬
терналарда күчереп йөртергә мөмкин.
Хлорид кислотасы ашказаны сыекчасында бар (0,3% чама¬
сы). Ул азыкның үзләштерелүенә булышлык итә һәм авыру ту¬
дыручы бактерияләрне үтерә. Ашказаны сыекчасында хлорид
кислотасы аз булганда врачлар аның эремәсен эчәргә тәкъдим
итәләр. Ашказаны сыекчасында хлорид кислотасының концент¬
рациясе зур булса, ул вакытта «сару кайный».
? 1. Марганецның оксидлашу дәрәҗәсе 4-2 булса, хлорид кислотасы белән:
а) марганец; б) марганец оксиды; в) марганец гидроксиды арасындагы
реакцияләрнең тигезләмәләрен языгыз.
A 2. Ике пробиркада хлорид һәм нитрат кислоталарының төссез эремәләре
бирелгән. Ничек итеп: а) аларның кислота эремәләре булуларын; б) алар-
ның берсе хлорид кислотасы булуын танып белергә?
3. 78,4 л водород хлориды синтезлау өчен нинди күләмдә водород һәм
хлор кирәк булыр (н. ш.)?
4. 136,4 г цинк хлориды табу өчен ничә грамм цинк оксиды һәм нинди кү¬
ләмдә 2 моль/л концентрацияле хлорид кислотасы кирәк?
5. 112 г тимер хлорид кислотасы белән үзара тәэсир итешкәндә нинди
күләмдә (н. ш.) газ аерылып чыгар?
6. Бакыр (II) хлоридын: а) хлорид кислотасын; б) хлорны кулланып табу
реакцияләренең тигезләмәләрен төзегез. Бакыр металы белән хлорид кисло¬
тасы арасында реакция барырмы? Сезгә таныш нинди матдәләр, хлорид
кислотасы белән реагирлашып, бакыр (II) хлориды хасил итәләр?
7. Хлорид кислотасын җитештергәндә йоттыру башняларында водород
хлоридын су белән йоттыру каршы агым принцибы нигезендә тормышка
ашырыла (57 нче рәсем): водород хлориды башняга астан, ә су — өстән
бирелә. Ни өчен шундый алым кулланыла?
15 нче лаборатор дәрес
ХЛОРИДЛАР. ХЛОРИД КИСЛОТАСЫ
1 нче тәҗрибә. Хлороводород һәм хлорид кислотасы табу.
Пробиркага аның күләменең '/ь чамасы натрий хлориды салы¬
гыз, һәм 28 нче рәсемдә күрсәтелгәнчә, штативка беркетегез.
Саклык белән генә, бары тик тоз тулысынча чыланырлык итеп,
куертылган сульфат кислотасы өстәгез. Пробирканы шунда ук
газүткәргеч көпшәле бөке белән каплагыз. Көпшәнең очын '/4
өлешенә кадәр су салынган пробиркага төшерегез, ләкин суга
155
батырмагыз. Көпшәнең очы судан 0,5 см өстәрәк торырга тиеш.
Катнашма салынган пробирканы җылытыгыз.
Водород хлориды суда эрегәндә нинди тышкы билгеләр кү¬
ренүенә игътибар итегез. Күзәтүләрегезне аңлатып бирегез.
Пробиркада реакция тәмамланганнан соң, җылытуны туктаты¬
гыз. Хасил булган хлорид кислотасын киләсе тәҗрибәләр өчен
файдаланырсыз.
Үткәрелгән реакциянең тигезләмәсен языгыз.
2 нче тәҗрибә. Хлорид кислотасының үзлекләре. Үзегез тап¬
кан хлорид кислотасын өч пробиркага бүлеп салыгыз һәм:
а) сез тапкан эремәнең кислота эремәсе булуын исбатлагыз.
Хлорид кислотасының электролитик диссоциациясе тигезләмәсен
төзегез; б) хлорид кислотасы эремәсенә цинк грануласы сал¬
ганда нәрсә булуын тикшерегез. Реакция тигезләмәсен төзегез;
в) водород хлориды эремәсенә магний оксиды салганда нәрсә
булуын тикшерегез. Реакция тигезләмәсен языгыз.
3 нче тәҗрибә. Хлоридлар. Хлорид-ионга сыйфат реакциясе.
a) Cl- ионына сезгә таныш булган реактивны кулланып, бу
ионнарның водород хлориды һәм натрий хлориды эремәләрендә
барлыгын тикшерегез. Төшкән утырымнарга 1 әр мл нитрат кис¬
лотасы өстәгез. Утырымнар эриләрме? Күзәтелгән реакцияләрнең
тигезләмәләрен төзегез, б) 1 мл натрий карбонаты эремәсенә
берничә тамчы көмеш нитраты эремәсе өстәгез. Күзәтү нәтиҗә¬
сен тозларның эрүчәнлеген күрсәткән таблицадагы мәгълүмат¬
лар белән чагыштырыгыз (кушымтаны карагыз). Реакция ти¬
гезләмәсен языгыз. Утырымның нитрат кислотасында эрүен яки
эремәвен тикшерегез. Көмеш хлориды утырымының көмешнең
башка тозлары утырымнарыннан аермасы нидән гыйбарәт?
«ЭРЕМӘДӘ ЭРЕГӘН МАТДӘНЕҢ
КҮПМЕ БУЛУЫН КҮРСӘТҮ ЫСУЛЛАРЫ АРАСЫНДА
ҮЗАРА БӘЙЛЕЛЕК» ТЕМАСЫНА КАРАТА КҮНЕГҮЛӘР
Күнегүләрне үтәүгә керешкәнче, эремәдә эрегән матдәнең
күпме булуын күрсәтүнең сезгә таныш булган ысулларын хә¬
терегезгә төшерегез.
1 нче мисал. Хлорид кислотасының 7,05% лы (р= 1,035 г/мл)
250 мл эремәсен хәзерләү өчен суда нинди күләмдәге (н.ш.)
водород хлоридын эретергә кирәк?
250 мл эремәнең массасы: m=Vp
250 мл-1,035 г/мл = 258,75 г тәшкил итә.
7,05% лы эремә хәзерләү өчен кирәк булган водород хлори¬
дының массасы
7,05 г-258,75 г
100 г
= 18,22 г га тигез.
156
Л4(НС1) = 36,45 г/моль, Vm = 22,4 л/моль. Димәк, 11,2 л чамасы
(н.ш.) HCl эретергә кирәк.
1 нче бирем. 20° C та аммиакның судагы эремәсендә 26%
аммиак була (р = 0,904 г/мл). 1 л шундый эремәдә ничә грамм
аммиак булыр? Бу эремәнең моляр концентрациясе нинди?
2 нче бирем. 62% лы (р= 1,45 г/мл) 750 мл эремәдә ничә
грамм фосфат кислотасы Н3РО4 бар?
2 нче мисал. 2,3% лы 75 мл сульфат кислотасы эремәсе
(р= 1,015 г/мл) белән алмашу реакциясенә керү өчен ничә
грамм барий хлориды кирәк булыр?
2,3% лы 75 мл сульфат кислотасы эремәсенең массасы:
75 мл-1,015 г/мл = 76,125 г.
2,3% лы эремәдә сульфат кислотасы
2,3 г-76,1 г . _с
100 ,-- =1’75 г була-
Алмашу реакциясенең тигезләмәсен төзик:
BaCl2H-H2SO4 = BaSO4I+2НС1
M(BaCl2) =208 г/моль; M(H2SO4)=OS г/моль.
Реакция тигезләмәсе буенча:
BaCl2
1 моль-208 г/моль
1,75 г
H2SO4
1 моль-98 г/моль
= BaSO4I+2HCI
208 г-1,75 г .
98 г 1
г
Җавап. Алмашу реакциясе өчен 3,71 г BaCl2 кирәк.
3 нче бирем. 11% лы натрий гидроксиды эремәсенең моляр
концентрациясе нинди (р= 1,12 г/мл)? 6,16 моль/л концентра¬
цияле 1 л хлорид кислотасы эремәсен нейтральләштерү өчен
натрий гидроксидының югарыда күрсәтелгән эремәсе нинди кү¬
ләмдә кирәк булыр?
4 нче бирем. 12,2% лы 30 мл хлорид кислотасы эремәсе
(р= 1,06 г/мл) белән алмашу реакциясе өчен ничә грамм кө¬
меш нитраты кирәк булыр?
§ 49. ХЛОРНЫҢ КИСЛОРОДЛЫ КУШЫЛМАЛАРЫ
Химик элементны өйрәнү өчен белешмәлекнең 4 нче биремен башкарыгыз
(§ 40 ны карагыз).
Кислород белән булган кушылмаларында хлор уңай оксид¬
лашу дәрәҗәләре күрсәтә, мәсәлән:
157
Хлорның
Хлорның
оксидлашу
оксидлашу
дәрәҗәсе + 1
дәрәҗәсе +7
Оксидлар
Cl2O
Cl2O7
Кислоталар
HClO
HClO4
гипохлорит
перхлорат
Тозлар
KCio
KClO4
гипохлорит
перхлорат
Хлор кислород белән турыдан-туры тәэсир итешми. Аның
кислородлы кушылмаларын читләтеп табалар. Әйтик, фтордан
аермалы буларак, хлор су белән тәэсир итешкәндә ике кислота
барлыкка китерә:
Ci2H-H2O = HCIH-HCIO
Бу реакциядә бары тик бер генә элементның — хлорның ок¬
сидлашу дәрәҗәсе үзгәрә:
о +1
Cl-^Cl
O -I
С1->С1
HClO кислородлы кислота гипохлорит кислотасы дип атала.
Хлор су белән үзара тәэсир итешкәнлектән, хлорлы суда хлор,
хлорид кислотасы һәм гипохлорит кислотасы була.
Гипохлорит кислотасы бик тотрыксыз. Җылытканда яисә
хәтта яктыда да ул таркала:
2НСЮ = 2НС1Ң-О2
Гипохлорит кислотасы — көчле оксидлаштыручы. Ул, атап
әйткәндә, буяу матдәләрен тарката. Мәсәлән, шәмәхә карага
яки лакмус эремәсенә манып буялган кәгазь аның тәэсиреннән
төссезләнә.
58 нче рәсемдә күрсәтелгән приборда тәҗрибә үткәрик. Банкадагы коры
хлор төсле тукыманы төссезләндерми, ягъни буягыч матдәне таркатмый. Cy са¬
лынган банкада хлор андагы су белән тәэсир итешә — тукыманы төссезлән¬
дерүче гипохлорит кислотасы хасил була.
Гипохлорит кислотасының тозларын — гипохлоритларны —
селте эремәләренә хлор белән тәэсир итеп табалар:
Cl2 4-2ОН" = Cl-+ CIO--I-H2O
Cl2+ 2К0Н = KCl+ KClO+ H2O
Гипохлоритлар — көчле оксидлаштыручылар. Гипохлорит
кислотасының тозы — кальций гипохлориты Ca(ClO)2 киң кул-
158
ланыш таба. Бу тоз хлорлы известь составына керә. Хлорлы из¬
весть— зәһәр исле көпшәк порошок. Аны суны йогышсызлан¬
дыру, дезинфекция ясау өчен кулланалар, аны шулай ук чүп-чар
чокырларына сибәләр.
Хлор (I) оксиды С1гО — үтә тотрыксыз саргылт-көрән газ.
Cy белән тәэсир итешкәндә гипохлорит кислотасы, ә селтеләр бе¬
лән реагирлашканда гипохлоритлар хасил итә.
Хлорның 4-7 югары оксидлашу дәрәҗәсе Cl2O? оксидында,
перхлорат кислотасында НСЮ4 һәм аның тозлары — перхло-
ратларда чагыла. Хлор (VII) оксиды CI2O7 — майсыман сыек¬
лык, су белән актив реагирлаша һәм перхлорат кислотасы ха¬
сил итә.
Хлорның башка кислородлы кушылмаларыннан калий хло¬
раты КСЮз тозы киң кулланыла. Гадәттә аны бертолет тозы дип
атыйлар. Бу тозны хлор кайнар селте эремәсе белән тәэсир
итешкәндә табалар:
ЗС124-6КОН = 5КС14-КСЮз4-ЗН2О
0 +5
Cl > Cl
о — 1
Cl—+ Cl
0 +5 -1
6С1 = Cl 4- 5С1
ЗС124-6ОН- = 5С1-4-С1Оз“4-ЗН2О
159
Җылытканда бертолет тозы кислород аерып чыгару белән
таркала:
2КС1Оз = 2КС1 + ЗО2|
Төрле янучан матдәләр белән (күкерт, күмер, фосфор) бер¬
толет тозы КСЮз бәрелүдән шартлый торган катнашмалар бар¬
лыкка китерә. Бертолет тозының төп өлеше шырпы җитештерү
промышленностенда кулланыла. Гадәти шырпы башында бер¬
толет тозының КСЮз масса өлеше 50% чамасы тәшкил итә.
Бертолет тозын пиротехникада (пирос — «ут») сигнал ракета¬
лары, бенгаль уты һәм башка җиңел кабынучы катнашмалар
хәзерләү өчен кулланалар.
? 1. 245 г бертолет тозы таркалганда ничә литр (н.ш.) кислород табарга
мөмкин?
▲ 2. а) Хлор (I) оксидының; б) хлор (VII) оксидының селте белән реакция¬
ләре тигезләмәләрен языгыз.
3. Калий гидроксиды эремәсендәге хлор «эремәсен» парга әйләндереп,
К. Бертолле калий хлориды белән беррәттән яңа тоз тапкан. Соңыннан бу
тозны аның исеме белән атаганнар. Бу реакциядә калий хлоридының берто¬
лет тозына караганда күп тапкырга артыграк хасил булу факты Бертолле-
ны аптырашка калдырган. Бу фактка аңлатма бирегез.
4. Түбәндәге әверелешләрнең реакция тигезләмәләрен языгыз:
НС1-*С12->НС1О->НС1
§ 50. ГАЛОГЕННАРНЫҢ ЧАГЫШТЫРМА
ХАРАКТЕРИСТИКАСЫ
Ни өчен фтор, хлор, бром һәм йод элементларның галогеннар табигый
семьялыгын тәшкил итәләр? Җавапны сезгә билгеле булган эксперименталь
фактлар һәм аларның теоретик аңлатмалары белән дәлилләгез.
9 нчы таблицадагы мәгълүматларны чагыштырыгыз һәм га¬
логеннарның нинди үзлекләре аларның атом номерлары арту
белән закончалыклы рәвештә үзгәрүен күрсәтегез.
Фтор төркемчәсе элементларының гади матдәләр рәтендә хи¬
мик активлыклары үзгәрүен анализлыйк. Моның өчен водородны
галогеннар белән оксидлаштыру реакцияләренең җылылык эф¬
фектлары кыйммәтләрен алыйк:
H2+F2 = 2HF,
Н2 + С12 = 2НС1,
Н2 + Вг2 = 2НВг,
Н2 + 12 = 2Н1,
A// = —541 кДж
AH = -186 кДж
AH = —68 кДж
AH = +53 кДж
Китерелгән мәгълүматлардан күренгәнчә, F2 — Cl2 — Br2 — I2
рәтендә галогеннарның водород белән реакцияләренең җылы¬
лык эффектлары кискен үзгәрә.
Иң күп микъдарда җылылык фторның водород белән реак¬
циясе вакытында аерылып чыга. Башка галогеннардан аермалы
160
9 нчы таблица. Галогеннарны» үзлекләре
Характеристика
Элементлар, гади матдәләр
фтор
хлор
бром
йод
Атом номеры
9
17
35
53
Чагыштырма атом масса¬
сы
18,998
35,45
79,90
126,90
Атомның тышкы катлавы¬
ның электроннар конфи¬
гурациясе
2s22p5
3s23p5
4s24p5
Ss2Sp5
Атомның ионлашу энергия¬
се, кДж/моль
1681
1251
1142
1008
Гадәти шартлардагы хәле
Г аз
Газ
Сыеклык
Кристаллар
Төсе
Ачык-яшел
Саргылт-
яшел
Коңгырт-
кызыл
Kapacy-
соры'
Эретелү температурасы, ° C
— 219,6
-101,03
—7,25
113,6
Кайнау температурасы, ° C
-188,13
— 34,1
59,2
185,5
1 Йодның парлары шәмәхә төстә. Бу йод элементының исеменә сәбәпче бул¬
ган (грекча иодос — «шәмәхә»).
буларак, йодның водород белән реакциясе гадәттәге шартлар¬
да — эндотермик процесс. Реакцияләрнең җылылык эффектлары
кимү — галогеннарның водородка карата оксидлаштыру актив¬
лыклары түбәнәюне күрсәтә.
Моның сәбәбе нидән гыйбарәт соң? HF — HCl — HBr — HI
рәтендә химик бәйләнешләрнең ныклыгы кими. Ә бу аларга
туры килүче галогеннарның атомнарында тышкы орбитальләрнең
зурлыклары арту (электроннар болытларының тыгызлыгы кими)
белән аңлатыла. Моннан шундый нәтиҗә килеп чыга: водород
атомы һәм галоген атомы электрон болытларының аралашу ты¬
гызлыгы кими (52 нче рәсемне карагыз). HF — HCl — HBr — HI
рәтендә бәйләнешнең ныклыгы кимүе F2—Cl2—Br2-I2 рәтендә
оксидлаштыру активлыгы түбәнәюнең төп сәбәбе булып тора.
Галогеннарның химик (оксидлаштыру) активлыклары бердәй
булмауны бер галогенны башка, активрак, галоген белән кыс¬
рыклап чыгару реакцияләрендә күзәтергә мөмкин. Натрий бро¬
миды эремәсенә хлорлы су өстик. Эремә шунда ук коңгырт
төскә керә. Бу вакытта бром аерылып чыга:
2NaBr + Cl2 = 2NaCl + Br2
-1 о
2Вг Br2
0 —1
Cl 2С1
1 1 П-236
161
59 нчы рәсем. Галогеннар молекулала¬
рының термик диссоциациясе.
Калий иодиды эремәсенә
бромлы су салганда, йод аеры¬
лып чыгу аркасында, эремә
коңгырт төскә керә:
2KI + Br2 = SKBr +12
-1 о
21 12
0 -I
Br2 2Вг
Иод аерылып чыгуны, эремәгә
крахмал эремәсе өстәп, бик җиңел ис¬
батларга мөмкин. Ирекле иод крахмал
белән куе зәңгәр төстәге продукт хасил
итә. Шуңа күрә крахмал йодка, һәм
киресенчә, иод крахмалга реактив бу¬
лып тора. Бу реакцияне иод-крахмал
реакциясе дип атыйлар.
Шулай итеп, бу реакцияләрдә химик (оксидлаштыру) актив¬
лык үзгәрүнең шул ук закончалыгы күренә: хлордан йодка таба
ул кими бара.
Бромның һәм йодның кушылмалары диңгез суларында һәм
нефть ятмалары суларында очрый, кайбер диңгез суүсемнәре
дә йодка бай булалар. Иод безнең организмыбызда да бар.
Йодның җитешмәве калкансыман бизнең эшчәнлеге бозылуга
һәм кешедә базед авыруы барлыкка килүгә сәбәп була. Йодның
кушылмалары организмга азык белән керә. Натрий иодиды еш
кына аш тозына катышкан була. Бромның һәм йодның кушыл¬
маларын медицинада да кулланалар.
60 нчы рәсем. Хлор (а) һәм иод (б) атомнары үзара тәэсир итешкәндә төшләр
арасы ераклыгына бәйле рәвештә потенциаль энергиянең үзгәрүе.
162
10 нчы таблица. Кайбер продуктларда
крахмал барлыгын тикшерү нәтиҗәләре
Продуктның
исеме
Иод тәэсирендә
төсе үзгәрәме
Нәтиҗә
Бәрәнге
Суганбаш
Алма
Чөгендер
Кишер
Ак икмәк
Oh
1. Галогеннарның кристаллык челтәрләре төеннәрендә нинди кисәкчекләр
урнашкан (41 нче рәсем)?
A 2. 59 нчы рәсем буенча аңлатып бирегез: а) ни өчен хлор, бром һәм йод
молекулаларының тотрыклылыклары төрле? б) ни өчен температура күтә¬
релгән саен молекулаларның атомнарга таркалу (диссоциация) дәрәҗә¬
се арта?
3. 60 нчы рәсемдә ике атомнан торган системаның: а) хлорның; б) йод¬
ның — атомнары арасындагы ераклыкка бәйле рәвештә потенциаль энер¬
гиясе үзгәрү күрсәтелгән. Ни өчен минимумның тирәнлеге һәм потенциаль
энергия кәкресенең абсциссалар күчәрендәге торышлары төрле?
4. а) Бром; б) водород бромиды молекулалары ясалганда электрон болыт¬
ларының аралашу схемаларын ясап күрсәтегез. Бәйләнешнең ныклыгы бу¬
енча бром молекуласы башка галогеннарның молекулаларыннан ничек ае¬
рылып тора һәм бу нәрсә белән аңлатыла? Водород бромиды молекуласы
бәйләнешенең ныклыгы буенча башка галогеноводородларның молекулала¬
рыннан нәрсә белән аерыла һәм моны ничек аңлатырга була?
5. Алюминийны галогеннар белән оксидлаштыру реакцияләренең тигез¬
ләмәләрен языгыз. Әгәр алюминий галогенидлары хасил булуга түбәндәге
җылылык эффектлары туры килсә,
ничек үзгәрә:
галогеннар
рәтендә химик активлык
AlF3
AlCl3
AlBr3
All3
A//, кДж/моль
— 1510
—704
—513
—308?
6. Йодны иод
ләнгән?
настойкасы
рәвешендә
куллану аның нинди үзлегенә нигез-
1. Cy салынган пробиркага бер тамчы йод настойкасы өстәгез. Суның төсе
үзгәрми диярлек. Икенче пробиркада су белән крахмалны катнаштырып
болгатыгыз һәм бераз гына беренче пробиркадагы эремәне өстәгез. Сез
нәрсә күзәтәсез? Яшелчәләрдә һәм җимешләрдә, икмәктә, онда, төелгән
ярмада, шулай ук үсемлекләрдән җитештерелгән теләсә нинди азык про¬
дуктында крахмал барлыгын тикшерегез. Тикшеренүләрегезнең нәтиҗәләрен
таблицага языгыз (10 нчы таблицаны карагыз).
2. Бу бүлеккә карата тәкъдим ителгән әдәбияттан файдаланып, галогеннар¬
ны ачу тарихы буенча чыгыш ясарга хәзерләнегез.
163
16 нчы лаборатор дәрес
ГАЛОГЕННАР
1 нче тәҗрибә. Калий бромиды һәм калий иодиды эремәлә¬
ренә тамчылап хлорлы су өстәгез. Күзәтүләрегезне аңлатып би¬
регез. Реакцияләрнең тигезләмәләрен төзегез. Аларның асылы
нидән гыйбарәт? ,
2 нче тәҗрибә. Калий хлориды һәм калий иодиды эремәлә¬
ренә бромлы су өстәгез. Нәрсә күзәтәсез? Иод аерылып чыгуын
ничек итеп тикшерергә мөмкин? Башкарылган реакциянең тигез¬
ләмәсен төзегез. Аның асылы нидән гыйбарәт? Оксидлаштыру
активлыклары буенча галогеннарны бер рәткә нинди эзлеклелек-
тә урнаштырырга мөмкин?
3 нче тәҗрибә. Көмеш бромидының һәм көмеш йодидының
суда эрүчәнлеген тикшерегез. Бу тозларны, тиешле эрүчән тоз¬
ларын кулланып, алмашу реакцияләре ярдәмендә табыгыз. Тыш¬
кы күренешләре белән көмеш бромиды, көмеш иодиды һәм кө¬
меш хлориды ничек аерылып торалар? Реакцияләрнең тигез¬
ләмәләрен төзегез һәм бу реакцияләрнең асылын аңлатып бире¬
гез.
4 нче тәҗрибә. Өч пробиркада натрий хлориды, натрий бро¬
миды, натрий иодиды каты матдәләре бирелгән, һәр матдәнең
кайсы пробиркада икәнлеген танып белегез.
5 нче тәҗрибә. Натрий хлоридында натрий иодиды катыш¬
масы юкмы, шуны ачыклагыз.
ХИМИК РЕАКЦИЯЛӘРНЕҢ
ГОМУМИ ЗАКОНЧАЛЫКЛАРЫ
Химик реакцияләрнең закончалыкларын белү, аларны тор¬
мышка ашыру буенча прогноз ясарга, алар белән идарә итәр¬
гә һәм үзлекләре алдан билгеләнгән матдәләр табарга мөмкин¬
лек бирә.
Бу бүлектә без химик реакциянең узу мөмкинлеген һәм аның
тизлеген нинди факторлар билгеләвен тикшерербез.
§ 51. ХИМИК РЕАКЦИЯЛӘРНЕҢ ЭНЕРГЕТИКАСЫ
Физика дәреслегеннән энергия саклану һәм әверелү законына кагылыш¬
лы материалны кабатлагыз.
Химик әверелеш вакытында атомнарның, ионнарның, моле¬
кулаларның электроннар структуралары үзгәреп яңадан төзелә.
Шуңа күрә химик реакция һәрвакытта энергетик үзгәрешләр
белән бара.
Реакцияләрнең җылылык эффектларын эксперименталь рә¬
вештә дә, термохимик исәпләүләр ярдәмендә дә билгелиләр.
Термохимик исәпләүләрнең нигезендә Г. И. Гесс тарафыннан
әйтелгән закон ята:
Реакциянең җылылык эффекты башлангыч матдәләрнең һәм
ахыргы продуктларның төренә һәм халәтенә бәйле һәм процесс¬
ның ничек булып узуына бәйле түгел.
Күмернең тулысынча яну реакциясенең термохимик тигез¬
ләмәсен (Термохимик тигезләмәләрдә матдәнең халәте күрсәте¬
лә: г—газ; с — сыеклык; к — кристаллик матдә; э —эрегән мат¬
дә) тикшерик:
C (к)+O2 (г)=СО2 (г), А//,= -393,5 кДж
Әйтик, бу реакция ике стадиядә уза ди. Башта күмер янганда
углерод (II) оксиды CO хасил була:
C (к) +‘/гОг (г) =CO (г), AZZ2 = —110,5 кДж
Аннары CO янганда углерод (IV) оксиды CO2 барлыкка килә:
CO (г) -J- 1Z2O2 (г)=СО2 (г), AZZ3= —283,0 кДж
165
С(к)+О2(г)
AH2=-HOtS кДж
coW2 O2 (г)
AH1=-393,5кДж AH3 =
=-263кДж
С02(г)
Энергия
, СНь(г)+20г(г]
AH1 =
=-890кДж
AH2=-607 кДж
СО/г^гШ)
,, ,, АН3=-283кДж
CO2(^HtOfr)
62 нче рәсем. Метан (CH4) янганда
аерылып чыккан җылылык микъдары
реакциянең бер яки ике стадиядә узуы¬
на бәйле түгел (AZZi =AZZ2 +AZZ3).
61 нче рәсем. Күмер (C) янганда аеры¬
лып чыккан җылылык микъдары реак¬
циянең бер яки ике стадиядә узуына
бәйле түгел (AZZi=Ahr2-I-AZZ3).
Бу ике стадиянең суммасын чыгарыйк:
C (K)H-V2O2 (г)=СО (г), AZZ2 = —110,5 кДж
CO (г) + '/2О2 (T)=CO2 (г), AZZ3= -283,0 кДж
C (K)H-O2 (T)=CO2 (г), AZZ2H-AZZ3 =
— — 110,5 кДж Ң- (— 283,0 кДж) = — 393,5 кДж
Гесс законы буенча CO2 хасил булуның җылылык эффект¬
лары, ул турыдан-туры гади матдәләрдән барлыкка килгәндә
дә, CO хасил булу һәм яну арадаш стадияләре аркылы бар¬
лыкка килгәндә дә бертигез икән:
AzZi=AZZ2H-AZZ3= -393,5 кДж
Югыйсә, энергия саклану законы бозылыр иде. Китерелгән фи¬
кер йөртүләр 61 нче рәсемдә диаграмма рәвешендә күрсәтелгән.
Башлангыч, арадаш матдәләрнең һәм ахыргы продуктларның
энергияләре дәрәҗәләрендәге аермалар диаграммада тиешле ре¬
акцияләрнең җылылык эффектларына туры киләләр. Бу диа¬
грамма буенча AZZi = AZZ2 Ң- AZZ3.
Күренекле рус химигы Герман Иванович Гесс (1802—1850)—Россиядә
термохимик тикшеренүләргә нигез салучы. Химия белән ул студент елларында
ук шөгыльләнә башлаган. Термохимик тикшеренүләр белән беррәттән, ул ми¬
нералларны, платинаны һәм аның каталитик тәэсирен, умарта корты балавы¬
зын һәм төрле сумалаларны өйрәнгән; Уралга, Байкал күле районына үткә¬
релгән экспедицияләрдә катнашкан. Гесс, Россиянең барлык уку йортлары өчен
озак еллар дәвамында химиядән төп уку китабы саналган, химия дәреслеген
язган.
166
Зур фәнни казанышлары өчен Г. И. Гесс Петербург фәннәр академиясе¬
нең академигы итеп сайланган. Фәнни тикшеренүләр белән бер вакытта ул зур
педагогик эшчәнлек тә алып барган: Петербург педагогия институтында, Tay
академиясендә, Артиллерия училищесында укыткан.
? 1. Күмер тулысынча янып бетмичә CO хасил иткәндә, реакциянең җылылык
эффектын эксперименталь рәвештә билгеләп булмый. Аны күмернең (C)
▲ углерод (IV) оксидына ((.(J2) кадәр яну һәм углерод (II) оксидының
(CO) углерод (IV) оксидына (СОг) кадәр яну реакцияләренең җылылык
эффектларыннан исәпләп чыгарырга мөмкин. Моны ничек башкарырга була?
2. 62 нче рәсемдә метанның СНч тулысынча яну һәм аның стадияләп яну
диаграммасы күрсәтелгән. Метанның, углерод (II) оксиды CO хасил итеп,
тулы булмаган януы җылылыгын исәпләп чыгарыгыз.
3. Сез ничек уйлыйсыз, ни өчен термохимик тигезләмәләрдә матдәнең ха¬
ләтен күрсәтәләр?
«ХИМИК КУШЫЛМАНЫҢ ЯСАЛУ ҖЫЛЫЛЫГЫ» ТЕМАСЫНА
КАРАТА КҮНЕГҮЛӘР
Бу дәрестә сез кушылмаларның ясалу җылылыкларын, кул¬
ланып термохимик исәпләүләр башкару белән танышырсыз.
Матдәнең ясалу җылылыгы дип гади матдәләрдән 1 моль
матдә хасил булу реакциясенең җылылык эффектын атыйлар.
Ясалу җылылыгын А//ясалу дип билгелиләр, кДж/моль белән
күрсәтәләр.
Тотрыклы гади матдәнең ясалу җылылыгы нульгә тигез.
Менә җылылык эффектлары 1 моль продуктның ясалу җы¬
лылыгына туры килгән реакцияләргә мисаллар:
Н2 (г) + 1 /2О2 (г) = H2O (г), АЯдсалу (H2O) = —241,8 кДж/моль
C (к) + O2 (г)=СО2 (г), А//ясалу (СОг) = —393,5 кДж/моль
4 мең чамасы матдә өчен ясалу җылылыклары билгеле. Алар
белешмәлекләрдә (кушымтадагы әдәбият исемлеген карагыз)
күрсәтеләләр. Кайбер химик кушылмаларның ясалу җылылык¬
лары кушымтада бирелгән.
Ясалу җылылыклары билгеле булганда, бары тик исәпләү¬
ләр нигезендә генә дә, бик күп төрле процессларның энергетик
эффектларын ачыкларга мөмкин.
Гесс законы буенча, реакциянең җылылык эффекты реак¬
ция продуктларының ясалу җылылыклары суммасы белән баш¬
лангыч матдәләрнең ясалу җылылыклары суммасы арасындагы
аермага тигез.
I нче мисал. Күмернең углерод (II) оксидына оксидлашу
реакциясенең җылылык эффекты нинди?
Реакциянең тигезләмәсе:
C (к)+ 1AO2 (г)=СО (г)
Бу — гади матдәләрдән кушылма хасил булу реакциясе, ягъ¬
ни аның җылылык эффекты углерод (II) оксидының CO ясалу
җылылыгына туры килә. Кушымтадан күренгәнчә, соңгысы, ягъ-
167
ни AWacajiy (СО) = —110,5 кДж/моль. Ул вакытта реакциянең
җылылык эффекты:
AW=I моль-(—110,5 кДж/моль) = —110,5 кДж.
C (к) + '/2О2 (г)=СО (г), AW = -110,5 кДж.
1 нче бирем. Гади матдәләрдән: а) углерод (IV) оксиды;
б) күкерт (IV) оксиды; в) алюминий (III) оксиды хасил булу
реакцияләренең тигезләмәләре һәм җылылык эффектлары нинди?
2 нче мисал. Алюминий оксиды һәм күкерт (Vl) оксиды
арасында тоз — алюминий сульфаты хасил булып уза торган ре¬
акциянең җылылык эффектын исәпләп чыгарырга.
Реакциянең тигезләмәсен төзик:
Al2O3 + BSO3 = Al2(SO4)3
Бу реакциянең җылылык эффекты продуктның ясалу җылылыгы
белән башлангыч матдәләрнең ясалу җылылыклары суммасы
арасындагы аермага тигез була:
AW—1 МОЛЬ • AДдсалу А1г(50л)з [1 МОЛЬ - AWacajly AhO1 —F
+ 3 МОЛЬ • A Wacajly SOs ]
Бу тигезләмәгә матдәләрнең 9 нчы таблицадан табылган (ку¬
шымтаны карагыз) ясалу җылылыкларын куеп чыгыйк:
АД=1моль (—3442 кДж/моль) —
— [1 моль (—1676 кДж/моль) +
+ 3 моль (—396 кДж/моль)] = —578 кДж
Реакциянең җылылык эффекты AW = —578 кДж тәшкил итә.
Экзотермик реакция, җылылык аерылып чыгу белән бара.
Ai2O3-I-SSO3 = AI2(SO4)3, AW= -578 кДж
2 нче бирем. Реагентларның һәм реакция продуктларының
ясалу җылылыклары буенча түбәндәге реакцияләрнең җылылык
эффектларын исәпләп чыгарыгыз:
а) SO2 (г) + '/2О2 (r) = SO3 (г)
б) CaO (к)+СО2 (г) =CaCO3 (к)
в) CaCO3 (к)=СаО (к)+СО2 (г)
г) 2Н2 (г)+02 (г)=2Н2О (г)
д) 4FeS2 (к)+ IlO2 (r)=2Fe2O3 (k)+8SO2 (г)
е) 2H2S (г) +3O2 (г) =2SO2 (г) + 2Н2О (г)
ж) 2H2S (г)+O2 (r)=2S (к)+2Н2О (г)
з) 2КС1О3 (к)=2КС1 (к)+ЗО2 (г)
Бу реакцияләрнең кайсылары — экзотермик, ә кайсылары
эндотермик реакцияләр?
3 нче бирем. Ацетиленның C2H2 яну җылылыгын исәпләп
чыгарыгыз.
4 нче бирем. Сыек суның парга әверелү җылылыгы нинди?
H2O (с)->Н2О (г)
§ 52. ДИНАМИК ТИГЕЗЛӘНЕШ
а) Сыеклык парга әйләнгәндә; б) пар куерганда (конденсацияләшкәндә)
нинди закончалыклар күзәтелә? Әгәр бу сорауларга җавап бирергә кыенсын¬
сагыз, VHI класс өчен физика дәреслегеннән файдаланыгыз.
Бериш процесслар үзләреннән-үзләре узалар, ә башкалары —
юк. Газ тутырылган баллонны ачсаң, газ баллоннан бөтен
бүлмәгә тарала. Шикәр үзеннән-үзе суда эри, спиртта йод эри.
Ачык савыттагы су үзлегеннән парга әверелә. Барлык бу про¬
цессларның ниндидер бер уртаклыгы бар. Башта матдәне (су,
шикәр, йод) тәшкил итүче молекулалар аз күләм биләп торды¬
лар. Процесс нәтиҗәсендә (парга әверелү, эрү) алар зуррак
күләмгә таралдылар (пар, эремә). Система кисәкчекләре тәр¬
типлерәк урнашкан халәттән кисәкчекләре тәртипсезрәк урнаш¬
кан халәткә күчте: системада тәртипсезлек дәрәҗәсе артты.
Системадагы тәртипсезлек дәрәҗәсен характерлау өчен
энтропия дип аталган зурлык кабул ителгән (грекча «әвере¬
лү»). Аны S дип билгелиләр. Система тәртиплерәк халәттән
тәртипсезрәк халәткә күчкәндә энтропия арта (AS >0).
Системаның тәртипсезрәк халәттән тәртиплерәк халәткә кү¬
чүе исә энтропиянең кимүе белән бәйләнгән (AS <0). Мондый
процессның үзлегеннән узуы бик шикле. Әйтик, газның үзеннән-
үзе җыелуын, туендырылмаган эремәдән шикәр кристаллары ае¬
рылып чыгуны күз алдына китерүе мөмкин түгел.
• Системада тәртипсезлекнең арту тенденциясен энтропия фак¬
торы характерлый.
Шулай итеп, табигатьтә энтропия факторы бар. Алай булгач
ни өчен соң газсыман матдәләр генә түгел, ә каты һәм сыек
матдәләр дә гамәлдә калалар? Ни өчен атомнардан молекула¬
лар барлыкка килүне хәтергә төшерик (40 нчы, 60 нчы рәсем¬
нәрне карагыз). Система тәртипсезрәк халәттән (ирекле атом¬
нар) тәртиплерәк халәткә (атомнар молекулаларга берләшкән¬
нәр) күчә. Сез атомнардан молекулалар барлыкка килгәндә
энергия аерылып чыгуын (АЯ<0) беләсез. Шулай итеп, таби¬
гатьтә системаның иң аз (минималь) энергияле халәткә омты¬
лышы чагыла. Бу тенденцияне энергетик фактор дип атыйк.
Шулай булгач, табигатьтә капма-каршы ике тенденция
чагыла: тәртипсезлеккә омтылыш (энтропия факторы) һәм тәр¬
типкә омтылыш (энергетик фактор). Кайсы фактор өстенлек алу¬
дан процессның юнәлеше бәйле була.
Энтропия факторы матдәләрнең эретелүен һәм парга әйлә¬
нүен, молекулаларның атомнарга таркалуын билгели; энергетик
фактор пар куерганда, сыеклыклар кристаллашканда, атомнар
молекулаларга яки кристалларга берләшкәндә һ. б. очракларда
чагыла.
Ә энтропия факторының тәэсире энергетик факторның тәэ¬
сире белән тигезләшкәндә ни була соң?
169
Түбәндәге тәҗрибәне күз алдына китерик. Ябык савытта
су салынган ампуланы ватканда су парга әверелә башлар. Лә¬
кин ябык савытта парга әйләнүнең билгеле бер чиккә кадәр —
пар белән туенганга кадәр генә булуы мөмкин. Ни өчен ябык
савытта парга әйләнүнең чиге бар? Сез парга әверелүнең эн¬
дотермик процесс икәнлеген беләсез. Шул рәвешчә, энергетик
фактор энтропия факторын чикли. Бер факторның йогынтысы
икенче факторның йогынтысын тигезләштергәндә тигезләнеш
урнаша. Бу очракта суның һәм су парларының микъдарлары
үзгәрми.
Әмма тигезләнеш һич тә процесслар тукталуын белдерми.
Парга әйләнү һәм конденсацияләшү процесслары өзлексез дә¬
вам итәләр. Пардагы молекулалар, су өслегенә бәрелеп, шунда
ук суга күчәләр. Шул ук вакытта башка молекулалар сыеклык¬
тан аерылып китәләр һәм парга күчәләр. Шуның белән бергә,
бер вакыт берәмлегендә парга әйләнгән молекулалар саны кон¬
денсацияләшкән молекулалар санына тигез була.
Парга әйләнүнең тизлеге конденсацияләшү тизлегенә тигез¬
ләшә. Шулай итеп, динамик тигезләнеш урнаша. Системаның
«сыек су —су пары» тигезләнеш халәтен мондый схема белән
күрсәтергә мөмкин:
НгО (сыеклык)^H2O (пар)
(Тигезләнеш халәтен капма-каршы юнәлдерелгән уклар белән
күрсәтү кабул ителгән).
Бер үк вакытта ике капма-каршы юнәлештә (туры һәм ки¬
ре) бара торган процесслар кайтма процесслар дип аталалар.
Динамик тигезләнеш үзгәрүчән: тышкы шартлар үзгәргәндә
тигезләнеш авыша һәм тигезләнешнең яңа халәте урнаша. Әй¬
тик, без тасвирлаган тәҗрибәдә температураны үзгәрткәндә нәр¬
сә буласын күз алдына китерү кыен түгел. Температураны кү¬
тәргәндә савыттагы парның микъдары артачак. Температураны
төшерү су парларының кимүенә китерер. Шулай итеп, темпера¬
тураны күтәрү тигезләнешне эндотермик процесс ягына авыш¬
тыра. Температураны төшерү исә тигезләнешне экзотермик про¬
цесс ягына авыштыра. Тикшерелә торган очрак өчен болай язар¬
га мөмкин:
температура күтәрелү
Н2О (сыеклык) — » H2O (пар)
температура төшү
? 1. Аңлатып бирегез: нәрсә ул энтропия факторы, энергетик фактор, динамик
тигезләнеш?
2. Энтропия: а) арту; б) кимү белән уза торган физик процессларга ми¬
саллар китерегез.
3. 63 нче рәсемдә кургашны җылытканда аның эчке энергиясе ничек үз¬
гәрүе күрсәтелгән. Кәкрене аңлатып бирегез. Кургашның эчке энергиясе
нык арту нинди процессларга туры килә? Моны ничек аңлатырга була?
4. 64 нче рәсемдә кургашны җылытканда аның энтропиясе ничек үзгәрүе
170
63 нче рәсем. Температурага бәйле рә¬
вештә кургашның эчке энергиясе үз¬
гәрү.
64 нче рәсем. Кургаш энтропиясенең
температурага бәйлелеге.
күрсәтелгән. Кәкрене аңлатып бирегез. Кургашның энтропиясе нык арту
нинди процессларга туры килә? Моны аңлатып бирегез.
5. 65 нче рәсем буенча утырым белән туендырылган эремә арасында нинди
процесслар узуын аңлатып бирегез.
6. Нафталинның парга әверелүе, аның, газлар эремәсе хасил итеп, һавада
эрүе булып тора. Ни өчен ачык савытта нафталин кристаллары, күпме
микъдарда булуга карамастан, вакыт узу белән бөтенләй «юкка чыга»,
ә ябык савытта, нафталинның микъдары җитәрлек булганда, бу күренеш
күзәтелми? Ябык савытта система нинди халәттә була? а) Нафталинның
газлар эремәсенә күчүен; б) нафталин парларының кристаллга күчүен нинди
тенденция билгели?
НафталиН(КпИСТаЛлар) — Нафталин(газ)
7. а) Кристалл эретелгәндә; б) пар куерганда; в) сыеклык парга әйләнгән¬
дә; г) сыеклык кристаллашканда молекулалар урнашуның тәртиплелек
халәте ничек үзгәрә? Бу процессларның кайсылары үзара капма-каршы
юнәлешләрдә уза?
8. Ни өчен суыкта юеш кер кибә? Бу вакытта энергетик һәм энтропия
факторларының тәэсирләре ничек чагыла?
65 нче рәсем. Йодның эрүе (а) һәм туендырылган эремәдә кристаллашуы (б).
171
МАТДӘЛӘРНЕҢ СУДА ЭРҮЧӘНЛЕГЕ» ТЕМАСЫНА
КАРАТА КҮНЕГҮЛӘР
Стаканда калий хлоридының туендырылган эремәсе һәм кристаллар бар.
а) Эремәне җылытканда; б) эремәне суытканда нинди процесслар булып узар?
Ни өчен температура үзгәрмәгәндә без бу процессларны күзәтмибез?
Матдәнең эрүчәнлеген аның бирелгән температурада туен¬
дырылган эремә барлыкка китерә торган массасының яки матдә
микъдарының эреткеч күләменә чагыштырмасыннан табалар.
Гадәттә эрүчәнлекне литрга граммнарда (г/л) яки литрга
мольләрдә (моль/л) күрсәтәләр.
1 нче мисал. 48 г туендырылган эремәне парга әйләндер¬
гәннән соң 28 г тоз кристаллашкан булса, 15° C та калий йо¬
дидының суда эрүчәнлеге күпме?
Мәгълүматлар буенча 48 г туендырылган эремәдә 28 г тоз
бар, ә су 48 г — 28 г = 20 г яки 0,02 л булыр. Ул вакытта эрү-
чәнлек:
WT = 1400 ^
Җавап. 15° C та калий йодидының эрүчәнлеге 1400 г/л
тәшкил итә.
M (KI) = 166 г/моль. Ул вакытта йодның эрүчәнлеге:
1400 г/л
166 г/моль
= 8,4 моль/л
1 нче бирем. 11,64 г массалы фарфор чашкага 15° C та
туендырылган калий нитраты KNOs эремәсе салынган. Чашканың
эремә белән бергә булган массасы 106,4 г, ә эремәне парга
әйләндергәннән соң чашканың массасы 30,54 г тәшкил иткән.
Күрсәтелгән температурада калий нитратының эрүчәнлеген та¬
быгыз. Исәпләүләрнең нәтиҗәсен 66 нчы рәсем буенча тикшере¬
гез.
2 нче мисал. 20° C та натрий хлоридының эрүчәнлеге 360 г/л
тәшкил итсә, аның 20° C та туендырылган эремәсендә натрий
хлоридының масса өлеше нинди?
Мәсьәләнең шарты буенча 360 г массалы натрий хлориды
1000 г массалы суда эрегән. Димәк, бу эремәнең массасы
360 г 4-1000 г= 1360 г га тигез.
Эремәдә натрий хлоридының масса өлеше
X6t?.г =0,2647 яки 26,47% тәшкил итә.
1360 г
Җавап: 26,47%.
2 нче бирем. 40° C та туендырылган эремәдә калий хлориды¬
ның масса өлеше 28,57% тәшкил итә. 40° C та калий хлориды-
172
66 нчы рәсем. Эрүчәнлек кәкреләре.
ның KCl суда эрүчәнлеге нинди? Җавапны 66 нчы рәсемдәге
мәгълүматлар белән чагыштырыгыз.
3 нче бирем. 66 нчы рәсем буенча калий нитратының 20° C та,
40° C та, 60° C та һәм 80° C та суда эрүчәнлеген ачыклагыз.
173
17 нче лаборатор дәрес
ЭКСПЕРИМЕНТАЛЬ МӘГЪЛҮМАТЛАР БУЕНЧА
МАТДӘНЕҢ ЭРҮЧӘНЛЕК КӘКРЕСЕН ТӨЗҮ
Сезгә түбәндә күрсәтелгән тозлардан берсенең: KCl, NaCl,
MgSO-t, K2SO4, NaNOs — төрле температуралардагы (20° С,
40° С, 60° C һәм 80° С) эрүчәнлеген билгеләргә кирәк булачак.
Тикшеренүләрне, 4—5 әр кешегә бүленеп, группаларда баш¬
карырсыз. Сезнең һәркайсыгыз күрсәтелгән температураларның
берсе өчен тозның эрүчәнлеген билгеләр. Табылган нәтиҗәләрне
тоз эрүчәнлегенең температурага бәйлелеге кәкресен төзү өчен
файдаланыгыз (66 нчы рәсемне карагыз). Биремне түбәндәге
эзлеклелектә башкарыгыз:
1. Фарфор чашканы үлчәгез.
2. Химик стаканда күрсәтелгән температурадан 1—2° C ка
югарырак булырлык итеп 40—50 мл су җылытыгыз.
3. Бирелгән температура өчен туендырылган эремә хәзер¬
ләгез. Моның өчен су салынган стаканга, пыяла таякчык белән
болгаткан хәлдә, тозның яңа порциясе эрүдән туктаганчы, аз-
азлап тоз өстәгез.
4. Туендырылган эремәнең температурасын үлчәгез. 25 мл ча¬
масы эремәне алдан үлчәнгән чашкага салыгыз. Эремә салынган
чашканы үлчәгез. Аннары эремәне парга әйләндерегез. Эремәнең
каты кайнамавын һәм тозның як-якка чәчрәмәвен күзәтегез (ял¬
кынны көйләгез).
5. Аерылып чыккан тозлы чашканы суытыгыз, ә аннары үл¬
чәгез.
6. Тозның һәм парга әйләнгән суның массасын исәпләп чы¬
гарыгыз. Бирелгән температурада тозның эрүчәнлеген исәпләгез.
7. Группадагы барлык укучылар тапкан мәгълүматларны
файдаланып, тозның эрүчәнлек кәкресен төзегез.
8. Бирелгән матдәнең сез төзегән эрүчәнлек кәкресен тикше¬
ренү группалары башка матдәләр өчен төзегән эрүчәнлек кәкре¬
ләре белән чагыштырыгыз.
3 Эремәләрнең табигатьтәге әһәмияте турында хикәя төзегез. Башта, табигать
белеме, ботаника, физика курсларында алган белемнәрегезне һәм үзегезнең
тормыш тәҗрибәгездән файдаланып, аның планын төзегез.
Бүлмә гөлләре өчен ашламаларның масса өлеше 2% булган эремә хәзер¬
ләгез. Эремәне бүлмә гөлләрен өстәмә тукландыру өчен кулланыгыз.
§ 53. ХИМИК ТИГЕЗЛӘНЕШ
Нинди шартларда системада динамик тигезләнеш урнаша? Динамик тигез¬
ләнешкә мисаллар китерегез.
Матдәләрнең эрү һәм кристаллашу процесслары (шулай ук
матдәләрнең парга әйләнүе һәм конденсацияләшүе, аларның
ябык савытта куылуы (возгонкасы) һәм кристаллашуы һ. б.)
174
билгеле бер чиккә кадәр генә — системада динамик тигезләнеш
урнашканчы гына — үзлегеннән узуы сезгә таныш инде. Химик
реакцияләрнең узуы да шул закончалыкка буйсына.
Химик реакцияләрнең күпчелеге кайтма реакцияләр, ягъни
бер үк вакытта бер-берсенә капма-каршы юнәлештә узалар.
Шундыйлардан
2Н2 (г)+О2 (г)^2Н2О (г)
кайтма реакциясен тикшерик.
Реакциянең туры юнәлештә узуы
2Н2 (г)+О2 (г)=2Н2О (г), А//<0, ASCO
энергия аерылып чыгу белән (ЛЯ<0) характерлана. Бу вакытта
системаның энтропиясе кими (AScO), чөнки реакция нәтиҗә¬
сендә 3 моль газдан 2 моль газ хасил була. Шулай итеп, бу
процесска энергетик фактор юнәлеш бирә.
Реакциянең кире юнәлештә узуы
2Н2О (г)=2Н2 (г)+О2 (г), АЯ>0, AS>0
энергия йотылу белән (А//>0) характерлана. Системаның энт¬
ропиясе арта (AS >0). Шулай итеп, бу процесска энтропия фак¬
торы юнәлеш бирә.
2000° C һәм атмосфера басымы шартларында ябык савытка
водород һәм кислород катнашмасы кертелгән дип күз алдына
китерик. Cy хасил булу процессы башлана. Аның узуын энерге¬
тик фактор билгели. Әмма су парлары барлыкка килү белән
энтропия факторы да тәэсир итә башлый: хасил булган суның
берникадәр өлеше водородка һәм кислородка таркала. Башта
энергетик факторның йогынтысы энтропия факторы йогынтысын¬
нан өстенлек итә. Ахыр чиктә бу факторларның тәэсирләре ти¬
гезләшә. Динамик тигезләнеш урнаша. Химик реакцияләр очра¬
гында ул химик тигезләнеш дип атала. Химик тигезләнеш ва¬
кытында бер вакыт берәмле¬
гендә туры реакциядә барлык¬
ка килә торган молекулалар
(яисә башка кисәкчекләр) са¬
ны кире реакциягә керә торган
молекулалар (кисәкчекләр) са¬
нына тигез була. Башкача әйт¬
кәндә, химик тигезләнеш вакы¬
тында башлангыч матдәләрнең
һәм реакция продуктларының
концентрацияләре үзгәрешсез
кала.
67 нче рәсем. Системаның тигезләнеш¬
кә якынлашуы белән матдәләрнең кон¬
центрациясе үзгәрү.
175
Димәк, ябык савытта водород белән кислород тулысынча
суга әверелмиләр. Реакция нәтиҗәсендә савытта өч газ — водо¬
род, кислород һәм су катнашмасы була. Шулай итеп, без шун¬
дый нәтиҗә ясый алабыз: кайтма химик реакцияләр үзлегеннән
билгеле бер чиккә кадәр генә — системада химик тигезләнеш
урнашканга кадәр генә — узалар. Тигезләнеш урнашканнан соң
шул шартларда матдәләрнең (башлангыч матдәләрнең һәм реак¬
ция продуктларының) концентрацияләре үзгәрешсез кала
(67 нче рәсем).
□
1. 2000° C һәм атмосфера басымы шартларында ябык савытка су керткән¬
нәр. Берникадәр вакыт узганнан соң савытта водород, кислород һәм су
“ газлары катнашмасы барлыгы беленгән. Вакыт узу белән бу газларның
концентрациясе үзгәрми. Бу тәҗрибәне аңлатып бирегез.
2. Водород, йод һәм водород иодиды катнашмасы булган савытка радио¬
актив йод керткәннәр. Водород йодидының HI радиоактивлыгын тикшер¬
гәндә вакыт узу белән радиоактив HI молекулалары бик тиз күбәйгәнлеге,
ә аннары аларның саны үзгәрешсез калуы беленгән. Бу күзәтүләрне аң¬
латып бирегез.
3. а) Температура күтәрелгәндә; б) температура төшкәндә
2Н2 (г) + O2 (г) = 2Н2О (г), ДЯ<0
системасының химик тигезләнеше кайсы якка авышыр?
§ 54. ХИМИК РЕАКЦИЯНЕҢ ТИЗЛЕГЕ
Хәрәкәт тизлеге төшенчәсенә билгеләмә бирегез (IX класс өчен физика дә¬
реслеген карагыз).
Бирелгән шартларда реакциянең мөмкин булуы ике фактор¬
ның— энергетик һәм энтропия факторларының суммар тәэсире
белән билгеләнә. Әмма химик реакция белән идарә итү өчен
аның тизлеген һәм узу механизмын белергә кирәк. Химик әве¬
релешләрнең тизлеген һәм механизмын химик кинетика өйрәнә.
Химик реакцияләр төрле тизлектә узалар. Аларның кайбер¬
ләре секундның бик аз өлеше эчендә, ә кайберләре меңәрләгән
еллар дәвамында булып уза. Билгеле булган реакцияләрдән иң
тиз уза торганнарының тизлеге иң акрын уза торганнарыны-
кыннан IO40 тапкырга зуррак. Әйтик, бүлмә температурасында
кислотаның селте белән нейтральләшү реакциясе күз ачып йом¬
ганчы булып уза. Tay токымнарының химик ашалуы (мәсәлән,
гранитның балчыкка әверелүе) меңәрләгән еллар дәвам итә.
Реакциянең тизлеге турында бер вакыт берәмлегендә баш¬
лангыч матдәләрнең берсенең концентарциясе үзгәрү буенча
фикер йөртергә мөмкин. Әйтик, газ хәлендәге A һәм B матдә¬
ләре ябык савытта реагирлашканда (A-I-B = AB) A матдәсенең
моляр концентрациясе вакытның ниндидер Л, моментында С,
(моль/л), ә вакытның /г моментында Ci (моль/л) тәшкил итсә,
реакциянең тизлеге
= C2- C1
I2 -
AC ,
--дгбУла-
176
Реакция нәтиҗәсендә башлангыч матдәнең концентрациясе
кими. Шуңа күрә тизлек минус тамгасы белән күрсәтелгән. Ре¬
акциянең тизлеге турында шулай ук бер вакыт берәмлегендә
реакция продуктының концентрациясе үзгәрү буенча да фикер
йөртергә мөмкин. Бу вакытта
Химик тигезләнеш торышында туры реакциянең тизлеге кире
реакциянең тизлегенә тигез була. Шунлыктан химик тигезлә¬
неш торышында матдәләрнең концентрацияләре үзгәрми.
Химик реакцияләрнең узу тизлегенә тәэсир итүче фактор¬
ларны тикшереп үтик. Барыннан да элек реакциянең тизлеге
реагирлашучы матдәләрнең табигатенә бәйле. Әйтик, сез ме-
талларның кислота белән үзара тәэсир итешү тизлеге аларның
табигатенә бәйле икәнлеген беләсез. Мәсәлән, хлорид кислота¬
сының магний белән тәэсир итешү реакциясенең тизлеге (водо¬
род аерылып чыгу тизлеге) шул ук кислотаның цинк белән
реакциясе тизлегеннән зуррак. Үз чиратында тимер хлорид кис¬
лотасы белән цинкка караганда әкренрәк тәэсир итешә.
Сез водород белән хлор реакциясе мисалында (47 нче пара¬
графны карагыз), реакция тигезләмәсе буенча аның узу меха¬
низмы турында фикер йөртеп булмавына ышандыгыз. Гадәттә
реакция тигезләмәсе химик процессның суммар нәтиҗәсен, ягъ¬
ни реакциягә нинди матдәләр керүен һәм аның нәтиҗәсендә
нинди матдәләр хасил булуын чагылдыра. Реакциянең механиз¬
мы турында бары тик эксперименталь күзәтүләргә яки теоретик
исәпләүләргә нигезләнеп кенә фикер йөртергә мөмкин.
Гомоген һәм гетероген реакцияләр була. (Грекча гомо —
«тигез», «бертөрле», «гетеро» — «бүтән», «башка» сүзләреннән.
Гомоген — «бер иш», гетероген — «төрле ишле», ягъни төрле иш¬
ле матдәләрдән яки төрле хәлдәге матдәләрдән (мәсәлән, пар —
сыеклык) торган.) Бер ишле тирәлектә, мәсәлән, газлар катнаш¬
масында бара торган реакцияләрне гомоген реакцияләр дип
атыйлар. Гетероген реакцияләр — каты матдә һәм газ; каты мат¬
дә һәм сыеклык һ. б. орыну өслегендә бара торган реакцияләр.
Реакция узсын өчен башлангыч матдәләрнең реагирлашучы
кисәкчекләре (атомнар, молекулалар, ионнар) бер-берсе белән
бәрелешергә тиеш. Бәрелешүләр никадәр ешрак булса, реакция
дә шулкадәр тизрәк бара. Күпчелек гомоген реакцияләр кисәк¬
чекләрнең пар-пар булып бәрелешүләре белән (атом молекула
белән, молекула молекула белән, ион молекула белән бәрелешә
һ. б.) уза. Аңлашыла ки, бирелгән температурада кисәкчекләр¬
нең бәрелешләр саны реагирлашучы матдәләрнең концентра¬
циясенә бәйле. Димәк, реакциянең тизлеге дә үзара тәэсир ите¬
шүче матдәләрнең концентрациясенә бәйле була.
Гетероген реакциянең тизлеге, мәсәлән, газ һәм каты матдә
арасында, газ молекулаларының каты матдә өслегенең бер мәй¬
12 П-236
177
дан берәмлегенә туры килгән бәрелүләр санына бәйле. Шуңа
күрә гетероген реакциядә, бер вакыт берәмлегендә күбрәк про¬
дукт табу өчен, реагирлашучы матдәләрнең орыну өслегенең
мәйданын арттырырга кирәк.
Сезгә шулай ук реакция тизлегенә температураның зур тәэсир
ясавы яхшы билгеле. Химик реакцияләрнең күпчелеге җылыт¬
канда тизрәк уза.
? 1. а) Матдәнең эрү тизлеген; б) аның эремәдән кристаллашу тизлеген микъ¬
дар ягыннан ничек күрсәтергә мөмкин?
▲ 2. «Хәрәкәт тизлеге» (IX нчы класс өчен физика дәреслеген карагыз) һәм
«химик реакция тизлеге» төшенчәләренең билгеләмәләрен чагыштыры¬
гыз. «Реакциянең моменталь тизлеге» төшенчәсенең билгеләмәсен әйтеп
бирегез.
3. a) Cy — боз; б) туендырылган эремә — утырым; в) газ — газ система¬
лары ниндиләргә керәләр: гомоген системаларгамы яки гетероген система¬
ларгамы?
4. Ни өчен бик вакланган матдә компакт матдәгә караганда тизрәк эри?
5. Матдәләрнең (мәсәлән, күмернең, күкертнең, водородның, тимернең) һа¬
вада һәм кислородта яну реакцияләренең тышкы билгеләрен чагыштыры¬
гыз. Кайсы очракта һәм ни өчен реакция тизрәк уза? Бу нинди реакция¬
ләр — гомоген реакцияләрме, әллә гетероген реакцияләрме?
6. Сезгә таныш булган: а) гомоген һәм гетероген реакцияләргә; б) гомо¬
ген һәм гетероген системаларга мисаллар китерегез.
§ 55. АКТИВЛАШТЫРУ ЭНЕРГИЯСЕ
Ни өчен күп кенә химик реакцияләр тәэсир итешүче матдәләрне бары тик
алдан җылытканда гына башланалар?
Реакция булып узсын өчен башлангыч матдәләрнең молеку¬
лалары (яки башка кисәкчекләре) бәрелешергә тиеш икәнлеген
сез беләсез инде. Әмма молекулаларның һәр бәрелешүе дә реак¬
циягә китерерме соң? Мөгаен, юктыр. Әйтик, газда нормаль
шартларда һәр молекула секундка IO10 тапкыр чамасы бәрелешә.
Аларның һәркайсы реакциягә китерсә, газлар арасындагы бар¬
лык реакцияләр дә практик яктан күз ачып йомганчы узарлар
иде. (Мәсәлән, водородта H2 ике бәрелеш арасындагы уртача
вакыт бары тик 5-IO 9 C тәшкил итә!)
Аеруча көчле итеп бәрелешкән молекулалар гына реакциягә
керәләр дип фараз итү нигезлерәк булыр. Энергияләре җитәр¬
лек булган молекулалар гына реакциягә керә алалар. Андый мо¬
лекулаларны актив молекулалар дип атыйлар.
Актив молекулаларның бәрелешүе активлаштырылган ком¬
плекс дип аталган кисәкчек хасил булуга китерә. Мәсәлән:
А2 + В2=2АВ
реакциясенең механизмын 1 төсле рәсемдәгечә яки мондый схе¬
ма белән күрсәтергә мөмкин:
178
A-A А А А А
+ >: • > +
B-B В в в в
Аг 4* Вг АгВг AB Ң- AB
Башлангыч Активлаштырылган Реакция
реагентлар комплекс продукты
(системаның (системаның (системаның
баштагы күчеш ахыргы
халәте) халәте) халәте)
Активлаштырылган комплекста атомнар арасындагы элек¬
троннар тыгызлыгы яңача бүленә. A — B бәйләнешләре ясалу
A — A һәм B — B бәйләнешләренең өзелүе белән бер үк вакытта
башлана. Активлаштырылган комплекста «ярымтаркалган» Аг
һәм Вг молекулалары һәм «ярымясалган» AB молекулалары бер¬
ләшкәндәй була. Активлаштырылган комплекс бик аз вакыт
(Ю-13 с чамасы) яши. Матдәләрне активлаштырылган комплекс
халәтенә әверелдерү өчен кирәк булган энергияне активлаштыру
энергиясе (£а) дип атыйлар. Активлаштыру энергиясенең кыйм¬
мәте реагирлашучы матдәләрнең табигатенә бәйле. Шуңа күрә
реакцияләр активлаштыру энергиясе белән аерылып торалар.
Реакция барганда системаның энергиясе үзгәрүне схема рә¬
вешендә (1 төсле рәсем) күрсәтергә мөмкин. 1 төсле рәсемдә
абсциссалар күчәре реакциянең барышын характерлый:
Башлангыч
халәт
Күчеш
халәте
Ахыргы
халәт_
Ординаталар күчәрендә системаның потенциаль энергиясе күр¬
сәтелгән. Башлангыч
//ахыр. энергиясенә ия.
ләренең энергияләре
тигез:
халәт Ябашл. энергиясенә, ә ахыргы халәт
Системаның башлангыч һәм ахыргы халәт -
аермасы реакциянең җылылык эффектына
A// — //ахыр. " //башл.
Активлаштырылган комплексның энергиясе системаның баш¬
лангыч һәм ахыргы халәтләре энергияләреннән югарырак. Ак¬
тивлаштыру энергиясен образлы рәвештә башлангыч матдәләр¬
не реакция продуктларыннан аерып торучы бер энергетик киртә
итеп күз алдына китерергә мөмкин.
2АВ = Аг + Вг
кире реакциясе, аңлашыла ки, шулай ук активлаштырылган АгВг комплексы
хасил булу белән бара. Ләкин бу очракта активлаштыру энергиясенең кыйм¬
мәте туры реакциянекеннән башкача булыр.
Җылытканда күпчелек химик реакцияләрнең тизлеге арта.
Әйтик, су синтезын
12!
179
2Н2 + О2 = 2Н2О
20° C та тормышка ашыру практик яктан мөмкин түгел, чөнки
бу температурада реакциянең тизлеге бик кечкенә (20° C та
башлангыч матдәләрнең 15% ы гына реакциягә керсен өчен дә
54 миллиард ел кирәк булыр иде!), 500° C та бу реакция бары
тик 50 минут, ә 700° C та процесс практик яктан күз ачып йом¬
ганчы уза. Моны нәрсә белән аңлатырга соң? Бу, мөгаен, җы¬
лытканда актив кисәкчекләрнең саны арту белән аңлатыладыр.
20° C та водород белән кислород катнашмасында «энергетик кир¬
тәне» үтеп чыга ала торган кисәкчекләр юк диярлек. Реакция
практик яктан бармый. Әмма 700° C та актив кисәкчекләрнең
саны шулкадәр күп, һәм процесс күз ачып йомганчы булып
уза.
Тәҗрибә юлы белән температура һәр IOoC ка күтәрелгән
саен гомоген реакциянең тизлеге 2—4 тапкыр артуы ачыклан¬
ган (Вант-Гофф кагыйдәсе, 1884).
Энергетик киртәләр реакцияләрнең узуларын чиклиләр. Шу¬
ңа күрә принципта мөмкин булган реакцияләр гадәттәге шарт¬
ларда тоткарланалар яки практик яктан бармыйлар. Әйтик, агач,
кәгазь, күмер, нефть, тукымалар һавада яна алалар. Ләкин алар
гадәти шартларда үзеннән-үзе кабынып китмиләр, чөнки алар-
ның яну реакцияләре югары активлаштыру энергиясе белән ха¬
рактерлана.
? 1. H2-Fh=ZHI
реакциясенең активлаштыру энергиясе £а = 168 кДж гә тигез. 500° C та
A бу реакция экзотермик (АЯ = —19 кДж) була. Активлаштырылган ком¬
плексның составы H2I2 булса, башлангыч халәттән ахыргы халәткә күчкән¬
дә бу системаның энергиясе үзгәрү графигын төзегез.
2. 1 л күләмле савытта (0,1 кПа һәм 560° С) 1 моль водород иодиды
молекулаларының бәрелешүләр саны 1 секундка 5,5-IO35 тәшкил итүе
исәпләп чыгарылган. Водород иодиды таркалганда хасил була торган йод¬
ның микъдары Hl молекулаларының 1 секундка бары тик 3,0- IO17 бәре¬
лешүенә генә туры килә. Бу туры килмәүчелекнең төп сәбәбе нидән гый¬
барәт?
3. Активлаштыру энергиясе зур булмаган процесслар гадәттәге шартларда
тиз, ә активлаштыру энергиясе зур булган процесслар акрын узалар. Реак¬
цияләрнең тизлекләрендәге мондый аерымлыкларның төп сәсәбе нидән
гыйбарәт?
4. Сезгә таныш булган түбәндәге фактларны ничек аңлатып бирергә мөм¬
кин: а) азык продуктларын түбән температураларда саклыйлар; б) аш-
суны югары температурада пешерәләр; в) ягулык янсын өчен, аны кабызып
җибәрәләр.
5. Әгәр температураны һәр 10° C ка күтәргән саен реакциянең тизлеге
икеләтә артса, температураны 100° C тан 200° C ка кадәр күтәргәндә реак¬
циянең тизлеге ничә тапкыр артыр?
180
§ 56. КАТАЛИЗ
а) Активлаштыру энергиясе; б) активлаштырылган комплекс төшенчәлә¬
ренә билгеләмәләр бирегез. Активлаштыру энергиясенең зурлыгы реакция тиз¬
легенә ничек тәэсир ясый?
Тимер белән күкертнең тимер (Il) сульфиды хасил итеп
бара торган сезгә таныш реакциясен ике ысул белән башка¬
рыйк. Порошок хәлендәге тимерне һәм күкертне катнаштырыйк.
Бу процессның узуын сизмибез. Моның сәбәбе бу реакциянең ак¬
тивлаштыру энергиясе югары булудан, һәм шунлыктан аның
гадәттәге шартларда бармавыннан гыйбарәт. Әгәр инде катнаш¬
мага кызган тимер чыбык белән орынсак, ул вакытта реакция
башланып китә һәм үзлегеннән дәвам итә. Реакциянең баруын,
атап әйткәндә, реакция массасының кызуы күрсәтә.
Хәзер шундый ук катнашмага берничә тамчы су өстик һәм
катнашманы камырсыман массага әверелгәнче болгатыйк. Бер¬
ничә минуттан без реакциянең баруын сизәрбез: матдәлбр кат¬
нашмасының массасы кыза һәм процесс тыштан карауга җы¬
лыткандагы кебек үк кыза. Бу юлы реакциянең узуына, бу оч¬
ракта катализатор буларак катнашучы, су булышлык итте.
Химик реакциядә катнашып, аның тизлеген арттыра һәм ре¬
акция ахырына үзе химик үзгәрми кала торган матдәне катали¬
затор дип атыйлар.
Катализатор катнашында бара торган реакцияләрне ката-,
литик реакцияләр дип атыйлар. Катализаторлар химик реак¬
циянең тизлеген аның узу механизмын үзгәртү исәбенә артты¬
ралар. Әйтик, A матдәсе һәм B матдәсе арасында AB матдәсе
хасил итеп тәэсир итешү мөмкин булсын ди:
A +B *-А...В -AB
Активлаштырылган
комплекс
Бу реакциянең активлаштыру энергиясе зур — шуңа күрә
реакциянең тизлеге бик кечкенә, практик яктан нульгә тигез.
Әйтик, A матдәсе белән бик җиңел тәэсир итешеп AK кушыл¬
масы хасил итә торган K матдәсе (катализатор) булсын ди:
А + К—-A...K -AK
Активлаштырылган
комплекс
Бу реакция тиз уза, чөнки аның активлаштыру энергиясе
кечкенә.
Шул сәбәпле үк AK кушылмасы B матдәсе белән, AB һәм K
матдәләре хасил итеп, ансат тәэсир итешә:
В + АК+В...А...К->АВ + К
Активлаштырылган
комплекс
181
68 нче рәсем. Катализатор булмаганда
һәм булганда реакция барышының
энергетик схемасы. Afa — катализ ва¬
кытында активлаштыру энергиясенең
кимүе.
Соңгы ике тигезләмәне сум-
малаштырып, табабыз:
А + К = АК
BH-AK = ABH-K
AH-B = AB
Шулай итеп, K матдәсе про¬
цесста катнашты, әмма аның
нәтиҗәсендә химик яктан үзгә¬
решсез калды. Катализатор
булмаганда реакция A һәм B
матдәләренең турыдан-туры
тәэсир итешүе белән бик акрын
барды. Каталитик реакция ике
стадиядә — арадаш AK кушыл¬
масы хасил булу аркылы — бик
тиз булып уза.
68 нче рәсемдә катализатор булганда һәм булмаганда реакция барышында
системаның энергиясе ничек үзгәрүе күрсәтелгән. Рәсемнән күренгәнчә, ката¬
литик реакциядә системаның потенциаль энергиясе үзгәрү кәкресендә ике энер¬
гетик киртә бар.
Беренче киртә A...K активлаштырылган комплексы хасил булу өчен кирәкле
активлаштыру энергиясенә, икенче киртә В...А...К активлаштырылган комплексы
хасил булуга кирәкле активлаштыру энергиясенә туры килә. Кәкредәге мини¬
мум арадаш AK кушылмасы хасил булуга туры килә.
Каталитик реакциянең активлаштыру энергиясе каталитик булмаган реак¬
циянекеннән шактый кимрәк. Бу катализатор катнашында бара торган реак¬
циянең тизлеге шактый зуррак булу белән аңлатыла. Әйтик, водород йодиды¬
ның водородка һәм йодка таркалу реакциясе өчен (500° C та) активлаштыру
энергиясенең бары тик 40 кДж гә генә кимүе дә реакциянең тизлеге 30 000 тап¬
кыр артуга туры килә.
Катализаторның тәэсир итү механизмын образлы рәвештә туристларның
тау сырты аша үтүе белән чагыштырырга мөмкин. Туристларга үтүе кыен бул¬
ган тау сыртының икенче ягына барып чыгарга кирәк дип күз алдына китерик.
Аларга бер генә юл билгеле: сырт башына озакка сузылган һәм куркынычлы
менү һәм аннан соң дәвамлы төшү. Ә шул урынны яхшы белгән юл күрсәтүче
юлаучыларны, сыртны читләтеп, тау сукмагы буйлап үткәрергә мөмкин. Сукмак
тау сыртына китереп чыгара торган туры юлга караганда боргаланганрак бул¬
са да, аның буенча бару җиңелрәк һәм билгеләнгән пунктка тизрәк килеп
җитәргә мөмкин. Туристлар билгеләнгән урынга килеп җиткәч, юл күрсәтүче
юл башына яңа группаны алырга кире кайта.
Катализатор, реакциядә катнашып, системаның башлангыч халәтеннән ахыр¬
гы халәтенә тизрәк күчүенә ярдәм итә.
Катализ табигатьтә гаять киң таралган, ул организмнарның
тереклек эшчәнлегендә искиткеч зур роль уйный. Сезгә, аерым
алганда, безнең организмда углеродлы кушылмаларның, һава
кислороды белән өзлексез оксидлашып, су һәм углекислый газ
хасил итүләре билгеле. Шул ук вакытта безнең организмның
эшчәнлеге өчен кирәк булган энергия аерылып 1Hbira. Углеродлы
182
кушылмаларның януы өчен аларны алдан җылытырга кирәк.
Катализаторлар катнашканлыктан, тере организмда мондый әве¬
релешләр гадәти шартларда булып узалар.
Каталитик реакцияләрнең әһәмияте промышленностьта да
зур. Промышленностьтагы каталитик реакцияләрнең кайбер ми¬
саллары белән сез берникадәр соңрак танышырсыз.
? 1. Катализаторның һәм реагирлашучы матдәләрнең агрегат хәленә карап,
гомоген яки гетероген катализ булырга мөмкин. Гетероген процесста ка¬
тализаторның өслеген нинди ысуллар белән арттырырга мөмкин?
A 2. Лабораториядә кислородны вертолет тозын таркатып табу өчен катали¬
затор итеп марганец (IV) оксидын кулланалар. Бу процесс нинди катализ¬
га керә: гомоген катализгамы яки гетероген катализгамы? Вертолет тозын
таркату реакциясенең тигезләмәсен языгыз.
3. Катализатор реакциянең җылылык эффекты кыйммәтен үзгәртәме?
4. Коры хлор тимергә тәэсир итми, һәм шуңа күрә аны тимер баллоннар¬
да сакларга мөмкин. Юеш хлор тимерне ашый. Бу вакытта су нинди роль
уйный?
ХИМИК ЭЛЕМЕНТЛАРНЫҢ
Д. И. МЕНДЕЛЕЕВ ПЕРИОДИК СИСТЕМАСЫНЫҢ
Vl ТӨРКЕМ р-ЭЛEMEHTJIAPbl
(КИСЛОРОД ТӨРКЕМЧӘСЕ)
§ 57. КИСЛОРОД
I. Кислород төркемчәсен нинди элементлар тәшкил итәләр? 2. Аларның
атомнарында электроннар сүрүенең тышкы катлавы төзелеше нинди? 3. Химик
элементларны өйрәнү өчен белешмәлектән файдаланып (§ 40 ны карагыз), кис¬
лородның үзлекләрен алдан әйтеп бирегез. 4. Атаклы швед химигы И. Бер¬
целиус әйткәнчә, «кислород, тирәсендә бөтен химия әйләнә торган, үзәк булып
тора». Бу сүзләрне аңлатып бирегез.
VI төркемнең төп төркемчәсен (кислород төркемчәсен) р-эле-
ментлар — кислород О, күкерт S, селен Se, теллур Te, полоний
Po — тәшкил итәләр. Төркемчә элементлары атомнарының тыш¬
кы электрон катлаулары төзелеше бертөрле — ns2np\
Электротискәрелеге буенча кислород фтордан гына калыша.
Аңа —2 тискәре оксидлашу дәрәҗәсе характерлы, һәм бары тик
фтор белән булган кушылмаларында гына +2 уңай оксидлашу
дәрәҗәсе күрсәтә.
Кислород — Җирдә иң күп таралган элемент (Җир кабыгын¬
дагы һәр 100 атомның 58 е — кислород атомнары), һава соста¬
вында аның масса өлеше 23% чамасы тәшкил итә. Әмма ат¬
мосферада ирекле кислород никадәр генә күп булмасын (1,5 X
XlOis т), бу кушылмалардагы кислородның гомуми микъда¬
рының бары тик 0,0001 өлеше генә. А. Лавуазье кислородның
күп кенә матдәләрдә, шул исәптән кислоталарда да барлыгын
күрсәткән. Аның Oxigenium дигән исеме дә грекча «оксос» —
ачы һәм «геннас» — тудырам сүзләреннән ясалган. Кислород су
(89% чамасы), ком (53%), балчык (56%) һ. б. составына керә.
Кеше организмында кислородның масса өлеше 65% тәшкил итә.
Кислородның молекуласы ике атомнан тора, һәр кислород
атомының икешәр парсыз электроны бар, шуңа күрә
алар үзара тәэсир итешкәндә ике ковалент бәйләнеш ясала:
s 6. +»6: O = O:
•• •• •• ••
Кислород молекуласы бик нык, молекулаларның атомнарга
таркалуы бары тик 1500° C тан да югарырак температурада гы¬
на сизелә башлый.
Кислородның кайбер үзлекләрен Oa молекуласының китерелгән структурасы
ярдәмендә аңлатып булмый. Мәсәлән, сыек һәм каты кислород магнитка тарты¬
ла. Магнитка бары тик парлашмаган электроннары булган матдәләр генә тар-
184
тыла алалар. Кислородның бу һәм кайбер башка үзлекләрен аның структурасын
түбәндәге рәвештә күрсәткәндә генә аңлатырга мөмкин:
Кислород атомнары зур булмаганлыктан, бәйләнештә катнашмаган электрон¬
нарның этелүе молекуладагы өчле бәйләнешне көчсезләндерә, һәм үзенең нык¬
лыгы белән өчле бәйләнеш икеле бәйләнешкә якынлаша. O = O структурасына
кислород, мәсәлән, җылытканда ия була. Кислород молекуласының төзелеше
турындагы сорауны хәл итү безнең белемнәребезнең чагыштырмача булуын күр¬
сәтә. Әйтик, кислородның үзлекләрен аңлату өчен төрле модельләрдән файда¬
ланырга мөмкин.
Кислородның табигатьтәге роле гаять зур. Аны бер үк ва¬
кытта барлыкка китерүче дип тә, җимерүче дип тә атарга мөм¬
кин. Органик матдәләрне оксидлаштырып, кислород сулауга, ди¬
мәк, тереклеккә ярдәм итә. Бу вакытта аерылып чыккан энергия
организмның тереклек эшчәнлеген тәэмин итә.
Әмма табигатьтә кислород катнашында җимерелү процессла¬
ры да өзлексез булып тора: металларның күгәрүе, үсемлек һәм
хайван калдыкларының черүе, матдәләрнең януы.
Бер төрле процесслар — тиз, ә икенчеләре акрын уза. Мо¬
ның сәбәбе нидән гыйбарәт соң? Кислород катнашында бара
торган реакцияләргә югары активлаштыру энергиясе хас. Шуңа
күрә бу реакцияләр гадәттәге шартларда акрын узарга тиеш.
Tepe организмнарда оксидлашу процесслары биологик катализа¬
торлар — ферментлар тәэсирендә (биокатализ) тиз узалар.
Матдәләр кислородта һавадагыга караганда шактый интен¬
сиврак яналар.
Әгәр күмерне горелка ялкынында кыздырып, аннары ялкыннан алсак, күмер
берникадәр вакыт пыскып торыр, ә аннан соң сүнәр. Ләкин кислород тутырыл¬
ган банкага керткәч, күмер бик каты кыза һәм ялкынсыз-төтенсез яна.
Кислородта күмер һавадагыга караганда шактый активрак
яна:
C-TO2 = CO2, ЬН<0
Шуңа күрә савытка кислород тулганны пыскып торган чыра¬
ның кабынып китүе буенча белергә мөмкин, һавада чыра пыс¬
кый, ә кислородта ул күз ачып йомганчы кабынып китә.
Һавада күкерт беленер-беленмәс кенә зәңгәрсу ялкын белән яна. Махсус
яндыру кашыгында янып торган күкертне кислород тутырылган савытка тө¬
шергәндә, ул ачык зәңгәр ялкын белән янып бетә.
Кислородта күкерт һавадагыга караганда интенсиврак яна:
S-TO2 = SO2, Д/7<0
Корыч чыбыкның бер очына шырпы кисәге беркетик. Шырпыны кабызыйк
һәм янып торган шырпы беркетелгән корыч чыбыкны кислород тутырылган
185
савытка төшерик. Янып торган шырпыдан тимер яна башлый. Як-якка күз
чагылдыргыч чаткылар — тимер касмагы кисәкчекләре тарала.
Һавада җылытканда без тимернең януын күзәтә алмыйбыз.
Бары тик ап-ак булганчы кызганда гына тимер өслегендә кас¬
мак барлыкка килә. Әгәр инде кызган тимер кислородта булса,
ул янып бетә.
Тимернең кислородта януы
3Fe-(-2O2 = Fe3O4 (FeO-Fe2O3), ДЯ<0
тигезләмәсе белән күрсәтелә.
Янучан матдәләр (водород, ацетилен һ.б.) кислородта янган¬
да бик күп микъдарда җылылык аерылып чыга һәм температура
бик нык күтәрелә. Шуңа күрә кислородны махсус горелкаларда,
температураны бик югары күтәрү өчен, янучан газларны оксид¬
лаштыручы итеп кулланалар. Әйтик, кислород-ацетилен горел-
касында ялкынның температурасы чама белән 3000° C ка кадәр
җитә.
Сыек кислородны ракета ягулыгын көчле оксидлаштыручы бу¬
ларак кулланалар (69 нчы рәсем). Сыек кислород сеңдерелгән
янучан матдәләрне (мамык, пычкы вагы, күмер һ. б.) шартлату
эшләрендә кулланалар. Мондый катнашма күз ачып йомганчы
реакциягә керсен өчен бер генә очкын да җитә. Бу вакытта бик
зур күләмдә газсыман продуктлар хасил була һәм алар шартлау
китереп чыгаралар.
Лабораториядә кислородны калий перманганатын KMnO4
таркатып табалар. Техникада кислородны сыек һавадан табалар.
Сыек һаваның состав өлешләре төрле температураларда парга
әйләнә һәм бу аларны бер-берсеннән аерырга мөмкинлек бирә.
Кислородны һәм водородны кайчакта суны электр тогы белән
таркатып табалар (суны электролизлау).
Промышленностьта кислород (яки кислород белән баетылган
һава) башлыча кайбер производство процессларын интенсивлаш¬
тыру өчен кулланыла. Металлургиядә, мәсәлән, кислород өр¬
дерү чуен эретеп чыгаруны тизләтә; химия промышленностен¬
да— сульфат кислотасы җитештерүне интенсивлаштыра һ.б.
Кислородны медицинада да кулланалар.
Кислород мендәрләреннән һәм палаткаларыннан тын кысыл¬
ганда файдаланалар.
Кислород химик элементы О, гадәттәге кислородтан O2 тыш,
тагын бер гади матдә — озон O3 барлыкка китерә.
Химик элементның берничә гади матдә рәвешендә булу кү¬
ренеше аллотропия дип атала. Бер үк элементтан барлыкка кил¬
гән һәр гади матдә бу элементның аллотропик үзгәрешле төре
дип атала.
Кислород O2 һәм озон O3 молекулаларының составлары ае¬
рылып торганлыктан, аллотропик төрләренең үзлекләре дә шулай
ук төрле була.
186
Сыек кислород
Приборлар биле¬
ге
Ягулык (спирт)
тутырылган
бак
Дрткы стаби¬
лизаторлар
Яну камера¬
сы
Чыгару ти¬
шеге
70 нче рәсем. Озонатор (схема).
69 нчы рәсем. Югары катлауларны өй¬
рәнү ракетасының схемасы
Озон кислородтан 1,5 тапкыр авыррак. Озон тотрыксыз, кис¬
лородка әверелеп, җиңел таркала:
2Оз = ЗО2, ДЖО
Оксидлаштыручы буларак озон кислородтан көчлерәк. Әйтик,
озонда эфир, скипидар, спирт үзләреннән-үзләре яна башлый¬
лар. Озонны суларга ярамый, чөнки ул сулыш юлларының ту¬
кымаларына зыян китерә. Озон суны йогышсызландыру өчен
(хлор урынына) кулланыла.
Озонны озонаторда кислород аша электр тогы уздырып та¬
барга мөмкин (70 нче рәсем):
ЗО2 = 2Оз, ДЯ>0
Озонның үзенә бер төрле исе кайчакта электр генераторлары
һәм моторлары янында да сизелә, һавада озон яшен вакытын¬
да электр бушануы аркасында хасил була.
1. а) Суны водородтан һәм кислородтан синтезлау; б) суны водородка һәм
кислородка таркату реакцияләренең тигезләмәләрен төзегез. Бу реакцияләр-
A нең кайсысы: а) җылылык аерылып чыгу белән; б) җылылык йотылу белән;
в) энтропия арту белән; г) энтропия кимү белән бара? Бу реакцияләрнең кай¬
сысы: а) энергетик фактор; б) энтропия факторы исәбенә бара?
2. Энтропия факторы һәм энергетик фактор турындагы карашлардан чыгып,
кислородның гадәти шартлардагы агрегат хәлен аңлатып бирегез.
187
Металлургия процессларын һәм химик процессларны интенсивлаштыру
71 нче рәсем. Кислородны куллану (схема).
3. Текстта китерелгән яну реакцияләренең тигезләмәләрендә коэффициентлар
куеп чыгыгыз.
4. Ацетиленның С2Н2 кислородта яну реакциясенең тигезләмәсен төзегез
(ацетиленда С2Н2 углеродның оксидлашу дәрәҗәсен —1 дип алырга мөм¬
кин). Iiy реакция нинди максатларда һәм ни өчен кулланыла? Яну җылы¬
лыгы 1305 кДж/моль тәшкил итсә, 2,24 л ацетилен (н. ш.) янганда күпме
микъдарда җылылык аерылып чыгар?
5. Ни өчен кислородны «табигать санитары» дип атыйлар?
6. Кислородның озонга әверелүе эндотермик процесс булса, кайсы алло-
тропик үзгәрешле төренең — кислородныкымы яки озонныкымы — химик ак¬
тивлыгы зуррак булыр?
7. Ни өчен җылыту матдәләрнең кислород белән оксидлашуын тизләтә?
Ни өчен кислородта реакцияләр һавадагыга караганда интенсиврак уза¬
лар?
8. Ни өчен компост хәзерләгәндә аны 2—3 тапкыр җилләтергә (көрәк бе¬
лән болгатырга) кирәк?
71 нче рәсем буенча кислородны куллану өлкәләрен тасвирлап бирегез.
Кислородны куллану аның нинди үзлекләренә нигезләнгән?
§ 58. ВОДОРОД ОКСИДЫ — СУ
Cy молекуласында кислород һәм водород атомнары электрон болытларының
аралашу схемасын сурәтләгез. Cy молекуласының составын һәм төзелешен аң¬
латып бирегез.
Табигатьтәге оксидларның иң әһәмиятлесе — водород окси-
дыНгО — су безнең планетада һәркайда таралган (гомуми запас¬
лары 1,4-10 8 т чамасы!). Суның төп массасы диңгезләрдә һәм
океаннарда тупланган. Төче су өлешенә бары тик 2,6% кына
туры килә. Өстәвенә аның күп өлеше Төньяк һәм Көньяк полюс¬
ларның боз массивларын тәшкил итә. Җир атмосферасы соста¬
вында да су күп.
Табигатьтә суның әһәмияте искиткеч зур. Судан башка те¬
реклекнең булуы мөмкин түгел: тере организмнарда суның мас¬
са өлеше 50% тан 99% ка кадәр җитә!
Суның иң мөһим үзлекләреннән берсе —аның күп кенә мат¬
дәләрне эретә алуы. Табигатьтә эрегән матдәләре булмаган су
юк. Хәтта яңгыр суында да углекислый газ, кислород, азот, нит¬
рат кислотасы һәм башка эрегән матдәләр булу билгеләре бар.
Cy Җирдә гаять зур эш башкара. Cy тау токымнарын җиме¬
рә, бөтен планета буйлап матдәләрнең бик зур массаларын кү¬
черә, утырма токымнар барлыкка китерә. Суның парга әйләнүе
һәм конденсацияләшүе Җирнең климатына тәэсир ясый, аны
билгеле бер җайга сала.
Cy молекулаларының төзелеше турында башлангыч белемнәр¬
не сез алдыгыз инде. Cy молекуласында ике поляр ковалент
H — O бәйләнеше бар:
яки
:О—н яки :О: н
н н
189
Алар кислород атомының ике бер электронлы р-болытының һәм
ике водород атомының бер электронлы s-болытларының арала¬
шулары исәбенә ясалганнар.
Cy молекуласында кислород атомының дүрт электрон пар¬
лары бар. Аларның икесе ковалент бәйләнешләр ясалуда кат¬
наша, ягъни алар-—бәйләүче электроннар. Калган ике электрон
пары бәйләүче электроннар түгел.
Молекулада дүрт корылмалар полюсы бар: икесе — уңай һәм
икесе — тискәре. Уңай корылмалар водород атомнарында туп¬
ланган, чөнки кислород водородка караганда электротискәрерәк.
Ике тискәре полюс кислородның бәйләүче булмаган ике электрон
парына туры килә:
6+
(f-.O—H
Суның төзелешен шулай күзаллау, суның күп кенә үзлекләрен,
атап әйткәндә бозның структурасын, аңларга мөмкинлек бирә.
Бозның кристаллик челтәрендә молекулаларның һәркайсы баш¬
ка дүрт молекула белән чолгап алынган. Яссылыкта аны болай
күрсәтергә мөмкин:
H
I
H-O H
: I
O-H-O-H-O-H
I I
H H
O-H
I
H
Бәйләнешнең механизмын аңлатып бирергә тырышыгыз. Схемада
молекулалар арасындагы бәйләнешнең водород атомы ярдәмендә
урнашуы күренә:
н
I
O-HO-H
Бер су молекуласының уңай корылган водород атомы икен¬
че су молекуласының тискәре корылган кислород атомына тарты¬
ла. Мондый бәйләнешне водородлы бәйләнеш дип атаганнар.
(Аны нокталар белән күрсәтәләр). Водородлы бәйләнешнең нык¬
лыгы ковалент бәйләнешнекеннән 15—20 тапкыр кимрәк. Шуңа
күрә водородлы бәйләнеш җиңел өзелә. Ул, мәсәлән, су парга
әйләнгәндә күзәтелә.
190
Сыек суның структурасы боз структурасын хәтерләтә. Сыек
суда молекулалар бер-берсе белән шулай ук водородлы бәй¬
ләнешләр ярдәмендә тоташканнар. Әмма суның структурасы боз¬
ныкы кебек үк «катгый» түгел. Молекулаларның судагы җылы¬
лык хәрәкәте аркасында кайбер водородлы бәйләнешләр өзелә¬
ләр, ә икенчеләре ясалалар.
Cy кешенең хуҗалык эшчәнлегенең барлык өлкәләрендә дә
кулланыла. Cy кулланылмаган бер генә производство процессын
да әйтергә практик яктан мөмкин түгел.
Промышленностьның бик тиз үсеше, шәһәр халкының артуы
белән бергә суны тоту да арта бара. Cy чыганакларын кимеп
бетүдән, шулай ук агынты сулар белән пычранудан саклау
мәсьәләләре иң мөһим әһәмияткә ия була бара. Агынты сулар¬
ның сулыкларда яшәүче организмнарга ни дәрәҗәдә зарар ки¬
терүе барыбызга да билгеле. Бу проблема, файдаланылган су¬
ларны сулыкларга агызмыйча, чистартканнан соң яңадан кул¬
лану өчен технологик процесска кайтару ысуллары булдыру юлы
белән хәл ителә.
Хәзерге вакытта мохитне, һәм аерым алганда табигый су¬
лыкларны, саклауга бик зур игътибар бирелә. Бу проблеманың
әһәмиятен исәпкә алып, безнең илебездә табигать ресурсларын
саклау һәм алардан рациональ файдалану турында Закон кабул
ителде. Илебез Конституциясендә: «Гражданнар табигатьне,
аның байлыкларын сакларга тиешләр» дип язылган.
1. Ни өчен суның һәм бозның парга әйләнүе — эндотермик процесс?
2. Водородлы бәйләнеш ковалент бәйләнештән нәрсә белән аерылып тора?
4 3. Cy һәм водород хлориды молекулалары арасында
H
төрдәге бәйләнеш булуы мөмкин. Бу бәйләнеш ничек ясала һәм ул ничек
атала? Ни өчен водород хлоридын суда эреткәндә җылылык аерылып чыга?
4. Cy белән: а) галогенның; б) актив металлның; в) металл оксидының;
г) неметалл оксидының реакцияләренә мисаллар китерегез.
5. Барий иң актив металларга керә. Аның су белән реакциясенең тигез¬
ләмәсен языгыз. Cyra 137 г барий тәэсир иткәндә нинди күләмдә (н. ш.)
водород аерылып чыгар?
1. Пластилиннан суның шарлы-таякчыклы моделен ясагыз.
2. Табигатьтә су әйләнеше турында сөйләп бирегез. Табигатьтә суның әһә¬
мияте нинди? Ни өчен суны «универсаль эреткеч» дип атарга мөмкин?
3. Академик А. П. Карпинский суны «иң файдалы казылма» дип атаган.
Бу сүзләргә аңлатма бирегез.
191
§ 59. КРИСТАЛЛОГИДРАТЛАР
Ни өчен бер иш реакцияләр — җылылык аерып чыгу белән, ә башкалары
җылылык йотылу белән узалар?
Төрле ике матдәне суда эретү тәҗрибәсен башкарыйк. Cy са¬
лынган ике стаканга термометрлар төшерик. Бер стаканга сел¬
те — калий гидроксиды КОН, ә икенчесенә тоз — калий нитраты
KNO3 өстик. Без нәрсә күзәтәбез соң? Без калий гидроксидын
эреткәндә температураның күтәрелүен, ә калий нитратын эрет¬
кәндә температураның төшүен күрәбез. Димәк, калий гидрокси-
дының эрүе — экзотермик процесс, ә калий нитратының эрүе —
эндотермик.
Ни өчен бер очракта эрү җылылык аерылып чыгу белән,
ә икенчесендә — җылылык йотылу белән бара. Эрегәндә матдә
кристалындагы кисәкчекләр арасындагы бәйләнешләр җимерел¬
гәнлектән, каты матдәләрнең эрүе җылылыкны йоту белән ба¬
рырга тиеш иде кебек бит. Әмма бу һәрвакытта да алай түгел.
Күрәсең, эрү бер матдә кисәкчекләренең икенче матдә кисәк¬
чекләре (молекулалары) арасында таралуына гына кайтып кал¬
мыйдыр. Эрү процессы эри торган матдәнең һәм эреткечнең
үзара химик тәэсир итешүе белән бара.
Эреткеч белән эри торган матдә арасында кушылмалар ха¬
сил булу турындагы карашлар Д. И. Менделеев тарафыннан
әйтелгән һәм нигезләнгән. Галим, эрү — физик процесс кына тү¬
гел, ә химик процесс та булып тора, дип санаган. Эрү — физик-
химик күренеш ул.
Тәҗрибә барышында без ионлы кушылмаларны — KOH һәм
KNO3 — эреттек. Эремәдә ионнар су молекулалары белән бәй¬
ләнгән булалар. Катионнарга су молекулалары үзләренең тискә¬
ре полюслары белән (кислород атомы аша), ә анионнарга —
уңай полюслары белән (водород атомы аша) тартылалар. Ион¬
ның су молекулаларыннан торган тышчасы гидрат тышчасы дип,
ә аның барлыкка килү процессы гидратлашу дип атала. Ион¬
нарның гидратлашуын 1 төсле рәсемдә бирелгән схема белән
күрсәтергә мөмкин.
Ионлы кушылмаларның эрүен ике стадия рәвешендә күрсә¬
тергә була: кристаллик челтәрнең ирекле ионнарга җимерелүе һәм
ионнарның гидратлашуы. Кристаллик челтәрнең җимерелүе —
эндотермик процесс (АЯчелт. > 0). Ионнарның гидратлашуы —
экзотермик процесс (АЯгидр. < 0). Ионлы кушылма эрүнең җы¬
лылык эффекты АЯэрү кристаллик челтәрнең җимерелү җылы¬
лык эффекты АЯчелт. белән гидратлашу җылылык эффектының
АЯгидр алгебраик суммасына тигез:
Atf3pv = A//
челт. H- A/7гидр.
Түбәндәге мәгълүматлар нигезендә калий гидроксидының
һәм калий нитратының эрү җылылык эффектларын исәпләп чы¬
гарыйк:
192
Д//ЧелТ.» кДж/мОЛЬ
кон
KNO3
790
684
А^А-идр., кДж/моль K +
OH-
NO3-
—339
—511
—310
KOH эрегән очракта эрүнең җылылык эффекты
Д//эрү = 790 кДж/мольҢ- [(—339 кДж/моль)+
+ (—511 кДж/моль)] = —60 кДж/моль була.
Ә KNOs эрегән очракта эрүнең җылылык эффекты
Д//эрү = 684 кДж/моль+ [(—339 кДж/моль)+
+ (—310 кДж/моль)] =35 кДж/моль була.
Шулай итеп, эрүнең җылылык эффекты кыйммәте уңай да,
тискәре дә булырга мөмкин. Калий гидроксиды (А/7эрү < 0) һәм
калий нитраты (Д/7эрү>0) эрегәндә без шуны күрдек тә инде.
Эрегән матдә кисәкчекләре һәм эреткеч кисәкчекләре — гид¬
рат тышчасы — арасындагы бәйләнеш җитәрлек дәрәҗәдә нык
була һәм матдә кристаллашканда сакланып кала.
Бакыр (II) сульфатына CuSOi (ак төстәге порошок) бераз гына су өстик.
Шулкадәр көчле җылыну була ки, хәтта суның берникадәр өлеше парга әй¬
ләнә. Химик процесс булып узуны шулай ук төс үзгәрү дә күрсәтә: порошок
зәңгәрсу төскә керә. Суны тагын да өстәгәндә порошок эри һәм зәңгәрсу төс¬
тәге эремә хасил була.
Суда бакыр (II) сульфатын CuS04 (ак төстә) эретеп, ә ан¬
нары эремәне парга әйләндергәндә башка матдә кристаллары —
бакыр купоросы CuSO4-SH2O (зәңгәр төстә) аерылып чыга.
Бакыр (II) сульфатының бакыр купоросына әверелүен
CuSO4 + 5H2O = CuSO4-5H2O, ДД<0
тигезләмәсе белән күрсәтергә була.
Бакыр купоросын җылытканда су аерылып чыга (дегидрат-
лашу) һәм яңадан бакыр (II) сульфаты табыла:
CuSO4-5H2O = CuSO4 + 5H2O, ДЯ>0
Кристаллар составына керә торган су кристаллизацион су
дип, ә кристаллизацион суы булган матдәләр кристаллогидрат-
лар дип аталалар.
Кристаллогидратларга мисал итеп бакыр купоросын CuSO4-SPbO — биш
сулы бакыр (II) сульфатын, тимер купоросын FeSO4-THjO — җиде сулы ти¬
мер (II) сульфатын, соданы NazCOs-IOHjO — ун сулы натрий карбонатын,
глаубер тозын NazSO4-IOHzO — ун сулы натрий сульфатын, гипсны CaSO4X
Х2Н2О— ике сулы кальций сульфатын күрсәтергә мөмкин.
Кристаллогидратларның тотрыклыгы төрле. Аларның күбе¬
се кристаллизацион суны бүлмә температурасында да югалта.
13 П-236
193
Әйтик соданың NaaCCh-IOFbO үтә күренмәле кристаллары ан¬
сат «ашалалар»: кристаллизацион суны югалталар һәм тонык¬
ланып, акрынлап порошокка әвереләләр. Башка кристаллогид-
ратларны сусызландыру өчен (мәсәлән, CuSO4-SHaO) шактый
көчле җылыту таләп ителә.
? 1. Түбәндәге мәгълүматлар буенча калий хлоридының KCl эрү җылылык
эффектын исәпләп чыгарыгыз: кристаллдагы ионнар арасындагы бәйләнеш-
▲ нең ныклыгы 730 кДж/моль, K+ һәм Cl- ионнарының гидратлашу җы¬
лылыгы тиңдәшле рәвештә 339 кДж/моль һәм 352 кДж/моль тәшкил итә.
Калий хлоридының KCl суда эрүе эндотермик процессмы яки экзотермик
процессмы? Ул нәрсә белән аңлатыла?
2. 1 моль натрий гидроксидын NaOH күп итеп алынган суда эреткәндә
күпме микъдарда җылылык аерылып чыгар яки йотылыр? Кристаллик чел¬
тәрне җимерү өчен 885 кДж/моль кирәк, ә Na+ һәм Cl- ионнары гидрат-
лашканда тиңдәшле рәвештә 423 кДж/моль һәм 511 кДж/моль аерылып
чыга.
3. Катионның һәм анионның гидрат тышчалары схемаларын сурәтләгез.
Аларның барлыкка килүен аңлатып бирегез.
18 нче лаборатор дәрес
АНАЛИЗ МӘГЪЛҮМАТЛАРЫ БУЕНЧА
КРИСТАЛЛОГИДРАТНЫҢ ФОРМУЛАСЫН АЧЫКЛАУ
Сезгә бакыр купоросының бирелгән микъдарындагы суның
һәм бакыр (II) сульфатының микъдарларын ачыкларга һәм ку¬
поросның формуласын билгеләргә кирәк булачак.
1. Чиста фарфор тигельне үлчәгез. Тигельнең массасын язып
куегыз. Аннары, тигельгә салып, 2—3 г бакыр купоросы үлчәп
алыгыз.
2. Тигельне штативның боҗрасы өстенә куелган тимер чы¬
быктан эшләнгән өчпочмакка урнаштырып, 8—10 минут кыз¬
дырыгыз. Нәрсә күзәтәсез?
3. Шуннан соң тигельне суытыгыз, ә аннары аны яңадан
үлчәгез. Тигельнең сусызландырылган продукт белән бергә үл¬
чәнгән массасын язып куегыз. Продуктның массасын табыгыз.
4. Кристаллогидраттагы кристаллизацион суның масса өле¬
шен ачыклагыз. Кристаллогидратның формуласын билгеләгез.
5. Сусыз бакыр (II) сульфатына тамчылап су өстәгез. Күзә¬
телгән күренешкә аңлатма бирегез.
? 1. 644 г глаубер тозын Na2SO4-IOH2O кыздырганда ничә грамм су аеры¬
лып чыгар? Бу кристаллогидратта суның масса өлеше күпме?
▲ 2. Барий хлориды кристаллогидратында кристаллизацион суның масса
өлеше 14,8% тәшкил итә. Кристаллогидратның формуласын билгеләгез.
3. Сез ничек уйлыйсыз, ни өчен натрий сульфатының Na2SO4 эрүе — экзо¬
термик процесс, ә глаубер тозының Na2SO4-IOHaO эрүе — эндотермик про¬
цесс?
194
§ 60. КҮКЕРТ
Химик элементны өйрәнү өчен белешмәлекнең (§ 40 ны карагыз) сораула¬
рына күкерткә карата җавап бирегез.
Шартларга карап, күкерт түбәндәге оксидлашу дәрәҗәләре
күрсәтергә мөмкин:
Электротискәрелеге белән күкерт галогеннардан, кислород¬
тан һәм азоттан гына калыша (кушымтаны карагыз). Шуңа
күрә бу элементлар белән булган кушылмаларында күкерт уңай
оксидлашу дәрәҗәләре күрсәтә, башка элементлар белән исә
күкерт тискәре оксидлашу дәрәҗәсе күрсәтә. Аеруча аңа югары
( + 6) һәм түбән (— 2) оксидлашу дәрәҗәләре характерлы.
Табигатьтә күкерт шактый күп таралган. Ул табигый күкерт
хәлендә дә, шулай ук башлыча сульфидлар S-2 һәм сульфат¬
лар S+ рәвешендә дә очрый. Алар арасында цинк обманкасы
ZnS1 кургаш ялтыравыгы PbS1 гипс CaSO4-2^0, глаубер тозы
Na2SO4-IOThO минераллары бар. Күкерт — тереклек эшчәнлеге
өчен кирәкле элемент, чөнки ул аксымнар составына керә. Кү¬
кертнең кушылмалары ташкүмер һәм нефть составына да керә¬
ләр. Табигый күкертнең төп чыганаклары Италиядә (Сицилия),
АКШ та урнашкан. Табигый күкерт шулай ук Идел буенда,
Урта Азиядә һәм Кырымда бар.
Күкерт атомнарының, парсыз ике электроннары исәбенә, Sra
чылбырлары хасил итеп берләшүләре мөмкин:
Чылбырлар ачык яки боҗра ясап йомылган булырга мөмкин.
Шулай итеп, төрле составлы күкерт молекулалары була. Шуңа
күрә күкерткә аллотропия күренеше хас. Аеруча тотрыклы мо¬
лекула сигез атомнан гыйбарәт Ss. Ромбик күкерт дип атал¬
ган аллотропик төр үзгәрешенең кристаллары шундый молеку¬
лалардан төзелгән. Күкерт —сары төстәге уалучан матдә. Кү¬
кертне порошок хәленә китерү бик җиңел. Күкерт практик як¬
тан суда эреми һәм хәтта чыланмый да. Җылылыкны һәм электр
тогын начар үткәрә. 119° C та эретелә.
Көчле җылытылган сыек күкертне тиз суытканда, мәсәлән,
салкын суга салганда, күкертнең башка төр үзгәреше: пластик
күкерт — коңгырт төстәге резина кебек масса хасил була. Аны
теләсә нинди формага кертеп, җеп шикелле сузып була. Плас¬
13:
195
тик күкертнең бу үзлекләре аның күкерт атомнарының озын
чылбырларыннан торуы белән аңлатыла. Пластик күкерт төе¬
рендә молекулалар — чылбырлар тәртипсез рәвештә чуалган
булалар, тартып сузганда алар тураялар һәм бер-берсенә па¬
раллель урнашалар. Пластик күкерт тотрыксыз: ул бик тиз
катылана һәм ромбик күкерткә әверелә.
Күкерт кайнаганда куе-коңгырт төстәге парга әверелә. Бу
парларны тиз суытканда, мәсәлән, күкерт парларында салкын
су салынган пробирканы тотканда, аның стеналарына бик вак
порошок утыра. Бу порошок (күкерт «чәчәге») ромбик күкерт¬
нең бик вак кристалларыннан гыйбарәт.
Күкерт оксидлаштыручы үзлекләрен дә, кайтаручы үзлеклә¬
рен дә күрсәтә. Оксидлаштыручы буларак ул металлар, водород
һәм кайбер неметаллар белән тәэсир итешә. Күкертнең тимер
белән булган реакциясен хәтергә төшерегез:
Fe-FS = FeS, ЛН<0
Тимер (II)
сульфиды
Кайнар пыяла таякчык белән күкерт һәм цинк катнашмасына
кагылганда, ул күз чагылдырырлык якты ялкын белән кабынып
китә һәм цинк сульфиды кисәкчекләреннән торган ак төтен хасил
була:
Zn-FS = ZnS, ДЯ<0
Цинк
сульфиды
Күкерт парларында бакыр яна (72 нче рәсем).
Күкертнең кайтаручы үзлекләре галогеннар һәм кислород бе¬
лән тәэсир итешкәндә чагыла. Сезгә күкертнең һавада зәңгәрсу
ялкын белән, ә кислородта
ачык-зәңгәр ялкын белән януы
билгеле:
72 нче рәсем. Бакырның күкерт пар¬
ларында януы.
S-FO2 = SO2, ҺН<0
Күкерт промышленностьта
һәм авыл хуҗалыгында киң
кулланыла (73 нче рәсем). Чы¬
гарылган күкертнең яртысы
диярлек сульфат кислотасы та¬
бу өчен тотыла. Шактый микъ¬
дарларда күкертне резина про¬
мышленностенда каучукны ре¬
зинага әверелдерү өчен кулла¬
налар. Күкерт порошогын үсем¬
лек корткычларына каршы кө¬
рәшү өчен кулланалар: аны
мамык һәм виноград үсемлек-
196
73 нче рәсем. Күкертне куллану (схема).
197
ләренең яфракларына сибәләр. Медицинада күкертне төрле мазь¬
лар ясауда, шулай ук матдәләр алмашы бозылганда куллана¬
лар.
Янучан матдә буларак, күкерт шырпы ясауда кулланыла:
ул шырпы башының составына керә. Күкерт кара дары (ау мыл¬
тыгы дарысы) җитештергәндә кулланыла.
1. а) Ромбик күкерт; б) пластик күкерт нинди молекулалардан гыйбарәт?
Күкертнең бу модификацияләре үзлекләре белән ничек аерылып торалар?
2. Гади матдәләрдән 3 нче период элементларының югары оксидлашу дә¬
рәҗәләренә туры килгән сульфидларны табу реакцияләренең тигезләмә¬
ләрен языгыз. Тигезләмәләрдә коэффициентларны куегыз.
3. Гади матдәләрдән түбәндәге оксидлар һәм сульфидлар хасил булганда
җылылык аерылып чыга:
A//, кДж/моль ZnO ZnS FeO H2O H2S FeS
— 351 —205 —265 —242 -21 —100
Бу мәгълүматлар нигезендә кислородның һәм күкертнең чагыштырма ок¬
сидлаштыру активлыгы турында нәрсә әйтергә мөмкин?
§ 61. СУЛЬФИДЛАР. СЕРОВОДОРОД
1. Д. И. Менделеев периодик системасының 2 нче һәм 3 нче периодлары
элементларының сульфидлары формулаларын языгыз. (Формулаларны төзе¬
гәндә кушымтадагы таблица буенча элементларның электротискәрелекләрен
исәпкә алырга онытмагыз). 2. Сероводород H2S молекуласында күкерт һәм
водород атомнарының электрон болытлары аралашу схемасын сурәтләгез.
Тискәре —2 оксидлашу дәрәҗәсен күкерт үзенә караганда
электротискәрелекләре кимрәк булган элементлар белән бинар
кушылмаларда күрсәтә. Андый кушылмаларны, белгәнегезчә,
сульфидлар дип атыйлар. Сульфидларның составы оксидларны¬
кына охшаш.
Күкертнең водород белән булган кушылмасы да сульфидлар¬
га керә. Сероводород молекуласының төзелеше су молекуласы¬
ның төзелешенә охшаган:
H- O: H-St
I I
H H
Сероводородның H2S һәм суның H2O үзлекләрендәге аерма¬
лык күкерт S атомының кислород O атомына караганда зуррак
булуына бәйле. Шуңа күрә H — S бәйләнеше H-O бәйләне¬
шеннән озынрак һәм көчсезрәк. Сероводород — суга караганда
җылытуга чыдамсызрак кушылма. Күкертнең электротискәрелеге
кислородныкыннан кимрәк булганлыктан, H-S бәйләнешенең
полярлыгы H-O бәйләнешенекеннән кимрәк.
Гадәттәге шартларда сероводород — газ. Ул начар исле. Са¬
сыган йомыркадан сероводород исе килә, чөнки сероводород
198
аксымнар таркалганда хасил була. Сероводород бик тә агулы!
Ул кандагы гемоглобинны тарката — тимер сульфиды барлыкка
килә. Шунлыктан сероводородны озак вакыт дәвамында сулау
үлемгә китерә.
Сероводород суда эри. Ул суда эрегәндә сероводород кисло¬
тасы хасил була, ягъни H2S молекулалары ионнарга диссоциа-
цияләшәләр. Электролитик диссоциация — кайтма процесс. Серо¬
водородның H2S диссоциациясе баскычлап уза. Башта бер
H+ ионы аерыла:
H2S^H+-F-HS-,
ә аннары икенчесе аерыла:
HS-=^H+-F-S2-
HS- ионын гидросульфид-ион дип атыйлар.
Сероводород кислотасын селтеләр белән нейтральләштер¬
гәндә ике төрдәге тозлар: урта (нормаль) тозлар — сульфидлар
һәм әче тозлар —- гидросульфидлар хасил була. Селте җитәр¬
лек булмаганда гидросульфидлар барлыкка килә, мәсәлән:
H2S + NaOH == NaHS + H2O
Натрий
гидросульфиды
Селтене тагын да өстәгәндә сульфидлар хасил була, мәсәлән:
NaHS + NaOH = Na2S + H2O
Натрий
сульфиды
Күпчелек сульфидлар суда эремиләр — аларны эрүчән тозлар
арасындагы алмашу реакцияләре ярдәмендә, мәсәлән:
Na2S-F-Pb(NO3)2 = PbSj-F-2NaNO3
Pb2++ S2-= PbSj
яки тоз эремәсе аша сероводород уздырганда җиңел табарга
мөмкин:
H2S+ Pb (NO3) 2 = PbSj+ 2HNO3
Кургаш сульфиды кара төстә, суда һәм кислоталарда прак¬
тик яктан эреми. Шуңа күрә кургашның эрүчән тозлары серо¬
водородка һәм сульфидларның эремәләренә реактив булып тора.
Газсыман сероводород барлыгын белү өчен кургаш тозы эремә¬
се сеңдерелгән кәгазьне кулланырга мөмкин. Кәгазьнең кара
төскә керүе сероводород барлыгын күрсәтә.
Cy кебек үк, сероводород гади матдәләр турыдан-туры тәэ¬
сир итешкәндә дә табыла:
H2 + S = H2S, АЖО
199
74 нче рәсем. Водород сульфидын син¬
тезлау.
Моның өчен водородны кай¬
нап торган күкерт өстенә җи¬
бәрәләр (74 нче рәсем).
Лабораториядә сероводо¬
родны Кипп аппаратында хло¬
рид кислотасы белән тимер
сульфидына тәэсир итеп таба¬
лар:
FeS+ 2Н+= Fe2+4-H2Sf
яки
FeS+ 2НС1 = FeCl2+ H2Sf
—2 оксидлашу дәрәҗәсе
күкертнең түбән оксидлашу дә¬
рәҗәсе булганлыктан, серово¬
дород кайтаручы ролен уйный.
Аның оксидлашу продуктла¬
ры — ирекле күкерт яки кү¬
кертнең уңай оксидлашу дәрә¬
җәсендәге кушылмалары. Әй¬
тик, кабызып җибәргәндә, се¬
роводород кислородта яисә һа¬
вада яна. Бу вакытта серово¬
дородның тулысыңча януы яки
тулы булмаган януы күзәтелә.
Тулысынча янганда күкерт
(IV) оксиды барлыкка килә:
2H2S + ЗО2 = 2SO2 + 2Н2О,
АЖО
Яну тулы булмаса (кисло¬
род җитәрлек булмаганда) кү¬
керт барлыкка килә:
2H2S + O2 = 2S + 2H2O,
АЯ<0
Янып торган сероводород ялкыны¬
на салкын предмет (мәсәлән, салкын су
салынган колба) кертик, ул чагында
предметның өслегендә сары тап рәве¬
шендә күкерт куныгы — күкерт «чәчә¬
ге» утыра (75 нче рәсем).
75 нче рәсем. Водород сульфидының
януы.
Табигатьтә сероводород кайбер чыганакларда (мәсәлән, Кав¬
каздагы атаклы Мацеста курорты) була. Мондый сулар серо¬
водородлы ванналар рәвешендә дәвалау максатларында кулла¬
нылалар.
Металларның сульфидлары, күрсәтеп үтелгәнчә, табигать¬
тә киң таралган. Төсле металларның сульфидлы рудаларын ме¬
таллургиядә төсле металлар эретеп алу өчен кулланалар. Кай¬
бер сульфидлар сульфат кислотасы һәм аның тозларын җитеш¬
терү өчен чимал булып торалар.
? 1. Сероводородлы су һавада торганда акрынлап болганчыклана һәм лак¬
мусны кызыл төскә кертми башлый. Моны нәрсә белән аңлатырга? Реакция¬
нең тигезләмәсен төзегез.
A 2. 1 моль сероводород кислородта тулысыңча янганда 563 кДж/моль, ә
тулысыңча янып бетмәгәндә 266 кДж/моль җылылык аерылып чыга. Ни
өчен беренче очракта икенче очрактагыга караганда күбрәк җылылык ае¬
рылып чыга?
3. Йодлы су өстәгәндә сероводородлы су болганчыклана. Реакциянең ти¬
гезләмәсен төзегез.
4. Күкерт, тимер һәм хлорид кислотасы булса, ничек сероводород табарга?
5. Кайбер металларны сульфидлы рудалардан тапканда, башта рудаларны
яндыралар, ә табылган металл оксидын күмер белән кайтаралар. (Бу ва¬
кытта күмер углерод (II) оксидына CO оксидлаша). Цинк обманкасыннан
ZnS цинк табу реакцияләренең тигезләмәләрен языгыз.
6. Кислородның оксидлаштыру үзлекләре күкертнекеннән көчлерәк чагы¬
луын күрсәткән реакцияләргә мисаллар китерегез.
7. а) Җылытканда; б) басымны арттырганда; в) суга селте өстәгәндә;
г) суга бакыр (II) нитраты эремәсен өстәгәндә савыттагы су өстендә булган
водород сульфидының эрүчәнлеге ничек үзгәрер?
8. Тимер (III) оксиды һәм күкерт (IV) оксиды хасил булуны күздә тотып,
FeSz ын яндыру реакциясенең тигезләмәсен төзегез (FeSz да күкертнең
оксидлашу дәрәҗәсен —1 дип алырга мөмкин). FeSz ның яну җылылыгы
—843 кДж/моль тәшкил итсә, 120 т FeSz янганда нинди микъдарда җы¬
лылык аерылып чыгар?
це Йомырка аксымын (бераз сарысыннан аерып алыгыз) кыздырылган кер
содасы салынган пробиркага өстәгез һәм җылытыгыз. Аннары 5—7 тамчы
кургаш примочкасы (аптекада сатыла) тамызыгыз. Нәрсә күзәтәсез? Кү-
зәтүләрегезне аңлатып бирегез.
§ 62. KYKEPT (IV) ОКСИДЫ. СУЛЬФИТЛАР
Күкерт (IV) оксидын: а) күкертне; б) цинк сульфидын; в) водород суль¬
фидын оксидлаштырып табу реакцияләренең тигезләмәләрен төзегез.
4-4 оксидлашу дәрәҗәсендәге күкерт түбәндәге кислородлы
кушылмалар составына керә:
SO2 H2SO3 Na2SO31 CaSO3
Күкерт (IV) Сульфит Тозлар — сульфитлар
оксиды кислотасы
Күкерт (IV) оксиды, яки сернистый газ SO2 — гадәттәге
шартларда төссез, үзенә генә хас зәһәр исле газ. Бу ис сез¬
гә таныш — шырпы кабызганда чыга торган ис.
201
Сернистый газ суда яхшы эри. Аның судагы эремәләре әче
тирәлеккә ия, чөнки SO2 су белән тәэсир итешкәндә сульфит
кислотасы H2SO3 барлыкка килә:
SO2 (г)+Н2О (C)^H2SO3 (э), ДЯ<0, ЛЗ<0
Сульфит кислотасы H2SO3 бары тик эремәдә генә була ала,
ул баскычлап диссоциацияләшә:
H2SO3^H+H-HSO3-
HSO3-=H+H-SOi-
Димәк, сернистый газның судагы эремәсендә
SO2 + H2O^H2SO3^H+ + HSO+*2H + + SO3-
тигезләнешләре урнаша.
Эремәдә һәрвакыт SO2 молекулалары булганлыктан, суль¬
фит кислотасы эремәсеннән зәһәр ис килә. Җылытканда китерел¬
гән тигезләнешләр сулга авыша. Сульфит кислотасын кайнат¬
канда эремәдәге сернистый газ тулысынча диярлек очып бетә.
Киресенчә, күкерт (IV) оксидының судагы эремәсенә селте
өстәгәндә тигезләнешләр уңга авышалар. Нейтральләшү реак¬
циясе булып уза — H+ ионнары OH- ионнары белән кушыла¬
лар:
H+-FOH- = H2O
Ике төрдәге тозлар хасил була (әче һәм урта тозлар):
H2SO3+ NaOH = NaHSO3 + H2O
NaHSO3 +NaOH = Na2SO3 +H2O
HSO3" ионын гидросульфит-ион дип, ә составларында шул
ион булган тозларны гидросульфитлар дип атыйлар.
SO3- ионын сульфит-ион дип, ә аның тозларын сульфит¬
лар дип атыйлар. Гидросульфитлардан аермалы буларак, суль¬
фитларның күпчелеге суда начар эри (кушымтаны карагыз).
Күкертнең арадаш оксидлашу дәрәҗәсендәге кушылмасы бу¬
ларак, күкерт (IV) оксиды, сульфит кислотасы һәм сульфитлар
кайтаручы үзлекләрен дә, оксидлаштыручы үзлекләрен дә күрсә¬
тәләр. Әйтик, һавада торганда ук сульфит кислотасының һәм
сульфитларның эремәләре акрынлап кислород белән оксидла¬
шалар. Бу вакытта туры килгәнчә сульфат кислотасы яки суль-
фат-ион хасил була:
2SO|- + O2 = 2SOi-
+ 4 +6
S -S
0
O2-2О”2 1
Кайтаручы ролендә SOi- ионнары гипохлорит-ионнар ClO- белән үзара
тәэсир итешкәндә катнашалар:
202
2
Jol - + ¢10 = SO42- + CI1-
+ 4 +6
S- S
Jl1-Cl-1
Бу реакциянең асылы ClO ионындагы кислород атомының SOi ионына
күчүеннән гыйбарәт:
O
2-
- -
—
O
2-
OS
+
OCl
=
OSO
+Ci
O
_о _
Кислород атомының SOi- ионына килеп кушылуы күкертнең оксидлашу
дәрәҗәсе үсүгә, ә С10“ ионының кислород атомын югалтуы хлорның оксид¬
лашу дәрәҗәсе түбәнәюгә китерә.
Шулай итеп, оксидлашу-кайтарылу реакцияләре кайтаручыдан оксидлаш¬
тыручыга электроннар күчү исәбенә дә, атомнар күчү исәбенә дә булып узарга
мөмкин. Тикшереп узган реакциядә кислород атомнарының күчеше күзәтелә.
Лабораториядә күкерт (IV) оксидын сульфитларга сульфат
кислотасы белән тәэсир итеп табалар, мәсәлән:
/H2O
Na2SO3 +H2SO4 = Na2SO4 +H2SO3/
+04
яки
SOi-+ 2Н+= H2SO3 = H2O+ SO2I
Бу процесста тигезләнеш SO2 газы хасил булу ягына авыш¬
кан, чөнки SO2 реакция сферасыннан аерылып чыга.
Промышленностьта сернистый газны күкертне яки сульфид¬
ларны яндырып табалар. Күкерт (IV) оксидын SO2 төп куллану
өлкәсе — сульфат кислотасы җитештерү.
Дымлы сернистый газ саламны, йонны, ефәкне һәм шикәрне
агарту өчен кулланыла. Әйтик, фуксин эремәсенә (кызыл буяу)
яки шәмәхә карага сернистый газ белән тәэсир иткәндә алар-
ның төссезләнүләрен күзәтергә мөмкин.
Күкерт (IV) оксиды микроорганизмнарны үтерә, шуңа күрә
ул яшелчә саклый торган урыннарны төтәсләү өчен, җиләк-
җимешләрне күчереп йөрткәндә һәм саклаганда кулланыла.
? 1. Сернистый газның һава буенча тыгызлыгын һәм 1 л күләмендәге (н. ш.)
массасын исәпләп чыгарыгыз. Сернистый газны SO2 савыттагы һаваны
этеп чыгару ысулы белән җыеп буламы?
▲ 2. Ни өчен: а) җылытканда; б) селте эремәсе белән нейтральләштергәндә
сернистый газның судагы эремәсендә тигезләнешләр авышалар?
3. Ничек итеп натрий гидросульфитыннан натрий сульфиты табарга? Тиешле
реакцияләрнең тигезләмәләрен языгыз. Сульфит кислотасы электролитик
диссоциациясенең кайсы баскычларында әче һәм урта тозлар хасил була?
Мисаллар китерегез.
4. Вулканнардан чыккан газлар арасында сернистый газ һәм сероводород
та бар. Сүнмәгән вулканнар янында (Сицилия) күкерт хасил булуны шул
ике газның үзара тәэсир итешүе белән аңлаталар. Вулканик күкертнең
203
хасил булуы нинди реакциягә нигезләнгән? Бу вакытта сернистый газ нинди
үзлекләр күрсәтә — оксидлаштыручы үзлекләреме яки кайтаручы үзлек¬
ләреме?
5. Барий сульфитын эрүчән тозлардан табу реакциясенең тигезләмәсен
языгыз.
6. Сульфит кислотасының һәм сернистый газның кислота үзлекләрен чагыл¬
дырган, сезгә таныш әверелешләрне китерегез.
7. 1 моль SOa оксидлашканда 98,9 кДж җылылык аерылып чыкса, 6,4 т
SO2 оксидлашканда нинди микъдарда җылылык аерылып чыгар?
§ 63. КҮКЕРТ (VI) ОКСИДЫ. СУЛЬФАТЛАР
1. Сыегайтылган сульфат кислотасының: а) электролитик диссоциациясе;
б) цинк белән реакциясе; в) металл оксиды белән реакциясе; г) металл гид¬
роксиды белән реакциясе тигезләмәләрен язып, кислоталар классына керүче
типик матдә буларак, үзлекләрен тасвирлагыз. 2. а) Суда эрүчән; б) суда аз
эрүчән; в) суда эремәүчән тозларга — сульфатларга мисаллар китерегез һәм
бу тозларны алмашу реакцияләре белән табуның тигезләмәләрен төзегез.
Күкертнең Ң-6 югары оксидлашу дәрәҗәсе аның кислородлы
һәм фторлы кушылмаларында чагыла, мәсәлән:
SO3 H2SO4 Na2SO4, CaSO4
Күкерт (VI) Сульфат Тозлар — сульфатлар
оксиды кислотасы
Күкерт (Vl) оксиды SO3 — гадәттәге шартларда очучан сы¬
еклык (эретелү температурасы 16,8° С).
76 нчы рәсем. Күкерт (IV) оксидын кислород белән каталитик оксидлаштыру.
204
һавада күкерт (VI) оксиды
«төтенли». Моны күкерт (VI)
оксидының һавадагы су парла¬
ры белән кислота тамчылары
хасил итеп, үзара тәэсир ите¬
шүләре белән аңлатырга мөм¬
кин:
H2O-I-SO3 = H2SO4, ДЖО
Техникада күкерт (VI) ок¬
сидын күпләп күкерт (IV) ок¬
сидын катализатор катнашын¬
да һәм шактый көчле җылыт¬
канда оксидлаштырып таба¬
лар:
2SO2 + O2^2SO3, ДЖО
77 нче рәсем. H2SO4 молекуласының
моделе.
76 нчы рәсемдә күрсәтелгән прибордан файдаланып, күкерт (IV) оксидын
катализаторсыз һәм катализатор катнашында оксидлаштыруны тикшереп узыйк.
Сернистый газ һәм һава катнашмасын катализатор салынмаган көпшә аркылы
башта бүлмә температурасында, ә аннары җылытканда үткәрсәк, күкерт (VI)
оксиды — ак томан — барлыкка килүен күрмәбез. Шулай итеп, сернистый газны
кислород белән оксидлаштыру реакциясенең тизлеге бик кечкенә. Көпшәгә ка¬
тализатор— тимер (III) оксиды кисәкләре урнаштырып, тәҗрибәне кабатлыйк.
Гадәттәге температурада SOs хасил булуын без шулай ук күрмибез. 500° C
ка һәм аннан да югарырак температурага кадәр җылытканда исә реакция
бара, без аны ак томан барлыкка килү буенча беләбез.
Сульфат кислотасы молекуласының төзелеше 77 нче рәсем¬
дә күрсәтелгән.
Сусыз (100% лы) сульфат кислотасы — төссез майсыман сы¬
еклык. Анда H2SO4 молекулалары водородлы бәйләнешләр яр¬
дәмендә берләшкәннәр. Сульфат кислотасы судан ике тапкыр
чамасы авыррак. Гадәттәге шартларда очучан түгел.
Сыегайтылган сульфат кислотасы кислоталарга хас булган
барлык үзлекләргә дә ия, судагы эремәләрендә баскычлап дис-
социацияләшә:
H2SO4^H+H-HSO4-
HSO4-^H+ + SOl-
Шуңа күрә H2SO4 эремәләрен нейтральләштергәндә ике төр¬
дәге тозлар — сульфатлар һәм гидросульфатлар хасил була:
H2SO4 + NaOH = NaHSO4 + H2O
NaHSO4 +NaOH = Na2SO4 +H2O
Сульфатларның күпчелеге суда яхшы эри. Ә менә кальций
сульфаты CaSO4 суда аз эри, кургаш сульфаты PbSO4 тагын
да азрак эри һәм барий сульфаты BaSO4 суда практик яктан
эреми (кушымтаны карагыз).
205
Күкерт (VI) оксиды һәм куертылган сульфат кислотасы көч¬
ле оксидлаштыручылар булып торалар (бигрәк тә җылытканда).
Бу вакытта сульфат кислотасы гадәттә күкерт (IV) оксидына
SO2 кадәр кайтарыла. Әйтик, ул водород иодидын оксидлаш¬
тыра:
2HI +H2SO4 = I2 +SO2 + 2H2O
-1 0
21 -I2
Куертылган сульфат кислотасы, активлык рәтендә ничек ур¬
нашуларына карамастан, күп кенә металларны оксидлаштыра.
Әйтик, җылытканда куертылган сульфат кислотасы бакыр белән
тәэсир итешә:
Cu + 2H2SO4 = CuSO4+SO2f+2H2O
O +2
Cu -Cu
Куертылган сульфат кислотасы (масса өлеше 75% тан ар¬
тыграк) тимергә тәэсир итми. Бу аны корычтан ясалган цистер¬
наларда сакларга һәм күчереп йөртергә мөмкинлек бирә.
Үлчәүдә куертылган сульфат кислотасы салынган стаканны тигезлик. Үлчәү
янына су салынган фарфор чашка куйыйк. Берникадәр вакыттан соң үлчәүнең
тигезләнеше бозылуын сизәргә мөмкин. Сульфат кислотасы салынган стаканның
массасы герләр массасыннан артыграк була. Куертылган сульфат кислотасы су
парларын йота. Моны сульфат кислотасының су белән тотрыклы гидратлар, мә¬
сәлән: H2SO4-IbO, H2SO4--IH2O һ. б. хасил итүеннән чыгып аңлатырга мөмкин.
Куертылган сульфат кислотасы су белән бик көчле тәэсир
итешә. Cy парларын йота алуына нигезләнеп, сульфат кислота¬
сын газларны киптерү өчен кулланалар. Ул кәгазьне, үзагачны
күмерләндерә. Моның шулай икәнлеген кислотаны кәгазьгә ти¬
дереп караганда бик җиңел белергә була.
Куертылган сульфат кислотасын сыегайтканда күп микъдар¬
да җылылык аерылып чыга. Шуңа күрә куертылган сульфат
кислотасын су белән катнаштырганда сак булырга кирәк: суль¬
фат кислотасы суга салына, ә киресенчә салырга һич тә яра¬
мый. Сульфат кислотасына су салганда, аерылып чыккан җы¬
лылык исәбенә, су, бик көчле җылынып, кайнарга мөмкин. Кис¬
лота чәчри башлар һәм аның тирегә, күзгә эләгүе ихтимал.
Куертылган сульфат кислотасы тәнне нык пешерә. Шунлык¬
тан тирегә яки тукымага тигән кислотаны шунда ук селкеп тө¬
шерергә, аны яхшылап су белән, ә аннары чәй содасы эремәсе
белән һәм яңадан су белән юарга кирәк.
206
Сульфат кислотасы ашламалар җитештерү, нефть продукт¬
ларын чистарту, тозлар һәм кислоталар җитештерү өчен кул¬
ланыла. Сульфат кислотасының органик синтез өчен әһәмияте
ЗУР-
? 1. Сыегайтылган сульфат кислотасының: а) металлар белән; б) металл
оксидлары белән реакцияләренә мисаллар китерегез.
A 2. Терекөмеш (II) сульфаты хасил булуны күздә тотып, куертылган суль¬
фат кислотасының терекөмеш белән тәэсир итешү реакциясенең тигезлә¬
мәсен языгыз.
3. 12,8 г бакыр сульфат кислотасы белән тулысынча оксидлаштырылганда
күпме күләмдә (и. ш.) сернистый газ табарга мөмкин?
4. Өч пробиркада натрий сульфаты, сульфиты һәм сульфиды бирелгән.
Ничек, бер реактив ярдәмендә, бу матдәләрнең һәркайсы нинди пробиркада
икәнлеген белергә?
5. Куертылган сульфат кислотасы ярдәмендә: а) сероводородны; б) кисло¬
родны; в) сернистый газны киптереп буламы? Җавапны дәлилләгез.
6. Билгеле булганча,
2SO2+O2^SO3, Д/7<0
реакциясе процессында 400° C та күкерт (IV) оксидының максимум 99,2% ы,
500° C та — 93,5% ы, 600° C та — 73% ы, ә 1000° C та бары тик 5% ы гына
оксидлаша. Реакция күпме вакыт барса да, газлар катнашмасында һәр¬
вакыт реагирлашмаган күкерт (IV) оксиды була. Моны ничек аңлатырга
мөмкин? Температура шартларының — җылытуның яки суытуның — кү¬
керт (VI) оксиды барлыкка килүгә йогынтысы нинди һәм бу нәрсә белән
аңлатыла?
19 нчы лаборатор дәрес
КҮКЕРТ ҺӘМ АНЫҢ КУШЫЛМАЛАРЫ
1 нче тәҗрибә. Натрий сульфиды эремәсенә хлорлы су өстә¬
гез. Реакциянең тигезләмәсен языгыз.
2 нче тәҗрибә. Пирит FeS2 кисәген кыскыч белән тотып го¬
релка ялкынына кертегез. Сез нәрсә күзәтәсез? Реакция продукт¬
ларының берсе тимер (III) оксиды булуын күздә тотып, реакция
тигезләмәсен төзегез.
3 нче тәҗрибә. Характерлы реакцияләр ярдәмендә сезгә би¬
релгән тозларның сульфатмы, сульфитмы яисә сульфидмы икән¬
леген билгеләгез.
4 нче тәҗрибә. Cy салынган пробиркага саклык белән генә
пыяла таякчык ярдәмендә берничә тамчы куертылган сульфат
кислотасы өстәгез. Эрүнең җылылык эффектына игътибар итегез.
Күзәтүләрегезне аңлатып бирегез.
5 нче тәҗрибә. Ике пробиркага 1 әр цинк грануласы салы¬
гыз. Пробиркаларның берсенә — сыегайтылган сульфат кисло¬
тасы, ә икенчесенә куертылган сульфат кислотасы өстәгез. Нинди
үзгәрешләр күзәтелә? Реакция күзәтелмәсә, пробирканы саклык
белән генә җылытыгыз. Күзәтүләрегезне аңлатып бирегез.
6 нчы тәҗрибә. Сыйфат реакцияләре ярдәмендә ике пробир¬
каның кайсында хлорид кислотасы, ә кайсында сыегайтылган
сульфат кислотасы икәнлеген билгеләгез.
207
§64. VI ТӨРКЕМ р-ЭЛ EMEHTJIAPbIHbIH,
ҮЗЛЕКЛӘРЕН ЧАГЫШТЫРУ
1. Кислород төркемчәсендәге элементларның атомнары төзелешендә нинди
охшашлыклар һәм аерымлыклар бар? 2. 11 нче таблицадагы мәгълүматлардан
чыгып, төркемчә элементларының атом номерлары белән: а) атомнарның радиус¬
лары; б) атомнарның ионлашу энергияләре арасындагы бәйлелек графикларын
төзегез һәм аңлатып бирегез. 3. Химик элементны өйрәнү өчен белешмәлектән
файдаланып (§ 40 ны карагыз), селенның, теллурның һәм полонийның үзлек¬
ләрен тасвирлагыз.
Кислород төркемчәсендә, фтор төркемчәсендәге кебек үк,
атом номерлары арткан саен, элементларның атом радиуслары
зурая, атомнарның ионлашу энергияләре кими. Моны 11 нче таб¬
лицадагы мәгълүматлардан күрергә мөмкин.
11.нче таблица. Vl төркем р-элементларының төп константалары
Химик
элемент
Атом
номеры
Валентлык
электрон¬
нары
Чагыштырма
атом мас¬
сасы
Атомның
радиусы,
HM
Атомның
ионлашу
энергиясе
кДж/моль
O
8
2s22p4
15,999
0,045
S
16
3s23p4
32,06
0,081
1314
Se
34
4s24p4
5s25p4
78,96
0,092
1000
Te
52
127,60
0,11
941
Po
84
6s26p4
[209]
0,12
869
813
Димәк, O — S — Se — Te-Po рәтендә элементларның үзлек¬
ләре үзгәрә. Бу, аерым алганда гади матдәләрнең структура¬
ларында һәм үзлекләрендә чагыла. 8 нче таблицадан күрен¬
гәнчә, кислородка һәм күкерткә — молекуляр кристаллик челтәр,
селенга һәм теллурга атомлы кристаллик челтәр хас, ә полоний
металлик кристаллар челтәренә ия. Гадәттәге шартларда кисло¬
род типик неметалл (газ), ә полоний — типик металл (кургаш¬
ка охшаган).
Элементларның атом номерлары арткан саен, төркемчәдә
элементларның электротискәрелек кыйммәтләре кечерәя (кушым¬
таны карагыз), тискәре оксидлашу дәрәҗәсен күрсәтү үзлеге
кими. О2—S — Se — Te рәтендә гади матдәләрнең оксидлаш¬
тыру активлыгы кими. Әйтик, күкерт һәм, бик үк актив булмаса
да, селен водород белән турыдан-туры тәэсир итешәләр, ә тел¬
лур исә водород белән реакциягә керми.
Водород селениды НгБе һәм водород теллуриды FUTe водо¬
род сульфиды шикелле үк,— начар исле, агулы газлар. НгО —
H2S — FhSe — FhTe рәтендә химик бәйләнешләрнең ныклыгы ки¬
ми, димәк, аларның термик тотрыклыгы да кими. Водород селе¬
ниды ның FhSe һәм водород теллуридының FhTe эремәләре, водо¬
род сульфидының FhS эремәсе кебек үк, кислоталар булып то-
208
ралар. Селеноводород һәм теллуроводород кислоталарының тоз¬
лары—селенидлар һәм теллуридлар эрүчәнлекләре ягыннан
сульфидларга охшаганнар. Табигатьтә селенидлар һәм теллурид¬
лар сульфид рудалары белән бергә очрыйлар.
Күкерт шикелле үк, селен һәм теллур -|-4 оксидлашу дәрә¬
җәсен күрсәтәләр. Селен һәм теллур яки водород селениды һәм
водород теллуриды янганда селен (IV) оксиды SeO2 һәм теллур
(IV) оксиды TeO2 барлыкка килә. Әмма, күкерт (IV) оксидыннан
SO2 аермалы буларак, алар — каты матдәләр. Бу оксидларга
селенит кислотасы H2SeOa һәм теллурит кислотасы H2TeO3, алар-
ның тозлары — селенитлар һәм теллуритлар туры килә.
Селенның һәм теллурның югары Ң-6 оксидлашу дәрәҗәсенә
SeO3 һәм TeO3 оксидлары туры килә. Селенат кислотасы H2SeO4
һәм аның тозлары үзлекләре белән тиңдәшле рәвештә сульфат
кислотасын һәм сульфатларны хәтерләтәләр. Теллурат кислота¬
сы НбТеОе бу кислоталардан нык аерылып тора. Аның молеку¬
ласында теллур атомын, H2SOi һәм H2SeOi молекулаларында
күкерт һәм селен атомнарын чолгап алганча, дүрт кислород
атомы түгел, ә алты кислород атомы чолгап алган (77 нче рә¬
семне карагыз).
Селен һәм теллур табигатьтә һәрвакыт бергә очрыйлар. Бу
аларның исемнәрендә дә чагылыш тапкан. Теллур исеме латин¬
ча «теллус» — җир, ә селен исеме грекча «селена» — Җир ияр¬
чене — ай дигән сүзләрдән килеп чыга.
Полоний — радиоактив элемент, ирле-хатынлы Кюрилар тара¬
фыннан ачылган һәм Мария Склодовская-Кюриның туган иле —
Польша хөрмәтенә аталган. Полонийны башлыча ясалма юл бе¬
лән — висмуттан төш реакцияләре исәбенә табалар.
Э 1. Селенның һәм теллурның; а) цинк белән; б) кислород белән тәэсир
итешү реакцияләренең тигезләмәләрен языгыз. Табылган матдәләр ничек
аталалар?
A 2. Тиешле селенидлардан һәм теллуридлардан селенның һәм теллурның
водородлы кушылмаларын алмашу реакцияләре ярдәмендә табу тигезләмә¬
ләрен языгыз.
3. Селенның һәм теллурның водородлы кушылмалары яну реакцияләренең
тигезләмәләрен төзегез. Бу элементларның башлангыч һәм табылган кушыл¬
малары ничек атала?
4. Түбәндә реакцияләрнең җылылык эффектлары китерелгән:
2H2S + O2 = 2H2O + 2S, ЬН= —530 кДж
H2Se+ S = H2S+ Se, ДЯ = —98 кДж
Кислородтан күкерткә һәм аннан селенга күчкәндә гади матдәләрнең оксид¬
лаштыру активлыклары ничек үзгәрә?
5. Селенатларның эрүчәнлеге сульфатларныкына охшаган. Нинди металлар-
ның селенатлары суда начар эри? Аларның формулаларын һәм аларны
алмашу реакцияләре белән табуга икешәр мисал китерегез?
Бу бүлеккә карата тәкъдим ителгән әдәбияттан файдаланып кислород төр¬
кемчәсе элементларын ачу тарихы турында чыгыш ясарга хәзерләнегез.
Периодик системаны образлы итеп «бер битле химик энциклопедия» дип
атыйлар. Бу әйтемгә аңлатма бирегез.
14 П-236
209
§ 65. СУЛЬФАТ КИСЛОТАСЫН ҖИТЕШТЕРҮ
Түбәндәге әверелешләрнең реакция тигезләмәләрен төзегез:
S-SO2-SO3-H2SO4
Сульфат кислотасы — химик, технологиянең мөһим продукт¬
ларыннан берсе (грекча технология — «һөнәрләр турындагы фән»
дигән мәгънәне аңлата). Химик технология — табигый чималны
куллану продуктларына һәм арадаш продуктларга күпләп эшкәр¬
түнең аеруча отышлы методлары һәм юллары турындагы фән.
Продуктны иң аз чагыштырма капитал салулар һәм эксплуата¬
ция чыгымнары белән табуга тиешле химик-технологик процесс¬
ларны, кирәкле җиһазларны һәм технологик схеманы сайлап
алу, һәм шулай ук контроль ясауны һәм технологик процесслар
белән идарә итүне автоматлаштыру юлы белән ирешелә.
Химия производствосын өйрәнү өчен белешмәлек
1. Күрсәтелгән продуктны нинди чималдан (арадаш продуктлардан) һәм
нинди реакцияләр ярдәмендә табарга була?
2. Реакция продуктның иң зур чыгышы белән узсын өчен нинди шарт¬
лар булдырырга кирәк (химик тигезләнешнең авышуы)?
3. Нинди шартларда реакцияләр иң зур тизлек белән узалар?
4. Гетероген процессларда җылылык алмашуга (реакциянең җылылыгын
куллану) һәм бу процессларның тулысынча узуына (эрү, яну һ. б.) нинди
алымнар ярдәмендә ирешергә мөмкин?
5. Продуктны тапканда чималдан һәм энергиядән максималь рәвештә
нәтиҗәле файдалануга нинди технологик схеманы һәм нинди җиһазлар¬
ны кулланганда ирешергә була?
Сульфат кислотасын ничек табалар соң? Сез аның күкерт
(VI) оксиды су белән тәэсир иткәндә хасил булуын беләсез.
Үз чиратында күкерт (VI) оксидын катализатор катнашында
күкерт (IV) оксидын оксидлаштырып табалар. Ә күкерт (IV) ок¬
сидын ничек табалар? Промышленностьта аны металларның
сульфидларын яки күкертне яндырып табалар. Шуңа күрә суль¬
фат кислотасын җитештерү түбәндәге стадияләрдән гыйбарәт:
1) күкерт (IV) оксидын табу; 2) күкерт (IV) оксидын кү¬
керт (VI) оксидына оксидлаштыру; 3) күкерт (VI) оксидыннан
сульфат кислотасы хасил булу. Сульфат кислотасын җитештерү
схемасы III төсле рәсемдә күрсәтелгән.
Безнең илебездә күкерт (IV) оксидын табу өчен чимал бу¬
лып нигездә күкерт колчеданы FeS2 (пирит), шулай ук күкерт
тора. Күкерт колчеданын яндыралар:
4FeS24-llO2 = 2Fe2O3+8SO2, Д//<0
Колчеданны яндыру — гетероген процесс. Димәк, аның тиз¬
леге һава кислороды белән колчедан кисәкчекләренең орыну
өслеге зурлыгына бәйле. Шунлыктан яндыру алдыннан колче-
210
данны ваклыйлар. Яндыруны махсус мичләрдә үткәрәләр (III
төсле рәсем). Оксидлаштыруны «кайнаучы катлам» дип аталган
метод белән тормышка ашыралар. Моның өчен вакланган кол¬
чедан аша астан күп сандагы трубалар буйлап бирелә торган
көчле һава агымы өрдерәләр. Колчедан кисәкчекләре һәрвакыт
хәрәкәттә булалар. Аларның торышы кайнап торган сыеклыкны
хәтерләтә, шуңа күрә бу методны «кайнаучы катлам методы»
дип атаганнар да инде. Барлыкка килүче сернистый газ реакция
сферасыннан чыгарылып тора, процесс бер генә юнәлештә уза
(«Кайнау катламында» температура 900° С).
Яндыру миченә колчедан ленталы транспортер ярдәмендә бун¬
кер аркылы бирелә (III төсле рәсем). Реакция процессында
барлыкка килгән огарок мичнең аскы өлешендәге тишектән чы¬
гарыла.
Колчеданның оксидлашуы күп микъдарда җылылык аерылып
чыгу белән уза. Билгеле ки, бу җылылыкны куллану, мәсәлән,
су пары җитештерү өчен, экономик яктан максатка ярашлы
була. Шунлыктан колчеданны яндыру мичләрендә пар казаны
трубалары көйләнгән. Трубаларга салкын су җибәрелә, ә аның
җылынуы нәтиҗәсендә хасил булган пар электр энергиясе алу
өчен яки башка максатларда файдаланыла.
Күкерт (IV) оксидын күкерт (VI) оксидына оксидлаштыру —
экзотермик процесс:
2SO2 + O2^2SO3, АЖО
Димәк, химик тигезләнешне күкерт (VI) оксиды барлыкка
килү ягына авыштыру өчен процессны мөмкин кадәр түбәнрәк
температурада үткәрү отышлырак. Әмма түбән температурада
реакциянең тизлеге бик кечкенә. Шулай итеп, без температура
факторының капма-каршы тәэсире белән очрашабыз. Процессны
нинди шартларда үткәрергә кирәк соң? Күрәсең, иң элек химик
реакцияне мөмкин кадәр түбән температурада тизләтүче ката¬
лизатор табарга кирәктер. Күкерт (IV) оксидын SO2 күкерт (VI)
оксидына SO3 оксидлаштыру катализаторлары арасында иң актив
катализатор — платина. Аның катнашында 350° C та реакция си¬
зелерлек тиз уза. Ләкин платина — бик кыйммәтле металл. Мак¬
сатлы эзләнүләр нәтиҗәсендә ванадий (V) оксиды V2Os ниге¬
зендә катализатор булдырылган. Бу катализатор 400° C та шак¬
тый актив була. Шулай итеп, ванадий (V) оксиды нигезендә
табылган катализаторның активлыгы платинаныкыннан кимрәк,
ләкин ул экономик яктан платинага караганда отышлырак.
Биредә безгә катализаторларның тагын бер үзенчәлеген бил¬
геләп үтәргә кирәк. Алар, каталитик агулар булып торучы, кай¬
бер матдәләргә карата бик сизгерләр. Каталитик агулар бул¬
ганда катализаторларның активлыгы нык кими. Шуңа күрә суль¬
фат кислотасын җитештерүдә иң күп хезмәт куюны таләп итә
торган һәм җаваплы операцияләрнең берсе булып, колчеданны
яндырганда табылган газлар катнашмасын чистарту тора. Баш¬
14*
211
та катнашманы тузаннан арындыралар, ә аннары газны су һәм
куертылган сульфат кислотасы белән юдырып, каталитик агу бу¬
лып торучы матдәләрдән чистарталар. Бу операцияләр вакытын¬
да колчеданны яндырып табылган газ (мич газы) суына. Шу¬
ңа күрә чистартылган газ җылыту өчен җылылык алмаштыр-
гычка җибәрелә.
Күкерт (IV) оксидын күкерт (VI) оксидына оксидлаштыру
контакт аппаратында башкарыла. Бу процессны үткәрү өчен газ
белән катализаторның яхшырак контактлашуын тәэмин итүче
шартлар булдырырга һәм оптималь температураны сакларга ки¬
рәк. Оксидлашканда бик күп микъдарда җылылык аерылып чык¬
канлыктан, газның һәм катализаторның температурасы күтәрелә.
Оптималь температура шартларын саклап калу өчен, газны ка¬
тализатор белән берничә стадиядә контактка кертәләр. Моның
өчен контакт аппаратында катализаторны махсус челтәр шүр¬
лекләргә катлам-катлам итеп салалар. Катализатор катламнары
арасына җылылык алмаштыргычның трубаларын урнаштыралар.
Трубалар буйлап, өстәмә рәвештә җылыну өчен, колчеданны ян¬
дырып табылган газны җибәрәләр. Катализатор белән контакт¬
ның һәр стадиясеннән соң газ җылылык алмаштыргычның тру¬
баларына үзенең җылылыгын бирә. Бер үк вакытта ике проб¬
лема хәл ителә: колчеданны яндырып табылган газ җылытыла,
ә контактлашучы газ кирәкле температурага кадәр суытыла.
Реакция җылылыгын куллануның күрсәтелгән принцибы — җы¬
лылык алмашу принцибы — химик технологиядә киң кулланыла,
чөнки ул ягулыкны экономияләргә һәм системада оптималь тем¬
ператураны сакларга мөмкинлек бирә. Шул рәвешчә үк контакт
аппаратыннан чыга торган газ җылылык алмаштыргыч труба¬
сына җибәрелә һәм җылылыгын трубалар арасыннан үтә торган
чистартылган мич газына бирә.
Җылылык алмаштыргычта суынган газлар катнашмасы йот¬
тыру башнясына җибәрелә, анда күкерт (VI) оксиды 98% лы
куертылган сульфат кислотасы белән йоттырыла. Бу вакытта
олеум хасил була. Олеум үзендә күкерт (VI) оксидын эреткән
сульфат кислотасыннан H2SO4-TiSOs гыйбарәт.
Күкерт (VI) оксидын йоттыру өчен су кулланылмый. Аерылып
чыга торган җылылык исәбенә су парга әйләнә, ә аның белән
SO3 томан хәлендәге сульфат кислотасының HzSO4 парларын
хасил итә. Шул ук сәбәп буенча сыегайтылган сульфат кисло¬
тасын да кулланмыйлар.
Күкерт (VI) оксидын SO3 сульфат кислотасы белән йотты¬
ру — гетероген процесс, һәм аның тизлеге газ белән сыеклыкның
бер-берсенә орыну өслегенә бәйле. Зуррак орыну өслеге бул¬
дыру өчен йоттыру башняларына насадка — кислота тәэсире¬
нә чыдам керамик боҗралар тутыралар. Кислота өстән аска агып
төшә, ә газ башняның аскы өлешеннән җибәрелә.
Табылган олеум складка җибәрелә. Олеумның бер өлешен
98% лы сульфат кислотасы барлыкка килерлек итеп сыегайта¬
лар һәм йоттыру башнясында сугару өчен кулланалар.
2 нче кисәк
ХИМИК ТИГЕЗЛӘНЕШ
§ 66. РЕАКЦИЯЛӘРНЕҢ
ЭНЕРГЕТИК ҺӘМ ЭНТРОПИЯ ФАКТОРЛАРЫ
ҺӘМ ЮНӘЛЕШЕ
1. Химик процесслар узуның энергетик һәм энтропия факторлары турын¬
да сез нәрсә беләсез? (52 нче параграфны карагыз). 2. Системаның энтропиясе:
а) арту; б) кимү белән узучы химик реакцияләргә мисаллар китерегез. 3. Сис¬
теманың энергиясе: а) кимү; б) арту белән уза торган химик реакцияләргә
мисаллар китерегез. Бу реакцияләрне ничек атыйлар? 4. а) гади матдәләрдән
су синтезлау; б) суны гади матдәләргә таркату реакцияләрендә А/7 һәм AS
кыйммәтләренең тамгалары нинди булыр?
Без өч йөздән артык гади матдә һәм алты миллионга якын
химик кушылма барлыгын беләбез. Алар катнашында искиткеч
күп реакция тигезләмәләрен төзергә мөмкин. Шундый сорау туа:
бу реакцияләрне тормышка ашырып буламы соң һәм нинди
шартларда? Химик процессның принципиаль узу мөмкинлегенең
билгесе булып нәрсә тора икән?
Бу сорауга җавап бирү өчен, химик реакцияләр узганда
энергетик һәм энтропия факторларының нинди роль уйнауларын
хәтерегезгә төшерегез.
Белгәнегезчә, энергетик фактор системаның иң аз энергияле
халәткә күчүен билгели. Микъдар ягыннан энергетик фактор¬
ны реакциянең җылылык эффекты A// буенча бәялиләр.
Энтропия факторы системаның тагын да тәртипсезрәк ха¬
ләткә күчүен билгели. Системаның тәртипсезлектәге халәте
TAS тапкырчыгышы белән күрсәтелә (температураның энтропия
үзгәрешенә тапкырчыгышы). Бу аңлатмада T абсолют темпера¬
тураны белдерә. Ул бары тик уңай кыйммәткә генә ия була
(IX класс өчен физика дәреслеген карагыз). Абсолют температу¬
ра Кельвиннарда (K) күрсәтелә: 7’К=273°С -\-t° С. Бу аңлат¬
мада температураның кыйммәте булу системадагы тәртипсезлек
дәрәҗәсенең артуына җылыту ярдәмендә ирешергә мөмкин икән¬
леген күрсәтә. Температура югарырак күтәрелгән саен, система¬
дагы тәртипсезлек арта. TAS тапкырчыгышын энергия берәмлек¬
ләрендә, ягъни (АЯ кебек үк) Джоульләрдә күрсәтәләр.
Энергетик фактор һәм энтропия факторы химик процесска
үзара капма-каршы булган йогынты ясыйлар. Шунлыктан химик
реакция узуның принципиаль мөмкин булуы яки мөмкин булмавы
бу факторларның иң соңгы, ягъни нәтиҗә буларак тәэсире белән
билгеләнә:
bH—T&S
213
Аңлашыла ки, процессның узуы өчен системаның энергиясе
кимү, ә энтропиясе арту халәте аеруча отышлы:
AZZCO, AS >0
Ул вакытта химик реакция узуның принципиаль мөмкинлеге
AZZ-Z1AScO
бәйләнеше белән билгеләнә.
CaO һәм CO2 оксидларыннан кальций карбонатының СаСОз
хасил булу реакциясенең тормышка ашырылуына энергетик һәм
энтропия факторларының ничек йогынты ясавын тикшереп чы¬
гыйк:
CaO (к)+CO2 (г) =CaCO3 (к); AZZcO; AScO
Бу — экзотермик реакция (AZZcO), күләмнең кимүе белән
уза (AS<0). Димәк, реакциянең узу мөмкинлеге энергетик фак¬
тор тәэсиренең энтропия факторының капма-каршы йогынтысын¬
нан өстенлек алуы белән билгеләнә (| AZZI > IZ1ASI абсолют
кыйммәте буенча).
Киресенчә, кальций карбонатының оксидларга таркалуы
CaCO3 (K)=CaO (к)+СО2(г); AZZ>0, AS>0
эндотермик реакция булып тора (AZZ >0), ул күләмнең артуы
белән уза (AS>0). Димәк, аның узу мөмкинлеген энтропия
факторы билгели. Югары температурада энтропия факторы энер¬
гетик фактор тәэсиреннән өстенлек итә, ягъни I Z1ASI > IAZZI:
\H-T\SCO
Күргәнебезчә,
CaO (к)+CO2 (г) =CaCO3 (к)
процессы — кайтма процесс. Югары температурада процесс каль¬
ций карбонатының CaCO3 таркалуы ягына таба уза; түбән тем¬
пературада, киресенчә, процесс CaCO3 хасил булу ягына таба
уза. Энергетик һәм энтропия факторларының тәэсире тигезләш¬
кәндә, ягъни
AZZ=TAS
булганда, химик тигезләнеш урнаша.
? 1. АЯ—TAS < O аңлатмасын АЯ һәм TAS кыйммәтләренең нинди нисбәтлә¬
ре канәгатьләндерүенә анализ ясагыз.
▲ 2. Башлангыч матдәләрдәге һәм реакция продуктларындагы химик бәйлә¬
нешләрнең ныклыгы төрле булу энергетик факторның ЛЯ кыйммәтендә һәм
тамгасында ничек чагылыш таба?
3. а) Гади матдәләрдән су синтезлау; б) суны гади матдәләргә таркату
реакцияләренең узу мөмкинлеген нинди фактор билгели: энергетик фактормы
яки энтропия факторымы? Бу реакцияләрне тормышка ашыру мөмкинлеге
температурага ничек бәйләнгән?
214
4. Түбәндәге реакцияләрнең һәркайсында ЛЯ һәм TAS нинди тамгалы бу¬
лырлар:
2502 (г) +O2 (г) = 2SO3 (г)
2503 (г) =2SO2 (г) +O2 (г)
H2O (с) +SO3 (г) =H2SO4 (с)
H2CO3 (э) =CO2 (г)+H2O (с) ?
5. Ни өчен АЯ—TAS >0 тигезсезлеге химик реакциянең үзлегеннән прин¬
ципиаль мөмкин булмавын билгели?
«ХИМИК РЕАКЦИЯЛӘРНЕҢ ЮНӘЛЕШЕ»
ТЕМАСЫНА KAPATA КҮНЕГҮЛӘР
1 нче мисал. 2Н2 (г)+02 (г)=2Н2О (г) реакциясе өчен
АЯ, AS һәм TAS нинди тамгалы булырлар?
Белгәнегезчә, бу — экзотермик реакция, ягъни АЯеО. Ул
булып узганда системаның күләме кими (3 моль газсыман матдә¬
дән 2 моль барлыкка килә), ягъни AScO һәм TASeO.
1 нче бирем. Күрсәтелгән реакцияләрнең һәркайсында АЯ, AS
һәм TAS нинди тамгалы булырлар:
Cu (к) H-Cl2 (г) =CuCl2 (к)
H2O (с) +CO2 (г) =H2CO3 (э)
2Zn (к) +O2 (г) =2ZnO (к)
H2SO3 (э) =H2O (c)+SO2 (г)?
2 нче мисал, a) T=298 K (25° С), әгәр A//= —484 кДж, TAS=
= —26 кДж; б) T=IOOO K (737°С), әгәр АЯ=-484 кДж,
TAS= —890 кДж булса,
2Н2 (г) +O2 (г) =2Н2О (г)
реакциясе нинди—туры яисә кире — юнәлештә булып узар?
Реакциянең узуы АЯ— TASeO шарты канәгатьләндерелгән-
дә мөмкин.
Бу аңлатмага АЯ һәм TAS кыйммәтләрен куйыйк.
а) Т = 298 K очрагында:
— 494 кДж — (—26 кДж) = —458 кДж
Димәк, 298 K булганда бу реакциянең туры юнәлештә узуы мөм¬
кин. Аның тормышка ашырылуын энергетик фактор билгели
(АЯеО; |АЯ| > ITASI ).
б) T=IOOO K очрагында:
— 484 кДж—( —890 кДж) =406 кДж
Шулай итеп, IOOO K булганда бу реакциянең туры юнәлештә
узуы мөмкин түгел. Әмма кире реакциянең узуы принципиаль як¬
тан мөмкин:
2Н2О (г) = 2Н2 (г) +O2 (г)
Аның узуын энтропия факторы билгели (TAS >0; ITASI > |АЯ|).
215
2 нче бирем, а) 298 К, әгәр АЯ= 172 кДж, TAS = 47 кДж;
б) 1500 К, әгәр АЯ= 172 кДж, TAS = 237 кДж булса,
C (к) + CO2 (г) =2СО (г)
реакциясе нинди — туры яки кире — юнәлештә узар?
3 нче мисал. 2КС10з (к) =2КС1 (к) + ЗО2 (г), АЯ<0 реак¬
циясе кайтма реакция булып торамы?
Бу реакция энтропиянең артуы белән уза (AS>0). Ә АЯ<0,
AS >0 булганлыктан,
АЯ— TbSCO
бәйләнеше АЯ һәм TAS теләсә нинди кыйммәткә ия булган¬
да да саклана. Башкача әйткәндә, бу реакция кайтма реакция
түгел — ул бер генә юнәлештә булып уза.
3 нче бирем. Цинк белән хлор арасындагы реакциянең тигез¬
ләмәсен төзегез. Бу реакция кайтма реакция булырмы? Реак¬
циянең җылылык аерылып чыгу һәм энтропиянең кимүе белән
узуын игътибарга алыгыз.
4 нче бирем.
2СО (г) +O2 (г) =2СО2 (г), АЯ<0
реакциясе кайтма реакция булырмы?
5 нче бирем. Мисаллар һәм биремнәр өчен табылган җавап¬
ларның нәтиҗәләре буенча 12 нче таблицаны төзегез.
12 нче таблица. Энергетик һәм энтропия факторларыныц
реакция юнәлешенә йогынтысы
Реакция
Тамга
Реакциянең юнәлеше1
ДЯ
TbS
югары T
түбән T
1) Тикшерелгән реакцияләрнең узу мөмкинлеген нинди фак¬
тор билгели: энергетик фактормы, әллә энтропия факторымы?
2) а) Югары температурада; б) түбән температурада бу
типтагы реакцияләрнең кайсыларының узуы бигрәк тә ихтимал?
§ 67. ХИМИК ТИГЕЗЛӘНЕШ КОНСТАНТАСЫ
1. а) Динамик тигезләнеш; б) химик тигезләнеш төшенчәләренең билге¬
ләмәләрен әйтеп бирегез (52—53 нче параграфларны карагыз). 2. Утырым һәм
туендырылган эремә арасында нинди процесслар булуын аңлатып бирегез. Ни
өчен бирелгән температурада туендырылган эремәнең концентрациясе даими
зурлык булып тора?
1 Реакциянең юнәлеше ук ярдәмендә күрсәтелә: яки
216
Сез кайтма химик реакцияләрнең үзеннән-үзе бары тик бил¬
геле бер чиккә — системада химик тигезләнеш урнашканчы гына
узуларын беләсез. Тигезләнешкә җиткәч, бирелгән шартларда
матдәләрнең (башлангыч матдәләр һәм реакция продуктлары)
концентрацияләре үзгәрешсез кала. Матдәләрнең химик тигезлә¬
неш халәтендәге концентрацияләрен тигезләнеш концентрациялә¬
ре дип атыйлар.
Химик тигезләнеш халәтен микъдарча ничек характерларга
соң? Башлангыч матдәләрнең һәм реакция продуктларының ти¬
гезләнеш концентрацияләре нисбәтен ничек бәяләргә?
Реакциядә A һәм B матдәләре катнаша дип фараз итик;
нәтиҗәдә D һәм E матдәләре хасил булсын ди:
аА + 6В—+D + ^Е,
монда a, b, d, е — матдәләрнең формулалары алдындагы коэф¬
фициентлар.
Шулай ук бу системада химик тигезләнеш урнашкан дип уй¬
лыйк. Бу вакытта туры һәм кире реакцияләрнең тизлекләре ти¬
гез булыр, ә системада матдәләрнең концентрацияләре үзгәрмәс.
Матдәләрнең тигезләнеш концентрацияләрен Ca , Cb , C0, Ce дип
билгелик.
Күп санлы тикшеренүләр күрсәткәнчә, матдәләрнең тигезлә¬
неш концентрацияләре билгеле бер төгәл чагыштырмада була¬
лар, ә атап әйткәндә:
Бирелгән температура өчен бу чагыштырма даими зурлык:
ул тигезләнеш константасы дип аталган (К хәрефе белән билге¬
лиләр).
Күргәнебезчә, тигезләнеш константасының аңлатмасы реак¬
ция продуктларының тигезләнеш концентрацияләре тапкырчыгы¬
шының башлангыч матдәләрнең тигезләнеш концентрацияләре
тапкырчыгышына чагыштырмасыннан гыйбарәт. Тигезләнеш кон¬
центрацияләренең кыйммәтләре дәрәҗәгә күтәрелгән. Бу дәрәҗә
күрсәткечләре реакция тигезләмәсендә матдәләрнең формулала¬
ры алдына куелган коэффициентларга санча тигез булып тора¬
лар.
Тигезләнеш константасын гадәттә эксперименталь мәгълүмат¬
лар нигезендә исәплиләр. Түбәндәге
H2 (г) +I2 (г)^2Н1 (г)
реакциясенең тигезләнеш константасын исәпләп чыгарыйк.
78 нче рәсемдә водород H2, йод I2 һәм водород иодиды HI
концентрацияләренең вакытка бәйле рәвештә үзгәрүе турындагы
эксперименталь мәгълүматлар бирелгән. Реакцияне үткәрү бары¬
шында башлангыч матдәләрнең концентрацияләре кими, ә реак-
217
ция продуктының концентра¬
циясе арта. Химик тигезләнеш
урнашкач Нг, Һ һәм HI матдә¬
ләренең концентрацияләре инде
үзгәрми. 78 нче рәсемнән күрен¬
гәнчә, тигезләнеш концентра¬
цияләре мондый: Нг — 0,15
моль/л, 12 — 0,05 моль/л, ә HI —
0,5 моль/л.
Тикшерелә торган реакция¬
нең тигезләнеш константасы
Chi
/< =
Ch2-Cl1 ’
78 нче рәсем. Системаның тигезлә¬
нешкә якынлашуы белән реакция про¬
дуктының (HI) һәм башлангыч матдә¬
ләрнең (H2, I2) концентрацияләре үз¬
гәрү.
анлатмасы рәвешендә була.
Бу анлатмада тигезләнеш
концентрацияләренең кыйммәт¬
ләрен языйк:
(0,5 моль/л)2
Җ <nwn»/<iZ „„
0,15 моль/л-0,05 моль/л ’
Күргәнебезчә, бу аңлатмада санаучы ваклаучыдан шактый
зуррак. Димәк, тикшерелә торган система тигезләнеш халәтендә
күбесенчә реакция продуктыннан тора.
Шулай итеп, тигезләнеш константасының кыйммәте нәрсәне
белдерә соң? Ул тигезләнеш халәтен микъдарча тасвирлый.
Әгәр К> 1 икән, системада продуктларның концентрациясе баш¬
лангыч матдәләрнең концентрациясеннән шактый артыграк була.
Константаның кыйммәте зур булмаганда (К<1) система күбе¬
сенчә башлангыч реагентлардан тора. Шулай итеп, тигезләнеш
константасы буенча химик процессның ни дәрәҗәдә тормышка
ашырылуы турында фикер йөртергә мөмкин.
1. а) Суны синтезлау; б) аммиакны NH2 синтезлау реакцияләре өчен тигез¬
ләнеш константаларының аңлатмаларын языгыз.
2. Тигезләнеш халәтендәге системага: а) башлангыч матдәнең; б) реакция
продуктының өстәмә микъдарларын керткәндә туры һәм кире реакцияләр¬
нең тизлекләре ничек үзгәрә? Бу очракларда тигезләнеш константасының
кыйммәте үзгәрәме?
3. 1 л күләмле ябык савытка (2000°C һәм атмосфера басымы шартларында)
1 моль водород H2 һәм 0,5 моль кислород O2 катнашмасы кертелгән.
Системада тигезләнеш урнашканнан соң савытта 0,994 моль су H2O1
0,006 моль водород H2 һәм 0,003 моль кислород O2 булган. Бу реакциянең
химик тигезләнеш константасын исәпләп чыгарыгыз һәм аны тормышка
ашыру мөмкинлеге турында фараз итегез.
4. Водород һәм хлордан водород хлориды хасил булу реакциясенең тигез¬
ләнеш константасы 0,6-IO15 тәшкил итә. Бу реакция өчен тигезләнеш кон¬
стантасы аңлатмасын языгыз. Параграфтагы материалдан файдаланып, во¬
дород хлоридын һәм водород иодидын синтезлауның тормышка ашырылу
дәрәҗәләрен чагыштырыгыз.
218
§ 68. КИСЛОТАЛАРНЫҢ ҺӘМ НИГЕЗЛӘРНЕҢ
ИОНЛАШУ КОНСТАНТАСЫ
1. Электролитик диссоциация турындагы күзаллаулардан чыгып: а) кисло¬
таның; б) нигезнең билгеләмәләрен әйтеп бирегез. 2. Электролитик диссоциация
процессының химик реакция булып торуына дәлилләр китерегез.
Сезгә билгеле булганча, электролитлар (кислоталар, нигез¬
ләр, тозлар) судагы эремәләрендә ионнарга диссоциацияләшә-
ләр — электролитик диссоциация була. Бу күзаллауларга (элек¬
тролитик диссоциация теориясенә) швед галиме С. Аррениус
(1887) нигез салган. Электролитик диссоциация теориясе күп ке¬
нә галимнәрнең хезмәтләрендә тагын да үсеш тапкан. Алар ара¬
сыннан бигрәк тә рус галимен — И. А. Каблуковны әйтеп
китәргә кирәк. Ул фәнгә ионнарның гид р атлашу ы турындагы
төшенчәне керткән.
Билгеле ки, эремәдә ионнар күбрәк булган саен, эремәнең
электр үткәрүчәнлеге дә арта. Бер үк моляр концентрацияле
(0,1 моль/л) хлорид һәм серкә кислоталары эремәләренең электр
үткәрүчәнлекләрен чагыштырыйк. Моның өчен, сезгә инде таныш
булган, эремәләрнең электр үткәрүчәнлеген өйрәнү приборын¬
нан файдаланыйк (26 нчы рәсем).
Лампочка электродларны хлорид кислотасына төшергәндә,
аларны серкә кислотасына төшергәндәгегә караганда, яктырак
яна. Бу тәҗрибәдән шундый нәтиҗә ясарга мөмкин: хлорид
кислотасы эремәсендә, серкә кислотасы эремәсе белән чагыштыр¬
ганда, ионнар күбрәк була.
Кислоталарның ионнарга таркала алу сәләтенең микъдарча
аңлатмасы бармы соң, һәм, тәҗрибә үткәрмичә генә, эремәдәге
ионнарның концентрациясе турында нәтиҗә ясап буламы?
Белгәнегезчә, кислоталар — эремәләрдә водород ионнары
H+ хасил итеп таркала торган электролитлар. Эремәдә тигез¬
ләнеш урнаша. Гомуми рәвештә аны болай язарга ярый:
HA^H++A-, монда
A- — кислота анионы (кислота калдыгы).
Бу реакциянең тигезләнеш константасы
V бн+-Сд-
K-" Cha
кислотаның ионлашу константасы дип атала. Ул кислота моле¬
кулаларының ионнарга таркалуын микъдарча характерлый.
HNO3 һәм HNO2 кислоталарының ионлашу константалары¬
ның кыйммәтләрен чагыштырып карыйк:
HNO3FiH + +NO3-
C“*'Cnw = 43.6
—
cHNO;
HNO2FiH + +NO2-
219
Ch+ 'Cno2-
Chno2
Ю-4
Константаларның K кыйммәтләреннән күренгәнчә, нитрит
кислотасына караганда (К=4-10“ ), нитрат кислотасы күб¬
рәк дәрәҗәдә (К=43,6) ионлаша (ионнарга таркала). Мондый
очракларда бер кислота икенчесенә караганда көчлерәк дип әй¬
тәләр: нитрат кислотасы HNO3 нитрит кислотасыннан HNO2 көч¬
лерәк. Гадәттә ионлашу константасының кыйммәте 1 • 10~* дән
артыграк булган кислоталарны көчле кислоталарга, ә константа¬
ның кыйммәте 1 • Ю-2 кимрәк булганнарын уртача көчле һәм көч¬
сез кислоталарга кертәләр. Кайбер кислоталар өчен ионлашу
константаларының кыйммәтләре кушымтада бирелгән.
Нигезләр өчен шулай ук ионлашу константаларының кыйм¬
мәтләрен табалар. Алар нигезләрнең көчен характерлыйлар. Әй¬
тик, кушымтадан күренгәнчә, литий гидроксиды (/( = 6,8-10-1)
натрий гидроксидыннан (А=5,9) көчсезрәк нигез булып тора.
1. Сульфит кислотасының H2SO3 баскычлап диссоциацияләшү тигезлә¬
мәсен төзегез. Кислота диссоциациясенең беренче һәм икенче баскычлары
өчен ионлашу константаларының аңлатмаларын языгыз. Кушымтадагы таб¬
лицадан файдаланып, беренче һәм икенче ионлашу баскычлары буенча
кислотаның көчен чагыштырыгыз.
2. Кушымтадан: а) көчле кислоталарның; б) көчле нигезләрнең
(К>1-102) формулаларын язып алыгыз.
3. Суның ионлашу константасы аңлатмасын языгыз.
§ 69. КИСЛОРОДЛЫ КИСЛОТАЛАР
1. 3 нче период элементларының силикат, фосфат, сульфат, перхлорат кис¬
лородлы кислоталары формулаларын языгыз (35 нче параграфны карагыз).
2. Бу кислоталарның эремәләрдә беренче баскыч ионлашу константаларының
аңлатмаларын төзегез. 3. Кислоталарның ионлашу константалары кыйммәт¬
ләреннән чыгып (кушымтаны карагыз), бу кислоталарның көчләрен чагышты¬
рыгыз. Кислоталарның көчләре ни өчен төрле булуын аңлатып бирегез.
13 нче таблица, р-элементларның югары оксидлашу дәрәҗәләрендәге
кислородлы кислоталары
Период
Төркем
Үзәк атом¬
ның коор-
динацион
саны1
III
IV
V
Vl
VIl
VIII
2
3
4
5
H3BO3
H2CO3
HiSiOi
H4GeO4
HNO3
H3PO4
H3AsO4
H2SO4
H2SeO4
H6TeO6
HClO4
HBrO4
H5IO6
H4XeO6
3
4
4
6
1 Үзәк атомның координацион саны — кислота калдыгында үзәк атом белән
тоташкан кислород атомнары саны ул. ЭОГ ионнарында Э .ның координацион
саны 3 кә, ә ЭОП’ , ЭО2- ионнарында тиңдәшле рәвештә 4 кә һәм 6 га тигез.
220
13 нче таблицада р-элементларның югары оксидлашу дәрә¬
җәләрендәге кислородлы кислоталарының формулалары бирел¬
гән.
Кислородлы кислоталарның төзелеше аларның үзлекләрендә
ничек чагыла соң? Кислородлы кислоталарның формулаларын
SOm(OH)n рәвешендә язарга мөмкин. Кислоталарда HO—Э һәм
S = O бәйләнешләре булуын күздә тотарга кирәк.
H-O O-H
Si
H-O O-H
Н4 SiO4
Кислотаның тибы
S(OH) 4
(41 = 0, п = 4)
H-O
H-O O-H
H3PO4
Кислотаның тибы
SO(OH) 3
(пг — 1, 4 = 3
H-O O
H2SO4
Кислотаның тибы
SO2(OH)2
(/4 = 2, 4 = 2)
H-O O
HClO4
Кислотаның тибы
SO3(OH)
(41 = 3, 4=1)
Тикшеренүләр күрсәткәнчә, кислоталарның көче п санына
(ОН-группалары санына) практик яктан бәйле түгел, әмма ул
т санының (ОН-группасы белән бәйләнештә булмаган кислород
атомнары санының) үсүе белән сизелерлек арта. Ионлашуның
беренче баскычы буенча S(OH)n тибындагы кислоталар көчсез
кислоталарга, SO(OH)n тибындагылары — уртача көчлеләргә,
SO2(OH)n тибындагылары — көчлеләргә һәм SO3(OH) п тибын¬
дагылары бик көчлеләргә керәләр.
41 санының үсүе белән кислоталарның көче нык артуны
H-O бәйләнешендәге электроннар тыгызлыгының S = O бәйлә¬
нешенә тартылуы белән аңлатырга мөмкин. Нәтиҗәдә H — O
бәйләнешенең ныклыгы кими һәм җиңелрәк өзелә. H4SiO4,
H3PO4, H2SO4, HClO4 кислоталары рәтен тикшереп узыйк.
Силикат кислотасы H4SiO4 S(OH)n тибындагы кислоталарга
керә —ул көчсез кислота. Бу силикат кислотасының ионлашу
константасыннан да күренә:
H4SiO4^H+ +H3SiO4- ,
K=
бң+ -CH3SiQ, _ 2. JQ- io
Ch1SIO,
Фосфат кислотасы H3PO4 SO(OH)n тибындагы кислоталарга
керә, ягъни уртача көчле кислота булып тора. H3PO4 кислотасы¬
ның ионлашу константасы H4SiO4 кислотасыныкыннан зуррак:
H3PO4^H++H2PO4-, K=——=7,52-10
Көчле кислоталарга SO2 (OH) „ тибындагы сульфат кислота¬
сы H2SO4 керә:
221
H2SO4^H+H-HSO4-
K=
Ch+ • Chso,-
=I-IO3
Ch2SO,
Ә
бик көчле кислоталарның
берсе —
перхлорат
кислотасы
HClO4
. Ул ЭОз (OH)n тибындагы
HCIO4^H+ +Cio4-,
кислоталардан:
„ Сн+ -Ccib,-
Chcio,
й IO8
. 1. Түбәндәге кислородлы кислоталарның формулаларын гомуми формага
китереп языгыз һәм аларның кайсысы көчлерәк булуы турында нәтиҗә
▲ ясагыз: a) H2SOa яки H2SO4 б) H2SO4 яки H6TeO6. Җавапны дәлилләү
өчен бу кислоталарның беренче баскыч ионлашу константаларының кыйм¬
мәтләрен күрсәтегез (кушымтаны карагыз).
2. HaBOa-H2COa — HNOa рәтендә кислоталарның көче ничек үзгәрә?
Бу кислоталарның беренче баскыч ионлашу константаларын языгыз (ку¬
шымтаны карагыз).
3. 4 нче период элементларының югары оксидлашу дәрәҗәләрендәге кис¬
лородлы кислоталарының формулаларын языгыз (13 нче таблица). Аларның
төзелешен һәм эремәләрендә ни дәрәҗәдә ионлаша алуларын тасвирлагыз.
Бу кислоталарның беренче баскыч ионлашу константаларының аңлатмала¬
рын төзегез һәм аларның көчен чагыштырыгыз (кушымтаны карагыз).
4. Сульфит кислотасының беренче һәм икенче баскыч ионлашу тигезлә¬
мәләрен төзегез. Сульфит кислотасының беренче һәм икенче баскыч ионлашу
константаларының аңлатмаларын языгыз. Ионлашуның кайсы баскычында
тигезләнеш башлангыч реагент ягына таба күбрәк авышкан? Җавапны
дәлилләү өчен ионлашу константаларының кыйммәтләрен күрсәтегез (ку¬
шымтаны карагыз).
«ХИМИК ТИГЕЗЛӘНЕШНЕҢ АВЫШУЫ.
ЛЕ ШАТЕЛЬЕ ПРИНЦИБЫ» ТЕМАСЫНА КАРАТА
КҮНЕГҮЛӘР
Бирелгән шартларда химик тигезләнеш халәте теләсә күпме
вакыт дәвамында саклана. Бу исә системадагы реагентларның
тигезләнеш концентрацияләре үзгәрмәвен аңлата.
Реакция продуктының тигезләнеш концентрациясен арттыру
өчен процессны ничек уздырырга кирәк соң? Сез моның өчен
химик тигезләнешнең продукт хасил булу ягына авышырлык
шартлар булдырырга кирәк икәнлеген беләсез (52 нче параграф¬
ны карагыз).
Шартларның динамик тигезләнеш халәтенә тәэсире хәрәкәт¬
чел тигезләнеш яки Jle Шателье принцибы дип йөртелүче (фран¬
цуз галиме исеме белән шулай аталган) кагыйдәгә буйсына.
Ле Шателье принцибы нигезендә, тигезләнеш халәтендәге
системага тышкы шартлар тәэсир иткәндә тигезләнеш тышкы
йогынтыны киметүче юнәлешкә авыша. Система тышкы йогынты¬
га каршы тора сыман.
Әйтик, җылыту эффекты җылылыкны йоту белән уза торган
процесс исәбенә киметелә; кысу эффекты (басымны арттырган¬
да) күләмнең кимүе белән узучы процесс исәбенә кими һ. б.
222
1 нче мисал. 2Н2 (г) +
+ O2 (г)^2Н2О (г), AtfcO
системасының тигезләнеш ха¬
ләтенә температураның, үзгәрүе
нинди йогынты ясый?
Температураны күтәргәндә
тигезләнеш эндодермик про¬
цесс — суның H2O таркалу ягы¬
на, ә температураны төшергән¬
дә — экзотермик процесс — су
H2O хасил булу ягына авыша.
1 нче бирем. Калий нитраты¬
ның KNO3 эрү җылылыгы
35 кДж/моль тәшкил итә. Бу
тозның эрүчәнлегенә темпера¬
тураны күтәрү нинди йогынты
ясый? Җавапны дәлилләү өчен
KNO3 тозының эрүчәнлек кәк¬
ресен төзегез (66 нчы рәсемне
карагыз).
79 нчы рәсем. Тигезләнеш халәтен¬
дә күкерт (IV) оксидының SO2 күкерт
(VI) оксидына SO3 әверелү дәрәҗәсе.
(Башлангыч катнашманың составы:
7% SO2, 11% O2, 82% N2.)
2 нче бирем. 79 нчы рәсем буенча күкерт (IV) оксидының
күкерт (VI) оксидына әверелү дәрәҗәсе 400, 500, 600 һәм
IOOOoC ларда күпме булуын ачыклагыз. Күкерт (IV) оксидының
күкерт (VI) оксидына әверелү дәрәҗәсенә (продуктның чыгышы¬
на) температураның үзгәрүе — җылыту һәм суыту — нинди йо¬
гынты ясый һәм моны ничек аңлатырга була?
2 нче мисал.
2Н2 (г) +O2 (г) ^2Н2О (г)
4 7 2 моль
системасының химик тигезләнеш халәтенә басымның үзгәрүе
нинди йогынты ясый?
Суны гади матдәләрдән синтезлау күләмнең кимүе белән
уза—3 моль газлардан (2Н2+О2) 2 моль газ (2Н2О) хасил
була. Басымны арттыру тигезләнешне күләмнең кимүе белән узу¬
чы процесс, ягъни су H2O хасил булу ягына авыштыра. Киресен¬
чә, басымны төшергәндә тигезләнеш суның H2O таркалуы ягына
авыша, чөнки бу процесс күләмнең артуы белән уза.
3 нче бирем. Ни өчен газлы су тутырылган шешәне ачкан¬
да газ аерылып чыга? Газның суда эрүчәнлегенә басым нинди
йогынты ясый?
4 нче бирем. ЗН2 (г) +N2 (r)^2H3N (г) системасында
тигезләнеш халәтендә әверелү дәрәҗәсенә (аммиакның тигезлә¬
неш халәтендәге чыгышына) басымның йогынтысы нинди?
5 нче бирем. Ни өчен химик тигезләнеш динамик тигезлә¬
неш булып тора?
223
6 нчы бирем, а) Күкерт (VI) оксиды белән су арасындагы;
б) кальций карбонатының кальций оксидына һәм углерод (IV)
оксидына термик таркалу реакцияләренең тигезләмәләрен язы¬
гыз. Температураны күтәргәндә бу реакцияләрнең тигезләнешлә¬
ре кайсы якка авыша?
7 нче бирем. 6 нчы биремдә китерелгән системаларның тигез¬
ләнеш халәтенә басымны арттыру нинди йогынты ясый?
8 нче бирем. Углерод (IV) оксиды белән су арасындагы
реакциянең тигезләмәсен языгыз. Водород ионнарының концент¬
рациясен арттырганда бу системаның тигезләнеше ничек авы¬
шыр?
§ 70. РЕАКЦИЯЛӘРНЕҢ БЕР ЮНӘЛЕШТӘ
УЗУ ШАРТЛАРЫ
1. а) Бакыр (II) гидроксидын; б) кургаш (II) сульфатын табу реакция¬
ләренең тигезләмәләрен языгыз. 2. Тимер (II) сульфиды һәм хлорид кислотасы
үзара тәэсир итешкәндә нинди продуктлар барлыкка килә? Реакциянең тигез¬
ләмәсен төзегез. 3. Нейтральләшү реакциясенең асылы нидән гыйбарәт? Реак¬
ция тигезләмәсен языгыз. 4. Ни өчен 1—3 нче күнегүләрдә тикшерелгән реакция¬
ләр ахыргача узалар?
Судагы эремәләрдә теге яки бу алмашу реакциясенең узу
мөмкинлеген тикшергәндә сез тозларның, кислоталарның һәм
нигезләрнең эрүчәнлекләре күрсәтелгән таблицадан файдалана¬
сыз.
Әйтик, бу таблицадан күренгәнчә, бакыр (II) гидроксиды
практик яктан суда эреми. Бакыр (II) гидроксидын табу өчен,
Cu2+ +2ОН-^Си(ОН)4
тигезләмәсеннән күренгәнчә, эрүчән бакыр (II) тозын алырга
һәм аның эремәсенә селте эремәсе салырга кирәк:
CuSO4 -J-2NaOH=^Cu (OH) 2f -J-Na2SO4
Бу системаның тигезләнеше реакция продукты — практик як¬
тан эремәүчән кушылма хасил булу ягына авышкан.
Кристаллар хәлендәге натрий хлоридына куертылган суль¬
фат кислотасы белән тәэсир итеп, водород хлориды табу реак¬
циясе дә практик яктан караганда, шулай ук кайтма реакция
түгел:
NaCl + H2 SO45-NaHSO4 + HClf
Бу реакция практик яктан ахыргача уза, чөнки хасил була
торган водород хлориды HCl газ хәлендә реакция сферасыннан
аерылып чыга.
Нейтральләшү реакциясе дә — практик яктан кайтма булма¬
ган реакция:
224
HCl+ К0Н^КС1 + Н20
H+H-OH-^tH2O
Моны суның гаять көчсез электролит булуы белән аңлатыр¬
га мөмкин. Аның ионлашу константасы бик кечкенә (бары тик
A=IjS-IQ-'6 тәшкил итә). Димәк, су хасил булганда реакция
сферасыннан H+ һәм ОН~ ионнары аерылып чыга.
Эремәләрдән көчсез электролитларны көчле электролитлар
кысрыклап чыгаруны аз диссоциацияләшә торган матдәләр хасил
булу белән аңлатырга мөмкин. Мәсәлән, көчле сульфат кислота¬
сы (A=I-IO3) көчсезрәк сероводород кислотасын (А = 6-10“8)
кысрыклап чыгара:
Na2S + H2SO4^tNa2SO4 + H2S
S-2 + 2H+^H2S
Китерелгән мисалларны йомгаклап шуны әйтергә мөмкин:
реакция нәтиҗәсендә утырым, газ яки аз диссоциацияләшүче
продукт рәвешендә, реакция сферасыннан аерылып чыга торган
матдә хасил булган очракларда, реакцияләр практик яктан ахыр¬
гача, ягъни практик яктан бер генә юнәлештә узалар.
? 1. Судагы эремәдә алмашу реакциясе барышында түбәндәге кушылмалар¬
ның хасил булуы мөмкинме: BaCO31 Pb(OH)31 NaCl1 AgCl1 H3S1 Fe(OH)31
A NaNO3 ? Реакцияләрнең тигезләмәләрен языгыз һәм аларны тормышка ашы¬
ру мөмкинлеген дәлилләгез.
2. Ни өчен бакыр (II) гидроксиды хлорид кислотасы яки сульфат кислотасы
тәэсирендә эри? Җавапны реакцияләрнең тигезләмәләрен язып дәлилләгез.
3. Натрий сульфиты Na3SO3 белән сульфат кислотасы эремәсе арасындагы
реакциянең тигезләмәсен төзегез. Ни өчен бу реакция практик рәвештә
ахыргача уза?
§ 71. ТОЗЛАРНЫҢ ГИДРОЛИЗЫ
1. Карбонат кислотасының беренче һәм икенче баскыч ионлашу константа¬
лары аңлатмаларын төзегез һәм аларның кыйммәтләрен чагыштырыгыз. Ион¬
лашуның кайсы баскычында тигезләнеш күбрәк дәрәҗәдә башлангыч реагент
ягына авышкан? 2. Кургаш гидроксидының беренче һәм икенче баскыч ионлашу
константалары аңлатмаларын төзегез һәм аларның кыйммәтләрен чагыштыры¬
гыз. Ионлашуның кайсы баскычында тигезләнеш күбрәк дәрәҗәдә башлангыч
реагент ягына авышкан? (Константаларның кыйммәтләре кушымтада бирелгән).
Түбәндәге тәҗрибәне башкарыйк. Натрий хлоридын NaCl1
натрий карбонатын Na2COs (Na2COa-IOH2O кристаллогидрат-
лары), алюминий хлоридын AlCl3 (А1С1з-6Н2О кристаллогидрат-
лары) алыйк. Аларны дистиллирланган суда эретик. Аннары кис-
лота-нигез индикаторлары ярдәмендә барлыкка килгән эремәләр¬
нең тирәлек характерын тикшереп карыйк. Сынаулар күрсәткән¬
чә, NaCl эремәсенең тирәлеге нейтраль, Na2CO3 эремәсенең тирә¬
леге селтеле, ә AlCl3 эремәсенең тирәлеге әче булыр. Бу исә,
NaCl эремәсендә H+ һәм 0Н~ ионнарының концентрацияләре
15 п-23б
225
бертигез, NazCCh эремәсендә OH ионнарының күбрәк, ә
AICl3 эремәсендә H+ ионнарының күбрәк булуын аңлата. Тоз
эремәсендә артык H+ яки OH- ионнары ничек барлыкка килгән
соң?
Суда эрегәндә тозларның ионнарга таркалуларын сез белә¬
сез инде. Гомумиләштереп аны болай язып булыр иде (K''4- —
катион, Ag-—анион):
КА^К?++А’-
Сезгә мәгълүм булганча, су бик аз гына булса да ионнар¬
га диссоциацияләшә, һәм тигезләнеш урнаша:
нон^н+ +он-
Шулай итеп, тозларның эремәләрендә K^+, H+ катионнары¬
ның һәм A’-, OH- анионнарының катнашмасы була. Корылма¬
лары төрле булган ионнар үзара тәэсир итешәләр:
К’+ +ОН-^КОН'"-')+
A’- + H +A'""0-
Аңлашыла ки, барлыкка килүче КОН(’-‘)+ һәм НА<‘,~1)- про¬
дуктлары никадәр азрак ионнарга диссоциацияләшсәләр, бу про¬
цесс шул дәрәҗәдә нәтиҗәлерәк булыр.
Тоз ионнарының су белән, нәтиҗәдә аз диссоциацияләшүче
кушылмалар (ионнар яки молекулалар) хасил итеп, үзара тәэсир
итешүе тозның гидролизы дип атала (грекча «гидро» — су, «ли¬
зис»— таркалу сүзләреннән «су катнашында таркалу» мәгънә¬
сендә) .
Без алган тозлар эремәләрендә нинди хәлдә булуларын тик¬
шереп карыйк.
Суда эрегән натрий хлориды ионнар рәвешендә була:
NaCl=^Na+ +Cl-
Эремәдә ионнар тәртипсез рәвештә хәрәкәт итәләр һәм үзара
гел бәрелешеп торалар. Шул исәптән Na+ һәм OH- ионнарының
да, H+ һәм Cl- ионнарының да үзара бәрелешүләре мөмкин.
Әмма бу бәрелешүләр кушылмалар хасил булуга китермиләр,
чөнки NaOH — көчле нигез, ә HCl — көчле кислота. Натрий хло¬
риды суда эрегәндә көчсез электролитлар хасил булмаганлыктан,
натрий хлориды гидролиз реакциясенә керми. Бу үзлек көчле ни¬
гез белән көчле кислотадан барлыкка килгән барлык тозларга
да хас.
Көчле нигез белән көчле кислотадан хасил булган тозлар
гидролиз реакциясенә кермиләр.
Натрий карбонаты NazCOs эремәдә ионнарга болай таркала:
Na2CO3=^Na+ +С0|~
226
Na+ һәм ОН" ионнарының үзара бәрелешүе кушылма хасил
булуга китерми. Ә менә H+ һәм COi- ионнары үзара тәэсир
итешкәндә аз диссоциацияләшүче гидрокарбонат-ион HCOjT
(/( = 4,84-10-11) барлыкка килә. H+ ионнарының аз диссоциа-
цияләшә торган продукт составында бәйләнешкә керүе сәбәпле,
суның ионнарга таркалуы көчәя:
COi-H-H+^HCO3-
HOH^H + +OH-
COi- +HOH HCOr +OH-
Шулай итеп, натрий карбонаты гидролиз реакциясенә керә.
Эремәнең реакциясе селтеле була. Көчле нигез һәм көчсез кис¬
лотадан барлыкка килгән барлык тозларның да эремәләренә шун¬
дый үзлек хас.
Көчле нигез белән көчсез кислотадан хасил булган тозлар¬
ның гидролизы кислота калдыгы анионнарына водород ионнары
килеп кушылудан һәм эремәдә суның диссоциациясе нәтиҗәсендә
барлыкка килүче гидроксид-ионнар тупланудан гыйбарәт.
Натрий карбонатының гидролизын
Na2CO3 + H2O^ NaHCO3 + NaOH
реакция тигезләмәсе белән күрсәтергә мөмкин.
Ә хәзер алюминий хлориды эремәсенең ни өчен әче тирәлек¬
ле булуын ачыклыйк. Эремәдә AlCl3 тозы ионнарга диссоциация-
ләшә:
AlCl3^AI3+ +ЗС1-
H+ һәм Cl- ионнарының үзара бәрелешүләре кушылма ха¬
сил булуга китерми. Эремәдәге ионнардан аз диссоциацияләшүче
продуктны Al3+ һәм OH- ионнары барлыкка китерә. OH- ион¬
нарының аз диссоциацияләшә торган AlOH2+ (/¢=1,38-10-9)
продукты составында бәйләнешкә керүе су молекулаларының
тагын да ионнарга таркалуына сәбәп була:
Al3+ +OH-^AIOH2+
HOH^H++OH-
Al3+ + HOH5=-AIOH2+ + H+
Шулай итеп, алюминий хлориды эремәсендә артык H+ ион¬
нары хасил булуга китерүче реакция күзәтелә, ягъни эремәгә
кислоталы реакция хас. Көчсез нигез һәм көчле кислота барлык¬
ка китергән барлык тозларның эремәләре дә шундый үзлеккә ия
була.
Көчсез нигез һәм көчле кислотадан хасил булган тозлар¬
ның гидролизы металл катионнарына гидроксид-ионнарның ки¬
15*
227
леп кушылуыннан һәм эремәдә суның диссоциациясе нәтиҗәсен¬
дә барлыкка килүче водород ионнары тупланудан гыйбарәт.
Алюминий хлоридының гидролизын
AlCl3 + H2O^AIOHCi2 + HCl
реакция тигезләмәсе белән күрсәтергә мөмкин.
? 1. Химик тигезләнеш турындагы күзаллаулардан чыгып караганда, тозлар¬
ның гидролизын ничек аңлатырга була? а) Натрий фосфаты; б) кальций
А. нитраты; в) бакыр (II) хлориды; г) натрий сульфиды; д) тимер (II) суль¬
фаты тозларының гидролиз реакцияләре тигезләмәләрен төзегез. Тиешле
тозларның гидролизы вакытында ни өчен эремәдә H+ яки ОН“ ионнары
туплануын аңлатып бирегез.
2. Cy тәэсиреннән алюминий сульфиды алюминий гидроксидына һәм серо¬
водородка таркала. Реакцияләрнең бер юнәлештә узу шартларыннан чыгып,
бу фактны аңлатып бирегез.
I Чәй содасы NaHCO3, кер содасы NaaCO3 һәм сабын эремәләренең тирә¬
лекләре нинди реакцияле икәнлеген тикшерегез. Кислота-нигез индикаторы
сыйфатында фенолфталеинны (пургенны) алыгыз. Сабын — көчсез органик
кислотаның натрийлы тозы булуын исәпкә алып, күзәтүләрегезне аңлатып
бирегез.
20 НЧЕ ЛАБОРАТОР ДӘРЕС
ИОНЛЫ РЕАКЦИЯЛӘР. ГИДРОЛИЗ
1 нче тәҗрибә. Химик реакцияләрнең бер юнәлештә узу шарт¬
лары. Түбәндәге эремәләр арасында реакцияләр үткәрегез:
1) Na2SO3 һәм HCl, CuSO4 һәм NaOH, KOH һәм H2SO4;
2) Na2SO3 һәм HNO3, MgCl2 һәм NaOH, KOH һәм HNO3;
Күзәтүләрегезне аңлатып бирегез. Реакцияләрнең тигезләмәлә¬
рен төзегез.
2 нче тәҗрибә. Тозларның гидролизы. Түбәндәге тозларның
эремәләре нинди тирәлекле икәнлеген тикшерегез:
1) ZnSO4, Na2SO41 K2SO3;
2) Na2SO3, NaNO3, AlCl3;
Күзәтүләрегезне аңлатып бирегез. Реакцияләрнең тигезләмә¬
ләрен төзегез. Бу реакцияләрнең асылы нидән гыйбарәт?
ХИМИК ЭЛЕМЕНТЛАРНЫҢ
Д. И. МЕНДЕЛЕЕВ ПЕРИОДИК
СИСТЕМАСЫНЫҢ
V ТӨРКЕМ р-ЭЛ EMEHTJIAPbI
(АЗОТ ТӨРКЕМЧӘСЕ)
§ 72. АЗОТ ТӨРКЕМЧӘСЕНӘ ГОМУМИ ХАРАКТЕРИСТИКА
Түбәндәге план буенча элементлар төркемчәсенә гомуми характеристика
бирергә тырышып карагыз. (Бу сорауларны «Элементлар төркемчәсен өйрәнү
өчен белешмәлек» буларак кулланырга мөмкин.)
1. Периодик системадан файдаланып, бу төркемчәгә нинди химик элемент¬
лар керүен ачыклагыз. Аларның символларын һәм исемнәрен язып алыгыз.
2. Төркемчәдәге һәр элемент атомының валентлык катлавы өчен электроннар
конфигурациясен языгыз. 3. Төркемчәдәге элементларның тәртип номеры арту бе¬
лән: а) атомнарның радиусы; б) атомнарның ионлашу энергиясе ничек үзгәрүен
аңлатып бирегез. 4. Төркемчә элементларының мөмкин булган оксидлашу дәрә¬
җәләрен әйтеп бирегез. 5. Тикшерелә торган элементларның югары оксидлары
формулаларын языгыз һәм аларның кислота-нигез үзлекләрен әйтеп бирегез.
6. Элементларның югары оксидлашу дәрәҗәсендәге гидроксидлары формула¬
ларын языгыз.
Периодик системадан күренгәнчә, V төркемнең р-элементла-
рына азот N, фосфор Р, мышьяк As1 сөрмә Sb һәм висмут Bi
керә. Алар азот төркемчәсен тәшкил итәләр. Бу элементларның
атомнарында тышкы катлау биш электроннан ns2np3 гыйбарәт:
һичшиксез, әгәр төркемчә элементларының валентлык элек¬
троннары саны бер үк икән, аларның бер-берсе белән охшашлык¬
лары да булырга тиеш. Бу охшашлыклар нәрсәдә чагыла соң?
Барыннан да бигрәк бу охшашлыкларның чагылышы шул эле¬
ментларның югары оксидлашу дәрәҗәләре бертөрле (Ң-5) булу¬
да күренә, һәм, шулай булгач, бу элементлар N2O5, Р2О5, AS2O5,
БЬгОз, Bi2C>5 кебек ике элементлы кушылмалар хасил итәләр.
Ә элементларның үзлекләрендәге аерымлыклар нидән гыйба¬
рәт һәм алар нәрсә белән аңлатыла? Азот төркемчәсендә эле¬
ментларның тәртип номерлары арту белән аларның атомнары
зуррак була бара (14 нче таблица).
229
14 нче таблица. V төркем р-элементларының
төп константалары
Химик
элемент
Элементның характеристикасы
Атом
номеры
Валентлык
электроннары
Чагыштыр¬
ма атом
массасы
Атом
радиусы,
HM
Атомның
ионлашу
энергиясе,
кДж/моль
N
7
2s22p3
14,007
0,052
1402
P
15
Зз2Зр3
30,974
0,092
1012
As
33
4s24p3
74,922
0,100
974
Sb
51
5s25p3
121,75
0.1 19
834
Bi
83
6s26p3
208,98
0,130
703
Иң кечкенә радиус азот атомыныкы, аның тышкы электрон¬
нары төшкә якын — икенче катлауда урнашалар; висмутның ато¬
мы—иң зурысы, аның тышкы электроннары төштән шактый
ераграк—алтынчы катлауда урнашканнар.
N — P-As-Sb-Bi рәтендә электроннар туплана торган
катлауларның саны арту белән һәм атомнар зуррак булган саен,
валентлык электроннарының төшкә тартылу көче кими. Шуңа кү¬
рә бу рәттә атомнарның ионлашу энергиясе дә кимрәк була бара
(14 нче таблица). Азот иң зур ионлашу энергиясенә ия булган
элементлардан санала. Висмут атомының ионлашу энергиясе
шактый кимрәк. Азот һәм висмут элементлары үзлекләренең
аерымлыклары, атап әйткәндә, аларның гади матдәләре үзлеклә¬
реннән күренә. Азот гадәттәге шартларда — неметалл (газ), ә
висмут — металл (кургашны хәтерләтә).
Шулай итеп, азот төркемчәсендә, барлык башка төп төркем¬
чәләрдәге кебек үк, элементның тәртип номеры арткан саен
аның неметалл гади матдәсе барлыкка китерә алу үзлеге кими,
ә металл гади матдәсе хасил итә алу үзлеге арта.
Азот төркемчәсе элементлары өчен аеруча так санлы: —3,
+ 3, Ң-5 оксидлашу дәрәҗәләре характерлы. Электротискәреле-
ге белән азот фәкать фтордан һәм кислородтан гына калыша. Бу
исә азотка тискәре оксидлашу дәрәҗәсе характерлы икәнлеген
аңлата. Әмма электротискәрелеге иң югары булган элемент¬
тан — фтордан — аермалы буларак, азот шулай ук уңай оксидла¬
шу дәрәҗәләрен дә күрсәтә. Висмут өчен бигрәк тә +3 оксид¬
лашу дәрәҗәсе тотрыклы.
? 1. V төркем р-элементларының тәртип номерларыннан: а) атом радиусла¬
ры; б) атомнарының ионлашу энергияләре бәйлелегенең графикларын төзе-
A гез. Килеп чыккан кәкреләрне аңлатып бирегез. Атомнарның зурлыклары
һәм ионлашу энергияләре үзгәрү элементларның үзлекләренә нинди йогын¬
ты ясый?
2. V төркем р-элементларының: а) +5; б) +3 оксидлашу дәрәҗәләренә
туры килүче оксидларның формулаларын языгыз.
230
3. Оксидлашу дәрәҗәләре +5 булганда: а) азотның; б) фосфорның;
в) мышьякның кислоталары формулаларын языгыз һәм аларның исемнәрен
атагыз. Бу элементлар атомнарының координацион саннары ни өчен төрле
булуын аңлатып бирегез (13 нче таблицаны карагыз).
4. а) Азотның; б) фосфорның водородлы кушылмалары формулаларын
языгыз. Бу кушылмаларның кайсысында химик бәйләнеш ныграк? Бу ку¬
шылмаларның кайсысы һә^с ни өчен термик яктан тотрыксызрак?
5. Табигый азот 14N һәм N изотопларыннан, ә фосфор 31P изотобыннан
тора. Бу изотопларның төш составларын билгеләгез.
§ 73. АЗОТ. ГАДИ МАТДӘ
1. «Химик элементны өйрәнү өчен белешмәлекнең» 1—3 нче сорауларына
азот элементына карата җавап бирегез (40 нчы параграфны карагыз). 2. Азот
атомының тышкы электроннар катлавында орбитальләрнең урнашу моделен су¬
рәтләгез.
Азот атомының (ls22s22p3) тышкы катлавында өч парлаш¬
маган электрон бар:
Шунлыктан азот атомнары бер-берсе белән өч пар электрон¬
нар ярдәмендә берләшәләр — өч ковалент бәйләнеш барлыкка
килә:
S N. +. N: N=N:
Молекуладагы атомнар арасында өч бәйләнеш N=N ясалуны болай күз
алдына китерергә мөмкин. Билгеле булганча, атомдагы р-орбитальләр үзара
перпендикуляр яссылыкларда, х, у һәм z күчәрләре буйлап урнашалар. Ике
азот атомы бер-берсенә якынлашканда электрон болытларының ничек аралашу¬
ларын тикшерик. Әйтик, атомнар х күчәре буйлап якынлашалар ди. Ул вакытта
бер атомның 2рх-электрон болыты икенче атомның 2рх-электрон болыты белән
атомнарның кушылу сызыгы буйлап аралашыр (80 нче рәсем).
Электрон болытлары атомнар кушылу сызыгы буйлап аралашканда бар¬
лыкка килә торган ковалент бәйлә¬
неш сигма-бәйлэнеш (о-бәйләнеш) дип
атала.
Якынлашучы атомнарда парлап
бер-берсенә параллель урнашкан элект¬
рон болытлары (81 нче рәсем, а)
башкача аралашалар. Бер атомның
2рг-электрон болыты икенче атомның
2рг-электрон болыты белән атомнар
якынлашу сызыгының һәр ике ягында
да аралашалар. Ике атомның 2ру- һәм
2р9-электрон болытлары да шул рә- «() нче рәсем, о-бәйләнеш ясалу схе-
вешчә үк аралашалар (81 нче рәсем, б). масы.
231
81 нче рәсем. 2р2-(а) һәм 2ру-(б) болытлары аралашканда л-бәйләнеш ясалу
схемасы.
Электрон болытлары атомнарны тоташтыручы сызыкның ике ягында да ара¬
лашканда ясала торган ковалент бәйләнешне пи-бәйлэнеш (л-бәйләнеш) дип
атыйлар. Шулай итеп, азот молекуласында өчле бәйләнеш: бер о-бәйләнеш һәм
ике л-бәйләнеш барлыкка килә.
Азот молекулалары N2 арасында үзара тәэсир итешү көч¬
ләре бик аз сизелә һәм алар молекулаларның тәртипсез рәвеш¬
тәге хәрәкәтенә каршы тора алмыйлар (энергетик фактор энтро¬
пия факторыннан кимрәк сизелә). Шуңа күрә гадәттәге шартлар¬
да молекуляр азот — газ. Ул аеруча түбән температурада эрете¬
лүче (эретелү температурасы — 210,5°С) һәм түбән температура¬
да кайный торган (кайнау температурасы —195,8°С) матдәләр¬
нең берсе. Сыек азотның кайнау температурасы сыек кислород¬
ныкына караганда түбәнрәк. Шул сәбәпле сыек һава парга әй¬
ләнгәндә аннан иң элек азот аерылып чыга. Техникада һавадан
азот табу шул күренешкә нигезләнгән.
Азотның суда эрүчәнлеге бик аз (OoC та 1 л суда 24 мл азот
эри), һәм кислородныкыннан азрак. Моның да сәбәбе шул ук —
азот молекулаларының су молекулалары белән үзара тәэсир ите¬
шүе бик көчсез.
Ирекле азотның химик үзлекләрендә аның төзелеше нинди
чагылыш таба икән? Барыннан да бигрәк, һичшиксез, азот мо¬
лекуласы N2 бик тотрыклы булырга тиеш. Дөрестән дә, ул —
иң тотрыклы молекулаларның берсе (бәйләнеш энергиясе Е6эйл =
= 940 кДж/моль): азот молекулаларының N2 атомнарга тарка¬
луы бары тик бик югары температурада гына (3000° C тан да
югарырак) башлана.
Химик бәйләнеше нык булганлыктан, гадәттәге шартларда
молекуляр азот химик яктан гаять инерт матдәләрдән санала.
Шуңа күрә Җирдә азот гади матдә хәлендә очрый. Җир атмо-
232
па
E
H=O, HOhm
E
K,= 0,121 HM ~
H = 0,142 HM
/
940 кДж/кмъ
а
" T
494кДж/моль
E
151 кДж/моль
в
82 нче рәсем. Азот (а), кислород (б), фтор (в) атомнары тәэсир итешкәндә потен¬
циаль энергиянең атомнар арасындагы ераклыкка бәйле рәвештә үзгәрүе.
сферасы күләменең 78% ын азот тәшкил итүе сезгә билгеле инде
(4- IO15 т чамасы; Җир өслегенең һәр 1 м2 мәйданына 7500 т
азот туры килә).
Шул ук вакытта азот аксым кушылмаларының состав өлешен
тәшкил итә һәм барлык тере организмнарда да була. Моннан
тыш азот җир катламнарында неорганик кушылмалар — тоз¬
лар— нитратлар хәлендә очрый, мәсәлән NaNOs — Чили селит¬
расы.
Азотны 1772 елда Д. Резерфорд ачкан. «Азот» атамасын А. Лавуазье бир¬
гән. Ул грекча «азоэ» — «тереклек өчен яраксыз» сүзеннән алынган. N символы
азотның латинча Nitrogenium исеменнән килеп чыга (латинча «Nitrum» — селит¬
ра һәм грекча «генао» — тудырам сүзләреннән, «селитра тудыручы» — селитра
хасил итүче дип тәрҗемә ителә).
Азотны инерт тирәлек булдыру өчен, ягъни тиешсез химик
реакцияләрне булдырмау өчен (мәсәлән, тиз кабына торган мат¬
дәләрне, кыйммәтле картиналарны, кулъязмаларны саклаганда)
кулланалар. Азотны электр лампалары эченә тутыралар. Азотны
кулланучы төп тармак — аммиак җитештерү.
? I. 82 нче рәсемдә N, O һәм F атомнары тәэсир итешкәндә төшләр арасын¬
дагы ераклыкка бәйле рәвештә потенциаль энергия үзгәрүнең кәкреләре күр-
A сәтелгән. N2—Ог — Fj рәтендә: а) төшләр арасындагы ераклык го;
бәйләнеш энергиясе (молекулаларның атомнарга таркалу энергиясе) ничек
һәм ни өчен үзгәрә?
2. Әгәр N2, Нг һәм HaN молекулаларының атомнарга таркалу энергияләре
туры килгәнчә 940 кДж/моль, 435,9 кДж/моль һәм 1173 кДж/моль булса,
гади матдәләрдән аммиак синтезлау реакциясенең җылылык эффектын исәп¬
ләп чыгарыгыз.
3. Азот немецча Stickstoff (буылдыручан матдә), инглизчә Nitrogen (се¬
литра тудыручы) дип атала. Бу атамаларның кайсысы — элементның, ә кай¬
сысы гади матдәнең үзлекләрен күбрәк чагылдыра?
4. Сез ничек уйлыйсыз, ни өчен азотның эретелү температурасы фторның
эретелү температурасына караганда шактый түбәнрәк?
233
§ 74. НИТРИДЛАР. АММИАК
1. Азотның: а) литий; б) кальций; в) алюминий; г) водород белән булган
реакция тигезләмәләрен языгыз. Бу реакцияләрдәге оксидлаштыручыны һәм кай¬
таручыны күрсәтегез. Реакция тигезләмәләрендә коэффициентларны куеп чыгы¬
гыз. Бу реакцияләрнең продуктлары ничек аталалар? 2. Аммиак HaN молекула¬
сында азот һәм водород атомнарының электрон болытлары аралашу схемасын
сурәтләгез. Аммиак молекуласының составын һәм төзелешен аңлатып бирегез.
Азот кушылмаларда тискәре оксидлашу дәрәҗәсе дә, уңай
оксидлашу дәрәҗәсе дә күрсәтә алганлыктан, аның гади матдә¬
се химик реакцияләрдә оксидлаштыручы булып та, кайтаручы бу¬
лып та катнашырга мөмкин. Азот барыннан да бигрәк аеруча ак¬
тив металларга һәм водородка карата оксидлаштыручы була:
о -з
N2-^2N
мәсәлән:
0 0 4-2—3
3Mg + N2 = Mg3 N2, ДЖО
Оксидлашу дәрәҗәсе—3 булган азотның ике элементлы ку¬
шылмалары нитридлар дип аталалар. Металларның нитридла-
ры — каты, авыр эретелүчән матдәләр. Магний нитриды MgsN2
(оксид белән бергә) магнийны һавада җылытканда хасил була.
Нитридлардан водород нитриды H3N — аммиак (гадәттә ам¬
миакның формуласын NH3 дип язалар) аеруча киң кулланыла.
Сезгә билгеле булганча, аммиак — гадәттәге шартларда зәһәр
исле газ. Аның молекуласындагы химик бәйләнешләр азот ато¬
мының парлашмаган өч электроны һәм өч водород атомының
өч электроны исәбенә ясалган:
H
I
SN. + З.Н — JN-H
H
83 нче рәсем. Аммиак молекуласының
төзелеше.
Шулай итеп, аммиак NH3
молекуласында дүрт пар элек¬
троннар — өч пар бәйләүче
электроннар һәм бер пар бәйлә¬
неш хасил итмәүче электроннар
бар. Парлы электроннар үзара
этеләләр. Шунлыктан аммиак
NH3 молекуласы пирамида фор¬
масында була (83 нче рәсем).
Азот атомы пирамиданың түбә¬
сендә, ә водород атомнары аның
нигезендә урнашалар.
234
Аммиак нинди үзлекләргә ия
булырга тиеш? N — H бәйләне¬
ше — поляр бәйләнеш. Аммиак
молекуласындагы азот атомын¬
да, электротискәрерәк элемент
булганлыктан, тискәре корылма
тупланган, ә водород атомна¬
рында уңай корылма тупланган.
Шуңа күрә NH3 молекулалары
арасында водородлы бәйләнеш
урнашуы мөмкин:
H H
I I
H-Nj--H-Ns
H H
84 нче рәсем. Аммиакның януы.
Шуңа күрә аммиакның эретелү температурасы ( — 77,8°С)
һәм кайнау температурасы (— 33.4° С) чагыштырмача югары.
Аммиак сыеклыкка җиңел әверелә һәм аның парга әйләнү җы¬
лылыгы югары. Шуңа күрә аммиакны суыткыч машиналарда
файдаланалар.
Аммиак суда бик яхшы эрүчән (20° C та 1 күләм суда 700 кү¬
ләм чамасы аммиак эри). Аның яхшы эрүчәнлеге NH3 һәм
H2O молекулалары арасында водородлы бәйләнеш барлыкка ки¬
лү белән аңлатыла:
H
I
H-Ns
н
-H-OS
I
H
Аммиакның судагы эремәсе аммиаклы су дип атала.
Аммиакта азот үзенең иң түбән —3 оксидлашу дәрәҗәсен
күрсәтә. Шунлыктан аммиакка кайтаручы үзлекләре хас. Әйтик,
ул кислородта молекуляр азот һәм су парлары хасил итеп яна:
-3 0 0 -2
4NH3 + 3O2 =2N2 + 6H2O, Д//<0, AS>0; IO228
Бу вакытта күп җылылык аерылып чыга.
Аммиакның кислородта януын күзәтү өчен 84 нче рәсемдә
күрсәтелгән прибордан файдаланырга була. Эчке көпшә аша
аммиак, ә тышкы көпшә буйлап кислород җибәреп, аммиак агын¬
тысына янып торган шырпыны якын китерсәк, аммиак кабынып
китә һәм күгелҗем ялкын белән яна. Реакция чылбыр механизмы
нигезендә уза. Шул сәбәпле аммиак кислород яки һава белән
шартлагыч катнашма хасил итә.
235
Аммиак — азот промышленностеның мөһим продукты булып
тора. Аны ашлама итеп тә, нитрат кислотасы, шартлаучан мат¬
дәләр һәм азотлы ашламалар җитештерүдә дә кулланалар.
? 1. Аммиакның һава буенча тыгызлыгын исәпләп чыгарыгыз. Аммиакны са¬
вытка һаваны этеп чыгару ысулы белән җыеп буламы? Савытны аммиак
A белән ничек тутырырга? Аммиакны савыттагы суны этеп чыгару ысулы бе¬
лән җыеп буламы?
2. Магний нитриды су белән реакциягә кергәндә магний гидроксиды һәм
аммиак барлыкка килә. Реакция тигезләмәсен төзегез.
3. Аммиакның азот хасил итеп яну реакциясендә химик элементларның
оксидлашу дәрәҗәләре үзгәрү схемасын төзегез. Бу реакциянең тигез¬
ләмәсендә коэффициентларны куеп чыгыгыз.
4. Бакыр (II) оксидын аммиак атмосферасында җылытканда бакыр хасил
була. Реакциянең тигезләмәсен төзегез. Оксидлаштыручыны һәм кайтаручы¬
ны күрсәтегез.
5. Тигезләнеш константасының кыйммәте аммиакның кислородта яну реак¬
циясе кайтма булмаган реакция икәнлеген раслый. Ни өчен бу реакция
кайтма түгел?
6. Инглиз галиме У. Рамзай үзе үткәргән тәҗрибәләрнең берсен болай
тасвирлаган: «һава кыздырылган бакыр ярдәмендә кислородсыз калдырыл¬
ды, аннары көпшәдәге магний кисәкләре белән бергә җылытылды. Азот¬
ның шактый микъдары магний тарафыннан йотылгач, калдыкның тыгыз¬
лыгы билгеләнде. Аның тыгызлыгы водород тыгызлыгыннан 15 тапкыр арты¬
грак булып чыкты, ә азотның тыгызлыгы водород тыгызлыгыннан 14 тап¬
кыр гына артыграк. Азотны тагын да йоттырган саен, бу тыгызлык арта
торды... Мин бу матдәне 100 см3 күләмендә таптым һәм аның тыгызлыгы
19,9 булуын белдем. Ул бер атомлы газ булып чыкты..., ул бернинди ку¬
шылмалар да хасил итмәде... (Xo да ко в Ю. В. Общая неорганическая
химия.— M., 1965,—235 б.) Бу тәҗрибә нигезендә нинди ачыш ясалган бу¬
ла? Тәҗрибә барышында нинди реакцияләр булып узган? (25 нче параграф¬
ны карагыз).
§ 75. АММИАКЛЫ СУ
Азоттан аермалы буларак, аммиак суда бик яхшы эри. Ни өчен бу газлар¬
ның эрүчәнлеге нык аерылып тора? Газлар суда нинди очракларда яхшы, ә
нинди очракларда — начар эриләр?
Аммиакны суда эретү тәҗрибәсен башкарыйк. Моның өчен
сезгә таныш булган прибордан (56 нчы рәсемне карагыз) файда¬
ланыйк. Югарыгы колбаны аммиак белән тутырыйк, ә түбәндәге¬
сенә берничә тамчы фенолфталеин өстәлгән су тутырып салыйк.
Резина көпшә аша һава өрдергәндә югарыгы савыт эченә
пыяла көпшә буйлап су керә. Берничә тамчы су эләгүгә, югары¬
гы савыт эчендә фонтан ургыла башлый. Бик тиз арада югарыгы
савытка су тула. Аммиак суда бик яхшы эрегәнлектән, югарыгы са¬
вытта газның сирәкләнүе була. Атмосфера һавасы басымы ас¬
тында су югарыгы савытка күтәрелә. Аммиакның суда эрүе
нәтиҗәсендә индикаторның төсе үзгәрүгә игътибар итегез — ул
кура җиләге төсенә керә.
Аммиакның суда яхшы эрүчәнлеге су һәм аммиак молекула¬
лары арасында водородлы бәйләнешләр ясалу белән аңлатыла.
236
Ә менә индикаторның төсе үзгәрүне ничек аңлатырга? Инди¬
каторның кура җиләге төсенә керүе селтеле тирәлек барлыкка
килүне күрсәтә.
Суда H+ һәм ОН~ ионнарының концентрациясе бертигез.
Аммиакны NH3 эреткәндә исә OH- ионнарының концентрациясе
арта. Бу аммиак молекулаларының һәм водород ионнарының
үзара тәэсир итешүләре белән аңлатыла:
NH3H-H+^NH4+
Аммоний ионы дип атала торган катлаулы ион NHj- барлыкка
килә:
H [Hl +
I I
н—N: +н+—Jh — n — h
H L H
Аммиак молекуласында азот атомының бәйләнеш хасил итмә¬
гән ирекле бер пар электроннары бар. Ә водород ионының H +
исә орбитале буш. Шунлыктан H+ ионы һәм NH3 молекуласы
үзара якынлашканда ковалент бәйләнеш хасил була. Бу бәйлә¬
неш NHih ионындагы башка өч бәйләнеш кебек үк. Тик ул баш¬
ка механизм нигезендә — азот атомының ике электронлы болыты
һәм водород ионының буш калган орбитале исәбенә ясалган.
Ковалент бәйләнешнең бер кисәкчекнең парлашкан электроннары һәм икен¬
че кисәкчекнең ирекле орбитале исәбенә ясалу механизмы донорлы-акцепторлы
механизм дип атала. Бәйләнеш ясалганда парлашкан электроннарын биреп
торган кисәкчек донор дип атала (латинча donare — бүләк итү, бирү сүзен¬
нән. Хәтерегезгә төшерегез: донор — дәвалаганда авыру кешегә күчереп салу
өчен үз канын бирүче кеше). Ә бу электрон парын үзенең буш орбиталенә
кабул итүче кисәкчек акцептор дип атала (латинча acceptor — кабул итүче
сүзеннән).
Аммиакның су белән үзара тәэсир итешүен суммар рәвештә
мондый тигезләмә белән күрсәтергә мөмкин:
NH3+ H2O^NH4+ +OH-, А = 6,3-10"5
яки
Бу — кайтма реакция. Аммиаклы су эремәсенең электр үт-
кәрүчәнлеген тикшерү эремәдә эрегән NH3 молекулаларының
бик аз өлеше генә NHj-HOHHapbiHa әверелгәнлеген раслый. (Мо¬
ны тигезләнеш константасының кыйммәтеннән A=6,3-10-5 кү¬
рергә була). Шуңа күрә аммиаклы судан аммиак исе килеп тора,
237
һәм ачык һавада торганда, бигрәк тә җылытканда, суда эрегән
аммиак бөтенләй диярлек очып бетә.
Аммиакның судагы эремәсен шартлы рәвештә NhUOH форму¬
ласы белән күрсәтәләр һәм аммоний гидроксиды дип атыйлар.
Аммоний гидроксидын көчсез һәм тотрыксыз нигезләргә кертә¬
ләр:
NH4OH NH4++OH-
NH4OH^NH3H-H2O
Аммиаклы суны нашатырь спирты исеме белән медицинада
кулланалар. (Аммиакны аз микъдарларда сулау йөрәкнең һәм
нерв системасының эшчәнлеген яхшырта, шуңа күрә һуштан яз¬
ган кешене аңга китерү өчен һәм агуланганда, мәсәлән, ис газы
CO белән агуланганда, нашатырь спирты иснәтәләр.)
Көчсез селте буларак аммиаклы суны химия лабораториялә¬
рендә һәм көнкүрештә: тапларны бетергәндә, кер юганда, келәм¬
нәрне һәм ювелир әйберләрне чистартканда файдаланалар.
Аммиакның куертылган эремәләрен авыл хуҗалыгында азот¬
лы ашлама сыйфатында кулланалар.
? I. Аммиакны суда эреткәндә нинди процесслар булып узуын аңлатып бире¬
гез. Аммиакның судагы эремәсендә нинди молекулалар һәм ионнар була?
2. Суда аммиакны һәм водород хлоридын эретү тәҗрибәләренең нәтиҗәлә¬
рен чагыштырыгыз (48 нче параграфны карагыз). Аммиакның һәм водород
хлоридының эремәләрендә кислота-нигез индикаторының төсе төрлечә үзгә¬
рүнең сәбәбе нидән гыйбарәт?
3. Аммиакның су белән реакциясе тигезләмәләрен языгыз, а) Җылытканда;
б) суытканда; в) селте өстәгәндә; г) кислота өстәгәндә Jle Шателье прин¬
цибы нигезендә бу системада тигезләнеш кайсы якка авышыр?
4. XVIII йөздә аммиакны «очучан селте» дип йөрткәннәр. Ни өчен аңа
мондый исем бирелгән?
5. Аммиакны углерод (IV) оксиды катышмасыннан ничек чистартырга?
§ 76. АММОНИЙ ТОЗЛАРЫ
1. Аммиакның су белән үзара тәэсир итешү реакциясенең тигезләмәсен
төзегез. 2. Аммиаклы суга хлорид кислотасын өстәгәндә нинди реакция булып
узар? Аның тигезләмәсен языгыз.
Аммоний тозы барлыкка килүне түбәндәге тәҗрибәдә күзә¬
тергә мөмкин. Пыяла колпак астына куертылган аммиаклы су
һәм куертылган хлорид кислотасы салынган чынаяклар урнашты¬
рыйк. Ак төтен барлыкка килү күзәтелә. Бу төтен аммоний хло¬
риды тозының вак кына кристалларыннан гыйбарәт.
Аммоний хлориды NHfhaM Cl- ионнарыннан тора. Бу ион¬
нарның ясалуын түбәндәге схема ярдәмендә күрсәтергә була:
H
H-NS +H-Cl-
I
H
H
H-N-H
I
H
238
Практик яктан барлык аммоний тозлары да суда эриләр.
Эремәдә алар аммоний һәм кислота калдыгы ионнарына таркала¬
лар, мәсәлән:
NH4Cl=^NH4++СГ
(NH4)2SO4^NH4+ + SO4-
Аммиакның су белән үзара тәэсир итешүе кайтма реакция
булганлыктан,
NH3+ H2O^=NH4++OH-
системасындагы тигезләнешне аммиак хасил булу ягына OH-
ионнарын өстәп авыштырырга мөмкин:
NH4++ OH- NH3f + H2O
Лабораториядә аммоний тозларына селте эремәсе белән тәэ¬
сир итеп аммиак табу шул реакциягә нигезләнгән.
Аммоний тозларын ашламалар сыйфатында киң кулланалар.
? 1. Аммиактан һәм тиешле кислотадан: а) аммоний бромидын; б) аммоний
нитратын табу реакцияләренең тигезләмәләрен төзегез. Бу тозларны тәшкил
A итүче ионнарның ясалуын аңлатып бирегез. Аммиакны куертылган сульфат
кислотасы аша үткәреп киптерергә буламы?
2. Бирелгән матдәнең аммоний тозы булуын ничек исбатларга мөмкин?
3. Югары температурада аммоний хлориды металл оксидлары белән реагир-
лаша. Нәтиҗәдә металлның өслеге оксид элпәсеннән арына. Металларны
эретеп ябыштырганда аммоний хлоридын (нашатырьны) куллану шуңа ни¬
гезләнгән. Мәсәлән, бакыр (II) оксидыннан бакырны кайтарганда
CuO-J- NH4CI—>Си -J- N2 -J-CuCh -J- Н2О
реакциясе уза. Химик элементларның оксидлашу дәрәҗәләре үзгәрү схе¬
масын төзегез һәм реакция схемасында коэффициентларны куеп чыгыгыз.
4. 134,4 л аммиактан (н. ш.) аммоний сульфаты табу өчен ничә килограмм
78% лы сульфат кислотасы кирәк?
21 нче лаборатор дәрес
АММИАК. АММОНИЙ ТОЗЛАРЫ
1 нче тәҗрибә. Аммиакның судагы эремәсенең кислота-нигез
үзлекләре.
а) Пробиркага 4—5 мл аммиакның судагы эремәсен салыгыз.
Кислота-нигез индикаторы ярдәмендә эремә тирәлегенең харак¬
терын билгеләгез. Эремә тирәлегенең характерын аңлатып бирә
торган реакциянең тигезләмәсен төзегез.
б) 4—5 мл аммиакның судагы эремәсенә 2—3 тамчы фенол¬
фталеин өстәгез. Эремәне кайнап чыкканчы җылытыгыз. Индика¬
тор төсенең үзгәрүен аңлатып бирегез. Реакциянең тигезләмә¬
сен языгыз.
в) 4—5 мл аммиакның судагы эремәсенә 2—3 тамчы фенол¬
фталеин өстәгез. Аннары индикаторның төсе юкка чыкканчы там¬
239
чылап сыегайтылган сульфат кислотасы эремәсе өстәгез. Күзәтү-
ләрегезне аңлатып бирегез. Реакция тигезләмәсен төзегез.
Башкарылган реакцияләр нигезендә, аммиак белән су ара¬
сындагы реакциянең тигезләнеш халәтенә нинди факторлар йо¬
гынты ясавын аңлатып бирегез.
2 иче тәҗрибә. Аммиакның судагы эремәсен металларның
гидроксидларын табу өчен куллану. 2—3 мл алюминий тозы эре¬
мәсе салынган пробиркага аммиакның судагы эремәсен өстәгез.
Күзәтүләрегезне аңлатып бирегез, реакция тигезләмәсен төзе¬
гез.
3 нче тәҗрибә. Аммиак табу һәм аның үзлекләре.
а) Бертигез күләмнәрдә алынган аммоний хлоридының һәм
кальций гидроксидының катнашмасын хәзерләгез. Пробиркага
'/< өлеше булырлык итеп катнашманы салыгыз. Пробирканы
газүткәргеч көпшәле бөке белән ябыгыз. Пробирканы, аның тө¬
бе авызыннан бераз өстәрәк булырлык итеп авыштырып, шта¬
тивка беркетегез (85 нче рәсем). Өскә юнәлтелгән газүткәргеч
көпшәгә коры пробирка кидертегез. Ни өчен аммиакны төбе бе¬
лән өскә каратылган пробиркага җыялар?
Катнашма салынган пробирканың башта бөтен җирен дә, ә
аннары тик катнашма яткан урынын гына җылытыгыз. Пробирка
стеналарында су тамчылары барлыкка килүенә игътибар итегез.
Аммиак җыела торган пробирка газ белән тулгач (бу туры¬
да пробирка авызы янында газ исе килә башлаудан белеп була),
ул пробирканы әкрен генә алыгыз, әйләндермичә, шунда ук про¬
бирка авызын баш бармак белән каплагыз. Пробирканы берничә
тамчы фенолфталеин өстәлгән сулы савытка төшерегез. Cy ас¬
тында бармакны пробирка авызыннан алыгыз. Ни өчен пробир¬
када су күтәрелде? Cy күтәрелүдән туктагач, пробирканың авы¬
зын су астында тагын зур бармак белән каплагыз һәм пробир¬
85 нче рәсем. Лабораториядә аммиак
табу.
каны судан чыгарыгыз. Амми¬
акның суда эрүчәнлеге турында
нинди нәтиҗә ясарга мөмкин?
Индикаторның төсе үзгәрүне
ничек аңлатырга була? Үткә¬
релгән реакцияләрнең тигезлә¬
мәләрен төзегез, күзәтүләрегез¬
не аңлатып бирегез. Аммиакны
су өстендә җыеп буламы?
б) Пробиркага бераз каты
хәлдәге аммоний сульфаты са¬
лыгыз. Аннары берничә тамчы
натрий гидроксиды эремәсе өс¬
тәгез. Аммиак аерылып чыгуын
эксперименталь рәвештә ачык¬
лагыз (фенолфталеин эремәсен¬
дә чылатылган кәгазьдән фай¬
даланыгыз) .
240
4 нче тәҗрибә. Аммоний тозлары хасил булу. Куертылган
аммиак эремәсе салынган пробирка авызына куертылган хлорид
кислотасына манылган таякчыкны якын китерегез. Төтен барлык¬
ка килүне аңлатып бирегез. Тәҗрибәне, хлорид кислотасы уры¬
нына куертылган нитрат кислотасы алып, кабатлагыз. Реакция¬
ләрнең тигезләмәләрен төзегез.
5 нче тәҗрибә. Аммоний тозларын танып белү. Пробиркага
2—3 мл аммоний тозының эремәсен салыгыз һәм шулкадәр үк
натрий гидроксиды эремәсе өстәгез. Пробиркадагы катнашманы
кайнап чыкканчы җылытыгыз һәм аерылып чыга торган газны
саклык белән генә иснәп карагыз. Пробирка авызы янына кисло-
та-нигез индикаторында чылатылган кәгазьне якын китерегез.
Күзәтүләрегезне аңлатып бирегез. Реакцияләрнең тигезләмәлә¬
рен языгыз.
§ 77. АЗОТ ОКСИДЛАРЫ
1. Азотның +1, 4-2, 4-3, 4-4, 4"5 оксидлашу дәрәҗәләрендәге оксидлары
формулаларын языгыз. 2. Азот (II) оксидының азот (IV) оксидына оксидлашу
реакциясенең тигезләмәсен языгыз. Элементларның оксидлашу дәрәҗәләре үзгә¬
рү схемасын төзегез. Оксидлаштыручыны һәм кайтаручыны күрсәтегез.
Азотның барлык мөмкин булган уңай оксидлашу дәрәҗәләре¬
нә дә ( + 1, +2, Ң-3, -J-4, +5) туры килүче оксидлары билгеле:
-Ы +2 +3 +4 +5
N2O NO N2O3 NO2 N2O5-
Гадәттәге шартларда азот кислород белән турыдан-туры
тәэсир итешми. XVIII гасырда һава аша электр очкыннары үт¬
кәргәндә азотның кислород белән реагирлашуын белгәннәр. Соң¬
рак бу реакция вакытында азот (II) оксиды хасил булуы дә-
лилләнгән:
N2 + O2 = 2NO, А//>0,
AS>0; К = 5-10~31
Бу реакциягә югары активлаштыру энергиясе хас. Ул бары
тик бик югары температурада гына (мәсәлән, электр бушануы
вакытында) булып уза ала.
Азот (II) оксиды NO гадәттәге шартларда да кислород белән
җиңел оксидлаша. Төссез газ — азот (II) оксиды тутырылган
цилиндрның капкачын ачыйк. Шунда ук цилиндр өстендә көрән
төстәге болыт күтәрелә башлый — азот (IV) оксиды газы бар¬
лыкка килә:
2NO + O2 = 2NO2, \Н<0
Азот (II) оксиды суда начар эри һәм аның белән тәэсир
итешми. Азот (IV) оксиды, азот (II) оксидыннан аермалы була¬
рак, су белән үзара тәэсир итешә.
16 П 236
241
86 нчы рәсем. Азот (II) оксидының
азот (IV) оксидына оксидлашуы һәм
азот (IV) оксидының су белән үзара
тәэсир итешүе.
Азот (II) оксиды тутырылган һәм
капкач белән капланган цилиндрны
әйләндереп суга төшерик тә капкачны
ачыйк (86 нчы рәсем). Газның эрүе
күзәтелми. Ә хәзер цилиндрга газо¬
метрдан кислород җибәрик, азот (II)
оксиды шунда ук көрән төстәге NOa
газын хасил итеп оксидлаша. Ци¬
линдрга су күтәрелә башлый. Димәк,
азот (IV) оксиды суда яхшы эри. Төс¬
сез эремә хасил була. Кислота-нигез
индикаторы ярдәмендә тикшерү эремә¬
нең кислота үзлекле булуын күрсәтә.
Химик анализ үткәреп, эремәдә нит¬
рат кислотасы барлыгын ачыкларга
мөмкин.
Азот (IV) оксидының NO2 су белән үзара тәэсир итешүен
түбәндәге суммар тигезләмә рәвешендә күрсәтергә була:
+ 4 +5 +2
3NO2 + 1ЬО^2Н NO3 + N0, \Н<0
+ 4 +2
N-N
+ 4 +5
N-N
1
2
+ 4 +2
+ 5
3N = N+2N
Бу процесста азот (IV) оксиды оксидлаштыручы да, кайта¬
ручы да булып тора.
Техникада азот (II) оксидын аммиакны һава кислороды бе¬
лән катализатор (платина) катнашында оксидлаштырып таба¬
лар:
4NH3 + 5О2 = 4NO + 6H2O, А//<0; AS>0; IO168
Азотның кислородлы кушылмаларын табуда бу реакциянең
практик әһәмияте зур.
? 1. Гади матдәләрнең турыдан-туры тәэсир итешүе ысулы белән азотның
оксидларыннан фәкать азот (II) оксидын гына табарга була. Барлык азот
A оксидларының да барлыкка килүе эндотермик процесс (АЯ>0) булуын күз¬
дә тотып, моның сәбәбен анлатып бирегез. Барлык башка оксидлардан
аермалы буларак, азот (II) оксидының NO барлыкка килүе энтропиянең бе¬
раз гына артуы белән (AS >0) уза. Ә калган оксидларның барлыкка килүе
энтропиянең кимүе (AS<0) белән бара.
2. Аммиакның кислород белән: а) катализатор (платина) катнашында;
б) катализаторсыз оксидлашу реакцияләренең тигезләмәләрен языгыз.
Бу реакцияләрнең химик тигезләнеш константалары кыйммәтләрен язып
242
куегыз (74, 77 нче параграфларны карагыз). Константаларның кыйммәт¬
ләре бик зур. Димәк, тикшерелә торган реакцияләр кайтма түгел. Моны
ничек аңлатып була?
3. Азот (IV) оксиды белән су арасындагы реакциянең тигезләнеш халә¬
тенә: а) температураның; б) басымның үзгәрүе нинди йогынты ясый? Бу
реакциянең тигезләнешен нитрат кислотасы хасил булу ягына таба ничек
авыштырырга?
4. Яшенләп яуган яңгыр суында бик аз гына нитрат кислотасы була. Моны
ничек аңлатырга мөмкин? Мөмкин булган реакцияләрнең тигезләмәләрен
төзегез.
5. Азот оксидларының берсенә ясалган анализ 30,0 г бу кушылмада 14,0 г
азот булуын күрсәткән. Тикшерелә торган азот оксидының формуласы нин¬
ди? Икенче бер азот оксидының 92,0 г массалы үрнәгендә 28,0 г азот
бар. Бу кушылманың формуласы нинди?
§ 78. АЗОТ (V) ОКСИДЫ. НИТРАТЛАР (V)
1. Азот (V) оксиды белән су арасындагы реакциянең тигезләмәсен төзегез.
2. Кислородлы кислоталарның формулаларын гомуми рәвештә языгыз һәм кайсы
кислота көчлерәк булуы турында нәтиҗә ясагыз: нитрат кислотасымы HNOa
яки нитрит кислотасымы HNOa. Җавапны дәлилләү өчен бу кислоталарның
ионлашу константалары кыйммәтләрен күрсәтегез (кушымтаны карагыз).
3. Нитрат кислотасы белән: а) селте; б) нигез оксиды арасындагы реакцияләр¬
нең тигезләмәләрен языгыз. Бу әверелешләрнең асылын аңлатып бирегез.
Азотның -|-5 югары оксидлашу дәрәҗәсенә
N2O5 HNO3 NaNOa1 Ca(NOa)J
азот (V) оксиды нитрат кислотасы нитратлар
кушылмалары туры килә.
Гадәттәге шартларда азот (V) оксиды N2O5 — төссез, каты,
очучан матдә. Азот (V) оксиды тотрыксыз. -
Азот (V) оксидын табу ысулларының берсе азот (IV) оксидын озон белән
оксидлаштырудан гыйбарәт:
2NO2+O3 = N2O5+O2, AtfcO
Гадәттәге шартларда азот (V) оксиды N2O5 акрынлап азот (IV) оксидына
NO2 һәм кислородка O2 таркала. Җылытканда таркалу шартлау белән уза.
Азот (V) оксиды N2O5 — көчле оксидлаштыручы.
Кислота оксиды буларак, азот (V) оксиды NjO5 су белән
реакциягә керә һәм нитрат кислотасы хасил итә. Сусыз нитрат
кислотасы — төссез сыеклык (кайнау температурасы 83° С). Бүл¬
мә температурасында һәм яктыда ул акрынлап таркала:
4HNO3=4NO2 -I-Oj 4-2Н2О, А//>0
Куертылган эремәләрдә дә нитрат кислотасы HNO3 шулай ук,
әмма азрак дәрәҗәдә, таркала. Куертылган нитрат кислотасына
көйрәп торган чыраны төшергәндә, ул якты ялкын белән янып
китә (87 нче рәсем).
16*
243
87 нче рәсем. Чыраның нитрат кисло¬
тасы парларында януы.
Нитрат кислотасының сые¬
гайтылган эремәләре шактый
тотрыклырак булалар, чөнки
HNO3 эремәдә ионнар хәлендә
була:
HNCWH+ +NO?, А = 43,6
Ионлашу константасының
кыйммәтеннән күренгәнчә (K=
= 43,6), нитрат кислотасы —иң
көчле кислоталарның берсе.
Нитрат кислотасы очучан кис¬
лота булганлыктан, аны нит¬
ратлардан башка көчлерәк, лә¬
кин очучан булмаган кислота
белән, мәсәлән, куертылган
сульфат кислотасы ярдәмендә,
кысрыклап чыгарырга мөмкин:
NaHSO4 Ң-HNO3 f
Бу реакциянең тигезләнеше реакция сферасыннан аерылып
чыгучы очучан нитрат кислотасы хасил булу ягына авышкан.
HNO3 парлары конденсацияләшкәндә куертылган (төтенли тор¬
ган) нитрат кислотасы барлыкка килә.
Актив металларның нитратлары (KNO31 Ca(NO3) 2) җылыту¬
га, нитрат кислотасының үзенә караганда, чыдамлырак. Селтеле
металларның нитратлары, мәсәлән, натрий нитраты NaNO3 бары
тик шактый көчле җылытканда гына (300°C тан югарырак) тар¬
кала:
2NaNO3 = 2NaNO2 + O2 J
Натрий яки калий нитратын пробиркада җылытыйк. Тоз эре¬
телә, ә тагын да җылытканда таркала. Пробиркага кызган күмер
кисәге төшергәндә, ул аерылып чыга торган кислородта янып
бетә.
Кислородлы кислота тозларының кислоталарга караганда тотрыклырак бу¬
луларын болай аңлатып бирергә мөмкин.
Сусыз нитрат кислотасы HNO3 молекулалардан, ә кристаллик нитрат,
мәсәлән,натрий нитраты NaNO3 Na+ һәм NO3 ионнарыннан тора. 88 нче рәсем¬
дә HNO3 молекуласында һәм NOr ионында атомнарның үзара урнашулары
күрсәтелгән. NO3" ионында өч кислород атомы да бердәй, анда электроннар ты¬
гызлыгы тигез бүленгән. Молекулада исә, ике кислород атомының торышы,
водород атомы белән ковалент бәйләнеш ярдәмендә тоташкан өченче кислород
атомының торышыннан аерыла. Шулай итеп, нитрат кислотасында HNO3 кисло-
244
род атомнары арасында электроннар
тыгызлыгының бүленеше симметрия¬
сез була. Җылытканда нитрат кисло¬
тасындагы HNOa химик бәйләнешләр,
симметрик NOr ионындагыга караган¬
да, күбрәк деформацияләнәләр һәм
җиңелрәк өзеләләр. Шулай булгач,
кислородлы кислоталарның үзләре ха¬
сил иткән тозлар белән чагыштыр¬
ганда тотрыксызрак булулары турын¬
дагы гомуми закончалык та аңла¬
шыла. Сусыз кислоталарга караганда
кислота эремәләренең тотрыклырак
булуларының да сәбәбе шул ук, чөн¬
ки эремәдә кислоталар гидратлашкан
ионнар хәлендә булалар.
88 нче рәсем. Нитрат кислотасы HNOs
молекуласының (а) һәм NOr ионының
(б) төзелеше.
Калий нитратын кара дары җитештерүдә кулланалар. Kapa
дары калий нитратыннан, агач күмереннән һәм күкерттән то¬
ра— (бу катнашманың якынча составы KNO3+ЗС-|-S). Аммо¬
ний нитраты шартлату эшләрендә кулланыла торган шартлаучан
катнашмалар (аммонитлар) составына керә. Нитратлар пиротех¬
ник катнашмалар составында пиротехникада кулланылалар.
Калий, кальций һәм аммоний нитратларын минераль ашлама¬
лар итеп кулланалар. Нитратларның барысы да суда яхшы эри.
? 1. Нитрат кислотасын типик кислоталарның берсе буларак характерлый
торган реакцияләргә мисаллар китерегез.
A 2. а) Азот (V) оксиды белән натрий гидроксиды; б) нитрат кислотасы бе¬
лән аммиак арасындагы реакцияләрнең тигезләмәләрен төзегез.
3. Нитрат кислотасы таркалу реакциясенең тигезләнеш халәтенә: а) темпе¬
ратураның; б) басымның үзгәрүе нинди йогынты ясый?
4. Ни өчен куертылган нитрат кислотасы гадәттә саргылт төстә, ә сые¬
гайтылган нитрат кислотасы төссез була?
5. Түбәндәге тозлар гидролиз реакциясенә керәләрме: а) тимер (III) нитра¬
ты; б) натрий нитраты; в) бакыр (II) нитраты? Җавапны дәлилләгез, ә ки¬
рәк булганда, реакцияләрнең тигезләмәләрен языгыз.
6. Нитратларны танып белү ысулларының берсе, утлы күмер өстенә бер че¬
метем нитрат сипкәндә, күмернең кабынып китүенә нигезләнгән. Бу про¬
цессның асылын аңлатып бирегез.
7. Әгәр аммоний нитратын эреткәндә, стаканны юеш юка фанер тактага куй¬
саң, стакан төбенә такта ябышып ката. Бу күренешне ничек аңлатырга
була? Нитратның эрү процессын нинди фактор билгели: энергетик фактор¬
мы яки энтропия факторымы?
§ 79. НИТРАТ КИСЛОТАСЫНЫҢ ОКСИДЛАШТЫРУ
ҮЗЛЕКЛӘРЕ
1. Нинди реакцияләрне оксидлашу-кайтарылу реакцияләре дип атыйлар?
2. Бакыр белән куертылган сульфат кислотасы арасындагы реакциянең тигез¬
ләмәсен языгыз (63 нче параграфны карагыз). Бу реакциянең асылы нидән
гыйбарәт? 3. Җылытканда куертылган нитрат кислотасы таркалу реакциясе¬
нең тигезләмәсен языгыз. Нитрат кислотасы HNOs таркалганда кайсы элемент¬
ларның оксидлашу дәрәҗәләре үзгәрә?
245
Нитрат кислотасы — көчле оксидлаштыручы, ул күп кенә гади
һәм катлаулы матдәләрне оксидлаштыра. Әйтик, ул барлык ме-
талларны да диярлек оксидлаштыра. Нитрат кислотасы метал¬
лар белән үзара тәэсир итешкәндә гадәттә водород аерылып чык¬
мый. Бу яктан нитрат кислотасы куертылган сульфат кислота¬
сына охшаган (63 нче параграфны карагыз). Бакыр кисәкләре
салынган колбага куертылган нитрат кислотасы агызыйк һәм бе¬
раз җылытыйк. Көрән төстәге газ — азот (IV) оксиды аерылып
чыга. Эремә зәңгәр төскә керә — гидратлашкан бакыр ионнары
Cu+2 барлыкка килә. Шулай итеп, бакыр белән куертылган
нитрат кислотасы арасындагы реакциянең тигезләмәсе мондый
була:
0 +5 +2 +4
Cu + 4HNO3 = Cu(NO3) 2 + 2NO2+2H2O
(куерт)
O
+ 2
Cu-
—- Cu
1
+ 5
+ 4
N—
-N
2
O +5 4-2 4-4
Cu + 2N =Cu +2N
Металлар белән үзара тәэсир итешкәндә нитрат кислотасы
һәрвакытта да азот (IV) оксидына кайтарыламы соң?
Нитрат кислотасының кайтарылу продуктлары металлның ак¬
тивлыгына да, нитрат кислотасының концентрациясенә дә бәйле.
Әйтик, без тәҗрибә ярдәмендә, активлыклары түбән булган
металлар (Cu, Pb, Ag, Hg) белән үзара тәэсир итешкәндә куер¬
тылган нитрат кислотасының азот (IV) оксидына кайтарылуын
белдек.
Сыегайтылган нитрат кислотасы шул ук металлар белән реак¬
циягә кергәндә күбесенчә азот (H) оксидына кайтарыла, мәсә¬
лән:
O +5 +2 +2
ЗСиҢ-8HNO3 = SCu(NO3) 2+ 2NO + 4H2O
(сыег.)
O
Cu-
4-2
—-Cu
3
+ 5
+ 2
N—
-N
2
O +5 +2 +2
3Cu + 2N = 3Cu +2N
Сыегайтылган нитрат кислотасы белән актив металлар
(Ca, Mg, Al, Zn) реакциягә кергәндә азотның түбән оксидлашу
дәрәҗәсендәге кушылмалары (N2O, N2, NH3) барлыкка килә.
246
Куертылган нитрат кислотасында алюминий, тимер, хром ме-
талларының өслеге кислотада эреми торган саклагыч оксид эл¬
пәсе белән каплана. Бу металлар пассивлашалар. Шуңа күрә
куертылган нитрат кислотасын (96—98% лы) корыч цистерна¬
ларда саклыйлар һәм күчереп йөртәләр.
Затлы металларны (Pt, Au һ. б.) нитрат кислотасы оксид¬
лаштырмый.
Нитрат кислотасы күп кенә неметалларны оксидлаштыра. Бу
вакытта неметаллга туры килүче кислота яки оксид хасил була.
Мәсәлән, куертылган нитрат кислотасында җылытканда, кү¬
керт сульфат кислотасына әверелә:
0 +5 +6 +4
S + 6HNO3 = H2SO4 + 6NO2 + 2Н2О
O +5 4-6 4-4
S+6N = S+6N
ә күмер углерод (IV) оксидына әверелә:
O 4-5 4-4 4-4
C-HHNO3 = CO2-HNO2+ 2Н2О
O
4-4
C
-C
1
4-5
4-4
N
-N
4
O 4-5
4-4
4-4
C-HN = C-HN
Нитрат кислотасы шулай ук
күп кенә органик кушылмалар¬
ны да оксидлаштыра. Әйтик,
төтенли торган нитрат кислота¬
сы тисә, скипидар, салам, кә¬
газь, пычкы чүбе кабынып ки¬
тә (89 нчы рәсем), ул йонны
ашый, тәнгә эләксә, аны сары
төскә кертеп җәрәхәтли. Нит¬
рат кислотасы белән эш ит¬
кәндә аеруча сак булырга ки¬
рәк!
89 нчы рәсем. Куертылган нитрат кис¬
лотасында скипидарның кабынып
китүе.
247
90 нчы рәсем. Нитрат кислотасының кулланылышы: ашламалар, шартлаучан
матдәләр,буягыч матдәләр, полимерлар, лаклар, дару матдәләре, сульфат кисло¬
тасы җитештерү.
«Төтенли торган» куертылган нитрат кислотасы ракета тех¬
никасында ягулыкны оксидлаштыручы буларак кулланыла. Нит¬
рат кислотасын куллану өлкәләре 90 нчы рәсемдә күрсәтелгән.
? I. Куертылган нитрат кислотасы белән: а) терекөмеш; б) кургаш арасында¬
гы реакцияләрнең тигезләмәләрен төзегез.
▲ 2. Составында алтын һәм көмеш булган 1 г эретмәне нитрат кислотасында
җылытканда 0,78 г көмеш нитраты табылган. Эретмәнең составын масса
өлешләрендә (процентларда) исәпләп чыгарыгыз.
3. Түбәндәге әверелешләр нинди шартларда тормышка ашырыла:
N2^-NO-*NO2-*-HNO3-»-Cu(NO3) 2 ? Реакцияләрнең тигезләмәләрен төзегез.
4. Бакыр (II) нитратын табуның өч ысулын китерегез.
5. Бакырның куертылган нитрат кислотасы белән үзара тәэсир итешүе —
экзотермик процесс (А//-С0). Бу процесс кайтма процесс булып торамы?
6. Актив магний металы белән сыегайтылган нитрат кислотасы арасындагы
реакция тигезләмәсен языгыз. Реакция продуктларының берсендә азотның
оксидлашу дәрәҗәсе —3 кә тигез булуын исәпкә алыгыз. Реакция тигезлә¬
мәсендә коэффициентларны кую схемасын төзегез.
7. Сыегайтылган нитрат кислотасы белән: а) фосфор; б) висмут арасында¬
гы реакцияләрнең тигезләмәләрен төзегез. Фосфор — неметалл, ә висмут —
металл булуын исәпкә алыгыз. Висмутның тотрыклы оксидлашу дәрәҗәсе
4-3 кә тигез.
8. Сыегайтылган һәм куертылган нитрат кислотасын эксперименталь юл
белән ничек аерырга?
9. Ни өчен тозның оксидлаштыру активлыгы, аңа туры килүче кислородлы
кислотаныкыннан түбәнрәк (78 нче параграфны карагыз)?
248
§ 80. ТАБИГАТЬТӘ АЗОТ ӘЙЛӘНЕШЕ
1. Түбәндәге әверелешләрне башкарырга мөмкинлек бирүче реакцияләрнең
тигезләмәләрен языгыз: N2-*-NO-*NO2-*HNOa-»-NH4NO3. 2. Нитрат кислотасы
кальций карбонаты белән реакциягә кергәндә кальций нитраты һәм углерод (IV)
оксиды хасил була. Реакция тигезләмәсен төзегез.
Химик элемент, гомумән барлык табигать кебек үк, Ф. Эн¬
гельс сүзләре белән әйткәндә, «өзлексез хәрәкәттә һәм үзгәреш¬
тә» була. (Ф. Энгельс. Диалектика природы,—M., 1965.—
15 б.)
Процесслар Җирнең өч — каты (литосфера), сыек (гидро¬
сфера), газсыман (атмосфера) —тышчасында да булып торалар.
Табигатьтә баручы әверелешләрдә биосфераның — тере орга¬
низмнар яши торган тирәлекнең роле шактый зур.
Бу процесслар нәтиҗәсендә химик элементлар өзлексез рә¬
вештә бер сферадан икенчесенә күчеп торалар. Теләсә кайсы
элемент өчен миграцияләү схемасын, ягъни аның табигатьтәге
әйләнешен, күз алдына китерергә мөмкин.
V төсле рәсемдә азот әйләнешенең схемасы сурәтләнгән, һа¬
ва азотының, туфрактагы азотның, шулай ук үсемлекләр һәм
хайваннар азотының үзара күчеш процессларының кайберләрен
тикшереп узыйк.
Сезгә биология курсыннан билгеле булганча, азот аксым¬
нар составына керә һәм, димәк, үсемлекләрнең һәм хайваннар¬
ның яшәвен билгели. Хайваннар һәм күпчелек үсемлекләр һава
азотын һәм туфрактагы органик матдәләрнең азотын үзләштерә
алмыйлар. Үсемлекләр азотны туфрактагы неорганик кушылма¬
лардан аммоний NHT Һәм нитрат NOr ионнары рәвешендә үз¬
ләштерәләр. Үсемлекләрдә аксым синтезлана. Үсемлекләрнең
ниндидер өлешен үсемлек белән туенучы хайваннар ашый һәм
аксым матдәләре хайван организмнарына эләгә. Кайбер бакте¬
рияләр катнашында үсемлек һәм хайван калдыклары таркалалар
һәм катлаулы биохимик процесслар нәтиҗәсендә яңадан азотның
неорганик кушылмаларына әвереләләр. Бу кушылмаларны яңа¬
баштан үсемлекләр үзләштерәләр, һәм, шулай итеп туфрак азо¬
ты — үсемлекләр һәм хайваннар азоты әверелешләр чылбыры
йомыла.
Яшен вакытында атмосфера азоты кислород белән үзара
тәэсир итешә һәм азот (II) оксиды барлыкка килә. Эзлекле реак¬
цияләр нәтиҗәсендә азот (II) оксиды нитрат кислотасына әвере¬
лә, ә ул яңгыр суы белән туфракка эләгә һәм анда кайбер ми¬
нераллар (мәсәлән, металл оксидлары, карбонатлар) белән реа-
гирлашып, нитратларга әверелә.
Биосферада молекуляр азотны катлаулы кушылмаларга нигез¬
дә туфракта яшәүче атмосфера азотын туплый торган бактерия¬
ләр әверелдерәләр. Бу микроорганизмнар кайбер кузаклы үсем¬
лекләрнең (тукранбаш, люцерна, люпин һ. б.) тамырларындагы
төерчекләрдә яшиләр.
249
Табигатьтә бер үк вакытта капма-каршы процесслар да —
азотлы кушылмаларның таркалуы һәм атмосферага ирекле азот
аерылып чыгу да күзәтелә. Бу кайбер бактерияләрнең тереклек
эшчәнлегенә бәйләнгән. Органик матдәләрдәге азот урманнар
янганда да ирекле азотка әверелә.
Шулай итеп, табигатьтә, бер яктан, өзлексез рәвештә атмо¬
сфера азотыннан кушылмалар хасил булу процесслары, ә икен¬
че яктан, кушылмаларның ирекле азот хасил итеп таркалу про¬
цесслары бара. Табигатьтә бу капма-каршы процесслар арасын¬
да берникадәр дәрәҗәдә тигезләнеш урнаша.
? 1. V төсле рәсемнән файдаланып, табигатьтә азот әйләнеше схемасын тө¬
зегез.
A 2. Молекуляр азотның туфрактагы нитратларга эзлекле әверелеше реак¬
цияләренең тигезләмәләрен төзегез.
3. Люцерна һәм тукранбаш чәчеп үстерелгән басуларда авыл хуҗалыгы
культураларының уңышы артуны ничек аңлатырга була?
4. XX гасыр башларында галимнәр алдында «бәйле азот проблемасы»,
ягъни молекуляр азотны кушылмаларга әверелдерү проблемасы кискен ки¬
леп баскан. Аны хәл итү юлларын тәкъдим итегез.
§ 81. БӘЙЛЕ АЗОТ ПРОБЛЕМАСЫ
1. Молекуляр азотның химик кушылмага әверелүе белән узучы нинди реак¬
цияләрне беләсез? 2. Түбәндәге әверелешләрнең реакция тигезләмәләрен төзе¬
гез: N2->NH3-^NO-^NO2-»HNO3->-NH4NO3.
Табигатьтәге азот әйләнешенә кешенең эшчәнлеге җитди
йогынты ясый. Әйтик, авыл хуҗалыгы культуралары уңышы бе¬
лән бергә басуларның туфракларындагы азот кушылмалары да
алып кителә (һәр ел саен 100 млн. т. чамасы). Моннан тыш туф¬
рактагы азотлы кушылмаларны яңгыр һәм җир асты сулары
юдырып алып китә. Болар барысы да авыл хуҗалыгы культура¬
ларының уңышын киметә. Авыл хуҗалыгы үсемлекләренең уңы¬
шын арттыру өчен туфракка азотлы ашламалар кертәләр һәм
кузаклы үсемлекләр чәчәләр.
XX йөз башларына кадәр азот кушылмасы булган бердәнбер
чимал Чили селитрасыннан NaNOs гыйбарәт иде. Ул ашлама
сыйфатында һәм нитрат кислотасы җитештерү өчен кулланыл¬
ган. Әмма нитрат кислотасына булган ихтыяҗның нык үсүе
(шартлаучан матдәләр һәм азотлы ашламалар җитештерү өчен)
азот кушылмаларын турыдан-туры атмосфера һавасыннан табу
бурычын куйган. Шул рәвешчә бәйле азот проблемасы туган.
Проблеманы хәл итүнең берничә ысулы, шул исәптән ирекле
азотны азот (II) оксидына һәм аммиакка әверелдерү дә, тәкъ¬
дим ителгән булган.
һавадан азот кушылмаларын табуның киң файдалана алыр¬
лык ысулы булып азот белән кислородтан азот (II) оксиды хасил
булу тора. Ләкин, сезгә мәгълүм булганча, азотның кислород бе-
250
91 нче рәсем. Электр дугасында гади
матдәләрдән азот (II) оксиды
барлыкка килү.
92 нче рәсем. Гади матдәләрдән
азот (II) оксиды синтезлауның
тигезләнеше.
лән үзара тәэсир итешүе — эндотермик реакция һәм бары тик
бик югары температурада гына, мәсәлән электр дугасы темпе¬
ратурасында, бара (91 нче рәсем).
Азот (II) оксидын бу ысул белән тапканда бик күп электр
энергиясе тотыла. Шуның белән бергә тигезләнеш халәтендәге
катнашмада азот (II) оксидының микъдары да бик аз була
(92 нче рәсем). Шунлыктан азот (II) оксидын бу юл белән
җитештерү икътисади файдалы түгел.
Хәзерге вакытта бәйле азот проблемасы азот һәм водород¬
тан аммиак
ЗН2Ң-N2^NH3,
ә аннары азотның башка кушылмаларын табу юлы белән хәл
ителә.
Җир йөзендәге халык санының артуы һәм авыл хуҗалыгы
продукциясенә булган ихтыяҗларның үсә баруы, азотлы ашла¬
малар җитештерүне арттыру бурычын хәл итүгә дә җитди караш
сорый. Шуңа күрә атмосфера азотын кушылмаларга әверелде¬
рүнең икътисади яктан отышлы яңа юлларын эзләүгә күп көч
куела. Эзләнү юлларының берсе — азот туплаучы бактерияләр
эшчәнлегендәге биологик һәм химик процессларның асылына
төшенүдән һәм аларның эшчәнлеген промышленность күләмендә
имитацияләүдән гыйбарәт.
Tepe организмнардагы химик процессларны биологик катализаторлар —
ферментлар тизләтәләр. Ферментлар кайбер химик реакцияләрне миллион һәм
миллиард тапкыр тизләтә алалар. Шуның өстәвенә ферментлар катнашында
реакцияләр гадәттәге шартларда узалар (температура бүлмә температурасына
якын һәм атмосфера басымы). Гадәти промышленность катализаторлары белән
251
чагыштырганда ферментларның гаять зур өстенлекләре булу сәбәпле, хәзерге
вакытта химиклар, физиклар һәм биологлар ферментларның төзелешен һәм алар-
ның каталитик активлыгы табигатен ачыклау өстендә эшлиләр. Бу исә мөһим хи¬
мик продуктларны (шул исәптән азотлы кушылмаларны) промышленностьта
отышлы рәвештә җитештерү мөмкинлекләрен ачачак.
? I. Гади матдәләрдән азот (II) оксидын синтезлаганда, катнашмадагы
азот (II) оксиды микъдарының температурага бәйлелек графигын хәтергә
төшерегез. Кәкрене аңлатып бирегез.
▲ 2. 92 нче рәсем буенча
N2-I-O2^NO
системасының химик тигезләнеш халәтенә температураны күтәрү нинди йо¬
гынты ясавын күрсәтегез. Моны ничек аңлатырга була? Нинди температура¬
да тигезләнеш катнашмасында: а) 1%; б) 4% NO булыр? Тикшерелә тор¬
ган системаны суытканда ни өчен азот (II) оксидының NO микъдары бик
нык кими (92 нче рәсем)?
3. Ни өчен азот (II) оксидын югары температурада турыдан-туры гади
матдәләрдән синтезлау рентабельле түгел?
4. 150 л 63% лы нитрат кислотасы (р=1,38 г/см3), составында 80% каль¬
ций гидроксиды булган, 40 кг сүндерелгән известь белән үзара тәэсир итеш¬
кәндә ничә тонна кальций нитраты барлыкка килер? Исәпләүләрне башкар¬
ганда производство югалтуларының 1% тәшкил итүен игътибарга алыгыз.
Практик чыгышны процентларда күрсәтегез.
§ 82. АММИАК ҖИТЕШТЕРҮНЕҢ ТЕОРЕТИК НИГЕЗЛӘРЕ
1. Авогадро законын әйтеп бирегез. 2. Ни өчен газсыман матдәләр бер-бер-
се белән билгеле бер төгәл күләм чагыштырмаларында тәэсир итешәләр?
3. Әгәр практик чыгыш теоретик чыгышның 95% ын тәшкил итсә, 2240 л (н. ш.)
аммиакны турыдан-туры синтезлап тапканда, водород һәм азот нинди күләм¬
нәрдә кирәк булыр? 4. «Химия производствосын өйрәнү өчен белешмәлекнең»
1, 2 нче сорауларына җавап бирегез (65 нче параграфны карагыз).
Сезгә мәгълүм булганча, производствоның төп бурычы про¬
дуктны икътисади яктан отышлы ысул белән табудан гыйбарәт.
Моның өчен барыннан да элек продуктның аеруча күп чыгышын
һәм процессның зуррак тизлек белән узуын тәэмин итүче опти¬
маль шартларны табарга кирәк.
Аммиак синтезлаганда нинди шартларның оптималь булула¬
рын ачыклыйк. Кирәкле информацияне реакция тигезләмәсеннән
белергә мөмкин:
3H2 + N2^2NH3
4 моль 2 моль
Д/7<0,
AS<0
Бу — кайтма реакция. Реакция барышында химик тигезләнеш
урнаша. Газлар арасында реакция күләмнең кимүе белән уза.
Шуның өстәвенә ул — экзотермик реакция.
Химик тигезләнешне аммиак хасил булу ягына авыштыру
шартларын ачыклау өчен Ле Шателье принцибын кулланыйк.
252
93 нче рәсем. Басымның һәм темпера¬
тураның функциясе буларак азот-водо-
род катнашмасында (3H2+N2) ам¬
миакның тигезләнеш халәтендәге кон¬
центрациясе.
Азотның водород белән реак¬
циясе экзотермик реакция бул¬
ганлыктан, тигезләнеш аммиак
хасил булу ягына температура¬
ны төшергәндә авышыр. Реак¬
ция күләмнең кимүе белән бара.
Тигезләнеш аммиак хасил булу
ягына басымны күтәргәндә авы¬
шыр (93 нче рәсем).
Әмма шундый сорау туа: ни¬
чаклы температураны түбәнәй¬
тергә, ә басымны арттырырга
мөмкин?
Белгәнегезчә, температура
түбәнрәк булган саен, реакция¬
нең тизлеге кими. Шунлыктан
аммиакны синтезлау зур тизлек
белән һәм мөмкин кадәр тү¬
бәнрәк температурада узсын өчен катализатор кулланырга кирәк.
Үз чиратында бик югары басым кулланылганда җиһазлар
кыйбатка төшә. Моннан тыш, газлар катнашмасын кысу өчен
күп энергия сарыф ителә.
Хәзерге вакытта, икътисади яктан аеруча отышлы саналган,
30 МПа чамасы басым астында һәм 450—550° C температура
шартларында эшли торган корылмалар аеруча киң кулланыла.
? 1. Газсыман азоттан, водородтан һәм аммиактан торган системада туры
һәм кире реакцияләрнең узуына энергетик һәм энтропия факторлары нинди
йогынты ясыйлар?
▲ 2. ЗНг + N23=s3NHa реакциясенең тигезләнеш халәтендәге аммиак чыгышы¬
на басымның йогынтысын күрсәтүче графикны хәтергә төшерегез һәм кабат
сызыгыз.
3. 93 нче рәсем буенча 500° C та һәм басым: а) 20МПа; б) 40 МПа;
в) 60 МПа булганда аммиакның тигезләнеш халәтендәге концентрациясен
билгеләгез. Ни өчен азот-водород катнашмасы тулысынча аммиакка әверел¬
ми? Реакциягә керми калган азот-водород катнашмасын аммиак синтезлау
процессында куллану ысулын тәкъдим итегез.
4. Реакция экзотермик характерда булса, каршы агым принцибын кулланып,
катализатор зонасында оптималь температураны ничек тәэмин итәргә мөм¬
кин?
253
§ 83. АММИАК ҖИТЕШТЕРҮ
«Химия производствосын өйрәнү өчен белешмәлектәге» сораулар буенча
аммиак җитештерү схемасын төзеп карагыз (65 нче параграфны карагыз).
Бу процессны теоретик дәлилләү производствоның аеруча
рациональ технологик схемасын сайлап алырга, һәм шулай ук
аерым аппаратларның төзелешен билгеләргә мөмкинлек бирә.
Аммиак җитештерү схемасы түбәндәге стадияләрне эченә алырга
тиеш:
Аммиак җитештерү схемасы IV төсле рәсемдә күрсәтелгән.
Азот-водород катнашмасын (3 күләм Н2 һәм 1 күләм N2) ком¬
прессор ярдәмендә кысалар һәм синтез колоннасына җибәрәләр.
Азот-водород катнашмасын тиешле температурага чаклы
ничек җылытырга һәм катализатор зонасында оптималь темпера¬
тураны ничек тәэмин итәргә?
һичшиксез, моның өчен «каршы агым» принцибын — реагент¬
ларның капма-каршы юнәлештәге хәрәкәтен — кулланырга ки¬
рәк. Азот-водород катнашмасы җылылык алмашу принцибы ни¬
гезендә реакциядә катнашкан газларның җылылыгы исәбенә җы¬
лытылырга тиеш. Моның өчен газлар катнашмасын синтез колон¬
насының ике стенасы арасындагы боҗрасыман бушлык аша кер¬
тәләр. Шул ук максатларда синтез колоннасында трубалы җылы¬
лык алмаштыргыч урнаштырылган була. Биредә азот-водород
катнашмасы җылылык алмаштыргычның трубалары арасыннан,
ә реакциягә кергән газлар катнашмасы трубалар эченнән узды¬
рыла. Белгәнегезчә, реакция җылысын куллану хәзерге заман хи¬
мия производствосының мөһим принципларыннан берсе булып
тора. Бу принципны тормышка ашыру энергия тотуны киметер¬
гә мөмкинлек бирә.
Азот-водород катнашмасы җылылык алмаштыргычтан үзәк
труба буйлап катализатор тартмасына катализаторга җибәрелә.
Промышленностьта аммиак синтезлау өчен катализатор итеп
кайбер матдәләр катнаштырылган (AI2O3, К2О) көпшәк тимер
кулланыла.
Кайбер матдәләр — каталитик агулар булганда катализатор¬
ның активлыгы кимүен сез беләсез инде. Тимер катализаторы
өчен шундый агулар булып кислород һәм кислородлы кушылма¬
лар (су парлары, углерод оксидлары), майлар, тузан һ. б. тора.
Шуңа күрә синтез колоннасына җибәрелә торган азотны һәм
водородны бик яхшылап чистарталар.
254
94 нче рәсем. Аммиакны минераль ашламалар, нитрат кислотасы, дарулар, шарт-
лаучан матдәләр җитештерүдә, көнкүрештә — эретеп ябыштыру эшләрендә
аммоний тозларын куллану.
Синтез колоннасыннан чыга торган газлар катнашмасында
10—12% аммиак була. Барлыкка килгән аммиак һәм реакциягә
керми калган газлар җылылык алмаштыргычның трубалары буй¬
лап суыткычка җибәрелә. Анда аммиак сыек хәлгә күчә. Шун¬
нан соң сепараторда сыек аммиакны реакциягә керми калган
газлар катнашмасыннан аерып алалар һәм әзер продукция скла¬
дына җибәрәләр. Реакциягә керми калган газларны азот-водород
катнашмасының яңа өлешенә катнаштыралар һәм синтез колон¬
насына кертәләр. Шул рәвешчә, продуктның чыгышын арттыру
өчен, хәзерге заман химия производствосының мөһим принци¬
бы— циркуляция принцибы тормышка ашырыла.
Сыек аммиакны корыч баллоннарда һәм корыч резервуарлар¬
да (танкларда) саклыйлар һәм күчереп йөртәләр.
? 1. Аммиак синтезлауның оптималь шартларын (температура, басым) ни¬
чек белергә? Катализатор зонасында оптималь температура ничек саклана?
A 2. Аммиак синтезлаганда һәм аммиакны газлар катнашмасыннан аерып
алганда теоретик нигезләнгән оптималь шартларны ничек тормышка ашыра¬
лар? Аммиак синтезлаганда җылылык алмашу, каршы агым һәм циркуля¬
ция принциплары ничек тормышка ашырыла? Бу принциплар үтәлгәндә
нәрсәгә ирешелә?
3. IV төсле рәсем буенча аммиак җитештерү технологиясе схемасындагы
һәр аппаратның ролен аңлатып бирегез. Синтез колоннасының һәм суыт¬
кычның эшләү принципларын аңлатыгыз.
4. Синтез колоннасының корпусын корычтан ясыйлар. Температура һәм
басым югары булганда корыч водород һәм аммиак тәэсиренә чыдамый.
IV төсле рәсемне кулланып, аммиак синтезлау колоннасының корпусын җы¬
лынудан, димәк химик ашалудан саклауны инженерлар ничек хәл итәргә
мөмкин икәнен аңлатыгыз.
5. 5 т аммиак җитештерү өчен водородны нинди күләмдә (н. ш.) алырга?
Циркуляция принцибын куллану аркасында продуктның чыгышы 95%.
6. 94 нче рәсем буенча аммиакны куллану өлкәләре турында сөйләгез.
255
§ 84. НИТРАТ КИСЛОТАСЫ ҖИТЕШТЕРҮ
1. Түбәндәге әверелешләрнең реакция тигезләмәләрен төзегез: NHa-^-NO-*-
-*-NO2-^-HNOa. 2. а) Азот (II) оксидының NO азот (IV) оксидына NO2 оксид¬
лашу реакциясенең; б) азот (IV) оксидының NO2 су белән үзара тәэсир итешү¬
нең тигезләнеш халәтенә температура һәм басым нинди йогынты ясый? 3. Ам¬
миакны оксидлаштыру реакциясенең җылылыгын куллану ысулын тәкъдим итегез.
4. «Химия производствосын өйрәнү өчен белешмәлекнең» сорауларына җавап би¬
регез (65 нче параграфны карагыз).
Хәзерге вакытта нитрат кислотасын җитештерү ике стадия¬
дән тора: 1) азот (II) оксидын табалар; 2) азот (II) оксидын
азот (IV) оксидына оксидлаштыралар һәм азот (IV) оксидын су
белән реакциягә кертәләр.
Азот (II) оксидын промышленностьта аммиакны оксидлашты¬
рып табалар:
4NH3 Н-5О2 =4NO + 6H2O, AW<0; A=IO168.
Нитрат кислотасын җитештерүнең икенче стадиясендә бер үк
вакытта
2NO + O2^±2NO2
3NO2 + H2O^2HNO3 + NO
реакцияләре булып уза.
Күрсәтелгән процессларны приборда үткәрик (95 нче рәсем).
Шешәдәге (1) аммиаклы су аша һава үткәргәндә һава куыкла¬
ры үзләре белән аммиакны да ияртәләр, аммиак белән һава кат¬
нашмасы хасил була. Бу катнашма катализатор салынган көпшә¬
гә (2) керә. Бүлмә температурасында газлар катнашмасын көп¬
шә аша уздырганда нинди дә булса үзгәрешләр сизелми. Ката¬
лизатор салынган көпшәне җылытканда аммиак оксидлаша. Са¬
вытта (3) коңгырт төстәге газ барлыкка килү һәм савыттагы
(4) суга өстәлгән индикаторның төсе үзгәрү шуны раслый.
Промышленностьта аммиакны оксидлаштыру контакт аппара¬
тында (750—800°C та) үткәрелә (96 нчы рәсем). Катализатор
итеп нечкә чыбыклардан үрелгән челтәр рәвешендәге платина-
родий эретмәләрен кулланалар. Оксидлашу процессында күп
микъдарда җылылык аерылып чыга. Шуңа күрә контакт аппара¬
тыннан чыга торган газларны («11% NO була) суыту өчен пар
казанына — утилизаторга кертәләр. Анда газның җылылыгын
файдалану исәбенә су пары җитештерелә.
Азот (II) оксидын NO азот (IV) оксидына NO2 әверелдерү
һәм азот (IV) оксидын суда эретү йоттыру башняларында
үткәрелә. Бу процесслар барышында системаның күләме киме¬
гәнлектән, басым мөмкин кадәр югарырак булырга тиеш (гадәт¬
тә 0,3-0,8 МПа басым астында үткәрәләр).
Азот (IV) оксиды NO2 су белән үзара тәэсир итешкәндә
азот (II) оксиды NO барлыкка килә. Шулай итеп, йоттыру
256
95 нче рәсем. Аммиакны оксидлаштыру:
1— аммиаклы су салынган шешә; 2— катализатор салынган көпшә; 3— һава
тутырылган савыт; 4—су салынган савыт.
башняларыннан сон, күпмедер микъдарда азот (II) оксиды кала.
Атмосфераның агулануын булдырмау өчен, атмосферага чыга
торган газларны, андагы азот (II) оксидын NO катализатор кат¬
нашында азотка һәм кислородка таркатып, чистарталар.
Без тикшергән ысул белән сыегайтылган нитрат кислотасын
(50—60% лы) табалар. Аны
ашламалар җитештерү өчен
кулланалар.
Куертылган нитрат кислота¬
сын (98% лы) сыек азот (IV)
оксидын су һәм кислород белән
реакциягә кертеп табалар:
4 NO2 + O2 + 2H2O^.4HNO3,
ДЯ<0, AS<0
Бу процесс басым астында
(5 МПа) үткәрелә.
96 нчы рәсем. Аммиакны оксидлашты¬
ру өчен кулланыла торган контакт
аппараты.
ЯмлаиаЛ Лә*» һаба
катнашмасы
дзот (ff)
оксиды
Cemна форма¬
сындагы
катали¬
затор
17 П-236
257
? 1. Азот (IV) оксиды белән су арасындагы реакциянең тигезләмәсен төзе¬
гез. Ни өчен бу реакция ярдәмендә куертылган нитрат кислотасы табып
A булмый?
2. Ни өчен куертылган нитрат кислотасын шактый югары басым астында
табалар?
3. Куертылган нитрат кислотасы тәэсирендә нинди металлар ашалмыйлар
һәм бу нәрсә белән аңлатыла?
4. Әгәр азот (II) оксидының чыгышы 98% тәшкил итсә, ә аннан соң
азот (II) оксидының NO 99% ы нитрат кислотасына HNOa әверелсә,
100% лы кислотага күчереп исәпләгәндә, тәүлеккә 1000 т җитештерүчән-
лекле агрегатта нитрат кислотасы җитештерү өчен тәүлек саен күпме амми¬
ак кирәк булыр?
5. Сыек азот (IV) оксидыннан NOa куертылган нитрат кислотасы табу
реакциясенең тигезләмәсендә коэффициентларны кую схемасын төзегез.
6. Әгәр нитрат кислотасы җитештерә торган завод трубаларыннан җирән
төстәге «төлке койрыгы» булып газлар күтәрелә икән, димәк, технология
режимы бозыла дигән сүз. Завод трубалары өстендә «төлке койрыгының»
күтәрелүе нәрсәгә бәйле һәм ни өчен бу газлар үсемлекләрне корыталар?
«Төлке койрыгын» ничек булдырмаска мөмкин?
§ 85. АЗОТЛЫ АШЛАМАЛАР
1. Аммоний сульфатын кокс җитештергәндә өстәмә продукт буларак таба¬
лар. Күмерне кокслаганда барлыкка килә торган аммиакны сыегайтылган
сульфат кислотасы белән йоттыралар. Бу реакциянең тигезләмәсен языгыз.
2. Кальций селитрасын (кальций нитратын) ничек табарга мөмкин? 3. Аммоний
нитратын (аммоний селитрасын) промышленностьта табу схемасын тәкъдим ите¬
гез.
Авыл хуҗалыгы культураларының уңышын арттыруда туф¬
ракка үсемлекләрнең үсүе һәм үсеше өчен кирәкле элемент¬
ларны кертү хәлиткеч әһәмияткә ия булып тора. Бу вакытта
уңдырышлылык кына күтәрелеп калмый, ә авыл хуҗалыгы куль¬
тураларының сыйфаты да яхшыра, мәсәлән, кыяклы үсемлекләр¬
дә аксымның, виноградта һәм шикәр чөгендерендә шикәрнең,
бәрәңгедә крахмалның микъдары арта һ. б. Үсемлекләргә кирәк¬
ле булган элементларны туфракка органик һәм органик булмаган
(минераль) ашламалар рәвешендә кертәләр. Органик ашлама¬
ларга тирес, торф һ. б. керә. Минераль ашламалар минераль
чималны химик эшкәртү продуктлары булып торалар. Үсемлек¬
ләрнең үсү һәм үсеш элементлары дип азотны, фосфорны һәм ка¬
лийны атыйлар. Шунлыктан аеруча күп микъдарларда туфракка
составларында азот, фосфор, калий булган ашламаларны кертә¬
ләр. Моннан тыш, үсемлекләрнең нормаль үсүе һәм үсеше өчен
күп кенә башка элементларның да булуы кирәк. Аларның кай¬
берләреңә үсемлекләр бик аз (микро-) микъдарларда гына мох¬
таҗ булалар. Бу элементларны микроэлементлар дип, ә состав¬
ларында бу элементлар булган ашламаларны микроашламалар
дип атыйлар. Tepe организмда микроэлементлар биохимик про¬
цессларны катализлаучы ферментларның состав өлеше булып то¬
ралар.
Минераль ашламалар җитештерү һәм аларны игенчелектә
258
куллану — авыл хуҗалыгының продуктлылыгын күтәрүдә төп ни¬
гез булып тора. Революциягә кадәр безнең илдә ашламалар
аз җитештерелгән, аларны башлыча чит илләрдән сатып алган¬
нар. Совет власте елларында минераль ашламалар җитештерүче
куәтле промышленность тармагы барлыкка килде (тук промыш¬
ленносте) .
Азотлы минераль ашламаларны тикшереп узыйк. Ашламалар¬
да азот аммиак NH31 аммоний ионы NHit; нитрат-ион NOr һәм
кайбер башка азотлы группалар составында була. Азотлы ашла¬
маларга Чили селитрасын NaNO3, калий селитрасын KNO3, Нор¬
вегия селитрасын Ca(NO3) 2, аммоний селитрасын NH4NO3,
аммиакны NH3, мочевинаны CO(NH2)2 һ. б. кертәләр.
Агрегат хәле буенча азотлы ашламаларны каты һәм сыек
ашламаларга бүлеп йөртәләр. Сыек ашламаларга сыек аммиак,
аммиакның судагы эремәсе, ашламаларның аммиаклы судагы
яки сыек аммиактагы эремәләре керә. Азотлы ашламаларның
барысы да суда яхшы эри. Азотлы ашламалар үсемлекләрнең
үсүен һәм аларның яшел массасы артуны стимуллаштыралар,
ягъни башлыча вегетатив органнарның (яшел сабакларның һәм
яфракларның) үсүенә йогынты ясыйлар.
Азотлы ашламалар турындагы кайбер мәгълүматлар 15 нче
таблицада бирелгән.
15 нче таблица. Азотлы ашламаларның төрләре
Ашламаның
исеме
Агрегат
хәле
Төп компонент
Азотның масса
өлеше, %
Аммоний селитрасы
Каты
NH4NO3
34 -34,8
Кальций селитрасы
Каты
Ca(NO3) 2
15,5% тан да ким
түгел
Аммоний сульфаты
Каты
(NH4)2SO4
20,5—20,8
Аммоний хлориды
Каты
NH4Cl
24—25
Карбамид (мочевина)
Каты
CO(NH2)2
46% тан да ким
түгел
Аммиаклы су
Сыек
NH3
16,5—20,8
Сыек ашламалар
Сыек
NH3 +NH4NO3+H2O
37—41
Аеруча күп микъдарларда каты азотлы ашламалар — аммо¬
ний селитрасы NH4NO3 һәм карбамид (мочевина) CO(NH2)2
эшләп чыгарыла. Соңгы елларда шактый микъдарларда сыек
азотлы ашламалар җитештерелә, һәм эшләп чыгарыла торган
азотлы ашламалар арасында аларның өлеше артканнан-арта
бара.
Азотлы ашламаларның иң әһәмиятлеләреннән берсе булып
аммоний селитрасы NH4NO3 санала. Аның составында азот
үсемлекләр тарафыннан үзләштерелә торган ике формада: аммо¬
ний ионы NHYhaM нитрат-ион NO3-хәлендә була. Аммоний ни¬
траты— суда яхшы эрүчән, төссез кристаллик матдә. Ул гаять
17*
259
гигроскопик, ягъни дымны тарта. Шуңа күрә саклаганда һәм кү¬
череп йөрткәндә аммоний селитрасы укмашып ката. Бу җитеш-
сезлеген киметү өчен, аны бөртекләндерәләр — селитраны бөр¬
текләр, 1—4 мм зурлыктагы гранулалар рәвешендә җитештерә¬
ләр.
Промышленностьта аммоний селитрасын табу газ хәлендәге
аммиакның сыегайтылган нитрат кислотасы белән реакциясенә
нигезләнгән:
NH3+ HNO3 = NH4NO31 SH <0
Промышленностьта бу реакция уздырыла торган аппарат
97 нче рәсемдә күрсәтелгән. Аппаратка (реактор-нейтрализатор-
га) өзлексез рәвештә аммиак һәм нитрат кислотасы кертелә,
ә аппараттан аммоний селитрасы эремәсе чыгарылып тора.
Аммоний нитраты NH4NO3 хасил булу — экзотермик процесс.
Аның барышында аерылып чыга торган җылылык исәбенә суның
берникадәр өлеше парга әйләнә һәм пар хәлендә үк аппараттан
чыгарыла. Барлыкка килгән селитра эремәсен тагын да парга
әйләндереп, югары концентрацияле эремә табалар. Бу эремә
(плав) бөртекләргә әверелдерелә. Бөртекләндерү башняларында
селитра (плав) әйләнеп торучы сиптергечләргә килеп тора
(98 нче рәсем). Башняның аскы өлешеннән кертелә торган һава
белән суытылу исәбенә плав тамчылары каты бөртекләргә әве¬
реләләр.
Аммоний селитрасын су үт¬
кәрми торган капчыкларда сак¬
лыйлар.
Татарстан Республикасында
нитрат кислотасын һәм аммо¬
ний селитрасын Яңа Менделе-
евск азотлы ашламалар заво¬
дында җитештерәләр.
Азотлы ашламаларның иң
югары концентрациялесе булып
карбамид (мочевина) C0(NHa)2
тора. Ул — суда эрүчән, төссез
кристаллик матдә.
Карбамидны югары басым астын¬
да аммиак белән углерод (IV) оксидын
реакциягә кертеп табалар:
CO2 4-2NH.3 =CO(NH2) 2 + H2O;
^NH2
O=C
^NH2
97 нче рәсем. Аммоний нитратын табу
аппараты.
260
NH^ NOjHbiH1
һава
һәм eg
парла¬
ры
һава
эремәсе
Сиптергеч
һава һәм
сунарла¬
ры
һава
Транспортерлар
98 нче рәсем. Бөртекләндерү башнясы.
Туфракта су тәэсиреннән карбамид аммоний карбонатына әверелә:
CO(NH2) 2+2Н2О= (NH4) 2СОз
Карбамид күшәүче хайваннар азыгына кушып бирү өчен дә кулланыла.
Промышленностьта карбамидны пластмассалар, дарулар җитештергәндә
кулланалар.
? 1. Аммоний нитраты NH4NOa һәм аммоний сульфаты (NH4)2SO4 катнаш¬
масыннан торган ашлама табу ысулын тәкъдим итегез.
A 2. Ни өчен аммоний нитратын җитештерү өчен куертылган нитрат кислота¬
сы түгел, ә сыегайтылганы кулланыла?
3. Югалтуларны исәпкә алмаганда, 1 т аммоний нитраты табу өчен нинди
күләмдә 50% масса өлешле нитрат кислотасы (р = 1,31 г/см3) кирәк булыр?
4. Азотлы ашламаларның үзлекләрен һәм аларның үсемлекләргә тәэсирен
исәпкә алып, бу ашламаларны туфракка кертү ысулын һәм вакытын тәкъ¬
дим итегез. Җавапны дәлилләгез.
5. Мочевинаның һәм аммоний нитратының гидролиз реакцияләре тигезлә¬
мәләрен языгыз. Кайсы очракта туфракның әчелеге артмас: мочевина керт¬
кәндәме, әллә аммоний селитрасы керткәндәме?
6. Совхозга, тышкы күренешләре белән бик тә охшаш булган, аммоний һәм
калий селитралары алып кайтканнар. Агроном томат үсемлекләрен калий¬
лы ашлама белән тукландырырга тиеш. Совхоз лабораториясендә бу ашла¬
маларны бер-берсеннән ничек танып аерырга мөмкин? Тиешле реакция¬
ләрнең тигезләмәләрен языгыз.
261
22 нче лаборатор дәрес
АММОНИЙ ТОЗЛАРЫН ТАБУ
Бу эш барышында сезгә, аммиак белән тиешле кислотаны
реакциягә кертеп, аммоний тозларының берсен табарга кирәк
булачак. Прибор белән танышыгыз (99 нчы рәсем). Колбада
(100 мл сыешлы) сез аммиаклы судан аммиак табарсыз, ә
U-сыман көпшәдә аммиакның кислота белән реакциясен үткәрер¬
сез. Аммиакның кислота белән үзара тәэсир итешүе — экзотер-
мик процесс. Шунлыктан U-сыман көпшәне карлы яки салкын су¬
лы стаканга төшерәләр. Эшне башкару өчен приборны җыегыз.
1 нче тәҗрибә. Аммоний нитратын табу. Аммоний нитратын
табу реакциясенең тигезләмәсен төзегез. Прибордагы колбага
30—35 мл аммиакның судагы эремәсен салыгыз һәм U-сыман
көпшә белән тоташтырыгыз. Көпшәгә воронка аркылы, көп¬
шәнең аскы өлеше күмелерлек итеп (рәсемдә күрсәтелгән
кадәр), нитрат кислотасы эремәсе салыгыз. Эремәнең тамчылары
чәчрәмәсен өчен воронканы көпшәнең тармагында калдырыгыз.
U-сыман көпшәне карлы яки салкын сулы стакан эченә урнаш¬
тырыгыз.
Аммиак эремәсе салынган колбаны саклык белән генә җылы¬
тыгыз. Горелканың ялкынын көйләп, аммиакның тыныч кына
чыгуын һәм кислотада тулысынча йотылуын күзәтегез. Аммиак
җибәрүне кислота тулысынча нейтральләшкәнче (U-сыман көп¬
шәдәге эремә аша аммиак куыклары күтәрелә башлар) дәвам
итегез. Табылган тоз эремәсенең берникадәр өлешен фарфор
савытка бушатыгыз һәм аның суын, кристаллар хасил булганчы,
саклык белән генә парга әйләндерегез. Кристалларны эремәдән
фильтрлап аерып алыгыз. Юеш кристалларны фильтр кәгазьләре
арасына салып киптерегез.
99 нчы рәсем. Аммоний тозларын табу.
Сез тапкан матдәнең аммо¬
ний нитраты булуын экспери¬
менталь рәвештә исбатлагыз.
Анализ барышында сез ясаган
реакцияләрнең тигезләмәләрен
төзегез.
2 нче тәҗрибә. Аммоний
сульфатын табу. Аммоний суль¬
фатын табу реакциясенең ти¬
гезләмәсен төзегез. Прибордагы
колбага 30—35 мл аммиакның
судагы эремәсен салыгыз һәм
аны U-сыман көпшә белән то¬
таштырыгыз. Воронка аркылы
көпшәгә, аның бөгелгән өлеше
тулырлык итеп, сульфат кисло¬
тасы эремәсе салыгыз (99 нчы
рәсем). Эремәнең тамчылары
262
чәчрәмәсен өчен воронканы көпшәнең тармагында калдырыгыз,
U-сыман көпшәне карлы яки салкын сулы стаканга төшерегез.
Аммиак эремәсе салынган пробирканы саклык белән генә
җылытыгыз. Горелка ялкынын аммиак тыныч кына чыгарлык һәм
кислотада тулысынча йотылып бетәрлек итеп көйләгез. Аммиак
җибәрүне кислота тулысынча нейтральләшкәнче (U-сыман көп¬
шәдәге эремә аша аммиак куыклары чыга башлар) дәвам итегез.
Табылган эремәнең суын фарфор савытта, кристаллар хасил
булганчы, парга әйләндерегез. Эремәдән кристалларны фильтр¬
лап аерып алыгыз. Юеш кристалларны фильтр кәгазьләре арасы¬
на салып киптерегез.
Сез тапкан матдәнең аммоний сульфаты булуын эксперимен¬
таль рәвештә исбатлагыз. Анализ барышында сез үткәргән реак¬
цияләрнең тигезләмәләрен төзегез.
§ 86. ФОСФОР
1. Параграфны укырга керешкәнче «Химик элементны өйрәнү өчен белеш¬
мәлекнең 1—3 нче сорауларына җавап бирегез (40 нчы параграфны карагыз).
2. Аллотропия күренешенең асылы нидән гыйбарәт? Химик элементның алло¬
тропии үзгәрешле төрләренә мисаллар китерегез. 3. Нинди кристаллик чел¬
тәрләр: а) атомлы; б) молекуляр челтәрләр дип аталалар? Кристаллик челтәр¬
ләре шундый булган гади матдәләргә мисаллар китерегез.
Валентлык электроннары саны (3s2Зр3) буенча фосфор азот¬
ның аналогы булып тора:
Әмма азот белән чагыштырганда фосфорның атомнары зур¬
рак һәм аларның ионлашу энергияләре кимрәк. Шунлыктан фос¬
форда неметалл элементы билгеләре азот элементына караганда
азрак чагыла. Бу, аерым алганда, азотка караганда, фосфорга
4-5 оксидлашу дәрәҗәсе күбрәк, ә тискәре —3 оксидлашу дә¬
рәҗәсе кимрәк характерлы булуда күренә.
Азоттан аермалы буларак, фосфор берничә аллотропик
үзгәрешле төр: ак, кара һәм кызыл фосфор барлыкка китерә.
Бу нәрсә белән аңлатыла соң? Фосфор атомнарында, азот атом¬
нарындагы кебек үк, парлашмаган өч электрон бар. Димәк, фос¬
фор атомнары бер-берсе белән өч ковалент бәйләнеш ярдәмендә
берләшәләр.
Әгәр атомнар арасында бер а- һәм ике л- бәйләнеш хасил булса, ул вакытта
ике атомлы молекула P2 барлыкка килә (P=P).
263
IOO нче рәсем. Фосфорның аллотропик
үзгәрешле төрләрендә химик бәйлә¬
нешләрнең пространствода урнашула¬
ры (а); ак фосфор молекуласының
төзелеше (б); кара фосфорның крис¬
таллик челтәре структурасы (в).
Ләкин атомнарның башкача да
берләшүләре мөмкин: һәр атом башка
өч атом белән өч а- бәйләнеш хасил
итә (100 нче рәсем, а). Фосфор атом¬
нары үзара ничек берләшкәндә химик
бәйләнешләр ныграк булалар? о-бәй-
ләнешләр (80 нче рәсем) һәм л-бәйлә-
нешләр (81 нче рәсем) барлыкка кил¬
гәндә электрон болытларының аралашу
схемаларын хәтерегезгә төшерегез. Ча¬
гыштырмача зуррак булган фосфор
атомнарының электрон болытлары
л-бәйләнеш хасил иткәндә, о-бәйләнеш
барлыкка килгәндәгегә караганда, аз¬
рак аралашалар. Шунлыктан бер о- һәм
ике л- бәйләнеш урынына өч о-бәйлә-
неш хасил булу энергетик яктан отыш¬
лырак була. Гадәттәге шартларда Pz
молекуласы тотрыксыз.
Фосфор атомы хасил итә торган өч ковалент бәйләнеш про¬
странствода пирамида кабыргалары юнәлешендә урнаша
(100 нче рәсем, а). Шулай итеп, фосфор атомнары дүрт атомнан
торган молекулага P4 берләшәләр (100 нче рәсем, б). Мондый
молекулада P4 фосфорның һәр атомы өч ковалент бәйләнеш ха¬
сил итә һәм пирамида түбәләренең берсендә урнаша. Ак фос¬
форның кристаллик челтәре шундый молекулалардан төзелгән
була. Ак фосфорга молекуляр челтәр хас булганлыктан, ул —
җиңел эретелүчән, очучан матдә. Ак фосфор органик эреткечләр¬
дә эри, бик тә агулы.
Башка аллотропик модификацияләрендә, атап әйткәндә кара
һәм кызыл фосфорда, фосфор атомнары атомлы кристаллик чел¬
тәргә берләшәләр (100 нче рәсем, в). Тышкы күренеше белән ка¬
ра фосфор графитны хәтерләтә; кызыл фосфорның исеме аның
кызгылт көрән төстә булуына бәйле. Атомлы кристаллик челтәр¬
ле барлык матдәләр кебек үк, кара фосфор һәм кызыл фосфор
бернинди эреткечләрдә дә эремиләр; алар очучан түгел.
Кызыл һәм бигрәк тә кара фосфорның активлыклары ак фос¬
форныкына караганда түбәнрәк. Әйтик, һавада ак фосфор 50° C
та үзеннән-үзе кабынып китсә, кызыл фосфор исә, 250° C тан
югарырак температурада, ә кара фосфор 400° C тан да югарырак
температурада гына яна башлый. Химик активлыгы бик зур
булганлыктан, ак фосфорны су астында һәм мөмкин кадәр ка¬
раңгыда саклыйлар, чөнки яктыда ул кызыл фосфорга әверелә.
Ак фосфор гадәттәге шартларда ук әкренләп һава кислороды
264
белән оксидлаша. Бу вакытта оксидлашу фосфорның яктырышы
белән уза һәм аны караңгыда ачык күрергә мөмкин. Фосфорны
беренчеләрдән булып тикшергән галимнәрне, аның бу үзлеге га¬
җәпкә калдырган, шуңа күрә аны фосфор дип атаганнар да:
грекча фосфор «яктылык чәчүче» дигән мәгънәне аңлата.
Акрынлап оксидлашканда фосфорның яктырышы — химик
энергиянең турыдан-туры яктылык энергиясенә әверелүе белән
уза торган реакцияләргә мисалларның берсе. Мондый әверелеш¬
ләр башка химик һәм биохимик процесслар булып узганда да
күзәтелә (мәсәлән, диңгез «яктырганда»)
Фосфор уңай һәм тискәре оксидлашу дәрәҗәләре күрсәткән¬
лектән, аның гади матдәләренә кайтаручы үзлекләре дә, оксид¬
лаштыручы үзлекләре дә хас. Оксидлаштыручы буларак фосфор,
мәсәлән, металлар белән үзара тәэсир итешә. Бу вакытта фос¬
фидлар (нитридлар белән чагыштырыгыз), мәсәлән, магний фос¬
фиды MgaPa барлыкка килә. Фосфорга тискәре оксидлашу дәрә¬
җәсе бик үк характерлы түгел.
Электротискәрекләре зуррак булган неметаллар — галоген¬
нар, кислород, күкерт һ. б. белән үзара тәэсир итешкәндә фос¬
фор кайтаручы ролен уйный.
Фосфорны табигый кальций фосфатыннан, электр мичләрендә
күмер (кокс) һәм кремний (IV) оксиды катнашында җылытып,
табалар:
2Са3 (PO4) 2 + ЮС + 6SiO2 = P4 + 1OCO + OCaSiO3
Бу — бик тә эндотермик процесс (АЯ>0). Аның узу мөмкинлеген энтропия фак¬
торы билгели (AS>0, чөнки газсыман P4 һәм CO матдәләре барлыкка килә).
Димәк, бу реакция узу өчен IZASI > |ДЯ| булырлык итеп җылыту таләп ителә.
Тикшерелә торган реакциянең асылын түбәндәгечә аңлатып бирергә мөмкин.
Кальций фосфатының Саз (PO4) 2 составын ЗСаО-PaOj дип күрсәтергә була.
Җылытканда нигез оксиды CaO кислота оксиды SiOa белән үзара тәэсир итешә:
CaO-I-SiOa =CaSiOa
ә фосфор (V) оксиды PaOs күмер бе¬
лән кайтарыла:
2Р2О5 4 IOC = P4-I-IOCo
Фосфорны фосфат кислота¬
сы җитештергәндә кулланалар.
Фосфор янганда куе төтен ха¬
сил була, шуңа күрә фосфорны
төтен снарядлары һәм бомба¬
лары ясау өчен файдаланалар.
Кызыл фосфорны шырпы ясау¬
да кулланалар (101 нче рәсем).
Шырпы башының составында
янучан матдә (мәсәлән, сөрмә
сульфиды) һәм көчле оксид¬
лаштыручы (мәсәлән, бертолет
тозы) була. Шырпы башын
IOl нче рәсем. Фосфорны шырпы
ясауда куллану.
265
шырпы тартмасының ян кырындагы сызгычка ышкыганда,
сызгыч составындагы фосфор бертолет тозы белән оксидлашып,
кабынып китә, һәм сөрмә сульфиды яна башлый — шырпы кабына.
? 1. Фосфор элементының аллотропик үзгәрешле төрләр барлыкка китерә
алуын ничек аңлатырга мөмкин? Kapa һәм ак фосфорның структураларын
A тасвирлагыз.
2. Ни өчен ак фосфорның физик үзлекләре һәм химик активлыгы кара һәм
кызыл фосфорның үзлекләреннән нык аерылып тора? Кызыл фосфорны ак
фосфордан аеру нинди ысул белән җиңелрәк?
3. Фосфор парларының һавага карата тыгызлыгы 800° C та 4,27 г/см3 тәш¬
кил итә, ә 1500°С та ул ике тапкыр кими. Күрсәтелгән шартларда фосфор
молекулалары ничәшәр атомнан торалар?
4. Ни өчен гадәттәге шартларда азот атомнары ике атомлы молекулаларга
берләшәләр, ә фосфор атомнары дүрт атомлы молекулалар яки атомлы
кристаллар хасил итәләр? Ни өчен, азоттан аермалы буларак, фосфор таби¬
гатьтә ирекле хәлдә очрамый?
5. Ак, кызыл һәм кара фосфор бер үк элементның аллотропик төрләре
икәнен ничек дәлилләргә мөмкин?
6. Шырпы яндырганда булып уза торган реакцияләрнең тигезләмәләрен
төзегез. Кызыл фосфорны бертолет тозы КСЮз белән оксидлаштырганда
фосфор (V) оксиды Р2О5 һәм калий хлориды барлыкка килүен күздә тоты¬
гыз. Шырпы кабызганда ис чыгу нәрсә белән аңлатыла?
7. Фосфор белән: а) фтор; б) хлор; в) кислород; г) күкерт; д) магний;
е) алюминий арасындагы реакцияләрнең тигезләмәләрен төзегез. Хасил бу¬
ла торган матдәләрнең исемнәрен языгыз. Фосфор кайсы очракларда —
оксидлаштыручы, ә кайсы очракларда кайтаручы ролен уйный. Бу нәрсә
белән аңлатыла?
8. 75 кг кальций фосфатыннан күпме фосфор табарга мөмкин һәм бу вакыт¬
та күпме кокс (саф күмер дип исәпләнә) кирәк булыр?
§ 87. ФОСФОР (V) ОКСИДЫ. ФОСФАТЛАР
1. «Химик элементны өйрәнү өчен белешмәлекнең» сорауларына җавап би¬
регез (§ 40 ны карагыз). 2. Типик кислота оксиды буларак фосфор (V) окси¬
дының үзлекләрен чагылдыручы реакцияләрнең тигезләмәләрен төзегез. 3. Фос¬
фат кислотасының электролитик диссоциациясе тигезләмәләрен баскычлап төзе¬
гез һәм аның диссоциациясенең һәр баскычы өчен ионлашу константалары
кыйммәтләрен языгыз. Көчлелеге буенча фосфат кислотасы нинди кислоталарга
керә? 4. Фосфат кислотасының нинди тозлары суда эри (кушымтаны карагыз)?
Фосфор Ң-5 уңай оксидлашу дәрәҗәсен, электротискәрелек-
ләре үзенекенә караганда зуррак булган элементлар белән бул¬
ган кушылмаларында, мәсәлән, кислородлы кушылмаларда, күр¬
сәтә:
P2O5 H3PO4 Na3PO4 Ca3(PO4)2
фосфор (V) фосфат фосфатлар
оксиды кислотасы
Фосфорның кислородлы кушылмалары, азотның кислородлы
кушылмалары белән чагыштырганда, шактый тотрыклырак.
Белгәнегезчә, фосфор (V) оксиды фосфорны яндырганда ак
төтен рәвешендә хасил була һәм савытның эчке ягына ак поро-
266
шок хәлендә утыра. Фосфор (V) оксиды — гаять гигроскопик
матдә —ул һавадагы су парларын бик көчле йота. Бу вакытта ул
акрынлап җеби һәм аморф массага әверелә. Фосфор (V) окси¬
дын лабораториядә газларны киптерү өчен кулланалар.
Фосфор (V) оксидына фосфат кислотасы Н3РО4 туры килә.
Гадәттәге шартларда ул — суда яхшы эри торган, очмаучан каты
матдә.
Башка күп нигезле кислоталарныкы кебек үк, фосфат кисло¬
тасының электролитик диссоциациясе баскычлап уза:
H3PO4^H+ +H2PO4-
H2PO4-^H+ +HPOl-
нроГ ^h+ +POi-
Фосфат кислотасының диссоциация тигезләмәсе суммар рәвештә
болай языла:
н3ро4^зн+ +POi-
Кислотаның һәр баскычтагы ионлашу константалары кыйм¬
мәтләрен чагыштырыйк:
= Ch+ -CH2POr^752 10_3
cH3PO4
K2 = Сн' ~СнроГ =6,31-10-8
cH2PO4-
+с„,- 1(Г„
ChpoS-
Бу мәгълүматлардан күренгәнчә, фосфат кислотасының
НзРО4 эремәсендә башлыча дигидрофосфат-ионнар H2POr була.
Диссоциациянең икенче баскычында барлыкка килүче гидрофос-
фат-ионнар HPO4- шактый азрак. Ә ионлашуның өченче баскы¬
чы продуктлары — фосфат-ионнар PO4- юк дәрәҗәсендә дияр¬
лек.
Ионлашуның беренче баскычы буенча фосфат кислотасы —
уртача көчлелектәге кислота, чөнки ул SO(OH)n тибындагы
гидроксидларга керә (69 нчы параграфны карагыз).
Өч төрдәге кислота калдыгы туры килгәнлектән, фосфат
кислотасын селтеләр белән нейтральләштергәндә дигидрофосфат-
лар, гидрофосфатлар һәм шулай ук фосфатлар барлыкка килә,
мәсәлән:
H3PO4 + NaOH = NaH2PO4 + H2O
натрий
ди гидрофосфаты
H3PO4 +2NaOH = Na2HPO4+ 2Н2О
натрий
гидрофосфаты
267
H3PO4 + 3NaOH = Na3PO4 + 3H2O
натрий
фосфаты
Тозларның составларындагы аерымлыкларга аларның үзлек¬
ләрендәге үзенчәлекләр дә бәйле, мәсәлән, аларның суда эрү-
чәнлекләре төрле (102 нче рәсем). Әйтик, барлык металларның
да диярлек фосфатлары (селтеле металларның фосфатларын¬
нан тыш) суда эремиләр. Киресенчә, барлык металларның ди-
гидрофосфатлары суда яхшы эриләр. Гидрофосфатлар суда эрү-
чәнлекләре буенча дигидрофосфатлар белән фосфатлар арасында
торалар.
Фосфат кислотасын табигый фосфатларга көчле кислота, мә¬
сәлән сульфат кислотасы, белән тәэсир итеп табалар:
Ca3(PO4) 2 +3H2SO4 =2H3PO4 + 3CaSO4, \Н<0
Бу вакытта бөтенләй диярлек эремәүчән кальций сульфаты
хасил була. Аны кислотаның судагы эремәсеннән фильтрлап
аералар.
Шактый чистарак булган фосфат кислотасын фосфорны фос¬
фор (V) оксидына оксидлаштырып, ә аннары оксидны гидрат-
лаштырып табалар.
Барлык мөмкин булган оксидлашу дәрәҗәләреннән +5 фос¬
фор өчен аеруча тотрыклы. Шуңа күрә, нитратлардан аермалы
буларак, фосфатлар оксидлаштыру үзлекләрен күрсәтмиләр
һәм җылытканда да тотрыклы булып калалар. Шул ук сәбәп
буенча Җир кабыгында фосфор башлыча фосфатлар рәвешендә
була. Кальций фосфаты киң таралган минераллар — апатитлар
Ca3(PO4)3F составына керә (соңгысы — катнаш тоз — кальций
фосфаты-фторидыннан гыйбарәт). Безнең илебездә фосфор ку¬
102 нче рәсем. Натрий фосфатының,
ги.трофосфатының, дигидрофосфаты-
нын, суда эрүчәнлеге.
шылмаларының ятмалары күп
очрый, мәсәлән, Кола ярымут¬
равында апатитның зур ятма¬
лары билгеле; фосфоритларның
бай ятмалары Көньяк Казах¬
станда табылды (Каратау тау¬
лары) .
Фосфатларны куллануның
төп тармагы — фосфорлы аш¬
ламалар җитештерү. Аммоний
фосфатын тагын агач шырпы
ясаганда да кулланалар — ам¬
моний фосфаты сеңдерелгән
агач шырпы сүндергәннән соң
пыскымый.
Кайбер фосфатлар синтетик
юу средстволары, атап әйткән¬
дә «Новость», «Космос», «Эра»
һ. б. тибындагы кер юу поро¬
268
шоклары составына керәләр. Фосфатларны кулланып утка чыдам
капламнар, махсус пыялалар, керамик материаллар, фосфатлы
цементлар һ. б. табалар. Фосфатлы цементларның берсе — теш¬
ләргә пломба куйганда кулланыла торган цинклы-фосфатлы
цемент.
? 1. Калий, кальций дигидрофосфатларының, гидрофосфатларының һәм фос¬
фатларының формулаларын языгыз.
A 2. Түбәндәге кушылмаларның исемнәрен атагыз: FePCh, NH4H2PO4, NaaPOi
Fea(POi)Z, Mn(HzPO4)Z, AIPO4, (NH4)2HPO4. Бу тозларның кайсылары
суда эри?
3. Ни өчен кальций гидроксиды эремәсенә кирәгеннән артык алынган фос¬
фат кислотасы белән тәэсир иткәндә башта барлыкка килүче утырым эри?
4. Көчле кислота белән кальций фосфатына тәэсир иткәндә фосфат кисло¬
тасы барлыкка килү процессын тизләтү өчен нинди шартлар булдырырга
кирәк?
5. Түбәндәге әверелешләрнең тигезләмәләрен төзегез:
Ca3 (PO4) 2-*Р^Р2О5-*НзРО4—Са(H2PO4) 2
6. Аммиакны, углекислый газны, водород сульфидын фосфор (V) оксиды
өстеннән җибәреп киптерергә ярыймы? Җавапны дәлилләгез.
7. Баетканнан соң Хибин апатитында фосфор (V) оксидының масса өлеше
40% тәшкил итә. 490 г фосфат кислотасы табу өчен күпме апатит кирәк
булыр?
§ 88. ФОСФОРЛЫ АШЛАМАЛАР
1. Кальций дигидрофосфатының: а) кальций фосфаты һәм фосфат кислота¬
сы; б) кальций фосфаты һәм сульфат кислотасы үзара тәэсир иткәндә хасил
булу реакцияләренең тигезләмәләрен төзегез. Бу гетероген процессларны нинди
алымнар ярдәмендә тизләтергә мөмкин? 2. Кальций гидрофосфатының кальций
гидроксиды белән фосфат кислотасы тәэсир итешкәндә барлыкка килү реак¬
цияләренең тигезләмәләрен төзегез.
Фосфор Җирдә гаять киң таралган элементларга керә. Фос¬
фор кушылмалары — хайван һәм үсемлек организмнарының
мәҗбүри була торган состав өлеше. Әйтик, кальцийның фосфат¬
лары сөяк һәм теш составына керәләр һәм аларга катылык үзле¬
ге бирәләр. Фосфор кушылмалары кайбер аксым матдәләре сос¬
тавында да булалар (нерв һәм мускул тукымалары). Кеше орга¬
низмында фосфорның масса өлеше 1% чамасы тәшкил итә.
Фосфор кушылмалары, азот кушылмалары кебек үк, таби¬
гатьтә һәрвакыт үзгәрүгә дучар булалар — табигатьтә фосфор
әйләнеше булып тора. Үсемлекләр туфрактагы фосфатларны үз¬
ләштерәләр һәм аларны катлаулы фосфорлы органик матдәләргә
әверелдерәләр. Үсемлек азык белән бу матдәләр хайваннар ор¬
ганизмына керәләр — нерв һәм мускул тукымаларының аксым
матдәләре, сөякләрдә кальцийның фосфатлары һ. б. хасил була.
Хайван һәм үсемлек калдыкларындагы фосфорлы кушылмалар
микроорганизмнарның тереклек эшчәнлеге нәтиҗәсендә таркала¬
лар һәм ахыр чиктә фосфатлар барлыкка килә. Шулай итеп,
P(тере организмнардагы) Ч--Р (туфрактагы) СХСМЗСЫ бСЛӘН КүрСӘТСЛӘ ТОрГӘН
269
әйләнеш төгәлләнә. Авыл хуҗалыгы культуралары уңышын җый¬
ганда фосфор кушылмалары бу әйләнештән чыгарыла — бу әйлә¬
неш бозыла. Туфракта җитешмәгән фосфор табигый юл белән
сизелерлек тулыландырылмый. Шуңа күрә туфракка фосфорлы
ашламалар кертергә кирәк була.
Фосфорлы ашламаларны промышленностьта ничек табалар?
Табигый фосфатлар — фосфоритлар һәм апатитлар суда эреми¬
ләр, ә туфрак эремәләрендә аз эриләр һәм үсемлекләр аларны
начар үзләштерәләр. Табигый фосфатларны суда эрүчән кушыл¬
маларга эшкәртү — химия промышленностеның бурычы. Ашла¬
мада туклыклы элементның — фосфорның күпме булуын фос¬
фор (V) оксидына Р2О5 күчереп бәялиләр.
Фосфорлы ашламаларның төп состав өлеше — кальций дигид-
рофосфаты яки кальций гидрофосфаты. Аеруча киң таралган
фосфорлы ашламалар:
гади суперфосфат Ca(H2PO4)ZH-CaSO4 (15—20% Р2О5)
икеле суперфосфат Ca(H2PO4) 2 (42—49% Р2О5)
преципитат CaHPO4 (46—48% Р2О5)
Фосфорлы ашламаларның туклыклылык кыйммәтен фос¬
фор (V) оксидына күчереп бәялиләр.
Гади суперфосфатны апатитка яки фосфоритка сульфат кис¬
лотасы белән тәэсир итеп табалар. Бу процессны мондый тигез¬
ләмә белән күрсәтергә мөмкин:
Саз (PO4) 2 + 2 H2 SO4 =Ca(H2PO4) 2 2CaSO4
суперфосфат
Гади суперфосфат — кальций дигидрофосфатының һәм каль¬
ций сульфатының катнашмасы ул. Гади суперфосфатта кальций
сульфаты да булганлыктан, бу ашламада туклыклы P2Os матдә¬
сенең масса өлеше күп түгел (15—20%). Кирәксез матдә —
кальций сульфаты булу ашламаны күчереп йөрткәндә артык чы¬
гымнарга китерә. Моннан тыш, кальций сульфаты туфракның
структурасын начарландыра (ул туфракның «артык гипслануы-
на» сәбәпче була). Хәзерге вакытта гади суперфосфат җитеште¬
рү үсеш алмый.
Фосфорлы ашламалардан иң югары концентрациялесен —
икеле суперфосфатны Ca(H2PO4)2 табигый фосфатларга фосфат
кислотасы белән тәэсир итеп табалар. Бу процессның асылын
Ca3(PO4) 2-HH3PO4 = SCa(H2PO4) 2
тигезләмәсе белән чагылдырырга була.
Бу — гетероген процесс, шунлыктан продуктның чыгышы
каты матдәнең һәм сыеклыкның орыну өслегенең зурлыгына,
кислотаның концентрациясенә, матдәләрнең ни дәрәҗәдә ара¬
лашуына бәйле.
270
Иң арзанлы фосфорлы ашлама булып фосфорит оны — бик
нык вакланган фосфорит тора. Әмма, кальций фосфаты суда
эремәгәнлектән, фосфорит онын фәкать органик кислоталарга
бай булган туфракларга гына кертергә ярый. Мондый әче туф¬
ракларда кальций фосфаты Caa(PCh)2 акрынлап эрүчән әче
тозга әверелә.
Фосфорит онын һәм преципитатны Казан шәһәрендәге «По-
лимерфото» химия заводында җитештерәләр (желатин производ¬
ствосы калдыклары кулланыла).
Минераль ашламаларны гади һәм комплекслы ашламаларга
аерып йөртәләр. Бер генә туклыклы элементы булган ашлама¬
ларны гади ашламаларга кертәләр. Комплекслы ашламаларда
берничә туклыклы элемент була, мәсәлән:
аммофос NH4H2PO4 (44% P2O5, 11%N)
диаммофос (NH4)2HPO4 (49% P2O5, 19% N)
Аммофос һәм диаммофос катнашмасын аммиак белән фосфат
кислотасын нейтральләштереп табалар. Нитрофоскада өч тук¬
лыклы элемент бар. Бу ашлама аммоний гидрофосфаты, аммо¬
ний нитраты һәм калий сульфаты (яки хлориды) катнашмасын¬
нан гыйбарәт.
Иң югары концентрацияле фосфорлы ашламаларны фос¬
фор (V) оксидының фосфат кислотасындагы эремәсе булган су¬
перфосфат кислотасы нигезендә җитештерәләр.
? 1. Икеле суперфосфат гади суперфосфаттан нәрсә белән аерылып тора? Бу
ашламаларның кайсысын җитештерү икътисади яктан отышлырак һәм моны
▲ ничек аңлатырга була?
2. Преципитат — гигроскопик булмаган ак төстәге порошок, аны кальций
гидроксиды белән фосфат кислотасын нейтральләштереп табалар. Реакция
тигезләмәсен төзегез.
3. Составында: а) азот һәм фосфор; б) азот һәм калий; в) фосфор һәм
калий; г) азот, фосфор һәм калий булган минераль ашламаларга мисаллар
китерегез.
4. Ни өчен, гади ашламаларга караганда, комплекслы ашламаларны кул¬
лану перспективалырак?
5. Составында 59,7% масса өлеше PsOs булган продукт табу өчен аммоний
дигидрофосфатын һәм аммоний гидрофосфатын нинди масса чагыштырмала¬
рында катнаштырырга кирәк? Бу продуктта азотның масса өлеше (%)
күпме булыр?
6. Фосфоритларда гадәттә кальций фториды, кальций карбонаты, тимер
(III) оксиды, алюминий оксиды катышмалары була. Фосфоритларга суль¬
фат кислотасы белән тәэсир иткәндә нинди реакцияләрнең узуы мөмкин?
7. Составында 62% масса өлеше Cas(PO4) 2 булган фосфоритка фосфат
кислотасы тәэсир иткәндә 1822 кг суперфосфат табылган. Продуктның чы¬
гышын теоретик чыгышка карата процентларда исәпләп табыгыз.
8. 230 т аммоний дигидрофосфаты (аммофос) табу өчен кирәкле аммиак¬
ның күләмен (н. ш.) һәм составында 38% масса өлеше HsPO4 булган
фосфат кислотасы эремәсенең массасын билгеләгез.
9. Мамык үсемлеге басуларына ашламаларны түбәндәге нормада кертәләр:
1 гектарга 75 кг PsOs, IOO—IlO кг N. Бу нормаларга туры килүче икеле
суперфосфатның һәм аммоний селитрасының массаларын исәпләп табыгыз.
271
23 нче лаборатор дәрес
ФОСФОР КУШЫЛМАЛАРЫ. МИНЕРАЛЬ АШЛАМАЛАР
1 нче тәҗрибә. Кальций фосфатларының эрүчәнлекләрен ча¬
гыштыру.
а) Өч пробиркага кальций фосфаты, кальций гидрофосфаты
һәм кальций дигидрофосфаты порошокларын салыгыз. Пробир¬
каларга су өстәгез һәм пыяла таякчык ярдәмендә болгатыгыз.
Күзәтүләрегезне аңлатып бирегез.
б) Кальций гидроксиды эремәсенә болгаткан хәлдә тамчылап
фосфат кислотасы эремәсе өстәгез. Утырым хасил булудан эре¬
мәнең болганчыклануын, ә аннары утырымның эрүен аңлатып
бирегез. Реакцияләрнең тигезләмәләрен төзегез.
2 нче тәҗрибә. Натрий фосфатының гидролизы. Натрий фос¬
фаты эремәсенең тирәлеге нинди — әчеме, селтелеме яки нейт¬
ральме булуын эксперименталь юл белән тикшереп ачыклагыз.
3 нче тәҗрибә. Минераль ашламалар белән танышу. Сезгә
бирелгән ашламаларның тышкы күренешләрен тасвирлагыз.
Аларның суда эрүчәнлекләрен чагыштырыгыз. Моның өчен һәр
ашламаны бал кашыгының 1 /4 күләмендә пробиркаларга салы¬
гыз һәм 5 әр мл су өстәп болгатыгыз.
Күзәтүләрнең нәтиҗәләрен 16 нчы таблица үрнәгендәге таб¬
лицага язып куегыз.
16 нчы таблица. Кайбер ашламаларга характеристика
Ашламаның
исеме
Химик
формуласы
Тышкы
күренеше
Гадәттәге температурада
суда эрүчәнлеге
4 нче тәҗрибә. Ашламаларга химик анализ ясау. Характерлы
реакцияләргә нигезләнеп, кайсы пробиркада нинди ашлама бу¬
луын билгеләгез: а) аммоний хлориды; б) аммоний селитрасы;
в) суперфосфат.
ХИМИК ЭЛЕМЕНТЛАРНЫҢ Д. И. МЕНДЕЛЕЕВ
ПЕРИОДИК СИСТЕМАСЫНЫҢ
IV ТӨРКЕМ р-ЭЛЕМЕНТЛАРЫ
(УГЛЕРОД ТӨРКЕМЧӘСЕ)
§ 89. УГЛЕРОД ТӨРКЕМЧӘСЕНӘ
ГОМУМИ ХАРАКТЕРИСТИКА
«Элементлар төркемчәсен өйрәнү өчен белешмәлекхнең сорауларыннан фай¬
даланып (72 нче параграфны карагыз), углерод төркемчәсенә характеристика
бирегез.
Химик элементларның Д. И. Менделеев периодик системасы¬
на күз салыйк. IV төркемнең р-элементларына углерод С, крем¬
ний Si, германий Ge, аккургаш Sn һәм кургаш Pb керә. Бу
элементлар углерод төркемчәсен тәшкил итәләр. Аларның атом¬
нарында тышкы катлау дүрт электроннан тора:
C Si Ge Sn Pb
2s22p2 3s23p2 4s24p2 5s25p2 6s26p2
Шуңа күрә углерод төркемчәсе элементларының ниндидер
охшашлыклары булырга тиеш. Аерым алганда, аларның югары
оксидлашу дәрәҗәләре бертөрле һәм Ң-4 кә тигез. Димәк, алар¬
ның ике элементлы югары оксидлашу дәрәҗәсендәге кушылмала¬
рының составлары охшаш, мәсәлән оксидлары: СО2, SiOa, GeOa,
SnOa, PbOa; фторидлары: CF4, SiF4, GeF41 SnF41 PbF4 һ. б.
Ә төркемчә элементларының үзлекләрендәге аерымлыклар
нәрсә белән аңлатыла?
17 нче таблица. IV төркем р-элементларының төп константалары
Химик
элемент
Элементның характеристикасы
Тәртип
номеры
Валентлык
электроннары
Чагыштырма
атом
массасы
Атом
радиусы,
HM
Атомның
ионлашу
энергиясе,
кДж/моль
C
6
2s22p2
12,01
0,062
1086,4
Si
14
3s23p2
28,09
0,107
786,5
Ge
32
4s24p2
72,59
0,109
762,2
Sn
50
5s25p2
118,69
0,124
708,6
Pb
82
6s26p2
207,2
0,122
715,6'
1 Аккургаш атомыныкына караганда кургаш атомының ионлашу энергиясе
зуррак, атом радиусы кечерәк. Моның сәбәбен аңлату урта мәктәп химия кур¬
сында күздә тотылмый.
18 П-236
273
Моның сәбәбе атомнарның радиуслары һәм аларның ионлашу
энергияләре төрле булуда (17 нче таблица).
C—Si—Ge—Sn—Pb төркемчәсендә неметалл элементы үзлек¬
ләре бик кискен рәвештә кими, ә металл үзлекләре көчәя. Бу
иң элек углеродның неметалл гади матдәсе (алмаз), ә кургаш¬
ның типик металл гади матдәсе хасил итүендә чагыла. Атомның
электрон тышчасы төзелеше буенча IV төркемнең р-элементла-
рына җөп оксидлашу дәрәҗәләре: 4~ 4, 4~2, —4 хас.
El
+ + -
■н
пз
Неметалл элементы билгеләренең кимүе төркемчәдә (С—Si—
—Ge—Sn—Pb) +4 уңай оксидлашу дәрәҗәсенең азрак, ә 4~2
оксидлашу дәрәҗәсенең күбрәк характерлы була баруын аңлата.
Әйтик, углерод үзенең аеруча тотрыклы кушылмаларында 4-4
оксидлашу дәрәҗәсен күрсәтә, ә кургашның, бигрәк тә тотрыклы
кушылмалары, +2 оксидлашу дәрәҗәсенә туры килә.
Ә менә элементларның —4 тискәре оксидлашу дәрәҗәсендәге
кушылмаларының тотрыклылыгы турында нәрсә әйтергә мөмкин?
VII—V төркемнәрдәге неметалл элементлары белән чагыштыр¬
ганда, IV төркемнең р-элементларында неметалл үзлекләре
азрак чагыла. Шунлыктан углерод төркемчәсендәге элементлар
өчен тискәре оксидлашу дәрәҗәсе типик булып тормый.
? 1. Элементларга хас булган оксидлашу дәрәҗәләрен күздә тотып, углерод¬
ның һәм кургашның тотрыклы: а) оксидлары; б) хлоридлары формулала-
•“ рын языгыз.
2. а) Углеродның; б) кремнийның; в) германийның -(-4 оксидлашу дәрә¬
җәсендәге кислоталары формулаларын языгыз. Бу элементларның коорди¬
национ саннарын игътибарга алыгыз (13 нче таблицаны карагыз).
3. а) Углеродның; б) кремнийның водородлы кушылмалары формулаларын
төзегез. Бу кушылмаларда водородның оксидлашу дәрәҗәсе нинди — уңай¬
мы яисә тискәреме? Бу кушылмаларның кайсысы һәм ни өчен термик як¬
тан тотрыксызрак?
4. Куертылган нитрат кислотасының: а) германий белән; б) кургаш белән
реакцияләре тигезләмәләрен языгыз. Бу реакциядә германийның неметалл
үзлекләре, ә кургашның металл үзлекләре күрсәтүенә игътибар итегез;
германийның характерлы оксидлашу дәрәҗәсе +4, ә кургашның характер¬
лы оксидлашу дәрәҗәсе 4-2 була.
5. РЬОг — оксидлаштыручы, ә HCl — кайтаручы икәнен күздә тотып, кур¬
гаш (IV) оксидының хлорид кислотасы белән реакциясе тигезләмәсен тө¬
зегез.
6. 207,2 г кургаш сыегайтылган нитрат кислотасы белән үзара тәэсир
итешкәндә хасил булучы азот (II) оксидының күләме (н. ш.) күпме булыр?
7. Германийны Винклер ысулы буенча табу реакциясенең тигезләмәсен
төзегез (5 нче таблицаны карагыз). 7,3 кг германий табу өчен башлангыч
матдәләрне күпмешәр алырга кирәк?
274
§ 90. УГЛЕРОД. ГАДИ МАТДӘЛӘР
«Химик элементны өйрәнү өчен белешмәлекхнең 1—3 нче сорауларына җа¬
вап бирегез (40 нчы параграфны карагыз).
Углерод — неметалл элемент. Әмма 2 нче периодның без тик¬
шереп узган элементларына — фторга, кислородка, азотка —
караганда углерод неметалл үзлекләрен азрак күрсәтә. Бу нәр¬
сәдә чагыла соң? Иң элек углерод химик элементы хасил иткән
гади матдәләрнең үзлекләрендә күренә.
Табигатьтә углеродның өч аллотропик үзгәрешле төре очрый:
алмаз, графит һәм карбин.
Углеродның бу модификацияләрне хасил итүен ничек аңлатырга? Углерод
атомында дүрт валентлык электроны бар:
Углерод атомнары
өч яки ике а-бәйләнеш
бер-берсе белән берләшкәндә аларның һәркайсы дүрт,
барлыкка китерә ала:
! V -с-
xV/
Шулай итеп, гади матдәләрдә углеродның координацион саны 4 кә, 3 кә һәм
2 гә тигез булуы мөмкин. Алмаз, графит һәм карбин углерод атомнарының шул
халәтләренә туры киләләр дә инде.
Алмаз — атомлы челтәрдән торган кристаллик матдә
(103 нче рәсем). Алмаз кристалында һәр атом үз тирәсендәге
дүрт атом белән нык ковалент бәйләнешләр ярдәмендә тоташкан.
Алмазның аеруча каты булуы шуннан килә. Алмазны бик каты
материалларны эшкәрткәндә, пыяла кискәндә, бораулау эшлә¬
рендә, нечкә металл чыбыклар эшләп чыгаруда һ. б. очракларда
кулланалар. Промышленностьта алмазлы эшкәртү инструментын
кулланганда җитештерүчәнлек 2—5 тапкыр арта.
Алмаз практик яктан электр тогын үткәрми, җылылыкны на¬
чар үткәрә. Үтә күренмәле алмаз үрнәкләре яктылык нурларын
бик нык сындыралар һәм кырлап шомартканнан соң матур ял¬
тырыйлар, андый алмазлардан бизәнү әйберләре (бриллиантлар)
ясыйлар.
Графит үтә күренмәле түгел, соры төстә, металлга хас
ялтыравыклы. Графитның кристаллик челтәрендә (104 нче рә¬
сем) углерод атомнары алты буынлы боҗралардан торучы кат-
18:
275
103 нче рәсем. Алмазның кристаллик
челтәре. Алмазны куллану: борау очы,
пыяла кискеч, бизәнү әйберләре (брил¬
лиантлар) .
104 нче рәсем. Графитның кристаллик
челтәре. Графитны куллану: электрод,
майлау материалы, карандаш, втулка.
лаулар булып урнашканнар. Аларда һәр углерод атомы янәшәдә-
ге өч атом белән нык ковалент бәйләнешләр ярдәмендә тоташ¬
кан. һәр катламның дүртенче валентлык электроннары исәбенә
металлик бәйләнеш барлыкка килә. Графитның металлга хас ял¬
тыравыгы һәм шактый яхшы электр һәм җылылык үткәрүчәнлек-
ләре шуның белән аңлатыла да инде. Графиттан электрохимия
һәм металлургия процесслары өчен электродлар ясыйлар.
Графиттагы катламнар арасында зур булмаган молекулаара
көчләр тәэсир итешәләр. Шуңа күрә графит кабырчыклардан
торган катлауларга ансат куба. Хәтта басмыйча гына ышкыган¬
да да графит кәгазьдә соры эз калдыра (латинча «графит» «яза
торган» дигәнне аңлата). Графитны карандаш грифельләре яса¬
ганда, техникада майлау материалы итеп кулланалар.
Графит авыр эретелүчән, химик яктан бик тотрыклы. Графит
белән балчык катнашмасыннан металлургиядә металлар коеп чы¬
гару өчен утка чыдам тигельләр ясыйлар. Графитны химия про¬
мышленностенда файдаланыла торган җылылык алмаштыргыч
трубалар ясау өчен материал буларак кулланалар. Төш реактор¬
ларында аны нейтроннарны акрынайткыч сыйфатында куллана¬
лар.
276
Карбин чагыштырмача күптән түгел билгеле булды. Аны
безнең илебез галимнәре табуга ирештеләр, ә соңрак аның таби¬
гатьтә дә очравы беленде. Ул — кара порошоктан гыйбарәт.
Кристаллик челтәре углеродның сызыкча чылбырларыннан тө¬
зелгән. Электр үткәрүчәнлеге буенча карбин алмаз (диэлектрик)
белән графит (үткәргеч) арасында тора: карбин — ярымүткәргеч.
Углеродның аллотропик модификацияләре бер-берсенә әвере¬
лә алалар. Графитны алмазга әверелдерү өчен бик югары басым
(I-IO11 Па чамасы) һәм югары температура (1500—3000° C)
таләп ителә. Хәзерге вакытта графиттан ясалма алмаз табу
производство күләмнәрендә дә башкарыла.
Табигатьтә алмаз зур булмаган чыганаклар рәвешендә Африкада, Якутия¬
дә очрый. Күрәсең, Җир кабыгында углерод зур тирәнлекләрдә (200—300 км)
2-10" Па чамасы басым астында һәм 3000° C чамасы температура шартларында
алмаз хасил итеп кристаллашкандыр.
Пробиркада агач йомычкасын һава кертмичә җылытканда
агач акрынлап кара төскә керә — күмер барлыкка килә һәм очу-
чан газлар аерылып чыга, һава кертмичә ташкүмерне җылыт¬
канда кокс хасил була. Кокс һәм агач күмере — шул ук графит,
ләкин ул эретелеп укмашкан бик вак кристаллардай тора.
Коксны металлургиядә кайтаручы сыйфатында кулланалар.
Бик вак кристаллардай торган графитның тагын бер төре —
корымның да практик әһәмияте зур. Корым күп кенә орга¬
ник матдәләр тулысынча янып бетмәгәндә барлыкка килә. Ко¬
рымны тушь һәм кара буяу (типографиядә, буяу эшләрендә һ. б.
кулланыла) ясау өчен файдаланалар. Җитештерелә торган ко¬
рымның төп өлеше резина тапканда кулланыла. Резина соста¬
вында корым аның ныклыгын арттыра.һәм озаграк файдаланыр¬
га мөмкинлек бирә (мәсәлән, автомобиль покрышкалары).
Үзагачны корылай куганда
төзелеше күзәнәкле булган агач
күмере барлыкка килә (105 нче
рәсем). Мондый төзелешле кү¬
мер төрле газларны һәм эрегән
матдәләрне яхшы йота. Күмер
порошогын һәм лакмус эремә¬
сен катнаштырыйк һәм селкеп
болгатыйк. Эремәнең төсе бе¬
тәр. Газларның һәм эрегән мат¬
дәләрнең каты матдә өслеге та¬
рафыннан йотылуы адсорбция
дип атала. Вак һәм күп күзәнәк¬
ле матдәләрнең адсорбция ак¬
тивлыгы катнашмалардан
кыйммәтле продуктларны ае¬
рып алганда, матдәләрне ка¬
тышмалардан арындырганда
105 нче рәсем. Вак һәм күп күзәнәкле
агач күмере.
277
киң кулланыла. Мәсәлән, спирт һәм шикәр эшләп чыгарганда
аларны төрле катышмалардан арындыру өчен активлаштырылган
күмердән файдаланалар. Медицинада активлаштырылган күмер
таблеткалар рәвешендә («карболен») эрегән зарарлы матдәләрне
ашкайнату системасыннан чыгару өчен кулланыла.
Активлаштырылган күмер сулый торган һаваны зарарлы
катышмалардан чистарту өчен фильтрлаучы противогазларда
файдаланыла.
Углерод шулай ук аморф формада да була. Аморф углерод¬
ның типик мисалы булып стеклоуглерод тора. Ул алмазның, гра¬
фитның һәм карбинның үзара тәртипсез рәвештә бәйләнгән
структур өлешләреннән гыйбарәт. Стеклоуглерод углеродлы мат¬
дәләрне термик таркатканда барлыкка килә. Бу материалга уни¬
каль үзлекләр хас — ул авыр эретелүчән, тыгызлыгы зур түгел,
агрессив матдәләр тәэсиренә чыдам, механик ныклыкка һәм
электр үткәрүчәнлеккә йя. Боларның барысы бергә аның техни¬
кадагы әһәмиятен билгели. Стеклоуглеродны агрессив тирәлек¬
ләрдә эшләтелә торган аппаратураларны ясау өчен кулланалар.
Аны космонавтикада һәм авиациядә файдаланалар.
Химик үзлекләре буенча углерод неметалларга керә. Аның
аллотропии үзгәрешле төрләре үзләренең химик активлыкларын
бары тик югары температураларда гына күрсәтәләр. Оксидлаш¬
тыручы буларак, углерод кайбер металлар белән үзара тәэсир
итешә. Нәтиҗәдә карбидлар барлыкка килә, мәсәлән:
0 0+2-4
2Ве + С = ВегС
бериллий
карбиды
Углеродка күбрәк кайтаручы үзлекләре хас. Әйтик, углерод¬
ны кабыну температурасына кадәр җылытканда, ул яна:
С + О2 = СОг, A//=—394 кДж
Ул янганда күп микъдарда җылылык аерылып чыга. Бу исә
барлыкка килә торган СОг молекуласындагы бәйләнешләрнең
бик нык булуларын раслый.
Югары температурада углерод күп кенә оксидларны кайтара.
Углеродны кокс рәвешендә металлургиядә металларны оксидла¬
рыннан кайтару өчен куллану шуңа нигезләнгән дә инде.
1. Алмазның һәм графитның физик үзлекләрендәге кискен аерма нәрсә
белән аңлатыла? Җавапны дәлилләү өчен бу модификацияләрнең каты-
лыгын, җылылык һәм электр тогын үткәрүчәнлекләрен, аларны куллану
өлкәләрен чагыштырыгыз.
2. Ни өчен һавада күмер гадәттәге температурада тотрыклы, ләкин җылыт¬
канда яна? 1 т күмер янганда күпме җылылык аерылып чыгар?
3. Углеродның: а) күкерт; б) бром; в) алюминий белән булган кушылма¬
ларының формулаларын төзегез һәм аларның исемнәрен атагыз. Кушылма¬
ларның кайсыларында углеродның оксидлашу дәрәҗәсе уңай, ә кайсы ку¬
шылмаларда аның оксидлашу дәрәҗәсе тискәре?
278
4. Металларны углерод белән: а) кургаш (IV) оксидыннан; б) бакыр (II)
оксидыннан кайтару реакцияләренең тигезләмәләрен төзегез. Ни өчен бу
реакцияләрне тормышка ашыру мөмкин?
5. Әгәр 1:1 күләм чагыштырмаларындагы углерод (II) оксидының һәм угле¬
род (IV) оксидының катнашмасы барлыкка килсә, составында 4% янмаучан
катышмалары булган 1 т коксны яндыру өчен нинди күләмдә (н. ш.)
һава тотылыр?
§ 91. УГЛЕРОД (IV) ОКСИДЫ. КАРБОНАТЛАР
1. «Химик элементны өйрәнү өчен белешмәлекхнең 3 нче соравына җавап
бирегез (40 нчы параграфны карагыз). 2. Типик кислота оксиды буларак угле¬
род (IV) оксидына хас реакцияләргә мисаллар китерегез. 3. Көче буенча кар¬
бонат кислотасы нинди кислоталарга керә? Җавапны дәлилләү өчен карбонат
кислотасының ионлашу константалары кыйммәтләрен китерегез (кушымтаны ка¬
рагыз) . 4. Карбонат кислотасының нинди тозлары суда эри (кушымтаны карагыз) ?
Углеродның +4 югары оксидлашу дәрәҗәсенә туры килүче
оксид, кислота һәм тозлар:
CO2
углерод (IV)
оксиды
H2CO3
карбонат
кислотасы
Na2CO3, CaCO3
карбонатлар
Каты хәлдәге углерод (IV) оксидына молекуляр кристаллик
челтәр хас (5 нче рәсем, а). Белгәнегезчә, гадәттәге шартларда
CO2 — газ, һавадан авыррак, суда чагыштырмача аз эри. Аны
бер савыттан икенчесенә «бушатырга» мөмкин (106 нчы рәсем).
Углерод (IV) оксиды — типик кислота оксиды, нигез оксид¬
лары белән үзара тәэсир итешә, мәсәлән:
CaOH-CO2 =CaCO3
Бу реакция барышында сүндерелмәгән известь үзлекләрен
«югалтып» карбонатка әверелә.
Шуңа күрә сүндерелмәгән из-
вестьне ачык һавада, мәсәлән
төзелештә, сакларга ярамый.
Бактерияләр һәм күгәрек
гөмбәләре углерод (IV) оксиды
атмосферасында яши алмый¬
лар, шунлыктан продуктларны
шул газ атмосферасында сак¬
лыйлар. Аны шулай ук сода
җитештерү өчен дә кулланалар.
Карбонат кислотасы H2CO3
тотрыксыз һәм бары тик эремә
хәлендә генә була. Ул баскыч¬
лап диссоциацияләшкәнлектән,
гидрокарбонат-ионнар:
106 нчы рәсем. Углерод (IV) оксидын
бушату һәм ялкынның сүнүе.
H2CO3^H+ +HCO3-,
K1 = 1,32-10-4
279
һәм карбонат-ионнар хасил итә:
HCO3-^H+ +COi-,
A2 ==4,84-IO-11
Карбонат кислотасы уртача кәйлелектәге кислоталарга керә
(OO(OH)n тибындагы кислота). Моны ионлашу константалары¬
ның кыйммәтләренә карап та белергә була.
Углерод (IV) оксидының су белән реакциясен
CO2+ H2O5-H2CO3; H2CO35-H+ + HCO3-;
HCO3-^H ++ coi-
тигезләмәләре ярдәмендә күрсәтергә мөмкин.
Боларның барысы да — кайтма процесслар. Аңлашыла ки,
углерод (IV) оксидының суда эрүенә селтеле тирәлек булышлык
итә (H+ ионнары OH- ионнары белән нейтральләшәләр). Кире¬
сенчә, кислота өстәгәндә H+ ионнарының;концентрациясе арта
һәм тигезләнеш H2CO3 барлыкка килү ягына авыша. Карбонат
кислотасы тотрыксыз һәм CO2 аерылып чыгу белән таркала:
H2CO3 = H2O + CO21
Аерым алганда, Кипп аппаратында кальций карбонатына (мәр¬
мәргә) хлорид кислотасы белән тәэсир итеп, углерод (IV) окси¬
ды табу да шул күренешкә нигезләнгән:
X CO2I
CaCO3 + 2НС1 = CaCl2 + H2CO3'
^4H2O
Көчле кислота белән карбонат кислотасының теләсә кайсы то¬
зына тәэсир иткәндә дә шуңа охшаш процесс күзәтелә.
Карбонат кислотасы тозларның ике рәтен: урта тозлар —
карбонатлар һәм әче тозлар — гидрокарбонатлар барлыкка ките¬
рә. Гидрокарбонатлар суда яхшы эриләр, урта тозлардан суда
селтеле металларның карбонатлары һәм аммоний карбонаты ях¬
шы эри. Гидролиз булу сәбәпле, селтеле металларның карбонат¬
ларының эремәләре көчле селтеле реакция күрсәтә:
COi- +HOH HCO3-+он-
Карбонат кислотасы тозларыннан сода: Na2CO3-IOH2O
(кристаллик сода), Na2CO3 (кальцинирланган сода) һәм
NaHCO3 (чәй содасы) рәвешендә бигрәк тә киң кулланыла.
Техникада тагын CaCO3 (известьташ, мәрмәр, акбур), K2CO3
(поташ) күп кулланыла.
2 1. «Коры боз»ны (прессланган каты CO2) нинди максатларда кулланалар?
Гадәти бозга караганда «коры бозхның өстенлеге нидән гыйбарәт?
280
2. 107 нче рәсемнән файдаланып,
газларның суда эрүчәнлеге нинди
факторларга бәйле булуын аңлатып
бирегез.
3. Ни өчен углерод (IV) оксиды¬
ның судагы эремәсеннән әче тәм
килә? HaO — COa системасындагы
тигезләнеш процессларын тасвирла¬
гыз.
4. Түбәндәге сорауларга карбонат
кислотасының нинди үзлегенә нигез¬
ләнеп җавап бирерсез: а) Бирел¬
гән матдә карбонат кислотасының
тозы икәнен ничек исбатларга мөм¬
кин? б) Чәй содасын медицинада
ашказаны сыекчысындагы кислота¬
107. нче рәсем. Углерод (IV) оксиды
ның суда эрүчәнлегенә басымның һәм
температураның йогынтысы.
куллану яхшырак?
ның микъдарын киметү өчен кулла¬
ну нинди үзлеккә нигезләнгән? в) Ни
өчен тарттырылган хәлдә известь-
ташны туфракның әчелеген киметү
өчен кулланалар (туфракны из-
вестьләү)?
5. Кипп аппаратында углерод (IV)
оксиды тапканда ни өчен сульфат
кислотасы түгел, ә хлорид кислотасы
6. Углекислый газны янгын сүндергәндә куллану нәрсәгә нигезләнгән?
7. 22,4 л углерод (IV) оксидын нормаль шартларда (н. ш.) табу өчен,
составында 80% масса өлеше кальций карбонаты булган, известьташны
күпме һәм хлорид кислотасын (р= 1,183 г/см3, HCl ның масса өлеше —
36%) нинди күләмдә алырга кирәк?
8. Составында 10% масса өлеше H3SO4 булган 65 г сульфат кислотасы
эремәсе һәм 18 г калий гидрокарбонаты үзара тәэсир итешкәндә ничә
литр (н. ш.) углерод (IV) оксиды барлыкка килә?
9. Менделеевск шәһәрендәге Л. Я. Карпов исемендәге химия заводында,
натрий карбонаты эремәсенә күкерт (IV) оксиды белән тәэсир итеп, нат¬
рий сульфиты NasSO3 табалар. Реакциянең бер юнәлештә генә булып
узуын чагылдырган тигезләмәне төзегез. Җавапны дәлилләү өчен карбонат
һәм сульфит кислоталарының көчләрен чагыштырыгыз (кушымтадагы
4 таблицаны карагыз).
24 нче лаборатор дәрес
УГЛЕРОД ҺӘМ АНЫҢ КУШЫЛМАЛАРЫ
1 нче тәҗрибә. Кислоталарның карбонатларга тәэсир итүе.
Өч пробиркага (пробиркаларның төпләре күмелерлек итеп кенә)
натрий карбонаты, натрий гидрокарбонаты, кальций карбонаты
салыгыз, һәр пробиркага 1 әр мл сыегайтылган хлорид кислота¬
сы эремәсе өстәгез. Нәрсә күзәтелә? Пробиркаларга янып торган
чыраны кертегез. Күзәтүләрегезне аңлатып бирегез. Реакцияләр¬
нең тигезләмәләрен төзегез.
2 нче тәҗрибә. Гидрокарбонатларга җылытуның тәэсире.
Прибор җыегыз (108 нче рәсем). Натрий гидрокарбонаты салын¬
ган (пробирка күләменең 0,1 өлеше чамасы) пробирканы газүт¬
кәргеч көпшәле бөке белән каплагыз һәм, 108 нче рәсемдә күр¬
сәтелгәнчә, штатив тоткычына беркетегез. Газүткәргеч көпшә-
281
108 нче рәсем. Натрий гидрокарбона-
тын таркату.
нең очын кальций гидроксиды
(известьле су) салынган про¬
биркага төшерегез. Натрий ги-
дрокарбонаты салынган про¬
бирканың җиңелчә генә башта
барлык урынын, ә аннары тоз
салынган өлешен җылытыгыз.
Күзәтүләрегезне тасвирлап би¬
регез. Реакцияләрнең тигезлә¬
мәләрен төзегез.
3 нче тәҗрибә. Карбонат-
ионга сыйфат реакциясе. Нат¬
рий карбонаты һәм барий хло¬
риды эремәләре арасындагы
реакциянең узу мөмкинлеген
тикшерегез. Барлыкка килгән
утырымга 1 мл сыегайтылган
хлорид кислотасы өстәгез. Кү¬
зәтүләргә аңлатма бирегез.
4 нче тәҗрибә. Карбонатларның гидролизы. Карбонатлар
һәм гидрокарбонатлар эремәләренең тирәлек үзлекләрен тикше¬
регез. Моның өчен пробиркаларга 1 әр мл шул эремәләрне салы¬
гыз. Аннары пыяла таякчык ярдәмендә һәр эремәнең тамчысын
кызыл лакмус кәгазенә тамызыгыз (һәр эремәдән соң таякчыкны
дистиллирланган су белән юдырыгыз). Күзәтүләргә аңлатма би¬
регез. Ни өчен карбонатлар гидрокарбонатларга караганда күб¬
рәк дәрәҗәдә гидролизлашалар? Җавапны дәлилләү өчен реак¬
цияләрнең тигезләмәләрен төзегез.
5 нче тәҗрибә. Карбонатларның барлыгын белү. Тәҗрибә
ясап, бирелгән пробиркаларның кайсысында карбонат, хлорид
һәм сульфат барлыгын белегез. Үзегез сайлап алган тикшеренү
методын дәлилләгез.
25 нче лаборатор дәрес
ИЗВЕСТЬТАШТАГЫ КАРБОНАТЛАРНЫҢ МАССА ӨЛЕШЕН БИЛГЕЛӘҮ
Известьташта булган карбонатларның масса өлешен аларга
кислота белән тәэсир итеп белергә мөмкин. Бу эш барышында
сезгә известьташтагы карбонатларны нитрат кислотасы белән
тәэсир итеп таркатырга кирәк булачак. Башлангыч матдәләрнең
массасы, аерылып чыккан углерод (IV) оксидының массасы һәм
реакциянең башка продуктлары массасы буенча известьташтагы
карбонатларның массасын билгеләрсез, ә аннары аларның масса
өлешен процентларда табарсыз.
Тәҗрибәне ясарга керешкәнче, прибор (109 нчы рәсем)
һәм тәҗрибәне башкару эзлеклелегенең тасвирламасы белән
танышыгыз. Тәҗрибәне үткәрү барышында алынган мәгълүмат¬
ларны язу өчен дәфтәрегезгә таблица сызыгыз (18 нче таблица).
282
18 нче таблица. Известьташтагы карбонатларның масса өлешләрен
эксперимент ярдәмендә тикшерү нәтиҗәләре
Известь¬
таш үлчә-
ме
Приборның массасы
Углерод
(IV) окси-
дының
массасы
Карбо¬
натлар¬
ның
массасы
Известь¬
таштагы
карбо¬
натларның
масса
өлеше
кислота
белән
кислота
һәм
известь¬
таш
белән
тәҗри¬
бәдән
соңгы
матдә
белән
1. Приборны җыегыз. Көпшәгә (2) ике мамык кисәге арасына
куеп, сусызландырылган кальций хлориды CaCh тутырыгыз.
Кальций хлориды тәҗрибә процессында аерылып чыга торган
су парларын йоттыру өчен кирәк.
2. Колбага (1) 75 мл чамасы 15% лы нитрат кислотасы салы¬
гыз. Колбаны көпшәләр (2 һәм 3) урнаштырылган бөке белән
каплагыз.
3. Приборны үлчәгез. Аның массасын таблицага языгыз.
4. Үлчәү тәлинкәсендәге прибор янына һәркайсы борчак
бөртегеннән зур булмаган, гомуми авырлыгы 5 грамм чамасын¬
нан артмаган, берничә кисәк известьташ салыгыз һәм үлчәгез.
Известьташның массасын таблицага язып куегыз.
5. Колбаны (1) берникадәр ачып, стена буйлап саклык белән
известьташ кисәкләрен төшере¬
гез һәм тиз генә ябыгыз.
6. Химик реакция тәмам¬
лангач көпшәгә (3) резина гру¬
ша тоташтырып, барлык аеры¬
лып чыккан углекислый газны
кысрыклап чыгарырлык итеп,
прибор аша әкрен генә һава
өрдерегез.
7. Приборны үлчәгез, аның
массасын таблицага язып куе¬
гыз.
8. Аерылып чыккан углерод
(IV) оксидының массасын исәп¬
ләп табыгыз һәм таблицага
язып куегыз.
9. Известьташ үлчәмендәге
карбонатларның массасын
исәпләгез. Исәпләүләрнең нәти¬
җәсен таблицага языгыз.
10. Известьташтагы карбо¬
натларның масса өлешен про¬
центларда исәпләп чыгарыгыз.
109 нчы рәсем. Известьташтагы карбо¬
натларның масса өлешләрен билгеләү
өчен прибор.
1— конус формасындагы колба; 2—
хлор-кальцийлы көпшә; 3— газүткәр¬
геч көпшә.
283
§ 92. УГЛЕРОД (II) ОКСИДЫ.
ЯГУЛЫКНЫ ГАЗИФИКАЦИЯЛӘҮ
а) Углерод (IV) оксиды белән күмерне бергә җылытканда углерод (II)
оксиды хасил булу; б) углерод (II) оксидын кислород белән оксидлаштыру
реакцияләренең тигезләмәләрен төзегез. Элементларның оксидлашу дәрәҗәләре
үзгәрү схемаларын төзегез. Оксидлаштыручыны һәм кайтаручыны күрсәтегез.
Углерод (II) оксиды CO — төссез һәм иссез газ, углеродлы
матдәләрнең тулы булмаган януы вакытында барлыкка килә.
Гадәттәге шартларда углерод (II) оксиды су, кислоталар
һәм селтеләр белән тәэсир итешми.
Углеродның +4 оксидлашу дәрәҗәсе тотрыклырак булган¬
лыктан, углерод (II) оксиды кайтаручы үзлекләрен күрсәтә, мә¬
сәлән:
2С0 + O2 = 2СО2, А/7 = — 572 кДж
Углерод (II) оксиды зәңгәр ялкын белән яна (һавада
700°С та кабына). Бу процесс күп микъдарда җылылык аерылып
чыгу белән уза.
Углерод (II) оксидының кайтаручы үзлеге металл оксидла¬
рына тәэсир иткәндә дә чагыла. Әйтик, углерод (II) оксидын
бакыр (II) оксиды CuO салынган көпшә аркылы уздырып җы¬
лытканда, кара төстәге CuO кызыл төсле бакырга әверелә:
CuO + CO = Cu + CO2
Характерлы үзлекләренә бәйле рәвештә, углерод (II) оксиды
металлургиядә кайтаручы итеп, яну җылылыгы югары булган
бик тә кулай ягулык һәм органик матдәләрне синтезлаганда баш¬
лангыч матдә сыйфатында кулланыла.
Углерод (II) оксиды — газсыман ягулык төрләренең берсе
булган генератор газының төп өлеше. Генератор газын җитеште¬
рүнең асылы түбәндәгедән гыйбарәт. Газогенератор дип атала
торган мичкә (110 нчы рәсем) каты ягулык, мәсәлән, кокс, туты¬
ралар. Астан генераторга һава өрдерелә. Кабызып җибәргәч
аскы катлаулардагы кокс яна:
С + О2 = СО2, A// = -393 кДж
Бу реакциянең җылылыгы хисабына югары катламнардагы
кокс кыза. Барлыкка килә торган углерод (IV) оксиды кызган
кокс катламнары аша уза. Бу вакытта углерод (IV) оксиды
углерод (II) оксидына әверелә:
С + СО2=2СО,‘ АД=173кДж
Нәтиҗәдә азот һәм углерод (II) оксиды белән бергә, берника¬
дәр микъдарларда углекислый газ һәм башка катышмалар да
(каты ягулыкны корылай куу продуктлары) булган газлар кат¬
нашмасы барлыкка килә.
284
Каты ягулыкны газсыман
ягулыкка әверелдерү ягулыкны
газификацияләү дип атала. Ка¬
ты ягулыкның барлык төрләрен:
ташкүмерне һәм соры күмерне,
антрацитны, торфны, үзагачны
һәм янучан сланецларны гази¬
фикациялиләр.
Безнең илебездә ягулыкны
Jtfup астында газификацияләү
ысулы эшләнгән. Бу ысулның
асылы җир асты ятмаларында¬
гы ягулыкны янучан газга әве¬
релдерүдән гыйбарәт. Күмерне
җир астында газификацияләү
турындагы фикерне беренче бу¬
ларак Д. И. Менделеев әйткән
(1888). Җир астында газифи¬
110 нчы рәсем. Газогенератор.
кацияләүнең химик асылы нигездә генератор газын җитештерүне¬
ке кебек үк. Скважина буйлап казылма күмер катламына басым
астында һава җибәрелә. Ягулыкны кабызып җибәргәндә (мәсә¬
лән, электр ярдәмендә җылытып кабызу) углерод (IV) оксиды
СО2 хасил була, ә ул ярыклар һәм тишекләр буйлап күмер кат¬
ламнары аша узганда углерод (II) оксидына кайтарыла һәм
икенче бер скважина буйлап газ җыйгычка туплана.
Ташкүмерне газификацияләүнең бу ысулын кулланганда,
файдалы ягулыкларны чыгарганда, һәм шулай ук аларны ташып
йөртүдә, аз җитештерүчәнлекле механик операцияләрнең кирәге
калмый, ә бу исә, нәтиҗәдә, хез¬
мәт җитештерүчәнлегенең күтә¬
релүенә китерә.
Углерод (II) оксиды чиктән
тыш агулы. Аны тагын ис газы
дип тә атыйлар. Ул кандагы ге¬
моглобин белән кушыла һәм кан
кислородны күчереп йөртә ал¬
мый. Углерод (II) оксиды белән
эш иткәндә аеруча сак булырга
кирәк.
1. 111 нче рәсемдә C-t-C0j^2C0
. системасындагы тигезләнешне экс-
“ перименталь юл белән тикшерү нә¬
тиҗәләре күрсәтелгән, а) Туры һәм
кире реакцияләрнең узуына энерге¬
тик фактор һәм энтропия факторы
нинди йогынты ясый? б) Бу систе¬
маның тигезләнеш халәтенә темпе¬
ратура нинди йогынты ясый?
111 нче рәсем. Температураның
C + СО2з=*2СО тигезләнеш халәтенә
тәэсире.
285
2. Углерод (II) оксидын тимер (III) оксидыннан кайтарып тимер табу өчен
кулланалар. 1 т тимер табу өчен, нормаль шартларга күчереп исәпләгән¬
дә, нинди күләмдә углерод (II) оксиды кирәк булыр?
3. Водород табу ысулларының берсе
со+н2о=со2-|-н2, ДЖО
реакциясенә нигезләнгән. Химик тигезләнешне водород барлыкка килү ягына
авыштыру өчен Ле Шателье принцибы буенча нинди шартлар булдырырга
кирәк? Бу системадагы башка матдәләрдән водородны аерып алу ысулын
тәкъдим итегез.
4. Мичтә каты ягулык яндырганда, яну продуктлары чыгарыла торган
юллыкта, ни өчен корым утыра?
§ 93. УГЛЕРОДНЫҢ ВОДОРОДЛЫ КУШЫЛМАЛАРЫ
1. Углеродның водород белән булган кушылмасында углеродның һәр
3,0 грамм массасына водородның 1,0 грамм массасы туры килүе беленгән. Бу
кушылманың формуласы нинди? 2. Табигый газның төп состав өлеше — метан
Cbh. Табигый газны ягулык итеп куллану нинди реакциягә нигезләнгән?
Углерод атомы, дүрт валентлык электроны булганлыктан,
водород атомнары белән CFh составлы молекула (метан) бар¬
лыкка китерә. Метан — төссез, иссез газ. Суда практик яктан
эреми.
Метан CFh молекуласында дүрт пар электроннар үзара
бер-берсеннән этеләләр, нәтиҗәдә водород атомнары бер-берсенә
һәм углерод атомына карата 112 нче рәсемдә күрсәтелгәнчә
урнашалар. CH4 молекуласында водород атомнары урнашкан
урыннарны сызыклар ярдәмендә тоташтырабыз дип күз алдына
китерсәк, тетраэдр фигурасы килеп чыгар (112 нче рәсем).
Углерод һәм водород электротискәрелекләренең кыйммәтләре
буенча бер-берсеннән бик аз ае¬
рылып торалар, шунлыктан
C-H бәйләнеше поляр булма¬
ган ковалент бәйләнешкә якын.
Метан формуласын язганда уг¬
леродның символын алда язу
кабул ителгән — CH4.
Гадәттәге шартларда метан
химик яктан актив түгел. Әмма
кабызып җибәргәндә ул яна һәм
бу вакытта күп микъдарда җы¬
лылык аерылып чыга:
CH4 + 2О2 =CO2 +2Н2О,
AH= —802 кДж
112 нче рәсем. Метан молекуласының Башка янучан газлар ШИ-
төзелеше. келле, метан һава белән Uiapr-
286
лагыч катнашма барлыкка китерә. Шуңа күрә метан һәм состав¬
ларында метан булган газ катнашмалары белән эш иткәндә бик
сак булырга кирәк!
Мётан тулысынча янып бетмәгәндә корым хасил була. Про¬
мышленностьта корым табу ысулларының берсе шуңа нигезлән¬
гән.
Табигатьтә метан һәрвакыт һавасыз урында, мәсәлән, сазлык
төпләрендә, ташкүмер катламнарында, органик матдәләр таркал¬
ганда ясала. Ташкүмер катламнарыннан метан күмер шахтала¬
рына үтеп керә. Шунлыктан аны рудник газы дип тә атыйлар.
Шахталарда бу газның булуы бик тә куркыныч. Саклык чара¬
ларын үтәмәгәндә рудник газының шартлавы шахталарда ава¬
рияләргә китерә. Безнең илебездә шахталарда эшләүчеләрдән
куркынычсызлык кагыйдәләрен төгәл үтәү таләп ителә.
Метан — табигый янучан газның төп состав өлеше (60—
99% күләм өлеше). Табигый янучан газ чыганакларына безнең
илебез бай. Ягулык буларак бу газны промышленностьта һәм
көнкүрештә киң кулланалар. Чыгару урыннарыннан куллану
урыннарына табигый газ йөзләрчә һәм меңнәрчә километрларга
сузылган газүткәргечләр буйлап җибәрелә. Шулай күчерү мөм¬
кинлеге — газсыман ягулыкның өстенлекләреннән берсе. Күп
микъдарларда метан ташкүмерне кокслаганда хасил була. Таби¬
гый янучан газлар һәм кокс газы —химия промышленносте өчен
бик мөһим чимал.
Метан башка планеталарда да бар. Тикшеренүләр нәтиҗәсен¬
дә Сатурнның һәм Юпитерның атмосфералары башлыча метан¬
нан торуы билгеле булды.
Углерод водород белән гаять күп төрле-төрле кушылмалар барлыкка китерә.
Моны углерод атомнарының бер-берсе белән тотрыклы чылбырлар хасил итә
алуына нигезләнеп аңлатырга мөмкин, мәсәлән:
HHH H
III I
Н—С—C-C C-H
III I
HHH H
Үз чиратында чылбырлар тармакланалар, йомык чылбырлар барлыкка ки¬
терәләр һ. б. Мондый күп төрле кушылмаларның барысы да органик химия
курсында өйрәнелә.
'J 1. Лаборатория горелкасында 2,2 л (н. ш.) метанны яндыру өчен ничә
литр һава кирәк булыр? Бу вакытта күпме җылылык аерылып чыгар?
“ 2. Газ горелкалары белән эш иткәндә нинди саклык чараларын үтәргә
кирәк?
3. Алюминий карбиды су белән реакциягә кергәндә барлыкка килүче про¬
дуктларның берсе метан икәнен белгән хәлдә, реакциянең тигезләмәсен тө¬
зегез.
4. Иң каты матдәләрнең берсе — вольфрам карбиды металл кисү инструмен¬
ты ясау өчен кулланыла. Бу кушылмада углеродның һәр 0,12 грамм мас¬
сасына 1,82 грамм массалы вольфрам туры килә. Вольфрам карбидының
составы нинди?
5. Сез ничек уйлыйсыз, ни өчен автомобиль шиннары гадәттә кара төстә
булалар?
287
§ 94. ТАБИГАТЬТӘ УГЛЕРОД ӘЙЛӘНЕШЕ
1. Табигатьтәге нинди реакцияләр атмосферадагы углекислый газның чыгана¬
гы булып торалар? 2. Сез казылма ягулыкның нинди төрләрен беләсез?
Җирдә углеродның масса өлеше чагыштырмача бик аз
(0,1%). Әмма аның табигать процессларындагы роле гаять зур.
Углерод органик матдәләр составына керә. Бу элементны био¬
сфера элементы дип атарга мөмкин. Литосферада углерод орга¬
ник матдәләр рәвешендә дә (ташкүмер, нефть, торф, янучан
сланецлар, табигый газ), неорганик кушылмалар хәлендә дә
очрый. Соңгыларыннан карбонатлы минераллар аеруча киң та¬
ралган. Кальций карбонаты СаСОз известьташ һәм акбур рәве¬
шендә кайчакта хәтта тау тезмәләре дә барлыкка китерә. Каль¬
ций карбонатының СаСОз башка формасы — мәрмәр сирәгрәк
очрый. Атмосферада һәрвакыт күләм буенча 0,03% ка чаклы уг¬
лерод (IV) оксиды була. Гидросферада углерод (IV) оксиды
кайбер минераль чыганаклар суында эрегән хәлдә була.
Табигатьтә углерод әйләнеше аның органик матдәләрдән
неорганик матдәләргә һәм киресенчә әверелешеннән гыйбарәт.
Фотосинтезның — яктыда яшел үсемлекләрдә углерод (IV)
оксидыннан һәм судан органик матдәләр ясалу процессының
асылын исегезгә төшерегез. Фотосинтез нәтиҗәсендә атмосфера¬
га кислород бүленеп чыга.
Фотосинтез реакциясен
пСО2 + /пН2О = С„ (H2O)m Ң-пОг, Д//>0
тигезләмәсе белән күрсәтергә мөмкин.
Бу бик тә эндотермик процесс, ул кояш нурлары энергиясен йоту исәбенә
булып уза. Фотосинтез процессы гадәттән тыш зур күләмнәрдә бара. Яшел
үсемлекләр турында фотосинтез процессында космик роль уйныйлар дип юкка
гына әйтмиләр. Ел дәвамында фотосинтез исәбенә 80 млрд. т чамасы органик
матдәләр хасил була, I-IO11 т кислород аерылып чыга һәм 1,7-IO21 кДж Кояш
энергиясе туплана! Бу бөтен дөнья күләмендә ел дәвамында тотыла торган
энергия микъдарыннан 10 тапкырдан артык күбрәк!
Хайваннарның һәм үсемлекләрнең сулыш процесслары, һәм
шулай ук аларның калдыклары таркалу кислород катнашында
уза. Бу вакытта барлыкка килүче углерод (IV) оксиды яңадан
атмосферага бүленеп чыга. Үсемлекләрнең һәм хайваннарның
тереклек эшчәнлеге нәтиҗәсендә углерод әйләнеше әнә шулай
өзлексез булып тора.
Узган дәверләрдә Җир атмосферасы башлыча углекислый
газдан торгандыр дип исәплиләр. Фотосинтез исәбенә аның ат¬
мосферадагы микъдары акрынлап кими барган. Борынгы үсем¬
лекләр һәм хайваннар калдыкларының берникадәр өлеше тора-
бара казылма ягулыкка — ташкүмергә, нефтькә, табигый янучан
газларга һ. б. әверелгән.
Шулай ук карбонатлар һәм углеродның башка неорганик ку¬
288
шылмалары да үзгәрешләргә дучар булалар. Бу реакцияләрнең
кайберләре турында сез соңрак белерсез.
Табигатьтәге углерод әйләнешенә кешенең эшчәнлеге дә
шактый зур йогынты ясый. Бу бигрәк тә казылма ягулыкны кул¬
лану күләмнәренең һаман да арта баруы белән бәйле. Ягулыкны
яндырганда атмосферага гаять күп микъдарларда углекислый
газ һәм тузан чыгарыла. Галимнәр фикеренчә, һаваны болай
пычрату нәтиҗәсендә атмосферадагы углекислый газның микъ¬
дары артырга мөмкин, ә моның үз чиратында табигатьтә про¬
цесслар тигезләнешенең бозылуына, аерым алганда Җирдә кли¬
матның үзгәрүенә китерүе ихтимал.
Атмосферадагы углекислый газ Кояш нурларын яхшы үткәрә, әмма ул Җир¬
нең нурланышын бик нык тоткарлый. Бу парник эффектын китереп чыгара —
углекислый газ катлавы теплица пыяласы ролен уйный. Шунлыктан Җирдәге
температура атмосферада күпме углекислый газ булуга бәйле. Миллионнарча
еллар дәвамында атмосферадагы углерод (IV) оксидының баштагы микъдары
кимү Җир климатының акрынлап суына баруына китергән.
Нигездә углекислый газдан торучы калын атмосфера катламы белән әйләнде¬
реп алынган Венера планетасының өслегендәге югары температураны (450° С)
парник эффекты белән аңлаталар.
Атмосферага углекислый газ чыгаруны киметү — бик мөһим
проблема, шуңа күрә галимнәр һәм инженерлар аны хәл итү
өстендә эшлиләр.
Мич газларындагы углерод (IV) оксидын бер күзәнәкле суүсемнәрнең, мә¬
сәлән хлорелланың, фотосинтезы өчен куллану тәкъдиме кызыклы. Моның өчен
мич газларын хлорелла үрчетелә торган сулык аша җибәрәләр. Кояш яктысында
яки ясалма яктылыкта фотосинтез процессы бара, хлорелла бик тиз үрчи. Шул
рәвешчә әйләнә-тирә мохитне саклау һәм яшел биомасса табу проблемалары
хәл ителә. Хлорелла — балыклар һәм авыл хуҗалыгы терлекләре өчен бик яхшы
азык. Моннан тыш, шундый ысул белән табылган биомассаны ягулык итеп
тә кулланырга мөмкин.
? 1. Углерод (IV) оксидын йоттыру өчен мич газларын кайвакыт поташның
куертылган салкын эремәсе аша җибәрәләр. Табылган эремәне җылытканда
углекислый газ яңадан аерылып чыга. Бу процессларны аңлатырга мөмкин¬
лек бирүче тигезләмәләрне төзегез.
2. Борынгы Грециядә һәм Римда соданың, поташның, акбурның, мәрмәрнең,
энҗенең кислоталарда чыжылдап эрүе билгеле булган. Бу процессларны
реакция тигезләмәләре рәвешендә чагылдырыгыз.
3. Ни өчен кечкенә бүлмәләрдә бүлмә гөлләрен күп үстерергә ярамый?
4. Составында 89,6% углерод, 2,0% водород, 0,8% кислород, 0,7% азот һәм
6,9% янмаучан матдәләр булган 2 т антрацитны тулысыңча яндыру өчен
теоретик карашка нинди күләм (н. ш.) һава кирәк? һавадагы кислородның
күләм өлешен 20,9% дип алыгыз.
5. 0,5 м3 һаваны барий гидроксиды эремәсе аркылы үткәргәндә 1,32 г барий
карбонаты хасил булган, һавадагы углерод (IV) оксидының масса өлешен
процентларда исәпләп чыгарыгыз.
6. VI төсле рәсемдә күрсәтелгән схема буенча табигатьтә углерод әйләне¬
шен аңлатып бирегез.
7. 0,5 г известьташка хлорид кислотасы белән тәэсир иткәндә 75 мл (н. ш.)
углерод (IV) оксиды табылган. Известьташтагы кальций карбонатының
масса өлешен процентларда исәпләп чыгарыгыз.
8. а) Вулкан атылганда; б) яшенле яңгыр вакытында хасил була торган
нитрат кислотасы тәэсир иткәндә металларның карбонатлары белән нәрсә
була?
19 п-236 289
§ 95. КРЕМНИЙ
1. «Химик элементны өйрәнү өчен белешмәлекянең 1—3 нче сорауларына
җавап бирегез (40 нчы параграфны карагыз). 2. Кристаллик кремнийның струк¬
турасы алмазныкына охшаш булса, аның төзелешен тасвирлагыз. 3. Кремний
белән: а) кислород; б) магний арасындагы реакцияләрнең тигезләмәләрен төзе¬
гез. Кайсы очракта кремний — кайтаручы, ә кайсы очракта оксидлаштыручы ро¬
лен уйный?
Валентлык элентроннарының саны буенча, кремний Si угле¬
родның аналогы булып тора:
Әмма углерод атомы белән чагыштырганда кремний атомы
зуррак һәм аның ионлашу энергиясенең кыйммәте углеродныкын¬
нан кечерәк. Шуңа күрә, углерод элементына караганда, кремний
элементына неметалл билгеләре азрак, ә металл үзлекләре күб¬
рәк хас. Әйтелгән фикернең дөреслеге иң элек бу элементлар
барлыкка китергән гади матдәләрнең физик үзлекләрен чагыш¬
тырганда раслана.
Тышкы күренеше белән кремний металлга охшый. Ләкин аны
металларга кертмиләр, чөнки ул уалучан, электр тогын бик аз
үткәрә. Кремний авыр эретелүчән (эретелү температурасы
1420°С), бик каты булуы белән аерылып тора.
Кремнийның структурасы алмазның структурасына охшаш
(7 нче рәсемне карагыз). Аның кристалында һәр атом башка
дүрт атом белән чолгап алынган һәм алар белән ковалент бәйлә¬
неш ярдәмендә тоташкан. Әмма кремний атомнары арасындагы
ковалент бәйләнеш алмаздагы углерод атомнары арасындагы
бәйләнешкә караганда шактый көчсезрәк. Гадәттәге шартларда
кремний кристалындагы ковалент бәйләнешләр өлешчә өзелгән
булалар һәм анда ирекле электроннар хәрәкәт итә. Бу электрон¬
нар кремнийның зур булмаган, әмма шулай да сизелерлек электр
үткәрүчәнлеген билгелиләр. Җылытканда һәм яктылык тәэсирен¬
дә тагын да күбрәк бәйләнешләр өзелә, ирекле электроннарның
саны арта, кремний электр тогын тагын да яхшырак үткәрә
башлый. Шулай булгач, кремний — ярымүткәргеч.
Бу кремнийны кояш нурларын турыдан-туры электр энергия¬
сенә әйләндерү өчен куллану мөмкинлеген бирә. Кремнийдан
эшләнгән пластинкалардан, мәсәлән, Җирнең ясалма иярченнә¬
рен электр энергиясе белән тәэмин итеп торучы «кояш батарея-
лары» ясыйлар.
290
Гадәттәге шартларда кремний химик яктан тотрыклы. Ләкин
бик нык кыздырганда порошок хәлендәге кремний яна һәм крем¬
ний (IV) оксиды хасил итә:
SiH-O2 = SiO2, ДЯ<0
Кремний янганда бик күп җылылык аерылып чыга. Бу кремний
(IV) оксидында SiO2 атомнар арасындагы бәйләнешләрнең
бик нык булуын раслый.
Кремнийны кремний (IV) оксидыннан кокс ярдәмендә кайта¬
рып табалар:
SiO2 +20 = Si + 2C0, ДЯ>0
Кремний (IV) оксидындагы химик бәйләнешләр бик нык бул¬
ганлыктан, бу реакция — эндотермик процесстан гыйбарәт. Ул
югары температурада энтропия факторы (TAS>0) исәбенә бара.
Тикшерелгән реакция нәтиҗәсендә табылган кремнийга ка¬
тышмалар катнашкан була. Ярымүткәргечләр техникасы өчен ае¬
руча саф кремний таләп ителә. Бу максат өчен кремнийны табу
ысулларының берсе —аның очучан кушылмаларын җылытканда
таркатудан гыйбарәт, мәсәлән:
SiH4 = Si + 2H2
Металлургиядә кремний кыздыруга һәм кислота тәэсиренә
чыдам кремнийлы корычлар табу өчен тотыла. Кремний электр
машиналары һәм трансформаторлар ясау өчен кирәкле тран¬
сформатор корычының состав өлеше булып тора. Аны шулай ук
металлар тапканда кайтаручы сыйфатында кулланалар.
Кремнийның кушылмаларыннан кремний карбидының SiC
(карборундның) әһәмияте зур. Карборундның кристаллик челтә¬
ре алмазныкы кебек — һәр углерод атомы дүрт кремний атомы
белән чолгап алынган, һәм киресенчә. Шуңа күрә карборунд ка¬
тылыгы белән алмазга якынлаша. Карборундтан кайрак ташлар
һәм шомарту түгәрәкләре ясыйлар. Карборунд авыр эретелүчән
булганлыктан (таркалу температурасы 2830° С), аны утка чыдам
материал итеп тә кулланалар.
? 1. Кремний 1420° C та, ә ак фосфор 44°С та эретелә. Бу гади матдәләрнең
эретелү температураларындагы шулкадәр кискен аерманы ничек аңлатырга
A була?
2. Үзлекләре буенча карборундның алмаз белән кремний арасында торуын
ничек аңлатырга мөмкин? Карборундның төзелеше нинди һәм аңа нинди үз¬
лекләр хас?
3. Ни өчен кремний (IV) оксидын углерод белән кайтарырга мөмкин һәм бу
процесс нинди шартларда тормышка ашырыла?
4. Сез ничек уйлыйсыз, ни өчен кремнийның графит тибындагы аллотропик
төре тотрыклы түгел, ә карбин тибындагысы — билгесез? Җавап биргәндә
2 нче һәм 3 нче период элементлары атомнарының бер-берсе белән үзара
тәэсир итешкәндә л-бәйләнеш барлыкка китерә алу үзлекләрен чагыш¬
тырыгыз (81 нче рәсем).
19!
291
§ 96. КРЕМНИЙ (IV) ОКСИДЫ. СИЛИКАТЛАР
1. «Химик элементны өйрәнү өчен белешмәлек»нең 4 нче соравына җавап
бирегез (§ 40 ны карагыз). 2. Углерод (IV) оксидының COz һәм кремний (IV)
оксидының SiO? (кварц — елга комының төп состав өлеше) физик үзлекләрен ча¬
гыштырыгыз. Ни өчен бу матдәләрнең үзлекләре кискен рәвештә аерылып то¬
ралар? 3. Көчлелеге буенча силикат кислотасы нинди кислоталарга керә (ку¬
шымтаны карагыз)? 4. Силикат кислотасының нинди тозлары суда эри (кушым¬
таны карагыз)?
Кремний —Җирдә таралышы ягыннан кислородтан соң икен¬
че элемент. Табигатьтә кремний күбрәк кремнезём SiOz һәм сили¬
катлар хәлендә очрый. Кремнийның кушылмалары үсемлек һәм
хайван организмнарында була. Мәсәлән, алар кайбер беркүзә-
нәклеләрнең скелетын тәшкил итәләр.
Кремнийны беренче булып 1822 елда Я. Берцелиус тапкан. Аның латинча
«силиций» атамасы silex — «кремень» (чакматаш) сүзләреннән килеп чыккан.
Углерод (IV) оксидының CCb һәм кремний (IV) оксидының
SiCb үзлекләрендәге зур аерымлыкларны ничек аңлатырга? Га¬
дәттәге шартларда CCb — газ (куу (возгонка) температурасы —
78° С), ә SiCb — авыр эретелүчән матдә (эретелү температура¬
сы 1713°С). Аларның үзлекләрендәге бу аерма төзелеш үзенчә¬
лекләренә бәйле булуын сез беләсез инде: углерод (IV) оксиды
CCb молекулаларыннан тора, ә кремний (IV) оксиды SiCb- поли¬
мер кушылма.
Кремний (IV) оксидының төзелешен тикшереп узыйк. 3 нче
периодның башка неметалл элементларыныкы кебек үк, югары
оксидлашу дәрәҗәсендә кремнийның координацион саны 4 була.
Димәк, кремний (IV) оксидында SiOz һәр кремний атомы тирә¬
сендә дүрт кислород атомы урнаша, ә һәр кислород атомы тирә¬
сендә ике кремний атомы (6 нчы рәсем). Атомнарның шулай
урнашуын яссылыкта мондый схема рәвешендә сурәтләргә мөм¬
кин:
292
Кремний (IV) оксидының бик каты һәм авыр эретелүчән бу¬
луы аның төзелеше белән аңлатыла.
Силикат кислоталары һәм силикатлар да тетраэдр рәвешендә¬
ге структур берәмлекләрдән торалар. Иң гади төзелешле сили¬
кат кислотасының составы H4SiO4:
OH
A^oh
HO OH
Полисиликат кислоталары шактый тотрыклырак. Аларда тет¬
раэдр рәвешендәге структур берәмлекләр чылбырлар яки катлам¬
нар хасил итеп берләшәләр, мәсәлән:
OH OH OH
I I I
HO-Si-O- Si Q-Si-OH
I I I
OH OH OH
Мондый төзелешле кислоталарның составы H2SiO3 формула¬
сына туры килә.
Тетраэдр рәвешендәге структур берәмлекләр кыска яки озын, ачык яки
звенолар саны төрлечә булган йомык цикл төзелешле чылбырлар барлыкка ки¬
терәләр (113 нче рәсем). Чылбырларның катламнар хасил итүләре мөмкин
(113 нче рәсем). Боларның барысы да силикатларның гаять күп булуын ките¬
реп чыгара, мәсәлән:
ЫагБЮз, NasSiaOy, NaaSiaOs һ. б.
Кремний (IV) оксиды — химик яктан актив булмаган матдә.
Атап әйткәндә, ул су белән реагирлашмый. Әмма, кислота ок¬
сиды буларак, кремний (IV) оксиды SiOa каты хәлдәге селтеләр
белән катнаштырып эреткәндә яки селте эремәләрендә озак итеп
җылытканда, алар белән үзара тәэсир итешә. Бу вакытта сили¬
катлар барлыкка килә:
2NaOH + SiO2 = Na2SiO3 + H2O
Силикатлардан бары тик селтеле металларның тозлары гына
суда эри. Натрий (калий) силикатының куертылган эремәсен
сыек яки эрүчән пыяла дип атыйлар. Аны үзагачка сеңдерү һәм
шуның белән үзагачны утка чыдам итү өчен, утка чыдам буяулар
һәм утка чыдам капламнар җитештергәндә кулланалар. Натрий
силикатын җилем сыйфатында, һәм шулай ук замаскалар ясау
өчен файдаланалар.
Полисиликат кислоталары суда эремиләр. Алар селтеле ме¬
талларның силикатларына кислоталар тәэсир иткәндә койкасы-
ман утырым рәвещендә аерылып чыгалар, мәсәлән:
293
113 нче рәсем. Силикат-ионнарның
кайбер типлары: кара түгәрәкләр —
кремний атомнары, ак түгәрәкләр —
кислород атомнары.
114 нче рәсем. Пыяласыман крем¬
ний (IV) оксидының структурасы.
Na2SiO3 4-2НС1 = H2SiO3I +2NaCl
Җылытканда полисиликат кислоталары акрынлап таркала¬
лар:
H2SiO3 = SiO2H-H2O
Бик күп күзәнәкле кремний (IV) оксиды — силикагель барлыкка
килә. Силикагель су парларын һәм газларны йоттыру өчен
кулланыла. Татарстан Республикасында аны Менделеевск шәһә¬
рендәге химия заводында җитештерәләр.
Табигатьтә кремний (IV) оксидының кристаллары башлыча
кварц рәвешендә, шулай ук гранитларга һәм башка тау токым¬
нарына катнашкан хәлдә очрый. Tay токымнары ашалганда
кремнезем ак ком рәвешендә елга үзәннәрендә җыела.
Кремнезем пыяласыман хәлгә ансат күчә.
Кристаллик (6 нчы рәсем) һәм пыяласыман (114 нче рәсем)
кремний (IV) оксидының структураларын чагыштыру күрсәткән¬
чә, пыяласыман халәттә тетраэдр рәвешендәге структур берәм¬
лекләрнең билгеле бер тәртиптә урнашулары бозыла. Шуның ар¬
касында аерым структур берәмлекләр арасындагы химик бәйлә¬
нешләр бер үк дәрәҗәдә тигез булмыйлар. Шунлыктан пыяла¬
сыман җисемнәргә билгеле бер эретелү температурасы хас түгел
һәм җылытканда алар акрынлап йомшаралар.
Кварц пыяласы химик яктан һәм җылытканда термик яктан
бик тә чыдам. Кварц бик аз киңәя. Шуңа күрә бик тиз суыт¬
канда да кварц пыяласыннан эшләнгән әйберләр чатнап ватыл¬
мыйлар. Кварцны химиядә кулланыла торган аппаратуралар
294
һәм оптикада приборлар ясау өчен файдаланалар. Кварц пыя¬
ласы ультрашәмәхә нурларны үткәрә, шунлыктан аннан медици¬
нада кулланыла торган кварц лампалары ясыйлар.
•j 1. Силикатларның гаять күп төрле булуы нәрсә белән аңлатыла?
’ 2. а) Натрий силикаты эремәсенә углерод (IV) оксиды тәэсир иткәндә;
▲ б) натрий карбонатын һәм кремний (IV) оксидын бергә катнаштырып кыз¬
дырганда химик тигезләнеш кайсы юнәлешкә һәм ни өчен авышыр?
3. Натрий силикатын тапканда кремний (IV) оксидын сода NajCOa белән
катнаштырып эретәләр. Реакция тигезләмәсен төзегез. Ни өчен бу реакция¬
нең булуы мөмкин?
4. Түбәндәге әверелешләрнең тигезләмәләрен төзегез:
SiOj-^Si^-SiOj^-NajSiOa^HzSiOa^-SiOj
5. Кристаллик һәм аморф (пыяласыман) җисемнәрнең структураларында¬
гы һәм үзлекләрендәге төп аерма нидән гыйбарәт? Җавап биргәндә физи¬
ка курсыннан белгән мәгълүматларны да кулланыгыз.
§ 97. СИЛИКАТ ПРОМЫШЛЕННОСТЕ
а) Пыяланы; б) керамиканы; в) цементны кайларда кулланалар?
Силикат промышленносте эшләп чыгара торган продукт¬
лар — керамика, пыяла, цемент.
Керамика әйберләре — керамика җитештерү өчен төп чимал
итеп балчык кулланыла (грекча «керамикос» — балчык дигән
сүзне аңлата). Керамика әйберләренә төзелеш кирпече, фаянс,
фарфор керә.
Керамика әйберләре җитештерү кешелек тарихында иң бо¬
рынгы кәсепләрнең берсе булып тора. Мисырда яңа эрага ка¬
дәр 6000 ел элек үк кирпеч эшли торган булганнар. Табигать¬
тә ак һәм тагын да ешрак кызыл балчык очрый. Кызыл бал¬
чыкның төсе аның составында тимер кушылмалары булуга
бәйле.
Балчык каолинит АКОзХ
X2SiC>2-2H2O минералының кат-
лам-катлам булып урнашкан
яссы формадагы бик юка һәм
бик вак кристалларыннан тора
(115 нче рәсем).
Балчыкны бераз су белән из¬
гәндә, үзенә бирелгән форманы
саклый торган, камырсыман
масса барлыкка килә. Киптер¬
гәннән һәм яндырганнан соң әй¬
бер таш кебек булып ныгый.
Яндырылган керамик әйберләр
күзәнәкле һәм дым үткәрә тор¬
ган була. Шуңа күрә керамика
әйберләрен глазурь — тиз эре¬
тел үчән, махсус эшкәртүдән соң
115 нче рәсем. 12 000 тапкыр зурайтыл-
ган каолинит кристаллары.
295
116 нчы рәсем. Табаклы пыяла суырту
машинасы.
әйбер өслегендә пыяласыман
катлам барлыкка китерүче кат¬
нашмалар белән каплыйлар.
Керамика әйберләреннән иң
күп күләмдә төзелеш кирпечен
җитештерәләр.
Бик борынгы заманнарда ук
кешеләр пыяла җитештерү сер¬
ләрен белгәннәр. Силикат пыя¬
ласын сода, известьташ һәм ком
катнашмасын кыздырып эрет¬
кәндә табалар. Бу вакытта нат¬
рий һәм кальций силикатлары¬
ның катнашмасы барлыкка ки¬
лә:
NazCOs + SiOz = NazSiOs -j- COz
СаСОз -|- SiOz = CaSiOs COz
Составлары катлаулы булганлыктан, силикатларның формула¬
ларын оксидлар кушылмасы рәвешендә язалар. Әйтик, гади
тәрәзә пыяласының якынча составын NazO-CaO-GSiO2 формула¬
сы белән күрсәтергә мөмкин. Тимер силикатлары гади пыялага
беркадәр яшькелт төс бирәләр.
Кристаллик төзелешле җисемнәрдән аермалы буларак, пыяла
температура күтәрелгәндә акрынлап йомшара, ә аннары эри. Ки¬
ре күчеш тә акрын гына уза — суынганда пыяласыман масса шу¬
лай ук акрынлап катылана. Пыяладан төрле әйберләр эшләү
аның шул үзлегенә нигезләнгән. Ярымсыек хәлдәге пыяладан
өрдерү яки кысу ысулы белән төрле-төрле әйберләр ясыйлар,
өзлексез сузып табаклы пыяла, пыяла көпшәләр һәм сүсләр җи¬
тештерәләр. Бу процесслар барысы да механикалаштырылган.
Табаклы пыяла суырту машинасы 116 нчы рәсемдә күрсәтелгән.
Пыялага теге яки бу физик һәм химик үзлекләр бирү (бик
тә үтә күренмәле итү, термик һәм механик ныклыгын арттыру
һ. б.) өчен аңа пыяланың составын һәм структурасын үзгәртә
торган тиешле өстәмәләр кертәләр. Әйтик, пыяла кайнатканда
сода урынына поташ К2СО3 кулланганда калийлы пыяла табыла.
Бу пыяланың йомшару температурасы натрийлы гади пыяланы¬
кыннан югарырак. Шуңа күрә калийлы пыяладан махсус лабора¬
тория савытлары һәм приборлар ясыйлар.
Кальций оксидын кургаш оксидына, ә натрий оксидын калий
оксидына алыштырганда пыяланың яктылык нурларын сындыру
күрсәткече нык арта. Мондый пыяладан (хрустальдән) оптикада
линзалар һәм призмалар эшлиләр, һәм шулай ук аны хрусталь
296
нәфис әйберләр, люстралар, вазалар, фужерлар һ. б. ясау өчен
дә кулланалар. Пыяла составына кобальт кушылмаларын өстә¬
гәндә ул зәңгәр төстә була, хром кушылмалары пыяланы ачык
яшел төскә кертәләр, марганец кушылмалары пыялага шәмәхә
төс бирәләр һ. б. Васильеводагы пыяла заводында «пыяла мас¬
сасына тимер (III) хлориды FeCls өстәп, алтын сыман төсле
пыяла табалар. Төсле пыяланы мозаикалар, нәфис витражлар
ясаганда, приборларда яктылык фильтры сыйфатында һ. б. кул¬
ланалар.
Кремний (IV) оксидын өлешчә башка кислота оксиды — В2О3
белән алыштырганда пыяланың үзлекләре нык үзгәрә. Югары
температурага һәм химик тәэсирләргә чыдамлы пыяла табыла.
Аны химия производстволары өчен трубалар һәм аппаратура
ясау өчен файдаланалар. Әгәр пыяла кристаллик структуралы
булса, аның ныклыгы арта. Промышленность эшләп чыгара тор¬
ган ситаллар дип аталган пыяла-кристаллик материалларның
ныклыгы чуенның ныклыгына якынлаша.
Татарстан Республикасында кызуга чыдам пыяладан төрле
химия лабораторияләре өчен кирәкле савытларны (колбалар,
пробиркалар, стаканнар, суыткычлар), һәм шулай ук көнкүреш
савыт-сабаларын (чәйнекләр, кофе кайнаткычлар, чынаяклар
һ. б.) Казаннан ерак түгел Васильево поселогындагы пыяла
заводында җитештерәләр.
117 нче рәсем. Цемент клинкерын табу өчен әйләнә торган мич.
297
Силикат промышленностеның төзелеш эшләрендә гаять күп
күләмнәрдә кулланыла торган аеруча әһәмиятле продукты булып
цемент тора.
Цементны известьташ һәм балчык катнашмасын, кызып укма¬
ша башлау хәленә җиткәнче, яндырып җитештерәләр (117 нче
рәсем). Бу вакытта кальций карбонаты углерод (IV) оксидына
һәм кальций оксидына таркала. Соңгысы, балчык белән реакция¬
гә кереп, кальций силикатлары һәм алюминатлары барлыкка ки¬
терә. Табылган массаны (клинкерны) яшькелт-соры төстәге поро¬
шок— цемент хасил булырлык итеп тарттыралар.
Цементны су белән катнаштырганда акрынлап ката торган
камырсыман масса ясала. Цемент берегеп «ката». Цемент эремә¬
сен вак таш яки ком белән катнаштырып бетон табалар. Бетон
эчендә тимер стерженьнәрдән яки өрлекләрдән торган каркас
булса, аны тимер-бетон дип атыйлар. Бетонны һәм бигрәк тә ти¬
мер-бетонны плотиналар, күперләр, заводлар һәм башка корыл¬
маларның корпусларын төзегәндә киң кулланалар.
? 1. Сез нинди төзелеш материалларын беләсез?
2. Пыяла җитештерүнең асылын аңлатып бирегез. Башлангыч материаллар
A сыйфатында ак ком, поташ КгСОз, кургаш (II) оксиды кулланылган бул¬
са, пыяла кайнатканда барган реакцияләрнең тигезләмәләрен языгыз. «Кур¬
гашлы» пыяла нинди үзлекләргә ия?
3. Ни өчен шешә пыяласы яшел төстә була?
4. Цемент, бетон, тимер-бетон дип нәрсәләрне атыйлар? 117 нче рәсем буен¬
ча цемент клинкерын табуны тасвирлап бирегез.
5. Ни өчен вакыт узу белән тәрәзә пыяласы тоныклана һәм яргалана?
6. 40 кг известьташны ком белән кушып эреткәндә 38 кг кальций силикаты
табылган. Табигый известьташтагы кальций карбонатының масса өлешен
процентларда исәпләп табыгыз.
7. 1 т тәрәзә пыяласы җитештерү өчен теоретик исәпләүләр буенча күпме
чимал кирәк булыр?
Щ Өстәмә әдәбияттан файдаланып, керамика әйберләре һәм аларны көнкү¬
рештә, төзелештә, химия промышленностенда куллану турында чыгыш
ясарга әзерләнегез.
26 нчы лаборатор дәрес
КРЕМНИЙ КУШЫЛМАЛАРЫ
1 нче тәҗрибә. Силикат кислоталарын табу. 1—2 мл сыек
пыяла салынган пробиркага шулкадәр үк су өстәгез, катнашма¬
ны болгатыгыз. Барлыкка килгән эремәгә тамчылап хлорид кис¬
лотасы салыгыз. Күзәтүләрегезгә аңлатма бирегез. Реакция
тигезләмәсен төзегез.
2 нче тәҗрибә. Силикат һәм карбонат кислоталарының көч¬
ләрен чагыштыру. Пробиркадагы сыегайтылган сыек пыяла эре¬
мәсе аркылы углерод (IV) оксиды уздырыгыз. Күзәтүләрегезне
аңлатып бирегез. Реакциянең тигезләмәсен төзегез. Күзәтел¬
гән күренешне тиешле карбонатны кремнезем белән катнашты¬
рып җылытканда металл силикаты хасил булу факты белән ничек
чагыштырып карарга мөмкин?
298
3 нче тәҗрибә. Натрий силикатының гидролизы. Пробиркага
1—2 мл сыек пыяла салыгыз һәм су өстәп сыегайтыгыз. Инди¬
катор ярдәмендә эремәнең кислота-нигез үзлеген ачыклагыз. Кү-
зәтүләрегезне аңлатып бирегез.
4 нче тәҗрибә. Пыяланың эреп чыгуы. Саклык белән генә
киледә берничә кисәк пыяланы төеп ваклагыз. Порошокны про¬
биркага салыгыз, 2—3 мл су өстәгез һәм бер тамчы фенолфта¬
леин тамызыгыз. Пробиркадагы катнашманы кайнатып чыгары¬
гыз. Индикатор төсенең үзгәрү сәбәбен аңлатып бирегез.
5 нче тәҗрибә. Эремәүчән силикатларны табу. Натрий сили¬
каты белән кальций, тимер (II), кобальт (II) тозларының эремә¬
ләре арасындагы алмашу реакцияләрен үткәрегез. Күзәтүләргә
аңлатма бирегез.
6 нчы тәҗрибә. Глазурь табу. Кремний (IV) оксидының һәм
кургаш (II) оксидының бик вак порошокларын 1:3 масса чагыш¬
тырмаларында яхшылап катнаштырыгыз. Катнашманы киптерел¬
гән яссы балчык кисәгенә салыгыз һәм, кыскыч белән тотып,
кызганчы горелкада җылытыгыз. Балчык кисәгенең глазурь бе¬
лән каплануын аңлатып бирегез.
7 нче тәҗрибә. Сыек пыяланы куллану. Tap гына фильтр кә¬
газе тасмасына сыек пыяла сеңдерегез. Горелка ялкыны өстендә
киптерегез, ә аннары ялкынга кертегез. Күзәткәннәргә аңлатма
бирегез.
8 нче тәҗрибә. Силикатлы минералларның структурасы. Ас¬
бест һәм слюданы микроскоп аша карагыз, аларның тышкы күре¬
нешләрен чагыштырыгыз.
§ 98. НЕМЕТАЛЛ ЭЛЕМЕНТЛАРЫ ГАДИ МАТДӘЛӘРЕНЕҢ
СТРУКТУРАЛАРЫ ҺӘМ ҮЗЛЕКЛӘРЕ (КҮЗӘТҮ)
1. а) Аргон; б) хлор; в) күкерт; г) фосфор; д) кремний гади матдәләренең
төзелешләрен тасвирлагыз. 2. Гади матдәләрдә химик бәйләнешләр ясалуда:
а) хлор; б) күкерт; в) фосфор; г) кремний атомнарының ничәшәр электроны
катнаша?
Без неметалл элементларының үзлекләрен системалы рәвештә
өйрәнүне тәмамладык. Моннан алдагы бүлекләрдә төп игътибар
элементларның үзлекләре периодик системаның төркемчәләрендә
ничек үзгәрүен тикшерүгә юнәлтелгән иде. Периодик система
закончалыкларын тагын да яхшырак аңлау өчен безгә элемент¬
ларның үзлекләре периодик системаның периодларында ничек
үзгәрүен тикшереп узарга кирәк. Атомның электроннар конфигу¬
рациясе гади матдәнең структурасында һәм үзлекләрендә ничек
чагылуына тукталыйк. Тикшерүне Ar—Cl—S—P—Si рәте миса¬
лында үткәрик.
Бу элементлар атомнарының валентлык катлавы төзелешен
хәтергә төшерик:
299
Ar Cl S P Sl
-H--HH- -HH--H -H-H-H -H-H-H -H-I—
Il зр II Зр II Зр II Зр Ii Зр
3s 3s 3s 3S 3S
Аргон атомында парлашмаган электроннар юк, шуңа күрә
аның атомнары бер-берсе белән химик бәйләнешләр барлыкка
китермиләр. Аргон атомнарын (башка инерт газларныкын да)
бер атомлы молекулалар дип исәпләргә мөмкин.
Берәр парлашмаган электроны булган хлор атомнары SCb ба¬
ры тик ике атомлы молекулаларга гына берләшә алалар:**
:С1*+ -Cl:-*С1-Cl
Күкерт атомнарында ике парлашмаган электрон бар: «S*.
Шуңа күрә аның атомнары чылбырлар хасил итеп берләшә ала¬
лар. Бу исә чиксез Sn чылбыры рәвешендәге полимер молекула:
яки йомык чылбырлар рәвешендәге, мәсәлән Se составлы
S\sXs"s/S
молекулалар ясалуга китерә.
Шулай итеп, күкерткә аллотропия күренеше хас. Пластик
күкерт Sn полимер молекулаларыннан гыйбарәт, ә ромбик кү¬
керт Ss циклик молекулаларыннан тора (60 нчы параграфны
карагыз).
Фосфор атомнарында *Р’өч парлашмаган электрон бар. Ди¬
мәк, фосфор атомнары катламнар хасил итеп тә, һәм шулай ук
P 4 составлы молекулаларга да берләшә алалар. Ак фосфор P4
молекулаларыннан гыйбарәт. Kapa һәм кызыл фосфор полимер¬
лар булып торалар (100 нче рәсем).
Кремний атомнары «Si* дүрт парлашмаган электрон исәбе¬
нә алмаз тибындагы өч үлчәнешле (координацияле) кристаллик
челтәргә берләшәләр (7 нче рәсем).
Аргон — хлор — күкерт — фосфор — кремний рәтендә гади
матдәләрнең структуралары катлаулана барган саен, аларның
үзлекләре дә үзгәрә. Әйтик, каты хәлдәге аргонга, хлорга,
ромбик күкерткә молекуляр кристаллик челтәр хас, ә кызыл фос¬
фор һәм кремний атомлы кристаллик челтәргә ия булалар.
Шуңа күрә бу рәттә, аерым алганда, эретелү температуралары
кискен арта (19 нчы таблица).
300
19 нчы таблица. Кайбер неметалларның эретелү температуралары
Аргон
Хлор
Ромбик
күкерт
Кызыл
фосфор
Кремний
Эретелү
температу¬
расы, 0C
-189
— 101
113
600
1420
Гадәттәге шартларда аргон һәм хлор — газлар, ә кремний —
авыр эретелүчән матдә. Гади матдәләрнең электр үткәрүчәнлек-
ләре дә төрле. Каты хәлдәге хлор — диэлектрик, ә кремний —
ярымүткәргеч һәм тышкы күренеше белән металлга охшаган.
Шулай итеп, физик үзлекләренең ничек үзгәрүеннән чыгып
шуны әйтергә кирәк: аргон — хлор — күкерт — фосфор —крем¬
ний рәтендә гади матдәләрдә металл үзлекләре көчәя, ә Неме¬
талл үзлекләре кими бара. Ә бу рәттәге гади матдәләрнең химик
үзлекләре ничек үзгәрә икән?
Аргон — затлы (инерт) газ, химик реакцияләргә керми.
Хлор гадәттә бары тик оксидлаштыручы үзлекләрен генә күр¬
сәтә. Күкерт оксидлаштыручы да, кайтаручы да була ала. Фос¬
форның оксидлаштыручы үзлекләре күкертнекеннән шактый ким¬
рәк чагыла, һәм, ниһаять, кремний — кайтаручы, ул оксидлаш¬
тыручы үзлекләрен бөтенләй диярлек күрсәтми. Югары темпера¬
турада, шул исәптән хлор һәм күкерт белән реакциягә кергәндә
дә, кремний оксидлаша.
Шулай итеп, химик үзлекләре, ягъни оксидлаштыру актив¬
лыгының кимүе һәм кайтару активлыгының артуы буенча да,
Cl—S—P—Si рәтендә гади матдәләрнең неметалл үзлекләре ки¬
ми, ә металл үзлекләре көчәя.
? 1. Каты хәлдәге аргонның кристаллик челтәре нинди кисәкчекләрдән тора?
Гадәттәге шартларда аргонның агрегат хәле нинди һәм моны ничек аңла-
A тырга була? Ни өчен аргон — химик яктан инерт матдә? Инерт газларны
кайларда кулланалар?
2. Хлор элементының аллотропик модификацияләре булуы мөмкинме? Струк¬
турасын исәпкә алып, ирекле хлорның физик үзлекләрен аңлатып бирегез.
3. Күкертнең аллотропик модификацияләренә мисаллар китерегез (60 нчы
параграфны карагыз). Аларның барлыкка килү мөмкинлеген аңлатып бире¬
гез.
4. Фосфор элементының аллотропик төрләре булуын ничек аңлатырга?
Структураларын исәпкә алып, бу модификацияләрнең физик үзлекләрен
тасвирлагыз.
5. Магний белән: а) хлор; б) күкерт; в) фосфор; г) кремний арасындагы
реакцияләрнең тигезләмәләрен төзегез. Бу матдәләрнең роле нинди: оксид¬
лаштыручымы, әллә кайтаручымы? Табылган кушылмаларның исемнәрен
атагыз.
6. Куертылган нитрат кислотасы белән: а) күкерт; б) фосфор; в) крем¬
ний үзара тәэсир итешкәндә нинди продуктлар барлыкка килә? Бу гади
матдәләрнең роле нинди: оксидлаштыручымы яисә кайтаручымы?
301
«НЕМЕТАЛЛ ЭЛЕМЕНТЛАРЫНЫҢ ҮЗЛЕКЛӘРЕ»
ТЕМАСЫНА КАРАТА КҮНЕГҮЛӘР
1. Неметалл элементлары атомнарының характерлы үзенчә¬
лекләре нинди?
Неметалларга атомнары: а) югары ионлашу энергиясе белән;
б) соңгы катлауларында электроннар күп булу (4—8) белән ха¬
рактерлана торган элементлар керә.
2. Неметалл элементларының периодик системада тоткан
урыннары нинди?
Неметалл элементлары VIII, VII һәм VI төркемнәрнең (поло¬
нийдан Po тыш) төп төркемчәләрендә урнашканнар. Моннан тыш
неметалларга V төркемнән — азот N, фосфор Р, мышьяк As;
IV төркемнән — углерод C һәм кремний Si; III төркемнән бор B
керә.
3. Неметалл элементы атомының нинди электроннары валент-
лык электроннары булып торалар?
Барлык неметалл элементлары (водородтан H һәм гелийдан
He тыш) р-элементларга керәләр. Димәк, аларның атомнарында
валентлык электроннары тышкы катлауда урнашканнар.
4. Неметалл элементлары атомнарының структурасы алар
барлыкка китергән гади матдәләрнең структурасында ничек ча¬
гыла? Әгәр атомнарның тышкы катлаулары тәмамланырга:
а) бер; б) ике; в) өч; г) дүрт электрон җитмәсә, атомнар бер-
берсе белән ничек берләшергә мөмкин? Периодик системаның
4 нче периодындагы неметалл элементлары барлыкка китергән
гади матдәләрнең структураларын фараз итегез, 4 нче период
элементларының атомнары 3 нче период элементлары атомнары¬
на караганда зуррак икәнен исәпкә алыгыз.
4 нче периодның неметалл элементларына мышьяк, селен
бром, криптон керә. (Аларның атомнарының тышкы катлаулары¬
ның электроннар конфигурациясен языгыз.)
Мышьяк атомнары өч ковалент бәйләнеш барлыкка китерә¬
ләр. Мышьякның тотрыклы модификациясе структурасы белән
кара фосфорга охшаган (100 нче рәсем, в). Селен атомнары
ике бәйләнеш хасил итәләр. Тотрыклы селен модификациясенең
кристаллик челтәре Sen полимер молекулаларыннан төзелгән.
Бром атомнары, бер бәйләнеш хасил итеп, ике атомлы молеку¬
лаларга Br2 берләшәләр. Криптон Kr атомында парлашмаган
электроннар юк, аның молекуласы бер атомнан гыйбарәт.
Бромның һәм криптонның кристаллик челтәрләре Br2 һәм Kr моле¬
кулаларыннан төзелгәннәр.
5. Гади матдәнең структурасы аның эретелү һәм кайнау тем¬
пературасында ничек чагыла?
Әгәр матдәгә молекуляр кристаллик челтәр хас булса, аның
эретелү һәм кайнау температуралары түбән була. Андый матдә¬
ләргә барыннан да элек бер һәм ике атомлы молекулалардан
торган матдәләр: инерт газлар, водород, галогеннар, кислород,
азот керә. Атомлы кристаллик челтәр хас булган матдәләр,
302
киресенчә, югары эретелү һәм кайнау температуралары белән
характерланалар. Аларга полимерлар: алмаз, графит, карбин,
кара фосфор, бор керә. Гади матдәләрнең шул ике төре ара¬
сында, эретелү һәм кайнау температуралары буенча, күп атомлы
молекулалардан торган матдәләр: ак фосфор (P4), күкерт (S8)
һ. б. урнаша.
6. Электр үткәрүчәнлекләренә карап, неметалларны ничек
классификациялиләр?
Атомнар арасында ковалент бәйләнеш нык булса, неметалл
диэлектрик үзлекләрен күрсәтә. Андыйларга водород, галогеннар
(йодтан һәм астаттан тыш), кислород, күкерт, азот, ак фосфор,
алмаз керә. Әгәр химик бәйләнешләр бик үк нык булмасалар,
һәм тышкы шартлар тәэсирендә (җылыту, яктылык тәэсире)
аларның кайберләре өзелә икән, ул чагында неметалл ярымүт¬
кәргеч үзлекләренә ия була. Мәсәлән, кремний, йод, селен, тел¬
лур.
7. C—N—O—F һәм P—S—Cl рәтләрендә атомнарның элек-
тротискәрелеге ничек үзгәрә? Бу элементлар бер-берсе белән ха¬
сил иткән ике элементлы кушылмаларның формулаларын язы¬
гыз. Бу кушылмаларда элементларның оксидлашу дәрәҗәләре
нинди? Кушылмаларның исемнәрен атагыз.
8. Куертылган нитрат кислотасы белән: а) углерод; б) фос¬
фор; в) күкерт; г) мышьяк; д) бор арасындагы реакцияләрнең
тигезләмәләрен языгыз. Куертылган нитрат кислотасы белән
үзара тәэсир итешкәндә неметаллар нинди кушылмалар бар¬
лыкка китерәләр?
9. Затлы газларның химик пассивлыгы нәрсә белән аңла¬
тыла?
Затлы газларның атомнарында тышкы электрон катлавы тә¬
мамланган: гелий атомының тышкы катлавында ике электрон,
ә төркемчәнең калган элементлары атомнарында — сигезәр элек¬
трон (II төсле рәсемне карагыз). Моннан тыш, аларның атомна¬
ры ионлашу энергияләренең кыйммәтләре зур булу белән харак¬
терланалар (38 нче рәсем). Гелий төркемчәсендә атомнар зурай¬
ган саен, аларның ионлашу энергияләре кими бара. Тышкы
катлау электроннарының төш белән бәйләнеше йомшара һәм
электроннарның химик бәйләнеш ясалуда катнашу мөмкинлеге
туа. 'Шунлыктан гелийдан, неоннан һәм аргоннан аермалы була¬
рак, криптон һәм, бигрәк тә, ксенон химик әверелешләрдә катна¬
ша алалар. Бәйләнеш ясалуга «бирә» торган электроннар санына
карап, ксенон -ф2, -ф4, -фб һәм -ф8 оксидлашу дәрәҗәләре
күрсәтә.
Турыдан-туры ксенон бары тик иң көчле оксидлаштыручы
фтор белән генә оксидлаша. Бу очракта XeFz, XeF4 яки XeF6 бар¬
лыкка килә. Ксенонның иң югары -ф8 оксидлашу дәрәҗәсендәге
XeO4 оксиды, ксенон кислотасы H4XeO6 һәм аның тозлары билге¬
ле. Затлы газларның кушылмалары — бик көчле оксидлаштыру¬
чылар. Алар ярдәмендә барлык элементларны да диярлек мөмкин
булган максималь оксидлашу дәрәҗәләренә кадәр оксидлашты¬
рырга мөмкин.
§ 99. НЕМЕТАЛЛ ЭЛЕМЕНТЛАРЫНЫҢ
ИҢ ГАДИ ВОДОРОДЛЫ КУШЫЛМАЛАРЫНА XAC
КИСЛОТА-НИГЕЗ ҮЗЛЕКЛӘРЕ (КҮЗӘТҮ)
Неметалл элементлары барлыкка китергән водородлы кушыл¬
маларның кислота-нигез үзлекләре бу элементларның периодик
системадагы нинди периодта һәм төркемдә урнашуларына бәйле
булуын тикшерик.
Моның өчен башта CH4, NH3, Н2О һәм HF водородлы ку¬
шылмаларының составын һәм төзелешен карап узыйк. Сезгә бил¬
геле булганча, бу кушылмаларның молекула составы неметалл
элементы атомындагы парлашмаган валентлык электроннарының
саны белән билгеләнә, мәсәлән:
C* N O F
+ 4-4" + + + +4-4- + + +
J 2/7 I I 2/7 | I 2/7 I J 2/7
2s 2s 2s 2s
Бу молекулаларның һәркайсында неметалл атомының (C, N,
O, F) дүрт пар (бәйләүче һәм бәйләнеш хасил итмәүче) элек¬
троннары бар:
H
Н—C-H H—N—H H-OS Н—F:
111"
HHH
Электрон парлары үзара этеләләр. Инде күрсәтеп үтелгәнчә,
бу метан CH4 молекуласының тетраэдр формасында булуына
китерә (118 нче рәсем, а). Аммиак NH3 молекуласында азот
атомының өч пар бәйләүче электроннары һәм бер пар бәйләнеш
хасил итмәүче электроннары бар. Водород атомнары күз алдына
китерелә торган тетраэдрның өч түбәсендә урнашалар, ә бәй¬
ләнеш хасил итмәүче электрон пары тетраэдрның дүртенче
түбәсенә юнәлә (118 нче рәсем, б). Димәк, NH3 молекуласы
түбәсендә азот атомы урнашкан өчпочмаклы пирамида форма¬
сында була. Шул рәвешчә фикер йөртеп, без су Н2О молекула¬
сының почмаклы формада (118 нче рәсем, в) булуы турындагы
нәтиҗәгә килербез, һәм, ниһаять, водород фториды HF молеку¬
ласы гантель формасында була (118 нче рәсем, г).
Молекулаларның структурасын исәпкә алып, ни өчен судагы
эремәләрендә водород фторидының — кислота, ә аммиакның ни¬
гез булып торуларын аңлатырга мөмкин. Бу яктан караганда
су арадаш урында тора. Ул кислота үзлекләренә дә, нигез үзлек¬
ләренә дә ия, чөнки H+ (кислота үзлеге) һәм ОН~ (нигез үзле¬
ге) хасил итеп диссоциацияләшә:
304
H2O^H + +OH-
Күп санлы тикшеренүләр
күрсәткәнчә, водород ионы H+
(протон) су молекуласы белән
үзара тәэсир итешә һәм гидро¬
ксоний ионы OH31" барлыкка
китерә:
H2O+H+ =OH3+
Гидроксоний ионы хасил бу¬
луны
H-O: +H+= Гн—б—Hl +
I I
н LhJ
схемасы ярдәмендә сурәтләргә
мөмкин.
Водород ионы килеп кушылу
исәбенә кислород атомы өченче
ковалент бәйләнеш O — H ха¬
сил итә. Икенче протон килеп
кушыла алмый, чөнки гидроксо¬
ний ионы OH+ уңай корылмага
ия булып тора.
Гидроксоний ионы OHf су молеку¬
ласы һәм водород ионы арасындагы до-
норлы-акцепторлы үзара тәэсир итешү
нәтиҗәсендә барлыкка килә: су молеку¬
ласындагы кислород атомы бер пар электроннарны (донор), ә водород ионы буш
орбитальне (акцептор) бирә. Гидроксоний ионының OHf барлыкка килүе
аммоний ионы NHJbхасил булуга охшаган (75 нче параграфны карагыз).
118 нче рәсем. Молекулаларның төзе¬
леше:
а — метан; б — аммиак; в — су;
г — водород фториды.
Шулай итеп, суның электролитик диссоциациясе
H2O + H2O =P- OH3++ он-
тигезләмәсе белән күрсәтелә.
Гидроксоний ионнары да, гидроксид-ионнар да, судагы эре¬
мәләрдә булган теләсә кайсы ион кебек үк, гидратлашкан хәлдә
булалар.
Шулай ук аммиак (75 нче параграфны карагыз) һәм водород
фториды молекулалары да үзләренә протонны китереп куша ала¬
лар. HF-—H2O—NH3 рәтендә бәйләнеш хасил итмәүче электрон
парларының саны кимегән саен, протонны китереп куша алу
үзлеге көчәя.
Әйтелгәннәргә туры килгәнчә, водород фторидын суда эрет¬
кәндә, гидроксоний ионнары OH31-хасил булу сәбәпле, HF молеку¬
лалары ионлашалар:
h2o+hf^oh3++f-
20 П-236
305
Ә менә аммиакны суда эреткәндә, киресенчә, аммоний ион¬
нары NH4+ хасил булу исәбенә, су молекулалары ионлашалар:
f I
NH3 + HOH NH4++ OH ~
Шулай итеп, водород фторидының судагы эремәсе — кислота
(ОНз1” ионнары күбрәк), аммиакның судагы эремәсе — нигез
(ОН- ионнары күбрәк), ә су — типик амфотер кушылма: HF бе¬
лән нигез үзлекләре, ә NH3 белән кислота үзлекләре күрсәтә.
Суда эреткәндә метан CH4 кислота-нигез үзлекләре күрсәтми.
Тикшерелгән мисаллардан чыгып, кислоталарга һәм нигез¬
ләргә түбәндәге билгеләмәләрне бирергә мөмкин.
Кислота — суда эрегәндә уңай корылмалы, гидроксоний ион¬
нарының OHsb концентрациясе арта торган кушылма ул.
Нигез — суда эрегәндә тискәре корылмалы гидроксид-ионнар-
ның OH- концентрациясе арта торган кушылма ул.
Шулай итеп, периодта неметалл элементларының атом номер¬
лары арту белән, алар барлыкка китергән водородлы кушылма¬
ларның кислота үзлекләре көчәя бара (20 нче таблица).
20 нче таблица. Неметалл элементларының водородлы
кушылмалары
Период
Төркем
IV
V
VI
VII
2
CH4
H3N
H2O
HF
3
SiH4
H3P
H2S
HCl
4
H3As
H2Se
HBr
5
H2Te
HI
Неметаллар барлыкка китергән водородлы кушылмаларның
кислота-нигез үзлекләре төркемчәләрдә ничек үзгәрә икән?
Мәгълүм булганча, төркемчәдә элементның тәртип номеры арт¬
кан саен, аның атом радиусы да зурая. Димәк, шул ук юнәлеш¬
тә Э—H бәйләнешнең ныклыгы кими. Шуңа күрә, мәсәлән,
HF — HCl — HBr — HI рәтендә ионнарга таркалу үзлеге көчәя,
ягъни кислоталарның көче арта (кушымтаны карагыз). Шул
ук сәбәп аркасында H3N-H3P-H3As рәтендә протонны китереп
кушу үзлеге, ягъни нигез үзлекләре кими.
• !.Неметаллар һәм металлар белән булган кушылмаларында водородның
оксидлашу дәрәҗәсе ничек аерыла (41 нче параграфны карагыз)?
** 2. Түбәндә парлап күрсәтелгән кушылмаларның кайсылары судагы эремәдә
көчлерәк ионлашалар: a) H2S яки H2Se; б) H2S яки HCl; в) H2Se яки
HI; г) HBr яки HF? Бу нәрсә белән аңлатыла? Җавапны дәлилләү өчен
306
кислоталарның ионлашу константаларын чагыштырыгыз (кушымтаны кара¬
гыз).
3. Натрий сульфиды һәм натрий селениды гидролизының тигезләмәләрен
языгыз. Бу тозларның кайсысы кемлерәк гидролизлата?
4. Фосфин H3P молекуласының пространстволы конфигурациясе нинди?
Ни өчен, аммиактан аермалы буларак, фосфин фәкать бик көчле кислоталар
белән генә (мәсәлән, HI һәм НСЮ4) үзара тәэсир итешә? Реакцияләрнең
тигезләмәләрен төзегез. Ни өчен фосфинның судагы эремәсенә селтеле үзлек
хас түгел?
5. а) Водород хлориды; б) водород сульфиды; в) аммиак; г) фосфин табу
реакцияләренең тигезләмәләрен языгыз. Җавапны,табыла торган матдәләр¬
нең кислота-нигез үзлекләреннән чыгып, дәлилләгез.
6. Водород селенидының пространстволы конфигурациясе нинди һәм аны
ничек аңлатырга була?
7. Ни өчен S1H4 кушылмасы СН4 кушылмасына караганда термик яктан
тотрыксызрак?
20:
МЕТАЛЛАР
§ 100. МЕТАЛЛАРГА ГОМУМИ ХАРАКТЕРИСТИКА
1. Металларга нинди үзлекләр хас һәм аларның сәбәбе нидән гыйбарәт
(38 нче параграфны карагыз)? 2. Металлик бәйләнешнең ничек барлыкка ки¬
лүен аңлатып бирегез. Аның ясалуы нинди шартларга бәйле?
Химик элементларның күпчелеге металл элементлары булып
торалар. Сезгә металл элементлары атомнарының тышкы катлау¬
ларында электроннар саны аз булуы билгеле. Металл элемент¬
лары атомнарының ионлашу энергияләре дә зур түгел. Югарыда
күрсәтелгән билгеләр белән характерлана торган химик элемент¬
ларның периодик системада тоткан урыны нинди соң? II төсле
рәсемдә күрсәтелгәнчә, металл элементларына (атомнарының
тышкы катлавында 1—3 электрон) 1 һәм II төркемнәрнең s-эле-
ментлары, III төркемнең р-элементлары (бордан тыш), барлык
d-элементлар һәм барлык /'-элементлар керә. Металл элементла¬
рына тагын III, IV, V, VI һәм VII төркемнәрнең атомнарының
ионлашу энергиясе зур булмаган кайбер р-элементлары да керә.
Металл элементлары атомнарының төзелеше алардан барлык¬
ка килгән гади матдәләрнең үзлекләрендә ничек чагыла икән?
Аларның атомнары бер-берсе белән кристаллик челтәр хасил
итеп берләшкәндә металлик бәйләнеш барлыкка килүен сез белә¬
сез инде (38 нче параграфны карагыз). Шуңа күрә аларның
гади матдәләре—металлар.
Металлик бәйләнеш, ковалент бәйләнеш кебек үк, атомнар¬
ның валентлык электроннары гомумиләшү исәбенә барлыкка ки¬
лә. Әмма химик бәйләнешләрнең бу төрләре арасында бик мө¬
һим аерымлыклар да бар. Ковалент бәйләнешне барлыкка ките¬
рүче электроннар нигездә бер-берсе белән кушылган ике атом
тирәсендә урнашалар. Мәсәлән, метан молекуласында (118 нче
рәсем) яки алмазда (7 нче рәсем) валентлык электроннарының
ничек урнашуларын хәтерегезгә төшерегез.
Металлик бәйләнеш очрагында, химик бәйләнешне барлыкка
китерүче электроннар бөтен металл кисәге буйлап күчеп йөри¬
ләр. Металларның сезгә яхшы таныш булган гомуми үзлекләре
нәкъ менә шуның белән билгеләнә дә инде. Металларга метал¬
лик ялтыравык хас, алар электр тогын һәм җылылыкны яхшы
үткәрәләр.
М. В. Ломоносов биргән билгеләмә буенча, «металл дип чүкеп
була торган ялтыравыклы җисем атала». Механик деформация
308
119 нчы рәсем. Механик тәэсир ясаганда кристаллик челтәрләрдәге катламнар¬
ның авышуы:
а — атомлы челтәрдә; б — ионлы челтәрдә; в — металлик челтәрдә.
вакытында ковалент, ионлы һәм металлик бәйләнешле матдәләр
белән нәрсә булуын чагыштырып карыйк. Каты җисемгә механик
тәэсир ясаганда аның кристаллик челтәрендәге аерым катламна¬
ры (атомнар, ионнар) авышалар (119 нчы рәсем). 119 нчы рә¬
семдә (а) күрсәтелгәнчә, ковалент бәйләнешле кристаллик чел¬
тәрдә мондый авышу бәйләнешләрнең өзелүенә һәм кристаллның
җимерелүенә китерә. Механик тәэсир җитәрлек көчле булганда
ионлы челтәр дә шулай җимерелә. Бу авышкан катламнарда бер
төрле корылмалы ионнарның үзара бер-берсеннән этелүе нәти¬
җәсендә була (119 нчы рәсем, б). Металлның механик деформа¬
циясе вакытында башка төрле күренеш күзәтелә. Электроннар
бөтен бер кристалл буйлап күчә алганлыктан, авышкан катлам¬
нар арасында тартылу саклана (119 нчы рәсем, в). Менә ни
өчен металларга пластиклык үзлеге хас: металларны чүкергә,
табакларга җәергә, чыбык итеп сузарга мөмкин.
Кайбер металлар турындагы мәгълүматлар кушымтада би¬
релгән.
Физик үзлекләре буенча металлар гаять күп төрле. Әйтик,
тыгызлыклары буенча металларны җиңел (р<5 г/см3) һәм
авыр (р>5 г/см3) металларга аерып йөртәләр. Металларның
иң авыры — осмий, ул иң җиңел литий металыннан 40 тапкыр¬
дан артык авыррак.
Эретелү температураларына карап, металларны авыр эрете-
лүчән (эретелү температурасы IOOOoC тан югарырак) һәм җи¬
ңел эретелүчән (эретелү температурасы 1000° C тан түбәнрәк)
металларга бүлеп йөртәләр. Иң авыр эретелүчән металл — воль¬
фрам (эретелү температурасы 3420° С), ә иң җиңел эретелүчән
металл — терекөмеш (эретелү температурасы—39°С).
309
Эретелү һәм кайнау температураларының нык аерылып торуы
металл атомнары арасындагы химик бәйләнешнең ныклыгы
(энергиясе) төрле булу белән аңлатыла. Металлдагы бәйләнеш
энергиясен металлны атомлаштыру энергиясенең кыйммәте буен¬
ча бәялиләр. Атомлаштыру энергиясе — матдәне ирекле атомнар¬
га таркату өчен тотыла торган энергия ул.
Металл (к)->Ирекле атомнар (г)
Атомлаштыру энергиясенең кыйммәте һәр металл өчен үзенә
бер төрле. Әйтик, цезий өчен атомлаштыру энергиясенең кыйм¬
мәте бары тик 78 кДж/моль тәшкил итсә, вольфрам өчен ул—
836 кДж/моль. Билгеле, атомлашу энергиясе зуррак булган
саен, эретелү һәм кайнау температуралары да югарырак була.
Металларның башка үзлекләре дә гаять күптөрле. Әйтик,
көмеш һәм бакыр электр тогын иң яхшы үткәрүче металлардай
саналалар. Ә менә висмутның электр үткәрүчәнлеге көмешнекен¬
нән 75 тапкыр кимрәк. Иң яхшы җылы үткәрүчәнлек тә шулай
ук көмешкә һәм бакырга хас, ә висмут һәм терекөмеш — җылы¬
лыкны иң начар үткәрүче металлар.
Э 1. Металл элементларына керә торган р-элементларны санап чыгыгыз. Җа¬
вапны дәлилләгез.
,, 2. Түбәндәге матдәләрнең кристаллик челтәрләрендә нинди типтагы бәйлә¬
нешләр күзәтелә: а) су; б) метан; в) кремний; г) кальций хлориды;
д) алюминий; е) углерод (IV) оксиды?
3. Кушымтада бирелгән металларның кайсысы бигрәк тә: а) җиңел;
б) авыр; в) авыр эретелүчән; г) җиңел эретелүчән? Күрсәтелгән метал¬
ларның кайсысында химик бәйләнеш; а) аеруча нык; б) иң көчсез? Бу ме¬
талларның эретелү һәм кайнау температураларын чагыштырыгыз.
4. Na—Mg—Al рәтендә: а) атомның валентлык электроннары саны;
б) гади матдәләрнең атомлашу энергиясе; в) металларның эретелү темпе¬
ратурасы ничек үзгәрә?
5. Электр кабелендә каршылык булу сәбәпле, урта полосада кышын югала
торган энергия микъдары җәен югалганга караганда 10% ка кимрәк. Моны
ничек аңлатырга мөмкин? 25
6. Металларның электр үткәрүчәнлеге башка матдәләрнекеннән IO20 —10
тапкыр артыграк. Бу нәрсә белән аңлатыла? Җавапны дәлилләгез.
7. Ни өчен температура күтәрелгәндә металларның электр үткәрүчәнлеге
кими, ә ярымүткәргечләрнеке — арта?
§ 101. МЕТАЛЛАРНЫҢ ХИМИК АКТИВЛЫГЫ
1. Металл белән: а) хлорид кислотасы яки сыегайтылган сульфат кислотасы;
б) куертылган һәм сыегайтылган нитрат кислотасы арасындагы реакцияләргә
мисаллар китерегез. Бу реакцияләрнең ионлы тигезләмәләрен төзегез.
Металлар кайтаручылар булып торалар. Гомуми рәвештә
аларның бу үзлеген
0 4- и
Me—>Ме
металл кушылма *
схемасы рәвешендә күрсәтергә мөмкин.
310
Металларның кайтаручы үзлеге аларның химик активлыгы
күрсәткече булып тора ала. Әйтик, селтеле металлар һавада
шунда ук оксидлашалар (рубидий һәм цезий хәтта кабынып ки¬
тәләр) һәм көпшәк хәлдәге оксидлашу продуктлары хасил
итәләр. Шундый ук шартларда платина белән ниндидер сизелер¬
лек үзгәрешләр булмый. Сыегайтылган сульфат кислотасына тө¬
шерелгән цинк аның белән актив реагирлаша, ә бакыр шул ук
кислота эремәсе белән реакциягә керми.
Металларның химик активлыкларындагы аермалыклар нәрсә
белән аңлатыла? Энтропия факторын исәпкә алмаганда, шуны
әйтергә мөмкин: реакция продуктларындагы химик бәйләнеш¬
ләр башлангыч матдәләрдәге бәйләнешләргә караганда ныграк
булган саен металлның химик активлыгы да зуррак була.
Металларның химик үзлекләрен бәяләү өчен, шул металлар
белән төрле агрессив тирәлекләрдә: кислородта, хлорда, төрле
кушылмаларның (кислоталарның, селтеләрнең, тозларның) суда¬
гы эремәләрендә һ. б. нәрсә булуын белергә кирәк. Металларның
су тирәлегендәге химик әверелешләрен тикшереп үтик. Мәгълүм
булганча, кайтаручы буларак, металл гидратлашкан катион
халәтенә күчә. Бу процессны түбәндәге стадияләр рәвешендә
күрсәтергә мөмкин:
1. Металлның атомлашуы:
Me (K) >-.Me (г), А//атОмЛашу 0
Металл Ирекле
металл
атомнары
2. Металл атомының ионлашуы:
Me (г)—цё->-Мел+ (г), А//„онлаШу>0
Ирекле Ирекле
металл металл
атомнары ионнары
3. Металл ионының гидратлашуы (электрон шулай ук гид¬
ратлата. Әмма исәпләүләрне гадиләштерү өчен электронның
гидратлашу энергиясен исәпкә алмаячакбыз):
Меп+ (г) + тН2О->Ме(Н2О)^+(э),
Ирекле Гидратлашкан
металл металл
ионнары ионнары
Д ^гидратлашу
<0
Кристаллик челтәрнең җимерелүенә (А//атомлашу) һәм атом¬
нарның уңай корылмалы ионнарга әверелүенә (А//ионлашу) энер¬
гия тотыла; киресенчә, ионнар гидратлашканда (А//гидратлашу)
энергия аерылып чыга. Суммар рәвештә энергия эффекты алгеб¬
раик суммага тигез була:
A//— А//атомлашу —Һ А//ионлашу —Һ А/7гидраТлашу
311
21 нче таблица. Цинкның, водородның һәм бакырның гидратлашкан
ионнар халәтенә күчешенә энергетик характеристика (кДж/моль)
Гади
матдә
Атомлашу
энергиясе
А^атомлашу
Ионлашу
энергиясе
А^ионлашу
Гидратлашу
энергиясе
A// гидратлашу
Суммар
энергия
АЯ
Цинк
130,5
2646,9
-2075,3
702,1
Водород
436,0
2636,4
— 2217,4*
855,0*
Бакыр
339,0
2710,1
-2129,6
919,5
*2 моль H һәм H+ исәбеннән
Шул күзаллауларны күздә тотып, судагы эремәләрдә цинк¬
ның, бакырның һәм водородның кайтару активлыкларын чагыш
тырыйк. 21 нче таблицада цинкның, бакырның һәм водородның
гидратлашкан ионнар халәтенә күчешенә энергетик характерис¬
тика китерелгән.
Китерелгән мәгълүматлардан күренгәнчә, тикшерелә торган
гади матдәләрнең гидратлашкан ионнар халәтенә күчеше энер¬
гия сарыф итүгә бәйле:
Zn (K)->Zn2+ (э),
H2 (г)->2Н+ (э),
Cu (к)-*Си2+ (э),
Д/7 = 702,1 кДж
ДД = 855,0 кДж
Д/7 = 919,5 кДж
Водородны кислотадан цинк белән этеп чыгару реакциясенең
ни өчен мөмкин булын тикшерик. Бу реакциянең асылын
Zn (к) 4-2Н+ (э) =Zn2+ (э)+Н2 (г)
ионлы тигезләмәсе белән күрсәтергә мөмкин.
Цинкны оксидлаштыруга
Zn (K)-^-Zn2+ (э), ДЯ = 702,1 кДж
энергия сарыф ителә. Водород ионнары кайтарылганда
2Н+ (э)-*-Н2 (г), ДЯ= -855,0 кДж
энергия аерылып чыга. Тулаем алганда цинкның кислота белән
үзара тәэсир итешүе — экзотермик реакция һәм ул үзеннән-үзе
бара.
Шуңа охшаш фикерләүләр бакырның кислоталардан водо¬
родны этеп чыгара алмавын күрсәтәләр, чөнки водород ионна¬
ры кайтарылганда аерылып чыга торган энергиягә (—855,0
кДж/моль H2) караганда, кристаллик бакырның гидратлашкан
ионнар халәтенә күчү процессына энергия күбрәк (919,5 кДж/моль
Cu) кирәк була.
Шулай итеп, сыегайтылган кислоталарга карата цинкның хи¬
312
мик активлыгы бакырныкыннан күп тапкыр артыграк. Бу нәрсә
белән аңлатыла соң? 21 нче таблицада бирелгән мәгълүматлар¬
ны карыйк. Бакыр атомнарының ионлашу энергиясе цинкныкына
якын. Ионнарның гидратлашу энергиясе буенча бакыр цинктан
активрак булырга тиеш. Димәк, бакырның химик активлыгы тү¬
бән булу аның атомлашу энергиясе югарырак булу (кристалл¬
дагы химик бәйләнешнең нык булуы) белән аңлатыла.
Тикшерелгән мисаллар, металлар кислоталарның һәм тозлар¬
ның судагы эремәләре белән реакциягә кергәндә, аларның кайта¬
ру үзлекләре гади матдәнең үзлекләренә дә (атомлашу энергия¬
сенә), аның атомнары үзлекләренә (ионлашу энергиясенә) һәм
ионнары үзлекләренә дә (гидратлашу җылылыгы) бәйле булуын
күрсәтәләр.
? 1. Түбәндәге әверелешләрнең суммар җылылык эффектларын исәпләп чы-
± гарыгыз:
Li (k)->Li (r)->Li+ (г)-* Li+ (э)
Na (к)->№ (r)-*Na + (r)->Na+ (э)
Cy тирәлегендә кайсы металл — литиймы яки натриймы — химик яктан
активрак һәм ул нигездә нәрсә белән билгеләнә? (Исәпләүләр өчен кирәк¬
ле мәгълүматлар кушымтада күрсәтелгән.)
2. Түбәндәге әверелешләрнең җылылык эффектларын чагыштырыгыз (ку¬
шымтаны карагыз):
Fe (к)-^Ре (r)->-Fe2+ (r)-*-Fe2+ (э)
Hg (с) Hg (r)-»Hg2+ (г) Hg2 + (э)
Бу металларның кайсысы кислоталардан водородны этеп чыгара ала?
Тимернең һәм терекөмешнең химик активлыклары төрле булуның төп
сәбәбе нәрсәдән гыйбарәт? Тимернең һәм терекөмешнең химик активлыкла¬
ры төрле булуны эксперименталь юл белән ансат кына ничек дәлилләргә
мөмкин?
3. Металлны гидратлашкан ионнар халәтенә әверелдерү энергиясе нинди
факторларга бәйле һәм ул металлның химик активлыгында ничек чагыла?
4. Кирәгеннән артык алынган сыегайтылган сульфат кислотасы белән 11,2 г
массалы тимер үзара тәэсир итешкәндә нинди күләмдә (н. ш.) водород
барлыкка килә?
§ 102. ГАЛЬВАНИК ЭЛЕМЕНТ.
ХИМИК ЭНЕРГИЯНЕҢ
ЭЛЕКТР ЭНЕРГИЯСЕНӘ ӘВЕРЕЛЕШЕ
CuSOi -(-Zn = Cu-F ZnSCL реакциясенең ионлы тигезләмәсен төзегез. Оксид¬
лаштыручыны һәм кайтаручыны күрсәтегез (43 нче параграфны карагыз).
Түбәндәге тәҗрибәне башкарыйк. Бакыр (II) сульфаты эре¬
мәсенә цинк пластинкасы төшерик. Без нәрсә күрәбез? Пластин¬
ка өслегендә кызгылт төстәге бакыр катламы утыра. Эремәнең
зәңгәр төсе (гидратлашкан бакыр ионнарына Cu2+ хас төс)
тора-бара юкка чыга. Цинк эри. Боларның барысы да цинк белән
бакырны аның тозы эремәсеннән этеп чыгару реакциясенең узуын
раслый:
313
Zn-I-CuSCh = ZnSCh + Cu
Zn0-FCu2+=Zn2+ +Cu0
Ни өчен бу процессның узуы мөмкин? Сез цинкның бакырга
караганда химик яктан активрак икәнен беләсез. 21 нче таблица¬
да күрсәтелгән мәгълүматлар буенча цинкның гидратлашкан
ионнар халәтенә күчүе өчен 702,1 кДж/моль, ә бакырның гид¬
ратлашкан ионнар халәтенә күчүе өчен 919,5 кДж/моль энергия
тотылырга тиеш:
Zn (K)->-Zn (r)->Zn2+ (r)->Zn2+ (э), АЯ = 702,1 кДж
Cu (k)->-Cu (r)->Cu2+ (r)->Cu2+ (э), A// = 919,5 кДж
Аңлашыла ки, кире процесс булганда — гидратлашкан ион¬
нар металлга әверелгәндә — шундый ук микъдарда энергия аеры¬
лып чыгарга тиеш.
Цинк ярдәмендә бакырны аның тозы эремәсеннән этеп чыга¬
ру процессының экзотермик процесс булуын күрсәтеп бирү кыен
түгел (А/7 = 702,1 кДж—919,5 кДж = —217,4 кДж):
Zn (к)+Cu2+ (э) =Zn2+ (э)+Cu (к), A//= —217,4 кДж
Бу процесс барышында цинк металының атомнары электрон¬
нарын бирәләр, ә бакыр ионнары электроннарны үзләренә ките¬
реп кушалар:
Zn0-2ё=Zn2+
Cu2+ +2ё+Си°
Шулай итеп, бакырны аның тозы эремәсеннән цинк белән
кысрыклап чыгару процессында электроннар цинк атомыннан ба¬
кыр ионнарына күчәләр (120 нче рәсем, а). Бу вакытта цинк ме-
талы кайтаручы үзлекләрен, ә бакыр ионнары оксидлаштыручы
үзлекләрен күрсәтәләр.
Электроннарның бу күчешен электр тогы барлыкка килерлек
итеп тормышка ашырып булмыймы икән? Физика курсыннан
белгәнегезчә, электроннарның мондый күчеше гальваник эле¬
ментта була.
Аның эшләү принцибын бакырны тозы эремәсеннән цинк бе¬
лән этеп чыгару реакциясе мисалында карап үтик. Моның
өчен 120 нче рәсемдә (б) күрсәтелгән прибордан файдаланыйк.
Көпшәк бүлгеч куелган савытның бер бүлегенә нинди дә булса
цинк тозының эремәсен (мәсәлән, ZnSCh эремәсе), ә икенче бү¬
легенә бакырның ниндидер тозы эремәсен (мәсәлән, CuSCh эре¬
мәсе) салыйк. Цинк пластинкасын цинк тозы эремәсенә, ә бакыр
пластинканы бакыр тозы эремәсенә төшерик. Металларны үт¬
кәргеч ярдәмендә тоташтырыйк. Цинк пластинкасында цинк ок¬
сидлаша һәм ионнар барлыкка килә:
Zn-2ё= Zn2+
314
120 нче рәсем. Бакыр (II) сульфаты эремәсеннән бакырны цинк белән этеп
чыгару:
а — цинк пластинкасын бакыр (II) сульфаты эремәсенә төшергәндә; б — цинклы-
бакырлы гальваник элементта.
Цинк атомнары биргән электроннар тышкы чылбыр буйлап
бакыр пластинкага күчәләр, ә анда бакыр ионнары кайтарыла¬
лар һәм металл хасил була:
Cu2+ Ң-2ё=Си
Электродларда бер үк вакытта бара торган оксидлашу-кай-
тарылу реакциясенең суммар тигезләмәсе болай языла:
ZnH-Cu2+ =Zn2+ +Cu, АЯ = -2'17,4 кДж
Чылбырга тоташтырылган гальванометр электр тогы барлы¬
гын, ягъни оксидлашу-кайтарылу реакциясендә катнашучы
электроннарның юнәлешле хәрәкәте булуын күрсәтә. Электролит-
таг — икенче төр үткәргечтә — корылмаларны көпшәк бүлгеч ар¬
кылы үтеп чыгучы сульфат SO2~ анионнары күчерә.
Шулай итеп, цинкны турыдан-туры бакыр тозы эремәсенә
төшергәндә оксидлашу-кайтарылу реакциясенең химик энергиясе
җылылык энергиясенә әверелә. Шул ук реакцияне гальваник эле¬
ментта үткәргәндә химик энергия электр энергиясенә әверелә:
химик реакция исәбенә электр тогы барлыкка килә.
Хәзерге вакытта сыек яки газсыман ягулык яну энергиясе исәбенә эшли
торган гальваник элементлар булдыруга аеруча игътибар бирәләр, мәсәлән:
2Н2+О2=2Н2О, ЬН<0
Мондый гальваник элементларны ягулыклы гальваник элементлар дип атый¬
лар.
315
121 нче рәсем. Гальваник элемент схемасы:
а — цинклы-кургашлы элемент; б — алюминийлы-көмешле элемент.
Электр тогының химик чыганаклары — гальваник элемент¬
лар һәм бигрәк тә аккумуляторлар киң һәм төрле кулланыш
табалар. Алар элемтә чаралары (радио, телефон, телеграф)
өчен электр энергиясе чыганагы, автомобильләрдә, тимер юл
вагоннарында яктылык чыганагы итеп кулланылалар, су асты
көймәләрен, Җирнең ясалма иярченнәрен һәм космик корабль¬
ләрне электр энергиясе белән тәэмин итәләр. Автомобильләрдә,
самолетларда, тракторларда стартерны эшләтә башлау өчен фай¬
даланылалар. Гальваник элементлар кесә электр фонарьлары,
транзисторлы радиоалгычлар һәм магнитофоннар, электр сәгать¬
ләре батареяларының һ. б. төп өлеше булып торалар.
? 1. VI—VII класслар өчен физика дәреслегенең 228 нче рәсеме буенча күр¬
сәтелгән процессларны аңлатып бирегез. Электр тогы нинди реакция исә-
A бенә барлыкка килә? Бу оксидлашу-кайтарылу реакциясен гальваник эле¬
ментта һәм Кипп аппаратында үткәрүнең аермасы нәрсәдә?
2. 121 нче рәсемдә күрсәтелгән гальваник элементларның ничек эшләүлә¬
рен аңлатып бирегез. ,
3. Гальваник элементларның мөмкин булган өч схемасын төзегез. Аларда
бара торган процессларны аңлатып бирегез.
4. 340 г массалы бакыр (II) сульфаты булган эремәгә 28 г массалы тимер
вагы салганнар. Аерылып чыккан бакырның массасы күпме булыр?
27 нче лаборатор дәрес
МЕТАЛЛАРМЫН, ХИМИК АКТИВЛЫГЫН ЧАГЫШТЫРУ
1 нче тәҗрибә. Цинкның һәм бакырның, кайтаручылар була¬
рак, активлыкларын чагыштыру. Бер пробиркага 2 мл цинк
тозы эремәсе салыгыз, ә икенче пробиркага шулкадәр үк ба¬
кыр (II) тозы эремәсен салыгыз. Беренче пробиркага бакыр ки¬
316
сәге, икенчесенә цинк кисәге төшерегез. Пробиркаларның кай¬
сында реакция бара? Күзәтүләрегезне тасвирлагыз. Реакция ти¬
гезләмәсен төзегез.
2 нче тәҗрибә. Цинкның һәм кургашның, кайтаручылар була¬
рак, активлыкларын чагыштыру. 2 мл цинк тозы эремәсе салын¬
ган пробиркага кургаш кисәге төшерегез (өслеген алдан игәү
белән чистартыгыз), ә 2 мл кургаш тозы эремәсе салынган про¬
биркага цинк кисәге төшерегез. Күзәтүләрегезне тасвирлагыз.
Реакция тигезләмәсен төзегез.
3 нче тәҗрибә. Кургашның һәм бакырның, кайтаручылар бу¬
ларак, активлыкларын чагыштыру. Кургаш тозы һәм бакыр (II)
тозы эремәсендә бакыр һәм кургаш белән нәрсә булуын тикше¬
регез (бакыр кисәге кургаш тозына, ә кургаш кисәге бакыр (II)
тозына төшерелә). Күзәтүләрегезне тасвирлагыз. Реакция тигез¬
ләмәсен төзегез.
Үзегез ясаган тәҗрибәләрнең нәтиҗәләренә таянып, тикше¬
релгән металларны, аларның химик активлыклары кимү тәрти¬
бендә, бер рәткә язып куегыз.
Тикшерелгән металларның бу рәттә бер-берсенә карата
урнашуларын металлның гидратлашкан ион халәтенә күчеш
энергиясенең суммар кыйммәтенә нигезләнеп аңлатып бирегез.
(Исәпләүләр өчен кирәк булган мәгълүматлар кушымтада күр¬
сәтелгән.)
§ 103. МЕТАЛЛАРНЫҢ ЭЛЕКТРОХИМИК
КӨЧӘНЕШЛӘР РӘТЕ
Металларның активлык рәтен язып куегыз (43 нче параграфны карагыз).
Бу рәттәге кайсы металлар кислоталардан водородны «этеп чыгаралар», ә кай¬
сылары — «этеп чыгармыйлар»?
Моннан алдагы дәрестә сез ясаган тәҗрибәләрнең нәтиҗәлә¬
рен тикшерик. Бер металлны химик активлыгы азрак булган
икенче бер металлның тозы эремәсенә төшергәндә оксидлашу-
кайтарылу реакциясе бара. Реакция нәтиҗәсендә актив металл
активлыгы кимрәк булган металлны аның тозы эремәсеннән кыс¬
рыклап чыгара.
Тимернең, терекөмешнең һәм бакырның химик активлыкларын
чагыштырыйк. Тимер пластинка бакыр (II) тозы эремәсенә тө¬
шергәндә бакырның кызгылт төстәге куныгы белән каплана:
Fe (K)H-Cu2+ (э) =Fe2+ (э)+Cu (к), АЖО
кайта- оксид-
ручы лашты-
ручы
Үз чиратында бакыр терекөмешкә караганда активрак. Әгәр
терекөмеш тозы эремәсенә бакыр пластинка төшерсәк, моңа
ышануы кыен булмас. Бакыр пластинка өслегендә терекөмеш
металы аерылып чыга:
317
Cu(K)H-Hg2+ (э) =Cu2+ (3)-|-Hg (с), ЛЖО
кайта¬
ручы
оксид¬
лашты¬
ручы
Башка металларның да кайтаручылар буларак активлыкла¬
рын шул рәвешчә үк эксперименталь юл белән чагыштырып ка¬
рарга мөмкин. Металларның чагыштырма химик активлыкларын
эксперименталь тикшерүләр ярдәмендә табу нәтиҗәләре 101 нче
параграфта башкарылган исәпләүләр юлы белән табылган нәти¬
җәләргә туры килә. Эксперименталь тикшерүләр һәм исәп¬
ләүләр нигезендә табылган мәгълүматларга таянып, химик ак¬
тивлыклары кимү тәртибендә металларны сезгә таныш булган
рәткә урнаштырырга мөмкин:
K, Ca, Na, Mg, Al, Zn, Cr, Fe, Pb, H2, Cu, Hg, Ag, Pt, Au
Металларның кайтару үзлекләре кими бара >
Металларның активлык рәтен шулай ук парлап алынган бил¬
геле металлардай төзелгән гальваник элементларның көчәнешлә¬
ре зурлыкларын чагыштырып та төзергә мөмкин. Аңлашыла ки,
металлар үзләренең химик активлыклары белән бер-берсеннән
ныграк аерылып торган саен, гальваник элементның электрод¬
ларында көчәнеш тә зуррак булачак.
122 нче рәсемдә күрсәтелгән прибор ярдәмендә электродлар
арасындагы көчәнешне үлчәргә мөмкин. Пыяла пластинкага төр¬
ле металларның тозлары эремәләре сеңдерелгән тар фильтр кәга¬
зе тасмалары урнаштырыла. Бу кәгазь тасмалар өстенә тозлары
сеңдерелгән металларның пластинкаларын куялар. Шул тасма¬
ларга аркылы итеп нинди дә булса электролит сеңдерелгән
122 нче рәсем. Гальваник элементларның электр көчәнешләрен үлчәү:
7—цинк; 2—тимер; 3—никель; 4—кургаш; 5— бакыр; 6— көмеш.
318
фильтр кәгазе тасмасын урнаштыралар. Активлык рәтендә
металлар бер-берсеннән никадәр ераграк урнашкан булсалар,
вольтметрга тоташтырылган электр үткәргечләре белән теләсә
кайсы металл пластинкаларының парына орынганда, аның угы
шулкадәр күбрәк тайпыла. Шуңа күрә бу рәтне гадәттә метал-
ларның электрохимик көчәнешләр рәте дип атыйлар.
Металларның электрохимик көчәнешләр рәтендә водород та
бар, чөнки водород, металлар шикелле үк, эремәдә катионнар
рәвешендә була ала. Бу рәттә водородтан алда торучы барлык
металлар да аны кислота эремәсеннән кысрыклап чыгаралар.
Бу рәттә водородтан соң урнашкан металлар аны кислоталар¬
дан кысрыклап чыгара алмыйлар. Алдарак урнашкан һәр металл
үзеннән соңрак килүче металларны аларның тозлары эремәлә¬
реннән кысрыклап чыгара ала.
Э 1. 22 нче таблицаны тутырыгыз. Моның өчен тозы эремәсеннән цинк, тимер,
бакыр белән кысрыклап чыгарыла торган металл ионы символы астына
A плюс тамгасы куегыз.
22 нче таблица. Кайбер металларның химик активлыкларын чагыштыру
Металл
Zn2+
Fe2+
Pb2+
Cu2+
Hg2+
Ag+
Zn
Fe
Cu
2. 0,449 г техник цинк үрнәге хлорид кислотасы белән үзара тәэсир итеш¬
кәндә 127,6 мл (н. ш.) водород аерылып чыккан. Техник цинктагы катнаш¬
маларның масса өлеше күпме?
3. Селтеле һәм селтеле-җир металларының суга тәэсире нинди? Алар башка
металларны тозларының судагы эремәләреннән кысрыклап чыгаралармы?
§ 104. ЭЛЕКТРОЛИЗ. ЭЛЕКТР ТОГЫНЫҢ ХИМИК
ТӘЭСИРЕ
Химик процесслар вакытында электроннар күчеше турындагы карашларга
нигезләнеп, оксидлаштыручыларга һәм кайтаручыларга билгеләмәләр бирегез.
Гальваник элементта оксидлашу-кайтарылу реакциясе бару
исәбенә электр тогы барлыкка килә. Электролиз вакытында,
киресенчә, оксидлашу-кайтарылу реакцияләре үзләре электр то¬
гы тәэсирендә узалар.
Электролиз — электролитларның эретелмәләре һәм эремәләре
аркылы электр тогы узганда электродларда бара торган оксид¬
лашу-кайтарылу процессы.
Натрий хлориды эретелмәсенә электролиз ясаганда нинди
үзгәрешләр булуын, ягъни бу эретелмә аркылы электр тогы үт¬
319
кәргәндә электродларда нинди процесслар баруын тикшереп
узыйк.
Эретелгән хәлдә натрий хлориды тәртипсез рәвештә хәрәкәт
итүче уңай корылмалы натрий ионнарыннан Na+ һәм тискәре
корылмалы хлорид-ионнардан С1~ тора:
NaCli-Na + Ң-С1"
Эретелмәгә ике электрод төшергәндә һәм даими ток чыга¬
нагы белән тоташтырганда электродларның берсе уңай корыла
(анод), ә икенчесе тискәре корыла (катод). Эретелмәдәге ион¬
нар юнәлешле рәвештә хәрәкәт итә башлыйлар.
Электр кыры тәэсирендә Na+ катионнары тискәре корылган
электродка — катодка, ә Cl" анионнары уңай корылган элек¬
тродка — анодка юнәләләр. Катодта катионнар үзләренә элек¬
троннар китереп кушалар һәм электронейтраль атомнарга әвере¬
ләләр:
Na+H-Ie = Na0
Натрий атомнары кристаллик челтәр барлыкка китерәләр —
катод өслегенә натрий металы утыра.
Анодта хлор анионнары, киресенчә, үзләренең берәр элек¬
троннарын бирәләр һәм хлор атомнарына оксидлашалар:
Cl--Ie = Cl0
Аннары хлор атомнары молекулаларга берләшәләр:
CiH-Ci=Ci2
һәм анодта ирекле хлор аерылып чыга.
Бу процессларны
Катод 2NaCl Анод
-*-2Na+H-2Cr->
2Na+ H-2e=2Na 2С1"—2е = С12
схемасы рәвешендә күрсәтергә мөмкин.
Реакциянең тигезләмәсен суммар рәвештә түбәндәгечә язар¬
га була:
электролиз
2NaCl (эретелмә) *2№Ң-С12
Шулай итеп, электролиз вакытында катодта кайтарылу про
цессы, ә анодта оксидлашу процессы бара.
Электр тогының кайтаручы һәм оксидлаштыручы буларак
тәэсире матдәләрнең—химик кайтаручыларның һәм оксидлаш¬
тыручыларның тәэсиреннән шактый көчлерәк. Шуңа күрә техни
када электрохимик оксидлаштыру аеруча актив неметалларны
320
(фторны, хлорны) табу өчен,
ә электрохимик кайтару нат¬
рий, магний, алюминий кебек
актив металларны тапканда
кулланыла.
? 1. 123 нче рәсем буенча промыш¬
ленностьта натрийны һәм хлорны
“ натрий хлориды эретелмәсенә элект¬
ролиз ясап табу схемасын төзегез.
2. Кайсы катион: Zn2+ яки Cu2+
ансатрак кайтарылыр? Җавапны
дәлилләгәндә 21 нче таблицада
күрсәтелгән мәгълүматлардан һәм
металларның электрохимик көчә¬
нешләр рәтеннән файдаланыгыз.
Металлның кайтару үзлеге һәм
аның катионының оксидлаштыру
үзлеге үзара нинди бәйләнештә бу¬
лалар?
3. Ag+, Cu2+, Fe2+ ионнары бул¬
ган эремәгә электролиз ясаганнар.
Бу металлар катод өслегенә нинди
эзлеклелектә утыралар? Дәлиллән-
гән җавап бирегез.
123 нче рәсем. Натрий хлориды эре-
телмәсенең электролизы:
/—анод; 2—катод; 3—диафрагма.
«ТОЗЛАРНЫҢ СУДАГЫ ЭРЕМӘЛӘРЕ ЭЛЕКТРОЛИЗЫ»
ТЕМАСЫНА KAPATA КҮНЕГҮЛӘР
1 нче мисал. Бакыр (II) хлоридының судагы эремәсенә элек¬
тролиз ясаганда күмер электродлар төшерелгән электролизерда
түбәндәгеләр күзәтелә. Катодта кызгылт төстәге утырым күренә.
Анодта газ аерылып чыга. Бакыр (II) хлоридының CuCU судагы
эремәсенә электролиз ясаганда нинди процесслар булып уза?
Электролиз схемасын төзегез.
Бакыр (II) хлориды эремәдә Cu2+ һәм Cl- ионнары хәлендә
була:
CuCWCu2++2СГ
Электродларны даими электр тогы чыганагына тоташтырган¬
да, ионнар юнәлешле рәвештә хәрәкәт итә башлыйлар: катион¬
нар — катодка, ә анионнар анодка таба юнәләләр.
Катодта Cu2+ катионнары кайтарылалар:
Cu2+ +2ё = Си°
Уңай корылган электродта — анодта хлор аерылып чыга.
(Хлорның барлыгын ничек белеп була?) Анодта хлорид-ионнар
оксидлашалар:
2СГ — 2e = Cl2
Шулай итеп, бакыр (II) хлоридының судагы эремәсенә элек¬
тролиз ясаганда
21 П-236
321
электролиз
CuCK-— - Cu-j-CK
процессы булып уза.
2 нче мисал. Түбәндәге эксперименталь күзәтүләргә таянып,
күмер электродлар төшерелгән электролизердагы калий йодиды¬
ның судагы эремәсенә электролиз ясаганда нинди процесслар
булып узуын аңлатып бирегез.
Электролиз вакытында катодта төссез һәм иссез газ аерылып
чыга. Катод тирәсендә фенолфталеин кура җиләге төсенә керә.
Анод тирәсендә эремә коңгырт-шәмәхә төскә керә. Ә анод ти¬
рәсендәге шул эремәгә крахмал эремәсе өстәгәндә коңгырт-шә¬
мәхә төс зәңгәр төскә керә.
Калий йодидының судагы эремәсенә ясалган электролизны
болай аңлатып бирергә мөмкин. Тозның судагы эремәсендә K+
катионнары һәм I- анионнары бар. Электрохимик көчәнешләр
рәтендә калий иң алда урнашкан. Судагы эремәгә электролиз
ясаганда калий катионнарының кайтарылуы мөмкин түгел. Cy
молекулалары кайтарылалар. Катодта
2Н2О + 2ё = H2 Ң-2ОН-
реакциясе бара. Водород аерылып чыккан саен, катод тирәсендә
гидроксид-ионнарның OH- концентрациясе арта бара. Дөрестән
дә, катод тирәсендә фенолфталеин кура җиләге төсенә керә.
Анодта иодид-ионнар оксидлашалар:
21~ — 2ё= I2
Калий йодидының судагы эремәсенә ясалган электролизны
түбәндәге схема белән күрсәтергә мөмкин:
2 KI
Катод If Анод
+-2 K+ +21-->
2Н2О + 2е=Н2 + 2ОН’ 21~-2е = 12
Электролиз вакытындагы суммар процессны
электролиз
2К1 + 2Н2О -Н24-2КОН + 12
тигезләмәсе рәвешендә язарга була.
Шулай итеп, калий тозының судагы эремәсенә электролиз
ясаганда катодта металл түгел, ә водород аерылып чыга һәм
селте эремәсе хасил була. Башка аеруча актив (селтеле, селте-
ле-җир һәм кайбер бүтән) металлар тозларының судагы эремәлә¬
ре электролизы да нәкъ шулай уза.
Бәян ителгәннәрдән чыгып, шундый нәтиҗә ясарга мөмкин:
кушылмаларның судагы эремәләренә электролиз ясап, барлык
элементларны да ирекле хәлдә табып булмый. Шул ук вакытта
кушылмаларның судагы эремәләренә электролиз ясап төрле мат¬
дәләр, атап әйткәндә селтеләр, табарга була.
322
1 нче бирем. Судагы эремәгә электролиз ясаганда электрод¬
ларда узучы оксидлашу-кайтарылу процессларында һәрвакытта
да эрегән кушылманың ионнары катнаша дип уйлау дөрес булыр¬
мы? Җавапны дәлилләгез.
2 нче бирем. Никель (II) хлоридының NiCla судагы эремә¬
сенә электролиз ясаганда катод өслегенә никель утыра. Ни¬
кель (II) хлоридының судагы эремәсенә ясалган электролизның
схемасын төзегез.
3 нче бирем. Водород йодидының судагы эремәсенә элек¬
тролиз ясаганда электродларда нинди процесслар бара?
4 нче бирем. Кислородлы кислоталарның судагы эремәләренә
электролиз ясаганда анод процессында су молекулалары катна¬
ша. Анод тирәсендә кислород һәм водород ионнары барлыкка
килә. Шул анод процессының тигезләмәсен төзегез.
21
ХИМИК ЭЛЕМЕНТЛАРНЫҢ Д. И. МЕНДЕЛЕЕВ
ПЕРИОДИК СИСТЕМАСЫНДАГЫ
ТӨП ТӨРКЕМЧӘЛӘРНЕҢ
МЕТАЛЛ ЭЛЕМЕНТЛАРЫ
§ 105. Ill ТӨРКЕМНЕҢ р-ЭЛEMEHTJIAPbIHA
ГОМУМИ ХАРАКТЕРИСТИКА
Параграфны укырга керешкәнче «Элементлар төркемчәсен өйрәнү өчен бе-
лешмәлек»нең сорауларына җавап бирегез һәм элементлар төркемчәсенә харак¬
теристика бирегез (72 нче параграфны карагыз).
Д. И. Менделеев периодик системасының III төркем р-эле-
ментларына бор В, алюминий Al, галлий Ga, индий In, таллий Tl
керә. Аларның атомнарының тышкы катлавында өч электрон
бар:
B Al Ga In Tl
2s22p' 3s23p' 4s24p‘ 5s25p' 6s26p'
Элегрәк тикшереп узган төркемчәләрдәге шикелле үк, монда
да уртак тенденция чагыла: элементның атом номеры арткан
саен, неметалл элементы билгеләре кими, ә металл элементы
билгеләре көчәя бара. Бор — неметалл элементы, таллий —
металл элементы. Борга +3 югары оксидлашу дәрәҗәсе (химик
бәйләнештә барлык 2s22p' электроннары катнаша), ә таллийга
Ң-1 оксидлашу дәрәҗәсе (бәйләнеш ясалуда 6р' -электроны кат¬
наша) характерлы.
Бу элементларның -)-3 оксидлашу дәрәҗәсе, мәсәлән, оксид¬
ларда: В2О3, AI2O3, ОагОз, 1пгО3; хлоридларда: BCl3, AlCl3,
GaCl3, InCI3; гидроксидларда: H3BO3, Al(OH)3, Ga(OH)3,
In(OH)3 чагыла. Таллийның + 1 оксидлашу дәрәҗәсендәге ку¬
шылмалары бигрәк тә тотрыклы, мәсәлән: ТЬО оксиды, TICl хло¬
риды, TlOH гидроксиды.
Гади матдәләр хәлендә бор — неметалл (кремнийны хәтер¬
ләтә), ә таллий — металл (кургашны хәтерләтә).
§ 106. АЛЮМИНИЙ
1. «Химик элементны өйрәнү өчен белешмәлек»нең 1—3 нче сорауларына җа¬
вап бирегез (40 нчы параграфны карагыз). 2. Алюминийны техниканың кайсы
өлкәләрендә кулланалар?
Ирекле хәлдә алюминий көмешсыман ак төстәге металл, ул
җиңел (р = 2,7 г/см3) һәм җиңел эретелүчән (эретелү темпера¬
турасы 659°С) металларга керә. Алюминий гаять пластик ме¬
324
талл: аны бик нечкә чыбык итеп сузарга һәм бик юка фольга
итеп җәяргә мөмкин. Алюминий җылылыкны һәм электр тогын
яхшы үткәрә (аның электр үткәрүчәнлеге бакыр электр үткәрү-
чәнлегенең 0,6 өлешен тәшкил итә). Алюминийны электр үткәр¬
гечләр ясау өчен куллану аның шул үзлегенә бәйле. Алюминий¬
дан ясаган үткәргечләр бакыр үткәргечләрдән ике тапкыр җи¬
ңелрәк.
Аеруча саф алюминий яктылык нурларын бик яхшы кире кай¬
тара. Безнең илебездә куелган дөньядагы иң зур алты метрлы
оптик телескопның төп көзгесе алюминий белән капланган. Бик
нык вакланган алюминий порошогы (аңлашыла ки, бик үк саф
булмаган) металлдан ясалган корылмаларны каплаганда кулла¬
ныла торган буяуның составына керә.
Алюминий — иң актив металларның берсе, ягъни ул көчле
кайтаручы булып тора. Бу үзлеге буенча алюминий бары тик
селтеле һәм селтеле-җир металларыннан гына калыша. Бик вак
алюминий порошогын горелка ялкынына сипкәндә, ул күз чагыл¬
дыргыч итеп кабына һәм янып бетә. Алюминий гадәттәге темпе¬
ратурада ук һава кислороды белән оксидлаша. Бу вакытта бар¬
лыкка килә торган алюминий оксиды AI2O3 алюминийның өсле¬
ген бик юка элпә рәвешендә каплый. Бу элпә механик тәэсирләр¬
дән дә, җылытканда да купмый.
Алюминий чыбыкны штативка беркетик. Чыбыкның түбәнге очын җылытыйк.
Бераздан алюминий эретелә, ләкин агып төшми, чөнки ул алюминий оксидын¬
нан торган үзенә күрә бер пәрдә белән капланган була. Оксид элпәсе алюминий¬
ны тагын да оксидлашудан саклый, аңа химик яктан пассивлык бирә.
Пассивлаша алу үзлегенә нигезләнеп, алюминийны эретмә¬
ләргә кызуга чыдамлылык, ягъни югары температурада оксидла¬
шуга каршы торучанлык үзлеге бирү өчен өстәмә итеп куллана¬
лар.
Оксид элпәсен бозганда алюминий үзенә хас химик активлы¬
гын күрсәтә.
Алюминий пластинканы терекөмеш тозы эремәсенә төшерик.
Эремә астында пластинка өслеген игәү белән ышкысак, бу урын¬
нарда алюминий тоз эремәсеннән терекөмешне кысрыклап чыга¬
ра һәм аның белән эретмә (амальгама) барлыкка китерә. Алю¬
минийның амальгамаланган урыннарында оксид элпәсе тормый,
кубып төшә. Амальгамаланган алюминий һавада калса, тора-
бара пластинка, бәс утыргандай, ак төстәге көпшәк алюминий
оксиды белән каплана. Бу пластинканы суга төшергәндә судан
водород аерылып чыга:
2 A1 + 6Н2О = 2А1 (OH) з + ЗН2|
Бу реакция алюминийның кайтаручы буларак активлыгы зур
икәнен раслый. Аның шундый активлыгы металларның электро¬
химик көчәнешләр рәтендәге урынына туры килә (103 нче па¬
раграфны карагыз).
325
Алюминий кислород белән оксидлашканда бик күп җылылык
аерылып чыга:
4А1 + ЗО2 = 2А120з, \Н= -3352 кДж
Димәк, алюминий оксидындагы химик бәйләнеш бик нык.
Шуңа күрә алюминий активлыклары азрак булган металларны
аларның оксидларыннан кайтара ала.
Алюминий һәм тимер оксиды порошоклары катнашмасын (термитны) гра¬
фиттан ясалган асты тишекле тигельгә салыйк. Тигельне калай кисәгенә утыр¬
тыйк. Калай астына ком салынган савыт урнаштырыйк. Катнашмага магний
тасмасы батырыйк. Магний тасмасына ут төрткәч катнашма кабынып китә.
Күп җылылык аерылып чыгу белән
8А1 + SFe3O4 =9Fe + 4Al2O3, A//= -3241 кДж
реакциясе булып уза. Бу реакция вакытында температура бик югары күтәрелә
(3000° C ка кадәр) һәм реакция продуктларының икесе дә эри. Графит тигель
тишеге астындагы калай да эри. Эрегән масса комга агып төшә.
Химик активлыгы югары булганлыктан, алюминийны метал¬
лургиядә кайтаручы итеп кулланалар.
? 1. Кушымтадагы мәгълүматлардан файдаланып, водородны кислоталар¬
дан алюминий ярдәмендә этеп чыгаруның җылылык эффектын исәпләп
A табыгыз.
2. Ни өчен алюминийдан ясалган савыт-саба кайнар су тәэсирендә бо¬
зылмый?
3. Куертылган нитрат кислотасының алюминийга тәэсире нинди һәм бу үз¬
лек алюминийның нинди практик кулланылышын билгели?
4. Термит «яну» процессында элементларның оксидлашу дәрәҗәләре үзгәрү
схемасын төзегез. Fe3O4 оксидын FeO-Fe2O3 дип карарга мөмкин.
§ 107. АЛЮМИНИЙ КУШЫЛМАЛАРЫ
1. Алюминий оксидының һәм гидроксидынын кислота-нигез үзлекләре нинди
(35 нче параграфны карагыз)? 2. а) Алюминий хлориды; б) алюминий нитраты
гидролизының тигезләмәләрен төзегез. Гидролиз продуктларын дәлилләү өчен
аларның ионлашу константаларын күрсәтегез (кушымтаны карагыз).
Периодик системада алюминий төркемчәдә бор неметалл эле¬
менты белән галлий металл элементы арасында, ә периодта маг¬
ний металл элементы белән кремний неметалл элементы арасын¬
да урнашкан. Алюминийның периодик системада тоткан урыны
оксидының һәм гидроксидының кислота-нигез үзлекләрендә ни¬
чек чагыла соң?
Аңлашыла ки, химик табигате ягыннан алюминий оксиды
Al2O3 һәм гидроксиды AI(OH) i амфотер кушылмалар булырга
тиеш. Алюминий гидроксиды AI(OH)3 — ак төстәге матдә, суда
эреми, амфотер үзлекле буларак, кислоталар белән дә, селтеләр
белән дә реагирлаша.
326
Алюминий гидроксидына Al (OH)з нинди дә булса кислота,
мәсәлән, хлорид кислотасы белән тәэсир иткәндә, утырым эри
һәм үтә күренмәле эремә хасил була:
Al (OH) з + ЗН+ = Al3+ +ЗН2О
Алюминий тозының судагы эремәсе барлыкка килә, мәсәлән:
Al(OH) з+ЗНС1 = А1С1з + ЗН2О
Бу реакциядә алюминий гидроксиды нигез үзлекләре күр¬
сәтә:
Ләкин Al(OH) з утырымы аңа селте эремәсе тәэсир иткәндә
дә эри:
Al(OH)3H-OH-=Al(OH)T
яки
Al(OH)3-J-NaOH = Na [AI(OH)4]
Бу реакциядә Al(OH)3 гидроксид-ионнарны үзенә китереп
куша, ягъни кислота үзлекләре күрсәтә. Шулай итеп, алюминий
элементы кушылмаларда уңай корылмалы Al3+ ионы рәвешендә
дә, тискәре корылмалы Al(OH)T ионы составында да була ала.
Әлбәттә, алюминий оксиды да Al2O3 амфотер үзлекләргә ия.
Алюминий металының кислота эремәләре белән дә, селте эремә¬
ләре белән дә үзара тәэсир итешә алуы алюминийның эремәләрдә
Ar+ катионы рәвешендә дә, Al(OH)T анионы составында да
була алуы белән аңлатыла. Алюминий чыбыкны кайнар селте
эремәсенә төшергәндә бераздан бик көчле водород аерылып чы¬
га башлый. Бу процессны болай аңлатырга мөмкин. Селте эре¬
мәсендә алюминий өслегендәге оксид элпәсе эри. Элпәдән арын¬
ган алюминий су белән үзара тәэсир итешә:
2А1 + 6Н2О = 2А1 (OH) з I + ЗН2
Ә барлыкка килгән алюминий гидроксиды селте белән реак¬
циягә керә:
AI(OH)3-TOh-=AI(OH) T
Яки суммар рәвештә:
2А1 + 2ОН- 4-6Н2О = 2А1(ОН)Т+ЗН2
Бу реакциядән рус-япон сугышы чорында химик И. А. Горбов
тәкъдиме буенча аэростатларга тутырырга кирәкле водородны
табу өчен файдаланганнар.
Алюминий — Җир кабыгында таралышы буенча өченче урын¬
да торучы элемент (кислородтан һәм кремнийдан калыша).
Ул кислородлы кушылмалар, барыннан да бигрәк алюмосили¬
катлар рәвешендә очрый. Алюмосиликатларны, кремний атом¬
нары өлешчә алюминий атомнарына алыштырылган, полимер
силикатлар дип карарга мөмкин.
327
Башкача әйткәндә, алюмосиликатларда алюминийның роле
кремний неметалл элементыныкы кебек үк, ягъни ул полимер
анион составына керә. Алюмосиликатларда катионнар булып
селтеле һәм селтеле-җир металларының ионнары тора. Алюмо¬
силикатлардан кыр шпатлары дип аталганнары аеруча киң та¬
ралган, мәсәлән KJAlSiaOg].
Моннан тыш, алюминий оксид хәлендә — корунд минералы рә¬
вешендә дә очрый. Корунд бик каты булуы белән аерылып то¬
ра. Үтә күренмәле корунд кристаллары кызыл төстә (рубин) һәм
зәңгәр төстә (сапфир) булалар. Хәзерге вакытта рубиннарны
һәм сапфирларны ясалма юл белән табалар. Рубиннарны төгәл
механизмнарда терәк ташлар сыйфатында (мәсәлән, сәгатьләр¬
дә), шулай ук лазерлар буларак кулланалар. Корундның үтә
күренмәүчән, төрле катышмалары күп булган кристалларын
(наждакны) абразив материал итеп файдаланалар. Наждактан
шомарту түгәрәкләре, металларны шомарту һәм ялтырату өчен
борыслар ясыйлар.
Төп состав өлеше алюминий гидроксиды булган бокситларны
алюминий оксиды (глинозем), ә аннан алюминий җитештерү
өчен кулланалар.
? 1. Әче һәм селтеле тирәлекләрдә алюминий нинди ионнар хәлендә була?
Алюминий гидроксидының кислота һәм селте белән реакцияләре тигезлә-
▲ мәләрен языгыз. Ни өчен алюминий гидроксидын тапканда алмашу реакция¬
се өчен көчле селтегә караганда аммиаклы суны куллану яхшырак?
2. Түбәндәге әверелешләрнең тигезләмәләрен төзегез:
Al2O3-AlCl3-Al(OH) 3—KIAl(OH) 4] -Al(OH) S-Al2O3
3. Эремәдә Al3+ ионнары барлыгын нинди реакцияләр ярдәмендә белергә
мөмкин?
4. Ни өчен алюминий водородны судан кысрыклап чыгармый, әмма селте¬
ләрнең судагы эремәләреннән кысрыклап чыгара? Җавапны реакцияләрнең
тигезләмәләрен язып дәлилләгез.
5. Алюминий хлориды гидролизының тигезләмәсен төзегез.
6. Kep содасы Na2CO3 эремәсен, һәм шулай ук сөт-кислоталы әчешү про¬
дуктларын алюминий савытларда сакларга ярыймы? Җавапны реакция¬
ләрнең тигезләмәләрен язып дәлилләгез.
7. 2,1 г алюминий һәм магний катнашмасына селте эремәсе белән тәэсир
иткәндә 1,12 л водород аерылып чыкса, ә шул ук массалы катнашмага
хлорид кислотасы тәэсир иткәндә 2,24 л водород аерылып чыкса (н. ш.),
катнашмадагы алюминий һәм магний порошокларының масса өлешлә¬
рен табыгыз.
28 нче лаборатор дәрес
АЛЮМИНИЙ ҺӘМ АНЫҢ КУШЫЛМАЛАРЫ
1 нче тәҗрибә. Алюминийның кислота эремәләре белән үзара
тәэсир итешүе. Ике пробиркага 2—3 әр кисәк алюминий салы¬
гыз. Бер пробиркага 3—4 мл хлорид кислотасы, ә икенчесенә
3—4 мл сыегайтылган сульфат кислотасы өстәгез. Реакция бар-
маса, пробиркаларны аз гына җылытыгыз. Реакцияләрнең ничек
узуларын чагыштырыгыз. Күзәтүләрегезне аңлатып бирегез.
Реакцияләрнең тигезләмәләрен төзегез.
328
2 нче тәҗрибә. Алюминийның селте эремәләре белән үзара
тәэсир итешүе. Пробиркадагы 2—3 алюминий кисәгенә натрий
гидроксиды эремәсе өстәгез. Реакция күзәтелмәсә, пробирканы
аз гына җылытыгыз. Күзәтүләргә аңлатма бирегез. Җавапны
реакцияләрнең тигезләмәләрен язып дәлилләгез.
3 нче тәҗрибә. Алюминийны пассивлаштыру. Алюминий
пластинканы хлорид кислотасы салынган пробиркага төшерегез.
Процессның ничек узуына игътибар итегез. Пластинканы кисло¬
тадан чыгарыгыз, су белән юдыртыгыз һәм куертылган нитрат
кислотасына төшерегез. Пластинканы нитрат кислотасыннан
чыгарыгыз, су белән юдыртыгыз һәм кабат хлорид кислотасына
төшерегез. Ни өчен бу очракта водород аерылып чыкмый? Кү¬
зәтүләрне аңлатып бирегез. Моның өчен процессларның тигез¬
ләмәләрен төзегез.
4 нче тәҗрибә. Алюминий гидроксидын табу һәм аның кис-
лота-нигез үзлекләрен тикшерү. Алюминий тозының эремәсе бе¬
лән аммиакның судагы эремәсе арасындагы алмашу реакциясе
ярдәмендә алюминий гидроксидын табыгыз. Табылган утырымны
ике өлешкә бүлегез. Аның бер өлешенә хлорид кислотасы, ә икен¬
че өлешенә артыгы белән алынган натрий гидроксиды эремәсен
өстәгез. Нәрсә күзәтелә? Реакцияләрнең тигезләмәләрен төзегез.
Алюминий гидроксидының кислота-нигез үзлекләре нинди?
5 нче тәҗрибә. Алюминий тозларының гидролизы. Экспери¬
менталь рәвештә: а) алюминий хлориды; б) алюминий сульфа¬
ты эремәләренең тирәлек характерын тикшерегез. Күзәтүләргә
аңлатма бирегез.
§ 108. II ТӨРКЕМНЕҢ s-ЭЛEMEHTJIAPbIHA
ГОМУМИ ХАРАКТЕРИСТИКА
Параграфны укырга керешкәнче «Элементлар төркемчәсен өйрәнү өчен бе-
лешмәлекхнен, сорауларына җавап бирегез (72 нче параграфны карагыз).
Периодик системада урнашулары буенча II төркемнең
s-элементларына бериллий Be, магний Mg, кальций Ca, строн¬
ций Sr, барий Ba, радий Ra керә. Бу элементлар бериллий төр¬
кемчәсен тәшкил итәләр. Аларның атомнарының тышкы, валент-
лык катлавында ике электрон бар:
Be Mg Ca Sr Ba Ra
2s2 Зр 4s2 5s2 6s2 7s2
Бу элементларга -|-2 окислашу дәрәҗәсе характерлы.
Д. И. Менделеев периодик системасының күрше төркемчәлә¬
рендәге элементларның үзлекләре белән чагыштырганда, тикше¬
релә торган элементларның химик үзлекләре нинди икән? Берил¬
лий периодик системада типик металл литий белән бор неметалы
арасында урнашкан. Бериллий оксидының һәм гидроксидының
амфотер үзлекләре күрсәтүләрен чамаларга мөмкин.
329
Бериллийга караганда магнийның атомы зуррак һәм аның
ионлашу энергиясе кимрәк. Димәк, бериллий белән чагыштыр¬
ганда магнийда металл элементы билгеләре күбрәк чагылырга
тиеш. Аерым алганда, нәкъ шул сәбәпле, магний оксиды һәм
гидроксиды нигез үзлекләрен күрсәтәләр. Магний гидроксиды
Mg (OH) 2 уртача көчлелектәге нигезләргә керә.
Ca—Sr—Ba—Ra рәтендә атомнар тагын да зураялар һәм
аларның ионлашу энергияләре кими бара. Шунлыктан бу рәттә
металл элементы үзлекләре тагын да көчәя бара. Бу элементлар
иң типик металл элементларына керәләр, аларның оксидлары
һәм гидроксидлары нигез үзлекләрен ачык күрсәтәләр. Аларның
гидроксидлары суда эрүчән, ягъни селтеләр булып торалар.
Оксидларының нигез үзлекләре көчәю турында аларның су
белән тәэсир итешкәндәге җылылык эффектларына карап та
фикер йөртергә була, мәсәлән:
CaO-FH2O = Ca(OH)2, A//= -67 кДж
BaO-FH2O = Ba(OH)2, Atf= -102 кДж
Кальцийны, стронцийны һәм барийны тагын селтеле-җир ме-
таллары дип тә атыйлар. Бу исем аларның оксидлары су бе¬
лән үзара тәэсир итешкәндә селтеләр барлыкка килүгә бәйле
рәвештә бирелгән. Элек бу металларның оксидларын «җирләр»
(«земля») дип атап йөрткәннәр (чагыштырыгыз: глинозем, крем¬
незем) .
Тикшерелә торган металларны ничек табалар?
Химик активлыклары бик көчле булганлыктан, бу металларны
аларның кушылмаларының эретмәләренә электролиз ясап таба¬
лар.
Магнийны һәм кальцийны металлургиядә кайтаручы итеп,
аерым алганда уран металын тапканда кулланалар. Кислород
һәм азот белән реакциягә керә алу үзлегенә нигезләнеп, барий¬
ны газларны йоттыру һәм приборларда югары вакуум булдыру
өчен кулланалар.
Бериллий һәм бигрәк тә магний җиңел эретмәләр җитештерү¬
дә кулланылалар.
? 1. II төркем s-элементларының атом номерларыннан: а) атомнарның ра¬
диуслары; б) атомнарның ике баскычлы ионлашу энергияләре; в) Э2+ ион-
▲ нарының гидратлашу энергияләре; г) металларның атомлашу энергияләре
бәйлелеген чагылдырган графикларны төзегез. Кәкреләргә аңлатма бире¬
гез. Графикларны төзү өчен кирәкле мәгълүматларны кушымтадан табы¬
гыз.
2. Ни өчен Be2+ ионының гидратлашу җылылыгы Ba2+ ионының гид¬
ратлашу җылылыгыннан артыграк?
3. Бериллий оксидының һәм гидроксидының амфотер үзлекләрен күрсәткән
реакцияләрнең тигезләмәләрен төзегез. Селте эремәсендә Be(OH)2- ион¬
нары булуына игътибар итегез.
4. Бериллийның кислота һәм селте эремәләре белән үзара тәэсир итешү
реакцияләренең тигезләмәләрен төзегез.
5. Кальцийны ирекле хәлдә аның тозының судагы эремәсеннән барий белән
кысрыклап чыгару ысулы ярдәмендә табарга мөмкинме?
330
6. Магнийны оксидлаштырып 1 моль MgO тапканда 602 кДж/моль җылы¬
лык аерылып чыга, ә титанны оксидлаштырып 1 моль ТЮг тапканда
944 кДж/моль җылылык аерылып чыга. Магний титанны аның оксидын¬
нан кайтара аламы?
7. 1 кг диңгез суында 0,052 моль Mg2+ ионнары бар. Производстводагы
югалтуларны исәпкә алмаганда, 1 кг: а) магний гидроксиды; б) магнии
металы табу өчен күпме диңгез суы кирәк булыр?
§ 109. КАЛЬЦИЙ
«Химик элементны өйрәнү өчен белешмәлекянең сорауларына җавап бире¬
гез (40 нчы параграфны карагыз).
Кальций — Җир кабыгында иң күп таралган элементларның
берсе. Барыннан да ешрак ул алюмосиликатлар һәм кальцит
СаСОз минералы хәлендә очрый. Кальцит — известьташның,
акбурның һәм мәрмәрнең төп состав өлеше.
Кальций — көмешсыман ак төстәге җиңел металл. Аңа югары
химик активлык (кайтару активлыгы) хас. Җылытканда кальций
һавада яна:
2Са + О2 = 2СаО, ДЖ0
Ул янган вакытта күп җылылык аерылып чыга. Кальций шу¬
лай ук практик яктан барлык неметаллар: водород, азот, күкерт,
графит һ. б. белән үзара тәэсир итешә.
Электрохимик көчәнешләр рәтендә кальций водородтан алда
урнашкан, шуңа күрә ул аны судан этеп чыгара:
Са + 2Н2О = Са2+Н-2ОН-+H2, ДЖ0
Кальцийның кушылмаларыннан аның оксидын һәм гидрокси-
дын тикшереп үтик. Оксиды CaO — ак төстәге авыр эретелүчән
матдә. Техникада аны кальций карбонатын (известьташны) җы¬
лытканда (IOOOoC чамасы) таркатып табалар:
CaCO3^CaO+ СОД, AW= 178 кДж
By — эндотермик процесс, аның югары температурада узу¬
ын энтропия факторы билгели.
Кальций оксидын практикада куллану аның гидроксид бар¬
лыкка китерә алуына бәйләнгән. Кальций оксидының CaO су
белән үзара тәэсир итешүе күп микъдарда җылылык аерылып
чыгу белән уза. Бу вакытта шулкадәр күп җылылык аерылып
чыгадыр ки, хәтта кальций оксидына CaO су белән тәэсир иткән¬
дә су кайный башлый. Шуңа күрә производствода бу реакцияне
сүндерү дип, кальций оксидын — сүндерелмәгән известь дип йөр¬
тәләр, ә кальций гидроксидын сүндерелгән известь дип атыйлар.
Сүндерелгән известьнең, суның һәм комның камырсыман
катнашмасы беркетүче материал (известь эремәсе) итеп кулланы¬
331
ла. һавадан углекислый газны йотып, кальций гидроксиды каль¬
ций карбонатына әверелә:
Ca (OH) 2 + CO2 = CaCO3 + H2O
Бер үк вакытта кремний (IV) оксидының берникадәр өлеше
силикатка әверелә:
Ca (OH) 2 + SiO2 = CaSiO3 + H2O
Катнашма әкренләп катылана («берегә») һәм бик нык масса¬
га әверелә. Известь эремәсен кайчакта төзелештә кирпечләрне
беркетү өчен кулланалар. Сүндерелгән известь эремәсен агарту
алдыннан стеналарны юу өчен файдаланалар.
Кальцийның урта тозларыннан бик азлары гына эри (ку¬
шымтаны карагыз). Аның әче тозлары шактый яхшырак эриләр.
Мәсәлән, кальций фосфаты суда эреми, ә кальций дигидрофос-
фаты эри (87 нче параграфны карагыз). Кислота тәэсир иткәндә
урта тозның әче тозга әверелүен сез беләсез инде, мәсәлән:
Ca3 (PO4) 2 -MH3PO4 = ЗСа (H2PO4) 2
Кальций карбонатының һәм гидрокарбонатының эрүчәнлеклә-
рен чагыштырыйк. Кальций гидроксиды эремәсе аша углерод
(IV) оксиды җибәрик. Эремә болганчыклана — суда эреми тор¬
ган кальций карбонаты барЛыкка килә:
Ca (OH) 2 + CO2 = CaCO31 + H2O
Углерод (IV) оксидын җибәрүне дәвам иттергәндә эремәнең
болганчыклыгы бетә — кальций карбонаты CaCO3 әче тирәлектә
гидрокарбонатка әверелә:
H2OH-CO2 = H2CO3
CaCO3 + H2CO3 = Ca (HCO3) г
Яки суммар рәвештә:
CaCO3 + CO2 + H2O = Ca (HCO3) 2
Кальций гидрокарбонаты бары тик эремәдә генә була. Cy
парга әйләнгәндә ул таркала:
^CO21
Ca (HCO3) 2 = CaCO31 + H2CO3
xH2O
Бу вакытта яңадан кальций карбонаты CaCO3 утырымга
төшә. Табигатьтә кальций карбонатының һәм гидрокарбонаты¬
ның үзара әверелеш процесслары өзлексез булып тора. Углекис¬
лый газ эрегән табигый сулар известьташ ятмалары аркылы үт¬
кәндә кальций карбонаты CaCO3 кальций гидрокарбонатына
Ca(HCO3)2 әверелә. Эрегән кальций гидрокарбонаты сулар бе-
332
124 нче рәсем. Карстлы тау куышлы¬
гындагы сталактитлар.
лән бергә китә. Күп гасырлар
дәвамында бу процесслар из-
вестьташ катламнарында гаять
зур бушлыклар — карстлы тау
куышлыклары барлыкка китер¬
гәннәр.
Җир өслегенә чыккач каль¬
ций гидрокарбонаты Ca(HCOs)2
эрегән сулар парга әйләнәләр,
СОг аерылып чыга һәм СаСОз
барлыкка килә. Кайвакыт каль¬
ций карбонаты гаҗәеп матур
сталактитлар һәм сталагмитлар
рәвешендә катып кала (124 нче
рәсем).
Табигый сулар белән океан¬
га килеп эләккән кальций гид-
рокарбонаты кайбер организм¬
нарның тереклек эшчәнлеге нә¬
тиҗәсендә кальций карбонаты¬
на әверелә, ә ул бу тере орга¬
низмнарның скелеты, кабыр¬
чыклары, панцирьлары соста¬
вына керә. Бу — кальций ку¬
шылмаларының эремәләрдән
аерылып чыгу юлларының бер¬
се. Әйтик, устрица кабырчыгының ясалуы өчен ул үз орга¬
низмы аша үзенең массасына караганда 50 мең тапкыр
күбрәк суны үткәрергә тиеш. Организмнар үлгәннән соң алар-
ның кабырчыклары диңгез төбенә төшеп утыра һәм күп гасырлар
дәвамында кальцитның зур ятмаларын барлыкка китерә. Акбур¬
ны микроскоп аша караганда аның үлгән бик вак организмнар¬
ның кабырчыкларыннан торуын күрергә була.
Известьташ хәлендә кальций карбонаты төзелеш материалы
итеп кулланыла. Аны известь һәм цемент җитештергәндә чимал
сыйфатында да кулланалар. Авыл хуҗалыгында известьташ туф¬
ракның әчелеген киметү һәм аның структурасын яхшырту
өчен, ә известь сөте агачларның кәүсәләрен агарту өчен кулла¬
ныла.
Табигатьтә гипс CaSO4-2Н2О минералы да күп таралган.
Бу минерал бик йомшак, аны тырнак белән дә кырырга мөмкин.
Җылытканда гипсны алебастрга CaSO4-OjSHzO (1 моль кальций
сульфатына CaSO4 0,5 моль су туры килә) әверелдерергә мөм¬
кин.
Алебастрга су өстәп болгатканда катнашма бераздан ката.
Гипс хасил була:
2 [CaSO4-O1SH2O] + ЗН2О = 2 [CaSO4 -2Н2О]
333
Гипсны куллану аның шушы үзлегенә нигезләнгән. Гипстан
әвәләп эшләнә торган бизәү әйберләрен, статуэткалар ясый¬
лар, аны сынган сөякләрнең дөрес ялгануын тәэмин итүче гипс
бәйләвечләр салганда кулланалар. Сүндерелгән известь белән
катнаштырылган алебастрны стеналар штукатурлау өчен фай¬
даланалар.
Э 1. Кальцийны конструкцион материал сыйфатында кулланырга ярыймы?
2. Кальций үсемлек һәм хайван организмнарында бар. Сөяк составына каль-
▲ ций нинди кушылма рәвешендә керә?
3. Кайбер туфракларга хлорид кислотасы тамызганда «кайнау» күзәтелә.
Бу нәрсә белән аңлатыла? Реакция тигезләмәсен төзегез.
4. Энергетик һәм энтропия факторларының тәэсирен исәпкә алып, каль¬
ций карбонатын термик таркатуның шартларын дәлилләгез (66 нчы пара¬
графны карагыз).
5. Элементларның табигатьтәге әйләнешендә тере организмнарның ролен
күрсәтүче сезгә таныш булган мисалларны китерегез.
6. Түбәндәге әверелешләрнең тигезләмәләрен төзегез:
CaCO i->-СаСҺ—>- Са->-СаО->-Са (OH) 2->-СаСОз-*-Са (НСОз) 2-*СаСОз
7. Әгәр суның масса өлеше 30,5% тәшкил итсә, кристаллогидратта 1 моль
кальций нитратына ничә моль су туры килә? Кристаллогидратның форму¬
ласы нинди?
8. Кальций карбонатын термик таркату реакциясенең химик тигезләнешен
авыштыруга: а) температураны төшерү; б) басымны арттыру; в) угле¬
род (IV) оксидының концентрациясен арттыру; г) башлангыч матдәнең
микъдарын арттыру нинди йогынты ясар? Җавапны дәлилләгез.
§ 110. ТАБИГЫЙ СУНЫҢ КАТЫЛЫГЫ
ҺӘМ АНЫ БЕТЕРҮ ЫСУЛЛАРЫ
1. а) Кальций карбонатының гидрокарбонатка әверелүе; б) кальций гид-
рокарбонатының карбонатка әверелүе реакцияләренең тигезләмәләрен төзегез.
2. Сез ничек уйлыйсыз, суны кайнатканда ни өчен юшкын хасил була?
Суның табигатьтә гаять зур эш башкаруын сез беләсез.
Ул тау токымнарын җимерә, гаять күп микъдарларда матдә¬
ләрне урыннан урынга күчерә. Хәтта төче дип аталган суда да
азмы-күпме эрегән матдәләр була.
Табигый төче суларда нигездә Ca2+ һәм Mg2+ катионнары
һәм SO2-, HCOy анионнары була. Моны кальций һәм магний
сульфатларының һәм гидрокарбонатларының суда эрүчән булу¬
лары белән аңлатырга мөмкин. Әгәр суда тозлар бик аз эрегән
булса, ул йомшак су дип, әгәр тозлар күп эрегән булса, ул каты
су дип атала. Йомшак суга мисал сезгә яхшы таныш: ул — яң¬
гыр суы.
Суның карбонатлы һәм карбонатсыз катылыгын аерып йөр¬
тәләр. Карбонатлы катылык суда гидрокарбонатлар булуга бәй¬
ле. Мондый суны кайнатканда гидрокарбонатлар таркалалар:
Ca(HCO3)2 = CaCO3]. + CO2f +H2O
Барлыкка килә торган карбонат савыт стеналарына юшкын
334
рәвешендә утыра. Шулай итеп, карбонатлы катылыкны суны
кайнатып бетерергә була, шунлыктан аны вакытлы катылык
дип атыйлар.
Карбонатсыз катылык кайнатканда суда утырым барлыкка
китерми торган тозлар булуга бәйле. Шуңа күрә аны даими
катылык дип атыйлар.
Каты суга кайбер үзенчәлекле үзлекләр хас. Әйтик, каты
суда сабын начар күбекләнә. Бу нәрсә белән аңлатыла соң?
Сабын — органик кислоталарның натрийлы яки калийлы тозлары
ул. Каты суда сабын катионнар алмашу реакциясенә керә.
Кальцийның һәм магнийның суда эреми торган тозлары барлык¬
ка килә, алар пычранган әйбернең өслегенә, мәсәлән тукыма
җепләре өстенә утыралар. Шул сәбәпле каты суда сабын фай-
дасызга сарыф була.
Әйтелгәннәрне тәҗрибә ясап дәлилләргә мөмкин. Бик каты су эремәсе әзер¬
лик. Моның өчен суда гипс эретик. Каты суга аз-азлап сабын эремәсе агызыйк,
һәр порцияне өстәгәннән соң, стакандагы каты суны яхшылап болгатыйк. Са¬
бын эремәсенең беренче порцияләрен өстәгәндә болгатканнан соң ябалак кар-
сыман утырым — кальцийның һәм магнийның эремәүчән тозлары барлыкка килә,
ә күбек хасил булмый. Утырым барлыкка килү тукталгач кына су йомшара,
эремәдә сабын күбекләре барлыкка килә башлый.
Каты су куллану пар казаннарын эшләтүне кыенлаштыра.
Казаннарның стеналарына юшкын утыра. Юшкын җылыны на¬
чар үткәрә, шуңа күрә суны җылыту кыенлаша, ягулык күбрәк
тотыла (юшкын катлавының калынлыгы 1 мм гына булганда да
ягулык 5% ка артыграк сарыф ителә). Моннан тыш юшкын
пар казанының артык кызуына һәм аның тизрәк тузуына сәбәпче
була.
Суның катылыгын бетерү өчен төрле ысулларны кулланалар.
Химик ысуллар кулланганда Ca2+ һәм Mg2+ ионнары эремәү¬
чән тозлар составына күчереләләр. Әйтик, карбонатлы катылык¬
ны суга кальций гидроксиды (известь сөте) өстәп бетерәләр:
Ca(HCO3)2 + Ca(OH) 2 = 2СаСО3| +2Н2О
Карбонатсыз катылыкны еш кына суга сода өстәү юлы белән
бетерәләр:
CaSO4 + Na2CO3 =CaCO3I + Na2SO4
Суның катылыгын бетерү өчен башка ысуллардан да файда¬
ланалар.
1. Суның катылыгын бетерү өчен кайчакта натрий фосфатын кулланалар.
• Бу тозны куллану нәрсәгә нигезләнгән?
* 2. Ни өчен табигый суда кальцийның һәм магнийның гидрокарбонатлары
була?
3. Дистиллирланган суны ничек табалар?
4. Юшкында карбонатлар барлыгын ничек дәлилләргә була? Өй шартла¬
рында савыт, мәсәлән, чәйнек стеналарындагы юшкынны химик ысул белән
ничек бетерергә мөмкин?
335
5. Каты суны йомшарту өчен составында поташ К2СО3 (20% чамасы)
булган көнбагыш көлен кулланырга мөмкин. 20,0 мг/л Ca2+ һәм 6 мг/л
Mg2+ булган 20 л суның катылыгын бетерү өчен ничә грамм чамасы шун¬
дый көл кирәк булачак?
6. 20 л кальций тозы эремәсенә артыгы белән алынган натрий карбонаты эре¬
мәсен өстәгәндә утырым төшкән. Аны эремәдән аерып алып киптергәннән соң
0,56 г матдә калган. Башлангыч эремәдә Ca2+ ионнарының моляр кон¬
центрациясе нинди?
7. 1120 м3 (н. ш.) водород табу өчен нинди микъдардагы кальций гид¬
ридын су белән тәэсир итеп таркатырга кирәк?
8. Koe суы һәм чишмә суы нинди суларга керәләр: йомшак суларгамы
яисә каты суларгамы? Ни өчен бу сулар тәмле була, ә яңгыр һәм кар суы¬
ның тәме юк?
§ 111. I ТӨРКЕМНЕҢ s-ЭЛEMEHTJlAPbIHA ГОМУМИ
ХАРАКТЕРИСТИКА
«Элементлар төркемчәсен өйрәнү өчен белешмәлекхнең сорауларына җавап
бирегез (72 нче параграфны карагыз).
I төркемнең s-элементлары үзлекләрен тикшерү белән без
периодик системаның төп төркемчәләрендәге элементларны өйрә¬
нүне тәмамлыйбыз. Моннан алдагы материал белән танышканда
сез I төркем s-элементларының һәм аларның кушылмалары үз¬
лекләренең тасвирламасы белән очрашкан идегез инде, s-эле-
ментлар төркемчәсендә чагыла торган гомуми закончалыклар
турында сөйләп бирү һәм аерым элементларның үзлекләрен
һәм аларның кушылмаларын характерлап бирү өчен хәзер сез¬
нең җитәрлек белемнәрегез бар.
Бу параграфтагы материал сораулар һәм аларга җаваплар
формасында бәян ителә. Элек сорауга җавап бирергә тырышы¬
гыз, ә аннары, текстны укып чыгып, җавабыгызның дөреслеген
тикшерегез.
1 нче сорау. I төркемнең s-элементларына нинди элемент¬
лар керә? Алар тәшкил итә торган элементлар төркемчәсен ничек
атыйлар?
Периодик системадан күренгәнчә, I төркемнең s-элементлары-
на литий Li, натрий Na, калий К, рубидий Rb, цезий Cs һәм
франций Fr керә. Бу элементлар литий төркемчәсен (селтеле
металлар төркемчәсен) тәшкил итәләр.
2 нче сорау. Тикшерелә торган элементларның периодик
системада тоткан урыннарына карап, аларның атомнарындагы
тышкы катлауның электроннар конфигурациясен ничек белергә
мөмкин?
Периодик системаның төп төркемчәләрендәге элементлар
(s- һәм р-элементлар) атомнарының тышкы катлауларындагы
электроннар саны бу элементлар урнашкан төркем номерына ти¬
гез була.
Литий төркемчәсе элементлары атомнарының тышкы катла¬
вында берәр электрон урнаша:
336
Li Na К
2s1 3s1 4s1
Rb Cs Fr
5s1 6s1 7s1
Бу элементлар белән периодик системадагы периодлар
(1 нче периодтан тыш) башланалар. Исемнәре аталган элемент¬
ларның һәркайсы үз периодында металл үзлекләре аеруча нык
чагылган элемент булып тора. Моның сәбәпләре сезгә яхшы та¬
ныш.
Үзләре урнашкан периодлардагы башка элементлар белән
чагыштырганда литий төркемчәсе элементларына атомнарының
радиуслары зуррак, ә ионлашу энергияләре азрак булу харак¬
терлы. Шуңа күрә алар кушылмаларында бер уңай корылмалы
ионнар хәлендә булалар. Үзләренең кушылмаларында күбесенчә
ионлы бәйләнеш хасил итәләр.
3 нче сорау. Төркемчәдә атом радиуслары һәм аларның ион¬
лашу энергияләре ничек үзгәрә? Җавапны дәлилләү өчен атом¬
нарының радиуслары һәм аларның ионлашу энергияләре эле¬
ментларның тәртип номерларына бәйле булуын күрсәтүче гра¬
фиклар төзегез (кушымтаны карагыз). Килеп чыккан кәкреләрне
аңлатып бирегез. Li—Na—K—Rb—Cs рәтендә электроннар бе¬
лән тутырыла торган катлаулар саны арткан саен, атомнар
зурая, ә аларның ионлашу энергияләре кими бара.
4 нче сорау. Ни өчен литий төркемчәсендәге элементлар
барлыкка китергән гади матдәләр металлар булып торалар?
Төркемчәдә элементларның атом номерлары арткан саен, селтеле
металларның эретелү һәм кайнау температуралары ничек үзгә¬
рә һәм моны ничек аңлатырга мөмкин?
Селтеле металларның атомнарында дүрт валентлык орбитале¬
нә бер электрон туры килә; моннан тыш, атомнарның ионлашу
энергияләре дә бик аз. Шуңа күрә селтеле металларның атом¬
нары кристаллик челтәргә берләшкәндә металлик бәйләнеш ха¬
сил була. Шул сәбәптән селтеле металлар металлик ялтыравыклы,
йомшак, бик тә пластик булалар, электр тогын һәм җылылыкны
яхшы үткәрәләр. Селтеле металларның эретелү һәм кайнау тем¬
пературалары башка металларның барысы белән диярлек чагыш¬
тырганда да аеруча түбән була.
Кушымтадагы таблицадан күренгәнчә, Li-Na—K—Rb—Cs
рәтендә эретелү һәм кайнау температуралары түбәнәя бара.
Бу металларның атомлашу энергияләре кимүеннән килә. Литий
кристалындагы чагыштырмача зур булмаган атомнар арасында¬
гы металлик бәйләнеш цезий кристалындагы зуррак атомнар ара¬
сындагы бәйләнешкә караганда ныграк.
5 нче сорау. Элементларның атом номерлары арткан саен,
селтеле металларның химик активлыгы ничек үзгәрә? Башка ме¬
таллар белән чагыштырганда селтеле металларның химик актив¬
лыгы нинди? Селтеле металларның химик активлыгы зур икә¬
нен күрсәтә торган реакцияләрнең тигезләмәләрен төзегез. Сел¬
теле металлар табигатьтә ирекле хәлдә очрыйлармы? Натрий
22 П-236
337
металы дымлы һавада калганда нинди реакцияләр булып узар?
Нинди соңгы продукт хасил булыр? Ни өчен янып торган нат¬
рийны су сибеп сүндерергә ярамый?
Li—Na—K-Rb—Cs рәтендә химик активлык (кайтару ак¬
тивлыгы) арта, чөнки металларда химик бәйләнешнең ныклыгы
һәм атомнарның ионлашу энергияләре кими бара.
Селтеле металлар барлык металлар арасында химик яктан
иң зур активлыкка ия булалар. Алар — иң көчле кайтаручы¬
лар. Электрохимик көчәнешләр рәте селтеле металлар белән
башлана. Селтеле металлар барлык неметаллар белән дә дияр¬
лек (водород, галогеннар, кислород, күкерт һ. б. белән) ту-
рыдан-туры үзара тәэсир итешәләр. Аерым алганда, натрийны
һәм калийны, химик активлыклары бик зур булганлыктан, лабо¬
раториядә керосин астында саклыйлар. Бу металларны авызы
эретеп ябыштырылган савытларда күчереп йөртәләр.
6 нчы сорау. Иң типик металл элементының оксидына һәм
гидроксидына нинди үзенчәлекләр хас? Натрий гидроксидының
һәм калий гидроксидының үзлекләрен тасвирлагыз. Аларның
техник атамалары нинди һәм бу нәрсә белән аңлатыла? Литий
гидроксидының һәм натрий гидроксидының ионлашу константа¬
ларын чагыштырыгыз (кушымтаны карагыз). LiOH—NaOH—
—KOH—RbOH—CsOH рәтендә нигезләрнең көче ничек үзгәрә
һәм бу нәрсә белән аңлатыла?
Иң типик металл элементының мөһим үзлеге шуннан гыйба¬
рәт: аның оксиды һәм гидроксиды — нигез үзлекләре күрсәтә
торган, химик яктан актив матдәләр. Әйтик, селтеле металлар-
ның оксидлары су белән бик көчле реакциягә керәләр һәм гид-
роксидлар — көчле селтеләр барлыкка китерәләр.
Лабораториядә һәм техникада киң кулланыла торган натрий
гидроксиды һәм калий гидроксиды — ак төстәге, металл ионна¬
рыннан һәм гидроксид-ионнардан төзелгән кристаллик матдә¬
ләр. Селтеләр гаять гигроскопик үзлекле (су парларын йота¬
лар) һәм шуңа күрә һавада җебиләр. Аларны суда эреткәндә
бик күп җылылык аерылып чыга. Селтеләрнең судагы эремәләре
капшап карауга сабынлы сыман тоела. Алар тирене, тукыма¬
ларны, кәгазьне ашыйлар. Шуңа күрә аларны зәһәр селтеләр
(зәһәр натр NaOH, зәһәр кали КОН) дип атыйлар. Селтеләр
белән бик сак эш итәргә кирәк! Тәнгә эләккәндә селтеләр озак
төзәлми торган җәрәхәтләр китереп чыгаралар. Башка селтеле
металларның гидроксидларына да без тикшереп үткән селтеләр¬
нең үзлекләре хас. Селтеле металлар ионнарының зурая баруы¬
на бәйле рәвештә, LiOH—NaOH—KOH—RbOH—CsOH рәтендә
селтеләрнең көче һәм эрүчәнлеге арта.
? 1. Куркынычсызлык техникасы кагыйдәләрендә тирегә яки күлмәккә эләк¬
кән селтене шунда ук су белән юып төшерергә кирәклеге турында әйтелә.
A Аннары җәрәхәтләнгән урынны нинди дә булса кислотаның (гадәттә серкә
кислотасының) бик нык сыегайтылган эремәсе белән чылатырга һәм юып
төшерергә кирәклеге күрсәтелә. Бу операцияләрнең асылын аңлатып бире¬
гез.
338
2. Франций — радиоактив элемент, аның барлык изотоплары да бик тиз
таркалалар. Францийның үзлекләре турында Li—Na—K—Rb—Cs—Fr рә¬
тендә без өйрәнгән үзлекләрнең үзгәрү закончалыкларына нигезләнеп фи¬
кер йөртәләр, а) Францийның эретелү температурасын; б) францийның кай¬
тару активлыгын (цезийныкына караганда зурракмы яки кимрәкме);
в) францийның оксиды һәм гидроксиды, хлориды, сульфиды һәм гидриды
формулаларын әйтеп бирегез.
3. 40 г калий гидриды су белән реакциягә кергәндә нинди күләмдә (н. ш.)
водород аерылып чыгар? Бу реакцияне оксидлашу-кайтарылу реакциясе бу¬
ларак тикшерегез.
4. Формулалары түбәндә китерелгән матдәләрнең эретелү һәм кайнау тем¬
пературалары нык аерылып торуны ничек аңлатырга мөмкин?
Т. эретелү oC Т. кайнау oC
NaCl 800 1465
Cl2 —101 —34
Na 98 883
5. Сез ничек уйлыйсыз, ни өчен металларның электрохимик көчәнешләр
рәтендә кальций натрийдан алда урнашкан? Na (к)-»-№+ (э) һәм Ca(к)->-
-»-Са2 + (э) күчешләренең энергияләрен чагыштырыгыз.
«СЕЛТЕЛЕ МЕТАЛЛАРНЫҢ КУШЫЛМАЛАРЫН КУЛЛАНУ»
ТЕМАСЫНА КАРАТА КҮНЕГҮЛӘР
Химия курсын өйрәнгәндә сез селтеле металларның күп
кенә кушылмалары белән таныштыгыз, һәм аларның күбесе өчен
куллану өлкәләрен әйтеп бирә аласыз. Моның өчен кирәкле
материалны атамалар күрсәткеченнән таба аласыз.
1 нче бирем. Натрий һәм аның кушылмаларын табу өчен
төп чимал — натрий хлориды. Натрий хлоридын таш тозының та¬
бигый ятмаларыннан чыгаралар һәм диңгез суларыннан табалар.
Безнең илебездә аш тозына бай нинди күлләр беләсез? Бу күл¬
ләр ничек барлыкка килгән?
2 нче бирем. Натрий хлоридыннан натрий металы һәм хлор
табалар. Бу продуктларны табу нинди процессларга нигезлән¬
гән һәм алар промышленностьта ничек үткәреләләр?
3 нче бирем. Натрий хлориды эремәсенә электролиз яса¬
ганда катодта һәм анодта нинди матдәләр аерылып чыга? Химия
промышленностеның нинди продуктын натрий хлориды эремәсе¬
нә электролиз ясап табалар?
4 нче бирем. Нәрсә ул кальцинирланган сода, кристаллик
сода, чәй содасы?
5 нче бирем. Промышленностьта соданы пыяла җитештергән¬
дә кулланалар. Тәрәзә пыяласын табу нинди реакцияләргә нигез¬
ләнгән?
6 нчы бирем. Күп гасырлар элек үк үсемлекләр янганда
барлыкка килә торган көлнең, су белән катнаштырылганда, пыч¬
ранган әйберләрне һәм тукымаларны чистартуын белгәннәр. Соң¬
рак, көлнең судагы сыгынтысын парга әйләндереп, ак төстәге
матдә — поташ К2СО3 тапканнар. Ни өчен көлнең су белән кат¬
нашмасы юу үзлегенә ия?
22*
339
Кальцинирланган соданы Na2CO3 юу матдәсе итеп куллану
аның нинди үзлегенә нигезләнгән?
7 нче бирем. Калий тозларын башлыча нинди максатларда
кулланалар?
8 нче бирем. Сезгә су һәм нитрат кислотасы бирелгән булса,
соданы, акбурны, натрий сульфатын, гипсны эксперименталь рә¬
вештә ничек танып белергә мөмкин?
9 нчы бирем. Составында 7,14 моль нитрат кислотасы булган
эремәне нейтральләштерү өчен 1 кг калий гидроксиды эремәсе
җитсен дисәк, бу эремәдәге селтенең минималь масса өлеше күп¬
ме булырга тиеш?
10 нчы бирем. Менделеев шәһәрендәге Л. Я. Карпов исе¬
мендәге химия заводында: a) BaSO4; б) CaCl2; в) NaHSO3;
г) Na2SO3 җитештерәләр. Сез ничек уйлыйсыз, башлангыч мат¬
дәләр сыйфатында туры килгәнчә: a) BaCl2; б) CaCO3;
в); г) Na2CO3 кулланылса, күрсәтелгән продуктларны җитеш¬
терү нинди реакцияләргә нигезләнгән?
29 нчы лаборатор дәрес
СЕЛТЕЛЕ ҺӘМ СЕЛТЕЛЕ-ҖИР МЕТАЛЛАР
1 нче тәҗрибә. Кушылмаларның ялкын төсен үзгәртүләре.
Селтеле һәм селтеле-җир металларының кушылмаларын танып
белү ысулларының берсе аларның горелка ялкынының төсен үз¬
гәртүләренә нигезләнгән. Дүрт пробиркага 10 ар мл натрий
хлориды, калий хлориды, кальций хлориды һәм стронций хлори¬
ды эремәләрен салыгыз. Тимер чыбыкны хлорид кислотасында
юдыртыгыз, ә аннары горелка ялкынында яхшылап кыздырыгыз.
Чыбыкны натрий хлориды эремәсендә чылатып алыгыз һәм го¬
релка ялкынына кертегез. Ялкын нинди төскә керә? Шул рәвешчә
үк калий, кальций, стронций кушылмаларыннан ялкынның төсе
ничек үзгәрүен тикшерегез.
Ни өчен тимер көпшә буйлап чыга торган водород төссез
ялкын белән яна, ә пыяла көпшәдән чыгучы водород сары ялкын
белән яна?
2 нче тәҗрибә. Натрий һәм калий тозларының гидролизы.
Кислота-нигез индикаторы ярдәмендә түбәндәге тозларның эре¬
мәләренә нинди характердагы тирәлек хас булуын тикшерегез:
натрий (калий) хлориды, натрий (калий) сульфаты, натрий (ка¬
лий) карбонаты, натрий (калий) фосфаты. Күзәтүләрнең нәти¬
җәләрен аңлатып бирегез. Реакцияләрнең тигезләмәләрен язы¬
гыз.
3 нче тәҗрибә. Кальций карбонатының һәм гидрокарбонаты-
ның эрүчәнлекләрен чагыштыру. Кальций гидроксиды эремәсе
салынган (10 мл чамасы) пробиркага эремә болганчыкланганчы
углерод (IV) оксиды җибәрегез. Күзәтүләргә аңлатма бирегез.
Аннары углерод (IV) оксидын җибәрүне эремә үтә күренмәлегә
әйләнгәнче дәвам иттерегез. Бу күренешкә аңлатма бирегез. Pe-
340
акцияләрнең тигезләмәләрен төзегез. Табылган эремәне алдагы
тәҗрибәне үткәрү өчен саклагыз.
4 нче тәҗрибә. Кальций гидрокарбонатының үзлекләре. Мон¬
нан алдагы тәҗрибәдә табылган эремәне өч пробиркага бүлеп
салыгыз. Аларның берсенә — кальций гидроксиды эремәсе (из-
вестьле су), икенчесенә натрий карбонаты эремәсе өстәгез, ә
өченчесен җылытыгыз. Күзәтелгәннәрне аңлатыгыз. Реакцияләр¬
нең тигезләмәләрен төзегез.
5 нче тәҗрибә. Суның катылыгы. Пробиркаларга дистиллир-
ланган су һәм CaSO4 эремәсе салыгыз. Башка ике пробиркага
кальций гидрокарбонаты эремәсе салыгыз. Шул эремә салынган
пробиркаларның берсен кайнап чыкканчы җылытыгыз. Суынган¬
нан соң дүрт пробирканың һәркайсына берничә тамчы үтә кү¬
ренмәле сабын эремәсе тамызыгыз. Кайсы пробиркаларда бол¬
ганчыклану күренә? Күзәтелгәннәрне аңлатып бирегез.
6 нчы тәҗрибә. Кальцийның су белән үзара тәэсир итешүе.
Cy салынган савытка кальций кисәге салыгыз. Күзәтүләргә аң¬
латма бирегез. Табылган эремәне кислота-нигез индикаторы яр¬
дәмендә сынап карагыз. Пыяла көпшә аркылы сулап чыгарыла
торган һаваны барлыкка килгән эремә аша өрдерегез. Күзәтел¬
гән күренешләрдә чагылыш тапкан реакцияләрнең тигезләмәләрен
төзегез.
ХИМИК ЭЛЕМЕНТЛАРНЫҢ Д. И. МЕНДЕЛЕЕВ
ПЕРИОДИК СИСТЕМАСЫНДАГЫ
ЯН ТӨРКЕМЧӘЛӘРНЕҢ ЭЛЕМЕНТЛАРЫ
§ 112. d-ЭЛ ЕМЕНТЛАРГА ГОМУМИ ХАРАКТЕРИСТИКА
I. Химик элементларны нинди билгеләргә карап: а) s-элементларга;
б) р-элементларга; в) d-элементларга бүлеп йөртәләр? 2. а) s-элементларда;
б) р-элементларда; в) d-элементларда кайсы орбитальләрдәге электроннар ва-
лентлык электроннары булып торалар? 3. Элементларның Д. И. Менделеев
периодик системасындагы 4 нче периодның d-элементлары символларын һәм
атамаларын китерегез.
Периодик системаның ян төркемчәләренең элементларына
d-элементлар керә. Бу элементларның характерлы үзенчәлеге
булып, аларның атомнарында валентлык электроннарының тыш¬
кы катлаудагы s-орбиталендә һәм тышкы катлаудан алдагы кат¬
лауның d-орбиталендә урнашулары тора, мәсәлән (периодик сис¬
теманы карагыз):
Sc Ti V Cr Mn Fe Co Ni Cu Zn
3d'4s2 3d24s2 3d34s2 3d54s‘ 3d54s2 3d64s2 3d74s2 3d84s23d104sl3d104s2
Мәгълүм булганча, элементларның үзлекләрен барыннан да
бигрәк атомнардагы тышкы электроннар катлавының структура¬
сы билгели.
d-элементларының атомнарында тышкы электроннар катлавы¬
ның структурасы бертөрле диярлек (1 яки 2 электрон). Шуңа
күрә d-элементларга кайбер уртак үзлекләр хас. Шул ук сәбәп¬
тән периодта d-элементларның үзлекләре, S- һәм р-элементлар
рәтендәгегә караганда, бик үк кискен үзгәрми.
d-элементларның атомнарына ионлашу энергияләренең ча¬
гыштырмача кечкенә кыйммәтләре характерлы һәм аларның атом¬
нарында буш валентлык орбитальләре бар. Шунлыктан d-эле¬
ментларның атомнары бер-берсе белән үзара тәэсир итешкән¬
дә металлик бәйләнеш барлыкка килә (38 нче параграфны ка¬
рагыз). Гадәттәге шартларда d-элементларның гади матдәләре
типик металлардай гыйбарәт.
Периодта янәшә урнашкан d-элементлар катнаш кристаллар
хасил итәләр. Бу d-элементларның электроннар конфигурациялә¬
ре охшашлар һәм аларның атомнары да бер чама зурлыкта.
Әйтик, тимер һәм никель эретелмәсе кристаллашканда катнаш
кристаллар аерылып чыгалар. Катнаш кристаллның челтәре ике
металл атомнары берләшмәләреннән тора (125 нче рәсем).
Катнаш кристаллар — бер металлның икенче металлдагы каты
эремәләре — эретмәләрнең бер төрен тәшкил итәләр.
342
125 нче рәсем. Каты эремә барлыкка килү:
а — A металы; б — В металы; в — A һәм B металларыннан барлыкка килгән
каты эремә.
Каты эремәләр төрендәге эретмәләргә акча ясау өчен кулланыла торган
эретмә керә. Көндәлек тормышта «көмеш акча» дип йөртелә торган акчалар
(10, 15 һәм 20 тиенлек акчалар һ. б.) бакыр һәм никель эретмәсеннән (80% Cu
һәм 20% Ni) эшләнгәннәр. Вак акчалар (5 гиенгә чаклы) бакыр һәм алюминий
эретмәсеннән (95% Cu һәм 5% Al) эшләнгән.
Ә 1. а) Марганец төркемчәсендәге; б) титан төркемчәсендәге; в) бакыр төр¬
кемчәсендәге элементларның символларын һәм аларның атомнарының элект-
A роннар конфигурацияләрен языгыз.
2. Катнаш металлар кристалы (каты эремәләр) барлыкка килгәндә металлик
бәйләнеш ясалуны аңлатып бирегез.
3. Түбәндә кайбер металларның никельдә эрүчәнлеген күрсәтүче мәгълү¬
матлар бирелгән:
Металл
Ni
Co
Fe
Mn
Cr
V
Ti
Ca
Валентлык
электрон¬
3d84s2
3d74s2
3d64s2
3d54s2 3ds4s'
3d34s2
3d24s2
4s2
нары
Атом ра¬
диусы, HM
0,126
0,125
0,126
0,130
0,127
0,134
0,146
0,197
Эрүчәнлек,
моль өлеш¬
ләре, %
—
100
IOll
100
50
43
15
0
Ни өчен Co—Ca
рәтендә металларның никельдә эрүчәнлеге кими?
§ 113. й-ЭЛЕМЕНТЛАРНЫҢ ОКСИДЛАШУ ДӘРӘҖӘЛӘРЕ
1. Түбәндәге кушылмаларда хромның оксидлашу дәрәҗәсе нинди: CrO1
Сг20з, CrO3, Cr(OH) 2, Cr(OH)3, HjCrO4? 2. Cr(OH)2 һәм H2CrO4 кушылма¬
ларының кислота-нигез үзлекләрен тасвирлап бирегез.
d-элементларның атомнарында өлешчә генә тутырылган d-ор¬
битальләре булганлыктан, алар төрле оксидлашу дәрәҗәләре
343
күрсәтәләр. Әйтик, әгәр кремний (3s23p2) +4 оксидлашу дәрәҗә¬
се күрсәтсә, титан (3d24s2) + 2, -4-3, + 4 оксидлашу дәрәҗәләре
күрсәтә (мәсәлән, TiO, Ti2O3, TiO2). Күпчелек d-элементларның
югары оксидлашу дәрәҗәләре үзләре урнашкан төркем номерына
туры килә. (Тимер, кобальт төркемчәсе элементлары, никель һәм
бакыр төркемчәләренең элементлары чыгарма булып торалар).
s-электроннар (d-электроннарга караганда) чагыштырмача җи¬
ңел аерылып киткәнлектән, 4 нче периодның d-элементлары +2
оксидлашу дәрәҗәсе күрсәтәләр.
Бирелгән d-элементның оксидлары һәм гидроксидлары төрле
оксидлашу дәрәҗәләрендә төрле кислота-нигез үзлекләренә ия
булалар. Мәсәлән, хром (3d54s') + 2, +3, Ң-6 оксидлашу дәрәҗә¬
ләре күрсәтә. Бу оксидлашу дәрәҗәләренә түбәндәге оксидлар
һәм гидроксидлар туры килә:
CrO
Cr2O3
CrO3
Cr(OH)2
Cr(OH)3
H2CrO4
Нигез
Амфотер
Кислота
үзлекле
үзлекле
үзлекле
кушылмалар
кушылмалар
кушылмалар
Шундый закончалык күзәтелә: d-элементның оксидлашу дә¬
рәҗәсе югарырак булган саен, аның оксиды һәм гидроксиды
нигез үзлекләрен азрак, ә кислота үзлекләрен күбрәк күрсә¬
тә. Әйтик, Cr(OH) 2 — уртача көчлелектәге нигез, Cr(OH) з—ам-
фотер кушылма, H2CrO4 — хромат кислотасы (көчле кислоталар¬
дан санала, 69 нчы параграфны карагыз).
d-элементларның оксидлашу дәрәҗәләре үзгәрүчән булган¬
лыктан, аларга оксидлашу-кайтарылу реакцияләре характерлы.
Әйтик, 4*6 оксидлашу дәрәҗәсендәге хром кушылмаларына ок¬
сидлаштыру үзлекләре, ә +2 оксидлашу дәрәҗәсендәге хром ку¬
шылмаларына кайтару үзлекләре хас.
Бераз гына сульфат кислотасы өстәлгән калий хроматы
KzCrO4 эремәсенә натрий сульфиты Na2SOa эремәсе салыйк.
Эремәнең төсе үзгәрә. Бу процессның асылы түбәндәге тигезләмә
белән күрсәтелә:
+ 6 4-4 +3 +6
2K2CrO4 H-SNa2SO3 4-5H2SO4 =Cr2(SO4) 3 + SNa2SO4 +
+ 2K2SO4+5H2O
+ 6
+ 3
Cr-
— Cr
2
+ 4
+6
S —
— S
3
+ 6 +4 +3 +6
2Cr+3S =2Cr+3S
Калий хроматы — оксидлаштыручы, ә натрий сульфиты кай¬
таручы ролен уйный.
344
? 1. Ti—Zn рәтендәге элементларның һәркайсы өчен + 2 оксидлашу дәрәҗә¬
сендәге: а) оксид; б) гидроксид; в) сульфат; г) хлорид формулаларын язы-
A гыз.
2. Хром гидроксидларының кислота-нигез үзлекләрен чагылдыра торган
реакцияләрнең тигезләмәләрен языгыз. Кислота-нигез үзлекләре буенча
хром (II) гидроксидының — магний гидроксидына, хром (III) гидроксиды-
ның — алюминий гидроксидына, ә хромат кислотасының сульфат кислотасы¬
на охшаш булуларын игътибарга алыгыз.
3. 3 нче период элементларының югары оксидлашу дәрәҗәләренә туры ки¬
лүче гидроксидларның формулаларын, һәм шулай ук хромның төрле оксид¬
лашу дәрәҗәләрендәге гидроксидлары формулаларын языгыз. Натрий гид-
роксидыннан хлор (VII) гидроксидына күчкәндә кислота-нигез үзлекләре¬
нең үзгәрүен оксидлашу дәрәҗәсе арткан саен хром гидроксидлары үзлек¬
ләренең үзгәрүе белән чагыштырыгыз.
4. Марганецның +2, Ң-4, + 6, +7 оксидлашу дәрәҗәләренә туры килүче
оксидларның һәм гидроксидларның формулаларын языгыз. Марганецның ок¬
сидлашу дәрәҗәсе арту белән аның гидроксидларының кислота-нигез үзлек¬
ләре ничек үзгәрә?
5. Түбәндәге реакция тигезләмәсен ахыргача язып бетерегез:
Cr2O3 +Cl2 + KOH-* K2CrO4 + ...
Бу реакциядәге оксидлаштыручыны һәм кайтаручыны күрсәтегез.
§ 114. КОМПЛЕКСЛЫ КУШЫЛМАЛАР
1. NHjb һәм ОН.У ионнарының донорлы-акцепторлы механизм буенча бар¬
лыкка килүләрен аңлатып бирегез (75 нче һәм 99 нчы параграфларны кара¬
гыз). а) Электроннар доноры; б) электроннар акцепторы төшенчәләренең мәгъ¬
нәләре нидән гыйбарәт? 2. Cr3+ ионының электроннар конфигурациясе нинди?
d-элементларга комплекслы яки координацион кушылмалар
дип аталучы кушылмалар хас. Мондый типтагы кушылмаларга,
мәсәлән, CrCls-GNHa һәм CrCle -3NHs керә. Бу кушылмаларның
төзелеше нинди? Аларның булуын ничек аңлатырга?
Бу сорауларга җавапны эксперименталь һәм теоретик тикше¬
ренүләр бирә. Менә шуларның берсе. Эремәдә хлорид-ионнар
Cl_ барлыгын көмеш нитраты AgNO3 эремәсе ярдәмендә белергә
мөмкин икәнлеге сезгә мәгълүм инде. Әгәр эремәдә Cl- ионнары
булса, көмеш нитраты AgNO3 эремәсе тәэсир иткәндә ак төстәге
көмеш хлориды AgCl утырымы төшә:
Ag++СГ =AgClI
Без өйрәнә торган кушылмаларның эремәләрен тикшергәндә
түбәндәге нәтиҗәләр килеп чыккан. CrCl3-GNH3 кушылмасын
тикшергәндә эремәдә барлык Cl- ионнарының да булуы беленгән
(1 моль CrCl3-GNH3 кушылмага 3 моль С1~ ионнары). Ә менә
CrCl3-3NH3 кушылмасын тикшергәндә бер генә Cl- ионының да
булуы беленмәгән! Бу фактны болай аңлатырга мөмкин. CrCl X
XGNH3 кушылмасында хром (III) атомы алты NH3 молекуласы
белән комплекслы ион [Cr(NH3)6] 3+ хасил итә. [Cr(NH3)6 ] Cl3
кристалы [Cr(NH3)6]3+ һәм Cl- ионнарыннан тора. Ә CrCl3X
345
X3NH3 кушылмасында хром (III) атомы өч NH3 молекуласы
һәм өч Cl атомы белән [Cr(NH3)3Cl3] молекуласына (ком¬
плексына) берләшә. Анда Cl- ионнары юк.
[Cr(NHs) 6 ]3+ һәм (Cr(NHs)SCls] комплекслары үзәгендә
хром (III) атомы урнашкан октаэдр формасында булалар:
NH3
NH3
H3Nz I 4NH3
NH3
Комплекс үзәк атомнан һәм лигандлар дип атала торган
аның тирәсендә координацияләшкән кисәкчекләрдән (молекула¬
лардан, ионнардан, атомнардан) гыйбарәт. Үзәк атом тирәсендә¬
ге лигандлар саны координацион сан дип атала. Без тикшерә
торган мисалларда үзәк атом — хром (III)—Cr (III); аның
координацион саны 6 га тигез. NH3 молекулалары һәм С1~ ион¬
нары лигандлар булып торалар.
Комплекс үзәк атомның һәм лигандларның донорлы-акцеп-
торлы механизм буенча үзара тәэсир итешүе исәбенә барлыкка
килә. + 3 оксидлашу дәрәҗәсендәге хром атомын нейтраль Cr
атомының (3^451 ) өч электронын югалту исәбенә хасил булган
Cr3+ ионы итеп күз алдына китерергә мөмкин:
3d
4s
*Р
Cr (lit),d
Алты пар электронның акцепторы
Cr3+ ионының алты буш орбитале бар. Димәк, хром (III)
алты пар электронның акцепторы булып тора, ягъни алты ли-
гандны — электрон парлары донорларын китереп куша ала, мә¬
сәлән:
Cr3++ 6 :NH3—»
NH3
H3N^ I ^NH3
H3NzI 4xNH3
NH3
Cr3+ + 6 :С|- —
346
Cr3+ + 6 :OH2
OH2
H2O. I OH2
/Crz
H2Oz I zOH2
OH2
3+
Хром (III) алты пар электронның акцепторы булганлыктан,
аның координацион саны 6 га тигез.
Кислоталар һәм селтеләр тәэсир иткәндә амфотер гидрок-
сидларның эрүе комплекслар хасил булу белән аңлатыла. Хром
(III) гидроксидын табыйк һәм аның кислота-нигез үзлекләрен
тикшерик. Хром (III) тозы эремәсенә селте өстәгәндә хром (III)
гидроксидының соргылт-яшел утырымы аерылып чыга:
Cr3+Ң-ЗОН-= Cr(OH)3I
Хром (III) гидроксиды амфотер үзлекле, ягъни кислоталар
белән дә, селтеләр белән дә үзара тәэсир итешә. Хром (III)
гидроксидына кислота тәэсир иткәндә шәмәхә төстәге эремә бар¬
лыкка килә. Бу эремәдә Cr(OH2)6+ комплекслы ионнары була:
Cr(OH) з + ЗН++ЗН2О= [Cr(OH2)6]3+
Хром (III) гидроксидына селте тәэсир иткәндә яшел төстәге
эремә барлыкка килә. Бу эремәдә (Cr(OH)6]3- анионнары була:
Cr (OH) з + ЗОН- = [Cr(OH)6]3-
— гексааквахром (III)
— гексаакваалюминий (III)
—тетрааквабериллий (II)
Лигандлары су молекулаларыннан торган комплекслар аква-
комплекслар дип аталалар:
[Cr(OH2)6]1 +
[AI(OH2)6]3+
[Be(OH2)4]2+
Лигандлары OH группаларыннан торган комплекслар гид-
роксокомплекслар дип аталалар:
[Cr(OH)6]3-
([Al(OH)6I3-
[Be(OH)4]12-
— гексагидроксохромат (III)
— гексагидроксоалюминат (III)
—тетрагидроксобериллат (II)
Аквакомплекслар күп кенә кристаллогидратларда булалар,
мәсәлән: AlCl3-BH2O, CrCl3-BH2O, BeSO4-4Н2О.
Комплекслы кушылмалар бик киң таралганнар. Алар үсем¬
лекләрнең һәм хайваннарның тереклек процессларында мөһим
роль уйныйлар. Шуны гына әйтү дә җитә, гемоглобин составына
тимернең комплекслы кушылмасы керә һәм ул организмда кисло¬
родның күчерелүен тәэмин итә. Хлорофилл — магнийның ком¬
плекслы кушылмасы.
Комплекслы кушылмаларны пигментлар, катализаторлар сый¬
фатында кулланалар. Алар барлыкка килүдән файдаланып, эле¬
ментларны аералар.
347
□ 1. Составларында 1 моль: a) CrCl3-SNHa; б) CrCl3-4NH3 булган эремәләр
бирелгән. Бу эремәләргә көмеш нитраты AgNO3 эремәсе өстәгәндә түбән-
A дәге күренешләр күзәтелә: а) беренче эремәдән 2 моль көмеш хлориды
AgCl утырымы төшә; б) икенче эремәдән 1 моль көмеш хлориды AgCl
утырымы төшә. Cl атомнарының һәм NH3 молекулаларының хром (III)
атомына координацияләшүе нинди? Бу кушылмалар нинди ионнардан то¬
ралар?
2. 1 нче күнегүдә китерелгән комплекслы ионнарның ничек барлыкка килү¬
ләрен аңлатып бирегез.
3. Zn2+ ионының электронлы төзелеше
Ap
ШН ’
схемасы рәвешендә күрсәтелсә, цинк (II) атомының координацион саны
нинди булыр? Амфотер үзлекле цинк (II) гидроксидының кислоталар һәм
селтеләр белән үзара тәэсир итешү реакцияләренең тигезләмәләрен төзегез.
Комплекслы ионнарны атагыз.
4. а) Калий гексагидроксоалюминаты; б) калий гексагидроксохроматы (III);
в) калий тетрагидроксоцинкаты формулаларын төзегез.
5. а) Гексааквахром (III) трихлориды; б) гексаакваалюминий трихлориды;
в) тетрааквабериллий (II) сульфаты формулаларын языгыз.
6. Криолит Na3AlFg — комплекслы кушылма — натрий гексафторалюмина-
ты. Комплекслы ионның структур формуласын төзегез.
§ 115. ТИМЕР
«Химик элементны өйрәнү өчен белешмәлек» буенча тимер химик элементына
характеристика бирегез. Җавап биргәндә тимергә 4-2 һәм 4-3 оксидлашу дә¬
рәҗәләре характерлы булуын исәпкә алыгыз.
Тимер — периодик системаның VIII төркем d-элементы. Аның
атомында сигез валентлык электроны (3d64s2) бар:
3d As Ap
# + + + +
Күпчелек башка d-элементлар кебек үк, тимер үзгәрүчән ок¬
сидлашу дәрәҗәләре күрсәтә. Аңа бигрәк тә +2 һәм 4-3 оксид¬
лашу дәрәҗәләре характерлы.
Гадәттәге шартларда тимер — көмешсыман ак төстәге гаять
пластик, җиңел чүкелүчән металл. Аның эретелү температурасы
югары (1536°С).
Тимер уртача химик активлыктагы металларга керә. Элек¬
трохимик көчәнешләр рәтендә ул водородтан алда урнашкан.
Шуңа күрә хлорид кислотасы һәм сыегайтылган сульфат кисло¬
тасы белән үзара тәэсир итешкәндә водородны этеп чыгара:
Fe-h2H+ =Fe2+ +H2J
348
Бу вакытта + 2 оксидлашу дәрәҗәсендәге тимер тозлары
барлыкка килә, чөнки аерылып чыга торган водород кайтаручы
тирәлек булдыра. Куертылган нитрат һәм сульфат кислоталарын¬
да гадәттәге температурада тимер пассивлаша. Җылытканда,
бигрәк тә вакланган хәлдә, тимер барлык неметаллар белән дә
диярлек оксидлаша. Элегрәк без тимернең кислородта януын
күзәткән идек. Тимер очкыннар чәчеп яна — реакция продук¬
ты — тимер касмагының Fe3O4 кызган кисәкчекләре төрле якка
чәчелеп китәләр. Бу кушылманы тимер (II) һәм тимер (III) ок¬
сидларының катнашмасы FeO-Fe2O3 итеп карарга мөмкин:
3Fe Н-2О2 = Fe3O4
Сезгә тимернең күкерт белән кушылып оксидлашуы да яхшы
таныш.
Тимер (II) оксиды һәм тимер (II) гидроксиды нигез үзлеклә¬
рен күрсәтәләр, ягъни кислоталар белән үзара тәэсир итешәләр:
FeO+ 2Н+= Fe2++ H2O
Fe(OH) 2+2Н+ =Fe2+ +2Н2О
Барлыкка килә торган эремәләрне парга әйләндергәндә Fe2+
тозлары гадәттә кристаллогидратлар рәвешендә аерылып чыга¬
лар, мәсәлән FeSO4 -YH2O {тимер купоросы).
Тимер (III) оксидына һәм тимер (III) гидроксидына амфотер
үзлекләр хас. Гадәттәге шартларда алар кислоталар белән үз¬
ара тәэсир итешәләр:
Fe2O3 + 6Н+ = 2Fe2+ + ЗН2О
Fe(OH) з + ЗН+ =Fe3+ +ЗН2О
Әмма тимер (III) оксиды һәм тимер (III) гидроксиды селте¬
ләр белән бары тик озак җылытканда гына реакциягә керәләр:
Fe(OH)3+ NaOH = Na [Fe(OH)4]
Fe(OH) з+ OH- =Fe(OH)F
Шулай итеп, аларның нигез үзлекләре кислота үзлекләренә
караганда күбрәк чагыла.
Тимер (II) һәм тимер (III) гидроксидларының көчләрен
чагыштырып шуны әйтергә була: Fe(OH)2—уртача көчлелектәге
нигез, ә Fe(OH)3—амфотер үзлекләр күрсәтүче, көчсез нигез.
Әче эремәләрне парга әйләндергәндә кристаллогидратлар
рәвешендә тимер (III) тозлары аерылып чыга, мәсәлән FeCl3X
Х6Н2О.
+ 2 оксидлашу дәрәҗәсендәге тимер кушылмалары кайтару¬
чы үзлекләре, ә +3 оксидлашу дәрәҗәсендәге тимер кушылма¬
лары оксидлаштыручы үзлекләре күрсәтәләр. Тимер (II) гидрок-
сидының һавада тотрыксыз булуы шуның белән аңлатыла.
349
Алмашу реакциясе ярдәмендә тимер (II) гидроксидын та¬
быйк:
Fe2+4-2ОН-=Fe(OH)2I
Яшькелт төстәге ябалак карсыман утырым төшә, һавада бу
утырымның төсе шунда ук үзгәрә башлый — ул көрән төскә керә.
Утырымның төсе үзгәрү тимер (II) гидроксидының һава кисло¬
роды тәэсирендә тимер (III) гидроксидына оксидлашуы белән
аңлатыла:
+ 2 +3
4Fe(OH) 2 + О2 + 2H2O = 4Fe(OH) 3|
+ 2 +3
Fe *- Fe
O -2
O2 -20
4
1
+ 2 O +3
4Fe H-O2 = 4Fe
-2
+ 20
+ 3 оксидлашу дәрәҗәсендәге тимер кушылмаларының ок¬
сидлаштыручы үзлекләрен түбәндәге тәҗрибәдә күзәтергә мөм¬
кин. Тимер (III) хлориды эремәсенә калий иодиды эремәсе са¬
лыйк. Эремәнең төсе үзгәрүен һәм йод аерылып чыгуын күрә¬
без:
2FeCl3 H-2KI = 2FeCl2 + 2КС1 + Һ
+ 3
4-2
Fe
—►Fe
2
I о
21
—*I2
1
+3 -I + 2 О
2Fe + 2I = 2Fe +I2
Кандагы гемоглобинның кислород белән кушылуы тимер ку¬
шылмаларының оксидлашу-кайтарылу реакцияләренә керә алу
үзлекләренә нигезләнгән (114 нче параграфны карагыз). Ycen
җиткән кешенең организмында кушылмалар хәлендә 4 г чамасы
тимер бар. Аз канлылык күзәтелгәндә тимер кушылмаларына
бай булган азыклар (карабодай, алма, салат) ашарга киңәш
ителә.
Тимернең кушылмалары гадәттә төрле төстә булалар. Сос¬
тавында Fe2O3 булган кушылмалар — мумия (кызыл төстә),
охра (сары төстә) минераль буяулар, эмальләр җитештергәндә
пигментлар сыйфатында кулланылалар.
Fe2O3 порошогы магнитлы тасмалардагы информация яз-
дырыла торган катлау составына керә («Физика —9» дәресле¬
ген карагыз). Мондый тасмалар Казанда «Полимерфото» про¬
изводство берләшмәсендә эшләп чыгарыла.
350
? I. Кушымтада бирелгән таблицадагы мәгълүматлардан файдаланып, тимер¬
нең кислоталардан водородны этеп чыгара алуын дәлилләгез (103 нче па-
A раграфны карагыз).
2. Бакча агачлары корткычларына каршы көрәшү өчен бакыр купоросын
кулланалар. Бакыр купоросы эремәсен тимер чиләктә әзерләргә һәм саклар¬
га ярыймы?
3. Ни өчен куертылган нитрат кислотасы белән эшкәртелгән тимер пластин¬
ка бакырны аның тозлары эремәсеннән кысрыклап чыгармый?
4. Fe(OH)J һәм Fe(OH)3 кушылмаларының ионлашу константаларын ча¬
гыштырыгыз (кушымтаны карагыз). Нинди нәтиҗә ясарга мөмкин?
5. Тимер (II) хлориды һәм тимер (III) хлориды гидролизларының тигез¬
ләмәләрен языгыз. Бу кушылмаларның кайсысы күбрәк гидролизлаша һәм
моны ничек аңлатырга була?
6. Түбәндәге әверелешләрнең тигезләмәләрен языгыз:
Fe-*FeCl2-* Fe(OH) 2-* Fe(OH) 3~*Fe2O3-* FeCl3 .
30 нчы лаборатор дәрес
ТИМЕР КУШЫЛМАЛАРЫ
1 нче тәҗрибә. Тимер (II) гидроксидының һәм тимер (IIl)
гидроксидының кислота-нигез үзлекләре. Алмашу реакцияләре
ярдәмендә тимернең гидроксидларын табыгыз. Табылган уты¬
рымнарга кислоталарның һәм селтеләрнең тәэсирен тикшерегез.
Реакцияләрнең тигезләмәләрен төзегез.
2 нче тәҗрибә. Тимер (II) һәм тимер (III) кушылмаларының
оксидлаштыру-кайтару үзлекләре.
а) Тимер (II) гидроксидын табыгыз. Утырымны пыяла таяк¬
чык ярдәмендә болгатыгыз. Утырымның төсе үзгәрүгә игътибар
итегез. Гидроксидны табу һәм аның һавада төсе үзгәрү реакция¬
ләренең тигезләмәләрен төзегез.
б) Тимер (III) хлориды эремәсе салынган пробиркага калий
иодиды эремәсен өстәгез. Бу реакцияләрдә нинди матдәләрнең
кайтаручы сыйфатында, ә кайсыларының оксидлаштыручы була¬
рак катнашуларын күрсәтегез.
3 нче тәҗрибә. Тимер (III) ионнарына сыйфат реакцияләре.
Тимер (III) тозы эремәсенә аммоний роданиды NH4CNS эремәсе
өстәгез. Күзәтүләргә аңлатма бирегез. Тимер (III) роданиды
барлыкка килүне күздә тотып, реакция тигезләмәсен төзегез.
4 нче тәҗрибә. Тимер (Il) тозларының гидролизы. Тимер (II)
сульфаты гидролизлашамы, әллә юкмы? Эксперименталь юл бе¬
лән ачыклагыз. Күзәткәннәргә аңлатма бирегез.
5 нче тәҗрибә. Тимерне пассивлаштыру. Тәҗрибәне суыру
шкафында башкарыгыз. Куертылган нитрат кислотасы салынган
пробиркага бик яхшы итеп чистартылган тимер чыбыкны төшере¬
гез. Реакция тәмамлангач, тимер чыбыкны кислотадан чыгары¬
гыз, суда юдыртыгыз һәм бакыр (II) сульфаты эремәсенә төше¬
регез. Игътибар итегез: реакция барамы? Тимер чыбыкның өсле¬
ген игәү белән ышкыгыз һәм чыбыкны яңадан бакыр (II) суль¬
фаты эремәсенә төшерегез. Күзәткәннәргә аңлатма бирегез.
Реакцияләрнең тигезләмәләрен төзегез.
351
31 нче лаборатор дәрес
«МЕТАЛЛАР»ТЕМАСЫ БУЕНЧА ЭКСПЕРИМЕНТАЛЬ МӘСЬӘЛӘЛӘР
ЧИШҮ
1 нче мәсьәлә. Тимер һәм бакыр металлары электрохимик
көчәнешләр рәтендә кайда: водородтан алда яки водородтан соң
урнашуын эксперименталь юл белән күрсәтегез.
2 нче мәсьәлә. Тимернең һәм бакырның химик активлыгын
тәҗрибә ярдәмендә ничек чагыштырырга?
3 нче мәсьәлә. Алюминийны кулланып, алюминий хлориды
табыгыз.
4 нче мәсьәлә. Тимерне кулланып, тимер (II) хлориды эремә¬
сен табыгыз, аннары тимер (II) хлоридын тимер (III) хлоридына
оксидлаштырыгыз.
5 нче мәсьәлә. Алюминийны кулланып, натрий гидроксо-
алюминаты табыгыз.
6 нчы мәсьәлә. Алюминий гидроксидының амфотер үзлеклә¬
рен тәҗрибәләр ярдәмендә раслагыз.
7 нче мәсьәлә. Кайсы пробиркада натрий хлориды, калий
хлориды, магний хлориды, тимер (II) хлориды, тимер (III) хло¬
риды һәм барий хлориды икәнлеген тәҗрибәләр ярдәмендә бил¬
геләгез.
8 нче мәсьәлә. Пробиркаларның кайсында алюминий сульфа¬
ты, тимер (III) сульфаты һәм тимер (II) сульфаты икәнлеген
билгеләгез.
9 нчы мәсьәлә. Тимер (II) һәм тимер (III) ионнарының ок-
сидлаштыру-кайтару үзлекләрен күрсәтүче реакцияләрне ясагыз.
10 нчы мәсьәлә. Түбәндәге химик әверелешләрне эксперимен¬
таль рәвештә башкару планын төзегез: Cu—>-CiiO--*CuSO.t—>-
-*Cu (OH) 2^-CuO—<-CuC12~*Cu. Эш планын укытучы белән бер¬
гә тикшергәннән соң, тәҗрибәләрне ясарга керешегез.
11 нче мәсьәлә. 2 нче һәм 3 нче лаборатор дәресләрдә ясал¬
ган тәҗрибәләргә аңлатма бирегез. Әгәр җавап бирергә кыен¬
сынсагыз, тәҗрибәләрне ясагыз.
§ 116. ТИМЕР ЭРЕТМӘЛӘРЕ
Сез тимернең нинди эретмәләрен беләсез? Алар кайларда кулланыла¬
лар?
Тимер — хәзерге заман техникасында кулланыла торган төп
металл. Дөнья күләмендә тимер барлык башка металларга кара¬
ганда 20 тапкыр күбрәк җитештерелә. Тимер — йомшак, химик
яктан шактый актив металл. Шуңа күрә саф хәлендә тимерне
кулланмыйлар диярлек, аны төрле эретмәләр рәвешендә файда¬
ланалар.
Күпчелек металларның эретмәләре (бронза, корыч) борынгы
заманнарда ук билгеле булганнар һәм аларны ул вакытта ук
352
киң кулланганнар. Әмма эретмәләрнең составлары һәм бигрәк
тә структуралары бары тик XIX гасыр ахырында һәм XX гасыр
башларында гына өйрәнелгән. Металларның эретмәләре табига¬
тен өйрәнүдә рус галимнәре һәм инженерлары П. П. Аносов,
Д. К. Чернов, H. С. Курнаков, француз галиме А. Ле Шателье,
немец галиме Г. Тамман һәм күп кенә башка галимнәрнең хез¬
мәтләре зур роль уйнаган.
Металлар эретмәсе төрле металларның каты эремәләреннән,
металларның бер-берсе белән булган кушылмаларыннан барлык¬
ка килгән системалардан гыйбарәт. Неметаллар, һәм шулай ук
неметалларның металлардагы каты эремәләре һәм аларның ку¬
шылмалары да эретмәләрнең компонентлары булуы мөмкин.
Тимернең күпчелек эретмәләрендә углерод була. Эретелгән
тимердә 4%ка кадәр углерод эри. Эретмә катканда углеродның
зур булмаган атомнары тимернең кристаллик челтәренә үтеп ке¬
рәләр. Углеродның тимердәге каты эремәсе барлыкка килә. Каты
эремәдә углерод 2% чамасы була. Эретелгән тимердә эрегән
углеродның калган өлеше эретмә каткан вакытта графит һәм ти¬
мер карбиды FesC рәвешендә аерылып чыга. Шулай итеп, тимер
белән углерод эретмәсенең составы һәм структурасы катлаулы
була. Углеродның эретмәдә нинди формада булуына һәм эретмә¬
нең структурасына бәйле рәвештә, бу эретмәнең үзлекләре дә
шактый аерылып торырга мөмкин.
Тимернең углеродлы эретмәләре чуеннарга һәм корычларга
бүленә. Углерод чуеннарда 2% тан артык, ә корычларда 2% тан
кимрәк була.
126 нчы рәсемдә чуен маркаларыннан берсенең микрофото-
рәсеме күрсәтелгән. Фоторәсемдә чуен составындагы графит туп¬
ланмалары күренә. Бу аңлашыла да, чөнки чуенда углерод, ти¬
мердә эри алганга караганда, күбрәк була. Соры чуенда графит
тупланмалары юка буй катламнары рәвешендә урнашалар
мондый чуен уалучан була. Сук¬
кан вакытта ул буй графит
катламнары буйлап ватыла.
Соры чуеннан плитәләр, маши¬
на станиналары һ. б. коялар.
Углеродтан тыш чуенда шулай
ук кремний, фосфор, күкерт һәм
марганец катышмалары да бу¬
ла.
Корычта углерод 2% тан
кимрәк була, шуңа күрә аның
үзлекләре чуенның үзлекләрен¬
нән бик нык аерылып тора. Әй-
(126 нчы рәсем). Шуңа күрә
126 нчы рәсем. Соры чуенның микро¬
скоп аша күренеше.
23 п-236
353
тик, чуеннан аермалы буларак, корычны чүкергә, штамповкаларга
һәм прокатларга мөмкин. Корычның үзлекләре үз чиратында
аның составындагы углерод микъдарына һәм аны термик эшкәр¬
тү ысулларына бәйле була.
Корычтан ясалган пластинканы горелка ялкынының яктыр¬
мыйча янган өлешендә тотканда аның өслеге башта сары төскә,
аннары күксел зәңгәр төскә һәм, ниһаять соры төскә керә. Җы¬
лыту нәтиҗәсендә тимер касмагының БезСҺ юка элпәсендә йө¬
герек төсләр барлыкка килә. Кызарганчы кыздырылган пластин¬
каны тиз генә салкын суга төшергәндә корыч уалучанлык үзле¬
генә ия була. Бөккәндә пластинка сына. Аның каравы ул каты¬
лыгы белән аерылып тора. Мондый корыч кисәге белән сызганда
пыяла өслегендә эз кала.
Корычның, катылыгын саклап, уалучанлыгын киметү өчен,
аны кайтаралар (отпуск). Корычны берникадәр вакыт дәвамын¬
да чагыштырмача югары булмаган температурага кадәр җылы¬
талар. Бу вакытта аның катылыгы үзгәрми диярлек, ә уалучан-
лыгы исә бик күп кими.
Корычны чыныктырганда һәм кайтарганда (отпуск) катлаулы
процесслар булып уза. Әйтик, температура үзгәргәндә тимернең
структурасында да үзгәрешләр күзәтелә. 910° C тан түбәнрәк
температурада а-тимер, ә шуннан да югарырак температурада
ү-тимер тотрыклы була. Тимернең бу формаларына төрле струк¬
туралы кристаллик челтәрләр хас, шуңа күрә аларда углерод
та төрле микъдарларда эри. а-тимердә углерод практик яктан
эреми диярлек, ә ү-тимердә углерод 2% була. Эретмәләрдән
корыч кристаллашканда углеродның ү-тимердәге каты эремәсе
барлыкка килә. Корычны суытканда ү-тимер а-тимергә әверелә.
Әгәр корыч акрынлап суынса, бу әверелеш каты эремәнең угле¬
родсыз тимергә һәм тимер карбидына БезС таркалуы белән бара.
Әгәр корыч тиз суытылса, ү-тимердә эрегән углерод аерылып чы¬
гарга өлгерми. Углеродның а-тимердәге үтә туендырылган эремә¬
се хасил була. Ул корычка катылык, сыгылмалылык, әмма шуның
белән бергә уалучанлык та бирә. Корычны кайтарганда (от¬
пуск) үтә туендырылган эремә өлешчә углеродсыз тимергә һәм
аның карбидына таркала. Әйтелгәннәрне схема рәвешендә болай
күрсәтергә мөмкин:
Тиз
суыну
Эретелмә->-Сның ү-тимердәге Z
каты эремәсе
C ның а-тимердәге
каты эремәсе
(чыныктырылган корыч)
O-Fe-I-Fe3C
(кайтарылган корыч)
(отпуск)
Акрынлап
суыну
Корычларга теге яки бу үзлекне бирү өчен, аларның соста¬
вына башка металларны (һәм шулай ук кремнийны) кертәләр.
Андый корычларны легирланган корычлар дип атыйлар. Легир¬
354
ланган корычларга үзенә бер төрле механик һәм физик-химик үз¬
лекләр хас. Мәсәлән, вольфрам өстәп легирланган корыч бик
каты булуы белән аерылып тора, шуңа күрә аннан инструмент¬
лар һәм кискечләр ясыйлар. Кремний, алюминий, хром кушып
легирлау корычны кызуга чыдамлы итә. Легирланган корычлар¬
ның кайбер төрләре белән без соңрак танышырбыз.
Корычны гадәттә чуеннан, андагы углеродны өлешчә оксид¬
лаштырып җитештерәләр. Чуенны үз чиратында тимер рудала¬
рын кайтарып табалар.
? 1. Ни өчен тимер белән углерод эретмәләренең үзлекләре алардагы угле¬
род микъдарына һәм аның эремәдәге халәтенә бик нык бәйле була?
▲ 2. Гомерның «Одиссея»сында: «Тимерче кызган балтаны яки секираны сал¬
кын суга салуга, тимер шаулап чыжылдый, утта һәм суда чыныкканда ти¬
мер ныграк була»,— дигән юллар бар. (Савицкий Б. M., К л я ч к о ВС.
Металлы космической эры.— M., 1978.) Бу сүзләрнең асылын аңлатып бире¬
гез.
3. Легирланган корычларны һәм аларны куллану өлкәләрен атагыз.
32 нче лаборатор дәрес
ЧУЕН ҺӘМ КОРЫЧ
1 нче тәҗрибә. Чуенның һәм корычның аерымлыклары. Про¬
биркаларның берсенә чуен кисәге, ә икенчесенә корыч вагы салы¬
гыз: аларның массалары бер чама булырга тиеш. Пробиркаларга
2—4 әр мл сыегайтылган хлорид кислотасы өстәгез һәм аз гына
җылытыгыз. Көчле газ аерылып чыгудан туктагач, кислотаның
яңа порциясен өстәгез һәм шул рәвешчә, газ аерылып чыкмый
башлаганчы, дәвам итегез. Кайсы пробиркада карасу төстәге
ябалак карсыман утырым күбрәк төшәр? Күзәтүләрегезгә аңлат¬
ма бирегез.
2 нче тәҗрибә. Корычны чыныктыру һәм кайтару (отпуск).
Тәҗрибә өчен юка корыч пластинка алыгыз. Аның пыяла өсле¬
гендә эз калдыру-калдырмавын тикшерегез. Кыскыч ярдәмендә
пластинканы горелка ялкынына кертегез. Пластинка кызарганчы
кызгач, аны салкын суга төшерегез. Саклык белән генә, кый-
пылчыклары күзгә эләкмәслек итеп, пластинканы бөгеп карагыз.
Күзәтүләргә аңлатма бирегез.
Пластинканы яңадан горелка ялкынына кертегез. Кызганнан
соң, аны ялкыннан чыгарыгыз. Суынгач, тикшереп карагыз,
пластинка бөгеләме, ул пыяла өстендә эз калдырамы? Күзәтү¬
ләргә аңлатма бирегез.
23
355
§ 117. МЕТАЛЛАР КОРРОЗИЯСЕ
Нинди әйберләрдә сезнең тутык күргәнегез бар? Бу предметлар нинди ме¬
таллдан (эретмәдән) ясалганнар?
Табигый шартларда һава, атмосферадагы һәм туфрактагы су¬
лар тәэсирендә металлар акрынлап ашалалар — коррозиягә ду¬
чар булалар (латинча «corrosio» — ашалу сүзеннән). Барыннан
да бигрәк коррозия нәтиҗәсендә тимер һәм аның эретмәләре
бозыла. Җитештерелә торган тимернең һәм аның эретмәләре¬
нең ‘/4 өлеше чамасы коррозиядән килгән зыянны каплауга
тотыла.
Әмма коррозия китерә торган зыян ашалу нәтиҗәсендә ме¬
таллның бозылуы белән генә чикләнми. Труба, пар казаны яки
химик аппарат бик кечкенә урында гына ашалса да бөтен бер
корылма яраксызлана, аны алыштырырга яки ремонтларга кирәк
була. Ә бит зур агрегатны, мәсәлән химия яки нефть химия¬
се производствосын, бер тәүлеккә генә туктатырга туры килгән¬
дә дә югалтулар уннарча мең сумнар белән исәпләнә. Корро¬
зиядән шулай ук әйләнә-тирә дә пычрана. Шулай итеп, корро¬
зиядән килгән зыян металлның бәясеннән йөзләрчә тапкыр ар¬
тыграк була.
Коррозия белән көрәшү өчен, аның сәбәпләрен һәм узу ме¬
ханизмын белергә кирәк. Коррозия нидән була? Металл элемент¬
ларының табигатьтә нинди хәлдә булуларын хәтергә төшерсәк,
бу сорауга җавап бирүе бик җиңел. Табигатьтә алар (сирәк
очраклардан башка) кушылмалар хәлендә очрыйлар. Металл эле¬
ментларының ирекле хәлдә булуы, аларның кушылмалар хәлендә
булуына караганда, энергетик яктан отышсызрак. Химик яктан
караганда коррозия — металларның үзләреннән-үзләре кушылма¬
ларга әверелүләренең оксидлашу-кайтарылу процессы ул.
Ике төрле: химик һәм электрохимик коррозияне аерып йөртә¬
ләр. Химик коррозиягә мисал итеп металларның коры газлар
тәэсирендә оксидлашуларын күрсәтергә мөмкин.
Химик коррозия продуктлары металл өслеген каплап, аны
тагын да оксидлашудан сакларга мөмкин. Алюминий, титан, хром
һавада шундый элпә белән капланалар. Шунлыктан бу металлар-
ны, корычларны кызуга чыдамлырак итү өчен, өстәмәләр рәве¬
шендә кулланалар (корычның оксидлашуга каршы торучанлыгы
арта).
Тимернең химик коррозиясе аны һавада җылытканда күзәтелә.
Оксидлашу исәбенә (600° C та һәм аннан да югарырак темпера¬
турада) тимернең өслегендә касмак барлыкка килә. Анда ярык¬
лар булганлыктан, касмак бик җиңел куба һәм металл тагын да
оксидлашудан саклана алмый.
Вольфрамны электр лампочкаларындагы кыздырма кылны
ясау өчен кулланалар. Әмма ул кызуга чыдам түгел. Лампочка¬
дагы вольфрам кылны алып ялкынга керткәндә, аның өслегендә
356
127 нче рәсем. Металл өслегенең бер¬
төрле булмаган структурасы:
1 — металлның аерым кристаллары;
2 — катышмаларның тупланмалары;
3— металлдагы ярык; 4— саклагыч эл¬
пә; 5— элпәдәге вак тишекләр.
җылытканда парга әйләнә тор¬
ган вольфрам (VI) оксидының
WO3 сары төстәге куныгы хасил
була.
Электрохимик коррозиянең
асылын тикшерик. Белгәнегез¬
чә, металлның өслеге бертөрле
түгел (127 нче рәсем). Анда
төрле катышмаларның туплан¬
малары була. Төп металлның
һәм катышмаларның химик активлыклары төрле. Димәк, металл¬
дан ясалган әйбер электролитка тиеп торса, күп кенә гальваник
элементлар барлыкка килә. Металл әйбер өслегенең аерым өлеш¬
ләре — анод, ә икенче бер өлешләре катод ролен уйныйлар. Металл
әйбер өслегенең анод участоклары ашала. Шулай итеп, металлар-
ның электрохимик коррозиясе микрогальваник элементлар тәэ¬
сире исәбенә була.
Электрохимик коррозиянең иң күп таралган төрләреннән бер¬
се булып гадәти корычның су тирәлегендә һәм һавада тутыгуы
тора. Металлдан ясалган әйберләрнең өслегендә һәрвакыт һава¬
дан адсорбцияләшкән су элпәсе була. Ул — электролит, чөнки бу
суда төрле газлар (СО2, SO2 һ. б.) эрегән була. Тимер карбиды
Fe.jC бөртекләренең химик активлыгы тимернекеннән кимрәк бул¬
ганлыктан, микрогальваник элементлар барлыкка килә: FeeC
бөртекләре — катод, ә саф тимер бөртекләре анод ролен уйный¬
лар. Тимер ашала — ул тутыга. Бу вакытта гаять катлаулы про¬
цесслар булып уза. Реакциянең бары тик суммар тигезләмәсен
генә языйк:
4Fe + ЗО2 + 2пНгО = 2РегОз • пНгО
Тутыкның составы төрле була: РегОз-пНгО.
Тутык барлыкка килүне болай аңлатырга мөмкин. Анод (тимер) участокла¬
рында тимер оксидлаша:
Fe = Fe2+ + 2е
Электроннар катодларга (углерод, тимер карбиды тупланмаларына) күчә¬
ләр, һәм катод участокларында
O2-HH+-He=2Н2О
процессы була.
Fe2+ ионнары су катнашында кислород белән оксидлашалар һәм тутык
барлыкка килә:
357
4Fe2+ + O2 + 4HzO + 2nH2O = 2Fe2O3 • nH2O + 8H +
Тасвирланган реакцияләрнең тигезләмәләрен кушсак, сезгә таныш булган ти¬
гезләмә килеп чыгар:
4Fe + ЗО2 + 2 ZiH2O = 2Fe2O3 • ZiH2O
Шулай итеп, тимернең тутыгу процессында кислород һәм
су катнаша. Кислород булмаса, тимер суда коррозиягә бирешми.
Шул ук вакытта дым булмаса, кислородка баетылган сыек май¬
ларда да тимер коррозиягә бирешми. Тозлар тәэсирендә тимер
тизрәк тутыга. Автомобильләрнең кышын көчлерәк тутыгуын шу¬
ның бүлән аңлатырга мөмкин, чөнки кышын бозлавыкны бетерү
өчен юлларга аш тозы сибәләр.
? 1. Тимердән ясалган әйбер өслегендә бакыр тупланмалары булсын ди. Бу
әйбернең хлорид кислотасындагы коррозиясен нинди процесслар китереп
чыгара?
A 2. Микрогальваник элементлар катнашындагы процессларны акрынайту
ысулларын тәкъдим итегез.
§ 118. METAJIJIAPHbl КОРРОЗИЯДӘН САКЛАУ
Тимердән ясалган әйберләрне тутыгудан саклауның үзегезгә билгеле бул¬
ган ысулларын әйтеп бирегез.
Сезгә коррозиянең асылы таныш. Шундый сорау туа: металл
өслеген, ә шулай булгач металл әйбернең үзен дә, коррозиядән
нинди ысуллар кулланып сакларга мөмкин? Билгеле, металлның
өслеген электролитлар белән орынмаслык итеп капларга яки мик¬
рогальваник элементлар катнашындагы процессларны тоткар¬
ларга кирәк.
Металларны коррозиядән саклау өчен, аларны лаклар һәм
буяулар белән каплыйлар. Әмма буяулар һәм лаклар мәңгелек
түгел, әйберләрнең өслеген яңадан буярга яки лак белән кап¬
ларга кирәк була. Моңа кул хезмәте куела, күп кенә лаклар
һәм буяулар сарыф ителә. Париждагы Эйфель башнясын буяу¬
га, аны төзүгә караганда, күбрәк чыгымнар тотылуын исәпләп
белгәннәр.
Корычны һәм чуенны коррозиядән саклау өчен кулланыла
торган неметалл капламалардан эмаль зур әһәмияткә ия. Эмаль
металл оксидлары өстәлгән силикат пыяласыннан гыйбарәт. Аны
материал өслегенә порошок хәлендә сиптерәләр һәм 500—
IOOOoC та яндыралар.
Эмаль капламалар селтеләр һәм кислоталар тәэсиренә чыдам
булалар, атмосфера тәэсирендә коррозиягә бирешмиләр. Ләкин
бәрелгәндә эмаль бик тиз ватыла. Эмальне йорт хуҗалыгы әй¬
берләрен һәм санитария техникасын каплау өчен киң куллана¬
лар. Биредә эмальнең термик чыдамлылыгын, декоратив булуын,
ансат чистартылуын исәпкә алалар.
358
128 нче рәсем. Протектор ярдәмендә саклау: а) металл конструкцияләрне;
б) судно корпусларын.
Металларны коррозиядән саклау (һәм аларның тышкы күре¬
нешен матурлау) өчен элек-электән металл капламалар куллана¬
лар. Тимернең өслеген цинк, аккургаш, никель, хром һ. б. белән
каплыйлар.
Башка металл ярдәмендә металлны коррозиядән икенче ысул¬
лар белән дә сакларга мөмкин. Мәсәлән, тимердән ясалган әй¬
берне яки корылманы үткәргеч ярдәмендә активрак булган ме¬
талл кисәге белән (128 нче рәсем, а), мәсәлән магний белән,
тоташтырганда гальваник элемент барлыкка килә. Бу вакытта
корылма (тимер) —катод, ә активрак булган металл анод ролен
уйный. Анод ашала, ә катод — коррозиядән саклана торган ме¬
талл — үзгәрми. Бу ысул, мәсәлән диңгез суы тирәлегендәге суд¬
ноларның корпусларын һәм корабльләрнең винтларын (128 нче
рәсем, б), җир астына салына торган трубаларны һ. б. коррозия¬
дән саклау өчен уңышлы кулланыла. Металларны коррозиядән
саклауның бу ысулы протектор ярдәмендә саклау дип атала.
Коррозия белән көрәшү ысулларының берсе ингибиторлар
куллануга нигезләнгән. Бу химик кушылмалар бик аз гына микъ¬
дарларда да коррозияне тулысынча диярлек туктаталар. Кай¬
бер очракларда ингибиторларны куллану аппаратураны тутык¬
мый торган корыч урынына гадәти корычтан ясарга мөмкинлек
бирә.
Металларның коррозиясе белән көрәшүнең иң нәтиҗәле юнә-
лешләреннән берсе — коррозиягә чыдам эретмәләр булдыру. Ту¬
тыкмый торган корычлар бик күп җитештерелә. Аларның составы¬
на тотрыклы саклагыч оксид элпәләре хасил итүче металлар (хром,
никель) керә. В. И. Мухинаның атаклы «Эшче һәм колхозчы»
скульптурасы хром-никель корычтан коелган. Бу скульптура
359
Мәскәүдә Бөтенроссия күргәзмәләр үзәге янында куелган. (Ул
һәркемгә «Мосфильм» киностудиясенең эмблемасы буларак та
яхшы таныш.)
Техника үсеш алган саен һәм промышленностьның яңа тар¬
маклары барлыкка килү белән металл материалларына да һәм
аларны коррозиядән саклауга да таләпләр арта бара. Азот про¬
мышленностеның көчле үсеше производствода тутыкмый торган
корычны киң куллануга бәйле, чөнки бу тармактагы төп аппа¬
ратлар нәкъ шул эретмәдән ясала.
Металлардай эшләнгән яңа материалларны кулланмыйча
атом энергиясеннән файдалану, галәм киңлекләрен үзләштерү
дә мөмкин булмас иде.
? 1. Ни өчен тимерне цинк (цинкланган тимер) һәм аккургаш (аккургаш
йөгертелгән тимер) белән каплыйлар? Әгәр тимердән ясалган әйберләр өс-
A легендәге шул капламалар бозылса, мәсәлән тимернең үзенә кадәр үтеп
керерлек итеп тырналган булса, тимер әйбергә нәрсә булыр?
2. Куертылган сульфат кислотасын корыч цистерналарда күчереп йөртергә
ярыймы? Әгәр цистерна ачык килеш запас юлларда калдырылган булса,
цистерналарның эчен тикшергәндә ачык ут (янып торган шырпы, шәм)
куллану ни өчен куркыныч? Цистерна стенкаларында коррозия эзләре кү¬
ренерме? Җавапны дәлилләү өчен реакция тигезләмәләрен языгыз.
33 нче лаборатор дәрес
КОРРОЗИЯ ҺӘМ METAJlJlAPHbI КОРРОЗИЯДӘН
САКЛАУ
1 нче тәҗрибә. Микрогальваник элементларның тәэсире.
Ике пробиркага чама белән бер үк зурлыктагы берәр цинк бөр¬
теге салыгыз һәм сыегайтылган сульфат кислотасы өстәгез. Реак¬
циянең тизлегенә игътибар итегез. Пробиркаларның берсенә
1—2 тамчы бакыр сульфаты эремәсе өстәгез. Нәрсә күзәтәсез?
Аңлатма бирегез.
Икенче пробиркадагы цинк бөртегенә бакыр чыбык белән
орыныгыз. Реакциянең тизлегенә ул нинди йогынты ясый? Газ
кайсы металл өслегендә аерылып чыга? Күзәтүләргә аңлатма би¬
регез. Бара торган химик процессларны реакция тигезләмәләре
ярдәмендә күрсәтегез.
2 нче тәҗрибә. Протектор ярдәмендә коррозиядән саклау.
Цинк бөртеген пробиркага салып эрегәнче җылытыгыз һәм
эретелмәгә очы шкурка ярдәмендә яхшылап чистартылган тимер
чыбык төшерегез. Тимер чыбыкның очы цинк белән каплана.
Тимер чыбыкны һәм очы цинк белән капланган тимер чыбык¬
ны сульфат кислотасының 10% лы эремәсенә төшерегез. 10—
20 минуттан соң нәрсә күзәтелә? Күзәтүләргә аңлатма бирегез.
3 нче тәҗрибә. Коррозия ингибиторлары. Ике пробиркага
1,5—2 мл хлорид кислотасы салыгыз һәм берсенә */г уротропин
таблеткасы өстәгез. Аннары һәр пробиркага яхшылап чистартыл¬
ган тимер чыбыклар төшерегез. Реакцияләрнең тизлеген уротро-
360
пин катнашында һәм уротропинсыз очраклар өчен чагыштыры¬
гыз. Күзәтүләргә аңлатма бирегез.
4 нче тәҗрибә. Корычны оксидлау. Наждак кәгазе белән
ике корыч пластинканы чистартыгыз. Аларның берсен йөгерек
төсләр хасил булганчы, ягъни оксид элпәсе барлыкка килгәнче
кыздырыгыз. Оксидланган һәм оксидланмаган пластинкаларга
берәр тамчы бакыр (II) сульфаты эремәсе тамызыгыз. Пластин¬
каларда карасу таплар хасил булу тизлеге буенча оксид элпәсе¬
нең саклагыч үзлекләрен бәяләгез. Реакцияләрнең тигезләмәлә¬
рен төзегез.
МЕТАЛЛУРГИЯ
§ 119. МЕТАЛЛАР ТАБУНЫҢ ГОМУМИ ПРИНЦИПЛАРЫ
Металларны аларның кушылмаларыннан табу нинди процесска нигезләнгән:
оксидлаштыругамы, әллә кайтаругамы? Җавапны дәлилләү өчен бакырны ба¬
кыр (II) оксидыннан: а) водород белән; б) углерод (II) оксиды белән тәэсир
итеп табу реакцияләренең тигезләмәләрен төзегез.
Металлар һәм аларның эретмәләре — хәзерге заман техни¬
касында кулланыла торган мөһим конструкцион материаллар бу¬
лып торалар. Хәзерге вакытта техникада берничә мең төрле эрет¬
мәләр кулланыла. Аларның составларында бер-берсе белән төрле¬
чә кушылган барлык химик элементлар да диярлек очрый.
Әлбәттә, теге яки бу металлны яисә эретмәне куллану аның
механик, физик һәм химик үзлекләренең практик әһәмиятенә
бәйле. Әмма металлны киң куллану мөмкинлеге чималны эшкәр¬
түнең арзанлы һәм аның запаслары күп булуы белән дә билге¬
ләнә.
Табигатьтә металлар башлыча кушылмалар хәлендә очрый¬
лар. Фәкать химик активлыклары зур булмаган металлар гына
(затлы металлар) табигатьтә ирекле хәлдә очрыйлар (платина
төркемчәсе металлары, алтын, бакыр, көмеш, терекөмеш). Кон¬
струкцион металлардай табигатьтә җитәрлек күп микъдарда ти¬
мер, алюминий, магний кушылмалары гына таралган. Алар ча¬
гыштырмача бай рудаларның зур ятмаларын барлыкка китерә¬
ләр. Бу исә аларны күпләп чыгарырга мөмкинлек бирә.
Кушылмаларда металлар оксидлашкан хәлдә булганлыктан
(уңай оксидлашу дәрәҗәсендә булалар), аларны ирекле хәлдә
табу кайтару процессына нигезләнә:
+ п 0
Me ►Me
Бу процессны химик яки электрохимик юл белән тормышка
ашырырга мөмкин.
Химик ысул белән кайтарганда кайтаручы итеп барыннан да
ешрак күмер яки углерод (II) оксиды, һәм шулай ук водород, ак¬
тив металлар, кремний кулланыла. Тимерне (домна процессын¬
да), күп кенә төсле металларны (аккургашны, кургашны, цинкны
һ. б.) углерод (II) оксидын кулланып табалар:
Fe3O4 + 4С0 = 3Fe + 4СО2
362
ZnO + CO = Zn + CO2
Водород белән кайтару, мәсәлән, вольфрам (VI) оксидын¬
нан вольфрам тапканда файдаланыла:
WO3+3H2 = W + 3H2O
Кайтаручы сыйфатында водородны куллану аеруча саф ме¬
талл табарга мөмкинлек бирә. Водородны бик тә чиста тимер,
бакыр, никель һәм башка металларны тапканда кулланалар.
Металларны башка металлар ярдәмендә кайтарып табу ысу¬
лы металлотермия ысулы дип атала. Бу ысул кайтаручы сый¬
фатында актив металларны куллануга нигезләнгән. Металлотер¬
мии реакцияләргә мисаллар:
алюминотермия:
Cr2O3 Ң-2А1 = 2Сг 4-Al2O3
магниетермия:
TiCl4 +2Mg = Ti 4-2MgCI2
Металларны барыннан да ешрак оксидларыннан кайтарып
табалар. Ә оксидларны табигый рудалардан аерып алалар. Баш¬
лангыч рудаларда сульфидлы минераллар булса, аларны янды¬
рып оксидлаштыралар:
2ZnS + 3O2=2ZnO + 2SO2t
Металларны электрохимик ысул белән тапканда тиешле ку¬
шылмаларның эретел мәл әренә электролиз ясыйлар. Аеруча актив
металларны — селтеле һәм селтеле-җир металларны, алюминий¬
ны, магнийны шулай табалар.
Электрохимик кайтару ысулын башка ысуллар белән табыл¬
ган «эшкәртелмәгән» металларны (бакырны, никельне, цинкны
һ. б.) рафинирлау (чистарту) өчен дә кулланалар. Электрохимик
рафинйрлау вакытында катышмалары булган металлны (карала¬
ма металлны) анод итеп, ә шул металлның кушылмасы эремә¬
сен электролит итеп алалар.
Металларны югары температураларда табу ысулларын пиро¬
металлургия. ысуллар дип атыйлар (грекча «руг» — ут сүзен¬
нән). Бу ысулларның күбесе борынгы заманнардан ук билгеле.
XIX—XX гасырлар арасында металларны гидрометаллургия ысул¬
лар белән табу үсеш ала башлый (грекча hydor — су сүзеннән).
Бу ысулларны кулланганда рудадагы компонентларны судагы
эремә халәтенә күчерәләр, ә аннары электрохимик яки химик
кайтару ысулы белән металлны аерып алалар. Мәсәлән, бакырны
шулай табалар. Составында бакыр (II) оксиды CuO булган ба¬
кыр рудасын сыегайтылган сульфат кислотасы белән эшкәртәләр:
CuO + H2SO4 = CuSO4 + H2O
363
Бакырны кайтару өчен табылган бакыр (II) сульфаты эремә¬
сенә электролиз ясыйлар, яисә эремәгә тимер порошогы белән
тәэсир итәләр.
Гидрометаллургик ысулның киләчәге зур, чөнки руданы җир
астыннан чыгармыйча да продукт табу мөмкинлеге бирә. (Метал-
ларны гидрометаллургик ысул белән табуның өстенлекләрен таш¬
күмерне җир астында газификацияләү белән чагыштырыгыз.)
? 1. Титан — химик яктан актив металл. Югары температурада кислород бе¬
лән һәм хәтта углерод белән дә үзара тәэсир итешә. Бу вакытта тиешле ти¬
тан оксиды TiOs һәм титан карбиды TiC барлыкка килә. Промышленность-
A та титанны аның хлоридыннан TiCh магний белән аргон атмосферасында
кайтарып табалар. Ни өчен титанны оксидыннан TiOs углерод яки магний
белән кайтарып тапмыйлар? Ни өчен титанны аргон атмосферасында таба¬
лар?
2. Водород белән (водородотермия): а) тимер (H) оксидын; б) никель (II)
оксидын кайтару реакцияләренең тигезләмәләрен төзегез.
3. а) Ванадий (V) оксидыннан ванадийны кальциетермия ысулы белән та¬
буның; б) ванадийны ванадий (III) хлоридыннан магниетермия ысулы бе¬
лән табуның; в) хромлы тимерташтан FeO-CrsOa углетермия ысулы белән
эретмә (феррохром) табуның тигезләмәләрен төзегез.
4. Кадмий сульфаты эремәсеннән кадмий табу өчен гидрометаллургиядә
цинк тузанын кулланалар. Бу металларны табу нинди реакцияләргә нигез¬
ләнгән?
5. Хәзерге вакытта цинкны пирометаллургии һәм гидрометаллургик ысул¬
лар ярдәмендә җитештерәләр. Башлангыч чимал итеп составларында цинк
сульфиды булган рудалар алынса, бу ысуллар нинди химик реакцияләргә
нигезләнәләр?
§ 120. ЧУЕН ҖИТЕШТЕРҮ
Тимерне углерод (II) оксиды белән тимер (III) оксиды үзара тәэсир итеш¬
кәндә табу реакциясенең тигезләмәсен языгыз.
Тимер —Җирдә таралышы ягыннан икенче урында (алюми¬
нийдан соң) торучы металл. Тимер башлыча тимер рудаларының
зур ятмаларын тәшкил итүче оксидлар хәлендә очрый. Промыш¬
ленность өчен кызыл тимерташ РегОз һәм магнитлы тимерташ
РезС>4 кебек рудаларның әһәмияте зур. Курск өлкәсендәге, Кри¬
вой Por тирәсендәге, Якутиядәге, Уралдагы һ. б. урыннардагы
чыганакларда тимер рудаларының мул запаслары ята. Тимер ру¬
далары запасы буенча безнең илебез дөньяда беренче урынны
алып тора.
Тимер рудасында буш токым — кремнийның, фосфорның, алю¬
минийның кислородлы кушылмалары, һәм шулай ук күкертнең
һәм кайбер металларның кушылмалары да була.
Чуенны домна мичләрендә җитештерәләр (VII төсле рәсемне
карагыз). Чуен табу рудалардагы оксидлардан тимерне кайтару
һәм буш токымны шлакка чыгару процессларыннан тора.
Табигый кушылмалардан тимерне ничек кайтаралар? Тимерне
рудалардан кайтару өчен кокс кулланыла. Кокс янганда темпера¬
тура бик югары күтәрелә.
364
C-I-O2 = CO2, А// со
Кызган кокс аша узганда, углерод (IV) оксиды СОг углерод (II)
оксидына CO әверелә:
С + СО2^2СО, АЯ>0
Югары температурада углерод (II) оксиды тимер оксидларын
кайтара, мәсәлән:
Fe2O3 + 3CO^-2Fe + ЗСО2
Тимер өлешчә углерод һәм углерод (II) оксиды белән үзара
тәэсир итешә һәм тимер карбиды Fe3C барлыкка килә. Тимер
углеродны, һәм шулай ук тимер карбидын үзендә эретә.
Рудада һәм кокста булган катышмалар белән дә катлаулы
үзгәрешләр булып уза. Югары температурада кушылмалардан
өлешчә кремний, фосфор, күкерт кайтарыла һәм алар шулай ук
тимердә эриләр. Барлык шушы процесслар нәтиҗәсендә чуен —
тимернең углерод, кремний, фосфор, күкерт белән булган һәм кай¬
бер кушылмалар катнашкан эретмәсе барлыкка килә.
Ә чуенның буш токымнан аерылуы ничек бара соң? Буш токым
шлакка — силикатларның, фосфатларның, алюминатларның, алю¬
мосиликатларның җиңел эретелүчән эретмәсенә күчә. Буш токым¬
ны шлакка чыгару өчен рудага флюслар өстиләр. Гадәттә флюс
сыйфатында известьташ (CaCO3) кулланыла. Югары температу¬
рада кальций карбонаты таркала:
CaCO3 = CaOH-CO2
Кальций оксиды буш токым белән реакциягә керә:
CaO-FSiO2 = CaSiO3
SCaO-FP2O5=Ca3(PO4)2 һ. б.
Эретелгән шлакның тыгызлыгы сыек чуенныкына караганда ким¬
рәк — шлак чуеннан аерылып өскә калкып чыга.
Хәзерге заман домна миче —30 метр һәм аннан да артык
биеклектәге вертикаль шахталы мичтән гыйбарәт (VII төсле рә¬
сем). Безнең илебездә дөньяда иң зур булган домна мичләре тө¬
зелде, аларның эчке күләме 5000 м3 га кадәр җитә. Мичнең корпу¬
сы табаклы корыч белән тышланган, ә эчтән утка чыдамлы кирпеч
белән капланган.
Домна миче ничек эшли? Домна миченә өстән шихта (руда,
кокс һәм флюслар) тутыралар (VII төсле рәсем). Астан мичкә
кислородка баетылган һава өрдерәләр. Домна миченең аскы өле¬
шендә кокс яна. Домна миче эшләү процессында каршы агым
принцибы тормышка ашырыла. Шихта акрынлап аска төшә, ә җы¬
лы газлар астан өскә хәрәкәт итәләр. Шул рәвешчә җылылык ал¬
машу һәм реагентларның каршы агымы кулланыла. Мичнең төрле
температура зоналарында чуен һәм шлак хасил булу процесслары
бара.
365
Шлак чуен өстенә калкып чыга һәм тимерне мичкә өрдерелә
торган кислород белән оксидлашудан саклый. Чуенны һәм шлакны
мичнең аскы өлешендәге тишек аша чыгаралар. Домна шлагын
нигездә төзелештә кулланалар. Мичтән чыга торган газда угле¬
род (II) оксиды була, шуңа күрә домна газын ягулык итеп кулла¬
налар. Домна мичләре — өзлексез эшләүче аппаратлар. Бер эшлә¬
тә башлаганнан соң мич берничә ел өзлексез продукция бирә.
Домна процессының югары тизлектә узуын һәм мичнең югары
җитештерүчәнлеген ничек тәэмин итәргә? Сез температура күтә¬
релгәндә реакциянең тизлеге артуын беләсез инде. Шуңа күрә дом¬
на процессын мөмкин кадәр югарырак температурада үткәрәләр.
Кокс яну процессларын интенсивлаштыру һәм югары температура¬
ны саклау өчен домна миченә кислородка баетылган һава өрдерә¬
ләр (кислород өрдерү). Мичкә кертелә торган һаваны һава җылыт¬
кычларда домна газының җылысы исәбенә алдан җылыталар.
Соңгы вакытларда домна мичендә газсыман ягулык (CH4)
куллана башладылар. Табигый газ янганда
CH4 + 2О2 = CO2 4-2Н2О, ЬН<0
бик күп җылылык аерылып чыга. Моннан тыш, домна газы кайта¬
ручыларга байый (CO, H2), чөнки кызган кокс табигый газның
яну продуктлары белән реакциягә керә:
C + СО2=й±2СО, ЬН>0
С + Н2О^СО + Н2, ДЯ>0
Шулай итеп, кислородны һәм табигый газны куллану реакция¬
нең тизлеген арттыруга һәм домна миченең җитештерүчәнлеген
күтәрергә мөмкинлек бирә.
Домна мичендә бара торган күпчелек реакцияләр — гетеро¬
ген реакцияләр. Аларның тизрәк һәм тулырак узуы нинди фак¬
торларга (температурадан тыш) бәйләнгән? Билгеле, реагирлашу-
чы матдәләрнең орыну өслекләрен арттырырга кирәк. Шунлык¬
тан мичкә тутырганчы шихтаның компонентларын ваклыйлар
һәм билгеле бер зурлыктагы кисәкләрне сайлап алалар. Бик вак
һәм тузансыман руда кисәкчекләрен һәм флюсларны бергә кат¬
наштыралар һәм җылытып укмаштыралар.
Мичнең җитештерүчәнлеген күтәрү өчен тимер рудасын алдан
баеталар — буш токымны аерып алып, тимер оксидларының кон¬
центрациясен арттыралар. Шихтаны хәзерләү, аны мичкә тутыру,
шлакны һәм чуенны мичтән чыгару операцияләренең барысы да
механикалаштырылган.
Домна процессы белән идарә итү һәм оптималь эш режимы
булдыру автоматлаштырылган тикшерү-үлчәү приборлары ярдә¬
мендә башкарыла.
366
129 нчы рәсем. Чуен җитештергәндә
бара торган химик процесслар.
? 1. Домна мичендә тимер оксидлары¬
ның кайтарылуы берничә стадиядә
бара:
Fe2O3 — Fe3O4 + FeO + Fe
▲ Реакцияләрнең тигезләмәләрен төзе¬
гез.
2. Ни өчен кислород өрдерү домна
миченең җитештерүчәнлеген күтә¬
рергә ярдәм итә?
3. Ни өчен табигый газны (CH4)
куллану домна миченең җитештерү¬
чәнлеген арттыра? Реакцияләрнең
тигезләмәләрен төзегез.
4. 129 нчы рәсем буенча чуен тап¬
канда домна мичендә бара торган
реакцияләрне тасвирлагыз.
5. VII төсле рәсемдәге схема буенча
домна миченең төзелешен җентекләп
тикшерегез. Домна миченә кислород
кайдан өрдерелә? Мичкә шихта ту¬
тыру һәм аннан чуенны һәм шлак¬
ны бушату ничек башкарыла?
§ 121. КОРЫЧ ҖИТЕШТЕРҮ
Чуенны эретеп корыч табалар. Корычка әверелдерү өчен китә
торган чуен эшкәртелмә чуен дип атала. Чуенда углерод, крем¬
ний, марганец, фосфор, күкерт була. Чуенны корычка эшкәртүнең
асылы артык углеродны һәм зарарлы катышмаларны оксидлашты¬
ру (яндырып чистарту) юлы белән бетерүдән гыйбарәт. Флюс кул¬
лану кремний белән марганецның да масса өлешләрен (процент¬
ның өлешләренә кадәр) киметергә мөмкинлек бирә.
Чуенны корычка эшкәртүнең кислородлы-конвертор ысулын
тикшереп узыйк (латинча Convertere әверелү мәгънәсен аңлата).
Бу ысул буенча катышмаларны яндыру конверторда үткәрелә
(VII төсле рәсем). Ул, эчтән утка чыдамлы кирпеч белән кап¬
ланган, табаклы корычтан ясалган груша формасындагы аппа¬
раттан гыйбарәт (300 т һәм аннан да артыграк сыешлы).
Конвертор — периодик рәвештә эшли торган аппарат. Аңа
сыек чуен тутыралар, тимер ватыклары һәм флюслар өстиләр. Кис¬
лород өрдергәндә эретелгән чуенда углерод, фосфор, кремний,
марганец оксидлашалар:
2С + О2 = 2СО, ДЯ<0
4Р + 5О2=2Р2О5 , АН<0
SiH-O2 = SiO2, А/7 <0
367
130 нчы рәсем. Легирланган корыч җи¬
тештерү өчен кулланыла торган электр
дугалы мич.
131 нче рәсем. Электрон-нурлы мич.
Реакцияләрнең җылылыгы исәбенә югары температура сакла¬
на һәм бу чуенны корычка эшкәртү процессын тизләтергә ярдәм
итә.
Конвертор ысулы белән эшкәрткәндә чуендагы углерод яна
(оксидлар барлыкка килә). Фосфорның һәм кремнийның кислота
оксидлары, кальций оксиды белән (флюс — известьташ таркалган¬
да хасил була) реакциягә кереп, кальций фосфатларына һәм си¬
ликатларына әвереләләр һәм сыек шлак рәвешендә табыла тор¬
ган корычтан аерылып чыгалар. Шулай ук күкерт тә кальций
сульфиды хәлендә шлакка күчә:
FeS -ф CaO = FeO -ф CaS
Процесс тәмамлангач, конверторны авыштырып башта шлак¬
ны, ә аннары корычны бушаталар.
Корыч җитештерүнең конвертор ысулына инглиз уйлап табучысы Г. Бессе¬
мер нигез салган (1856). Бессемер ысулында сыек чуен аша өрдерү өчен һава кул¬
ланылган. һавада кислородның микъдары аз булганлыктан, температура кирәкле
дәрәҗәгә җитмәгән һәм оксидлашу-кайтарылу процессларының интенсивлыгы тү¬
бән булган. Шуңа күрә табыла торган корыч та түбән сыйфатлы булган. Кисло¬
род җитештерү үсеш алу белән бергә Бессемер ысулын камилләштерү өчен дә
шартлар туды.
Чуенны корычка шулай ук электр мичләрендә дә эшкәртергә
мөмкин (130 нчы һәм 131 нче рәсемнәр). Аларда температураны
бик югары (2000°C һәм аннан да югары) күтәрергә була. Шуның
исәбенә фосфорны һәм күкертне шлакка тагын да тулырак күче¬
рергә мөмкин. Димәк, эретмә алардан күбрәк арындырыла. Электр
мичләрендә легирланган корычлар (шул исәптән авыр эретелүчән
эретмәләр дә) һәм ферроэретмәләр коялар. Ферроэретмәләр —
368
тимернең күп микъдардагы башка металлар белән булган эретмә¬
ләре, мәсәлән феррохром, феррованадий, ферросилиций, ферро¬
марганец һ. б.
Безнең илебездә дөнья күләмендә җитештерелә торган корыч¬
ның 1/5 өлеше диярлек эретелә. Kapa металлургия алдында килә¬
чәккә тагын да зуррак бурычлар тора. Домна процессын һәм чу¬
енны корычка эшкәртүне эченә алган металлургия процессы бик
катлаулы. Шуңа күрә корыч кою производствосының структура¬
сын тамырдан үзгәртү бурычы тора. Хәзерге вакытта рудадан
турыдан-туры корыч табу процессына игътибар арта бара. Корыч¬
ны бу ысул белән җитештергәндә домна процессы үткәрелми. Бу
ысулның перспективалы булуына әле Д. И. Менделеев ук күрсә¬
теп үткән.
Тимерне турыдан-туры кайтару ысулларының берсе тимер ок¬
сидының табигый газ белән үзара тәэсир итешүенә нигезләнгән:
4Fe2O3 + ЗСН4 = 8Fe + 6Н2О| + ЗСО2 J
Моның өчен баетылган рудадан шарчыклар (окатыш) җитеш¬
терәләр һәм аларны әйләнә торган цилиндр рәвешендәге мичләр¬
гә тутыралар. Мич бераз авыш итеп салынган, шунлыктан шар¬
чыклар акрынлап аның түбәнге өлешенә күчәләр. Шунда ук таби¬
гый газ кертелә. Кайтару тимернең эретелү температурасыннан
түбәнрәк температурада үткәрелә. Бу вакытта көпшәк тимер бар¬
лыкка килә. Аннан электр мичләрендә корыч табалар.
? 1. Чуен җитештерүнең һәм корыч эретүнең аерымлыгы һәм охшашлыгы нидән
гыйбарәт?
▲ 2. Домна һәм конвертор процессларында ни өчен кислород өрдерү кулланыла?
3. Корычта эрегән тимер (II) оксидының микъдарын киметү өчен «раскис-
лительләр», мәсәлән ферросилиций кулланыла. Тимер (Il) оксидының кайта¬
рылу тигезләмәсен төзегез.
4. а) Кайтарулы; б) оксидлаштырулы эретеп кою кайсы очракта кулланыла:
чуен койгандамы яки корыч койгандамы?
§ 122. АЛЮМИНИЙ ҖИТЕШТЕРҮ
Алюминий халык хуҗалыгының төрле тармакларында киң
кулланыла. Әле Н. Г. Чернышевский ук «алюминий эрасы» җи¬
тәчәген алдан күреп әйткән. Бөек язучы заманында алюминий
кыйммәтле металлардай саналган, аны киң куллану, алюминий¬
дан төрле конструкцияләр төзү кыю хыял гына булып күренгән.
«Нәрсә эшләргә?» әсәреннән Bepa Павловнаның атаклы төшен
хәтерлисезме: «Көтмәгәндә алюминийдан төзелгән зур йорт кү¬
ренде, һәм анда барысы да алюминийдан ясалган...»? Ул заман¬
нарда алюминий табуның рациональ һәм арзанлы ысулы әле бил¬
геле булмаган. Алюминий химик яктан бик актив булганга күрә,
аны ирекле хәлдә табу өчен иң көчле кайтаручы — электр тогы
таләп ителә. Хәзерге вакытта алюминийны аның оксидына
электролиз ясап табалар.
24 П-236
369
Алюминий оксиды AI2O3 югары температурада гына
(2500° С) эретелә. Мондый температурада оксид эретелмәсенә
электролиз ясау мөмкин түгел, чөнки электролиз ванналарын
һәм электродларны ясау өчен кирәкле мондый шартларга чыдам
материаллар юк. Әмма алюминий оксиды эретелгән криолитта
NasAlFe (эретелү температурасы IOOOoC чамасы) яхшы эри.
Бу электролит — алюминий оксидының эретелгән криолиттагы
эремәсе, һәм аны электролиз ясап алюминий тапканда куллана¬
лар.
Процесс IOOOoC та үткәрелә. Криолит эремәсендә алюминий
оксиды ионнарга диссоциацияләшә:
Al2CWAl3+ +AlOi-
Электролиз нәтиҗәсендә катодта алюминий аерылып чыга:
Al3+ +Зё = Al
Анодта кислород аерылып чыга:
4АЮ3- -12ё=2А12Оз + ЗО2
Алюминий сыек хәлдә табыла һәм, тыгызлыгы электролит
тыгызлыгыннан зуррак булганлыктан, ванна төбенә җыела.
Катод хезмәтен электролит ваннасының күмер түшәлмәсе һәм
алюминий үзе үти. Анод итеп эретелмәгә төшерелә торган күмер
электродларны кулланалар. Анодта барлыкка килүче кислород
күмерне оксидлаштыра, һәм шуңа күрә анодта углеродның ок¬
сидлары аерылып чыга. Анод яна барган саен, аны әледән-әле
үстереп торалар. Электролизердан сыек алюминийны вакуум-чү-
меч ярдәмендә суыртып алалар.
Алюминийны электрохимик ысул белән җитештерү өчен бик
күп энергия кирәк. Шуңа күрә алюминий җитештерүче заводлар
гадәттә эре гидроэлектростанцияләр (Братск, Красноярск һ. б.)
тирәсендә урнашкан булалар.
Алюминий җитештерү өчен кирәкле алюминий оксидын (гли-
ноземны) табигый бокситлардан һәм нефелиннан табалар. Бок¬
ситлар күп чыга торган урыннар Ленинград өлкәсендә, Уралда,
Казахстанда бар. Нефелин күп чыга торган урыннар Кола ярым¬
утравында, Красноярск краенда һәм Кемерово өлкәсендә бар.
Җитештерелә торган алюминийның төп өлеше аның җиңел
эретмәләрен табу өчен тотыла. Алюминийның эретмәләре аның
үзенә караганда шактый ныграк булалар һәм механик ныклыгы
ягыннан корычка якынлашалар. Дуралюмин эретмәләре («каты
алюминий») аеруча киң кулланылалар. Җиңел, нык, шулай ук
һава һәм су тәэсиренә чыдам булганга күрә, алюминийның эрет¬
мәләрен самолетлар, автомобильләр, тимер юл вагоннары һ. б.
төзү эшендә кулланалар. Әйтик, самолетның 2/3 өлеше, ә авто¬
мобиль моторының 1/4 өлеше алюминий эретмәләреннән ясал¬
ган.
370
Дуралюмин эретмәсеннән A. Н. Туполев конструкциясендәге
тоташ металлдан эшләнгән беренче совет самолеты АНТ-2 төзел¬
гән иде. Тимер һәм никель өстәп легирланган дуралюмин эрет¬
мәләрен үтә тиз очучан лайнерларның конструкцияләрен ясаган¬
да кулланалар.
Халык хуҗалыгында куллану өлкәләренең саны буенча алю¬
минийның эретмәләре корычтан һәм чуеннан гына калышалар.
'J 1. Алюминий беренче тапкыр алюминий хлоридына калий белән тәэсир итеп
табылган. Реакциянең тигезләмәсен төзегез һәм аның ни өчен мөмкин бу-
A луын аңлатып бирегез. Ни өчен хәзерге вакытта промышленностьта алю¬
минийны бу ысул белән тапмыйлар?
2. 1 т алюминий оксидын гади матдәләргә таркату өчен күпме энергия то¬
тарга кирәк (106 нчы параграфны карагыз). Промышленностьта бу процесс
нинди энергияне куллану исәбенә үткәрелә?
3. Алюминий өстәп легирланган эретмәләрнең кызуга чыдамлы булуларын
ничек аңлатырга мөмкин?
4. Сез көнкүрештә файдалана торган нинди әйберләр алюминий эретмә¬
ләреннән ясалган? Алюминийны һәм аның эретмәләрен куллану бу очрак¬
ларда аларның нинди үзлекләренә бәйләнгән?
5. Яңгыр яудыру җайланмаларын, кырда ашлык саклау амбарларын төзе¬
гәндә ни өчен тимер эретмәләрен түгел, ә алюминий эретмәләрен кулла¬
налар?
24
НЕОРГАНИК ХИМИЯ
ҺӘМ МОХИТНЕ САКЛАУ
§ 123. МОХИТНЕ САКЛАУ ПРОБЛЕМАЛАРЫ
1. Табигатьтә: а) кислород; б) углерод; в) су әйләнешен билгеләүче төп
процессларны тасвирлагыз. 2. Кешенең хуҗалык эшчәнлеге табигатьтәге про¬
цессларга нинди йогынты ясый?
Техник процесс белән бергә кешенең табигатькә ясаган йо¬
гынтысы да гаять зур масштаблардагы табигый процесслар бе¬
лән чагыштыра алырлык дәрәҗәгә җитте.
Кешенең контрольсез эшчәнлеге еш кына әйләнә-тирәлектә:
Җир атмосферасында, гидросферада, җир астында һәм аның
уңдырышлы катлавында тискәре үзгәрешләргә, хайваннарны һәм
үсемлекләрне бетерүгә китерә. Шундый проблема килеп туа:
кеше үзен һәм үзенең яшәү мохитен үз эшчәнлегенең тәэсирен¬
нән сакларга тиеш.
Мохитне пычратучы чыганакларга барыннан да бигрәк җылы¬
лык электростанцияләре, кара һәм төсле металлургия, таудан
чыгару промышленносте предприятиеләре, автомобиль транспор¬
ты, химия промышленносте, чүп яндыру предприятиеләре керә.
Атмосферага углерод, азот һәм күкерт оксидлары, метал-
ларның кушылмалары, органик матдәләр, һәм шулай ук тузан
чыгарыла.
Казылма ягулыкны һаман да арта баручы күләмнәрдә кулла¬
ну табигатьтә углерод әйләнешенә йогынты ясый (94 нче пара¬
графны карагыз). Атмосферада углекислый газның микъдары
арта бару Җирдә климатның җылынуына, поляр бозлыкларның
эрүенә һәм Дөнья океаны тигезлегенең күтәрелүенә китерүе
мөмкин.
Атмосферада тузанның күбәюе капма-каршы нәтиҗәгә ките¬
рә. Тузан кояш нурларын тотып кала, ә моның Җирдә темпера¬
тураның кимүенә китерүе мөмкин. Вулканнарның активлыгы нә¬
тиҗәсендә атмосфераның тузанлануы үз вакытында Җирдә боз¬
лык чоры урнашуга сәбәп булган дип уйлыйлар.
Атмосферада күкерт һәм азот оксидларының (кислота ок¬
сидлары) микъдары артуы сәбәпле кислоталы яңгырлар ява, нә¬
тиҗәдә, туфракның әчелеге арта, аның уңдырышлылыгы кими,
урманнар корый һәм сулыклардагы организмнар һәлак була, һа¬
ва массаларының ерак араларга күчүе аркасында (чикләр аша
күчү) кислоталы яңгырларның күп территорияләрдә булуы мөм¬
кин.
372
Кислоталы яңгырлар төзелеш корылмаларын, архитектура
һәйкәлләрен бозалар, металларның коррозиясен бик нык тизлә¬
тәләр.
Автотранспорт чыгара торган газлар проблемасы да бик ак¬
туаль. Бу газларда агулы углерод (II) оксиды, азот оксидлары,
күкерт (IV) оксиды, углеводородлар, кургаш кушылмалары бу¬
ла. Автомобиль хәрәкәте интенсив булган зур шәһәрләр өстендә
төтенле томан тора.
Промышленность предприятиеләре, бигрәк тә таудан чыгару
һәм металлургия промышленностьлары, җылылык электростан¬
цияләре— каты калдыкларның төп чыганаклары. Бу каты кал¬
дыкларның өемнәре сөрү җирләренең зур мәйданнарын алып
торалар, ландшафтны ямьсезлиләр, мохитне агулыйлар.
Промышленностьта һәм көнкүрештә кулланудан пычранган
сулар гидросферага зарар китерә. Алар сулыкларда үзлегеннән
бара торган табигый чистарту процессларын боза, андагы орга¬
низмнарга зыян китерә.
Мохитне саклау проблемасын хәл итүдә аеруча мөһим роль¬
не химия һәм химия промышленносте уйный.
? 1. Төсле металлургия предприятиеләрендә күкерт (IV) оксиды нинди реак¬
цияләр нәтиҗәсендә барлыкка килә? Реакцияләрнең тигезләмәләрен язы¬
гыз.
A 2. һава составындагы күкерт (IV) оксиды мәрмәргә тәэсир итә (архитек¬
тура һәйкәлләре һәм сәнгать әсәрләре әкренләп ашалалар). Мәрмәрнең
гипска әверелүен күздә тотып, реакцияләрнең тигезләмәләрен төзегез.
3. Бензинның (төп компоненты — октан C8H18): а) углерод (IV) оксиды;
б) углерод (II) оксиды; в) корым хасил итеп, ахыргача һәм тулы булмаган
януының тигезләмәләрен языгыз.
4. Ни өчен кислота оксидлары металларның коррозиясен тизләтәләр?
§ 124. АТМОСФЕРАНЫ САКЛАУ
1. Азот (IV) оксидының су белән реакциясе тигезләмәсен языгыз. Нитрат
кислотасы җитештергәндә барлыкка килүче калдык газлардагы азот (II) окси¬
дыннан ничек арынырга мөмкин? 2. Ничек итеп сероводородны күкерткә әве¬
релдерергә була?
Атмосферага чыгарыла торган мохит өчен зарарлы газларны
чистарту төрле ысуллар ярдәмендә хәл ителә. Әйтик, химия пред¬
приятиеләрендә азот оксидларыннан чистарту бу оксидларны ка¬
тализатор катнашында азотка һәм кислородка таркатудан:
2NO = N2+O2
һәм шулай ук оксидларны табигый газ яки аммиак ярдәмендә
кайтарудан гыйбарәт:
6NO + 4NH3 =5N2 + 6Н2О
373
Металлургия предприятиеләренең күп микъдарда күкерт (IV)
оксиды булган калдык газлары атмосферага чыгарылмый, ә суль¬
фат кислотасы җитештерү өчен тотыла.
Калдык газларда күкерт (IV) оксиды SO2 аз булса, аны фай¬
далануның күпчелек ысуллары SO2 матдәсенең кислота оксиды
үзлекләренә һәм S (IV)-* S (VI) әверелешенә нигезләнгән. Кай¬
нар калдык газлардан күкерт (IV) оксидын һава кислороды кат¬
нашында известьташ белән реакциягә кертеп аерып алырга мөм¬
кин. Бу реакция барышында кислота оксиды SO2 башка кислота
оксидын (CO2) этеп чыгара:
СаСОз -I- SO2 = CaSOa CO2,
ә барлыкка килә торган кальций сульфиты кальций сульфатына
оксидлаша:
2CaSO3 H-O2 = 2CaSO4
Суммар рәвештә күкерт (IV) оксидын йоттыруны түбәндәге
тигезләмә белән күрсәтергә була:
2СаСО3 + 2SO2 + O2 = 2CaSO4 + 2СО2
Җылылык электростанцияләре, котельныйлар чыгара торган
калдык газлардагы сернистый газдан SO2 котылу проблемасы
бик катлаулы. Бу газларда күкерт (IV) оксиды аз була. Шуңа
күрә аларны SO2 матдәсеннән химик ысуллар белән арындыру
экономик яктан кулай түгел. Бу проблеманы хәл итүнең иң
отышлы варианты — яндырганчы ягулыкны күкерт кушылмала¬
рыннан арындыру. Менә шуңа бер мисал. Астрахань тирәсендә
табыла торган табигый газда агулы сероводород H2S бик күп.
Газдагы сероводородны, органик эреткечләрдә эретеп, аерып
алалар. Аннары сероводородны эремәдән аерып чыгаралар һәм
тулы булмаган яну исәбенә кыйммәтле продуктка — күкерткә
әверелдерәләр:
2H2S + O2=2S + 2H2O
Сыек һәм каты ягулыкны күкерт кушылмаларыннан микро¬
биологик методлар ярдәмендә — микроорганизмнарның тереклек
эшчәнлеге исәбенә чистарту буенча тикшеренүләр алып барыла.
Мохитне саклау проблемасын хәл итүнең әһәмиятле юлы
булып ягулык итеп водородны куллану тора (42 нче параграфны
карагыз). Электрохимик ягулык элементларын куллану да пер¬
спективалы (102 нче параграфны карагыз). Җылылык электро¬
станцияләрен атом электростанцияләре белән алыштыру да һава¬
ның пычрануын бетерүгә китерә.
? Төсле металлургия предприятиеләренең калдык газларын күкерт (IV) окси¬
дыннан чистарту ысулларының берсе буенча түбәндәге операцияләр баш-
▲ карыла. һава катнашында газны эретелгән сода аша җибәрәләр. Барлыкка
374
килгән продуктны, натрий сульфиды һәм углерод (IV) оксиды хасил бу¬
лырлык итеп, күмер белән кайтаралар (800°C та). Аннары углерод (IV)
оксиды һәм су парлары тәэсирендә натрий сульфиды сероводородка һәм
натрий карбонатына әверелә. Сероводородның тулы булмаган януы исәбенә
күкерт барлыкка килә. Реакцияләрнең тигезләмәләрен языгыз.
§ 125. ГИДРОСФЕРАНЫ САКЛАУ
1. Эремәне: a) Pb2+ ; б) PO) ' ионнарыннан арындырырга мөмкинлек бирү¬
че реакцияләрне тәкъдим итегез. 2. Сулыкларны промышленностьның пычранган
агынты суларыннан саклауның иң рациональ ысулы нинди?
Табигый суларның ни дәрәҗәдә чиста булуын аларда эрегән
кислород микъдары буенча белергә мөмкин. Кислород судагы
организмнарга яшәү өчен кирәк. Бактерияләр (аэроб бактерия¬
ләр) эшчәнлеге исәбенә кислород хайван һәм үсемлек организм¬
нары калдыкларындагы органик матдәләрне оксидлаштыруга то¬
тыла һәм бу вакытта CO2, Н2О, NOT, SO?-, PO?- хасил була.
Шулай итеп су табигый рәвештә үзлегеннән чистара. Пычран¬
ган агынты суларны биологик чистарту шул принципка ни¬
гезләнгән. Чистартыла торган суга тиешле бактерияләрне кертә¬
ләр һәм су аркылы һава өрдерәләр.
Органик матдәләр артык күп булганда аэроб бактерияләр¬
нең тереклеге өчен эрегән кислород җитешми. Мондый шартлар¬
да органик матдәләрнең таркалуы башка төр бактерияләрнең
(анаэроб бактерияләр) тереклек эшчәнлегенә бәйле була һәм бу
вакытта CH41 NH3, H2S, H3P барлыкка килә. Судан черек исе
килә, балыклар һәм сулыктагы башка организмнар һәлак була.
Туфрактан юылып, кар һәм яңгыр сулары белән сулыкларга
килеп эләгүче минераль ашламалар да табигый суларга зур за¬
рар ясыйлар. Ашламалар (бигрәк тә нитратлар, фосфатлар) чүп
үләннәрнең һәм суүсемнәрнең күбәеп үсүенә сәбәпче булалар.
Мондый күренешләрне булдырмау өчен, минераль ашламаларны
мембрана үзлекле элпәдән ясалган капсулаларда җитештерү
ысулын эшлиләр. Мондый капсулалар ашламаны юылып агып
китүдән генә саклап калмый, ә бәлки озак вакытлар дәвамында
үсемлекләрнең бертөрле тигез туклануын тәэмин итәләр, ашлама¬
ларның әрәм-шәрәм булуын киметәләр.
Сулыклардагы организмнарга бигрәк тә, агулы матдәләр,
аерым алганда, агулы металларның кушылмалары булган, про¬
мышленность агынты сулары зур зарар китерә.
Пычранган агынты суларны чистарту ысуллары бу суларда
нинди ташландыклар булуга бәйле. Көнкүреш агынты суларында
башлыча органик матдәләр була. Шуңа күрә алар, хлор яки озон
белән эшкәртеп зарарсызландырганнан соң, микроорганизмнар¬
ның тереклек эшчәнлеге исәбенә, биологик чистартуга җибәрелә.
Бу вакытта биомасса хасил була. Бу биомассаны терлекчелектә
өстәмә азык буларак кулланыла торган витаминлы-аксым кон¬
центраты табу өчен файдаланалар. Биологик чистарту узган су¬
375
ны табигый сулыкларга агызалар, анда ул үзлегеннән табигый
чистару циклына килеп кушыла.
Промышленностьта кулланудан пычранган агынты суларны
чистарту бигрәк тә катлаулы. Бу суларда микроорганизмнар өчен
агулы матдәләр була, шунлыктан аларны биологик методлар
белән чистартып булмый. Промышленность агынты суларын ме¬
таллардай арындыру методларының берсе бу металларны эреми
торган матдәләр рәвешендә (мәсәлән, сульфидлар хәлендә)
утырымга төшерүдән гыйбарәт:
Hg2++S2-=HgSj
Неорганик тозлардан арындыру өчен суны дистиллирлау, туң¬
дыру һәм башка алымнар кулланыла.
Сулыкларны промышленность агынты суларыннан саклауның
һәм төче суга экономия ясауның иң рациональ ысулы — суларны
сулыкларга агызмыйча, йомык су әйләнеше системалары булды¬
ру (58 нче параграфны карагыз).
? 1. Суны дистиллирлау нәрсәгә нигезләнгән?
2. Агынты суларны: a) Cu2+; б) Pb2+, в) Zn2+; г) PO4"; д) SO2- ион-
A нарыннан арындыру өчен бу ионнарны нинди эремәүчән тозларга әверел¬
дерергә кирәк? Реакцияләрнең тигезләмәләрен төзегез. Берләшкән Милләт¬
ләр Оешмасы инициативасы буенча 1981 —1990 унъеллык төче су унъеллы¬
гы дип игълан ителгән иде. Суның тереклек өчен әһәмияте, техникадагы ро¬
ле һәм аны сакчыл тоту һәм пычранудан саклау проблемалары турында
чыгыш ясарга хәзерләнегез.
§ 126. КАЛДЫКСЫЗ ТЕХНОЛОГИЯ
Нәрсә ул: а) химик технология; б) калдыксыз технология; в) чималны ком¬
плекслы куллану; г) йомык су әйләнеше?
Д. И. Менделеев химиядә калдыкларның булмавына, теләсә
нинди калдыкны башка химик продуктларны табу өчен чимал
итеп куллану мөмкинлеген күрсәтеп үткән. Калдыксыз производ¬
стволар булдыру — мохитне саклау проблемасын хәл итүдә хи¬
миянең һәм химик технологиянең мөһим бурычы. Калдыксыз
технологиянең асылын түбәндәге схема чагылдыра:
чимал ^куллану
чыганаклары-* производство'"'^ |
(җитештерү) *- калдыклар—> өстәмә
чыганаклар
Калдыксыз технология мисалы сыйфатында апатит-нефелин
рудасын комплекслы эшкәртеп файдалы продуктлар табуны тик¬
шереп узыйк. Иң элек бу руданы флотация ысулын кулланып
апатитка Cas(PO4) зЕ һәм нефелинга M(AISiO4) (М—Na, К)
аералар. (Рудаларны флотацияләү аларның состав өлешләре
(бу очракта — нефелин минералы һәм апатит минералы) суда
376
төрлечә чылануга нигезләнгән. Аз чылана торган кисәкчекләр
күбек белән бергә өскә калкып чыгалар.)
Нефелин M(AlSiO4) натрий һәм калий алюмосиликатларын¬
нан гыйбарәт. Нефелиннан глинозем AUO3, сода NazCO3, поташ
K2CO3, цемент һәм башка матдәләр табалар.
Нефелинны эшкәртүнең асылы түбәндәгедән гыйбарәт. Нефе¬
линны известьташ белән бергә трубалы мичләрдә җылытып ук¬
маштыралар (1200—1300°C та). Нәтиҗәдә селтеле металларның
алюминатларыннан, кальций силикатыннан торган эреп укмаш¬
кан катнашма (спек) барлыкка килә һәм углерод (IV) оксиды
аерылып чыга:
M(AlSiO4) +CaCO3 = CaSiO3 + MAlO2 + СО2|
Эреп укмашкан массага су белән тәэсир итәләр. Селтеле
металларның гидроксоалюминатлары эремәсе хасил була:
MAlO2+ 2Н2О = М [Al (OH)4]
Суда эремәүчән кальций силикатын CaSiO3 (шламны) эре¬
мәдән аерып алалар һәм цемент табу өчен кулланалар. Гид-
роксоалюминатлар эремәсе аша элегрәк табылган углерод (IV)
оксидын җибәрәләр. Бу вакытта алюминий гидроксиды утырымга
төшә һәм селтеле металларның гидрокарбонатлары эремәсе бар¬
лыкка килә:
M [Al (QH)4] +CO2 =MHCO3+ Al (0Н)3|
Калган эремәдән аерып алынган алюминий гидроксидын
AI(OH)3 кыздыралар (1200°С та) һәм глиноземга әверелдерә¬
ләр:
2А1 (OH)3 =AlzO3+ 2Н2О
Калган эремәне парга әйләндереп сода һәм поташ табалар.
Арзанлы нефелинны шулай ук арзанлы известьташ ярдәмен¬
дә комплекслы эшкәртү, 1 т глинозем җитештергәндә, 1 т сода
һәм поташ, 7,5 т цемент табарга мөмкинлек бирә. Нефелин чи¬
малыннан продуктлар җитештерүгә тотылган экономик чыгымнар
бу продуктларны башка төр промышленность ысуллары белән
тапкандагы чыгымнардан 10—15% ка кимрәк. Нефелин чималын
комплекслы эшкәртү методын эшләгән өчен бер төркем галимнәр¬
гә һәм инженерларга Ленин премиясе бирелгән иде.
Апатитны эшкәрткәндә фосфат кислотасы, фосфорлы ашла¬
малар табыла. Фосфат кислотасын җитештерү апатитка сульфат
кислотасы белән тәэсир итүгә нигезләнгән:
Ca5 (PO4) 3F + 5H2SO4 = 3H3PO4 + SCaSO4 +HF
Фосфат кислотасыннан башка тагын фосфогипс CaSO4 • 2Н2О
һәм водород фториды HF да барлыкка килә. Фосфогипсны таби¬
377
гый гипс урынына катыр туфракларны (тозлы) химик мелиора¬
цияләүдә, гипслы беркетүче матдәләр җитештерү һәм алардан
әйберләр ясау өчен, катнаш метод белән сульфат кислотасы һәм
цемент тапканда кулланырга мөмкин. Водород фторидын фтор
кушылмаларын табу өчен файдаланалар.
Химия һәм химик технология алдында җылылык электростан¬
цияләренең, таудан чыгару промышленностеның, металлургиянең
һәм кайбер башка производстволарның каты калдыкларын фай¬
далану буенча бик мөһим бурыч тора.
Хәзерге вакытта домна шлакларын цемент җитештерү про¬
мышленностенда кулланалар. Кайбер предприятиеләрдә хәтта
иске өемнәрдәге шлакларны да эшкәртә башладылар. Төзелеш
материаллары җитештерү өчен ТЭСлардан чыккан шлакларны
һәм көлләрне куллана башладылар.
Төсле металлургия предприятиеләренең шлаклары — метал¬
лар табу өчен кыйммәтле чимал. Бу шлакларда оксидлар, алю-
минатлар һәм силикатлар рәвешендә кальций, магний, тимер,
марганец, бакыр, никель, кобальт, кургаш, кадмий, сирәк метал¬
лар була. Мондый шлаклардагы металларны аерып алу өчен
эретелгән шлакны электр мичләрендә известьташ катнашында
кокс белән кайтару методы эшләнгән. Процессның асылын бакыр
табу мисалында түбәндәге схема белән күрсәтергә мөмкин:
CuSiO3 + C + CaCO3-++ + CaSiO3 + CO2
Бу процесс нәтиҗәсендә хасил була торган кальций сили¬
катын цемент җитештерүдә кулланалар.
Күргәнебезчә, бер предприятиенең калдыклары икенчеләре
өчен чимал булып торырга мөмкин. Шуңа күрә бүгенге көндә
бөтен бер экономик район масштабында калдыксыз технология
принциплары нигезендә үзара бәйләнештәге предприятиеләрдән
торучы территориаль-промышленность комплекслары булдыру
бурычы куела.
Ә 1. Апатитны эшкәрткәндә барлыкка килә торган фтороводородны натрий
гидроксиды эремәсе белән үзара тәэсир итешү исәбенә файдаланырга мөм-
▲ кин. Натрий гидроксидын регенерацияләү өчен эремәгә сүндерелмәгән из¬
весть белән тәэсир итәргә була. Бу вакытта тагын кальций фториды
да CaFs барлыкка килә. Реакцияләрнең тигезләмәләрен төзегез.
2. Катнаш метод белән эшкәртеп гипстан сульфат кислотасы һәм цемент
тапканда гипс, ком һәм балчык катнашмасын әйләнә торган цемент җитеш¬
терү мичләрендә яндыралар (117 нче рәсемне карагыз). Бу вакытта угле¬
род (IV) оксиды, күкерт (IV) оксиды һәм цемент клинкеры хасил була.
Күрсәтелгән продуктларның барлыкка килүен аңлатып бирегез. Реакция¬
ләрнең тигезләмәләрен төзегез һәм күкерт (IV) оксидыннан сульфат кис¬
лотасын тапканда аларның нинди шартларда узуларын күрсәтегез.
3. Безнең илдә металлургия предприятиеләреннән ерак түгел 15 цемент за¬
воды төзелгән. Моның сәбәбе нәрсәдә?
4. Калдыксыз технология принциплары нигезендә чуен, корыч, цемент табу
производстволары бер-берсе белән нинди бәйләнешләрдә торалар? Аңлатма
биргәндә параграф текстындагы калдыксыз технология схемасыннан фай¬
даланыгыз. Күрсәтелгән производстволарның асылын чагылдыручы реак¬
цияләрнең тигезләмәләрен төзегез.
378
§ 127. НООСФЕРА —АКЫЛ СФЕРАСЫ
Академик В. И. Вернадский әле гасыр башында ук, кеше био¬
сфера эволюциясенә йогынты ясаучы төп факторга әвереләчәк
заман килер, дип әйткән.
Биосфера үсемлекләрнең, хайваннарның һәм микроорганизм¬
нарның тереклек эшчәнлеге нәтиҗәсендә формалашкан һәм шул
эшчәнлек исәбенә яши. Бүген исә биосферада төп рольне кеше
уйный. Аның хезмәте белән үсемлекләрнең яңа сортлары, хай¬
ваннарның яңа токымнары барлыкка китерелгән, очсыз-кырый-
сыз басуларда культуралы үсемлекләр үстерелә, каналлар һәм
яңа диңгезләр булдырыла, сазлыклар һәм чүлләр юкка чыгары¬
ла, казылма токымнарның гаять зур массалары күчерелә, яңа
материаллар барлыкка килә һәм яңа химик элементлар синтез¬
лана. Кешенең үзгәртеп кору эшчәнлеге инде океан төпләренә
һәм галәм киңлекләренә үтеп керә. Кешенең әйләнә-тирәлеккә
һаман да үсә баручы йогынтысы кеше белән табигать арасында¬
гы бәйләнешләрдә катлаулы проблемалар китереп чыгара.
К. Маркс: «...культура,— әгәр ул аңлы рәвештә юнәлдерел¬
мичә, стихияле үсеш алса, ... үзеннән соң чүл калдыра»,—
дип язган. (Маркс K-, Энгельс Ф. Соч.— 2-е изд,—Т. 32.— 45 б.)
Кеше табигатьнең бер өлеше, шуңа күрә кешенең җитештерү
эшчәнлеген дә табигать һәм аның мөмкинлекләреннән чыгып
карарга кирәк. В. И. Вернадский кешелек дөньясына биосфера¬
ны эзлекле рәвештә үстерергә өйрәнергә туры киләчәк дип сана¬
ган. Киләчәктә ноосфера (грекча ноо — акыл) өстенлек алачак.
Җитештерү һәм куллану, кешелек җәмгыяте белән табигать
арасындагы тулы гармониягә нигезләнеп, акыл белән һәм рацио¬
наль итеп оештырылачак.
В. И. Вернадский: «Әгәр кешелек дөньясы үзенең акылын
һәм үзенең көчен үз-үзен бетерүгә җикмәсә һәм шуны аңласа,
биосфераның геологик тарихында кешелек алдында гаять зур
киләчәк ачыла»,— дип язган.
? А. В. Виноградов: «...биосфера кеше эшчәнлегеннән башка, калдыксыз
производство принцибы буенча оешкан — бер организмның тереклек эшчән-
▲ леге продуктлары башкаларының тереклеге өчен кирәк, биосфераның бөек
биологик әйләнешендә бар нәрсә дә файдаланыла дип әйтергә мөмкин,—
дигән. Академик А. В. Виноградовның әйткән фикеренә анлатма бирегез.
ЙОМГАКЛАУ
§ 128. ХИМИЯ ҺӘМ ФӘННИ-ТЕХНИК ПРОГРЕСС
Без, фән һәм техника казанышлары һәм аларның халык ху¬
җалыгына үтеп керүе белән билгеләнә торган, фәнни-техник
прогресс дәверендә яшибез. Еш кына сез: «Без космик эрада,
атом энергетикасы гасырында, автоматлаштыру заманында, по¬
лимерлар чорында һ. б. яшибез»,— дигән сүзләрне ишетәсез.
Безнең заманда гаять төрле булган фәннәр дә үзара бәйләнештә
торалар һәм бер-берләренә йогынты ясыйлар. Алар бер максат¬
ка — табигать серләрен танып белүгә хезмәт итәләр. Безнең көн¬
нәрдә физиклар атом төшенең серләренә һаман да тирәнрәк
үтеп керәләр; физиклар, химиклар һәм энергетиклар атом энер¬
гиясеннән тагын да отышлырак файдалану ысулларын булдыру
өстендә эшлиләр. Биохимиклар һәм биофизиклар катлаулы хи¬
мик процессларны модельләштерү, бу процессларның продукт¬
ларын синтезлауны өйрәнү өчен тере организмнардагы биохимик
процессларны җентекләп тикшерәләр. Кешенең яшәү ресурсла¬
рын арттыру максатларында, шулай ук аның организмында бара
торган биохимик реакцияләр белән идарә итү мөмкинлекләрен
табу да мөһим булып тора.
Бер-берләренә якын булган фәннәр чигендә яңа белем тар¬
маклары, мәсәлән космос медицинасы, космик металлургия, кос¬
мик химия технологиясе һ. б. барлыкка килә. Бары тик бик күп
төрле белем тармаклары галимнәренең һәм техникларының ты¬
рышлыклары белән генә хәзерге заманның яңа энергетик ресурс¬
ларын эзләү, мохитне саклау, галәмне яулау, дөнья океанының
минераль байлыкларыннан файдалану һ. б. кебек глобаль һәм
актуаль проблемаларны хәл итү мөмкин.
Фәнни-техник прогресс шактый дәрәҗәдә химиянең һәм хи¬
мия промышленностеның да уңышларын билгели.
Фән һәм техниканың үсеше химиклар алдына яңа, табигать¬
тә билгеле булмаган матдәләр табу бурычын куя. Химия булыш¬
лыгыннан башка хәзерге заман техникасының бер генә тарма¬
гында да зур казанышларга ирешү мөмкин булмас иде. Ракета
техникасының һәм космонавтиканың үсешендә химиянең роле
гаять зур. Ракета ягулыгын һәм аны оксидлаштыручыларны, шу¬
лай ук иярченнәрнең һәм космик корабльләрнең конструкциялә¬
рендә кулланыла торган төрле ясалма материалларны булдыру
кешенең космик пространствога чыгуын тәэмин итте.
380
Атом энергиясен үзләштерүдә — «төш ягулыгын» һәм реак¬
торлар өчен, шулай ук радиациядән саклаучы материаллар бул¬
дыруда да химиянең роле бик зур.
Яңа материаллар — гадәттән тыш үткәрүчән матдәләр, ярым¬
үткәргечләр һәм изоляторлар — электрониканың һәм радиоэлек¬
трониканың көчле үсешен тәэмин иттеләр, кеше эшчәнлегенең
төрле өлкәләрендә киң кулланыла башладылар (телевизорлар,
транзисторлы приемниклар, магнитофоннар һ. б.).
Халык хуҗалыгының практик яктан барлык тармакларында
да кулланыла торган полимер материаллар җитештерү искиткеч
зур темплар белән үсә.
Химиянең әһәмияте кешегә кирәкле материаллар җитештерү
белән генә чикләнми. Хәзерге вакытта халык хуҗалыгының бик
зур темплар белән химияләштерелүе бара. Химияләштерү
химия промышленностеның һәръяклы үсешен генә түгел, ә химик
процессларны промышленностьның башка тармакларында, авыл
хуҗалыгында, медицинада һәм көнкүрештә куллануны да күздә
тота.
Әйтик, сезгә билгеле булганча, химик ашламалар һәм авыл
хуҗалыгы культураларының авыруларына һәм корткычларына
каршы химик көрәш чараларын куллану авыл хуҗалыгының
продукциялелеген кискен арттыра. Авыл хуҗалыгы производст¬
восы өчен шулай ук чүп үләннәрнең үсешен әкренәйтеп, культу¬
ралы үсемлекләргә зыян китерми торган матдәләрне куллануның
да әһәмияте зур. Шул рәвешчә «химик чүп утау» башкарыла:
аз җитештерүчәнлекле авыр физик хезмәтнең кирәге калмый.
Файдалы казылмаларны тапканда, металлдан эшләнгән әй¬
берләрнең өслеген чистарканда һәм аларны икенче бер металл
белән каплатканда механик операцияләрне химик операцияләргә
алыштыру һ. б. хезмәт җитештерүчәнлеген нык арттыра.
? 1. Академик H. Н. Семенов: «Химик әверелеш, химик реакция — химиянең
төп предметы ул. Элементларның һәм аларның кушылмаларының, аерым
▲ алганда, атомнарның һәм молекулаларның төзелешен өйрәнү асылда химия¬
гә төп бурычны, химик әверелеш белән рациональ идарә итү бурычын
җиңеләйтүче ярдәмче материал бирә... Без матдәнең үзлекләрен һәм аның
төзелешен никадәр тирәнтенрәк һәм тулырак белсәк, химик синтезлауларны
да шулкадәр үк ышанганрак хәлдә башкарачакбыз,— дип язган. Теоретик
һәм эксперименталь химия, химия технологиясе арасындагы бәйләнешләрне
аңлата торган мисаллар китерегез.
2. Академик Ю. А. Овчинниковның «Бүген химиянең кодрәте табигать¬
нең иң искиткеч күренешләрен — тере күзәнәктәге процесслардан башлап
матдәләрнең Җир һәм Океан тирәнлекләрендә һәм башка планеталардагы
әверелешләренә кадәр танып белүгә җәелә»,— дигән сүзләрен аңлатып бире¬
гез. Бу сүзләрне, шулай ук химия казанышларын фәндә, техникада, авыл
хуҗалыгында һәм көнкүрештә куллануны раслаучы мисаллар китерегез.
3. Физика, биология, математика курсларының нинди сорауларын өйрән¬
гәндә сез химия буенча белемнәрегездән файдаландыгыз? Нинди химик
күренешләрне аңлатканда сез физика, биология, математика курсларында
алган белемнәрегезне кулландыгыз?
4. Танып белү процессының чиксез һәм фәнни хакыйкатьнең чагыштырмача
булуын мисаллар белән дәлилләгез.
АТОМ-МОЛЕКУЛЯР ТӘГЪЛИМАТНЫ
БУЛДЫРУДА КАТНАШКАН
КҮРЕНЕКЛЕ ГАЛИМНӘР
Атом-молекуляр тәгълиматны булдыруга Р. Бойль, М. В. Ло¬
моносов, Л. Лавуазье, Д. Дальтон, А. Авогадро аеруча зур өлеш
керткән.
РОБЕРТ БОЙЛЬ
(1627—1691)
Роберт Бойль — атаклы ин¬
глиз физигы һәм химигы.
Р. Бойль теориясе буенча,
әйләнә-тирә җиһан күп санлы
корпускулалардан — бердәм
беренчел материянең зурлык¬
лары, формалары, массалары
белән төрле булган, бик вак
кисәкчекләреннән төзелгән. Бу
корпускулалар һәрвакыт хәрә¬
кәттә булып, бер-берсе белән
берләшеп һәм бер-берсеннән
аерылып, су, тимер, терекөмеш
һ. б. кебек сыйфат ягыннан
төрле «җисемнәр» хасил итә¬
ләр. «Химик-скептик» исемле
китабында Р. Бойль: «Төрле
элементлар... минем фикерем¬
чә, беренчел материянең яки
субстанциянең бары тик сос¬
тавлары һәм тәме, исе, янучан-
лык кебек башка үзлекләре белән бик аз гына бердәй булмаган
төрләреннән гыйбарәт»,— дип язган.
Ул химик экспериментка зур игътибар биргән. Аны «химик
анализның атасы» дип атыйлар. Эксперименталь мәгълүматларга
нигезләнеп ул мөһим теоретик нәтиҗәләр һәм йомгаклаулар
ясаган. Физика законнарының берсе аның исеме белән аталган
(Бойль — Мариотт законы).
Ул ясаган ачышлар һәм теоретик гомумиләштерүләр, химия¬
гә эксперименталь методларны куллануны кертү «фәнни химия»
тууга булышлык иткәннәр. Ф. Энгельс сүзләре белән әйткәндә,
«Бойль химияне фәнгә әверелдергән».
382
МИХАИЛ ВАСИЛЬЕВИЧ ЛОМОНОСОВ
(1711 — 1765)
М. В. Ломоносовның иҗади
эшчәнлеге ихтыяҗларының
гаять киң булуы һәм табигать
серләренә тирәнтен үтеп керүе
белән аерылып тора. Бөек рус
галиме турында А. С. Пушкин
образлы итеп болай дигән:
«Ломоносов мәгърифәтнең бар¬
лык тармакларын да кочып ал¬
ган. Фәнгә атлыгу дәрт тулы
бу җанның аеруча көчле мавы¬
гуы булды. Тарихчы, ритор,
механик, химик, минералог, ху¬
дожник һәм шагыйрь, ул бары¬
сын да сынаган һәм барысын
да аңлаган».
Үзенең теоретик күзаллау¬
ларында М. В. Ломоносов мат¬
дә төзелешенең атом-молеку¬
ляр теориясенә һәм матдәнең
һәм хәрәкәтнең саклану прин¬
цибына таянып фикер йөрткән. 1748 елда ул болай дип язган:
«...табигатьтә бара торган үзгәрешләр түбәндәгегә кайтып кала:
бер җисемгә күпме өстәлсә, икенче җисемнән нәкъ шулкадәр
алына. Әйтик, нинди дә булса күпмедер материя өстәлсә, икенче
җисемнән нәкъ шулкадәр кими... Бу табигатьнең гомуми законы
булганлыктан, ул хәрәкәт кагыйдәләрен дә үз эченә ала...»
Бу закон матдәләрнең массасы саклану законын һәм энергия
саклану законын берләштерә.
М. В. Ломоносов «химияне өйрәнү ике максатны куя: берсе —
табигать фәннәрен камилләштерү, икенчесе — тормыш байлыкла¬
рын арттыру»,— дип санаган. «Чын химик теоретик та, практик
та булырга тиеш»,— дип язган Ломоносов. Ул үзе химия произ¬
водстволарын (пыяла, фарфор, глазурь, неорганик пигментлар
җитештерү) булдыруга зур өлеш керткән.
Галим дингә фән үсешен тоткарлаучы киртә итеп караган:
Ул: «Күпләр юкка гына барысы да иң элек илаһи тарафыннан
булдырылган дип саныйлар...»,— дип язган.
Ул үзенең белемен халыкка бирүгә, аның материаль һәм
рухи тормышын яхшыртырга омтылган. Ул, рус академикларын¬
нан беренче булып, химия буенча дәреслек язган. Аның инициа¬
тивасы белән Россиядә беренче университетка нигез салынган
(1755): Мәскәү дәүләт университеты Ломоносов исемен йөртә.
М. В. Ломоносовтан тыш матдәләрнең массасы саклану зако¬
нының әйтелешен француз химигы А. Лавуазье да әйткән.
383
АНТУАН ЛАВУАЗЬЕ
(1743—1794)
Бөек француз галиме. Үзе
үткәргән тәҗрибәләр нигезендә
һаваның төрле газлар катнаш¬
масы булуы турында нәтиҗә
ясаган. Ә ул заманда һаваны
гади җисем дип уйлаганнар.
Ул, яну — матдәләрнең, һава¬
ның состав өлеше кислород бе¬
лән тәэсир итешүе икәнен ис¬
батлаган. Шулай итеп, яңа хи¬
мия һәм аның нигезе — кисло¬
род теориясе барлыкка килгән;
күп кенә химик күренешләргә
(яну, металларны яндыру, су¬
лыш алганда углекислый газ
аерылып чыгу) аңлатмалар би¬
релгән.
Лавуазьеның казанышы
шактый дәрәҗәдә яну һәм кай¬
тару процессларын өйрәнгән¬
дә микъдар методларын, биг¬
рәк тә үлчәү методын, куллануга бәйле. Ф. Энгельс әйткәнчә,
«Лавуазье иң беренче тапкыр бөтен химияне аякка торгыз¬
ды».
Лавуазье суның, азот оксидларының, углекислый газның,
сульфат кислотасының, кайбер минералларның составларын
ачыклаган. Башка галимнәр белән берлектә, барлык матдәләр¬
не гади һәм катлаулы матдәләргә бүлеп, химик номенклатураны
төзегән. Ул тәкъдим иткән күп кенә атамалар (оксид, сульфат,
нитрат һ. б.) хәзер дә кулланылалар.
384
ДЖОН ДАЛЬТОН
(1766—1844)
Күренекле физик һәм хи¬
мик. Газларны һәм аларның
катнашмаларын өйрәнү ато¬
мистик теориягә, кушылмалар¬
да атомнарның билгеле бер
микъдар чагыштырмаларында
булулары турындагы фикергә
китергән: «Атом теориясен
танымаганда, билгеле бер ча¬
гыштырмалар турындагы тәгъ¬
лимат миңа мистик булып кү¬
ренә». Химик процессларның
асылын образлы рәвештә су¬
рәтләп, Дальтон: «Химик ана¬
лиз һәм синтез кисәкчекләрнең
бер-берсеннән аерылуыннан
һәм аларның яңадан кушы¬
луыннан гайре берни түгел...
Без башкара ала торган бер¬
дәнбер үзгәрешләр кушылма
яки тоташу халәтендәге кисәк¬
чекләрнең бер-берсеннән аерылуыннан, һәм бер-берсеннән нинди¬
дер ераклыктагы кисәкчекләрнең килеп кушылуыннан гыйба¬
рәт»,—дип язган. Водородның атом массасын I гә тигез дип
алып, Дальтон водородның, азотның, углеродның, күкертнең
һәм фосфорның чагыштырма атом массаларының беренче табли¬
цасын төзегән, ул суның, аммиакның, углерод оксидларының
һәм азотның чагыштырма молекуляр массаларын билгеләгән. Бу
атомистик күзаллауларны Дальтон химик әверелешләрнең бары¬
шын аңлату өчен кулланган. Дальтон, ике элементның, мәсәлән
бакыр (I) оксиды һәм бакыр (II) оксиды яки метан һәм этан
кебек, төрле кушылмаларында аларны хасил иткән элементлар¬
ның билгеле бер микъдар чагыштырмаларында булуларын ачык¬
лаган. Шулай итеп ул гади кабатлы чагыштырмалар законын
ачкан. Дальтон элементларны һәм кушылмаларны билгеләр яр¬
дәмендә күрсәтүне тәкъдим иткән (соңыннан бу билгеләр эле¬
ментларның хәзерге символларына алмаштырыла).
Дальтонның хезмәтләре химиянең бөтен киләчәк үсеше өчен
нигез булганнар. Ф. Энгельс: «Дальтон — хәзерге заман химия¬
сенең атасы»,— дип юкка гына әйтмәгән.
25 п-236
385
АМЕДЕО АВОГАДРО
(1776—1856)
Күренекле итальян физигы
һәм химигы. Молекуляр тео¬
риягә нигез салган. Бер үк тем¬
пература һәм басым шартла¬
рында тигез күләмле газларда
молекулалар саны бертигез бу¬
луы турындагы законны ачкан.
Хәзерге вакытта без беләбез
ки, 22,4 л күләмендәге газлар¬
да 6,02-IO23 молекула була.
Белгәнегезчә, бу сан итальян
галиме хөрмәтенә Авогадро са¬
ны дип аталган.
Авогадро күп кенә матдә¬
ләрнең составын һәм чагыш¬
тырма молекуляр массасын
билгеләгән. Водород, кислород,
азот, хлор молекулаларының
икешәр атомлы булуларын дә¬
лилләгән. Аның хезмәтләре
атом-молекуляр тәгълиматның
киләчәктә үсешенә булышлык
иткән.
КУШЫМТА
ЛАБОРАТОР ЭШЛӘР ТЕХНИКАСЫ
ҺӘМ КУРКЫНЫЧСЫЗЛЫК ТЕХНИКАСЫ НИГЕЗЛӘРЕ
Лаборатория штативы белән эш итү. Лаборатория штативы
(132 нче рәсем) тәҗрибәләр ясаганда приборларны беркетү өчен
хезмәт итә. Ул металл стерженьнән һәм чуен аслыктан тора.
Стерженьгә ике винтлы кыстыргычлар (зажимнар) ярдәмендә
боҗраларны һәм тоткычларны беркетеп куялар. Винтларның
берсе кыстыргычны стерженьгә, ә икенчесе — стерженьгә тоткыч¬
ны яки боҗраны беркетү өчен кирәк.
Тоткычның да үз винты бар, ул пробирканы яки колбаны
беркетеп кую өчен кулланыла (133 нчы рәсем). Моның өчен
винтны бушайта төшәләр, тоткычка пробирканы яки колбаның
муенын кертеп урнаштыралар. Винтны саклык белән генә борып
куярга кирәк, югыйсә пробирканың яки колбаның шартлавы
мөмкин. Гадәттә пробирканы авызы яныннан беркетәләр. Болай
иткәндә пробирканың бөтен җирен җылытырга мөмкин.
Җылыту. Лабораториядә җылытуны горелка, спиртовка яки
электр җылыткычы ярдәмендә башкаралар.
Спиртовка тар муенлы пыяла савыттан (резервуардан),
дисклы металл көпшәгә кертелгән филтәдән һәм капкачтан тора
(134 нче рәсем). Спиртовканы эшкә әзерләгәндә воронка аша
резервуарга күләменең 2/3 өлеше кадәр спирт салалар. Спир¬
товканы янып торган шырпыдан яисә чырадан кабызалар.
Спиртовканы икенче бер спиртовкадан кабызырга ярамый! Болай
эшләгәндә янгын чыгуы ихтимал. Янып торган спиртовканы өреп
сүндерергә дә ярамый, югыйсә бу очракта шулай ук янгын
чыгуы мөмкин. Спиртовка ялкынын сүндерү өчен аны капкачы
белән капларга гына кирәк. Спирт парга әйләнмәсен өчен,
спиртовкадан файдаланмаганда аны капкачы белән каплап куя¬
лар.
Ут капканда, аны сүндерү өчен яна торган әйберне берәр
нәрсә белән капларга (135 нче рәсем), аңа ком сибәргә, су яки
утсүндергечтән чыгучы күбекне сиптерергә кирәк. Ут сүнә, чөн¬
ки кислород керү туктала.
136 нчы рәсемдә төрле газ горелкалары күрсәтелгән. Горел-
каларның төзелеше төрле булуы мөмкин, әмма аларның эшләү
принцибы бер үк. Газ горелканың аслыгындагы газүткәргеч көп¬
шә аша бирелә. Газ һава белән аралаша һәм көпшәдән чыга.
25*
387
132 нче рәсем. Лаборатория штативы:
/— аслык; 2— стержень; 3— винтлар;
4— тоткыч; 5— божра.
Газ һәм һава кертүне көйләү
өчен горелкаларның бер төрен¬
дә винт һәм боҗра куелган.
Бу винтны бераз борып чыгар¬
ганда керә торган һаваның
микъдарын көйләргә була.
Горелканы кабызу өчен шыр¬
пыны (чыраны) кабызырга,
кранын ачырга һәм янып торган
шырпыны горелка тишегенә
якын китерергә кирәк (утны
нәкъ менә яннан якын китерер¬
гә кирәк, югыйсә газ агымы
аны сүндерүе мөмкин), һава¬
ның керүен горелка ялкыны күз
чагылдырып янмаслык итеп
(газ тулысынча янып бетәрлек
булсын) көйләргә кирәк. Горел¬
каны сүндерү өчен газ кранын
борып ябу җитә. Газ кирәк
булмаганда, газ краннары һәр¬
вакытта ябык торырга тиешле-
ген онытмагыз!
Горелка, шәм, спиртовка ял¬
кыны бериш түгел (137 нче рә¬
сем). Аның эчке өлеше караң¬
гырак, температура бик югары
түгел. Ялкынның кырыйлары һәм өске өлеше якты һәм температу¬
ра чагыштырмача югары була. Нәкъ менә шуңа күрә дә, җылы¬
тырга кирәк булган әйберне ялкынның өске өлешенә кертергә
кирәк.
Ачык утта пыяладан ясалган савытлардан бары тик пробир¬
каларны гына җылытырга ярый. Пробирка шартлап ярылмасын
өчен, башта аның барлык урынын ялкын өстендә күчереп җылы¬
талар.
Стаканнарны һәм колбаларны махсус челтәр өстенә куеп
җылыталар.
133 нче рәсем. Пробирканы штатив
тоткычына беркетү.
Реактивлар белән эш итү.
Тәҗрибәләр ясаганда сезгә төр¬
ле матдәләрне — реактивларны
кулланырга кирәк булачак.
Аларны бөке белән капланган
банкаларда, ә эремәләрне тар
муенлы пыяла савытларда —
склянкаларда (шешәләрдә)
саклыйлар. Реактив саклана
торган һәр савытта тиешле
язу — этикетка булырга тиеш.
388
134 нче рәсем. Спиртовка: 135 нче рәсем. Ут капкан спиртны сүн-
1— капкач; 2— дисклы көпшә; дерү.
3— филтә; 4— резервуар
136 нчы рәсем. Газ горелкалары:
1 — көпшә; 2 — катнаштыргыч;
3 — боҗра; 4 — винт.
137 нче рәсем. Ялкынның төзелеше:
1— ялкынның салкынрак өлеше; 2—
кайнар өлеше; 3— ялкынның иң кай¬
нар өлеше.
Шулай булмаганда реактивларның буталуы һәм билгелән¬
гән тикшеренүнең барып чыкмавы ихтимал.
Матдәләрнең тәмен татып тикшерергә ярамый! Исен белү
өчен матдәне саклык белән генә иснәргә кирәк. Моның өчен уч
төбе белән матдә саклана торган савыт авызыннан борынга таба
җиңелчә җилпү хәрәкәтләре ясау җитә (138 нче рәсем). Матдә
парларын күп микъдарларда эчкә сулау сулыш юлларының ял¬
кынсынуына китерүе мөмкин.
389
138 нче рәсем. Газны тикшерү ысулы.
Түгелеп чәчелгән реактив¬
ларны кире савытка җыеп са¬
лырга ярамый.
Кислоталар һәм селтеләр бе¬
лән эш иткәндә аеруча сак бу¬
лырга кирәк. Әгәр тирегә кис¬
лота, селте яки башка зәһәр
матдә тисә, аларны суны күп
агызып юдырып төшерергә ки¬
рәк. Түгелгән кислотага сода
сибәргә яки сода эремәсе са¬
лырга кирәк.
Тиз кабынып китә торган
һәм шартлаучан матдәләр белән эшләгәндә махсус күзлёк кияргә
кирәк.
Лаборатор эшләр башкарганда гомуми кагыйдәләр
1. Лаборатор эшне башкаруга керешкәнче, игътибар белән
аның тасвирламасын укып чыгарга, аның максатына төшенергә
һәм аны башкару эзлеклелеген аңларга кирәк. Эшне башкарган¬
да тасвирламада бирелгән күрсәтмәләрне һәм куркынычсызлык
техникасы кагыйдәләрен төгәл үтәргә кирәк.
2. Эш урынында чисталык һәм тәртип саклау мөһим. Аны эш
өчен кирәксез әйберләр белән тутырмагыз, өстәлгә портфель
һәм китапларыгызны куймагыз.
3. Үзегезне химик савыт-саба белән пөхтә эшләргә күнек¬
терегез; файдаланылган савытларны тәҗрибәне ясап бетергәч
тә юып куегыз.
4. Кайнар приборларны һәм савытларны бары тик махсус ас¬
лыкларга гына куярга ярый. Кулга алганчы кайнар пыяланың
суынганын көтәргә кирәк. (Тышкы күренеше белән кайнар пыяла
салкын пыяладан берничек тә аерылып тормый!)
5. Раковинага шырпы, фильтр кәгазе салырга ярамый. Каты
калдыкларны махсус банкаларга ташларга кирәк.
6. Раковинага куертылган кислота һәм селте эремәләрен тү¬
гәргә ярамый. Аларны суырткыч шкафта торучы махсус банка¬
ларга салырга кирәк.
7. Эш тәмамланганнан соң эш урынын яхшылап җыештырыр¬
га, суның һәм газның ябылган, электрның сүндерелгән булуын
тикшерергә кирәк.
390
НЕОРГАНИК МАТДӘЛӘРНЕ СИНТЕЗЛАУ
Сезгә кайбер неорганик матдәләрне синтезларга кирәк була¬
чак. Экспериментка керешкәнче, аны башкаруга яхшылап әзер¬
ләнегез.
1. Биремне алганнан соң күрсәтелгән матдәне синтезлауның
тасвирламасы белән танышыгыз.
2. Синтезлауга нигез булып торучы реакциянең тигезләмә¬
сен төзегез.
3. Башлангыч матдәләрнең, күрсәтелгән микъдарда синтезла¬
на торган матдә табу өчен, кирәкле микъдарларын исәпләп чы¬
гарыгыз. (Әгәр теге яки бу исәпләүләрне ничек башкарырга ки¬
рәк икәнлеген онытсагыз, атамалар күрсәткеченнән файдаланып,
дәреслекнең тиешле бүлекләрен карагыз.)
4. Экспериментның планын төзегез.
5. Эш өчен кирәкле савыт-сабаны, приборларны, реактив¬
ларны әзерләп куегыз.
6. Экспериментның планын һәм башкарылган исәпләүләрнең
нәтиҗәләрен укытучыга күрсәтегез һәм, рөхсәт алганнан соң,
эшкә керешегез.
Лабораториядә эшләү кагыйдәләрен төгәл үтәгез. Синтезлау¬
ны башкарганда тикшеренү операцияләренең эзлеклелеген тулы-
сынча саклагыз.
7. Эш тәмамланганнан соң табылган матдәне үлчәгез һәм
продуктның чыгышын процентларда исәпләп чыгарыгыз.
8. Табылган матдәнең берникадәр микъдары белән сыйфат
реакцияләре ясагыз.
9. Синтезланган матдәне пробиркага салыгыз, пробиркага
үзегезнең фамилиягез һәм тәҗрибәне үткәрү датасы язылган
этикетка ябыштырыгыз.
10. Препаратны, шулай ук эш планы белән отчет язылган
лаборатория көндәлеген укытучыга тапшырыгыз.
11. Үзегез синтезлаган матдәнең төзелеше, үзлекләре, аны
табу ысуллары һәм куллану турында тиешле китаплардан файда¬
ланып, чыгыш ясарга хәзерләнегез.
Дүрт сулы кальций нитраты Са( 1ЧОз)2-4Н2О
Ca (NO3) 2-4Н2О кристаллогидраты һавада җеби торган, үтә
күренмәле призма рәвешендәге кристаллардай гыйбарәт. Аның
эретелү температурасы 42,5° C тәшкил итә.
Кальций нитратын нитрат кислотасы белән кальций гидрокси-
дын нейтральләштереп яки кальций карбонаты һәм нитрат кисло¬
тасы үзара тәэсир итешкәндә табарга мөмкин.
Бу реакцияләрнең тигезләмәләрен төзегез. Реакция тигезлә¬
мәсе буенча күрсәтелгән микъдарда кристаллогидрат табу өчен
күпме массалы кальций карбонаты (гидроксиды) алырга кирәк
икәнлеген исәпләп чыгарыгыз. Синтезлау өчен нитрат кислотасы¬
391
ның 10% лы эремәсе кулланыла. Синтезлауны башкару өчен бу
эремә нинди күләмдә кирәк булачагын исәпләп табыгыз.
Синтезлауны түбәндәгечә башкарыгыз. Колбадагы нитрат
кислотасына аз-азлап кына кальций карбонаты (гидроксиды)
өстәгез.
Эреп бетмәгән утырымны фильтрлап аерыгыз һәм эремәне,
аның өслегендә кристаллардай торган элпә хасил булганчы, кай¬
нар сулы савыт өстенә куеп парга әйләндерегез. Туендырылган
эремәне берничә көнгә кристаллашырга калдырыгыз.
Синтезлау өчен алынган кальций карбонатының (гидрокси-
дының) массасы буенча продуктның чыгышын процентларда
исәпләп чыгарыгыз.
Ca2+ һәм NOF ионнарына хас сыйфат реакцияләрен ясагыз.
Ca(NO3)2-iIH2O кристалларын табуның 2—3 башка ысулын
тәкъдим итегез һәм бу ысуллар нигезләнгән реакцияләрнең тигез¬
ләмәләрен языгыз.
Натрий гидрокарбонаты NaHCO3
Натрий гидрокарбонаты NaHCO3 — кардай ак төстәге крис¬
таллик порошок. Суда эрүчән. Җылытканда аннан су H2O һәм
углерод (IV) оксиды СОг аерылып чыга һәм ул натрий карбона¬
тына Na2CO3 әверелә.
Промышленностьта сода табу ысулларының берсе
H2O+ NH3=^ NH4OH
NH4OH +CO2=^NH4HCO3
NaCl+ NH4HCO3=^NaHCO31 +NH4Cl
реакцияләренә нигезләнгән.
Синтезлау процессында натрий хлоридының NaCl туендырыл¬
ган эремәсе һәм аммиакның 25% лы эремәсе кулланыла.
20° C та туендырылган 50 мл эремә хәзерләү өчен кирәк
булган натрий хлоридының массасын исәпләп чыгарыгыз. Нат¬
рий хлоридының туендырылган эремәсен колбада хәзерләгез.
Эремәгә 20 мл 25% лы аммиак эремәсе өстәгез. Аннары барлык¬
ка килгән катнашма аша 25—30° C та 20 минут дәвамында бал¬
лоннан яки Кипп аппаратыннан углерод (IV) оксидының шактый
көчле агымын җибәрегез. 15 минуттан соң сыеклык болганчык¬
лана, ә аннан соң шул сыеклыктан натрий гидрокарбонатының
бик күп утырымы төшә.
Бюхнер воронкасында утырымны эремәдән аерыгыз.
Киптерелгән препаратны үлчәгез һәм синтезлау өчен алын¬
ган натрий хлоридының массасы буенча продуктның чыгышын
исәпләгез.
Гидрокарбонат-ионга сыйфат реакциясе ясагыз һәм натрий
ионнарының барлыгын ялкынның төсе үзгәрү буенча ачыклагыз.
Ни өчен
392
NaCl + NH4HCO3^NaHCO3 + NH4Cl
системасында тигезләнешнең натрий гидрокарбонаты хасил булу
ягына авышканлыгын аңлатып бирегез.
Өч*сулы бакыр (II) нитраты Cu(NO3)S-SHzO
Cu(NO3)Z-SHzO кристаллогидраты куе зәңгәр төстәге приз¬
ма рәвешендәге суда яхшы эрүчән кристаллардай гыйбарәт.
Аның эретелү температурасы 114,5°С. Нык кыздырганда бакыр
(II) оксиды хасил итеп таркала. Дңмлы һавада җеби.
Cu(NO3)z-3HzO кристаллогидратын табу ысулларыннан
берсе бакырның нитрат кислотасы (р = 1,18 г/см3) белән реа-
гирлашуына нигезләнгән. Бу реакциянең тигезләмәсен төзегез.
Кристаллогидратны күрсәтелгән микъдарда табу өчен бакыр һәм
нитрат кислотасы нинди микъдарларда кирәк булачагын исәпләп
чыгарыгыз.
Бакырның исәпләп чыгарган микъдарын һәм нитрат кислота¬
сының исәпләп чыгарган күләмен үлчәп алыгыз.
Бакырның нитрат кислотасы белән тәэсир итешү реакциясе
суырткыч шкафта үткәрелә! Фарфор чынаяктагы үлчәп алынган
бакырга үлчәп алынган нитрат кислотасы өстәгез. Катнашмалы
чынаякны кайнар комлы савытка куеп җиңелчә генә җылытыгыз.
Азот оксидлары аерылып чыгу бераз кимегәч, җылытуны көчәй¬
тегез. Бакыр тулысынча эреп беткәннән соң җылытуны туктаты¬
гыз.
Суынган катнашмага тигез күләмдә дистиллирланган су са¬
лыгыз. Барлыкка килгән эремәне фильтрлагыз. Фильтратны, эре¬
мә өслегендә кристаллар элпәсе күренгәнче, парга әйләндерегез.
Эремәне суынырга калдырыгыз. Хасил булучы кристалларның
формасына игътибар итегез. Кристалларны эремәдән аерып алы¬
гыз һәм фильтр кәгазьләре арасына салып корытыгыз. Табылган
матдәне үлчәгез һәм продуктның чыгышын процентларда исәп¬
ләгез.
Cu2+ һәм NO3"ионнарына сыйфат реакцияләре ясагыз.
Cu(NO3)S-SHzO кристаллогидратын табуның башка 2—3
ысулын тәкъдим итегез һәм алар нигезләнгән реакцияләрнең
тигезләмәләрен языгыз.
Ике сулы бакыр (II) хлориды CuClz-2HzO
CuCl2-2Н2О кристаллогидраты яшькелт-күк төстәге призма
рәвешендәге, һавада җеби торган кристаллардай гыйбарәт. Тоз
суда эрүчән. HOoC та сусызландырыла.
Кристаллогидратны оксидлаштыручы катнашында бакырга
хлорид кислотасы белән тәэсир итеп табарга була. Оксидлашты¬
ручы итеп нитрат кислотасын кулланырга мөмкин.
CuCl2-2Н2О кристаллогидратын күрсәтелгән ысул белән табу
реакциясенең тигезләмәсен төзегез.
393
CuCl2-2Н2О кристаллогидратының күрсәтелгән микъдарын
табу өчен кирәкле хлорид кислотасының (р=1,19 г/см3) һәм
нитрат кислотасының (р= 1,2 г/см3) күләмнәрен исәпләп чыга¬
рыгыз. Кристаллогидратны синтезлау өчен кирәк булган бакыр¬
ның массасын исәпләп табыгыз.
Синтезлауны суырткыч шкафта башкарыгыз! Фарфор чына¬
яктагы үлчәп алынган бакырга хлорид кислотасы өстәгез. Чы¬
наякны кайнар комлы савытка куегыз һәм чамалап кына җылыт¬
кан хәлдә аз-азлап нитрат кислотасы салыгыз.
Бакыр эреп беткәч, эремәнең 1/3 күләм өлешен парга әйлән¬
дерегез һәм суынырга калдырыгыз. Барлыкка килгән кристаллар-
ны Бюхнер воронкасында аертып алыгыз. Әгәр кристаллар яшел
төстә икән, аларны суда эретеп яңадан кристаллаштырырга ки¬
рәк.
Табылган кристалларны үлчәгез һәм продуктның чыгышын
процентларда исәпләгез.
Табылган матдәнең бакыр (II) һәм хлорид-ионнардан торган¬
лыгын дәлилләүче сыйфат реакцияләрен ясагыз.
Бакыр (II) хлоридын табуның башка 2—3 ысулын тәкъдим
итегез.
Тетрааммин бакыр (П)нең бер сулы сульфаты
[Cu(NH3) 4] SO4 H2O
[Cu(NH3)4] SO4-H2O кристаллогидраты бакыр (II) сульфа¬
ты эремәсе һәм аммиак тәэсир итешкәндә барлыкка килә. Синтез¬
лау өчен бакыр купоросын CuSO4-SH2O алырга ярый.
[Cu(NH3)4] SO4-H2O кристаллогидратын табу реакциясенең
тигезләмәсен төзегез.
Күрсәтелгән микъдарда продукт табу өчен кирәкле бакыр ку¬
поросының һәм 25% лы аммиак эремәсенең (р = 0,9 г/см3) микъ¬
дарларын исәпләп чыгарыгыз.
Үлчәп алынган бакыр купоросының 20° C та туендырылган
эремәсен хәзерләгез (матдәләрнең эрүчәнлеге турындагы мәгълү¬
матларны белешмәлектән табыгыз).
Синтезлау реакциясен суырткыч шкафта башкарыгыз! Исәп¬
ләп чыгарылганнан икеләтә күләмдә артыграк аммиак эремәсе
үлчәп алыгыз (тигезләнеш аммиакат хасил булу ягына авышсын
өчен). Бакыр купоросы эремәсен кайнап чыкканчы җылытыгыз.
Аннары, пыяла таякчык белән яхшылап болгаткан хәлдә, бакыр
купоросы эремәсенә башта төшкән утырым эреп беткәнче, аз-аз¬
лап аммиак эремәсе өстәгез.
Хасил булган бакыр (II) аммиакатының карасу зәңгәр эре¬
мәсенә тамчылап, болгатмыйча гына этил спирты салыгыз
(спиртның күләмен аммиак эремәсенең күләменә тигез итеп алы¬
гыз) . Эремәне берничә сәгатькә кристаллашырга калдырыгыз.
Барлыкка килгән кристалларны Бюхнер воронкасында аертып
алыгыз.
394
Табылган препаратны үлчәгез һәм продуктның чыгышын про¬
центларда исәпләп чыгарыгыз.
Аммиакка, сульфат-ионга һәм бакыр (II) ионына хас сыйфат
реакцияләрен ясагыз.
Алюмокалий ачуташы K2SO4-AI2(SO4)S-24Н2О
4-3
Ачуташлар дип M2SO4 -M2 (SO4) з -24Н2О составлы тозларны
атыйлар. Монда M—Na+, K+, Rb+, Cs+, NH4*"; M—Al3+, Cr3+,
Fe3+, V3+, Ga3+.
Алюмокалий ачуташы K2SO4-Al2 (SO4) з-24Н2О төссез, үтә
күренмәле октаэдр формасындагы кристаллардай гыйбарәт. Сал¬
кын суда начар, ә кайнар суда бик яхшы эри. Җылытканда
сусызлана һәм ак төстәге порошокка әверелә.
Алюмокалий ачуташын KaSO4 һәм Al2(SO4)S тозлары эремә¬
ләрен бергә кушып табарга була. Реакция тигезләмәсен төзегез.
Ачуташны табу өчен K2SO4 тозының 20% лы эремәсен һәм
Al2(SO4)S-IBH2O матдәсенең 50% лы эремәсен алалар. Күрсә¬
телгән микъдардагы алюмокалий ачуташын синтезлау өчен күп¬
ме башлангыч матдәләр кирәклеген исәпләп чыгарыгыз.
Эремәләрне хәзерләгез һәм аларны кайнап чыкканчы җылы¬
тыгыз. Аннары аларны бергә кушыгыз һәм кристаллашырга кал¬
дырыгыз.
Дөрес формалы аерым эре кристаллар хасил булсын өчен
эремәгә җепкә беркетелгән кристалл төшерергә кирәк.
Кристалларны калган эремәдән аерып алыгыз һәм фильтр кә¬
газендә киптерегез. Калган эремәне махсус банкага салыгыз.
Продуктны үлчәгез һәм аның чыгышын исәпләгез.
Al3+ һәм SO4- ионнарына хас сыйфат реакцияләрен башка¬
рыгыз. Табылган ачуташны горелка ялкынына керткәндә аның
төсе ничек үзгәрүен күзәтегез.
Хромокалий ачуташы KaSO4 -Cr2(SO4)S -24H2O
Хромокалий ачуташы K2SO4-Cr2 (SO4) з-24Н2О куе шәмәхә
төстәге, кызыл якутсыман үтә күрәнүчән октаэдр рәвешендәге
кристаллардай гыйбарәт.
һавада ачуташ ашала һәм аксыл шәмәхә төстәге кунык белән
каплана. Ачуташ суда эри.
Хромокалий ачуташын калий дихроматыннан (VI) K2Cr2O7
сульфат кислотасы катнашында кайтарып табарга була. Кайта¬
ручы сыйфатында этил спиртын алырга мөмкин. Реакция
K2Cr2O7 -HH2SO4 + SC2H5OH + 17Н2О =
K2SO4 • Cr2 (SO4) з • 24Н2О + SC2H4O
тигезләмәсе белән күрсәтелә.
395
Хромокалий ачуташының күрсәтелгән микъдарын синтезлау
өчен күпме калий дихроматы (VI) К2СГ2О7 кирәк булачагын
исәпләп чыгарыгыз. Синтезлау өчен куертылган сульфат кислота¬
сын (р= 1,84 г/см3) 1 г алынган К2СГ2О7 тозына 2,8—3,0 мл
кислота туры килерлек итеп алырга кирәк. 1 г К2СГ2О7 тозына
1 —1,5 мл этил спирты туры килергә тиеш.
Үлчәп алынган К2СГ2О7 тозын 10% лы эремә хасил булырлык
итеп суда эретегез. Барлыкка килгән эремәгә өзлексез болгатып,
кар яки өзлексез агып торучы салкын су белән суыткан хәлдә,
аз-азлап куертылган сульфат кислотасы өстәгез. Шуннан соң
болгатып торган хәлдә аз-азлап этил спирты салыгыз. Эремә
карасу төскә керә һәм аннан черегән алма исе килә башлый.
Эремәне берничә көнгә кристаллашырга калдырыгыз.
Кристалларны эремәдән Бюхнер воронкасында аертып алы¬
гыз. Фильтратны махсус банкага салыгыз.
Синтезлау продуктын үлчәгез һәм продуктның чыгышын про¬
центларда исәпләгез.
K+, Cr3+, SOl- ионнарына сыйфат реакцияләрен ясагыз.
Ачуташның эре кристалларын табу өчен, моннан алдагы эш¬
тәгечә эшләгез.
Кургаш (II) иодиды Pbh
Кургаш (II) иодиды Pbh — сары төстәге порошок, эре крис¬
таллар хәлендә алтынсыман ялтыравыклы яфракчыкларны хә¬
терләтә. Pbh суда бик аз эри.
Кургаш (II) иодидын тозлар эремәләре арасындагы алмашу
реакциясе нигезендә табарга мөмкин. Моның өчен кургаш (II)
ацетаты РЬ(СгН3О2)2 эремәсенә калий иодиды KI эремәсен са¬
лалар.
Бу реакциянең тигезләмәсен төзегез. Күрсәтелгән массалы
кургаш (II) иодидын табу өчен калий йодидының KI һәм
РЬ(СгНзОг) -ЗНгО кристаллогидратының 10% лы эремәләре күп¬
мешәр кирәк булачагын исәпләп чыгарыгыз.
Калий йодидының KI серкә кислотасы өстәлгән эремәсенә
нечкә генә агынты белән кургаш ацетаты РЬ(СгНзО2)г эремәсен
салыгыз. Сары төстәге утырым хасил була. Кургаш (II) йодиды¬
ның Pbh эрерәк кристалларын табу өчен, утырымны, җылыткан
хәлдә, күп итеп алынган һәм 1—2 мл куертылган нитрат кисло¬
тасы өстәлгән суда эретегез. Эремәне суынганда кристаллаштыру
өчен калдырыгыз. Алтынсыман яфракчыклар рәвешендәге Pbh
кристаллары хасил булуга игътибар итегез.
Кристалларны Бюхнер воронкасында аертып алыгыз. Крис¬
талларны киптерегез һәм үлчәгез. Продуктның чыгышын исәплә¬
гез.
396
Кристаллик иод I2
Бу эштә сезгә йод кушылмаларын кулланып үткәрелгән тәҗ¬
рибәләрдән соң җыелган «лаборатория калдыкларыннан» йодны
аерып алырга туры киләчәк. Бу «калдыкларда» ирекле хәлдәге йод
та, кушылмалар хәлендәге иод та (оксидлашу дәрәҗәсе — 1 гә
тигез) бар. Йодны I2 аерып алу өчен йодлы калдыкларны
әче тирәлектә калий дихроматы (VI) белән оксидлаштыралар.
Бу процессны
61- +Cr2O72- -Н4Н+ =312+2Сг3+ +7Н2О
тигезләмәсе белән күрсәтергә була.
1 л йодлы калдыкларга 1,5 мл куертылган сульфат кислота¬
сы (р=1,84 г/см3) һәм 10—40 мл 20°С та туендырылган калий
дихроматы (VI) эремәсе өстәгез. 5—6 сәгатьтән соң утырым өс¬
тендәге сыеклыкны сифон ярдәмендә агызып алыгыз. Калган
йодны Шотт воронкасында фильтрлагыз, 3—4 тапкыр су белән
юдыртыгыз һәм сульфат кислотасы салынган эксикаторда кип¬
терегез.
Коры йодны калий йодидының KI берничә кристалы салын¬
ган киледә төегез. Табылган катнашманы колбага күчерегез
һәм кудырыгыз. Колба стеналарына утырган йод кристалларын
пыяла шпатель ярдәмендә әледән-әле бюкска бушатып торыгыз.
Иод — уалучан, карасу-соры төстәге, металлга хас ялтыра¬
выклы ромб рәвешендәге кристаллардай гыйбарәт. Суда аз эрү-
чән, спиртта яхшы эри. Йодның парлары лайлалы тышчаны
ярсыталар. Эшне суырткыч шкафта башкарыгыз!
1 нче таблица. Кайбер химик элементларның исемнәре, химик билгеләре
һәм чагыштырма атом массалары (түгәрәкләп алынды)
Элементның
русча
исеме
Элементның
татарча
исеме
Элементның
латинча
исеме
Химик
билге
Химик
билгенең
әйтелеше
Чагыш¬
тырма
атом
массасы
Азот
Азот
Nitragenium
N
Эн
14
Алюминий
Алюминий
Aluminium
Al
Алюминий
27
Барий
Барий
Barium
Ba
Барий
137
Бром
Бром
Bromum
Br
Бром
80
Водород
Водород
Hydragenium
H
Аш
1
Железо
Тимер
Ferrum
Fe
Феррум
56
Иод
Иод
Iodum
I
Иод
127
Калий
Калий
Kalium
K
Калий
39
Кальций
Кальций
Calcium
Ca
Кальций
40
Кислород
Кислород
Oxygenium
O
O
16
Кремний
Кремний
Silicium
Si
Силициум
28
Магний
Магний
Magnesium
Mg
Магний
24
Медь
Бакыр
Cuprum
Cu
Купрум
64
Натрий
Натрий
Natrium
Na
Натрий
23
Никель
Никель
Niccolum
Ni
Никель
59
Олово
Аккургаш
Stannum
Sn
Станум
119
Ртуть
Терекөмеш
Hydrargyrum
Hg
Гидраргирум
201
Свинец
Кургаш
Plumbum
Pb
Плюмбум
207
Сера
Күкерт
Sulfur
S
Эс
32
Серебро
Көмеш
Argentum
Ag
Аргентум
108
Углерод
Углерод
Carboneum
C
Це
12
Фосфор
Фосфор
Phaspharus
P
Пэ
31
Фтор
Фтор
Fluorum
F
Фтор
19
Хлор
Хлор
Chlorum
Cl
Хлор
35,5
Цинк
Цинк
Zincum
Zn
Цинк
65
2 нче таблица. Кайбер элементларның электротискәрелеге (Э. T.)'
Элемент
Э.Т.
Элемент
Э.Т.
Элемент
Э.Т.
Элемент
Э.Т.
Li
Be
B
C
N
O
F
1,0
1,5
2,0
2,5
3,0
3,5
4,0
Na
Mg
Al
Si
P
S
Cl
0,9
1,2
1,5
1,8
2,1
2,5
3,0
K
Ca
Sc
Ge
As
Se
Br
0,8
1,0
1,3
1,7
2,0
2,4
2,8
Pb
Sr
In
Sn
Sb
Te
I
0,8
1,0
1,3
1,7
1,8
2,1
2,6
1 Литийның электротискәрелеге 1 гә тигез итеп алынган. Бу шкала буенча
водородның электротискәрелеге 2,1 гә тигез.
398
3 иче таблица. Тозлар, кислоталар һәм нигезләрнең суда эрүчәнлеге
Ионнар
H +
K+
Na +
Ag +
Ba2 +
Ca2 +
Mg2+
Zn2+
Cu2+
Hg2+
Pb2+
Fe2 +
Fe3 +
Al3+
OH-
э
э
—
э
A
A
ю
ю
—
Ю
ю
ю
Ю
NOj
э
э
э
э
э
Э
Э
э
э
э
э
э
э
э
СГ
э
э
э
ю
э
э
Э
э
э
э
A
э
э
э
Br-
э
э
э
ю
э
э
э
э
э
э.
A
э
э
э
I-
э
э
э
ю
э
э
э
э
э
э
Ю
э
—
э
“S^“
э
э
э
ю
э
э
—
ю
ю
ю
Ю
ю
э
—
SOi-
э
э
э
A
A
A
A
A
—
—
Ю
A
ю
—
SOl-
э
э
э
A
Ю
A
Э
Э
э
—
ю
Э
э
э
col-
э
э
э
Ю
Ю
Ю
Ю
Ю
ю
—
ю
Ю
—
—
Sior
э
—
—
—
Ю
Ю
Ю
Ю
—
—
ю
ю
—
—
РОГ
э
э
э
ю
Ю
Ю
Ю
Ю
ю
ю
ю
ю
ю
ю
Э — эрүчән (10 г/л дан артык); A — аз эрүчән (10 г/л дан 0,01 г/л га кадәр);
Ю — практик яктан эремәүчән (0,01 г/л дан ким); сызыкча — матдә суда таркала
яки аның булмавын күрсәтә.
4 нче таблица. Кислоталарның ионлашу константалары (K)
Кислота
Формула
K'
Арсенат
HsAsCh
(I) 5,6-10“3
Бромид
HBr
I-IO9
Германат
H4GeO4
(I) 7,9-10-1°
Йодид
HI
1-10"
Карбонат
H2CO3
(I) 1,32-IO-4
(II) 4,84-10-"
Нитрат
HNO3
43,6
Нитрит
HNO2
4-IO-4
Пербромат
HBrO4
-IO8
Перйодат
H5IO6
(I) 3,09-IO-2
(II) 7,08-IO-9
(III) 2,5-10-15
Перманганат
HMnO4
2-102
Перхлорат
HClO4
IO8
Селенат
H2SeO4
(I) I-IO3
(II) 1,2-10-2
Селенид
H2Se
(I) 1,7-10-4
(II) 1-ю-"
Селенит
H2SeO3
(I) 3,5-10"3
(Il) 5-10-9
' Рим цифрлары ионлашу баскычын күрсәтәләр.
399
Дәвамы.
Кислота
Формула
K'
Силикат (мета)
Силикат (орто)
Сульфат
Сульфид
Сульфит
Теллурат
Теллурид
Фосфат (орто)
Фосфат (икеле)
(пирофосфат)
Фторид (плавик)
Хлорид
Хромат
H2SiO3
H4SiO4
H2SO1
H2S
H2SO3
H6TeO6
H2Te
H3PO4
H4P2O7
HF
HCl
H2CrO4
(I) 2,2-Ю”10
(II) 1,6-10"'2
(I) 2-10-'°
(II) 2-10~12
(III) ою-'2
(I) I-IO3
(II) 1,2-10"2
(I) 6-10~8
(II) 1-ю-'3
(I) 1,58-10-'-’
(II) 6,31-10-“
(I) 2,0-IO-8
(I) 1,0-IO"3
(I) 7,52-IO"3
(II) 6,31-ю-8
(III) 1,26-Ю-'2
(I) 1,4-10-'
(II) 1,1-Ю"2
(III) 2,1-10 7
(IV) 4,1-IO-'0
6,61-ю-4
(I) 1-ю
(II) 3,16-10
5 нче таблица. Нигезләрнең ионлашу константалары (K)
Нигез
Формула
K
Алюминий гидроксиды
Al(OH)3
(III) 1,38-IO-9
Аммоний гидроксиды
NH4OH
6,3-10“5
Бакыр (II) гидроксиды
Cu(OH)2
(II) 3,4-IO-7
Барий гидроксиды
Ba(OH)2
2,3- Ю”'
Ванадий (III) гидроксиды
V(OH)3
(III) 8,3-Ю"'2
Кургаш гидроксиды
Pb(OH)2
(I) 9,6-10-"
(II) 3,0-IO-8
Литий гидроксиды
LiOH
6,8-10-'
Магний гидроксиды
Mg(OH)2
(II) 2,5-Ю"3
Марганец (II) гидроксиды
Mn(OH)2
(II) 5,0-IOz4
Натрий гидроксиды
NaOH
5,9
Стронций гидроксиды
Sr(OH)2
(II) 1,50-10-'
400
Дәвамы
Нигез
Формула
K
Тимер (II) гидроксиды
Тимер (III) гидроксиды
Хром (III) гидроксиды
Цинк гидроксиды
Fe(OH)2
Fe(OH)3
Cr(OH)3
Zn(OH)2
(II) 1,3-10-"
(H) 1,82-10-"
(HI) 1,35-Ю”12
(IH) 1,02-10-"’
(H) 4-10~5
6 н ч ы таблица. Кайбер металларның үзлекләре
Металл
Тыгызлык,
г/см3
Атомлашу
энергиясе,
кДж/моль
Эретелү
температу¬
расы, 0 C
Кайнау
температу¬
расы. ° C
Электр
үткәрүчән-
леге,
Hg=I
Агалтын
21,5
563,4
1773
3800
9,7
Аккургаш
7,3
300,9
232
2720
8,3
Алтын
19,3
354,0
1063
2850
39,6
Алюминий
2,7
318,4
659
2550
36,1
Бакыр
9,0
339,0
1083
2880
56,9
Барий
3,8
195,6
710
1640
1,9
Бериллий
1,9
326,0
1284
2970
5,2
Висмут
9,8
207,1
271
1427
0,8
Вольфрам
19,3
836,0
3420
5370
17,5
Кадмий
8,7
112,0
321
770
12,6
Калий
0,9
91,6
63
776
13,6
Кальций
1,5
176,4
850
1490
21,9
Кобальт
8,9
428,4
1495
2250
15,3
Кургаш
11,3
195,0
327
1751
5
Көмеш
10,5
286,0
961
2160
59,0
Литий
0,5
158,9
180
1350
11,2
Магний
1,7
147,7
650
1103
21,8
Марганец
7,4
278,8
1244
2120
21,8
Натрий
1,0
108,0
98
883
20,8
Никель
8,9
430,1
1455
2140
13,9
Осмий
22,6
780
3030
5000
10,1
Рений
21,0
776,0
3180
5640
4,5
Рубидий
1,5
82,0
39
686
7,7
Стронций
2,6
163,4
770
1357
4,2
Сөрмә
6,7
262,5
630
1625
2,5
Терекөмеш
13,6
61,2
— 39
357
1
Тимер
7,9
417,5
1536
2770
9,8
Титан
4,5
469,9
1670
3170
2,2
Хром
7,1
397,1
1875
2670
5,1
Цезий
1,9
78,0
29
666
4,8
Цинк
7,1
130,5
419
913
16,0
26 П-236
401
7 нче таблиц а. Кайбер элементларның атом радиусы
һәм ионлашу энергиясе
Элементның
тәртип номеры
Элемент
Атом
радиусы, нм
Ионлашу
процессы
Ионлашу энер¬
гиясе AW11011,
кДж/моль
1
H
0,053
н—н+
1318,2
3
Li
0,159
Li-Li +
520,2
4
Be
0,104
Be-Be2+
2656,6
11
Na
0,171
Na-Na+
495,8
12
Mg
0,128
Mg-Mg2+
Al-OAl3+
2188,4
13
Al
0,131
5138,2
19
K
0,216
К-о K+
418,8
20
Ca
0,169
Ca-Ca2+
1735,3
24
Cr
0,143
Cr-Cr3+
5234,7
25
Mn
0,128
Mno-Mn2+
2226,4
26
Fe
0,123
Fe-Fe2+
2323,0
Fe-Fe3+
5274,0
27
Co
0,118
Co-Co2+
2405
28
Ni
0,114
Ni-Ni2+
2487,7
29
Cu
0,119
Cu-Cu2+
2710,1
30
Zn
0,107
Zn-Zn2+
2646,9
37
Rb
0,229
Rb-Rb +
403,0
38
Sr
0,184
Sr-Sr2+
1613,6
47
Ag
0,128
Ag-Ag+
731,0
48
Cd
0,118
Cd-Cd2+
2499,2
50
Sn
0,124
Sn—Sn2+
1419,7
55
Cs
0,252
Cs-Cs+
375,7
56
Ba
0,206
Ba-Ba2+
1468,0
80
Hg
0,113
Hg-Hg2+
Pb-Pb*+
2816,8
82
Pb
0,122
2166,0
8 нче таблица. Кайбер ионнарның гидратлашу җылылыгы
Ион
Гидратлашу
җылылыгы
AWrllap, кДж/моль
Ион
Г идратлашу
җылылыгы
AWriiap, кДж/моль
Ag+
AP+
— 489,5
Li+
— 531,4
—4707,0
Mg2+
— 1953,9
Ba2+
— 1338,9
Mn2+
— 1878,6
Ca2+
— 1615,0
Na +
— 422,6
Cs+
— 280,3
Ni2 +
—2138,0
Cu2+
—2129,6
Pb2+
— 1514,6
H +
— 1108,7
Rb +
— 313,8
Fe2+
— 1924,6
Hg2+
к+
— 1850,3
Sr2+
— 1476,9
— 338,9
Zn2+
—2075,3
402
9
н ч ы таблица. Кайбер матдәләрнең ясалу җылылыклары
ДЯясалу (25° С)
Матдә
Формула
А//Ясалу, КДЖ/МОЛЬ
Алмаз
Аммиак
Ацетилен
Бромоводород
Cy
Cy пары
Иодоводород
Кальций карбонаты
Натрий карбонаты
Кислород
Метан
Озон
Алюминий оксиды
Кальций оксиды
Күкерт (IV) оксиды
Күкерт (VI) оксиды
Углерод (II) оксиды
Углерод (IV) оксиды
Пирит
Сероводород
Алюминий сульфаты
Фтороводород
Хлор
Калий хлораты (V)
Калий хлориды
Натрий хлориды
Хлороводород
С(к)
NH3 (г)
C2H2 (г)
HBr (г)
H2O (с)
H2O (г)
HI (г)
CaCO3 (к)
Na2CO3 (к)
O2 (г)
CH4 (г)
O3 (г)
Al2O3 (к)
CaO (к)
502 (г)
503 (г)
CO (г)
CO2 (г)
FeS2 (к)
H2S (г)
Al2(SO4)3(K)
HF (г)
Cl2 (г)
KClO3 (к)
KCl (к)
NaCl (к)
HCl (г)
1,88
— 46,19
226,7
— 34,12
— 285,8
— 241,8
26,6
— 1206,9
— 1130,9
O
— 74,86
142,3
— 1676
— 635,5
— 296,9
— 396,1
— 110,5
— 393,5
— 163,3
— 20,9
—3442
— 270,9
0
— 391,2
— 435,9
— 4Ц,1
— 92,8
26*
ӘДӘБИЯТ1
Первоначальные химические понятия
Семенов H. H., Петрянов И. В. Неведомое на вашу долю.— M.:
Педагогика, 1974.
Книга для чтения по неорганической химии: В 2 ч./ Coct. В. А. Крицман.—
M.: Просвещение, 1983—1984.
Рич В. Виток спирали.— M.: Детская литература, 1974.
Манолов К., Лазарев Д., Лилов И. У химии свои законы.—
Л., Химия, 1975.
Конарев Б. Н. Любознательным о химии: Неорганическая химия.—
M.: Химия, 1978.
Никулин Ф. Е. Чудеса подлинные и мнимые: Страницы истории безбож¬
ной науки — химии.— M.: Молодая гвардия, 1978.
Манолов К. Великие химики.— M.: Мир, 1985.
Крицман В. А. Роберт Бойль, Джон Дальтон, Амедео Авогадро. Созда¬
тели атомно-молекулярного учения в химии.— M.: Просвещение, 1976.
Pa вич Н. А. Повесть о великом поморе.— M.: Детская литература, 1976.
Периодический закон и периодическая система
химических элементов Д. И. Менделеева. Строение вещества
Петрянов И. В., Трифонов Д. Н. Великий закон.— M.: Педагогика,
1976.
Агафошин Н. П. Периодический закон и периодическая система элемен¬
тов Д. И. Менделеева.— M.: Просвещение, 1982.
M а карен я A. A., P ы с е в Ю. В. Д. И. Менделеев,—M.: Просвещение,
1983.
Книга для чтения по неорганической химии / Сост. В. А. Крицман.— M.:
Просвещение, ч. 1, 1983.
Третьяков Ю. Д., Метл ин Ю. Г. Основы общей химии.— M.: Про¬
свещение, 1980.
Трифонов Д. H., Трифонов В. Д. Как были открыты химические эле¬
менты.— M.: Просвещение, 1980.
Фигуровский Н. А. Открытие элементов и происхождение их назва¬
ний.— M.: Наука, 1970.
1 Тәкъдим ителгән китаплардагы материаллар буенча дәрестә чыгыш ясау
өчен кыскача хикәяләр төзи аласыз.
404
Общие закономерности химических реакций
Третьяков Ю. Д., Метл ин Ю. Г. Основы общей химии.— M.: Про¬
свещение, 1980.
Николаев Л. А. Катализ в природе и промышленности.— M.: Просве¬
щение, 1976.
Николаев Л. А., Фадеев Г. Н. Молекула, скорость, реакция.—
M.: Просвещение, 1975.
Хомченко Г. П., Севастьянова К. И. Окислительно-восстановитель¬
ные реакции,—M.: Просвещение, 1975.
Эпштейн Д. А. Химия и промышленность.— M.: Просвещение, 1976.
Фиалков Ю. Я. Необычные свойства обычных растворов.— M.: Педаго¬
гика, 1978.
Очкин А. В., Фадеев Г. Н. Химия защищает природу.— M.: Про¬
свещение, 1984.
Гудкова А. С. и др. 500 задач по химии.— M.: Просвещение, 1977.
Б а л е з и н С. А. От чего и как разрушаются металлы.— M.: Просвещение,
1976.
Химические элементы
Книга для чтения по неорганической химии / Сост. В. А. Крицман.— M.:
Просвещение, ч. 1, 1983, ч. 2, 1984.
Популярная библиотека химических элементов / Под ред. И. В. Петрянова-
Соколова: В 2-х кн.— M.: Наука, 1978.
Барков С. А. Галогены и подгруппа марганца. Элементы VII группы
периодической системы Д. И. Менделеева.— M.: Просвещение, 1976.
Немчанинов Г. Л. Путешествие по шестой группе. Элементы Vl группы
периодической системы Д. И. Менделеева.— M.: Просвещение, 1976.
Петрянов И. В. Самое необыкновенное вещество в мире.— M.: Педаго¬
гика, 1975.
Фадеев Г. Н. Пятая вертикаль периодической системы. Элементы V груп¬
пы периодической системы Д. И. Менделеева,—M.: Просвещение, 1973.
Вишневский Л. Д. Под знаком углерода. Элементы IV группы перио¬
дической системы Д. И. Менделеева.— M.: Просвещение, 1978.
Дерягин Б. В., Федосеев Д. В. Алмазы делают химики.— M.: Педа¬
гогика, 1980.
Литвак Ш. И. Фосфор на службе урожая.— M.: Просвещение, 1979.
Шалинец А. Б. Провозвестники атомного века. Элементы III группы пе¬
риодической системы Д. И. Менделеева.— M.: Просвещение, 1975.
Пурмаль А. П., Цирельников В. И. Рожденные электричеством.
Элементы Il группы периодической системы Д. И Менделеева.— M.: Просвеще¬
ние, 1983.
Попова Л. Ф. От лития до цезия. Элементы I группы периодической си¬
стемы Д. И. Менделеева.— M., Просвещение, 1972.
Руттен М. Я. Три триады и шесть невидимок. Элементы VIII группы пе¬
риодической системы Д. И. Менделеева.— M.: Просвещение, 1976.
Любимов И. М. Редкие элементы и их география.— M.: Просвещение,
1977.
405
Трифонов Д. Н. Цена истины. Рассказ о редкоземельных элементах.—
M.: Педагогика, 1977.
Венецкий С. И. Рассказы о металлах.—M.: Металлургия, 1986.
Савицкий Е. M., К л я ч к о В. С. Металлы космической эры.— M.: Ме¬
таллургия, 1978.
Фадеев Г. H., C ы ч е в А. П. Мир металлов и сплавов.— M.: Просве¬
щение, 1978.
Справочная литература
Б у с е в А. И., E ф р е м о в И. П. Определения, понятия, термины в хи¬
мии.— M.: Просвещение, 1977.
Зоммер К. Аккумулятор знаний по химии.— M.: Мир, 1977.
Рабинович В. А., Хавин 3. Я. Краткий химический справочник.—
Л.: Химия, 1978.
Справочник по химии / Под ред. П. И. Воскресенского.— M.: Просвещение,
1978.
Химия. Справочные материалы / Под ред. Ю. Д. Третьякова.— M.: Просве¬
щение, 1984.
Энциклопедический словарь юного химика/Под ред. М. А. Прокофьева.—
M.: Педагогика, 1982.
Энциклопедия школьника. Неорганическая химия / Под ред. М. А. Прокофь¬
ева,—M.: Советская энциклопедия, 1975.
Уку ярдәмлегендә бирелгән кайбер терминнарның
һәм төшенчәләрнең татарча-русча сүзлеге
Авогадро законы
Агалтын
Агач күмере
Агрегат хәле
Адсорбция
Азот
Азот-водород катнашмасы
Акбур
Аккургаш
Аксым
Активлаштырылган күмер
Активлаштыру энергиясе
Активлаштырылган комплекс
Алебастр
Аллотропия
Алмаз
Алтын
Алюминий
Алюмосиликат
Алюмотермия
Амальгама
Аммиак
Аммиаклы су
Аммиак-һава катнашмасы
Аммоний ионы
Амфотерлык
Анализ
Анион
Апатит
Аргон
Ареометр
Астат
Атом массасы
Атом номеры
Атом радиусы
Атомнарның координациясе
Атомлаштыру энергиясе
Ацетилен
Аш тозы (натрий хлориды)
— закон Авогадро
— платина
— древесный уголь
— агрегатное состояние
— адсорбция
— азот
— азотоводородная смесь
— мел
— олово
— белок
— активированный уголь
— энергия активизации
— активированный комплекс
— алебастр
— аллотропия
— алмаз
— золото
— алюминий
— алюмосиликат
— алюмотермия
— амальгама
— аммиак
— аммиачная вода
— аммиачновоздушная смесь
— ион аммония
— амфотерность
— анализ
— анион
— апатит
— аргон
— ареометр
— астат
— масса атома
— атомный номер
— атомный радиус
— координация атомов
— энергия атомизации
— ацетилен
— поваренная соль (хлорид
натрия)
407
Ашламалар
— азотлы
— бөртекләндерелгән
— гади
— удобрения
— азотные
— гранулированные
— простые
— комплекслы
— комплексные
— минераль
— органик
— фосфорлы
— минеральные
— органические
— фосфорные
Бакыр
Бакыр купоросы
Балчык
Барий
Бензин
Бериллий
Вертолет тозы
Бетон
Боксит
Бор
Бром
Бюретка
Бәйле азот
Бәйләнеш
— медь
— медный купорос
— глина
— барий
— бензин
— бериллий
— бертолетова соль
— бетон
— боксит
— бор
— бром
— бюретка
— связанный азот
— связь
— донорлы-акцепторлы
— металлик
— пи-бәйләнеш
— сигма-бәйләнеш
Бәйләнеш энергиясе
— донорно-акцепторная
— металлическая
— пи-связь
— сигма-связь
— энергия связи
Валентлык
Ванадий
Вант-Гофф кагыйдәсе
Висмут
Водород
Вольфрам
— валентность
— ванадий
— правило Вант-Гоффа
— висмут
— водород
— вольфрам
Гальваник элемент
Галлий
Галоген
Гафний
Гелий
Генетик бәйләнеш
Генератор газы
Германий
Гигроскопиклык
Гидратлашкан ион
Гидроксоний ионы
Гидролиз
— гальванический элемент
— галлий
— галоген
— гафний
— гелий
— генетическая связь
— генераторный газ
— германий
— гигроскопичность
— гидратированный ион
— ион гидроксония
— гидролиз
408
Гидрометаллургии ысул
Глазурь
Глинозем
Гесс законы
Гидратлашу
Гидратлашу энергиясе
Гидрат тышчасы
Гидрид
Гидроксид
Гипс
Глаубер тозы
Гранит
Графит
— гидрометаллургический способ
— глазурь
— глинозем
— закон Гесса
— гидратация
— энергия гидратации
— гидратная оболочка
— гидрид
— гидроксид
— гипс
— глауберова соль
— гранит
— графит
Дейтерий
Динамик тигезләнеш
Дистиллирланган су
Дистиллирлау (куу)
Домна газлары
Домна миче
Дуралюмин
— дейтерий
— динамическое равновесие
—дистиллированная вода
— дистилляция (перегонка)
— доменные газы
— доменная печь
/
— дуралюмин
Елга комы
— речной песок
Затлы газлар
Затлы металлар
— благородные газы
— благородные металлы
Известьташ
Известь
— известняк
— известь
— сүндерелгән
— сүндерелмәгән
Известьле су
Известь сөте
Изотоп
Ингибитор
Индекс
Индикатор
Индий
Инерт газлар
Ионлашу энергиясе
Ионлашу константасы
Ионлы кушылма
Ионлы реакция
Ис газы
Иттрий
Йоттыру башнясы
— гашеная
— негашенная
— известковая вода
— известковое молоко
— изотоп
— ингибитор
— индекс
— индикатор
— индий
— инертные газы
— энергия ионизации
— константа ионизации
— ионное соединение
— ионная реакция
— угарный газ
-— иттрий
— поглотительная башня
Кальцит
Kapa дары
— кальцит
— черный порох
409
«Кайнаучы катлам»
Кайтаручы
Кайтарылу
Калий
Калий перманганаты
Кальций
Карбамид (мочевина)
Карбин
Карборунд
Каршы агым принцибы
Катализ
Катализатор
Каталитик агу
Катион
Катнашма
Катылык
Каты ягулыкны
газификацияләү
Катышма
Кварц
Керамика
Киле
Кислоталар
— арсенат
— борат
— бромид
— гипохлорит
— германат
— иодид
— карбонат
— нитрат
— нитрит
— пербромат
— перйодат
— перманганат
— перхлорат
— селенат
— селенид
— селенит
— силикат
— сульфат
— сульфид
— сульфит
— теллурат
— теллурид
— теллурит
— фосфат
— фторид (плавик)
— «кипящий слой»
— восстановитель
— восстановление
— калий
— перманганат калия
— кальций
— карбамид (мочевина)
— карбин
— карборунд
— принцип противотока
— катализ
— катализатор
— каталитический яд
— катион
— смесь
— твердость
— газификация твердого топлива
— примесь
— кварц
— керамика
— ступка
— кислоты
— мышьяковая
— борная
— бромоводородная
— хлорноватистая
— германиевая
— иодоводородная
— угольная
— азотная
— азотистая
— бромная
— иодная
— марганцевая
— хлорная
— селеновая
— селеноводородная
— селенистая
— кремниевая
— серная
— сероводородная
— сернистая
— теллуровая
— теллуроводородная
— теллуристая
— фосфорная
— фтороводородная (плавиковая)
410
— хлорид (хлороводород)
— хромат
Киптерү башнясы
Кислород
Кислота калдыгы
Кобальт
Кокс
Kokc газы
Комплекслы кушылмалар
Конвертор
Контакт аппараты
Корунд
Корым
Коры боз
Корыч
Корычны оксидлау
Кремнезем
Коэффициент
Кремний
Криптон
Кристаллаштыру
Кристаллизацион су
Кристаллик челтәр
— атомлы
— соляная (хлороводородная)
— хромовая
— сушильная башня
— кислород
— кислотный остаток
— кобальт
— KOKC
— коксовый газ
— комплексные соединения
— конвертор
— контактный аппарат
— корунд
— сажа
— сухой лед
— сталь
— оксидирование стали
— кремнезем
— коэффициент
— кремний
— криптон
— кристаллизация
— кристаллизационная вода
— кристаллическая решетка
— атомная
— металлик
— металлическая
— молекуляр
— ионлы
Кристаллогидрат
Ксенон
Кудыру кубы
Кургаш
Кургаш ялтыравыгы
Kyy (возгонка)
Курчатовий
Кушылма
Кыр штаты
Көмеш
Күкерт
— пластик
— ромбик
Күренеш
— физик
— химик (химик реакция)
— молекулярная
— ионная
— кристаллогидрат
— ксенон
— перегонный куб
— свинец
— свинцовый блеск
— возгонка
— курчатовий
— соединение
— полевой штат
— серебро
— сера
— пластическая
— ромбическая
— явление
— физическое
— химическое (химическая реакция)
Лакмус
Лантан
Лантаноидлар
Ле Шателье принцибы
Литий
— лакмус
— лантан
— лантаноиды
— принцип Ле Шателье
— литий
411
Магний
Марганец
Матдә
— гади
— катлаулы
— неорганик
— органик
Матдәләрнең массасы
саклану законы
Матдә микъдары
Матдә төзелеше
— молекуляр
— молекуляр булмаган
Матдәнең яну җылылыгы
Менделевий
Металлар
— авыр
— авыр эретелүчән
— җиңел
— җиңел эретелүчән
Металлар коррозиясе
Металларны пассивлаштыру
Металларның электрохимик
көчәнешләр рәте
Металлотермия
Метан
Микроэлемент
Метилоранж
Молекулаара тәэсир
итешү көчләре
Молибден
Моль
Моляр күләм
Моляр масса
Мышьяк
Мәрмәр (мрамор)
Наждак
Натрий
Нейтральләшү реакциясе
Нейтрон
Неметалл
Неон
Неорганик химия
Нигез
Никель
Ниобий
— магний
— марганец
— вещество
— простое
— сложное
— неорганическое
— органическое
— закон сохранения массы веществ
— количество вещества
— строение вещества
— молекулярное
— немолекулярное
— теплота сгорания вещества
— менделевий
— металлы
— тяжелые
— тугоплавкие
— легкие
— легкоплавкие
— коррозия металлов
— пассивирование металлов
— электрохимический ряд
напряжений металлов
— металлотермия
— метан
— микроэлемент
— метилоранж
— силы межмолекулярного
взаимодействия
— молибден
— моль
— молярный объем
— молярная масса
— мышьяк
— мрамор
— наждак
— натрий
— реакция нейтрализации
— нейтрон
— неметалл
— неон
— неорганическая химия
— основание
— никель
— ниобий
412
Озон
Оксид
— амфотер оксид
— нигез оксиды
— кислота оксиды
Оксидлашу
Оксидлашу дәрәҗәсе
Оксидлашу-кайтарылу
реакциясе
Орбита
Орбиталь
Парга әйләндерү
Период
— зур
— кечкенә
Пирометаллургик ысул
Пипетка
Пирит (тимер колчеданы,
күкерт колчеданы)
Плавик шпаты (флюорит)
Пластиклык
Полоний
Поташ
Процесслар
— кайтма
— кайтма булмаган
— кире
— туры
Протий
Протон
Пыяла
— кварц пыяласы
— тәрәзә пыяласы
— хрусталь пыяла
— эрүчән (сыек) пыяла
Радий
Радиоактивлык
Радон
Раскислитель
Реакциянең җылылык эффекты
Рубидий
Рубин (кызыл якут)
Сапфир (зәңгәр якут)
Саф матдәләр
Селен
•— озон
— оксид
— амфотерный
— основной
— кислотный
— окисление
— степень окисления
— окислительно-восстановительная
реакция
— орбита
— орбиталь
— выпаривание
— период
— большой
— малый
— пирометаллургический способ
— пипетка
— пирит (железный колчедан,
серный колчедан)
— плавиковый шпат (флюорит)
— пластичность
— полоний
— поташ
— процессы
— обратимые
— необратимые
— обратные
— прямые
— протий
— протон
— стекло
— кварцевое
— оконное
— хрустальное
— растворимое (жидкое)
— радий
— радиоактивность
— радон
— раскислитель
— тепловой эффект реакции
— рубидий
— рубин
— сапфир
— чистые вещества
— селен
413
Селитра
— селитра
Селте
— щелочь
Селтеле-җир металлары
— щелочноземельные металлы
Селтеле металлар
— щелочные металлы
Сернистый газ (күкерт (IV) оксиды)
— сернистый газ (оксид серы (IV) )
Сероводород
— сероводород
Силикагель
— силикагель
Синтез
— синтез
Система
— система
— гетероген
— гетерогенная
— гомоген
— гомогенная
Системаның халәте
— состояние системы
Ситалл
— ситалл
Скандий
— скандий
Скипидар
— скипидар
Сода
— сода
— кальцинирланган сода
— кальцинированная
— кристаллик сода
— кристаллическая
— кер содасы
— стиральная
— чәй содасы
— питьевая
Стеклоуглерод
— стеклоуглерод
Стронций
— стронций
Суның катылыгы
— жесткость воды
— карбонатлы (вакытлы)
— карбонатная (временная)
— карбонатсыз (даими)
— некарбонатная (постоянная
Суперфосфат
— суперфосфат
— гади
— простой
— икеле
— двойной
Сөрмә
— сурьма
Табигый газ
— природный газ
Таллий
— таллий
Теллур
— теллур
Терекөмеш
— ртуть
Термохимик реакция
— термохимическая реакция
Термохимик тигезләмә
— термохимическое уравнение
Термит
— термит
Тигезләнеш константасы
— константа равновесия
Тигель
— тигель
Тимер
— железо
Тимер-бетон
— железобетон
Тимер купоросы
— железный купорос
Тимерташ
— железняк
— кызыл
— красный
— магнитлы
— магнитный
— соры
— бурый
Титан
— титан
414
Тоз
— соль
— урта яки нормаль
— әче
Тондыру
Торий
Тоткыч
Тритий
Тыгызлык
Төйгеч
Төркем
Төркемчә
— төп
— средняя или нормальная
— кислая
— отстаивание
— торий
— держатель, держалка
— тритий
— плотность
— пестик
— группа
— подгруппа
— главная
— ян
Төш корылмасы
Төш реакциясе
— побочная
— заряд ядра
— ядерная реакция
Уалучанлык
Углекислый газ (углерод
(IV) оксиды)
Углерод
Утырым
Уран
— хрупкость
— углекислый газ (оксид угле-
рода (IV) )
— углерод
— осадок
— уран
Фарфор
Фаянс
Фенолфталеин
Ферроэретмә
Физик җисем
Фильтрлау
Флюс
Фосфид
Фосфор
Фосфорит
Фотосинтез
Франций
Фтор
— фарфор
— фаянс
— фенолфталеин
— ферросплав
— физическое тело
— фильтрование
— флюс
— фосфид
— фосфор
— фосфорит
— фотосинтез
— франций
— фтор
Химик бәйләнеш
— химическая связь
— водородлы
— ионлы
— водородная
— ионная
— поляр ковалент
— поляр булмаган ковалент
Химик кинетика
Химик кушылманың ясалу
җылылыгы
Химик реакциянең тизлеге
Химик тигезләмә
Химик тигезләнеш
— ковалентная полярная
— ковалентная неполярная
— химическая кинетика
— теплота образования химического
соединения
— скорость химической реакции
— химическое уравнение
— химическое равновесие
415
Химик формула
Химик элемент
Химик элементның билгесе
(символы)
Химик элементның масса
өлеше
Химик элементларның периодик
законы
Химик элементларның
Д. И. Менделеев периодик
системасы
Хлор
Хлорлы известь
Хлорлы су
Хром
Цезий
Цинк
Цинк обманкасы
Цирконий
Цемент
— фосфатлы
Циркуляция принцибы
Чагыштырма атом массасы
Чагыштырма молекуляр масса
Чагыштырма тыгызлык
Чуен
Чылбыр реакцияләр
Чүкел үчәнлек
Шартлагыч катнашма
Шихта
Шлак
Экзотермик реакция
Электр дугалы мич
Электр үткәрүчәнлек
Электролиз
Электролитик диссоциация
Электрон
Электрон болыты
Электрон болытларының
аралашуы
Электроннар катлавы
Электроннар конфигурациясе
Электроннар сүрүе
— химическая формула
— химический элемент
— знак (символ) химического элемента
— массовая доля химического
элемента
— периодический закон химических
элементов
— периодическая система химических
элементов Д. И. Менделеева
— хлор
— хлорная известь
— хлорная вода
— хром
— цезий
— цинк
— цинковая обманка
— цирконий
— цемент
— фосфатный
— принцип циркуляции
— относительная атомная масса
— относительная молекулярная
масса
— относительная плотность
— чугун
— цепные реакции
— ковкость
— гремучая смесь
— шихта
— шлак
— экзотермическая реакция
— электродуговая печь
— электропроводность
— электролиз
— электролитическая диссо¬
циация
— электрон
— электронное облако
— перекрывание электронных
облаков
— электронный слой
— электронная конфигурация
— электронная оболочка
416
Электротискәрелек
Эндотермик реакция
Энергетик фактор
Энтропия
Энтропия факторы
Эрегән матдәнең масса өлеше
Эремә
— куертылган
— сыегайтылган
— туендырылган
— туендырылмаган
Эремәнең моляр концентрациясе
Эремәнең тыгызлыгы
Эреткеч
Эретелмә
Эретмә
Эрүчәнлек
Эрүчәнлек кәкресе
Юдыргыч
Яндыру миче
Яну
Үзлек
— физик
— химик
Үлчәү колбасы
Үтә күренүчәнлек
Җылылык алмаштыргыч
Җылылык алмашу принцибы
Җылы үткәрүчәнлек
һава
һава җылыткыч
— электроотрицательность
— эндотермическая реакция
— энергетический фактор
— энтропия
— энтропийный фактор
— массовая доля растворенного
вещества
— раствор
— концентрированный
— разбавленный
— насыщенный
— ненасыщенный
— молярная концентрация
раствора
— плотность раствора
— растворитель
— расплав
— сплав
— растворимость
— кривая растворимости
— промывалка
— обжиговая печь
— горение
— свойство
— физическое
— химическое
— мерная колба
— прозрачность
— теплообменник
— принцип теплообмена
— теплопроводность
— воздух
— воздухонагреватель
27 п-236
ЭЧТӘЛЕК
1 НЧЕ КИСӘК
Башлангыч химик төшенчәләр
§ 1. Химия — матдәләр һәм аларның әверелешләре турындагы фән . .
1 нче лаборатор дәрес Матдәләр һәм аларның үзлекләре
2 нче лаборатор дәрес. Химик реакцияләрнең билгеләре
§ 2. Химик элемент. Чагыштырма атом массасы
§ 3. Химик формулалар. Чагыштырма молекуляр масса
§ 4. Атомнар. Молекулалар. Молекуляр кристаллар
§ 5. Атомнар. Атомлы кристаллар
3 нче лаборатор дәрес. Кристалларны микроскоптан күзәтү
§ 6. Гади матдәләр
§ 7. Катлаулы матдәләр
§ 8. Моль. Моляр масса
4 нче лаборатор дәрес. Гади матдәләрдән катлаулы матдәләр табу . .
Катлаулы матдәнең формуласын чыгаруга күнегүләр
Кушылмаларның формулаларын йөзүгә күнегүләр
Д. И. Менделеев периодик системасында урнашуларына карап,элементлар
ның оксидлашу дәрәҗәләрен билгеләүгә күнегүләр
§ 9. Ике элементлы кушылмалар
Кушылмада элементларның масса өлешләрен билгеләүгә күнегүләр . .
§ 10. Матдәләрнең катнашмалары. Эремәләр
5 нче лаборатор дәрес. Сыеклыкны кудырып чистарту
6 нчы лаборатор дәрес. Матдәләрне яңадан кристаллаштырып аеру . .
Эрегән матдәнең эремәдәге масса өлешен табуга күнегүләр
7 нче лаборатор дәрес. Эремә хәзерләү һәм аның тыгызлыгын үлчәү . .
§ 11. Матдәләрнең массасы саклану законы
Химик реакцияләрнең тигезләмәләрен төзүгә күнегүләр
Реакцияләрнең тигезләмәләре буенча исәпләүләргә күнегүләр ....
§ 12. Реакциянең җылылык эффекты
Термохимик тигезләмәләр буенча исәпләүләргә күнегүләр
3
5
5
6
9
10
12
14
15
17
19
21
22
24
26
28
30
31
33
34
36
38
39
41
43
44
46
Неорганик матдәләрнең аеруча әһәмиятле класслары
§ 13. Тозлар 48
§ 14. Электролитик диссоциация 50
8 нче лаборатор дәрес. Оксидлар. Гади матдәләрдән оксидлар хасил
булу 51
§ 15. Кислоталар 53
§ 16. Неметалл. Кислота оксиды. Кислота 54
§ 17. Металл. Нигез оксиды. Нигез 56
§ 18. Нейтральләшү реакциясе 58
9 нчы лаборатор дәрес. Кислоталар һәм нигезләр 59
§ 19. Кислородлы кислоталарның тозлары 61
§ 20. Ионлы реакцияләр 63
Реакцияләрнең ионлы тигезләмәләрен төзүгә күнегүләр 65
10 нчы лаборатор дәрес. Ионлы реакцияләр 66
«Эремәләрнең моляр концентрациясе» темасына карата күнегүләр ... 67
11 нче лаборатор дәрес. Күрсәтелгән моляр концентрацияле эремә хәзер¬
ләү 69
§21. Оксидларның кислоталар һәм нигезләр белән үзара тәэсир итешү¬
ләре 71
418
12 нче лаборатор дәрес. Матдәләрнең класслары арасында генетик бәйлә¬
неш 72
§ 22. Неорганик матдәләрнең классификациясе 73
Периодик закон һәм химик элементларның
Д. И. Менделеев периодик системасы
§ 23. Периодик законның алтарихы 76
§ 24. Д. И. Менделеев тарафыннан периодик законны һәм химик элемент¬
ларның периодик системасын ачу 78
§ 25. Д. И. Менделеевның фәнни казанышы 80
§ 26. Дмитрий Иванович Менделеев 84
§ 27. Атом төзелеше 87
§ 28. Изотоплар 88
§ 29. Электронның атомдагы хәрәкәте 91
§ 30. Атомның электроннар сүрүе 92
§31. Периодик система һәм атом төзелеше 94
§ 32. Д. И. Менделеев периодик системасының структурасы 97
Элементларның Д. И. Менделеев периодик системасында урнашуына ка¬
рап, химик элементның атом төзелешен билгеләүгә карата күнегү¬
ләр 100
§ 33. Элементларның атом номерлары функцияләре буларак атом радиус¬
лары 102
§ 34. Элементларның атом номерлары функцияләре буларак атомнарның
ионлашу энергияләре 103
13 нче лаборатор дәрес. 3 нче период элементларының оксидлары һәм
гидроксидлары 105
§ 35. Элементларның периодик системада урнашулары һәм аларның оксид¬
ларының һәм гидроксидларының үзлекләре 107
Химик бәйләнеш. Матдә төзелеше
§ 36. Атомнарның үзара тәэсир итешүе. Химик бәйләнеш Ill
«Химик бәйләнеш һәм молекулаларның төзелеше» темасына карата күне¬
гүләр 113
§ 37. Поляр һәм поляр булмаган бәйләнешләр. Электротискәрелек ... 115
§ 38. Элементларның периодик системада урнашулары һәм аларның гади
матдәләренең структурасы 117
§ 39. Гади матдәләрнең оксидлашу-кайтарылу үзлекләре 120
Оксидлашу-кайтарылу реакцияләренең тигезләмәләрен төзүгә күнегү¬
ләр 121
Водород
§ 40. Водород. Водородның физик үзлекләре 124
«Газларның чагыштырма тыгызлыгы» темасына карата күнегүләр ... 126
§41. Водородның химик үзлекләре 128
§ 42. Водородны ягулык буларак куллану. Химик реакцияләрнең энер¬
гетикасы 131
Реагентларның һәм реакция продуктларының химик бәйләнешләре энер¬
гияләре буенча реакциянең җылылык эффектын исәпләүләргә күне¬
гүләр 133
§ 43. Водородны табу 134
14 нче лаборатор дәрес. Водород һәм аның үзлекләре 137
«Газларның моляр күләме. Химик реакцияләр вакытында газларның кү¬
ләм чагыштырмалары» темасына карата күнегүләр 138
27*
419
Химик элементларның Д. И. Менделеев
периодик системасының Vll теркем р-элементлары
(фтор төркемчәсе)
§ 44. Фтор төркемчәсенә гомуми характеристика 141
§ 45. Фтор 144
§ 46. Хлор 146
§ 47. Хлоридлар 150
§ 48. Хлороводород кислотасы 153
15 нче лаборатор дәрес. Хлоридлар. Хлорид кислотасы 155
«Эремәдә эрегән матдәнең күпме булуын күрсәтү ысуллары арасында
үзара бәйлелек» темасына карата күнегүләр 156
§ 49. Хлорның кислородлы кушылмалары 157
§ 50. Галогеннарның чагыштырма характеристикасы 160
16 нчы лаборатор дәрес. Галогеннар 164
Химик реакцияләрнең гомуми закончалыклары
§51. Химик реакцияләрнең энергетикасы 165
«Химик кушылманың ясалу җылылыгы» темасына карата күнегүләр . . . 167
§ 52. Динамик тигезләнеш 169
«Матдәләрнең суда эрүчәнлеге» темасына карата күнегүләр 172
17 нче лаборатор дәрес. Эксперименталь мәгълүматлар буенча матдәнең
эрүчәнлек кәкресен төзү 174
§ 53. Химик тигезләнеш 174
§ 54. Химик реакциянең тизлеге 176
§ 55. Активлаштыру энергиясе 178
§ 56. Катализ 181
Химик элементларның Д. И. Менделеев
периодик системасының Vl төркем
р-элементлары (кислород төркемчәсе)
§ 57. Кислород 134
§ 58. Водород оксиды — су 189
§ 59. Кристаллогидратлар 192
18 нче лаборатор дәрес. Анализ мәгълүматлары буенча кристаллогидрат¬
ный формуласын ачыклау 194
§ 60. Күкерт 195
§ 61. Сульфидлар. Сероводород 198
§ 62. Күкерт (IV) оксиды. Сульфитлар 201
§ 63. Күкерт (VI) оксиды. Сульфатлар 204
19 нчы лаборатор дәрес. Күкерт һәм аның кушылмалары 207
§ 64. VI төркем р-элементларының үзлекләрен чагыштыру 208
§ 65. Сульфат кислотасын җитештерү 210
420
2 НЧ E КИСӘК
Химик тигезләнеш
§ 66. Реакцияләрнең энергетик һәм энтропия факторлары һәм юнәлеше . . 213
«Химик реакцияләрнең юнәлеше» темасына карата күнегүләр 215
§ 67. Химик тигезләнеш константасы 216
§ 68. Кислоталарның һәм нигезләрнең ионлашу константасы 219
§ 69. Кислородлы кислоталар 220
«Химик тигезләнешнең авышуы. Ле Шателье принцибы» темасына карата
күнегүләр 222
§ 70. Реакцияләрнең бер юнәлештә узу шартлары 224
§71. Тозларның гидролизы 225
20 иче лаборатор дәрес. Ионлы реакцияләр. Гидролиз 228
Химик элементларның Д. И. Менделеев
периодик системасының V төркем
р-элементлары (азот төркемчәсе)
§ 72. Азот төркемчәсенә гомуми характеристика 229
§ 73. Азот. Гади матдә 231
§ 74. Нитридлар. Аммиак 234
§ 75. Аммиаклы су 236
§ 76. Аммоний тозлары 238
21 нче лаборатор дәрес. Аммиак. Аммоний тозлары 239
§ 77. Азот оксидлары 241
§ 78. Азот (V) оксиды. Нитратлар (V) 243
§ 79. Нитрат кислотасының оксидлаштыру үзлекләре 245
§ 80. Табигатьтә азот әйләнеше 249
§81. Бәйле азот проблемасы 250
§ 82. Аммиак җитештерүнең теоретик нигезләре 252
§ 83. Аммиак җитештерү 254
§ 84. Нитрат кислотасы җитештерү 256
§ 85. Азотлы ашламалар 258
22 нче лаборатор дәрес. Аммоний тозларын табу 262
§ 86. Фосфор 263
§ 87. Фосфор (V) оксиды. Фосфатлар 266
§ 88. Фосфорлы ашламалар ' 269
23 нче лаборатор дәрес. Фосфор кушылмалары. Минераль ашламалар . . 272
Химик элементларның Д. И. Менделеев периодик
системасының IV төркем р-элементлары
(углерод төркемчәсе)
§ 89. Углерод төркемчәсенә гомуми характеристика 273
§ 90. Углерод. Гади матдәләр 275
§ 91. Углерод (IV) оксиды. Карбонатлар 279
24 нче лаборатор дәрес. Углерод һәм аның кушылмалары . 281
25 нче лаборатор дәрес. Известьташтагы карбонатларның масса өлешен
билгеләү 282
§ 92. Углерод (II) оксиды. Ягулыкны газификацияләү 284
§ 93. Углеродның водородлы кушылмалары 286
§ 94 Табигатьтә углерод әйләнеше 288
§ 95. Кремний 290
421
§ 96. Кремний (IV) оксиды. Силикатлар 292
§ 97. Силикат промышленносте 295
26 нчы лаборатор дәрес. Кремний кушылмалары 298
§ 98. Неметалл элементлары гади матдәләренең структуралары һәм үзлек¬
ләре (күзәтү) 299
«Неметалл элементларының үзлекләре» темасына карата күнегүләр . . . 302
§ 99. Неметалл элементларының иң гади водородлы кушылмаларына хас
кислота-нигез үзлекләре (күзәтү) 304
Металлар
§ 100. Металларга гомуми характеристика 308
§ 101. Металларның химик активлыгы 310
§ 102. Гальваник элемент. Химик энергиянең электр энергиясенә әвере¬
леше 313
27 нче лаборатор дәрес. Металларның химик активлыгын чагыштыру . . 316
§ 103. Металларның электрохимик көчәнешләр рәте 317
§ 104. Электролиз. Электр тогының химик тәэсире 319
«Тозларның судагы эремәләре электролизы» темасына карата күнегүләр . 321
Химик элементларның Д. И. Менделеев периодик
системасындагы т»п төркемчәләрнең металл
элементлары
§ 105. Ill төркемнең р-элементларына гомуми характеристика 324
§ 106. Алюминий 324
§ 107. Алюминий кушылмалары 326
28 нче лаборатор дәрес. Алюминий һәм аның кушылмалары 328
§ 108. Il төркемнең s-элементларына гомуми характеристика 329
§ 109. Кальций . . ■ . 331
§ 110. Табигый суның катылыгы һәм аны бетерү ысуллары 335
§ 111. I төркемнең s-элементларына гомуми характеристика 336
«Селтеле металларның кушылмаларын куллану» темасына карата күнегү¬
ләр 339
29 нчы лаборатор дәрес. Селтеле һәм селтеле-җир металлар 340
Химик элементларның Д. И. Менделеев периодик
системасындагы ян төркемчәләрнең элементлары
§ 112. d-элементларга гомуми характеристика 342
§ 113. d-элементларның оксидлашу дәрәҗәләре 343
§ 114. Комплекслы кушылмалар 345
§115. Тимер 348
30 нчы лаборатор дәрес. Тимер кушылмалары 351
31 нче лаборатор дәрес. «Металлар» темасы буенча эксперименталь мәсьә¬
ләләр чишү 352
§ 116. Тимер эретмәләре 352
32 нче лаборатор дәрес. Чуен һәм корыч 355
§ 117. Металлар коррозиясе 356
§ 118. Металларны коррозиядән саклау 358
33 нче лаборатор дәрес. Коррозия һәм металларны коррозиядән саклау . 360
422
Металлургия
§ 119. Металлар табуның гомуми принциплары 362
§ 120. Чуен җитештерү 364
§ 121. Корыч җитештерү 367
§ 122. Алюминий җитештерү 369
Неорганик химия һәм мохитне саклау
§ 123. Мохитне саклау проблемалары 372
§ 124. Атмосфераны саклау 373
§ 125. Гидросфераны саклау 375
§ 126. Калдыксыз технология 376
§ 127. Ноосфера — акыл сферасы 379
Йомгаклау
§ 128. Химия һәм фәнни-техник прогресс 380
Атом-молекуляр тәгълиматны булдыруда катнашкан күренекле галимнәр . 382
Кушымта 387
Әдәбият .• 404
Уку ярдәмлегендә бирелгән кайбер терминнарның һәм төшенчеләрнең та-
тарча-русча сүзлеге 407
Дәреслектән файдалану турында белешмәләр
№
Укучының исеме
һәм фамилиясе
Уку
елы
Дәреслекнең торышы
ел
башында
ел
ахырында
1
2
3
4
5
Учебное издание
Ахметов Наиль Сибгатович
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Учебное пособие для учащихся 8—9 классов
школ с углубленным изучением химии
В двух частях
(Перевод с русского на татарский язык)
Редакция мөдире Ф. Г. Иштирэкова
Редакторы Р. 3. Закирова
Бизәлеш редакторы Р. А. Сайфуллина
Техник редакторлары Ф. X. Габдрахманова, Л. М. Тилк
Корректорлары Р. С. Хәмидуллина, Р. В. Галләмова, Д. Р. Мифтахова
И Б № ПО
Җыярга тапшырылды 3.09.93. Басарга кул куелды 17.05.94. Форматы 60Х90'/>&- 50 гр. китап-
журнал кәгазе. «Литературная» гарнитурасы. Офсет басма. Басма табагы 26,5Ң-рәс. 0,5 +
+ форзац 0,25. Шартлы буяу-оттиск 56,0. Нәшер-хисап табагы 26,96 + рәс. 0,55 + форзац 0,41.
Тиражы 13 900 данә. Заказ П-236. С-36.
«Мәгариф» нәшрияты. 420111. Казан, Бауман ур., 19.
Издательство «Магариф» 420111. Казань, ул. Баумана, 19.
Татарстан Информация һәм матбугат министрлыгының К. Якуб исемендәге полиграфия-произ¬
водство берләшмәсе. 420111. Казан, Бауман ур., 19.
Ионнарның гидратлашуы
Реакциянең активлаштырылган комплекс хасил булып узу механизмы
I рәсем. Ионнарның гидратлашуы. Реакциянең активлаштырылган ком¬
плекс хасил булып узу механизмы. Реакциянең энергетик схемасы.
Ia Химик элементларның Д. И. Менделеев
H
IIa
3 Li
6.941
2s'
Питии
4 Be
9.01218
2sa
CfPnn Лии
11 Na
22.98977
3s
НАТРИИ
12Mg
24,305
3s1
МАГНИИ
IIIG
IV6
Vfi
VI6
VII6
I
-VlIIfi
19 к
39,098
4s
КАЛИИ
20Ca
40.08
4s’
КАЛЬЦИИ
21 Sc
44,9559
3d'4s*
СКАНДИИ
22 Ti
47,90
36’45’
ТИТАН
23 у
50.9414
3d’4s*
ВАНАДИЙ
24Cr
51,996
3d’4s
ХРОМ
25Mn
54.9380
3d*4s’
MAPCAHt Ц
26 Fe
55,847
3d‘4s’
ЖЕ ЛЕ ЭО
27 Со
58,9332
3d’4s’
КОБАЛЬТ
jRb
85.4678
5s
РУБИДИИ
38Sr
87.62
5s’
СТроиции
39 ү
88,9059
4d’5s’
ИТ ТРИи
40Zr
91,22
4d’5s’
ЦИРКОНИИ
"Nb
92,9064
4d45s’
ниобий
42Mo
95,94
4d*5s
МОЛИБДЕН
43 Tc
|97|
4d*5s1
ТЕ ХНЕЦИИ
"Ru
101,07
4d’5s
РУТЕНИЙ
45Rh
102.9055
4d*5s
РОДИИ
55Cs
132.9054
6s
Uf ЗИИ
56Ba
137.34
6s*
БАРИИ
57La
138.9055
,5(1651
ЛАНТАН
72Hf
178,49
5d’6s’
T АФНИИ
73 Та
180.9479
5d’6s’
ТАНТАЛ
74 W
183<85
Sd4Gs1
ВОЛЬФРАМ
75Re
186,207
SdsGs1
РЕНИИ
76Os
190,2
5d‘6s’
ОСМИИ
77 Ir
192,22
5d'6s‘
ИРИДИИ
87 Fr
I 223|
7s
ФРАНЦИИ
88Ra
|226|
7s*
РАДИИ
89Ac
|227|
6d7s*
АКТИНИЙ
imKu
|261|
6dJs’
КУРЧАТОВИЙ
105Ns
1261|
!НИЛЬС СОРИИ!
юв
[265]
107
Г 262]
108
12651
109
Г 266 J
периодик системасы
Vila VIIIa
«
IIIa IVa Va Via
1 H
1,0079
1S
ВОДОРОД
2He
4.00260
ISx
ГЕЛИЙ
—I 16 IIfi
5 в
10.81
2s’2p
БОР
26,98154 I
3s’3p' I
АЛЮМИНИИ I
6 C
12,011
2s’2p’
УГЛЕРОД
7 N
14,0067
2s’2p*
АЗОТ
8 о
15,9994
2$’2р*
КИСЛОРОД
* F
18.99840
2s’2p’
ФТОР
lirNe
20,179
2s’2p*
НЕОН
14 Si
28,086
3s’3p’
КРЕМНИЙ
15 p
30,97376
3s’3p’
ФОСФОР
“ S
32.06
3s’3p4
СЕРА
17 Cl
35,453
Зв’Зр*
ХЛОР
18 Ar
39,948
3s’3ps
АРГОН
28Ni
28,70
3dH4s'
НИКЕ ЛЬ
29Cu
63,546
SdMs
МЕДЬ
30Zn
65,38
3d-4s’
ЦИНК
31Ga
69.72
4s’4p’
ГАЛЛИЙ
32Ge
72,59
4s14p’
ГЕРМАНИЙ
33As
74.9216
4s’4p*
МЫШЬЙК
34 Se
78,96
4s’4p*
CE ЛЕН
35 Br
79,904
4s’4p*
БРОМ
36Kr
83,38
4s’4p‘
криптон
40Pd
106,4
4d"5s°
ПАЛЛАДИИ
47Ag
107.868
4d°5s
CE РЕБРО
48Cd
112,40
4d"5s’
КАДМИИ
49 In
114,92
Ss1Sp'
индии
50Sn
118.69
Ss1Sp1
ОЛОВО
51 Sb
121,75
Ss1Sp1
СУРЬМА
52Te
127,60
Ss1Sp4
ТЕЛЛУР
53 I
126,9045
Ss1Sp*
ИОД
54Xe
131,30
5s'5p‘
КСЕНОН
78 Pt
195.09
5d’6s
ПЛАТИНА
79Au
196.9665
Sd10Gs
ЗОЛОТО
80Hg
200,59
5d,e6s’
“ Tl
204.37
6s’6p
ТАЛЛИИ
«2 pb
207,2
Gs1Sp1
СВИНЕЦ
03 Bi
208,9804
6s’6p’
ВИСМУ T
"Po
1209|
Ss’6p4
ПОЛОНИИ
85At
|2Ю|
6s6p*
АСТАТ
80Rn
(2221
Gs1Gp1
РАДОН
элементлар
элементлар
■элементлар
элементлар
‘ЛАНТАНОИДЛАР
“АКТИНОИДЛАР
58Ce
140,12
4f 5d’6sa
ЦЕРИЙ
59 Pr
14,9077
4f’6s*
ПРАЗЕОДИМ
“Nd
144,24
4f*6s’
HE 0ДИМ
"Pm
I 145|
41’65’
ПРОМЕТИИ
62Sm
150,4
4f*6s’
САМАРИИ
90 Tb
91 Pa
92 U
93Np
94Pu
(231|
I 2311
238,029
1237}
I 244|
6d Js1
Sf1GdJs1
SFedJs1
Sf4GdJs1
SfJs1
ПРОТАКТИНИИ
УРАН
нептунии
ПЛУT0НИИ
03Eu
151,96
4f'6s’
Европии
64Gd
157,25
4f'5d6s’
ГАДОЛИНИИ
65Tb
158.9254
4fW
ТЕРБИИ
“Dy
162,50
4C6S1
ДИСПРОЗИИ
87Ho
164,9304
4f”6s5
ГОЛЬМИИ
68
Er
167,26
4Г651
ЭРБИИ
69Tm
168,9342
4FJ6s'
ТУЛИИ
70Yb
173,04
4f,46s’
ИТТЕРБИИ
71 Lu
174,97
4f'*5d’6s’
ЛЮТЕЦИИ
95Am
96Cm
97Bk
98 Cf
99 Es
iwFm
101Md
102(No)
103(Lr)
I 2431
1247}
|247|
12511
1254}
I 257 J
!258}
!259}
I 2601
SfJs1
SF1GdJs1
SCGdJs1
SfteTs1
SfJs1
SfJs1
SftJs1
SfwZs1
5fM6d Js'
АМЕРИЦИИ
КЮРИИ
61ркпии
КАЛИФОРНИЙ
JMHUJl E инии
ФЕ РМИИ
МЕНДЕЛЕВИИ
(НО&Е ЛИИ)
(лрурГ нгии!
Il рәсем. ХИМИК ЭЛЕМЕНТЛАРНЫҢ Д. И. МЕНДЕЛЕЕВ
ПЕРИОДИК СИСТЕМАСЫ (18 шакмаклы варианты).
«Кайнаучы
Күкерт
катламда»
яндыру
Электрофильтр
Циклон
һава
Мич
Контакт
аппараты
Суертылган
сульфат -
кислотасы
Сульфат
кислотасы
Киптерү
башн Btbi
Җылытылга
газ
Җылылык алмаштыргыч
сульфат
кислотасы
Складка
җибәрелүче
олеум
IH рәсем. СУЛЬФАТ КИСЛОТАСЫН ҖИТЕШТЕРҮ.
Синтезлау колоннасы Суыткыч
IV рәсем. АММИАК ҖИТЕШТЕРҮ.
V рәсем. ТАБИГАТЬТӘ АЗОТ ӘЙЛӘНЕШЕ.
Vl рәсем. ТАБИГАТЬТӘ УГЛЕРОД ӘЙЛӘНЕШЕ.
lawn ; Кислород
Vll рәсем. ДОМНА МИМЕ. КОНВЕРТОР.
2неь> АТОМНАРНЫҢ ЭЛЕКТРОН СҮРҮЛӘРЕНЕҢ
МОДЕЛЬЛӘРЕ