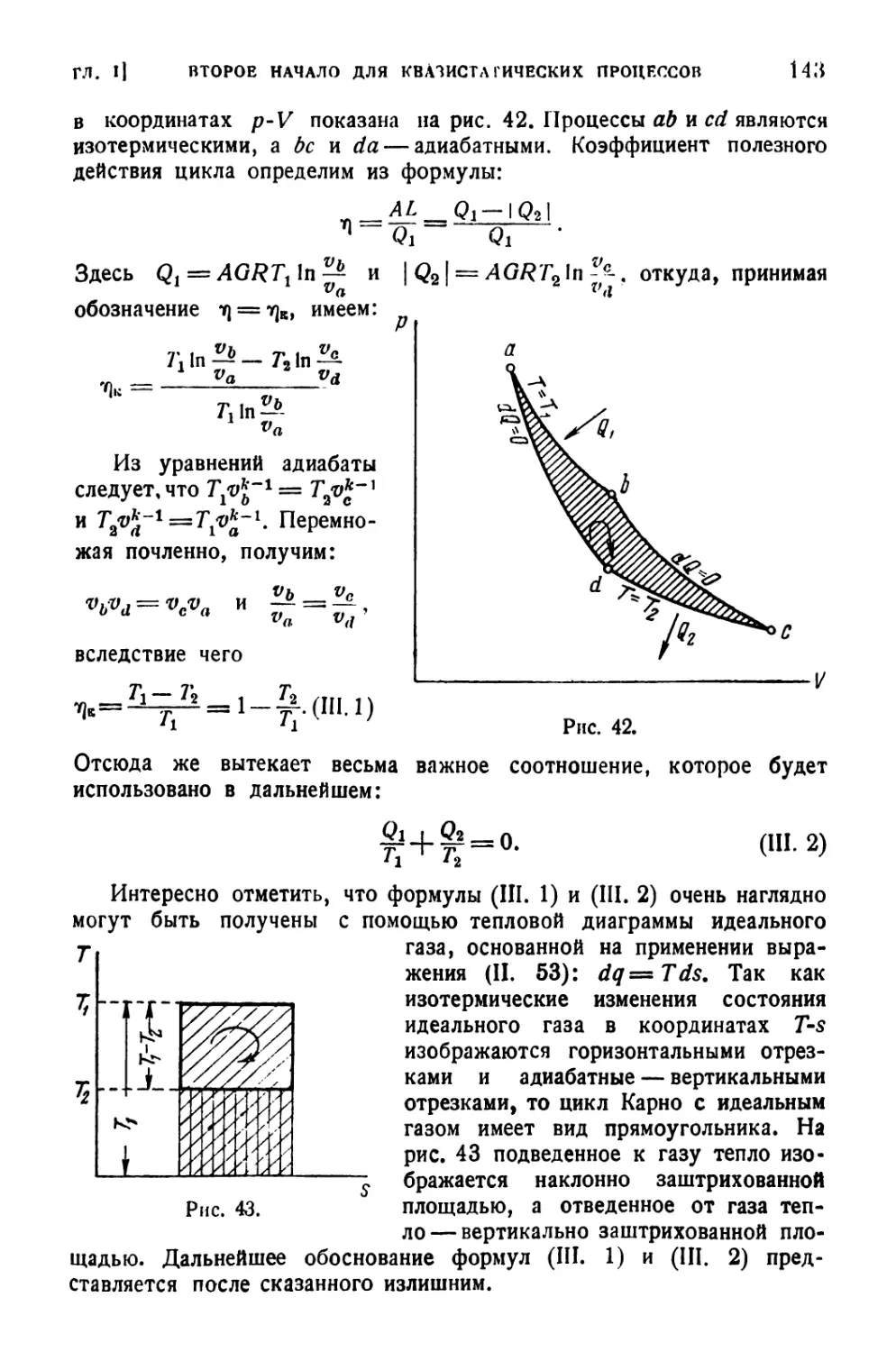
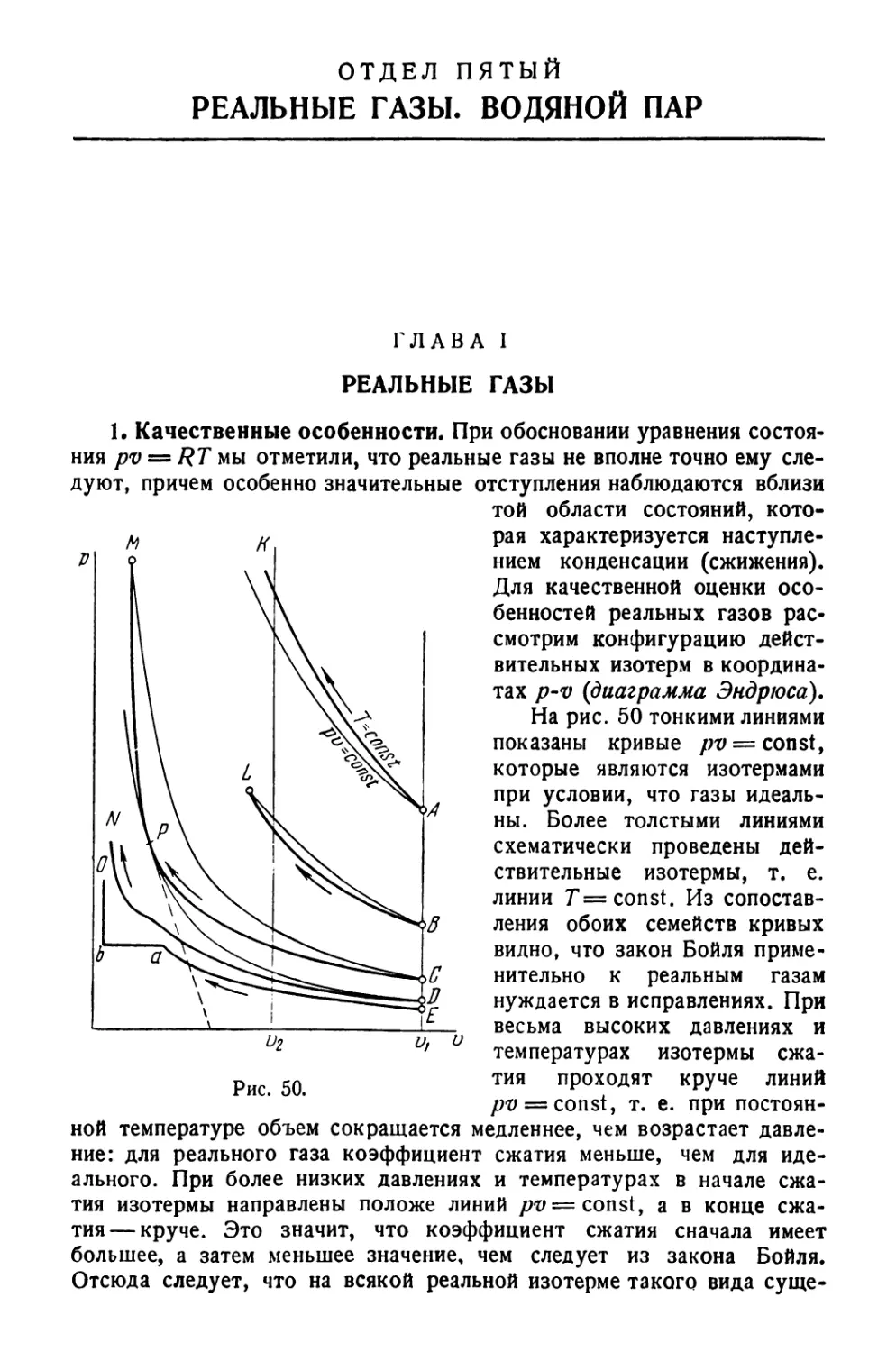
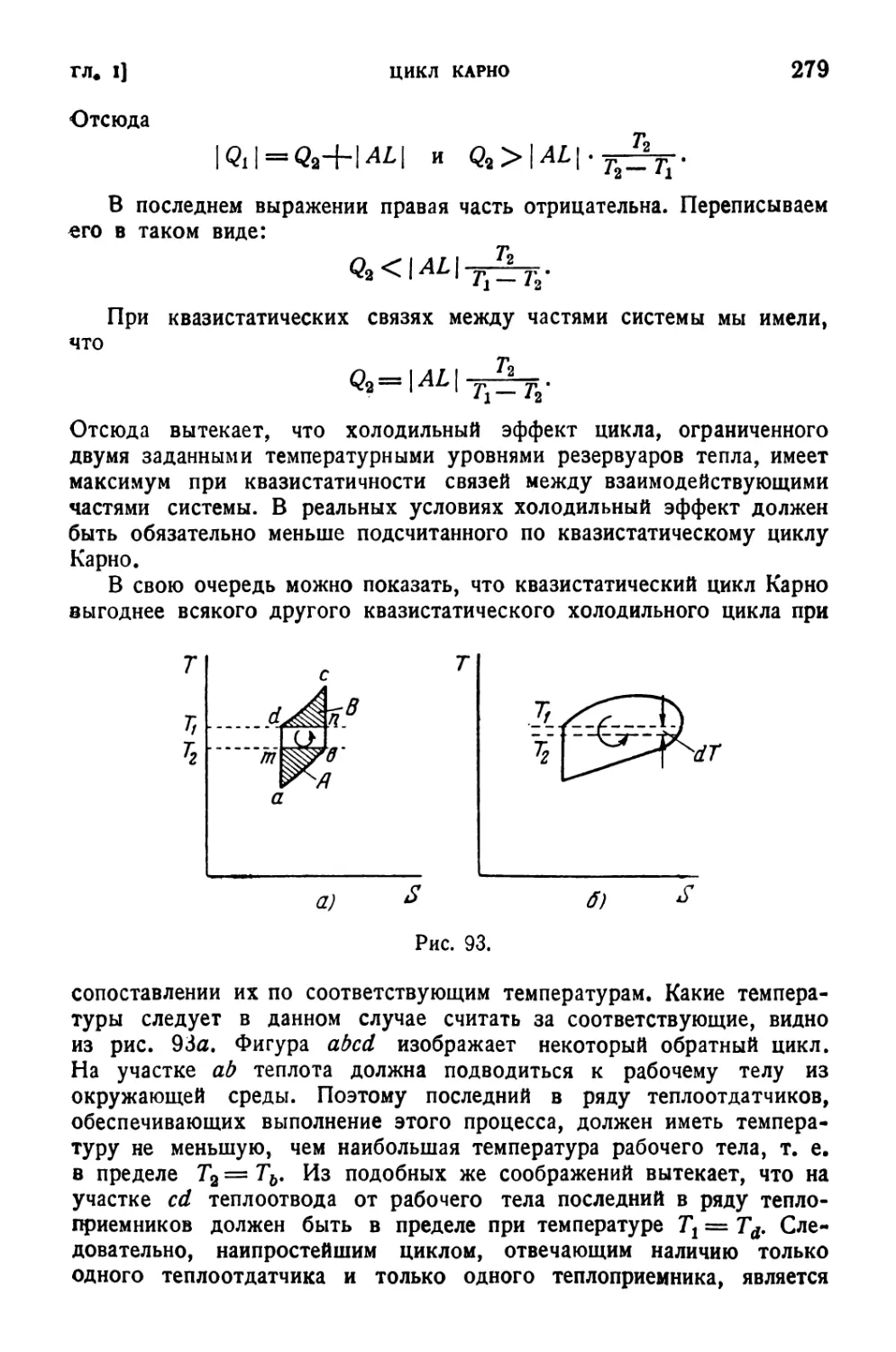
Текст
В.С ЖУКОВСКИЙ
ТЕХНИЧЕСКАЯ
ТЕРМОДИНАМИКА
л
V-
■*
В. С . ЖУКОВСКИЙ
ТЕХНИЧЕСКАЯ
ТЕРМОДИНАМИКА
ИЗДАШ1Е ТРЕТЬЕ,
ПЕРЕРАБОТАННОЕ
Допущено Министерством высшего
образования СССР в качестве учебного пособия
для студентов теплотехническим
специальностей вузов
ГОСУДАРСТВЕННОЕ ИЗДАТЕЛЬСТВО
ТЕХНИКО-ТЕОРЕТИЧЕСКОЙ ЛИТЕРАТУРЫ
МОСКВА .1954
13- 5-2
ОГЛАВЛЕНИЕ
Предисловие к третьему изданию .
Введение .
ОТДЕЛ ПЕРВЫЙ
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Глава I. Принцип исключенного вечного двигателя .
.
.
1. Термодинамическое тело и термодинамический процесс (21). —
2. Работа и количество теплоты (23). —
3. Принцип исключенного веч
ного двигателя (25). —
4. Тепловой эквивалент механической ра
боты (27).
Глава II. Первое начало термодинамики
5. Закон сохранения и превращения энергии. Внутренняя энергия
(29). —
6. Первое начало термодинамики (33). —
7. Полные и непол
ные дифференциалы в термодинамике (35). —
8. Работа против рас
пределенного по поверхности давления (39). —
9. Частные выраже
ния закона сохранения энергии (45). —
10. Физическая трактовка
энтальпии (46). —
11. Закон Гесса (47).
Глава III. Квазистатические процессы. Уравнения состояния .
12. Термодинамическое равновесие (51). —
13. Квазистатические про
цессы (54). —
14. Термические параметры состояния (57). —
15. Тер
мическое уравнение состояния (59). —
16. Единицы измерения тер
мических параметров состояния (62). —
17. Выражения первого
начала в переменных v, t и р, t (64).
ОТДЕЛ ВТОРОЙ
ИДЕАЛЬНЫЕ ГАЗЫ
Глава I. Термическое уравнение состояния идеальных газов .
1. Экспериментальные основы (67). —
2. Термическое уравнение
состояния (72). —
3. Уравнение состояния газовых смесей (76). —
4. Термические коэффициенты (80).
Глава II. Внутренняя энергия, энтальпия и теплоемкости идеаль
ных газов.
.....
5. Внутренняя энергия (82). —
6. Энтальпия (86) . —
7. Теплоем
кости cvи ср(89).
Глава III. Частные виды процессов . . .
8. Содержание задачи (94). —
9. Изохорный
процесс (95). —
10. Изобарный процесс (96). —
11. Смешение газов (99). —
12. Диа-
4
ОГЛАВЛЕНИИ
грамма i'- t и ее применение (103).
—
13. Изотермический процесс
(105). —
14. Адиабатный процесс (108). —
15. Показатель адиабаты
(113). —
16. Энтропия идеального газа (116). —
17. Тепловая диаграмма
и расчетные формулы для энтропии идеальных газов (121) . —
18. Политропные процессы (128). —
19. О подборе политропы (133).
ОТДЕЛ ТРЕТИЙ
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Глава I. Второе начало термодинамики для квазистатических
процессов.
.
139
1. Содержание вопроса (139). —
2. Обратимость и необратимость
(141). —
3. Цикл Карно и его свойства при использовании идеаль
ного газа (142). —
4. Постулат второго начала для квазистатических
процессов (145).
—
5. Математическое выражение второго начала для
квазистатических процессов (148). —
6. Абсолютная термодинамиче
ская температура (153). —
7. О физическом смысле второго начала
для квазистатических процессов (156).
Г л а в а II. Второе начало термодинамики для нестатических про
цессов
.
.
.
159
8. Содержание вопроса (159). —
9. Особенности нестатических явле
ний в адиабатных системах (160). —
10. Особенности нестатической
теплопередачи (163). —
11. Общее выражение второго начала (167). —
12. Об использовании второго начала для количественного анализа
нестагических явлений (169). —
13. Стремление изолированных си
стем к равновесию (175). —
14. Границы второго начала термодина
мики и их статистическое толкование (180).
ОТДЕЛ ЧЕТВЕРТЫЙ
ДИФФЕРЕНЦИАЛЬНЫЕ УРАВНЕНИЯ ТЕРМОДИНАМИКИ
1. Калорические уравнения состояния (189). — 2 . Основные дифферен
циальные уравнения термодинамики (194). —
3. Соотношение между
абсолютной и эмпирической температурами (197).
отдел пятый
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
1'лаваI.Реальныегазы.
.............................
202
1. Качественные особенности (202). —
2. Количественные данные
(209). —
3. Термические уравнения состояния (220).
Глава II. Изменения агрегатного состоя ния.............................
231
4. Диаграмма равновесия агрегатных состояний (231).—
5. Скрытая
теплота превращения (239). —
6. Влажный насыщенный пар (242). —
7. Элементы построения энтропийных диаграмм (244).
Глава III. Вода и водяной пар
.
....
219
8. Состояние вопроса (249). —
9. Свойства жидкости (253).
—
10.На
сыщенный и перегретый пар (257). —
И . Изобара (262). —
12. Изо
хора (263). —
13. Адиабата (265). —
14. Дросселирование (268).
ОГЛАВЛЕНИЕ
5
ОТДЕЛ ШЕСТОЙ
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
Г лава I. Цикл Карно .
.
270
1. Содержание задачи (270).—
2. Прямой цикл Карно (271). —
3. Об
ратный цикл Карно (277).
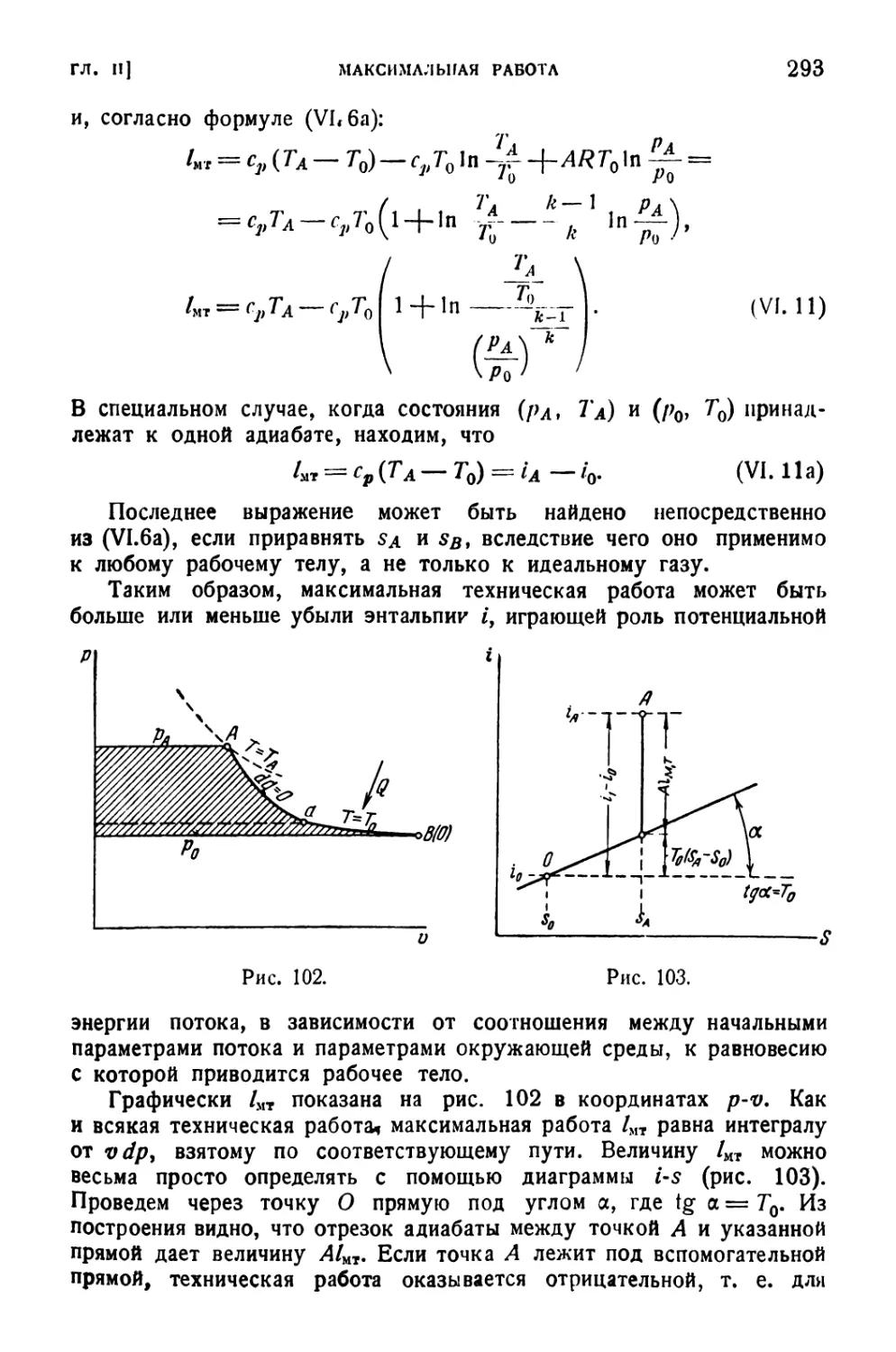
Глава II. Максимальная работа
282
4. Общие формулы для максимальной работы (282). —
5. Максималь
ная работа в частных случаях (284). —
6. Интерпретация энтропии
(294). —
7. Термодинамические потенциалы (297).
Глава III. Циклы компрессоров, двигателей внутреннего сгорания
и газотурбинных установок .
.
.
.
301
8. Содержание задачи (301). —
9. Циклы
компрессоров (305). —
10. Циклы двигателей внутреннего сгорания (308). —
11. Циклы газо
турбинных установок (314).
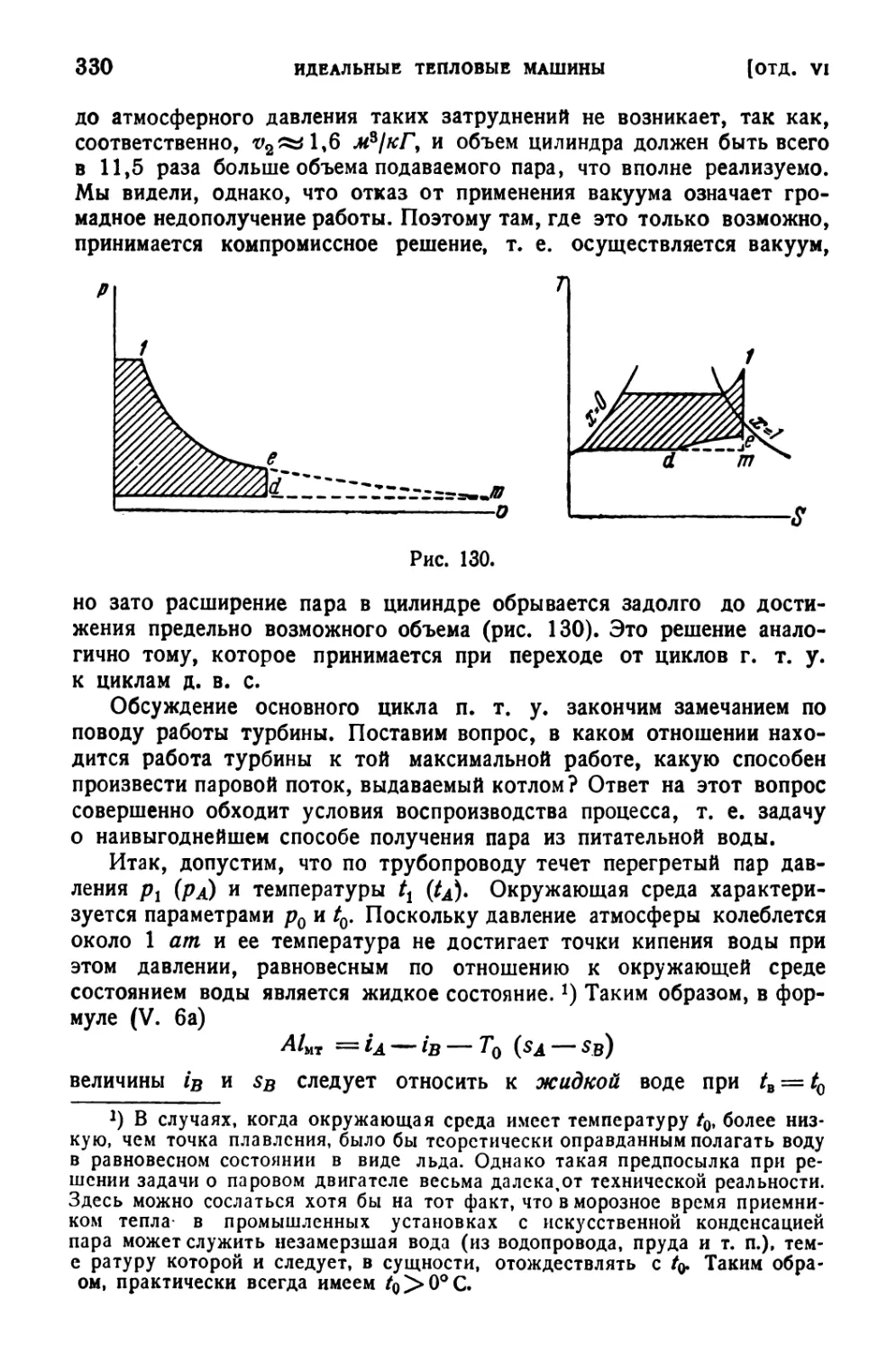
Глава IV. Циклы паротурбинных и холодильных установок .
322
12. Основной цикл п. т . у . (322). —
13. Методы приближения цикла
н.т.у.кциклу Карно(333). —
14. Циклы холодильных установок (344).
ОТДЕЛ СЕДЬМОЙ
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
Глава 1. Основные положения
.
348
1. Упрощающие предпосылки (348).—
2. Основные уравнения без
учета трения (350).
—
3. Основные уравнения с учетом трения (352).
Глава I I . Адиабатное течение при отсутствии трения и техниче
ской работы
35(3
4. Соотношения
между скоростью и термическими параметрами
(356). —
5. Критическая скорость. Соотношения в приведенных пара
метрах (360). —
6. Продольный профиль трубы (366). —
7. Исследова
ние задачи об истечении через сопла (369). —
8. Расчет истечения
через сопла (378). —
9. Поправки на начальную скорость (383).
Глава III. Течение газа с трением, с теплообменом и с производ
ством технической работы
.
.
.
.
386
10. Адиабатное течение с трением при dlj = 0 (386). —
11. Дроссели
рование (392).
—
12. Общий случай течения (394).
—
13. Идеальный
турбореактивный двигатель (403).
ТАБЛИЦЫ
1. Критические параметры и тепловые характеристики газов (410). —
2. Теплоемкость воздуха в идеально-газовом состоянии (412).
—
3. Мольная энтальпия газов в идеальном состоянии (414). — 4 .Мольная
внутренняя энергия газов в идеальном состоянии (415). —
5. Насы
щенный пар и вода на линии насыщения (416). —
6. Насыщенный пар
и вода на линии насыщения (420). —
7. Вода и перегретый водяной
пар (424).
ДИАГРАММЫ
(вкладные листы)
1. Диаграмма i'-t -s ' для газов.
—
2. Диаграмма i s для водяного
пара.
ПРЕДИСЛОВИЕ К ТРЕТЬЕМУ ИЗДАНИЮ
Настоящее, переработанное, издание по объему затрагиваемого
материала значительно шире двух предыдущих изданий. В нем д о
полнительно представлены или подробнее изложены такие вопросы,
как стремление изолированных систем к равновесию, дифференциальные
уравнения термодинамики, термодинамические потенциалы, циклы газо
турбинных и холодильных установок и т. п. Однако в части узко
технических приложений термодинамики я считал правильным о гра
ничиться здесь только самым необходимым и отнести детали
к специальным курсам. Назначение общего курса я вижу в том,
чтобы дать ясное представление о принципиальной постановке
возникающих во просов, о специфическом методе их разрешения и,
наконец, о взаимосвязи данного метода научного анализа с другими.
Примеры и задачи для самостоятельной проработки в предлагаемом
учебном пособии немногочисленны и не имеют систематического х а
рактера. В последнее время вышли специальные задачники по техни
ческой термодинамике, дублировать которые нет надобности.
Выражаю большую благодарность А . А . Гухману, В . А . Кириллину
и Д . Л . Тимроту за их ценные замечания, которые я постарался
учесть в своей работе над рукописью.
Ленинград.
Апрель 1952 г.
В. С . Жуковский
ВВЕДЕНИЕ
Одним из наиболее общих физических законов природы является
закон сохранения и превращения энергии, который выражает основное
положение диалектического материализма о неуничтожаемости мате
риального движения, об извечном взаимном превращении одних форм
движения материи в другие.
«Современное естествознание вынуждено было заимствовать у фи
лософии положение о неуничтожимоеTM движения; без этого положения
естествознание теперь не может уж е существовать. Н о движение
материи — это не одно только грубое механическое движение, не
одно только перемещение; это — теплота и свет, электрическое и
магнитное напряжение, химическое соединение и разложение, жизнь и,
наконец, сознание. Говорить, будто материя за все время своего
бесконечного существования имела один только единственный раз —
и то на одно мгновение по сравнению с вечностью ее существо
вания— возможность дифференцировать свое движение и , таким
образом, развернуть все богатство этого движения и что до этого и после
этого она навеки ограничена одним простым перемещением, — говорить
это значит утверждать, что материя смертна и движение преходяще.
Неуничтожимость движения надо понимать не только в количествен
ном, но и в качественном с м ы с л е ... Движение, которое потеряло
способность превращаться в свойственные ему различные формы, хотя
и обладает еще dynam ls (возможностью), но не обладает уж е energeia
(действенностью) и, таким образом, частично уничтожено. Н о и то
и другое немыслимо». *)
Различным формам движения материи соответствуют различные
виды энергии. Как мы увидим, в термодинамике приходится иметь
дело только с разностями полной энергии тела в двух его состоя
ниях. П оэто м у , если в определенных областях существования физи
ческих тел некоторые составляющие полной энергии остаются прак
тически неизменными, то с ними можно не считаться. Например,
энергия многих газов при комнатной температуре определяется
согласно классической молекулярно-кинетической теории только через
энергию поступательного и вращательного движения молекул. При
*) Ф. Энгельс, Диалектика природы, 1948, стр. 18, 19.
8
ВВЕДЕНИЕ
расчете энергии тех же газов при высоких температурах приходится
учитывать на основе квантовой статистики также и колебательную
энергию атомов. Напротив, при снижении температуры, по мере при
ближения к конденсации, для реальных газов важное дополнительное
значение приобретает изменение потенциальной молекулярной энергии.
В сл уча я х, когда изменения состояния тела связаны с нарушением
молекулярной структуры , в состав энергии требуется включать еще
внутримолекулярную энергию того или иного вида (при диссоциации,
химических превращениях, явлениях радиоактивности и т. п .) .
Современная физика позволяет определить полный запас энергии
любого тела. О н на основании теории относительности, как известно,
равен произведению из массы тела т на квадрат скорости света
в пустоте с2. Последнюю величину можно рассматривать в качестве
постоянного коэффициента пропорциональности и считать, что абсо
лютное значение энергии тела однозначно определяется его массой.
Таким образом, всякое изменение энергии тела непременно сопряжено
с изменением его массы. *) С другой стороны, закон сохранения
энергии, который сводится к утверждению постоянства суммы про
изведений тс2, взятых для всех элементов, составляющих замкнутую
систему, оказывается эквивалентным закону сохранения массы в такой
системе. Впрочем, в нашей практической деятельности мы сталки
ваемся с такими незначительными изменениями массы при энергети
ческом обмене, что получаем право массу тел считать постоянной.
(Так, например, при теплотворности топлива порядка 10 4 ккал!кГумень
шение его массы в результате освобождения химической энергии при
сгорании составляет величину порядка 1 0 - 9 от первоначальной
массы.) Только поэтому закон сохранения массы и закон сохранения
энергии можно формулировать как самостоятельные, взаимно не свя
занные законы.
Изучение механизма превращения одних форм движения в другие
составляет предмет специализированных физико-химических дисциплин,
которые для этого привлекают более или менее глубокие сведения
о строении вещества. Термодинамика обходит вопрос о механизме
превращения форм движения, и в связи с этим ее требования к зна
нию структуры и молекулярно-кинетических свойств взаимодействую
щих тел оказываются очень ограниченными. В термодинамике приме
няется исключительно макрофизический метод анализа, мало связанный
с представлениями о микростроении материи и о микропроцессах,
обусловливающих непосредственно воспринимаемое поведение тел.
Термодинамические соотношения основываются на небольшом коли
честве общенаучных принципов, имеющих прямое опытное про исхо
ждение, и формулируются настолько широко, что позволяют охватить
*) Заметим, что впервые связь между энергией и массой была экспери
ментально установлена применительно к свету выдающимся русским физи
ком П. Н . Лебедевым в 1899 г.
ВВЕДЕНИЕ
9
различные категории явлений природы, начиная от механических,
тепловых, электрических, химических и кончая явлениями физической
деятельности живых организмов.
Нуж но, однако, подчеркнуть, что в отказе термодинамики от
микрофизического анализа механизма физических явлений кроется ее не
сомненная ограниченность. Н е имея ответа на вопросы, что именно,
происходящее в недрах физических тел, вызывает проявление различных
форм энергии и к а к идет процесс передачи энергии, мы лишаемся
возможности судить о границах приложимости термодинамических
рассуждений. Ярким примером ограниченности термодинамики является
так называемое второе начало термодинамики. Второе начало отнюдь
не принадлежит к абсолютным законам природы, и сама термодина
мика не в состоянии определить пределов его приложимости. Э то д о л
жно быть сделано с помощью микрофизики и других дисциплин,
изучающих структуру вещества. Впрочем, эти пределы, вообще го
воря, настолько широки, что в нашей практической деятельности
обычная термодинамика остается могущественным и надежным инстру
ментом познания.
История возникновения термодинамики непосредственно связана
с историей тепловых двигателей. Потребности теории тепловых дви
гателей и вообще теплотехники определяют круг вопросов, затраги
ваемых в настоящее время в курсах технической термодинамики,
которая и отражает в неприкосновенном виде многие первоначальные
идеи развития предмета. Специализированные отделы термодинамики
строятся на той же общей основе, отличаясь от технической термо
динамики преимущественно по характеру приложений.
Несмотря на глубокую давность открытия превращаемости ме ха
нического движения в теплоту, человек осознал осуществимость о б
ратного превращения тепловой энергии в механическую работу не
давно, если иметь в виду масштабы истории человеческой культуры.
Такие изобретения, как шар Герона Александрийского (около
120 лет до нашей эры), являющийся далеким примитивом паротур
бинной установки, в течение многих веков не оказывали какого-
либо влияния на постановку вопроса о промышленном тепловом д ви
гателе.
Лишь во второй половине X V III столетия новый этап развития
производительных сил — зарождение крупной машинной промышлен
ности на месте мануфактурного производства — и формирование новых
социально-производственных отношений — капитализма — обусловили
технически приемлемое разрешение задачи о создании универсального
теплового двигателя. Такой двигатель был призван удовлетворять
разнохарактерным потребностям быстро разраставшихся промышлен
ности и транспорта.
10
ВВЕДЕНИЕ
Приоритет в деле создания универсального двигателя принадлежит
выдающемуся русскому инженеру И. И . Ползунову (1728— 1766).
Восемнадцатый век был периодом формирования в России элемен
тов капиталистического производства. Высокого промышленного уровня
на базе крепостного права достиг Урал , который не только покрывал
потребности страны в железе, но и стал крупным экспортером
железа в Англию, где собственная металлургия не справлялась с по
требностями бурно развивавшегося хлопчатобумажного станочного
производства.
В 1763 г. Ползунов представил начальнику Колывано-Воскре-
сенских заводов докладную записку, в которой после обширной
теоретической части дается описание предлагаемой им паромашинной
установки. Новизна проекта заключалась в следующем: машина
Ползунова предназначалась не для подъема воды, как это всегда
бывало до него, а для заводских целей; благодаря применению
дву х цилиндров со связанным движением поршней машина впервые
должна была обеспечить непрерывное действие; парораспределение
и питание водой предусматривались автоматически действующими;
наконец, вместо громоздких балансиров, применявшихся в машинах
того времени, Ползунов предложил использовать вал и шкивы,
что открывало возможность привода от одного двигателя нескольких
машин.
С некоторыми отступлениями от своего проекта (вероятно, под
давлением официальной консервативной критики) Ползунов построил
свою машину, по тому времени самую мощную в мире (32 л . с .) ,
но она была пущена в эксплуатацию только после его смерти,
в 1766 г.
Дальнейшее усовершенствование паровой машины применительно
к фабрично-заводским нуждам было осуществлено Уаттом (1736— 1819),
первый патент которого относится к 1769 г. Только намного позже
началось завоевание паровой машиной сухо пу т но го транспорта.
В 1834 г. в Нижнем Тагиле в эксплуатацию вступила паровая желез
ная дорога Черепановых. Через год начала работать первая железная
дорога в Германии. В 1837 г. была открыта железнодорожная ли
ния Петербург — Царское село. Успехи паротехники к этому вре
мени были огромны: универсальный двигатель приобрел относительно
совершенные формы и стал определяющим фактором развития как
промышленности, так и транспорта.
Естественным образом возникает во пр ос: в какой мере физика
того времени содействовала усовершенствованию теплового двигателя,
какие руководящ ие принципы были ею установлены в отношении
законов превращения теплоты, выделяющейся при сжигании топли
ва, в механическую работу? Как это ни удивительно, ответ на этот
вопрос говорит не в пользу физики. Правда, физика конца XVIII
и начала X I X столетий овладела техникой точных измерений, н ако
пила богатый экспериментальный материал в области механических
ВВЕДЕНИЕ
11
и тепловых свойств разнообразных тел, создала математическую
теорию теплопроводности, осветила некоторые законы теплового из
лучения.
Однако наука того времени характеризовалась метафизическими
представлениями о сущности явлений и полным отсутствием широких
обобщений по поводу взаимосвязи наблюдаемых природных пр оц е с
сов. Достаточно сказать, что фундаментальный закон естествознания —
закон сохранения и превращения энергии, без которого понимание
принципов работы теплового двигателя совершенно немыслимо, не
был еще тогда сформулирован в законченной научной форме,
В старом естествознании электрические, тепловые, химические
явления рассматривались как результат простых перемещений неких
невесомых субстанций, каждая из которых играла роль носителя
соответствующих физических или химических свойств. Предполагалось,
что количество субстанции каждого данного вида остается в природе
совершенно неизменным и что возможно только перераспределение
этой субстанции между находящимися в контакте телами. С оо тве т
ственно, теплота понималась как особого рода невесомая всепрони
кающая ж идкость — теплороду по отношению к которой всякое
тело играло роль сосуда, емкости. Из этой концепции возникли,
например, представления о «теплоемкости» и «скрытой теплоте»,
которые и до сего времени выражаются старыми терминами, хотя
смысл этих понятий коренным образом изменился.
«Теория невесомых» могла удовлетворительно объяснить прямой
теплообмен между твердыми или жидкими телами с различной тем
пературой. Однако объяснение ею нагревания тел при трении могло
казаться правдоподобным лишь потому, что наличный опытный ма
териал о тепловых явлениях был совершенно недостаточен. Тепловой
эффект трения приписывался то м у , что отделяемые от тела стружки
или опилки обладают меньшей теплоемкостью, чем сплошная масса
вещества. Т ак как в каждой единице объема вещества количество
теплорода принималось неизменным (поскольку обмен теплородом
между рассматриваемым телом и окружающими телами был устранен),
то нагревание стружек казалось столь же естественным, как ощу
щаемое увлажнение губки при ее сжимании. Н е более состоятельной
была трактовка рабочего процесса в паровом двигателе или, напри
мер, тепловых явлений при прохождении электрического тока.
Метафизическое учение о «невесомых» расчленяло мир на застывшие
и взаимно не связанные составляющие, оно приводило к концепции
о всеобщей неизменности « с и л » . Учение это смыкалось с витализмом,
с утверждением мистической «жизненной силы ».
В этой обстановке возник гений М . В . Ломоносова (1711— 1765).
Огромным его вкладом в дело материалистического понимания при
роды было первое экспериментальное доказательство в 1756 г . закона
сохранения массы при химических реакциях. Это открытие не было
для Ломоносова случайным. У ж е в начале своей научной деятельности
12
ВВЕДЕНИЕ
Ломоносов в самом широком смысле провозглашает всеобщий принцип
сохранения движения и материи. В письме Л . Эйл еру, тоже члену
Петербургской Академии, он пишет: «В се перемены в Н атуре сл у
чающиеся такого суть состояния, что сколько чего у одного тела
отнимется, столько присовокупится к другому. Так, ежели где убудет
несколько материи, то умножится в другом месте; сколько часов
положит кто на бдение, столько же сну отнимет. Сей всеобщий
естественный закон простирается и в самые правила движения:
ибо тело, движущее своею силою другое, столько же оныя у себя
теряет, сколько сообщает другому, которое от него движение
получает».
По этому поводу у С . И . Вавилова читаем: « В отличие от своих
предшественников Ломоносов говорит о любых «переменах в Н атуре
случающихся'), об их общем сохранении, и только в качестве приме
ров он перечисляет отдельно взятые сохранение материи, сохранение
времени, сохранение силы. Мож но предполагать, что перед умствен
ным взором Ломоносова, когда он наносил на бумагу приведенные
строки, вырисовывалось несравненно более широкое и глубокое по
нятие материи, чем тот ограниченный, специализированный образ,
характеризуемый только массой и ее непроницаемостью, который
имели в виду физики X V III в . , говоря о материи. О б этой «материи»,
как о частном примере своего общего начала, упоминает Ломоносов.
Другая материя в общем смысле, охватывающая «все перемены в
Натуре случающиеся» и сохраняющаяся в целом, о которой думал
Ломоносов, близка к пониманию материи в ленинском диалектико
материалистическом философском значении».*)
Т о, что и закон сохранения массы, и закон сохранения движения
были для Ломо носо ва только отдельными звеньями в общем «законе
сохранения и превращения», доказывается позицией, которую он занял
в отношении теплорода. В своей замечательной диссертации « Р а с
суждения о природе тепла и холода» (1749) Ломоносов пишет:
«... имеется достаточное основание теплоты в движении. А так как
никакое движение без материи происходить не может, то необходимо,
чтобы достаточное основание теплоты состояло в движении какой-либо
материи». И далее: «Тепло состоит во внутреннем движении веще
ства , нечего приписывать теплоту тел сгущению какой-то тонкой, для сего
специально предназначенной материи». Н аконец, в заключение Л о м о
носов заявляет: «Елементарной огонь Аристотельской, или по новых
ученых штилю, теплотворная особливая м а т е р и я ... есть только один
вымысел».
Ломоносов не удовлетворяется высказываниями общих идей: он
закладывает конкретные основы кинетической теории материи и,
в частности, кинетической теории тепла. П о отношению к своему
ближайшему предшественнику Д . Бернулли Ломоносов в этих теориях
*) С. И . Вавилов, газета «Правда», 1949, N° 5.
ВВЕДЕНИЕ
13
делает крупный шаг вперед, вскрывая самый механизм молекулярного
взаимодействия и впервые выявляя в кинетической картине роль
соударения микрочастиц. Также впервые в истории науки Ломоно
сов дает правильное
в принципиальном отношении толкование
механизма теплопроводности.
Нет возможности в кратких словах обрисовать выдающиеся и
разносторонние заслуги Ломоносова как основоположника современного
учения о теплоте, гармонично сочетавшего в сво их теориях макро-
и микрофизический аспекты анализа. Крайняя примитивность факти
ческих знаний, характерная для того времени, не дала ему возмож
ности облечь свои представления в законченную аналитическую форму .
Достаточно, например, сказать, что тогда еще не существовало чет
кого различия понятий о температуре и количестве теплоты. Вместе
с петербургским академиком Г . В . Рихманом Ломоносов только начал
создавать калориметрию. Именно Рихману принадлежит заслуга
нахождения
формулы
калориметрии для
определения
темпе
ратуры смеси д ву х порций воды, имевших в начале различные
температуры. Если при таком зачаточном состоянии науки Ломоносо ву
удалось сформулировать великое множество прогрессивных идей,
которые были по достоинству оценены лишь целым столетием позже,
то это нужно всецело приписать его познавательному мо гуществу,
стихийно носящему диалектико-материалистические черты. Лучшим
выражением методологии Ломоносова служат его слова: « И з наблю
дений установлять теорию, через теорию исправлять наблюдения есть
лучший всех способ к изысканию правды».
Накопление опытных фактов, приведших к окончательному утвер
ждению кинетической теории тепла и взаимопревращаемости энергии,
происходило медленно. Д аж е Карно (1796— 1832), который может
быть признан основоположником метода современной термодинамики,
стоял на позициях теплорода. Карно считал (1824), что, по аналогии
с водяным колесом, количество теплоты, получаемой водой в паровом
котле, равно количеству теплоты, содержащейся в отработавшем
паре, и что работа происходит благодаря падению теплорода с высо
кого температурного уровня (котел) на более низкий (конденсатор).
Отрицать принцип неуничтожаемости тепла, говорит Карно , «значило
бы опрокинуть всю теорию тепла, для которой он служит основой».
И з посмертного издания труда Карно (1878), в котором были
опубликованы его наброски, видно, что он полностью выяснил
для себя взаимопревращаемость теплоты и механической работы и
пришел к численному значению теплового эквивалента работы. Однако
ко времени этой публикации закон сохранения и превращения энер
гии был уже сформулирован другими.
Знаменательной датой в деле становления закона сохранения
энергии является 1840 г. В этом году член Петербургской Академии
14
ВВЕДЕНИЕ
наук Г . Г . Гесс экспериментально установил важнейший закон химий,
получивший название закона Гесса. Э то т закон представляет собой
частную формулировку закона сохранения энергии в применении
к химическим реакциям. П о Г е ссу , тепловой эффект реакции не зави
сит от рода и числа промежуточных реакций и полностью опреде
ляется начальным и конечным состояниями системы. Л егко видеть,
что это утверждение равнозначно тезису о происхождении теплового
эффекта реакции за счет изменения энергии системы, причем это
изменение является функцией одних только крайних состояний
системы.
После 1840 г. идея о взаимной превращаемости форм движения мате
рии стала развиваться быстрым темпом. В 1842 г . вышла в свет первая
работа Р . М айера, который сформулировал идею о качественных превра
щениях и количественном сохранении всевозможных «сил », ввел понятие
о механическом эквиваленте тепла и расчетным путем на основании
известных тогда теплоемкостей газов cv и ср определил значение этого
эквивалента. Однако Майер пренебрег прямым опытом, без которого
ничто не казалось убедительным для его современников, избегавших
всяких широких обобщений, которые выходили за рамки непосред
ственно обнаруженных факто в. Слава в опытном решении вопроса
досталась русскому академику, ректору Петербургского университета
Э . X . Ленцу (1804— 1865) и англичанину Джоулю (1818— 1889).
В 1843 г. Джоуль опубликовал экспериментальную работу, в которой
сообщалось, что количество теплоты, выделяемой в проводнике
индукционным током, пропорционально квадрату силы тока и что
«количество теплоты, которое в состоянии нагреть 1 фунт воды
на 1°,
равно и может быть превращено в механическую силу , к о
торая в состоянии поднять 838 фунтов на вертикальную высоту
в 1 фут».
В 1844 г . появилась работа Ленца. Совершенно независимо от
Джоуля Ленц определил закон тепловыделения в проводнике, к кото
рому от источника подводится электрический ток. Им было показано,
что выделяемая теплота пропорциональна квадрату силы тока, сопро
тивлению проводника и времени. Э то т закон вошел в физику под
названием закона Ленца — Д ж о у л я . И м была доказана взаимопревра-
щаемость и эквивалентность электрической работы и теплоты. Что
касается прямого определения эквивалента механической работы и
теплоты, то оно было произведено Джоулем в том виде, как это
обычно описывается в учебниках физики, лишь в период с 1847
по 1850 г.
В 1847 г . была опубликована работа Гельмгольца « О сохранении
силы». В ней дается строго научное изложение всеобщего закона
сохранения «силы», или, как мы теперь выражаемся, «сохранения
энергии». Однако подход к решению проблемы был у Гельмгольца
чисто механическим и, следовательно, более узким, чем у Майера.
Вспоминая прием, оказанный этой работе, Гельмгольц пишет, что
ВВЕДЕНИЯ
15
авторитеты по физике «склонны были отрицать самый закон и
в усердной борьбе против гегелевской натурфилософии, которую они
тогда вели, объявить и мою р або ту фантастической спекуляцией».
Далее Гельмгольц говорит: «О работах Джоуля на ту же тему я тогда
знал очень мало, о работах же Майера не знал ничего». Однако
Гельмгольц прямо ссылается на Гесса , указывая на то , что его закон
является частным случаем общего закона сохранения энергии. В том
же смысле он высказывается по по воду правил электромагнитной
индукции Ленца. Таким образом, активная роль русских ученых сере
дины X I X в. в деле обоснования закона сохранения энергии была
признана их иностранными современниками.
Совместными усилиями нескольких поколений было, наконец,
построено здание, которое задумал и в эскизном виде начертал
Ломоносов. Однако на этом история закона сохранения энергии еще
не кончилась. Соображения и факты, положенные в основу этого
закона, не были сцементированы и не были обобщены посредством
законченного диалектико-материалистического мировоззрения. Э то
было сделано только в результате применения к физическим п р о
блемам марксистского метода. Блестящий образец этого был дан
Ф. Энгельсом в его классических произведениях «Анти-Дюринг» и
«Диалектика природы». Сколь важно руководство со стороны фило
софии в развитии наших знаний об окружающей природе, показывает
развитие представлений о законе сохранения и превращения энергии,
начиная со второй половины X IX в. до самых последних дней. Подроб
ное освещение этого вопроса выходит за рамки настоящего к ур са .
Здесь отметим только два обстоятельства. Первое из них — это по
кушение на материалистическую трактовку закона, предпринятое
В . Оствальдом и его школой «энергетиков», которые отрывали дви
жение от материи, энергию от атомов и молекул и которые объявляли
лишенную материального носителя энергию единственным кирпичиком
всего сущего . Разгром этого воинствующего антиматериалистического
учения был произведен В . И . Лениным в книге «Материализм и
эмпириокритицизм». Д руго е обстоятельство заключается в том, что,
вопреки пониманию закона сохранения и превращения энергии как
всеобщего закона природы, некоторые физики неоднократно нападали
на него, силясь доказать неприменимость закона в области квантовых
явлений. В о всех случаях эти попытки оказывались бесплодными,
однако борьба за торжество диалектико-материалистического пони
мания закона бывала нелегкой и не может еще считаться закончен
ной, так как физика капиталистических стран с неизбежностью
запутывается в идеализме, который ядовито окрашивает самую
ткань ее научных теорий.
Собственно термодинамика как некоторый специальный метод
физического анализа берет свое начало от Карно, который, однако,
16
ВВЕДЕНИЕ
придал своим «Размышлениям» целеустремленный технический характер.
Таким образом, техническая термодинамика является, как уж е отме
чалось, старейшей ветвью общей термодинамики.
В 1850 г. была опубликована первая работа Р . Клаузиуса
(1822— 1888) «О движущей силе теплоты». В ней воскрешаются
рассуждения Карно, однако под новым углом зрения, который стал
возможен благодаря установлению взаимопревращаемости теплоты и
механической работы. При этом заостряется во прос о специфических
особенностях теплоты, которые проявляются при реальных, необра
тимых п роцессах и которых закон сохранения энергии не вскрывает.
Почти одновременно с этой работой выходит несколько работ
В. Томсона « О динамической теории тепла». Продвигаясь в общем
параллельно, Клаузиус и Томсон примерно в течение десяти лет
создают «второе начало механической теории тепла», т. е . второе
начало термодинамики, трактовка которого на долгое время стано
вится классической. При этом второе начало формулируется в виде
всеобщего закона, управляющего вселенной и заставляющего ее при
ближаться к предельному состоянию, к «тепловой смерти», из кото
рого вывести, вселенную может только нематериальная сила, «палец
бо га » . Лженаучным тезисом, выражающим эту тенденцию, является
утверждение Клаузиуса: «Энтропия вселенной стремится к максимуму».
Так рядом с «царицей мира» — энергией — становится ее «тень» —
энтропия, и вокруг термодинамики завязывается острая борьба между
материализмом и идеализмом, не затихшая до наших дней.
Клубок заблуждений и противоречий, возникших в связи с пред
ставлением о тепловой смерти вселенной, разрубается марксистской
философией, трудами Ф. Энгельса. Энгельс доказывает абсурдность
фидеистической идеи Клаузиуса, которая идет в разрез с идеей не-
уничтожаемости движения и которая противоречит всеобщему закону
сохранения и превращения энергии.
Энгельс пишет: «Мы приходим, таким образом, к выводу, что
излученная в мировое пространство теплота должна иметь возможность
каким-то п ут ем ,— путем, установление которого будет когда-то
в будущем задачей естествознания, —
превратиться в другую форму
движения, в которой она может снова сосредоточиться и начать
активно функционировать. Тем самым отпадает главная трудность,
стоявшая на пути к признанию обратного превращения отживших
солнц в раскаленную туманность»;1) «... у нас есть уверенность,
что материя во всех сво их превращениях остается вечно одной и
той же, что ни один из ее атрибутов никогда не может быть утрачен
и что поэтому с той же самой железной необходимостью, с какой
она когда-нибудь истребит на земле свой высший цвет — мыслящий
д у х , она должна будет его снова породить где-нибудь в другом
месте и в другое время». 2)
*) Ф. Энгельс, Диалектика природы, 1948, стр. 20.
а) Там же, стр. 21.
ВВЕДЕНИЕ
17
Создавая свою «Диалектику природы», Энгельс не знал еще
о подготовлявшихся Л . Больцманом (1844— 1906) трудах по стати
стическому истолкованию наблюдаемой односторонности природных
явлений. Больцман развенчал тезис о тепловой смерти вселенной,
осветив закон возрастания энтропии с микрофизической точки зрения,
которая выявила ограниченность этого закона.
Дело Больцмана было блестяще продолжено М . Смолуховским
(1872— 1917), который вскрыл далее истинный смысл односторон
ности и закона возрастания энтропии. Некоторые подробности по
этому поводу имеются в третьем отделе настоящего курса.
Классическое построение основных понятий и положений термо
динамики, отражающее преемственность по отношению к теории
теплорода и во многом лишенное логического совершенства, стало
подвергаться серьезной критике, начиная с рубежа нынешнего сто ле
тия. Большая заслуга в этом принадлежит отечественным ученым и
прежде всего профессору Киевского университета Н . Н . Шиллеру
(1848— 1910), работы
которого
по
этому
поводу относятся
к 1897— 1901 гг. В своих методологических исследованиях Шиллер
не ограничился только критикой, а построил совершенно оригинальную,
более строгую систему обоснования второго начала термодинамики.
В 1928 г. вышла очень важная работа Т . А . Афанасьевой (Москва)
«Необратимость, односторонность и второе начало термодинамики».
В этой работе завершается анализ физических предпосылок и логи
ческих основ второго начала, убедительно показывается несовершен
ство его классических построений, обосновывается целесообразность
раздельного формулирования второго начала для идеализированных —
равновесных и реальных — неравновесных процессов и показывается,
что свойства последних играют иную роль, чем им обычно припи
сывают. При этом Афанасьева отмечает, что Шиллер подходил ближе,
чем кто-либо иной, к сущности второго начала.
После работы Афанасьевой классическая трактовка основ термо
динамики перестает быть единственной не только в специальной, но
и в учебной литературе. Усилия, в особенности со стороны со ветских
ученых, направленные к совершенствованию методологии термодина
мики, не прекращаются до последних дней.
Для решения конкретных прикладных вопросов термодинамика
нуждается в знании физических свойств тех тел, с которыми в каждом
отдельном случае приходится иметь дело. В свою очередь выяснение
взаимосвязей между физическими и даже химическими свойствами
чрезвычайно облегчается, если для этого привлечь аппарат термодина
мики. Начиная с середины прошлого столетия, накопление экспери
ментальных данных о свойствах тел пошло быстрыми темпами. Задача
2 Зак. 3543. В. С . Жуковский.
18
ВВЕДЕНИЕ
Изучения свойств тел стала решаться и теоретическим путем, на основе
развивавшейся кинетической теории материи, прогресс которой был
обеспечен той же плеядой ученых, которые трудились над созданием
основ термодинамики. Однако в дальнейшем и микрофизические иссле
дования отошли к разделу физики, который обособился под названием
статистической физики.
Начало периода развернутого изучения физических и химических,
свойств тел во взаимосвязи этих свойств символизируется фигурой
великого русского ученого Д . И . Менделеева (1834— 1907). Здесь
мы не будем касаться мирового значения Менделеева как химика, т ак
же как не место говорить о его разносторонней и прогрессивной
деятельности в общем плане. Достаточно, имея в виду нашу ограни
ченную зад ачу, упомянуть о его приоритете в установлении и объ
яснении критического состояния при фазовых превращениях, о на хо
ждении им формулы теплового расширения жидкостей, получившей
впоследствии название закона Менделеева, о предложенном им урав
нении состояния реальных газов, о созданной им теории растворов.
В каждой из своих работ Менделеев обнаруживает ломоносовское-
Понимание научного анализа как синтеза методов механики, физики
и химии. Менделеев отвергал простую регистрацию фаКгов и во
главу своих исследований ставил теорию и гипотезу, способные
отражать реальную действительность. О н решительно высказался про
тив энергетизма Оствальда и его последователей. Менделеев писал*
что они «... отрицают вещество, ибо, говорят они, мы знаем только
энергию, веществом предъявляемую (жесткость, сопротивление, вес
и т. д .) , и , следовательно, вещество есть только энергия. Такое, на
мой взгляд чисто схоластическое представление очень напоминает
тот абстракт, по которому ничего не существует, кроме „ я а, по
тому что все проходит через сознание. Полагать можно, что по
добные представления... удержаться не могут в умах сколько-нибудь
здравых».
Почти одновременно с Менделеевым развернул свою плодотвор
нейшую деятельность в Московском университете А . Г . Столетов
(1839— 1896), вдохновитель передовой физической школы в России.
Столетов поднял на большую высоту научную работу кафедры физики
и со здал прекрасный курс лекций по теории теплоты. Специальной
заслугой Столетова являются его работы по поводу критического
состояния вещества, в которых была развернута глубокая критика
обширных, но разноречивых литературных данных и была внесена
полная ясность в состояние вопроса.
Наряду с Московским университетом большую роль в деле изу
чения физики тепла сыграл Киевский университет, где эту работу
возглавил современник Столетова М . П . Авенариус (1835— 1895),
преемником которого по кафедре физики был уже упомянутый выше
Н . Н . Шиллер. Сам Авенариус со своими учениками К. Н . Жуком*
В. И . Зайончевским, А . И . Надеждиным, О . Э . Страусом и другимй
ЙЙЕДЕНИЕ
19
специально занялся изучением критического состояния вещества.
Многочисленные полученные впервые в лаборатории Авенариуса
экспериментальные данные о критических температурах и об особен
ностях критического состояния вошли в русские и иностранные
справочники, заслужив всеобщее признание.
Отечественные ученые внесли большой вклад в физику не только
3 указанной специальной области, но также в связи с широким и зу
чением теплоемкостей, теплот превращения, фазовых равновесий,
уравнений состояния и пр. Т а к , например, важнейшие работы по
во просу об упругости насыщенных паров смесей жидкостей были
выполнены Д . Г1. Коноваловым. П о вопросу об упругости насыщения
паров много сделал также Л . Г . Богаевский, которому, кроме того,
Принадлежат важные работы по теории соответственных состояний.
Громадный и общепризнанный труд был выполнен О . Д . Х во л ь -
соном, который в своем многотомном курсе физики собрал и кри
тически оценил различные физические теории и экспериментальные
данные, нужные, в ч астности, для термодинамических приложений.
Совершенно новая эпоха в области изучения вопросов термодина
мики и вообще теоретических основ теплотехники началась у нас
в первые же годы после Великой Октябрьской социалистической ре
волюции благодаря основанию ряда специализированных научно -иссле
довательских институтов и среди них — Всесоюзного теплотехнического
института (ВТИ) им. Дзержинского, Центрального котлотурбинного
института (ЦКТИ) им. Ползунова и Энергетического института (ЭНИН)
А Н С С С Р им. Кржижановского. Эти институты, дополняемые дру
гими, отраслевыми, институтами, были призваны заниматься как опе
ративными, т ак, в о собенности, перспективными вопросами тепло
техники и теплоэнергетики. Для этого было необходимо создать
экспериментально обоснованные теории расчета рабочих процессов,
касающиеся термодинамических признаков ц иклов, течения газов и
жидкостей, теплопередачи, внутрикотловых процессов (циркуляции,
сепарации, уноса солей), водоподготовки и т. д . Во всех случаях
необходимо было уточнять и расширять знания о физических свой
ствах применяемых рабочих тел — газов, воды и ее пара, ртути,
холодильных агентов и пр. Здесь мы отметим выдающиеся достиже
ния со ветских исследователей только в связи с изучением термоди
намических свойств воды и водяного пара.
Естественно, что накопленные данные о термодинамических свой
ствах воды и ее пара очень обширны. Однако до работ советских
исследователей эти данные обрывались в области высоких парамет
ров пара и позволяли судить об области сверхвысоких параметров
только посредством малонадежных экстраполяций. М ежду тем в связи
с ростом экономичности энергетических установок при увеличении
2*
20
ВВЕДЕНИЕ
давления и температуры пара возникла настоятельная потребность
в расширении знаний основных свойств воды.
Раньше всех в
Советском Союзе этими вопросами стали заниматься во В Т И , от
куда в начале тридцатых годов вышла работа В . Шугаева и
М . Ф . Ш ирокова (вторая — в теоретическом плане) по определению
вязкости водяного пара, сначала — до 400°С и 93 am и затем до
400° С и 200 am. В этом направлении работа была продолжена
Д . Л . Тимротом (до 600° С и 300 am). Полученные результаты не
имеют себе равных ни по достоверности, ни по широте охвата пара
метров. Под руководством Д . Л . Тимрота и Н . Б . Варгафтика во
В Т И был затем осуществлен цикл работ по определению теплопро
водности, теплоемкости и связи между давлением, объемом и тем
пературой для воды и водяного пара. Весь указанный комплекс
работ впервые затрагивал область сверхвысоких параметров (напри
мер, теплоемкости исследовались до 300 am и 600° С) и был удо
стоен в 1950 г. Сталинской премии.
Наряду с ВТИ в Московском энергетическом институте (МЭИ)
им. Молотова была развернута работа по опытному определению
взаимосвязи между давлением, объемом и температурой пара. Н а
созданной по оригинальной идее установке лауреатами Сталинской
премии В . А . Кириллиным и Л . И . Румянцевым были определены
удельные объемы воды и водяного пара при давлениях до 524 a m . и
температурах до 650ЭС . Так далеко экспериментальная база, касаю
щаяся водяного пара, не была продвинута ни в какой другой стране.
Советские ученые имеют крупные успехи также в деле разра
ботки теории реальных газов и, в частности, водяного пара. Принци
пиально новый и очень сильный метод получения уравнения со сто я
ния реальных газов на основе развития аппарата статистической
физики дан Н . Н . Боголюбовым. В прикладном отношении пока
более важен другой теоретический метод — метод М . П . Вукаловича
и И . И . Новикова. Вычисленные лауреатом Сталинской премии Вука-
ловичем (М Э И ) таблицы и соответствующие диаграммы для водяного
пара являются наиболее обширными и точными и получили всеобщее
распространение.
Приведенные выше исторические замечания не могут претендовать
ни на полноту, ни на глубину анализа и не содержат некоторых
ссылок и подробностей, имеющихся далее в тексте. В частности,
в них совершенно обходятся имена деятелей, обеспечивших прогресс
узко-технических приложений термодинамики. Если, однако, наше
введение поможет оценить роль отечественных ученых в развитии
термодинамики и в накоплении опытных данных, нужных для техни
ч еских приложений термодинамики, то его цель будет достигнута.
ОТДЕЛ ПЕРВЫЙ
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
ГЛАВА I
ПРИНЦИП ИСКЛЮЧЕННОГО ВЕЧНОГО ДВИГАТЕЛЯ
1.
Термодинамическое тело и термодинамический процесс. П ер-
вый шаг термодинамического анализа заключается в выделении из
совокупности взаимодействующих тел конкретного физического объекта
изучения. Объект изучения называется термодинамическим или
рабочим телом (в случае сложной структуры — термодинамической
системой), а все, что лежит вне его границ, — окружающей средой.
Сп о со б построения замкнутой по верхности, ограничивающей термо
динамическое тело, вообще говоря, совершенно произволен и потому
должен определяться только задачей исследования, а также удобством
и простотой предстоящих рассуждений и выкладок. Н е обязательно,
чтобы термодинамическое тело было веществом молекулярной стр ук
туры, оно может быть, например, электромагнитным излучением в вак у
уме. Принципиально важно лишь, чтобы термодинамическое тело
допускало макрофизические приемы наблюдения и не было бы в силу
этого слишком малым.
Вторая оговорка по по воду выделения термодинамического тела
сводится к условию , чтобы наблюдаемые макрофизические свойства
отличались друг от друга внутри термодинамического тела и вне
его. Есл и, например, в какой-то массе однородного газа, имеющего
повсеместно совершенно одинаковую температуру и одинаковое
давление, мы выделим некоторый элемент и ему в качестве о к ру
жающей среды противопоставим остальной газ , то в термодинами
ческом отношении это будет бесплодно . Термодинамика ничего не
может сказать о результатах смешения д ву х порций одного и того
же газа, находившихся в абсолютно тождественных условиях, после
того как удалена разделявшая их перегородка. Напротив, если речь
идет о смешении различных газов или даж е одного и того же газа ,
но взятого при разных начальных давлениях или температурах,
термодинамика способна судить о возникающих эффектах.
Поверхность термодинамического тела в общем случае проницаема
для всевозможных воздействий окружающей среды. Однако при вы
полнении особых физических условий, а также в результате пренебре
жения малыми эффектами могут рассматриваться такие поверхности,
которые проницаемы только для некоторых воздействий и , следо
вательно, осуществляют изоляцию системы от прочих воздействий.
22
ПЕРррЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. I
Предельный случай изоляции мыслим тогда, когда ни одно из
внешних воздействий не способно проникнуть сквозь поверхность
термодинамической системы, ввиду чего последняя является абсолютно
изолированной от окружающей среды. Разумеется, этот случай фак
тически во всей своей строгости не может быть реализован. Будучи,
однако, рассматриваем именно как предельный случай, он позволяет
установить следующий очень важный для термодинамики закон опыт
ного происхождения.
Абсолютно изолированная термодинамическая система непре
менно приходит к состоянию внутреннего равновесия, в котором
она остается неограниченно долгое время. В ы ход из этого ст а
бильного равновесного состояния и возникновение каких-либо из
менений (макрофизических) в системе возможны только в резуль
тате снятия абсолютной изоляции и осуществления тех или
иных воздействий окружающей среды на систему.
Необходимо решительно подчеркнуть, что закон со самоненару-
шимости равновесных состояний» (по выражению К. А . Путилова *))
является ограниченно верным. Этот вопрос специально разбирается
далее в главе II третьего отдела. Там разъясняется, что при переходе
к космическим масштабам указанный закон несправедлив или, по
крайней мере, нуждается в дополнительном уточнении своего смысла.
Следует в отдельных случаях считаться с возможностью его несоот
ветствия действительности и в пределах земного опыта. О дн а к о , если
оставаться на почве обычной, повседневной практики, то нужно
будет признать, что он не имеет исключений. В о всяком случае,
в технической термодинамике стремление изолированных систем
к внутреннему равновесию, после достижения которого самопроиз
вольные изменения в макроскопических свойствах системы невоз
можны, считается непреложным фактом.
Термодинамическим процессом можно назвать всякий макрофи-
зический процесс в теле, вызываемый воздействиями со стороны
окружающей среды.
В связи с произвольностью выбора границ термодинамического
тела во многих случаях удается трактовать изменения, происходящие
в совокупности взаимодействующих тел, как термодинамический про
цесс, происходящий с одним из них. Говоря иначе, часто предста
вляется возможным внутренние процессы в совокупности тел пере
вести в категорию процессов, побуждаемых внешними причинами, а
именно — работой, которую производит окружающая среда над искус
ственно выделенным термодинамическим телом (системой).
Существуют, однако, явления, возникновение которых не может
быть приписано внешним воздействиям, как бы мы ни старались
очертить границы тела. Здесь имеются в виду самопроизвольные
*) К. А . Путилов, Лекции по термодинамике, ВХО им. Д . И . Менде
леева, Москва, 1930.
ГЛ. I]
ПРИНЦИП ИСКЛЮЧЕННОГО ВЕЧНОГО ДВИГАТЕЛЯ
23
{спонтанные) процессы , по самому наименованию своему свидетель
ствующие об их независимости от внешних воздействий. Представим
с.ебе, например, что путем быстрого охлаждения воды в колбе
удалось достичь температуры более низкой, чем температура обра
зования л ьда. Э т у колбу можно затем оставить в изолированном
состоянии и неопределенно долгое время не замечать в ней каких-либо
изменений. Однако достигнутое равновесное состояние является не
устойчивым, метастабильным. В любой момент следует быть готовым
к возникновению весьма бурного процесса замерзания воды, который
может начаться без всякой видимой внешней причины. Конечно,
если бы представилось возможным проследить за ничтожными флюк
туациями температуры в колбе, за конвекционными токами, за пере
мещением мельчайших пылинок и других зародышей кристаллизации,
то вопрос о моменте начала замерзания удалось бы свести к термо
динамической задаче, разбивая содержимое колбы на маленькие
элементы, которые противопоставлялись бы друг другу, как термо
динамическое тело окружающей среде. Для этого, однако, потре
бовался бы такой арсенал измерительных приборов и такой сложный
аппарат обработки наблюдений, что практически наше намерение
разыскать локализованные причины внезапной кристаллизации при
шлось бы признать нереализуемым, а возникновение и хо д процесса —
«самопроизвольными». Впрочем, несмотря на невозможность описания
само го механизма явления, термодинамика способна предвидеть свой
ства того устойчивого равновесного состояния, к которому рано
или поздно обязана придти переохлажденная вода.
2.
Работа и количество теплоты. Количественной мерой воз
действия окружающей среды на тело является работ а. Посредством
производства работы энергия окружающей среды переходит к термо
динамическому телу (или наоборот). Переход энергии сопрово
ждается изменением формы первоначального движения материи. П о
этому поводу Ф. Энгельс пишет:
«Изменение формы движения является всегда процессом, проис
ходящим по меньшей мере между двумя телами, из которых одно
теряет определенное количество движения такого -то качества ..., а
другое получает соответствующее количество движения такого-то
другого качества... Следовательно, количество и качество соответ
ствуют здесь друг другу взаимно и обоюдосторонне».1)
Далее у Энгельса читаем:
«Но как же выражает современная механика.. . превращение ме
ханического движения в другую форму движения, количественно
пропорциональную первому? Это движение, — говорит механика,—
произвело работу, и притом такое-то и такое-то количество работы.
Н о понятие работы в физическом смысле не исчерпывается этим.
Если теплота превращается . . . в механическое движение ..., если
J) Ф. Энгельс, Диалектика природы, 1948, стр. 41.
24
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. I
теплота разлагает какое-нибудь химическое соединение . • . ,
если
электрический ток выделяет из разбавленной серной кислоты со ста в
ные элементы воды или если, наоборот, высвобождающееся при
химическом процессе какого-нибудь гальванического элемента дви
жение (иначе говоря, энергия) принимает форму электричества, а
это последнее в свою очередь превращается в замкнутой цепи в теп
л о т у , — то при всех этих явлениях форма движения, начинающая
процесс и превращающаяся благодаря ему в другую форму, совер
шает работу, и притом такое количество ее, которое соответствует
ее собственному количеству.
Таким образом, работа — это изменение формы движения, рас
сматриваемое с его количественной стороны» . г)
И з приведенных соображений следует, что не всякую меру внеш
него воздействия на тело можно называть работой, а только такую,
которая при надлежащих условиях способна количественно характе
ризовать качественное изменение формы движения материи.
В термодинамике классификация видов работы производится по
признакам тех изменений, которые происходят в термодинамическом
теле под действием окружающей среды.
Если происходит изменение положения или формы термодинами
ческого тела, то работу называют механической. Как известно, ме
ханическая работа определяется скалярным произведением силы на
путь. Поскол ьку термодинамическое тело должно быть ограничено
замкнутой поверхностью , в расчет надлежит вводить внешние силы,
действующие на тело. Рабо ту этих внешних сил называют работой,
производимой окружающей средой над телом. Обозначим ее через L e.
Величина L e положительна в том случае, когда угол между напра
влениями силы и пути меньше прямого. В противном случае L e о т
рицательна. Величину L , противоположную L e по знаку, называют
работой тела против сил окружающей среды. В сущности Ье и L = — L9
выражают по величине одну и ту же внешнюю работ у, но только
применительно к разным объектам воздействия: в первом случае та
ким объектом служит термодинамическое тело, во втором случае —
окружающая среда.
Разумеется, изменения положения или конфигурации тела могут
вызываться силами самой различной природы. Такой эффект произ
водят, например, сила тяжести, поверхностное натяжение, пондеро-
моторные силы в электрическом поле, сила давления света и т. д . Однако
в термодинамике все виды воздействия на систему , обусловливающие
изменение ее положения или конфигурации, объединяются независимо
от их происхождения в категорию механической работы. О бсу ж д е
ние их специфических особенностей является предметом соответствую
щих отраслей физики, где устанавливаются условия совершения той
или иной работы и определяются методы ее расчета.
*) Ф. Энгельс, Диалектика природы, 1948, стр. 72.
ГЛ. I]
ПРИНЦИП ИСКЛЮЧЕННОГО ВЕЧНОГО ДВИГАТЕЛЯ
25
Кроме механической работы, существуют также многочисленные
виды работы немеханической, к а к - т о : работа электрических сил, вы
ражающаяся в переносе электрического заряда (количества электри
чества) под действием разности потенциалов, работа магнитных сил ,
выражающаяся в намагничивании, работа химических сил, выражаю
щаяся в переносе массы вещества от исходных веществ к продуктам
реакции, и т . д . К категории немеханических воздействий окружаю
щей среды на тело относится также и теплопередача, возникающая
в случае, когда взаимодействующие тела имеют неодинаковые темпе
ратуры.
Механизм теплопередачи может быть в различных условиях р аз
личным. Если взаимодействующие тела находятся в непосредственном
контакте, мы. имеем дело с теплопередачей соприкосновением (явле
ния теплопроводности и конвекции); если эти тела отделены вакуум ом ,
теплопередача происходит через излучение. В общем случае эти п р о
цессы накладываются друг на друга. И х анализ и установление р ас
четных приемов относятся к учению о теплопередаче (иначе выра
жаясь, к теории теплообмена).
В качестве количественной меры теплопередачи следовало бы
ввести понятие о тепловой работ е, подобно тому как это делается
применительно ко всем прочим видам внешних воздействий. Однако
в силу исторических причин взамен термина «тепловая работа» в н ауку
и технику вошел термин «количество подведенной теплоты» , о б о
значаемый буквой Q . Мы принимаем, что количество теплоты Q , под
веденной к термодинамическому тел у, положительно, если это тела
находится под тепловым воздействием более нагретой среды. В пр о
тивном случае, когда окружающая среда менее нагрета, чем термо
динамическое тело, говорится, что тело отдает среде некоторое к о
личество теплоты и, соответственно, величина подведенной теплоты Q
считается отрицательной. г)
3.
Принцип исключенного вечного двигателя. Ранее мы уже
пользовались известным из физики представлением об энергии. О д
нако для последовательного изложения основ термодинамики ц ел есо
образно ввести это представление позднее, а в качестве пер
вичного понятия взять работу, понимая последнюю обобщенным обра
зом, т. е. учитывая не только механическую работу, но также, на
пример, и количество передаваемой теплоты.
Следующее положение служит фундаментальным законом физики:
исключается возможность создания машины, способной непрерывно
совершать работ у какого-либо вида без столь же непрерывного
производства работы другого вида окружающей средой.
Такая неосуществимая машина получила название вечного двига
теля (perpetuum mobile) первого рода. 2) Принцип исключенное
*) Об единицах измерения для количества теплоты см. п. 4 .
2) О вечном двигателе второго рода будет сказано в третьем отделе.
26
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. 1
вечного двигателя (первого рода) был вначале сформулирован при
менительно к одним только механическим явлениям. Расширение опыт
ных фактов привело в дальнейшем к распространению этого принципа
за пределы механики, в область физики, где наряду с механической
работой рассматриваются и немеханические виды работы.
Математическое выражение принципа исключенного вечного дви
гателя связывается с понятием круговых процессов. Круговым про
цессом или круговым циклом назовем процесс, в результате кото
рого термодинамическое тело под влиянием внешних воздействий
возвращается в свое исходное состояние. При этом характеристикой
определенного состояния тела будем считать совокупность всех его
механических и физико-химических свойств (совокупность парамет
ров состояния).
Всякий двигатель промышленного назначения выполняет м но го
кратно повторяющиеся операции. По это му естественным образом воз
никла идея в качестве прототипа двигателя считать машину, в которой
соответствующее термодинамическое (рабочее) тело последовательно
совершает некоторые круговые процессы. В таком случае, согласно
высказанному выше принципу, можно утверждать, что если любое
термодинамическое тело выполняет круговой цикл и совершает тем
самым внешнюю работу
то с необходимостью должна быть от
лична от нуля внешняя работа хотя бы одного другого вида L " .
Если V является механической работой, в качестве L " может сл у
жить и тепловая работа, т. е . подведение к телу тепла из окружаю
щей среды. В этом случае двигатель называется тепловым двига
телем. В некоторых двигателях циклическое возвращение рабочего
тела к своему исходному состоянию осуществляется в пределах са
мого двигателя. В других случаях такое возвращение происходит вне
двигателя, в атмосфере, куда выбрасывается отработавшее рабочее
тело и откуда в свою очередь черпаются новые порции этого тела,
направляемые в двигатель.
Так или иначе, совершающее круговой процесс тело способно
производить внешнюю работу требуемого вида только благодаря не
прерывному воздействию на тело извне. Рабочее тело в рассматри
ваемом случае является лишь орудием взаимного преобразова
ния работ различного физического происхождения, в частности о ру
дием превращения теплоты в механическую работу. При этом, как
показывает о пыт, имеет место количественный закон:
в результате совершения любым термодинамическим телом
кругового процесса должна быть равна нулю алгебраическая сумма
всех работ, произведенных окружающей средой над телом,
включая в эт у сум му количество теплоты, подведенной извне
к телу:
о-1)
В этой формуле каждое слагаемое представляет собой результат
?Л. I]
ПРИНЦИП ИСКРОЕННОГО ВЕЧНОГО ДВИГАТЕЛЯ
£7
суммирования соответствующих элементарных величин работы за
время, в течение которого тело выполняет круговой процесс, что
можно записать таким образом (опуская штрихи при символах L e):
Le= §dLe;
(1.2)
Зак он , представленный формулой (1.1), выражает собой одновре
м ен но как принцип исключенного вечного двигателя, так и принцип
эквивалентности различных видов работы.
Первый из них, первоначальная формулировка которого была дана
выше, получается из формулы (1.1), если положить все члены, кроме
какого-либо одного, равными нулю. Тогда оставшийся член тоже
должен обратиться в нуль.
Друга я формулировка принципа исключенного вечного двигателя
может быть получена из уравнения (1.1) в его полной форме.
Ни при каких условиях выполнения термодинамическим те
лом кругового процесса работа не «создается» и не «уничто
жается». Работа подчиняется закону сохранения: взамен затра
ченной работы одн их видов производится работа друг и х видов.
Вторая смысловая часть формулы (1.1) заключается, как было
-сказано, в принципе эквивалентности различны х видов работы.
Полагая все члены в формуле (1.1), кроме каких-либо двух, равными
п у л ю , мы видим, что оставшиеся два равны по абсолютной величине
И отличаются только знаком.
Взамен работы, производимой окружающей средой над рабочим
телом в течение кругового процесса, последнее возвращает о к ру
жающей среде такое же точно количество работы другого вида.
Это положение имеет смысл, разумеется, только в том случае,
-если работа независимо от ее вида измеряется всегда в одних и тех
ще единицах. Если же для каждого вида работы выбраны свои еди
ницы измерения, то численные значения каждой пары работ при
условии полного взаимного превращения последних должны отличаться
постоянным коэффициентом, который раз навсегда может быть опре
делен опытным путем. Э т о т коэффициент называется соответствующим
эквивалентом работы определенного вида. В частности, если имеется
а виду механическая и тепловая работа (количество теплоты), то
указанный коэффициент называется тепловым эквивалентом м е х а
нической работы или, соответственно, м еханическим эквивалентом
теплоты.
4.
Тепловой эквивалент механической работы. Принцип экви
валентности теплоты и механической работы для случаев, когда те
плота и работа полностью взаимопревратимы, выражается формулами:
Q+ ALe= О, Q=*AL,
(1.3)
в которых А является тепловым эквивалентом механической работы.
Числовое значение А зависит только от выбора единиц измерения для Q u L .
28
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. !
Величина, обратная А , называется механическим эквивалентом
теплоты и обозначается через J .
В технической термодинамике основными единицами измерения
служат: килограмм (сила), метр, секунда. Вследствие этого меха
ническая работа измеряется в килограммометрах (1 к Г м ).2) Оче
видно, что и количество теплоты можно выражать в килограммометрах
и считать тогда А равным единице. Однако такой способ исчисления
неудобен, так как в теплотехнике за единицу количества теплоты
принимают обычно килокалорию.
В физике одна килокалор ия определяется как количество теплоты,
необходимое для нагревания массы воды в один килограмм на 1 ° С
при нормальном атмосферном давлении. При этом оговаривается,
начиная с какого температурного уровня производится нагревание
на 1 °С . У нас в С С С Р за нормальную температуру принимается 20° С .
В связи с этим при определении килокалории указывается, что
имеется в виду нагревание от 19,5 до 20,5 ° С .
В технике килокалорию относят к одному килограмму веса. Чтобы
такое определение килокалории имело смысл, нужно сделать до по л
нительную оговорку об условии, при котором устанавливается вес
принятой массы воды. Вес должен отвечать месту, где ускорение
свободного падения принято за нормальное, равное 980,665 см/сек2
(на уровне моря, широта 45°). При других условиях массе в один
килограмм не в точности соответствует вес в один килограмм и,
следовательно, величины одной «весовой» килокалории могут быть
несколько отличны.
Нуж но сказать, что приведенное определение килокалории не
является теперь единственным. Согласно решению интернациональной
конференции по таблицам пара в 1929 г . ,
подтвержденному между
народной энергетической конференцией в 1930 г . ,
одна килокалория
определяется как 1/860 интернационального киловатт-часа. Э та кило
калория называется интернациональной (электрической); 1 инт. к к а л
(электрическая) = ^
инт. квт-ч = 4,186 инт. кдж — 4,187 абс.
кдж = 427 кГм. 2)
Электрические единицы не зависят от поля земного тяготения,
стандартизованы в интернациональном масш табе и поддаются особенно
точным способам измерения. Поэтому определение калории электри
ческим путем весьма желательно. Принятое численное значение интер*
национальной килокалории выбрано таким образом, что килокалории,
применявшиеся ранее в различных странах, отличаются от него не более,
1) Обозначение кГ введено 1 января 1934 г., согласно ОСТ/ВКС 6052,
для различения килограмма-силы и килограмма-массы (кг).
2) Последнее число является общепринятым
округлением величины
426,94 кГм\инт. ккал . В любой системе единиц 1 квт-ч = 3,6* 103 кГм, при
чем.1абс. кдж= 101,972кГм.
гл. И]
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
29
чем на -f - 0 ,0 5 % . В частности, наша двадцатиградусная килокалория
по стандарту ОСТ/ВКС 6259 равна
к к а л интернациональной.
Должно быть ясно, что соглашение об интернациональной кило
калории является по существу соглашением о численном значении те
плового эквивалента, который принимается равным 860 ш а л / к в т -ч ,
не нуждаясь более в определении экспериментальным путем. С о вер
шенно иначе обстоит дело при определении единицы количества теп
лоты по калориметрическому эффекту. В этом случае численное
значение А не вытекает из соглашения о величине одной килокалории
и может быть установлено только путем прямого опыта. Такое пря
мое опытное определение А было впервые произведено Д жо улем .
В теплотехнике принимаются следующие значения А :
А ==860
ккал
квт-ч
1 ккал
427 ~кГм
=
632
ккал
л.с.-ч.
ГЛАВА II
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Б. Закон сохранения и превращения энергии. Внутренняя
анергия. Принцип исключенного вечного двигателя имеет точный
смысл применительно к случаям, когда термодинамическое тело выпол
няет какой-либо круговой процесс. Естественным образом возникает
задача обобщить этот принцип на некруговые процессы.
При совершении телом всякого некругового процесса сумма внеш
них работ не равна нулю. В связи с этим в круг рассмотрения вво
дится энергия термодинамического тела. При построении термодина
мики, как и в случае механики, понятие энергии целесообразно
основать на предварительно введенном понятии работы. П о эт о м у
начнем с термодинамического определения энергии.
Сумма всех работ, произведенных окружающей средой над
термодинамическим телом, плюс количество т епла, подведенного
к телу со стороны окружающей среды за некоторый промежуток
времени, равна приращению энергии тела за тот же промежуток
времени.
Обозначив приращение энергии тела через ДЕ и выражая его
в тепловых единицах, мы, следовательно, можем написать;
AL'e-] -ALe+ ... + Q=Д£,
(I. 4)
ЗдесьА'уА"у ...
—
тепловые эквиваленты соответствующих видов
работы, каждая из которых измеряется в своих единицах.
Если к сказанному ничего более не прибавить, то оно останется
Ие более чем соглашением о наименовании алгебраической суммы не
30
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД; t
скольких величин, каждая из которых может быть непосредственным
образом измерена. Однако за сформулированным предложение*
кроется несравненно большее, чем словесное соглашение, и в этом
дополнительном обстоятельстве заключается фундаментальное значение
понятия энергии. Оказывается, что приращение энергии обладает
следующим свойством:
При совершении всяким телом какого-либо процесса прираще
ние энергии поела зависит исключительно только от начального
и конечного состояний тела.
Иначе говоря, каким бы путем йи переходило тело из одного
фиксированного состояния в др уг о е , сумма всех произведенных над
ним работ и подведенного количества теплоты не зависит от п р и
нятого способа перехода и определяется исключительно начальным
и конечным состояниями тела.
Легко видеть, что это замечательное свойство внешней работы и,
соответственно, энергии тела является следствием изложенного ранее
принципа исключенного вечного двигателя. В самом деле, представим
себе, что тело совершило переход из состояния 1 в состояние 2 У
а затем возвратилось каким-либо путем в исходное состояние / .
Первую часть выполненного телом кругового процесса обозначим
через /я2, вторую часть — через 2с/, как сим
волически показано на рис. 1. Согласно опре
делению энергии и принципу исключенного
вечного двигателя, имеем:
Д£1о* + Д£** = 0.
(*>
Допустим теперь, что из состояния 1 в состоя
ние 2 тело переводится некоторым путем 1Ь2У
отличным от принятого в первом варианте,
в возвращается по прежнему пути. Т огд а для
нового кругового процесса мы можем написать:
+
=
(**)
Таким образом, должно непременно удовлетворяться равенство
ДEia2 +
2d=
“ Ь Д^2с1*
Отсюда ясно, что всегда
ДEiaa = &Eib2f
что и требовалось показать.
Рассмотрим два важных следствия, вытекающих из общих свойств
энергии.
1)
Представим себе, что в каких-либо конкретных условиях лабора
торного опыта мы произвели над выбранным телом некоторую^
работу и подвели к нему определенное количество тепла. При этом
мы знаем, каково приращение энергии тела. Измерим теперь со от ве т-
Ь
гл. и]
ПЕРЙОЁ НАЧАЛО ТЕРМОДИНАМИКИ
31
сТвующие параметры Начального и конечного состояний тела. С о п о
ставив вычисленное ранее приращение энергии тела с найденными
начальными и конечными параметрами состояния, мы можем устано
вить вид функциональной зависимости А Е от этих параметров. Если
теперь, изменив постановку опыта, мы совершим другими средствами
И другим путем переход тела из того же начального в то же конеч
ное состояние, то величина АЕ останется прежней. В частности, это
будет так, если осуществлен процесс, в котором производство работы
и теплообмен настолько переплетаются друг с другом, что их раз
дельная количественная оценка оказывается затруднительной. Таким
образом, нам достаточно произвести лишь однажды опытное опреде
ление зависимости А Е от свойств каждого тела и изменения его пара
метров состояния с тем, чтобы полученные сведения можно была
в дальнейшем применять безотносительно к условиям взаимодействия
термодинамического тела с окружающей средой.
2)
Объединим термодинамическое тело и окружаю щую среду
в одну систему, которая по отношению к прочему миру была бы
изолированной. Применив формулу ( 1 .4) последовательно к обоим
элементам нашей системы, заключаем, что на сколько энергия о днога
из них увеличивается, на столько же энергия друго го уменьшается»
Это обстоятельство можно выразить следующим образом.
Эн ергия изолированной системы тел остается постоянной npti
Любых условиях взаимодействия образующих систему элементов.
Указанное положение и выражает собой закон сохранения энер
ги и. О н означает, что в любой физической области, изолированной
от окружающего мира, энергия не может Ни создаваться, ни уничто
жаться. Энергия может только перераспределяться между взаимодей
ствующими телами. Такой процесс перераспределения называется
энергетическим обменом.
Несмотря на открытие со времени установления закона сохране
ния энергии целого ряда новых неизвестных ранее физических явле
ний, достоверность закона сохранения энергии остается совершенно
непоколебимой, и он имеет значение фундаментального закона природы .1)
Практически очень удобно расчленить энергию тела Е на две
составляющие: внешнюю и внутреннюю энергию. Внешней энергией
называют механическую энергию тела, рассматриваемого как одно
неделимое целое. Внешняя механическая энергия представляет собой
сумму кинетической й потенциальной энергий. Первая из ни х, если
1) Заметим, что в механике закон сохранения механической энергии
(сумма кинетической и потенциальной энергий системы сохраняет при дви
жений системы постоянную величину) является попросту теоремой, доказы
ваемой применительно к случаю наличия потенциальных сил. Эта теорема
вытекает из законов Ньютона. Между тем общефизический принцип сохра
нения энергии не может быть доказан из более простых положений и требует
вишь, в соответствии с расширением знаний, постоянного уточнения й попол
нения своего конкретного вы/ражения.
32
ПЕРВОЙ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. I
пренебречь кинетической энергией вращения вокруг центра инерции
тела, равна Gw2/2g кГм, где О — вес тела и w — скорость центра
инерции тела. Вторая равна G h , где h — высота центра тяжести
над условным уровнем, п оскольку в расчет вводится только одна
объемная сила — сила тяготения. Что касается внутренней эн ергии,
обозначаемой буквой U , то она представляет собой микроструктурную
энергию тела, определяемую теми скрытыми движениями материи,
которые присущи телу даже при наличии механического покоя. Таким
образом:
Д£= AGД(-J
-
+h)+Ш.
Потенциальной энергией поля силы тяжести можно раз навсегда пре
небречь, так как она в термодинамике приобретает ощутимое значение
исключительно редко. Тогда общее выражение закона сохранения
энергии получает вид:
i4/li+i4^+...+Q —i40A-g -+ Af/.
(1.5)
Конкретные изменения внутренней энергии того или иного тела
устанавливаются в термодинамике с помощью формулы (1.5), в кото
рой все члены кроме Ш
поддаются прямому измерению. Очень
важно то, что в термодинамике оперируют только с изменениями
внутренней энергии, которые возникают в результате взаимодействия
рассматриваемого тела и окружающей среды. Если мы пожелаем
составить представление об энергии термодинамического тела незави
симо от его отношения к другим телам, то нам необходимо будет ,
как неоднократно указывалось, обратиться к анализу физической
структуры тела и тех скрытых от поверхностного наблюдения дви
жений, которые присущи е му , несмотря на видимый внешний покой.
Говоря конкретно, для этого необходимо принять, что внутренняя
энергия тела обусловливается молекулярными и внутримолекулярными
движениями, свойственными каждому данному макроскопическому
состоянию тела.
Характер этих движений, как было уже упомянуто, весьма разно
образен. В идеальных одноатомных газах внутренняя энергия численно
равна сумме кинетических энергий поступательного хаотического дви
жения молекул; в идеальных многоатомных газах к энергии п ос ту
пательного движения добавляется энергия вращения молекул, а при
высоких температурах — и энергия колебания атомов в молекулах;
в конденсированных системах (жидкости, твердые тела), где атомы
расположены на близких расстояниях друг от друга, существенную
роль играет потенциальная энергия их взаимодействия. С макроско
пической точки зрения, принятой в термодинамике, все эти виды
энергии объединяются в общем понятии энергии U .
В заключение сделаем замечание по поводу терминологии. Не
следует говорить, что «работа и теплота являются формами энергии».
гл. и]
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
33
Рабо та , как и теплота, представляющая собой разновидность работы,
служит мерой воздействия одних тел на другие. Разумеется, эти во з
действия представляют собой акты превращения энергии в системе
взаимодействующих тел. Однако работа — количественная мера и з
м енения формы движения — не тождественна самой первообразной
форме движения, присущей материи независимо от того, производится
или не производится работа.
В связи со сказанным нужно предостеречь от смешения понятий
количества теплоты в термодинамике и «тепловой энергии» в моле
кулярной физике. П од тепловой энергией в физике обычно понимают
энергию теплового движения молекул. Только в самых простых и
частных случаях количество отдаваемой телом теплоты равно убыли
энергии теплового движения молекул. Э т о , например, имеет место
для идеального газа, если его объем сохраняется постоянным. Однако
в общем случае фигурирующее в термодинамике количество теплоты
передается от одного тела к другому в связи с изменением не одной
только энергии теплового молекулярного движения, а также благодаря
превращениям иных составляющих запаса энергии (в процессах изме
нения агрегатного состояния, теплопередачи путем излучения и т . п .) ,
причем выделение макрофизическими методами «тепловой энергии»
из общего запаса энергии представляет, как правило, непреодолимые
трудности.
Нуж но , однако, подчеркнуть, что количественное подтверждение
на примере идеальных газов то го , что механическое движение веще
ственных частиц определяет собой теплоту, могущую быть в извест
ных условиях отданной в окружающую среду, явилось в историческом
плане огромным событием в деле материалистического объяснения
природы. В этой связи следует еще раз обратиться к сказанному
во введении о гениальном русском ученом М . В . Ломоносове. Не кто
иной, как Ломоносов, первый восстал против продолжавшей господ
ствовать до середины X IX столетия теории теплорода и сформулиро
вал отправные идеи кинетической теории тепла.
Отдавая себе полный отчет в том, сколь важна была в свое время
демонстрация молекулярно-кинетической природы теплоты на примере
идеальных газов, нам остается только указать, что в наши дни
отождествление количества передаваемой теплоты с энергией тепло
вого движения (тепловой энергией), присущей любому телу, не только
лишено точного смысла, но и приводит к пагубной путанице в самих
основах термодинамики. К затронутым вопросам мы будем еще в о з
вращаться в дальнейшем.
6.
Первое начало термодинамики. Всеобщий физический закон,
выражаемый уравнением (1.4), в термодинамическом методе исследо
вания играет фундаментальную роль. Поэтому этот закон по спра
ведливости называется первым началом термодинамики. Однако
на практике удобнее называть первым началом термодинамики частный,
но очень распространенный случай указанного всеобщего закона.
3 Зак. 3543. В . С . Жуковский.
34
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
(ОТД. I
Условимся первым началом термодинамики в у з к о м понимании
называть уравнение (1.4), отнесенное к таким условиям, когда центр
масс термодинамического тела остается в покое, вследствие чего
из уравнения (1.4) должны выпасть члены, связанные с изменением
механической энергии. Е сл и, например, на газ, заключенный в сф е
рическую деформируемую оболочку, действуют только поверхностные
внешние силы, давление которых повсеместно одинаково, и если
внутренние силы заставляют газ равномерно расширяться (вследствие
нагревания), то центр масс не сместится. Кинетическая энергия га з о
вой массы оказывается при этом постоянной, и из уравнений (1.4)
12)2
и (1.5)выпадает член AGa-^
-.
Внешняя механическая работа сво
дится только к работе деформации газа и не включает работы,
обусловленной перемещением газа как единого целого. Конкретизован-
ное соответствующим образом уравнение (1.5) и является одним из
видов первого начала термодинамики в узком понимании последнего.
Что касается полного уравнения (1.5), то мы назовем его уравнен ием
сохранения энергии.
В технической термодинамике в рассмотрение вводятся воздей
ствия на тело только в виде механической работы и теплопередачи.
Для выражения этого ограничения термодинамическое тело иногда
называют термомеханическим телом (системой). Такое тело имеет,
следовательно, две степени свободы — механическую и тепловую.
Для термомеханического тела первое начало термодинамики при
нимает вид:
ALe-\-Q=Ш.
(1.6а)
Взамен L e введем L — механическую работу, которую тело произво
дит против сил окружающей среды:
Q=MJ+AL.
(1.6)
Первое начало термодинамики в форме (1.6) имеет простой смысл:
теплота, подведенная к термодинамическому телу извне, частью
увеличивает его внутреннюю энергию и в остальном превращается
в механическую работу, которую тело производит против сил
окружающей среды.
В дифференциальной форме первое начало записывается так:
dQ= d(J+ AdL.
(1.7а)
Предполагая, что тело однородно и во всех своих частях харак
теризуется одинаковыми параметрами, можно считать все величины,
входящие в первое начало, пропорциональными весу тела О (точнее,
массе). В этом предположении правильность формул не нарушается,
_
О
и
L
если отнести их к одному килограмму. Обозначая
~q И~q
соответственно буквами qy и9 /, получаем:
dq= du-\ -AdL
(1.7)
171. II]
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
35
Величины q> и и I называются удельными величинами (количества
теплоты, внутренней энергии, работы).
При пользовании приведенными выражениями первого начала
следует помнить правило знаков. Величину Q (или dQ) мы считаем
положительной, если тепло подводится к телу из окружающей среды.
Величину L (или dL) мы считаем положительной, если внутренние
силы, приложенные к поверхности тела, производят работу, преодо
левая действие внешних сил. Относительно знака A U (или d(J)
уславливаться не приходится, так как он в каждом отдельном случае
вытекает из численного соотношения остальных членов, входящих
в уравнение первого начала.
7. Полные и неполные дифференциалы в термодинамике. Как
мы видели, количество теплоты и механическая работа объединены
некоторыми общими свойствами. Совершенно иными свойствами обл а
дает энергия и, в частности, внутренняя энергия. Физические разли
чия между указанными величинами накладывают свой отпечаток
и на их аналитические особенности, играющие весьма важную
роль.
Внутренняя энергия U , подобно кинетической энергии в механике,
принадлежит к классу функций состояния (функций точки).
Выражаясь точнее, внутреннюю энергию в термодинамике следо
вало бы считать функцией парных состояний, так как, по определе
нию, при задании д ву х состояний однозначно устанавливается ее
приращ ение (см. п. 5). Что касается численной величины «внутренней
энергии в данном состоянии», то эта величина в термодинамике
может иметь лишь условный смысл. Действительно, для того чтобы
в рамках термодинамики приписать тому или иному состоянию системы
определенную энергию, надо выбрать условно некоторое состояние
за начальное, присвоить энергии в этом состоянии произвольное зна
чение (например, нуль) и тем самым однозначно установить измене
ние энергии при переходе из принятого начального в любое другое,
нас интересующее, состояние. Иначе говоря, «энергия в данном
состоянии» представляется величиной, устанавливаемой с точностью
до произвольной постоянной, которая служит предметом соглашения,
не имеющего физического смысла, хотя и удобного в некоторых
расчетах. Впрочем, во всех приложениях технической термодинамики
можно полностью обойтись знанием приращения энергии, которое
только и фигурирует в выражении первого начала.
То обстоятельство, что внутренняя энергия есть функция состо я
ния, в математическом отношении означает, что ее дифференциал
является полным дифференциалом. Не входя пока в рассмотрение,
какие именно независимые одна от другой переменные (параметры
состояния) должны быть введены в термодинамическое исследование,
обозначим их буквами хи х2, ...,
хп, так что
U= U{х^ х2у. ••» Яц)»
3*
36
Нервов начало термодинамики
[отд. 1
При изменении состояния тела все параметры, или хотя бы один из
ни х, претерпевают некоторые изменения. В общем случае будем
иметь:
M=£dx,+
TM tdXt+ ...+ »Ldx„.
(1.8)
В связи с независимостью второй производной от порядка д иф
ференцирования существует попарное равенство накрест взятых про
изводных от коэффициентов при dx:и d x 2,
dxni а именно:
д (dU\_ д (dU\ д(dU\__ д /дЦ\
дх2\дхх) дхх\дх2)’ дхъ\дхх) дхх\дхъ) И Т* Д*
В математическом анализе показывается, что удовлетворение
условиям, выражаемым последними формулами, является необходи
мым и достаточным признаком то го , что дифференциал функ
ции U принадлежит к числу полных дифференциалов. Э то обратное
утверждение используется для нахождения интегрирующего множителя
х2>•
х п ) к любому не являющемуся полным дифференциа
лом линейному дифференциальному выражению типа
Ххdxj-f -Х2dx2-} -••• “hХпdxny
где
Xjc= Xk(xu х2у
-*n)*
Как известно, интегрирующим множителем называется такая ф унк
ция переменных, после умножения на которую линейное дифферен
циальное выражение превращается в полный дифференциал. Э т о обсто я
тельство используется, например, в п . 16 второго отдела.
Важное свойство полного дифференциала состо ит в том, что при
его интегрировании вдоль определенного пути величина интеграла
зависит только от координат начальной и конечной точек и не зави
сит от самого пути. Если поэтому путь интегрирования имеет вид
замкнутой кривой, т . е . начальная и конечная точки совпадают, то
величина интеграла обращается в нуль. Применительно к внутренней
энергии это записывается так:
2
Jrf£/=t/a— Ut;
jdU=0.
Количество теплоты Q и работа L по своим математическим свой
ствам совершенно не походят на внутреннюю энергию. Эти величины
являются фун кц иям и процесса (функциями линии). Такие функции
определяются не заданием комбинации переменных, а заданием комби
нации изменений переменных. Говоря конкретнее, величины Q и L
зависят от вида процесса, приводящего термодинамическое тело из
заданного начального в заданное конечное состояние. Есл и бы Q и L
были функциями состояния, то всегда мы имели бы, что <brfQ = 0
ГЛ. II]
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
37
и ^ d L = 0 . Это предположение противоречит хотя бы факту суще
ствования тепловых двигателей, которые в результате повторения
круговых процессов производят работу за счет теплоты. Значит,
QФfC*l>
х п)>
LФf
Х2,...,
х п).
Представим себе, что теплота (или работа) подводится к телу
таким образом, что все параметры состояния кроме первого остаются
неизменными. Обозначая приращение этого первого параметра через d x u
мы, очевидно, можем написать:
dQ
dx3
dx3
= kidxu
где k x есть коэффициент, зависящий от характера элементарного
процесса. Таким же образом имеем:
dQ
—
/&2dx2
dxt= о
dxз=О
ит.д.
При одновременном изменении всех параметров на весьма малые вели
чины dxlf d x 23 ... , d x n суммарное количество теплоты (работы) опре
деляется путем сложения частных значений d Q { (или d L {). О тсю да
dQ = kxdx1-\ -k2dx2-\-
...
- j-kndxn.
(1.9)
Полученное выражение (1.9) не похоже на (1.8), так как в нем коэф
фициенты отнюдь не являются производными от Q по соответствую
щим параметрам, и потому накрест взятые производные от величин k
вовсе не равны друг другу. Это свидетельствует о том, что dQ и dL
не являются полными дифференциалами. Для напоминания об этом
иногда применяют специальную символику. Так например, примени
тельно к неполным дифференциалам пишу т:
#Z,, или 8Q, 8I , или
d 'Q , d 'L , тогда как для полного дифференциала от U сохраняют
обычную запись: d U . Мы различия в обозначениях делать не будем.
В связи со сказанным важно отметить, что dQ (подобно dL) нельзя
называть «приращением» количества теплоты (соответственно, « п р и
ращением» работы), а самой величине Q (или L) нельзя приписывать
смысла «содержания» или «запаса», как это представляется условно
допустимым применительно к энергии. Правильным словесным выра
жением является только такое: dQ (или dL) есть элементарное коли
чество подведенного тепла (или работы).
2
2
Нельзя также писать, что JdQ = Q2—Qi и §dL = L2—Lx.
i
i
Последние два интеграла не могут быть взяты до тех пор, пока не
будут заданы частные признаки процесса, происходящего между
38
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОГД. I
состояниями 1 и 2 , причем всякому новому варианту процесса будет
отвечать свое численное значение интеграла. Поэтому остается лишь
только обозначать операцию интегрирования следующим образом:
2
2
J*dQ=Qit2
иJ*
=
1
1
помня о том, что при совпадении пределов интегрирования 1 и 2
Qi,i=£ 0 и
^о*
Рекомендация избегать выражения «содержание тепла в теле» н а хо
дится в противоречии с общеупотребительной терминологией элемен
тарной физики и инженерного обихода. Представление о том, что
теплота есть нечто, заполняющее физическую материю, что она есть
«вещь», «субстанция», господствовало в старом, давно отвергнутом
учении о теплороде, который считался носителем теплоты и которому
приписывалась способность перераспределяться между телами без изме
нения общего его количества. Н о не только в силу исторических
причин приходится иногда слышать о то м, что «в теле содержится
столько-то тепла».
Представим себе, например, что энергетический обмен между о к ру
жающей средой и телом сводится исключительно к передаче тепла,
тогда как механическая работа не производится. Э т о может быть
в тех случая х, когда границы тела искусственно закреплены или когда
имеются в виду твердые или жидкие тела, объем которых практи
чески неизменен. Тогда в формуле (1.7а) следует положить d L — О,
откуда
dQ—dU и Q1,o= U2—U1.
Мы видим, что в данном частном случае количество подведенной
к телу теплоты равно приращению внутренней энергии, т . е. является
однозначной функцией дву х крайних состояний тела. Э т о может дать
повод для истолкования процесса подвода тепла к телу как процесса
увеличения «запаса тепла» в нем, а процесса отнятия тепла от тела
как процесса расходования «запаса тепла». При таком понимании
дела внутреннюю энергию U можно было бы принять за «теплосодер
жание» тела в данном состоянии. Однако подобное наименование не
имеет ни точного смысла, ни предполагаемой общности. Действительно,
мы уже отметили, что внутренняя энергия в данном состоянии опре
деляется лишь с точностью до произвольной постоянной. Сл едова
тельно, «за пас тепла» в теле оказывается вовсе не фиксированным,
а требующим термодинамически не обоснованного соглашения.
Кроме то го , рассмотренный частный случай энергетического обмена
является не единственным, когда подведенное тепло оказывается ф унк
цией парных состояний. Мы увидим, в частности, что если к телу
подводится тепло при постоянном давлении (и, следовательно, при
ГЛ. II]
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
39
меняющемся объеме) или если оно подводится при поддержании те м
пературы на постоянном уровне, то Q , 2 также является функцией
от двух крайних состояний 1 и 2. Последнее будет верно вообще
во всех тех случаях, когда имеется в виду один единственный, ана
литически заданный переход из состояния 1 в состояние 2 . Разумеется,
каж дому конкретному переходу отвечает свой вид функции от парных
состояний, дающей количество теплоты Q 12. Поэтому, если уже при
менять название «теплосодержание», то для определенности нужно
оговаривать, какое именно теплосодержание имеется в виду; тепло
содержание при постоянном объеме, или при постоянном давлении,
или при постоянной температуре, или еще какое-либо иное тепло
содержание. Таким образом, говорить о содержании тепла в теле
безотносительно к условиям теплообмена представляется совершенно
бессмысленным. П о ск ол ьку в элементарной физике речь идет о кало
риметрии твердых и ж идких тел, вошедшее в историю представление
о «содержании тепла» может быть терпимо. Однако в термодинамике,
трактующей произвольные случаи энергетического обмена, такому
термину не должно быть места.
Сказанное о «содержании тепла» полностью относится и к работе.
Положив в формуле (I.7a) dQ = 0 , будем иметь:
AdL= —dU и ALh2=Ut—U2.
Таким образом, при отсутствии теплообмена между телом и о кру
жающей средой работа тела является функцией от крайних состояний,
притом внутренняя энергия U могла бы быть трактована как «со д ер
жание» или «запас» работы в теле. Однако и здесь, помимо указан
ного, существуют бесчисленные случаи, для которых работа выра
жается как функция от парных состояний. Следовательно, нам
пришлось бы иметь дело со столькими видами «запаса» работы,
сколько можно придумать подобных частных случаев. Э т о значит,
что понятие о «содержании» или «запасе» работы в обобщенном
смысле лишено всякой почвы.
8. Работа против распределенного по поверхности давления.
Примем, как это всегда делается в технической термодинамике, что
рабочее тело производит внешнюю механическую работу против р а с
пределенного по его поверхности давления со стороны окружающей
среды. Этому условию удовлетворяют газы, пары и жидкости.
Выделим элемент поверхности тела / и будем считать, что на него
действует изнутри равномерно распределенное давление р (абсолютное).
Если этот элемент переместится в нормальном направлении на отре
зок d n , то со ответствующая работа определится выражением:
dL= pfdn=pdQ,
(1.10)
где dQ — бесконечно малый объем, описываемый элементом поверх
ности при перемещении вдоль своей нормали. Величина этого объема
считается положительной, если перемещение поверхности происходит
40
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. I
по нормали, внешней по отношению к рабочему телу. Заметим, что
р имеет размерность работы, отнесенной к единице описанного объема,
что не противоречит первичному определению давления как отноше
ния силы к поверхности ее приложения.
В дальнейшем нас будут интересовать только два случая работы:
работа тела, находящегося под равномерно распределенным внешним
давлением, и работа при таком неравномерно распределенном давле
нии, которое свойственно потоку газа (или жидкости) в закрытых
ка на ла х. В обоих случаях мы не будем учитывать работы объемных
сил (сил тяжести).
1. При давлении, равномерно распределенном по всей замкнутой
поверхности тела F , формула (1.10) принимает вид:
з
dL= j pdQ=pf dQ=pdV,
Llii = fpdV,
(1.11)
F
F
1
где d V — приращение объема тела V , считаемое положительным при
расширении тела и отрицательным при его сжатии.
В общем случае давление может произвольным образом меняться
при изменении объема, что и показано на рис. 2 . Очевидно, элемен
тарная работа d L изображается заштри
хованной площадкой, а вся работа
Z,1>2— площадью а12Ь. Другой функ
циональной связи между давлением и
объемом, например вдоль линии 7m2,
соответствует другая работа 1 1>2, опре
деляемая большей площадью a lm 2b.
Поэтому, как было уже сказано, нельзя
писать J* dL— Z,2—
а остается
лишь обозначать эту величину как Z,li2.
В обоих процессах, показанных на
рис. 2 , работа положительна, так как
имеет место увеличение объема тела.
Следует помнить, что при вычислении работы в формулы вводится
абсолютное давление. Соответственно этому получаемую работу
называют абсолютной работой. В ряде случаев бывает нужно знать
не всю величину абсолютной работы, а лишь ту ее часть, которая
может быть полезно использована в реальных условиях действия
машины. Рассмотрим, например, случай расширения газа в цилиндре
под поршнем. Если давление окружающей атмосферы на поршень
с внешней стороны исключено, то полезная работа, передаваемая через
кривошипный механизм, со впадает с абсолютной работой. Если же
поршень находится снаружи под атмосферным давлением, то а б с о
лютная работа расширения газа частично затрачивается на преодоле-
ГЛ. II]
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
41
ние противодавления, и лишь разность площади, заштрихованной на
рис. 2 , и площади прямоугольника с высотой, равной атмосфер
ному давлению, изображает работу , которая может быть полезно и с
пользована.
Диаграмма p - V , дающая графическое изображение работы, назы
вается рабочей диаграммой.
2. При течении газов в закрытых каналах устанавливается неравно
мерно распределенное поле давлений. Известно, однако, что при одно
мерном течении распределение давлений
по каждому поперечному сечению, пер
пендикулярному к элементарным струям,
равномерно.
Рассмотрим такое сечение потока газа
в канале, а также притекающую к нему
и удаляющуюся от него массы газа (рис. 3).
Притекающий к данному сечению поток
выполняет функцию поршня, который вытесняет заполняющую канал
сплошную среду. Соответствующая работа вытеснения непосредствен
но определяется формулой (1.10), в которой dQ имеет смысл объем
ного количества среды, проходящей сквозь выбранное поперечное
сечение за время dz.
В связи с этим перепишем (1.10) в виде
dL--
d&
dz
--P7^dz
обозначив ^ через V * 9 получим:
dL — pV*dz9 L
(1. 12)
Здесь V* [м*/сек] является мгновенным объемным расходом газа, рав
ным при стационарном режиме количеству кубических метров среды,
протекающей через сечение канала в одну секунду. Зависимость р
и V * от времени может быть в общем случае какой угодно, в связи
с чем работа вытеснения оказывается функцией процесса, развиваю
щегося в данном сечении канала. При условии стационарности тече
ния, когда в каждом сечении канала существует стабильный режим,
работа вытеснения становится функцией состояния, определяясь
попросту значениями р и V * в этом сечении и длительностью про
цесса:
L = pV*z[KrM]f
N=-^
-
= p l/* [кГМ'Сек],
(1*13)
где N есть работа в единицу времени (мощность). В дальнейшем мы
будем иметь дело только со стационарными случаями, в связи с чем
42
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. I
удобно относить работу вытеснения к единице объема или к единице
веса сред ы , протекающей через то или иное сечение. При отнесении
рассматриваемой работы к единице объема получаем:
1'= ^ - = Р1кГм;м*\.
(1. 14)
Таким образом, при условии стационарности каждый кубический метр
п отока, проходящий через сечение канала, производит р аботу , численно
равную р килограммометрам.
Для отнесения работы вытеснения к протекающему весу следует /'
разделить на удельный вес среды у
/=-
—= pv [кГм^Г].
(1.15)
Должно быть ясно, что величины к и г» в последней формуле пред
ставлены только в связи с пересчетом работы на единицу веса и по
своей роли не равноценны давлению.
Полученными формулами не исчерпывается вопрос о вычислении
работы потока. Как было сказано, в термодинамическом анализе
предусматривается противопо
ставление термодинамического
(рабочего) тела, которое долж
но быть ограничено замкнутой
поверхностью,
окружающей
среде.
В связи с этим, проведем
мысленно два поперечных се
чения потока 1—1 и 2—2 и
в качестве рабочего тела будем
рассматривать м ассу газа (или
жидкости), которая ограничена
этими сечениями и стенками
канала (рис. 4).
Внешняя работа выделенного рабочего тела складывается из
работы против сил, действующих со стороны стенок, и из суммарной
работы вытеснения в сечениях 1— 1 и 2 — 2 . Начнем с вычисления
этой последней.
В сечении 2— 2 выделенная из потока масса производит, согласно
(I. 13), в единицу времени работу вытеснения (мощность):
Nt= ptVv
Мощность притекающего к сечению 1— 1 потока равна ptV* . Рабочее
тело в этом сечении имеет ту же мощность, но с обратным знаком:
Ni^-PiK
43
ГЛ. II]
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Суммарная мощность вытеснения определяется как
+
(1.16)
Долж но быть ясно, что эта мощность совершенно не зависит от
количества газа (жидкости) в выделенном из потока объеме, а за
висит от секундного расхода среды в обоих поперечных сечениях
трубы. По это му вычисляемые ниже величины удельной работы отно
сятся не к 1 кГ или 1 М'3 выделенного элемента, а к 1 кГ или
1 лА пронизывающего то или иное сечение потока.
Отнесение суммарной работы вытеснения к одному кубическому
метру протекающей среды, т . е . использование формулы (I. 14), с о
гласно которой
/'= /'-f/'= р2—pt[кГммЦ,
возможно при одном существенном ограничении. Таким ограничением
служит несжимаемость текущей среды. Если среда сжимаема (соб
ственно газы), то 1 м8 проходит в разных сечениях канала за р а з
личные промежутки времени, и величины /' и /' непосредственно не
сопоставимы. Э то видно, конечно, и из (1.16), где объем V *
оказывается не равным I/*. В этом случае большое преимущество
имеет отнесение работы к 1 кГ> так как при условии стационарности
весовой расход G* [кГ/сек] во всех сечениях канала остается оди
наковым, а следовательно, 1 кГ протекает в равные промежутки
времени. Прибегая к формуле (I. 15), мы непосредственно получаем,
что
I=h+k=lhv*—Pivi\кГ*/*Л•
(1.17)
Небесполезно отметить, что применимость формулы ( I. 17) о гр а
ничивается не только условием стационарности, но также предпо
ложением об отсутствии убыли или пополнения текущей среды по
ходу ее движения. Если, например, в воздушный поток между сече
ниями 1— 1 и 2— 2 вводится твердое или жидкое горючее, образую
щее при сжигании газообразные продукты, присоединяющиеся к пер
воначальной массе потока, то длительность прохождения одного
килограмма в этих сечениях будет неодинаковой, и расчет пр и хо
дится вести не по удельной работе, а по мощностям, т. е . по фор
муле (I. 16).
П о причинам, указываемым далее, в качестве рабочего тела часто
бывает целесообразно рассматривать массу газа, заключенную между
стенками канала и двумя бесконечно близкими поперечными сече
ниями. Соответственно, в этом случае суммарная работа вытеснения
представляется также бесконечно малой величиной и при расчете на
1 кГ определяется как
dl=d (pv).
(I. 17а)
44
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. I
То обстоятельство, что дифференциал суммарной работы вытесне
ния является полным дифференциалом, объясняется, как следует из
сказанного, частным характером решаемой задачи, а именно, стацио
нарностью процесса. Расчленяя дифференциал в формуле (I. 17а) на
два слагаемых, имеем:
d(pv)= vdp-\ -pdv.
Величина v dp определяет рабо ту , производимую элементарным объемом
(за время, в течение которого через канал протекает 1 к Г газа),
если считать выделенную массу несжимаемой. Э то выражение может
быть прямо получено из (1.1 4) в результате умножения t = р на
удельный объе м, который считается постоянным. Работа v d p произ
водится против сил, действующих на выделенный элемент со стороны
остальной жидкости и не уравно
вешенных относительно его центра
инерции. Она обусловлена, как сле
дует из механики, либо сопротив
лением трения, либо изменением к и
нетической энергии элемента, либо
тем и другим одновременно. Второе
слагаемое, p d v , отвечает допол
нительной работе, которую переме
щающийся элемент должен совер
шать в связи со своей деформацией
под действием равномерно распре
деленного давления. Э то уравно
вешенное относительно центра инер
ции давление, изменяясь по хо ду
течения, заставляет элемент р а с
ширяться или сжиматься, как если бы деформировался неподвиж
ный элемент благодаря изменяемости поверхностного давления во
времени. Работа элемента газа против неуравновешенных сил и работа
деформации, каждая в отдельности, являются в координатах p - v
функциями процесса, как это показано на рис. 5 . Однако их сумма
представляет собой функцию парных состояний, так как
а
/ d{pv) = p2v2— plVl.
1
Обратимся теперь к работе против сил, действующих со стороны
стенок. Такими силами являются касательные силы трения и нормаль
ные силы гидромеханического давления. Р аботу против сил трения
временно исключим из рассмотрения. Работу против нормальных сил
обозначим через dlr и назовем т ехнической работой. Техническая
работа равна нулю во всех тех случаях, когда стенки канала непо
движны. Однако бывает и так, что направляющие поток стенки пере-
ГЛ. Itj
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
45
мещаются. Э т о , например, имеет место при течении пара или газа
через рабочее колесо турбины. Величина rf/T может быть произвольной,
так как силы давления потока на стенки зависят от очертания стенок
(например, от профиля и угла установки лопаток в рабочем колесе),
а направление и длина перемещений стенок устанавливаются по жел а
нию. В связи с этим в паровых и газовых турбинах техническая
работа имеет положительное значение, в осевых или центробежных
компрессорах — отрицательное, а при течении по трубам эта работа
обращается в нуль.
Полная внешняя работа выделенного из потока элемента, обязан
ная перемещению его границ, складывается, на основании сказанного,
из дву х частей (работа против сил трения исключена):
dl= d(pv)^dl1t
(1.18)
9.
Частные выражения закона сохранения энергии. Первый
случай — рабочее тело в течение процесса находится под равно
мерно распределенным давлением, и кинетическая энергия тела не
изменяется. К этому случаю практически относятся процессы в ц и
линдрах паровых машин и двигателей внутреннего сгорания, а также
многие другие процессы , совершаемые газообразными рабочими телами
в технических условиях. Соответствующее частное выражение закона
сохранения энергии является одной из форм первого начала термоди
намики в узком понимании этого термина.
И з (I. 7а) и (I. 11) получаем:
а
dQ= dU-\ -ApdV,
Qli2= U2- U 1-\ -AfpdV. (I. 19а)
1
Первое начало термодинамики можно представить и в удельных
величинах, согласно формуле (I. 7):
а
dq= du-\ -Apdv,
qu^= a2— ut-{-ЛJ pdv.
(I. 19)
l
Второй случай — рабочим телом является элемент стационар
ного потока сжимаемой жидкости (газа). Внешние воздействия на
элемент сводятся к производству работы благодаря перемещению
границ элемента и к теплопередаче. Трение в расчет не принимается.
Применяя к данным условиям формулу (I. 5) и используя (I. 18),
получаем уравнение сохранения энергии, отнесенное к одному кило
грамму протекающей жидкости:
dq= du+ Ad(pv)-\ -Ad-^ -\ -AdlT.
(1.20)
Сумму двух полных дифференциалов: du и Ad(pv) представля
ют в виде дифференциала некоторой новой функции состояния /,
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
46
[ОТД. 1
называемой энтальпией. Таким образом, нижеприводимая форму
ла (1. 2 1 ) является определением энтальпии:
di= du-\ -Ad(pv).
(I. 21)
Введя энтальпию в выражение (I. 20), получаем:
dq=di+Ad-f -+ Adl,.
(1.22)
Если в качестве рабочего тела принимается не бесконечно тонкий
элемент потока, а масса жидкости, ограниченная двумя произвольно
отдаленными поперечными сечениями 1 и 2 , то
2
2
w%— w<
Q\,2 =
h—h4" ^
------ §g----------- 0 * 2 2 a )
Здесь все члены выражены в удельных, отнесенных к 1 к Г , величи
на х. Н е составляет труда отнести формулы и к единице времени.
10.
Физическая трактовка энтальпии. Функция состояния, на
званная энтальпией, определена формулой (I. 2 1 ):
di = du -\ -Ad{pv).
Хотя эта функция была введена в связи с получением уравнения
сохранения энергии для потока, нужно сказать, что роль ее выходит
за пределы указанной частной задачи. В технической термодинамике
встречаются два физических толкования энтальпии.
1) В процессе, проходящем при постоянном давлении, энтальпия
тела имеет смысл «содержания тепла», определенного с точностью
до произвольной постоянной.
Действительно, выразим в формуле (I. 19) du через di соответ
ственно (I. 21). Тогда первое начало приобретает вид:
dq= di—Avdp.
(I. 23)
Последняя формула представляет собой второе выражение первого
начала для тела, находящегося под равномерным давлением.
Положив dp = 0 , имеем:
dq= di;
q1^= i%— iv
Таким образом, если давление неизменно, подведенное к телу тепло
равно приращению функции /. Поэтому, условившись о начале от
счета для функции / или о начале отсчета для внутренней энергии и
(величина A p v вполне определена по своему абсолютному значению),
можно понимать i как теплосодержание при постоянном давлении.
В соответствии с такой трактовкой за функцией / в технической
литературе закрепилось это название. Однако слова «при постоянном
давлении» для краткости обычно опускаются, и функцию называют
просто «теплосодержанием». Нет надобности возвращаться к тому,
ГЛ. II]
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
41
что этот краткий термин является в высшей степени неудачным.
Поэто му мы предпочтем называть функцию i энтальпией. В сущности
говоря, термин энтальпия также не может быть признан совершен
ным, ибо в переводе на русский язык (по гречески ev — в , дяАтгоа —
теплота) означает «втепление». Однако он имеет то преимущество,
что не допускает неправильного истолкования по видимому слово
образованию термина.
2) В потоке сплошной среды энтальпия имеет смысл, аналогичный
внутренней энергии в стандартных условиях термодинамики.
Под стандартными условиями мы понимаем такие, когда огра
ниченное зам кнут ой поверхностью рабочее тело противопоставляется
окружающей среде, причем последняя производит на тело те или
иные воздействия, вызывая соответствующие изменения внутренней
энергии.
П о внешнему виду формула (I. 22) аналогична формуле (I. 19).
В обеих фигурирует количество теплоты, подводимое фактически
извне, а также производимая фактически против внешних сил работа.
Однако поверхность стенки, предполагаемая формулой (I. 22) и у ч а
ствующая в теплопередаче и в совершении технической работы , не
замыкает собой рабочее тело. Имеются еще две другие по верхности
рабочего тела, которые являются внешними только условно и сквозь
которые распространяется в виде работы вытеснения часть воздей
ствий на поток, исходящих со стороны кольцевого элемента стенки.
Таким образом, условия, предполагаемые в формуле (I. 22), не
являются стандартными. При этом энтальпия играет роль, которая
принадлежит обычно внутренней энергии. Э то оказывается возможным
потому, что работа вытеснения A p v , прибавляемая к внутренней
энергии, представляет собой однозначную функцию состояния потока,
так как она определяется исключительно давлением и удельным
объемом в данном сечении.
Если при течении потока нет обмена теплом с окружающей сре
дой и не производится техническая работа, то из (1. 22) следует, что
сумма приращений энтальпии и кинетической энергии равна нулю.
Это обстоятельство наталкивает на понимание энтальпии как потен
циальной энергии потока. Бесспорно, такая механическая аналогия
удобна, хотя она и несколько чужда духу термодинамического анализа.
К затронутым вопросам мы вернемся в последнем отделе настоящего
курса.
11.
Закон Гесса. Как было указано во введении, одним из важ
нейших этапов в процессе становления закона сохранения энергии
было открытие петербургским академиком Г Г Гессом закона, но
сящего его имя. Этот закон, опубликованный в 1840 г. и обобщав
ший обширные экспериментальные исследования автора в области
химических реакций, очень скоро стал основным и широко приме
няемым законом термохимии, а затем занял важное место и в хими
ческой физике.
48
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. 1
Современная формулировка закона Гесса связывается с понятием
об эффекте р еа к ц и и . При протекании любой химической реакции
термодинамическая система
может, вообще
говоря, находиться
в теплообмене с окружающей средой и производить внешнюю работу
как механическую (в связи с расширением или сжатием), так и не
механическую (например, электрическую). В отличие от принятого
ранее соглашения в химической термодинамике считают количество
теплоты положительным, если теплота от системы отводится в о к р у
жающую среду. Эту отводимую теплоту назовем теплотой реакции
и обозначим через Q , так что Q = — Q . Таким образом, внешний
эффект реакции равен алгебраической сумме теплоты реакции и
работы, которую система произвела против окружающей среды. Если
из состава работы исключить все виды немеханической работы, то
2
эффект реакции будет равен сумме Q и AL = A jp d V . Если те-
1
плота реакции положительна, то последняя называется экзотермиче
ской, в противном случае, когда система поглощает теплоту из
окружающей среды, реакция — эндотермическая.
Согласно первому началу (1.19а) имеем:
2
Q+ AfpdV^Ui —U»
1
т . е . эффект реакции равен соответствующей убыли внутренней
энергии системы. По это му под эффектом реакции можно понимать
также величину U x — U 2, которую мы обозначим через U .
Закон Гесса сводится к утверждению, что эффект реакции не
зависит от промежуточных реакций и определяется исключи
тельно начальным и конечным состояниями системы, в которой
развивается данный химический процесс.
Разумеется, это утверждение представляет собой элементарное
следствие первого начала термодинамики, п оскольку последнее счи
тается предварительно установленным. Однако в историческом плане
закон Гесса не был непосредственно подготовлен предшествовав
шими общими идеями и явился большим шагом вперед на пути
к установлению закона сохранения энергии.
Измерение эффекта реакции производится с помощью калориметров,
обеспечивающих либо постоянство объема системы, либо постоянство давле
ния. При этом температура продуктов реакции приводится к первоначаль
ной температуре исходных веществ.
Если реакция происходит при постоянном объеме, то внешняя работа
равна нулю, и эффект реакции становится равным измеряемой при калори-
метрировании теплоте реакции при постоянном объеме Q v:
QV= U>
IJI. Ill
HF.PROR НАЧАЛО ТЕРМОДИНАМИКИ
40
Отсюда следует, что закон Гесса относится в равной степени как к эффек
там реакции, так и к тсплотам реакции при постоянном объеме.
В случае, когда реакция идет при постоянном давлении, первое начало
принимает вид:
Qp+ Ap{y*-Vi)= U-
Следовательно, теплота реакции при постояшюм давлении Q p может ока
заться больше пли меньше эффекта реакции U в зависимости от того, про
исходит ли в результате реакции сокращение или увеличение объема
системы. В конденсированных системах, т. е . системах, состоящих только из
твердых и жидких тел, поправка на работу против внешнего давления пре
небрежимо мала, так что Qp = Q v = }J, Однако при наличии в системе газо
образных веществ эта поправка может быть ощутимой.х) Но какова бы она
ни была, нам важно отмстить, что выражение U — Ap(V^ — Kj), равное Qp
при фиксированных начальном и конечном состояниях системы, не зависит
от промежуточных стадий процесса. Прибегая к функции, названной ранее
энтальпией или теплосодержанием при р = const, можно на основании урав
нения (1.23) тот же результат представить в другой форме:
QP=h-h =I
где / — убыль энтальпии системы в результате химической реакции. Подобно
внутренней энергии энтальпия является функцией состояния системы. Таким
образом, мы видим, что закон Гесса можно со всей строгостью распростра
нить и на теплоты реакции при постоянном давлении.
Закон Гесса применяется для проверки экспериментальных данных об
эффекте реакции U = Q v (или о величине Qp), если только возможно дан
ную реакцию осуществить в разных вариантах, минуя различные промежу
точные стадии, каждая из которых поддается опытному исследованию в кало
риметре. Еще большее значение закон Гесса получает в тех случаях, когда
требуется определить эффект реакции, непосредственно неосуществимой
или приводящей к значительным трудностям в постановке опыта. Так, на
пример, прямое и точное измерение эффекта реакции сгорания углерода С
в окись углерода СО невозможно по той причине, что наряду с СО всегда
образуется некоторое количество углекислоты С 0 2. М ежду тем, подобных
затруднений применительно к реакциям С + 02= С02 и С0 + -^ -02=С02
не возникает. Для последних опыт даст при р = 1 am = const и t = 18° С :2)
[С]+ {02>— {СО,} = 94050ккал;
{СО}+ ^ <Оа}—{СО,} = 67630 ккал.
!) Считая газообразные вещества подчиняющимися законам идеальных
газов, можно
к
ним
применять формулу: p V = 848vT (см. далее),
где V — число киломолей газа. При р = const и Т = const тогда получаем:
Ap(V2— Vx) =
-4"
^
Т = 1,986 (v2— vj) Т. Здесь v2—
—
увеличение
числа киломолей газообразной части системы в результате реакции. Напри
мер, в реакцииС0 + -^ -02= С02имеем:
=
1~,
v2= 1,
v2—vj=
—
~
Т
иАр(Ка—V\)= — 1,986-g -.
При Т = 293° абс. работа равна минус 292 к кал.
*) По «Справочнику машиностроителя», Машгиз, I, 1951.
4 Зак. 3543. В. С . Жуковский.
50
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. I
Символы исходных веществ и продуктов реакции, заключенные в скобки,
обозначают здесь соответствующие величины энтальпий, считая на 1 кило
моль, причем прямые скобки показывают, что вещество находится в твер
дом виде, а фигурные — что оно газообразно. Числа с правой стороны обо
значают теплоты сгорания при постоянном давлении. Вычитая почленно
второе уравнение из первого, получаем искомую теплоту сгорания С в СО :
[CJ+Yт
—
{СО} = 26420 ккал.
Другим примером, основанным на использовании тех же опытных данных,
служит определение теплоты реакции восстановления С 0 2 в окись углерода
с помощью древесного угля (углерода). Имеем:
[С]+{02>—{С02>= 94050ккал
± 2(СО)ip{02}± 2{С02}= =р135260ккал
[С]+{С02>—2{СО}=
—
41 210 ккал
Таким образом, данная реакция эндотермична: для ее проведения при по
стоянном давлении и комнатной температуре необходимо к системе подвести
извне 41 210 ккал.
Практические возможности
применения
закона Гесса расширяются
в связи с тем, что в справочной литературе имеются сведенные в таблицы
данные о теплот ах образования соединений. Теплотой образования соеди
нения называется теплота реакции образования этого соединения из хими
ческих элементов при нормальной температуре. Агрегатные состояния по
следних подразумеваются такими, какие наблюдаются при атмосферном дав
лении и комнатной температуре. Соответственно, закон Гесса можно форму
лировать таким образом:
Теплота реакции при нормальных условиях равна алгебраической
сумме теплот образования продуктов реакции минус алгебраическая
сумма теплот образования исходных веществ.
Для примера определим теплоту сгорания при р = const метана в угле
кислоту и жидкую воду, т. е . Qp в уравнении:
{СН4>+ 2{02>- {С02>- 2(Н20)= Qp.
Здесь круглыми скобками обозначено жидкое состояние. Из таблицы, нами
не воспроизводимой, находим теплоты образования продуктов реакции —
углекислоты и воды при 1 am и 18J С:
[С]+ {02>— {С02>= 94050ккал;
{Н2>+ у {02>- (Н20)= 68370ккал.
Для теплоты образования исходного соединения — метана
—
имеем:
[С]+ 2{Н2>- {СН4}= 17890 ккал.
Складываем почленно первые два уравнения, умножив предварительно вто
рое из них на два, и из полученной суммы вычитаем третье. В результате
находим:
{СН4>+ 2{03}—{С02>- 2 (Н20)= 212900 ккал.
Теплота реакции меняется вместе с температурой. С помощью закона
Гесса можно найти удобную формулу для выражения этой связи. Ради
определенности будем считать, что система помещена в калориметр по
стоянного объема. Представим себе, что исходные вещества находились при
температуре Т, а продукты
реакции приведены к температуре Г + б Г ,
где Ь Т — малая величина . Такой переход системы из начального в. конечное
состояние можно осуществить двумя способами.
гл. m]
КВАЗИСТАТИЧЕСКИЕ ПРО ЦЕССЫ . УРАВНЕНИЯ СОСТОЯНИЯ
51
Первый способ предусматривает два этапа: а) осуществление химиче
ской реакции с приведением продуктов реакции к первоначальной темпера
туре Г, при этом выделяется теплота реакции Q v; б) нагревание продуктов
реакции от температуры Т до Г + ojt, для чего требуется подвести к си
стеме теплоту С ^ЬТ ккал. В итоге система отдаст в окружающую среду
теплоту в количестве
(Qv —
*&71) ккал.
Второй способ предусматривает также два этапа: а) нагревание исход
ных веществ от Т до 7’+ ЬТ, для чего необходимо подвести к системе
к к а л ; б) осуществление химической реакции на уровне температуры
Т-\ -ЬТ . При этом выделяется теплота реакции
+
В итоге от си
стемы будет получено (Qv + oQv — C vlbT) ккал.
В обоих вариантах тепловые эффекты реакции должны быть одинако
выми, так что
Qv
ЬТ—Qv-J-oQv CviоT,
*>Qv — (^vi — ^^v2)^71
Деля почленно на ЬГ и переходя к бесконечно малым, получаем:
dQv
dT
CV1 Cv2»
Таким образом, производная от теплоты реакции при постоянном объеме по
температуре равна разности между полной теплоемкостью при постоянном
объеме исходных веществ и такой же теплоемкостью продуктов реакции.
Нетрудно видеть, что аналогичный закон справедлив и для теплоты реакции
при постоянном давлении.
ГЛАВА III
КВАЗИСТАТИЧЕСКИЕ ПРОЦЕССЫ. УРАВНЕНИЯ СОСТОЯНИЯ
12.
Термодинамическое равновесие. В термодинамическом ме
тоде анализа очень важное значение имеет представление о т ермо
динамическом равновесии.
Какое-либо тело считается находящимся в термодинамиче
ском равновесии с окружающей средой, если наложение на него
соответствующей изоляции от энергетических воздействий окру
жающей среды не вызывает никаких макроскопических изменений
состояния тела. Иными словами, термодинамическим равновесием
называется такое сопряжение тела с окружающей средой, при кото
ром сколь угодно долго сохраняется внутреннее макроскопическое
равновесие тела, если оно было уже предварительно установлено.
Напомним, что внутренним равновесием называется такое состояние
тела, к которому оно рано или поздно приходит после помещения
его в абсолютно изолирующую оболочку.
Поясним смысл сделанного определения на примерах. Представим
себе цилиндр, под поршнем которого находится газ, причем стенки
цилиндра и поршень теплонепроницаемы. Будем считать, что един
ственным энергетическим воздействием окружающей среды на газ
может быть работа силы, действующей на поршень (газ имеет
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
|ОГД. I
2
одну, механическую, степень свободы). Примем, далее, что газ оказы
вает на стенки равномерное давление и что внешнее давление на
поршень равно этому внутреннему давлению. При таких обстоятель
ствах нет повода для нарушения стабильного состояния газа — он
находится в термодинамическом равновесии с окружающей средой.
Если бы мы застопорили поршень и тем самым исключили возмож
ность и механического воздействия окружающей среды на газ,
подобно тому как с самого начала мы исключили тепловое воздей
ствие, то в газе никаких видимых изменений не произошло бы.
Разумеется, мы не касаемся здесь тех непрестанных, но скрытых от
непосредственного наблюдения микроструктурных изменений в газе,
которые идут при любых условиях его сопряжения с окружающей
средой, но которые при наличии внутреннего равновесия не сказы
ваются на статистически определяемых макроскопических свойствах.
Наш пример нуждается в одной оговорке. Термодинамическое
равновесие газа с окружающей средой, совпадающее в данном сл у
чае с понятием механического равновесия, может наблюдаться и при
неравенстве внутреннего и внешнего давлений. Для этого достаточно
соединить поршень нашего цилиндра штоком со вторым поршнем
другого диаметра, заставляя окружающую среду воздействовать на
этот последний (по принципу гидравлического пресса). Однако эта
оговорка не меняет толкования равновесия при наличии механиче
ской степени свободы , и потому мы впредь не будем ее учитывать.
Возьмем другой пример — тело, обладающее тепловой степенью
свободы. В отличие от предыдущего вообразим, что стенки цилиндра
хорошо проводят тепло, но поршень застопорен, так что объем газа
не может изменяться, т. е. механическое воздействие окружающей
среды исключено. Если газ в цилиндре имеет повсеместно о д и
наковую температуру и такую же температуру имеет окружающая
среда, то, как показывает опыт, налицо тепловое равновесие с о к ру
жающей сред ой, гарантирующее и внутреннее равновесие газа. П о
следнее сохранится, если мы в любой момент вообразим стенки ц и
линдра утерявшими теплопроводящие свойства. Единственная, с у щ е
ственная для некоторых дальнейших выводов, разница по сравнению
с первым примером заключается лишь в том, что термодинамическое
равновесие при наличии теплопроводных стенок может иметь место
не иначе как при взаимном равенстве внешней и внутренней темпе
ратур, тцгда как при подвижных стенках его можно искусственно
установить и в условиях неодинаковости внешнего и внутреннего
давлений.
Опытные наблюдения показывают, что указанные признаки равно
весия сохраняются и в тех случаях, когда рабочее тело имеет одно
временно две степени свободы — механическую и тепловую. Однако
при всех обстоятельствах следует иметь в виду следующее. Пред
ставим себе, что в газе, который заключен в цилиндре, происходит
химическая реакция, или радиоактивный распад, или какой-либо
ГЛ. Ill)
КВАЗИСТАТИЧЕСКИЕ ПРО ЦЕССЫ. УРАВНЕНИЯ СОСТОЯНИЯ
53
иной, независимый от воздействия внешней среды процесс превра
щения форм движения материи. Если в некоторый момент и было
установлено взаимное равенство внутренних и внешних значений
давления и температуры, то это еще не обусловливает термодина
мического равновесия системы газ — окружающая среда. Действи
тельно, наложение на газ механической и тепловой изоляции не может
непосредственно стабилизировать внутреннее состояние газа: процесс
в нем продолжается, выражаясь, в частности, в изменении давления
и температуры газа. Следовательно, внутреннее равновесие в газе
отсутствует, несмотря на такое исходное сопряжение газа с окру
жающей средой, которое, казалось бы, должно это равновесие обес
печивать. Заметим, однако, что после наложения изоляции неравно
весный процесс в газе будет итти по направлению установления
равновесного состояния и в конце концов прекратится. В дальнейшем
одинаковость внутренних и внешних значений давления и температуры
станет единственным условием существования как термодинамиче
ского, так и внутреннего равновесия. Напротив, их различие явится
достаточной причиной для возникновения процесса в термомеханиче
ском теле.
Принятое уточнение вопроса о равновесии подсказывает нам
прием рассмотрения таких случаев, когда внутри рабочего тела про
исходит, например, реакция горения. При этом изменения состояния
горючей смеси в цилиндре лишь отчасти зависят от условий сопря
жения с окружающей средой. В основном эти изменения определяются
внутренними химическими процессами. Для того чтобы задачу о т
нести к категории термодинамических, нужно взамен внутренних
процессов ввести такие фиктивные внешние воздействия на рабочее
тело, которые по своему влиянию на состояние тела равноценны
внутренним процессам. Т а к , вместо процесса горения в цилиндре
надлежит рассматривать такой воображаемый внешний теплопровод
к газовой смеси, который приводит к соответствующему росту ее
температуры. Э то т прием не дает, разумеется, полного соответствия
действительности, так как он не способен отразить фактических
изменений в химическом составе газов, заключенных в цилиндре,
однако в технической термодинамике он применяется весьма широко.
В заключение отметим, что в реальных процессах ни внутреннее,
ни термодинамическое равновесие во всей строгости не наблюдаются.
Вообразим, например, что во время работы автомобильного двигателя
мы мгновенно застопорили поршень и сделали все стенки цилиндра
теплонепроницаемыми, т . е . осуществили полную изоляцию газа от
окружающей среды. Останется ли газ в цилиндре в таком же со
стоянии, в котором он был в момент наложения изоляции? Конечно,
нет. В момент наложения изоляции температура газа была заведомо
неравномерной, не вполне одинаковыми были и давления, внутри
газового объема наблюдались видимые вихревые и струевые движе
ния. Такое положение не может сохраниться. Газ, предоставленный
54
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД, Г
самому себе, должен притти к состоянию, в котором видимые дви
жения погаснут, давление и температура будут постоянны, причем
никакие макрофизические свойства газа в дальнейшем не станут из
меняться.
Нуж н о, однако, сказать, что отсутствие термодинамического
равновесия, принципиально несовместимое с условиями внутреннего
равновесия, во многих случаях практически допускает принятие
этого последнего. Если, например, учесть, что основная масса газа
в цилиндре двигателя имеет равномерную температуру и только
в тонком газовом сло е, прилегающем к стенкам, проявляется влияние
внешней среды, что давление в пределах цилиндра, действительно,
почти равномерно и что кинетическая энергия видимых движений
газа может быть очень малой, то при этих условиях изменения со
стояния газа, происходящие вслед за мгновенным наложением изоля
ции на цилиндр, можно считать несущественными. Иными словами,
несмотря на неравновесные условия сопряжения рабочего тела
с окружающей средой, иногда не будет большой ошибкой считать,
что внутреннее состояние тела равновесно.
13.
Квазистатические процессы. Допустим, что под невесомым
поршнем вертикального цилиндра с теплонепроницаемыми стенками
заключен газ. Установим вне цилиндра какое-л ибо давление и выждем
наступления в газе внутреннего равновесия. При этом внутреннее
давление станет повсеместно одинаковым и равным давлению внеш
нему. Н арушим теперь термодинамическое равновесие и подвергнем
газ сжатию следующим образом. С помощью идеального приспо
собления, не требующего затраты работы, будем последовательно
надвигать очень малые гирьки на поршень. Нарушаемое в результате
каждой из операций внутреннее равновесие газа будет в связи с умень
шением объема цилиндра вновь достигаться на новом уровне давле
ния, так как возмущающему действию внешней среды противостоят
восстанавливающие равновесие молекулярные процессы в газе. Если
вес каждой из гирек можно считать бесконечно малым, внутреннее
давление в газе во всякий момент будет повсюду отличаться от д а
вления со стороны вдвигаемого поршня на пренебрежимо малую ве
личину. Уменьшение объема газа в цилиндре на конечную величину
потребует при описанных условиях бесконечно долгого периода
времени. Затрачиваемая на сжатие работа будет при этом равномерно
распределяться по всей массе газа, благодаря чему одна и та же
величина удельной работы будет характерна как для газа в целом,
так и для любого малого его элемента. Следовательно, для каждой
ступени сжатия будет верна формула dl = р d v , а для процесса
2
сжатия в целом— формула А, 2= J рdv.
1
Иными свойствами должно отличаться сжатие при движении
поршня с конечной скоростью. В этом случае процесс принципиально
гл. ш]
КВАЗИСТАТИЧЕСКИЕ ПРО ЦЕССЫ . УРАВНЕНИЯ СОСТОЯНИЯ
55
неосуществим без того.,
чтобы давление на газ со стороны поршня
более или менее резко превосходило давление, оказываемое газом на
неподвижные стенки цилиндра. Причина такого неравенства о бъ яс
няется тем, что давление газа есть результат отдачи импульсов м о
лекулами, ударяющимися о стенку. При вдвигании поршня в цилиндр
увеличиваются как частота удар о в , так и относительная скорость
молекул, а следовательно, и давление газа. Динамическая добавка
давления на поршень должна, по смыслу, быть тем большей, чем
больше отношение скорости поршня к характерной скорости мо
лекул. При соизмеримых значениях этих д ву х скоростей можно
ожидать чрезвычайно больших неоднородностей давления в процессе
сжатия газа. Для примера можно сослаться на картину сжатия при
вдвигании поршня таким быстрым рывком, который равнозначен
действию местного взрыва.
Из обрисованных д в у х картин сжатия газа поршнем видно, что
давление может сохраняться строго равномерным на каждой стадии
процесса при том только условии, что сжатие производится предельно
медленно. Именно в такой обстановке механического воздействия на
газ отдельные элементы газового объема неотличимы друг от друга
по своим свойствам, так как, с одной стороны, всем им свойственно
одинаковое давление, совпадающее с внешним давлением, и, с другой
стороны, изменения их объемов пропорциональны самим объемам
(иначе говоря — соответствующим массам), так что удельный объем
в каждом промежуточном состоянии газа повсеместно одинаков. При
быстром сжатии, даже если оно является всесторонним, в газе воз
никают неравномерности давлений и удельных объемов, тем более
резкие, чем больше скорость возмущающих равновесие внешних воз
действий по сравнению со скоростью распространения внутренних
упругих деформаций. При этом самый вопрос о величине мгновен
ного давления внутри газа теряет определенность. Правда, предста
вляется допустимым воображаемым образом разбить газ на много
малых частей, «подтел», в пределах которых отклонения параметров
состояния от соответствующих им средних значений были бы пре
небрежимо малы. Однако при этом количественный анализ повеления
всего газа не может уж е ограничиться средствами термодинамики,
игнорирующей скорость изменения процессов во времени и отстра
няющейся от рассмотрения внутреннего механизма развития физи
ческих явлений. В частности, если для каждого из упомянутых
«подтел» и применима формула d l = p d v (с учетом местного давле
ния), то для всего термодинамического тела она уже неприюдна.
Взамен нее приходится прибегать к формуле, дающей работу по
величине внешней силы и по пути, пройденному соответствующим
элементом поверхности тела.
Подобное же положение вещей имеет место применительно к теп
ловому воздействию окружающей среды на тело. В реальных у сл о
виях теплообмен происходит при конечных разностях температур и,
56
первой начало термодинамики
[отд. I
следовательно, при наличии неравномерности температурного ноля
в пределах термодинамического тела. Вид температурного поля и
внутренний механизм теплопередачи определяют собой скорость и
эффект возникающего процесса. Изменения состояния отдельных
частей термодинамического тела в этих условиях становятся зави
симыми не только от воздействия окружающей среды, но также от
состояния и поведения других частей того же тела, и вся задача
выходит за рамки термодинамики. Только в том предположении, что
тепловое воздействие вызывается бесконечно малой разностью тем
ператур, термодинамический метод анализа приводит к законченному
количественному результату. Такое предположение в свою очередь
означает, что для конечного изменения температуры рабочего тела,
пространственно равномерной на каждой стадии процесса, необхо
димо располагать в окружающей среде бесконечно большим набором
тел, отличающихся по температуре на бесконечно малые величины,
и эти тела последовательно приводить в контакт с рабочим телом.
Но в этом случае, реализуемом со всей строгостью только в нашем
воображении, длительность конечного изменения состояния рабочего
тела должна быть бесконечной.
Проц ессы взаимодействия между термодинамическим телом и
окружающей средой, которые можно рассматривать в виде последо
вательности термодинамически равновесных состояний, мы будем на
зывать квазистатичесними (почти статическими) процессами взаимо
действия. Реальные процессы взаимодействия являются в большей
или меньшей степени нестатическими. Чем медленнее развивается
реальный процесс, тем ближе он к квазистатическому.])
Представление о квазистатичности процесса взаимодействия, являясь
только приближенным, конечно, содержит внутренние противоречия.
В самом деле, по определению, всякое промежуточное состояние
совокупности тел должно быть равновесным. Между тем, переход из
данного промежуточного состояния к отличному от него смежному
может произойти только благодаря отсутствию равновесия внутри
совокупности. Опыт и теоретический анализ показывают, однако, что
многие действительные процессы взаимодействия могут быть с у д о
влетворительной точностью описаны формулами, выведенными приме
нительно к весьма малым смещениям из равновесия. Более то го , п о
нятие квазистатичности взаимодействия между телом и окружающей
средой может быть сужено до понятия внутренней, индивидуальной
квазистатичности процесса (в самом теле). Оказывается, что мгно
венные состояния рабочего тела часто бывают близки к внутренне
равновесным, даже если условия термодинамического равновесия между
О Мы оставляем здесь в стороне специальные случаи, когда в теле воз
никают внутренние эффекты, затормаживающие наступление равновесия.
В таких случаях очень медленное развитие процесса нс является гарантией
прохождения телом равновесных состояний.
ГЛ. Ill]
KBA3HG ГАТИЧЕСКИЕ П РОЦ ЕССЫ . УРАВНЕНИЯ СОСТОЯНИЯ
57
телом и окружающей средой нарушены и процесс идет с конечной
скоростью. Поэтому представление о квазистатичности имеет громад
ное практическое значение. К сожалению, простого и универсального
критерия для предварительной оценки меры нестатичности не с у
ществует. В конечном счете этот вопрос решается только опытным
путем.
Во всем дальнейшем изложении будут рассматриваться исключи
тельно квазистатические процессы, если только не будет сделано с о
ответствующей оговорки.
14.
Термические параметры состояния. Для описания состояния
тела может быть привлечено множество самых разнородных парамет
ров. Однако из этого множества параметров для термодинамического
анализа в каждом конкретном случае выделяется небольшая группа
существенны х параметров, остальные же оставляются без внимания,
как не характерные для данного процесса. Выбор существенных пара
метров естественно связать с условиями энергетического взаимодей
ствия тела с окружающей средой, яснее говоря, с наличными степенями
свободы термодинамического тела. Как было сказано, мы будем д о
пускать две степени свободы — механическую и тепловую, причем
будем считать, что на поверхность тела
действует равномерно распределенное дав- р
ление.
Механическая степень свободы озна
чает возможность изменения объема тела
под действием разности внешнего и внут
реннего давлений. Легко видеть, что объем
тела и давление связаны при этом одно
значным образом. Действительно, если за
ставить тело, имеющее одну только ме
ханическую степень свободы, совершить
круговой процесс, то работа всего про
цесса должна быть равной нулю, как это вытекает из принципа
исключенного вечного двигателя. М еж ду тем, допустив неодно
значность связи между р и V (например, возможность д ву х разных
давлений при одном объеме), нельзя было бы получить, что 1 =
p d V = 0 . Таким образом, при наличии одной только механи
ческой степени свободы круговой процесс рабочего тела должен и зо
бражаться на диаграмме p - V отрезком кривой, который посл е
довательно проходится на встречных направлениях (рис. 6).
Полезно еще отметить, что в рассмотренном случае увеличению
давления должно соответствовать непременно уменьшение объема, и
наоборот. Действительно, увеличив внешнее давление по отношению
к его первоначальному равновесному значению и, тем самым, вызвав
сжатие тела, мы должны притти к новому состоянию равнове
сия тела с окружающей средой, т. е . к повышенному внутреннему
V
Рис. 6.
58
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. I
давлению, которое было бы равно новому внешнему давлению. Если
бы внутреннее давление при сжатии тела уменьшилось, то это привело
бы к неспособности тела восстанавливать равновесие на произвольном
уровне давления. П од воздействием бесконечно малого внешнего
импульса тело катастрофически стремилось бы сжаться, и ни
о какой сопротивляемости его приложенным извне силам не могло
бы быть речи.
Из сказанного видно, что существенными параметрами состояния
тела, имеющего только механическую степень свободы, являются
давление и объем. Впрфчем, можно заметить, что объем тела, взятый
сам по себе, не может еще служить критерием для оценки свойств
тела в данном состоянии. Действительно, представим себе, что изо
тропное, однородное тело (мы только такие тела имеем здесь в виду),
находящееся в равновесии или выполняющее квазистатический процесс,
разделено на несколько частей тонкими переборками, которые св о
бодно деформируются и пропускают теплоту. При этом, очевидно,
внутреннее равновесие не нарушается, если только мы отвлечемся от
возможных поверхностных явлений вблизи переборок. М еж ду тем,
величина V для каждой из частей получает при разделении тела с о
вершенно случайные значения, зависимые от произвольных размеров
той или иной части. Следовательно, для определения состояния тела
может быть применима лишь такая производная от V величина, кото
рая сохраняет одинаковое значение как для всего тела, так и для
любой его части. Этой производной величиной является удельный
объем ъ =
.
Итак, мы пришли к двум параметрам состояния: р иг/.
Для выбранного тела любой из них может рассматриваться как не
зависимый, поскольку они связаны друг с ApvroM однозначным образом.
Переходя к обсуждению состояния тела с одной тепловой степенью
свободы, мы можем констатировать, что теплопередача происходит
под действием разности внешней и внутренней температур, причем
внутренняя температура с необходимостью изменяется в сторону сбли
жения с внешней. Поэтому температура t получает значение нового
параметра состояния тела. J)
Если тело является термомеханическим, т . е . имеющим одновре
менно и механическую и тепловую степени свободы, то существен
ными параметрами состояния тела оказываются давление р , удельный
объем v и температура t. Э ти величины называются термическими
Э Температура при теплопередаче играет ту же роль, какую имеет давле
ние при совершении механической работы. Естественно поставить вопрос,
не существует ли специфического параметра состояния тела, который с не
обходимостью изменялся бы всякий раз, как тело всы пает в обмен тепла
с окружающей средой, подобно тому как при механической работе изменяется
удельный объем? Такой параметр действительно имеется и называется удель
ной энтропией. Поставленный вопрос решается вторым началом термодина
мики,
ГЛ. Ill I
КВАЗИСТАТИЧЕСКИЕ ПРОЦЕССЫ. УРАВНЕНИЯ СОСТОЯНИЯ
59
параметрами сост ояния. Ими на практике задаются первичные физи
ческие свойства, которые определяют собой состояние изотропного,
однородного термомеханического тела. Такое тело часто называют для
краткости простым телом.
Из трех термических параметров состояния независимыми служат
два параметра: либо v и ty либо put. Соответствующий третий
параметр является однозначной функцией от первых д ву х :
Р= Р(V, t);
v=v(p,t).
(1.24)
Последнее обстоятельство может быть иллюстрировано с помощью
принципа исключенного вечного двигателя. Заставим тело, обладаю
щее двумя степенями свободы , совершить
круговой процесс, в результате которого
происходит взаимное превращение некото
рого количества теплоты в работу. В диа
грамме p - v круговой процесс должен изо
бражаться какой-либо кольцевой, замыкаю
щейся линией (рис. 7). Заштрихованная пло
щадь, образованная замкнутой линией про
цесса,
пропорциональна итоговой работе
цикла /ц . Ясно, что давление в этих условиях
не может быть однозначной функцией только
от удельного объема. Оно зависит и от
удельного объема, и от температуры. Каждая из последних величин
устанавливается совершенно независимым друг от друга способом .
Когда они приходят к своим первоначальным значениям, состояние тела
во всех отношениях восстанавливается, в частности восстанавли
вается и давление.
15,
Термическое уравнение состояния. Наличие взаимосвязи
между термическими параметрами состояния простого тела, устанавли
ваемое формулами (I. 24), может быть выражено в виде уравнения
F(p,v,0=0.
(1.25)
Это уравнение называется термическим уравнением состояния.
Для каждого тела вид функции F ( p t v , t) определяется опытным
путем и лишь в редких случаях его удается вывести теоретически,
на основе микрофизических представлений. С математической точки
зрения, любые два из трех термических параметров состояния можно
выбрать за независимые переменные. 1)
Уравнение состояния определяет собой некоторую поверхность
в трехосной системе координат /?, v t t, называемой пространством
*) Принятие р и v в качестве независимых менее целесообразно, так
как при этом t не обязательно является их однозначной функцией. Например,
жидкая вода из-за известной аномалии ее плотности около 4° С может при
заданных р и v иметь две разные температуры. Разъяснение физического
преимущества комбинаций (р, t) и (v, t) выходит за рамки настоящего курса,
60
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. I
состояний. Все возможные равновесные состояния тела отображаются
на этой поверхности в виде отдельных точек. Построение и практи
ческое использование пространственных графиков сопряжены с не
которыми трудностями и лишены непосредственной наглядности. О т
этих недостатков свободны двумерные графики равновесных состо я
ний, сущность которых заключается в следующем: в пространстве
р , v , t (рис. 8) проводится ряд плоскостей, перпендикулярных к одной
из осей, например к оси /. Эти плоскости пересекаются с поверх
ностью F(p, vy f)= 0, об
разуя семейство линий, пред
ставляющих собой геометри
ческое место точек, в которых
один из параметров состояния,
в данном случае температура,
сохраняет одинаковое значе
ние. Совмещая все эти линии
в одной из секущих плоско
стей, мы получаем график, по
добный показанному на рис. 8 .
Каждая линия t = ti разделяет
плоскость на две области: в
верхней располагаются то чки,
имеющие температуру t > t4,
в нижней — точки, имеющие
температуру t < t4. Расстояние между двумя соседними линиями харак
теризует степень влияния изменения объема и давления на темпера
т уру. Если в качестве независимых параметров состояния приняты р и
t или v и /, то взамен приведенного графика удобнее прибегать
к изображению состояний в плоскостях р , t и соответственно v , t.
Имея в виду определение квазистатических процессов, мы можем
всякую линию на поверхности F (/?, v , t) — 0 понимать не только
как изображение совокупности раздельных состояний, но также как
картину развития соответственного п роцесса. Т ак например, любая
линия tss=ti показывает ход квазистатического процесса, при кото
ром температура тела сохраняет постоянное значение, равное t4.
По уравнению состояния можно судить об основных упругих и
термических свойствах тела. Представим себе, что тело находится
в равновесии. Изменим на очень малую величину один из параметров,
сохраняя искусственно за вторым первоначальное значение. Интенсив
ность соответствующего изменения третьего параметра будет, очевидно,
отражать характерные особенности данного тела, присущие ему в тех
или иных областях состояний. Так, (dvjdp)t характеризует скорость
изменения удельного объема с увеличением давления при постоянной
температуре, или сжимаемость тела; {dvjdt)p характеризует т ерм и
ческую расширяемость, т. е . скорость увеличения объема при на
гревании, если давление остается неизменным. Н аконец, {dpjdt)v ха-
ГЛ. III)
КRАЛИС I АТ И11ПСК11R ПРОЦЕСС 1.1. УРАВНЕНИЯ СОСТОЯНИЯ
рактеризует термическую упругост ь, или интенсивность нарастания
давления при увеличении температуры, если объем тела не изме
няется. J) Перечисленные частные производные называются т ерми
ческими коэффициентами тела.
Легко видеть, что термические коэффициенты не являются неза
висимыми: один из них может быть выражен как функция остальных.
В самом деле,
Отнесем эту формулу к такому изменению состояния, при котором
dp — 0. В этом случае отношение d vjdt будет представлять собой
частную производную (dvjdt)pi откуда
Выражение (1.26) может рассматриваться как термическое уравне
ние состояния в дифференциальном виде. Им часто пользуются для
вычисления коэффициента термической упругост и , который может быть
достаточно точно определен прямым экспериментальным путем только
для газообразных тел. В случае твердых или жидких (капельных) тел
сохранение постоянного объема во время опыта представляет большие
трудности. Э то видно хотя бы на примере ртути, давление которой
при нагревании в постоянном объеме на один градус возрастает от
1до46am.
Дл я придания термическим коэффициентам характера ф изических
пост оянных вводятся относительные величины :
коэффициент сжатия
Знак минус в выражении для коэффициента сжатия вводится для
т о го , чтобы последний имел положительное значение. В противном
случае он был бы отрицательным, так как с увеличением давления
1)
Нижние индексы обозначают параметр, который остается неизменным
при дифференцировании.
(1.26)
(1.27)
коэффициент термического расширения
(1.28)
коэффициент термической упругост и
(1.29)
62
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. I
при t — const объем всегда уменьшается. Индексы при v и р озна
чают, что производные отнесены к некоторому нормальному удель
ному объему и нормальному давлению. В выражении для 7 принято
относить объем v 0 к давлению в 760 мм Н g при соответствующей
температуре t. В выражении для ар обычно считают v Q для темпера
туры таяния льда (нуль градусов в практической шкале температуры)
при том или ином давлении. Аналогичный смысл имеет величина av.
Впрочем, в некоторых случаях приведение к нормальным условиям не
производится.
16. Единицы измерения термических параметров состояния.
Рассмотрим принятые единицы измерения параметров состояния. Удел ь
ный объем v измеряют в мР/кГ.. Вместо удельного объема часто
вводят обратную величину — удельный вес Т =
Размерность
выражается в кГ\л$.
Единицей давления служит 1 кГ/м2. Для практического пользо
вания эта единица не всегда достаточно удобна, так как является
очень малой величиной, поэтому давление часто выражают в кГ/см2.
Давление, равное 1 кГ/см2, называют одной технической (или мет
рической) атмосферой.
Очевидно,
1 am = 104 кГ/м:2.
Иногда давление измеряется высотой h вертикального столба
жидкости (ртути, воды, спирта и т . п .) . Взаимная связь между обоими
способами измерения устанавливается следующей зависимостью:
P= th,
где т — удельный вес жидкости.
Так например, эквивалентная 1 am высота водяного столба равна
(при 4° С)
h=Е =1000см=10мН20,
а высота ртутного столба (при 0° С )
h= 73,56 см= 735,6 мм Hg.
В физике за единицу давления принимают давление, соответствую
щее 760 мм H g, — физическую атмосферу (1 Ат). Легко видеть,
что 1Ат= 1,0332 ат= 10332кГ/м2.
В английских мерах единицей давления является фунт [дм 2, причем
100 фунт/дм2 ^ 7 am.
Применяемые в технике измерительные приборы (манометры, инди
каторы) показывают обычно разность давлений в месте измерения и
внешней атмосферы, т . е . так называемое рабочее давление. В зави
симости от того, положительна эта разность или отрицательна, мы
ГЛ. Ш]
КВАЗИСТАТИЧЁСКИЕ ПРОЦЕССЫ . УРАВНЕНИЯ СОСТОЯНИЯ
63
говорим об избыточном давлении или
разрежении
(вакуум).
Состояние тела определяется, очевидно, не этим рабочим давлением
pi ъб> величина которого в зависимости от атмосферных условий имеет
случайный характер, но абсолютным давлением р &, представляющим
собой сумму атмосферного и рабочего давления при избыточных дав
лениях и их разность — при разрежениях. х)
Единицей для измерения температуры служит градус м еж дун а
родной температурной шкалы. Согласно общесоюзному стандарту:
«1) Международная температурная шкала, принятая VIII Генераль
ной конференцией по мерам и весам в 1933 г . ,
является практиче
ским осуществлением термодинамической стоградусной температурной
шкалы, 2) у которой температура плавления льда и температура кипе
ния воды при нормальном атмосферном давлении обозначены соответ
ственно через 0° и 100°.
2) Международная температурная шкала основывается на системе
постоянных точно воспроизводимых температур равновесия (постоян
ных точек), которым присвоены численные значения. Для определения
промежуточных температур служат интерполяционные приборы, гр а
дуированные по этим постоянным точкам.
3) Температуры, измеряемые по международной шкале, обозна
чаются знаком °С (например, 960,5° С)» .3)
Помимо двух упомянутых в стандарте приняты еще четыре посто
янные точки:
точка кипения кислорода
—
182,97° С ,
точка кипения серы
+
444,60° С ,
точйа затвердевания серебра +
960,5°С ,
точка затвердевания золота + 1063,0° С .
Для целей интерполяции температуры стандарт предусматривает
применение эталонных термометров сопротивления и эталонной термо-
*) Часто абсолютное давление обозначается как ата, а избыточное дав
ление — ати. Таким образом, если давление измеряется в кГ/см2 числом /я,
пишут р = т (ата) и, соответственно, р = т (ати). Подобное соглашение
не является, однако, безупречным, ибо может дать повод к заключению, что
существуют две различные единицы для измерения давления: ата и ати.
В действительности же мы имеем лишь одну единицу: 1 am= 1 кГ/см2, но
производим отсчет от разных начальных точек — в одном случае от р = 0,
а в другом случае — от давления, равного атмосферному.
Поэтому более предпочтительным является применение подходящих ин
дексов при самом символе давления — букве р.
2) Термодинамическая
шкала основывается на специальном принципе,
сущность которого будет изложена в дальнейшем. Основной смысл его за
ключается в том, что определение температуры связывается не с какими-либо
случайными физическими свойствами тех или иных тел, а с некоторыми
универсальными их свойствами. Поэтому такая шкала температур называется
в термодинамике абсолютной.
8) Эту запись неверно произносить как «градус Цельсия». Здесь буква
С принадлежит русскому слову
«стоградусный» или латинскому слову
centum (сто).
Ivl
IFF.PROF. НАЧАЛО ТЕРМОДИНАМИКИ
ОГД. I
п ари , а выше точки затвердевания золота — монохроматического о п
тического пирометра. Установленные стандартом правила измерений
мы здесь опускаем.
Для практических температурных измерений существует множество
методов. Некоторые из них аналогичны интерполяционным методам
стандарта, но не согласованы с ним в деталях. Другие методы осно
вываются на использовании совершенно иных приборов, в стандартах
не упоминаемых: жидкостных и газовых термометров, радиационных
пирометров и т. п . *) Если необходима большая точность, все эти
«эмпирические температуры» путем сверки с эталонными приборами
приводятся к международной стоградусной шкале, т. е . в конечном
счете к термодинамической абсолютной температуре.
17.
Выражения первого начала в переменных v, t и р , /.
Имея в виду применения первого начала к простым телам, состояние
которых однозначно определяется любыми двумя из числа трех тер
мических параметров: /?, v , t , приведем некоторые частные выраже
ния, которые будут широко использованы в дальнейшем.
Выведем уравнения для и и для /, приняв в качестве независимых
переменных для первой величины t и v и для второй величины t и р
(выбор этих переменных удобен для дальнейших выкладок):
u= u{t, v);
i=i(t, v).
Имеем:
du= (w\
dv>
di= (w\dtJr(f)tdP- (*)
Легко показать, что производные (dujdt)v и (dijdt)pJ входящие
в (*), имеют смысл удельных теплоемкостей cv и ср .
Удельной теплоемкостью с 9 как известно, называется отношение
бесконечно малого количества теплоты, подведенной к телу, к соот
ветствующему приращению температуры, если это количество теплоты
отнесено к 1 кГ вещества:2)
с=\тШ
=
^-|
\Д//д*-»о
dtL
ккал
кГ град
(1.30)
!) Здесь полезно вспомнить способ построения шкалы Цельсия [°Ц]. Эта
шкала наносится в ртутных или спиртовых термометрах путем разделения
жидкостного столба между точками плавления льда и кипения воды на 100
равных частей (градусов), причем первая из точек принимается за нуль.
Вне указанного температурного интервала шаг полученной шкалы повто
ряется до таких температурных уровней, за которыми данный термометр
более непригоден. Ясно, что жидкостные термометры
изготовленные из
разных материалов и различными способами, могут давать совершенно несо
гласованные показания в шкале Цельсия. Последняя не удовлетворяет нас
и потому, что она ограничена пределами применимости жидкостных термо
метров.
2) Здесь не имеет принципиального значения, что удельную теплоемкость
относят также и к 1 молю или к 1м3, ибо к этим же количествам вещества
можно отнести все выражение первого начала.
ГЛ. Ill)
КВАЗИСТАТИЧЕСКИЕ ПРОЦЕССЫ. УРАВНЕНИЯ СОСТОЯНИЯ
65
Удельная теплоемкость не является физической константой, без
оговорочно характеризующей то или иное вещество, так как она может
принимать любые значения в зависимости от соотношения между
подводимым к телу теплом и производимой работой деформации. Э то
связано непосредственно с тем фактом, что dq не есть полный диф
ференциал. Поэтому каждому процессу, начинающемуся в заданном
состоянии, отвечает свое собственное значение теплоемкости. Если
в калориметрии ж идких и твердых тел с многозначностью теплоемкости
обычно не приходится считаться, то происходит это только потому,
что работа термического расширения указанных тел пренебрежимо
мала по сравнению с затрачиваемой теплотой. Вследствие этого их
объем может рассматриваться как величина, практически не изменяю
щаяся (d l = 0), так что условия нагревания (охлаждения) приобретают
специальный характер (dq=d u).
Применительно к газам или парам, которые деформируются
с чрезвычайной легкостью, теплоемкость получает конкретный смысл
только при указании на частные условия изменения состояния тела.
Т а к , изменению состояния при постоянном объеме соответствует
теплоемкость c = cv> а изменению состояния при постоянном да -
влении с = ср . Вернемся теперь к уравнениям ( * ) , отнеся первое из
них к процессу при постоянном объеме и второе — к процессу при
постоянном давлении:
приdv= 0
du= (J^^dt,
приdp= 0 di=
dt.
Применив к тем же условиям выражения первого начала
(I. 23), получаем:
приdv= 0
du= dq=c^dty\
приdp= Q di= dq= cpdt. J
Сравнивая (**) и (***) , находим, что
(1.19) и
(I. 31)
Одновременно, имея в виду, что u = u(t, v) и i = i(t, p), заключаем
о наличии зависимости указанных теплоемкостей от термического
состояния тела:
с®— fi(t, ®); Ср— /a(f, р)-
Вид функций Д и / 2 устанавливается на основании опытных данных.
Сочетая формулы (1.31) и ( *) , получаем:
du= cvdt+(^)tdv,
di= cpdt+ (j^ tdp
(1.32)
5 Зак. 3543. В. С . Жуковский.
66
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. I
и, подставляя последние в (1.19) и (1.23), находим:
dq= cvdt-\ -[(!£), + Ар\dv,
dq= cpdt+\(^)-Av\dp.
И з первого начала, представленного в виде формул (1.33), следует,
что только часть подводимого к телу тепла обусловливает изменение
температуры. Э т а част ь , называемая иногда свободной теплотой,
при постоянном объеме равна cv d t9 а при постоянном давлении — cp dt.
Друга я часть тепла не приводит к изменению температуры и потому
называется скрытой теплотой. Выражение
является
скрытой теплотой изменения объема, a
—
A v скрытой теплотой
изменения давления. В состав скрытой теплоты входит количество
теплоты, расходуемое на внутреннюю работу молекулярных сил, свя
занную с деформацией тела, и количество теплоты, превращаемое
в работу внешнюю. Ясно, что понятие о скрытой теплоте не должно
быть ограничено случаями, когда мы имеем дело с переходом из
одного агрегатного состояния в другое.
Вернемся к формулам (1.32). Эти формулы, служащие для выра
жения внутренней энергии и энтальпии через независимые термиче
ские параметры состояния, принадлежат к числу так называемых
калорических уравнений состояния. Как видим, для вычисления du
и di необходимо знать удельные теплоемкости cv и ср , а также величины
(du/dv)t и (di/dp)t. В дальнейшем на основе второго начала термоди
намики будет показано, что необходимое число опытных данных
можно еще более сократить, ограничившись знанием из опыта одной
из дву х теплоемкостей и термического уравнения состояния.
ОТДЕЛ ВТОРОЙ
ИДЕАЛЬНЫЕ ГАЗЫ
ГЛАВА I
ТЕРМИЧЕСКОЕ УРАВНЕНИЕ СОСТОЯНИЯ
ИДЕАЛЬНЫХ ГАЗОВ
1.
Экспериментальные основы. Термическое уравнение состояния
газов может быть найдено на основании сопоставления д ву х экспери
ментальных законов: закона Бойля и закона Гей-Л ю ссака.
Закон, открытый Бойлем в 1662 г . , заключается в следующем.
При сравнении между собой различных состояний, в которых газ
обладает одинаковой температурой, обнаружено, что два других
термических параметра состояния, р и v , не могут получать вполне
произвольных значений. Как показывает опыт, соотношение между
ними выражается формулой:
Эта формула носит название закона Бойля и означает, что в состоя
ниях, характеризующихся одинаковой температурой, отношение давле
ний равно обратному отношению удельных объемов.
Очень важно заметить, что для установления закона Бойля нет
необходимости измерять температуру, достаточно лишь располагать
способом фиксировать ее постоянство. В связи с этим буква t
может означать температуру, выраженную в совершенно произволь
ной практической шкале.
Закон Гей-Люссака (1802) выражает связь между параметром v
(или р) и специальным образом измеряемой температурой. В перво
начальном смысле этот закон сводится к следующему. Если темпе
ратура t измеряется в шкале Цельсия жидкостным термометром, то
при нагревании газа при постоянном давлении от нуля до /(°Ц) соо т
ветствующее приращение удельного объема (у —
пропорционально
числу гр адусов температуры:
при t = const
Таким образом ,
pv = fit).
(ИЛ)
V— v0—kt.
5*
68
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. II
Коэффициент пропорциональности k в свою очередь является произ
ведением из первоначального объема v 0 на число <хр ,
которое для
всех газов, как показывает опыт, практически одинаково и постоянно.
Таким образом,
v — v0= apv0t,
(II.2)
где ар — коэффициент термического расширения газа, определен
ный уравнением (1.28). Разница состоит лишь в том, что здесь
f
» т. е - Речь идет 0 среднем коэффициенте в преде-
*
VQ\t—iQ/p
лах от /0= 0 [°Ц] до /[°Щ . Однако поскольку среднее значение <хр
принимается не зависящим от верхней границы температурного интер
вала, коэффициенты ару определенные обоими способами, оказываются
тождественными.
Между давлением и температурой при постоянном объеме су щ е
ствует аналогичная зависимость:
p — p0= avp0t.
(Н.2а)
Приведенная трактовка закона Гей-Л ю ссака, обычная для курсов
общей физики, в термодинамике должна быть заменена другой трак
товкой. Шкала Цельсия, построенная с,помощ ью жидкостных термо
метров, мало удовлетворяет требованиям, предъявляемым к эталонной
шкале. Связывать свойства газов с таким эмпирическим способом
измерения температуры, который имеет только исторический интерес,
в настоящее время было бы неразумно. Поэтому закон Гей-Люссака
следует понимать прежде всего как способ построения рациональ
ной температурной шкалы на основе применения самого газа в каче
стве термометрического вещества.
Идея осуществления газового термометра может иметь смысл лишь
в том сл у чае , если термические свойства газа отличаются некоторыми
специальными особенностями, а именно, если доказано , что объем
газа при постоянном давлении или давление газа при постоянном
объеме изменяются всегда в одну сторону со степенью нагретости
газа. Доказательство этого и является первым элементом закона Гей-
Люссака. Отсутствие тривиальности в указанной однозначной связи меж
ду v (или р) и степенью нагретости видно на примере воды. При за
полнении термометра водою его показания не следовали бы всегда
в одну сторону за нагреванием, так как объем воды от точки таяния
льда до 4 ° Ц уменьшается и лишь затем монотонно увеличивается.
Применив на основании сказанного в качестве термометрического
вещества газ, следует условиться о построении температурной шкалы.
Температурная шкала строится при помощи линейной функции, и это
соглашение является вторым элементом закона Гей -Л ю ссак а. Поясним
нашу мысль, имея в виду газовый термометр постоянного давления.
Положим, что некоторое весовое количество газа вводят в резер
вуар, в котором давление можно, по желанию, привести к первона
ГЛ. I]
ТЕРМИЧЕСКОЕ УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНЫХ ГАЗОВ
69
чальному значению. Затем резервуар помешают последовательно
в тающий лед и пары воды (при атмосферном давлении) и измеряют
соответствующие объемы газа. Указанные температурные уровни по ме
чают цифрами 0 и 100, а им отвечающие удельные объемы — бук
вами v 0 и v m . О тсюда находят средний коэффициент термического
расширения газа * р:
~
_
_
^100—v0
р~
100v0 •
После этого принимается соглашение, что при любом другом объеме v
(если только р = const) температуре газа надлежит приписывать то
число градусов t, которое следует из формулы (II.2), образующей
линейную шкалу температуры:
у --Щ
_
хор
apv о
«'юо
(Н.З)
В газовом термометре постоянного объема температура, соответ
ственно, считается линейной функцией давления.
Следует отметить, что для определения температуры газовым термоме
тром вовсе не обязательно следовать Гей-Люссаку. Например, Дальтон пред
ложил логарифмическую
шкалу
температуры
соответственно формуле
In (vlv0) = $(t — 10). В этой формуле число $ можно определить так, чтобы для
тающего льда £0= 0° и Для кипящей воды t = 100°. Однако ни при одном
значении температуры, кроме как в этих двух реперных точках, обе шкалы
не совпадают друг с другом. В частности там, где по Гей-Люссаку
t=
—
273,16 (положение абсолютного нуля, как будет далее разъяснено), по
Дальтону получается t = — со . Подобная шкала обладает некоторыми досто
инствами, однако никаких шансов на распространение она не имеет в связи
с глубочайшим внедрением линейной шкалы в науку, технику и быт.
Как бы существенны ни были оба указанных аспекта закона Гей-
Л ю ссака, наиболее важным является третий, который заключается
в экспериментальном утверждении, что для всех газов существует
универсальное численное значение ар, совпадающее со значением a v .
П о современным данным
«,=«• = 0,003661= 5^ .
Таким образом , всякий газ, нагреваемый при неизменном давлении на
один гр адус, увеличивает свой объем на 1/273,16 величины объема,
который он занимал бы при нуле градусов и том же давлении. А н а
логичное положение можно сформулировать для газа, нагреваемого
при неизменном объеме.
Шкала газовых термометров, построенная вышеописанным обра
зом, называется стоградусной газовой шкалой температуры. Как будет
показано, число градусов в этой шкале совпадает с числом градусов
70
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. II
в международной стоградусной шкале (°С), ввиду чего для показа
ний газовых термометров мы примем также обозначение ° С .
Для дальнейших выкладок придадим закону Гей-Люссака другой
вид. Н а основании (Н.2) имеем:
откуда
1j____h _
_
v2__1 ^ 273,16 ___ 273,16+
v1..tx
“
273,16 + tx 9
273,16
Приписывая числу 273,16 смысл некоторого отрезка той же стогра
дусной шкалы, можно понимать сумму 273 ,1 6-} -/ как температуру,
отсчитываемую от нуля, смещенного на 273,16° ниже точки таяния
льда. Обозначая сумму 273,16-} -/ буквой Г, имеем:
273,16 + ./
(II.4)
иприр= const будемиметь:—=
5.
vi
п
Таким образом,
Т = ?(/>)•
(П.5)
Соответственно, из формулы (Н .2 а) получаем:
-
f=
(Н.5а)
Шкала газового термометра, получаемая путем смещения нуля от
точки таяния льда на 273,16° в направлении убывающих температур,
называется абсолютной газовой шкалой (или шкалой Кельвина),
а температура Г , в ней измеряемая, — абсолютной газовой темпе
ратурой (°абс. или °К).
В технической термодинамике принято считать нуль градусов
в абсолютной шкале на 273° абс. ниже нуля в стоградусной шкале,
так что
Г=/+273.
(11.4а)
Законы Бойля и Гей-Лю ссака обладают типичными свойствами
эмпирических формул: они удовлетворительно описывают реальные
соотношения лишь в известных областях, обширность которых зави
сит от назначаемой степени то чности. В большинстве технических
приложений термодинамики к газам точность формул Бойля и Гей-
Люссака оказывается совершенно достаточной.
Чрезвычайно важно отметить, что формулы Бойля и Гей-Л ю ссака
могут быть установлены чисто теоретическим путем, исходя из кине
тической теории газов. Для этого необходимо лишь положить, что
ГЛ. I]
ТЕРМИЧЕСКОЕ УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНЫХ ГАЗОВ
71
газ представляет собой совокупность упругих молекул, соударяю
щихся в результате хаотического движения, причем: 1 ) объем, зани
маемый молекулами, пренебрежимо мал по сравнению с объемом газа
и 2 ) силы взаимного притяжения между молекулами равны нулю.
Указанные структурные признаки систем, подчиняющихся законам
Бойля и Гей-Л ю ссака, отражают специфические особенности разре
женных газов, ибо вместе с увеличением объема возрастает среднее
расстояние между молекулами и падают силы взаимного притяжения.
Газы ,#строго подчиняющиеся законам Бойля и Гей-Люссака, на
зываются идеальными. И з сказанного вытекает, что реальные газы
приближаются к идеальным по мере уменьшения давления или у ве
личения объема. Относительно роли температуры можно сказать, что
снижение температуры неблагоприятно отзывается на точности обоих
законов. Э то связано с приближением к области сжижения, где
взаимодействие молекул становится чрезвычайно существенным. И з
табл. 1 (в конце книги) видно, что при атмосферном давлении тем
пературы сжижения таких газов, как кислород, азот, водород, лежат
гораздо ниже комнатной температуры.*) Поэтому даже при более
высоких давлениях эти газы мало отклоняются от идеальных, если
только не подвергаются глубокому охлаждению.
Таким образом, законы Бойля и Гей-Л ю ссака воспроизводят
реальные связи между термическими параметрами состояния газов
приближенно. Степень приближения увеличивается по мере разрежения
газов и возрастания их температуры.2) Более конкретные данные по
этому поводу приведены в четвертом отделе.
Интересно в заключение отметить, что первое кинетическое о б ъ
яснение закона Бойля с указанием на существенную роль объема,
занимаемого самими микрочастицами газа, было дано Д . Бернулли
в его «Гидродинамике» (1738). Однако Бернулли не рассматривал
вопрос о механизме молекулярного взаимодействия и, в частности,
игнорировал отталкивание частиц. Подлинное физическое обосно ва
ние кинетического взгляда на строение материи принадлежит М . В . Л о
моносову. Применительно к газам свои идеи Ломоносов изложил
в труде: «Опыт теории упругой силы воздуха» (1748), который вместе
с его другими замечательными исследованиями помещен в первом томе
«Новы х комментариев» Академии наук за 1749 г. Ломоносов предвос
хитил основное положение кинетической теории газов о хаотическом
движении частиц и их мгновенных соударениях, возникающих между
периодами свободного движения. Чтобы судить о соответствии взгля-
Ч Подобные газы долгое время считались вовсе несжижаемыми и полу
чили название постоянных газов. В настоящее время, разумеется, этот тер
мин потерял физический смысл.
2) Последняя тенденция не распространяется на возможные случаи,
когда в газе под влиянием особо высоких температур наступают изменения
химической структуры, как, например, разложение сложных молекул (диссо
циация).
72
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. И
дов Ломо носо ва современным представлениям, приводим выдержку из
упомянутого труда: «Отсюда ясно, что отдельные атомы воздуха
в нечувствительные промежутки времени сталкиваются с другими, с о
седними, в беспорядочной взаимности, когда одни находятся в сопри
косновении, другие отскакивают друг от друга и снова сталкиваются
с другими, более близкими, снова отскакивают, так что стремятся
рассыпаться во все стороны, постоянно отталкиваемые друг от друга
такими очень частыми взаимными ударами».
Ломоносов пришел к выводу, что «взаимодействие атомов о б
условлено только теплотой». !) Специально по поводу закона Бойля
Ломоносов доказал, что этот закон не может быть безусловно вер
ным и что «отношение упругостей воздуха должно отличаться от отно
шения плотностей при наибольшем его сжатии». «Таким образом, — как
пишет А . К . Тимирязев,2) — Ломоносов на основе своей теории пред
видел те самые отступления от закона Бойля-Мариотта, которые впо
следствии привели в полное недоумение физиков, не опиравшихся
в своих исследованиях столь глубоко на теорию, как это было у Л о
моносова. Как известно, эти мысли Ломоносова нашли свое полное
развитие в классической диссертации Ван-дер-Ваальса в 1872 г . , т . е .
через 127 лет после опубликования диссертации Л омоносова».
2.
Термическое уравнение состояния. Исходя из законов Бойля
и Гей-Л ю ссака, можно найти уравнение состояния идеальных газов.
Разделим левую и правую стороны формулы (11.1) на Т:
? = Л(7),
и обе стороны формулы (II.5) умножим на р :
Полученные выражения совместимы др уг с другом при том только
условии, что величина p v jT не зависит ни от температуры, ни от
давления. Иными словами, величина p v/T есть физическая константа,
могущая зависеть только от отличительных особенностей газа, т . е .
от его химической структуры. Называя эту константу газовой по
стоянной R , имеем:
у-= /?,илиpv=RT.
(II.6)
Это уравнение, называемое именем Клапейрона, и есть искомое
термическое уравнение состояния идеальных газов. Оно дает зави
симость между термическими параметрами состояния для всех тех
случаев, когда газ находится в состоянии внутреннего равновесия.
*) Нужно учесть, что в X V III столетии не существовало различения по
нятий о теплоте и температуре.
2) Очерки по истории физики в России, Учпедгиз, 1949.
ГЛ. I]
ТЕРМИЧЕСКОЕ УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНЫХ ГАЗОВ
73
Газовая постоянная R является величиной, характерной для к аж
дого данного газа. Ее численное значение может быть найдено, если
для какого-либо состояния известны взаимно соответствующие зна
чения параметров р , v и Т . В таблицах физических величин обычно
относят различные физические свойства веществ к определенным нор
мальным условиям. В качестве нормальных условий в физике прини
мают температуру точки таяния льда (0° ' С ) и давление, равное
760 мм H g . Обозначая параметры, отнесенные к нормальным у сл о
виям, индексом 0 , находим:
п __Povo___ Ю332__ . 37,85
Г0“ 273Y0—То*
37 85
Так например, для азота То=1>25 кГ/м* и /?= ygy = 30,3.
мерность R = ^ r определяется формулой:
кГtjk3
я1*кГ
град *
или
кГ *м
кГ•град*
Раз-
Килограмм в числителе и килограмм в знаменателе, с формальной
точки зрения, могут быть сокращены. Однако делать этого не реко
мендуется, чтобы не утерять физического смысла R t о котором б у
дет сказано в п. 10.
Уравнение (II 6) является основной формой термического уравне
ния состояния. И з него можно получить две другие производные формы,
имеющие большое значение. Первая из них выводится непосредственно
путем замены удельного объема v отношением V /G :
pV=GRT.
(II. 7)
Это уравнение относится к произвольному количеству G килограм
мов.
Второй производной формой является уравнение, отнесенное к о д
ному киломолю. Э т о важнейшее уравнение, впервые данное Д . И . М е н
делеевым, следует из закона Авогадро, который утверждает, что
одинаковые объемные количества газов содержат в тождественных
термических состояниях одинаковые числа молекул. И з закона А в о
гадро вытекает правило: удельные веса газов, находящихся при оди
наковых температурах и давлениях, относятся как их молекулярные
веса [х, т. е.
п=
или ^
= н*®*-
Таким образом, при р = const, Т = const
pv = const.
(II. 8)
Вес вещества, равный (i килограммам, называется киломолем.
Произведение jtv =
определяет собой объем 1 кмоль. Формула (II.8)
74
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. II
означает, что в тождественных термических состояниях все газы
имеют одинаковый объем 1 кмоль, т. е .,
например, объем 32 к Г
кислорода равен объему 44 к Г углекислоты и т . п .
Объем киломоля в нормальных условиях может быть определен
по удельному объему любого газа в случае, когда последний доста
точно близок к идеальному состоянию. Если, например, известен удель
ный вес кислорода
=
1 ,429 кГ/м8, то тем самым определяется объем
моля при 0ЭС и 760лш Hg:
09
Vpfо= | 429 == 22,4 м?/кмоль.
Напротив, исходя из объема киломоля в нормальных условиях,
легко найти соответствующий удельный вес f 0, если только известны
химическая формула газа и, следовательно, его молекулярный вес:
16
Так например, удельный вес метана ( С Н 4) равен То= 224 = 0»716 кГ/м*.
Точное значение объема 1 кмоль идеальных газов:
Vji, о = 22 ,416 м?!кмоль.
Если теперь вместо произвольного количества килограммов О
ввести в формулу p V = G R T 1 кмоль, то получим:
PV» = vRTy
или, подставляя взаимно соответствующие ч и с л а :1)
10332.22 ,416 = R •273,16,
находим, что
у/?= 847,9 кГ•м}(кмоль •град.
В технических приложениях принято это число округлять до трех
знаков. Тогда
jjlR = 848 кГ •м!кмоль • град = 1,986 ккал/кмоль • град. (НЛО)
Величина jx/?, очевидно, совершенно не зависит от природы газа.
Поэтом у ей присвоено название универсальной газовой постоянной.
Вводя в уравнение состояния универсальную газовую постоянную,
получаем уравнение Менделеева:
р^ = 848Г,
(11-11)
рУ=Ш v7\
(II. 11а)
где v — число киломолей газа.
1) Вычисление производится по точным данным, так как подлежащая
определению величина принадлежит к числу констант общей физики.
ГЛ. I]
ТЕРМИЧЕСКОЕ УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНЫХ ГАЗОВ
75
Уравнения (11.11) и (11.11а) не содержат каких-либо признаков,
характерных для того или иного газа. Они имеют большое распро
странение в химической термодинамике. В технической термодинамике
предпочитают применять другую модификацию универсального урав
нения. состояния, относя его к «нормальному кубическому метру» —
некоторой специальной единице веса , которая является производной
от киломоля.
Нормальным кубическим метром (нм3) называется весовое к о
личество газа, содержащееся в 1 м3 при нормальных условиях, т . е .
при 0° С и 760 мм Hg. Таким образом,
1нмЪ= Ша кмоль = 227кГ
О1-12)
и , следовательно, число килограммов, отвечающее 1 нмъ, равно ч ис
ленному значению *f0. Подобно тому как 1 кмоль может занимать
какой угодно объем в зависимости от задаваемого термического с о
стояния, объем 1 нм8 является величиной неопределенной, пока не
фиксированы давление и температура газа. Применяя для объема, за
нимаемого 1 нмъ, символ v ' , имеем:
pv' =
Ш Т== 37,85 т-
(Н.13)
Отсюда, например, при р = 1,2 am и t — 1000° С объем 1 нмй
v'=
37,85 1 ^
=
4 ,0 2 мР/нм*
Ясно, что в такой расчет не могут входить какие-либо индивидуаль
ные характеристики газа, так как 1 нм3 есть не более, чем опреде
ленная доля киломоля. Разумеется, самый термин «нормальный куби
ческий метр» нельзя признать особенно удачным.
В заключение отметим, что газовая постоянная R может быть вы
числена не только из формулы ( II.6), но также из (11.10):
Я=
(11.10а)
В технических расчетах принято округлять молекулярные веса до ц е
лых чисел. Вследствие этого нормальные удельные веса и газовые
постоянные могут несколько отличаться от табличных данных. Однако
при пользовании логарифмической линейкой эти различия становятся
почти незаметными.
Примеры. 1
.
За время подачи компрессором сжатого воздуха в резер
вуар давление в нем повышается от нуля до 4 am (избыточных) и темпера
тура от 15 до 25° С . Объем резервуара 24 м\ Сколько килограммов воздуха
Подано компрессором? Барометрическое давление 750 мм Hg.
п _ (750•13,6+ 4•104)•24
U“
29,3 •298
750-13 ,6 .24
29,3 • 288
=
138—29= 109 кГх
76
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. II
2. Вентилятор имеет объемную производительность V * = 15000 мР/час
при температуре газов 700° С и давлении 735 мм Hg. Какова объемная произ
водительность в нормальных условиях, а также весовая производительность,
если для просасываемых газов (х = 30,2?
Имеем:
273рУ*
К°“
760 У
= 0,359
735-15 000
973
4070 м?/час.
Весовая производительность G * = То^о» где» согласно (II.9),
И»
30,2
То— 22.4 22,4
1,35 кГ/м3,
а * = 1,35•4070 = 5500 кГ/час.
Величину весовой производительности можно получить и иначе. Согласно
(11.13)
Т
Q7Q
У* 1^ПОП
vr= 37,85— = 37,85^ = 36,7м*!нм\ G* = —г =
=
4070 имение,
р
104
v'
36,7
'
Таким образом, весовая производительность в нмР/час численно равна при
веденной к нормальным условиям объемной производительности в м31час.
3.
Уравнение состояния газовых смесей. Под газовой смесью
мы будем подразумевать механическую смесь, в которой составляю
щие ее газы неизменно сохраняют свою химическую индивидуальность.
Н а основании опыта можно притти к следующим заключениям:
1) Формула Клапейрона применима для газовых смесей в такой же
мере, как и для чистых газов, если только в расчет вводится газовая
постоянная смеси /?т , зависящая от состава смеси:
pV = GRm7.
(11.14)
2) В смеси газов каждый отдельный газ подчиняется своему урав
нению состояния и притом та к, как будто остальных составных
частей не существует.
Для уяснения этого положения представим себе, что все компо
ненты кроме одной удалены из смеси при сохранении температуры
на постоянном уровне, например посредством химииеского поглоще
ния. В таком случае давление оставшегося газа окажется более низ
ким, чем общее давление смеси р . Э т о новое давление называют
парциальным (или частичным) давлением и обозначают индексом,
соответствующим данной компоненте. О чевид но, для выделенного
/-го газа уравнение состояния может быть представлено в таком
виде:
р{У=ОД{Т.
(11.15)
Мы утверждаем теперь, что это же уравнение остается для данного
газа справедливым и тогда, когда он находится в смеси с осталь
ными газами. Иначе говоря, всякий газ в смеси, занимая весь предо
ставленный ей объем, находится под тем парциальным давлением,
которое было бы ему свойственно при удалении из смеси всех прочих
газов.
ГЛ. I]
ТЕРМИЧЕСКОЕ УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНЫХ ГАЗОВ
77
3)
Давление газовой смеси равно сумме парциальных давлений
(закон Дальтона):
р=2л-
(п .16)
И схо д я из указанных экспериментальных фактов, легко установить
основные свойства газовых смесей. Просуммируем по всем компо
нентам уравнение (11.15):
у2л=гЦад.
Заменяем на основании (11.16) 2 P i через р :
pV=T '2l
Сопоставляя это уравнение с (11.14), находим, что
р
2 °<*<
УOfо
Отношение G J G показывает, какая часть от общего веса смеси при
ходится на долю данной компоненты. Э то отношение называется
весовым содержанием компоненты и обозначается через g 4. О чевид но,
2 g * = 1. Окончательно имеем:
/г*=2 «Л-
(п.17)
Так же легко получить формулу для определения парциальных
давлений. И з (11.15) и (11.14) находим, что
откуда
Pi= giW~P•
(ИЛ 8)
Пример. Воздух состоит, по весу, из 23,2% кислорода и 76,8% азота.
Каково парциальное давление обеих компонент в миллиметрах ртутного
столба при давлении воздуха, равном 760 мм Hg?
*о2= ^ = 26,52;
/?К2= ^
= 30.13;
*т = £02*02+ £n2* n2= °-232•26-52+ 0,768•30,13= 29.27;
Яо2 = 0,232
= 0,21р = 0,21.760 = 159,8 мм Hg;
рN2= 0 ,768р= 0,79р= 0,79•760=600,2ммHg.
Весьма часто состав газовой смеси характеризуется не весовыми,
а объемными содержаниями. Э то определение связано с понятием
о парциальных объемах компонент.
78
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. 11
Мы отметили, что при удалении из смеси всех газов, кроме любого
одного, оставшийся газ находится при давлении, меньшем общего
давления смеси р . Если при неизменной температуре подвергнуть
оставшийся газ сжатию , то давление его может быть произвольным
образом увеличено. Тот объем газа, при котором достигается общее
давление р , называется парциальным объемом V t
(рис. 9). Согласно закону Бойля,
vt=v&.
*
р
у.
Отношение - у = г{ называется объемным содер
жанием, причем 2 ri — J •Итак,
вследствие чего на основании (11,18):
=
(II. 19)
К представлению о парциальном объеме можно подойти несколько
иначе. Допустим, что из нескольких взаимно индиферентных газов
надо образовать смесь при давлении р и температуре Т. Для этого
можно поместить каждую из требуемых компонент в отдельный сосуд
при тех же значениях р и Г , затем эти сосуды приложить друг
к другу и убрать разделяющие их стенки. Благодаря диффузии газы
перемешиваются без изменения давления и температуры. Пропорция
полученной смеси будет определяться объемами газов до диффузии.
Эти первоначальные объемы и называются парциальными, а их о тно
шения ко всему объему смеси — объемными содержаниями.
Формула (11.19) применяется для пересчета весовых содержаний
на объемные. Однако ее использование в обратном направлении з а
труднительно, так как величина R m определяется непосредственно
только через искомые (в данном случае весовые содержания g t).
Поэтому для перехода от объемных содержаний к весовым пред
почтительнее избрать другой путь.
Введем представление о кажущемся молекулярном весе смеси
который определим формулой
V'vi^m s== 848,
аналогичной формуле (11.10). Название «кажущийся молекулярный
вес» (или эквивалентный молекулярный вес) уместно в связи с тем,
что величина
имеет лишь формальный смысл, поскольку смесь
не является химической индивидуальностью, и молекулы смеси не
существует.
Смесь
р,КТ
L-й газ
Pi.к т
□i -й газ
P.Vl.T
Рис. 9.
ГЛ. I)
ТЕРМИЧЕСКОЕ УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНЫХ ГАЗОВ
79
Итак, по определению,
Н о для любого газа произведение из молекулярного веса ц* на газо
вую постоянную
равно 848, откуда
== Noп == F4ТГ'*
£Noт =
si
Отсюда прежде всего находим второй, иногда более удобный способ
вычисления jiw. Действительно, в результате почленного суммиро
вания
Рт2 Si= 2 гNo<
и, следовательно,
=
(11. 20)
Таким образом , для вычисления кажущегося молекулярного веса
достаточно знать объемные содержания и молекулярные веса отдель
ных компонент. Н о в таком случае пересчет объемных содержаний
на весовые легко осуществляется с помощью формулы
*=■ <•<£.
(Н .21)
Н уж н о заметить, что все соотношения, данные здесь для газовых
смесей, действительны со всей строгостью , если речь идет об идеаль
ных га зах . В противном случае закон Дальтона становится неточным,
и уже это обстоятельство делает все выкладки приближенными.
П римеры. 1. Анализ топочных газов показал объемное содержание:
углекислоты 12,2%, кислорода 7,1% и окиси углерода 0,4%. Определить
состав смеси по весовым содержаниям компонент.
Поскольку четвертой компонентой является азот, содержание которого
находится как дополнение до единицы (rN2 = 0,803), кажущийся молекулярный
вес смеси согласно (II. 20) равен:
= 0,122 •44 + 0,071 •32 + 0,004 .28 + 0,803 •28 = 30,28.
Поэтому из (II. 21) имеем:
gCOi=0,122-^1 = 0.177= 17,7%;
g0i= 0,071^
= 0,075= 7,5%;
gc0 - 0.004щ
= 0,0037 = 0 ,37%;
= 0,803 ^
= 0,744 = 74,4%.
2. Найти закон изменения состава воздуха с высотой над уровнем земли
в стратосфере, предполагая, что температура стратосферы повсеместно оди
накова и воздушные течения в ней отсутствуют. Вычислить состав воздуха
на высоте Я =20км, если на высоте HQ=12км: г0а= rQ=0,21;rNa=
=
1—r0=0,79иt= —60°С= const.
80
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. I!
Для решения задачи считаем, что парциальные давления изменяются по
тому же закону, какой относится к общему барометрическому давлению.
Имеем:dpt= —уdH,гдеу=
-J^p.
dpi = _____ L
Pi
тугdH;m
Я*?
PiO
я-я0
Я-Я0.
я-я0
Л=Ло*
= Ач>* 848Г
__
РОд _
/*02
1
_
_ ______________________ 1
___ ______ ______ _____
Г02_ Р
~
Р0*+РП2
l+(P*i) e- W (^2-^02)
Р02
2'О
JJ-_д
I,1—/р^848Т ^02"^N2)
^
Го
Для Н =20 км получаем:
Г02 =
1
8000 ,
1 I 0’79 848-213 *4
^ 0,21е
= 0,182 = 18,2%;
rNa= 0,818 = 81,8%.
Отсюда видим, что на больших высотах содержание кислорода в воздухе
уменьшается. Впрочем, при высотных полетах еще большее значение имеет
весьма резкое снижение барометрического
давления (при Н = 20 км
р ^ 10“2 am).
4.
Термические коэффициенты. На основании термического
уравнения состояния идеальных газов можно сделать заключение об
их основных упругих и термических свойствах, как было установлено
в п. 14 первого отдела.
Найдем выражение для коэффициента сжатия, согласно формуле
(I. 27):
*— £(&•
D7*
Таккакv=
—
,то
Р
(др\
___R T
Vдр)т * "
р2•
RT
Кроме того, г;0 = — , где р0— нормальное давление. Производя под
становку, находим:
v ___Ро R Г _____Ро
x~RTp* ~ р2’
Таким образом , относительный коэффициент сжатия газов оказы
вается независящим от температуры и обратно пропорциональным
квадрату давления. Э то означает, что объем газа, отнесенный к не
которой фиксированной начальной величине, сокращается при изо-
ГЛ. I]
ТЕРМИЧЕСКОЕ УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНЫХ ГАЗОВ
81
термическом росте давления тем менее резко, чем выше давление:
если при низких давлениях газы легко подвергаются сжатию, то при
больших давлениях их дальнейшее сжатие требует чрезвычайно зна
чительного повышения давления. В пределе при сверхвысоких д а
влениях газы должны становиться столь же несжимаемыми, как и
жидкости или твердые тела.
При отнесении коэффициента сжатия к текущему объему мы
получаем:
__
_
_
__1_/dv\ = J_
v\др)“р’
что вновь указывает на уменьшение сжимаемости газа при росте
давления.
Аналогичным образом находится коэффициент термического р а с
ширения ар . Так как
=~
и
=
т о н а основании (1.28):
= } _(dv\
/?
1_____1 _
вр ~ v0\дт)р /?7Ь р ~ У’о
273'
Этот результат уже известен из закона Гей-Люссака.
Коэффициент термического расширения, отнесенный к текущему
объему, определяется как
\_/0у \
1
v\7njp~Т'
Наконец, коэффициент термической упругости вследствие того,
что
и Ро—
> выражается, в соответствии с (I. 28а),
таким образом:
а—JL(?Е\ —JL
__1_1
*
Ро\dTjv~ /?7’о » ~
Г0— 273-
Коэффициент термической упругости, представленный в долях от
текущего давления, равен
J (д£\
1
Р\дти Т'
Таким образом, коэффициент термической упругости газов равен
коэффициенту термического расширения.
Разумее тся , все приведенные здесь формулы справедливы по*
стольку, поскольку уравнение p v = R T применимо для описания
равновесных состояний газов.
6 Зак. 3543. В. С . Жуковский.
82
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. 11
ГЛАВА II
ВНУТРЕННЯЯ ЭНЕРГИЯ, ЭНТАЛЬПИЯ И ТЕПЛОЕМКОСТИ
ИДЕАЛЬНЫХ ГАЗОВ
б.
Внутренняя энергия. Частные свойства внутренней энергии и
энтальпии газов могут быть найдены непосредственно из опыта.
Первый опыт, выясняющий свойства внутренней энергии газов,
был произведен Гей-Люссаком в 1806 г. В более совершенном виде
этот опыт был повторен позднее Джоулем. Джоуль поместил в водя
ной калориметр два железных цилиндра,
соединенных краником (рис. 10). Предвари
тельно, при закрытом кранике, в первый ци
линдр нагнетался газ до давления порядка
20 am, а из второго откачивался воздух.
Посл е измерения начальной температуры ка
лориметра краник открывался, и спустя не
которое время вновь измерялась температура
калориметра. В результате оказывалось, что
конечная температура совпадает или почти
совпадает с первоначальной.
Истолкование описанного опыта Джоуля не представляет затруд
нений. При своем расширении газ никакой внешней работы не про
изводит, поскольку за внешнюю среду принимается металл и окру
жающая его вода. J) Вместе с тем, как показывает опыт, в итоге
перетекания не наблюдается получения или отдачи теплоты газом.
Следовательно, на основании первого начала (I. 6):
Q=W-\-AL,
где 1 = 0 и Q = 0, заключаем, что Д£/= 0, т. е. внутренняя энер
гия газа имеет в конце расширения такую же величину, какой харак
теризовалось начальное состояние. М ежду тем объем газа, как и его
давление, благодаря расширению изменились резким образом. О с т а
лась неизменной только температура. Следовательно, приняв за не
зависимые параметры температуру и объем или температуру и дав
ление, приходим к выводу, что внутренняя энергия идеального
газа может зависеть только от его температуры.
Этот замечательный вывод был проверен Джоулем на несколько
видоизмененной установке. Вместо одного было использовано три
калориметра, заключавших порознь оба цилиндра и трубку с кра-
*) Было бы ошибочно судить о наличии внешней работы на основании
формулы (i.ll): dL = pdV, считая dV за приращение объема газа, находив
шегося вначале в сжатом состоянии. Эта формула верна для случаев ква-
зистатического расширения, тогда как расширение газа в пустоту является
резко нестатическим процессом, при котором не может быть и речи о по
всеместной равномерности давления в каждый момент процесса.
Рис. 10.
Ьт. и]
ВНУТРЕННЯЯ ЭНЕРГИЯ, ЭНТАЛЬПИЯ И ТЕПЛОЕМКОСТИ
Ь‘6
ником. В начале опыта во всех трех калориметрах устанавливалась
одинаковая температура. В конце опыта калориметры принимали
разную температуру, а именно: тот, в котором сначала находился
сжатый газ, оказывался при температуре несколько меньшей, чем
первоначальная, остальные два — при температуре несколько большей,
чем первоначальная. Однако сумма количеств теплоты, полученной и о т
данной газом окружающей среде, в этом случае также практически рав
нялась нулю, что вполне подтверждало первоначальное заключение
о независимости внутренней энергии газа от занимаемого им объема
(или от давления).
Результаты этих опытов позволяют внести ясность в явления,
сопровождающие процесс протекания газа из одного цилиндра
в другой. Кинетическая энергия струек газа, образующихся при пере
текании, возникает за счет уменьшения внутренней энергии газа, т . е .
энергии хаотического движения молекул, что связано с понижением
температуры газа. В свою очередь это понижение температуры газа
вызывает приток тепла от калориметра к первому цилиндру.
Во втором цилиндре происходит обратный процесс. Молекулы
газа, врывающиеся в него с большой скоростью, теряют вследствие
ударов о стенки и взаимных столкновений свое направленное дви
жение и обусловливаемую им кинетическую энергию. Так как при
этом никакой внешней работы газ не производит, то исчезающая
кинетическая энергия (направленное движение молекул) восстанавли
вается в виде внутренней энергии газа (хаотическое движение моле
кул), вследствие чего температура газа повышается.
Следствием
повышения температуры во втором цилиндре является некоторое на
гревание окружающей его воды.
Нагревание краника объясняется другой причиной. При течении
всякого газа по трубке возникают силы внутреннего трения, работа
которых обычно невелика, но никогда не равна нулю. Работа трения
совершается за счет кинетической энергии потока и в свою очередь
превращается в теплоту, вызывая нагревание трубки. Этот тепловой
эффект трения по сравнению с эффектом охлаждения и нагревания
основных калориметров чрезвычайно слаб, вследствие чего в опытах
Джоуля оказался малозначащим. Однако очевидно, что строгой ком
пенсации изменений внутренней энергии в обоих цилиндрах нельзя
ожидать, так как выделение теплоты трения в соединительной
трубке не имеет ничего общего с основными процессами, происходя
щими в цилиндрах.
Круг вопросов, затронутых описанными исследованиями Д ж о уля ,
был настолько важным, что сам Д ж оу л ь и в дальнейшем целый ряд
Других ученых поставили своей целью разобраться в нем самым
тщательным образом. Первоначальная экспериментальная методика
была оставлена и уступила место другим, более точным способам
изучения свойств газов. При этом было установлено, что по мере
приближения реальных газов к таким областям, для которых законы
б*
84
ИДЕАЛЬНЫЕ ГАЗЫ
(ОТД. Й
Бойля и Гей-Л ю ссака становятся все более справедливыми, возра
стает точность утверждения о независимости внутренней энергии от
объема (от давления). Обратно , при наличии заметных отклонений
от указанных законов отмечается также более или менее существен
ное влияние объема (или давления) на величину внутренней энергии
газов.
Итак , внутренняя энергия идеальных газов, свойства которых
выражают предельные свойства газов реальных, зависит, как пока
зывает опыт, только от температуры.
В дальнейшем будет важно учесть , что для установления этого
опытного факта нет надобности опираться на абсолютную шкалу
температур. Сам Д ж о у л ь не знал о существовании абсолютной тем
пературы и пользовался практической шкалой, даваемой жидкостным
термометром. Е му было достаточно узнать, что температура воды
в калориметре во время опыта не изменяется или изменяется мало.
Чтобы отразить это обстоятельство, мы могли бы здесь написать:
и= а(/),
понимая под t температуру в любой практической шкале. Считая,
что в общем случае внутренняя энергия и могла бы зависеть от
этой температуры и, кроме то го , от удельного объема, мы имели бы:
da^{w\dt+{&)tdv
и, следовательно, применительно к идеальным газам:
Между тем, согласно формуле (1.30), мы имеем:
и, окончательно, для идеальных газов:
du = cvdt.
(II. 22)
Совершенно очевидно, что выбор температурной шкалы сказы
вается одновременно как на величине cvi так и на величине dt таким
образом, что du остается от этого выбора не зависящим. Поэтому,
в частности, в качестве измерителя температуры можно взять газо
вый термометр и использовать абсолютную газовую шкалу. В таком
случае мы получим формулу
da = cvdTt
(11.22а)
которая для идеальных газов верна всегда, безотносительно к то му,
какое изменение состояния испытывает газ.
ГЛ. II]
ВНУТРЕННЯЯ ЭНЕРГИЯ, ЭНТАЛЬПИЯ И ТЕПЛОЕМКОСТИ
85
Вдумаемся несколько в молекулярно-кинетический смысл полу
ченного результата. Внутренняя энергия газа представляет собой
сумму кинетической и потенциальной энергии молекул и энергии
периодических движений внутримолекулярных частиц (атомов, элек
тронов и т . д .) . Кинетическая энергия молекул и внутримолекуляр
ных частиц зависит исключительно от температуры газа. П отен
циальная энергия молекул определяется их средним относительным
положением, т. е, является функцией удельного объема. Следова
тельно, независимость внутренней энергии в целом от удельного
объема может иметь место при
том только условии, что потен
циальная энергия молекул также
не зависит от объема. Последний
вывод только на первый взгляд
кажется парадоксальным.
Как известно, силы молеку
лярного
взаимодействия
могут
быть схематически изображены
в зависимости от расстояния г
между молекулами, как показано
на рис. 11. В узком интервале
весьма близких расстояний имеют
место силы отталкивания. В осталь
ном господствуют силы взаимного притяжения, которые, начиная от ма
ксимума их абсолютного значения, быстро убывают по мере удаления
молекул друг от друга, достигая практически нуля как раз при
таких расстояниях, которые в среднем характерны для большинства
газов.
Изменение потенциальной энергии ДЕр при увеличении расстояния
от г г до г2 находится из формулы:
ДЕп
и, следовательно, изображается заштрихованной площадью, ограни
ченной ординатами г х и г2. Если потенциальную энергию принять за
нуль на таком расстоянии между молекулами, где силы отталкива
ния сменяются силами притяжения, то при любом другом расстоя
нии г она будет изображаться всей заштрихованной площадью до
текущей абсциссы г . Х арактер изменения этих площадей с ростом г
показан линией Е р . Мы видим, что по мере увеличения расстояния
между молекулами темп увеличения потенциальной энергии быстро
падает, вследствие чего у ж е при умеренных значениях г потенциаль
ная энергия становится практически постоянной. Следовательно, газ,
внутренняя энергия которого не зависит от объема, представляет
собой совокупность молекул, настолько удаленных друг от друга,
86
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. II
что дальнейшее разрежение или небольшое сжатие никакого измене
ния потенциальной энергии притяжения не вызывает. Вместе с тем
ясно, что резкое сжатие газа, в частности при приближении его
к области конденсации, приводит к усилению роли потенциальной
энергии.
Указанные соображения вскрывают соотношение, существующее
между свойствами внутренней энергии газа и термическим уравне
нием состояния. Было отмечено, что уравнение p v = R T выводится
теоретически при условии отсутствия молекулярных сил сцепления.
Вместе с тем, о тсутствие этих сил в полной мере объясняет тот
факт, что ( ~ ^ г ==0. Следовательно, применимость уравнения p v = R T
и справедливость формулы (Jfir ) T = ® вытекают из одних и тех же
физических предпосылок. Напротив, если эти предпосылки (отсут
ствие сил сцепления) не соответствуют действительности, то в при
менении к реальным газам одновременно становится неверным как
уравнение p v = R T , так и утверждение о независимости внутренней
энергии от объема.
В заключение отметим, что для производства практических р а с
четов иногда бывает удобно пользоваться величиной внутренней
энергии в данном состоянии, а не только ее приращением. Э то воз
можно, если приписать внутренней энергии совершенно условно зна
чение нуль при некоторой начальной температуре. Обычно прини
мается, что приt= 0°С, т. е. приТ—273°К, я = 0.
Тогда
t
т
и= Гcvdt, или и= ГcvdT,
(И. 23)
О
278
Взятие интеграла возможно, если известна теплоемкость cv как
функция температуры, о чем говорится далее.
6. Энтальпия. Классическими опытами, служащими для нахожде
ния свойств энтальпии газов, являются опыты Д ж о у л я , проведенные
им совместно с Томсоном. В трубку с те
плонепроницаемыми стенками (бамбук) был
вставлен ватный тампон (рис. 1 2 ), сквозь
который медленно прожимался исследуемый
газ. Перед тампоном устанавливалось
давление вплоть до 6 am и температура
в пределах от 0 до 100° С . За тампоном
давление, естественно, было меньшим на
чального на величину Др . Такое явление
протекания газа через местное сопротив
ление называется дросселированием или
мятием газа. Наблюдения Джоуля и Томсона показали, что в резуль
тате дросселирования температура газа изменяется чрезвычайно мало,
Г71. II]
ВНУТРЕННЯЯ ЭНЕРГИЯ, ЭНТАЛЬПИЯ И ТЕПЛОЕМКОСТИ
87
Так, в одном из опытов при рх= ±ат и /?2= 1am было из
мерено, что tx— ^а = 0,7° С для воздуха и tx— /2 = 3,9°С для угле
кислого газа. Некоторые газы вместо охлаждения обнаружили при
знаки слабого нагревания. Например, при дросселировании водорода
соответственно Д/? = 1 am, начиная с комнатной температуры, было
отмечено повышение температуры на 0 ,04° С .
Изменение температуры при дросселировании называется э ф ф ек
том Д ж о у л я — Томсона. При количественной оценке этого эффекта
обнаруживается, что он тем менее значителен, чем точнее газ сле
дует термическому уравнению состояния идеального газа. По это м у,
поскольку идеализация газа вообще допустима, можно положить,
что в пределе эффект Джоуля— Томсона равен нулю, т. е. tx= /2.
Выводы из этого экспериментального факта таковы. По у сл о
виям опыта в уравнении сохранения энергии для потока ( I. 2 2 а ):
w\—wi ,
Чи2=h—h+ А—2^-----Ь
следует принять, что
w\—w\
Ч\,г—0; А
■!=0; Л/,= 0. ’)
Таким образом, при дросселировании энтальпия остается н еиз
менной:
ix= i2.
(11.24)
Между тем, i = i(t,p). Поскольку в данном случае р хФр%,
a tx = t2, то условие i x = /2 возможно лишь при независимости
энтальпии от давления. И так ,
(|-),= 0-
На основании формулы (I. 32) находим, что
di= cpdt.
(II. 25)
Выбрав для измерения температуры абсолютную газовую ш кал у, мы
получим формулу:
di= срdT.
(II. 25а)
П о смыслу вывода эта формула для идеальных газов верна незави
симо от того, какой вид имеет процесс, совершаемый газом.
*) Тепловой эквивалент изменения кинетической энергии положен рав
ным кулю, так как лишь при скоростях порядка десятка метров в секунду
и более он может получить в энергетическом балансе некоторое значение.
88
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. II
Должно быть ясно, что знание термического уравнения состо я
ния делает излишним раздельное экспериментальное определение
свойств внутренней энергии и энтальпии, так как d i = da 4 - A d ^pv).
Было бы совершенно достаточно установить опытным путем, что
для идеальных газов du = cv dT. Тогда простой расчет дал бы, что
di= {cv-\ -AR)dT.
Легко видеть, что
= ср . Действительно, если отнести
первое начало (1.19) к идеальному газу, испытывающему изменение
состояния при р = const, то
cpdT= cvdT-\ -Apdv = cvdT-{ -ARdT,
откуда получаем формулу:
cp= cv+ AR.
(11.26)
Таким образом, из формулы du=*cvdT и уравнения pv — RT прямо
следует формула di = cp dT, и наоборот.
Установление свойств газов по опыту с расширением в пусто ту
не является достаточно надежным в связи с незначительностью тепло
емкости газового заряда по сравнению с теплоемкостью самого кало
риметра. Ещ е Д ж о у л ь заметил это обстоятельство и стал искать
способ для осуществления более точного эксперимента. Упомянутые
опыты Д ж оу ля и Томсона явились в указанном смысле блестящим
разрешением задачи.
В заключение полезно отметить, что взаимное равенство энталь
пии до и после дросселирования отнюдь не означает, что течение
самого процесса постоянно удовлетворяет требованию: i = co n s t.
Живое сечение пористого тампона во много раз меньше сечения
трубки, ввиду чего скорость газа в порах может достигать довольно
больших величин. М ежду тем, полная энергия газового потока по
условиям опыта не может меняться. Следовательно, заметное увели
чение кинетической энергии потока должно вызывать столь же о щ у
тимое эквивалентное понижение энтальпии. П о выходе из тампона
скорость газа вновь падает. Торможение потока приводит к восста
новлению его энтальпии. В идеальном газе убыль и прирост энталь
пии полностью компенсируют друг друга, так что it в итоге оказы
вается совпадающей с /2. С микрофизической точки зрения это
означает, что на первом этапе процесса происходит увеличение с к о
рости направленного, регулируемого руслом движения молекул за
счет уменьшения энергии хаотического теплового движения. На вто
ром этапе, напротив, средняя компонента переносной скорости моле
кул падает, предпочтительное направление движения молекул стано
вится менее выраженным, и энергия теплового движения возрастает.
Таким образом, после охлаждения газа в начале процесса затем про
исходит его нагревание. Т о обстоятельство, что в итоге температура
не изменяется, связано с тем, что в случае идеального газа i является
ГЛ. Ill
ВНУТРЕННЯЯ ЭНЕРГИЯ, ЭНТАЛЬПИЯ И ТЕПЛОЕМКОСТИ
89
функцией одной только температуры, так как di = du-\ - Ad(pv)y а
du—cvdTиpv= RT.
Как и применительно к внутренней энергии, в расчетной прак
тике часто прибегают к значению энтальпии при данной температуре,
отсчитывая энтальпию условно от 0° С .
Тогда
t
т
i= J cpdt,
или
i= f cpdT.
(11.27)
О
278
7.
Теплоемкости cv и ср. Перед обсуждением экспериментальных
данных о теплоемкостях cv и ср для идеальных газов подытожим о б
щие сведения по этому поводу.
Теплоемкостью (точнее — удельной теплоемкостью) называется
коэффициент пропорциональности в формуле
dq = cdt,
связывающей элементарное количество подведенной к телу теплоты
(удельной) с соответствующим приращением температуры. И наче го
воря, теплоемкость есть отношение элементарного количества подве
денной теплоты к соответствующему бесконечно малому приращению
температуры. Величина теплоемкости зависит о т физических особен
ностей тела и от частных условий изменения его состояния. Среди
различных теплоемкостей, возможных для каждого данного тела,
особый интерес имеют теплоемкости cv и ср , отвечающие подведению
теплоты при постоянном объеме и при постоянном давлении.
Имея в виду, что внутренняя энергия а и энтальпия i идеальных
газов являются исключительно температурными функциями, а также
то обстоятельство, что в общем случае согласно (1.31)
заключаем, что у идеальных газов с0 и ср могут быть также функ
циями одной только температуры:
=
ср = <?а(О-
Если температура измеряется в абсолютной газовой шкале, то
Cv=fi(T);
c9= ft(T).
М еж ду теплоемкостями cv и ср существует связь, устанавливаемая
формулой (11.26):
ср= cv
ARy
т. е . обе эти теплоемкости отличаются друг от друга на постоянную
для данного идеального газа величину.
90
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. II
Благодаря последней формуле открывается возможность ограни
чиваться экспериментальным определением только одной из двух
интересующих нас теплоемкостей и переходить затем к другой по
средством простого расчета. В качестве первичной теплоемкости
обычно принимают ср , измерение которой удается точнее, чем cv.
Опытный материал, относящийся к теплоемкостям газов, чрезвы
чайно обширен. Однако вследствие разнообразия методов измерения
и неодинаковой степени точности, достигавшейся различными эк сп е
риментаторами, существующие численные данные иногда не вполне
совместимы, особенно при высоких давлениях и температурах. Уч и
тывая некоторую несогласованность опытных данных, следовало бы
располагать периодически обновляемыми стандартами численных зна
чений теплоемкостей, которые обязательны для все х . Применительно
к водяному пару подобные стандарты разрабатывались, но для газов
их, к сожалению, не существует.
Как было указано , теплоемкости идеальных газов могут изменяться
только с температурой. М еж ду тем, в реальных газах обнаруживают
влияние на теплоемкость также и давления или, соответственно,
объема. Теплоемкость ср принято выражать как функцию от Т и р ,
a cv — как функцию от Т п v . Вид указанных функций отличается
чрезвычайной сложностью , о которой можно судить по данным, при
веденным в пятом отделе. Если речь идет об идеальных газах, то
в расчет вводятся некоторые предельные значения находимых из
опыта теплоемкостей. Предельные значения теплоемкостей, согла
сующиеся со свойствами идеальных газов, получаются путем экстра
поляции опытных данных к нулевому давлению. Для большинства
технически важных газов уже при одной атмосфере (если темпера
туры берутся выше нормальной) значения теплоемкостей совпадают
с экстраполированными на давление р = 0 .
Экстраполяция теплоемкостей обосновывается тем, что при
0
независимо от температуры реальные газы приближаются сколь
угодно близко к идеальным газам. Как показывает и опыт, и кван
товая теория теплоемкостей, экстраполированные на нулевое давле
ние теплоемкости действительно изменяются с температурой, а
именно — растут при увеличении температуры. Для двухатомных газов
это увеличение составляет примерно 1°/0 на каждые 100° С ; для трех-
и многоатомных газов темп увеличения значительнее. Напротив, о д
ноатомные газы имеют практически совершенно не зависящие от
температуры теплоемкости. Э т о , как и самые численные значения
теплоемкостей одноатомных газов, хорошо согласуется с элементар
ной кинетической теорией, которая для них дает, что \icv=
= 2,98 ккал/кмоль •град, \icp = 4,98 ккал1кмолъ •град и k = -^ - =
=
1,67. Для более сложных газов, как легко показать теоретически,
теплоемкости имеют, соответственно, более высокие значения, а их
отношение, обозначенное здесь через k , — более низкие значения.
гл. II]
ВНУТРЕННЯЯ ЭНЕРГИЯ, ЭНТАЛЬПИЯ И ТЕПЛОЕМКОСТИ
91
Экстраполированную на нулевое давление теплоемкость при
постоянном давлении в справочной литературе обозначают иногда
через сРо. В связи с тем, что условие р - * 0
равноценно условию
v
о о , аналогичную теплоемкость при постоянном объеме обозначают
через cVco. В технических приложениях приходится прибегать к столь
ким специфическим индексам, что сохранение всякого общего индекса
может допускаться лишь при крайней необходимости. Поэтому знач
ков 0 и оо мы не будем применять, помня, что если газы считаются
подчиняющимися уравнению Клапейрона, то во все расчеты могут
входить только величины ср и cVjo. Одна из этих д ву х теплоемкостей
может быть найдена при знании другой расчетным путем с помощью
формулы (11.26).
Учет температурного влияния на теплоемкость производится либо
посредством использования эмпирических формул, либо с помощью
справочных таблиц или графиков.
Примерно до 1925 г . эмпирические формулы представляли тепло
емкость обычно в виде линейной функции от температуры. Так на
пример, распространенные тогда данные Ш ю ле основывались на ф ор
муле для теплоемкости ср азота, которая считалась пригодной для
температур до 1000— 1200°С :
ср = 0,2491 0,000019/ [ккал/кГ • град].
Для более высоких температур рекомендовалась аналогичная формула,
но с другими числовыми постоянными. Очень характерным было и
то обстоятельство, что мольные теплоемкости (теплоемкости, отне
сенные к 1 кмоль) считались для всех двухатомных газов одинако
выми, как это вытекает из классической кинетической теории газов,
согласно которой газы одинаковой атомности отличаются одинако
вой мольной теплоемкостью. Применительно к трех - и многоатомным
газам указанное свойство теплоемкостей совершенно не оправдывается,
тогда как для двухатомных газов оно казалось достаточно точно
отвечающим действительности. Исходя отсюда, Шюле пересчитал
приведенную формулу для ср азота на 1 кмоль и полученную таким
образом формулу
\ьср = 6,98 —|
—
0,000532/ [ккал\кмолъ • град]
рекомендовал применять для все х двухатомных газов и их смесей,
исключая разве только водород , который давал слишком заметные
отклонения.
Позднейшие исследования показали, что температурный ход тепло
ем кости плохо укладывается в линейные формулы, если интервал
температур превосходит несколько сотен градусов, и что, кроме того,
мольные теплоемкости заметно неодинаковы даже для двухатомны х
газов,
92
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. II
В настоящее время мы располагаем точными отечественными дан
ными о теплоемкостях газов в идеальном состоянии. Эти данные
получены лауреатами Сталинской премии
М . П . Вукаловичем,
В. А . Кириллиным и В. Н . Тимофеевым совместно с В. С . Силецким
и помещены, например, в Справочнике машиностроителя, т . I , 1951 г.
В указанном источнике приводятся интерполяционные формулы
для истинных и средних (см. ниже) мольных теплоемкостей при п осто
янном давлении. Например, соответственно уравнению вида )хср = ар -| -
- f mbt [к/сал//смоль • град\ для истинных теплоемкостей имеем:
Наименование
Предел
температур
ГС]
ар
Ъ•10*
Максимальная
ошибка
при темпе
ратуре [°С]
%
Кислород
»
Воздух
»
0-1000
1000—2 700
0—1 000
1000-2700
7,0651
8,0874
6,8682
7,8715
1,6649
0,5243
1,3664
0,4253
1000
2000
0
1000
1.76
0,48
0,94
1,21
Интересно отметить, что для трехатомных газов линейные форму
лы менее точны. Например, для углекислоты или сернистого ангид
рида линейные формулы дают максимальную ошибку в 16 и 10% .
Для тех ж е истинных теплоемкостей соответственно уравнению
вида ^Cp = ap -\ -b t-\ -c P [/с/сал//смоль • град] имеем:
Наименование
Предел
температур
[°С]
ар
6-103 с-106
Максимальная
ошибка
при темпе
ратурерС]
%
Кислород
0-1000 6,9244 2,6030 -0 ,9381
0
0,86
»
1 000—2700 7,8365 0,8150 -0 ,0730
1 600
0,11
Воздух
0—1000 6,8733 1,3223 +0 ,0441
0
0,87
»
1000—2700 7,3226 1,0692 — 1,740
1000
0,24
Для углекислоты и сернистого ангидрида при пользовании форму
лами последнего вида максимальная ошибка падает, соответственно,
до4и2%.
Табличные темплоемкости классифицируются по разным признакам:
а) по количеству газа, к которому они относятся; при этом разли
чаются весовые (на 1 к Г ), мольные (на 1 /смоль) и объемные (на 1 нмь)
теплоемкости; б) по роду термодинамического процесса; здесь имеются
в виду теплоемкости при постоянном давлении и теплоемкости при
93
frt. 11]
ВНУТРЕННЯЯ ЭНЕРГИЯ, ЭНТАЛЬПИЯ И ТЕПЛОЕМКОСТИ
постоянном объеме; в) по интервалу температуры, что будет разъяснено
ниже.
Соотношение между теплоемкостями устанавливается форму
лами (НЛО), (11.12) и (11.26):
ci)= cp — AR [ккал/кГ-град],
= рСр — 1 ,986 [ккал/кмоль • град] ,
с'=с'—
= с'р — 0 ,0887 [ккал/нм9•град].
П о поводу третьего признака классификации теплоемкостей*нужно
сказать следующее. Если интервал температуры, к которому относится
теплоемкость, берется бесконечно малым в соответствии с определе-
удачно называют, ист инн ую , теплоемкость. Если интервал темпера-
—
2
туры берется конечной величины, согласно формуле с = -
—
т
о
теплоемкость
называется средней
теплоемкостью.
Графическая
интерпретация средней теплоемкости дана на рис. 13а. Заштрихован
ная площадь под линией c = f { t) определяет количество теплоты,
необходимой для нагревания от tt до t%. Высота прямоугольника,
равновеликого этой площади и имеющего то же основание, дает сред
нюю теплоемкость в пределах от tt до
Если бы линия с = f(t)
была прямой, то средняя теплоемкость совпадала бы с точечной
теплоемкостью, отнесенной к полусумме крайних температур.
Табличные значения средних теплоемкостей даются в пределах от
нуля и до той температуры, которая значится в соответствующей
строке таблицы. Эти значения получаются из формулы
t
и показаны на рис. 13& Поскольку кривизна линии с = /(/) неве
лика, средние теплоемкости мало отличаются от точечных, взятых
для половинной температуры. Т а к , для воздуха из второй таблицы
94
ИДЕАЛЬНЫЕ ГАЗЫ
1отд. п
имеем: для 400°С ср= 0,246, в то время как для 200°С
ср = 0,245 ккал!кГ. град. Разумеется, с ростом температуры расхо
ждение увеличивается. Т а к , для 2000° С
= 0 ,278, тогда как для
1000° С ср = 0,283 ккал/кГ •град.
Пользуясь табличными значениями средних теплоемкостей, можно
вычислить внутреннюю энергию и энтальпию газов при любой тем
пературе, если условиться о том, что при 0 ° С эти функции равны
нулю, как это предполагается формулами (11.23) и (11.27). Для указан
ного определения величин и и / нужно табличную среднюю тепло
емкость помножить на соответствующую температуру, и эту операцию
повторить столько раз, сколько строк имеется в таблице. Таким путем,
составлены табл. 3 и 4 в приложении, дающие внутреннюю энергию
и энтальпию газов на 1 к моль.
И з табл. 3 и 4 видно, что мольные теплоемкости двухатомных
газов не вполне одинаковы и что расхождение между ними растет
вместе с температурой. Действительно, делая выборку из таблицы
мольной энтальпии, имеем:
{А/
при 100° С
при 1000° С
n2
о2
со
Воздух
696,1
704,9
696,8
696,2
7480
7908
7555
7548
сказано, унификация двухатомных газов
при точных расчетах неосновательна.
Теплоемкость газовой смеси , которую мы будем помечать индек
сом т, вычисляется (независимо от того, берется ли она при v = const
или при р = con st) по теплоемкостям компонент следующим очевид
ным образом:
ст= 2 Sici [ккал/кГ •град],
(jjlc)w = 2 r{ (р.с)< [ктл/кмоль • град],
с'т = 2 г/ { мал/нм* • град].
ГЛАВА III
ЧАСТНЫЕ ВИДЫ ПРОЦЕССОВ
8.
Содержание задачи. Процессы, протекающие в тепловых ма
шинах и аппаратах, не являются в полном смысле квазистатическими.
Однако во многих случаях можно без ощутимой погрешности предпола
гать индивидуальную квазистатичность в изменениях состояния рабо
чего тела, хотя между последним и окружающей средой равновесие
никогда не устанавливается. Допущение хотя бы ограниченной квази
статичности реальных процессов позволяет применять к ним с боль
шой пользой термодинамический анализ, который и образует обычно
основу для их всестороннего исследования в специальных курса х .
ГЛ. Ill]
ЧАСТНЫЕ ВИДЫ ПРОЦЕССОВ
95
При изменениях состояния рабочего тела термические пара
метры р , v и Т могут изменяться произвольным образом, лишь бы
только удовлетворялось термическое уравнение состояния: F (р, v ,
Т) = 0 . И з многообразия возможных изменений состояния выбираются
сначала простейшие частные процессы, а именно — процессы при
постоянном объеме (dv = 0), при постоянном давлении {dp = 0) и
при постоянной температуре (d T = 0).
Наряду с этими простейшими случаями могут быть исследованы
те частные задачи, которые вытекают из структуры первого начала
термодинамики. Принимая во внимание, что в нем в простейшем сл у
чае фигурируют три члена, каждый из которых имеет самостоятельный
физический смысл, можно установить три типа процессов по тому
признаку, что для них один из членов обращается в нуль. О тсю да
вытекает представление о следующих процессах: процесс, при кото
ром между рабочим телом и окружающей средой исключен обмен
тепла (dq = 0); процесс, при котором рабочее тело лишено возмож
ности отдавать или получать энергию в виде механической р а
боты ( d l= 0); и, наконец, процесс, при котором обмен тепла и
совершение работы протекают та к, что внутренняя энергия рабочего
тела не изменяется (du = 0). Очевидно, определения d v = О и d l = 0
равнозначны, ибо d l = p d v . Кроме то го , равнозначны определе
ния d T = 0 и du = 0 , так как внутренняя энергия идеальных газов
есть функция одной только температуры. П о этом у в итоге остаются
четыре частных случая изменения состояния, получившие следующие
названия: 1) изохорное (dv = 0), 2) изобарное (dp = 0), 3) изо
термическое {dT = 0) и 4) адиабатное {dq = 0). Многие реальные
процессы развиваются в условиях, достаточно близких к одному из
перечисленных случаев, благодаря чему их изучение является практи
чески важным. Однако, помимо них, следует рассмотреть еще поли-
тропный процесс, открывающий возможность аналитического о писа
ния и таких случаев, которые не сводимы к одному из четырех
простейших.
9. Изохорный процесс. Этот процесс определяется условием
dv=0 или v=const,
так что изменяется только давление и температура. Взаимная связь
между Ъшми вытекает из уравнения состояния г а з о в ,*) согласно кото
ромуy—
и, следовательно,
у = const.
(II. 28)
*) Уравнение состояния привлекается здесь ради установления общего
метода. Данное уравнение состояния уж е построено на заранее известном
соотношении между р и Т при v = const.
96
Идеальные газы
[отд. it
Относя уравнение (11.28) к любым двум точкам процесса, получаем:
Р2
Pi
Тхш
В координатах p - v и зохо ра изображается вертикальными линиями,
причем перемещение вверх имеет место при подведении к газу
теплоты из окружающей среды, а перемеще
ние вниз — при отдаче теплоты в окружающую
среду (рис. 14).
Работа при изохорном процессе равна нулю.
Следовательно, этот процесс может происходить-
только при наличии обмена тепла с окружающей
средой, причем на основании первого начала
dq= du, или ql2= u2— ии
Рис. 14.
т * е * подводимая к телу извне теплота цели
ком превращается во внутреннюю энергию.
Как было указано ранее,
(fq= du= с„dty
j
01,2 = tfo— ux= J C„dt= cv{t2—tx).
l
(II. 29)
Черта над cv означает усреднение теплоемкости в пределах температур
от tx до t2. В тех случаях, когда теплоемкость, в зависимости от
температуры, может быть представлена линей
ной функцией cv= av-\ -bty
г t\“f"to.
Ь—2— •
Есл и крайние температуры при изохорном
процессе лежат между нулем и двумя-тремя
сотнями градусов, можно без заметной по
грешности принимать cv z & a v. Впрочем, при
наличии таблиц величин внутренней энергии и
или энтальпии /, с которой и связано фор
мулой и = /— A R t, надобность в знании фор
мулы для с„ вообще отпадает. Пример пользования таблицами дан
в следующем пункте.
10. Изобарный процесс. В координатах p -v изобарный процесс
изображается горизонтальными отрезками (рис. 15), ибо его ура в
нение
Рис. 15.
dp= 0, или р= const.
1'Л. Ill
ЧАСТНЫЕ ВИДЫ ПРОЦЕССОВ
97
Согласно уравнению состояния имеем:
=
т.е-
r=const, или Р=
(11.30)
V
*\
v\
Работа по изобаре
а
2
/j.2= Jpdv= pJ
i
i
т. e.
= P(v2— vx)= R(T2— Г,).
(II. 31)
Отсюда можно установить физический смысл газовой постоянной
о ...
*1.2 ГКГ-М1
7’2—Тх\_кГ■градJ*
а именно: газовая постоянная численно равна удельной работе газа
при изобарном процессе соответственно изменению температуры
наГС.
Изменение внутренней энергии подсчитывается, как было выше
сказано, на основании формулы (11.22):
Ч'
а количество теплоты
<7i,з=
2
- “i—Jcvdt=cv(ti—tl),
1
2
h h= j cpdt—cp(ta
^i)‘
Средняя теплоемкость cp по своим свойствам аналогична cv. Если
справедлива эмпирическая формула
ср — ap-\ -bty
то
*“*
I F ”f"to
—2
П римеры. 1. В цилиндре двигателя внутреннего сгорания находится
воздух при температуре ^ = 5‘ 0 °С . Вследствие сгорания впрыскиваемого
в цилиндр жидкого топлина выделяется столько тепла, что занимаемый воз
духом объем удваивается. При этом давление в цилиндре остается практи
чески одинаковым. Определить соответствующее повышение температуры,
а также удельные количества теплоты и работы. Изменения веса и состава
газа при горении не учитывать.
Согласно (11.30)
То = (550+273). 2 = 1646° К;
*8= 1373°С.
Вычисляем ? 12 сначала по данным о точечных теплоемкостях (табл. 2)»
Имеем, округляя до трех знаков:
при 550° С
ср = 0,264 ккал/кГ - град,
> 1373°С Ср= 0,292
7 Зяк. 3943. В. С. ЖукошскиА.
9ft
ИДЕАЛЬНЫЕ ГАЗЫ
ОГД. II
Среднюю теплоемкость считаем в указанном интервале как среднюю ариф
метическую из двух крайних значений:
0,264 + 0,292
ло_0
ср = ---------- 2 --------- =
0,278 ккал/кГ •град,
отсюда
__
qu а = с (t2— tx) = 0 ,278 (1373— 550) = 229 ккал/кГ.
Для сравнения определим ту же величину qltа по величинам энтальпии
(табл, 2):
при 550° С
ix— 137 ,2 ккал!кГ,
»
1373° С
/*2= 368,3
отсюда
qltа“ £а—*i“
^68,3 “ “ 137,2 = 231,1 икал\кГ.
Расхождение между обоими значениями ^ 2 составляет 0,9%. Разумеется,
второе значение qx2 является более точным, чем первое.
Работа расширения
/U2 == /?(Г2— Тх)= 29,3*823 = 24110 кГм/кГ.
Соответствующее изменение внутренней энергии находим из формулы:
м2—их—qltа— ^ i,а = 231-------=
/скал/кГ.
2* В калориметрической бомбе находится кислород при tx= 25° С . Опре
делить его температуру t2после подведения 100 ккална каждый килограмм
(такого рода задачи типичны для нахождения теоретической температуры
горения).
Задачу можно решать различными приемами.
а) Если теплоемкость cv известна в виде линейной формулы, то
*1.2=
~ *,) =(“о+Ь
((2~
Это выражение является относительно
квадратным уравнением, только
один корень которого имеет физический смысл. На основании данных стр.94
av=
--------—
--------- =
0,159иb= —
Ю-3
=
0,052* 10~3. После решения урав
нения получаем
=
000°С.
б)
При наличии таблицы точечных теплоемкостей возможен способ по
следовательных приближений. Из таблицы теплоемкостей кислорода, здесь
нс помещенной, для 25°С находим:
cv = 0,157 ккал/кГ •град.
Если бы теплоемкость оставалась постоянной, то температура возросла бы
на 100/0,157 = 637 °С . Действительный рост температуры будет несколько
меньшим. Предположим, что конечная температура £2= 000 °С , ввиду чего
на основании таблицы имеем:
при 600° С
с0= 0,193 ккал/кГ •град,
0,157 + 0,193 Л1_
отсю да cv = --------- ----------= 0,175 ккал)кГ •град и
/?=^+~
-
= 25-+
100
0J75
=
597°С .
Гл . Ill)
ЧАСТНЫЕ ВИДЫ ПРОЦЕССОВ
99
Полученное значение
не в точности совпадает с предположенным,
Если расхождение между предположенной температурой и полученной было
бы порядка сотни градусов, то следовало бы произвести пересчет, взяв
в качестве верхнего предела усреднения cv температуру
найденную в по
следнем варианте. Однако в данном случае подобного пересчета не тре
буется, так как на величине средней теплоемкости не может отразиться
замена /2= 600° С величиной t%= 597° С . Итак, мы получили, что t2= 597°С.
в) Удобно и точно расчет может быть произведен с помощью таблиц
внутренней энергии (табл. 4 в приложении). Из таблицы находим соответ
ственно заданной величине ^ = 25°С, что ри1= \27 ккал/кмоль. Затем
определяем jjlh2= ^иг - f \xqt 2= 127 -f- 3200 = 3327 ккал/кмоль. Наконец,
простой интерполяцией табличных данных определяем ту температуру
при которой р.и = р.ц2. Эта температура оказывается равной 595° С .
г) Несколько ниже будет рассмотрен простой графический способ на
хождения t2 по заданным tt и qx а.
11.
Смешение газов. Для нахождения равновесного состояния
газов после смешения необходимо знать начальные состояния все х
компонентов до смешения и условия их взаимодействия с о круж аю
щей средой в течение процесса смешения. Считая газы химически
индиферентными, рассмотрим два случая : смешение в замкнутом п р о
странстве при сохранении постоянным объема и смешение газовых
потоков без отдачи технической работы. В обоих случаях мы пола
гаем, что смешивающиеся газы изолированы от окружающей среды
в тепловом отношении.
а)
Смешение при V = const. Положим, что до смешения газы
занимают объемы V u V2f Vd, . . .
при давлениях p Jt р 2, /?3>
и
температурах tl9 t2, /3,
Требуется найти равновесные значения
давления и температуры после взаимного смешения газов при у сл о
вии, что объем смеси V равен сумме объемов V {.
Для решения задачи воспользуемся первым началом термодина
мики. Т ак как обмена тепла между смешиваемыми газами и о к р у
жающей средой не происходит и так как система, сохраняющая не
изменным свой объем , внешней работы не производит, внутренняя
энергия смеси равна сумме внутренних энергий газов до их смеше
ния. Обозначая индексами i номера отдельных компонентов, имеем:
Ои= 2
Величины внутренних энергий, входящие в это уравнение, могут
быть отсчитываемы от произвольно расположенного нуля. При о т
счете от 0°С:
Gcvt= 2 <Vr{t{
и при отсчете от 0 °К
GcvT=^iGiCvtT.
Усреднение теплоемкостей производится здесь в пределах от 0 ° С
(или от 0° К) до той температуры, на которую умножается каждая
100
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. it
данная теплоемкость. Для второго случая запишем это так:
Сопоставляя выражения (а) и (Ь), определяем искомую темпера
туру Т:
Второй вариант формулы удобнее потому, что эксперименталь
ные данные о теплоемкостях чаще всего приводятся от 0 ° С . В обоих
случаях вместо молекулярных теплоемкостей можно вводить тепло
емкости 1 нмь.
Давление после смешения может быть вычислено следующим
образом:
Непосредственное пользование формулой (11.32) весьма затрудни
тельно, так как в ее правой части под знаком суммы содержится
подлежащая определению температура Т в качестве верхнего пре
дела усреднения теплоемкости. Таким образом, значение Т приходится
искать подбором. Эта формула может быть упрощена для тех сл у
чаев, когда смешению подвергаются либо одноатомные газы, либо
газы двухатомные, имеющие близкие температуры. При этом мо
лярные теплоемкости компонентов имеют практически одинаковые зна
чения, вследствие чего
OcXT= '2GicJ*‘Ti.
(а)
Теплоемкость смеси находим по формуле:
(Ь)
Но
вследствие чего
(II. 32)
pV=GRmT=T ^QiRi, или
(II. 83)
у PiVi
Ziт
(II. 34)
Из формуль- **,/— ’r 'V rs D nna указанного случая имеем:
или
(II. 35)
ГЛ. Ill)
ЧАСТНЫЕ ВИДЫ ПРОЦЕССОВ
101
П ример. 0,5 мА сжатого воздуха, имеющего избыточное давление 5 am
и температуру 40° С , смешивается с 2 мА воздуха при атмосферном давле
нии (760 мм Hg) и — 10°С . Каковы давление смешения р и температура
смешения О
На основании (11.35) имеем:
1
0,5+2
(6,033.0,5 + 1,033 •2)= 2»03 am,
т, е. избыточное давление равно 1 am .
Искомую температуру находим из (11.34):
6,033 .0 ,5 -4 - 1,033 •2
6,033 • 0 ,5 1,033 *2
313 +
263
= 291°К,
или
*= 291 -273= + 18°С.
б)
Смешение при / = const. Положим, что весовые расходы
смешивающихся потоков равны О*, О*, G*,
(объемные расходы
V*, V*, V*, ...) . Их давления и температуры соответственно равны
Pv р2>Ръ>
иTitT’q»Г3, ...
Равновесное давление после смеше
ния р устанавливается по произволу, но не выше наименьшего из
значений р{ путем дросселирования газовых потоков при входе в сме
сительную камеру. Дросселирование осуществляется, например, по
средством регулирования открытия задвижек или клапанов, стоящих
на концах подводящих трубопроводов. Равновесная температура Т
после смешения подлежит определению.
Для нахождения Т обратимся к уравнению сохранения энер
гии (1.22) для газового потока. Отнеся все величины к единице
времени, считая в (1.22) индекс 1 относящимся к состояниям до
смесительной камеры, а индекс 2 — за смесительной камерой, и п ро
изводя суммирование по всем компонентам в пренебрежении измене
нием кинетической энергии, имеем:
Q*i = 2 G*i{.
Таким образом, в результате смешения энтальпия газов не изменяется,
что непосредственно вытекает из физического смысла энтальпии как
потенциальной энергии газово го потока.
Принимая во внимание, что для получения численных значений
энтальпии следует в формулах для внутренней энергии лишь заме
нить cv на сру мы можем непосредственно написать уравнение для Г ,
аналогичное (11.32):
Т=
—
it
АГ,^Мо
ИЛИ t=
VP<V<г-,
2j Т,
V/’X
—
Zl Ц Noр){
\и*
(II. 36)
102
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. II
Объемный расход смеси в этом случае, однако,
сумме объемных расхо до в компонентов и может
основании (11.33):
Р
h
вообще не равен
быть вычислен на
Если молярные теплоемкости, входящие в (11.36), практически
одинаковы, то температура смеси определяется той же формулой
(11.34), которая найдена для случая V = const. В этом случае, как
легко показать, внутренняя энергия U * оказывается постоянной,
а следовательно, и работа вытеснения A p V * , производимая подле
жащими смешению газовыми потоками, равна работе вытеснения,
совершаемой полученной смесью. В случаях, когда указанное упро
щение задачи недопустимо, следует считаться с изменением работы
вытеснения.
Дальнейшее упрощение можно получить при условии, что помимо
одинаковых молярных теплоемкостей все смешиваемые газы имеют
равное давление. Тогда
Г=
V*
ЖУА
(И. 34а)
(II. 35а)
П р и м е р . В сборном борове котельной смешиваются имеющие атмо
сферное давление отходящие газы от трех котлов. Ради простоты прини
мается, что состав газов одинаков, а именно:
rN, = 0’75(3; г0# = 0,068;
Количества газов в мг1час таковы:
гсо3= ОД18 и Гцл0= 0,058.
v\=7100; V*a = 2600иv\=11200при = 170;t2=220иt9=120°С.
Найти температуру после смешения и объемный расход газов через дымо
вую трубу при этой температуре.
В данном случае крайние температуры смешивающихся потоков отли
чаются всего на 100° С, ввиду чего изменением теплоемкости с температу
рой можно пренебречь. Так как р = const и состав газовых потоков одина
ков (каков он именно— несущественно), решаем задачу с помощью фор
мул (11.34 а) и (11.35 а):
Г= ЖА1
Y-
lu Ti
7100 + 2600+11 200 20900
7100 ( 2600 f 11200 “ 49-8
443^493+ 393
t = 420—273= 147° С,
420° К,
V*= ^ К = 20900мУчас.
Решим с показательной целью ту же задачу с учетом изменения тепло
емкостей при изменении температуры. В нашем случае, когда давление одц-
ГЛ. Ill]
ЧАСТИМЕ ВИДЫ ПРОЦЕССОВ
103
иаково и смешиваемые газы имеют одинаковый состав, формула (11.36) пере
писывается так:
Здесь сохранены величины р, чтобы расчет вести непосредственно по объем
ным содержаниям. Пользуясь табл. 3, имеем:
при 100° С I*/ = 0.756 •696 + 0,068 -705 + 0,118-917 + 0,058 •806 = 730,
» 200°С \н = 0,756•1397+ 0,068 •1430+ 0,118 •1923 + 0,058•1630 = 1477,
» 300°С !<•/ = 0,756• 2106 + 0,068 •2178 + 0,118• 3005 + 0,058• 2477 = 2241.
Отсюда при 120° С
170° С
220° С
jjl/ = 879
1253
1630 ккал/кмоль.
Зададимся температурой после смешения 150°С . Тогда \icp
t—
7100
443
1630 4
11200
393
iso 1Ю4
=
=
7,37,
о
1о0
879
/7100 2600
11 200N
'
V443 493^ 393)
=
146°С.
Как и следовало ожидать, учет изменения
случае излишен.
теплоемкостей в данном
12.
Диаграмма i' - t и ее применение. В технических прило
жениях термодинамики широко используется возможность графиче
ского решения задач. О пи
сываемая ниже диаграмма
представляет значительный
интерес.
Построим по несколь
ким произвольным точкам
(рис. 16) кривую i = cp t как
функцию L Кроме того, из
начала координат проведем
прямую под углом к оси t y
тангенс которого равен A R .
Отрезки между осью t и кри
вой i определяют энтальпию
при заданной температуре,
а отрезки между наклонной
прямой и той же кривой —
соответствующие значения
внутренней энергии и . Таким
образом,
способ решения
задачи об определении коли
чества теплоты qU2 при /? = const и при v = const соответственно
заданным t x и /2 не требует пояснений.
и
Рис. 16.
104
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. II
Решение задачи о конечной температуре 1а при заданных tx и
^
показано на рис. 16. Последовательность операций для случая р = const
отмечена сплошными и для v = const — пунктирными стрелками.
Существенные выгоды в применении диаграммы могут быть полу
ченыприотнесении/нек1кГ>ак1кмолъилижек1нм*.
Если при этом пренебречь отклонениями в молярных теплоем
костях двухатомных газов, то для всех них можно построить одну
диаграмму взамен многих индивидуальных диаграмм, пригодных только
для одного из газов. Обозначая энтальпию 1 нм3 при температуре t
через
имеем (см. (II. 12)]:
и'= i'-
22,4
22,4
0,0887/.
Отсюда следует, что наклонную прямую для отсчета и' нужно про
вести под углом с тангенсом, равным 0 ,0887 и одинаковым для всех
без исключения газов. Н а вкладном листе в конце книги помещена
подобная диаграмма. В ней нанесена кривая энтальпии для воздуха,
пригодная для Na, О а, С О и их смесей в тех случаях, когда расчет
не требует большой точности. Кроме того , нанесены кривые if для
водяного пара (как газа) и углекислого газа. Масштабная линия
для I' помещена сверху.
Для вычисления энтальпии 1 нм3 смеси следует пользоваться ф ор
мулой
i'= 2
Если в смеси содержится несколько двухатомных газов, то их можно
непосредственно объединить в один член ( n ') 2.ai . Так например, при о б ъ
емном содержании rCOj= 10%. '‘оа= 8%, rNj= 72% и rHj0= 10%:
*■' =
0>%О,
~ЬО.^н.о1
В диаграмме i' - t можно находить и температуру газов после сме
шения. Положим, что имеются два газа, состояние которых опреде
ляется параметрами V v plt tx и V2, р2, h- Приводим заданные объ
емы Vj и V a к нормальным условиям:
у __у273Pi.
•'o.i— М 7} 1,033’
273 р2
7\ 1,033’
На 1 нм8 первого газа приходится V0iJ V 0>1 нм3 второго газа, откуда
при условии V = const:
П о нескольким точкам построим левую часть уравнения как функцию
температуры, перенося из диаграммы i' - t ряд отрезков и' и доба
ГЛ. ш|
ЧАСТНЫЕ ВИДЫ ПРОЦЕССОВ
105
вляя к ним умноженные на V 0t2/V0it отрезки и2, отнесенные к со о т
ветственно равным температурам. Затем найдем в масштабе по отдель
ным кривым для обоих компонентов сумму величины и ' , взятой при
температуре tv и величины V Qi^ V Q§1 • и2> взятой при температуре /2.
Отыскав на вспомогательной кривой то место, на котором абсцисса
равна указанной сумме о трезков, прочитываем на вертикальной оси
искомую температуру t.
П ример. Найти температуру смешения при атмосферном давле
нии 5,4 мв углекислоты, имеющей температуру 1000° С , и 1 м9 холодного
воздуха, находящегося при 10° С .
Определить также объем смеси.
На 1 м* воздуха при0°С и
760 мм Hg приходится
М3
Vo.r Vxr%- 1 1273“
H
углекислоты. Строим кривую для
1.2 нмъ углекислоты, увеличивая
соответствующие абсциссы диа-
граммы
в
1,2 раза (рис. 17).
Складывая абсциссы кривой для
1 нм3 воздуха с абсциссами для
1.2 ил*3 углекислоты, получаем
кривую энтальпии для смеси. Ищем
ту температуру, при которой эн
тальпия смеси равна сумме эн
тальпии 1 нм* воздуха при 10° С
и 1,2 нм п углекислоты при 1000°С.
Эта температура оказывается рав
ной 695° С . Объем смеси опреде
ляется из формулы (11.33) и ра
вен V = 7,53 м6. Как видно, объем
смеси больше суммы объемов ком
понентов (Kj + У2= 6,4 ж8).
Заметим, что при смешении указанных компонентов не при неизменном
давлении, а при неизменном объеме, температура смеси оказалась бы почти
той же самой (732°С),
Обратим внимание на т о , что при смешении газов, не подчиняю
щихся уравнению p v = R T (вследствие близости к конденсации или
нахождения под очень большими давлениями), отыскание температуры
смеси графическим путем остается вполне закономерным, тогда как
применение формул (II. 32— II . 36) совершенно недопустимо. Впрочем,
для ответственных расчетов построения, унифицирующие тепловые
свойства двухатомных газов, недостаточно точны.
Описанная диаграмма i' - t комбинируется на одном листе с энтро
пийной диаграммой /-s ' , о чем речь будет дальше.
13.
Изотермический процесс. Изотермический процесс опреде
ляется условием:
НТ= 0 или Т= const,
106
ИДЕАЛЬНЫЕ ГАЗЫ
[ОГД. II
В координатах p - v изогермы газа изображаются равнобочными
гиперболами (рис. 18), уравнение которых непосредственно полу
чается из формулы (II. 1):
pv= const, или —=
—
1.
Построение гиперболы, проходящей через заданную точку А (pv г^),
показано на рис. 19. Из начала координат проводят луч до пере
сечении в точке В " с горизонталью, проходящей через А . Легко
видеть, что точка В , лежащая на вертикали В 'В " и отстоящая от В "
на отрезок, равный АА"> принадлежит к искомой изотерме. Действи
тельно,
BrB"
OB'
v.
А'А "
ОА'9
р2 vi
Повторяя о перацию , получаем произвольное количество точек
гиперболы. Н а рис. 20 выполнено построение линии изотермического
расширения, а на рис. 21 — линии изотермического сжатия, берущих
начало в точке Л ,
гл. Ill]
ЧАСТНЫЕ ВИДЫ ПРОЦЕССОВ
107
Таким образом , правило построения изотермы заключается в сле
дующ ем : через точку А проводят горизонталь и вертикаль. И з на
чала координат проводят несколько лучей под любыми углами. Из
взаимно соответствующих то чек пересечения этих лучей с горизон
талью и вертикалью проводят новые вертикальные и горизонтальные
линии, точки пересечения которых образуют в совокупности равно
бочную гиперболу, т . е . изотерму.
Каждая изотерма разделяет плоскость p - v на две части. Над
изотермой находятся точки, имеющие более высокую температуру,
чем вдоль изотермы; под изотермой — точки, имеющие более низкую
температуру.
Так как внутренняя энергия идеальных газов зависит только от
температуры, то изотерма является процессом при постоянной в ну
тренней энергии:
т. е . в этом случае все количество теплоты, сообщаемое газу, пре
вращается в положительную механическую работу, или, обратно,
совершение работы над газом требует отнятия от него эквивалент
ного количества теплоты.
Если охлаждение газа при уменьшении его объема не столь интен
сивно, чтобы dQ — A d L , то при сжатии газ нагревается; если отво
димое тепло превосходит величину затрачиваемой работы, газ при
сжатии охлаждается.
Работа процесса может быть найдена из формулы:
при dT=0 du= cvdT=0.
Следовательно, при изотермическом процессе
dQ= AdL, или Qb2= ALlfi,y
2
где р и V связаны условием pV = pxV Имеем:
Li,i=Pivt]n-pi>
Z-j>2 =
Работа 1 к Г газа, соответственно, равна:
(И. 37)
108
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. U
При пользовании формулами следует помнить, что в результате
интегрирования мы получили натуральный логарифм отношения о б ъ
емов, который в 2 ,3 раза больше десятичного, так что
= 2»3pxvxlg
Условимся также о значении индексов 1 и 2. Индекс 1 будем отно
сить к началу процесса, индекс 2 — к его концу. Таким образом,
при расширении v 2 > v t и р г > р2, вследствие чего работа будет
иметь положительное значение. При сжатии все знаки изменятся на
обратные.
Количество теплоты, подводимой к газу вдоль изотермы, в т о ч
ности равно совершаемой работе. Подсчитать его иным путем, поль
зуясь представлением об удельной теплоемкости, невозможно. Д ей
ствительно, теплоемкость определяется формулой c = dq/dt. Вдоль
изотермы dt = 0 , тогда как dq Ф 0; следовательно, ст— ± оо, т. е.
теплоемкость тела должна быть бесконечно большой, чтобы, несмотря
на сообщение или отнятие тепла, температура тела не подвергалась
изменению.
Задачи. 1 . Построить график, выражающий зависимость изотермиче
ской работы сжатия 1 кГ воздуха от конечного давления р2»считая послед
нее меняющимся до 100 am. Принять р\ = 1 am и температуру £ = 20 °С .
2. При изотермическом
расширении
воздуха совершена работа
12000 кГм\кГ. В начальном состоянии Т = 400°К и i/j= 0,2 мв/гсГ. Опре
делить конечное состояние и количество подведенного тепла. От в.: 2,1 am.
14.
Адиабатный процесс. По определению, адиабатный процесс
имеет место, если dq = 0. Физический смысл условия dq = 0 заклю
чается в том, что изменение состояния тела совершается без тепло
обмена с окружающей средой. В чистом виде процесс может быть
осуществлен в таком замкнутом пространстве, границы которого
являются абсолютными тепловыми изоляторами, т . е . непроницаемыми
для прохождения тепла. Таких абсолютно теплонепроницаемых
материалов в действительности не существует . Тем не менее выводы,
вытекающие из условия rf<7 = 0 , остаются практически справедливыми
для всех тех случаев, когда отношение dq к элементарной работе A dl
представляет достаточно малую величину.
Разумеется, никакого универсального критерия применимости ура в
нений адиабаты к описанию реальных процессов предложить нельзя.
В каждом отдельном случае следует проанализировать условия п ро
цесса с точки зрения закономерности его схематизации. Однако суще
ствует один признак, который указывает на приближение термоди
намического явления к условиям адиабатного изменения состояния.
Количество теплоты, передаваемой от газа твердым стенкам, про
порционально времени их взаимного соприкосновения. Если это время
мало, то количество отданной или полученной теплоты также должно
быть небольшим, хотя бы интенсивность теплообмена была велика,
ГЛ. Ill]
ЧАСТНЫЕ ВИДЫ ПРОЦЕССОВ
109
Поэтому во всех случаях, когда рабочее тело совершает большую
удельную работу в течение весьма малых промежутков времени,
можно считать, что процесс имеет тенденцию приближаться к ади
абатному. Так например, адиабатным процессом практически является
процесс, происходящий в стволе орудия при выстреле. Пороховые
газы производят громадную работу ускорения снаряда в столь малые
промежутки времени, что по сравнению с этой работой количество
отдаваемой стенкам теплоты составляет пренебрежимо малую величину.
П о той же причине следует считать адиабатным процесс течения
пара в лопаточных каналах турбин. Скорости течения достигают
здесь величин порядка сотен метров в секунду. Поэтому время сопри
косновения со стенками одного и того же элемента струи очень незна
чительно, а отдача тепла не влияет существенным образом на х а р а к
тер термодинамических процессов.
Большие по абсолютной величине потери тепла в окружаю щую
среду объясняются в подобных случаях в основном тем, что сумма
даже совершенно ничтожных удельных (отнесенных к 1 к Г рабочего
тела) потерь тепла может достигать больших значений при отнесе
нии ее к единице времени. Таким образом, основанием для рассмо тре
ния процесса как адиабаты служит утверждение, что отношение dqjA dl
представляет собой очень малую величину, хотя бы Q * = G * ^ dq
само по себе и не было столь незначительным. Чем быстрее протекает
изменение состояния при прочих равных условиях, тем ближе отно
шение dqjAdl к нулю.
Здесь полезно со всей возможной ясностью установить не только
физический смысл процесса, но и его математическую формулировку.
Мы приняли в качестве математического определения адиабатного
процесса условие dq = 0 . Возникает вопрос, можно ли признать
адиабатным всякий конечный пр оцесс /—2, который характеризуется
условием ^ 9 = 0 ? Примером такого процесса может служить сжатие
горючей смеси в цилиндре двигателя внутреннего сгорания. Темпера
тура смеси в начале сжатия всегда ниже температуры стенок. Несмотря
на охлаждение стенок проточной водой, при сжатии по мере повы
шения давления повышается и температура в цилиндре. Вследствие
этого в конце хода сжатия температура смеси оказывается более
высокой, чем температура стенок. Л егк о видеть, что вместе с изме
нением знака разности температур между смесью и стенками изме
няется и направление потока тепла: если в первой части хода сжатия
газовая смесь получает тепло от стенок, то во второй части она уже
отдает тепло более холодным стенкам. В итоге может случиться,
что алгебраическая сумма элементарных количеств теплоты вдоль ли
нии сжатия окажется равной или весьма мало отличающейся от нуля, т. е .
но
ИДЕАЛЬНЫЙ ГАЗЫ
|отд. II
Значит ли это, что процесс сжатия есть в данном случае процесс
адиабатный?
Из самого описания процесса сжатия ясно, что с физической
точки зрения его нельзя признать адиабатным, так как баланс прихода
и расхода тепла оказался при сжатии равным нулю не потому, что
обмена тепла вообще не было, а лишь по той причине, что положи
тельные и отрицательные количества теплоты скомпенсировали друг
друга. Поэтому нет оснований ожидать, что при замене действитель
ного процесса адиабатным, исходящим из той же начальной точки / ,
будет наблюдаться исчерпывающее сходство между ними. Таким
образом, условие
= 0 является с математической точки зрения
необходимым, но не достаточным для утверждения об адиабатности
рассматриваемого процесса.
Совершенно неверным определением адиабаты является выражение
q = const. Так как q не есть функция состояния и dq не есть пол
ный дифференциал, то условие dq = 0 отнюдь не приводит к выводу,
что <7= co nst. Последнее выражение неправильно в такой же мере,
как неправильно заявление, что в изохорном процессе / = co n st,
поскольку d l = 0 [см. (I. 8)].
Полагая в выражении первого начала d q = 0 , получаем:
Это означает, что при адиабатном процессе работа совершается
за счет внутренней энергии тела. Наоборот, совершение работы
над телом обусловливает соответствующее возрастание внутренней
энергии. Так как для идеальных газов du = cv dT, то
Следовательно, при адиабатном расширении (/1>2 > 0) температура
газа падает (Тг > Г2), при адиабатном сжатии (/!,2 < 0 ) она растет
Исходя из найденного выражения для работы, возможно устано
вить уравнение адиабатного изменения состояния в координатах p - v .
Из уравнения состояния имеем:
du-\ -Adl=Q
или их— а2= Л/ь2.
Adl= — du= — cvdTt
=ui
u2 = c*(Ti
^2)-
(H. 38)
(Ti < Tq).
pdv-\ -vdp= RdT
Исключаем отсюда d T , имея в виду, что (согласно (11.38))
—
crdT=Арdvy
откуда
dT ==
Таким образом,
гл. ш|
ЧАСТНЫЕ ВИДЫ ПРОЦЕССОВ
111
Но A R = ср — c.v\ следовательно,
Q
—
рdv-\~vdp—0.
cv
Отношение ср к c v9 обозначаемое буквой &, является физической
константой. Поскольку теплоемкости газов ср и с„ меняются с тем
пературой, k также оказывается ф ун к
цией от температуры:
р
^ = *=/(7>
(Н.39)
CV
Итак,
kpdv-\ -vdp = 0, или
+
(И. 40)
Последнее уравнение интегрируется
просто лишь в том случае, если вели
чина k рассматривается как постоянная.
При k = const имеем:
ArIn-и-[ -In р = const;
pvk = const.
(II. 41)
Таким образом, в координатах p - v адиабатные процессы изобра
жаются семейством неравнобочных гипербол, параметрами которых
являются числа Р0^ = = const (рис. 22). Так как &>1, линии адиа
бат проходят круче линий изотерм. Это
обстоятельство имеет простое физическое
объяснение.
Действительно, мы установили, что
адиабатное расширение сопровождается
уменьшением внутренней энергии, а сле
довательно, падением температуры. П р о
ведем через начальную то чку (/?0, ^ 0)
процесса расширения изотерму, как пока
зано на рис. 23. Имея в виду, что точки,
в которых температура Т < То, располо
жены под линией изотермы, приходим к
заключению, что адиабата должна в диаграмме p - v падать круче изо
термы. Поэтому работа адиабатного расширения от произвольного
начального состояния (/?0, v 0) до некоторого объема v меньше изо
термической работы газа, совершаемой в тех же границах.
Отсюда можно, между прочим, сделать следующее заключение.
Если по техническим причинам заданы начальное состояние газа и
предельный объем, до которого может быть допущено его расши
рение, то в целях извлечения наибольшей удельной работы выгодно
приближать процесс к изотермическому, хотя в последнем случае
112
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. И
внутренняя энергия газа и не освобождается для превращения ее во
внешнюю работу , т . е . газ является только посредником при пре
образовании извне подводимой теплоты в энергию, возвращаемую
обратно в виде работы расширения.
Как следует из математического вывода, уравнение p v k = const
справедливо только в применении к идеальным газам при дополни
тельном предположении, что к = co n st. Задаваясь видом функции
k = f ( T ) 9 можно было бы найти уравнение адиабаты, более точно
воспроизводящее реальные соотношения. Однако такой путь избирается
довольно редко, так как приводит к сложным зависимостям, мало
удобным в технических расчетах. Поэтому рекоменд) ется применять
простое уравнение адиабаты p vk = co n st, в котором влияние темпе
ратуры учитывается надлежащим выбором значения показателя к у
а именно, показатель адиабаты вычисляется как средняя арифмети
ческая между значениями для предельных температур процесса.
Указанный прием не является математически строгим, однако рас
четная практика его полностью оправдывает. Для иллюстрации в сл е
дующем пункте будет рассмотрен численный пример.
В отличие от уравнения p v k = const дифференциальное уравнение
(II. 40) остается справедливым при любых свойствах теплоемкостей.
Геометрические свойства адиабаты таковы: 1) касательная адиа
баты наклонена к оси v под углом ср, тангенс которого равен — k p jv , и
2) подкасательная равна — v tk (рис. 24).
Вернемся
к
уравнению
(11.41):
pvk = const и исключим из него с по
мощью уравнения состояния давление р .
Так как p = RT/v, получаем:
„vk
pvk=RT —= RTvk~l= const,
или
Tvk~l = const .
(II. 42)
Аналогичным образом находим:
T
к-1
fr
= const.
(II. 43)
Для работы при адиабатном процессе нами было найдено выражение:
/1>2 = с „ (7\ — 7*8). Однако из практических соображений часто удоб
нее пользоваться формулами иного вида, получаемыми путем непо-
а
средственного вычисления интеграла J p d v . Н уж но заметить, что
если вычисление работы через с„ и разность температур дает
точный результат и в том случае, когда теплоемкость меняется с тем
пературой, приводимое ниже вычисление является точным только при
гл. ш]
ЧАСТНЫЕ ВИДЫ ПРОЦЕССОВ
ИЗ
условии постоянства теплоемкости. Имеем:
2
8
Л,з=Jpdv=constJ^ =
—
v\~k)>
где
const = pxv\ = p2v2•
или
Вводя значение const в скобки, находим:
=
=
<“•44>
/1.з = ^ Г1(Г1- Г а).
Интересно это последнее выражение сравнить с формулой (II. 31)
для работы при изобарном процессе: /1|2 = R (T 2— Tt), Легко видеть,
что между одинаковыми изотермами работа адиабатного процесса
в (k — 1) раз меньше работы изобарного процесса.
Заменяя в (11.44) отношение Т2/Тг из формул (II. 42) и (II. 43),
находим также:
-
®П-*®г[•
•
(П- 44а>
При выборе той или иной формулы для работы следует руковод
ствоваться соображениями об удобстве вычислений.
15.
Показатель адиабаты. В формулах, относящихся к адиабат
ному процессу, физические свойства газа проявляются в величине
показателя адиабаты k — cp/cv. Опыт показывает, что при нор
мальной температуре (0° С) показатель адиабаты для всех двухатом
ных газов почти совершенно одинаков и равен 1 ,40. К тому же зна
чению приводит кинетическая теория.
Легко видеть, что показатель k является убывающей функцией от
температуры, ибо
_
_
cv~\~AR j . AR
cv
cv
cv
Так как * изменяется в относительно еще более узких пределах, чем
cv или ср , всегда представляется возможным подобрать такую линей
ную формулу, которая хорошо совпадала бы с указанной гипербо
лической зависимостью. Для технических расчетов в пределах от 0
до 2000° С можно пользоваться формулами:
*=1,40—0,5-10"**
(11.45)
для двухатомных газов и
* = 1,35—0,55 •10-**
для чистых продуктов горения среднего состава.
8 Зак. 3543. В. С . Жуковский.
114
ИДЕАЛЬНЫЕ ГАЗЫ
(ОТД. II
Заметное влияние температуры на величину показателя адиабаты
сказывается лишь при высоких температурах, порядка сотен гр ад у
сов. Так, для двухатомных газов при 1000° С k = 1,40 — 0,05 = 1,35.
Поэтому при исследовании адиабатных процессов, протекающих при
невысоких температурах, может быть принято значение &, соответ
ствующее 0° С . Н о если интервал температур, между которыми про
текает адиабата, достигает нескольких сотен гр адусов , следует во
все формулы вводить средние значения k .
Показатель адиабаты k = cpjc v вычисляется по найденным из опыта
значениям ср и cv. Однако существуют также и непосредственные
экспериментальные методы его определения.
Ниж е приводим один из них, предложенный
Клеманом и Дезормом.
Газ, показатель адиабаты которого под
лежит определению, помещается в со суд, со
единенный с U -образным манометром (рис. 25 ).
До начала опыта в сосуде устанавливают
давление, несколько превышающее атмо
сферное. Это начальное состояние, в котором
температура газа равна температуре о кру
жающей среды, будем обозначать индексом 1 .
Затем открывают кран, вследствие чего
происходит быстрое вытекание газа из со суда,
без заметного обмена тепла с окружающей
средой. В момент, когда давление газа в сосуде становится равным
атмосферному, кран вновь закрывают. Соответствующая температура
газа вследствие адиабатного характера его
расширения оказывается меньше первоначаль
ной. Э т о состояние обозначим точкой 2.
Оставшийся в сосуде газ предоставляет
ся постепенному нагреванию до уровня темпе
ратуры окружающей среды. При этом дав
ление в сосуде вновь поднимается, следуя
правилам для изохорного изменения состоя
ния. Конечное равновесное состояние о б о
значим индексом 3 . Диаграмма процесса по
казана на рис. 26.
Так как точки 1 и 3 лежат на одной изотерме, можно написать:
Piv i = Ръ°ъ-
С другой стороны,
рМ= Ptfh= P2v3-
Возводя обе части первого уравнения в степень k и деля почленно
полученное выражение на второе уравнение, получаем:
или —=
( —')
(а)
Р2 \pj
У
л
Pi
р±
/>2
ГЛ. Ill)
ЧАСТНЫЕ ВИДЫ ПРОЦЕССОВ
115
в этом уравнении р2= ра и Pi= ра-\ -ьр'\ рй= ра-\ -Ьр",
где
W и 8р " согласно условию представляют собой относительно малые
величины. П о эт о м у , переписав уравнение (а) в виде:
Ра+ Ър' _(Ра+ Ьр'\к
Ра
~\Ра+Ьр") ’
ИЛИ
Ьа’^ (Ра+ Ър'
Ра
\Ра + Ър"
к
мы можем преобразовать правую часть, пренебрегая степенями коли
честв 8// и 8р" выше первой. В таком случае
,+^=fi+
i
1Pa
V'Pa
Pa)
1
Pa
откуда
bp* — bp,r*
(b)
Таким образом, определение показателя k сводится к весьма про
стым измерениям с помощью манометра.
Наиболее точные измерения этим методом были произведены Рент
геном, который применил высокочувствительный мембранный манометр
и ввел поправку на отклонение процесса истечения до момента з а
крытия крана от адиабатного изменения состояния. Для воздуха при
18° С он нашел, что k — 1,4053.
П рим еры . 1. В стальном цилиндре с легко подвижным поршнем нахо
дится гремучий газ (2Н2+ 0 2) при 20° С . Начальный объем гремучего газа
100 см6. С какой высоты должен упасть на поршень груз весом 5 кГ, чтобы
газ воспламенился? Температура самовоспламенения равна 500° С . Давление
в начале сжатия считаем нормальным и пренебрегаем нестатичностью процесса.
На основании формулы (11.38) находим работу сжатия. Так как энергия
газа в табл. 3 отнесена к 1 кмоль, выразим заданное количество газа в кило
молях. Приведем объем V\ к нормальной температуре Т0. Разделив полу
ченный объем на 22,4, найдем количество киломолей гремучего газа, подвер
гавшегося адиабатному сжатию. Отсюда
Для 20° С имеем:
для 500° С:
/ _ VjTotixUi — ixut)
~
22,4 TjA
[Ш= :..н, =
\.97.5+i ’100.5=98,
О
о
\ш={Ш,= J
•2004 +
.
2746 = 2258.
Высота падения груза
А=^
=
0,77м.
О
2. Воздух, находящийся вначале при 350° К , подвергается адиабатному
сжатию. Определить конечную температуру, если объем сокращается в 15 раз.
8*
116
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. II
Для вычисления конечной температуры следует воспользоваться форму
лой (11.42), в которую нужно ввести среднее значение к. Ввиду того что
верхний предел усреднения k пока неизвестен, приходится решать задачу
способом последовательных приближений.
Зададимся предположительно величиной Т2= 1100° К. Тогда
А= 1,40-0,5 •10-^ —° + 1100—27з)= 1,40—0,02= 1,38,
Г2= 350 •150*38 = 350 •2,80 = 980° К.
Полученная температура отличается от предположенной более чем на 100° К.
Пересчета, однако, производить не требуется, так как показатель адиабаты
принято округлять до трех знаков, в связи с чем при усреднении k между
350 и 980° абс. получается тоже &= 1,38.
Произведем теперь сравнение численного результата с тем, который мо
жет быть получен путем интегрирования уравнения (11.40) при условии, что k
есть не постоянная величина, а линейная функция от температуры. Опуская
вывод, воспользуемся формулой Шюле, которая может быть представлена
в таком виде:
Здесь а и k0— коэффициенты в эмпирической формуле для k:
к= Ar0—аТ.
Внашем случае, следовательно, k0= 1,40+ 0,5*273* 10-4=1,414 иа=0,5 •10~4.
Имеем:
0,5 •350-10~4\ 1
0,414
7*=
150,414
0,5 •350 •К)-4
0,414
350
0,3547 = 987° К.
= 0,3547,
Мы видим, таким образом, что рекомендованное нами приближенное решение
(980° К) менее чем на 1% отличается от точного (987° К). Между тем, если бы
мы вовсе не учли изменения к с температурой, введя в формулу (II. 42)
к = 1,40, то получили бы
Т2= 350 *150,40 = 1033° К,
46
т. е. расхождение на 1 0 0 ^ = 4,66%. Показанные соотношения вполне ти
пичны для задач на вычисление конечных параметров при адиабатном про
цессе.
3. Определить работу сжатия соответственно данным предыдущего при
мера.
Применяем формулу (11.44), заменяя p^ji через RT^ и считая к как
среднее в известных температурных пределах:
/1.3=т~т (1--^)= 290,38^(1~2,80)= - 48600кГфГ.
16. Энтропия идеального газа. Как мы видели, существуют три
Л-1
комбинации термических параметров (pvk,
Tjp к ), каждая из
которых сохраняет при адиабатном изменении состояния газов постоян
ное значение. Всякой точке на плоскостях p - v , T - v и Т -р отве-
ГЛ. Ill]
ЧАСТНЫЕ ВИДЫ ПРОЦЕССОВ
117
fe-1
чает определенное численное значение комбинаций p v k, T v 4* 1 и Т/р к ,
и это численное значение С , С ' или С ш является параметром тех не
пересекающихся друг с другом линий адиабат, которые заполняют
соответствующие координатные плоскости.
Важно отметить, что адиабатность изменения состояния газов
равноценна требованию, чтобы дифференциал каждого из трех пара
метров С', С" и С" был равен нулю:
Напротив,
приdq= 0должно бытьdC= 0.
при dq=£0 должно быть dC=£0.
Более то го , можно видеть, что сообщение газу теплоты заставляет
линию процесса отклоняться в ту сторону, где проходят адиабаты
с большими значениями параметра С , и, наоборот, т. е .
при dq> 0 должно быть dC> О,
приdq<0 должно бытьdC< 0.
Таким образом, для идеальных газов существую т такие функции
состоянияС=С(р,v),С"= С7(Г,v) иС"=
С " (Г, р), которые
растут при теплоподводе к газам, убывают при теплоотводе и остаются
постоянными при условии адиабатности процесса.
В противоположность dq, который лишен свойств полного диф
ференциала, величины d C у d C r и d C m являются полными дифферен
циалами. С математической точки зрения это значит, что dq имеет
ряд интегрирующих множителей, т. е . таких функций состояния,
умножив на которые величину d q , мы получаем полный дифферен
циал некоторых новых функций состояния.
То обстоятельство, что применительно к идеальным газам dq не
есть полный дифференциал, видно из выражения первого начала:
dq= cvdT-\ -Арdv.
Рассматриваем накрест взятые производные от коэффициентов при
dTиdv:
Первая из производных равна нулю, так как теплоемкость идеаль
ных газов, как известно из опыта, не зависит от объема. М ежду
тем, вторая производная равна A R / v , т. е. непременно отличается
от нуля. Таким образом, выражение для элементарного количества
теплоты, подводимой к идеальному газу, не удовлетворяет требова
ниям, предъявляемым к полным дифференциалам, что, впрочем, и не
могло быть иначе по соображениям, изложенным в начале курса.
Умножим теперь dq на некоторую, наперед не установленную,
функцию состояния идеального газа Х = Х ( Г , v) и потребуем, чтобы
Xdq = dty,
cv\dT-J-ApKdv =
118
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. II
где dty должен быть полным дифференциалом. В этом выражении
накрест взятые производные от коэффициентов при d T и d v должны
быть взаимно равными. Отсю да получается уравнение для нахожде
ния общего вида функции X от независимых переменных Т и v .
Частных видов функции k ( T , v ) существует произвольно большое
количество. Д опустим, например, что мы нашли один из частных
видов этой функции Х0(Г, v)f так что
dty0= cvk0dT-\ - Лрк0dv.
Если мы введем любую однозначную функцию Ф (^0) , то произведе
ние Ф(фо)</фо можно рассматривать как полный дифференциал не
которой новой функции состояния 2 = 2 ( Г , v):
dQ= $(%)d%= с„Х0Ф(у dT+ АрХ0Ф(ф0)dv.
Ясно теперь, что интегрирующим множителем для dq служит про
изведение Х0Ф (6 0).
В математическом отношении все возможные интегрирующие мно
жители равноценны. По это м у преимущества одних множителей перед
другими следует искать, если возможно, в их физическом смысле.
Как мы увидим несколько дальше, для dq интересным в таком отно
шении является интегрирующий множитель, который представляет
собой функцию одной только температуры Т. Приняв обозначение
0 = 0 (Г), поставим задачу раскрыть вид этой функции примени
тельно к случаю идеальных газов.
Из формулы cvQdT-\ - ApQdv = dty имеем:
(*Ш) =А(д-Ш
.
\dv/т
\дТJv
Так как с„ и в не зависят от объема v и (jpp)
то
de,a/?
de,е
Р
II~
4Г~Г т
откуда
и , наконец,
^ + ^г=0;rfln(0Г)=0
в=
К_
Т’
где К — произвольная постоянная, которую ничто не мешает принять
за единицу. В таком случае
0=f'
И т ак , в качестве интегрирующего множителя для элементарного
количества теплоты может служить в случае идеальных газов вели
чина, обратная абсолютной газовой температуре 7\ Иными словами,
ГЛ. in)
ЧАСТНЫЕ ВИДЫ ПРОЦЕССОВ
119
температура Т представляет собой интегрирующий делитель для d q .
Частное значение функции
отвечающее этому интегрирующему
делителю, обозначим через 5 и назовем его энтропией (удельной)
идеального газа. Имеем:
ds= ^f,
(11.46)
ds= cet£+AR^.
(11.47)
,r
dv
dT
dp
dT
dp,dv
ЛГ%
Учитывая, что -
=
—
=
y+—иcp—c„= AR,
можно выразить d s через две другие пары независимых переменных:
ds=cp^ —AR^,
(11.48)
ds=c»^J+ cPT'
О1- 49)
И з последних трех формул получаем:]
s= I*с„у +ARInг»+ 40,
(II. 47а)
=
jСрЦ—ARInр+40,
(И. 48а)
S=
Jc*7T+so*
(И. 49а)
Если считать теплоемкости cv и ср постоянными, т о , соответственно,
находим, что
5= ^1пГ+Л/?1п^4-50,
(II. 50)
5= срInТ—ARInр
(II. 51)
s= cvInр4“срInv+ S0.
(II. 52)
Фигурирующая в этих формулах величина s0 является произвольной
постоянной.
cp
AR
AR k-\
Имея в виду, что —= k
,
—
=k—1,
—
=
С-у
cv
ср
k
формулы
(II. 50), (II. 51) и (II. 52) можно представить также в виде:
4 = си 1п(7Ч>*-1) + «о>
4 = Ср 1п/+«0>
\ркI
s = cv\n(pvk)+ s0.
Таким образом, оказывается, что энтропия идеального газа при
cv == const и Ср = const пропорциональна (с точностью до произволь
ной постоянной) логарифмам найденных ранее параметров адиабаты
С,С иС".
120
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. 11
Из формулы (И. 46) следует, что
если dq = 0 , то d s — 0 и энтропия 5 остается постоянной;
если dq > 0, то ds > 0 и энтропия 5 увеличивается;
если dq < 0, то ds < 0 и энтропия s уменьшается.
За приведенными словесными выражениями по поводу энтропии
скрывается, как мы видим, тот простой смысл, что при адиабатном
изменении состояния идеального газа некоторые определенные ком-
к—1
бинации термических параметров {(У = p v k>С " =
Тдк“19С" =
Т/рк)
остаются постоянными. Изменить их можно только посредством тепло
обмена с окружающей средой. При этом знак изменения этих ком
бинаций полностью определяется знаком количества теплоты. Таким
образом, указания об изменении энтропии идеального газа содержат
определенные сведения о характере изменения термического со сто я
ния газа при адиабатных и неадиабатных процессах.
Теперь нам остается выяснить вопрос, в чем заключаются пре
имущества интегрирующего делителя Т перец любым другим инте
грирующим делителем (или множителем) и, со ответственно, п реим у
щества функции состояния ^ перед С \ С \ С " или какими-либо
иными параметрами адиабаты. Формулу (II. 46) можно переписать
так:
dq=Tds.
(11.53)
В этом виде формула для «тепловой работы» идеального газа оказывается
аналогичной формуле (I. И ) для механической работы при равномерном
распределении давления: d l — p d v . Э т а аналогия не ограничивается
только внешней формой записи, но затрагивает самое существо
обстоятельств, при которых возникает квазистатический энергети
ческий обмен между газом и окружающей средой:
1) подобно тому как объем газа может быть изменен только
в связи с совершением им механической работы, энтропию газа
можно изменить только посредством сообщения ему количества
теплоты. Напротив, если созданы условия, при которых исключено
изменение объема или изменение энтропии идеального газа, то тем
самым исключена механическая и, соответственно, тепловая степени
свободы газа, т . е . исключена возможность энергетического обмена
газа с окружающей средой в форме механической работы и, соот
ветственно, в форме передачи тепла;
2) подобно тому как неодинаковость давлений в газе и в окру
жающей среде является необходимой побудительной причиной со ве р
шения механической работы, такой необходимой причиной возникно
вения теплопередачи является неодинаковость температур. Напротив,
повсеместное равенство давлений, как и равенство температур,
исключает возможность совершения механической работы и, со о т
ветственно, передачи теплоты. Таким образом, выражения d l — p d v
ГЛ. Ill]
ЧАСТНЫЕ ВИДЫ ПРОЦЕССОВ
121
и d q — l ds отражают общность природы двух рассматриваемых нами
форм энергетического обмена между идеальным газом и окружающей
средой. Вместе с тем, каждое из этих выражений обнаруживает и
специфику, присущую разным формам энергетического взаимодей
ствия, без которой их противопоставление стало бы невозможным.
В связи со сказанным сравним формулу d q = T d s , например,
с формулой
dq= $ rid(Tvb-'),
в правильности которой легко убедиться, выполнив операцию диф
ференцирования и последующие простые преобразования (при
cv = const). Комплекс Тюк~ г = С ' , как мы уже видели, имеет равное
значение с энтропией идеального газа s . Однако комплекс cvj v k-1
по своей физической роли ни в какой степени не походит на тем
пературу Г : неодинаковость этого комплекса не имеет отношения
к наличию или отсутствию теплообмена. Более того, если окружаю
щая среда не является идеальным газом, то вычисление для нее
величины c j v к~ х будет по просту бессмысленным. И з этого примера
еще раз видно, что формула d q = T d s является, действительно,
исключительной по своему физическому содержанию. К ее обсужде
нию мы вернемся еще в третьем отделе, касающемся второго начала
термодинамики.
17.
Тепловая диаграмма и расчетные формулы для энтропии
идеальных газов. Формула (II. 46) и вытекающие из нее частные
формулы имеют большое
практическое значение в свя- ^
зи с возможностью построе
ния на их основе тепловой
диаграммы идеальных газов,
облегчающей решение ряда
задач, в частности выполне
ние расчетов адиабаты при
переменных теплоемкостях
и анализ к. п. д . теорети
ческих циклов двигателей.
Легко видеть, что в ко
ординатах
Г-5 изменение
состояния идеального газа
изображается линией, под
которой площадь дает в со
ответствующем масштабе количество подведенной теплоты (рис. 27),
подобно тому как в координатах p - v аналогичная площадь опре
деляла работу. Если поэтому диаграмма p - v называется рабочей,
то диаграмма Г - $ может быть названа тепловой диаграммой.
Линии, отклоняющейся вправо, в сторону возрастающей энтропии,
отвечает подвод теплоты к газ у. Линии, отклоняющейся влево9 в с т о
122
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. II
рону убывающей энтропии, отвечает отвод теплоты от газа. Адиа
бата изображается вертикальным о трезком, независимо от то го , сч и
тается ли теплоемкость газа постоянной или переменной. Движение
вниз по вертикали сопряжено с расширением газа, так как при
адиабатном расширении температура должна падать. Движение вверх
по вертикали сопряжено с адиабатным сжатием газа. Изотермиче
ский процесс изображается горизонтальным отрезком. При переме
щении вправо по горизонтали мы имеем изотермическое расширение
газа, так как последнее требует подведения к газу теплоты, т. е .
сопровождается увеличением его энтропии. Напротив, перемещение
влево по горизонтали соответствует изотермическому сжатию газа.
Круговой процесс (цикл) идеального газа изображается в тепловой
диаграмме какой-либо замыкающейся на себя линией (рис. 28). П л о
щадь , заключенная внутри этой линии, дает алгебраическую сумму
подведенных количеств теплоты, ко
торая на основании первого начала
равна работе цикла, выраженной
в килокалориях (А/ц):
^ Tds=
= ^Adl=АК
Отношение этой площади к пло
щади, определяющей подведенное
количество теплоты, дает к. п . д .
цикла yj :
Рис. 28.
Такое наглядное изображение к. п . д . ,
чрезвычайно облегчающее
сравнительный анализ циклов, не может быть получено с помощью
диаграммы p - v .
Обратимся теперь к расчетным формулам для энтропии идеаль
ных газов и к некоторым подробностям по поводу изображения
отдельных процессов в тепловой диаграмме.
В технической термодинамике нет надобности знать абсолютную
величину энтропии газа в том или ином состоянии, а достаточно
располагать только разностями энтропии. Поэто му взамен формул
(II. 50), (II. 51) и (II. 52) пользуются, если допустимо теплоемкости
считать не зависящими от температуры, такими:
62 Sl
62 ^'i
42 --- Sl
= с„1п-^ + Л/?1п^,
(II. 50a)
-
Cp^T -ARlafr
(II. 51a)
=c^J^cP]nTl'
(11. 52a)
ГЛ. Ill I
ЧАСТНЫЕ ВИДЫ ПРОЦЕССОВ
123
Иногда бывает удобно для какого-либо фиксированного состояния
газа принять энтропию условно за нуль. Если, например, ввести
соглашение, что при Т =Т0= 273°К и р= р0= 1 am энтропия
идеального газа s = s0 = 0 , то из последних формул мы получим
условное значение самой энтропии в любом другом состоянии:
5= cv1п273“I"
1п9
у
s= cp\n273—AR\np,
s= cv\np+cpln-^f
где v0= RT0/p0= 0,0273 R и p выражено в атмосферах.
При желании учесть изменяемость теплоемкостей идеального газа
от температуры можно практически удовлетвориться подстановкой
в приведенные формулы обычных средних (по температурам) тепло
емкостей. Этот прием математически нестрог, но достаточно точен
в связи с незначительностью температурных изменений величин cv
и ср. Если для последних применимы линейные формулы:
cv= av-f-ЬТ\
ср= арН""
то из (И. 47а) и (II. 48а) можно получить и точные решения:
а-2—5, =
In
+ д(Т2—Г,)+ARIn
,
V- s1= арInif+b(Г,— 7*,)- ARInЬ..
Следует отметить, что здесь теплоемкость должна быть выражена
как функция абсолютной температуры, вследствие чего постоянные
av и ар отнесены к Т = 0 и имеют лишь математический смысл.
Если мы пожелаем воспользоваться формулами для теплоемкостей,
в которые входит температура t, то вместо данных av и ар следует
подставить (av — 273 b) и (ар — 273 Ь), так как, например,
av-\ -bt= av~\ -b(T—273)= (а„ — 273 Ь)+ ЬТ.
И з (II. 50а) и (II. 51а) получаем:
При V = const
•^2
^у»
(II. 54)
при р = const
1 7*2
^2
*^1 Cp\ft у
(II. 55)
при Т — const
Ао—
= ARIn^ = AR\n-^ .
21
P-,
(И. 56)
Эти формулы могли бы быть получены непосредственно из ( II. 46),
так как при изохорном и изобарном процессах мы имеем, соответ-
124
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. II
ственно, dq = cv d T и dq = cp d T , а при изотермическом процессе
dq—Adl—Apdv.
В координатах Т -s (или £-$) изохора и изобара изображаются
линиями с выпуклостью, обращенной вниз (рис. 29). При условии,
что теплоемкости постоянны, эти
линии
являются
показательными.
Линия изохоры идет круче линии
изобары. Это видно, например, из
то го , что подкасательная для любой
точки линии равна теплоемкости.
Действительно,
dq _cdT_^
5sT
ds
*
ds
с
&
§L
£
//
//>
//1
d7’ = ^ .(II.57)
Рис. 29.
------------
Так как cv < ср , то подкасательная
s к изохоре меньше подкасательной
к изобаре, проходящей через вы
бранную точку.
Для построения сетки изохор
и изобар достаточно нанести на
диаграмму только одну изохору и одну изобару. Остальные полу
чаются путем простого смещения исходной линии вправо и влево.
Рассмотрим, например, изобару. Приращение энтропии при изобарном
изменении состояния определяется из
формулы:
т
bsn= (s—
fс„dT
T
°p
pj*•
Поскольку принимается, что тепло
емкость ср является функцией только
температуры, разность ( s — s0)p не
зависит от давления. Если мы про
ведем какую-либо одну изобару
в координатах Г -s , то все другие
изобары должны быть ей эквиди
стантны, т . е . получаться из первой
простым смещением в направлении
оси энтропии (рис. 30). То же са
мое относится к линии изохор, ибо приращение энтропии в опре
деленном температурном интервале при движении вдоль изохоры не за
висит от величины удельного объема, которым изохора характеризуется.
Расстояние в горизонтальном направлении между двумя изобарами
равно участку изотермического процесса, для которого
&st=(s—s0)T=AR\a~ =
—ARIn
.
Рис. 30.
гл. ш]
ЧАСТНЫЕ ВИДЫ ПРОЦЕССОВ
125
Придавая давлению р значения p v р2 и т. д .,
мы можем вычи
слить и изобразить графически величины соответствующих пере
мещений.
При этом очевидно, что переход к более высокому давлению при
неизменной температуре происходит в направлении убывающих энтро
пий, и обратно. Н а рис. 30 приведен масштаб, с помощью которого
можно определить величину перемещения для любого заданного о тно
шения давлений р/р0. Разумее тся , абсолютная величина перемещения
не изменяется при переходе от сжатия к расширению между теми
же давлениями р0 и р .
Таким же точно образом определяется перемещение изохорных
линий, ибо ДsT может быть выражено также в виде Дs2 = AR\nvjv0.
Разница заключается только в том, что здесь при переходе к боль
шему объему перемещение должно быть совершено вправо от началь
ной изохоры.
Остается теперь условиться, какие изохоры и изобары мы будем
считать начальными. Примем, что начальные изохора и изобара пере
секают ось температур в точке, для которой Т = 273° К- Иными
словами, будем полагать, что при объеме v 0 и давлении р0 энтропия
обращается в нуль на уровне температуры тающего льда. В таком
случае энтропия в любой точке начальной изобары будет о преде
ляться из выражения:
**L
Lp т1
278
(а)
которое может быть вычислено, если известен закон изменения ср
с температурой. Совершенно аналогичным образом устанавливается
конфигурация начальной изохоры. Указанное соглашение о способе
проведения линий р = р 0= const и ^ = ^0 = const принято при по
строении диаграммы t - s f (см. приложение).
Свойство эквидистантности изохорных и изобарных линий в ко
ординатах T -s избавляет нас от необходимости загромождать д и а
грамму большим количеством кривых р = const и v = const. Распо
лагая одной лишь парой исходных линий и масштабом для переме
щений при переходе к другим давлениям и удельным объемам, можно
производить все те графические подсчеты, которые допускаются пол
ными диаграммами. Описанный принцип построения диаграммы обла
дает лишь одним существенным недостатком, а именно: изобары и
изохоры различных газов, а также и масштабы для перемещений не
совпадают друг с другом. Поэтому при оперировании с газовыми смеся
ми необходимо пользоваться одновременно несколькими диаграммами.
Легко видеть, что в известной степени этот недостаток может быть
устранен, если только принять, что двухатомные газы обладают прак
тически совпадающими мольными теплоемкостями. При этом, умножив
ИДЕАЛЬНЫЕ ГАЗЫ
126
[ОТД. I!
выражение (а) на у , мы получаем универсальную для этих газов
расчетную формулу
т
с__Г
dT
H'fyo
JWp-p•
273
В нормальных условиях объем одного моля газов равен 22 ,4 м3.
Таким образом, относя энтропию к 1 м3 газа при нормальных у сл о
виях, имеем:
т
1
22,4
273
В соответствии с этим формулы (II. 26) переписываются таким
образом:
<-K
= c'vm f-+ 0,0887In%- = с'рin-р-4 -0,0887In— =
Т\
р2
Если мы построим начальную изобару в координатах Т- s ' для
какого-либо одного двухатомного газа, то она будет справедлива
для всякого другого двухатомного газа (поскольку правильна пред
посылка об одинаковости рСр). Э т о же относится и к изохорам. Так
как технические газы обычно состоят из азота, кислорода, окиси
углерода, углекислоты и водяного пара, то в диаграмме Т- s ' до
статочно нанести три пары кривых: одну общую для воздуха, N2, 0 2
и СО, вторую для С02и третью для Н20, что и сделано на диа
грамме (в приложении).
Это т прием позволяет вместе с тем применять один общий для
всех газов масштаб перемещений, так как, например,
А4= (s'-s'0)T=
l*(s — S0)t
22,4
АрЛ, Po
In—
22,4
1,986
p0
2»31g y -
22,4
Us' = 0,2041g^ = 0,204lg—
Линии изохор на диаграмме смещены вправо от изобар в целях
большей наглядности. В связи с этим величины энтропий для изохор
следует отсчитывать от нуля, помещенного под осью абсцисс.
Энтропию смесей газов, отнесенную к 1 нм3, следует подсчитывать
по формуле
s' = г,2-ат
2-пт +Г <СОа 5СО* +
']Н,0 *Ha0‘
Энтропийная диаграмма может применяться для перенесения про
цесса любой конфигурации из координат p - v в координаты T -s . Если
в какой-либо начальной точке Л известны все три параметра состоя-
гл. Ill]
частные виды процессов
127
ния, т о , пользуясь изображением процесса в координатах p - v ,
можно подсчитать температуру в любой другой точке из уравнения:
Т= Т0
ру
РоУо ’
Полагая условно, что точка А расположена на изобаре р0> нане
сенной в нашей диаграмме Г - s , мы находим следующую точку
заданного процесса таким образом. Сначала мы по
логарифмическому масштабу устанавливаем отре
зок тг, соответствующий выбранном^ отноше
нию р !р 0, и затем от точки С (на уровне извест
ной температуры Т) откладываем этот отрезок
в надлежащем направлении (рис. 31). Конец его,
обозначенный буквой В , отвечает искомой точке.
Разумеется , поставленную задачу можно было бы
решить аналогичным путем, отправляясь от начер
ченной в энтропийной диаграмме изохоры.
Задача. Построить в прямоугольных координа
тах Г-s изобары для воздуха, соответствующие 1.
10и0,1 am,принявs=0при£0=0°С ир0=1am.
Построение произвести по точкам, отстоящим на 300° С ,
в пределах от 0 до 1500° С . Теплоемкость считать
линейной функцией от температуры.
Тепловая диаграмма чрезвычайно удобна для быстрого опреде
ления адиабатных изменений состояния идеальных газов. Е сл и, на
пример, заданы начальная температура газа t0 и отношение давлений
PiPo — ^y то соответствующая сте
пень сжатия (расширения) e =
и конечная температура t могут быть
при условии адиабатности процесса
найдены следующим образом (рис. 32).
Положим условно, что показан
ная на диаграмме изобара отвечает
давлению />0, вследствие чего началь
ное состояние процесса изображается
точкой А . В таком случае конечная
точка В адиабаты должна лежать на
той изобаре р , которая смещена о т
носительно первой изобары на о тре
зок 7г, взятый из логарифмического
м асш таба. Совершенно очевидно, что
температура t может быть графически найдена без помощи изобары р .
В самом деле, нужно лишь от точки А отложить в соответствующем
направлении отрезок тг и через найденную точку D провести верти
каль до пересечения с изобарой р0. Точки С и В лежат, разумеется,
на одном и том же температурном уровне /.
128
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. II
Не менее просто можно найти степень сжатия. Для этого через
точки А и С проводят горизонтали до пересечения с изохорой v 0
в точках А' и С . Отрезок В'С или равный ему отрезок A'D ' сно
сят на логарифмический масштаб, где прочитывается значение и ско
мойе=vv0.
Численный пример показан на диаграмме t - s ' , помещенной в при
ложении. Заданы начальная температура воздуха /о = 1580°С и от
ношение конечного давления к начальному p jp 0 = Vio- При условии
адиабатности процесса находим, что конечная температура t = 7 7 0 ° С .
Соответствующая степень расширения е = 6 ,3 . С помощью той же
диаграммы определяется изменение энтальпии и внутренней энергии:
/'— /'= A'D —СЕ=300нкал/нм*,
и[—и'—A'D'—СЕ'=
230 ккал/нмъ.
Последнее число определяет также работу расширения, так как
при адиабате А1' = а,1— и'.
Для пересчета величин на 1 к Г газа
нужно, как обычно, воспользоваться нормальным удельным весом.
18. Политропные процессы. Отправной точкой при изучении
термодинамических процессов в машинах обычно является индика
торная диаграмма, т . е . изображение цикла в координатах p - v .
Известно , что небольшие отрезки любых кривых линий могут быть
аналитически выражены уравнениями степенного вида. В частности,
всегда можно выбрать такое число я , при котором уравнение
p Vn — const достаточно близко воспроизводило бы разнообразные
встречающиеся в практике линии индикаторных диаграмм. Если вся
заданная кривая, от начала до конца, не может быть выражена единым
уравнением p v n = co nst, ее можно разбить на несколько интервалов,
каждый из которых характеризуется своим показателем п . Вследствие
этого применение уравнения p v n = const, где п может быть любым,
но постоянным в некотором интервале числом, дает в руки почти
универсальное средство для изучения индикаторных диаграмм. С о в о
купность процессов, описываемая этим уравнением, называется по-
литропной, от греческих слов: поли — много, тропос — путь, на
правление.
Очевидно, что при некоторых частных значениях показателя
политропы уравнение p v n = const должно превращаться в те урав
нения, которые были нами установлены для простейших термоди
намических процессов. Действительно, полагая в уравнении
pvn — const
(11.58)
п= 0, имеем pv° = p = const, т. е. изобару,
л = =+ioo, имеем pv±OQ= const, или p±<x>v = v = const, т. е. изо
хору,
я = 1, имеем pv = const, т. е. изотерму,
п= k = cp/cvtимеем
= const, т. е . адиабату.
r;i. ш]
ЧАСТНЫЕ ВИДЫ ПРОЦЕССОВ
129
Чрезвычайно важно уяснить связь между величиной показателя
политропы и конфигурацией последней в координатах p - v . Н а
рис. 33 показаны основные и промежуточные случаи политропных
Рис. 33.
Рис, 34.
процессов. Закон изменения показателя как функции направления
процесса представлен на рис. 34 в виде годографа. Для ориенти
ровки на рисунке проведена помимо линий изобары и изохоры еще
касательная к изотерме. Длина
лучей пропорциональна показате
лю п в соответствующем направ
лении.
Область,
ограниченная
сплошной линией и вертикалью,
соответствует положительным зна
чениям п .
Пунктир ная линия, ограничи
вающая область отрицательных
значений //, симметрична сплош
ной линии относительно верти
кали. Объясняется это тем, что
в координатах p -v подкасатель
ная для любой точки политропы
равна — v jk (для адиабаты под
касательная равна — v/k). Лучи ,
симметричные относительно вер
тикали, имеют при одинаковой абсциссе v одинаковые по абсолют
ной величине, но противоположные по знаку подкасательные. Значит,
соответствующие показатели политропы отличаются друг от друга тоже
только по знаку.
9 Зяк. 3513. В. С . Жуковский*
130
ИДЕАЛЬНЫЕ ГАЗЫ
(ОТД. II
На рис. 35 показано примерное очертание типичных политропных
процессов в координатах T -s (пунктиром обозначено сжатие). Полезно
обратить внимание на т о , что узкая серповидная область между
процессами изотермического и адиабатного расширения в ко о р
динатах p - v занимает в координатах T -s целую четверть. Противо
положное преобразование испытывает область между изохорой и
изобарой. Соответствующий годограф показателя политропы п показан
на рис. 36.
Рис. 3(3.
Уравнение политропы совпадает по форме с уравнением адиабаты.
Поэто му все математические выводы, основанные на применении
уравнения p vk = co n s t, могут быть непосредственно перенесены на
политропный процесс, если показатель k заменить числом п. Так,
уравнения политропы в координатах v - T и р -Т подобны уравне
ниям (II. 42) и (II. 43), а именно:
Tvn~1 = const,
Т
га- 1
к
Р
= const.
(II. 59)
(II. 60)
гл. ml
ЧАСТНЫЕ ВИДЫ ПРОЦЕССОВ
131
То же самое относится к выражениям для работы:
7 ________^
.(Т
т\___Pivi P-v
-
h,4 —
iVi-l*)--------л —
-1
’
(И. 61)
»-1
-(5 Г 1 -^['-(й)*]- <аб2>
Изменение внутренней энергии при политропном процессе опре
деляется, как обычно для газов, из формулы:
и2
и\= cv (Г2 7Д
а количество подведенного тепла на основании первого начала как
= ия—
Однако это количество теплоты можно определять и иначе,
прибегая к представлению о теплоемкости политропного п роцесса.
Как было неоднократно отмечено, теплоемкость зависит от вида
процесса. Каждому элементарному процессу, начинающемуся в некото
рой фигуративной то чке, соответствует свое значение теплоемкости.
Из бесконечного числа значений, какие может принимать теплоемкость,
нами были выделены два характерных, соответственно изменению
состояния при постоянном объеме и при постоянном давлении.
Всякому политропному процессу должна отвечать также некоторая
специфическая теплоемкость. Найдем ф ормулу, связывающую тепло
емкость политропы с с ее показателем п.
Имеем: dq= cdT\ с другой стороны, dq= cvdT-\ -Apdv. Выра
зим p d v через температуру. Так как
npdv-\ -vdp= 0 и pdv-\ -vdp= RdT,
to
pdv(l—n)=RdT и pdv= \i~~n •
Следовательно,
cdT=cvdT^^dT
И
C= C„
Cp Cv
1—П
ncv—cp
n—1
cv
n—k
n—1 (II.63)
Легко убедиться в том, что при соответствующем выборе числен
ных значений п формула (И. 63) приводит к величинам теплоемкости
Аля рассмотренных ранее частных термодинамических пр оц ессов. Так
например, при
« = 0 (изобара)
£
I
I
I
I
п= ± оо(изохора) с= с,,•1= <7,
п = \ (изотерма)
1—к
c=
=СО,
п — k (адиабата)
к—k
п
с-с"к-1
-
°-
132
ИДЕАЛЬНЫЕ ГАЗЫ
|ОГД. II
Теплоемкость политропы с является функцией от температуры
в такой же мере, как и cv. Если принять теплоемкость с вместе
с cv за постоянную, то политропному изменению состояния газов
можно приписать некоторый специальный физический смысл. Так как
Adl—dq—du= (с—cr)dTy
то
Adi
dq
с
cv
с
(II. 64)
Правая часть равенства определяется исключительно свойствами
газа и величиной показателя п. Следовательно, вдоль всякой поли
тропы идеального газа при условии постоянства теплоемкостей отно
шение A dljdq оказывается по
стоянным, т. е. во внешнюю р а
боту превращается повсеместно
одна и та же доля от подводи
мого количества теплоты.
Указанное обстоятельство ино
гда кладут в основание определе
ния политропы. Этим, однако,
практическая роль политропы в
деле изучения действительных тер
модинамических процессов силь
но принижается, так как игнори
рование изменений теплоемкости с
с температурой, вообще говоря,
недопустимо. Н о если принять,
что cv= /(/), то Adljdqф0.Та
ким образом, нерационально свя
зывать возможность применения
уравнений политропы с требова
нием, чтобы отношение A d ljd q
было постоянным числом в течение
всего процесса. Наоборот, вполне
естественно прибегать к представлению о политропном изменении с о
стояния как о процессе, уравнение которого есть p v n = co n st, с целью
более или менее приближенного описания многообразных явлений,
протекающих в тепловых машинах. При этом никакой потребности
в идеализации газов в отношении свойств теплоемкости cv не возникает.
Связь между теплоемкостью политропы и характером процессов,
берущих начало в некоторой произвольной точке, представлена
наглядно на рис. 37. Последний по принципу построения аналогичен
рис. 34. Концы лучей, пропорциональных положительным значениям с ,
соединены сплошной линией. В области, лежащей между изотермой
и адиабатой, 1 < п < &, вследствие чего теплоемкость с отрицательна.
В соответствии с этим ее годограф изображен пунктиром.
гл. ш]
ЧАСТНЫЕ ВИДЫ ПРОЦЕССОВ
133
Отрицательные значения теплоемкости c = d q jd T объясняются тем,
что знаки dq и d T в указанной области различны. Так например,
при сжатии, проходящем между изотермой и адиабатой, температура
возрастает, т. е . r f T > 0 , тогда как тепло отводится во внешнюю
среду, т. е . dq < 0. Иными словами, нагревание происходит не за
счет сообщения теплоты, а вследствие затраты извне механической
работы, количество которой настолько значительно, что часть ее даже
возвращается обратно в виде теплоты.
Признаки процессов, отличающихся отрицательными теплоемко
стями, особенно наглядно усматриваются с помощью диаграммы Г -6 .
На рис. 38 приведен годограф теплоемкости в координатах T - s .
Сплошные и пунктирные линии симметричны относительно горизон
тали, так как подкасательная к линии политропы в этих координатах
равна, согласно (II. 57), теплоемкости с. Поскольку тангенсы угла
наклона лучей, симметричных относительно горизонтали, отличаются
друг от друга только знаком, со ответствующие теплоемкости политроп
также отличаются только знаком.
19. О подборе политропы. Для нахождения показателя политропы
по заданной кривой процесса в координатах p - v весьма удобно поль
зоваться графическим способом. Сущность его заключается в следую
щем. Логарифмируя почленно уравнение политропы, имеем:
lgp+/*lgt/ = const.
Следовательно, в координатах y = \gp и x = \gv политропа изобра
жается в виде прямой линии с угловым коэффициентом, равным п.
Обратно, если ряд фигуративных точек в логарифмической анамор-
134
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. II
ф о зе 1) координат р и v определяет собой прямую, то соответствующее
изменение состояния является политропным, так как подчиняется
уравнению p v n — co nst, где п равен тангенсу угла наклона прямой;
п = IgPi—tePa
Ig^—Ig^i *
Для примера на рис. 39 нанесена в логарифмическом масштабе
кривая, соответствующая процессу расширения в некотором газовом
двигателе. Как видно, эта кривая весьма
незначительно отклоняется от прямой линии.
Вследствие этого процесс расширения может
быть отнесен к категории политропных изме
нений состояния, причем средний показа
тель / / = 1 ,3 2 . Полезно обратить внимание
на то , что при определении угла наклона
в логарифмической анаморфозе не играет роли
выбор масштаба для самих величин р и г>.
Поэто му для построения логарифмической
анаморфозы с указанными целями можно
исходить из непосредственно измеряемых к о
ординат точек в диаграмме p - v без предва
рительного пересчета их в кГ/м2 и мг)кГ .
Существует и другой способ определения п. Подобно адиабате,
подкасательная в любой точке политропы равна v jn (п входит вместо k).
Таким образом, измеряя длину подкасательной, можно узнавать мест
ные значения п в различных точках предложенного графика. Однако,
не говоря уже о затруднительности точного проведения касательных,
указанный прием неудобен по тому , что не дает непосредственного
критерия, на каком протяжении можно считать заданную линию
политропной. М еж ду тем практическое значение политропы заклю
чается не в том, что она может подойти для описания бесконечно
малых изменений состояния, а в ее пригодности для более или менее
крупных этапов рабочего процесса.
О роли погрешности в определении показателя п можно сказать
следующее;
1) Если при нахождении показателя политропы совершается не
которая ошибка, то приблизительно такого же порядка ошибка имеет
место при вычислении работы и при воспроизведении кривой пр о
цесса в координатах p-v и T-s .
2) Погрешность в определении количества теплоты при обычных
значениях величин п и степени расширения (сжатия) во много раз
превышает погрешность в определении показателя.
Рис. 39 .
*) Анаморфозой (прямолинейной) в номографии называется преобразова
ние кривой посредством такой функциональной сетки, в которой кривая
линия выпрямляется.
IV!. Ill|
ЧАСТНЫЕ ВИДЫ ПРОЦЕССОВ
135
Таким образом, сведение реальных процессов к политропным
изменениям состояния отнюдь не является полноценным средством
их всестороннего изучения. Удовлетворительно разрешая вопрос
о воспроизведении элементов индикаторной диаграммы, оно практи
чески непригодно для установления картины обмена тепла с о к руж а ю
щей средой. Поэтому анализ индикаторной диаграммы с точки зрения
теплового баланса требует специальных приемов исследования.
Вместо выполнения логарифмической анаморфозы координат р u v ,
позволяющей установить, является ли исследуемый процесс с практи
ческой точки зрения политропным, и в положительном случае о пре
делить подходящее значение показателя п 9 часто пользуются другим,
еще более простым методом решения задачи.
Эт о т метод не предполагает исследования характера течения дей
ствительного процесса, а служит лишь для получения опорных точек
в индикаторной диаграмме. Заключается он в том, что по двум
известным крайним точкам процесса вычисляется показатель той
политропы, которая проходит через эти две точки. Определяемая
таким образом политропа, конечно, может оказаться мало похожей
на заданный процесс. Воспроизводя точно конечную точку процесса
по начальной, эта политропа во всем остальном приводит к данным,
о верности которых заранее ничего не известно. В частности, может
оказаться несовместимой с истинной работа политропного п роц есса,
не говоря уже о количестве теплоты. Поэтому указанный прием не
может быть рекомендован к употреблению.
Уравнение p v n = const служит для приближенного описания реаль
ных процессов. Степень приближения становится тем большей, чем
точнее исследуемый процесс преобразуется в прямую линию в коор
динатах \gp и
Если весь процесс в целом единой прямой не
образует, его можно разбить на две-три части, подобрав к каждой
из них подходящую политропу. При всяком спрямлении линии суще
ствует известный произвол, который должен в дальнейшем сказы
ваться на численных результатах применения различных формул.
Спрашивается, в какой мере некоторая неопределенность величины
показателя п влияет на достоверность вычислительных выводов, принимая
во внимание, что сама задаваемая зависимость между р n v устанавливается
с помощью
измерительных приборов, неизбежно вносящих известные
ошибки?
Положим, что некоторый процесс признан политропным, причем пока
затель политропы определен с точностью до 1%, т. е . Ьп/п = 0,01. Погреш
ность в определении п в действительности должна быть во всех случаях
более высокой хотя бы потому, что самый прибор для записи диаграммы
процесса — индикатор — отличается меньшей точностью. Поэтому можно
считать, что назначенная точность в определении п является едва ли
когда-нибудь достигаемым оптимумом.
Будем полагать, что начальная точка процесса, которую мы обозначим
индексом 0, задана со всей возможной тщательностью тремя параметрами:
р, v и Г. Независимой переменной при изменении состояния будем считать
удельный объем v , который может быть измеряем с произвольной точностью.
ИДЕАЛЬНЫЕ ГАЗЫ
136
[отд. 11
В связи с этим давление и температура вдоль политропы могут быть вычи
слены из уравнений:
р=р0г”
И
где e = i/0/t/ в случае уменьшения объема называется степенью сжатия (0 >1),
а в случае увеличения объема — степенью расширения (е<1).
Абсолютная ошибка в определении р и Т находится путем выполнения
операции, аналогичной дифференцированию, если в качестве переменной при
нять показатель политропы п. Имеем:
Ьр=
Ins•Ьп и
оГ=Г0г"-Чиг•Ьп.
Относительная ошибка соответственным образом определяется из выра
жений:
Ьр,
f
Ьп
—
= In£•on=sпInг----
ЬТtЬп
—
=
/tin £ ----- .
Т
п
Приняв, для примера, что я =1 ,2; е= 10 и bnjn = 0,01 (как было ука
зано ранее), получаем:
^
~
=
1,2 •2 ,3 •0,01 = 0,0276 = 2.760/,,.
Значения для п и е, взятые в численном примере, характерны для прак
тических приложений. Из приведенного расчета видно, что относительная
погрешность в определении давления и температуры обычно превышает при
мерно в два-три раза относи
тельную погрешность в опре
делении показателя п. О пре
деление величины ошибки мо
жет быть легко произведено
с помощью графика, изобра
женного на рис. 40. По верти
кали отложены отношения от
носительных погрешностей
=Д7
pin r
Tin
как функции г при нескольких
значениях показателя п, лежа
щих в пределах от п= I до
п= k.
Обратимся теперь к вычислению относительной погрешности в опреде
лении работы при политропном процессе. Из формулы
Рис. 40.
1=
(1 _ е«-1)
/I--14
'
находим:
5/“ ¥ =2т(-
1— ,Я-1
■е^-1In8)Ьп,
(
I
ь^-Чпе^
(пгП-1\т\г
п
,Ьп
\~П^\ ~1-е ’1-1)bn=*\7n-i —1
>ЛЯЯ
Ы
1"V 100.3—1
Подставляя я = 1,2, г = 10 и Ьп/п= 0,01, находим:
'1,2- 10о,а.2 .3
(7.48 - 6.00)•0 ,01 .0 .0148 =» 1,48%.
ГЛ. HI)
ЧАСТНЫЕ ВИДЫ ПРОЦЕССОВ
137
Еслил= 1,2, е=0,1 и ол/л=0,01,то
Ь/
(
1,2 - Юо.з
•2,3
1,2
' 0,2
I— = (+4,72- 6,00)—=
—
0.0128=-1,28%.
п
п
Юо.з
Перемена знака погрешности при переходе от политропного сжатия
к расширению легко объясняется при рассмотрении графиков процессов:
увеличение показателя л при сжатии обусловливает увеличение отрицатель
ной работы, а при расширении — уменьшение положительной работы.
Абсолютная погрешность
в
обоих
случаях представляет собой вели
чину того же порядка, как и погрешность в определении л. Отношение
Ы /Ьп
„
у / — мало зависит от величин л и е, вследствие чего найденный результат
является характерным для величины погрешности при вычислении работы.
Совершенно иные отношения имеют место при вычислении количества
тсилоты. Так как q= c(T—Г0), то
Ьд_Ъ(Т-Г0).5с
Я~Г-Г0+с
Ь(Г— Г0)_ Т0гП-1|пг
__
яеП-11Пеg,/
Т-Г0“ Г0(е^“1—1) П""еП-1
—
1Щ’
t/л—k\
~
Cvb(,7^-ТJ~Cv
л—1
—
л-+•к
ос
с
k—1
Ьп=
(Л—1)2 5,1“ С"
*—1
8л
oq __ Гле^-Мп s
~q
Iiw-i
—
1
6—1
15/1
o-oO-l)'"
6-1
(n-lf5/1,
Принимая и = 1 ,2 , £=10, 6=1,4 и Ьп/п = 0,01, имеем:
Ч
------
'
0,01 = (7,48 — 11,98) •0.01 = -
0,045= -4,5%.
“ О-га) 1
При тех же данных, но при е = 0,1, имеем:
Ц- = (4.72— 11,98)•0,01 = — 0,0726= — 7,26%.
На рис. 41 в графической форме показано решение этого уравнения
при трех значениях показателя л(л = 1,1; 1,2 и 1,3).
Если показатель п мало отличается от показателя адиабаты 6, то по
грешность в определении количества теплоты может достигнуть громадной
величины. Так, при п =■ 1,3 и е = 10 ошибка в определении количества теплоты
превосходит в 11 раз ошибку в величине показателя политропы.
Точность определения становится еще меньшей при расчетах, относя
щихся к политропному расширению.
То обстоятельство что при л, лежащем между единицей и показателем
адиабаты 6, малая вариация Ьп слабо отражается на величине работы и очень
сильно — на величине количества теплоты, видно при сопоставлении диа
грамм p -v и T -s . Если в первой из них будет проведена линия политропы,
на волосок смещенная от какой-либо исходной линии, то на площади под
линией это отразится незначительно. Иное положение имеет место в диа
138
ИДЕАЛЬНЫЕ ГАЗЫ
[ОТД. II
грамме T-s . Так как узкая серповидная область диаграммы p -v , ограниченная
изотермой и адиабатой, преобразуется здесь в целую четверть, то малое
смещение политропы в первой из них дает вполне ощутимое смещение во
второй. Поэтому и площадь, лежащая под линией процесса в координатах
T-s, оказывается весьма чув
ствительной к вариации пока
зателя л. Это особенно сказы
вается при малом отличии по
казателя политропы от к, так
как вариация площади должна
при этом сопоставляться
с
исходной площадью, которая
близка к нулю.
Задачи. 1. Воздух при
р1= 4 am иtx= 25°С приво
дится к давлению р2—\ат по
средством
процесса: а) при
i/=const, b) при * = const; с) ади-
абатно, d) политропно при п = 1,2; е) политропно при п = 1,5. Найти для каж
дого случая конечную температуру, совершенную работу и подведенное тепло,
рассчитывая на 4 к Г воздуха. Изобразить взаимное расположение линий
в диаграммах p -v и T-s . Теплоемкости считать постоянными, отнеся их к 0 °С .
Ответ. а) *2= — 198°С, q1% =38 ,3 ккал/кГ; Ь) /1#3= 12100 кГм/кГ,
Я\я= 28.4 ккал/кГ; с) /2= — 72°С,/1>2= 7140 кГмкГ; d) *2= — 37°С.
Рис. 41.
/13= 9050 кГм/кГ, ql3= 10,6 ккал/кГ; е) /2= — 86°С, 112 = 6530 кГм/кГ,
qjа= — 3,8 ккал\кГ.
2. Воздух расширяется политропно, начиная от р х = 10 am и t\ = 527°С ,
производя при этом работу 10000 кГм !кГ . Подведенное тепло равно поло
вине указанной работы. Определить показатель политропы п и конечные па
раметры процесса. Теплоемкость считать постоянной.
Ответ: v2= 0,362 м?/кГ.
3. Газовая смесь состоит по весу из V4 светильного газа и 3/4 воздуха
прирх= 10 am, tx= 30°С,
^=0,1м*.
Смесь нагревается изобарно до
/2= 800° С , затем расширяется политропно до первоначальной температуры
при л = 1,4. Определить произведенную работу, подведенное тепло, прира
щение внутренней энергии и приращение энтропии. Построить процесс в ко
ординатах p-v и T-s. Для светильного газа /?= 72 кГм/кГ•град, k = 1,33 и
для воздуха cv = 0,172 ккал\кГ •град.
Ответ. Q1>3= 242+ 13,3 = 255,3 ккал.
4. Политропное расширение воздуха происходит при л = 1,36 от tx= 1400
до /2= 300° С . Сравнить величины количества теплоты, вычисленные без
учета и с учетом изменения теплоемкости с температурой.
ОТДЕЛ ТРЕТИЙ
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
ГЛАВА I
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
ДЛЯ КВАЗИСТАТИЧЕСКИХ ПРОЦЕССОВ
1.
Содержание вопроса. Руководящим принципом в предыдущем
изложении являлся закон сохранения и превращения энергии и его
частное выражение — первое начало термодинамики. Принципом
этим утверждается в конечном счете ьзаимопреобразуемость различных
форм движения материи, устанавливается общая мера движения в при
роде, выявляется количественное постоянство движения при все воз
можных изменениях его качества. Естественным образом возникает
потребность выявления не только единства движения, говоря точнее,
взаимопревращаемости и эквивалентности разных форм проявления
энергии, но также и специфических особенностей, которые присущи
одним из них, но не свойственны другим. Для этой цели можно и
должно обратиться к изучению внутренней природы тех или иных
форм проявления энергии, к рассмотрению их механизма на основе
микрофизических теорий. Однако наряду с таким микрофизическим
анализом следует также найти пути для решения вопроса одними
только макрофизическими средствами. Второе начало термодинамики
и представляет собой широкое обобщение особенностей теплоты,
обнаруживаемых при макрофизическом подходе к явлениям природы.
Особенности теплоты формулируются вторым началом термо
динамики под двумя углами зрения. Прежде всего устанавливаются те
особенности, которые существенны при квазистатических изменениях
состояния рабочего тела, затем выявляются и те особенности, которые
придают теплоте исключительное положение в условиях реальных,
нестатических процессов. Этим раздвигаются узкие рамки теории
квазистатических процессов и открывается возможность в известной
мере приобщить количественное изучение реальных процессов к изут
чению предельных явлений, какими только, казалось бы, способна
заниматься термодинамика. Очевидно, такая возможность имеет боль
шое теоретическое и практическое значение.
П оско л ьку происхождение и начальное развитие термодинамики
обязаны экономической потребности создания промышленного тепло
вого двигателя, второе начало, в исторической перспективе, о ка-
140
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. III
залось переплетенным с вопросами теории тепловых машин. Характерно
и т о , что в классическом построении второго начала существенную
роль играют свойства газов, как наиболее простых и ранее всех
других изученных тел.
Известен факт, что к . п. д . наиболее совершенных тепловых
двигателей и теплосиловых установок невелик, едва достигая вели
чины порядка 50% . Разумеется, на рубеже X IX столетия соответ
ствующий предел был еще во много раз ниже. Возникает во прос,
является ли столь невысокая экономичность тепловых двигателей
следствием их технического, а следовательно, преходящего несо
вершенства или здесь сказываются обстоятельства принципиального
характера, ограничивающие возможность осуществления произвольно
больших к. п. д.
Первое начало термодинамики ограничений в отношении величины
к. п. д . не ставит, допуская полное превращение в механическую
работу всего количества теплоты, подводимого извне к рабочему телу.
Для реализации кругового цикла с к. п . д . , равным единице, сле
довало бы на одном из участков цикла подводить к рабочему телу
тепло, обеспечив на остальных участках адиабатное протекание про
цессов . Схематизируя принцип работы такого идеального двигателя,
можно было бы сказать, что непрерывное его действие нуждается
лишь в наличии одного источника тепла произвольной температуры.
Легко видеть, что последствия, которые вытекают из подобного
положения вещей, были бы необозримы. Действительно, из о к р у
жающей нас атмосферы, земной коры, водных бассейнов можно
было бы черпать практически неограниченное количество теплоты.
Исли бы э ту теплоту было возможно преобразовывать в механи
ческую работу, то была бы разрешена проблема создания бесплат
ного теплового двигателя непрерывного действия. Эконом ическое зна
чение такого двигателя было бы равносильно изобретению вечного
двигателя, аналогичного то му , который отвергается законом с о х р а
нения энергии. Вечный двигатель, не противоречащий первому
началу, но представляющий периодически действующий механизм,
в котором рабочее тело совершает внешнюю работу, вступая в теп
ловой обмен с одним единственным источником тепла, называется
вечным двигателем второго рода. П о определению, вечный двигатель
второго рода должен обладать к . п. д . , равным единице.
Каким бы образом ни обосновывать второе начало термодинамики,
приходится признать, что осуществить вечный двигатель второго
рода невозможно. Нуж но отметить, что это фундаментальное поло
жение теории тепловых машин было высказано еще Карно в 1824 г.
Однако в то время Карно не преодолел заблуждений, вытекавших
из теплородной гипотезы, вследствие чего его аргументация п о д
верглась в дальнейшем существенному пересмотру.
Принцип исключенного вечного двигателя второго рода, выра
женный в той или иной модификации, часто кладется в основание
ГЛ. I]
ВТОРОЕ НАЧАЛО ДЛЯ КВАЗИСТАТИЧЕСКИХ ПРОЦЕССОВ
14I
второго начала термодинамики. Э то сделаем и мы, внеся в изложение
предмета некоторые отклонения от стандартных образцов, вызванные
необходимостью критически отнестись к историческому наследию.
2.
Обратимость
и необратимость. Прежде чем приступить
к изложению второго начала термодинамики, необходимо предвари
тельно ввести понятия об обратимых и необратимых пр оцессах .
Процессу выполняемый некоторым телоМу называется обра
тимым, если физически допустимо вообразить возвращение 3 mozot
тела к исходному состоянию одновременно с приведением всех
взаимодействующих с ним тел также к своим исходным состоя
ниям . В противном случае процесс называется необратимым.
Квазистатичность процессов, протекающих в системе взаимодей
ствующих тел, обеспечивает обратимость изменений состояния для
каждого из тел, входящих в систему. Для иллюстрации можно обра
титься к примеру очень медленного сжатия газа в теплоизолированном
цилиндре (см. п. 13 первого отдела). Поставим задачу по окончании
сжатия привести газ к исходному состоянию. Очевидно, это можно
сделать путем поочередного сбрасывания с поршня тех малых гирек,
которые прежде были использованы для сжатия. Вслед за снятием
последней гирьки исходное состояние будет восстановлено, причем
газ отдаст точно такую же работу, какую было необходимо затра
тить вначале на сжатие. Следовательно, сжатие обратимо, поскольку
можно представить себе такое расширение, в результате которого
ни в газе, ни в окружающей среде не останется каких-либо следов
протекших в системе процессов.
Легко видеть, что сжатие при движении поршня с конечной ско
ростью является необратимым. В этом случае внешняя работа,
затрачиваемая на сжатие, будет превышать работу квазистатического
сжатия. Напротив, внешняя работа при расширении окажется меньше
или, в лучшем случае, равна работе квазистатического процесса.
Таким образом, если вслед за произведенным быстрым сжатием
вообразить даже бесконечно медленное расширение, газ не будет
в состоянии вернуть в полном количестве р або ту , какая прежде
была затрачена для быстрого сжатия, что указывает на неизбежность
остаточных изменений как в газе, так и вне е го . Действительно,
согласно первому началу, если Q = 0 , то \AL\ = Ш . Следовательно,
несмотря на восстановление объема, внутренняя энергия газа о к а
зывается изменившейся в сторону увеличения. Не вдаваясь в излишние
здесь подробности, мы все же можем сказать, что равновесная тем
пература газа после обращения процесса возросла. Для возвращения
газа к исходному состоянию не только в отношении объема, но
и по всем прочим признакам необходимо понизить внутреннюю
энергию при закрепленном поршне. Э то может быть достигнуто
снятием тепловой изоляции газа и отнятием от него тепла в коли
честве, эквивалентном совершенной ранее внешними силами работе.
Однако в таком случае во внешней среде, взаимодействующей
142
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. Ш
с газом, неизбежны последствия в виде понижения уровня некото
рого количества гирь и соответствующего увеличения внутренней
энергии за счет отнятого от газа тепла. Эти последствия могли бы
быть сняты только в результате привлечения каких-то новых тел,
не участвовавших в первоначальной схеме. Таким образом, неста
тическое сжатие является необратимым.
Высказанные соображения легко распространяются на явление
теплообмена. Наличие в каждый данный момент лишь бесконечно
малых температурных разностей в пределах системы обусловливает
ее квазистатичность и тем самым обратимость процессов для ка
ждого из компонентов системы. При действии конечных температурных
разностей справедливо противоположное заключение.
3.
Цикл Карно и его свойства при использовании идеального
г а з а . Развивая свои мысли о принципиально необходимых условиях
действия тепловых двигателей, Карно предложил рассмотреть к р у
говой процесс, осуществляемый
следующим образом.
Рабочее
тело заключено в цилиндр, закрытый подвижным поршнем. Вне
цилиндра находятся два других тела очень большой массы, имеющих
разную степень нагретости. Более нагретое внешнее тело является
по отношению к рабочему телу в цилиндре источником тепла, а менее
нагретое — приемником тепла. Как следует из условия большой массы,
отдача тепла источником и получение тепла приемником не вызывают
изменения их температуры.
Представим себе теперь, что рабочее тело вступает в теплообмен
с источником тепла, от которого получает Q t калорий. И з условия
квазистатичности взаимодействия рабочего тела с окружающей средой,
которое мы будем сначала считать обязательным, вытекает, что в про
цессе получения тепла рабочее тело должно иметь температуру, меньшую
температуры источника на бесконечно малую величину, т. е . должно
претерпевать изотермическое изменение состояния. При этом объем
рабочего тела будет увеличиваться.
П о окончании теплоподвода
к рабочему телу дадим ему возможность дальнейшего расширения,
но уже без всякого теплообмена с окружающей средой, т. е . адиа
батным образом. Когда температура рабочего тела упадет до уровня,
превышающего температуру приемника тепла на бесконечно малую
величину, установим контакт между приемником и рабочим телом
и начнем изотермически сжимать последнее, чтобы обеспечить квази-
статическую отдачу Q2 калорий приемнику тепла. Наконец, с целью
возвращения рабочего тела к первоначальному состоянию произведем
надлежащее адиабатное сж атие, благодаря которому температура воз
растет до уровня температуры источника. В итоге выполненного цикла,
который состоит из двух изотерм и двух адиабат, разность количеств
теплоты Q x и \Q.2 \ будет превращена в работу A L y равную превышению
работы расширения тела над работой, затраченной на его сжатие.
Выясним свойства рассмотренного цикла Карно в предположении,
что рабочим телом является идеальный газ. Конфигурация цикла
ГЛ. i]
ВТОРОЕ НАЧАЛО ДЛЯ КВЛЗИСТА ГИЧЕСКИХ ПРОЦЕССОВ
14.4
в координатах p - V показана на рис. 42. Процессы аЬ и cd являются
изотермическими, а Ьс и da — адиабатными. Коэффициент полезного
действия цикла определим из формулы:
_____
AL____Qi—I(?2I
4~Qi~
Qi
Здесь Qj = AGRTtIn ^
и
va
обозначение т| = 7]к, имеем:
'Пк =
1\In— — Т21п^-
Уд
Vd
In—-
Уд
И з уравнений адиабаты
следует,что Г ^ " 1= Г^*""1
и
= Т х*о*-1. Перемно
жая почленно, получим:
<Wi= <W»
va
Vtl ’
вследствие чего
7Js==Ii^k ==i_ ^
. (iIU)
|Q21= AGRT2In
.
откуда, принимая
Рис. 42.
Отсюда же вытекает весьма важное соотношение, которое будет
использовано в дальнейшем:
^4-^=0.
(III. 2)
Интересно отметить, что формулы (III. 1) и (III. 2) очень наглядно
могут быть получены с помощью тепловой диаграммы идеального
газа, основанной на применении выра
жения (II. 53): dq=Tds. Так как
изотермические изменения состояния
идеального газа в координатах Г-5
изображаются горизонтальными отрез
ками и адиабатные — вертикальными
отрезками, то цикл Карно с идеальным
газом имеет вид прямоугольника. На
рис. 43 подведенное к газу тепло изо
бражается наклонно заштрихованной
площадью, а отведенное от газа теп
л о — вертикально заштрихованной пло
щадью. Дальнейшее обоснование формул (III. 1) и (III. 2) пред
ставляется после сказанного излишним.
i44
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. 111
Поскольку в цикле Карно, в частности при использовании идеально
го газа, условия взаимодействия рабочего тела с окружающей средой
считаются квазистатическими, процесс в системе источник тепла —
рабочее тело — приемник тепла является обратимым. В связи с этим
цикл называется обратимым прямым циклом Карно. Определение
«прямой» служит условным указанием на то, что речь идет о цикле,
посредством которого теплота, получаемая телом из внешней среды,
превращается в работу. Такой цикл в координатах p - v изображается
при использовании любого рабочего тела линией, обводимой непре
менно в направлении часовой стрелки. Машинная установка, осущест
вляющая прямой цикл, выполняет функцию теплового двигателя.
Обратимым обратным циклом К арн о называется описанный цикл
в том случае, когда изображающая его линия обводится в направле
нии против часовой стрелки. И з условия обратимости цикла следует, что
все эффекты взаимодействия рабочего тела с окружающей средой,
оставшись неизменными по абсолютной величине, будут иметь теперь
противоположные знаки. Иными словами, источником тепла станет
более холодное тело, от которого рабочее тело получит Q2 калорий,
а приемником тепла — более горячее тело, которому рабочее тело от
дает Q t калорий. Так как по абсолютной величине Q j больше, чем Q2,
то для совершения обратного цикла необходимо затрачивать работу.
Ценой затраты этой работы теплота извлекается из более холодного тела
и переносится к более горячему. Машинная устано вка, выполняющая
обратный цикл Карно, может служить для искусственного поддержания
в каком-либо помещении более низкой температуры, чем имеет окружаю
щая атмосфера, ввиду чего ее называют холодильной установкой.
В реальных условиях в системе источник тепла — рабочее тело —
приемник тепла происходят только необратимые процессы, ввиду
чего, в частности, и цикл Карно оказывается необратимым. П од
необратимым циклом Карно разумеется реальный круговой цикл,
в котором рабочее тело вступает в теплообмен только с двумя те
лами, имеющими разные, но фиксированные температуры, причем
остальные два элемента цикла являются адиабатными. Конечно, не
обратимый цикл Карно может быть как прямым, так и обратным.
Долж но быть ясно, что в необратимом цикле температура рабочего
тела при получении и отдаче им теплоты отличается соответственно
от температуры источника и приемника тепла и вовсе не обязательно
остается постоянной. Помимо того, адиабатные участки цикла не
подчиняются более формулам адиабаты, выведенным из условия
квазистатичности. Например, при использовании газа нельзя у твер
ждать, что будет применима формула pvk = const, где k = cplc0J
или другая, от нее производная. Наконец, нельзя получить отобра
жение необратимого цикла в какой-либо из применяемых в термо
динамике диаграмм. Впрочем, чтобы не вступить в противоречие со
сказанным в п . 12 первого отдела, нужно заметить, что, несмотря
на необратимость процессов в системе взаимодействующих тел, не
ГЛ. l)
ВТОРОЕ НАЧАЛО ДЛИ КВАЗИС ГАТИЧНСКИХ ПРОЦЕССОВ
145
исключается возможность индивидуальной квазистатичнос ги, в в и д у
чего к рабочему телу при некоторых условиях становится практи
чески применимы обычные расчетные формулы термодинамики, если,
однако, входящие в них величины давления и температуры относить
не к окружающей среде, а к самому рабочему телу. При этом фор
мулы (III, 1) и (III. 2) остаются верными только для очень частного
вида необратимого цикла Карно, а именно, если необратимость по
следнего возникает исключительно из-за конечных разностей тем
ператур в периоды внешнего теплообмена и если, кроме то го , эти
периоды можно считать за изотермические изменения состояния р або
чего тела. Необратимость механического происхождения делает ф о р
мулы (III. 1) и (III. 2) заведомо неприменимыми.
4.
Постулат второго начала для квазистатических про
цессо в. Круговой цикл, названный именем Карно, считается прото
типом, наипростейшим образцом любых мыслимых циклов, так как
он о тражает принципиально необходимые черты непрерывного в о с
производства процессов превращения теплоты в работу и работы
в теплоту. Основная идея цикла Карно, а следовательно, и всех
других более сложных циклов заключается в том, что: 1) периоди
чески повторяющийся процесс превращения теплоты в работу неотделим
от процесса переноса некоторого количества теплоты с высокого на
более низкий температурный уровень и 2) переход тепла от холо д
ного тела к более нагретому неотделим от периодически повторяю
щегося процесса затраты некоторой работы и превращения ее в теп
лоту, которая передается более нагретому телу.
Возникает важный во прос: действительно ли цикл Карно выражает
предельные свойства круговых процессов? Нельзя ли осуществить
цикл, еще более простой, чем цикл Карно? Быть может, достаточно,
помимо рабочего тела, располагать только одним единственным резер
вуаром тепла, а не двумя, которые требуются схемой Карно? Нако
нец, если уж необходимы два резервуара, то исключена ли возмож
ность того, что от них обоих рабочее тело получает теплоту и сумму
полученных теплот возвращает в окружающую среду в виде работы?
На эти вопросы можно дать точный ответ, если иметь в виду
обратимый цикл с использованием в качестве рабочего тела идеального
газа. Для последнего справедлива формула (II. 53): d q = T d s, которая
вытекает из основных положений термодинамики, группирующихся
вокруг первого начала.
Каки$ бы промежуточные состояния ни проходил идеальный газ,
в результате квазистатического кругового процесса его энтропия
должна принять первоначальное значение, так что
$*=§т=°-
Температура идеального газа Г , измеряемая посредством его же
самого, может быть только положительной, так к ак , например, при
10 Зак. 3543. в. С . Жуковский.
14(э
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
|0ТД. 111
изобарном приближении к Т = 0 объем идеального газа стремится
к нулю. О тсю д а непосредственно вытекает, что замыкание рабочего
процесса возможно только при условии знакопеременного обмена
тепла между газом и окружающей средой. Иными словами, на одних
участках процесса к газу необходимо подводить тепло, а на других
участках необходимо отводить. Невозможно создать такой идеально
газовый двигатель, который не передавал бы в окружающую среду
некоторое количество теплоты, оставшееся не превращенным в работу.
Стол ь же очевидно, что идеальный газ должен вступать в тепло
обмен с окружающей средой по крайней мере при двух различ
ных температурах. Если бы на всех участках цикла, вдоль кото
рых dq Ф 0, газ находился при одной и той же температуре Т9 то
мы имели бы:
А§dl=§dq=Т^ds=0.
Следовательно, в результате совершения такого цикла мы не получили
бы возможности превратить конечное количество теплоты в работу .
Из условия обратимости непосредственно следует, что участки
процесса, на которых рабочее вещество вступает в контакт с резер
вуарами тепла, должны быть изотермическими. Н о две изотермы не
могут образовать кругового процесса. Единственный способ его
реализации, если исключить теплообмен при конечны* разностях
температур, заключается в соединении изотерм Тг и Г 2 двумя о трез
ками адиабат, вдоль которых рабочее тело подвергается одним только
механическим воздействиям со стороны окружающей среды.
Приведенными соображениями доказывается, что в случае идеаль
ного газа цикл Карно действительно является наипростейшим
круговым обратимым циклом. Важно
заметить, что одним из скрытых моти
вов доказательства было знание того
факта, что в любой из координатных
систем линии адиабат идеального газа
изображаются в виде непересекающихся
кривых. Если бы из какой-нибудь фи
гуративной точки можно было пр о
вести две линии адиабат, то для о с у
ществления кругового цикла достаточно
было бы располагать только одним ре
зервуаром тепла (рис. 44). Легко обнару
жить, что последняя возможность исклю
чается не только в случае идеального
газа, но и при любом простом телеу поскольку состояние последнего
определяется двумя независимыми параметрами. Выражение первого
начала для такого тела имеет вид:
Р
dq= Ххdxx-j -Х2dx2,
ГЛ. lj
ВТОРОЕ НАЧАЛО ДЛЯ КВАЗИС'ГАТИЧЕСКИХ ПРОЦЕССОВ
147
где X1= X l(xl1х2); Х2—X2(xl9лг2), причем под х{ и х2разу
меется любая пара из трех термических параметров: р , v и t%где /
может быть эмпирической температурой. Относительно коэффициен
тов Х х и Х 2 известно, что. каковы бы ни были физические свой-
дХу ^дХо „
ства тела,
ф . Если тело подвергается адиаоатному изменению
состояния, то
dq= 0 и Ххdxt-j-Х2dx2= 0.
Э т о уравнение накладывает известные ограничения на сво боду выбора
приращений переменных. И з д ву х переменных ( х г и л:2) при условии
адиабатности процесса независимой остается лишь одна. Иными сло
вами, если dq = 0 , то из всякого равновесного состояния не может
быть достигнуто любое смежное состояние. Достижимыми являются
только те из них, которые относительно исходного состояния лежат
в направлении, наклоненном к оси х х под углом с тангенсом:
*,>.
о
Э то обыкновенное дифференциальное уравнение определяет семейство
однопараметрических линий
Ф(хи *а)=
где
—
постоянные величины (параметры), зависящие исключительно
от координат той i-й точки, через которую мы желаем провести
соответствующую
интегральную
кривую. Касательные к линии
^(лгр лг2) = ^ наклонены так, как предписано уравнением (*) , т. е .
указывают только одно направление, в котором можно переместиться
из данной точки, не нарушая условия dq = 0 .
И з сказанного ясно, что идея цикла Карно как простейшего
обратимого цикла возникает для всякого просто го тела чисто д едук
тивным путем. Ч то касается сложных термодинамических систем,
описываемых более чем двумя независимыми параметрами, то для них
схема цикла Карно не является у же математической очевидностью,
вытекающей из структуры первого начала термодинамики. Е сл и, на
пример, имеются три независимых параметра х и х 2 и лг3, то условие
адиабатности приводит к такому символическому уравнению:
Х± dx^ —j
—
Х 2dx2-j —Х 3dx3= 0.
He зная конкретного вида функций X {(xu х 2, дг3), X 2(xv х 2, лг3)
и Х3(х19лг2, лг3), — а
знать вид этих функций можно только при
наличии точных уравнений состояния, которых, как правило, не
существует, — нельзя наперед утверждать, что решение последнего
уравнения дает семейство непересекающихся поверхностей в простран
стве х 19 лг2, х 3. 2) Поэтому та принципиальная схема превращения
*) Подробности по этому поводу см. во втором издании настоящего
курса, 1940 г., главу II третьего отдела.
10*
148
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
|ОТД. Ill
теплоты в работу , которая дана Карно и которая принимается за
прототип тепловых двигателей, оказывается в общем случае недо
казуемой. Ее остается только постулировать как широкое обобщение
опыта.
Итак, в основу второго начала термодинамики может быть поло
жен следующий постулат, уточняющий смысл принципа исключен
ного вечного двигателя второго рода:
Исключена возможность такого кругового процесса, в резуль
тате которого происходит превращение теплоты в работ у без
того, чтобы некоторое количество теплоты перешло от более
нагретого тела к менее нагретому.
Этот постулат утверждается безотносительно к тому, обратим ли
круговой процесс или необратим. Однако наши ближайшие рассужде
ния будут относиться только к обратимым процессам .
Взамен высказанного постулата можно принять и другой, сл уж а
щий обобщением свойств обратного цикла Карно :
Исключена возможность такого кругового процесса, в резул ь
тате которого происходит перенос тепла от менее нагретого
тела к более нагретому без того, чтобы некоторое количество
работы превратилось в тепло.
5.
Математическое выражение второго начала для квазиста-
тических процессов. На основе постулата второго начала в части
прямых обратимых циклов докажем теорему.
Коэффициент полезного действия прямого обратимого цикла
Карно не зависит от свойств применяемого рабочего тела и
определяется исключительно темпе
ратурами источника и приемника
тепла.
Содержание теоремы и идея дока
зательства принадлежат Карно, в ра с
суждениях которого содержалась, о д
нако, ошибка, вытекавшая из учения
о теплороде.
Представим себе агрегат, состоящий
из двух машин, из которых одна рабо
тает по обратимому прямому, а д ру
га я — по обратимому обратному циклу
Карно, причем никаких условий в отноше
нии выбора рабочих тел не ставится. Теплообмен рабочих тел с о к ру
жающей средой осуществляется путем общения только с двумя телами,
находящимися при различных температурах tx и
(рис. 45), измерить
которые можно любым эмпирическим образом. Первое тело служит
теплоотдатчиком для двигателя и теплоприемником для холодильной
машины, второе тело выполняет противоположные функции. О бе
машины сидят на одном валу и отрегулированы таким образом, чтобы
количество отбрасываемой двигателем теплоты было в точности равно
Двига■
Г\ Холод.
о
тель__ 1
__
машина
AL
гл. 11
Н Ю РО Е НАЧАЛО ДЛЯ КВАЗИСГАТИЧКСКИХ ПРОЦЕССОВ
149
количеству теплоты, получаемой холодильной машиной из внешней
среды, т. е. чтобы| 1= Q'.
Допустим, что работа прямого цикла A L X с избытком покрывает
затрачиваемую на обратный цикл работу \ALI I \i благодаря чему
агрегат способен производить положительную внешнюю работу
AL= ALI —\ALII\>0.
Согласно первому началу, ALI = Q1— |Q21; |ALU |= |Q' | — Q
Ввиду условия |Q21= Q ' получаем, что
AL= Ql-\Q[\>0.
Следовательно, при нашем допущении в результате действия машин
ного агрегата окажется возможным непрерывно превращать теплоту,
извлекаемую из тела tv в работу без того, чтобы некоторое коли
чество теплоты перешло от более нагретого тела tx к менее нагретому
телу /а. М еж ду тем, такая возможность исключена принятым п осту
латом. Таким образом, остается до
пустить, что
Можно показать, что в последней
формуле знак неравенства следует также
отбросить. Действительно, пользуясь
свойством обратимости, представим себе,
что агрегат пущен в противоположном
направлении, ввиду чего двигатель стал
выполнять функции холодильной маши
ны, а холодильная машина — функции
двигателя (рис. 46). В таком случае знаки
при всех количествах теплоты и работы изменятся на противопо
ложные, тогда как их абсолютные значения останутся прежними.
Допустив возможность неравенства, оставшегося после первого
варианта наших рассуждений, мы получим:
AL—|ALj|— ALn < 0, соответственно, ALn > |ALX| и Q[> \QX|.
Мы приходим, следовательно, к отвергнутому первому варианту,
и остается считать, что AL = 0, т. е. |ALT|= ALU и Q' =
||.
И т ак , обе машины, пущенные как двигатель, должны производить
одинаковую работу |A LX | = |A Ln | за счет одинакового количества
теплоты | [ = |Q ' |. Следовательно, независимо от свойств рабочих
тел к . п . д . обратимых циклов Карно одинаковы и могут зависеть
только от величин tx и /а:
150
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. Ill
Из доказанной теоремы вытекает весьма важное обстоятельство.
Если бы мы знали вид функции /(£ ,, /2) для какого-либо одного
рабочего тела, то это выражение было бы обязательным и для всех
возможных других тел. Таким хорошо известным телом является
идеальный газ, для которого было найдено (III. 1), что
*1в 1 Ti■
Следовательно, и для всякого тела, которое выполняло бы прямой
обратимый цикл Карно, эта формула будет верна. Одновременно
получит универсальный характер и формула (III. 2):
Ql|@2
Т\'Т2
0.
Мож но усомниться в уместности привлечения к конечному выводу
идеального газа на том основании, что он является фикцией, плодом
нашего воображения, а вовсе не реальным телом. Э то сомнение имеет
несколько академический характер. Мы знаем, что реальные газы при
надлежащем выборе параметров подчиняются сколь угодно точно
законам идеальных газов, ввиду чего последние практически пр иоб
ретают права действительных физических тел. Впрочем, существует
спосо б нахождения вида функции
f ( t j , t2) без ссылки на идеальные
газы и, следовательно, в рассма
триваемом отношении безупречный.
Этот способ, приводящий к тому
же результату, мы для краткости
изложения опустим.
Обобщим выражение (III. 2) на
любой круговой цикл , обладаю
щий свойствами обратимости. Ч то
бы сделать рассуждения нагляд
ными, мы ограничимся случаем
простого рабочего тела, состояние
которого определяется, например,
величинами р и V.
Доп устим , что рабочее тело выполняет обратимый круговой цикл
произвольной формы (рис. 47). С помощью бесконечно большого
числа адиабат разобьем фигуру на полоски, каждой из которых
отвечает по одну сторону сообщение dQ{ калорий и по другую сто
рону— отнятие dQ2 калорий. Одна из таких полосок обозначена
как aa'b 'b . Проведем через точки а и Ьг элементы изотерм: ас и Ь'с'.
Легко видеть, что замена границ полоски аа' и b'b линиями ас
и bfcr приводит к погрешностям в количествах теплоты, имеющим
величину.второго порядка малости. Обозначим абсолютную величину
количества теплоты, отвечающего линии а с , через d Q ' и рассмот
рим 47.
IV!. 11
ВТОРОЕ НАЧАЛО ДЛЯ КВАЗИСТАТИЧЕСКИХ ПРОЦЕССОВ
151
рим круговой цикл аа'са. Имеем: dQi — dQ[ = Л dL, где работа dL
определяется в координатах /;- V площадью треугольника. О ч е
видно, рассматривая dQ{ и dQ[ как величины первого порядка
малости (подобно dp и dv) , мы должны заключить, что их разность,
равная работе цикла, является величиной высшего порядка малости.
То же самое можно сказать применительно к количествам теплоты
на участкак b'b и Ь'с' Таким образом, плавный контур цикла можно
заменить зигзагообразным, образованным из бесконечно малых о т
резков изотерм и адиабат, без внесения ощутимой погрешности
в определение внешнего теплообмена и внешней работы.
Из сказанного ясно, каким образом можно осуществить заданный
обратимый цикл. Для этого нужно располагать бесконечно большим
количеством источников и приемников тепла, отличающихся по тем
пературе на бесконечно малые величины. Рабочее тело следует
поочередно приводить в тепловой контакт с ними, подвергая тело
между всякими двумя такими операциями адиабатному сжатию или
расширению, до достижения им (телом) температуры следующего
в ряду резервуара тепла. Разумеется, во избежание нестатичности
механического происхождения изменения состояния рабочего тела
должны быть чрезвычайно медленными.
Итак, каждая элементарная полоска цикла может трактоваться
как малый обратимый цикл Карно, для которого
dQi I dQi__л
ТХ~Г т2—и-
Интегрируя это выражение между точками М и Л/, где крайние
адиабаты касаются заданного контура, получаем:
MaN
NbM
0.
Сумма интегралов является интегралом, взятым по замкнутому
контуру, так что
0 =0.
(111.3)
Интеграл от dQtТ называется интегралом Клаузиуса.
Равенство нулю интеграла Клаузиуса для обратимых круговых
циклов свидетельствует о том, что подинтегральное выражение
является дифференциалом функции состояния. Э та функция названа
Клаузиусом энтропией тела и обозначена буквой S . Формула
(Ш.4)
служит математическим выражением второго начала для обратимых
(квазистатических) изменений состояния рабочего тела.
152
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[отл. III
Существенно подчеркнуть, что в формулу (III.4) можно вводить
как температуру окружающей среды, так и температуру рабочего
тела, ибо они по смыслу обратимости отличаются друг от друга на
бесконечно малую величину.
Развернутое выражение второго начала для обратимых процессов
имеет такой вид:
dS= dU+ *pdV.
(III.5)
Энтропия 5 имеет размерность [ккал\град\. Ввиду того что в
однородных телах количество теплоты распределяется равномерно по
всей массе, можно ввести величину удельной энтропии s соответ
ственно выражению
ds=Цг.
(Ш.4а)
Величина 6' имеет размерность [ккал/кГ • град] подобно теплоем
кости, от которой, однако, она резко отличается по своему физи
ческому смыслу. Удельную энтропию можно относить также к 1 моль,
1нм6ит.п.
Изменение энтропии неоднородной системы при обратимом изме
нении состояния равно сумме изменений энтропии ее однородных
частей. Э г о вытекает из условия, что для внутреннего равновесия
все части системы должны иметь одну общую температуру. Если,
например, система состоит из д ву х тел, то
и, согласно (III.4),
dS= rf»Sj-j -dS^.
Таким образом, энтропия обладает свойством аддитивности.
Разумеется, этого нельзя сказать о системах, между отдельными
частями которых имеются теплонепроницаемые стенки, оставляющие
возможность одного только механического взаимодействия. Однако
такие случаи не интересны в термодинамическом о тношении.
На основании (III.4) энтропия может быть определена с точностью
до постоянной интегрирования, характеризующей энтропию в каком-
либо условно принятом нормальном состоянии тела. О численном
значении этой начальной энтропии термодинамика никаких указаний
дать не может. В технических приложениях термодинамики доста
точно знать лишь разности энтропий, вычисляемые согласно формуле
а
(III.6)
i
ГЛ. 11
ВТОРОЕ НАЧАЛО ДЛЯ КВАЗИСТАТИЧЕСКИХ ПРОЦЕССОВ
153
В частном случае адиабатных обратимых изменений состояния
второе начало выражается, согласно формуле (IH.4), следующим
образом:
при</ф= 0 имеем dS= 0, 5 = const.
(1II.7)
Энт ропия адиабатно изолированной системы, испытывающей
обратимые (квазистатические) изменения состояния, сохраняет
постоянное значение. Энт ропия может измениться только при
снятии тепловой изоляции с системы и вступлении последней
в теплообмен с окружающей средой.
В заключение отметим, что применительно к идеальным газам
существование энтропии математически очевидно. В торое начало
термодинамики показывает, что свойства идеальных газов в отношении
количества теплоты, приводящие к понятию энтропии, не являются
исключительными, а верны для любых физических тел.
6.
Абсолютная термодинамическая температура* Формула (III.4)
еще не в полном объеме выражает собой содержание второго начала
термодинамики. Входящая в эту формулу температура Т является
абсолютной газовой температурой. Как видим, эта последняя по
своему теоретическому значению далеко выходит за рамки случайной
эмпирической температуры, рассматриваемой наравне с множеством
других существующих эмпирических температур.
Нетрудно показать, что, поскольку формула (III.4) считается
установленной, можно для измерения температуры вообще отказаться
от какого-либо термометра, в том числе от идеально-газового, и
определять температуру по шкале, которая совершенно не была бы
связана с частными свойствами тех или иных термодинамических тел.
В сущности, именно такая абсолютная термодинамическая темпе
рат ура 0 должна была бы фигурировать взамен Г в формуле (III.4).
То обстоятельство, что роль 0 может играть газовая температура Г ,
есть следствие специальных свойств идеального газа. *)
Поставленная задача решается здесь в соответствии с идеей
В . Томсона (Кельвин), впервые обосновавшего метод абсолютизации
температурной шкалы.
И з предыдущего ясно, что при любом рабочем теле, выполняющем
прямой обратимый цикл Карно, имеет место соотношение:
AL
\QoJ~
Т2’
х) Заметим, чго при использовании идеального газа в качестве термо
метрического вещества можно так построить температурную шкалу, что она
вовсе не будет обладать признаками абсолютной термодинамической шкалы.
Так, если бы, следуя Дальтону, мы приняли логарифмическую шкалу темпе
ратур (см. п . 1 второго отдела) взамен линейной, как это сделано Гей-Л юс-
саком, то абсолютизировать такую логарифмическую шкалу нам не удалось бы.
С другой стороны, не только идеальные газы способны образовать эмпири
ческую шкалу температур, удовлетворяющую особенностям абсолютной тер
модинамической шкалы*
154
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. Ш
где Тх и Т2 — температуры источника и приемника тепла, измеренные
газовым термометром, и A L — работа цикла в тепловых единицах.
Э т о соотношение можно понимать как уравнение для нахождения
любой из дву х величин, входящих в левую часть, если измерены
температуры, входящие в правую часть уравнения. Можно решить и
обратную задачу: по измеренным величинам A L и |Q2| получить
суждение о температурах, которые должен был бы показать газовый
термометр, если бы он был в действительности применен. Тем самым
мы могли бы, и не прибегая к газовому или какому-либо иному
термометру, произвести оценку температурного состояния, присущего
источнику или приемнику тепла, т. е . взамен термометров использо
вать самый цикл Карно для температурных измерений. Именно это
обстоятельство используется для введения понятия абсолютной термо
динамической температуры.
Предварительно условимся о цене деления в абсолютной шкале.
Совершенно естественно установить цену деления в указанной шкале
таким же точно образом, как это делается в практических шкалах,
а именно: принять температурный интервал между реперными точками
таяния льда и кипения воды за 100°. Существенно, что при этом
совершенно не нужно владеть методами термометрии, так как у д о
стовериться в постоянстве точек перехода из одного агрегатного
состояния в другое достаточно на основе одних только термоско
пических наблюдений. *)
Условившись о цене деления абсолютной шкалы, выясним сначала,
какое число градусов отвечает в этой шкале точке таяния льда. Для
этого представим себе, что в цикле Карно источником тепла является
кипящая под атмосферным давлением вода, а приемником — тающий
лед. Тогда Т2= 0лед и Тг— Г2=100. Отсюда:
0лод= 100 I@2!лод
Т7
*
“^дар-лед
Мы видим, что численное определение величины 7л од может быть
произведено путем измерения за один цикл Карно работы и количества
теплоты, отдаваемой тающему льду, если только источником тепла
служит кипящая вода. Осуществление этих двух измерений не тре
бует привлечения каких бы то ни было термометров, в том числе и
газового . М е ж д у тем, независимо от выбора рабочего тела для цикла
Карно правая сторона формулы может иметь лишь одно значение:
273,16 — то самое, которое показывал бы газовый термометр, если
*) Термоскопом называется прибор, показывающий соответствие темпе
ратурного состояния какому-либо одному температурному уровню, отмечен
ному на шкале прибора. Оставив на шкале ртутного термометра только одну
нулевую черту, мы получим, например, ртутный термоскоп для фиксирования
точки таяния льда,
гл. i]
НТОРОЕ НАЧАЛО ДЛЯ КВДЗПСГАТПЧЕСКНХ ПРОЦЕССОВ
155
бы он был погружен в тающий лед. J) Таким образом, число 273,16
лишается тех признаков произвола, которые связаны с выбором
именно идеального газа, а не какого-либо другого тела в качестве
термометрического вещества.
Посмотрим теперь, как в принципе можно измерить без всякого
термометра любую степень нагретости. Д опустим, что с этой целью
тело, имеющее искомую температуру 0 , используется в качестве
источника тепла для цикла Карно. Приемником тепла остается таю
щий лед, причем цикл регулируется с таким расчетом, чтобы отда
ваемое льду тепло было равно величине | Q2 |лоД» установленной
в первый раз, при определении 0 ЛСД. Тогда при любом рабочем теле
^^Т-лел
® ^лод
^пар-лол-
ЮО‘
Левая часть уравнения определяется путем измерения работы цикла
в д ву х описанных вариантах. В правой части 0 лел можно считать
уже известной, равной 273,16. О тсю да вычисляется искомая вели
чина 0 . Таким образом, численное значение 0 устанавливается на
основе одних только м ехан и ческих измерений (взамен механических
можно было бы использовать тепловые измерения количества пере
даваемой теплоты). Если бы мы решили прибегнуть к определению 0
посредством газового термометра, то получили бы ту же самую
величину 7 = 0 . Таким образом, измерения температуры в абсолют
ной шкале газового термометра могут быть замещены измерениями,
в которых совершенно не требуется знания физических особен
ностей тех или иных тел (в том числе их термометрических свойств),
как и не требуется каких-либо соглашений о способе построения
температурной шкалы, за исключением только одного: соглашения
о числе делений шкалы между выбранными реперными точками.
Ш кал а, построенная на основе такого рода измерений, называется
абсолютной термодинамической шкалой температуры. Разумеется,
удобно цену деления в этой шкале определить из условия, чтобы
между точками таяния льда и кипения воды было 100°.
Из приведенных соображений ясно, что для придания формуле
(III.4) подлинной всеобщности ее следовало бы представлять в виде
dQ= QdxP,
(III.8)
где 0 — абсолютная термодинамическая температура и Ф — функция
состояния, равноценная энтропии. В частности, роль 0 может вы
полнять абсолютная газовая температура Г , и тогда, соответственно,
на место W становится функция S . Э то значит, что газовая темпе
ратура Т является абсолютной не только по названию (абсолютной
1) В этом можно убедиться, взяв, например, в качестве рабочего тела
насыщенный водяной пар. Соответствующие расчеты с помощью таблиц
рекомендуем выполнить самостоятельно, считая изотермический теплоподвод
к рабочему телу происходящим в пределах от х = 0 до х = 1 (см, четвер
тый отдел),
второй начало термодинамики
[о ГД. Ill
156
газовой температурой называется температура
идеально-газового
термометра /, отсчитываемая в стоградусной шкале, плюс число
273,16), но и по своему термодинамическому смыслу.
Существенно то , что абсолютная термодинамическая температура
не может принимать по самому своему смыслу отрицательных зна
чений, подобно тому как таковых не имеет абсолютная газовая тем
пература Т.
Физическое обоснование абсолютного нуля температуры произ
ведено, повидимому, впервые Ломоносовым. И сходя из своей кине
тической теории теплоты, Ломоносов пишет: «И т ак, высшая и по
следняя степень холода состо ит в абсолютном прекращении враща
тельного движения и по необходимости может существовать» (§ 26
«Размышлений о причине теплоты и холода»). И в другом месте:
«Величайший холод в теле — абсолютный покой; если хоть где-либо
имеется малейшее движение, имеется и теплота».
Производство температурных измерений посредством обратимого
цикла Карно практически нереализуемо. М еж ду тем, пользование
абсолютной шкалой температуры совершенно необходимо для у ста
новления разнообразных свойств тел и основных физических законов.
Поэтому возникает существенная задача найти способы перехода от
той или иной эмпирической шкалы температуры к шкале абсолютной.
Располагая указанными способами перехода, можно для каждой
эмпирической шкалы составить систему по правок, позволяющих
привести температурный отсчет к абсолютной шкале. Задача эта
не снимается тем обстоятельством, что роль абсолютной термодина
мической температуры может играть абсолютная газовая температура.
Газовый термометр становится неприменимым при температурах выше
1500°, а также вблизи абсолютного нуля. Более то го , его показания
не всегда могут быть приняты за абсолютную газовую температуру,
п оскольку реальные газы отклоняются от идеальных. В связи со
сказанным мы коснемся еще в дальнейшем вопроса о соотношении
между эмпирическими и абсолютной температурами.
7.
О физическом смысле второго начала для квазистатиче-
ск их п роц ессо в. Математическое выражение второго начала термо
динамики для квазистатических, обратимых, процессов позволяет,
с одной стороны, увидеть в количестве теплоты черты, общие для
всех форм энергетического обмена, но оставшиеся невскрытыми
первым началом термодинамики, и, с другой стороны,— и это наи
более существенно — утвердить за количеством теплоты специф и
ческие особенности, которые обусловлены качественной несводи-
мостью тепловых воздействий к воздействиям механическим.
Энергетической мерой механических воздействий служит работа,
элементарное количество которой d L в общем случае равно произ
ведению из некоторой обобщенной силы у на приращение соответ
ствующей обобщенной координаты X :
сiL=ydX;
(Ш.9)
ГЛ. lj
ВТОРОЕ НАЧАЛО ДЛЯ КВАЗИСГАТПЧЕСКИХ ПРОЦЕССОВ
15?
Существует множество известных нам немеханических явлений,
которые, однако, возникают из-за механических силовых взаимодей
ствий или, напротив, сами порождают такие взаимодействия. Э то
облегчает непосредственное вычисление немеханической работы через
отвечающие ей немеханические параметры тел, причем неизменно
оказывается, что работа выражается формулой типа (III.9). Так на
пример, работа электрических сил, выражающаяся в переносе коли
чества электричества, равна V d E , где V — разность потенциалов,
Е — количество электричества; работа магнитных сил, выражающаяся
в намагничивании, равна ~ ^ d B , где Н — напряженность магнитного
поля, В — магнитная индукция, и т. п. Ввиду сказанного, понятия
обобщенной силы и обобщенной координаты выходят за рамки меха
ники и могут быть истолкованы в расширенном физическом плане.
Помимо внешних, формальных, признаков обобщенной силы и
обобщенной координаты, вытекающих из структуры формулы для той
или иной работы, существуют очень важные физические свойства,
которыми они должны обладать.
Поскольку производится работа какого-либо вида, с необхо
димостью должна изменяться соответствующая этой работе
(<сопряженная) обобщенная координата.
Напротив, если созданы условия, при которых изменение некото
рой обобщенной координаты исключено, то тем самым исключена
возможность производства работы соответствующего вида.
С другой стороны, выполнение работы какого-либо вида одним
телом над другим возможно не иначе> к а к при наличии неодина
ковости соответствующих (<сопряженных) обобщенных сил, харак
теризующих состояние того и другого тела.
Напротив, при равенстве обобщенных сил, характеризующих с о
стояние двух взаимодействующих тел, отсутствуют условия для про
изводства работы соответствующего этим силам вида.
Последнее означает, например, что при одинаковости давления
по обе стороны поверхности, разделяющей два газообразных тела,
нет причины для совершения механической работы; при одинаковости
электрических потенциалов в цепи нет причин для производства
работы электрическими силами; при одинаковости напряженности
магнитного поля нет причины для производства работы магнитными
силами и т. д.
Итак, величины у и X в обобщенной формуле (III.9) отражают
совершенно специфические особенности различных видов взаимодей
ствия окружающей среды и термодинамического тела — особенности,
которые не могут быть сводимы друг к другу. Это положение слу
жит естественным дополнением принципа эквивалентности различных
воздействий: наряду с общностью природы всех возможных воздей
ствий должны существовать признаки, отличающие одни воздействия
от всех прочих в качественном отношении.
158
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. Ш
Среди немеханических воздействий тепловое воздействие занимает
особое место, так как в процессе теплопередачи никаких силовых
эффектов не возникает. Э то служит препятствием для непосредствен
ного нахождения формулы «тепловой работы », каковой термин и не
вошел в обиход, дав место термину «количество теплоты». В этих
условиях выражение второго начала ( III.4)
dQ= TdS
получает большой принципиальный смысл. О но прежде всего обна
руживает единство формы, в какой проявляется всякий энергетический
обмен, включая теплопередачу. Для количества теплоты абсолютная
температура получает смысл обобщенной силы, а энтропия — обоб
щенной координаты.
Аналогия между выражениями (III.4) и (III.9) не ограничивается
одним их внешним сходством . Параметры состояния Т и S полностью
удовлетворяют тем физическим условиям, которым подчинены все
другие известные нам формы энергетического обмена. П оскол ьку
происходит передача теплоты, с необходимостью должен изменяться
некоторый сопряженный параметр состояния у частвующ их в этом
процессе тел (энтропия). С другой стороны, передача теплоты воз
можна не иначе, как при неодинаковости в д вух взаимосвязанных
телах другого сопряженного параметра (температуры).
Чтобы оценить физическую особенность формулы d Q = T d S ,
достаточно сравнить ее с другой общеизвестной формулой для коли
чества теплоты dQ = c d T . Легко видеть, что теплоемкостью, являю
щаяся коэффициентом при дифференциале переменной, отнюдь не
играет роли обобщенной силы, а сама переменная — температура
Т — не удовлетворяет признакам обобщенной координаты. Действи
тельно, неодинаковость теплоемкостей взаимосвязанных тел не имеет
никакого отношения к причине возникновения теплообмена. Ч то к а
сается температуры, то ее изменение вовсе не обязательно для
утверждения того, что тело получает или отдает теплоту. Так,
в процессе парообразования жидкости под постоянным давлением
к ней подводится извне теплота, но температура при этом остается
постоянной.
Таким образом, важнейший смысл второго начала термодинамики
для обратимых квазистатических процессов заключается в том, что
тепловое воздействие, с одной стороны, становится в ряд с другими
энергетическими воздействиями в отношении условий их осуществле
ния и, с другой стороны, для теплового воздействия выявляются
специфические признаки несводимости к качественно иным воздей
ствиям.
Нуж но сказать, что второму началу термодинамики для обрати
мых процессов можно дать и узко техническую интерпретацию, свя
занную с проблемой теплового двигателя.
ГЛ. Ill
RTOHOE НАЧАЛО ДЛЯ НЕСТАТИЧЕСКИХ ПРОЦЕССОВ
159
Положим, что теплота, извлекаемая из одного или нескольких
источников, превращается в работу посредством кругового, во всех
отношениях обратимого цикла. Приемником тепла служит окружающая
атмосфера, температуру которой Т0 можно считать постоянной.
В духе изложенного в п. 5 представим заданный цикл как результат
наложения элементарных циклов Карно и обратимся к любому из
последних. Количество теплоты Q0, отдаваемое атмосфере и непревра
тимое далее в механическую работу, определяется выражением:
1<?о1=7о%-
Поскол ьку температура TQ зафиксирована природными условиями,
|Q0| может зависеть только от отношения Q JT ^ Но Q{jT1равно AS,
т . е . расстоянию между адиабатами цикла в координатах T - S .
Ввиду взаимного равенства температур рабочего тела и окружающей
среды при наличии между ними теплообмена, А5 определяет также
увеличение энтропии атмосферы в результате поглощения ею тепла,
оставшегося непревращенным в работу. Таким образом, в формуле
IQol^oAS
величина AS — увеличение энтропии естественного теплоприем•
ника (окружающей атмосферы) — оказывается мерой теплоты,
выделяемой двигателем и безвозвратно потерянной для производ
ства полезной работы, поскольку другого, более холодного есте
ственного теплоприемника не имеется. Такая интерпретация энтропии
остается в силе при работе двигателя и по более сложным циклам,
чем обратимый цикл Карно.
ГЛАВА II
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ ДЛЯ НЕСТАТИЧЕСКИХ
ПРОЦЕССОВ
8. Содержание вопроса. Особенности различных форм энергети
ческого обмена, проявляющиеся в условиях обратимости (квазистатич
ности) процессов, применительно к теплообмену нашли свое отра
жение в существовании абсолютной термодинамической температуры
и энтропии. Однако роль энтропии выходит далеко за рамки наших
знаний об обратимых процессах . Э то объясняется исключительным
положением, которое занимает тепловое микродвижение среди разно
образных микродвижений материи. В действительных условиях взаимо-
превращаемость энергии не отличается подлинной взаимностью: энер
гия теплового движения имеет преимущественную жизнеспособность,
стремясь сохраниться или даже приумножиться за счет энергии других
форм. В термодинамическом плане такое положение вещей приводит
160
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
|01Д. Ill
к утверждению, что энтропии тел при всех реальных изменениях их
состояния имеет тенденцию возрастать, даже если к этому нет пр и
чины в виде внешнего теплоподвода. Теоретические и практические
следствия из указанного утверждения, обобщающего богатый опыт,
чрезвычайно обширны.
Ит ак , второе начало термодинамики в части, относящейся к не
обратимым процессам, является формулировкой особенностей, отли
чающих реальные процессы от идеальных, обратимых, а также опре
делением того специального положения, которое в природе принад
лежит энтропии. Конечно, оставаясь только на почве термодинамики,
нечего думать о полном описании развития нестатического процесса,
о составлении детальной картины внутренних явлений. Однако вполне
доступным является получение некоторых качественных суждений
весьма общего характара, с помощью которых можно определить
результативные изменения в термодинамическом теле, вызываемые не-
статичностью (необратимостью). Более то го , в отдельных случаях
можно благодаря упрощающим предположениям и привнесению
в термодинамику сведений, заимствуемых из других дисциплин, о с у
ществлять в определенных границах и количественный анализ неста
тических процессов.
9. Особенности нестатических явлений в адиабатных системах.
Рассмотрим прежде всего случай теплоизолированного тела, которое
может производить механическую работу . Для конкретности примем,
что речь идет о газе, заключенном в адиабатном цилиндре под по рш
нем. В связи со сказанным в п. 12 первого отдела работа, затрачи
ваемая на сжатие газа при конечной скорости поршня, когда внеш
нее давление превосходит внутреннее давление также на конечную
величину, должна быть больше, чем работа при деформации беско
нечной малости скорости. Напротив, при быстром расширении произ
веденная газом внешняя работа имеет меньшее значение, чем при
медленном расширении.
Попутно обратим внимание на то, что при быстром движении
поршня представление L e в виде интеграла от p d V , где р — давление
газа на стенки цилиндра, не имеет точного смысла, так как нам не
известны ни способ усреднения мгновенных величин внутреннего д а
вления р , ни связь между средним давлением и объемом газа. Поэтому
также нельзя изобразить процесс быстрого сжатия в диаграмме
p -V в виде линии, если, как это ранее считалось, понимать под р
давление внутри цилиндра.
Представим себе теперь для определенности, что газ подвергнут
адиабатному сжатию от заданного начального до заданного конечного
объема. Согласно первому началу, энергия газа должна при этом
возрасти на величину затраченной извне работы. Так как реальная
работа A L e больше работы A L etC1i отвечающей квазистатическому
сжатию, то
Ш—А£/ст= 8£/>0.
ГЛ. II]
ВТОРОЕ НАЧАЛО ДЛЯ НЕСГАТИЧЕСКИХ ПРОЦЕССОВ
161
Поско л ьку имеется в виду термомеханическая система, можно
положить, что U = U (V, S ) . 1) Для того чтобы это выражение имело
точный смысл в случае нестатического процесса, мы будем применять
его только к начальному и. конечному состояниям тела и притом
условимся, что этим состояниям предшествуют достаточно длитель
ные промежутки времени, в течение которых тело абсолютно изоли
руется от окружающей среды и получает возможность при неизмен
ном U притти к соответствующему внутреннему равновесию.
Итак , поскольку крайние объемы газа в рассматриваемом случае
сжатия зафиксированы, неравенство W > 0 обусловливает также и
неравенство A S — А5СТ= 85= ^ 0 . Легко видеть, что последнее имеет
конкретную форму: 85 > 0. Покажем это, поставив вопрос, каким
образом можно по окончании быстрого сжатия газа снять добавочно
приобретенную им энергию 8£/? Для уменьшения внутренней энергии
газа на величину 8U имеется одно средство: устранить тепловую изо
ляцию цилиндра и изохорно отвести от газа количество теплоты,
равное Ъ и, отчего температура газа у падет , и уменьшится его энт
ропия. Таким образом, конечная скорость сжатия при тепловой
изоляции газа обусловливает добавочное увеличение энергии газа b U
(по сравнению со случаем бесконечно медленного сжатия) и во з
растание энтропии газа, т . е . 85 > 0, хотя для каждого элемента
процесса dQ = 0.
Такой же вывод можно сделать применительно к расширению. При
быстром расширении газ производит меньшую работу , чем при мед
ленном. Следовательно, при быстром расширении убыль энергии газа
должна быть менее значительной. Ч тобы , зафиксировав конечный
объем газа, привести его энергию к значению, которое отвечает
квазистатическому расширению, нужно снять тепловую изоляцию ц и
линдра и отвести от газа некоторое количество теплоты, вследствие
чего энтропия газа уменьшится. О тсю да видно, что и здесь 85 > 0 ,
хотя для всякого элемента процесса dQ = 0 .
Если бы благодаря адиабатности энтропия оставалась постоянной, то
объем был бы единственной обобщенной координатой, посредством которой
можно было бы однозначно определять изменения состояния термодинами
ческого тела. Между тем в действительности вопреки адиабатности
энтро
пия тела увеличивается, и притом на величину, которая может быть самой
различной в зависимости от темпа процесса и свойств тела. Итак, несмотря
на наличие только одной внешней степени свободы (деформационной), изме
нение состояния тела приходится задавать двумя обобщенными координа
тами (объемом и энтропией).
Энтропия лишается того свойства, которое мы ранее считали основным
для обобщенных координат: свойства изменяться при том только условии,
*) Объем и энтропия тела выбираются здесь за независимые переменные,
так как, если бы процесс был квазистатичен, они естественным образом опре
деляли бы состояние системы, отражая независимые и произвольно задавае
мые внешние воздействия. При таком выборе переменных проще всего усма
тривается различие между нестатическнми и квазистатическими процессами.
11 Зак. 3543. В. С . Жуковский,
162
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. 111
что на термодинамическое тело производится некоторое сопряженное внеш
нее воздействие. Причиной изменения энтропии ^теперь оказываются уже
внутренние явления в газе, возникающие при быстром темпе сжатия или
расширения.
Возрастание энтропии можно обнаружить и на другом примере
нестатического адиабатного процесса. Обратимся хотя бы к класси
ческому опыту Джоуля по определению теплового эквивалента. Как
следует интерпретировать этот опыт? Содержащуюся в калориметре
жидкость можно считать адиабатно изолированным от внешней среды
термодинамическим телом. Вращающиеся в жидкости лопасти, приво
димые в движение падающими грузами, осуществляют механическое
воздействие окружающей среды на термодинамическое тело. Гири
совершают работу против сил, возникающих в жидкости вследствие
трения при относительном сдвиге ее элементов. Таким образом, здесь
механическая работа требуется не для деформирования -тела как целого,
а для изменения состояния отдельных образующих его элементов.
Произведенная работа L e обусловливает эквивалентное увеличение
внутренней энергии жидкости Д £ / и как следствие — возрастание ее
температуры. Чем быстрее вращаются лопасти, тем значительнее не-
статичность процесса. Напротив, при бесконечно медленном вращении
лопастей процесс оказывается квазистатическим: никакой затраты
внешней работы при этом не потребуется ( L e = 0), так как вместо
гири достаточно было бы подвесить песчинку пренебрежимо малого
веса, так что для изменения внутренней энергии жидкости на конеч
ную величину нет причин (U — const, 5 = const). Как и в первом при
мере, несмотря на адиабатность нестатического процесса, возникает
изменение энтропии термодинамического тела. Э то изменение про ис
ходит в сторону увеличения энтропии, ибо снять остаточное измене
ние внутренней энергии Д U можно только посредством отнятия тепла
от калориметра.
Можно было бы привести много примеров, подобных двум рас
смотренным. Все они подтвердили бы тот ф акт , что совершение над
любым адиабатно изолированным термомеханическим телом внеш
ней механической работы вызывает в условиях нестатичности
увеличение энтропии тела. В дифференциальной форме это может
быть записано так:
при dQ= 0 имеем 85> 0.
Неуправляемое внешним теплоподводом возрастание энтропии
может быть не единственной внутренней реакцией тела на нестатич-
ность механического воздействия окружающей среды. Более того,
этот эффект наверняка не является единственным, пока длится само
механическое воздействие. Т ак, в обоих разобранных примерах произ
водство внешней работы непременно связывается с возникновением
кинетической энергии макроскопического движения, охватывающего
более или менее крупные части термодинамического тела. Только по
гл. n]
второе Начало для йестатических процессов
163
окончании механического воздействия, когда мы полагаем тело предо
ставленным самому себе, это макроскопическое движение утихает
из-за сопротивления трения, и энергия в некоторой степени согласо
ванного движения молекул превращается в энергию их хаоти ческого
теплового движения. Именно в этом кроется объяснение «самопроиз
вольного» увеличения энтропии газа или жидкости, заключенных
в адиабатной оболочке.
Однако бывают и такие случаи, когда в термодинамическом теле,
связанном с окружающей средой только механическим образом,
остаю тся одновременно с тепловым эффектом и другие немеханические
эффекты. Например, не исключается возможность того, что тело
в течение самого воздействия, а также после его окончания оказы
вается изменившим свои электрическое, магнитное, химическое состоя
ния. В качестве иллюстрации можно сослаться хотя бы на электро
статическую машину с трением, функционирование которой по внеш
ности похоже на действие крыльчатки в упомянутом опыте по опре
делению теплового эквивалента механической работы. Н о если в п о
следнем случае нестатичность вызывает только эффект нагревания,
то при работе электростатической машины возникает еще и новое
явление — электризация, создающая разность потенциалов на конду
кторах машины. И так, обобщая многочисленные опытные данные,
можно утверждать, что:
ка кие бы свойства теплоизолированного тела ни изменились
вследствие нестатичности внешних механических воздействий,
непременно среди э т и х изменений будет более или менее значи
тельное возрастание энтропии тела. При прочих равных усло
виях это возрастание проявляется тем резче, чем быстрее раз
вивается процесс.
10.
Особенности нестатической теплопередачи. Обратимся
теперь к случаю, когда воздействие окружающей среды на тело
сводится к одной только теплопередаче, то гда как механическая р а
бота исключается. При этом единственным ответом тела на внешний
теплообмен, как бы он ни протекал, может быть только измене
ние энтропии тела, поскольку изменение объема, которое в отноше
нии к тепловому воздействию являлось бы вторичным эффекто м, не
допускается постановкой задачи. 1) Таким образом, энтропия остается
одной независимой переменной, исчерпывающим образом характери
зующей изменение состояния тела в связи с сообщением или отнятием
тепла. В этом отношении рассматриваемый случай решительно отли
чается от предыдущего: для описания состояния адиабатной системы
требовалось при наличии нестатичности механического воздействия
два независимых параметра: объем и энтропия, тогда как здесь
х) Вообще говоря, наряду с изменением энтропии могли бы возникать
изменения и других немеханических координат. Однако опыт показывает,
что этого не происходит.
11*
164
ЙТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. Ш
достаточен только один — энтропия, безотносительно к условиям
теплообмена с окружающей ср ед ой .!)
Указанное своеобразие теплового воздействия на тело свидетель
ствует также о том, что подводимое или отводимое при постоянном
объеме количество теплоты всегда зависит только от начального и
конечного значений энтропии тела. Вместе с тем, поскольку здесь
для описания состояния тела достаточна только одна независимая
переменная (энтропия), то в качестве такой независимой переменной
может служить и любой другой параметр (например, температура),
в общем случае выражаемый как функция энтропии и объема тела.
Таким образом, если, скаж ем , температура тела, имеющего закреплен
ные границы, изменилась от 7\ до Т2, то тем самым однозначно
определено необходимое количество теплоты Q i , 2) как бы велика ни
была нестатичность теплопередачи,2) Отсю д а, между прочим, следует,
что хотя развитие нестатического процесса нельзя изобразить в д иа
грамме i s линией, тем не менее обусловливающее процесс коли
чество теплоты можно определить как площадь под квазистатической
изохорой в пределах заданных крайних температур.
Продолжая рассуждение далее, легко видеть, что при наличии
одной только тепловой степени свободы восстановление первоначаль
ного состояния тела (о котором можно судить либо по его энтропии,
либо по температуре, либо по давлению и т. п .) сопровождается
обращением в нуль итогового количества подведенного извне тепла.
Совершенно иначе обстоит дело применительно к теплоизолированному
телу. В этом случае восстановление телом первоначального объема
связано с некомпенсированной благодаря нестатичности затратой внеш
ней механической работы.
В чем же проявляется эффект нестатичности теплопередачи, если
при заданном количестве теплового воздействия тело фиксированного
объема испытывает всегда одни и те же результативные изменения?
Этот эффект, оказывается, всецело относится к окружающей тело
среде: изменение энтропии среды будет совсем иным при действии
конечных разностей температур, чем при исчезающе малых темпера
турных разностях.
В самом деле, посмотрим, как изменяется энтропия окружающей
среды 3) при изменении энтропии термодинамического тела от 5 , до 5 а,
если механическая работа над телом не производится? Для конкрет
ности допустим, что тело отдает теплоту среде. Так как температура
*) Как и раньше, говоря о том или ином состоянии тела, мы предпола
гаем, что тело имело достаточно времени, чтобы притти к равновесию.
а) Этим объясняется, что понятие количества теплоты, возникшее впервые
из калориметрии, связывалось именно с изменением температуры.
3) Чтобы понятие энтропии окружающей среды имело ясный смысл,
нужно последнюю представить себе ограниченной только той узкой физи
ческой областью, которая практически взаимодействует с термодинамическим
телом.
ГЛ. II]
ВТОРОЕ НАЧАЛО ДЛЯ НЕСТАТИЧЕСКИХ ПРОЦЕССОВ
165
среды должна быть при этом меньше температуры тела либо на б е с
конечно малую величину — при квазистатическом теплообмене, либо
на конечную величину — при нестатическом, то приращение энтропии
среды d S e = d Q ,T e будет относительно более значительным в случае
нестатического теплообм ена.*) Суммируя элементарные эффекты и
а
учитывая, что общее количество теплоты Qlt 2 = J dQ одинаково
1
в обоих случаях, заключаем, что итоговое увеличение энтропии окру
жающей среды при конечных разностях температур больше, чем при
бесконечно малых. М еж ду тем, при последнем условии энтропия
окружающей среды увеличивается как раз настолько, насколько
уменьшается энтропия т е л а .2)
Нетрудно видеть, каковы должны быть последствия в окружающей
среде, если мы захотим привести тело к первоначальному значению
энтропии $ 1Э т. е . к первоначальному состоянию, вернув телу то
количество теплоты, которое сначала было от него отведено. Так как
при сообщении тепла телу температура среды должна превышать
те мпературу тела, по крайней мере, на бесконечно малую величину,
а при этом условии энтропия среды уменьшится так, как она увели
чилась бы при квазистатическом отнятии тепла от тела, то в резуль
тате возвращения энтропии тела к первоначальному значению измене
ние энтропии среды остается нескомпенсированным, а именно, энтро
пия среды увеличится.
Приведенные соображения можно видоизменить таким образом,
чтобы влияние нестатичности теплопередачи было отнесено к самому
термодинамическому телу. Для этого удобно принять, что окружаю
щая среда, имеющая фиксированную температуру Г е, служит источ
ником тепла для тела, температура которого меньше Тв один раз
на исчезающе малую величину, а другой раз — на конечную величину.
В обоих случаях бесконечно малое изменение энтропии среды опре
деляется формулой
Если теплопередача происходит квазистатически, то такое же
точно изменение энтропии, но с обратным знаком испытывает тело.
!) Здесь сделано обычное для таких случаев допущение о том, что
в окружающей среде процессы квазистатичны, хотя между средой и термо
динамическим телом имеет место нестатическое взаимодействие.
2) Сказанное, разумеется, верно и в том предположении, что тело хо
лоднее окружающей среды. Тогда dSe отрицательно, причем более резкой
нестатичности отвечает меньшая абсолютная величина этого дифференциала.
Иными словами, изменение энтропии окружающей среды получает благодаря
нестатичности положительную добавку.
166
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. III
Однако если имеют место конечные температурные разности,
то бесконечно малое изменение энтропии тела оказывается боль
ш им, чем отношение dQ/Te:
Чтобы показать это, расчленим тело на малые элементы, в п ре
делах каждого из которых можно пренебречь неравномерностью
температуры. Изменения состояния таких элементов можно считать
квазистатическими и определять приращение их энтропии по обыч
ной формуле dSk= dQkITk, где k — номер элемента. Поскольку при
ращение энтропии термодинамического тела d S равно сумме прира
щений энтропии его частей 2 d S k (см. ниже), будем иметь:
Так как любая величина Тк меньше ТвУ можно написать, что
Но '^j dQk = dQ — количеству теплоты, подведенному к телу извне.
Следовательно, действительно:
Таким образом, приращение энтропии термодинамического тела
выражается, вообще говоря, такой формулой:
dS>4£-,
где знак неравенства соответствует реальным, нестатическим п р оц ес
сам теплопередачи, а знак равенства — идеальным, квазистатическим
процессам. Важно помнить, что входящая в формулу температура
относится не к термодинамическому телу, а к окружающей среде.
В данной главе это подчеркивается индексом при Г , в остальных
местах курса индекс опускается.
В заключение интересно еще раз провести параллель между проявле
ниями нестатичности при одном только механическом и одном только тепло
вом воздействиях на тело.
гл. и]
ВТОРОЕ НАЧАЛО ДЛЯ НЕСТАТИЧЕСКИХ ПРОЦЕССОВ
167
При одном только механическом
воздействии
При одном только тепловом
воздействии
1. Независимо от степени неста
тичности взаимодействия сумма изме
нений объема тела и окружающей
среды всегда равна нулю.
2. Возвращение тела к первона
чальному
объему
не
вызывает
в окружающей среде последствий
в виде изменения объема или эн
тропии.
Однако при нестатичности остает
ся нескомпенсированной произве
денная внешней средой механиче
ская работа. Поэтому несмотря на
тепловую изоляцию тела, в нем
происходит изменение обобщенной
тепловой координаты — энтропии.
1. Только при квазистатичности
взаимодействия
сумма
изменений
энтропии тела и окружающей среды
равна нулю. В противном случае
изменения энтропии внутри совокуп
ности не компенсируют друг друга.
2. Возвращение тела к первона
чальной энтропии только при ква
зистатичности не вызывает в окру
жающей среде последствий в виде
изменения энтропии или объема.
При нестатичности возникает
остаточное
изменение
энтропии
внешней среды. Однако несмотря
на это, произведенная ею тепловая
работа оказывается скомпенсирован
ной. Последнее связано с невозмож
ностью, по условию задачи, измене
ния нетепловой обобщенной коорди
наты тела — его объема.
Мы видим, таким образом, что в двух сопоставленных нестатических
явлениях свойства действующей работы и отвечающей ей обобщенной коор
динаты меняются в некотором смысле местами.
11.
Общее выражение второго начала. Из раздельного рас
смотрения эффектов нестатичности при одном только механическом
и при одном только тепловом воздействиях окружающей среды на
тело вытекает, что в обоих случаях приращение энтропии тела d S
не подчиняется формуле d S = d Q ;T e. Величина d S оказывается
большей, чем отношение dQ/Te. Разумеется, если механическое и
тепловое воздействия производятся одновременно, то указанное не
равенство может только усилиться. Таким образом, для реальных
случаев справедлива формула:
а
dS>^-\
S2—Sj>J
(III. 10)
16
В частности, если реальный процесс адиабатен (dQ = 0), то
d S > 0: термодинамическое тело переходит к таким состояниям,
в которых его энтропия оказывается больше первоначальной. Коротко
это выражают словами: в реальных процессах энтропия теплоизо
лированного {адиабатного) тела раст ет .
Закон возрастания энтропии при правильном его обосновании ни
в какой степени не вытекает из факта существования энтропии,
являясь следствием совершенно самостоятельного экспериментального
168
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. II
утверждения об одностороннем характере отклонений реальных про
цессов от квазистатических. Однако нужно решительно предосте
речь от то го , чтобы закон возрастания энтропии возвести в ранг
фундаментального закона природы, не могущего иметь вообще каких-
либо ограничений. О таких ограничениях будет сказано дальше.
Чтобы сделать наглядным качественное отличие нестатических
процессов от процессов квазистатических, целесообразно объединить
применительно к обоим случаям формулы для приращения энтропии
термодинамического тела. Очевидно, мы придем к формуле
Знак неравенства относится к нестатическим процессам. Чем менее
резко проявляется нестатичность, тем слабее становится неравен
ство, и для квазистатических процессов оно превращается в равен
ство. В этом последнем случае разница между внутренней и внеш
ней температурами исчезает ( Г = Г в), и последняя формула может
быть представлена в обычном виде (III. 4):
Формула (III. 11а) является общим математическим выражением
второго начала термодинамики.
Индекс при Т обычно опускается, и формула (III. 11а) записы
вается в виде
Отметим, что только для квазистатических изменений состояния
величина d S имеет точный смысл, вытекающий из понятий о состоя
нии внутреннего равновесия, о параметрах состояния, а также об
обобщенных координатах.
Однако опыт показывает, что и при
нестатичности процессов в совершенно подавляющем большинстве
случаев d S становится ясно определимым, а именно: дифференциал
энтропии тела оказывается равным сумме дифференциалов энтропии
таких элементарных частей тела, каждая из которых изменяет свое
состояние практически квазистатическим образом.
Закон возрастания энтропии указывает на односторонние откло
нения реальных процессов от идеальных. Чтобы сохранить энтропию
системы, внутри которой совершаю тся нестатические пр оцессы , на
постоянном уровне, необходимо компенсировать неуправляемое внеш
ними воздействиями изменение энтропии обменом тепла с окруж аю
щим миром. Для нестатических явлений, которые известны нам по
земному опыту, эта компенсация может быть достигнута только
путем отнятия тепла от системы. Поэтом у, например, в кооодина-
тах Т - S реальная адиабата всегда приводит к таким состояниям
термодинамического тела, которые лежат правее вертикали, п р о хо -
dS>4£
(III. 11а)
(III. 11)
ГЛ. II]
ВТОРОЕ НАЧАЛО ДЛЯ НЕСТАТИЧЕСКИХ ПРОЦЕССОВ
169
дящей через начальную точку (рис. 48). Если процесс протекает при
подводе тепла со стороны окружающей среды, то возрастание энтро
пии тела происходит более интенсивным образом, чем это следует,
если судить по количеству подведенной теплоты и температуре
окружающей среды. Если процесс сопровождается отнятием тепла от
тела, то энтропия последнего убывает в мень-
шей степени, чем это должно было бы быть '
при квазистатическом процессе. Разумеется,
может случиться, что несмотря на отвод тепла
от тела его энтропия даже растет. Насколько
расходятся реальный и идеальный случаи —
этого второе начало термодинамики, взятое
само по себе, предсказать не в состоянии.
Однако можно на основании опыта утвер
ждать, что расхождение это тем значитель
нее, чем резче самопроизвольное возрастание
энтропии, и наоборот. Поэтому
неуправляемое внешнам теплоподеодом возрастание энтропии
термодинамического тела может служить мерой нестатичности
реального процесса.
Как показывает опыт, закон возрастания энтропии может быть
в земных условиях обобщен на любые нестатические процессы
в макрофизических системах независимо от свойств образующих их
тел и рода внешних воздействий. Это значит, что какая бы работа,
механическая или немеханическая, ни производилась над термодина
мическим телом, в нем возникают наряду с сопряженными измене
ниями обобщенных координат такие внутренние процессы, как если
бы извне подводилось некоторое количество теплоты. С энергети
ческой точки зрения указанный эффект не противоречит, р азу
меется, закону сохранения энергии, так как энергия термодинами
ческого тела при любых обстоятельствах изменяется количественно
в точности на величину произведенной над телом работы и подве
денной теплоты. Однако обратное превращение всей приобретенной
телом энергии в ту же внешнюю работу становится более невоз
можным. Энергия оказывается при нестатическом развитии процесса
в качественном отношении иной, чем при квазистатическом течении:
она обесценивается в отношении своей работоспособности. Э та сто
рона проблемы будет рассмотрена дальше, в шестом отделе.
12.
Об использовании второго начала для количественного
анализа нестатических явлений. Существуют возможности перейти
от неравенства (III. 10), выражающего второе начало, к формулам,
которые имеют вид равенства. Первая из них естественным образом
вытекает из (III. 10):
dS=-^
- - \ -dSBCT, S2—S ,=
Г-^
-
+ Д5НС1.
(III.12)
*с
•'
*е
170
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. III
Последние выражения получают практический смысл при условии,
что имеются основания для расчета нестатического увеличения энтро
пии Д 5 Н0т, которое тело испытывает сверх изменения энтропии, при
внесенного из окружающей среды. При наличии таких расчетных
оснований можно было бы охватить количественным термодинами
ческим анализом и нестатические процессы, что, конечно, является
чрезвычайно желательным. Нуж н о, однако, иметь в виду, что этот
путь сопряжен с неизбежностью ряда упрощающих предпосылок и
принципиально не может быть строгим. Во всяком случае он не
способен дать полной картины развития нестатического процесса
во времени.
Составление формул для h S HCi применительно к ряду типичных
случаев можно произвести с помощью того же уравнения (III. 12),
если только имеется средство для вычисления соответствующего
фактического изменения энтропии S 2— S t. Ради этого вычис
ления S 2— S t приходится прибегать к серьезному упрощению
задачи, а именно, к предположению, что нестатический процесс
начинается и кончается равновесным состоянием термодинамического
тела. При этом условии S 2—
равно изменению энтропии, отве
чающему любому квазистатическому процессу, который только спо
собен соединить оба крайних равновесных состояния тела. Иными
словами, вычисление S 2— S t возможно путем замены реального
процесса эквивалентным квазистатическим, в котором действуют
воображаемые внешние источники тепла.
Обозначая текущую температуру тела в эквивалентном квази-
статическом процессе через Т и фиктивное количество теплоты от
привнесенных искусственно источников через */ффивт» имеем:
Тх
Так как интегрирование производится здесь по квазистатическому
процессу, то, согласно (I. 19а),
^Q$hkt == dU + ApdV
Последняя формула имеет важное самостоятельное значение, безот
носительно к то му, используется она или нет для вычисления d S ucl.
Действительно, она позволяет применить все обычные формулы
термодинамики для вычисления энтропии, давая итоговое изменение
энтропии тела, если только приемлема сделанная ранее предпосылка
о равновесности крайних состояний. В качестве компромисса должно
выполняться хотя бы условие о том, что в крайних состояниях по
(III. 13)
и
(III. 14)
ГЛ. II]
ВТОРОЕ НАЧАЛО ДЛЯ НЕСТАТИЧЕСКИХ ПРОЦЕССОВ
171
давляющая часть тела отличается равномерным распределением пара
метров состояния и специально — равномерной температурой. Если
это последнее условие считать допустимым не только для крайних,
но и для каждого промежуточного состояний тела, то открывается
возможность вычисления энтропии по всему хо ду нестатического
процесса. Так поступают, например, при обсуждении работы паро
силовой или холодильной установки. Несмотря на то, что между
рабочим телом и окружающей средой имеются нестатические связи,
полагают значение энтропии рабочего тела однозначно зависящим от
величин давления, температуры, объема, измеряемых в том или ином
месте установки (см. п . 12 первого отдела).
Преж де чем обратиться к примерам вычисления Д 5 НСт, приведем
еще одну форму записи второго начала в виде равенства. Если вся
кое мгновенное состояние тела может быть практически характери
зовано единым значением температуры, т о , очевидно, получает смысл
формула:
dS=
dQ + AdLtt01
Т
(111. 15)
где dQ — фактически полученная телом извне теплота, которая опре
деляется из первого начала:
dQ= dU-\ -AdL.
Здесь d L — фактически произведенная телом внешняя работа, a d L nст—
разность между возможной квазистатической и действительной не
статической работами.
Правильность такого истолкования можно показать, приравнивая
правые части формул (III. 14) и (III. 15). Имеем:
dU+ ApdV=dU + AdL+ AdLEст,
d^нот ~
—
*р dV dIf»
(III. 16)
Наличие этой разности приводит к внутренним эффектам , равно
сильным внешнему теплоподводу (тепловыделение вследствие меха
нической работы трения, вследствие электрической работы преодо
ления омического сопротивления проводника и т. п .) .
Применим выражения второго начала, представленные в виде
равенств, к отдельным частным случаям.
1.
В опыте Джоуля по определению теплового эквивалента кало
риметрическая жидкость и металл до и после опыта находятся
в равновесии. Поэтому формулу (III. 13) можно применить со всей
строгостью. Имеем:
Т-,
Тг
dS==^^£;
172
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. III
где С — полная теплоемкость калориметра с его содержимым. Факти
чески подведенное к калориметру тепло равно нулю. Поэтому из ф ор
мулы (III. 12) получаем:
Д5Нот= 5а— St= f
П оск о л ьк у объем калориметра по условию опыта не меняется,
из (III. 16) имеем:
dL’nci= =
—
dLy
т. е . вся внешняя работа, взятая по абсолютному значению, вызы
вает эффект внутреннего тепловыделения. И з формулы (III. 15) п о
лучаем :
•р AdL«vt _ dU CvdT
WO
J,■
p,
что совпадает с результатом, полученным из (III. 12).
2. Изменение энтропии газа, происходящее в результате его
втекания в сосуд, откуда выкачан воздух (опыт Джоуля), также
вычисляется на основании формулы (III. 13), которая с помощью (III. 14)
и известных газовых законов приводит к общему выражению:
5а—Sx—AQR\n^-\ -GcvIn
(см. II . 50а). При идеальном газе 7\ = Га
So— S , = i4G/?ln— = ЛО./?1п
21
Л
Из формулы (III. 12) получаем:
Д5„ст= 52—5, = ЖИ?1п-& .
Я2
И з формулы (III. 16):
dLEC7=s р dV;
^нст= GRT 1п
т: е. вся возможная квазистатическая работа дает эффект, равноцен
ный внешнему теплоподводу. Формула (III. 15) приводит к тому же
значению S 2— S lf как и (III. 12).
3. При прохождении по проводнику электрического тока выде
ляется тепло, т. е . электрическая работа необратимым путем увели
чивает энергию металла и вызывает эффект его нагревания. Чтобы
избежать нагревания, нужно компенсировать работу внешним тепло
отводом. Примем проводник за термодинамическое тело и будем
считать, что процесс стационарен, в связи с чем состояние провод
ника не меняется во времени, так что S 2— S t = 0 . Кроме того
будем для простоты считать, что благодаря интенсивному охлаж де
[Л. II]
ВТОРОЕ НАЧАЛО ДЛЯ НЕСТАТИЧЕСКИХ ПРОЦЕССОВ
173
нию проводника его постоянная температура практически совпадает
с температурой окружающей среды (Те = Т ) . Тогда из (III. 12) имеем:
дс
____
5-
а °НСТ ----- jT .
Здесь Q — подведенное к проводнику извне тепло, т. е . в данном
случае — величина отрицательная, численно равная A k V h , где A V ’ —
разность потенциалов, / — сила тока, т — время и А — тепловой
эквивалент электрической работы.
Таким образом,
А5 нет ----
AbVh
Т•
Из формулы (III. 13) следует, что */ффИКТ= 0, а так как dU = О,
то и выражение, аналогичное ApdV> обращается в нуль. Это объяс
няется следующим образом. Обобщенной силой для электрической
работы служит разность потенциалов (аналог давления р). При условии
квазистатичности электрическое сопротивление проводника должно
отсутствовать. Если, кроме того, отсутствует возможность превраще
ния электрической работы во внешнюю работу какого-либо иного
вида, то нет оснований, чтобы разность потенциалов отличалась от
нуля. Э то значит, что соответствующая электрическая работа равна
нулю, т . е . вообще никакого квазистатического процесса в указанных
условиях быть не может.
Из формулы (III. 15) получаем:
A dLKGi =
—
dQ, ALE07= A AVh = TД5НСТ.
Наконец, формула (III. 16) дает:
d Z*hct ==
dL.
Этот результат аналогичен тому, какой был получен в первом част
ном случае для калориметра Джоуля.
Пример. В баллоне емкостью V = 100 л находится сжатый воздух при
р1= 50 am и /j = 20°С. Окружающий воздух имеет рг= 1 am и t2= 20°С.
Определить увеличение энтропии в результате выпуска воздуха из баллона
в окружающую среду, предполагая процесс столь постепенным, что можно
практически не считаться с охлаждением выпускаемого воздуха.
В указанном процессе принимают участие два тела: воздушный заряд
баллона и окружающий атмосферный воздух, которые в совокупности обра
зуют изолированную систему. Задачу можно решить путем раздельного вычис
ления изменения энтропии каждого из двух тел, т. е. величин Д5аар и Д£оврф
Дальше будет показан более быстрый, но несколько менее поучительный
способ нахождения ответа.
Сравним состояние воздушного заряда до выпуска и по окончании вырав
нивания его параметров с окружающей средой. При этом отметим, что ника
кой роли не играет то обстоятельство, что вытекший в атмосферу заряд
перестает быть отличным от остального воздуха. Иными словами, для вто
рого состояния нам достаточно знать термические признаки такой весовой
174
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. Ill
порции воздуха, которая соответствует первоначальному заряду баллона,
хотя бы эта порция воздуха состояла из молекул, в баллоне вовсе и не быв
ших. Поскольку воздушный заряд подвергся расширению, сохранив неизмен
ную температуру, ондолжен был получить извне теплоту в количестве (Qj2 )зар-
Соответственно этому энтропия заряда увеличилась на ДS единиц. Кон
кретное вычисление AS3ap основывается на том, что при 7^ = Г2= Г = const
^зар =
(О^зар
12узар __ _
Pi
откуда
Д5зар
50-104.0,1.
-0 _ 195500
427 •293
427 •293
1,56 ккал/град.
Обратимся к окружающему воздуху. Ввиду того что от него заим
ствуются те же (С?1а)заРккал ПРИ той же температуре Г = 2 9 3 ° К , энтропия
его уменьшается на величину AS3ap, так что AS3Kp = — AS3ap. Однако этим
не ограничивается изменение энтропии окружающего воздуха. Дело в том,
что газ, изотермически расширяющийся под поршнем, мог бы произвести
внешнюю работу, равную (Z,J2)3ap. В действительности он совершает лишь
работу для преодоления атмосферного противодавления, измеряемую про
изведением /* 2 (У2— ^ \)зар* Таким образом, разность величин [(^12)зар—
—
р2(Уg— VjJgajj определяет собой работу, которая могла бы быть допол
нительно получена при условии медленного расширения воздуха в цилиндре,
а не вытекания его в атмосферу. С энергетической точки зрения ясно, что
указанная возможная работа расходуется на трение воздушных масс и пре
вращается в атмосфере в эквивалентное тепло. Действительно, струйки
вытекающего воздуха рано или поздно приходят к состоянию видимого покоя,
а это значит, что благодаря вязкости воздуха направленное движение моле
кул исчезает, уступая место более интенсивному тепловому движению.
В итоге энтропия окружающего воздуха увеличивается на
< 4.=ТК^2)зар- P
^
-
VlW-
Суммарное изменение энтропии AS0Kp= AS3Kp-f AS3Rp. Подставляя, находим:
Д$окр = -
ASaap+ ASaap—J РЯ(^ ~ ^ W
т. е.
AS,окр - т P*W*-vx\8ар‘
Теперь остается взять сумму AS3ap и AS0Kp. Имеем:
AS= AS3ap+ AS0Rp=4 [(^,2)заР-P M
-
V.aPb
где
Р2(V*- УJ)зар = 104(5—0,1) = 49000 кГм.
AS= ---- 4277293----- = + U7 ккал!град.
Из изложенного ясно, какое рассуждение можно предложить для вто
рого, ускоренного решения задачи. Изотермически расширяющийся воздуш
ный заряд мог бы произвести внешнюю работу (L ) , а в действитель-
ГЛ. И]
ВТОРОЕ НАЧАЛО ДЛЯ НЕСТАТИЧЕСКИХ ПРОЦЕССОВ
175
ности произвел работу Р2(У2— )зар- Разность этих величин измеряет теп
лоту трения, оставшуюся внутри системы. Так как выделение теплоты трения
происходило при повсеместно одинаковой температуре Т = Т1= jT2, то энтро
пия системы увеличилась на
д5 = у [(А 12)зар—р2 (К2— )за1>] = 1,17 гскал/град.
Остается заметить, что такой простой способ рассуждения был бы не
годен в случае, когда вытекание заряда происходит неизотсрмичсски. Здесь
возникает вопрос, к какой температуре следует относить теплоту трения
для вычисления Д5, что требует выполнения специального исследования.
13. Стремление изолированных систем к равновесию. Мы уже
констатировали, что в абсолютно изолированной термодинамической
системе, если она не находится в состоянии внутреннего равновесия,
такое равновесие рано или поздно непременно наступит, и вывести
систему из него могут только внешние воздействия, которые воз
можны при частичном или полном снятии изоляции. Высказывая это
положение, мы отвлекаемся от непрестанных микродвижений элемен
тарных частиц материи. Такова термодинамика, которая рисует только
картину большого плана, оказывающуюся неудовлетворительной,
когда мы подходим к протяженностям порядка радиуса сферы пря
мого действия молекулярных процессов .
Поставим следующие вопросы: не существует ли какого-либо
всеобщего термодинамического критерия для суждения о наличии
или об отсутствии внутреннего равновесия в изолированной физиче
ской области; будут ли и в каком именно направлении станут разви
ваться односторонние процессы на пути к внутреннему равновесию?
Н а эти вопросы можно непосредственно ответить, если в качестве
термодинамической системы мы имеем простое однородное тело.
Напомним, что однородное тело называется простым тогда, когда
для описания его состояния достаточно знать термические п а
раметры состояния: р , v и Г . Учтем затем, что неодинаковость
давлений и температур в соприкасающихся физических объемах д о л
жна служить активной причиной взаимодействия последних путем
производства механической работы или теплопередачи. Напротив,
повсеместное равенство давлений и температур свидетельствует об
отсутствии причины для производства внутренней работы, т. е .
о существовании внутреннего равновесия. Таким образом, ответы на
поставленные вопросы ясны.
Внутреннее равновесие в изолированной простой однородной си
стеме о тсутствует, если давление и температура распределены в ней
неравномерно. В этом сл учае в системе непременно возникают одно
сторонние процессы, которые приводят к равновесному состоянию,
отличающемуся повсеместным равенством давления и температуры.
Это правило не выполняется в том случае, если система разделена
на ряд ячеек с неподвижными или теплонепроницаемыми стенками.
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
176
[ОТД. III
Однако такой случай не имеет общего интереса и потому не рас
сматривается.
Может показаться, что приведенная формулировка условий равно
весия исчерпывает всю проблему. Однако легко убедиться, что если
термодинамическое тело является физически или химически неодно
родной системой, то одинаковость давления и температуры во всех
ее частях еще не дает гарантии равновесия.
Для иллюстрации представим себе, что в двух отделениях тепло
изолированного ящика находятся два разных газа, но при одинаковых
давлениях и температурах. Убрав разделяющую их перегородку, мы
обнаружим стремление каждого из газов распространиться по всему
объему. Этот медленный процесс диффузии газов заканчивается рав
новесным состоянием, в котором молекулы обоих газов статистически
равномерно распределены по всему объему ящика. Если газы идеальны,
то давление и температура в результате диффузии не меняются.
Диффузия является своеобразным нестатическим процессом, так
как она обусловлена не столько конечной скоростью перемешивания
газов, сколько маловероятным начальным распределением молекул
в пространстве. О наличии самопроизвольного перехода системы
к состоянию равновесия в этом случае можно судить не по давле
нию на стенки или по температуре, которые вовсе не изменяются,
а по другим, но непременно индивидуальным макрофизическим сво й
ствам газов, как то : по значениям газовой постоянной, теплоемкости,
удельного веса или подобных величин, отражающих статистически
усредненные свойства смеси в местах взятия пробы.
Если приведенный пример относился к случаю, когда в системе
происходит физический процесс, то коррозия металла в окислитель
ной среде может служить примером развития медленного химического
процесса, ведущего к равновесному состоянию при сохранении прак
тически постоянными величин давления и температуры. Мы видим,
таким образом, что равномерность давления и температуры в преде
лах термодинамической системы является условием необходимым, но
не доста то чны м*) для утверждения о внутреннем равновесии, так как
последнее требует взаимного равенства всех обобщенных сил, а су щ е
ственное значение некоторых из них может быть даже скрыто от
поверхностного наблюдения.
Опыт показывает, что для суждения о стремлении термодинами
ческих систем к равновесию достаточно предложить один единствен
ный термодинамический критерий — энтропию. Энтропия обладает
экстремальными свойствами, которые нам известны из механики
По поводу давления можно было бы повторить оговорку, сделанную
в п. 11 первого отдела. Там было указано, что посредством механических
устройств можно сохранять равновесие и при разных давлениях взаимодей
ствующих тел. Однако мы не будем без нужды усложнять рассуждений пред
положением о том, что отдельные части термодинамического тела связаны
друг с другом такими устройствами.
ГЛ. II]
ВТОРОЕ НАЧАЛО ДЛЯ НЕСТАТИЧЕСКИХ ПРОЦЕССОВ
177
в отношении потенциальной механической энергии. Действительно,
если потенциальная механическая энергия не находится при своем
возможном минимуме, устойчивое равновесие не имеет места. М е х а
ническая система обязательно стремится изменять свое состояние так,
чтобы ее потенциальная энергия превращалась в непотенциальную,
кинетическую энергию, поскольку это только допустимо наложен
ными связями. Подобно этому справедливо следующее утверждение:
Если среди возможных вариаций энтропии 85, допускаемых
природой изолированной системы, находится вариация с поло
жительным знаком 85 > 0, то это свидетельствует об отсут
ствии внутреннего равновесия и о неизбежности самопроизволь
ного перехода к нему системы. Признаком равновесного со
стояния системы служит достижение ею возможного максимума
энтропии и , следовательно у равенство нулю всех возможных
вариаций энтропии (85 = 0). Самовозбуждаемое убывание энтро
пии изолированной системы не наблюдается.
П о поводу возможных вариаций энтропии нужно заметить сл едую
щее. В отличие от дифференциала d S t который относится к факти
чески осуществляемому (квазистатическому или нестатическому) беско
нечно малому изменению состояния системы, вариация 85 принадлежит
к совокупности всех воображаемых, «виртуальных», изменений. В числе
этих воображаемых изменений могут быть такие, которые приближают
систему к равновесию, и такие, которые уводят ее о т равновесия,
лишь бы вычисление 85 не противоречило физическим особенностям
системы. О днако не все возможные вариации 85 на самом деле имеют
физический смысл: те из них, которые несовместимы с принципом
возрастания энтропии, необходимо исключить как противоречащие
опыту. Оставшиеся вариации покажут, с каким состоянием системы
мы имеем дело. Если все они равны нулю, то мы можем быть уве
рены, что система находится в равновесном состоянии. Если среди
величин 85 имеются положительные величины, то мы можем быть
столь же уверены, что исходное состоя
ние системы не является равновесным и что
в системе непременно возникнут внутрен
ние изменения, которые рано или поздно
приблизят ее к равновесию.
ЧЧЧЧЧУ^ У ч
Общность между энтропией изолиро-
ванной физической системы и потенциаль-
а)
б)
ной механической энергией, как показы
вает опыт, распространяется также на при
знаки устойчивости равновесия. Для разъя
снения обратимся к общеизвестному примеру из области механики.
Н а р и с . 49 показаны три случая равновесного положения кирпича,
соприкасающегося с горизонтальной плоскостью. Случай б, отвечаю
щий наивысшему возможному положению центра тяжести кирпича,
относится к категории неустойчивых равновесий. Малейшее смещение
Рис. 49.
12 Зак. 3543. В . С . Жуковский.
178
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. Ilf
из неустойчивого равновесия приведет кирпич в положение а или в.
Каждое из последних характеризует устойчивое равновесие, так как
при всяком малом изменении положения кирпича он непременно
вернется к соответствующему исходному положению. Э то связано
с тем, что все возможные вариации высоты центра тяжести имеют
в случаях а и в положительный знак, т . е . потенциальная энергия
тяжести обладает минимумами при малых нарушениях соприкасания
граней кирпича с плоскостью. Однако, несмотря на принадлежность
к положениям устойчивого равновесия, случаи а и в не вполне равно
ценны. П о отношению к а положение в является менее устойчивым,
так как центр тяжести в последнем случае не занимает все же самого
низкого положения из всех возможных. Э то значит, что вариация
потенциальной энергии, превышающая некоторую конечную величину,
не позволит более кирпичу вернуться в первоначальное положение в,
приведя его к более устойчивому положению а . В этом смысле поло
жение а представляется абсолютно устойчивым.
Совершенно таким же образом можно судить об устойчивости
равновесия термодинамических систем. Если всякая бесконечно малая
вариация энтропии изолированной системы из состояния ее равнове
сия имеет положительный знак, то такое равновесие является неустой
чивым. Неустойчивых равновесий на практике нельзя осуществить.
Есл и всякая бесконечно малая вариация 85 имеет отрицательный знак,
то это свидетельствует о наличии устойчивого равновесия системы
по отношению ко всем состояниям, смежным с исходным состоянием.
Есл и , наконец, в последнем случае найдется вариация энтропии, конеч
ной величины и положительного знака, то это означает, что су щ е
ствует еще и другое состояние устойчивого равновесия и притом
более устойчивого, чем первоначальное. Равновесное состояние, от
вечающее относительному максимуму энтропии (аналогичное в), назы
вается метастабилънымЛ а отвечающее абсолютному максимуму
энтропии (аналогичное а) называется абсолютно устойчивым. С этими
представлениями приходится, понятно, часто сталкиваться при изуче
нии физически или химически неоднородных систем.
Для иллюстрации того обстоятельства, что равновесное состояние
изолированной системы отличается большей энтропией, чем исходное
неравновесное, обратимся вновь к смешению газов посредством д иф
фузии.
Выясним, каким квазистатическим путем можно было бы осущ е
ствить такое же итоговое смешение газов, какое наблюдается при
самопроизвольном стремлении системы к равновесию? Можно вооб
разить устройство , использующее так называемые полупроницаемые
перегородки и позволяющее посредством последовательных б е с
конечно малых смещений из равновесия смешать без затраты
работы и без обмена тепла газы, занимающие равные объемы V
при одинаковой температуре Г , но разных давлениях. Таким образом*
остается лишь предварительно привести в раздельных со суда х газы
ГЛ. и]
ВТОРОЕ НАЧАЛО ДЛЯ НЕСТАТИЧЕСКИХ ПРОЦЕССОВ
179
из их начальных состояний до диффузии (Р , Т , V4) к одинаковым
объемам
сохранив неизменной температуру Г . Поскольку
этот предварительный этап должен быть также квазистатическим,
надлежит к каждому из газов подвести извне теплоту соответственно
известным формулам для изотермического процесса. Допуская одно
только механическое взаимодействие газов с окружающей средой,
нельзя сохранить постоянства температуры, так как при адиабатном
расширении температура должна падать. И так , заменяя реальную
диффузию искусственным квазистатическим процессом с такими же
крайними состояниями термодинамической системы, легко обнар\жить
неизбежность увеличения ее энтропии. Для каждого из диффунди
рующих газов согласно ( I I. 56) имеем:
Д5<=AG^In
>0.
Следовательно, для системы в целом:
Д5= 2Д5<>0.
Следует отчетливо уяснить себе смысл, вкладываемый в обсуждае
мое стремление изолированных систем к равновесию. Ранее было уже
установлено, что если такая система совершает нестатический про
цесс любого р од а, то ее энтропия растет. В этом отношении пример
с взаимной диффузией газов, как и любой другой, который еще
можно предложить, ничего нового не д а е т .!) Новым является утвержде
ние обратного характера. Если энтропия системы не достигла своего
максимально возможного значения, то неизбежен самопроизвольный
нестатический процесс, который приведет систему к равновесию и
притом так, что энтропия будет все время расти. Таким образом,
ранее формулировались следст вия, вытекающие из факта наличия
нестатического процесса в изолированной системе. Теперь же опре
деляются условия, необходимые и достаточные для того, чтобы пред
сказать возникновение нестатического процесса, который должен
*) Интересно указать на парадокс, заключающийся в том, что при взаим
ной «диффузии» двух порций одного и того же газа, находящихся при оди
наковых температурах и давлениях, их энтропия должна была бы увеличиться.
Конечно, это заключение абсурдно. Очевидно, при разделении некоторого
газового объема перегородкой его внутреннее состояние не изменяется, так
же как и при удалении вставленной перегородки, если газ находится в рав
новесии. Между тем, судя по формулам для ДS{ и Д5, в результате удаления
перегородки энтропия возрастает. Ошибка в рассуждении заключается в том,
что никакой диффузии вообще не происходит, если приводятся в контакт
две массы одного и того же газа, находящиеся в одинаковых термических
состояниях. О диффузии можно говорить только тогда, когда имеются в виду
разные газы или хотя бы разные первоначальные состояния одного и того
же газа, т. е . когда по макроскопическим признакам обе массы отличны
Друг от друга. Соответствующее указание по этому поводу было уже сделано
в п. 2 первого отдела.
12*
180
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. III
перевести систему из состояния с меньшей энтропией в состояние
с большей энтропией. Э то т новый обратный принцип составляет еще
один и очень важный аспект второго начала термодинамики.
Располагая критерием стремления изолированных систем к равно
весию, можно приобщить к термодинамике и категорию самопроиз
вольных процессов. Примером такого процесса служит внезапное
выпадение льда из переохлажденной воды. Средствами термодинамики
нельзя предвидеть момента, когда именно возникнет спонтанный про
цесс. Однако второе начало термодинамики позволяет обнаружить,
что переохлажденное состояние жидкости является метастабильным,
что абсолютно равновесным должно быть состояние, когда вся
жидкость или определенная часть ее (в зависимости от глубины пере
охлаждения) кристаллизована, и что, следовательно, при благоприятном
стечении обстоятельств, пусть и не поддающихся термодинамическому
описанию, неминуемо выпадение из жидкости твердой фазы с соот
ветствующим повышением температуры.
Располагая критерием стремления изолированных систем к равно
весию , возможно формулировать ряд других , производных, критериев,
которыми определяется стремление к равновесию систем , находящихся
в частных условиях связи с окружающей средой. В связи с этим,
например, в химической термодинамике большое значение приобретает
свободная энергия F и термодинамический потенциал Ф (см . четвер
тый отдел). Однако здесь эти вопросы не затрагиваются.
14.
Границы второго начала термодинамики и их статисти
ческое толкование. В предыдущем изложении не раз обращалось
внимание на то , что термодинамический метод анализа имеет свои
границы, за пределами которых он явно недостаточен или же вовсе
неприменим. Эти ограничения не относились, однако, к самому закону
сохранения и превращения энергии, который составляет основу те р
модинамики и в наиболее широком понимании является всеобщим
законом природы. Хотя второе начало термодинамики уже по одному
своему наименованию претендует на равноправие с первым началом,
в действительности оно не обладает свойствами универсальности
в той своей части, которая относится к реальным, необратимым п ро
цессам. Таким образом, применительно ко второму началу следует
поставить вопрос не только о законности приемов его использования,
но и об его собственной безусловности. Этот вопрос тем более
актуален, что с давних пор один из важных узлов борьбы между
материалистическим и идеалистическим миропониманиями был завязан
вокруг толкований далеко идущих выводов из второго начала.
Вопрос о границах второго начала приобрел большую остроту
одновременно с введением в науку самого понятия об энтропии
в результате необоснованной экстраполяции повседневного опыта на
всю вселенную, допущенной 100 лет назад Р . Клаузиусом. О тпра
вляясь от того наблюдаемого ф акта , что энтропия изолированных
термодинамических систем возрастает в результате их стремления
ГЛ. И]
ВТОРОЕ НАЧАЛО ДЛЯ НЕСТАТИЧЕСКИХ ПРОЦЕССОВ
181
к равновесию, Клаузиус провозгласил тезис: «энтропия вселенной
стремится к максимуму». Этот тезис равнозначен утверждению, что
эволюция вселенной является односторонней, ведущей к замиранию
ее жизни, к наступлению извечного равновесия, к «тепловой смерти»
вселенной. Термин «тепловая смерть» призван, очевидно, выразить
то положение вещей, что все мыслимые формы энергии самопроиз
вольно превратились в энергию теплового движения элементов миро
здания, а это привело в свою очередь к всеобщему выравниванию
температуры под действием обычного механизма теплообмена. Иными
словами, хотя общее количество энергии во вселенной не изменилось,
качественный соста в энергии стал унифицированным. Э т о значит,
что энергия потеряла способность к последующим превращениям.
Следует отметить, что такая концепция несколько ранее Клаузиуса
была высказана В . Томсоном (Кельвин), с той разницей, что послед
ний не пользовался понятием энтропии, в то время еще не суще
ствовавшим.
Концепция «тепловой смерти» неминуемо приводит к признанию
начала в существовании вселенной. Действительно, если обеднение
форм движения материи, «тепловая смерть», являются обязательными
для развития вселенной и если вселенная не имеет начала во времени,
то почему же еще сохранилось в нашу эпоху богатство природы,
почему эта «смерть» не наступила? Факт существования хотя бы нас
самих свидетельствует о том, что существование вселенной о гр а
ничено конечным временем. Отсюда прямая дорога к провозглаше
нию внематериального импульса — бога , который сотворил мир из
хаоса и создал физические законы, которых до этого акта не
существовало.
Именно по этим причинам абсурдная концепция «тепловой смерти»
энергично поддерживалась идеалистическим лагерем и находит при
знание в настоящее время у некоторых реакционных ученых загни
вающего империализма.
В противоположность описанной концепции диалектический мате
риализм учит, что богатство форм движения материи и их п о
стоянная взаимопревращаемость представляют собой неотъемлемое
свойство природы и что жизнь ее не может иметь ни начала, ни
конца во времени. Блестящее изложение такого миропонимания дано
Ф. Энгельсом во введении к «Диалектике природы». Одна выдержка
из этого введения цитировалась уже в п. 5 первого отдела. При
ведем здесь еще две выдержки.
Отвечая на вопрос, как материя нашего мирового острова пре
вратила в теплоту такое огромное количество движения, что отсюда
могли развиться солнечные системы, постепенное умирание которых
равным образом несомненно, Энгельс говорит: « . . . здесь мы вынуж
дены либо обратиться к помощи творца, либо сделать тот вывод,
то раскаленное сырье для солнечных систем нашего мирового о ст
ова возникло естественным путем, путем превращений движения
182
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. Ш
которые присущи от природы движущейся материи и условия
которых должны, следовательно, быть снова воспроизведены мате
рией, хотя бы спустя миллионы миллионов лет, более или менее
случайным образом, но с необходимостью, присущей также и
случаю».*)
Свое введение Энгельс заключает словами: « . . .
—
у нас есть уве
ренность, что материя во всех своих превращениях остается вечно
одной и той же, что ни один из ее атрибутов никогда не может
быть утрачен и что поэтому с той же самой железной необходи
мостью, с какой она когда-нибудь истребит на земле свой высший
цвет — мыслящий д у х , она должна будет его снова породить где-нибудь
в другом месте и в другое время». 2)
Специально по поводу экстраполяции второго начала Клаузиусом
Энгельс пишет:
« В каком бы виде ни выступало перед нами второе положение
Клаузиуса и т. д ., во всяком случае, согласно ему, энергия теряется,
если не количественно, то качественно. Энтропия не может у н и
чтожаться естественным пут ем, но зато может создаваться.
Мировые часы сначала должны быть заведены, затем они идут, пока
не придут в состояние равновесия, и только чудо может вывести их
из этого состояния и снова пустить в хо д . Потраченная на завод
часов энергия исчезла, по крайней мере в качественном отношении,
и может быть восстановлена только путем толчка извне. Значит,
толчок извне был необходим также и вначале; значит, количество
имеющегося во вселенной движения, или энергии, не всегда одина
ково; значит, энергия должна была быть сотворена; значит, она
сотворима; значит, она уничтожима. Ad absurdum! [До аб сурда!]»3).
«Клаузиус — if correct [е:ли я его правильно понимаю]— доказы
вает, что мир сотворен, следовательно, что материя сотворима, сле
довательно, что она уничтожима, следовательно, что и сила (соот
ветственно — движение) сотворима и уничтожима, следовательно, что
все учение о «сохранении силы» бессмыслица, — следовательно, что
и все его выводы из этого учения тоже бессмыслица».4)
Таким образом, по Энгельсу, принятие «тепловой смерти» вселен
ной равнозначно о тказу от принципа сохранения и превращения энер
гии, выражающего основной физический закон жизни природы.
Мы не имеем возможности осветить полемику, возникшую вокруг
реакционного умозаключения Клаузиуса. Конечно, далеко не все
представители физических наук соглашались разделить его крайние
выводы. Некоторые противопоставляли Клаузиусу чисто логические
возражения по поводу закономерности экстраполяции второго начала
')
2)
Ф. Энгельс, Диалектика природы, 1948, стр. 19.
Там же, стр. 21.
Г.1 . II]
ВТОРОЕ НАЧАЛО ДЛЯ НЕСТАТИЧЕСКИХ ПРОЦЕССОВ
183
на вселенную. К этим возражениям принадлежат, например, такие:
подобно тому как макрофизические, с нашей обыденной точки зре
ния, законы теряют смысл для молекулярных и внутримолекулярных
явлений, нет оснований распространить эти законы на сверхмакро-
физическую систему , каковой является вселенная; сами понятия о тем
пературе, энтропии и подобных свойствах тел, имеющих микромас
штабную корпускулярную структуру, непереносимы непосредственно
на вселенную, для которой роль «кирпичиков» играют не молекулы,
а звезды и планеты — образования макромасштабных размеров; нельзя
наперед утверждать, что из вселенной возможно выделение таких
областей, которые были бы изолированы от воздействия «окруж аю
щей среды», и т. п.
Как бы ни были серьезны логические возражения Клаузиусу*
более существенными являются поиски научно обоснованных об ъяс
нений механизма воспроизводства жизни вселенной. Обратим внима
ние на то, что при этом речь идет во всяком случае об определе
нии условий самопроизвольного развития физических процессов
в направлении, противоположном обычно нами наблюдаемому (пере
хо д тепла от менее нагретых тел к более нагретым, возникновение
сложных веществ из простых и т. п .) . Разумеется, эти проблемы
выходят далеко за рамки нашего курса, и мы их касаться не станем.
Мы должны только признать, что решающих успехов на этом пути
еще не достигну то. Э т о неудивительно, так как экспериментальные
факты, долженствующие лечь в основу соответствующих теорий,
приходится искать в областях, весьма удаленных от узких границ
нашего скромного опыта. В связи с этим уместно привести меткое
высказывание Г . Н . Лью иса: «Термодинамика не дает оснований для
предположения, что вселенная гибнет. Выигрыш энтропии всегда озна
чает проигрыш в осведомленности и ничего больше».
Большую революционизирующую роль в борьбе против концеп
ции тепловой смерти вселенной сыграл Л . Больцман. О н завершил
начатое его предшественниками здание кинетической теории газов,
создав статистическую механику как метод нахождения связи между
макроскопическими и молекулярными закономерностями.
Основной предпосылкой метода является возможность расчленения
макроскопической системы на чрезвычайно большое число элементарных и
одинаковых частиц. При этом взаимные действия элементарных частиц
(в газах — соударения молекул) считаются независимыми друг от друга,
т. е . наступление какого-либо одного случая взаимодействия (удара) пред
полагается не влияющим на возможность в последующем всякого другого
случая (неупорядоченность молекулярных движений).
Определенное макроскопически равновесное состояние, заданное, ска
жем, какими-либо из величин объема, температуры, давления, энергии,
с микроскопической точки зрения представляет собой картину непрерывного
движения и изменения. Ввиду невозможности описать положение и скорость
каждой из огромного числа частиц в начальный момент наблюдения в микро
физике приходится отказаться от аналитического вычисления их координат и
состояния движения в последующие моменты, как это удается, например,
184
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. Ill
сделать в небесной механике. Взамен аналитического метода используется
метод вероятностей, или, как его называют иначе, статистический метод.
Макроскопически воспринимаемые свойства тела представляются при этом
как статистически усредненные величины.
Наряду с понятием о макросостоянии в кинетической теории оперируют
с понятием о микросостоянии. Микросостояние тела считается определенным,
если в среднем известно число частиц, отличающихся тем или иным распо
ложением и состоянием движения. Вопреки видимому постоянству статисти
ческих свойств изолированного, находящегося в равновесии, тела его микро
состояние непрерывно меняется. Чередование отдельных микросостояний
подвержено случаю. Однако в этой случайности имеется своя закономер
ность. Именно, известные микросостояния возникают особенно часто — их
называют наивероятнейшими, другие же наступают более или менее редко,
и притом тем реже, чем дальше от наивсроятнейшего отстоит данное микросо
стояние. Отклонения микросостояний от наиболее вероятного из них про
являются на макроскопических свойствах в виде так называемых флюктуа
ций, т. е . случайных колебаний статистически определяемых параметров от
их преобладающего во времени значения. Если этих флюктуаций мы не заме
чаем при, как обычно, довольно грубом наблюдении равновесных макросо
стояний, то объясняется это особой причиной. Для конкретизации мы обра
тимся к одному из простейших примеров.
Представим себе, что в изолированном ящике находится газ, и усло
вимся в отношении его микросостояний интересоваться исключительно рас
пределением молекул в пространстве, а именно, частотой пребывания того
или иного количества молекул в одной половине ящика. Предварительно
проведем небольшой показательный расчет. Допустим, что в ящике имеется
десять молекул. Существует единственная возможность сочетать молекулы
так, чтобы все они занимали одну половину ящика. Нетрудно видеть, что
число возможных сочетаний, приводящих к нахождению в этой половине
девяти молекул, равно десяти. Соответствующее число для восьми молекул
10 •9
в одной половине будет уж е равно
7 = 45. Наконец, для равномерного
1•z
распределения молекул между обеими половинками число сочетаний оказы-
10.9 -8 -7 .6
осо _д
*
вается равным "i "2 3
’ т*е*
видим’ таким образом, что число
различных возможностей осуществления данного распределения резко растет
при переходе к более равномерным распределениям. Темп этого роста еще
более усиливается при увеличении наличного количества молекул в ящике.
Так, если бы мы имели дело со 100 молекулами, то число сочетаний, дающих
равномерное распределение, оказалось бы равным 11,15* Ю ^при, попрежнему,
оДном единственном сочетании, способном сгруппировать все 100 молекул
в одной половине ящика.
Г
Если бы мы стали периодически сосчитывать молекулы, которые имеются
налицо в фиксированной части объема, то при весьма большом их общем
количестве мы обнаружили бы, что в совершенно подавляющем числе наблю
дений распределение молекул между обеими частями было бы, естественно,
равномерным или близким к равномерному. Назвав количество способов,
которыми достигается данное микросостояние, термодинамической вероят
ностью этого состояния, можно сказать, что наивероятнейшими микросо
стояниями являются те, которые обладают наибольшей термодинамической
вероятностью. Напротив, шансы на то, что будут возникать состояния,
отличающиеся относительно малой вероятностью, чрезвычайно ничтожны.
Чтобы дождаться группировки молекул в одной только половине предо
ставленного им объема, нужно при реальных плотностях газов продолжать
наблюдения в течение астрономического периода времени.
Весьма важно учесть, что острота различия между состояниями с боль
шей и меньшей вероятностью сглаживается по мере уменьшения общего
ГЛ. II]
ВТОРОЕ НАЧАЛО ДЛЯ НЕСТАТИЧЕСКИХ ПРОЦЕССОВ
185
числа микрочастичек. При десяти молекулах будет приходиться в среднем
один случай на 252 случая; когда все молекулы сгруппируются в половине
ящика, а если бы молекул было всего две штуки, то одинаково часто мы их
видели бы вместе и порознь в каждой из двух половин. Теперь уже выяс
няется, почему мы, измеряя макроскопические параметры системы, не заме
чаем обычно флюктуаций. Это происходит потому, что мы применяем при
боры, которые реагируют только на воздействие со стороны колоссального
количества микрочастиц, и еще более колоссальные количества последних
заполняют физические объемы, с которыми нам приходится иметь дело.
Чтобы при этих условиях ощутить заметные и потому кратковременные
флюктуации плотности, надлежит наблюдать за системой в течение проме
жутков времени, несоизмеримо больших по сравнению с длительностью
человеческой жизни. К такому же заключению можно притти, интересуясь
не только распределением микрочастиц в пространстве, но также, например,
распределением между ними скоростей.
Представим себе теперь, что некоторая изолированная система взята
в термодинамически неравновесном состоянии. Исходное микросостояние
системы обладает очень малой вероятностью, и его можно рассматривать
как некую резкую флюктуацию по отношению к будущим, повсеместно
одинаковым, статистическим параметрам. Разница между этой флюктуацией
и рассмотренными выше флюктуациями заключается лишь в том, что она
возникла не самопроизвольным образом при движении микрочастиц, а уста
новлена принудительно действием каких-то внешних причин. На последую
щем развитии событий это различие в происхождении флюктуации нс отра
жается.
Итак, начальное микронеравновесное состояние изолированной системы
является резкой флюктуацией, сколь-нибудь длительное существование кото
рой невозможно. Поэтому микросостояния системы начинают непрерывно
сменяться таким образом, что вскоре во времени начинает преобладать
наивероятнейшее микросостояние, что на языке термодинамики означает
одностороннее приближение к внутреннему равновесию. Однако, несмотря
на устанавливающуюся стабильность статистических параметров, физически
вполне обоснованы самопроизвольные местные отклонения их от наблюдае
мых усредненных значений. В чрезвычайно малых частичных объемах системы,
не поддающихся обследованию обычными измерительными приборами (мано
метром, термометром и т. д .), такие отклонения возникают непрерывно, но
ввиду малости не оказывают практического влияния на статистическое
равновесие системы. Что касается резких флюктуаций, которые способны
нарушить видимым образом однородность макроскопических свойств системы
и, следовательно, самопроизвольно вывести систему из состояния, которое
в термодинамике называют равновесным, то такие резкие флюктуации вовсе
не исключены. Их вероятная частота только весьма мала, и поэтому они
воспринимаются с нашей ограниченной точки зрения как невозможные.
Лишь в таком смысле, оказывается, получает силу основной для термодина
мики принцип, согласно которому всякая предоставленная самой себе система
приходит к стабильному состоянию внутреннего равновесия.
Таким образом, микрофизический анализ показывает, что одностороннее
развитие непосредственно наблюдаемых процессов вовсе не является абсо
лютным законом природы, а имеет лишь вероятностный характер. Стремление
к термодинамическому равновесию равнозначно тому факту, что наиболее
вероятным является самопроизвольный переход микросостояний с меньшей
вероятностью к тем, вероятность которых больше.
Больцман обратил внимание на параллельность свойств энтропии и
термодинамической вероятности в изолированных системах. Формальное от
личие этих величин сводится лишь к тому, что энтропия аддитивна» а вероят
ность мультипликативна, ввиду чего простой линейной связи между ними
не может быть. Нетрудно видеть, что такая связь должна иметь место
186
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. III
между энтропией и логарифмом вероятности. Эту теорему, доказанную для
простого случая — газа, Больцман счел возможным распространить на любые
физические системы. Ввиду этого второе начало термодинамики, подобно
тезису об односторонности реальных процессов, перестало быть безуслозным
законом и стало лишь законом статистическим. При достаточно длительном
наблюдении (при большом количестве элементарных частиц оно несоизме
римо с человеческой жизнью) с необходимостью, присущей вероятному
случаю, изолированная система должна вернуться хотя на мгновение сколь
угодно близко к своему исходному состоянию, как бы оно ни было мало
вероятным. Этим снимается обязательный характер необратимости и прин
ципа возрастания энтропии. Одновременно вырисовываются и границы второго
начала термодинамики.
Больцман пишет: «Мир можно представить себе как механическую си
стему, состоящую из огромного числа частиц и существующую неизмеримо
долго. Вся наша звездная система ничтожна в сравнении с размерами этой
системы, а промежутки времени, измеряемые необозримыми эпохами — эонами,
будут бесконечно малы по сравнению с временем существования вселенной.
Почти всюду в этой вселенной господствует тепловое равновесие и, как его
следствие, смерть. Но, то там, то здесь, в небольших областях, небольших,
говоря относительно, они будут порядка нашего звездного мира (мы их
будем называть индивидуальными мирами), будут иметь место значительные
отступления от термического равновесия и притом в течение промежутков,
весьма коротких по сравнению с величиной зона. Число таких частей вселен
ной, для которых вероятность состояний возрастает, одинаково с числом
тех, для которых оно убывает. . . Этот метод мне представляется единствен
ным, позволяющим принять второй принцип термодинамики, термическую
смерть каждого индивидуального мира, не навязывая необратимости всей
вселенной и не считая, чго она от определенного начального состояния пере
ходит к определенному конечному». !)
Материалистическая позиция Больцмана встретила в свое время актив
ную оппозицию со стороны многих ученых. Высказывались возражения
не только по поводу широких обобщений его теории, но даже в отно
шении уместности принятой атомистической предпосылки, которая тогда вы
нуждена была оставаться только на положении гипотезы, как бы хорошо
ни совпадали с опытом выведенные статистическим путем закономерности. 2)
В связи с этим решающее значение имели работы М. Смолуховского, кото
рый на экспериментальных данных о броуновском движении доказал не
оспоримость физической статистики. По интересующему нас вопросу отметим
следующее.
Мы установили, что при уменьшении общего числа частичек, будь то
благодаря переходу к весьма малым объемам или благодаря понижению
средней плотности распределения частичек во всем объеме, вероятности
крайних микросостояний по своей величине быстро приближаются друг
к другу. Поэтому самопроизвольное наступление даже очень маловероятных
микросостояний .может получить такую заметную частоту, что его можно
будет регистрировать уже при кратких временах наблюдения за системой.
Смолуховский пишет 8): «Я получил точное решение не раз выдвигавшейся
Больцманом и другими задачи, которая касается вопроса о возможности
самопроизвольного разложения воздуха на его составные части. Если при-
*) Л. Больцман, Очерки методологии физики, изд. Гос. Тимирязевского
института, 1939, Москва.
2) Прогрессивная роль Больцмана в борьбе против идеалистической фило
софии, феноменологической физики М аха, энергетики Оствальда неодно
кратно подчеркивается В. И . Лениным в книге «Материализм и эмпирио
критицизм».
3) Сборник статей «Броуновское движение», ОНТИ, 1936, стр. 363—364,
ГЛ. II]
ВТОРОЕ НАЧАЛО ДЛЯ НЕСТАТИЧЕСКИХ ПРОЦЕССОВ
187
нять во внимание количество воздуха, содержащееся внутри сферической
поверхности радиуса а , и вычислить то время 0 , по истечении которого
концентрация кислорода воздуха станет на 1% выше нормальной, то полу
чится следующая картина:
а
1
5• 10-5
с
о
о
1
с
«
2,5 -10 -5
1.10-5см
0
10<“и>
1068
10*
1
10-11 сек.
Таким образом, для объемов, наблюдаемых невооруженным глазом, полу
чается столь колоссальное время возврата !) для флюктуации концентрации
Ь = 1/100, что диффузию следует считать практически необратимой, в то
время как для объемов, стоящих по величине на границе микроскопической
видимости, флюктуации концентрации настолько велики и происходят так
быстро, что там не может быть никакой речи о ее необратимости. Понятие
диффузии в обычном смысле этого слова теряет в этом случае свою при
годность ...».
Далее у Смолуховского читаем: «То обстоятельство, что при процессах
диффузии, трения и теплопроводности наблюдается обычно только необра
тимое поведение, происходит вследствие того, что в макроскопической прак
тике, как правило, исходят из начальных состояний, которые отклоняются
от нормального состояния далеко за значение средних флюктуаций, т. с .
чрезвычайно невероятны в смысле атомистической теории; поэтому в боль
шинстве случаев они возвращаются к своим первоначальным значениям
лишь по прошествии чрезвычайно большого промежутка времени, и практи
чески это почти никогда не наблюдается...» .
Таким образом, статистическая механика приводит в общем к резуль
тату, что энтропия может как возрастать, так и убывать, т. е . что теплота
сама собой может переходить от более холодного тела к более нагретому, —
может быть даже всю солнечную теплоту следует рассматривать лишь как
само собой появившееся скопление теплоты внутри системы, находящейся
в состоянии равновесия, — однако, если выйти за область средних флюктуа
ций, то вероятность такого скопления уменьшается несравненно быстрее,
чем его величина. Но так как вероятность соответствует «среднему по
времени», то законы обычной термодинамики сохраняют свое значение в не
сколько видоизмененной, ограниченной формулировке, например «теплота
не может в течение продолжительного времени сама собой переходить от
более холодного тела к более нагретому».2)
Резюмируя свои соображения, Смолуховский пишет: «Точно сформули
рованные в предшествующих разделах понятия времени возврата дают
подлинные критерии для границ применимости закона энтропии. Представ
ляется ли нам какой-либо (зависящий от одного параметра) процесс обра
тимым или необратимым, а это и является основным пунктом всего вопроса,
зависит не от хода процесса, а только от начального состояния и от про
должительности наблюдения, причем все может быть выражено простым
правилом: процесс представляется нам | Необратимым } *если РассматРивае*
мое состояние обладает | ПраткимНЫМ } вРеменем возврата (или временем
ожидания) по сравнению с продолжительностью наблюдения». 3)
*) Временем возврата называется промежуток времени, требующийся для
того, чтобы молекулярная система вернулась к микросостоянию, близкому
.к первоначальному.
а) Сборник статей «Броуновское движение», ОНТИ, 1936, стр. 202—203 .
3) Там же, стр. 303.
188
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
[ОТД. ПГ
Это толкование второго начала, данное Смолуховским, окончательно
опровергает теорию Клаузиуса о тепловой смерти, согласно которой в ре
зультате непрерывного роста энтропии во вселенной в конце концов должно
наступить абсолютное равновесие.
Согласно Смолуховскому, здесь может итти речь самое большее о ста
тистическом равновесии, о равновесии, непрерывно сопровождающемся,
однако, флюктуациями и притом произвольно большими; только время воз
врата последних настолько огромно, что мы не в состоянии даже составить
себе о нем какое-либо представление.
Тот факт, что второе начало термодинамики находит столь широкое
применение в пределах нашего опыта, следует приписать лишь тому об
стоятельству, что случайно мы находимся как раз в очень «аномальной»
фазе, благодаря чему, согласно Смолуховскому, у нас создается впечатление
полной необратимости. Однако последнее свойственно как раз только нам,
людям, в соответствии с нашими «случайно» большими размерами по срав
нению с миром молекул. Если бы мы имели размеры порядка бактерий, мы
никогда не пришли бы ко второму началу.
Идеи Больцмана и его последователя — Смолуховского, противо
поставленные тезису о «тепловой смерти» вселенной, в своей крити
ческой части бесповоротно снимают идеалистическое заблуждение
Клаузиуса. Однако в положительной части описанные идеи, повиди-
м ому, не могут быть признаны завершающими действительную картину.
Мы не можем примириться с мыслью, что процессы становления
во вселенной имеют характер мимолетных вспышек на фоне всеобщей
смерти. Флюктуационная гипотеза Больцмана исключает возможность
квазициклического развития мира, который наделяется всеми призна
ками статистически равновесной системы, изредка испытывающей
пространственно-временные флюктуации.
Идеи Больцмана и Смолуховского основываются на предположе
нии, что физическая статистика, приспособленная к природе и свой
ствам элементарных частиц, которые пока стали доступными нашему
знанию, обязательна для всей вселенной. Однако можно допустить,
что события, кажущиеся нам необычайными, происходят в мире не
только потому, что их вероятность хотя и весьма мала, но все же
не равна нулю, а и по другой причине. Быть может, в физических
условиях, отличающихся от земной обстановки, состояния большей
вероятности могут получить прямо противоположные признаки, чем
это принято считать на основании опыта, ограниченного предметом,
методом и временем. Таким образом, т о , что нам кажется маловероят
ным, может в иных условиях оказаться наиболее вероятным. При
таком расширении признаков вероятного отпадает необходимость
примирения «невероятного» с вероятным. Вместо этого появится кон
куренция между наиболее вероятными тенденциями отдельных элемен
тов мира, которая и должна будет определить собой квазицикличе-
ский характер развития его крупных частей.
ОТДЕЛ ЧЕТВЕРТЫЙ
ДИФФЕРЕНЦИАЛЬНЫЕ УРАВНЕНИЯ
ТЕРМОДИНАМИКИ
1. Калорические уравнения состояния. На основании первого
начала и второго начала, отнесенного к квазистатическим изменениям
состояния, можно составить много дифференциальных уравнений,
посредством которых взаимно связываются разнообразные физические
свойства термодинамических тел. Большое практическое значение этих
уравнений заключается в том, что они позволяют сократить коли
чество непосредственно получаемых из опыта данных о физических
свойствах тел, открывая возможность определения других свойств
чисто расчетным путем. С другой стороны, если мы уже располагаем
независимым образом полученными данными о различных физических
величинах, то дифференциальные уравнения термодинамики позволяют
проверять их согласуемость и обнаруживать возможные ошибки изме
рений или обработки исходного материала.
Поставим прежде всего задачу составить уравнения, которые
связывают функции и , / и s с термическими параметрами состояния,
имея в виду применение этих уравнений к простым телам. Уравнения
такого типа называются калорическими уравнениями состояния.
Выведем сначала уравнение для внутренней энергии и , считая
и = и(Ту v) . Для этого обратимся к формуле (III. 5), в которой
В качестве температуры мы здесь всегда будем подразумевать а б с о
лютную температуру, измеряемую, в частности, идеально-газовым
термометром. И так ,
Так как d s есть полный дифференциал, накрест взятые производные
от коэффициентов при d T и d v должны быть взаимно равны:
ds= т(яг),rfT+ 7[О г+ Ар\dv-"
(IV' l)
190
ДИФФЕРЕНЦИАЛЬНЫЕ УРАВНЕНИЯ ТЕРМОДИНАМИКИ
[ОТД. IV
Выполним соответствующие операции, помня, что независимыми пере
менными служат Т и V. Значки Т и v при вторых производных
опустим:
1d*u_1dht
ТdvdT~ ТdTdv ^ Т\дТ)„ 7*[(iu)t + Ap\-
Так как от порядка дифференцирования значение второй производной
не изменяется, первые два члена сокращаются, и
(IV. 2)
Учитывая теперь, что согласно (I. 30),
находим, что
(IV. 3)
Уравнение для энтальпии /, где i — i (Г, р), получается аналогич
ным образом. Имея в виду (I. 23), получаем:
*= т(»)/г+т(й)1. - /1'’К
(IV' 4>
дГ1/di\1_____дГI(di\
Avl
др[ Т\дТ)р\т~ дТ[ Т\др)т— Т I/
1No_1дЧ
А (до\
1 |7д*\
.1
Г дрдТ Т дТдр Г \дт)р Г*1\dj)T~ AV\'
(!),-4г©
,-4
<IV- 5>
Так как
(дт)р = СР’
окончательно находим:
di= cpdT—A^T(^) —v\dp.
(IV.6)
Уравнение для энтропии получаем подстановкой в (IV.1) выраже
ния (IV. 3):
ds= ^dT+A(^)jv
(IV.7a)
или подстановкой в (IV.4) выражения (IV.5):
(IV.7b)
1]
КАЛОРИЧЕСКИЕ УРАВНЕНИЯ СОСТОЯНИЯ
191
И з уравнения (IV .3) видно, что для вычисления du необходимо
знать теплоемкость cv и термическое уравнение состояния. Собственно
говоря, даже нет необходимости знать уравнение состояния, а лишь
только величину коэффициента термической упругости av (1.28а)
в функции от Т и V. Для вычисления di необходимо знать, соответ
ственно, ср и ар . Вместе с тем нужно заметить, что di можно опре
дели ib прямо по du и термическому уравнению состояния, пользуясь
основным определением (1.21): di = du -j - Ad(pv). Отсюда, между
прочим, ясно, что между cv и ср должно существовать соотношение,
связанное с конкретным видом уравнения F ( p , v , Т) = 0 . Для его
установления исключим du из выражения первого начала (1.19):
dq-d u ~ \ -A pdv посредством (IV.3), и применим полученную фор
мулу к изобарному процессу. Тогда
Подчеркивая еще раз, что здесь принято условие р = const, оконча
тельно получаем:
И з последней формулы видно, что из опыта достаточно знать одну
из д ву х теплоемкостей: другая находится расчетным путем, если
только известно термическое уравнение состояния. Этим широко поль
зуются для вычисления cv по ср9 так как прямое измерение ср оказы
вается обычно более простым и надежным, чем измерение cv.
Применим для примера полученные соотношения к идеальным га
зам. Из уравнения pv = R T имеем:
(IV.8)
/др\ _R
_
.
/\__R
\di')v
v’
V di')p
p
Поэтому из уравнения (IV .2) получаем:
из (IV.3):
из (IV. 5):
du= cvdT,
из (IV.6):
из (IV.8):
di= срdT,
ср—с»+АТ^ y
—
cc~\ -AR
и, наконец, из (IV.7a) и (IV.7b):
AR
с.
С,
AR
192
ДИФФЕРЕНЦИАЛЬНЫЕ УРАВНЕНИЯ ТЕРМОДИНАМИКИ
[ОТД. IV
Из тех же уравнений (IV.7a) и (IV.7b) после приравнивания на
к рест взятых производных находим такие общие выражения:
Применительно к идеальным газам, поскольку имеет место урав
нение pv = RT , находим, что
В се обнаруженные здесь свойства идеальных газов были нам ра
нее уж е известны. Однако тогда мы их обосновывали путем ссылки
на специальные опыты. Теперь, пользуясь вторым началом термодина
мики для квазистатических процессов, мы все эти свойства газов
непосредственно вывели из термического уравнения состояния.
Для иллюстрации широчайших возможностей, кроющихся в ана
лизе калорических уравнений состояния, обратимся еще к одному
примеру, а именно, к термодинамическому выводу одного из о снов
ных законов излучения, который известен под названием закона
Стефана — Больцмана. При этом, разумеется, мы не сможем здесь
входить в детали всей проблемы, которая рассматривается специально
в курсах физики.
Представим себе снабженный поршнем цилиндр, в котором у ста
новлен вакуум. Пусть стенки цилиндра имеют повсеместно одинако
вую те мпературу. Так как излучение энергии является неотъемлемым
свойством всех тел молекулярной структуры, полое пространство со
держит некоторое количество лучистой энергии. Назовем плотностью
лучистой энергии и количество ее, приходящееся на единицу объема:
u = U j V . Плотность энергии определяется исключительно температу
рой стенок Г и не зависит от их материала, как это можно было бы
показать отдельно. Э ту температуру следует приписать самой лучи
стой энергии, поскольку температурное состояние стенок остается
стабильным. Понятие о температуре излучения было впервые введено
Б. Б . Голицыным.*)
Помимо температуры и энергии, применительно к излучению дей
ствительно также понятие о давлении. Несмотря на ничтожную ве
личину последнего, оно было экспериментально обнаружено и изме
рено. Приоритет в этом замечательном по своей тонкости экспери
менте принадлежит П . Н . Лебедеву (1901). Лебедев не ограничился
определением давления света на твердые тела, но впервые решил еще
2) Б. Б. Голицын, Исследования по математической физике, ч. II
(О лучистой энергии), Москва, 1893.
(IV.8b)
(IV.8a)
1]
КАЛОРИЧЕСКИЕ УРАВНЕНИЯ СОСТОЯНИЯ
193
более трудную экспериментальную задачу — измерение давления света
на газы (1908).
В пределах всесторонне ограниченной полости излучение оказы
вает одинаковое по всем направлениям давление, подобно тому как
это наблюдается в пространстве, заполненном газом. Величина давле
ния может быть связана с плотностью энергии формулой:
которая вытекает из электромагнитной теории света.
И так , излучение, пронизывающее внутреннее пространство полого
тела, занимает определенный объем, оказывает определенное давление
на стенки и обладает определенной температурой. Эти три величины
не независимы друг от друга. В самом деле, если при заданном коли
честве энергии изменится объем полости, то это повлечет за собой
изменение плотности энергии, а следовательно, и давления. В свою
очередь плотность энергии однозначно связана с температурой.
Но в таком случае мы получаем право, не входя в рассмотрение
существа излучения, применять к нему все термодинамические приемы
исследования, установленные для термомеханических систем. Н а этом
пути нельзя получить ответов на все вопросы, какие могли бы у нас
возникнуть. Однако некоторые вопросы получат полное разрешение,
будучи свободными от каких-либо физических гипотез.
Поставим, например, задачу найти вид функции и = и(Т). Д оп у
стим, что мы нарушили взаимное равновесие между излучением в по
лости цилиндра и его стенками посредством бесконечно малого
теплоподвода. Применим к соответствующему элементарному измене
нию состояния излучения первое начало термодинамики, отнеся по
следнее ко всему объему цилиндра V (расчет на 1 к Г излучения не
имеет смысла). Имеем:
dQ—dU+ApdV=* Vdu-{ -udV-j -1±jt=Vdu-{
- judV.
Но
= dSиdu=
d T . Следовательно,
AS—
-jrdu+у-уdV—
- ^dV.
Приравнивая накрест взятые производные, получаем:
д(V_du\__4
_
д /и\
W \T йТ)т~ з" дТ\т)у
тdu
JLifL_A
_
_
d7’ _
“
t *!L—4u-
du—1dT
TdT—3
T%
dT
’
и
T
и окончательно:
и= СГ4.
13 Зак. 3543. В. С . ЖуковскиД.
194
ДИФФЕРЕНЦИАЛЬНЫЕ УРАВНЕНИЯ ТЕРМОДИНАМИКИ
(ОТД. IV
Таким образом, плотность лучистой энергии внутри полого тела про
порциональна четвертой степени абсолютной температуры. Э та зави
симость была впервые экспериментально установлена Стефаном и
позднее найдена из термодинамических соображений Больцманом,
вследствие чего носит название закона Стефана — Больцмана.
В заключение найдем еще уравнение адиабаты для излучения
в переменных р , v . Положив в выражении первого начала dQ = О,
находим, что
du__4dV
1Г~У
~V~'
Производя интегрирование, получаем:
uV*‘3= const.
Имея в виду, что и = ЗАр> находим:
р У 4/3= const,
т. е . уравнение, по виду совпадающее с уравнением адиабаты для
идеальных газов.
2. Основные дифференциальные уравнения термодинамики.
Выведем уравнения, связывающие энтропию с термическими пара
метрами состояния. При этом будем помнить, что термодинамическое
тело считается имеющим две степени свободы и, следовательно, о пре
деляемым двумя независимыми параметрами.
И з (IV . 7а) мы непосредственно получаем, что
и из (IV.7b)
(IV.9)
(IV. 10)
Представляют значительный интерес также и такие уравнения,
в которых за независимые приняты энтропия и один из термических
параметров. Путем сочетания выражений первого начала (1.7) и (1.23)
с формулой dq=Tds получаем:
du= Tds—Apdvf
(IV . 11)
dl= Tds+ Avdp.
(IV. 12)
Приравнивая накрест взятые производные, находим, соответственно:
др\
,„г,оч
дТ
2]
ОСНОВНЫЕ ДИФФЕРЕНЦИАЛЬНЫЕ УРАВНЕНИЯ ТЕРМОДИНАМИКИ
195
Отметим, что уравнения (IV .9) и (IV . 10) могут быть получены также
и иначе — приемом, аналогичным принятому при выводе (IV. 13)
и (IV . 14). Для этого нужно ввести новые функции состояния, диффе
ренциал которых выражался бы один раз через дифференциалы Т
и v и другой раз — через дифференциалы Т и /?.
Преобразуем (IV. 11) к виду:
du—Tds—sdT= — sdT—Apdv,
du— d(Ts)= — sdT—Apdv.
Левая сторона может быть представлена как дифференциал некоторой
новой функции состояния F :
dF=du—d(Ts).
(IV. 15)
Установленная формулой (IV. 15) функция называется свободной э нер
гией тела. Имеем:
dF= — sdT—Арdv.
(1V.16)
Для перехода к независимым Т и р преобразуем уравнение (IV . 12):
di—Tds—sdT= — sdT-\ -Avdp,
di—d(Ts)= — sdT-\ -Avdp.
Введем обозначение:
d$= di—d(Ts) = du-\ -Ad(pv)—d(Ts).
(IV . 17)
Функция Ф называется часто термодинамическим потенциалом. Это
название не вполне удачно, так как понятие о термодинамическом
потенциале целесообразно считать собирательным, включающим в себе
не только функцию Ф , но также и и 9 i и F , как будет разъяснено
в шестом отделе. Для Ф можно встретить также название свободная
энтальпия. Вводя эту функцию, получаем:
d<$>= — sdT-\ -Avdp.
(IV . 18)
Из формул (IV. 16) и (IV. 18) типичным для термодинамики способом
получаем уже найденные раньше формулы (IV.9) и (IV . 10). Этим д о
стигается, если так можно выразиться, полная симметрия в выводе
формул (IV.9 и 10) и (IV.13 и 14). Функции состояния и, /, F и Ф
принадлежат к числу характеристических функций. Такое название
присвоено таким функциям состояния, через которые и через произ
водные которых (разных порядков) могут быть явно выражены все
термодинамические свойства тел. Подробности по этому поводу изла
гаются в специальных к урсах термодинамики. Свободная энергия и
термодинамический потенциал имеют, кроме то го , особое и очень
важное значение в физико-химических приложениях термодинамики.
Формулы ( IV .9 , 10, 13, 14) играют чрезвычайно существенную
роль в термодинамике. Э та роль тем более велика, что указанные
13*
196
ДИФФЕРЕНЦИАЛЬНЫЕ УРАВНЕНИЯ ТЕРМОДИНАМИКИ
[ОТД. IV
формулы допускают самое широкое обобщение на случаи тел, подвер
женных каким угодно двум внешним воздействиям со стороны о к р у
жающей среды. Е сл и , например, наряду с тепловым воздействием на
тело имеется любое другое воздействие, в том числе — немехани
ческого вида, распространение уравнений достигается заменой величин
р и v на соответствующую обобщенную силу у и обобщенную коор
динату X . В таком случае уравнения получают следующую форму:
(IV. 19)
Эти основные дифференциальные уравнения термодинамики иногда
называют именем Максвелла.
Для иллюстрации возможности применения последних уравнений
рассмотрим магнато-термический эффект , с помощью которого
удалось достичь температуры, рекордно близкой к абсолютному нулю.
Представим себе, что некоторое тело из парамагнитного вещества
помещено под вакуумом в переменное магнитное поле, создаваемое
катушкой с током. Внешними воздействиями на тело в этом случае
уу
являются: работа намагничивания d L = — —
где Н — напряжен
ность магнитного поля и В — магнитная индукция (знак минус по
ставлен потому, что работа тела против внешних магнитных сил по
ложительна, когда магнитная индукция падает), и передача теплоты
dQ = T d s , которая может происходить из-за излучения. Деформа
ционная работа исключается, так как давление, по условию, равно
нулю. Таким образом, тело имеет две степени свободы.
Обратимся к последней из формул (IV. 19). В ней обобщенной си-
уу
лой у является теперь величина —
,
а обобщенной координатой
X — величина В . Поэтому получаем:
где А — соответствующий тепловой эквивалент магнитной работы.
Производная (-^уу) » дающая изменение температуры тела при
адиабатном изменении напряженности магнитного поля, определяет
магнито-термический эффект.
Физическое
происхождение этого
эффекта аналогично то му, которое столь привычно нам применительно
к газу, находящемуся в цилиндре с подвижным поршнем. В самом
деле, магнитная работа против внешних сил при адиабатном размагни
чивании аналогична механической работе при адиабатном расширении.
О бе они производятся за счет внутренней энергии термодинамического
тела, что и обусловливает понижение его температуры.
3].
СООТНОШЕНИЕ МЕЖДУ АБСОЛЮТН. И ЭМПИРИЧ. ТЕМПЕРАТУРАМИ 19 7
Преобразуем правую часть последней формулы, отнеся ее к еди
нице объема тела. Имеем:
где р — плотность, с — теплоемкость единицы массы тела (разница
между ср и cv в вакууме пропадает; кроме того, магнитный фактор
на величине теплоемкости не сказывается) и В = \ьН, где ц — маг
нитная проницаемость.
Производя подстановки и считая теплоемкость постоянной, на
ходим :
\dS)H-
Л9с\дг)н'
откуда
\dMjg—
л 4крс \дГ)п -
Как было сказано, магнито-термический эффект был использован
для осуществления предельно низких температур. И з последней ф о р
мулы видно, что темп охлаждения при быстром, адиабатном размаг
ничивании (оно достигается мгновенным выключением тока в катушке,
создающей магнитное поле) пропорционален первоначальной напря
женности поля. Кроме то го , он зависит от величины
($г)я >К0Т°РУЮ
выгодно иметь возможно большей. Применяя глубоко охлажден
ную смесь квасцов, которая подвергалась размагничиванию от
20 075 до 1 2с, в 1933 г. была получена температура 0,0044°, счи
тая от абсолютного нуля. Н уж н о , однако, подчеркнуть, что по мере
приближения к абсолютному нулю температурные изменения любых
физических свойств тел, и в том числе магнитной проницаемости \l,
становятся все слабее, стремясь в пределе к нулю. Поэтому никаким
способом невозможно получение температуры, в точности равной нулю
по абсолютной шкале.
3. Соотношение между абсолютной и эмпирической температурами.
Вернемся
прежде
всего к важному
вопросу о соотношении между
идеально-газовой и абсолютной термодинамической температурами. Теперь
мы осветим этот вопрос так, как если бы соображений, объединенных
под названием второго начала термодинамики и изложенных в предыдущем
отделе, не существовало.
Вспомним трактовку выведенной на основе первого начала функции
состояния, которая была названа энтропией идеального газа (п. 16 второго
отдела). Существование этой функции состояния свидетельствовало о специ
фических особенностях теплового взаимодействия газа с окружающей средой,
о непересекаемости линий адиабат в любой из координатных плоскостей,
а следовательно, о невозможности без помощи теплообмена осуществлять
все те произвольные изменения состояния газа, которые доступны при одно
временном воздействии на него и теплотой и механической работой. На этом
198
ДИФФЕРЕНЦИАЛЬНЫЕ УРАВНЕНИЯ ТЕРМОДИНАМИКИ
[ОТД. IV
основании далее, в’ п. 3 третьего отдела, была образована схема цикла Карно
с идеальным газом и получен вывод, что превращение в круговом газовом
цикле теплоты в работу неотделимо от переноса тепла от более нагретого
тела к менее нагретому. Чтобы притти к всеобщему выражению второго
начала для квазистатических процессов, нам пришлось в этом месте выска
зать постулат, утверждающий, что обнаруженные на примере идеального
газа условия превращения теплоты в работу посредством круговых циклов
обязательны для всех без исключения термодинамических тел. Именно такое
развитие идей соответствует построению второго начала в классическом
духе. Нельзя, впрочем, скрыть тот факт, что ограничения, накладываемые
на принцип действия тепловых двигателей основным постулатом второго
начала, не кажутся многим самоочевидными, о чем свидетельствуют непре-
кращающиеся попытки (заведомо бесплодные) многочисленных изобретателей
придумать вечный двигатель второго рода. Поэтому действительную силу
постулат приобретает только в связи с тем, что все бесчисленные и разно
образные следствия, вытекающие из него, неизменно подтверждаются на
опыте (в границах, предопределенных для термодинамики).
Имея в виду сказанное, можно было бы избрать другой, на наш взгляд,
прямой и более естественный путь обоснования второго начала для квази
статических изменений состояния. После того как доказано существование
энтропии идеального газа соответственно формуле dQ=TdS, последняя
сопоставляется со всеми знакомыми нам формулами для работы (как меха
нической, так и нсмеханичсской) которые, как известно, приводятся к виду
dL=ydX. Выясняется что температура Т обладает такими же физическими
признаками, какие присущи обобщенным силам v. a S — такими же призна
ками, какие присущи обобщенным координатам X (см. п. 16 второго отдела).
После этого ставится вопрос, имеются ли принципиальные основания считать,
что идеальные газы (а с ними и все простые тела) являются исключением
в отношении структуры формулы для dQ7 Разве не следует ждать того,
что для любых тел тепловому воздействию отвечает своя специфическая
обобщенная координата наряду с особой обобщенной силой? Если это так,
то не следует ли предположить, что общность происхождения разных форм
энергетического обмена проявляется и в общности количественной меры
этого обмена, выражаемой через определяющие ее величины? На эти вопросы
может быть дан один ответ: имеются все основания утверждать, что для
любых тел при квазистатичсском изменении состояния должна иметь место
формула, которую мы раньше обозначили индексом (III. 8):
dQ=SdW,
где 9 — абсолютная термодинамическая температура, однозначно определяе
мая через какую-либо эмпирическую температуру, а W— некоторая функция
состояния рассматриваемого тела. Разумеется, это положение подлежит про
верке опытом, как и всякое другое физическое обобщение, в том числе
принятый нами ранее постулат второго начала термодинамики. Однако это
положение ведет прямо к цели, избавляя нас от необходимости прибегать
к громоздким и в известной степени неочевидным рассуждениям.
Итак, будем считать, что для любого (простого или сложного) тела,
испытывающего квазистатическое
изменение состояния, верна формула
dQ = 9 dW. Поставим задачу выразить абсолютную термодинамическую тем
пературу 9 через идеально-газовую температуру Г, т. е. найти вид функции
9=9(Г).
Будем исходить из следующих положений, каждое из которых нс требует
предварительного знания того, что температура Т способна заместить абсо
лютную термодинамическую температуру 9:
1)
Существует абсолютная термодинамическая температура 9, являющаяся
множителем пропорциональности между элементарным количеством подве
денной к телу теплоты dQ и дифференциалом некоторой функции состоя
ния
этот множитель должен быть исключительно температурной функцией.
3]
СООТНОШЕНИЕ МЕЖДУ АБСОЛЮТН. И ЭМПИРИЧ. ТЕМПЕРАТУРАМИ 1 9 9
2)
Одной из возможных эмпирических температур служит абсолютная
газовая температура, измеряемая согласно формуле
р_/+ 273,16 _
Т
Ро
273,16
“
273,16 '
газовым термометром постоянного объема, заполненным идеальным газом.
Идеальный газ представляет собой воображаемое вещество, которое, однако,
может быть реализовано с любой наперед заданной точностью. На основании
предыдущего 0 = 0 (7').
3)
Внутренняя энергия идеального газа, как показывает опыт, не зависит
от объема, если температурный уровень газа сохраняется постоянным (см.
п. 5 второго отдела):
(а=°-
Обратимся теперь к формуле (IV. 2), заменив в ней Т на 0 , поскольку
первичной формулой считается теперь dQ = 0 ёФ. Имеем:
Так как 0 является однозначной функцией от Т, то
(а«\ = /дц\
dvA
\dvj
Следовательно,
Здесь
(др\_Ро.
_
РоТ
1д77„ “
273,16 ’
р 273,16 '
Производя подстановку, получаем:
2706Г)=0
’
Из последней формулы находим, что
0=КТ,
dQ_
0
dT
Г'
где К— произвольная постоянная, обращающаяся в единицу при тождествен
ном способе градуировки обеих температурных шкал.
Итак, доказано, что идеально-газовая температура Т может играть роль
абсолютной термодинамической температуры 0 . При таком замещении вели
чина
получает частное значение, которое обозначают буквой 5. Из приве
денного вывода становится также ясно, по каким двум причинам показания
термометра, заполненного реальным газом, могут расходиться с абсолютной
термодинамической шкалой, потому что, в отличие от случая идеального газа,
1) средний коэффициент термической упругости отличается от 1/273,16;
2) внутренняя энергия зависит от объема при постоянной температуре.
Заметим еще следующее.
1) Наш вывод останется в силе также при использовании термометра
постоянного давления, заполненного идеальным газом.
2) Идеальный газ является не единственным термометрическим вещест
вом, шкала которого имеет свойства шкалы абсолютной термодинамической
температуры. Можно показать, например, что такая особенность не противо
речит также газам, подчиняющимся уравнению Ван-дер-Ваальса и некоторым
еще более сложным уравнениям.
200
ДИФФЕРЕНЦИАЛЬНЫЕ УРАВНЕНИЯ ТЕРМОДИНАМИКИ
[ОТД. IV
3)
Разумеется, если температура, входящая в термическое уравнение
состояния идеального газа, считается наперед тождественной абсолютной
термодинамической температуре, то формулу
= 0 нет надобности
устанавливать особо экспериментальным путем: она попросту вытекает из
дифференциальных уравнений термодинамики, как было показано в п. 1
настоящего отдела.
Идея построения второго начала со всеми относящимися к нему физи
ческими комментариями, которая не требует прямого использования ни
идеально-газовых законов, ни цикла Карно, ни классических постулатов вто
рого начала, является прогрессивной. Соображения в пользу освобождения
термодинамики от груза традиционных методологических воззрений были
впервые в совершенно оригинальном виде высказаны отечественными уче
ными. Среди них нужно прежде всего указать на Н. Н . Шиллера, который
на рубеже X IX и X X столетий подверг ревизии классические представления,
связываемые со вторым началом термодинамики, и указал на новые пути
решения вопроса, предвосхитившие значительно более позднюю систему
Каратеодори (1909). Глубокий анализ основ классической термодинамики,
ясно вскрывший их логическое несовершенство, был дан в 1928 г. Т . А . Афа
насьевой. Вопрос об основаниях термодинамики очень радикально решен
в самое последнее время А. А . Гухманом. Выше дано некоторое представле
ние о его подходе к задаче получения формулы dQ = ТdS. Полный отказ
от принимаемой обычно последовательности изложения основ термодинамики,
желательный с точки зрения автора, еще недостаточно подготовлен кругом
специалистов и в рамках учебного пособия пока нецелесообразен. Поэтому
интересующихся остается лишь отослать к первоисточникам Л)
По каж ем , каким образом от любой эмпирической температуры т
можно перейти к абсолютной термодинамической температуре. П о
скольку в качестве последней, как бы ни обосновывать второе начало
термодинамики, служит идеально-газовая температура Г , вернемся
к основной линии нашего изложения и выявим способы приведения
показаний любого термометра к показаниям газового термометра.
Эта задача может быть выполнена на основе всякого дифференциаль
ного уравнения термодинамики, имеющего в своем составе темпера
туру. Воспользуемся, например, уравнением (IV. 2):
*) Н. Н . Шиллер, Происхождение и развитие понятий о «температуре»
и о «тепле», Киевские университетские известия, XXXIX, 1899, No 7; О вто
ром законе термодинамики и сб одной новой его формулировке, Отчеты и
протоколы Физ.-м а т е м . об-ва при Киевском университете за 1897 г. и Ж ур
нал Русского физ.-х и м . об-ва, часть физ., XXX, 1899; Опытные данные и оп
ределения, лежащие в основании второго закона термодинамики, Отчеты
и протоколы Физ.- м а т е м . об-ва при Киевском университете за 1900 г.;
Т. А . Афанасьев а-Э р е н ф е с т, Необратимость, односторонность и вто
рое начало термодинамики, Ж урн. прикл. физ., вып. 3—4, 1928; Курс физики
под редакцией академика Н. Д . П апалекси, 1, 1948, часть третья «Тер
модинамика
и
молекулярная физика»,
написанная Г. С . Гореликом;
А. А . Г у х ма н, Об основаниях термодинамики, АН КазССР, Алма-Ата, 1947.
Ввиду однозначной связи между Г и т имеем:
(ди\
(ди\ .
/д/?\ (др\
\dv)T = \dv)z'
\дТ)9~ \fo)vdT ’
3]
СООТНОШЕНИЕ МЕЖДУ АБСОЛЮТН. И ЭМПИРИЯ. ТЕМПЕРАТУРАМИ 201
откуда
В правую сторону последней формулы входят величины, для измере
ния которых нет надобности знать что-либо об абсолютной темпера
туре Т. Действительно, чтобы получить величину производной
,
нужно только уметь обеспечить постоянство температурного уровня,
для чего пригоден любой термометр. Что касается величины
,
то она определяется как раз по той эмпирической шкале т, от кото
рой мы желаем перейти к идеально-газовой шкале.
Проинтегрируем полученную формулу в пределах от ^ до т2 и,
соответственно, от Тг до Г2. Получаем:
di.
Правая часть этого уравнения имеет определенное численное значе
ние, вытекающее из опытных данных. Обозначим его буквой М .
Отсюда
In
=
*1
или h
Тх
С другой стороны, если мы потребуем, чтобы число делений по эм
пирической и идеально-газовой шкалам было одинаковым между
обеими реперными точками, то получим второе уравнение:
Г2 Тг= т2
zx= N.
Из последних д ву х уравнений мы можем совершенно однозначно
определить численные значения абсолютных температур, соответствую
щих выбранным реперным точкам Tj и т2. Чрезвычайно существенно
отметить, что положение нуля в абсолютной шкале определяется
также вполне однозначно, так как система уравнений
^=
и
—
T1= N
не содержит никакой произвольной аддитивной постоянной интегри
рования. Развивая описанный метод, можно для любого числа граду
сов в эмпирической шкале найти соответствующую поправку для
перехода к абсолютной шкале. При этом, однако, нельзя будет ожи
дать, что абсолютная и эмпирическая температуры будут непременно
связаны линейной зависимостью, как это было обнаружено в случае
идеально-газового термометра.
ОТДЕЛ ПЯТЫЙ
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
ГЛАВА I
РЕАЛЬНЫЕ ГАЗЫ
1. Качественные особенности. При обосновании уравнения состоя
ния p v = R T мы отметили, что реальные газы не вполне точно ему сле
дую т , причем особенно значительные отступления наблюдаются вблизи
той области состояний, кото
рая характеризуется наступле
нием конденсации (сжижения)
Для качественной оценки о со
бенностей реальных газов рас
смотрим конфигурацию дейст
вительных изотерм в координа
тах p - v (<диаграмма Эндрюса)
На рис. 50 тонкими линиями
показаны кривые pv — const,
которые являются изотермами
при условии, что газы идеаль
ны. Более толстыми линиями
схематически проведены дей
ствительные изотермы, т . е.
линии Т = const. Из сопостав
ления обоих семейств кривых
видно, что закон Бойля приме
нительно к реальным газам
нуждается в исправлениях. При
весьма высоких давлениях и
температурах изотермы сж а
тия
проходят круче линий
pv = const, т. е. при постоян-
Рис. 50.
ной температуре объем сокращается медленнее, чем возрастает давле
ние: для реального газа коэффициент сжатия меньше, чем для иде
ального. При более низких давлениях и температурах в начале сж а
тия изотермы направлены положе линий pv — const, а в конце сжа
тия— круче. Это значит, что коэффициент сжатия сначала имеет
большее, а затем меньшее значение, чем следует из закона Бойля .
Отсюда следует, что на всякой реальной изотерме такого вида суще-
ГЛ. I]
РЕАЛЬНЫЕ ГАЗЫ
203
ствует точка (например Я), в которой производная
имеет зна
чение, равное значению этой производной для идеального газа .
В подобной точке действительная изотерма имеет общую касательную
(пунктирная прямая) с проходящей через нее гиперболой, ввиду чего
(fy)=_£
\dvjT
v*
Таким образом, каждой температуре отвечает некоторое опреде
ленное давление, в непосредственной близости к которому закон
Бойля оказывается справедливым со всей строгостью . Чем меньше
отличается в подобной точке кривизна изотермы от кривизны равно
бочной гиперболы, тем шире становится область, внутри которой
применение закона Бойля не приносит заметных погрешностей.
Расхождение между изотермами и линиями p v = const быстро
усиливается по мере уменьшения температуры. Благодаря этому вер х
ние точки пересечения кривых pv = const и Т = const, попарно выхо
дящих из общих точек, перемещаются тем дальше в сторону исклю
чительно высоких давлений, чем меньше начальное давление сжатия,
и не могут быть для низких температур показаны на чертеже при
выбранном масштабе оси ординат.
Начиная с некоторого определенного для газа температурного
уровня, процесс изотермического сжатия приобретает специфический
характер, отличающий действительные физические свойства газов от
свойств идеальных газов не только в количественном, но и в каче
ственном отношении. Т а к , на примере линии Е а Ь О мы видим, что
изотермическое сжатие сопровождается возрастанием давления лишь
до известного состояния а .
При дальнейшем изотермическом сжатии тело, представлявшее
ранее гомогенную (однородную) газообразную среду, становится не
гомогенным: во многих центрах конденсации появляются капл и, кото
рые по мере сгущения выпадают на дно сосуда, и образуется влаж
ный насыщенный пар. Пар, находящийся в состоянии, соответствую
щем точке я , которая лежит на границе области конденсации,
называется су х и м насыщенным паром.
При перемещении в направлении к точке Ь количество конденси
рованной фазы увеличивается, пока, наконец, в точке Ь все веще
ство не превращается целиком в жидкость.
С этого момента дальнейшее сжатие будет вновь сопровождаться
возрастанием давления. Так как сжимаемость жидкостей ничтожна,
процесс их сжатия изображается почти вертикальными линиями.
На рис. 51 воспроизведена изотерма Е аЬО в большом масштабе.
Если мы нанесем на чертеже близлежащие изотермы, то обнаружим ,
что длина участ ков , ограничивающих область от начального момента
конденсации до ее завершения, изменяется в зависимости от темпе
ратуры , а именно, при более высоких температурах длина горизон-
204
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
[ОТД. V
тальных участков становится меньшей. Следовательно, представляется
возможным осуществить такое изотермическое сжатие, при котором
обе предельные точки переходной области совместятся в одну. В этой
точке К линия изотермы имеет перегиб и касательную, направленную
по горизонтали. Вышележащие изотермы нигде горизонтальных каса
тельных не имеют.
Опыт показывает, что при температурах, лежащих выше изо
термы С К , ни при каких условиях невозможно достигнуть сжижения
газов. Напротив, при более низких температурах всегда можно найти
такое достаточно высокое давление, при котором переход из газо
образной формы в жидкую будет осуществим. Вследствие этого тем
пература, отвечающая изотерме С К , называется критической. При
температурах, превышающих критическую, вещество может нахо
диться только в газообразном состоянии. В связи с этим газы, кри
тическая температура которых лежит гораздо ниже нормальной, дол
гое время считались вовсе неконденсируемыми и потому получили
название постоянных газов. В настоящее время этот термин утерял
физический смысл.
Приоритет в установлении существования критической темпера
туры принадлежит Д . И . Менделееву. Именно Менделеев впервые
ГЛ. lj
РЕАЛЬНЫЕ ГАЗЫ
205
(1861), когда еще не существовало учения о критическом состоянии,
высказал положение о том , что всякой жидкости свойственна « а б со
лютная температура кипения», названная впоследствии критической
температурой. Подводя итоги своих трудов, Менделеев в «Основах
химии» по этому поводу писал:
«Каньяр де Латур, нагревая эфир в запаянной трубке около 190°,
заметил, что при этой температуре жидкость ср азу превращается
в пар, занимающий прежний объем, т . е . имеющий плотность жидко
сти. Дальнейшие исследования Дриона, а также и мои, показали,
что для всякой жидкости существует такая температура абсо
лютного кипения, выше которой жидкость не существует и пре
вращается в плотный газ.
Чтобы истинное значение такой температуры выступило явственно,
следует обратить внимание на то , что жидкое состояние характери
зуется сцеплением частиц, отсутствующим в газах и парах. Сцепле
ние жидкостей выражается в капиллярных явлениях. Сцепление ж и д к о
стей уменьшается при их нагревании, поэтому уменьшаются и капил
лярные высоты. Опыт показывает, что это уменьшение пропорцио
нально температуре, а потому из капиллярных наблюдений получаем
понятие о том, что при некоторой возвышенной температуре сцепле
ние становится == 0 . . . Если в жидкости исчезает сцепление частиц,
она становится газом, ибо между этими двумя состояниями нет, кроме
сцепления, иного различия. Преодолевая его, жидкости при испаре
нии поглощают теплоту. П оэто му температура абсолютного кипения
определена мною (1861), как такая, при которой: а) жидкость не
существует и дает газ, не переходящий в жидкость, несмотря на уве
личение давления, Ь) сцепление равно 0 и с) скрытая теплота исп а
рения = 0.
Понятия эти мало распространялись, пока Эндрюс (1869) не
выяснил дела с другой стороны, именно исходя из газов. Он нашел,
что углекислый газ при температурах высших, чем 31°, не сгущается
ни при каких давлениях, при низких же температурах может сжи
жаться. Температуру эту он назвал критической. Очевидно, что она
тождественна с температурой абсолютного кипения».
Непосредственно за Менделеевым вопросами критического состо я
ния и вообще физикой двухфазных систем в России занялись
М. П. Авенариус, А. Г. Столетов, Л. Г. Богаевский, А. И . Надеж
дин, К. Н . Жук, В. И . Зайончевский идр. В частности, О. Э . Страус
в 1880 г. впервые определил критическую температуру смеси д ву х
жидкостей, а в 1882 г . на основе своих опытов опубликовал дан
ные о критической температуре воды, по точности превосходившие
распространенные в то время литературные данные. В связи с этим
интересно следующее указание А . С . Предводителева: «Столетов от
мечает, что около одной четверти всего экспериментального мате
риала по критическому состоянию, помещенного в известном спра
вочнике Ландольта — Бернштейна за 1894 г. (2-е изд.) , принадлежит
206
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
[ОТД. V
лаборатории Авенариуса в Киевском университете».1) Разбор работ
указанного направления выходит за рамки технической термодина
мики и должен производиться в курсах физики.
И т а к , при температурах ниже критической вещество в зависи
мости от соотношения между давлением и удельным объемом может
существовать в различных видах: в гомогенном жидком, гомогенном
газообразном и негомогенном, при котором жидкая и газообразная
фазы находятся в устойчивом равновесии. Перечисленные три области
состояний отделяются друг от друга пограничной кривой M b K a N
(ее называют также ортобарной кривой), которая в диаграмме p - v
является геометрическим местом то чек, лежащих на концах горизон
тальных у частков изотерм. Таким образом, в заштрихованной области
вещество находится в виде влажного насыщенного пара; левее по
граничной кривой оно может существовать только в виде жидкости
и правее — только в виде газа. Левую ветвь пограничной кривой на
зывают часто нижней пограничной кривой (или кривой жидкости),
а правую — верхней пограничной кривой (или кривой пара).
Чрезвычайно важно отметить, что возможность агрегатных пре
вращений газ — жидкость ограничивается не только некоторой харак
терной для данного вещества температурой, но также и характерным
давлением, которое называется критическим давлением р к. Каким бы
изменениям состояния ни подвергалось вещество в области, располо
женной над горизонтальной линией) проходящей на рис. 51 через
точку К у оно всегда остается вполне однородным. При этом всякому
смещению из одного равновесного состояния в другое соответствует
непрерывное изменение физических свойств вещества. М ожно ли при
этих условиях наметить границу между двумя агрегатными со сто я
ниями вещества, жидким и газообразным? Разумеется, такой границы
наметить нельзя. Рассмотрим, например, процесс изобарного охлажде
ния газа по линии т п. Вблизи точки т вещество обладает всеми
признаками газа. П о мере сжатия плотность вещества возрастает и
постепенно изменяются его упругие и термические свойства. В ч аст
ности, падает сжимаемость вещества, стремясь к нулю около точки п.
Таким образом, вещество приобретает постепенно то свойство, к о то
рое считается специфическим для жидкости, а именно, почти пол
ную несжимаемость. Друго е (обычно подразумеваемое) свойство ж ид ко
с т и — способность к образованию свободной поверхности на гра
нице раздела с другой жидкостью или газом, в сущности говоря, не
является вовсе специфическим, ибо и газы обладают тем же сво й
ством, если только их окружают другие газы с другой плотностью.
Так например, можно переливать на открытом воздухе из одного
сосуда в другой углекислоту или хлор, которые во всех отношениях
будут подчиняться законам гидростатики.
0 Очерки по истории физики в России, под ред. А . К . Тимирязева,
Учпедгиз, 1949, статья А . С . Предводителева «Физика тепла и моле
кулярная физика», стр. 207—222.
РЕАЛЬНЫЕ ГАЗЫ
207
Какие бы иные механические или термические свойства ни выби
рались нами для сравнения между собой состояний вблизи точек т
и п , мы не могли бы указать ни одного, которое в той или иной
мере не было бы присуще обоим крайним состояниям. П ереход через
критическую изотерму в этой «надкритической» области тоже не
проявляется в каком-либо раликальном видоизменении структуры или
поведения вещества, вследствие чего температура 7 = Гк не заслу
живает здесь даже названия критической. Одним словом, в области,
расположенной выше критического давления, качественные отличия
накапливаются постепенно, и отличие жидкого от газообразного
состояния представляется довольно условным.
Совершенно иначе обстоит дело при рассмотрении нижней части
диаграммы. Здесь имеются специфические кризисные состояния, изо
бражаемые в совокупности пограничной кривой, при переходе через
которую свойства вещества изменяются резким скачком. Д ву хфазная
система, отвечающая области под пограничной кривой, оказывается
образованной из жидкой фазы в том состоянии, которое характери
зуется нижней пограничной кривой, и из газообразной фазы, опреде
ляемой верхней пограничной кривой. П о это м у приобретает полную
силу противопоставление не только обеих сосуществующих фаз, но
также и состояний по обе стороны пограничной кривой. Впрочем,
это противопоставление становится менее отчетливым по мере при
ближения к вершине пограничной кривой. Вблизи последней отличия
свойств жидкости от сухо го насыщенного пара сглаживаются и совер
шенно исчезают в точке К . Таким образом, при давлениях, превы
шающих критическое, нет бесспорных критериев для противопоста
вления жидкости и газа друг друга, и выбор названий «жидкость»
или «газ» является вопросом скорее терминологии, чем термодина
мического анализа.
Энгельс пишет: «Hard and fast lines [абсолютно резкие раз
граничительные л и н ии ] несовместимы с теорией развития . . . Для
такой стадии развития естествознания, где все различия сливаются
в промежуточных ступенях, все противоположности переходят друг
в друга через посредство промежуточных членов, уже недостаточно
старого метафизического метода мышления. Диалектика, которая
точно так же не знает hard and fast lines [абсолютно резких раз
граничительных линий] и безусловного, пригодного повсюду „или —
или“ , которая переводит друг в друга неподвижные метафизические
различия, признает в надлежащих случаях наряду с „или — илиа
также „как то, так и другое“ и опосредствует противоположности, —
является единственным, в высшей инстанции, методом мышления,
соответствующим теперешней стадии развития естествознания. Р а з у
меется, для повседневного обихода, для научной мелкой торговли
метафизические категории сохраняют свое значение».!)
*) Ф. Энгельс, Диалектика природы, 1948, стр. 169.
208
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
[ОТТЬ V
Еще большее затруднение, чем размежевание понятий «жидкость»
и «газ» при р > p R, представляет собой различение «газа» и «нена
сыщенного или перегретого пара» — так называют часто вещество
в состояниях, лежащих вправо от верхней пограничной кривой. П р и
нято, например, говорить о парах воды, ртути, бензина, нафталина,
если эти вещества и не сосуществуют со своим конденсатом. Однако,
когда говорят о парах кислорода, азота, гелия, то разумеют только
их насыщенные пары, а ненасыщенные пары называют просто газами.
Известным критерием здесь может явиться величина /к. Если она
настолька высока, что вблизи нормальной температуры вещество
может находиться как в газообразной, так и в жидкой или твердой
форме, то однородную газообразную форму обычно именуют нена
сыщенным или перегретым паром. О чевид но, такая терминология
отражает лишь особенности технической практики, но не имеет
строгого научного обосновании.
Для иллюстрации непрерывности изменения свойств вещества вне
четко ограниченной области насыщенного пара можно сослаться, на
пример, на рабочий процесс в котлах со сверхкритическим давле
нием пара. В отличие от обычных паровых котлов, питательный насос
подает в такие котлы воду с давлением, превышающим 225 am
(для воды /?к = 225,65 am). Собственно котел состоит из парал
лельно включенных т рубо к , омываемых снаружи топочными газами.
Проходящая по трубкам вода подвергается нагреванию при постоян
ном давлении (например, вдоль линии пт на рис. 51). Н а выходе из
трубок мы получаем то состояние, которое принято называть пере
гретым паром сверхвысокого давления. Если подача такого пара
в турбину нежелательна, можно путем дросселирования в регулирую
щем вентиле понизить давление до технически приемлемой величины.
В этом последнем состоянии пар ничем не будет отличаться от пара,
получаемого от нормального котла. Однако в отличие от последнего
в циркуляционной системе котла со сверхкритическим давлением не
существует места, где вещество, ранее бывшее водой, переставало
бы существовать в этом виде, совершая качественный скачок типа
взрыва в новое агрегатное состояние.
Явления, связанные с изменением агрегатного состояния, требуют
специального рассмотрения, и к этому вопросу мы вернемся в сле
дующей главе. В настоящей главе мы будем иметь в виду лишь
такие состояния вещества, в которых оно остается газообразным,
т. е . реальные газы в узком смысле слова.
Мы видели, что реальные газы, вообще говоря, не подчиняются
закону Бойля. Можно убедиться в том, что и закон Гей-Люссака
является для них только приближенным законом. Следовательно, для
реальных газов формула Клапейрона в качестве термического ур а в
нения состояния не действительна, по крайней мере до тех пор, пока
отсутствуют сведения о вносимой ею погрешности. В таком же поло
жении находится вопрос и о калорических функциях. Опыт показы-
РЕАЛЬНЫЕ ГАЗЫ
209
гл. i]
вает, что внутренняя энергия и энтальпия, а в связи с ними и тепло
емкости с „ и ср оказываются зависящими не только от температуры газа,
но также от одного из двух прочих параметров термического состоя
ния. Короче говоря, все количественные соотношения, установленные
для идеальных газо в, нуждаются в критическом пересмотре примени
тельно к реальным газам, если даже оставить в стороне область, где
происходят резкие качественные изменения состояния.
В термодинамике реальных газов характерным является примене
ние таблиц или диаграмм, систематизирующих опытные данные.
В следующем пункте мы рассмотрим некоторые из количественных
данных, на основании которых можно составить представление
о типичных особенностях реальных газов. Детальные сведения по
этому поводу могут быть найдены в специальной физической литературе.
2. Количественные данные. Чрезвычайно широким распростра
нением пользуется изображение свойств реальных газов в виде ряда
сопоставленных значений произ
ведения p v и давления р при не
изменной температуре (как пара- ^
метре). Н а рис. 52 для примера
показан результат, полученный для
углекислоты. Впервые подобное
построение предложил в 1893 г .
А мага, измерения которого со хра
нили до настоящего времени перво
степенное значение для описания
поведения реальных газов, в о со
бенности — при высоких давле
ниях.
На рис. 52 значения pv вы
ражены в долях от PqVq, т. е. от
величины этого произведения в
нормальных условиях, а именно,
при 0°С и 760 мм Hg. Изотермы
идеальных газов в координатах
p v - p должны быть горизонтальными линиями. Следовательно, откло
нения действительных изотерм от горизонтального направления на
глядно демонстрируют отступление углекислоты о т закона Бойля.
Если при росте давления изотерма падает, то это свидетельствует
о большей сжимаемости газа по сравнению с идеальным газом. Н а
против, вдоль восходящей ветви изотермы сжимаемость оказывается
относительно меньшей, ибо объем сокращается не так быстро, как
это должно было бы быть при условии p v = const. Легко видеть,
что между диаграммой Амага для углекислоты и качественной кар
тиной, приведенной на рис. 51, имеется полное соответствие. Это
относится также и к области насыщенного пара С 0 2, которая пока
зана на рис. 52 штриховкой.
14 Зон. 3543. В . С . ЖуковскиА.
т
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ЙАР
10ТД. V
Пунктирной кривой, обозначенной буквой £ , соединены точки,
лежащие в местах, где
~]г=0(СР-сточкойРнарис.50).
Эта линия называется кривой Б о й л я . Кривая Бойля пересекает ось
ординат примерно при 500° С . При этой температуре, именуемой
температурой Бой л я, углекислота
в области давлений, близких к нор
мальному атмосферному, строго под
чиняется закону Бойля. Температура
Бойля играет важную роль в технике
сжижения газов, так как охлажде
ние газа посредством дроссель-эф
фекта Джоуля— Томсона возможно
только при температурах, практи
чески не превышающих 7д. Поэтому,
например,
гелий, для
которого
Гв=18,2 °К , должен быть предва
рительно глубоко охлажден жидким
воздухом, затем жидким водородом
(температура кипения равна 1 1 ,5 ° К
при давлении 60 мм Hg) и лишь
только после того подвергнут дрос
селированию, в результате которого
он конденсируется.
Помимо кривой Бойля, на рис. 52
показана также «идеальная кривая» 7 ,
соединяющая то чки , где величины p v
возвращаются к значениям, соответ
ствующим той же температуре при
р -► 0. Отправляясь от небольших
давлений, можно притти в эти точки
так, как будто газ не отклоняется
от идеального, т . е . подчиняется
повсеместно закону Бойля (ср. с точ
ками В,LиС,М нарис.50,пред
ставив себе, что точки В и С отне
сены вправо, к р->0).
Свойства углекислоты, обнару
живаемые
в координатах
pv-p ,
характерны для всех реальных газов. Отличия газов друг от друга
проявляются лишь в значениях температур и давлений, между кото
рыми имеет место та или иная форма изотерм. На рис. 53, 54, 55
приведены диаграммы Амага для азота, воздуха и водорода в интер
вале температур от 0 до 200° С . С помощью этих диаграмм можно
найти действительный удельный объем газа по заданным р и Т.
Рис. 55.
ГЛ. l]
РЕАЛЬНЫЕ ГАЗЫ
211
Обозначая прочитываемое на оси ординат число буквой К , имеем:
HL—к-
1_=
!<Ро
V= K£°
Р<Рй
'
Щ
р
YoР'
Нормальный удельный вес
может быть взят из табл. 1 в прило
жении, если вычисление по идеальным законам представляется недо
статочно точным. Т ак например, для углекислоты при р = 200 am и
*=50°С
находим АГ= 0 ,49, f 0= 1,977 [по формуле (II. 9)
То “ р/22,41 = 1 ,963], откуда
0,49-1,033
1,977 - 200
=
1,28 - 10-8 мг/кг.
Если бы С 0 2 подчинялся уравнению Менделеева, то
Ж '323
_
_
44
■ Рвд
200-10*
Таким образом, ошибка составила бы
3,11—1,28
100
1,28
= 3,11-10-8 мъjKr .
“ 3%.
„
n
v
КТЬ 273,16 К
*
Легко видеть,1) что — =
-
^=
—
~—
.
Таким образом, в диа-
^ИД
1
1
грамме Амага одна лишь изотерма / = 0 ° С дает непосредственную
меру отклонения реального газа о т идеального состояния в отно ше
нии обоих законов: Бойля и Гей-Л ю ссака. С этой точки зрения более
удобным является графическое изображение свойств газов в коор
динатах Цг-р или Щ -t.
1) Определяя ?0 из формулы Клапейрона.
14*
212
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
1отд. V
На рис. 56 приведена диаграмма у -p для воздуха. Величины ~
обозначены для краткости через R ' и выражены в долях от R — газо
вой постоянной, отвечающей идеальному состоянию (/? = 2 9 ,3).
v
КТ
Ввиду того что при заданных р и Т отношение — ==
,
где
VHA 1
берется из диаграммы Амага, то , следовательно, и
Povo
Rr_v
273,16 К
А, 1ч
/?-^ яд-
т•
Очевидно, величина
отнюдь не является газовой постоянной,
ибо зависит от параметров термического состояния.
Из формулы (V. I) имеем:
г'-г'ид
R'—R
v
~
R'’
Ар
или —
v
R'—R
R'9
(V. 2)
где £l v = v — г;вд есть поправка к значению удельного объема, вычис
ленному в предположении, что газ идеален. В случаях, когда / ?'> /?,
эта поправка положительна, что имеет место при достаточно высо
ких по отношению к критической температурах или же при чрезвы
чайно больших давлениях (тем больш их, чем ниже температура).
В остальных случа я х , по мере приближения к области конденсации,
поправка отрицательна. Так например, для воздуха при / = 2 0 0 ° С и
Ь/
/>= 175 am, согласно диаграмме R’ -p получаем: -^ -=1,06; R' —
=
1,06-29,3 = 31,1; ®=
= 0,0084 мЦкГ и
_
31,1— 29,3
31,1
и
р—60
V,
= 0,058, т. е . 5,8%. Соответственно, при t= — 130ЭС
am
имеем:
-^
-
= 0,33; #' = 0,33 29,3 = 9,67;
тКж-- °’0023
ит-
=-2>03’т-е-
—
203%.
На рис. 57 экспериментальные данные, относящиеся к воздуху,
представлены в виде зависимости /?' = p v jT от /, причем в качестве
параметра служит давление. Э та диаграмма может иметь такое же
применение, как и предыдущая. При ее рассмотрении следует о бра
тить особое внимание на то, что изобара, экстраполированная до
давления /? = 0 , проходит горизонтально на уровне R '/ R = 1 ,0 (ср.
со слиянием все х изотерм на оси ординат в диаграмме /?'-/?).
Таким образом , здесь совершенно ясным становится указание, что
стремление давления газа к нулю является более действительным
способом приближения к идеальному состоянию, чем повышение
температуры (см. п . 1 и 7 второго отдела). П о этой причине реаль
ные газы и пары (ненасыщенные) при давлениях, меньших, чем
ГЛ. l]
РЕАЛЬНЫЕ ГАЗЫ
213
нормальное а тмосферное, ведут себя практически, как идеальные газы.
В частности, это относится к водяному пару, содержащемуся во
влажном воздухе или в топочных газах. В этих случаях парциальное
давление водяного пара бывает настолько незначительным, что можно
с полным основанием считать (если только отсутствует выпадение
росы ), что пар подчиняется уравнению Клапейрона со всеми выте
кающими отсюда следствиями. Т а к , теплоемкость водяного пара, при
мешанного к в о здуху , можно считать функцией только от температуры
и пользоваться данными табл. 3 и 4 или диаграммой I в приложении.
Есл и не говорить о небольшой области весьма малых давлений,
то следует указать, что вместе с термическим уравнением состояния
реальных газов их калорические функции приобретают также очень
сложные свойства. Для примера приводим ниже данные о теплоем
кости для воздуха по Ребаку (1925— 1930). Можно констатировать,
что зависимость теплоемкости о т температуры при фиксированном
давлении не является простой. При давлениях порядка нескольких
атмосфер ср меняется в одну сторону с температурой. Так, при
1 am величина ср для воздуха увеличивается в интервале от 0 до
100°С от 0,2405 до 0,2424, т. е. на 1%, считая на 100°С . Однако
при 20 am и выше влияние температуры оказывается обратным. При
давлениях порядка сотен атмосфер падение с р при нагревании воз
духа становится уже очень чувствительным. Например, при 220 am
в интервале от 0 до 250° С ср уменьшается на 17,5°/0, что состав
ляет 7°/0 на каждые Ю0°С,
214
РЕАЛЬНЫЕ РАЗЫ. ВОДЯНОЙ ПАР
[ОТД. V
ср [нкал/кГ- град] для воздуха
при р = 1 сип и различных температурах t [°С]
t
—100 -50
0
50
100
150
200
250
Ср
0,2385 0,2394 0,2405 0,2415 0,2424 0.2434 0.2443 0.2453
при t = 0° С и различных давлениях р [am]
Р
1
20
60
100
140
180
220
СР
0,2405 0,2492 0,2656 0,2838 0,2985 0,3093 0,3183
при t = 250° С и различных давлениях р [am]
Р
1
20
60
100
140
150
220
ср
0,2453 0,2468 0.2500 0,2536 0,2566 0,2596 0,2622
При фиксированной температуре ср изменяется в одну сторону
с давлением. При этом влияние давления падает, если температура
берется более высокой или если давление приближается к нулю.
Последнее значение надо понимать в том смысле, чт о, например,
при 0 ° С двадцатикратное увеличение давления от 1 am приводит
к росту ср на 3,6°/0, а трехкратное увеличение давления от 20 am—
к росту Ср на 6,7°/0. Таким образом, опытные данные о теплоем
кости подтверждают, что по мере приближения к идеальному газо-
во му состоянию, которое наиболее эффективно достигается посред
ством уменьшения давления, роль давления становится все менее
заметной, и величина ср оказывается зависящей от одной только тем
пературы. Как отмечалось, уже при давлении порядка нескольких
атмосфер, если температура выше комнатной, многие газы в отноше
нии теплоемкости ведут себя, как газы идеальные. Однако при сни
жении температуры и приближении ее к критическому значению
теплоемкость все сильнее начинает зависеть о т давления. Н а рис. 58
приведена диаграмма ср -Т для воздуха в области температур ниже
нормальной. В деталях эта диаграмма может подвергнуться в бу д у
щем исправлениям, но для качественных суждений она вполне по ка
зательна. Следя за ходом изобар влево, мы замечаем, что:
ГЛ. I]
РЕАЛЬНЫЕ ГАЗЫ
215
1) При глубоком охлаждении воздуха теплоемкость начинает воз
растать, обнаруживая свойства, качественно отличные от присущих
идеальным газам.
2) По ка давления остаются меньше критического, теплоемкость уве
личивается вместе с давлением, что со гласуется с особенностями воз
духа при высоких температурах. В этой области изобары обрываются
на пунктирной линии, представляющей собой пограничную кривую
между газом и насыщенным паром. Влияние давления сказывается
216
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
[ОТД. V
здесь тем меньше, чем ближе само давление к нулю или чем выше
температура.
3)
Монотонность влияния давления при р > р к нарушается, так как
линии изобар проходят через максимумы, и притом тем более рез
кие, чем ближе расположено давление к критическому значению.
В связи с этим при весьма высоких давлениях более не наблюдается
интенсивного роста ср при охлаждении во здуха , и линия, отвечающая
200 am, идет почти горизонтально, пересекая линии менее высоких
давлений, вплоть до р = 20 am.
Одновременно с усложнением свойств сру специфические особен
ности получает также и теплоемкость cv. При этом картина измене-
0 °С воздух в отношении величины k ведет себя так, как показано
на рис. 59. Мы вновь убеждаемся, что поправки к идеальным зако
нам растут по мере снижения температуры или увеличения дав
ления.
Н а рис. 60 приведена для примера тепловая диаграмма T -s для
воздуха. Н а диаграмме вычерчено семейство изобар и линий /= const
(дросселирование). В нижней части диаграммы толстой линией по ка
зана пограничная кривая, на вершине которой находится критическая
точка /С. Н ад пограничной кривой изобары получаю т необычное для
идеальных газов очертание по мере увеличения давления и снижения
температуры. Одновременно наблюдается резкое искривление линий
i = const, в особенности вблизи пограничной кривой. Это искривле
ние свидетельствует о том, что воздух при дросселировании испы
тывает более или менее интенсивное охлаждение (положительный
эффект Джоуля— Томсона), исчезающее при переходе в область иде
ального газового состояния (практически при давлениях около 1 am).
Таким образом, энтальпия воздуха наравне с теплоемкостью ср о ка
зывается зависящей и от температуры и от давления. Нужно под
черкнуть, что рассматриваемая диаграмма обрывается сверху при
температурах, близких к нормальной. Если бы она была продолжена,
то можно было бы видеть, что линии i = const сначала спрямились
бы, а затем начали бы искривляться в противоположном направле
нии, т. е . с левой стороны книзу. Здесь, следовательно, при дрос
селировании воздух должен был бы нагреваться (отрицательный
эффект Джоуля— Томсона).
50
100
Рис. 59.
150 am Z00
—
-д
*
ния cv в координатах cv- T отнюдь
не похожа на картину, показан
ную на рис. 58, ибо для реальных
газов соотношение ср — cv = A R
становится неверным. Суждение о
наблюдаемых здесь расхождениях
между диаграммами для ср и cv
можно получить, имея в виду, что
k = cpjc v оказывается зависящим
от давления. Д ля температур выше
ГЛ. I]
РЕАЛЬНЫЕ ГАЗЫ
217
В области насыщенного воздушного пара изобары не являются
строго горизонтальными линиями, как это имеет место в случае хими
чески однородных газов, для которых условие р = const тожде
ственно с условием Т = co nst. Нарушение этого свойства насыщен
ных паров объясняется тем, что воздух представляет собой смесь
газов, имеющих при заданном давлении разные температуры кипения.
При кипении воздуха происходит обеднение жидкой фазы азотом,
переходящим в газообразное состояние легче, чем кислород. П о
этому парообразование воздуха завершается при температурах, при
ближающихся к температуре кипения чистого кислорода. К деталям
картины, характеризующей область насыщенного пара, мы вернемся
впоследствии.
На рис. 61 приведена диаграмма i s для воздуха. В отличие
от предыдущей эта диаграмма охватывает лишь область температур
выше 0ЭС . В согласии с конфигурацией линий / = const в координа
та х T s изотермы в области низких давлений идут горизонтально
(см. рис. 60), в области же высоких давлений отклонения качественно
218
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
[ОТД. V
различны в зависимости от температурного уровня. Отсюда явно сле
дует, что не только величина, но и знак дроссель-эффекта Джоуля—
Томсона зависит от того, в какой области он производится. Каждому
давлению может быть приведена в соответствие такая температура,
выше которой дросселирование ведет к повышению температуры, а
ниже которой — к ее понижению. Определяемые таким образом точки
называются инверсионными, а геометрическое место их — инверсион
ной кривой.
Можно показать, что инверсионные точки отвечают таким состоя
ниям реального газа, в которых коэффициент термического расш и
рения совпадает с вычисленным по уравнению Клапейрона, т . е .
удовлетворяет условию
V
т
Действительно, обратимся к уравнению (IV . 6):
di—cpdT A|V(d7^
dp.
ГЛ. I]
РЕАЛЬНЫЕ ГАЗЫ
219
Так как при дросселировании di — 0 (имеется в виду дифференци
альный дроссель-эффект, отвечающий предельно слабому явлению
дросселирования), то
СР
Следовательно, dT = 0 , если
—
v= 0.
Имея в виду указанное условие, легко находить инверсионные
точки с помощью диаграммы
построенной по эксперименталь
ным данным. Инверсионные точки расположены там, где изобары
в этих диаграммах проходят через максимум или минимум, так как
в таких местах
'(¥
дТ
=
Р
Т{дт)р V
—
о
те
No=
—
j
Т%
’
г*
е'
\дТ)р Т ■
Типичный ход кривых показан на рис. 62. Вершины кривых на
ходятся при давлениях, превышающих критические значения при
мерно в 11,5 раза, и при приблизи
тельно двухкратных по сравнению
с критической температурой, что
оказывается несколько ниже темпе
ратур Бойля. Правая ветвь оканчи
вается вблизи температуры, в 5— 6
раз большей, чем критическая. П од
инверсионной кривой дросселируемое
вещество охлаждается, а над ней —
нагревается.
И з краткого обзора конкрет
ных свойств некоторых реальных
газов видно, сколь трудной задачей является подыскание точных и
вместе с тем простых формул, которые могли бы охватить всю сумму
экспериментальных данных применительно к тому или иному газу.
Еще труднее найти аналитические выражения универсального ха р а к
тера, позволяющие объединить индивидуальные особенности различ
ных газов. Однако, сколь ни сложны указанные проблемы, они про
должают оставаться предметом настойчивых и кропотливых исканий
со времен Джоуля и Томсона, Менделеева, Ван-дер-Ваальса (вторая
половина прошлого столетия) и до наших дней. Э то объясняется тем,
что непрерывно обновляемые экспериментаторами сведения касаются
непосредственно лишь некот оры х физических свойств изучаемого
вещества и оставляют в стороне многие другие или ж е, в лучшем
случае, освещают подробно особенности нескольких избранных веществ,
220
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
[ОТД. V
давая для всех прочих только отрывочный исходный материал*
Задачи, возникающие из подобного положения вещей, имеют бога
тую историю и продолжают интенсивно развиваться в том направле
нии, которое по справедливости может быть названо физической
термодинамикой. Термодинамика техническая не может опираться на
такой материал, который приводит при решении каждого конкрет
ного вопроса к трудоемким математическим выкладкам, перерастаю
щим в самостоятельную формальную задачу . П о этой причине при
практических расчетах, касающихся реальных газов и паров, исклю
чительную роль играют диаграммы или таблицы, специально приспо
собленные для быстрого разыскания необходимых физических вели
чин. В третьей главе мы к этому вернемся.
3. Термические уравнения состояния. Исключительное место
среди множества уравнений состояния для реальных газов занимает
теоретическое уравнение Ван-дер-Ваальса (1873). Это уравнение
прекрасно предсказывает основные качественные особенности реаль
ных газов, отличающие их от идеальных. Правда, в количественном
отношении оно не может быть признано удовлетворительным, что
вполне естественно вытекает из крайней простоты принятой для него
схемы. Несмотря на недостаточность уравнения Ван-дер-Ваальса
для точных расчетов, его рассмотрение чрезвычайно поучительно.
Как известно, уравнение Ван-дер-Ваальса вносит две поправки
к представлению о поведении молекул идеального газа. Первая по
правка имеет целью учесть объем газа, закрытый для движения моле
кул. Вокруг каждой молекулы может быть мысленно описана сфера,
внутрь которой не могут в среднем проникать летящие навстречу
молекулы вследствие возникновения очень больших сил отталкива
ния. Таким образом, свободное для молекулярного движения про
странство должно определяться разностью между видимым объемом
газа v и коволюмом (сообъемом) Ь> который представляет собой
сумму упомянутых элементарных сфер. Величина коволюма имеет
порядок объема жидкости и для простейшей модели, согласно теоре
тическим расчетам, равна учетверенному объему самих молекул. В то
рая поправка связана с необходимостью учесть межмолекулярные
силы, имеющие противоположное направление, а именно, силы вза
имного' притяжения. Э ти последние создают, очевидно, у ограничи
вающих газ стенок равнодействующую силу , направленную внутрь
газового объема. П оэтом у показания всякого манометра определяют
преуменьшенные значения того давления, которое должно характери
зовать термическое состояние газа. По Ван-дср-Ваальсу, добавка
к внешнему давлению, называемая молекулярным давлением, обратно
пропорциональна квадрату объема газа, т . е . равна a/v2, так как,
например, уменьшение объема приводит, с одной стороны, к увели
чению количества молекул вблизи стенки и, с другой стороны, к у си
лению взаимодействия между ними благодаря сокращению средних
расстояний. В итоге взамен уравнения Клапейрона получаем формулу
1Л. t)
РЕАЛЬНЫЕ ГАЗЫ
‘221
Ван-дер-Ваальса:
(p+£)(v—b)=RT.
(V. 3)
Теоретическое вычисление постоянных а и b принципиально воз
можно на основании детальных сведений о структуре молекулы и
межчастичных силах взаимодействия, рд нак о даже современная
микрофизика способна решать эту задачу только для самых простых
систем. Поэтому формула Ван-дер-Ваальса может получить практи
ческий смысл, если величины а, д и R определять опытным путем.
При чрезвычайно больших разрежениях (v - * оо) формула Ван-
дер-Ваальса должна переходить и действительно переходит в ф ор
мулу Клапейрона ^
<^.р и b<^iv9 так что pv = RT^j. Поэтому
величину R надлежит считать обычной газовой постоянной для
идеального состояния. Что касается а и Ь, то их можно было бы
вычислить, измерив взаимосвязанные параметры р , v и Т в любых
двух состояниях газа. Однако опыт показывает, что величины а и b
оказываются зависящими от выбора исходных термических состояний
или, иначе говоря, что а и b не являются строго постоянными.
Таким образом, сразу выясняется необходимость представлять вели
чины а и b как функции, скажем, v и Г, т . е . отвергнуть сколько-
нибудь простое изображение свойств реального газа.
Несмотря на количественную непригодность формулы В ан -д ер -
Ваальса в ее простейшем виде (при постоянных значениях а и Ь),
интересно знать, как вел бы себя тот или иной газ, если бы он ей
точно подчинялся. Для этого желательно найти такой эмпирический
способ определения а и Ь, который был бы физически обоснованным,
давал бы единственное решение и, следовательно, не содержал бы
элементов случайности. Подобный способ может быть предложен и
заключается в вычислении величин а и b как постоянных по крити
ческим параметрам газа.
Легко видеть, что относительно объема v уравнение Ван-дер-
Ваальса является уравнением кубичным. Поэтому для каждого давле
ния р оно дает при температуре Т как параметре три корня: три
вещественных или один вещественный и два мнимых. При специально
выбранной температуре три вещественных корня должны получить
совпадающие значения. При этом линия Т = const должна иметь
в координатах p - v перегиб с горизонтальной касательной. И з у к а
занных условий нетрудно найти координаты точки перегиба р к, v л
и Гк. Имеем:
Р‘=Ш
’
«■= “: 7'«=2ш-
<v'4>
Очевид но, точка (pR, v R, TR) физически определена свойствами
газа, если только уравнение Ван-дер-Ваальса отражает вообще эти
свойства. Легко видеть, что ее следует сопоставить с критической
ёёальные газы, водяной пар
|отд. V
ш
точкой К) обнаруживаемой чисто опытным путем. Н о в таком случае
систему (V. 4) можно решить относительно величин а , Ь и R с целью
вычисления их через эмпирически найденные значения /?к, v R и TR.
В отношении а и Ь подобный способ вычисления избавляет нас от
случайных соглашений, приводящих к противоречивым значениям этих
величин. Итак, находим:
а= ЗрМ\ Ь=
8
*=3
^-=
2,67^- .
(V. 5)
*К
Заметим теперь, что при условии достоверности уравнения Ван-дер-
Ваальса величина R , вычисленная из (V . 5), не должна отличаться от
/? = 848/jx, что соответствует идеальному газовому состоянию. Опыт
показывает, однако, что газовая постоянная R может быть получена
из pRv R/TR путем умножения на число, только большее, чем 2,67.
Наименьшее расхождение имеет место для водорода, для которого
это число, называемое критическим коэффициентом, равно 3,03 .
Для азота и кислорода он равен 3.42, для углекислоты 3,49. Для
воды этот коэффициент отличается еще больше (4,46), так как моле
кулы воды в жидкой фазе сильно ассоциируются, т . е. группируются
в более или менее сложные комплексы, силовые взаимодействия между
которыми не могут быть схематизированы так просто, как в случае
неассоциируемых молекул неполярных веществ. Отклонение критиче
ского коэффициента от расчетного значения может служить удобным
критерием для суждения о применимости с количественной стороны
уравнения Ван-дер-Ваальса. Оказывается, что величины а и Ь , вы
численные из (V .4 ), также не наилучшим образом удовлетворяют
опытным данным. Удовлетворительное согласие уравнения В ан - дер -
Ваальса с экспериментально найденными термическими параметрами
наблюдается тогда, когда принимаются примерно вдвое меньшие зна
чения а а
чем то следует из давления и объема в критической
точке.
Покажем теперь, что для описания свойств газа по Ван-дер-
Ваальсу можно вовсе обойти вопрос о численном значении постоян
ных а , Ь и R . Для этого следует лишь представить уравнение (V . 3)
в безразмерной форме* выбрав в качестве масштабов для давления,
объема и температуры их соответствующие критические величины.
Назовем приведенными (безразмерными) термическими параметрами
следующие выражения:
Выразйм В (V. 3) р у v и Т через приведенные параметры и одно
временно исключим постоянные а 9 b и R посредством системы ф о р
мул (V. 5). Тогда мы получим, что
(V. 7)
1'Л. 1]
РЕАЛЬНЫЕ ГАЗЫ
223
Замечательной особенностью уравнения (V . 7) является то , что оно
не содержит каких-либо индивидуальных постоянных, характерных
для того или иного газа. Иными словами, это уравнение выражает
универсальные свойства всех молекулярных систем, удовлетворяющих
схеме Ван-дер-Ваальса. Таким образом, если два независимых терми
ческих параметра, выраженные в долях от их критических значений,
выбраны для разных газов одинаковыми, то и третий, приведенный
параметр, должен быть для всех газов одинаковым. Состояния газов,
определенных некоторой комбинацией приведенных параметров, назы
ваются соответственными (сходственными), а уравнение ( V . 7)—з а
коном соответственных состояний по Ван-дер-Ваальсу.
Частным следствием закона соответственных состояний является
одинаковость очертания приведенных изотерм в безразмерных коорди
натах p n-v n. Это построение, согласно (V. 7), выполнено из рис. 63 .
Мы видим, что при Тп > 1 изотермы идут в общих чертах так, как
это представляется обычным. Бросающееся в глаза различие заклю
чается лишь в том, что изотермы идеальных газов имеют асимптотой
ось ординат, тогда как системы Ван-дер-Ваальса, соответственно —
вертикаль, абсцисса которой v n = г/ъ. Э то т приведенный объем о тве
чает, по смыслу вывода, компактной упаковке молекул при свер х
высоком сжатии вещества. Для детального суждения об особенностях
систем Ван-дер-Ваальса гораздо удобнее воспользоваться диаграммой
Амага. Из (V. 7) следует, что
g
вместо pnvn=
— Тп для такого случая, когда vn-> со,а рп 0, т. е.
когда система Ван-дер-Ваальса приближается к идеальному газовому
состоянию. Н а рис. 64 произведено построение диаграммы Амага по
Ван-дер-Ваальсу. Совершенно ясно, что уравнение Ван-дер-Ваальса
обнаруживает все те особенности термического состояния реальных
газов, которые были демонстрированы ранее на рис. 52— 55 . Вместе
с тем видимые отличия в поведении различных газов, например воз
духа и водорода, получают теперь простое объяснение: все дело
в том, что интервалу температур от 0 до 200° С для воздуха отве
чает меньшая приведенная температура (2 < Тп < 3,6), чем для водо
рода (8,3 < Гя < 14,3).
Пунктирной линией В на рис. 64 обозначена кривая Бойля. Можно
показать, что приведенная температура Бойля характеризуется числом
3,375, т. е . что Тв/Тк = 3 ,375. Действительные температуры Бойля
сведены в помещенную здесь таблицу. Мы видим вновь, что коли
чественные данные, вытекающие из уравнения В ан-дер-Ваальса, не
столь хороши, как качественные заключения. Впрочем, и среди послед
них находятся также такие, которые не соответствуют действитель-
224
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
|ОТД. V
ности. Например, переписав уравнение в форме
RT
а
Р
ф»
находим, что
При этом согласно (IV. 8а),
с
Ыг)т=АТ{Ш„'
=
0> т . е* теплоемкость cv не должна зависеть от объема и
может быть функцией только от температуры. Как известно, реаль
ные газы таким простым свойством теплоемкости не обладают.
Обратимся теперь к области подкритических температур, где
Тп < 1. Если мы приписываем критической точке по Ван-дер-Ваальсу
ГЛ. I]
РЕАЛЬНЫЕ ГАЗЫ
225
Температура Бойля
и критическая температура Гк [°К]
Не
Н2
Ne
N,
Аг
о*
/
Воздух
TR
5,3
33,2
44,5
126,1
150,8
154,4
132,5
Тв
23
109
121
326
412
423
347
Tb IT*
4,34
3,28
2,72
2,59
2,73
2,74
2,62
физический смысл действительного критического состояния реального
газа, то следовало бы ожидать на рис. 63 при Тп < 1 наличия горизон
тальных участков изотерхМ, как
это было показано на рис. 51,
выражающем данные опыта.
Мы видим, однако, что уравне
ние (V . 7) взамен горизонталь
ных участков дает петлевид
ные, S -образные кривые abcde.
Установим прежде все го , что
отрезки этих кривых между
соответствующим
минимумом
и максимумом, т . е . линии bed,
не могут быть физически реа
лизуемы. В самом деле, пред
ставим себе, что под поршнем
цилиндра находится вещество
в каком-либо из равновесных
состояний, отвечающих этому
отрезку. Уменьшим на малую
величину нагрузку на поршень.
Было бы естественно ожидать,
что малому изменению внешней
нагрузки отвечает столь же
малое
приращение
объема.
Между тем, если линия bed
имеет смысл, вместе с расши
рением вещества должен происходить рост внутреннего давления, и
начавшееся расширение сможет прекратиться не ранее, чем будет
достигнута точка максимума d . Напротив, вызвав ничтожное сжатие
вещества путем незначительного увеличения внешней нагрузки на
поршень, мы должны были бы заметить самопроизвольное со кр ащ е
ние объема, по крайней мере, до точки Ь. Это значит, что состоя
ния, изображаемые отрезком bed, являются абсолютно неустойчивыми
и опытным путем воспроизведены быть не могут. Таким образом,
Рис. 64.
15 Зак. 3543. В. С . Жуковский.
226
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
[ОТД. V
каждая изотерма Ван-дер-Ваальса распадается на две разорванные
ветви, удовлетворяющие условию динамического равновесияid p / d v ^ O .
Левая ветвь должна отвечать свойствам жидкости, а правая — свой
ствам пара (реального газа).
Положим, что под поршнем находится жидкость, причем внешняя
нагрузка постепенно уменьшается, а температура жидкости поддер
живается постоянной, т . е . , иначе го воря, что мы движемся вдоль
ветви изотермы Ван-дер-Ваальса сверху вниз. При наступлении не
которого достаточно малого давления в точке а жидкость должна
закипать. Как было ранее указано , до полного превращения жидкости
в пар изотермическое расширение является вместе с тем изобарным,
т . е . точкой а определяется горизонтальный участок ab. Вспомним
теперь, однако, что для кипения жидкости необходимы благоприят
ствующие этому процессу условия, а именно, наличие пузырьков
растворенного в жидкости или адсорбированного стенками воздуха
или других газов. Хорош о известно также и из опыта, что если, на
пример, сосуд и находящаяся в нем жидкость обеднены воздухом
в результате продолжительного кипения, то при повторном нагрева
нии кипение начинается при более высокой температуре, чем раньше.
Это значит, что понижение давления в цилиндре до р а при изотер
мическом расширении жидкости является условием, необходимым для
закипания, но не достаточным. Искусственным путем можно задержать
закипание жидкости несмотря на дальнейшее понижение давления. Таким
образом,отрезок ab изотермы Ван-дер-Ваальса отвечает поведению пере
гретой жидкости. Реальность этого отрезка была неоднократно доказана
на опыте. Более того, при соблюдении особых предосторожностей
удавалось спускаться вдоль изотермы в область отрицательных давле
ний, т. е . подвергать жидкость растяжению, избегая при этом ее
закипания. Для иллюстрации можно сослаться на такой эксперимент.
Небольшое пространство над ртутью в чашечном барометре с глубоко
погруженным концом заполняется предварительно прокипяченной чи
стой водой. Легко убедиться в том, что при поднятии трубки столб
ртути в ней может получить значительно большую высоту, чем это
отвечает первоначальному равновесию. Несмотр я на возникающее
растяжение, вода не отрывается от стенок и, следовательно, не пре
вращается в пар. Предельное растяжение, достигнутое в случае холод
ной воды, равно примерно минус 40 a m .
И так , мы установили, что отрезки изотерм, подобные ab, имеют
вполне реальный смысл, но требуют для своего осуществления с о
здания специальных условий. Однако состояние вещества в виде пере
гретой жидкости не является вполне устойчивым. Стоит только ввести
в такую жидкость зародыш новой фазы, например опустить в нее
кусок фарфора (включает много воздуха), как произойдет бурное
вскипание жидкости, в итоге которого будет достигнуто надлежа
щее термодинамически равновесное состояние на прямой ас. А нал о
гичное толкование следует дать о трезку ed. Последний отвечает тому
ГЛ. 1]
РЕАЛЬНЫЕ ГАЗЫ
227
случаю, когда при изотермическом сжатии в отсутствии центров кон
денсации (пылинок, капель тумана, ионизированного воздуха) пар не
выпадает в виде жидкости, хотя плотность его превзошла значение,
достаточное для конденсации при благоприятных условиях. Такой пар
называется пересыщенным. Иначе его можно получить путем о хла
ждения сухо го насыщенного пара (хотя бы по адиабате), если только
он свободен от центров конденсации (этому благоприятствует также
большая скорость охлаждения). В связи со сказанным пересыщенный
пар называют также переохлажденным. Переохлаждение пара наблю
дается, например, в высоких слоях атмосферы, где содержащаяся в воз
духе влага может оставаться неконденсированной, несмотря на очень
низкую температуру. Аналогичное явление может иметь место при св о
бодном вытекании насыщенного пара через отверстие в стенках паро
вого пространства котла. В этом случае часто струя становится
видимой лишь на некотором удалении от отверстия, х о т я , следуя
адиабатному расширению, пар должен был бы конденсироваться непо
средственно при выходе на руж у. В действительности же он получает
эту возможность только позднее, когда благодаря интенсивному пере
мешиванию паровой струи с воздухом в пар вовлекаются пылинки —
зародыши жидкой фазы. С переохлаждением пара приходится встре
чаться также в паровых турбинах при течении пара в расширяю
щихся насадках сопел Лаваля. В этом случае переход пересыщен
ного пара к более устойчивому двухфазному состоянию сопрово
ждается скачкообразным падением скорости течения и таким же
возрастанием давления.
Состояния вещества в виде перегретой жидкости и переохла
жденного пара называются метастабильными. Механической анало
гией таких состояний является случай, когда в небольшой ямке на
вершине холма лежит шарик. Е го положение остается устойчивым
лишь по отношению к таким толчкам, которые не способны п о дка
тить шарик к самому гребню вала, окружающего ямку. Если же
толчок силен, то шарик перекатывается через вал и о ттуда стреми
тельно падает вниз, пока не достигает подножия холма, где прихо
дит к состоянию абсолютно устойчивого равновесия. Условия возник
новения метастабильных состояний и перехода их в другую фазу
рассматриваются в теории поверхностных явлений. Как ни важны
в практическом отношении эти во просы , мы должны их оставить, так
как они выходят за рамки технической термодинамики.
Подводя итоги сказанному, следует признать, что уравнение Ван-
дер-Ваальса в области подкритических температур хорошо предска
зывает существование метастабильных состояний воды и пара. П р я
мых указаний на наличие устойчивого перехода в другое агрегатное
состояние оно не дает. Если, однако, исходить из того опытного
факта, что подобный переход совершается вдоль горизонтальных
отрезков изотерм, то легко определить единственно возможное поло
жение таких отрезков относительно S -образных кривых abode (рис. 63).
15*
228
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
[ОТД. V
Для этого нужно представить себе, что вещество выполняет круго
вой цикл abcdecdy имеющий вид восьмерки. Э то т цикл, как изотер
мический, согласно условию
не может произвести внешней работы, так как для круго вого цикла
q = AL Это значит, что прямая асе должна проходить так, чтобы
площадь abc была равна площади edc. Получаемые при этом взаимно
соответствующие величины давления и температуры кипения (конден
сации) совпадают приблизительно с опытными данными.
Итак, уравнение Ван-дер-Ваальса позволяет охватить особенности
вещества в самых разнообразных формах его существования: в газо
образной и в жидкой фазах, а также косвенным путем — в двухфаз
ном стабильном состоянии, где жидкость и пар сосуществуют в равно
весии. Это является свидетельством непрерывности жидкого и газо
образного состояний, о которой мы уже говорили ранее. Ввиду
столь богатых возможностей уравнения Ван-дер-Ваальса возникло
множество предложений построить на его базе количественно более
точные уравнения состояния. О бзор этих предложений выходит за
рамки технической термодинамики. Н уж н о лишь подчеркнуть у сп е х ,
достигнутый на указанном пути в самые последние годы М . П . В у к а -
ловичем в сотрудничестве с И . И . Новиковым. Вукалович внес в урав
нение Ван-дер-Ваальса поправку на ассоциацию молекул, давшую
хороший результат даже для водяного пара, который, как было
принято считать, не укладывается ни в какие теоретические схемы
решения.
В заключение отметим, что термические свойства газов могут
быть иногда более или менее уверенно предсказаны и без помощи
какого-либо теоретического уравнения состояния. Обратим внимание
на тот факт , что безразмерные, приведенные к критическим пара
метрам, характеристики газов хотя и отличаются от рассчитанных по
Ван-дер-Ваальсу, но обнаруживают во многих случаях бросающуюся
в глаза близость друг к другу. Это можно видеть на примерах кри
тического коэффициента R T J p nv n, температуры Бойля, кривой ин
версии дроссель-эффекта и многих других, о которых здесь не место
распространяться. При детальном анализе родственных в указанном
смысле газов выясняется, что они принадлежат к группе неассоци-
ируемых веществ. Такие вещества принято называть нормальными.
Ввиду сказанного возможно, не прибегая вовсе к гипотезам о меж
частичных силах и механизме внутреннего движения в нормальных
веществах, объединить их свойства на основе чисто эмпирических
соотношений. В частности, если поведение какого-либо вещества
в некоторой области неизвестно, то можно восполнить пробел, при
писывая этому веществу такие ж е связи между приведенными вели
чинами, которые найдены из опыта дл я соответственных состояний
ГЛ. I]
РЕАЛЬНЫЕ ГАЗЫ
229
и ны х веществ. Так именно поступил Камерлинг О ннес (1901) при
составлении эмпирического уравнения состояния в приведенных пар а
метрах. При этом было показано, что в пределах группы подобных
веществ отдельные представители отличаются друг от друга только
масштабом одноименных величин, т. е . относятся друг к другу, как мо
дель относится к своему образцу. Таким образом , наилучшей моделью
нормальных веществ является не система Ван-дер-Ваальса, а какое-
нибудь из них самих, если только опытные сведения о нем представ
ляются достаточно надежными. Впрочем, экспериментальный закон
соответственных состояний1) также не может служить абсолютно точ
ным инструментом для пересчетов. Точность этого закона возрастает
при выделении из группы нормальных веществ еще меньших подгрупп,
однако практическая ценность такого приема весьма сомнительна. Для
веществ ассоциируемых закон соответственных состояний применения
не получил.
Полезно отметить, что экспериментальный закон соответственных
состояний является частным выражением теории физического подобия
и показывает, что по своей внутренней природе многие вещества
совершенно тождественны. В частности, это значит, что молекулы
таких веществ имеют практически одинаковое строение и одинако
вую форму.
П оск ол ьку перегретый водяной пар принадлежит к числу сильно
ассоциируемых веществ, большое распространение получили чисто
эмпирические уравнения состояния, которые специально предназна
чены именно для водяного пара и не претендуют на пригодность
к другим газам. Непосредственное экспериментальное определение
вида функции Ф (р, v , Т) = 0 сопряжено с большими трудностями.
До последнего времени считалось, что более просто и точно под
даются измерению, например, теплоемкость пара ср или величина др ос
сель-эффекта. Так как между свойствами калорических функций и
термическим уравнением состояния существую т связи, вытекающие
из уравнений термодинамики в частных производных, то открывается
возможность находить функцию Ф расчетным путем, кладя в основу
экспериментальные данные, не имеющие прямого отношения к тер
мическим параметрам состояния р , v и Т.
Так, если желательно исходить из данных по теплоемкости ср , то нужно
взять уравнение (IV. 8Ь):
1) Его нужно отличать от теоретического закона соответственных состо
яний по Ван-дер-Ваальсу.
Проинтегрируем это уравнение по переменной Т:
т
230
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
[ОТД. V
Здесь ф(/?) представляет собой постоянную интегрирования, которая
может быть, очевидно, функцией одного только давления.
Повторим операцию интегрирования по Т еще один раз. В таком случае
получаем:
Тт
’>-9(Р)+ПР)Т-]с{Ц\(^)т4Т>}г
(V.8)
R7
Желая придать уравнению состояния перегретого пара форму v = —
-J-
+ Дг/, можно найти вид функций ср(р) и ф(р). Для этого вспомним, что
(дср\
теплоемкость ср идеального газа не зависит от давления, т. е . у -ф ) т = 0.
Обозначим через Г0 ТУ температуру, при которой уравнение вырождается
(дс*л
в уравнение для идеального газа и одновременно\ - ^ ) тобращается в нуль.1)
RT
Относя уравнения (V. 8) и г>= —
+ Дг/ к этой температуре
находим, что
откуда
ч(р)= ° и
=
у•
Окончательно находим, что
тт
р
АVIJ Г\др'т
Jр
(V.9)
В формуле (V.9) интегрирование
может быть выполнено аналитическим
или графическим путем, если известен закон изменения ср с давлением на
различных температурных уровнях. Этот путь решения задачи был исполь
зован многими исследователями. Для наглядности смысл формулы (V. 9)
схематически показан на рис. 65. Сплошной линией обозначен путь интегри
рования для получения v по данным р и 71.
В дальнейшие подробности по поводу эмпирических уравнений состоя
ния мы не будем входить. Разумеется, они в принципиальном отношении
менее ценны, чем теоретические уравнения, к каковым принадлежит упомя
нутое выше уравнение Вукаловича — Новикова.
В связи с быстрым ростом советской энергетики и интенсивным
внедрением в промышленность пара высоких параметров в С С С Р
были развернуты большие работы в области изучения свойств водя
ного пара. В частности, в последнее время прямому опытному опре
делению была подвергнута зависимость объема перегретого пара от
давления и температуры (Д. Л . Тимрот и Н . Б . Варгафтик в ВТИ
!) Нужно заметить, что указанный прием реализуется практически недо
статочно удовлетворительно. Так, даже при 600° С водяной пар значительно
отклоняется от идеального газа, причем ср продолжает изменяться вместе
с давлением, Поэтому выводимая формула (V.9) не может быть признана
удачной.
гл. и]
ИЗМЕНЕНИЯ АГРЕГАТНОГО СОСТОЯНИЯ
231
им. Ф.Э . Дзержинского, В. А . Кириллин и Л. И . Румянцев в МЭИ
им. В . М . Молотова). При этом выяснилось, что существовавшее
ранее мнение о малой доступности и недостаточной точности со от
ветствующих измерений ошибочно. Новые таблицы М . П . Вукало-
вича (см. далее) опираются, в частности, на данные об объемах пара,
полученные в результате работ советских экспериментаторов.
ГЛАВА II
ИЗМЕНЕНИЯ АГРЕГАТНОГО СОСТОЯНИЯ
4.
Диаграмма равновесия агрегатных состояний. В настоящей
главе, как и во всем дальнейшем, будут рассматриваться устойчивые,
стабильные состояния вещества, так как состояния метастабильные
и условия их превращения нуждаются в специальном аппарате иссле
дования. Вместе с тем всякие изменения состояния будут считаться
квазистатинескими. П о этой причине, например, мы вовсе не будем
касаться той формы парообразования, которая называется кипением
жидкости и противопоставляется испарению. В отличие от испарения
кипение является процессом парообразования во всем объеме ж и д ко
сти и начинается только при наличии ощутимого перегрева жидкости
по отношению к возникающему пару. Подобно этому и процесс
конденсации может протекать двояким образом. Обратным по сравне
нию с поверхностным испарением является процесс конденсации пара
при весьма медленном изобаро-изотермическом сжатии паро-ж идк о
стной смеси, вначале находившейся в термическом равновесии.
Таку ю конденсацию можно рассматривать как квазистатическую.
Совершенно иначе протекает конденсация в тех случаях, когда пар
соприкасается, например, с более холодными стенками, как это имеет
место в промышленных конденсаторах и разнообразных теплообмен
ных аппаратах. При этом выпадающий на стенках конденсат оказы
вается холоднее пара, и , следовательно,
процесс принадлежит
к категории по существу нестатических превращений. Изучение не
статической конденсации и кипения производится в теории тепло
обмена на основе законов термодинамики, молекулярной физики
и гидромеханики.
Обе фазы — жидкая и газообразная — могут находиться во вза
имном равновесии, т. е . сосуществовать в изолированном от внеш
него мира пространстве неограниченное время, оставаясь в неизменном
количественном соотношении. Вместе с тем это количественное с о
отношение может быть установлено каким угодно, т. е . процент
ное содержание конденсата в смеси может лежать в пределах от
О до 100%.
Состояние каждой из фаз в отдельности не зависит от их отно
сительного содержания, будучи функцией исключительно от темпе
ратуры системы или от ее давления,
232
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
[ОТД. V
Газообразную фазу, находящуюся в равновесии с жидкой фазой,
называют с у х и м насыщенным паром. Указанное равновесие с точки
зрения микрофизики является динамическим, устанавливаясь тогда,
когда число молекул, вылетающих из жидкости, равно в среднем
числу молекул, возвращающихся обратно в жидкость.
Равновесную систему, состоящую из жидкой и газообразной фаз,
называют влажным насыщенным паром. О чевид но, газообразным
компонентом этой системы является сухой насыщенный пар, а
жидким компонентом — ж и дко сть , находящаяся в состоянии начала
парообразования.
При нагревании жидкости парообразование наступает в тот
момент, когда температура жидкости достигает уровня, на котором
давление могущего образоваться сухого насыщенного пара р а стано
вится равным заданному давлению. Если жидкость может находиться
в соприкосновении только со своим паром, то высказанное утвер
ждение не нуждается в каком-либо разъяснении. Однако, если над
свободной поверхностью жидкости находится посторонний нейтраль
ный газ, то наша формулировка должна быть дополнена, а именно:
под заданным давлением следует понимать заданное парциальное
давление пара р а.
Н а последнем случае необходимо остановиться подробнее. Когда
жидкость сосуществует с посторонним газом, то испарение наблю
дается при всякой, сколь угодно низкой температуре. Этот процесс
идет самопроизвольно, т. е . без подвода тепла извне, до тех пор
пока в изолированной системе жидкость — газ количество пара,
образовавшегося в заполненном газом пространстве, не достигает
определенного предела. В предельном состоянии наступает динами
ческое равновесие между процессом испарения жидкости и процес
сом конденсации пара на свободной поверхности жидкости, вслед
ствие чего видимое испарение прекращается. Э то компенсированное
состояние устанавливается, когда пар над жидкостью будет обладать
признаками сухого насыщенного пара, совершенно такими ж е, какие
наблюдались бы при отсутствии постороннего газа. Иными словами,
в паро-газовой смеси, находящейся в равновесии с соответствую
щей жидкостью, парциальное давление пара р П равно давлению насы
щения р н, отвечающему общей температуре системы. Я сно , что ква-
зистатическое парообразование может иметь начало только из такого
равновесного состояния, т . е . при условии , формулированном выше,
с оговоркой о задании именно парциального давления пара.
Для пояснения посмотрим, каким образом можно было бы в зам
кнутом пространстве образовать систему из некоторого количества
воды и паро-воздушной смеси при давлении, например, в 1 am —
=
735,6 мм H g (рис. 66). Если температуру системы желательно иметь,
скажем, равной 30° С , то можно поступить следующим образом:
1) заполнить освобожденное от воздуха пространство водой, на
ходящейся в равновесии со своим паром при 30° С . При этом давле-
ГЛ. II]
ИЗМЕНЕНИЯ АГРЕГАТНОГО СОСТОЯНИЯ
233
ние будет равно примерно 0 ,04 кГ/см2, что отвечает насыщенному
пару выбранной температуры /?п = /?н. Е сл и в крышке имеется от
верстие площадью 1 см2, закрытое тарельчатым клапаном, то для
уравновешивания внешнего давления надлежит приложить, как по ка
зано на схеме а, силу в 0,96 кГ\
2) впустить в паровое пространство во здух, нагретый до 30° С ,
в таком количестве, чтобы его парциальное давление р в стало равно
0,96 кГ]сл1 2, а общее давление внутри системы достигло 1 кТ/см2.
0,96 иГ\
]
Пар 0,04 кГ
Пар 0.04 кГ
Воздух096кГ
~
:= Тода ~
7^Идда^'
-
-
------ -
-
-
-
-
-
-
-
-
-
—
.
-
30°С
9
Пар 0.25кг
~—
Вода--
L-L
-
Пар 0.25кГ
Воздух Q75 кГ
Ег?ода_—
Пар1кГ
-^BojTa 'z
99fC
9
659С
9
Рис. 66.
Соотношение давлений, получающихся при 65° С , показано на
схеме Ь. Наконец, последняя схема с отвечает случаю, когда вода
с паром (без воздуха) имеет температуру 99,1 ° С , при которой дав
ление /?п = /?н сравнивается с заданным (1 кГ/см2). В этом случае
добавка во здуха невозможна без того, чтобы давление превысило
атмосферное. Е сл и воздух будет все же добавлен и система затем
будет возвращена к атмосферному давлению посредством увеличения
ее объема, то равновесной температурой окажется температура,
меньшая чем 99,1 ° С . Чем больше воздуха находится при заданном
давлении в замкнутом пространстве над водою, тем более низкой
оказывается температура равновесия. При полном отсутствии во з
духа она имеет максимальное значение, определяемое состоянием
чистого насыщенного пара, давление которого равно заданному.
Нужно заметить, что жидкость, находящаяся в открытом на воз
духе со суде, никогда не может быть в равновесии с газосодержащим
пространством. Если ее температура ниже точки кипения, происхо
дит более или менее постепенное испарение жидкости, заканчиваю
щееся полным превращением ее в пар. Есл и температура жидкости
выше точки кипения хотя бы на бесконечно малую величину, то
в принципе должно начаться кипение. Кипение может быть задер
жано искусственно путем лишения жидкости центров парообразо
вания (полированные стенки со су да , удаление из жидкости взвешенных
твердых частиц и растворенного ra sa ). При этом в известных преде
лах жидкость может оказаться перегретой.
234
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
[ОТД. V
Однако, при каких бы обстоятельствах ни началось кипение, не
посредственно над поверхностью жидкости образуется слой насы
щенного пара, а наличие воздуха обнаруживается лишь на некотором
удалении, где благодаря диффузии, перемешиванию и конденсации
пар постепенно уступает место воздуху. Поэтому пар вблизи поверх
ности кипящей на воздухе воды имеет температуру, в точности рав
ную температуре насыщенного пара для существующего барометри
ческого давления, т. е . например, 99,1° С при р = 1 кГ/см*. Это
обстоятельство позволяет однозначно определять точку кипения и
используется при устройстве паровых бань для точной градуировки
термометров.
Отметим здесь, что в ряде практических случаев бывает необхо
димо рассматривать паро-газовую смесь в отсутствии или, по край
ней мере, в независимости от жидкой фазы. Для определенности
будем иметь в виду воздух, содержащий то или иное количество
водяного пара. Если парциальное давление водяного пара р п равно
давлению насыщения р п при заданной температуре, то воздух назы
вается насыщенным, если же р п < р п, т. е . пар находится в пере
гретом состоянии, то воздух называется ненасыщенным. При добав
лении к насыщенному воздуху жидкой воды, имеющей ту же темпе
ратуру, эта вода без изменения остается в жидком состоянии; при
добавлении пара он конденсируется и выпадает в виде тумана,
дождя или росы. При изобарном охлаждении ненасыщенного воздуха
такое выпадение влаги наступает в момент достижения точки росы,
т. е. температуры, при которой рп = р и.
Отношение парциального давления пара р п к давлению насыще
ния при данной температуре р Е называется относительной влаж но
стью ср:
Для сухого воздуха <р= 0 . В примерах на рис. 66 относительная
влажность воздуха ? = 1 (или 100%)- Повышение температуры при
постоянном полном давлении и <р= 1 приводит к тому, что р п вме
сте с р а растут, и на долю сухого воздуха остается все меньшее
парциальное давление р в. При этих условиях наступает момент,
когда сухой воздух уже не может более сосуществовать с паром
(на рис. 66 при 99,1 ° С). Дальнейшее увеличение температуры при
водит к то му, что пар становится (в отсутствии воздуха) перегретым.
Характеристикой состава влажного воздуха может быть также
так называемое влагосодержание. Влагосодержание есть отношение
веса содержащегося во влажном воздухе пара Ол к весу fy^oro
воздуха G B;
Оя
ГЛ. И]
ИЗМЕНЕНИЯ АГРЕГАТНОГО состояния
235
Считая и пар и воздух идеальными газами, имеем:
pnV=GnRnT=dGBRnT9 pBV=GBRBT,
откуда
Для воздуха \lb = * 29, для водяного пара ]1п =з 18. Поэтому
d.= 0,622— = 0,622<е—
.
Р,
тРь
Наибольшее возможное значение влагосодержания при данной тем
пературе получается при подстановке взамен парциального давления
ра величины р я (соответственно < р = 1 ). Заметим, что если воздух
характеризуется относительной влажностью <р = 1 или наибольшим
влагосодержанием (при температурах, меньших температуры насы
щения, относящейся к данному полному давлению), то это еще ни
чего не говорит о возможном наличии жидкой воды наряду с влаж
ным воздухом.
В подробности по поводу расчетов процессов с влажным возду
хом мы в настоящем курсе не будем входить. Отметим только, что
эти расчеты чрезвычайно облегчаются благодаря применению диа
граммы i-d влажного воздуха, впервые предложенной Л. К . Рам-
зиным в 1918 г.
Соотношение между температурой и давлением насыщенного пара
показано для ряда веществ на рис. 67. В о всех случаях давление
растет гораздо быстрее, чем температура. Кривые сверху обрываются
в критической то чке, где температура и давление получают значе
ния t9 и р *. Для аммиака, воды и ртути эти значения выходят за
236
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
[ОТД. V
пределы диаграммы. Каждая кривая определяет состояния, в которых
жидкая и газообразная фазы вещества сосуществую т, находясь
в устойчивом равновесии. Точки слева от кривой соответствуют
чистой жидкой фазе, а справа — газообразной фазе. В области над
кривой равновесия противопоставление указанных агрегатных состо я
ний может иметь лишь условный смысл.
Если мы станем охлаждать при постоянном давлении жидкость,
то рано или поздно она перейдет в новое агрегатное состояние —
твердое. Температура затвер
девания (плавления) однозначно
определяется давлением и за
малым исключением (например,
для воды) изменяется в одну
сторону с ним, подобно темпе
ратуре конденсации (парообра
зования). Существует ли на
кривой плавления своя крити
ческая точка, до сих пор остает
ся неясным. Во всяком случае
опыты Бриджмена, доведен
ные до 20 000 am, такой точки
В некоторой характерной
для каждого вещества точке
кривые парообразования и плавления пересекаются (рис. 68). Э то озна
чает, что при определенных давлении и температуре возможно со су щ е
ствование всех трех ф аз, и притом — в любых количественных со
отношениях. Такая точка называется тройной, а изображаемое ею
состояние — фундаментальным. Ниже тройной точки устойчивой
жидкой фазы быть не может, и вещество находится либо в твердом,
либо в газообразном состоянии. Линия, отделяющая оба эти состо я
ния, определяет комбинации давления и температуры, при которых
твердая и газообразная фазы находятся в равновесии. П ере хо д через
линию слева направо изображает процесс сублимации, или возгонки,
при котором твердое вещество превращается в пар, минуя проме
жуточную жидкую фазу. Кривая возгонки, согласно опытным наблю
дениям, приходит к 0° абс.,
где давление возгонки обращается
также в нуль. Три кривые равновесия разделяют диаграмму p -t
на области твердого, жидкого и газообразного агрегатных состояний. г)
х) Кривая равновесия жидкость — пар может спускаться и несколько
ниже тройной точки. В таком случае она относится к метастабильным со
стояниям. Так как всегда эта продолженная кривая располагается левее
кривой возгонки, то оказывается, что при некотором^ давлении существова
ние жидкости с паром имеет место при более низкой температуре, чем для
твердой фазы и ее пара. Именно по этой причине для ацетилена и углекислоты
в табл. 1 указывается, что температура точки кипения лежит ниже темпера
туры точки плавления, поскольку в основу положено нормальное давление.
гл. и]
ИЗМЕНЕНИЯ АГРЕГАТНОГО СОСТОЯНИЯ
237
Показанная схематически на рис. 68 диаграмма равновесия отно
сится к углекислоте. И з диаграммы видно, что стабильная жидкая
углекислота может существовать только при температурах больших,
чем — 5 6 ,6 ° С . Нельзя сконденсировать углекислый газ при меньшей
температуре, как бы высоко ни поднимать его давление; можно лишь
превратить газ в твердую углекислоту. Если заполнение какого-либо
баллона сжатой углекислотой производится при комнатной температу
ре - f -2 0 °C , то в нем при 58,5 am начинает образовываться жидкая
углекислота. Выпуская затем жидкую углекислоту в воздух через вен
тиль, расположенный внизу баллона, мы не сможем увидеть ж идко
сти, ибо при атмосферном давлении в таком агрегатном состоянии
углекислота не существует.
У самого
выхода струя
жидкости станет бурно испа
ряться, охлаждаясь сама и
производя местное охлажде
ние воздуха. Это охлажде
ние будет продолжаться до
тех пор, пока не будет до
стигнута температура воз
гонки, соответствующая ба
рометрическому давлению,
т. е.
—
78°С при 1am. При
этом часть углекислоты вы
падает в твердом виде, так
что ее можно собрать в ме
шок, помещенный под струей. Разумеется, постепенно твердая угле
кислота будет превращаться в газообразную, в меру притока к ней
тепла из более нагретого окружающего воздуха. Однако до полного
ее исчезновения температура в мешке будет оставаться постоянной
и равной — 78° С . Таким образом, твердая углекислота может при
меняться как «сухой лед». Иначе обстоит дело для воды (рис. 69),
у которой тройная точка находится при 0,00623 am и 0,0098 ° С ,
т. е . практически при температуре плавления под нормальным атмо
сферным давлением, но при очень значительном разрежении. П оэто м у
при постепенном нагревании обычного льда на во здухе он сначала
должен растаять и лишь затем может превращаться в пар. Ясно, что
для целей замораживания, например скоропортящихся продуктов,
удобнее пользоваться «сухим льдом», производство которого в на
стоящее время широко распространено. Нуж но сказать, что со спо
собностью твердой воды возгоняться при температурах, меньших
0° С мы также встречаемся на опыте. Так, возможность сушки
белья на морозе объясняется именно возгонкой замерзшей воды.
Из приведенных примеров видно, что диаграммы равновесия агре
гатных состояний являются удобным средством для решения многих
задач.
238
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
(ОТД. V
Некоторые вещества имеют твердую фазу, кристаллическая струк
тура которой видоизменяется при определенных термических состоя
ниях. Т а к, при весьма высоких давлениях были обнаружены четыре
разновидности льда, которые, в отличие от обычного льда, обладают
большей плотностью, чем вода. Один из этих льдов — «горячий
лед» — наблюдался вплоть до 4 “ 8 0 °С , для чего было необходимо
создать давление в 20 000 a m . Усложненные диаграммы равновесия
в связи с аллотропическими превращениями вещества, а такж е диа
граммы для многокомпонентных систем мы здесь рассматривать
не будем.
В дозволенных кривыми равновесия пределах можно любым обра
зом сочетать давление и температуру, оставаясь при данном агре
гатном состоянии. При этом удельный объем является однозначной
функцией от р и Г. Иначе обстоит дело в состояниях, указываемых
самими кривыми равновесия. В виду того что попарно взятые фазы
могут сосуществовать во всяком количественном соотношении, удель
ный объем двухфазной системы не определяется однозначно давле
нием и температурой, а может иметь любое значение между объ
емами прежней и новой фаз, взятыми по обе стороны от кривой
равновесия. Обращаясь специально к области жидкость — пар, мы,
например для воды, получаем картину, показанную на рис. 70.
По поводу вида изохор на рис. 70 заметим следующее. Всякая
жидкость обладает очень высокой термической упругостью. Поэтому
слева от кривой равновесия изохоры идут почти вертикально. В об
ласти перегретого пара, согласно п. 2 , имеем v = фид- | -Д ^ , где
Д ^ = / ( р , Т) вблизи кривой равновесия есть заведомо отрицательная
величина. Поэтому
V= 1»вд—|AvI= у —IДг>|.
ГЛ. II]
ИЗМЕНЕНИЯ АГРЕГАТНОГО СОСТОЯНИЯ
239
Если v = const, то
Для идеальных газов изохоры являются прямыми, проходящими
через начало координат в плоскости р - Т (например, луч О А).
В случае же перегретого пара они отклоняются от прямой и, будучи
продолженными до пересечения с осью абсцисс, пересекают послед
нюю в положительной части (линия А В ) . При этом точки пересече
ния а , Ьу с, тем ближе расположены к абсолютному нулю, чем боль
ший удельный объем занимает пар, т. е . чем меньше давление при
некоторой заданной температуре. П о мере удаления от кривой
равновесия с жидкостью изохоры превращаются в пучок прямых
лучей, выходящих из начала координат, если только отвлечься от
поправок, существующих для реальных газов при высоких приведен
ных температурах.
Величины давления, температуры и предельных удельных объемов,
определяемые кривыми равновесия, сводятся в таблицы. Д ля системы
вода— пар такие таблицы помещены в конце книги (таблицы 5— 6 по
Вукаловичу). В них содержатся взаимно соответствующие значения
давления и температуры насыщенного пара, удельный объем ж идко
сти v ' на нижней пограничной кривой, а также удельный объем v "
и удельный вес
сухого насыщенного пара, т. е . на верхней погра
ничной кривой.
5.
Скрытая теплота превращения. Взаимные превращения агрегат
ных состояний при постоянной температуре возможны лишь при
сообщении или отнятии теплоты, которая при этом называется
скрытой теплотой превращ ения (теплота парообразования— конден
сации, плавления— затвердевания, сублимации— десублимации). Наиме
нование теплоты как скрытой в настоящее время лишено того смысла,
который был ему придан создателями теории теплорода. П оэтом у
приставку «скрытая» можно без ущерба для понимания дела опускать.
В дальнейшем мы будем интересоваться только теплотой испарения,
хотя наши общие рассуждения в равной степени применимы и к двум
другим теплотам превращения.
Так как изотермический процесс парообразования является вместе
с тем изобарным, то соответствующая удельная теплота превраще
ния Гу согласно первому началу, равна
В этих формулах одним штрихом помечены величины, относящиеся
к жидкости в начальный момент парообразования, и двумя штри
хами — к су хо м у насыщенному пару, завершающему превращение
в новое агрегатное состояние. Такая индексация узаконена и для
г=а"—а'+Ар(у"—v')9
(V. Ю)
или
(V. 11)
240
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
[ОТД. V
других величин, относимых к нижней и верхней пограничным кри
вым. *)
Из (V. 10) следует, что теплота парообразования, во-первых,
является источником увеличения внутренней энергии вещества и,
во-вторых, превращается во внешнюю работу, затрачиваемую на
расширение при переходе из жидкой в газообразную ф азу. Увеличе
ние внутренней энергии происходит потому, что вылетающие из
жидкости молекулы должны приобрести столь большую скорость
теплового движения, какая нуж на , чтобы вырваться из сферы притя-
женйя соседних молекул. Затрата работы против внутренних сил
сцепления тем более значительна, чем больше разность объемов v "
и v '9 т. е. чем меньше, давление. Разность и" — и' называется внут
ренней теплотой парообразования и обозначается буквой р. В н е ш
ней теплотой парообразования ^ называется величина A p { v " — v ') .
Для воды <J* имеет максимальное значение вблизи 20 a m . В крити
ческой точке обе составляющие теплоты парообразования г обра
щаются в нуль.
Н а основании сказанного формула (V . 10) может быть переписана
в таком виде:
г=р-И
.
(V . 10а)
Для примера вычислим р и ^ для углекислоты при t = 20° С . Из
таблиц, помещенных в «Справочнике машиностроителя» (1951), н а хо
дим: при t = 20°С;р = 58,46 am; и 'а 1,30 дм^/кГ; v " = 0,00529лР/кГ;
r = i" — /' = 37,1 ккал1кГ. Отсюда ty= Ap(v" — v') = 58,46* Ю4Х
Х 0 ,00399/427 = 5,4 ккал/кГ и р= г — ф»= 37,1—5 ,4 =31,7 ккал/нГ.
Т о обстоятельство, что внутренняя теплота парообразования значи
тельно превышает внешнюю теплоту, типично во всех случаях, за
исключением области вблизи критического состояния.
Полезно вспомнить, что понятие скрытой теплоты было уж е
введено нами ранее при обсуждении формул (I. 32). Отнести послед
нюю из них к процессу парообразования нецелесообразно, так как
в ней dt и dp при этом не независимы друг от друга. Если же при
менить первую, то легко получить, что
vn
r= [J[(-^r)t+ар\to\ =и"—U '+Ap(v" — v')=р+->,
V'
где величины, помеченные штрихами, берутся на пограничных кривых
при одинаковой температуре (одинаковом давлении). Н уж но п од
ч еркнуть, что превращение жидкости в пар возможно не только
посредством изобаро-изотермического процесса, а каким угодно путем,
*)мЧто касается давления насыщения, то оно здесь и далее обозначается
буквой р без индекса. Поэтому при пользовании формулами нужно само
стоятельно учитывать смысл входящего в них давления.
ГД. Ill
ИЗМЕНЕНИЯ АГРЕГАТНОГО СОСТОЯНИЯ
241
имеющим начало на нижней и конец на верхней пограничных кривых.
Однако в таком случае необходимая затрата теплоты не равна теп
лоте парообразования г , по определению относящейся лишь к изо
баро-изотермическому превращению.
Выведем теперь формулу, связывающую калорическую функцию г
с термическими параметрами состояния.
Наиболее коротким является вывод, основанный на применении
уравнения (IV.9):
Вместо
можно написать
(Ё1)
\dvjT
Так как подводимое при
KdvjT
у
изотермическом парообразовании количество теплоты пропорциональ
но соответствующему увеличению объема системы, то отношение
^
при Т = const можно заменить через [ _
.
Кроме того, для
области равновесия фаз можно частную производную ( ^ f) v заме
нить полной производной. В таком случае имеем:
г
v" —v'
(V. 12)
Формула (V. 12) носит названиеуравнения Клапейрона—Клаузиуса.
В термодинамике насыщенных паров уравнение Клапейрона —
Клаузиуса играет большую роль. Если для какого-либо вещества
известна кривая упругости насыщенного пара, т . е . вид функции
р = / ( 7 ) , и, кроме того, экспериментально определено изменение
объема при парообразовании на различных температурных уровнях,
то из уравнения (V. 12) можно найти расчетным путем теплоту паро
образования. Наоборот, если из опыта известно г , то легко
вычисляется v " — тЛ Н аконец , если считаются заданными величины г
и v ” — v r как функции термического состояния, то можно определить
связь между давлением и температурой парообразования, вследствие
чего уравнение Клапейрона — Клаузиуса иногда называется законом
смещения равновесия.
Совершенно очевидно, что уравнение ( V . 12) применимо не только
к таким двухфазным системам, которые состо ят из жидкости и ее
насыщенного пара, но также и к системам, образованным твердым
телом и паром или твердым телом и жидкостью. При этом изменяется
только формальное содержание величин v f, v " и г. Величина г при
обретает смысл теплоты сублимации в первом случае и теплоты
плавления — во втором.
Приложим уравнение (V. 12) к процессу плавления. Величины Л ,
Т и теплота плавления являются по существу положительными.
Следовательно, знак dT/dp определяется вполне знаком разности
10 Зак. 3543. В. С . Жуковский.
242
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
[ОТД. V
у"—v '.
Как правило, твердая фаза тяжелее жидкой, вследствие чего
температура плавления возрастает вместе с увеличением давления.
Однако существуют некоторые тела, которые при плавления всплы
вают, как например, лед, висмут, чугун. Для них увеличение
давления вызывает понижение точки таяния.
Вычислим величину dT/dp для л ьда, находящегося при Т = 273° К*
Теплота плавления льда равна 79,4 кал\кГ\ v " =
1,0002* 1 0 мР/кГ;
v'=
1,0908 • Ю -з
_
0,0906 .10“3м*/кГ. Отсюда
dT_
dp
0,0906-10-3 .273
427 •79,4
0,000730- 10-8
=
9
кГ\М2
= — 0,00754
град
Ат
Таким образом, при увеличении давления на 1 Л т = 760 мм H g
температура плавления падает всего лишь на семь тысячных гра
дуса. Иными словами, для смещения точки плавления льда на 1 °С
необходимо изменить давление примерно на 130 a m . Э то т результат
вполне совпадает с непосредственными экспериментальными данными:
II=
—
0,00755 град:Ат.
Чрезвычайно большое постоянство точки плавления льда освобо
ждает нас от необходимости вводить поправку на давление при гра
дуировках термометров. Менее простой оказывается градуировка
в парах кипящей воды, так как влияние давления на температуру
кипения не является пренебрежимо малой величиной. Для давлений,
лежащих в пределах от р = 680 мм Hg до р = 780 MM\ig, соответ
ствующая температура кипения воды может быть подсчитана из
эмпирической формулы:
/= 100,000 + 0,367 (р — 760) — 0,000023 (р — 760)2.
Если, например, р = 740 мм Hg, то
t = 100,000 — 0,0367 - 20— 0 ,000023.400 = 99,257°С .
6.
Влажный насыщенный пар. Влажный насыщенный пар может,
в зависимости от относительного содержания в нем жидкой фазы,
занимать любой удельный объем в пределах от v r до v " . Концентра
ция пара задается обычно в виде отношения веса су хо го насыщен
ного пара, содержащегося в некотором пространстве, к весу всей
смеси сухого пара с жидкостью. Это отношение называется /шро-
содержанием, или сухостью пара, и обозначается буквою лг. Можно
определить пропорцию пара также и влажностью пара, т . е . относи
тельным весовым содержанием жидкости во влажном паре. Непосред
ственно ясно, что влажность определяется числом, дополняющим
сухость х до единицы.
Распространяя понятие сухости пара вплоть до пограничных
кривых, следует положить, что на нижней пограничной кривой х = О
ГЛ. II)
ИЗМЕНЕНИЯ АГРЕГАТНОГО СОСТОЯНИЯ
243
и на верхней х = 1. Имея в виду, что объем влажного пара равен
сумме объемов жидкости и сухого насыщенного пара, можно легко
определить удельный объем соответственно любому заданному значе
нию х из формулы:
v=(1—х)v'-J-xv”= v'
х(v"—v').
(V. 13)
Очевидно,чтопри*=0имеемv=v'иприх=1имеем
•о — г/'.
В области малых и средних давлений удельный объем v " во
много раз превосходит объем v ' .
Помимо этого, часто в практически
интересных случаях сухость х мало отличается от единицы. Поэтому
произведением (1 — x ) i/ ввиду его малости по сравнению с x v "
можно пренебречь. Т огд а получим:
v«xv".
(V. 14)
Так например, для водяного пара, приняв х = 0 ,8 , имеем:
р[am]=1,
v" [м3/кГ] = 1,725
xv"
»
= 1,382
(1—x)v'
»
=0,0002
^=^[°/о)=0,014
15
0,1342
0,1075
0,00024
0,22
30
0,06797
0,0544
0,00024
0,44
100
0,01846
0,01476
0,00029
2,0
Таким образом, даже при 30 am объем, занимаемый водой,
составляет всего 0 ,440/0 от объема сухого насыщенного пара в смеси,
достигая 2°/0 только при 100 am. Есл и при выполнении расчетов
число значащих цифр ограни
чено точностью логарифмиче
ской линейки, то до 15 am
объем воды никакого влияния
на результат иметь не может.
Разумеется, при весьма высо
ких
давлениях пользоваться
приближенной формулой (V. 14)
совершенно недопустимо.
В координатах p - v нанесе
ние точек, отвечающих влаж
ному пару заданной сухости,
может
быть
осуществлено
с большой легкостью. Действи
тельно, из уравнения (V . 13)
находим:
х=
V—V'
v" —v'
Числитель изображается на р ис . 71 отрезком горизонтали АС>
соответствующей рассматриваемому давлению (или температуре);
знаменатель v" — v ‘ равен отрезку АВ. Следовательно, для нахож-
16*
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
244
[ОТД. V
дения удельного объема влажного пара нужно только нанести точку С ,
делящую отрезок А В в заданном отношении х/1.
Если для ряда давлений мы отметим точки, в которых сухость
одинакова, и через эти точки проведем непрерывную кривую, то пол у
ченная таким образом линия будет являться изображением процесса
при постоянной сухости: х — const. При изменении состояния влаж
ного пара вдоль линии постоянной сухости вес жидкой фазы не
изменяется; при перемещении в область, лежащую над линией
х = const (например, по С М ), жидкость подвергается испарению, и,
наконец, при переходе в область, лежащую под линией х = const
(например, по C N ), влажность увеличивается. Э то последнее напра
вление процесса присуще, в частности, адиабатному расширению.
Все прочие функции, изменяющиеся вместе с массой вещества,
вычисляются для влажного пара подобно объему. Поэтому, например,
«= (1— лг)ir«-J-xir/=i ' -{ -лт,
и= (1—л;)и'4”хи" =
и'-\ -хр,
5= (1---Лг)Sf—J—XSrf = S' - { -JCy.
Отсюда имеем:
V—V' _
/—/'
_
5—5'
Хv"—V'
5^—5'*
7.
Элементы построения энтропийных диаграмм. Для изобра
жения процесса парообразования в координатах T -s следует прежде
всего выяснить очертание нижней пограничной кривой. Обобщим
понятие о теплоемкости в применении к процессу вдоль нижней
пограничной кривой и обозначим эту величину через с ' . Энтропию
жидкости на нижней погрпничной кривой обозначим через s \ В таком
случае мы имеем очевидную формулу:
(V. 15)
(V. 16)
s—s'
(V. 17)
В частном случае, если мы условимся считать при Г0= 273°К вели
чину 5' = 0, энтропия в любом месте пограничной кривой опреде
лится как
5/
Т
273
(П
Т
(V. 17а)
Вдалеке от критической точки с ' практически не отличается от
обычной теплоемкости жидкости, которая мало меняется в зависимости
от температуры. Поэтому в области температур, намного меньших
критической, нижняя пограничная кривая имеет вид, похожий на
изохору для идеальных газов. Однако при увеличении температуры
ГЛ. Il]
ИЗМЕНЕНИЯ АГРЕГАТНОГО СОСТОЯНИЯ
245
кривая испытывает перегиб, меняя вблизи критической точки свою
кривизну,
В самом деле, подставляя в формулу первого начала dq — da-\ -
- \ -Apdv взамен da выражение (IV.3), имеем:
dq=cvdT+AT^dv.
Относя это уравнение к элементу нижней пограничной кривой и деля
обе его части на dt, получаем:
—
^
—
с 4-АТ(^Л —
.
С~ dT~С«+АУ\dT)vdT9
Здесь с„ и
соответствуют изохоре, берущей начало на нижней
пограничной кривой. Э ти величины повсюду имеют конечные значе
ния. Однако производная ^
подобно ~ ( v ' есть функция только
от Т или от р) при подходе к кри
тической точке стремится к -t ~oo ,
что видно из рис. 51, 52, 56. Таким
образом, в критической точке тепло
емкость обращается в бесконечность,
а нижняя пограничная кривая в диа
грамме T -s получает горизонталь
ное направление (ср. с изотермой
идеального газа, для которой тепло
емкость также равна бесконечности).
Типичный вид нижней погранич
ной кривой показан на р ис. 72.
Начало отсчета энтропий s ' положе
но в точке таяния льда. Площадь под
пограничной кривой определяет q\
т . е . то количество теплоты, которое
необходимо подвести к 1 к Г жидко
сти , чтобы от 0 ° С привести ее к текущей температуре, поддерживая
равновесие с насыщенным паром.
Начертив нижнюю пограничную кривую, мы без труда можем
провести и верхнюю пограничную кривую. Действительно, изобаро
изотермическому превращению 1 к Г жидкости в сухой насыщенный
пар отвечает приращение энтропии s " — s , = r jT . Отложив от ниж
ней пограничной кривой на нескольких температурных уровнях гори
зонтальные отрезки длиной г/ Т и соединив концы этих отрезков
плавной линией, мы получим, очевидно, верхнюю пограничную кри
вую, абсциссы которой
Рис. 72.
s"= s'+~
.
(V.18)
246
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
[отд. V
Площади прямоугольников, ограниченных сверху изобаро-изотерми
ческим процессом парообразования, дают теплоту парообразования г.
Разделение г на р и ф может быть произведено с помощью диа
грамм p - v , где площади аналогичных прямоугольников (с основанием
ч Г — v ') определяют ф/А
Верхней пограничной кривой может быть приписана своя теплоем
кость с” .
Для того очертания верхней пограничной кривой, которое
показано на рис. 72, теплоемкость с " повсеместно отрицательна. Э то
значит, что при повышении температуры сухо го насыщенного пара
без нарушения равновесия с конденсатом затрачивается столь боль
шая работа на сжатие, что она с избытком покрывает приращение
внутренней энергии пара и потому должна быть частично возвращена
обратно в виде теплоты. Если бы
сжатие производилось по адиаба
те , то вначале сухой насыщенный
пар стал бы перегреваться. Ясно ,
что указанная особенность пара
отнюдь не является обязательной.
При заданном очертании нижней
пограничной
кривой
характер
верхней пограничной кривой все
цело определяется законом изме
нения г вместе с температурой Г .
Для многих веществ, в том числе
для воды, диаграмма T -s подобна
изображенной на рис. 72. Однако,
например, для бензола (С6Н 6), д и-
0 0J Ц2 0,3 QfikKMlKFwd фенилоксида ( С 12Н 80 ) , этилового
5
эфира [(С2Н б)20 ] , трихлорэтилена
Рис- 73.
(С2НС1)3 и некоторых других орга
нических соединений, верхняя по
граничная кривая падает частично или целиком влево (рис. 73).
Если сухо й насыщенный пар подобных веществ расширяется адиа-
батно, то , в отличие от водяного пара, он может оставаться сухим
или даже перегреваться. Э то свойство чрезвычайно выгодно для прак
тической работы тепловых машин и потому привлекает внимание со
временных теплотехников к использованию таких веществ в паровых
двигателях и холодильных установках.
Как следует из (V.16), линии постоянной сухости х = const раз
деляют, как в координатах p - v , прямые отрезки изобаро-изотерми
ческого парообразования на части, пропорциональные x j 1 (рис. 72).
Нам остается выяснить, как сопрягаются тепловые диаграммы
систем: жидкость — пар и твердая фаза — пар. Области твердая
фаза — жидкость мы касаться не будем, так как для рабочих тел,
применяемых в теплотехнике, она приобретает интерес обычно лишь
при сверхвысоких давлениях! Н а рис. 74 приведена диаграмма T -s
ГЛ. II)
изменения агрегатного состояния
247
для воды, продолженная вниз от тройной то чки. Как было сказано,
температура в тройной точке (фундаментальная температура) практи
чески не отличается от 0 ° С . При 0 ° С , чему соответствует давление
насыщенного пара 4 ,58 мм H g , вода замерзает. Верхняя пограничная
кривая этой новой области является продолжением верхней пограничной
кривой насыщенного пара. Нижняя же пограничная кривая смещена на
248
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
[ОТД. ¥
уровне 0°С влево на отрезок, равный 79,4/273 ккал\кГ •град, ибо
теплота плавления льда г = 79,4 ккал!кГ. В точке Я могут сосуще
ствовать в любых относительных количествах, все три фазы (лед,
вода, пар) одновременно. Для нахождения относительного количе
ства сухого насыщенного пара в смеси с жидкостью или со льдом
во всем остальном поле на диаграмме показаны линии постоянного
паросодержания: х — const.
Рис. 75.
Обратимся теперь к диаграмме /-$, которая иногда называется
именем Молье, предложившего ее в 1904 г.
Нижняя пограничная кривая в этой диаграмме мало отличается от
аналогичной кривой в координатах T - s . Там наклон касательных
dTТ
к пограничной кривой определяется формулой — =
—
,
тогда как
di
i*T
dT di
_
здесь^«7,ибоas=c
=-у
.
Расхождение между
обоими изображениями пограничной кривой наблюдается лишь вблизи
критической точки в связи с резким изменением там теплоемкости с \
При изобарном процессе d s = ^
= ^r > откуда
(й),=
г-
Поскол ьку изобарное парообразование является вместе с тем изотер
мическим, заключаем, что в диаграмме /-$ соответствующие линий
являются прямыми с угловым коэффициентом, равным Г . Э т и прямые,
изображающие изобары насыщенного пара, веером расходятся от
нижней пограничной кривой, образуя практически семейство ка са
тельных к ней (рис. 75). Длина изобар между пограничными кри
гл. Ill]
ВОДА И ВОДЯНОЙ ПАР
249
выми определяется тем, что их проекция на вертикаль i" — V = г
или проекция на горизонталь s " — s ' = r/T. Предельная изобара,
которая должна проходить через критическую то чку, имеет наклон
rJ K= Тя и длину, стремящуюся к нулю. Таким образом, точка К
должна лежать на левом склоне диаграммы, а не в ее вершине.
Энтальпия су хо го насыщенного пара не может возрастать неуклонно
вплоть до критического состояния, но при каком-то среднем давле
нии имеет максимум.
На основании (V. 16) линии постоянной сухости х = const строятся
таким же образом, как и в координатах p -v и T -s . Однако,
по скольку изобары в диаграмме i~s являются наклонными прямыми,
здесь было бы неверно делить на пропорциональные части отрезки
горизонталей, кончающиеся на пограничных кривых, а делить нужно
именно наклонные линии изобар. Теплота парообразования г изобра
жается на диаграмме /-$, как было сказано, в виде отрезка, что
выгодно отличает эту диаграмму от диаграммы T s . Начало отсчета
для i' является, разумеется, произвольным.
В области перегретого пара, начиная от верхней пограничной
кривой, изобары постепенно отклоняются кверху от прямолинейного
направления, так как по окончании парообразования температура
растет. Что касается линий изотерм, то они при переходе через верх
нюю пограничную кривую изламываются и по мере удаления от
пограничной кривой стремятся выйти на горизонтали. Э то объясняется
тем , что в идеально-газовом состоянии d i = cp dt и, следовательно,
условие t = const равнозначно условию i = const.
§ 8. Состояние вопроса. Изучением свойств воды и ее пара зани
малось множество исследователей. Большой интерес, проявленный
к воде, легко объясняется той практической ролью, которую она
играет в быту и в технике. Особенно велика потребность во все
стороннем знании свойств воды и водяного пара для теплоэнергетики,
где вода широчайшим образом применяется в качестве рабочего тела
или охлаждающей среды. Поэтому, например, уже И . И . Ползунов,
создавая свой первый в истории промышленный двигатель — универ
сальную паровую машину, счел нужным лично поставить экспери
менты, касающиеся определения плотности воды и механизма паро
образования.
Начало комплексного физико-химического изучения веществ было
положено Д . И . Менделеевым, который посвятил жидкостям и газам
два тома своих классических сочинений. В последней четверти минув
шего столетия исходные экспериментальные данные по поводу термо-
ГЛАВА III
ВОДА И ВОДЯНОЙ ПАР
250
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
[ОТД. V
динамических свойств воды и водяного пара получили, наконец, такую
определенность, что стало возможным систематизировать их и пред
ставить в виде таблиц, удобных для инженерных расчетов. При этом
выяснилось, что как раз вода, будь то в виде жидкости или в виде
пара, является не совсем типичным веществом, и ее свойства плохо
укладываются в теоретические представления. Применительно к жидкой
воде в к урсах физики приводится ряд особенностей, которые назы
ваются аномалиями воды. И х причиной является сильная ассоциируе-
мость молекул воды. В жидкой воде молекулы группируются в ком
плексы (вероятно до девяти молекул), которые при увеличении
температуры постепенно распадаются.
Аналогичное явление имеет место и в перегретом водяном паре.
В связи с этим установилось обычное правило основывать количе
ственные сведения об уравнениях состояния воды и ее пара только
на экспериментальных данных и более или менее удачно подбираемых
интерполяционных формулах. Конечно, всякая экстраполяция бывала
при этом мало достоверной, поскольку попытки привлечения теоре
тически обоснованных формул оставались неудачными. М е ж д у тем
практика все настойчивее требовала унификации взаимно несогласо
ванных материалов и расширения диапазона параметров, охватывае
мого таблицами. Поэтому в период между 1929 и 1934 гг. состоялись
три международные конференции, в итоге которых были составлены
так называемые «скелетные таблицы» воды и перегретого водяного
пара, содержавшие для нескольких температур с 50-градусным интер
валом и для ряда ступеней давления наиболее вероятные средние
значения величин удельного объема и энтальпии. При каждом среднем
значении были указаны соответствующие до пуски , за которые в даль
нейшем не должны были выходить составители таблиц. П о такому же
принципу были построены скелетные таблицы для кипящей воды и
насыщенного пара.
Скелетные таблицы имели и продолжают иметь большое значение
как нормативный материал в исследованиях воды и ее пара. Однако
они ограничены температурой 500— 550° С , а положенные в их основу
экспериментальные данные не выходят за пределы 450° С . Современную
теплоэнергетику это уже не удовлетворяет. В особенности серьезно
ограниченность достоверных сведений о водяном паре сверхвысоких
параметров была оценена в Советском Сою зе. Только в нашей стране
существую т условия для наиболее интенсивного и широкого внедрения
новой техники. Для примера можно указать, что по данным IV Миро
вой энергетической конференции (Лондон, 1950 г.) почти половина
новых электростанций в Англии запроектирована для работы на низ
ких параметрах пара (42 am, 370— 430° С). Между тем в 1950 г.
выпущенные нашими заводами котлы высокого давления по паро-
производительности имели 72°/0 от общей паропроизводительности
изготовленных ими в том же году крупных котлов, а выпуск мощных
турбин высокого давления доведен до 60°/0 от всей мощности выпу-
ГЛ. Ill]
ВОДА И ВОДЯНОЙ ПАР
251
щенных турбин. П о плану 1951 г. со ответствующие показатели были
е щ е более высокими. Принятая установка на повышение параметров
пара в отечественной энергетике обусловила развертывание научно-
исследовательских работ, которые призваны образовать базу для нахо
ждения нужных технических решений.
Уж е до Отечественной войны во В Т И им. Дзержинского в резуль
тате экспериментальных работ Д . Л . Тимрота и В . Шугаева была
определена вязкость воды и водяного пара в области 150— 600 ° С
вплоть до 300 a m . Эти работы переросли впоследствии в комплекс
исследований, выполненных под руководством Д . Л . Тимрота и
Н . Б . Варгафтика и касающихся также теплопроводности, тепло
емкости ср и удельного объема водяного пара. Указанный комплекс
исследований, удостоенный в 1950 г. Сталинской премии, в части
теплоемкостей пара охватывал область до 300 am и 600° С и в части
удельных объемов — область до 300 am и 550° С . Такие высокие
параметры пара были подвергнуты исследованию впервые.
В последние годы большая экспериментальная работа была пред
принята лауреатами Сталинской премии В . А . Кириллиным и Л . И . Румян
цевым в М Э И им. Молотова. Здесь была разработана оригинальная
методика измерения удельных объемов воды и водяного пара, причем
опыты были доведены до рекордных параметров — 525 am и 650° С .
Данные В Т И и М Э И , которые только могут быть сопоставлены,
совпадают в пределах точности эксперимента, т . е . до 0 ,2 % .
Начиная с 1935 г. М . П . Вукалович, к которому несколько позже
присоединился И . И . Новиков, предпринял работу по изысканию тео
ретически обоснованного уравнения состояния водяного пара. Э та
работа оказалась очень плодотворной и также была удостоена С т а
линской премии (в 1951 г.) . Теперь уже нет необходимости при
составлении таблиц перегретого пара оставаться на почве одних только
опытных данных, как это приходилось делать в течение столетнего
периода, а имеется полная и проверенная возможность сцементировать
опытные данные соответствующей теорией и получить, таким образом,
уверенность в предпринимаемых экстраполяциях. Термическое уравне
ние состояния реального газа, предложенное Вукаловичем, представляет
собой теоретическое развитие уравнения Ван-дер-Ваальса, учитывающее
ассоциацию молекул газа в двойные и тройные комплексы под дей
ствием сил взаимодействия между молекулами. г) Для краткого разъ
яснения идеи вывода уравнения приведем выдержку из последнего,
четвертого, издания таблиц и диаграмм Вукаловича: 2)
« В основу вывода уравнения было положено соображение о наличии
в реальных газах ассоциации молекул в двойные, тройные и более
сложные комплексы.
^М. П. Вукалович и И. И. Новиков, Уравнение состояния реаль
ных газов, Энергоиздат, 1948.
2)М. П . В у к а л о в и ч, Термодинамические свойства воды и водяного пара
Машгиз, 1951.
252
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
[ОТД. Г
При этом в данном случае ассоциация предполагается лишь в том
смысле, что отдельные одиночные молекулы чисто механическим путем
соединяются в более сложные комплексы, приобретающие роль и зна
чение самостоятельной газовой частицы, но имеющие при этом только
некоторые свойства одной большой молекулы.
Считается , что основной причиной образования комплексов являются
силы взаимодействия между молекулами реального газа и что именно
энергия этого взаимодействия является той энергией, которая связы
вает простые молекулы в комплексы.
Предполагается также, что простые одиночные молекулы, входящие
в состав комплекса, сохраняют все виды своих движений, хотя пол.-
ностью их не реализуют. При этом колебательные движения реали
зуются полностью, поэтому потеря части движений может быть
отнесена лишь к потере некоторых вращений.
Рассматривая реальный газ как смесь нескольких газов, со стоящ их
из одиночных, двойных и т. д . комплексов, и предполагая, что между
этими газами идет своеобразное взаимодействие, заключающееся в р а с
паде более сложных комплексов в менее сложные и обратном объеди
нении, подобный процесс можно рассматривать аналогично химической
реакции. При этом, если система находится в равновесии, то процессы
распада и восстановления комплексов будут взаимно компенсировать
один другой, т . е . система будет находиться в динамическом равно
весии.
Считая отдельные газы подчиняющимися уравнению состояния
реальных газов и применяя к ним закон действующих м а с с. . . ,
огра
ничиваясь при этом рассмотрением комплексов, состоящ их из двойных
и тройных молекул, можно получить в следующей окончательной
форме уравнение состояния реальных газов:
pv=RT(l-A±-B±y.
Здесь А и В — известные функции от температуры и постоянных а и Ьу
входящих в уравнение Ван-дер-Ваальса и определяемых обычным об
разом по критическим параметрам. В состав этих функций входят
такие коэффициенты, которые «могут быть в известной степени при
ближения оценены на основании чисто теоретических соображений,
однако точное значение их в настоящее время может быть получена
лишь из экспериментальных данных. При этом не требуется наличия
большого числа опытных точек; важно, чтобы они были достаточно
достоверны».
Опуская дальнейшие подробности, которые содержатся в ориги
нальных работах, отметим, что, по указанию Вукаловича, в четвертом
издании таблиц полностью учтены большие экспериментальные ра
боты М Э И , данные распространены до 700° С , а весь цифровой мате
риал заново пересмотрен и выверен. В конце этой книги приводятся
выборочные данные из указанного последнего труда Вукаловича.
гл. m)
БОДА И ВОДЯНОЙ ПАР
253
9* Свойства жидкости. При грубых расчетах считают удельный
вес воды постоянным и равным 1 Г/см* = 1 0 0 0 кГ/м*. В действи
тельности вода является сжимаемой жидкостью и обладает заметным
термическим расширением. Э т о значит, что при / = const с увеличе
нием давления удельный объем воды падает, а при р = const удель
ный объем воды растет вместе с температурой. При следовании вдоль
нижней пограничной кривой кверху вторая тенденция проявляется
резче первой, и мы получаем все большие удельные объемы, т . е .
меньшие удельные веса. Соответствующие значения v ' для воды
в функции от давления или от температуры помещены в табл. 5 и 6 .
Если речь идет о воде в состояниях левее нижней пограничной кри
вой, то точные значения удельного объема v надлежит брать из табл. 7 ,
где цифры влево от жирной ступенчатой линии относятся к ж идкости.
И з последней таблицы видно, что влияние давления на величину v
совершенно незначительно, так что им по праву часто можно прене
бречь. Так, при 80° С изменению давления от 1 до 10 am отвечает
уменьшение удельного объема от 1,0289 до 1,0285 дм*/кГ, неуло
вимое счетной линейкой. М ежду тем, переходу при 1 am от темпе
ратуры 80° С до нижней пограничной кривой (99 1° С ) соответствует
увеличение удельного объема от 1,0289 до 1,0428 дм*/кГ, уже
довольно чувствительное при производстве расчетов.
Иногда принимают, что теплоемкость воды является функцией
только от температуры. М ежду тем, строго говоря, теплоемкость
зависит от характера процесса нагревания жидкости. Э т о , в частности,
проявляется в том, что линии изобар имеют тенденцию проходить
в координатах T -s более полого, чем нижняя пограничная кривая
(рис. 72).
Удельной теплотой жидкости q называется количество теплоты,
необходимое для нагревания 1 к Г жидкости от 0 ° С до температуры
насыщения при постоянном давлении.
Удельной теплотой жидкости вдоль нижней пограничной кр и
вой q' называется количество теплоты, необходимое для нагревания 1 к Г
воды от 0 ° С до некоторой заданной температуры при том условии,
что по мере роста температуры производится повышение давления,
определяемое ходом нижней пограничной кривой.
Вплоть до температур 120— 150° С (до 2— 5 am) обе теплоты q
и q' не отличаются заметным образом друг от друга и численно могут
быть приняты равными самой температуре, так как в этих пределах
теплоемкости воды ср и с ' (последняя относится к нагреванию вдоль
нижней пограничной кривой) практически равны единице:
П о мере приближения к практической точке обе теплоты жидкости
начинают заметно расходиться. Соотношение между ними видно из
диаграммы T - s .
И
(V. 19)
254
РЕАЛЬНЫЕ ГАЗЫ . ВОДЯНОЙ ПАР
[ОТД. V
При построении диаграммы 7-5 для воды уславливаются считать
энтропию равной нулю на нижней пограничной кривой при темпера
туре 7 = 70 = 273° К . Энтропию в любой другой точке нижней погра
ничной кривой мы получим тогда из формулы (V . 17а):
т
278
Пока теплоемкость с ' может быть принята за единицу, последняя
формула дает
$л*1пТГз'
т . е . нижнюю пограничную кривую в виде показательной лини»
(рис. 76).
Теплота жидкости вдоль нижней пограничной кривой изображается
в диаграмме 7-5 заштрихованной наклонно площадью. Теплота жидко
сти q превышает величину q' на пло
щадь, отмеченную горизонтальной
штриховкой. Для наглядности эта
добавочная площадь на ри с. 76
сильно преувеличена. Мож но , напри
мер, видеть, что адиабатное сжатие
воды от 50° С на нижней погранич
ной кривой до 25, 100 и 200 ат
мосфер вызывает нагревание, соо т
ветственно, всего только на 0,1;
0,35 и 0,71°С.
Определение количества теплоты
в области жидкости производится
на основании табличных значений
энтальпии 7 , на которых мы кратко
остановимся. Начало отсчета энтальпии воды положено в той же
то чке, в которой принята равной нулю энтропия, а именно — на ниж
ней пограничной кривой при 0 °С . Соответствующее давление насы-
щейия равно 0,00623 am. Итак, при / = 0 °С
5=5'=
°;
/=/;=
о.
Заметим, что для внутренней энергии никакого дополнительного
соглашения о началу отсчета не следует вводить, так как при 0 ° С
“о= г'о—
—
0,00623 • 104 • 1,0002 • 10~3
427
= — 0,000146 ккал\кГL
Это число лежит в пределах точности, вообще достижимой для
калорических функций, вследствие чего принимается для 0 ° С и ^ = 0
ГЛ. Ill]
ВОДА И ВОДЯНОЙ ПАР
255
в практическом соответствии со шкалой теплосодержания при постоян
ном давлении.
Вычисление величины i 9 для любой другой точки на нижней погра
ничной кривой может производиться *) на основе измеряемых в опыте
теплот жидкости q. Имеем:
?=Ь+Я-
(V.20)
Здесь, помимо q , следует знать также величину /0, т . е . энтальпию
воды при 0 ° С , но при том давлении, для которого берется
Со
гласно определению энтальпии, /0 = и0 -} - A p v 0. Внутренняя энергия
воды, как и газов, в ничтожной степени зависит от давления, хотя
объясняется это совершенно различными причинами. Так или иначе
можно считать, что
м0~ 0 , /0« Apv0,
т . е . что при 0 ° С энтальпия воды является практически линейной
функцией от давления. Для 100 am отсю да, например, получаем:
/0« 100 •104•0,995 •10_3 •
2,33 ккал.кГ.
Соответствующее точное значение энтальпии по таблице: /0 = 2 ,4 .
Сколь невелика поправка на и0 даже выше 100 am, можно судить
по тому, что при 200 am, как это можно вычислить с помощью
таблицы, и0 равно приблизительно 0,1 кк ал к Г .
Для температур до 150— 200° С величины
и' и q можно счи
тать равными, однако далее они заметно расходятся. Соотношение
между ними вытекает из следующих формул, отнесенных к изобар
ному нагреванию воды:
<■’ =
“о+ APvo+ Я\ u'= u0-^q~Ap(v' — v0),
откуда
*'— и'= Apv'>0; i—q=u0+Apv0=i0>0;
u>— q
—
u0—Ap(v'— 1>0)<0.
Так например:
при 200° С и 15,86am
i* = 203 ,6и1= 203,1
q'=
203,1
»
300° С и 87,61
»
321,2
318,1
318,9
350° С и 168,63
399,2
392,0
395,0
Уместно обратить внимание на технический смысл разницы между
величинами /' и q, которая равна /0. Э г а разница определяет затрату
работы для непрерывного
приведения воды к тому повышенному
давлению, при котором затем производится изобарное нагревание и
4)
М. П . Вукалович вычисляет V иным методом, более удобным при соста
влении таблиц.
256
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
[ОТД. V
испарение. Очевидно, это приведение возможно с помощью насоса,
рабочая диаграмма которого схематически показана на рис. 7 7 .* ) При
лагая первое начало в форме dq = di — A vdp к процессу сжатия
в насосе, имеем:
р
Iq= 9наооо*4“ J*
&Рш
Ро
Интеграл в этом выражении определяет работу идеального насоса ,
а *7наооо — т0 количество теплоты, которое необходимо подвести (от
вести), чтобы удержать температуру воды на
постоянном уровне (0°С ). Соотношение между
работой и этим теплом может быть самым р аз
личным, если представить себе собственно сж а
тие неизотермическим (однако работа насоса
не может быть равна нулю), но их сумма,
определяющая /0, должна иметь только одно
численное значение. Э г о последнее и дает за
трату энергии на подготовку холодной воды
к изобарному превращению ее в пар при давле
нии, превышающем 0,00623 am. Разумеется,
в реальной обстановке работа нагнетания дол
жна вследствие наличия разных потерь превос
ходить указанную величину /0. Однако с термо
динамической точки зрения она имеет весьма
важный смысл, ибо отражает принципиальную
необходимость расходования механической работы для создания на
правленного движения вещества по системе парового котла.
И з всего сказанного вытекает, что для вычисления количеств теп
лоты, необходимых для нагревания или охлаждения воды, можно не
прибегать к каким-либо расчетным тонкостям, если только темпера
тура не превышает 100— 150° С . В этих случаях величина q x ^ мало
зависит от характера процесса и определяется с достаточной точ
ностью лишь начальным и конечным значениями температуры. При
том вполне возможно пользоваться следующей формулой:
(V. 21)
или, несколько более грубо,
<7i,2~ ^2
^1*
(V. 21а)
*) Изотерма идет, при соблюдении масштаба, практически вертикально,
так как, например* при 100 am и 0°С объем воды на 0,£% меньше, чем
в нулевой точке при той же температуре, тогда как на нижней пограничной
кривой при 100 am объем больше, чем в нулевой точке (сравниваются таб-
/ч
1445— 1000 1ЛЛ
..-А/
личные значения v') н а
г^п—
• 100 = 44,5%.
гл. Ill]
ВОДА И ВОДЯНОЙ ПАР
257
Значения /' и /' берутся из табл. 5 или б (в конце книги).
В более высоком интервале температур формула (V. 21) становится
не очень точной. Так например, нагреванию воды от 140 до 240° С
отвечает по формуле (V. 21) <7Ь 2 « 2 4 7 ,8 — 140,7 = 107,1 гсгсал/гсГ
Меж ду тем, если это нагревание производится при 40 а т , то из
табл. 7 следует, что ? 1>2 = 247,8 — 141,2 = 106,6; при 100 am
мы получаем уже <71>2 = 247,9 — 142,1 = 105,8, а при 200 am
qu 2 = 248,2 — 143,7 = 104,5 . Таким образом, всякие расчеты по мере
приближения к критической точке требуют внесения соответствующих
уточнений.
10.
Насыщенный и перегретый пар. Помимо данных для кипя
щей воды, табл. 5 и 6 (в конце книги) содержат также данные,
относящиеся к насыщенному пару.
Первая из таблиц построена по ступеням давления, вторая — по
ступеням температуры.
Критические параметры водяного пара таковы:
= 374,15° С; рл = 225,65 кГ)см2; vK= 0,0031 лА/кГ.
Начало отсчета энтальпии и энтропии принято, как у ж е говори
лось, в состоянии, где вода при 0° С находится под давлением насы
щения, которое равно 0,00623 am. Величины V , /" и г связаны фор
мулой (V. 11):
—
/'= г,
а величины s' и s" — формулой (V. 18):
Для грубых подсчетов могут быть полезны две легко запоминаю
щиеся эмпирические формулы. Первая из них дает давление насы
щения как функцию температуры:
При этом давление получается с преувеличением, если * < 2 1 0 ° С ,
при более высокой температуре оно преуменьшено; точность — при
мерно 2— 3°/0. Вторая формула представляет собой уравнение верхней
пограничной кривой в координатах p - v :
Ре[ат]
=
2.
Эта формула имеет точность около 2% между 8 и 60 ат.
Чтобы сделать более наглядными табличные данные об объеме
перегретого пара, обратимся к диаграммам у - p на рис. 78 и 79.
Для точных количественных определений эти диаграммы непригодны.
Поско л ьку температура пара недалека от критической, поправка
к идеальному объему Дг> по всюду отрицательна. Ее относительная
17 За*. 3543. В . С . Жуковский.
258
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
|ОГД. V
величина может быть в практических случаях весьма большой. Так,
если р= 15amи/=350°С, тоR'— /?= — 1.Для водяногопара
в идеально-газовом состоянии имеем /?== 848/18 = 47 ,1 , так что
/?' =
46,1 и, согласно (V.2),
Av
v
1
46,1
= -2,2%.
Уменьшение перегрева, т . е . перемещение по вертикали вниз, о б у с
ловливает быстрое возрастание отношения k v / v . Приняв при том же
Р—
-
давлении /= 200°С, имеем /?' — /?=
—
4;/?'= 43,1и
А®__ ____ 4
_
_ ____о оо/
®“
43,1
~
/о*
При увеличении давления отклонения от идеального состояния
должны сказываться в еще более резкой форме. Например, при
R'=
34,9 , что соответствует, положим, 100 am и 330°С:
Ау
V
122
-
Щ=
-
35%>
259
ГЛ* III]
ВОДА И ВОДЯНОЙ ПАР
а при Т?7«■ 25, что может быть при 200 am и 375°С,
Av
22»!_______ по ло/
Ч Г ------- "25"
00,4:/0.
Н а р ис. 78 пунктиром очерчена область, где изотермы почти
прямолинейны. Здесь A v является функцией от одной только темпе
ратуры, так как угловой коэффициент всякого изотермического луча
17*
260
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
[ОТД. V
есть величина постоянная, а —^ = ( / ? /— R)p> Вне этой небольшой
области A v оказывается функцией не только от температуры, но и
от давления пара.
В связи со сказанным отметим, что некоторой известностью до
сих пор пользуется эмпирическое уравнение Тумлирца (1899) — Линде
(1905):
v=—
—
0,016.
Р
И з изложенного ясно, что это уравнение построено совершенно
неверно, ибо поправка к объему оказывается постоянной величиной,
Рис. 80.
не зависящей ни от давления, ни от температуры. Поэтому для с о
временных параметров пара уравнение Тумлирца — Линде должно
быть совершенно отброшено.
Таблица 7 (в конце книги) содержит выборочные данные по Вукало-
вичу и является продолжением таблиц 5 и 6 в область перегретого
пара.
Помимо взаимно соответствующих термических параметров с о
стояния, в табл. 7 помещены также значений энтальпии i и энтро
пии s . Э ти величины могут быть вычислены по отношению к значе*
ГЛ. Ill]
ВОДА И ВОДЯНОЙ ПАР
261
ниям f и s" , взятым при одинаковых давлениях, согласно форму
лам:
2
s
—
(
V
,
22)
т*
т
/_{"«=
(V. 23)
т.
Значения теплоемкости ср, полученные опытным путем, построены
на рис. 80 и 81. И з обоих графиков видно, что вблизи пограничной
кривой ср изменяется не только с температурой, но в еще большей
степени — с давлением. Действительно, если при температуре насы
щения и р=1 ant теплоемкость Ср~0,5, то прир=40amте
плоемкость Ср~ 1, а при /7=120 am она становится равной <у^2,3 ,
т. е . в четыре с лишком раза больше, чем при 1 am. Линии теплоем
кости обладают общим свойством: при заданном давлении и увели
чении степени перегрева теплоемкость сначала падает, достигает
наименьшего значения и затем начинает возрастать, При весьма вы
соких перегревах семейство линий ср постепенно стягивается в узкую
262
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
[ОТД. V
полоску, утоняющуюся по мере увеличения температуры. В этой
области перегретый пар по своим свойствам все более приближается
к идеальным газам, для которых теплоемкость может быть функцией
только от температуры.
В связи с этим при низких давлениях, так же как при высоких
перегревах, если только давления не очень высоки, для перегретого
пара становится все более точной формула:
di= срdt,
которая была получена для идеальных газов. Отсюда же сле
дует, что одновременно с / = const при этих условиях должно быть
t = const. По этой причине в правой части диаграммы T-s
рис. 60 линии i = const для перегретого пара выходят на горизон
тали так ж е, как в диаграмме i - s на горизонтали выходят справа
линии t = const.
11.
Изобара. На рис. 82 процесс изображен в трех координат
ных системах. Диаграмма i- s дана в урезанном виде, без области,
прилегающей к нижней пограничной кривой, так, как и принято на
практике.
В координатах T -s изобара жидкости сливается с нижней погра
ничной кривой. На верхней пограничной кривой изобары изла
мываются, так как в области перегретого пара они идут подобно
газовым изобарам, т . е . имеют характер показательных линий. Н а
против, в координатах i - s изобары, которые для насыщенного пара
изображаются прямыми линиями, переходят через верхнюю погранич
ную кривую плавно, так как тангенс угла их наклона равен абсо
лютной температуре в каждой данной то чке: температура при
р = const постоянна, пока пар остается насыщенным, и растет не
прерывным образом, когда пар становится перегретым.
Теплота, необходимая для изобарного превращения сухого насы
щенного пара в перегретый, называется теплотой перегрева q0op*
_
_
;:П
f/nei>— 1 1 •
Изображение этой величины в энтропийных диаграммах не требует
пояснений.
гл. ш]
ВОДА И ВОДЯНОЙ ПАР
263
В области влажного насыщенного пара расчетные формулы изо
бары таковы:
Щ— vl + (v"—'v')(xa—.* ,); qUi = r(x2—x1); и2— и, = р(*а— *,);
h.а= Р(*>" — V')(х2—Xj)= (лга—JCj)А-.
Эти формулы могут быть представлены в более общем виде, который
удобен и для области перегретого пара:
?1.2 = /2— hi
«2 — «1 = 4 —h —AP(V4—VlY> A.2 = />(®2—vl)-
Вычисления можно производить как с помощью таблиц, так и
посредством диаграммы i- s .
Пример. 1 кГ пара, давление которого р = 14 am и сухость лг= 0,9
подвергается изобарному перегреву до 300°С . Определить увеличение объема
пара, необходимую затрату теплоты и произведенную внешнюю работу.
Согласно (V. 14),
VlЯ5xxv" = 0,9•0,1434=0,1291м^кГ.
Здесь, как и впредь, все табличные данные насыщенного пара обозначаются
внизу индексом той точки, для которой производится вычисление, чтобы
подчеркнуть их соответствие по давлению или температуре. По табл. 7 на
ходим объем пара v2 но заданным р и t2:
Отсюда
v2= 0,1859 м*/кГ.
v2— vx = 0,1859— 0,1291 = 0,0568 жЦкГ.
что по отношению к начальному объему v x составляет около 44%. Далее.
q u2=
—
(l[ + x trt) = 725,9 — (197,3 + 0,9• 468,9) = 106,7 ккал’,кГ,
l12 = р (v2— vx) = 14 •104•0,0568= 7920 кГн\кГ.
12.
Изохора. Из диаграммы p-v (рис. 83) видно, что при изо-
хорном нагревании влажного пара могут быть получены качественно
различные результаты в зависимости от того, больше или меньше
объем пара критической величины v K. Если v > v K, то при нагре
вании пар подсушивается и затем становится перегретым. Если v < t f K>
то рано или поздно влажный пар нацело превращается в жидкость
264
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
[ОГД. V
(см. на рис. 83 линии 1т2 и ab). Э т о последнее обстоятельство
связано с тем, что объем воды в смеси с сухим паром при нагре
вании стремится изменяться в д ву х противоположных направлениях.
С одной стороны, вода увеличивается в объеме, следуя нижней по
граничной кривой; с другой стороны, происходит убыль ее объема
благодаря превращению в пар, насыщающий свободное от воды про
странство. При весьма малых сухостях, т . е. при преобладании по
весу воды, первая тенденция проявляется сильнее второй. Э т о можно
показать на примере, имея в виду, что в области влажного пара
Vi+ X,(v"— v[)= t>2+ +>(vl—v[),
lit
/"I //
//V. —
V,
A'o =
В случаях, ког/fci сухость близка к единице и давления не очень
велики, формула упрощается:
//
Хп~ Х<—ff .
V*
Решим теперь такую задачу. Калориметрическая бомба на две трети
заполнена водой. Остальное пространство содержит сухой насыщенный пар.
Определить объемное и весовое содержания воды при поднятии давления
в бомбе до 100 am, если начальное давление было 1 am.
Находим Хх как отношение веса сухого пара к весу смеси:
*!=•
1*
Л1
0.5797
2/
3*1
= 3 ,015.10 "4.
0,5797 +
0,001043
Легко видеть, что v<^vs, так как
v = v[+ xl(v" — v[) = 0,001043+ 3,015•10~<•1,724= 0,001562.
Таким образом, наш процесс принадлежит к типу, показанному на
рис. 83 линией ab.
Вычисляем х 2:
ОЛ1, 1Л . 1,724
0,000402
*г
3.15-10
-
001701 0.01701
= 0,03057— 0,00237= 0,02820 = 282,0 •10-* > х {.
Таким образом, сухость при нагревании до 309,5° С (100 am) возросла,
т. е . весовое содержание воды снизилось.
Вычислим теперь объемное содержание воды. Конечная влажность
(1— лг2) = 0,9718. Следовательно, вода, приходящаяся на 1 кГ смеси, зани
мает объем
(1—хг)t,' =
0.9718 •0,001445.= 0.001405,
тогда как удельный объем смеси v = 0,001562. Отсюда объемное содержа
ние воды равно
0.001405
0,001562
:0,90> -7J-,
171. Ill]
ВОДА И ВОДЯНОЙ ПАР
265
т. е. теперь вода занимает уже 9/10 бомбы. При дальнейшем изохорном на
гревании объемное содержание воды продолжало бы неуклонно возрастать,
а сухость (весовое содержание пара), пройдя через максимум, стала бы
быстро падать к нулю. В итоге весь пар должен был бы сконденсироваться,
когда давление в бомбе поднялось бы примерно до 130 am, ибо при этом
табличное значение v r совпадает с заданным удельным объемом v .
По поводу изохорных линий в координатах T -s нужно заметить,
что те из них, которые приходят к верхней пограничной кривой, не
могут пересекать нижней пограничной кривой, как бы тесным ни
казалось их сближение. Изохоры влажного пара в диаграмме i s
изображаются в виде почти прямых линий, наклоненных несколько
круче изобар. Такое же относительное расположение имеет место и
для перегретого пара.
Для изохоры в общем виде имеем:
Яи2= Я2— «!—AvОа—Pi).
13.
Адиаб ата. Адиабатные изменения состояния легче всего обо-
зримы в энтропийных диаграммах, где они представляют собой вер
тикальные линии (рис. 84). Вначале перегретый водяной пар (точки /)
при адиабатном расширении становится насыщенным (точки т ) ,
затем увлажняется и в случае глубокого охлаждения (до 0° С и ниже)
начинает превращаться в лед или снег. Адиабатное расширение воды
или очень влажного пара приводит к парообразованию по мере па
дения давления (линия ab). В энтропийных диаграммах линия
х = 0 ,5 = const идет из критической точки почти вертикально и,
следовательно, практически разделяет области подсушивания и у влаж
нения пара при адиабатном увеличении объема.
Точный расчет адиабатных процессов производится с помощью
таблиц. П о начальному состоянию находится энтропия s t. В конеч
ном состоянии, для которого задается давление (температура), энтро
пия
должна быть равной s t. Отсюда легко находится х 2, если
пар влажен, или температура (давление), если пар еще перегрет.
Пусть, например, рх— 10 am, ^ = 260°С, р%= 1 am, Опреде
лить конечное состояние.
266
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
[ОТД. V
Из таблиц перегретого пара находим: s x = s = 1 ,6650. Это зна
чение ниже s *2 = 1 ,7593, отвечающего давлению 1 am . Следовательно,
в конце расширения пар влажен. Для него s 2 = s'2-f - х 2(s'z— s%) и
должно равняться $x = s . Отсюда
s—s«
1,6650 — 0,3097
а
4 —s2 1,7593 —0,3097
П осл е того как крайние термические состояния известны, вы
числяем:
А1\,2= #1 #2=
—
^2--- ^ (pl^l
Вместо расчета по таблицам определять конечное состояние и
изменение функции i чрезвычайно удобно графически по диаграмме
i s . Так как адиабатный процесс расширения пара является основ
ным элементом теоретических циклов паровых машин и турбин, то
диаграмма i s играет о собую роль в теплотехнике.
Чрезвычайная сложность термического уравнения состояния для
перегретого пара не позволяет теоретически вывести простой фор
мулы адиабаты в координатах p - v . Поэтому здесь исключительное
распространение имеют чисто эмпирические формулы, которые, однако,
не могут претендовать на большую точность.
Опытным путем установлено, что между давлением и температурой
при адиабатном изменении состояния перегретого пара существует
соотношение, действительное вплоть до критического давления:
=
const.
(V. 24)
j’B
Принято считать, что в координатах p - v адиабата перегретого пара
практически описывается формулой:
pvl>* = const.
(V. 25)
Разумеется, здесь показатель адиабаты отнюдь не равен k = cp/cVf
а является не более чем некоторым опытным коэффициентом.
Таким образом, адиабата перегретого водяного пара, подобно
адиабате идеального газа, принадлежит к семейству политропных
кривых. В связи с этим к ней в полной мере приложимы те формулы
для вычисления работы, которые вытекают из условия p v n — co n st,
как например:
п-1
Отсюда, полагая л = 1 ,3 , имеем:
/1.>= 3,ЗЗрЛ [1-(^)МИ].
Следует помнить, что указанные здесь формулы применимы лишь
до тех пор, пока пар остается в перегретом состоянии. Начиная от
гл. Ill]
ВОДА И ВОДЯНОЙ ПАР
267
точки пересечения адиабаты расширения с верхней пограничной кри
вой, дальнейший процесс адиабатного расширения может быть при
ближенно описан с помощью уравнения:
p^i,i35 =
const#
(V.26)
Более удовлетворительный способ установления показателя адиа
баты для расширения пара, который вначале был сухим насыщенным,
возможен с помощью диаграммы Цинзена на рис. 85. Зная конечное
состояние при расширении, по кривым линиям находят соответствую
щую величину k. Т а к , при расширении сухо го насыщенного пара до
состояния 1 величина k = 1 ,137; при расширении до состояния 2
величина k = 1 ,127.
Для аналитического нахождения точки в рабочей диаграмме,
в которой ранее перегретый пар становится сухим насыщенным,
следует решить совместно уравнение адиабаты /п;1»3 = p xv {*3 и урав
нение верхней пограничной кри-
вой p v " = 2. Получаемый резуль-
jqq
л
тат заведомо неточен, вследствие
чего предпочитают решать задачу
графически с помощью энтропий
ных диаграмм. В координатах p - v
[
адиабата перегретого пара резче 600
отклоняется от верхней погранич
ной кривой, чем адиабата насы
щенного пара.
В качестве приближенной ф о р
мулы адиабаты для перегретого
^
пара в случае малых и средних
давлений может служить также
формула:
2^.= const.
ЬОО
1
;
Таким образом, в диаграмме /?'-р
адиабатный процесс может быть
изображен правее пограничной кривой горизонтальными линиями,
которые позволяют
находить связь между термическими п а
раметрами в крайних то чках и, в частности, место превращения
перегретого пара в насыщенный. Уступая в отношении точности
расчету по энтропийным диаграммам, этот спосо б практического р а с
пространения не получил.
Если пар в начале адиабатного расширения уже является влаж
ным, то часто применяется старинная формула:
,035 + 0,1а? _
const,
V 1,6 1,7 1,6 1,9 2,0 2,1
S
Рис. 85.
(V. 27)
268
РЕАЛЬНЫЕ ГАЗЫ. ВОДЯНОЙ ПАР
[01Д. V
где х — начальная сухость. Эта формула не вяжется с уравнением
pVi,m _ COnst для расширения пара, бывшего вначале сухим, ибо
они оба дают два направления адиабаты, проходящей через какую-либо
начальную точку.
Вообще при расчетах адиабаты следует предпочитать пользова
ние таблицами или энтропийными диаграммами.
14.
Дросселирование. Как было указано в п. 7 второго отдела,
дросселированием называется процесс, возникающий при прохож де
нии потока через местное сопротивление в трубопроводе. Если уча
сток, на котором происходит дросселирование, адиабатно изолирован
от окружающей среды и разностью кинетических энергий перед и за
дросселем можно пренебречь, то можно утверждать, что в итоге
дросселирования энтальпия не изменяется:
h= *2-
При дросселировании течение может происходить только в сто
рону пониженного давления. Следовательно, этот процесс является
необратимым, нестатическим, и сопровождается увеличением энтропии
(см. четвертый отдел). Для нахождения конечного состояния после
дросселирования пара по заданному начальному состоянию удобнее
всего пользоваться диаграммой i s , в которой точка 2 должна лежать
на горизонтали, проходящей через точку 1 (рис. 86). Сама по себе
Рис. 86.
горизонталь не имеет физического смысла, ибо между сечениями 1
и 2 состояние потока может изменяться любым образом, зависящим
от местных условий. П оэтом у проведение горизонтальных линий из
начального состояния (/?,, tx) до заданного противодавления р 2
должно рассматриваться лишь как графический прием для нахожде
ния остальных параметров конечного состояния.
Из построения видно, что перегретый пар при дросселировании
охлаждается (положительный эффект Дж оуля — Томсона), в особен
н о ст и — вблизи пограничной кривой. Влажный насыщенный пар в р е
гл. ill)
ВОДА И ВОДЯНОЙ ПАР
269
зультате дросселирования высушивается и даже становится перегре
тым. В случае пара высокого давления это подсушивание может на
чаться не сразу, ибо кривые х = const падают в обе стороны от
своей вершины. В диаграмме T -s линии / = const могут быть по
строены по точкам.
Дросселирование широко применяется для регулирования давле
ния и расхода пара в технических установках. Здесь мы рассмотрим
пример, когда дросселирование
используется для измерения с у
хости пара, текущего по трубо
проводу. Для указанной цели не
большая часть ответвляется в дрос
сель-калориметр,
схематически
показанный на рис. 87. Если
в камере за вентилем пар пере
грет, то возможно измерить его
температуру /2, не зависящую от
давления р 2. П о этим данным на
мечается в диаграмме i s точка 2,
и из нее проводят влево гори
зонталь до измеренного давле
ния р г в трубопроводе. Отсюда
находят сухость пара x v Решение
задачи в аналитической форме можно основать на таком соотношении:
k *iг!= *2”Ьср(к—к).
Из последней формулы видно, что с помощью дроссель-калори
метра можно изучить также свойства теплоемкости ср. Для этого
нужно провести серию опытов, в которой начальное состояние пара
неизменно, а дросселирование проводится до нескольких ступеней
давления р 2. Многие исследования перегретого пара произведены на
основе этого метода.
Рис. 87.
ОТДЕЛ ШЕСТОЙ
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
ГЛАВА I
ЦИКЛ КАРНО
1. Содержание задачи. В технической термодинамике рассматри
ваются д ва случая производства работы. Первый случай относится,
например, к энергетическим паросиловым установкам. Выбрав по дхо
дящее термодинамическое тело, можно поставить его в такие условия
взаимодействия с -окружающей средой, при которых оно будет
последовательно выполнять круговые циклы. Благодаря этому удается
непрерывно извлекать тепло из окружающей среды и возвращать
обратно некоторое количество механической работы. Рабочее тело
играет при этом только роль посредника, выходящего из каждого
кругового процесса в своем прежнем состоянии.
Бывают и такие случаи, когда рабочее тело совершает некруго
вые процессы, производя работу как за счет подводимой к нему
извне теплоты, так и за счет запаса собственной энергии. Высвобож
дение энергии может быть связано с физическими и химическими
изменениями состояния тела. Таким образом, в этих случаях рабочее
тело является не только посредником, но и прямым участником в про
изводстве работы.
Применительно к случаям второго типа возникает такая задача.
Некоторое термодинамическое тело (система) находится в состоянии А ,
которое не является равновесным по отношению к окружающей нас
атмосфере. Э та последняя характеризуется давлением р 0 и температу
рой Г0. С помощью какого-либо устройства тело получает возмож
ность притти к состоянию равновесия с атмосферой (состояние В ) и
при этом отдать внешнюю работу. Как и для круговых циклов, здесь
требуется найти условия получения и величину наивыгоднейшего эффек
т а, отвечающего идеальной обстановке термодинамического процесса.
Значение второго способа отдачи работы следует из того, что
всякий рассматриваемый изолированно двигатель, входящий в состав
теплосиловой установки, совершает внешнюю работу именно путем
использования перехода соответствующего тела к состоянию наи
более близкому к равновесию по отношению к окружающей среде.
Возьмем ли мы воздушный двигатель, или паровую машину, или т у р-
ГЛ. 1]
цикл Карно
271
бину, — во всех случаях начальные параметры (все вместе или хотя
бы один) далеки от возможных равновесных значений, а конечные
параметры приближаются к ним, п о скольку это вообще практически
реализуемо. Сказанное относится во всяком случае к давлению рабо
чего тела. Что же касается его температуры, то если на выходе из
машины температура и отличается от атмосферной, рано или поздно
она сравнивается с последней. Правда, чаще всего выравнивание тем
пературы происходит вне машины — в самой атмосфере или в конден
са то р е,— однако существа задачи это не меняет. Сказанное отно
сится в полной мере и к двигателям внутреннего сгорания. Вводимую
в них горючую смесь (топливо с воздухом) надлежит рассматривать
как систему, находящуюся в химическом отношении в неустойчивом
равновесии. При благоприятных условиях (превышение температуры
самовоспламенения, искусственное зажигание) причины, тормозящие
изменения химического состояния, устраняются, и развивается экзотер
мическая реакция, после чего продукты горения приходят к полному,
устойчивому равновесию с окружающей атмосферой. При этом за
счет высвобождающейся химической энергии происходят обмен тепла
с атмосферой и отдача внешней работы . Аналогичный смысл имеют
явления в специальных механизмах однократного действия, как то:
в артиллерийском орудии, ракетном и минном двигателях и др.
Н ар яд у с машинным производством работы, в технике приходится
иметь дело с производством холода. Машинное производство холода
осуществляется посредством обратных круговых циклов за счет за
траты механической работы. Машины, предназначенные для этой опе
рации, называются холодильными. Кроме того, существуют машины,
производящие тепло для отопления или технологических нужд также
благодаря затрате механической работы. Такие машины называются
тепловыми насосами. В настоящем отделе излагаются элементы тер
модинамической теории, относящейся ко всем перечисленным случаям.
2. Прямой цикл Карно. Как было указано в третьем отделе,
при изложении второго начала термодинамики, прототипом круго вы х
циклов тепловых машин является цикл Карно. Если имеются в виду
прямые циклы, относящиеся к тепловым двигателям, то это надо
понимать в том смысле, что превращение теплоты в работу возможно
не иначе, как в связи с переносом некоторого количества теплоты от
более нагретого тела (теплоотдатчика) к менее нагретому телу (теп-
лоприемнику). Соответственно, наипростейшим вариантом будет такой,
когда имеется один теплоотдатчик при постоянной температуре Тг и
один теплоприемник при постоянной температуре Г2. Требуя соблю
дения квазистатичности всех звеньев ц икла, следует теплообмен
рабочего тела с обоими внешними телами осуществлять при бе ско
нечно малых температурных разностях, т . е . ,
соответственно, по
изотермам Т = Тх и Т = Т 2. В остальных своих частях цикл должен
состоять из адиабат, так как в противном случае возникнут конечные
разности температур между рабочим телом и окружающей средой.
272
идеальные тейловые машинь!
[ОТД. VI
Необходимость располагать, помимо рабочего тела, по крайней мере еще
двумя другими, различным образом нагретыми телами была нами доказана
для идеальных газов и постулирована для произвольных термодинамических
систем. При этом идея цикла Карно послужила предпосылкой для получения
выражения второго начала dQ = i 'dS. Понимание цикла Карно как прото
типа всех возможных круговых циклов не изменится, если в качестве ис
ходного положения второго начала мы примем выражение (II1.8): dQ = tid'V
с соответствующим физическим истолкованием величин 0 и
и с последую
щим показом того, что в последней формуле взамен 0 можно ввести Г с целью
перехода к обычной форме записи: dQ = i 'd S (см. п. 8 четвертого отдела).
Необходимые при этом рассуждения должны были бы являться повторением
сказанного в п. 3 третьего отдела. Действительно, утверждая наперед суще
ствование абсолютной температуры, которая имеет только один знак, и суще
ствование энтропии как функции состояния, легко заключить, что в течение
кругового процесса обмен тепла между рабочим телом и окружающей сре
дой должен быть знакопеременным. Кроме того, он должен происходить,
по меньшей мере, при двух температурах тела, так как иначе работа за один
цикл будет равна нулю.
Самое наглядное представление о цикле Карно может быть по лу
чено путем изображения его в координатах Т-S (рис. ь8). Пунк
тирными линиями Тх и Г2 показаны
уровни температур теплоотдатчика и
теплоприемника. Вдоль изотермы ab
рабочее вещество получает от теплоот
датчика количество теплоты Q j . При
этом, разумеется, объем вещества уве
личивается и совершается положитель
ная внешняя работа. П о окончании изо
термического расширения тепловая связь
между рабочим веществом и окружаю
щей средой устраняется, вследствие чего
дальнейший процесс происходит ади
абатным путем. Так как он должен слу
жить средством для квазистатического
понижения температуры рабочего тела до более низкого уровня , то он
должен быть процессом адиабатного расширения Ьс. В точке с рабочее
вещество принимает температуру теплоприемника. Следовательно,
здесь представляется возможным восстановить тепловой контакт
с окружающей средой с тем, однако, чтобы осуществить надлежащий
отвод тепла Q2 к приемнику. Таким образом, следующее звено цикла
(линия cd) изображает процесс изотермического сжатия. Вслед за
изотермическим сжатием следует вновь адиабатно изолировать рабочее
вещество и для замыкания цикла подвергнуть его новому сжатию
вдоль линии d a . Л егко видеть, что одна из четырех величин: Тх, Г2,
Q lf Q a — определяется однозначно через остальные и притом со вер
шенно независимо от физических свойств рабочего вещества. Э то
следует из того свойства энтропии, что ее приращение d S , равное
d Q jT , не связано с индивидуальными особенностями тел. Т а к , если
в цикле Карно заданы Тх и Q lf то этим определяется основание пря-
ГЛ. I]
ЦИКЛ КАРНО
273
моугольника AS = Q 1/T1 независимо от выбора рабочего вещества.
Если, кроме того, указана температура Г2, то определяется также
высота прямоугольника А Т = Т Х— Г2, а следовательно, и относитель
ное расположение всех четырех точек: а , Ь, с и d . Этим доказывается,
что любую физическую субстанцию, каждому состоянию которой
может быть приписана определенная температура, возможно исполь
зовать в качестве рабочего вещества в тепловом двигателе, получая
при заданных T v П и Qj одинаковый внешний эффект. Техническое
применение в качестве рабочих тел одних только газов и паров объ
ясняется соображениями исключительно практического характера.
Коэфф ициент полезного действия цикла Карно определяется выра
жением:
%=^
~
^
1= 1—
=
1—
(VI. 1)
так как Qx= T ^S и |Q21= Г2Д5. Величина тг)к зависит только от
температур источника и приемника тепла и совершенно не связана
с физическими особенностя
ми рабочего тела. В обще
принятом изложении эта о со
бенность цикла Карно яв
ляется предпосылкой закона
существования энтропии.
Коэффициент полезного
действия цикла Карно может
стать равным единице только
в двух случаях: при Т2= О
или при 7^= 00.Так как
оба они лишены какого бы
то ни было реального смы
сла, то мы еще раз убеж
даемся в невозможности со
здания такого теплового двигателя, в котором все подводимое теуло
превращалось бы нацело в механическую работу.
Важно отметить, что цикл Карно может состоять не только из
двух изотерм и двух адиабат, но также из двух изотерм и двух
произвольных процессов, лишь бы последние два процесса изобра
жались в координатах Г -5 линиями, которые в горизонтальном
направлении равноудалены друг от друга. В таком случае цикл Карно
служит прототипом регенеративных циклов и называется поэтому
регенеративным циклом К ар н о.
Н а рис. 89 изображен некоторый регенеративный цикл Карно abed.
П о условию , линия Ьс получена простым смещением вправо линии ad
на расстояние ab (или на расстояние dc). Хотя линии Ьс и da отве
чают процессам, протекающим при наличии теплообмена между рабо
чим телом и окружающей средой, идея, положенная в основу цикла
18 Зак. 3543. В. С . Жуковский.
274
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
Карно, не нарушается. В самом деле, представим себе, что помимо
рабочего тела, теплоотдатчика с температурой Tt и теплоприемника
с температурой Т » имеется еще бесконечно большое количество тел,
отличающихся по температуре на бесконечно малые величины и
в совокупности образующих всю гамму температур от Тг до Г2.
Представим себе далее, что по окончании изотермического расш и
рения при температуре Тг (линия ab) рабочее тело приводится пооче-г
редно в контакт с упомянутыми дополнительными телами, начина»
с самого горячего из них, температура которого ближе всего к 7\.
В о время происходящих элементарных актов теплообмена рабочее
тело расширяется или сжимается, или сохраняет свой объем, соот
ветственно тому, в какую сторону отклоняется от изохоры тот или
иной отрезок линии Ьс. В нашем примерном цикле процесс Ьс на
всем протяжении происходит при теплоотводе от рабочего тела*
однако сначала рабочее тело испытывает расширение, а затем о на
подвергается сжатию . Количества теплоты, получаемые от рабочего
тела дополнительными телами, показаны схематически столбиками Q ' ,
Q" , . . . , QW . Легко видеть, что, прибегая к противоположной после
довательности контактирования рабочего тела с дополнительными телами*
можно в принципе осуществить процесс d a , возвращая рабочему
телу те количества теплоты Q(n), . . . , Q " , Q ' , которые были аккуму
лированы ранее дополнительными телами. В итоге количество теплоты*
отнятое от рабочего тела и изображаемое площадью b efc, будет ему
возвращено, так как площадь aghd равна площади befc, т . е . отнятое
тепло будет регенерировано. В связи с этим, дополнительные тела
называются регенераторами, а получаемый с их помощью цикл —
регенеративным.
П оск ол ьку действующие во время теплообмена разности температур
на каждом элементе цикла остаются бесконечно малыми, цикл в целом
будет равновесным. Каждый из регенераторов представляет собой
внутренний тепловой источник, в котором в результате цикла не
возникает каких-либо остаточных изменений. Рабочее тело, как и
в простейшем цикле Карно, получает извне Q t калорий вдоль изо
термы Т = Тг и отдает вовне Q 2 калорий вдоль изотермы Т = Г2.
В итоге никакого другого внешнего теплообмена не имеется. Таким
образом, и из геометрических, и из физических соображений следует,
что во внешнюю механическую работу в регенеративном цикле Карно
превращается та же разность величин Q j и |Q21, как и в простом
цикле. Одинаков в обоих случаях и к. п . д . , если только одинаковы
температуры теплоотдатчика и теплоприемника. П оэтому описанный
регенеративный цикл представляет собой тот же цикл Карно, но только
требующий для своего осуществления более сложной обстановки.
Практическое осуществление простого цикла Карно при условии
полной квазистатичности всех п роцессов, протекающих в системе
теплоотдатчик — рабочее тело — теплоприемник, невозможно. Тем менее
возможно осуществить, соблюдая это условие, регенеративный цикл
гл. i]
цикл карно
275
Карно. В последнем случае затруднение возникает уже хотя бы п о
тому, что число регенераторов должно быть бесконечно большим.
Как будет указано далее, регенеративные циклы имеют большое при
менение. Однако число регенераторов ограничивается обычно несколь
кими единицами, и теплообмен между ними
и рабочим телом происходит при конеч
ных разностях температур. Конечные р а з
ности неизбежны и во все х прочих звеньях
цикла. Однако, как было уже не раз ука
зано, отсутствие квазистатичности в си
стеме взаимодействующих тел не мешает
часто практически процесс, выполняемый
самим рабочим телом, рассматривать как
квазистатический. Э то упрощающее пред
положение широко используется при ана
лизе циклов.
На первый взгляд может показаться,
что вывод о невозможности к. п. д ., рав
ного единице, лишен той общности, к о то
рую мы желаем ему приписать, ибо цикл Карно не является един
ственно возможным циклом теплового двигателя. В самом деле, мы
могли бы привлечь к участию в процессе превращения теплоты в ра
боту не два резервуара тепла, а про
извольно большое количество резер
вуаров, составляющих целую гамму тем
пературных уровней (здесь не имеются
в виду регенераторы). При этом круго
вой цикл имел бы в координатах Г -5
форму не прямоугольника, а любого
замкнутого контура, как, например,
показано на рис. 90 , соответствующего
четырем источникам и двум приемникам
тепла. При ограниченном количестве
рис> 91.
источников мы не имеем права изобра
жать цикл в виде плавной кривой, п о
скольку вводим условие о квазистатичности процессов взаимодей
ствия между рабочим веществом и окружающей средой. Поэтому
сложный цикл мы можем рассматривать лишь как результат после
довательного наложения отдельных циклов Карно, число которых
в данном случае равно пяти.
Увеличивая количество источников тепла до бесконечности, мы
уменьшаем беспредельно размеры отдельных элементарных циклов
Карно и получаем в результате плавный контур, как показано на
рис. 91.
Сравним к. п. д. циклов, приведенных нарис 90 и91, с к. п. д.
цикла Карно, показанным на рис. 89 . При этом будем полагать, что
---------------------
S
Рис. 90.
18*
276
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
крайние температурные уровни, между которыми развиваются со п о
ставляемые циклы, совпадают друг с другом. Обозначая площадки,
дополняющие рассматриваемый цикл до площади цикла Карно, бук
вамиА,В,С,D,имеем:
Qi-\Q*\-(A+B+C+D) _
л
\q2\+c+d
1
Qi- {A+ B)
—
Ql—(Л-f-В)•
Если хотя бы одна из площадок—А,В,С или D—не равна
нулю, к. п . д . сложного цикла будет меньше к. п . д . цикла Карно:
<%•
Следовательно, максимальным к . п . д . , который может быть
достигнут при работе двигателя меж ду двумя заданными пре
дельными температурными уровнями, обладает цикл Карно. Если
к. п. д . последнего меньше единицы, то к. п . д . любых других цик
лов будут и подавно меньше единицы.
Посмотрим теперь, каковы численные значения к. п . д . циклов
Карно. Положим, что приемник имеет температуру атмосферы, рав
ную 20° С , так что Г2 = 293° К . Придавая источнику различные тем
пературы, получим следующие соотношения:
(г = ЮО 200400 600 800 1000 1500ЭС
Тх = 373 473673 873 1073 1273 1773° К
*г)к = 0,21 0,38 0,56 0,66 0,73 0,77 0,83
И з таблицы видно, что увеличение температуры источника является
весьма эффективным средством для поднятия к. п . д . Этим объяс
няется, между прочим, низкая степень использования тепла в паро
вых машинах по сравнению с использованием его в двигателях внут
реннего сгорания.
Очевидно, что увеличение к. п . д . может быть также достигнуто
путем снижения температуры приемника тепла. Однако использова
ние этой возможности не имеет практического значения, так как
естественные тепловые резервуары обладают температурами, обычно
превышающими 0 ° С , тогда как искусственное создание низкой тем
пературы требует затраты механической работы, на чем мы оста но
вимся в следующем пункте.
Выше мы полагали, что взаимодействие между рабочим веществом
и окружающей средой удовлетворяет условиям квазистатичности.
Однако в реальной обстановке это взаимодействие всегда бывает
нестатическим. Нестатичность связей между частями системы имеет
место хотя бы потому , что явления обмена тепла протекают при
конечных разностях температур. Весьма существенно установить, какие
следствия вытекают из факта нестатичности процессов взаимодействия.
При этом следует помнить, что нестатичность связей между телом и
средой может не противоречить практическому рассмотрению про
цессов внутри рабочего тела как квазистатических.
ГЛ. I]
ЦИКЛ КАРНО
277
Решение поставленного вопроса естественно связать с принципом
возрастания энтропии при нестатических процессах. Включим в круг
нашего рассмотрения все тела, изменение состояния которых связано
с совершением кругового цикла в тепловом двигателе. Совокупность
этих тел, состоящая из рабочего вещества и резервуаров тепла,
является адиабатной системой. В адиабатной системе
2дSi>о.
Будем относить приращения энтропии отдельных частей системы
к такому периоду времени, в течение которого рабочее вещество
совершит один круговой цикл. Т а к как всякий квазистатический
процесс внутри рабочего вещества можно рассматривать как резуль
тат последовательного наложения элементарных циклов Карно , то
представляется достаточным проанализировать систему, состоящую
всего только из трех тел: рабочего вещества и д ву х резервуаров
тепла, имеющих температуры Тг и Т2. В таком случае
Д5габ.Тела=|^ = 0; Д51==—
Д52=
-
Ш.
Поэтому
] £ д ^ = Д5рав. Тела+А^1
^
>0.
Н о на основании первого начала для рабочего тела
^;dU=Q1— |(?21 — AL = 0,
следовательно,
\Q2\= Ql-AL
.
Подставляя это значение |Q 2 | в первое выражение, находим:
AL<^bQ,.
Есл и бы взаимодействие между рабочим телом и резервуарами
'Р __р
тепла было квазистатическим, то A L = - ± - ~ — 2Q v Следовательно, при
Л1
наличных резервуарах тепла всякого рода нестатичность взаимодей
ствия имеет следствием понижение мощности двигателя по сравнению
с той, которая могла бы быть получена при затрате того же тепла,
но в условиях квазистатического взаимодействия.
3. Обратный цикл Карно. Поставим себе задачу отнять некото
рое количество теплоты от «источника холода», имеющего темпера
т у р у Т2 более низкую, нежели температура Тх природных резервуаров
тепла (атмосферы, речной воды и т. п .) . Для этого выберем подхо
дящее рабочее вещество и заставим его совершать круговой процесс.
Очевидно, этот круговой процесс должен состоять в простейшем
278
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
случае из тех же элементов, из которых складывается цикл Карно
для теплового двигателя, а именно, из двух изотерм, вдоль которых
рабочее вещество вступает в теплообмен с обоими источниками Т2
и 7 „ и двух адиабат, вдоль которых вещество подвергается одному
лишь механическому воздействию со стороны окружающей среды.
Однако направление, в котором об
водится контур цикла, должно быть
иным: если раньше мы двигались по
часовой стрелке, то теперь мы будем
следовать в направлении, обратном
движению часовой стрелки, как по
казано на рис. 92.
Так как по абсолютной величи
не Qj больше, чем Q2, то для со
вершения цикла необходимо затра
чивать механическую работу в к о
личестве, эквивалентном площади
прямоугольника abed.
Для того, чтобы получить представление о порядке затрат мощ
ности на «производство холод а», рассмотрим численный пример.
Пусть температура Т2 той среды, которую необходимо искусственно
охлаждать, равна — 30° С . Температура Тг охлаждающей воды, по
средством которой производится отнятие тепла от рабочего вещества,
пусть будет равна -{ -30 оС . В таком случае
отведенная теплота
_
.
1Oil . т>.
_
303
—
1 947
холодопроизводительность
<?2
То 243'
—
1
1
затраченная работа
__
_
IQil—С?2
__
.
т,-
1
1
1
о
холодопроизводительность
(?2
т,
243
В практике предпочитают пользоваться величиной е, обратной
последнему отношению и служащей мерой холодильного эффекта.
v
м
,.
холодопроизводительность
Г2
Холодильный коэффициент е = ---------- -------------- ---------- =
~
=
затраченная работа
—
72
243
.
ккал (холода)
.
270 000 ккал
ккал
60
ккал (работы)
’
427 л . с.-ч.
л. с.-ч.
Таким образом, при работе холодильной машины по циклу Карно
между принятыми температурными уровнями на каждую затраченную
силу-час приходится 2560 ккал, искусственно отнимаемых от холод
ной среды. Разумеется, в действительных установках холодильный
коэффициент составляет значительно меньшую величину. Показать
это можно с помощью рассуждений, приведенных в конце предыду
щего пункта. Изменяя знаки в составляющих баланса на противопо
ложные, имеем:
IQlI
Q2^П
..
r\
I
IIIАТI
/ч
гл. 1]
Отсюда
цикл КАРНО
279
|Qil=Qa+No
и
>|
|•т~т1*
В последнем выражении правая часть отрицательна. Переписываем
«го в таком виде:
Q%<\AL\1^ Ti.
При квазистатических связях между частями системы мы имели,
что
Q2= |AL\ Ti2. - f2u
О тсю да вытекает, что холодильный эффект цикла, ограниченного
двумя заданными температурными уровнями резервуаров тепла, имеет
максимум при квазистатичности связей между взаимодействующими
частями системы. В реальных условиях холодильный эффект должен
быть обязательно меньше подсчитанного по квазистатическому циклу
Карно.
В свою очередь можно показать, что квазистатический цикл Карно
выгоднее всякого другого квазистатического холодильного цикла при
сопоставлении их по соответствующим температурам. Какие темпера
туры следует в данном случае считать за соответствующие, видно
из рис. 93а. Фигура abed изображает некоторый обратный цикл.
На участке ab теплота должна подводиться к рабочему телу из
окружающей среды. Поэтому последний в ряду теплоотдатчиков,
обеспечивающих выполнение этого процесса, должен иметь темпера
туру не меньшую, чем наибольшая температура рабочего тела, т . е .
в пределе Г2 = Ть. И з подобных же соображений вытекает, что на
участке cd теплоотвода от рабочего тела последний в ряду тепло-
приемников должен быть в пределе при температуре Тг — Td. С л е
довательно, наипростейшим циклом , отвечающим наличию только
одного теплоотдатчика и только одного теплоприемника, является
280
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. V I
Л<?
Конденсатор
pf, Т/ — v/WWVVVWWv----- Pi>Ъ
цикл Карно m bnd. П о сравнению с этим циклом в исходном цикле
холодопроизводительность меньше на величину площади А , а затра
ченная работа больше на величину суммы площадей Л и Л . Таким
образом, холодильный коэффициент е оказывается наибольшим для
соответствующим образом построенного цикла Карно.
В примерном цикле abed имелись два адиабатных участка: Ьс
и da. Если хотя бы один из них сходил на нет, то определяющие
цикл Карно температуры Г2 и Тг сближались бы друг с другом,
стремясь к взаимному совпадению. Поэто му для цикла, показанного
на рис. 93tf, соответствующий эталонный цикл Карно должен изо
бражаться прямоугольником, имеющим бесконечно малую высоту d T .
Холодильный коэффициент такого цикла Карно равен бесконечно
сти, что делает исходный цикл заведомо менее экономичным. З а
метим, однако, что не для любого обратного цикла можно пред
ложить для сопоставления
в качестве эталонного
цикл Карно. г)
В первых холодиль
ных установках в качестве
рабочего тела применялся
воздух. Вследствие низ
кой экономичности и гр о
моздкости они б^ли со
вершенно оставлены и
уступили место холодиль
ным машинам, работаю
щим на
специальных
«хладоагентах»: аммиаке
(NH3), углекислоте (С 0 2),
сернистом ангидриде ( S 0 2)
и некоторых галогенных
соединениях углеводоро
дов (например, дифтордихлорметане C F 2C l 2), имеющих собирательное
название «фреоны» . Отличительной особенностью этих веществ является
низкая температура кипения при давлениях, близких к атмосферному,
отсюда — реальная возможность максимального приближения к циклу
Карно при работе по схеме рис. 94.
Циркуляционная система для хладоагента состоит из испарителя,
компрессора, конденсатора и расширителя (паровой машины — двига
теля). В испаритель поступает жидкий хладоагент при давлении р%
и температуре т£, несколько меньшей температуры Г2 охлаждаемого
расшири_.
тел* -ЗП
Компрессор
Охлаждаемое
^ помещение
Рис. 94.
1) Специальный термодинамический анализ холодильных циклов произ
веден в книгах В. С . Мартыновского «Холодильные машины (Термо
динамические процессы)», Пищепромиздат, 1950 и «Термодинамические ха
рактеристики циклов тепловых и холодильных машин», Энергоиздат, 1952.
ГЛ. 1]
ЦИКЛ КАРНО
281
помещения. В испарителе он превращается в пар той же температуры,
отнимая из помещения Q2 калорий. В компрессоре пар адиабатна
сжимается до достижения температуры т'и слегка превышающей
температуру Tt охлаждающей воды. П о выходе нз конденсатора,
благодаря отдаче воде Q t калорий вновь получается жидкий хладо-
агент, однако при давлении р х > р2 и т[ > Т2. Замыкание цикла,
соответственно, производится посредством расширителя* где, расш и
ряясь адиабатно и отдавая работу *), хладоагент приходит к исходным
величинам давления (/?2) и температуры ( Г 2). Таким образом, цикл
хладоагента можно в принципе образовать двумя изотермами и двумя
адиабатами. О некоторых более близких к практике циклах х о л о
дильных установок будет сказано дальше.
Технически интересным применением обратного цикла Карно
является также использование его для отопительных целей в качестве
теплового насоса. В отличие от холодильных машин здесь цикл
выполняется в интервале температур, лежащем выше тем пература
окружающей среды. Ясно, что при этих условиях можно к отапли
ваемому помещению подводить при надлежащей температуре ф кал о
рий, складывающихся из тепла Q2, «выкачиваемого» из атмосферы,
и эквивалента затрачиваемой на установку работы. В идеальном сл у
чае отопительный коэффициент определяется так:
где Т г и Г2— температуры отапливаемого помещения и холодного*
окружающего воздуха. При ^
+ 30°С и/2= — 30°С, например,
303
имеем отопительный коэффициент равным -gg- = 5 ,0 5 . При непосред
ственном превращении в тепло механической работы (трением) или
электрической работы (ленц-джоулево тепло) мы имели бы отопитель
ный коэффициент равным единице. Таким образом, теоретическая
выгодность теплового насоса бесспорна, если имеются налицо есте
ственные источники механической работы, стоимость которой оказы
вается достаточно низкой. Вообще же говоря, механическая работа
не является дешевым продуктом. Т ак, коэффициент отдачи электро
энергии крупной теплосиловой станцией составляет величину по
рядка 20— 2 5% . Если даже не считаться с потерями в электромоторе,
суммарный отопительный коэффициент в рассматриваемом случае
окажется равным 5,05 (0,20 -* -0 ,25) та 1. Это значит, что на каждую
калорию сожженного под котлами топлива можно при идеальном
тепловом насосе получить одну калорию тепла, передаваемого о та
пливаемому помещению. Действительный эффект должен быть более
низким, что в сочетании с дороговизной машинного отопления делает
его технически оправданным лишь в специальных случая х.
]) Разумеется, эта работа меньше работы, затрачиваемой компрессором^
отопительный коэффициент
IOil _
Тх
IAL| 1\—Т29
282
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
И з приведенного анализа становится понятным, что цикл Карно
получает громадное значение в теории тепловых машин. Е го роль
не ограничивается только сферой чистой теории. Ц икл Карно дает
возможность подсчитать тот оптимальный экономический эффект,
который вообще может быть достигнут при работе теплового двига
теля или холодильной машины в идеальных условиях термодинами
ческих связей.
ГЛАВА II
МАКСИМАЛЬНАЯ РАБОТА
4.
Общие формулы для максимальной работы. В соответствии
со сказанным в п. 1 полагаем, что некоторое тело из состояния А
переходит в равновесное по отношению к атмосфере состояние В .
Последнее характеризуется постоянными параметрами р 0 и Т0. Един
ственно возможным теплообменом считается обмен с атмосферой,
в результате которого тело получает Q калорий. Как и в предыду
щих пунктах, будем рассматривать совокупность рабочего тела и
окружающей среды как адиабатную область.
Н а основании второго начала имеем:
Sb-S a—
- ^>Q
(*)
и на основании первого начала:
Ub—Ua= Q—AL.
(**)
Исключая из (*) и (**) величину Q, находим:
AL^U a— Ub—Т0(Sa—SB)=(UA—T0SA)—(UB—T0SB).(VI.2)
Знак равенства в (IV. 2) соответствует тому идеальному случаю ,
когда изменения состояния тела во всех частях квазистатичны. Знак
неравенства отвечает всякому реальному нестатическому ходу процесса.
Обратим теперь внимание на то , что правая сторона формулы (V I. 2)
однозначно определена условиями задачи, ибо t /в и 5 в для данной
массы тела вычисляются при условии р в = р0 и Тв = Т0.
Следовательно, внешняя работа имеет максимум, зависящий
исключительно от начального состояния тела и параметров
атмосферы и не зависящий от способа перехода к конечному равно
весию, поскольку этот переход осуществляется квазистатическим
путем. В отношении отдачи работы все квазистатические про-
цессыу заданные начальным состоянием тела и параметрами атмо
сферы, равноценны. Называя предельное значение A L максимальной
работой, получаем:
AU = (UA— T0SA)—(UB—T0SB)= UA—UB— T0(SA—SB). (VI.3)
ГЛ. II]
МАКСИМАЛЬНАЯ РАБОТА
283
Таким образом, формула (VI. 3) отвечает на вопрос, каковы усл о
вия получения и величина предельной отдачи работы при некруговых
изменениях состояния.
Легко видеть, что A L K дает величину абсолютной, но не полезно
используемой работы. При изменении объема тела от VA д о V b должна
быть совершена работа против давления атмосферы, равная A pQ(Vb — V а)
калориям, и лишь только избыток A L ^ над указанной работой пре
одоления окружающего давления может иметь техническое примене
ние. Поэтому мы определяем максимальную полезную работу A Lмл
следующим образом:
AL1An= UA-U B— T0(SA- S B)+ Ар0(VA— VB)=
= (Ua— T,Sa+ Ap0Va)—{Ub—T0Sb+A PqVb): (VI.4)
Следует подчеркнуть, что изложенные здесь рассуждения относятся
к случаю производства работы неизменным количеством тела, заклю
ченным в непроницаемую для массы оболочку.
Решим аналогичным путем задачу о максимальной полезной ра
боте в случае непрерывно текущего пот ока. Полезной работой
в данном случае является так называемая техническая работа. Для
этого сопоставим формулу (*) с уравнением (1.22), отнеся их к ча
совому расходу:
Sb—$а—Яг-
О
п*____ г*
г*
I
.
Г*WB““ WA I ЛГ*
Q —Ав—Ia^t-AG —2^------\ -ALT.
Исключая попрежиему Q * , находим:
=
(Л- ToS*A+ AG*
-
(l*B- ToS*B4-AQ*^).
При отнесении к 1 к Г протекающего потока имеем:
\w\—w\
AL7^ iA—is-f-T0($д— sb)-bA
—
^
=
3
3
= (u- T0SA+ a
(iB- TqSB+ a ^ ). (VI.5)
Ясно, что максимальную работу можно получить, если привести ско
рость на выходе из двигателя к нулю и осуществить наименьшее
значение разности {iB — T0s b ) , совместимое с параметрами атмосферы.
284
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
Отсю д а, подразумевая только что сказанное,
w\
А1т —
1в— т0(sA
sB) “4“ А
===
w\
= (U—TtsA)—(iB—ВД+Л-ф
.
(VI. 6>
В частных случаях начальной кинетической энергией можно пренебречь.
Тогда
= U — 1в — Т0(sA— sB)= (iA— T0sA)—(iB— TQsB). (VI.6a)
Формула (VI. 6a) по сравнению с (VI. 4) дает ббльшую удельную
работу на величину Л (рА — р0) vA. Этой величиной определяется
затрата механической работы (на насос или другой побудитель цир
куляции) для непрерывного поднятия давления 1 к Г потока от р 0
до р А при неизменном объеме.
5. Максимальная работа в частных случаях. Рассмотрим не
сколько частных случаев вычисления максимальной работы, имеющих
важное практическое значение.
а) Разрядка газового аккумулятора. В аккумуляторе
емкостью VА содержится газ при давлении рА > р 0 и температуре 7 ^ ,
совпадающей с температурой окружающей атмосферы Т0. Путем раз
рядки через соответствующий механизм газ отдает полезную работу.
Находим максимальную величину этой работы в соответствии с изло
женным в п. 4.
Начальное состояние газа характеризуется величинами рА> VA и Т0>
конечное — величинами р 0, VB, Т0. В формуле (VI. 4), следовательно*
имеем:
согласно (II. 22а),
UA—UB= О,
согласно (11.56), T0(SA— SB)= — AGRT0\n^>
согласно (II. 1), Ap0(VA— VB)= Ap0VA(l — ^ ) ,
так что
AL*n= AGRTQ\n~ -\ -Арцl'Afl—y^),
и окончательно:
^
=
+
<VL7>
Посмотрим теперь, каким именно путем можно получить макси
мальную полезную работу (VI. 7). Изменения состояния газа должны
ТЛ. II]
МАКСИМАЛЬНАЯ РАБОТА
285
быть квазистатическими. П о это м у расширение о т начального давле
ния до атмосферного должно с необходимостью проводиться изотер
мически. Во всяком другом случае нельзя избежать теплообмена между
газом и окружающей атмосферой при конечных разностях температур,
что влечет за собой нестатичность процесса !). На рис. 95 наивыгод
нейший путь перехода газового заряда к равновесию по отношению
к атмосфере показан линией А В . Соответствующая полезная работа
равна разности между абсолютной работой расширения и работой,
необходимой для преодоления атмо
сферного противодавления. Таким р
•образом, £мп изображается заштри
хованной площадью.
В качестве упражнения полез
но эту площадь определить как
p d V , откуда должна быть вновь
А-В
-С
получена формула (VI. 7).
Заметим теперь следующее: 1) в
данном частном случае показанный
путь перехода является единственно
возможным прямым квазистатическим
путем; 2) отдача максимальной работы газовым зарядом происходит
не за счет использования его внутренней энергии, а благодаря пре
вращению в работу извне подводимой теплоты. При желании исполь
зовать также и внутреннюю энергию заряда пришлось бы вести рас
ширение до давления р 0 по линии более крутой, чем изотерма,
вследствие чего, однако, отдача работы уменьшилась бы.
б)
Работа воздушной турбины и турбокомпрес
сора. Рассмотрим случай производства работы не дозированным,
количественно неизменным воздушным зарядом, а потоком воздуха,
который непрерывно поступает из напорной сети. Начальные пара
метры рАу vA и Г0, так же как и конечные параметры р0, vB и TQ
отработавшего во здуха , принимаются неизменными во времени.
Поставленная задача принципиально выполнима с помощью воз
душной турбины, проточная часть которой осуществляет установив
шийся процесс изменения состояния воздушного потока. Поршневой
воздушный двигатель с одним цилиндром заведомо неприменим для
этого, так как он является механизмом, периодически прерывающим
перетекание воздуха из напорной сети в окружающую среду. В таком
Двигателе за один оборот кривошипа последовательно происходят
три процесса: наполнение цилиндра сжатым воздухом, расширение
поступившего в цилиндр воздушного заряда и, наконец, выпуск от-
*) Вообще говоря, помимо прямого квазистатического пути перехода мо
гут оказаться мыслимыми непрямые, требующие привлечения новых меха
низмов, где будут работать дополнительные посредники.
286
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
работавшего воздуха наружу. В течение среднего из этих процессов
полость цилиндра полностью отсоединена от напорной сети и о т
окружающей среды. В о время наполнения и выпуска эта полость
сообщается либо только с напорной сетью, либо только с атмосфер*
ным воздухом. Таким образом, установившегося течения воздуха здесь
не имеется. Разумеется , при применении многоцилиндрового двигателя,
в котором цилиндры работают, как это всегда делается, с относи
тельным сдвигом ф аз, итоговый эффект приближается к условиям
стационарности, однако этого случая мы здесь не будем касаться.
Итак, обратимся к формуле (V I. 6а), полагая, что можно прене
бречь разностью кинетических энергий потока в напорной сети и на
выходе из турбины. Тогда имеем:
согласно (II. 25),
1А— iB= О,
согласно (II. 56),
Т0(sA — sB) =
—
ART0ln^-,
так что
°
'» = 'гг«1п77= ',Л |п7Г
<vl-8>
Мы видим, что максимальная техническая работа, как и в пре
дыдущем случае, производится в связи с изотермическим расшире
нием и, следовательно, совершается только за счет
тепла, подводимого к рабочему воздуху извне.
И з полученной формулы для /мт по видимости
следует, что работа воздушной турбины измеряется
площадью, лежащей в координатах p - v под линией
изотермического расширения, т . е . что она равна
абсолютной работе расширения. Э т о , вообще говоря,
неверно.
На рис. 96 схематически изображена турбомаши
на (будь то турбодвигатель или турбокомпрессор)
с подводящим и отводящим трубопроводами. Со стоя
ние потока в подводящем трубопроводе обозначим
индексом 1 и в отводящем — индексом 2. Примем далее, что раз
ность кинетических энергий в этих состояниях пренебрежимо мала по
сравнению с остальными составляющими энергетического баланса, ч то ,
как правило, и бывает в действительности. Тогда на основании (I. 20)
получаем:
At, =
qi, а— (и9— «Л — A (plv1— р2г»2).
С другой стороны, согласно выражению первого начала (1.19), к о-
торое сохраняет силу и для текущего потока, если мы отвлечемся
от проявления трения в нем (этот вопрос специально рассматривается
в последнем отделе), имеем:
gi.2 — (и2—ut)=Ajрdv.
ГЛ. II]
МАКСИМАЛЬНАЯ РАБОТА
Производя подстановку, получаем:
287
2
1
ll=/Рdv+
—
P*vа= / vdP-
(V1- 9)
1
2
Обратим внимание на то (это очень важно), что последняя формула
для технической работы турбомашины верна безотносительно к тому,
каковы условия теплообмена между рабочим потоком и окружающей
средой на пути от входа в машину и до выхода из нее.
Из формулы (VI. 9) видно, что работа, производимая потоком
в воздушной турбине (эта работа в относящихся к по току терминах
названа технической), складывается из работы расширения потока
2
в турбине ^J р dv ^ и из превышения работы проталкивания во вп уск-
1
ном трубопроводе ( р ^ х) над работой проталкивания в выпускном
трубопроводе (p2v 2). В координатах
р - v работа расширения изображается
(рис. 97) фигурой c l — 2d и указанное
превышение работ проталкивания —
разностью площадей прямоугольников
a lcO и b2dO. В результате техниче
ская работа /т оказывается равной з а
штрихованной площади а1 — 2Ь. Эта
площадь в свою очередь может быть опре-
1
делена и непосредственно как J v d p .
2
В совершенно частном случае, когда температуры Tt и Т2 в на
чале и в конце расширения воздуха одинаковы, произведение p {v t
равно произведению р2х>2 (площадь a lcO равна площади b2dO). Вот
почему и было указано, что отождествление работы турбины с р а
ботой расширения воздуха в ней, вообще говоря, неверно. О но верно
только в том случае , когда расширение происходит изотермически.
Следует отметить, что в технических условиях не удается при
расширении воздуха в турбине поддерживать температуру на постоян
ном уровне, подводя нужное количество теплоты. Температура воз
духа во время расширения падает, и соответствующий процесс о ка
зывается более близким к адиабате, чем к изотерме. Ввиду этого
действительная техническая работа воздушной турбины оказывается
меньше максимальной величины /мт, как видно из рис. 98 . В числе
других причин недополучения работы находится также практическая
неизбежность остановки расширения несколько раньше, чем давле
ние воздушного потока сравняется с противодавлением а тмосферы .
288
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
Заметим, что воздушные турбины, приводимые в движение неподо-
гретым воздухом, применяются редко. Что касается газовых турбин,
то о них будет сказано дальше.
Остановимся кратко на турбокомпрессорах — машинах, поставляю
щих сжатый воздух (или сжатый газ). Формула (VI. 8) с соответственно
измененными индексами дает в этом случае минимальную техническую
работу, которую требуется затра
чивать, чтобы, забирая воздух из
окружающей среды, поднимать его
давление до нужного уровня и в сж а
том виде, но при прежней темпера
т уре, направлять непрерывно потре
бителю. Легко видеть (рис. 99), что
затрата работы на компрессор мини
мальна при ведении сжатия по изо
терме. Осуществление сжатия по
более пологой линии невозможно,
так как требует охлаждающей среды
более холодной, чем окружающая
компрессор атмосфера.
Если отвод тепла в процессе сжатия менее интенсивен, чем это
требуется для удержания температуры воздуха на постоянном уровне,
кривая сжатия идет круч е , что приводит к увеличению затрачиваемой
на компрессор работы. Правда, при этом температура выдаваемого
компрессором воздуха оказывается выше
температуры в окружающей среде, что,
вообще говоря, для дальнейшего ис
пользования сжатого воздуха может
быть выгодно. Однако поставленная
здесь теоретическая задача такого ис
пользования не предусматривает, что
отвечает ряду практических случаев,
когда потребители сжатого воздуха
находятся в удалении от компрессора.
Вследствие этого нагрев воздуха, если бы
он и был осуществлен в машине, не
смог бы сохраниться из-за естественного
охлаждения напорной сети. Конечно,
при тесной компоновке компрессора с потребителем, например с камерой
сгорания в газотурбинной установке, минимальность затрачиваемой
на компрессор работы перестает быть критерием технической целе
сообразности. Дальше мы познакомимся со схемами теплосиловых
установок, в которых в качестве идеального компрессора принимается
компрессор с адиабатным сжатием.
Дополнительно к сказанному заметим, что реальные возможности
охлаждения воздуха при сжатии в турбокомпрессоре чрезвычайно
Рис. 99 .
ГЛ. ll]
Максимальная работа
289
ограничены. Поэтому даже тогда, когда нагревание воздуха в турбо
компрессоре бесполезно с точки зрения дальнейшего использования,
приходится отступать от изотермического сжатия, т . е . от условия
минимальности технической работы. При этом во всех случаях техни-
1
ческая работа турбокомпрессора определяется формулой /т= J v d p ,
а
2
а по абсолютной величине — формулой \lt \= J v d p . Только при
1
изотермическом сжатии работа турбокомпрессора совпадает с работой
а
собственно сжатия:
p d v (индекс 1 относится здесь к линии
1
всасывания, а 2 — к линии нагнетания). Дальнейшие сведения о ком*
прессорах имеются в п. 9 .
П ример. Определить мощность идеального изотермического KoMitpeC*
сора и количество теплоты, передаваемой охлаждающей воде, если он подает
сжатый до 4 ат и воздух в количестве 100 м ъ\час\ давление, атмосферы
/?о= 1,033 ата. Расход воздуха отнесен здесь не к всасываемому, а к нагне*
таемому воздуху.
Изменив индексы в (V I. 8) соответственно рис. 99, имеем:
Л,т= 'к=/W"Г1=
In
•
Рв
Рв
Заменив удельный объем часовым объемным расходом сжатого воздуха,
получаем:
С =pBv*BIn^
= 2,3 •5,033 ♦ lCKIg
= — 7970 • 10» кГм/час,
Pji
O.UOO
N=
7970-103
270-103
=s—29,5 л. с.
Таким образом, мощность двигателя к идеальному компрессору равна
29,5 л. с . В действительных условиях эта мощность должна быть, разумеется,
более высокой.
Количество теплоты Q , переданное охлаждающей воде, находим из
формулы:
7970 • 103
Q——Фож= — 427—
=
18660 ккал! час-
Определим теперь, в каком отношении к найденной находится работа
компрессора при сжатии по адиабате того же количества воздуха.
Затрачиваемая на компрессор работа, определяемая как j vdp, при
2
условии адиабатного сжатия, согласно (V. 11), в k раз больше работы про-
19 Зак. 3543. В. С . Жуковский.
290
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
|ОТД. Vt
2
цссса сжатия, равной
/дд к—
/»,~к-\
*п»
к~1
*
Ро_
Рв
Рв
5,033
Таким образом, затрата работы на компрессор при адиабатном сжатии
на 27% больше, чем при изотермическом сжатии.
в)
Работа потока топочных газов. В предыдущих зада
чах были рассмотрены случаи, когда для совершения потоком газа
работы используется напор давления. Теперь мы определим макси
мальную техническую работу газового потока при использовании
напора температуры. Э то т случай интересен в связи с оценкой
эффективности паросиловых установок.
Сжигая топливо под котлом, мы получаем горячие топочные газы при
атмосферном давлении. Проходя через котел, топочные газы испаряют
в о ду. Образующийся пар повышенного давления поступает в машину
или турбину и после расширения либо выбрасывается в атмосферу,
либо возвращается в котел в виде конденсата, получаемого в особом
конденсаторе. Таким образом, для превращения энергии топлива в р а
боту избирается далеко не прямой путь, сопряженный с многочислен
ными потерями. Ясно, что для получения работы можно было бы дей
ствовать и непосредственно, направляя топочные газы в надлежащим
образом сконструированный механизм, по выходе из которого они при
шли бы к равновесию с атмосферой. Вычислим максимальную техни
ческую работу, которую при этом можно получить от 1 л:Г, если
поддерживается непрерывное течение газов через топку и двигатель.
Начальное состояние топочных газов задано величинами р0 и Та ,
конечное — величинами р0 и Т в = Т 0. Поэтому в формуле (VI. 6а)
имеем (теплоемкость считаем постоянной):
согласно (II. 24а),
U—*в= ср(Та—Т0)
гЛ. и]
МАКСИМАЛЬНАЯ РАБОТА
291
согласно (II. 26в), откуда
/мт= ср(ТА— Т0)— срТ0\п ~
hr— lA—t
'
o“Н
•
Посмотрим теперь, каким именно путем следует вести квазиста-
тический процесс, обеспечивающий производство указанной работы
(рис. 100). Первый этап должен заключаться в адиабатном расшире
нии газов в турбине до достижения ими температуры атмосферы
(линия А а ). Только начиная с этого момента, может быть осуществлен
обмен тепла между газами и атмосферой. Так как давление в точ
ке а ниже атмосферного, единственным способом приведения га
зов к конечному равновесию ^
с атмосферой является сжатие
в компрессоре, которое должно
обеспечивать постоянство тем
пературы ( Г = Т0) благодаря Ро
отнятию от газов тепла (ли
ния аВ). В итоге получаем
работу, показанную заштрихо
ванной площадью. Эта работа,
как и всякая техническая р а
бота турбомашин, определяется
формулой
А
l7=jvdp.
Рис. 10Э.
В
В данном случае, когда интегрирование производится по пути, с о
стоящему из изотермы В а и адиабаты а А , получаем максимальную
работу /мт:
/мт= Г vdp.
ВаА
Для воспроизводства работы к каждому килограмму газов следует
подводить в топке (/^ — /0) калорий* Отсюда определяется макси
мальный к . п . д . идеальной газовой установки:
Так, если Г0= 300°К иТа= 1200°К, то т)м= 0,54.С этимк.п.д.
интересно сравнить к . п . д . реальной паросиловой установки. Считая,
-—
СрТх
срТ0^1 Н“ In
)>
(VI. 10)
19*
292
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
|ОТД. VI
например, для котла у}вот = 0 ,85 и для турбины
=
0,30 , имеем
эффективный к. п . д . установки
= 0,85 •0,30 = 0,255, что соста
вляет 47°/о от возможного максимального к . п . д . Что означает эта
цифра? О на определяет потери, возникающие благодаря непрямому
использованию топочных газов для производства работы и много
численным отклонениям процесса в котлотурбинной установке от
идеальных условий, характеризующих выбранную схему. Мы видим,
что эти потери составляют примерно половину от возможной в наи-
лучшем случае работы.
Помимо оценки относительной эффективности реального рабочего
процесса, важно иметь суждение также и о достоинствах самой прин
ципиальной схемы, в которой воспро
изводство высокой начальной темпера
туры газов происходит путем изобар
ного нагревания без тепловых потерь.
Для этой цели, очевидно, нужно со п о
ставить величину, обозначенную нами
как т)м, с к. п. д . цикла Карно. Для
принятых значений ТА и Т0 имеем
т)к = 0 ,75. В долях от этой величи
ны т]м составляет 7 2% .
На рис. 101 показана зависимость^
от отношения ТА/Т0. Для сравнения
дана также кривая yjr . И з графика видно,
что поднятие начальной абсолютной температуры газов выше чем
в 5 — 6 раз против атмосферной не приносит существенной теорети
ческой выгоды, тогда как при этом практические затруднения и не
принципиальные с термодинамической точки зрения потери в котло
турбинном агрегате чрезвычайно возрастают. Впрочем, с ростом TAjT 0
темп увеличения т)м более значителен, чем темп увеличения т]в. Т а к ,
при изменении ТА/Т0 от 5 до 6 tjm возрастает относительно перво
начальной величины на 7%, a yjb— на 3,75%*
г)
Работа газовых и паровых турбин. В паровых и
газовых турбинах поток производит работу при наличии напора
давления и напора температуры.
Примем, что в подводящем к турбине трубопроводе находится
газ при давлении р А и температуре ТА, в атмосфере, соответственно,
имеем р0 и Т0. Н а 1 к Г газового потока (теплоемкость считаем
постоянной)
U—h =Ср(Та— Тв)9
т
Tq(sa
sB^= cp^n~Y0
%
80
60
40
20
2J45TA/T0
Рис. 101.
ГЛ. II]
МАКСИМАЛЬНАЯ РАБОТА
293
и, согласно формуле (VI, 6а):
/мг = СР(ТА— Т0)— с„т0In
- + -ART0In^
=
—
cv Ta
^<7о(1-Н п
k
Ait— ciiTa " ■CjTo 1+ ln
ft-1
•
(VI. 11)
В специальном случае, когда состояния (/>л, Т а ) и (/;0, Т0) принад
лежат к одной адиабате, находим, что
/Мт—Ср{Тa Tq)—1а — /о*
(VI. 11 а)
Последнее выражение может быть найдено непосредственно
из (VI.6a), если приравнять s a и s b , вследствие чего оно применимо
к любому рабочему телу, а не только к идеальному газу.
Таким образом, максимальная техническая работа может быть
больше или меньше убыли энтальпии i , играющей роль потенциальной
Рис. 103.
энергии по тока, в зависимости от соотношения между начальными
параметрами потока и параметрами окружающей среды, к равновесию
с которой приводится рабочее тело.
Графически /мт показана на рис. 102 в координатах p - v . Как
и всякая техническая работа* максимальная работа /мт равна интегралу
от v d p y взятому по соответствующему пути. Величину /мт можно
весьма просто определять с помощью диаграммы i - s (рис. 103).
Проведем через точку О прямую под углом а, где tg а = Т0. Из
построения видно, что отрезок адиабаты между точкой А и указанной
прямой дает величину А1и1. Если точка А лежит под вспомогательной
прямой, техническая работа оказывается отрицательной, т . е . дли
294
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
проталкивания потока требуется затрачивать большую работу, чем
можно получить благодаря расширению тела до равновесия с атмо
сферой.
Для суждения об эффективности рассматриваемого способа
производства работы следует выяснить, какие затраты необходимы
для получения повышенного давления и повышенной температуры
против атмосферы. Очевидно, здесь нужно в общем случае прибегнуть
не только к подводу тепла, но также и к израсходованию некоторой
работы на сжатие. Следовательно, для воспроизводства процесса
отдачи работы приходится создать установку, в которой помимо
двигательной части будет налицо еще компрессорная часть в сочетании
с теплообменником, где к циркулирующему потоку должно под
водиться тепло. Разумеется, итоговая работа установки окажется
меньшей, чем вычисленная из формулы (VI. 11). Ч то касается к . п . д .
такой установки, то он будет иметь наибольшее значение, если
осуществляемый в ней круговой цикл является циклом Карно (между
температурами Та и Г0). Специально о циклах теплосиловых уста
новок говорится далее.
6. Интерпретация энтропии. Термодинамическое тело может
производить работу либо в результате круго вы х, либо в результате
некруговых процессов. Рассматривая первый из этих случаев, мы
видели, что производство работы непременно сопровождается от
бросом некоторого количества теплоты теплоприемнику. При фикси
рованных температурах теплоотдатчика и теплоприемника и заданном
количестве получаемого телом тепла этот отброс тем более велик,
чем резче проявляется нестатичность процессов взаимодействия тела
с окружающей средой (см. п . 7 третьего отдела и п. 2 настоящего
отдела). В конечном счете это значит, что из-за функционирования
тепловых двигателей энтропия природных теплоприемников (ок ру
жающей нас атмосферы, водоемов, почвы) растет, и степень возра
стания их энтропии определяет ту энергию, которая потеряла цену
для последующего превращения в работу . Обесценение энергии тем
значительнее, чем дальше отклоняется процесс в двигателе от условий
полной квазистатичности.
Рассмотрим теперь производство работы в результате некруговых
процессов. Пусть какая-либо система тел переходит из состояния 1
в состояние 2 один раз обратимым, а другой раз необратимым путем.
Здесь под системой мы понимаем все без исключения взаимодей
ствующие тела, кроме окружающей среды, с которой имеет место обмен
тепла. В обоих случаях изменения энтропии системы одинаковы.
Однако в окружающей среде приращение энтропии при необрати
мом процессе ( A 5 He06p) должно быть согласно основному неравенству
второго начала большим, чем при обратимом процессе (Д 5 0бр)«
Примем обозначение:
85— Д5Яеобр А5обр^ 0.
гл. и]
МАКСИМАЛЬНАЯ РАБОТА
295
Величина 85 характеризует изменения в окружающей среде, связанные
с отклонением процесса от обратимого изменения состояния. Поэтому
85 может служить мерой необратимости.
Положим теперь, что атмосфера находится при постоянной
температуре Г0, причем распространение в ней получаемого (отдавае
мого) тепла происходит квазистатическим образом. В таком случае
изменение ее энтропии на 85 может иметь место только в связи
с поглощением количества теплоты bQ = Г 085, добавочного по
сравнению с обратимым процессом:
®Q — фнеобр— фобр— ТQ(Д5Н0обр— Д50бр) — Т0^5•
Так как наша система в целом ни с какими другими телами,
кроме атмосферы, теплом не обменивается и в обоих вариантах
испытывает одинаковые изменения внутренней энергии, то , сл едо
вательно, отдача ею дополнительного количества теплоты возможна
лишь в связи с недополучением от нее эквивалентного количества
работы. Обозначая последнюю как b A L , имеем:
bAL = Л10бр— ALBeo6?= bQ,
откуда bAL = Т0 85.
В предельном, идеальном случае 85 = 0 , 8Л/, = 0 , и система отдает
максимальную возможную работу А ЬЛ, г)
При всяком переходе системы взаимодействующих тел из
одного заданного состояния в другое полезная работа уменьшается
на величину, пропорциональную тому возрастанию энтропии
теплоприемника, которое обусловлено необратимостью процесса.
Коэффициентом
пропорциональности является температура
теплоприемника — окружающей атмосферы.
Резюмируя изложенное в настоящем пункте, можно сказать, что
при получении работы от окружающих нас тел как с помощью
круговых, так и с помощью некруговых реальных процессов, энтропия
природных приемников тепла возрастает. Э т о возрастание определяет
количество обесцениваемой энергии с точки зрения возможного
в дальнейшем превращения теплоты в работу. Как было отмечено,
подобное положение нельзя рассматривать как универсальный закон
вселенной.
задачи. 1. От источника тепла, имеющего температуру 7^, может
быть заимствована для передачи приемнику при температуре Г* теплота
в количестве Q килокалорий двумя различными способами: 1) путем
непосредственного теплообмена; 2) посредством машинного агрегата, со
стоящего из двигателя и теплового насоса, работающих по обратимым
циклам Карно.
1)В отличие от двух предыдущих пунктов здесь считается необязательным,
чтобы состояние 2 было равновесным по отношению к атмосфере. Это не
меняет постановки вопроса, приводящей к формуле (УI. 2) и последующим.
296
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
Двигатель выполняет цикл между температурными уровнями Тхи 7д,
причем Т*< Т2< 7^ а производимая им работа расходуется на тепловой
насос, действующий между температурами
и Т2.
Определить отношение количеств теплоты, получаемых в обоих слу
чаях
приемником
при
температуре Т2, если
^ = 1527° С ; t2=\7°C]
t9= 7°С . Указать, в каком направлении следует изменять Т\и Т2при
неизменном значении Г3 с тем, чтобы указанное отношение увеличивалось.
2. Двигатель работает но обратимому циклу Карно. 1,2 мв воздуха
при 0,95 am и 20° С сжимаются изотермически до 5 am и затем адиабттно
до 40 am. Проверить правильность вычисления к. п. д .,
сравнив значения,
полученные из конк етного теплового баланса и из общего выражения к. п . д .
Обратить внимание на численную величину среднего индикаторного давления
по сравнению со средними величинами, характеризующими паровые машины
и дзигатели внутреннего сгорания.
3. Воздушная холодильная установка работает между температурами
охлаждаемого помещения Т2и окружающей среды 7’,. Последовательность
выполняемых воздухом процессов такова (ср. с рис. 94): 1) воздух, выходящий
из
охлаждаемого помещения при р2= 1 am и t2=
—
10° С , сжимается
адиабатно компрессором до pj=4 am и до температуры Т[> Tv причем
*! = + 2 0 ° С; 2) в холодильнике воздух изобарно при р = Р\ охлаждается
от Т[до 7\; 3) в расширительном цилиндре воздух адиабатно приходит
к состоянию р2 и Т2< Г2; 4) в охлаждаемом помещении воздух изобарно
при р = р2 нагревается от Т2до Г2.
Определить холодопроизводительность, потребляемую работу и отдаваемое
в окружающую среду тепло, считая на 1 кГ воздуха. Найти холодильный
коэффициент е. Теплоемкости считать постоянными (для (PC). Как можно
было бы увеличить теоретически величину е; какого предела можно было бы
достичь?
3. Холодопроизводительность
установки,
описанной
в предыдущей
задаче, Q 2 = 100 000 ккал/час. Определить потребляемую мощность N[л. с.]
часовое
количество передаваемой охлаждающей воде теплоты Q* вес
циркулирующего в час воздуха G* и объемы обоих цилиндров двойного
действия, считая число оборотов п —90 в минуту. Найти мощности: произ
водимую расширительным
цилиндром
и
затрачиваемую компрессором.
Какова эффективная мощность установки, если трение и прочие потери
в каждом цилиндре составляют 25% от приходящейся на соответствующий
цилиндр теоретической
работы?. Сравнить эффективный
холодильный
коэффициент установки с коэффициентом е, относящимся к теоретическому
циклу
воздушной установки, и с величиной ек вычисленной для цикла
Карно между заданными температурами Тхи Т>.
4. В атмосфере
при /j= + 2 0 °С происходит таяние 100 кГ льда,
начальная температура которого равна — 5° С . Образующаяся вода при
нимает температуру 4-20 °С . Теплота таяния льда, равна 79,4 ккал\кГ, его
удельная теплоемкость 0,486 ккал\кГ?рад. Определить увеличение энтропии,
происходящее в результате указанного необратимого процесса, а также
затрату работы для прохождения процесса в обратном направлении, считая
замораживание обратимым.
5. Для приведения в движение торпеды может быть использован сжатый
воздух. Какую работу можно получить в наивыгоднейшем случае от надле
жащего баллона со сжатым воздухом при емкости его в 200л и давлении 150am,
если торпеда отрегулирована к движению на глубине 4 м под уровнем
волы? Температура воды (и торпеды) равна 15° С . Найти силу тяги Я,
производимую торпедой при отсутствии потерь в ее механизме, если радиус
действия торпеды должен быть 10 км.
ГЛ. II]
МАКСИМАЛЬНАЯ РАБОТА
297
7. Термодинамические потенциалы. Рассмотрим специальный
случай производства работы, когда начальная и конечная температуры
термодинамической системы одинаковы и равны Т. Э то т случай
очень важен в химических приложениях термодинамики, и некоторое
представление о нем необходимо составить.
Соответственно предпосылке о равенстве крайних температур
системы, перепишем формулу (V I. 2), заменив в ней температуру
окружающей среды Т0 на Т :
AL^(UX—TSt)—(U2—TS2).
(Vi. 12)
Знак равенства в формуле (VI. 12) относится к тому случаю,
когда между системой и окружающей средой процесс взаимодействия
протекает квазистатически. Если система находится в непрерывном
теплообмене с источником постоянной температуры 7 , то квазиста
тичность процесса требует того, чтобы во время процесса температура
системы оставалась бесконечно близкий к температуре Г , т. е. чтобы
процесс развивался чрезвычайно медленно. Впрочем, условие о посто
янстве температуры на всем протяжении процесса не является
единственно возможным. Считая, что внутри системы происходит
химическая реакция, можно представить, себе, что на первой стадии
изменение состояния системы происходит адиабатным квазистати-
ческим путем, в результате которого температура системы оказы
вается равной первоначальной температуре, совпадающей с температурой
источника 7 . Начиная с этого момента, процесс вступает во вторую
стадию — квазистатического обмена тепла и работы с окружающей
средой. В обоих случаях максимальное значение внешней работы,
совершенной системой, определится из уравнения
ALu= {Ux— TSJ—(U2— TS2).
(VI. 13)
Очевидно, что выражение U — T S является функцией состояния
рабочей системы. Согласно (1.36), эта функция обозначена через F
и названа свободной энергией системы. Таким образом,
Л7</71—F2.
(VI. 12а)
Из последней формулы следует, что при квазистатическом изо
термическом процессе производимая системой работа зависит только
от начального и конечного состояний и равна убыли некоторой
функции состояния F . Поэтому функции F может быть приписано
энергетическое содержание подобно функции U> которая определяется
выражением AL — Q = U 1— U2. Однако между U и F существует
большое принципиальное различие, как это легко видеть из следующих
простых рассуждений.
При адиабатном процессе системы внешняя работа совершается
за счет внутренней энергии U :
Al—Ux—и2.
298
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
При изотермическом процессе, если он квазистатичен, соответ
ствующая внешняя работа определяется выражением
AL= Ft—F2.
Сопоставляя оба равенства, можно последнее из них истолковать
(правда, несколько условно) как утверждение, что изотермическая
работа, подобно адиабатной, совершается за счет изменения энергии
системы. Однако здесь идет речь не о полной внутренней энергии U,
а лишь о ее некоторой части F , которая названа свободной (для
совершения работы) энергией.
Другу ю часть изменения полной внутренней энергии, равную
(£/,— U2)— (F }— F 2), можно в таком случае назвать, в противо
поставление, изменением связанной энергии. Согласно определению
функции Z7, изменение связанной энергии (Ux— U 2) — ( F x— F 2)
равняется TSX— TS2.
При условии квазистатичности T SX— TS2 = — Q . Следовательно,
убыль связанной энергии представляет собой не что иное, как
отданную окружающей среде теплоту. Следует помнить, что раз
ложение полной энергии на свободную и связанную имеет смысл
только в предположении, что при вступлении в теплообмен с о к р у
жающей средой система совершает изотермический процесс.
Поясним сказанное на примере изотермического расширения
идеального газа. Полная внутренняя энергия газа остается во время
процесса постоянной. При расширении газ производит положительную
внешнюю работу . Следовательно, его свободная энергия, а вместе
с ней и способность совершения в дальнейшем внешней работы, по
мере увеличения объема непрерывно падает. Наборо т, связанная
энергия газа увеличивается и притом так, что сумма величин ДF
и Т Д5 на каждом участке пути обращается в нуль.
При изотермическом процессе системы функция F может быть
изменена только на величину отданной в окружающую среду работы.
При всяком другом квазистатическом процессе приращение F зависит
от соотношения внешней работы и подведенного тепла. В самом
деле,
dF= dU—TdS—SdT= — (AdL+SdT).1) (VI.14)
Таким образом , d F может быть найдено графически из изображений,
процесса в координатах p -V и Г - S (рис. 104). В случае про
цесса, направленного вдоль стрелок, d F равно сумме заштрихованных
площадок, взятой с обратным знаком.
J) В этом выражении, как и во всех ему подобных уравнениях химической
термодинамики, обычно приписывают положительный знак работе, совер
шенной над системой, вследствие чего (VI. 14) принимает вид d F = A d L — SdT.
Однако мы не будем отступать от правила знаков, принятого нами во всем
предыдущем изложении.
гл. и]
МАКСИМАЛЬНАЯ РАБОТА
299
Чрезвычайно существенно, что для вычисления d F нужно знать
абсолютное значение энтропии S . В технической термодинамике
подобной необходимости мы не видели. Вопрос о рациональном
способе вычисления абсолютной величины энтропии мог бы служить
предметом специального исследования.
Сказанное по поводу свободной энергии F как функции, изме
нение которой определяет максимальную изотермическую работу,
имеет совершенно общий характер. Оно справедливо, когда система
способна производить одну только механическую деформационную
работу. В равной степени оно верно и тогда, когда наряду с меха
нической работой система производит также и немеханическую
(электрическую, магнитную и др.) работу, которую обозначим здесь
через AL'.
В последнем случае выражение (V I. 12а) переписывается
в виде
AL-\ -AV</71—/V
Примем теперь, что объем термодинамической системы поддержи
вается постоянным, т . е . что деформационная работа A L равна, по
условию , нулю. Если одновременно мы поместим систему в термостат
и посредством него приведем начальную и конечную температуры
системы к одному и тому же значению, то получим:
AL'KFx— F2.
Это значит, что немеханическая работа в изотермо-изохорном про
цессе меньше или равна убыли свободной энергии системы. При
условии обратимости, а следовательно, изотермичности процесса во
время теплообмена эта работа получает максимальное значение А1!^\
AZ=Ft-Fr
Последнюю формулу можно получить непосредственно из ( IV . 14):
dF=
— S d T — Ap d V , если правую сторону дополнить еще членом,
выражающим немеханическую работу. Тогда
dF= —SdT—АрdV—AdV,
300
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
Полагая rff=0 и ^К=0, находим:
AdU= —dF\ AU=Fx—F2.
Указанным путем нельзя только установить, что получаемая работа
является максимальной: для этого необходимо
воспользоваться
дополнительными соображениями, вытекающими из второго начала
термодинамики.
В некоторых случаях химическая энергия превращается в работу
почти обратимым путем. Так например, происходит дело в аккуму
ляторах (вторичных гальванических элементах), которые служат для
взаимного превращения химической энергии в электрическую работу.
При этом условии максимальную работу химического процесса можно
определять с удовлетворительной точностью, измеряя непосредственно
отдачу электрической работы.
Что касается технических топлив, то прямому экспериментальному
измерению в калориметрах поддается их теплота реакции (теплотвор
ная способность), которая при постоянном объеме равна U x — 1/2.
Вместе с тем известно, что для таких топлив изменение связанной
энергии составляет лишь 1— 2 % от теплоты реакции. Отсюда сле
дует , что теоретически возможно получать при сжигании полезную
работу в количестве, почти эквивалентном теплотворной способности.
Н а практике мы такого непосредственного способа превращения хи
мической энергии в работу пока не знаем. Применяемые нами методы
являются непрямыми, ибо предполагают получение энергии теплоты
и лишь затем — превращение теплоты в рабо ту . Резкая необратимость
этих процессов приводит к чрезвычайно низкой отдаче работы тепло
выми двигателями и теплосиловыми установками.
Нар яду с изотермо-изохорным процессом большое значение имеет
изотермо-изобарный процесс. Он выполняется в случаях, когда си
стема, находящаяся в термостате, испытывает постоянное атмосфер
ное давление. Считая процесс обратимым, применим формулу (IV. 17):
йФ= — SdT-\ -AVdp,
пополнив правую часть ее членом, выражающим немеханическую ра
боту. Имеем:
d<f>= — SdT+AVdp—AdL'.
Полагая, что
находим:
dT= 0 и dp—0У
AdL!= — d^\
AU=Ф1—Ф,.
Легко убедиться, что вычисляемая из последней формулы работа
является в данных условиях максимальной работой:
Л1^ = ф1— ф2.
гл. ш]
ЦИКЛЫ КОМПРЕССОРОВ, Д .П .С . И Г .Т .У .
301
Из приведенных рассуждений следует, что свободная энтальпия Ф
обладает свойством, аналогичным свойствам свободной энергии F ,
но только в несколько измененной обстановке процесса.
Характеристические функции, убыль которых в квазистатическом
процессе, протекающем при сохранении постоянства значений опре
деленной пары термодинамических параметров ( Г и V ; Т и р; S
и р; S и V и т. д .) , равна произведенной системой немеханической
работе, называются термодинамическими потенциалами. Таким
образом, свободная энергия и свободная энтальпия принадлежат к
числу термодинамических потенциалов.
На стр. 195, когда функция Ф была впервые введена в рассмотре
ние, было сказано, что ее называют иногда термодинамическим п о
тенциалом, однако это название неудачно. Теперь причины такой
оценки терминологии ясны: термодинамический потенциал является
термином собирательным, и функция Ф служит одним из многих
термодинамических потенциалов. В Г О С Т 3270-46 функция Ф названа
изобарным термодинамическим потенциалом. Э т о тоже не вполне
хорошо, так как имеется в виду не вообще изобарный процесс, а
изотермо-изобарный процесс. Поэтому мы и предпочли принять для
Ф название «свободная энтальпия», которое ср а зу устанавливает о бщ
ность между функцией Ф и функцией F , последняя из которых имеет
не дающее повода для критики название «свободная энергия».
ГЛАВА III
ЦИКЛЫ КОМПРЕССОРОВ, ДВИГАТЕЛЕЙ ВНУТРЕННЕГО
СГОРАНИЯ И ГАЗОТУРБИННЫХ УСТАНОВОК
8.
Содержание задачи. Действительные процессы в тепловых
машинах и устано вках чрезвычайно сложны. Большей частью мы о к а
зываемся в затруднении не только создать физически обоснованный
во всех деталях метод расчета рабочего процесса проектируемой
машины, но даже произвести такое экспериментальное исследование
уже существующей машины, которое исчерпывающим образом объяс
нило бы развитие отдельных элементов процесса, связав его со всеми
особенностями конструкции и эксплуатации. Впрочем, подобный анализ
вообще должен был бы выходить за рамки термодинамики и являться
предметом специальных курсов . Термодинамика рассматривает только
идеальные тепловые машины и устано вки, действие которых отра
жает принципиальные и в некотором смысле предельные свойства
рабочих процессов и, соответственно, только их идеальные, термо
динамические к. п. д . По этим предельным свойствам мы можем
судить о наибольшей эффективности и наименьших габаритах, кото
рых можно было бы ждать от машины того или иного назначения,
и о характере влияния основных параметров на протекание термо
динамического процесса и на качественные показатели машины.
302
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
(ОТД. VI
О приемах идеализации рабочего процесса в машинах лучше всего
судить на примере. В качестве такового возьмем процесс в поршне
вом компрессоре. Р ис . 105 дает представление о характере инди
каторной диаграммы компрессора. При удалении поршня от крышки
в цилиндр через всасывающий клапан поступает извне воздух (или газ).
При этом в цилиндре устанав-
JJpomuBo'
атм
Рис. 105.
ливается давление, несколько
меньшее атмосферного вслед
ствие гидравлических потерь
в фильтре, трубопроводе и кла
пане. П о окончании всасывания
начинается сжатие воздуха, про
должающееся до того момента,
когда давление в цилиндре не
сколько превысит противодав
ление в напорной сети. Тогда
открывается
нагнетательный
клапан, и поршень выталкивает сжатый воздух в приемный ресивер.
К началу повторного движения поршня от крышки в цилиндре остается
некоторое количество сжатого воздуха, который затем подвергается
расширению до момента достижения давления, немного меньшего, чем
в окружающей атмосфере. Только с этого момента вновь начинается
всасывание, и рабочий процесс воспроизводится в прежнем порядке.
Посмотрим теперь, как следует пред
ставлять себе рабочий процесс идеального
поршневого компрессора, в котором при
наилучшем использовании габаритов затра
чивалась бы наименьшая работа? Прежде
всего заметим, что работа, связанная с с о
зданием разрежения при всасывании и из
быточного давления при нагнетании, не
является принципиально необходимой с тер
модинамической точки зрения, ибо мысли
мы такие конструктивные мероприятия,
с помощью которых можно эту работу
сделать сколь угодно малой. Затем мы
нагнетания некоторого остатка сжатого
водит к сокращению количества всасываемого воздуха, так как
начало всасывания запаздывает против мертвой точки. Следова
тельно, в идеальной машине нужно подводить поршень вплотную
к крышке, т . е . устранить вредный объем камеры сжатия. Что ка
сается сжатия, то в связи с требованием затрачивать наименьшую
работу на компрессор оно должно быть изотермическим. (Мы не будем
повторять здесь аргументов, приведенных ранее в п . 5 .) Таким обра
зом, в идеальном компрессоре должен происходить процесс, изо
бражаемый так, как это показано на рис. 106. Здесь линия а 1
учтем, что наличие после
воздуха в цилиндре при-
гл. ш]
ЦИКЛЫКОМПРЕССОРОВ,Д.В .С . ИГТ.У.
303
воспроизводит всасывание, линия 1 — 2
—
сжатие и линия 2Ь — на
гнетание воздуха. Важно отметить, что этот процесс не является
термодинамически круговым циклом. Более того , компрессор не является
даже тепловой машиной, по скольку последняя своим прототипом
имеет машину Карно.
В связи с последними замечаниями дополнительно установим, что
существует много способов классификации тепловых двигателей и
теплосиловых установок. При любом из них для термодинамического
анализа нужно прежде всего отдать себе отчет в том, является ли
выполняемый рабочий процесс термодинамически круговым циклом
или нет. В отдельно взятых двигателях, как и в компрессоре, не бы
вает термодинамически круговых циклов, так как рабочее тело п о ст у
пает в двигатель и покидает его в различных состояниях. Правда, в порш
невых машинах имеет место цикличность выполняемых ими операций,
однако она неравноценна цикличности, понимаемой в термодинамическом
смысле. Если в некоторых случаях мы и осуществляем термодина
мические круговые цикл ы, то прибегаем для этого к целому ряду
специализированных машин и аппаратов, образующих в совокупности
более или менее сложную теплосиловую или холодильную установку,
в которой поддерживается непрерывная рециркуляция рабочего тела.
В качестве примера можно указать на любую конденсационную котло
турбинную установку, состоящую из парового котла, турбины, кон
денсатора и насосов, поддерживающих постоянный круговорот воды.
Другим примером может служить газотурбинная установка, работаю
щая по так называемому закрытому циклу. В этом цикле рабочим
телом служит во здух , заполняющий замкнутую на себя цепь машин
и аппаратов и отделенный от тракта продуктов горения и других
тепловых источников, с которыми рабочий воздух вступает в тепло
обмен. В подобных случаях возможно непосредственное применение
термодинамического анализа. Однако для отдельно взятых тепловых
двигателей и для установок с термодинамически некруговыми циклами
приходится вводить некоторую условность.
Прежде чем обратиться к обсуждению указанной условности,
заметим, что в теплоэнергетике следует различать двигатели внутрен
него сгорания и двигатели внешнего сгорания. К последним о тно
сятся паровые двигатели (поршневые и турбинные) и газовые турбины,
выделяемые в качестве объекта рассмотрения из соответствующих
теплосиловых установок. Двигатели внутреннего сгорания являются
действительно тепловыми двигателями в термодинамическом смысле
этого понятия, так как они служат для непрерывного превращения
теплоты в механическую работу , осуществляя это превращение авто
номным образом . Однако паровые двигатели и газовые турбины, взя
тые сами по себе, не могут считаться тепловыми двигателями, а
представляют собой, строго говоря, механизмы, назначение которых
заключается в производстве полезной работы за счет энергии потока
рабочего тела. Сообщение рабочему телу нужной энергии осущест
304
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
(ОТД. VI
вляется благодаря подводу тепла к нему, но только не в пределах
рассматриваемого механизма, а вне его — в паровом котле или в ка
мере сгорания, помещаемой перед газовой турбиной. При этом роль
теплового двигателя выполняет вся котлотурбинная или вся газо тур
бинная установка, понимаемая как единое целое. Поэтому, говоря об
отдельно взятых тепловых двигателях, противопоставляемых тепло
силовым установкам, мы будем иметь в виду только двигатели вну
треннего сгорания.
Условность, вводимая в теорию двигателей внутреннего сгорания
и теорию теплосиловых установок, имеющих термодинамически не
круговые циклы, заключается в трактовке этих циклов как термо
динамически круго вы х. Чтобы разобраться в допустимости такого
замещения, рассмотрим изображение реального изменения состояния
газа в цилиндре двигателя внутреннего сгорания в координатах p - V
(индикаторная диаграмма двигателя). Индикаторная диаграмма о бра
зована из самых различных элементов: здесь имеется сжатие газа,
сгорание, расширение, выпуск и всасывание или продувка цилиндра.
Совершенно независимо от существа этих элементов индикаторной
диаграммы площадь последней измеряет работу , совершенную в ц и
линдре за один кинематически круговой цикл , так как L =
Представим себе теперь, что линия, образующая индикаторную
диаграмму, представляет собой изображение термодинамически кру
гового цикла. Ясно, что он дает ту же работу, как и заданный
некруговой цикл. Э то следует из того , что величина элементарной
внешней работы dL = p d V совершенно не отражает причин изменения
объема цилиндра, в котором поршень может двигаться как потому,
что некоторое постоянное количество рабочего тела подвергается
механическим и тепловым воздействиям, так и потому, что количество
рабочего тела в цилиндре является переменным вследствие всасыва
ния, нагнетания, выпуска, подачи топлива и пр. Таким образом,
с целью вычисления работы за один циклический рабочий процесс
можно толковать индикаторную диаграмму так, как будто она изо
бражает собой термодинамически круговой цикл. Н о в таком случае
работу в точном смысле круго во го цикла можно определять не только
Нужно подчеркнуть, что если замена действительного процесса
термодинамически круговым циклом не дает расхождений в вычис
ляемой работе на одну порцию всосанного газа, то в отношении
теплообмена в цилиндре она может привести к самым превратным
заключениям. Дело в том, что в термодинамике величина Q опреде
ляется как интеграл Ос Д^, где G при интегрировании считается
постоянной. Если же при каком-либо процессе О изменяется, и при
том по неизвестному закону, то прежний способ вычисления Q ли
шается смысла, тем более, что ход изменения температуры оказы
ГЛ. Ill]
ЦИКЛЫ КОМПРЕССОРОВ, Д .В .С . И Г .Т .У .
305
вается неопределимым. Только при условии, что мгновенный вес
рабочего тела, содержащегося в цилиндре, известен как функция от
объема цилиндра V , можно с помощью индикаторной диаграммы у ста
новить всякую мгновенную температуру. После этого можно разбить
процесс на такие малые участки, для каждого из которых допустимо
принять G за постоянную, и уже тогда воспользоваться обычным
приемом вычисления Q . Совершенно очевидно, что действительное
значение Q , найденное указанным способом на основе анализа реаль
ных условий работы двигателя, не может совпадать с фиктивным
значением, получаемым в предположении, что вес G остается неиз
менным. П оэто м у количества теплоты, подсчитываемые при замене
истинного некругового процесса круговым циклом, на участках всасы
вания, вы пуска и пр. могут получить совершенно неправдоподобные зна
чения. Тем не менее, однако, алгебраическая сумма все х , частью неправ
доподобных, значений Q дает правильную величину работы за один
циклический процесс. Правильным получается и значение к. п . д . , кото
рый определяется как отношение работы цикла к соответствующему
количеству теплоты, выделившемуся при сгорании топлива в цилиндре.
Приведенные соображения имеют общий характер. Они определяют
место , занимаемое термодинамически круговыми циклами в теории
двигателей внутреннего сгорания и теплосиловых установок. Преж де
чем перейти к элементам этой теории, мы обратимся еще раз вкратце
к компрессорам.
9.
Циклы компрессоров. Понятие о цикле компрессора имеет
прямой смысл только применительно к поршневому компрессору. При
этом, однако, важно помнить, что цикл этот не является круговым
в термодинамическом смысле.
Как было сказано, в идеальном поршневом компрессоре отсут
ствует вредное пространство, всасывание происходит при атмосферном
давлении и нагнетание — при давлении в напорной сети. Что касается
процесса сжатия, то для минимальной затраты работы на машину он
должен быть изотермическим. Соответствующий цикл показан на
рис. 106. Сравнивая последний с рис. 9 9 , мы видим, что работа, за
трачиваемая на идеальный компрессор, не зависит от того, является
ли машина поршневым компрессором или турбокомпрессором. Р а зу
меется, положение не изменяется в тех случаях, когда сжатие проис
ходит адиабатно или, например, политропно с одинаковым для обеих
машин показателем п. Поэто му приводимые ниже формулы относятся
к компрессорам любого типа.
Работа /к, затрачиваемая на компрессор, не совпадает, вообще
говоря, с работой /сж, необходимой для собственно сжатия. Прини
мая, что сжатие политропно, имеем:
1
2
I*vdp= пJрdvy
k = nlсж.
(VI. 15)
20 Зак. 3543. В. С . Жуковский.
306
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
Таким образом, для «изотермического компрессора» п — 1 и
141= |/с*|=ЯЛn
= рм Inf [кГм'кП
на 1 м8 всасываемого воздуха получаем:
Теоретическая мощность идеального компрессора производитель
ностью V* [м*/час] по всасываемому воздуху равна
аг
РтУ\,Р*,
у
^ — 270000п77
Для «адиабатного компрессора» я = й и
l'.| = T^T«r,[(&)"r
-
l ] \„Гм!нГ\.
В этом случае верна также вытекающая из первого начала формула
|А1%|= A J vdp — /2— it [ккал/кГ],
из которой в случае идеальных газов получаем:
|А1К| = ср (Г2— Тх) [к/сал/кГ].
В связи со сказанным, в координатах i s работа адиабатного
компрессора измеряется длиной вертикального отрезка линии сжатия,
а в координатах T -s
—
площадью под отрезком
изобары, как это пока
зано на рис. 107.
Покажем теперь, что
формулы, найденные ра
нее для работы идеаль
ного компрессора, могут
быть получены путем за
мены его
некругового
цикла фиктивным круго
вым циклом такой же кон
фигурации. Применительно к компрессорам эта задача обычно не ста
вится, хотя она полезна для понимания приемов анализа рабочего
процесса в других машинах, И так, мы будем считать, что цикл на
рис . 106 есть термодинамически круговой цикл , выполняемый, ск а
жем, 1 к Г воздуха. Работа цикла Л/ц = ? а1+
+
а, где
гл. Ill]
ЦИКЛЫ КОМПРЕССОРОВ, Д .В .С . И Г .Г .У .
307
^Р(Т Та)у^12==sAp\V\ ^ PifPoj
(^6 Л. QbaT^^viTa
^б)’
Здесь температуры Ть и Га должны быть положены равными 0° К .
Физического смысла это, однако, не имеет. Поскольку переход
к круговому циклу является в целом формальным приемом, против
введения фиктивного температурного предела возражать не прихо
дится. Таким образом,
+ qba= ° иЫ=р^г1пр,/р2,т.е.
/ц= /к, что и требовалось доказать. Попутно полезно еще раз от
метить, что величины qal и q2b не имеют ничего общего с соответ
ствующими количествами теплоты в реальном компрессоре. В част
ности, если компрессор поршневой, то теплообмен на участках вса
сывания и сжатия может быть каким угодно по величине и по знаку
в зависимости от температуры стенок цилиндра.
Рис* 108.
Нуж н о сказать, что на практике не удается осуществлять столь
совершенного охлаждения, которое позволило бы вести сжатие по
изотерме. М е ж д у тем во многих случаях нет надобности выдавать
из компрессора подогретый воздух. Тогда для снижения затрачивае
мой мощности применяется двойное (двухступенчатое) или даже мно
гократное (многоступенчатое) сжатие. Конечное давление достигается
при этом в результате последовательного сжатия воздуха в несколь
ких цилиндрах. По пути к каждому последующему цилиндру воз
дух проходит через соответствующий холодильник, омываемый
охлаждающей водой. В этих холодильниках нагретый от предшест
вующего сжатия во здух всякий раз изобарно приводится к перво
начальной температуре. Как видно из рис. 108, при двухступенчатом
адиабатном сжатии получается экономия работы, измеряемая верти
кально заштрихованной площадью.
В компрессорах высокого давления многократное сжатие бывает
совершенно необходимо независимо от указанных экономических
соображений. При ведении сжатия только в одном цилиндре сильное
нагревание воздуха приводило бы к росту механических потерь,
20*
308
ИДЕАЛЬНЫЕ ТЕГ1ЛОЕЫЕ МАШИНЫ
[отд. Vi
повысило бы требования к применяемым материалам и даж е вызвало
бы опасность самовоспламенения смазки цилиндра. К этому присо
единялось бы еще резкое сокращение участка нагнетания. Простой
расчет показывает, что его длина в долях хода поршня при изо
термическом сжатии в идеальном компрессоре от 1 до 51 am со
ставляет 2 % . Для того чтобы подача сжатого воздуха в реальном
компрессоре имела место, следовало бы при таком условии почти
полностью избавиться от вредного пространства в цилиндре, что
не представляется возможным по конструктивным причинам. П оэтому
применение трех- четырехступенчатых
поршневых
компрессоров
в технике газов высокого давления является совершенно обыч
ным. Промежуточное охлаждение применяется также и в турбоком
прессорах.
10.
Циклы двигателей внутреннего сгорания. Существует три
типовых идеальных цикла двигателей внутреннего сгорания (д. в . с .):
цикл с изобарным теплоподводом, цикл с изохорным теплоподводом
и цикл с изохорно-изобарным теплоподводом. Для краткости мы их
будем называть изобарным, изохорным и смешанным циклами д . в . с .
Изохорный цикл д . в . с . считается прототипом рабочего про
цесса в двигателях с искусственным зажиганием (автомобильных,
авиационных,
газовых). Этот цикл, идеализирующий очертание
индикаторной диаграммы указанных двигателей, состоит из д ву х
адиабат и двух изохор (рис. 109). Адиабата 3 —4 отвечает сжатию
горючей смеси, изохора 4 — 1 сгоранию смеси, которое принимается
мгновенным, адиабата 1 — 2 расширению продуктов сгорания и изо
хора 2 —3 выпуску их в атмосферу. Последний процесс считается
также мгновенным. При этом, поскольку фигура 1— 2 — 3 —4 пони
мается как изображение кругового цикла, мгновенный выпуск газов
в атмосферу заменяется изохорным охлаждением взятого в постоян
ном количестве газа до достижения первоначального состояния перед
сжатием.
ГЛ. Ill]
ЦИКЛЫ КОМПРЕССОРОВ, Д .В .С . И Г .Т .У ,
309
Определим сначала прямым путем работу цикла, рассчитывая ее
на 1 к Г газового заряда. Как обычно, здесь теплоемкость прини
мается постоянной. И меем, согласно (II. 39):
Это т результат верен безотносительно к то му, понимается ли линия 2 —3
как линия выпуска (при этом точка 3 представляет одновременно
состояние новой порции горючей смеси) или как линия охлаждения
остающегося в неизменном количестве газа.
Легко видеть, что, считая фигуру 1—2 — 3 —4 за изображение
кругового цикла, мы получаем ту же формулу для работы. Дейст
вительно,
При этом, однако, величина q ^ = cv{T^— ^2) ни в какой степени
не соответствует истинной теплоотдаче за время выпуска газов, кото
рая может, вообще говоря, и вовсе отсутствовать.
Вычислим теперь к. п . д . цикла. Имеем:
Эта величина соответствует действительности, так как на участке 4 — 1
количество газов в цилиндре остается на самом деле постоянным и,
следовательно, при вычислении qu мы не впадаем в существенное
противоречие с истиной. Поэтому величину к. п. д . можно опреде
лять также и графически с помощью диаграммы Г - s , беря, как
обычно, отношение площади 1 -2 -3 -4 к площади, лежащей под ли
нией 4-1 .
Приведем формулу к. п. д . к более простому виду. Назовем
отношение v^lvi степенью сжатия е:
Таким образом, к . п. д . цикла с изохорным теплоподводом оказы
вается зависящим при заданных свойствах газа только от степени
сжатия. С увеличением последней к. п. д . растет.
Найденный к . п . д . цикла принадлежит к категории термодина
мических к . п . д. Последние определяют собой полноту превращения
А1= Л/12+Л/84= cv(Г, — Г2+ Г8- TJ.
Al= qu + <723= scv (Tt— Г4+ Г8— Г2).
cv(Г]— г2+
г3—ТА)__-
____
г2—г3
-
1 Тх-Т^
Vi
Согласно (11.42),
откуда
(VI. 16)
310
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
теплоты в работу с помощью идеальных циклов. Действительное
значение к. п. д . для данного типа двигателя и для данных пара
метров рабочего процесса отстает от соответствующего термодина
мического к . п . д . , который поэтому получает смысл наивыгодней
шего к. п. д . в конкретных условиях задачи.
Цикл с изобарным теплоподводом показан на рис. П О . Он
состоит из двух адиабат, изобары и изохоры. Этот цикл относится
к дизелям, в которых впрыск и распыливание топлива производятся
с помощью сжатого воздуха (компрессорные дизели),
отношение v j v 1 через р:
=Р>
Обозначив
и назвав эту величину степенью предварительного р а сш ир ен ияу
можно получить формулу:
4
=
1
—
0
Л
.
1
Т
)
Смешанный цикл изображен на рис. 111 . Введя обозначение:
£i
*6
гл. Ill]
ЦИКЛЫ КОМПРЕССОРОВ, Д .В .С . И Г .Т .У ,
311
находим:
4= 1-
1
Xpfc— 1
-
1 (A-l)-t Л*(р-1)-
В частных случаях, когда р = 1 или Х = 1, смешанный цикл
д. в. с . вырождается в изохорный цикл д . в. с . и, соответственно,
изобарный цикл д . в. с .
Вывод последних д вух формул предоставляем сделать читателю.
Обсуждение полученного к. п. д . в связи с вопросами теории
двигателей внутреннего сгорания производится в специальных к ур
сах. Здесь уместны только некоторые замечания по поводу термо
динамической оценки идеальных циклов этих двигателей.
Совершенство каждого конкретного цикла следует оценивать
путем сопоставления его к. п. д . с к. п . д . цикла Карно, отвечаю-
и 1 max* Разумеется, при
щего заданным крайним температурам
любых обстоятельствах идеальный цикл
двигателя внутреннего сгорания будет
уступать по своему к. п . д . циклу Карно.
Помимо сопоставления идеальных ц и к
лов с соответствующим циклом Карно не
обходимо еще располагать способом срав
нения циклов друг с другом. В отноше
нии к . п. д . такое сравнение производится
часто по случайным признакам и оказы
вается довольно бессодержательным. П р а
вильная в термодинамическом отношении
постановка вопроса была сформулирована
В. С . Мартыновским. *)
Преж де всего следует установить, что всякий данный цикл
может быть заменен эквивалентным по к . п. д . циклом Карно, по
строенным по средним температурам участков подвода и отвода
теплоты. Для разъяснения на рис. 112 показан изохорный цикл
д.в.с.1—2 —3—4. Если в эквивалентном емупок.п.д.цикле
Карно подведенное тепло Q t выбрано равным Q * » то отведенное
тепло (?2 должно быть равно Q,23. Величина Q u равная Q 41, изобра
жается прямоугольником, имеющим основание, равное расстоянию
между адиабатами 1— 2 и 3 — 4 и высоту, определяемую средней
температурой теплоподвода Tv Последняя находится из формулы:
Ti (^i
^4) = cv (Тх ТА)У
где
5^— Cv\n-
*) В. С. Мартыновский, Термодинамическое сравнение образцовых
циклов двигателей внутреннего сгорания, Дизелестроение, 1939, No 12,
а также «Термодинамические характеристики циклов тепловых и холодиль
ных машин», Энергоиздат, 1952,
312
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОГД. VI
откуда, как видно, для всякой политропы 4— 1 при с = const
Tl
Графически T t находится из условия равенства треугольников
4аЬ и Ы с . Средняя температура теплоотвода Т2 вычисляется как
_
У'__т
Т2 = 2 у. 3 и определяется на диаграмме из условия, что фигуры
in -4^
*3
3de и e 2 f равны. Следовательно, к . п . д . заданного цикла равен
1—(W -
Теперь легко показать, что сравнение относительной выгодности
дву х разнотипных циклов двигателей внутреннего сгорания нельзя
произвести по одному только при
знаку одинаковости крайних тем
ператур, так как к. п . д . цикла
данного типа может меняться в за
висимости от других параметров.
На рис. 113 для примера показа
ны два изохорных цикла д. в. с .,
ограниченных одинаковыми темпе
ратурными уровнями.
Совершенно очевидно, что для
правого цикла величины Т 1 и Т2
отличаются друг от друга меньше, чем для левого. Следовательно,
к. п. д . правого цикла уступает к. п . д . левого цикла. Поскольку
в данном случае речь идет о циклах с изохорным теплоподводом,
это можно было и предвидеть, так как мы показали, что их к. п . д .
зависит только от степени сжатия е, которая для левого цикла
выше, чем для правого цикла. Однако в более сложных случаях
сопоставления анализ формул для к. п . д . может быть не таким
простым, тогда как рассмотрение диаграммы T -s остается вполне
наглядным.
Вопрос о том, какой из дву х разнотипных циклов выгоднее, если
они оба ограничены одинаковыми температурными уровнями, может
иметь единственное решение, если дополнительно оговорено, какая
другая характеристика обоих циклов сохраняется одинаковой при
сравнении. В ыбор дополнительного условия при сравнении циклов
определяется рядом инженерных соображений. Ценные указания по
этому поводу даны в цитированных работах Мартыновского. Здесь
мы ограничимся только тем, что сравним между собой циклы с изо
хорным и с изобарным теплоподводом, полагая, что они оба выпол
няются как в одинаковых пределах температур, так и в одинаковых
пределах давлений. Такие два цикла показаны на рис. 114, причем
1— 2 —3 —4 изображает первый из них, а 1— 2— 3 —4 ' второй. Ясно,
ГЛ. Ill]
ЦИКЛЫ КОМПРЕССОРОВ, Д .В .С . И Г.Т .У .
313
что средняя температура подвода тепла выше в цикле с изобарным
теплоподводом, чем в цикле с изохорным теплоподводом, тогда как.
отвод тепла производится в одинаковых условиях. Следовательно,
при выбранном способе сравнения более выгодным является изобар
ный цикл д . в. с . Н а основании сказанного ранее такой вывод не
может быть обобщен без помощи дополнительного анализа. М огут
быть и бывают такие условия сравнения циклов, при которых более
выгодным окажется изохорный цикл д. в. с . Нужно только иметь
в виду, что при любых основаниях для сравнения циклов их пре
дельные температуры должны выбираться одинаковыми. В противном
случае сравнение будет неправильным в термодинамическом о тно
шении.
Наши краткие указания заключим замечанием по поводу терминологии.
В нашей литературе было принято называть изохорный цикл д. в . с . циклом
Отто, изобарный цикл — циклом Дизеля и смешанный цикл — циклом Сабатэ.
Эти традиционные названия оказываются при внимательном рассмотрении
неосновательными: ни один из трех указанных деятелей не предложил
приписываемых им циклов и не занялся их анализом. Имена Отто, Дизеля
и Сабатэ были привлечены на том основании, что их носители построили
двигатели, рабочие процессы которых были впоследствии подвергнуты иссле
дованию и при идеализации оказались подходящими к одному из трех рас
смотренных выше круговых циклов. Однако, если стать на этот путь, то
смешанный цикл следует называть не циклом Сабатэ, а циклом Тринклера.
Русский инженер Г. В . Тринклер, ныне профессор Горьковского института
инженеров водного транспорта, впервые в 1898— 1904 гг. создал двигатель,
имевший индикаторную диаграмму, к которой близок идеальный смешанный
цикл. То же самое сделал Сабатэ (Франция), но значительно позднее, только
начиная с 1912 г. Что касается построения и анализа смешанного цикла, то
это было, повидимому, в первый раз сделано на заводе Нобеля (ныне —
«Русский дизель» в Ленинграде) в 1910 г. в связи с потребностью разобраться
в данных испытаний построенных на этом заводе новых типов быстроход
ных (по тому времени) машин. Нужно отмстить, что в иностранной литера
туре три образцовых идеальных цикла двигателей внутреннего сгорания
вовсе не именуются, за редчайшим исключением, циклами Отто, Дизеля
и Сабатэ, а характеризуются по их существенным термодинамическим при
знакам, подобно тому как сделано у нас выше.
314
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
11.
Циклы газотурбинных установок. В отличие от двигателя
внутреннего сгорания собственно газовая турбина не является тепло
вым двигателем. Эти функции выполняет газотурбинная установка
в целом. Газотурбинная установка (г. т . у ) в своем простейшем
виде состоит из компрессора, камеры сгорания и газовой турбины.
В более сложных вариантах к этим элементам прибавляются еще
различного рода теплообменные аппараты. В качестве простейших
циклов газотурбинных устано вок приняты д ва: изобарный цикл
г. т. у . и изохорный цикл г. т. у . Оба они отличаются от соответ
ствующих циклов д . в. с . только одним: расширение газа происходит
до достижения давления всасывания, а не прекращается на некотором
промежуточном давлении (рис. 115 и 116). Разумеется, применение
полного расширения газов дает существенную выгоду. В газовых
турбинах оно осуществл яется без особых затруднений, тогда как
в двигателях внутреннего сгорания, которые являются поршневыми
машинами, оно конструктивно нереализуемо.
Рабочий процесс в газотурбинных установках может быть термо
динамически круговым, и тогда он называется закрытым циклом.
Однако большее распространение имеет некруговой в термодинами-
ГЛ. Ill]
ЦИКЛЫ КОМПРЕССОРОВ, Д .В .С . и Г .Т .У .
315
Рис. 117.
К —компрессор; Г — турбина; К. С . —
камера сгорания.
ческом смысле цикл — открытый цикл. Схема простейшей установки,
работающей по открытому циклу, показана на рис. 117. Работа
компрессора изображается на рис. 115 фигурой ЬЗ— 4а, работа тур
бины— фигурой а1— 2Ь, поскольку горение в камере принимается
изобарным. В итоге устано вка дает работу в виде заштрихованной
площади 1—2—3 —4. Процессы 1—2
и 3 —4 считаются при идеализации р а
бочего процесса адиабатными.
Если имеется в виду изохорный
теплоподвод, воспроизводящий взрыв
ное сгорание в камере, то истолкова
ние соответствующего рис. 116 оказы
вается не совсем простым. В самом деле,
работа газовой турбины должна изо
бражаться, казалось бы, площадью
а1— 2с и работа компрессора — пло
щадью Ь4— Зс. Разность этих площа
дей — фигура а1—2— 3 —4Ь — должна
была бы дать итоговую работу г. т . у . Между тем совершенно
очевидно, что итоговая работа в действительности изображается мень
шей площадью — фигурой 1— 2 — 3 —4 . Возникает вопрос, как устра
нить это противоречие?
Дело заключается в том, что для осуществления изохорного
цикла необходимо допускать прерывность действия установки, попе
ременно отсоединяя камеру сгорания то от турбины, то от компрессора,
а во время самого сгорания — от обеих машин. При этом параметры
потока на нагнетательной линии компрессора и на подводящей линии
турбины должны периодически изменяться во времени, и соответ
ствующая работа не может более изображаться фигурами а 1 — 2с
и Ь4— Зс, имеющими смысл только применительно к стационарным
условиям. Практическая осуществимость последних возможна не
иначе, как посредством установки за компрессором и перед турбиной
двух достаточно емких ресиверов и включения между ними большого
числа мелких камер сгорания, действующих со сдвигом фаз их кла
панного распределения.
Вдумаемся теперь в обстановку работы одной из таких камер
сгорания. Когда при закрытом выпускном клапане камеры откры
вается впускной клапан, она заполняется воздухом из первого р еси
вера при давлении р А. Затем закрываются оба клапана, и происходит
сгорание топлива с повышением давления в камере до p v Н аконец,
открывается выпускной клапан, чтобы продукты сгорания могли
выйти из камеры в следующий ресивер и затем на турбину. Очевидно,
давление во втором ресивере не может быть равно p v так как при
этом не будет причины для опорожнения камеры. Давление в пред-
турбинном ресивере не может лежать также в интервале между р х
и р ^ так как если остаточные газы в камере будут иметь давление,
316
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
превышающее р4, то следующая порция воздуха не сможет из воз
душного ресивера переместиться в камеру сгорания. Следовательно,
наибольшим возможным давлением в ресивере перед турбиной может
быть давление р4, начиная от которого и будет происходить в ней
обычное адиабатное расширение газов. Н о в таком случае примене
ние изохорного сгорания становится бесполезным, так как во время
истечения газов из камеры в ресивер происходит потеря ими рабо
тоспособности из-за резкой необратимости процесса внезапного тор
можения газовой струи. При этом та часть диаграммы, которая р ас
положена на рис. 116 над уровнем давления р 4, не соответствует
более какой-либо полезной работе, и , несмотря на изохорное сгорание,
газотурбинная установка фактически выполняет некоторый изобарный
цикл.
Существует ли все же способ поддерживать в ресивере за ка
мерой сгорания стабильное давление р и превышающее давление р 4?
Такой способ существует, но он требует усложнения газотурбинной
установки, а именно, замены описанной камеры сгорания особым
насосом, в котором повышение давления было бы обязано не сжатию,
а сообщению теплоты. Этот насос забирал бы воздух из первого
ресивера при давлении р 4, затем при постоянном объеме в полости
насоса производилось бы сжигание топлива и, наконец, продукты
сгорания при давлении р г выталкивались бы во второй ресивер. Ясно ,
что для приведения в действие воздушного насоса-подогревателя
нужно затрачивать работу, измеряемую прямоугольником a l ^ - 4 b .
Это заключение относится в равной степени как к поршневому на
сосу, так и к турбокомпрессору-подогревателю, поскольку для
последнего, в пренебрежении трением и изменением кинетической
энергии, согласно (VI. 9) имеем:
Включая в схему г. т. у . два ресивера и между ними насос,
скомбинированный с камерой сгорания, мы можем создать единую
проточную систему, действующую в условиях стационарного режима.
При этом противоречие в истолковании рис. 116 отпадает: работа
г. т . у . будет равна работе турбины (площадь а 1 — 2с) за вычетом
работы компрессора (площадь Ь4— Зс) и работы насоса-подогрева
теля (площадь а1— 4Ь).
Практическое осуществление насоса-подогревателя с изохорным
повышением давления очень затруднительно. Его назначение мог бы
в некотором приближении выполнять многоступенчатый адиабатный
турбокомпрессор, снабженный изобарными подогревателями во здуха,
стоящими между каждыми двумя смежными ступенями. В принципе,
при стремлении количества ступеней к бесконечности, линия про
цесса в таком компрессоре совпала бы с изохорой. Потребность
1
ГЛ. I!l)
ЦИКЛЫ КОМПРЕССОРОВ, Д .В .С . И Г .Т .У .
317
в насосе между компрессором и турбиной не возникает при изобар
ном цикле г. т . у . , так как перемещение по горизонтали в коорди
натах p - v не сопряжено с затратой технической работы и полностью
соответствует возможностям стабильно действующей камеры с г о
рания.
Изохорный цикл , изображенный на ри с . 116, является прототипом
газотурбинной установки, действующей и по такой схе ме , в которой
нет ресивера перед турбиной. Н е вдаваясь в подробности, которые
излагаются в специальных к у р са х газовых турбин, отметим, что при
этом турбина работает в условиях падающего от р г до р4 начального
давления, и только заключительная стадия расширения газов в т у р
бине происходит при стабильном давлении р 4 перед нею. Можно
показать, что на первой стадии работа турбины меньше работы,
отвечающей стабильному начальному давлению р 19 на величину пря
моугольника а1— 4Ьу т. е . как раз на ту величину, которая в схеме
с двумя ресиверами соответствует затрате работы на насос-подогре
ватель. Так или иначе, изохорный цикл, показанный на рис. 116,
считается одним из основных циклов в теории газотурбинных у ст а
новок.
Хотя рабочий процесс в газотурбинной установке, устроенной по
схеме рис. 117 или более сложной схеме, не является термодинами
чески круговым, фигуры 1— 2 — 3 —4 на рис. 115 и 116 можно на
основании соображений предыдущих пунктов трактовать как изоб
ражение кругового процесса, не делая ошибки в вычислении ра
боты и к . п. д . Н а этом основании и сделано перенесение фигур
1—2 —3—4 из координат p-v в координаты T-s на рис. 115 и 116.
Вывод к. п . д . изобарного цикла г. т . у . вполне аналогичен
выводу для изохорного цикла д. в. с . Имеем:
Ч
М_
Я*1
1
=
1
1 /7..
Ъ-т ,
Т\ — 7]|'
Докажем, что
Т\ 7\
Тъ Т3’
ввиду чего
T i - T z _ Т3 _______________1
_
Ti- П
Г4~ е»-‘
-
Действительно, для изобарных процессов получаем, что
=
A=£l
Tt Vi' T3 vs’
откуда
TiT3 Vil/3
318
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
С другой стороны, для адиабат имеем:
1
1
= (JY\*-* .
(2Y\k~ '
V2
9
v4 \Т3)
Производя подстановку, получаем:
1
т2 тА—\гх tJ
и отсюда
7\_7\
т2~ V
Учитывая доказанное, представляем к . п . д . изобарного цикла
г . т . у . в таком окончательном виде:
ч=1— га•
(V I- 18>
е
Мы видим, таким образом, что к. п . д . этого цикла имеет такое же
выражение как и для изохорного цикла д. в . с . В обоих случаях е
есть степень сжатия, т . е . отношение начального объема сжатия
к конечному объему.
Для изохорного цикла г. т . у . имеем:
4=1+
=
1
1Яа
(7*2— тз,)
Сь(П-Т4)
(VI. 19)
Выразим величины Ти Г2 и Т4 через Г 3:
Т4= Г8е*-ь
Тг= ХГ4= Г8Хе*“ ь
Г2
где
вследствие чего
Р±
Рз
_
Л
Л-1
Xкел_1
=
г 3х1/й.
Ь _____
к—1 >
Производя подстановку и сокращая на Тъ, получаем:
71— 1
Tj=l
_fc-l
xVfe- 1
X—1
(VI. 20)
Произведем теперь сопоставление циклов по некоторым характер
ным признакам.
ГЛ. 1IIJ
ЦИКЛЫ КОМПРЕССОРОВ, Д .В .С . И Г .Т .У .
319
Прежде всего выясним эффект, получаемый от полного расши
рения газов. Сопоставляя к. п. д . изобарных циклов с неполным и
полным расширением (VI. 17) и (VI. 18), мы видим, что при фикси
рованной степени сжатия е относительная выгодность последних р а
стет вместе с увеличением степени предварительного расширения
в первых. Добавочно получаемая благодаря полному расширению
работа изображается на рис. 118 треугольниками abc. В количе
ственном выражении имеем (при k = 1 , 4 ) :
прир=2и3
~
1,17 и 1,31>
Это значит, например, что если к. п . д . изобарного цикла г. т . у .
равен 0 ,65 (соответственно е = 14), то к . п . д . изобарного цикла
д. в. с. прир= 2равен: 1—0,35»1,17= 0,59, а прир=3 равен
всего только 1— - 0 ,35 • 1,31 = 0 ,54. Нужно, однако, заметить, что
преимущество полного расширения в газотурбинных устано вках не
удается практически использовать, так как в них из соображений
жаростойкости нельзя допускать таких высоких степеней сжатия
(в = 1 4 — 17), которые приняты для дизелей.
При сопоставлении изохорных циклов д. в . с . и г . т . у . пара
метр цикла X играет ту же роль, что и р в предыдущем случае.
Однако и здесь полноценное использование преимущества полного
расширения, которое особенно значительно при высоких значениях X,
практически затруднительно. Э то объясняется необходимостью иметь
в г. т. у . умеренные значения X, меньшие чем в д. в. с ., чтобы не
допустить возникновения очень высоких температур, которых может
не выдержать рабочее колесо турбины. Впрочем, температурное огра
ничение будет в г . т . у . сказываться с течением времени все меньше
в связи с прогрессом в области создания жаростойких материалов
и повышением эффективности искусственного охлаждения лопаток
турбины.
При сопоставлении между собой разных циклов следует у чи
тывать не только температурное ограничение, но и ряд других
320
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОГД. VI
практических, инженерных факторов. И х игнорирование может при
вести к тому, что обнаруживаемые достоинства и недостатки циклов
оказываются совершенно абстрактными, не отражающими действитель
ности. Всестороннее и полноценное обсуждение циклов производится
в специальных к урса х . Здесь мы ограничимся только еще одним
примером сопоставления, а именно, сравним изохорный и изобарный
циклы г. т . у . при условии одинаковости крайних температур. Н а
Рис. 119.
рис. 119 изохорный цикл изображен жирной линией, а соответствую
щий изобарный цикл — тонкой. Как видно, средняя температура
теплоподвода Тг для обоих циклов одинакова. Однако средняя темпе
ратура теплоотвода Т2 для изобарного цикла выше, чем для изо-
хорного. Отсюда следует, что в данных условиях к. п . д . изобарного
цикла г. т . у . уступает к. п. д. изохорного цикла. Некоторые дру
гие теоретические соображения
также говорят в пользу изохор
ного цикла. Однако в конструк
тивном отношении он выполним
труднее, чем изобарный.
Жесткое практическое огра
ничение циклов газотурбинных
установок по их максимальной
температуре побуждает искать
пути увеличения к. п. д ., хотя бы
для этого пришлось значительно
усложнить схему установки. Весьма действенным методом увеличения
к . п . д . является применение регенеративных циклов. Схема установки
с регенератором показана на рис. 120. Назначение регенератора заклю
чается в подогреве сжатого воздуха перед поступлением его в камеру
сгорания за счет энергии отходящих газов из турбины. Н а выходе
из компрессора температура воздуха равна Г 4. В идеальном случае
во здух может быть нагрет до температуры
равной температуре
гл. ш]
ЦИКЛЫ КОМПРЕССОРОВ, Д .В С И Г .Т .У .
321
отходящих газов Г2. Соответственно, последние в результате тепло
отвода примут температуру Гв, равную Г 4 (различие теплоемкостей ср
воздуха и продуктов горения здесь не учитывается). Описанный ра
бочий процесс схематически показан на рис. 121 . Должно быть ясно,
что в координатах Г -s площади, лежащие под отрезками изобар
2— 6 и 5 —4 , одинаковы. Этими площадями определяется теплообмен
на д вух этапах изменения состояния рабочего тела, который пол
ностью сбалансирован внутри газотурбинной установки. Посредством
внешнего теплообмена с окружающей средой остается в камере сго
рания догреть воздух до температуры Тг, начиная с температуры Г б.
Соответственно, для приведения выходящих из установки газов при
температуре Г в к исходной температуре Г3, которую имеет всасы
ваемый воздух, остается изобарно доохладитъ их, что и происходит
естественным образом в атмосфере, служащей последним звеном для
превращения рабочего процесса в термодинамически круговой цикл.
Для оценки преимуществ регенеративного цикла достаточно по
смотреть на диаграмму Г - s , где показаны средние температуры
в процессах внешнего подвода и внешнего отвода тепла: Г , и Г2.
Если в цикле без регенерации эти две температуры близки друг
к другу, то при наличии регенерации они расходятся в разные сто
роны. Я сно , что цикл Карно, эквивалентный регенеративному циклу
посвоемук.п.д.,
является более выгодным, чем эквивалентный
обычному циклу. Разница между ними может быть весьма суще
ственной Разумеется, в действительных условиях нельзя реализовать
в полной мере количественного преимущества теоретического регене
ративного цикла, однако при всех поправках принципиального и
конструктивного характера это преимущество решает выбор схемы
г. т . у . в пользу схемы с регенераторами.
Термодинамика указывает на то , что усилить эффект регенерации
можно путем замены адиабатного сжатия в компрессоре изотермиче
ским. Н а практике к изотермическому процессу можно приблизиться,
применяя многоступенчатое сжатие с промежуточным охлаждением,
21 Зак. 3543. в. С . Жуковский.
322
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
(ОТД. VI
как было уже указано при обсуждении рабочего процесса компрес
соров. Если бы еще представилось возможным осуществить много
ступенчатое расширение с промежуточным нагревом воздуха (см. п . 5),
то при сочетании все х трех мероприятий можно было бы, с точки
зрения теории, получить к. п . д ., очень близкий к к. п . д . цикла
Карно. При строго изотермическом ходе сжатия и расширения и при
условии совершенной регенерации, к . п . д . газотурбинной установки
был бы в точности равен к. п . д . цикла Карно (см. п. 2).
Некоторые дополнительные замечания по по воду работы тепло
силовых установок будут сделаны в следующей главе, в связи
с обсуждением циклов паротурбинных установок.
ГЛАВА IV
ЦИКЛЫ ПАРОТУРБИННЫХ И ХОЛОДИЛЬНЫХ УСТАНОВОК
12.
Основной цикл паротурбинной установки. Основная схема
п. т . у . показана на рис. 122. Рабочее тело — вода — в результате
последовательного прохождения через котельный агрегат, турбину,
конденсатор и насос, совер
шает круговой процесс в точ
ном смысле этого термина.
Идеализированное изображение
этого кругового процесса дано
на рис. 123. Перегретый пар,
выдаваемый котлом, испыты
вает в турбине адиабатное рас
ширение до достижения проти
водавления, устанавливающего
ся в конденсаторе соответствен
но температуре охлаждающей
воды. Конденсат, образующий
ся вследствие теплоотвода от
отработавшего пара, забирается
насо сом , подвергается адиабат
ному сжатию и подается в к о
тел, где при постоянном дав
лении вновь превращается в перегретый пар, получая тепло со сто
роны газового тракта котла.
Следует иметь в виду, что все три картины на рис. 123 изо
бражены с нарушением единого масштаба. В координатах p - v
нижняя пограничная кривая сливается с осью ординат, если при ее
построении соблюсти принятый для верхней пограничной кривой
масштаб. Поэтому неотличимой от оси давлений оказывается и ли
ния сжатия 3—4 в насосе. В координатах T-s и i s точки 3 и 4
совмещаются в одну, так как адиабатное сжатие жидкости почти
ВП5ИСП6пп
Рис. 122.
В П —водоподогреватель; И С П —испаритель; П П —
пароперегреватель; Т —турбина; К —конденсатор;
Я —насос.
ГЛ IV|
ЦИКЛЫ П .Т .У . И ХОЛОДИЛЬНЫХ УСТАНОВОК
323
не изменяет ее температуры. Та к, при адиабатном сжатии от 50° С
на нижней пограничной кривой до 25, 100 и 200 am температура
возрастает, соответственно, только на 0 ,1; 0,35 и 0 ,71° С . В свою
очередь это приводит к совмещению линий изобары 4 — 5 с нижней
пограничной кривой. Поэтому рис. 123 может быть с достаточным
основанием замещен рис. 124. Это значит, что круговой цикл п. т . у .
можно практически считать составленным из д в у х изобар, адиабаты
и отрезка нижней пограничной кривой. Э тот основной цикл п. т . у . ,
встречающийся в литературе под названием цикла Ренкина имеет
фундаментальное значение в теории.
Соответственно первоначальному изображению цикла п . т . у .
на р и с. 123 удельная работа /0 за один цикл определяется как
разность между подведенным теплом ^подв = i%— 1А и отведенным
теплом q07B= i2— is :
Al0= fi fg— (*4— *з)«
(VI. 21)
Поскольку /4— /8 принимается за нуль, получаем:
AIq=
—
fg.
21*
324
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
Разумее тся , таким же образом определяется работа основного цикла
на рис. 124:
Al0= /j— /2.
(VI. 22)
Последнюю формулу можно еще получить как алгебраическую
сумму работ на отдельных участках цикла, вычислив непосредственно
интеграл от v d p в пределах от точки 2 до точки / , согласно диа
грамме p-v на рис. 124. Так как dq= di—Avdp (1.23), а про
цесс 1—2 является адиабатным, имеем:
1
Avdp= di\ AJvdp= ix—/2; Al0= lx—
a
Полезно учесть, что работу установки можно также определить,
оставляя без внимания во прос, является ли цикл круговым или не
круговым в термодинамическом смысле. В самом деле, механическое
взаимодействие рабочего тела с окружающей средой осуществляется
только в двух звеньях установки: в турбине и в насосе. Сквозь тур
бину протекает стационарный поток пара, имеющий во входном
паропроводе состояние 1 и в выходном — состояние 2. Между этими
сечениями процесс, по условию, адиабатен. Если из энергетического
баланса исключить изменение кинетической энер
гии, то, согласно (1.22), имеем для турбины
AlJtJ= ix—k .
(VI. 22а)
Соответственно, для насоса
AlTt„ =
/8— U.
(VI. 22Ь)
1^
Разность /3— /4 была положена равной нулю,
вследствие чего итоговая работа установки
*
равна исключительно работе, произведенной
турбиной, т . е . разности /, —
Графически
это выражается тем, что работа насоса , изо
бражаемая фигурой аЗ —4Ь на рис. 125, пре
небрежимо мала по сравнению с плошадью 4 — 1— 2 — 3 в координа
тах p - v . дающей на рис. 124 работу турбины. Количественное с о
отношение между этими двумя работами видно из такого примера.
Пусть всасывание в насос происходит при давлении 0,1 ат%а нагне
тание— при 20 am. Считая воду несжимаемой, получим затрату
работы на насос: 0,001 19,9 • 104/427 = 0 ,466 ккал\кГ, тогда как
отдача работы идеальной турбиной в том же диапазоне давлений
и при температуре пара в 350° С равна 222,5 кнал/кГ. Таким обра
зом, работа насоса составляет в данном случае менее 0,25°/0 от ра
боты турбины. Впрочем, в реальной установке относительная роль
насоса окажется несколько более значительной.
Рис. 125.
ГЛ. IV]
ЦИКЛЫ П. Г. У . И ХОЛОДИЛЬНЫХ УСТАНОВОК
325
Итак, удельная работа пара в установке определяется формулой
(VI. 22):
Л10= i1 /2.
Графически ее очень удобно определять, измеряя в масштабе длину
отрезка 1— 2 в координатах i s на рис. 124.
Что касается величины подведенного тепла в основном цикле,
то она на рис. 124 изображается площадью фигуры а4— 5 — б — lb
в координатах T s и разностью ординат в точках 7 и 3 в коор
динатах i s . Количество подведенной теплоты в действительной схеме
установки отличается от этой величины на выраженную в килока
лориях площадь треугольника 3— 4— 5 в координатах Г-5 и, соот
ветственно, на длину отрезка 3— 4 в координатах i s (рис. 123).
Эта разница не имеет практического значения, если давление в котле
не приближается к критическому давлению. В прочем, в принципиаль
ном отношении замена в энтропийных диаграммах ломаной линии
3 —4 —5 отрезком нижней пограничной кривой 3— 5 означает сущ е
ственное видоизменение действительной схемы установки, так как
заставляет предполагать наличие насоса, который одновременно сл у
жит и подогревателем воды. Однако качественное различие обоих
вариантов доведения воды до начала парообразования не приводит
к заметному количественному расхождению энергетических балансов.
Итак, в основном цикле
4додв= h
h=h V
Величину /8 можно обозначить как
откуда
?подв=Ч-£
(VI. 23)
С помощью формул (VI. 22) и (VI. 23) находим к. п . д . основного
циклап.т.у.:
^7^7'
(VI-24)
*1~” *3
Поскольку основной цикл воспроизводит с большой точностью
соотношения, имеющие место в типовой п. т . у . ,
целесообразно
произвести его всестороннее исследование.
Выясним прежде всего влияние противодавления р2 на удельную
работу и к. п . д . основного цикла. Из рис. 126 видно, что умень
шение противодавления /?2 (увеличение вакуума в конденсаторе) при
водит к росту удельной работы пара. В координатах p -v и T s
добавочная работа изображается заштрихованными площадками, а в к о
ординатах i s — отрезком 2— 2 '.
Эта добавочная работа получается
иеноюдополнительной
затраты теплоты, так как
поступающий
в котел конденсат оказывается более холодным. Однако разность
^лодв *— ?„одв меньше, чем разность АТ0— А10. Поэтому к. п. д . цикла
326
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
при уменьшении р 2 заведомо возрастает. Уменьшение р 2 особенно
эффективно, если p t не очень высоко и если в конденсаторе осуще
ствим высокий вукуум , так как изобары насыщенного пара сильно
Рис. 126.
расходятся в правой части диаграммы /-$. Взяв для примера
Рх= 30 am и^ = 420°С, получаем:
при /?2 = 0,16
0,12
0,08
0,04 am
Л/0 = 239
248
260
279 ккал!кГ
увеличение на 3,75
4,75
7,25%
^подв= ^7
733
741
753 ккал\кГ
y]0= 0,33
0,34
0,35
0,37
увеличение на 3
3
5,75%
В этой таблице увеличение А10 и т]0 дается в процентах от соответ-
ствующего предыдущего значения.
Приняв ту же начальную температуру tx = 420° С , но р г — 110 am,
находим:
при
/?2= 0,08
0,04 am
Л/q = 283
301 ккал/кГ
увеличение на 6 -g-%
W =709
721 к«ал1кГ
i)o = 0,40
0,418
увеличение на 4,5%
Как и следовало ожидать, относительная выгода увеличения вакуума
при новом, высоком начальном давлении уменьшилась.
В связи с рассматриваемым вопросом легко выявить роль кон
денсатора в схеме установки. В маломощных энергетических установ
к ах, а также на паровозах (имеются в виду паровозы с поршневыми
паровыми машинами) конденсатор обычно не ставится, вследствие
чего отработавший пар выпускается непосредственно в атмосферу,
а котел питается водой из естественного водоема или цистерны,
имеющей температуру окружающего воздуха. Рабочий процесс в уста-'
ГЛ. IV]
ЦИКЛЫ П. Т . У . И ХОЛОДИЛЬНЫХ УСТАНОВОК
327
новке перестает быть при этом термодинамически круговым циклом,
замыкаясь лишь в атмосфере, где выброшенный пар превращается
в холодную воду. Обозначив температуру питательной воды через /пв,
в этом случае получаем:
Здесь /2 — энтальпия пара в конце расширения. Я сно, что при таких
обстоятельствах работа и к . п . д . будут значительно меньше, чем
для конденсационной п. т . у . Так например, приняв р х = 30 am,
f1= 420° С , р 2 = 1 апг> *1111=10 ккал/кГу получаем:
Л/=172 ккал!кГ\ дгполв= 772 ккал/кГ; т)= 0,22.
Сопоставля я полученный результат с данными предыдущей таблицы,
находим, что по сравнению с основным циклом при р 2 = 0 ,04 am
удельная работа установки относительно уменьшилась на
279— 172
279
:38,4%, а к. п.д. на
0.37 — 0,22
0.37
40,5%.
Обратимся теперь к роли начального давления р х при постоянных
значениях tx и р2 (рис. 127). Из диаграмм p-v и Г-s, если они
Рис. 127.
построены не в масштабе, трудно усмотреть влияние p v Более на
глядна картина в диаграмме i s . В самом деле, изотермы перегре
того пара в правой части диаграммы почти горизонтальны, тогда как
изобары насыщенного пара наклонены. П о это м у при увеличении p t
(точка 1' вместо /) расстояние между этими линиями растет — работа
цикла увеличивается. Однако эта тенденция все более слабеет при
переходе р х в область сверхвысоких давлений, где изотермы пере
гретого пара начинают все более круто спадать: более того, при каком-
то определенном высоком значении p t дальнейшее его увеличение
вызовет падение работы цикла Л/0. Что касается подведенного коли
чества теплоты ^подв, то оно, как видно из рис. 127, с увеличением р х
неуклонно падает, и особенно сильно при переходе к высоким
328
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
давлениям. Таким образом, к . п . д . цикла должен расти при увеличе
нии р г и достигнуть максимума позднее, чем наступит максимум
удельной работы. Количественное влияние р х может быть обнаружено
из приведенного примера. Если ^ = 420° С и /?2= 0 ,04 am, то
при /?!= 30
110 am
Л/0= 279
301 ккал/кГ
увеличение на 7,9%
7додв = 753
721 ккал/кГ
Чо = 0,37
0,418
увеличение на 13%
Теперь нам остается выяснить влияние температуры перегрева tt
(рис. 128). И з всех трех диаграмм видно, что увеличение tx обусло
вливает увеличение удельной работы пара Л/0. Однако одновременно
растет и количество подводимого тепла qnQRJi. Тем не менее к . п. д .
цикла также растет. Э то вызвано, как легко видеть из диаграммы T -s ,
увеличением средней температуры теплоподвода при сохранении преж
него значения температуры теплоотвода. (Перегрев пара берется не
настолько большим, чтобы в конце расширения пар оказался пере
гретым.) И так , увеличение температуры перегрев* tx является дей
ствительным средством повышения экономичности установки.
Подводя итоги, можно сказать, что с точки зрения термодина
мики в п. т . у . выгодно: увеличивать начальные параметры пара р х
и tx перед турбиной и увеличивать вакуум в конденсаторе (умень
шать р2). Инженерная практика полностью руководствуется этими
указаниями. При этом окончательный выбор оптимальных папаметров
производится на основании сопоставления разных вариантов и их
термодинамической, конструктивной, экономической и эксплуатацион
ной оценок.
На рис. 129 приведен сводный график, из которого видно влия
ние отдельных факторов на к. п. д основного цикла п. т . у . Противо
давления выше 1 am применяются в установках, где отработавший
ГЛ. IV]
ЦИКЛЫ П . Т . У . И ХОЛОДИЛЬНЫХ УСТАНОВОК
329
пар используется для отопления (теплофикационные установки) или для
технологического производства (в текстильной, пищевой промышлен
ности). Э то т случай имеет место и при работе на паре очень высо
кого давления, когда за котлом помещается специальной конструкции
предвключенная турбина, выбрасывающая пар среднего давления
в обычную турбину.
В устано вках с противодавлением теплофикационного типа вели
чина г)0 дает неполное представление о степени использования затра-
Рсбочеедавление
Рис. 129.
ченной теплоты. Так например, каков бы ни был термодинамический
к. п . д . теплофикационной установки, рассматриваемой как тепловой
двигатель, эта установка вместе с сетью теплового потребления может
дать полное использование подведенного к воде тепла, если бы у д а
лось тепло, не превращенное в рабо ту , без остатка использовать
для нужд отопления. Так как, однако, наиболее ценным продуктом
в любой комбинированной теплосиловой установке является механи
ческая (электрическая) работа, то повышение экономичности той
части установки, которая в качестве теплового двигателя предназна
чена для производства работы, всегда остается первоочередной за
дачей. Обсуждение таких вопросов производится в специальных
курсах.
Остановимся еще вкратце на образцовом цикле установок с поршне
выми машинами. Поршневая машина, в которой расширение пара
должно дойти до глубокого вакуума, имеет неконструктивные раз
меры. Так, если принять pj = 20 am, /j = 350°C и pQ= 0,06 am,
то ^ ,^ 0 ,1 4 мъ,кГ и ‘Г/о^20 л/3,л;Г, т. е. ход поршня должен более
чем в 140 раз (при отсутствии вредного пространства) превышать
отрезок наполнения. В этом смысле при ведении расширения только
330
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
до атмосферного давления таких затруднений не возникает, так ка к,
соответственно, г>2 « 1 , 6 м*1кГ, и объем цилиндра должен быть всего
в 11 ,5 раза больше объема подаваемого пара, что вполне реализуемо.
Мы видели, однако, что отказ от применения вакуума означает гро
мадное недополучение работы. Поэтому там, где это только возможно,
принимается компромиссное решение, т. е . осуществляется вакуум,
но зато расширение пара в цилиндре обрывается задолго до д ости
жения предельно возможного объема (рис. 130). Э то решение анало
гично тому, которое принимается при переходе от циклов г. т . у .
к циклам д. в. с.
Обсуждение основного цикла п. т . у . закончим замечанием по
поводу работы турбины. Поставим вопрос, в каком отношении нахо
дится работа турбины к той максимальной работе, какую способен
произвести паровой поток, выдаваемый котлом? Ответ на этот вопрос
совершенно обходит условия воспроизводства процесса, т . е . задачу
о наивыгоднейшем способе получения пара из питательной воды.
Итак, допустим, что по трубопроводу течет перегретый пар дав
ления pj (рх) и температуры tt (tх). Окружающая среда характери
зуется параметрами р 0 и t0. П о ско л ьку давление атмосферы колеблется
около 1 am и ее температура не достигает точки кипения воды при
этом давлении, равновесным по отношению к окружающей среде
состоянием воды является жидкое состояние.!) Таким образом, в фор
муле (V. 6а)
Л/мт= iA—iB—Т0(sa—$в)
величины 1В и sB следует относить к жидкой воде при /в = /0
*) В случаях, когда окружающая среда имеет температуру /0, более низ
кую, чем точка плавления, было бы теоретически оправданным полагать воду
в равновесном состоянии в виде льда. Однако такая предпосылка при ре
шении задачи о паровом двигателе весьма далека.от технической реальности.
Здесь можно сослаться хотя бы на тот факт, что в морозное время приемни
ком тепла в промышленных установках с искусственной конденсацией
пара может служить незамерзшая вода (из водопровода, пруда и т. п .), тем-
е ратуру которой и следует, в сущности, отождествлять с /q. Таким обра-
ом, практически всегда имеем /0>0 °С .
гл. IV]
ЦИКЛЫ П. Т . У . И ХОЛОДИЛЬНЫХ УСТАНОВОК
331
и рв — ро- Вид рабочего процесса схематически показан на рис. 131
в предположении, что в конце адиабатного расширения (точка т)
пар становится насыщенным. Рассмотрим совместно все три диаграммы.
Адиабата, начинающаяся в точке А (/), должна быть доведена
до достижения паром температуры /в = t0, что для водяного пара
Ро^о
Насосу
ЛА
Двигатель
Конденсатор
_
_
_
_
_
PmJo
Охлаждаю
щаявода
возможно лишь при создании надлежащего разрежения (рт < р0).
Выравнивание температуры пара и окружающей среды необходимо,
разумеется, в целях обратимости последующего процесса теплообмена.
Линия 1 — т изображает изменение состояния пара, происходящее
в турбине. О тработавший в тур
бине пар не может быть вы-
_________ Магистраль_____
брошен непосредственно в ат
мосферу, так как он имеет по
ниженное против нее давление.
Поэтому выхлоп пара должен
быть производим в конденса
тор. Проц есс конденсации изо
бражается отрезком тп. За
конденсатором ставится насос.
Его назначение не ограничи
вается только поддержанием ва-
Рис. 132.
куума в конденсаторе, но также
вытекает из необходимости изотермического приведения воды к атмо
сферному давлению р в = р0 > р т. Сжатие в насосе показано линией п В .
Таким образом, для получения от пара максимальной технической ра
боты необходимо располагать установкой, состоящей из трех звеньев:
турбины, конденсатора и насоса (рис. 132).
Описанная выше установка может быть в принципе сведена к
одному единственному цилиндру с подвижным поршнем, в котором
последовательно совершаются процессы наполнения паром (а А ), р а с
ширения (Ат), конденсации (тп), сжатия воды (пВ) и выталкивания
воды в атмосферу (Вд). Однако более наглядной является схема из
двух цилиндров (рис. 133). Первый играет роль расширителя-кон
денсатора (наполнение, расширение, конденсация и выталкивание ко н
денсата в соединительный резервуар), второй служит насосом (вса-
332
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
сывание конденсата, сжатие и выталкивание в атмосферу). Суммарная
работа этого агрегата изображается разностью площадей, заш тр ихо
ванных вертикальными и горизонтальными линиями. В отношении вели
чины работы совершенно несущественно, происходит ли действительно
в первом цилиндре конденсация пара или ж е , начиная от точки т ,
идет простое выталкивание пара без изменения его состояния, кото
рое (изменение) наступит
лишь в особом конденсато
ре, включенном между рас
ширительным цилиндром и
насосом.
И з изложенного ясно, что
максимальная техническая ра
бота парового потока в диа
грамме p-v на рис. 131
изображается разностью пло
щадей, заштрихованных на
клонными и горизонтальны
ми линиями. Обратим теперь
внимание на то, что работа
конденсатного насоса, вы
талкивающего воду в окружающую среду, очень мала по сравнению
с работой двигателя (расширителя-конденсатора). В диаграммах T s
и i s это проявляется в практическом совпадении точек В с со о т
ветствующими точками п на нижней пограничной кривой. О тсюда на
основании формулы (VI 6а) следует, что максимальная техническая
работа в координатах T s изображается наклонно заштрихованной
площадью. В координатах i s величина А1Ы1 изображается практи
чески отрезком 1 — т . Итак, с точностью до затрачиваемой на кон
денсатный насос работы, максимальная техническая работа паро
вого потока равна изоэнтропическому падению функции i («теп
ловому перепаду») между начальным состоянием (/>д, U) и
наинизшей температурой пара t0, заданной окружающей средой:
Aim = Ца iw)e•
Впредь, как было принято, мы буд^м обозначать начальное со
стояние рабочего пара не буквой А , а цифрой 1 , ввиду чего
Л/мт = (i1- i m)a.
(VI. 25)
Зная возможную максимальную работу, можно судить о влиянии
всяких отклонений от наивыгоднейших условий. Для этого необходимо
лишь вспомнить и уточнить ранее упоминавшиеся формулы для техни
ческой раб /гы (не максимальной) по тока. И з (1.22) при пренебрежении
кинетической энергией потока и при условии адизбатности следует:
Alj=(it—/2)>
(VI. 26)
т, е. техническая работа потока при адиабатном расширении
Насос
PoJo
4.
Р
к*
Магистраль
'P,,h
Е Расширитель'
конденсатор
' PmJo
Р
а}
jn
Рис. 133.
ГЛ. IV]
ЦИКЛЫ П .Т .У . И ХОЛОДИЛЬНЫХ УСТАНОВОК
333
равна падению функции i меж ду начальным состоянием (p v tx)
и соответствующим конечным состоянием, произвольно заданным
по давлению /?2 или температуре /2. Формула (V I. 26) справедлива
независимо от то го , является ли адиабатное расширение обратимым
или необратимым. Однако в последнем случае адиабата отклоняется
в сторону возрастающих энтропий (s2 >
причем степень откло
нения термодинамически определена быть не может. П оэтому при
необратимом адиабатном расширении конечное состояние должно быть
задано не одним только параметром, а двум я: давлением и темпера
турой, если пар остается перегретым, или давлением и сухостью,
если пар стал насыщенным.
Влияние необратимости показано на рис. 134, где первый, идеаль
ный вариант обозначен цифрами 1— 2 ' и отвечающая ему работа —
через Ж , так что
= (ix— i2)8= i\— **2- (VI. 26а)
Отношение 4//мт назовем иде
альным коэффициентом произ
водительности 7)цр, а отноше
ние /т//мт действительным ко эф
фициентом производительности
7]др турбины:
/__^в
_
_
**
^пр— “7“!
’Пир —
• (VI. 27)
*МТ
*NT
Коэффициенты производительно
сти характеризуют совершенство
процесса производства турбиной
работы при заданных параметрах
приемника. Величина
называется относительным внутренним к . п . д . турбины. Н а вели
чине 7]цр в сильнейшей степени сказывается температурный напор
между паром и охлаждающей водой, который приходится допускать
в конденсаторе, учитывая условия теплопередачи в реальных кон
струкциях. Что касается коэффициента г\0{9 то он для конденсацион
ных турбин средней мощности имеет величину порядка 8/4. О б с у ж
дение мероприятий по увеличению производства работы в турбинах
возможно только в специальных курсах.
13.
Методы приближения цикла п. т . у . к циклу Карно. Из
изложенного ясно, что при задании начальных параметров пара и
противодавления основной цикл п . т . у . является циклом, в котором
334
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
производимая работа имеет максимальное значение. В этом смысле
основной цикл представляется наивыгоднейшим. Однако этот цикл не
является наивыгоднейшим в отношении термодинамического к. п. д . ,
так как оптимальным к. п . д . обладает цикл
Карно.
Расхождение между т)0 и т]К прежде всего
рассмотрим на численном примере. Для
рх= 30 ату tx= 350°С, р2= 0,04 am мы
имеем:
743,6 — 485 ___л оап
7)0— 743,6 —28.6
—
0,352 *
При тех же условиях (/2= 28,6 °С)
301,6
Т]к= 1
623
: 0,516,
ш 0 300 350*? т. е. на 42,5% выше к. п. д. основного
^ ----- '----- 1
цикла п. т. у.
'
'
Н а рис. 135 показано соотношение между
Рис. 135.
обоими
коэффициентами при выбранных
р х и р 2. Мы видим, что наибольшей близости
они достигают при работе на сухом насыщенном паре, тогда как
при перегреве пара превышение г\к над v\Q чрезвычайно резко увели
чивается.
Причины указанного расхождения между циклом Карно и основ
ным циклом п. т . у . заключаются в следующем. П о определению,
цикл Карно выполняется при таких условиях: 1) изменения состояния
рабочего тела обратимы, 2) совершаемый рабочим телом процесс
термодинамически замкнут, 3) рабочее тело вступает в теплообмен
с окружающей средой только на д вух температурных уровнях. П ер
вые два условия в основном цикле п. т . у . соблюдаются. Однако
третье условие не выполняется, ибо подогрев жидкости и перегрев
пара не являются изотермическими процессами. С точки зрения при
ближения к циклу Карно эти два процесса являются нежелательными.
О тсю д а ясно, что при исключении перегрева пара и при сохранении
только одного неизотермического процесса — подогрева жидкости —
величина t)Q может близко подойти к соответствующему значению щ .
Перегретый пар имеет много технических преимуществ перед насы
щенным и прежде всего позволяет увеличить абсолютную величину
к. п . д . Поэтому отказ от его применения на основе односторон
них соображений о возможности подтягивания yj0 к щ совершенно
исключается. С другой стороны , прямое осуществление взамен под о
грева жидкости адиабатного сжатия влажного пара с расчетом,
чтобы он при достижении рабочего давления нацело сконденсировался,
также нецелесообразно. При таком решении следует за конденса
тором иметь пароводяной ком прессор, отличающийся большими габа
ритами и потребляющий относительно двигателя значительную мощ-
ГЛ. IV]
ЦИКЛЫ П. Т . У. И ХОЛОДИЛЬНЫХ УСТАНОВОК
335
ность, которая при учете потерь в обеих машинах сводит на нет
термодинамическое преимущество схемы . Есл и прибавить сюда труд
ность точной дозировки влажности насыщенного пара, у гр о зу раз
рушительных водяных ударов в конце сжатия и подобные обсто я
тельства, то станет ясна безнадежность выполнения этой части цикла
Карно в реальной обстановке.
Таким образом, устранение в круговом цикле неизотермического
подогрева воды при подведении теплоты из внешней среды может быть
выполнено лишь непрямым путем. Однако каков бы ни был этот
путь, поднятие термодинамического к . п . д . выше т)0 может быть
достигнуто лишь ценою недополучения удельной работы по сравне
нию с работой основного цикла, определенной начальным состоянием
пара, противодавлением и свойствами вещества.
Указанный выше непрямой путь заключается в регенеративном
подогреве питательной воды, в связи с чем весь цикл называется
регенеративным. Особенность этого цикла сводится к тому, что кон
денсат частично подогревается за счет внутренних источников тепла,
которыми можно располагать внутри самой системы. Такими источни
ками являются ответвления парового потока от прямого пути через
машину или турбину , используемые не для получения работы, а для
простого переноса тепла от пара к питательной воде. Для ясности
обратимся к схеме на рис. 136. Э та схема не является единственно
возможной, однако принципиальную сторону задачи она разъясняет
полностью.
В качестве двигателя примем паровую турбину, разделенную на
три части: высокого, среднего и низкого давления. Поступающий из
котельного агрегата пар имеет давление р г и температуру tx; давле
ние в конденсаторе р 2. Положим теперь, что не весь генерируемый
пар проходит в неизменном количестве через турбину, так как в пре
делах каждого из трех цилиндров турбины производится частичный
отбор пара. Из 1 к Г рабочего пара после какой-либо ступени высо
кого давления отбирается g a [кГ\ при давлении р а\ затем после не
которой ступени среднего давления —
при давлении рь и,
наконец, вблизи выхода пара из турбины — g c [кГ\ при давлении р с .
Таким образом, в конденсатор входит только g = l —(ga &+ g c) [кГ\
отработавшего пара.
Образующийся конденсат, имеющий температуру /2, равную тем
пературе насыщенного пара при давлении /?а, специальным конденсат
ным насосом подается в сборный резервуар питательной воды. О тб и
раемый пар из турбины направляется в три водоподогревателя, кон
денсируется там и поступает, минуя дроссельные вентили, в тот же
сборный резервуар, имея параметры, показанные на схеме. П осле
смешения потоков конденсата в резервуаре устанавливается темпера
тура /, при которой вода забирается питательным циркуляционным
насосом, возвращающим котлу килограмм воды. По пути вода последо
вательно проходит через три подогревателя, нагреваясь, в идеальном
336
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
случае, сначала до fj, а затем до % и, наконец, до
В итоге пита
тельная вода поступает в котел не при температуре конденсатора,
а при гораздо более высокой. Чем ближе к вхо ду в турбину произ
водится отбор пара, тем меньше отличается температура питательной
воды от температуры в котле. Такова в общих чертах схема уста
новки с промежуточным отбором пара.
1кГ
Рис. 136.
Наметим теперь некоторые количественные зависимости, характе
ризующие новый рабочий процесс. Идеальная работа турбины, отне
сенная к 1 к Г рабочего пара, не будет равна теперь 1Х— /а калориям,
так как основной поток пара имеет несколько ответвлений. Обозна
чая теоретическую работоспособность пара до места первого отбора
через Дiv между местами первого и второго отбора — через Д/а и
т. д . , находим, что
М = А/,+ (1—ga)bii+Q —ga—gb)А‘з+ (!—ga—gb—gc)д*4- (а)
Мы видим, что и числитель и знаменатель формулы для yi = Al/qnoAB
при работе по описанной схеме получают значения, меньшие чем
ГЛ iv]
ЦИКЛЫ П .Т .У . И ХОЛОДИЛЬНЫХ УСТАНОВОК
337
в простой установке. Вопрос о направлении изменения rj решим сна
чала непосредственным расчетом. В качестве заданных параметров
примем: р19 tv р2, ра, рь и рс. Пусть для примера /^ = 30 am,
/1==350°С, р2= 0,04 am, ра= 7 am, рь= 2 am, рс= 0,5 am.
П о диаграмме i s находим (округляя до единиц):
/х= 744, ia= 663, /ь= 610, /с= 560, /2= 485.
Следовательно,
= 81, Д/2 = 53, Д/3= 50, Д/4= 75 ккал1кГ.
Поэтому
81+ (1—ga)53+ (1—ga—gb)50+ (1—ga—gb—gc)75
•
744 — 166
Таким образом , мы приходим к необходимости найти удельные
количества отбираемого пара g a, g b и g c. Для этого решим систему
уравнений:
&»-Ьёь-Ь
-Ь£—i»
(1)
(ga+£ь+ge)С+No=i,
(2)
g а(г'а
^а)
ia
(3)
gb(h—i'b)+gaОа—i'b)=i'b — ie,
(4)
gc(*0—Ic)+ (ga~\ ~gb)Об—i'c)=4—/.
(5)
Уравнение (1) есть уравнение материального баланса установки.
Уравнение (2) есть уравнение теплового баланса для сборного резер
вуара конденсата. Наконец, уравнения (3), (4) и (5) являются урав
нениями теплового баланса для водоподогревателей-регенераторов.
Кроме трех основных неизвестных g a, g b и g c, в этой системе урав
нений содержатся еще две неизвестные: g и /.
Из диаграммы i-s имеем: /а=166, /&=120, /с= 81, /а= 28,6.
Поэтому из (3) и (4) получаем:
8а—
£>> =
166 120 ___q 0925*
663-166 “
°’0925’
120—81
—
0,0925(166— 120) _ _ 34,75
610— 120
490
= 0,071.
Подставляя найденные величины g a и gb в (5), находим:
gc(560—81)-f 0,1635(120—81)= 81—
/= 74,6 — 479g*c.
Это выражение для I вводим в (2), учитывая также ( 1):
(0,1635+ gc)81+ (0,84—gc)28,6 = 74,6 —479^
откуда
g__М* __0,0704.
Se 531
’
22 эм. 3543. В. С . Жуковой*.
338
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
Следовательно,
_
_
81 + 0.908.53 + 0.84 - 50 + 0.766.75 _ 228.5
ол сП/
•q—
744 — 166
—
578 — °’dy5—dy,t>/о*
Для основного цикла мы имеем, соответственно, yj0 = 3 6 ,2 % и
для цикла Карно vj = 51,6 °/0.
Оценим теперь полученный результат. С помощью отбора пара
в трех местах турбины и использования его для подогрева конден
сата представилось возможным повысить температуру питательной
воды от 29 до 164Э С . При этом термодинамический к . п . д . возрос
от 36,2 до 39,5%, т. е. на 9,1%. В обычной установке, работаю
щей по основному циклу, такой эффект мог бы быть достигнут лишь
при давлении порядка 60 am (вместо принятых 30 am).
Преимущество регенеративного принципа в отношении его к . п . д .
достигается ценой увеличения мощности котла. Действительно, р а
бота на 1 к Г пара заданных начальных параметров из-за примене
ния регенерации уменьшается. О на в нашем примере становится
равной 228,5 к к а л ,к Г , тогда как для основного цикла она равна
259 кк а л \ кГ . П о сравнению с последним регенеративный цикл тре
бует увеличения расхо д а пара на турбину требуемой мощности на
100 *(259— 228,5)/228.5 = 13,4% . Э го обстоятельство не должно
казаться противоречивым, так как нужно учесть, что для получения
1 к Г пара при устройстве регенерации нужно затрачивать меньшее
количество теплоты: вместо 715 н кал/кГ всего только 578 мсал/кГ,
т. е. меньше на 100 •(715— 578) •715 = 19,2%. В итоге на турбину
заданной мощности в регенеративном цикле потребуется затрачивать
теплоту, которая в отношении к затрачиваемой в основном цикле
составляет 113,4 *(1— 0,192) = 91,7%. Это значит, что к. п. д .
регенеративного цикла составляет (1/0,917)= 1,091 от к. п . д . основ
ного цикла, что мы и констатировали с самого начала.
Остается еще выяснить из общих соображений, почему к . п . д .
регенеративной установки, превосходя к . н . д . основного цикла,
все же остается далеко позади к. п . д . цикла Карно? Применение
регенерации увеличивает к . п . д . по тому, что сокращается неизотер
мический процесс подогрева воды извне подводимым теплом. Однако
этот неизотермический процесс подогрева воды не устраняется пол
ностью (в нашем примере вода догревается путем внешнего тепло-
подвода от 164 до 233° С). Кроме того, остается прежним неизо
термический процесс перегрева пара. Поэтому разрыв между реге
неративным циклом и циклом Карно продолжает быть очень
большим.
Легко видеть, ч то, отказавшись от перегрева пара и устраивая
первый отбор пара ближе к входу пара в турбину, можно сделать
неизотермический процесс подогрева воды внешним теплом сколь
угодно коротким. Есл и, кроме того, вообразить бесконечно большое
ГЛ. IV]
ЦИКЛЫ П. Т . У . И ХОЛОДИЛЬНЫХ УСТАНОВОК
339
30ат.350'С
число отборов, первый из которых будет находиться непосредственно
у входа сухо го насыщенного пара в турбину, то можно будет притти
к к. п . д . цикла Карно, как будет разъяснено ниже.
Рассмотрим теперь регенеративный цикл в тепловой диаграмме.
Нужно подчеркнуть, что линии в этой диаграмме отображают реаль
ные изменения состояния только в том случае, если количество рабо
чего вещества остается постоянным. П о это м у построение регенера
тивного цикла паросиловой
установки в координатах Г-$
сопряжено с частичной уте
рей физического соответ
ствия между картиной и дей
ствительностью.
На рис. 137 показан
с приблизительным соблюде
нием масштаба регенератив
ный цикл при рассмотрен
ных выше параметрах. О сн о
ва диаграммы построена из
расчета на 1 кГ пара. Точ
ка а отвечает месту перво
го отбора (7 am). Если и за
этим местом в турбине пр о
должал бы расширяться 1 к Г
пара, то до достижения дав
ления второго отбора (2 am)
работа измерялась бы ф и гу
рой паахпх. Поскольку в дей
ствительности в турбине ра с
ширяется только 1 —ga (т. е.
0,9075) к Г пара, изобразим
фактически произведенную
работу меньшей фигурой
nbcnv Точки b и с получе
ны разделением отрезков па
и пхах в отношении (1 — ga) : 1 (т. е. 0 ,9075:1). Линия Ьс практически
является прямой. За вторым отбором до места третьего (0,5 am) в турби
не проходит 1 — ga— gb (т. е . 0,8365) кГ пара. Поэтому вместо работы
одного килограмма, изображаемой фигурой пха ха^п^ фактически п ро
изводится работа, соответствующая фигуре n xden2> где точки d и е
делят отрезки пхах и л2а2 в отношении (1 — ga— gb): 1(т. е. 0,8365:1).
Точно так же получаем фактическую работу пара между третьим
отбором и конденсатором (0,04 am) в виде фигуры nqfgm , где то чк и /
и g делят отрезки я2а2 и m2 в отношении (1 — ga— gb— g*c):l
(т. е . 0 ,7661:1). В итоге работа, приходящаяся на 1 кГ впускаемого
в турбину пара, получается в виде площади m oplabcd efgm , а недо-
Рис. 137.
22*
340
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
полученная работа по сравнению с основным циклом — в виде пло
щади abcdefg2a.
Рабо ту регенеративной паросиловой установки можно принять
за результат выполнения воображаемого термодинамически-кругового
цикла, образованного вышеуказанной фигурой, и приравнять соответ
ствующей разности подведенного и отведенного количеств теплоты.
При этом, как уже бывало в подобных случаях, на некоторых участ
ках воображаемого кругового цикла количества теплоты окажутся
фиктивными, не отвечающими действительному теплообмену. Здесь
фиктивный смысл имеет количество теплоты, изображаемое заштри
хованной площадью под ступенчатой линией ab cd efg, подобно тому
как условной является сама эта линия, дающая превратное предста
вление об адиабатном процессе между первым отбором пара (точка а)
и конденсатором (точка 2).
Чтобы разобраться в картине, представим себе на время, что
отбираемый пар не используется для подогрева конденсата, а попросту
выпускается в атмосферу. Тепло, фактически отведенное от рабочего
тела в конденсаторе, изобразится прямоугольником под линией mg>
тогда как подведенное в котлоагрегате тепло изобразится площадью
под линией m o p l. О чевид но, для получения действительной работы
приходится ввести дополнительный, фиктивный, теплоотвод, который
заместил бы собою потерю работы из-за последовательного умень
шения количества проходящего через турбину пара.
Вернемся теперь к предположению, что отбираемый пар идет на
подогрев конденсата. О тбросное тепло в конденсаторе останется преж
ним, т. е . измеряемым прямоугольником под линией mg. Однако
количество извне подведенного тепла сократится, так как теплоту,
изображаемую заштрихованной площадью под линией т пу доставит
воде не котлоагрегат, а греющий пар из отборов, который является
внутренним источником тепла. Отсюда следует, что площадь под
ступенчатой линией a b cd efg должна представлять количество теплоты,
отдаваемой отборным паром воде в регенераторах, т . е . что заштри
хованные фигуры взаимно равны. Таким образом , правая фигура
приобретает при наличии регенеративного подогрева в некотором
отношении реальный смысл, но только не в связи с тем процессом,
который совершает пар, проходя через турбину.
В тепловой диаграмме наглядно видно соотношение между числом
отборов пара и к. п . д . регенеративного цикла. Если бы при приня
тых ранее основных параметрах цикла был устроен только один
отбор в состоянии а , мы имели бы
£а
166— 28,6
663 — 28,6
0,217.
Соответствующая работа за один цикл определялась бы площадью
m o p laklm , а подведенное извне тепло — попрежнему площадью под
ГЛ. IV]
ЦИКЛЫ П .Т . У . И ХОЛОДИЛЬНЫХ УСТАНОВОК
341
линией tiopl. Ясно, что в таком варианте к. п . д . будет ниже, чем
в первом варианте, так как недополученная работа аЫ2 возрастет.
Напротив, при увеличении числа отборов пара недополученная работа
уменьшается. При стремлении числа отборов к бесконечности с т у
пенчатая линия приближается к линии a h y равноотстоящей от отрезка
нижней пограничной кривой т п%причем точка I приходит к точке h.
В выражении к. п . д . числитель, т . е . работа цикла, оказывается
наибольшим возможным при фиксированном значении знаменателя —
подведенной в котлоагрегате теплоты. Физической причиной увеличе
ния работы цикла при увеличении числа отборов пара является
ослабление вредной внутренней необратимости процессов теплообмена
благодаря уменьшению действующих температурных напоров между
греющим паром и нагреваемой водой. При бесконечно большом числе
отборов к . п . д . нижнего яруса цикла, где осуществляется регенера
ция, равен к. п. д . соответствующего цикла Карно, что было отме
чено уже выше.
Совершенно иная принципиальная возможность приближения к циклу
Карно заключается в выборе в качестве рабочего тела не воды, а дру
гих термодинамически более подходящих веществ. Очевидно, преиму
щество должно принадлежать таким веществам, которые в энтропий
ных диаграммах имеют возможно более отвесную нижнюю пограничную
кривую и, кроме того, и прежде всего, критическую температуру,
значительно превышающую tR для воды. Первое свойство, связанное
с малым значением теплоемкости жидкой фазы, должно привести
к слабому отклонению процесса подогрева жидкости от адиабаты.
Второе свойство должно позволить избежать перегрева пара, ибо и
насыщенный пар может находиться при столь больших температурах,
какие только допустимы для механической прочности металлов
(550— 600 ° С ). В ысокое расположение критической точки в диаграмме
Г- s обусловливает к тому же возможность при работе на очень
горячем насыщенном паре получать не слишком малую удельную ра
боту цикла, если только теплота парообразования не является малой
величиной уже при нормальной температуре. Практически опробован
ным рабочим телом этого типа является ртут ь.
Теплоемкость жидкой ртути при 200° С и атмосферном давлении
равна 0,0325 ккал]кГ 2 раду теплота парообразования до 600° С изме
няется слабо и имеет величину порядка 70 кк а л !кГ . Температура
кипения ртути равна 357° С , а критическая точка ртути находится
при ^ = 1460° С и pR= 1077 am. Температуре 500° С отвечает для
ртути давление насыщения всего в 8 ,34 ат 9 что также чрезвычайно
удобно, ибо облегчает конструкцию котла и турбин по сравнению
с теми, которые рассчитаны на водяной пар высокого давления.
Точка затвердевания ртути при атмосферном давлении лежит около
—
39° С , т. е . ниже, чем для воды. Высокий удельный вес жидкой
ртути позволяет при расположении ртутного котла под конденсато
ром избежать применения питательного насо са , так что циркуляция
342
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
в схеме может происходить благодаря одной только разности весов
ртутного заполнения в подъемном и опускном контурах. Разумеется,
ртуть имеет свои недостатки. К ним относятся: малая относительно
воды теплота парообразования, дороговизна ртути, ее ядовитость,
скверная теплоотдача к кипящей ртути (вследствие несмачиваемости
ею чистых стенок кипятильных труб) и ряд других более или менее
существенных дефектов.
При температуре окружающей среды ртутный пар имеет чрезвы
чайно низкое давление. Т а к , давление насыщения его при 30° С изме
ряется высотой ртутного столба в 0,003 мм, тогда как для воды, со
ответственно, имеем 31,81 мм ,
т. е. в 10 600 раз больше. По
этому , хотя молекулярный вес
ртути и превышает молекуляр
ный вес воды в (200,6/18) =
=
11,15 раза, отношение удель
ных
объемов
(vwJ vh$o) ~
=
(10 600/11,15) = 950, т . е .
ртутный пар занимает почти
в 1000 раз больший объем, чем
водяной пар. Это означает прак
тическую невозможность вести
расширение ртутного пара до
достижения им обычной темпе
ратуры охлаждающей воды, ибо
габариты машин и сечения па
ропроводов должны были бы
достигать невероятных разме
ров. Так как, однако, полное использование естественных приемников
тепла необходимо в целях увеличения термического к . п . д . , то у к а
занное важнейшее затруднение приходится специальным образом о б х о
дить. Решение задачи заключается в создании бинарного цикла, к о
торый является сопряжением д ву х раздельных ц иклов: ртутного и
водяного.
Простейшая схема бинарного цикла приведена на рис. 138. Т ол
стыми линиями показан замкнутый на себя ртутный контур, со сто я
щий из котла, турбины, конденсатора, насоса (его можно избежать)
и экономайзера (ртутного подогревателя). Если котел выдает насы
щенный ртутный пар при 500° С , то его давление равно 8 ,34 am .
В турбине пар может, например, срабатываться до 250° С , чему отве
чает давление 0,1 ат . Очевидно, скрытую теплоту, отнимаемую в ртут
ном конденсаторе при столь высокой температуре, можно использо
вать для парообразования воды при давлении порядка 35 ат , в связи
с чем конденсатор в ртутном цикле надлежит рассматривать как
испаритель в водяном цикле. Э т о т последний никаких отличий от
обычного основного цикла п. т . у . не имеет.
Рис. 138.
/ — к о т е л ; 2—турбина; 3—конденсатор-испаритель;
4—насос; 5 —перегреватель; б— турбина;/ —кон
денсатор; 8—насос; 9 —экономайзер.
ГЛ. IV]
ЦИКЛЫ П .Т .У . И ХОЛОДИЛЬНЫХ УСТАНОВОК
343
Для улучшения термического к. п . д . схему установки можно
усложнить. Регенеративный подогрев ртути большой эффективности
не может принести и во избежание усложнений не применяется.
Однако в водяной части он полностью сохраняет свою целесообраз
ность.
На рис. 139 показана тепловая диаграмма примерного бинарного
цикла. Она отнесена к 1 кГ воды и 9,37 кГ ртути. Приблизительно
таким обычно должно быть со -
Г
Ртупи
1500°СЫ7ат\
отношение между количествами
обоих веществ, ибо теплота
конденсации ртути рассчиты
вается на превращение воды
в су хо й пар (при температуре
на 10— 15° С меньшей, чем
с ртутной стороны конденса- 4
тора-испарителя). В данном | ^
случае теплота ртути р асхо- 7
дуется на подогрев воды от
температуры, соответствующей
точке q,до235°С инаеепо
следующее
парообразование.
В области под указанным тем
пературным уровнем подогрев
воды предположен регенератив
ным при бесконечно большом
числе отборов. Ввиду этого
адиабатное расширение водя
ного пара условно показано
линией <7/, равноотстоящей от
нижней пограничной кривой и,
следовательно, ограничивающей сверху такую же площадь. В водяной
ступени предусматривается так ж е, как обычно, перегрев пара. О н может
быть осуществлен за счет использования энергии отходящих из ртут
ного котла топочных газов.
Затраченное извне тепло изображается площадью под линией abc
(ртутный экономайзер и котел) плюс площадь под линией f g (водя
ной пароперегреватель). В долях этого количества теплоты при п о
казанных на диаграмме параметрах 27,4 °/0 превращается в работу
в верхней ступени, 29,4% — в работу в нижней ступени и 43,2%
выбрасывается в виде тепла в окружающую среду. Таким образом,
при идеальном течении процессов термодинамический к . п . д . уста
новки т)= 56,8% при т)к= 60,5%.
Действительная эффективность установки должна быть, конечно,
меньшей, однако при любых условиях она намного превышает эф фек
тивность пароводяных схем и соответствует показателям лучших дви
гателей внутреннего сгорания.
М1ккал/кГгра(1
Рис. 139.
344
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
Ведущим институтом в Советском Со ю зе, где под руководством
А . Н . Ложкина разрабатываются вопросы, связанные с бинарными
установками, является Центральный научно-исследовательский котло
турбинный институт им. И . И . Ползунова (ЦКТИ — Ленинград). Этот
институт, как и Всесоюзный теплотехнический институт им. Ф ЧЭ . Д зер
жинского (ВТИ — Москва), а также Энергетический институт Акаде
мии наук СССР (ЭНИН АН СССР), систематически занимается про
блемами сложных теплосиловых циклов. Н а этом пути у нас имеется
немало достижений, о которых следует говорить в специальных кур
сах. В частности, мы здесь не касаемся парогазовых циклов, кото
рые являются вполне перспективными.
14.
Циклы холодильных установок. Мы уже имели случай уста
новить, что прототипом холодильных установок является машина,
работающая по обратному циклу Карно. Непременным условием про
изводства холода, т. е . извлечения теплоты из тела, более холодного,
чем окружающая среда, служит затрата работы. Этот принцип соблю
дается непосредственно в холодильных установках, называемых ко м
прессионными,. В свою очередь эти, имеющие наибольшее распр остра
нение, компрессионные установки делятся по роду холодильного агента
на воздушные и паровые. В последних применяются вещества с низ
кой температурой кипения, как т о : аммиак, углекислота, сернистый
ангидрид, некоторые углеводороды и фреоны, характерным предста
вителем которых является фреон- 12 (CF2C12). Здесь мы коснемся
циклов только паровых компрессионных установок. Следует, однако,
отметить, что существую т холодильные установки, основанные на
совершенно иных эффектах, а именно: пароэжекторные и абсорб-
цаонные холодильные установки. В них для производства холода
затрачивается извне не работа , а теплота высокого потенциала (т. е .
высокой температуры), причем, как показывает специальный анализ,
затрачиваемая теплота сначала в прямом цикле превращается в ме ха
ническую энергию, а затем эта последняя в обратном цикле произво
дит нужный холодильный эффект. Таким образом, основной принцип
действия холодильных установок остается всегда в силе.
На рис. 94 была приведена исходная схема паровой компресси
онной холодильной установки. В идеальном случае такая схема позво
ляет осуществлять цикл Карно, показанный на рис. 140. Холодо-
производительность цикла q0 изображается в координатах T -s
прямоугольником под линией 4— 1 . Затрачиваемая на компрессор
работа в координатах p - v изображается фигурой а1— 2Ь и в ко ор
динатах T -s
—
фигурой m l—2 —3 (здесь принято, что изобары в об
ласти жидкости совпадают с нижней пограничной кривой). Произве
денная расширительным цилиндром (детандером) работа изображается,
соответственно, фигурами ЬЗ— 4а и 3— 4т. Таким образом, пло
щадь 1— 2 — 3 —4 дает итоговую работу установки за один цикл.
Н а практике приходится отступать от описанного цикла Карно.
Прежде всего в подавляющем числе случаев отказываются от р ас-
ГЛ. IV]
ЦИКЛЫ П . Т , У . И ХОЛОДИЛЬНЫХ УСТАНОВОК
345
ширительного цилиндра и заменяют его простым дроссельным клапа
ном. Этому варианту отаечают линии 3—4 ' на рис. 140. Процесс
дросселирования необратим, и по этому , несмотря на адиабатность,
сопровождается возрастанием энтропии. Таким образом, поступающий
в испаритель пар оказывается более сухим , чем в обратном цикле
Карно, а холодопроизводительность цикла понижается на величину,
измеряемую прямоугольником под линией 4— 4 ' в координатах Г -5 .
Было бы ошибкой считать, что затрачиваемая на новый цикл работа
тоже понижается в связи с тем, что площадь фигуры 1— 2 — 3 —4 '
меньше площади прямоугольника 1— 2 — 3 —4 . Линия 3— 4 отвечаю
щая резко необратимому процессу, носит условный характер, и только
ее крайние точки нанесены в соответствии с практически равно вес
ным состоянием вещества перед и за клапаном. П о эт о м у и площадки,
ограничиваемые линией 3— 4\ физического смысла не имеют. Д е й
ствительно, легко видеть, что при отсутствии расширительного
цилиндра единственным звеном устано вки с механической степенью
свободы служит компрессор, так что работа цикла с дроссель
ным клапаном совпадает с работой компрессора, которая измеряется
фигурами а1— 2Ь и, соответственно, m l— 2— 3 . Таким образом,
отказ от расширительного цилиндра приводит к тому, что затрата
работы на уста но вку увеличивается на величину площади а 4— ЗЬ
в координатах p-v и т4 — 3 в координатах Г-5.
И з сказанного следует , что при замене расширительного цилиндра
Дроссельным клапаном холодильный коэффициент установки у худшается
по двум причинам: во-первых, из-за падения холодопроизводитель-
ности на величину Д^0 и, во-вторых, из-за возрастания затрачиваемой
работы на величину Д A L Разумеется, понижение эффективности
цикла в связи с включением в него необратимого процесса можно
было предвидеть на основании второго начала термодинамики. Итти
на такое понижение в реальных условиях приходится ради упрощ е
ния и удешевления холодильной установки. При этом можно заме
346
ИДЕАЛЬНЫЕ ТЕПЛОВЫЕ МАШИНЫ
[ОТД. VI
тить, что отклонение от идеальных соотношений цикла Карно должно
быть меньше для таких хладоагентов, которые обладают меньшей
теплоемкостью жидкости. Для пояснения этого обстоятельства прежде
всего покажем , что дополнительная затрата работы на цикл Д А1
равна недополученной холодопроизводительности Д<70. Действительно,
в обоих вариантах количество теплоты, отдаваемое хладоагентом
в окружающую среду в конденсаторе (линия 2— 3), одинаково. С о
гласно первому началу это количество теплоты q , взятое по а б со
лютной величине, равно сумме холодопроизводительности и абсолют
ной величины работы цикла. Для цикла Карно имеем: | q I == <70+ | А1\.
Для цикла с дроссельным клапаном \q\=*q()— Д<70-{ -|Л/|Ц-Д A L
Приравнивая правые стороны, находим, что Д^0= ДЛ/. Теперь уже
видно, что чем круче проходит через точку 3 нижняя пограничная
кривая, тем меньше будут величины и недополученной холодопро
изводительности и перерасходованной работы. Следует еще обратить
внимание на то, что ухудшение цикла из-за дроссельного клапана
должно относительно слабее сказываться при том условии, что обе
пограничные кривые отстоят друг от друга в координатах T -s
возможно дальше, т . е . при условии возможно большей величины
теплоты парообразования. И так , из высказанных соображений сл е
дует , что для компрессионных установок имеют преимущество те
хладоагенты, у которых теплоемкость жидкости мала и теплота
парообразования велика.
Применение дроссельного клапана является не единственным ф акто
ром, отличающим реальные схемы холодильных установок от тео
ретической схемы по Карно. Всасыва
ние из испарителя в компрессор влаж
ного насыщенного пара (состояние /)
вызывает много технических затруд
нений (из-за энергичного теплообмена
между влажным паром и стенками ци
линдра, оседания на последних капель
жидкости, необходимости дозировать
сухость пара с таким расчетом, чтобы
в конце сжатия пар оказался сухим
насыщенным и п р .) . Поэтому в настоя
щее время употребляются компрессоры
только с «сухим ходом». Соответствую
щий цикл (с дроссельным клапаном) по
казан на рис. 141. Как видно, в этом варианте холодопроизводитель*
ность растет на величину Д ^ по сравнению с предыдущим вариантом,*
конечно, ценою затраты дополнительной работы Д Л/. Еще одним
средством увеличения холодопроизводительности служит переохлажде
ние жидкого хладоагента. Дело в том, что температура охлаждающей
воды всегда бывает ниже температуры конденсации при том давле
нии хладоагента, которое существует в конденсаторе. Поэтому, при-
ГЛ. IV]
ЦИКЛЫ П . Т . У . И ХОЛОДИЛЬНЫХ УСТАНОВОК
347
меняя противоточное устройство теплообменника, можно образовав
шийся из насыщенного пара конденсат несколько охладить, следуя
линии 3—3 '.
При этом после дроссельного клапана, в состоянии 4
пар оказывается менее сухим, чем в состоянии 4 , и холодопроизво-
дительность установки возрастает на величину ДQq.
Цикл 1— 2— 3 — 3 ' — 4 ' считается основным циклом компрессион
ных паровых холодильных устано вок. Е го холодопроизводительность
определяется формулой
= h —Ur= /-(1—х),
где х — сухость пара в точке 4' за дроссельным клапаном. Затра
чиваемая на цикл работа совпадает с работой компрессора:
А1= /2— /j.
Холодильный коэффициент цикла равен
Г(\-Х)
k-h
•
Применительно к рассматриваемым установкам, как и в случае
паросиловых установок, существуют усложненные варианты циклов,
приводящие к повышению эффективности: циклы с многоступенчатым
сжатием, регенерацией тепла и т . д .
ОТДЕЛ СЕДЬМОЙ
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
ГЛАВА I
ОСНОВНЫЕ ПОЛОЖЕНИЯ
1.
Упрощающие предпосылки. Изучение газовых потоков выхо
дит за рамки собственно термодинамики и образует своеобразную
комплексную проблему, в которой сочетаются термодинамические
и механические методы анализа. Теория газовых по токов, достигшая
в настоящее время большой глубины, оформилась в виде самостоя
тельной дисциплины, называемой газовой динам икой. Газовая дина
мика является обобщением гидродинамики на случаи, когда недопу
стимо пренебрегать сжимаемостью текущей среды . Газы вследствие
своей легкой сжимаемости способны производить значительную деф ор
мационную работу , которая связана с изменением их внутренней энер
гии. Кроме то го , эта работа может происходить в результате теплооб
мена потока с окружающей средой. По этой причине и приходится
привлекать к анализу газовых течений термодинамику, которая в во
просах течения капельных жидкостей остается совершенно излишней.
Н иже излагаются только основы газовой динамики, а из основ —
только вопросы стационарных течений. При этом постановка задачи
совершенно тождественна принятой в гидравлике, где главной
упрощающей предпосылкой служит одномерность течения. И сто р и
чески сложилось так, что в связи с потребностями паротурбострое-
ния задачи «газовой гидравлики» стали излагаться в к урсах техниче
ской термодинамики, и мы от этого обычая отступить не можем.
Сл едуя приему, применяемому в гидравлике, мы будем опериро
вать только с усредненными значениями параметров газового потока,
не принимая во внимание деталей картины течения. Усреднение
параметров производится, во-первых, в каждой точке по времени,
так что турбулентные пульсации параметров выпадают из рассмо тре
ния. В о -в т о р ы х , усреднение является пространственным в том смысле,
что в каждом сечении трубы из местных, средних по времени, вели
чин образуются средние по всему сечению значения параметров,
которые и считаются представительными для одномерного по тока.
Существую т разные способы усреднения параметров поперек газо
вой струи. Наиболее простым является расчет согласно формуле
$xdf
ГЛ. I]
ОСНОВНЫЕ ПОЛОЖЕНИЯ
349
где х — местное значение параметра, х — его среднее значение,
d f — элемент сечения и F — полный размер сечения струи. Примени
тельно к скорости эта формула дает величину, являющуюся средней
объемной скоростью:
fwdf
Следует заметить, что пользование таким образом усредненными
величинами в некоторых случаях заведомо приводит к неточностям.
Есл и , например, среднюю кинетическую энергию одного килограмма
протекающего газа определять через квадрат упомянутой средней
объемной скорости, то в практической обстановке неизбежно полу
чение преуменьшенного значения энергии. Для вычисления средней
по сечению кинетической энергии нужно было бы исходить из вели
чины среднего по сечению квадрата скорости, который вовсе не
равен, а больше, чем квадрат средней объемной скорости. Впрочем,
чем более плоской является эпюра скоростей в поперечном сечении
трубы, тем меньше проявляется разница в средней кинетической
энергии, вычисленной указанными двумя способами, и вообще тем
меньше разница в способах усреднения любых величин по попереч
ному сечению. Подробности по этому поводу излагаются в курсах
гидравлики. В нашем изложении мы будем исходить из то го , что
средние параметры уже определены надлежащим образом, и поскольку
только они будут входить во все рассуждения, мы черту усреднения
над соответствующими буквенными символами будем о пускать .
И та к , выделяя из потока элемент, ограниченный стенками и двумя
бесконечно близкими поперечными сечениями, мы будем приписывать
ему одно, среднее, значение скорости, одно значение температуры,
плотности, давления и т. д . Соответственно, под дифференциалом
скорости, температуры, плотности и т . д . будем понимать бесконечно
малое приращение данного параметра при перемещении элемента
вдоль осевой линии трубы в направлении средней скорости . Чтобы
к выделенному элементу можно было применять уравнения состояния
(для соблюдения индивидуальной квазистатичности), будем считать
в его пределах пренебрежимыми относительные отклонения терми
ческих параметров и скорости от соответствующих средних величин.
Это последнее упрощение задачи является сильным упрощением. О но
сразу устраняет возможность рассмотрения таких течений, в к от о
рых существуют скачки уплотнения и ударные волны. Разрывные
явления такого рода возникают только при сверхзвуковых скоростях
и принадлежат к категории резко нестатических процессов. Однако
и при дозвуковых скоростях неоднородности в распределении пара
метров бывают велики. Сглаживание возникающего противоречия
возможно двумя путями: либо путем перехода к менее протяженным
областям потока, чем выделенный ранее элемент (отказ от гидравли
ческого приема выделения элемента из потока); либо путем введения
350
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[ОТД. VII
дополнительной абстракции — абсолютно невязкого газа (идеальная
жидкость или идеальный газ в гидродинамическом смысле). Мы при
мем вторую возможность и, таким образом, приоб ним газовые тече
ния к категории квазистатических пр оцессов . Искусственный прием
изучения потоков вязкого газа будет рассмотрен о с о б о . *)
2.
Основные уравнения без учета трения. При стационарном
(установившемся) течении, как было отмечено в п. 9 первого отдела,
весовое количество газа, проходящего в единицу времени через
любое сечение трубы , не меняется со временем и остается по все
местно одинаковым. (Возможное ответвление потока или присоеди
нение к нему других потоков не рассматривается.) Обозначая весо
вой расход газа (вес газа, проходящего в единицу времени) через G * ,
имеем: G * = const. Величина G * равна произведению объема газа F w ,
проходящего через данное сечение в секунду, на удельный вес к:
G*=Fwy=^
= const.
(VII. 1 )
Это кинематическое уравнение называется уравнением неразрыв
ности (или сплошности). В гидравлике оно получает более простой
вид:
V*= Fw=const,
так как там удельный объем v движущихся жидкостей считается
существенно постоянным (капельные жидкости или очень медленно
перемещающиеся газы).
Общее уравнение сохранения энергии для потока было получено
уже ранее в (1.22). При выводе предполагалось, что работа силы
тяжести может быть опущена и трение отсутствует. Э то уравнение
приводим заново:
dq=di-\ -Ad2^
^ dl?.
(VII, 2)
Входящая сюда энтальпия i имеет смысл, аналогичный внутренней
энергии в стандартных условиях термодинамики. Напомним еще, что
в по исках механической аналогии энтальпию можно условно понимать
как потенциальную энергию потока. При этом входящая в состав i
внутренняя энергия и получает смысл потенциальной термической
энергии, а величина A p v — смысл потенциальной механической энер
гии. Последняя своим происхождением обязана механической работе,
!) Не нужно смешивать понятий идеального газа в термодинамике
и идеальной жидкости в гидродинамике. Первый из них определяется как
газ, строго подчиняющийся уравнению pv = RT. Из молекулярно-кинетиче
ской теории, а также и из опыта следует, что такой газ вовсе не лишен
вязкости. Таким образом, используемая в гидродинамике идеализация жидко
сти или газа в отношении вязкости не имеет никакого отношения к виду
термического уравнения состояния. Говоря об идеальной жидкости (в част
ное! и, об идеальном газе), в гидродинамике имеют в виду только прене
брежение влиянием вязкости на развитие течения.
ГЛ. 1]
ОСНОВНЫЕ ПОЛОЖЕНИЯ
351
которая совершается извне приложенными силами (сила тяги дымо
вой трубы, компрессор, вентилятор и т . п .) над покоящимся газом
при вовлечении его в ток по трубопроводу. При этом изменение
энергии газа, происходящее на входе или на выходе трубопровода,
передается от частицы к частице газа благодаря его упругости. Р а зу
меется, на этом пути первоначальный импульс может благодаря энер
гетическому обмену претерпеть те или иные изменения. Однако прин
ципиально необходимо, чтобы во всяком сечении трубы набегающий
поток сохранял способность производить работу вытеснения, т . е .
чтобы любое местное значение A p v было больше нуля, что и обеспе
чивается структурой этого выражения.
Для идеальных газов pv = R T , причем температура Годнозначно
определяет внутреннюю (термическую) энергию и . По это му создается
впечатление, что величина A p v , равная в этом случае A R T , отнюдь
не имеет механического происхождения. Э то впечатление является
поверхностным и отражает случайные в общем плане свойства идеаль
ных газов. Для дополнительного разъяснения отнесем работу вытесне
ния не к 1 кГу а к 1 л3. Тогда взамен выражения Apv [ккал\кГ\
получим А р [ккал/м*]%т. е . выражение, которое уже не дает ника
кого повода понимать его как термическую энергию. Соответственно,
для энтальпии будем иметь: mfi = cvf T - { - А р [ккал/м*\. Таким о бра
зом, в потоке потенциальная энергия (единицы объема газа) скла
дывается из д ву х частей: из термической энергии, которая свой
ственна газу независимо от характера его видимого движения, и из
механической энергии, которая при отнесении к единице объема
зависит от одного только давления /?, т. е . от прямой меры упру
гого состояния газа. Качественно таким же образом обстоит дело и
при течении реальных газов и ж идкостей.
Наряду с общим уравнением сохранения энергии (V II.2) для газо
вого потока может быть написано известное в гидравлике уравнение
Бернулли сохранения механической энергии. Там это уравнение имеет
вид:
Pi-Pi.
.
wl—w\ ft
7
2g
Применительно к газам величину f нельзя считать постоянной, всл ед
ствие чего уравнение следует представлять в дифференциальной форме.
Кроме того, ради общности в уравнение нужно ввести дополнитель
ный член — техническую работу. Обобщенное уравнение Бернулли
будем представлять в такой форме:
vdp-\-dЩ+dlr= 0.
(VII. 3)
Вычитая почленно из уравнения (VII. 2) уравнение (VII. 3), полу
чаем:
dq= du-\ -Apdv= di—Avdp}
(VII. 4)
352
основы газовой динамики
[отд. VII
т. е . выражение первого начала в форме (I. 19) и (1.23). Таким
образом, оказывается, что для потока упругой жидкости применимо
то выражение первого начала, которое было выведено в предполо
жении о равномерном давлении по поверхности рабочего элемента.
Очевид но, это следует объяснить взаимным наложением д ву х явлений
при перемещении газового элемента в трубе. Первое явление заклю
чается в расширении элемента и производстве им деформационной
работы благодаря подведению извне теплоты или изменению внутрен
ней энергии. Э то явление происходит так, как если бы элемент
оставался на месте, и описывается уравнением (VII. 4). Второе явление
заключается в изменении состояния движения элемента, который р ас
сматривается как материальная то чка, под действием неуравновешен
ных относительно его центра тяжести сил. О но подчиняется уравне
нию сохранения механической энергии (VII. 3). В совокупности оба
уравнения образуют общее выражение закона сохранения энергии
(V II. 2).
Отсутствие противоречивости между формулами (V II. 2 ), (VII. 3)
и (VII. 4) можно также объяснить зависимостью энергетического ба
ланса от способа наблюдения за происходящими в потоке процессами.
Для наблюдателя, перемещающегося вместе с элементом, последний
будет казаться неподвижным, и энергетический баланс представится
в виде уравнения (VII. 4). Для наблюдателя, неподвижного относи
тельно стенок трубы и следящего за поведением проходящего мимо
него центра тяжести элемента, в энергетический баланс войдут исклю
чительно механические факторы: работа сил, неуравновешенных отно
сительно центра тяжести элемента, и изменение кинетической энергии
элемента как единого целого — уравнение (VII. 3). Наконец, для того же
наблюдателя, неподвижного относительно стенок трубы , при учете
все х сторон энергетических превращений (а не только механической
стороны) баланс выразится уравнением (V II. 2).
Поск о л ьк у изменения состояния считаются квазистатическими,
входящее в уравнения (VII. 2) и (VII. 4) количество теплоты можно
представить в виде:
dq= Tds.
(VII. 5)
Формулы (VII. 1 ) — (VII. 5) являются основными в дальнейшем
изложении.
3.
Основные уравнения с учетом трения. При выводе уравнения
сохранения энергии для потока газа была использована следующая
схема: из потока был выделен элемент, образованный двумя попе
речными сечениями и стенками трубы, была определена внешняя
работа элемента, и эта работа вместе с подведенной к элементу
теплотой была надлежащим образом приравнена изменению энергии
элемента. В состав внешней работы должна была бы войти работа
элемента против касательных сил у стенок, однако ею мы в свое
время пренебрегли. Рассмотрим теперь спосо б учета трения в потоке.
ОСНОВНЫЕ ПОЛОЖЕНИЯ
353
Дело в том, что работа преодоления трения только искусствен
ным образом причислена нами к разряду внешних воздействий на
выделенный элемент. Действительно, во всякой жидкости при о тно
сительном сдвиге соседних частиц возникают силы вязкого трении,
затормаживающие перемещение. В турбулентном потоке, помимо этих
сил трения, появляются еще кажущиеся силы трения, обусловленные
тем, что перемешивание хаотически д вижущихся в поперечном напра
влении частиц вызывает такой же затормаживающий эффект, какой
имеет место при обычной вязкости. Более того, при развитой турбу
лентности сопротивление, возникающее вследствие переноса количе
ства движения частицами, имеющими одну среднюю скорость, в такие
слои жидкости, где средняя скорость другая, значительно превосхо
дит эффект вязкого трения. Как бы то ни было, сопротивление тече
нию сказывается во всем объеме выделенного нами тонкого попе
речного слоя жидкости.
Для учета суммарного действия сопротивления можно приложить
к внешней кольцевой поверхности элемента касательную силу, напра
вленную против течения и эквивалентную сумме сил, затормаживаю
щих продольное перемещение элемента как целого. Такое гидравли
ческое рассмотрение задачи является только удобным приемом с х ем а -
тизации процесса, но не должно затушевать природы сопротивления,
связанной с внутренним механизмом течения жидкости.
М е ж д у тем, этот внутренний механизм течения таков, что работа
против сил трения, производимая за счет работы неуравновешенных
(относительно центра масс) гидромеханических сил, или за счет т е х
нической работы, или за счет кинетической энергии, увеличивает
энергию элемента, и притом таким образом, как будто к элементу
подводится теплота. Говоря просто , работа трения превращается
в теплоту.
Поскол ьку внутренняя работа трения была переведена в категорию
внешних воздействий на рабочее тело, в уравнении сохранения энер
гии надлежит к количеству извне подведенной теплоты dq присоеди
нить еще теплоту трения dqтр, как если бы последняя передавалась
элементу через его поверхность. Н а основании сказанного
dq \-dqTV= di-\ -Ad
AdlT-fAd^,
В общем случае может оказаться, что вследствие теплоотдачи
в окружающую среду не вся теплота трения, эквивалентная d l^ ,
передается выделенному из жидкости элементу (элементарному о б ъ
ему). Однако мы будем считать, что такого рассеяния теплоты трения
не наблюдается и что вся она подводится к элементарному объему.
При этом предположении величины dqтр и A d l ^ входящие в послед
нюю формулу, взаимно равны и подлежат сокращению. В результате
мы приходим к уравнению сохранения энергии (V II. 2), которое было
ранее установлено применительно к невязкому по току.
2 3 Зек. 3543. В. С . Жуковский.
354
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[ОТД. VII
М ож ет создаться впечатление, что наличие или отсутствие вязкости
(трения) вообще не играет роли в развитии процесса течения. Такое
заключение было бы весьма ошибочным. Преж де чем обсудить этот
вопрос, вернемся к уравнениям (VII. 3) — (VII. 5).
Уравнение (V II. 3), представляющее собой выражение сохранения
механической энергии, должно быть при учете трения пополнено
новым членом — работой трения, как это и делается в гидравлике
при выводе уравнения Бернулли. Таким образом, вместо (VII. 3) сле
дует писать:
O '11- За)
Вычитая почленно (V II. За) из (V II. 2), находим:
dq=di—Avdp—Adlr = da-{-Apdv—Adl, .
(VII. 4a)
Соответственным образом видоизменяется при учете трения и ф ор
мула (VII. 5). Проявление трения в потоке обусловливает необрати
мость течения и тенденцию возрастания энтропии по хо ду течения.
Согласно второму началу, следует взамен (VII. 5) писать:
dq<Tds.
(VII. 5а)
Чрезвычайно важно, что формулы (VII. 2), (VII. За), (VII. 4а) и
(VII. 5а) согласуются друг с другом и могут быть применяемы одно
временно, соответственно надобности. И з рассмотрения трех послед
них уравнений видно, что трение существенным образом влияет на
процесс течения, чего нельзя было обнаружить из первой формулы.
Независимость формулы (VII. 2) от того, учитывается или не учи
тывается трение в потоке, объясняется следующим. Формула (VII. 2)
дает суммарный эффект энергетического взаимодействия выделенного
из потока элемента с окружающей средой. Очевидно, что приращение
энергии системы при заданном количестве полученной извне теплоты
и заданной* величине внешней работы определяется вполне однознач
ным образом. При этом совершенно несущественно, какие именно
внутренние процессы происходили в элементе на пути между его
начальным и конечным положениями. Отсюда и следует, что изме
нение энергии элемента
д‘-МД-|
ни в какой мере не зависит от то го , проявляется или не проявляется
трение при течении жидкости или газа по трубе. Однако самым не
посредственным образом трение влияет на распределение приращения
энергии между отдельными ее составляющими — энтальпией и кине
тической энергией. При фиксированных внешних воздействиях можно
представить себе любое количество комбинаций величин А/ и Д - ^ г ,
ГЛ. lj
ОСНОВНЫЕ ПОЛОЖЕНИЙ
355
которые в сумме удовлетворяют уравнению сохранения энергии. Каждая
комбинация будет удовлетворять некоторым специальным условиям
превращения энергии внутри элемента. Наличие трения вызывает
эффект необратимого превращения кинетической энергии в энергию
.
.
.
ДОЗ
теплового движения, вследствие чего соотношение между Дi и Д - ^ г
оказывается иным, чем было бы при отсутствии трения.
Как именно изменяется кинетическая энергия при течении с тре
нием, видно из обобщенного уравнения Бернулли (VII. За), которое,
будучи уравнением чисто механическим, содержит член, прямо о тра
жающий роль трения. Что касается в отдельности взятого изменения
энтальпии, то оно может быть найдено из уравнения первого начала
(VII, 4а), также в явном виде учитывающего трение в виде работы
элемента против касательных сил. Наконец, влияние трения прояв
ляется также на энтропии текущего газа. Основным неравенством
второго начала (V II. 5а) намечается односторонняя тенденция, о пре
деляющая собой характер отклонения действительного изменения вели
чины s от ее идеального изменения, возможного при невязком газе.
Эта тенденция фиксирует, в частности, определенный знак поправок
к вычисленной для идеального случая кинетической энергии в конце
вом сечении струи . Таким образом, не прибегая даже к механическим
соображениям, можно с помощью одного только второго начала, при
влекаемого в дополнение к уравнению сохранения энергии, установить
то направление, в котором происходит из-за трения перераспреде
ление энергии потока между ее потенциальной и кинетической со ста
вляющими.
Нуж н о отметить, что уравнение первого начала представляют
обычно в такой форме:
dq-\ -dqr —du\Apdv = di—Avdp,
(VII. 4b)
где dq7p— теплота трения, равная работе трения. Такая запись урав
нения (VII. 4а) нуждается в разъяснении, так как дает повод сомне
ваться в правильности основной формулировки первого начала. П о
следнее, как было сказано в п. 7 первого отдела, утверждает, что
извне подведенная теплота равна сумме приращения внутренней энер
гии и совершенной внешней работы. Между тем, в (VII. 4Ь), наряду
с извне подведенной теплотой, входит еще внутреннее тепловыделение
от трения dqтр. Происхождение этого противоречия должно быть
ясным. Теплота трения dqтр фигурирует в уравнении только как экви
валент внешней работы трения rf/Tp, которая значится в первоначаль
ном уравнении (VII. 4а). Как было ранее сказано , последнее уравнение
представляет собой выражение сохранения энергии для наблюдателя,
скрепленного с движущимся элементом. Такой наблюдатель не заме
чает энергетических эффектов движения элемента, если трение о тсут
ствует. Однако при наличии трения он не может не регистрировать
23*
356
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[О'ГД. VII
работы, расходуемой на преодоление тормозящих движение сил, по
скольку они считаются приложенными к внешней кольцевой поверх
ности элемента. Э то можно наглядно представить, прибегнув к обра
щению движения, т . е . вообразив элемент неподвижным, а ограничи
вающие его стенки — перемещающимися с равной скоростью , но
в противоположном направлении. Если трение о стенки имеет место,
то наблюдатель хотя бы с помощью подходящего динамометра должен
непременно обнаружить возникновение касательных сил в месте с о
прикосновения элемента со стенками, а следовательно, и соответствую
щую работу трения. М еж ду тем, отличительной особенностью работы
трения в рассматриваемом случае является то , что эта работа связана не
с передачей энергии от элемента к окружающей среде, а с возвратом
расходуемой энергии самому элементу. Поэтом у, переписав уравне
ние (VII. 4а) в виде
du= dq—Арdv-\ -Adlrv,
мы получаем, что приращение внутренней энергии элемента равно
полученному извне теплу минус работа расширения плюс работа тре
ния. Т ак как работа трения возвращается элементу в таком виде,
как если бы извне к нему было подведено некоторое добавочное
количество тепла, то получает физический смысл и формула (V II. 4Ь).
ГЛАВА II
АДИАБАТНОЕ ТЕЧЕНИЕ ПРИ ОТСУТСТВИИ ТРЕНИЯ
И ТЕХНИЧЕСКОЙ РАБОТЫ
4. Соотношения между скоростью и термическими параметрами.
Представим себе, что по каналу произвольной конфигурации дви
жется невязкий газ (или пар). Стенки канала будем считать тепло
непроницаемыми. Внешней технической работы поток не производит.
В таком случае уравнение сохранения энергии (VII. 2) принимает вид:
12?
12? — 12?
di+ Ad-^ = 0,
г-/0+А-2g.0=0.
(VII. 6)
Здесь начальное сечение обозначено индексом 0 . И з формулы
(VII. 6) получаем, что
= |/"Ч + -X('о- о= V4S+8378(/0—О- (VII.7)
Знак разности (i0 — i) определяется знаком изменения давления
вдоль течения, так как на основании формулы (VII. 4) имеем:
di= Avdp.
(VII. 4с)
Если давление падает(dp<0), то(/0—/)>0 пw>w09ина
оборот, если давление возрастает, то w < w0.
ГЛ. Ill
АДИАБАТНОЕ ТЕЧЕНИЕ
357
Прямая связь между изменением кинетической энергии и давле
нием вытекает, разумеется, и из механического уравнения (V II. 3):
d^^-vdp.
(VII. 8)
Для нахождения разности энтальпий, или, как ее называют,
теплового напора (теплоперепада), проще всего пользоваться д и а
граммой i s , где рассматриваемый случай течения изображается вер
тикальным отрезком.
Решим, например следующую задачу. В направляющий аппарат
(сопло) паровой турбины вступает пар, имеющий р 0 = 7am , t0 = 180° С
и w 0 = 20 м\сек. Найти скорость пара в том сечении направляющего
аппарата, где давление р — Ъ ат . П о диаграмме i s находим:
/0—i=669—653,5 =15,5ккалнГ,
откуда
w= Уж +8378.15,5 = /Тоо+Лзоооо = 362м/сек.
Попутно из диаграммы могут быть определены конечная темпера
тура (151 °С) и сухость (0.995).
И з приведенного примера видно, что начальная скорость мало
сказывается на результатах вычисления. В данном случае ее влияние
на конечную скорость не превосходит 1°/0 вплоть до w0 = 55 м/сек.
Если мы вовсе пренебрежем начальной скоростью, то получим про
стую формулу:
w= 91,53yio—i-
(VH . 7а)
Для ускорения расчета в диаграмме i s часто помещается д о
полнительная шкала для непосредственного прочтения скорости w по
тепловому напору.
Определяя кинетическую энергию потока по изменению энтальпии,
мы не имеем возможности оценивать в явном виде роль давления.
Однако с точки зрения динамики движения чрезвычайно существенно
располагать соотношением между действующими силами и изменением
скорости. Э то соотношение вытекает из уравнения (VII. 8). Производя
интегрирование в соответствии с формулой обратимой адиабаты
pv^ = c o n st, где для газов k = {cp lcv), для перегретого водяного пара
£ = 1 ,3 и для насыщенного пара при начальной сухости л: = 1 зна
чение k = 1 ,135, получаем:
л—1
(VII. 9)
358
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
|ОТД. VII
Если начальной кинетической энергией можно пренебречь (этот
случай будем для краткости называть истечением), то
w—
2g-j -^p0v0(l—
(
V
I
I
.
9а)
где р = р//70.
Для уяснения характера зависимости между скоростью и вели
чиной (3 построим график (рис. 142), который с качественной ст о
роны справедлив для всех обычных
значений k. И з графика видно, что из
менение скорости с давлением имеет
более сложный вид, чем изменение ск о
рости с энтальпией. Темп увеличения
скорости вблизи |3= 1 весьма велик.
П о мере уменьшения (3 этот темп п о
степенно снижается. Однако в области
значений (3 порядка 0 ,5 кривая имеет
перегиб (точка перегиба обозначена
абсциссой рл), что указывает на новое
нарастание темпа увеличения скорости.
ро О но становится особенно заметным
после достижения давлением 0,1 перво
начальной величины. В интервале меж
д у (3= 0 ,8 и (3= 0,2 скорость растет приблизительно по линейному
закону.
Интересно заметить, что если конечное давление в струе прибли
жается к нулю ((3-► ()), то скорость отнюдь не стремится к беско
нечности, а имеет предел доЮАХ, где
Р(Ро
Э то значит, что при истечении газа в совершенный вакуум в самом
крайнем случае можно исчерпать хаотическое молекулярное движ е
ние и превратить обусловленную им энергию нацело в кинетическую
энергию направленного движения, но не больше. Такое объяснение
становится особенно наглядным, если мы обратимся к идеальному
газу, для которого p0v0= RT0 и
«'max=УГ
=
Ср Т0
Последнюю формулу можно получить и из (VII. 7а), если принять
/0— i = cp (T0— Т) и положить Т = 0. Отсюда следует, что: 1) ма
ксимальная скорость полностью определяется начальной температурой
Tq, которая является мерой начальной энергии истекающего идеаль
ного газа, и 2) в месте, где следует ждать максимальной скорости,
гл. п|
АДИАБАТНОЕ ТЕЧЕНИЕ
359
температура газа должна была бы упасть до абсолютного нуля, т . е .
тепловое молекулярное движение должно было бы прекратиться.
Разумеется, такого эффекта в действительности нельзя достигнуть
хотя бы потому, что всякий реальный газ рано или поздно окажется
сконденсированным.
В технических расчетах следует пользоваться для определения
скорости формулами (VII. 7) и (VII. 7а), ибо только в редких слу
чаях показатель k , входящий в формулы (VII. 9) и (VII. 9а), может
рассматриваться как величина постоянная. В частности, если пар,
бывший вначале перегретым, в каком-либо сечении трубы становится
насыщенным, то показатель k претерпевает резкий скачо к. В таких
случаях вычисление конечной скорости с помощью формулы типа
(VII. 9) должно быть разбито на два этапа: вычисление скорости
в сечении, отделяющем область насыщенного пара от перегретого, и
затем вычисление последующего приращения скорости в области
насыщенного пара.
Обратим теперь внимание на связь между формулой (VII. 9) и
общеизвестной формулой гидравлики: w = ] f2 g H , где Н — напор
давления. Величину (3 представим в виде
р__Р=Ро—*Р_2Ьр
РРо
Ро
Ро9
где 8р — падение давления на рассматриваемом участке канала. Если
падение давления по сравнению с самим давлением является очень
малой величиной, т. е . если — <С^1, то в разложении в ряд
Ро
Л-1
—
(\2Е.\к—1
k—lbp k—\ 1 /Ьру _
Рк=\
Ро)
kр0
k 92k\p0)
членами, содержащими 8р/р0 в степенях выше первой, можно прене
бречь. Таким образом,
Л-1
».к
З-Г 1
°Л_
Р
k Ро9
Подставляя последнее выражение в формулу, находим:
k^\Роv0ИГ ^
=
]/*2^ •
Здесь
—
удельный вес в начальном сечении. В виду сделанного
предположения о чрезвычайной малости падения давления нет смысла
отличать удельный вес т во всяком другом сечении струи от у0,
так что Т= То= const и
]/
(VII. 9b)
360
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[ОТД. VII
Эт а формула и есть обычная формула гидравлики для определе
ния скорости истечения, 8p/f обозначается там буквой Н .
Приведенные выкладки показывают, что формулы термодинамики
для потока сжимаемой жидкости содержат в себе как частный вариант
формулы гидравлики для потока несжимаемой жидкости. Вместе с тем
по смыслу вывода формулы (VII. 9Ь) ясно, что она применима не
только для несжимаемых жидкостей, но в известных пределах и для
легко сжимаемых газов и паров. В последнем случае ошибка в под
коренном выражении имеет порядок отношения третьего члена ряда
1
0/7
разложения ко второму члену, т . е . величины
—
, и во всяком
^
р0
случае она меньше — - .
При этой ошибке в подкоренном выражении
о
мы допускаем вдвое меньшую относительную ошибку Aw jw при
вычислении скорости:
Aw
w
Отсю д а, например, следует, что ошибка от пренебрежения сжимае
мостью газа не превосходит 0 ,5% скорости, если Ьр < 4 • 0,005 р0=
=
0,02 р0. При р0= I am указанное соотношение дает Ьр < 0,02 am—
= 200 кГ/м2 = 200 мм Н 20 . Этот расчет наглядно показывает,
почему во многих случа ях формулы гидравлики в приложении к газам
или парам дают приемлемый результат. В частности, при измерении
скоростей газа или пара посредством дроссельных диафрагм или сопел,
а также при пользовании пневмометрическими трубками с успехом
используется формула (VII. 9Ь), если только речь не идет о скоростях
порядка сотни метров в секунду, когда по сравнению с р0 величина
8р может стать значительной.
5.
Критическая скорость. Соотношения в приведенных пара
м е т р а х . Для получения обобщенных соотношений между термическими
параметрами газового потока и его скоростью целесообразно каждую
из величин выражать в долях от соответствующего характерного
значения этой величины в пределах изучаемого явления. В качестве
характерных масштабных величин для давления, температуры и удель
ного объема удобно воспользоваться их начальными значениями перед
истечением газа, т. е . значениями р 0, Т0 и v 0. Подобным образом
поступить применительно к скорости нельзя, если считать начальную
скорость за нуль. Поэтому в качестве масштабной скорости прихо
дится брать некоторую скорость , которую рассматриваемый поток
фактически может и не иметь, но которая однозначно определяется
конкректными условиями задачи. Такой масштабной скоростью может
служить скорость звука.
В физике рассматривается задача о скорости распространения ма
лых деформаций в упругой среде. При нарушении внутреннего равно
весия упругой среды путем местного изменения давления (плотности)
вся среда постепенно охватывается процессом, выводящим се из
гл. п]
АДИАБАТНОЕ ТЕЧЕНИЕ
361
равновесия. Вследствие большой скорости происходящих при этом
местных изменений плотности процесс является адиабатным. М ож но п о
казать, что скорость распространения упругих деформаций, предста
вляющая собой не что иное, как скорость звука а , определяется
выражением
где р — плотность газа. Приняв в качестве уравнения адиабаты ф ор
мулу pvk = const, т. е . р/рЛ= const, находим:
Для газов, подчиняющихся уравнению p v — R T , скорость звука
определяется формулой
________
a— VgkRT.
(VII. 10а)
Из этой формулы видно, что для каждого данного газа а зависит
только от температуры Т. Так, для воздуха при 0 °С имеем: & = 1,4
и а — ]/9,81 1,4 •29,27 273 = 332 м, сек. Среди практически инте
ресных газов наибольшей скоростью распространения деформации
обладает водород вследствие своей малой плотности. При 0 ° С для
водорода а — 1270 м 'хек.
Скорость звука в реальных газах и парах не вполне точно опре
деляется формулой a = Y g k R T 9 так как для них отсутствует прямая
пропорциональность между p v и Т . Одн ак о с качественной стороны
всегда верным остается утверждение, что скорость звука изменяется
в одну сторону с температурой.
Выразим в уравнении сохранения механической энергии (V II. 8)
величину v d p через скорость звука а , согласно формуле (VII. 10).
Имеем:
(VII. 10)
с,)
Из формулы p vk — const получаем:
d (pv)___k — 1dp
pv
kp
Используя вновь формулу (VII. 10), находим:
d (pv)___da*
pv
a-’
dp___ k da1
p k—1d1’
вследствие чего
362
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[ОГД. VII
Подставляя найденное выражение в (*), получаем:
Таким образом, уравнение (VII. 8) приводится к виду:
(VII. И )
или
(V II. 11а)
Скорость w , входящая в последнюю формулу, представляет собой
действительную скорость газового потока в том или ином сечении
струи. Скорость а является, однако, не более чем расчетной вели
чиной, отвечающей местному состоянию газа. С такой скоростью
распространялся бы звук в газе, если бы в нем при данных пара
метрах было произведено малое изменение давления (плотности).
газ оказывается пронизанным звуковыми волнами, исходящими из
отдельных точек на стенках. Если местная скорость течения w меньше
соответствующей величины а у то звуковые волны распространяются
в потоке как по течению, так и против течения, причем из-за своей
малой интенсивности заметного влияния на поток не оказывают.
Если w > я , то фронт звуковой волны сносится вниз по течению,
как видно схематически на рис. 143.
Здесь кружками показаны последовательные положения зоны воз
мущения, которое возникает у точечного препятствия и распростра
няется со скоростью , пропорциональной радиусу самого маленького
из кружков. Скорость потока пропорциональна повторяющемуся рас
стоянию между центрами. Я сно , что звуковое возмущение не может
проникнуть за линию, которая является обверткой растущих вниз
по течению круж ков . Линия эта, называемая линией возмущений,
служит геометрическим местом точек, где отдельные волны наклады-
Рис. 143.
Физическую наглядность эта
местная скорость звука а при
обретает в том реальном сл у
чае, когда течение газа про
исходит по трубе, имеющей на
стенках отдельные зазубрины
или шероховатость, если по
следняя состоит из многих
игольчатых выступов. Всякая
зазубрина или выступ служат
источником тех самых упругих
возмущений, которые порож
дают звуковую волну. Таким
образом , текущий по трубе
гл. и]
АДИАБАТНОЕ ТЕЧЕНИЕ
363
ваются друг на друга и где наблюдается хоть слабый, но ощутимый
скачок давления (плотности). Н а рис. 144 показана картина линий
возмущений при сверхзвуковом течении по расширяющейся трубе,
полученная оптическим, так называемым теневым методом. Внутри
трубы с абсолютно гладкими
стенками линии возмущений
возникнуть не могут. Таким
образом, проявление звуковой j
"•
скорости в том или ином про-
извольно выбранном сечении по -
тока не является органическиН1НВ11Н1Н1ННННЁВ1НМ
связанным с основным процес
сом течения.
Рис. 144.
Представим себе теперь, что
изменяющаяся вдоль трубы скорость потока да в некотором сечении
равна местной скорости звука а. Назовем эту скорость потока кри
тической скоростью и пометим взаимно сопряженные значения да
а * , и из формулы (VII. 11а) получается:
и а звездочками. Тогда да*
2
2
w
а
Т“г-k—\:
k—1
a2k+ 1
~2 Т^Т
(VII. 12)
Легко видеть, что критическая скорость а * для заданного газа
однозначно определяется начальными значениями давления и удел ь
ного объема, какие свойственны газу перед его истечением ( посколь
ку начальной скоростью мы пренебрегаем). Действительно, пола
гая в формуле (VII. 12) да = дао = 0 и на основании (VII. 10)
а~ = я? = gkp0v0, получаем:
gkpovo
~а
k—l
a*k+1
Т 1Г=Т
У 2gk+\Ро°о■
Для идеального газа последняя формула принимает вид:
а*= уГ2g-А+1RT,„
(VII. 13)
(V II. 13а)
В этом последнем случае критическая скорость для данного газа
зависит исключительно от начальной температуры Т0.
Есл и рассматривается случай, противоположный истечению, когда
скорость газа вначале велика и спадает вниз по течению, то темпе
ратура Т0 в формуле (VII. 13а) получает смысл температуры, отве
чающей полной остановке потока. Э ту температуру называют тем
пературой торможения. Вследствие обратимости течения, о б ус л о
вленной отсутствием трения, начальную температуру Т0 при истечении
можно понимать тоже как температуру торможения.
364
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
|огд. VII
Из формулы (VII. 13) видно, что критическая скорость, т. е . ско
рость течения, совпадающая с местной скоростью звук а, является
характерной величиной для газовой струи и может быть поэтому
принята в качестве масштабной скорости. Отношение местной с к о
рости течения к критической скорости
будем называть приведенной скоростью течения.
При истечении приведенная скорость увеличивается от нуля до
Ашах. Значение Атах отвечает уже найденному значению ^ тах:
w шах
k
k—1Ро%>
откуда
\
_
«W_■Ан-Г
“«
я*
\ k—1
Для воздуха приk=1,4, А=Y6«2,45и0^А<12,45.Эти
же пределы остаются в силе для замедляющегося вниз по течению
потока.
Нам остается теперь выразить безразмерные, приведенные величины
термических параметров как функции А. И з формул (VII. 12) и (VII. 13)
имеем:
w‘*
-
gkpv
_
_
1k+ 1
~
2
k
“
Tk^V
1* (*~ 1)2^*
РФ*
откуда
ру_
1 __k —\,0
Povо
k+\'"
(VII. 14)
Так как для адиабаты — = ( —Л
v0 \ро/
х-л
ру
к
РцУо \Ро)
то
откуда
Ро\
*+1 )
(VII. 15)
Го\
(VII. 16)
J_
TV Р«
(VII. 16а)
ГЛ. It]
Адиабатное течение
365
Формулы (VII. 14), (VII. 15), (VII. 16) и (VII. 16а) выведены
в предположении, что адиабата определяется формулой p v k = con st.
При этом никаких предположений о виде термического уравнения
состояния не делалось. Если имеется в виду специально идеальный
газ, для которого p v = R T , то формула (VII. 14) получает частный
вид:
к~1°
(VII. 14а)
То
к+1
Остальные три формулы остаются без изменения.
Соотношения (VII. 14а), (VII. 15) и (V II. 16а) показаны графически
на рис. 145 соответственно & = 1 ,4 . Ввиду важного значения этих
соотношений они приводятся в табличном виде для нескольких зна
чений показателя адиабаты k в р ук о
водствах по газодинамике.
Обратим внимание на то (это нам
понадобится еще в дальнейшем), что
при к = 1, т. е. при критической ско
рости потока, которая совпадает с мест
ной скоростью звука, значения приве
денных параметров определяются исклю
чительно величиной показателя адиаба
ты k . Эти значения, называемые кр и -
тинесним и, устанавливаются с помощью
формул:
1,00
0,75
0,50
(ру)*,
PoVq
*+Г
А-
2 \*-1
Ро U+1/
1
У*—( 2V-*
Vo “ U+1/
(VII. 17)
(VII. 18)
(VII. 19)
025
>|\
V
\Т
1
Д ^Jo
V\\ р
L)л
\
рА
Ро\
L_
\
\
Vл\
Nо К.
N
(V,L19a>
1.0
2J> А
Рис. 145.
Для идеального газа формула (V II. 17) приводится к
Г*
2
То А+1‘
виду:
При6= 1,4:
Приk=1,3:
р»!ро = °.52s; ти/то= р*/ро= °-634;
7*/7’о = 0,833 (если pv = RT).
P*IPo = °.546; т*/То = Р*/Ро = °>628;
7у /0= 0,870 (если pv = RT).
(VII. 17а)
(V II. 20)
(VII. 21)
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[О ГД. VII
366
6.
Продольный профиль трубы. В предыдущем изложении мы
совершенно не касались вопроса о необходимой связи между изме
нением состояния потока и профилем направляющего канала. В сл у
чае течения несжимаемой жидкости, т . е . жидкости в обычном пони
мании этого слова (например, воды, нефти и т. п .) , задача решается
чрезвычайно просто. И з уравнения постоянства расхода (VII. 1)
G*=
= const
V
мы получаем, принимая во внимание условие v = const, следующую
зависимость:
Fw = const.
Таким образом, для увеличения скорости течения следует умень
шать площадь поперечного сечения трубы, а для уменьшения ск о р о
сти следует соответственным образом площадь поперечного сечения
увеличивать. Имея в виду при этом, что скорость и давление в п о
токе жидкости являются величинами взаимно связанными, мы п олу
чаем возможность составить полную кинематическую картину развития
движения. Т ак например, желая описать процесс движения воды
в коническом переходе от трубы большего диаметра к трубе мень
шего диаметра, мы поступаем следующим образом . О твлекаясь от
затраты энергии на трение, мы сначала подсчитываем для ряда
сечений конической трубы средние скорости воды, исходя из задан
ной начальной скорости и из уравнения постоянства расхода. Затем,
подставляя эти значения скоростей в уравнение (VII. 8), находим соот
ветствующие им разности давлений.
Гораздо сложнее обстоит дело при течении сжимаемого газа.
Некоторые качественные заключения могут быть у ж е сделаны на
основе общего анализа условия постоянства расхода.
Положим для определенности, что в направлении течения с к о
рость потока увеличивается. Спросим себя, каким образом должен
при этом изменяться размер поперечного сечения трубы . Закон обрат
ной пропорциональности между F н w справедлив лишь до тех пор,
пока удельный объем v остается величиной практически неизменной.
Однако в данном случае удельный объем увеличивается, ибо по мере
нарастания скорости изменение состояния жидкости все более при
ближается к адиабатному независимо от условий обмена тепла со
стенками. Поэтому конфигурация трубы должна определиться одно
временно характером изменения скорости w и удельного объема v .
Если темп относительного возрастания скорости превосходит темп
относительного увеличения удельного объема, то труба должна
сужаться в направлении течения. Если же удельный объем увеличи
вается относительно быстрее, чем скорость, то труба должна рас
ширяться. Э т о т , на первый взгляд парадоксальный, результат является
не только математически возможным решением, но и вполне реальным
ГЛ. !!]
АДИАБАТНОЕ ТЕЧЕНИЕ
36?
с физической точки зрения случаем. Ввиду большой практической
важности вопроса обратимся к количественному анализу явления.
И з уравнения постоянства расхода (VII. 1) определим площадь
поперечного сечения F :
F=
Закон относительного изменения сечения выражается, очевидно,
такой формулой, которая получается из последнего выражения путем
логарифмирования и последующего дифференцирования:
dF
dv
dw
,
v
Т=Ц—IF -
(а)
Выразим правую часть формулы как функцию изменения давления.
Положим, что изменение состояния газа подчиняется уравнению
адиабаты p vk = const и что течение происходит без вредных сопро-
тивлений. В таком случае имеем:
dp
Р1
V
=0,или
dv ___
V*
и
—
vdp
,W2wdw
dw
=
------
или
g
w
\_dp_
кр
(Ь)
gpv dp
w3Р
Вводя в последнюю формулу скорость звука, согласно (VII. 10) по
лучаем :
dw___
d2 dp
w
kw2 p
Подставляя формулы (b) и (с) в (а), находим:
dF___cfl— w2dp
F
kw2 p
(c)
(VII. 22)
Проанализируем формулу (VII. 22) в соответствии с двумя воз
можными случаями: когда вниз по течению движение ускоряется и
когда оно замедляется.
Первый случай. Если вниз по течению движение ускоряется, то
знак d p jp отрицателен— давление падает, происходит адиабатное
dF
расширение. В этом случае, согласно (VII. 22), -рг < 0 лишь до тех
пор, пока w < а . Начиная с того сечения, в котором скорость те
чения w переходит через звуковую скорость а> должно иметь место
dF
неравенство -рг > 0 . Таким образом, продольный профиль струи д о л
жен быть сначала сходящимся, подобно тому как это бывает при
ускоренном течении воды, но затем, начиная с места, где скорость
308
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
(ОТД* VII
течения достигла звуковой скорости, профиль должен быть р а схо
дящимся. Только при этом условии может осуществляться дальней
шее ускорение газа вниз по течению. В наименьшем сечении струи
(горловина трубы) скорость газа совпадает с местной звуковой ск о
ростью. Именно по той причине, что совпадение этих д ву х скоростей
вызывает качественные особенности, отличающие течение газа от те
чения капельной жидкости, все признаки места совпадения w и а
носят названиt критических (кри
тическое сечение Z7* , критическая
скорость w * = а * , критическое
давление /?* и т. п.).
На рис. 146 схематически по
казана связь между скоростями
w и а. Вниз по течению ско
рость w растет, скорость звука а
падает (при расширении темпера
тура падает). Д о критического
сечения /%. (минимальное сече
ние) профиль сходится (конфу-
зор), за ним — расходится (диф
фузор). Обе части профиля долж
ны сопрягаться плавно, без изло
ма, так как приw=w^=а*
должно быть рг = 0. В дозву
ковой области течения местная скорость звука а превышает кри
тическую скорость л *, в сверхзвуковой области, напротив, она всегда
остается меньше величины я ;{;. Все сказанное можно записать в такой
форме:
dFЛ
-рг<0, покаw<а или а>я;И
dF“ Л
^
.
рг>0,когдаw>аили а<а
dF
Л
—
=0
приw=а=а*.
Второй случай. Если вниз по течению движение замедляется,
то знак dp jp положителен — давление растет за счет падающей кине
тической энергии, происходит адиабатное сжатие. В этом случае п р о
дольный профиль должен быть расходящимся (как для воды), если
только начальная скорость газа не достигает соответствующей зву- ,
ковой скорости. Если же начальная скорость является сверхзвуковой,
то для замедления струи требуется иметь сходящийся профиль (кон-
фузор), и только тогда перейти на расходящийся профиль (диффузор),
когда скорость снижена до достижения местной звуковой скорости
при~ <0
гл. и]
АДИАБАТНОЕ ТЕЧЕНИЕ
369
(скорость потока равна критической). Положение вещей схематически
показано на рис. 147. Имеем:
приу-> О
^<0,
£>0,
dF
Т-=°
покаw>аилиа<а*,
когдаw< аилиа>а*,
приw=a=а*.
Обобщая оба случая, можно высказать следующее утверждение.
Если скорость газа лежит ниже критической скорости (д о к р и -
тический режим), то профили
ровка трубы должна качествен
но совпадать с принимаемой
в гидравлике. При скорости газа,
превышающей критическую ско
рость {сверхкритический ре
жим),
профилировка
трубы
должна быть качественно про
тивоположной той, которая
обычна для гидравлики. Следует
иметь в виду, что при переходе
через критическую скорость изме
няются не только привычные ки
нематические свойства
потока,
но и целый ряд динамических
свойств. С этим приходится серьез
но считаться при создании про
филей лопаток для турбин и осевых компрессоров, а также при
проектировании авиационных профилей, так как между обтеканием
последних и внутренним течением вдоль криволинейных труб имеется
далеко идущая аналогия. Такие явления, как волновое сопротивление,
скачок уплотнения, отклонение струи в косом срезе, независимость
режима течения в трубе от величины противодавления и т . п . , с о
вершенно неизвестны гидравлике, которая занимается вопросами тече
ния практически несжимаемых жидкостей.
7.
Исследование задачи об истечении через сопла. Короткую
конфузорную трубу с плавным входом в технике принято называть
сходящимся или простым соплом. Комбинацию простого сопла
с диффузором называют соплом Л аваля по имени инженера Лаваля,
который в 1889 г. впервые применил расходящуюся насадку за кон-
фузором с целью получения особо высоких скоростей подачи пара
на рабочее колесо паровой турбины.
Задача об истечении через сопла из большого резервуара, в к о
тором параметры газа поддерживаются постоянными во времени,
24 Зак. 3543. В. С . Жуковский.
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
370
[ОТД. VII
очень важна в практическом отношении. Э т у задачу приходится
решать в д вух вариантах:
задаются расход газа и граничные условия, подлежат определению
основные размеры сопла и режим истечения газа или
задаются основные размеры сопла и граничные условия, подлежат
определению расход газа и режим истечения.
Разумеется, в обоих случаях свойства текущей среды считаются
известными. Кроме того , для получения отправных суждений анализ
производится вначале без учета трения.
Стандартными граничными условиями в задаче об истечении через
сопла считаются: давление р0 и температура Т0 (или удельный
объем v 0) в резервуаре, откуда начинается истечение. Соответствую
щая начальная скорость w 0 принимается равной нулю, чему эквива
лентно условие F q = о о . Все эти условия относятся к любому сече
нию резервуара, не слишком близкому к месту входа струи в сопло.
Последняя оговорка важна потому, что у входного устья сопла газ
устремляется к нему, получая заметное ускорение и образуя свобод
ную струю , являющуюся естественным началом струи, направляемой
в дальнейшем твердыми стенками. В этом районе параметры газа
отличаются от первоначальных, причем близость входа сказывается
по-разному в зависимости от конфигурации сопла. Помимо начальных
параметров р 0 и t0, в состав граничных условий входит противо
давление р а за соплом.
В качестве первого положения при исследовании следует принять,
что в минимальном сечении сопла, какое бы сопло ни рассматрива
лось, скорость истечения не может превзойти местной скорости звука.
Второй шаг исследования заключается в выводе формулы , связы
вающей поперечное сечение сопла F с местным давлением /;. Имеем:
где w определяется из формулы (VII. 8а), а удельный объем v — из
уравнения адиабаты:
/1
л+1
jГ
л-1
*)=р* V
* )> <vlI-23)
ввиду чего
Р*)•
Введя обозначение
получаем:
(VII. 24)
ГЛ. II]
АДИАБАТНОЕ ТЕЧЕНИЕ
371
Весовой расход вдоль сопла есть величина постоянная. П оэтом у из
последней формулы находим, что для каждого конкретного случая
истечения
Таким образом, размер поперечного сечения и соответствующая вели
чина ф обратно пропорциональны друг другу.
Из формулы (VII.23), выражающей ф в функции от р, видно, что
фобращается в нуль прир=1, т. е. прир=р0, и прир=0,
т. е . при р = 0 . Соответственно, значение F обращается при этом
в бесконечность.
М еж ду своими двумя предельными значениями величина ф имеет
максимум. Условие максимума находят обычным путем. Имеем:
Полученное значение р , при котором ф имеет максимум, совпадает
с величиной отношения p j p 0, согласно формуле (VII. 18). Таким об
разом, это значение р является критическим значением р^, при к о то
ром скорость потока совпадает с местной скоростью звука:
Разумеется, такой результат можно было предвидеть. Действи
тельно, согласно (V II.25), условию ф = фтах отвечает F = F m[lu а мы
уже показали, что критическая скорость может иметь место не иначе,
как в месте наименьшего сечения струи. Характер кривых ф = ф(Р)
и F = F ( Р) при заданных значениях О*, р0 и v 0 показан на рис. 148.
Приступим теперь к исследованию поставленной задачи об исте
чении через сопла. При этом будем считать, что начальные пара
метры газа зафиксированы. Для придания рассуждениям наглядности
построим рис. 149, повторяющий предыдущий рис. 148 в отношении
кривых F = F ($), каждая из которых отличается постоянным пара
метром G*, G*, G* и т. д . Такое семейство линий F = F($) исчер
пывает все возможные правила профилирования сопел при выбран
ных р 0 и v 0. Каждая из линий определяет некоторый частный закон
изменения F в функции от р применительно к такому теоретическому
случаю, когда р пробегает от одного крайнего значения р=зр0= 1 ,
на входе, до другого крайнего значения Р = Ра = 0 , на выходе.
/^ф
=
const.
(VII.25)
к
к
24*
372
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[О ГД. VII
Первый вариант задачи. Даны: р0, v0, (За =
,G*иk.Ha
Ро
рис. 149 из семейства линий F = F ( p ) выбираем ту линию, которая
имеет параметром заданный расход G*. Пусть, например, эта линия
отвечает G *. Отмечая на горизонтальной оси место, где |3 равно
заданной величине ра, по ординате линии F находим размер выход
ного сечения сопла F a. Если [30 > (3#, то сопло должно быть про
стым (конфузорным); если (За < [ ^ , как принято на рисунке, сопло
надлежит снабдить расходящейся насадкой (диффузором). В послед
нем случае необходимый размер минимального сечения (горловины)
F m[n = F 4 может быть снят из графика. Только эти два размера
Faи
вытекают из термодинамических соображений. Что касается
длины д иффузора, то она выбирается из чисто газодинамических
соображений. При большом угле раствора диффузора возникает опас
ность отрыва струи от стенки, при малом угле раствора p a cre t длина
расходящейся части сопла и непомерно увеличиваются потери на
трение. При этом диффузор только в грубых случаях можно делать
коническим (угол конусности принимается обычно в пределах 8— 12°,
хотя имеются основания считать, что этот у гол может быть взят
гораздо большим без опасности отрыва от стенок, поскольку поток
ускоряется вниз по течению). Если же предъявляются специальные
требования об устранении скачков уплотнения, то продольный про
филь диффузора получается криволинейным. В се эти обстоятельства
выходят за фамки термодинамики. Таково же положение вопроса
о длине и продольном профиле простого, конфузорного, сопла. Для
него термодинамика может дать только один размер — размер вы ход
ного сечения F a.
Если при прежних фиксированных параметрах р0 и v 0 и при
прежнем расходе G* задается меньшее значение ра , т о , как следует
гл. и]
АДИАБАТНОЕ ТЕЧЕНИЕ
373
из рис. 149, расходящуюся насадку нужно удлинить, с тем чтобы
струя на выходе имела больший размер поперечного сечения. При
увеличении задаваемого (За против первоначального значения р а с х о
дящуюся насадку следует укоротить или даже ее отбросить.
Соображения по поводу режима течения отличаются такой же
простотой. В случаях, когда
> |3#, имеют место дозвуковые скорости
вплоть до выходного сечения F a. Если (За <
то за горловиной,
в диффузорной части, устанавли
ваются сверхзвуковые скорости.
Второй вариант задачи, слу
чай простого сопла.
Даны: р0, v0,
= (ра/р0), F a
и k . Подлежит нахождению рас
ход G*.
Здесь могут представиться в свою
очередь два случая:
лежит между
и единицей, и |За лежит между ну
лем и р*.
Пусть Р .< Р0< 1.
На рис. 150, повторяющем осно
ву рис. 148, проведена горизон
таль на уровне F a. На этой гори
зонтали
соответственно заданному
значению ра фиксируется точка, относящаяся
сопла, а по такой точке определяется линия
Так например, если (За = |За§1, то линия
койаиО*
—
о;-
к выходному сечению
искомого расхода О \
l9 Ivj линии расхода определяется точ-
При уменьшении р а, т. е . при уменьшении (За, по
проведенной горизонтали приходится перемещаться влево, пересекая
линии все больших расходов. Так, для ра = рв>2 получаем точку b,
для которой G* = G* > G*. Такая закономерность длится до дости
жения некоторой точки т , где уровня F a = const касается некоторая
из линий G* = const. При этом ра = р#, и расход через сопло с за
данным выходным сечением F a оказывается наибольшим из возможных.
Пусть 0< р0< р..
В этом случае продолжение движения влево по горизонтали
F a = const не имеет более физического смысла. В простом, конфу-
зорном, сопле выходное сечение F a является одновременно и мини
мальным. Н о , как было уже выяснено, нельзя в минимальном сечении
получить скорость выше критической, а эта последняя уже устано
вилась при |30 = р%. Следовательно, как бы ни было уменьшено (За по
сравнению с
повлиять на режим истечения нельзя. Давление у вы
ходной кромки со пл а, достигшее критической величины при у ста
новлении противодавления р а = j ^p0, остается постоянным, несмотря
на дальнейшее снижение противодавления ра. Вместе с тем, незави
симо от величины ра9 все другие параметры струи (скорость, темпе-
374
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[ОТД. VII
ратура, удельный объем) остаются постоянными и равными своим
критическим значениям. Постоянным остается и р асхо д G * = G *ax.
Примерный характер падения давления по длине простого сопла
приведен на рис. 151. Уменьшение противодавления р а вплоть до
достижения критического давления вызывает перестройку режима
течения по всей длине сопла. Однако дальнейшее снижение противо
давления не оказывает влияния ни на развитие процесса в сопле, ни
на значения параметров струи у его вы
ходной кромки. Обозначив давление на
выходе из сопла через р'а , в этом случае
имеем:
Ра= кРо>Ра-
Таким образом, достижение газовой струей
заданного снаружи противодавления про
исходит за соплом, в свободном про
странстве, где струя получает возможность
несколько расширяться в поперечном на
правлении. Н е следует думать, что при
этом скорость продолжает расти так, как
если бы струя была направлена д иф фу
зором: расхо д энергии на вовлечение не
подвижной окружающей среды в зону
струи, а также потери, связанные с возни
кающими уплотняющими ударами, в силь
нейшей степени тормозят истекающий газ.
Полезно вдуматься в физическую причину того, почему давле
ние и скорость на выходе из простого сопла не могут перейти через
положенные для них пределы. Представим себе струю, вытекающую
при критическом режиме со звуковой скоростью в резервуар, в кото
ром давление поддерживается в точности равным критическому.
С помощью отсасывающего вентилятора создадим внезапно в резер
вуаре давление, несколько меньшее критического. Э ? о значит, что
от винта вентилятора станет непрерывно распространяться в стороны
и достигнет выходного сечения сопла волна разрежения, скорость
распространения которой по отношению к газу равна скорости звука.
Если у честь , что выходящая газовая струя движется навстречу
с такой же скоро стью , то будет ясна невозможность проникновения
возмущающего действия разрежения внутрь сопла. Э то остается спра
ведливым, как бы далеко мы ни снижали противодавление. А н ал о
гично можно объяснить, почему режим сопла Лаваля, поставленного
в условия работы на пониженное против расчетного противодавление',
совершенно не отличается от нормального режима.
Второй вариант задачи, случай сопла Лаваля.
Даны: р0, v0, Р0 = (pJPo),
т= (Fa‘Fm) иk. Требуется
найти расхо д G * и установить режим течения.
Рис. 151.
ГЛ. IIj
АДИАБАТНОЕ ТЕЧЕНИЕ
375
Пусть
Численное значение величины К и как б у
дет показано ниже, определяется как функция степени расширения
диффузора т и показателя k\ эта функция показана на рис. 152.
В рассматриваемом подварианте р ас
ход G* находится непосредственно по дан
ным, относящимся к выходному сече
нию F a. То обстоятельство, что выходу
предшествует сначала сужение, а затем
расширение струи, не играет роли, так
как течение предполагается обратимым и,
следовательно, промежуточные состояния
не оказывают влияния на итог процесса
истечения. Для иллюстрации обратимся
к рис. 153. Исходя, например, из задан- т
ных значений F a и Pttil, определяем точ
ку а , / , а по ней и соответствующую ве
личину G* = G*. Для установления пара
метров струи в минимальном сечении над
лежит спуститься по линии G* = G j = const
до достижения ординаты F = F m, т. е . до
точки L В данном случае
^ и, сле
довательно, на всем протяжении сопла
Лаваля скорости не достигают критиче
ского значения. О т входа до горловины
линия постоянного расхода проходится сверху вниз, а начиная от гор
ловины и до выхода — снизу вверх. В целом сопло с расходящейся
насадкой выполняет здесь роль,
аналогичную трубе Вентури в гид
равлике.
Оценим теперь в качественном
отношении, как изменится работа
сопла при уменьшении противо
давления. Приняв, что р а%2 < p at j,
получим для выхода точку а , 2 ,
которая лежит левее точки а , 1 и,
следовательно, определяет более
значительный расход G*. чем в пер
вом случае. Соответственно этому
давление в горловине сопла оказы
вается меньше (точка 2), прибли
жаясь к критическому. Переходя
к еще более низким противодав
лениям, мы достигнем такого режима, при котором в минимальном
сечении установится критическое давление (точка т) и, следовательно,
скорость звука. Соответствующее отношение противодавления к на-
376
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[ОТД. VII
чальному давлению обозначим буквой K v Этот случай будет харак
теризоваться максимальным расхо дом , возможным для данного сопла
при фиксированных значениях начальных параметров.
Величина предельного отношения (рп//р0) = К х могла бы быть
найдена из того же графика на рис. 153, если бы он был построен
в масштабе. Ее можно определить и аналитически, произведя сл едую
щие выкладки. Имеем:
Уд
U>m
£а_ Wa_ Vm_ _
тМдУщ_j
У>т Уд
TMт Уд
Y
1+2g-
k PmVm
k—1 wl,
k-1
k
1‘"(£)*]’
Ут
Уд
1
k
При объединении этих формул учтем, что величинам, помеченным
индексом т , нужно приписать критические значения, так что
PmVm =
P0VO< wm =*2gjZpiP0V0>
Ра__Ра
Ро __
Ра
Рт
Ро
Рт
к*
Л-1
После надлежащих подстановок и преобразований нетрудно получить
такое уравнение:
а
к+1
к—1
(*)
И з этого уравнения видно, что при заданном т та величина |За,
которая отвечает звуковой скорости в горловине и которая обозна
чена через К 19 является функцией одного только показателя адиа
баты к.
Результат решения (*) при * = 1 ,4 и 1,3 приведен на рис. 152,
как было уже упомянуто ранее.
Из рассмотрения последнего рисунка, между прочим, видно, что
уже при совсем малом расширении диффузора т в нем происходит
почти полное восстановление первоначального давления. Так напри
мер, при т = 1,1 и при звуковом режиме в горловине /С1 = 0 ,7 4 >
т. е . давление на выходе из сопла достигает 7 4% от давления
в резервуаре (при * = 1 ,4). Однако дальнейшее восстановление давле
ния становится все более затруднительным. Т ак , только при т = 2
получаем К г = 0 ,95. Поэтому, если учесть неизбежные в действи
тельности потери на трение, применение длинных диффузоров с боль
шой степенью расширения т становится практически бесполезным.
гл. и]
АДИАБАТНОЕ ТЕЧЕНИЕ
377
Целесообразно еще раз указать, что если $а задано равным К и
то весовой расход через сопло является максимальным из возмож
ных. Если 1 > Р а > /С 1, то устанавливается любой расход, в пре
делах от нулевого и до максимального. При этом режим течения
повсеместно остается докритическим.
Продолжим исследование на случай, когда §а = К2 <
причем К 2
определяется как функция т и к , как это видно из рис. 152, соот
ветственно к = 1 ,4 и 1,3.
Обратимся к рис. 153. На кривой G * = G * ax, отвечающей кри
тическому режиму в заданном минимальном сечении F m, имеются
две точки с ординатой F a = rnFm. Первая из них а ' характеризуется
абсциссой $а = К 1 и определяет минимальное противодавление, при
котором диффузор способен нормально работать в качестве заме
длителя струи и восстановителя давления, о чем речь была выше.
Вторая точка а" с абсциссой ра = К 2 относится к случаю, когда
диффузор выполняет функцию ускорителя газовой струи. Истечение
получается при этом сверхкритическим. П оскольку величина расхода
устанавливается здесь постоянной, мы, в сущности, возвращаемся
к случаю , изображенному ранее на рис. 149. Разница заключается
лишь в том, что там была задана величина $а и следовало найти ей
соответствующую площадь сечения F a , теперь же фиксируется F a,
а ищется отвечающее ей расчетное значение [За = /С2. Из ри с. 153
видно, что при наличии в горловине критического режима су щ е
ствует только одно единственное противодавление р а = К 2р0, кото
рое однозначно связано с заданной степенью расширения т . Э то проти
водавление совпадает с давлением струи у выходной кромки диффузора.
При заданных начальных параметрах последнее зависит только от т .
Величину (За = /(2 как функцию т и к можно найти, естественно,
и из уравнения (*), которое имеет два корня. Первый из них, обо
значенный через К и был уже использован при обсуждении докрити-
ческих режимов и такого критического режима в горловине, при
котором диффузор работает как восстановитель давления. Второй
корень, обозначенный через /С2, также относится к критическому
режиму в горловине, но при условии, что диффузор предназначен
для дальнейшего снижения давления и получения сверхкритических
скоростей. Кривая К 2 является почти симметричной по отношению
к кривой K v Поэтому сказанное ранее о недостаточной эффектив
ности больших степеней расширения диффузора т остается в силе
и для сопел Лаваля, от которых требуется получение возможно
больших скоростей истечения.
В заключение обратимся к работе заданного сопла Лаваля на
нерасчетных режимах. Нерасчетными режимами называются такие,
при которых К2
или 0 <(За < А г2. На рис. 152 они изобра
жаются точками, для которых (За лежит между кривыми
и
или
под кривой Ко. На рис. 153 это же условие выражается тем, что
Рв лежит между точками а' и а" или же левее точки а".
378
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[ОТД. VII
При нерасчетных режимах соответствие между размерами сопла
Лаваля и граничными параметрами газа нарушается, и режим истече
ния оказывается заведомо ненормальным. Если |3rt < /С2, то режим
течения остается нормальным на всем протяжении сопла Лаваля,
вплоть до выходной кромки, где устанавливается расчетное давле
ние р 'а , большее чем р а . Ненормальность истечения имеет место уже
за соплом , где давление в свободной струе сравнивается с противодавле
нием только на некотором расстоянии от места в ыхода, в связи с чем
свободная струя отчетливо расширяется. Вследствие перемешивания
со спокойной средой и особенно из-за возникающих скачков у пл от
нения выходящая из сопла струя сильно подтормаживается, и ожидае
мого увеличения скорости не происходит. Если поэтому применение
сопла Лаваля имеет целью создание возможно больших скоростей за
счет падения давления, то уменьшение противодавления ниже расчет
ного никакого практического выигрыша в скорости дать не может.
Если (Зд лежит между К г и /С2, то противодавление р а оказы
вается выше расчетного давления /?', которое должно было бы у ста
новиться перед выходом струи из сопла.
В этом случае ненормальность режима
проявляется внутри самого диффузора.
Давление в нем совпадает с расчетным
давлением только до того места, в ко
тором это расчетное давление дости
гает заданного противодавления р а .
Говоря точнее, нормальный характер
изменения давления вдоль сопла со хр а
няется даже несколько дольше, в связи
с чем давление в набегающей струе
оказывается немного меньше противо
давления. Однако более или менее глу
боко внутри диффузора проявляется
неустойчивость такого движения, и п р о
исходит скачкообразное возрастание
давления до величины противодавления,
струя затормаживается, отрывается от
стенок, и возникает сложное явление
резко нестатического, необратимого характера, приводящее к росту
энтропии. Отрыв струи от стенок и уплотняющий удар вызывают боль
шие потери кинетической энергии струи , и скорость на выходе из соплп
оказывается меньше той, которую можно было бы получить, если бы диф
фузор был укорочен соответственно принятому противодавлению. Пр ед
ставление о поведении потока при нерасчетных режимах дает рис. 154.
8. Расчет истечения через сопла. Расчетные формулы для исте
чения через сопла могут быть простым образом получены из урав
нений одномерной газовой динамики только в том предположении.
гл. Ill
АДИАБАТНОЕ ТЕЧЕНИЕ
379
что адиабата подчиняется уравнению p v k = co nst, где показатель
адиабаты k остается постоянной величиной. Э то условие не собл ю
дается, если имеется в виду истечение газов при очень резком падении
их температуры или истечение перегретого водяного пара, который
внутри сопла переходит в насыщенное состояние. В таких случа ях
расчет рекомендуется производить графически, с помощью диа
граммы i-s .
Простые сопла. Если обычные формулы гидравлики неприменимы
вследствие необходимости учитывать сжимаемость, то расчет ведется
по формулам (VII. 9а), (VII. 24), (VII. 23):
««= V 2^т=тг р&оО- РТ"); о*= Fa% j/*а
где
При этом, согласно (VII. 13),
«*= уЛ2gj^PoVo
иК=^
=
V £=г{(1-Р«*)
В приведенных здесь формулах ра означает отношение противо
давления р а к начальному давлению /?0. Такое понимание ра законно
лишь до тех пор, пока
Если Рд< (3* =
[см. (VII. 18) и (VII. 13)], то давление
на выходе из сопла остается равным критическому независимо от
величины противодавления р а. Поэтому в приведенных здесь форму
лах следует взамен |За подставить |3*. При этом получаем: Х0 = 1 и
= Я* =»]/"2g
*+1 Povo
Если*= 1,4,то
= я*= 3,38YРо°<у>еслик= 1,3,тодо0= а#=
“ ■3,33Ур<р0.
__
о*= Glax= Fai(шах|/*^ ,
где
4 =Г_2 _У'Г-Т1/'Ж
.
Vmax \^+ 1/ У *+1
Если*= 1,4, то ф1ШИ=2,15;если *=1,3, то <|»т„ = 2,1.
380
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[ОТД. VII
С помощью диаграммы i s расчет истечения через простые со
пла ведется следующим образом. И з точки, изображающей начальное
состояние, опускается вертикаль до линии заданного противодавле-
ния р а (если р а > /?*). Длина полученного отрезка дает в соответ
ствующем масштабе убыль энтальпии (изоэнтропический теплопере-
пад). Согласно (VII. 7а), имеем:
где v a находится с помощью той же диаграммы i s .
Указанный графический расчет верен, как было оговорено , только
дотехпор,пдкаР0>р*, т. е./>0>р*. Если ра<р*, тонавы-
ходе из сопла устанавливаются критическое давление и критическая
скорость, не зависящие от противодавления р а. В таких случаях на
диаграмме i s следует опускать вертикаль из начальной точки только
до достижения линии критического давления р * = 13*/?0, т . е . до
р*= 0,528р0при/5= 1,4 и
0,546 р0 при /5= 1,3.
В остальном расчет повторяется.
Сопла Лаваля (при расчетном режиме). Приводимые формулы
комментариев не требуют:
Сп о со б графического расчета покажем на числовом примере.
Пусть требуется рассчитать сопло Лаваля для водяного пара, если
перед соплом /?0=15 am, /^= 300°С и за соплом /?0=1 ,4ат.
Отвлекаясь от потерь, находим из диаграммы i s располагаемый
тепловой напор (разность энтальпий). И меем :
откуда конечная скорость, если начальной можно пренебречь:
wa= 91,53/г0— го.
Для определения расхода применяем формулу
Q*_
FgWg
При этом Аа>1, гак как раКр*•
1
где
/0— ia~ 725— 612= 113 ккал}кГ,
wa= 91,53 V 113= 973 Mlсек.
Выходное сечение сопла
Гл. II
АДИАБАТНОЕ ТЕЧЕНИЕ
381
где, согласно той же диаграмме,
=
1,19 мй/кГ,
11Q
Fa= щ G* = 0,001224 G*[лР\= 12,24 G*[см%
Величина любого другого сечения F должна определяться из
условия
F_ waу
Fa WVа'
Если в диаграмме i s на уровне точки а отложить в некотором
масштабе величину F a, то по
нескольким точкам, соот
ветствующим
произвольно
выбранным давлениям, не
трудно
провести кривую
(рис. 155), абсциссы кото
рой пропорциональны п о пе
речным сечениям
паровой
струи.*) Рассматривая эту
кривую в целом, легко убе
диться в необходимости то
го знакопеременного измене
ния сечения, которое было
установлено в предыдущем
пункте на основе других
соображений. Вместе с тем
можно непосредственно най
ти величину минимального се
чения F m. В долях от выход
ного сечения оно состав
ляет 4 3% ; состояние пара,
которое в этом сечении уста
навливается, характеризуется параметрами: р т= 8,2 ат\ tm = 2 3 0 °С .
Отсюда же находится и скорость в минимальном сечении w m:
wm= 91,53 У i0— im= 91,53 У 34= 534 м/сек.
Но смыслу наших рассуждений эта скорость является скоростью
звука, отвечающей условиям в сечении F m.
П оск ол ьку минимальное и выходное сечения сопла определены,
можно соответственно выбранному у глу конусности насадки и форме
ее поперечного разреза вычислить осевую длину насадки. Длина с у
жающейся части сопла является довольно произвольной и принимается
х) На уровне начального давления кривая уходит в бесконечность ввиду
того, что входная скорость w0 положена равной нулю.
382
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[ОТД. VII
в соответствии с данными практики. Изображенное на рис. 156 сопло
предположено в сечении прямоугольным и имеющим постоянную
ширину при конусности по высоте равной 10 °.
Таким образом, ли
нейные размеры показанного разреза по высоте -сопла оказываются
пропорциональными площадям сечения на рис. 155. Для нахождения
параметров состояния пара в любом месте сопла следует с помощью
циркуля отыскивать на рис. 155 сечения, которым в масштабе соот
ветствует тот или иной линейный размер рис. 156. Затем по засе ч
кам адиабаты на сетке диаграмы i s можно все интересующие нас
параметры перенести на разрез сопла. Таким путем на рис. 156
построены кривые изменения по течению величин р у v , t и w . О с о
бенно интересным является сопоставление кривых v и w . Мы видим,
что относительно медленное возрастание скорости в области сверх
звуковых скоростей сопровождается резким увеличением удельного
объема, что и приводит к необходимости обеспечивать расширение
струи. Противоположная картина имеет место в дозвуковой области
на входном участке.
Из изложенного ясно, что каждому заданному расходу при задан
ных начальных параметрах соответствует определенный размер мини
мального сечения сопла. Следовательно, и обратно, каждому задан-'
ному размеру минимального сечения однозначно отвечает некоторый
весовой р асхо д , выше которого нельзя подняться, не изменив началь
ных параметров потока. Т о обстоятельство, что конечные параметры
не играют здесь роли, вытекает из способа построения рис. 155, на
гл. п]
адиабатное течение
383
котором можно, например, отсечь вплоть до места минимума F любой
концевой отрезок без какого бы то ни было влияния на очертание
кривой от входа и до указанного минимума.
9. Поправки на начальную скорость. В ряде практических слу
чаев нельзя пренебрегать начальной скоростью w0 перед соплом.
Соответствующие поправки особенно существенны, если сопло при
соединено не к резервуару, а встроено в трубу, площадь сечения
которой близка к площади сечения горловины.
Выразим прежде всего критическую скорость звука, для чего вер
немся к формуле (VII. 12). Имеем:
Для исследования результата целесообразно вместо этой развернутой,
удобной для вычисления формулы составить др угую , вернувшись
к величине а0. Получаем:
с формулой (VII. 12). В этом случае а#<а0, так как £>1. По
скольку звуковая скорость меняется в одну сторону с температурой
газа, заключаем, что в критическом сечении температура должна быть
меньше, чем в начальном: струя адиабатно расширяется, и ее ск о
рость w растет. Этот случай был нами подробно рассмотрен.
При отклонении числа М 0 от нуля критическая скорость а * растет.
Это значит, что критическая скорость достигается уже при меньшей,
чем в первом варианте степени адиабатного расширения. Есл и М 0= 1,
т. е. начальная скорость совпадает с местной звуковой скоростью,
то а# = а0. При Af0> l получаем <г*>я0. Таким образом, если
начальная скорость является сверхзвуковой, то критическая скорость
Достижима в связи с увеличением температуры струи, т . е. п о сред
ством ее адиабатного сжатия. Как было уже ранее указано, это о су
ществимо благодаря геометрической конфузорности струи.
Переходим к формулам для приведенных параметров. Возвращаясь
к формуле (VII, 12), имеем:
“'о ,
"о
,
2
Л—1 “ 2 ■А?—1
2 А—1в
Подставляя сюда вместо a l величину gkpQvQy находим:
/2
а2
_
1 fc+l
2 ‘ (k—1)я2 2 k—l9
384
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[ОТД. VII
где а\ выражается формулой (VII. 26) и а 2 = gkp v. Производя под
становку, обозначая отношение w 0/a0 через М 0 и выполняя алгебраи
ческие преобразования, находим:
ру
РNo>
(VIL27)
Формула (V II. 14) является частным видом этой последней формулы.
Соответственно взамен формулы (V II. 15) получаем:
Ро
k—1}2I^—1
Т+\К"•
2~ (*
(VII. 28)
Критическое отношение давлений находим, положив Л = 1:
ь-2
-(
k—1
k+l 'k+\
м1)к~
(VII. 29)
Последняя формула показывает, что (3* имеет наименьшее значение
при М0= 0, т. е. при w0= 0. Если w0ф О -и задается все более
значительным, то |3* монотонно растет, переходя через единицу при
М 0= 1 . Это вновь подтверждает,, что для достижения струей крити
ческих параметров следует адиабатное расширение делать тем меньше,
чем выше начальная скорость, а при сверхзвуковой начальной ско
рости адиабатное расширение нужно заменить сжатием.
Исходя из приведенных здесь формул, можно спроектировать сопло
по заданным условиям его работы. Однако для решения обратной задачи
эти формулы неудобны. Если размеры сопла заданы, то учет началь
ной скорости целесообразно производить через степень сужения кон-
фузора m = (F m/F0) (естественно, что условие ((У0 Ф О равнозначно
условию F 0 Ф оо). Имеем:
Fmwm _ FqW0.
_
Vm
vm
v09
m
m v0•
Возведем последнюю формулу в квадрат и подставим
выражение, согласно (VII. 8):
Л—1
wl= wl-2g
вместо w 0
Решив полученное уравнение относительно w m и заменив отношение
Vo/Vm через {рт'р0У1к =
найдем:
■w„
уггщт■
(1- р«‘ )
(V II. 30)
ГЛ. II
АДИАБАТНОЕ ТЕЧЕНИЕ
385
Для весового расхода соответственно получается:
где
G*=
^ т^т
Vm
(VII. 31)
Как видим, поправка на начальную скорость, или, что то же, по
правка на степень сужения, выражается множителем .
1=.
Формулы (VII. 30) и (VII. 31) применимы как для простых, кон-
фузорных, сопел, так и для сопел Лаваля, если сопла присоединены
к трубопроводу. В случае простых сопел нужно понимать
как (За,
т. е . как отношение противодавления р а к />0. Разумеется, при (3а< [3*
на выходе из простого сопла устанавливается критическая скорость,
и р асхо д получает максимальное значение. При этом в указанные две
т
Рис. 157.
формулы нужно вместо (3W подставить J3*. Э то же критическое отно
шение давлений имеет место и в сопле Лаваля при его работе на р ас
четном режиме. Отыскание
производится путем нахождения макси
мума величины <5>w = /(?w) при k = const и т = const из формулы
(VII. 31) или путем выражения в формуле (V II. 29) величины М 0 че
рез т и (3*. Получающееся уравнение имеет вид:
2
1_- к
тЦк-1)р*+2?fc-(*+l)= 0;
-
^ 1 ------^
=тцк-1).
б£
$кк
К4сожалению, это уравнение не решается относительно {3* в за
конченной аналитической форме. Результат его графического решения
представлен на рис. 157. Р и с . 158 дает соответствующие значе-
ИИЯ ('} „ ,)max-
25 Зак. 3543. В. С . Жуковский.
386
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[ОГД. VII
В формулы для скорости и для расхода, имеющие в своем со-
ставе степень сужения конфузора т , не входит в явном виде началь
ная скорость w0. Между тем в случае, когда на выходе из конфузора
установилась критическая скоро сть , величина w 0 имеет совершенно
определенное значение, которое является максимально возможным при
заданных /и, р 0 и v 0. Обозначив скорость w 0, сопряженную со ск о
ростью
в минимальном сечении через w 0, имеем следующую рас
четную формулу:
1^
^Qmax___FтЩ .
^Qniax _ _
jк
W*
/*оV*’
‘*
Искусственное превышение скорости w 0mo,x с необходимостью об
условливает изменение установленных ранее при входе параметров
в сторону увеличения р 0 или уменьшения v 0.
ГЛАВА III
ТЕЧЕНИЕ ГАЗА С ТРЕНИЕМ, С ТЕПЛООБМЕНОМ
И С ПРОИЗВОДСТВОМ ТЕХНИЧЕСКОЙ РАБОТЫ
10. Адиабатное течение с трением при dlT= 0. Адиабатное те
чение с трением при отсутствии технической работы описывается
следующими основными уравнениями:
dl-{ -Ad^ = Q;
(VII. 32)
vdp-|-d^-\ -dlr= 0;
(VII. 33)
dqr= di—Avdp;
(VII. 34)
ds>0.
(VII. 35)
Формула (V II. 35) показывает, что реальное адиабатное изменение
состояния изображается в диаграмме l - s линией, отклоняющейся
в сторону возрастающих значений энтропии. Поэтому действительное
приращение энтальпии А/ между заданными изобарами оказывается
меньше идеального при расширении газа и больше идеального — при
сжатии. Имея в виду, что, согласно (VII. 32),
Д/+АД|=0,
приходим к такому вы воду: при течении газа в направлении пони
жающегося давления наличие трения замедляет рост кинетической
энергии; при течении газа в направлении возрастающего давления
фиксированное увеличение последнего при наличии трения происхо
дит за счет большего падения кинетической энергии, чем требуется
при отсутствии трения.
ГЛ. Ill]
ТЕЧЕНИЕ С ТРЕНИЕМ И С ТЕПЛООБМЕНОМ
387
Обратимся специально к случаю истечения, когда начальная
скорость принимается за нуль. Обозначив теоретически возможную
в идеальных условиях скорость через w f и действительную скорость
через w , можно связь между ними выразить в такой форме:
Коэффициент пропорциональности, называемый коэф фициентом ск о-
рост и%всегда имеет значение, меньшее единицы: <р < 1 . Задача к о р
ректирования термодинамических расчетов сводится к эксперимен
тальному определению величины <р. Н уж но иметь в виду, что най
денный для какого-либо одного сечения коэффициент скорости не
может быть механически отнесен к любому другому сечению. Кроме
того, коэффициент скорости для заданного газа и заданной конфигу
рации сопла является функцией от числа R = pwdl'\Li где d — опре
деляющий размер сопла и (х — коэффициент вязкости. При больших
скоростях величина ср может еще меняться вместе с числом Маиевского
M = w ja 9 т. е . с отношением скорости к местной скорости звука.
П о коэффициенту скорости легко определить количество теряемой
кинетической энергии. Если в идеальном случае кинетическая энергия
должна была бы равняться E K = (w/2/2g)9 то в действительности
она равна Е к = (w -feg). Разность этих величин дает потерянную
кинетическую энергию, которую обозначим через £ к, г :
Величина 1— ср2 обозначается буквой С и называется коэф ф и-
11itлитл *й ил miлnft аилгупни
(VII. 36)
s
течения и определить соответствующую ско-
рис 159
рость w. На рис. 159 отрезок ОА' дает
в масштабе E s = (w,aj2g). Разделив его на части, относящиеся друг
к другу как I — С относится к С, получаем точку N :
Рис. 159.
ON_ I
-
С
NA'~
С'
25*
388
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[ОТД. VII
Н а заданной изобаре помечаем точку А , которая лежит на том же
уровне, что и точка ЛЛ Эта точка и отображает термическое состоя
ние газа, устанавливающееся в результате адиабатного течения с тре
нием. Обратно , если из непосредственного опыта установлено действи
тельное термическое состояние газа в струе, то путем сопоставления
его с теоретически возможным состоянием находят величину ко эф ф и
циента потери энергии, а следовательно, и коэффициент скорости.
Что касается вычисления скорости w /> то оно производится по одной
из двух следующих формул:
да=91,531lA;
w = 91,53<pj/i0— iA, .
Учитывая трение, следует при заданном расхо де размеры сопел
брать ббльшими, чем в идеальном случае. Э то ясно из формулы (V II. 1 ):
F—G*
W
Здесь скорость w отстает, как было выяснено, от идеальной ск о
рости w'.
Напротив, удельный объем v превосходит идеальную вели
чину v ' благодаря расширению потока из-за внутреннего тепловыде
ления.
Задача. С опло Лаваля работает на перегретом водяном паре при
Pq = 1 0 am и /0= 35°С . Противодавление p a = Q,l am, коэффициент потерн
энергии С = 0,3. Определить площадь выходного сечения сопла в отношении
к рассчитанной для идеального случая.
При адиабатном течении пара без потерь его конечное состояние опре
делялось бы точкой А ', в которой х = х А/ = 0,884. В действительности ко
нечная точка лежит на отклоняющейся вправо линии О А . Проекция этой
линии на вертикаль должна составлять (1 — ?)-ю часть от О А С другой
стороны, точка А должна лежать на линии 0,1 am. Отсюда находим точку А,
в которой х = х А = 0,988. В ней удельный объем пара превышает теорети
чески возможный в 0,988/0,884 = 1,13 раза, тогда как скорость меньше тео
ретически возможной в Y 1 —
У \ — 0,3 = 0,838 раза. В соответствии
с этим площадь выходного сечения должна быть в 1,13/0,838= 1,338 раза
больше рассчитанной для идеального случая.
Продолжим рассмотрение адиабатного истечения с трением. Из
формулы (VII. 34) видно, что этот процесс не подчиняется бо
лее уравнению адиабаты p v k — co n st, справедливость которого об
условлена требованием, чтобы du~\ - A p d v = 0. Вследствие трения
линия расширения О А идет в координатах p - v более полого,
чем линия О А \ изображающая адиабату в идеальном случае течения
(рис. 160), так как в местах соответственно равного давления
удельный объем v ' должен быть всегда меньше действительного
удельного объема v .
Для описания в координатах p - v действительного хода расши
рения можно прибегнуть к уравнению политропного типа p v n = const,
где заведомо известно, что п < А. Возможность использования такого
ГЛ. Ill]
ТЕЧЕНИЕ С ТРЕНИЕМ И С ТЕПЛООБМЕНОМ
389
уравнения дает повод назвать самый процесс истечения политропным.
Однако применительно к данному случаю этот термин является
двусмысленным, может привести к ошибкам и поэтому не должен
рекомендоваться. В этом отношении название процесса «адиабат
ным течением с трением»
имеет безусловное пре
имущество.
Для иллюстрации воз
можных недоразумений,
проистекающих из пони
мания процесса как по-
литропного,
обратимся
к формуле для вычисле
ния скорости через |3.
Если применительно к р а с
сматриваемому случаю о т
нестись поверхностно к
—
о'—
j
происхождению формулы
ми
pvn = const, то можно
Рис. 160.
ошибочно приравнять ин
теграл от v d p изменению кинетической энергии, в видимом со о т
ветствии с формулой (VII. 9). Тогда при w0= 0 мы получим, что
—
р").
(*)
Однако эта формула неверна для процесса, в котором проявляется
трение, что ясно из уравнения (V II. 34), согласно которому
так как уравнение содержит еще один член — работу трения. Ф ор
мула (*) применима только к такому случаю, когда трение отсут
ствует, а политропность обусловливается внешним теплоподводом.
По типу формулы (*) может быть построена правильная формула,
относящаяся к адиабатному течению с трением. К сожалению, это
осуществимо только в предположении, что газ считается идеальным.
Из (VII. 32) имеем:
«'*
ср(Т0—Т) _ с рТ0/
Т\ cpp0v0/
Т\
’Ig^
А
АV
Tj~ ARV1 Г0Г
k
П1
Здесь (cJAR)=b — : и, поскольку р©*»= const, то ~
=
"
R1
1о \/>о/
390
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[ОТД. VII
Следовательно:
« = ] / %ёk~\Povo(1-
)•
(VH. 39)
Последняя формула иногда используется при аналитическом исследо
вании адиабатного течения идеального газа. Однако для пара, и тем
более для влажного пара, формула эта принципиально непригодна.
Вопрос о связи между показателем реальной адиабаты п и коэффи
циентом скорости ср здесь рассматриваться не будет.
Для выяснения некоторых деталей адиабатного течения с трением
сопоставим идеальное и действительное течение в диаграмме p - v .
На основании (VII. 3) и (VII. 33) имеем:
Ро
Ро
Производя вычитание, получаем:
р
Ек,r= E'R—EK= lJf—j(v' — v)dp.
(VII. 40)
Ро
Интеграл, стоящий в правой части, всегда положителен, так как
v ' — г > < 0 и rfp < 0. Поэтому потерянная кинетическая энергия Е КрГ
меньше работы /тр, затраченной на преодоление сил сопротивления.
Иными словам и, внутренняя работа /тр частично восстанавливает кине
тическую энергию, затраченную сначала адиабатным потоком в коли
честве, эквивалентном величине /тр, и лишь частично теряется для
создания скорости в связи с относительным возрастанием работы вы
теснения и внутренней энергии в выходном сечении.
И з этих соображений, между прочим, следует, что коэффициент
потери С не характеризует полностью энергии, расходуемой на пре
одоление сил трения. В самом деле, согласно уравнению (V II. 38),
Перепишем уравнение (VII. 40) в таком виде:
где £ тр = /тр, а Е г = J (т/ — v) dp равно восстановленной величине
Ро
кинетической энергии. Сочетая оба последних уравнения, находим:
Ятр= С
гл. Ill]
ТЕЧЕНИЕ С ТРЕНИЕМ И С ТЕПЛООБМЕНОМ
391
Таким образом, мы вновь убеждаемся в том, что полная энергия,
затрачиваемая на трение, превосходит величину кинетической энергии,
потерянной в итоге, по сравнению с идеальным случаем.
Для иллюстрации вернемся к примеру, уж е приведенному в этом
параграфе. Идеальный процесс сопла изображается в координатах Г -5
вертикальной линией С М ' , а приращение кинетической энергии — п ло
щадью, заштрихованной горизонтальными линиями (рис. 161). П о л н а я ,
что коэффициент потери С = 0 ,3 сохраняет неизменное значение на всем
пути следования пара, мы полу
чаем изображение реального про -
о
цесса в виде СМ. Полное коли
чество
теплоты,
выделившееся
внутри потока вследствие тренгя ,
определяется площадью О А т п .
Следовательно, площадь эта с о
ответствует энергии Е 7р, затра
ченной за счет возникающей кине
тической энергии пара на преодо
ление сил трения. Однако часть
этой энергии вновь восстанавли
вается в кинетическую энергию,
так как EKtг< Етр, а именно,
Ек. г = £тР— Егу вследствие чего
пар может совершить в турбине
работу большую, чем разность Е к— Е Т{. Легко видеть, что в коор
динатах Г -5 величина Е г равна площади О А А ' ,
заштрихованной
наклонными линиями и эквивалентной площади О А А ' на рис. 160.
Н о в таком случае площадь А А 'т п , заштрихованная вертикальными
линиями, должна соответствовать величине £ к>г, т . е . потерянной ки
нетической энергии. П о условию , недополученная кинетическая энергия
Е к%г составляет 3 0% от теоретически возможной, т . е .
==0,30.
Восстановленная же в результате внутреннего тепловыделения ки
нетическая энергия равна, как показывает планиметрирование, 1 7%
ОААг
от теоретически возможной, т. е .
—
—
= 0,17.
Итак, на преодоление сил трения израсходовано всего 17+ 30 = 47%
от теоретически возможной кинетической энергии. И з них 1 7 % в о с
становилось вновь в кинетическую энергию, а 3 0 % оказалось окон
чательно потерянным для создания скорости за счег энергии давле
ния. Согласно диаграмме Г -5, эта потеря равна г ( х А — * А/)=
= /А — 1Ап причем
1А ~ 1А>= аА— иА<+ АР(VA— VA')•
Подобную же интерпретацию мы можем дать в координатах p - v
(рис. 160). Кинетическая энергия Е к, получаемая в случае адиабат-
392
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[ОТД. VII
ного течения невязкого пара и нацело превращаемая в работу в идеаль
ной турбине, изображается площадью М О А ' т , заштрихованной гори
зонтальными линиями. Работа £ тр, затрачиваемая на преодоление
трения, складывается из площади ОАА'= Ег и А'тпЫ = Е^г. Эта
последняя получается в результате нахождения на идеальной адиабате
точки N , в которой энтальпия равна энтальпии
в конце реальной
адиабаты. Определяемая этой точкой площадь M O N tt равна действи
тельной кинетической энергии, которая получается после уменьшения
максимально возможной энергии Е^ = М О А ' т на величину
£kr= A'mnN.
Можно было бы думать, что действительная кинетическая энергия
меньше идеальной на полную величину работы трения, т. е . на
площадь OAm nNO. Мы видим, однако, что это не так: часть работы
трения, равная Е г, отнюдь не уменьшает получаемой при невязком
паре кинетической энергии. Следовательно, при адиабатном процессе Е г
представляет собой работу трения, восстанавливающуюся в виде кине
тической энергии.
Разумеется , если мы будем сопоставлять реальный адиабатный
процесс О А не с идеальным адиабатным же процессом О Л ' , а с идеаль
ным процессом ОА , который, очевидно, может иметь место при усл о
вии подведения извне тепла в количестве dq = dqrv, то получим
совершенно иную картину. В самом деле, при обратимости процесса О А ,
т. е . при условии dqTV= 0 , площадь М О Ат равна приобретенной
потоком кинетической энергии. При необратимом адиабатном про
цессе ОАу несмотря на тот же закон изменения давления с удельным
объемом, кинетическая энергия окажется меньшей. При этом разность
указанных кинетических энергий равна всей работе /тр, затраченной
на преодоление трения. Таким образом , здесь необратимость превра
щения энергии потока в теплоту сказывается на полезном эффекте
работы пара в полной мере.
1 1 . Дросселирование. Изложенные соображения о роли потерь
на трение в потоке могут быть доведены до логического предела
в применении к явлению дросселирования. Как известно, дроссели
рованием называется преодоление потоком местного сопротивле
н и я . В чистом виде дросселирование имеет место тогда, когда в энер
гетическом балансе можно пренебречь разностью кинетических энергий
по обе стороны местного сопротивления. В большинстве практиче
ских задач это вполне допустимо, даже если поперечное сечение
канала остается неизменным. Говоря строго , в последнем случае
конечная скорость несколько превышает начальную благодаря р а с
ширению вследствие падения давления.
Обозначая параметры состояния перед дросселем индексом 1 и за
дросселем — индексом 2 и исключая на этом протяжении внешний
393
ГЛ. Ill]
ТЕЧЕНИЕ С ТРЕНИЕМ И С ТЕПЛООБМЕНОМ
теплообмен, из уравнения сохранения энергии (V II, 2) получаем:
/,= />.
(VII. 41)
2
2
ч—щ
2g
: 0. Кроме
Здесь, согласно условию, принимается, что А
того, А1Г = 0.
Имея в виду эти частные условия процесса, из уравнения (VII. 33)
получаем:
Рз
Рз
j vdp -f -/7p= 0;
/тр= — J vdp.
Pi
Pi
Таким образом, здесь вся площадь, аналогичная площади М О А т на
рис. 160, эквивалентна работе трения, вследствие чего коэффициент
потери энергии С = 1. К такому же результату можно притти с по
мощью диаграммы i s . На рис. 162 по
казаны две изобары в виде отрезков пря
мых линий. М ежду ними проведена ли
ния адиабаты без трения; ее длина при
нята за единицу. Кроме то го , проведена
линия произвольной адиабаты с трением,
соответствующее ей увеличение энтропии
равно As, а кроме того — линия дроссе
лирования, ее длина обозначена через As*.
Из подобия треугольников имеем:
As__С.
As,- ”
1’
As = С,As{.
Последняя формула является, вообще говоря, приближенной, так как
изобары изображаются в диаграмме i s кривыми линиями, а не пря
мыми, если только не говорить об области влажного насыщенного
п ара. Точность формулы возрастает по мере уменьшения перепада
давления, а также по мере приближения коэффициента С к единице.
Таким образом, обращению As в As^ отвечает С = 1 . Иными словами,
на преодоление трения расходуется кинетическая энергия £ * , которая
могла бы возникнуть при адиабатном течении без трения между за
данными давлениями р г и р 2 плюс дополнительная кинетическая энер
гия Е гУ образующаяся вследствие увеличения удельного объема газа
от внутреннего тепловыделения.
Дросселирование широко применяется для регулирования давле
ния и расхода газа или пара в технических условиях, в частности
для регулирования мощности паровых турбин.
Т а к , например, если какая-л ибо паровая турбина рассчитана на
нормальную работу при р х = 12 am и ^ = 300° С , то для получения
от нее меньшей мощности можно было бы с помощью вентиля др ос
селировать свежий пар, скажем, до 10 am . Н а первый взгляд кажется.
394
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[ОТД.. VII
что такой простой способ регулирования является вместе с тем вы
годным, Однако простое графическое построение показывает обрат-
„
Г,
ное. При нормальном режиме термодинамический к . п . д . yi =
-4----- -- ,
11—1ив
тогда как при пониженной мощности т) =
L-1л,_
*1—‘А,
(рис. 163).
--
«ПВ
--
ШВ
Ясно, что во втором случае т] меньше, чем в первом. В числах мы
будем иметь следующее: если ^ = 12 am, ^ = 300° С , /?2= 12 am,
противодавление р а = 0 ,2 am и темпера
тура питательной воды
при нормальном режиме
727 — 554
/Пв =30°С, то
7]=
727—30
= 0,248
Рис. 163.
и при пониженной мощности
727-560
Л ОЛЛ
^
727—30
0,24 °*
Уменьшение к. п . д . в результате дрос
селирования непосредственно следует из
второго начала термодинамики. Процесс
дросселирования является резко необратимым процессом, сопровож
дающимся быстрым ростом энтропии. М еж ду тем увеличение энтро
пии вследствие внутренних необратимых процессов превращения энер
гии всегда обусловливает понижение работоспособности теплового
двигателя. В виду этого для регулирования мощности турбины пред
почтительнее пользоваться не дросселированием, а изменением коли
чества подаваемого пара без изменения его качества.
12. Общий случай течения. Общий случай стационарного тече
ния сжимаемого газа с трением, с теплообменом и с производством
технической работы получил в последние годы большое практическое
значение. Теория и прикладная сторона разнообразных во просов,
связанных с этим случаем, продвинулась в течение короткого срока
очень далеко, в особенности благодаря трудам со ветских аэродинами
ков и теплофизиков. Подробное освещение возникших отсюда задач
является предметом специальных курсо в прикладной газовой динамики,
а также статей в журнальной литературе. Здесь мы остановимся
коротко на одной стороне проблемы — на основных условиях пере
хода через критическую скорость. Изложение этого вопроса дается
по Л.А . Вулису.г)
Приведем формулу (VII. 22):
dF а2—w2dp
F
kw2 р
!) Л. А . В у ли с. Термодинамика газовых потоков, Энсргоиздат, 1950.
См. также приведенную там литературу, в частности работы А , А , Гухмана
и И. И . Новикова.
ГЛ. Ill]
ТЕЧЕНИЕ С ТРЕНИЕМ И С ТЕПЛООБМЕНОМ
395
к виду:1)
¥=
!)?•
(VII. 42)
Г1о типу этой последней формулы составим новую формулу, относя
щуюся к общему случаю течения. При этом, однако, условимся не
выходить за рамки свойств идеальных газов, тем более, что распро
странение анализа на реальные газы не меняет качественных выводов,
полученных применительно к идеальным газам.
Будем исходить из системы уравнений (VII. 1), (V II. 2), (VII. За),
к которым присоединим формулы pv = R T и di = cpdT. Для удобства
выкладок введем повсюду взамен удельного объема v плотность р,
где*> =
—
.
Соответственно, получаем:
dF.dw
,
dp
л
~F
'Iv
'У
~
°’
(a)
dq—cpdT-\ -Ad~2j,-\ -Adll9
(b)
*l-\
-d'£-\
- gdlr+gdlrt=0,
(c)
f=gRT.
(d)
Представим давление р как функцию р и Г . Тогда
*£ — (0Е\ i(dp\
dp
\dp)r'\dl')9dp*
Принимая во внимание формулу (d), а также (VII. 10 а), получаем:
Р
Подставим полученное выражение для ^ в уравнение (с), пере
писанное в виде
%j+dT+gdl'+edl'р=0-
Исключим из последнего уравнения dp/p с помощью формулы (а):
gRdT-\ -d ^ -f -£dlt + gdlTf
^_(dF\dw\
k\F‘w)
1) Имеем: vdp-\ -d
w2
2g
=0;
dp,wdw
PVJ + -------
g
396
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[ОТД. VII
Исключим, наконец, отсюда dT, прибегнув к уравнению (Ь), обе сто-
роны которого умножим предварительно на g ^ . В
последова
тельном порядке получаем:
S
dq= AgRdT+AЦ -1df
Ц -1dlt,
k—1 ,
.
a1fdF . dw\
А.w1Ag
^
ft
—
AT\T~^~w) kd2
ft
Ag dln'>
k— \<
.
drdF,A,о
o\dw
Ag ..
A
s—
ЛftT + ft(я-----TM
rf/*'
£
k—1
-
pAj ,,
w' — ofidw
if—
-^rrf/T —
, ,>dq— ~
dl7V =
----- 5
--------- .
t
a*TsAa-4
a3TM
а2w
Вводя число Л1, последнее уравнение представляем в таком оконча
тельном виде:
F
Л
dU— g
ft— 1
Aa*
dq-^dlr, =(M»-1)^.
(VII.43)
Левая сторона уравнения (V II. 43) является алгебраической сум
мой разнородных членов, каждый из которых отражает некоторый
специфический способ воздействия на скорость газового потока.
Если единственным способом воздействия на скорость является изме
нение поперечного сечения струи, т . е. если все члены с левой сто
роны, кроме первого, равны нулю, то из (VII. 43) получается част
ная формула (VII. 42). Следствия, вытекающие из нее в отношении
формы канала, необходимой для перехода через критическую звуко
вую скорость, были уже рассмотрены выше. Обратимся к другим
частным случаям, предположив сначала, что трение в потоке от
сутствует.
а) Механическое сопло. Примем, что поперечное сечение
газовой струи остается постоянным и что внешний теплообмен о т
сутствует. Поскольку трением мы пренебрегаем, данный случай харак
теризуется условиями:
dF= 0; dq=0; rf/TJ1= 0.
Уравнение (VII. 43) получает вид:
(V II. 44)
Из этого уравнения следует, что при rf/T > 0 и М < 1, величина
dw
—
> 0. Таким образом, если дозвуковой газовый поток производит
положительную техническую работу, действуя, например, на пропел
лерную турбину, встроенную в цилиндрическую трубу, то скорость
потока растет. Одновременно температура газа падает.
ГЛ. Ill]
ТЕЧЕНИЕ С ТРЕНИЕМ И С ТЕПЛООБМЕНОМ
397
Действительно, из уравнения (а) следует, что
dp
dw
р
W’
т. е . что при увеличении скорости w плотность р непременно падает.
Падение р при адиабатности процесса свидетельствует о том, что газ
испытывает расширение, а следовательно, охлаждается. Последнее
заключение можно получить и непосредственно из уравнения со х р а
нения энергии (Ь):
cpdT= — Ad~
—
Adi„
если положить в нем, как было условлено, что — > 0 и rf/T > 0.
Вместе с температурой газа по ходу течения падает и местная с к о
рость звука я, так как a = ygkRT. Поскольку скорость w растет
и скорость звука а падает, число М приближается к единице. В рас
сматриваемой обстановке предельным режимом является звуковой,
когда число М = 1. Для того чтобы превзойти скорость звука, т. е.
осуществлять М > 1 , необходимо изменить знак механического
взаимодействия потока с окружающей средой, а именно, взамен
dlT > 0 иметь dlT < 0. Отрицательная техническая работа соответ
ствует, например, тому случаю, что пропеллер, встроенный в трубу,
приводится в движение от постороннего двигателя, создавая неко
торую искусственную тягу. Газ продолжает поэтому адиабатно р ас
ширяться, его температура и местная скорость звука уменьшаются,
и величины w и а изменяются в противоположные стороны. При
таком сверхзвуковом режиме, как видно из уравнения сохранения
энергии, увеличение кинетической энергии потока не может покры
ваться одной только убылью его потенциальной энергии (убылью эн
тальпии), а требует еще механического воздействия — затраты р а
боты, производимой каким-либо двигателем.
Резюмируя сказанное, мы заключаем, что монотонное увеличение
скорости течения и переход от дозвукового режима к сверхзвуко
вому осуществимы посредством механического воздействия на поток,
причем знак воздействия должен быть изменяем в том сечении цилин
дрической трубы, где число М оказывается равным единице. Таким
образом, в качественном отношении положение вещей совершенно
аналогично тому, которое имеет место в сопле Лаваля. Если сопло
Лаваля назвать геометрическим соплом, то цилиндрическую трубу,
в которой осуществляется знакопеременная техническая работа с целью
перехода через М = 1 , можно назвать механическим соплом.
б) Тепловое сопло. Примем, что
dF=0; Лт= 0; rf/Tp=0.
398
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[ОТД. VII
Таким образом, единственным воздействием на поток газа в цилин
дрической трубе является внешний теплообмен. Уравнение (V II. 43)
приобретает такую форму:
=
(VII. 45)
Из уравнения (VII. 45) видно, что увеличение скорости течения
при дозвуковом режиме (М < 1) требует подвода тепла к газу извне
(idq > 0). По скол ьку поперечное сечение струи остается постоянным,
в этом случае уравнение (а), как и для механического сопла, прини
мает вид:
dp
dw
р
w
Отсюда следует, что плотность газа по ходу течения падает. На
одном этом основании нельзя, однако, судить о характере изменения
температуры, как было сделано в случае механического сопла, так как
здесь процесс не является адиабатным.
Чтобы судить д ходе температуры, обратимся к уравнению со сто я
ния (d), согласно которому относительное изменение температуры
зависит от относительного изменения давления и плотности:
cLL—d£_<l?
(*\
т~р
р•
w
Относительное изменение давления находится из уравнения (с):
dpp_
Р?
dp______^ w2dw_
р
a1w
■■— kM2— ,
W
Очевидно, давление р , подобно плотности, по хо ду течения падает,
но коэффициент пропорциональности между величинами dpjp и dw/w
оказывается переменным, зависящим от числа М . Подставляя в фор-
мулу (*) найденные значения dpjp и d p jp , получаем:
Цг={\-кМ*)^.
(**)
Из формулы ( **) следует, что изменение температуры при подводе
тепла к газовому потоку не отличается монотонностью. Пока
1—kM2>0,т.е.покаМ<
, температура Т по хо ду течения
г^
растет. Соответственно этому растет и местная скорость звука а.
Чтобы решить вопрос, в какую сторону изменяется при этом число М
(непосредственно это не ясно, так как одновременно увеличивается и w
и а) сделаем следующие выкладки:
dM dw_ da
Мw
а
!'Л . Ill]
ТЕЧЕНИЕ С ТРЕНИЕМ И С ТЕПЛООБМЕНОМ
399
%>0,
Используя формулу (**), а также (VII. 10 а), находим:
(1М _
1dT
1dl\
М
1—кМг Т
2Т1
dM
1+£АР dT
М
2(1—kMz) Т '
Отсюда уже очевидно, что, поскольку при 1 — kM 2 > 0
число М растет.
Итак, развитие процесса выглядит следующим образом. На входе
в цилиндрическую трубу установлена скорость w , значительно мень
шая местной скорости звука. Вдоль трубы к газу подводится извне
теплота. Благодаря этому скорость течения газа возрастает. Одновре
менно по ходу течения падает давление и растет температура. С о о т
ношение между ростом температуры и ростом скорости w склады
вается так, что число М растет, т. е . режим течения приближается
к звуковому. Такое положение вещей продолжается до достижения
числом М величины М = —
В этом сечении трубы рост
У^
температуры приостанавливается: температура Т достигает своего
максимума. При дальнейшем теплоподводе скорость те;, согласно (VII. 45),
продолжает расти , давление продолжает падать. Вместе с тем, как
видно из формулы ( * *) , начинает падать и температура Т. Что касается
числа Ж , то оно увеличивается и дальше. Это вытекает из фор-
dТ
мулы (***), в которой следует положить у < 0 и 1— kM2< 0, и,
кроме то го , непосредственно из самого определения числа М . Д ей -
ствительно, Ж =
—
, причем w растет, тогда как а, следуя за тем
пературой, падает. Таким образом , режим течения продолжает при
ближаться к звуковому. С энергетической точки зрения в интервале
< М < 1 кинетическая энергия не в состоянии увеличиваться за
счет одного только подводимого тепла, а требует еще уменьшения
потенциальной энергии потока. При достижении числом М единицы,
т. е . при наступлении звукового режима, наступает кризис: превы
шение скоростью местного значения скорости звука а невозможно.
Чтобы осуществить переход через скорость звука, т. е . получить
М > 1, требуется переменить знак внешнего воздействия на поток,
а именно, нужно вместо подвода тепла начать отвод тепла от газа.
На это ясно указывает формула (VII. 45), согласно которой при М > 1
dxtf
величина — > 0 , только если dq < 0. Как видно из формулы (с),
примененной к рассматриваемому случаю , давление продолжает падать
и в сверхзвуковой области. Согласно ( * *) , падает также и темпера
тура, следуя ходу, начавшемуся с сечения трубы, в котором М =
—
)L=.
Уk
400
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[ОТД. VII
Это значит, как видно из (Ь), что кинетическая энергия растет все
цело за счет убыли потенциальной энергии потока. Более то го , п о
тенциальная энергия должна еще при этом частично расходоваться на
теплоотдачу во внешнюю среду.
Оставляя в стороне дальнейшее обсуждение подробностей, заклю
чаем, что в цилиндрической трубе ускорение потока вниз по тече
нию и переход через критическую, звуковую, скорость возможны
благодаря последовательному сочетанию внешнего теплоподвода и
теплоотвода. В качественном отношении это решение аналогично то му,
которое осуществляется применительно к соплу Лаваля. Поэтому
цилиндрическую трубу, в которой с целью получения сверхзвуковых
скоростей осуществляется знакопеременный теплообмен, уместно на
звать тепловым соплом.
И з рассмотренного следует, что сопло Лаваля является не един
ственным инструментом для перехода через звуковую скорость. Такую
же функцию , наряду с соплом Лаваля, которое может быть названо
геометрическим соплом, несут механическое и тепловое сопла. Во
всех трех случаях осуществление сверхзвукового режима требует
изменения знака того внешнего воздействия на газовый по ток, п о
средством которого вызывается увеличение его скорости по течению.
в)
Адиабатное течение в цилиндрической трубе
с трением. Приведенный выше анализ уравнения (VII. 43) основы
вался на упрощающем предположении, что трение в потоке о тсут
ствует. Кроме то го , принималось, что из всех возможных воздействий
на газовый поток осуществляется какое-л ибо одно единственное: или
геометрическое, или механическое, или тепловое. Рассмотрим теперь
частный случай, когда воздействием на поток служит только трение.
Итак, примем, что
dF= 0, dlT=0, dq=0.
Тогда уравнение (VII. 43) получает вид:
=
(VII. 46)
Из уравнения (VII. 46) следует, что если число М меньше единицы
(М < 1), то наличие трения в цилиндрической трубе (rf/xp > 0) об
условливает увеличение скорости газа (dw > 0). Температура при этом
падает (dT< 0), как следует из относящегося к этому случаю вида
уравнения (Ь):
CpdT+Ad^g = 0,
W
а число М = — увеличивается ( <Ш > 0 ). Эта тенденция сохраняется
при соответствующей длине трубы вплоть до достижения потоком
звуковой скорости (М = 1). Однако в отличие от всех трех преды
дущих случаев здесь переход к сверхзвуковой скорости, т. е . полу
гл. ш]
ТЕЧЕНИЕ С ТРЕНИЕМ И С ТЕПЛООБМЕНОМ
401
чение М > 1, невозможен, так как невозможно обращение эффекта
трения: знак d/Tp является существенно положительным.
Нетрудно обнаружить, что при наличии сверхзвуковой скорости
в начале трубы, т. е . при Ж > 1, скорость течения в связи с тре
нием замедляется, а температура растет. Число М при этом падает,
имея своим нижним пределом единицу. Переход к дозвуковому режиму,
как показывает формула (VII. 46), нереализуем. Здесь только необ
ходимо оговориться, что имеются в виду случаи непрерывного изме
нения скорости, описываемые уравнением (VII. 46). Как правило,
возникает скачкообразный переход от сверхзвуковой скорости к д о
звуковой скорости из -за образования прямой ударной волны. Впрочем,
эффект удара не является принципиально неизбежным, по крайней
мере, с точки зрения термодинамических соображений. Обсуждение
этого вопроса выходит за рамки настоящего курса.
Интересно выяснить, каково критическое отношение давлений при
адиабатном течении в цилиндрической трубе с трением? В соответ
ствии с постановкой аналогичного вопроса при анализе сопла Лаваля
примем, что труба присоединена к резервуару, в котором параметры
помечены индексом нуль, причем w 0 = 0 . Будем считать, что на
выходе из трубы скорость газа равна звуковой скорости: w = w * = a ^
Нахождение критических параметров на выходе из трубы удобно
произвести с помощью формулы (V II. 11а).
Формула (V II. 11а) была выведена из уравнения Бернулли в пред
положении, что трение отсутствует и что состояние газа хотя бы и
неидеального изменяется по адиабате p vk = const. Можно, однако,
показать, что формула (VII. 11а) верна и при наличии трения
в потоке, если только имеется в виду адиабатный процесс идеаль
ного газа (при этом, конечно, адиабата не совпадает с изоэнтропой
и не подчиняется более уравнению p v k = const). В самом деле, из
уравнения (Ь), верного безотносительно к то м у , проявляется или не
проявляется трение, имеем:
ср
Ъ
.
a
.
£
1
%
I
t
©
Здесь dT=
t откуда
ilLrf(/w)+ rf_^ = 0;
ARv''
2g
’
k da*
dw* ___
k—\gk
27
da*
,
dw2
л
a3
,
w'1
,
к—112
'
Л?—1г2
const-
Полученная формула и есть формула (VII. 11а).
Важно учесть , что в последнем выводе показатель адиабаты к
фигурирует не потому, что фактически происходящее изменение
состояния идеального газа считается подчиняющимся обратимой адиа
бате p v k = co n st. Напротив, никаких предположений о действитель-
26 Зак. 3543. В. С . Жуковский.
402
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[ОТД. VII
ной связи между р и v по ходу течения не было сделано. Показа
тель адиабаты появился только в связи с использованием обозначе
ния:—=
&, а также из-за необходимости прибегнуть к уравнению
cv
обратимой адиабаты p v k = const для выражения местной скорости
звука ‘ = УГФ , через местные значения р и v.
Принимая во внимание сказанное, для рассматриваемого случая
адиабатного истечения идеального газа с трением можно применить
выведенную ранее формулу (V II. 14а):
k—1
k+\
к*
и, положив в ней Х=1 , притти к формуле (VII. 17а):
Г*_
2
T0~k+V
Таким образом, последняя формула дает критическую температуру Г*
при адиабатном истечении независимо от того, достигается ли выход
ная звуковая скорость благодаря поджатию струи газа, текущего без
трения, или благодаря эффекту трения в цилиндрической трубе,
которая присоединена к резервуару. Разница между этими двумя
принципиально противоположными способами осуществления звуковой
скорости проявляется лишь при определении критического давления /;*
или критического объема v * . Если в случае отсутствия трения соот
ношение между любыми двумя температурами в потоке определялось
формулой обратимой адиабаты
то при наличии
Соответственно,
получаем:
к-1
Уо 'Ро'
гдеk= -?->
Cv
трения взамен этой формулы приходится писать:
п—1
У*_____/Р\ п
^
,
ср
М) 'Ро*
Cv
взамен формулы (V II. 18), для течения с трением
Таким образом, критическое давление р * при наличии трения выше,
чем при его отсутствии. Какова разница между ними в количественном'
выражении, можно сказать, зная величину п. Однако из чисто термо
динамических соображений величина п не может быть установлена.
Она зависит от размеров трубы , коэффициента трения и весового
расхода газа. Расчетные методы, относящиеся к течению сжимаемого
ГЛ. Ill]
ТЕЧЕНИЕ С ТРЕНИЕМ И С ТЕПЛООБМЕНОМ
403
газа в трубах с трением, излагаются в курсах прикладной газовой
динамики.
В заключение нашего анализа мы коснемся еще только одного
вопроса — вопроса о влиянии учета трения на условия перехода через
критическую скорость. Представим формулу (VII. 43) для геометри
ческого, механического и теплового сопел при наличии трения. Со о т
ветственно, имеем:
г= (М2-1)^;
(VII. 42а)
—
jjg <U*
rf/Tr= 0W2-l)^ ;
(VII. 44а)
-
8к-Ш d<l~S dl*»•= (М2~ О
•
O '11- 45а)
В связи с тем, что работа трения dl1? имеет всегда существенно
положительный знак, заключаем, что при ускоренном по течению
газовом потоке число М достигает единицы только в диффузорной
части геометрического сопла (где d F > 0), на газососном участке
механического сопла (где rf/T< 0 ) и на теплоотводном участке тепло
вого сопла (где d q < 0 ) . Таким образом, при наличии трения наступ
ление звуковой скорости затягивается и переносится в ту часть со пла,
в которой при отсутствии трения наблюдался бы уже сверхзвуковой
режим. Что касается места, где внешнее воздействие на газовую
струю меняет свой знак (dF= 0, или rf/T= 0, или dq= 0), то в нем
режим течения остается еще докритическим.
13. Идеальный турбореактивный двигатель. Как известно,
в современной авиации широко применяются реактивные двигатели.
Не входя в обсуждение деталей устройства, технических и эксплуата
ционных особенностей разных типов реактивных двигателей, остано-
Рис. 164.
вимся кратко на принципиальной схеме одного из них, а именно — на
турбореактивном двигателе (Т Р Д), который имеет наибольшее расп ро
странение.
Простейшая схема Т Р Д показана на рис. 164. В полетных условиях
атмосферный воздух поступает в кольцевую полость диффузора D ,
в котором происходит замедление потока с соответствующим увели
чением давления. Затем воздух проходит через осевой компрессор
(нагнетатель) К , в котором он подвергается дальнейшему сжатию .
Сжатый воздух входит в камеры сгорания Л , куда подается жидкое
26*
404
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[ОТД. VII
топливо. Продукты сгорания пропускаются через газовую турбину Г,
мощность которой в точности покрывает мощность, потребляемую
компрессором. Отработавшие газы вытекают с большой скоростью
из выходного сопла В , создающего тягу, которая и является полез
ным эффектом двигателя. Во всех сво их частях идеальный рабочий
процесс считается адиабатным, кроме камеры сгорания, где внутрен
нее тепловыделение заменяется внешним теплоподводом.
Преж де чем обратиться к изображению рабочего процесса, вернемся
к формулам для вычисления теоретической работы компрессора и
турбины. Эти формулы значились под индексами ( V I. 10) или (VI. 22а)
и (VI. 22Ь). При их выводе предполагалось, что скорости на входе
и на выходе из машины малы, так что соответствующим изменением
кинетической энергии можно пренебречь. Указанные скорости в Т Р Д
могут иметь существенное значение, вследствие чего названные ф о р
мулы должны быть заменены более общими, учитывающими неодина
ковость кинетических энергий на входе и выходе каждой из машин.
Из уравнения сохранения энергии для адиабатного потока следует,
что
Alj= ij—/q—|
—
А*
w*—w\2
2g9
где индексы 1 и 2 относятся к сечениям потока перед и за машиной.
Считая, что рабочим телом служит идеальный газ, получаем:
Al^c^-T^+A
w:—wz
2g
М,= с,[(Г,+Л$г)-{тг+А^ -)].
Легко видеть, что выражение вида (т -^ -А -щ ^ - ) представляет собой
не что иное, как температуру торможения, понятие о которой было
уж е дано в п. 6 . Напомним, что температурой торможения названа
такая температура, которую должна принять газовая струя при сни
жении ее скорости до нуля в условиях адиабатного процесса, без
производства технической работы. Обозначая температуры торможения
дополнительным индексом 0 , находим, что
А1т= ср (Тио — Т2,о).
(VII. 47)
Подобно температуре торможения, можно пользоваться также
понятием энтальпии торможения /0 = ср Т0 и давлением торможения р 0.
Последнее находится путем интегрирования формулы (VII. 9):
о
V?
Jvdp;
i
i
l
r
Р
к
I
I
1-f*
(V II. 48)
1Л. lllj
ТЕЧЕНИЙ С ТРЕНИЕМ И С ТЕПЛООВМЕНОV
405
Поскольку формула (VII. 47) переписывается в виде
А/т= *1,о— h,Of
(VII. 49)
энтальпия торможения получает смысл полной энергии потока, за счет
убыли которой в адиабатной машине производится техническая работа.
Что касается давления торможения, то оно имеет смысл, аналогичный
смыслу температуры торможения, но с оговоркой, что имеется в виду
обратимое торможение.
Заметим, что давление торможения тождественно полному напору,
непосредственно показываемому измерительной пневмометрической
трубкой с отверстием навстречу газовому потоку, если скорость
последнего не достигает скорости звука. При сверхзвуковых ск о
ростях перед носиком измерительной трубки садится скачок уплотнения,
при прохождении через который энтропия газа вследствие необрати
мости процесса растет, так что взятие интеграла от v d p не может
быть произведено с помощью формулы pvk = const, где k = cpjcv}
не говоря у ж е о том, что сама формула (V II. 9) оказывается при этом
неполной. В указанном случае давление, измеряемое пневмометрической
трубкой, связано с числом М специальной формулой, выводимой из
теории прямого скачка уплотнения. Однако независимо от этой новой
формулы, которой мы здесь не будем касаться, совпадающее с полным
напором давление торможения всегда выражается одинаковым образом
через число М , поскольку воображаемое торможение потока считается
непременно обратимым. И з сказанного, между прочим, следует, что
так как в идеальном Т Р Д все процессы обратимы, то между темпера
турой торможения Т0 и давлением торможения р0 существует совер
шенно однозначная связь, устанавливаемая обычным уравнением
адиабаты:
В свою очередь это значит, что таким же образом, как для работы,
например, турбины при малых входных и выходных скоростях из
формулы
теперь, при больших скоростях, получается аналогичная формула:
Alt—ср(Т1 Г2)
могла быть получена формула
406
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[ОТД. VI?
Следовательно, в координатах p - v работа компрессора и турбины
изображается стандартным образом, если только на линиях адиабат
крайние точки берутся по соответствующим величинам давления
торможения и объема торможения (т. е . по температурам торможения).
После сделанных разъяснений легко разобраться в р ис. 165, где
рабочий процесс Т РД изображен в координатах p -v и i s . Для
упрощения рассуждений следует только еще, пожалуй, воспользо
ваться правилом относительности скоростей и представить себ е, что
двигатель стоит на месте, а воздух набегает на него. Параметры
атмосферного воздуха пометим индексом а> скорость его набегания
на двигатель обозначим через w a и соответствующую кинетическую
изображено на линии атмосферного давления точкой а .
Проведем через точку а линию адиабатного сжатия и пометим
на ней точку а0 соответственно давлению торможения (температуре
торможения) набегающего на двигатель воздуха . Независимо от то го ,
как далеко зашло торможение воздуха в диффузоре D , работа ком
прессора должна определяться координатами этой точки а0. В част
ности, можно было бы предположить, что в конце диффузора скорость
падает до нуля и что воздух всасывается компрессором при давлении
торможения.
Пометим теперь на той же линии адиабатного сжатия точку Ь0
на уровне давления торможения за компрессором. Как было сказано,
работа компрессора определяется точками а0 и Ь0 независимо от
существующего соотношения между потенциальной и кинетической
энергиями потока на входе и выходе из машины. Иными словами,
работа компрессора будет изображаться в координатах p - v пло
щадью 2а0Ь04.
Проц есс в камере сгорания считается в идеальном Т Р Д изобарным,
причем имеется в виду сохранение постоянным давления торможения.
Как видно из формулы (V II. 48), истинное давление может при этом
испытывать изменения в той мере, в какой число М изменяется вдоль
Г
О
v
О
S
Рис. 165.
ui. шj
ТЕЧЕНИЕ С ТРЕНИЕМ И С ТЕПЛООБМЕНОМ
407
камеры сгорания. Оставляя в стороне подробности по этому поводу,
пометим точку с0, отвечающую выходу из камеры сгорания и входу
на турбину. Расширение в турбине пойдет по линии адиабаты до
точки tf0, положение которой определяется из условия равенства
площадей 2ajb04 и 4c0d03 f так как работы компрессора и турбины
по абсолютным значениям взаимно равны. И з равенства указанных
площадей следует, что равны друг другу также и те площади, которые
на рис. 164 обозначены штриховкой.
Отработавшие в турбине газы расширяются в реактивном сопле
до давления ра— точка d. Поскольку точка ^соответствует затормо
женным в начале сопла газам, кинетическая энергия покидающих
двигатель газов Е к ц определится площадью 3dQd l . Последняя пло
щадь на основании равенства заштрихованных ф игур равна также
сумме площадей ab0c0d и 2а0а1. М еж ду тем площадь 2а0а1 дает
кинетическую энергию E Ki входящего в двигатель воздуха. Таким
образом, увеличение кинетической энергии воздуха при прохождении
через двигатель устанавливается формулой:
Екп —Ек1
ab^d .
Это увеличение кинетической энергии воздуха и является полезным
в термодинамическом смысле эффектом турбореактивного двигателя.
Термодинамическим к. п . д . двигателя будет, очевидно, являться
отношение теплового эквивалента площади ab0ctfl к подведенной
теплоте в камере сгорания.
В координатах i s отдельные элементы рабочего процесса интерпре
тируются следующим образом. О трезок аа0 пропорционален кинети
ческой энергии £ Kj , отрезок a0bQ— работе, затрачиваемой компрессо
ром, разность ординат точек с0 и Ь0 — количеству подведенной теплоты,
отрезок c0d0— работе турбины и, наконец, отрезок d^L — кинети
ческой энергии Е к ц . Термодинамический к. п. д . турбореактивного
двигателя устанавливается формулой
_
_
Ус0 *’d) (*60 “ “ *а)
4
в которой числитель равнозначен площади ab0cQd , дающей в коорди
натах p - v теоретическую работу.
Легко видеть, что изображение рабочего процесса и формула
для к . п . д . турбореактивного двигателя тождественны тем, которые
относились к изобарному циклу газотурбинной установки. Поэтому
для к . п . д . турбореактивного двигателя мы можем непосредственно
взять формулу (VI. 20):
408
ОСНОВЫ ГАЗОВОЙ ДИНАМИКИ
[О ГД. VII
где только в данном случае степень сжатия е должна пониматься как
отношение объема торможения за компрессором к объему п осту паю
щего в двигатель из атмосферы воздуха . Степень сжатия может быть
заменена надлежащим образом степенью увеличения давления ic = tcdic* ,
Раа
Рьл D
где izq =
—
и
=
—
.
В таком
Ра
*
Ра»
случае
4 = 1 ------------ (VII. 50)
(*/»•**) *
Из формулы (VII. 50) следует, что
термодинамический к. п . д . ТРД за
висит только от степени увеличения
давления в диффузоре и в компрес
соре. Графически зависимость по
казана на рис. 166. Ч то касается
удельной работы Т РД, то при фик
сированной степени увеличения д ав
ления она растет вместе с ростом температуры газов, поступающих
на турбину, т . е. при удлинении горизонтального отрезка
в коор
динатах p - v . Благодаря этому газы подходят к реактивному соплу
с большими значениями температуры и давления, так что кинетическая
энергия £ к я увеличивается. Дальнейшие подробности можно найти
в специальных курсах, например в учебнике Н. В . Иноземцева
и В. С . Зуева, Авиационные газотурбинные двигатели, Оборонгиз,
1949.
V
ТАБЛИЦЫ
410
таблицы
КРИТИЧЕСКИЕ ПАРАМЕТРЫ И
1a.
Норм.
Температура в °С
удельн.
-вес то
«3
С? :►>
X
>-»
2
О
5X
кГ/м*
О*
о
X
Газ
О
•0*
ж
X
X
о
H
iX
н
а°
к
еэ
§о
о*5
3X
«
3
си•
во.
К
XО
о
’5°
3о
*
«с a-
аз
и
Ч
а
а
о
я3
а
а
v
X
Я
XCOs*
оc
и
X
о.
а>
ч
ш
2
О9Я со
э*
3
gs
(0
X
.
<Xueg
■JUИ
СО
a
а
Азот
N* 28,02 30,26 1,250 1,251 — 195,8
— 210,01
Аммиак
N H 3 17.03 49,79 0,760 0,771 — 33,4
—
77,7
Аргон
Аг 39,94 21,26 1,782 1,784 — 186,0
— 189,3
Ацетилен
С 2Н» 26,02 32,59 1,162 1,171 —83,6 (возг.)
—
81
Воздух
—
(28,95) 29,27 1,292 1,293 — 192— 195
—
Водород .
н2
2,016 420,6 0,0899 0,899
—252,8
- 259,2
Г елий
Не 4,002 212,00 0,1786 0,1785 -26 8 ,95 —271,4(30<ш)
Двуокись азота
N 0 2 46,01 18,40 2,054 —
+21,2
-
10,8
Дифтордихлорме-
тан
c f 2c i 2 120,92 7,01 5,394 5,083
—
29,8
— 155.0
Кислород
о 2 32,000 26,5 1,428 1,429 -182,98
— 218,74
Метан .
СН4 16,03 52,90 0,715 0,717 — 161,7
- 182,6
Неон
N e 20,183 41,98 0,900
—
- 246,0
- 248,6
Окись азота .
N O 30,01 28,26 1,339
—
— 151,0
— 163,7
»
углерода . С О 28,00 30,29 1,250 1,250 — 191,5
— 205
Пропан
с 3н 8 44,06 19,25 1,967 2,019 — 42,6
— 189,9
Сероводород
H 2S 34,09 24,90 1,521 —
—
60,2
-
83
Двуокись серы
s o 2 64,06 13,24 2,858 2,926 — 10,0
—
75,3
Углекислота
С О а 44,00 19,27 1,963 1,977 —78,5 (возг.)
—
56
Хлор
C l2 70,91 11,96 3,16 3,22
—
33,95
— 100,5
Этан
C 2He 30,06 28,21 1,341 1,356 - 88.6
- 186,3
Этилен
C2H, 28,03 30,25 1,251 1,261 -103,5
—
169,4,
Вычисленные значения у0 получены делением ц на 22.416; расхождения
от идеально-газового состояния.
ТАБЛИЦЫ
411
ТЕПЛОВЫЕ ХАРАКТЕРИСТИКИ ГАЗОВ
Таблица 1
Теплота в ккал/кГ
Критические параметры
и
о
к
Q.
В
в,
«о
л'в
5&
о**
1C
S3
£3
k — Ср(сп
при 0°С
и
с
п
а
р
е
н
и
я
п
р
и
т
е
м
п
е
р
а
т
у
р
е
к
и
п
е
н
и
я
,
с
о
о
т
в
е
т
с
т
в
у
ю
щ
е
й
7
6
0
м
м
р
т
.
с
т
.
п
л
а
в
л
е
н
и
я
°с
Рх
Ат
7*
кГ/м3
47,58
6,1
—
147,1
33,5
310,96
0,248
1,40
328
83,7
+ 132,4
111,5
236
0,492
1,32
38,9
6,7
-122,4
48,0
531
0,125
1,66
198
—
+ 36,0
61,7
231
0,385
1,26
47
—
- 1 4 0 ,7 5 — 140,65 37,25—37,17 310—350
0,240
1,40
108,5
14
-239,9
12,8
31
3,397
1,41
4,66
1,365
— 267,9
2,3
69,3
1,250
1,66
170,0
33,3
+ 158,2
100,0
570
—
—
39,9
—
+ 111,5
39,56
556
—
1,14
50.92
3,3
—
118,8
49,7
429,9
0.218
1,40
122
14,5
—
82,0
45,8
162
0,518
1,31
20,5
3,4
— 228,7
25,9
483,5
—
—
106,6
18,4
—
94
65
520
—
—
50,5
8.0
—
138,7
34.6
311
0,248
1,40
102
19,2
+ 96,8
42,0
232
0,371
U4
131
18,5
+100,4
188,9
—
0,253
1,32
94
32,2
+157,2
77,7
520
0,151
1,29
137
45,3
+ 31,0
72,9
460
0,194
1,30
72.95 30,1
+144,0
76
573
0,115
1,36
116
29,2
+ 32,1
48,8
210
0,386
1,22
115
28,5
+9,7
50,7
220
0,357
1,25
^Жду вычисленным и измеренным значениями объясняются отклонениями
412
ТАБЛИЦЫ
ТЕПЛОЕМКОСТЬ ВОЗДУХА В ИДЕ
t
в°С
Теплоемкость
мольная в ккал/моль °С
весовая в ккал\кГ °С
('■ ср I4cv I4ср l4cv
ср
Cv
СР
0 6,943 4,957 6,943 4,957 0,2397 0.1711 0,2397 0.1711
100 6,990 5,004 6,962 4,976 0,2413 0.1727 0,2403 0.1718
200 7,088 5,102 6,999 5.013 0,2446 0.1761 0,2416 0,173!
300 7,231 5,245 7,052 5,066 0,2496 0.1810 0,2434 0,1749
400 7,393 5,408 7.116 5,130 0,2552 0,1866 0,2456 0,1771
500 7,557 5,571 7,189 5.203 0.2608 0.1923 0,2481 0,1796
600 7,716 5,730 7 263 5,278 0,2663 0,1978 0,2507 0,1822
700 7,859 5,873 7,339 5,353 0,2713 0,2027 0,2533 0,1848
800 7,986 6,000 7,412 5,426 0,2757 0,2071 0,2559 0,1873
900 8,098 6,112 7.482 5,496 0,2795 0,2110 0,2583 0,1897
1000 8,198 6,212 7,548 5,562 0.2829 0,2144 0,2606 0,1920
1100 8,284 6,298 7,612 5,626 0,2859 0,2174 0,2628 0,1942
1200 8,361 6,375 7,671 5,685 0,2886 0,2200 0,2648 0,1963
1300 8,429 6,443 7,729 5,743 0,2909 0,2224 0,2668 0,1983
1400 8,491 6,505 7,782 5,796 0,2931 0,2246 0,2687 0,2001
1500 8,545 6,559 7,832 5,846 0,2950 0,2264 0,2704 0,2018
1600 8,595 6,610 7.878 5,892 0.2967 0,2281 0,2720 02034
1700 8,641 6,655 7,922 5,936 0,2983 0,2297 0,2735 0,2049
1800 8,682 6,696 7,963 5.977 0,2997 0,2312 0,2749 0,2063
1900 8,721 6,735 8,002 6,016 0,3010 0,2325 0,2762 0,2077
2000 8,757 6,771 8.038 6,052 0,3023 0,2337 0,2775 0 2089
2100 8,792 6,806 8,073 6.088 0,3035 0.2349 0,2787 0,2101
2200 8,825 6,839 8,106 6,120 0.3047 0,2361 0,2798 0,2113
2300 8,855 6,869 8,138 6,152 0,3057 0,2371 0.2809 0,2124
2400 8,880 6,894 8,168 6,182 0,3065 0,2380 0.2819 02134
2500 8.907 6.921 8.197 6,211 0,3074 0,2389 0,2829 0,2144
2600 8,930 6.944 8.224 6,239 0,3082 0.2397 0,2839 0,2153
2700 8,954 6,968 8.251 6,266 0,3091 0.2405 0,2848 0,2163
ТАБЛИЦЫ
413
Таблица 2
АЛЬНО-ГАЗОВОМ СОСТОЯНИИ
Энтальпия
объёмная в ккал/нм3 °С
/сп
/с„
г
г
/
см
V-cp -t
Cpt
ср1
р
V
р
V
в ккал/моль в ккал/кГ в ккал/нм3
0.3097
0,2211
0,3097
0,2211
0
0
0
0,3119
0,2233
0,3106
0,2220
696,2
24,03
31,06
0,3162
0,2276
0,3123
0,2237
1 400
48,32
62,46
0,3226
0,2340
0,3147
0,2261
2116
73,02
94,41
0.3299
0,2413
0,3175
0,2289
2 846
98,24
127,0
0,3372
0,2486
0,3207
0,2321
3 594
124,0
160,3
0,3442
0.2556
0,3241
0,2355
4 358
150,4
194,5
0.3506
0,2620
0.3275
0,2388
5 137
177,3
229,2
0,3563
0,2677
0,3307
0,2421
5 930
204,7
264,6
0,3612
0,2726
0,3338
0,2452
6 734
232,5
300,4
0,3658
0,2772
0,3367
0,2481
7 548
260,6
336,7
0,3696
0,2810
0,3396
0,2510
8 373
289,1
373,6
0,3730
0,2844
0,3422
0,2536
9 205
317,8
410,6
0,3761
0,2875
0,3448
0,2562
10 050
346,8
448,2
0,3788
0,2902
0,3472
0,2586
10 890
376,2
486,1
0,3812
0,2926
0,3494
0,2608
11740
405,6
524,1
0,3835
0,2949
0,3515
0,2629
12610
435,2
562,4
0,3855
0,2969
0,3534
0,2648
13 460
464,9
600,8
0,3873
0,2987
0,3552
0,2666
14 330
494,8
639,4
0,3891
0,3005
0,3570
0,2684
15 200
524,8
678,3
0.3906
0,3020
0,3586
0,2700
16070
555,0
717,2
0,3023
0,3037
0,3602
0,2716
16950
585,3
756.4
0,3937
0,3051
0,3616
0,2730
17 830
615,6
795,5
0,3951
0,3065
0,3631
0,2745
18710
646,1
835,1
0,3962
0,3076
0,3644
0,2758
19 600
676,6
874,6
0,3974
0,3088
0,3657
0.2771
20 492
707,2
914.2
0,3984
0,3098
0,3670
0,2784
21382
738,1
954,2
0,3995
0,3109
0,3682
0,2796
22 278
769,0
994,1
414
ТАБЛИЦЫ
Таблица 3
МОЛЬНАЯ ЭНТАЛЬПИЯ ГАЗОВ В ИДЕАЛЬНОМ
СОСТОЯНИИ р/[ккал/кмоль]
N. 1*
М°сГ\
н2
2,016
о2
32,000
n2
28,02
СО
28,00
со2
44,00
н2о
18,016
0
0
0
0
0
0
0
100
691,7
704,9
696,1
696,8
917.2
805,9
200
1390
1430
1397
1400
1923
1630
300
2090
2178
2106
2115
3005
2 477
400
2 792
2950
2828
2 846
4149
3352
500
3497
3741
3557
3 595
5344
4255
600
4206
4 552
4 321
4 361
6583
5187
700
4 922
5 375
5 092
5140
7 857
6151
800
5646
6212
5876
5 930
9162
7145
900
6380
7 058
6673
6 738 10493
8170
1000
7125
7 908
7480
7 555 11848
9224
1 100
7 878
8772
8298
8383 13222 10 306
1200
8642
9 642
9125
9 220 14611 11414
1300
9417
10514
9 962
10070 16013 12546
1400
10200
11395
10805
10 920 17426 13702
1500
11000
12 282
11653
11775 18 849 14 877
1600
11800
13 174
12506
12 634 20 282 16072
1700
12 610
14 074
13 362
13 496 21724 17 287
1800
13 430
14 976
14 222
14364 23 175 18517
1900
14 260
15884
15 086
15234 24630 19758
2000
15 090
16798
15952
16108 26 092 21016
Примечание. Таблицы 3 и 4 составлены по данным М. П . Вукало-
вича, В . А . Кириллина, В . Н . Тимофеева и В. С . Силецкого, помещенным
в «Справочнике машиностроителя», т. 1, 1951, а применительно к Н2— по
данным о средних мольных теплоемкостях в «Сборнике задач по техниче
ской термодинамике» В . А . Кириллина и А . Е . Шейндлина, 1949.
ТАБЛИЦЫ
415
Т АБЛИЦА 4
МОЛЬНАЯ ВНУТРЕННЯЯ ЭНЕРГИЯ ГАЗОВ В ИДЕАЛЬНОМ
СОСТОЯНИИ ри \ккал\кмоль\
*1°сГ\
н,
2,016
32Л&0
N2
28,02
СО
28,00
со2
44,00
Н20
18,016
0
0
0
0
0
0
0
100
493,1
506,3
497,5
498,2
718,6
607,3
200
993
1033
1000
1003
1526
1233
300
1494
1 583
1510
1519
2 439
1882
400
1998
2154
2 034
2052
3 354
2558
500
2 504
2 746
2 574
2602
4351
3262
600
3014
3 356
3130
3169
5 391
3 995
700
3 532
3 986
•3702
3 750
6 467
4 761
800
4 057
4 621
4 287
4 344
7 573
5556
900
4 593
5268
4 885
4951
8 706
6383
1000
5139
5 922
5494
5570
9 862
7 238
1 100
5139
6 585
6114
6199 11037
8121
1200
6 259
7 253
6 742
3595 12228
9031
1300
6 835
7 934
7 380
7488 13432
9 965
1400
7 420
8 614
8025
8140 14 645 10921
1500
8 021
9303
8 675
8796 15 870 11898
1600
8 622
9 997
9 328
9 456 17104 12894
1700
9 234
10698
9 986
10120 18 348 13911
1800
9855
11401
10 647
10789 19 600 14942
1900
10490
15884
11313
11463 20856 15 985
2 000
11 120
12 826
11980
12136 22 120 17 044
н
а
с
ы
щ
е
н
н
ы
й
п
а
р
и
в
о
д
а
н
а
л
и
н
и
и
н
а
с
ы
щ
е
н
и
я
416
ТАБЛИЦЫ
IS$
со
ю
сч
©
©
8
©
©5?
©
8
©©©©сч
§
300
00
<м©
©
05 ь-
сч
©©
©
’”1
©©
©©05©©
©©000000
оо©00
<м сч
сч
ci сч
сч
сч
см
©оо
©©
©
©
с$
©
8
Oj
00сосо©
©©сч
©
©
сч
о
<о
22ю
©©сч©to
©©©
S3
я
Ь-
о
о
©©©
©
1—1
**
сч
сч
СЧ
сГ©‘©
о
©©“©©©
о
©©*©©*
©©©
сою
©©
сч
т*4 ©
00
©
сч
сч©
С0щ со
ьГ
00 СО
со©
ь-*
rf ^_г
©©
38
я
rS оо
о
о>©00оо
3
©
г>-
©©
©
3
Tt*
ю
©ююю
ю
ю
ю
ю
ю
©©©©
©
©
cqю
©©
сч
©
©
©
сч сч
©
СОт© ©
ь-
8
со
©"
оо©
сч
гг* ©
©»-чсо©
оГ ,—
4©
05
8
S
©
сч
сч
сч
сч
3
©
ю
ю
©
©©©©©
©©©©©
©
©
со
о
rt4
©©S
3
сч
©©©8.
©
©
©
©
©
©8
©
©
©
©8
сч
©
о
ю
©юоо
ю
0%
ю
©ю
05
©
05*
Tt4
8
©
сч
сч
©
т*4
©©©©
S
©
ь- со
00
05©сч©
TfS
сч
U0 Tf
©
сч
сч
§
оо
г-
8
©сч
©©
8
© Tt*
©
©
СО
сч
©о
IS
©
S3
©
тг©
29
С\) ©
г-
88
8
©о
сч
©
©
©
©
©©
©соСО©
чГ
СЧOJз.
Оо©©©
©©©©©**
©"“©‘©
о
©
©О©
©©
©
3
29©
Tt*
©©Tfю©
Tf4
%©
Tt4
3
©
СЧ
V*
СО
СО
(М
ьГ со
©
ьГ
00
t-r
3
©
сч
сч
ю
ю
03
сч
©
©
сч
©
©
©
©
©
4t
00
СЧ
О
©
ю
©сч
сч
СЧ
©©
Tt4
©©
$
©
©©
33
88
т*4
О
о
о
8
о
188
©
3
©
©h-
88
©
©
©
сч
©
£
©
©
©§
сч
©
О
8
о
о
©
©
©
©
©
©
8
8
888
888
©
©8
©
©
©
©
О
о
Оо©~©©
©©©©©
©©©©©
©©
00
со
сч
сч
о?
00ю©
8
ю
сч
©
©
©
сч
1-*
R
©
©1—i©©
8
со
00 сч
©
сч
ь-©
©©
3
сч
©
3
©
©
о
о
о
о
©©8
©
©S©о
8
сч©
ч
3
©
©
о
©~©~©©
©©©‘©©
©©“©©©
©*©О
о
ю
©©©
ю
©ю©©
©©©
3
©
©
8
©
сч
сч
©©
ч*1
©©©
ь-
©
ТАБЛИЦЫ
417
СЧСЧ СОсо05Ь-
1
Ю Г»1
со
$00
8
00СЧ ю
гН
8 00t'-
СОСО юю
t".
СОСОСОсо
1-Нгн Г-Н1-Нт-н1-Н1—i Т-Н1-Н1—ГГ
-
Н
5
оо Ь-
соСЧм счсо
CSО)(N
СОМ-нОО!
сО СО(О(ОЮ
юо
(Мсо --
.
00NСО1Л
юююю
8сосч
тгЮ
-
Tf
ю
gj882?
и NСОЮСО
00 со
^00
оо О)
_
_
СЧСЧ СОс^сососо
оо
ооo'оо
осчюь-
tsО)ОНW
со со
Tf Tf
оо"ооо
05ОО05Ь-
О(N^ЮS
ЮсоNоо
"
^ Tt< rt<
ООООО
3
оюо
S-CS
-
тгЮЮ
ооооо
83
СЧ
о00соTfт**
СОоосоt'H о со
юю
соосо1-1
юСЧ 05ЮСЧ05со"
Й05toСЧоо ю_гtC
05
8"
ьГСЧ§
тг
8
сосоСЧСЧ
о
оо05оо
оо
г-
юо
lOююю юююSю
юю
сч счж
<3 со"
СО со
V—40500со4J<
1-Н00^ О
ю
05o'СЧ
со"
обоТТ-Нсо•#
со
3
TJ1
TJ1
Т*1
3
ю»юю
со
СОСОсо
СО
СОсоСО
ою
СО
юioio8S
СОСОсоСОсо
тГ сосоюсо
СЧсоrfюсо
со сосососо
со сосососо
SN О^05Ю
О
rHrHCNСО
ОuOo'юоюо
0505 ОО
СЧ
Ч
Ю.СОN 00 ОжСЧ
LOОЮОЮ г-Гсо
СЧСОсо^тг
юю
сою00 ососо05СЧ
со
СЧ S5
оо
соСОtx
00со 05
ю
со
ю
1 СОсч
ю,
оосоооСОсч
ю00осч
СЧо 05 СЧсосч 0505 ооTfl
00ю сч
ТГю
с-оо05
сччгк05сч
ю00счСО
оо
оо"о"о 1—1
1—1 1-Н *—
1Г-1 сч
счсчсоСО
о TJ1
юю0505
со
соо
ю"юсо
сч СО05осо
Гн
СО 00
Г—4 со 05
со05СОтгсчооо
сч" 1-Н
^4 1-Н1-Но
ТГ СОо
^
О обСЧ00со
N
0СОо^
союю
о
о
о
о
о
88
00ЮСО
00505^С5
8СЧСЧ
СОсоСОсоо
Г"-
тг
1-105t>-Ю
^
СОсосоСЧCN[ СЧГ-нГ-нт
-
н^ Г-н
о
оо
о
о
о
о
о
о*о
Йi
8S
ю^ю
СОSН
SoS
00
8
о
со
о
со
о
05
3
о
NN0н
05тг05Ю
8ё&§
ЮСЧ1-н1-нrf
осоСЧ00^
0505ОО
ОО1-нг
-
н^н
88
o' o'
§88
ООО
о
о
о"
8
о"
о
о
о
8888
ос?оо
88888
ооооо
§К5
СЧСЧСО
Ю05
5S?
о
QоОО
о
о
о
о
о
905счоо805ю
^нСО S сЗСО?5о!
ь.
о"
00
<544
1-Н ^н
тг
1^
ол
сч
со
^
0
^СЧЮЬ
СО Ю0500СО
СОNгнs
СЧ СЧсосо^
^
QСЧСО со
0^ОТГ^
00
СОСО^1-1
о
rf юсо
оо
т-нЮсоою
О СЧЮОсо
»—
СЧ
00 СЧ
оГ
o'
сч Tf
9
0
9
5
88228
ю
сч
о
соЙ
ою
4J1 Т}1
1-Н
Т-Н 1—н
о
ю
ююSIOо
со
ю
о
00юою
0ОО)
27 Затс. 3543. В. С . ЖуковскнЛ
П
р
о
д
о
л
ж
е
н
и
е
т
а
б
л
.
418
ТАБЛИЦЫ
см
СО
ю
00
__
ю
о
со
со
00
Гр
05
со
о
сч
1.
со
со
сч
£
8
§
сч
05
гр
00
к
г-
СО
8
о
ю
ГР
3
Гр
сч
со
о
05
05
8
ю
to
to
ю
гр^
ГГ
Гр
гр
гр
ГР
Гр
Гр
ГР
Гр
грв
со
со
г—«
т—<
гн
Т-Н
о
со
гр
гр
гр
гр
Гр
со
сч
сч
о
8
2
оо
05
со
ь-
о
8
сч
СО
гр
ю
со
1>
00
05
о
сч
8
Чо
ю
со
8
сч
2
Гр
ю
СО
г^-
00
о
сч
СО
ю
ю
ю
ю
СО
СО
со
СО
со
СО
со
к
о
о
о
о
О
о
о
о*
о
о*
о*
о
о
о
о
о
о
о*
»о
о>
о>
гр
о
to
с*.
00
ь-
со
00
сч
сч
о
to
ь.
8
00*
ю
со
ю
8*
со
гр
00
5?
со
8
сч
сч
ю*
05*
о
со
о
8
о
05
8
СО
г^.
00
СО
гг
гр
гр
гр
гр
гр
Гр
Гр
Гр
со
со
со
со
со
8
со
00
со
ю
ю
гр
о
ю
05
со
со
сч
05
Гр
к
8
со
00
05
05
05
05
05
05
05
00
ьг
t"T СО
to
со
сч
•»ч
2
СО
СО
82
СО
СО
со
СО
со
со
со
со
СО
СО
со
со
со
со
СО
СО
со
со
со
СО
со
СО
83
СО
о
О
гр
05
ю
сч
00
со
со
сч
сч
рг
со
о
гр
о
to
о
СО
сч
г-Г
СО
05
2
сч
Т_^
со
05
ю
8сч
я
8
СО
сч
со
сч
гр
сч
Гр
сч
2
ю
сч
сч
£ч
00
сч
8
05
сч
§
S
00
00
8
СО
СЧ
со
8
сч
СО
о
оо
00
сч
со
05
2
05
2
00
СО to
СО
СО ь-
СО
05
00
о
»»н
Г*
Ь-*
00*
о>
о
»-Н
сч
со
ю
СО 00*
05*
r-S СО* to
00
о
8
со
У—4
*-н
т-н
сч
сч
сч
сч
со
со
2
СО
ь-
t-
сч
СО 1—<
to
сч
о
Гр
со
Гр
СЧ
со
8
со
гр
сч
8
СО
о
05
1-н
СО
г^-
ю
ГР
гр
00
ю
3
о
ю
сч
00
ю
сч
с?
id
СЧ
о
05
00
со
2
ю
Гр
Гр
8
СО
8
сч
О
О
о
о
о
о
о
о
о
о
о
о
о
сГ
о
о
О
о
о
о
о*
о
о
о
о
о
о
о
о
о*
2
Гр
СО сч
0
сч
05
сч
ги
ю
СО
8
00
гр
сч
Q
05
00
00
05
05
СО to
00
со
сч
об
ю
СО
00
ОТ 05
о
сч
СО
ю
СО
00
о
8
V
Т—4
«»н
*4
сч
сч
сч
сч
сч
сч
сч
сч
со
со
2
88
о
о
88
о
о
о
о
8
о
о
о
о
8§8
о
о
о
о
888
О
о
о
О
О
о
о
о*
о
о*
о
о
о
о
о
о
о
о
2
ю
со
05
h-
05
о
Гр
со
со
Сц
2
ю
гр
гр
2
8.3
со
сч
гг
Гр
°ч
СО
ю
о
00
00
Гр
СО
§
iO
Г-^
рС
»-н
о>
сч
СО*
СЧ
е5йсо3
со
855?ю
со
ю
8
2
"К*
8
ю
о
о
г-Н
ю
о
сч
28
2
82
о
to
38
2
6
5
о
2
7
5
8
Л
СЧ сч
сч
сч
сч
сч
сч
сч
сч
сч
сч
сч
сч
сч
сч
сч
ТАБЛИЦЫ
419
счо
соо
00 _н
сою
ю
оосо05чрсо
ю
сч
счсососчсч
*—105hn чр0
тг
со
ю
to
00 Г'—
со
ц
чрСОсч
0500N-сЗ
чр
4
о
ооЧрN-
со СО
со
сососо
сосчсчсч(NСЧ
сч
о
"
~
т—*
о
сч
ч*00соо05о
сч со »-н
ю
чрСОю
сч
3
со
со
N- оо
00о
сч со
сч
со
со
оо
чр СО
чр
N
00
со
8
оо
SS
ю
to
сч
оо
СО
2
/
о
о
о
N
о
оо
о"
оо
о
оо
о
оо
о
оо
о"
оо
o'
00
©
00
о
05
о"
3
о
05
о"
05
о"
05
о*
со сч
чр сч
соN
СОсчсосо
сч05_
Чр
сч ч^
ю
ш
сосою
чрсч05СОо
соЧР^нЧРЧрnT
ю
чр
со
о
8
оо
ю
чр со
05
чро
сч
СЧсососососо
счсчсчсчсч
сч гн ^■н г-* 1-Н
N- 00
сосччрсо05о
00сч05toсососчNj
о
00СОгг,-нооГГ
г-нсо"r-Zсо05счсосчоосо
сч"
§ юсо
ю
со8
8
Чр
СОS
чр
со3
3
сч
со3
3
о
СО
05
toю
to
ю
3
^н
со
СЧо
о
сч
N.
ю
ю
05оосчЧ*
f-M о
со
00 чр
00чрсч“05со
3
счо
050505о
чр сч"
to
8
счсчсочрчр
ю
00
8
05осчсою
оо
со
сососососо
сосоСОсо
соЧрЧрчр
ю
со
о
8
сч сч
N.о
соСОчр
гн
ю
сч сч
Чр
ю
чрN*со
СО г-«
о
оо
о
сч
соо
чр 05
3
о
ьГ
3*
сч сч
со nT
5
СО СО
00
со чр
чрю
ю
ю
f>- N
05о
сч
соо
оо
т-Н
г-нгнт
-
Нсч
сч
ю
05 со
Чр «-Н
чрсчсчсоto
N-чроок
о
СО4f05соN
Юю
СО05СО00чр
гн05ооь-
0000050505Чр
ю
со
05оосою
чр сч
о
05ооNСО•о
Чр
со
CN сч
сч
^н
^■н
о
о
о
о
о
8
о
Оо
о
о
о
о
о
о
о
о
о
о
о
о
о
о
о
о
о
о
о
о
о" о*
о"о
о
о
о
о
о
о
о
о"
о
ю
ю
о
со
СО
сою
Nсч0505сч052?СО
N.
со 00
о
сч чр
05счСО05СОоо
5о05счсч
8
со со
чрчрчрчрчр
сою
ю
СО со
оо00о
тН
сч сч
сч
88
8
8
о
о
о
о
§
8
о
о
8
о
о
1
о
о
8
о
о
8
о
о
о
о
о
о
о
о
о
о"о
o'о
о
о
о
о
о"о
о
о
о"
CN
8.
8.
чр05счю
00 to
СО чр
СОчрсч
00
я
05
со
СО со
^н
05
0005ю
со
сч Чтг
сч
«Э
ю
N- СО
8
ю
сч
Г-Н0500оо
оо05о
сч
Чр
to
00
00 05
о
сч
со СО
2
ю
со
05о
сч
.-н
т-Н
Т-Н
1—« ГН сч
сч
сч
§8
8
8
о
г—Н
ю
о
сч
ю
сч
3
3
0
3
3
4
0
ю
чр
о
ю
3
5
5
8
»
о
R
СЧ сч
соСОсоСОСО
СО
со
со
со
сосоСО
со
27*
П
а
р
а
м
е
т
р
ы
к
р
и
т
и
ч
е
с
к
о
г
о
с
о
с
т
о
я
н
и
я
Т
е
м
п
е
р
а
т
у
р
а
.
3
7
4
,
1
5
°
С
Д
а
в
л
е
н
и
е
.
2
2
5
,
6
5
к
Г
/
с
л
Р
У
д
.
о
б
ъ
е
м
.
0
,
0
0
3
1
м
Ц
к
Г
Н
А
С
Ы
Щ
Е
Н
Н
Ы
Й
П
А
Р
И
В
О
Д
А
Н
А
Л
И
Н
И
И
Н
А
С
Ы
Щ
Е
Н
И
Я
420
ТАБЛИЦЫ
<
SJ
S
г;
(4
<
н
V
со
тг
см
о
см
8
ю
3
о
00
05
05
о
СО
см
тН
см
со
см
гН
Ч*
см
со
»—<
4f
о
4f
ю
ч?
05
8
00
05
ю
см
ю
СО
о
оо
ЧГ
f-H
3
см
8f-H
оо
о
05
см
Ч*
05
ю
N-
053
3
оооо
о'о'оo'с>ооо"о"о"ооооо"оО
юСОо
05,4fоь-СОююСОt-;05смЧ^
о
Tfю
V.
со*
05
ю
г-Г
00
ю
чб
00
ю
3
ю
оо
ю
1-Г
ю
К
ю
Ч*
N-
ю
см
юю
о"
ю
05"
СО
ю
об
СО
ю
t-T
СО
ю
88
юю
ю"
со
ю
чб
со
ю
тг
8
38
юю
0500ооюо>
,
см
1оооСОсо05ю
СО г-н СО
о
••**4
о
о
со
3‘
СО
о"
со
оГ
8
гН
3
см
33
ю
3
СО
3
1-Г
3
ьГ
3
об
3
05
3
05"
3
8
СО
3
со
см
со
см
см
со
я'
СО
со
см
СО
ю
см
СО
со
800СО
1-н
ю8СО
СО
ю
4f
см
СО
ю
о
СО
СО
05
ю
со
05
05 05
со8
38
•*«4
СО t-T со"
см
оо"
см
см
со 8'
об
со5
СО
4f
ю
05
4f S?
см"
юSS
со
ю
t-T
ю
об
ю
05
ю3
,_ц
42ю0505
00о
ю
4F
ю
00
о
ю
ю
см
8
г-.
г-.
8
со
ю
оо
4tf«
ооо
о05_СП05СП05
см" см см" см" см г-Г г-н Г-н *-Г *-Г
оn-
СО 05
СОСО05ч*
00СО00
WV.'Ч^
W*N'W4V
^
N
Tfсо(Nгнг—<о О05О)
СМ 00
8ь!
00 00
3S§ CJ^(NО^
_
00со00<мСО
't
^
00^
т—<
о
<СМСМСО
^^
iO со
ос>ооо
©©©©
©©©©ооооо
ОгнСОCSсо
00W
со 00
О СО05Ю^
О
NN
00 О)
ооооо
о*o'ооо
S-СМсоТ*
00^ососм
gОгнГН^
©©©"© "©
^52
00 00
смю
Г—I
о*4 о"
3§8
см 05
$
о
юСО05N-05о8к
2
см 05
оо
00
ГН 05
ю05со
СО оо
соо
со
8
о"
см
об со"
сосмf-Hо
ооГ05оообt-TСО
см
ю
гчСОN
ОДсм
8§8
88888
о"с>о*о о
§о
со-чО?
^
00ЮНNСО05СО
соgООгн(Nсо
со^
Юьосо(О2
8
о
ооооо
ооооо
оо
8^00ООоОQООООО©©
ООООООО ООООО оо
ос>о
ооооо
ооооо
оо
8й~
СО СМл
со
CDNсо00
—
'смсм
ю
СМсоСО
*-4Ю М
СОN 00
©Н»»~i
•«* h*
СО
lO
00 С£) »N
^
TfcOOCOr-ji
СООСМ^LOСОЮ
СМЮООг-ГсоюN
О»О(NСО^СОьГобоГч£
со
сосо^
^
юююююю
со
ООООО 2П222Ю0N00О)£0Ю
оос>о
оооосГооооООo'ОООоо
ОО83
ТАБЛИЦЫ
421
OON't
CONCOSPD
OJCO^O^ SiONWO>
0
ЮMO)rf
w
^
(MCO005COSM0ГИsCN00
Ю—'00ЮTfCO(N*H©
©©OgN-N-©©ЮЮ
©00N-N.N-N-N-N-
©©
N.
CDs©ЮЮ
CDCDCO
00 Tt4
2S00
CD CD
I305
о
305 g
CD©CDю
rH
со
см
Т*4
05
00
00
оо
CD8
§ю$905Tt4
о
сГО-о”о
H4
Ю
CMCMCON-©ID©
^
О)обО)соЮ0
CMЮ©ОCNCO^0
N
WINCOCOCOCOco
©©©о"оооо"
О)N05Ю»
©—■■©Юi—«
0
SSОО05
сососососо
00-000
©S©©
^
^
т*4^ Tt4Н4
о
о
о
О
1—1N-Ю
соСОтГ00юН4со
05соtNсо05IDCM
об©
05сол
о
оо
CD
смо
со
ьГ ID
CMr-:
ОNT
Ю©
со
Sююсм
CMсмсмсм ^н
rH
1—4 О
ЮЮюю
ЮююююЮLDIDЮIDIDЮID
см©см©
3
Ю
00Tf05Ю
©О)0000
HP Tt4
00<o00
00N-co00r-tCOCOсоCMо
H4i-i00cq
CD
ID00©смcoy;?<QnT0005о
О
CMCMCO
CM
CDs
CO
CD
CO
CD3
H4r&Ti
COCDCC
PH4
>
CD333
VD
CO
ID
co
Ю
CD
ID
CD
ID
CD
ID
CD
05CM©©^оCMCO
CD00©i-<
iDIDЮCD
CDCDCDCD
CM
8
CDCOCM0500(MЮ
00О
CD00058
058 h405©05IDrHH4IN000500 rHrHco
ID
CMCD05соID00rHCO8
N^ 05
oo CM05IDl-HCD
rH rH r—4CMCMCMco CO
coCOH4 Tt4Ю*DCD
4—1 rH
^H
rH 1—4
*TM1
© i—4 i—i
CO
N
COCODN
0ОTpNW
—<
COrJ4 iD CD
О
О<5ОО
3О
05_
N- 05
Оо
мСО
8TJ4О)NЮNО1—IСМСОСОtJ4
т*4СОО*нQЮ00
О
О И гн и N СМСМСМСМСМ
CSNСМ^О00CD
050
н
СМСОTf0СОЬ-0005О
1-*СО
СО«—<CDОю
(М*М гл
H405N.ЮID05
3
oo
SPI IDID
rH
8©©
N-
©
©
00
CM05ЮCM
4
ID r-H
8о CM
©
00
COCMCMIN
CM
05 00
N.©
©IDID
ЮCOCM"
IrHrH©-©©©©
-
©-©
-
©©-
ID
r-H
CM
N-
r-H
©
Tt4
rH
CM
©
N-
©
3
©
©
Tf4
co CMCMCM
©
©©©©©
888
СО 0005 05 05
СМ т000О
NNNN00
ООООО
05Ю
СМ N.
оо оо
оо
00оо05см
М
05Sсоо
05
05О »-<
СМ
О
О
«
I88888888388§
-
о
о
о
©*о
оо
©©©©©
©
©8CM
©
©
ID
CM
ТГ
N.S
.
8CM
©
ID
©
©
H48
iD
©
88©OO©
©
CM
05
©
CM
T-* ©
©
N-
©a
об
©8©
05
©©
ГН8
CN
rH
CO
rH
05
H
gg§©©
CM
CO8
nT
CO
©-
©5
9
nT
H4
rH
Ю
00
Ю
rH1
05
©
H4*
N-
©Ю
UJ
©CMrf©©
©CM
©©
©.CMHI©©
©ID
©-©
-
©
^
~
-
r-T
-ГCMCM-CMCMCM©©©©©-H4*H4*Ю#©N.©©
П
р
о
д
о
л
ж
е
н
и
е
m
a
o
.
422
ТАБЛИЦЫ
00О о00о смоо
ооь- ь- 00
»о 0-еЗч3юр
"Г О»33
юю
ю соТ-Ч
00
1
со см053Ч[
05 смсо
% юсоююЮ
чюю8см
ююю
*ч
ю88
05ч*жч8 ооч чч3соч»
^4
^ч
^ч
гЧ
83 00соЧ
смюЧ см 8
ч*чоо£Jч юч05 05
см
ю
ю3ю
о Чососм
00СО смсо ю 05 3СО
оо
со
ою
^ч
ю3
»о
юю83t—
ю00Ю8805юSSSSSсм
СО см
со 3 юСО8
оооо©"оооо'оo'о"О*ооооооо*оооос>
T—IЧ о 05 05»-*00со СОгЧ смо
юсм,р о0505 00
S3ооюсм00 и5оо8 ю смо Г-Гto00 88 со"ч"см o' 3 оо"ч
г>. Ь.со СО8 toюююЧrfЧ4
3оо300 см ^-ч
чччЧЧЧ чЧЧччЧTJ*ч« ч* ч
чччч
со__ 05сосм г—<ю00см ю 05осм ооч*ч^toю соч юч см
соч3со
юсо СО
8со
оо оо $со
0505 0505оГ0505 0505050505
СОсососо 8 8 о сосоСО
со8
8
8
соСО8 сосо СО
со СО
со соСО
сосо сосо $
сосо СО
со8
00ь- 00сооо о смCM 05сосмоосм СО05ж<мч to СО1^сооо05
ю05ооь- о ч
ооо юоог-чоосообо"
3
to 05об
гЧ
3'
**
0000000505 р р
8
см8
см см
3
оооо 00ч ч
ю
*-н
смсм CMсм смсмсм см см смемCM смсмсмсмсм
Ч«ч00Ч Ч смоо05смсм
ю00
05ь -
юоо
00 ю ч смооо ь- СОЧ400CM ооо000500
оюоч05ч05ч оооо оо0000оо
см см см05сорСО
ю юСОсосо ьГ
00od05ofo'o'wS,-н смсмоб00 чюсоьГоб
У—
*
г—
•
тЧ ^ч
008
05
СОю05СО8оо смCM оючсм
88
ч см«—( ю ю Чч*оо 3ю003 05Г--05юю
СО оо ч СОооCM8 8 см8 Tt4
юсм
00 05 СО3
0500сою2 оосм *—1 о 8 8
оо 1^
88ю
»—< *■—«»
—
<*—
•
»—«»
—
«
оо
ооооо
ооо
ооо*оо"ооооооооооo'о"ооооооo'о
СМ0500СОсо ю см00CMСО 05см3
тГ 3см8 юсмю8СОю
СОсо см смЬ; СОо Ч05
058оч
to3
<м ооЧЧ юю5СО
ь- 000005 0505р ^ч см Op
*—i
^ч
^ч чЧ
смсмсм смсм CMсм
&
^ч
гЧ ^чf-H ^■ч
^ч
8888888оо88 88888 8оооооо88
о
о888
Ооооооооооo'оооо оо*ооo'о*оооо
я8оо оо800юч
оо ю003ю о8 оо05союь-ч
ооу—
*
Чоо оо оо00см t^- 05 о0500ь-оо t—р
0500|С8 Ч оС8 00(Л8 об со ооcT смч7ьГоб о смсо 05об
3
N00оо 0505 о
у—4 см
смсм00оооо3ч
^Ч
^ч
*>н смсм см смсмсмсмсм
смсмсм смсм смсм
О смоочюсо ооо>о смооTt« toСО ооО)8
смч со 00
^ч
смсмсмсмсм смсмсмсмсм 00оо оо 00
ТАБЛИЦЫ
423
NОООЮ
-нЮCNS
Югртр
тр TP
°28
N-^
О^н(NСО
—
I^
rfQ5Ю'-iN
N (>■ \’J
WWWUJIHtN^щoo^
tp ет>Ю i—•
CNOUCNю N ■'TO*—lOO
Eсосо
1222J25?onсойюtcn^оoomo^ojo
oocomoo
£H*
Tf
^
COCO COCOCOCOCO COCOCOCO<N NINCNWIN нниО
00О(NN't
(N 00CNЮN
N
Ю
(NО s
82
rp000500ЮООCO0000(MHо
oo CO
Ю<-•S
CO05юооо~
cm
COCOCM—О
CONN000005ОCMСОгрЮCON0005
""4
""ч 'л
CONN'NN«"^
^
^
^
W
COCOCOCOCO
о*оооо
ЮCON0005
NNNNN
ООООО
ООООО
СМ00ЮN rf OO^iOC4N 'tCOCOO
5юriюгн lOO^G5rf r-lrHn)Tf
05»—<СОгрСО NО)6r-tm
юN05CN
N^oqoqoooq oooocfio50j 05^05 05 0
ooooo ooooo сГс?сГг-Г
сооюосо
смf-T*“ГсмСОоюСМ05N^ юоСО00о
00_|Njсо
Гр
оN^соОСО
со
гС 05 ,_г
грСО05
грN-СОоосо05соnT1-гсмсмо
г
5§
о
чр
О05
гр со
о
со
00
СОсо8
СО
со
ю
со88
со
со
см
со
со88
N-
см
ю
см
гр
см
см
см см
05
Г-Н
юсм
IV г-
N- гр
©
00ЮCM05ЮСОгр^© СООсо0 NI
05 00ОО00N^N соЮ
N tH*С5N Ю
СО соСОсо со СОСО сосо со COlOlOlO
со
сосососо сососососососОсОсо
ОS(NЮ(NN
О»^N
СМN^
ujw ri(,n
г—Iuj ln
A 1Л^
COCO (Nн и ОО) ООСОгрСМ
О сососососо соС£5сосоЮ ЮЙ ЮЮ
®.
*400°
-
-
ioo o ^ cmco г-Tiocm
гр00осмсо
сою «1ооо о00ГР00
смсм05ГрN.05
Гр
Грcqю
оо
ю3
lO
со
оо
со
pH
N.
гр »-г
оо
00
00а
i-r
о
сз
см* 00
838“ 3
яS
см
33gо
$3 83
05
N-
смсмсмсмсм
смсмсмсмСОсо33сосо
со
сосососо
ГрГрГрГРГрГр
о
соСО05 гр0000Гр
со0000
05
ю lOСОо
1-г
см
N*
N^N*N- 00
05N- со
ю N;оо
о соГ—1сО 0005
смю
05ж о>
05о Г-*см*со* тр
осмю 00Г-НГр
о Грг-1оо3 Гр со
ю 00со
СО05 00
смсмсмсм смсмсосоСО СОГрГрГрю
юсосо
оо 05о
см Гр
f-г
3оо
я
со
см
СО05соСО00 05ЮГОсо
СО00соСОсм
ю*—•со
N- 05»—«гр СОСО 05СОСО0005ЮсоСО1ЛСО00СОСОСМ СОСМОООN
N. СМО05ОС4!СО»—«СО05ООО^05ЮTfCOCO’-'OO
СО (О СО 00О)
'
00СОсоСМО СОСОо N ЮгрСМ©0500СОгрСО ' ОФ00N“
^ гр^Р00СОсоCM CMOJСМ^1 —
.
_н ,-ч
©©©
ААА<->оос5ОООООООООООО оооо
ООООО 000*00 ООООО ОО
о
о*о о о*о
о.о о
00U3СОсо
со со
/—С/—ч /—ч/—ч
см
ЮСОN СОсо
емй
^
оto
оюсм
__
_
—.
—
.О
ООN.fw£■>
rfrt(50(NОN
Sfc
ООNN
гн 0^00
05 смгрN^о
rpLOЮЮсо
СМ смсм смсм
О
05О)t®NCMCDСМО
N СОCNlOТГ^СОжОО05ОО
СМ00гр05*Н*“о о? N.^ ю
ср СО NN 00 00050500
(N смсмсмсмсмСм Смсо со
33?’
ЮО05
соож
05 СО*СО 051C
о
смсмсо
со сосососо
со
^ соЮСМООсо
ю
Nсосоооо
^
^со
о
lOо"Ю05гр00СМ00
тр
грЮЮЮсосоNN
со
сососо с5 СОсосоСО
о
Тр
§й§8с- «288ою
050582ООО
СМСОтр
о
ю
ООО
©ООгр
NооО)О
СМ СМ
^_г
_н
1 -н <—•«—« 1— 1 г-г смсмсмсм
424
ТАБЛИЦЫ
ВОДА И ПЕРЕГРЕТМЙ
Числа слева от ступенчатой линии относятся к
Nv
t
40°
60°
80°
100’
120°
140°
160°
нГ/см"1
0,051 Г
29,42
614,8
2,0164
31,31
623,9
2,0439
33,19
633,0
2,0703
35,08
642,1
2,0953
36,96
651,1
2,1190
38,85
660,2
2,1415
40,73
669,4
2,1631
0,061 1
24,50
614,8
1,9965
26.08
623,9
2,0237
27,65
632,9
2,0500
29,23
642,1
2,0751
30,80
651,1
2,0988
32,37
660,2
2,1214
33,91
669,4
2,1430
0,081 1
1,0079
40,0
0,1365
19,56
623,8
1,9919
20,74
632,9
2,0183
21,92
642,1
2,0432
23,10
651,1
2,0669
24,28
660,1
2,0896
25,46
669,3
2,1112
0,101
1,0079
40,0
0,1365
15,64
623,7
1,9672
16,58
632,8
1,9935
17,53
642,0
2,0136
18,47
651,0
2,0428
19,42
660,1
2,0649
20,36
669,3
2,0865
0,121 /
1,0079
40,0
0,1365
13,02
623,6
1,9470
13,81
632.8
1,9733
14,60
641,9
1,9984
15,39
651,0
2,0221
16,18
660,1
2,0448
16,96
669,3
2,0664
0,16 {Г
1,0079
40,0
0,1365
9,759
623,4
1,9150
10,36
632,6
1,9415
10,95
641,8
1,9666
11,54
650,9
1,9903
12,13
660,0
2,0129
12,72
669,2
2,0347
0,201i
1,0079
40,0
0.1365
7,797
623,2
1,8903
8,277
632,5
1,9166
8,752
641,7
1,9417
9,226
650,8
1,9655
9,699
659,9
1,9882
10,17
669,1
2,0098
0.24 {Г
1,0079
40,0
0,1365
1,0171
60,0
0,1984
6,893
632,3
1,8962
7,290
641,5
1,9215
7,685
650,7
1,9454
8,080
659,9
1,9681
8,474
669,1
1,9897
0,301Ч
1,0079
40,0
0,1365
1,0171
60,0
0,1984
5,507
632,1
1,8713
5,826
641,4
1,8965
6,143
650,6
1.9204
6,459
659,8
1,9431
6,776
669,0
1,3648
0,4011
1,0079
40,0
0,1365
1,0171
60,0
0,1984
4,123
631,7
1,8389
4,365
641,1
1,8646
4,604
650,3
1,8887
4,842
659,5
1,9116
5,079
668,8
1,9334
О
с
л
о
О
:
<
2
1,0079
40,0
0,1365
1,0171
60,0
0,1984
1,0290
80,0
0,2567
3,487
640,8
1,8397
3,679
650,1
1,8639
3,870
659,3
1,8866
4,060
668,6
1,9084
0,601\
1,0079
40,0
0,1365
1,0171
60,0
0,1984
1,0290
80,0
0,2567
2,902
640,4
1,8186
3,063
649.9
1,8432
3,223
659,2
1,8662
3,382
668,5
1,8880
°-70U
1,0079
40,0
0,1365
1,0171
60,0
0,1984
1,0290
80,0
0,2567
2,484
640,2
1,8012
2,623
649,7
1,8257
2,760
659,0
1,8488
2,896
668,3
1,8706
ТАБЛИЦЫ
425
Таблица 7
ВОДЯНОЙ ПАР
воде. Для последней v выражено в дм^кГ.
о
0
0
200°
220°
240°
260°
280°
300°
t
/P
кПсм2
42,62
44,50
46,39
48,27
50,15
52,04
53,92
V\
г,78,6
687,8
697,0 706,4
715,8
725,2
734,8
i \0,05
2,1839 2,2039 2,2231 2,2415 2,2595 2,2769 2,2938 s 1
35,51
37,08
38,65
40,22
41,79
43,36
44,93
V\
678,5
687.8
697,0
706,4
715,8
725,2
734,8
i l0,06
2,1638 2,1838 2,2030 2,2214 2,2393 2,2568 2,2737 s 1
26,64
27,82
28,99
30,17
31,35
32,52
33,70
V\
678,5
687,8
697,0
706,3
715,7
725,2
734,8
i \0,08
2,1319 2,1518 2,1711 2,1897 2,2076 2,2249 2,2418 s J
21,30
22,24
23,19
24,13
25,07
26,02
26,96
V)
678,5
687,7
697,0
706,3
715,7
725,2
734,8
i>0.10
2,1073 2,1273 2,1465 2,1650 2,1830 2,2009 2,2172 s I
17,75
18,54
19,32
20,11
20,89
21,68
22,46
V)
678,5
687,7
697,0
706,3
715,7
725,2
734,8
i }0,12
2,0872 2,1072 2,1264 2,1450 2,1630 2,1803 2,1972 s 1
13,31
13,90
14,49
15,07
15,66
16,25
16,84
V1
678,4
687,7
696,9
706,2
715,7
725,2
734,8
i [0,16
2,0554 2,0753 2,0946 2,1132 2,1310 2,1484 2,1654 s 1
10,64
11,12
11,59
12,06
12,53
13,00
13,48
V1
678,3
687,6
696,9
706,2
715,6
725 2
734,8
i [0,20
2,0306 2,0506 2,0698 2,0885 2,1065 2,1238 2,1409 s /
8,869
9,262
9,656 10,05
10,45
10,84
11,23
V1
678,3
687,6
696,9
706,2
715,6
725,1
734,7
i }0,24
2,0105 2,0305 2,0497 2,0683 2,0863 2,1037 2,1206 s J
7,092
7,407
7,722
8,038
8,352
8,667
8,983
V1
678,2
687,5
696,8
705,1
715,5
725,1
734,7
i
0,30
1,9856 2,0058 2,0250 2,0436 2,0616 2,0790 2,0959 s J
5,317
5,553
5,790
6,026
6,263
6,500
6,736
V1
678,0 687,4
696,7
706,1
715 5
725,1
734,7
i }0,40
1,9542 1,9742 1,9934 2,0120 2,0300 2,0475 2,0644 s J
4,250
4,440
4,629
4,819
5,008
5,197
5,387
V1
677,9
687,2
696,6
705,9
715,4
725,0
734,6
i
0,50
1,9294 1,9494 1,9686 1,9873 2,0053 2,0228 2,0397 s J
3,540
3,700
3,858
4,016
4,174
4,331
4,489 V )
677,7
687,1
696,5
705,9
715,3
724,9
734,5
i
0,60
1,9089 1,9289 1,9483 1,9669 1,9849 2,0023 2,0193 s J
3,033
3,169
3,304 3,440
3,576
3,711
3,847 V 1
677,5
687,0 696,4
705,8
715,3
724,9
734,5
i 0,70
1,8916 1,9118 1,9311 1,9499 1,9679 1,9853 2,0024 s J
426
ТАБЛИЦЫ
Р4
кГ}см'
*
40°
60°
80°
100°
120°
140°
160°
(V
1,0079 1,0171 1,0289 2,169
2,292
2,413
2,532
0,80 i 40*0
60,0
80,0
639,9
649,4
658,8
668,2
1S
0,1365 0,1984 0,2567
1,7859 2,8107 1,8339 1,8559
(V
1,0079 1,0171 1,0289
1,925
2,035
2,143
2,249
0,90 i 40,0
60,0
80,0
639,5
649,2
658,6
668,0
1s
0,1365 0,1984 0,2567
1,7722 1,7973 1,8206 1,8426
(V
1,0079 1,0170 1,0289
1,730
1,830
1,926
2,023
1,0 i 40,0
60,0
80,0
639,2
649,0
658,4
667,8
1s
0,1365 0,1984 0,2557
1,7609 1,7851 1,8083 1,8303
(V
1,0078 1,0170 1,0289
1,0435 1,521
1,602
1,683
1,2 i
40,0
60,0
80,0
100,1
648,5
658.0
667,5
1s
0,1365 0,1984 0,2567 0,3121 1,7640 1,7875 1,8097
(V
1,0078 1,0170 1,0289
1,0435 1,300
1,371
1,440
1,4 i
40.0
60,0
80,0
100,0
648,0
657,7
667,2
1s
0,1365 0,1984 0,2567 0,3121 1,7461 1,7700 1,7924
(V
1,0078 1,0170 1,0289
1,0435 1,135
1,197
1,258
1,6 i 40,0
60,0
80,0
101,1
647,5
657,3
666,9
1s
0,1365 0,1984 0,2567
0,3121 1,7306 1,7548 1,7771
(V
1,0078 1,0170 1,0289
1,0435 1,006
1,062
1,117
1,8 i 40,0
60,0
80,0
100,1
647,0
656,9
666,6
1s
0,1365 0,1984 0,2567 0,3121 1,7166 1,7409 1,7637
(V
1,0078 1,0170 1,0289
1,0435 0,9027 0,9545 1,004
2,0|i
40,0
60,0
80,0
100,1
646,5
656,5
666,4
1s
0,1365 0,1984 0,2567 0,3121 1,7043 1,7284 1,7515
(V
1,0078 1,0170 1,0289
1,0434 1,0603 0,7597 0,8003
2,5 i 40,0
60,0
80,0
100,1
120,3
655,6
665,5
1s
0,1365 0,1984 0,2567 0,3121 0,3647 1,7024 1,7258
(V
1,0078 1,0170 1,0288
1,0434 1,0602 0,6296 0,6643
3,0 i
40,0
60,0
80,0
100,1
120,3
654,5
664,7
1s
0,1365 0,1983 0,2567 0,3121 0,3647 1,6802 1,7044
ГV
1,0077 1,0169 1,0288
1,0433 1,0602 1,0798 0,4940
4,0 i 40,1
60,0
80,0
100,1
120,3
140,7
663,1
1s
0,1365 0,1983 0.2566 0,3120 0,3646 0.4150 1,6697
(V
1,0077 1,0168 1,0287
1,0433 1,0601 1,0797 0,3917
5,0|i
40,1
60,0
80,0
100,1
120,3
140,7
661,3
\s
0,1365 0,1983 0,2566 0,3120 0,3646 0,4150 1,6420
IV
1,0077 1.0168 1,0287
1,0432 1,0601 1,0797 0,3232
6,0|i 40,1
60,1
80,1
100,1
120,3
140,7
659,4
1s
0,1365 0,1983 0,2566 0,3120 0,3646 0,4150 1,6186
{V
1,0076 1,0168 1,0286
1,0432 1,0600 1,0796 1,1020
7,0 i 40.1
60.1
80,1
100.1
120,3
140,7
461,3
\s
0,1365 0,1983 0,2566 0,3120 0,3646 0,4150 0,4637
ТАБЛИЦЫ
427
Продолжение табл. 7
180°
200°
220°
240°
260°
280°
300°
t
'
P
кГ1см9
2,652
2,771
2,890
3,009
3,127
3.246
3,364 V \
677,5
686,9
696,3
705,7
715,2
724,8
734,4
i 10,80
1,8769 1,8971
1,9165 1,9351 1.9531 1,9706 1,9876 s 1
2,356
2,462
2,568
2,673
2,779
2,884
2,989
V)
677,3
686,7
696,1
705,6
715.1
724,7
734,3
i 10,90
1,8637 1,8839 1,9033 1,9220 1,9400 1,9575 1,9745 s /
2,119
2,214
2,310
2,405
2,500
2,595
2,690
V1
677,2
686,6
696,0
705,5
715,1
724,7
734,3
i}1,0
1,8515 1,8717 1,8913 1,9101 1,9284 1,9461 1,9634 s J
1,763
1,843
1,923
2,002
2,082
2,161
2,240 V 1
676,9
686,4
695,8
705,3
714,9
724,5
734,2
i 1,2
1,8310 1,8514 1,8710 1,8898 1,9079 1,9258 1,9431 s J
1,509
1,578
1,647
1,715
1,783
1,851
1,919 V )
676,7
686,1
695,6
705,1
714,7
724,3
734,0
i 1.4
1,8136 1,8340 1,8536 1,8725 1,8909 1,9086 1,9259 s 1
1,319
1,379
1,439
1,499
1,559
1,619
1,678 V 1
676,4
685,9
695,4
704,9
714,5
724,2
733,9
i
1,6
1,7984 1,8188 1,8386 1,8576 1,8759 1,8936 1,9109 s 1
1,171
1.225
1,278
1,332
1,385
1,438
1,491 V )
676,1
685,7
695,2
704,8
714,4
724,0
733,8
i 1,8
1,7852 1,8056 1,8252 1,8442 1,8626 1,8804 1,8977 s J
1,053
1,101
1,150
1,198
1,246
1,294
1,342 V 1
675,9
685,4
695,0
704,6
714,2
723,9
733,7
i 2,0
1,7732 1,7937 1,8133 1,8324 1,8509 1,8687 1,8858 s 1
0,8399 0,8790 0,9179 0,9567 0,9953 1,033
1,072 V )
675,2
684,8
694,4
704,0
713,7
723,5
733,3
i 2,5
1,7475 1,7683 1,7882 1,8072 1,8256 1,8435 1,8609 s )
0,6975 0,7304 0,7631 0,7956 0,8281 0,8603 0,8923 V )
674,5
684,2
693,9
703,6
713,4
723,2
733,0
i 3,0
1,7263 1,7471 1,7671 1,7864 1,8048 1,8227 1,8402 s J
0,5197 0,5448 0,5697 0,5944 0,6190 0,6433 0,6676 V )
673,2
683,0
692,9
702,7
712,6
722,5
732,4
i}4,0
1,6927 1,7139 1,7341 1,7535 1,7723 1,7904 1,8080 s 1
0,4129 0,4334 0,4537 0,4736 0,4935 0,5131 0,5327 V
671,7
681,7
691,7
701,7
711,7
721,8
731,8
i}5.0
1,6659 1,6875 1,7079 1,7277 1,7467 1,7649 1,7826 s 1
0,3416 0,3591 0,3763 0,3932 0,4099 0,4264 0,4428 V 1 e
670,1
680,6
690,7
700,9
710,9
721,1
731,2
i 6,0
1,6431 1,6655 1.6864 1,7064 1,7254 1,7438 1,7616 s 1
0,2906 0,3059 0,3209 0,3356 0,3501 0,3644 0,3785 V
1.л
668,8
679,5
689,7
700,0
710,1
720,3
730,5
i
1,6235 1,6467 1,6680 1,6882 1,7075 1,7260 1,7439 s J
428
ТАБЛИЦЫ
кГ/см3
t
40°
60°
о
0
0
100°
120°
140°
160°
(V
1,0076
1,0167
1,0286
1,0431
1,0600
1,0795
1,1020
8,0 i
40,2
60,1
80,1
100,2
120,3
140,7
161,3
1s
0,1365
0,1983
0,2566
0,3119
0,3646
0,4149
0,4636
(V
1,0075
1,0167
1,0285
1,0430
1,0599
1,0795
1,1019
9,0 i
40,2
60,1
80,1
100,2
120,4
140,7
161,3
\s
0,1364
0,1983
0,2565
0,3119
0,3645
0,4149
0,4636
V
1,0075
1,0166
1,0285
1,0430
1,0599
1,0794
1,1018
н»
i 40,2
60,1
80,1
100,2
120,4
140,7
161,3
1s
0,1364
0,1983
0,2565
0,3119
0,3645
0,4149
0,4635
V
1,0074
1,0165
1,0284
1,0429
1,0598
1,0793
1,1017
12i
40,2
60,2
80,2
100,2
120,4
140,8
161,3
1s
0,1364
0,1982
0,2565
0,3119
0,3645
0,4148
0,4635
V
1,0073
1,0164
1,0283
1.0428
1,0598
1,0792
1,1015
14
i
40,3
60,2
80,2
100,3
120,4
140,8
161,4
1s
0,1364
0,1982
0,2564
0,3118
0,3644
0,4148
0,4634
V
1,0072
1,0163
1,0282
1,0427
1,0595
1,0791
1,1014
16 i 40,3
60,2
80,2
100,3
120,5
140,8
161,4
I{s
0,1364
0,1982
0,2564
0,3118
0,3644
0,4147
0,4633
Ifv
1,0071
1,0162
1,0281
1,0425
1,0594
1,0789
1,1013
18 i 40,4
60,3
80,3
100,3
120,5
140,9
161,4
11^
0,1364
0,1982
0,2564
0,3117
0,3644
0,4147
0,4633
IfV
1,0070
1,0161
1,0280
1,0425
1,0593
1,0788
1,1011
20
i
40,4
60,3
80,3
100,4
120,5
140,9
161,4
Ils
0,1364
0,1981
0,2563
0,3117
0,3643
0,4146
0,4632
|\v
1,0068
1,0159
1,0278
1,0422
1,0591
1,0785
1,1008
25
.
40,5
60,4
80,4
100,5
120,6
141,0
161,5
I15
0,1363
0,1980
0,2562
0,3116
0,3642
0,4145
0,4630
Ifv
1,0066
1,0157
1,0275
1,0419
1,0588
1,0782
1,1004
30
i 40,6
60,5
80,5
100,5
120,7
141,1
161,6
1is
0,1362
0,1980
0,2561
0,3115
0,3641
0,4144
0,4629
1\v
1,0064
1,0155
1,0273
1,0417
1,0585
1,0779
1,1001
35
l
40,7
60,6
80,6
100,6
120,8
141,1
161,6
1i5
0,1362
0,1979
0,2561
0,3114
0,3640
0,4143
0,4627
|fV
1,0062
1,0152
1,0271
1,0414
1,0582
1,0776
1,0997
40
i
40,8
60,7
80,7
100,7
120,9
141,2
161,7
115
0,1362
0,1978
0,2560
0,3113
0,3639
0,4142
0,4625
IrV
1,0060
1,0150
1,0269
1,0412
1,0580
1,0773
1,0994
45
t
40,9
60,8
80,8
100,8
121,0
141,3
161,8
!1s
0,1361
0,1978
0,2559
0,3112
0,3638
0,4141
0,4624
1Гv
1,0057
1,0148
1,0266
1,0409
1,0577
1,0770
1,0990
50
i 41,0
60,9
80,9
100,9
121,1
141,4
161,8
is
0,1361
0,1977
0,2558
0,3111
0,3637
0,4140
0,4622
ТАБЛИЦЫ
429
Продолжение табл. 7
о
О
о
о
200°
220°
240°
260°
280°
300°
t
к Г/см*
0,2524
0,2662
0,2795
0,2925
0,3054
0,3180
0.3305
V'i
667,3
678,2
688,7
699,0
709,3
719,6
729,9
i
8,0
1,6063
1,6300
1,6517
1,6722
1,6916
1,7102
1,7282
s,I
0,2226
0,2353
0,2472
0,2589
0,2704
0,2818
0,2930
v'1
665,5
676,8
687,5
698,1
708,5
718,9
729,3
/}9,0
1,5905
1,6147
1,6369
1,6577
1,6776
1,6964
1,7145
1
0.1987
0,2103
0,2214
0,2321
0,2425
0,2528
0,2630
*1I
663,8
675,4
686,5
697.2
707,7
718,2
728,6
10
1,5760
1,6008
1,6236
1,6449
1,6650
1,6839
1,7019
5J1
1,1273
0,1728
0,1825
0,1918
0,2006
0,2095
0,2181
V1I
182,3
672,9
684,5
695,4
706,0
716,7
727,3
i
12
0,5106
1,5762
1,6000
1,6220
1,6425
1,6617
1,6801
sj1
1,1272
0,1460
0,1547
0,1629
0,1707
0,1784
0,1859
*1I
182,3
670,0
682,3
693,5
704,4
715,2
725,9
i
14
0,5105
1,5545
1,5796
1,6020
1,6229
1,6426
1,6612
s,1
1,1270
1,1565
0,1338
0,1411
0,1482
0,1550
0,1618
v'1
182,3
203,6
679,8
691,4
702,6
713,7
724,7
i
16
0,5104
0,5562
1,5610
1,5843
1,6056
1,6257
1,6447
sI
1,1268
1,1563
0,1175
0,1242
0,1307
0,1369
0,1430
V\
182,3
203,6
677,0
689,3
700,8
712,1
723,3
i
18
0,5103
0,5561
1,5438
1,5681
1,5901
1,6105
1,6299
sJ
1,1267
1,1561
0,1043
0,1108
0,1167
0,1225
0,1280
V
182,3
203,6
674,4
687,2
699,0
710,6
722,0
iу20
0,5102
0,5560
1,5280
1,5530
1,5757
1,5967
1,6166
sJ
1,1263
1,1556
1,1899
0,08643 0 ,09158 0,09640 0 ,1010
V)
182,3
203,6
225,4
681,4
694,2
706,5
718,5
i
25
0,5100
0,5558
0,6009
1,5200
1,5443
1,5665
1,5873
sj
1,1259
1,1552
1,1892
0,06987 0 ,07459 0,07889 0,08293 V
182,4
203,6
225,4
675,0
688,9
702,1
714,9
iУзо
0,5098
0,5556
0,6006
1,4900
1,5167
1,5405
1,5624
sJ
1,1255
1,1547
1,1886
1,2290
0,06234 0 ,06630 0 ,06998 V )
182,5
203,7
225,4
247,8
683,8
697,8
711,1
iУ35
0,5096
0,5553
0,6004
0,6448
1,4919
1,5173
1,5403
sJ
1,1251
1,1542
1,1880
1,2282
0,05302 0,05679 0.06022 V \
182,5
203,7
225,4
247,8
678,0
693,0
706,9
iУ40
0,5094
0,5551
0,6001
0,6445
1,4684
1,4957
1,5202
sJ
1,1247
1,1537
1Л 874
1,2274
0,04567 0,04935 0,05260 V \
182,6
203,8
225,4
247,8
671,6
687,9
702,5
i
45
0,5092
0,5549
0,5999
0,6442
1,4458
1,4757
1,5018
sJ
1,1243
1,1532
1,1868
1,2266
1,2751
0,04330 0 ,04646 V )
182,6
203,8
225,5
247,8
271,1
682,7
698,4
iУ50
0,5090
0,5547
0,5996
0,6439
0,6885
1,4564
1,4844
sJ
430
тлвлицы
РN
кГ/см*
40°
60"
80°
о
о
120°
i
о
160°
V
1,0053 1,0144 1,0262
1,0404 1,0572 1,0764 1,0984
60Ii
41,2
61,1
81,1
101,1
121,2
141,5
162,0
1s
0,1360 0,1976 0,2556
0,3109 0,3635 0,4137 0,4619
V
1,0049 1,0139 1,0257
1,0399 1,0566 1,0758 1,0977
70i
41,4
61,3
81,2
101,2
121,4
141,7
162,1
1S
0,1359 0,1974 0,2555
0,3107 0,3633 0,4135 0,4617
V
1,0045 1,0135 1,0252
1,0394 1,0561 1,0752 1,0970
80 i 41,6
61,5
81,4
101,4
121,6
141,8
162,2
1s
0,1359 0,1973 0,2553
0,3105 0,3631 0,4133 0,4614
V
1,0040 1,0130 1,0248
1,0389 1,0556 1,0746 1,0963
90 i 41,8
61,7
81,6
101,6
121,7
142,0
162,4
1s
0,1357 0,1971 0,2551
0,3103 0,3628 0,4130 0,4611
v
1,0036 1,0126 1,0243
1,0384 1,0550 1,0740 1,0957
1001i 42,1
61,9
81,8
101.8
121,9
142,1
162,5
Is
0,1356 0,1970 0,2550 0,3101 0,3625 0,4128 0,4608
1rV
1,0028 1,0117 1,0234
1,0375 1,0540 1,0728 1,0943
120|i 42,5
62,3
82,2
102,1
122,2
142,4
162,8
1
0,1355 0,1967 0,2547
0,3097 0,3623 0,4124 0,4603
IrV
1,0019 1,0109 1,0225
1,0365 1,0529 1,0717 1.0930
140 i
42,9
62,7
82,5
102,5
122,6
142,8
163,1
1{s
0,1352 0,1965 0,2544
0,3094 0,3619 0,4119 0,4598
|fv
1,0011 1,0100 1,0216
1,0356 1,0519 1,0705 1.0917
160 i 43,3
63,1
82,9
102,9
122,9
143,1
163,4
1LS
0,1351 0,1962 0,2541
0,3090 0,3615 0,4115 0,4593
IrV
1,0003 1,0092 1,0207
1,0347 1,0508 1,0694 1,0905
180{i 43,7
63,5
83,3
103,2
123,2
143,3
163,6
1„s
0,1350 0,1959 0,2538
0,3087 0,3611 0,4110 0,4588
IrV
0,9995 1,0083 1,0198
1,0337 1,0498 1,0682 1,0892
200 i 44,1
63,8
83,7
103,6
123.6
143,7
163,9
1{s
0,1347 0,1958 0,2536
0,3084 0,3607 0,4106 0,4583
1\v
0,9986 1,0075 1,0190
1,0328 1,0488 1,0671 1,0879
220 1i 44,5
64,2
84,0
103,9
123,9
144,0
164,2
Iis
0,1345 0,1955 0,2533
0,3081 0,3603 0,4101 0,4578
IfV
0,9978 1,0067 1,0181
1,0318 1,0478 1,0661
1,0866
240 i 44,9
64,6
84,4
104,3
124,3
144,3
164,5
Iis
0,1344 0,t953 0,2530
0,3077 0,3599 0,4097 0,4573
I\v
0,9954 1,0042 1,0154
1,0291
1,0448 1,0628 1,0830
300 i 46,2
65,8
85,5
105,4
125,3
145,2
165,4
1l$
0,1338 0,1947 0,2522
0,3068 0,3587 0,4084 0,4539
ТАБЛИЦЫ 7
431
Продолжение табл. 7
180°
200°
220°
240°
260°
280°
С
о
О
о
о
t
/P
кГ/см3
1,1235 1,1522 1,1857 1,2251
1,2729 0,03405 0,03711 V \
182,8
203,9
225.5
247,8
270,9
671,0
689,0
i160
0,5086 0,5543 0,5991 0,6433 0,6878 1,4188 1,4513 s 1
1,1226 1,1513 1,1845 1,2236 1,2709 1,3308 0,03029 V )
182,9
204,0
225,6
247,8
270,9
295,2
678,7
i
70
0,5082 0,5539 0,5986 0,6428 0,6871 0,7317 1,4195 s 1
1,1219 1,1504 1,1833 1,2221
1,2689 1,3279 0,02503 V \
183,0
204,1
225,7
247,8
270,9
295,1
667,0
i180
0,5079 0,5535 0,5982 0,6423 0,6864 0,7308 1,3875 s J
1,1211
1,1494 1,1822 1,2206 1,2669 1,3250 1,4024 V 1
183,1
204,2
225,7
247.9
270,9
295,0
321,1
il90
0,5075 0,5532 0,5977 0,6417 0,6858 0,7300 0,7764 s J
1.1203 1,1485 1,1810 1,2192 1,2650 1,3222 1,3979 V 1
183,2
204,3
225,8
247,9
270,9
294,9
320,7
i 1100
0,5072 0,5527 0,5973 0,6412 0,6852 0,7293 0,7751 s 1
1,1188 1,1466 1,1788 1,2163 1,2613 1,3169 1,3897 V 1
183,5
204*5
225,9
248,0
270,8
294,6
320,1
i
120
0,5066 0,5520 0,5964 0,6402 0,6839 0,7278 0,7729 s J
1,1172 1,1448 1,1766 1,2136 1,2576 1,3118 1,3820 V 1
183,7
204,7
226,1
248,0
270,8
294,5
319,5
i \140
0,5060 0,5513 0,5955 0.6392 0,6827 0,7263 0,7709 s 1
1,1157 1,1430 1,1744 1,2108 1,2541 2,3070 1,3746 V 1
183,9
204,9
226,2
248,1
270,7
294,4
319,1
i 160
0,5054 0,5506 0,5946 0,6382 0,6816 0,7250 0,7690 s J
1,1143 1,1412 1,1722 1,2082 1,2506 1,3023 1,3678 V )
184,2
205,1
226,3
248,2
270,7
294.2
318,7
i V180
0,5048 0,5499 0,5938 0,6372 0,6804 0,7236 0,7673 s J
1,1128 1,1395 1,1701
1,2055 1,2472 1,2977 1,3612 V 1
184,4
205,3
226,5
248,2
270,7
294,0
318,4
i}200
0,5042 0,5492 0,5930 0,6363 0,6792 0,7222 0,7655 s J
1,1113 1,1379 1,1680 1,2029 1,2439 1,2933 1,3549 V )
184,7
205,4
226,6
248,3
270,7
293,9
318,0
i}220
0,5037 0,5485 0,5922 0,6353 0,6781 0,7208 0,7638 s J
1,1099 1,1362 1,1660 1,2005 1,2408 1,2891 1,3489 V \
184,9
205,6
226,7
248,4
270,7
293,8
317,8
i}240
0,5031 0,5477 0,5914 0,6343 0,6769 0,7195 0,7622 s J
1,1057 1,1312 1,1602 1,1933 1,2317 1,2773 1,3328 V 1
185.7
206,2
227,1
248,6
270,7
293,5
317,0
i >300
0,5015 0,5459 0,5890 0,6315 0,6736 0,7154 0.7574 s 1
432
ТАБЛИЦЫ
р\
кГ/см?
t
320°
340°
360°
380°
о
о
т
Г
420°
4
^
О
о
f V 55,80
57,69
59,57
61,46
63,33
65,21
67,09
0,05 i 744,4
754,0
763,8
773,6
783,4
793,3
803,3
\s
2,3102 2,3261 2,3418 2,3569 2,3717 2,3863 2,4006
(V
46,50
48,07
49,64
51,20
52,78
54,35
55,92
0,061 i 744,4
754,0
763,8
773,6
783,4
793,3
803,3
1s
2,2900 2,3059 2,3216 2,3368 2,3516 2,3662 2,3805
( V 34,88
36.05
37,23
38,41
39,59
40,76
41,94
0,08 i 744,4
754.0
763,8
773,6
783,4
793,3
803,3
1s
2,2582 2,2742 2,2898 2,3049 2,3198 2,3343 2,3486
[V
27,90
28.84
29,78
30,72
31,67
32,61
33,55
0,10 i 744,4
754,0
763,8
773,6
783,4
793,3
803,3
\s
2,2337 2,2497 2,2652 2,2804 2,2953 2,3098 2,3240
V
23,25
24.03
24,82
25,60
26,39
27,17
27,95
0,12 i 744,4
754,0
763,8
773,6
783,4
793,3
803,3
\s
2,2135 2,2295 2,2451 2,2603 2,2752 2,2897 2,3040
IrV
17,43
18,02
18,61
19,20
19,79
20,37
20,96
0,16 i 744,4
754,0
763,8
773,6
783,4
793,3
803,3
1,s
2,1819 2,1978 2,2133 2,2286 2,2435 2,2580 2,2722
IrV
13,95
14,42
14,89
15,36
15,83
16,30
16,77
0,20 i 744,4
754,0
763,8
773,6
783,4
793,3
803,3
1s
2,1573 2,1732 2,1887 2,2040 2,2189 2,2334 2,2476
|rV
11,62
12,02
12,41
12,80
13,20
13,59
13,98
0,24 i 744,3
754,0
763,8
773,6
783,4
793,3
803,3
1,s
2,1371 2,1531 2,1686 2,1839 2,1988 2,2133 2,2275
|rV
9,298
9,612
9,926 10,24
10,55
10,87
11,18
0,30 i 744,3
754,0
763,8
773,6
783,4
793,3
803,3
1,s
2,1124 2,1285 2,1441 2,1592 2,1741 2,1887 2,2030
|’V
6,971
7,207
7,443
7,679
7,916
8,151
8,387
0,40 i 744,3
753,9
763,7
773,5
783,3
793,2
803,2
1.s
2,0807 2,0968 2,1124 2,1276 2,1425 2,1571 2,1714
|rV
5,577
5,767
5,955
6,144
6,333
6,521
7,710
0,50 i 744,2
753,9
763,7
773,5
783,3
793,2
803,2
1
2,0560 2,0721 2,0876 2,1029 2,1177 2,1323 2,1467
IrV
4,646
4,804
4,961
5,118
5,277
5,434
5,591
0,60 i 744,1
753,8
763,6
773,4
783,3
793,2
803,2
1„s
2,0359 2,0519 2,0675 2,0827 2,0976 2,1122 2,1265
1rV
3,982
4,117
4,252
4,388
4,522
4,657
4,792
0,70 | i 744,1
753,8
763,6
773,4
783,2
793,1
803,1
2,0189 2,0349 2.0504 2,0657 2,0806 2,0951 2,1094
ТАБЛИЦЫ
433
Продолжение табл. 7
460°
480°
500°
520°
550°
600°
700°
t
/p
кГ/см'1
68,98
70,86
72,74
74,62
77,45
82,17
91,58
V\
813,3
823,4
833,6
843,8
859,3
885,5
938,9
i 0,05
2,4146 2,4283 2,4417 2,4550 2,4745 2,5057 2,5637 s J
57,48
59,05
60,62
62,18
64,55
68,47
76,32
V)
813,3
823,4
833,6
843,8
859,3
885,5
938,9
i 0,06
2,3945 2,4082 2,4217 2,4349 2,4544 2.4836 2,5436 s 1
43,12
44,30
45,47
46,65
48,41
51,35
57,24
V\
813,3
823,4
833,6
843,8
859,3
885,4
938.9
i }0,08
2,3626 2,3764 2,3899 2,4031 2,4226 2,4539 2,5119 s I
34,49
35,43
36,38
37,32
38,73
41,08
45,79
V1
813 3
823,4
833,6
843,8
859,3
885,4
938,9
i 0,10
2,3381 2,3519 2,3654 2,3786 2,3980 2,4293 2,4873 s J
28,74
29,52
30,31
31,10
32,27 34,24
38,16
V\
813,3
823,4
833,6
843,8
859,3
885,4
938,9
i 0,12
2,3181 2,3318 2,3453 2,3585 2,3780 2,4092 2,4672 s 1
21,54
22,13
22,72
23,31
24,20
25,68
28,62
V\
813,3
823,4
833,6
843,8
859,3
885,4
938,9
i J0,16
2,2863 2,3001 2,3137 2,3271 2,3466 2,3775 2,4355 s J
17,23
17,70
18,17
18,64
19,35
20,54 22,89
V1
813,3
823,4
833,6
843,8
859,3
885,4
938,9
i >0,20
2,2617 2,2755 2,2891 2,3025 2,3220 2,3529 2,4109 s J
14,37
14,76
15,16
15,55
16,14
17,12
19,08
V1
813,3
823,4
833,6
843,8
859,3
885,4
938,9
i 0,24
2,2416 2,2554 2,2690 2,2824 2,3019 2,3329 2,3908 s J
11,50
11,81
12,12
12,44
12,91
13,69
15,262 V 1
813,3
823,4
833,6
843,8
859,3
885,4
938,9
i 0,30
2,2171 2,2309 2,2445 2,2579 2,2773 2,3082 2,3662 s J
8,623
8,858
9,093
9,329
9,682 10,269 11,446 V 1
813,2
823,4
833,6
843,8
859,3
885,4
938,9
i 0,40
2,1855 2,1993 2,2128 2,2261 2,2456 2,2765 2,3345 s )
6,898
7,087
7,275
7,464
7,746
8,215
9,157 V |
813,2
823,3
833,5
843,7
859,3
885,4
938,8
i 0,50
2,1607 2,1745 2,1880 2,2014 2,2209 2,2519 2,3099 s 1
5,750
5,906
6,063
6,220
6,454
6,846
7,630
V)
813,2
823,3
833,5
843,7
859,2
885,4
938.8
i 0,60
2,1495 2,1542 2,1678 2,1811 2,2007 2,2318 2,2899 s J
4,927
5,061
5,196
5,331
5,532
5,867
6,5.40 V )
813,1
823,3
833,5
843,7
859,2
885,3
938,8
l 0.70
2,1235 2,1372 2,1508 2,1641 2,1837 2,2148 2,2728 s
28 Зак. 3543. В. С . Жуковский.
434
тлвлицы
N4
t
PN.
к Г!см? \
C
o
4
1
340°
360°
380°
8
o
420°
440°
ft;
3,482
3,601
3,720
3,838
3,956
4,074
4,191
0,80 i 744,0
753,7
763,5
773,3
783,2
793,1
803,1
\S
2,0039 2,0199 2,0856 2,0508 2,0657 2,0803 2,0946
[v
3,095
3,200
3,305
3,410
3,515
3,620
3,725
0.90 < i 743,9
753,6
763.4
773,2
783,2
793,1
803.1
\S
1,9908 2,0063 2.0226 2,0377 2,0526 2,0671 2,0813
(V
2,784
2,880
2,975
3,068
3,163
3,257
3,352
1,0 { i 743,9
753,6
763,4
773,2
783,1
793,1
803,1
\s
1,9800 1,9961 2,0118 2,0271 2,0421 2,0568 2,0711
(v
2,320
2,399
2,478
2,556
2,635
2,713
2,792
1,2 { i 743,8
753,5
763,3
773,1
783,0
793,0
803,0
1$
1,9598 1,9759 1,9916 2,0069 2,0218 2,0365 2,0509
(V
1,987
2,056
2,123
2,190
2,258
2,325
2,393
1,4 i 743,6
753,4
763.2
773,0
783,0
793,0
803,0
\S
1,9426 1,9587 1,9744 1,9898 2,0048 2,0194 2,0337
[V
1,738
1,798
1,857
1,916
1,975
2,034
2,093
1,6 { i 743,5
753,3
763,1
773,0
782,9
792,9
802,9
1s
1,9276 1,9439 1,9596 1,9749 1,9899 2,0046 2,0189
(V
1,545
1,598
1,650
1,702
1,755
1,807
1,860
1,8 i 743,4
753,2
763,0
772,9
782,8
792,8
802,8
\s
1,9145 1,9308 1,9465 1,9618 1,9768 1,9915 2,0058
(V
1,390
1,437
1,485
1,532
1,579
1,627
1,674
2,0 { i 743,3
753,1
762,9
772,8
782,7
792,7
802,7
1,9027 1,9190 1,9349 1,9503 1,9652 1,9799 1,9942
(v
1,111
1,149
1,187
1,225
1,263
1,301
1,339
2,5 l 743,1
752,9
762,6
772,6
782,5
792,5
802,5
\s
1,8778 1,8941 1,9100 1,9255 1,9406 1,9553 1,9696
iv
0,9243 0,9563 0,9882 1,020
1,052
1,083
1,115
3,0 | / 742,8
752,6
762,5
772,4
782,4
792,4
802,4
l5
1,8572 1,8737 1,8895 1,9051 1,9202 1,9349 1,9492
[v
0,6917 0,7158 0,7398 0,7637 0,7875 0,8114 0,8352
4,0 i 742,3
752,2
762,1
772,0
782,0
792,0
802,1
\s
1,8249 1,8412 1,8574 1,8730 1,8881
1,9029
1,9173
[v
0,5521 0,3715 0,5908 0,6101 0,6294 0,6485 0,6676
5,0 i 741,7
751,6
761,6
771,6
781,6
791,6
801,8
\s
1,7997 1,8161
1,8322 1,8479 1,8632 1,8780 1,8924
[v
0,4591 0,4753 0,4915 0,5077 0,5237 0,5398 0,5558
6,0 { i 741,2
751,1
761,1
771,1
781,2
791,3
801,5
1,7786 1,7953 1,8113 1,8271
1,8424 1,8574 1,8719
(V
0,3926 0,4066 0,4206 0,4345 0,4483 0,4621 0,4759
7,0 i 740,5
750,6
760,7
770,8
780,9
791,0
801,2
\s
1,7610 1,7776 1,7939 1,8097 1,8252 1,8402 1,8547
ТАВЛИЦЫ
435
Продолжение табл. 7
О
8
480°
500°
520°
С
л
С
л
о
о
600°
700°
/P
Kl'fCMa
4,309
4,427
4,545
4,663
4,840
5,134
5,722 V \
813,1
823,3
833,5
843,7
859,2
885,3
938,8
i }0,80
2,1086 2,1224 2,1360 2,1494 2,1690 2,2001 2,2581 S 1
3,830
3,936
4,040
4,145
4,302
4,563
5.086
V
813,1
823,2
833,4
843,6
859,2
885,3
938,8
i >0,90
2,0954 2,1092 2,1228 2,1362 2,1558 2,1871 2,2451 s J
3,446
3,540
3*635
3,729
3,871
4.107
4,578 v '1
813,1
823,2
833,4
843,6
859,2
885,3
938,8
ih,o
2,0851 2,0988 2,1123 2,1254 2,1446 2,1755 2,2335 s .I
2,871
2,950
3,028
3,107
3,225
3,422
3,814 v 'l
813,0
823,2
833,4
843,6
859,1
885,3
938,8
i !,2
2,0649 2,0786 2,0921 2,1053 2,1245 2,1554 2,2134 s .(
2,460
2,528
2,595
2,662
2,765
2,933
3,269 v '|
813,0
823,1
833.3
843,5
859,1
885,2
938,7
iU
2,0476 2,0613 2,0747 2,0879 2,1072 2,1384 2,1964 s 1
2,152
2,211
2,270
2,330
2,418
2,566
2,860
V1
812,9
823,1
833,3
843,5
859,0
885,2
938,7
i 11,0
2,0328 2,0464 2,0600 2,0732 2,0924 2,1236 2,1816 s t1
1,913
1,965
2,018
2,071
2,150
2,281
2,542 v I1
812,8
823,0
833,2
843,4
859,0
885,1
938,6
i 1,8
2,0198 2,0335 2,0469 2,0601 2,0794 2,1106 2,1686 s J1
1,721
1,768
1,815
1,864
1,935
2,052
2,288 v }1
812,8
823,0
833,2
843,4
858,9
885,1
938,6
i 2,0
2,0081 2,0218 2,0352 2,0484 2,0678 2,0989 2,1570 s \1
1,377
1,415
1,453
1,490
1,547
1,641
1,830
v1I
812,7
822,9
833,1
843,3
858,8
885,0
938,6
i 2,5
1,9837 1,9975 2,0109 2,0241 2,0434 2,0743 2,1324 s ,1
1,147
1,178
1,210
1,242
1,288
1,368
1,5250 v 1I
812,5
822,7
832.9
843,1
858,7
884,9
938,5
l 3,0
1,9633 1,9771 1,9906 2,0039 2,0232 2,0541 2,1122 S j1
0,8590 0,8828 0,9066 0,9304 0,9660 1,025
1,1434 V }1
812,3
822,5
832,7
842,9
858,5
884.8
938,4
i 4,0
1,9314 1,9452 1,9587 1,9720 1,9913 2,0223 2,0804 s J1
0,6867 0,7058 0,7248 0,7439 0,7724 0,8198 0,9145 v }I
812,0
822,2
832,4
842,7
858,3
884,6
938,2
i 5,0
1,9055 1,9204 1,9339 1,9472 1,9665 1,9976 2,0558 s J1
0,5717 0,5876 0,6036 0,6194 0,6431 0,6829 0,7618 v 1|
811,7
821,9
832,2
842,5
858,1
884,4
938,1
/ 6,0
1,8860 1,8999 1,9135 1у9268 1,9463 1,9773 2,0356 S J1
0,4896 0,5033 0,5169 0,5306 0,5510 0,5851 0,6528 V \1
811,4
821,6
831,9
842.3
857,9
884,2
938,0
i 7,0
1,8688 1,8827 1,8963 1,9096 1,9291 1,9602 2,0185 s J1
28*
436
ТАБЛИЦЫ
р^
кГ/см*
t
320°
340°
360°
380°
400°
420°
440°
[V
0,3429
0,3552
0,3674
0.3796
0,3918
0,4039
0,4159
8,0{i
740,0
750,2
760,3
770,4
780,5
790,7
800,9
\s
1,7455
1.7622
1,7787
1,7946
1,8101
1,8251
1,8396
(V
0,3040
0,3150
0,3260
0,3369
0,3477
0,3586
0,3693
9,0 i
739,5
749,7
759,8
769,9
780,1
790.3
800,5
1s
1,7318
1,7486
1,7651
1,7810
1,7965
1,8116
1,8262
<V
0.2731
0,2831
0,2930
0,3029
0,3126
0,3223
0.3321
10i
738,9
749,1
759,3
769.5
779,7
789.9
800,1
\s
1,7195
1,7364
1,7530
1,7690
1,7845
1,7996
1,8143
,
|V
0.2265
0,2350
0,2432
0,2515
0,2599
0,2680
0,2761
12i
737,7
748,1
758.3
768,6
778,9
789.1
799,5
1s
1,6979
1,7150
1,7316
1,7478
1,7635
1,7787
1,7935
1 V ____0,1933
0,2007
0,2079
0,2150
0,2222
0,2291
0,2363
и
i
736.5
747,0
757,4
767,8
778,2
788,5
798,9
\s
1,6793
1.6966
1,7136
1,7300
1,7458
1,7611
1,7760
1V
0,1683
0,1749
0,1813
0,1876
0,1939
0,2001
0,2063
ш
i
735,4
746,0
756,5
767,0
777,4
787,8
798,2
1ks
1,6630
1,6807
1,6978
1,7144
1,7304
1,7459
1,7608
1rV
0,1490
0,1548
0,1606
0,1663
0,1719
0,1773
0,1829
18i
734,2
744,9
755.5
766,1
776,6
787,1
797,6
1Ls
1,6484
1,6663
1,6836
1,7002
1,7163
1,7318
1,7468
„
1fv
0,1334
0,1388
0,1440
0,1492
0,1543
0,1593
0,1642
20
i
733,1
743,9
754,6
765,2
775,8
786,3
796,9
115
1,6354
1,6534
1,6708
1.6875
1,7037
1,7192
1,7343
„„
IrV
0,1055
0,1098
0,1142
0.1184
0,1225
0,1267
0.1308
25
i 730,1
741,2
752,2
763,1
773,9
784,7
795,4
I1s
1,6070
1,6254
1,6432
1,6604
1,6770
1,6928
1,7081
IrV
0,08680
0,09058
0,09426
0,09787
0,1014
0,1049
0,1084
30\i 727,0
738,4
749,6
760,8
771,9
782,9
793,7
1
1,5826
1,6018
1,6202
1,6376
1,6544
1,6705
1,6861
|fV
0,07346
0,07680
0,08004
0,08321
0,08632
0,08938
0,09239
35|i 723,6
735,6
747,1
758,5
769,8
781,0
792,0
1i^
1,5615
1,5812
1,6000
1.6180
1,6352
1,6516
1.6674
|rV
0,06339
0,06642
0,06935
0,07220
0 07498
0,07771
0,08039
40|i
720,2
732,6
744,5
756,2
767,8
779,1
790,3
\ks
1,5424
1,5631
1,5824
1.6007
1,6181
1,6348
1.6508
|rV
0,05556
0,05835
0,06103
0,06363
0,06616
0,06863
0,07106
45 {i 716,3
729,5
742,0
753.9
765,7
777.4
788,7
1
1,5250
1,5462
1,5651
1,5849
1,6027
1.6197
1,6360
IГv
0.04927
0,05187
0,5436
0,05676
0,05909
0.06136
0,06358
50 1i 712,9
726,5
739,4
751,7
763,6
775,4
786,9
,s
1,5087
1,5307
1,5511
1,5703
1,5885
1,6059
1,6225
ТАБЛИЦЫ
437
Продолжение табл. 7
460°
480°
500°
520°
550°
600°
о
о
'
P
кI'/cm*
0,4280 0,4400 0,4519 0,4639 0,4819 0,5117
1
0,5710 v 11
811,1
821,3
831,7
842,1
857,7
884,1
937,9
/\8,0
1,8537 1,8676 1,8812 1,8946 1,9141
1,9453 2,0037 5 j1
0,3800 0,3907 0,4014 0,4121 0,4280 0,4546 05074 v 1I
810,8
821,1
831,5
841,9
857,5
883,9
937,7
9,0
1,8405 1,8545 1,8681 1,8815 1,9010 1,9322 1,9906 5 J1
0,3417 0,3515 0,3611 0,3707 0,3851 0,4090 0,4566 V }I
810,4
820,8
831,2
841,6
857,3
883,7
937,6
i10
1,8286 1.8426 1,8563 1,8697 1,8892 1,9204 1,9789 s J1
0,2842 0.2925 0,3005 0,3086 0,3205 0,3405 0,3802 V '|
809,9
820,3
830,7
841,1
856,9
883,4
937,4
i12
1,8080 1,8221 1,8358 1,8492 1,8688 1,9001 1,9586 s .1
0,2433 0,2501 0,2572 0,2641 0,2745 0,2916 0,3257 V 1
809,3
819.7
830,2
840,6
856,5
883,0
937,1
i14
1,7905 1,8046 1,8184 1,8319 1,8415 1,8828 1,9414 s .1
0,2125 0,2186 0,2247 0,2308 0,2399 0,2549 0,2848 V |
808,7
819,1
829,7
840,1
856,0
882,6
936,8
i16
1,7753 1,7894 1,8032 1,8167 1,8364 1,8677 1,9265 s )
0,1884 0,1939 0,1994 0,2048 0,2129 0,2264 0,2531 V \
808,1
818,6
829,2
839,7
855,6
882,3
936,6
i18
1,7613 1,7755 1,7894 1,8030 1,8228 1,8545 1,9133 s J
1,1692 0,1743 0,1792 0,1841 0,1915 0,2036 0,2276 V )
807,5
818,1
828,7
839,3
855,2
881,9
936,3
i V20
1,7490 1,7633 1,7772 1,7909 1,8109 1,8426 1,9016 s J
0,1348 0,1388 0,1428 0,1468 0,1527 0,1625 0,1818 V )
806,1
816,8
827.4
838,1
854,2
881,0
935,6
i25
1,7229 1,7373 1,7514 1,7652 1,7853 1,8172 1,8766 s J
0,1118 0,1152 0,1185 0,1219 0,1269 0,1351 0,15130 V ) о
804,5
815,3
826.1
836,9
853,1
880,2
935,0
i 1зо
1,7012 1,7158 1,7301 1,7441
1,7645 1,7964 1,8558 s J
0,09536 0,09830 0,1012 0,1041 0,1084 0,1155 0,12949 V |
803,0
813,9
824,8
835,7
852,0
879,3
934,3
i >35
1,6825 1,6972 1.7116 1,7257 1,7461 1,7786 1,8383
sJ
0,08303 0,08564 0,08822 0,09078 0,09458 0,1008 0,11313 V 1
801,5
812,5
823,5
834,5
851,0
878,4
933,7
i }40
1,6661 1,6810 1.6955 1,7097 1,7304 1,7631 1,8231 s )
0,07344t 0,07579 0,07811 0,08041 0,08382: 0,08942 0,10041 V )
799,9
811,1
822,2
833,3
849,9
877,5
933,1
i45
1,6518 1,6669 1,6816 1,6959 1,7166 1,7494 1,8096
sJ
0,06575i 0,06789l 0,07001 0,072101 0,07520l 0,08028 0,09023 V ]
798,3
809,7
820,9
832,1
848,8
876,6
932,4
i }50
1,6384 1,6538 1,6687 1,6832 1,7042 1,7370 1,7975 s J
438
1'АВЛИЦЫ
Р4
KVjcM*
о
О
340°
360°
380°
о
о
г
о
о
о
440°
V
0,03976 0.04212 0 ,04432 0 ,04644 0 ,04848 0 ,05045 0,05236
60|i 705,2
720,1
733,9
746,9
759,3
771,5
783,4
IS
1,4788
1,5030
1,5245
1,5447
1,5636
1,5816
1,5988
V
0,03287 0,03511 0,03714 0,03905 0,04088 0 ,04264 0 ,04433
70|i 797,1
713,3
728,0
741,8
754,8
767,4
779,8
ls
1,4510
1,4773
1,5007
1,5220
1,5417
1,5602
1,5777
fV
0,02759 0,02977 0,03170 0,03348 0 ,03516 0,03676 0,03830
80|i 688,1
706,1
721,9
736,5
750,3
763,4
776,1
ls
1*4239
1,4535
1,4789
1,5013
1,5217
1,5408
1,5590
\V
0,02336 0 ,02554 0,02745 0,02914 0 ,03070 0,03218 0 ,03360
90 i 667,7
698,2
715,4
731,0
745,5
759,1
772,4
\s
1,3968
1,4302
1,4579
1,4818
1,5033
1,5232
1,4521
[V
0,01988 0,02210 0,02397 0,02562 0,02711 0,02851 0,02984
100 i 666,0
689,4
708,6
725,3
740,6
754,9
768,6
ls
1,3688
1,4071
1,4376
1,4632
1,4858
1,5066
1,5263
fV
1,495
0,01679 0,01870 0,02027 0,02168 0 ,02297 0,02417
120 I i 348,8
669,1
692,8
712,7
730,1
745,9
760,7
ls
0,8225
1,3594
1,3978
1,4282
1,4537
1,4765
1,4975
[V
1,481
0,01253 0,01471 0,01637 0,01775 0,01896 0 ,02008
140 i 347,5
642,8
674,5
698,7
718,7
736,3
752,4
ls
0,8189
1,3055
1,3563
1,3935
1,4234
1,4487
1,4713
rV
1,468
1,621
0,01154 0,01332 0 ,01471 0,01591 0,01699
160 | i 346.4
379,4
651,8
682,4
706,0
725,8
743,6
ls
0,8159
0,8708
1,3112
1,3584
1,3934
1,4222
1,4468
iV
1,457
1,596
0,00862 0 ,01082 0 ,01231 0 ,01351 0,01456
180 | i 345,5
376,9
620,3
663,6
691,8
714,7
734,2
ls
0.8133
0,8654
1,2543
1,3218
1,3643
1,3967
1,4235
(V
1,446
1,573
1,841
0,00870 0,01033 0 ,01156 0,01259
200 | i 344,7
375,0
416,6
640,3
675,8
702,2
724,1
1s
0,8109
0,8611
0,9280
1,2780
1,3334
1,3706
1,4007
(V
1,436
1,554
1,768
0,00662 0,00862 0 ,00993 0 ,01097
220 | i 344,2
373,5
411,0
606,7
657,5
688,6
711,8
ls
0,8087
0,8575
0,9179^ _
1,2215
1,2981
1,3445
1,3778
(V
1,427
1,538
1,722
0,00370 0,00708 0,00851 0,00959
240 i 343,6
372,2
407,3
564,2
633,9
673,5
701,5
ls
0,8065
0,8544
0,9108
1,0945
1,2604
1,3180
1,3559
1V
1,403
1,497
1,635
0,00190 0 ,00307 0,00520 0,00645
300 i 342
369,1
400,2
440,9
517,8
603,3
658,8
ls
0,8002
0,8456
0,8958
0,9580
1,0851
1,2206
1,2833
ТАБЛИЦЫ
439
Продолжение табл. 7
460°
480°
500°
520°
550°
600°
700е
t
'
P
кГ!см9
0,05423 0,05606 0,05787 0,05966 0,06229 0,06658 0,07497 V }
795.2
806,8
818,3
829,7
846,7
874,7
931,2
i
60
1,6152 1,6308 1,6459 1,6606 1,6819 1,7153 1,7763 s J
0,04598 0,04760 0,04919 0,05075 0,05305 0,05680 0,06406 V \
791,9
803,8
815,6
827,3
844,5
873,0
929,8
i|70
1,5943 1,6104 1,6259 1,6410 1,6628 1,6968 1,7584 s J
0,03979 0.04124 0,04267 0,04407 0,04612 0,04944 0,05588 V \
788,6
800,9
812,9
824,7
842,2
871,1
928,4
i180
1,5764 1,5930 1,6088 1,6241 1,6460 1,6805 1,7426 s J
0,03497 0,03630 0,03760 0,03887 0,04073 0,04373 0,04952 V
785,3
797,8
810,1
822,2
840,0
869,3
927,1
i[90
1,5601 1,5772 1.5934 1,6089 1,6310 1,6659 1,7286 s J
0,03111 0,03234 0,03354 0,03471 0,03641 0,03916 0,04443 V \
781,9
794,8
807,3
819,6
837,7
867,4
925,8
i}100
1,5419 1,5624 1,5789 1,5946 1,6173 1,6526 1,7159 s I
0,02530 0,02639 0,02744 0,02847 0,02994 0,03230 0,03679 V \
774,8
788,4
801,5
814,4
833,2
863,6
923,1
i >120
1,5170 1,5353 1,5527 1,5693 1,5929 1,6292 1,6937 s J
0,02114 0,02213 0,02306 0,02397 0,02529 0,02739 0,03133 V ]
767,4
781,7
795,6
809,0
828,4
859,8
920,3
i >140
1,4921
1,5115 1,5298 1,5471 1,5715 1,6088 1,6746 s J
0,01798 0,01890 0,01977 0,02061 0,02181 0,02370 0,02723 V \
759,7
774,9
789,5
803,5
823,6
855,9
917,6
i >160
1,4689 1.4895 1,5087 1,5267 1,5522 1,5907 1,6577 s J
0,01551 0.01638 0,01720 0,01797 0,01909 0,02083 0,02404 V
751,6
767,8
783,2
797,8
818,7
851,9
914,8
i}180
1,4474
1.4690 1,4893 1,5084 1,5348 1,5743 1,6425 s J
0,01352 0,01436 0,01514 0,01587 0,01692 0,01854 0,02150 V )
743,2
760,6
776,7
791,9
813,7
847,8
911,9
i [200
1,4266 1,4499 1,4713 1,4911
1,5184 1,5592 1,6287 s J
0,01186 0,01267 0,01341 0,01411 0,01512 0,01666 0,01941 V
732,3
750,9
767,9
783,9
806,5
841,6
909,0
i }220
1,4058 1,4306 1,4527 1,4729 1,5005 1,5422 1,6160 s 1
0,01052 0,01134 0,01206 0,01271 0,01364 0,01509 0,01767 V
724,9
744,9
763,1
779,7
803,3
839,6
906,2
i }240
1,3866 1,4132 1,4367 1,4588 1,4881 1,5318 1,6041 s J
0,00743 0,00825 0,00895 0,00957 0,01039 0,01167 0,01388 V )
693,7
719,8
741,6
760,9
787,3
827,0
897,7
i }300
1,3266 1,3608 1,3892 1,4141
1,4477 1,4958 1.5725 s j
Редактор В . Т. Хозяинов.
Техн. редактор Я . А . ТуМаркина.
Корректор А . С . Каган.
★
Подписано к печати 25/VIII 1952 г. Т-02168.
Объем 14,5 бум. л. 27,5 печ. л. + 2 вкладки.
32,3 уч.-изд. л. 43 812 тип. зн. в печ. л. Тираж 15 000 экз.
Цена 9 р. 70 к. Переплет 1 р. Зак. No 3543.
¥
4 тип. им. Ев. Соколовой Главполитрафиздата
при Совете Министров СССР . Ленинград,
Измайловский, 29.
ДИАГРАММА No 1
200 300 400 500 600 700 800 900 1000 1100 1200 1300ккал/нм3
ОА 3' 0J5
0,9 к кал/нм3град
В. С. Жуковский. Техническая термодинамика.
Э
н
т
а
л
ь
п
и
я
l
K
K
O
J
i
j
k
r
Диаграмма N2
Ю
2J
1,7
J,8
Энтропия S, ккал!кГ •град
Опечатки
Стр. Строка
Напечатано
Следует читать
19
14 сн.
термодинамических
термодинамического
признаков
анализа
64
21 св.
*(*. V).
i(t,P).
84
13 сн.
(1.30)
(1.31)
98
14«
стр. 94
стр. 92
100
7 св.
2 GiCv{
ПО
19«
см. (1.8)
см. пункт 1.7
126
8«
(И. 26)
(И. 50а, 51а, 52а)
129
7 сн.
—
v\k
—
vjn
132
19
0
const
164
16 св.
i—s
Г—S
260
1
(R'-R)p
(R'-R)lP
262 Рис.82,б
Надпись ^пер не читать.
265
15 св.
—
Av(p.,— pt)
=h—h
—
Av(Рг—Pi)
333
15«
I
I
O
*
.
H
k
l
386
7«
щ
®0mai
Зак. 3543.
ГОСУДАРСТВЕННОЕ ИЗДАТЕЛЬСТВО
ТЕХНИКО-ТЕОРЕТИЧЕСКОЙ ЛИТЕРАТУРЫ
195 2