Автор: Лурия С. Дарнелл Дж.
Теги: биология клетки и субклеточных частиц цитология медицина вирусология
Год: 1970
Текст
С.Лурия, Дж. Дарнелл
ОБЩАЯ
ВИРУСОЛОГИЯ
ИЗДАТЕЛЬСТВО
«МИР»
GENERAL VIROLOGY
SECOND EDITION
S. E. LURIA
Sedgwick Professor of Biology
Massachusetts Institute of Technology
Cambridge, Massachusetts
JAMES E. DARNELL, Jr.
Professor of Biochemistry and Cell Biology
Albert Einstein College of Medicine
New York, New York
JOHN WILEY & SONS, INC.
New York, London, Sydney
1968
С. Лурия, Дж. Дарнелл
ОБЩАЯ
ВИРУСОЛОГИЯ
Перевод со второго английского издания Л. Б. Меклера
Под редакцией
и с предисловием
д-ра мед. наук Ю. 3. Гендона
ИЗДАТЕЛЬСТВО «МИР» МОСКВА 1970
УДК 576.858
Книга представляет собой ценнейшее руководство по об-
щей вирусологии. В ней очень полно рассмотрены современные
концепции учения о вирусах, свойства вирусов и методы их
изучения, химия и серология вирусных частиц, влияние на них
различных физических и химических факторов, взаимодействие
вирусов животных и растений с клеткой-хозяином и организ-
мом, генетика и радиобиология бактериофага, лизогения, опу-
холеродные вирусы и т. д.
Предназначена для студентов и преподавателей медицин-
ских, сельскохозяйственных и педагогических институтов и био-
логических факультетов университетов, а также для научных
работников всех биологических и медицинских специальностей.
Редакция биологической литературы
2-10-2
104-70
ПРЕДИСЛОВИЕ К РУССКОМУ ИЗДАНИЮ
Со времени первого издания книги С. Лурия «Общая вирусология»
прошло более 15 лет. Появление этой книги было огромным событием
для того времени, ибо автор ее — один из крупнейших специалистов в об-
ласти вирусологии, ныне лауреат Нобелевской премии — впервые обоб-
щил все накопившиеся к тому времени сведения о вирусах и наметил
дальнейшие пути развития этой науки. Труд С. Лурия стал настольной
книгой как начинающего исследователя, так и маститого ученого; по этой
книге учились студенты, ее цитировали в научных статьях. Вполне воз-
можно, что многие из известных ныне вирусологов избрали своей спе-
циальностью именно этот раздел биологии под влиянием книги С. Лурия.
Второе издание книги «Общая вирусология», написанной С. Лурия
совместно с Дж. Дарнеллом, вышло в свет в 1968 г., т. е. через 15 лет
после первого издания. Это был период исключительных успехов вирусо-
логии как в практическом, так и в теоретическом отношении. Именно
в это время благодаря созданию высокоактивных вакцин против полио-
миелита заболевание это удалось ликвидировать в ряде стран мира.
Поистине фантастические успехи были достигнуты в области молекуляр-
ной биологии и генетики вирусов. Достаточно вспомнить лишь такие
выдающиеся открытия, как расшифровка генетического кода, выяснение
молекулярных механизмов изменчивости, тонкой структуры гена и др.
За этот период был открыт ряд новых вирусов, получило исключитель-
ное развитие изучение вирусов позвоночных, огромное внимание исследо-
вателей привлекли опухолеродные вирусы. В результате вирусология из
скромного раздела микробиологии превратилась в самостоятельную нау-
ку, охватывающую глубокие и принципиальные вопросы, имеющие обще-
биологическое значение. Естественно поэтому, что второе издание этой
книги, в котором глубоко и всесторонне освещаются современные проб-
лемы вирусологии, в сущности написано заново.
В научной литературе не так уж много книг, принадлежащих перу
крупных ученых, в которых строго научная трактовка сложнейших проб-
лем сочетается с доступностью изложения. Настоящая книга написана
в такой форме, что ее с захватывающим интересом прочитает и мало-
подготовленный читатель и квалифицированный специалист; в каждой
главе, помимо последовательного и глубокого изложения данных, можно
найти оригинальные обобщения и критические построения, касающиеся
не только вирусологии, но и генетики, молекулярной биологии, цитоло-
гии и даже физики.
В отличие от многих узко специализированных монографий в книге
С. Лурия и Дж. Дарнелла отобраны и систематизированы наиболее зна-
чительные данные, касающиеся проблем общей вирусологии в целом,
причем эти проблемы рассматриваются под единым углом зрения.
За время, прошедшее с момента выхода в свет второго издания, ряд
разделов вирусологии развился в еще большей степени, были разрешены
5
6
Предисловие к русскому изданию
некоторые неясные вопросы, а некоторые казавшиеся бесспорными поло-
жения пришлось пересмотреть заново. Естественно, что многие работы,
появившиеся в последнее время, не нашли отражения в книге, но мы не
сочли нужным снабжать перевод многочисленными примечаниями, ибо
главная ценность этой книги в том, что она знакомит широкий круг чита-
телей с основными и принципиальными положениями общей вирусо-
логии.
Нет сомнения, что книга будет весьма полезна всем читателям, инте-
ресующимся вирусологией, начиная от студента и кончая академиком,
ибо каждый может найти в ней для себя исключительно интересные
страницы.
Главы I, IV и VII переведены А. В. Реуновым; вся остальная кни-
га — Л. Б. Меклером.
Ю. ГЕНДОН
ИЗ ПРЕДИСЛОВИЯ АВТОРОВ КО ВТОРОМУ
АНГЛИЙСКОМУ ИЗДАНИЮ
Первое издание этой книги вышло в свет к концу 1953 г.— года, став-
шего свидетелем ряда блестящих достижений вирусологии. После того
как в 1952 г. Херши и Чейз выяснили, что главную роль в заражении
бактерии фагом играет его нуклеиновая кислота, природа первичного
генетического материала была, наконец, установлена неопровержимо.
Этим материалом, действительно, оказалась ДНК, о чем убедительней-
шим образом свидетельствовали еще результаты исследований Эвери и
его сотрудников по трансформации бактерий. Таким образом, эра, в те-
чение которой химическая природа гена оставалась неизвестной, завер-
шилась, и наступила новая эра развития биологии — эра молекулярной
биологии, т. е. изучения функциональной организации клеток и организ-
мов в терминах и понятиях структуры, свойств, ассоциаций и динамиче-
ского взаимодействия специфических видов молекул. Начало эре молеку-
лярной биологии положила модель строения ДНК в виде двойной спи-
рали, предложенная в 1953 г. Уотсоном и Криком.
Сильно стимулировали развитие вирусологии и два других события,
происшедших в том же 1953 г. Во-первых, Виатт и Коэн открыли новое
пиримидиновое основание, оксиметилцитозин, и показали, что это осно-
вание является одним из главных компонентов некоторых бактериофагов
и тем самым представляет собой уникальный инструмент для биохими-
ческого анализа биосинтеза и репликации фаговой ДНК. Во-вторых,
Дульбекко, используя разработанный Эрлом и Эндерсом способ выра-
щивания вирусов животных в клетках культуры тканей, предложил ме-
тод титрования выращиваемых на таких клетках вирусов животных,
основанный на подсчете числа бляшек. Это позволило перенести точные
количественные методы биологического анализа, разработанные для изу-
чения фагов, на исследования с вирусами животных.
Эти события повлекли за собой столь бурное развитие вирусологии
во всем мире, какое редко наблюдалось в истории биологии. Одно из
следствий этого стремительного развития состояло в том, что первое
издание этой книги начало устаревать, едва успев выйти в свет. Некото-
рым утешением автору служит надежда, что, быть может, пробудив
интерес к изучению вирусов и являясь полезным пособием для обуче-
ния, эта книга в известной мере сама помогла себе устареть.
Непрерывное ускорение развития вирусологии начиная с 1953 г.
крайне затруднило пересмотр книги и подготовку нового издания. Когда
авторы решили, что книгу безусловно следует переиздать (хотя остава-
лось неясным, удастся ли с этим справиться), перед ними встала проб-
лема отбора материала для такой книги. Будучи учебником, она должна
была оставаться небольшой по объему, не становясь при этом слишком
компактной. Следовало решить, какую роль должна будет играть эта
книга при чтении курса вирусологии. При написании первого издания
имелось в виду включить в него главным образом материал, соответст-
7
8
Из предисловия авторов ко второму английскому изданию
вующий полугодовому курсу вирусологии (или по крайней мере мате-
риалу, который автор излагал в то время в таком курсе). Настоящая
книга, сохранив относительно неизменную структуру первого издания,
весьма отличается от него по широте рассматриваемого материала. Мы
задумали создать книгу, которая бы содержала основные сведения о ви-
русах, необходимые студентам, но в то же время могла бы служить не-
ким остовом для чтения более специализированного курса, с тем чтобы
преподаватель на фоне материала, содержащегося в книге, мог посвя-
тить свои лекции детальному анализу более сложных или текущих
научных проблем.
Эти довольно тонкие различия в конечной цели заставили внести ряд
изменений в построение книги. Так, при составлении библиографии мы
не стремились сделать ее как можно более полной, а старались отобрать
лишь небольшое число классических исследований, статьи с изложением
основных методов исследования, и главным образом статьи обзорного
характера или же оригинальные новые работы, но такие, по которым
можно было бы проследить за всем развитием данной проблемы. Мы по-
нимаем, что нам не удавалось строго выдержать эти критерии. Оба ав-
тора сами активно работают в области вирусологии, и им трудно было
не поддаться искушению лишний раз обосновать собственные представ-
ления ссылками на те или иные источники, даже когда в этом и не было
особой необходимости. На отбор цитируемой литературы повлияли и
многие другие причины — случайность, особо яркое впечатление, остав-
шееся у авторов о некоторых оригинальных статьях, иногда неосведом-
ленность, иногда сознательное или подсознательное ощущение чувстви-
тельности некоторых авторов к вопросам приоритета. Поэтому мы при-
носим искренние извинения как за невольные пропуски, так и за вклю-
чение в библиографию некоторых работ, без которых можно было
обойтись.
С учебниками вирусологии на английском языке ситуация на се-
годня остается такой же, какой она была в 1953 г. Насколько нам изве-
стно, после первого издания этой книги ни одного учебника вирусологии
не появилось. Две книги, посвященные фагам — «Бактериофаги»
М. Адамса, вышедшая после смерти автора, и особенно «Молекулярная
биология вирусов бактерий» Г. Стента,— очень ценные книги, полезные
как для исследователей, эак и для преподавателей и студентов, однако
обе они посвящены только вирусам бактерий. Великолепная книга
Дж. Уотсона «Молекулярная биология гена», вероятно, может служить
самым подходящим предварительным чтением для подготовки к изуче-
нию нашей книги.
Мы надеемся, что второе издание «Общей вирусологии» поможет
поддержать репутацию вирусологии как науки, сочетающей в себе
«единство в разнообразии», которую вирусология приобрела благодаря
сознательному сочетанию сравнительного подхода с возможностями, соз-
даваемыми специфическим взаимодействием вирус — хозяин. Благодаря
этой своеобразной двойственности вирусологических исследований —
сочетания четко разработанных общих методов с чрезвычайным разно-
образием конкретных ситуаций, в которых эти методы можно приме-
нить,— едва ли можно найти такую проблему в области биологии клет-
ки, в разрешение которой изучение вирусов не могло бы внести фунда-
ментальный вклад.
С. Е. Лурия
Дж. Е. Дарнелл
Глава I
ВВЕДЕНИЕ. НАУКА ВИРУСОЛОГИЯ
ВИРУСОЛОГИЯ КАК БИОЛОГИЧЕСКАЯ НАУКА
Вирусология по праву стала теперь одной из основных биологиче-
ских наук. Подобно тому как в начале нашего века из некоторой важной,
но чисто практической области возникла микробиология как одна из от-
раслей биологии, так и в середине века вирусология превратилась в
определенную совокупность знаний и концепций со своими собственными
перспективами и путями развития. Возникнув вначале как ветвь пато-
логии — патологии человека и животных, с одной стороны, и фитопато-
логии — с другой,— вирусология достигла того уровня, когда ее прогресс
определяется логикой внутреннего развития в той же мере, как и требо-
ваниями практики.
Основным стимулом к становлению вирусологии явилось накопление
знаний о вирусах бактерий, или бактериофагах, и объединение изучения
бактериофагов с генетикой бактерий. Вирусологи, занимающиеся изуче-
нием вирусов животных и растений, при решении различных вирусоло-
гических проблем пытались использовать методы работы с фагами и
концепции, возникшие при исследовании этих объектов. Это способство-
вало облегчению контактов между вирусологами, которые стали более
плодотворными, доказательством чему служит преуспевание журнала
«Virology», основанного в 1955 г.
В это же время возникла новая отрасль биологии — молекулярная
биология, изучающая свойства, функции и организацию биологических
макромолекул. Вирусология стала составной частью молекулярной био-
логии, поскольку она изучает субклеточные объекты — вирусы, структура
и организация которых лежат на макромолекулярном уровне.
Что представляет собой вирусология сегодня? Основные биологиче-
ские науки можно классифицировать в соответствии с природой изучае-
мого ими предмета как описательные, интегративные и редукционист-
ские науки. Описательные науки, такие, например, как ботаника, мико-
логия, энтомология, ихтиология или маммология, характеризуются тем,
что изучаемый ими предмет представляет собой группу организмов, обра-
зующих определенную таксономическую единицу, т. е. имеющих общее
происхождение и историческое развитие. Интегративные науки — физио-
логия, экология, генетика — анализируют общие или специализирован-
ные свойства живых организмов в их динамических связях и превраще-
ниях. Редукционистские науки, как, например, биохимия и биофизика,
изучают элементарные процессы и функции организмов на уровне моле-
кул, атомов, электронов, представляющих собой мельчайшие единицы
материи.
РАЗЛИЧНЫЕ ОПРЕДЕЛЕНИЯ ВИРУСОВ
Отнести вирусологию к одному из трех приведенных выше подраз-
делений, на которые можно классифицировать биологические науки, не-
просто. Чтобы определить предмет, который изучает вирусология, т. е.
9
по
Глава I
вирусы, нельзя пользоваться теми обычными критериями, которые мы
применяем для определения животных или растений. Само по себе опре-
деление вируса несколько произвольно, и было предложено много ва-
риантов, что доказывает сложность задачи.
Львов [547] предложил определять вирусы как «строго внутрикле-
точные, потенциально патогенные агенты, обладающие инфекционной
фазой, содержащие лишь один тип нуклеиновой кислоты, репродуцирую-
щиеся в форме генетического материала, неспособные к росту и делению
и лишенные системы Липмана» (т. е. одной из ферментных систем, уча-
ствующих в производстве энергии). Это определение, справедливость
которого будет подтверждена в последующих главах, подчеркивает не-
клеточную природу вирусов, их зависимость от метаболизма клетки-хо-
зяина и тот факт, что на определенной стадии цикла репродукции специ-
фический материал вируса представлен одной только нуклеиновой кис-
лотой.
Согласно другому определению, вирусы рассматриваются как «эле-
менты генетического материала, которые могут детерминировать в клет-
ках, где они репродуцируются, биосинтез специфического аппарата, обес-
печивающего их проникновение в другие клетки» [536]. Это определение
подчеркивает в большей степени способность вирусов распространяться
из клетки в клетку, нежели отсутствие у них собственной метаболиче-
ской активности.
В первом издании этой книги (а это было время, когда природа
генетического материала еще окончательно не была установлена и когда
данные о его функции и репликации отсутствовали) нам казалось целе-
сообразным использовать чисто операциональное определение, т. е. та-
кое, которое ограничивалось бы перечислением критериев, дающих осно-
вание включать или не включать объекты в категорию вирусов. Приня-
тое тогда определение было таким: «Вирусы есть субмикроскопические
объекты, способные проникать в определенные живые клетки и репроду-
цироваться только внутри этих клеток». В настоящее время наиболее
приемлемым является следующее определение: «Вирусы — это объекты,
геном которых представлен нуклеиновой кислотой —ДНК или РНК; эта
нуклеиновая кислота репродуцируется в живых клетках и, используя их
синтетический аппарат, заставляет клетки синтезировать специализиро-
ванные частицы, или вирионы, содержащие геном вируса и способные
передавать его в другие клетки».
Все эти определения отражают два качества вирусов: во-первых, на-
личие у вируса собственного генетического материала, который внутри
клетки-хозяина ведет себя как часть данной клетки, и, во-вторых, суще-
ствование внеклеточной инфекционной фазы, представленной специали-
зированными частицами, или вирионами, которые репродуцируются в
клетке под генетическим контролем данного вируса и служат для введе-
ния генома вируса в другие клетки. Предложенные определения отли-
чаются друг от друга тем, какое место в них отводится другим свойст-
вам вирусов, таким, например, как субмикроскопические размеры вирус-
ных частиц (подразумевая под субмикроскопическими размерами
размеры менее 2000 А, что находится на пределе разрешения обычного
светового микроскопа) или патогенность — свойство вируса, без которого
невозможно установить его присутствие в клетке-хозяина. Патогенность
вирусов может быть либо явной, когда инфицированные клетки и орга-
низмы изменяются или разрушаются, либо скрытой, когда клетки сосу-
ществуют с геномом вируса на протяжении многих поколений без за-
метного фенотипического проявления. Все же вирус должен в конце кон-
цов вызвать изменение в синтетических процессах клетки, результатом
Введение
11
которого будет образование инфекционных вирусных частиц, или ви-
рионов.
Внутриклеточный паразитизм свойствен не только вирусам, но и
другим классам паразитов, в том числе некоторым бактериям, грибам
и простейшим. Однако в определениях вирусов подчеркивается особая
природа их паразитизма, который можно назвать паразитизмом на гене-
тическом уровне. Такие паразиты, как малярийный плазмодий, бациллы
проказы, риккетсии, имеют клеточную организацию — хромосомные ге-
ны, рибосомный аппарат и митохондриальный аппарат или эквивалент
последнего с более или менее сложными системами для освобождения и
утилизации энергии. Очевидно, что эти паразиты являются клеточными
организмами независимо от того, устроены ли они по принципу эукарио-
тических клеток, т. е. клеток животных и растений, для которых харак-
терно наличие набора хромосом и полностью развитой системы внутри-
клеточных мембран, либо по принципу прокариотических клеток, подоб-
ных бактериальным, с менее выраженной компартментализацией [804].
Тот факт, что эти организмы способны выживать и размножаться только
внутри других клеток, объясняется не отсутствием собственной клеточ-
ной организации, а их потребностью в поступлении «готовых» (экзоген-
ных) источников питания.
Долгое время к вирусам относили группу внутриклеточных патоген-
ных агентов, таких, например, как возбудители пситтакоза, венерической
лимфогранулемы и других сходных болезней животных. В настоящее
время эти возбудители классифицируются как Chlamydozoaceae, а по
самой последней классификации как род Miyagawanella (в составе клас-
са риккетсий). К вирусам их нельзя относить по двум причинам: они
содержат два типа нуклеиновой кислоты, что предполагает наличие
у них клеточной организации, и они сохраняют эту организацию внутри
клетки, где они растут, т. е. увеличиваются в размерах и размножаются
делением надвое [605].
Репликация вирусов находится в строгой зависимости от клетки-хо-
зяина. Этим они отличаются от субмикроскопических, но свободно живу-
щих организмов, таких, как PPLO, или Mycoplasma, которые обладают
клеточной организацией и, по-видимому, являются бактериями, лишен-
ными жесткой клеточной стенки. Зависимость PPLO практически от всех
метаболитов, которые могут проникать через полупроницаемую мембра-
ну, привела к крайнему сокращению их генома, ферментного аппарата,
клеточных структур и соответствующему уменьшению их размеров [459].
Образование так называемых L-форм, которые представляют собой обыч-
ные бактерии, утратившие в результате мутаций способность образовы-
вать клеточную стенку [792], возможно, следует рассматривать как мо-
дель того процесса, который привел к появлению Mycoplasma.
Специфичность круга хозяев у вирусов является дополнительным до-
казательством того, что отношение вирус — хозяин не ограничивается
лишь питанием, а носит более сложный характер. Если бы нашелся та-
кой внутриклеточный паразит, который, будучи неспособен размножаться
в свободном состоянии, тем не менее мог бы размножаться в живых
клетках любого типа, то мы вправе были бы допустить, что этот паразит
будет размножаться и в свободном состоянии, если только он получит
какие-то пока еще не известные нам (возможно, нестойкие) вещества,
которые обычно ему поставляет клетка. Позднее мы увидим, однако, что
взаимоотношения вирусов с клеткой-хозяином очень сложны; ожидать,
что вирус будет размножаться в свободном состоянии, можно только
в том случае, если нам удастся выделить из клетки и реконструировать
in vitro клеточный аппарат, необходимый для того, чтобы макромолеку-
лярные синтезы протекали упорядоченным образом.
12
Глава I
Размеры частиц—вопрос, который мы будем детально обсуждать
ниже,— являются недостаточным критерием для отнесения исследуемых
частиц к категории вирусов. Это становится очевидным, если мы сопо-
ставим эти размеры, с одной стороны, с мельчайшими клетками Myco-
plasma (диаметр ~ 100 ммк, т. е. меньше, чем у самых больших вирусов)
и, с другой, например, с молекулами гемоцианина (молекулярный вес
3- 106 дальтон — величина, сравнимая с массой достаточно мелкого бак-
териофага).
Возможно, в растительных и животных клетках могли бы образовы-
ваться вирусные частицы диаметром в несколько микронов. Но именно
малые размеры вирусов сыграли в свое время важную роль в создании
соответствующих вирусологических методов. С самого зарождения виру-
сологии для отделения инфекционных вирусных частиц от бактерий (за-
грязняющих препарат вируса) и для доказательства небактериальной
природы изучаемых заболеваний использовались бактериальные фильт-
ры. Отсюда и традиционное название фильтрующийся вирус, заменившее
прежнее ультравирус, а затем в свою очередь замененное общепринятым
в настоящее время словом вирус.
СВЯЗЬ ВИРУСОЛОГИИ С ДРУГИМИ БИОЛОГИЧЕСКИМИ НАУКАМИ
Связь вирусологии с бактериологией основывается как на общности
методов (микроскопия, фильтрация, стерилизация), так и на общности
объекта (и бактерии и вирусы принадлежат к группе патогенных мик-
робов).
Изучение вирусов тесно связано с изучением обусловленных ими
патологических изменений в организме хозяина, ибо выявление, иденти-
фикация и титрование вирусов зависят почти исключительно от наблю-
дений аномальных изменений, вызываемых ими в некоем организме. Сле-
довательно, вирусология тесно связана с патологией человека, животных
и растений. Однако в первую очередь эта наука должна изучать свойства
и функции вирусов, чтобы в конечном счете оказалось возможным интер-
претировать прямо или косвенно все обусловленные вирусами патологи-
ческие изменения в организме хозяина в концепциях механизмов, посред-
ством которых вирусы взаимодействуют с его клетками.
Вирусология тесно связана с химией белков и физической химией
и заимствует применяемые в этих областях методы исследования, по-
скольку небольшие размеры вирусных частиц в какой-то степени совпа-
дают с размерами макромолекул белков и нуклеиновых кислот. Методы
очистки и определения размеров, однородности и плотности частиц сход-
ны в отношении вирусов и белков. Однако эта связь между вирусологией
и макромолекулярной химией благодаря сходству применяемых в этих
областях методов исследования не должна затемнять то различие, кото-
рое существует между вирусами и различными классами макромоле-
кул— белками и нуклеиновыми кислотами, являющимися компонентами
как всех клеток, так и вирусных частиц.
ПРИРОДА ВИРУСОВ
Вопрос о природе вирусов — один из наиболее неясных вопросов ви-
русологии. Является ли вирус организмом? Можно ли считать его жи-
вым? Когда было найдено, что вирионы некоторых вирусов после выде-
ления их из экстрактов инфицированных клеток и соответствующей
очистки имеют почти одинаковые размеры, форму, химический состав
и даже могут кристаллизоваться [806], возникла необходимость прими-
рения «молекулярной» природы этих частиц с их способностью репро-
Введение
13
дуцироваться. Как обычно в таких случаях, трудности носили скорее
семантический характер. Такие слова, как «организм» и «живой», одно-
значны только в применении к тем объектам, в отношении которых они
были первоначально введены. Так, лягушка — это организм; собака, ко-
торая бегает и лает, несомненно живая. Но почему, собственно, лягуш-
ка — это организм?
Согласно Львову [547], организм — это некая независимая единица
интегрированных и взаимосвязанных структур и функций. Лягушка пред-
ставляет собой такую единицу; отдельные же клетки ее тела (хотя каж-
дую из них тоже можно рассматривать как некую единицу интегриро-
ванных и взаимосвязанных структур и функций) не являются незави-
симыми в обычном смысле слова. (Отметим, что и сама лягушка не во
всех отношениях подходит под определение «независимой единицы», хотя
бы, например, из-за существования двух разных полов.) У простейших,
т. е. у одноклеточных форм, именно клетка является независимой едини-
цей, иными словами, организмом. Клеточные органеллы — митохондрии,
хромосомы, хлоропласты — это не организмы, ибо они не являются не-
зависимыми.
Таким образом, если придерживаться определения Львова, то вирус
нельзя назвать организмом, поскольку он не обладает независимостью.
Инфекционная вирусная частица полностью зависит от живой клетки-
хозяина; вне этой клетки невозможны ни размножение вируса, ни реали-
зация его генетических потенций. В этом отношении вирусы в такой же
степени зависят от клетки-хозяина, как и ее собственные гены, выраже-
ние которых осуществимо также при условии целостности клетки. Ген и
хромосома не являются организмами (это следует из наших рассужде-
ний), следовательно, и вирус не организм.
Мы можем рассмотреть и другое определение организма, которое
подчеркивает не столько функциональную независимость, сколько инди-
видуальность, историческую непрерывность и эволюционную независи-
мость. Клеточный ген или генный комплекс имеет индивидуальность и
историческую непрерывность, но его эволюция ограничена пределами
одной линии клеток; следовательно, он не организм. У многоклеточных
видов независимо от того, представляют ли они собой виды животных
или растений, отдельные линии клеток не могут эволюционировать неза-
висимо друг от друга; следовательно, их клетки не являются организ-
мами.
Для того чтобы изменение было эволюционно значимым, оно дол-
жно быть передано новому поколению особей. В соответствии с этим
рассуждением организм представляет собой элементарную единицу не-
которого непрерывного ряда со своей индивидуальной эволюционной
историей.
Вирус обретает относительно независимую эволюционную историю
благодаря свойственной ему способности передаваться от хозяина к хо-
зяину. Он может пережить клетку и организм, в которых паразитирует.
Круг хозяев вируса в ряде случаев не ограничивается лишь каким-либо
одним видом организмов. Один и тот же вирус может встречаться и у
представителей разных видов, родов и даже типов. Он может переда-
ваться от растения насекомым и размножаться в клетках тех и других.
Вирус может, обладая соответствующей приспособляемостью, испробо-
вать предоставляемые ему очень далекие друг от друга ниши. Таким об-
разом, вирус обладает, конечно, большей независимостью, чем любая
клеточная органелла; он в большей степени организм с эволюционной
точки зрения, чем хромосома или даже клетка многоклеточного живот-
ного, хотя функционально значительно менее независим, чем любая та-
кая клетка.
14
Глава I
Подобный же ход рассуждений может помочь нам выйти из тога
затруднительного положения, в котором мы находимся, обсуждая вопрос
о том, куда относить вирусы: к царству живого или к царству неживого.
Львов [547] определяет жизнь как «свойство, проявление или состояние
клеток и организмов, охарактеризованных как независимые структурные
и функциональные единицы. Поэтому он рассматривает вирусы как не-
живые, ибо не считает их организмами. В первом издании этой книги
отправной точкой дискуссии о природе вирусов было подобного же типа
утверждение, а именно: «жизнь представляет собой свойство некоей ор-
ганизованной части материи, т. е. свойство организмов», однако и в этой
дискуссии подчеркивалась репродуктивная и эволюционная непрерыв-
ность и независимость вирусов. Было выдвинуто следующее операцио-
нальное определение: «Живым мы называем то, что, будучи изолиро-
вано, сохраняет свою специфическую конфигурацию, так что эта конфи-
гурация может быть реинтегрирована, т. е. вновь включена в цикл, в
котором участвует генетическое вещество».
Это отождествляет жизнь с наличием независимого, специфического,,
самореплицирующегося способа организации. Белок с этой точки зрения
«неживой», ибо аминокислотная последовательность, как таковая, никог-
да не копируется в клетке. Специфическая же последовательность осно-
ваний нуклеиновой кислоты того или иного гена может копироваться:
ген — это некая часть запаса информации, которым располагает живой
организм.
Следует ли в таком случае считать нуклеиновую кислоту живой?
Упомянутое выше определение предлагает в качестве теста на живое
экстракцию и воспроизведение в различных клеточных линиях и в ряде
поколений организмов. Вирус, согласно этому тесту, живой, точно так же
как и любой другой фрагмент генетического материала, о котором мы
знаем, что его можно извлечь из клетки, вновь ввести в живую клетку
и что при этом он будет копироваться в ней и станет хотя бы на неко-
торое время частью ее наследственного аппарата.
Фрагменты ДНК различных видов бактерий (принадлежащих к ро-
дам Pneumococcus, Streptococcus, Hemophilus, Bacillus и некоторым дру-
гим) способны к такой реинтеграции при введении в живые клетки соот-
ветствующего вида. Это так называемый феномен «трансформации» [35].
Следовательно, мы должны сказать, что любой фрагмент ДНК этих бак-
терий обладает признаками живого.
Существует, однако, важное различие в способности к передаче бак-
териальной ДНК и ДНК вирусного генома. Передача фрагментов ДНК
бактерий, хотя она и имеет место в природе, является, по-видимому, слу-
чайным событием, не имеющим важного эволюционного значения, тогда
как передача генома вируса составляет основной смысл существования
этих форм — результат их селективной специализации.
Как мы увидим далее, нуклеиновая кислота некоторых вирусов, вы-
деленная из вирусных частиц или из инфицированных клеток, может
проникать в другие клетки и реплицироваться в них. Однако в большин-
стве случаев эффективность инфекции при этом заметно снижается па
сравнению с инфекцией, вызванной целыми вирусными частицами.
Иными словами, перенос генетического материала в форме целых вирус-
ных частиц осуществляется более эффективно, чем в форме одной только
нуклеиновой кислоты вируса. Это дает возможность считать вирусы
«более живыми», чем какие-либо другие фрагменты генетического мате-
риала, и «более организмами», чем любые клеточные органеллы, вклю-
чая хромосомы и гены.
Введение
15»
РАЗВИТИЕ УЧЕНИЯ О ВИРУСАХ
Как и всякая другая наука, вирусология развивалась путем посте-
пенного накопления фактов. Самостоятельность и перспективы она об-
рела лишь в последние 20 лет. Болезни же, о которых мы в настоящее
время знаем, что они вызываются вирусами, были известны в течение
тысячелетий. Эпидемия, описанная в X в. до н. э. в Китае, напоминает
оспу. Желтая лихорадка, веками господствовавшая в тропической Аф-
рике и являвшаяся бедствием судовых команд африканских торговых
кораблей, послужила, по-видимому, основой легенд о «Летучем гол-
ландце» и других кораблях, над которыми тяготело проклятье [ИЗ].
Такое вирусное заболевание растений, как скручивание листьев карто-
феля, известно несколько столетий, а пестролепестные тюльпаны, пестрая
окраска которых вызвана вирусом, выращивали еще в XVI в. [54}.
Контагиозность вируса оспы была известна в течение столетий;
в конце XVIII в. в медицинскую практику Запада была введена прививка
Дженнера — вакцинация экстрактами, содержащими вирус коровьей
оспы [405]. В 1884 г. Пастер приготовил вакцину против бешенства из
аттенуированного штамма вируса. Майер в 1886 г. продемонстрировал
возможность передачи мозаичной болезни табака путем механической
инокуляции соком больных растений.
Успехи, достигнутые в конце XIX в. в изучении бактериальных воз-
будителей болезней человека, усилили интерес к тем инфекционным бо-
лезням, возбудители которых были неизвестны. Мысль о существовании
субмикроскопических патогенных агентов еще не имела эксперименталь-
ной основы. В 1892 г. Ивановский сообщил о возможности передачи
мозаичной болезни табака соком, профильтрованным через бактериаль-
ные фильтры. Его сообщение осталось незамеченным; даже сам автор
полностью не осознал значения своего открытия.
В 1898—1899 гг. Лефлеру и Фрошу удалось передать ящур, а Бейе-
ринку—мозаичную болезнь табака фильтратами, в которых никаких
микроорганизмов обнаружить не удавалось. Пораженный этим откры-
тием, Бейеринк описал этот возбудитель мозаичной болезни табака как
contagium vivum fluidum, имея в виду инфекционный агент, способный
размножаться и, следовательно, живой, но пребывающий в диспергиро-
ванном состоянии, несвойственном организмам.
Скоро, однако, стало очевидным, что инфекционные агенты суще-
ствуют в форме дискретных вирусных частиц. Под микроскопом они
имели вид элементарных телец и статистический анализ показал, что
инфекция может быть вызвана одной-единственной вирусной частицей.
Задолго до того, как были достигнуты успехи в химическом изучении
вирусов, цитологические исследования позволили обнаружить в инфици-
рованных вирусами тканях специфически измененные и определенным
образом локализованные участки, получившие название внутриклеточ-
ных включений. Изучение морфологии и цитохимии этих внутриклеточ-
ных включений помогало не только диагносцировать определенные ви-
русные инфекции, но и дало также возможность составить некоторое
представление о путях биосинтеза вирусов [94].
Потребность в удобных экспериментальных моделях организма-хо-
зяина, с помощью которых можно было бы изучать патологию вирусных
инфекций, стимулировала культивирование клеток in vitro. Исследова-
ния, проведенные на культурах тканей, показали, что репродукция виру-
сов возможна только в живых клетках; в мертвых клетках вирусы не
размножаются. Серологическими методами была обнаружена антигенная
специфичность вирусных белков, что послужило основой для диагности-
ки, терапии и профилактики вирусных болезней.
16
Глава
В 1911 г. Раус сообщил об открытии вируса, который вызывал зло-
качественные опухоли у кур. Некоторые обобщения результатов изуче-
ния целой группы злокачественных опухолей у птиц послужили основа-
нием к признанию вирусов одним из основных агентов, индуцирующих
опухолевые трансформации как у животных, так и у растений.
Открытие бактериофагов, или вирусов бактерий, Туортом [862] и
д‘Эреллем [332] явилось основным стимулом к единению вирусологии и
превращению ее в самостоятельную науку.
Когда стали доступны современные физические и химические ме-
тоды исследования, с помощью электронного микроскопа удалось вы-
явить детали структуры вирионов даже самых мелких вирусов. С по-
мощью же рентгеноструктурного анализа удалось вскрыть детали внут-
ренней организации некоторых вирусных частиц еще до того, как это
было сделано посредством электронного микроскопа [70]. Выделение в
чистом виде сначала вируса табачной мозаики [806], а затем и некоторых
других вирусов привело к их успешной кристаллизации и дало возмож-
ность изучить их химические свойства.
Определяющая роль нуклеиновой кислоты в вирусной инфекции
была доказана на примере фаговой инфекции, которая, как было обна-
ружено, начинается с освобождения нуклеиновой кислоты из вириона и
проникновения ее внутрь бактерии-хозяина [342]. Способность очищенной
вирусной нуклеиновой кислоты вызывать инфекцию впервые была пока-
зана на примере РНК вируса табачной мозаики [272], а затем на РНК
и ДНК многих других вирусов, включая бактериофаги, а также вирусы
растений и животных.
Образование вирусных частиц можно рассматривать как кульмина-
ционный момент в морфогенетическом процессе, детерминируемом виру-
сом. Геном вируса представлен нуклеиновой кислотой. Эта нуклеиновая
кислота реплицируется и вынуждает клетку синтезировать особый
(вирусоспецифичный) белок, из которого строится белковая оболочка
вируса, или капсид. Полностью сформированная вирусная частица, со-
стоящая из нуклеиновой кислоты, капсида, а иногда также и иных, внеш-
них оболочек, составляет вирион [529].
С эпидемиологической точки зрения важным достижением явилось
выявление роли насекомых-переносчиков в передаче многих вирусов жи-
вотных и растений [669] и изучение комплексов хозяин-переносчик-вирус
[764], показавшее роль латентных инфекций в сохранении патогенных
вирусов в природе. Анализ спонтанного мутирования вирусов способ-
ствовал пониманию эпидемиологии вирусных болезней; этот анализ вы-
явил, что вирусы представляют собой автономно эволюционирующие ге-
нетические системы.
ОСНОВНЫЕ ГРУППЫ ВИРУСОВ
Стало уже обычным подразделять вирусы в соответствии с природой
их хозяев на вирусы растений, вирусы животных и вирусы бактерий,
или бактериофаги. Но даже такое общее подразделение не свободно от
противоречий. Вирусы растений, например, могут размножаться в насе-
комых-переносчиках. Поскольку вирусы были открыты как патогенные
агенты, т. е. агенты, вызывающие появление каких-то аномальных при-
знаков у некоторых хозяев, логично подразделять их по принципу
«основного хозяина», т. е. хозяина, у которого такие аномалии впервые
были обнаружены человеком. Каждый вирус имеет какой-то «набор» хо-
зяев — более или менее родственных организмов, в которых он может
репродуцироваться. Для сохранения вирусов в природе часто более важ-
ны те хозяева, в которых вирусы вызывают наименьшие изменения, а не
основные хозяева, представляющие интерес для человека.
Введение
17
Вирусы бактерий
Что касается вирусов бактерий, то едва ли существуют легко куль-
тивируемые бактерии, для которых бактериофаги еще не обнаружены.
До сих пор фаги не были обнаружены только у миксобактерий. Сведе-
ния же о фагах железобактерий, серных и нитрифицирующих бактерий
весьма ограниченны.
Специфичность фагов в отношении хозяина обычно соответствует
таксономическим группам бактерий. Так, фаги, поражающие микрокок-
ки, не размножаются в стрептококках, а фаги кишечных бактерий не
размножаются в Pseudomonas (правда, в отдельных случаях они могут
адсорбироваться на этих бактериях и убивать их) [13]. Однако в тех слу-
чаях, когда классификационные границы, например границы между ро-
дами и видами бактерий, четко не установлены, специфичность фага
может быть либо шире, либо уже условно установленных классификаци-
онных групп. Так, один какой-либо фаг может размножаться только в клет-
ках определенного штамма Escherichia coli, тогда как другой репродуци-
руется в клетках многих штаммов этого рода и в клетках тесно связан-
ного с ним рода Shigella. Как мы увидим в дальнейшем, бактерии могут
приобретать устойчивость к фагам благодаря ряду отдельных мутацион-
ных событий, так что штамм, чувствительный одновременно к несколь-
ким фагам, может дать серию стабильных мутантов, устойчивых к од-
ному или более фагу.
Обнаружен фагоподобный вирус, который действует на некоторые
сине-зеленые водоросли [711, 791]. Это служит дополнительным под-
тверждением широко признанного биохимического и таксономического
родства между Cyanophyceae и бактериями [805].
Вирусы животных
В табл. 1 приведен частичный перечень имеющих важное значение
вирусов животных. Среди беспозвоночных вирусные болезни обнаружены
только у насекомых, которые являются наиболее важным в экономиче-
ском отношении и поэтому наиболее изученным классом этого типа жи-
вотных. Изучение вирусных болезней насекомых, которое стимулирова-
лось огромными убытками в шелководстве Франции в XIX в., в настоя-
щее время является большим разделом вирусологии.
Среди позвоночных вирусные болезни известны у рыб (оспа карпа,
«инфекционные опухоли») и у амфибий (опухоль почки у леопардовой
лягушки, которая, по-видимому, имеет вирусное происхождение) [528].
Многие вирусные болезни известны у птиц; некоторые из них очень
важны, как, например, ньюкаслская болезнь и ларинготрахеит. Вирусные
опухоли у птиц, такие, как саркома и лейкозы, служат излюбленной
моделью при изучении вирусной природы опухолей.
Среди млекопитающих вирусные болезни обнаружены у большин-
ства домашних и у многих диких животных. У человека вирусными яв-
ляются такие болезни, как оспа, желтая лихорадка, полиомиелит, корь,
свинка, бешенство и различные энцефалиты. В табл. 1 представлен спи-
сок имеющих важное значение вирусов млекопитающих и болезней, ко-
торые они вызывают у своих основных хозяев.
Вирусы растений
Перечень вирусов растений, имеющих важное значение, приведен
в табл. 2. Сведения о вирусных болезнях низших растений недостаточны
и не представлены в таблице. В литературе описаны лишь случаи лизиса
2 Заказ № 1214
Таблица 1
Характеристика и представители основных групп вирусов животных
Группа Представитель Характерные свойства груп- пы, подгруппы или отдель- ных вирусов Основной хозяин
Р Н К-co держащие вирусы Мелкие РНК-ви- русы Подгруппа I Энтеровирусы Риновирусы Подгруппа II Энтеровирусы Прочие Реовирусы Миксовирусы Подгруппа 1 Вирус полиомие- лита Вирус Коксеки А Вирус Коксеки В ЕСНО-вирусы Вирус ящура Прочие вирусы Вирус энцефало- миокардита Вирус. Колумбия- SK Вирус Менго Вирус энцефало- миокардита птиц Реовирус Вирус гриппа Кубическая симметрия, внешняя оболочка от- сутствует, молекуляр- ный вес РНК около 2-Ю6 дальтон, раз- множаются в цито- плазме 3 серотипа 23 6 серотипов 30 62 серотипа Вызывают энцефаломио- кардит и энцефало- миелит мышей Кубическая симметрия, внешняя оболочка от- сутствует, РНК двух- цепочечная; размножа- ются в цитоплазме Все реовирусы, незави- симо от хозяина, по своим антигенным свойствам входят в одну и ту же группу, включающую три под- группы Вирионы имеют внеш- нюю оболочку; внут- ри вириона заключена спиральная структура, содержащая РНК Ядерная стадия в цик- ле репликации; моле- кулярный вес РНК точно не установлен 3 серотипа (А, В, С); тип А встречается чаще других, вызывает мас- совые эпидемии; тип В — большинство спо- радических случаев, тип С — редкие спора- дические случаи Человек Крупный рогатый скот Кошка, свинья, крупный рога- тый скот, птицы и т. д. Мышь Птицы Многие млекопи- тающие Человек
Продолжение
Группа Представитель Характерные свойства груп- пы, подгруппы или отдель- ных вирусов Основной хозяин
Подгруппа II Арбовирусы Подгруппа А Подгруппа В Подгруппа С Прочие ДНК-co держа- щие вирусы Вирусы группы ос- пы Вирус классичес- кой чумы птиц Вирус . гриппа уток, свиней и лошадей Вирус ньюкасл- ской болезни Вирус парагриппа Вирус эпидемичес- кого паротита (свинки) Вирус кори 1 Вирус бешенства2 Вирус птичьего лейкоза 2 Вирус лейкемии мышей 2 Свыше 200 разных типов Размножаются в цито- плазме, молекуляр- ный вес РНК (6—8 • 106 дальтон) 4 серотипа; вызывают тяжелые заболевания дыхательных путей у детей По своей структуре бли- зок к миксовирусам / Наличие внешней обо- 1 лочки и большие I размеры молекул k РНК Наличие внешней обо- лочки и малые разме- ры вирионов, РНК- содержащий нуклео- капсид, вероятно об- ладающий икосаэдри- ческой симметрией; передается кровосо- сущими членистоно- гими, вызывает энце- фалит Около 20 типов, в том числе вирус западного и восточного энцефа- ломиелита лошадей Около 35 типов, в том числе вирус желтой лихорадки и вирус ден- ге Распространены в основ- ном в Южной Амери- ке Распространены по все- му свету Крупные, напомина- ющие по форме кир- пичики вирионы, име- ющие внешние оболоч- ки; содержат по край- ней мере 10 белков и большую молекулу ДНК; размножаются в цитоплазме, имеют общие антигены и ан- тигены, специфичные для каждого штамма Главным образом куры Соответственно названию виру- са Птицы Человек Человек и многие млекопитающие Птицы Мышь Человек и низшие животные; ви- рус размножа- ется также в насекомых-пе- реносчиках То же Патогенность не доказана
2*
Продолжение
Группа Представитель Характерные свойства груп- пы, подгруппы или отдель- ных вирусов Основной хозяин
Вирусы группы герпеса Аденовирусы Мелкие ДНК-ви- русы Вирус натураль- ной оспы Оспоподобные ви- русы Вирусы оспы птиц Вирусы миксомы и фибромы кро- ликов Вирус герпеса простого Вирус псевдобе- шенства Вирус ветряной оспы Вирус цитомега- лии Подгруппа виру- сов, поражаю- щих человека Подгруппа виру- сов, поража- ющих иных млекопитающих Подгруппа виру- сов, поража- ющих птиц Вызывает оспу К этой группе относят- ся вирусы осповак- цины, коровьей оспы, оспы кроликов, эктро- мелии, или оспы мы- шей и др. Вызывают скоротечную инфекцию и доброка- чественные опухоли (соответственно) Крупные вирионы, име- ющие внешнюю обо- лочку и обладающий икосаэдрической сим- метрией капсид, внут- ри которого заключе- на ДНК Вызывает пузырчатую лихорадку Вызывает сильный зуд Вызывает сыпь на коже Подобно другим штам- мам герпеса, вызыва- ет интенсивное обра- зование так называе- мых гигантских кле- ток Вирионы имеют форму икосаэдра, лишены внешней оболочки, со- держат ДНК- Имеют общие антигены, а также антигены, спе- цифичные для каждо- го типа Выделены от больных с катаром верхних ды- хательных путей или конъюнктивитом; спо- собны вызывать малиг- низацию клеток у хо- мяка; известно 28 се- ротипов Вирионы имеют форму икосаэдра, лишены внешней оболочки, со- держат кольцевые мо- лекулы ДНК; общих антигенов не имеют. Большинство типов спо- собны вызывать малиг- низацию клеток Человек Различные мле- копитающие Птицы Кролики Человек Свинья, крупный рогатый скот Человек Человек и различ- ные виды жи- вотных Человек Собака, мышь, обезьяна, круп- ный рогатый скот Птицы
Введение
Продолжение
Группа Представитель Характерные свойства груп- пы, подгруппы или отдель- ных вирусов Основной хозяин
Вирус папилло- мы Шоупа Вирус папилло- мы человека Вирус папилломы млекопитающих Вирус полиомы Вирус SV-40 Вызывает папиллому у домашних и диких кроликов Вызывает появление бо- родавок Подобно предыдущему, вызывает появление бородавок Выделен от мышей; вы- зывает различные опу- холи Выделен из обезьяньей почки; способен вы- зывать малигнизацию клеток человека и хо- мяка Кролики Человек Собака, лошадь, крупный рога- тый скот Мыши, хомяки Обезьяна, человек
1 Предположительно относится к группе миксовирусов.
2 Групповая принадлежность не установлена.
дрожжевых клеток, сопровождающиеся образованием фагоподобных ча-
стиц [521], а также вирусные болезни шляпочных грибов [361].
Цветковые растения явлйются хозяевами для многих типов вирусов.
По ущербу, причиняемому экономически важным культурам, вирусы
уступают только патогенным грибам. К числу важнейших проблем фито-
патологии относится изучение вирусных болезней картофеля, бобов, свек-
лы, табака, сахарного тростника, кокосовой пальмы и плодовых культур.
НОМЕНКЛАТУРА И КЛАССИФИКАЦИЯ ВИРУСОВ
Номенклатура и классификация вирусов долгое время вызывала
большие трудности. Причины этого должны быть ясны из обсуждения
природы вирусов. Цель классификации любого класса организмов со-
стоит в том, чтобы сгруппировать в разумные категории те организмы,
которые наиболее близки. В такой группировке могут быть использованы
морфологические или физиологические критерии, либо те и другие.
Идеал, к которому мы стремимся,— это создать такую классификацию,
которая отражала бы эволюционные и филогенетические взаимоотноше-
ния организмов, а также обеспечивала бы удобную и рациональную си-
стему номенклатуры.
В настоящее время, однако, нет оснований считать, что вирусы обра-
зуют группу организмов, имеющих общее происхождение и общую эво-
люционную историю. Родство вирусов с клеточными органеллами так же
правдоподобно, как и родство их друг с другом, и можно пытаться дока-
зывать, что новые вирусы возникают путем дифференцировки клеточных
органелл (см. гл. XIX). Таким образом, ни одна классификация вирусов
не может особенно претендовать на то, чтобы отражать филогенетиче-
ское родство, и служит главным образом в качестве «определительной
таблицы», используемой исследователями в практических целях.
По традиции номенклатура вирусов состояла в том, что за словом
«вирус» ставили название болезни основного хозяина. Бактериофаги име-
новались символами (буквами и числами, как, например, Tl, С16, S13,
срХ174), возникшими из лабораторной практики. Этот не имеющий серь-
езной основы способ номенклатуры устраивал исследователей в их по-
вседневной работе. Однако по мере накопления информации о вирусах
22
Глава J
Таблица 2
Некоторые основные группы вирусов растений И
Группа
Типичные представители
Форма вирионов
Вирус мозаики табака
Х-вирус картофеля
У-вирус картофеля
ВТМ; вирус аукуба-мозаики то-
мата; подорожниковый вирус
Холмса; вирусы огуречной мо-
заики 3 и 4
Штаммы Н, G, L и др.; вирус
крапчатости картофеля; вирус
кольцевой пятнистости картофеля
Вирус полосатой мозаики карто-
феля; вирус морщинистой мозаи-
ки картофеля; вирус С карто-
феля
Жесткие палочки дли-
ной 3 000 А
Гибкие палочки длиной
-5 000А
Гибкие палочки длиной
-7 000А2)
Вирус «rattle» табака
Вирус гравировки таба-
ка
Вирус мозаики белены
Вирус мозаики сэи
Вирус желтухи сахар-
ной свеклы
Вирус кольцевой пят-
нистости табака
Вирус некроза табака
(группы А, В, С)
Вирус-сателлит вируса
некроза табака
Вирус кустистой карли-
ковости томата
Вирус южной мозаики
фасоли
Вирус желтой мозаики
турнепса
Вирус мозаики люцерны
Вирус желтой карлико-
вости картофеля
Вирус Gomphrena
Жесткие палочки длиной
1750А
Гибкие палочки
»
Гибкие палочки длиной
12 500А2)
Квазисферические части-
цы диаметром 260А3>
То же 300А
170 А
280А
280А
280А
Вытянутый эллипсоид,
от 180x360 до 180Х
ХбООА
Вирионы бациллоподоб-
ной формы, имеющие
внешнюю оболочку,
750X3 800А
Вирионы бациллоподоб-
ной формы, имеющие
внешнюю оболочку,
1 000X2 600 А
1) Вирусные группы устанавливаются по отсутствию перекрестной серологической реакции между
вирионами ([53], с изменениями).
2) Значения, по-видимому, завышены вследствие агрегации вирионов.
3) Имеющие форму дельтоэдра; см. гл. IV.
необходимость и значение классификации в разумные группы тех из
них, которые обнаруживали сходные свойства, стала очевидной.
Уже при первых попытках классифицировать вирусы возникла про-
блема выбора критериев для такой классификации. В качестве крите-
риев можно было использовать природу основных хозяев, тип болезни,
вызываемой у них вирусом, особенности репродуктивного цикла вирусов
или свойства вирусных частиц. Вместо этого можно было бы принять
систему классификации, в которой используются некоторые или все эти
Введение
23
критерии либо на равных правах, либо при условии, что одним отдается
предпочтение перед другими.
Фитопатологи долгое время предпочитали системы классификации
вирусов, подобные биномиальной системе Линнея, хотя такие системы не
могли иметь реального таксономического значения. В 1948 г. Холмс пред-
ложил биномиальную систему, основанную главным образом на таких
характеристиках, как круг хозяев, симптомы болезни и способы ее пере-
дачи. Вирусы объединялись в порядок Virales, куда входили три подпо-
рядка: Phagineae (бактериофаги) Phytophagineae (вирусы растений) и
Zoophagineae (вирусы животных), которые далее подразделялись на се-
мейства, роды и виды. Эта система с последующими модификациями
была включена в качестве приложения в определитель бактерий Берд-
жи. Слабым местом системы Холмса было то, что она не учитывала
свойства вирионов. По мере накопления данных по химии вирусов и уста-
новления роли их химической структуры в репродукции все яснее ста-
новилась необходимость учета химических особенностей вирусов при их
классификации; пренебрегать этими критериями в пользу патоморфоло-
гических критериев казалось теперь просто невозможным.
Развитие электронной микроскопии позволило получить достаточно
много данных о размерах и морфологии вирионов наиболее известных
вирусов. Тем временем генетические исследования бактериофагов пока-
зали, что такие характеристики вирусов, как круг хозяев и тип реакции,
вызываемой в организме хозяина, подвержены мутационным изменениям
в большей степени, чем другие. Следовательно, эти характеристики менее
пригодны в качестве критериев классификации, чем, например, сероло-
гическая специфичность, которая отражает основную химическую струк-
туру белковых компонентов вирусных частиц.
Морфологические и серологические свойства были выбраны в каче-
стве основных критериев для классификации бактериофагов, поражаю-
щих одни и те же группы бактерий [8]. Обоснованность этих критериев
была подтверждена опытами по генетической рекомбинации, которые по-
казали, что рекомбинация может происходить только среди родственных
фагов, дающих перекрестные серологические реакции [9].
Тем временем ученые, занимающиеся изучением вирусов животных
и человека, продолжали свои попытки разработать какую-то всеобъем-
лющую систему номенклатуры. Подкомитет по номенклатуре вирусов
Международного комитета по номенклатуре бактерий рекомендовал вре-
менную систему «нелиннеевских» биномиальных названий, не претен-
дующую на строгое соответствие принципам таксономии и эволюции [24].
Эта система, однако, не получила широкого одобрения.
Важным шагом в разработке классификации вирусов явилось пред-
ложение системы, которая приняла за основу структуру и состав вирио-
нов и могла охватить все вирусы, подпадающие под общепринятые опре-
деления этой группы [549]. В данной системе номенклатуры (табл. 3)
в качестве основного критерия используется геометрия вирусного кап-
сида ([133]; см. гл. IV).
Общая схема таксономии вирусов, основывающаяся на тех же кри-
териях, что и система 1962 г., но использующая латинские биномиалы,
была предложена в 1965 г. Временным комитетом по номенклатуре виру-
сов для обсуждения на IX Международном конгрессе микробиологов.
Согласно этому предложению (но еще не в окончательной форме), все
вирусы включаются в царство Vira, подразделяющееся на подцарства,
классы, порядки, подпорядки, семейства и роды. Такое предложение по-
зволяет осуществить глубокую систематизацию вирусов с учетом точного
иерархического статуса по разным критериям. Наряду с этим сущест-
вуют биологически менее оправданные системы номенклатуры вирусов,
24
Глава I
Критерии классификации вирусов 1
Таблица 3
Нукле- иновая кисло- та Тип симметрии капсида Нали- чие внеш- ней оболоч- ки Диаметр спираль- ного капсида или число морфологи- ческих единиц3 Типичные представители Примечания или группы
РНК
Спиральная
100—130 А Х-вирус картофеля
170—200 А ВТМ
250 А Вирус штриховатой мо-
заики ячменя
100 А Вирус гриппа; вирус Группа миксо-
классической чумы вирусов
Ч- птиц
170 А Вирус ньюкаслской бо-
лезни; вирус кори
Кубическая — 32 единицы 60 единиц 92 единицы РНК-фаги; вирус жел- той мозаики турнепса Вирус полиомиелита; ви- рус кустистой карли- ковости Реовирус; вирус ране- вых опухолей расте- ний Двухцепочеч- ная РНК
Спиральная 900—100 А? Вирус осповакцины Группа вирусов оспы
ДНК Кубическая — 12 единиц 42 единицы 252 единицы 812 единиц Фаг фХ174 Вирус полиомы; вирус папилломы Аденовирус Радужный вирус долго- ножки
+ 162 единицы Вирус герпеса; вирус псевдобешенства Группа вирусов герпеса
Кубическая Т-четные и другие фаги
(имеется — с отростками
отросток)
1 По Львову и др. [548], с незначительными изменениями.
2 Морфологические единицы, или капсомеры, — это единицы, составляющие капсид, которые
видны на электронных микрофотографиях (см. гл. IV для сравнения капсомеров со структурными
белковыми субъединицами).
основанные на так называемом принципе Адансона, который учитывает
в равной степени все основные свойства вирусов [796].
Суммируя, следует сказать, что в настоящее время вполне удовле-
творительной системы классификации вирусов еще не существует, что и
не удивительно, если учесть множественность требований, предъявляе-
мых к такой классификации, и ограниченность используемых критериев.
ПЛАН КНИГИ
Цель настоящей книги состоит не в том, чтобы описать отдельные
вирусные болезни, а в том, чтобы дать общее представление о вирусах
как о группе биологических объектов, рассматривая фактические данные
и методы вирусологии в целом. Изучая свойства вирусов и их взаимоот-
Введение
25
ношения с клеткой-хозяином, создается возможность глубоко заглянуть
в сущность тех процессов, в концепциях которых мы в конце концов смо-
жем объяснить все вирусные болезни.
Материал, излагаемый в настоящей книге, мы расположили в такой
последовательности:
1. Выявление и титрование вирусов (гл. II и III).
2. Свойства вирусных частиц и их компонентов: размер, структура,
химический состав, серология и физическая химия вирионов (гл.
IV—VII).
3. Взаимодействие вируса с клеткой и репродукция вирусов.
а) Общие положения (гл. VIII).
б) Бактериофаги (гл. IX—XI).
в) Вирусы животных (гл. XII—XVI).
г) Вирусы растений (гл. XVII).
д) Вирусы насекомых (гл. XVIII).
4. Место вирусов в живой природе и происхождение вирусов
(гл. XIX).
Глава II
ВЫЯВЛЕНИЕ И ИДЕНТИФИКАЦИЯ ВИРУСОВ
ОБЩИЕ ВОПРОСЫ МЕТОДОЛОГИИ
Нельзя изучать вирусы, не имея в своем распоряжении методов,
позволяющих выявить присутствие этих патогенных агентов и осущест-
вить их идентификацию. Это условие в равной степени обязательно вне
зависимости от того, хотим ли мы изучать вирусы, имея в виду опреде-
ление их свойств, или нашей целью является выделение вируса из боль-
ного организма-хозяина. О присутствии вируса в организме как при
спонтанном заболевании, так и при экспериментальном заражении хо-
зяина судят по появлению каких-либо аномальных реакций. Лишь в
крайне редких случаях вирус удается выявить непосредственно путем
визуального наблюдения вирусных частиц. Поскольку, находясь вне
клетки, вирусы метаболически инертны, т. е. не размножаются и не
вызывают активных изменений окружающей среды, все наиболее важные
формы их активности реализуются внутри клеток организма-хозяина и
проявляются в виде симптомов соответствующего заболевания.
Всякий раз, когда возникает подозрение о присутствии вируса в изу-
чаемом объекте, приходится подбирать соответствующий комплекс усло-
вий— подходящий организм и адекватный способ заражения, ведущий
к появлению у зараженного организма распознаваемых изменений. По-
этому, подобно тому как в практике бактериологических исследований
большую часть времени занимает культивирование бактерий, при виру-
сологических исследованиях значительное количество усилий приходится
тратить на разработку методов экспериментальных инфекций и их про-
ведение. Экспериментальная вирусная инфекция аналогична опыту,
целью которого является выращивание бактерий. Применяемые в бак-
териологии метод культивирования на селективных средах и метод обо-
гащения имеют соответствующие аналоги в вирусологии.
Рассмотрим теперь проблему диагностики вирусных инфекций. Изве-
стно, что для доказательства того, что данное заболевание действительно
вызывается каким-то определенным микроорганизмом, необходимо вы-
полнить так называемые постулаты Коха: 1) показать, что данный мик-
роорганизм регулярно обнаруживается в больном организме, 2) полу-
чить культуру этого микроорганизма на искусственной питательной сре-
де, 3) пользуясь выделенной культурой микроорганизма, воспроизвести
данное заболевание на экспериментальном животном и, наконец, 4) пов-
торно выделить данный микроорганизм, но теперь уже из организма
искусственно инфицированного хозяина. Те же постулаты mutatis mutan-
dis справедливы и для диагностики вирусных заболеваний. В этом слу-
чае, согласно Риверсу, предъявляемые требования формулируются сле-
дующим образом: 1) необходимо выделить вирус из организма больного
хозяина, 2) культивировать вирус в организме или в клетках экспери-
ментального хозяина, 3) доказать фильтруемость инфекционного агента
(чтобы исключить патогенные агенты большего размера, например бак-
терии), 4) воспроизвести подобное же заболевание у иной особи дан-
26
Выявление и идентификация вирусов
27
ного или родственного вида и, наконец, 5) повторно выделить данный
вирус.
Культивирование и идентификация вирусов — основные вирусоло-
гические методы, используемые в практической вирусологии при диагно-
стике вирусных заболеваний. Эти методы являются также основным
инструментом любого вирусолога вне зависимости от того, исследует ли
он теоретические проблемы репродукции вирусов, изучает ли патологию
клеток при вирусных инфекциях или эпидемиологию вирусных заболева-
ний или занимается вопросами профилактики, вакцинации или химио-
терапии. Несмотря на то, что общих правил культивирования и иденти-
фикации вирусов пока не существует, имеет смысл более подробно обсу-
дить некоторые аспекты культивирования вирусов, целью которых
является их концентрирование и идентификация.
Во-первых, обсудим вопрос об источниках получения материала, со-
держащего вирусы, и условиях его сохранения. Материал, в котором по-
дозревается наличие вируса, например лизат бактерий, кусочек ткани
или биологическая жидкость, следует оберегать от нагревания и других
резких воздействий. Часто бывает желательно хранить материал, содер-
жащий вирус, при очень низких температурах (—70°). При необходимо-
сти из ткани следует приготовить суспензию, измельчая ее путем расти-
рания в смеси со стерильным песком или порошкообразным стеклом,
как правило на холоду, и добавляя к смеси буферный раствор. Для того
чтобы удалить из суспензии большие фрагменты клеток и загрязняющие
ее микроорганизмы, можно применить центрифугирование и фильтрова-
ние. Получив такую суспензию, следует заразить ею подходящего экспе-
риментального .хозяина. Выбор хозяина и способа введения материала
определяется природой предполагаемого вируса и часто является прин-
ципиально важным. Цель данной работы — вызвать у подопытного хо-
зяина четко выявляемые симптомы заболевания.
Различают два типа экспериментальных инфекций: 1) инфекции, на
которые организм реагирует общей реакцией, и 2) инфекции, на которые
организм реагирует местной реакцией.
Для того чтобы вызвать местную реакцию, содержащую вирус жид-
кость следует нанести на слой чувствительных, клеток таким образом,
чтобы вирус смог инфицировать одну или большее число клеток, размно-
житься в них, проникнуть затем в соседние клетки и в результате вы-
звать изменения, видимые простым глазом. Местные (локальные) изме-
нения могут быть вызваны полной или частичной деструкцией или ано-
мальной пролиферацией клеток. Появление повреждений, как правило,
является достаточно характерным признаком, свидетельствующим о на-
личии вируса. Соответствующие примеры будут приведены ниже. Число
локальных поражений говорит о числе успешно осуществленных инфи-
цирований. Связь между числом таких локальных поражений и содержа-
нием вируса в инокулуме будет обсуждена далее в гл. III.
Для того чтобы изучить общую реакцию организма-хозяина на вве-
дение вируса, исследуемый материал вводят в подходящий организм,
а затем наблюдают, не появятся ли соответствующие признаки успеш-
ного заражения: смерть, заболевание, аномальное развитие организма
или какие-либо иные специфические реакции, например образование
антител.
При необходимости вызвать локальное поражение главной пробле-
мой является выбор тест-системы. Важными параметрами являются при-
рода клеточного слоя и условия заражения. При заражении, целью кото-
рого является индукция общей реакции у достаточно сложного орга-
низма, существенное значение могут иметь оба фактора: выбор хозяина
и способ заражения. Экспериментатор должен попытаться либо приве-
28
Глава II
сти исследуемый материал в непосредственный контакт с чувствитель-
ными клетками, вводя некоторое его количество в соответствующую
полость организма, выстланную такими клетками, либо, если это невоз-
можно, обеспечить косвенное воздействие путем введения испытуемого
материала животному подкожно, внутримышечно, внутривенно или
в мозг.
Всегда необходимо поставить соответствующие контроли. В качестве
контролей можно использовать растворитель или, что еще лучше, препа-
рат нормального незараженного материала, подвергшегося той же обра-
ботке, что и испытуемый опытный материал. Последнее особенно важно
в связи с тем, что в организмах растений и животных, так же как и в
бактериях, могут содержаться латентные вирусы. Поэтому отсутствие
адекватного контроля может привести к ошибочному суждению об этио-
логической роли обнаруженного вируса при изучаемом явлении. Следует*
однако, подчеркнуть, что на латентные вирусы не следует смотреть
только как на потенциальный источник ошибок. Обнаружение латентного
вируса может явиться для вирусолога важным сигналом, указывающим
на его возможную патогенность, а также послужить источником инфор-
мации, проливающей свет на природу взаимоотношений между вирусами
и организмом-хозяином и проблему происхождения вирусов.
Наконец, возможны случаи, при которых даже успешное заражение
может не привести к появлению каких-либо симптомов заболевания. Это
может случиться либо вследствие отсутствия достаточно активного раз-
множения вируса, либо из-за неспособности данного вируса вызвать
у избранного хозяина какие-либо патологические симптомы. В подобных
случаях вирусолог может провести так называемые «слепые пассажи»
в надежде, что в результате такого рода пассажей количество вируса
настолько увеличится, что путем заражения материалом последнего пас-
сажа иных организмов того же или другого биологического вида вирус
в конечном счете все же удастся обнаружить.
ВЫЯВЛЕНИЕ БАКТЕРИОФАГОВ
Главным симптомом действия фага на чувствительные бактерии яв-
ляется лизис, т. е. растворение бактериальных клеток, сопровождаемое
выходом в среду вновь образовавшихся фаговых частиц. Чувствительная
культура бактерий лизируется более или менее полно по мере размно-
жения фага, его выхода в среду и заражения им все новых и новых
бактериальных клеток. При заражении бактерий фагом часто может
наблюдаться и‘неполный лизис. Причиной его может явиться: 1) пре-
кращение роста бактерий из-за истощения питательной среды (а боль-
шинство фагов может размножаться только в таких бактериальных клет-
ках, у которых идет активный обмен веществ); 2) наличие в культуре
клеток, обладающих устойчивостью либо генетического (фагоустойчивые
мутанты), либо фенотипического происхождения (например, временная
утрата клеткой рецепторов, к которым присоединяется фаг); 3) лизоге-
ния, т. е. переход бактериальной клетки в состояние, при котором она
становится носителем генома фага и приобретает иммунитет к лизису
в случае повторного заражения этим фагом; в таких лизогенных культу-
рах иногда происходит высвобождение фаговых частиц. Если резистент-
ные, или иммунные, клетки будут расти быстрее, чем клетки, чувстви-
тельные к фагу и, следовательно, лизирующиеся, то может случиться
так, что лизис вообще не удастся обнаружить.
Часто решающее значение имеет состав культуральной среды. Неко-
торые фаги способны присоединяться к бактерии только при весьма
определенной концентрации или соотношении ионов (см. гл. IX). Состав
Выявление и идентификация вирусов
29
питательной среды или температура, при которой ведется инкубация, мо-
гут также либо избирательно усиливать, либо избирательно ослаблять
размножение фагов, а дакже и степень вызываемого ими лизиса бак-
терий.
Если на поверхности чашки с агаром содержится количество бакте-
рий, достаточное для образования сплошного слоя роста, то нанесение
надлежащего количества фага ведет к образованию локальных участков
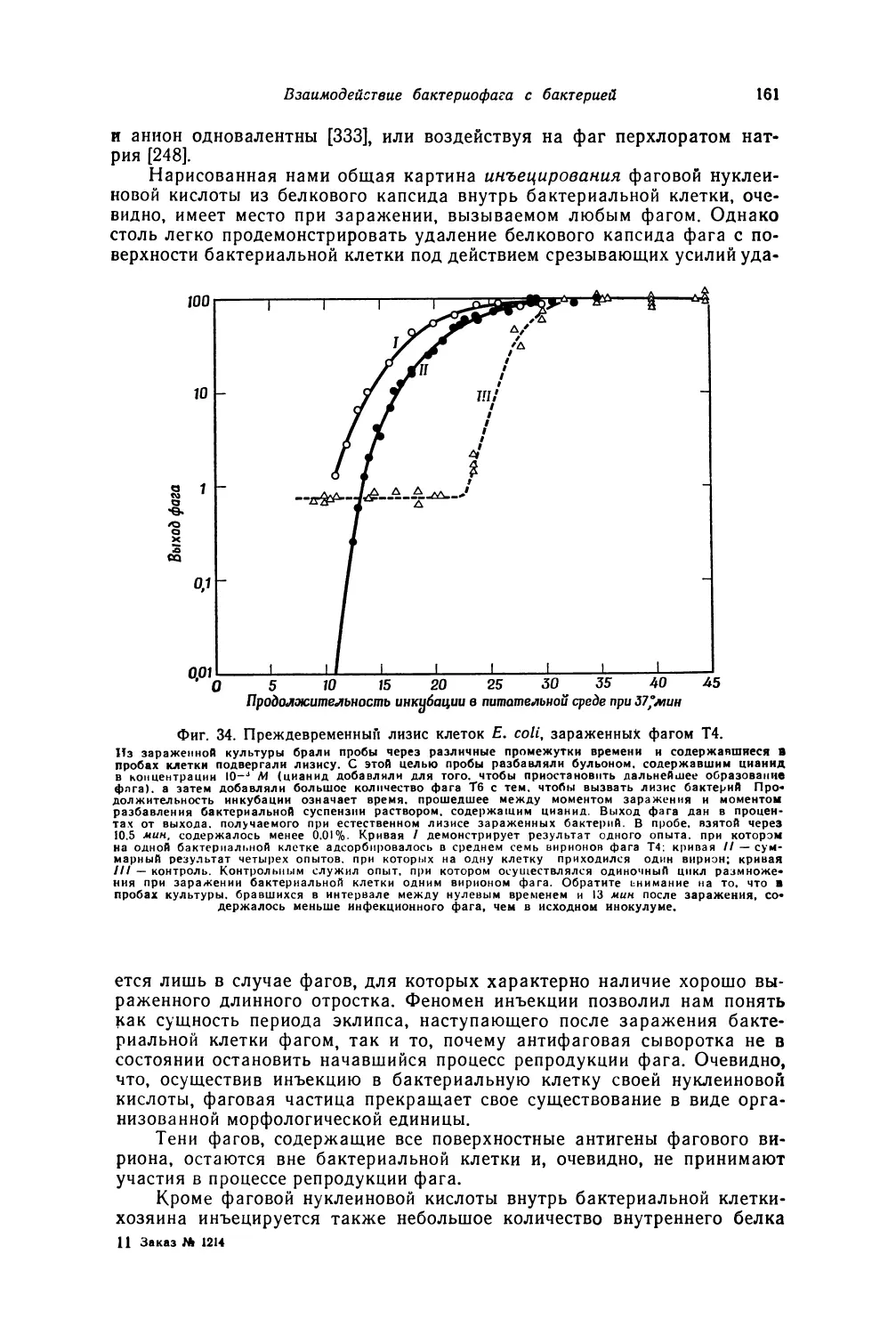
лизиса — так называемых бляшек (фото 1) L Бляшки представляют со-
бой колонии фагов. Смесь фага с бактериями либо прямо засевают на
поверхность чашки с агаром, либо сначала смешивают с жидким агаром,
а затем наслаивают на поверхность плотного агара (метод агаровых
слоев [291]).
В случае когда из-за истощения питательной среды или накопления
ингибиторов у бактерий прекращается обмен веществ, прекращается и
рост бляшек. Размер бляшек уменьшается также с увеличением концен-
трации агара, ибо в этом случае уменьшается скорость диффузии фага.
Их размер зависит и от размера фаговых частиц, ибо чем меньше вели-
чина фага, тем быстрее он диффундирует в агар, а также от скорости
репликации фага, скорости освобождения фаговых частиц из клеток и их
адсорбции на поверхности новой, неинфицированной бактериальной
клетки. Морфология бляшки обычно является признаком, характерным
для данного фага, и может служить ценным маркером при изучении гене-
тики фагов. По этому признаку можно судить о степени завершенности
лизиса, которая определяется в свою очередь конкуренцией между проз-
рачными и мутными бляшками, а также о иных аспектах репродукции
фага. Вследствие волнообразного изменения скорости роста бактерий
(возможно, из-за действия ингибиторов, выделяющихся при лизисе) мо-
жет наблюдаться образование кольцеобразных бляшек. Вследствие обра-
зования ферментов, обладающих способностью атаковать капсулу бакте-
рий и слизь [11, 635], или из-за неполного лизиса бактерий на периферии
вокруг бляшек могут образоваться ореолы.
На фото 1 представлены различные типы бляшек с прозрачным
центром, образуемых различными фагами при лизисе одних и тех же
бактерий, растущих на одинаковой питательной среде.
Приведенные на этой микрофотографии картины отнюдь не являют-
ся примерами самых резких из возможных различий. Образуемая фагом
бляшка содержит от 106 до 109 фаговых частиц, а иногда и больше.
Извлечение фагов из одной изолированной бляшки используется в ка-
честве метода выделения чистой линии фага.
Иной, нелитический тип фаговой инфекции приводит к изменениям
свойств бактериальной клетки, наблюдаемым при лизогении. Эти изме-
нения имеют большое значение для интерпретации взаимодействия фага
с бактериальной клеткой-хозяином и являются типичным проявлением
недеструктивного взаимодействия вирусов с клетками организма-хозяи-
на. Лизогенные бактерии выявляются либо благодаря их способности
время от времени высвобождать фаг, либо по наличию у них иммунитета
к повторному заражению (суперинфекции) (гл. XI).
ВЫЯВЛЕНИЕ ВИРУСОВ животных
Комплекс методов, которые следует использовать при изучении экс-
периментальных инфекций, определяется видом используемого живот-
ного и сложностью его организма. Кожа животных непроницаема для
вирусов. Поэтому для того, чтобы вирусы смогли достичь чувствитель-
1 Все фотографии помещены между стр. 320 и 321.
30
Глава II
ных клеток, следует либо прибегнуть к инъекции, либо к капельному
заражению, например нанося содержащий вирус материал на конъюнк-
тиву глаза или слизистую носа. Симптомы вирусной инфекции могут
наблюдаться на уровне клетки, ткани и всего организма в целом. Повы-
шение температуры, параличи и смерть; воспалительные и дегенератив-
ные изменения в тканях легких, печени и других органов; появление
геморрагических пятен на коже и слизистых; образование внутриклеточ-
ных включений, таких, например, как тельца Негри при бешенстве,— все
это симптомы, свидетельствующие о наличии вируса в организме и по-
зволяющие его идентифицировать. Однако даже в тех случаях, когда
заражение вирусом не приводит к появлению видимых симптомов, нали-
чие вируса в организме испытуемого животного может быть выявлено
по образованию специфических антител.
Характерным признаком определенной вирусной инфекции часто яв-
ляется латентный (инкубационный) период, т. е. время, прошедшее
между заражением вирусом и появлением симптомов соответствующего
заболевания. Так, например, у человека при заболевании корью этот
период длится 10—12 дней, при заболевании свинкой—18—21 день,
а при заболевании оспой — 12 дней. Длительность латентного периода
определяется временем, необходимым для достижения вирусом чувстви-
тельных клеток и проникновения его в клетку, продолжительностью ре-
продукции и выхода вируса из клеток, а также числом повторных циклов
репродукции, необходимых для того, чтобы в конечном счете число пора-
женных клеток было достаточным для проявления заболевания. Продол-
жительность инкубационного периода зависит также от количества вве-
денного вируса и пути его введения (см. гл. III).
Различия в путях введения вируса могут даже привести к различиям
в индуцируемых симптомах. Например, если вирус гриппа ввести мыши
в нос, то он вызовет у животного пневмонию, но если тот же вирус ввести
в большом количестве в мозг мыши, то он может вызвать токсические
симптомы, за которые ответствен абортивный цикл репродукции вируса
[328]. Вирус полиомиелита при введении в рот сначала локализуется
в клетках эпителия кишечника и лишь изредка проникает в центральную
нервную систему. Если же его ввести непосредственно в мозг, то он вы-
зовет энцефалит. Для работы с вирусами типа арбовирусов, переносимых
в естественных условиях от одного организма к другому членистоногими,
было разработано два метода заражения переносчиков: 1) непосредст-
венная инъекция вируса в организм переносчика и 2) кормление пере-
носчика кровью зараженного организма. При том и другом способе за-
ражения возникают локальные поражения слоев чувствительных клеток.
Удобной системой для индукции локальных поражений является
хориоаллантоисная мембрана куриного эмбриона [78]. Суспензия вируса,
нанесенная на эту мембрану, оказывается локализованной на слое
однотипных клеток, фиксированных на своеобразном матриксе, хотя и
влажном, но не слишком, так что вирус, выделяющийся из какой-либо
клетки мембраны, может распространяться в соседние клетки только
контактным способом, а не путем переноса к клеткам, расположенным
на отдаленных участках этой мембраны. На хориоаллантоисной мем-
бране хорошо растут многие вирусы. При этом образуются характерные
очаги поражения, выявление которых часто используется в целях диаг-
ностики (фото 2).
Еще более полезными для выявления вирусов оказались однослой-
ные культуры клеток, культивируемых in vitro. В вирусологии исполь-
зуют два типа однослойных культур: культуры, образуемые из клеток,
получаемых непосредственно из тканей животных (первичные культуры),
и культуры, образуемые из установившихся линий культивируемых кле-
Выявление и идентификация вирусов
31
ток (перевиваемые культуры). Инфицирование таких культур клеток мо-
жет привести либо к типичному цитопатическому эффекту, т. е. к дест-
рукции клеток, либо к их пролиферации. Если после инокуляции вируса
на слой клеток нанести смесь питательной среды с раствором затверде-
вающего агара, размножение вируса будет ограничено контактирую-
щими друг с другом клетками, в результате чего образуются очаги пора-
жений, или бляшки [196] (см. фото 3). Вообще говоря, всегда можно
подыскать несколько типов клеточных культур, на которых любой дан-
ный вирус будет образовывать характерные бляшки. Облегчить выявле-
ние бляшек можно путем обработки клеточных культур прижизненными
красителями (например, нейтральным красным), позволяющими отли-
чить живые клетки от мертвых. Использование однослойных культур
клеток и метода бляшек позволило применить для изучения вирусов
животных самые разнообразные методы и осуществить большое число
весьма тонких экспериментов (гл. XIII).
При заражении однослойных культур культивируемых клеток опу-
холеродными вирусами могут образоваться центры клеточной пролифе-
рации [559, 697]. Образование таких центров является результатом инду-
цированной вирусом модификации клеток. Эта вызываемая вирусом мо-
дификация приводит к тому, что клетки, которые ранее при размножении
могли расти только в виде монослоя (контактное ингибирование клеток)
[4], начинают расти, образуя многослойную культуру, т. е. наползая друг
на друга.
Может случиться, что вирус, впервые выделенный из инфицирован-
ного в естественных условиях материала, на используемой в экспери-
менте системе будет размножаться плохо. В этом случае успешное куль-
тивирование вируса станет возможным лишь после так называемой адап-
тации его к данной системе. Адаптация представляет собой селекцию
вариантов, способных размножаться в новом хозяине. Специфичность
вируса в отношении хозяина контролируется генетическими свойствами
как вируса, так и организма-хозяина и часто бывает весьма узкой. При
изучении вирусных инфекций таких видов животных, как, например,
мыши, в работе с которыми можно пользоваться чистыми линиями, воз-
никает возможность проанализировать ту роль, которую играют генети-
ческие свойства хозяина в специфичности эффектов, вызываемых дейст-
виями вируса. Например, за полную резистентность мышей линии PRI
к вирусу желтой лихорадки штамма 17D ответствен один доминантный
ген, подавляющий размножение вируса [707]. Чувствительность клеток
кур к определенному штамму вируса РАВ — так называемого Раус-ассо-
циированного вируса — также детерминируется одним доминантным ге-
ном [699].
Важным фактором, влияющим на результат вирусной инфекции, яв-
ляется также возраст животных-хозяев. Ко многим вирусам молодые
животные более чувствительны, чем взрослые. Некоторые из таких ви-
русов, и в особенности опухолеродные, вызывают типичное заболевание
только при заражении ими новорожденных животных. Предполагается,
что критическим фактором в этом случае является формирование вскоре
после рождения компетентной иммунологической системы. Способность
организма-хозяина образовывать противовирусные антитела может при-
вести либо к невозможности инфицирования организма вирусом, либо
к изменению типа вызываемой вирусом реакции. Например, вирус по-
лиомы вызывает у мышей и крыс опухоли только в том случае, если жи-
вотные заражаются вирусом в первые часы или дни после рождения.
С другой стороны, вирус лимфоцитарного хориоменингита у новорожден-
ных мышей вызывает бессимптомную инфекцию, а у взрослых мышей —
аллергическую воспалительную реакцию (гл. VI).
32
Глава II
В общем выделение вирусов из природных источников и их иденти-
фикация требуют от вирусолога применения всего его мастерства. Для
каждого вирусного заболевания приходится разрабатывать свои, спе-
циальные методы выделения вируса с тем, чтобы максимально увели-
чить шансы на успех. В основе всех этих методов лежат серийные пас-
сажи на чувствительных животных одного или нескольких видов и зара-
жение тканевых культур в сочетании с различными серологическими
тестами.
Освоение методов работы с тканевыми культурами привело к выде-
лению многих ранее неизвестных вирусов, причем не только из организ-
мов больных, страдавших заболеваниями различной степени тяжести и
ранее неизвестной этиологии, но также и из организмов или тканей, не
обнаруживавших каких-либо признаков заболевания и не считавшихся
вирусоносителями. Эти вирусы были открыты благодаря их способности
оказывать на тканевые культуры цитопатогенное или ингибирующее дей-
ствие. Иногда затем удавалось получить данные, позволявшие инкрими-
нировать некоторым из этих вирусов роль возбудителей уже известных
заболеваний. Однако часто создается впечатление, что в организме своего
естественного хозяина эти вирусы не вызывают никаких патологических
реакций. В подобных случаях возникает вопрос, не относятся ли эти
формы к числу вирусов, способных к установлению постоянных проч-
ных связей с организмом хозяина, или не образуются ли они вообще из
обычных компонентов клетки? (См. гл. XIX).
ВЫЯВЛЕНИЕ ВИРУСОВ РАСТЕНИЙ
Обычно для того, чтобы заразить растение вирусом, препарат ви-
руса втирают в листья. При этом обязательным условием успешного
заражения является разрыв клеточных оболочек. Обычно это происходит
само собой, когда лист трут пальцем, щеткой или марлей, а иногда с этой
целью к инокулуму приходится добавлять какой-нибудь абразив, напри-
мер карборунд. Многие вирусы (однако далеко не все), введенные в лист
путем механической инокуляции, вызывают на участках проникновения
вируса в клетки локальные поражения. Наиболее распространенным
типом таких поражений являются некротические поражения, которые
обычно имеют вид пятен желтого, коричневого или черного цвета, имею-
щих характерную форму. Часто вокруг этих пятен образуется кольцо или
ореол (фото 4). Образование таких дискретных очагов поражений яв-
ляется результатом крайне быстрой гибели зараженных клеток, благо-
даря чему некротический участок остается локализованным вблизи ме-
ста проникновения вируса. Например, при заражении вирусом табачной
мозаики (ВТМ) растений Nicotiana glutinosa или некоторых видов бобо-
вых растений некротические поражения образуются, но вирус далее не
распространяется, и растение выживает. Способность растения реагиро-
вать на заражение вирусом некротической реакцией обусловлена гене-
тически.
У перца, например, реакция на заражение ВТМ контролируется ге-
ном, существующим в трех аллельных формах. У растений, имеющих ген
L (доминантный), ВТМ вызывает локальные некрозы; у растений, гомо-
зиготных по гену — замедленную некротическую реакцию, приводящую
сначала к потере листьев, а затем к системной инфекции, а у растений,
несущих ген /,— реакцию, проявляющуюся в форме общего хлороза [365].
Можно вывести гибридные линии растений, обладающие желаемым ти-
пом реакции на заражение данным вирусом. Такие линии используются
как в экспериментальных целях, так и в практическом растениеводстве
(в целях защиты урожая).
Выявление и идентификация вирусов
33
Другим типом поражений листьев, локализующихся и выявляю-
щихся в месте проникновения вируса, являются очаги инфекции, выяв-
ляемые йод-крахмальной пробой [363]. В таких пораженных участках
листа нарушен обмен крахмала. Эти участки можно выявить, удалив из
них хлорофилл спиртом, а затем окрасив их йодом. Если исследуемое
растение предварительно находилось в светлом помещении (а свет, как
известно, стимулирует синтез крахмала в нормальных клетках), то пора-
женные вирусом участки из-за их неспособности адекватно реагировать
на действие света выявляются в виде светлых пятен на темном фоне.
Если же растение предварительно находилось несколько часов в тем-
ноте, то пораженные вирусом участки могут быть темнее, чем остальная
часть листа вследствие того, что скорость переноса крахмала от этих
пораженных участков снижается.
В тех случаях, когда не удается выявить локальные поражения, воз-
можность выявления вирусной инфекции часто зависит от способности
вируса индуцировать симптомы системного поражения: хлороз, мозаич-
ность, полосатость, желтуху, кольцевую пятнистость и скручивание
листьев. Перечисленные выше симптомы — это по существу термины,
описывающие специфические виды деформаций, обесцвечивания и ано-
малий роста, наблюдаемые у больных растений (фото 5). Обесцвечен-
ные участки листьев могут иметь кольцеобразную форму (кольцевая
пятнистость), быть неправильной формы (мозаичность), образовывать
полосы или, наконец, иметь вид более или менее равномерно пожелтев-
ших зон. Большинство этих изменений является либо следствием нару-
шения процессов фотосинтеза, либо нарушения транспорта питательных
веществ или воды вследствие повреждения проводящих тканей. Многие
своеобразные названия вирусных болезней растений как раз и отражают
характерные черты описанных выше симптомов (см. табл. 2).
Некоторые вирусы растений вызывают пролиферацию клеток, кото-
рая может привести к образованию энаций (т. е. выростов) — бородав-
чатых или компактных разрастаний, возникающих из жилок листа, или
к образованию истинных опухолей. Вирус раневых опухолей вызывает
образование множественных опухолей, возникающих главным образом
в местах поранений растений [82] (см. фото 6).
У цветков симптомы вирусной инфекции могут выражаться в фор-
ме пестролепестности. Пестролепестные тюльпаны, известные уже не-
сколько сот лет и особенно высоко ценящиеся, возникают в результате
заражения вирусом или группой вирусов. Эти вирусы либо вовсе не
повреждают растение, либо вызывают у растения незначительные по-
вреждения.
Симптомы системного поражения появляются обычно на вновь об-
разующихся листьях растения, возникающих уже после распростране-
ния инфекции. На старых, прекративших рост листьях соответствующие
симптомы можно вызвать лишь путем их непосредственного инфициро-
вания. Иногда может показаться, что растение выздоровело, так как
вновь появившиеся листья выглядят здоровыми, хотя в них еще содер-
жится вирус. Очевидно, что в подобных случаях мы имеем дело лишь
с кажущимся выздоровлением.
Симптоматика вирусной инфекции определяется не только вирусом
и его хозяином, но также и внешними условиями, в особенности темпе-
ратурой окружающей среды и характером питания растения. Некото-
рые вирусы не размножаются, если температура становится выше опре-
деленного значения. Более того, при некоторых вирусных инфекциях
вирусы можно даже убить, просто нагрев зараженное растение до
определенной температуры. Например, для того чтобы вылечить пер-
сиковые деревья от некоторых вирусных заболеваний, достаточно по-
3 Заказ № 1214
34
Глава II
грузить растения в воду, нагретую до 35° [480]. Возможно, что именно
чувствительностью к температурным воздействиям объясняется редкая
встречаемость некоторых вирусных заболеваний в областях, где летние
температуры оказываются выше тех температур, которые может вы-
держать данный вирус, вызывающий эти заболевания. В других слу-
чаях изменение температуры окружающей среды вызывает лишь изме-
нение симптомов вирусного заболевания. Так, например, ВТМ при тем-
пературе, превышающей 30°, вызывает у растений менее тяжелые симп-
томы поражения, чем при более низких температурах, поскольку при
этой температуре селективно размножается менее вирулентный штамм
вируса [364]. Все эти обстоятельства следует иметь в виду при выборе
растения для изучения вирусной инфекции в эксперименте и разра-
ботке условий содержания инфицированных растений.
Не всяким вирусом можно заразить растения путем простого ме-
ханического введения инфекционного материала в листья. Некоторые
вирусы передаются от одного хозяина к другому только членистоногими-
переносчиками. Эти членистоногие заражаются вирусом во время пита-
ния зараженным растением, а затем переносят вирус в чувствительную
ткань растения-реципиента (гл. XVII). Разработаны, однако, и методы
непосредственного введения вируса в организм насекомого-переносчика
[562, 822]. Можно также осуществить контролируемый перенос вируса
насекомыми-переносчиками, поместив насекомое сначала в клетку, содер-
жащую зараженные растения, а затем, после питания насекомого на
больных растениях, в клетку с незараженными растениями. Можно так-
же «накормить» насекомое бесклеточным экстрактом, содержащим
вирус.
Изящный метод был предложен для работы с вирусом курчавости
верхушки свеклы [63]. В этом случае переносчика вируса — цикадку
Circulifer tenellus, помещают в небольшую клетку, представляющую со-
бой стеклянный цилиндр, на одном из концов которого натянута тонкая
мембрана. На внешнюю сторону мембраны наносят капельки содержа-
щего вирус экстракта. Для того чтобы добраться до экстракта, насекомое
вынуждено пронзить мембрану стилетом. Тщательно регулируя освеще-
ние и иные условия, можно даже изменять время, в течение которого
насекомое питается. Затем цикадку переносят на здоровые растения.
При работе с вирусами растений широко применяется метод пере-
носа, в основе которого лежит прививка черенков или почек зараженных
растений на здоровые. Таким образом удается перенести вирус от при-
воя здоровому растению и вызвать у реципиента системную инфекцию.
При помощи данного метода можно перенести от одного хозяина к дру-
гому подавляющее большинство вирусов растений. Исключение состав-
ляют вирусы, поражающие такие растения, как, например, хлебные
злаки, так как у них либо очень трудно, либо вообще невозможно осу-
ществить прививку, а также вирусы, вызывающие только локальные по-
ражения.
Одним из тонких методов переноса вирусов растений является их
перенос при помощи паразитного растения — повилики (Cuscuta sp.).
Сначала этому растению дают возможность поселиться на зараженном
хозяине, а затем, после того как гаустории повилики проникнут в зара-
женные клетки и окажутся, таким образом, содержащими вирус, по-
вилику переносят на здоровое растение [410]. Используя повилику в ка-
честве переносчика, многие вирусы удается перенести на растения таких
видов, которые недостаточно родственны друг другу, чтобы между ними
можно было осуществить прививку. Пользуясь этим методом, можно
сравнить свойства вирусов, полученных из самых различных источников,
путем их размножения в клетках одного общего хозяина.
Выявление и идентификация вирусов 35
Доказательство вирусной этиологии болезней растений, передавае-
мых только насекомыми-переносчиками или путем прививки, часто яв-
ляется весьма трудной задачей. В качестве примера можно привести за-
болевание, выражающееся в появлении мозаичности у Abutilon (декора-
тивное растение) и переносимое от одного растения к другому только
насекомыми или с помощью прививки. Единственным доводом в пользу
того, что за данное состояние растения ответствен вирус, является сход-
ство симптомов этого заболевания с симптомами, вызываемыми другими
вирусами. В качестве еще одного примера можно привести картофель
сорта Кинг Эдуард, являющийся носителем вируса морщинистой курча-
вости листьев картофеля, на не обнаруживающий никаких симптомов
вирусного заболевания. Картофель обычно размножается вегетативно,
при помощи клубней, и все растения этого сорта заражены вирусом.
Патогенные свойства этого вируса могут быть выявлены путем прививки
инфицированного растения на другие сорта картофеля, после чего вирус
можно выделить и уже затем переносить механически обычным спосо-
бом [55].
Вирус картофеля сорта Кинг Эдуард обычно приводят в качестве
типичного примера латентного вируса, т. е. вируса, постоянно присутст-
вующего в организме хозяина, но не вызывающего в то же время ника-
ких симптомов заболевания. Несомненно, что и в теле растений, и в
организме животных содержится много таких латентных вирусов. Однако
характер их связи с клетками организма-хозяина, по-видимому, отли-
чается от той формы прочной связи, в которую вступает умеренный фаг
с бактерией, соединяясь в виде профага с хромосомой бактериальной
клетки. В некоторых случаях латентные вирусы могут оказаться дефект-
ными; при размножении таких вирусов репродуцируется только их ге-
ном, а зрелые вирионы не образуются (гл. VIII). Иногда таким дефект-
ным вирусом удается заразить другого хозяина. Это оказывается воз-
можным либо в результате мутационной реверсии к форме, способной
давать зрелые вирионы, либо при использовании метода, позволяющего
заражать растения чистой вирусной нуклеиновой кислотой. Что же ка-
сается вирусов растений, которых удается перенести от хозяина к хозя-
ину только с помощью насекомых-переносчиков, повилики или путем
прививки, то в настоящее время мы не можем ответить на вопрос, пере-
даются ли в этих случаях от хозяина к хозяину полные вирионы или
инфекционная вирусная нуклеиновая кислота.
3
Глава III
ТИТРОВАНИЕ ВИРУСОВ
ИНФЕКЦИОННАЯ ЕДИНИЦА
Активность вируса измеряется путем определения количества содер-
жащего вирус материала, необходимого для того, чтобы вызвать у хо-
зяина специфическую реакцию. Индуцируемая вирусом реакция может
быть либо типа «все или ничего» (т. е. произошло инфицирование или
нет), либо может быть выражена количественно, например в виде про-
должительности времени, необходимого для проявления инфекции, или
в виде числа поражений, образовавшихся в слое чувствительных клеток.
Количественное определение вирусной активности и называется титро-
ванием.
Несмотря на то что эта процедура была названа титрованием, тит-
рование вируса по своему смыслу ближе к подсчету числа жизнеспо-
собных бактерий, чем к химическому титрованию. Действительно, при
химическом титровании определяют количество стандартного химиче-
ского вещества, необходимое для специфического взаимодействия с не-
известным количеством другого, анализируемого, химического вещества.
Ни один метод химического титрования не обладает чувствительностью,
необходимой для измерений в той области концентраций, в которой
любое изменение числа молекул, содержащихся в анализируемом ра-
створе, может повлиять на конечный результат анализа. В свою очередь
хорошо известно, что при титровании вируса вирус может воспроизвести
ранее наблюдавшийся результат путем усиления эффекта, вызываемого
очень малым количеством вируса, вследствие чего проявления действия
малого или большого количества вируса часто бывает невозможно отли-
чить друг от друга. Иными словами, вследствие того что при титровании
вирусов конечный результат может определяться действием единичного
элемента, т. е. одного вириона или одной молекулы нуклеиновой кис-
лоты, мы часто наблюдаем реакцию типа «все или ничего».
Титруя вирус, мы определяем наименьшее количество вирусной сус-
пензии, способное вызвать у чувствительного хозяина распознаваемое
проявление инфекции, а именно общее заболевание или локальное пора-
жение. Наименьшее количество вируса, способное вызвать соответствую-
щую реакцию, называется инфекционной единицей. В свою очередь титр
исходной вирусной суспензии выражается в количестве инфекционных
единиц, содержащихся в единице объема. Например, если наименьшее
количество суспензии вируса гриппа, вызывающее у мыши пневмонию
при интраназальном введении инфицированной эмульсии ткани легкого
в разведении 1 106, равно 0,1 мл, то это значит, что титр вируса гриппа
в исходной эмульсии ткани легкого равен 107 инфекционных единиц на
1 лы (1/(10-1 10-6) = 107).
Как правило, обязательным компонентом метода титрования являет-
ся тест, позволяющий оценить результат инокуляции как положительный
или отрицательный. При титровании вирусов животных, например, таким
тестом может быть наличие или отсутствие видимых поражений в куль-
туре клеток, воспалительная реакция на месте инокуляции вируса в ко-
36
Титрование вирусов
37
жу и роговицу, параличи, возникающие в результате введения вируса
в мозг, и т. д. Иногда репродукцию вируса можно выявить и при отсут-
ствии видимой реакции со стороны организма-хозяина. В качестве при-
мера можно привести выявление гемагглютининов в аллантоисной жид-
кости куриных эмбрионов, зараженных миксовирусами. Наиболее удов-
летворительные результаты как при титровании вирусов животных, так
и при титровании вирусов растений и бактерий дают методы, в основе
которых лежит подсчет числа дискретных поражений, образуемых на
определенной площади слоя клеток, зараженных известным количеством
содержащего вирус материала. Очевидно, что подсчет числа вызываемых
вирусом локальных поражений или, как их иначе называют, бляшек,
подобен подсчету числа колоний, образуемых бактериями на агаре (за
исключением, однако, титрования вирусов растений путем подсчета числа
пораженных участков на листьях, в случае которого между этими мето-
дами нет полного соответствия, см. стр. 44).
ТИТРОВАНИЕ БАКТЕРИОФАГОВ
Наиболее точным методом титрования бактериофагов является ме-
тод, основанный на подсчете числа образуемых ими бляшек. Согласно
этому методу, суспензии фага определенного разведения и объема, содер-
жащие избыточное количество бактерий, засевают на чашки с содержа-
щей агар питательной средой соответствующего состава либо обычным
путем, либо методом агаровых слоев [291].
Фиг. 1. Линейная зависимость между числом бляшек и концентрацией фага в суспен-
зии, использованной для инокуляции [215].
Результаты получены при анализе двух препаратов бактериофага.
Число бляшек, образующихся в результате инкубации на сплошном
слое бактерий, прямо пропорционально количеству внесенного в чашку
фага (фиг. 1).
Пусть у — число образовавшихся бляшек, и— объем суспензии фага
(в мл), нанесенной на чашку с агаром, а х — разведение нанесенной сус-
пензии; тогда титр суспензии и, выраженный в числе бляшкообразующих
единиц на 1 мл, будет равен
их
38
Глава III
Допустим, например, что при инкубации чашек, в которые было внесено
по 0,1 мл суспензии фага в разведении 1 105, образовалось в среднем
по 230 бляшек на чашку. Следовательно, титр исходной суспензии фага
равен в этом случае 230/(0,1 • 10-5) =2,3-108 бляшкообразующих единиц
на 1 мл.
В случае если при титровании фага на каждое разведение берут по
N чашек и принимают, что распределение бляшек в каждой из серий
является случайным (т. е. из всех возможных ошибок учитывают только
ошибку выборки), то стандартное отклонение а будет равно корню квад-
ратному из среднего числа бляшек и, приходящегося на одну чашку.
Сравнивая экспериментально найденную величину стандартного откло-
нения
о' - д/ —«)2
У N— 1
с теоретической величиной а, можно получить представление о том, на-
сколько распределение частиц действительно является случайным. Чем
— а'
больше величина и, тем меньше будет коэффициент вариации _^=_-
Конечно, если число бляшек будет слишком велико, то они сольются
друг с другом и подсчитать их станет невозможно. Стандартная ошибка
среднего и определяется выражением t/j/W. Следовательно, чем большее
число чашек берут для титрования одного разведения, тем ближе прибли-
жается найденная величина п к ее истинному значению.
Кроме ошибки выборки, причиной которой является случайное рас-
пределение фаговых частиц, при титровании фагов возможны и некото-
рые другие ошибки, являющиеся следствием процедуры разведения. На-
пример, если при титровании использовано 5 разведений, причем каждое
разведение проведено с ошибкой порядка 9%, то вероятная ошибка всей
серии разведений будет равна 9]/5%.
При любом методе титрования вирусов каждое последовательное
разведение должно выполняться другой пипеткой. В отличие от химиче-
ского титрования при титровании вирусов это требование является со-
вершенно обязательным, ибо вирусная активность часто бывает столь
велика, что даже при коэффициентах разведения, равных 1 10 или
1 100, приходится готовить много последовательных разведений. Оче-
видно, что едва ли можно обычным промыванием полностью отмыть от
вируса пипетку, содержавшую миллиарды вирусных частиц.
Эта очевидная предосторожность часто игнорируется начинающими
вирусологами, в связи с чем этот вид небрежности был даже удостоен
специального термина и назван «ошибкой пипетирования».
ТИТРОВАНИЕ ВИРУСОВ животных
Локальные поражения, бляшки и «фокусы» трансформации
или пролиферации
Для того чтобы разработать методы титрования вирусов животных,
равноценные титрованию фагов путем подсчета числа бляшек, был
испробован ряд подходов. Одной из относительно удобных возможностей
явилось использование дискретных поражений или пятен типа оспин,
образующихся на хориоаллантоисной мембране куриного эмбриона [78].
Титрование вирусов
39
В зависимости от вида вируса на такой зараженной мембране удается
подсчитать от 20 до 100 пятен. Однако этот метод можно использо-
вать для титрования лишь некоторых вирусов, ибо большинство из них
не вызывает подобных изменений хориоаллантоисной мембраны. Еще
более ограниченное значение имеет метод, в основе которого лежит под-
счет пустул, образуемых некоторыми вирусами на скарифицированных
участках кожи или роговицы кролика. Данный метод используется в
основном лишь при определении титра вируса в оспенных вакцинах.
Большой шаг вперед был сделан при введении в вирусологию ме-
тода однослойных культур клеток, растущих in vitro [200]. Цитопатиче-
ские вирусы, т. е. вирусы, вызывающие деструкцию клеток, образуют
в клеточных культурах бляшки, число которых соответствует количеству
вируса, использованному для заражения культуры. Таким образом обес-
печивается наиболее точное титрование вирусов животных, конечный
результат которого, подобно титрованию фагов, выражается в количе-
стве бляшкообразующих единиц. Аналогичным образом титруют опухо-
леродные вирусы, дающие очаги пролиферации. В этом случае титр ви-
руса выражают числом единиц, образующих очаги поражения [697].
Вирусы, которые не вызывают видимых цитопатических поражений
или фокусов пролиферации, тем не менее также можно титровать путем
подсчета числа локальных участков поражений типа фокусов пролифе-
рации, но несколько иного типа. Например, при заражении культуры
клеток вирусами, образующими гемагглютинины, в монослое чувстви-
тельных клеток появляются участки, в которых сосредоточены клетки,
содержащие вирус. Эти клетки можно выявить при помощи так назы-
ваемого метода гемадсорбции. Гемадсорбцией называется способность
клетки связывать добавленные к культуре эритроциты и удерживать их
на своей поверхности, несмотря на отмыв культуры [759]. Еще одна воз-
можность количественного титрования вирусов состоит в подсчете под
микроскопом числа поликариоцитов или синцитиальных участков, обра-
зуемых в однослойных клеточных культурах при заражении их некото-
рыми вирусами, например вирусом герпеса.
Метод конечных разведений
Некоторые вирусы животных не удается титровать на однослойных
клеточных культурах. Их титрование оказывается возможным только
при помощи тех или иных вариантов метода конечных разведений.
Согласно этому методу, чувствительным животным или в чувствительные
культуры клеток вводят определенный объем суспензии вируса в после-
довательно возрастающих разведениях и, учитывая результат каждого
введения как положительный или отрицательный, рассчитывают затем
конечную точку титрования. В этих случаях инфекционный титр выра-
жают в количестве инфекционных единиц на 1 мл. Эту величину рассчи-
тывают, исходя из допущения, что в последнем разведении, давшем поло-
жительный результат, содержится по меньшей мере одна инфекционная
единица. Обычно готовят серийные разведения с коэффициентом разве-
дения, равным 10,1^10 или 2. Очевидно, что чем меньше коэффициент
разведения, тем более точную величину титра удается получить.
При проведении титрований подобного типа всегда может наблю-
даться неопределенная зона, т. е. такая зона, в которой одно какое-то
разведение может дать отрицательный результат, а какое-то следующее,
большее разведение — положительный. Это объясняется тем, что одна
инфекционная единица часто представляет собой одну активную вирус-
40
Глава III
ную частицу, которая случайно может попасть не в менее разбавленный,
а в более разбавленный инокулум L
В случае если исследуют действие нескольких проб одного и того
же разведения, точность титрования методом конечных разведений повы-
шается. Вблизи конечной точки титрования в одном или нескольких раз-
ведениях могут выявиться как положительные, так и отрицательные ре-
зультаты. Обычно путем интерполяции определяют разведение, дающее
50% отрицательных результатов, и титр выражают числом 50%-ных
инфекционных доз, LD50 (табл. 4).
Таблица 4
Титрование вируса путем определения 50%-ной конечной точки1) титрования [637]
Разведение Объем инокулума Количество положи- тельных результатов (гибель) Количество отрица- тельных результатов (выживание) Положительные результаты, %
Ю-з 0,1 МЛ 4 0 100
10—4 0,1 » 4 0 100
Ю-з 0,1 » 3 1 75
10-е 0,1 » 1 3 25
10-7 0,1 » 0 4 0
0 50%-ная конечная точка = 10 5*5-0,1 мл суспензии разведения 10-5*5=0,1 -3,16- 10-6 мл =
= 1LD5o. Титр в LD50 на 1 мл = ----------------------- =3,16- 10е.
ОД 3,16 10 -«
Табл. 5 демонстрирует использование усовершенствованного ва-
рианта этого метода, введенного Ридом и Менчем [671] и особенно ши-
роко используемого при титровании противовирусных сывороток.
Согласно методу Рида и Менча, процент положительных результатов
рассчитывается исходя не из действительных частот ответов, наблюдае-
мых при различных разведениях, а из так называемых «аккумулирован-
ных сумм» положительных и отрицательных результатов, используемых
затем для расчета величины LD50 путем интерполяции. В основе метода
Рида и Менча лежит допущение (не являющееся, однако, общепризнан-
ным), согласно которому каждый испытуемый объект (например, мышь
или куриный эмбрион), ответивший положительно на введение вируса
данного разведения, ответит положительной реакцией и на введение
более концентрированного вируса. И наоборот, в случае если данное
разведение дало отрицательную реакцию, постулируется, что при введе-
нии пробы большего разведения также обязательно будет получена
отрицательная реакция.
Таблица 5
Титрование вируса по методу Рида и Менча ])
Разведение Количество положитель- ных результа- тов Количество отрицательных результатов Общее количество положительных ре- зультатов (в данном разведении и всех более высоких) Общее количество отрицательных ре- зультатов (в данном разведении и всех более низких) Доля положи- тельных результатов, %
Ю-з 4 0 11 0 100
10-4 4 0 7 0 100
10-5 2 2 3 2 60
10-6 1 3 1 5 16
10-7 0 4 0 9 0
*) 50%-ная конечная точка титрования рассчитана методом графической интерполяции [504].
1 Предположим, что в 1 мл суспензии разведения 10~4 содержится 50 частиц. Тог-
да в 0,1 мл такой суспензии в среднем будет содержаться 5 частиц, в 0,1 мл суспензии
разведения 10-5 — в среднем 0,5 единицы, а в 0,1 мл суспензии разведения 10-6 —
в среднем 0,05 единицы. Поэтому возможно, что в 0,1 мл суспензии разведения 10-6
будет содержаться 1 частица (в 1 пробе из 20), а в 0,1 мл суспензии разведения
10-5 — ни одной (в одной пробе из двух).
Титрование вирусов
41
Этот метод расчета является строгим лишь в том случае, если верно
допущение о том, что за флуктуации реакций, наблюдаемые при введе-
нии проб одного разведения, ответственна только различная индиви-
дуальная чувствительность хозяина по отношению к титруемому агенту.
Возможно, что это допущение справедливо при титровании токсических
веществ, для которых этот метод и был, кстати, вначале предложен,
однако весьма сомнительно, чтобы оно строго выполнялось при титрова-
нии вирусов. Поскольку при благоприятных обстоятельствах вирусная
инфекция может быть инициирована единичной вирусной частицей, ясно,
что вблизи конечной точки титрования, по крайней мере частично, ре-
зультат будет зависеть от вероятности присутствия или отсутствия
в инокулуме дискретных частиц. Следовательно, при титровании вирусов
методом Рида и Менча следует пользоваться с известной осторож-
ностью.
Следует иметь в виду, что при любом методе титрования вирусов жи-
вотных конечный результат (т. е. получаемая величина титра вируса)
зависит не только от количества вируса, но также и от способа введения
вируса, свойств организма-хозяина и многих других факторов. Поэтому,
если получаемые результаты подлежат сравнению друг с другом, необ-
ходимо стандартизировать эти факторы. У интактного животного все
виды защитных механизмов — механические, гуморальные и клеточ-
ные— направлены на то, чтобы уменьшить вероятность развития инфек-
ции. Аналогичным образом условия культивирования культуры клеток
in vitro могут повлиять на вероятность образования бляшек. Поэтому
величины получаемых титров в действительности соответствуют числу
инфекционных единиц, реализующихся при данных конкретных условиях
постановки опыта. Например, препарат вируса при титровании на кури-
ных эмбрионах может иметь титр 108, а при титровании на мышах или
на монослое клеток in vitro— 106 или 105 на 1 мл соответственно. Эти
отличия являются следствием различной возможности успешного инфи-
цирования, а также в определенной степени результатом наличия в ис-
ходном препарате нескольких типов вирусных частиц, отличающихся
друг от друга по способности эффективно атаковать различных хозяев.
Эта ситуация аналогична наблюдаемой при титровании бактериальной
суспензии, когда число колоний, образуемое суспензией, зависит от того,
насколько оптимальной по составу является среда, использованная для
посева.
Метод титрования, в основе которого лежит определение
длительности инкубационного периода
Для титрования вирусов методом конечных разведений требуется
большое количество животных, и чтобы обойти это затруднение, были
предложены иные методы титрования. В основе одного из интересных
методов, предложенных с этой целью, лежит часто наблюдаемая весьма
точная зависимость между количеством введенного вируса и длитель-
ностью инкубационного периода, т. е. временем, прошедшим с момента
заражения до появления ожидаемого симптома. Например, между интер-
валом времени t от момента введения в кожу кролика вируса папилломы
до появления самой папилломы и концентрацией вируса С в инокулуме
существует следующая зависимость:
— Zj = & (10g С! —log С2).
График зависимости между t и log С имеет вид прямой. Поэтому при
титровании суспензии вируса папилломы неизвестного титра можно поль-
зоваться калибровочной кривой (фиг. 2).
42
Глаза III
Подобного рода обратная зависимость между концентрацией вируса
и временем появления симптомов заболевания или гибели хозяина на-
блюдается при титровании многих вирусов. Поэтому для получения бо-
лее точной величины титра вируса наряду с результатами, полученными
при титровании методом конечных разведений, следует учитывать и дан-
ные, выражающие зависимость между количеством введенного вируса и
длительностью инкубационного периода [301].
Фиг. 2. График, демонстрирующий обратную зависимость между продолжительностью
инкубационного периода и логарифмом количества вируса папилломы Шоупа, исполь-
зовавшегося при инокуляции [107].
pl — десятичный логарифм коэффициента разведения.
Зависимость типа t2—tx = b (logCi—logCz) можно интерпретировать
как указание на то, что симптомы заболевания (или гибель хозяина) по-
являются, когда концентрация вируса достигает критического значения,
а репродукция вируса представляет собой экспоненциальный процесс L
Гард [254], работая с вирусом энцефалита мышей, наблюдал иную зави-
1 Допустим, что У — предельная концентрация вируса, при которой еще появля-
ются симптомы заболевания, а зависимость между количеством введенного вируса у
и временем появления симптомов выражается уравнением
у = ekt\ log у = kt.
Допустим затем, что Т — время, которое должно пройти для того, чтобы из 1 ин-
фекционной единицы образовалось У инфекционных единиц вируса. Тогда время tu
в течение которого из инокулума, содержащего Ci инфекционных единиц, образуется
У инфекционных единиц вируса, будет меньше времени Т на величину, которая тре-
буется для того, чтобы из 1 инфекционной единицы образовалось Ci инфекционных
единиц:
log У-log С, = k [Г — (T —Л)] = ktx. (а)
По аналогии для инокулума С2 можно написать
log Г-log С2 = Л [Т — (Г — /2)] = kt2. (б)
Вычитая а из б, получим
log Ct— log С2 = k (t2 — Л).
Титрование вирусов
43
симость между временем появления параличей и концентрацией вируса
в инокулуме. Зависимость, приводимая Гардом, имеет следующий вид:
(10g Q —log С2).
ч h
Это уравнение наводит на мысль, что при инфекции, изучавшейся
Гардом, имело место ускорение скорости размножения вируса по мере
развития заболевания. Такой процесс может, например, иметь место
в случае прогрессивного возрастания способности вируса преодолевать
защитные силы организма-хозяина с увеличением концентрации вируса.
ТИТРОВАНИЕ ВИРУСОВ РАСТЕНИИ
Вирусы растений в тех случаях, когда это возможно, титруют путем
подсчета числа некротических или иных поражений, появляющихся на
листьях, зараженных вирусом. Этот метод был разработан Холмсом* [362]
Фиг. 3. Зависимость между числом некротических поражений, вызываемых вирусом
табачной мозаики на листьях Nicotiana glutinosa, и концентрацией вируса в инокулуме.
Концентрация вируса выражена в числе единиц вирусного антигена, определенном при помощи ре-
акции преципитации.
с целью титрования вируса табачной мозаики, но затем был применен
для титрования многих других вирусов растений. При титровании по
этому методу пробы серийных разведений содержащих вирус препара-
тов втирают в поверхность листьев чувствительных растений. Лист раз-
глаживают и, беря в руку марлю или иной подходящий материал, смо-
ченный вирусной суспензией, втирают вирус в лист. Исходя из числа по-
ражений, возникающих после втирания суспензии вируса определенного
разведения, рассчитывают количество вируса, содержащегося в исход-
ной суспензии (фиг. 3).
При титровании вирусов растений успех и достоверность получаемых
результатов в большой мере зависят как от наличия у экспериментатора
опыта, так и от стандартизации применяемых процедур. Так, например,
число возникающих на листе пораженных участков (очагов поражений)
существенно зависит от силы, с которой вирус втирается в лист, ибо раз-
множаться могут лишь те вирусные частицы, которые проникают в клет-
ки листа через разрывы его поверхности. Если суспензию вируса предва-
рительно смешивают с каким-либо абразивным порошком, например кар-
борундом, или этот абразивный порошок наносят на лист до нанесения
вирусной суспензии, то, как правило, число пораженных участков, обра-
зующихся после втирания вируса, существенно увеличивается. Если же
лист сначала натирают, а затем через различные интервалы времени
44
Глава III
погружают в суспензию вируса, то с увеличением промежутка времени
между натиранием листа и нанесением вируса число образуемых очагов
поражений уменьшается, ибо сказывается результат происходящих в этот
период процессов регенерации поверхности листа.
В исходный метод Холмса впоследствии был введен ряд усовершен-
ствований. Так, согласно одному из них, два сравниваемых образца ви-
руса втирают в две противоположные половинки одного и того же листа
или в разные листья, а затем подсчитывают число очагов поражения,
возникших при заражении каждым из образцов. Оказалось, что резуль-
таты, получаемые при титровании одной и той же суспензии вируса,
варьируют не только тогда, когда титрование проводят на разных расте-
ниях, но даже и в случае титрования на разных листьях одного растения
в зависимости от положения листа на стебле. Напротив, результаты, по-
лучаемые при титровании на двух половинках одного и того же листа,
очень хорошо совпадают. При титровании по методу латинских квадра-
тов [933] серию образцов сравнивают путем втирания их в разные листья
нескольких растений. При этом один и тот же образец втирают в листья,
взятые с различных участков разных растений. В случае когда число
растений или листьев, имеющихся в распоряжении исследователя, огра-
ниченно, используют более точные схемы [932]. Установлено, что для тит-
рования ВТМ с точностью не менее 10% необходимо использовать около
50 растений. Для того чтобы повысить точность титрования, были разра-
ботаны специальные методы статистического анализа [310, 355].
Зависимость между числом некротических поражений, индуцируе-
мых на листьях вирусом, и концентрацией вируса является нелинейной
и описывается кривой, приведенной на фиг. 3. Из этой кривой можно ви-
деть, что число поражений с увеличением концентрации вируса увеличи-
вается не беспредельно. Это объясняется тем, что максимальное число
поражений, которое можно получить на одном листе, используя стан-
дартную технику заражения, не может превышать числа поранений на
поверхности листа, через которые вирус может проникнуть в клетки.
Поэтому точной мерой активности вируса служит отношение числа пора-
жений, возникших в данном опыте, к их максимальному числу, т. е.
к числу поражений, которые возникают при заражении листа наиболее
концентрированным образцом вируса. Желательно работать в той об-
ласти концентраций, для которой кривая зависимости числа поражений
от концентрации вируса идет наиболее круто и ближе всего к прямой,
ибо именно в этом диапазоне изменение концентрации вируса особенно
сильно сказывается на числе образуемых поражений.
СТАТИСТИЧЕСКАЯ ИНТЕРПРЕТАЦИЯ ПОНЯТИЯ
«ИНФЕКЦИОННАЯ ЕДИНИЦА»
Определение инфекционной единицы как наименьшего объема сус-
пензии вируса, способного вызвать положительный эффект, подразуме-
вает существование некоего критического количества вируса. Каково же
это критическое количество? Рассмотрим две крайние возможности. Сна-
чала примем, что положительная реакция на введение вируса может
быть получена лишь в случае, если материал, содержащий вирус, будет
введен в организм в количестве, достаточном для достижения какой-то
минимальной концентрации вируса. Эта ситуация аналогична той, кото-
рую мы наблюдаем в случае яда, токсическое действие которого на орга-
низм может проявиться лишь при достижении некоторой минимальной
концентрации яда. Другой крайностью является предположение, что по-
ложительный эффект может быть лишь результатом случайного содер-
жания в инокулуме по меньшей мере одной гирусной частицы, способной
Титрование вирусов
45
вызвать инфекционный процесс, аналогично тому, как рост бактерий на
питательной среде зависит от наличия в инокулуме хотя бы одной полно-
ценной бактериальной клетки. Если верной является вторая гипотеза, то
тогда титр, выраженный в инфекционных единицах, скорее является ве-
личиной, отражающей число вирусных частиц, чем число, кратное мини-
мальной эффективной концентрации. (Однако справедливость второй
гипотезы не означает, что величина титра обязательно равна общему
количеству вирионов, содержащемуся в данном объеме; см. стр. 48.)
Подсчет числа бляшек
В случае когда титр определяется путем подсчета числа образуемых
фагом бляшек выбор между первой и второй гипотезами не представ-
ляет затруднений. Действительно, подсчет числа бляшек совершенно
аналогичен подсчету числа колоний, осуществляемому при определении
титра бактерий. Зависимость между числом образовавшихся бляшек и
числом фаговых частиц, содержащихся в инокулуме, является строго
линейной (см. фиг. 1). Эту линейную зависимость можно объяснить
только исходя из допущения, что каждая бляшка образуется в резуль-
тате действия одной-единственной материальной частицы. Если бы для
возникновения бляшки требовалось более одной фаговой частицы, то при
уменьшении количества вносимого фага число образующихся бляшек
уменьшалось бы быстрее, чем при линейной зависимости [531]. Аналогич-
ные соображения справедливы и для подсчета числа бляшек, образуемых
вирусами животных, ибо и в этом случае число бляшек растет линейно
с увеличением концентрации вируса !.
Метод конечных разведений
Независимое распределение материальных частиц в индивидуальных
объектах описывается так называемым распределением Пуассона
Л = (III. 1)
где s — среднее число частиц, приходящихся на один объект, г — дейст-
вительное число частиц, содержащихся в данном объекте, г! = г(г—1)Х
X (г—2)...-3-2-1, а рт—вероятность содержания в данном индивидуаль-
ном объекте г частиц (и, следовательно, ожидаемая частота индиви-
дуальных объектов, содержащих г частиц). Если г = 0, то pQ = e~s (ибо О!
по определению равен 1). Это выражение дает частоту индивидуальных
объектов, не содержащих ни одной частицы. Очевидно, что частота инди-
видуальных объектов, содержащих одну частицу, определяется формулой
1 Предположим, например, что образование 100 бляшек в чашке, содержащей
108 клеток, явилось результатом инфекции, вызываемой попаданием в клетку одной
частицы. Это означает, что в данном случае на 106 клеток приходится одна инфи-
цированная клетка и, следовательно, одна частица. При уменьшении объема инокулума
вдвое число инфицированных клеток и. следовательно, число образовавшихся бляшек
также уменьшится вдвое (линейная зависимость). Допустим теперь, что для индукции
инфекции требовалось две частицы. Поскольку относительное число инфицированных
клеток (в которые попали две частицы) по-прежнему равно 10-6, относительное число
таких клеток, в которые попала одна частица, равно 10-3 (10-3 10-3=10-6). Следо-
вательно, таких клеток будет 103 на каждый миллион клеток. Уменьшение объема
инокулума вдвое приведет к уменьшению числа клеток, зараженных одной частицей,
до величины 9
а числа клеток, зараженных двумя частицами, — до величины
- * = * . Следовательно, разведение 1 : 2 должно привести к уменьшению
(2-103)2 4-Ю6
числа бляшек до 1 4 (квадратичная зависимость).
46
Глава III
pi = se~s, а частота индивидуальных объектов, содержащих две частицы,
$2
формулой Р2=— e~s и т. д. Действительная частота распределения бля-
шек в серии чашек, зараженных равными количествами нескольких раз-
ведений суспензии фага, подобно частоте распределения колоний бакте-
рий, очень хорошо согласуется с величинами, рассчитанными по формуле
(III. 1).
Формула (III. 1) применима и для случаев титрований, результат
которых оценивается по реакции типа «все или ничего», например по
наличию или отсутствию заболевания у зараженного животного. При
Фиг. 4. Теоретическая зависимость между частотой встречаемости объектов, дающих
положительную реакцию (т. е. объектов, содержащих по меньшей мере п частиц), и
концентрацией частиц в инскулуме [491].
Кривые I, II, III и IV демонстрируют ожидаемые частоты для п=1, л=2. п=3 и п=4 соотгетствен-
по. По оси абсцисс отложен логарифм концентрации (в произвольном масштабе), по оси ординат —
частота положительных проб. Обратите внимание на увеличение крутизны кривой по мере возрас-
тания минимального числа частиц, требуемого для того, чтобы вызвать поражение.
этом, однако, возникает следующий вопрос: ответственно ли за положи-
тельный эффект (в случае его наличия) действие одного вириона или
кумулятивное действие минимального числа вирионов, которое больше
единицы?
Пусть среднее число частиц, приходящееся на индивидуальный
объект, равно, как и ранее, s. Пользуясь формулой (III. 1), найдем, ка-
кова вероятность того, что на одну особь приходится более 0 частиц, бо-
лее 1 и более 2 частиц.
Рг>0 = 1 — Ро = 1 — e~s, (III. 2)
pr>l = 1 - (Pl + Ро) = 1 - (s + l)e-\ (III. 3)
pr>2 = 1 - (p2 + pt + p0) = + s + Ip-5 (П1. 4)
Эти формулы позволяют также рассчитать частоту индивидуальных
объектов, содержащих по меньшей мере 1, 2 или 3... частицы. Эта вели-
чина зависит от среднего числа частиц. Кривые, изображенные на фиг. 4,
демонстрируют зависимость величины рг>п-\ от log s для различных
значений п.
Форма кривых, выражающих зависимость р от log s, отражает тот
факт, что чем больше частиц требуется для индукции эффекта, тем более
резко частота положительного эффекта зависит от концентрации вируса,
ибо в этом случае переход от концентраций, при которых все индиви-
дуальные объекты получат недостаточное число частиц, к концентра-
циям, когда число частиц у всех таких объектов окажется больше мини-
мального, будет происходить быстрее.
Титруя вирус, мы готовим серию разведений и действие каждого
разведения вируса испытываем на серии одинаковых индивидуальных
Титрование вирусов
47
объектов. Среднее (неизвестное) число вирионов в каждой серии про-
порционально концентрации. Проведя титрование, мы строим график
зависимости частоты положительных эффектов от логарифма разведе-
ния. Эта частота будет отражать наличие или отсутствие необходимого
минимума частиц. Полученный результат можно сравнить с теоретиче-
скими кривыми, изображенными на фиг. 4.
Фиг. 5. Частота положительных эффектов (лизиса} в серии бактериальных культур,
зараженных различными количествами бактериофага.
Каждая точка соответствует данным, полученным при анализе 160 культур. Сплошная линия ана-
логична кривой Л приведенной на фиг. 4.
В случае бактериофага наиболее простой способ проверки состоит
в заражении серии бактериальных культур серийными разведениями
суспензии фага и регистрации отсутствия или наличия лизиса. Резуль-
таты такого опыта приведены на фиг. 5. Легко убедиться, что эти резуль-
таты превосходно согласуются с формулой (III. 2) (г>0; для индукции
лизиса достаточно одной частицы). Это означает, что одна фаговая ча-
стица может инициировать отчетливый лизис чувствительной бактериаль-
ной культуры. Иными словами, в случае бактериофага инфекционная
единица представляет собой одну материальную частицу, что согласует-
ся с данными, полученными путем титрования методом подсчета числа
бляшек.
Сходные результаты были получены при работе с некоторыми виру-
сами животных. Так, например, Паркер [636], титруя один из штаммов
вируса осповакцины на коже кроликов, получил результаты, превос-
ходно согласующиеся с допущением о том, что одна инфекционная еди-
ница этого вируса представляет собой одну частицу (фиг. 6). Аналогич-
ный вывод справедлив, в частности, и для вируса энцефаломиелита мы-
шей [238].
Иногда, однако, частота положительных результатов возрастает
с увеличением концентрации вируса несколько медленнее, чем это можно
ожидать, исходя из уравнения (III. 2). Отклонения этого типа можно
объяснить, допустив, что хотя инфекционный процесс действительно мо-
жет инициироваться одним вирионом, на относительную вероятность
положительного эффекта, даже при большом объеме инокулума, могут
влиять и иные факторы. Скорее всего это индивидуальные вариации
48
Глава III
в чувствительности хозяина к действию вируса, что и приводит к умень-
шению относительной вероятности положительного эффекта.
Подобные соображения справедливы также и для случая титрова-
ния вирусов растений методом подсчета числа локальных поражений
(см. фиг. 3). Зависимость между отношением y/N (где у — число наблю-
даемых поражений, индуцируемых вирусом данной концентрации, a N—
максимально достижимое число поражений) и величиной s описывается
формулой y!N=\—e~s. Эта формула аналогична формуле (III. 2). Она
Фиг. 6. Частота положительных эффектов, наблюдавшихся в эксперименте при нанесе-
нии на кожу кроликов различных количеств препарата вируса осповакцины [491].
По оси абсцисс отложен логарифм концентрации вируса осповакцины (в произвольном масштабе),
а по оси ординат — частота положительных эффектов. Сплошная линия представляет собой кри-
вую I, приведенную на фиг. 4.
показывает, что вирусная инфекция может быть результатом действия
одной частицы, проникшей в соответствующий участок листа [40, 491].
Наблюдаемые иногда отклонения, по-видимому, вызваны обратимой
агрегацией вирионов, имеющей место в суспензиях, характеризующихся
большой концентрацией вируса.
СВЯЗЬ МЕЖДУ ИНФЕКЦИОННЫМИ ЕДИНИЦАМИ И ВИРИОНАМИ
Необходимо иметь в виду, что из статистических данных типа рас-
смотренных нами выше вовсе не следует, что каждый присутствующий
в инокулуме вирион действительно сумеет вызвать инфекцию. Несмотря
на то что инфекция в самом деле может быть вызвана одним вирионом,
бывает и так, что некоторые вирионы фактически не индуцируют инфек-
ции либо вследствие присущих лишь им особенностей (по сравнению
с остальными вирионами инокулума), либо из-за различий в условиях
проведения опыта. Так, например, некоторые вирионы могут оказаться
инактивированными ингибиторами, а другие, скажем, присоединятся
к мертвым клеткам и т. п. Результаты статистического анализа говорят
лишь о том, что для инициирования инфекции в принципе действительно
достаточно единичной вирусной частицы и не требуется взаимодействия
нескольких частиц.
Титр вируса, полученный при помощи одного из описанных выше
методов, можно сравнить с действительным количеством вирусных ча-
стиц, содержащихся в инокулуме, подсчитав их число при помощи ка-
кого-либо прямого или косвенного метода. Подобное сравнение было
проведено для нескольких бактериофагов, и при этом обнаружилось пре-
восходное совпадение результатов. Оказалось, что отношение числа ви-
рионов к числу бляшкообразующих единиц, полученному при титровании
в оптимальных условиях на наиболее чувствительных бактериях, нахо-
дится в пределах 1—2,5 [542]. Это означает, что по меньшей мере 40%,
а иногда почти все 100% вирусных частиц являются инфекционными и
действительно образуют бляшки.
Титрование вирусов
49
Для вирусов растений и животных столь хорошее соответствие на-
блюдается весьма редко. Что касается вирусов растений, то этот резуль-
тат едва ли является неожиданным, ибо хорошо известна иключительно
малая эффективность методов инокуляции, основанных на втирании ви-
руса в лист. Для вируса табачной мозаики была получена относительно
большая величина: 1 инфекционная единица соответствовала примерно
1000 частицам. Однако более характерными являются величины отноше-
ний порядка 10“6 или 10-7.
Для вирусов животных величина отношения числа вирионов к числу
инфекционных единиц варьирует весьма широко. Число вирионов,
содержавшихся в некоторых препаратах вируса осповакцины, лишь в
4 раза превышало инфекционный титр этих препаратов. Для вируса
энцефаломиелита мышей величина этого отношения оказалась еще
меньше — порядка 2,6 [241]. Для препаратов очищенного вируса полио-
миелита величина отношения числа вирионов к числу бляшкообразую-
щих единиц варьировала от одного препарата к другому, причем иногда
получали величину меньше 100 [747], но в большинстве случаев эта вели-
чина была выше.
Одна «опухолеобразующая» единица вируса папилломы кролика
соответствует примерно 107—108 частиц. Титрование путем втирания
в скарифицированную кожу кролика крайне неэффективно. В тех слу-
чаях, когда шанс на успешный «захват» вируса столь мал, основное
влияние на форму кривых, описывающих зависимость числа положи-
тельных результатов от концентрации вируса, могут оказать вариации
в индивидуальной чувствительности хозяина [107].
Инфекционные нуклеиновые кислоты независимо от того, выделены
ли они из фагов или из вирусов животных и растений, как правило,
обладают значительно меньшим инфекционным титром, чем исходный
вирус. Следовательно, величина отношения числа молекул к числу ин-
фекционных единиц для инфекционных нуклеиновых кислот больше, чем
для соответствующих вирионов. Однако и при титровании свободной
нуклеиновой кислоты форма кривой титрования совпадает с той, кото-
рую можно ожидать, исходя из уравнения (III. 2). Отсюда следует, что
одна молекула нуклеиновой кислоты также может вызвать инфекцию
[241]. Иногда вирусная РНК почти столь же инфекционна для растений,
как и исходный вирус. В качестве примера можно привести РНК вируса
костра [90]. Как правило, инфекционны только интактные молекулы РНК.
Интересное исключение, подтверждающее, однако, общее правило, на-
блюдается при множественном заражении бактерий молекулами нуклеи-
новой кислоты, содержащими неполный геном фага [629].
Резюмируя сказанное выше, можно сделать вывод, что титр вирус-
ной суспензии, выраженный в числе инфекционных единиц, содержащих-
ся в единице объема, как правило, соответствует числу частиц, способ-
ных при условиях данного опыта вызвать инфекцию. Количественное
соотношение между числом вирионов, способных инициировать инфек-
цию, и общим числом вирионов, содержащихся в титруемой суспензии,
не может быть установлено только при помощи титрования или иных
статистических методов. Для этого необходимо сочетание статистических
методов с прямым подсчетом вирионов. В свою очередь путем визуаль-
ного наблюдения вирионов, используемого при их прямом подсчете, не-
возможно отличить активные, т. е. инфекционные, вирионы от инактиви-
рованных или различить вирионы, отличающиеся друг от друга по сте-
пени инфекционности для различных хозяев или по эффективности
индукции при различных путях введения вируса в организм чувствитель-
ного хозяина.
4 Заказ № 1214
Глава IV
СВОЙСТВА ВИРИОНОВ
ЦЕЛЬ очистки
В предшествующих главах мы рассмотрели методы выявления и тит-
рования патогенных агентов, которые вызывают вирусные болезни жи-
вотных, растений и бактерий. Теперь мы обратимся к физическим и
химическим свойствам этих агентов, обладающих инфекционностью,—
вирусным частицам, или вирионам,— и их компонентам, некоторые из
которых сами по себе способны вызывать вирусную инфекцию при попа-
дании их в восприимчивые клетки.
Получив препарат, обладающий вирусной активностью, например
тканевой экстракт или жидкость, которая представляет собой продукт
секреции того или иного патологически измененного органа, вирусолог
приступает к характеристике и выделению вируса. Его задача состоит
в том, чтобы обнаружить присутствие какого-то фактора, который отсут-
ствует в аналогичных препаратах, полученных из неинфицированных
источников, доказать инфекционность этого фактора, отделить его от
посторонних веществ и дать по возможности полное описание его физи-
ческих и химических свойств. Необходимо поэтому изолировать вирус-
ные частицы, применить соответствующие методы их очистки, если воз-
можно, кристаллизовать их, изучить химический состав и визуально
наблюдать эти частицы, чтобы определить их морфологические особен-
ности. Методы дифракции рентгеновских лучей позволяют установить
структуру вирусных частиц, а данные, полученные методами центрифу-
гирования и диффузии,— определить их форму, размеры и плотность.
Прежде чем обсуждать эти методы и те сведения, которые мы таким об-
разом получили, по-видимому, полезно коротко рассмотреть значение
некоторых положений в применении их к вирусам.
МЕТОДЫ очистки ВИРУСНЫХ ЧАСТИЦ
И КРИТЕРИИ ЧИСТОТЫ ВИРУСНЫХ ПРЕПАРАТОВ
Когда мы говорим об очищенном вирусном препарате, мы имеем
в виду препарат (кристаллический или суспензию), состоящий из прак-
тически однородных частиц и в достаточной мере сврбодный от примесей
веществ невирусного происхождения. Вирионы каждого данного вируса
однородны по целому ряду признаков. И в самом деле, они более одно-
родны по химическим и физическим свойствам, чем, скажем, бактериаль-
ные или дрожжевые клетки из чистой культуры. Эту однородность вирус-
ных частиц можно сравнить с однородностью белковых молекул; в лю-
бом очищенном белке все молекулы имеют, по крайней мере в первом
приближении, одинаковые размеры, форму и состав. Такая однородность
свойственна объектам, которые не растут и не делятся, а образуются
путем какого-то определенного объединения более мелких субъединиц:
так, аминокислоты объединяются в полипептидные цепи, полипептидные
50
Свойства вирионов 51
цепи — в белковые молекулы, а молекулы нуклеиновой кислоты и бел-
ка — в вирионы.
Как будет ясно из последующих глав, образование вирусных частиц
является кульминационным моментом процесса, включающего реплика-
цию вирусного генетического материала, синтез специфических генных
продуктов и сборку этих материалов в зрелые вирионы. Любой процесс
свертывания и сборки происходит под влиянием «организующих» сил,
заставляющих систему принимать конфигурацию с минимальной энер-
гией (как при кристаллизации или образовании ориентированных гелей).
Гомогенность какой-либо популяции вирионов свидетельствует, следова-
тельно, о существовании единственной, наиболее вероятной конфигура-
ции всех вирусных частиц, входящих в данную популяцию.
Такая интерпретация однородности вирионов требует некоторых по-
яснений. Как отмечал Пири [648], все критерии гомогенности и чистоты
вирусных препаратов могут быть только относительными. Разрабатывая
методы очистки, мы стремимся достичь идеала; критерии чистоты уста-
навливаются эмпирически и зависят от специфических наблюдений и из-
мерений. Любое определение чистоты должно быть операциональным и к
тому же удовлетворять конкретным целям исследователя. При этом не-
обходимо учитывать следующие моменты, более подробно изложенные
в других разделах настоящей главы:
1. Незначительные отклонения в химическом составе могут остаться
незамеченными. Например, вирусный препарат может содержать смесь
инфекционных и неинфекционных частиц, и в этом случае иногда трудно
решить, является ли малая величина отношения инфекционного титра
к числу вирусных частиц следствием неоднородности свойств вирионов
или неоднородности условий заражения.
2. Вирусы делятся на два основных класса в зависимости от того,
обладают ли их вирионы внешними оболочками, окружающими капсид
(см. стр. 68). Вирионы с внешними оболочками менее однородны, чем
те из них, которые имеют один лишь капсид, вероятно, вследствие того
что образование внешней оболочки является менее точным процессом,
чем образование капсида.
3. Даже у вирусов, единственным внешним компонентом которых
является капсид, может возникнуть неоднородность в результате слу-
чайных отклонений в процессе сборки, вследствие чего образуются ча-
стицы, имеющие различные размеры и молекулярный вес. Характерными
для данного вируса инфекционными свойствами обычно обладают ви-
рионы лишь одного размера; другие вирионы, как правило, содержат
неполный геном данного вируса.
4. Вирионы, как таковые, редко являются единственным результатом
процессов синтеза, ведущих к образованию вирусных частиц. В зара-
женных вирусом клетках обычно содержатся как полностью сформиро-
ванные вирионы, так и целый ряд вирусоподобных веществ. Некоторые
из них являются предшественниками вирусных компонентов, другие —
побочными продуктами синтеза вируса. К сожалению, при очистке виру-
сов удаляются также и вирусоподобные вещества, анализ которых часто
может отражать важный этап в изучении вируса.
5. Вызвать инфекцию способен не только полностью сформирован-
ный вирион, но и свободная нуклеиновая кислота. Следовательно, очи-
щенные вирионы нельзя рассматривать как частицы, представляющие
собой минимальную единицу инфекционного материала.
6. Очистка всегда более или менее относительна; даже кристалличе-
ские препараты могут содержать существенные количества примесей.
С помощью обычных химических методов не всегда удается обнаружить
небольшие количества примесей; в этом случае могут оказаться полез-
4*
52
Глава IV
ными более тонкие химические или биохимические методы. Например,
примеси РНК в препаратах ДНК-вируса можно обнаружить с помощью
изотопов. Чужеродные белки можно выявить серологическими методами
даже в кристаллических вирусных препаратах.
МЕТОДЫ очистки
Концентрирование и выделение вирусных частиц достигается ком-
бинированием различных методов фракционирования. Исходный мате-
риал представляет собой биологическую жидкость, суспензию или
экстракт,'полученный либо разрушением клеток или тканей ультразву-
ком, либо растиранием их с песком или стеклянным порошком, жела-
тельно при низкой температуре.
Для контроля степени очистки вирусов определяют инфекционность
в последовательно отбираемых фракциях. В отношении большинства ви-
русов, вирионы которых отличаются по величине от стабильных клеточ-
ных компонентов, с успехом применяется дифференциальное центрифу-
гирование. Центрифугирование в градиенте плотности сахарозы делает
возможным более тонкое разделение частиц, седиментационные свойства
которых незначительно отличаются друг от друга. Методом равновесной
седиментации в градиентах плотности цезиевых или рубидиевых солей
можно разделить частицы, обладающие различной плотностью. Прин-
ципы этих методов будут обсуждаться в следующих разделах.
В случае если вирусы приходится выделять или концентрировать из
больших объемов содержащих вирус биологических жидкостей, прибе-
гают к высаливанию сернокислым аммонием, к осаждению спиртом
и к осаждению в изоэлектрической точке различными агентами (если эти
методы не вызывают инактивации или разрушения вирусных частиц).
Наряду с этим используется адсорбция и избирательное элюирование на
смолах или других материалах (путем механического встряхивания или
на колонке). Короче говоря, большинство методов, используемых для
очистки макромолекул, особенно белков, применимы к вирусам. Однако
существует и ряд специфических методов, применимых для очистки
только вполне определенных вирусов. Например, миксовирусы можно
очистить, используя их способность адсорбироваться на эритроцитах.
Концентрируя эритроциты, можно таким образом сконцентрировать и
вирус. Затем вирусы можно отделить от эритроцитов, используя их
ферментативную активность.
Для удаления бактерий или крупных частиц ткани из исходных эк-
страктов (или экстрактов, полученных на различных стадиях очистки)
можно использовать фильтрование через бактериальные фильтры. Став-
шие классическими фильтры из инфузорной земли (типа Беркефельда)
и фарфоровые (типа Шамберлена) были заменены бумажными или ас-
бестовыми прокладками (фильтры типа Зейца), стеклянными, а в по-
следнее время целлюлозными мембранными фильтрами (типа миллипо-
ровых). Обычно используемые бактериальные фильтры задерживают ча-
стицы с наименьшими линейными размерами 0,5 мк или более 1. Наи-
При работе с вирусами для измерения длины обычно пользуются микронами
(1 лпс= 10~4 см), миллимикронами (1 ммк=\0~7 см), ангстремами (1 А=10~8 см). Рас-
стояние между центрами двух углеродных атомов в молекуле этана составляет околс
1,5А; расстояние между соседними аминокислотными остатками в полипептидной цепи
(фибриллярный белок)—3,5А; расстояние между парами оснований вдоль оси двойной
спирали ДНК 3,4А. Сферическая молекула яичного альбумина, содержащая около
350 аминокислотных остатков, имеет радиус 27А. Масса сферической частицы с ра-
диусом г и' плотностью Q, равная *3”W3q, может быть выражена в граммах (или микро-
граммах) или в числах, кратных единице молекулярного веса (jg массы кислородного
Свойства вирионов
53
меньшие линейные размеры вирионов известных нам вирусов колеблют-
ся в пределах от 100 до 3000 А (от 0,01 до 0,3 мк). Некоторые вирионы
могут задерживаться на бактериальных фильтрах под влиянием сил
электростатистического притяжения. Многие фаги, например, необрати-
мо задерживаются на асбестовых фильтрах Зейца.
УЛЬТРАФИЛЬТРАЦИЯ
Методом ультрафильтрации можно определять размеры вирусных
частиц даже в тех случаях, когда концентрация вируса очень мала и
раствор содержит много примесей. Наилучшими ультрафильтрами для
Фиг. 7. Влияние величины пор градоколовой мембраны на фильтруемость различных
вирусов [213].
/ — вирус осповакцины; II — вирус ящура; III — стафилококковый бактериофаг.
измерения и разделения вирионов оказались нитроцеллюлозные (кол-
лодиевые) мембраны. Такие мембраны готовят из растворов коллодия
в уксусной кислоте или, что еще лучше, в смеси этанола с эфиром (гра-
доколовые мембраны [213]). Величина пор образованной таким образом
мембраны зависит от концентрации коллодия в исходном растворе, при-
роды и концентрации растворителя и скорости удаления растворителя.
Средний диаметр пор (с.д.п.) оценивается по величине давления, необ-
ходимого для продавливания пузырьков воздуха через мембрану в воде
или для продавливания через нее воды с определенной скоростью. Для
того чтобы установить соотношение между с.д.п. и размером вирусных
частиц, которые могут проходить через эту мембрану, проводят калиб-
атома, или 1,66• 10-24 г=1 дальтон). Была предложена удобная единица Mh, соответ-
ствующая 106 единиц молекулярного веса, но она редко используется.
Часто пользуются величиной, обратной единице молекулярного веса. Это так на-
зываемое число Авогадро W=6,02- 1023. Если m — масса в граммах, то величина mN/lff
выражает ту же массу в единицах Mh. Так, частица сферического вируса диаметром
20 ммк, плотность которой равна 1.3 г/см3, имеет объем 4 «3,14* 103/3 жяк3 = 4190 ммк3 =
=4,19- 10~18 см3 и массу 4,19- 10”18- 1,3 г = 4,19- 1,3- 10~18/1,66- 10"24 далътон=32г- 10е
дальтон = 3,3 Mh.
54
Глава IV
ровку, используя частицы известной величины. По данным Маркхема
и его сотрудников, наибольшие частицы, которые могут проходить через
фильтр, примерно в 1,25 раза меньше с.д.п.
Для гомогенного по размерам вируса должен иметь место резкий
переход от фильтров, пропускающих все вирионы, к фильтрам, задержи-
вающим их. Такой резкий переход наблюдается только для самых мел-
ких вирусов (фиг. 7). Отклонения, вероятно, связаны с задержкой ви-
рионов на поверхности пор, а не с различиями в их размерах.
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ
РАЗМЕРОВ ВИРУСНЫХ ЧАСТИЦ
Осаждение сферических частиц
Многие способы определения размеров вирионов основаны на ана-
лизе скорости их движения в суспендирующей жидкости. Наиболее про-
сто такой анализ производится в случае сферических частиц. Сфериче-
ская частица радиуса г, находящаяся в жидкости с плотностью d0, будет
седиментировать в гравитационном поле или в поле центробежных сил,
если плотность частицы d больше, чем dQ. В гравитационном поле дви-
жущая сила Р равна произведению ускорения силы тяжести g на раз-
ность между массой частицы и массой соответствующего объема среды:
Рё= —xr1 * 3(d—d0)g. В центробежном поле ускорение силы тяжести g
заменяется центробежным ускорением с= (2лсо)2х, где со — число оборо-
тов в единицу времени, а х—расстояние частицы от оси вращения:
= (d-d0)c,
О
При наличии ускорения скорость частицы v непрерывно возрастает,
что в свою очередь вызывает увеличение трения. Сила трения (p = fv, где
f—коэффициент трения. Для сферических частиц величина f равна
6 лт)Г, где т] — вязкость среды. После того как скорость достигает значе-
ния, при котором сила трения ср уравновешивает центробежную силу Рс,
частица начинает двигаться с некоторой постоянной скоростью. Поэтому,
когда ф = Рс,
— кг3 (d — dQ) с =
3
v = 2cr2(—-Y (IV. 1)
' 9-q /
г = У9ъц/2с (d— d«)
Эти равенства (первое из них называется формулой Стокса) описывают
движение сферических частиц в жидкости при идеальных условиях, т. е.
условиях, когда взаимодействие между частицами, а также конвекция
отсутствуют и частицы велики по сравнению с молекулами раствори-
теля.
Величина S=—, называемая константой седиментации, характери-
с
зует поведение данной частицы в данной среде при данной температуре !.
1 Все величины, входящие в обе части равенства, должны быть измерены в одной
и той же системе единиц, например в системе CGS (сантиметр—грамм—секунда). В этой
системе г и х выражаются в см, a g и с — в см!сек2. Значение со должно быть дано
в оборотах в секунду. Если плотность выражена в г см~3, а скорость измеряется в еди-
ницах CGS (г « см~' • сек~х), то константа седиментации выражается в секундах. Часто ее
выражают в единицах Сведберга; одна единица Сведберга соответствует скорости се-
диментации в воде при 20° под действием единицы центробежной силы.
Свойства вирионов
55
Из формулы Стокса следует, что
4 3. 4 „ L
— itr3d — — Ttr3d0 m\ \ — —
s _ 3 3 _ \ d ,
6К7]Г f
(IV. 2)
Так как центробежная сила, плотность среды и ее вязкость могут
быть измерены, из уравнений (IV. 1) и (IV 2) можно определить радиус
и массу сферической частицы при условии, если мы можем измерить ее
плотность и скорость в центрифуге.
Вирионы некоторых наиболее крупных вирусов хорошо седименти-
руют в скоростных центрифугах обычного лабораторного типа, однако
для осаждения более мелких вирионов и для точных измерений нужны
ультрацентрифуги. В современных ультрацентрифугах достигаются ско-
рости 60 000 об/мин и выше. Для частицы, находящейся на расстоянии
6 см от оси вращения, скорости 60 000 об/мин соответствуют центробеж-
ной силе, превышающей силу тяжести в 250 000 раз. Ротор находится
в высоком вакууме, чтобы уменьшить трение и влияние температуры.
Используя аналитические роторы, в которых луч видимого или ультра-
фиолетового света проходит через центрифужные ячейки с прозрачными
стенками, можно производить измерения при движении центрифуги. При
седиментации однородной популяции светопоглощающих частиц обра-
зуется резкая подвижная граница, положение которой определяют либо
непосредственно путем измерения поглощения света, либо по положению
области, где показатель преломления столба жидкости резко изменяется
(шлирен-метод). Суспензия одинаковых частиц должна давать единст-
венную границу, которая несколько размывается из-за диффузии. Вирус-
ные препараты, содержащие лишь 1 мкг вируса на 1 мл, можно изучать
в аналитической центрифуге.
Измерение плотности
Плотность вирионов можно также измерять путем центрифугирова-
ния в ряде растворов различной плотности. Растворы должны обладать
низкой осмотической активностью (например, раствор сывороточного
альбумина), чтобы свести к минимуму изменения в гидратации. Экстра-
полируя результаты измерения скорости седиментации до нуля, находят
плотность, соответствующую нулевой скорости седиментации (фиг. 8).
Этим методом получены значения плотности 1,1 —1,2, тогда как путем
взвешивания очищенных и высушенных препаратов вируса— 1,3 или вы-
ше. Количество гидратационной воды составляет от 50 до 100% сухого
веса, т. е. больше, чем обычно обнаруживают у белков (30—35%), что,
вероятно, связано с осмотическими явлениями, а также с высокой сте-
пенью гидратации нуклеиновых кислот.
Центрифугирование в градиенте плотности
Это понятие относится к центрифугированию частиц в столбе жидко-
сти с плотностью, распределенной в непрерывном градиенте. В резуль-
тате частицы локализуются в зонах, плотность которых соответствует
плавучей плотности частиц. Существуют два наиболее важных метода:
метод скоростного зонального центрифугирования и метод изопикниче-
ского, или равновесного, центрифугирования в градиенте плотности
[978].
Метод скоростного зонального центрифугирования, обычно в гра-
диенте сахарозы, используют главным образом для определения скоро-
56
Глаоа IV
стей седиментации, а также для разделения материалов, отличающихся
по величине и форме.
Исследуемый препарат наносится на желаемый градиент, предвари-
тельно созданный путем наслаивания или смешивания соответствующих
растворов сахарозы. Этот градиент препятствует конвекции и стабилизи
рует локализованные зоны частиц. По окончании центрифугирования
производится анализ зон, для чего прокалывают дно центрифужной про-
бирки и последовательно собирают фракции.
Фиг. 8. Скорость седиментации вируса гриппа А в зависимости от плотности раст-
ворителя.
Плотность меняется от 0 до 25% путем добавления бычьего сывороточного альбумина. По осн орди-
нат отложена скорость седиментации. Экстраполяция к нулевой скорости (осаждение отсутствует>
дает плотность 1,104. На фигуре представлены данные двух экспериментов.
При изопикническом, или равновесном, центрифугировании в гра-
диенте плотности [588] частицы суспендируют в растворе соли соответ-
ствующей концентрации, которая обладает высокой плотностью, напри-
мер в растворе хлористого цезия, сульфата цезия или хлористого руби-
дия. После продолжительного центрифугирования создается устойчивый
градиент плотности раствора. Он возникает как следствие равновесия,
устанавливающегося между осаждением и диффузией из более концен-
трированных областей в более разбавленные. Частицы собираются на
том уровне, где плотность среды равна их собственной плотности, и в
конце концов образуется четкая граница. Равновесие достигается тогда,
когда действие центробежных сил, под влиянием которых частицы дви-
жутся к той области, которая соответствует им по плотности, уравнове-
шивается диффузией, заставляющей их перемещаться из областей с наи-
высшей концентрацией (см. следующий раздел). Ширина границы (опре-
деляемая величиной стандартного отклонения для гауссова распределе-
ния концентраций около среднего значения) зависит от массы частиц.
Значения массы и плотности частиц, полученные таким образом, за-
висят от используемой среды и отличаются от значений массы и плот-
ности для сухих частиц или для частиц, исследуемых в другой среде.
Свойства вирионов
57
так как концентрированные растворы солей в значительной степени
изменяют степень гидратации белков и нуклеиновых кислот.
Равновесное центрифугирование в градиенте плотности позволяет
определять относительное содержание белка и нуклеиновой кислоты в
вирионах, содержащих только эти два компонента. Так, если плотность
нуклеиновой кислоты данного вируса составляет плотность белка
SPf а плотность вириона Sv, то объем, занимаемый нуклеиновой кисло-
той в вирионе, будет выражаться формулой
Sv — Sp
v х = —-----’
— Sp
, x Vx-Sx
а ее масса MN равна-------.
Sv
Вирионы, имеющие плотность меньше 1,3, представляют собой ча-
стицы, содержащие большое количество липидов в своих внешних обо-
лочках [153].
Модификацией метода центрифугирования в растворах солей высо-
кой плотности является метод центрифугирования в ступенчатом гра-
диенте плотности [868], который позволяет разделять частицы в соответ-
ствии с их размерами на определенные группы с большей эффектив-
ностью, чем обычный метод градиентного центрифугирования. В этом
случае сначала с помощью ультрацентрифуги создается очень пологий
градиент плотностей, причем он ниже градиента плотности частиц, кото-
рые подлежат исследованию.
Затем на образовавшийся градиент наносят суспензию анализируе-
мого вещества таким образом, чтобы она образовала достаточно узкую
зону. При центрифугировании частицы седиментируют и, проходя че-
рез градиент, располагаются очень однообразно.
Диффузия
Если между слоем суспензии частиц и слоем среды существует пло-
ская граница, то в результате хаотичного движения частиц некоторые из
них пересекают границу, и имеет место тенденция к прогрессивному вы-
равниванию концентраций. Если размеры частиц значительно превы-
шают размеры молекул среды и частицы не взаимодействуют друг с дру-
гом, их кинетическая энергия зависит только от температуры. Сопротив-
ление, которое среда оказывает движению частиц, зависит от их скоро-
сти и коэффициента трения.
Изменение концентрации за 1 сек в результате диффузии через гра-
ницу площадью 1 см2 при условии, что концентрации соприкасающихся
растворов различаются на единицу, называется коэффициентом диффу-
зии D. Его значение определяется равенством
D = —см2 • сек-1,
Nf
где Т—абсолютная температура, R— газовая постоянная (8-10~7 эрг-
• град-1 • моль-1), N — число Авогадро (6,06-Ю23) nf—коэффициент тре-
ния, который для сферических частиц равен 6 лт]г. (Наличие множителя
RT отражает одинаковый характер движения молекул в идеальном газе
и сферических частиц в идеальном растворе.)
Для определения коэффициента диффузии D несколько раз изме-
ряют концентрацию частиц на определенных расстояниях от первона-
чальной границы. Радиус сферических частиц определяется равенством
г = —— (IV. 4).
^Z)6r.71
(IV.3>
58
Глава IV
Несферические частицы
Для несферических частиц положение осложняется тем, что сила
трения является сложной функцией их линейных размеров (длина, шири-
на, толщина). Эту трудность можно обойти, если измерить как кон-
станту седиментации, так и коэффициент диффузии. Их отношение не
зависит от коэффициента трения и, следовательно, от формы частиц
[см. равенства (IV.2) и (IV.3)] и пропорционально только их массе:
т 1 — — N
S L \ d /I 9 9
— = —ь-----*———сек2 • СМ~2 ,
D RT
Если все единицы выражены в системе CGS, масса измеряется в граммах.
По существу равноценным методом является метод, состоящий в из-
мерении так называемого седиментационного равновесия. В центробеж-
ном поле повышение концентрации частиц в направлении от оси враще-
ния приводит к усилению их диффузии в обратном направлении. Когда
седиментация и диффузия уравновешивают друг друга, наступает равно-
весие, и в этот момент массу частиц можно определить непосредственно
по измерению их концентрации в двух точках центрифужной пробирки.
Если масса и плотность асимметричной частицы известны, легко рас-
считать объем, радиус и коэффициент трения /о, которые эта частица
имела бы в том случае, если бы форма ее была сферической. Отношение
измеренного коэффициента трения f к fQ называется коэффициентом асим-
метрии и характеризует степень отклонения формы частицы от сфериче-
ской. (Эта величина может характеризовать не только ассимметрию ча-
стицы, но и степень ее гидратации. 1 идратированная частица диффунди-
рует медленнее, так как ее эффективный радиус больше, а увеличение
объема при гидратации вызывает соответствующее уменьшение плотно-
сти. Поэтому значения плотности, используемые для расчета радиуса и
массы, должны представлять собой значения, характерные для гидрати-
рованной частицы.)
Электрофорез и рассеяние света
Эти два дополнительных метода также могут давать информацию
о размерах, форме и степени однородности вирусных частиц. При элек-
трофорезе измеряется скорость движения частиц в электрическом поле.
Эта скорость зависит от общего электрического заряда частиц, который
в свою очередь определяется электролитической диссоциацией кислотных
и основных групп. Метод электрофореза используется при очистке и
идентификации белков, при определении степени их чистоты и часто
применяется для характеристики вирусов [662].
Метод рассеяния света основан на том, что интенсивность света, рас-
сеиваемого суспензией частиц, зависит от числа частиц и их объема [190].
Измерение количества света, рассеянного под разными углами, позво-
ляет также рассчитывать степень асимметрии удлиненных частиц.
МОРФОЛОГИЯ ВИРУСНЫХ ЧАСТИЦ
Пользуясь описанными выше физико-химическими методами, можно
определять размеры, а иногда и форму вирионов. Световой микроскоп
дает возможность различить лишь наиболее отчетливые особенности
Свойства вирионов
59
•структуры самых крупных вирусных частиц. Разрешающая способность
светового микроскопа, т. е. величина, обратная тому наименьшему рас-
стоянию, на котором два объекта могут быть отчетливо различимы, опре-
деляется равенством 2^, где NA — числовая апертура линзы объек-
тива, а X — длина волны. Поскольку предел разрешения лучших свето-
вых микроскопов составляет около 200 А, в этот микроскоп можно уви-
деть лишь самые крупные вирионы, даже при условии применения мето-
дов окрашивания или импрегнации. Буист в 1887 г. и Пашен в 1917 г.
увидели и описали элементарные тельца при осповакцине и установили
их идентичность с инфекционным материалом. Позже были разработаны
методы диагностики для визуального наблюдения таких телец в объек-
тах, пораженных другими вирусными болезнями.
Микроскопия в темном поле и фазово-контрастная микроскопия
использовались главным образом для изучения динамики поражений в
тканях, зараженных вирусом; с помощью этих методов можно опреде-
лять присутствие, но не морфологию крупных вирионов и вирионов сред-
них размеров. Иногда использовался ультрафиолетовый микроскоп, ме-
нее удобный в обращении, чем световой, но имеющий несколько более
высокую разрешающую способность. Значительно более эффективным
методом, правда, позволяющим выявлять не отдельные вирионы, а боль-
шие скопления вирусных компонентов в зараженных клетках, является
флуоресцентная микроскопия. Интересно применение флуоресцентных
красителей, например акридина оранжевого, который флуоресцирует по-
разному в зависимости от того, соединяется ли он с РНК или с ДНК [17].
Наряду с этим важное применение находят флуоресцирующие анти-
тела [59], например у-глобулин, меченный флуоресцентным красителем.
Этот метод может применяться как для непосредственной идентифика-
ции вирусных антигенов с помощью меченых противовирусных антител,
так и для косвенной — путем использования так называемой методики
сэндвича: сначала препарат обрабатывается антивирусной сывороткой
данного животного, например кролика; затем добавляют меченые анти-
тела против у-глобулина этого животного (сыворотка курицы, иммунизи-
рованной кроличьим у-глобулином).
Электронная микроскопия
Детали структуры вирионов многих вирусов удается различить лишь
с помощью электронного микроскопа. Он обеспечивает увеличение до
100 000 и позволяет различать структуры до 10 А и ниже. Материал для
простейшего электронно-микроскопического анализа суспендируют в хо-
рошо испаряющейся среде, например в воде или в аммонии-ацетатном
буфере, и высушивают на сетке с подложкой, представляющей собой
вещество, слабо поглощающее электроны, например коллодийную или
углеродную пленку. Чтобы избежать повреждения исследуемых объек-
тов, образец сушат в замороженном состоянии [916] или по так называе-
мому методу «критической точки» [20].
Поскольку рассеяние электронного пучка обусловлено взаимодейст-
вием его с электронами образца, электронно-микроскопическое изобра-
жение отражает локальные различия в толщине, плотности и химиче-
ском составе образца (особенно присутствие в нем тяжелых атомов).
Более тонкие детали можно наблюдать при использовании метода
напыления [918]. Этот метод заключается в том, что тяжелые металлы —
золото, палладий или уран — напыляют под известным углом к плоско-
сти, на которой лежит образец, в результате чего образуется тень, по
которой можно судить о высоте и форме образца. На фото 7 представ-
60
Глава IV
лена микрофотография радужного вируса долгоножки, полученная
с помощью метода двойного напыления; этот метод позволяет четко про-
демонстрировать, что вирионы этого вируса имеют форму икосаэдра.
Очень тонкие детали поверхностей обнаруживаются с помощью ме-
тода реплик, при применении которого делается матрица, или реплика,
объекта путем покрытия его раствором пластического материала, кото-
рый после высыхания снимается. Рельеф реплики воспроизводит детали
поверхности вириона.
Для увеличения электронной плотности используются такие «краси-
тели», как четырехокись осмия, фосфовольфрамовая кислота и другие
вещества, которые содержат атомы тяжелых металлов и соединяются
с различными группами на поверхности макромолекул. Более ценным»
является метод негативного контраста [103], при применении которого
исследуемые объекты обрабатывают нейтральными фосфовольфраматом
или уранилацетатом. При нейтральном pH эти соли плохо соединяются
с белками или нуклеиновыми кислотами, но при обезвоживании создают
довольно однородный, непроницаемый для электронов фон, на котором
такие объекты, как вирионы, четко выделяются в своих деталях. Эти рас-
сеивающие электроны вещества могут проникать в углубления и «зазо-
ры» между соседними макромолекулярными компонентами вириона; в ре-
зультате на микрофотографии обнаруживаются тончайшие структурные
детали, как видно на фото 12. Полые вирионы, т. е. «пустые» белковые
оболочки, легко отличить в этом случае от целых вирусных частиц вслед-
ствие того, что в их внутреннюю полость проникает контрастирующее ве-
щество, рассеивающее электроны (фото 15).
Метод тонких срезов для электронной микроскопии, позволяющий
получать срезы образцов толщиной в несколько сот ангстрем, исполь-
зуется как для изучения вирусов в клетках, так и при изучении вирусов^
находящихся в осадке или в кристаллическом состоянии.
Подсчет числа вирусных частиц с помощью электронного
микроскопа
С помощью электронного микроскопа можно производить подсчет
числа вирионов; при этом необходимо принять ряд мер предосторожно-
сти, чтобы обеспечить равномерное распределение частиц при высыхании
суспензии. Согласно методу, основанному на определении относитель-
ного содержания частиц [917], вирусный препарат смешивают с суспензи-
ей полистирольного латекса, представляющей собой частицы в форме сфе-
ры известного диаметра и плотности. Смесь мелко распыляется на сетку
с подложкой, и ведется подсчет частиц, содержащихся в каждой отдель-
ной капле (фото 8 и 9). По соотношению числа частиц латекса и числа
вирионов можно рассчитать концентрацию вирионов в исходной смеси.
Согласно второму методу, основанному на осаждении частиц центрифу-
гированием [756], сетку с подложкой помещают на дно центрифужной
пробирки. Осаждающиеся вирионы фиксируются на подложке, в резуль-
тате чего при последующем высушивании образца их распределение на
подложке не изменяется. Титр вируса можно определить по соотноше-
нию числа вирионов и числа шариков латекса или косвенно, по извест-
ным условиям центрифугирования.
Согласно методу, основанному на фильтровании [444], капли суспен-
зии распыляют на подложку, лежащую на слое твердого, хорошо высу-
шенного агара. В этом случае растворитель быстро всасывается в агар,,
и распределение вирусных частиц на подложке остается ненарушенным.
Свойства вирионов
61
Рентгеноструктурный анализ
Очищенные препараты вирусов, которые образуют либо истинные
кристаллы, как в случае вируса полиомиелита, вируса кустистой карли-
ковости томатов и некоторых других вирусов животных и растений, либо
паракристаллы, например ориентированные гели палочкообразных час-
тиц, подобных частицам ВТМ, можно исследовать с помощью метода
рентгеноструктурного анализа, который дает информацию как о взаим-
ном расположении вирионов, так и об их внутренней структуре. Иногда
можно получить дополнительную информацию, используя метод изомор-
фного замещения, при котором в определенные участки частицы вводят
атомы тяжелых металлов, не нарушая при этом общей структуры сос-
тавляющих ее компонентов.
Цель состоит в том, чтобы выявить элементы симметрии в распре-
делении структурных единиц, составляющих частицы. Методом рентге-
ноструктурного анализа впервые было обнаружено, что вирион не амор-
фен, а имеет определенную структуру, построенную из регулярно распо-
ложенных субъединиц. Как будет показано в дальнейшем, расположение
этих субъединиц определяет характерные особенности молекулярной
симметрии вириона.
ТИПЫ ОРГАНИЗАЦИИ ВИРИОНОВ
Наиболее поразительная особенность вирусных частиц состоит в их
однородности по форме и величине. В отличие от популяции растущих и
делящихся клеток в популяции вирионов определенного типа нельзя об-
наружить частиц различного размера. Они даже более однородны, чем
покоящиеся споры бактерий. С помощью электронного микроскопа уда-
лось показать, что эта однородность по форме и размерам сопряжена с
подобной же однородностью организации белков, окружающих вирус-
ную нуклеиновую кислоту. Несколько менее однородными являются
внешние, содержащие липиды оболочки, характерные для некоторых ти-
пов вирионов.
Основные компоненты всех вирионов — нуклеиновая кислота и бел-
ки (гл. V) не связаны друг с другом ковалентными связями. Форма ви-
риона определяется его капсидом, или белковой оболочкой, внутри кото-
рого заключена нуклеиновая кислота. Капсиды построены из белковых
субъединиц, собранных строго определенным образом, в соответствии
€ относительно простыми геометрическими принципами. Следовательно,
вирионы двух разных вирусов, например вируса полиомиелита и вируса
желтой мозаики турнепса, могут быть построены точно по одному плану
и быть практически неразличимы морфологически.
Капсид любого вируса построен из структурных субъединиц подобно
тому, как кирпичное здание построено из одинаковых кирпичей. Эти струк-
турные субъединицы представляют собой белковые молекулы, синтези-
рующиеся под контролем вируса; существование их впервые было обна-
ружено у вируса табачной мозаики. Общность этого принципа организа-
ции, постулированная Криком и Уотсоном [156] на основе генетических
и физико-химических исследований, в настоящее время полностью под-
тверждена.
Существуют два типа организации, при которой идентичные, асим-
метричные субъединицы соединяются друг с другом с образованием
правильного капсида: спиральная сборка и формирование замкнутых
белковых оболочек. Соответственно существуют лишь два типа капси-
дов— спиральные и изометрические (или квазисферические); капсиды
всех вирусов относятся к одной из этих двух категорий. Не все структур-
62
Глава IV
ные субъединицы обязательно должны быть идентичны. И в самом делег
большинство изометрических капсидов, по-видимому, построены более
чем из одного типа белковых молекул, которые могут образовывать либо-
последовательные слои, либо регулярно чередоваться в одном каком-то
слое.
Помимо уже описанных выше типов организации, для вирионов ча-
сто бывает характерна еще одна особенность, а именно наличие обо-
лочки, внешней по отношению к капсиду, которая образуется вокруг него*
на заключительных стадиях формирования вирусной частицы. В этой
оболочке может быть заключен либо спиральный, либо изометрический
капсид.
Вирусы со спиральными капсидами
Вирионы многих вирусов растений состоят из «голых» спиральных
капсидов (внешняя оболочка отсутствует). Наиболее хорошо изученным
среди вирусов является ВТМ, который можно использовать как модель
для изучения вирусов со спиральными капсидами {236, 250].
В электронном микроскопе вирионы ВТМ имеют форму палочек
толщиной 150—170 А (фото 10). На микрофотографиях эти палочки ча-
сто несколько варьируют по длине, но инфекционностью обладают лишь
те из них, длина которых составляет 3000 А. Фрагменты палочек ВТМ
при рассмотрении их в направлении оси вириона имеют форму шести-
угольников, причем имеется центральная полость диаметром 40 А. Этот
центральный канал хорошо виден на электронных микрофотографиях,,
полученных методом негативного контраста.
С помощью рентгеноструктурного анализа влажных или высушен-
ных гелей ВТМ было показано, что период вдоль оси равен 69 А. Это
свидетельствует о том, что белковые субъединицы расположены в виде
спирали, в которой на каждые 3 витка приходится 49 субъединиц
(фиг. 9). Вирион содержит 2130 (±2%) идентичных белковых субъеди-
ниц, каждая из которых представляет собой белковую молекулу с моле-
кулярным весом 17 400. Белковые субъединицы как бы заострены сна-
ружи и образуют желобок на поверхности частиц, хорошо различимый
на микрофотографиях препаратов, полученных методом негативного
контраста (фото 10). Существуют некоторые указания на то, что смеж-
ные субъединицы могут объединяться вместе, по крайней мере при ка-
ких-то аномальных внешних условиях. Аминокислотная последователь-
ность этих белковых молекул полностью установлена (см. фиг. 21). Ви-
рион ВТМ имеет молекулярный вес 39 1 06 (±3%) и содержит одноце-
почечную РНК с молекулярным весом 2,06 106 дальтон.
Концентрированные препараты ВТМ спонтанно образуют пара-
кристаллы, или жидкие кристаллы, в которых соседние вирусные части-
цы очень хорошо пригнаны друг к другу. При высыхании паракристал-
лов расстояние между центрами частиц становится равным 152 А. Во
влажном геле расстояние между частицами составляет 175 А, что при-
мерно равно расстоянию между наружными концами субъединиц. Цепь
РНК у ВТМ уложена в спираль и находится в желобке, образованном
белковыми субъединицами, как это показано на фиг. 9.
При обработке вирионов ВТМ слабой щелочью происходит освобож-
дение белкового компонента вируса в частично агрегированной форме,
который носит название А-белка. Этот А-белок может вновь соединиться
с РНК этого вируса с образованием палочек, обладающих инфекцион-
ностыо [230]. Белок ВТМ может также реагировать с РНК других ви-
русов [830] или с синтетическими полинуклеотидами. Реагрегация А-бел-
ка с образованием палочек со спиральной симметрией может происхо-
Свойства вирионов
63;
дить даже в отсутствие РНК. При исследовании осевого распределения
плотности в этих белковых палочках методом рентгеноструктурного ана-
лиза обнаружено отсутствие ряда рефлексов, наблюдаемых на рентгено-
граммах целых вирионов и обязанных своим присутствием цепи РНК,
расположенной на расстоянии 40 А от оси частицы. При реагрегации мо-
жет возникать также необычная форма белка, состоящая, вероятно, из
плоских дисков [568]. Процесс реагрегации белка ВТМ четко иллюстри-
рует тот принцип, что сборка вирусных белковых субъединиц в спираль-
ные капсиды представляет собой явление, подобное кристаллизации и
отражающее свойства, присущие самим этим субъединицам.
Фиг. 9. Схема строения ВТМ.
Изображенный фрагмент из 6 витков соответствует —длины полного вириона. Спираль РНК прохо-
дит между витками спирали белковых субъединиц, шаг которой равен 23 А; диаметр спирали РНК
О э
составляет 80 А. Центральная полость имеет диаметр 40 А.
Капсиды ВТМ обладают относительно жесткой структурой, что слу-
жит указанием на то, что связи между субъединицами в последователь-
но расположенных витках спирали довольно прочны. Обработка вирио-
нов анионными детергентами вызывает отщепление субъединиц, причем
процесс этот начинается преимущественно с одного конца вириона [579].
Спиральные капсиды некоторых других вирусов растений, например
Х-вируса картофеля, обладают менее жесткой структурой (фото И). Ви-
рионы миксовирусов представляют собой структуру, состоящую из слож-
ной внешней оболочки и содержащегося внутри нее гибкого спирального
капсида (фото 27). Вирионы некоторых вирусов животных содержат
трубчатые структуры (фото 29), часть из которых представляет собой
спиральные капсиды, искусно свернутые и уложенные в виде кокона.
Изометрические (квазисферические) капсиды
Многие вирусы имеют почти сферические капсиды, однако в элек-
тронном микроскопе видно, что на самом деле эти капсиды представляют
собой не сферы, а правильные многогранники. Составляющие их едини-
цы, видимые на микрофотографиях и называемые капсомерами, или
морфологическими единицами, могут быть округлыми или призматиче-
скими по форме, сплошными или полыми и часто имеют хорошо выра-
женные отростки. У вирионов большинства вирусов капсомеры образуют
дельтоэдры, т. е. многогранники с равносторонними треугольными гра-
нями [133]. Специальный класс такого типа многогранников — так на-
64
Глава IV
зываемые икосадельтоэдры, включает многогранники, симметрия кото-
рых подобна симметрии икосаэдра, правильного многогранника с 12 вер-
шинами, 20 гранями и 30 ребрами. И коса дельтоэдр имеет 207 граней,
где Т — триангуляционное число, равное Pf1 2 (f — любое целое число;
Р=1, 3, 7, 19 ... = h2 + hk + k2 при hy=k). Ниже перечислены различные
классы икосадельтоэдров и приведены примеры вирусов.
Классы икосадельтоэдров и примеры вирусов, капсиды которых от-
носятся к этим классам [133, с изменениями.] Триангуляционное число
T = Pf2.
Р = h2 -г hk 4- /?2, где h и k — целые числа, не имеющие общего
множителя
f = 1,2,3,4
Классы.
А=1; /г=0; Р = 1; 7=1,4,9,16,25...
А = Г, А=1; 7 = 3; 7 = 3,12,27
Число треугольных граней=20 7.
Число структурных единиц=60 7.
Число морфологических единиц (капсомеров) = 107+2 [10(7—1)
гексамеров +12 пентамеров].
Примеры.
Фаг <рХ174:7=1; 12 капсомеров (каждый, вероятно, содержит
15 структурных единиц !).
Вирус желтой мозаики турнепса: 7=3; 32 капсомера (20 гексаме-
ров+12 пентамеров); 180 структурных единиц.
Вирус герпеса: 7=16; 162 полых капсомера (150 гексамеров +
+ 12 пентамеров); (960 структурных единиц?).
Аденовирус, тип 5: 7=25; 252 капсомера (240 гексамеров+12 пен-
тамеров); (1500 структурных единиц?).
Капсиды большинства вирусов представляют собой икосадельто-
эдры, на поверхности которых с помощью электронного микроскопа мож-
но обнаружить различное число морфологических единиц, причем число
это равно 107 + 2. Согласно данным рентгеноструктурного анализа и
электронной микроскопии, эти морфологические единицы состоят из
структурных субъединиц, одиночных или, что бывает чаще, собранных в
группы, которые представляют собой отдельные белковые молекулы кап-
сида (фиг. 10). На фото 12 и следующих далее микрофотографиях при-
ведены характерные примеры вирусных капсидов, иллюстрирующие эти
принципы.
Для вирионов аденовирусов, например, характерно наличие типич-
ного икосаэдрического капсида с 252 капсомерами ([369]; см. фото 12
и 13). Вирионы вируса желтой мозаики турнепса (фото 14) имеют
32 капсомера, а вирионы вируса герпеса содержат под внешней оболоч-
кой 162 капсомера ([913]; см. фото 16). Вирионы вируса раневых опу-
холей растений имеют форму икосаэдра, и их капсид состоит из 92 кап-
сомеров. Очень крупный вирус насекомых — радужный вирус долгонож-
ки (фото 7), по-видимому, имеет 812 капсомеров. Мельчайшие
бактериофаги, например фаг <рХ174, имеют только 12 капсомеров (фо-
то 19), каждый из которых, вероятно, содержит 15 белковых субъединиц
[131]. Исключительная правильность этих структур отражает принципы,
на основе которых формируются замкнутые белковые оболочки путем
сборки идентичных или почти идентичных субъединиц {133]. Дельтоэдры,
1 Заметьте, что при наличии 180 субъединиц эта структура подобна структуре
вируса желтой мозаики турнепса, но субъединицы сконцентрированы в точках, так что
они соответствуют симметрии 5-го порядка.
Свойства вирионов
65
представляющие собой наиболее близкое приближение к сферической
форме, возможное при условии, что они построены из большого числа
идентичных субъединиц, имеют так называемую кубическую симметрию
(тип симметрии 532). Правильный икосаэдр, например, имеет 6 осей
симметрии пятого порядка, проходящих через две противоположные вер-
шины, 10 осей симметрии третьего порядка, которые проходят через
центры треугольных граней, и 15 осей симметрии второго порядка, сое-
диняющих середины ребер.
Фиг. 10. Схема строения вируса желтой, мозаики турнепса [227].
А. Схематическое изображение наружной поверхности частицы. Капсид состоит из 180 субъединиц;
группа из 3 субъединиц образует асимметричную кристаллографическую единицу. Морфологические
единицы — пентоны и гексоны — возникают в результате объединения субъединиц в группы. Б. Срез
частицы, на котором схематически показано положение одиночной нити РНК относительно белковых
субъединиц.
На поверхности сферы можно симметрично уложить 60 идентичных
субъединиц, но поскольку у всех до сих пор изученных вирусов обнару-
жено значительно большее число субъединиц, белковая оболочка долж-
на иметь структуру икосаэдра. Если капсид строится из белковых субъе-
диниц одинаковой величины в соответствии с этими правилами, то субъе-
диницы образуют пяти- и шестичленные кольца, причем пятичленные
кольца образуют вершины икосаэдра. В вирусных капсидах группы из 5
или 6 субъединиц часто объединяются в морфологические единицы—кап-
сомеры, которые видны на электронных микрофотографиях вирионов.
Такие пяти- и шестиугольные капсомеры, или пентоны и гексоны [275],
различимы на очень хороших (наилучших) электронных микрофотогра-
фиях вирусов (фото 16, 17; см. также фото 12, 13). В некоторых случаях
эффект объединения субъединиц в капсомеры, который мы наблюдаем
на электронных микрофотографиях, может представлять собой артефакт,
вызванный высыханием.
Число капсомеров в вирусных капсидах определяется по формуле
N= 10х(п — 1)2 + 2,
5 Заказ » 1214
66
Глава IV
где N — число капсомеров, х равно 1 или 3 и п — целое число, большее
единицы (см. стр. 64). Так, у фага фХ174 А=12, х=1. п = 2; у вируса
желтой мозаики турнепса А = 32, х = 3, п = 2; у аденовируса х=1, п = 6,
А = 252. Возможно, существуют классы капсидов с более высоким зна-
чением х, но они, по-видимому, менее стабильны и до сих пор не об-
наружены.
Линейные размеры квазисферических капсидов колеблются в преде-
лах от 150 до 1300 А. Сравнительно часто встречаются капсиды с разме-
рами 250—300 А. Икосадельтоэдры могут быть деформированы таким
образом, что на основании тех же принципов образуются удлиненные
эллипсоиды, а не квазисферические тела. Это легко продемонстрировать
на примере вирионов вируса папилломы Шоупа, которые могут иметь
любую из указанных форм (фото 18); обладают ли инфекционностью
вирионы и той и другой формы или лишь сферические, неизвестно.
Данные о размерах и организации изометрических капсидов, полу-
ченные с помощью рентгеноструктурного анализа вирусных кристаллов,
хорошо согласуются с данными, полученными с помощью электронной
микроскопии. Если размер белковых субъединиц известен на основании
химических данных, как это имеет место в случае вируса желтой мозаики
турнепса, то расположение белковых субъединиц в капсомерах можно
выяснить с помощью рентгеноструктурного анализа [461] и подтвердить
это с помощью электронно-микроскопических данных [227]. В отношении
большинства вирусов, однако, до сих пор не имеется определенных до-
казательств того, что все субъединицы изометрических капсидов иден-
тичны.
Организация нуклеиновой кислоты у вирусов с изометрическими
капсидами
О том, как уложены РНК или ДНК внутри вирусных частиц, изве-
стно мало. ДНК, молекула которой обладает довольно большой жест-
костью, должна быть свернута не беспорядочно, а каким-то правильным
образом. В результате исследования ориентированных фаговых волокон
с помощью поляризованного света и рентгеновских лучей выявлен не-
который способ внутренней организации [624]. Имеют ли РНК и одноце-
почечная ДНК вид беспорядочно свернутых клубков или уложены как-
то аккуратно, неизвестно, но по крайней мере в отношении вируса жел-
той мозаики турнепса на основе данных рентгеноструктурного анализа
полагают, что РНК образует выпячивания, расположенные симметрично
по отношению к капсомерам белковой оболочки [461].
Сложные капсиды
Доказательства сложного строения капсидов были получены в мор-
фологических и серологических исследованиях. Так, в вирионах адено-
вирусов, которые сначала казались построенными из капсомеров одного
типа, были обнаружены особые капсомеры, расположенные у вершин
икосаэдрических капсидов с отростками, обладающими иной антигенной
специфичностью ([866], см. фото 13).
Фото 19—25 и фиг. И иллюстрируют морфологию различных типов
бактериофагов. Только самые мелкие фаговые частицы имеют форму
икосаэдра, и их капсиды состоят из 12 капсомеров (фото 19); у самых
крупных фагов имеются отростки, или хвосты, которые служат органами
прикрепления к клеткам бактерии-хозяина (см. гл. IX). Существует
немного биологических объектов, которые были бы более удивительны,
чем Т-четные фаги, вирионы которых содержат по крайней мере 15 или
Свойства вирионов
67
20 белков, а возможно и больше, и обладают высокоорганизованной, изу-
мительно сложной и правильной структурой (фиг. 11). Белковая обо-
лочка головки этих фагов соответствует деформированному икосаэдру
[597]. У фага Т4 иногда наблюдается образование частиц с двумя отрост-
ками вместо одного (фото 23).
650 А
Фиг. 11. Схематическое изображение вириона фага Т4, его компонентов и механизма
проникновения стержня отростка сквозь оболочку бактериальной клетки.
А. Вирион с вытянутыми нитями отростка. Б. Вирион с сократившимися чехлом отростка и зубцами
базальной пластинки, соприкасающимися с оболочкой бактериальной клетки. 1 — воротничок: 2 — не-
сократившийся чехол отростка, 24 витка; 3 — стержень с центральным каналом; 4 — базальная плас-
тинка; 5 — сократившийся чехол, 12 витков; 6 — оболочка бактериальной клетки.
Воротничок и базальная пластинка Т-четных фагов характеризуются
гексагональной симметрией, подобной симметрии головки (фото 24, 25).
Изменение в одном из структурных белков белковой оболочки у некото-
рых мутантов фага Т4 приводит к образованию изометрического кап-
сида, который может содержать неполную молекулу ДНК. Известно
существование фагов с маленькими головками, которые не являются му-
тантами, а возникают в результате нарушения нормального процесса
созревания.
Выход нитей нуклеиновой кислоты из фаговых частиц можно наблю-
дать в электронном микроскопе, а иногда удается увидеть и измерить
полную длину молекулы ДНК.
5*
68
Глава IV
Внешние оболочки
Многие вирусы животных и некоторые вирусы растений имеют
внешние оболочки, окружающие их капсиды (фото 16). Природа и струк-
тура этих оболочек еще недостаточно изучены. Во многих случаях внеш-
ние оболочки содержат как вещества, специфичные для вирусов, так и
вещества, которые по своим химическим и серологическим свойствам
родственны некоторым компонентам мембраны клетки-хозяина. Внешние
оболочки, содержащие фосфолипиды, легко разрушаются растворите-
лями липидов [376]. На электронных микрофотографиях срезов Клеток,
зараженных вирусами с такими липидсодержащими внешними оболоч-
ками, внутри клеток можно наблюдать капсиды, лежащие непосредст-
венно у внутренней поверхности клеточной мембраны. Проходя через
поверхность клетки, они как бы обволакиваются этой мембраной и воз-
никают внешние оболочки, состоящие из одного или нескольких слоев.
В случае вируса герпеса аналогичный процесс может иметь место при
выходе их из ядра в цитоплазму.
Как будет более детально обсуждаться в гл. XIV, внешние оболочки
могут формироваться при выходе капсидов из клеток. Следует также
отметить, что их образование может иметь и функциональное значение,
ибо, сливаясь своей поверхностью с клеточной мембраной, они могут
служить частью механизма, облегчающего проникновение вновь сфор-
мированного вируса в другие клетки. На электронных микрофотогра-
фиях наружные слои таких внешних оболочек часто обнаруживают
структуру элементарной мембраны, характерную для цитоплазматиче-
ских мембран [683], но вместе с тем имеют также наружные выступы,
функция которых не ясна (фото 26). Вирионы некоторых вирусов, для
которых характерно наличие внешних оболочек, особенно миксовирусов,
имеют разнообразный внешний облик, т. е. они полиморфны; форма их
может быть при этом как сферической, так и удлиненной, нитевидной.
Это может отражать неточность процесса формирования внешней обо-
лочки у клеточной поверхности и, возможно, образование структур, со-
держащих только вещество оболочки и не содержащих внутреннего кап-
сида, очерчивающего контур частиц.
Вирионы некоторых других вирусов, таких, например, как вирусы
группы оспы и вирус контагиозного пустулезного дерматита, хотя и
имеют сложные внешние оболочки, полностью формируются в цито-
плазме, не чувствительны к эфиру, не дают перекрестных реакций с анти-
генами клетки-хозяина и, вероятно, содержат только вирусоспецифич-
ные вещества. Их морфология представлена на фото 28 и 29.
Частицы вируса везикулярного стоматита часто имеют форму напер-
стка (фото 30); их внешняя оболочка, по-видимому, образуется из кле-
точной мембраны [374]. Это неинфекционные неполные частицы — так на-
зываемые частицы Т. Инфекционные вирионы — частицы В — имеют
форму пули [379].
Полиэдры и капсулы
Некоторые вирусы насекомых вызывают образование интересных
структур в инфицированных клетках (гл. XVIII). Один класс вирусов —
вирусы гранулёза — имеют вирионы, состоящие из палочкообразных кап-
сидов, окруженных внешней оболочкой. Чаще всего эти вирионы заклю-
чены в большие белковые гранулы, или капсулы, имеющие овальную
форму и размеры около 500X200 А. Эти капсулы присутствуют в цито-
плазме, но не наблюдаются в ядрах инфицированных клеток. Другая
группа вирусов насекомых вызывает образование находящихся в ядре
Свойства вирионов
69
или в цитоплазме полиэдров, состоящих из белка. Внутри полиэдров и
вне их обнаруживаются палочкообразные вирионы, подобные вирионам
вируса гранулёза. Белки полиэдров и капсул серологически не связаны
с вирионами.
Не полностью сформированные вирионы
Неочищенные вирусные препараты, полученные из инфицированных
клеток, наряду со зрелыми вирионами всегда содержат другие продукты
вирусной активности. Упомянутые выше полиэдры вирусов насекомых
как раз и являются примером таких продуктов. В большинстве других
случаев, однако, вещества, связанные с вирусной активностью, морфоло-
гически или химически имеют прямое отношение к некоторым компонен-
там вириона. Например, в растениях, зараженных ВТМ, содержится так
называемый Х-белок, неотличимый от А-белка, который можно выделить
из зрелых вирионов. Подобно вирусу, этот Х-белок может образовывать
палочкообразные частицы, длина которых варьирует и которые, как пра-
вило, короче полностью сформированных вирионов.
В клетках, инфицированных вирусами с изометрическими капсидами,
наряду с полными вирионами часто встречаются пустые капсиды. Ней-
тральный фосфовольфрамат проникает в пустые капсиды и таким обра-
зом выявляется толщина и структура этих белковых оболочек. Пустые
белковые оболочки иногда могут быть кристаллизованы вместе с пол-
ными капсидами, но они легче и их можно отделить центрифугирова-
нием (верхний компонент при центрифугировании препарата вируса
желтой мозаики турнепса [569]). В некоторых случаях эти полые капсиды
не совсем пусты, а содержат уменьшенное количество нуклеиновой кис-
лоты [211, 752], а иногда и белок нуклеоида, возможно ассоциированный
правильным образом с нуклеиновой кислотой (фото 15, 21).
Пустые капсиды могут представлять собой либо разрушенные ви-
рионы, лишившиеся своей нуклеиновой кислоты, либо белковые обо-
лочки, собранные без нуклеиновой кислоты. Последнее, вероятно, имеет
место при образовании пустых капсидов в клетках, инфицированных
ДНК-содержащим вирусом псевдобешенства, когда биосинтез нуклеино-
вой кислоты избирательно ингибируется 5-фтордезоксиуридином [675].
Третья возможность, которую можно себе представить, а именно то, что
полые капсиды являются предшественниками зрелого вируса, кажется
невероятной, так как если бы это было так, то необходимо было бы за-
полнение пустых белковых оболочек нуклеиновой кислотой.
Процесс, посредством которого белковые субъединицы собираются в
изометрические капсиды, заполненные нуклеиновой кислотой, или лишен-
ные ее, объяснить трудно, так как белковая оболочка, пока она еще не
сформировалась, не является системой с минимальной свободной энер-
гией [133]. Поэтому для скрепления субъединиц в процессе их «кристал-
лизации» в монослой необходимы какие-то специфические химические
силы. Стабилизировать монослой может нуклеоид, если он присутст-
вует [98].
Тщательные исследования бактерий, зараженных фаговыми мутан-
тами, лишенными способности формировать нормальные вирионы («мор-
фогенетические» мутанты), подтверждают, что сборка капсидов происхо-
дит всегда вокруг некой сердцевины, или нуклеоида [445]. В капсидах
фага X [426], и даже в аномальных частицах некоторых мутантов фага Т4
[445], обнаружены нуклеоиды, в которых наряду с нуклеиновой кислотой
содержится белок.
70
Глава IV
Заключение
Структура и морфология вирусных частиц знакомит нас с увлека-
тельными проблемами морфогенеза на молекулярном уровне. Действи-
тельно, очевидно, что вся проблема молекулярной организации белковых
слоев и спиральных нитей может быть, по-видимому, решена наиболее
эффективно путем изучения вирусов, хотя проблема эта в основных чер-
тах, по-видимому, одинакова для таких процессов, как сборка вирусов,
синтез мембран, образование жгутиков и нитей актина, а также других
нитевидных структур и макромолекул. Те несколько принципов, на ос-
нове которых строятся макромолекулярные структуры, таковы, что число
различных размеров и форм, которые могут иметь вирионы, оказывается
весьма ограниченным. Это ограничивает, но не сводит к нулю возмож-
ность использования морфологии вирионов как основного критерия для
классификации вирусов. Однако для установления сходства, отражаю-
щего генетическую гомологию, требуются более тонкие критерии, осно-
ванные на химическом и серологическом исследовании вирусных частиц,
а также на изучении естественной истории взаимоотношений вирус —
хозяин.
Глава V
ХИМИЯ ВИРУСОВ
МЕТОДОЛОГИЯ
Химия вирусов по существу является одним из разделов химии бел-
ков и нуклеиновых кислот. Поскольку вирусы служат одним из лучших
источников белков и нуклеиновых кислот, относящихся в каждом случае
к одному типу и легко поддающихся очистке, некоторые из наиболее
значительных достижений в изучении структуры и функции макромоле-
кул явились результатом исследования именно компонентов вирусов.
Ключом к изучению химии любого вещества является получение его в
чистом виде. Поэтому мы должны начать и данную главу с обсуждения
проблемы очистки вирусов.
Для химического изучения вирионов необходимо иметь препараты
значительно более чистые, чем для физического изучения их морфологии,
размера и структуры. Например, применение изотопной метки имеет
смысл лишь в том случае, если препарат вируса может быть полностью
очищен от посторонних радиоактивных примесей.
Очистка вирионов
Большинство методов очистки вирусов, применявшихся в раннем пе-
риоде их изучения, было основано на применении нескольких последо-
вательных циклов высокоскоростного и низкоскоростного центрифугиро-
вания. Бактериофаги, а также вирусы осповакцины и табачной мозаики
были очищены еще до 1940 г., причем только при помощи одного диф-
ференциального центрифугирования. Благодаря широкому распростра-
нению и доступности ультрацентрифуг этот метод и <по сей день остается
основой большинства схем очистки вирусов.
Первый кристаллический препарат вируса — а это был вирус табач-
ной мозаики — был получен Стэнли [806] при помощи метода высалива-
ния, заимствованного из химии белков. В основе этого метода лежит тот
факт, что растворимость различных классов белков при определенном
pH с изменением концентрации соли изменяется по-разному. Благодаря
этому, постепенно увеличивая концентрацию соли, можно последователь-
но перевести различные белки один за другим из раствора в осадок. Для
концентрирования вирусов, устойчивых к действию спирта, можно
использовать еще одно физико-химическое свойство белков — нераство-
римость в спиртах. Иногда вирионы могут увлекаться в осадок при осаж-
дении нуклеиновых кислот спиртом. Осаждение спиртом является пер-
вым этапом при очистке вируса полиомиелита [138] и некоторых бакте-
риофагов. Некоторые фаги удается концентрировать путем осаждения
кислотой [334].
Вирус гриппа можно частично очистить, используя его специфиче-
скую способность агглютинировать эритроциты [6]. Вирионы этого вируса
при низких температурах специфически связываются эритроцитами, ко-
торые осаждают центрифугированием и отмывают от клеточного дет-
71
72
Глава V
рита. Если затем комплекс вирус — эритроциты инкубировать при 37°, то
вирус элюируется с поверхности эритроцитов. Этот элюировавший в ра-
створ вирус легко отделить от эритроцитов, ибо эритроциты осаждаются
при обычном центрифугировании.
Первичное обогащение содержащего вирус материала и очистку его
от клеточного детрита можно с успехом осуществить, используя двух-
фазные системы жидких полимеров, ибо в таких системах вирус и кле-
точный детрит распределяются по-разному [647]. Некоторые вирусы жи-
вотных можно очистить, смешивая содержащие вирус экстракты с фтор-
углеродными соединениями, например с трихлортрифторэтаном, ибо эти
соединения действуют на белки клеток как денатурирующие агенты.
В большинстве случаев при помощи описанных выше методов не
удается получать препараты вирусов высокой степени чистоты. По-
этому, как правило, эти методы используются лишь в качестве первич-
ных этапов очистки вирусов, предшествующих иным, более тонким
методам.
Зональное и изопикническое центрифугирование — два метода,,
использующие мощь ультрацентрифуги значительно эффективнее и по-
зволяющие достичь большего разрешения, чем простые попеременные’
циклы высокоскоростного и низкоскоростного центрифугирования, уже
были обсуждены в гл. IV. Разрешение, достигаемое при центрифугиро-
вании в градиентах CsCl или Cs2SO4, очень велико. Например, при по-
мощи этого метода удается легко разделить частицы бактериофагов,,
отличающиеся друг от друга по плотности всего на 0,05 г-см-3. Этому
различию в плотности, согласно Уэглю и его сотрудникам, соответст-
вует относительное различие в содержании ДНК порядка 1%. При ис-
пользовании этих методов в качестве препаративных способов очистки
вирусов благодаря достигаемой в этом случае высокой степени разре-
шения удается получить также аналитические данные о вирусном
препарате.
Успехи, достигнутые за последние годы в области хроматографии
на колонках, оказались очень полезными для всех областей эксперимен-
тальной биологии и биохимии, в том числе и для вирусологии. Пожалуй,
наиболее широко в вирусологии применяется колоночная хроматогра-
фия на модифицированной целлюлозе [644, 797], которая часто дает луч-
шие результаты, чем, например, хроматография на гелях фосфата каль-
ция или алюминия. Для очистки вирусов применяется и гель-фильтрация.
[651], при помощи которой удается достичь не меньшей степени разре-
шения, чем при помощи колоночной хроматографии. Эти методы сходны
между собой, но при гель-фильтрации разделение компонентов осуще-
ствляется не за счет различий в их химических свойствах, а за счет раз-
ницы в их размерах.
Очищенные препараты вирусов растений и животных часто кристал-
лизуются. Кристаллизация, как таковая, не является, однако, абсолют-
ным критерием чистоты, несмотря на то что любой кристаллизующийся
вирусный препарат в основном состоит из вируса. Считается, что истин-
ные кристаллы образуют лишь частицы, обладающие очень упорядочен-
ной конфигурацией поверхности с регулярно повторяющимися центрами
связывания. И действительно, сложные бактериофаги и содержащие ли-
пиды вирусы животных не образуют кристаллов. Кристаллы наиболее
правильной формы образуют вирусы, характеризующиеся икосаэдриче-
ской симметрией, например вирус желтой мозаики турнепса или вирус
полиомиелита. Палочкообразные вирусы со спиральной симметрией типа
ВТМ образуют ориентированные гели (паракристаллы или жидкие кри-
сталлы). На фото 31 изображены кристаллы, образуемые некоторыми
вирусами, и показано расположение вирионов на поверхности кристалла
Химия вирусов
73
Критерии оценки химической чистоты вирусов
Для того чтобы избежать ошибок, которые могут возникнуть при
изучении загрязненности вирусных препаратов, необходимо иметь кри-
терии, позволяющие верно оценить степень чистоты вируса. Пределы и
типы допустимых загрязнений диктуются специфическими целями опыта,
для которого предназначается получаемый препарат вируса. Например,
если целью опыта является получение антисыворотки, специфичной по
отношению к белку вирусного капсида, то присутствие в препарате, при-
меняемом для иммунизации, небольших количеств клеточных нуклеино-
вых кислот по существу не скажется на конечном результате, тогда как
загрязнение этого препарата клеточными белками может повлиять на
специфичность полученной антисыворотки.
При изучении взаимодействия вируса с клеткой методами, при ко-
торых используются меченные радиоактивными изотопами аминокис-
лоты, входящие в состав вирусных белков, необходимо тщательно уда-
лить из препарата вируса все свободные меченые аминокислоты. В слу-
чае, если такие аминокислоты имеются, может быть получен неверный
результат, ибо они проникают в клетки быстрее и эффективнее, чем ви-
русный белок. Для проведения подобных опытов необходимо иметь пре-
парат вируса, в равной степени очищенный как от макромолекул неви-
русного происхождения, так и от малых молекул, в составе которых мо-
жет содержаться используемая метка. Эта цель лучше всего достигается,
если очистку вируса проводят при помощи наиболее совершенных мето-
дов: зонального центрифугирования, центрифугирования в градиенте
плотности или хроматографии на колонках.
ОСНОВНЫЕ СВОЙСТВА НУКЛЕИНОВЫХ КИСЛОТ И БЕЛКОВ
Все до сих пор изученные вирусы содержат нуклеиновую кислоту
только одного типа, т. е. рибонуклеиновую кислоту (РНК) или дезокси-
рибонуклеиновую кислоту (ДНК). Во всех до сих пор анализировав-
шихся вирусах растений была обнаружена только РНК. Вирионы многих
вирусов растений содержат белок лишь одного типа. Вирусы бактерий
и животных в этом отношении более вариабельны. Так, например, неко-
торые из них содержат один или несколько белков, тогда как другие —
много самых различных типов белковых молекул. В состав некоторых
вирусов животных, в том числе и в состав их внешних оболочек, входят
липиды и липопротеиды. Однако, прежде чем перейти к более подроб-
ному обсуждению свойств вирусных белков и нуклеиновых кислот, имеет
смысл кратко суммировать основные данные, полученные при изучении
биохимии и биологии нуклеиновых кислот и белков вообще.
Структура нуклеиновых кислот
Нуклеиновые кислоты представляют собой длинные неразветвлен-
ные полимерные цепи, состоящие из основных единиц (мономеров), на-
зываемых нуклеотидами, В свою очередь в состав каждого нуклеотида
входят три компонента: азотистое основание, сахар (рибоза в случае
РНК и дезоксирибоза в случае ДНК) и остаток фосфорной кислоты. Азо-
тистое основание, соединенное с сахаром при помощи N-гликозидной
связи, называется нуклеозидом. Следовательно, нуклеотид является фос-
форным эфиром нуклеозида. Три из пяти классических азотистых осно-
ваний — аденин, гуанин и цитозин — обнаружены как в РНК, так и в
ДНК, четвертое основание — урацил — только в РНК (за исключением
ДНК некоторых бактериофагов), а пятое — тимин — лишь в ДНК. Аде-
74
Глаеа V
нин и гуанин — это пуриновые основания; цитозин, урацил и тимин —
пиримидиновые основания (фиг. 12).
Помимо обычных азотистых оснований, в гидролизатах некоторых
РНК и ДНК были обнаружены в небольших количествах и многие дру-
гие азотистые основания. Некоторые из них, согласно Флейснеру и
Бореку, являются метилированными производными обычных азотистых
оснований и образуются путем ферментативного метилирования послед-
них уже после их включения в состав полинуклеотидных цепей. Биологи-
Пиримидины
nh2
Лденин
'Фиг 12. Структурные формулы
входящих
основных пуриновых и пиримидиновых
в состав нуклеиновых кислот.
оснований,
ческое значение метилирования пока остается неясным. Некоторые не-
обычные азотистые основания были обнаружены только в ДНК некото-
рых бактериофагов. Эти азотистые основания были использованы в ка-
честве удобных химических маркеров при изучении репликации этих
фагов, что будет подробно рассматриваться в гл. IX. В РНК вирусов
животных и растений необычные основания пока обнаружены не были
[566].
В полинуклеотидной цепи соседние нуклеотиды соединены друг
с другом фосфодиэфирными связями между З'-углеродным атомом ри-
бозы (или дезоксирибозы) одного нуклеотида и б'-углеродным атомом
другого (фиг. 13). Количество нуклеотидов, образующих единичную по-
линуклеотидную цепь у изученных к настоящему времени РНК, встре-
чающихся в природе, варьирует от 70 (у транспортной РНК [369]) до
40 000 (у некоторых вирусных РНК). У некоторых вирусов молекулы
ДНК состоят из более чем 500 000 нуклеотидов. Получены данные, сви-
детельствующие о том, что геном бактерии — это одна молекула ДНК,
цепь которой состоит примерно из 107 нуклеотидов [122].
Химическая стабильность нуклеиновых кислот
Сильные кислоты гидролизуют как РНК, так и ДНК. Обычно для
этой цели используют муравьиную или хлорную кислоты. В результате
гидролиза нуклеиновые кислоты расщепляются на составляющие их
нуклеотиды. Их разделение и количественное определение можно осу-
ществить при помощи хроматографии на бумаге или на колонках.
Благодаря тому что РНК и ДНК отличаются друг от друга по на-
личию или отсутствию ОН-группы у 2'-атома углерода сахарного остат-
ка, в щелочных растворах они ведут себя различно. Несмотря на то что
при высоких значениях pH структура ДНК резко изменяется, дезокси-
Химия вирусов
75
полинуклеотидная цепь остается интактной. Напротив, РНК в этих усло-
виях разрушается до 2'-, З'-мононуклеотидов (см. фиг. 14). Последние
можно легко отделить и измерить их количество. Щелочной гидролиз
РНК — весьма полезная процедура, поскольку она приводит к переносу
3'- конец,
Фиг. 13. 3,'5'-связи, образуемые
между нуклеотидами полирибонуклеотидной цепи.
Фиг. 14 Щелочной гидролиз РНК.
Обратите внимание на то, что фосфатный остаток (Ф), который при образовании полирибонуклеотид-
ной цепи был присоединен к 5'-углеродному атому рибозы, при гидролизе переносится на 3-углерод-
ный атом рибозы. Прерывистой линией обозначено место разрыва цепи при щелочном гидролизе,
цифры 3 и 5 обозначают 3Z, 5'-атомы углерода рибозы, Осн — основания.
фосфатного остатка из положения 5' одного нуклеотида в положение 3'
соседнего нуклеотида.
Поскольку большинство молекул РНК представляет собой достаточ-
но длинные цепи, распределение нуклеотидов внутри цепи приближается
76
Глава V
к случайному. Если РНК выделена из клетки, меченной Р32, то ее нукле-
отидный состав может быть определен просто по распределению Р32 в.
различных 2'-, З'-рибонуклеотидах, полученных путем щелочного гидро-
лиза. Подобным методом были обнаружены различия между отдельными
фракциями РНК, полученными из цельных клеток или вирусов [354, 878]:
Последовательность расположения азотистых оснований в РНК или
ДНК не является, однако, совершенно случайной. Эта закономерность их
расположения лежит в основе методов изучения распределения нуклео-
тидов в нуклеиновых кислотах, синтезируемых in vitro ферментативным
путем.
Ферменты, гидролизующие нуклеиновые кислоты (общие сведения)
В любых клетках вне зависимости от их типов содержится много
различных ферментов, гидролизующих нуклеиновые кислоты [210, 500].
Эти ферменты оказали неоценимую услугу при изучении нуклеиновых
кислот, несмотря на то что их наличие в клетках представляет собой
потенциальную опасность для выделения нуклеиновых кислот в интакт-
ном состоянии. Специфичность различных ферментов, гидролизующих
нуклеиновые кислоты, варьирует от очень широкой до очень узкой, при-
чем некоторые из них атакуют как РНК, так и ДНК, тогда как другие —
только РНК или только ДНК. Существуют ферменты, специфичные лишь
в отношении одноцепочечной или лишь двухцепочечной ДНК. Нуклеазы
могут атаковать полинуклеотид либо с конца (экзонуклеазы), либо в
любом случайном месте (эндонуклеазы).
Одним из первых ферментов, полученных в кристаллическом со-
стоянии, была панкреатическая рибонуклеаза (РНК-аза) — эндонуклеа-
за, гидролизующая только связи, образованные между З'-фосфатом пи-
римидиновых нуклеотидов и 5'-гидроксилом соседнего нуклеотида. Полу-
чаемый в результате гидролизат представляет собой смесь мононуклео-
тидов, а также олигонуклеотидов различной степени сложности. Остаю-
щийся в З'-положении фосфатный остаток образует 2,-3,-циклический
фосфодиэфир, в результате распада которого образуется либо 2'-, либо<
З'-мононуклеотид. Панкреатическая рибонуклеаза исключительно устой-
чива к нагреванию. Интересным свойством рибонуклеазы является тот
факт, что полирибонуклеотиды, связанные водородными связями с ком-
плементарными полинуклеотидами (содержащими как рибозу, так и
дезоксирибозу), она атакует намного медленнее, чем одноцепочечную
РНК. Следовательно, действуя на соответствующие препараты разбав-
ленным раствором РНК-азы, можно избирательно гидролизовать одно-
цепочечную РНК; при этом двуспиральные молекулы РНК и гибриды
ДНК—РНК практически не изменяются.
Близкие по активности ферменты обнаружены в самых различных
тканях животных и растений, а также в бактериальных клетках. Следо-
вательно, деградация клеточной РНК при ее выделении из тканей дол-
жна быть обычным явлением. И действительно, одно из наибольших пре-
имуществ изучения этой нуклеиновой кислоты на модели вирусных РНК
состоит в том, что РНК вирусов можно выделить в условиях, почти пол-
ностью исключающих загрязнение препарата клеточными ферментами.
Показано, что рибонуклеазы, выделенные из нескольких иных источни-
ков, отличаются друг от друга по специфичности в отношении суб-
страта. Например, РНК-аза, выделенная из В. subtilis, специфична в от-
ношении пуриновых З'-нуклеотидов [619], тогда как многие другие нук-
леазы атакуют связи, образуемые между любыми нуклеотидами. Рибо-
нуклеаза, выделенная из такадиастазы, коммерческого продукта, полу-
Химия вирусов
77
чаемого из Aspergillus oryzae, почти избирательно гидролизует РНК у
^'-гидроксила, примыкающего к гуаниловой кислоте [210].
Фосфодиэстераза змеиного яда является экзонуклеазой. Она содер-
жится в яде ядовитых змей практически всех видов [490]. Этот фермент
осуществляет ступенчатое расщепление РНК и частичное расщепление
ДНК, начиная со свободного З'-конца цепи, в результате чего высвобож-
даются 5'-мононуклеотиды.
Фосфодиэстераза селезенки обладает в основном экзонуклеазной
активностью как по отношению к олигорибонуклеотидам РНК, так и по
отношению к ДНК, однако в отличие от фосфодиэстеразы змеиного яда
при действии этого фермента последовательно отщепляются З'-нуклео-
тиды, начиная с 5'-конца цепи [331]. Действуя на РНК совместно с пан-
креатической рибонуклеазой, этот фермент количественно расщепляет
РНК до монорибонуклеотидов. В смеси же с ДНК-азой из микрококков
этот фермент расщепляет ДНК до монодезоксирибонуклеотидов [421].
Панкреатическая ДНК-аза является фосфодиэстеразой. В резуль-
тате ее действия на ДНК образуется некоторое количество З'-монодезок-
синуклеотидов, значительное количество динуклеотидов, но в основном
образуются олигонуклеотиды [777]. Эта ДНК-аза атакует как нативную,
так и денатурированную, т. е. одноцепочечную, ДНК. Атакуя двухцепо-
чечную ДНК, она, по-видимому, разрывает обе цепи не одновременно.
Интересным свойством обладает фосфодиэстераза, выделенная из
Е, coll [500]. Этот фермент атакует только денатурированную, одноцепо-
чечную ДНК.
Структура и функция ДНК
Открытие, сделанное Эвери с сотр. [35] и показавшее, что пневмо-
кокки одного серологического типа могут быть превращены в пневмо-
кокки другого серологического типа путем добавления к первым ДНК,
выделенной от вторых, пробудило интерес к ДНК как к носителю гене-
тической информации. Обнаружение у бактериофагов ДНК, а также тот
факт, что компонент, проникающий в бактерию при репликации фага,—
это именно ДНК, а не белок [342], еще более подкрепило убеждение, что
ДНК является веществом, функция которого состоит в хранении генети-
ческой информации.
Большая часть того, что мы знаем в настоящее время о действии
нуклеиновых кислот, имеет своим истоком работу Уотсона и Крика [891],
пролившую свет на структуру ДНК. Предложенная ими модель ДНК
согласуется с двумя главными наблюдениями: 1) в большинстве препа-
ратов ДНК содержание гуанина равно содержанию цитозина, а содер-
жание аденина — содержанию тимина [137]; 2) при рентгеноструктурном
анализе волокон обнаружена их спиральная структура [915]. Согласно
модели Уотсона и Крика, ДНК состоит из двух полидезоксирибонуклео-
тидных цепей, свернутых в виде спирали и удерживаемых друг относи-
тельно друга системой водородных связей, образуемых между гуанином
и цитозином и аденином и тимином (см. фиг. 15, 16; фото 32). Таким
образом, становится понятным, почему эти пары азотистых оснований
содержатся в ДНК в равных количествах: ведь каждому остатку гуани-
на, находящемуся в одной цепи, обязательно соответствует расположен-
ный против него остаток цитозина, входящий в состав второй цепи,
а каждому остатку аденина подобным же образом соответствует оста-
ток тимина. Благодаря такой структуре при репликации ДНК вся содер-
жащаяся в ней генетическая информация точно сохраняется в виде вос-
производимой специфической последовательности оснований. Каждая из
двух цепей ДНК может детерминировать образование комплементарной
78
Глава V
себе пары. Этот процесс происходит путем отбора соответствующих
нуклеотидов-предшественников для синтеза новых полинуклеотидных
цепей [892].
К числу наиболее важных экспериментов, поставленных с целью
проверки справедливости следствий, вытекающих из модели ДНК, пред-
Фиг. 15. Водородные связи, образуемые, согласно предположению Уотсона и Крика,
между парами аденин — тимин (Л) и гуанин — цитозин (Б).
ложенной Уотсоном и Криком, можно отнести опыты, посвященные ана-
лизу механизма репликации ДНК, разделения цепей ДНК и их отжига,
а также исследования по изучению механизмов ферментативного син-
теза ДНК-
Репликация ДНК
Мезельсон и Сталь [587] пришли к заключению, что если ДНК син-
тезируется в соответствии со схемой, предложенной Уотсоном и Криком,
то после одного цикла репликации ДНК каждая состоящая из двойной
спирали молекула должна содержать по одной вновь образовавшейся и
Химия вирусов
79
одной родительской цепи. Метод равновесного центрифугирования в гра-
диенте плотности CsCl, при помощи которого можно разделить молекулы
ДНК, обладающие различной плавучей плотностью, позволил проверить
справедливость этой гипотезы в прямом опыте. С этой целью бактерии
выращивали на питательной среде, содержащей N15H4C1, а затем пере-
Фиг 16. Взаимное расположение двух цепей ДНК, образующих двойную спираль
Уотсона—Крика [891].
носили их в среду, содержащую N14H4C1. Через различные промежутки
времени из бактерий выделяли двухцепочечную ДНК и анализировали
ее при помощи центрифугирования в градиенте плотности CsCl.
Вся ДНК, выделенная из бактерий, взятых в начале опыта, обнару-
живалась в одной «тяжелой» фракции. После одной генерации, т. е. после
одного цикла удвоения ДНК в среде, содержащей N14, основная масса
ДНК сосредоточивалась точно посредине между фракциями, в которых
локализовались Г414-ДНК и М15-ДНК соответственно (зона промежуточ-
ной плотности ДНК). Через две генерации появлялась фракция, в кото-
рой локализовалась «легкая» М14-ДНК, однако фракция, содержащая
ДНК промежуточной плотности, выявлялась как в этом препарате, так
и в препаратах, полученных из бактерий следующих генераций. Этот
опыт показывает, что процесс репликации ДНК включает превращение
каждой цепи исходной двойной спирали в гибридную молекулу, состоя-
щую наполовину из родительской, а наполовину — из вновь синтезиро-
ванной цепи.
Глава V
80
Аналогичные результаты были получены при изучении репликации
ДНК клеток Chlamydomonas [828] и ДНК клеток млекопитающих [772].
Изучение разделения и воссоединения нитей ДНК
при помощи физических методов
При нагревании в соответствующей среде структура ДНК разру-
шается. Об этом свидетельствует резкое уменьшение вязкости и увели-
чение поглощения в ультрафиолете [571].
Нагревание должно вести к уменьшению молекулярного веса ДНК,
ибо в этом случае происходит разрыв водородных связей, удерживаю-
щих две цепи ДНК в единой молекуле [571]. Гибридная ДНК, получен-
ная в опытах Мезельсона и Сталя, при нагревании до 100° разделялась
на две фракции, содержавшие цепи, меченные N14 и N15 соответственно.
Молекулярный вес ДНК, содержавшейся в каждой из фракций, был
вдвое меньше молекулярного веса нативной ДНК. «Плавление» ДНК
происходит при различной температуре в зависимости от вида организ-
ма. Чем больше содержится в ДНК пар гуанин — цитозин, тем выше тем-
пература, при которой она плавится. Если горячий раствор ДНК быстро
охладить, то ДНК остается денатурированной. Если охлаждение вести
медленно, то вязкость раствора повышается, а поглощение в ультрафио-
лете уменьшается. В результате медленного охлаждения молекула вновь
приобретает структуру двойной спирали. Эта процедура медленного
охлаждения носит название отжига. В результате ДНК претерпевает
ренатурацию. Поскольку в основе ренатурации нагретой ДНК лежит
регенерация водородных связей, образуемых между специфически рас-
положенными в соответствующих цепях нуклеотидами, этот метод яв-
ляется мощным инструментом изучения генетической гомологии и, что
еще важнее, способом изучения гибридов РНК—ДНК, которые можно
получить, используя подобную же технику.
Ферментативный синтез ДНК
Другим источником информации о структуре ДНК и механизме ее
репликации явилось открытие ферментов — ДНК-полимераз, способных
катализировать образование полидезоксирибонуклеотидов из дезоксири-
бонуклеозидтрифосфатов [470]. Синтез ДНК in vitro, осуществленный
впервые, был проведен при помощи очищенного фермента, выделенного
из Е. coli [501]. Активность этого фермента зависела от присутствия в
среде ДНК и всех четырех трифосфатов: дАТФ, дГТФ, дЦТФ и дТТФ.
Было обнаружено, что матричную функцию может выполнять как ДНК
Е. coll, так и любая другая ДНК. Образующаяся в результате этой реак-
ции ДНК обладает суммарным нуклеотидным составом, дополнительным
по отношению к ДНК-матрице [503].
При помощи так называемого метода ближайших соседей было по-
казано, что распределение азотистых оснований в синтезированной фер-
ментативным путем молекуле ДНК является зеркальным отражением
их распределения в ДНК-матрице [421]. В этих опытах были использо-
ваны четыре различные реакционные смеси, в каждой из которых один
из трифосфатов метили Р32 по проксимально локализованной фосфатной
группе, связанной с 5'-углеродным атомом дезоксирибозы. Синтезирован-
ную ДНК разрушали таким образом, что фосфатный остаток переходил
из 5'-положения одного нуклеотида в З'-положение соседнего нуклеотида
(т. е. процесс шел аналогично распаду РНК, показанному на фиг. 14).
Количество Р32, содержащегося в каждом нуклеотиде, служит пока-
зателем частоты, с которой каждый из нуклеотидов соседствует с каж-
Химия вирусов
81
дым другим нуклеотидом. Оказалось, что частота встречаемости различ-
ных пар нуклеотидов во вновь синтезированной ДНК определяется ДНК-
матрицей и специфична именно для нее, причем даже в тех случаях,
когда в качестве матрицы используют ДНК со сходным суммарным
нуклеотидным составом (табл. 6). Было, однако, обнаружено, что неко-
торые пары нуклеотидов всегда встречаются в равных количествах.
Например, количество аденина, соседствующего с цитозином, всегда
равно количеству гуанина, соседствующего с тимином. Такой характер
распределения говорит о том, что фермент катализирует копирование
каждой из цепей двухцепочечной структуры ДНК, обладающей свойст-
вами двойной спирали Уотсона и Крика.
Ферменты, обладающие свойствами ДНК-полимеразы, были выде-
лены из клеток самого различного происхождения. Были открыты ДНК-
полимеразы, специфичные для клеток, зараженных вирусами. Этот во-
прос будет рассматриваться далее в гл. IX и XIV.
Таблица 6
Относительная частота встречаемости различных нуклеотидных пар в ДНК из
Hemophilus influenzae 1
Меченый трифосфат Выделенные 3'-дезоксирибонуклеотиды
Тф Аф Цф Гф
дАТФ33 ТфАа 0,073 АфА6 0,116 I ЦфАв 0,06711 ГфАг 0,054111
дТТфзз ТфТб 0,1161 АфТа 0,095 ЦфТг 0,0491V ГфТв 0,048 V
дГТфзз ТфГ* 0,06711 АфГе 0,050IV ЦфГж 0,038 ГфГ3 0,036 VI
дЦТфзз ТфЦе 0,05 III АфЦД 0,049 V ЦфЦз 0,037VI ГфЦж 0,053
1 Цифры в таблице представляют собой выраженное в процентах содержание каждой данной
нуклеотидной пары по отношению к общему содержанию нуклеотидов в данной ДНК.
Метод определения частоты ближайших соседей был разработан Джоссом и сотр. [421] с целью
изучения продукта, образуемого при действии ДНК-полимеразы. Его основная идея заключается в
изучении ДНК, образующейся в четырех реакционных смесях, отличающихся друг от друга только
тем, какой из 5'-нуклеозидтрифосфатов содержит Р32. Синтезированную ДНК затем гидролизуют
при помощи фермента, переносящего Р32 в З'-положение соседнего нуклеотида, в соста-
ве которого Р32 затем и выделяется. Анализ полученных данных показал, что распределение радио-
активности между различными нуклеотидами детерминируется ДНК-матрицей и специфично для
каждой ДНК. Здесь уместно обратить внимание на одно очень важное обстоятельство, имеющее
прямое отношение к этим опытам. Дело в том, что если двойная спираль ДНК состоит из антипа-
раллельных цепей (т. е. из цепей с направлением связей 5* -> 3' в одной цепи и 3'-> 5' в противо-
положной), то в этом случае должна наблюдаться определенная закономерность в распределении
нуклеотидных пар, например количество гуанина, соседствующего с тимином, должно равняться ко-
личеству аденина, соседствующего с цитозином. Пары нуклеотидов, которые соответствуют такому
антипараллельному расположению цепей, обозначены одинаковыми римскими цифрами. Если же
две нити ДНК не антипараллельны, а, скажем, содержат связи типа 5'-> 3'. то следует ожидать
получения иных результатов. Например, количество гуанина, соседствующего с ти-
мином, в этом случае должно быть равно количеству цитозина, соседствующего с
аденином (пары нуклеотидов, которые соответствовали бы такому не антипараллельному располо-
жению цепей, обозначены одинаковыми буквами в верхнем индексе). Эти опыты подтвердили пред-
положение о том, что цепи, образующие молекулу ДНК, антипараллельны.
От ДНК к РНК и далее от РНК к белку
Примерно в 1955 г. приобрела популярность гипотеза, согласно ко-
торой ДНК является первичным хранителем генетической информации,
реализующейся при синтезе специфических белков благодаря посредни-
ческой функции РНК. Одной из главных причин, приведших к мысли,
что РНК обладает способностью осуществлять функцию переносчика
генетической информации, послужило существование вирусов, содержа-
6 Заказ № 1214
82
Глава V
щих только РНК и тем не менее реплицирующихся, образуя генетически
идентичное потомство. Обнаружение инфекционных свойств у РНК, вы-
деленной из вируса табачной мозаики, показало, что именно РНК ответ-
ственна за синтез белка капсида этого вируса.
Однако, прежде чем перейти к изложению современного представ-
ления о роли ДНК и РНК в синтезе белка, мы кратко изложим данные
о строении белков.
СТРУКТУРА И СИНТЕЗ БЕЛКОВ
Молекулы белков представляют собой длинные неразветвлённые
цепи, называемые полипептидами. Элементарными звеньями полипепти-
дов служат аминокислоты. Вообще в природе обнаружено много различ-
ных аминокислот, но в белках чаще всего встречаются 20 из них. Строе-
ние любой аминокислоты можно описать следующей формулой:
R
NH2 — СН — СООН
В образовании остова полипептидной цепи принимают участие обе реак-
ционные группы аминокислоты — аминогруппа и карбоксильная группа,
так что получается структура, схематически изображенная ниже:
R R R R
NH2CHCO — NHCHCO------NH^HCO — NH(!hCOOH
а Ь у z
Аминокислотный остаток а, находящийся на левом конце этой полипеп-
тидной цепи, содержит свободную аминогруппу. Этот остаток называют
N-концевым, а аминокислотный остаток г, имеющий свободную карбок-
сильную группу, называют С-концевым. Амидная связь, образующаяся
между двумя аминокислотами, называется пептидной связью.
Длина полипептидных цепей широко варьирует [731]. Так, А-цепь
инсулина состоит из 21 аминокислотного остатка, молекула рибонуклеа-
зы— из 124, а тяжелая цепь у-глобулина — примерно из 500. Молекулы
большинства белков содержат две или более полипептидные цепи, кото-
рые могут быть либо идентичными, либо отличаться друг от друга. Так,
молекула инсулина состоит из двух различных полипептидных цепей,
молекула щелочной фосфатазы Е. coli — из двух идентичных цепей, а мо-
лекула гемоглобина — из четырех полипептидных цепей (две а- и две
0-цепи).
Считается общепринятым, что наиболее важным, если не единствен-
ным фактором, определяющим структуру белка, является его первичная
структура, т. е. последовательность аминокислот, входящих в состав
образующих белковую молекулу полипептидных цепей. Как полагают,
именно первичная структура определяет характер и расположение внут-
римолекулярных связей, ответственных как за вторичную структуру, так
и за способ, каким полипептидная цепь свертывается, приобретая свой-
ственную ей трехмерную конфигурацию (третичная структура). Более
того, считается, что первичная структура определяет даже результат
взаимодействия друг с другом сложенных полипептидных цепей при
образовании ими в конечном счете готовой молекулы белка (четвертич-
ная структура). Эта концепция является основой, на которой строится
ответ на вопрос, каким образом нуклеиновые кислоты определяют
структуру белка. Если линейная последовательность аминокислот опре-
деляется линейной нуклеотидной последовательностью, то не требуется
Химия вирусов
83
никаких дополнительных механизмов генетического контроля для сохра-
нения структуры белковой молекулы.
Изучению первичной структуры белка способствовал ряд принци-
пиальных открытий. В 1952 г. Сэнгер обнаружил, что динитрофторбензол
реагирует с N-концевым аминокислотным остатком полипептидной цепи
(а также с е-аминогруппами лизина), и, используя этот метод, показал,
что молекула инсулина содержит две N-концевые аминокислоты — гли-
цин и фенилаланин. Исходя из этих данных, он пришел к выводу, что
молекула инсулина состоит из двух полипептидных цепей. При действии
на инсулин муравьиной кислоты эти цепи отделяются друг от друга и
частично деградируют. Получаемые в результате пептидные фрагменты
можно разделить при помощи метода хроматографии на бумаге и элек-
трофореза. Определив аминокислотный состав каждого фрагмента, а за-
тем сопоставляя частично перекрывающиеся фрагменты, Сэнгер уста-
новил полную аминокислотную последовательность полипептидных це-
пей, образующих молекулу бычьего инсулина [727]. Это замечательное
достижение показало, что в чистых препаратах белка, например инсу-
лина, все молекулы идентичны, так что эти препараты вовсе не пред-
ставляют собой гетерогенную смесь различных полипептидных цепей.
Последовательность аминокислотных остатков от одного конца пептида
до другого у всех молекул данного белка совершенно одинакова.
Определение при помощи метода Сэнгера полной последовательно-
сти аминокислот для достаточно большого числа белков само по себе
является грандиозной задачей. Важное упрощение в этот метод ввел
Ингрэм [388]. Известно, что протеолитический фермент трипсин гидроли-
зует только те пептидные связи белка, которые образуются лизином или
аргинином. Поэтому молекула белка, подвергнутая действию трипсина,
должна распасться на столько фрагментов, сколько остатков лизина и
аргинина содержится в ее полипептидной цепи. Такая деградация всегда
приводит к получению одних и тех же пептидных фрагментов. Ингрэм
показал, что гемоглобин, подвергнутый действию трипсина, всегда дает
один и тот же набор пептидов, и продемонстрировал, что нормальный
гемоглобин человека отличается от гемоглобина людей, страдающих сер-
повидноклеточной анемией (наследственное заболевание), по одному
пептиду, в котором изменена всего одна аминокислота. Таким образом,
наиболее сложная генетическая система — генетическая система челове-
ка — явилась моделью, при исследовании которой впервые было дока-
зано, что мутация приводит к замене в белке всего одной аминокислоты.
Разработанный Ингрэмом метод, получивший название метода «отпе-
чатков пальцев», позволяет быстро обнаружить незначительные разли-
чия между близкородственными белками, например между белками
обычного вируса и его мутанта.
Механизм синтеза белка и определение типов РНК
Ранние работы Браше и Касперсона [см. 96] продемонстрировали
поразительную корреляцию между скоростью синтеза белка и содержа-
нием РНК. При изучении роли, которую играют различные фракции кле-
ток печени при включении аминокислот в кислотонерастворимые про-
дукты in vitro, было достоверно показано, что РНК принимает участие
в биосинтезе белка [936]. Оказалось, что большая часть РНК, содержа-
щаяся в активной, микросомной фракции, локализуется в частицах, полу-
чивших название рибосом. Включение аминокислот в белок не происхо-
дит в отсутствие АТФ и подавляется рибонуклеазой. Было обнаружено,
что для включения аминокислот необходим еще ряд факторов, в том
числе набор особых ферментов, превращающих каждую аминокислоту в
6*
Глава V
ее аминоацил-АМФ-производное. В результате этого процесса от АТФ
отщепляется молекула пирофосфата. Затем активированные аминокис-
лоты переносятся к молекулам особой разновидности РНК, получившей
название растворимой, или транспортной РНК (s-PHK). Для каждой
аминокислоты существует по меньшей мере одна, а часто несколько спе-
цифических типов молекул s-PHK. Функция s-PHK состоит в переносе
аминокислот к растущей полипептидной цепи. Включение аминокислот
в эту цепь осуществляется системой, связанной с рибосомами.
РНК-полимераза
ДНКаЬ
Фиг. 17. Выявление участков с идентичной последовательностью нуклеотидов при по-
мощи процесса гибридизации РНК и ДНК.
В системе, содержащей двуспиральную ДНК. благодаря действию РНК-полимеразы на одной из
цепей ДНК копируется комплементарная ей молекула РНК. После разделения цепей ДНК синтези-
ровавшаяся РНК образует двуспиральную гибридную молекулу с комплементарной ей цепью ДНК.
При смешивании такой РНК с цепями ДНК из других источников гибридов не образуется.
Полная нуклеотидная последовательность одной из s-PHK впервые
была установлена Холли [360]. Оказалось, что молекулы s-PHK несут на
конце одинаковую последовательность из трех нуклеотидов — триплет
ЦЦА, к которому и присоединяется аминокислота. Ясно, однако, что в
молекуле s-PHK должно содержаться еще по меньшей мере два специ-
фических участка — один, распознаваемый активирующим ферментом,
и другой, распознаваемый соответствующим данной аминокислоте трип-
летом информационной РНК (об этой РНК мы расскажем ниже). Нали-
чие такой двойной специфичности было установлено в специальном
эксперименте, в котором аминокислоту, уже присоединенную к s-PHK,
изменяли химически [136]. При использовании таких «обманных» моле-
кул в бесклеточной системе (см. ниже) измененная аминокислота вклю-
чается в положение, которое обычно занимает исходная, неизмененная,
аминокислота. Очевидно, что s-PHK просто выполняет функцию пере-
носчика и не содержит информации, определяющей специфичность син-
тезируемого белка. Если же носителями такой информации являются
рибосомы, то очевидно, что для каждого белка должна существовать
своя разновидность рибосом.
Принципиальное доказательство отсутствия у рибосом такой специ-
фичности было получено при изучении бактериофагов (см. гл. IX).
Этими опытами было также показано, что информация, необходимая
для синтеза белка, содержится в ином классе молекул РНК, получивших
название информационных (m-РНК). Оказалось, что у бактерий, зара-
женных колифагом Т2, новые рибосомы не образуются, но зато обнару-
живается новая РНК, быстро синтезирующаяся и быстро распадающаяся
[878]. Бреннер и сотр. [104], изучая бактерии, меченные тяжелым изото-
Химия вирусов
65
пом и зараженные бактериофагом, показали, что быстро синтезирую-
щиеся после заражения фагом молекулы РНК оказываются связанными
с рибосомами, образовавшимися еще до заражения. В свою очередь
Холл и Спигелман [306] показали, что эта быстро синтезирующаяся РНК
действительно специфична для фага, ибо она образует гибридные моле-
кулы не с бактериальной, а с одноцепочечной фаговой ДНК (см. фиг. 17),
денатурированной нагреванием.
Примерно одновременно с демонстрацией физического существова-
ния /п-РНК был выяснен ферментативный механизм, ответственный за
ее образование [385, 815, 906]. Обнаруженный фермент, названный РНК-
полимеразой, катализирует образование РНК из рибонуклеозидтрифос-
фатов только в присутствии ДНК, причем ДНК служит матрицей, опре-
деляющей порядок расположения нуклеотидов во вновь синтезирую-
щейся РНК в соответствии с правилом спаривания оснований согласно
модели Уотсона и Крика. Образующаяся in vitro РНК является компле-
ментарной копией ДНК-матрицы. При использовании высокоочищенной
РНК-полимеразы и принятии специальных мер, позволяющих сохранить
целостность ДНК-матрицы, оказалось, что образующаяся in vitro РНК
является копией только одной из двух цепей ДНК [296]. Было обнару-
жено, что in vivo матрицей для синтеза РНК также служит лишь одна
из цепей ДНК. Решающим доказательством справедливости этого
утверждения послужили данные, показавшие, что при инфекции неко-
торыми фагами, ДНК которых является двуспиральной и может быть
разделена на две цепи при помощи центрифугирования в градиенте
плотности, вновь образующаяся в бактериях РНК гибридизируется лишь
с одной из двух цепей ДНК [570].
Таким образом, становится очевидной та ключевая роль, которую
играет РНК-полимераза в процессе транскрипции m-РНК с ДНК-матри-
цы, т. е. в процессе, ответственном за передачу генетической информации
от генов к местам синтеза белков в клетке. '
Прямое доказательство использования для синтеза белка информа-
ции, заключенной в m-РНК, было представлено Ниренбергом и Маттеи
[618]. Эти авторы работали с бесклеточными системами, способными
включать аминокислоты в полипептиды. Они показали, что специфиче-
ские полинуклеотиды, добавленные к клеточным экстрактам, содержав-
шим рибосомы, источник энергии, ферменты, активирующие аминокис-
лоты, и s-PHK, вызывают включение в полипептид специфических амино-
кислот. Так, добавление к экстракту полиуридиловой кислоты ведет
к специфическому образованию полифенилаланина. РНК вируса табач-
ной мозаики индуцирует включение аминокислот в белок даже в том
случае, если s-PHK и рибосомы получены из Е, coli. Этот этап переноса
генетической информации от ДНК к белку получил название трансляции.
Использование системы Ниренберга для изучения генетического
кода, т. е. числа и последовательности нуклеотидов, соответствующих
каждой аминокислоте,— одна из хорошо известных глав истории науки
[617]. Еще одно открытие — связывание рибосомами специфических мо-
лекул аминоацил-s-PHK в присутствии специфических тринуклеотидов
[495] — подтвердило триплетную природу генетического кода, установ-
ленную ранее при помощи генетических методов ([155]; см. гл. X), и по-
зволило решить вопрос о действительной последовательности располо-
жения нуклеотидов в каждом триплете.
Сегодня мы знаем, что генетический код является вырожденным,
т. е. большинство аминокислот кодируется не одним, а несколькими три-
плетами, и что генетический код универсален или почти универсален,
т. е. m-РНК, выделенная из любого организма, транслируется синтези-
рующим белок аппаратом любого другого организма. Некоторые из
86
Глава V
64 возможных триплетов, т. е. сочетаний по три из четырех оснований,
входящих в состав нуклеиновых кислот (4X4x4), не кодируют амино-
кислот, т. е. являются бессмысленными. Возможно, что они служат сиг-
налами пунктуации, т. е. сигналами, обозначающими начало и конец
цепи. В табл. 7 приводится словарь кодовых слов в том виде, в каком
он был известен к маю 1965 г. [617, 798].
Таблица 7
Генетический код
Положение 1 (5'-конец) Положение 2 Положение 3 (З'-конец)
у 1 Ц А г
У Фен Сер Тир Цис У
Фен Сер Тир Цис ц
1J 1еи | Сер Бессмысленный А
Леи Сер Бессмысленный Три Г
ц Про Гис Apr У
Лей Про Г ис Apr Ц
Про Глун Apr А
Лей Про Глун Apr Г
А Илей Тре Ас пн Сер У
Илей Тре Аспн Сер ц
|Мет| Тре Лиз Apr А
Мет Тре Лиз Г
Г Вал Ала Аси Гли У
Вал Ала Асп Гли Ц
Вал Ала Гл у Гли А
Вал Ала Глу Гли Г
’) Данные взяты из работы Ниренберга и др. [617} и Солла и др. [793]; речь идет об экспери-
ментах по стимуляции включения аминокислот под действием полинуклеотидов, а также по связы-
ванию с s-PHK. Смысл кодонов УУА (Лей) и АУА (Мет) расшифрован предварительно, исходя из
факта слабого связывания с з-РНК.
Природа и функция концевых групп молекул ттг-РНК
ДНК структурного гена и транскрибируемая с нее аи-РНК предоп-
ределяют порядок расположения аминокислот в кодируемом ими поли-
пептиде. Выяснение роли, которую играют в процессе передачи инфор-
мации концевые группы молекулы информационной нуклеиновой кисло-
ты, соответствующие начальному и конечному участку гена, выдвигает
важные проблемы, большинство из которых еще ждет своего разреше-
ния. Поскольку незавершенные пептидные цепи в клетках не накапли-
ваются, следует допустить, что в начале молекулы /n-РНК имеются ка-
кие-то специальные сигнальные группы, обладающие специфической спо-
собностью связываться с рибосомами, что и позволяет последним начать
синтез пептидной цепи с верной точки. Динцис [185] показал, что синтез
полипептидных цепей гемоглобина происходит последовательно начиная
с N-конца и не прекращается до тех пор, пока на конце полипептидной
цепи не появится С-концевая аминокислота. Отсюда можно сделать вы-
вод, что «начальный» конец /n-РНК кодирует N-концевую аминокислоту.
Изучение биосинтеза нескольких других белков подтвердило этот вывод.
Химия вирусов
87
Опыты, поставленные на бесклеточных, синтезирующих белок систе-
мах, показали, что стартовой точкой /n-РНК при синтезе белка является
ее 5'-конец [849]. У многих, если не у всех, белков Е. coli полипептидная
цепь начинается с одной и той же аминокислоты метионина, причем его
концевая аминогруппа блокирована формильной группой [129]. После
окончания синтеза полипептидной цепи формильная группа или целиком
формилметионин обычно отщепляются. Эти данные наводят на мысль
о существовании специального механизма, который заставляет рибосомы
считывать /п-РНК с должного положения.
Окончание синтеза цепи также, по-видимому, закодировано в
m-РНК. Так, было показано, что так называемые амбер-мутанты бакте-
риофагов (см. гл. X) не могут расти на некоторых бактериальных штам-
мах вследствие мутации, приводящей к тому, что молекулы белка не
достраиваются до конца; синтез цепи преждевременно заканчивается в
точке, определяемой данной мутацией [728], ибо с мутантного амбер-трип-
лета m-РНК считывается информация, означающая, что «цепь законче-
на». Эти данные, а также тот факт, что некоторые нуклеотидные трипле-
ты, по-видимому, не кодируют включение аминокислот in vitro, наводят
на мысль, что вышеупомянутые бессмысленные триплеты, может быть, и
являются кодовыми словами, детерминирующими окончание синтеза по-
липептидной цепи.
Использование мутагенеза для расшифровки генетического кода
В основе другого подхода к раскрытию генетического кода лежит
тот факт, что с помощью химических мутагенов можно вызвать специфи-
ческие изменения азотистых оснований нуклеиновых кислот, причем это
обстоятельство оказалось полезным благодаря тому, что уже полностью
расшифрована аминокислотная последовательность по крайней мере
одного вирусного белка.
Например, действуя на нуклеиновую кислоту вируса азотистой кис-
лотой, можно дезаминировать гуанин, цитозин и аденин [745]. При дез-
аминировании, в особенности при дезаминировании цитозина и аденина,
возникают соединения, образующие комплементарные пары с другими
основаниями (фиг. 18), вследствие чего комплементарная цепь, синтези-
рующаяся на поврежденной цепи, обладает последовательностью нуклео-
тидов, отличающейся от нормальной. В свою очередь копирование комп-
лементарной цепи приводит к повторению происшедшего изменения
последовательности азотистых оснований. Дезаминирование цитозина
приводит к его превращению в урацил. Такая мутация, при которой про-
исходит замена одного пиримидина на другой, называется транзицией.
Дезаминирование аденина приводит к его превращению в гипоксантин.
Мутация, в результате которой происходит замена пуринового основания
на пиримидиновое, называется трансверсией [246]. Используя азотистую
кислоту или иные мутагены, механизм действия которых известен, для
получения in vivo мутаций, в результате которых изменяется также уже
известная последовательность аминокислот, можно получить информа-
цию о соответствии тех или иных кодовых слов РНК тем или иным ами-
нокислотам [921].
Роль рибосом и конечные этапы биосинтеза белка
Кое-что о роли, которую играют рибосомы при биосинтезе белка,
уже было сказано выше. По-видимому, роль рибосомной РНК состоит
в поддержании правильной конфигурации поверхности рибосомных бел-
ков. Каждая рибосома состоит из двух субъединиц. Константа седимен-
Урацил
Фиг. 18. Мутагенное действие азотистой кислоты.
HNO2 дезаминирует аденин и цитозин, в результате чего образуются соответственно гипоксантин и
урацил. При образовании комплементарной цепи гипоксантин образует пару с цитозином, а урацил—
с аденином, так что считывание информации искажается и возникают ошибки. В результате при
последующем копировании комплементарной цепи возникшие изменения в последовательности азо
тистых оснований сохраняются.
Химия вирусов
89
тации интактных бактериальных рибосом 70S, а их субъединиц — 50S
и 30S соответственно [855]. При воссоединении 50S- и 305-субъединиц
образуется асимметричная структура с желобком на поверхности. На
каждой 505-субъединице имеются два, а быть может, три участка, обла-
дающих способностью связывать s-PHK. К одному из них при помощи
s-PHK-пептидильной связи присоединяется растущая полипептидная
цепь [273].
В ходе трансляции /n-РНК, по-видимому, располагается в желобке.
Трансляция идет лишь при условии, что в инкубационной среде содер-
жатся s-PHK, несущие необходимые аминокислоты. s-PHK связывается
с /n-РНК в результате взаимодействия кодона /п-РНК с соответствую-
щим антикодоном s-PHK. Затем благодаря действию специального фер-
мента (или ферментов) завершается образование пептидной связи [525,
863]. К одной молекуле /n-РНК одновременно присоединяются несколько
рибосом, так что трансляция /n-РНК происходит в нескольких разных
точках. Большинство молекул m-РНК достаточно велики, благодаря чему
к каждой из них одновременно могут присоединиться пять и даже более
рибосом [271, 887]. Такие сложные рибосомные структуры были названы
полирибосомами, или полисомами. Были обнаружены полисомы как с ви-
русной, так и с клеточной т-РНК [641]. На фиг. 19 схематически пока-
зана последовательность событий, происходящих при биосинтезе белка.
ВИРУСНЫЕ НУКЛЕИНОВЫЕ КИСЛОТЫ
Выделение нуклеиновой кислоты из вирионов
Исследователи, изучавшие вирусные нуклеиновые кислоты до 1956 г.,
испытывали большие затруднения в связи с отсутствием метода, позво-
лявшего получать свободную от белка вирусную нуклеиновую кислоту
в нативном состоянии. Большим шагом вперед в этом отношении была
разработка Гирером и Шраммом метода фенольной экстракции [272].
Недеградированную РНК вируса табачной мозаики можно получить так-
же при помощи анионных детергентов, например додецил- или лаурил-
сульфата натрия, вызывающих денатурацию и солюбилизацию белка и
переход нуклеиновой кислоты в раствор [230]. Одним из преимуществ
этих методов является обеспечиваемая ими эффективная инактивация
нуклеаз, всегда присутствующих даже в очищенных препаратах вирусов.
Другие методы выделения нуклеиновых кислот, как, например, встряхи-
вание со смесью хлороформа с октанолом, экстракция горячим раство-
ром NaCl и фракционирование по Шмитту — Тангаузеру, пригодны
главным образом лишь для количественного химического определения
нуклеиновых кислот. При помощи этих методов нельзя получить препа-
раты нуклеиновых кислот, пригодные для физико-химических или биоло-
гических исследований.
Свойства вирусных РНК
Как уже указывалось в гл. IV, РНК, выделенная из ВТМ при по-
мощи экстракции фенолом, оказывается инфекционной для растений
[272]. Френкель-Конрат и Вильямс показали, что, смешивая РНК ВТМ,
с вирусным белком, можно реконструировать вирус и получить препарат,
обладающий почти полной инфекционностью исходного вируса. Генети-
ческие свойства реконструированного вируса всегда детерминируются
его нуклеиновой кислотой, а не белком [229].
Молекулярный вес РНК ВТМ составляет примерно 2 106 дальтон
[269]. Инфекционностью обладает лишь целая молекула, ибо, как былц
в
Фиг. 19. Схема, изображающая постепенный рост полипептидной цепи.
/1 Растущая полипептидная цепь, присоединенная через концевую группу s-PHK к центру, связы-
нлюн ему белок Б. Присоединение специфической молекулы Ак-s-PHK к (л+1)-му кодону цепи
т РНК при помощи водородных связей. В. Перенос растущего пептида к комплексу Ak4-s-PHK и
образование пептидной с язи между Акз и Ак4. Г. Перемещение растущей полипептидной цепи от
центра связывания Ак-s-PHK к центру, связывающему белок. Одновременное перемещение молеку-
лы m-РНК, в результате которого (п+2)-й кодон попадает на центр связывания Ак-s-PHK.
Химия вирусов
91
показано, инфекционной была лишь та фракция, константа седимента-
ции которой соответствовала константе седиментации целостных нераз-
рушенных вирусных частиц. Обработка РНК азотистой кислотой или ее
инактивация нагреванием приводили к потере инфекционности. Изучение
кинетики инактивации показало, что этот процесс подчиняется уравне-
нию реакции первого порядка, на основании чего можно судить о том,
что для потери инфекционности достаточно одного события [607]. Было
обнаружено, что в вирионах многих других РНК-содержащих вирусов,
включая сюда как вирусы растений, так и вирусы животных и бактерий,
также содержится по одной молекуле инфекционной нуклеиновой кисло-
ты [733]. Удивительно, что хотя РНК, и в особенности m-РНК, подвер-
гается в клетках распаду, в вирионы включаются, как правило, только
цельные молекулы вирусной нуклеиновой кислоты.
Инфекционная РНК была экстрагирована из многих мелких вирусов
и нескольких бактериофагов. Однако до сих пор не удалось получить
инфекционную нуклеиновую кислоту из миксовирусов, РНК которых на-
ходится внутри спирального капсида, окруженного в свою очередь внеш-
ней оболочкой. Было высказано предположение, что геном миксовирусов
состоит не из одной, а из нескольких молекул нуклеиновой кислоты,
вследствие чего при экстракции РНК извлечение ее в активном состоя-
нии (инфекционность) становится невозможным или сильно затрудняет-
ся. Было, однако, показано, что из вируса ньюкаслской болезни удается
экстрагировать РНК, константа седиментации которой равна 57S [194],
а из вируса саркомы Рауса — молекулы РНК даже еще большего раз-
мера (константа седиментации этой РНК была равна примерно 70S, что
соответствует молекулярному весу более 107 дальтон) [684]. Тем не ме-
нее даже эти столь большие молекулы РНК не обнаруживали инфек-
ционных свойств.
Таблица 8
Вариабельность соотношения оснований у РНК-содержащих вирусов1)
Вирус А У г Ц
ВТМ, обычный штамм 29,8 26,3 25,3 18,5
Вирус желтой мозаики турнепса 22,6 22,1 17,2 38,1
Вирус кустистой карликовости томатов 25,7 25,7 27,9 20,8
Х-вирус картофеля 34,2 21,3 21,8 22,3
Вирус раневых опухолей 31,1 31,3 18,6 19,1
Вирус ящура 26,0 22,0 24,0 28,0
Вирус полиомиелита, тип 1 (дан- ные Шеффера) 29,0 25,0 24,0 22,0
Вирус полиомиелита, тип 1 (дан- ные Левинтова) 29,3 23,8 23,8 23,2
Вирус гриппа А, различные штам- мы 22-25 30-33 18-20 24,0
Вирус, ассоциированный с виру- сом саркомы Рауса 2) 25,1 22,4 28,3 24,2
Рсовирус, тип 3 28,0 27,9 22,3 22,0
Вирус ньюкаслской болезни 20,1 31,2 25,4 23,2
Вирус Синдбис 29,6 19,7 25,8 24,9
Фаг Г2 22,1 25,1 25,9 26,8
’) А — аденилат, У — уридилат, Г — гуанилат, Ц—цитидилат.
2) Этот вирус принято называть Раус-ассоциированный вирус (РАВ).
92
Глава V
Соотношение азотистых оснований в молекулах вирусных РНК ши-
роко варьирует от одного вируса к другому (табл. 8). Почти во всех
случаях характерные для ДНК соотношения А = Т и Г = Ц у вирусных
РНК не наблюдаются. Несмотря на многочисленные усилия, в вирусных
РНК не удалось обнаружить каких-либо необычных, метилированных
оснований, входящих, как известно, в состав s-PHK и большинства
ДНК. При нагревании вирусных РНК не происходит резкого изменения
поглощения в ультрафиолете, столь характерного для ДНК. В соответ-
ствии с этим находятся и данные о том, что при рентгеноструктурном
анализе РНК вируса табачной мозаики не было обнаружено существо-
вания двойной спирали. Итак, был сделан вывод, что молекулы РНК
представляют собой одноцепочечные полинуклеотидные цепи, хотя в них
и имеются отдельные участки со спаренными основаниями [744].
Существуют и исключения из правила, утверждающего, что все
РНК-вирусы содержат молекулу одноцепочечной РНК. Так, Гоматос и
Тамм [282] показали, что РНК, выделенная из реовирусов, обладает по-
добным ДНК, т. е. комплементарным, нуклеотидным составом (А = У и
Г = Ц), характеризуется резким увеличением поглощения в ультрафио-
лете при нагревании, нечувствительна к действию формальдегида при
низкой температуре, устойчива к действию рибонуклеазы и дает рентге-
нограмму, характерную для двойной спирали [487]. Вирус раневых опу-
холей растений также содержит двухцепочечную РНК, напоминающую
РНК реовирусов (см. гл. XVII). Однако возможность того, что РНК этих
вирусов представляет собой одну цепь РНК, закрученную сама на себя,
полностью не исключена. Как уже упоминалось в предыдущем разделе,
РНК таких вирусов, как, например, ВТМ или вирус полиомиелита, в си-
стемах in vitro функционирует как тРНК и взаимодействует с клеточны-
ми рибосомами, образуя полисомы.
Свойства вирусных ДНК
Излюбленными источниками ДНК, использовавшимися в качестве
объектов при физических исследованиях ее структуры, были бактерио-
фаги, атакующие Е. coli, в особенности фаги Т2, Т4 и Тб. Одним из важ-
ных достижений этой серии исследований было установление того, что
большая часть ДНК, содержащейся в препаратах, которые получали еще
сравнительно недавно (всего несколько лет назад), была более или ме-
нее деградированной [173, 339]. Дело в том, что молекулы ДНК, имею-
щие форму двойной спирали, представляют собой почти негнущиеся па-
лочки, в ходе обычных процедур легко распадающиеся на фрагменты.
Например, когда раствор ДНК набирают простой пипеткой, то вследст-
вие различной скорости истечения жидкости, локализующейся у края
отверстия пипетки и в ее центре, возникает срезывающее усилие, доста-
точное для того, чтобы разорвать фосфодиэфирный остов молекул ДНК.
В настоящее время благодаря разработке более мягких процедур
удается выделить почти всю ДНК, содержащуюся в больших вирусах
типа Т-четных фагов или вирусов группы оспы в виде целой неповреж-
денной молекулы. Даже всю ДНК генома Е. coli удается получить в виде
единой молекулы [122]. В табл. 9 в качестве примера приведен перечень
вирусов, молекулярный вес ДНК которых уже определен. Можно ви-
деть, что размеры молекул вирусных ДНК изменяются в значительно
больших пределах, чем размеры молекул вирусных РНК.
Хотя большинство вирусных ДНК ведет себя как настоящие двух--
цепочечные молекулы, описано и несколько интересных исключений.
Химия вирусов
93
Таблица 9
Молекулярный вес вирусных нуклеиновых кислот и вирионов
Вирус Молекулярный вес
нуклеиновая кислота вирион
ДНК-содержащие вирусы Колифаг Т2 120 • 106 300 • 106
Колифаг Т5 77 106
Колифаг Т7 24 • 106 50 • IO6
Колифаг X 33 • 106
Колифаг Р22 28 • 106
Колифаг Fd 1,3 • 10б1) 10 • 106
Колифаг <рХ174 1,7 10б!> 6,2 • 10в
Бактериофаг SP8 (В. subtilis) ПО • 106
Аденовирус 23 • 106 177 10в
Вирус герпеса 60-80 • 106
Вирус псеьдобешенства 60-80 • 106
Вирус оспсвакцины 150 • 106 2000 • 10е
Вирус полиомы 3,5 • 106 40 • 10«
Вирус папилломы Шоупа 5 ,3 • 106
РНК-содержащие вирусы Колифаг MS-2 1 106 3,6 • 10»
Вирус полиомиелита 2,2 • 106 6,8 • 106
Вирус энцефаломиокардита 2,1 106
Вирус восточного энцефаломиелита лошадей .2 • 106 50 • 10»
Вирус гриппа 1 10б2> 280 • IO»
Вирус ньюкаслской болезни -6,8 • 106 800 • 10е
Раус-ассоциированный вирус -107
Реовирус -Ю^ 70 • 10«
Вирус табачной мозаики 2,1 106 40- 10в
Вирус кустистой карликовости томатов 1,7 106 11 106
Вирус желтой мозаики турнепса 1,7 106 5- 10»
Вирус-сателлит вируса некроза табака 3 1(Р 2 • 106
Вирус южной мозаики фасоли 1,4 • 106 6,6 • IO»
Одноцепочечная ДНК.
2) Молекулярный вес рассчитан, исходя из предположения, что вся РНК вириона представляет
собой одну молекулу.
3) Двухцепочечная РНК.
ДНК, имеющая форму одиночной нити или замкнутого кольца
Первое исключение из общих представлений о строении вирусных
ДНК было обнаружено при изучении мелких бактериофагов S13 и
фХ174. Эти вирусы значительно более чувствительны к действию радиа-
ции, чем другие бактериофаги, содержащие эквивалентное количество
двухцепочечной ДНК [847]. Причины этого явления будут обсуждены
в гл. VII. Здесь же мы ограничимся констатацией факта, что изучение
физических и химических свойств ДНК этих бактериофагов показало,
что эти ДНК (молекулярный вес их равен 1,7-106 дальтон) являются
одноцепочечными [778]. Эти фаги, а также один недавно выделенный
мелкий вирус животных [154] являются до сих пор единственными из
известных пока вирусов, у которых обнаружена одноцепочечная ДНК.
94
Глава V
Нативная ДНК бактериофага <рХ174 обладает еще одним интерес-
ным свойством: ее молекула представляет собой замкнутую цепь [226].
Это означает, что в молекуле этого фага не содержится свободных 3х-
или 5х-концевых групп. Экзонуклеаза — фермент, атакующий цепи ДНК
со свободных концов,— не действует на эту ДНК. Константа седимента-
ции нативной ДНК этого бактериофага равна 12S. Однако даже кратко-
временное воздействие панкреатической ДНК-азы приводит к тому, что
большая часть замкнутых молекул превращается в линейные молекулы,
чувствительные к действию экзонуклеазы, константа седиментации кото-
рых равна 10S.
Еще одно интересное явление было обнаружено при изучении фага
X и родственных ему фагов. Оказалось, что ДНК этих фагов существует
в двух альтернативных формах, отличающихся друг от друга по седи-
ментационным свойствам. В вирионах содержится форма ДНК с более
низкой константой седиментации. Нагревая эту форму ДНК до 70° и мед-
ленно охлаждая, можно превратить ее в форму с более высокой кон-
стантой седиментации, чем исходная [340]. Объяснение этого явления
состоит в следующем: ДНК, содержащаяся в вирионе фага X, представ-
ляет собой линейную молекулу; на обоих концах этой линейной молекулы
имеется по одноцепочечному участку, причем эти концевые участки ком-
плементарны друг другу (см. фиг. 55), вследствие чего они могут как бы
слипаться. При этом может происходить следующее: либо концы одной
и той же молекулы соединяются друг с другом так, что возникает обыч-
ная кольцевая структура, либо соединяются несколько молекул своими
концами, так что иоразуются кольца или цепи большего размера. Ре-
зультаты, полученные при радиоавтографическом исследовании молекул
ДНК фага X, меченных тритием, а также изучение этих молекул с по-
мощью электронного микроскопа [677] подтвердили справедливость та-
кой интерпретации. Есть основания полагать (подробно этот вопрос
обсуждается в гл. XI), что ДНК фага X, присутствующая в зрелых ви-
рионах в линейной форме, прежде чем реплицироваться в клетке-хозяи-
не, превращается в молекулу, имеющую форму замкнутого кольца.
Все двухцепочечные молекулы фаговой ДНК состоят из двух отли-
чающихся друг от друга полидезоксирибонуклеотидных цепей, раз-
деляющихся при нагревании ДНК до температуры, превышающей тем-
пературу ее плавления. Если раствор ДНК, нагретый до температуры
плавления, быстро охладить до 0°, то ДНК останется в денатурирован-
ном, одноцепочечном состоянии. Линейные молекулы ДНК некоторых
фагов, а также некоторых вирусов животных при медленном их охлаж-
дении после нагревания до температуры плавления образуют замкнутые
кольца. Механизм этого процесса описан Томасом и Рубинштейном и бу-
дет описан в гл. X (см. фиг. 48).
Еще одно необычное явление наблюдалось при изучении некоторых
опухолеродных вирусов, а именно вируса полиомы и вируса папилломы
Шоупа, которые также имеют замкнутые молекулы ДНК [893, 903]. ДНК
этих вирусов при нагревании до 100° и быстром охлаждении не разде-
ляются полностью на две цепи. Тем не менее ДНК вируса полиомы ха-
рактеризуется четкой точкой плавления и нуклеотидным составом, кото-
рый свидетельствует о двухцепочечной структуре. По-видимому, моле-
кулы ДНК вируса полиомы и вируса папилломы представляют собой
кольцевые молекулы, замкнутые при помощи ковалентных связей, кото-
рые в двухцепочечном состоянии приобретают конфигурацию суперспи-
рали, как это показано на фиг. 20.
Конфигурации I, II и III выражают различные состояния ДНК ви-
руса полиомы [869]. Конфигурация I — это суперспираль, состоящая из
двухцепочечной, также закрученной в спираль структуры, которая на
Химия вирусов
95
электронных микрофотографиях выявляется в виде скрученных колец.
Разрыв одной из цепей этой двойной спирали лежит в основе превра-
щения конфигурации I в конфигурацию II. В результате становится воз-
можным вращение и снимается напряжение, ответственное за «супер-
спирализованное» состояние. При этом, однако, молекула ДНК сохра-
няет форму замкнутого кольца. В результате разрыва обеих цепей
возникает конфигурация III, т. е. линейная молекула. При щелочной де-
натурации молекулы ДНК каждой из этих конфигураций образуются
различающиеся по своим седиментационным свойствам одноцепочечные
сххххюоооооооооосх
III, 14 S
53S 18S 16S 16S
Фиг. 20. Модели различных конфигураций молекулы ДНК вируса полиомы [869].
Нативная молекула ДНК (конфигурация I) представляет собой суперспираль, состоящую из двух-
цепочечной, также закрученной в спираль структуры, концы которой соединены при помощи ко <а-
лентных связей. В результате разрыва одной из цепей этой двойной спирали конфигурация I пре-
вращается в конфигурацию II. а при разрыве обеих цепей возникает конфигурация III. При дена-
турации молекулы ДНК конфигурации I образуется беспорядочный клубок с высокой кснстантой
седиментации. При денатурации молекулы ДНК конфигурации II образуется одна замкнутая цепь
и одна незамкнутая цепь и, наконец, при денатурации молекулы ДНК конфигурации III возника-
ют только одиночные незамкнутые цепи.
структуры. Это исследование является превосходным примером решения
проблем структуры биологических молекул при помощи простых физико-
химических методов.
Химический состав вирусных ДНК
В ДНК Т-четных фагов содержится вместо цитозина 5-оксиметилци-
тозин. Некоторые из фагов Bacillus subtilis также содержат необычные
основания. ДНК умеренных фагов, например фага X и фага PLT22, по
количественному соотношению оснований, как правило, близки ДНК
соответствующих клеток-хозяев. В табл. 10 приведены данные о хими-
ческом составе молекул ДНК различных вирусов.
ВИРУСНЫЕ БЕЛКИ И ДРУГИЕ КОМПОНЕНТЫ ВИРУСОВ
Белки, образуемые в ходе вирусной инфекции под контролем генома
вируса, можно разделить на три группы: 1) белки, катализирующие реп-
ликацию вирусной нуклеиновой кислоты; 2) структурные белки, вклю-
чающиеся в состав новых вирусных частиц; 3) белки, изменяющие неко-
торые функции или структуру клетки-хозяина. В данном разделе будут
рассмотрены лишь те белки, которые являются частью вирионов. Вопрос
о ферментах, образующихся в ходе вирусной инфекции, и других белках,
синтез которых детерминируется вирусом, мы рассмотрим в гл. IX,
XIV и XV.
16
Глава V
Таблица 10
Относительное содержание различных оснований в вирусных ДНК
Вирус Аденин Тимин Гуанин Цито- зин 5-окси- метил- цито- зин Урацил 5-окси- метил- урацил
Колифаг Т2 32,5 32,5 18,2 — '6,8
Колифаг Т4 32,3 33,3 18,1 — 16,3
Колифаг Тб 32,4 33,4 17,7 — 16,5
Колифаг Т1 27 25 23 25
Колифаг Т3 242) 242)
Колифаг Т5 30,3 30,8 19,5 19,5
Колифаг Т7 242) 242)
Колифаг X 24,53) 24,53)
Колифаг Р22 52) 252)
Колифаг <рХ174 25 33 23 19
Колифаг Fd (палочкообразный) 23 36 20 21
Фаг PBS1 (В. subtilis) 36 14 14 36
Фаг SP8 (В. subtilis) 28,5 — 21,5 21,5 28,5
Аденовирус, тип 12 242) 242)в
Дденовпрус, тип 2 22 21 27 29
Вирус осповакцины 31,5 31,5 18 19
Вирус полиомы 242) 242)
Вирус аборта лошадей 22 22 29 27
Вирус цитометалии человека 292) 292)
Вирус герпеса 14,5 13,1 38 35
Вирус псевдобешенства 13,2 13,5 37,0 36,3
Некоторые оксиметильные группы глюкознлированы и содержат один или два остатка глюко-
зы (см. табл. 17).
2) Состав рассчитан, исходя из величины плавучей плотности ДНК в CsCl [580].
Молекулу ДНК фага к можно разделить на две половины, одна из которых содержит 52%
Г+Ц, а вторая — 48% Г-ЬЦ.
Белки капсида
Нуклеиновая кислота интактного вириона не подвергается действию
нуклеаз благодаря тем защитным функциям, которые несет состоящая
из белка оболочка вируса. Другой функцией белка капсида, по крайней
мере у вирионов, не обладающих внешними оболочками, является специ-
фическое присоединение вирусных частиц к чувствительным клеткам-
хозяевам.
Белки вирусных капсидов не обладают какими-либо особыми свой-
ствами, отличающими их от других белков.
Следует тем не менее отметить, что в белках капсида некоторых ви-
русов отсутствуют определенные аминокислоты. Так, в белке капсида
ВТМ отсутствуют гистидин и метионин [463], а в белке капсида бактерио-
фага f2 — гистидин [151]. Однако подобные «неполные» белки были вы-
делены также и из других невирусных источников. Для белков вирус-
ного капсида, как и для клеточных белков, связанных с нуклеиновыми
кислотами, характерна некоторая тенденция к увеличению относитель-
ного содержания основных аминокислот (табл. 11). Быть может, это
увеличение содержания основных аминокислот связано с одной из их
возможных функций — нейтрализацией кислых групп нуклеиновых
кислот.
Химия вирусов
97
Таблица 11
Аминокислотный состав общего капсидного белка некоторых вирусов
Аминокислота Колифаг Т2*) Колифаг тз*) 1 Вирус желтой мозаики гурнепса ) Вирус полиомиелита Аденови- рус, тип 21)
в граммах t на 100 г аминокис- лот з молях на 100 моль амино- кислот
Аланин 7,0 8,9 5,7 5,3 7,8 9,4
Аргинин 4,7 5,7 2,5 6,6 4,7 8,8
Аспарагиновая кислота 10,7 10,9 5,1 12,2 11.9 н.з
Цистеин 1 1 2,5 0,7 0,8 —
Глутаминовая кислота 10.0 9,9 9.6 8,7 7,7 9,2
Глицин 8,7 7,7 2,9 3.9 6.8 7,2
Гистидин 0,8 1,7 2,1 2,9 2,4 1,9
Лейцин 5,5 8,9 10,3 8,3 8,5 7,8
Изолейцин 6,1 4,4 10,8 4.8 4,8 3,6
Лизин 5,9 5,7 10,7 5,0 4,7 4,3
Метионин 2,0 1.9 2.85 2,4 1,5 2,0
Фенилаланин 5,1 3,3 3,8 5,7 4,4 3,1
Пролин 3,7 4,2 Ю.7 7,0 7,2 7,5
Серин 4,9 3,8 8,1 5,3 7,0 5,6
Треонин 5,5 6,5 15,1 8,5 9,1 6.6
Триптофан 1,14 — — —
Тирозин 5,9 4,8 2,45 6,0 3,9 5.1
Валин 5,5 6,1 8,45 6.6 7,2 6,6
NH3 1,25 1,9 17,2 19,0
‘) Содержание выражено числом граммов данной аминокислоты на 100 2 суммарного содержа-
ния аминокислот в белке.
2) Содержание выражено числом молей данной аминокислоты на 100 моль аминокислот, содер-
жащихся в белке.
Крик и Уотсон [156] обратили внимание на одно важное обстоя-
тельство, которое пролило свет на строение белков капсидов мелких
РНК-содержащих вирусов. Сравнив число нуклеотидов, содержащихся
в РНК вируса, с числом аминокислот, входящих в состав его белка, они
показали, что количество генетической информации, содержащейся в
РНК таких вирусов, едва ли достаточно для кодирования полипептидной
цепи соответствующей длины. Отсюда следует вывод, что белок капсида
представляет собой не одну непрерывную полипептидную цепь, но со-
стоит из нескольких одинаковых полипептидных цепей. В настоящее
время мы знаем, что и спиральные и полиэдрические капсиды действи-
тельно построены из небольших белковых субъединиц, молекулярный
вес которых различен у различных вирусов и колеблется в пределах
примерно от 10 000 до 80 000 дальтон (гл. IV).
Впервые данные, свидетельствующие о том, что вирусный капсид
построен из идентичных белковых субъединиц, были получены при изу-
чении действия карбоксипептидазы на целые частицы ВТМ. Оказалось,
что в этом случае единственной отщепляемой от вируса аминокислотой
является треонин, причем на каждые 17 000 дальтон молекулярного веса
вирусного белка отщепляется одна молекула треонина [463]. Аналогич-
ная величина минимального молекулярного веса получается и в том слу-
чае, если вести расчет, исходя из содержания в белке цистеина — амино-
кислоты, содержащейся в белке ВТМ в наименьшем количестве (на
одну субъединицу приходится один остаток цистеина). Было показано
7 Заказ № 1214
12 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21
V Ацетил Сер-Тир-Сер-Илей-Тре-Тре-Про-Сер-Глун-Фен-Вал-Фен-Лей-Сер-Сер-Ала-Три-Ала»Асп-Прс-Илей-
D Ацетил Сер-Тир-Сер-Илей-Тре-Сер-Про-Сер-Глун-Фен-Вал-Фен-Лей-Сер-Сер-Вал-Три-Ала-Асп-Про-Илей-
Т
22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 I 42 43 44
V Глу-Лей-Илей-Аспн-Лей-Цис-Тре-Аспн-Ала-Лей-Гли. - Аспн-Глун-Фен-Глун-Тре-Глун-Глун-Ала-Ара | Тре-Вал-Глун-
D Глу-Лей- Лей-Аспн- Вал-Цис- Тре-Сер-Сер-Лей -Гли-Аспн-Глу н-Фен-Глун-Тре-Глун-Г лун-Ала-Ара 1 Тре-Тре-Глун-
V
D
45 46
Вал-Ара
Вал-Глун
Т
47 48 49 50 51 52 53 54 55 56 5 7 58 59 60 61
Г лун-Фен-Сер-Г лун-Вал-Три-Лиз-Про-Сер-Про-Глун-Вал-Тре-Вал-Ара
Г лун-Фен-Сер-Г лу-Вал-Три-Лиз-Про-Фен-Про-Глун-Сер-Тре-Вал-Ара
Т
62 63 64 65 66 67 68 69
Фен-Про-Асп-Сер-Асп-Фен-Лиз Вал-
Фен-Про-Гли-Асп-Вал-Тип-Лиз ,, Вал-
70 71
V Тир-Ар a
D Тир-Ара
Т Т
I 72 73 74 75 76 77 78 79 80 81 82 83 84 85 85 87 88 8 9 90
I Тир-Аспн-Ала-Вал-Лей-Асп-Про-Лей-Вал-Тре-Ала-Лей-Лей-Гли-Ала-Фен-Асп-Тре-Ара
| Тир-Аспн-Ала-Вал-Лей-Асп-Про-Лей-Илей-Тре-Ала-Лей-Лей-Гли-Тре-Фен-Асп-Тре-Ара ,,
Т
91 92 93 94
Асин-Ара Илей-Илей-
Аспн-Ара , Илей-Илей-
Т
95 96 97 98 99 100 I'll 102 103 104 105 1 06 107 108 109 ПО 111 112 113 114 115 116 117 118
V
D
Глу-Вал-Глу-Аспн-Глун-Ала- Аспн-Про-Тре-Тре-Ала-Глу-Тре-Лей-Асп - Ала-Тре-Арг Apa-Вал-Асп-Аси-Ала-Тре-
Глу-Вал-Глу-Аспн-Глун-Глун-Сер- Про-Тре-Тре-Ала-Глу-Тре-Лей-Асп - Ала-Тре-Ара ,, Ара-Вал-Асп-Асп-Ала-Тре-
119 120 121 122
V Вал-Ала-Илей-Арг-
D Вал-Ала-Илей-Арг-
123 124 125 126 127 128 1 29 130 131 132 133 134 I 135 136 137 138 139 140 141 | 142
Сер-Ала-Асп - Илей-Аспн-Лей-Илей-Вал-Глу-Лей-Илей-Apa \ Гли-Тре-Гли-Сер-Тир-Асин-Ара- | Сер-
Сер-Ала-Аспн-Илей-Аспн-Лей-Вал-Асин- Глу-Лей-Вал- Ара | Гли-Тре-Гли-Лей-Тир-Аспн-Глун, | Аспн-
143 144 145 146 147 1 48 149 150 151 152 153 154 155 156 157 158
V Сер-Фен-Глу-Сер-Сер - Сер-Гли-Лей-Вал-Три-Тре-Сер-Гли-Про-Ала- Тре
D Тре-Фен-Глу-Сер-Мет-Сер-Гли-Лей-Вал-Три-Тре-Сер-Ала-Про-Ала-Сер
Фиг. 21. Сравнение последовательности расположения аминокислотных остатков в по-
липептидных цепях белка капсида двух штаммов В ГМ [921].
V —штамм vulgare. D — штамм dahlemense. Различающиеся участки подчеркнуты. Связи, гидро-
лизуемые трипсином, обозначены стрелками и буквой Т.
Химия вирусов
99
также, что аминогруппа N-концевой аминокислоты — серина — ацетили-
рована [859]. В дальнейшем исследователям удалось выделить субъеди-
ницу белка ВТМ в чистом виде и, используя современные методы ана-
лиза пептидов и аминокислот, установить полную последовательность
аминокислот в его полипептидной цепи [16, 360, 911] (фиг. 21).
В результате в распоряжении исследователей оказался белок, для
которого, с одной стороны, была известна полная последовательность
аминокислот, а с другой — была доступна в чистом виде m-РНК, коди-
рующая его синтез. Данные, полученные при изучении влияния действия
мутагенов на последовательность аминокислот, образующих пептидную
цепь этого белка, как уже упоминалось выше, послужили одним из глав-
ных источников информации о природе генетического кода. Оказалось,
однако, что существуют такие мутантные штаммы, у которых капсидный
белок совершенно идентичен капсидному белку исходного штамма ВТМ.
Это свидетельствует о том, что в геноме вируса содержится информация
также о каких-то иных вирусоспецифичных белках, не входящих в со-
став капсида. Результаты, полученные при этих исследованиях, позво-
лили также понять физиологический механизм действия химических му-
тагенов.
Например, как мы уже видели выше, в основе мутаций, индуци-
руемых азотистой кислотой, лежит изменение нуклеотидного состава,
вызванное дезаминированием отдельных азотистых оснований и их
ошибочным копированием. Результатом таких событий является замена
одних аминокислот на другие, причем очевидно, что повторная обработка
азотистой кислотой не должна приводить к восстановлению исходной
последовательности аминокислот в полипептидной цепи капсида, т. е.
к обратимости этого процесса. И в самом деле, у мутантов ВТМ, индуци-
рованных азотистой кислотой, не удалось получить реверсий путем
повторного воздействия этой кислотой. Ни у одного из таких мутантов
не было обнаружено одновременного изменения двух соседних амино-
кислот. Этот факт еще раз свидетельствует о том, что генетический код
является неперекрывающимся, т. е. что каждый нуклеотид входит в со-
став только одного кодона.
Сборка белков, образующих капсид вируса
При правильно выбранных условиях белок ВТМ агрегирует спон-
танно, образуя длинные, полые, палочкообразные частицы неопределен-
ной длины. Если во время агрегации смешать этот белок с РНК, то мо-
лекулы белка, агрегируя, образуют цилиндры, длина которых соответ-
ствует длине молекулы РНК. По-видимому, белковая спираль, форми-
рующаяся вокруг молекулы нуклеиновой кислоты, значительно прочнее
белковой спирали, образующейся из одних белковых субъединиц в от-
сутствие РНК [133].
Некоторые вирионы, имеющие форму икосаэдра, например вирионы
вируса желтой мозаики турнепса, построены из однотипных субъединиц
[317]. Напротив, вирионы вируса полиомиелита [518] и вируса энцефа-
лита грызунов [702], хотя и имеют также форму икосаэдра с субъедини-
цами, характеризующимися молекулярным весом, равным 25 000—30 000
дальтон, но эти субъединицы построены из полипептидных цепей более
чем одного типа. Таким образом, некоторые икосаэдрические капсиды
представляют собой как бы мозаику из различных белков (фото 13 и
33). В состав капсидов наиболее сложно построенных вирионов, напри-
мер вирионов бактериофагов, имеющих отростки, или вирионов вирусов
группы оспы, входит много различных белков (гл; IX и XIV).
7*
100
Глава V
Хотя из теоретических представлений о структуре и назначении кап-
сида следует, что сборка капсида дельтоэдрических вирусов должна
происходить спонтанно, такую автосборку субъединиц этих вирусов в це-
лые вирионы in vitro наблюдать пока не удалось. Возможно, что это
объясняется очень плохой растворимостью выделенных субъединиц. Не
исключено, однако, что неудачи таких опытов на самом деле объясняют-
ся участием в процессе сборки вириона каких-то иных систем, присут-
ствующих в клетке при синтезе вируса. На мысль о существовании си-
стемы, осуществляющей функцию сборки, наводит обнаружение мутант-
ных бактериофагов, не образующих цельных вирионов, несмотря на то
что в инфицированной клетке синтезируются все белки, обнаруженные
в составе зрелого вириона.
СТРУКТУРНЫЕ КОМПОНЕНТЫ ВИРИОНА,
НЕ ВХОДЯЩИЕ В СОСТАВ ЕГО КАПСИДА
Не все содержащиеся в вирионе белки входят в состав его капсида.
Так, например, в состав вирионов Т-четных фагов, кроме большого числа
различных белков, образующих капсид, входит по крайней мере еще
один, так называемый внутренний белок, отличающийся по серологиче-
ским характеристикам от белков, локализованных на поверхности ви-
риона [507]. Функцию некоторых белков фагов мы рассмотрим в гл. IX.
Интригующими компонентами вирионов являются липиды, содержа-
щиеся, например, во внешней оболочке миксовирусов, арбовирусов и ви-
русов группы герпеса (гл. XIV). Использование радиоактивных изотопов
при изучении биосинтеза этих вирусов показало, что липиды, входящие
в состав вирионов миксовирусов, имеют клеточное происхождение, ибо
предсуществуют в клетке до вирусной инфекции и по составу сходны
с липидами, входящими в состав мембраны клетки-хозяина.
Геном миксовирусов детерминирует синтез по крайней мере трех
белков, входящих в состав вириона: 1) белка капсида, который, связы-
ваясь с нуклеиновой кислотой, образует спиральную структуру, близкую
по своим размерам к ВТМ, но в отличие от ВТМ гибкую; 2) гемагглюти-
нина— белка, обладающего способностью агглютинировать эритроциты
животных самых различных видов, и 3) муколитического фермента, на-
званного сиалидазой или нейраминидазой. Функциональная роль этих
белков будет обсуждаться в гл. XIII. Кроме веществ, перечисленных
выше, в препаратах некоторых вирусов систематически обнаруживаются
различные малые молекулы. Так, например, в головке Т-четных фагов
содержатся полиамины спермидин и путресцин [15]. Возможно, что функ-
ция полиаминов состоит в нейтрализации отрицательных зарядов ДНК,
т. е. в осуществлении процесса, вероятно необходимого для правильной
упаковки ДНК внутри головки фага. Кроме того, в отростке Т-четных
фагов содержится в связанном состоянии АТФ, а также ионы Са2+. АТФ
и Са2+, по-видимому, принимают участие в процессе сокращения белка,
находящегося в чехле отростка,— одного из этапов процесса инъекции
ДНК в бактериальную клетку [886].
Т-четные фаги присоединяются к поверхности бактерии лишь в том
случае, если нити отростка имеют должную конфигурацию. В связи
с этим высказано предположение, что производное фолиевой кислоты,
обнаруживаемое в Т-четных фагах (несколько молекул на частицу), при-
нимает участие в поддержании правильной структуры нитей отростка
фага [474].
В состав некоторых вирусов растений (морщинистости турнепса,
крапчатости фасоли и табачной мозаики) входит полиамин бис-(3-ами-
Химия вирусов
101
нопропил)-амин. Можно полагать, что функция этого полиамина, как и
полиаминов, входящих в состав фагов, состоит в нейтрализации зарядов
вирусной РНК [411]. Поскольку этот полиамин не был обнаружен в здо-
ровых листьях, возможно, что он синтезируется только в зараженных
клетках.
Содержание в вирионах веществ типа липидов и полиаминов варьи-
рует как в количественном, так и в качественном отношении и изме-
няется в зависимости от того, на каких клетках был выращен вирус.
Не всегда бывает просто решить, являются ли подобные второстепенные
компоненты составной частью вириона или примесями, адсорбирован-
ными на его поверхности.
Глава VI
СЕРОЛОГИЧЕСКИЕ СВОЙСТВА ВИРУСОВ
ВИРУСЫ КАК АНТИГЕНЫ
Вирусные частицы содержат белки. Поскольку большинство бел-
ков— хорошие антигены, то следует ожидать, что вирионы также будут
обладать антигенными свойствами. Как известно, антигеном называется
вещество, которое при его введении животному вызывает у последнего
образование антител, т. е. молекул у-глобулинов, циркулирующих в кро-
ви и способных специфически реагировать с антигеном [423]. У животных,
иммунизируемых путем длительного введения антигена, образуются
главным образом антитела, относящиеся к категории 75-у-глобулинов
(молекулярный вес 150 000 дальтон). В антисыворотках, получаемых от
животных вскоре после введения антигена, часть антител является 19S-
у-глобулинами. Антитела этого типа инактивируются меркаптоэтанолом
[250].
При любой реакции антиген — антитело происходит специфическое
связывание этих двух реагентов. Специфичность антител определяется
химической природой антигена. Часто, пользуясь антителами, можно вы-
явить такие различия между антигенами, которые при помощи любых ана-
литических химических методов, известных в настоящее время, выявить
вообще невозможно. Например, антитела в состоянии различить два бел-
ка, выделенные идентичным методом из одной и той же ткани двух род-
ственных видов животных или даже из идентичной ткани двух разных
особей животных одного вида. Поэтому серологические реакции при их
правильном использовании являются исключительно тонким инструмен-
том структурного анализа белков и других антигенов, в том числе вирио-
нов вирусов или клеток, содержащих индуцированные вирусом антигены.
Наличие реакции между каким-либо антигеном и антисывороткой,
полученной при иммунизации другим антигеном (такие реакции в про-
тивоположность гомологичным были названы гетерологичными реакция-
ми), свидетельствует о том, что в молекулах этих двух антигенов имеют-
ся аналогичные или близкие по составу и строению химические группи-
ровки. Иногда антитела могут специфически реагировать с веществом,
представляющим собой часть молекулы антигена, но неспособным выз-
вать образование антител. Такими свойствами обладают простые хими-
ческие соединения и некоторые макромолекулы, например полисахари-
ды. Подобного типа молекулы, которые при присоединении к белкам
ведут себя как антигенные детерминанты, называются гаптенами.
В каждом вирусе содержатся специфические антигены, отличающие-
ся как от антигенов клетки-хозяина, в которой вирус синтезировался,
так и от специфических антигенов других вирусов. При помощи противо-
вирусных антител можно выявить и количественно определить материал
вирусного происхождения, причем даже в том случае, если этот мате-
риал не удается выделить в инфекционном состоянии. Серологические
реакции позволяют выявить как различия, так и сходства между двумя
штаммами вирусов. Данные, получаемые при помощи серологических
реакций, с успехом используют для классификации вирусов, а также при
102
Серологические свойства вирусов
103
эпидемиологических обследованиях. Серологические исследования лежат
в основе большинства методов диагностики вирусных заболеваний.
В условиях лаборатории для получения противовирусных сывороток
чаще всего используют кроликов, хотя иногда иммунизируют и морских
свинок, кур, мышей, хорьков и лошадей. При диагностике вирусных за-
болеваний человека пользуются сыворотками больных и известными
вирусными антигенами. Сыворотки, полученные от животных, которым
антиген вводили несколько раз подряд, часто называют гипериммунными.
Повторное введение антигена ранее иммунизированному животному ин-
дуцирует быстрое вторичное, или анамнестическое, образование антител.
РЕАКЦИИ АНТИГЕН —АНТИТЕЛО,
ВОЗНИКАЮЩИЕ ПРИ ВЗАИМОДЕЙСТВИИ ВИРИОНОВ С АНТИТЕЛАМИ
Результат реакции, возникающей при смешивании антигена с гомо-
логичной антисывороткой, зависит от физических свойств антигена,
разнообразия специфических функций, которыми обладает данный анти-
ген, и используемого метода [423].
Иммунологические реакции, наблюдаемые при взаимодействии ан-
тигена с антителом, можно разделить на несколько групп. К первой из
них относятся реакции, в основе которых лежит изменение степени дис-
персности антигена; таковы, например, реакции преципитации и агглю-
тинации. Термин «преципитация» применяют для обозначения реакций с
антигенами, находящимися в исходном растворе в виде отдельных мо-
лекул, а термин «агглютинация» — для обозначения реакций с клеточ-
ными антигенами, такими, например, как бактерии или эритроциты. Пре-
ципитат представляет собой трехмерную сетку, или решетку, образован-
ную связавшимися друг с другом молекулами антигена и антител.
Очевидно, что решетка сможет образоваться лишь в том случае, если
и антиген и антитело будут поливалентными или в крайнем случае двух-
валентными, ибо для образования решетки необходимо, чтобы каждая
молекула антигена могла связаться по меньшей мере с двумя молекула-
ми антител, и, наоборот, каждая молекула антитела—с двумя молекула-
ми антигена. И в самом деле, было показано, что каждая молекула ан-
титела обладает двумя активными центрами идентичной специфичности
[620]. Протяженность образуемой решетки зависит от относительных
концентраций реагентов. Для каждой пары антиген — антитело сущест-
вует характерная величина соотношения компонентов, наиболее благо-
приятная для образования решетки. Эта величина называется точкой
эквивалентности. В смесях, содержащих избыток антигена или избыток
антител, преципитат может не образоваться.
Видимые крупинки преципитата образуются лишь в том случае, если
в растворе содержится достаточно большое количество антигена. Мини-
мальное количество вируса, необходимое для образования видимого пре-
ципитата, составляет примерно 0,1—1,0 мкг. Очень маленькие гроздья,
образующиеся при взаимодействии вирионов с антителами, можно на-
блюдать с помощью электронного микроскопа.
Вирус можно выявить также при помощи непрямого метода, в осно-
ве которого лежит агглютинация противовирусными антителами относи-
тельно больших частиц, например гранул коллодия, бактерий или эрит-
роцитов, к поверхности которых искусственно присоединен вирус. При-
соединить вирус к частице можно при помощи неспецифического метода,
например адсорбируя вирус осповакцины на поверхности частиц кол-
лодия [285], или при помощи специфического метода (адсорбция бакте-
риофага на поверхности убитых нагреванием бактерий) [116].
104
Глава VI
Реакции преципитации можно изучать также в агаровом геле. При
этом раствор антигена и раствор антител помещают в различные участ-
ки, например в лунки, которые высверливают в слое агара. Антиген и ан-
титела диффундируют в агар (в том числе и навстречу друг другу). Мож-
но использовать спонтанную диффузию, как это делают при работе по
методам Удена и Оухтерлони, либо прибегнуть, кроме того, и к электро-
форезу, как это делают при работе по методу иммуноэлектрофореза.
В участке, где антиген и антитело встречаются в эквивалентной концент-
рации, появляется линия преципитации (фото 33) [423]. Методы преципи-
тации в агаре особенно полезны при изучении сложных смесей антигенов,
а также при необходимости выявления перекрестных реакций. Однако
вследствие того, что вирионы очень медленно диффундируют в агаровый
гель, эти методы более пригодны для анализа субвирусных фракций, чем
интактных вирионов.
Ко второй группе иммунологических реакций относят тесты, при ко-
торых о результате взаимодействия антигена с антителом судят по изме-
нениям, возникающим в сыворотке. Типичным примером в данном случае
является реакция связывания комплемента. В основе этой реакции ле-
жит способность комплекса антиген — антитело связывать компле-
мент— термолабильное вещество, содержащееся в нормальной сыво-
ротке крови. При реакции связывания комплемента известное его ко-
личество (обычно в качестве комплемента используют нормальную
сыворотку морской свинки) добавляют к смеси антигена с антителом (ан-
тисыворотку, содержащую антитела, предварительно прогревают с
целью разрушения комплемента). Исчезновение или «фиксацию» ком-
племента определяют затем при помощи индикаторной системы, состоя-
щей из смеси бараньих эритроцитов и антисыворотки к бараньим эрит-
роцитам. В зависимости от количества комплемента, добавленного к ин-
дикаторной системе, наблюдается та или иная степень гемолиза
эритроцитов. Отсутствие лизиса или уменьшение его интенсивности слу-
жит мерилом количества комплемента, связавшегося анализируемой си-
стемой антиген — антитело. Реакция связывания комплемента лежит в
основе многих ценных методов выявления противовирусных антител и ча-
сто используется в диагностических целях. Для постановки реакции свя-
зывания комплемента не нужен столь концентрированный и чистый пре-
парат вируса, как для реакции преципитации или агглютинации, что без-
условно является одним из преимуществ этой реакции.
Критерием, лежащим в основе третьей группы иммунологических ре-
акций, используемых в вирусологии, является потеря вирионами инфек-
ционности вследствие соединения их с антителами. Реакции такого типа
получили название реакций нейтрализации. Потеря вирионом инфекци-
онности говорит о том, что присоединение к вириону антитела приводит
к блокированию функции какой-то существенной части вирусной части-
цы. Не все противовирусные антитела обладают нейтрализующим дейст-
вием. Дело в том, что в вирионе могут присутствовать несколько различ-
ных антигенов, и обусловлено это либо содержанием в вирионе субъеди-
ниц, отличающихся друг от друга по антигенной структуре, либо наличием
в каждой субъединице нескольких отличающихся друг от друга анти-
генных детерминант. Очевидно, что нейтрализующим действием облада-
ют лишь те антитела, которые соединяются с детерминантными группа-
ми, определяющими возникновение инфекционного процесса.
Очень полезным серологическим методом является реакция иммуно-
флуоресценции [150]. Пользуясь этой реакцией, можно выявить локали-
зацию вирусных антигенов, находящихся как на поверхности, так и внут-
ри клетки. При прямом методе иммунофлуоресценции специфическим
реагентом служит выделенный из антисыворотки у-глобулин, к которому
Серологические свойства вирусов
105
при помощи химической связи присоединен флуоресцентный краситель.
При непрямом методе сначала ставится реакция между антигеном и не-
меченой специфической антисывороткой, например сывороткой человека,
а затем выявляют наличие комплекса антиген — антитело путем добав-
ления флуоресцирующего у-глобулина, полученного из сыворотки кроли-
ка, иммунизированного глобулином человека. Возможности цитоимму-
нохимического анализа были расширены с введением метода ферритино-
вых антител, который позволяет выявлять антигены с помощью электрон-
ного микроскопа. Ферритин представляет собой белок, в молекуле кото-
рого имеется железосодержащее ядро, обладающее высокой электронной
плотностью. Благодаря этому оно выявляется на электронных микрофо-
тографиях в виде черного кружка, что позволяет судить о локализации в
клетке антитела, связанного с молекулой ферритина и, следовательно,
соответствующего антигена [599].
Перекрестные серологические реакции
Как правило, иммунная сыворотка наиболее сильно, т. е. при наи-
большем разведении, реагирует с гомологичным антигеном. Иммунная
сыворотка может давать и перекрестные реакции, но обычно эти реакции
являются более слабыми. Данные, приведенные в табл. 12, иллюстри-
руют одну из подобных ситуаций.
Таблица 12
Перекрестные реакции нейтрализации, наблюдаемые при реакции соответствующих
антисывороток с бактериофагами группы Т1—Т7
Антисыворотка, специфичная в отношении ука- занных фагов Константа (k)' скорости инактивации при реакции со следующими фагами, мин-1
T1 T2 тз Т4 Т5 Т6 Т7
Т1 80 0 0 0 0 0 0
Т2 0 400 0 150 0 80 0
тз 0 0 120 0 0 0 30
Т4 0 75 0 250 0 20 0
Т5 0 0 0 0 80 0 0
Тб 0 200 0 40 0 500 0
Т7 0 0 75 0 0 0 120
* См. уравнение (VI.1).
Добавляя к антисыворотке избыточное количество гомологичного
антигена, можно удалить все содержащиеся в ней специфические анти-
тела. Напротив, адсорбция гетерологичным антигеном, дающим пере-
крестную реакцию, обычно приводит к удалению из антисыворотки толь-
ко части антител.
Перекрестные реакции являются следствием наличия у молекул раз-
личных антигенов общих структурных группировок. Антигенные детер-
минанты представляют собой небольшие участки поверхности молекулы,
имеющие обычно размеры порядка 10—25 А [423]. Молекула белка или
полисахарида может иметь несколько идентичных или различных анти-
генных детерминант. За гомологичные реакции двух перекрестнореаги-
рующих гетерологичных антисывороток ответственна либо та часть ан-
тител, которая обладает наиболее выраженной специфичностью по отно-
шению к собственным гомологичным детерминантам, либо, что более
характерно, та часть антител, которая направлена против антигенных де-
106
Глава VI
терминант, содержащихся только в одном из двух антигенов. Частич-
ные перекрестные реакции с такими сложными антигенами, как вирио-
ны, могут также быть обусловлены тем, что в таких перекрестнореаги-
рующих вирионах, кроме специфических для каждого из них субъединиц,
имеется некоторое количество субъединиц, общих для этих вирионов.
Для того чтобы правильно интерпретировать перекрестную сероло-
гическую реакцию вирусов, необходимо в каждом отдельном случае осу-
ществить антигенный анализ их структуры, т. е. доказать, что в составе
данного вируса содержатся различные антигенные компоненты, которые
поддаются разделению. Иногда вирусные антигены удается искусствен-
но выделить из интактных вирионов. В других случаях их удается обна-
ружить в зараженных клетках и выделить в виде растворимых специфи-
ческих веществ из экстрактов, полученных из этих клеток. Под специфи-
ческими веществами в данном случае понимаются гаптены или антигены,
являющиеся либо предшественниками компонентов, из которых образу-
ются вирионы, либо компонентами, входящими в состав неполных вирио-
нов, либо самими компонентами вирионов, синтезировавшимися в инфи-
цированных клетках в избыточных количествах.
Помимо антигенов, входящих в состав вирионов, в зараженных ви-
русом клетках в ответ на вирусную инфекцию могут также синтезиро-
ваться специфические, связанные с клеткой антигены. Лучше всего из них
изучены антигены, образующиеся в клетках при хронической вирусной
инфекции, не сопровождающейся гибелью клеток. Однако при заражении
некоторыми вирусами сходные антигены обнаруживаются в клетках так-
же и вскоре после заражения. Эти клеточные антигены не дают пере-
крестных реакций с антигенами вирионов. По-видимому, они являются
новыми компонентами клеток, которые синтезируются под прямым или
косвенным контролем вирусного генома. К этой группе антигенов отно-
сятся, в частности, измененные антигены полисахаридной природы, обра-
зующиеся у лизогенных салмонелл под контролем генома фага [682],
а также связанные с клеткой антигены, обнаруживаемые в клетках жи-
вотного происхождения, трансформированных вирусами группы полио-
мы, папилломы и аденовирусов [874]. Вопрос о значении и функции этих
индуцированных вирусами клеточных антигенов будет рассматриваться
в последующих главах.
СЕРОЛОГИЯ БАКТЕРИОФАГОВ
Почти каждый штамм бактериофага, выделенный из природного ис-
точника, обладает четкой и характерной для данного штамма антиген-
ной специфичностью. Вирионы и соответствующие клетки бактерий-хо-
зяев не дают перекрестных серологических реакций.
Очень часто бактериофаги, сходные в отношении способности раз-
множаться в том или ином виде бактерий, полностью отличаются друг
от друга серологически. Бактериофаги, дающие перекрестные серологиче-
ские реакции, обладают также и другими сходными свойствами, напри-
мер сходной морфологией. Степень выраженности перекрестных реакций
может быть использована в качестве критерия филогенетического род-
ства [8, 9]. Большая часть известных коли-дизентерийных фагов была
разделена на 11 основных серологических групп, не дающих межгруппо-
вых перекрестных реакций [112].
Большое внимание было уделено изучению реакции нейтрализации.
Это объясняется тем, что, используя методы титрования, можно осущест-
влять точные количественные исследования. В табл. 12 приведены ре-
зультаты типичного опыта такого рода, проведенного с целью изучения
перекрестных реакций нейтрализации некоторых колифагов. На основе
Серологические свойства вирусов
107
результатов, полученных при изучении нейтрализации фагов, был сфор-
мулирован так называемый «закон процентного отношения». Этот закон
утверждает, что при данной концентрации антисыворотки за данный про-
межуток времени инактивируется определенное относительное количест-
во фага независимо от общего количества фага, находящегося в сфере
реакции [25]. Этот закон справедлив для области избытка антител, т. е.
лишь для тех случаев, когда количество антител, приходящееся на один
вирион, не изменяется значительно вследствие истощения антисыворотки.
Реакция нейтрализации идет в соответствии с уравнениями
^- = e-klc-, ln — = ktC\ igA = o,43 ktC, (VI. 1)
Po p p
где Pq — исходный титр фага, P — остаточный титр фага после t минут
контакта с антисывороткой, С—концентрация антисыворотки, ай —
Фиг. 22. Нейтрализация бактериофагов гомологичной или гетерологичной антисыво-
роткой.
Показана зависимость между величиной Р/Рп (отношение остаточного титра вируса к исходному)
и временем инкубации смеси фаг — антисыворотка при 37°. / — смесь фаг Т2+антисыворотка к фагу
Т2. разбавленная в отношении 1 64 000; // — смесь фаг Т2+антисыворотка к фагу Т2, разбавленная
в отношении I : 16 000; ///—смесь фаг Т2 + антисыворотка к фагу Т2, разбавленная в отношении
1 4000; IV — смесь фаг Т4+антисыворотка к фагу Т2, разбавленная в отношении 1 4000.
константа (константа скорости инактивации). Эта константа характери-
зует скорость инактивации данного фага данной антисывороткой в ус-
ловиях, для которых справедливо уравнение (VI. 1).
Графическое изображение результатов эксперимента, описываемого
уравнением (VI.1), приведено на фиг. 22. Уравнение (VI.1) описывает
кинетику реакции первого порядка. Аналогичным уравнением описыва-
ется также кинетика псевдомономолекулярной реакции, т. е. двухмоле-
кулярной реакции, идущей при большом избытке одного из реагентов.
Таким образом, очевидно, следует, что одна молекула антитела может
нейтрализовать одну фаговую частицу (вирион).
Часто, однако, реакция нейтрализации значительно отклоняется от
направления, предсказываемого уравнением (VI. 1). Этот вопрос был де-
108
Глава VI
тально изучен в опытах с колифагом Т2 [128], и причины двух видов ано-
малий, а именно появления начального лаг-периода нейтрализации и
уменьшения скорости нейтрализации, были объяснены следующим об-
разом.
Вирионы, содержащиеся в фаговых лизатах, не однородны в отноше-
нии их способности атаковать бактерии. У некоторой части вирионов спо-
собность атаковать бактериальные клетки ингибируется вследствие при-
соединения к этим вирионам некоего бактериального вещества, которое
можно удалить из среды путем ее прогревания при 65° в течение несколь-
ких минут [712]. В антисыворотках, полученных путем иммунизации не-
очищенными препаратами фагов, кроме антифаговых антител, содержат-
ся антитела, которые «активируют» ингибированные вирионы, по-види-
мому, путем удаления ингибитора. Этот процесс приводит к кажущейся
начальной задержке реакции нейтрализации. Если предварительно до-
биться полной активации препарата фага (что достигается кратковре-
менным прогреванием), то нейтрализация фага иммунной сывороткой
идет в полном соответствии с уравнением (VI.1), однако лишь до тех
пор, пока количество выживших фагов не уменьшается примерно до 1%
исходного. Далее скорость реакции нейтрализации уменьшается, что свя-
зано с наличием в суспензии вирионов, частично устойчивых к действию
антисыворотки. Вероятно, устойчивыми к нейтрализации являются те ви-
рионы, к поверхности которых уже присоединилось некоторое количество
антител, но таким образом, что определенные критические участки, обус-
ловливающие инфекционность вирионов, остаются еще свободными, од-
нако менее уязвимыми к действию нейтрализующих антител, возможно,
по причине стерического препятствия, которое оказывают молекулы ан-
тител, присоединившиеся в соседних участках.
При титровании обработанного антисывороткой фага на различных
клетках-хозяевах, например на Е. coli или S. dysenteriae, могут получить-
ся различные величины остаточных титров. Это явление наводит на
мысль, что молекулы антител, присоединившиеся к участкам поверхно-
сти фага, необходимым для присоединения фага к бактерии, или к со-
седним с ними участкам, могут по-разному изменять способность фага
присоединяться к соответствующим рецепторам различных клеток. У фа-
гов, имеющих отросток, критический участок поверхности, который дол-
жен быть экранирован нейтрализующим антителом, вероятно, находится
на этом отростке—структуре, при помощи которой фаг присоединяется
к поверхности бактериальной клетки-хозяина. Нейтрализованный сыво-
роткой фаг Т2 еще сохраняет способность к обратимой адсорбции на бак-
терии, но теряет способность к необратимому связыванию с ней [856].
Фаг, необратимо адсорбировавшийся на бактерии, по-видимому, ста-
новится нечувствительным к действию нейтрализующих антител. Это яв-
ление лежит в основе использования антисыворотки для удаления неад-
сорбированного фага из смесей фага с бактериями — метода, широко
применяемого при подсчете числа инфицированных бактерий.
Используя отдельные компоненты, выделенные из вирионов фага,
можно показать, что в антифаговой сыворотке содержатся различные
группы антител, а именно антитела, специфичные в отношении головки,
отростка или внутреннего белка фага соответственно [488, 507]. Большая
часть групп этих антител не обладает способностью нейтрализовать ви-
рионы, хотя и может их агглютинировать. Было показано, что критиче-
ский участок, подлежащий обязательной экранировке нейтрализующими
антителами, составляет не более 5% поверхности отростка фага [408].
Фаги, нейтрализованные антителами, содержащимися в гипериммун-
ных сыворотках, при разбавлении смеси практически не реактивируют-
ся. Реактивацию, однако, иногда удается осуществить, удаляя антитела
Серологические свойства вирусов
109
с поверхности фага путем расщепления их папаином. Нейтрализующие
антитела, содержащиеся в «ранних» антисыворотках, т. е. в антисыво-
ротках, полученных от животных, которым антиген вводили всего один
или два-три раза, связываются с вирионами менее прочно. Благодаря
этому нейтрализованные такими антисыворотками фаги иногда удается
реактивировать путем разбавления смеси (фиг. 23).
Фиг. 23. Реактивация обратимо инактивированного фага Т4 путем разведения [408].
Кривая / показывает инактивацию фага Т4 «ранней» антисывороткой. Кривая // демонстрирует
максимальную реактивацию, обнаруженную после инкубации разбавленной реакционной смеси. Дан*
ные, по которым построена кривая /. получены при помощи так называемого метода «решения»
(decision method). Согласно этому методу, смесь фаг — сыворотка до ее разведения подвергают
действию концентрированной суспензии бактерий, после чего добавляют избыточное количество ги-
периммунной сыворотки, убивающей все фаги, не сумевшие присоединиться к клеткам (инактиви-
рованные фаги). Большая часть таких фагов реактивируется при разбавлении смеси.
На реакцию нейтрализации большое влияние оказывает ионная сила
среды. Например, фаг Т2, суспендированный в 1 М растворе NaCl, вооб-
ще не нейтрализуется антисывороткой, а в 10~3 М растворе NaCl нейтра-
лизуется в 100 раз быстрее, чем фаг, суспендированный в 0,1 М раство-
ре соли. Возможно, что за это явление ответственны некий нейтрализую-
щий кофактор, вероятно содержащийся в антисыворотке, который
отделяется от антител при увеличении ионной силы раствора [409], или
какие-то изменения, происходящие в нитях отростка при уменьшении
ионной силы раствора.
Подобно всем другим антителам, антитела, нейтрализующие фаги,
можно адсорбировать избытком антигена. В любом неочищенном фаго-
лизате всегда содержится некоторое количество свободных фаговых ан-
тигенов, не вошедших в состав вирионов, которые могут адсорбировать
нейтрализующие антитела. Эти свободные, или «растворимые», антигены
выявляют по их блокирующей серологической активности, т. е. по их спо-
собности конкурировать с вирионами за нейтрализующие антитела (см.
табл. 13). Содержащиеся в таблице данные показывают, что предвари-
тельная инкубация антифаговой сыворотки с инактивированным ультра-
по
Глава VI
фиолетом гомологичным очищенным фагом или с не содержащим фага
ультрафильтратом фаголизата гомологичного фага уменьшает способ-
ность антисыворотки нейтрализовать гомологичный фаг. Тест на блоки-
рующую серологическую активность — обычный способ изучения дина-
мики синтеза фагового антигена в инфицированных бактериях [181].
Таблица 13
Блокирующая серологическая активность фага и ультрафильтрата фаголизата [183]
№ про- бирки Содержимое Титр тест-фага Доля выжив- шего тест- фага, %3)
1 Бульон 7,7 105 100
2 Антисыворотка 2,2- 104 3
3 Антисыворотка 4-7,0 • 109Т2 2) (инактивированного УФ) 7,7 105 100
4 Антисыворотка 4-2,3 109Т2 (инактивированного УФ) 4,8 • 105 62
5 Антисыворотка 4- 7,7 108Т2 (инактивированного УФ) 1,8 • 105 23
6 Антисыворотка 4- 2,6 • 108Т2 (инактивированного УФ) 4,3 • 10< 6
7 Антисыворотка 4- 8,7 107Т2 (инактивированного УФ) 1,6 • 104 2
8 Антисыворотка 4- ультрафильтрат в разведении 1 :3 1,7 105 22
9 Антисыворотка 4- ультрафильтрат в разведении 1 :9 5,3 • 104 7
10 Антисыворотка 4- ультрафильтрат в разведении 1 : 27 2,5 • 104 3
’) Антисыворотка к фагу Т2 имела титр 1 40 000.
2) Смеси инкубировали 4 час при 48° В качестве тест-фага использовали фаг Т2г.
Серологическая блокирующая активность ультрафильтрата соответствует приблизительно
2 • 109 частиц фага Т2, облученных ультрафиолетом
Ерне [407] открыл удивительную группу антифаговых антител. Эти
антитела стабилизируют активированное состояние одного из штаммов
фага Т4, присоединяющегося к бактериальным клеткам лишь в присут-
ствии триптофана, выполняющего в данном случае роль активирующего
кофактора [19]. В отсутствие антисыворотки активацию фага Т4 трипто-
фаном удается полностью и быстро реверсировать путем разведения сус-
пензии активированного фага. Антисыворотка фиксирует степень актива-
ции, достигнутую к моменту ее добавления. Наиболее правдоподобное
объяснение этого явления состоит в том, что стабилизирующие антитела,,
видимо, связываются с теми структурами фага, к которым присоединяют-
ся нити отростка, когда вирионы фага находятся в неактивном состоянии
(фото 25). Поэтому после удаления триптофана нити не могут снова вер-
нуться в положение, занимаемое ими при неактивном состоянии вириона.
Стабилизирующие антитела можно обнаружить в исключительно ма-
лых количествах. Благодаря этому Ерне и удалось показать, что антите-
ла этого типа практически выявляются во всех сыворотках, в том числе
и в полученных от неиммунизировавшихся животных. Этот результат
привел Ерне к мысли, что в сыворотках нормальных индивидуумов, ве-
роятно, содержатся в незначительных количествах в принципе все су-
ществующие типы антител, а введение антигена просто индуцирует уве-
личение синтеза антител, способных реагировать с введенным животному
антигеном. Эта идея является центральным положением селекционной
теории образования антител (ее ранней формы) (см. Бернет [114]).
Серологические свойства вирусов
111
Другим уникальным антигеном Т-четных колифагов является их
ДНК. Ранее уже упоминалось, что ДНК этих фагов вместо цитозина со-
держит глюкозилированный оксиметилцитозин (ОМЦ) (см. гл. V). Обыч-
ные ДНК являются слабыми антигенами. Пока не удалось показать им-
мунологической специфичности обычных ДНК, выделенных из самых
различных источников. Исключением являются ДНК Т-четных фагов.
Специфическими антигенными детерминантами этих ДНК являются глю-
козильные остатки ОМЦ-нуклеотидов [508].
СЕРОЛОГИЯ ВИРУСОВ РАСТЕНИЙ
Растения не образуют веществ, аналогичных антителам. Следует, од-
нако, отметить, что при некоторых вирусных инфекциях в теле растения
образуются неспецифические ингибиторы вирусов [750]. Антисыворотки,
образующиеся при иммунизации животных вирусами растений, исполь-
зуют для выявления соответствующих вирионов, определения их числа и
очистки вирионов при помощи специфической преципитации.
К одному вириону ВТМ может присоединиться по крайней мере
60 молекул антител. Это намного меньше числа идентичных субъединиц,
входящих в состав вириона (в состав одного вириона ВТМ входит при-
мерно 2100 субъединиц). По-видимому, из-за стерических препятствий не
все белковые субъединицы вириона могут соединиться с антителом (за-
метьте, что молекулярный вес 75-антитела примерно в 9 раз больше мо-
лекулярного веса субъединицы ВТМ).
Детальный анализ реакции нейтрализации вирусов растений до сих
пор проведен не был. Частично это объясняется неэффективностью мето-
дов титрования, частично — легкостью ингибирования вирусной инфек-
ции растений самыми различными белками [54]. Для обнаружения вирус-
ных белков в тканях и тканевых экстрактах растений были использованы
флуоресцирующие антитела. При помощи таких флуоресцирующих ан-
тител и реакции связывания комплемента было показано, что некоторые
вирусы растений, переносимые членистоногими, как у растений-хозяев,
так и. у членистоногих-переносчиков индуцируют образование серологи-
чески идентичных белков [776].
Между частицами нормального ВТМ и частицами ВТМ, образовав-
шимися в растениях, обработанных аналогом урацила — тиоурацилом,
замещающим некоторые остатки урацила вирусной РНК, — были обна-
ружены антигенные различия. Эти данные говорят о том, что небольшие
различия в аминокислотном составе, скорее всего ведущие лишь к тонким
изменениям третичной структуры белковых субъединиц, могут привести
к резкому изменению антигенных свойств [404].
СЕРОЛОГИЯ ВИРУСОВ животных
Иммунологические проблемы, которые приходится решать при изу-
чении вирусов животных, можно разделить на две группы. Объясняется
такое разделение тем, что комплекс иммунологических реакций, возни-
кающих у животных, в организме которых вирус размножается, а часто
вызывает также соответствующее заболевание, отличается от иммуноло-
гической реакции, возникающей в ответ на введение вируса у животных,
в организме которых данный вирус размножаться не может.
Такое подразделение представляет не только практический интерес,
хотя большое значение иммунологических процессов в профилактике,
диагностике, патогенезе и клинике вирусных инфекций совершенно оче-
видно. Эта классификация принципиально важна, ибо, как уже упоми-
налось выше, иммунологические реакции животного в ответ на введение
112
Глава VI
вируса могут существенно отличаться друг от друга в зависимости от то-
го, размножается ли инокулированный вирус в данном организме или
нет. Действительно, введенный в организм неразмножающийся вирус, на-
пример фаг или какой-либо вирус растений, ведет себя подобно любому
другому чужеродному антигену. Напротив, введение размножающегося
вируса приводит к появлению в организме все возрастающего количества
антигена. В свою очередь на размножение вируса влияют антитела, обра-
зовавшиеся в ответ на введение данного вируса. Очевидно, что комплекс
явлений, возникающих при проникновении в организм размножающегося
вируса, не только более интересен, но и труднее поддается анализу, чем
комплекс явлений, наблюдаемых при введении в организм неразмножаю-
щегося вируса.
Другой характерной чертой вирусов животных, отличающей их от
имеющих отросток фагов, является отсутствие у этих вирусов специаль-
ного органа для присоединения вириона к клетке-хозяину. Вместо этого
на поверхности вирионов вирусов животных имеется большое количество
рецепторов, каждый из которых может быть использован для специфи-
ческого присоединения вириона к поверхности клетки и инициирования
вирусной инфекции. Это обстоятельство не может не влиять на кинетику
реакции нейтрализации.
Реакция нейтрализации
В первом исследовании в этой области Бернет, Кеог и Луш [116], ис-
пользуя в качестве метода количественной оценки вирусной инфекции
подсчет числа поражений, образующихся на хориоаллантоисной мемб-
ране куриного эмбриона, изучили реакцию нейтрализации на модели не-
скольких вирусов. Они пришли к выводу, что нейтрализация вируса яв-
ляется результатом соединения вириона с антителами и что при разбав-
лении реакционной смеси этот комплекс легко распадается на исходные
компоненты. Однако Дульбекко и сотр. [204] показали, что реакцию ней-
трализации вирусов и ее обратимость необходимо изучать при условиях,
которые позволяют прервать реакцию таким образом, чтобы содержа-
щиеся в системе вирус и антитела не смогли бы вновь взаимодействовать
друг с другом. В случае когда эти условия были выполнены, кинетика
нейтрализации вируса полиомиелита и вируса западного энцефаломиели-
та лошадей соответствующими гомологичными гипериммунными сыво-
ротками подчинялась уравнению (VI.1) вплоть до инактивации по мень-
шей мере 99% вирионов, т. е. описывалась простой логарифмической кри-
вой. Разбавление не приводило к обратимости нейтрализации, однако
небольшая часть вирионов не поддавалась нейтрализации.
Однако если нейтрализованный антисывороткой вирус смешать с из-
быточным количеством вируса, инактивированного ультрафиолетом, то
некоторая часть нейтрализованного вируса реактивируется. Вирус полио-
миелита, нейтрализованный антисывороткой, можно также частично ре-
активировать инкубированием в кислых или щелочных растворах, воз-
действием ультразвука или обработкой фторуглеродными соединениями
[560]. В противоположность этим данным Фазекаш де Гросс и др. [223],
анализируя механизм реакции нейтрализации, получили эксперименталь-
ные данные, говорящие о полной обратимости реакции нейтрализации
вирусов животных.
Различие в результатах, полученных разными авторами, по-видимо-
му, объясняется тем, что прочность комплекса антиген — антитело очень
варьирует в зависимости от использованной антисыворотки [482]. Так, на-
пример, основная масса антител, содержащихся в гипериммунных сыво-
ротках, образует с антигеном прочные связи, тогда как в «ранних» сы-
Серологические свойства вирусов
ИЗ
воротках и сыворотках реконвалесцентов в основном содержатся антите-
ла, образующие с антигеном слабые связи. Необратимой нейтрализации,
по-видимому, предшествует обратимое связывание антител. Кроме того,
антитела, образующие слабые связи, так же как и не нейтрализующие
антитела, реагирующие с вирусными антигенами, расположенными
по соседству с рецепторами, которые осуществляют присоединение
вируса к клетке, могут, по-видимому, препятствовать образованию не-
обратимой связи между соответствующими рецепторами и специфичны-
ми по отношению к ним антителами, образующими прочную связь.
Такого рода «защиту» легко наблюдать, действуя, например, на ви-
рус гриппа одновалентными фрагментами антител [482]. Возможно, что
для стабильной нейтрализации необходимо соединение обоих активных
центров молекулы антитела с двумя соседними антигенными детерми-
нантами вириона, тогда как обратимая инактивация, быть может, проис-
ходит благодаря присоединению только одного активного центра анти-
тела [483] (фото 34).
Ранние кроличьи антисыворотки, специфичные по отношению к ви-
русу полиомиелита, содержат в основном нейтрализующие антитела
195-типа. Нейтрализующие 75-антитела появляются на один-два дня
позднее [834]. Если доза вводимого антигена очень мала, то образуются
только 195-антитела, а иммунологическая реакция со стороны организ-
ма очень непродолжительна.
Поскольку каждый вирион, по-видимому, обладает большим числом
рецепторов, служащих для присоединения к клетке-хозяину, трудно себе
представить, чтобы кинетика нейтрализации вирусов животных описыва-
лась «одноударной» кривой. Проще всего предположить, что присоедине-
ние к вириону какого-то числа молекул антител не обязательно должно
воспрепятствовать адсорбции вириона на клетке. Вирион будет учтен как
нейтрализованный лишь в том случае, если он присоединяется к клетке
именно тем рецептором, который связался с антителом [860]. Так, напри-
мер, вирион, у которого некоторые из рецепторов присоединили антите-
ла, будет вести себя как нейтрализованный лишь в том случае, если его
необратимое присоединение к клетке-хозяину осуществляют именно эти,
а не какие-либо иные рецепторы. Для того чтобы была полностью исклю-
чена возможность адсорбции вириона на клетке-хозяине, к нему должно
присоединиться большое количество молекул антител [701].
Антигенная мозаичность вирионов
В большинстве случаев вирионы вирусов животных — это весьма
сложные структуры. Разрушая вирионы и далее фракционируя их, мож-
но получить несколько компонентов, отличающихся друг от друг по анти-
генным свойствам. Некоторые из этих компонентов содержатся в инфи-
цированных клетках также и в свободном состоянии. Вероятно, они пред-
ставляют собой избыточные вирусные субъединицы, которые по каким-то
причинам не были использованы при сборке полных вирионов. Такие ви-
русоспецифичные растворимые вещества часто имеют важное значение
для диагностики, ибо легко могут быть обнаружены при помощи реакции
связывания комплемента.
Многие антигены, входящие в состав вирусов, родственных друг дру-
гу, часто можно отличить друг от друга, определяя их способность давать
перекрестные реакции. Так, например, одни антигены всегда обнаружи-
ваются во всех штаммах вирусов данной родственной группы. Такие ан-
тигены называются группоспецифическими. Напротив, другие антигены
удается обнаружить только в каком-нибудь одном штамме вируса дан-
ной группы. Поэтому такие антигены были названы штаммоспецифиче-
8 Заказ № 1214
114
Глава VI
скими. Эти различия весьма важны и широко используются в практиче-
ской эпидемиологии, ибо выявление штаммоспецифических антигенов ле-
жит в основе идентификации штаммов вирусов, выявления новых вари-
антов и типов вирусов и изготовления специфических вакцин.
Вирионы вируса осповакцины — типичного представителя вирусов
группы оспы, содержат много различных антигенных компонентов. Ос-
новными из них являются: 1) внутренний белок, связанный с ДНК;
2) так называемый LS-белок, у которого есть две антигенные детерми-
нанты: L-термолабильная и S-термостабильная, и 3) антиген, индуцирую-
щий образование нейтрализующих антител, который пока еще не удалось
выделить в растворимой форме. По-видимому, в состав вириона вируса
осповакцины входит еще ряд антигенов, ибо при анализе экстракта этого
вируса методом диффузии в агаре выявляется восемь различных анти-
генных компонентов. Эти компоненты в виде растворимых антигенов об-
наруживаются также и в экстрактах клеток, зараженных вирусом оспы
[572]. По меньшей мере один из выявленных антигенов является общим
для всех вирусов группы оспы [925].
В состав вирионов миксовирусов входит несколько антигенов. Один
из них соответствует гемагглютинину. Антитела к гемагглютинину легко
выявляются благодаря простой постановке реакции торможения гемаг-
глютинации. Эта реакция широко используется также для выявления им-
мунитета к миксовирусам. Реакция торможения гемадсорбции [759],
т. е. реакция, тормозящая фиксацию эритроцитов на однослойной куль-
туре клеток, зараженных миксовирусом, является модификацией реакции
гемагглютинации.
В клетках, зараженных миксовирусом, содержится еще один раство^
римый антиген. Этот антиген представляет собой белок, образующий
специфический комплекс с РНК вириона — так называемый спиральный
нуклеокапсид вириона.
Для того чтобы выявить, в каких участках клетки синтезируются те
или иные компоненты вируса, можно использовать флуоресцирующие ан-
титела, специфичные по отношению к отдельным вирусным антигенам.
Например, при помощи метода флуоресцирующих антител было обнару-
жено, что белок, входящий в состав нуклеокапсида миксовирусов, появ-
ляется сначала в ядре зараженной клетки, тогда как гемагглютинины,
напротив, обнаруживаются только в цитоплазме [100].
Сложной антигенной структурой обладают также вирионы, не имею-
щие внешней оболочки. Например, в состав удивительно красивого кап-
сида аденовируса входит по крайней мере три различных антигена. Каж-
дый из этих антигенов является самостоятельной морфологической струк-
турой; один из них составляет основную часть поверхности вириона, об-
разуя субъединицы поверхности, другой локализуется в вершинах углов
капсида, образуя субъединицы вершин, а третий представляет собой так
называемые «спайки», т. е. фибриллы, выступающие в виде «антенн» над
поверхностью вируса [866] (фото 12 и 33).
Важной группой индуцируемых вирусом антигенов являются неин-
фекционные капсиды, не соединившиеся с вирусной нуклеиновой
кислотой и поэтому оставшиеся пустыми. Иногда при помощи анти-
генного анализа удается выявить некоторые различия между этими
пустыми и полными вирионами. Например, в сыворотках боль-
ных острым полиомиелитом содержатся так называемые С-антитела, бо-
лее интенсивно реагирующие с неполными, напоминающими вирионы
частицами или инактивированными нагреванием полными вирионами,
чем с интактными инфекционными вирионами, тогда как в сыворотках
реконвалесцентов содержатся так называемые D-антитела, специфичные
по отношению к целым частицам [687]. Следовательно, частицы вируса
Серологические свойства вирусов
115
полиомиелита могут содержать некоторые антигенные детерминанты,
доступность которых для антител изменяется в зависимости от того, со-
держится в вирионах РНК или нет.
Антигены хозяина и вирусные антигены, входящие в состав вирионов
Даже если вирусный капсид состоит только из специфичных в отно-
шении вируса антигенов, во внешней оболочке вириона (если она у него
имеется) могут содержаться антигены, специфичные в отношении клетки-
хозяина. Так, например, частицы вируса гриппа из культуры, выращен-
ной на аллантоисе куриного эмбриона, в отличие от частиц того же ви-
руса из легочной ткани можно агглютинировать антисывороткой к аллан-
тоисной жидкости, но не антисывороткой к легким мыши, и наоборот
[462]. Предполагается, что при сборке вириона антигены клеточной мемб-
раны взаимодействуют с вирусными антигенами, в результате чего и об-
разуется внешняя оболочка вириона. Группоспецифический антиген кро-
ви— В, типичный клеточный антиген, включается в состав вирионов ви-
руса парагриппа, выращенных на почечных клетках макак-резусов [392].
Однако предстоит еще выяснить, не является ли артефактом обнаружен-
ное в этих исследованиях включение клеточных антигенов в состав ви-
риона или оно действительно отражает один из истинных аспектов ме-
ханизма сборки вирионов вирусов этой группы.
Клеточные вирусоспецифичные антигены
Заражение.опухолеродными вирусами ведет к конверсии или транс-
формации некоторой части содержащихся в культуре клеток в опухоле-
вые клетки. В этих опухолевых клетках содержатся антигены, отсутст-
вующие в нетрансформированных клетках и не дающие перекрестных ре-
акций с антигенами вирионов [304, 873, 874]. Индуцированные вирусом
антигены этого типа были выявлены при помощи реакции связывания
комплемента или тестов на приживаемость трансплантата или толеран-
Хогенность. В основе первого из упомянутых тестов лежит способность
организма изологичной взрослой мыши отторгать трансплантат, пред-
ставляющий собой трансформированные клетки, полученные от мыши
той же чистой линии, в основе второго — индукция аналогичным транс-
плантатом толерантности у новорожденного животного.
Один и тот же вирус, например вирус полиомы или вирус SV-40,
всегда индуцирует одни и те же клеточные вирусоспецифичные антигены,
независимо от штаммовых или видовых различий клеток, подвергшихся
трансформации. Вопрос об отношении индуцируемых вирусом антигенов
этого типа к явлению трансформации будет рассматриваться в гл. XVI.
МЕДИЦИНСКИЕ АСПЕКТЫ СЕРОЛОГИИ ВИРУСОВ ЖИВОТНЫХ
Наиболее важными областями медицинской вирусологии, в которых
широко используются серологические методы изучения вирусов, являют-
ся диагностика и профилактика вирусных заболеваний. В основе диагно-
стики вирусных инфекций лежит выявление специфических противови-
русных антител в сыворотке крови и серологическая характеристика ви-
руса, выделенного из больного организма. Вновь выделенный вирус
может оказаться известным штаммом, новым штаммом уже известного
вируса или вообще новым вирусом.
После некоторых вирусных заболеваний, например после кори или
ветряной оспы, организм приобретает стойкий иммунитет, часто сохра-
няющийся на всю жизнь. Стойкость иммунитета, приобретаемого в ре-
s’
116
Глава VI
зультате упомянутых заболеваний, наводит на мысль, что различные
штаммы вирусов, вызывающих эти заболевания, мало отличаются друг
от друга в антигенном отношении. Следует, однако, подчеркнуть, что
механизм, ответственный за стойкий противовирусный иммунитет, ясен
не до конца, ибо часто наблюдаются расхождения между уровнем цирку-
лирующих антител и степенью иммунитета. Неоднократно наблюдавшие-
ся случаи приобретения стойкого противовирусного иммунитета лицами,
страдающими агаммаглобулинемией, вследствие генетически детермини-
рованной неспособности их организма синтезировать антитела наводят
на мысль, что в формировании противовирусного иммунитета определен-
ную роль могут играть какие-то механизмы клеточной резистентности
[284].
Во всяком случае, антитела к вирусам могут выявляться в организ-
ме в течение очень длительного времени после выздоровления. Остается,
однако, неизвестным, связано ли столь длительное присутствие антител
в крови со столь же длительным присутствием вируса в каких-то клетках
организма. Не выяснен по сей день и более общий вопрос: необходимо ли
вообще для присутствия какого-либо антитела столь же длительное при-
сутствие антигена в организме [423].
Однако после некоторых вирусных заболеваний приобретенный им-
мунитет теряется очень скоро, несмотря на то что циркулирующие ан-
титела могут выявляться в течение весьма длительного времени после
выздоровления. В этих случаях решающей причиной является изменчи-
вость вируса. По-видимому, благодаря естественному отбору, происходя-
щему при распространении в популяции чувствительных организмов раз-
личных антигенных мутантов вируса, через довольно частые промежутки
времени появляются новые штаммы вируса, четко отличающиеся друг
от друга по серологическим свойствам. Быстрое выявление и выделение
новых штаммов вируса является обязательной предпосылкой приготов-
ления вакцин для профилактики таких инфекций. Еще более ограниче-
ны возможности успешной вакцинации против вирусов, вызывающих
кратковременные вспышки заболеваний, например против риновирусов.
По-видимому, каждая вспышка инфекции в этом случае вызывается
штаммами вируса, отличающимися по своим серологическим свойствам
[863].
Поучительная ситуация была обнаружена при изучении вируса грип-
па А [232]. В течение нескольких десятилетий, прошедших после откры-
тия этого вируса, возникновение новых антигенных вариантов вируса
гриппа А шло так быстро, что в настоящее время известны уже четыре
отчетливых антигенных «семейства» этого вируса: вирус гриппа свиней,
вирус гриппа А, вирус гриппа А1 и вирус гриппа А2, называемый также
азиатским вирусом гриппа. Каждое из этих антигенных семейств ответст-
венно за определенную эпидемию гриппа. Так, например, большая пан-
демия 1918—1920 гг. была, вероятно, вызвана штаммами вируса гриппа
свиней, а пандемия, разразившаяся в период 1960 г., была вызвана появ-
лением азиатского штамма. Напротив, вирус гриппа В лишь незначитель-
но изменил свою антигенную структуру в период между 1940 и 1960 гг.
Вакцинация
Целью вакцинации является индукция иммунитета к соответствую-
щему заболеванию. У людей состояние иммунитета обычно выявляют
путем определения титра циркулирующих антител. У подопытных жи-
вотных напряженность иммунитета и иммуногенность вакцины может
быть проверена путем непосредственного введения вируса.
Серологические свойства вирусов
117
Живые вакцины обычно готовят из мутантных, вызывающих заболе-
вание штаммов вируса, обладающих ограниченной патогенностью, но до-
статочной иммуногенной активностью. Вакцинация подобными штамма-
ми вирусов вызывает заболевание в легкой форме, как, например, в слу-
чае вакцинации против оспы по методу Дженнера путем введения вируса
осповакцины. После введения живой вакцины может и вовсе не наблю-
даться появления каких-либо симптомов заболевания. Например, при
пероральной вакцинации против полиомиелита по Сэбину с использова-
нием живого штамма [709] никаких симптомов заболевания не наблюда-
ется. Размножение вируса в тканях организма приводит к повышению
уровня соответствующих антител. Иногда необходимой концентрации за-
щитных антител удается достичь только после многократного введения
вакцины. Часто, однако, для формирования стабильного иммунитета, со-
храняющегося в течение многих лет, бывает достаточно однократного
введения вакцины. В качестве примера можно привести вакцинацию
против оспы. Повторное введение вакцины через определенные интерва-
лы времени вновь индуцирует иммунологическую реакцию и приводит к
увеличению концентрации антител (так называемый вторичный ответ).
Убитые вакцины представляют собой препарат инактивированного
вируса. При вакцинации убитой вакциной иммунологическая реакция ин-
дуцируется только вводимой дозой антигена, ибо увеличения количества
антигена из-за отсутствия размножения вируса в этом случае не наблю-
дается. Поэтому при вакцинации убитым вирусом обычно приходится
вводить значительно большие количества вируса, чем при вакцинации
живой вакциной. Преимуществом убитых вакцин является возможность
использования для иммунизации вирулентного штамма вируса, более
близкого по серологическим свойствам к вирусу, против которого необхо-
димо создать иммунитет. Часто, как при вакцинации живыми, так и при
вакцинации убитыми вакцинами приходится использовать смесь различ-
ных штаммов вируса. Например, убитая вакцина против полиомиелита
представляет собой смесь соответствующих штаммов трех основных ти-
пов вируса полиомиелита [714].
Вне зависимости от типа вакцины при вакцинации всегда приходит-
ся решать две группы проблем, которые связаны с необходимостью по-
лучения препарата, обладающего достаточной иммуногенностью, но в то
же время достаточно безопасного для вакцинируемого организма. Имму-
ногенность вакцины определяется экспериментально: при вакцинации
людей — путем определения способности вакцин индуцировать появле-
ние достаточного уровня нейтрализующих антител; при вакцинации жи-
вотных — путем наблюдения за результатом инокуляции активного ви-
руса. В некоторых случаях при интерпретации полученных результатов
могут возникнуть трудности, например из-за отсутствия соответствия
между уровнем циркулирующих антител и степенью иммунитета, о чем
уже упоминалось выше, или из-за невозможности использовать резуль-
таты, полученные при вакцинации животных одного вида, при работе с
животными другого вида.
Проблемы обеспечения* безопасности при разработке живых и уби-
тых вакцин решаются по-разному. Имея дело с живыми вакцинами, не-
обходимо контролировать возможность реверсии слабо патогенных
штаммов в более вирулентные. В случае вируса полиомиелита, напри-
мер, для проверки реверсии вакцинных штаммов в вирулентные и отбора
вакцин, не дающих измеримой реверсии, была использована большая
чувствительность к нагреванию (в отношении интенсивности размноже-
ния) вакцинных штаммов, чем вирулентных [548]. При разработке уби-
тых вакцин возникают проблемы, связанные с установлением полноты
отсутствия живого вируса в инактивированных препаратах и изыска-
1)8
Глава VI
нием достаточно мягкого метода инактивации, обеспечивающего получе-
ние полностью неинфекционного препарата, сохраняющего в то же время
необходимую иммуногенную активность. В идеале с помощью такого ме-
тода, используемого для получения вакцины, должен быть создан препа-
рат, обеспечивающий индукцию иммунитета, максимально приближаю-
щегося к естественному, и в то же время не обладающий инфекцион-
ностью.
Проблема доказательства полного отсутствия живого вируса в
больших количествах вакцины, необходимых для массовой вакцинации,
была детально изучена исследователями, разработавшими вакцину про-
тив полиомиелита, и предприятиями, осуществившими ее массовое из-
готовление. Важным теоретическим аспектом этой проблемы является
степень надежности методов определения выживаемости вируса, что осо-
бенно важно в тех случаях, когда определение условий, обеспечивающих
полную гибель вируса, производится путем экстраполяции эксперимен-
тально найденной скорости инактивации ([255]; см. также гл. VII). Сле-
дует также остерегаться возможной реактивации вируса, которая может
произойти как вследствие удаления связанных с вирусом реагентов, так
и при множественном заражении клеток.
Еще одной опасностью, которую следует иметь в виду, является воз-
можность присутствия в вирусных вакцинах посторонних патогенных
агентов. Вакцина может оказаться загрязненной бактериями (например,
стафилококками, которые часто вызывают затруднения при изготовлении
вакцины против оспы) или какими-либо посторонними вирусами. Живые
вирусные вакцины, получаемые на тканевых культурах, могут оказаться
зараженными PPLO, ибо эти микроорганизмы часто содержатся в ткане-
вых экстрактах и быстро размножаются в культивируемых клетках [327].
Может случиться и так, что даже инактивированные вакцины ока-
жутся загрязненными живыми патогенными агентами, что наблюдается
в тех случаях, когда посторонние патогенные агенты более устойчивы к
используемому инактивирующему воздействию, чем вакцинный вирус.
Особенно опасны в этом отношении споры бактерий и посторонние ви-
русы. В качестве примера можно привести обнаружение в культурах
тканей обезьян, ранее использовавшихся для получения вакцины против
полиомиелита, небольшого ДНК-содержащего вируса (SV-40), обла-
дающего онкогенными свойствами [836].
Ясно, что выбор вакцин, методы их приготовления и даже решение
об осуществлении любой программы вакцинации должны производиться
с учетом не только всех уже известных возможных осложнений, но и та-
ких, причины которых в настоящее время предвидеть не представляется
возможным. Любое решение о вакцинации, в особенности в случае мас-
совой вакцинации против относительно легких эпидемических заболева-
ний, может быть принято лишь на основе правильного взвешивания от-
носительной значимости -соответствующих медицинских, санитарных и
социальных факторов.
Иммунологическая толерантность при вирусной инфекции
Иммунологической толерантностью называется явление, при кото-
ром животное, получившее антиген во время внутриутробного развития
или немедленно после рождения, становится неспособным образовывать
антитела к данному антигену [79, 580]. Предполагают, что именно этот
механизм лежит в основе того, что организм животного не образует ан-
тител против своих собственных белков и других антигенов, аналогичных
по антигенной специфичности белкам его организма (механизм, отличаю-
щий «свое» от «чужого» [115]).
Серологические свойства вирусов
119
В качестве поучительного примера влияния иммунологической толе-
рантности на течение вирусного заболевания можно привести лимфоци-
тарный хориоменингит. При этом заболевании, встречающемся главным
образом у мышей, отмечаются воспалительные изменения в центральной
нервной системе, синтез активного вируса в мозгу и образование ней-
трализующих антител. Трауб [857] обнаружил, что у мышей, зараженных
этим вирусом сразу после рождения, не появляются симптомы заболева-
ния, а возникает толерантность к повторной инфекции. Однако толерант-
ные самки могут передавать заболевание детенышам во время их внут-
риутробного развития.
Для характера реакции на заражение решающее значение, по-ви-
димому, имеет время введения вируса, т. е. был ли вирус введен до или
после первой недели внеутробной жизни, когда организм мыши стано-
вится способным отвечать на введение антигена индукцией иммунитета,
а не образованием толерантности. Новорожденные животные или жи-
вотные, инфицированные во время внутриутробного развития, становят-
ся вирусоносителями, но их организм не вырабатывает нейтрализующих
антител и не реагирует воспалительной реакцией на присутствие вируса.
У мышей, зараженных в возрасте одной недели или в более старшем воз-
расте, возникает заболевание с симптомами воспаления, и их организм
образует нейтрализующие антитела. Облучая таких мышей рентгенов-
скими лучами или вводя им кортизон, т. е. применяя воздействия, пре-
дупреждающие развитие иммунологической реакции, можно пресечь
развитие заболевания [371].
Следовательно, животные, инфицированные при рождении, становят-
ся толерантными к вирусу и теряют способность реагировать на вирус-
ный антиген иммунологической реакцией. Очевидно, что за симптомы
этого заболевания ответственны поражения, вызываемые не размноже-
нием вируса, а иммунологической реакцией на вирусный антиген. Пред-
стоит, однако, выяснить, вызываются ли симптомы заболевания имму-
нологической реакцией, направленной непосредственно на вирус или на
какие-то индуцируемые вирусом клеточные антигены.
Глава VII
ДЕЙСТВИЕ ФИЗИЧЕСКИХ И ХИМИЧЕСКИХ ФАКТОРОВ
НА ВИРИОНЫ
ПОВРЕЖДЕНИЕ ВИРИОНОВ
Как уже обсуждалось в предыдущих главах, любой вирион пред-
ставляет собой морфологическую структуру, состоящую из «ядра»—ну-
клеиновой кислоты — и окружающего его белкового капсида. Некоторые
вирионы, кроме того, обладают еще дополнительными внешними оболоч-
ками. Нуклеиновая кислота представляет собой геном вируса. Она де-
терминирует процесс репликации вируса в клетке-хозяине, в том числе и
белков его оболочки, обусловливая, таким образом, способность вируса
проникать в те или иные клетки. Внешние оболочки и капсид являются
защитными структурами, но играют также роль и в инициировании ви-
русной инфекции. Результат воздействия того или иного физического
или химического агента на вирус определяется тем, какие химические из-
менения данный агент вызывает в компонентах, из которых состоит ви-
рион. Наблюдаемым экспериментатором выражением этих изменений
является либо изменение инфекционного титра вируса, либо изменение
его физических свойств, либо более тонкие изменения его химического
состава. Часто наблюдается селективное изменение свойств вирионов,
например потеря инфекционности при сохранении антигенности или се-
рологической активности, что может быть использовано в практических
целях, в частности при изготовлении вакцин. Потеря вирусом инфекци-
онных свойств может быть вызвана либо каким-то изменением вирусного
генома, что ведет к неспособности вируса продуцировать нормальное ви-
русное потомство, либо повреждением его оболочек, что приводит к не-
способности вируса прикрепиться к клетке или проникнуть в нее, а сле-
довательно, и инициировать репликацию вируса и его созревание. Ана-
лиз процесса взаимодействия инактивированных вирионов и клеток-хо-
зяев часто является полезным для понимания инфекционного процесса,
поскольку таким образом создается возможность для выявления специ-
фических стадий, на которых прекращается дальнейшее размножение
вирусов.
ВЛИЯНИЕ ХИМИЧЕСКИХ ФАКТОРОВ НА ВИРИОНЫ
Ферменты
В большинстве случаев вирионы исключительно устойчивы к дейст-
вию рибонуклеаз, дезоксирибонуклеаз и различных протеаз. Очевидно,
что нуклеиновая кислота интактных вирионов экранирована белком и
поэтому защищена от действия нуклеаз. Это обстоятельство широко ис-
пользуется при очистке вирусов от присутствующих в вирусных препара-
тах нуклеиновых кислот, которые удаляют путем воздействия нуклеаза-
ми на соответствующие препараты.
Активированный папаин инактивирует Х-вирус картофеля и некото-
рые другие вирусы растений, но не инактивирует ВТМ, вирус полиомие-
120
Действие физических и химических факторов
121
лита и бактериофаги. Более того, фаг, нейтрализованный антителами,
иногда удается реактивировать, воздействуя на него папаином.
Следует, однако, подчеркнуть, что воздействие протеолитических
ферментов на вирусы не сводится только к возможности инактивации их
инфекционных свойств. Так, например, карбоксипептидаза, не инактиви-
руя инфекционных свойств очищенного ВТМ, отщепляет в то же время
от его белка большую часть С-концевого треонина, что приводит к рез-
кому изменению серологических свойств вируса и его электрофоретиче-
ской подвижности. Таким образом, очевидно, что С-концевой треонин
субъединицы ВТМ (гл. V) в интактном вирионе легко доступен дейст-
вию фермента и не является необходимым для инициирования инфекции.
Возможны и другие химические изменения белка ВТМ без потери этим
вирусом инфекционности. Так, интенсивное ацетилирование аминогрупп
и йодирование сульфгидрильных групп не отражается на инфекционности
вирионов, однако йодирование тирозиновых остатков вызывает их ча-
стичную инактивацию [807].
Агенты и факторы, вызывающие денатурацию белка
Среди различных агентов и факторов, которые вызывают денатура-
цию белка, для изучения организации вирионов наиболее часто исполь-
зуют следующие: 1) синтетические детергенты, как, например, лаурил-
сульфат натрия; 2) мочевину и гуанидин, которые вызывают главным
образом разрыв водородных связей, и 3) высокие и низкие значения pH.
Различные вирусы обладают разной чувствительностью к действию
детергентов. Так, те вирусы, в состав внешних оболочек которых входят
липиды, а именно миксовирусы, арбовирусы, вирусы группы герпеса, лег-
ко инактивируются синтетическими детергентами, а также растворите-
лями липидов, например эфиром или хлороформом. Воздействие этих
веществ на вирионы приводит к их распаду. В результате в среду выхо-
дят внутренний капсид и нуклеиновая кислота в виде частиц различ-
ной степени агрегации. Дезинтеграция растворителями липидов приме-
няется как первый шаг при химическом фракционировании некоторых
вирусов [376, 492].
Мочевина или гуанидин, так же как и анионные детергенты или фе-
нол, могут быть использованы для дезинтеграции вирионов ВТМ и дру-
гих вирусов и освобождения интактной, часто обладающей инфекцион-
ностью нуклеиновой кислоты [229, 272]. Дезинтеграция детергентами мо-
жет быть ступенчатой; с помощью электронного микроскопа иногда
можно наблюдать частично депротеинизированные вирионы [319] или по-
врежденные частицы с изливающимися из вириона нитями нуклеиновой
кислоты. Напротив, воздействие щелочей на ВТМ приводит к отделению
белковых субъединиц различной степени агрегации [270]. Если эти бел-
ковые фрагменты смешать при pH 6 с очищенной интактной РНК ВТМ
или любого из мутантов этого вируса, то происходит реагрегация и вновь
образуются вирионы, обладающие относительно высокой инфекцион-
ностью (до 10% исходного титра) [230]. В генетическом отношении по-
томство этих вновь образованных вирионов, конечно, всегда напоминает
тот родительский штамм, РНК которого участвовала в процессе реагре-
гации, а не тот, который «поставлял» белок.
Если возникает необходимость получения вирусных компонентов в
интактной форме, то лучше использовать какой-либо иной разрушающий
вирус агент, а не мочевину. Хотя мочевина и обладает способностью
инактивировать ВТМ и некоторые фаги при концентрациях меньших,
чем вызывающие дезинтеграцию вирионов, она денатурирует белки при-
мерно с той же самой скоростью, что и разрушает вирусные частицы.
122
Глава VII
Было показано, что при воздействии мочевины на вирусы некоторые из-
менения белков наблюдаются даже у тех вирионов, которые еще сохра-
няют активность. Например, зависимый от триптофана штамм фага Т4
в результате воздействия мочевины становится независимым от этой ами^
нокислоты. Можно полагать, что за это изменение его свойств ответст-
венны изменения конформации белков, входящих в состав структур, осу-
ществляющих присоединение фага к поверхности бактерии [730]. Инте-
ресные данные были приведены Фрейфельдером [248]. Этот автор
наблюдал инактивацию вирионов фага и освобождение его ДНК при
воздействии на фаги перхлората натрия.
Окисляющие агенты
Перекиси инактивируют вирионы и иногда вызывают в них струк-
турные изменения. Обработка Т-четных фагов Н2О2 приводит к освобож-
дению их нуклеиновой кислоты [443]. Эффект, вызываемый Н2О2, а также
озоном и свободными радикалами, образующимися в воде под воздейст-
вием рентгеновских лучей (см. «Действие излучений»), возможно, связан
с какими-то окислительными изменениями в белках. Влияние этих аген-
тов существенно зависит от состава среды, усиливаясь при наличии сле-
дов металлов и ослабляясь при наличии посторонних белков. Восстанав-
ливающие агенты также оказывают сильное защитное действие против
перекисей.
Азотистая кислота обладает способностью инактивировать вирус и
вызывать у него мутации, в связи с чем и представляет особый интерес.
HNO2 дезаминирует нуклеотиды (при этом NH2-rpynna замещается на
гидроксил), преобразуя аденин в гипоксантин, цитозин в урацил, а гуа-
нин в ксантин [745]. Эти изменения приводят к инактивации вируса или
к неправильному спариванию оснований, в результате чего возникают
мутации. Как уже упоминалось выше (гл. V), мутанты ВТМ, образую-
щиеся вследствие обработки цельных вирионов или свободной нуклеино-
вой кислоты HNO2, сыграли особенно важную роль при изучении приро-
ды генетического кода [921].
Алкилирующие агенты, как, например, азотный аналог иприта и
иные этилирующие вещества типа этиловых эфиров этан- и метансуль-
фоновых кислот, также вызывают инактивацию и мутации вирусов. При
действии этилирующих агентов на нуклеиновые кислоты этилируется
главным образом углеродный атом гуанина, связанный с атомом азота в
положении 7 [52]. Этилированный гуанин затем отщепляется от полину-
клеотидной цепи, и если вместо него включается неправильное основа-
ние, может возникнуть мутация.
p-Пропиолактон, сильный алкилирующий и ацилирующий агент,
добавляют к биологическим материалам с целью освобождения их от ви-
русов (например, для разрушения вируса гепатита в сыворотке крови),
поскольку он быстро инактивирует многие вирусы, а затем и сам быстро
разрушается [448].
Формальдегид
Этот реагент имеет большое значение в связи с тем, что он легко инак-
тивирует вирионы, не вызывая в то же время заметного изменения их
антигенных свойств, что является весьма ценным при изготовлении вак-
цин [714]. Реакция формальдегида с вирусами весьма сложна. Этот реа-
гент может взаимодействовать со многими химическими группами (воз-
можно, что в реакции участвует его гидрат— метиленгликоль СН2(ОН)2).
Тот факт, что формальдегид подавляет инфекционность некоторых виру-
сов при любом pH среды, наводит на мысль, что в основе этого эффекта
Действие физических и химических факторов
123
лежит взаимодействие формальдегида с неионизированными группами
каких-то компонентов вируса. Быть может, в этом случае формальдегид
реагирует не с амино- и иминогруппами вирусного белка, а скорее с ами-
ногруппами и рибозными остатками его нуклеиновой кислоты [130].
In vitro НСНО легко реагирует с РНК или с одноцепочечной ДНК,
но не реагирует с двухцепочечными нуклеиновыми кислотами.
При изготовлении инактивированных вакцин воздействием на вирус
формальдегида, помимо необходимости исключить возможность присут-
ствия посторонних вирусов, устойчивых к этому реагенту, следует так-
же принимать в расчет относительную кинетику инактивации инфекци-
Фиг. 24. Кинетика инактивации вируса полиомиелита, тип 2 формальдегидом [255].
Черные кружки относятся к опытам, в которых обработанные формальдегидом образцы были диа-
лизованы перед исследованием на выживаемость. Для целей инактивации использовали ь-и—‘ М
НСНО плюс 2 10—глицин при pH 7.0 и температуре 25' При таких уело иях антигенная актив-
ность вируса уменьшалась примерно лишь на 10% в течение 10 дней.
онности и антигенности. На конечный результат влияют время, концен-
трация реагента и условия проведения реакции. Уменьшение антигенно-
сти определить точно гораздо труднее, чем уменьшение инфекционности,
однако вполне возможно значительно уменьшить инфекционный титр без
потери антигенности. При промышленном производстве вакцин приходит-
ся иметь дело с очень большими количествами вируса, и гарантировать
полное отсутствие инфекционности во всем объеме получаемой партии
вакцины очень трудно. Например, для инактивации 10 миллионов доз
вакцины против полиомиелита, в каждой из которых содержится 106 ин-
фекционных единиц вируса, необходимо гарантировать относительное
уменьшение инфекционности, значительно большее, чем 1013. Очевидно,
что такой результат можно обеспечить, лишь тщательно изучив кинетику
инактивации.
Экспоненциальная зависимость
(VII. 1)
выражающая относительное количество обладающего инфекционностыо
вируса как функцию времени t и концентрации инактивирующего соеди-
нения С (k и п—константы), часто оказывается справедливой только
для первой части кривой инактивации. При инактивации вируса фор-
мальдегидом величина п равна приблизительно 1 ^реакция первого по-
рядка). Однако было обнаружено, что по ходу инактивации остаточная
124
Глава VII
инфекционность часто становится все более и более устойчивой к дейст-
вию инактивирующего агента (фиг. 24). Гард [255] нашел, что для вируса
полиомиелита экспериментальные данные достаточно точно описываются
уравнением
10g (Уо/у) = «log (1 + bt),
и предположил, что вирусная популяция может быть неоднородной по
своей чувствительности к формальдегиду. Он полагает, что в основе этой
неоднородности лежит не генетическая или фенотипическая гетероген-
ность вируса, а скорее так называемый мембранный, или «таннизирую-
щий», эффект. Он считает, что в тех случаях, когда воздействие фор-
мальдегидом не приводит к инактивации вируса, оно уменьшает чувст-
вительность к дальнейшему воздействию этого реагента, так как упоми-
навшийся выше эффект, вызывающий изменение структуры белка кап-
сида, приводит к уменьшению способности формальдегида достичь нук-
леиновой кислоты вириона.
ВЛИЯНИЕ ФИЗИЧЕСКИХ ФАКТОРОВ НА ВИРИОНЫ
Нагревание
Большинство вирусов в случае, когда они содержатся в исходных
тканевых экстрактах или суспендированы в средах, содержащих доста-
точно сложные органические соединения, как правило, вполне устойчивы
при комнатной температуре. Уменьшение инфекционности таких препа-
ратов вируса удается обнаружить лишь при их инкубации при темпера-
турах порядка 50—60°. Очевидно, что это именно та область температур,
при которых денатурация многих белков идет с уже заметной скоростью.
Существуют, однако, и различия между разными вирусами в отношении
чувствительности к температуре. Так, некоторые из них, как, например,,
вирус табачной мозаики, практически стабильны при 65° и заметно инак-
тивируются лишь при температуре около 70°, тогда как другие вирусы
быстро разрушаются при гораздо более низких температурах. Вирус
гриппа, как и другие чувствительные к эфиру вирусы, например вирус
герпеса, чувствительны также и к нагреванию.
Вирус желтухи астр инактивируется в насекомом-переносчике при
32° Зараженные этим вирусом растения можно вылечить путем содержа-
ния их в теплых комнатах [481]. Однако для подобной же инактивации в
организме хозяина ситуация может быть и совсем иной.
Начальная скорость инактивации вирионов при различных темпера-
турах подчиняется экспоненциальной зависимости. Отношение вирусной
активности V к начальной активности Vo уменьшается с увеличением
времени экспозиции t в соответствии с уравнением
VIV0 = e~kTt,
где kT — константа скорости инактивации, зависящая от температуры.
С увеличением времени экспозиции часто наблюдаются отклонения от
этой зависимости. Характер инактивации некоторых вирусов при различ-
ных температурах представлен на фиг. 25.
Экспоненциальный характер инактивации первого порядка, вызы-
ваемой нагреванием, означает, что в каждую единицу времени воздейст-
вию химического инактивирующего агента подвергается постоянная доля
вирионов и что для инактивации вириона достаточно одного акта такого
воздействия. Такого рода кинетическая зависимость интерпретирована
в том смысле, что участвующие в реакции молекулы представляют собой
популяцию молекул с различной энергией и что в наблюдаемой реакции
Действие физических и химических факторов
125
могут участвовать (с данной вероятностью) только те молекулы, кото-
рые обладают определенной энергией активации, характерной для дан-
ной реакции. С увеличением температуры доля активированных молекул
увеличивается.
Зависимость скорости реакции Кт от абсолютной температуры Т
•описывается уравнением Аррениуса
KT = Ae~ElR1, (VII. 2)
где R — газовая постоянная (1,987 кал1моль1°С), А — константа, харак-
терная для данной реакции, и Е — энергия активации *. Энергия актива-
ции, необходимая для тепловой инактивации большинства вирусов, вы-
сока и составляет величину порядка 30 000—150 000 кал/моль. Такая
Фиг. 25. Инактивация вирусов нагреванием.
Л. Инактивация фага Т5 в бульоне при различных температурах. Б. Инактивация вирусов растений
® растительном соке, / —вирус кольцевой пятнистости табака, 50°; // — вирус табачной мозаики, 90°;
/// — вирус некроза табака, 86°; /V —вирус мозаики люцерны, 62,5°.
высокая энергия активации соответствует большому значению Qi0 (отно-
шение величин скоростей реакции при температурах, отличающихся на
10°С), что означает быстрый переход от области стабильности к области
инактивации.
1 Такая кинетика, характерная для мономолекулярной реакции, объясняется тем, что
скорость, с которой реагируют активированные молекулы, мала по сравнению со ско-
ростью, при которой устанавливается равновесие между молекулами с различными энер-
гиями, так что в каждый момент времени доля молекул с энергиями, превышающими
энергию активации, постоянна. Таким образом, скорость реакции определяется долей
молекул, энергия которых равна энер!ии активации, необходимой для протекания дан-
ной реакции, или превышает ее. Зависимость скорости реакции от температуры выра-
жается в соответствии с теорией абсолютных скоростей реакций [278] уравнением
кт = —e-lF*IRT =kle-<AH*-TbS*)IItT = ^1е-(Д£*4-РДИ*-ГД5»)/₽Г (VII. 3)
h h h
Это уравнение выражает кинетику двух реакций, в одной из которых (обратимой)
исходные молекулы становятся активированными, а в другой — активированные моле-
кулы претерпевают химическое изменение. В уравнении (VI 1.3) k и h—постоянные Боль-
цмана и Планка; АГ*, ДЯ* и Д5*— изменения свободной энергии, общей энергии и
энтропии в реакции активации [ДЯ* соответствует Е в уравнении (VI 1.2)]; ДЯ*— изме-
нение энергии при постоянном давлении; Р — давление; Дк*— изменение объема при
реакции активации. Уравнение (VI 1.3) объясняет, почему даже реакции с высокой энер-
гией активации могут протекать быстро, если активация сопровождается большим уве-
личением энтропии, так что общее изменение свободной энергии мало. Изучение скоро-
стей реакции при различных давлениях дает информацию об изменениях молекулярного
объема, что имеет место при переходе в активированное состояние.
126
Глава VII
Тепловая инактивация некоторых вирусов сопровождается потерей
их антигенных свойств. Так, например, вирионы ВТМ разрушаются при
нагревании и при этом освобождается нуклеиновая кислота; белок де-
натурирует и коагулирует, а РНК остается инфекционной. Мелкие ква-
зисферические вирусы, как, например, вирус кустистой карликовости
томата, вирус некроза табака и вирус полиомиелита, инактивируются
при более низких температурах, но при этом они не разрушаются и не
теряют своей серологической специфичности. Тепловая инактивация, од-
нако, не пригодна для приготовления вакцин, так как при этом трудно
достичь полной стерилизации.
Чувствительность вирионов к нагреванию сильно зависит от Свойств
среды, в которой суспендированы вирусы. Очищенные препараты виру-
сов часто в значительно большей степени чувствительны к нагреванию,
чем неочищенные. Такое различие объясняется тем, что очищенный ви-
рус более чувствителен к воздействию окисляющих агентов, кстати,
в свою очередь также чувствительных к температуре. Иногда причиной
потери инфекционности является денатурация специфического вирусно-
го белка, вызванная нагреванием, которая может зависеть от влияния
факторов окружающей среды; например, фаг Т5 (но не его устойчивые
к нагреванию мутанты) быстро инактивируется при 37° в отсутствие ди-
валентных катионов и полностью стабилизируется в присутствии 10-3 Af
СаС12 или 10-2 М MgCl2 [10].
Механические и другие воздействия
Сильные встряхивания, как, например, в гомогенизаторе Уоринга,
оказывают на вирионы обычно меньшее влияние, чем изменения поверх-
ностного натяжения. Весьма интересным является разрушение вирионов
фага, локализующихся в белковой пленке, образующейся на границе
раздела воздух — вода. Это явление было использовано для изучения
фаговой ДНК с помощью электронного микроскопа (фото 35) [457].
Резкие изменения осмотического давления, которые наблюдаются,
например, при перенесении вирионов из 4 М раствора КС1 в воду, вызы-
вают разрушение вирионов некоторых фагов [21]. Можно наблюдать воз-
никновение и устойчивых к осмотическому давлению мутантов, причем
их появление коррелирует с изменениями белков капсида [101]. В общем
же вирионы большинства вирусов вполне устойчивы к резким изменени-
ям осмотического давления.
Обработка ультразвуком (в течение нескольких минут с частотой
10 000—20 000 кгц) приводит к разрушению вирионов таких вирусов, как
ВТМ, имеющих палочкообразную форму, или фаг Т2, для которого ха-
рактерно наличие отростка, обладающего жесткой структурой, но отно-
сительно слабо действует на квазисферические вирионы и может исполь-
зоваться для разрушения агрегатов вирионов.
Некоторые вирусы, например фаг Т1 и мелкие РНК-содержащие
фаги, переносят высушивание при комнатной температуре лучше, чем
многие другие вирусы, которые при этом легко инактивируются. Многие
вирусы очень хорошо сохраняются в лиофилизированном состоянии. Еще
лучше вирусы сохраняются в сыворотке крови или в среде, содержащей
глицерин, при температуре —70°, особенно в атмосфере СО2.
ДЕЙСТВИЕ ИЗЛУЧЕНИЙ
Излучения занимают особое место среди физических факторов, дей-
ствующих на вирусы. Чтобы пояснить, в чем состоит эта особенность, нам
придется коснуться некоторых элементов радиобиологии [493].
Действие физических и химических факторов
127
Прежде всего рассмотрим электромагнитные излучения, т. е. инфра-
красные, видимые, ультрафиолетовые, рентгеновские и у-лучи; все эти
типы излучения отличаются друг от друга только длиной волны. Излу-
чение имеет двойственный характер, проявляя себя, с одной стороны,
как волна, а с другой — как поток дискретных пакетов, или квантов,
энергии. Энергия кванта Е (в электронвольтах) связана с длиной вол-
ны % (в ангстремах) соотношением Е= 12 400/Х. Так, у ультрафиолето-
вых лучей с длиной волны 2537 А, испускаемых ртутными («бактерицид-
ными») лампами низкого давления, энергия кванта равна 4,9 эв. Квант
рентгеновских лучей с длиной волны 0,1 А составляет 124 000 эв.
Таким образом, при облучении вещество бомбардируется потоком
квантов. Все радиационные эффекты обусловлены поглощением энергии
излучения и зависят от энергии квантов и природы поглощающего ма-
териала. Если энергия квантов достаточно велика (порядка 10 эв или бо-
лее), то под действием излучения из атома может быть выбит электрон,
что приводит к химическому изменению вещества—превращению ато-
ма в положительно заряженный ион. Этот процесс называется иониза-
цией. К излучениям, способным вызвать такой эффект (так называемые
ионизирующие излучения), относятся рентгеновские и у-лучи.
Электроны, выбитые из атомов под действием излучения, обычно об-
ладают достаточной энергией, чтобы вызывать ионизацию других ато-
мов; этот процесс продолжается до тех пор, пока вся энергия первичных
электронов не истощится. Выбитые электроны в конце концов захваты-
ваются другими атомами, в результате чего образуются отрицательные
ионы; таким образом, каждый акт ионизации сопровождается возникно-
вением одной пары ионов. Молекула, из которой выбит электрон, может
подвергнуться химическому изменению вследствие перестроек ее элек-
тронных оболочек, причем вероятность такого изменения весьма высока.
Корпускулярные излучения — р-частицы (быстрые электроны),
а-частицы, протоны, дейтроны — действуют подобно быстрым электро-
нам, выбиваемым из атомов при бомбардировке рентгеновскими лучами.
Основное различие состоит в величине плотности ионизации вдоль сле-
дов частиц. Более тяжелые частицы вызывают так называемую «колон-
ную» ионизацию: их следы очень плотны вследствие многочисленных ак-
тов ионизаций, вызываемых вторичными электронами (б-электроны)
Нейтроны, не имеющие электрического заряда, проявляют свое дейст-
вие косвенно, образуя вторичные протоны и электроны.
У ультрафиолетовых, видимых и инфракрасных лучей энергия кван-
тов недостаточна для ионизации вещества. Такие неионизирующие излу-
чения способны вызвать только возбуждение, т. е. поднимать электроны
на более высокие энергетические уровни. Возникающие при этом пере-
стройки электронных оболочек также могут приводить к химическим
изменениям, но со значительно меньшей вероятностью, чем в случае
ионизации, так как большинство возбужденных молекул возвращается
в невозбужденное состояние, не претерпевая никаких химических изме-
нений, и основная часть поглощенной энергии рассеивается в виде тепла.
Возбуждение вызывают, конечно, и ионизирующие излучения; примерно
половина энергии жестких рентгеновских лучей расходуется таким об-
разом.
Важнейшее различие между ионизирующим и неионизирующим из-
лучениями состоит в том, что ионизирующее излучение поглощается не-
селективно, т. е. всеми атомами и молекулами вещества. Вероятность
ионизации атома обычно не зависит от его окружения; так, поглощение
рентгеновских лучей зависит только от плотности вещества и порядко-
вого номера атомов, входящих в его состав (т. е. от числа электронов
на единицу объема). Поглощение же ультрафиолетовых и видимых лу-
128
Глава VII
чей зависит от химического состава объекта. Кванты этих излучений по-
глощаются только теми электронами, энергия возбуждения которых
соответствует энергии кванта; при поглощении ультрафиолетовых и види-
мых лучей органическими соединениями возбуждаются главным обра-
зом валентные электроны. Например, значительное поглощение ультра-
фиолета нуклеиновыми кислотами связано с возбуждением л-электро-
нов их пуриновых и пиримидиновых колец.
Фиг. 26. Ультрафиолетовые спектры поглощения.
/ — бактериофаг Т2; // — вирус табачной мозаики; /// — рибонуклеиновая кислота; /V —бычий сы-
вороточный глобулин. Оптическая плотность в области выше 320 ммк обусловлена рассеянием света.
Обратите внимание на сходство между спектром нуклеиновой кислоты и спектром фага, который
содержит около 40% нуклеиновой кислоты. В спектре вируса табачной мозаики, содержащего 94%
белка, отчетливо видно поглощение, обусловленное белками.
Спектры поглощения некоторых объектов в ультрафиолетовой обла-
сти изображены на фиг. 26. Видимый свет поглощается только окрашен-
ными веществами; обычно он менее эффективен в индуцировании хими-
ческих изменений, чем ультрафиолет, ибо его квант составляет не более
3,1 эв, или 70 ккал, т. е. меньше энергии диссоциации большинства ко-
валентных связей в веществах органического происхождения.
Таким образом, характерным результатом поглощения излучения
является образование возбужденных или ионизированных атомов и мо-
лекул. Поскольку процесс поглощения носит локальный характер, хи-
мические изменения возникают в отдельных дискретных участках объек-
та. Следовательно, в разных местах вирусной частицы могут продуциро-
ваться различные повреждения, приводящие к утрате свойств вируса.
Таким образом, излучение как бы является хирургическим инструмен-
том, пользуясь которым можно воздействовать на различные функции
вириона.
Ионизирующие излучения
При действии ионизирующего излучения на биологический объект
оно может поглощаться либо непосредственно самими биологическими
молекулами (первичные фотохимические реакции), либо средой; в по-
следнем случае излучение действует на объект косвенно, через посредст-
во веществ, образующихся под его влиянием в среде (вторичные эффек-
Действие физических и химических факторов
129
ты). Косвенное действие излучения на вирионы обнаруживается по
более высокой скорости инактивации вирионов, суспендированных в вод-
ных или солевых растворах, чем содержащихся в неочищенных препа-
ратах (фиг. 27), и обусловлено короткоживущими радикалами [Н] и
[ОН], образующимися из молекул воды и сравнительно стабильных вто-
ричных продуктов, как, например, перекиси. Эти вторичные эффекты
можно изучать на системах, образуемых при добавлении вируса к об-
лученной воде [890]. Действие радикалов и перекисей на вирионы факти-
Фиг. 27. Инактивация бактериофагов рентгеновскими лучами либо в питательном бульо-
не (прямое действие), либо в фосфатном буфере (прямое и косвенное действие) [890].
Мощность дозы рентгеновских лучей составляет 80 000 г/час.
чески может быть различным; так, фаг Т2, инактивируемый облученной
водой, сохраняет способность адсорбироваться на бактериях, но теряет
эту способность при облучении его в воде.
Белки и восстанавливающие агенты, как, например, тиомочевина,
защищают вирионы от косвенного действия излучения и уменьшают
скорость инактивации до какого-то остаточного уровня, ниже которого
защитить вирусы от действия излучения в принципе невозможно. Этот
уровень чувствительности сходен с чувствительностью к инактивации в
сухом состоянии, уровень которой определяется в свою очередь ско-
ростью инактивации, за которую ответственно прямое поглощение излу-
чения вирионом [540].
Инактивация, обусловленная прямым действием излучения, обычно
подчиняется экспоненциальному закону
= (VII. 4)
где V — конечный титр вируса; Vo — исходный титр и D — доза излуче-
ния. Эта прямая инактивация представляет собой истинную фотохими-
9 Заказ № 1214
130
Глава VII
ческую реакцию. Она не зависит от температуры и по закону Бера за-
висит только от дозы излучения D, а не от продолжительности облуче-
ния (репаративные процессы в этом случае отсутствуют).
Если доза излучения измеряется в рентгенах \ соответствующих
числу актов ионизации на единицу объема, то константа k имеет раз-
мерность объема.
Уравнение (VII.4) показывает, что каждый вирион инактивируется
в результате одного независимого события, или удара, вероятно, в ре-
зультате одного акта ионизации. При дозе Р//Одля которой V/VQ = e-1
(около 37% выживаемости), Wi/e = l. При такой дозе каждый вирион
подвергается в среднем одному инактивирующему удару. Чтобы быть
эффективным, удар должен произойти в какой-то чувствительной области
вируса — так называемой мишени. Теория, разработанная Ли [493] на
основе этого понятия, носит название теории мишени.
Таблица 14
Связь между чувствительностью вирионов к рентгеновским лучам (прямое действие)
и типом и количеством нуклеиновой кислоты вириона [435, 846, с изменениями]
Вирус Нуклеиновая кислота Средняя ле- тальная доза D,. . rad 1/е Эффектив- ность* (число инактивирую-*] щих ударов на акт ионизации)
количество в одном вири- оне, далъп он
Фаг R17 РНК 9 • Ю5 8,4 • 105 0,5
Вирус кольцевой пятнистости табака РНК 1,5 • 106 4,6 - 105 0,5
Вирус кустистой карликовости то- мата РНК 1,5 • 106 4,5 - 105 0,5
Вирус табачной мозаики РНК 2,С6 • 106 2,0 - 105 0,9
Вирус саркомы Рауса РНК 1,2 • IO? 2,0 - 105 0,15
Вирус ньюкаслской болезни РНК — 1,0 • 107 4,0 - 104 ~0,9
Фаг срХ174 ДНК, од- нсцепо- чечная 1,6 . 106 3,8 • ДР 0,6
Вирус папилломы Шоупа ДНК 5 • 106 4,4 - 105 0,17
Фаг Т7 ДНК 2,4 • 107 1,3 - 105 0,12
Фаг X ДНК 3,3 • 107 1,0 - 105 0,11
Аденовирус, тип 5 ДНК 2,3 • 107 7,0 - 10Q 0,23
Фаги Т2, Т4, Тб ДНК 1,3 • IO» 4,0 - 104 0,07
Вирус осповакцины ДНК 1,6-108 ~5 - 10< 0,05
• Эффективность е рассчитывается следующим образом: е — 3,7 • <где N ~ количество
нуклеиновой кислоты), ибо доза в 1 rad вызывает 2* 1012 актов ионизации в 1 г воды, что соответ-
ствует примерно 3.7* 10“ актам ионизации на 3,7- 10й дальтон вещества со средним атомным весом
нуклеиновых кислот.
Константа скорости инактивации k выражает объем, в котором
должен произойти один акт ионизации, или один удар. Это, следователь-
но, и есть объем мишени. Для потоков а-частиц или дейтронов доза D
может быть также измерена числом треков, приходящимся на 1 см2 по-
1 Один рентген (г) — это доза рентгеновских лучей или у-квантов, под действием
которой в 1 г воздуха возникает 1,61 10* * В * * * 12 пар ионов (это соответствует 83 эрг).
В 1 см3 воды или вещества со средней плотностью и составом, характерным для био-
логических объектов, под действием такой дозы г роисходит около 1,9* 1012 актов иони-
зации (93 эрг). Дозы а-частиц, протонов и нейтронов обычно вмражают в единицах
гер или rad. Последняя соответствует дозе, при которой 1 г вещества сообщается
100 эрг энергии; это соответствует 6- 1013 эв или примерно 2-Ю12 актов ионизации
па 1 г. Таким образом, дозы излучения, выраженные в единицах г, гер или rad, указы-
вают число актов ионизации, вызываемых излучением в единице объема.
Действие физических и химических факторов
131
верхности. Тогда k становится поперечным сечением мишени, пересекае-
мым при одном ударе. Объем мишени или ее поперечное сечение можно
затем сравнить с известным объемом вириона (или его компонентов),
чтобы определить чувствительную мишень.
Такой анализ очень прост. Его можно сравнить с экспериментом,
в котором производится много выстрелов наугад в мишень, которая из-
дает свистящий звук, когда удар приходится в яблоко мишени. По числу
выстрелов и числу услышанных свистков можно вычислить площадь яб-
лока мишени.
Если вирион действительно имел критическую «чувствительную об-
ласть», в пределах которой каждая ионизация вызывала инактивирую-
щее повреждение, то вычисленная величина мишени должна соответст-
вовать величине этой чувствительной области. Чувствительные объемы,
вычисленные таким образом для ряда вирусов, приблизительно соответ-
ствовали содержанию нуклеиновых кислот. Это говорит о том, что по-
вреждение нуклеиновой кислоты является действительно критическим
повреждением. Картина становится более ясной и очень интересной, если
сравнивать чувствительность к рентгеновским лучам различных вирусов,
принимая во внимание как тип, так и количество нуклеиновой кислоты
([846]; см. табл. 14). Оказывается, что для вирионов, содержащих одно-
цепочечную нуклеиновую кислоту (РНК или ДНК), эффективность инак-
тивации, обусловленной рентгеновскими лучами, т. е. число инактиви-
рующих повреждений (на ионизацию) в нуклеиновой кислоте, находится
в пределах между 0,5 и 1, тогда как для вирионов с двухцепочечной ДНК
эффективность ионизации лежит в пределах между 0,05 и 0,2.
Это удовлетворяет гипотезе, что почти каждая ионизация вызывает
разрыв в полинуклеотидной цепи. Такое повреждение является леталь-
ным для вирусов с одноцепочечной нуклеиновой кислотой, тогда как для
вирусов с двухцепочечной ДНК лишь небольшая часть разрывов в одной
цепи вызывает инактивацию. Обычно инактивация является следствием
разрывов обеих цепей, что случается значительно реже. Некоторые из
повреждений вирионов, которые возникают в результате воздействия на
них рентгеновскими лучами и приводят к их инактивации, могут быть
также вызваны химическими изменениями в пиримидиновых основаниях.
Такого типа повреждения можно ослабить, либо исключить вообще пу-
тем добавления цистеина в облучаемую среду [247].
Дальнейшее усовершенствование теории мишени состоит в сравне-
нии эффективностей излучений различной энергии, как, например, жест-
кие и мягкие рентгеновские лучи, нейтроны, дейтроны и а-частицы. Ис-
ходя из зависимости величины мишени от плотности ионизации, вызывае-
мой различными излучениями, можно рассчитать асимметрию мишени,
которая выражает отклонение ее поперечного сечения от поперечного
сечения сферы.
Помимо утраты инфекционности, можно также определить утрату
вирусом иных свойств, как, например, гемагглютинирующая способность,
серологическая специфичность или способность прикрепляться к клет-
кам-хозяевам. Для каждого из этих свойств может быть определена ве-
личина чувствительной мишени.
Этот вид анализа впервые был осуществлен Ли [493] и сравнитель-
но недавно с большой изобретательностью Поллардом [649, 650]. К со-
жалению, этот анализ оказался менее плодотворным, чем ожидалось,
отчасти потому, что он не дает однозначных результатов. Одно из огра-
ничений метода связано с лежащим в его основе допущением, согласно
которому каждый удар, наносимый непосредственно на (гипотетическую)
чувствительную мишень, оказывается эффективным, а все удары, попа-
дающие в области, находящиеся за пределами данной мишени, неэффек-
9*
132
Глава VII
тивны. Эту гипотезу трудно принять. Можно легко представить себе
вирион состоящим, скажем, из i частей, внутри каждой из которых иони-
зация с вероятностью pi способна вызвать химическую реакцию, приво-
дящую к потере инфекционности. Например, потеря инфекционности с
90-процентной вероятностью может быть вызвана ионизациями в ну-
клеиновой кислоте и с 20-процентной вероятностью— ионизациями в бел-
ке капсида. Характер инактивации тогда будет выражаться уравне-
нием V/V0 = e~~^kiPlD , которое для случая рг-, Pj, pk 0, 0 прини-
мает более простой вид: V/V0 = e-kD [уравнение (VII.4)] [535].
Реакция, обусловленная излучением, не всегда описывается уравне-
нием (VII.4). Иногда имеют место реакции многоударного типа, в об-
щей форме выражающиеся уравнением
= e-kD у (kD}n.. (VII. 5)
Pq Л=о л!
В этом уравнении предполагается, что для возникновения реакции
мишень должна получить не менее (х+1) удара. Теория многоударных
реакций разработана еще менее строго, чем теория одноударных реак-
ций.
Для исследования вирусов представляет интерес использование по-
токов очень мягких электронов, проникающая способность которых
зависит от их энергии. Инактивация может иметь место только тогда, ког-
да энергия электрона является достаточной для достижения им чувстви-
тельной мишени. Так, фаг Т1 инактивируется только такими электрона-
ми, которые могут проникать на расстояние 120 А [386], т. е. на величи-
ну, соответствующую толщине капсида.
Ультрафиолетовый свет
Инактивация вирусов ультрафиолетом представляет собой, как пра-
вило, одноударную реакцию, удовлетворяющую уравнению (VII.4).
Обычно допускают, что поглощение одного кванта может инактивиро-
вать вирус. Однако лишь очень немногие из поглощенных квантов яв-
ляются эффективными. Квантовый выход, который представляет собой
отношение числа эффективных квантов к числу поглощенных, составляет
величину порядка 10-3 или менее; это показывает, что подавляющее
большинство поглощенных квантов либо неспособно вызывать длитель-
ные химические изменения, либо вызывает изменения, не сопровождаю-
щиеся потерей инфекционности [632]. Для инфекционных РНК ВТМ и
вируса полиомиелита, которые примерно равны по величине, квантовый
выход при 2537 А составляет около 8 10-4 [623].
Спектр действия инактивации ультрафиолетом, т. е. квантовый вы-
ход для различных длин волн, почти полностью совпадает со спектром
поглощения нуклеиновых кислот. Таким образом, большинство инакти-
вирующих квантов поглощается этими соединениями.
В случае вирусов, облученных ультрафиолетом в воде или в солевых
растворах, незначительно поглощающих это излучение, вторичными эф-
фектами обычно можно пренебречь. Многие органические вещества, од-
нако, уменьшают истинную эффективность ультрафиолета за счет экра-
нирования, проявляющегося в поглощении излучения.
Давно известно, что химическое действие ультрафиолета на ДНК
обусловлено главным образом поглощением этого излучения пиримиди-
новыми кольцами. Поглощение ультрафиолета цитозином вызывает его
гидратацию путем присоединения воды к углеродным атомам в положе-
ниях 4 и 5. Другой реакцией, наблюдаемой в двухцепочечной ДНК, яв-
Действие физических и химических факторов
133
ляется образование сшивок между двумя цепями. Однако ни одна из
этих реакций не в состоянии объяснить действительно наблюдаемые эф-
фекты воздействия ультрафиолета на вирусы и клетки, ибо дозы облуче-
ния, необходимые для индукции химических изменений, слишком велики
и намного превышают те, об эффекте которых идет речь.
В 1960 г. Бьюкерс и Берендс обнаружили, что действие малых доз
ультрафиолета на растворы тимина приводит к образованию димеров
тимина (фиг. 28) с максимумом эффективности при Х = 2700 А. Более
Фиг. 29. Подавление различных свойств вируса гриппа при облучении его ультра-
фиолетом.
/--инфекционный титр; // — интерференция; ///—иммунизирующая способность; /V —титр реак-
ции гемагглютинации; V — реакция связывания комплемента.
высокие дозы УФ расщепляют эти димеры с максимальной эффектив-
ностью при 2400 А [754]. В настоящее время твердо установлено, что ос-
новным механизмом повреждения ДНК ультрафиолетом, имеющим био-
логическое значение, является образование димеров между соседними
пиримидиновыми основаниями в одной и той же полинуклеотидной цепи
[881]. Репликация ДНК, по-видимому, блокируется димерами тимина.
Образуются также тимин-цитозиновые и цитозин-цитозиновые димеры;
последние являются значительно менее стабильными и, вероятно, иг-
рают меньшую роль в радиационном повреждении, хотя и могут иметь
отношение к мутагенезу, обусловленному ультрафиолетом.
134
Глава VII
Замена тимина 5-бромурацилом в ДНК бактериофагов и других
вирусов делает их более чувствительными к ультрафиолету, а также к
видимому свету [434]. Такая замена уменьшает эффективность некото-
рых репаративных механизмов, описанных ниже. В РНК под действием
ультрафиолета образуются димеры урацила, которые, вероятно, ответст-
венны за большинство повреждений РНК-содержащих вирусов, вызван-
ных ультрафиолетом.
Однако чувствительность РНК-содержащих вирусов к ультрафио-
лету определяется не только их нуклеиновой кислотой. Известны два
штамма ВТМ, Ui и U2, один из которых в 6 раз более чувствителен к
ультрафиолету, чем другой, однако инфекционная РНК обоих вирусов
обладает одинаковой чувствительностью к этому излучению [768]. Сле-
довательно, чувствительность более чувствительного штамма должна
быть обусловлена некоторой особенностью строения его белкового кап-
сида.
Большие дозы ультрафиолета не только инактивируют инфекцион-
ность, но и изменяют ряд других свойств вируса, что, по-видимому,
объясняется повреждением ультрафиолетом различных составных частей
вириона (фиг. 29). Ультрафиолетовый свет, так же как и ионизирующие
излучения, вызывает мутации у вирусов. Мутационные изменения, на-
блюдаемые у бактериофага Т4 при облучении его ультрафиолетом, по-
видимому, обусловлены в основном замещением цитозина тимином [373].
Репаративные механизмы
Если облученный фаг адсорбируется бактериальными клетками в
условиях высокой множественности заражения, наблюдается частичная
реактивация. Эта множественная реактивация, вызываемая генетической
комплементацией и рекомбинацией, рассматривается в гл. X.
Другим типом репаративного механизма является фотореактива-
ция— общераспространенное явление, открытое Келнером [449]. Повреж-
дения, вызванные ультрафиолетом, а также рентгеновскими лучами, мо-
гут быть частично устранены при помощи света с максимумом эффек-
тивности при 3200—4500 А. Фотореактивация вирионов фагов или виру-
сов, инактивированных ультрафиолетом, происходит только при
освещении зараженных клеток, но не самих вирионов [195].
Репаративный механизм этого типа состоит в расщеплении пирими-
диновых димеров ферментом, активированным светом, который был об-
наружен в экстрактах дрожжей и других клеток и, по-видимому, при-
сутствует в клетках большинства типов [705]. Были обнаружены мутан-
ты бактерии Escherichia coli [315], неспособные к фотореактивации фага.
У них, по-видимому, отсутствует фермент, расщепляющий димеры, и бла-
годаря этому не наблюдается репарация фага, инактивированного уль-
трафиолетом, с помощью видимого света. Фотореактивация в клетках-
хозяевах продемонстрирована также для некоторых вирусов растений
и животных.
Другим типом репаративного механизма является реактивация под
влиянием клетки-хозяина, которая до сих пор обнаружена только у бак-
териофагов, но не обнаружена у других вирусов, однако, по-видимому,
присуща всем клеткам [95, 257, 313, 754]. Этот тип репаративного меха-
низма состоит в том, что в клетке имеется фермент или группа фермен-
тов, которые удаляют тиминовые димеры- из облученной ДНК, в резуль-
тате чего в полинуклеотидной цепи появляется разрыв. Этот разрыв за-
полняется затем с помощью, как полагают, по крайней мере трех
ферментов. Первый фермент увеличивает разрыв путем удаления еще
нескольких нуклеотидов (по-видимому, с З'-конца), второй ресинтези-
Действие физических и химических факторов
135
рует цепь от З'-конца путем копирования гомологичной цепи и третий
восстанавливает химическую целостность цепи, катализируя образование
фосфодиэфирной связи с 5'-конца (фиг. 30).
Было выделено несколько мутантов Е. coli, у которых отсутствуют
либо фермент или ферменты, удаляющие димеры, либо репаративные
ферменты. Эти мутанты не только сами по себе более чувствительны
к ультрафиолету, но у них отсутствуют также репаративные механизмы,
с помощью которых можно было бы устранить повреждения, вызванные
Фермент (ферменты),
разрывающий цепь
Экзонуклеазы
ДНК- полимераза
Фермент,
соединяющий цепь
Фиг. 30. Схема восстановления повреждения в ДНК, вызванного ультрафиолетом.
ультрафиолетом у фагов. Интересно, что с помощью репаративного ме-
ханизма, свойственного клетке-хозяину (Е. coli), можно устранить по-
вреждения, вызванные ультрафиолетом, у фагов Tl, ТЗ и X, но не удает-
ся устранить такие повреждения у фагов Т2 или Т5. Два последних фага
относятся к такому типу фагов, которые в процессе заражения препят-
ствуют синтезу ферментов клетки-хозяина (гл. IX); следовательно, воз-
можно, что некоторые из репаративных ферментов образуются только
ь присутствии поврежденной излучением ДНК. И в самом деле, предше-
ствующее заражению облучение клеток-хозяев ультрафиолетом увели-
чивает возможность репарации вызванных ультрафиолетом повреждений
фага Т1 либо путем устранения некоего конкурирующего процесса [313],
либо, возможно, путем стимуляции индуцибельной репаративной систе-
мы. Вероятно, что некоторые мутации, вызванные ультрафиолетом и дру-
гими излучениями, являются следствием ошибок при спаривании осно-
ваний, которые наблюдаются в ходе репаративных процессов.
Поврежденные ультрафиолетом РНК-содержащие фаги не реак-
тивируются под влиянием клетки-хозяина, так же как и фаг срХ 174 с од-
ноцепочечной ДНК. Двухцепочечная (репликативная форма) ДНК фага
<рХ174, однако, «ремонтируется», как и следует ожидать из только что
рассмотренного механизма [689].
Некоторые из ферментов Е. coli, участвующие в репарации вызван-
ных ультрафиолетом повреждений, по-видимому, также играют роль
в воссоединении цепей ДНК, разорвавшихся в процессе генетической ре-
комбинации. Действительно, известны классы чувствительных к. ультра-
фиолету мутантов, у которых не происходит репарации; оказалось, что у
136
Глава VII
этих мутантов не имеет места также и генетическая рекомбинация (му-
танты гес-) (141]. Видимо, при отсутствии репаративных механизмов ре-
комбинация должна приводить к летальному исходу.
У бактерий, зараженных поврежденными ультрафиолетом Т-четны-
ми фагами, наблюдается еще один репаративный механизм, который, по-
видимому, подобен фотореактивации, но контролируется каким-то геном
самого фага и не зависит от света. Этот механизм свойствен фагу Т4, но
не свойствен фагу Т2 или мутантам фага Т4, которые, подобно фагу Т2,
обладают примерно вдвое большей чувствительностью к ультрафиолету
по сравнению с фагом Т4 дикого типа [314].
Внутренние репаративные механизмы, так же как репарация фер-
ментами клетки-хозяина, помимо фагов несомненно присущи и другим
вирусам, хотя их существование до сих пор еще не продемонстрировано.
Несомненно, что как клетки, так и вирусы выработали в процессе
эволюции замечательные механизмы, защищающие их нуклеиновые кис-
лоты от различных повреждений, в особенности вызываемых действием
излучений. Можно предположить (и нам такое предположение представ-
ляется весьма интересным), что подобные механизмы должны были иг-
рать очень большую роль на ранних стадиях эволюции жизни, когда в
атмосфере Земли содержалось мало кислорода, а следовательно, либо
вовсе не было озона, либо его было слишком мало, почему защита от
ультрафиолетового излучения Солнца должна была практически отсут-
ствовать.
Фотодинамическое действие
Воздействие света на вирионы, суспендированные в среде, содержа-
щей некоторые красители, как, например, акридины или метиленовый
синий, приводит к быстрой инактивации вируса. Для того чтобы этот
эффект осуществился, необходимо, чтобы в среде содержался кислород.
Цистеин защищает вирусы от такого эффекта. Изменение температуры
и pH изменяют скорость инактивации. Следовательно, химическая реак-
ция, лежащая в основе этого эффекта, представляет собой окисление
красителя, активированного светом [632]. Здесь уместно отметить, что
«вставка» молекул акридинового красителя между двумя соседними па-
рами оснований двухцепочечной нуклеиновой кислоты [506], быть может,
ответственна за мутагенное действие этих красителей, но не за их фото-
динамическое действие.
Радиоактивный распад
Полинуклеотиды являются линейными полимерами, построенными
из остатков сахара и фосфорной кислоты, соединенных фосфодиэфирны-
ми связями. Если фосфат содержит атомы Р32, то их распад (с образо-
ванием ядер S32) может привести к разрыву полинуклеотидной цепи.
Этот эффект, впервые изученный на фаге Т2 ([343]; см. фиг. 31), наблю-
дался на бактериях, а также на других клетках и вирусах [813], вклю-
чая вирус полиомиелита [330].
Инактивация под влиянием радиоактивного распада атомов Р32
представляет собой одноударный процесс. Эффективность инактивации
для фагов с двухцепочечной ДНК составляет величину порядка 10% при
температуре 0° и 4% —при температуре —196° Для РНК- содержащих
фагов или для фагов с одноцепочечной ДНК эффективность инактива-
ции равна приблизительно 1,0, т. е. почти каждый акт распада Р32 при-
водит к утрате инфекционности.
Более низкую эффективность инактивации в случае наличия двух-
иепочечной ДНК можно объяснить [316], постулировав, что распад ато-
Действие физических и химических факторов
137
мов Р32 вызывает три типа повреждений: 1) разрыв двух цепей, когда
эффективность инактивации равна приблизительно 1,0; 2) разрыв од-
ной цепи, который обычно может быть исправлен и который является
летальным только в том случае, когда он происходит в функционально
активной цепи (цепь, служащая матрицей для синтеза m-РНК), где рас-
положены некоторые гены, детерминирующие жизненно важные функ-
Фиг. 31. Инактивация бактериофага Т2 в результате распада включившихся в фаговую
ДНК атомов Р32 [343].
Числа на кривых указывают радиоактивность в мкюри на 1 мг фосфора. Значения на верхней осн
абсцисс соответствуют времени, необходимому для распада, а значения на нижней оси абсцисс — ко-
личеству распавшихся радиоактивных атомов. X — постоянная радиоактивного распада атомов Ри,
равная 0,0485 атома в день, п — число неинактивированных частиц.
ции, необходимые для инициирования репликации фага, а возможно так-
же и для «ремонта» его ДНК (гл. X); 3) некоторые повреждения, обус-
ловленные свободными радикалами и предотвращаемые соединениями,
инактивирующими радикалы [573].
Распад Р32, включенного в фаги, может происходить в клетках-хо-
зяевах, зараженных меченым вирусом. Этот процесс можно изучить бла-
годаря тому, что, подвергая бактериальные клетки глубокому замора-
живанию, мы можем создать условия, при которых наблюдается времен-
ное прекращение жизненных функций у этих клеток, по возобновлении
которых восстанавливается их способность продуцировать вирус. Путем
замораживания бактерий, зараженных меченным Р32 фагом, через раз-
личные промежутки времени после этого заражения и при наличии рас-
пада Р32 можно изучить роль родительской ДНК фага на различных ста-
диях инфекции [813]. Полученные данные говорят о том, что для боль-
шинства фагов целостность ДНК необходима лишь на самых ранних
фазах, т. е. до того, как произойдет ее репликация (после этого способ-
ность клеток продуцировать фаг как бы стабилизируется). Данные, ка-
сающиеся тех исключительных случаев, когда у фагов имеется одноце-
почечная ДНК, рассматриваются в гл. IX.
Глава VIII
ВЗАИМОДЕЙСТВИЕ ВИРУСА С КЛЕТКОЙ-ХОЗЯИНОМ.
ОСНОВНЫЕ ПРОБЛЕМЫ И ЯВЛЕНИЯ
МЕТОДОЛОГИЯ
Вирусная частица, или вирион, является инертной, статической фор-
мой вируса. Когда вирионы находятся вне клетки, они не репродуцируют-
ся и не индуцируют каких-либо обменных процессов. Все события, со-
вершающиеся при вирусных инфекциях в динамике — биосинтез вирус-
ных компонентов, повреждения, наносимые организму хозяина, — про-
исходят лишь в том случае, когда вирус проникает внутрь клетки-хозяина.
Отсюда ясно, что истинно биологическими являются те аспекты виру-
сологии, которые имеют целью изучение взаимодействия вируса с хо-
зяином, или, точнее, с клеткой-хозяином. Даже у многоклеточного
хозяина решающие события, наблюдаемые при вирусной инфекции, про-
исходят на клеточном уровне. Распространение вируса совершается пу-
тем повторения цикла: взаимодействие вируса с клеткой — выход вируса
во внеклеточную среду.
Ознакомившись с химическими и физическими свойствами вирионов,
мы обратимся теперь к изучению взаимодействия вируса с клеткой-хо-
зяином. Принимая во внимание сказанное выше о различных компонен-
тах вирионов, нетрудно предвидеть, что внутри клетки-хозяина вирус не
может быть организован подобно вириону. И действительно, все до сих
пор полученные экспериментальные факты — в следующих главах они
будут изложены подробно — свидетельствуют о том, что события, про-
исходящие в зараженной вирусом клетке, влекут за собой глубокое
преобразование вирусных компонентов, а часто также и структур, входя-
щих в состав клетки-хозяина. В результате этих событий возникает прин-
ципиально новая система, т. е. комплекс вирус—клетка, функциональ-
ная организация которой является следствием временного или постоян-
ного включения вирусных компонентов в структурно-функциональный
аппарат клетки-хозяина. События, происходящие в различных систе-
мах вирус — клетка, не являются абсолютно идентичными во всех своих
деталях. Более того, может быть весьма различным даже сам конечный
результат инфекции, который варьирует от размножения вируса и быст-
рой деструкции клетки-хозяина до образования между вирусом и клет-
кой связи, причем связи столь прочной, что она сохраняется в бесконеч-
ном числе клеточных генераций. К тому же вирусная инфекция может
оказаться также абортивной, т. е. закончиться разрушением инфекцион-
ного вируса и его элиминацией без видимых последствий для клеток.
Среди методов, разработанных в экспериментальной вирусологии
для изучения различных фаз взаимодействия вируса с клеткой, некото-
рые (по сути дела представляющие собой методы изучения функцио-
нальной организации клетки) оказались чрезвычайно ценными для мо-
лекулярной биологии. И действительно, изучение вирусов не только при-
вело к получению результатов, вошедших в основной фонд достижений
молекулярной биологии, но и послужило большим стимулом для удиви-
138
Взаимодействие вируса с клеткой-хозяином
139
тельно стремительного развития этой науки после 1945 г. В том, что ви-
русологии предстояло сыграть ту роль, которую она сыграла в развитии
молекулярной биологии, нет ничего удивительного, ибо методы, разрабо-
танные для изучения вирусов, предоставляли уникальные возможности
для выделения вирусов из клетки в нативном и функционально актив-
ном состоянии и давали возможность не только изучать и даже изменять
их состав и структуру, но и позволяли затем вновь вводить эти потенци-
альные клеточные компоненты в живые клетки и наблюдать за их рабо-
той и последующей судьбой.
Как правило, построение общей схемы, отражающей истинную по-
следовательность и совокупность событий, имеющих место в заражен-
ных вирусом клетках, производится на основе более или менее фраг-
ментарной информации, получаемой при помощи самых разнообразных
методов. Так, например, для получения сведений о количестве и свойст-
вах зрелых вирионов или вирусных субкомпонентов, обладающих инфек-
ционностью, приходится сочетать методы фракционирования клеток и
вирусов с определением инфекционности экстрактов клеток и тканей.
Информацию о судьбе вирусоспецифичных антигенов и локализации их
в клетке получают, используя иммунологические и иммунохимические
методы, в том числе метод флуоресцирующих антител. Для выявления
в зараженных вирусом клетках места локализации и синтеза нуклеино-
вых кислот и иного типа макромолекул применяют различные цитоло-
гические методы, в том числе электронную микроскопию и радиоавто-
графию, а также многочисленные цитохимические методы. Изучение био-
синтеза вирусов ведут, сочетая методы изотопной техники и тех или
иных вариантов фракционирования с определением активности соот-
ветствующих ферментов.
Для обнаружения вирусоспецифичных ДНК и РНК и репликатив-
ных форм вирусных нуклеиновых кислот пригодны чисто специфиче-
ские методы молекулярной биологии, как, например, поиск нуклеиновых
кислот с комплементарной последовательностью оснований. Наконец,
взаимодействие между геномами родственных вирусов и между генома-
ми вирусов и клеток, а также вопросы, касающиеся сохранения непре-
рывности генетической информации вируса при его размножении в клет-
ках, изучают при помощи генетических методов.
ЭКЛИПС, РЕПЛИКАЦИЯ И СОЗРЕВАНИЕ
Общая картина взаимодействия вируса с клеткой, вырисовывающая-
ся при анализе результатов исследований, которые подробно обсужда-
ются ниже, выглядит следующим образом. В результате контакта между
вирусной частицей и чувствительной клеткой наблюдается серия реак-
ций, ведущих к появлению внутри клетки, свободного генетического ма-
териала вируса. Следовательно, в этот момент инфицирующие вирионы
перестают существовать как организованные структуры. Поскольку ин-
фекционность генетического материала вируса, т. е. его свободной ну-
клеиновой кислоты, как правило, во много раз меньше инфекционности
цельной вирусной частицы, освобождение вирусного генома и введение
его внутрь клетки-хозяина сопровождается уменьшением или исчезно-
вением инфекционности. Инфекционность не обнаруживается в течение
так называемого скрытого периода инфекции. Это явление, наблюдаемое
при любой вирусной инфекции, получило название эклипса, а период,
в течение которого отсутствует инфекционность, периода эклипса.
Истинные вирусы никогда не репродуцируются так, как клетки,
е. путем увеличения их размеров, сопровождающегося делением. Раз-
140
Глава VIII
множение вирусов происходит путем репликации генетического мате-
риала. Основные события, имеющие место при репликации вирусов, про-
исходят на том же биохимическом уровне, что и репликация макромоле-
кулярных компонентов клетки, обладающих генетической непрерыв-
ностью, т. е. нуклеиновых кислот и органелл клетки.
Проникновение нуклеиновой кислоты вируса в клетку в процессе
ее заражения может происходить различными путями. Так, у фагов этот
процесс, т. е. освобождение ДНК и ее последующая инъекция сквозь обо-
лочку бактериальной клетки, происходит непосредственно на поверхно-
сти этой клетки сразу же после прикрепления к ней фага [342]. В других
случаях в результате взаимодействия внешней оболочки вируса с плаз-
матической мембраной в цитоплазму клетки сначала целиком про-
никает внутренний капсид вируса, и лишь затем происходит освобожде-
ние генома, т. е. нуклеиновой кислоты, от белков капсида. При некоторых
других вирусных инфекциях, например при заражении клеток вирусом
осповакцины, сначала весь вирион, прикрепившийся к поверхности клет-
ки, окружается выпячивающейся клеточной мембраной, в результате
чего этот вирион в конце концов оказывается внутри клеточной вакуо-
ли. Дальнейший процесс освобождения вирусной нуклеиновой кислоты
идет при активном участии самого вируса, индуцирующего образование
в клетке ферментов и активаторов ферментов, необходимых для депро-
теинизации вирусной нуклеиновой кислоты [415]. Несколько вирионов в
одной клетке могут активно кооперироваться при осуществлении этих
процессов [121].
Как только вирусный геном—носитель генетической информации ви-
руса — освободится от белка, он может быть использован, во-первых,
для репликации и, во-вторых, для индукции биосинтеза специфических
соединений. Репликация, однако, начинается лишь в том случае, если
предварительно выполнены соответствующие условия, для чего может
потребоваться осуществление ряда этапов. Одним из таких условий яв-
ляется достижение вирусным геномом соответствующего участка клетки.
Например, у одного из миксовирусов, а именно у вируса гриппа, ранняя
стадия репродукции происходит в ядре, что, вероятно, вызвано специфи-
ческими условиями освобождения вирусной РНК из нуклеокапсида. Ча-
сто предварительным условием репликации является образование в клет-
ке новых ферментов. Например, для того чтобы началась репликация
ДНК вируса оспы (этот процесс происходит в цитоплазме клетки-хозяи-
на), необходимо, чтобы сначала синтезировались ферменты, катализи-
рующие синтез ДНК. Было показано, что «фабрики», производящие цель-
ные вирионы вируса оспы, также образуются в цитоплазме 1121]. Близ-
кая по характеру ситуация имеет место при синтезе ДНК некоторых
фагов. Было показано, что для синтеза ДНК таких фагов необхо-
дим ряд ферментов, отсутствующих в незараженной бактерии-хозяине,
в связи с чем в этих случаях обязательным условием синтеза фаго-
вой ДНК является предварительная индукция синтеза этих фермен-
тов [145].
Удивительная ситуация возникает при репродукции РНК-содержа-
щих вирусов, требующей предварительного синтеза специфических и
идентичных РНК-репликаз. Имеются убедительные доказательства, что
репродукция многих РНК-содержащих вирусов происходит без предва-
рительного образования ДНК-реплики. Так, например, было показано,
что ингибирование синтеза ДНК не оказывает какого-либо отрицатель-
ного действия на репродукцию РНК-содержащих вирусов [772]. С по-
мощью метода отжига было также установлено, что РНК вирусов, по-
видимому, не обнаруживает гомологии в отношении к ДНК клетки-хо-
зяина.
Взаимодействие вируса с клеткой-хозяином
141
До сих пор в незараженных клетках не были обнаружены фермен-
ты, способные катализировать независимый от ДНК синтез РНК. Име-
ются веские основания полагать, что такой процесс существовать не мо-
жет. Поэтому можно прийти к выводу, что в клетках, зараженных РНК-
содержащими вирусами, синтез ферментов, необходимых для репликации
вирусной РНК (РНК-репликаз [44, 803]), генерируется самими ви-
русами.
Очевидно, что в упомянутых выше случаях вирусный геном должен
обеспечить стимул, а часто и структурную генетическую информацию,
требуемую для биосинтеза новых ферментов. Если вирус содержит до-
статочно большое количество генетического материала, то возможность
выполнения им подобной совокупности функций представляется вполне
реальной. Например, крупные фаги и вирионы вирусов группы оспы со-
держат количество ДНК, вполне достаточное для кодирования синтеза
полипептидных цепей пятидесяти, а быть может, и большего числа раз-
личных белков (см. табл. 9). Интересный вопрос возникает, однако,
в связи с репродукцией наиболее мелких вирусов, ДНК или РНК кото-
рых имеют молекулярный вес порядка 106 дальтон. Генетическая инфор-
мация, содержащаяся в таких вирусах, в состоянии обеспечить синтез
лишь очень небольшого числа белков. Поскольку одна аминокислота
(средний молекулярный вес аминокислот составляет примерно 110 даль-
тон) кодируется тремя нуклеотидами (молекулярный вес трех нуклеоти-
дов составляет примерно 1000 дальтон, а трех нуклеотидных пар —
2000 дальтон), отношение молекулярного веса нуклеиновой кислоты к
молекулярному весу кодируемого ею белка для одноцепочечных ДНК
или РНК равно 9 : 1, а для двухцепочечной ДНК— 18:1. Следовательно,
реализация комплекса функций, выполняемых в клетке-хозяине такими
мелкими вирусами, зависит от активности очень небольшого числа генов.
В качестве примера крайней ситуации, при которой нуклеиновая
кислота вируса содержит крайне незначительное количество генетиче-
ской информации, можно привести репродукцию вируса-сателлита ви-
руса некроза табака, фактически представляющего собой «субвирус».
РНК этого вируса-сателлита состоит всего из 1200 нуклеотидов, а харак-
терный для него капсид построен из белковых субъединиц, каждая из
которых состоит из 400 аминокислотных остатков [673]. Очевидно, что ко-
личество генетической информации, содержащейся в РНК этого вируса-
сателлита, не превышает необходимой для синтеза его капсида, а для
какой-либо дополнительной информации в РНК этого вируса просто не
остается места! Следовательно, либо при репродукции данного вируса
функцию РНК-репликазы выполняет белок капсида, либо эту функцию
выполняют какие-то иные компоненты, доставляемые в клетку извне.
И действительно, этот вирус является «паразитом», или сателлитом, дру-
гого РНК-содержащего вируса — вируса некроза табака, обладающего,
по-видимому, неспецифической РНК-репликазой.
Как только в клетке возникают благоприятные условия, вирусная
нуклеиновая кислота начинает реплицироваться. Иногда репликацию
удается выявить по косвенным признакам. Одним из таких признаков
является, например, эктопическое образование ДНК, имеющее место,
в частности, при размножении вирусов группы оспы, происходящем, как
известно, в цитоплазме. Однако непосредственным доказательством та-
кой репликации является увеличение содержания в клетке экстрагируе-
мой инфекционной нуклеиновой кислоты или нуклеиновой кислоты, об-
ладающей специфическим химическим составом, характерным для дан-
ной вирусной нуклеиновой кислоты. Впрочем, вирусная нуклеиновая
кислота, находящаяся в репликативной форме, по своей структуре дей-
ствительно может отличаться от нуклеиновой кислоты, выделяемой из
142
Глава VIII
вирионов. Так, например, фаги, в вирионах которых содержится одноце
почечная ДНК, при репродукции индуцируют образование двухцепочеч
ных структур, служащих промежуточной репликативной формой [780].
У некоторых фагов линейная молекула ДНК вириона при репродукции в
клетке-хозяине превращается в молекулу, имеющую форму замкнутого
кольца, или индуцирует образование длинных цепей ДНК.
Несмотря на то что возникновение контактов между несколькими
копиями нуклеиновой кислоты одного и того же или родственных виру-
сов может привести к генетической рекомбинации, вирусный геном в про-
цессе размножения вируса не распадается на отдельные фрагменты. Ре-
зультаты, полученные при изучении генетических рекомбинаций у фагов
и вирусов животных, показывают, что последовательность расположения
генетических детерминантов в вирусном геноме сохраняется, даже если
и имеет место некоторая реорганизация, аналогичная наблюдаемой на-
ми в генетическом материале высших организмов (делении, инверсии и
даже перенос генов клетки-хозяина в геном вируса). И действительно,
включение генома фага в геном клетки-хозяина, наблюдаемое у лизоген-
ных бактерий, представляет собой один из примеров генетической пере-
стройки [126].
Согласно одному из наиболее важных обобщений, вирусная нуклеи-
новая кислота во время репликации не связывается со специфическими
белками или иными веществами, содержащимися в зрелых вирионах.
В самом деле, бурная репликация вирусной нуклеиновой кислоты может
иметь место даже в том случае, когда биосинтез белка полностью пред-
отвращен, например при действии химических ингибиторов биосинтеза
белка. Обычно, когда биосинтез белков капсида только начинается, реп-
ликация вирусной нуклеиновой кислоты уже давно находится в полном
разгаре. Благодаря синтезу этих белков накапливается фонд предшест-
венников, служащих источником материала, используемого при сборке
капсида. Образование капсида является, по-видимому, конечной стадией
процесса в том смысле, что вновь синтезированная нуклеиновая кислота,,
заключенная в капсид, внутри той же клетки, как правило, не освобож-
дается. Следовательно, при сборке капсида вирусный геном удаляется из
реплицирующейся популяции. Внешние оболочки в тех случаях, когда
они имеются у вириона, присоединяются к капсиду позднее, что происхо-
дит часто при физическом контакте капсида с внутриклеточными мем-
бранами или с плазматической мембраной клетки.
В один и тот же капсид или внешнюю оболочку вируса могут вклю-
чаться белки, детерминированные геномами различных вирусов. Это
явление было названо фенотическим смешиванием [625]. В результате
фенотического смешивания образуются частицы, у которых специфич-
ность, определяемая белками вириона, отличается от специфичности со-
держащегося в них генома. Комплекс явлений, ведущих к включению
вирусного генома в капсид и к завершению формирования вириона, на-
зывается созреванием.
Конечным этапом репродукции вируса является либо лизис клетки-
хозяина, сопровождаемый выходом полностью сформированных вирио-
нов во внешнюю среду, либо выталкивание вируса во внешнюю среду
вместе с частью цитоплазмы, либо, наконец, выход из клетки единичных
вирионов или небольших их групп. Вместе с целыми вирусными части-
цами во внешнюю среду могут выходить как не полностью сформиро-
ванные вирионы, так и их отдельные компоненты. Вся совокупность со-
бытий, ведущих к образованию зрелых вирионов и выходу их во внеш-
нюю среду, называется продуктивным циклом. Некоторые вирусы живот-
ных с трудом выделяются из клетки во внешнюю среду. Выход таких.
Взаимодействие вируса с клеткой-хозяином
143
вирусов из клеток и их распространение по организму хозяина осуществ-
ляется благодаря захвату фагоцитами убитых вирусом клеток и их пе-
ревариванию.
РЕГУЛЯТОРНЫЕ ЯВЛЕНИЯ
Продуктивный цикл не является единственно возможным результа-
том развития вирусной инфекции чувствительных клеток. Одним из наи-
более важных аспектов процесса развития вируса является удивительное
явление — регуляция репликации и созревания вирионов.
Наиболее четко регуляторные явления выражены при взаимодейст-
вии с бактериями так называемых умеренных фагов. Умеренными были
названы фаги, способные вступать с бактериальной клеткой в своеоб-
разный вид взаимосвязи, при осуществлении которого фаг не разрушает
бактерию, а продолжает существовать внутри жизнеспособной бактери-
альной клетки-хозяина в состоянии профага, превращая таким образом
клетку-хозяина в лизогенную (гл. XI). Ключевой стадией при лизогени-
зации бактерии является инициация детерминируемой фагом специфи-
ческой иммунной реакции, полностью исключающей возможность созре-
вания фага. В лизогенной бактериальной клетке белки вириона фага не
образуются, вследствие чего геном фага остается «голым» и физически
соединяется с бактериальной хромосомой в единую структуру. Пока ви-
русный геном остается в состоянии профага, гены фага, детерминирую-
щие различные стадии его созревания, остаются репрессированными и
не функционируют. Функционирующий при иммунитете механизм репрес-
сии действует также при заражении лизогенной бактерии любым родст-
венным, «коиммунным» фагом, способным проникнуть в лизогенную
бактерию. Поэтому коиммунные фаги в лизогенных бактериях не репли-
цируются и не созревают.
Вирусы, находящиеся в клетках-хозяевах в виде провирусов, часто
бывает трудно обнаружить, ибо провирусы не инфекционны. Успех зави-
сит от того, перейдет ли вирус из состояния профага в репликативное
состояние, т. е. определяется процессом, который является совершенно
случайным. Если такой переход совершится, то затем наступит созрева-
ние фага и вновь образовавшиеся инфекционные вирионы выйдут из бак-
терии во внешнюю среду. Иногда переход вируса в репликативное сос-
тояние удается индуцировать, облучая лизогенные клетки ультрафиоле-
том или воздействуя на них каким-либо иным образом. Содержит ли
данная культура провирус, можно проверить и косвенным методом, ис-
пользуя, например, такой симптом, как иммунитет к суперинфекции. Воз-
никновение провирусного состояния, контролируемого репрессорами —
компонентами иммунной системы, — было показано только для умерен-
ных фагов, хотя и предполагается, что сходное явление имеет место
также и при взаимодействии с клетками опухолеродных вирусов
(гл. XVI).
Однако существование регуляторных механизмов, контролирующих
временную последовательность событий, происходящих при биосинтезе
и созревании вируса, по-видимому, является весьма распространенным
явлением. Например, как при заражении бактерии фагами, так и при
инфекциях, вызываемых вирусами группы оспы, вновь проникший в
клетку вирус может индуцировать синтез некоторых ферментов, необхо-
димых для репликации вируса. Однако синтез белков вириона не начи-
нается до тех пор, пока репликация нуклеиновой кислоты не достигнет
своего апогея. Эти данные говорят о том, что некоторые гены вируса
функционируют на ранних стадиях репродукции вируса, а другие — на
поздних. В то же время многие гены вируса функционируют в течение
всего процесса репродукции.
144
Глава VIH
Возможно, что механизмы, ответственные за последовательную и ко-
ординированную активацию и репрессию определенных групп вирусных
генов, близки по своей природе общим механизмам клеточной регуля-
ции, не допускающим считывания большей части клеточного генома. Из-
вестно, например, что нервные клетки мозга не синтезируют многих фер-
ментов, синтезируемых в большом количестве клетками печени или клет-
ками поджелудочной железы, обладающими аналогичным объемом
генетической информации. Широко распространено мнение, что изучение
вирусов может дать в руки исследователей ключ к пониманию механиз-
мов, ответственных за регуляторные процессы, наблюдаемые при этих
явлениях [400].
Вирус может оказаться неспособным осуществить полный цикл ре-
продукции не только вследствие ограничений, индуцируемых регулятор-
ными механизмами, но также и в случае, если поврежден его геном.
Вирус, лишившийся способности осуществить ту или иную функцию, не-
обходимую для его репликации или созревания, вследствие того что в
его геноме произошла мутация, называется дефектным. Не всякая му-
тация вирусного генома является летальной.
С одной стороны, вызванный мутацией генетический дефект может
привести к вредным последствиям при размножении вируса в клетках
одного типа и вовсе не выявиться при размножении в клетках другого
типа или, скажем, проявиться только при каких-либо определенных ус-
ловиях внешней среды, например в определенном диапазоне температур.
Мутации такого типа были названы условно летальными мутациями
[209]. Действительно, было показано, что одна и та же мутация при раз-
множении вируса в клетках одного типа может привести к блокированию
одних стадий его репродукции, при размножении в клетках другого ти-
па — к блокированию других стадий, а при размножении в клетках
третьего типа — не проявиться вовсе [720]. С другой стороны, дефектный
вирус может существовать внутри клетки-хозяина в виде провируса в
течение неопределенного периода времени (гл. XI). Более того, такой
вирус может осуществить полный цикл репликации и созревания при ус-
ловии, что дефектная функция будет выполнена содержащимся в той
же клетке другим родственным ему недефектным вирусом (генетическая
комплементация).
Некоторые дефектные вирусы могут использовать помощь со сторо-
ны неродственных вирусов. Вирусы этого типа всегда обнаруживаются
совместно с так называемыми «вирусами-помощниками». О вирусе-са-
теллите вируса некроза табака, не содержащего генетической информа-
ции, необходимой для синтеза реплицирующих ферментов, мы уже упо-
минали выше. Среди вирусов животных вирус саркомы Рауса, по-види-
мому, также является дефектным, ибо для его репродукции нужна
помощь какого-либо вируса из группы так называемых Раус-ассоцииро-
ванных вирусов [311]. Дериват опухолеродного вируса SV-40 также, по-
видимому, является дефектным, ибо в клетках почек обезьян он размно-
жается только в присутствии аденовируса, обеспечивающего его белком,
необходимым для образования капсида. В свою очередь дефектный ви-
рус SV-40 служит помощником для аденовируса, ибо один аденовирус в
клетках почек обезьян размножаться не может [93] Ч
Своеобразный тип дефектности был обнаружен у фагов. Было по-
казано, что существуют фаговые вирионы, содержащие лишь часть ге-
1 Отношения между вирусом SV-40 и аденовирусом являются весьма сложными,
ибо по крайней мере часть генома вируса SV-40 непосредственно соединяется с геномом
аденовируса прочными химическими связями, образуя единую молекулу ДНК, заклю-
ченную в каспид аденовируса (Baum S. et а!.. Proc. Nat. Acad. Sci. USA, 1966, 56,
1509). — Прим. ped.
Взаимодействие вируса с клеткой-хозяином
145
нома фага, т. е. не цельную молекулу ДНК фага, а лишь какой-либо из
фрагментов, образовавшийся при случайном разрыве этой молекулы.
Тем не менее при множественном заражении подобные вирионы благо-
даря кооперированию и рекомбинации могут образовывать нормальный
фаг [402].
Проблемы, возникшие в связи с открытием явления дефектности
вирусов, относятся к числу наиболее запутанных и трудных проблем ви-
русологии. Иногда бывает непросто решить, ответственна ли за аномаль-
ное свойство клетки мутация, происшедшая в ее геноме, или присутствие
в клетке дефектного вируса. Этот и другие вопросы, связанные с пробле-
мой дефектности, более подробно будут обсуждены в гл. XIX.
Следует заметить, что не всякий дефект в геноме вируса приводит
к превращению вируса в дефектный. Например, умеренный фаг может
мутировать в вирулентную форму, неспособную превратить бактерию в
лизогенную. Очевидно, что вирулентный мутант тем не менее является
нормальным вирусом, ибо при заражении бактерии осуществляется пол-
ный цикл развития, т. е. заражение, репликация и созревание. У мутант-
ного фага отсутствует лишь одно свойство, характерное для исходного
фага, а именно способность переходить в состояние профага.
ЗАКОНОМЕРНОСТИ, ОПРЕДЕЛЯЮЩИЕ СПЕЦИФИЧНОСТЬ ВИРУСОВ
ПО ОТНОШЕНИЮ К КЛЕТКАМ-ХОЗЯЕВАМ
Одним из наиболее интригующих аспектов биологии вирусов явля-
ется проблема механизмов, определяющих специфичность вируса по от-
ношению к клетке-хозяину. Эта специфичность по отношению к хозяину
представляет собой одно из наиболее характерных свойств вирусов.
Между тем если выйти за рамки наиболее очевидных ситуаций, то ока-
зывается, что природа этой специфичности требует более пристального
внимания. Так, например, интактные вирионы вируса полиомиелита не
способны заразить клетки почки кролика, тогда как выделенная из ви-
рионов РНК вызывает заражение [359]. Очевидно, что в данном случае
барьер специфичности детерминирован свойствами капсида вируса, а не
его РНК. Подобных примеров можно привести много. Наиболее отчетли-
во отсутствие специфичности проявляется, конечно, в удивительной спо-
собности некоторых вирусов растений размножаться как в клетках рас-
тения-хозяина, так и в клетках насекомого-переносчика ([88]; см.
гл. XVII).
В связи с этим возникает вопрос, не может ли любая вирусная ну-
клеиновая кислота, если она проникнет в клетку в интактном состоянии,
функционировать в любой клетке, т. е. вне зависимости от специфичности
данной клетки начать реплицироваться в ней и индуцировать образование
зрелых вирионов? Все возрастающая уверенность в универсальности или
почти полной универсальности генетического кода (гл. V) делает это
предположение вполне вероятным. Однако ряд фактов говорит о том,
что, несмотря на вероятную универсальность механизмов взаимодействия
вирусов е клетками (а быть может, именно вследствие этой универсаль-
ности), у некоторых типов клеток в процессе эволюции возникли барье-
ры, препятствующие проникновению и функционированию в клетке чу-
жеродных нуклеиновых кислот. Возможно, одним из таких барьеров яв-
ляется образование интерферона, продуцируемого клетками животных
в ответ на внедрение многих вирусов [389]. Еще одним из таких меха-
низмов является модификация вируса, индуцируемая хозяином, которая
впервые была обнаружена у бактериофагов [534], а впоследствии и у
других вирусов. Недавно было показано, что этот механизм, возможно,
10 Заказ № 1214
146
Глава VIII
является частным проявлением более общего механизма распознавания
и отторжения чужеродных нуклеиновых кислот ([30]; см. гл. X).
Наконец, вполне вероятно, что обязательным условием возможности
репликации вирусной нуклеиновой кислоты является не только отсутст-
вие у клетки механизма специфического отторжения, но также и наличие
определенного комплекса неких иных условий, например подходящего
«места» для репликации. Этот вопрос, однако, остается открытым, иба
для его решения нам необходимы дополнительные сведения о природе
контрольных механизмов, регулирующих репликацию генетического ма-
териала [397].
ДЕЙСТВИЕ ВИРУСОВ НА КЛЕТКИ
Что же происходит с клеткой-хозяином во время вирусной инфек-
ции? Очевидно, что реализация всех потенций вируса обусловлена гене-
тическими и физиологическими возможностями клетки-хозяина. Почти
все биосинтетические потребности вируса удовлетворяются за счет клет-
ки. Так, нуклеотиды — предшественники нуклеиновой кислоты вируса —
и аминокислоты — предшественники его белков — поставляются клеткой.
Лишь в редких случаях вирус детерминирует образование дополнитель-
ной специфической системы ферментов, необходимой для синтеза неко-
торых предшественников нуклеиновой кислоты. Поэтому в большинстве
случаев ограничение поступления в клетку питательных веществ приво-
дит также к ограничению размножения вируса. Подобным же образом
размножение вируса невозможно без использования систем клетки, гене-
рирующих энергию, и аппарата, необходимого для биосинтеза белка: фер-
ментов, активирующих аминокислоты, транспортных РНК и рибосом.
Вирус не образует своей собственной «клетки внутри клетки», а функ-
ционирует лишь как дополнительный фрагмент генетического материала.
Было показано, что для размножения некоторых крупных вирусов
животных, а именно вирусов группы оспы и вирусов группы герпеса,
в клетке должны содержаться некоторые необычные типы транспортной
РНК [827]. Если эти данные подтвердятся, то их можно будет интерпре-
тировать как указание на то, что в ходе эволюции у этих вирусов возник-
ли некоторые изменения в самом смысле триплетов генетического кода,,
а также появилась способность синтезировать некоторые компоненты
считывающей генетический код системы, резко отличающиеся от соот-
ветствующих компонентов их сегодняшних клеток-хозяев.
Диапазон изменений функций клетки, вызываемых проникшими в
клетку вирусами, очень широк. Появление вируса в клетке может при-
вести к быстрому подавлению всех процессов биосинтеза, а следователь-
но, и к гибели клетки, может вызвать стойкое нарушение характера ро-
ста клеток и их деления, а может и вовсе не сказаться на функциях клет-
ки или привести лишь к едва заметному их изменению. Изменения кле-
ток, вызываемые вирусами, можно разделить на несколько групп. Одни
из таких изменений являются следствием процесса присоединения виру-
са к клетке и его проникновения внутрь клетки, другие — следствием
продуктивного цикла развития вируса, а третьи — следствием стойкого
присутствия в клетке вирусного генома. Однако в любом случае, прямо
или косвенно, можно проследить путь от изменений, вызванных в клетке
вирусом, до функций, осуществляемых геномом вируса.
Описан ряд случаев, наблюдавшихся главным образом при изучении
фагов, при которых одно лишь присоединение вируса к оболочке клетки
вызывало резкие нарушения процессов биосинтеза, протекающих в клет-
ке. Очевидно, что в тех случаях, когда эти нарушения ведут к необрати-
мым изменениям, например к распаду ДНК клетки, присоединение ви-
Взаимодействие вируса с клеткой-хозяином
147
руса к поверхности клетки несовместимо с длительной жизнью клетки.
Однако индукция столь резких повреждений инфицирующим вирионом
как таковым является скорее исключением, чем правилом. Значительно
чаще после проникновения вируса в клетку и освобождения его нуклеи-
новой кислоты наблюдается более или менее полное подавление лишь
некоторых биосинтетических процессов клетки. Энтеровирусы, например,
блокируют лишь образование клеточной РНК [716]. Механизм этих ин-
тереснейших нарушений регуляции функции клетки, к сожалению, до сих
пор еще не понят. В других случаях зараженная вирусом клетка в тече-
ние достаточно длительного промежутка времени функционирует более
или менее нормально.
Конечно, индуцируемое вирусной инфекцией нарушение различных
процессов, протекающих в клетке, вызвано не простой конкуренцией за
субстрат между синтетическими процессами, ведущими к образованию
вирусных или клеточных компонентов. Синтез вирусных компонентов,
как таковой, редко оказывается непосильным бременем для общей био-
синтетической системы клетки. Более часто повреждение клетки являет-
ся следствием действия специфической активности вирусных ферментов.
В качестве примера можно привести образуемые фагом литические фер-
менты, которые, разрушая жесткий слой стенки бактериальной клетки,
осуществляют конечную стадию продуктивного цикла репродукции фага.
По-видимому, повреждение клеточных мембран лежит также в основе
слияния клеток и образования поликариоцитов, наблюдаемом при за-
ражении клеток животных вирусом простого герпеса и некоторыми дру-
гими вирусами.
В случае когда клетка выживает после вирусной инфекции и стано-
вится родоначальницей новой линии клеток, содержащих вирус в стаби-
лизированной форме, у клеток новой линии обнаруживаются новые инду-
цированные вирусом свойства, отсутствовавшие у исходной незаражен-
ной клетки. Некоторые из новых свойств таких клеток являются
следствием индукции вирусом отсутствовавших ранее у клетки синтети-
ческих процессов, реализующихся в конечном счете в образовании
структур, обладающих новыми антигенными или ферментативными
свойствами. Например, в лизогенных бактериях и в клетках опухолей,
индуцированных вирусами, часто обнаруживаются новые антигенные
компоненты. В образовании новых антигенов геном вируса может играть
более или менее прямую роль, индуцируя образование ферментов, необ-
ходимых для синтеза этих антигенов, или изменяя регуляторные про-
цессы клетки, либо, наконец, выполняя как первую, так и вторую из упо-
мянутых функций. У клеток, содержащих провирус, может измениться
чувствительность к заражению другими вирусами. Эту функцию прови-
рус осуществляет, либо изменяя строение клеточных рецепторов, либо
индуцируя образование ферментов, способных разрушить нуклеиновую
кислоту соответствующего вируса.
Наконец, и это очень важно, в результате вирусной инфекции могут
измениться свойства клетки, определяющие характер ее репродукции и
развития. Наиболее четко проявляются такие изменения у клеток опу-
холей, индуцированных вирусами. Клетки таких опухолей ускользают
из-под контроля систем, благодаря действию которых репродуктивные
и морфогенетические потенции их неопухолевых предшественников не
выходят за пределы нормы. Хотя не все изменения, наблюдаемые у
трансформированных вирусом клеток, вызваны действием вируса, в ряде
случаев морфогенетическая роль вируса не вызывает сомнений. Подроб-
но этот вопрос будет рассматриваться в гл. XVI.
Подводя итоги изложенному выше общему обзору взаимодействия
вируса с клеткой, легко прийти к выводу, что ключевым явлением, ха-
10*
148
Глава VIII
рактерным для любой вирусной инфекции и определяемым самой ее при-
родой, является введение в клетку фрагмента чужеродного генетического
материала, осуществляемое специализированным проводником — ви-
рионом. Конкретные события, наблюдаемые в каждом отдельном случае,
детерминируются специфической природой конкретного вирусного гено-
ма и клеток, в которых ему приходится функционировать. Этот краткий
обзор преследует вполне определенную цель — изложить в виде после-
довательной картины все наиболее характерные, на наш взгляд, особен-
ности вирусной инфекции с тем, чтобы при последующем обсуждении
свойств отдельных групп вирусов у читателя не сложилось бы впечатле-
ние о вирусологии как о науке, описывающей непонятный и хаотический
набор множества фактов и явлений. Имея в виду несколько основных
обобщений, обсужденных выше, и в то же время не забывая об их огра-
ничениях, мы теперь вернемся к детальному изучению динамических
аспектов вирусологии.
Глава IX
ВЗАИМОДЕЙСТВИЕ БАКТЕРИОФАГА С БАКТЕРИЕЙ.
ПРОДУКТИВНЫЙ ЦИКЛ
ТИПЫ ВЗАИМОДЕЙСТВИЯ
Характер взаимодействия бактериофагов с их клетками-хозяевами»
т. е. с бактериями, определяется множеством различных обстоятельств.
Поэтому данные, полученные при изучении одной системы фаг — бакте-
рия, столь же рискованно и неразумно распространять на другую систе-
му фаг — бактерия, как и данные, полученные при изучении любых дру-
гих систем вирус — клетка. Тем не менее, поскольку некоторые фаги изу-
чены значительно более глубоко, чем другие, имеет смысл, хотя бы даже
из познавательных соображений, сконцентрировать внимание на описа-
нии небольшого числа модельных систем, ибо это позволит нарисовать
весьма последовательную и исчерпывающую общую картину. При этом,
однако, никогда не следует забывать, что неожиданные наблюдения, не
укладывающиеся в общую, обычную картину, часто могут оказаться
ключом к пониманию явлений, проливающих свет на совершенно неожи-
данные аспекты взаимодействия вирусов с клетками.
Во-первых, познакомимся с двумя главными типами взаимодейст-
вия фагов с бактериями: лизогенным и литическим (или продуктивным).
При лизогенном типе взаимодействия геном фага в неинфекционной фор-
ме передается бактериальными клетками от одной генерации клеток дру-
гой, причем время от времени в некотором количестве клеток синтезиру-
ются соответствующие вирионы, лизирующие эти клетки и выходящие
затем во внешнюю среду. Лизогенные клетки, повторно зараженные эти-
ми вирионами, не лизируются (ибо они иммунны к этому вирусу), так
что лизогенная культура растет вполне нормально. Присутствие свобод-
ных вирионов можно выявить путем воздействия на клетки каких-либо
иных, нелизогенных штаммов бактерий, лизируемых данным фагом
(индикаторные штаммы).
Литическим называется такой тип взаимодействия фагов с бакте-
риями, при котором заражение фагом приводит к лизису самой заражен-
ной клетки или ее непосредственного потомства, и внезапному выходу в
среду вновь образовавшихся вирионов.
Фаги, способные лизогенизировать заражаемые ими бактерии, назы-
ваются умеренными, а фаги, у которых такая способность отсутствует,
вирулентными, В особую группу иногда выделяют чрезвычайно вирулент-
ные, так называемые гиперагрессивные (intemperate) фаги, которые уже
на ранних стадиях инфекции вызывают непоправимые повреждения бак-
териальной клетки.
Любой фаг, в том числе и умеренный, при условии заражения соот-
ветствующих клеток-хозяев в принципе способен осуществить все функ-
ции, характерные для продуктивного цикла инфекции, и поэтому может
быть обнаружен по вызываемому им лизису. При продуктивном цикле
инфекции образуются новые фаги, в связи с чем этот процесс был назван
вегетативным размножением. Поскольку продуктивный, или литический,
тип взаимодействия является процессом, характерным для любого фага,
149
150
Глава IX
обсуждение проблемы взаимодействия фагов с бактериями удобнее на-
чать с описания именно этого типа взаимодействия. К настоящему вре-
мени получена большая информация о процессах этого типа, благодаря
концентрированию усилий на изучении небольшого числа систем. Од-
ной из таких систем являются бактерии Escherichia coli (штамм В) и
семь фагов: Т1—Т7. В табл. 15 суммированы некоторые данные, дающие
представление о свойствах этих и некоторых других хорошо изученных
колифагов.
ЛИТИЧЕСКИЙ ТИП ВЗАИМОДЕЙСТВИЯ ФАГА С КЛЕТКОЙ-ХОЗЯИНОМ
Общую картину литической инфекции можно наблюдать при по-
мощи микроскопии в темном поле или при помощи фазово-контрастной
микроскопии, а еще предпочтительнее — на электронных микрофотогра-
фиях, сделанных через определенные промежутки времени после прибав-
ления фага к бактериям. Сначала частицы фага прилипают к поверхно-
сти бактерии. Затем следует латентный период, во время которого
совершаются события, происходящие внутри бактериальной клетки, и ко-
торый завершается внезапным и бурным лизисом культуры и освобож-
дением фаговых частиц (см. фото 36 и 37). Часто в конечном счете от
бактериальных клеток остаются лишь бесформенные обрывки разрушен-
ной клеточной стенки.
Чтобы количественно изучить последовательность событий, совер-
шающихся при единичном цикле репродукций фага, Эллис и Дельбрюк
разработали специальный метод, получивший название метода одиноч-
ного цикла размножения [215]. Разработка этого метода послужила боль-
шим стимулом для количественного изучения процессов, происходящих
при взаимодействии фагов с бактериями. Подробное изложение каждого
из этапов метода Эллиса и Дельбрюка приводится в последующих разде-
лах, а сейчас мы опишем лишь наиболее существенные его моменты.
Концентрированную суспензию чувствительных бактерий, культиви-
рованных в стандартных условиях, смешивают с фагом. Для фиксации,
или адсорбции, фага на бактериях смесь инкубируют в течение весьма
краткого периода, не превышающего по своей продолжительности ми-
нимального латентного периода, т. е. минимального промежутка времени,
проходящего между адсорбцией и лизисом. Полученную смесь сильно
разбавляют, с тем чтобы резко уменьшить вероятность столкновения фа-
га с бактерией и, следовательно, свести к минимуму или полностью ис-
ключить возможность дальнейшей адсорбции фага на бактериях. Затем
через определенные интервалы времени из смеси берут пробы, высевают
их на чашки и подсчитывают число образовавшихся бляшек. На фиг. 32
в качестве примера приведен результат опыта такого типа. Начальный
участок кривой, идущий в непосредственной близости от оси абсцисс,
соответствует латентному периоду, на протяжении которого число бля-
шек остается постоянным, ибо в данном случае каждая зараженная бак-
терия образует на плотной среде только одну бляшку вне зависимости
от числа фаговых частиц, содержавшихся внутри клетки в момент по-
сева. Увеличение числа бляшек соответствует периоду лизиса, а конечное
плато кривой отражает завершение лизиса, ибо вновь синтезировавшие-
ся и вышедшие во внешнюю среду вирионы не в состоянии встретиться с
новыми бактериями из-за сильного разбавления суспензии и остаются
свободными до посева. Таким образом, эта методика позволяет наблю-
дать одиночный цикл размножения бактериофага.
Средний выход фага на одну бактерию равен отношению: (общее
количество освободившегося фага)/(число первоначально зараженных
бактерий). В случае когда на бактериях адсорбировался не весь содер-
Свойства некоторых фагов £. coll
Таблица 16
Фаг Морфология вириона Нуклеиновая кислота1) Продолжи- тельность латентного периода, мин Цикл размножения при 37°
отросток средний выход фага на клетку лизогения характерные особенности
Т1 Икосаэдр, 500 А 100 • 1500А ДНК; 2,5 • 10s 13 150 — Устойчив к высушиванию
Т2, Т4, Тб Вытянутый ико- саэдр, 650 950А 250- 1100А ДНК; 1,2 • 108 21—25 150-400 — Содержат глюкозилированный окси- метилцитозин
ТЗ, Т7 Икосаэдр, 470А 100 • 150А ДНК; 2,4 • 10’ 13 300 — Дают полуумеренные мутанты
Т5 Икосаэдр, 650 А 100 • 1700А ДНК; 7,5 • 107 40 200 — ДНК инъецируется в два этапа
X, <f>80 Икосаэдр, 540 А 100 • 1400А ДНК; 3,3 • 107 35 100 + ДНК как in vivo, так и in vitro за- мыкается в кольцо
Р1 Икосаэдр, 650 А 120 • 1500А ДНК; 6 • 107 45 80 + Трансдукция
Р2 Икосаэдр, 500 А 100 • 1500А ДНК; -5 • 107 30 120 + Множественная локализация в хро- мосоме
<f>X174, S13 Икосаэдр, 300 А Отсутствует ДНК одпоцепо- чечпая; 1,7 10б 13 180 — ДНК имеет форму замкнутого кольца
f2, MS2 Икосаэдр, 240 А Отсутствует РНК; 9 • 105 22 20 000 — Специфичны в отношении мужских штаммов, присоединяются к поло- вым ворсинкам
fl, fd Отсутствует 60 8000А ДНК одноцепо- чечная; 1,3 • 106 30 100—200 (непре- рывное выделе- ние фага) — Специфичны в отношении мужских штаммов; ДНК имеет форму замк- нутого кольца
X2) Икосаэдр, 675 А 125 • 2300А ДНК 60 200 — Присоединяется к подвижным жгу- тикам
«) Молекулярный вес нуклеиновой кислоты дан в дальтонах.
2) Не является колифагом, размножается на многих штаммах Salmonella.
152
Глава IX
жавшийся в инокулуме фаг, необходимо ввести поправку, определяемую
отношением (F—U)/(I—U), где F — конечный титр фага, U — число фа-
говых частиц инокулума, не адсорбировавшихся на бактериях, I — число
бляшек, образуемых пробой, взятой в латентный период, причем
I=B + U, где В — число зараженных бактерий, a U — число фаговых
частиц инокулума, не адсорбировавшихся на бактериях. В табл. 15 при-
ведены величины среднего выхода для некоторых колифагов.
Фиг. 32. Кривая, демонстрирующая одиночный цикл размножения бактериофага Т1
в клетках Escherichia coli, штамм В, которые инкубировали в питательном бульоне
при 37°.
Фаг и бактерии в соотношении 1 10 смешивали в момент времени t — 0. Через 4 мин, когда 45% до-
бавленного фага адсорбировалось на поверхность бактерий, смесь разбавляли. Через определенные
промежутки времени после разбавления смеси определяли количество зрелого фага. Средний выход
фага на одну зараженную бактериальную клетку составил 62-100/45—138.
Если исходную смесь не разбавляют, то вместо одиночного цикла
размножения наблюдают серию налагающихся друг на друга циклов
адсорбции и выходов фага во внешнюю среду. Количество образующе-
гося лизата зависит от количества осуществившихся циклов размножения
фага. В лизатах, характеризующихся высоким титром, часто содержит-
ся до 1011 инфекционных единиц на 1 мл и даже более.
Впоследствии было предложено бесчисленное число модификаций
метода одиночного цикла размножения, предназначенных для изучения
специальных вопросов, например единичной, множественной, смешанной
или синхронной инфекций.
Одной из важных модификаций этого метода является вариант,
разработанный Бернетом "[111] и предназначенный для определения чис-
ла вирионов фага, образующихся в единичных клетках (опыт с полу-
чением единичного выхода фага) (фиг. 33). В этом случае после адсорб-
ции фага на бактериях суспензию разбавляют до такой степени, чтобы
она содержала очень небольшое число бактерий, скажем две бактери-
альные клетки на 1 мл. Затем небольшие объемы смеси, например по
0,2 мл, распределяют до начала лизиса в серии пробирок. Большая часть
пробирок в этом случае не будет содержать зараженных бактерий (в при-
веденном выше примере их относительное количество будет равно
е-°,4 = о,б7), некоторая часть пробирок будет содержать по одной бакте-
риальной клетке (их относительное количество будет равно 0,4 е"ол =
= 0,268) и лишь очень небольшая часть пробирок—более одной бакте-
Фиг. 33. Схема постановки опыта, позволяющего определить число вирионов фага, обра-
зующихся в единичной бактериальной клетке (опыт с получением единичного выхода
фага).
Одна из шести пробирок второго ряда содержит зараженную бактерию, одна — неадсорбированныЛ
фаг и одна — незараженную бактерию. Через 30 мин зараженные бактерии лизируются. Содер-
жимое каждой пробирки высевают на отдельную чашку, после чего подсчитывают число фаговых
частиц. Число бляшек, содержащихся в первой чашке (левая чашка, нижний ряд), показывает, ка-
кое число фаговых частиц образовалось в зараженной бактерии.
154
Глава IX
риальной клетки (их относительное количество будет равно
1—(1+0,4) е-0’4 = 0,062). Эти величины рассчитаны с помощью уравне-
ния (III. 1) (стр. 45) в предположении, что распределение зараженных
бактерий является случайным.
Затем пробирки инкубируют и по окончании лизиса все содержи-
мое каждой пробирки засевают на отдельную чашку с целью подсчета
урожая фага. В большинстве чашек бляшки не образуются вовсе или
образуется одна или несколько бляшек, что зависит от остаточного коли-
чества неадсорбировавшегося фага. На остальных чашках образуются
бляшки, отражающие выход фага из одной клетки (редко выход из двух
или нескольких клеток). Выход фага из отдельных клеток сильно варьи-
рует. Разброс полученных величин значительно шире, чем можно было
бы ожидать исходя, например, из распределения размера бактериальных
клеток. Такой результат свидетельствует о сильных колебаниях интен-
сивности размножения фага в отдельных бактериальных клетках. Ниже
приведено распределение урожая фага, получаемого из отдельных бак-
териальных клеток Escherichia coli, зараженных фагом Т2 (распределе-
ние единичных выходов фага):
а) Среднее число зараженных бактерий, приходящихся на одну
чашку, рассчитанное, исходя из количества введенного фага
б) Общее число чашек
в) Ожидаемое число чашек, не содержащих бляшек
г) Действительное число чашек» не содержащих бляшек
д) Среднее число зараженных бактерий, приходящихся на одну
чашку, рассчитанное из величины, полученной в пункте «г»
е) Число чашек, содержащих по одной зараженной клетке
ж) Число чашек, содержащих по две зараженные бактериальные
клетки
з) Число чашек, содержащих по три или более зараженные бакте-
риальные клетки
0,73
96
96 • £—0.73 = 46
39
1п(39/9б) = 0,9
96-0,9 «6-0.9=35
96(0,92/2)е-0.9 =
= 16
96[1—(1+0,9+
+0,92/2)]б-о.9=
Таблица 16
Распределение числа бляшек, обнаруженных на чашках
9 67 92 114 161 260
31 67 92 117 163 278
41 70 99 118 165 291
45 75 101 124 192 298
48 76 102 130 201 407
49 81 103 130 206 413
55 86 105 132 209 477
56 89 106 135 215
58 90 ПО 136 216
65 91 ПО 151 230
Суммарное число бляшек 7938
Средний выход, рассчитанный на ос-
новании величины, полученной в 7933
пункте «д»
= 92
96-0,9
При проведении опытов с одиночным циклом размножения и с по-
лучением единичного выхода фага неадсорбировавшийся фаг часто уда-
ляют до начала лизиса, либо центрифугируя и отмывая бактериальные
клетки, либо, что более удобно, добавляя к суспензии некоторое количе-
ство антифаговой сыворотки. Антифаговая сыворотка инактивирует
свободный и не влияет на адсорбировавшийся фаг 1178]. Для того чтобы
Взаимодействие бактериофага с бактерией
155
исключить возможность инактивации сывороткой вновь образующегося
фага, смесь затем разбавляют, что приводит к прекращению действия
сыворотки.
АДСОРБЦИЯ БАКТЕРИОФАГА БАКТЕРИЯМИ
Кинетика адсорбции фага
Фиксация фага на чувствительных бактериях, которую легко можно
наблюдать при помощи электронного микроскопа, была изучена коли-
чественно путем определения кинетики исчезновения из смеси свободного
фага в интервале времени от момента добавления фага до конца латент-
ного периода. Латентный период можно увеличить, понижая температу-
ру. Можно также использовать бактерии, убитые нагреванием, если они
при этом не утрачивают способности адсорбировать фаг (некоторые фа-
ги, например фаг Т2, адсорбируются на убитых нагреванием клетках,
тогда как другие, например фаг Т1, Не адсорбируются). Фаговые ча-
стицы, необратимо адсорбировавшиеся на убитых нагреванием клетках,
теряются, так как они не образуют бляшек.
Процесс адсорбции фага во времени следует кинетике реакции пер-
вого порядка и зависит как от изменения концентрации бактерий, так
и от изменения концентрации фага
= KPfB\ = e~KBt, (IX. 1)
где Pf—концентрация свободного фага в расчете на 1 см3, Ро — исход-
ная концентрация фага, В — концентрация бактерий, К — константа
скорости адсорбции (имеет размерность см3 • мин~\ если t выражается
в минутах). Если К известно, то с помощью уравнения (IX. 1) можно пред-
сказать, какое количество фага адсорбируется на данном числе бактери-
альных клеток за определенный промежуток времени. Уравнение (IX. 1)
справедливо для смесей, содержащих избыточное количество фага (ча-
сто вплоть до значений Ро/В>100). Следовательно, еще задолго до пол-
ного заполнения всех рецепторных участков, имеющихся на поверхности
бактерии, на одной клетке может адсорбироваться много вирионов.
Отношение PaddB (среднее число адсорбировавшихся фаговых ча-
стиц, приходящееся на одну бактериальную клетку) называется множе-
ственностью заражения. (Этот термин часто используется также и в слу-
чаях, когда Радс!В<\.)
Следует отметить, что зависимость, выражаемая уравнением (IX.1),
соответствует наблюдаемой на практике при прерывании адсорбции фа-
га путем разбавления смеси.
В случае когда адсорбционная емкость отдельных бактериальных
клеток примерно одинакова, доля бактерий Вп)В, адсорбировавших
п частиц, подчиняется распределению Пуассона и определяется выраже-
нием
= (Радс1В)п е~(Радс1В)
В п\
а количество бактерий, не адсорбировавших фаг, — выражением
Вь = Ве-(радс!в\
В некоторых случаях адсорбция единичной фаговой частицы приводит к
гибели бактериальной клетки. В подобных случаях путем подсчета чис-
ла колоний, образуемых выжившими бактериями (Во), можно опреде-
156
Глава IX
лить отношение PadJB. Этот метод определения числа адсорбировавших-
ся фаговых частиц особенно удобен при изучении поврежденных или не-
полных фаговых частиц, неспособных к размножению, но тем не менее
убивающих бактерии.
Для определения концентрации фагов, составляющей несколько про-
центов от исходной и менее, уравнение (IX. 1) непригодно, ибо эта доля
фага хуже адсорбируется на бактериях, чем остальная часть его попу-
ляции. Тем не менее эта малая фракция популяции фага дает потомство,
обладающее нормальной адсорбируемостью. Возможно, что эта хуже-
адсорбирующаяся фракция образуется путем связывания обычным фа-
гом ингибиторов — фрагментов бактериальных клеток [712].
Химические вещества, необходимые для адсорбции
Адсорбция фага зависит от физиологического состояния бактерии
(имеется в виду, например, меньший размер старых бактериальных кле-
ток, образование бактериями слизи или капсулы и т. д.) и состава куль-
туральной среды. На бактериях, суспендированных в чистой дистиллиро-
ванной воде или в растворах, содержащих одновалентные ионы в кон-
центрации, не превышающей 10-4 М и меньшей, большинство фагов-
вовсе не адсорбируется. Для каждого фага, как и для каждого иона,
характерна своя, оптимальная, концентрация, обеспечивающая макси-
мальную скорость адсорбции. При концентрациях ионов, превышающих
оптимальные, скорость адсорбции уменьшается [856]. Ниже приведены
оптимальные концентрации ионов, необходимые для необратимой ад-
сорбции некоторых фагов на клетках Escherichia coli, штамм В [856]:
Фаг Оптимальные концентрации
Т1 5- 10-Ш Mg2+, Са2+, Ва2+, Мп2+, Zn2+;
10-Ш L1+-, Na+, К+, NH4+
Т2, Т4, Тб 10-Ш Na+, К+, NH4+
ТЗ 10-зм Na+, К+, NH4+
Т7 10-2М Na+, К+, NH4+; 10—ЗА1 Mg2+
При данных концентрациях ионов адсорбция фага происходит с мак-
симальной скоростью. Обратите внимание на то, что для серологически
родственных фагов ТЗ и Т7 величины оптимальных концентраций раз-
личны.
Если фаг адсорбировался на бактериях при малых концентрациях
катионов, то иногда, разбавляя суспензию или заменяя обычную среду
дистиллированной водой, удается отделить фаг от бактерий. В этом слу-
чае как элюировавшие фаги, так и освободившиеся от них бактерии не
отличаются от исходных [659]. С увеличением концентрации ионов обра-
тимая адсорбция «затмевается» быстро идущей необратимой фиксацией
фагов. При оптимальных условиях константа скорости адсорбции К для.
таких фагов, как, например, фаг Т2, равна примерно 3 • 10~9 см3 • мин-1
в расчете на одну бактерию. Эта величина приблизительно вдвое меньше
теоретической, рассчитанной исходя из допущения, что каждое столкно-
вение фага и бактерии ведет к фиксации фага. Как показал Дельбрюк
[176], значение /С=4лг2), где г — среднее значение радиуса бактерии,
a D — константа диффузии фага [176]. Этот факт наводит на мысль, что
фактором, лимитирующим скорость адсорбции фага, является не только
частота столкновений. Во всяком случае, предстоит еще выяснить, явля-
ются ли эффективными только те столкновения, при которых специфиче-
ские рецепторные участки фага и бактерии соответствующим образом
ориентированы друг относительно друга, или любое столкновение уве-
Взаимодействие бактериофага с бактерией
157
.личивает вероятность присоединения фага к бактерии. Для адсорбции
фаговых частиц на катионитах и на стекле (например, на пористых стек-
лянных фильтрах) необходимы примерно те же концентрации ионов, что
и для адсорбции на бактериях. Это говорит о том, что с биологической
точки зрения адсорбция фага является совершенно неспецифическим
процессом [659]. Вероятно, для адсорбции необходимо наличие опреде-
ленной мозаики распределения электрических зарядов на некоторых спе-
цифических участках поверхности фага.
Кофакторы адсорбции
Некоторые фаги, и в особенности фаг Т4, адсорбируются на бакте-
риях или на стеклянных фильтрах только при наличии в среде опре-
деленных кофакторов, наиболее эффективным из которых является
L-триптофан [19]. Кофакторной активностью обладает и ряд производных
триптофана, получаемых путем введения замещающих групп в арома-
тическое кольцо (например, 5-метилтриптофан). Напротив, введение ка-
ких-либо химических групп в а-аминопропионильную боковую цепь при-
водит к исчезновению кофакторной активности. Индол, один из аналогов
триптофана, выступает как его конкурент [179]; кроме того, он подавляет
-адсорбцию некоторых штаммов фага, не нуждающихся в кофакторах.
Кинетика активирующего действия триптофана достаточно сложна. Ами-
нокислота обратимо связывается с фагом, а зависимость активации и де-
зактивации от концентрации триптофана свидетельствует, что каждая
молекула триптофана обратимо и независимо захватывается фаговой ча-
стицей. Активация является следствием образования относительно ста-
бильной конфигурации, возникающей в том случае, когда вирион свя-
зывает пять или шесть молекул аминокислоты [814].
Известно, что для того, чтобы осуществилось присоединение фага Т4
к бактерии, нити его отростка должны находиться в вытянутом состоя-
нии (см. фото 23). Было обнаружено, что именно для этого необходимо
присутствие в среде ионов магния и триптофана, тогда как индол, на-
против, удерживает нити в сжатом состоянии [430]. Поэтому представля-
ется вероятным, что действие кофакторов состоит в изменении конфигу-
рации нитей отростка (в данном случае фага Т4) — органа, при помощи
которого фаг присоединяется к бактерии. Когда нити обвиты вокруг чех-
ла отростка, они, по-видимому, прикреплены своей средней частью к его
проксимальному сегменту. Находясь в таком состоянии, фаг не может
прикрепиться к бактерии. Однако, когда нити вытягиваются, фаг приоб-
ретает способность к адсорбции [102]. Обвитые вокруг чехла отростка
нити, по-видимому, прикрепляются к особой структуре вириона, вероят-
но представляющей собой белок. Особая фракция антител, содержащая-
ся в антисыворотке к фагу Т4 и отличающаяся от нейтрализующих ан-
тител, обладает способностью стабилизировать активированный трипто-
фаном фаг Т4 в адсорбируемом состоянии. Вероятно, благодаря действию
этих особых антител нити приобретают вытянутую форму [408].
Природа рецепторных участков фагов и бактерий
Структуры, при помощи которых фаги прикрепляются к чувствитель-
ным бактериям, являются частью белковой оболочки вирионов фага. Фа-
ги, имеющие отросток, присоединяются к бактерии именно при помощи
этого отростка. В случае если имеются нити отростка, то, как уже упо-
миналось выше, основным органом, ответственным за прикрепление фага
к бактерии, являются именно эти нити. Способ присоединения к бакте-
158
Глава IX
риям фагов, у которых не обнаружены нити отростка или отросток, не-
известен.
Что же касается бактерий, то, как правило, адсорбируют фаг лишь
те бактерии, которые в состоянии его вырастить. Известны, однако, исклю-
чения из этого правила. Так, наблюдались случаи, когда бактерии, весь-
ма отдаленные друг от друга в таксономическом отношении, адсорбиро-
вали фаг, размножения которого они не поддерживали. Было обнаруже-
но, что неродственные друг другу бактерии, адсорбирующие одни и те
же фаги, дают перекрестные серологические реакции. Как правило, на-
блюдается четкая корреляция между чувствительностью бактерий к
определенным бактериофагам и наличием у них определенных антигенов.
Например, фаги, активные по отношению к бактериям рода Salmonella,.
можно разделить на несколько групп, одни из которых активны только
по отношению к S-штаммам (штаммы, образующие гладкие колонии),
а другие — только по отношению к R-штаммам (штаммы, образующие
шероховатые колонии). Известно, что способность образовывать гладкие
и шероховатые колонии зависит от наличия у бактерии тех или иных
полисахаридов.
Некоторые фаги S. typhi специфичны по отношению к штаммам, со-
держащим Vi-антиген, присутствие которого характерно для вирулент-
ных штаммов. Эти фаги и их варианты используются для идентификации
тифозных бацилл методом фаготипирования [152]. Метод этот вообще
широко используется в эпидемиологических целях. Специфичность по
отношению к фагу определяется иногда наличием у бактерий специфи-
ческих клеточных рецепторов, а иногда — иными факторами, контроли-
рующими способность бактерии поддерживать размножение фага [18].
Способность специфических компонентов стенки бактериальной клет-
ки служить рецепторами для адсорбции фага была доказана эксперимен-
тально. В ряде опытов было продемонстрировано, что в экстрактах сте-
нок чувствительных к фагам бактериальных клеток содержатся веще-
ства, специфически связывающиеся с фагами и инактивирующие их.
Клеточная стенка кишечных бактерий представляет собой жесткую му-
кополисахаридопептидную решетку, окруженную фиксированными на
ней слоями липопротеидных молекул и прикрепленную к липополисаха-
риду, входящему в состав так называемого соматического антигена [530].
Бактериальные вещества, обладающие способностью инактивировать
фаг, иногда содержатся в одной фракции экстракта стенки бактериаль-
ной клетки, а иногда—в другой. Например, у Е. colt специфические ре-
цепторы для фагов Т2 и Тб, вероятно, являются липопротеидами, тогда
как специфические рецепторы для фагов ТЗ, Т4 и Т7, по-видимому,
представляют собой часть липополисахаридной структуры. Анализ Т5-
рецепторов, выделенных в чистом виде, показал, что каждый такой ре-
цептор, вероятно, представляет собой небольшую липополисахаридную
частицу, имеющую липопротеидную оболочку [899]. Из мутантных бак-
терий, устойчивых к фагу, не удалось выделить каких-либо специфиче-
ских «рецепторов», которые обладали бы способностью инактивировать
фаг. Более сложная ситуация наблюдалась при изучении грамположи-
тельных бактерий, клеточная стенка которых содержит более плотный
жесткий слой.
Рецепторные участки, ответственные за способность бактерии ад-
сорбировать данный фаг, могут обладать весьма специфическим хими-
ческим строением. Так, например, изменение одной связи между двумя
соседними мономерными звеньями полисахаридных цепей у Salmonella
(группа Е) приводит к исчезновению у этих бактерий рецепторов, спе-
цифичных для одних фагов, и к появлению рецепторов, специфичных для
других фагов (гл. XI, фиг. 58).
Взаимодействие бактериофага с бактерией
159
Окончательная природа взаимодействия между бактериальными
рецепторами и белками фага остается неясной. Очевидно, однако, что
фактором, определяющим возможность присоединения фага к бактерии,
является точное соответствие конфигурации некоторых химических групп,
расположенных на поверхности белка фага и стенки бактериальной клет-
ки соответственно. Лишь при осуществлении контакта между этими
группами возможно инициирование дальнейших реакций, необходимых
для последующих этапов взаимодействия фаг — клетка, в том числе и
для проникновения в клетку нуклеиновой кислоты фага.
По крайней мере две группы фагов обладают способностью специфи-
чески присоединяться к выростам бактериальной клетки. Фаг х адсор-
бируется только на жгутиках 1590], а затем, по-видимому, соскальзывает
вдоль жгутика к поверхности бактерии. Фаги второй группы — РНК-со-
держащие фаги Е. coll, специфичные по отношению к мужским штаммам
бактериальных клеток [939], — соединяются с некоторыми половыми вор-
синками, имеющимися только у мужских штаммов (мужским называет-
ся штамм, функционирующий при конъюгации в качестве донора генети-
ческого материала [402]). Сферические фаги, специфичные по отношению
к мужским штаммам, присоединяются к боковой поверхности половых
ворсинок, а нитевидные, как это видно на фото 38, — к кончику такой
ворсинки. По-видимому, половая ворсинка представляет собой полую
белковую трубку, внутри которой имеется канал диаметром менее 30 А.
Предполагают, что именно по этому каналу клеточная ДНК переходит
при конъюгации от мужских особей к женским. Поэтому разумно пред-
положить, что фаговая ДНК также может проникнуть в клетку через
этот канал [105].
Вместе с тем некоторые колифаги присоединяются как к мужским,
так и к женским штаммам, но реплицируются только в женских штам-
мах [158]. Очевидно, половой фактор F ограничивает некоторые этапы
репродукции этих фагов.
ЛАТЕНТНЫЙ ПЕРИОД ВНУТРИКЛЕТОЧНОГО РАЗВИТИЯ ФАГА
Основные проблемы репродукции фага
В течение промежутка времени, проходящего между адсорбцией фа-
га и лизисом, внутри бактериальной клетки образуется много фаговых
частиц. Иногда, однако, инфекция является абортивной. При этом фаго-
вые частицы не образуются, и клетка гибнет. Особым случаем является
лизис извне [177], наблюдаемый при адсорбции на бактерии очень боль-
шого числа фаговых частиц. В результате повреждается значительная
часть поверхности бактерии, что ведет к интенсивному истечению содер-
жимого клетки в культуральную среду. Если, однако, бактерия находит-
ся в аномальном физиологическом состоянии, аналогичный процесс мо-
жет возникнуть даже вследствие адсорбции всего нескольких фаговых
частиц.
В обычных условиях уже через несколько минут после заражения
бактериальной клетки вирусной частицей во внешнюю среду выделяется
несколько сот, а часто даже несколько тысяч фаговых частиц. Какова же
связь между исходной фаговой частицей, заразившей бактериальную
клетку, и фаговыми частицами, образовавшимися в результате этого за-
ражения? Содержится ли исходный вирион среди частиц-потомков? Или,
быть может, он отдает свое вещество какой-либо одной или многим из
таких частиц, а если да, то в какой форме? Каким образом инфицирую-
щий фаг контролирует образование и специфичность вновь синтезирую-
щихся фаговых частиц? Индуцирует ли он образование себе подобных
160
Глава IX
частиц путем трансформации предсуществовавших в клетке макромоле-
кул или направляет синтез вновь образующихся фаговых частиц из
неспецифических строительных блоков? И если верно второе предположе-
ние, то откуда берутся эти блоки — из бактериальной клетки, из внеш-
ней среды или из обоих этих источников? Кто создает структуры и сис-
темы, осуществляющие синтез и сборку новых фаговых частиц, — бакте-
рия или фаг? Какие типы механизмов действуют? И наконец, откуда
берется энергия, необходимая для синтеза новых фаговых частиц?
В следующих разделах содержится весьма разнообразная информа-
ция о процессах внутриклеточного развития фага. В результате выри-
совывается сложная серия событий, на соответствующих стадийх кото-
рых инфицирующие фаговые частицы вводят в бактериальную клетку-
хозяина свой генетический материал, изменяющий свойственную этой
клетке*схему процессов синтеза, используют ферментные системы клет-
ки-хозяина для производства энергии и образования строительных бло-
ков и «организуют» свою собственную репликацию. Подобное развитие
событий представляет собой истинный морфогенетический процесс, в хо-
де которого происходит постепенная и упорядоченная реализация гене-
тических потенций фага в пределах основной схемы клеточного метабо-
.лизма. В качестве конечных продуктов этого процесса образуются новые,
зрелые инфекционные фаговые частицы.
Преждевременный лизис и эклипс
Зараженные фагом бактерии можно разрушить через различные
♦промежутки времени после заражения, причем таким образом, чтобы не
повредить зрелый фаг. Этой цели можно достичь, используя декомпрес-
сию, действие поверхностно-активных веществ или вызывая лизис извне
с помощью какого-либо другого фага. Сначала в зараженной бактери-
альной клетке интактные инфекционные вирионы не выявляются. Этот
период инфекционного процесса называется эклипсом. Затем появляют-
ся зрелые вирионы, число которых все время возрастает, пока, наконец,
не начинается лизис (фиг. 34).
Наличие периода эклипса говорит о том, что заражение бактерии
фагом влечет за собой глубокую перестройку фагового материала. Объ-
яснить это удалось благодаря классическому опыту, который поставили
Херши и Чейз [342]. Эти авторы метили частицы фага Т2 радиоактивным
фосфором и радиоактивной серой, выращивая фаги на соответствую-
щей питательной среде, содержавшей эти изотопы (при этом в первом
случае вся радиоактивность была сосредоточена в нуклеиновой кислоте,
а во втором случае — в белке). Затем фаги очищали и использовали для
заражения немеченых клеток Е. coli, штамм В. Зараженные бактериаль-
ные клетки помещали в гомогенизатор Уоринга, где под действием
срезывающего усилия основная часть фагового белка отрыва-
лась от поверхности бактериальной клетки, однако процесс репродукции
фага не прерывался. Р32 (т. е. нуклеиновая кислота), содержавшийся в
инфицирующем фаге, очень быстро проникал внутрь бактерии и не уда-
лялся под действием срезывающих усилий (фиг. 35). Этот опыт показал,
что при заражении происходит отделение нуклеиновой кислоты фага от
основной массы его белков, остающихся на поверхности бактериальной
клетки.
Аналогичное разделение фага Т2 на фракцию, содержащую высоко-
полимерную ДНК, и богатую серой, но свободную от фосфора фракцию,
содержащую так называемые тени, можно получить при помощи осмоти-
ческого шока, т. е. путем быстрого разбавления дистиллированной водой
• фага, суспендированного в 4 М или 5 М растворе соли, у которой катион
Взаимодействие бактериофага с бактерией
161
и анион одновалентны [333], или воздействуя на фаг перхлоратом нат-
рия [248].
Нарисованная нами общая картина инъецирования фаговой нуклеи-
новой кислоты из белкового капсида внутрь бактериальной клетки, оче-
видно, имеет место при заражении, вызываемом любым фагом. Однако
столь легко продемонстрировать удаление белкового капсида фага с по-
верхности бактериальной клетки под действием срезывающих усилий уда-
ПроЪолжителъностъ инкубации в питательной среде при 37°мин
Фиг. 34. Преждевременный лизис клеток Е. coli, зараженных фагом Т4.
Из зараженной культуры брали пробы через различные промежутки времени и содержавшиеся В
пробах клетки подвергали лизису. С этой целью пробы разбавляли бульоном, содержавшим цианид
в концентрации IO-J М (цианид добавляли для того, чтобы приостановить дальнейшее образование
фага), а затем добавляли большое количество фага Тб с тем. чтобы вызвать лизис бактерий Про-
должительность инкубации означает время, прошедшее между моментом заражения и моментом
разбавления бактериальной суспензии раствором, содержащим цианид. Выход фага дан в процен-
тах от выхода, получаемого при естественном лизисе зараженных бактерий. В пробе, взятой через
10.5 мин, содержалось менее 0,01%. Кривая / демонстрирует результат одного опыта, при котором
на одной бактериальной клетке адсорбировалось в среднем семь вирионов фага Т4; кривая // — сум-
марный результат четырех опытов, при которых на одну клетку приходился один вирион; кривая
III — контроль. Контрольным служил опыт, при котором осуществлялся одиночный цикл размноже-
ния при заражении бактериальной клетки одним вирионом фага. Обратите внимание на то, что в
пробах культуры, бравшихся в интервале между нулевым временем и 13 мин после заражения, со-
держалось меньше инфекционного фага, чем в исходном инокулуме.
ется лишь в случае фагов, для которых характерно наличие хорошо вы-
раженного длинного отростка. Феномен инъекции позволил нам понять
как сущность периода эклипса, наступающего после заражения бакте-
риальной клетки фагом, так и то, почему антифаговая сыворотка не в
состоянии остановить начавшийся процесс репродукции фага. Очевидно,
что, осуществив инъекцию в бактериальную клетку своей нуклеиновой
кислоты, фаговая частица прекращает свое существование в виде орга-
низованной морфологической единицы.
Тени фагов, содержащие все поверхностные антигены фагового ви-
риона, остаются вне бактериальной клетки и, очевидно, не принимают
участия в процессе репродукции фага.
Кроме фаговой нуклеиновой кислоты внутрь бактериальной клетки-
хозяина инъецируется также небольшое количество внутреннего белка
11 Заказ № 1214
162
Глава IX
и некоторые другие вещества, в том числе основные олигопептиды и по-
лиамины [337].
Некоторые из этих веществ, вероятно, связаны с ДНК ионными свя-
зями, за счет чего отрицательный заряд ее молекулы становится несколь-
ко меньше. Функция внутреннего белка неизвестна. Олигопептиды, воз-
можно, являются фрагментами фаговых белков, попадающих внутрь ви-
риона в процессе его сборки.
Фиг. 35. Схематическое изображение процесса инъекции ДНК фага в бактериальную
клетку [342].
1 — исходный фаг и бактерия; 2 — адсорбция фага на бактерии; 3 — отделение ДНК фага (обозна-
чена точками) от его белковой оболочки; 4 — отделение белковой оболочки фага от бактерии под
действием срезывающего усилия, возникающего в гомогенизаторе Уоринга; 5 — образование нового
фага. Очевидно, что оболочка инфицирующего бактерию фага в этом процессе не участвует.
Проникновение в клетку
Фаги, подобные фагу Т2, инъецируют свою ДНК в клетку бактерии-
хозяина через отросток. Процесс инъекции состоит из серии весьма слож-
ных этапов [473]. Прикрепление к стенке бактерии сначала нитей отрост-
ка фага, а затем — базальной пластинки этого отростка с 6 зубцами,
по-видимому, «обнажает» фермент фага, атакующий стенку клетки.
В результате от клеточной оболочки отделяется некий компонент, веро-
ятно Zn2+, вызывающий сокращение чехла отростка, так что из 24 вит-
ков, на каждый из которых приходится 6 субъединиц, образуется 12 вит-
ков из 12 субъединиц [22]. Этот механизм имеет ряд характерных осо-
бенностей, напоминающих мышечное сокращение. Очевидно, что у этих
двух процессов имеются некоторые общие черты, проявляющиеся на мо-
лекулярном уровне. Так, в отростке фага Т2 содержится около 100 мо-
лекул АТФ, около 100 ионов кальция и некоторые производные фолиевой
кислоты, функция которых неизвестна [474]. АТФ, по-видимому, прини-
мает участие в процессе сокращения чехла (фото 39), в результате ко-
торого полый стержень отростка как бы вонзается в стенку клетки,
после чего ДНК инъецируется внутрь клетки как сквозь иглу шприца.
У различных фагов процесс инъекции происходит по-разному. На-
пример, фаг Т5 инъецирует всю ДНК только в бактерии, синтезирующие
в момент инъекции белки. Если синтез белка подавлен, то в бактерию
инъецируется только часть ДНК, составляющая примерно 8% генома
фага [489]. По-видимому, первая часть инъецируемой ДНК индуцирует
в клетке какой-то неизвестный пока процесс, способствующий дальней-
шему проникновению в клетку остальной части ДНК фага.
Механизм, ответственный за введение в бактериальную клетку ДНК
фагов, имеющих форму икосаэдра, у которых отсутствует отросток, пока
неизвестен. В процессе заражения бактериальных клеток РНК-содержа-
щими фагами, специфичными по отношению к мужским штаммам бакте-
рии, можно выделить короткий период времени, когда РНК фага чув-
ствительна к действию рибонуклеазы, так что в присутствии этого фер-
Взаимодействие бактериофага с бактерией
163
мента заражения бактерий такими фагами не происходит [634]. Вероятно,
РНК фага подвергается действию рибонуклеазы во время пребывания
в половой ворсинке бактерии.
Часто вслед за проникновением в клетку фаговой нуклеиновой кис-
лоты наблюдается истечение в культуральную среду ряда клеточных
макромолекул, в особенности РНК. Истечение, однако, быстро прекра-
щается благодаря «зарастанию» отверстия, сквозь которое оно происхо-
дит.
Изменения в строении мембраны бактериальной клетки, происходя-
щие при ее «зарастании», возможно, ответственны за то, что новые фаго-
вые частицы, адсорбирующиеся на поверхности бактериальной клетки че-
рез несколько минут после заражения, часто не в состоянии принять уча-
стие в начавшемся процессе размножения фага (гл. X) и изливают свою
нуклеиновую кислоту в окружающую среду.
ПРОЦЕССЫ БИОСИНТЕЗА,
ПРОИСХОДЯЩИЕ В ЗАРАЖЕННЫХ ФАГОМ КЛЕТКАХ
После проникновения в клетку фаговой нуклеиновой кислоты собы-
тия развертываются таким образом, что приводят либо к продуктивно-
му циклу размножения фага, либо к лизогении. Изучение последователь-
ности этих событий явилось одной из самых увлекательных и впечатляю-
щих глав молекулярной биологии.
Источники материала, используемого при биосинтезе фага
С помощью соответствующей изотопной метки инфицирующего фага,
незараженных бактерий, соединений, входящих в состав культуральной
среды, а также путем анализа очищенных препаратов зрелого фага мож-
но определить, какие из компонентов изучаемой системы служат источни-
ком материала, входящего в состав нового фага. Обычно при анализе
процесса образования фаговой ДНК пользуются Р32 или меченым ти-
мидином, при анализе процесса образования фаговой РНК — меченым
урацилом, а при анализе процесса образования фаговых белков—мече-
ными аминокислотами или S35. При анализе указанных процессов исполь-
зовали также метку тяжелыми изотопами — N15 (в виде N15H4) и
дейтерием (в виде D2O), — а также 5-бромурацилом (это соединение мо-
жет заменять тимидин) в сочетании с центрифугированием в градиенте
плотности, ибо метка тяжелыми изотопами приводит к увеличению плот-
ности соответствующих соединений.
Основные выводы из этих исследований (данные получены главным
образом при изучении Т-четных фагов) таковы:
1. Примерно 50% фосфора и оснований, входящих в состав нуклеи-
новой кислоты инфицирующего фага, переходит в состав потомства фага.
Потери обусловлены главным образом недостаточной эффективностью
инфекционного процесса. При этом некоторые инфицирующие частицы
теряются для потомства в результате абортивной инфекции, а часть из
тех, которые развиваются далее, вследствие того что оказываются сфор-
мированными не полностью. Родительские молекулы ДНК фага либо во-
обще не разрушаются до мелких кислоторастворимых фрагментов, либо
разрушаются в очень малой степени. Что же касается белков, то лишь
незначительная часть внутреннего белка исходного фага включается в
состав вновь синтезирующейся популяции вирионов.
В случае таких фагов, как Т2 и Т4, ДНК, содержавшаяся в роди-
тельской частице, распределяется между многими частицами фагового
потомства [47]. При репродукции две цепи родительской ДНК разделя-
11*
164
Глава IX
ются, так что родительская ДНК выявляется в геноме потомства в виде
фрагментов, спаренных с вновь синтезированными комплементарными
непями-партнерами (полуконсервативная репликация ДНК). Молекулы
фаговых ДНК, меньшие по длине, более устойчивы к разрывам. Поэтому
у таких фагов, как фаг X, в частицах-потомках обнаруживаются цельные
цепи родительской ДНК [589]. Как правило, родительские цепи спарены
с вновь синтезировавшимися цепями ДНК. Однако в небольшом числе
случаев они остаются связанными с исходными цепями-партнерами, что
свидетельствует о возможности включения в зрелую частицу нереплици-
ровавшегося элемента ДНК. Опыты по изучению генетических рекомби-
наций у фагов с меченой ДНК показывают, что разрывы и воссоединения
фрагментов происходят и при репликации таких фагов, как фаг X (гл. X).
2. При репродукции таких фагов, как Т2 или Т5, происходит интен-
сивный распад ДНК клетки-хозяина до нуклеотидов. Впоследствии эти
нуклеотиды включаются в фаговую ДНК. При необходимости они сна-
чала превращаются в фагоспецифичные нуклеотиды (например,
дЦМФ-^дОМФ). Эндогенные дезоксирибонуклеотиды, смешиваясь с де-
зоксирибонуклеотидами, синтезированными из компонентов культураль-
ной среды, образуют фонд низкомолекулярных предшественников, кото-
рые в свою очередь поступают в фонд молекул — предшественников фа-
говой ДНК. Поскольку при синтезе молекул ДНК отсутствует избира-
тельное использование предшественников, частицы фага, образующиеся
в конце инфекционного процесса, как правило, содержат пропорциональ-
но меньшее количество нуклеотидов, входивших в состав разрушенной
бактериальной ДНК, чем частицы, образовавшиеся в начальный период
заражения.
Степень использования нуклеотидов, входящих в состав ДНК клет-
ки, для образования фаговой ДНК сильно варьирует от одного вида фага
к другому. При размножении одних фагов ДНК потомства фага почти
целиком образуется из нуклеотидов, ранее входивших в состав бактери-
альной ДНК, при размножении других — почти целиком из нуклеотидов,
синтезировавшихся из предшественников, поступивших в зараженную
клетку из культуральной среды.
3. Белки вирионов фага в основном синтезируются de novo из ком-
понентов, поступающих в клетку из культуральной среды. Однако не-
большая часть аминокислот, выявляемых в фаговых белках, происходит
из материала бактериальной клетки, причем даже в тех случаях, когда
в клетках содержится совсем мало свободных аминокислот, как это, на-
пример, имеет место у грамотрицательных бактерий. Эти данные наводят
на мысль, что при инфекции в какой-то мере происходит распад белков
клетки-хозяина.
Биосинтез вирионов
Две особенности фагов Т2 и Т4 делают их незаменимыми для изу-
чения биохимических процессов, происходящих при биосинтезе фага.
Во-первых, благодаря тому что в состав их ДНК вместо цитозина вхо-
дит оксиметилцитозин (ОМЦ) [927], возможно изучение динамики и на-
копления фаговой ДНК в присутствии ДНК клетки-хозяина. Во-вторых,
эти фаги представляют собой гиперагрессивные фаги, в результате взаи-
модействия с которыми почти мгновенно прекращается синтез ДНК,
РНК и белков, специфичных для клетки-хозяина. Поэтому в бактериаль-
ных клетках, зараженных этими фагами, синтезируются только макромо-
лекулы, детерминированные геномом фага. Очевидно, что выявление со-
ответствующих фаз биосинтеза у тех фагов, в результате взаимодействия
Взаимодействие бактериофага с бактерией
165
с которыми синтез бактериальных макромолекул не прекращается, явля-
ется значительно более сложной задачей.
В период, непосредственно следующий за заражением бактерий фа-
гом Т4 или каким-либо другим родственным ему фагом, синтез белка в
целом продолжается с прежней интенсивностью, тогда как увеличение
содержания в клетке ДНК и РНК прекращается [144]. Однако вскоре
Фиг. 36. Динамика биосинтеза в клетках Е. coli, зараженных фагом Т4.
Пунктирными линиями в нижней части фигуры обозначен синтез соответствующих ферментов в бак-
териальных клетках, зараженных условным мутантом фага, неспособным инициировать репликацию
ДНК. / — общий белок; // — фаговая ДНК; /// — белок вириона; /V — инфекционные вири >ны;
V — общая РНК; V/ — бактериальная ДНК; V//— общая ДНК; V/// —лизоцим фага; IX — ранние
ферменты фага; X — бактериальные ферменты.
после этого синтез ДНК возобновляется и идет со скоростью даже боль-
шей, чем в незараженных бактериях (фиг. 36). Вновь синтезирующаяся
ДНК представляет собой фаговую ДНК, которая в этот период не на-
ходится в комплексе с каким-либо из характерных белков фагового ви-
риона [464]. Общее содержание РНК в клетке остается приблизительно
постоянным. Однако небольшая фракция РНК, выявляемая при помощи
импульсной метки (Р32-фосфат или С14-урацил), синтезируется очень
быстро, но столь же быстро и распадается. Эта быстро обменивающаяся
фракция РНК является информационной РНК фага. По составу осно-
ваний она сходна с фаговой ДНК, может гибридизоваться с денатуриро-
ванной нагреванием одноцепочечной фаговой ДНК и при гибридизации
конкурирует с РНК, транскрибируемой in vitro РНК-полимеразой с мат-
рицы фаговой ДНК [296].
Обнаружение этой быстро обменивающейся фагоспецифичной РНК
[878] сыграло важную роль в открытии m-РНК и послужило одним из
166
Глава IX
доказательств того, что именно информационная, а не рибосомная РНК
определяет специфичность белков. Соответствующий эксперимент был
проведен следующим образом [104].
Незараженные бактерии метили N15 и С13, в результате чего рибо-
сомы этих бактерий становились «тяжелыми». Затем «тяжелые» бакте-
рии заражали фагом и тяжелые изотопы заменяли N14 и С12 с тем, что-
бы вновь синтезированный в зараженной клетке материал был бы «лег-
ким». Синтезирующуюся в зараженных клетках РНК метили Р32. Через
несколько минут после заражения клетки экстрагировали и выделенную
из экстракта фракцию рибосом анализировали при помощи центрифуги-
рования в градиенте плотности. Таким путем было обнаружено, что
в зараженных клетках образуется комплекс, состоящий из вновь синте-
зировавшейся «легкой» m-РНК и предсуществовавших в клетке «тяже-
лых» рибосом. Следовательно, фагоспецифичным может быть только
«легкий» компонент, а не рибосомы.
ДНК некоторых фагов, в том числе ДНК фага а В. megaterium
и ДНК фага SP8 В. subtilis, обладают интересной особенностью. У этих
ДНК различие в среднем нуклеотидном составе цепей, образующих их
двухспиральную молекулу, достигает такой величины, что, центрифуги-
руя в градиенте плотности предварительно расплавленную ДНК, можно
получить соответствующие цепи в виде двух раздельных фракций. За-
тем отделенные друг от друга «тяжелые» и «легкие» цепи можно исполь-
зовать для того, чтобы выяснить, одна или обе цепи ДНК фага служат
матрицей для синтеза m-РНК в зараженной бактериальной клетке. На-
пример, если матрицей для синтеза m-PHK in vivo служит только «тя-
желая» цепь ДНК, то m-РНК, экстрагированная из зараженных бакте-
рий, будет образовывать гибридные комплексы только с этой цепью.
Опыт показал, что это предположение действительно справедливо [5].
Было показано, что даже в том случае, когда синтез m-РНК идет
in vitro, но в качестве матрицы используется недеградированная высоко-
молекулярная фаговая ДНК, а транскрипция ДНК катализируется очи-
щенным препаратом РНК-полимеразы, полученной из Е. coli, матрицей
для синтеза m-РНК служит только одна из цепей ДНК—та самая, ко-
торая используется в качестве матрицы и при синтезе m-PHK in vivo
[259, 296].
Поскольку т-РНК бактериальных клеток — нестабильная молекула,
то блокированием синтеза m-PHK клетки-хозяина можно объяснить пре-
кращение синтеза ферментов клетки-хозяина. Белки, синтезирующиеся
вскоре после заражения бактерии фагом, представлены лишь неболь-
шим количеством внутреннего белка фага и рядом новых ферментов, не-
обходимых для биосинтеза компонентов, из которых образуется фаговая
ДНК (см. ниже). На ранней стадии периода эклипса специфические бел-
ки вириона фага, выявляемые при помощи антифаговых антител, не син-
тезируются вовсе. На этой стадии репродукции фага вновь синтезирую-
щаяся фаговая ДНК не связана с фаговыми белками. Эта ДНК обра-
зует внутри бактерии одну или несколько зон скоплений (фондов), легко
выявляемых при помощи электронного микроскопа (фото 40). При за-
ражении бактерий фагами Т2, Т4, Т5 или родственными им фагами, вы-
зывающими тяжелые повреждения нормальных структур бактериальной
клетки, этот «морфологический фонд» фаговой ДНК заменяет ядерный
аппарат бактерии. Эти изменения могут быть также выявлены и при
помощи цитохимических методов (фото 41).
Количество фаговой ДНК-предшественника можно определить пу-
тем импульсной метки Р32 или меченым тимидином (фонд фаговой ДНК-
предшественника; см. [335]). Количество этой ДНК в 30—40 раз превы-
шает количество ДНК, содержащееся в одной фаговой частице, т. е. при-
Взаимодействие бактериофага с бактерией
16/
мерно соответствует 30—40 «фаговым эквивалентам». Если на этой
стадии удается экстрагировать недеградированную фаговую ДНК, то
часто в ней можно обнаружить более длинные нити, чем нить ДНК, со-
держащаяся в единичной фаговой частице. Эти данные указывают на
существование связи между фаговыми геномами (гл. X). Впоследствии
фаговая ДНК начинает конденсироваться в морфологически выявляемые
элементы, похожие по форме на головку фага [442] (фото 42). Если до
начала конденсации ДНК добавить к системе какой-либо ингибитор син-
теза белка, например хлорамфеникол, то количество ДНК продолжает
увеличиваться, но конденсации ее не происходит, а образуется гигант-
ский фонд ДНК. Механизм, ответственный за конденсацию ДНК, пока
остается неизвестным. Изучение условных мутантов (гл. X) показало
наличие корреляции между процессом конденсации ДНК и процессом
биосинтеза основной массы белков, образующих белковую оболочку го-
ловки фага.
Белки вириона начинают появляться примерно по окончании первой
трети латентного периода, в результате чего в зараженной клетке обра-
зуется фонд предшественника фагового белка. Вскоре затем образуются
цельные фаговые частицы. В это же время в клетке появляется фермент,
или лизин, сходный с содержащимся в яичном альбумине лизоцимом,
который в конце концов вызывает лизис клетки.
Изучение химического состава фагов, созревающих через различные
промежутки времени после заражения, показывает, что в процессе соз-
ревания в состав фага включаются компоненты, извлекаемые наугад из
различных фондов предшественников фага. Следовательно, компоненты,
используемые для сборки определенной фаговой частицы, не обязательно
должны синтезироваться в одном месте. Справедливость этого положе-
ния отчетливо выявляется при фенотипическом смешивании. Так, на-
пример, при специфическом заражении одной и той же бактериальной
клетки двумя мутантами фага Т2 или фага Т4, отличающимися друг от
друга по структуре нитей отростка, нити одного специфического типа мо-
гут оказаться присоединенными к вириону, содержащему ДНК другого
типа. Следовательно, в данном случае образуются вирионы, фенотип ко-
торых не соответствует их генотипу [625].
При лизисе зараженных бактерий в культуральную среду выделяют-
ся не только структурно завершенные фаговые частицы, но также и смесь
различных неполных фаговых компонентов: пустые головки (которые ис-
ходя из их изображения в электронном микроскопе были названы «буб-
ликами» 1181]), пустые тени и свободные молекулы белков и ДНК. Не-
которые из этих компонентов, по-видимому, являются неиспользованны-
ми предшественниками фага, другие, возможно, образуются при распаде
собранных не до конца вирионов.
Изучение многих самых различных фагов показало, что созревание
вирионов всегда происходит путем сборки раздельно синтезированных
компонентов. Некоторые вещества, как, например, профлавин и другие
акридиновые красители, обладают способностью препятствовать осу-
ществлению некоторых фаз процесса созревания фага. Поэтому при до-
бавлении таких веществ в культуральную среду из зараженных бактерий
выделяется не зрелый фаг, а разрушенные, неполные фаговые частицы
[181].
Ферментативные процессы, происходящие при синтезе фага
Для того чтобы осуществился биосинтез ДНК и белков фага, необ-
ходим не только состоящий из многих компонентов синтетический аппа-
рат клетки (рибосомы, транспортные РНК, различные ферменты), но
168
Глава IX
также и источник энергии и низкомолекулярные предшественники (ну-
клеозидтрифосфаты, аминокислоты и т. д.). Что касается источника энер-
гии и аминокислот, то здесь ситуация совершенно ясна: они доставляют-
ся ферментативным аппаратом клетки-хозяина. Например, если клетка
теряет способность использовать определенные источники энергии или
становится неспособной синтезировать какую-либо аминокислоту, то по-
дУЛФ дУТФ ЦДФ
дУМФ ЭЦДФ
Бактершыь-
наяДНК ”
©®
Фиг. 37. Ферментативный биосинтез ДНК фага Т4 и сопутствующие этому синтезу
реакции.
Указанными ниже номерами обозначены ферменты, активность которых либо выявляется только
после заражения бактериальной клетки, либо возрастает после заражения, / — эндонуклеаза: 2 —
экзонуклеаза: 3 — дезоксицитидинтрифосфатаза, дезоксицитидиндпфосфатаза. дезоксиуридинтри-
фосфатаза или дезоксиуридиндифосфатаза: 4 — тимидилатсинтетаза; 5 — дигидрофолатредуктаза;
6 — цитидиндифосфатредуктаза; 7 — дезоксицитидилатоксиметилаза: 8 — дезоксинуклеотидкнназа;
9 — дезоксицитидилатдезаминаза; 10 — ДНК-полимераза; // — а-глюкозилтрансфераза; 12 — 0-глю-
коз ил трансфер аза; 13 — ДНК-метилаза; 14 — ДНК-киназа.
следствия этих изменений сохраняются и во время воспроизведения фага
[144]. Следовательно, большинство ферментов клетки продолжает функ-
ционировать и в зараженных фагами клетках даже в том случае, когда
в результате заражения синтез белков клетки-хозяина подавляется.
Совершенно иная ситуация имеет место при синтезе компонентов ну-
клеиновой кислоты (см. обзоры [145, 146]). Наиболее четко это демон-
стрируют результаты, полученные при изучении воспроизведения Т-чет-
ных фагов в клетках Е. coli. ДНК этих фагов содержит глюкозилирован-
ный ОМЦ (см. табл. 17). ОМЦ не синтезируется незараженными
бактериями и не утилизируется ими даже в том случае, если он добавлен
к культуральной среде. В зараженной клетке благодаря действию фер-
мента дЦМФ-оксиметилазы образуется производное ОМЦ — 5-оксиме-
тилдезоксицитидилат (дОМФ) (фиг. 37). дЦМФ-оксиметилаза появля-
Взаимодействие бактериофага с бактерией
169
ется в клетке через несколько минут после заражения. Структура этого
фермента детерминируется структурным геном, содержащимся в геноме
фага, ибо мутация, затрагивающая специфический цистрон генома фага
(ген 41; см. гл. X и фиг. 44), приводит к появлению в зараженной клетке
измененной формы этого фермента.
Описанный фермент представляет собой только один из нескольких
ферментов, появляющихся в бактериальной клетке после заражения ее
фагом. Другим ферментом является тимидилатсинтетаза, которая ката-
лизирует реакцию дУМФ-^дТМФ. Тимидилатсинтетаза обычно содер-
Таблица 17
Содержание глюкозилированного оксиметилиитозинде-
зоксирибозида в ДНК Т-четных фагов [502]
ОМЦ: R=H
а-Глюкозил-ОМЦ: R^a-Ппокозил
fl-Глюкозил - ОМЦ: R- fl-Глюкозил
А(1-6)-Глюкозил-
а-глюкозил-ОМЦ: R-р(1-6)-Глюко-
зил-а-глюкозил
Фаг
ОМЦ
а- Глюко-
зил-ОМЦ
Р-Глюко-
зил-ОМЦ
3 (1—6)-Глюкозил-
а-глюкозил-ОМЦ
Т2 25%
Т4 0
Тб 25%
70%
70%
3%
0
30%
0
5%
0
72%
жится в клетках Е. coli. Однако даже мутантные штаммы бактерий, не
содержащие тимидилатсинтетазы, начинают синтезировать этот фермент
после заражения Т-четными фагами. Благодаря этому даже в отсутст-
вие тимина в культуральной среде в зараженных мутантных клетках
синтезируется фаговая ДНК и образуется некоторое количество фага.
На схеме, изображенной на фиг. 37, приведен ряд других ферментов,
синтезирующихся в бактериальной клетке после ее заражения Т-четными
фагами. Некоторые из функций, выполняемых этими ферментами, неза-
раженная бактериальная клетка вовсе не в состоянии осуществить. К чис-
лу таких функций относятся, например, введение глюкозы в остаток ОМЦ
фаговой ДНК, катализируемое ферментом, глюкозилирующим ОМЦ
[471], и превращение предшественников бактериальной ДНК в соедине-
ния, используемые при синтезе фаговой ДНК (это превращение катали-
зируется несколькими другими ферментами). В качестве примера одного
из таких процессов можно указать на превращение дЦТФ и дЦМФ, в ре-
зультате чего исключается возможность использования дЦТФ в каче-
стве субстрата для синтеза клеточной ДНК и образуется субстрат, необ-
ходимый для действия дЦМФ-оксиметилазы. В качестве примера другой
группы детерминируемых фагом ферментов, «двойники» которых при-
сутствуют в клетке до заражения, можно привести тимидилаткиназу и
ДНК-полимеразу. При заражении фагом Т4 образуется также одна
ДНК-аза (а быть может, и несколько).
170
Глава IX
По неизвестным причинам для синтеза фага Т4 некоторые новые фа-
госпецифичные ферменты необходимы даже в том случае, если в клетке
имеются свои ферменты, способные осуществлять аналогичные функции.
Так, мутантные фаги, образующие дефектную ДНК-полимеразу (цист-
рон 43), неспособны индуцировать репликацию собственной ДНК [880].
Интересно, что in vitro фаговая ДНК может копироваться ДНК-полиме-
разой из Е. coli, тогда как для синтеза фаговой ДНК in vivo необходи-
ма фагоспецифичная ДНК-полимераза.
Кроме ферментов, приведенных на фиг. 37, в бактериальных клетках,
зараженных фагом Т4, синтезируется несколько других фагоспецифичных
белков, причем некоторые из них появляются вскоре после заражения,
еще до появления упоминавшихся выше ферментов. Эти дополнительные,
индуцируемые фагом белки были открыты при помощи электрофореза
в геле [512], и, по-видимому, они также являются ферментами, или им
присущи функции регуляторов действия генов фагового и бактериального
геномов.
Ситуация, близкая к наблюдаемой у Т-четных фагов, была обнару-
жена при изучении нескольких вирулентных фагов В. subtilis, в ДНК ко-
торых вместо тимина содержится урацил или 5-оксиметилурацил. При
воспроизведении этих фагов также ингибируются образуемые клеткой
ферменты, катализирующие образование тимина, и появляются новые
ферменты, необходимые для синтеза нуклеотидов фаговой ДНК [27]. Не-
которые другие фаги, несмотря на то что в состав их ДНК не входят ка-
кие-либо необычные основания, также индуцируют образование новых
ферментов, необходимых для синтеза их ДНК. Так, например, колифаг
Т5 вызывает образование как новой специфической тимидилатсинтетазы,
так и новой специфической ДНК-полимеразы [631].
Ни один из упоминавшихся выше ферментов, необходимых для син-
теза компонентов-предшественников ДНК, не был обнаружен в клетках,
зараженных умеренными фагами, например фагом Л, ДНК которых по
составу весьма близка к ДНК клетки-хозяина. Все же и при заражении,
вызываемом умеренными фагами, синтезируется ряд важных ферментов,
детерминируемых фагом, — так называемых «ранних ферментов», вклю-
чая и экзонуклеазу [469]. Роль, которую играют эти, а также и другие
ферменты, детерминируемые умеренными фагами, рассматривается в
гл. XI.
В клетках Е. coli, зараженных фагом Т4, в период, когда начинается
синтез новой фаговой ДНК, внезапно прекращается синтез ранних фер-
ментов. Эти два события отчетливо коррелируют друг с другом. В слу-
чаях, когда синтез новой ДНК начаться не может, например при зара-
жении бактерий мутантными фагами, неспособными синтезировать ДНК,
или фагами, инактивированными ультрафиолетом [219], интенсивный
синтез ранних ферментов продолжается и тогда, когда обычный срок их
синтеза заканчивается [186, 912]. Синтез ранних ферментов и синтез бел-
ков капсида фага, по крайней мере при нормальных условиях, по-види-
мому, являются взаимоисключающими процессами, поскольку белки
капсида образуются только после того, как начинает синтезироваться но-
вая ДНК. Процессы, регулирующие реализацию и последовательность
считывания различных групп генов фага (гл. X и XI), пока все еще не
выяснены. Можно полагать, что их объяснение явится важным шагом
на пути к пониманию механизмов, обусловливающих — на клеточном
уровне — процессы последовательного развития организма.
Неизвестно, регулируется ли последовательность считывания генов
фага на уровне транскрипции (синтез m-РНК на ДНК-матрице) или
на уровне синтеза белка. Как показали эксперименты, в основе которых
лежало использование методов гибридизации и конкурентного замеще-
Взаимодействие бактериофага с бактерией
171
яия, m-РНК, синтезируемая вскоре после заражения, соответствует ог-
раниченному участку генома фага [305]. Этот вывод справедлив как в
-отношении фага X, так и в отношении фага Т4. Даже в том случае, когда
ДНК фага Т4 используется в качестве матрицы для транскрипции, осу-
ществляемой в опытах in vitro РНК-полимеразой из Е. coli, предпочти-
тельно транскрибируется часть ДНК, соответствующая ранним генам
[258].
Что же касается прекращения синтеза ранних ферментов, то это яв-
ление, вероятно, вызвано не прекращением синтеза ранней ап-РНК, а ин-
гибированием ее трансляции, ибо ранняя иг-РНК продолжает выявлять-
ся в зараженных клетках и после прекращения синтеза ранних фер-
ментов.
Инфекционная фаговая нуклеиновая кислота
Е. coli относится к числу тех бактерий, у которых еще не была об-
наружена способность к трансформации, т. е. к захвату из внешней сре-
ды и включению в геном клетки фрагментов хромосомной ДНК. Наличие
инфекционных свойств у фаговых компонентов, менее полных, чем ин-
тактный вирион фага, впервые было продемонстрировано опытами, в ко-
торых обработанные мочевиной частицы Т-четных фагов, так называе-
мые л-частицы, инициировали нормальное заражение сферопластов
Е. coli. (Сферопластами называют клетки, лишенные большей части кле-
точной стенки вследствие обработки их этилендиаминтетраацетатом
(ЭДТА) и лизоцимом [556].) Инфекционные свойства л-частиц изменя-
ются под действием трипсина, но не изменяются под действием ДНК-азы.
По-видимому, л-частицы представляют собой вирионы с измененными
сократительными структурами отростка, способные, однако, инъециро-
вать свою ДНК в мембрану сферопласта [606].
При помощи л-частиц было показано, что фрагменты чистой фаго-
вой ДНК также могут проникать в сферопласты Е. coli. Когда сферо-
пласты подвергали действию смеси л-частиц фага Т4 и фрагментов ДНК,
полученных из мутантного фага Т4, то некоторая часть фагового потом-
ства приобретала генетические признаки, свойственные свободной ДНК.
Эти фаги возникали благодаря рекомбинации между геномом л-частицы
и фрагментами ДНК [280].
Полученные тем или иным методом сферопласты Е. coli можно за-
разить, правда с небольшой эффективностью, также и ДНК фага лис
большей эффективностью — одноцепочечной ДНК фага <рХ174 или ее
двухцепочечной репликативной формой ([303]; см. ниже).
Интересное явление было обнаружено при изучении фага X и род-
ственных ему фагов. Оказалось, что нормальные клетки Е. coli можно
также заразить одной лишь фаговой ДНК, но при условии, что их одно-
временно заражают нормальным фагом X (фаг-помощник). Механизм
действия фага-помощника неизвестен. При этом либо молекула ДНК
фага X полностью, либо ее фрагменты могут проникнуть в бактерию и
затем передать соответствующие генетические маркеры фаговому по-
томству [427]. Поскольку возможно физически отделить друг от друга
«правые» и «левые» половины молекулы ДНК фага X, совместное зара-
жение бактерий фагом-помощником и одним из этих фрагментов позво-
ляет установить, в каком из фрагментов локализованы соответствующие
гены фага [428, 663].
В случае фагов, размножающихся на легко трансформируемых бак-
териях, таких, например, как В. subtilis, заражение «голой» ДНК осу-
ществляется сравнительно легко при условии, что фаговой ДНК зара-
жают клетки, находящиеся в таком физиологическом состоянии, при ко-
172
Глава IX
тором они чувствительны к трансформирующему действию ДНК. Веро-
ятно, это физиологическое состояние соответствует той фазе роста, при
которой клеточная стенка и плазматическая мембрана бактериальной
клетки несколько модифицированы [688]. В литературе сообщалось, что
компетентные клетки В. subtilis могут даже захватывать ДНК вирусов
осповакцины или полиомы и давать урожай этих вирусов [2, 56]. Эти
удивительные результаты требуют, однако, дальнейшего подтверждения.
Значение обсуждавшихся выше открытий свидетельствует не только-
о том, что генетический код должен быть почти одинаков как у бактерий,
так и у клеток млекопитающих. Эти открытия одновременно говорят о
том, что при наличии соответствующего механизма практически любой
фрагмент генетического материала может проникнуть в любую клетку
и затем начать функционировать в ней (за исключением случаев, при ко-
торых в клетке функционирует специфический механизм отторжения;
см. гл. X). Будет ли воспринятый клеткой фрагмент генома размножать-
ся или нет, это, вероятно, зависит от того, обладает ли он собственным
«репликоном», т. е. структурой, инициирующей репликацию (гл. XI).
Репродукция фагов, содержащих одноцепочечную ДНК
Две группы колифагов, а именно фаг <рХ174 и группа нитевидных
фагов, специфичных по отношению к мужским штаммам, содержат од-
ноцепочечную ДНК, молекулярный вес которой составляет примерно
Родительская
цепь РФ
0-0}'
Фиг. 38. Схема, изображающая процесс репликации ДНК фага <р XI74 [174].
1,7 106 дальтон. Каждая молекула такой ДНК не имеет свободных вто-
ричных фосфатных групп и представляет собой замкнутое кольцо [226].
ДНК, выделенной из очищенных вирионов, можно заразить сферопла-
сты Е. coli.
Взаимодействие бактериофага с бактерией
173
Как же репродуцируется такой фаг? Согласно современным пред-
ставлениям, после проникновения в клетку-хозяина молекула одноцепо-
чечной ДНК фага qpX174 (механизм выхода ДНК из мелких вирионов,
имеющих форму икосаэдра, пока неизвестен) быстро превращается в
двухцепочечную кольцевую репликативную форму (РФ) ([184]; фиг. 38).
Превращение одноцепочечной ДНК в двухцепочечную репликативную
форму, по-видимому, катализируется бактериальной ДНК-полимеразой,
ибо этот процесс наблюдается также в случае ингибирования синтеза
«белка. Плюс-цепь (т. е. цепь, содержащаяся в вирионе) направляет син-
тез комплементарной ей минус-цепи.
РФ-молекулы инфекционны для сферопластов. Синтез РФ-молекул
продолжается в течение нескольких минут, затем прекращается, после
чего начинает накапливаться фонд одноцепочечных колец плюс-типа,
включающихся впоследствии в состав вновь образующихся вирионов фа-
га. Плюс-цепи инфицирующих частиц фага <рХ174, по-видимому, не вхо-
дят в состав вирионов-потомков. Однако родительская ДНК другого фа-
га, также содержащего одноцепочечную ДНК, так называемого фага fd,
обнаружена в потомстве этого фага. Детали механизма репликации ДНК
у фагов этих групп пока неясны. Вероятно, образование одноцепочечных
плюс-колец на РФ-матрице катализируется каким-то специальным фер-
ментом, синтезируемым под контролем генома фага. Быть может, конку-
ренция со стороны этого фермента и служит причиной прекращения син-
теза РФ-структур.
Только минус-цепь служит матрицей для синтеза информационной
РНК фага <рХ174. m-РНК, образуемая в зараженной бактерии или син-
тезируемая in vitro на РФ-матрице при действии РНК-полимеразы, го-
мологична плюс-цепи ДНК фага и комплементарна ее минус-цепи [326].
Заражение этим фагом существенно не влияет на синтез ДНК, РНК
и белка клетки-хозяина вплоть до момента наступления лизиса [703]. До-
казательства существования специфического литического фермента, ин-
дуцируемого этим фагом, пока отсутствуют.
Репродукция РНК-co держащих фагов
Сам факт существования РНК-содержащих фагов, в качестве при-
мера которых можно привести некоторые фаги, специфичные в отноше-
нии мужских штаммов Е. coli [939], а также РНК-содержащих вирусов
вообще, выдвигает ряд увлекательных проблем биологической реплика-
ции. Несмотря на то что в незараженных клетках не было обнаружено
никакого механизма автономной репликации РНК, в клетке-хозяине, за-
раженной РНК-содержащим фагом, уже через несколько минут после
заражения обнаруживаются тысячи реплик РНК (фото 43). Поскольку
репликация РНК-содержащих фагов происходит при полном отсутствии
образования ДНК, ясно, что синтез ДНК для этого процесса не нужен.
В бактериях, зараженных РНК-содержащими фагами, появляется
новый фермент, а быть может, несколько новых ферментов, способных
при использовании в качестве матрицы фаговой РНК катализировать
синтез РНК in vitro {322, 323, 803, 804, 907]. Синтез этих ферментов in
vitro в бактериях, зараженных РНК-содержащим фагом f2, легко отли-
чить от синтеза белка капсида фага, ибо белок капсида фага f2 не со-
держит гистидина. При заражении фагом f2 штаммов бактерий, нуждаю-
щихся в гистидине, культуральная среда должна содержать гистидин
только в течение первых нескольких минут после заражения, что необ-
ходимо, по-видимому, для синтеза фермента. Последующий синтез белка
капсида фага может происходить и в отсутствие гистидина [151].
174
Глава IX
Механизм действия этого фермента, называемого РНК-синтетазои
или РНК-репликазой, до сих пор не совсем ясен. Имеются убедительные
данные, свидетельствующие о том, что в бактериальной клетке РНК ин-
фицирующего фага превращается в двухцепочечную РНК. Этот процесс
не идет в присутствии хлорамфеникола. В связи с этим было высказано
предположение, что РНК зрелого фага образуется двухспиральной фор-
мой РНК благодаря действию второго фермента аналогично тому, как
образуется ДНК фага <рХ 174.
Используя высокоочищенный препарат фермента, полученный из
зараженных РНК-содержащим фагом бактерий, Спигелман и его сотруд-
ники разработали метод, позволяющий осуществить in vitro интенсивную
и неограниченную репликацию фаговой РНК в инфекционной форме,
способную генерировать образование полностью сформированных фаго-
вых частиц. Таким образом, этими авторами впервые был осуществлен
ферментативный синтез in vitro функционально активной молекулы ну-
клеиновой кислоты.
Примечательно, что фермент, индуцируемый РНК-содержащим фа-
гом, специфичен только в отношении своей собственной РНК. Фермент
более активно катализирует синтез РНК, если вирусная РНК-матрица
сохранила свою целостность. Эти данные наводят на мысль, что в моле-
куле фермента имеется механизм, позволяющий ей выявлять как нужную
последовательность оснований, так и интактность специфической РНК-
матрицы. Возможно, что сигналом, на который реагирует фермент, яв-
ляется обратимый переход линейной молекулы РНК в кольцевую.
При синтезе РНК, индуцируемом препаратом этого фермента, новые
плюс-цепи образуются в значительно большем числе, чем минус-цепи.
В связи с этим даже возник вопрос, необходим ли вообще синтез минус-
цепи. В случае если синтез минус-цепей действительно не нужен, для
объяснения процесса репликации РНК-содержащих вирусов должен быть
предложен какой-то совершенно иной, принципиально новый механизм.
Как сама фаговая РНК, так и ее реплики, синтезируемые in vitro,,
инфекционны для сферопластов бактерий. Они могут также служить
матрицами для синтеза белка in vitro [616].
Эти РНК ведут себя как полицистронные информационные РНК и
генерируют образование нескольких белков, в том числе специфического
белка капсида, РНК-синтетазы и, вероятно, ряда других ферментов. Вы-
деление зависимых от температуры мутантов РНК-содержащих фагов,
у которых были блокированы те или иные их функции, показало, что, по-
видимому, эти фаги в процессе их репродукции не только индуцируют
образование репликазы и белка капсида, но выполняют по крайней мере
еще одну функцию {368]. При заражении бактерий мутантами, у которых
был блокирован локус генома, детерминирующий один из ранних этапов
инфекционного процесса — образование двухспиральной фаговой РНК,
новый фаг совершенно не синтезировался. Это указывает на то, что по
крайней мере in vivo образование двухцепочечной формы РНК, быть мо-
жет, является обязательным этапом репликации.
При рассмотрении необычайно интересной проблемы репликации
РНК-содержащих фагов остается еще много вопросов, требующих даль-
нейшего выяснения. Несомненно, что дальнейшее изучение этих фагов,
а также процесса репликации других РНК-содержащих вирусов приведет
нас к новым успехам и замечательным открытиям.
Фаговая инфекция и организация бактериальной клетки
Проникновение генетического материала фага в бактерию ведет к
изменению структуры и функций бактериальной клетки. Диапазон этих
изменений может быть весьма широк — от обратимых изменений про-
Взаимодействие бактериофага с бактерией
175
цессов синтеза, наблюдаемых, например, при заражении бактерий уме-
ренными фагами, до полной дезорганизации всех обменных процессов,
что происходит при заражении бактерий Т-четными фагами или фагом
Т5. Механизм этой дезорганизации, ведущий к быстрому прекращению
синтеза бактериальных ДНК, РНК и ферментов, еще неясен, однако из-
вестно, что для его реализации необходим синтез некоторых белков, де-
терминируемых геномом фага.
Было обнаружено одно наводящее на размышления явление: изме-
нение в одной фракции лейциновой транспортной РНК [829]. Такое из-
менение может избирательно подавлять трансляцию информационных
РНК клетки-хозяина и, косвенно, их образование. Нелегко, однако, по-
нять, каким образом такое изменение может привести к внезапному пре-
кращению синтеза ДНК клетки-хозяина. Осуществление этого эффекта
может зависеть от какой-то иной функции фага.
Распад бактериальной ДНК при заражении бактерий такими фага-
ми, как Т2 или Т5, представляет собой медленный процесс, осуществляе-
мый, вероятно, нуклеазами, синтез которых детерминирован геномом
фага. По-видимому, существуют какие-то механизмы, предохраняющие
фаговую ДНК от судьбы, уготованной для ДНК клетки-хозяина. Во вся-
ком случае, ясно, что для процесса вегетативного размножения фага ин-
тактная бактериальная ДНК не нужна.
Значительно более редко встречается крайняя форма генетического
паразитизма, наблюдаемая при заражении бактерий гиперагрессивными
фагами. Эти фаги, индуцируя определенную серию процессов, сначала
ингибируют функцию ДНК клетки, а затем разрушают ее, в результате
чего геном бактериальной клетки, по-видимому, полностью замещается
геномом фага. Многие фаги, как умеренные, так и вирулентные, не вы-
зывают прекращения синтеза специфичных для бактериальной клетки
макромолекул, хотя довольно часто на ранней стадии инфекции преры-
вают репликацию ДНК. Действительно, известно, что успех лизогениза-
ции зависит от правильной последовательности функционирования груп-
пы генов фага, сначала приостанавливающих, а затем восстанавливаю-
щих синтез клеточной ДНК [787]. Эти явления будут рассматриваться
в гл. XI.
ЛИЗИС КЛЕТКИ-ХОЗЯИНА И ВЫХОД ФАГА
Латентный период в случае продуктивного цикла развития фага за-
канчивается лизисом бактерий и освобождением вновь образовавшихся
фаговых частиц. Исключением является лишь одна группа фагов, а имен-
но тонкие, нитевидные фаги, содержащие одноцепочечную молекулу ДНК,
имеющую форму замкнутого кольца и специфичные по отношению к
мужским штаммам бактерий. У этих фагов вновь образовавшиеся вирио-
ны отделяются от поверхности бактерии сразу же после завершения их
сборки, не вызывая при этом ни лизиса, ни гибели продуцирующей их
бактериальной клетки. Бактерии, зараженные такими фагами, могут
продолжать образование колоний [353]. Однако при заражении некото-
рыми мутантами этих фагов некоторых их хозяев наблюдается гибель
бактериальных клеток [653]. В тех случаях, когда наблюдается лизис бак-
териальных клеток он, по-видимому, является результатом действия ли-
зоцимоподобных ферментов, или лизинов [753], способных атаковать же-
сткий мукопептидный слой стенки бактериальной клетки. Синтез этих
ферментов детерминируется геномом фага. Клетки, зараженные мутан-
тами фага, неспособными синтезировать лизоцим, можно лизировать фер-
ментом, добавленным извне [825].
Время наступления лизиса, индуцируемого фагом, находится под
контролем весьма сложной системы. Хотя индуцируемый фагом лизин
176
Глава IX
появляется в бактериальной клетке примерно в середине латентного пе-
риода, т. е. приблизительно в то же время, когда образуются белки вирио-
на, лизис бактериальной клетки начинается значительно позже. Если на
бактерии подействовать каким-либо веществом, блокирующим образова-
ние энергии, например цианидом, или соединениями, разрушающими
плазматическую мембрану, например хлороформом, то бактерии, уже
содержащие лизин, быстро лизируются. Эти данные наводят на мысль,
что естественный лизис зараженных фагом бактерий может быть резуль-
татом некоторых более поздних, контролируемых фагом событий, преры-
вающих поступление энергии и, как следствие этого, создающих воз-
можность для атаки лизином мукопептида, входящего в состав бактери-
альной стенки. Возможно, что в случае аэробных бактерий таким позд-
ним событием является повреждение плазматической мембраны, в кото-
рой, как известно, локализуется у этих бактерий процесс окислительного
фосфорилирования.
Как при репродукции Т-четных фагов, так и при репродукции неко-
торых других фагов какое-то количество лизоцима включается в состав
вириона [465, 610]. Тем не менее до сих пор не было доказано, что свя-
занный с вирионом лизоцим участвует в процессе проникновения ДНК
фага в клетку. Быть может, он не играет никакой роли в ослаблении обо-
лочки клетки или ему принадлежит известная роль в этом процессе,
а возможно, он ответствен за то, что пустые белковые тени некоторых фа-
гов обладают ограниченной способностью к убийству бактериальных
клеток. Лизоцим, образуемый фагом Т4, — это небольшая белковая мо-
лекула, состоящая из 160 аминокислотных остатков и обладающая ос-
новными свойствами [845]. Этот фермент сыграл важную роль в молеку-
лярной биологии, поскольку его разновидности, образуемые различными
мутантными фагами, позволили проверить справедливость некоторых
основных постулатов современной теории генетического кода. Эти дан-
ные будут рассматриваться в гл. X.
Глава X
ГЕНЕТИКА И РАДИОБИОЛОГИЯ БАКТЕРИОФАГОВ
ВИРУСОЛОГИЯ и ГЕНЕТИКА
Вирусная инфекция по существу имеет генетическую природу, ибо в
ее основе лежит введение в клетку фрагмента экзогенного генетического
материала. Поэтому следует ожидать, что генетические исследования ви-
русов будут играть важную роль в изучении их поведения. В сущности
генетика вирусов стала сейчас одним из наиболее активно развивающих-
ся разделов молекулярной генетики. Во-первых, фаги и другие вирусы
могут мутировать как находясь вне клетки, так и при репликации,
и анализ мутационного процесса дает нам информацию о состоянии ге-
нетического материала вирусов. Во-вторых, изучение влияния мутаций
на свойства вирусов — физиологическая генетика вирусов — открывает
некоторые новые аспекты действия генов. В-третьих, во взаимодействиях
между генетически родственными вирусами (комплементация и реком-
бинация) выявляются функциональные и структурные особенности ви-
русного генома. Наконец, следует подчеркнуть, что изучение генетиче-
ской рекомбинации у бактериофагов оказалось главным источником ин-
формации о физической и биохимической основе процесса рекомбинации,
как такового [586].
МУТАЦИИ У БАКТЕРИОФАГОВ
Типы мутантов и их выделение
Любое свойство фага может быть изменено в результате генетиче-
ского изменения, обладающего характерными признаками мутации: ста-
бильностью, индуцибельностью под действием мутагенных факторов и
локализацией в специфическом локусе генома. Очень полезными оказа-
лись мутанты, образующие бляшки, или стерильные пятна, необычной
формы (фото 44). Различия бляшек по размерам и внешнему виду от-
ражают физиологические различия между исходным и мутантным фа-
гами. Так, например, г-мутанты Т-четных фагов (от англ, rapid — «быст-
рый», так как данный мутант быстро лизирует зараженные им бакте-
рии) образуют большие бляшки, поскольку такие мутанты нечувстви-
тельны к «подавлению лизиса», т. е. к увеличению продолжительности
латентного периода между заражением и наступлением лизиса [187].
Мутанты другой хорошо известной группы, так называемые h-мутан-
ты (от англ, host-range—«круг хозяев»), отличаются от исходного фага
по спектру литического действия и способны заражать бактерии, устой-
чивые к действию фага дикого типа [532]. Удобной системой для изучения
таких мутаций являются мутантные бактерии, устойчивые к фагу. На-
пример, у Е. coli известна мутация, приводящая к изменению некоторых
компонентов ее стенки и как следствие этого — к устойчивости, т. е. к
неспособности адсорбировать некоторые фаги. Напротив, у фагов в ре-
зультате мутации могут возникнуть варианты, обладающие расширенным
спектром литического действия (h-мутанты) и способные заражать как
12 Заказ № 1214
178
Глава X
нормальные, так и мутантные бактерии (табл. 18). У h-мутантов Т-чет-
ных фагов изменен белок, образующий нити отростка. В изменении какой
структуры проявляется ft-мутация у фагов, не имеющих нитей, неиз-
вестно.
Таблица 1&
Мутанты Escherichia coli В, устойчивые (У) или чувствительные (Ч)
к различным бактериофагам группы Т
Мутанты Т1 Т2 Т4 Тб тз Т7 Т5
Е. coli В Ч ч ч ч ч ч ч
Е. coli В/10 У ч ч ч ч ч ч
Е. coli В/1,5 У ч ч ч ч ч У
Е, coli В 6 Ч ч ч У ч ч ч
Е. coli В/3,4 ч ч У ч У ч ч
Е. coli В/3,4,7 ч ч У ч У У ч
Е. coli В/3,40,72) ч ч У ч У У ч
О Главным образом, делеции, часто также try
2) Дефекты в отношении синтеза уридиндифосфатглюкозы: при заражении фагами Т2 или Тб
образуют Т*2 или Т*6 фаги, которые содержат неглюкозилированную ДНК [324) (см. табл. 23).
В качестве индикатора, позволяющего выявить мутантный фаг в сус-
пензии фага, состоящей в основном из фаговых частиц дикого типа, ис-
пользуется какая-либо бактерия, устойчивая к исходному фагу и чув-
ствительная к его мутанту. Такая методика применяется при всех видах
экспериментов, предпринимаемых для изучения смешанного заражения
и рекомбинаций.
Некоторые мутантные фаги выделить легко, другие — труднее. На-
пример, мутанты фага Т4, которые в отличие от исходного фага не нуж-
даются в триптофане в качестве кофактора адсорбции, выявляются лег-
ко. Напротив, мутанты, у которых изменены белки головки фаговой ча-
стицы, удается выделить лишь в том случае, если вызываемое мутацией
изменение обусловливает повышение проницаемости капсида для ионов
и как следствие этого — повышение устойчивости фага к осмотическому
шоку [102]. Для того чтобы выделить мутанты, неспособные синтезиро-
вать лизоцим, берут инфицированные фагом бактерии, дают им лизиро-
ваться, удаляют освободившийся фаг при помощи антисыворотки, выде-
ляют все нелизировавшиеся бактериальные клетки, а затем лизируют
эти клетки искусственно, добавляя к ним лизоцим яичного белка "[825].
Некоторые мутантные фаги стабильны, а другие ревертируют; ре-
вертанты часто удается выделить, пользуясь каким-либо прямым или
косвенным методом. Например, у нас пока нет прямых методов, позво-
ляющих отделить Ь+-ревертанты от h-мутантов фага. Оказалось, однако»
что у Ь+-ревертантов Т-четных фагов нити отростка, как правило, более
устойчивы к нагреванию, чем нити h-мутантов; поэтому, прогревая по-
томство h-мутанта, можно получить препарат, обогащенный частицами
Ь+-ревертанта. В свою очередь мутанты фага Т4, устойчивые к осмотиче-
скому шоку (вследствие их большей проницаемости для ионов), в то же
время более чувствительны к действию азотного аналога иприта; поэто-
му селекцию ревертантов можно осуществить, воздействуя на суспензию
потомства мутантного фага этим реактивом.
У стабильных мутантов, которые никогда не ревертируют, часто об-
наруживаются делеции генетического материала. У фагов X в результате
некоторых из наиболее обширных делений количество ДНК настолько
уменьшается, что соответствующие мутантные частицы можно отделить
Генетика и радиобиология бактериофагов
179
от нормальных при помощи центрифугирования в градиенте плотности,
гак как уменьшение отношения ДНК : белок ведет к существенному
уменьшению удельного веса частиц фага {446].
Частота мутаций и мутационный процесс
Частота появления в фаговом потомстве тех или иных мутантов
варьирует в весьма широких пределах. Например, некоторые h-мутанты
образуются с частотой, не превышающей 10-9, тогда как г-мутанты воз-
никают с частотой 10~3 и выше. Эффект высокой частоты мутаций часто
нивелируется происходящим одновременно снижением селективной цен-
ности. Например, вследствие того что фаг Т4 дикого типа дает больший
выход, чем его мутанты Т4г, последние вытесняются ревертантами г+;
поэтому в потомстве фага Т4 соотношение мутантов г и г+ нередко при-
ближается к генетическому равновесию.
Высокая спонтанная частота обычно характерна для таких мутаций,
которые проявляются одинаково независимо от того, в какой из много-
численных точек данного локуса они возникают. В тех случаях, когда
нормальный признак соответствует функциональной форме гена, а му-
тантный признак появляется благодаря какому-то изменению, возникаю-
щему в любой точке данного локуса, частота прямых мутаций будет вы-
ше, чем частота обратных, так как обратные мутации должны приводить
к восстановлению нормального состояния. Иногда ревертанты оказыва-
ются на самом деле не истинными, а псевдоревертантами; это происхо-
дит либо в результате изменений в каком-либо другом гене (супрессор-
ные мутации), либо вследствие неполного восстановления мутировавшего
гена (например, при замене одного нуклеотида на другой).
У зрелых, покоящихся фаговых частиц спонтанные мутации возни-
кают с очень низкой частотой, так как нуклеиновые кислоты, когда на
них не действуют ферменты, весьма стабильны. У покоящихся фагов му-
тации можно индуцировать, воздействуя на них какими-либо мутаген-
ными факторами, например рентгеновскими или ультрафиолетовыми лу-
чами, азотистой кислотой, гидроксиламином или алкилирующими сое-
динениями, такими, как этилметилсульфонат (ЭМС) [246]. Азотистая
кислота дезаминирует азотистые основания нуклеотидов, а ЭМС эти-
лирует их. Гидроксиламин превращает цитозин в урацил, а 5-оксиметил-
цитозин (ОМЦ) — в оксиметилурацил.
Кроме того, мутации возникают также вторично вследствие ошибок,
происходящих при репликации химически измененной нуклеиновой кис-
лоты. Например, если на фаг, содержащий двухцепочечную ДНК, воздей-
ствовать азотистой кислотой, а затем нанести его на неселективную сре-
ду, позволяющую выявить бляшки, образуемые мутантным фагом, то в
большинстве бляшек обнаруживается также и некоторое количество нор-
мального фага. Это происходит потому, что реплицируются обе цепи
ДНК, причем одна дает нормальные фаговые частицы, а другая — му-
тантные. Однако при воздействии азотистой кислоты на фаг, содержащий
одноцепочечную ДНК, как и следует ожидать, образуется чистый клон
мутанта [847].
При размножении фага могут возникать как спонтанные, так и инду-
цированные мутации. Используя различные мутагены, механизм дейст-
вия которых установлен (или предполагается), например аналоги азо-
тистых оснований, HNO2, ЭМС и гидроксиламин, и изучая их влияние на
скорость прямых и обратных мутаций, можно выяснить химическую ос-
нову мутационного процесса [373]. Принципы, лежащие в основе таких
исследований, обсуждались в гл. V.
12*
180
Глава X
Изучение кинетики мутационного процесса, происходящего во вре-
мя размножения фага, имеет более прямое отношение к анализу разви-
тия фага. Сначала рассмотрим спонтанный мутационный процесс. В бак-
териальной клетке, в которой произошла мутация фага, образуется как
нормальный, так и мутантный фаг. Число мутантных фаговых частиц,
содержащихся в популяции фага, выходящей из данной единичной бакте-
риальной клетки, очевидно, определяется характером размножения фа-
га, ибо новые гены фага могут образоваться лишь путем репликации
предсуществовавших генов. Если данная мутация возникает при каждой
репликации с одинаковой вероятностью, то число мутантов., образую-
Фиг. 39. Возможные типы репликации вирусных геномов.
А. Повторная редупликация. Б. Последовательная репликация исходного элемента. В. Репликация
последнего образовавшегося элемента.
щихся в результате данной мутации, зависит от механизма репликации.
Например, если каждая реплика фага образуется независимо от всех
других, то распределение мутантных реплик среди инфицированных бак-
терий будет случайным (фиг. 39, Б). Если же, напротив, каждая из обра-
зующихся реплик будет в свою очередь размножаться, образуя все но-
вые реплики, то мутантные реплики будут образовывать группы, или кло-
ны, состоящие из мутантных сибсов (фиг. 39, Л).
Для того чтобы проверить, какое из этих предположений справедли-
во, были проведены следующие эксперименты [533]. Бактериальные клет-
ки заражали фагом Т2 и подсчитывали число бляшек, образуемых му-
тантными частицами Т2г, в выходе фага для каждой из нескольких ты-
сяч зараженных бактерий. Затем находили распределение по частоте
клонов, содержащих 1, 2, 3, 4, 5 мутантов, и сравнивали найденное
распределение с рассчитанным, которое было основано на допущении,
что воспроизведение фаговых генов — экспоненциальный процесс, сос-
тоящий из последовательных дупликаций, а вероятность мутирования ге-
на при каждой репликации — величина постоянная. Если эти допущения
справедливы, то следует ожидать, что частота ух, с которой образуются
клоны, содержащие х=2п мутантов, будет подчиняться следующему
уравнению:
где т — вероятность мутации, N—конечное число копий гена, а п —
число генераций фаговых генов, полученных в данном опыте. Поскольку
на практике геномы фага реплицируются не синхронно, удобнее анали-
зировать распределение мутантов, исходя из частоты Yx образования
клонов, содержащих х или более мутантов:
Распределение, полученное в эксперименте (фиг. 40), очень хорошо
совпадает с теоретическим, особенно если учитывать влияние, которое
Генетика и радиобиология бактериофагов
181
оказывают на результат опыта ограниченная величина каждого выхода
фага и случайный характер процесса созревания фага — сборки зрелых
фаговых частиц из фонда реплицирующихся элементов [810].
Из полученных данных следует, что репликация генома фага — эк-
споненциальный процесс, аналогичный размножению любого организма,
которое происходит путем повторных делений. Конечно, эта аналогия но-
сит чисто формальный характер и является просто следствием полукон-
Фиг. 40. Экспериментально найденное распределение спонтанных г-мутантов фага Т2
в отдельных выходах фага [810].
Yх —доля клонов, содержащих я или более мутантов. По оси абсцисс отложены Igx, а по оси орди-
нат— IgYх- Сплошная линия построена по точкам, координаты которых рассчитаны при помощи урав-
нения (X. 2). Пунктирные линии соответствуют двум различным величинам 7 (7 — отношение ко-
личества фага, синтезировавшегося в одной клетке, к общему количеству вегетативного фага).
сервативного механизма репликации фаговой ДНК, т. е. результатом
образования из каждой двухцепочечной молекулы ДНК двух новых двух-
цепочечных молекул.
Интересная ситуация была обнаружена при анализе распределения
мутантов, образовавшихся в результате обработки покоящегося фага Т4
мутагеном ЭМС [292]. Оказалось, что клоны с 1, 2, 4, 8 мутантами встре-
чались с примерно одинаковой частотой. Известно, что действие ЭМС
на фаговую ДНК состоит в этилировании гуанинового остатка. Поэтому
полученные данные были интерпретированы в том смысле, что для каж-
дого остатка этилгуанина, входящего в состав ДНК, существует некото-
рая постоянная вероятность замены в единицу времени на неправильное
основание. Следовательно, некая мутация может возникнуть с равной
вероятностью в любой генерации фага и все копии, образующиеся после
этого события, будут мутантными. Результаты этого опыта показали так-
же, что нити ДНК исходных частиц фага Т4 неоднократно копировались
внутри одной зараженной бактериальной клетки.
182
Глава X
Физиологическая генетика фага — условно летальные мутации
Любая выявляемая фаговая мутация, по-видимому, приводит к из-
менению какого-то продукта одного из фаговых генов или к прекраще-
нию образования этого продукта. Иногда при помощи химических мето-
дов или путем изучения различных функций фага удается выяснить, ка-
кой из специфических компонентов фага изменяется в результате мута-
ции: например, у h-мутантов наблюдаются изменения нитей отростка,
а у осмотических мутантов фага Т4 — изменения белка головки фага.
Конечно, утрата некоторых функций оказывается для фага летальной,
и поэтому генетические изменения, затрагивающие способность фага вы-
полнять такие функции, выявить не удастся. Например, если в резуль-
тате мутации прекратится синтез какого-то фермента, детерминируемого
одним из фаговых генов и необходимого для размножения фага, то фаг
не сможет размножаться и погибнет. Вместе с тем если мутация приве-
дет к такому изменению фермента, при котором он сохранит функцио-
нальную активность, то фаг будет продолжать размножаться и мутация
может оказаться невыявленной.
Значительным шагом вперед было открытие так называемых услов-
но летальных мутантов и их систематическое изучение. Условно леталь-
ными называют мутанты, способные размножаться в одних условиях, по
неспособные делать это в других [219]. Наиболее простым примером слу-
жат температурочувствительные, или ts-мутанты. В результате такой
мутации какой-то жизненно важный продукт гена сохраняет способность
синтезироваться и функционировать при низкой температуре, например
при 28°, но либо не синтезируется, либо разрушается при более высокой
температуре, например при 42°. Очевидно, что такой мутантный фаг смо-
жет размножаться при 28, но не при 42°.
Условно летальные мутанты отобрать легко, ибо для того, чтобы
осуществить отбор, не обязательно знать, какая из функций фага изме-
нилась в результате мутации; может оказаться затронутой любая из
жизненно важных функций фага. Так, например, среди ts-мутантов могут
быть такие, у которых изменены белки вириона, какие-либо жизненно
важные ферменты или же регуляторные функции.
Помимо ts-мутантов, известны еще две другие группы условно ле-
тальных мутантов: 1) дефектные мутанты умеренных фагов (гл. XI) и
2) мутанты, чувствительные к супрессии (sus-мутанты). Вторую группу
мутантов называют также мутантами, зависящими от хозяина [126,
219]. Sus-мутанты растут только на определенных бактериях-хозяевах,
называемых пермиссивными (рт+), и не растут на других, непермиссив-
ных (pm-). Пермиссивные клетки-хозяева содержат ген-супрессор, мас-
кирующий или компенсирующий эффект мутации фага. Действие гена-
супрессора не ограничено компенсацией функции конкретного, заме-
щаемого им гена, а состоит в компенсации определенного типа мутаций,
которые могут произойти в любом гене. Подобные «аллель-специфичные»
супрессоры [931] уже обнаружены у многих организмов, в том числе у
бактерий и грибов. Супрессорные мутации, возникающие у бактерий, мо-
гут супрессировать эффект мутации как бактериальных, так и фаговых
генов.
Наиболее общепринятое объяснение этого явления, подкрепляемое
данными биохимического исследования ферментов фагов и бактерий,
состоит в следующем. Предполагается, что при супрессорных мутациях
возникают изменения в системе, осуществляющей процесс трансляции,
необходимый для биосинтеза белка, а именно изменения активирующих
аминокислоты ферментов, s-PHK или рибосом [68]. Допустим, например,
что в результате супрессорной мутации кодон XYZ, соответствующий
Генетика и радиобиология бактериофагов
183
аминокислоте т, иногда будет транслироваться как аминокислота п;
в результате в некоторых молекулах соответствующего белка на месте
аминокислотного остатка m оказывается аминокислотный остаток п.
Предположим далее, что в ДНК фага произошла такая мутация, в ре-
зультате которой кодон XYW, соответствующий аминокислоте п, прев-
ратится в кодон XYZ. В нормальной клетке-хозяине последовательность
XYZ будет считываться как аминокислота т; мутация кодона XYW в
кодон XYZ приведет к замене аминокислоты п на аминокислоту гл, а сле-
довательно, к синтезу генного продукта, лишенного функциональной ак-
тивности; в результате фаг размножаться не сможет. Напротив, в пер-
миссивной клетке-хозяине последовательность XYZ иногда будет тран-
слироваться как аминокислота п, в результате чего какое-то количество
продукта данного гена будет обладать функциональной активностью и
какое-то количество фага все же образуется. Как и следует ожидать, раз-
личные супрессоры такого типа компенсируют различные типы мутаций,
рассеянные по всему геному фага.
Особую группу образуют супрессоры, превращающие «бессмыслен-
ные» кодоны в «осмысленные», т. е. такие супрессоры, при наличии ко-
торых бессмысленные кодоны, не соответствующие ни одной аминокисло-
те, начинают кодировать какую-то аминокислоту. Подобные супрессоры
восстанавливают смысл кодонов, ставших бессмысленными в результа-
те мутации. Этот новый смысл может полностью совпадать с прежним
смыслом, а может и отличаться от него, т. е. может быть «ошибочным»;
в первом случае в соответствующем месте полипептидной цепи будет на-
ходиться такой же аминокислотный остаток, как и в молекуле нормаль-
ного белка, а во втором — какой-то иной остаток. Если во втором слу-
чае все же образуется белок, обладающий функциональной активно-
стью, то говорят, что супрессор восстанавливает функцию, индуцируя
считывание «приемлемого ошибочного смысла».
В ряде случаев, сочетая биохимические и генетические методы, уда-
лось установить, в чем именно состоят изменения кодона, вызываемые у
клеток Е. coli К12 некоторыми мутациями, подавляющими бессмыслен-
ные мутации [435, 901]. Разумеется, такие супрессорные мутации могут
исправлять ошибки, возникающие при бессмысленных мутациях как в
геноме фага, так и в геноме бактерии. Например, группа бессмысленных
мутаций, названных янтарными мутациями (am-мутации от англ, am-
ber— «янтарь»), соответствует кодону УАГ в информационной РНК;
эти мутации могут быть супрессированы по меньшей мере тремя супрес-
сорами, транслирующими кодон УАГ соответственно как серин (нор-
мальный кодон УЦГ), глутамин (ЦАГ) или тирозин (УАУ или УАЦ).
Другая группа супрессоров обладает способностью исправлять ошибки,
вызываемые другим бессмысленным триплетом — УАА, или Ochre.
Особую группу условных мутантов образуют ril-мутанты Т-четных
фагов, которые подробно обсуждаются в одном из следующих разделов.
Открытие условно летальных мутантов ts и sus сделало возможным
изучение мутантных фагов, у которых повреждена любая из жизненно
важных функций, связанных с синтезом белка. Имея в своем распоряже-
нии группу условных мутантов и определяя для каждого мутанта ста-
дию, на которой при непермиссивных условиях культивирования (рт~-
хозяин или высокая температура) прекращается размножение фага,
можно попытаться выяснить физиологическую природу генетического
блока. Применение этого метода для изучения мутантов фага Т4 дало
очень важные результаты. Оказалось, что у одних мутантов блокиро-
вание происходит до начала синтеза ДНК, у других — до начала синтеза
белков капсида, у третьих — на уровне синтеза ряда специфических
структурных белков, у четвертых — на стадии сборки вириона; наконец,
184
Глава X
были обнаружены мутанты, неспособные синтезировать литический фер-
мент или синтезировавшие литический фермент, обладавший необычны-
ми свойствами (фиг. 44). В качестве особенно яркого примера можно
привести некоторые мутанты фага Т4, образующие в рт~-хозяине вместо
нормальных полиэдрических головок пустотелые белковые трубки («po-
lyheads»; фото 45).
Если у двух различных условно летальных мутантов мутации за-
трагивают различные функциональные локусы или цистроны 165], то при
смешанном заражении бактерий этими мутантами, каждый из которых
сам по себе размножаться не способен, может происходить комплемен-
тация и в результате образуется зрелый фаг. Этим методом в геноме
фага Т4 к настоящему времени удалось выявить около 70 локусов, в ге-
номе фага X—более 20 и 5 локусов в геноме очень мелкого фага S13.
Л^естоположение этих локусов на генетической карте фага (фиг. 43)
было определено методом генетической рекомбинации (см. ниже). Были
идентифицированы локусы, детерминирующие синтез нескольких инду-
цируемых фагом ферментов и некоторых белков капсида, а также от-
крыт ряд новых функций фага.
Смешивая экстракты непермиссивных бактерий, зараженных фага-
ми, содержавшими мутации в различных цистронах, удалось даже осу-
ществить in vitro комплементацию и наблюдать образование полных ви-
рионов [209, 902].
ВЗАИМОДЕЙСТВИЕ МЕЖДУ ФАГАМИ ПРИ СМЕШАННОМ ЗАРАЖЕНИИ
При заражении бактериальной клетки одновременно несколькими
вирионами одного фага мы говорим о множественном заражении, а не-
сколькими вирионами различных фагов — о смешанном заражении. При
множественном заражении продолжительность латентного периода,
время появления внутри клетки зрелого фага и выход фага мало отли-
чаются от наблюдаемых при заражении бактериальной клетки единич-
ным вирионом.
Если бактерию, уже зараженную фагом, спустя несколько минут
суперинфицируют этим же фагом, то иногда второй контингент фага не
участвует в размножении и не передает своей ДНК потомству. Было
показано, что фаговые частицы, попавшие в клетку позднее, разру-
шаются и их ДНК изливается в культуральную среду [289]. Такое раз-
рушение вирионов при суперинфекции наблюдалось лишь у некоторых
фагов.
При смешанном заражении отдельные фаги можно выявить при
помощи индикаторных штаммов бактерий\ обычно ими служат мутант-
ные штаммы бактерий, устойчивые к одному из фагов, использованных
при смешанном заражении (см. табл. 18). В общем для любой пары
фагов можно получить подходящие индикаторные штаммы. Обычно
удобно пользоваться так называемым методом смешанных индикаторов.
При этом фаг высевают на чашку, содержащую два штамма бактерий,
каждый из которых чувствителен только к одному из фагов; прозрач-
ные участки возникают только там, где бляшки, образуемые каждым из
фагов, налагаются друг на друга или же где бактерии, зараженные
двумя фагами, освобождают частицы обоих фагов (фото 46).
Исход смешанного заражения зависит от степени родства между
участвующими в нем фагами. Если эти фаги, судя по морфологическим
и серологическим признакам, неродственны между собой, то наблю-
дается тип интерференции, называемый полным исключением (данная
бактериальная клетка освобождает вирионы лишь одного из двух фа-
гов, использовавшихся для заражения, но никогда не освобождает ви*
Генетика и радиобиология бактериофагов
185
рионы обоих фагов). Часто наблюдается также эффект депрессии, т. е.
уменьшение выхода фага, которому удалось размножиться [178].
Механизм взаимного исключения неродственных фагов пока не
ясен, и вполне возможно, что для разных пар фагов он различен. Репли-
кация и созревание фага — процессы, состоящие из ряда последователь-
ных и взаимоисключающих стадий, причем некоторые из них оказывают
подавляющее действие на биосинтез клетки-хозяина; поэтому не удиви-
тельно, что две такие различные последовательности событий могут
иметь несовместимые стадии.
Смешанное заражение родственными фагами
При заражении бактерий двумя родственными фагами взаимного
исключения не происходит. Многие бактериальные клетки освобождают
фаговые частицы обоих типов [180]. Если фаги очень близки друг другу,
например если это мутанты одного фага, то каждая зараженная бакте-
риальная клетка продуцирует частицы обоих типов. В лизате, получен-
ном в результате одновременного заражения культуры смесью двух
мутантов одного фага, соотношение частиц двух типов обычно такое же,
как в исходном инокулуме. Если же заражение культуры вторым мутан-
том производится на несколько минут позднее, чем первым, то это может
привести к исключению второго фага. Было показано, что в одной бак-
териальной клетке может размножаться одновременно до десяти фаго-
вых частиц и даже более [197].
ГЕНЕТИЧЕСКАЯ РЕКОМБИНАЦИЯ
При смешанном заражении двумя родственными фагами, отличаю-
щимися друг от друга по крайней мере по двум генетическим признакам,
наблюдается новое явление: образование частиц таких типов, каких не
было в исходной смеси, причем эти новые частицы обладают призна-
ками, представляющими собой комбинацию признаков родительских фа-
гов. Так, например, при заражении культуры смесью фагов Т4г и Т2
образуются фаговые частицы четырех типов: Т2, Т2г, Т4 и Т4г; при зара-
жении культуры смесью фагов T2h и Т2г образуются фаги T2h, Т2г,
T2hr и Т2.
Открытие этого явления генетической рекомбинации фагов [335] по-
ложило начало развитию нового раздела генетики. Вскоре стало ясно,
что каждый признак, ведущий себя при рекомбинации как самостоятель-
ная единица, является одним из двух (или более) альтернативных со-
стояний, или аллелей, неких дискретных участков фаговой частицы или,
иначе говоря, ее гена; а рекомбинация представляет собой перетасовку
генов фага [345]. Поэтому, используя принятые в генетике обозначения,
мы можем записать это явление в следующем виде:
T2hr+ X T2h+r -> T2hr+, T2h+r, T2hr, T2h+r+,
где знак + означает аллель дикого типа.
Скрещивание фагов обычно производят путем смешанного зараже-
ния бактериальных клеток в опытах с одиночным циклом заражения,
используя два родственных фага, образующих распознаваемые рекомби-
нанты. Конечно, не все рекомбинанты можно отличить от родительских
штаммов. Например, независимо выделенные г-мутанты фага Т4 (му-
танты, образующие большие бляшки) в большинстве случаев неаллель-
ны; иными словами, соответствующие мутации возникли в различных
участках генома, в результате чего при скрещивании двух г-мутантов
186
Глава X
образуется некоторое количество г+-рекомбинантов, а также некоторое
количество Г1Г2-рекомбинантов:
Т4Г1 ХТ4г2 -> T4rn Т4г2, Т4г+, Т4Г1г2.
Рекомбинанты г+ фенотипически легко выявляются по своим типич-
ным бляшкам. Однако пгг-рекомбинанты образуют такие же бляшки,
как и г-мутанты. Поэтому пгг-рекомбинанты можно отличить от роди-
тельских г-форм только на основании результатов обратного скрещи-
вания.
ЭКСПЕРИМЕНТАЛЬНЫЕ ОСНОВЫ ФОРМАЛЬНОЙ ГЕНЕТИКИ ФАГОВ
Задачей формальной генетики фагов является интерпретация орга-
низации генетического аппарата фага на основе количественных ре-
зультатов скрещивания фагов. Такой подход можно сочетать с изуче-
нием ДНК физическими методами, что позволяет получить дополни-
тельные данные о взаимодействии между фагами, заражающими одну
и ту же бактериальную клетку. Подобные исследования проводились
главным образом на Т-четных фагах (Т2, Т4) и фагах Т1 и X. Как мы
увидим ниже, использование в качестве моделей Т-четных фагов ввиду
некоторых особенностей, присущих их геномам, создало ряд осложне-
ний в развитии генетики фагов. В табл. 19—22 приведены результаты
некоторых таких экспериментов по рекомбинации у фага Т2.
Из всех этих экспериментов можно сделать следующие важные
выводы:
1. Частота рекомбинаций. При скрещивании между мутантами
одного и того же фага, например T4a+bXT4ab+, рекомбинанты обра-
зуются с определенной для данной пары частотой. В стандартных усло-
виях эта частота зависит только от природы мутантных признаков, или
генетических маркеров, родительских штаммов. За исключением тех слу-
чаев, когда некоторые аллели обладают селективным преимуществом,
в полученной массе лизата реципрокные рекомбинанты (а+Ь+ и ab) по-
являются примерно в равном количестве. Частоты рекомбинаций при-
мерно одинаковы независимо от того, находились ли мутантные при-
знаки в родительских штаммах в фазе сцепления (abXa+b+) или в фазе
отталкивания (a+bXab+).
Таблица 19
Частота различных генотипов в потомстве, образовавшемся
при смешанном заражении мутантами фага Т2
Скрещивание Родительские фаги Рекомбинанты Частота рекомби- наций
I h г13 hrl3 |_
59 39 0,74 0,94 1,7
II hrl3 + + h г
48 50 0,8 0,8 * 1,6
III h г7 hr7 4- +
56 32 6,9 6,4 13,3
IV h Г1 hrl + +
42 34 12 12 24
Выводы: 1. Частота рекомбинантов примерно одинакова независимо от того, нахо-
дятся ли мутантные признаки в фазе сцепления (скрещивание II) или в фазе отталки-
вания (скрещивание I).
2. Сцепление с h последовательно ослабляется в ряду г13, г7, г1 (скрещивания I,
III, IV).
) Цифры означают долю данной фракции (%) в общем урожае фага.
Генетика и радиобиология бактериофагов
187
Таблица 20
Частота рекомбинаций при ди- и трифакториальных скрещиваниях »
Скрещи- вание Тип скрещивания Рекомбинант г+ Частота рекомбинаций
Дифакториальные2)
V rl X г7 15 30
VI rl X г13 15 30
VII г 7 X г 13 7 14
VIII г4 X г7 3,5 7
IX г4 X г 13 7 14
Трифакториальные
X г4г!3 X г7 1,8
XI г7г 13 X г4 0,7
XII г4г7 х г 13 5
Выводы: 1. Наиболее вероятный порядок скрещивания г 7—г4—г13, так как час-
тота образования рекомбинантов г+ минимальна при скрещивании XI, при котором в
Г г 7 + Г13 ]
случае такого порядка скрещивания должно произойти два кроссинговера -------------
« L + 14 + J
2. Если принять изложенное в выводе 1 допущение о порядке скрещивания, то
частота рекомбинаций при дифакториальных скрещиваниях не является аддитивной
(скрещивания VII, VIII, IX). Можно видеть, что действительная частота рекомбинаций
между наружными маркерами ниже, чем следовало ожидать исходя из уравнения
z=x+y—2ху. Это указывает на наличие отрицательной интерференции (z=x+y—
—2\ху\ I> 1).
3. При трифакториальных скрещиваниях число двойных рекомбинантов г+ не-
сколько выше, чем следовало бы ожидать, если бы частота рекомбинаций соответст-
вовала числу дифакториальных скрещиваний; это подтверждает наличие отрицатель-
ной интерференции (например, при скрещивании XI ожидаемая частота рекомбинаций =
= 0,07 0,07 = 0,0049, или 0,49%, а наблюдаемая частота = 0,7%).
Цифры означают долю данной фракции (%) в общем урожае фага.
%' Дефекты в отношении синтеза уридиндифосфатглюкозы; при заражении фагами Т2 или Тб
стоте рекомбинантов г+, так как рекомбинанты гг неотличимы от родительской формы г.
Скрещивание фагов трех различных родительских типов
Таблица 21
Скрещивание Родительские фаги Частота рекомбинантов-^-F+
XIII r4 X г7 х г 13 7,3
XIV r4r7 X г4г 13 X г7г 13 0,16
Вывод. Рекомбинация между несколькими различными родительскими фагами,
вероятно, происходит путем последовательных актов спаривания, ибо ни при каком
спаривании двух родительских фагов не .могут возникнуть образовавшиеся при скре-
щивании XIV рекомбинанты + + +.
2. Сцепление. Существует ясно выраженная система сцепления, ко-
торая позволяет точно определить место каждой мутации на линейной
генетической карте. Так, например (за некоторыми исключениями, о ко-
торых будет сказано ниже), на основании относительных частот реком-
бинаций между парами маркеров а и Ь; а и с\ b и с соответственно можно
твердо сказать, какова истинная последовательность расположения мар-
188
Глава X
Таблица 22
Увеличение частоты рекомбинаций с увеличением выхода фага1)
Скрещивание Родительские фаги Выход фага1) Частота рекомбинаций
XV h X г13 120 2,6
300 6,0
450 9,5
Вывод. С увеличением выхода фага частота рекомбинаций возрастает.
Замечание. Частота рекомбинаций в скрещивании XV выше, чем в скрещивании
1, хотя в обоих случаях участвуют одни и те же фаги. Эго объясняется тем, что
скрещивание XV проводилось в условиях, обеспечивающих одновременное смешанное
заражение всех бактерий, что повышает частоту образования рекомбинантов [513J.
В таких условиях и при больших выходах фагог частота рекомбинаций при скрещива-
ниях IV. V и VI составит примерно 40%.
Ч Число фаговых частиц, образуемых в одной бактериальной клетке.
керов: abc, acb или Ьас. Это подтверждается результатами трифакто-
риальных скрещиваний типа abc'Xa+b+c+. Если маркеры расположены
в последовательности abc, то рекомбинантов типа аЬ+с и а+Ьс\ для об-
разования которых должно произойти по два обмена, будет значительно
меньше, чем рекомбинантов единичного типа.
Эксперименты с большим числом генетических маркеров на ряде
фагов показали, что во всех случаях все генетические маркеры данного
фага образуют единую линейную генетическую карту.
Если перетасовка генетических маркеров обусловлена событиями,
вероятности которых независимы, то следует ожидать, что частоты ре-
комбинаций между парами маркеров, такими, как а-b и b-с, должны
быть аддитивны, а частота образования двойных рекомбинантов при
трифакториальных скрещиваниях должна быть линейной комбинацией
частот образования рекомбинантов единичного типа. Таким образом,
если маркеры расположены в последовательности abc и если частота
рекомбинаций для пары а-b равна х, а для пары b-с, равна у, то ча-
стота рекомбинаций для пары а-с будет равна z = x+y—2ху, а частота
образования двойных рекомбинантов будет равна ху.
Как и в случае рекомбинации при мейозе, это предсказание под-
тверждается достаточно хорошо для относительно близко расположен-
ных маркеров. С увеличением расстояния между маркерами явление
множественной рекомбинации наблюдается все чаще и чаще. Состояние
насыщения достигается после того, как средняя частота множественной
рекомбинации становится намного больше единицы и создается впечат-
ление, что лежащие далеко друг от друга маркеры вообще не сцеплены.
3. Некоторые особые случаи, а) Для таких фагов, как Т2 или Т4,
у которых общая сумма частот рекомбинаций между парами тесно
сцепленных маркеров достигает 600—700%, наибольшая частота реком-
бинаций между парой маркеров составляет не 50%, как следовало бы
ожидать, если бы множественная рекомбинация вела к полной рандо-
мизации, а только около 40% (при стандартном скрещивании).
б) Для трех тесно сцепленных маркеров, располагающихся в по-
рядке а, b и с, частота рекомбинаций (z) между маркерами а и с выше,
чем предсказываемая для независимых событий уравнением z = x + y—
—2ху. Это — явление так называемой отрицательной интерференции
1 Коээфициент интерференции / определяется уравнением z'=x+*/—21ху. Если
/<1, мы говорим о положительной интерференции (z'>z; слишком мало двойных ре-
комбинаций). Если />1, мы говорим об отрицательной интерференции (z'<z; слишком
много двойных рекомбинаций).
Генетика и радиобиология бактериофагов
189
состоящее в том, что рекомбинация в одной области повышает вероят-
ность одновременной рекомбинации в другой области.
4. Зависимость частоты рекомбинаций от выхода фага. Частота ре-
комбинаций изменяется в зависимости от выхода фага. Например, в слу-
чае фага Т4 с увеличением выхода фага от нескольких фаговых частиц
на одну бактериальную клетку (такой выход получается при раннем
преждевременном лизисе) до нескольких сотен фаговых частиц (такой
выход получают в опытах с подавлением лизиса) возрастает и частота
рекомбинаций.
5. Рекомбинация при взаимодействии нескольких родительских фа-
гов. При заражении бактерий смесью фагов T4abc+, Т4а+Ьс и Т4аЬ+ с об-
разуется некоторое количество рекомбинантов а+Ь+с+ Такие рекомби-
нанты никак не могут возникнуть в результате взаимодействия только
двух родительских фагов.
Описанным выше особенностям рекомбинации впервые дали надле-
жащее объяснение Висконти и Дельбрюк [870]. В основе их теории лежит
допущение, что скрещивание фагов нельзя рассматривать как классиче-
ское генетическое скрещивание (например, между самцом и самкой
дрозофилы), а следует воспринимать его как эксперимент в области
генетики популяций. В зараженной фагом бактериальной клетке между
парами или группами фаговых геномов может произойти множество
различных повторных взаимодействий или спариваний, причем каждое
спаривание с определенной вероятностью может дать рекомбинантное
потомство.
Висконти и Дельбрюк предположили, что спаривания между двумя
геномами происходят случайно и что в них могут с равной вероятностью
участвовать как генетически различные, так и генетически идентичные
родительские фаги, а также их потомки. Это предположение было под-
тверждено результатами скрещиваний, для которых два родительских
фага использовались в разных количествах. (Некоторое отклонение от
•случайности может быть вызвано неполным смешиванием фаговых гено-
мов внутри бактериальных клеток, подвергнутых смешанному зара-
жению.)
Теория Висконти — Дельбрюка позволяет легко объяснить явление
отрицательной интерференции, наблюдаемое при полифакториальных
скрещиваниях. Это объяснение сводится к следующему. Если спарива-
ния происходят случайно, то некоторые дочерние фаговые частицы бу-
дут происходить от таких линий, в которых в прошлом произошло боль-
ше спариваний, чем в других. Группу дочерних фаговых частиц, для
которых установлено наличие рекомбинации между двумя маркерами,
скажем а и Ь, нельзя считать случайной выборкой, адекватно представ-
ляющей популяцию в целом. Поскольку у предков этих частиц имели
место спаривания, в среднем у них имелось больше возможностей для
«рекомбинаций не только между маркерами а и ft, но также и между
маркерами, локализованными в других областях генома, в том числе
в участке Ь-с.
Аналогичным образом частота рекомбинаций между маркерами,
расположенными далеко друг от друга, меньше 50%. Это объясняется
тем, что вследствие случайного характера процесса спаривания некото-
рые фаговые частицы происходят от таких линий, у которых было
меньше возможностей для спаривания, чем у других.
Функция картирования и природа акта спаривания
Поскольку скрещивание фагов представляет собой популяционное
явление, наблюдаемая в эксперименте частота рекомбинаций должна
.как-то зависеть от расстояния на карте, т. е. от вероятности рекомби-
190
Глава X
нации при отдельном акте спаривания. В соответствии с формулиров-
кой, данной Висконти и Дельбрюком и модифицированной Херши [338]„
общее уравнение функции картирования для скрещиваний axb имеет
следующий вид:
ХаЬ = 2ЛВ/, 4(1- e~mFp), (X. 3>
где Хаь — доля рекомбинантов, образующихся при скрещивании; А и В —
относительная частота родительских фагов а и b в инокулуме (Л+ 5=1);
fi — поправочный коэффициент, учитывающий случайный характер ад-
сорбции фага на индивидуальной бактериальной клетке (что в конечном
счете влияет на величину а/b для индивидуальных бактериальных кле-
ток); f2—поправочный коэффициент, учитывающий возможность не-
полного смешивания геномов фаговых частиц внутри зараженной бакте-
риальной клетки (для случая, когда смешивание полное, f2 = 1); р—рас-
стояние на карте (вероятность обмена на одно спаривание); т— сред-
нее число актов спаривания в ряду поколений, связывающем родитель-
ские фаги, заразившие клетку, с дочерними вирионами, вышедшими из-
клетки; F—максимально возможная доля рекомбинантов среди потом-
ков одного акта спаривания (но не одного скрещивания!).
Сложность этой формулы, выведенной на основании строгого мате-
матического анализа [810], отражает ряд неясностей в отношении осо-
бенностей акта спаривания.
Для того чтобы понять сказанное выше, представим себе бакте-
риальную клетку, зараженную равным числом частиц двух различных
фагов, Т4а и Т4Ь. Допустим, что все эти фаговые частицы, а точнее, их
полные ДНК-геномы, размножаясь в этой клетке, образуют хорошо-
перемешанный фонд и случайно спариваются друг с другом с соблюде-
нием некоторых правил. Что же это за правила? Предположим, напри-
мер, что акт спаривания представляет собой спаривание двух полных
фаговых геномов, за которым следуют реципрокные обмены, вероятности
которых, как и в модели классического кроссинговера, пропорциональны
расстояниям на карте. Тогда в уравнении (Х.З) F= 1, a mF = m. В слу-
чае когда можно определить величину mF (а это можно, например, сде-
лать, определив ее зависимость от величины выхода фага [513]), вели-
чину р можно рассчитать по Хаь [см. уравнение (X. 3)].
Предположим теперь, что акт спаривания заключается в спарива-
нии двух фаговых геномов, но рекомбинанты образуются в результате
копирования дочерней частицей сначала одного, а потом другого роди-
тельского фага (копирование с переменой матриц). Очевидно, что в этой
случае 5=7з, a m = 3 mF, и зависимость между р и Хаь оказывается со-
вершенно иной.
Можно представить себе и более сложную ситуацию. Рассмотрим,
например, случай, когда в акте спаривания принимают участие не два,,
а несколько фаговых геномов, так что между ними могут иметь место
групповые взаимообмены (модель группового спаривания). Тогда при
скрещивании abcXa+b+c+ вероятность образования рекомбинанта ab+c
или ab+c+ будет иной, чем вероятность образования таких рекомбинан-
тов при парном скрещивании.
Эти примеры иллюстрируют трудности, связанные с определением
величины т, т. е. числа скрещиваний, происходящих внутри каждой
бактериальной клетки, а также с выяснением природы акта спарива-
ния. Каждой группе допущений отвечает иной вид функции картирова-
ния. По-видимому, вопрос о природе акта спаривания следует изучать
не на основании частот рекомбинаций, а каким-то иным путем.
Анализ отдельных выходов фага, получаемых при скрещивании типа
аб+Ха+6, показывает, что в урожаях, образуемых отдельными клетками,.
Генетика и радиобиология бактериофагов 191
корреляция между числом реципрокных рекомбинантов ab и а+6+ незна-
чительна или отсутствует вовсе [345]. Следовательно, либо эти два ре-
комбинанта вместе не образуются, т. е. событие рекомбинации не яв-
ляется реципрокным, либо при последующем воспроизведении и созре-
вании имеющееся между ними численное соответствие затемняется. Это
обстоятельство демонстрирует одну из сложностей данной ситуации,
а именно наличие связи между рекомбинацией и репликацией. Наиболее
ценные данные об этих процессах были получены при комплексном ана-
лизе результатов генетических и биохимических исследований. Ниже мы
кратко изложим некоторые из наиболее важных наблюдений и .их со-
временную интерпретацию.
Разрывы и воссоединения молекул ДНК и роль этого процесса
в генетической рекомбинации
Репликация ДНК, в том числе бактериальной ДНК, осуществляется
по полуконсервативному 1 типу. Это означает, что каждая из двух моле-
кул, образующихся -при репликации, состоит из одной старой и одной
новой полинуклеотидной цепи [587] (см. гл. V и фиг. 41).
Фиг. 41. Три возможных типа репликации молекул ДНК.
А. Консервативная. Б. Пол у консервативная. В. Дисперсивная.
Если репликация фага происходит путем полуконсервативной репли-
кации его полного генома, без фрагментации ДНК, то родительская фа-
говая частица, содержащая меченую ДНК, передаст метку только двум
дочерним частицам. Среди потомков какого-либо скрещивания генетиче-
ская конституция этих двух частиц будет отражать то обстоятельство,
что каждая из них содержит по крайней мере одну цепь родительской
ДНК (фиг. 41). Если бы рекомбинация осуществлялась только путем
копирования с переменой матриц или во всяком случае механизм ее не
был бы связан с разрывом родительской ДНК, то меченая ДНК роди-
1 Консервативной называется репликация, при которой родительская ДНК сохра-
няет целостность. При дисперсивной репликациии атомы родительской ДНК распре-
деляются между частицами-потомками.
192
Глава X
тельской фаговой частицы всегда обнаруживалась бы в частицах-потом-
ках, соответствующих типу родительских частиц. Однако имеется множе-
ство экспериментальных данных, свидетельствующих о том, что разрывы
и воссоединения нитей ДНК несомненно имеют место, причем число их
коррелирует с частотой генетической рекомбинации.
1. Если фаг ХаЬ, содержащий меченую ДНК, скрещивать с фагом
Ха+Ь+, содержащим немеченую ДНК, в инкубационной среде, не содер-
жащей метки, то образуется некоторое количество меченых рекомбинан-
тов. Если в качестве меток используют тяжелые изотопы (тяжелая роди-
Фиг. 42. Соотношение частиц родительского типа и рекомбинантных частиц в потомст-
ве от скрещивания между «тяжелым» фагом Xcl ml и «легким» фагом Х++ [589].
А. Распределение в градиенте CsCl потомства «тяжелых» фаговых частиц, полученного при зара-
жении «тяжелыми» частицами «легких» бактерий на «легкой» среде: / — целиком родительская
ДНК (консервативное воспроизведение); // — наполовину новая ДНК (полуконсервативное воспро-
изведение); /// — целиком новая («легкая») ДНК. Б. Распределение частиц родительского типа и
рекомбинантных частиц, содержащих родительскую или наполовину новую ДНК.’ В качестве маркера
плотности легкого фага к системе добавляли фаг Xh.
тельская ДНК содержит N15 и С13, а легкая — N14 и С12), то частицы-по-
томки можно разделить путем центрифугирования лизата в градиенте
плотности, а затем подвергнуть полученные фракции анализу. Резуль-
таты подобных экспериментов показали, что рекомбинантные фаговые
частицы содержат меченую (родительскую) ДНК [589] (фиг. 42).
2. При скрещивании двух мутантных фагов ХЬ2 и ХЬ5 (с неперекры-
вающимися делециями), каждый из которых образует фаговые частицы
легче нормальных, были получены рекомбинанты Ь+ и b2bs; первые оказа-
лись тяжелее, чем частицы каждой из родительских линий, а вторые —
легче. Если ДНК одной из родительских линий метили Р32, то метка
обнаруживалась не только в частицах-потомках, идентичных родитель-
скому типу, но и в рекомбинантных частицах. Количество Р32, содержав-
шееся в различных рекомбинантах, соответствовало ожидаемому, если
исходить из предположения, что рекомбинации образуются в результате
разрывов между двумя делециями и соединения соответствующих фраг-
ментов [447].
3. У фагов Т2 и Т4, рекомбинирующих значительно чаще, чем фаг X,
наблюдается выраженная фрагментация родительской ДНК и распре-
Генетика и радиобиология бактериофагов
193
деление фрагментов среди частиц-потомков. Любая содержащаяся в
родительской ДНК метка распределяется между многими частицами-
потомками, но не случайным образом, как это было бы, если бы роди-
тельская ДНК деградировала и имела место реутилизация входивших
в ее состав нуклеотидов, а в виде крупных фрагментов, составляющих
по величине от 5 до 10% полного генома фага. В коротких фрагментах
ДНК потомства, содержащих родительскую ДНК, метку содержит лишь
одна из двух нитей; это говорит о том, что нити родительской ДНК
реплицируются по полуконсервативному механизму, а затем происходит
фрагментация [472].
Таким образом, по меньшей мере часть генетических рекомбинаций,
наблюдающихся у фагов, определенно связана с разрывами и воссоеди-
нением фрагментов цепей ДНК.
В чем же состоит механизм этого процесса разрывов и воссоедине-
ний? Некоторые моменты прояснились в экспериментах с фаговой ДНК,
экстрагированной из зараженных бактерий [26]. Так, при смешанном
заражении бактерий двумя различными штаммами фага Т4, меченными
тяжелым изотопом с различной интенсивностью, и выращивании зара-
женных бактерий на питательной среде, содержавшей небольшое коли-
чество KCN (с целью ограничения образования макроэргических соеди-
нений), наблюдается образование цепей ДНК, обладающих промежуточ-
ной плотностью и состоящих из двух фрагментов родительских ДНК.
Вначале эти фрагменты соединены друг с другом только при помощи
водородных связей, так что «тяжелый» фрагмент можно отделить от
«легкого» нагреванием до «точки плавления» фаговой ДНК. Однако
после инкубации зараженных бактерий в среде, содержащей KCN, в те-
чение 15 мин или более между фрагментами ДНК начинают образовы-
ваться фосфодиэфирные связи, после чего разделить воссоединившиеся
фрагменты ДНК путем нагревания уже не удается. Если в момент зара-
жения бактерий к культуре добавляют хлорамфеникол, подобные ком-
плексные структуры не образуются. Это свидетельствует о том, что для
разрыва фаговой ДНК и воссоединения образовавшихся фрагментов не-
обходимо наличие индуцированного фагом нового белка. Используя
условные мутанты, неспособные синтезировать тот или иной ранний фа-
говый фермент, удалось показать, что за образование фрагментов фаго-
вых ДНК, связанных друг с другом ковалентными связями, ответственны
ферменты, индуцируемые фагом, в том числе ДНК-полимераза, а воз-
можно, и дезоксицитозинмонофосфатоксиметилаза.
Т-четные фаги, а также фаг X и некоторые другие способны к нор-
мальной генетической рекомбинации при размножении в мутантах
Е. coli, потерявших способность рекомбинировать при скрещивании
(гес_-бактерии, [141]). Это подтверждает предположение о том, что такие
фаги сами детерминируют образование ферментов, необходимых для
рекомбинации (или восстановления нормальной структуры ДНК после
рекомбинации).
Кольцевые генетические карты
По мере открытия все новых и новых генетических маркеров гене-
тическая карта фага становится все более полной и детальной. Как уже
говорилось выше, все генетические маркеры данного фага связаны друг
с другом, образуя линейную структуру. При построении генетической
карты фага Т4 обнаружилось, однако, новое явление. Оказалось, что
генетические маркеры этого фага, расположенные в крайних точках его
линейной генетической карты, сцеплены друг с другом. Отсюда следует,
что генетическая карта фага Т4 представляет собой кольцо [824]. Коль-
13 Заказ № 1214
194
Глава X
цевую форму имеют также генетические карты других фагов Т-четной
группы, но это не относится к некоторым хорошо известным фагам, на'
пример X и Т5.
Мы уже видели, что для большинства фаговых генов, по-видимому,
для тех, которые кодируют образование белков, известны условные му-
танты, в том числе температурочувствительные (ts) и супрессорчувстви-
Фиг, 43. Кольцевая генетическая карта фага Т4, демонстрирующая положение на гене’
тической карте «классических» генетических маркеров (внутренний круг), температу-
рочувствительных мутаций (средний круг) и аш-мутаций (внешний круг).
Поперечные линии показывают, какие мутанты были использованы при скрещиваниях, прово-
дившихся для координации этих трех карт.
тельные (sus) [208, 219]. При картировании таких мутаций фага Т4 по-
лучается кольцевая генетическая карта, изображенная на фиг. 43. Для
одного фага, молекулярный вес ДНК которого равен 120 • 106 дальтон
(такое количество ДНК может содержать генетическую информацию,
достаточную для синтеза белков, суммарный молекулярный вес которых
равен 7 106 дальтон), известно примерно 70 локусов. Если принять, что»
молекулярный вес каждой полипептидной цепи фагового белка равен
35 000 дальтон, то легко подсчитать, что геном фага может кодировать.
200 таких полипептидных цепей.
На фиг. 44 представлен один из вариантов кольцевой генетической
карты фага Т4, на которой указано, какие физиологические функции
фага блокируются при мутациях, происходящих в тех или иных гена^..
Несколько генов, детерминирующих функции фага, реализующиеся на
Генетика и радиобиология бактериофагов
195
ранней стадии инфекции и необходимые для синтеза его ДНК, объеди-
нены в одну группу; подобным же образом многие другие гены, напри-
мер гены, детерминирующие поздние стадии морфогенеза — образование
головки или отростка,— также расположены по соседству. Однако на-
блюдается и ряд исключений. Причины, определяющие связь между
Фиг. 44. Положение на генетической карте локусов, контролирующих различные функ-
ции бактериофага Т4 [208].
генами, детерминирующими сходные функции, неизвестны. Аналогичную
ситуацию у бактерий объясняют тем, что обладающие близкими функ-
циями и соседствующие друг с другом гены сгруппированы в «опероны»,
представляющие собой единицы генетической транскрипции, с общими
для всех генов данного оперона регуляторными механизмами [400]. При-
ложимо ли подобное объяснение к некоторым группировкам фаговых
генов, остается пока неясным.
В чем же состоит смысл кольцевой генетической карты? Действи-
тельно ли геном фага имеет форму кольца или же к кольцевой генети-
ческой карте приводят какие-то особенности рекомбинации?
A priori первое предположение кажется весьма привлекательным.
Мы знаем, что генетическая карта бактерии Е. coli представляет собой
кольцо [402] и что действительно «хромосома» Е. coli, т. е. ее ДНК, кото-
рую можно выделить из бактерии, имеет вид кольца [169]. Кроме того,
ДНК некоторых фагов, в том числе и фага X, как in vivo [91], так и
in vitro [340] имеет форму кольца. Тем не менее генетическая карта фага
X не имеет кольцевидной формы. Далее, ДНК мелкого фага <рХ174 —
13*
196
Глава X
настоящая кольцевая молекула, не имеющая свободных вторичных фос-
фатных групп.
Этого, однако, не наблюдается у Т-четных фагов. Как ДНК, экстра-
гированная из их вирионов, так и ДНК, экстрагированная из заражен-
ных ими бактерий, не представляют собой кольцевой молекулы. Следо-
вательно, можно полагать, что кольцевая генетическая карта этих фагов
представляет собой топологическое описание каких-то специфических
особенностей процесса рекомбинации между линейными геномами. На-
пример, если при скрещивании фагов рекомбинанты всегда возникают
ABCDEF________YZAB
EFGH_____________ ABCDEF
LMNO JKLM
Фиг. 45. Циклическая перестановка генов в линейных геномах.
парами, или, во всяком случае, в четном числе, то получаемая в ре-
зультате генетическая карта будет, очевидно, иметь кольцевую форму,
поскольку наиболее удаленные друг от друга маркеры почти всегда
окажутся рядом.
Ближе к истине, вероятно, другая, весьма изящная гипотеза. Сог-
ласно этой гипотезе, все частицы фага Т4 содержат молекулы ДНК рав-
ной длины, но отличаются друг от друга циклической перестановкой
маркеров. В результате получается генетическая карта, имеющая форму
кольца (фиг. 45). Ряд экспериментальных данных удовлетворяет этой
гипотезе. Однако, для того чтобы понять их смысл, следует сначала оста-
новиться на другой особенности, наблюдающейся при генетической ре-
комбинации фагов: образовании гетерозиготных фагов.
Гетерозиготы и концевая избыточность
Некоторая доля фаговых частиц, образующихся при скрещивании
родственных фагов, является гетерозиготами (Het-частицы), т. е. содер-
жит аллели от обеих родительских форм [341]. Такие частицы не яв-
ляются полными диплоидами. Каждая гетерозиготная область пред-
ставляет собой лишь короткий участок; так, у фага Т4 этот участок
составляет лишь около 2% всего генома фага. У потомков фага, обра-
зующихся при скрещивании, в гетерозиготной форме может оказаться
с равной вероятностью любой из маркеров. Если маркерами являются
точковые мутации, то частота образования Het-частиц примерно оди-
накова для всех маркеров данного фага (около 2% у фага Т2, 1,5% У
фага Т4 и 0,1 % у фага X).
При скрещивании двух фагов с генотипами abc и а+Ь+с+ соответст-
венно, генетические маркеры которых расположены в этой последова-
тельности и не слишком близко друг к другу, фаговые частицы, гетеро-
зиготные по среднему маркеру, часто являются рекомбинантами по
внешним маркерам, т. е. гетерозиготы b/b+ несут либо гены ас+, либо
а+с [511]. Эти данные, а также некоторые другие соображения наводят
на мысль, что, вероятно, Het-частицы образуются у фагов главным об-
разом в результате тех же событий, которые приводят к образованию
истинных рекомбинантов. Такому представлению отвечает структура,
показанная на фиг. 46, Л (Het-частица типа гетеродуплекса), где гетеро-
зиготная область изображена в виде участка ДНК, в котором обе цепи
происходят от разных родительских частиц. Такой гетеродуплекс (воз-
Генетика и радиобиология бактериофагов
197
пикающий, например, при разрыве и воссоединении родительских моле-
кул ДНК) будет затем при полуконсервативной репликации приводить
к образованию рекомбинантов. Имеется ряд данных, свидетельствующих
о том, что у фагов X Het-частицы имеют именно такое строение.
Фиг. 46. Схемы двух типов частично гетерозиготных (Het) фаговых геномов, обра-
зующихся в результате скрещивания, и типы потомства, которые они могут дать.
А. Частицы гетеродуплексного типа. Б. Частицы перекрывающегося типа.
При скрещивании фагов Т4 положение осложняется существова-
нием другого типа Het-частиц, генетическая структура которых пока-
зана на фиг. 46, Б (фаговые Het-частицы перекрывающегося типа). Их
существование подтверждается данными о том [188], что бактериальная
клетка, зараженная одной Het-частицей этого типа, освобождает ча-
стицы, среди которых лишь у немногих имеются маркеры, расположен-
ные непосредственно близ постулированных свободных концов, как если
бы эти маркеры были пропущены при генерировании нормальных цепей
ДНК (поляризованное расщепление). Het-частицы такого типа были
обнаружены только у фагов Т-четной группы, где они составляют
2/з всех частиц; оставшуюся треть представляют собой частицы гетеро-
дуплексного типа [346].
498
Глава X
Модель Стрейзингера
Открытие у фагов Т4 Het-частиц перекрывающегося типа послужило
основой для весьма остроумной и плодотворной интерпретации кольце-
вого строения их генетической карты [748, 824]. Сущность этой интерпре-
тации (фиг. 47) сводится к следующему:
А
LIWN
---- Генам инфицирующего фага
Репликация
MNO
MNO
MNO
LMN
LMN
LMN
(или)
(или)
@ /Спаривание
MNO"
MNO
(б) ! Полимеризация
LMN
МНО
LMN
MNO
Полимеризация
♦
MNO
LMNO
LMNO
LMN
Повторение I
(Г@@ 1
V LMNO
Повторение
@Т Фр агмента - @(5)©
1 ция
АВС ______________ZAB
FGH_______________EFG
PQR_______________OPQ
BCD_______________АВС
Фиг. 47. Схема процесса репликации и рекомбинации ДНК фага Т4 по Стрейзангеру:
А. Единичное заражение. Б. Смешанное заражение NwXnW.
1. Для молекул ДНК фага Т4 характерна концевая избыточность.
Это означает, что они содержат нормальный геном плюс небольшой кон-
цевой участок, гомологичный другому концу.
2. Для молекул ДНК этого фага характерна циклическая переста-
новка маркеров, так что у разных частиц конец молекулы приходится
на разные маркеры.
3. Во время репликации фага некоторое количество цепей фаговой
ДНК возникает вследствие рекомбинаций (вероятно, осуществляющихся
путем разрывов и воссоединений). При заражении бактерии одной фа-
говой частицей такие цепи, конечно, могут образоваться вследствие ре-
комбинаций между избыточными концами дочерних молекул ДНК
(фиг. 47).
4. При созревании фага длинные цепи ДНК разделяются на фраг-
менты, каждый из которых несколько больше полного генома фага (дли-
на такого фрагмента соответствует количеству ДНК, которое может по-
меститься в головке фага), но имеет различные концевые участки. Затем
Генетика и радиобиология бактериофагов
199
каждый такой фрагмент оказывается заключенным в капсид фаговой
частицы.
5. Фаговая частица, содержащая рекомбинантную молекулу ДНК,
на двух избыточных концах которой содержатся различные маркеры,
представляет собой Het-частицу перекрывающегося типа и демонстри-
рует поляризованное распределение этих маркеров.
АВ МЫ шХ 48 CD Мп WX СР ]
МЫ и/Х АВ MN Мп WX АВ Мп V иифццир
u>X АВ МЫ wX WX CD Мп WX I
| Репликация
| Спаривание
АВ MN wX АВ wX АВ МЫ и>Х
CD Мп WX СР
Мп WX СР Мп
АВ MN WX СР
шХ АВ МЫ WX CD Мп.
Фрагментация
6. Поскольку сцепление между маркерами воссоздается в цепях
ДНК, из описанной выше схемы следует, что генетическая карта такого
фага должна иметь форму кольца.
В пользу этой теории говорят многие генетические данные, в том
числе следующие:
1. Среди Het-частиц частиц гетеродуплексного типа мало или же в
них отсутствуют генетические маркеры, соответствующие делениям ка-
ких-то генетических участков (вероятно, делении предотвращают спари-
вание); однако имеется много Het-частиц перекрывающегося типа (как
это и должно быть, если их образование связано с какой-то важной
структурной особенностью процесса созревания).
2. Скрещивания в среде, содержащей 5-фтордезоксиуридин (этот
ингибитор подавляет репликацию ДНК, но не рекомбинацию), приводят
к увеличению частоты образования гетеродуплексных Het-частиц, но не
Het-частиц перекрывающегося типа (гетеродуплексные Het-частицы об-
разуются в результате рекомбинации, но вследствие ограниченной реп-
ликации ДНК их распад не происходит).
200
Глава X
3. При скрещивании двух родительских фагов с генотипами а н а+
и с достаточно большими делениями, затрагивающими разные участки
генома, образуется больше Het-частиц а/а+ перекрывающегося типа (это
необходимо для того, чтобы компенсировать уменьшение длины, вызван-
ное делецией).
Если модель Стрейзингера верна, то популяция молекул ДНК, вы-
деленных из различных частиц фага Т4, должна быть гетерогенна по
химическому строению; очевидно, что в таких молекулах ДНК подобно
перестановке маркеров происходит также циклическая перестановка
азотистых оснований, в результате чего азотистые основания, находя-
щиеся на концах цепи в одной из частиц, в другой частице могут ока-
заться расположенными в центре цепи. Элегантные опыты, проведенные
Томасом и Рубинштейном [852], показали, что это действительно так.
Опыты, поставленные этими авторами, состояли в следующем
(фиг. 48). Из фага экстрагировали молекулы ДНК, осторожно разры-
вали их на две части [110] и выделяли участки, которые были несколько
короче половины исходной молекулы ДНК («короткие половинки»); эти
«короткие половинки» затем фрагментировали и разделяли на отдель-
ные цепи, после чего в опытах с гибридизацией изучали их способность
конкурировать с фрагментами полных цепей фаговой ДНК, меченных
другим изотопом. Если у всех молекул ДНК фага последовательность
генов, а следовательно, и азотистых оснований одинакова, то фрагменты,
полученные из «коротких половинок», должны менее эффективно кон-
курировать за центральную часть молекул ДНК. В опытах с фагами
типа фага Т5, в ДНК которых нет циклических перестановок, был по-
лучен именно такой результат. Однако для фага Т2 результаты оказа-
лись противоположными; у них в полном соответствии с теорией Стрей-
зингера не наблюдалось избирательности по отношению к центральным
последовательностям.
Томас и Макхэтти [851] сумели также показать, что при нагревании
и охлаждении молекул ДНК фага Т2 in vitro эти молекулы могут при-
обретать кольцевую форму, вероятно, в результате соединения друг
с другом цепей ДНК с циклическими перестановками (фиг. 48).
С теорией Стрейзингера согласуется также наблюдение, обнаружив-
шее, что из бактерий, зараженных фагом Т4, можно выделить молекулы
фаговой ДНК, которые длиннее молекулы ДНК, содержащейся в зрелой
фаговой частице [234].
Еще одна группа фактов, подтверждающая теорию Стрейзингера,
получена при изучении неполных частиц фага Т4, о которых уже гово-
рилось в предыдущих главах. Эти более мелкие частицы фага Т4 состав-
ляют несколько процентов общей популяции; они намного легче нор-
мальных и содержат молекулу ДНК, длина которой равна 2/3 длины
молекулы ДНК нормальной частицы [602]. По-видимому, более мелкие
частицы образуются вследствие того, что в некоторых случаях, по ошиб-
ке, от длинной нити ДНК отрезаются фрагменты, длина которых
меньше, чем полагается. Более мелкие частицы, содержащие лишь две
трети ДНК, дефектны и при множественности заражения, равной еди-
нице, не размножаются. Однако при смешанном заражении такие ча-
стицы могут эффективно кооперировать и путем рекомбинации регене-
рировать нормальный фаг. Эффективность этой кооперации в точности
соответствует тому, чего следует ожидать, если принять, что в каждой
отдельной частице, содержащей две трети ДНК, отсутствует одна любая
сцепленная группа генов, соответствующая примерно 7з генетической
карты фага [603], как это и предсказывает теория Стрейзингера.
Томас и сотр. [850] подвергли аналогичному анализу молекулы ДНК
ряда различных фагов и пришли к выводу, что для большинства, если
Генетика радиобиология бактериофагов
201»
не для всех молекул фаговых ДНК, характерна концевая избыточность.
Кроме Т-четных фагов, молекулы ДНК с циклической перестановкой,
маркеров были обнаружены еще у одной группы фагов.
I. Опыт с "короткими половинками"
Пион опыта:
Немеченый фаг Т2 Фаг Т2,меченный С * ФагТЭ,меченный Рзг
hl 1111111111ШЗ 111111Ш1111ПТТТП
Денатурация, I Воздействие
нанесение на I ультразвукомt
коленку из агара * денатурация
I Разрыв, отделение
’ "коротких половинок"
I Воздействие ультразвуком,
| денатурация
Смешивание, пропускание
через колонку @ ,
промывание колонки
для удаления фрагментов,
не связавшихся с ДНК колонки
Элюция, измерение
соотношения С^/Р32
----------------------1
Т5-соотношение 1,25
I------------
Т2-соотношение 1,0
Интерпретация:
Циклическая перестановка:
"короткие половинки "
содержат все части генома
Уникальная последовательность;
в "коротких половинках "отсутствует
Центральная часть генома
Фиг. 48. Схема опытов Томаса и Рубинштейна [852], подтверждающих теорию генети
ческого строения ДНК Т-четных фагов, сформулированную Стрейзингером.
Трансформация, вызываемая ДНК фага X, и коллинеарность
генетической карты фага X и молекулы его ДНК
Кайзер и Хогнесс (427] открыли удивительное явление — «трансфор-
мацию», вызываемую фагом X. Было показано, что интактные молекулы
ДНК фага X могут проникать в бактерии, незадолго до того зараженные
нормальным фагом X, после чего может произойти рекомбинация между
двумя фаговыми геномами. Молекулы ДНК фага X можно разорвать
на две части в точке, близкой к середине молекулы, и образовавшиеся
полумолекулы при помощи центрифугирования в градиенте плотности
можно разделить на две группы: 1) половинки молекул, содержащие
большую часть (52%) Г—Ц-пар, 2) половинки молекул, содержащие
202
Глава X
-их меньшую часть (48%). Такие половинки молекул ДНК фага К могут
проникать в бактерии, зараженные фагом X, и рекомбинировать с ин-
тактным фагом X. Оказалось, что одна группа таких половинок содержит
гены «левой половины» генетической карты, а другая — гены «правой
половины» ({428]; см. фиг. 55). Эти опыты служат очень изящным дока-
зательством того, что генетическая карта фага имеет молекулярную
основу, подобно классическим цитологическим доказательствам локали-
зации генов в специфических участках хромосом животных и растений.
ГЕНЕТИКА ФАГОВ И МОЛЕКУЛЯРНАЯ ГЕНЕТИКА
Читатель уже, вероятно, успел убедиться, что изучение генетики
•фагов тесно связано с исследованием некоторых основных проблем моле-
кулярной генетики, например структурной основы генетической реком-
бинации и гомологичного спаривания между молекулами ДНК (и хро-
мосомами). Незавершенность генетики фагов попросту отражает неза-
вершенность изучения более общей темы — молекулярных сил и собы-
тий, лежащих в основе организации и функциональной активности гене-
тического материала. Вирусы, и в частности фаги,— излюбленные объ-
екты исследователей, работающих в области молекулярной биологии,
ибо из вирусных частиц можно выделить трансмиссивные, функциональ-
ные геномы, которые затем можно изучать физическими и химическими
методами. В объеме данной книги невозможно рассмотреть все области
применения идей, результатов и методов генетики фагов, однако не-
сколько приведенных ниже примеров иллюстрируют возможности, ко-
торые открывает экспериментирование с фагами в качестве инстру-
мента генетического анализа.
Мутанты г11. Система Бензера
rII-Мутанты Т-четных фагов представляют собой особую группу му-
тантов. Эти мутанты сыграли особую роль в развитии молекулярной
генетики [64].
При заражении клеток Е. coli В эти мутанты дают так называемый
г-фенотип: они образуют крупные бляшки; при суперинфекции заражен-
ных этими мутантами клеток подавления лизиса не наблюдается. г11-Му-
танты не размножаются на клетках Е. coli, лизогенных по фагу X (за
исключением случаев, когда в инкубационной среде содержатся ионы
_Mg2+ в концентрации 10~2 А1). В бактериях, лизогенных по фагу X, ре-
пликация ДНК фага rll прекращается уже на ранней стадии и белки
капсида не образуются [256].
Мутанты rll можно разделить на две группы — А и В, Все /77-мута-
ции группы А располагаются на небольшом участке фагового генома,
все мутации rll группы В сосредоточены в участке, непосредственно при-
мыкающем к области мутаций группы А (фиг. 44). Смешанное зараже-
ние клеток Е. coli К12 (X) любой парой мутантов rll, из которых один
относится к группе А, а другой — к группе В, приводит к нормальному
росту фага. Бензер [64], работая с мутантами rll, для обозначения еди-
ницы области, обладающей генетической функцией и идентифицируемой
по цис-транс-тесту на комплементацию, ввел термин цистрон. При сме-
шанном заражении двумя родительскими фагами, содержащими две
мутации Г1 и г2> считается, что мутации эти лежат в одном цистроне, если
фаг образуется, когда мутации находятся в цис-положении (г\Г21г+г+),
и не образуется, когда мутации находятся в транс-положении (г\г+/г+г2).
Ясно, что во втором случае отсутствует «хорошая» копия гена, способная
осуществлять необходимую функцию.
Генетика и радиобиология бактериофагов
203
Свойства мутантов rll делают их особенно удобными для генетиче-
ских исследований. Одно из их свойств — легкость выявления ревертан-
тов. Путем заражения клеток Е. coli К12 (X) можно обнаружить одну
г+-частицу среди 108 или даже большего числа г-частиц. Вместе с тем,
поскольку цистроны А и В занимают около 2% всей генетической карты
фага Т4 и любая мутация в любом из них приводит к образованию
фенотипа г, мутации обнаружить очень легко. Путем рекомбинации
легко получить двойные мутанты rll;, rllj. Все эти свойства делают си-
стему особенно ценной для изучения прямых и обратных мутаций и му-
тагенеза [245]. Мутанты rll были использованы также в большей части
исследований, посвященных изучению Het-частиц, рассматривавшихся
в предыдущих разделах.
Анализ тонкой структуры
У независимо выделенных мутантов rll мутации, как правило, бы-
вают локализованы в разных точках генома, вследствие чего при сме-
шанном заражении такие мутанты дают г+-рекомбинанты. К 1961 г.
•было выделено и картировано более 2500 независимых точковых мутаций
rll фага Т4. В результате удалось построить такую полную карту тонкой
структуры группы генов, какой в настоящее время не существует ни для
какого другого организма (фиг. 49). Мутации rll возникают в 308 раз-
личных мутационных участках — сайтах, из которых 202 возникают в
цистроне А, а 106 — в цистроне В; можно рассчитать, что предстоит
•открыть еще по крайней мере 72 новых сайта. Если область rll действи-
тельно составляет 2% общего генома фага, то она должна содержать
примерно 4000 пар нуклеотидов. Таким образом, число сайтов весьма
•близко к числу нуклеотидов. (Было, однако, обнаружено несколько сай-
тов, в которых мутации rll возникают с необычно высокой частотой; эти
сайты были названы «горячими точками». В некоторых из них мутации
возникают в 1000 раз чаще, чем в других. Поэтому можно полагать, что
скорость изменения нуклеотидов, по меньшей мере частично, опреде-
ляется положением данного нуклеотида в общей последовательности,
а не только его химической природой.)
Некоторые мутации rll фага Т4 представляют собой делеции. Про-
тяженность этих делеций можно определить, установив спектр точковых
мутаций, с которыми они не дают г+-рекомбинаций в опытах со смешан-
ным заражением. Группу картированных делеций можно использовать
для определения положения группы участков области rll, что облегчает
картирование новых мутаций. Любая мутация, не дающая рекомбинаций
с данной делецией, должна быть локализована в соответствующем уча-
стке (картирование делеций; фиг. 50). Используя эту систему, Бензер
[65] показал, что генетическая карта области rll строго линейна; он не
обнаружил в этой области никаких следов ветвления. Некоторые откло-
нения от линейности наблюдаются лишь в том случае, если измерять
очень низкие частоты рекомбинации; вероятно, на этом уровне начинает
проявляться эффект необычных, «незаконных» рекомбинационных собы-
тий в негомологичных сайтах (?) [848].
Весьма удивительным является то обстоятельство, что, несмотря на
упорные генетические исследования генов области rll, их биохимическая
функция остается неизвестной; соответствующие белки, по-видимому,
ферменты, в которых фаг нуждается только в том случае, когда он раз-
множается в бактериях, лизогенных по фагу X, пока идентифицированы
не были. Неизвестно также, в чем состоит действие Х-профага, препят-
ствующее размножению фагов rll, хотя и установлено, что решающее
значение в этом процессе играет ген фага X, определяющий иммунитет
.i т.
•нн»9-р- г^9-?¥т-?-9?- р-99 199? 99» 19 ? । ।
Ala Albi Alb2
A2c A2e
i i i r i* SH-—
A2a A2b A2d
-T-rnr-l- -^p-
A2f
A2g
A4d A4c A4a A3h
A3g A3f A3e A3a-d
J~A~* A ’ * A I A A A A fl й A A ji A
A2hl
Фиг. 49. Карта точковых мутаций в области rll бактериофага Т4 [67].
Участки этой генетической области соответствуют участкам, установленным с помощью делеций,
показанных на фиг. 50. Пунктирными линиями показаны границы цистронов А и В.
1272
Фиг. 50. Генетические делении в области ill генетической карты фага Т4 [67].
Каждая деления обозначена на генетической карте толстой черной линией; соответствующий мутант
не дает рекомбинантов rb ни с одним из мутантов, у которого имеется точковая мутация в соответ-
ствующем участке генома (фиг. 49).
206
Глаза X
к этому фагу. Тем не менее изучение генов области rll позволило разре-
шить некоторые важные проблемы, касающиеся механизма функциони-
рования гена.
Выделение /n-РНК мутантов rll
В экспериментах на мутантах фага Т4 с делецией в области rll
впервые удалось получить m-РНК, соответствующую определенному гену
[51]. Путем гибридизации меченой m-РНК бактерий, зараженных фагом
Т4, с нитями денатурированной ДНК, выделенной из фага с делецией
в области rll (Т4 rlldel), из раствора сначала удаляли всю m-РНК фага,
за исключением т-РНК, соответствовавшей области rll. Остающаяся в
растворе свободная фаговая m-РНК специфически гибридизировалась
с полными нитями ДНК фага Т4, но не гибридизировалась с нитями ДНК
фага Т4 rlldel; следовательно, именно эта m-РНК соответствует генам
области rll.
Мутанты rll и генетический код
Блестящим примером использования мутантов rll служат класси-
ческие исследования Крика и его сотрудников [155] по генетическому
коду, которые вкратце сводятся к следующему (фиг. 51):
1. Большая часть делеций rll нарушает функцию цистрона, в кото-
ром локализована данная делеция. Исключение составляет делеция, про-
стирающаяся от цистрона А до первого участка цистрона В, но не подав-
ляющая функцию цистрона В [135]. В то же время известно несколько
точковых мутаций rll, возникающих в том же участке цистрона В и иск-
лючающих возможность его функционирования. Эти результаты наводят
на мысль, что «необязательный» участок цистрона В кодирует какую-то
не строго необходимую часть молекулы соответствующего белка, т. е.
такую часть, полное отсутствие которой переносится легче, чем ошибка
в ее строении. Такого результата следует ожидать в том случае, если ци-
строн, детерминирующий синтез данного белка, транслируется, начиная
с одного конца, так что какие-либо ошибки, локализующиеся вблизи
начала цистрона, приведут к полному прекращению трансляции.
2. Существует особая группа мутаций, возникающих либо спонтан-
но, либо под действием профлавина — красителя, молекулы которого^
по-видимому, вклиниваются между соседними парами азотистых осно-
ваний молекулы ДНК. Предполагается, что такие мутации представляют
собой либо делении, либо вставки единичных, а быть может, и несколь-
ких нуклеотидов в полинуклеотидную цепь молекулы ДНК. Если такая
мутация произойдет в несущественном участке области rll цистрона В,
ее эффект может компенсироваться другой мутацией в пределах того же
участка. Можно полагать, что вторая мутация представляет собой изме-
нение, комплементарное изменению, вызываемому первой мутацией (на-
пример, приводит к добавлению одного нуклеотида, если в результате
первой мутации произошла утрата нуклеотида).
3. Некоторые комбинации трех мутаций, приводящих каждая
к вставке в ДНК одного нуклеотида, или трех мутаций, ведущих каж-
дая к делеции, в начальном участке области rll цистрона В, нередка
дают восстановление функции этого цистрона.
Для того чтобы объяснить эти результаты, было постулировано, что
трансляция данной m-РНК всегда начинается с точки, соответствующей
одному концу цистрона, и продолжается таким образом, что каждая
последовательная группа из трех нуклеотидов кодирует одну амино-
кислоту. Тогда в случае, если начальный участок полипептидной цепи —
A
Интерпретация:
АТТГЦАТЦГ AUUT......А ГAT HU Г АТИЦ АГ
47
АТТГНТЦГАИЦТ........АГАТНЦГАТЦЦА Г
АТТГЦТЦГАЦиТ........А Г АТЩ1Г АЦТ ЦЦАГ
Ген г ПА Ген гПВ
4--------------------------------1—
Делеция 1589
। । Ген А неактивен
• Ген В активен
• Мутация
I -f-или —
. ф, Оба гена
неактивны
Фиг. 51. Опыты с использованием мутаций, вызывающих «сдвиг считывания», постав-
ленные для проверки гипотезы о триплетной природе генетического кода [155].
А. Мутации, связанные с добавлением или утратой одного нуклеотида. Белые квадраты — мутации.,
приводящие к добавлению нуклеотида ( + ); черные квадраты—мутации, приводящие к делеции (—).
Некоторые пары ( + )- и (—)-мутаций компенсируют друг друга, так что в конечном счете образуется
функционирующий ген. Для этого необходимо, чтобы «сдвиг считывания» на участке между этими
двумя мутациями не привел бы к появлению какого-либо бессмысленного кодона, так как это выз-
вало бы остановку синтеза белка. Некоторые сочетания трех ( + )- или трех (—)-мутаций также
восстанавливают функцию гена.
Б. Деления 1589 (фиг. 50) соединяет друг с другом гены rllA и rIIB\ при этом функции
гена гПВ не элиминируются, но они могут быть утрачены при возникновении в оставшейся части-
гена rllA ( + )- или (—)-мутаций.
208
Глава X
продукта данного гена — не имеет существенного значения для функции
данного белка, для успешного осуществления функции должны быть
выполнены следующие условия:
1) в соответствующем участке ДНК не должно происходить обра-
зования «бессмысленных» кодонов, которые бы приводили к остановке
'считывания;
2) мутации не должны приводить к «сдвигу считывания», нарушаю-
щему порядок считывания остальной части гена (в противном случае
ошибка считывания в одной точке приведет к тому, что после этой точки
на всем протяжении цепи будет считываться тарабарщина). Поскольку
данный участок полипептидной цепи не принимает участия в функции,
выполняемой молекулой белка — продуктом данного гена, изменение по-
следовательности аминокислот между сайтами двух взаимно компенси-
рующих мутаций может оказаться терпимым. Мутации с подобным дей-
ствием были названы «мутациями, приводящими к сдвигу считывания».
Эти опыты дали первые генетические доказательства триплетной
природы генетического кода. Однако прямое подтверждение справедли-
вости триплетной теории было получено при изучении лизоцима, обра-
зуемого фагом Т4 [826]. Было показано, что при подавлении и последую-
щем восстановлении функции лизоцимного гена, вызываемых двумя ком-
пенсаторными мутациями, первая из которых ведет к добавлению, а вто-
рая — к выпадению одного нуклеотида, синтезируется фермент, полипеп-
тидная цепь которого отличается от полипептидной цепи нормального
фермента лишь по 5 последовательным аминокислотным остаткам из об-
щего числа 160 остатков, образующих полипептидную цепь этого белка.
Был обнаружен другой случай, когда в результате мутации, приво-
дящей к сдвигу считывания, молекула фаговой ДНК удлинилась на два
нуклеотида [628].
МОДИФИКАЦИИ ФАГА, ВЫЗВАННЫЕ ХОЗЯИНОМ
Даже в тех случаях, когда фаг мутирует, находясь в бактерии-хо-
зяине, бактерия обычно не принимает участия в определении природы
генетического изменения фага. Однако у фагов существуют изменения
.другого типа, в которых главную роль играет клетка-хозяин. Они полу-
чили название модификаций, вызванных хозяином. Важность этого яв-
ления для молекулярной биологии состоит в том, что оно продемонстри-
ровало способность внутриклеточной среды вызывать изменения в хими-
ческом строении генетического материала, не изменяя закодированной
в нем генетической информации [31, 534].
Типичные результаты подобных наблюдений приведены в табл. 23.
Разберем, например, случай, когда фаг <р имеет двух хозяев, А и В. Фаг
гр, выращенный на клетках А (такой фаг обозначается символом ср* А),
успешно размножается на клетках А, но эффективно «отвергается» клет-
ками В (например, эффективность посева, или ЭП, этого фага не превы-
шает 10-4). У небольшого числа фаговых частиц, все же размножив-
шихся на клетках В (такие частицы обозначают символОхМ <р*В), это
ограничение снимается (ЭПА = ЭПв=1). Один цикл размножения на
•клетках А восстанавливает исходное ограничение, что можно записать
следующим образом: <р -А В А=ср А. Иными словами, размножение
фага ф на клетках А модифицирует фаг ф, так что его спектр литического
действия ограничивается штаммом А, а размножение частиц дочерней
популяции на клетках В модифицирует его таким образом, что он уже
не «отвергается» клетками В. Никаких мутаций при этом не возникает.
Модификации этого типа обычно возникают во всех фаговых частицах,
образующихся в модифицирующем хозяине.
Генетика и радиобиология бактериофагов
209
Таблица 23
Примеры модификаций фагов, вызванных хозяином
Пример I Е. coll S. dysenteriae
В в^о* Brgl Sh Sh/42>
Т2 • В 1 1 1 1 1
Т2 • В/40 10-5 10-5 1 1 1
Т2 • Brgl 1 1 1 1 1
Т2 • Sh 1 1 1 1 1
Т2 • Sh/40 10-5 10-5 1 1 1
Пример II с3) в3) к3) К(Р1)
х.с 1 10-< 4 • 1О-4 10—7
X . в 1 1 4- 10—4 10-7
К - к 1 10—4 1 10-5
X • К(Р1) 1 10-4 1 1
О Все цифры выражают* долю продуцирующих фаг зараженных бактерий, взятых из растущих
культур; символы Т2 В, Л- К и др. указывают последнего хозяина, в котором размножался фаг.
2>В/4о и Sh/40 — мутантные бактерии, неспособные синтезировать уридиндифосфатглюкозу; они
дают фаговую ДНК, содержащую неглюкозилированный оксиметилцитозин. Brgl — мутантная бак-
терия, ставшая пермиссивной для фага, ДНК которого не глюкозилирована. Фаг Тб ведет себя
подобно фагу Т2.
С, В и К —независимо выделенные штаммы Е. coli.
В особых случаях могут возникнуть более сложные ситуации. Так,
например, известны системы, в которых фаги ф • А «отвергаются» клетка-
ми В, а фаги ф • В «отвергаются» клетками А (двустороннее ограниче-
ние). Известны также случаи, когда фаги ф -В «отвергаются» как клет-
ками А, так и клетками В, но способны размножаться в клетках третьего
хозяина С. В табл. 23 приведены примеры всех трех ситуаций.
Кроме того, при изучении этого явления было обнаружено сле-
дующее:
1. Фаг нормально адсорбируется на непермиссивных хозяевах и вво-
дит свою ДНК в их клетки, однако часть этой ДНК быстро разрушается
и репликации фага не происходит.
2. Ограничивающее и модифицирующее действие данного штамма
бактерии иногда определяется геномом не самой бактерии, а содержа-
щегося в ней профага [18, 497]. Например, клетки Е. coli К12 (Р1) «от-
вергают» фаг ХК(Р1), однако иногда фаг X успешно размножается в
клетках К(Р1), и тогда эти клетки модифицируют фаг X в фаг X - К(Р1),
способный размножаться как в клетках К, так и в клетках К(Р1). Геном
Р1 ответствен как за ограничение спектра литического действия фага,
так и за его модификацию. Некоторые мутации фага Р1 могут приводить
к изменению либо одной, либо обеих этих функций.
3. Один и тот же фаг может одновременно подвергнуться нескольким
модификациям. Так, например, фаг К К(Р1) может размножаться на
клетках Е. coli К(Р1), Е. coli К и Е. coli С, фаг X • К может размножаться
на клетках Е. coli К или С, но не на клетках К(Р1), а фаг X • С не может
размножаться ни на клетках К, ни на клетках К(Р1).
4. Модификации подвергается нуклеиновая кислота фага, о чем
свидетельствует следующий опыт [32]. Если заразить культуру клеток
Е. coli С фагом X К и выделить фаг, образовавшийся в первом цикле
размножения, то выход фага (примерно 100 частиц на одну бактериаль-
14 Заказ № 1214
210
Глава X
ную клетку) состоит в основном из частиц Z C; однако примерно 1% ча-
стиц еще сохраняет способность размножаться на клетках Е. coli К.
Если исходный фаг X • К был помечен тяжелым изотопом, то, центрифу-
гируя лизат Х-С в градиенте плотности, легко показать, что несколько
частиц, содержащихся в лизате от одного цикла размножения, которые
все еще «помнят», как размножаться в клетках К,— это те частицы, в
ДНК которых содержится по меньшей мере одна из цепей тяжелой ДНК,
синтезированной в бактериях штамма К. Природа химических измене-
ний, ответственных за подобные модификации фаговой ДНК, вызывае-
мые клеткой-хозяином, окончательно не выяснена. Возможно, что одним
из процессов, ведущих к таким изменениям, является метилирование
остатков цитозина и аденина молекулы ДНК фага, катализируемое мети-
лирующими ферментами [279], которые различаются у разных штаммов,
бактерий [30].
Возможно, что модификации, индуцируемые хозяином, играют су-
щественную роль в процессе эволюции, выполняя роль механизма, пре-
пятствующего проникновению и обоснованию в бактериальной клетке
неприемлемой для нее чужеродной ДНК. И в самом деле, бактерия А,,
отвергающая фаг, размножившийся на клетках штамма В, отвергает
также ДНК бактерий В, если такая ДНК вводится в клетку А при
помощи конъюгации или трансдукции.
Уникальный пример модификации, вызванной хозяином, был обна-
ружен при изучении Т-четных фагов. Некоторые мутантные бактерии
модифицируют Т-четные фаги в форму Т*, неспособную размножаться
в бактериях Е. coli, но способную размножаться в клетках S. dysenteriae.
Было обнаружено, что в основе этой модификации лежит нарушение
у бактерии-хозяина биосинтеза уридиндифосфатглюкозы — донора глю-
козы, необходимого для реакции глюкозилирования ДНК фага, вслед-
ствие чего оксиметилцитозин в ДНК вновь синтезирующегося фага не
может глюкозилироваться [324] (см. табл. 23).
При проникновении в клетки Е. coli неглюкозилированная ДНК
Т-четного фага разрушается, чего не происходит, если она проникает
в клетки S. dysenteriae (или некоторых мутантов Е. coli). Природа «огра-
ничивающих» ферментов, атакующих проникающую в клетки фаговую*
ДНК, пока еще неизвестна.
ИЗУЧЕНИЕ РАЗВИТИЯ ФАГА РАДИОБИОЛОГИЧЕСКИМИ МЕТОДАМИ
В гл. VII отмечалось, что облучение вирусных частиц, находящихся
вне клетки, может привести к нарушению различных функций вируса и к
остановке цикла развития вируса на той или иной стадии. Облучение
вирусов применяется и в более тонких исследованиях, например при
изучении влияния излучения на бактериальные клетки, зараженные фа-
гом, или при изучении взаимодействия нормального и облученного
фага.
Облучение фага, находящегося внутри клетки
Если зараженные фагом бактерии подвергнуть действию ультрафио-
летовых или рентгеновских лучей, то их способность генерировать фаг
(измеряемая по количеству образующихся «продуктивных комплексов»^
т. е. комплексов фаг—бактерия) уменьшается со скоростью, зависящей
как от вида фага и бактерии, так и от времени между моментом зара-
жения и началом облучения. Хотя в некоторых случаях производитель-
Генетика и радиобиология бактериофагов
211
ность клетки хозяина, т. е. ее способность поддерживать размножение
фага, очень чувствительна к облучению, в общем, как пpaiвилo, клетка
более устойчива, чем фаг; это делает вполне возможным изучение про-
цесса инактивации фага облучением внутри клетки [68, 541].
Непосредственно после заражения бактериальных клеток чувстви-
тельность фага, находящегося в комплексе с бактерией, к облучению не
отличается от чувствительности свободного фага, однако вскоре чувстви-
тельность начинает уменьшаться. У некоторых фагов постоянно наблю-
0 100 200 300 0 100 200 300 400 500 600
Длительность облучения,сек
Фиг. 52. Изменение чувствительности к ультрафиолету инфекционных комплексов Е. coli
В, зараженных фагом Т2г.
Цифры, стоящие у кривых, указывают время облучения.
дается переход от кривой выживания одноударного типа к кривой вы-
живания многоударного типа; такой переход указывает на то, что для
образования фага инфекционным комплексом необходимо, чтобы после
облучения сохранился по крайней мере один неповрежденный фаговый
геном.
При облучении ряда других фагов, в том числе и Т-четных фагов,
возникает более сложная ситуация (фиг. 52). Сначала выживание инфек-
ционных комплексов описывается одноударной кривой с постепенно убы-
вающим наклоном, что указывает на постепенное повышение устойчиво-
сти инфекционного комплекса к облучению. Это согласуется с данными
о том, что некоторые гены необходимы фагу лишь на ранних стадиях
цикла его развития; поэтому любое вызванное облучением повреждение
этих генов, подавляющее их функцию, но не репликацию, будет леталь-
ным лишь в том случае, если оно произойдет до того, как эти гены дол-
жны осуществлять свою функцию. В последующей части латентного
периода кривые выживания приобретают вид многоударных кривых.
Дополнительные явления, в том числе множественная реактивация (см.
ниже), а также конкурирующие процессы — восстановление поврежде-
ний, репликация и лизис — осложняют анализ кривых выживания, соот-
ветствующих этому периоду.
Большая устойчивость фага Т4 к облучению ультрафиолетом на ран-
ней стадии инфекции по сравнению с фагом Т2 вызвана наличием у фага
Т4 и отсутствием у фага Т2 гена, который детерминирует некоторое вос-
становление повреждений фаговой ДНК, вызываемых ультрафиолетом
[314].
14*
212
Глава X
Множественная реактивация, перекрестная реактивация
(спасение маркеров) и чувствительность гена
Если чувствительную бактериальную клетку подвергнуть множест-
венному заражению фагом, облученным ультрафиолетом, или если облу-
чить ультрафиолетом бактериальную клетку вскоре после множествен-
ного заражения, устойчивость инфекционных комплексов к облучению
оказывается выше, чем можно было ожидать; это обусловлено так на-
зываемой множественной реактивацией. Реактивация этого типа имеет
место только при множественном заражении бактериальных клеток фа-
говыми частицами, способными к генетической кооперации и рекомби-
нации. Для того чтобы объяснить явление множественной реактивации,
было сделано допущение [47, 539], что повреждения, вызываемые у фага
при облучении, локализуются в специфических участках его ДНК; по-
этому благодаря кооперации между геномами фагов, поврежденными
в различных участках, становится возможным успешное образование
активного фага из нескольких поврежденных родительских частиц.
Для того чтобы произошла реактивация фага, необходимы следую-
щие условия:
1) в группе фаговых частиц, заражающих бактериальную клетку,
должен содержаться хотя бы один полный набор функционально непов-
режденных локусов, обеспечивающих основные функции, инициирующие
развитие фага;
2) число проникших в клетку фаговых геномов должно обеспечивать
значимую вероятность встречи друг с другом неповрежденных частей
геномов и образование путем рекомбинации по меньшей мере одного
нормального фагового генома. Следовательно, эта ситуация аналогична
той, с которой приходится встречаться при множественном заражении
частицами фага Т4, содержащими неполное количество ДНК [602].
Некоторая множественная реактивация наблюдается также при по-
вреждении фаговой ДНК рентгеновскими лучами или при радиоактив-
ном распаде входящих в ее состав атомов Р32 при условии, что фаг был
поврежден, находясь в бактериальной клетке. Если же вирионы подверг-
лись воздействию рентгеновских лучей или радиоактивного распада Р32
до того, как они проникли в клетку, то при заражении в клетку вводится
не вся фаговая ДНК и реактивация крайне незначительна либо не про-
исходит вовсе.
При заражении бактерии двумя родственными фагами, например Т4
и T4abc, из которых один нормальный, а другой был предварительно
облучен, в потомстве фага часто обнаруживаются рекомбинантные ча-
стицы. Результаты генетического анализа рекомбинантов отчетливо по-
казывают, что в подобных случаях имеет место не реактивация облучен-
ного фагового генома in toto, а спасение одного или большего числа гене-
тических маркеров инактивированного фага, происшедшего благодаря
осуществившейся рекомбинации [189]. Частота, с которой происходит
одновременное спасение двух маркеров, зависит от положения этих мар-
керов на генетической карте фага, причем совместное «спасение» тесно
сцепленных маркеров наблюдается чаще.
В опытах такого типа можно также определить чувствительность
к облучению функции того или иного специфического локуса фага. Для
этого бактерии заражают смесью из облученного фага и необлученного
мутантного фага, у которого изучаемая функция нарушена. Например,
если клетку Е. coli К12 (X) заразить несколькими частицами активного
фага Т4 rll и одной частицей облученного фага Т4 гП+, то в такой бак-
терии фаг образуется только в том случае, если в облученной частице
функция гП+ не была повреждена. Изучение чувствительности к облуче-
Генетика и радиобиология бактериофагов 213
нию ультрафиолетом нескольких локусов фага Т4, проведенное этим
методом, показало, что она составляет примерно от 7зо ДО Vso общей
чувствительности фага [475]. Эти величины кажутся приемлемыми, если
допустить, что чувствительность разных цистронов к облучению различна
и зависит от их размеров, от стадии развития фага, на которой данный
цистрон функционирует, а также, возможно, и от того, в какой степени
тот или иной цистрон поддается действию репаративных механизмов.
Глава XI
ЛИЗОГЕНИЯ
ОСНОВНЫЕ ЧЕРТЫ ЛИЗОГЕННОГО СОСТОЯНИЯ БАКТЕРИЙ
Так называемые умеренные бактериофаги могут находиться в проч-
ной, длительной взаимосвязи со своими клетками-хозяевами. Это явление
было названо лизогенией [72, 546]. Лизогенные бактерии растут нормаль-
но, однако их колонии всегда содержат некоторое количество фага. Каж-
дая клетка такой бактериальной культуры порождает лизогенный бак-
териальный клон. Из лизогенных бактерий фаг освобождается не путем
выделения, а в результате случайного лизиса некоторых бактериальных
клеток. При этом из каждой лизировавшейся бактериальной клетки
освобождается примерно такое же количество фаговых частиц, как и в
случае лизиса, происходящем при литическом цикле развития фага.
Частота спонтанного лизиса в лизогенных культурах, т. е. относительное
количество бактериальных клеток каждой генерации, лизирующихся
спонтанно, варьирует от 1 100 (очень большая частота лизиса) до 1 : 106
и даже менее. Частоту лизиса можно увеличить, воздействуя на лизоген-
ную культуру различными агентами. Лизис лизогенных бактериальных
клеток, вызываемый различными агентами, называется индукцией.
Освобождающийся в лизогенной культуре фаг может адсорбиро-
ваться на других клетках данной бактериальной культуры, но не лизи-
рует их. Лизогенные бактерии обладают специфическим иммунитетом
по отношению к фагу или к фагам, которые они освобождают (однако
они не иммунны по отношению к другим умеренным фагам). В основе
этого вида иммунитета лежит не отсутствие у фага способности адсорби-
роваться на иммунных к нему бактериях и не неспособность фага инъе-
цировать в эту иммунную бактерию свою нуклеиновую кислоту, а блоки-
рование репликации нуклеиновой кислоты фага в иммунной бактериаль-
ной клетке. Умеренный фаг выявляют и количественно титруют по лити-
ческому действию, которое он оказывает на некоторые чувствительные
штаммы бактерий. Бактериальный штамм А, лизогенный к фагу ф, обо-
значают символом А (ф), а его нелизогенный двойник (иногда) символом
Аф8 или, что менее удобно,— А(ф~). Все известные умеренные фаги яв-
ляются ДНК-содержащими фагами.
За состояние иммунитета ответственно действие специфического ре-
прессора, образуемого под контролем какого-то гена фага. Мутации
в этом гене приводят к тому, что фаг теряет способность продуцировать
репрессор. В результате такой мутантный фаг становится неспособным
лизогенизировать бактерию (или поддерживать состояние лизогении,
если мутация произошла после того, как бактерия была лизогенизиро-
вана фагом). Анализ причин, определяющих появление у лизогенных
бактерий иммунитета (см. далее), послужил основным фундаментом для
разработанной Жакобом и Моно [400] теории, объясняющей контроль
действия гена влиянием диффундируемых репрессоров.
Заражение чувствительной клетки умеренным фагом может приве-
сти либо к продуктивной инфекции (литический цикл), либо к редуктив-
ной инфекции (лизогенный цикл). Литический цикл умеренного фага
в бактериях, заражение которых ведет к продуктивной инфекции, идет
— 214 —
Лизогения
215
но типу, описанному в гл. IX. Как и при литической инфекции, вызывае-
мой вирулентными фагами, в этом случае в обычной последовательности
наблюдаются вегетативная репликация, генетическая рекомбинация, соз-
ревание и лизис. Продуктивный цикл умеренного фага X изучен примерно
в той же степени, что и Т-четных фагов (см. табл. 15).
Умеренные фаги образуют мутные бляшки, ибо в результате инфек-
ции некоторые зараженные бактериальные клетки становятся лизоген-
ными и иммунными к данному фагу. При посеве лизогенных бактерий
..на чувствительные индикаторные штаммы образуются кольцеобразные
бляшки (фото 47). Поскольку некоторые вирионы умеренного фага вы-
зывают у первично инфицируемых ими бактериальных клеток редуктив-
ную инфекцию, число бляшек, образуемых умеренными фагами, всегда
несколько меньше общего числа вирионов. Частота лизогенизации, т. е.
отношение числа бактериальных клеток, ответивших на заражение фа-
гом редуктивной инфекцией, к общему числу зараженных бактерий,
варьирует от 1% и менее до 90% и более. При высокой множественности
заражения частота лизогенизации часто возрастает, и такая зависимость
наводит на мысль, что вероятность, с которой фаг может взаимодейство-
вать с бактериальным ядром редуктивно, т. е. по типу, ведущему к лизо-
гении и предупреждающему лизис, одинакова для каждого генома
фага [73].
ПРОФАГ
Положение профага в хромосоме
У лизогенного бактериального штамма большинство клеток не со-
держит ни зрелых вирионов, ни белков, из которых вирионы образуются.
Зрелые вирионы и белки, входящие в состав вирионов, обнаруживаются
только в той части бактериальных клеток лизогенной культуры, которые
либо спонтанно, либо вследствие индукции перешли в вегетативное (ли-
тическое) состояние и вскоре лизируются и освободят фаг. В лизогенных
клетках генетическая информация, необходимая для образования вирио-
нов, т. е. геном фага, сохраняется в клетке в виде профага.
Число профагов, приходящихся на одну бактерию, можно опреде-
лить, суперинфицируя бактериальную культуру, лизогенную по фагу X,
известным количеством мутантного фага Хт. Суперинфицирующий ге-
ном фага не размножается и передается неизмененным одной из дочер-
них клеток. При исследовании потомства фагов, освобождаемого бакте-
риями последующих генераций либо спонтанно, либо благодаря индук-
ции, обнаруживаются смеси фагов X и Хт. Соотношение числа вирионов
фагов X и Хт зависит как от множественности суперинфекции, так и от
того, на какой генерации бактерий проводится исследование. Пользуясь
величинами этих отношений, рассчитывают отношение числа геномов X
к числу геномов Хт, а отсюда — число профагов X, приходящихся на
•одну клетку. Это число варьирует от двух до четырех, что сравнимо
•с числом бактериальных геномов, приходящихся на одну бактериальную
клетку [71].
В случае Е. coll наличие физической связи между бактериальным
геномом и профагом может быть продемонстрировано при помощи скре-
щивания бактерий. В этом случае при конъюгации нелизогенного муж-
ского штамма бактерий с женским штаммом, лизогенным по фагу X, не-
которые из рекомбинантов бактериального потомства могут оказаться
нелизогенными. (При реципрокном скрещивании лизогенного мужского
штамма с нелизогенным женским штаммом вследствие зиготной индук-
ции наблюдаются более сложные явления; см. далее.) Если мужской
гптамм лизогенен по фагу X, а женский — по фагу Хт, некоторые из
бактериальных рекомбинантов будут содержать геном X, а другие —
геном Хт. Ни один из рекомбинантов не будет содержать обоих фаго-
вых геномов. Следовательно, профаг ведет себя, как бактериальный
генетический маркер, и может быть картирован исходя из его специфи-
ческой связи с другими маркерами [923]. При помощи этого метода для
нескольких фагов, лизогенизирующих Е. coli, было определено положе-
ние, которое соответствующие профаги занимают на генетической карте
Фиг. 53. Генетическая карта штамма К12 Escherichia coli [402, с изменениями].
На внешней стороне окружности показано расположение генетических детерминантов различных
биохимических признаков, на внутренней — места присоединения различных профагов. Фигурными
скобками отмечены детерминанты, котрансдуцируемые фагом Р1.
этой бактерии (фиг. 53). Большинство умеренных колифагов присоеди-
няется к хромосоме клетки-хозяина в одном, строго определенном месте
[402], но некоторые могут присоединяться к двум или более различным
точкам, отдавая предпочтение тем или иным из них [783].
Способ присоединения профага
Каким образом профаг присоединяется к бактериальной хромосоме?
Очевидно, что профаг может либо встроиться в структуру хромосомы,
либо каким-то образом присоединиться к ней сбоку (фиг. 54). Поскольку
бактериальная хромосома, по всей вероятности, представляет собой
одну кольцевую двухцепочечную молекулу ДНК [122], наиболее вероят-
ным является предположение о том, что профаг встраивается в струк-
туру хромосомы бактерий, ибо во всех других случаях потребовалось бы
принять ряд дополнительных допущений, для того чтобы объяснить мо-
лекулярные механизмы присоединения профага к геному бактерии.
Наиболее исчерпывающая информация по этому вопросу была получена
при изучении генетики бактерий, лизогенных по умеренным фагам, та-
ким, например, как фаг Л, генетическая карта которых хорошо известна.
Результаты, полученные при скрещивании бактерий, несущих про-
фаги X, отличающиеся по нескольким генам, показывают, что можно по-
строить линейную генетическую карту лизогенной бактерии, причем гены
профага на этой карте будут встроены между маркерами бактерии. Когда
эта работа была выполнена, то оказалось, что последовательность рас-
положения генетических маркеров фага в геноме профага X отличается
от последовательности их расположения в геноме вегетативного фага Ъ
[123]. На фиг. 55 показана интерпретация этих опытов, предложенная
Лизогения
217
Кэмпбеллом [126]. Все данные, полученные впоследствии, подтвердили
правильность объяснения, предложенного Кэмпбеллом.
После проникновения в бактерию ДНК фага X приобретает форму
кольца. Между этим кольцом и гомологичным ему участком бактериаль-
ной хромосомы происходит синапс. В результате одного кроссинговера
профаг встраивается в хромосому бактерии, и если гомологичная область
находится не на конце, а в каком-либо ином месте генетической карты
фага, то последовательность генов в геноме профага будет отличаться от
их последовательности в геноме вегетативного фага. При обратном про-
цессе произойдет возвращение к последовательности генов, характерной
для вегетативного фага. Эта гипотеза объясняет также происхождение
Фиг. 54. Гипотетические альтернативные способы присоединения профага X к хро-
мосоме бактерии.
Д. Линейная вставка. Б. Присоединение одним концом. В. Медиальное присоединение. Г. Частичная'
вставка. Д. Синапс.
трансдуцирующих фагов, в геном которых оказываются встроенными
ближайшие к профагу бактериальные гены и одновременно, причем до-
вольно часто, наблюдается утрата некоторых генов фага.
Различные факты подтверждают правильность модели интеграции
генома фага с хромосомой бактерии, предложенной Кэмпбеллом. Неко-
торые из них приводятся ниже:
1. При помощи трансдукции (см. далее) можно картировать гены
профага X, т. е. устанавливать их положение по отношению к соседним
генам бактерии. На полученной подобным методом генетической карте
маркеры профага X локализуются между генами gal (галактоза) и bio
(биотин) бактерии, образуя последовательность, которую можно было
ожидать, исходя из гипотезы Кэмпбелла (692].
2. Профаг ф80, напоминающий профаг %, но присоединяющийся
к хромосоме Е. coli вблизи генов try (триптофан), может быть картиро-
ван относительно генов try путем применения специального метода кар-
тирования, основанного на использовании делеции. Полученные резуль-
таты также удовлетворяют гипотезе Кэмпбелла (235].
3. Были выделены мутанты фагов X и <р80 с делециями, у которых
отсутствовал сегмент генома, содержащий локус, ответственный за при-
соединение генома к хромосоме бактерии, существование которого было
постулировано Кэмпбеллом (фиг. 55). Хотя эти мутанты размножались
вегетативно вполне нормально, они оказались неспособными переходить
в состояние профага [235, 446].
218
Глава XI
4. За интеграцию профага с хромосомой клетки-хозяина ответствен,
по-видимому, специфический фермент, синтез которого детерминируется
геномом фага. Этот фермент синтезируется только в неиммунных бакте-
риях [770]. Были обнаружены мутанты, по-видимому дефектные в отно-
шении синтеза этого фермента [941].
5. Показано, что ДНК фага X, <р80 и других родственных фагов
действительно приобретает кольцевую форму, как это было постулиро-
вано теорией Кэмпбелла в качестве обязательного условия интеграции
профага, причем оказалось, что это явление происходит как in vitro [340],
так и in vivo (в случае фага X) [91, 192, 934]. Кольцевая молекула обра-
зуется в результате гибридизации гомологичных друг другу двух одноце-
почечных участков, находящихся на двух концах молекулы ДНК фага
[823] (фиг. 55). Конечно, два конца молекулы ДНК фага, вошедшей в
состав хромосомы, должны быть соединены друг с другом не только
водородными, но также и ковалентными фосфодиэфирными связями.
Однако механизм, при помощи которого концы кольца замыкаются при
интеграции и открываются при индукции профага, остается неизвестным.
А
л h cl
А ВСDЕ F 6Н I J N О Р Q R
X
КТЕ
gal
bio
Область
Кэмпбелла
Хромосома
бактерии
Область
Кэмпбелла
КТЕ N QPQRABCDEFGH1J Ыо
flat Профаг Л
Б
ABODEFGHJJ N О Р Q R
Суперспираль -<--
Интеграции не происходит
Кольцо
Кольцо с одним разрывом
Фиг. 55. Предложенная Кэмпбеллом схема, изображающая процесс интеграции про-
ката X с бактериальной хромосомой (Д) и объясняющая неспособность мутанта ХЬ2,
в геноме которого имеется делеция, переходить в состояние профага (Б).
Объяснение см. в тексте.
Лизогения
219
Множественная лизогения
Суперинфекция лизогенной бактерии, как и смешанное заражение
чувствительной бактерии двумя умеренными фагами, иногда приводит
к двойной лизогении. Если используемые для заражения фаги отличают-
ся друг от друга, они ведут себя независимо. Штаммы бактерий, лизо-
генные одновременно по нескольким различным фагам, легко обнару-
жить среди обычных штаммов бактерий, а также вывести искусственно.
Значительно реже встречаются лизогенные бактерии, несущие не-
сколько экземпляров одного и того же фага или несколько разных его
мутантов. В случае когда в хромосоме бактерии имеется несколько локу-
сов, к которым может присоединиться геном данного фага, присоедине-
ние геномов фага к соответствующим локусам может произойти одно-
временно или последовательно. При заражении фагом X, для генома ко-
торого в хромосоме бактерии имеется лишь один локус присоединения,
тоже иногда наблюдается образование дважды лизогенных бактерий.
В этом случае либо два сцепленных друг с другом профага встраиваются
в бактериальную хромосому [127], либо один из профагов встраивается
в структуру другого [124].
Спонтанная частота утраты профага низка. Для фага X она состав-
ляет примерно 10~6 на клетку на генерацию. Частоту «исцеления» можно
увеличить, подвергая бактерии интенсивному облучению ультрафиолетом
или суперинфицируя их другим умеренным фагом. Хотя обычно исце-
ленные бактерии утрачивают весь профаг, описаны случаи, при которых
в геноме бактерии оставались отдельные локусы генома профага
(228, 235].
Репрессор, иммунитет и индукция лизогенных бактерий
Когда геном фага находится в состоянии профага, большая часть
•его генов, очевидно, не функционирует. В этом случае в бактериальной
клетке не синтезируются ни белки вириона, ни лизин. Тем не менее
лрофаг не является генетически неактивной структурой. Некоторые из
его генов функционируют, и в первую очередь те из них, функция кото-
рых состоит в поддержании состояния специфического иммунитета. Под
иммунитетом в данном случае понимается такое состояние бактерии, при
котором исключается возможность вегетативного размножения как са-
мого профага, так и суперинфицирующих родственных фагов. Вероятно,
за блокирование размножения профага и суперинфицирующего фага
ответствен один и тот же механизм.
В иммунных бактериях профаг размножается как составная часть
хромосомы, тогда как геном суперинфицирующего фага, существующий
в клетке в виде самостоятельной молекулы, не связанной с хромосомой
бактерии, вовсе не может размножаться. Однако стадию внутриклеточ-
ного превращения в кольцевую форму геном суперинфицирующего фага
проходит. И действительно, было показано, что из иммунных бактерий,
суперинфицированных меченым фагом X, можно выделить фаговую ДНК,
молекула которой представляет собой суперспирализованну^о кольцевую
•структуру [91].
Когда состояние иммунитета снимается, то как профаг, так и геном
любого суперинфицирующего коиммунного фага, т. е. фага, чувствитель-
ного к контролирующему действию того же иммунного механизма, что и
фаг, лизогенизировавший данную бактерию, вступают в цикл вегетатив-
ной репликации и созревания. У бактерий, лизогенных по фагу X или по
какому-либо другому умеренному фагу, массовый переход из лизогенного
состояния в литическое можно вызвать действием индуцирующих аген-
220
Глава XI
тов. Одним из наиболее мощных индукторов является ультрафиолет.
Сильным индуцирующим действием обладают также многие химические
соединения, в частности перекиси и антибиотик митомицин С. У этих
агентов есть одно общее свойство: способность прекращать или замед-
лять синтез ДНК. У бактерий, лизогенных по фагу X и неспособных эндо-
генно синтезировать тимин, временное лишение бактерий экзогенного
тимина приводит к индукции [582]. Однако для того, чтобы синтезирова-
лась фаговая ДНК, необходимо затем вновь добавить тимин. Это говорит
о том, что в геноме фага X в отличие от генома фагов типа Т2 или Т5
отсутствует генетическая информация, необходимая для восстановления,
синтеза тимидилата.
В основе «сдерживающего» механизма, ответственного за состояние
иммунитета, лежит образование специфического иммунитетного репрес-
сора. Как уже упоминалось выше, биосинтез этого репрессора специфи-
чески детерминируется геном умеренного фага, ответственным за имму-
нитет [400, 429]. Соответствующий ген (cl) фага X, детерминирующий
синтез репрессора, был идентифицирован благодаря тому, что, как ока-
залось, его мутации приводили либо к потере фагом способности инду-
цировать иммунитет (вследствие превращения фага в нелизогенный му-
тант), либо к образованию устойчивого к действию ультрафиолета не-
индуцибельного мутанта (inch;; [398]). Другие мутации в том же самом
гене, так называемые с/и-мутации, ведут к тому, что вместо обычного
репрессора образуется репрессор, чувствительный к повышению темпе-
ратуры. В результате, если соответствующие бактерии культивируют при
30°, то они, как обычно, остаются лизогенными, но в случае, когда их в
течение короткого промежутка времени инкубируют при 42°, они начи-
нают синтезировать фаг и в конце концов лизируются. Чувствительность
репрессора к повышению температуры и ряд других данных наводят на
мысль, что репрессор, по-видимому, является белком или по крайней
мере содержит белок в качестве одного из компонентов своей молекулы.
Пока остается неизвестным, в чем состоит сущность механизма, при
помощи которого облучение ультрафиолетом и другие воздействия,
влияющие на синтез ДНК, вызывают индукцию профага. Скорее всего
в основе этого механизма лежит не разрушение репрессора, а изменение
его активности, вызываемое, возможно, накоплением в бактериальной
клетке каких-то предшественников ДНК. Известен ряд фагов, не инду-
цируемых ультрафиолетом. В качестве примера можно привести фаг Р2
и родственные ему фаги.
Очевидно, что ответственный за иммунитет репрессор представляет
собой продукт действия гена, способный диффундировать из участка
бактериальной клетки, где он образуется, в другое место клетки, где он
осуществляет свою функцию. Так, профаг X препятствует репликации и
выражению признаков суперинфицирующего фага Xcj, не образующего
своего собственного репрессора. Далее, если бактерия, лизогенная по
фагу Хс+ь суперинфицируется фагом X ind~, образующим репрессор,
устойчивый к ультрафиолету, а затем облучается ультрафиолетом, то
она не индуцируется и остается живой и лизогенной. Подобным же обра-
зом суперинфекция фагом Xc+i предохраняет бактерии, лизогенные по
фагу Хсйь от индукции путем нагревания [520].
У фага X некоторые мутации приводят к потере чувствительности
к действию репрессора, ответственного за иммунитет. В результате та-
ких мутаций фаг превращается в вирулентный мутант, способный лизи-
ровать бактерии, лизогенные по фагу X. Мутанты такого типа являются
комплексными мутантами, у которых мутация в гене Q сочетается с му-
тацией в одной из соседних областей генома, названной областью х-у
(фиг. 56) [212]. Однако функцию этих генов предстоит еще выяснить.
Лизогения
221
Как уже подчеркивалось выше, иммунитет фагоспецифичен. Изве-
стен ряд фагов, родственных фагу X (так называемые «лямбдоиды» —
фаги 21, 434, 80, 82 и др.), которые способны рекомбинировать друг
с другом и в то же время являются гетероиммунными, т. е. образуют
различные репрессоры и чувствительны лишь к своему собственному ре-
прессору. Геномы этих фагов присоединяются к различным участкам
хромосомы Е. coli (фото 47). Гибридные рекомбинанты этих фагов со-
храняют тип иммунитета, свойственный той из родительских клеток, чей
imm434
-----С|П —-----N--------С,-------С„-------------------0-----Р -
Ц с844 с68
с67 sus7 sus213 с90 сБО i сБО с17 с 42 с2ОО2 i sus8 susS
1-----1-----1 I , I ,1'1-------1 I fl 11 —Irrr1-------1| I1
Oj p22 t27 0,06 tn QJ.___ 0,4^t5|f71 t3J |
«____Qfi____* 0,6_* t65^__0,6_x x 0,5 t6° t67
____» < °>7__
___________16___________t69+_°A.___________________+
ч____________2,4________f7? < 0-3 > Л_____________+
0,9 _______
__12_____________
Фиг. 56. Детальная генетическая карта медиальной области генома фага X [212].
<-Мутанты — это мутанты, образующие прозрачные бляшки [425); sus — супрессор-чувствительные
мутанты [125) pat - дефектные мутанты профага. Символы над картой — различные генные ло-
кусы, или цистроны, числа под картой — частоты рекомбинации, выраженные в процентах, imm434 —
специфическая область генома фага 434, содержащаяся в геноме гибридного фага i434h\
ген ci вошел в состав генома рекомбинанта [429]. Например, гибрид,
образовавшийся в результате скрещивания фага X и фага 434, может
обладать иммунной специфичностью фага 434 и спектром литического
действия фагаХ. Обозначение этого фага Х-434 hy i434hx отражает эти его
свойства.
Зиготная индукция
Иной вид индукции профага наблюдается, когда профаг проникает
в неиммунную клетку во время конъюгации бактерий. При конъюгации
клеток Е. coli часть ДНК хромосомы мужских клеток проникает в жен-
скую клетку (см. [402]). Если в женскую клетку Е. coli, чувствительную
к фагу X, проникает профаг мужской клетки, лизогенной по фагу X, то
этот профаг индуцируется и зигота лизируется [402]. Время проникнове-
ния профага можно определить, прерывая скрещивание. По-видимому,
в неиммунных женских клетках репрессор, ответственный за иммунитет,
образуется недостаточно быстро для того, чтобы он мог предотвратить
индукцию. Благодаря зиготной индукции оказалось возможным пока-
зать, что профаг состоит из ДНК, и сравнить его фактическую длину
е размерами ДНК зрелого фага [402]. В этих опытах культуру мужского
штамма бактерии, лизогенного по фагу X, интенсивно метили Р32 с тем,
чтобы вызвать «самоубийство» ДНК вследствие радиоактивного распада
Р32. Затем полученную культуру скрещивали с нелизогенными женскими
клетками, спаренные клетки отделяли, мужские клетки убивали, бакте-
рии замораживали и хранили с тем, чтобы дать проявиться эффекту ра-
диоактивного распада Р32. Через определенные интервалы времени брали
пробы, которые оттаивали и засевали для выявления инфекционных
центров, содержащих фаг X.
222
Глава XI
Таким образом выявлялись оставшиеся клетки, в которых тем не
менее произошла зиготная индукция. Скорость, с которой «терялась»
зиготная индукция, служила мерилом повреждения профага. Она оказа-
лась равной скорости, с которой уменьшалась инфекционность вирионов-
фага X, меченных Р32 аналогичным образом. Следовательно, в вирионах
фага X и профаге X содержится примерно равное количество ДНК.
Фаза, определяющая переход к лизогении
В бактериальной культуре, зараженной умеренным фагом, одни бак-
териальные клетки отвечают на заражение литическим процессом, а дру-
гие становятся лизогенными. Выбор, или решение, по какому из двух пу-
тей пойдет инфекционный процесс, происходит в течение определенного,
так называемого критического периода, во время которого можно путем
того или иного воздействия изменить относительную частоту перехода
инфекции на тот или иной путь. Например, понижение температуры
способствует переходу инфекции на путь, ведущий к лизогении. Анало-
гичный эффект оказывает ингибирование биосинтеза белка [72]. Одним
из факторов, определяющих, какое «решение» будет в конечном счете
принято, является состязание в скорости двух последовательностей био-
синтетических процессов: одной, ведущей к формированию иммунитета,
и второй — к необратимому этапу, определяющему переход к созреваник>
фага и к лизису. Если состояние иммунитета сформируется раньше, чем
вторая последовательность биосинтетических процессов достигнет необ-
ратимой стадии (вероятно, на этой стадии синтезируется какой-то кри-
тически важный белок), то тогда вторая последовательность реакций
блокируется и бактериальная клетка может стать лизогенной.
Даже у бактерий, перенесших фаговую инфекцию и давших лизоген-
ное потомство, присоединение профага к бактериальной хромосоме мо-
жет настолько задержаться, что растущие бактерии в течение несколь-
ких генераций или даже бесконечно долго будут в состоянии выделять
нелизогенное, чувствительное к фагу потомство [446]. Очевидно, что,
прежде чем инфекция достигнет этапа, на котором принимается «реше-
ние», проникший в бактериальную клетку геном фага может начать ре-
плицироваться, в результате чего в клетке, до того как сработает репрес-
сия, ответственная за иммунитет, вероятно, образуется некоторое коли-
чество копий фагового генома.
Генетическая основа решения, определяющего переход к редуктив-
ной инфекции, изучалась на моделях нескольких фагов. Как в случае
фага X, так и в случае фага PLT22 Salmonella typhimurium наблюдалась
очень сходная картина. В обоих случаях функционировали по крайней
мере три гена фага, локализованные рядом друг с другом, а именно гены
Ci, Сц и Сщ. Как мы уже видели ранее, ген Q— это ген, детерминирую-
щий биосинтез репрессора. Мутации в одном из этих генов либо исклю-
чают возможность лизогении, либо резко уменьшают частоту редуктив-
ной инфекции. При смешанном заражении двумя мутантами данного
фага, у каждого из которых поврежден не тот ген, который поврежден
у партнера, например ген Ci и Сц, возможна комплементация и редуктив-
ная инфекция [425, 509].
Детальный анализ событий, происходящих после заражения бакте-
рий мутантами фага PLT22 [786, 787], позволил выявить природу неко-
торых стадий процесса, определяющего характер решения (фиг. 57). При
заражении фагом дикого типа с+ первой является весьма непродолжи-
тельная стадия, во время которой происходит синтез как фаговой, так и
бактериальной ДНК, однако через несколько минут синтез ДНК пол-
ностью прекращается. Примерно через 20 мин синтез ДНК возобнов-
Фиг. 57. Динамика синтеза ДНК, наблюдаемая при заражении Salmonella typhimurium
LT2 фагом Р22 или его мутантами, дающими прозрачные бляшки [786].
Фаг Р22 между 7-й и 20-й минутами после заражения блокирует синтез ДНК (ранний блок). Му-
тант фага Р22 С| не в состоянии блокировать синтез ДНК, и заражение ведет к лизису бактериаль-
ных клеток. Мутант фага Р22 сг не в состоянии образовать ответственный за иммунитет репрессор,
р результате чего, когда синтез ДНК возобновляется, происходит вегетативная репликация фага И
бактериальные клетки лизируются.
*224
Глава XI
ляется. Синтезирующаяся на этой стадии ДНК — это ДНК бактериаль-
ная. Вегетативная репликация фаговой ДНК репрессирована. При зара-
жении, вызванном одним из классов мутантов (который соответствует
мутантам Сц фага X), синтез фаговой ДНК не блокируется, фаг размно-
жается и клетки лизируются. При заражении, вызванном мутантами дру-
гих классов (мутанты класса Ci или дефектные в отношении образования
репрессора), синтез ДНК сначала блокируется, как и в случае зараже-
ния мутантами класса с+, но при возобновлении его синтезируется фаго-
вая ДНК и клетки лизируются. Отсюда ясно, что ген с+п вызывает вре-
менное ингибирование синтеза ДНК, необходимое для того, чтобы успел
накопиться ответственный за иммунитет репрессор, синтез которого де-
терминирует ген c+j. Функция гена сщ пока остается неизвестной.
Конечно, ответственный за иммунитет репрессор блокирует только
автономную репликацию фаговой ДНК, но не репликацию профага,
включившегося в геном бактерии. Этот профаг реплицируется как часть
бактериальной хромосомы под контролем системы, регулирующей репли-
кацию хромосомы [397].
Регуляторные явления, ответственные за способность умеренного
фага тормозить принятие решения, определяющего переход к литиче-
скому типу инфекции, и поэтому увеличивающие вероятность интеграции
профага, не являются уникальным свойством умеренных фагов. У нели-
зогенных фагов известны полуумеренные мутанты, при заражении кото-
рыми бактерии могут осуществить несколько делений, прежде чем одна
или несколько зараженных клеток лизируются и освободят синтезиро-
вавшийся в них фаг [242].
Дефектные профаги
Иногда лизогенные бактерии образуют мутанты, которые, оставаясь
иммунными, либо освобождают мало активного фага, либо вовсе не в
состоянии образовывать активный фаг. Такие мутации изучались глав-
ным образом на модели фага X, хотя они наблюдаются у всех умерен-
ных фагов. Приводя к инактивации некоторых генов фага, функция
которых необходима для образования зрелых фаговых частиц, такие му-
тации вызывают превращение нормального фага в дефектный. Дефект-
ность такого профага легко продемонстрировать путем обработки соот-
ветствующих лизогенных бактерий индуцирующими агентами, например
ультрафиолетом, а затем суперинфицировать родственным фагом. В ре-
зультате функция, отсутствующая у дефектного фага, выполняется супер-
инфицирующим фагом, геном дефектного фага получает возможность
размножаться, и его копии включаются в состав зрелых вирионов. В та-
кой бактерии образуется смешанное потомство фага, состоящее из ак-
тивных и дефектных вирионов. Выделившийся дефектный фаг при зара-
жении чувствительной бактерии не в состоянии индуцировать нормаль-
ный литический цикл инфекции, хотя и может лизогенизировать бакте-
рию, заново образуя дефектную лизогенную бактериальную клетку.
Изредка наблюдается, что дефектные лизогенные бактерии все же
образуют вирионы фага либо спонтанно, либо в результате индукции.
За это явление ответственны обратные мутации, ведущие к превращению
дефектных форм лизогенных бактерий в полноценные. Были установ-
лены две группы дефектов: 1) дефекты, препятствующие автономной ре-
пликации (т. е. исключающие возможность осуществления ранних функ-
ций) и 2) дефекты, препятствующие созреванию (т. е. осуществлению
поздних функций). Если у данного профага возник дефект, ведущий
к блокированию ранних функций, то фаг будет продуцироваться лишь
теми бактериями, у которых обратная мутация произошла непосредст-
Лизогения
22Е
венно в геноме профага. Такая бактерия будет давать полный урожай
фага. При дефектах профага иного типа вегетативное размножение ге-
нома фага происходит как обычно, а препятствия возникают только на
стадии созревания фага. В этих случаях после индукции обратные мута-
ции могут возникнуть в популяции геномов фага, размножающейся веге-
тативно, вследствие чего выход вновь образовавшегося нормального
фага, продуцируемого данной клеткой, будет меньше обычного. Поэтому
путем сравнения распределения выхода ревертантного фага, образуе-
мого единичными клетками, можно установить, какого типа дефект имел
место в данном случае.
В табл. 24 приводятся свойства некоторых дефектных мутантов фага
X. На фиг. 56 показано, в каком месте генетической карты этого фага
локализуются мутации, ответственные за те или иные дефекты.
Таблица 24
Свойства некоторых дефектных мутантов профага X [212]
Мутант профага Цистрон1) Компоненты, образуемые после индукции
х-днк экзонуклеаза активность, блокирующая действие анти- сыворотки2) компоненты вириона3) эндолизин
Р16 ? + + +
Р22 — — — — —
Т11 X — + + — — —
Т5 0 — + — Мало 5%
Т71 0 — + Малая Мало 0
Т67 р — + Малая 0 5%
См. фиг. 55 и 56.
2) См. табл. 13.
3) Исследовались экстракты индуцированных бактерий с помощью
электронного микроскопа.
КОНВЕРСИЯ СВОЙСТВ БАКТЕРИЙ ПРИ ПОМОЩИ ФАГА
Лизогенная бактерия иммунна к лизису, вызываемому фагами, род-
ственными ее профагу. Этот иммунитет представляет собой новое свой-
ство бактерии. Подобным же образом некоторые профаги изменяют так-
же и реакцию бактериальной клетки-хозяина на заражение другим,
неродственным фагом (вызываемая профагом интерференция, модифи-
кация фага, контролируемая профагом). Об этом явлении уже упомина-
лось в гл. X. Например, фаг X, полученный путем размножения на клет-
ках Е. coli К12, ограничен в отношении его способности размножаться на
бактериях, лизогенных по фагу Р1. Однако если фаг X получен путем
размножения на клетках Е. coli К12 (Pl), то все потомство фага А
в состоянии размножаться на бактериях, лизогенных по фагу Р1. Эта
способность снова теряется, если фаг прошел один цикл размножения
на клетках Е. coli К12 Pls [72]. Выше уже было показано, как профаг А
изменяет лизогенные бактерии, превращая их в непермиссивные для
мутантов rll фага Т4.
Иммунитет и модификации типа описанных выше свидетельствуют
о том, что геном профага может придавать бактерии-хозяину новые, ра-
нее отсутствовавшие у нее свойства. В некоторых случаях профаг несет
определенную ответственность за появление у бактерии каких-то новых
свойств, на первый взгляд не имеющих отношения к жизненному циклу
фага, например свойств, определяющих изменение морфологии колоний
[5 Заказ № 1214
226
Глава XI
или их пигментации. В этих случаях мы говорим о явлениях конверсии.
В качестве наиболее удивительных примеров конверсии следует указать
на изменение соматических антигенов Salmonella, открытое Исеки и Са-
каи [393], и появление токсигенности у Corynebacterium diphtheriae [244].
В клеточной стенке Salmonella содержится липополисахарид, выяв-
ляемый в качестве «соматического» О-антигена (названного так в отли-
чие от жгутиковых антигенов). За антигенную специфичность липополи-
Группа Ej —-----Группа Ег----------► Группа Е3
О-ацетил-D- галактозил D-галактозил
О-антиген
S-форм,
повторяющиеся
единицы
структуры
' «I1'6
D-маннозил
ь-рамнозил
?|1-3
О-ацетил-D-галактозил
^р-6
D-маннозил
?|1 -4
Ъ-рамнозил
?|1-3
D-галактозил
D-галакгозил-
D-маннозил
?р-4
L-рамнозил
?|1-3
D-галактозил-
1-4
D-глюкозил
D-глюкозил
Базисная
часть
молекулы
Ы-ацетил-О-глюкозаминил
I
D-глюкозил
D- галактозил
I
D-глюкозил *—D-галактозил
I
Гептозал
2-кето-З-дезокси-
октоновая кислота
f
Фосфат
Фосфатидил-
этаноламин
Лапид А
D-глюкозаминил I Фосфат
I I-*—fl-Оксимиристил
* fl-Оксидеканоил
^Лцетил
D-глюкозами»
Фиг. 58. Вероятное химическое строение липополисахаридов Salmonella (группы Ei
Е2 и Ез).
сахарида ответствен его полисахаридный компонент, в свою очередь
состоящий из базисной части и присоединенных к ней боковых цепей
(фиг. 58). Для каждого серотипа Salmonella характерно свое строение
боковой цепи. Исходя из результатов перекрестных серологических реак-
ций каждому штамму Salmonella была приписана своя антигенная фор-
мула, например 1, 4, 5, 12 или 3, 10, 15. Каждая цифра в этой формуле
указывает на наличие у данного штамма соответствующей антигенной
детерминанты, реагирующей со специфической по отношению к ней анти-
сывороткой. Некоторые антигенные детерминанты контролируются фа-
гами. Например, для S. anatum характерна антигенная формула 3,10.
Однако после заражения фагом е15 серологическая антигенная детерми-
нанта 10 исчезает и вместо нее у бактерии появляется серологическая
детерминанта 15. Бактерии, становящиеся лизогенными по фагу е15, со-
храняют новую антигенную структуру 3,15 до тех пор, пока в их составе
сохраняется профаг, и переходят в форму 3,10 только в том случае, если
они теряют профаг. И в самом деле, было показано, что все дикие штам-
мы Salmonella, содержащие антигены 3,15, содержат и фаг е15.
Через несколько минут после заражения S. anatum фагом 815 у всех
бактериальных клеток, в том числе и у тех, которые вскоре лизируются,
быстро появляется антиген 15 [864]. У бактериальных клеток, становя-
щихся лизогенными, антиген 10 не разрушается, а «разбавляется» в ре-
зультате последующих делений. Конвертирующее действие фага 815 вы-
Лизогения
227
зывает биохимические изменения трех разных типов [682]: 1) образуется
фермент, который катализирует образование полисахаридных цепей
с 0-гликозидными связями между остатками галактозы и маннозы,
2) репрессируется или ингибируется фермент, катализирующий образо-
вание а-гликозидных связей между этими двумя сахарами, и 3) репрес-
сируется клеточный фермент, катализирующий ацетилирование остатков
галактозы (фиг. 58). Были выделены мутанты фага е15, лишенные спо-
собности вызывать то или иное из этих изменений.
Конвертирующее действие, которое оказывает фаг е15 на полисаха-
риды Salmonella, является лишь одним из примеров большой группы
подобных явлений. Другие примеры приведены в табл. 25.
Таблица 25
Конверсия бактериофагами соматических антигенных детерминант Salmonella
[682, с изменениями]
Бактерии группы Salmonella Фаг Изменение формулы О-антигенов1)
В Р22 или i 4,12 > -/,4,12
4,5,12 < -7,4,5,12
в 27 4,12 > ►4,12,27
Ct 14 6,7 , ►(6) ,(7), 14
с2 98 6,8 ; *-8,8,20
Ех £15 3,10 > -3,15
Е2 £34 3,15 = ► 3,15,34
к 6-14 18 . -6,14,18
) Антигенные детерминанты, приобретаемые или утрачиваемые в результате конверсии, изобра-
жены курсивом. В скобках показаны антигенные детерминанты, количество или реакционная спо-
собность которых уменьшается под влиянием конверсии.
Мутанты, утратившие способность вызывать конверсию, растут столь
же хорошо, как и исходные фаги. Поэтому можно полагать, что утра-
ченные функции не существенны для фага. Тем не менее ответственность
полисахаридов Salmonella за адсорбцию фага на этих бактериях наво-
дит на мысль о возможной эволюционной роли конвертирующих генов
фага в определении спектра литического действия этого фага, т. е. круга
бактерий, который данный фаг способен использовать в качестве хозяев.
Была выяснена также роль, которую играют фаги в детерминирова-
нии способности С. diphtheriae продуцировать дифтерийный токсин. Ока-
залось, что токсигенные бактерии содержат профаги группы 0, а неток-
сигенные бактерии можно превратить в токсигенные, лизогенизируя их
этими фагами [300]. Известны нетоксигенные мутанты фагов 0. Однако
остается неизвестным, при помощи какого биохимического механизма
фаг контролирует образование токсина. Действуя на бактерии нелизо-
генными мутантами фага 0, можно индуцировать образование бактерия-
ми токсина в краткий период между их заражением и лизисом [574].
ГЕНЕТИЧЕСКАЯ ТРАНСДУКЦИЯ, ОСУЩЕСТВЛЯЕМАЯ ФАГОМ
Явление конверсии наводит на мысль, что в геноме фага могут со-
держаться некоторые гены бактерий. Каким же образом эти гены могут
стать частью фага? Не касаясь вопроса о происхождении и природе виру-
сов, который рассматривается ниже (гл. XIX), мы можем здесь лишь
15*
228
Глаба XI
задаться вопросом, существуют ли какие-либо процессы, приводящие
к обмену генетическим материалом между фагом и бактерией. И в самом
деле, оказалось, что такие процессы действительно имеют место и реали-
зуются они в виде явления, получившего название трансдукции.
Общая трансдукция
Циндер и Ледерберг [940] обнаружили, что умеренный фаг PLT22
Salmonella typhimurium может переносить генетические маркеры от одно-
го бактериального штамма к другому. Например, заражение бактериаль^
ного штамма, нуждающегося в какой-либо аминокислоте, скажем в ме-
тионине, фагом, выращенным на прототрофной бактерии, т. е. на бакте-
рии, способной расти на минимальной среде, может привести к тому,
что небольшая часть бактериальных клеток, содержащихся в культуре,
приобретет способность расти на среде, не содержащей метионина. При
помощи такого способа можно получить трансдуктанты по любому из
многочисленных генетических признаков (способность к определенной
ферментативной реакции, потребность в тех или иных питательных веще-
ствах, подвижность, устойчивость к фагам или антибиотикам и т. д.),
если только мы располагаем методом, позволяющим вести отбор по
этому признаку. Поэтому это явление получило название неспецифиче-
ской, или общей трансдукции.
Способностью к трансдукции такого типа обладают многие умерен-
ные фаги бактерий кишечной группы и иных бактерий, в том числе
Pseudomonas, бацилл и микобактерий. Осуществляемая фагами транс-
дукция оказалась мощным инструментом генетического анализа бакте-
рий. В случае Е. coll, чья генетическая карта хорошо известна благодаря
данным, полученным методом генетического анализа, основанном на
скрещивании, способность к трансдукции, присущая такому фагу, как,
например, фаг Р1, дала возможность поставить ряд дополнительных
важных генетических экспериментов [505]. Что же касается бактерий, для
которых не известны ни трансформирующие системы, ни методы скре-
щивания, осуществляемая фагом трансдукция часто является единствен-
ным доступным способом рекомбинационного генетического анализа.
Генетический материал, переносимый трансдуцирующим фагом, пред-
ставляет собой единичный фрагмент генома бактерии. Любой из генети-
ческих маркеров бактерий трансдуцируется данным фагом с примерно
одинаковой вероятностью (от 10~6 до 10-5 на инфекционную единицу
в случае фага Р1). •
Тесно сцепленные генетические маркеры могут трансдуцироваться
совместно, причем вероятность совместной трансдукции зависит от сте-
пени генетического сцепления. Чем дальше друг от друга расположены
генетические маркеры, тем меньше вероятность их совместной трансдук-
ции. В состав наибольшего из известных сегментов бактериальной хро-
мосомы, трансдуцируемых фагом Р1, входят по меньшей мере четыре
соседствующие друг с другом группы бактериальных генов (а может
быть, и намного больше), что соответствует по крайней мере 2% генома
Е. coli. Эта же величина соответствует в свою очередь молекуле ДНК
длиной по крайней мере 20 мк. Количество ДНК, содержащееся в ви-
рионе фага Р1, меньше, чем 7 107 дальтон, что соответствует молекуле
ДНК длиной около 32 мк. Таким образом, очевидно, что трансдуцируе-
мый фрагмент бактериальной ДНК может занимать большую часть про-
странства, ограниченного белковым капсидом вириона фага.
Фаг Р1 может также трансдуцировать профаг другого фага, напри-
мер фага X. При этом могут переноситься одновременно также гены
бактерии, контактирующие с профагом, например гены gal, ответствен-
Лизогения
229
ные за усвоение бактерией галактозы, и ген Ыо, ответственный за био-
синтез биотина (фиг. 55). Более того, фаг Р1 может даже переносить
гены gal совместно с двумя профагами X, которые локализуются рядом
с этими генами. Кроме того, фаг Р1 может также трансдуцировать поло-
вой фактор F Е. coli и другие дополнительные генетические элементы,
или плазмиды, содержащиеся в этих бактериальных клетках [29].
В настоящей книге нельзя детально рассмотреть те многочисленные
возможности, которые открывает использование метода трансдукции для
решения проблем генетики бактерий [321]. Некоторые аспекты этого яв-
ления имеют, однако, прямое отношение к проблемам, касающимся
функции, происхождения и эволюции вирусов, которые мы затрагиваем
в этой книге.
Трансдуцирующий фаголизат состоит из смеси трансдуцирующих и
нетрансдуцирующих частиц. Очевидно, что как первые, так и вторые
обладают нормальным капсидом, содержат сходное количество ДНК,
судя по величине их плавучей плотности, и инактивируются антифаго-
вой сывороткой. Тем не менее трансдуцирующие частицы не являются
нормальными в функциональном отношении фагами. Трансдуктанты,
т. е. бактериальные клетки-реципиенты, которым были переданы транс-
дуцированные генетические маркеры, не становятся лизогенными, за
исключением случаев, когда они одновременно инфицируются нетранс-
дуцирующими частицами фага [7]. Трансдукцию можно даже осущест-
вить, используя лизаты, содержащие вирулентные мутанты трансдуци-
рующих умеренных фагов. Это говорит о том, что трансдуцирующие
частицы не индуцируют нормального цикла репродукции фага, ибо в про-
тивном случае воздействие их на бактерии привело бы к лизису по-
следних.
Трансдукция генетических маркеров трансдуктантам может приве-
сти к двум различным состояниям последних, получившим название
полной или абортивной трансдукции. При полной трансдукции перене-
сенные генетические маркеры включаются в структуру хромосомы бак-
териальной клетки-реципиента или одного или большего числа ее бли-
жайших потомков, заменяя гомологичный генетический элемент реци-
пиента. При абортивной трансдукции введенный фагом геном находится
в нереплицирующемся состоянии в виде добавочных генетических фраг-
ментов и при каждом делении передается только одной из двух дочер-
них клеток. Подобная абортивная трансдукция выявляется благодаря
реализации функции генов, входящих в состав трансдуцированного фраг-
мента бактериального генома. Например, при помощи абортивной транс-
дукции неподвижную, не обладающую жгутиками бактериальную клетку
можно превратить в подвижную, снабженную жгутиками клетку, спо-
собную генерировать клон, у которого в каждом поколении лишь одна
клетка будет образовывать новые жгутики [496]. Аналогичным образом
в случае, когда при трансдукции переносится ген, ответственный за син-
тез фермента, отсутствующего у реципиента, этот фермент будет синте-
зироваться лишь одной из клеток каждой генерации данного клона [633].
Окончательная судьба фрагмента, переносимого в абортивно транс-
дуцируемые клоны, неизвестна. Очевидно, что этот фрагмент ДНК мо-
жет впоследствии включиться в структуру генома клетки-реципиента,
а может и разрушиться.
Абортивная трансдукция наблюдается значительно чаще (иногда
даже в 10 раз), чем полная. Полная трансдукция, вероятно, является
следствием рекомбинации между бактериальной хромосомой и трансду-
цированным генетическим фрагментом. И действительно, было показано,
что абортивные трансдуктанты можно превратить в полные, воздействуя
на них небольшими дозами радиации, что, вероятно, увеличивает воз-
230
Глава Xi
можность генетической рекомбинации между трансдуцированным фраг-
ментом и хромосомой бактерии-реципиента.
Следовательно, трансдуцирующие частицы фага, по-видимому, со-
держат в себе фрагменты бактериальной хромосомы, которые, если они
включают какие-либо полные функциональные гены бактерий, могут
либо функционировать в клетке-реципиенте (как свободные генетические
элементы при абортивной трансдукции), либо рекомбинировать с хро-
мосомой этой клетки, что приведет к полной трансдукции. Трансдуцирую-
щие частицы фага дефектны как в отношении осуществления функций,
присущих фагу, так и, по-видимому, в отношении полноты содержаще-
гося в них генома фага. Было показано, что большинство из них дейст-
вительно содержит лишь фрагмент бактериальной хромосомы и вовсе не
содержит генетического материала фага [387]. Можно полагать, что в
процессе созревания фага в клетке накапливаются фрагменты хромо-
сомы бактерии примерно той же длины, что и молекула фаговой ДНК,
которые затем проникают внутрь белковой оболочки фага вместо его
генома. Вероятное сходство между таким процессом и образованием
однородных сегментов ДНК фага Т4 (составляющих обычное содержи-
мое головок фага; см. гл. X) остается пока предметом предположений.
Специфическая трансдукция
При изучении способности фага X к трансдукции было открыто не-
ожиданное явление [601]. Оказалось, что фаголизаты клеток, лизогенных
по фагу X, полученные путем индукции, могут трансдуцировать признак
gal+ (способность усваивать галактозу) от штаммов gal+ к мутантам
gal~ Е. coli К12. Ни один из других признаков трансдуцировать не уда-
лось; не удалось также наблюдать и трансдукцию признаков gal+ в том
случае, когда в эксперименте использовались фаголизаты, полученные не
путем индукции лизогенных по фагу X бактериальных клеток, а при ли-
тическом цикле развития этого фага.
Частота трансдукции признака gal+ индуцированными лизатами,
содержащими фаг Л, низка и составляет примерно 1 на каждые 105 или
106 частиц этого фага. В случаях выделения трансдуктантов они часто
•оказывались нестабильными в отношении сохранения признака gal+, т. е.
с высокой частотой выщепляли варианты gal“. Облучение таких бакте-
рий ультрафиолетом может привести к образованию Х-лизатов, обла-
дающих высокой трансдуцирующей активностью (HFT-лизаты !). Исход-
ные лизаты, обладающие низкой частотой трансдукции, называют LFT-
лизатами 1 2.
При дальнейшем изучении трансдукции этого типа было обнаруже-
но следующее:
1. Трансдукцию признака gal+ осуществляют дефектные фаговые ча-
стицы, содержащие, кроме части генома фага X, гены gal. Эти фаговые
частицы получили название Xdg (дефектные частицы, несущие признак
gal+). Лизаты HFT содержат примерно равные количества нормальных
фаговых частиц и частиц Xdg. В случае когда бактерию заражает одна
частица фага Xdg, вероятность лизогенизации бактериальной клетки
незначительна. Если зараженная бактерия представляет собой вариант
gal-, то она превращается в вариант gal+, поскольку в дополнение к ее
1 Ог английского high frequency of transduction—«высокая частота трансдукции»—
Прим, перев.
2 От английского low frequency of transduction — «низкая частота трансдукции». —
Лрим. перев.
Лизогения
231
собственному хромосомному гену gal~ она несет и ген gal+, относящий-
ся к дефектному профагу Xdg.
Такие бактерии называются гетерогенотами. Хромосомный компо-
нент gal~ является эндогенотой, a gal+ — компонент, входящий в состав
профага,— экзогенотой. (Поскольку область gal содержит три гена —
К, Г и Е,— ответственных за синтез трех различных ферментов, гетеро-
генота gal+ может образоваться в результате комплементации между,
скажем, эндогенотой gal~^ и экзогенотой gal~^.) Иногда, в особенности
при трансдукции индуцированными ультрафиолетом Х-лизатами, гены
gal+, вносимые в бактериальную клетку фагом Xdg, включаются в хро-
мосому клетки-реципиента вместо обычных, постоянных для данной
клетки генов gal-,
2. Если в бактерию gal- одновременно проникают фаговая частица
Xdg и нормальная фаговая частица X, вероятность успешной трансдук-
ции признака gal+ резко увеличивается. Образующиеся трансдуктанты
обычно дважды лизогенны — по фагу Z и по фагу Xdg. Следовательно,
в этом случае нормальный фаг X «помогает» фагу Xdg стать профагом.
3. Бактерии, лизогенные только по фагу Xdg, иммунны также к фагу
X. При облучении ультрафиолетом такие бактерии лизируются, не обра-
зуя, однако, никаких фаговых частиц. Следовательно, профаг Xdg яв-
ляется дефектным и неспособен сам по себе образовать зрелый фаг.
Однако бактерии, лизогенные по фагам X и Xdg, в результате индукции
лизируются, освобождая примерно равные количества фагов X и Xdg.
Бактерия, содержащая только профаг Xdg и суперинфицированная после
индукции нормальным фагом X, может образовать смесь, состоящую из
фага X и фага Xdg. Следовательно, в этом случае нормальный фаг к
снова выполняет роль помощника фага Xdg, не только увеличивая вероят-
ность лизогенизации, но также и способствуя созреванию частиц фага
Xdg. Ясно, что функции фага, отсутствующие у фага Xdg, обеспечивают-
ся генами фага X.
4. Фаг Xdg может рекомбинировать с фагом X. Используя подходя-
щие генетические маркеры, удалось показать, что в геноме фага Xdg
отсутствует часть генома фага X; Причем у разных штаммов фага Xdg
отсутствует участок различной длины [125]. Как показало центрифугиро-
вание в градиенте плотности, частицы различных штаммов фага Xdg
отличаются друг от друга также по плавучей плотности, причем, чем
больше участок генома, отсутствующий у частицы, тем легче частица.
Такой результат объясняется тем, что величина белковой оболочки
у всех штаммов фага Xdg одинакова, тогда как количество ДНК, содер-
жащееся в частице каждого из штаммов этого фага, соответствует вели-
чине генома, свойственного данному штамму. Чем меньше ДНК содер-
жится в фаговой частице, тем меньше ее плотность.
Предложенная Кэмпбеллом [126] модель (фиг. 55) позволяет объяс-
нить эти данные. Соответствующая схема представлена на фиг. 59.
Можно видеть, что нормальный профаг X располагается между группой
генов gal и геном Ыо. При индукции обычно происходит регенерация
нормального генома фага X. Однако иногда, вероятно вследствие ано-
мальной циркуляризации, образуется сегмент, соответствующий геному
фага Xdg. Концы такого сегмента могут находиться в различных точках.
Следовательно, расстояние между этими точками может варьировать,
а это значит, что также будет варьировать и количество ДНК, содер-
жащееся в том или ином вирионе фага Xdg.
В соответствии с этой моделью находятся и два факта, обнаружен-
ные впоследствии. Во-первых, оказалось, что фаг X может трансдуциро-
вать не только гены gal, но также и ген Ыо+ (биотин). В результате бак-
терии штамма bio- превращались в бактерии штамма bio+ [922]. Обра-
232
Глава XI
тите внимание на то, что ген Ыо расположен по соседству с геномом
профага Л, на противоположной стороне от области gal. Во-вторых, было
показано, что родственный фагу X фаг<р80, профаг которого присоединяет-
ся к хромосоме бактерии вблизи места локализации генов try (ответст-
венных за биосинтез триптофана), может трансдуцировать часть или
все эти гены точно таким же образом, как фаг Л трансдуцирует бакте-
риальные гены, располагающиеся по соседству с его профагом (575].
Фиг. 59. Образование дефектного трансдуцирующего фага Xdg согласно модели Кэмп-
белла [126] (фиг. 55).
Можно получить гибриды фагов X и <р80, способные трансдуцировать
либо гены gal, либо гены try (в зависимости от того, в каком месте ге-
ном гибридного профага присоединяется к хромосоме бактерии), а иног-
да и другие гены, если случится, что они смещены в положение, нахо-
дящееся вблизи от этих участков хромосомы бактерии.
Некоторые трансдуцирующие фаги Abio и <p80try не являются де-
фектными и могут как размножаться, так и лизогенизировать бактерии,
не нуждаясь в фаге-помощнике.
Связь между общей и специфической трансдукцией
Из изложенного выше ясно, что между общей и специфической
трансдукцией имеется глубокое различие. При общей трансдукции в бел-
ковую оболочку фага вместо его генома включаются фрагменты ДНК
клетки-хозяина. При специфической трансдукции образуется генетиче-
ский элемент, частично состоящий из генов фага, а частично из генов
клетки-хозяина. Тем не менее известны случаи, когда между этими двумя
механизмами может иметься определенная взаимосвязь. Например, фаг
Р1 —типичный представитель фагов, осуществляющих общую трансдук-
цию, иногда образует варианты, геном которых представляет собой ком-
плексную структуру, состоящую из связанных друг с другом генома фага
той или иной степени дефектности и некоторых генов клетки-хозяина.
Так, в состав генома фага Pldl входят гены lac (гены, определяющие
способность бактерии усваивать лактозу) Е. coli [538], а в состав генома
Лизогения
233
фага Pl СМ — ген, определяющий устойчивость бактерии к действию
хлорамфеникола [467]. В литературе описан ряд других наблюдений ана-
логичного типа.
Наиболее правдоподобное объяснение этого явления состоит, ви-
димо, в том, что умеренный фаг, способный также размножаться авто-
номно, иногда рекомбинирует с генетическим материалом клетки-хозяи-
на, в результате чего образуется комплексная структура, которая может
функционировать как нормальный или дефектный фаг в зависимости от
того, сохранит ли этот фаг величину и структуру, необходимую для об-
разования цельного вириона и продолжения существования в новой
клетке-хозяине. Возможно, что именно такой механизм ответствен за
возникновение фагов, вызывающих конверсию.
ФАГИ И ПЛАЗМИДЫ
Явления лизогении и трансдукции демонстрируют наличие тесной
взаимосвязи между геномами фага и бактерии-хозяина и склонность
этих геномов рекомбинировать друг с другом. Геном умеренного фага
представляет собой генетический элемент, который, будучи введенным
внутрь бактериальной клетки и являясь, таким образом, дополнением
к ее геному, может существовать и функционировать в виде автономно-
размножающейся молекулы фаговой ДНК, в виде профага, размножаю-
щегося как часть хромосомы клетки-хозяина, или, в случае его проник-
новения в иммунную бактерию, в виде неразмножающейся суперинфици-
рующей молекулы ДНК. В зависимости от того, в какой из этих форм
находится геном фага, в нем функционирует тот или иной набор генов.
Такого рода комплекс свойств не является уникальной особенностью
умеренных бактериофагов. Некоторыми из них обладают также и дру-
гие генетические элементы бактерий. Фактически умеренные фаги яв-
ляются прототипами группы дополнительных генетических элементов»
которые могут присутствовать в бактерии, а могут и отсутствовать, при-
чем, находясь в клетке, могут размножаться либо автономно, либо бу-
дучи присоединены к геному бактерии. Эти генетические элементы были
названы эписомами [402].
Термин эписома применяется также для описания других необяза-
тельных генетических элементов бактериальной клетки, у которых со-
стояние ассоциации с геномом клетки-хозяина может и отсутствовать
[126]. Однако, быть может, лучше использовать его лишь в том смысле,
который придали ему его авторы, а для описания всех дополнительных
генетических элементов, как ассоциирующихся с хромосомой клетки-хо-
зяина, так и не вступающих в такую ассоциацию, использовать более
общий термин плазмида [495]. Свойства плазмид и вопрос об их возмож-
ной общности с вирусами рассматриваются в гл. XIX.
К числу эписом бактерий относятся умеренные фаги и половые фак-
торы — F-фактор Е. coli и фактор PF Pseudomonas aeruginosa. Воз-
можно, что так называемые факторы передачи устойчивости (RTF) [888]
также являются эписомами в том смысле, что генетические элементы»
относимые к этой группе, могут вступать в связь с хромосомой бактерии.
Особое место среди плазмид бактерий занимают факторы бактериоцино-
генности, которые, с одной стороны, имеют близкое отношение к фагам,
а с другой — к половым факторам бактерий. Данные, полученные при
изучении факторов бактериоциногенности, позволяют прийти к выводу,
что для плазмид бактерий вне зависимости от различий между ними ха-
рактерно наличие ряда общих свойств и типов взаимодействия с геномом
бактерии.
234
Глава XI
Бактериоцины и бактериофаги
Многие штаммы бактерий продуцируют вещества, способные уби-
вать бактериальные клетки родственных штаммов. Эти вещества были
названы бактериоцинами. Бактериоцины, продуцируемые Е. coli, носят
название колицинов, продуцируемые Pseudomonas aeruginosa,— пиоци-
нов, а продуцируемые Pasteurella pestis,— пестицинов {243]. В состав бак-
териоцинов входит белок, но нуклеиновые кислоты в них не обнаружены.
Анализ активных бактерицидных компонентов бактериоцинов, проведен-
ный в тех случаях, когда их удалось выделить в чистом виде, показал,
что они являются белками.
Бактериоцины не секретируются непрерывно всеми растущими клет-
ками культуры, а подобно фагам, выделяемым лизогенными бактериями,
освобождаются в виде «вспышки» небольшим числом клеток. Было по-
казано, что образование бактериоцинов, подобно образованию умерен-
ных фагов, часто удается индуцировать воздействием на бактериальные
клетки ультрафиолетом или митомицином С.
Бактериоцины убивают чувствительные бактериальные клетки, но
они не в состоянии их лизировать или заставить продуцировать большее
количество бактериоцина. Содержащийся в культуральной жидкости
бактериоцин можно легко обнаружить и протитровать, нанося раз-
личные разведения культуральной жидкости на выращенные на агаре
колонии чувствительных клеток и выявляя бляшки. В основе более точ-
ных методов количественного определения бактериоцинов лежит подсчет
числа выживших бактерий.
Гибель бактерии вследствие действия бактериоцина, например коли-
цина,— это одноударный процесс. Бактериальную клетку может убить
одна молекула колицина, хотя не каждая молекула колицина, адсорби-
рованная бактериальной клеткой, оказывается эффективной [401].
Механизм, при помощи которого бактериоцины убивают бактерии, не
является единым для всех бактериоцинов. Например, в основе действия
мегацина А — бактериоцина, продуцируемого Bacillus megaterium, лежит
медленное разрушение барьера проницаемости цитоплазматической мем-
браны [395]. Что же касается колицинов, то колицин Ei и колицин К
вызывают быстрое блокирование большинства реакций бактериальной
клетки, нуждающихся в источниках энергии, ибо они выключают систе-
мы, генерирующие энергию; колицин Е2 вызывает специфический распад
бактериальной ДНК, а колицин Е3—прекращение биосинтеза бел-
ка [622].
Наиболее удивительным является то обстоятельство, что все упомя-
нутые виды воздействий оказывают молекулы колицинов, присоединяю-
щиеся к поверхности бактерии, т. е. по сути дела находящиеся вне бак-
териальной клетки. Жизнеспособность бактерий может быть восстанов-
лена путем разрушения и удаления бактериоцинов с поверхности бакте-
рии при помощи протеолитических ферментов, например воздействием
на них трипсином (если не произошел распад ДНК). По-видимому, бак-
териоцин остается все время на внешней части клеточной стенки и реа-
лизует свой «повреждающий» эффект, воздействуя на какие-то контроли-
рующие механизмы, локализующиеся на цитоплазматической мембране
бактерии.
Подобно фагам, бактериоцины присоединяются к специфическим ре-
цепторам, расположенным в клеточной стенке бактерии. И в самом деле,
рецепторы для фага и рецепторы для бактериоцина часто представляют
собой одну и ту же структуру, и мутация может привести к появлению
у бактерии устойчивости к фагу и к какому-либо одному, а иногда и к
нескольким бактериоцинам. В основе классификации колицинов, предло-
Лизогения
235
женной Фредериком [243], лежит подразделение их на группы в соответ-
ствии с данными, полученными при изучении перекрестной резистентно-
сти. Представляется, однако, что более осмысленной является классифи-
кация, основанная на различии в механизме «поражающего» действия
колицинов.
Бактерии иммунны к колицину, который они сами продуцируют. Бак-
териальные клетки, продуцирующие колицин, адсорбируют его, но он их
не убивает. Следует, однако, подчеркнуть, что это удивительное свой-
ство не аналогично иммунитету по отношению к умеренному фагу, инду-
цируемому профагом, ибо в основе иммунитета, индуцируемого профа-
гом, лежит предупреждение возможности репликации генетического ма-
териала фага, проникшего в бактерию, и считывания записанной в нем
генетической информации. Поскольку колицины являются белками, а не
нуклеиновыми кислотами — веществами, из которых состоит геном,—
очевидно, что они не могут быть чувствительны к репрессии того же
типа.
Факторы бактериоциногенности
Способность продуцировать каждый данный бактериоцин, как и им-
мунитет к его действию, определяется наличием у бактерии дополни-
тельного генетического элемента, получившего название фактора бакте-
риоциногенности. Соответствующий фактор Е. coli называется фактором
колициногенности или фактором col. Эти факторы выявляются по их
способности передаваться от колициногенных бактерий неколициноген-
ным (которые в результате этого приобретают признак со1+), реализую-
щейся путем скрещивания соответствующих штаммов или при помощи
трансдукции [143].
Факторы col состоят из ДНК. Молекулярный вес этих ДНК, судя по
данным, полученным при измерении величины переносимой ДНК или
определении воздействия распада Р32, оказался порядка 5- 107 дальтон.
Наибольшая из таких молекул ДНК достаточно мала для того, чтобы ее
мог трансдуцировать фаг Р1, и в то же время слишком велика для того,
чтобы ее могли трансдуцировать мелкие трансдуцирующие фаги.
Изучение поведения факторов колициногенности при скрещивании
бактерий показало, что они реплицируются в бактериальных клетках как
автономные плазмиды, не вступая в физическую связь с хромосомой
бактерии [613]. Факторы колициногенности могут передаваться от Е. coli
другим, весьма отдаленным в таксономическом отношении микроорга-
низмам, например Salmonella.
Тот факт, что некоторые факторы col придают бактериям способ-
ность действовать в качестве генетических доноров, т. е. образовывать
конъюгационные мостики и передавать эти факторы другим бактериям,
наводит на мысль о существовании сходства между факторами col и
половым фактором бактерий (F). И действительно, некоторые факторы
col по своим свойствам еще в большей степени напоминают половые
факторы бактерий, ибо придают бактерии способность служить донором
хромосомных генов при конъюгации [143, 794], обусловливая возмож-
ность процесса, аналогичного переносу хромосомных генов при скрещи-
вании, реализуемом под влиянием фактора F. Из числа факторов col,
способствующих переносу хромосом, наиболее тщательно был изучен
фактор col I Salmonella typhimurium. Использование этой системы по-
зволило детальнейшим образом картировать геном этой бактерии.
Бактерия, только что получившая фактор col I, является очень хоро-
шим донором хромосомных генов («перенос с высокой частотой»). По-
видимому, после проникновения в новую бактериальную клетку (по-
236
Глава XI
скольку состояние репрессии устанавливается не мгновенно), фактор
колициногенности размножается более интенсивно и обладает большей
вероятностью инициировать конъюгацию и способствовать передаче хро-
мосомы.
Еще более вероятность родства между половым фактором и факто-
ром col подкрепляется наблюдением, согласно которому некоторые фак-
торы col действительно физически связываются в единую структуру
с фактором F [612]. В этой форме фактор col также, по-видимому, мо-
жет оказаться вставленным в бактериальную хромосому.
Весьма выражено также сходство между факторами col и умерен-
ными фагами. Так, например, при индукции колициногенных бактерий
ультрафиолетом наблюдается не только продуцирование колицина, но»
также и вегетативная репликация самого фактора col [14]. В основе ме-
ханизмов иммунитета и индукции как у лизогенных, так и у колицино-
генных бактерий могут лежать регуляторные системы сходной природы..
Наконец, факторы col могут иметь некоторое родство с так назы-
ваемыми гиперагрессивными фагами, т. е. с фагами, которые убивают
бактерии при помощи одного лишь присоединения к их поверхности.
Некоторые факторы col могут представлять собой фрагменты генома не-
которых фагов, способные программировать синтез лишь компонента
капсида фага, который убивает бактериальную клетку. Действительно^
при помощи электронной микроскопии было показано, что препараты
некоторых из предполагаемых бактериоцинов, в том числе колицина 15-
и пиоцина, состоят из полных или разрушенных капсидов дефектных фа-
гов {395, 585].
Из предшествующего обсуждения очевидно, что в бактериальных
клетках содержится ряд дополнительных генетических элементов, или
плазмид. Некоторые из плазмид, а именно фаги, являются вирусами,,
поскольку они вызывают образование свободных частиц, специализиро-
ванных в отношении переноса от клетки к клетке их генетических эле-
ментов. Другие плазмиды, хотя и не являются вирусами, обладают неко-
торыми присущими им свойствами, включая способность к автономной
репликации. Существует ряд переходных этапов, ведущих от фагов к фак-
торам колициногенности и далее к половым факторам. В связи с этим
возникает вопрос, не являются ли фаги, а возможно, и все вирусы вообще
представителями группы генетических элементов, принимающих участие
в процессах, ответственных за перенос генетического материала от од-
них клеток к другим?
Глава XII
ВВЕДЕНИЕ В БИОЛОГИЮ КЛЕТОК ЖИВОТНЫХ
РОЛЬ ТКАНЕВЫХ КУЛЬТУР В ИЗУЧЕНИИ ВИРУСОВ животных
До последних лет изучение вирусов животных стимулировалось глав-
ным образом тем большим значением, которое имеют для человеческого
общества некоторые вирусные заболевания человека и животных, на-
пример оспа, грипп, полиомиелит и ящур крупного рогатого скота. Дан-
ные, необходимые для понимания процесса взаимодействия отдельных
вирусов с их клетками-хозяевами, накапливались очень медленно. Наи-
более важными и характерными результатами, полученными при изуче-
нии вирусов в этот ранний период, было доказательство существования
множества различных видов вирусов животных, вызывающих самые раз-
личные заболевания; наблюдения, свидетельствовавшие об узкой специ-
фичности вирусов по отношению к своим хозяевам, и разработка вакцин
против некоторых вирусных заболеваний. В большинстве ранних работ
вирусы размножали путем заражения целостного организма лаборатор-
ного животного. Трудности, связанные с содержанием больших коли-
честв животных, необходимых для проведения точных количественных
исследований, служили серьезным препятствием для прогресса в области
изучения вирусов. Некоторые из этих трудностей частично были преодо-
лены, когда был разработан метод культивирования вирусов в куриных
эмбрионах.
Первое издание этой книги вышло в свет в 1953 г., когда период
бурного изучения вирусов животных еще только начинался. До 1952 г.,
когда Дульбекко разработал метод определения числа вирусных частиц
в суспензии, основанный на подсчете числа образуемых вирусом бля-
шек [196], почти единственным случаем использования точного количе-
ственного метода в изучении вирусов животных были исследования зара-
жения вирусом гриппа куриных эмбрионов. Главное ограничение, с ко-
торым приходится сталкиваться при использовании куриных эмбрионов
для изучения вирусов, как, впрочем, и при использовании для этих целей
целостных организмов, состоит в том, что в этих случаях возникают труд-
ности в исследовании вопросов, связанных с процессами, идущими в от-
дельных зараженных клетках. В связи с этим невозможно проверить,
насколько на системах отдельных клеток животных, зараженных виру-
сами, выполняются те закономерности и концепции взаимодействия ви-
русов с клетками, которые были установлены при изучении бактерио-
фагов.
В принципиально важной работе Эндерса и сотр. [216] была проде-
монстрирована возможность выращивания вирусов при точно контроли-
руемых условиях в тканях, содержащихся в культуральных сосудах. Это
достижение в сочетании с количественным титрованием вирусов при по-
мощи подсчета числа бляшек, приспособленным Дульбекко для систем
вирус — клетка животного, почти заново открыло область количествен-
ной вирусологии, изучающей вирусы животных.
Методы, при которых в качестве хозяев при изучении взаимодействия
вирусов с клетками использовались культивируемые клетки животных,
- 237 -
238
Глава XII
быстро прогрессировали. Вначале использовали так называемые первич-
ные культуры, т. е. клетки, выделявшиеся из трипсинизированных тка-
ней, например клетки почек обезьян, семенников и фибробласты кури-
ных эмбрионов. Однако такие клетки не растут бесконечно долго, что,
в случае необходимости вернуться к первично выделенному материалу,
ведет к определенной степени невоспроизводимости результатов. Методы
выращивания клеток, непрерывно растущих в культуре, пригодные для
работы с вирусами, были разработаны в лаборатории Эрла. В конце
40-х годов Эрл и его сотрудники получили штаммы мышиных клеток,
которые могли расти в культуре неопределенно долгое время, а также
вырастили культуру клеток, происходившую от единичного мышиного
фибробласта.
Принципиальными новшествами, обеспечившими получение культур-
клеток, пригодных для широкого использования, были: 1) использование
антибиотиков, не повреждающих клетки животных, но предотвращаю-
щих загрязнение культур бактериями; 2) получение из карциномы чело-
века клеточной линии HeLa, способной расти в культуре неопределенно
долгое время и чувствительной к большому числу вирусов человека
[263, 738]; 3) разработка Иглом простой питательной среды, пригодной
для поддержания роста многих различных культур клеток, и 4) усовер-
шенствование методов получения клонов из единичных клеток млеко-
питающих [660].
Использование культур клеток и метода количественного определе-
ния вирусов, основанного на подсчете числа образуемых вирусом бля-
шек, в равной степени стимулировало развитие двух направлений виру-
сологии. Клинические и эпидемиологические исследования привели к от-
крытию сотен новых, ранее неизвестных вирусов. Некоторые из этих
вирусов не удалось связать с синдромами уже известных заболеваний.
Другие вообще были выделены от людей или животных, по-видимому
не страдавших каким-либо заболеванием. С другой стороны, вирусо-
логи, интересовавшиеся основными вопросами взаимодействия вирусов
с клетками, получили информацию об условиях, необходимых для ини-
циирования инфекции и контролируемого размножения в клетках самых
различных вирусов.
С углублением наших знаний оказалось возможным разработать
методы получения и очистки больших количеств ряда вирусов. Были так-
же разработаны методы получения на тканевых культурах при контро-
лируемых условиях достаточно больших количеств вакцины против по-
лиомиелита, что позволило к началу 60-х годов вакцинировать не-
сколько сот миллионов человек. Разработка метода получения вирусов
в больших количествах оказалась также очень полезной для общей виру-
сологии, потому что очистка вирусов благодаря этому вошла в практику,
и клетки, имеющие общее происхождение и могущие быть зараженными,
одновременно стали доступными в достаточных количествах, что позво-
лило проводить изучение вирусной инфекции биохимическими методами.
За последнее время количество исследований, посвященных изуче-
нию вирусов животных, увеличивается столь быстро, что мы вынуждены
ограничиться детальным описанием лишь нескольких, наиболее хорошо
изученных систем вирус — клетка и лишь изредка, при необходимости,
привлекать материал, полученный при изучении других вирусов. Адено-
вирусы, вирус гриппа, вирус классической чумы птиц, вирус осповак-
цины, вирус полиомиелита и вирус герпеса относятся к числу наиболее
хорошо изученных вирусов. Проблема опухолеродных вирусов вследствие
ее крайней важности для понимания сущности рака — одной из главней-
ших медицинских проблем — и большой значимости фактов, полученных
при изучении вирусного онкогенеза, для понимания процесса интеграции
Введение в биологию клеток животных
239
вирусов со своими клетками-хозяевами, будет обсуждена отдельно
(гл. XVI).
Несколько следующих глав будут посвящены детальному описанию
взаимодействия вирусов животных с их хозяевами — клетками живот-
ных. Однако, прежде чем перейти к описанию таких процессов, как
адсорбция вирусов, проникновение вирусов в клетки, освобождение со-
держащейся в вирионе нуклеиновой кислоты, репликация вирусной
нуклеиновой кислоты, а, также к описанию влияния, которое оказывает
вирусная инфекция на клетки и организм хозяина в целом, мы кратко
коснемся вопроса о типах взаимодействия вирусов животных с их клет-
ками-хозяевами, а также некоторых вопросов биологии животной клет-
ки, концентрируя в основном внимание на тех аспектах проблемы, кото-
рые были изучены при помощи метода культуры ткани.
ХАРАКТЕРИСТИКА ВЗАИМООТНОШЕНИИ МЕЖДУ ВИРУСОМ
И КЛЕТКОЙ ЖИВОТНОГО
Исследования вирусных инфекций на моделях, создаваемых путем
заражения целостного организма животного, показали, что некоторые
вирусы, например вирус саркомы Рауса и вирус папилломы Шоупа,
можно выделить из организма зараженного животного через весьма
продолжительный период времени после заражения, тогда как другие
вирусы, например вирус полиомиелита, попав в организм и вызвав ин-
фекционный процесс, затем исчезают. В подобных случаях выделить ви-
рус из организма заболевшего животного можно лишь в течение очень
непродолжительного периода времени после заражения. Однако экспери-
ментальный подход к решению этой проблемы на уровне изучения взаи-
модействия вирусов с отдельными клетками стал возможен только после
введения в практику метода культуры тканей.
При изучении взаимодействия вирусов с клетками культуры ткани
было обнаружено два крайних типа такого взаимодействия, а также не-
которые переходные формы между ними. Быстрая дегенерация и гибель
клеток, т. е. так называемая цитоцидальная реакция, является результа-
том заражения культуры вирусами самых различных видов. В качестве
типичного примера можно привести картину, наблюдаемую при зараже-
нии культуры ткани энтеровирусами (например, вирусом полиомиелита
и вирусом Коксеки) и вирусами, переносимыми членистоногими (арбо-
вирусами), например вирусами восточного и западного энцефаломиелита
лошадей. В качестве другого примера вирусов, регулярно вызывающих
цитоцидальное действие, но, правда, не столь быстро, как только что
упомянутые, можно привести вирус осповакцины, аденовирусы и реови-
русы. Возможно, что замедленный цитоцидальный эффект, вызываемый
этими вирусами, связан с более продолжительным циклом развития ви-
русов этой группы.
На противоположном конце этого спектра находятся опухолеродные
вирусы, например вирус полиомы мышей, обезьяний вирус 40 (SV-40)
и вирус куриной саркомы Рауса. Ни один из вирусов этой группы обычно
не убивает клетки-хозяева, однако эти вирусы обладают способностью
заражать и изменять соответствующие клетки, превращая их в опухо-
левые. Трансформированные вирусом клетки не разрушаются. Напротив,
их способность к росту возрастает. Сильно изменяются также и другие
их биологические свойства. В этом случае между вирусом и клеткой
образуется длительная связь. Несмотря на то что внешняя аналогия
между индуцируемым вирусами превращением нормальных клеток жи-
вотных в опухолевые и лизогенией у бактерий представляется весьма
привлекательной, механизм образования связи между вирусом и клеткой
240
Глава XII
при ее превращении в опухолевую и сущность этой связи пока остаются
неизвестными. Тем не менее, до тех пор пока не будет достигнуто лучшее
понимание взаимосвязи, возникающей между вирусами животных и их
клетками-хозяевами, Дульбекко [198] предложил называть опухолерод-
ные вирусы умеренными вирусами L
Хотя действие цитоцидальных вирусов на клетки-хозяева в конеч-
ном счете приводит к их гибели, деструктивный процесс не всегда про-
является немедленно. Например, в клетках HeLa, зараженных вирусом
гриппа или вирусом ньюкаслской болезни (NDV), даже во время син-
теза вирусного белка может полностью завершиться митотический цикл
{909]. Вирусы кори и герпеса, введенные в культуру в небольших коли-
чествах, вызывают слияние зараженных и незаряженных клеток, в ре-
зультате чего возникают клеточные комплексы, каждый из которых со-
держит много ядер. Несмотря на то что эти поликариоциты, по-видимо-
му, не делятся, они тем не менее остаются живыми, ибо в них все еще
продолжается обмен веществ и они остаются прикрепленными к поверх-
ности стекла [685].
В настоящее время невозможно решить, являются ли различия
в реакции клеток на вирусную инфекцию следствием качественного или
количественного различия свойств соответствующих вирусов, ибо сущ-
ность ни одного из описанных выше эффектов, наблюдаемых при дейст-
вии вирусов на клетки, еще не понята на молекулярном уровне. Более
детально эта проблема рассматривается в гл. XVI.
ОСОБЕННОСТИ СТРУКТУРЫ И РОСТА ЖИВОТНЫХ КЛЕТОК
За последние годы интерес к изучению основных проблем биологии
животных клеток пробудился у ученых самых различных специально-
стей. У ученых, ранее работавших с бактериями и вирусами или зани-
мавшихся изучением биохимии липидов, нуклеиновых кислот и белков,
иногда наблюдается тенденция к игнорированию морфологической и
организационной сложности клеток животного. Напротив, исследовате-
ли, воспитанные в традициях классической цитологии, скептически отно-
сятся к правомерности распространения на клетки животных результа-
тов, полученных при изучении бактерий. При таких ситуациях наиболее
верной обычно бывает какая-то промежуточная точка зрения.
Многие из наиболее плодотворных современных идей, объясняющих
механизм процессов биосинтеза и процессов, контролирующих функ-
циональную активность клетки — двух ключевых проблем биологии
клетки,— возникли под влиянием результатов, полученных при изучении
бактерий. В какой мере возможно проверить экспериментальным путем
применимость этих новых идей к животным клеткам, этот вопрос в на-
стоящее время еще изучается. Известно, однако, что многие фермента-
тивные реакции и такие сложные фундаментальные процессы, как, на-
пример, биосинтез белка, идут сходным или идентичным образом как
в бактериальных клетках, так и в клетках растений и животных.
Наше краткое обсуждение проблем биологии животной клетки не
претендует на ознакомление неосведомленного читателя со всеми тай-
нами подобного типа клетки. Его целью является, скорее, концентриро-
В настоящее время имеются данные о том, что в трансформированных вирусами
.животных клетках отсутствует свободная вирусная ДНК; в то же время оказалось, что
ДНК вируса и клетки, по-видимому, связана ковалентной связью, устойчивой к дейст-
вию щелочи (Sa mb rook J., Westphal H., Srinivasan P., Dulbecco R.,
Proc. Nat Ac. Sci. USA, 1968, 60, 1288; Doertier W., Proc. Nat. Ac. Sci. USA, 1968,
<60, 636). — Прим. ped.
Введение в биологию клеток животных
241.
вание внимания читателя на некоторых фактах, касающихся тех аспек-
тов структуры и состава животных клеток, которые имеют близкое отно-
шение к процессам инициации вирусной инфекции, размножения вирусов
и деструктивного действия вирусов на их клетки-хозяева. При этом осо-
бое внимание уделяется культурам животных клеток и в особенности
некоторых тканей, которые, по-видимому, кажутся наиболее перспектив-
ными для изучения животных клеток методами молекулярной биологии.
При исследовании клеток многоклеточных организмов с помощью
светового микроскопа наглядно видно, что клетки одной ткани четко
отличаются от клеток другой. Поэтому может показаться наивной по-
пытка описать «животную клетку», как таковую. Тем не менее верно и
то, что у многих клеток животных имеются три общие характерные осо-
бенности: 1) сходное общее содержание во всех клетках ДНК, РНК и
белка; 2) наличие у многих различных клеток сходной по строению липо-
протеидной мембраны и 3) наличие у большинства клеток органелл, или
частиц, обладающих характерной структурой,— митохондрий, рибосом,
лизосом, с которыми связаны специализированные функции клеток.
Кроме того, у всех животных клеток имеется ядро, в котором нахо-
дится ДНК. (Исключением являются эритроциты, которые в процессе
созревания теряют свое ядро. Зрелый эритроцит — это в сущности ко-
нечная стадия клетки эритробластического ряда.) Концентрируя внима-
ние при обсуждении данной проблемы на этих общих для всех животных
клеток чертах, будет легче показать, почему данные, полученные в ре-
зультате экспериментов с различными типами животных клеток, могут
быть с пользой и должным образом использованы для построения общей
картины.
Состав клеток животных
Как правило, животные клетки весьма велики по своим размерам.
Так, например, куриный фибробласт в культуре ткани весит примерно
5 • 10-8 мг (сухой вес), а клетка HeLa — около 5 • 10”7 мг. Для сравнения
полезно отметить, что клетка Е. coli весит примерно 2 10~10 мг. Наибо-
лее доступные для исследования животные клетки, а именно клетки
крови и костного мозга, близки по величине клеткам HeLa. Подавляю-
щее большинство животных клеток имеют вес, находящийся в пределах
от 10~6 до 5- 10~8 мг (сухой вес единичной клетки). В их число входят
клетки печени, селезенки, легких, почек, костного мозга, кишечника и
соединительной ткани. Исключением являются мышечные клетки и не-
которые клетки центральной нервной системы, которые могут обладать
значительно большей массой, чем другие клетки организма животного.
Однако в мышечной клетке имеется много ядер, лежащих в пределах
как бы одной очень большой клетки.
Примерно 60%, сухого веса обычной животной клетки приходится на
долю белка. Количество липидов варьирует от 5 до 20%. На долю РНК
приходится примерно 10% массы клетки, а на долю ДНК — примерно
5%. В нормальной клетке человека содержится примерно 10 пг ДНК
(10 10~12 г), что эквивалентно молекулярному весу 6-Ю12 дальтон.
Если принять, что размер гена в среднем равен 4 105 дальтон (см. гл. V),
то легко рассчитать, что генетический потенциал клетки человека состав-
ляет более 107 генов. В ядре любой диплоидной клетки данного вида жи-
вотного содержится постоянное количество ДНК. Колебания в общем
содержании ДНК на клетку среди различных млекопитающих также
невелики, хотя число хромосом и их размеры могут значительно варьи-
ровать от вида к виду.
16 Заказ № 1214
242
Глава XII
Помимо макромолекул в описываемой нами животной клетке содер-
жатся малые молекулы, которые можно отделить от макромолекул, осаж-
дая последние холодной кислотой. Совокупность всех этих веществ
обычно называют клеточным фондом, в который входит множество раз-
личных соединений. Наиболее важными из них являются аминокислоты,
рибонуклеотиды, присутствующие главным образом в виде нуклеозидтри-
фосфатов, причем в наибольшем количестве содержится аденозинтри-
фосфат, промежуточные продукты реакций энергетического обмена, пред-
шественники липидов, полйамины и, конечно, неорганические анионы и
катионы. Эти соединения являются составной частью фонда растворимых
соединений животной клетки. Большая часть вирусного материала, обра-
зующегося при репликации вируса, синтезируется именно из соединений,
образующих этот фонд.
Структура и организация животной клетки
Представляется логичным начать описание структуры и организации
животной клетки с ее наружной мембраны и перейти затем к описанию
внутренних компонентов клетки. Действительно, в свете современных
Фиг. 60. Схема строения животной клетки, демонстрирующая внутренние структуры
клетки и впячивания клеточной мембраны.
/ — элементарная мембрана; 2 — митохондрия; 3 — ядерная оболочка; 4 — гранула; 5 — рибосомы;
6 — цитоплазма; 7 — эндоплазматическая сеть; 8 — впячивание; 9 — каналец; 10 — тельце Гольджи.
концепций необходимо сначала рассказать о клеточной мембране, ибо
наблюдаемая нами внутренняя организация клетки, по-видимому, ча-
стично определяется впячиваниями и сложными внутренними складками
мембранной структуры, идентичной или близкой по своему характеру
соответствующим образованиям, одевающим клетку снаружи.
У животных клеток нет жесткой наружной стенки, подобной имею-
щейся у бактерий или растительных клеток. Поэтому гибкая плазмати-
ческая мембрана, которую Робертсон [683] рассматривает как элемен-
тарную мембрану (фиг. 60), является единственной поверхностью, за-
держивающей или поглощающей молекулы, необходимые для содержи-
мого клетки, и единственным барьером, который должны преодолеть про-
никающие в клетку частицы, такие, например, как вирусы. Клетки жи-
вотного можно представить себе, как структуру, где процесс впячивания
и складывания элементарной мембраны приводит к тому, что различные
органеллы клетки, обладающие специфическими функциями (митохонд-
Введение в биологию клеток животных
243
рии, тельца Гольджи, ядро и др.), оказываются окруженными мембра-
нами. В результате клеточные органеллы отделяются друг от друга, хотя
часто благодаря неполному смыканию мембран непрерывный контакт
с остальной частью цитоплазмы сохраняется (фото 48). Конечно, такое
представление о клетке животного является не более чем схематической
моделью ее истинного строения.
На срезах клеток это множество складчатых мембран выглядит в
виде сети непрерывных линий, которая носит название эндоплазматиче-
ской сети [652]. Ядерная оболочка, отграничивающая от цитоплазмы
ядро, в котором происходит синтез клеточных ДНК и РНК, является
частью эндоплазматической сети. Однако ядерной оболочке свойственны
некоторые особенности, которые отличают ее от других компонентов си-
стемы цитоплазматических мембран. Например, в ядерной оболочке
имеются очень отчетливые поры (порядка 1000 А), которые достаточно
велики для того, чтобы обеспечить прохождение через них веществ ядер-
ного и цитоплазматического происхождения.
В митохондрии содержатся сложные специализированные структу-
ры, в которых осуществляется окислительное фосфорилирование. Наруж-
ная мембрана митохондрии, по-видимому, в некоторых отношениях
сходна с мембранами, отграничивающими другие клеточные структуры.
Другие клеточные органеллы также окружены липопротеидными
мембранами. В качестве примера можно привести лизосомы [174] — цито-
плазматические структуры, встречающиеся во многих животных клетках
и содержащие гидролитические ферменты. Эти ферменты отделены от
остальной части клетки липопротеидной мембраной, и представляется
вероятным, что многие из событий, происходящих на последних стадиях
вирусной инфекции и ведущих к деструкции клеток, являются результа-
том освобождения ферментов, содержащихся в лизосомах.
Обычно принято считать, хотя это, вероятно, является крайним упро-
щением, что в любой клетке (фото 48) можно выделить три фазы: 1) ка-
налы, которые по существу являются экстрацитоплазматическими струк-
турами, впячивающимися внутрь клетки снаружи, 2) мембраны и 3) ин-
трацитоплазматическую фазу.
Поэтому при попытках изолировать мембраны путем механического
разрушения клетки получают обрывки и кусочки интрацитоплазматиче-
ского вещества, остающегося присоединенным к фрагментам мембраны.
Объектом большинства ранних исследований, посвященных изучению
мембран и проводившихся как биохимическими, так и биофизическими
методами, служили два типа клеток, из которых вследствие своеобразия
их строения удавалось сравнительно легко получить вещество мембран
в относительно чистом виде. Мы имеем в виду эритроциты и аксоны
нервных клеток. Внутреннее содержимое эритроцитов легко удалить при
помощи осмотического шока. Аксоны нервных клеток можно рассматри-
вать как длинные тонкие цитоплазматические выросты; некоторые из них
окутаны толстой-оболочкой, образованной мембранами окружающих
аксон (шванновских) клеток (миелиновая оболочка [683]). За последнее
время в области разработки методов получения мембран достигнут зна-
чительный прогресс. Разработаны методы получения из клеток других
типов препаратов, значительно обогащенных липидами — главными со-
ставными частями мембран—и содержащих антигенные компоненты
клеток, которые, как полагают, локализованы на поверхности клет-
ки [347].
Химический анализ препаратов мембран такого типа, как и мембран,
полученных из эритроцитов и нервных клеток, показал, что в состав
мембран входит большое количество липидов и белков и некоторое коли-
чество углеводов. Хотя углеводы содержатся в мембранах в небольших
16*
244
Г лава XII
количествах, они, возможно, играют решающую роль в определении анти-
генной специфичности каждой отдельной мембраны. К числу наиболее
важных липидов, определяющих структуру мембран животных клеток,
относятся фосфолипиды, главным образом лецитины и кефалины. Леци-
тины и кефалины представляют собой довольно сложные молекулы. Они
состоят из высших жирных кислот (олеиновой, стеариновой, пальмитино-
вой и линолевой), этерифицированных глицерином, к которым в свою
очередь через остаток фосфорной кислоты присоединено азотистое осно-
вание.
Хотя истинная структура липопротеидной мембраны пока точно не
установлена, наиболее общепринятым является мнение, что она имеет
вид бимолекулярного липопротеидного листка [174]. В основе этой идеи
лежат данные, полученные Гортером и Гренделом [286]. Эти авторы по-
казали, что поверхность, занимаемая суммарным количеством липидов,
содержащихся в эритроците, примерно вдвое больше поверхности эри-
троцита. Исследования мембран эритроцитов и нервных клеток, прове-
денные при помощи рентгеноструктурного анализа, подтвердили эту
точку зрения. При помощи этого метода в мембранах эритроцитов и нерв-
ных клеток были обнаружены высокоупорядоченные структуры, что со-
гласуется с интерпретацией, согласно которой мембрана имеет вид бимо-
лекулярного липопротеидного листка. Данные, полученные при помощи
электронной микроскопии, показали, что такого рода структуры яв-
ляются определяющими компонентами многих мембран. Поэтому пред-
ставляется вполне разумным вывод, что мембраны, по крайней мере в их
обычном состоянии, представляют собой двойные ламеллярные липо-
протеидные структуры, в которых длинные цепи жирных кислот каждого
листка обращены друг к другу, а на наружных поверхностях структуры
расположены белковые слои.
Результаты, полученные при исследовании жидких кристаллических
фаз, образующихся на границе раздела липид — вода [543], подсказали
другую интересную возможность объяснения на молекулярном уровне
процесса избирательной проницаемости — одной из наиболее важных
функций мембран. Согласно этому предположению, несколько молекул
липидов, взаимодействуя друг с другом, образуют не листоподобную
структуру, а кольцо, стенки которого представляют собой контактирую-
щие друг с другом, обращенные внутрь кольца гидрофильные группы
липидов. Внутри такого кольца должен иметься тонкий канал, заполнен-
ный молекулами воды. Такой заполненный водой канал может функцио-
нировать как отверстие в поверхности клетки, ведущее к ее внутренним
структурам. Если мембраны клетки действительно образуются вследст-
вие подобного рода взаимной ориентации молекул, то стабильность мем-
браны должна зависеть от таких параметров, как температура, концен-
трация липидов и электрический заряд. Очевидно, что такая мембрана
будет обладать свойствами, которые смогут обеспечить ей способность
к избирательной проницаемости. Большое впечатление произвело иссле-
дование, проведенное с помощью электронного микроскопа и показав-
шее, что в кристаллах некоторых липидов действительно имеются такого
рода каналы [529].
Однако, честно говоря, молекулярный механизм проникновения ма-
лых молекул через мембраны клеток животных еще весьма далек от ясно-
сти. До сих пор нельзя отдать предпочтение ни одному из предположе-
ний, а именно возможности проникновения малых молекул внутрь клетки
через отверстия, имеющиеся в мембране, избирательного растворения
таких молекул в липидах, входящих в состав мембраны, или лишь взаи-
модействия их с веществами, входящими в состав мембраны, например
с фосфорной кислотой фосфолипидов.
Введение в биологию клеток животных.
245
При попытке понять, каким образом проникают в клетки большие
частицы, как, например, вирусы или молекулы нуклеиновой кислоты, воз-
никают дополнительные трудности. В основе механизмов, обусловли-
вающих проникновение различных материалов через мембраны живот-
ной клетки, лежат процессы, которые, по-видимому, являются следствием
возникновения структур, обладающих более высоким уровнем организа-
ции, чем структуры, возникающие в результате взаимодействия лишь
небольшого числа различных молекул. Двумя такими процессами, харак-
терными для некоторых животных клеток, являются пиноцитоз и фаго-
цитоз. Этими терминами обозначается способность животной клетки
включать в состав внутренней части видимой границы клетки и в конеч-
ном счете в цитоплазму либо микрокапельки раствора (пиноцитоз), либо
микроскопически малые твердые частицы (фагоцитоз). Хотя движения
мембраны животной клетки и ее цитоплазмы, наблюдаемые при таком
типе поглощения находившегося вне клетки вещества, несомненно ответ-
ственны за захват пограничными областями клетки вирусных частиц, для
того чтобы столь большие частицы, как вирусы, смогли проникнуть
внутрь цитоплазмы клетки, может потребоваться частичная дезинтегра-
ция вируса.
Ясно, что для того, чтобы получить исчерпывающее представление
о функции мембраны и «архитектуре» внутренних составных частей
клетки, необходимы дополнительные данные о химической структуре
мембран. Вполне возможно, что продолжение исследования процесса
проникновения вирусов животных в их клетки-хозяева и связи специфи-
ческих функций вирусов с различными внутриклеточными структурами
поможет получить данные, способствующие решению этой чрезвычайно
важной проблемы.
Рост и функция животных клеток
Выше в качестве предмета нашей дискуссии были специально изб-
раны исследования, посвященные изучению самых различных видов кле-
ток. Это было сделано для того, чтобы продемонстрировать основные
общие проблемы, возникающие при изучении структуры и организации
этих клеток. Однако с точки зрения функционирования различных видов
клеток в многоклеточном организме поразительной особенностью яв-
ляется различие в поведении дифференцированных клеток. Так, некото-
рые клетки в теле животного растут и делятся быстро, другие — медлен-
но, а третьи — вовсе не растут и не делятся. Специфические белки син-
тезируются некоторыми клетками в больших количествах, тогда как дру-
гие не синтезируют их вовсе.
Поскольку все соматические клетки организма являются диплоид-
ными и образуются в результате деления одного оплодотворенного яйца,
принято считать, что во всех, даже самых различных соматических клет-
ках, содержится качественно идентичный генетический материал, а раз-
личие в функциональной способности дифференцированных клеток яв-
ляется результатом различия в реализации общего фонда генетической
информации, содержащейся в данных клетках. В пользу гипотезы,
утверждающей, что каждая соматическая клетка содержит один и тот
же объем генетической информации, говорят две группы фактов. Во-пер-
вых, было показано, что во всех соматических клетках данного орга-
низма количество ДНК, приходящееся на одно ядро, а также число и
морфология содержащихся в клетке хромосом не отличаются друг от
друга {592]. Во-вторых, опыты, в которых в яйцо амфибий с предвари-
тельно удаленным ядром пересаживали ядра, взятые из клеток на раз-
личных стадиях развития амфибии, показали, что вне зависимости от
24G
Глава XII
того, на какой из стадий развития клетки-донора берется имплантируе-
мое ядро, из клетки-реципиента может вырасти жизненеспособный эмб-
рион [302, 451].
Чем более дифференцирована клетка, из которой берется имплан-
тируемое ядро, тем меньше вероятность успешной трансплантации. Тем
не менее очень важно, что даже в случае имплантации ядер, извлеченных
из полностью дифференцированных клеток, иногда удается получить
жизнеспособные эмбрионы. Эти результаты являются веским аргументом
в пользу точки зрения, согласно которой в каждой соматической клетке
содержится вся ДНК, характерная для организма данного биологиче-
ского вида.
Если это действительно так, то основным вопросом, вытекающим из
факта существования дифференцированных клеток, является следующий:
какой механизм ответствен за репрессированное состояние большей ча-
сти генетической информации, содержащейся в дифференцированной
клетке, и за реализацию ее меньшей части? Можно полагать, что при
помощи недавно разработанного метода, позволяющего выявить ком-
плементарные последовательности нуклеотидов (гибридизация ДНК
с РНК), удастся определить как степень сходства или различия между
информационными РНК, полученными из клеток различных органов, так
и решить вопрос о том, одинаковые ли количества идентичных последо-
вательностей нуклеотидов содержатся в ДНК, выделенных из различных
тканей одного и того же организма.
Первые результаты, полученные исследователями, пытавшимися
разрешить эти вопросы, показали, что ДНК из различных органов кры-
сы, гибридизуются друг с другом одинаково легко, тогда как между об-
щей «быстро метящейся» РНК (в которую входят все виды РНК), полу-
ченной соответственно из клеток печени и почек, могут наблюдаться
совершенно четкие различия [552]. Если эти данные, указывающие на
различия между m-РНК, содержащимися в различных тканях, будут
окончательно подтверждены, то можно будет сосредоточить усилия на
выяснении механизма, при помощи которого осуществляется избира-
тельная транскрипция соответствующих областей ДНК. Данные, полу-
ченные за последнее время при изучении функционирования Х-хромосом
клеток млекопитающих, указывают, что одним из механизмов контроля
реализации генетической информации, содержащейся в животных клет-
ках, может быть подавление функции всей хромосомы в целом [170].
Можно полагать, что уверенность в выявлении молекулярных основ мно-
гих аспектов механизма, ответственного за поддержание дифференци-
ровки, не является выражением неоправданного оптимизма.
ИСПОЛЬЗОВАНИЕ КУЛЬТУР ТКАНЕЙ ПРИ ИЗУЧЕНИИ
РОСТА И ДИФФЕРЕНЦИРОВКИ КЛЕТОК
Пониманию сущности процессов роста и дифференцировки клеток
в большой мере способствовала стимуляция интереса к методам куль-
тивирования клеток, вызванная широким применением этих методов
в вирусологии. Было подмечено, что при росте клеток в культуре неко-
торые специфические функции клетки могут либо интенсифицироваться,
либо ослабляться и, следовательно, могут быть подвергнуты анализу.
Органом, который наиболее часто используется для получения первич-
ных клеточных культур с целью размножения затем вирусов in vitro,
является почка. Одним из наиболее характерных свойств клеток почки,
как, впрочем, и клеток многих других дифференцированных тканей, яв-
ляется наличие у них тканеспецифичных антигенов, по-видимому локали-
зующихся на поверхности клетки. Несмотря на то что культивируемые
Введение в биологию клеток животных
247
клетки почек хомяка внешне являются вполне здоровыми и хорошо ра-
стут в культуре, они очень быстро, в течение периода, который короче
одной клеточной генерации, теряют большую часть активности, выявляю-
щейся в виде специфических почечных антигенов [905]. Интересно, что
такого рода измененйя наблюдаются даже в тех случаях, когда клетки
сохраняют способность группироваться в структуры, по своей морфоло-
гии подобные почечным канальцам.
Еще одним удивительным изменением специфичности поверхности
клеток, происходящим при культивировании почечных клеток in vitro,
является появление рецепторов, специфичных по отношению к вирусу
полиомиелита. Было показано, что как клетки амниона человека, так и
клетки почки обезьяны адсорбируют вирус полиомиелита только в том
случае, если они предварительно культивировались in vitro [357].
По-видимому, наиболее важные результаты дало использование
культур клеток in vitro для изучения одной из самых сложных специа-
лизированных функций животных клеток, а именно их роста и деления.
Проблема изучения процесса роста клеток поглощает основную часть
усилий большого числа исследователей, работающих в области эмбрио-
логии, онкологии, биохимии нуклеиновых кислот и белка, биофизики и
молекулярной биологии. Некоторые аспекты этой проблемы, в разреше-
нии которых может быть полезно использование метода культуры тка-
ней, рассматриваются в настоящей главе, другие же будут обсуждены
в гл. XVI.
В развивающемся эмбрионе все входящие в его состав клетки в те-
чение значительного периода времени растут и делятся. Однако по мере
того, как дифференцировка клеток становится все более и более очевид-
ной, рост замедляется. В полностью дифференцированном организме
животного клетки некоторых тканей продолжают делиться, тогда как
деление клеток других тканей прекращается. Так, замена клеток крови
и клеток кишечного эпителия происходит за счет клеток-предшественни-
ков, делящихся со скоростью, близкой к максимальной скорости деления
эмбриональных клеток и наиболее быстро растущих клеток, культиви-
руемых in vitro. Было показано, что даже опухолевые клетки никогда не
пролиферируют столь быстро, как клетки костного мозга и камбиальные
клетки кишечного эпителия [658]. Другие клетки, например клетки, обра-
зующие базальный слой кожи, заменяются не столь быстро, как клетки
крови и кишечного эпителия, однако тоже делятся. Такие клетки, как
фибробласты, способствующие заживлению ран, обладают потенциаль-
ной способностью к делению, но реализация этой способности происхо-
дит, по-видимому, только в том случае, когда клетки получают соответ-
ствующий стимул. Аналогично этому клетки почек и печени взрослого
организма, которые в норме обычно делятся очень медленно или вовсе
не делятся, тем не менее сохраняют способность к быстрому делению,
реализующуюся, например, после удаления одной почки или одной доли
печени соответственно.
Были предприняты попытки культивировать почти все клетки жи-
вотных. В некоторых случаях исследователям удалось получить куль-
туру специализированных клеток. Например, было показано, что выде-
ленные из мышцы куриного эмбриона клетки, напоминающие фибробла-
сты, после прекращения роста в культуре способны дифференцироваться
в клоны мышечных клеток [467]. Однако обычно наблюдается, как пра-
вило, другая картина: клетки из многих, самых различных источников
(кожа, легкие, кишечник, почка), хотя и продолжают расти в культуре
в течение весьма продолжительного времени, тем не менее (почти во всех
случаях) теряют сходство с клетками органа, из которого они были по*
лучены. Теряя характерные черты, свойственные клеткам соответствую-
248
Глава XII
щих органов, они приобретают вид либо недифференцированных фибро-
бластов, либо эпителиальных клеток, не обладающих какими-либо
специфическими отличительными свойствами. Пока нет ни одного дейст-
вительно достоверного случая образования из нормальной ткани переви-
ваемой, непрерывно растущей культуры, продолжающей функциониро-
вать столь же специфически, как и орган, из которого эта культура была
получена.
Было показано, что длительно культивируемые культуры клеток со-
храняют способность синтезировать ферменты, характерные для роди-
тельских клеток данной культуры. Так, например, клетки культуры, по-
лученной из кожи здорового человека, как и исходные клетки, могут
использовать в качестве источника энергии галактозу, тогда как клетки
культуры, полученные из кожи больных, страдавших галактоземией, не
могут утилизировать галактозу и не приобретают этой способности даже
после роста в культуре в течение нескольких генераций (477]. Высокоспе-
циализированные функции демонстрируют некоторые культуры клеток,
полученные из опухолей животных. Например, Сато и его сотрудники
показали, что культуры клеток, полученные из опухоли гипофиза крысы,
синтезируют адренокортикотропный гормон (АКТГ), а клетки другой
опухоли, полученной из надпочечника крысы, в ответ на воздействие
этого гормона синтезировали стероиды [109].
Первые эксперименты, выполненные в лабораториях Эрла (724] и Па-
ка [660], показали, что из единичной изолированной клетки животного
можно вырастить колонии или клоны, состоящие из многих тысяч кле-
ток. Метод выделения клона был назван клонированием. Эффективность
получения макроскопической колонии из единичных клеток уже образо-
вавшейся перевиваемой культуры очень велика и достигает 100%. Сус-
пензии клеток, полученных из цельных эмбрионов, также можно клони-
ровать с достаточно высокой эффективностью, достигающей примерно
10—40%. Однако клетки, получаемые из органов взрослых животных,
образуют колонии с очень малой эффективностью, изменяющейся в пре-
делах от 10-4 до 10~6, причем, как уже упоминалось выше, переживаю-
щие клетки не обладают свойствами клеток родительского органа. Из
культур клеток, сохранивших способность к росту в течение продолжи-
тельного времени, удается получать субкультуры. Время генерации ко-
леблется от 24 до 48 час. Хромосомы клеток таких культур могут сохра-
нить нормальную морфологию, а число хромосом в клетке может остать-
ся эуплоидным. Почти всегда такие эуплоидные культуры перестают
расти после культивирования в течение периода, изменяющегося от не-
скольких месяцев до двух лет.
В редких случаях такие культуры претерпевают спонтанные измене-
ния, в некоторых отношениях напоминающие трансформацию нормаль-
ных клеток, осуществляемую опухолеродными вирусами (гл. XVI). В по-
добных случаях измененные клетки приобретают способность к непре-
рывному росту, образуя так называемые перевиваемые линии, время
генерации клеток которых составляет от 18 до 30 час. Такие непрерывно
растущие линии клеток всегда являются анеуплоидными, т. е. содержат
хромосомный набор, в котором число хромосом не кратно основному
числу. Предстоит, однако, выяснить, является ли анеуплоидия причиной
или следствием изменений, ведущих к появлению у клеток способности
к быстрому и непрерывному росту.
Вопрос о наборе питательных веществ, необходимом для роста пе-
ревиваемых линий клеток животных, изучался в опытах, в которых
использовали как большие популяции клеток, так и единичные клетки
[515]. Наиболее удивительными оказались результаты, показавшие отно-
сительное однообразие в требованиях к составу питательной среды. За
Введение з биологию клеток животных
249*
исключением небольших различий, потребность различных культур в тех
или иных аминокислотах, витаминах или солях оказалась идентич-
ной [206].
Обязательными компонентами питательной среды являются некото-
рые аминокислоты, как, например, гистидин, аргинин, тирозин и глу-
тамин, синтезируемые определенными клетками организма, но не синте-
зируемые клетками человека или мышиными клетками в культуре. Хотя
культивируемые клетки содержат, по-видимому, тот же набор молекул
ДНК, что и нормальные клетки, простого отсутствия в питательной среде
той или иной аминокислоты недостаточно для того, чтобы реализовать
способность генома индуцировать синтез ферментов, необходимых для
синтеза данной аминокислоты. Исключением является индукция синтеза
глутаминсинтетазы — фермента, катализирующего синтез глутамина из
глутаминовой кислоты. Было показано [182], что, культивируя клетки
животных в питательной среде, содержащей вместо глутамина глутами-
новую кислоту, можно «индуцировать» синтез этого фермента. Добавле-
ние глутамина приводит к репрессии его синтеза.
Весьма существенно, что клетки, поддающиеся такой индукции, со-
держат небольшие количества глутаминсинтетазы еще до лишения их
глутамина. Не удалось обнаружить ферментов, катализирующих синтеэ
аргинина, гистидина или тирозина, ни до индукции, ни после попыток
вызвать ее. Таким образом, в отношении этих трех аминокислот не уда-
лось продемонстрировать наличия индукции или репрессии типа дейст-
вующей у бактерий.
Скорость роста клеток в культуре варьирует весьма широко. Так,
например, у некоторых линий клеток минимальное время генерации со-
ставляет примерно 12 час, тогда как у диплоидных клеток оно может
составлять несколько дней, неделю и даже больше. Интересно рассмот-
реть вопрос о том, какие факторы могут лимитировать скорость роста
животной клетки по сравнению с бактериальной. Две основные реакции
совершенно отчетливо определяют это уменьшение скорости роста:
1) для синтеза полипептидной цепи определенной длины в ретикулоци-
тах [185] и клетках HeLa [640] требуется примерно в 20 раз больше вре-
мени, чем в клетках Е. coli [554]; 2) хотя синтез ДНК в клетке животного
происходит только в течение одного из периодов цикла деления, а именно
S-периода, предельно минимальное время, необходимое для этого про-
цесса, составляет все же от 4 до 6 час [658].
Кроме интервала времени, необходимого для синтеза ДНК, продол-
жительность М-периода, т. е. стадии, в течение которой совершается про-
цесс митоза, составляет примерно 30 мин, а промежуток времени между
окончанием синтеза ДНК и ингибированием митоза, так называемый
период G2, длится примерно 4 час. Длительность этих стадий клеточного»
цикла животного примерно постоянна. Поэтому было высказано предпо-
ложение, что большее время генерации некоторых клеток животных по
сравнению с другими, может быть вызвано изменением длительности так
называемого периода Gb т. е. промежутка времени между окончанием
митоза и началом нового цикла синтеза ДНК [175].
Недавно проведенные наблюдения, целью которых было выявление
прекращения синтеза РНК во время митоза, явились исходными для по-
пыток определить порядок реализации последовательности событий, про-
исходящих во время каждой из стадий цикла деления. Прескотт и др.
[654] обнаружили, что у простейших одноклеточных Euplotes транскрип-
ция РНК с ДНК прекращается в каждой из точек хромосомы, с которой
начинался синтез новой ДНК. Было показано, что в других клетках жи-
вотных при митозе имеет место резкое уменьшение суммарного синтеза
РНК. Данные, полученные при помощи радиоавтографии, также под-
*250
Глава XII
твердили это наблюдение. Что же касается фаз деления клетки, то, ко-
нечно, после окончания клеточного цикла последовательность образова-
ния соответствующих типов m-РНК диктует и порядок образования раз-
личных белков.
Одним из аспектов проблемы роста клеток животных в культуре,
изучение которого позволило получить определенную информацию, яв-
ляется образование внутри клетки определенных морфологически орга-
низованных структур. Известно, что в растущих клетках тканевых куль-
тур большая часть образующихся белков синтезируется на рибосомах,
объединенных в группы, называемые полирибосомами, или полисомами.
Все рибосомы, входящие в состав полисомы, участвуют в трансляции
информации с нити данной информационной РНК, т. е. переводят эту
информацию в аминокислотную последовательность соответствующего
пептида.
Первым этапом образования этих структур в растущих клетках, по-
видимому, является присоединение новой цепи яг-РНК к меньшей из
двух субъединиц рибосомы. Однако неизвестно, происходит это присое-
динение у ядерной оболочки или сразу же после проникновения яг-РНК
в цитоплазму. Очень скоро после присоединения к первой рибосоме
яг-РНК соединяется еще с несколькими рибосомами, образуя в резуль-
тате полирибосому. Имеются определенные доказательства, свидетель-
ствующие о том, что, хотя рибосомы и являются продуктами жизнедея-
тельности ядерной органеллы — ядрышка, они проникают в цитоплазму
в виде субъединиц [276]. Известно, что в ядрах клеток тканевых культур
завершенные рибосомы не обнаруживаются {639]. Вопрос же о том, как
•обстоит дело в клетках интактного организма, предстоит еще выяснить.
Большая часть вопросов, касающихся биологии животной клетки
(кратко мы рассматривали их выше), настолько сложны, что не так про-
сто найти адекватные пути для их экспериментального разрешения.
Использование вирусов в качестве чужеродных генетических элементов,
которые можно ввести в клетку в контролируемых условиях с тем, чтобы
попытаться прозондировать некоторые из этих вопросов,— одна из задач,
решаемых вирусологами, изучающими вирусы животных. Залогом успеха
этой работы является успешный прецедент — опыт изучения бактерий,
в ходе которого многие фундаментальные процессы сначала наблюдались
при исследовании бактериальных клеток, зараженных фагами, и лишь
затем заново открывались при исследовании растущих бактерий.
Опираясь на материал, изложенный в настоящей главе, мы можем
теперь перейти к детальному обсуждению процессов размножения виру-
сов животных и влияния этих процессов на клетки-хозяева, внутри кото-
рых эти процессы происходят.
Глава XIII
ВИРУСЫ ЖИВОТНЫХ. АДСОРБЦИЯ, ПРОНИКНОВЕНИЕ
В КЛЕТКУ И ОСВОБОЖДЕНИЕ НУКЛЕИНОВОЙ КИСЛОТЫ
МЕТОДЫ ЭКСПЕРИМЕНТАЛЬНОГО ИЗУЧЕНИЯ
ВЗАИМОДЕЙСТВИЯ ВИРУСА С КЛЕТКОЙ
Эта глава посвящена проблеме начальных стадий инвазии вирусов,
а именно первичному присоединению вирусов животных к их клеткам-
хозяевам, этапам, ведущим к проникновению вирусов внутрь клетки и
освобождению содержащегося в вирусах наследственного вещества —
нуклеиновой кислоты. Специфичность этой начальной фазы вирусной
инфекции особенно важна в связи с тем, что спектр чувствительных
к вирусу хозяев определяется именно на этом уровне, ибо очевидно, что
•если какая-либо клетка не в состоянии адсорбировать вирусную частицу,
то она застрахована от любого вида повреждений, которые могут быть
вызваны данным вирусом.
Молекулярные основы процессов адсорбции вирусов животных и по-
следующего освобождения их нуклеиновой кислоты стали привлекать
внимание исследователей лишь в самое последнее время, в связи с чем
эти вопросы изучены менее детально, чем процесс проникновения в бак-
терии ДНК бактериофага. По-видимому, в основе проникновения в
клетку вирусов животных лежит достаточно простой механизм, во вся-
ком случае несравнимый по сложности с тем механизмом, который
«используют» Т-четные фаги для введения своей ДНК внутрь бакте-
риальной клетки-хозяина. Фактически инфекционные агенты, отличаю-
щиеся друг от друга по свойствам своей поверхности, например миксо-
вирусы, вирус полиомиелита и вирусы группы оспы, могут сильно отли-
чаться друг от друга и в отношении событий, происходящих на молеку-
лярном уровне при проникновении их в клетку.
Прежде чем перейти к описанию деталей механизма проникновения
вириона в клетку, характерных для каждого типа вирусов в отдельности,
представляется целесообразным сначала описать методы, используемые
для экспериментального исследования процессов адсорбции и проникно-
вения вирусов в клетки.
Успех в изучении процесса взаимодействия вируса с клеткой зависит
от точности определения числа вирусных частиц до и после их присое-
динения к клеткам. С введением в практику научных исследований тит-
рования вирусов животных при помощи метода бляшек [196] стало воз-
можным точное определение как количества свободного вируса, так и
числа зараженных клеток, а благодаря этому и изучение условий, необ-
ходимых для присоединения вируса к клеткам и, следовательно, его
исчезновения из культуральной жидкости. Однако процесс исчезновения
вируса при его проникновении внутрь клетки и разрушение вирусной ча-
стицы внутри клетки могут быть изучены только косвенным образом.
Отсюда ясно, что детали взаимодействия между вирусными частицами
и клеточными мембранами пока изучены недостаточно хорошо.
Для того чтобы проследить судьбу присоединившегося к клетке ви-
руса, с успехом используют следующие пути и критерии: 1) потерю чув-
ствительности вируса к действию противовирусных антител; 2) способ-
- 251 -
252
Глава Xlll
ность адсорбированной инфекционной вирусной частицы элюироваться-
с поверхности клетки; 3) выделение клеточного рецептора, обладающего-
способностью специфически инактивировать инфекционность вируса;
4) изучение судьбы вируса, меченного радиоактивным изотопом, и 5) изу-
чение влияния ингибиторов обмена веществ, например лекарственных пре-
паратов, или изменения температуры на процесс проникновения вирусов
в клетку. Особенно мощным инструментом изучения судьбы адсорбиро-
вавшегося на клетке вириона является электронный микроскоп. Не сле-
дует, однако, забывать, что при помощи электронного микроскопа из
огромного числа частиц, содержащихся в изучаемом образце, удаётся
выявить лишь единичные, вследствие чего данные морфологических на-
блюдений, как правило, следует интерпретировать с учетом результатов,
полученных при'помощи биохимических методов.
Ниже мы подробно обсудим взаимодействие с клетками трех типов
вирусов: 1) миксовирусов — РНК-содержащих вирусов, внешняя липо-
протеидная оболочка которых в момент ее возникновения представляет
собой часть мембраны, зараженной данным вирусом клетки; 2) вируса
полиомиелита — небольшого РНК-содержащего икосаэдрического виру-
са, не имеющего внешней оболочки, и 3) вируса осповакцины — боль-
шого ДНК-содержащего вируса, в состав которого входят также и ли-
пиды, при проникновении которого в клетку наблюдается ряд сложных
явлений, являющихся следствием взаимодействия вируса с клеткой.
Вирус гриппа и другие миксовирусы
Обсуждение процессов присоединения вируса к клетке и его проник-
новения через клеточные мембраны обычно принято начинать с описания
взаимодействия с клеткой вируса гриппа. Дело в том, что хориоалланто-
исная мембрана куриного эмбриона, зараженная вирусом гриппа, яви-
лась первой системой, для которой оказалось возможным получить на
клеточном уровне количественные данные о процессе взаимодействия
вируса с клеткой. Кроме того, неотъемлемой частью вириона вируса
гриппа, а также и других миксовирусов является муколитический фер-
мент, который может принимать участие в процессе проникновения мик-
совируса в клетку. Материал, полученный при изучении этого вопроса,
до сих пор является единственным источником твердо установленных
фактов, позволяющих понять некоторые детали вероятного химического
механизма инвазии клеток вирусами.
Изучение муколитического фермента вируса гриппа — сиалидазы
стимулировало открытие Херстом [349] способности вируса гриппа агглю-
тинировать эритроциты различных видов животных, а затем элюировать
с агглютинированных эритроцитов. Явление гемагглютинации имеет
смысл обсудить более детально, ибо оно нашло очень полезное приме-
нение в области диагностики вирусных инфекций, послужило ценной мо-
делью для изучения начальных стадий взаимодействия вирусов с клет-
ками и сыграло важную историческую роль в изучении вирусов.
Гемагглютинация и муколитические ферменты миксовирусов
В самом начале изучения размножения вируса гриппа в куриных
эмбрионах было обнаружено, что в случае, когда в аллантоисную жид-
кость, извлекаемую из зараженных этим вирусом куриных эмбрионов,
попадают эритроциты, последние склеиваются друг с другом и, образуя
глыбки, быстро оседают на дно пробирки. Херст [349—351] тщательно
проанализировал это явление и установил, что реакция гемагглютинации
Вирусы животных
253
не зависит от температуры, но для того, чтобы она осуществилась, в ре-
акционной среде должны содержаться электролиты. Далее оказалось,
что скорость реакции гемагглютинации зависит от концентрации вируса,
а антитела к вирусу блокируют эту реакцию. Херст пришел к выводу,
что в основе гемагглютинации лежит образование решетки из комплек-
сов, состоящих из эритроцитов и вирусных частиц. Вскоре было обнару-
жено, что способность давать реакцию гемагглютинации не является
специфическим свойством только вируса гриппа, но наблюдается и у
многих других вирусов. Оказалось также, что агглютинироваться виру-
сами могут эритроциты не только кур, но и многих других видов живот-
ных. При некоторых вирусных инфекциях в зараженных клетках обра-
зуется агглютинирующий агент, или, как его принято называть, гемаг-
глютинин, не входящий в состав инфекционных вирусных частиц.
Ценность явления взаимодействия вирусов с эритроцитами для изу-
чения вирусов еще более возросла, когда Фогель и Щелоков [759, 871]
обнаружили, что клетки, зараженные некоторыми гемагглютинирую-
щими вирусами, приобретают способность адсорбировать на своей по-
верхности эритроциты. Это явление было названо гемадсорбцией. Оно
дало в руки вирусологов еще один метод выявления зараженных виру-
сами клеток. На фото 49 показана клетка HeLa, зараженная вирусом
ньюкаслской болезни, на поверхности которой адсорбированы эритро-
циты. Данные о гемагглютинирующей способности различных вирусов
приведены в табл. 26.
Реакция гемагглютинации быстро приобрела важное значение как в
качестве метода диагностики вирусных заболеваний и идентификации
вирусов, так и в качестве одного из методов научного исследования, ибо
с ее помощью стало возможным быстрое определение количества ви-
руса, содержащегося в суспензии. При постановке реакции гемагглюти-
нации в макроварианте по обычно используемой методике положитель-
ный результат получается в том случае, если в анализируемой вирусной
суспензии содержится не менее 105—106 вирусных частиц на 1 мл. При
помощи усовершенствованного варианта реакции гемагглютинации, ког-
да используют избыточное количество эритроцитов, можно подсчитать
число содержащихся в суспензии отдельных вирусных частиц [510]. Дело
в том, что, хотя каждый вирион обладает большим количеством рецеп-
торных точек, тем не менее он может присоединиться только к двум эри-
троцитам, ибо несравнимо большая величина эритроцитов исключает
возможность одновременного приближения к одному вириону более двух
эритроцитов. Поэтому, подсчитав число димеров-эритроцитов, можно
определить количество содержащихся в суспензии вирионов.
Другой областью практического применения реакции гемагглютина-
ции является ее использование для определения противовирусных анти-
тел, обладающих способностью блокировать реакцию гемагглютинации.
Основанная на этом явлении реакция торможения гемагглютинации яв-
ляется простым, быстрым и надежным способом выявления противови-
русных антител. Благодаря этому эпидемиология заболеваний, вызывае-
мых гемагглютинирующими вирусами, изучена намного лучше, чем эпи-
демиология других вирусных заболеваний.
Вторым фундаментальным открытием, сделанным Херстом в этой
области [350, 351], было обнаружение способности вируса элюировать
с поверхности эритроцита, если суспензию агглютинированных вирусом
эритроцитов в течение весьма непродолжительного периода времени
инкубируют при 37° Существенно, что элюировавший с эритроцитов
вирус сохраняет способность агглютинировать другую порцию эритроци-
тов, тогда как ранее агглютинированные эритроциты после такой инку-
бации теряют способность к повторной агглютинации этим же или близ-
Таблица. 2&
Гемагглютинация, вызываемая вирусами животных
Вирус Видовая принадлежность эритроцитов, усло- вия проведения реакции гемагглютинации и некоторые дополнительные сведения Гемадсорбция
Миксовирусы Агглютинируют эритроциты кур, морских сви- нок, человека и других видов; для осущест- вления реакции необходимо наличие в реак- ционной среде одновалентных ионов; реак- ция идет при 4°, спонтанная элюция — при 37° в широком диапазоне pH среды Положительная
Вирусы группы оспы Агглютинируют эритроциты различных видов животных, однако экспериментаторы пред- почтительно используют эритроциты кур. Оптимальная температура для осуществле- ния реакции 37°; элюции не происходит; свободный гемагглютинин можно отделить от инфекционных вирусных частиц; такой гемагглютинин образуется не всеми штамма- ми вирусов Положительная
Вирус кори Для реакции гемагглютинации предпочтитель- но использовать эритроциты обезьян; опти- мальная температура для осуществления этой реакции 375; вирус не элюирует с эрит- роцитов; часть гемагглютининов отделяется от вирусных частиц Положительная
Арбовирусы Для реакции гемагглютинации предпочитают использовать эритроциты цыплят или гусей; реакция очень чувствительна к изменению pH среды (оптимальная величина pH 6—7); липиды, содержащиеся в обычных сыворот- ках крови, ингибируют реакцию
Вирус полиомы Наиболее часто используют эритроциты морс- ких свинок
Энтеровирусы Агглютинируют эритроциты человека группы 0; вирион обладает гемагглютинирующей ак- тивностью. Не все энтеровирусы могут аг- глютинировать эритроциты; реакция идет на холоду; спонтанная диссоциация происходит при 37°, не вызывая какого-либо изменения эритроцитов Отрицательная
Аденовирусы Агглютинируют эритроциты различных видов животных; реакция идет в диапазоне тем- ператур от 4 до 37° Отрицательная
Реовирусы Эритроциты человека агглютинируются реови- русами всех трех типов. Напротив, эритро- циты быка агглютинирует только реовирус, тип 3. Рецепторы эритроцитов быка разру- шаются RDE, но не вирусом Отрицательная
Вирусы животных
25S
кородственным вирусом. Измерения показали, что у таких эритроцитов
изменяется также электрофоретическая подвижность. Херст пришел к со-
вершенно справедливому выводу, что наблюдавшееся им явление было
вызвано наличием в составе вирусной частицы компонента, обладающего
ферментативной активностью.
Исследования ферментативных реакций этого типа очень стимули-
ровало открытие, сделанное Бернетом и Стоуном [117]. Эти авторы обна-
ружили, что в фильтратах культур Vibrio cholerae содержится фермент,
действие которого на эритроциты лишает последние способности агглю-
тинироваться вирусом гриппа. Этот фермент, названный рецепторразру-
шающим ферментом (RDE)1, представляет собой сиалидазу или нейра-
минидазу. Он катализирует гидролитический разрыв гликозидной связи,
в образовании которой участвует гидроксильная группа галактозы и ке-
тогруппа нейраминовой кислоты. В результате разрыва этой связи отщеп-
ляется молекула N-ацетилнейраминовой кислоты [287].
Воздействуя RDE на соответствующие клетки, можно предотвратить
возможность присоединения вируса гриппа не только к эритроцитам —
клеткам, в которых вирус гриппа не размножается, но и к выращенным
в культуре клеткам, полученным из легкого мыши, предотвратив в по-
следнем случае также и размножение вируса в этих клетках. Утверж-
дают также, что введение мыши RDE путем ингаляции защищает ее от
заболевания гриппозной пневмонией. Предварительное воздействие RDE
позволяет также предотвратить развитие и других миксовирусных инфек-
ций. Например, вирус ньюкаслской болезни не размножается в клетках
HeLa, предварительно подвергшихся воздействию RDE. Однако через
несколько часов после отмыва RDE от клеток на поверхности последних
снова появляются соответствующие рецепторы, вследствие чего вновь
становится возможным специфическое присоединение к клеткам соот-
ветствующего вируса и последующее развитие инфекции [565, 821]. Хотя
эти опыты убедительно продемонстрировали, что для присоединения ви-
руса к клетке на ее поверхности должны иметься соответствующие ре-
цепторы, они не доказали, что за проникновение вируса в клетку ответ-
ственна только вирусная нейраминидаза. Ниже, обсудив некоторые со-
временные данные, касающиеся взаимодействия между клеточными
мембранами и миксовирусами, мы вновь вернемся к рассмотрению роли,
которую, возможно, играет вирусная нейраминидаза в процессе проник-
новения вируса в клетку.
Взаимоотношения между вирусом гриппа и поверхностью клетки
Химические анализы липидов и углеводов, содержащихся в препа-
ратах очищенного вируса гриппа, неизменно говорят о существовании
взаимосвязи между липидами, входящими в состав вируса гриппа, и ли-
пидами клетки-хозяина. Наиболее убедительные данные были получены
в исследовании, целью которого был сравнительный анализ липидов, со-
державшихся в клетках культур почек теленка, куриного эмбриона и в
очищенных препаратах вируса гриппа, выращенного на каждой из этих
культур соответственно [439]. В обоих случаях было обнаружено очень
близкое соответствие между липидным составом вируса и клеток, на ко-
торых данный вариант вируса был выращен. Эти данные, полученные
при помощи химических методов, подтвердили высказанное Хойлом [377]
предположение, что внешняя оболочка вирусной частицы образуется из
клеточной мембраны. Проведенные недавно электронно-микроскопиче-
1 От англ, receptor destroying enzyme — «рецепторразрушающий фермент». —
Прим, перев.
-256
Глава XIII
ские исследования показали, что процесс образования внешней оболочки
вируса действительно идет медленно у поверхности, зараженной клетки
[599]. Необходимо, однако, подчеркнуть, что анализ наиболее тщательно
очищенных препаратов вируса гриппа не обнаружил какого-либо анти-
генного сходства между белками вируса и белками клетки-хозяина; это
говорит в пользу того, что белковая часть вируса, вероятно, синтезирует-
ся de novo, а не заимствуется у клетки. Более подробно, однако, эта про-
блема будет рассматриваться в гл. XVIII.
Исходя из того, что частица вируса гриппа по существу представляет
собой как бы вирус, обернутый в кусочек плазматической мембраны за-
раженной клетки, Хойл [378] высказал предположение, что процесс про-
никновения вируса гриппа в клетку, быть может, является процессом,
обратным процессу выхода вируса из клетки. В пользу справедливости
этой точки зрения говорят данные, полученные при электронно-микро-
скопических исследованиях взаимодействия вирусных частиц с кусоч-
ками цитоплазмы, заключенными в плазматическую мембрану, которые
систематически отрывались от поверхности клетки. На фото 50 видны
различные этапы процесса распада внешней оболочки вируса, инициируе-
мого при ее контактировании с мембраной клетки. Можно видеть, что
при этом в какой-то степени подвергается дезинтеграции также и струк-
тура клеточной мембраны. Во время этой реакции изменяется также
состояние входящих в состав вируса липидов, благодаря чему увеличи-
вается доля вирусных липидов, экстрагируемых эфиром. Поэтому этот
тип взаимодействия, быть может, олицетворяет первую стадию процесса
проникновения миксовирусов в их клетки-хозяева.
Об очень тесной связи, возникающей между вирусной и клеточными
мембранами вскоре после адсорбции вируса, свидетельствуют также
данные, полученные другими исследователями, изучавшими с помощью
электронного микроскопа проникновение вируса гриппа и вируса нью-
каслской болезни в интактные чувствительные клетки [160, 771]. Было
обнаружено, что вирусные частицы, контактирующие с клеточными мем-
бранами, теряют характерную для вируса структуру и внутри клетки
отсутствуют свободные вирусные частицы с интактными, неповрежден-
ными оболочками. Наблюдалось полное поглощение вирусной частицы
плотно облегавшей ее клеточной мембраной и образование в результате
этого внутри клетки вакуоли (фото 51). Дальнейшие исследования при-
вели к мысли, что образование подобной вакуоли, в которой каждая из
точек всей поверхности вируса контактирует с клеточной мембраной,
является обязательным предварительным условием разрушения вириона.
Вирус ньюкаслской болезни может присоединиться к поверхности
клетки при 0°. Однако поглощения вируса клеткой при этой температуре
не наблюдается. Если затем комплекс вирус — клетка сначала подверг-
нуть действию противовирусных антител, а потом инкубировать при 37°,
то поглощение вируса клетками удается в значительной степени предот-
вратить. В результате почти все вирусные частицы элюируют с поверх-
ности клетки в культуральную среду. Отсюда можно сделать вывод, что
антитела, по-видимому, препятствуют возникновению контактов между
мембранами вируса и клетки, благодаря чему вирусная сиалидаза полу-
чает возможность разрушить клеточный рецептор, что приводит к отде-
лению вириона от поверхности клетки. Вполне возможно, что в обычных
условиях вирусной инфекции после поглощения вируса клеткой такое
растворение или слияние вируса с клеточной мембраной осуществляется
посредством ферментативной атаки, инициируемой вирусным ферментом.
После распада внутрицитоплазматической вакуоли происходит, по-
видимому, освобождение РНК-содержащего спирального капсида мик-
•совируса, который оказывается в цитоплазме клетки. Однако о том, в ка-
Вирусы животных
257
ком состоянии находятся компоненты вируса по окончании этой стадии,
мы, по сути дела, ничего не знаем. Можно полагать, что если размноже-
ние вируса гриппа, по крайней мере частично, происходит в ядре клетки
(см. гл. XIV), то либо весь капсид, либо по меньшей мере вирусная
нуклеиновая кислота должны со временем достичь ядра. Однако о том,
как этот процесс осуществляется, пока ничего не известно.
ВИРУС ПОЛИОМИЕЛИТА. НАЧАЛЬНЫЕ СТАДИИ
ВЗАИМОДЕЙСТВИЯ С КУЛЬТИВИРУЕМЫМИ КЛЕТКАМИ
Как уже отмечалось в гл. IV, многие вирусы животных, а быть мо-
жет и большинство, не имеют внешних оболочек, вследствие чего можно
полагать, что процесс их присоединения и проникновения в клетку
сильно отличается от соответствующего процесса, наблюдаемого при
заражении клеток миксовирусами. Основные вопросы, возникающие при
изучении этого процесса, касаются химической основы начальных стадий
взаимодействия вируса с клеткой и распада капсида, т. е. процессов, не-
обходимых для освобождения содержащейся в вирионе нуклеиновой кис-
лоты. Информацию о механизмах адсорбции и проникновения вируса
полиомиелита в клетку можно получить, наблюдая за судьбой адсорби-
ровавшегося инфекционного начала и изучая состояние, в котором нахо-
дится вирусная РНК в различные периоды времени после начала
инфекции.
Первичное присоединение вируса к клетке
Условия, необходимые для оптимального присоединения вируса по-
лиомиелита к клеткам культуры ткани, известны достаточно хорошо.
В случае присоединения к клеткам HeLa и к клеткам почек обезьян вели-
чины констант, соответствующих наибольшей скорости присоединения,
равны примерно 4 10-9—5 10-9 и 2 10~8—3 • 10-8 см/мин на клетку соот-
ветственно [37, 167]. Скорость первичного присоединения относительно
мало зависит от изменения температуры. Для того чтобы вирус полио-
миелита присоединился к клетке, необходимо, чтобы в культуральной
среде содержались катионы. Двухвалентные катионы несколько лучше
способствуют присоединению вируса к клетке, чем одновалентные. Пер-
вичное присоединение вируса к клетке, за которое, вероятно, ответствен-
но действие электростатических сил, тем не менее, как это было пока-
зано, является специфическим, ибо имеет место только при взаимодей-
ствии вируса полиомиелита с клетками, полученными из тканей прима-
тов [358]. Некоторые клетки приматов in vivo не имеют рецепторов, необ-
ходимых для адсорбции вируса полиомиелита, однако культивирование
этих клеток in vitro приводит к появлению у них способности адсорби-
ровать вирус полиомиелита и подвергаться инфекции. Последнее спра-
ведливо по крайней мере в отношении клеток почек обезьян и свежевы-
деленных клеток амниона человека [357].
Проникновение вируса в клетку и разрушение капсида
Для того чтобы проследить за тем, как разрушается вирусная ча-
стица, образовавшая комплекс с чувствительной клеткой, исследователи
предпринимали ряд попыток. Они пытались выделить из клетки инфек-
ционный вирус, изучить процесс перехода меченой РНК в форму, чувст-
вительную к действию РНК-азы, а также выделить клеточные рецеп-
торы, к которым присоединяется вирус.
17 Заказ № 1214
258
Глава XIII
Было обнаружено, что если адсорбировать вирус на чувствительных,
клетках при 0°, а затем на комплекс вирус — клетка воздействовать про-
тивовирусной антисывороткой, то инфекционные свойства вируса еще
можно нейтрализовать. Однако по мере нагревания комплекса вирус —
клетка чувствительность инфекционных свойств вируса к действию анти-
тел неуклонно уменьшается. При 37° период полузавершения этой реак-
ции составляет менее 5 мин, а при 22° — примерно 30 мин [560]. Отсюда
можно сделать вывод, что при взаимодействии вируса с клеткой идет
процесс, чувствительный к изменению температуры, под влиянием кото-
рого вирус движется от поверхности клетки к области, куда антисыво-
ротка уже проникнуть не в состоянии. Однако на этой стадии процесса
из клетки все еще можно выделить инфекционные вирионы, скажем, раз-
рушив клетку воздействием растворов додецилсульфата натрия или со-
лей большой концентрации [561].
Факт потери вирусом полиомиелита чувствительности к действию
антител по мере разрушения вирусной частицы и освобождения из ви-
русной частицы РНК был подтвержден и иным способом. Было пока-
зано, что вирус полиомиелита, выращенный в присутствии акридинового
оранжевого или нейтрального красного, сенсибилизирован к действию
видимого света даже после того, как он адсорбируется на клетках
при 0°, тогда как его инфекционная нуклеиновая кислота не сенсибилизи-
руется к такому воздействию. Эти данные наводят на мысль, что в сво-
бодном состоянии вирусная РНК не связывает красители [734, 919]. Опи-
раясь на эти данные, можно попытаться определить время освобождения
вирусной нуклеиновой кислоты из вириона после его присоединения
к клетке. Оказалось, что вирусные частицы, сенсибилизированные к дей-
ствию света, после присоединения к клетке теряют чувствительность
к действию антител раньше, чем к инактивирующему действию света.
Это указывает на то, что разрушение капсида вируса происходит уже
после того, как интактная вирусная частица прошла сквозь поверхность
клетки. Превращение адсорбированного вируса из чувствительного к дей-
ствию света в нечувствительный к этому воздействию идет нормально
при полном отсутствии синтеза белка в клетке. Это обстоятельство дока-
зывает, что за способность освобождать вирусную нуклеиновую кислоту
из капсида вириона ответствен компонент, обычно присутствующий в чув-
ствительной клетке, а не индуцируемый после инфекции.
Что же касается топографической локализации места разрушения
капсида, то ни один из описанных выше экспериментов не исключает
возможности, что, подобно тому как это имеет место при проникновении
в клетку вируса ньюкаслской болезни, вирус полиомиелита присоеди-
няется к рецептору, находящемуся на поверхности клетки, а нечувстви-
тельным к действию антител становится просто благодаря тому, что
сразу же после присоединения к клетке он обволакивается плазматиче-
ской мембраной. Иными словами, для того чтобы вирус потерял чувстви-
тельность к действию антител, вовсе не требуется, чтобы он покинул
место первичного присоединения к поверхности клетки.
Наиболее прямым методом наблюдения за процессом разрушения
капсида вируса является изучение зависимости изменения физико-хими-
ческих свойств вирусной РНК от времени, прошедшего после адсорбции
вирусных частиц на клетках. (В таких опытах используют вирус, РНК
которого мечена радиоактивным изотопом.) Полученные в этих исследо-
ваниях данные показали, что примерно половина вирусных частиц, при-
соединившихся к клеткам при 0°, при последующем инкубировании си-
стемы при 37° элюируется или отрывается от клетки. Существенно, что
прочность структуры вирусных частиц, оторвавшихся от клетки, меньше,
чем исходных. Об этом свидетельствует тот факт, что такие вирусные-
Вирусы животных
259
частицы разрушаются в растворах CsCl высоких концентраций, тогда
как нативные вирусные частицы устойчивы к такому воздействию, бла-
годаря чему их можно подвергнуть очистке при помощи центрифугиро-
вания в градиенте плотности [418]. Элюировавшие частицы содержат
полностью инфекционную РНК. Такие вирусные частицы повторно при-
соединиться к клетке не в состоянии. По-видимому, они обладают и
меньшей плотностью, чем нативные вирусные частицы, возможно, вслед-
ствие того, что соединены с фрагментами клеточного вещества типа ли-
попротеида [225].
Судьбу вирусных частиц, остающихся прочно связанными с клет-
ками, можно изучить, разрушая клетки и определяя, остается ли вирус-
ная РНК интактной или приобретает чувствительность к действию рибо-
нуклеазы. Изучение динамики разрушения вирусного капсида, проведен-
ное при помощи этого метода, показало, что распад капсида начинается
уже через несколько минут после адсорбции вируса. Через 20 мин после
заражения примерно 50% общего количества прочно адсорбировавше-
гося вируса уже находится в распавшемся состоянии. В то же время
около 20% прочно адсорбировавшегося вируса не распадается вовсе.
РНК, содержащаяся во многих из распавшихся вирусных частиц, разру-
шается до кислоторастворимых веществ. Поскольку лишь очень неболь-
шая часть вирусных частиц является инфекционной (примерно 1 частица
из 200), невозможно определить, РНК каких вирионов в действительно-
сти обладает функциональной активностью. Известно, однако, что при-
мерно 10% из числа вирусных частиц, прочно прикрепляющихся к клет-
ке, переходят в такое состояние, при котором их РНК, оставаясь высоко-
молекулярной, в то же время является доступной действию РНК-азы.
Изучение бесклеточных экстрактов чувствительных клеток позво-
лило получить следующую информацию о процессах, происходящих при
присоединении вируса полиомиелита к клетке и освобождении его
нуклеиновой кислоты. Оказалось, что содержащая мембраны фракция,
полученная из «микросомного осадка» разрушенных клеток, обладает
способностью связывать и инактивировать вирус полиомиелита. Актив-
ность таких препаратов чувствительна к действию протеолитических
ферментов и растворителей липидов [357]. Было показано, что экстракты,
полученные аналогичным методом из клеток, нечувствительных к вирусу
полиомиелита и неспособных его адсорбировать, не обладают способ-
ностью связывать и инактивировать этот вирус. Поэтому было высказано
предположение, что в активных фракциях содержатся рецепторы, с ко-
торыми специфически связывается вирус полиомиелита. Остается, од-
нако, неизвестным, чем определяется специфичность рецептора, т. е. от-
ветственны ли за эту специфичность какие-то липиды, углеводы или
белки, или в ее основе лежит наличие у рецептора специфической про-
странственной конфигурации, образуемой какими-либо из этих компо-
нентов, а быть может, и всеми вместе. Важным обстоятельством, имею-
щим, очевидно, непосредственное отношение к факторам, определяющим
патогенность вируса полиомиелита, является тот факт, что бесклеточную
фракцию, обладающую рецепторной активностью, удается экстрагиро-
вать лишь из тех тканей (в том числе и центральной нервной системы),
чувствительных к этому вирусу животных, в которых вирус полиомие-
лита в состоянии размножаться [355].
Хотя указанные выше бесклеточные препараты рецепторов способны
связывать вирус полиомиелита, они не способны изменить структуру его
капсида. Воздействуя на комплекс вирус — рецептор концентрирован-
ными растворами солей, можно полностью выделить из комплекса со-
держащийся в нем вирус, причем этот выделенный вирус не отличается
от исходного. Однако из зараженных клеток можно получить фракцию,
17*
260
Глава XIII
содержащую ранее адсорбированные вирусные частицы, капсид которых,
как показали наблюдения in vitro, подвергается резко выраженным
изменениям. При разрушении зараженных клеток в гипотонической среде
такие вирусные частицы обнаруживаются в так называемой «ядерной
фракции», в состав которой, по-видимому, входит также и плазматиче-
ская мембрана. Пока такие экстракты содержатся при 0°, из них также
можно выделить и инфекционные вирусные частицы.
Содержащаяся в таких частицах РНК все еще остается нечувстви-
тельной к действию РНК-азы и при помощи экстракции фенолом может
быть выделена в виде инфекционной РНК. Однако, если температуру,
при которой инкубируется препарат, увеличить до 37°, происходит необ-
ратимый эклипс. Белок капсида изменяется, в результате чего вирусная
частица становится чувствительной к разрушающему действию протео-
литических ферментов и пропускает РНК-азу. Следовательно, хотя ви-
русная частица, вероятно, и остается присоединенной к плазматической
мембране, структура ее тем не менее изменяется. Интересно, что добав-
ление к препарату антител предотвращает упомянутое изменение струк-
туры капсида, тогда как воздействие на клетки или соответствующие
экстракты некоторых ингибиторов обмена веществ, например NaF или
пуромицина, не оказывает защитного действия. Эти результаты вновь
свидетельствуют о том, что необратимый эклипс может иметь место при
остановке таких видов обмена веществ, как генерирование энергии или
биосинтез белка.
Таким образом, можно полагать, что способность клеток индуциро-
вать перегруппировку белков капсида и освобождение из вириона содер-
жащейся в нем РНК, зависит от того, имеются ли у клеток в момент
заражения их вирусом рецепторные структуры необходимого типа. До-
полнительные данные в пользу справедливости этой идеи были получены
при изучении линий клеток, относительно устойчивых к заражению
цельным вирусом полиомиелита. Две группы фактов, полученных при
этих исследованиях, указывают на то, что изменения каких-то свойств,
присущих устойчивым линиям клеток, могут влиять на эффективность,
с которой они воздействуют на капсид вируса. Так, экстракты плазмати-
ческих мембран этих клеток оказались довольно неэффективными в от-
ношении способности вызывать необратимый эклипс вирусных частиц
in vitro [357]. Напротив, инфекционная нуклеиновая кислота одинаково
эффективно заражала как относительно устойчивые, так и чувствитель-
ные клетки [167].
Изложенные выше данные позволяют нарисовать следующую кар-
тину первичных этапов инфекции, вызываемой вирусом полиомиелита.
Сначала вирус при помощи специфических связей электростатической
природы присоединяется к специфическому компоненту клеточной мем-
браны. Затем он занимает такое положение в клетке, при котором ста-
новится недоступным для антител. Вслед за этим, хотя вирусная частица,
по-видимому, остается фиксированной в месте первичного присоедине-
ния к мембране клетки, белок капсида вируса подвергается перегруп-
пировке, ведущей к освобождению РНК из вириона.
НАЧАЛЬНЫЕ СТАДИИ ИНФЕКЦИИ, ВЫЗЫВАЕМОЙ ВИРУСОМ
ОСПОВАКЦИНЫ
Детали механизма, ответственного за проникновение вируса оспо-
вакцины в клетку-хозяина, изучены довольно хорошо. Этот вирус яв-
ляется одним из представителей вирусов группы оспы. Вирионы вирусов
группы оспы представляют собой очень большие частицы (2400X200 А),
в состав которых входит много различных белков, в том числе липо-
Вирусы живс-тных
261
протеидный компонент, расположенный, вероятно, на поверхйости ви-
риона, и нуклеопротеидный комплекс, находящийся внутри вириона. Пер-
вичная стадия присоединения вируса осповакцины к клетке-хозяину на*
поминает процесс взаимодействия, обусловленный электростатическими
силами, который, как уже упоминалось выше, лежит также в основе
присоединения к клеткам вирусов гриппа и полиомиелита. Два направ-
ления исследований, в основе которых лежит использование меченых
вирусов и результатов, полученных с помощью электронного микроскопа,
позволили получить данные, пролившие свет на процесс проникновения
вируса осповакцины в клетку-хозяина и последующее разрушение его
капсида. Оказалось, что это весьма сложный процесс, в основе которого
лежит многостадийное взаимодействие между компонентами клетки и
вируса.
Поскольку в состав вируса осповакцины входит как ДНК, так и
фосфолипид, Р32-ортофосфат может включаться в оба упомянутых ком-
понента вириона. С другой стороны, используя меченый тимидин или
меченые аминокислоты, можно специфически пометить как ДНК, так и
белок вириона соответственно. Используя такие меченые вирионы и изу-
чая их судьбу в зараженной клетке, удалось выявить весьма важные
детали процесса распада вируса осповакцины, происходящего после кон-
такта вируса с клеткой’хозяином.
Первой стадией «раздевания» (этим термином Йоклик [412] назвал
суммарный процесс освобождения из вириона его ДНК) является отде-
ление от вириона фосфолипида. Пока не удалось подыскать вещества,
ингибирующие эту стадию процесса, и она протекала независимо от са-
мых различных видов воздействий, которым подвергали как клетки, так
и вирус. Напротив, судя по данным, полученным путем разрушения ком-
плекса вирус —клетка и обработки клеточных экстрактов ДНК-азой
с последующим определением количества вирусной ДНК, переходившей
в кислоторастворимую фракцию, процесс освобождения из вириона его
ДНК можно блокировать самыми различными способами. Анализ явле-
ний, наблюдавшихся при ингибировании процесса освобождения из ви-
риона его ДНК, позволил построить схему, демонстрирующую, каким
именно образом происходит «раздевание» вируса осповакцины.
Сначала было обнаружено, что ингибиторы биосинтеза белка прак-
тически полностью подавляют «раздевание» вируса осповакцины. Акти-
номицин D также полностью блокировал «раздевание» этого вируса. Эти
результаты показали, что за процесс освобождения всей ДНК вируса
осповакцины ответствен какой-то белок, образование которого, по-види-
мому, зависит от синтеза нового типа m-РНК, индуцируемого после на-
чала инфекции. В связи с этим возник вопрос: чей геном — вируса или.
клетки — является источником информации для биосинтеза этого белка?
Йоклик [415] пришел к выводу, что процесс «раздевания» вируса оспо-
вакцины возможен лишь при активации каких-то генов клетки-хозяина.
Этот вывод он аргументировал следующими фактами. Во-первых, было
показано, что прекращение биосинтеза РНК путем облучения клеток-
хозяев ультрафиолетом до их заражения вирусом в большей степени
подавляет процесс «раздевания» вируса, чем суммарный биосинтез бел-
ка. Во-вторых, вирус осповакцины, инактивированный путем обработки
азотным аналогом иприта, который действует, по-видимому, главным
образом на вирусную ДНК, «раздевается» нормально, тогда как вирус,
инактивированный путем обработки мочевиной или при помощи нагре-
вания, что сказывается только на вирусных белках, йе в состоянии ини-
циировать процесса «раздевания».
На фиг. 61 представлена схематическая модель этого процесса, пред-
ложённая Йокликом для объяснения вышеизложенных данных. Некая*
262
Глава XIII
часть внешней оболочки вируса, отделяющаяся от вируса вследствие его
взаимодействия с клеткой, выполняет функцию индуктора, вызывающего
реакцию со стороны клетки. В результате образуется новая клеточная
m-PHK, ранее отсутствовавшая в клетке, которая и кодирует образова-
ние нового белка, ответственного за освобождение вирусной ДНК из
вириона.
Одно наблюдение наводит на мысль, что, кроме событий, отражен-
ных в этой схематической модели, в процессе «раздевания» вируса
имеется и еще ряд других стадий. Мы имеем в виду тот факт, что вирус
Фиг. 61. Схема, демонстрирующая освобождение из вируса осповакцины I его ДНК>
происходящее внутри клетки-хозяина 2.
Отщепляющийся от вириона белок-индуктор 3 мигрирует в ядро 4, где он индуцирует образование
новой /п-РНК 5. Затем образуется сраздевающий» белок 6, воздействие которого приводит к осво-
бождению ДНК вируса осповакцины 7.
осповакцины, облученный ультрафиолетом, практически не «раздевает-
ся». Хотя это облучение, возможно, и может вызвать повреждение белка,
тем не менее известно, что из числа молекул, входящих в состав вириона,
наиболее чувствительной к ультрафиолету является его нуклеиновая кис-
лота. В связи с этим возникает вопрос, не играет ли определенную роль
в процессе «раздевания» вируса осповакцины также и его собственная
ДНК? Измерения, проведенные Иокликом, показывают- что у вируса,
облученного ультрафиолетом, в «раздетом» состоянии находится менее
2% его ДНК. Следовательно, если вирусная ДНК и принимает участие
в процессе «раздевания» вириона, то фактически в нем участвует лишь
малая часть вирусного генома L
Электронно-микроскопические исследования процесса проникнове-
ния вируса осповакцины в клетку прекрасно дополняют данные, получен-
ные при помощи биохимических методов. Благодаря тому что вирус оспо-
вакцины характеризуется большими размерами и обладает очень четким
морфологическим строением, на электронных микрофотографиях удается
1 Полученные в последнее время данные свидетельствуют о том, что «раздеваю-
щий» вирус осповакцины фермент, по-видимому, закодирован в геноме вируса, а не
клетки. Этот фермент, вероятно, может транслироваться с тех вирусных m-PHK, кото-
рые транскрибируются с «нераздетого» нуклеоида вируса, причем эта транскрипция осу-
ществляется вирусной ДНК-зависимой РНК-полимеразой, входящей в сосгав белков
вирусного нуклеоида (Kates J., McAuslanB., Proc. Nat. Ac. Sci. USA, 1967, 57,
314; 58, 134). — Прим. ped.
Вирусы животных
263
.идентифицировать адсорбировавшиеся на клетке вирусные частицы, соот-
ветствующие первичной стадии адсорбции вируса, и изучить влияние,
оказываемое процессом проникновения вируса в клетку, на морфологию
самой клетки. Так, удалось увидеть, что уже через несколько минут
после смешивания вируса с клеткой, когда одни вирионы еще остаются
фиксированными на внешней поверхности клеточной мембраны, другие
уже находятся внутри цитоплазматических пузырьков, окруженные кле-
точной мембраной (фото 52). Эти пузырьки, по-видимому, представляют
собой впячивания наружной клеточной мембраны, поскольку находящие-
ся внутри таких пузырьков частицы в этот момент не достигают цито-
плазматического матрикса.
Быть может, существенное значение имеет то обстоятельство, что
находящиеся во внутриклеточных вакуолях частицы вируса осповакцины
по-иному взаимодействуют с клеточной мембраной, чем миксовирусы.
Так, например, миксовирусы образуют в клетке маленькие пузырьки,
и контакт между миксовирусом и мембраной пузырька является, по-ви-
димому, непрерывным, тогда как в пузырьке, образуемом вирусом оспо-
вакцины, может находиться несколько вирионов, поверхность которых
соприкасается с мембраной пузырька лишь в ограниченном числе точек.
В дальнейшем можно наблюдать, что попавшие внутрь пузырька вирус-
ные частицы через некоторое время начинают распадаться, и в то же
самое время, по-видимому, разрушаются и пузырьки. Независимо от
того, в каком из участков цитоплазматического матрикса обнаруживают-
ся эти вирусные частицы, вирион вируса осповакцины имеет уже изме-
ненную морфологию [162]. Изменяется характерная форма нуклеоида
вириона (см. фото 52, Б) и исчезает ограничивающая его мембрана, ко-
торая отчетливо видна на электронных микрофотографиях очищенных
вирусных частиц. Остается, однако, выяснить, являются ли наблюдаемые
изменения структуры вириона результатом воздействия на вирус каких-
то активных компонентов клетки, или внешняя часть вириона сама ак-
тивно участвует в процессе проникновения вируса в клетку и теряется
лишь по мере осуществления этого процесса.
ОБЩИЕ ВЫВОДЫ
Вполне вероятно, что в основе присоединения к клеткам тех типов
вирусов, механизм первичного взаимодействия которых с клетками-хо-
зяевами был детально обсужден выше, как и в основе присоединения
к клеткам других вирусов животных, лежит электростатическое притяже-
ние между заряженными группами, расположенными в виде своеобраз-
ной мозаики на поверхности вирусной частицы и комплементарными им
группами, образующими также мозаику на поверхности клетки. В пользу
этой точки зрения, существенно аргументированной данными, получен-
ными при изучении начальной стадии присоединения к клеткам-хозяевам
вирусов гриппа, полиомиелита и осповакцины и детально изложенными
выше, говорит также способность вирусов присоединяться к заряженным
поверхностям, что можно продемонстрировать с помощью методов хро-
матографии [661, 935], и то обстоятельство, что присоединение бактерио-
фага к бактерии осуществляется благодаря электростатическому притя-
жению между белками вириона и компонентами поверхности бактерии
(гл. IX).
Компоненты, определяющие специфичность, необходимую для при-
соединения вируса к клетке, содержатся как в вирусе, так и в клетке-
хозяине. Например, многие вирусы могут заражать только клетки, полу-
ченные из тканей приматов, поскольку они не в состоянии присоеди-
ниться к клеткам, полученным из тканей других животных, тогда как
Глава XIII
другие вирусы обладают более широкой специфичностью, т. е. в состоя-
нии заразить клетки не только тех видов животных, из которых они
были впервые выделены. Так, аденовирус, выделенный из организма
человека, может заразить морских свинок, крыс и хомяков. Подобным
же образом клетки одного типа, например клетки HeLa, могут адсорби-
ровать два вируса — вирус полиомиелита и вирус осповакцины, которые
отличаются друг от друга по способности присоединяться к другим ви-
дам клеток. Например, клетки куриного эмбриона адсорбируют вирус
осповакцины, но не адсорбируют вирус полиомиелита. Очевидно, что
для реакций присоединения характерна двойная специфичность. Однако
химическая природа этих реакций остается неясной, ибо вещества, обра-
зующие поверхность одних вирусов,— это липопротеиды, которые отсут-
ствуют у других, а специфичность поверхности клетки может опреде-
ляться по крайней мере тремя компонентами клеточной мембраны —
белками, липидами или углеводами.
Первичная стадия вирусной инфекции — адсорбция вируса на клет-
ке, как и последующее событие — освобождение из вириона его нуклеи-
новой кислоты, представляют собой явления, наблюдаемые при любой
вирусной инфекции. И все же при инфекциях, вызываемых различными
вирусами, химическая природа событий, происходящих в промежутке
между электростатическим взаимодействием, наблюдаемым между ви-
рионами и мембранами клеток, и освобождением вирусной нуклеиновой
кислоты, должна быть различной.
Следует рассмотреть два главных механизма освобождения вирус-
ной нуклеиновой кислоты внутри клетки: 1) механизм, обусловленный
тем, что вирусную частицу атакуют клеточные ферменты, которые либо
предсуществуют в клетке, либо индуцируются после контакта клетки
с вирусом, и 2) освобождение вирусной нуклеиновой кислоты вследствие
физического разрыва вирусного капсида, что наблюдается при его свя-
зывании со специфическими рецепторами клетки. При инфекциях, вызы-
ваемых вирусом осповакцины или миксовирусами, вне зависимости от
того, какой из этих механизмов лежит в действительности в основе осво-
бождения вирусной нуклеиновой кислоты, этот процесс, вероятно, проис-
ходит внутри пузырьков, представляющих собой впячивания клеточной
мембраны. Не ясно, однако, атакуют ли вирион в этих вакуолях фер-
менты, или эта стадия проникновения вируса в клетку просто создает
условия, необходимые для физического освобождения из вириона его
нуклеиновой кислоты. В случае вируса полиомиелита получены убеди-
тельные данные, свидетельствующие в пользу того, что связывание
с клеткой приводит к уменьшению прочности капсида. Следовательно,
представляется вполне вероятным, что освобождение вирусной нуклеи-
новой кислоты может быть объяснено действием одних лишь физиче-
ских сил.
Хотя многие из деталей процесса проникновения вирусов животных
в их клетки-хозяева предстоит еще выяснить, сейчас уже ясно, что ни у
одного из вирусов животных нет какого-либо сложного аппарата для
введения внутрь клетки своей нуклеиновой кислоты, который можно было
бы сравнить с «микрошприцем»,• имеющимся у некоторых бактериофагов.
Если принять во внимание природу животной клетки, этот факт не по-
кажется неожиданным, ибо барьер, который предстоит преодолеть ви-
русу животного на его пути в клетку, представляет собой мягкую и гиб-
кую мембрану, а не жесткую клеточную стенку.
Освобождение вирусной нуклеиновой кислоты запускает процесс, ле-
жащий в основе явления инфекционной наследственности. Следующая
стадия — это размножение вируса' в клетке, которое мы обсудим
в гл. XIV.
Глава XIV
РАЗМНОЖЕНИЕ ВИРУСОВ ЖИВОТНЫХ
ЦИКЛЫ РАЗМНОЖЕНИЯ
Важнейшим свойством вирусов, позволяющим их обнаружить, яв-
ляется их инфекционность. Поэтому понятно, что первым вопросом, под-
вергшимся исследованию при изучении процесса репликации вирусов жи-
вотных, было определение зависимости между количеством инфекцион-
ного вируса, выделяемого из организма животного, яйца или культуры
клеток, и временем, прошедшим между моментом заражения и взятием
пробы. Результаты, полученные при изучении размножения вирусов в ор-
ганизмах животных — единственном объекте, использовавшемся для
этой цели в ранний период развития вирусологии,— создавали впечат-
ление, что вирусы животных размножаются достаточно медленно, ибо
инфекционные титры достигали максимальной величины только через
несколько дней или недель после заражения. Конечно, результат, полу-
чаемый в подобных опытах, является суммарным выражением результа-
тов многих циклов взаимодействия вирус—клетка, происходящих в ор-
ганизме зараженного животного. Такое положение сохранялось до тех
пор, пока не были поставлены опыты по методу одиночного цикла раз-
множения, благодаря которым были получены точные данные о продол-
жительности циклов развития вирусов.
Как уже указывалось в гл. VIII, цикл размножения вируса можно
разделить на несколько стадий. Через некоторое время после адсорбции
инфицирующий клетку вирус уже не удается выделить из клетки (эк-
липс). Затем следует латентный период, продолжительность которого
является величиной, характерной для каждой системы вирус — клетка,
во время которого не удается выявить образование нового вируса. По
окончании латентного периода наступает стадия, когда происходит бы-
строе увеличение количества вируса. В это же время или вслед за этой
стадией происходит выделение вируса из зараженной клетки. В основе
опыта, исходя из результатов которого можно построить кривую раз-
множения вируса в форме, позволяющей провести осмысленное сравне-
ние различных систем вирус — клетка, лежит адсорбция на клетках до-
статочно большого количества вирусных частиц, благодаря чему дости-
гается быстрое заражение существенной части клеток культуры. Затем
неадсорбировавшуюся часть «посеянного» вируса удаляют и через опре-
деленные промежутки времени берут пробы культуральной жидкости и
зараженных клеток, в которых определяют содержание вируса.
Обычно кривые размножения вирусов животных лучше строить при
высокой множественности заражения, ибо когда множественность зара-
жения равна единице, продолжительность латентного периода в отдель-
ных клетках сильно колеблется [120]. Об этом говорит тот факт, что раз-
мер бляшек, образуемых вирусами животных, всегда широко варьирует,
что обусловлено колебаниями во времени начала первого цикла размно-
жения вируса.
- 265 -
Число бляшкообразующих единиц на 1 клетку
Число бляшкообраздющцх единиц на 1 клепкц
Фиг. 62. Кривые одиночного цикла размножения различных вирусов в культурах клеток.
Все данные получены в опытах, при проведении которых количество добавлявшегося к культуре ви-
руса было достаточным для того, чтобы были заражены все клетки культуры. Белыми кружками
обозначены данные, характеризующие общее содержание вируса в культуре, а черными кружками—
данные, характеризующие количество вируса, спонтанно выделившегося из зараженных клеток (в слу-
чаях Г и Д количество спонтанно выделившегося вируса было заведомо меньше указанных значе-
ний). Определение инфекционного титра во всех случаях проводили путем подсчета числа бляшек, а
результат выражали средним числом бляшкообразующих единиц, приходящимся на одну клетку,
принимая, что все клетки культуры продуцируют вирус. А. Вирус полиомиелита. Б. Вирус ньюкасл-
ской болезни. В. Реовирус. Г. Вирус осповакцины. Д. Аденовирус. Е. Вирус герпеса.
268
Глава XIV
Параметры, характеризующие кривые размножения различных ви-
русов животных, резко отличаются друг от друга. Эти различия в свою-
очередь являются одним из многочисленных проявлений глубоких раз-
личий, существующих между разными вирусами животных. В табл. 27
и на фиг. 62 представлены некоторые из основных параметров, характе-
ризующих циклы размножения вирусов, относящихся к различным так-
сономическим группам. Все приведенные в таблице и на графиках дан-
ные получены в результате экспериментов, при которых клетки-хозяева
заражали вирусом одновременно в условиях, обеспечивавших высокую
множественность заражения. Мелкие вирусы, не имеющие внешней обо-
лочки и содержащие одноцепочечную РНК, имеют латентный период,
продолжительность которого составляет примерно 2 час, что является
наименьшей величиной, наблюдавшейся у вирусов животных. Несмотря
на то что миксовирусы имеют липопротеидную оболочку и вообще обла-
дают значительно более сложной структурой, чем квазисферические
РНК-содержащие вирусы, их латентный период составляет примерно
только 3 час.
Латентный период развития всех до сих пор изученных ДНК-содер-
жащих вирусов, включая как те из них, которые частично образуются
в ядре (вирус герпеса и аденовирусы), так и те, которые образуются
в цитоплазме (вирус осповакцины), значительно- продолжительнее.
Большей продолжительностью характеризуется также латентный период
вируса, содержащего двухцепочечную РНК, так называемого реовируса,
который образуется, по-видимому, в цитоплазме. В табл. 27 включены
также данные, характеризующие размножение двух опухолеродных ви-
русов: вируса саркомы Рауса (вирион этого вируса содержит РНК)
и вируса полиомы (вирион этого вируса содержит ДНК). Латентный
период развития вируса саркомы Рауса продолжительнее, чем любого
другого РНК-содержащего вируса, тогда как латентный период вируса
полиомы, геном которого меньше генома любого из всех известных пока
ДНК-содержащих вирусов животных, по крайней мере не больше ла-
тентного периода, характерного для других вирусов, содержащих ДНК-
Интересно, что у простых мелких РНК-содержащих вирусов быст-
рее, чем у более сложных и крупных вирусов, протекает не только стадия
между заражением и началом размножения, но и весь цикл размноже-
ния вируса. Так, например, вирус полиомиелита и вирус ящура размно-
жаются в течение примерно 3 час, а созревание их завершается в пре-
делах между пятым и шестым часом после заражения. В свою очередь
созревание миксовирусов происходит в период между третьим и десятым
часом после заражения. Напротив, крупные вирусы могут продолжать
размножаться даже через 24 час после заражения. Причина, определяю-
щая это различие в характере размножения разных вирусов, неизвестна.
Возможно, что оно связано с более сложной последовательностью собы-
тий, которая в свою очередь зависит от того, что крупные вирусы содер-
жат больше нуклеиновой кислоты. Что касается вирусов полиомиелита
и осповакцины, различие между размерами которых выражено наиболее
резко, то разрыв во времени, необходимом для освобождения нуклеино-
вой кислоты, а следовательно, и в возможности начала ее функциониро-
вания выявляется очень скоро.
Для очень многих вирусов была определена также и скорость обра-
зования вируса. В этом случае часто утверждают, что скорость размно-
жения вируса является «экспоненциальной». Это означает, что вновь
образующееся потомство вируса способно редуплицироваться. Данные,
приводимые в качестве доказательства этого утверждения, не являются
достаточно строгими. В большей части кривых размножения, опублико-
ванных в литературе, имеется слишком мало точек, соответствующих по-
Параметры, характеризующие размножение различных вирусов животных
Таблица 27
Вирус Клетка-хозяин Продолжи- тельность латентного периода, час1) Продолжитель- ность периода увеличения коли- чества синтези- руемого вируса после заражения, час Время, необходи- мое для выделе- ния вируса из клетки2) Относительное ко- личество вируса, выделяющееся из клетки в культу- ральную среду, о/ Число бляш- кообразующих единиц на 1 клетку Число частиц на 1 клетку
Вирус ящура Клетки почки теленка 2 2-4,5 60 мин >75 200 2 • 10^—10*
Вирус полиомиелита, тип 1 HeLa 2,5 2,5-6 5 -10 час >90 500 2 • 10->
Вирус энцефаломиокардита L-клетки 2 2-6 2—3 час >90 10 000 10’
Вирус Менго L-клетки 2 2-6 8—12 час >90 10 000 10>
Вирус ньюкаслской болезни Клетки легкого куриного эм- бриона 3 3-10 30 мин >90 50
Вирус классической чумы птиц Клетки куриного эмбриона 2 2-6 30 мин—2 час >90 30-100 3000-10 000
Вирус везикулярного стомати- Клетки почки обезьяны 2 2-5 30 мин >90 66
та
Вирус Синдбис Фибробласты курицы 4 4-16 30 мин >90 100
Реовирус, тип 3 L-клетки 7 7-15 <30 1000 10 000
Вирус осповакцины, штамм HeLa 10 10-24 <10 100-200 400 — 2000
V-MH
Вирус осповакцины, штамм HeLa 6 6-12 100-200 400 - 2000
WR
Аденовирус кв 14 14-25 <10 10 10
Вирус герпеса Клетки кролика 6 5-15 3 час >50 300 3000
Вирус псевдобешенства Клетки почки кролика 4 4-10 — — 800
Вирус полиомы Клетки эмбриона мыши 12 12-48 — <10 100 10
Вирус саркомы Рауса Фибробласты курицы 12 Непрерывно <30 мин >90 1 (за час) 1000 (за 5 час)
Время, прошедшее до начала заметного увеличения содержания инфекционного вируса.
2) Среднее время пребывания в клетке инфекционного вируса после завершения его образования.
270
Глава XIV
явлению вируса в интервале времени между образованием каждой зара-
женной клеткой по крайней мере одной новой инфекционной частицы и
окончанием цикла размножения. Начинать измерения, цель которых —
установление «экспоненциального» характера размножения вируса, сле-
дует лишь тогда, когда есть уверенность в том, что все содержащиеся
в культуре клетки, способные продуцировать вирус, действительно его*
продуцируют.
Форма кривых размножения, полученных при анализе репродукции
вируса в популяциях клеток, зараженных вирусом при множественности,
равной единице, не может служить достоверным критерием истинного-
характера размножения вируса, ибо, как уже упоминалось выше, при
такой множественности заражения размножение вируса в различных
клетках, как правило, начинается асинхронно [120].
Вопрос о том, может ли геном фага-потомка сам размножаться в той
же клетке (и таким образом влиять на выход фага), был решен, когда
удалось показать, что распределение мутантов в потомстве фага, полу-
ченном из отдельных клеток, носит клональный характер ([533], см. гл. X).
Дульбекко и Фогт [201] представили данные, свидетельствующие о том.,,
что аналогичный вывод, видимо, справедлив в отношении мутантов,
вируса полиомиелита. Сходные результаты были получены и в отношении
вируса энцефаломиокардита мышей [99].
Число инфекционных вирусных частиц, образуемых в одной клетке,
зависит от типа вируса и варьирует очень широко. Однако, поскольку
различные вирусы сильно отличаются друг от друга как по размерам
вирионов, так и по числу частиц, приходящихся на одну бляшкообра-
зующую единицу, количество образуемого в клетке инфекционного ви-
руса не является величиной, позволяющей достоверно измерить количе-
ство вирусоспецифичных веществ, образующихся в клетке. В случае,,
когда учитывалось это обстоятельство, было найдено, что в клетке жи-
вотного, зараженной вирусом, на долю вирусоспецифичных веществ при-
ходится от 0,1 до 5% массы клетки. (При заражении вирусом энцефало-
миокардита— 0,1%, вирусом полиомиелита — 0,3%, вирусом осповакци-
ны— 1%, аденовирусом — 5% [293, 414, 478, 514].) Эти величины очень
сильно отличаются от соответствующих величин, полученных для бакте-
риофагов. Известно, что бактериофаги используют для своего воспроиз-
ведения относительно большую часть массы бактерии. Так, например,
для бактериофага Т4 эта величина составляет 40%. Причина прекраще-
ния размножения вирусов животных неизвестна.
События, имеющие место при выделении из клеток вновь образовав-
шегося вируса, подобно другим особенностям цикла размножения раз-
личных вирусов животных, варьируют очень значительно. Известно, на-
пример, что для вирионов ряда вирусов, относящихся к различным так-
сономическим группам, характерно наличие липопротеидных внешних
оболочек, причем отсутствие этих оболочек лишает вирион инфекцион-
ности. Те миксовирусы и арбовирусы, которые приобретают внешнюю
оболочку во время прохождения через плазматическую мембрану клеток,
т. е. для которых последней стадией созревания является «отщепление»
от клетки, выделяются в культуральную среду сразу же после их обра-
зования. Фактически такие вирусные частицы, становясь уже инфекцион-
ными, почти не находятся в связанном с клеткой состоянии, т. е. этот
промежуток времени весьма невелик [700]. Отдельные клетки, заражен-
ные вирусом такого типа, могут выделять вирус в культуральную среду
в течение многих часов. Вирусы других групп — вирус герпеса и вирус
осповакцины, вирионы которых также содержат липопротеиды, но обра-
зуются внутри клетки, остаются в клетке в течение длительного периода
Размножение вирусов животных
27 F
времени после созревания. Такие вирусы можно полностью удалить из
клетки, только прибегнув к ее искусственному разрушению.
Образуются ли липопротеидные оболочки этих вирусов из клеточных
мембран, подобно тому как образуются эти оболочки у миксовирусов и
арбовирусов, или каким-либо иным путем, остается неясным. Электрон-
ные микрофотографии наводят на мысль, что по крайней мере часть
своей мембраны вирус герпеса получает от ядерной оболочки [600, 913].
Что касается вируса осповакцины, то его геном столь велик (молекуляр-
ный вес ДНК равен 1,6- 108), что может обеспечить образование собст-
венной системы, способной осуществить синтез мембран вириона [413].
В отличие от упомянутых выше вирусов у икосаэдрических вирусов,
не имеющих внешней оболочки, единой сходной картины выделения ви-
рионов из клеток обнаружено не было. Например, вирус полиомиелита
и вирус Менго образуются быстро, но затем остаются в клетке в течение
весьма продолжительного времени — в среднем от 8 до 10 час, после
чего вдруг в виде вспышки выделяются из клетки [375]. Динамика выхода
вируса из клеток является свойством, контролируемым именно вирусом,
ибо как это свойство, так и динамика размножения этих вирусов одина-
ковы вне зависимости от того, в каких клетках-хозяевах они размно-
жаются. Однако вирионы некоторых штаммов вируса энцефаломиокар-
дита, другого мелкого РНК-содержащего икосаэдрического вируса, по
своим физическим свойствам идентичного, а по антигенным свойствам
родственного вирусу Менго, покидают клетки уже через несколько минут
после своего образования, причем та же картина наблюдается при их
размножении в клетках того же типа, в которых вирус Менго остается
после своего образования на 8 час и более [161]. Ни реовирус— имеющий
форму икосаэдра РНК-содержащий вирус, образующийся в цитоплаз-
ме,— ни аденовирус — такой же формы ДНК-содержащий вирус, созре-
вающий в ядре,— не выделяются спонтанно из клетки-хозяина в сколько-
нибудь заметной степени.
ОБРАЗОВАНИЕ МОЛЕКУЛ-ПРЕДШЕСТВЕННИКОВ ВИРУСОВ
Определение характерных особенностей кривой размножения вируса
является первым обязательным этапом исследований, цель которых —
понимание сущности репликации вируса. Следующим этапом является
определение временной последовательности образования компонентов,
из которых в конечном счете образуется вирусная частица. С целью по-
лучения этой информации широко используются четыре группы методов,
описываемых ниже.
Химические методы
Понимание цикла размножения бактериофага по существу было до-
стигнуто благодаря открытию Виатта и Коэна [927], которые показали,
что ДНК Т-четных бактериофагов вместо цитозина содержит 5-оксиме-
тилцитозин. Эта особенность состава ДНК послужила инструментом,
пользуясь которым биохимики смогли определить синтез фагоспецифич-
ной ДНК в зараженной клетке. К сожалению, подобные счастливые об-
стоятельства не были обнаружены в системах, образуемых вирусами жи-
вотных, вследствие чего для химических определений динамики синтеза
вирусоспецифичных компонентов в зараженных клетках пришлось изы-
скивать иные пути. Быть может, из числа методов, используемых для
достижения этой цели, наиболее прямым и общеприменимым является
метод, в основе которого лежит тот факт, что вирусные белки и нуклеи-
новая кислота состоят из аминокислот и нуклеотидов, извлекаемых из
фонда растворимых клеточных компонентов. Поскольку радиоактивные
272
Глава XIV
аминокислоты и предшественники нуклеиновых кислот, добавляемые
к культуральной жидкости, быстро проникают в этот фонд, можно,
используя соответствующую аналитическую технику, следить за динами-
кой биосинтеза вирусной нуклеиновой кислоты и вирусоспецифичных
белков.
С этой целью к различным пробам зараженной вирусом культуры
клеток через различные промежутки времени после заражения добав-
ляют аминокислоты или нуклеотиды, меченные радиоактивным изотопом.
Когда образование вируса заканчивается, вирус, содержащийся в каж-
дой из проб, собирают, очищают и определяют его относительную радио-
активность. Наибольшей удельной радиоактивностью обладает вирус,
выросший в культуре, к которой радиоактивная метка была добавлена
в самом начале инфекции, а наименьшей — вирус, выращивающийся в
культуре, куда такая метка была добавлена в конце инфекции. Добавляя
же метку в промежуточные интервалы времени, можно установить, когда
начинается образование молекул-предшественников вируса, и опреде-
лить, с какой скоростью идет их образование. Информация такого рода
была получена при изучении размножения вирусов полиомиелита, Менго,
Синдбис и классической чумы птиц [166, 478, 645, 894].
Главным ограничением этого метода является то обстоятельство,
что его чувствительность недостаточна для изучения ранних стадий
инфекции, при которых образуется относительно малое количество виру-
соспецифичных компонентов. Поскольку данный метод позволяет отли-
чить друг от друга только пробы, которые весьма существенно отли-
чаются по удельной радиоактивности (по крайней мере на величину,
составляющую 10% максимальной), то очевидно, что таким путем вы-
явить первые из вновь образовавшихся молекул трудно. Другим недо-
статком этого метода является то обстоятельство, что, пользуясь им,
можно выявить и количественно определить только те вирусоспецифич-
ные молекулы, которые включаются в состав вновь образовавшихся пол-
ных вирионов.
В основе еще одного прямого физико-химического метода, позволяю-
щего проследить за синтезом вирусной ДНК, лежит тот факт, что ДНК
некоторых вирусов, например вируса герпеса, вируса псевдобешенства
и некоторых аденовирусов, содержит относительно больше ГЦ-пар, чем
ДНК клетки-хозяина, в которой содержание ГЦ-пар колеблется в пре-
делах 42—45% (293, 432]. Благодаря вызванному этим различию в плот-
ности ДНК можно четко отделить вирусную ДНК от клеточной и осуще-
ствить ее количественное определение при помощи равновесного центри-
фугирования в градиенте плотности CsCl. Пользуясь этим методом, мож-
но обнаружить всю содержащуюся в клетке вирусную ДНК, как вошед-
шую в состав цельных вирионов, так и не связанную с капсидом. Исполь-
зуя различие в плотности, можно также измерить количество содержа-
щейся в клетке вирусоспецифичной РНК, ибо различиям в нуклеотидном
составе вирусной и клеточной РНК должны сопутствовать различия в их
плотности, а методы фракционирования РНК в градиенте плотности сер-
нокислого или муравьинокислого цезия уже разработаны и вполне
доступны.
При работе с вирусами группы оспы в связи с тем, что эти вирусы
размножаются только в цитоплазме, а ДНК клеток локализована в ядре,
можно непосредственно проследить процесс синтеза вирусной ДНК, пред-
варительно отделяя ядра клетки от цитоплазмы [121, 415]. В связи с этим
биосинтез ДНК вируса осповакцины можно специфически и вполне ко-
личественно определять по степени включения тимидина в цитоплазма-
тическую ДНК.
Размножение вирусов животных
273
Инфекционная нуклеиновая кислота
Другой метод определения динамики синтеза вирусной нуклеиновой
кислоты состоит в экстрагировании нуклеиновой кислоты из популяции
зараженных вирусом клеток и измерении степени ее инфекционности.
Теоретически этот метод применим при изучении любого вируса, у кото-
рого можно определить содержание инфекционной нуклеиновой кислоты.
Однако на практике этот метод был использован только для изучения
тех вирусов, в отношении которых точно установлены условия, при кото-
рых следует вести экстрагирование и количественное определение их
инфекционной РНК или ДНК. Мы имеем в виду вирус полиомиелита,
вирус западного энцефаломиелита лошадей и вирус полиомы. Необхо-
димо отметить, что данные, получаемые при количественном определе-
нии содержания инфекционной нуклеиновой кислоты в клеточных экст-
рактах, следует интерпретировать с достаточной осторожностью.
Дело в том, что в зараженных вирусом клетках содержатся три ком-
понента, в составе которых имеется инфекционная нуклеиновая кислота:
1) родительский вирус (он может находиться в зараженной клетке либо
в интактном состоянии, либо в депротеинизированной форме), 2) вновь
синтезированный цельный вирус и 3) вновь синтезированный вирус,
сборка которого полностью еще не закончена. Содержание первого ком-
понента можно считать фоновой величиной. Установление различия
между свойствами уже сформированного и еще находящегося в состоя-
нии сборки нового вируса имеет важное практическое значение, так как
было показано, что, например, при работе с вирусом западного энцефа-
ломиелита лошадей холодным фенолом удается экстрагировать инфек-
ционную РНК только из предшественника вируса, тогда как горячим фе-
нолом инфекционная РНК экстрагируется как из предшественника, так
и из цельного, зрелого вируа [895].
Однако основным возражением против абсолютной достоверности
«кривой размножения» вирусной нуклеиновой кислоты, построенной по
результатам определения экстрагируемой инфекционной нуклеиновой
кислоты, является малая чувствительность метода, используемого для
ее построения. Дело в том, что минимальное количество молекул нуклеи-
новой кислоты, необходимое для выявления инфекционности, т. е. одна
инфекционная единица, не является величиной постоянной, а соответст-
вует примерно от 105 до 108 молекул вирусной нуклеиновой кислоты. Не
зная же точного значения этой величины для каждого образца, прихо-
дится допустить, что эта величина, т. е. эффективность определения
инфекционности, является неизменной для нуклеиновой кислоты, экстра-
гируемой из проб, бравшихся в различные интервалы времени после
заражения.
Иммунологические измерения
Для идентификации вирусного белка, содержащегося в зараженных
вирусом клетках, широко используется разработанный Кунсом метод
флуоресцирующих антител (гл. IV), который позволяет определить как
число клеток, продуцирующих вирусный антиген, так и место, в котором
вирусный антиген локализуется в клетке. Применяя этот метод, можно
получить информацию как о времени первичного появления вирусного
белка в клетке, так и о влиянии химических веществ, способных при-
остановить образование инфекционного вируса, но не всегда могущих
нарушить синтез вирусного белка. Следует, однако, иметь в виду, что
при помощи метода флуоресцирующих антител можно обнаружить лишь
те компоненты, которые иммунологически подобны антигену, использо-
18 Заказ № 1214
274
Глава XIV
вавшемуся для приготовления антисыворотки. Так, например, если при
получении антисыворотки в качестве антигена использовался очищенный
вирус, то, пользуясь такой антисывороткой, можно будет обнаружить
лишь те белки, у которых имеются антигенные детерминанты, аналогич-
ные или подобные антигенным детерминантам вириона. Кодируемые ви-
русом белки, не входящие в состав цельного вируса, или те из белков,
находящихся внутри вириона, которые в организме иммунизированного
животного почему-либо не отделились от вириона в виде самостоятель-
ных молекул и поэтому не вызвали образования соответствующих анти-
тел, а также предшественники вируса, не обладающие антигенными
свойствами, в этом случае останутся не обнаруженными.
Количественная интерпретация данных, полученных при помощи
иммунофлуоресценции, весьма затруднительна. Однако был предложен
другой иммунологический метод, позволяющий осуществить количест-
венные анализы [735]. В основе этого метода лежит получение специфи-
ческого преципитата, состоящего из вирусного белка, антител к вирус-
ному белку и антител к антителам, использованным в первом этапе реак-
ции. Если вирусные белки по ходу их синтеза были помечены радиоак-
тивными аминокислотами, то радиоактивным будет также и получаемый
затем преципитат, содержащий вирусоспецифичный белок. При анализе
таких вирусов, как вирус осповакцины, в состав которого входит ряд
различных, отделимых друг от друга антигенных компонентов, пользуясь
этим методом, можно определить время и динамику синтеза каждого из^
вирусных белков в отдельности.
Использование специфических ингибиторов
Одним из наиболее важных событий в области изучения вирусов,
животных было открытие ингибиторов биосинтеза нуклеиновых кислот
и выяснение механизма их действия. Первым из соединений, у которых
было обнаружено такое свойство, явился 5-фтордезоксиуридин (ФДУ) —
соединение, ингибирующее образование тимидилата и вследствие этого
весьма эффективно блокирующее синтез ДНК [147]. Добавляя ФДУ
к культуре клеток через определенные промежутки времени после зара-
жения вирусом и определяя эффект, оказываемый этим препаратом на
конечный выход вируса, можно изучить динамику образования вирусной
ДНК [715]. При помощи ФДУ можно также классифицировать вновь
выделяемые вирусы. Так, например, если добавление к культуральной
среде ФДУ до конечной концентрации 10~5 М не приводит к подавлению
размножения вируса, то можно с уверенностью утверждать, что данный
вирус является РНК-содержащим вирусом. Напротив, если в подобных
же условиях размножение вируса подавляется, то очевидно, что мы
имеем дело с ДНК-содержащим вирусом [718].
Другим очень ценным ингибитором является актиномицин D — сое-
динение, блокирующее синтез всех РНК, образующихся на ДНК-матрице,
но не влияющее на размножение многих видов РНК-содержащих виру-
сов [672]. Поэтому, добавляя актиномицин к культурам клеток, заражен-
ных соответствующим вирусом, и определяя степень включения в соот-
ветствующую фракцию радиоактивного предшественника РНК, можно
изучить процесс синтеза вирусной РНК.
Ни один из многих других известных ингибиторов, использовавшихся
при изучении вирусов, не применялся столь широко и успешно, как упо-
минавшиеся выше. Это объясняется тем, что механизм их действия не
столь хорошо понятен, как механизм действия ФДУ и актиномицина.
Например, такие ингибиторы синтеза белка, как пуромицин и л-фтор-
фенилаланин, неоднократно применявшиеся при изучении биосинтеза ви-
Размножение вирусов животных
275
русов, хотя и подавляют синтез вирусных белков, но в то же время
влияют и на синтез нуклеиновой кислоты. Конечно, вполне возможно, что
эти осложнения вызваны не недостаточной специфичностью этих ингиби-
торов, а взаимозависимостью между синтезом белка и синтезом нуклеи-
новой кислоты.
РЕПЛИКАЦИЯ ВИРУСА ПОЛИОМИЕЛИТА
И ДРУГИХ МЕЛКИХ ИКОСАЭДРИЧЕСКИХ РНК-СОДЕРЖАЩИХ ВИРУСОВ
Динамика биосинтеза вирусных белков и РНК
Возможно, что в настоящее время процесс репликации мелких, не
содержащих липидов и имеющих форму икосаэдра РНК-содержащих ви-
русов, одним из типичных представителей которых является вирус полио-
миелита, изучен более детально, чем процесс размножения любых других
вирусов животных. Вследствие их стабильности, простоты строения и
легкости очистки эти мелкие РНК-содержащие вирусы были излюблен-
ным объектом исследования. В состав вирионов этих вирусов входят
только белки капсида, вероятно состоящие из трех или четырех различ-
ных пептидных цепей [558, 702, 831], и одна молекула одноцепочечной
РНК, состоящей примерно из 6000 нуклеотидов [733]. Поскольку основ-
ные черты процесса репликации вирусов полиомиелита, Менго и энцефа-
ломиокардита сходны, мы детально обсудим лишь процесс репликации
вируса полиомиелита и лишь изредка будем касаться вопросов, связан-
ных с особенностями репликации остальных из них.
После проникновения вируса полиомиелита в клетку, например в
клетку HeLa, его нуклеиновая кислота тут же выходит из вириона. Син-
тез большей части молекул, из которых затем образуется цельный вирус,
завершается через 2,5—5 час после заражения, и образование из соот-
ветствующих компонентов полностью сформированных вирионов идет без
сколько-нибудь существенного лаг-периода. Синтез вирусного белка и
вирусной РНК происходит почти одновременно и заканчивается при-
мерно за 1 час до завершения созревания вируса, а созревает вирус через
5—6 час, считая с момента заражения. Поскольку молекулы предшест-
венников вируса синтезируются из аминокислот и нуклеотидов клеточ-
ного фонда, исследователи пришли к выводу, что они образуются в зара-
женной клетке de novo. И действительно, метка радиоактивными изото-
пами показала, что удельная радиоактивность белка и нуклеиновой кис-
лоты очищенного вируса определяется величиной удельной радиоактив-
ности клеточного фонда в период образования вируса [165, 717].
Динамика биосинтеза основной массы белков и РНК вируса полио-
миелита изучалась при помощи всех четырех методов, описанных в пре-
дыдущем разделе. На фиг. 63 представлены полученные при этом ре-
зультаты. Очевидно, что подавляющая часть молекул, входящих впо-
следствии в состав вируса, синтезируется через 2—5 час после зараже-
ния. Однако ни один из использованных методов не позволяет опреде-
лить время начала синтеза вируса. Поскольку в одной клетке в среднем
образуется примерно 105 вирусных частиц, для выявления самых первых
из образующихся вирусоспецифичных компонентов нужно обладать
очень чувствительным методом, позволяющим обнаруживать ничтожные
доли (10-4—10-5) конечного выхода вируса.
Для того чтобы разрешить проблему, связанную с началом синтеза
вирусоепецифичных компонентов, был предложен следующий путь
[45, 46]. К содержащим актиномицин D зараженным вирусом клеткам
(фиг. 63, В) сразу же после заражения добавляли радиоактивный пред-
шественник РНК. Единственными макромолекулярными РНК, образую-
18*
Фиг. 63. Синтез РНК и белка вируса полиомиелита в клетках HeLa, зараженных этим
вирусом.
А. Цельный вирус (белые кружки) и инфекционная нуклеиновая кислота (черные кружки). Б. Изме-
рения, проведенные при помощи метода радиоактивных изотопов [166]. Культуру, зараженную виру-
сом полиомиелита, разделяли на ряд проб, к каждой из которых через различные промежутки вре-
мени после заражения добавляли С14-аденозин или С,4-валин. Из каждой пробы выделяли вирус,
очищали его и определяли его радиоактивность. Чем меньше удельная радиоактивность данной про-
бы вируса (т. е. чем больше она отличается от пробы, обладающей максимальной удельной радио-
активностью), тем раньше синтезировалось соответствующее количество вирусного белка (черные
кружки) или вирусной РНК (белые кружки). В. Использование актиномицина для количественного
определения синтеза вирусной РНК [937]. К культуре добавляли актиномицин, заражали ее виру-
сом полиомиелита, а затем добавляли к системе С14.уридин, после чего через различные промежут-
ки времени брали пробы и определяли общую радиоактивность кислотонерастворимой фракции
(черные кружки). Контролем служили соответствующие фракции, полученные из содержавшей ак-
тиномицин незараженной вирусом культуры (белые кружки). Г. Определение содержания белка кап-
сида вируса при помощи иммунологического метода [735]. К клеткам сразу после заражения их
вирусом добавляли меченные С14 аминокислоты. Для того чтобы выявить вновь образовавшийся бе-
лок вируса полиомиелита, к экстрактам клеток сначала добавляли кроличью антисыворотку против
очищенного вируса полиомиелита, а затем образовавшийся комплекс осаждали овечьей антисыворот-
кой к кроличьему у-глобулину. Общее количество вновь образовавшегося белка вируса полиомиели-
та определяли путем измерения радиоактивности, обусловленной атомами С14, содержащимися в пре-
ципитате.
Размножение вирусов животных 277
щимися при этих условиях, являются вирусоспецифичные РНК. Путем
экстрагирования РНК из таких клеток и определения их константы седи-
ментации удалось обнаружить, что через 30—60 мин после заражения
в клетках образуются молекулы РНК, седиментационные свойства кото-
рых характерны для вирусной РНК, и показать, что в пределах первых
2,5 час цикла репликации количество вновь синтезируемой вирусной
РНК увеличивается экспоненциально (см. фиг. 65). Этот опыт удалось
осуществить потому, что общая радиоактивность включавшихся предше-
ственников была столь велика, что удалось легко наблюдать включение,
составлявшее 10-4 часть от суммарного.
Ясно, что в клетках, зараженных вирусом полиомиелита, синтез ви-
русной РНК начинается очень скоро после заражения, а созревание
вирусного потомства — лишь на третий час после заражения. Роль вирус-
ной РНК в раннем и позднем периоде инфекции рассматривается в сле-
дующем разделе.
Механизмы синтеза вирусоспецифичных компонентов
Очевидно, что для синтеза белка вируса полиомиелита и его РНК
не нужно какое-либо промежуточное участие ДНК. Ингибиторы синтеза
ДНК, например аналоги тимидина, не влияют ни на скорость образова-
ния вируса полиомиелита, ни на частоту его мутаций [718, 773]. Не влияет
также на репликацию вируса полиомиелита блокирование транскрипции
ДНК актиномицином. Такой вывод означает, что РНК вируса полиомие-
лита должна обладать способностью управлять своей собственной реп-
ликацией. Поскольку ДНК, по-видимому, не принимает никакого участия
в биосинтезе этого вируса, представляется вероятным, что вся совокуп-
ность событий, ведущих к образованию вируса полиомиелита, происхо-
дит только в цитоплазме. И действительно, первые же опыты, в которых
для изучения места синтеза вируса полиомиелита в клетках были исполь-
зованы метод флуоресцирующих антител и электронная микроскопия,
показали, что скопления вируса и вирусного белка обнаруживаются
именно в цитоплазме зараженных клеток.
Выдвижение концепции об информационной РНК как о молекуле,
управляющей процессом синтеза белка, и в особенности демонстрация
Ниренбергом и Маттеи способности РНК ВТМ стимулировать синтез
белка в системе рибосом, выделенных из клеток Е. coli [618], навели на
мысль, что РНК вируса полиомиелита, быть может, так же функциони-
рует как информационная РНК. И в самом деле, вскоре было показано,
что РНК вируса полиомиелита, будучи добавленной к рибосомам, выде-
ленным из клеток Е. coli, действительно может функционировать in vitro
в качестве информационной РНК, стимулируя синтез компонента, сход-
ного по своим антигенным свойствам с дериватом белка капсида вируса
полиомиелита [163].
Затем было доказано, что РНК вируса полиомиелита образует ком-
плекс с рибосомами цитоплазмы клетки-хозяина и действительно выпол-
няет функцию информационной РНК. Открытие полисом—цепочек, со-
стоящих из рибосом,— сделанное при изучении процесса синтеза гемо-
глобина [271, 887], стимулировало поиск подобных структур в клетках
HeLa. Такие структуры действительно вскоре были обнаружены в нор-
мальных клетках такого типа. Что же касается клеток HeLa, зараженных
вирусом полиомиелита, то в них был обнаружен новый тип полисом, зна-
чительно превышающих по своим размерам полисомы, обнаруженные
в нормальных клетках [641]. Эти большие полисомы можно обнаружить
только после того, как разрушатся полисомы клетки-хозяина. Они выяв-
278
Глава XIV
ляются лишь при наступлении времени, соответствующего периоду мак-
симальной скорости образования белка вирусного капсида.
Специфичность полисом, образуемых вирусом полиомиелита, уда-
лось доказать, продемонстрировав, что вновь образовавшаяся РНК> свя-
занная с рибосомами клетки, обладает теми же седиментационными
свойствами и нуклеотидным составом, что и РНК, выделенная из очи-
щенного вируса полиомиелита [640, 831]. Было также показано, что боль-
шая часть белка, синтезированного на индуцированных вирусом полисо-
мах, по своим антигенным свойствам идентична белку капсида вируса
[737]. Таким образом, представляется вероятным, что интактная вирусная
РНК функционирует как информационная РНК при образовании всех
вирусоспецифичных белков описываемого нами вируса.
Обширные исследования были посвящены изучению процесса обра-
зования вирусной РНК. Несколько ранних наблюдений наводили на
мысль об образовании в зараженной клетке нового, вирусоспецифичного
фермента, катализирующего синтез вирусной РНК. Было замечено, что,
если к культурам клеток, зараженных вирусом полиомиелита или виру-
сом западного энцефаломиелита лошадей, во время латентного периода
развития вируса добавить такие ингибиторы, как пуромицин или и-фтор-
фенилаланин, и, таким образом, прервать биосинтез белка, то вирусная
РНК вовсе не образуется [516, 898]. Если, однако, к клеткам одновре-
менно с вирусом добавить ингибитор биосинтеза белка, а затем через
два часа отмыть культуру от ингибитора, то синтез вирусной РНК, кото-
рый можно выявить, также отдаляется на два часа. Следовательно, для
того чтобы инициировать синтез вирусной РНК, необходимо, чтобы в
клетке сначала синтезировались какие-то новые белки.
Тот факт, что в цитоплазме клеток, зараженных РНК-содержащими
вирусами, синтез РНК идет в присутствии актиномицина [239], весьма
убедительно указывает на появление в цитоплазме клетки нового белка,
способного, по-видимому, катализировать образование вирусной РНК на
матрице, представляющей собой, вероятно, также вирусную РНК. Балти-
мор и Франклин [43] идентифицировали фермент — РНК-зависимую
РНК-полимеразу,— обладающий способностью включать в состав РНК
рибонуклеотиды — компоненты рибонуклеоздитрифосфатов. Подобный
вид ферментативной активности впервые был обнаружен в цитоплазма-
тических экстрактах фибробластов мышей, зараженных вирусом Менго,
а впоследствии — в экстрактах клеток HeLa, зараженных вирусом по-
лиомиелита. Для того чтобы эта ферментативная активность проявилась,
необходимо, чтобы в инкубационной среде одновременно присутствовали
все четыре рибонуклеозидтрифосфата. При выполнении этого условия
в состав вновь синтезируемой РНК включались все четыре рибонуклео-
тида.
Монтажье и Сэндерс [596] показали, что в клетках, зараженных ви-
русом энцефаломиокардита, появляется инфекционная двухцепочечная
форма вирусной РНК. РНК аналогичной структуры была обнаружена
также в цитоплазме клеток, зараженных вирусом полиомиелита [42].
Впоследствии было показано, что такая двухцепочечная РНК состоит из
одной цепи вирусной РНК и одной полной комплементарной ей цепи
[80, 440].
Данные, полученные в дополнительных экспериментах, в которых
клетки, зараженные вирусом полиомиелита, инкубировали с Н3-уридином
в течение коротких промежутков времени (по сравнению с теми, какие
необходимы для синтеза полных молекул РНК), привели к мысли, что
двухцепочечная РНК играет роль матрицы при ферментативном синтезе
вирусной РНК. Постановка таких экспериментов оказалась возможной
благодаря тому, что одноцепочечная РНК выпадает в осадок в концен-
Размножение вирусов животных
279
трированных растворах хлористого лития, тогда как двухцепочечная
РНК в этих условиях остается в растворе. Включившиеся в состав РНК
нуклеотиды при образовании комплекса с двухцепочечной РНК ведут се-
бя так, как если бы они входили в состав одноцепочечной РНК, вследст-
вие чего образовавшийся комплекс в концентрированном растворе со-
ли лития выпадает в осадок. Эти данные говорят о том, что растущие
цепи РНК, по-видимому, связаны с двухцепочечной формой РНК [45].
шп
"Холодные " полинуклеотиды
lllllllllH] Н3-полинуклеотиды
Растущие,
связанные v
с матрицей
цепи
Синтезирован-
ные цепи, <
отделившиеся
от матрицы
Фиг. 64. Схема, изображающая процесс биосинтеза РНК вируса полиомиелита.
При добавлении Н3-уридина к клеткам HeLa, зараженным вирусом полиомиелита, радиоактивность
сначала появляется в растущих, связанных с матрицей цепях РНК- По завершении образования
некоторых цепей радиоактивность появляется в вирусной РНК с константой седиментации 35S, не
присоединенной к матрице. По прошествии периода времени, соответствующего средней продолжи-
тельности времени синтеза одной молекулы вирусной РНК, радиоактивность материала, соединенно-
го с матрицей, становится равной радиоактивности материала, не связанного с матрицей.
В ходе этих экспериментов была определена продолжительность
времени, необходимого для синтеза и освобождения полной цепи вирус-
ной РНК. Поскольку полные, отделившиеся от матрицы цепи РНК можно
отличить от цепей РНК, еще связанных с матрицей, то, варьируя интер-
валами времени, которое отводится для включения меченого нуклеотида
в синтезирующуюся РНК, можно определить отношение величины радио-
активности, еще остающейся связанной с матрицей, к величине радиоак-
тивности цельных молекул РНК. Схема, приведенная на фиг. 64, показы-
вает, что если время инкубации с радиоактивным предшественником
увеличивают до тех пор, пока половина включающегося радиоактивного
предшественника оказывается локализованной в завершенных цепях
РНК, то это время оказывается равным среднему значению времени,
необходимому для синтеза молекулы РНК. Подобным образом было
найдено, что для синтеза молекулы РНК вируса полиомиелита в клет-
ках HeLa требуется примерно 1 мин. (Подобный ход рассуждений был
использован ранее Динцисом (185] при определении среднего значения
времени, необходимого для синтеза на рибосомах ретикулоцита одной
полипептидной цепи молекулы гемоглобина.)
280
Глава XIV
Описанные выше опыты с большой степенью вероятности говорят
о том, что РНК вируса полиомиелита синтезируется на двухцепочечной
матрице. Полученные в этих опытах данные можно суммировать сле-
дующим образом.
Когда клетки, образующие главным образом одноцепочечную вирус-
ную РНК с константой седиментации 35S, инкубируют с радиоактивны-
ми предшественниками РНК в течение меньшего периода времени, чем
то, которое необходимо для образования законченной цепи одноцепочеч-
Фиг. 65. Накопление в зараженных вирусом полиомиелита клетках HeLa, меченных
Н3-уридином, различных типов вирусоспецифичных РНК [45].
РПФ — репликативная промежуточная форма, которая представляет собой комплекс, состоящий из
двухцепочечной РНК и недостроенных цепей одноцепочечной РНК. РФ — репликативная форма, кото-
рая представляет собой двух цепочечную РНК, не обнаруживающую активного синтеза вирусной
РНК. 35S-PHK — это одноцепочечные завершенные цепи вирусной РНК (значения ординат для этой
кривой увеличены в 10 раз). По оси ординат — логарифмическая шкала.
ной РНК, вновь включившаяся радиоактивность, физически отделимая
от законченных цепей РНК, должна быть связана с матрицей. Часть этой
матрицы является двухцепочечной РНК. Изучение суммарной скорости
накопления одноцепочечной РНК с константой седиментации 35S, как и
комплексов, состоящих из двухцепочечной и одноцепочечной РНК, го-
ворит о том, что в ранний период инфекции количество обеих форм РНК
увеличивается экспоненциально и параллельно (фиг. 65).
Для того чтобы изучить этапы ферментативной реакции, катализи-
руемой РНК-зависимой РНК-полимеразой, необходимо сначала очистить
этот фермент (или ферменты). Недавно из клеток Е. coli, зараженных
мелким РНК-содержащим фагом, удалось выделить подобный фермент.
Его назвали РНК-репликазой. Этот фермент обладает замечательной
способностью катализировать синтез полных инфекционных молекул
РНК, используя в качестве матрицы интактные молекулы вирусной РНК
[803]. Это исследование открывает путь для изучения синтеза вирусных
Размножение вирусов животных 28 Г
РНК in vitro, применимый также и для изучения синтеза РНК вирусов
животных.
Рассматривая вопрос об интеграции процессов биосинтеза вирусного*
белка и вирусной нуклеиновой кислоты, необходимо обсудить еще один
аспект образования мелких РНК-содержащих вирусов. Дело в том, что
в незараженных клетках HeLa полисомы не связаны с мембранами, тог-
да как в специализированных клетках, например в клетках печени, они
прикреплены к мембранам [640]. Это отчетливо видно на фото 53. Спра-
ведливость этого положения подтверждает также и наблюдение, что для
выделения полисом из экстрактов клеток HeLa путем седиментации
не требуется предварительной обработки веществами, разрушающими
мембраны. Однако во время синтеза вируса полиомиелита вирусоспе-
цифичные полисомы, а также вирусная РНК-полимераза и большая
часть вирусоспецифичных молекул, в том числе и РНК и белок, по-ви-
димому, присоединены к каким-то большим содержащим липиды струк-
турам. Поэтому представляется вероятным, что образование вируса про-
исходит на каких-то организованных мембранных структурах.
На электронных микрофотографиях ультратонких срезов клеток, за-
раженных вирусом полиомиелита, соответствующих периодам функцио-
нирования структур, на которых идет образование вируса, не видно ка-
ких-либо четко выявляемых вирусных «фабрик». В то же время эти мик-
рофотографии (фото 53) наводят на мысль, что вирусные полисомы,
быть может, связаны с частицами эндоплазматической сети. Если какие-
то морфологически оформленные синтезирующие вирус тельца действи-
тельно существуют, то, возможно, их функция состоит в создании окру-
жения, необходимого для осуществления синтеза вируса вопреки интен-
сивному ингибирующему и деструктивному действию, оказываемому ви-
русом на синтез клеточных компонентов (гл. XV), и в обеспечении ло-
кальных условий, возможно, увеличивающих эффективность процесса
сборки вирионов. Как показывает опыт, около 50% вирусной РНК, как
и белка капсида, образующихся в клетках HeLa, включаются в состав
морфологически завершенных вирусных частиц [165, 937].
Образование морфологически завершенных вирусных частиц
Ранее уже говорилось о том, что репликация вирусной РНК начи-
нается вскоре после заражения клеток. Сначала вновь синтезировавшая-
ся РНК выявляется не в полных вирусных частицах, а в полирибосомах.
Только через 2—2,5 час после заражения вирусная РНК начинает об-
наруживаться в зрелых вирионах [46]. Неизвестно, однако, является ли
сигналом для инициации процесса созревания вируса просто достаточ-
ное накопление белков капсида, или за соответствующую команду ответ-
ственны какие-то более тонкие механизмы.
После того как процесс созревания начался, каждая вновь образую-
щаяся молекула РНК через 2—3 мин после своего образования обнару-
живается уже внутри цельного вириона. Напротив, молекулы белков
включаются в состав вирионов в среднем лишь через 20 мин после окон-
чания синтеза [640, 736, 889]. Наличие лаг-периода свидетельствует о томг
что процесс сборки является упорядоченным процессом, нуждающимся
в наличии фонда белка, при котором заранее образовавшийся белок как
бы кристаллизуется вокруг вновь образовавшейся молекулы РНК. Дан-
ные, свидетельствующие о том, что такой процесс действительно проис-
ходит, были получены в опытах, при которых подавляли биосинтез бел-
ка, добавляя к системе циклогексимид — вещество, ингибирующее синтез
белка. Эти опыты показали, что вирусная РНК, образующаяся через
282
Глава XIV
несколько минут после прерывания синтеза белка циклогексимидом^,
тем не менее обнаруживается внутри полного вируса.
Таким образом, последовательность событий, ведущих к образова-
нию вирусной частицы, выглядит следующим образом: 1) синтез вирус-
ного белка; 2) «созревание» белка; 3) связывание белка с вновь образо-
вавшейся вирусной РНК; 4) образование полных вирусных частиц.
Использование вируса полиомиелита для изучения
процесса трансляции, ведущего к синтезу белка
Чтобы показать, как много еще предстоит сделать для понимания
всех тонкостей различных процессов, связанных с образованием вирус-
ных компонентов, рассмотрим кратко процесс функционирования вирус-
ной РНК в качестве РНК информационной. Одной из причин, привлек-
ших внимание исследователей к мелким РНК-содержащим вирусам, бы-
ла мысль о том, что количества генетической информации, содержащей-
ся в геноме, представляющем собой столь относительно малую молекулу
нуклеиновой кислоты, может, по-видимому, хватить лишь для выполне-
ния небольшого числа функций. Единственными белками, выделенными
из вируса и достоверно закодированными в вирусном геноме, являются
четыре полипептида, из которых образуется белок капсида. Вероятно,
однако, что для выполнения ряда других функций, осуществляемых при
образовании вируса, также требуется образование специфических бел-
ков. Так, например, цитоплазматическая вирусная РНК-полимераза, по-
видимому, также является вновь образующимся вирусоспецифичным бел-
ком. Кроме того, остановка биосинтеза, идущего в клетке-хозяине (раз-
рушение полисом клетки-хозяина, подавление синтеза РНК клетки; см.
гл. XV), быть может, также осуществляется вновь синтезирующимися
вирусоспецифичными белками.
Еще одним событием, для осуществления которого необходим синтез
белка, является явная стимуляция потребления холина, наблюдающаяся
в клетках, зараженных вирусом полиомиелита в период, соответствую-
щий максимуму синтеза вируса, — обстоятельство, которое, быть может,
связано с ассоциацией вирусных полисом с мембранами клетки [642].
Очевидно, что для осуществления столь большого числа специфич-
ных для вируса функций необходимо образование по крайней мере от 8
до 10 белков или во всяком случае столько же полипептидных цепей, ибо
некоторые белки могут состоять из двух или нескольких различных по-
липептидных цепей. Если принять, что молекулярный вес каждого из
этих 8 пептидов в среднем равен молекулярному весу пептидных цепей,
образующих белок капсида, т. е. составляет примерно 25 000 дальтон,
что соответствует приблизительно пептиду, состоящему из 250 аминокис-
лотных остатков, то тогда общее количество аминокислотных остатков,
которое должно кодироваться РНК вируса полиомиелита, будет равно
приблизительно 2000. Полученная величина соответствует кодовому отно-
шению три нуклеотида на одну аминокислоту, ибо РНК вируса полио-
миелита содержит 6000 нуклеотидов.
Были поставлены опыты, при которых в зараженных вирусом клет-
ках, содержавших радиоактивные аминокислоты, синтезировались только
белки, кодируемые вирусом. Электрофорез меченых белков, выделенных
из таких клеток, показал, что в данных условиях в клетках синтезирова-
лось по крайней мере 10 полипептидов [832]. На фиг. 66 представлена
электрофореграмма радиоактивных вирусоспецифичных полипептидов,
синтезировавшихся в клетках, зараженных вирусом полиомиелита. Мож-
Размножение вирусов животных
283
но видеть, что в этих условиях, кроме полипептидов, входящих в состав
капсида, образуется также и ряд иных L
Интересно отметить, что несмотря на то, что в зараженной вирусом
полиомиелита клетке образуется много качественно различных полипеп-
тидных цепей, не все из этих цепей образуются с одинаковой частотой.
Так, например, две из четырех полипептидных цепей капсида, образуются
в большем числе, чем две остальные. Некоторые из некапсидных пептид-
ных цепей также образуются в количествах, сильно отличающихся друг
Номер фракции
Фиг. 66. Вирусоспецифичные пептиды, образующиеся в клетках, зараженных вирусом
полиомиелита [831].
Из зараженных вирусом клеток, метившихся Н3-аминокислотами после подавления синтеза белка
клеток более чем на 95%, готовили экстракт, который смешивали с очищенным вирусом полиомиели-
та, меченным С14. Смесь фракционировали при помощи электрофореза в полиакриламидном геле.
Кривые распределения радиоактивности (С14 — светлые кружки, правая ось ординат, Н3 — черные
кружки, левая ось ординат) показывают, что в состав очищенного вируса входят четыре пептида
(/—4). Зараженные клетки продуцируют, кроме того, ряд других пептидов, не входящих в состав
капсида (каждому из них соответствует максимум на кривой).
ют друга. Эти результаты свидетельствуют о существовании контроли-
рующего механизма, благодаря функционированию которого некоторые
из областей РНК вируса полиомиелита транслируются более часто, чем
другие 1 2,
1 Дальнейшие исследования (Summers D., М a i z е 1 J., Proc. Natl. Ac. Sci. USA.,
59, 966, 1968) показали, что только несколько из обнаруженных в цитированной работе
[832] вирусных белков являются продуктами «первичной» трансляции вирусной РНК.
В ходе инфекционного процесса «первично» транслирующиеся белки расщепляются на
•более мелкие функциональные молекулы и, естественно, изменяют электрофоретическую
подвижность. Таким образом, при электрофорезе цитоплазматического экстракта кле-
ток, зараженных вирусом полиомиелита, обнаруживаются вирусоспецифичные белки,
находящиеся на различных стадиях расщепления, суммарный молекулярный вес ко-
торых превышает истинный молекулярный вес белков, первично транслирующихся с
.молекулы РНК вируса полиомиелита. — Прим. ред.
2 Исследования, проведенные в последнее время (Jakobson М., Baltimore D.,
Proc., Natl. Ac. Sci. USA, 61, 77, 1968), показали, что с полицистронной молекулы РНК
вируса полиомиелита транслируется лишь несколько, а возможно, всего одна цепочка
белка, которая в дальнейшем расщепляется на обладающие функциональной актив-
ностью более мелкие белковые молекулы. В связи с этим представляется маловероят-
ным наличие механизма, обеспечивающего большую или меньшую степень трансляции
«отдельных цистронов РНК вируса полиомиелита. — Прим. ред.
284
Глава XIV
Очевидно, что для изучения контроля трансляции полицистронных
/n-РНК РНК-содержащие вирусы по-прежнему остаются наиболее под-
ходящей экспериментальной моделью.
РЕПЛИКАЦИЯ МИКСОВИРУСОВ И АРБОВИРУСОВ
Общность некоторых аспектов процесса созревания этих вирусов,
а именно завершение их образования у клеточной поверхности путем
приобретения липопротеидной внешней оболочки, позволяет рассмотреть
процесс размножения вирусов этих двух групп одновременно.
К сожалению, по сравнению с тем, что удалось узнать о размноже-
нии мелких РНК-содержащих вирусов, не имеющих внешней оболочки,
о размножении миксовирусов и арбовирусов известно относительно мало.
РНК арбовирусов реплицируется в цитоплазме [897]. Миксовирусы в
соответствии с топографией их размножения можно разделить на две
группы. У представителей первой группы, а именно у вируса гриппа и
вируса классической чумы птиц, одна из стадий синтеза, или созрева-
ния, происходит в ядре клетки. Миксовирусы второй группы — к ним
относятся вирус кори, вирус парагриппа и вирус ньюкаслской болезни —
размножаются только в цитоплазме.
Определенная часть весьма важной информации о биохимических
событиях, происходящих при биосинтезе миксовирусов, была получена
при изучении вируса классической чумы птиц [732, 742]. По размеру,
составу и строению вириона этот вирус весьма сходен с вирусом гриппа.
В его состав, кроме липидной оболочки, входит по крайней мере два ви-
русных белковых антигена — S-антиген, связанный с РНК, и гемагглю-
тинин. Молекулярный вес РНК этого вируса, если она представляет
собой одну цепь, составляет примерно 2 • 106 дальтон.
Образование вирусоспецифичных компонентов изучали как при по-
мощи метки радиоактивными изотопами, так и при помощи иммунофлуо-
ресценции. РНК вируса классической чумы птиц метится Р32 наиболее
интенсивно тогда, когда этот радиоактивный изотоп вводят в культураль-
ную среду во время размножения вируса, тогда как липиды вируса ме-
тятся Р32 тем интенсивнее, чем более продолжительное время клетки
инкубируются с Р32 до их заражения вирусом [894]. Эти данные гово-
рят о том, что вирусная РНК образуется в клетке de novo, а фосфолипи-
ды, используемые вирусом, предсуществуют в клетке.
Динамика синтеза S-антигена и гемагглютинина вирусов гриппа и
классической чумы птиц изучалась при помощи иммунофлуоресценции.
Примерно через 3—4 час после заражения вновь синтезированный S-
антиген обнаруживается в ядре клетки. Спустя еще 1 час в цитоплазме
появляется гемагглютинин L Полный же вирус обнаруживается на по-
верхности клетки по прошествии примерно еще одного часа. Используя
n-фторфенилаланин в качестве ингибитора биосинтеза белков, удалось
четко разделить эти события [938]. Когда ингибитор добавляли в течение
первого часа после заражения, выявить синтез белка не удавалось. Если
же ингибитор добавляли через 2 час после заражения, то наблюдали
появление S-антигена в ядре, однако в цитоплазму этот антиген не про-
никал, и гемагглютинин не обнаруживался. Когда ингибитор добавляли
по прошествии 3 час с момента заражения, то синтезировалось нормаль-
ное количество S-антигена и некоторое количество гемагглютинина, од-
нако инфекционный вирус не выявлялся вовсе.
1 В последнее время получены данные, что все вирусоспецифичные белки вируса
гриппа синтезируются в цитоплазме, откуда некоторые из них мигрируют в ядро
(Taylor J., Hampson A., White D., Virology, 39, 419, 1969).
Размножение вирусов животных
285
Если вместо куриных фибробластов вирусом классической чумы
птиц заражали мышиные L-клетки, то S-антиген образовывался в ядре
точно так же, как и в куриных фибробластах. Однако в цитоплазму он
не переходил и инфекционный вирус не выявлялся [238]. Поскольку
S-антиген— это компонент вириона миксовирусов, связанный с его РНК,
представляется вероятным, что вирусная РНК также образуется в ядре.
Попытка использовать актиномицин для того, чтобы, подавив синтез
клеточной РНК, точно выяснить место синтеза вирусной РНК, привела
к неожиданному результату. Оказалось, что если актиномицин содер-
жится в культуральной среде с момента заражения, то размножение
вируса гриппа ингибируется [48]. В то же время другой миксовирус,
а именно вирус ньюкаслской болезни, у которого ядерная фаза образо-
вания S-антигена отсутствует, не ингибируется актиномицином. Во вре-
мя репликации вируса ньюкаслской болезни наблюдается синтез РНК
в цитоплазме [693].
Тем не менее было бы неосторожно утверждать, что в процессе реп-
ликации РНК вируса гриппа имеется ДНК-зависимая стадия. Добав-
ление актиномицина через 1 час после заражения не подавляет образо-
вания инфекционного вируса [911]. Цитозинарабинозид, аналог нуклео-
тида, входящего в состав нуклеиновых кислот, обладающий свойством
подавлять синтез ДНК клеток, тем не менее не прекращает репликации
вируса гриппа [38]. Эти данные также говорят о том, что в процессе син-
теза РНК вируса гриппа отсутствует обязательная стадия синтеза ДНК.
Таким образом, какая-то ранняя стадия синтеза миксовирусов груп-
пы гриппа блокируется, если приостанавливается процесс транскрипции
клеточной РНК с ДНК-матрицы. Когда эта стадия заканчивается, репли-
кация вируса гриппа становится независимой от функции генома клетки-
.хозяина. Это перекликается с событиями, наблюдаемыми на ранней ста-
дии инфекции, вызываемой вирусом осповакцины (гл. XIII). Напомним,
что ДНК вируса осповакцины оказывается «раздетой» лишь в том случае,
если не нарушены функции клетки-хозяина. Вероятно, для освобожде-
ния РНК вируса гриппа от оболочки также требуется функционирование
генома клетки-хозяина.
Совершенно очевидно, что многие детали образования РНК и белков
миксовирусов пока остаются неизвестными. До сих пор наиболее инте-
ресные данные в отношении репродукции миксовирусов были получены
при изучении любопытнейшей стадии их размножения, наблюдаемой в
конце их образования, а именно «заимствования» этими вирусами у за-
раженной клетки части ее мембраны для образования своей внешней обо-
лочки.
Несколько групп данных указывают на ту важную роль, которую
играют вирусы, содержащие липопротеиды, в процессе преобразования
мембраны зараженной клетки в форму, необходимую для созревания
вируса. Морган и сотр. [599] показали, что антитела к полному вириону
вируса гриппа, соединенные с ферритином, могут фактически связывать-
ся всей поверхностью зараженной вирусом клетки (фото 54). В состав
ферритина входит много железа, благодаря чему этот белок, а вместе с
ним и связанные с ферритином антитела легко выявляются с помощью
электронного микроскопа. На электронных микрофотографиях клеток,
зараженных вирусом парагриппа, можно наблюдать локальные изме-
нения в структуре поверхности клетки, все более распространяющиеся
по мере развития инфекционного процесса (Морган, личное сообщение).
Анализ липидов, входящих в состав вируса гриппа, показал, что они
представляют собой те же липиды, которые имеются в клетке-хозяине
[439]. Эти данные подкрепляют ранее высказанную мысль [377], что одной
из стадий конечного этапа размножения миксовирусов является созрева-
286
Глава XIV
Ийе вирионов у клеточной поверхности в тесной связи с плазматической
мембраной.
Данные, полученные при изучений размножения вируса Синдбис —
одного из арбовирусов, прямо указывают, что источником информации,,
используемой для образования основной части белкового компонента
липопротеидной оболочки этого вируса, является его геном [645, 646].
Метка аминокислотой клеточного фонда и белков очищенного вируса
Синдбис показывает, что все белки, входящие в состав вириона, в том
числе и те, которые входят в состав липопротеидной внешней оболочки,,
синтезируются после начала вирусной инфекции, тогда как липиды, ис-
пользуемые при образовании вируса, присутствуют в клетке до ее за-
ражения (аналогично тому, что наблюдается при заражении клеток ви-
русом классической чумы птиц).
На основе этих опытов вырисовывается следующая картина. Коди-
руемый вирусом белок, обладающий способностью проникать в клеточ-
ную мембрану и связываться с ней, образуется после заражения клетки
вирусом. При созревании вирусов, характеризующихся наличием внешней
оболочки, для образования этой оболочки используется часть такой изме-
ненной клеточной мембраны. Вполне возможно, что для образования
внешней оболочки вируса макромолекулы, предсуществовавшие в клет-
ке до ее заражения вирусом, не используются.
ВИРУС ОСПОВАКЦИНЫ И ДРУГИЕ ВИРУСЫ ГРУППЫ оспы
Репликативный цикл вируса осповакцины
Вирус осповакцины является не только первым ’вирусным агентом,,
который был обнаружен двести лет назад (вакцина Дженнера), но и
одним из первых вирусов животных, привлекших серьезное внимание эк-
спериментаторов в наше время. Уже в 1936 г. был разработан хороший
метод количественного определения этого вируса, основанный на под-
счете числа оспенных пустул [450], а в 1939 г. была успешно осуществле-
на его очистка [785]. Вирус осповакцины — один из наиболее сложных
вирусов животных. В его состав входит много различных белков [28] и<
одна большая молекула ДНК. Молекулярный вес этой ДНК составляет
около 160 000 000 дальтон [415].
Вирус осповакцины является типичным представителем большой
группы вирусов — вирусов группы оспы. Вирусы этой группы сходны в
морфологическом, структурном и химическом отношении, но обладают
как общими, так и специфическими антигенами. Йоклик [413] сравнил
ДНК, полученные из нескольких различных представителей вирусов
группы оспы, и обнаружил, что у всех этих ДНК содержание ГЦ-пар со-
ставляет примерно 37%. Существенные успехи, достигнутые в понима-
нии механизма размножения вирусов группы оспы, показали, насколько
успешно может быть использован вирус осповакцины при изучении слож-
ных проблем молекулярной генетики животных клеток [415], в особенно-
сти в связи с тем, что ДНК этих вирусов образуется исключительно в.
цитоплазме клетки.
Впервые тщательное исследование динамики биосинтеза макромо-
лекул при образовании вируса осповакцины было осуществлено Кэйрн-
сом [121], использовавшим для этой цели метод радиоавтографии. Уже
давно было известно, что в цитоплазме клеток, зараженных вирусом ос-
повакцины, образуются характерные тельца-включения, так называемые
тельца Гварниери, видимые в световой микроскоп. Применив радиоавто-
графический метод, Кэйрнс показал, что включения представляют собой:
Размножение вирусов животных
287
места активного синтеза белка и ДНК. Поскольку в нормальных клет-
ках ДНК в цитоплазме не образуется, он пришел к выводу, что ДНК ви-
руса осповакцины синтезируется на этих «фабриках вируса». Данные,,
полученные при помощи метода флуоресцирующих антител, показали,
что по крайней мере часть белков, образующихся на этих «фабриках»,
являются вирусными. Полный вирус появляется примерно через 3 час
вслед за фазой синтеза ДНК и через 2 час вслед за фазой синтеза белка
соответственно. При высокой множественности заражения промежуток
времени между заражением культуры вирусом и началом функциониро-
вания структур, в которых идет синтез вируса, можно сократить до ми-
нимума. В этих условиях все структуры клетки, где происходит синтез
вируса, начинают функционировать одновременно.
Для того чтобы изучить динамику синтеза ДНК вируса осповакци-
ны, к зараженным клеткам через различные промежутки времени после
заражения добавляли ФДУ и определяли степень уменьшения конечного
выхода вируса в соответствующих пробах [715]. Синтез ДНК начинается
примерно через 2—3 час после заражения и за 2—3 час до появления
инфекционного вируса. Затем оба процесса идут параллельно, заканчи-
ваясь через 6—7 и 10—12 час соответственно [718].
Вновь синтезировавшаяся вирусная ДНК проникает сначала в не-
полные вирусные частицы, которые затем, медленно созревая, превра-
щаются в полные вирионы [416]. За это замедление, видимо, ответствен-
но последовательное или направленное встраивание в структуру вириона
различных вирусных белков.
Образование вирусных белков-предшественников изучалось при по-
мощи нескольких методов. Путем использования антител к различным
вирусным белкам было обнаружено, что они образуются в течение пер-
вых 6 час после заражения, причем в определенной и закономерной по-
следовательности [524]. Количественный анализ содержания общего ви-
русного белка, проведенный при помощи иммунологической преципита-
ции вирусных белков, меченных радиоактивными изотопами, кроличьей
антисывороткой, полученной иммунизацией живым вирусом осповакци-
ны [757], показал, что синтез этих белков начинается вскоре после нача-
ла синтеза вирусной ДНК, приблизительно через 1,5 час после зараже-
ния клеток, и продолжается примерно с одинаковой скоростью в течение
всего процесса инфекции. Следует иметь в виду, что поскольку вирус ос-
повакцины в организме кроликов размножается, в использовавшейся
кроличьей антисыворотке могли содержаться антитела не только к
структурным белкам вириона, но и к другим белкам, индуцируемым ви-
русом.
Для того чтобы определить, ингибирование какой из стадий синтеза
белка ведет к прекращению синтеза инфекционного вируса, к заражен-
ным культурам через различные промежутки времени после заражения
добавляли n-фторфенилаланин и определяли конечный выход вируса в
соответствующих культурах. Благодаря этому удалось выявить самую
позднюю, чувствительную к действию ингибиторов стадию синтеза бел-
ка, необходимую для образования инфекционного вируса. Было’ обнару-
жено, что какой-то вирусный белок, без которого инфекционный вирус
не образуется, синтезируется лишь за 30 мин до начала созревания ви-
руса, что опять указывает на последовательный характер процессов, ве-
дущих к образованию этого сложного вируса. Природа этого позднего
белка неизвестна. Можно, однако, полагать, что поскольку внешняя обо-
лочка вируса содержит липопротеид, поздний белок, возможно, представ-
ляет собой его составную часть. На фиг. 67 графически представлена ди-
намика синтеза различных вирусоспецифичных компонентов, синтези-
руемых в клетках, зараженных вирусом осповакцины.
288
Глава XIV
«Фиг. 67. Сравнение образования инфекционого вируса осповакцины и его ДНК и белка.
7 — ДНК; II — белок; Ш — инфекционный вирус. О времени синтеза вирусных ДНК и белка суди-
ли по влиянию, которое оказывали специфические ингибиторы биосинтеза ДНК и белка — 5-фторде-
зоксиуридин и л-фторфенилаланин соответственно — на общий выход вируса. С этой целью к раз-
личным пробам зараженной культуры через разные промежутки времени добавляли соответствую-
щий ингибитор и, беря пробы через каждые 24 час, титровали их. определяя содержание инфекцион-
ного вируса. Для определения динамики максимального накопления вируса через различные интер-
валы времени брали пробы из культур, не содержавших ингибиторов, и эти пробы титровали с
целью определения содержания в них инфекционного вируса. Количество синтезировавшихся вирус-
ных ДНК и белка рассчитывали, сравнивая выход вируса в соответствующих пробах культур, со-
державших и не содержавших соответствующий ингибитор, и принимая, что уменьшение выхода
вируса в культуре, содержащей ингибитор, соответствует уменьшению образования молекул иссле-
дуемого предшественника вируса с момента добавления ингибитора. В культуре, не содержащей
ингибиторов, синтез вирусной ДНК заканчивается через 6 час после заражения, синтез белка — че-
рез 8—10 час, а синтез полного вируса — через 12 час.
Синтез белков вируса осповакцины и контролирование этого процесса
Белки вируса осповакцины синтезируются в полирибосомных систе-
мах, состоящих из m-РНК вируса осповакцины и рибосом клетки-хозяи-
на. Синтез вирусной m-РНК начинается в первый час после заражения.
Эту m-РНК можно выявить и идентифицировать при помощи трех мето-
дов: 1) путем определения фракции РНК, быстро и интенсивно включаю-
щей радиоактивный предшественник, так как клеточная цитоплазмати-
ческая РНК включает метку значительно медленнее, чем вирусная;
2) путем определения ее нуклеотидного состава и 3) путем специфиче-
ского отжига с ДНК вируса осповакцины. Изучение судьбы этой т-РНК,
проведенное путем кратковременной инкубации зараженных вирусом
клеток с мечеными предшественниками РНК и выявления радиоактив-
ной РНК в соответствующих фракциях клетки, показало, что по мере ее
образования эта РНК быстро образует комплекс с рибосомами, в ре-
зультате чего возникают полисомы [417].
В клетках, зараженных вирусом осповакцины, наблюдается увели-
чение активности некоторых ферментов, особенно тимидинкиназы и
ДНК-полимеразы [422]. При ингибировании биосинтеза белка увеличе-
ния активности этих ферментов не наблюдается. Соответствующие фер-
менты, выделенные из зараженных клеток, в какой-то степени отличают-
Размножение вирусов животных
289
ся по своим свойствам от аналогичных ферментов, выделенных из неза-
раженных клеток. Вирус осповакцины вызывает образование некоторого
количества тимидинкиназы даже в тех штаммах клеток мыши, в которых
обычно этот фермент не выявляется [452, 453]. Эти данные наводят на
мысль, что образование этих ферментов, вероятно, кодируется геномом
вируса. Однако вирус осповакцины, облученный ультрафиолетом, кото-
рый, как полагали, не должен депротеинизироваться, тем не менее инду-
Фиг. 68. Влияние актиномицина D и пуромицина на образование и репрессию синтеза
тимидинкиназы в клетках HeLa, зараженных вирусом осповакцины. Активность тими-
динкиназы определяли в суммарных гомогенатах клеток после каждой обработки.
/ — ингибиторы не добавлялись; // — через 2 час после заражения добавлен актиномицин; /// — че-
рез 2 час после заражения добавлен пуромицин; /V — пуромицин добавлен также через 2 час после
заражения, но через 5,5 час отмыт; V — через 2 час после заражения добавлен пуромицин, через
5 час — актиномицин, а через 5,5 час отмыт пуромицин.
цирует образование тимидинкиназы (но не ДНК-полимеразы). Поэтому,
по крайней мере в отношении тимидинкиназы, пока остается неясным,
какой из геномов — вирусный или клеточный — ответствен за синтез
новых ферментов, образующихся в клетках, зараженных вирусом оспо-
вакцины !.
Индукция ферментов вирусом осповакцины в некоторых отношениях
напоминает события, происходящие в клетках Е. сс<П, зараженных Т-чет-
ными фагами. Активность ферментов начинает увеличиваться в первый
час после заражения и продолжает расти примерно в течение пяти часов,
после чего увеличение активности прекращается (фиг. 68). В случае
когда ингибируется синтез ДНК, продолжительность периода, в течение
которого происходит увеличение активности ферментов, намного возра-
стает. Подобным же образом при заражении культуры вирусом, облучен-
ным ультрафиолетом, блокирования синтеза тимидинкиназы не наблю-
дается, вследствие чего ее активность возрастает до величины, превы-
шающей нормальную в 38 раз. Добавление актиномицина в период первых
2 час после заражения культуры ингибирует образование тимидин-
киназы. Однако добавление его через 2, 3 или 4 час после заражения не
1 В настоящее время показано, что m-РНК, кодирующая тимидинкиназу вируса
осповакцины, может транслироваться с родительской ДНК, когда вирус не полностью
депротеинизирован (с нуклеокапсида) (Kates J., Me Auslan В., Proc., Natl. Ac. Sci.
USA, 57, 314, 1967). — Прим. ред.
19 Заказ №1214
290
Глава XIV
уменьшает скорости индукции тимидинкиназы. Более того, в этом случае
отсутствует стабилизация активности, обычно наступающая через
6—7 час после заражения, и активность фермента продолжает возра-
стать по крайней мере в течение 18 час после заражения [550, 551]. Эти
данные показывают, что в основе механизма, ответственного за прекра-
щение синтеза тимидинкиназы при нормальной инфекции, лежит не про-
стое прекращение синтеза соответствующей m-PHK, а ингибирование
уже функционирующей и остающейся стабильной m-PHK.
Для того чтобы это ингибирование произошло, необходим синтез
РНК и белка. Если пуромицин добавляют через 2 час после заражения,
а через 5,5 час отмывают культуру от пуромицина, репрессия запазды-
вает еще на 4 час. Если к моменту удаления пуромицина добавлен акти-
номицин, то репрессия тем не менее устанавливается. Если, однако, ак-
тиномицин (чье действие необратимо) содержится в культуре во время
действия пуромицина, репрессии не наблюдается. Эти данные говорят о
том, что для осуществления репрессии необходим синтез как белка, так
и РНК, и наводят на мысль, что образование белка-репрессора тими-
динкиназы детерминируется вирусной ДНК, программирующей также и
время его синтеза, вследствие чего через 6—7 час после заражения син-
тез тимидинкиназы внезапно прекращается.
АДЕНОВИРУСЫ И ВИРУСЫ ГРУППЫ ГЕРПЕСА
Несмотря на то что аденовирусы и вирусы группы герпеса отлича-
ются друг от друга по строению, циклы их размножения имеют опреде-
ленное сходство. Так, например, и аденовирусы, и вирусы группы герпе-
са созревают в ядре клетки. Однако еще не совсем ясно, все ли компо-
ненты этих вирусов образуются в ядре клетки, или часть из них образу-
ется в цитоплазме, а затем транспортируется в ядро.
Синтез ДНК у аденовирусов начинается примерно через 12 час пос-
ле заражения клегок. Еще 5 час спустя появляется инфекционный вирус
[293]. Количество образующейся вирусной ДНК и вирусных антигенов
намного превышает используемое обычно для образования полного ви-
руса. Вирусоспецифичная РНК, по всей вероятности представляющая
собой m-PHK, была обнаружена в период между шестым и девятым ча-
сом после заражения [690]. Аденовирусную m-PHK можно обнаружить в
цитоплазматических полисомах зараженных клеток [294]. Неясно, одна-
ко, являются ли эти полисомы местом синтеза белка, впоследствии вклю-
чающегося в состав вирионов. Если окажется, что белки вириона дейст-
вительно образуются в цитоплазме и затем транспортируются в ядро, то
эта система может быть с успехом использована в качестве модели для
изучения процесса синтеза ядерных белков как такового.
Синтез ДНК вирусов группы герпеса и вируса псевдобешенства
можно изучить, пользуясь методом центрифугирования в градиенте
плотности, ибо содержание ГЦ-пар в ДНК этих вирусов составляет 74%>
тогда как в клеточной ДНК — 44%. Для того чтобы отличить ДНК ин-
фицирующего вируса от ДНК его потомства, можно для заражения ис-
пользовать вирус, ДНК которого содержит метку, увеличивающую плот-
ность этой нуклеиновой кислоты. Это достигается благодаря полуконсер-
вативному характеру репликации вирусной ДНК [433]. Разрыв цепей и
их воссоединение по типу, наблюдающемуся у Т-четных фагов, у ДНК
вируса псевдобешенства встречается редко. Как ДНК вируса герпеса,
так и ДНК вируса псевдобешенства образуется лишь за час до появле-
ния в клетке полного вируса [432, 706] и накапливается в количестве, пре-
вышающем включающееся впоследствии в полный вирус. Активность
Размножение вирусов животных 291
ДНК-полимеразы и тимидинкиназы в клетках, зараженных вирусом гер-
песа, увеличивается.
В клетках, зараженных этим вирусом, образуются вирусные части-
цы двух типов: у одних частиц имеются внешние оболочки, у других —
нет. Как первые, так и вторые, по-видимому, инфекционны. Полагают,
что внутреннюю оболочку вирус приобретает, когда покидает ядро,'
а полная оболочка образуется только при прохождении вируса через ци-
топлазму [913]. У клеток, зараженных вирусом герпеса, на поверхности
появляются новые антигены. Появление этих антигенов, вероятно, свя-
зано с конечным этапом созревания вируса [680].
ГЕНЕТИКА ВИРУСОВ ЖИВОТНЫХ
В разработке проблемы размножения бактериофагов генетические
эксперименты сыграли по меньшей мере столь же большую роль, как и
биохимические исследования в понимании событий, происходящих при
репликации вирусов. Когда изучение вирусов животных вступило в «ко-
личественную фазу», предпринимались многочисленные попытки разра-
ботать систему, которая подходила бы для проведения генетических эк-
спериментов. Некоторые из этих попыток позволили получить ценные
данные, однако подлинной генетики вирусов животных пока еще не су-
ществует. Основная причина неудачи состоит в трудности получения
мутантов вирусов животных, образующих бляшки различного типа,
и плохой воспроизводимости фенотипа мутантных вирусов.
В табл. 28 приведено описание различных типов мутантов вирусов
животных, пригодных для исследований, проводимых с применением ме-
тода культуры клеток.
Таблица 28
Типы мутантов вирусов животных
Вирус Селективный агент или способ идентификации Примечания
Вирус полиомие- лита Вирус энцефало- миокардита 1. Гуанидин или ОББО 2. Цистин 3. Нагревание 4. Ингибитор, содер- жащийся в лоша- диной и бычьей сы- воротке крови 5. Кислое агаровое покрытие 1. Внешний вид бля- шек 2. Электрофорез 3. Полисахарид Различные препараты подавляют образова- ние РНК вируса дикого типа; существу- ют устойчивые и зависимые мутанты Наличие в культуральной среде цистина по- давляет размножение некоторых штам- мов вирусов; существуют устойчивые и зависимые мутанты Существуют условно летальные мутанты Содержащийся в сыворотке неспецифиче- ский фактор подавляет размножение ви- руса дикого типа; мутанты устойчивы к его действию d-Мутакты (задерживаемые) под таким агаровым покрытием бляшек не образу- ют; вирусы дикого типа обозначаются d+ Существуют мутанты, образующие большие или маленькие бляшки, шероховатые илц гладкие, с ореолом или без ореола Вирус дикою типа и мутанты могут быть разделены при помощи электрофореза в жидкой среде Вирус дикого типа чувствителен к присут- ствию некоторых полисахаридов; сущест- вуют мутанты, устойчивые к действию полисахаридов
19’
292:
Глава XIV
Продолжение
Вирус Селективный агент или спо:об идентификации Примечания
Вирус Синдбис 1. Температура
Вирус НЫ осповакци- 1. Внешний вид пора- жений, вызывае- мых вирусом 2. Условная леталь- ность 3. Тепловой шок 4. Тимидинкиназа
Вирус гриппа 1. Образование бля- шек 2. Различные иные проявления
Вирус ньюкаслс- 1. Внешний вид бля-
кой болезни шек 2. Нагревание
Вирус герпеса 1. Внешний вид бля- шек 2. Тимидинкиназа
Вирус псевдобе- 1. Внешний вид бля-
шенства шек
1)2-(<х-оксибензил)-бензимидазол.
Существуют условно летальные мутанты
двух типов: образующие инфекционную
РНК и не образующие такой РНК; ни
первые, ни вторые при температуре выше
39° полный вирус не образуют
Особенно распространены мутанты, образу-
ющие белые или красные оспенные пус-
тулы (см. текст). Многие маркеры выя-
вляются при размножении вирусов в ор-
ганизме животных
Существуют штаммы, размножающиеся в
клетках почки свиньи, но не размножа-
ющиеся в клетках КВ (явление, аналоги-
чное образованию супрессор-чувствитель-
ных мутантов фагов)
Вирионы вирусов дикого типа чувствитель-
ны к тепловому шоку, мутанты (не ус-
ловно летального типа) относительно
устойчивы
При инфекции, вызываемой вирусом дико-
го типа, активность этого фермента уве-
личивается; мутанты подобного эффекта
не вызывают
Большинство штаммов вируса гриппа не
образует бляшек in v;tro; один же из
штаммов вируса типа А образует их
У зараженных животных выявляются раз-
личные серологические и иные проявле-
ния инфекции
Мутные или прозрачные бляшки
Существуют как чувствительные, так и ус-
тойчивые к нагреванию вирионы (мутанты
не условно летального типа)
Существуют штаммы либо образующие
бляшки, либо образующие синцитий
Мутанты ведут себя аналогично мутантам
вируса осповакцины
Размер бляшек
Генетика вируса полиомиелита
В опытах по смешанному заражению было выявлено несколько типов
взаимодействия между различными штаммами вируса полиомиелита.
При одновременном заражении клеток вирусами полиомиелита ти-
па 1 и 2 некоторые из вирионов-потомков содержат белки, характерные
для обоих вирусов, но лишь один тип РНК [499]. При высокой множест-
венности заражения степень такого фенотипического смешивания дости'
гает 100%, что говорит о существовании связи между отдельными участ-
ками клетки, в которых идут процессы образования белка капсида и
сборки вирионов соответственно. Анализ зависимости частоты фенотипи-
Размножение вирусов животных
293
ческого смешивания от множественности заражения показывает, что не-
которые вирионы вируса полиомиелита, не оказывающие эффективного
влияния на генотип вирусного потомства, могут тем не менее индуциро-
вать синтез капсидных белков вируса.
Добавление к клеткам, зараженным вирусом полиомиелита типа 1,
который был инактивирован ультрафиолетом, больших количеств вируса
полиомиелита типа 2 приводит к реактивации генома вируса полиомие-
лита типа 1 [192]. Это было названо перекрестной реактивацией. Как
полагают, в ее основе лежит компенсирование активной частицей ка-
кой-то существенной функции, которую инактивированная частица осу-
ществить не в состоянии (вызываемое ультрафиолетом функциональное
повреждение при отсутствии генетического повреждения). Эти резуль-
таты свидетельствуют о том, что частицы вируса полиомиелита, отличаю-
щиеся друг от друга по белкам капсида, выполняют функции, результат
которых может использоваться при репликации в данной клетке ви-
руса, обладающего иным геномом. Эта гипотеза возникла в связи с
обнаружением у мутантов вируса полиомиелита, чувствительных к ин-
гибирующему действию гуанидина, способности расти в его присутствии
при смешанном заражении, в котором участвовали и мутанты, устойчи-
вые к действию этого соединения [896].
Были получены штаммы вируса полиомиелита с такими генетиче-
скими различиями, которые позволили осуществить их селективное тит-
рование и с помощью которых удалось продемонстрировать процесс ге-
нетической рекомбинации. Максимальная частота образования рекомби-
нантов составляла приблизительно 0,4%. Относительное содержание
рекомбинантов в популяции несколько увеличивалось с увеличением вре-
мени, прошедшего после заражения, что наводит на мысль об участии в
инфекционном процессе вновь образовавшихся вирусных геномов [498].
Генетика миксовирусов
Уже первые попытки изучения генетики вируса гриппа, предприня-
тые еще до разработки метода титрования вирусов путем подсчета чис-
ла бляшек, оказались удивительно успешными и привели к обнаружению
ряда интереснейших явлений. Рекомбинация, т. е. появление у одной
вирусной частицы нового комплекса генетических признаков, получен-
ного ею от двух родительских вирусов, была обнаружена при заражении
куриных эмбрионов вирусом гриппа двух четко отличающихся друг от
друга типов [114]. Были обнаружены также фенотипическое смешивание
и перекрестная реактивация [359].
Более количественный подход возможен при работе с вирусом нью-
каслской болезни и некоторыми штаммами вируса гриппа, ибо эти виру-
сы можно титровать при помощи определения числа бляшек. Изучение
смешанного заражения различными штаммами вируса гриппа показало,
что даже в том случае, когда множественность заражения составляет
всего 1 БОЕ на клетку, почти половина вирусного потомства представ-
ляет собой рекомбинанты (следует, однако, иметь в виду, что 1 БОЕ ви-
руса гриппа соответствует нескольким вирионам) [352]. Столь высокая
частота рекомбинаций наводит на мысль, что в данном случае они, быть
может, осуществляются по какому-то необычному механизму. Такая воз-
можность может возникнуть, например, в том случае, если в одном ви-
рионе вируса гриппа содержится не одна, как это бывает обычно, а не-
сколько молекул РНК.
В пользу такой точки зрения говорит также и ряд других данных.
Так, из вирусов гриппа и вируса классической чумы птиц никогда не уда-
валось экстрагировать фрагменты РНК, молекулярный вес которых пре-
294
Глава XIV
вышал бы 3 105—4 • 105 дальтон, что составляет примерно от 7б до
Vs РНК, содержащейся в одном вирионе. Кроме того, спиральный нук-
леокапсид также выделяется из внешней оболочки вириона скорее в виде
фрагментов, чем в виде одной нити. При смешанном заражении культу-
ры двумя различными штаммами вируса ньюкаслской болезни 10% ви-
рионов потомства являются гетерозиготами [290], т. е. частицами, обла-
дающими свойствами обоих родителей. Гомозиготные и гетерозиготные
частицы вируса ньюкаслской болезни инактивировались ультрафиолетом
с равной скоростью, что указывает на то, что гетерозиготные частицы не
содержат двух полных наборов функционирующих геномов.
Эти данные, полученные при исследованиях, проводившихся в самых
различных направлениях, согласуются с представлением о геноме вирио-
на миксовируса как о структуре, состоящей из нескольких молекул РНК.
Тем не менее справедливость подобного объяснения особенностей генети-
ки миксовирусов сомнительна, ибо из вирионов вируса ньюкаслской бо-
лезни можно экстрагировать молекулы РНК, молекулярный вес которых
составляет примерно 7 106 дальтон. Одна молекула РНК такого моле-
кулярного веса соответствует полному содержанию РНК в вирионе этого
вируса [194]!.
При смешанном заражении клеток штаммом вируса гриппа А, не-
способным образовывать бляшки, и штаммом, убитым ультрафиолетом,
но способным образовывать бляшки и обладающим иной серологической
специфичностью, наблюдается другой тип генетического взаимодействия
[774], а именно образование стабильных рекомбинантов. Однако эти ре-
комбинанты образуются с низкой частотой, сравнимой по величине с ча-
стотой рекомбинаций, наблюдаемой при смешанном заражении вирусом
полиомиелита. В случае этого типа рекомбинаций, возможно, происходит
разрыв и воссоединение цепей РНК.
Генетика вирусов группы оспы
Изучались два вида генетических взаимодействий между вирусами
группы оспы: рекомбинация и реактивация. Рекомбинация у этих круп-
ных ДНК-содержащих вирусов осуществляется очень легко и по суще-
ству представляет собой явление того же типа, что и рекомбинация у
Т-четных фагов.
Наиболее четкие результаты дали эксперименты с серией различных
мутантов вируса осповакцины, у которых, однако, мутация выражалась
в изменении лишь одного свойства — цвета оспенных пустул, образуемых
вирусом на хориоаллантоисной мембране. В соответствии с результата-
ми, полученными при попарном скрещивании этих мутантов путем сме-
шанного заражения тканевых культур, они были разделены на две груп-
пы. Мутанты каждой из групп при взаимодействии друг с другом не об-
разовывали рекомбинантов, однако в каждой из этих групп имелся по
крайней мере один член, при взаимодействии которого с мутантами дру-
гой группы возникали рекомбинанты дикого типа. Оказалось, что можно
определить, в какой линейной последовательности располагаются му-
тантные локусы [260, 261]. Формально можно считать, что у вирусов этих
групп имеются мутации в двух цистронах, каждый из которых контроли-
рует проявление одного и того же фенотипического признака, по анало-
гии с rll-мутантами Т-четных фагов (гл. X).
1 В настоящее время доказано, что РНК вируса гриппа в отличие от РНК вируса
ньюкаслской болезни не является единой молекулой, а состоит из нескольких дискрет-
ных фрагментов (Duesbery Р., Proc. Natl. Ac. Sci. USA, 59, 930, 1968; Pons М.,
Hirst G., Virology, 34, 385, 1968). — Прим. ped.
Размножение вирусов животных
295
При смешанном заражении, вызванном инактивированным ультра-
фиолетом вирусом осповакцины одного штамма и активным вирусом ос-
повакцины другого штамма, рекомбинанты образуются очень легко.
В случае когда для подобных опытов используют смесь соответствующих
вирионов, подвергнутых действию концентрированного раствора магние-
вой соли (такое воздействие приводит к агрегации вирионов), количест-
во рекомбинантов в потомстве вирионов возрастает по сравнению с на-
блюдаемым при заражении смесью неагрегирующих вирионов [1]. (Ана-
логичное воздействие также приводит к увеличению частоты рекомбина-
ций у вируса ньюкаслской болезни.) Это наблюдение наводит на мысль,
что низкая частота рекомбинаций у вирусов животных объясняется, воз-
можно, слишком большими размерами животной клетки, вследствие чего
вероятность контакта между вирусными геномами, происходящими из
двух родительских вирионов, очень мала. Агрегация вирионов перед за-
ражением увеличивает возможность локального контакта между вирус-
ными нуклеиновыми кислотами, что способствует рекомбинациям. Дей-
ствительно, результаты исследований, проведенных с применением мето-
да радиоавтографии, показывают, что в клетках, зараженных вирусами
группы оспы с высокой множественностью, действуют как бы отдельные
«вирусные фабрики», начинающие сливаться друг с другом только на
поздней стадии инфекции [121].
Другой тип взаимодействия между вирусами группы оспы, ведущего
к «взаимопомощи»,— феномен Берри — Дедрика, имеет нерекомбинаци-
онную природу. Если на клетках сначала адсорбировать вирус оспы,
предварительно лишенный инфекционности путем нагревания или обра-
ботки мочевиной (но не ультрафиолетом), а затем суперинфицировать
те же клетки каким-либо иным вирусом группы оспы, то в вирусном по-
томстве будет содержаться некоторое количество инфекционного вируса
того типа, который был инактивирован [419, 420]. Интересно, что реак-
тивировать вирус, убитый нагреванием или мочевиной, может даже ви-
рус, чья ДНК частично повреждена действием азотного аналога иприта.
За явление реактивации этого типа ответствен механизм депротеини-
зации ДНК вируса осповакцины, уже описанный выше в гл. XIII [415].
Инфицирующая частица вируса индуцирует образование клеткой «раз-
девающего» фермента, который и освобождает вирусную ДНК из ее кап-
сида. Вирус оспы, инактивированный мочевиной или нагреванием, не в
состоянии вызвать эту реакцию со стороны клетки, но в случае, если эта
функция выполняется какой-либо другой частицей вируса группы оспы,
даже генетически отличающейся от первой, механизм, приводящий к де-
протеинизации, воздействует на все вирусные частицы, содержащиеся в
данной клетке
Другим многообещающим подходом, применимым при изучении ге-
нетики вирусов группы оспы, является использование условно летальных
мутаций. Думается, что различие в способности определенных штаммов
вируса осповакцины размножаться в соответствующих штаммах клеток
обусловлено генетическими различиями, подобными супрессор-чувстви-
тельным мутациям бактериофагов (гл. X). Например, можно полагать,
1 Как уже отмечалось в примечании к стр. 262, депротеинизация вируса оспо-
вакцины осуществляется, по-видимому, белком, закодированным в геноме вируса. Син-
тез гл-PH К, кодирующих ряд ранних вирусоспецифичных белков, в том числе, ви-
димо, и «раздевающий» вирус фермент, осуществляется ДНК-зависимой РНК-полиме-*
разой, входящей в состав белков нуклеокгпсвда вириона (Kates J., М с A u s 1 а п,
Proc. Natl. Ac. USA. 58, 134, 1967). Этот фермент оказался высокочувствительным
к действию повышенной температуры (Woodson В., Bacteriol Rev., 32, 127, 1968).
Видимо, инактивация этого фермента и лежит в основе феномена Берри — Дедрика.—
Прим. ред.
296
Глава XIV
что соответствующий штамм может расти в клетках курицы, но не в
клетках почки свиньи из-за того, что некоторые его гены могут трансли-
роваться, образуя активные продукты, с помощью трансляционных ме-
ханизмов клетки курицы, тогда как в клетках почки свиньи этот процесс
осуществляться не может [224, 553]. Такого рода ситуация, если ее спра-
ведливость подтвердится, может дать в руки исследователей мощный ин-
струмент, с помощью которого можно будет определить функцию отдель-
ных генов генома вируса оспы.
Глава XV
ДЕЙСТВИЕ ВИРУСОВ ЖИВОТНЫХ НА КЛЕТКУ
И ОРГАНИЗМ
ОБРАЗОВАНИЕ ВИРУСА И ПОРАЖЕНИЕ ХОЗЯИНА
Исследования событий, наблюдаемых при вирусной инфекции кле-
ток животных, в основном имели целью изучение синтеза вновь обра-
зующихся вирусных компонентов, а не влияния, оказываемого вирусной
инфекцией на зараженные клетки. В значительной степени это было выз-
вано тем, что за судьбой чужеродного вирусного материала можно про-
следить сравнительно легко, тогда как методы, необходимые для изуче-
ния влияния вирусной инфекции на клеточные процессы, разрабатыва-
лись медленно. Однако определенную роль сыграло и то обстоятельство,
что для обеспечения синтеза вируса исходными веществами, по-видимо-
му, не требуется большого нарушения целостности клетки животного.
Большинство вирусов животных использует для синтеза вновь обра-
зующихся вирионов максимум от 0,1 до 2 или 3% общей массы заражен-
ной клетки, причем новые вирионы могут строиться из компонентов кис-
лоторастворимого фонда, существующего в клетке в момент заражения.
Поэтому можно полагать, что полное разрушение клетки с целью реути-
лизации ее составных частей необязательно. Таким образом, многие из
наблюдаемых нами на поздней стадии репликативного цикла вируса из-
менений клетки могут не иметь никакого отношения к образованию но-
вого вируса. Одно дополнительное наблюдение особенно подчеркивает
различную природу событий, происходящих при образовании вируса,
и событий, специфически влияющих на животную клетку: у многих ви-
русов животных, размножающихся в цитоплазме, часть из их наиболее
выраженных воздействий сказывается не на цитоплазме, а на ядре
клетки.
Поэтому нам представляется целесообразным самостоятельное рас-
смотрение вопросов, связанных с процессом образования вируса, кото-
рые мы описали в гл. XIV, и вопросов, связанных с влиянием, оказывае-
мым вирусом на клетку. Кроме того, во многих случаях взаимодействия
вирусов животных с клетками за специфические изменения клеток, вызы-
ваемые вирусами, могут быть ответственны продуцируемые вирусом ве-
щества, отличающиеся от тех, которые необходимы для его репликации.
Справедлива ли эта концепция в отношении любых вирусных инфекций,
неизвестно. Ниже мы еще вернемся к рассмотрению этого вопроса, ког-
да будем обсуждать влияния, оказываемые вирусами животных, сначала
на клеточном уровне, а затем и на уровне организма в целом.
ВЛИЯНИЕ вирусной инфекции на клеточном уровне
Различают три вида воздействий, оказываемых вирусами животных
на их клетки-хозяева. Наиболее легко выявляется деструктивный, или
цитолитический, эффект, характерной особенностью которого является
общая деструкция или растворение клетки, наступающие вслед за мно-
жеством визуально наблюдаемых морфологических изменений. Многие
— 297 —
Глава X V
f’-
из таких изменений, ведущих к столь катастрофической реакции, могут
быть на самом деле вторичными последствиями небольшого числа пер-
вичных, специфически вызываемых вирусом событий. Недавние наблю-
дения обнаружили образование вирусоспецифичных соединений, возмож-
но имеющих отношение к нарушению функций клетки. Быть может, имен-
но эти соединения инициируют цепь событий, ведущих к деструкции клет-
ки, которые осуществляются в конечном счете продуктами метаболизма
самой клетки.
Другим крайним проявлением действия вирусов на клетки-хозяева
является реакция, получившая название реакции трансформации зара-
женной вирусом клетки. Наиболее убедительные данные, которыми мы
располагаем в настоящее время, указывают на то, что при такого рода
влиянии, оказываемом на клетку вирусом, весь геном вируса (или часть
его) находится в клетке в течение неопределенно долгого времени, что
приводит, однако, не к гибели клетки, а к приобретению ею способности
к неограниченному размножению. Явлению трансформации клетки опу-
холеродными вирусами посвящена гл. XVI. Действие некоторых вирусов
на клетки по своему характеру является промежуточным между резко
выраженным деструктивным и таким, при котором имеет место интегра-
ция вируса с клеткой, продолжающей функционировать в течение не-
которого промежутка времени после заражения.
Клетки отвечают на вирусную инфекцию еще одним, третьим, видом
реакции, который мы далее будем называть индуктивным действием
вируса на клетку. Под этим термином имеется в виду способность вируса
индуцировать образование в инфицированной клетке веществ, детерми-
нируемых не вирусным, а клеточным геномом, но в норме, по-видимому,
не продуцируемых данным типом клеток. Подобным свойством обладают
многие вирусы. Этот тип реакции клетки на вирусную инфекцию не обя-
зательно связан с тем или иным типом конечного результата взаимодей-
ствия вируса с клеткой.
ДЕСТРУКТИВНОЕ ДЕЙСТВИЕ ВИРУСОВ НА КЛЕТКИ
Морфологические наблюдения
Попытки обнаружить корреляцию между патогистологическими из-
менениями, возникающими в различных тканях целостного организма,
и динамикой развития вирусной инфекции наталкивались на трудности,
связанные с тем, что часто было невозможно ответить на вопрос, дей-
ствительно ли заражена данным вирусом та или иная изучаемая клетка.
После широкого введения в практику вирусологических исследований
метода культур клеток большое число исследований было посвящено изу-
чению морфологических изменений, вызываемых отдельными вирусами
в культивируемых клетках различного типа. При этом широко использо-
вались обычная световая и электронная микроскопия, а также метод
флуоресцирующих антител. В табл. 29 суммированы данные, получен-
ные при изучении морфологических изменений, наблюдаемых при зара-
жении некоторыми из наиболее хорошо изученных вирусов, а на фото 55
в качестве примера приведены соответствующие микрофотографии.
При суммировании результатов этих исследований становится оче-
видным, что в ответ на заражение вирусом, в клетках наблюдаются са-
мые различные реакции и в ряде случаев обнаруживаются весьма ха-
рактерные изменения.
Например, вирус полиомиелита и вирус западного энцефаломиелита
лошадей вызывают цитолитическую реакцию, характерной особенностью
которой является сморщивание зараженных клеток, слипание ядерного
Действие вирусов животных на клетку и организм
299
содержимого и истечение из этих клеток содержащихся в них веществ.
В свою очередь вирус осповакцины и вирус ньюкаслской болезни вызы-
вают округление клеток, которое не так резко бросается в глаза, а дест-
рукция клеток в этом случае происходит со значительно меньшей ско-
ростью. Очень интересное явление, названное поликариоцитозом, наблю-
далось при заражении клеток вирусами герпеса и кори. В культурах,
зараженных этими вирусами, наблюдается слияние клеток, тогда как от-
дельные ядра, по-видимому, сохраняют свою самостоятельность. Одним из
первых эффектов, наблюдаемых при заражении культуры клеток адено-
вирусами, является изменение свойств поверхности зараженных клеток,
вследствие чего эти клетки отрываются от стекла. Эти данные наводят
на мысль, что вирус очень быстро вызывает сильно выраженное изме-
нение свойств поверхности зараженных клеток. Значение этих изменений
поверхности мы обсудим в гл. XVI, когда будем рассматривать изменения
клеток, вызываемые опухолеродными вирусами.
Четкой корреляции между степенью изменения клеток и продолжи-
тельностью соответствующих стадий репродукции вируса не наблюдает-
ся. Многие из изменений клеток, вызываемых вирусом, выявляются лишь
на самых поздних стадиях инфекции, и их можно обнаружить лишь после
того, как образование нового вируса уже завершилось. Это обстоятель-
ство наводит на мысль, что возникающие при вирусной инфекции изме-
нения клеток не обязательно должны быть прямым, непосредственным
результатом функционирования генома вируса. Более того, для выявле-
ния цитопатического действия вируса совершенно не обязательно, чтобы
в соответствующем порядке реализовался весь цикл событий, кульмина-
ционным пунктом которых является образование инфекционного вируса.
Например, деструктивное действие, оказываемое вирусом гриппа на
клетки HeLa, наблюдается при отсутствии образования инфекционного
вируса [277]. Однако вирусный антиген при этом образуется, и не исклю-
чено, что первичное повреждение клеток может быть результатом реа-
лизации той части генетических потенций вируса, которая действительно
реализуется при этой абортивной инфекции.
Аналогично в клетках HeLa, зараженных вирусом полиомиелита, на-
рушение обмена липидов и синтеза белков и нуклеиновых кислот проис-
ходит даже в том случае, когда репликации вирусной РНК не происхо-
дит [642]. Следовательно, в этом случае функции, выполняемой прони-
кающими в клетку цепями вирусной РНК, достаточно для того, чтобы
вызвать изменения этой клетки, несмотря на то что «машина», действие
которой ведет к образованию нового вируса, блокирована. Примечателен
тот факт, что эти зараженные вирусом полиомиелита клетки, в которых
блокирован синтез вирусной РНК, выглядят нормальными с точки зре-
ния их морфологии в течение многих часов после заражения [36]. Ответ
на вопрос о том, какие из морфологических изменений клетки, наблюда-
ющихся при вирусных инфекциях, являются прямым результатом дей-
ствия вируса, а какие из них — следствием вторичных реакций клетки,
может быть получен только путем проведения детального биохимического
анализа.
«Классические» изменения, наблюдаемые в клетках тканей зара-
женных животных при помощи обычного светового микроскопа, напри-
мер образование телец-включений, легко воспроизводятся при заражении
соответствующим вирусом тканевой культуры. Большинство, если не все
тельца-включения, представляют собой центры синтеза и накопления
вируса. Наиболее убедительно это было показано в отношении цитоплаз-
матических включений, образующихся при заражении клеток вирусами
группы оспы, и ядерных включений, образующихся при заражении кле-
ток вирусом герпеса [121, 598].
Типичные цитопатические изменения в клетках, зараженных вирусами животных
Таблица 29
Вирус Изменения, наблюдаемые в ядре Изменения, наблюдаемые в цитоплазме Примечания
Мелкие РНК-содержашие вирусы, не имеющие внешней оболочки Миксовирусы Вирус гриппа и вирус классической чумы птиц Вирус свинки и вирус ньюкаслской болезни Реовирус Вирус кори Пикноз; ядро занимает эксцентричес- кое положение в клетке Пикноз Пикноз Ядра почти не изменяются Наблюдаются включения, локализу- ющиеся как в цитоплазме, так иног- да и в ядре В некоторых клетках выявляются большие массы эозинофильного ве- щества, вызывающие смещение яд- ра; резко увеличенная базофилия; по периферии клетки наблюдается «вскипание» цитоплазмы Вакуолизация цитоплазмы, сморщи- вание и дегенерация. При элект- ронно-микроскопических исследо- ваниях на поверхности клерки вы- является «отпочковывание» ви- руса Образуются отчетливые эозинофипь- ные цитоплазматические включе- ния, дающие при окраске по Фёль- гену отрицательную реакцию В цитоплазме образуются характер- ные массы эозинофильного вещест- ва, постепенно занимающие боль- шую часть цитоплазмы Путем конденсирования небольших скоплений эозинофильного вещест- ва образуются эозинофильные вклю- чения, которые при окраске по Фёльгену дают отрицательную ре- акцию Эти вирусы относятся к числу наи- более быстро действующих цитопа- тических инфекционных агентов При вызываемой ими деструкции клеток какие-либо специфические особенности не наблюдаются. Из- менения клеток могут происходить даже в том случае, когда размно- жение вируса блокируется При деструктивных изменениях, вы- зываемых этими вирусами, каких- либо четко выраженных хапактер- ных особенностей не наблюдается При заражении вирусом свинки часто наблюдается слияние клеток при отсутствии деления ядер При окраске акридиновыми красите- лями цитоплазматические массы флуоресцируют желто-зеленым цве- том (поскольку одноцепочечная РНК при такой окраске флуорес- цирует красным цветом, это гово- рит о наличии в данном случае двухцепочечной РНК) Характерно образование гигантских клеюк; образуются также верете- новидные и звездчатые клетки
Вирусы группы оспы
Маргинания и зернистость хромати
на
Вирусы группы герпеса
Аденовирусы
Уже на раннем этапе развития ин-
фекции обнаруживается смещение
ядрышка; хроматин приобретает
вид сеточки, а затем становится
зернистым и наблюдается его мар-
гинация; в центре ядра сохраняет-
ся характерное фёльген-положи-
тельное включение
Типы 1, 2, 5 и 6 вызывают образова-
ние небольших эозинофильных
включений, увеличивающихся в
размерах и в конце концов выяв-
ляющихся в виде фёльген-положи-
тельных телец, окруженных пузырь-
ками, причем в этих тельцах с по-
мощью электронного микроскопа
обнаруживаются кристаллы вируса.
Вторая группа вирусов (типы 3, 4,
и 7) вызывает образование скоп-
лений, имеющих вид розеток; кри-
сталлы, выявляемые в этих розет-
ках при помощи электронного ми-
кроскопа, состоят, по-видимому, из
вирусного белка
Образуются отчетливые фёльген-по-
ложительные цитоплазматические
включения, содержащие вирионы,
количество которых по мере раз-
вития инфекции увеличивается;
число включений на ранней стадии
инфекции зависит от множествен-
ности заражения
Вакуолизация, особенно выраженная
в гигантских клетках
Вирусы этой группы отличаются друг
от друга в отношении скорости и
степени вызываемой ими деструк-
ции клеток и компактности пора-
жений, образуемых в клеточном
пласте
Конечный результат инфекции может
быть различным; наблюдается ли-
бо пролиферация клеток [с амито-
тическим делением ядер и (или)
образованием гигантских много-
ядерных клеток], либо деструкция
Обнаруживаются небольшие измене-
ния
Клетки, особенно зараженные адено-
вирусами типа I, 2, 5 и 6, теряют
способность прикрепляться к стек-
лу; цитопатические изменения раз-
виваются медленно; отчетливые
бляшки образуются не ранее 9—
11-го дня после заражения
302
Глава XV
Важные данные, касающиеся морфологических изменений клеток,
вызываемых вирусной инфекцией, были получены при изучении хромо-
сом клеток, зараженных ДНК-содержащими вирусами, размножающими-
ся в ядре. Оказалось, что как вирус герпеса, так и вирус полиомы очень
часто вызывают образование хромосомных мостиков. Вирус герпеса, по-
видимому, вызывает разрывы некоторых определенных хромосом, тогда
как действие вируса полиомы менее специфично и он может, вероятно,
вызывать повреждения всех хромосом зараженной клетки {818, 875]. Еще
один интригующий факт был обнаружен при изучении морфологических
изменений, вызываемых реовирусом. Оказалось, что белок капсида рео-
вируса обладает сродством к веретену — одному из элементов митоти-
ческого аппарата клетки (фото 55). Было обнаружено, что в интерфаз-
ной клетке белок этого вируса образует линейную структуру, локализую-
щуюся вблизи ядра в той области, где располагаются нити веретена.
Эти данные были сначала получены при помощи метода флуоресци-
рующих антител, а затем подтверждены при электронно-микроскопиче-
ских исследованиях [159, 802].
Таким образом, прекращение митотических делений, наблюдающее-
ся при многих вирусных инфекциях, по крайней мере в случае зараже-
ния вирусом герпеса и реовирусами, имеет морфологическую основу.
Участвующий в этом биохимический механизм пока остается неясным.
В зараженных вирусом клетках наблюдается еще одна морфологи-
ческая аномалия, биохимическая основа которой также пока не изуча-
лась, а именно разрушение митохондрий. В клетках, зараженных виру-
сом полиомиелита, разрушение митохондрий является одним из важней-
ших событий, происходящих на ранних этапах репродукции вируса. Это
явление наблюдается в клетках при заражении их также и другими ви-
русами, оказывающими цитолитическое действие [161].
Биохимические процессы
Поскольку обязательным условием роста клеток является увеличе-
ние содержания в них белка и нуклеиновых кислот, существенную инфор-
мацию о процессах взаимодействия вируса и клетки можно получить пу-
тем определения содержания в зараженных клетках как общего белка,
так и нуклеиновых кислот. При проведении такого рода исследований же-
лательно не только определить содержание в клетках белка, РНК и ДНК,
но и, используя методы радиоавтографии и фракционирования клеток,
установить как место синтеза или накопления в клетке соответствующих
макромолекул, так и последовательность происходящих событий, напри-
мер выяснить, необходим ли предварительный синтез белка для того,
чтобы происходил синтез вирусной нуклеиновой кислоты.
Синтез клеточной ДНК при вирусной инфекции
Способностью прекращать синтез клеточной ДНК обладают многие
вирусы, однако механизмы, благодаря действию которых этот эффект
достигается при той или иной вирусной инфекции, могут сильно отличать-
ся друг от друга. Так, РНК-содержащие энтеровирусы, например вирус
полиомиелита и вирус Менго, размножаются в цитоплазме, что, видимо,
не требует вмешательства в функции клеточного ядра или его ДНК. Тем
не менее в клетках, зараженных этими вирусами, синтез ДНК прекра-
щается через несколько часов после заражения и митотических делений
больше не наблюдается [237, 716]. ДНК клетки-хозяина не претерпевает
больших изменений. Об этом можно судить по тому, что изучение мат-
ричной функции ДНК, экстрагированной из таких клеток, показало, что
Действие вирусов животных на клетку и организм
303
в реакции с РНК-полимеразой эта ДНК ведет себя подобно ДНК, эк-
страгированной из интактных клеток. Тем не менее остается неизвест-
ным, происходит ли увеличение активности ДНК-азы или изменение ак-
тивности ДНК-полимеразы в клетках, зараженных РНК-содержащими
вирусами, или нет.
Вирус осповакцины также размножается в цитоплазме и тоже вы-
зывает прекращение синтеза ДНК клетки-хозяина. Однако различные
штаммы этого вируса прекращают синтез ДНК клеток через различные
промежутки времени после заражения. Так, например, в клетках, зара-
женных медленно размножающимися штаммами вируса осповакцины,
синтез ДНК остается почти не нарушенным по прошествии около 6 час
после заражения [121, 310]. Затем синтез ДНК резко подавляется, но
тем не менее в этих клетках еще можно наблюдать митотическое деление
ядра. В клетках, зараженных более быстро размножающимся штаммом
вируса осповакцины, также наблюдается резкое уменьшение скорости
синтеза ДНК клетки, но это происходит уже в течение первого часа пос-
ле заражения вирусом [416]. В клетках, зараженных описываемым нами
вирусом осповакцины, обнаруживается несколько видов ДНК-азной ак-
тивности, отличающихся друг от друга по специфичности в отношении
одноцепочечных и двухцепочечных ДНК и по оптимумам действия. По-
видимому, в таких клетках образуются различные ДНК-азы. Играют ли
эти ДНК-азы какую-либо роль в прекращении синтеза ДНК клетки,
остается неизвестным [220].
ДНК-содержащие вирусы, относящиеся к группе герпеса, а именно
вирус простого герпеса и вирус псевдобешенства, размножающиеся в
цитоплазме, также прекращают синтез ДНК клетки-хозяина, причем это
происходит по прошествии 2—10 час после заражения [432, 686]. Этот
эффект можно легко продемонстрировать, используя метку тимидином,
ибо большое различие между вирусной и клеточной ДНК в отношении
содержания ГЦ-пар (65—70 и 44% соответственно) позволяет разделить
эти ДНК при помощи центрифугирования в градиенте плотности CsCl.
Вирусы группы герпеса также подавляют митотические деления [820].
Как и в случае заражения вирусом осповакцины, в данном случае тоже
наблюдается увеличение ДНК-азной активности. Вызвано ли это осво-
бождением клеточной ДНК-азы или синтезом ДНК-азы, детерминируе-
мой геномом вируса, не ясно. Однако обнаружены некоторые мутанты
вируса, которые, как оказалось, не в состоянии индуцировать увеличение
активности ДНК-азы, но тем не менее могут размножаться и вызывают
цитопатический эффект.
Следует подчеркнуть, что при этих вирусных инфекциях, несмотря
на появление ДНК-азы, ДНК клетки-хозяина не деградирует слишком
сильно. Одной из причин этого может служить то, что большая часть
ДНК в клетках животных связана с гистонами, что предохраняет ее от
действия ДНК-азы. Возможно, что именно разрушение небольшой части
незащищенной ДНК ответственно за прекращение ее синтеза или за
ошибки, возникающие при действии репаративных ферментов, резуль-
татом чего является образование хромосомных мостиков.
Несмотря на отсутствие прямых биохимических доказательств, ряд
косвенных данных говорит за то, что некоторые другие вирусы также по-
давляют процесс синтеза ДНК клетки. При аденовирусной инфекции,
например, наблюдается образование очень большого количества виру-
соспецифичной ДНК, а интенсивность синтеза всей ДНК в целом не из-
меняется. Поэтому представляется вероятным, что в таких клетках обра-
зование клеточной ДНК подавлено [293]. Арбовирусы и многие миксови-
русы могут вызвать полную дезорганизацию и разрушение клетки в
течение нескольких часов после заражения. Вирус западного энцефало-
304
Глава XV
миелита лошадей был первым вирусом животных, при работе с которым
удалось получить литические бляшки [196], а вирус ньюкаслской болез-
ни очень быстро разрушает фибробласты куриного эмбриона [240]. Эти
вирусы прекращают синтез не только ДНК, но и всех других макромоле-
кул, образующихся в клетке.
Спектр действия микровирусов не ограничен, однако, явлениями,
вызывающими полную деструкцию клеток. Известны случаи, когда при
инфекциях, вызываемых миксовирусами, гибель клеток наступает да-
леко не сразу, как, например, при заражении клеток HeLa вирусом
ньюкаслской болезни {909]. Известен по крайней мере один пример,
а именно заражение клеток почек обезьян обезьяньим вирусом 5, когда
продуцирование клетками больших количеств вируса в течение длитель-
ного времени, по-видимому, совместимо с непрерывным ростом клеток и
их делением [140].
Синтез РНК и белка клетки при вирусной инфекции
Известно, что заражение клеток вирусами полиомиелита и Менго
приводит к резкому подавлению образования клеточных РНК и белка
[165, 237, 716]. В выяснении механизма этого ингибирующего действия
был достигнут некоторый прогресс. Так, было обнаружено, что при за-
ражении L-клеток вирусом Менго резкое прекращение синтеза клеточной
РНК в течение первого часа после заражения происходит лишь в том
случае, если не препятствуют синтезу белка в зараженной клетке. Это
означает, что ингибирование вызывает вирусоспецифичный белок.
. Подвергая интактное ядро, выделенное из незараженной клетки,
действию цитоплазмы зараженных клеток, можно вызвать в нем огра-
ниченное подавление синтеза РНК. Фактор, ответственный за этот эф-
фект, чувствителен к действию трипсина и экстрагируется кислотой, а
это говорит в пользу того, что он, быть может, является основным бел-
ком, обладающим свойствами гистона [39]. Было показано, что кривая,
отражающая подавление вирусами полиомиелита и Менго суммарного
синтеза РНК клетки, идет параллельно кривой, отражающей уменьше-
ние содержания в клетке комплекса ДНК—РНК-полимераза, который
можно выделить из нормальных клеток [237, 356]. Поскольку суммар-
ная скорость синтеза РНК отражает главным образом скорость образо-
вания рибосомной РНК [739], не удивительно, что в клетках, заражен-
ных вирусом полиомиелита, в первую очередь отмечается подавление
синтеза именно этого вида РНК [164]. На ранних стадиях инфекции ви-
рус мало влияет на количество синтезируемой клеткой /n-РНК и про-
цесс ее перехода из ядра в цитоплазму. Пока не известно, что является
точкой первичного воздействия вируса: клеточная РНК-полимераза или
ДНК?
При изучении синтеза клеточного белка было обнаружено, что ко-
личество содержащихся в клетках обычных полисом, где происходит
синтез белка, начинает уменьшаться уже в течение первого часа после
заражения, а через 2,5—3 час, прошедших с момента заражения, все
они по существу оказываются уже разрушенными [641]. Этот процесс
является результатом специфического воздействия вируса на полисомы
клетки-хозяина, ибо параллельно распаду полисом, специфичных для
клетки, идет образование вирусоспецифичных полисом и осуществляет-
ся биосинтез вирусного белка. Прекращение синтеза белков клетки-хо-
зяина и исчезновение клеточных полисом нельзя объяснить простым пре-
кращением поступления в цитоплазму новых молекул информационной
РНК, ибо было показано, что в клетках, зараженных вирусом, полисо-
мы исчезают значительно быстрее, чем в клетках, подвергшихся дейст-
Действие вирусов животных на клетку и организм ЗС5
вию актиномицина D—антибиотика, немедленно прекращающего син-
тез РНК клетки. Что же касается причин разрушения полисом клетки-
хозяина, то отсутствие каких-либо указаний на образование в заражен-
ных клетках индуцированной вирусом нуклеазы, которая могла бы быть
ответственной за разрушение полисом, наводит на мысль, что в основе
этого процесса лежит весьма тонкий механизм, быть может изменение
способности рибосом образовывать комплекс с /n-РНК клетки-хозяина
или изменение каких-то видов s-PHK. Разрешение этой проблемы мо-
жет дать ключ к пониманию механизмов цитоцидального действия ви-
русов.
Влияние вирусной инфекции на биосинтез белка и РНК клетки бы-
ло детально изучено и на модели вируса осповакцины. При этой ин-
фекции также происходит замена клеточных полисом на полисомы, со-
стоящие из клеточных рибосом и вирусной /n-РНК. Несмотря на то что
клеточная РНК продолжает синтезироваться в ядре еще в течение не-
скольких часов после заражения клеток вирусом осповакцины, образо-
вание новых рибосом блокируется уже в течение первого часа после
заражения [57, 719]. Предстоит, однако, выяснить, продолжается ли
в этих условиях синтез клеточной /n-РНК или вирусная m-РНК, обра-
зующаяся в избытке, «завладевает» всеми клеточными рибосомами.
Другой крупный ДНК-содержащий вирус—вирус псевдобешенства,
реплицирующийся в ядре клетки, — также ингибирует синтез белка и
РНК клетки-хозяина. В этом случае, судя по данным, полученным при
изучении динамики включения в состав белка меченых аминокислот,
общая скорость синтеза белка не изменяется, однако по мере развития
инфекционного процесса увеличивается относительное содержание им-
мунологически специфичного вирусного белка [307]. Ингибирование син-
теза общего белка и РНК было обнаружено также при заражении кле-
ток вирусом Синдбис, что опять наводит на мысль, что и в этом случае
имеет место прекращение образования рибосом [645, 646].
На ранних стадиях аденовирусной инфекции синтез белка и РНК
продолжается, однако деления клеток не наблюдается. Возможно, что
в этом случае взамен какой-то части клеточного синтеза идет вирусо-
специфичный синтез [293]. Все же следует иметь в виду, что, поскольку
вирусоспецифичная РНК выполняет, по-видимому, только функцию
m-РНК, вряд ли для размножения вируса требуется большое количест-
во такой РНК. Поэтому наблюдаемое при аденовирусной инфекции не-
прерывное увеличение содержания в клетке суммарной РНК наводит
на мысль, что в течение ряда часов после заражения в клетках продол-
жает синтезироваться рибосомная РНК. И действительно, как было
показано, в клетках, зараженных аденовирусом, в пределах 10 час после
заражения образуется очень мало вирусной т-РНК [690]. На поздних
стадиях инфекции все функции клетки-хозяина подавляются. Возможно,
что за этот эффект ответствен один из белков капсида. Нитевидный
белок, который образует длинные и тонкие, похожие на антенны выпя-
чивания, исходящие из вершин аденовирусных вирионов (см. фото 12),
по-видимому, способен подавлять размножение клеток [274].
Ни в одном из проведенных до сих пор исследований не удалось
выяснить, за какие деструктивные процессы, наблюдаемые при инфек-
циях, вызываемых вирусами животных, ответственно освобождение кле-
точных ферментов или ингибиторов, а за какие — действие специфиче-
ских вирусных ферментов. Даже в тех случаях, при которых было пока-
зано, что без предварительного синтеза белка изменений клеток не на-
ступает, не исключена возможность того, что действие вирусного белка
состоит во включении каких-то специфических клеточных функций, ре-
ализация которых в свою очередь приводит к подавлению функции.клет-
20 Заказ № 1214
306
Глава XV
ки в целом. И действительно (в гл. XII мы об этом уже говорили),
в клетках животных имеются специальные структуры — лизосомы, в ко-
торых, как в «кладовых», содержатся ферменты, обладающие деструк-
тивными свойствами. Для того чтобы решить, вирусную ли природу име-
ют ферменты, появляющиеся в тех или иных случаях в зараженных
клетках, в каждом отдельном случае приходится выделять и изучать
свойства этих ферментов, сочетая эту работу с генетическим изучением
мутантов соответствующего вируса.
Индуктивное действие
Стимулирование образования клеточных белков в ответ на вирус-
ную инфекцию было продемонстрировано с достаточной четкостью лишь
в нескольких случаях. Однако это явление представляется достаточно
важным для того, чтобы оправдать его обсуждение в качестве отдель-
ной проблемы. В связи с этим были изучены два примера: 1) образова-
ние в клетках, зараженных вирусами группы оспы, какого-то активного
компонента, ответственного за освобождение внутри клетки ДНК ви-
риона; 2) образование белка, способного ингибировать размножение
многих, самых различных вирусов. Этот белок был назван интерферо-
ном.
«Раздевающий» белок вирусов группы оспы
Процесс, ведущий к образованию «раздевающего фермента», был
детально обсужден в гл. XIII. Здесь мы лишь снова подчеркнем, что ин-
дуцирующий агент этого вируса представляет собой, по-видимому, не
нуклеиновую кислоту, а какой-то лабильный белок или липопротеид.
Можно думать, что скорее всего это компонент, входящий в состав
внешней оболочки вируса ’. Для того чтобы клетка могла синтезиро-
вать компонент, обладающий «раздевающей» активностью, необходимо,
чтобы ее геном сохранил функциональную целостность. Облученные
клетки не продуцируют этого компонента.
Интерферон
Ограничивать обсуждение проблемы интерферона рассмотрением
лишь той ее стороны, которая касается появления в клетке какого-то
вещества, образуемого ею в ответ на вирусную инфекцию и, между про-
чим, интерферирующего с вирусной инфекцией, — это значит игнориро-
вать историю открытия интерферона и связь, существующую между этим
открытием и явлением интерференции вирусов [740].
Уже давно было известно, что животное часто удается защитить от
вирулентного действия одного вируса путем одновременного или пред-
варительного заражения его либо менее вирулентным штаммом того
же вируса, либо каким-либо другим неродственным вирусом. Впервые
явление интерференции было подвергнуто количественному анализу при
изучении подавляющего действия, оказываемого на размножение в тка-
невых культурах нейротропного штамма вируса гриппа другими, не-
нейротропными штаммами этого вируса [23]. Поскольку было показано,
что образование инфекционного вируса гриппа в куриных эмбрионах
ингибируется облученным ультрафиолетом вирусом гриппа, очевидно,
что, для того чтобы вызвать интерференцию, вирус не обязательно дол-
жен обладать инфекционными свойствами [329].
1 См. примечания к стр. 262 и к стр. 295.
Действие вирусов животных на клетку и организм
307
Айзекс и Линдеман [391] нашли, что аллантоисная жидкость кури-
ных эмбрионов, в которые был введен облученный вирус, обладает ин-
терферирующей активностью, и показали, что за эту активность ответ-
ственно какое-то вещество, отличающееся от вируса. Это вещество и
было названо интерфероном. Оно обладает способностью блокировать
размножение многих, самых различных вирусов как в курином эмбрио-
не, так и в культуре куриных фибробластов.
Методы определения активности интерферона, применявшиеся в ран-
ний период его изучения, а именно определение степени защиты живот-
ных, куриных эмбрионов или тканевых культур от цитопатического дей-
ствия заражающего вируса, в настоящее время заменены другим, ко-
личественным методом, в основе которого лежит определение степени
уменьшения числа образующихся бляшек [884]. Согласно этому методу,
культуру клеток, находящуюся в чашке Петри, предварительно обраба-
тывают раствором интерферона, а затем заражают заранее известным
количеством бляшкообразующих единиц соответствующего тест-вируса.
Пользуясь этим методом, можно точно определить относительное содер-
жание интерферона в различных препаратах.
Очищенный интерферон столь активен, что интерферирующую ак-
тивность можно уже обнаружить в пробе, содержащей всего 4-Ю"9 г
белка. Судя по результатам определения удельной активности (выра-
жаемой числом единиц активности на 1 г белка), лучшие препараты
интерферона были очищены примерно в 4000—6000 раз [484, 585]. Это од-
нако, не означает, что полученный этими авторами кажущийся гомоген-
ным белок, молекулярный вес которого равен 20 000 дальтон, действи-
тельно представляет собой чистый интерферон, ибо в 4-Ю"9 г белка мо-
жет тем не менее содержаться более 1010 молекул. Интерфероны, обра-
зуемые клетками многих различных видов животных, обладают одним
общим свойством: их активность ингибируется протеолитическими фер-
ментами, но не чувствительна к действию таких ферментов, как а-ами-
лаза или фосфолипаза [389]. Активность интерферона, полученного из
клеток млекопитающих или птиц, не изменяется, если инкубировать этот
белок при 50° в течение 1 час. Интерферон, полученный из клеток кур,
несколько более устойчив к нагреванию, чем интерферон, полученный
из клеток мыши или кролика. Клетки 6-дневного куриного эмбриона
являются худшими продуцентами интерферона, чем клетки 11-дневного
эмбриона [390]. Раньше полагали, что культивируемые штаммы опухо-
левых клеток не могут продуцировать интерферон, однако сейчас из-
вестно, что некоторое количество интерферона такие клетки все же об-
разуют.
Характерной особенностью интерферона является его видовая спе-
цифичность и отсутствие у него вирусной специфичности. Это означает,
что куриный интерферон, образовавшийся в ответ на заражение клеток
кур любым из нескольких различных вирусов, будет защищать клетки
кур от заражения многими самыми различными вирусами, но не будет
защищать клетки мыши, а интерферон, образовавшийся при заражении
клеток мыши, не будет защищать клетки кур [585]. Отсутствие у интер-
ферона способности к перекрестной защите вызвано не отсутствием
у соответствующих клеток способности адсорбировать гетерологичный
интерферон, а, по-видимому, связано с какой-то его внутриклеточной
функцией.
Для достижения одной и той же степени защиты данной культуры
клеток в случае заражения различными вирусами требуется различное
количество интерферона. Так, например, для того, чтобы достичь экви-
валентной степени защиты куриных фибробластов при заражении их
20*
308
Глава XV
вирусом О’ ньонг-ньонг, нужно добавить примерно в тридцать раз мень-
ше интерферона, чем в случае заражения вирусом ньюкаслской болез-
ни [704]. Миксовирусы, арбовирусы и вирус осповакцины, у вирионов
которых имеется внешняя оболочка, содержащая липиды, более чувст-
вительны к действию интерферона, чем аденовирусы и энтеровирусы.
Однако некоторые из вирусов с внешними оболочками, в том числе ви-
рус герпеса и вирус ньюкаслской болезни, более устойчивы к действию
интерферона, чем другие вирусы. К числу вирусов, наиболее устойчивых
к действию интерферона, относятся мелкие икосаэдрические РНК-содер-
жащие вирусы.
Что же касается механизма действия интерферона, то было показа-
но, что в клетках, подвергнутых его действию, адсорбция вируса и про-
никновение его в клетку происходят нормально [882, 883]. Тем не менее,
поскольку в таких клетках не только не происходит синтез полного ви-
руса, но подавляется даже синтез инфекционной РНК, можно полагать,
что действие интерферона осуществляется на относительно ранней ста-
дии размножения вируса. Большие количества интерферона могут умень-
шить выход вируса даже в том случае, если интерферон добавляют по-
сле начала созревания вируса [523]. Было показано, что в L-клетках,
подвергнутых действию интерферона и зараженных вирусом западного
энцефаломиелита лошадей, может синтезироваться некоторое количест-
во вирусного антигена [884]. Выяснение механизма действия интерферо-
на может также способствовать пониманию некоторых важных аспектов
контроля и регуляции биосинтеза компонентов клетки.
Образование интерферона и установление состояния интерференции
Какая из специфических частей вируса непосредственно ответствен-
на за стимулирование образования интерферона, неизвестно. Однако
твердо установлено, что индуцировать его образование может и неин-
фекционный вирус. Вирус гриппа, убитый облучением ультрафиолетом
или нагреванием до 56°, способен индуцировать образование интерферо-
на, тогда как вирус, убитый формальдегидом, лишен этой способности
[389]. Поэтому индуцирующим агентом, вероятно, является либо простой
вирусный белок, либо вирусный липопротеид1. Очень эффективным ин-
дуктором образования интерферона является статолон — анионный по-
лисахарид, полученный из Penicillium stoloniferum [458]. Это наблюде-
ние дает в руки исследователей многообещающий инструмент, пользуясь
которым можно изучить биохимические события, ведущие к образованию
интерферона.
Вне зависимости от того, какова природа химического сигнала, ве-
дущего к образованию интерферона, несомненно, что и для образования
интерферона и для реализации его активности необходимо активное уча-
стие генома клетки. Одного лишь контакта интерферона с клеткой недо-
статочно для предупреждения размножения вируса. Если к культуре од-
новременно с добавлением интерферона добавляют и актиномицин D,
активность интерферона полностью блокируется. Чем больше проме-
жуток времени между обработкой культуры интерфероном и добавлени-
ем актиномицина, тем больше степень ингибирования размножения ви-
1 В настоящее время имеется большое число работ, свидетельствующих о том,
что индуктором интерферона является двухспиральная РНК как вирусного происхож-
дения (репликативная форма), так и полученная искусственно. Частичный синтез двух-
спиральной вирусной РНК. обнаруживается также в клетках, инфицированных миксови-
русами, полностью инактивированными ультрафиолетом (Н u р р е г t J., Н i 11 о v о J.,
Nature, 1969, 223, 1015). — Прим. ред.
Действие вирусов животных на клетку и организм 309
руса, т. е. тем больше реализуется активность интерферона. Если, одна-
ко, вместе с актиномицином к культуре добавляют пуромицин, ингиби-
рующее действие интерферона в зараженных клетках оказывается менее
выраженным. Следовательно, для проявления активности проникшего в
клетку интерферона необходимо, чтобы он индуцировал образование
какой-то клеточной /n-РНК и какого-то клеточного белка [522]. Одна-
ко природа этого белка, ответственного за вирусную интерференцию,
пока еще остается неизвестной.
Если к клеткам, обычно реагирующим на заражение живым или уби-
тым вирусом образованием интерферона, до заражения вирусом или
вскоре после него добавить актиномицин, то интерферон не образуется.
Обычно при образовании РНК-содержащих вирусов, например вируса
западного энцефаломиелита лошадей, в конце инфекционного цикла вы-
рабатывается большое количество интерферона. Если же к зараженной
культуре добавляют актиномицин, то наблюдается значительное увели-
чение выхода вируса и уменьшение образования интерферона [884].
Таким образом, за обеспечиваемую интерфероном устойчивость кле-
ток к вирусной инфекции, ответственна вызываемая им индукция синтеза
какой-то клеточной m-РНК, в противном случае не образующейся.
В свою очередь эта m-РНК программирует синтез нового белка. Сам ин-
терферон, по-видимому, образуется вследствие индукции функциониро-
вания соответствующего гена клетки. Вирусы, которые быстрее преры-
вают функционирование клетки, очевидно, в меньшей степени способны
вызывать образование интерферона, чем вирусы, которые подавляют
синтез клеточной m-РНК более медленно (последние также и более чув-
ствительны к действию интерферона).
ЗАБОЛЕВАНИЯ, ВЫЗЫВАЕМЫЕ ВИРУСАМИ ЖИВОТНЫХ
Детальное описание вирусных болезней не входит в задачу данной
книги. Тем не менее представляется целесообразным кратко остановить-
ся на некоторых основных проблемах клинической вирусологии с тем,
чтобы читатель мог увидеть, насколько знания, добываемые при прове-
дении фундаментальных вирусологических исследований, могут быть
необходимы при разрешении этих проблем.
Вирусные болезни человека
Многие серьезные болезни человека — оспа, полиомиелит, желтая
лихорадка, грипп, а также корь, свинка и ветряная оспа — представ-
ляют собой инфекции, вызываемые специфическими вирусами. Уже дав-
но подозревали, что и многие болезни человека, протекающие в легкой
форме, — как спорадические, так и эпидемические — также вызываются
вирусами. Доказать вирусную этиологию таких болезней путем зараже-
ния животного трудно, ибо единственными явными результатами вирус-
ного заболевания животного являются паралич или смерть. С введением
в практику современных методов тканевых культур и обнаружением ци-
топатического действия вирусов на эти культуры резко изменились и ме-
тоды, используемые клинической вирусологией. Благодаря этому виру-
солог приобрел возможность не только быстро и эффективно выделять
уже известные вирусы, но и получил в руки инструмент, пользуясь кото-
рым можно предпринять поиски агентов, ответственных за заболевание
неизвестного происхождения. Результатом этого оказался почти непре-
кращающийся поток открытий. Было обнаружено несколько сот ранее
неизвестных агентов, способных заражать человека [380].
310
Глава XV
Выше нами была предпринята попытка в краткой форме предста-
вить информацию о вирусах, способных вызывать заболевания человека
и животных (гл. I, табл. 1). Некоторые группы в этой таблице включают
большое число разных вирусных агентов, хотя и родственных друг другу,
но серологически различных. Перечисленные же в этой таблице вирусы
вызывают заболевания различной тяжести, начиная от скоротечных и
смертельных, таких, как оспа, желтая лихорадка и энцефалиты, наибо-
лее известным примером которых является полиомиелит, до легко про-
текающих респираторных инфекций и некоторых детских болезней, со-
провождающихся сыпью.
При некоторых вирусных инфекциях тяжесть болезни варьирует в ши-
роких пределах. Например, при полиомиелите поражения центральной
нервной системы, ведущие к развитию параличей или к смерти, наблю-
даются менее чем в 10% случаев. Напротив, при других вирусных инфек-
циях клиническая картина болезни весьма однообразна. Например, при
кори почти всегда наблюдаются характерные для этого заболевания
классические симптомы. В США более 90% населения, достигшего
20-летнего возраста, успевает перенести корь. Столь же широко распро-
странена и свинка, также являющаяся вирусным заболеванием. Судя по
данным серологических исследований, более 90% населения поражается
вирусом свинки. Однако лишь 50% индивидуумов, в крови которых об-
наружены антитела к вирусу свинки, подтверждают, что они действи-
тельно перенесли это заболевание. Очевидно, этот вирус весьма часто
вызывает субклинические или латентные формы заболевания.
Диагностика вирусных заболеваний
В современной вирусологической лаборатории идентификация и
классификация вирусов, вызывающих заболевания, обычно проводится
по следующей схеме. К инфекционному материалу, например к пробе
крови, мочи, кала, к смыву из носоглотки или с конъюнктивы глаза, до-
бавляют антибактериальные антибиотики и либо фильтруют, либо цент-
рифугируют этот материал, чтобы уменьшить вероятность бактериаль-
ного загрязнения. Затем к полученному материалу вновь добавляют ан-
тибиотики, после чего им заражают культуру ткани или куриные эм-
брионы.
На фиг. 69 представлена схема строения куриного яйца с эмбрионом
и способ, обычно используемый для введения вируса в эмбрион. Зара-
женные эмбрионы и культуры тканей периодически исследуют на нали-
чие цитопатических изменений, и если подобные изменения выявляют,
то, используя либо культуральную жидкость, либо аллантоисную или
иные жидкости эмбриона, проверяют, пассируется ли предполагаемый ин-
фекционный агент. В тех случаях, когда цитопатический агент удается
пассировать, приступают к его идентификации, для чего используют мор-
фологические, биохимические и серологические методы. Определенным
критерием может служить характер цитопатического действия, а также
спектр чувствительных хозяев. Однако в отличие от бактерий по одним
этим данным вирус идентифицировать невозможно. Определяя чувстви-
тельность идентифицируемого агента к действию ингибиторов синтеза
нуклеиновых кислот—актиномицина D или 5-фтордезоксиуридина,—
можно классифицировать выделенный вирус как ДНК- или РНК-содер-
жащий.
Окончательный вывод о том, является ли вновь выделенный вирус
действительно ранее неизвестным вирусом, основывается на данных, по-
лученных при сравнении его иммунологических свойств со свойствами
уже известных вирусов. С этой целью пробы, содержащие вновь выделен-
Действие вирусов животных на клетку и организм
311
ный вирус, смешивают с соответствующими антисыворотками против
известных вирусов и проверяют, будут ли такие смеси вызывать цитопа-
тический эффект. Отсутствие цитопатического эффекта говорит о том, что
данная антисыворотка специфична по отношению к вновь выделенному
вирусу. Однако для того, чтобы можно было с уверенностью утверждать,
что выделенный вирус действительно является новым вирусом, необходи-
мо изучить действие на данный вирус антисывороток к очень многим уже
известным вирусам.
Фиг. 69. Схема куриного яйца с эмбрионом после 11-дневного инкубирования. Видно
искусственное воздушое пространство, служащее для заражения хорииаллантоисной
мембраны эмбриона.
/ — хориоаллантоис; 2 — белок; 3 — амнион; 4 — воздушный мешок; 5 — желточный мешок; 6 —•
экстраэмбриональная полость; 7 — аллантоисная полость.
Необходимо подчеркнуть, что одного выделения вируса из организ-
ма больного недостаточно для того, чтобы утверждать, что данный ви-
рус, будь он новым вирусом или ранее известным, действительно являет-
ся агентом, вызвавшим данное заболевание. Чтобы иметь возможность
сделать такой вывод, необходимо располагать дополнительной инфор-
мацией. В качестве одного из наиболее ценных источников такой инфор-
мации могут быть использованы данные, полученные при серологическом
обследовании больного. Предполагается, что в случае, если выделенный
вирус действительно ответствен за наблюдаемое заболевание, в сыворот-
ке крови больного, взятой в первые дни болезни, должны отсутствовать
антитела к этому вирусу и, напротив, в сыворотке крови, взятой у боль-
ного в период реконвалесценции, такие антитела должны обязательно
содержаться. Обычно для выявления антител ставят реакцию связыва-
ния комплемента. Однако в случае, когда выделенный вирус обладает
способностью агглютинировать эритроциты, для выявления антител мож-
но использовать также и реакцию торможения гемагглютинации. В этом
случае вирус смешивают с сывороткой крови больного, после чего к по-
лученной смеси добавляют эритроциты. Если в сыворотке содержатся
антитела, реагирующие с вирусом, то вирус блокируется и эритроциты не
агглютинируются.
Увеличение титра нейтрализующих, антигемагглютинирующих или
связывающих комплемент антител является веским аргументом в поль-
Глава XV
312
зу того, что наблюдавшееся заболевание было действительно вызвано
выделенным вирусом. Повторное выявление взаимосвязи между данным
вирусом и синдромом, характерным для изучаемого заболевания, счи-
тается достаточным для того, чтобы утверждать, что выделенный вирус
действительно является возбудителем данного заболевания. За послед-
ние 10 лет подобным методом было изучено много вновь выделенных ви-
русов. Однако большая часть этих новых вирусов не удовлетворяла тем
критериям, которые необходимы для инкриминирования этим вирусам
роли возбудителей соответствующих заболеваний.
Представляется, однако, вероятным, что основные группы вирусов,
вызывающих у человека острые заболевания, в настоящее время уже
идентифицированы. Длительные, проводившиеся в динамике вирусоло-
гические обследования целых семей с целью изучения широты распрост-
ранения различных вирусов и вирусных заболеваний (см., например,
[595]) показали, что как из организма взрослых, так и из организма са-
мых маленьких детей в общем выделяются одни и,те же группы вирусов.
Эти данные наводят на мысль, что все вирусы, которые в принципе мож-
но выявить заражением куриных эмбрионов и культур клеток, обычно
используемых для выделения вирусов, а именно клеток почек обезьян,
клеток HeLa и других линий опухолевых клеток, а также перевиваемых
линий клеток, полученных из органов здоровых эмбрионов и взрослых
животных (см. гл. XII), к настоящему времени уже выявлены.
Остается, однако, открытым вопрос, действительно ли уже известны
все поражающие человека вирусы или на самом деле существует еще
очень много вирусов, которые могут быть идентифицированы только
путем заражения особых клеток организма человека, и возможно только
таких клеток, которые не растут в культуре? Например, было показано,
что эпидемический гепатит—часто встречающееся и достаточно тяже-
лое заболевание — можно вызвать у добровольцев, заражая их не со-
держащей бактерий сывороткой крови или фекалиями больных, страдаю-
щих этим заболеванием 1325]. Инфицирующий агент чувствителен к дей-
ствию ультрафиолета и, как полагают, представляет собой вирус. Тем
не менее, несмотря на настойчивые усилия, вирус гепатита человека по-
ка выделен не был. Может быть, неудача объясняется неспособностью
этого вируса размножаться в клетках культур, использовавшихся для
его выделения, а может быть, тем, что этот вирус не вызывает в клетках
изменений, обнаруживаемых имеющимися в нашем распоряжении мето-
дами. Возможно, что подобными причинами объясняются и неудачи, пре-
следующие исследователей, пытающихся выделить вирусы — предпола-
гаемые возбудители опухолей человека. Следует, однако, подчеркнуть,
что в этом случае, конечно, доводы в пользу вирусной этиологии забо-
левания не столь убедительны, как в случае эпидемического гепатита.
МЕХАНИЗМЫ ПЕРЕДАЧИ ВИРУСНЫХ ЗАБОЛЕВАНИЙ
Механическая передача
Как уже упоминалось в гл. II, основной проблемой для обеспечения
доступа вируса к клеткам, в которых он должен размножиться, чтобы
вызвать заболевание, является вопрос о входных воротах инфекции,
В природе заражение обычно происходит вследствие механической пе-
редачи вируса организму. Такая передача осуществляется либо путем
прямого контакта организма с зараженным материалом, либо вследст-
вие попадания вируса в организм с зараженной пищей или водой. В ряде
случаев контакт вируса с чувствительной клеткой осуществляется легко.
Например, вирусы, вызывающие поражения верхних дыхательных путей,
Действие вирусов животных на клетку и организм
313
попадая в мельчайшие капельки слизи из носа больных, переносятся
затем к здоровому организму, непосредственно оседая на чувствительных
клетках носоглотки здорового человека. Этот путь является основным
путем передачи вирусных заболеваний верхних дыхательных путей. В не-
посредственный контакт с поражаемыми клетками организма могут
также вступать вирусы, вызывающие конъюнктивит. Вирус гриппа и ви-
рус кори также легко вступают в контакт с чувствительными клетками
дыхательных путей, однако для того, чтобы вызвать типичную картину
соответствующего заболевания, они должны сначала размножиться, про-
никнуть в кровоток и распространиться по всему организму.
Другие вирусы, переносимые механическим путем, прежде чем выз-
вать клинические проявления болезни, должны сначала попасть в желу-
дочно-кишечный тракт, где происходит их размножение. Оттуда они
проникают в кровь и лимфу и распространяются по всему организму.
Подобный путь проходит в организме вирус полиомиелита. Лишь после
интенсивного размножения в лимфатической ткани кишечника, а возмож-
но также и в области зева, он может достичь центральной нервной систе-
мы и проникнуть в ее клетки. Каким образом происходит этот процесс,
все еще неизвестно. Вирус может переноситься кровью непосредственно
в мозг, а может сначала проникать в нервные ганглии, а уже оттуда в
спинной и головной мозг (92].
Способность циркулирующих антител не допустить проникновения
вируса к органам и тканям, расположенным вдали от места проникно-
вения этого вируса в организм, объясняет нам, почему наличие соответ-
ствующих антител в крови предупреждает развитие вирусных заболе-
ваний, при которых обязательным условием появления клинических
симптомов является стадия вторичного распространения вируса по ор-
ганизму.
Передача вирусов переносчиками
В западном полушарии заболевания, вызываемые вирусами, кото-
рые распространяются переносчиками, встречаются намного реже, чем
заболевания, при которых передача вируса происходит механическим
путем. Тем не менее примеры успешной борьбы именно с такими вирус-
ными заболеваниями человека относятся к наиболее ярким эпизодам
волнующей истории медицинской микробиологии. После драматического
открытия Вальтером Ридом и сотр. [669, 670] роли москитов в передаче
желтой лихорадки это заболевание было по существу ликвидировано в
США. Открытие Пастером вирусной этиологии бешенства и разработка
им методов вакцинации собак против бешенства [638] привели к тому,
что по крайней мере в наиболее развитых странах собака перестала
быть переносчиком этого вируса. Эти классические примеры показывают,
что ликвидация заболеваний, вызываемых вирусами, которые передают-
ся переносчиками, является значительно более простой задачей, чем
борьба с теми заболеваниями, при которых передача вируса осущест-
вляется механическим путем.
Наиболее важной группой вирусов, передача которых осуществля-
ется переносчиками, являются вирусы, переносимые членистоногими (ар-
бовирусы). Эти вирусы вызывают самые различные заболевания чело-
века — желтую лихорадку, лихорадку денге, различные геморрагические
заболевания и некоторые еще не дифференцированные лихорадки.
В США из числа заболеваний, вызываемых арбовирусами, наибольшую
опасность представляют энцефалиты. Имеются две большие группы этих
вирусов, в состав которых входит более 200 арбовирусов, и по крайней
мере 50 из них вызывают заболевания у человека [132]. Эпидемии, вызы-
314
Глава XV
ваемые арбовирусами, возникают и по сей день, и поскольку эти ви-
русы подразделяются на ряд серологических групп, единственной прак-
тически реальной мерой борьбы с эпидемиями, по-видимому, является
борьба с переносчиками этих вирусов.
В большинстве случаев арбовирусы сохраняются благодаря суще-
ствованию цикла переносчик — хозяин, причем человек в этом цикле
не участвует. Переносчиками арбовирусов служат четыре семейства кро-
вососущих насекомых (Culicidae, Ceratopogonidae, Pschodidae и Ixo-
didae). Природными хозяевами и резервуаром вируса являются различ-
ные позвоночные, главным образом дикие млекопитающие и птицы. Ви-
рус сохраняется в природе лишь в том случае, если существуют сбалан-
сированные популяции хозяев и переносчиков и обеспечивается контакт
между ними.
Одним из наиболее интересных свойств арбовирусов является их
способность размножаться как в. организме позвоночного-хозяина при
температуре до 39° включительно, так и в организме насекомого-пере-
носчика при температуре порядка 30° и меньше [384]. Организм насеко-
мого, по-видимому, не повреждается вирусом.
СПОНТАННОЕ ИЗЛЕЧЕНИЕ ПРИ ВИРУСНЫХ ИНФЕКЦИЯХ
До сих пор мы не знаем, почему течение вирусного процесса часто
прекращается. Первая неясность возникает уже на клеточном уровне.
Почему размножение вирусов животных в большинстве случаев прекра-
щается, несмотря на то что для синтеза новых вирионов используется
лишь небольшая часть массы зараженной клетки (от 0,1 до 2%), тогда
как при размножении вирусов растений и бактерий используется до 20%
сухого веса зараженной клетки, а иногда и больше. При рассмотрении
этой проблемы на уровне всего организма животного в целом возникает
еще один вопрос: почему размножение вируса, а следовательно, и его
перенос к новым чувствительным клеткам не всегда продолжается до
тех пор, пока не будут заражены все чувствительные клетки?
«Львов [548] рассмотрел влияние различных переменных факторов
на размножение вируса полиомиелита in vitro в гомогенной популяции
клеток. Он нашел, что размножение этого вируса подавляется при не-
подходящей температуре инкубации (либо слишком* высокой, либо слиш-
ком низкой), что pH среды, оптимальной для размножения вируса, мож-
но изменять лишь в относительно узких пределах, а в некоторых систе-
мах клеток степень насыщения среды кислородом определяет конечный
выход вируса. Известно, что при инфекции в различных частях организ-
ма все эти переменные имеют различные значения. Температура тела
повышается, pH внеклеточной жидкости зараженной области организма
уменьшается, и степень насыщения кислородом может также в какой-то
степени ухудшаться.
В какой степени изменения этих неспецифических факторов, наблю-
даемые при любой воспалительной реакции, могут влиять на конечный
результат вирусной инфекции, остается неясным. Тем не менее нельзя
не согласиться с тем, что действительно наблюдаемые величины измене-
ний этих факторов потенциально достаточны для того, чтобы в опреде-
ленной степени контролировать степень размножения вируса. Например,
мышей, зараженных штаммом вируса энцефаломиокардита, чувстви-
тельным к повышенной температуре, можно вылечить, если на некоторый
промежуток времени повысить температуру их тела до определенной
величины [643].
Наиболее специфичной реакцией организма на вирусную инфекцию
является, конечно, образование антител. Раньше считали, что антитела
Действие вирусов животных на клетку и организм 315
не играют роли в естественном прекращении вирусной инфекции, по-
скольку циркулирующие антитела к вирусу, инфицировавшему организм,
часто удается впервые обнаружить лишь через много дней после спон-
танного прекращения вирусного заболевания. Однако недавно было по-
казано, что интенсивность синтеза антител, необходимая для того, чтобы
ликвидировать локальную инфекцию, намного ниже той интенсивности,
которая необходима для появления в крови количества антител, выяв-
ляемого при помощи обычно используемых серологических реакций. Бо-
лее того, прямым экспериментом было показано, что, используя доста-
точно чувствительный метод, в сыворотке кролика, иммунизированного
вирусом полиомиелита, антитела к этому вирусу можно обнаружить уже
через 24 час после первичного введения вируса (835]. Поэтому вполне
вероятно, что специфические антитела играют существенную роль в про-
цессе затухания вирусной инфекции, который кажется нам самопроиз-
вольным.
Другим фактором, который, как предполагают, служит главным
барьером, препятствующим безграничному распространению вирусного
заболевания, является интерферон [389]. Было показано, что у мышей,
зараженных сублетальными дозами вируса гриппа, выраженность симп-
томов заболевания уменьшается параллельно увеличению образования
интерферона в легких. Далее, размножение вируса осповакцины в клет-
ках кожи кроликов и морских свинок можно предупредить, если предва-
рительно на заражаемую область нанести интерферон (размножение ви-
руса, однако, не блокируется, если интерферон наносят после зараже-
ния). У куриных эмбрионов увеличению способности к образованию
интерферона сопутствует увеличение устойчивости к заражению вирусом.
Поэтому представляется вполне вероятным, что в процессе регулирова-
ния течения вирусного заболевания животного определенную роль играет
также интерферон. Тем не менее нельзя не обратить внимание на то, что
мыши, зараженные вирусом лимфоцитарного хориоменингита, приобре-
тают устойчивость к заражению некоторыми другими неродственными
вирусами, несмотря на то что интерферона у них обнаружить не удается.
Этот факт указывает на существование каких-то иных гуморальных фак-
торов, которые играют роль в процессе контролирования течения вирус-
ного заболевания [884].
БОРЬБА С ВИРУСНЫМИ ИНФЕКЦИЯМИ
Одной из главных целей вирусолога является накопление информа-
ции о вирусах и вирусных заболеваниях с тем, чтобы уметь успешно бо-
роться с этими болезнями. Кроме уже упоминавшегося выше уничтоже-
ния переносчиков вирусов, два подхода к решению этой проблемы имеют
наибольшее значение. Один из них — вакцинация — широко и успешно
используется в течение многих лет. Второй, новый путь — это химиотера-
пия. Пока еще не ясно, насколько ценным может оказаться этот метод
на практике.
Вакцинация
Осуществленная Эдвардом Дженнером в 1798 г. успешная иммуни-
зация против оспы ознаменовала начало успешной борьбы против любо-
го инфекционного заболевания независимо от его вирусной или бактери-
альной природы. Триумф Дженнера был обусловлен тем, что он исполь-
зовал в качестве иммунизирующего средства вирус коровьей оспы, кото-
рый, будучи иммунологически родственным вирусу натуральной оспы,
ЗГ6
Глава XV
в то же время достаточно отличается от него, вследствие чего не вызы-
вает у вакцинируемого общего заболевания организма. В течение многих
лет считали, что длительную и эффективную защиту против вирусного
заболевания можно обеспечить лишь в том случае, если следовать прин-
ципам вакцинации, разработанным Дженнером. В пользу этой точки
зрения говорило также и то, что антирабическая вакцина была приго-
товлена Пастером из аттенуированного штамма вируса бешенства, полу-
ченного путем многократных пассажей через мозг кролика, а вакцина
против желтой лихорадки также представляет собой аттенуированный
штамм вируса желтой лихорадки.
В основе другого подхода к решению этой проблемы лежит исполь-
зование убитых вирусных вакцин. Важным импульсом к этому была раз-
работка Солком [713] тривалентной вакцины против полиомиелита. Это
достижение явилось триумфом не только клинической вирусологии, но
также знаменовало собой огромные успехи в методах культивирования
клеток животных. Получение эффективной убитой вакцины против полио-
миелита стало возможным лишь благодаря разработке Эндерсом и др.
[216] простого метода, позволившего выращивать большие количества ви-
руса. Для того чтобы из инфицированной культуральной жидкости полу-
чить вакцину, достаточно было инактивировать вирус формалином.
С помощью одного из самых больших когда-либо проводившихся на
людях экспериментов было показано, что вакцина Солка действительно
является эффективным индуктором иммунитета к вирусу полиомиелита.
Таким образом, оказалось, что при наличии достаточно большого коли-
чества вирусного антигена можно вполне приготовить эффективную уби-
тую вакцину [233]. Широкое применение этой вакцины началось весной
1954 г., а уже в 1957 г. частота заболеваний полиомиелитом резко умень-
шилась. Были разработаны также живые аттенуированные вакцины про-
тив полиомиелита [468, 708], и было доказано, что их использование так-
же приводит к уменьшению заболеваемости. Поскольку живую вакцину
можно вводить per os, а иммунитет, вызываемый ею, более надежен,
многие эксперты в области вакцинации сегодня отдают предпочтение жи-
вой вакцине.
Трудности, с которыми приходится встречаться при получении
и применении вакцин
Имея в виду победы, одержанные над оспой, желтой лихорадкой и
полиомиелитом, представляется вполне разумной мысль, что любое ви-
русное заболевание, вызываемое каким-либо одним или очень неболь-
шим числом вирусных агентов, можно эффективно пресечь путем реали-
зации адекватной программы вакцинации. Однако, прежде чем при по-
мощи вакцинации живыми или убитыми вакцинами удастся победить все
вирусные заболевания, придется преодолеть немало препятствий. Так,
например, оказалось, что, используя в качестве вакцины формалинизи-
рованный препарат вируса гриппа, хотя и можно ограничить широту рас-
пространения гриппозной эпидемии, но возникающий при этом эффект
непродолжителен, ибо иммунитет, вызываемый вакцинацией против грип-
па, нестоек. Титр противогриппозных антител в сыворотке крови, увели-
чивающийся после вакцинации, вскоре уменьшается, и устойчивость к
повторному заражению вирусом гриппа, в особенности штаммами виру-
са гриппа типа А, резко уменьшается уже через 6 месяцев после оконча-
ния вакцинации [233].
Трудности, связанные с кратковременностью иммунитета, можно бы-
ло бы преодолеть, повторяя вакцинацию ежегодно. Однако это не ре-
шает проблемы противогриппозной вакцинации, ибо, как уже упомина-
Действие вирусов животных на клетку и организм
31
лось в гл. VI, естественная изменчивость вируса гриппа приводит к тому,
что при появлении нового варианта вируса заболевают и вакцинирован-
ные люди. В последний раз последствия этой изменчивости продемонст-
рировала охватившая весь мир эпидемия гриппа 1956—1957 гг. Эта эпи-
демия была вызвана появлением нового варианта вируса гриппа типа А,
получившего название «азиатского». Весьма важным явилось то обстоя-
тельство, что иммунологический барьер, который мог бы воспрепятство-
вать распространению этого варианта вируса гриппа, отсутствовал.
Если будет доказано, что способность вируса гриппа к изменению
своей антигенной структуры не является беспредельной, а ограничена
образованием не слишком большого числа вариантов, то со временем,
быть может, откроется возможность получения поливалентной противо-
гриппозной вакцины, содержащей все главные варианты вируса. Можно
полагать, что достаточно частое введение такой вакцины могло бы пре-
дохранить от заболевания гриппом.
Еще более сложные проблемы возникают при попытке разработать
общую программу вакцинации против других респираторных вирусов.
Поскольку каждый из известных респираторных вирусов человека ответ-
ствен лишь за очень ограниченную часть всех наблюдаемых вирусных
респираторных инфекций, очевидно, что для эффективной вакцинации
необходимо иметь вакцину, состоящую из множества различных вирусов.
Если в качестве средства решения проблемы избрать вакцинацию живой
вакциной, то предварительно необходимо получить аттенуированные
штаммы каждого вируса, которые необходимо вводить последовательно,
ибо очевидно, что при одновременном введении всех вирусов иммунитет
к некоторым из них может не развиться вследствие интерференции.
Однако самой важной проблемой, возникающей при намерении ис-
пользовать живые вакцины для борьбы с относительно легкими вирус-
ными заболеваниями, является необходимость гарантировать отсутствие
загрязнения живых вакцин вирусами, способными вызывать образование
опухолей. Известно (подробнее эта проблема будет обсуждена в гл. XVI),
что многие вирусы обладают способностью индуцировать образование
опухолей в организме животных. Некоторые из таких вирусов были об-
наружены в куриных эмбрионах и в культурах клеток почек обезьян, ис-
пользовавшихся при получении вакцин. Несмотря на то что в настоящее
время отсутствуют доказательства, что у кого-либо из лиц, вакциниро-
ванных живыми вакцинами, возникла опухоль, индуцированная вакци-
ной, нельзя исключить потенциальную возможность такого процесса.
Поэтому в настоящее время расчет на то, что такое же широкое приме-
нение живых вакцин, как и раньше, не приведет к образованию опухолей,
представляется неблагоразумным. В особенности это справедливо в от-
ношении вакцинации детей — основного контингента населения, подвер-
гающегося вакцинации и, конечно, получающего от нее наибольшую
пользу.
Принято считать, что если проблема вакцинации против не слишком
распространенных или не слишком тяжелых вирусных заболеваний во-
обще может быть разрешена, то ключ к ее решению лежит в получении
очищенных вирусных вакцин. Поскольку за последние годы достигнуты
большие успехи как в отношении понимания природы вирусов, так и в
части разработки методов, позволяющих инактивировать вирусную ну-
клеиновую кислоту, не повреждая белков вируса, можно полагать, что
уже сейчас налицо принципиальная возможность получения комбиниро-
ванной убитой вакцины, представляющей собой смесь чистых препара-
тов многих вирусов, достаточно иммуногенной и в то же время достаточ-
но безопасной в отношении возможного загрязнения опухолеродными
вирусами.
318
Глава XV
Химиотерапия вирусных инфекций
Быстрому прогрессу понимания сущности процессов, контролирую-
щих биосинтез белка, к числу которых, как известно, относится тран-
скрипция ДНК и последующая трансляция информационной РНК (см.
гл. V), помогли успехи, достигнутые в понимании способа действия ме-
дикаментов— ингибиторов, таких, как пуромицин, актиномицин, цикло-
гексимид и митомицин. Однако, поскольку эти препараты не оказывают
более выраженного воздействия на синтезы, контролируемые геномом
вируса, чем на синтезы, контролируемые геномом клетки-хозяина, оче-
видно, что они не имеют никакой перспективы в отношении использова-
ния их в качестве противовирусных химиотерапевтических препаратов.
Действительно, взаимосвязь между синтетической активностью вируса и
клетки столь сложна, что некоторые исследователи отчаялись в возможно-
сти получения лекарственных препаратов, способных специфически пре-
пятствовать синтезу вирусных компонентов, не влияя одновременно на
синтез компонентов клетки-хозяина. Тем не менее были обнаружены
соединения, обладающие активностью, правда, лишь в отношении огра-
ниченного числа вирусных инфекций, и работа в этой области продол-
жается в надежде обнаружить в конце концов противовирусные вещест-
ва, которые имели бы практическую ценность [839].
Два вещества, а именно 2-(а-оксибензил)-бензимидазол (ОББ) и
гуанидин, блокируют размножение некоторых энтеровирусов (вирусов
полиомиелита, Коксеки и ЕСНО-вирусов). Было показано, что клетки,
подвергнутые воздействию какого-либо из этих соединений, адсорбируют
вирус, но не синтезируют заметных количеств вирусной РНК, вирусной
РНК-полимеразы или белка капсида вируса. Однако пока точно не из-
вестно, какая из стадий размножения вируса блокируется этими соедине-
ниями. Было обнаружено, что проникшая в клетку цепь вирусной РНК
может тем не менее вызывать подавление синтеза белка и РНК клетки-
хозяина [164, 642]. Возможно, что гуанидин блокирует отрыв растущих
цепей вирусных РНК от матрицы, на которой они синтезируются.
Хотя спектр активности ОББ и гуанидина в общем сходен, наблю-
даются и некоторые существенные различия. Данные, содержащиеся в
табл. 30, показывают, что ОББ не в состоянии подавить размножение
вируса Коксеки А и некоторых риновирусов, размножение которых по-
давляет гуанидин. Кроме того, существуют мутантные штаммы этих ви-
русов, которые устойчивы к действию одного из этих препаратов и лишь
частично устойчивы к действию другого. Попытки использовать эти пре-
параты для подавления соответствующих вирусных инфекций у животных
дают в какой-то степени обнадеживающие результаты, однако следует
отметить, что эффект наблюдался в том случае, когда препарат вводи-
ли животному на ранней стадии инфекции. Все же использование ОББ
и гуанидина в качестве терапевтических средств не имеет перспектив
вследствие большой скорости появления мутантных форм вируса, устой-
чивых к действию этих препаратов. Можно полагать, что, поскольку раз-
множение вируса все же имеет место и при лечении, в образующейся по-
пуляции вирионов должны содержаться устойчивые мутанты, способные
преодолеть действие этих лекарственных препаратов.
Другой класс соединений — тиосемикарбазоны, и в особенности иза-
тин-р-тиосемикарбазон (ИБТ), обладают защитным действием против
оспы у мышей [309, 854]. Электронные микрофотографии зараженных ви-
русом осповакцины клеток, подвергнутых действию ИБТ, показывают,
что в таких клетках образуются незрелые формы вируса, содержащие
как вирусный белок, так и ДНК, но тем не менее, по-видимому, лишен-
ные инфекционности [207]. ИБТ не влияет на события, происходящие на
Действие вирусов животных на клетку и организм
319
Таблица 30
Ингибирование гуанидином и 2-(а-оксибензил)-бензимидазолом (ОББ)
репликации РНК-содержащих вирусов [839]
Вирусы, чувствительные к действию гуанидина Вирусы, устойчивые к действию гуанидина
Вирусы, чувствительные к действию ОББ Вирусы, устойчивые к действию ОББ Вирусы, чувствитель- ные к действию ОББ Вирусы, устойчивые к действию ОББ
Вирус полиомиелита (все типы) Вирус Коксеки А и В ЕСНО-вирусы Вирус Коксеки А Риновирусы Нет Риновирусы ЕСНО-вирусы, тип 22 н 23 Вирус Менго
ранних стадиях синтеза вируса осповакцины, однако на стадии утилиза-
ции ди-РНК этого вируса наблюдаются нарушения, в результате чего
подавляется формирование полного инфекционного вируса [926]. Попыт-
ки использовать другие специально синтезированные производные тио-
семикарбазона для лечения натуральной оспы людей дали обнадежи-
вающие результаты [50]. Это важный «рывок» вперед в области химио-
терапии вирусных заболеваний, ибо в странах, где вакцинация против
оспы регулярно не проводится, от оспы и по сей день погибает много
людей.
В качестве еще одного примера успешной химиотерапии вирусных
инфекций можно привести использование бром- и иоддезоксиуридина
(БДУ и ИДУ) для лечения заболеваний глаз, вызванных вирусом гер-
песа [441]. Этот счастливый результат оказался в определенной степени
неожиданным, поскольку ранее было показано, что фтордезоксиуридин
в культуре ткани не оказывает избирательного действия на вирус и в
равной степени подавляет как синтез вируса, так и рост клеток. Причина
этих различий, как было обнаружено, заключается в том, что ФДУ бло-
кирует синтез тимидиловой кислоты и тем самым препятствует синтезу
ДНК, тогда как БДУ и ИДУ не блокируют синтеза ДНК, а включаются
в ее молекулу вместо тимидина, что приводит к образованию дефектных
молекул ДНК [675].
Если концентрация этих препаратов не слишком велика, клетки про-
должают расти в течение ряда генераций, тогда как синтез инфекцион-
ного вируса, будь то вирус герпеса или осповакцины, быстро подавляет-
ся и образуются неинфекционные вирусные частицы. Тем не менее этой
весьма относительной избирательности оказывается вполне достаточно
для успешного лечения с помощью БДУ и в особенности ИДУ герпети-
ческих кератитов, а также кератитов и дерматитов, вызываемых виру-
сом осповакцины. То, что эти препараты эффективны только при лечении
заболевания глаз, объясняется, видимо, тем, что в этом случае поражен-
ные вирусом клетки легко доступны действию лекарственного препарата,
а их размножение (сопровождаемое включением ИДУ в ДНК клетки)
происходит слишком медленно, вследствие чего клетки организма не
повреждаются. Общие заболевания, вызываемые вирусом герпеса, нель-
зя лечить ИДУ, ибо этот препарат очень токсичен.
Все упоминавшиеся выше противовирусные препараты действуют
внутри клетки, подавляя образование инфекционного вируса или ви-
русной нуклеиновой кислоты. Многообещающей является также
попытка воспрепятствовать распространению вирусной инфекции,
воздействуя на стадию адсорбции вируса на поверхности клетки. О том,
320
Глава XV
что такой путь достаточно реален, говорит тот факт, что, воздействуя на
легкие мышей нейраминидазой до заражения животных вирусом гриппа
(нейраминидазу вводили путем ингаляции), удается блокировать разви-
тие вирусной пневмонии {821]. Следовательно, теоретически вполне воз-
можно таким образом воздействовать на чувствительные клетки, чтобы
они, не погибнув, в то же время лишились рецепторов, необходимых для
присоединения к ним вируса. Если действительно будет доказано, что
процессы биосинтеза белков и нуклеиновых кислот вируса и клетки-хо-
зяина столь взаимосвязаны друг с другом, что дальнейшие попытки по-
лучения противовирусных химиотерапевтических препаратов, действую-
щих путем избирательного подавления синтеза вируса, окажутся совер-
шенно бесперспективными, то может случиться, что поиск агентов, воз-
действующих на поверхность клеток, явится более многообещающим под-
ходом к химиотерапии вирусных заболеваний.
Один противовирусный препарат — солянокислый 1-адамантанамин,
по-видимому действующий именно таким образом, в настоящее время
уже изучается. Этот препарат обладает сильным защитным действием,
если применять его в случае заражения мышей вирусом гриппа, и по-
скольку его ингибирующее действие проявляется в промежутке между
присоединением вируса к клетке и проникновением его внутрь клетки,
полагают, что это соединение блокирует какой-то из этапов взаимодейст-
вия вируса с клеточной поверхностью.
Tf T2 ТЗ
Т4 Т5 Тб
Фото 1. Бляшки, образуемые шестью различными фагами при заражении одного и
того же хозяина — Escherichia coli, штамм В (’/з натуральной величины).
Фото 2. Поражения хориоаллантоисной мембраны, образуемые при заражении виру-
сом миксомы (Д) и вирусом энцефалита долины Мэррея (Б).
Фото 3. Бляшки, образуемые вирусом западного энцефалита лошадей на культуре
клеток фибробластов куриного эмбриона (Д) и вирусом полиомиелита на культуре
клеток HeLa (Б),
Фото 4. Локальные некротические поражения, вызываемые вирусами растений.
4. Поражения, вызываемые вирусом табачной мозаики на листьях Nicotiana glutinosa. Б. Пора-
жения, вызываемые вирусом мозаики томатов на листьях N. glutinosa. В. Поражения, вызывае-
мые вирусом кустистой карликовости томата на листьях N. glutinosa. Г. Поражения, вызываемые
вирусом кольцевой пятнистости табака на листьях N. tabacum.
Фото 5.
А. Лист здорового растения Nicotiana tabacum. Б. Лист растения, пораженного ВТМ.
Фото G. Опухоли на корнях донника, по-
раженного вирусом раневых опухолей.
Фото 7. Вирион радужного вируса долго-
ножки, исследованный методом двойно-
го напыления для выявления его икоса-
эдрической формы.
Фото 8. Капля суспензии, содержащей ВТМ и частицы полистирольнэго латекса. Кон-
центрация частиц латекса в смеси известна, а концентрацию вирусных частиц можно
определить, исходя из соотношения числа частиц обоих типов. В области расширяюще-
гося сектора вирусные частицы видны более отчетливо.
Обратите внимание на то. что палочкообразные вирусные частицы располагаются параллельно краю
капли вследствие изменения поверхностного натяжения при высыхании.
Фото 9. Капля суспензии, содержащей вирус полиомиелита и частицы полистирольного
латекса.
Объяснен в подписи к фото 8.
Фото 10. Вирионы ВТМ, обработанные нейтральным фосфовольфраматом (метод нега-
тивного контраста).
Обратите внимание на центральный канал (Д) и тонкую исчерченность (Б), соответствующую спи
ральной борозде между субъединицами (см. фиг. 9).
Фото 11. Вирионы вируса желтухи свеклы.
Фото 12. Электронная микрофотография вириона аденовируса (Д) и модель структуры
его капсида (Б) [866].
См. также фото 13.
Фото 13. Морфология антигенных компонентов капсидов аденовирусов [866].
Я. Гексон, окруженный в капсиде шестью смежными капсомерами [275]. Б. Пентон, окруженный
пятью гексонами. В. Фибрилла, представляющая собой отросток пентона. См. модель на фото 12, Б.
Фото 14. Вирионы вируса желтой мозаики турнепса [227].
4. Двумерный кристалл, лежащий на углеродной подложке, применяемой в электронной микро-
скопии. Б. Группа вирионов, у которых видно расположение морфологических единиц.
Фото 15. Пустые капсиды вируса папилломы человека, окрашенные уранилацетатом.
Обратите внимание на нуклеоид.
Фото 16. Вирус герпеса [913].
А. Вирион с частично разрушенной внешней оболочкой. Б. Капсид с полыми призматическими
капсомерами.
Фото 17. Вирионы вируса огуречной мозаики с пятиугольными капсомерами (пенте-
нами) (Л) и шестиугольными капсомерами (гексенами) (Б).
Фото 18. Вирионы вируса кроличьей папилломы Шоупа, имеющие разную форму и диа-
метр; видны полые капсомеры.
Фото 19. Морфология фага фХ174.
Л. Электронная микрофотография фагов, на поверхности которых видны выпуклости. Б. Модель
предполагаемой формы вириона.
Фото 20. Молекулы ДНК бактериофага <рХ174, имеющие форму замкнутого кольца.
Фото 21. Частицы бактериофага Z.
Обратите внимание на исчерченность отростка и нуклеоид в полом капсиде (снимок слева).
Фото 22. Вирионы фага q;29 Bacillus subtilis.
В верхнем правом углу микрофотографии помещен разрез отростка в его дистальной части.
Фото 23. Вирионы бактериофага Т4, причем у одного разрушена головка, а у другого
имеется два отростка.
Нити отростка вытянуты.
Фото 24. Электронная микрофотография, полученная методом негативного контраста,
на которой видны детали структуры бактериофага T2L.
Обратите внимание на отсутствие воротничка, имеющегося у фага Т4 (см. фото 23). В верхнем пра-
вом углу видна базальная пластинка со спицеподобными придатками, характеризующаяся гекса-
гональной симметрией. На микрофотографии имеется один полый вирион с нормальным отрост-
ком, один оторванный стержень отростка и один стержень, прикрепленный к полому капсиду. Дру-
гой полый вирион имеет сократившийся чехол.
Фото 25. Два вириона фага Т4 (Я), у одного из которых некоторые нити отростка при-
соединены к воротничку, образуя своего рода чехол, и отделенная базальная пластинка
(Б) с нитями отростка.
Фото 26. Вирионы вируса гриппа.
Фото 27. Компоненты частиц вируса ньюкаслской болезни.
А. Спиральный капсид. Б. Гемагглютинин.
Фото 28. Вирионы вируса осповакцины с внутренним «тройным элементом», вероятно
капсидом, в разных ориентациях (А—В).
Фото 30. Частицы вируса везикулярного стоматита [374].
А. Свободные вирионы. Б. Вирионы, образующиеся на клеточной поверхности в межклеточном
пространстве.
Фото 31.
А. Кристаллы вируса кустистой карликовости томата (световой микроскоп). Б. Поверхность кри-
сталла вируса некроза табака (электронный микроскоп).
Фото 32. Пространственная модель молекулы ДНК, показывающая взаимное располо-
жение атомов в этой молекуле.
Фото 33. Линии преципитации, образовавшиеся при двойной диффузии в агаре и демон-
стрирующие наличие у аденовируса типа 5 нескольких антигенов [866].
В центральную лунку (S) была введена кроличья антисыворотка к аденовирусу; в лунку 5 — не-
фракционированный экстракт, содержащий антигены вируса; в лунку 5В — очищенный антиген В
(антиген-пентон; см. фото 13, Б); в лунку 5ВТ — антиген-пентон, подвергнутый действию
зрипсина; в лунку 5С — очищенный антиген-фибрилла (см. фото 13, В). Обратите внимание на
реакцию идентичности между антигеном-фибриллой и антигеном-пентоном, подвергнутым действию
лрипсина, и на реакцию частичной идентичности (образование «шпоры») между полным анти-
геном-пентоном и антигеном-фибриллой.
то 34. Взаимодействие вируса гриппа с гомологичными антителами [453].
эн вируса гриппа. Б. Мостики, образованные антителами между соседними выступами,
асположенными на поверхности вириона. В, Г. Агглютинация вирионов антителами.
Фото 35. ДНК, освободившаяся из частицы фага Т2 под действием осмотического шока.
Фото 36. Лизис клетки Е. coli, зара-
женной фагом Т2 [538].
Фото 37. Стенка клетки Е. coli, лизи-
рованной фагом Т2 [538].
Фото 38.
Л. Клетки Е. соН с половыми ворсинками. Видны вирионы фага MS2 (нкосаэдрическпй фаг) и ви-
рионы фага MI3 (нитевидный фаг), присоединившиеся к половым ворсинкам бактерии. Б. Два
нитевидных вириона фага fl. присоединившиеся к кончику половой ворсинки бактериальной клетки
мужского штамма Е. c(5li, и множество вирионов фага f2, присоединившихся к половой ворсинке
вдоль ее боковой поверхности.
I
Фото 39. Частично лизированная клетка Е. coli В, к поверхности которой присоединены
вирионы фага Т4.
Обратите внимание на пустой капсид, сократившиеся чехлы отростков и расстояние между базаль-
ной пластинкой отростка фага и стенкой бактериальной клетки. Отчетливо виден также воротничок
вириона фага.
Фото 40. Срез клетки Е. coli, штамм В, через 30 мин после заражения ее фагом Т2г.
Видно образование внутри бактерии огромного фонда ДНК (светлые участки, содержащие нитевид-
ные структуры). Для того чтобы не допустить созревания фага, через 8 мин после заражения
к суспензии бактерий добавляли хлорамфеникол.
Фото 41. Цитологические изменения, выявляемые в клетках Escherichia соЩ штамм В,
зараженных фаг ом Т5.
а — г. Окраска ядерным красителем (HCl-Гимза): а — незаряженные бактериальные клетки; б —
через 15 мин после заражения в клетках не обна'руживается оформленных ядерных телец; в — че-
рез 30 мин после заражения в клетках можно наблюдать некоторое количество гранулярного мате-
риала; г — через 48 мин после заражения клетки начинают лизироваться, д—з. Окраска цитоплаз-
матическим красителем тионином, который не выявляет ядерных структур: д — незаряженные
бактериальные клетки; е — 10 мин спустя после заражения фагом; ж — 30 мин спустя после
заражения фагом; з — 45 мин спустя после заражения фагом. Обратите внимание на то, что в дан-
ном случае выявляется картина, противоположная выявляемой при окраске хроматина.
Фото 42. Срез клеток Е. coli через 30 мин после заражения фагом Т2.
Обратите внимание иа то, что конденсаты ДНК имеют форму многогранника. На вставке
большем увеличении показан один из таких конденсатов, окруженный мембраной.
Фото 43. Внутриклеточный кристалл, состоящий из вирионов бактериофага f2.
Фото 44. Бляшки, образуемые фагом Т4 и его различными мутантами.
/ _ дикий тип; 2—m мутант (от англ, minute — <мелкий»); 3— tu-мутант (от англ, turbid — «мут
ный»); 4 — tn, tu-мутант (двойной tu-мутант); 5—г-мутант; 6 — г. т-мутант; 8 — г, tu, tu-мутан!
Обратите внимание на супрессивное действие, которое оказывают на бляшки, образуемые г мутанта
ми, соседние бляшки, образуемые мутантами иного типа
Фото 45. Белковые трубки ат50-мутанта фага Т4, выделенные из лизата непермис-
сивных бактерий, и нормальный вирион фага Т4 (в центре).
Обратите внимание на своеобразную молекулярную структуру этих трубок и их различную ширину.
Предполагают, что такие структуры образуются в непермиссивных бактериях, зараженных этим му-
тантным фагом, вследствие конденсации вокруг центрального белкового стержня концентрических
трубок (см. врезку).
Фото 46. Заражение различных индикаторных бактерий смесью фагов Т1 и Т2 (~Х2,5).
/1. Смесь индикаторных штаммов В/1 .. В/2. Б. Индикаторный штамм В/2, чувствительный только к
фагу TI. В. Индикаторный штамм В/1, чувствительный только к фагу Т2. Оба фага образуют мут-
ные бляшки, а светлые участки лизиса видны там, где бляшки, образуемые каждым из фагов,
налагаются друг на друга.
Фото 47. Кольцеобразные бляшки, образующиеся при посеве смеси, состоящей из не-
большого количества отмытых клеток лизогенного штамма бактерий и избыточного
количества чувствительных бактерий.
Чувствительные бактерии лизируются фагом, освободившимся из колоний лизогенных бактериаль-
ных клеток.
Фото 48. Электронная микрофотография фибробласта куриного эмбриона.
Видно ядро, окруженное ядерной оболочкой, внутри которого находится ядрышко. Мембраны эндо-
плазматической сети усеяны рибосомами. Там, где срез этих мембран прошел тангенциально, вид-
ны полисомы. Отчетливо видны также митохондрии и зоны Гольджи. На участках, расположенных
вне плазматической мембраны, можно различить коллагеновые волокна, / — митохондрия; 2 — по-
лнсомы; 3—эндоплазматическая сеть; 4 — клеточная мембрана; 5 — зона Гольджи; 6 — ядерная
оболочка; 7 — ядро; 8 — ядрышко; 9 — коллаген.
Фото 49. Адсорбция эритроцитов быка на
поверхности клетки Hela, зараженной виру-
сом ньюкаслской болезни.
Фото 50. Разрушение вируса грип-
па при его контакте с клеточными
мембранами.
Фото 51. Начальные стадии взаимодействий вируса ньюкаслской болезни с его клет-
кой-хозяином.
.1. Присоединение вируса к клетке, которое осуществляется благодаря специфическому связыванию
вирусной мембраны с определенным участком плазматической мембраны клетки-хозяина. Б. Сле-
дующий этап, состоящий в окружении вирусной частицы тесно прилегающим к ней слоем клеточ-
ной мембраны и образовании в результате этого вакуолеобразного пузырька. Обратите внимание на
то, что на этих стадиях вирус не теряет своей мембраны. 1 — вирус; 2 — плазматическая мембрана.
Фото 52. Электронные микрофотографии ультратонких срезов клеток Hela, зараженных
вирусом осповакцины, на которых можно наблюдать различные стадии разрушения
проникших в клетку вирионов.
/1. Вирион вируса осповакцины (имеющий характерную для этого вируса форму «кирпичика»), при-
соединившийся к поверхности клетки, и вирион, находящийся внутри плазматического пузырька и
связанный с клеточной мембраной, но пока сохранивший еще исходную морфологическую целост-
ность. Б. Частицы вируса осповакцины, лишившиеся внешней оболочки (так называемые «нуклеои-
ды») и находящиеся теперь в цитоплазматическом матриксе. В. Нуклеоид вируса осповакцины, в
одной из точек поверхности которого появилось отверстие, сквозь которое из нуклеоида выбрасывав
ется его содержимое, в том числе и его ДНК.
Фото 53. Электронные микрофотографии. демонстрирующие локализацию и распреде-
ление рибосом в клетках HeLa, зараженных вирусом полиомиелита, а также кривые,
полученные при изучении выделения полисом (при помощи центрифугирования в гра-
диенте сахарозы) из экстрактов клеток, метившихся в течение 5 мин (^-аминокисло-
тами [641, 831].
Л. Нормальные клетки. Видно, что рибосомы группируются в виде скоплений, по-видимому нс сни-
занных с мембранами. />. Клетки HeLa. зараженные вирусом (прошло примерно 2 часа с момента
заражения). Видно исчезновение скоплений рибосом, обычно содержащихся в нормальных клетках
этого типа. В. Период синтеза вируса Видно появление больших полисом, часто локализующихся
в непосредственной близости к мембранным структурам. На графиках, находящихся иод мик-
рофотографиями, сплошными линиями обозначена оптическая плотность при /. 260 ммк. которая
отражает содержание рибосом, а пунктирными линиями — радиоактивность образующихся белков.
Фото 54. Выявление антигенов вируса гриппа на поверхности зараженных им клеток.
Зараженные вирусом гриппа клетки подвергали воздействию соединенных с ферритином антител к
этому вирусу (ферритин — белок, содержащий железо)
Меченые антитела выявляют антигены вируса гриппа по всей поверхности заражен
Фото 55. Действие, оказываемое различными вирусами животных на клетки.
а—в — клетки, окрашенные флуоресцирующим красителем акридиновым оранжевым: а — нормаль-
ные клетки, б и в—многоядерные клетки, образуемые вирусом герпеса и кора соответственно; г —
электронная микрофотография частиц реовируса, связанных с нитями веретена; д — ультратонкий
срез L-клетки, зараженной вирусом Менго. Видна пораженная митохондрия и множество цитоплаз-
матических вакуолей;
е — кристаллы вируса полиомиелита в клетке HeLa и нарушение структуры всей цитоплазмы спустя
5—6 час после заражения культуры; ж — часть клетки, зараженной аденовирусом. В ядре видны
вирусные частицы, образующие кристаллоподобные структуры.
Фото 56. Фокус клеток, трансформированных вирусом саркомы Рауса, при небольшом
увеличении.
Фото 57. Колонии клеток, возникшие из одной клетки нормальной культуры ткани мы-
ши (Л) и одной злокачественной клетки, трансформированной вирусом полиомы (Б).
Фото 58. Клетка волоска табака, содержащая кристалл вируса табачной мозаики.
/1. Микрофотография сделана до лиофилизации. Б. Препарат после лиофилизации. В. Кристалл,
извлеченный при помощи микроманипулятора из лиофилизированного препарата. Г Отделение от
кристалла характерных вирионов при его частичном растворении в воде.
Фото 59. Электронная микро-
фотография части клетки, на-
ходящейся на периферии по-
раженного участка в листе
Chenopodium а та г anticolor (10
дней после заражения ВТМ).
Видны агрегаты ВТМ в продольном
и поперечном разрезе.
Фото 60. Микрокристаллы вируса раневых опухолей, обнаруженные в цитоплазме жи-
ровой клетки переносчика Agallia consiricla (сем. Cicadellidae).
Фото 61. Лист Nicotiana tabacum,
зараженный ВТМ.
Видно яркое пятно, образованное мутан-
том. вызывающим появление желтой мо-
заичности (ср. с фото 5).
Фото 62. Аномальный белок, образую-
щийся в листьях Nicotiana tabacum,
зараженных дефектным мутантом ВТМ.
Фото 63. Листья Nicotiana sylvestris, у которых прямое заражение ВТМ вызвало опре-
деленную степень устойчивости к заражению вирусом аукуба-мозаики.
В участки листа, на которых отсутствуют некротические поражения, вызываемые вирусом аукуба-
мозаики, за пять дней до заражения этим вирусом был втерт ВТМ.
Фото 64. Лист картофеля и тля Myzus pseudosolani в разрезе. Виден путь, проходи-
мый стилетом насекомого, достигшим флоэмы.
Фото 65. Полиэдры из Choristoneura
fumiferana (световой микроскоп).
Фото 66. Капсулы (Л) и вирионы (Б), вы-
деленные из организма бабочки Choristo-
neura fumiferana, больной гранулезом.
Фото 67. Полиэдр из Prodenia praefica, частично растворенный щелочью.
Видны оболочка полиэдра и содержащиеся внутри него скопления вирионов.
Фо го 68. Вирионы, выделенные из полиэдров тутового шелкопряда Bombix mori.
Видны интактные вирионы и вирионы, представляющие собой пустые структуры, по-видимому,
являющиеся внутренними мембранами.
Глава XVI
ОПУХОЛЕРОДНЫЕ ВИРУСЫ
ТРАНСФОРМАЦИЯ КЛЕТОК ВИРУСАМИ
Как уже упоминалось в предыдущих главах, заражение животной
клетки вирусом может привести к одному из двух результатов. Наиболее
часто наблюдается цитоцидальная реакция. В этом случае образуется
новый вирус, а клетка перестает делиться или даже разрушается. Виру-
сы, вызывающие цитопатические реакции такого типа, благодаря тому
что они обладают способностью быстро разрушать клетки, приводят к
возникновению острых заболеваний. Некоторые вирусы, однако, оказы-
вают совершенно иное действие на клетку. Мы имеем в виду так назы-
ваемые опухолеродные, или онкогенные, вирусы. Эти вирусы изменяют
зараженную клетку таким образом, что она приобретает способность к
непрерывному росту и делению. Частота, с которой происходит подобное
изменение, зависит как от вируса, так и от клетки. Такая трансформация
может закончиться, а часто и’действительно заканчивается превраще-
нием трансформированной клетки в злокачественную опухолевую клет-
ку, делящуюся бесконтрольно, что приводит к гибели животного.
Подобный процесс, наблюдающийся в культуре клеток животных,
был назван трансформацией, о чем можно лишь пожалеть, ибо обычно
этот термин используется для описания генотипического изменения ка-
кого-либо бактериального штамма вследствие поглощения нуклеиновой
кислоты (ДНК) бактерий другого штамма. На наш взгляд, для описания
этого явления более подошел бы термин конверсия, применяемый иссле-
дователями, работающими с фагами, для описания изменений свойств
бактерий, вызываемых фагом. Тем не менее далее для описания конвер-
сии клеток животных, т. е. явления, при котором нормальные клетки
животных, зараженные вирусом, переходят в состояние, находясь в ко-
тором они обладают способностью к неограниченному росту и во многих
случаях отличаются по своей морфологии от исходных, родительских
клеток, мы будем использовать термин «трансформация».
Следует подчеркнуть, что пока еще не удалось показать, что какой-
либо вирус, обладающий способностью индуцировать злокачественную
трансформацию, действительно может вызывать образование опухолей
у человека. Однако благодаря несомненному существованию опухолей,
индуцированных вирусами, у многих, самых различных животных и край-
не важному значению проблемы опухолей человека исследования в об-
ласти вирусологии опухолей за последнее время очень активизировались.
В этой главе мы хотим рассмотреть роль вирусов в образовании злока-
чественных опухолей. Особое внимание будет при этом уделено анализу
явления трансформации клетки, индуцируемой вирусом, о чем мы уже
упоминали выше.
ОПУХОЛИ: ЧТО ЭТО ТАКОЕ?
Опухолями, или неоплазмами, называются различного рода аномаль-
ные новообразования, возникающие у многоклеточных организмов—расте-
ний или животных. Клетки, из которых состоит опухоль, могут на первый
21 Заказ № 1214 — 321 —
322
Глава XVI
взгляд совершенно не отличаться от соответствующих клеток нормаль-
ных тканей. Тем не менее опухоли отличаются от патологических гипер-
плазий отсутствием функциональной координации с остальными клетка-
ми (под патологическими гиперплазиями понимают избыточный рост
нормальных клеток, как, например, при образовании костной мозоли на
месте перелома). Автономный рост клеток, образующих опухоль, факти-
чески превращает опухоль в паразита, живущего за счет остальной ча-
сти организма. Например, опухоль жировой ткани, или липома, сохра-
няет жир даже в том случае, когда вследствие заболевания или голода-
ния остальные ткани организма утрачивают почти весь содержащийся в
них жир.
Следует подчеркнуть, что степень паразитического воздействия опу-
холей на организм у разных опухолей различна. Например, доброкаче-
ственными неоплазмами называют такие опухоли, которые растут, не раз-
рушая активно соседние органы, не нарушают обмена веществ организма
и не обладают способностью образовывать метастазы (метастазами на-
зываются вторичные опухоли, образующиеся вследствие миграции опу-
холевых клеток по организму и имплантации этих клеток в другие ор-
ганы). Обычная доброкачественная опухоль, как, например, липома или
фиброма, служит главным образом механической помехой, поскольку в
процессе роста она оттесняет другие органы. Переход от доброкачест-
венной к злокачественной опухоли, в просторечии называемой раком,,
совершается почти незаметно. Раковые опухоли представляют собой не-
оплазмы, обладающие рядом характерных свойств. К их числу относятся
быстрый рост клеток, инвазия и разрушение клетками опухоли нормаль-
ных органов и тканей и образование метастазов. Существенной особен-
ностью клеток раковых опухолей являются частые и обычно аномальные
митозы.
Необходимо подчеркнуть, что не следует смешивать способность
опухоли к неограниченному локальному росту со способностью клеток
опухоли инвазировать другие ткани и разрастаться среди них. Раковые
опухоли человека обладают как первым, так и вторым свойством. Раз-
личие между этими двумя свойствами можно продемонстрировать и в
эксперименте, используя тканевые культуры. Так, было показано, что
клетки культуры можно трансформировать таким образом, что в куль-
туре они растут неограниченно, но при имплантации в организм живот-
ного вызывают образование лишь локальных опухолей. Некоторые линии
трансформированных клеток при дальнейшем культивировании in vitro
приобретают свойства истинных злокачественных клеток. При импланта-
ции их в организм животного они не только образуют опухоль в месте
имплантации, но и вызывают образование метастазов в различных орга-
нах и тканях организма [808, 875].
Опухолевые клетки родственны нормальным клеткам и часто осу-
ществляют ряд специфических функций, секреторных или иных, свойст-
венных клеткам тканей, из которых они произошли, несмотря на отсут-
ствие координации между ними и нормальными компонентами организ-
ма. Например, уже давно были обнаружены опухоли поджелудочной
железы, образующие избыточное количество инсулина. Более того, в ря-
де случаев было показано, что опухоли специализированной ткани, на-
пример легкого, вдруг начинают секретировать гормон свойственный
нормальному организму и обычно продуцируемый совершенно другой
специализированной тканью, например паращитовидной железой [760].
Следовательно, клетки опухоли могут не только сохранить или утерять
способность к осуществлению специфических функций, но й приобрести
способность осуществлять новые функции, не выполняемые родитель-
ской тканью.
Опухолеродные вирусы
323
По аналогии с родительскими тканями принято различать два типа
опухолей, гистологически отличающихся друг от друга: опухоли эпители-
альные и опухоли соединительной ткани. В качестве примера эпители-
альных опухолей можно привести папилломы, эпидермальные опухоли
(в том числе обычные бородавки), а также аденомы, или опухоли желез.
Из опухолей соединительной ткани можно назвать хондромы — опухоли
хрящей, остеомы — опухоли костей и много других. Даже в случае наи-
более атипичных раковых опухолей можно уловить некоторые черты
сходства между тканевой организацией опухоли и тканевой организа-
цией какой-либо нормальной ткани. Сказанное справедливо как в отно-
шении эпителиальных злокачественных опухолей, или карцином, состоя-
щих из опухолевых клеток эпителиального происхождения и стромы —
неопухолевой соединительной ткани, так и в отношении злокачественных
опухолей соединительной ткани, называемых обычно саркомами. Спо-
собность образовывать опухоли является свойством, присущим клеткам
как таковым. Опухолевые клетки, выращиваемые в культуре, сохраняют
свои особенности. При пересадке подходящему хозяину такие клетки
воспринимаются его организмом как «свои» и вызывают образование
опухолей.
Пересадка опухолей в другой организм является одним из главных
методов экспериментальной онкологии. При пересадке опухолей млеко-
питающим сохраняют силу все ограничения, которые следует иметь в
виду при пересадке нормальных тканей. Известно, что гетерологичные
трансплантаты не «воспринимаются» организмом. В конечном счете за от-
торжение ответственна генетические факторы, вследствие действия ко-
торых в ответ на пересадку гетерологичного трансплантата организм сра-
зу же отвечает токсической реакцией, а через некоторое время — образо-
ванием антител к чужеродным тканям. Однако если пересадка осущест-
вляется, например, в мозг или переднюю камеру глаза [298], а также в
куриный эмбрион [609], т. е. в системы, в какой-то мере изолированные от
всего организма и характеризующиеся пониженной способностью к об-
разованию антител, а, возможно,также и меньшей эффективностью дру-
гих механизмов, ответственных за резистентность, то приживаются и
гетерологичные трансплантаты, причем взятые не только от животных
другого вида, но и другого рода. Вообще же для того, чтобы успешно
перевивать опухоли на лабораторных животных, необходимо располагать
высокоинбредными, так называемыми чистыми линиями животных, по-
лучаемыми путем повторного скрещивания между сибсами*
ЭТИОЛОГИЯ ОПУХОЛЕЙ
Канцерогенные вещества
В чем же причина того, что какая-то клетка или группа клеток ор-
ганизма животного приобретает способность к неопластическому росту
и превращается в опухоль? Обычно мы не знаем, почему это происходит,
и говорим в таких случаях о спонтанной опухоли. Известно, однако, что
ряд агентов может вызвать образование неоплазм в эксперименте и не-
которые из них, несомненно, играют роль и в образовании опухолей,
встречающихся в естественных условиях.
К числу наиболее хорошо изученных агентов такого рода относится
группа циклических углеводородов (например, метилхолантрен, 3,4-бенз-
пирен, 1,2,5,6-дибензантрацен [299]). Нанесение этих соединений, напри-
мер на кожу, в очень большом числе случаев вызывает образование
опухолей. Многие химически индуцированные опухоли подобны опухо-
21*
324
Глава XVI
лям, образующимся спонтанно. Однако таким путем были получены и
опухоли, которые ранее никогда не наблюдались. Возможно, это объяс-
няется тем, что подобные опухоли спонтанно возникают крайне редко.
Например, при введении одного из таких канцерогенных веществ крысе
в ряде органов возникают изменения, которые вначале невозможно от-
личить от хронического воспаления, но затем более или менее быстро
образуются истинные неоплазмы, а часто и раковые опухоли. В неоплаз-
ме канцерогены не содержатся, но клетки, ее образующие, тем не менее
изменяются необратимо.
Из числа исследований, посвященных изучению химических канце-
рогенов, наибольшую известность, вероятно, получила работа, показав-
шая, что конденсат табачного дыма может вызвать образование у жи-
вотного опухолей того же гистологического типа, что и бронхогенная кар-
цинома человека. Эти данные согласуются с результатами массовых ста-
тистических исследований, показавших наличие связи между курением и
увеличением частоты рака легкого.
Уже давно существует мнение, что, кроме химических канцерогенов,
определенную роль в образовании опухолей играют некоторые физиче-
ские факторы, и в первую очередь ультрафиолет и рентгеновские лучи.
Ряд экспериментальных исследований, посвященных изучению влияния
этих факторов на образование опухолей у животных, как и несколько
превосходных статистических исследований, документально продемонст-
рировали увеличение частоты ряда злокачественных заболеваний у лиц,
подвергавшихся интенсивному воздействию радиации [517, 581]. Извест-
но, что 'компонентом клетки, наиболее чувствительным к действию ра-
диации, является ее нуклеиновая кислота, а изменения свойств клетки,
ответственные за ее превращение из нормальной в опухолевую, переда-
ются по наследству от родительской клетки дочерним. Поэтому много-
кратно предпринимались попытки выявить различия между нуклеино-
выми кислотами опухолевых и соответствующих нормальных клеток. Од-
нако пока не удалось установить каких-либо важных различий. Един-
ственным исключением явилось обнаружение несколько большего отно-
сительного содержания метилированных оснований в нуклеиновых кис-
лотах, выделенных из опухолевых клеток [861].
Попытки использовать химические или физические канцерогены для
изучения в эксперименте механизма канцерогенеза пока не дали сколь-
ко-нибудь существенных результатов, ибо при помощи этих агентов не
всегда удается индуцировать рак in vitro. Так, начальную стадию взаи-
модействия между нормальной клеткой и вызывающим образование опу-
холей химическим или физическим агентом, в результате которого эта
клетка превращается в опухолевую, изучить на клеточном уровне так
и не удалось. Поскольку это ограничение не относится к опухолеродным
вирусам, изучение вирусного канцерогенеза приобрело большую попу-
лярность. Необходимо подчеркнуть, однако, что при работе с доступны-
ми пока системами вирус — клетка частоту трансформации нормальных
клеток в раковые все еще точно контролировать не удается. Тем не ме-
нее эти системы намного лучше, чем любые другие системы, предлагав-
шиеся до сих пор для изучения in vitro канцерогенного действия хими-
ческих и физических агентов.
ОПУХОЛИ, ВЫЗВАННЫЕ ВИРУСАМИ
Прежде чем приступить к рассмотрению роли вирусов в образовании
опухолей, имеет смысл сначала кратко описать ряд опухолей вирусного
происхождения, встречающихся в природе или образующихся в экспе-
риментах на животных (табл. 31). Некоторые из перечисленных опухоле-
Опухолеродные вирусы
325
родных вирусов вызывают широко распространенные в природе забо-
левания, например лейкозы птиц, лейкемию и рак молочной железы
мышей, папилломы и фибромы различных млекопитающих, а также боро-
давки человека (доброкачественная опухоль). Ряд же других опухоле-
родных вирусов вызывает в естественных условиях заболевания лишь
изредка. Например, вирус полиомы мышей, хотя и широко распростра
нен в природе, в естественных условиях редко вызывает образование нео-
плазм [692]. Следует, однако, отметить, что впервые он был выделен имен-
но из такой опухоли [818]. Однако этот вирус регулярно вызывает транс-
сформацию культивируемых клеток, в связи с чем широко используется
при экспериментальных исследованиях.
Таблица 31
Опухолеродные вирусы животных 18371
Год от- крытия Название вируса и основной хозяин HyKj ота’)
1908 Вирус лейкемии птиц РНК
1911 Вирус саркомы птиц, вирус саркомы Рауса (куры) »
1917 Вирус бородавок человека ДНК
1920 Вирус папилломы быка »
1932 Вирус оральной папилломы собак »
1933 Вирус папилломы кроликов
1933 Вирус лимфомы птиц РНК
1936 Вирус оральной папилломы кроликов ДНК
1936 Вирус рака молочной железы мышей РНК
1951 Вирус кожной папилломы лошадей ДНК
1951 Вирус лейкемии мышей Гросса РНК
1953 Вирус фибромы белок ДНК
1955 Вирус фибромы оленя »
1956 Вирус лейкемии мышей Фрейнд РНК
1957 Вирус полиомы (мышь) ДНК
1962 Вирус SV-40 (обезьяна)
1962 Аденовирусы (человек) 1>
Вызывают ли эти вирусы образование опухолей в естественных условиях, неизвестно.
Не во всех случаях тип нуклеиновой кислоты был определен адекватными методами, и в не-
которых случаях мы приводим его по аналогии с хорошо изученными вирусами сходной структуры.
Способностью трансформировать клетки в культуре обладают и дру-
гие вирусы, перечисленные в табл. 31, однако до сих пор не было обна-
ружено, чтобы они вызывали опухоли в естественных условиях. В каче-
стве примера такого типа вирусов можно привести вирус SV-40, впервые
выделенный из первичной культуры клеток почек обезьян, и аденовиру-
сы человека [758, 858]. Оба эти агента обладают способностью вызывать
малигнизацию клеток хомяка, как в культуре, так и при введении виру-
са животному. Вирус SV-40 способен также трансформировать культи-
вируемые in vitro клетки человека. Однако ни в отношении вируса SV-40,
ни в отношении аденовирусов не было показано, что они вызывают опу-
холи у своих естественных хозяев, т. е. соответственно у обезьян и че-
ловека.
Поскольку объем этой книги не позволяет подробно изложить исто-
рию открытия всех до сих пор обнаруженных опухолеродных вирусов,
мы вынуждены ограничиться упоминанием лишь наиболее выдающихся
открытий.
Впервые осуществить успешную перевивку опухоли от одного жи-
вотного другому путем введения сыворотки или бесклеточного экстракта
удалось Эллерману и Бангу [214]. Эти авторы показали, что для пассиро-
вания висцерального лимфоматоза кур от одного животного к другому
не обязательно вводить реципиенту интактные клетки донора. Однако в
326
Глава XVI
то время не было известно, что это сложное заболевание по своему ха-
рактеру близко злокачественной опухоли кроветворной системы млеко-
питающих. Действительным же началом развития отрасли науки, назы-
ваемой теперь вирусологией опухолей, послужила работа Пейтона Рауса
[694], в которой он показал, что «естественная» саркома кур породы пли-
мутрок может быть пассирована от одного животного к другому путем
инокуляции бесклеточного, не содержащего бактерий фильтрата опу-
холи.
В течение многих лет сама возможность существования опухолерод-
ных вирусов казалась сомнительной. Объяснялось это главным образом
отсутствием понимания общей природы вирусов, а также тем, что мно-
гие экспериментаторы-патологи совершенно не считались с данными, по-
лученными на каких-либо других объектах, помимо млекопитающих.
Новым стимулом к изучению опухолеродных вирусов послужили иссле-
дования, начатые в 1932 г. Шоупом и его сотрудниками, избравшими в
качестве объекта изучения вирус, вызывающий папиллому у кроликов
[763, 765]. Этот вирус можно легко выделить из папиллом, как возник-
ших, так и индуцированных в естественных условиях, у диких американ-
ских кроликов, однако следует отметить, что лишь изредка эти опухоли
превращаются у них в злокачественные.
Когда же этим вирусом заразили домашних кроликов (эти живот-
ные относятся к другому роду), были обнаружены два поразительных
факта. Так, оказалось, что, во-первых, индуцировавшиеся у домашних
кроликов папилломы систематически превращались в злокачественные
карциномы и, во-вторых, инфекционный вирус, который можно было
выделить из папиллом диких кроликов без особых трудностей, из опухо-
лей домашних кроликов удавалось выделить очень редко, хотя его при-
сутствие можно было обнаружить, используя чувствительные антиген-
ные тесты. Эти исследования дали толчок к изучению роли «маскирован-
ных» вирусов в образовании опухолей («маскированными» называют
вирусы, не обнаруживаемые методами, основанными на выявлении ин-
фекционности).
В 1936 г. Биттнер открыл еще один важный опухолеродный вирус
[81]. Этот исследователь показал, что рак молочной железы возникает
у тех мышей, которые были вскормлены молоком, содержащим особый
фактор (так называемый фактор молока). Впоследствии было показано,
что этот фактор обладает свойствами, характерными для вируса, а имен-
но проходит через бактериальные фильтры и стимулирует образование
антител. На электронных микрофотографиях зараженных вирусом опу-
холевых клеток, культивировавшихся in vitro, можно было ясно обна-
ружить наличие в них вирусных частиц. Тем не менее до сих пор не уда-
лось адаптировать этот вирус к тканевым культурам, что не позволяет
осуществить его количественное изучение.
Одно интересное свойство этой системы, в особенности привлека-
тельное для экспериментаторов, состоит в том, что рак молочной желе-
зы возникает лишь у тех зараженных этим вирусом самок мышей, мо-
лочная железа которых подвергается воздействию соответствующих гор-
монов, либо введенных искусственно, либо поступающих в кровоток при
беременности. Эти данные вновь продемонстрировали, что опухолерод-
ным вирусам свойственно находиться в латентном, или маскированном,
состоянии. Очень важно, что эти эксперименты обратили также внимание
исследователей на тот факт, что для образования вирусом опухоли не-
обходимо какое-то вторичное событие, в данном случае гормональный
стимул.
Работы Рауса, Шоупа и Биттнера стимулировали поиск опухолерод-
ных вирусов, и в результате за последние 15 лет было открыто много но-
Опухолеродные вирусы
327
вых онкогенных вирусов. Однако за последнее время внимание исследо-
вателей сосредоточилось не столько на поиске новых, сколько на изуче-
нии свойств уже открытых опухолеродных вирусов, проводящемся на
клеточном уровне. Во многом этому способствовали успехи, достигнутые
в совершенствовании методов работы с культурами клеток, что позволи-
ло разработать количественные методы изучения трансформации клеток
опухолеродными вирусами in vitro.
Наиболее тщательному изучению подверглись следующие системы:
1) фибробласты кур, трансформированные вирусом саркомы Рауса
(ВСР), и 2) фибробласты млекопитающих, трансформированные ДНК-
содержащими вирусами, в том числе вирусом полиомы, вирусом SV-40
и аденовирусами. Ниже мы сначала рассмотрим каждую из этих систем
в отдельности, а затем обсудим возможные общие стадии событий, на-
блюдаемых при трансформации клеток вирусами.
Саркома Рауса
Несмотря на то что в период между 1911 и 1955 гг. изучению вируса
саркомы Рауса было посвящено большое количество экспериментальных
исследований, многие фундаментальные вопросы, касающиеся как
свойств вируса, например его размера, состава, стабильности, скорости
размножения и т. д., так и свойств зараженных им клеток, остались не-
разрешенными. Содержит ли вирус каждая опухолевая клетка? Может
ли клетка продуцировать вирус и одновременно делиться? Очевидно,
что получение ответов на эти принципиальные вопросы имеет большое
значение.
В 1958 г. Темин и Рубин [843] разработали метод количественного
определения вируса саркомы Рауса in vitro. В основе предложенного
ими метода лежит явление, ранее обнаруженное Менакером и Групэ
[559]. Эти авторы подметили, что нанесение небольшого количества ви-
руса саркомы Рауса на однослойную культуру куриных фибробластов
приводит к образованию групп, или фокусов, измененных клеток, число
которых можно подсчитать (фото 56). Этот метод по своей сущности яв-
ляется как бы противоположностью метода подсчета числа бляшек, при
помощи которого, как известно, подсчитывают число зон разрушенных
клеток, каждая из которых возникает в результате распространения ви-
руса из одной первично зараженной клетки. Метод определения транс-
формирующей активности вирусов путем подсчета числа «фокусов
трансформации» сыграл роль инструмента, пользуясь которым удалось
осуществить ряд весьма плодотворных исследований, посвященных изу-
чению взаимодействия клетки с опухолеродными вирусами [698].
Число фокусов трансформации, образующихся при заражении одно-
слойной культуры куриных фибробластов вирусом саркомы Рауса, прямо
пропорционально количеству вируса, введенного в культуру, а это гово-
рит о том, что за образование фокуса трансформации ответственна одна
вирусная частица (см. гл. III). Вирусы, образуемые клетками, принад-
лежащими к какому-либо одному фокусу трансформации, можно рас-
сматривать как относящиеся к одному клону. Было показано, что такой
чистый клон вируса саркомы Рауса способен трансформировать в сарко-
матозные мезодермальные и энтодермальные клетки, а также эктодер-
мальные клетки радужной оболочки глаза [218].
Детальное изучение процесса размножения вируса саркомы Рауса,
в том числе и методами, позволяющими культивировать отдельные клет-
ки в микрокаплях культуральной жидкости, показало, что большинство
клеток, трансформированных этим вирусом (использовали вирус одного
жлона), может одновременно и продуцировать вирус и делиться в неогра-
328
Г лава X VI
ниченном числе генераций. Необходимо подчеркнуть, что пока не было
обнаружено другой системы вирус — клетка, где клетки были бы способ-
ны делиться и одновременно продуцировать вирус. Вирусные частицы
образуются медленно. Одна клетка продуцирует один вирион примерно
за 5 час [844]. Внутри клеток содержится очень мало вирусных частиц,
и большая часть вируса, связанного с клетками, нейтрализуется анти-
сывороткой. Этот факт говорит о том, что вирус саркомы Рауса созре-
вает у поверхности клетки, а зрелые вирионы почти немедленно после
сформирования выходят из клетки. Как уже указывалось в гл. XV, такой
тип созревания характерен для миксовирусов и арбовирусов.
Одним из наиболее загадочных вопросов, возникших в связи с ре-
зультатами, полученными при изучении опухолей животных, индуциро-
ванных вирусом саркомы Рауса, явилось обнаружение образования опу-
холей, не содержавших вируса, — факт, находящийся в противоречии с
результатами, полученными при изучении взаимодействия этого вируса
с клетками in vitro [108, 656, 695]. Было обнаружено, что при введении
животному небольшого количества вируса вероятность образования опу-
холи, не содержащей вируса, выше, чем при введении большого количе-
ства вируса. Причина этого явления, как и ряда других аномалий, наблю-
давшихся при изучении трансформации клеток вирусом саркомы Рауса
in vitro, была в конце концов выяснена. Оказалось, что вирус саркомы
Рауса является дефектным вирусом, вследствие чего для его созревания
необходимо присутствие в клетке другого родственного вируса [311, 761].
История открытия дефектности вируса саркомы Рауса такова. Сна-
чала было обнаружено, что многие куры и куриные эмбрионы заражены
некоторыми штаммами большой группы вирусов, вызывающих лейкозы
у птиц. Некоторые из этих вирусов вызывают образование опухолей кро-
ветворных органов, но в большинстве случаев у кур и куриных эмбрионов
никаких заболеваний не наблюдается. Далее было обнаружено, что
клетки, зараженные одним из этих кажущихся безвредными вирусов,
приобретают устойчивость к заражению и трансформации вирусом сар-
комы Рауса. Используя метод количественного определения трансфор-
мирующей активности вируса саркомы Рауса (подсчет фокусов транс-
формации), можно обнаружить и количественно определить содержа-
щийся в системе интерферирующий вирус (фактор, ингибирующий вирус
саркомы Рауса — ФИР). Таким образом удалось отобрать культуры ку-
риных фибробластов, не содержащих ФИР. В свою очередь, используя
эти культуры, удалось выявить, какие из имеющихся препаратов вируса
саркомы Рауса содержат другие вирусы этой группы, а какие— нет. Та-
ким путем Рубин в изучавшихся им препаратах вируса саркомы Рауса
обнаружил новый вирус, который он назвал Раус-ассоциированным ви-
русом (РАВ). Этот вирус, подобно ФИР, интерферировал с вирусом сар-
комы Рауса в образовании фокусов трансформации (фиг. 70). Раус-ас-
социированный вирус серологически родствен как вирусу саркомы Рауса,
так и другим ФИР-вирусам.
Следующей страницей истории изучения вируса саркомы Рауса бы-
ло обнаружение того, что иммунологическая толерантность к вирусу
ФИР играет роль в процессе, контролирующем наличие или отсутствие
вируса в опухолях кур, индуцированных вирусом саркомы Рауса. Им-
мунологическая толерантность к данному антигену является результа-
том наличия этого антигена в иммунологически незрелом организме [580].
Если данный антиген снова ввести в такой организм после окончатель-
ного созревания иммунологической системы, то организм не ответит на
его введение образованием соответствующих антител. И действительно,
было показано, что если в ранний период развития организма заразить
его вирусом ФИР, то курица становится толерантной к вирусу саркомы
Опухолеродные вирусы
329»
Рауса, в результате чего титр этого вируса повышается. Таким образом,
титр вируса саркомы Рауса в опухолях, полученных от толерантных кур,
значительно выше, чем в контрольных. Более того, в некоторых опухолях,
полученных от животных, не толерантных к вирусу ФИР, вирус саркомы
Рауса вовсе не удается обнаружить. Опухоли, индуцированные у нето-
лерантных животных, обычно рассасываются, вероятно вследствие им-
Фиг. 70. Тест на наличие Раус-ассоциированного вируса (РАВ).
В две чашки Петри, содержащие куриные фибробласты, вводят различные количества раствора,
содержащего некоторое количество вируса саркомы Рауса (черные кружки) и избыточное количе-
ство РАВ (белые кружки). В чашках, куда попал вирус саркомы Рауса (ВСР), образовались фоку-
сы трансформированных клеток. Клетки, содержащиеся в чашках, в которые попал только РАВ, быст-
ро инфицируются этим вирусом и приобретают устойчивость к заражению вирусом саркомы Рауса.
А. Фокусы трансформации, индуцируемые BCP, отсутствуют. Размножается РАВ. Б. Все клетки со-
держат РАВ. В. Два фокуса трансформации, индуцированные ВСР. Г. Индуцируемые ВСР фокусы
трансформации отсутствуют, ибо клетки устойчивы к действию этого вируса.
мунологического отторжения, тогда как у толерантных животных опу-
холи растут до тех пор, пока не убивают животное [761].
Очевидно, что конечный результат инфекции, вызванной вирусом
саркомы Рауса, и в особенности образование опухолей, не содержащих
вируса, зависит от каких-то факторов, родственных ФИР. В связи с этим
возникает вопрос: ответственна ли за образование безвирусных опухолей
лишь интенсивная иммунологическая реакция организма хозяина или
в основе этого явления лежат более тонкие биологические механизмы?
Ответ на этот вопрос был получен при изучении образования вируса
клетками, трансформированными при их заражении малым количеством
вируса. Было обнаружено, что при разбавлении смеси, содержащей ви-
рус саркомы Рауса (ВСР) и Раус-ассоциированный вирус (РАВ), сильно
разбавленные пробы содержат чистый РАВ (фиг. 70). Это означает, что
в исходном материале концентрация РАВ превышает концентрацию ВСР.
Для того чтобы очистить ВСР, Ханафуза и сотр. [311] вводили в культуру
очень небольшие количества вируса (низкая множественность зараже-
ния), после чего небольшое количество зараженных клеток переносили
в другую чашку. В результате в одной чашке появлялось максимум два-
три фокуса трансформации. Для того чтобы предупредить распростра-
330
Глава XVI
некие образующегося вируса от клетки к клетке, к культуре добавляли
антисыворотку.
Когда клетки, трансформированные ВСР, были выделены и размно-
жены, в результате чего исследователи получили достаточно большое
количество линий таких клеток, оказалось, что более 80% линий транс-
формированных клеток не продуцировали ни ВСР, ни РАВ. Действие
Фиг. 71. Образование клеток, трансформированных вирусом саркомы Рауса, но не
продуцирующих вирус.
Куриные фибробласты заражали инокулумом, содержащим небольшое количество смеси ВСР —
РАВ. Для того чтобы предупредить распространение вируса от клетки к клетке, к культуре добавля-
ли агар и антисыворотку (пунктирные линии вокруг клеток). Затем клетки клона, трансформиро эн-
ного ВСР, переносили в другую чашку, получая в результате культуры трансформированных клеток,
не продуцирующих вирус. Если к такой культуре доба ить «вирус-помощник» РАВ-1 или РАВ-2, то
клетки начинают продуцировать как ВСР, так и вирус-помощник.
ультрафиолета или другие типы воздействия, эффективные при индук-
ции образования фага лизогенными бактериями, не привели к образова-
нию вируса. Однако, когда к таким не продуцирующим вирус культурам
добавляли небольшое количество РАВ, наблюдалась неожиданная
вспышка синтеза как РАВ, так и ВСР (фиг. 71). Подобным образом вел
себя любой из клонов трансформированных клеток, не продуцировав-
ших вирус. Было обнаружено, что образование ВСР индуцирует не толь-
ко РАВ, но и многие другие родственные штаммы вирусов, вызывающих
лейкозы, в том числе и исходный вирус ФИР.
РАВ и ФИР, обладая некоторым серологическим родством, тем не
менее серологически отличаются друг от друга. Вирионы же ВСР, обра-
Опухолеродные вирусы
331
зующиеся под влиянием одного из этих вирусов, иммунологически иден-
тичны индуцирующему вирусу [311]. Таким образом, резюмируя сказан-
ное выше, можно прийти к выводу, что вирус саркомы Рауса является
дефектным вирусом, неспособным индуцировать образование какого-то
компонента, входящего в состав вириона. Поэтому зрелый ВСР может
образоваться лишь в том случае, если этот компонент будет синтезиро-
ван либо РАВ, либо ФИР Вновь синтезировавшийся зрелый ВСР по
антигенной структуре будет походить на вирус, индуцировавший синтез
недостающего компонента его вириона.
Следовательно, каждая трансформированная клетка содержит ге-
ном ВСР, однако в отсутствие вируса-помощника информация, содержа-
щаяся в этом геноме, для образования вируса не используется. Однако
в том случае, когда зрелый ВСР уже образовался, он может трансформи-
ровать клетку, не прибегая к содействию вируса-помощника. У живот-
ных, не зараженных РАВ, вирус саркомы Рауса индуцирует образование
опухолей, состоящих из клеток, не продуцирующих вирус, причем в орга-
низме этих животных антитела, нейтрализующие ВСР, не образуются.
Резюмируя, мы можем прийти к выводу, что образование у живот-
ных опухолей, не продуцирующих вирус, можно объяснить двумя при-
чинами. С одной стороны, у животных, зараженных ВСР и РАВ, иммуно-
логическая реакция со стороны организма может привести к тому, что
опухоль, индуцированная ВСР, не будет содержать вируса вследствие
уменьшения количества свободного РАВ. С другой стороны, как и в опы-
те in vitro, опухоль, состоящая из клеток, не продуцирующих вирус, мо-
жет возникнуть вследствие того, что клетка-родоначальница опухоли бы-
ла трансформирована ВСР при отсутствии в ней вириона РАВ.
События, происходящие на молекулярном уровне, при трансформации
клетки вирусом саркомы Рауса
Эксперименты, описанные в предыдущем разделе, выявили два важ-
ных события, происходящих при трансформации клеток вирусом сарко-
мы Рауса, которые требуют объяснения на молекулярном уровне. Эти со-
бытия таковы: 1) интеграция вирусного генома с клеткой-хозяином, пре-
терпевшей трансформацию, которая происходит таким образом, что
вирусный геном сохраняется во всех генерациях трансформированных
клеток, и 2) воздействие, оказываемое вирусом на клетку, результатом
которого является трансформация свойств клетки.
В настоящее время ясно, что материалом, использовавшимся иссле-
дователями, пытавшимися прежде определить состав и свойства вируса
саркомы Рауса, служил не чистый вирус Рауса, а его смесь с вирусом-
помощником, содержание которого в этой смеси превалировало. Анализ
показал, что единственной нуклеиновой кислотой, содержащейся в та-
ких смесях ВСР и РАВ, является РНК. Было установлено, что молеку-
лярный вес этой РНК необычайно велик — около 107 дальтон, что при-
мерно в пять раз превышает молекулярный вес РНК вируса полиомиели-
та [684]. Данные, полученные при изучении влияния на размножение
вируса саркомы Рауса различных ингибиторов синтеза ДНК, а именно
5-фтордезоксиуридина, аминоптерина и цитозинарабинозида, показали,
что добавление этих ингибиторов к зараженным клеткам после начала
образования ВСР не прерывает его дальнейшего синтеза [38, 841], и, та-
ким образом, подтвердили, что в состав ВСР действительно входит толь-
ко РНК.
Оказалось, однако, что, несмотря на то что уже начавшийся синтез
вируса Рауса действительно продолжается при ингибировании синтеза
ДНК, синтез ДНК является необходимым условием самого обоснования
332
Глава XVI
этого вируса в клетке. Так, например, было показано, что облучение кле-
ток с равной эффективностью блокирует как рост клеток, так и их транс-
формацию ВСР [698], а ингибирование синтеза ДНК эффективно подав-
ляет как инициирование трансформации клеток ВСР, так и инициирова-
ние образования самого ВСР. Дальнейшие эксперименты показали, что
период, в течение которого синтез ДНК необходим для последующего
развития процессов, индуцируемых ВСР, заканчивается примерно через
5 час после заражения клеток вирусом. Интересно, что, несмотря на то
что образование вируса не начинается раньше чем через ~15 час после
заражения клетки, процессы, идущие по окончании 5 час. после зараже-
ния вирусом, не прерываются при подавлении синтеза ДНК [38].
Для объяснения этих результатов Темин [842] предложил следующую
схему синтеза ВСР. Согласно этой схеме, геном вируса саркомы Рауса,
т е. его РНК, служит матрицей для образования комплементарной ей
двухспиральной ДНК-реплики (провирусной ДНК), в свою очередь ин-
тегрирующейся с ДНК клетки. Вновь образующаяся вирусная РНК
транскрибируется с интегрированной клеточной вирусоподобной ДНК.
Эта схема объясняет еще одно неожиданное наблюдение, а именно ин-
гибирование уже начавшегося синтеза ВСР актиномицином D — анти-
биотиком, как известно, подавляющим синтез РНК на ДНК-матрице.
Хотя эта схема и противоречит ортодоксальным представлениям,
она тем не менее стимулирует дальнейшее изучение этой проблемы-
Следует, однако, подчеркнуть, что результаты, полученные при изучении
влияния ингибиторов на взаимодействие ВСР с клеткой, можно объяс-
нить и другим образом. Например, известно, что хотя актиномицин прак-
тически не подавляет размножения ряда РНК-содержащих вирусов, на
синтез вируса ньюкаслской болезни он оказывает такое действие. В ви-
рионе этого вируса содержится примерно столько же РНК, сколько и в
вирионах ВСР — РАВ. Однако этот вирус размножается в цитоплазме и
поэтому ни в коей мере не зависит от клеточной ДНК. Следовательно, за
ингибирование действия ВСР актиномицином может быть ответственно
не блокирование синтеза РНК на ДНК-матрице, а какой-то иной эффект^
оказываемый этим антибиотиком.
ТРАНСФОРМАЦИЯ КЛЕТОК ДНК-СОДЕРЖАЩИМИ ВИРУСАМИ
И ДОКАЗАТЕЛЬСТВА ИНТЕГРАЦИИ ВИРУСНОГО ГЕНОМА
При изучении действия вирусов на культуры клеток был обнаружен
еще один вид индуцируемой вирусами трансформации клеток — конвер-
сия фибробластов эмбрионов млекопитающих в опухолевые клетки, вы-
зываемая вирусом полиомы, вирусом SV-40 и аденовирусами. Из пред-
ставителей этой группы трансформирующая активность была обнаруже-
на сначала у вируса полиомы — вируса, впервые выделенного из опухоли
слюнной железы мыши [816]. Этот вирус обладает удивительным свойст-
вом: он вызывает образование опухолей самых различных органов, при-
чем не только у мышей, но и у хомяков и у иных животных. Примеча-
тельно, что подобным широким спектром действия обладают также и
клоны, выделенные из отдельных бляшек. Способность вируса полиомы
индуцировать трансформацию клеток культуры ткани впервые была
обнаружена Фогт и Дульбекко [872]. Затем Шейн и Эндерс [758] пока-
зали, что вирус SV-40 способен трансформировать клетки эмбриона че-
ловека, а Трентин [858] обнаружил способность аденовирусов вызывать
образование опухолей у хомяков.
При воздействии этих вирусов на первичные эмбриональные клетки
трансформируется менее 1 % клеток, подвергшихся заражению. В этом
отношении эти вирусы резко отличаются от вируса саркомы Рауса, спо-
Опухолеродные вирусы
333
собного трансформировать до 20—40% эмбриональных клеток культуры.
Вначале трансформацию клеток вирусом полиомы удавалось наблюдать
лишь в массе культивировавшихся клеток, причем не ранее чем через
10 дней после заражения, когда разросшаяся зона трансформированных
клеток становилась легко видимой. Недавно было показано, что уже
установившиеся культуры нормальных клеток трансформируются виру-
сами полиомы и SV-40 в опухолевые с частотой, варьирующей от 1 : 2
до 1 : 10.
Частота трансформации может быть определена непосредственно
путем количественного анализа клонов клеток, растущих в культураль-
ной среде, содержащей агар [556, 818]. Нормальные фибробласты не в
состоянии расти в такой среде, тогда как большинство трансформиро-
ванных клеток обладает таким свойством.
После того как было установлено, что трансформация клеток виру-
сом полиомы является четким, хорошо воспроизводимым явлением, были
предприняты попытки определить, сохраняется ли вирус в трансформиро-
ванных клетках. Очевидно, можно представить себе две возможности:
1) клетка может сохранять состояние трансформации лишь в том случае,
если гены вируса интегрированы с геномом клетки; 2) роль вируса сво-
дится к инициации у клетки каких-то изменений, передающихся затем
клеткам всех последующих генераций, однако дальнейшее присутствие
вируса в клетке для поддержания состояния трансформации не обяза-
тельно. Анализ многих клонов трансформированных клеток, при полу-
чении которых в культуральную среду добавляли антивирусную сыво-
ротку, показал, что большинство, если не все клональные линии транс-
формированных клеток, не содержат цельного инфекционного вируса
[202, 873, 874]. Более того, все попытки обнаружить в этих линиях транс-
формированных, не содержащих инфекционного вируса клеток, инфек-
ционную вирусную ДНК, антигены, сходные с белками капсида, а также
все попытки реактивировать вирусные гены путем заражения трансфор-
мированных клеток родственными мутантными вирусами (метод демас-
кировки гена) оказались совершенно безуспешными.
Однако в то же время с помощью иных иммунологических методов
были получены данные, позволяющие предполагать, что в трансформи-
рованных вирусом полиомы клетках содержится и функционирует по
крайней мере часть генома вируса. Эти исследования показали, что в
таких клетках содержится чужеродный антиген, отличающийся от анти-
генов капсида вируса и ответственный за отторжение этих клеток орга-
низмом иммунологически компетентного животного [304, 784]. Еще более
важным оказалось то, что все опухоли, индуцированные вирусом полио-
мы, по-видимому, содержат одинаковый вирусоспецифичный антиген.
Наиболее вероятная интерпретация этих результатов состоит в том, что
в таких клетках содержится геном вируса, который и ответствен за об
разование трансплантационного антигена.
Данные, полученные впоследствии при изучении клеток, трансфор-
мированных другими ДНК-содержащими вирусами, убедительно пока-
зали, что вышеизложенная интерпретация правильна. Так, было обнару-
жено, что в сыворотке крови животных, являющихся носителями свобод-
ных от вируса опухолей, индуцированных аденовирусами типа 12 и 18,
содержатся комплемент-связывающие антитела против антигенов, содер-
жащихся в экстрактах культивируемых клеток, продуцирующих эти
вирусы [382]. Более того, эти антитела обладали соответствующей типовой
специфичностью, т. е. у животных, в организме которых имелась опухоль,
индуцированная аденовирусом типа 12, в сыворотке крови имелись и ан-
титела против антигенов аденовируса типа 12, а не типа 18, и наоборот.
Дальнейшие эксперименты показали, что в сыворотке крови хомяков,
334
Глава XVI
в организме которых имеются опухоли, индуцированные аденовирусом,
содержатся антитела к той части капсида аденовируса, которая опреде-
ляет типовую специфичность вируса. Эти данные свидетельствуют о не-
сомненном наличии по крайней мере части генома вируса в не содержа-
щих инфекционного вируса опухолях [382].
Дополнительные доказательства справедливости изложенной выше
точки зрения были получены при изучении клеток, трансформированных
вирусом SV-40. Оказалось, что в этих клетках содержится опухолевый
антиген, названный Т-антигеном (от английского tumour — «опухоль»),
который отличается от антигенов капсида вируса. Т-антиген был обна-
ружен также в клетках, зараженных вирусом SV-40, которые продуци-
руют инфекционный вирус и реагируют на заражение цитопатической
реакцией. В таких клетках Т-антиген появлялся за много часов до появ-
ления антигенов капсида вириона. Более того, в случае когда к заражен-
ным клеткам с целью предотвращения синтеза вирусной ДНК добавляли
фтордезоксиуридин или цитозинарабинозид, синтеза антигена капсида
вируса не наблюдали никогда, тогда как опухолевый антиген синтези-
ровался как обычно. Поэтому представляется вполне вероятным, что по
крайней мере те гены вируса, которые детерминируют образование ан-
тигена этого типа, действительно включаются (интегрируются) в геном
клетки [666].
Весьма противоречивы мнения о том, сколь велика часть генома ви-
руса, включающаяся в геном клетки. Изучение относительной чувстви-
тельности к облучению цитопатической активности вируса полиомы
(т. е. способности образовывать бляшки) и его трансформирующей ак-
тивности показало, что при увеличении дозы ультрафиолета вирус сна-
чала теряет способность образовывать бляшки и лишь при дальнейшем
воздействии оказывается неспособным трансформировать клетки [49, 61].
Эти данные согласуются с представлением, согласно которому для осу-
ществления трансформации необходимо сохранение целостности, а воз-
можно, и интеграции с геномом клетки лишь части генома вируса.
С другой стороны, были опубликованы данные, согласно которым
линии клетки, трансформированные вирусом SV-40, спорадически об-
разуют зрелый инфекционный вирус [710]. Однако такой способностью
обладают далеко не все клетки, трансформированные вирусом. Действи-
тельно, как было показано впоследствии [89, 583], большинство линий
клеток, трансформированных вирусом SV-40 и выделенных в виде от-
дельных клонов из культур, росших на культуральных средах, которые
содержали антивирусную сыворотку, по-видимому, никогда не образуют
полного вируса. Было, однако, обнаружено, что если эти клетки смешать
с клетками почек африканских зеленых мартышек, то в такой культуре
индуцируется образование вируса SV-40 [262]. Кроме того, было показа-
но, что некоторые вирусные частицы, по своему генотипу являющиеся
вирусом SV-40, могут размножаться лишь в том случае, когда в куль-
туре одновременно содержится аденовирус. Однако образующиеся при
их размножении вирионы обладают капсидом аденовируса [93]. Поэтому
возможно, что за наблюдаемое иногда образование вируса SV-40 транс-
формированными клетками ответствен вирус-помощник.
Недавно было показано, что быстро метящаяся РНК (по-видимому,,
информационная РНК), выделенная из клеток, трансформированных
вирусом полиомы, специфически гибридизуется с ДНК вируса полиомы
[62]. Эти данные также свидетельствуют в пользу того, что в трансфор-
мированных клетках действительно содержится вирусная ДНК, причем,
вероятнее всего, включенная в геном клетки. В клетках, трансформиро-
ванных аденовирусом, эта вирусоспецифичная РНК концентрируется
главным образом в полисомах. Этого и следует ожидать в случае, если
Опухолеродные вирусы
335
часть содержащегося в трансформированной клетке вирусного генома
активно функционирует [251].
Таким образом, весьма вероятно, что в большинстве клеточных ли-
ний, трансформированных мелкими ДНК-содержащими вирусами, дей-
ствительно содержатся гены вируса, которые, по-видимому, функциони-
руют и продуцируют вирусоспецифичные молекулы РНК и вирусоспеци-
фичные антигены.
Природа интеграции вирусной ДНК
Молекулярная сущность процесса интеграции молекулы вирусной
ДНК с геномом клетки пока остается неясной, хотя результаты, получен-
ные при изучении генетики умеренных бактериофагов, свидетельствуют
о физическом включении ДНК фага в цепь ДНК хромосомы бактериаль-
ной клетки (см. гл. XI)
Для решения этой проблемы могут оказаться полезными некоторые
данные, полученные при изучении ДНК-содержащих опухолеродных ви-
русов. В настоящее время твердо установлено, что значительная часть
молекул ДНК вируса полиомы,. выделенных из чистого вируса, имеет
форму замкнутого кольца [868]. Исходя из того, что своеобразные седи-
ментационные свойства ДНК вируса папилломы также наводят на мысль,
что ее молекула имеет кольцевую форму, и принимая во внимание, что
молекула ДНК умеренного фага X может замыкаться в кольцо (что, по-
видимому, и происходит при ее интеграции с геномом бактериальной
клетки; см. гл. XI), Дульбекко выдвинул гипотезу о существовании связи
между способностью ДНК образовывать кольцевую молекулу и ее инте-
грацией с геномом клетки [203].
Было показано, что заражение вирусом полиомы монослойных куль-
тур эмбриональных клеток мыши, разросшихся до такой максимальной
плотности, при которой синтез ДНК в клетках прекращается, приводит
к стимуляции образования ферментов, катализирующих синтез ДНК, и,
как следствие этого, к увеличению синтеза ДНК в клетках [199, 904, 920].
По крайней мере часть этой вновь синтезированной ДНК представляет
собой клеточную, а не вирусную ДНК. Таким образом, вполне возможно,
что интеграция вирусного генома становится возможной вследствие ано-
мального или несбалансированного синтеза ДНК клетки-хозяина.
Интересные результаты были получены и исследователями, рабо-
тавшими в несколько ином направлении. Так, Грин и Ласи [295] показа-
ли, что ДНК аденовирусов типа 12 и 18 (аденовирусы этих типов инду-
цируют образование опухолей) более близка по нуклеотидному составу
ДНК клетки-хозяина, чем ДНК аденовирусов некоторых других типов.
Оказалось также, что степень гомологии между ДНК различных опухо-
леродных аденовирусов выше, чем между ДНК опухолеродных аденови-
русов и ДНК аденовирусов, не индуцирующих образование опухолей.
В связи с этим нельзя не вспомнить, что ДНК умеренных фагов также
обладает нуклеотидным составом, сходным с нуклеотидным составом их
бактерий-хозяев, и в ней действительно имеются последовательности ос-
нований, гомологичные ДНК этих бактериальных хозяев.
В чем сущность трансформации и каков ее механизм?
Каким же образом осуществляется трансформация клетки и каков
механизм этого процесса? Какова роль вирусного генома, содержаще-
гося в трансформированной клетке (если он действительно в ней содер-
жится), в поддержании состояния трансформации?
Эти проблемы имеют самостоятельное значение вне зависимости от
того, содержится ли в трансформированной клетке часть вирусного ге-
-336
Глава X VI
нома или полный вирусный геном, и сохраняют свою силу даже в том
случае, если бы оказалось, что в трансформированной клетке вирусный
геном вовсе не содержится.
Микроскопические картины роста трансформированных клеток, рас-
тущих в культуре, резко отличаются от нормальных (фото 56 и 57). При
изучении подвижности живых нормальных куриных фибробластов ме-
тодом киносъемки было обнаружено, что в случае возникновения кон-
такта между двумя нормальными клетками или даже между нитевид-
ными выступами на поверхности клеток движение клеток прекращается
(контактное ингибирование движения). Нормальные клетки вскоре после
возникновения контакта между ними перестают делиться, благодаря че-
му при росте на поверхности стекла они образуют только монослойные
культуры (контактное ингибирование роста).
При росте трансформированных клеток наблюдаются различного ро-
да нарушения этих правил. Например, клетки, трансформированные ви-
русом саркомы Рауса (как продуцирующие ВСР и РАВ, так и не проду-
цирующие вирус), не обладают способностью к контактному ингибирова-
нию и поэтому наползают друг на друга, образуя многослойные фокусы
трансформации. Трансформация клеток этим вирусом приводит также к
изменению формы клетки, причем это изменение вируса специфично.
Известны мутантные штаммы вируса Рауса, индуцирующие образова-
ние стабильных линий клеток различной формы [840].
Подобные же фибробласты, трансформированные вирусом полиомы,
характеризуются чрезвычайно разнообразной формой, и способность к
контактному ингибированию у них отсутствует. На фото 57 представ-
лена форма клеточного пласта, образованного нормальными клетками
и клетками, трансформированными вирусом полиомы. Эти микрофото-
графии демонстрируют крайнюю степень различия между такими куль-
турами.
По-видимому, наиболее эффективно контактное ингибирование про-
является в том случае, когда обе контактирующие клетки выполняют
специфические функции [819]. Так, например, трансформированная ви-
русом полиомы клетка, контактирующая с нормальной клеткой, теряет
способность к делению, однако если такая клетка контактирует с другой
трансформированной клеткой, то она сохраняет эту способность. Подоб-
ным же образом облученная трансформированная клетка, потерявшая
способность к делению, ингибирует способность к делению другой, кон-
тактирующей с ней трансформированной клетки. Таким образом, можно
полагать, что контактное ингибирование наблюдается, по-видимому,
в том случае, если нормальная или трансформированная клетка полу-
чает сигнал со стороны нормальной клетки или клетки, потерявшей
способность к росту.
Результаты, полученные в опытах, описанных выше, имеют несколь-
ко весьма важных аспектов. Известно, что клетки опухолей животных,
индуцированные вирусом полиомы, по микроскопической картине весь-
ма напоминают наиболее злокачественные типы клеток. Тем не менее
эти опухоли имеют резко очерченные границы и обычно не метастази-
руют. Возможно, причина такого поведения этих опухолей кроется в кон-
тактном ингибировании нормальными клетками размножения лишь тех
трансформированных клеток, которые расположены на‘поверхности опу-
холи, тогда как размножение клеток, расположенных внутри опухоли,
продолжается. Наиболее выраженными признаками злокачественности,
в том числе и способностью к метастазированию, обладают клетки, не
способные ни посылать, ни воспринимать сигналы, ведущие к контакт-
ному ингибированию. Такие клетки образуются и в опухолях, Индуци-
рованных вирусом полиомы, и причиной их образования являются даль-
Опухолеродные вирусы
337
нейшие генетические изменения опухолевых клеток. Этот процесс был
назван прогрессией. Наиболее вероятно, что в основе прогрессии лежит
аномальность хромосомного набора трансформированных клеток. Как
показали исследования [873], у трансформированных клеток, растущих в
культуре, хромосомный набор не сохраняется постоянным, а колеблется,
как у длительно перевиваемых клеточных линий. Такие единичные жиз-
неспособные клетки могут проникнуть в кровоток и инициировать образо-
вание масс опухолевых клеток в участках организма, расположенных
вдали от первичной опухоли.
Результаты, полученные при изучении контактного ингибирования,
навели на мысль, что поверхность клетки, быть может, и является той
областью, где в конечном счете реализуются индуцируемые вирусом из-
менения, ведущие к трансформации клетки. Вообще говоря, о способно-
сти вирусов индуцировать изменения поверхности зараженных ими кле-
ток свидетельствуют многочисленные уже ранее известные факты (см.
гл. XI и XV). Впервые такая мысль возникла под влиянием данных, по-
лученных при изучении вируса гриппа. Так, Хойл [378] при помощи мик-
роскопии в темном поле обнаружил, что на поверхности клеток алланто-
исного мешка куриного эмбриона, зараженных вирусом гриппа, идет
активный процесс. Дальнейшие исследования, проведенные с помощью
электронного микроскопа, показали, что этот процесс представляет собой
конечную стадию созревания вируса гриппа — заключение вирусного
нуклеопротеида в оболочку, представляющую собой участок мембраны
зараженной клетки. Как уже упоминалось в гл. IV и XIV, в липопротеид-
ной оболочке вирионов миксовирусов, а, вероятно, также и арбовирусов
содержатся компоненты, специфичные для мембраны клетки. Остается,
однако, неясным, имеет ли место при этом процессе проникновение в
мембрану новых вирусоспецифичных белков и, как следствие, изменение
мембраны, или механизм этого явления какой-то иной.
Хорошо известен и ряд других воздействий, оказываемых вирусами
на поверхность инфицируемых ими клеток. Например, при заражении
клеток вирусами герпеса, кори или вирусом Сендай происходит слияние
мембран зараженных клеток, в результате чего образуются гигантские
многоядерные клетки. Клетки, зараженные аденовирусами или вирусом
полиомиелита, отрываются от поверхности стекла, а некоторые виды кле-
ток при заражении вирусом осповакцины слипаются, образуя бесформен-
ные массы (см. гл. XV).
Таким образом, мы видим, что способность вирусов изменять свой-
ства поверхности инфицируемых ими клеток проявляется не только в том,
что при действии опухолеродных вирусов клетки оказываются лишенны-
ми способности к контактному ингибированию, но и в ряде иных, весьма
близких явлений. В связи с этим естественно возникает вопрос о меха-
низме, ответственном за эти изменения. Фогт и Рубин [876] представили
данные, свидетельствующие о том, что вирус саркомы Рауса созревает
у поверхности клетки, и обратили внимание на корреляцию между мас-
сивным выходом вирусных антигенов из зараженных клеток и морфоло-
гической трансформацией клеток. Но эти изменения наблюдались только
в продуцировавших вирус опухолевых клетках, содержащих ВСР и РАВ.
Далее было показано [877], что клетки, трансформированные виру-
сом саркомы Рауса, но не продуцирующие вирус, тем не менее содержат
группоспецифичный трансплантационный антиген, по всей вероятности
локализующийся на поверхности клетки.
Четко доказано, что в клетках, трансформированных ДНК-содержа-
щими вирусами (аденовирусами, вирусом полиомы и вирусом SV-40),
также содержатся новые антигены. Однако данные, приводимые с целью
доказать причинную связь между появлением в клетке новых антигенов
22 Заказ Хе 1214
338
Глава XVI
и морфологической трансформацией клетки, а также утратой ею способ-
ности к контактному ингибированию, менее убедительны, ибо резуль-
таты, полученные при помощи метода флуоресцирующих антител, гово-
рят о том, что основная масса опухолевого антигена, реагирующего с
такими антителами, локализуется в области ядра клетки. Тем не менее
нельзя игнорировать и тот факт, что специфические противоопухолевые
антитела могут реагировать и с цельной клеткой, а это говорит о том, что
по крайней мере один опухолевый антиген локализуется на поверхности
клетки. Однако предстоит еще выяснить, ответствен ли этот антиген за те
изменения свойств клеток, которые составляют сущность ее трансформа-
ции и малигнизации.
Тщательному изучению подвергся также вопрос о содержании новых
антигенов в опухолях, индуцированных химическими канцерогенами. Бы-
ло показано, что в клетках таких опухолей действительно всегда содер-
жатся новые антигены, однако в отличие от новых антигенов, обнаружи-
ваемых в опухолях, индуцированных вирусами, эти антигены варьируют
по своей специфичности от опухоли к опухоли [456]. Возможно, что раз-
личия в специфичности новых антигенов связаны с прогрессией, ответст-
венной за приобретение злокачественных свойств клетками, вначале под-
вергшимися действию канцерогена. Эти данные не говорят в пользу ги-
потезы, утверждающей, что все опухоли, индуцируемые канцерогенами^
образуются вследствие активации канцерогенами опухолеродной актив-
ности латентных опухолеродных вирусов. Однако они и не опровергают
этой теории, ибо вполне можно постулировать наличие во многих тканях
большого числа самых различных латентных вирусных агентов, как это,,
например, наблюдается у кур, в организме которых содержится множе-
ство различных вирусов группы лейкоза.
Резюмируя сказанное выше, становится очевидным, что данные, по-
лученные при изучении двух главных групп опухолеродных вирусов, поз-
воляют нарисовать последовательную картину событий, на основании
которой можно построить полезную рабочую модель, исходя из которой
планировать затем дальнейшую работу в этом направлении. Согласно
этой модели, справедливость которой, однако, пока не доказана, основ-
ными этапами процесса вирусного онкогенеза являются интеграция ви-
русной нуклеиновой кислоты с геномом клетки-хозяина, детерминирова-
ние интегрированным геномом синтеза одного или нескольких новых бел-
ков, проникновение этих белков в мембрану клетки и, как следствие, по-
теря клеткой способности к контактному ингибированию. В окружении
других трансформированных клеток такие клетки растут без всяких ог-
раничений и теряют способность посылать сигналы, приводящие к кон-
тактному ингибированию. Однако одних этих событий недостаточно для
того, чтобы клетка приобрела все свойства, характерные для истинной
злокачественной клетки. Для того чтобы это случилось, должны про-
изойти еще другие события, в которых вирусный геном, может быть,,
и не принимает участия.
Можно полагать, что эта крайне упрощенная версия событий, про-
исходящих при очень сложном процессе взаимодействия вируса с клет-
кой, в ближайшие годы подвергнется тщательной экспериментальной
проверке. Эта схема позволяет наметить ряд новых направлений экспе-
риментальных исследований, что даст возможность составить более точ-
ное представление о способе действия по крайней мере одного типа кан-
церогенных агентов — вирусов L
1 В отечественной литературе более новые данные о взаимодействии опухолерод-
ных вирусов с клетками можно найти в обзоре Киселева Л. Л. (Успехи совр. биол., 68,
381, 1969). — Прим. ред.
Глава XVII
ВЗАИМОДЕЙСТВИЕ МЕЖДУ ВИРУСАМИ РАСТЕНИЙ
И ИХ ХОЗЯЕВАМИ
ЭКСПЕРИМЕНТАЛЬНЫЕ СИСТЕМЫ
Наши знания о взаимодействии вирусов растений с их хозяевами
все еще весьма ограниченны. Объясняется это рядом причин. Так, напри-
мер, методы титрования этих вирусов неэффективны, культуры клеток,
поддающиеся заражению вирусами растений in vitro, отсутствуют (ис-
ключением являются культуры тканей насекомых; см. ниже). Более того,
прямое заражение удается осуществить далеко не всегда, вследствие че-
го при необходимости заразить растение вирусом часто приходится при-
бегать либо к прививке, либо к использованию членистоногих-перенос-
чиков. Поэтому для изучения размножения вирусов растений до сих пор
не удалось применить один из важнейших методов — анализ кривой оди-
ночного цикла размножения. Большая часть наших знаний о фазах раз-
множения этих вирусов была получена в результате проведения иссле-
дований, сочетавших применение ряда косвенных методов, таких, напри-
мер, как облучение, действие ингибиторов, изотопный анализ, с обычны-
ми цитохимическими методами и определением содержания вирусного
материала в зараженных тканях растений. При изучении вирусов расте-
ний использовали и тканевые культуры, однако они оказались менее по-
лезными, чем при изучении вирусов животных.
Систематическому изучению подверглось лишь небольшое число ви-
русов растений. Выбор объекта исследования определялся либо тем, что
изучение вируса имеет большое практическое значение, либо удобством
обращения с ним. Из числа палочкообразных вирусов наиболее тщатель-
ному изучению подверглись вирус табачной мозаики (ВТМ) и Х-вирус
картофеля, из группы икосаэдрических вирусов — вирус желтой мозаи-
ки турнепса (ВЖМТ) и вирус некроза табака (ВНТ), а из группы виру-
сов, переносимых членистоногими,— вирус курчавости верхушки свеклы,
вирус желтухи астр и вирус раневых опухолей.
Биохимические исследования взаимодействия вирусов растений с
хозяевами концентрируются вокруг данных о том, что все вирусы расте-
ний, которые были изучены, являются РНК-содержащими вирусами. Было
показано, что свободная РНК многих вирусов растений является инфек-
ционной. Однако удельная инфекционность этой РНК (т. е. количество
инфекционных единиц, приходящихся на единицу веса РНК), как пра-
вило, по крайней мере в 1000 раз меньше, чем удельная инфекционность
вириона (см. гл. III). В состав вирионов вируса раневых опухолей и ви-
руса карликовости риса входит двухцепочечная РНК [86, 594]. Все из-
вестные вирусы растений содержат РНК. Утверждалось, однако, что
ДНК фага fd при ее введении в листья табака образует зрелые фаговые
частицы, а, возможно, даже и индуцирует размножение вируса [723]. Од-
нако эти данные пока подтверждены не были.
22* — 339 —
340
Глава XVII
РАЗМНОЖЕНИЕ И СИНТЕЗ
Вирусы растений могут накапливаться в зараженных клетках в ог-
ромном количестве. Так, например, было подсчитано, что в одной клетке
волоска табака может содержаться 6 • 107 частиц ВТМ [621]. На долю
ВТМ приходится до 10% сухого веса зараженного растения.
В большинстве случаев в опытах, поставленных с целью построения
кривой размножения вирусов растений, передача вируса достигается
Фиг. 72. Кривая размножения вируса табачной мозаики в листьях Nicotiana tabacum.
Кривая построена по результатам определения содержания числа вирионов в экстрактах участков
листьев, бравшихся на анализ через определенные промежутки времени после заражения. Число ви-
рионов определяли при помощи электронной микроскопии. По оси ординат отложено в (логарифми-
ческом масштабе) число вирионов, приходящееся на 1 г ткани листа (сырой вес).
механической инокуляцией либо путем втирания в листья материала, со-
держащего вирус, либо путем погружения натертых листьев в суспензию
вируса. Поражаемые участки, возникающие вследствие поранения листь-
ев (благодаря их натиранию), быстро исчезают (залечиваются) после
погружения в жидкость, в связи с чем процесс заражения вирусом, если
он и осуществляется, представляет собой быстрый процесс. Уже через
несколько минут после инокуляции ВТМ в листья AL glutinosa нанесение
детергентов на места инокуляции не влияет на ВТМ [252]. Каждый спо-
собный заразиться участок даже в том случае, когда лист заражают
смесью вирусов, инфицируется лишь каким-либо одним вирусом (766].
Кривые размножения вирусов строят по данным, .полученным путем
определения содержания вируса в экстрактах цельных листьев или выре-
занных из листьев дисков, анализируя пробы, взятые через определенные
промежутки времени после механической инокуляции вируса. Содержа-
ние вируса в экстрактах определяют либо при помощи титрования, выра-
жая результат в количестве содержащихся в экстракте инфекционных
единиц, либо при помощи химического анализа, или, наконец, путем элек-
тронно-микроскопических исследований, причем в одних случаях анали-
зируют экстракт как таковой, тогда как в других его предварительно
фракционируют. На фиг. 72 представлена типичная кривая размножения
Взаимодействие между вирусами растений и их хозяевами
341
вируса растений. Такие кривые демонстрируют суммарное содержание
вируса, образовавшегося в результате серии последовательных циклов
размножения, имевших место во многих клетках листа. Следовательно,
они отражают два процесса: размножение вируса и его распространение
от клетки к клетке. Результаты, полученные при изучении динамики об-
разования белка ВТМ при помощи флуоресцирующих антител к этому
вирусу, показали, что вирусный белок появляется в зараженной клетке
примерно через 18—24 час после заражения [611], что соответствует дан-
ным, полученным при анализе экстрактов. В некоторых случаях, однако,
продолжительность латентного периода бывает меньшей. Следует отме-
тить, что пока не известно, имеет ли место при размножении этого вируса
истинный период эклипса, т. е. промежуток времени, в течение которого
из зараженных клеток не удается выделить инфекционного вируса, ибо
до сих пор не было представлено прямых доказательств ни за, ни про-
тив его наличия.
При выявлении событий, происходящих на ранних этапах вирусной
инфекции, больше данных было получено в результате применения кос-
венных методов. Одним из полезных путей оказалось изучение измене-
ния устойчивости к действию различных агентов. В качестве такого аген-
та использовали, например, рибонуклеазу, которую при работе с отде-
ленными листьями можно ввести через черешок. Было обнаружено, что
введение рибонуклеазы в пределах первых 15 мин после заражения пре-
дупреждает размножение ВТМ, тогда как ее введение через 2 час после
заражения уже не оказывает такого эффекта [308]. Эти данные наводят
на мысль, что в процессе размножения ВТМ имеется стадия, в течение
которой РНК находится в свободном, т. е. в не связанном с белком со-
стоянии.
К аналогичному мнению приводят результаты, полученные при оп-
ределении чувствительности ВТМ к облучению ультрафиолетом на ран-
них этапах инфекции. В этом случае листья N. glutinosa заражали ВТМ,
в результате чего возникали локальные некротические поражения. Затем,
через различные промежутки времени, зараженные листья облучали
ультрафиолетом, после чего, подсчитывая число локальных поражений,
строили кривые выживания инфекционных центров (фиг. 73). В случае
когда листья заражали интактным вирусом, чувствительность к облуче-
нию ультрафиолетом не изменялась в течение примерно 2 час после за-
ражения и соответствовала чувствительности к облучению свободного
вируса. Затем устойчивость инфекционных центров к облучению ультра-
фиолетом постепенно увеличивалась. Кривые, построенные для интерва-
лов времени, не превышающих 5 час после заражения, соответствуют од-
ноударному процессу, а кривые, построенные для больших интервалов
времени, скорее соответствуют процессу многоударному. В тех случаях,
когда листья заражали не полным ВТМ, а его нуклеиновой кислотой
(РНК), чувствительность инфекционных центров к облучению ультра-
фиолетом уменьшалась более быстро, благодаря чему создавалось впе-
чатление, что в этом варианте опыта те события, которые при заражении
полным вирусом происходят в промежутке времени между началом ин-
фекции и первым или вторым часом после заражения, не происходят
вовсе.
Поэтому представляется вероятным, что первой стадией размноже-
ния ВТМ является освобождение вирусной РНК от белка инфицирующе-
го вириона, т. е. процесс, которого следует ожидать исходя из того, что
мы знаем о размножении других вирусов. Данные, полученные при ис-
следованиях иного рода, также согласуются с этим выводом. Так, напри-
мер, если листья, зараженные Х-вирусом картофеля, облученным ультра-
фиолетом, через различные сроки после заражения подвергать действию
342
Глава XVII
видимого света, то оказывается, что существует короткий промежуток
времени, в течение которого возможна фотореактивация вируса. Можно
полагать, что это и есть период, когда содержащаяся в клетке инфекци-
онная РНК находится в свободном от белка состоянии и поэтому чув-
ствительна к воздействию фотореактивирующих ферментов.
Изучение включения радиоактивных изотопов в РНК синтезирую-
щихся вирионов показало, что эта РНК в основном образуется из пита-
тельных веществ, поступающих в клетку уже после ее заражения виру-
Фиг. 73. Кривые выживания инфекционных центров (некротических поражений), обра-
зующихся на листьях, облучавшихся ультрафиолетом через различные промежутки вре-
мени после заражения [767].
Числа, стоящие у соответствующих кривых, указывают продолжительность времени (в часах) между
заражением и облучением.
сом [149]. В клетках, зараженных ВТМ, происходит также и интенсивный
распад РНК клетки-хозяина, что может привести к образованию пред-
шественников, используемых затем для синтеза вирусной РНК [668].
В экстрактах клеток, зараженных вирусом, обнаруживаются не
только интактные вирионы, но и ряд других вирусоспецифичных компо-
нентов. Увеличению содержания в зараженных клетках вирионов ВТМ
предшествует увеличение содержания в них инфекционного компонента,
чувствительного к действию РНК-азы. Вероятно, этот компонент пред-
ставляет собой не экранированную белком вирусную РНК [789]. В расте-
ниях, зараженных ВТМ, обнаружены также двухцепочечные вирусоспе-
цифические молекулы РНК. Одна из цепей такой РНК идентична РНК
ВТМ (плюс-цепь), а вторая комплементарна ей по своей нуклеотидной
последовательности (минус-цепь) [762, 908]. Сказанное справедливо так-
же в отношении растений, зараженных ВЖМТ [664]. Как и в случае
других РНК-содержащих вирусов, точно не известно, какую роль играет
двухцепочечная форма РНК. В качестве предположения можно выска-
зать мысль, что она является «репликативной формой», возникающей в
процессе образования вируса, однако то, что она может служить источни-
ком плюс-цепей, используемых для синтеза нового вируса, очевидно.
Судя по тому, что размножение ВТМ не подавляется актиномици-
ном D, для синтеза РНК ВТМ ДНК-матрица не нужна. Молекулярный
вес РНК ВТМ составляет примерно 2 • 106 дальтон. Генетической инфор-
мации, содержащейся в РНК, обладающей таким молекулярным весом,
достаточно для кодирования синтеза белка с молекулярным весом
Взаимодействие между вирусами растений и их хозяевами 343
220 000 дальтон. Поскольку молекулярный вес мономера белковой обо-
лочки вириона ВТМ равен 17 000 дальтон, очевидно, что этот мономер
является лишь одним из нескольких белков, детерминируемых РНК
ВТМ. Один или два из этих белков, видимо, представляют собой фер-
менты, катализирующие репликацию вирусной РНК.
Из растений, зараженных вирусом желтой мозаики турнепса, были
получены экстракты, при добавлении к которым нуклеозидтрифосфатов
наблюдалось включение нуклеотидов в состав РНК даже в присутствии
актиномицина D и ДНК-азы [34]. Эти данные говорят о том, что в таких
экстрактах, вероятно, содержится индуцированная вирусом РНК-репли-
каза.
В тканях растений, зараженных вирусом, белки капсида образуют
различные структуры. Относительное содержание этих структур не оди-
наково. Так, например, в тканях растений, сильно пораженных вирусом
табачной мозаики, на долю не связанного с РНК вирусного белка, назы-
ваемого одними авторами Х-белком, а другими — растворимым антиге-
ном, приходится только 5% общего количества вирусного белка, содер-
жащегося в зараженных тканях. Х-белок легко выявляется при помощи
серологических методов. Он обладает тенденцией к образованию харак-
терных спиралеподобных агрегатов, в состав которых может иногда вхо-
дить и РНК вируса табачной мозаики [838]. Изучение динамики включе-
ния радиоактивных аминокислот в Х-белок вируса и полные вирионы,
проведенное при помощи импульсной метки, показало, что меченые ами-
нокислоты сначала включаются в неинфекционный вирусный белок и
лишь затем обнаруживаются в составе вирионов. Эти данные наводят на
мысль, что по крайней мере часть этого белка является предшественни-
ком вирионов [867].
Коммонер [148] предложил модель «линейного биосинтеза» ВТМ.
Согласно этой модели, синтез РНК и белка ВТМ представляет собой
конкурентный взаимосвязанный процесс, конечным результатом которого
является образование полных вирионов. Линейный биосинтез такого
типа может быть результатом действия механизма, при помощи которого
вновь образуемые цепи РНК ВТМ, скорее всего плюс-цепи, синтезируе-
мые на двухцепочечной матрице, сразу же по мере их отделения от мат-
рицы «одеваются» в оболочку, состоящую из вновь синтезируемых моно-
меров вирусного белка, что происходит также по мере образования этих
мономеров. Однако маловероятно, чтобы каждая цепь РНК ВТМ исполь-
зовала для образования своей оболочки как раз те молекулы белка, ко-
торые были синтезированы в результате трансляции именно данной моле-
кулы РНК. Прямым доказательством использования при сборке вирио-
нов мономеров, образовавшихся в результате трансляции различных
молекул вирусной РНК, могло бы явиться обнаружение фенотипиче-
ского смешивания вирусов у растений, подвергшихся смешанному зара-
жению различными мутантами вируса. Однако пока такие данные опуб-
ликованы не были.
Не все обнаруживаемые в зараженном растении вирусоспецифичные
белки, близкие по составу белку капсида, в действительности исполь-
зуются для образования зрелого вируса. Справедливость этого положе-
ния особенно четко демонстрируют данные, полученные при изучении
сферических вирусов. Так, например, в клетках, зараженных вирусом
желтой мозаики турнепса, кроме полных вирионов, можно наблюдать
большое количество пустых белковых оболочек (верхний компонент при
центрифугировании препарата этого вируса) [569]. Вероятно, молекулы
вирусного белка при благоприятных условиях могут взаимодействовать
друг с другом, образуя капсиды даже в отсутствие нуклеиновой кислоты
вируса, составляющей, как известно, его сердцевину. В клетках расте-
344
Глава XVII
ний, зараженных вирусом желтой мозаики турнепса, кроме пустых кап-
сидов и нормальных вирионов, можно наблюдать несколько других типов
неполных, неинфекционных вирусных частиц, содержащих различное ко-
личество РНК [577, 578]. Возможно, что эти частицы являются не каки-
ми-то промежуточными формами, образующимися в процессе синтеза
полных вирионов, а представляют собой повредившиеся при экстрагиро-
вании обычные «недостроенные» вирионы.
На процесс биосинтеза вирусов растений оказывают влияние самые
различные ингибиторы. Интересные результаты были получены с анало-
гами предшественников нуклеиновых кислот. Так, было обнаружено, что*
2-тиоурацил, а также азагуанин и другие аналоги пуринов и пиримиди-
нов подавляют размножение вирусов растений и могут включаться в со-
став вирусной РНК. При синтезе ВТМ в присутствии тиоурацила от 5
до 20% урацила, входящего в состав его РНК, может быть замещено на
тиоурацил. Такой вирус обладает меньшей удельной инфекционностью,
чем нормальный вирус [403]. Введение в зараженное растение тиоура-
цила препятствует появлению внутриклеточных включений и даже подав-
ляет развитие инфекции. Это действие тиоурацила полностью снимается
добавлением урацила. В состав РНК ВТМ может включаться и 8-азагуа-
нин, замещая от 3 до 5% гуанина РНК ВТМ. Это приводит к замедле-
нию размножения вируса и уменьшению его выхода.
Механизм действия этих аналогов предшественников нуклеиновых
кислот не вполне понятен. Некоторые из них могут влиять на скорость
репликации РНК, другие — вызывать ошибки в процессе трансляции при
биосинтезе белка. Неожиданно было обнаружено, что замещение в РНК
ВТМ всего лишь 1% урацила на тиоурацил ведет к образованию вирио-
нов, хуже связывающих антитела к ВТМ, чем нормальные вирионы. По-
видимому, в основе этого явления лежит изменение конфигурации белка
оболочки ВТМ [404].
Противоположные данные были представлены в другом сообщении
[367], показавшем, что белок ВТМ, в РНК которого более 20% урацила
замещено на 5-фторурацил, не отличается по последовательности амино-
кислот от белка нормального ВТМ.
Имеются данные о том, что соответствующая вирусная РНК может
индуцировать в бесклеточной системе синтез белка капсида вируса-сател-
лита вируса некроза табака [142]. Это наблюдение наводит на мысль,
что по крайней мере часть белков, синтез которых детерминируется ви-
русом, кодируется плюс-цепью вирусной РНК. Можно полагать, что
использование подобных систем уже в ближайшее время позволит полу-
чить данные, необходимые для разрешения ряда проблем, в том числе
и тех, которые касаются идентификации детерминируемых вирусом бел-
ков, которые не входят в состав вириона.
В растениях, зараженных вирусами, были обнаружены какие-то
противовирусные факторы. Так, экстракт N. glutinosa, зараженного ВТМ,
может ингибировать размножение ВТМ и вируса огуречной мозаики
даже в уже зараженных растениях. В состав активного фактора, по-ви-
димому, входит РНК и его действие проявляется при введении в расте-
ния не только того вида, из которого он был выделен, но также и других
видов [751]. Этот фактор подавляет действие каких-то ферментов, инду-
цируемых вирусом.
На течение вирусной инфекции у растений можно воздействовать и
физическими факторами. Так, например, ВТМ не размножается при
температурах, превышающих 32°. Более того, некоторые вирусы расте-
ний, например вирус желтухи астр, при инкубировании зараженных ра-
стений в течение нескольких дней при повышенных температурах не
только не размножаются, но даже разрушаются.
Взаимодействие между вирусами растений и их хозяевами
34S
ЦИТОЛОГИЧЕСКИЕ ДАННЫЕ,
ПОЛУЧЕННЫЕ ПРИ ИЗУЧЕНИИ ВИРУСНЫХ ИНФЕКЦИЙ
В течение долгого времени считали, что репликация ВТМ происхо-
дит только в цитоплазме. Однако некоторые данные, полученные при*
цитологических и цитохимических исследованиях, позволяют предпола-
гать, что первичным местом репликации РНК этого вируса является, ве-
роятно, ядро [41, 793], где уже в первый час после заражения наблю-
дается увеличение содержания РНК. Однако предстоит еще выяснить,
является ли эта вновь синтезирующаяся РНК вирусной, а если это и
подтвердится, то вся ли вирусная РНК образуется в ядре. Если окажет-
ся, что РНК ВТМ действительно образуется в ядре, а белок ВТМ —
в цитоплазме, то несостоятельность гипотезы линейного биосинтеза ста-
нет совершенно очевидной.
Следует, однако, подчеркнуть, что пока не ясно, в каком именно
месте клетки действительно синтезируется белок ВТМ [755]. Опыты, в ко-
торых для выявления места синтеза этого белка были применены флуо-
ресцирующие и ферритиновые антитела, дали весьма неопределенные
результаты. Сначала белок ВТМ появляется в цитоплазме и обнаружи-
вается главным образом вокруг ядерной оболочки, где его можно наблю-
дать в клетках листа через несколько дней после их заражения. Белок
ВТМ обнаруживается также в ядре, однако цельные вирионы на элек-
тронных микрофотографиях можно наблюдать лишь в цитоплазме. По-
этому представляется вероятным, что вирионы ВТМ образуются в цито-
плазме, хотя и не исключено, что некоторые из белков, необходимых для
образования вирионов, поступают в цитоплазму из ядра.
Вирионы вируса желтой карликовости картофеля, для которых ха-
рактерно наличие внешних оболочек и которые морфологически весьма
напоминают миксовирусы [88], обнаруживаются на срезах, зараженных
этим вирусом клеток в тесной связи с ядерной оболочкой [555]. Возмож-
но, что ядерная оболочка является источником некоторых компонентов,
входящих в состав внешней оболочки этого вируса. Вирионы этого ви-
руса в ядре не обнаруживаются, однако вирионы некоторых других ви-
русов, например вируса штриховатости ячменя, выявляются именно
в нуклеоплазме.
Одним из наиболее частых и характерных воздействий, оказывае-
мых вирусами растений на клетки, является образование внутриклеточ-
ных включений, В большинстве случаев эти включения представляют
собой агломераты вирусных частиц, либо свободных, либо связанных
с составными частями клетки. Морфология и локализация включений
варьируют в зависимости от вируса, вызвавшего заболевание. Большин-
ство вирусов образует только цитоплазматические включения, но вирус
гравировки табака, а также некоторые вирусы бобовых растений обра-
зуют кристаллические включения в ядре клетки и даже в ядрышке.
Однако вопрос о том, представляют ли собой эти включения вирусные
кристаллы, еще не ясен. Когда клетка, в ядре которой содержатся кри-
сталлы вируса гравировки табака, делится, эти кристаллы выталки-
ваются в цитоплазму, а в ядрах дочерних клеток образуются новые
включения [54]. Вирус желтухи свеклы образует кристаллические вклю-
чения, локализующиеся в хлоропластах.
В клетках растений, зараженных ВТМ, обнаруживаются два типа
цитоплазматических включений. Одни включения представляют собой
амебоидные, аморфные частицы, или Х-тела, состоящие из вирионов
ВТМ, а также некоторых цитоплазматических компонентов. Включения
второго типа представляют собой истинные гексагональные кристаллы
(фото 58), состоящие почти целиком из одних вирионов. Обработка раз-
•346
Глава XV JI
бавленными растворами кислот превращает эти кристаллы в массы,
состоящие из типичных иголочек ВТМ, или паракристаллы. Входящие
в состав гексагонального кристалла вирусные частицы ориентированы
более регулярно, чем вирусные частицы в паракристаллах, и образуют
систему последовательных плоских слоев, расположенных параллельно
друг другу [914] (см. фото 59). Не ясно, однако, каковы те условия, ко-
торые определяют образование в клетке включений того или иного типа.
Некоторые штаммы ВТМ не образуют каких-либо кристаллических
включений, и в клетке можно наблюдать лишь тонкие нити вирусного
материала.
Изучение под микроскопом характера образования продуцируемых
ВТМ включений говорит о том, что они представляют собой преципитаты
или конгломераты вирусных частиц, объединившихся благодаря движе-
нию цитоплазмы, которая увлекает их за собой, а не очаги размножения
вируса. В этом отношении эти включения отличаются от «фабрик», обра-
зуемых вирусом осповакцины в клетках животных и представляющих
собой истинные внутриклеточные колонии вируса.
Хлоропласты, содержащиеся в клетках, зараженных вирусами, де-
формируются и часто дегенерируют. Образование новых хлоропластов
в таких клетках также ингибируется. Эти изменения ответственны за
хлороз, наблюдаемый при многих вирусных инфекциях растений. Как
правило, в хлоропластах зараженных клеток частицы ВТМ обнаружи-
ваются лишь на самых последних стадиях инфекции. Вероятно, эти ви-
русные частицы проникают в уже поврежденные хлоропласты. Однако
скопление вирусного белка вокруг хлоропластов можно наблюдать на
весьма ранних стадиях инфекции, что указывает на то, что биосинтез
вируса происходит в участках клетки, содержание АТФ в которых ве-
лико. Судя по полученным результатам, общая скорость реакций энер-
гетического обмена при размножении ВТМ не изменяется по крайней
мере до достижения той стадии инфекции, когда зараженная клетка
оказывается уже сильно «поврежденной». Иначе, однако, обстоит дело
при размножении вируса желтой мозаики турнепса. Было показано, что
в этом случае хлоропласты изменяются уже на ранней стадии инфекции,
в связи с чем даже было высказано предположение, что, возможно, они
являются структурами, в которых образуется репликативная форма ви-
русной РНК [674]
Включения, образуемые в клетках, зараженных другими вирусами
растений, также могут быть амебоидными или кристаллическими и иметь,
следовательно, различную форму. Некоторые из них весьма характерны
по своему внешнему виду. Так, например в цитоплазме опухолевых кле-
ток, образуемых вирусом раневых опухолей, обнаруживаются очень ха-
рактерные шарики [85]. При помощи электронной микроскопии в клетках,
зараженных этим вирусом, были обнаружены микрокристаллы, состоя-
щие из вирионов, сходные с кристаллами, образующимися из очищен-
ного вируса (см. фото 60). Следует, однако, заметить, что состав микро-
кристаллов, содержащихся в шарикообразных включениях, выявляемых
в опухолевых клетках, точно не установлен.
ИЗМЕНЧИВОСТЬ ВИРУСОВ РАСТЕНИЙ
Встречающиеся в естественных условиях различные штаммы многих
вирусов растений хорошо известны. Об общности происхождения таких
штаммов свидетельствует сходство морфологии вирионов и серологиче-
ских свойств. Мутации могут приводить к очень резким изменениям
свойств вирионов, так что два родственных вируса могут после очистки
Взаимодействие между вирусами растений и их хозяевами
347
образовывать кристаллы, отличающиеся друг от друга по форме [54].
Некоторые мутации фенотипически проявляются в индукции вирусом
у зараженного хозяина необычных симптомов заболевания. Так, напри-
мер, известны мутанты ВТМ, которые вызывают появление желтых пятен
на зеленых листьях с симптомами мозаичности (см. фото 61). Этот вид
изменчивости напоминает изменчивость у фагов, приводящую к образо-
ванию мутантов, вызывающих появление бляшек необычной формы.
Простым способом получения мутантов является воздействие мутаге-
нами на интактный вирус, а еще лучше, на его инфекционную РНК [608].
Мутация может привести как к изменению течения инфекционного про-
цесса, так и к изменению свойств вновь образовавшихся вирионов.
Мощнейшим стимулом для изучения мутантов ВТМ послужила воз-
можность использования получаемых при этом результатов для анализа
генетического кода, ибо белок ВТМ является одним из нескольких бел-
ков, для которых полностью установлена последовательность аминокис-
лот (см. гл. V). Поэтому выявление изменений в аминокислотном составе,
вызываемых воздействием мутагена, позволяет получить данные, спо-
собствующие определению состава кодонов, соответствующих той или
иной аминокислоте (см. гл. V).
Некоторые мутанты ВТМ, полученные путем воздействия на вирус
мутагенами in vitro, вызывают у зараженных растений симптомы, отли-
чающиеся от наблюдаемых при заражении обычным ВТМ, и в то же
время образуют вирионы, не отличающиеся от обычного ВТМ ни по.
‘белку оболочки, ни по нуклеотидному составу. Эти данные вновь свиде-
тельствуют о том, что геном вируса кодирует синтез не только белка
капсида вириона, но и других вирусоспецифичных белков. Положение
в молекуле РНК генного локуса, ответственного за появление на листьях
табака вместо симптомов мозаичности локальных некротических пора-
жений, было определено при помощи простого опыта. Сущность его со-
стояла в удалении белковых субъединиц с одного из концов вириона
и воздействии мутагенами на оголившуюся часть РНК [424].
Некоторые мутанты ВТМ являются дефектными. Их дефектность
проявляется в нарушении способности к сборке вирионов или их созре-
ванию. При заражении растения такими мутантами симптомы заболева-
ния наблюдаются и продуцируется инфекционная РНК, однако полные
вирионы либо вовсе не образуются, либо образуются в крайне незначи-
тельном количестве [759]. Однако при помощи метода флуоресцирующих
антител было показано, что в этом случае некоторое количество белка
капсида все же образуется. Был обнаружен мутант, индуцирующий обра-
зование аномального полипептида, неспособного свертываться в нор-
мальную трехмерную молекулу белка, а также другой мутант, изменяю-
щий молекулу белка в такой степени, что этот белок оказался не в со-
стоянии образовать нормальные капсиды вириона даже при наличии
в системе вирусной РНК [41] (см. фото 62).
Дефектность на стадии созревания вируса наблюдается не только
у индуцированных искусственно, но также у встречающихся в природе
мутантов вирусов растений. Так, например, у вируса «гаШе» табака
обнаружено много спонтанных вариантов, у которых стадия созревания
дефектна [118]. Однако причиной этого столь часто встречающегося де-
фекта, вероятно, является не генетическая мутация, а фенотипическое
изменение, сходное с модификацией, индуцируемой хозяином.
У вируса некроза табака (ВНТ; штамм Ротамстед) имеется вирус-
сателлит, вирионы которого меньше вирионов ВНТ и отличаются от них
по антигенным свойствам. В гл. IV уже упоминалось о характерных
особенностях этого вируса. Один вирус-сателлит не может инициировать
ни инфекционного процесса, ни образования зрелых частиц, однако при
348
Глава XVII
смешанном заражении, в котором участвует и вирус некроза табака, со
зревают оба вируса. Следовательно, этот вирус-сателлит дефектен по
весьма существенной функции, восполняемой вирусом некроза табака.
Интересно, что ни один из других вирусов (а их было исследовано не-
сколько) не смог заменить в этом отношении вирус некроза табака.
РНК вируса-сателлита вируса некроза табака состоит всего из 1200 ну-
клеотидов, что как раз достаточно для кодирования синтеза белка кап-
сида, состоящего из 372 аминокислотных остатков [673]. Очевидно, что
столь малая молекула РНК не может содержать такого количества гене-
тической информации, которое нужно для кодирования белков, необхо-
димых для инициирования инфекции и репликации вируса. Поэтому
понятно, что этот вирус-сателлит зависит от вируса некроза табака, вы-
полняющего за него эти функции.
Иная ситуация наблюдается при инфекции, вызываемой вирусом
крапчатости бобов фасоли. Некоторые вирионы этого вируса обладают
меньшей плотностью, чем другие, содержат меньше РНК и неинфек-
ционны. При заражении растения этим вирусом такие неинфекционные
частицы кооперируются с частицами, содержащими полную молекулу
РНК, и таким образом принимают участие в инициировании инфекцион-
ного процесса [924]. Эти данные наводят на мысль, что, быть может,
множественное заражение вообще является обязательным условием ре-
продукции этого вируса или по крайней мере обеспечивает наилучшие
.возможности для реализации этого процесса. Сходные данные были по-
лучены при изучении других вирусов растений. В связи с этим читатель,
быть может, вспомнит о совместном заражении бактерий Е. coli или
В. subtilis неполными частицами их фагов.
Смешанное заражение и рекомбинация
Уже давно предпринимались попытки выяснить, имеет ли место гене-
тическая рекомбинация при смешанном заражении растения двумя род-
ственными вирусами. Несомненно, что два неродственных вируса часто
могут размножаться в одной и той же клетке. Было показано, что в
клетке, зараженной двумя вирусами, образуются включения двух типов,
каждое из которых характерно для соответствующего вируса. Механи-
ческое введение в одну клетку смеси двух штаммов ВТМ приводило
к образованию «смешанных» поражений, содержавших оба штамма этого
вируса [60].
В случае когда в одном растении присутствуют два родственных ви-
руса, в потомстве вируса иногда удается обнаружить новые штаммы,
обладающие, по-видимому, свойствами, характерными для обоих виру-
сов. Такое явление наблюдалось при заражении соответствующих ра-
стений различными штаммами вируса пятнистого увядания томата [75]
и Х-вируса картофеля, а также и других вирусов картофеля [853]. Имею-
щиеся в настоящее время данные говорят о том, что рекомбинации
между вирусами растений, вероятно, действительно происходят, однако
этих данных недостаточно для того, чтобы быть полностью уверенным
в этом. Для решения этого вопроса было бы крайне желательно провести
генетическое исследование в случае смешанного заражения, вызываемого
парами мутантов какого-либо хорошо изученного вируса, например ВТМ.
РАСПРОСТРАНЕНИЕ ВИРУСОВ ПО РАСТЕНИЮ
И ИХ ВОЗДЕЙСТВИЕ НА КЛЕТКИ РАСТЕНИЙ
Вирусы, введенные в растение путем механической инокуляции, рас-
пространяются от первично инфицированных клеток к соседним очень
медленно. Скорость их распространения составляет примерно 1 мм в
Взаимодействие между вирусами растений и их хозяевами
349
.день, а иногда бывает и еще меньшей. По-видимому, вирус, попавший
в клетку, сначала в ней размножается, а затем уже проникает в соседние
клетки по межклеточным канальцам, через которые проходят выросты
цитоплазмы в виде тончайших нитей — плазмодесм. Прежде чем ВТМ на-
чинает двигаться из первично зараженной клетки в соседнюю, проходит
несколько часов, и до сих пор неизвестно, каким же образом передается
инфекция из клетки в клетку: путем ли переноса полных вирионов или
молекул инфекционной нуклеиновой кислоты. На мысль о возможности
распространения инфекции молекулами инфекционной нуклеиновой кис-
лоты наводит существование вариантов вируса, неспособных к созрева-
нию. Однако не столь легко исключить в подобных случаях и возмож-
ность распространения инфекции путем переноса неполных вирионов.
Когда вирус, попадает в проводящую ткань либо из соседних парен-
химных клеток, либо непосредственно вводится туда насекомым-пере-
носчиком, он движется сначала по жилкам, затем по черешку листа и,
наконец, попадает в стебель. Вирус курчавости верхушки свеклы может
переноситься по растению со скоростью, достигающей 2,5 см)мин.
В принципе вирус может распространиться по всему растению, причем
степень генерализации процесса зависит как от свойств вируса, так и от
свойств растения-хозяина. Большинство вирусов, переносимых механи-
чески, относятся к числу гистологически «неограниченных» вирусов, а это
•означает, что они могут проникать почти во все ткани зараженного ра-
стения [221]. Как правило, первыми атакуются вирусом активно растущие
ткани и корни. Перенос вируса на значительные расстояния происхо-
дит главным образом по флоэме вместе с током пластических веществ,
хотя движение вируса может осуществляться также и по водопроводя-
щей ткани растения — ксилеме. Вирусы могут перемещаться вместе
< водным раствором органических веществ по членикам ситовидных
трубок флоэмы, но это не обязательно приводит к заражению вирусом
этих клеток. Однако некроз флоэмы при вирусных болезнях растений —
отнюдь не редкое явление, доказательством чего может служить хорошо
всем известный некроз этой ткани у американского ильма.
Существуют анатомические, а возможно, и физиологические ограни-
чения, препятствующие проникновению вирусов в некоторые ткани ра-
стений. Например, перенос вирусов семенами наблюдается весьма редко,
а перенос вируса пыльцой — еще реже. Особенности процесса морфо-
генеза цветка, очевидно, таковы, что они препятствуют возможности про-
никновения вирусов в гаметы. Вообще же клетки апикальных меристем
зараженных вирусом растений, как правило, содержат мало вируса,
а иногда и вовсе свободны от вирусных частиц.
Степень распространения вируса по зараженному растению опреде-
ляется тем, как реагирует на инфекцию зараженная клетка. Реакция же
клеток растений на вирусную инфекцию весьма варьирует и, к сожале-
нию, до сих пор биохимическими методами она детально не исследова-
лась. Одним из крайних проявлений реакции клеток растений на вирус-
ную инфекцию являются некротические поражения. В этом случае клетки
отмирают столь быстро, что часто даже не успевают передать вирус со-
седним клеткам. Полагают, что в основе механизма, ведущего к локаль-
ному некрозу, лежит неспецифическая реакция клетки на химические
изменения ее состава, вызываемые каким-то неизвестным изменением
процессов обмена клетки. Известно, что при некротической вирусной
инфекции, как и при иных повреждающих воздействиях, в тканях листа
увеличивается синтез полифенолов и хинонов. В клетках, зараженных
вирусами, вызывающими некроз, обнаружено увеличение синтеза поли-
фенолоксидазы. Было высказано предположение, что за образование
локальных некротических поражений в определенной степени ответст-
350
Глава XVII
венны очень токсичные вещества, синтез которых катализируется поли-
фенолоксидазой [222]. Однако пока не представлены данные, свидетель-
ствующие о способности вирусов детерминировать синтез ферментов,
обладающих свойствами оксидаз.
Вторым крайним проявлением реакции растений на заражение виру-
сом являются почти бессимптомные инфекции, выявляемые лишь по
очень слабым симптомам или благодаря тому, что наличие вируса в теле
кажущегося здоровым растения обнаруживается по эффекту, который
вызывает этот вирус при его введении другому виду растений. В этих
случаях зараженные клетки повреждаются незначительно и, как пра-
вило, сохраняют способность к делению. Как было обнаружено, типич-
ной реакцией клеток растений на заражение некоторыми вирусами яв-
ляется интенсивная пролиферация и даже опухолевая трансформация.
Механизм опухолеродного действия вируса раневых опухолей пока
остается неизвестным. Не ясно, также, какое значение в этом процессе
играет поранение растения [85]. Следует учитывать возможность совме-
стного действия гормонов растений с вирусами (синергизм) в процессе
индукции и стимуляции роста опухоли.
Вирусные инфекции растений приводят к самым различным измене-
ниям физиологических процессов, свойственных растениям (см. [54]).
При вирусных заболеваниях с симптомами мозаичности вирус концен-
трируется главным образом в паренхимных тканях, вследствие чего
в этих случаях симптомы заболевания отражают изменения, происходя-
щие в паренхиме тела растения. Симптомы, наблюдаемые при заболева-
ниях типа желтухи, вызываются главным образом изменениями в прове-
дении пластических веществ, происходящими вследствие поражения ви-
русом флоэмы.
В настоящее время отсутствуют данные, которые бы свидетельство-
вали о способности вирусов растений вызывать общие нарушения обмен-
ных процессов в теле растения. Бдлыпая часть изменений обменных
процессов, наблюдаемых при вирусных болезнях растений, вероятно, яв-
ляется результатом побочных эффектов, оказываемых вирусной инфек-
цией на процессы фотосинтеза, дыхания, регуляции роста, а также транс-
порта воды, пластических и других веществ. Нарушения регуляции роста
приводят к морфогенетическим аномалиям самой различной значимо-
сти— от мозаичности цветков до аномальной пролиферации побегов.
В местах некротических поражений часто накапливаются некоторые ве-
щества типа скополетина — флуоресцирующего ароматического соедине-
ния, однако доказательства специфической роли вируса в биосинтезе
этих веществ пока отсутствуют.
Вообще говоря, установление корреляции между биохимическими
изменениями, наблюдаемыми в тканях зараженных вирусом растений,
и специфическими стадиями вирусной инфекции является исключительно
трудной задачей, ибо большая часть возникающих изменений наблю-
дается на последних стадиях вирусной инфекции. Очевидно, что для
изучения клеточной патологии вирусной инфекции растений крайне не-
обходимо разработать более простые системы. Пока же прогресс в этой
области вирусологии идет весьма медленно.
ВЫЗДОРОВЛЕНИЕ, ПРИОБРЕТЕННЫЙ ИММУНИТЕТ
И ПЕРЕКРЕСТНАЯ ЗАЩИТА
Если зараженные вирусом растения не погибают, то наблюдавшиеся
у них симптомы заболевания часто становятся выраженными все слабее
и даже создается впечатление, что растение выздоровело. На новом при-
росте в подобных случаях могут вовсе отсутствовать симптомы заболе-
Взаимодействие между вирусами растений и их хозяевами
351
вания. Тем не менее вирус в теле растения все же сохраняется. Попытки
прямого выделения вируса из экстрактов листьев не всегда дают поло-
жительные результаты, ибо количество вируса в выздоровевших расте-
ниях обычно резко уменьшается. Поэтому при желании убедиться в на-
личии вируса в теле такого растения лучше прибегнуть к так называе-
мому тесту на приобретенный иммунитет. При наличии у выздоровев-
шего растения приобретенного иммунитета вторичное заражение тем же
или родственным вирусом не приводит к локальной или системной ин-
фекции [655].
Выздоровление не является обязательным условием формирования
приобретенного иммунитета. Если листья, активно зараженные штаммом
вируса, не образующим некрозов, например соответствующим штаммом
ВТМ, через несколько дней заразить другим штаммом того же вируса,
вызывающего некрозы, то некрозы тем не менее не образуются
(фото 63). Вытесняемый штамм вируса действительно лишается возмож-
ности размножаться. Механизм этого явления пока остается неизвест-
ным. Быть может, в основе его лежит механизм, родственный иммуни-
тету, наблюдаемому у лизогенных бактерий, т. е. подавление функции
какого-то важного гена вируса, суперинфицирующего уже зараженную
клетку. Нельзя, однако, исключить и иной возможности, т. е. предполо-
жить, что в данном случае в основе этого явления лежит механизм, по-
добный тому, который мы наблюдаем при инфекциях, вызываемых фа-
гами или вирусом оспы, когда инфицирующий вирус инициирует в зара-
женной клетке последовательность регуляторных процессов, препятст-
вующих размножению других вирусов. Оба эти объяснения совместимы
с наблюдением, обнаружившим, что перекрестный иммунитет наиболее
часто наблюдается при инфекциях, вызываемых родственными виру-
сами.
Не исключено, однако, что определенную роль в этом явлении иг-
рают и менее специфические механизмы. На такую возможность указы-
вает, например, тот факт, что листья, на одной половинке которых
имеются некротические поражения, вызванные заражением одним виру-
сом, приобретают устойчивость к заражению другим вызывающим не-
крозы вирусом при его инокуляции в другую половинку листа [691].
Ингибиторное действие такого типа распространяется также от листьев,
расположенных в нижней части стебля, к листьям, расположенным в его
верхней части. Возможно, что из некротической ткани выделяются инги-
биторы, напоминающие неспецифический ингибитор, выделенный из
листьев Nicotiana glutinosa, зараженных ВТМ, о котором уже упомина-
лось выше [751].
Существованием определенных форм приобретенного иммунитета
некоторые авторы объясняют характерную мозаичность поражений, вы-
зываемую некоторыми вирусами, при которой участки листьев с пора-
женными клетками, где наблюдается интенсивная концентрация вируса,
чередуются с участками нормальной ткани, либо вовсе не содержащей
вируса, либо содержащей его в крайне незначительном количестве [674].
Что же касается того, синтезируются ли в теле растения специфические
противовирусные вещества, действующие подобно антителам, то пока не
получено каких-либо данных, указывающих на образование в растениях,
зараженных вирусами, соединений подобного типа и механизма действия.
Перекрестная защита, как правило, наблюдается при тех вирусных
болезнях растений, которые вызываются вирусами, родственными друг
другу. Поэтому тест на перекрестную защиту широко используется в ка-
честве метода установления родства между вирусами (см. [655]). Изве-
стны, однако, исключения из этого правила. К их числу относятся и слу-
чаи, когда родственные вирусы лишены способности «исключать» друг
352
Г лава XVII
друга [437]. Вследствие отсутствия каких-либо экспериментальных дан-
ных, способных объяснить механизм интерференции между вирусами ра-
стений, пока не представляется возможным дать разумное объяснение
явлению перекрестной защиты, а следовательно, и объяснить, в чем,
собственно, состоит родство, выявляемое при помощи этого теста.
Поэтому этот тест хотя и является практически полезным, но представ-
ляет собой пока чисто эмпирический метод установления родства между
различными вирусами растений.
У некоторых растений смешанное заражение двумя вирусами ведет
к синергизму, проявляющемуся как в большей выраженности симптомов,
вызываемых каждым из вирусов-партнеров, так и в усилении интенсив-
ности размножения обоих вирусов. В других случаях совершенно не-
ожиданно было обнаружено противоположное явление, а именно обоюд-
ное подавление инфекции, в результате чего симптомы заболевания
отсутствовали, несмотря на то что у растения удавалось обнаружить
либо один, либо даже оба вируса [249].
МЕХАНИЗМЫ ПЕРЕДАЧИ ВИРУСОВ РАСТЕНИИ
Механическая передача вирусов растений на поверхность листа мо-
жет быть осуществлена в эксперименте со многими вирусами, однако
маловероятно, чтобы такой путь передачи был бы основным способом
распространения вирусов в естественных условиях. Лишь незначительное
число вирусных инфекций растений может распространяться от одного
растения к другому путем контактирования их листьев. Передачу почти
любого вируса можно осуществить прививкой. Однако этот способ зара-
жения используется главным образом при экспериментальных работах,
хотя он может играть значительную роль в распространении вирусных
болезней плодовых деревьев и декоративных растений. Подобным же
образом паразитное растение повилика, гаустории которой внедряются
в стебли растений-хозяев (таким образом устанавливается живая связь
между сосудистыми системами растения-хозяина и паразита), является
весьма полезным инструментом для изучения передачи вирусов новым
хозяевам, однако очевидно, что этот путь передачи не играет существен-
ной роли в распространении вирусов в природе.
Известен ряд болезней растений, считающихся обычно вирусными,
но передающихся от растений к растению только путем прививки. Воз-
можно, что некоторые из этих болезней вызываются вирусами, потеряв-
шими вследствие мутации либо способность к созреванию, либо способ-
ность передаваться переносчиками. В других случаях наличие вируса
просто трудно продемонстрировать. Например, растения картофеля сорта
Кинг Эдуард не обнаруживают никаких симптомов заболевания, но при
прививке этих растений на растения других сортов картофеля у послед-
них возникает заболевание, известное под названием морщинистая кур-
чавость листьев картофеля. После многочисленных неудачных попыток
вирус, вызывающий это заболевание, был все же выделен, и оказалось,
что он может передаваться и механической инокуляцией [55].
Передача вирусов растений членистоногими-переносчиками
В естественных условиях наибольшую роль в передаче вирусов от
одного растения к другому играют животные, питающиеся на этих ра-
стениях. Иногда такая передача вируса, осуществляемая переносчиком,
представляет собой чисто механический процесс, т. е. непосредственную
Взаимодействие между вирусами растений и их хозяевами
353
инокуляцию здоровых растений насекомыми или другими животными,
несущими на своих ротовых частях вирус, приобретенный ими во время
питания на зараженных растениях. Однако в большинстве случаев пере-
дача вирусов растений животными-переносчиками является специфиче-
ским процессом, отражающим определенные связи, существующие между
вирусом, переносчиком и растением.
Наиболее важную роль в передаче вирусов растений играют члени-
стоногие, особенно насекомые, но иногда также и клещи. Существует
много общего между взаимоотношениями некоторых вирусов растений
с их членистоногими-переносчиками и взаимоотношениями арбовирусов
животных (переносимых членистоногими) с их переносчиками. Однако
диапазон связей, существующих между вирусами растений и их пере-
носчиками, значительно шире. Хотя многие аспекты этой проблемы еще
ждут своего разрешения, в изучении характера связей, существующих
между вирусами растений и их членистоногими-переносчиками, достиг-
нут значительный прогресс. Были разработаны специальные методы серо-
логической идентификации вируса, содержащегося в организме насеко-
мого, вес которого составляет примерно 1 мг, методы введения экстрак-
тов в организм столь малых переносчиков, а также методы кормления
насекомых капельками жидкости, содержащей вирус.
В настоящее время уже можно использовать культуры тканей насе-
комых-переносчиков в качестве экспериментального материала, по-
скольку оказалось возможным заразить такие культуры in vitro виру-
сами растений и показать, что в этих культурах вирус размножается
в серийных пассажах [139]. Эти эксперименты открывают путь к даль-
нейшему и, можно надеяться, весьма продуктивному изучению вирусов
растений.
Членистоногие-переносчики с колющим хоботком, высасывающие
сок растений, весьма эффективно переносят вирусы, поскольку они обла-
дают способностью вводить вирус в относительно глубоко расположен-
ные ткани растения — ксилему или флоэму (см. фото 64). Распростра-
нение лишь небольшого числа вирусов растений ограничено ксилемой,
значительно большее их число встречается во флоэме. Наиболее широк
спектр вирусов растений, переносимых тлями, например Myzus persicae,
которая является переносчиком более 50 различных вирусов картофеля,
фасоли и других растений.
Различают два типа переноса вирусов растений тлями и другими на-
секомыми [84, 563]:
1. Внешний перенос, осуществляемый стилетом насекомого, при ко-
тором вирус не циркулирует по организму переносчика. В этом случае
вирус адсорбируется на вершине стилета насекомого, когда оно питается
на одном растении, и может быть немедленно перенесен на другое ра-
стение. Способность к передаче вируса сохраняется в течение ряда
дней, но после очередной линьки насекомое теряет инфекционность. Спе-
цифический характер переноса некоторых вирусов, передаваемых от ра-
стения к растению таким образом, говорит в пользу того, что в основе
этого типа переноса лежит не просто механический контакт, а какие-то
иные, более сложные явления.
2. Перенос, при котором имеет место циркуляция и размноже-
ние вируса в организме переносчика. В этом случае переносчик сохра-
няет способность передавать вирус другому растению в течение значи-
тельно более продолжительного периода времени. Существенно, что при
данном типе переноса вирус может быть передан другому растению не
сразу после питания переносчика на больном растении, а лишь по окон-
чании определенного латентного периода. Продолжительность его может
составлять от нескольких часов до нескольких дней. Было показано, что
23 Заказ № 1214
354
Глава XVII
при переносе этого типа вирус циркулирует в тканях насекомого и при
линьке способность к переносу приобретенного вируса не теряется. Неод-
нократно наблюдали, что в случае, когда вирус, переносимый тлями, цир-
кулирует по тканям этого насекомого, имеет место также и размножение
вируса. Продолжительность латентного периода как раз и соответствует
тому промежутку времени, который необходим для того, чтобы вирус,
попавший в организм насекомого-переночика, успел бы размножиться и
достичь ротовых частей насекомого. Повышенная температура может
предотвратить размножение вируса, а следовательно, и его передачу.
Некоторые насекомые сохраняют способность к передаче попавшего в цх
организм вируса в течение всей своей жизни.
Обязательным условием передачи вируса от одного растения к дру-
гому, осуществляемой другим классом переносчиков — цикадками (Ci-
cadellidae),— также почти всегда является предварительное размноже-
ние вируса в организме насекомого. К этому классу относятся перенос-
чик вируса желтухи астр Macrosteles divisus, переносчик вируса раневых
опухолей Agallia constricta и многие другие. Демонстрация персистенции
вируса в течение 21 генерации и повторные переносы вируса путем инъ-
екций разбавленных экстрактов тканей зараженных насекомых не остав-
ляют никаких сомнений в том, что некоторые вирусы могут размножать-
ся в тканях цикадок в течение неопределенно долгого времени [83]. У не-
которых из этих переносчиков имеет место трансовариальная передача
вируса. Вирус курчавости верхушки свеклы, также переносящийся ци-
кадками, по-видимому, не размножается в организме своего перенос-
чика Circulifer tenellus, хотя и может проникать в его гемолимфу.
Вирусы, размножающиеся в тканях насекомых, можно обнаружить
и идентифицировать при помощи флуоресцирующих антител, использо-
вав для получения последних антисыворотки к вирусу, экстрагирован-
ному либо из растения, либо из организма насекомого-переносчика [776].
Отсюда следует, что в организме обоих хозяев синтезируется один и тот
же вирусный белок. Изучение динамики распространения вируса ране-
вых опухолей по тканям цикадки, питавшейся на заряженном растении,
которое проводилось путем выявления вируса в различных участках
тела переносчика, показало, что сначала вирус размножается в фильтра-
ционной камере кишечника и лишь через две недели появляется в гемо-
лимфе и различных органах насекомого [775]. Была изучена также дина-
мика размножения вирусов растений в организме переносчиков после
непосредственной инокуляции вируса насекомым [910].
В течение длительного времени полагали, что вирусы растений не
вызывают у своих членистоногих-переносчиков симптомов заболеваний.
Однако впоследствии был описан ряд случаев, когда эти вирусы не
только вызывали заболевания своих переносчиков, но даже убивали их
[406]. Зарегистрирован и любопытный случай благотворного влияния ви-
руса растения на организм цикадки-переносчика. Так, кукурузная ци-
кадка, искусственно зараженная вирусом желтухи астр, приобретает
способность питаться как на астрах, так и на некоторых других расте-
ниях. Эту способность цикадки сохраняют до тех пор, пока в их орга-
низме содержится этот вирус [564].
Способность насекомого переносить тот или иной вирус контроли-
руется генетически и может определяться различием в одном гене.
В этом случае, по-видимому, именно этот ген контролирует проницае-
мость кишечника для вируса. В пользу такой точки зрения говорит тот
факт, что после пунктирования брюшка насекомое, неспособное переда-
вать вирус, приобретает эту способность. Аналогичное явление, как это
уже упоминалось, наблюдается и у насекомых-переносчиков вирусов
животных.
Взаимодействие между вирусами растений и их хозяевами 355
Вирусы растений, кроме тлей и цикадок, могут переносить также и
другие насекомые, в том числе алейродиды, червецы и трипсы. Взаимо-
отношения этих переносчиков с вирусами пока детально не изучены.
Известно также, что некоторые важные вирусы растений передаются
клещами.
В связи со способностью некоторых вирусов растений размножаться
в организме насекомых возникает важная проблема: являются ли в дей-
ствительности такие вирусы вирусами животных или вирусами растений?
Эта проблема является не только семантической. Очень большое значе-
ние она имеет и для правильного понимания эволюции вирусов. Имея
в виду интимные связи между насекомыми и растениями, на которых
они питаются, можно полагать, что вирусы в ходе эволюции распростра-
нились от одного класса хозяев на второй и оказались избирательно
адаптированными к «двойному» образу жизни. Как уже говорилось
в гл. VIII, существенным этапом инфекции является проникновение
в клетку вирусной нуклеиновой кислоты, чьи генетические потенции,
объединенные с генетическими потенциями клетки, и определяют воз-
можность размножения вируса. Способ, при помощи которого вирусная
нуклеиновая кислота проникает в клетку, вероятно, имеет меньшее зна-
чение, чем метаболические и биосинтетические условия, существующие
в клетке, в которую проник вирусный геном.
Как уже упоминалось выше, некоторые вирусы растений, передавае-
мые насекомыми, по каким-то своим свойствам напоминают вирусы жи-
вотных. Так, у вирионов вируса пятнистого увядания томата имеются
внешние оболочки [76], а вирионы вирусов желтой карликовости карто-
феля и вируса Gomphrena напоминают вирионы миксовирусов [88,
454, 555].
Интересное сходство имеется также между вирусом раневых опухо-
лей— типичным представителем вирусов растений, переносимых насеко-
мыми,— и реовирусами. Вирионы этих вирусов близки друг другу по мор-
фологическому строению и содержат двухцепочечную РНК, сходную по
составу оснований [282]. Если некоторые вирусы растений и позвоночных
действительно являются близкими родственниками, то невольно возни-
кает вопрос, какие изумительные эволюционные изменения превратили
одни из них в вирусы, патогенные для человека, а другие в вирусы, пато-
генные для растений?
Перенос вирусов растений нематодами и грибами
Заболевания растений, передающиеся почвой, известны давно [119].
Однако роль нематод в переносе некоторых вирусов растений, в том
числе вируса кольцевой пятнистости табака и вируса «rattle» табака,
была установлена лишь недавно [348]. Эти черви «приобретают» и пере-
дают вирус, паразитируя на корнях растений, и могут служить ему убе-
жищем в течение ряда месяцев, однако потомству червей через яйца ви-
рус, по-видимому, не передается.
Известно, что вирус некроза табака и по крайней мере еще два ви-
руса растений переносятся примитивным паразитным фикомицетом
Olpidium brassicae [438]. Способность к переносу специфична как в отно-
шении штаммов вируса, так и в отношении штаммов переносчика, и ви-
рус переносится, по-видимому, зооспорами гриба. Могут ли другие грибы
служить переносчиками передающихся почвой вирусов, пока не известно.
23*
Глава XVIII
ВИРУСЫ, ПАТОГЕННЫЕ ДЛЯ НАСЕКОМЫХ
ВКЛЮЧЕНИЯ И ИХ СВЯЗЬ С ВИРУСНОЙ ИНФЕКЦИЕЙ
Известны различные вирусные болезни насекомых. Некоторые из них
поражают полезных насекомых, таких, например, как тутовый шелко-
пряд, другие же — насекомых-вредителей, и в механизме, контролирую-
щем численность популяции этих насекомых, быть может, важную роль
играют вирусные заболевания.
Одной из характерных особенностей многих вирусных заболеваний
насекомых является образование в клетках зараженных животных поли-
эдрических включений. Именно поэтому такие заболевания и были на-
званы полиэдрозами (см. [69, 788]). Полиэдры являются специфическими
продуктами жизнедеятельности инфицировавших клетку вирусов. При
одних вирусных инфекциях полиэдры образуются в ядре зараженных
клеток, тогда как при других — в цитоплазме (фото 65). При некоторых
же вирусных заболеваниях насекомых, называемых гранулёзами, в по-
раженных клетках образуются не полиэдры, а гранулярные включения,
или капсулы (фото 66). Иногда патогенные для насекомых вирусы вовсе
не образуют внутриклеточных включений.
До последнего времени исследования, касающиеся биологии виру-
сов насекомых, лимитировались отсутствием адекватных методов, необ-
ходимых для изучения размножения вируса в контролируемых системах.
Не считая исследований, связанных с изучением патологии зараженных
животных, большая часть работ была посвящена изучению морфологии
и химии телец-включений и вирусных частиц. Все, что мы сегодня знаем
о размножении этих вирусов, является результатом электронно-микро-
скопических исследований. Однако настойчивые усилия, предпринимав-
шиеся с целью разработки культур тканей насекомых, пригодных для
изучения вирусов, не так давно были вознаграждены, благодаря чему
и в этой области достигнуты определенные успехи [59, 288, 928]. В связи
с этим мы можем с полным основанием надеяться, что в дальнейшем
наши знания об этой интересной группе вирусов будут быстро попол-
няться.
Ядерные полиэдрозы
Ядерные полиэдрозы были описаны среди насекомых у чешуекры-
лых, перепончатокрылых и двукрылых. Типичным примером подобного
заболевания является полиэдроз тутового шелкопряда Bombix mori.
Через несколько дней после заражения гусеницы этого насекомого либо
путем инъекции ей вируса, либо путем питания на больном растении
в ядрах клеток большинства тканей насекомого появляются включения.
Постепенно их число и размеры увеличиваются и некоторые из них могут
достигать величины 10 и даже 15 мк. В одном ядре может содержаться
до 100 полиэдров. В конце концов ядерный хроматин исчезает, клетки
гибнут, а свободные полиэдры появляются в гемолимфе насекомого.
Полиэдры тутового шелкопряда представляют собой кристаллы, со-
стоящие из белка с высоким молекулярным весом, достигающим при-
— 356 -
Вирусы, патогенные для насекомых
357
мерно 300 000 дальтон, который состоит из субъединиц с молекулярным
весом примерно 20 000 дальтон. Белок полиэдров очень устойчив к дей-
ствию протеолитических ферментов. Его изоэлектрическая точка при-
мерно соответствует pH 5,6, и растворяется он только в щелочи. Воз-
можно, что именно эти свойства ответственны за его способность кри-
сталлизоваться в ядерном соке. Как правило, белки полиэдров являются
хорошими антигенами. Обнаружено, что белки таких полиэдрических
включений, выделенных из организмов различных пораженных вирус-
ными заболеваниями насекомых, дают перекрестные серологические
реакции. Однако белки организма-хозяина и белки полиэдров перекре-
стных серологических реакций друг с другом не дают [479]. Возможно,
что синтез белков полиэдров детерминируется структурными генами ге-
нома вируса.
Некоторые вирусы удалось в эксперименте передать другому насеко-
мому-хозяину [789]. Однако частое наличие у насекомых латентных виру-
сов осложняет интерпретацию такого рода экспериментов. Белки поли-
эдров, образуемых данным вирусом у различных хозяев, серологически
идентичны.
Заключенные внутри полиэдров вирусные частицы либо образуют
скопления, либо локализуются в виде единичных частиц (фото 67). Под-
вергая полиэдры мягкому щелочному гидролизу, легко выделить содер-
жащиеся в них вирионы. Они состоят в основном из палочкообразных
капсидов, внутри которых находится двухспиральная ДНК, окруженная
двумя мембранами — внутренней мембраной, вероятно представляющей
собой единичный слой белка, и внешней мембраной — так называемой
оболочкой развития, окружающей скопления вирусных частиц и состоя-
щей из белка и липидов (фото 68). По-видимому, эти мембраны экви-
валентны капсидам и оболочкам других вирусов животных.
ДНК различных вирусов насекомых обладают характерным нуклео-
тидным составом. Молекулярный вес ДНК, содержащейся в отдельной
вирусной частице, составляет примерно около 108 дальтон. Размер ви-
рионов различных вирусов насекомых колеблется в пределах от 30 до
50 ммк в поперечнике до 200—320 ммк в длину. Среди таких больших
вирионов обычно содержатся мелкие сферические частицы. Было выска-
зано предположение, что сферические частицы представляют собой раз-
вивающиеся формы вируса, и даже описан цикл развития этих вирусов.
Согласно этой схеме, сферические частицы представляют собой исход-
ную форму вируса, из которой сначала образуются незрелые палочки и
затем, наконец, зрелые палочкообразные вирионы [69]. Однако в основе
этой схемы лежат лишь данные, полученные морфологическими метода-
ми, в связи с чем в настоящее время нельзя исключить и того, что мел-
кие частицы представляют собой не развивающиеся частицы, а скорее
неполные или распавшиеся вирионы.
Было показано, что ДНК, экстрагированная из полиэдров тутового
шелкопряда, инфекционна для гусениц. Молекулярный вес этой ДНК
составлял примерно 2 • 106 дальтон [630]. Эта величина, по сравнению
с количеством ДНК, содержащимся в отдельном вирионе, оказалась
неожиданно маленькой. Это обстоятельство очень важно для понимания
молекулярной биологии этого вируса, и поэтому выяснение его причины
является необходимым условием дальнейших исследований в этой инте-
ресной области вирусологии.
Цитоплазматические полиэдрозы
Эти заболевания наблюдаются у чешуекрылых и двукрылых. Их ха-
рактерной чертой является образование заключенных в мембраны масс
358
Г лава X VIII
небольших полиэдров. Каждый из вирусов насекомых образует, по-ви-
димому, либо цитоплазматические, либо ядерные включения, но никогда
не образует и те и другие. Вирусные частицы, содержащиеся в цитоплаз-
матических полиэдрах, обычно представляют собой почти правильные
сферические частицы и некоторые из них, по-видимому, содержат РНК
(см. [69]).
Гранулёзы
Гранулёзы представляют собой заболевания, характерные для чешуе-
крылых. Образующиеся при этом включения представляют собой состоя-
щие из белка овальные зерна или капсулы размером порядка
200x500 ммк. В каждой из таких гранул содержится один или несколько
палочкообразных вирионов, напоминающих вирионы, содержащиеся
в ядерных полиэдрах (см. фото 66). Внутри вирионов содержится вирус-
ная ДНК. Капсулы обнаруживаются главным образом (но не всегда)
в цитоплазме зараженной клетки и освобождаются при ее разрушении.
Процесс образования вокруг вириона капсулы был описан Хьюджесом
[383], который считает, что он начинается у одного конца вириона и, рас-
пространяясь затем на остальную его поверхность, заканчивается у дру-
гого конца. В клетках зараженных вирусом личинок обнаруживаются
также длинные, разветвленные нитевидные структуры, представляющие
собой, по-видимому, аномальные компоненты вирионов [790].
Вирусные заболевания насекомых, при которых включения
не образуются
В качестве примеров таких заболеваний можно привести болезни,
вызываемые радужными вирусами у Tipula paludosa и Sericesthis pruinosa
[812]. Полагают, что мешотчатая детка медоносной пчелы — заболева-
ние, при котором включения не образуются,— также вызывается виру-
сом. Капсиды радужных вирусов представляют собой правильные ико-
саэдры с поперечником от 120 до 150 ммк (см. фото 7). Внутри жировых
телец зараженных личинок содержатся кристаллы, состоящие из этих ви-
русов, которые и придают зараженной личинке типичную радужную
окраску. Похожую окраску имеет осадок этого вируса, полученный при
помощи центрифугирования. Радужные вирусы можно титровать более
действенно, чем вирусы, образующие включения, что является сущест-
венным преимуществом при изучении закономерностей размножения ви-
русов.
РАЗМНОЖЕНИЕ ВИРУСОВ НАСЕКОМЫХ
В основе схем, описывающих циклы развития полиэдрических виру-
сов, лежат данные, полученные при морфологических наблюдениях. Эти
схемы в лучшем случае можно считать лишь гипотетическими моделями
процесса размножения вирусов насекомых. Определение инфекционно-
сти вируса, содержащегося в личинке,— весьма сложная и малоэффек-
тивная процедура, вследствие чего количественное изучение процесса
размножения этих вирусов пока является практически невыполнимым.
Разработка методов длительного культивирования клеток яичника ли-
чинки насекомых, например Antherea eucalypti, существенно улучшила
положение. Клетки таких линий можно заразить полиэдрическими виру-
сами, в результате чего в зараженных клетках образуются полиэдры
[288]. Такие культуры, причем с еще большим успехом, были использо-
ваны для изучения радужного вируса Sericesthis [59]. Удалось получить
Вирусы, патогенные для насекомых
359
по крайней мере семь последовательных пассажей вируса на тканевых
культурах.
Для титрования этих вирусов был применен также метод флуорес-
цирующих антител. Таким путем уже через несколько дней после зара-
жения вирусом выявляются очаги инфекций, локализующиеся в цито-
плазме зараженных клеток. Для обнаружения наличия ДНК в этих оча-
гах размножения вируса можно применить либо метку Н3-тимидином,
Фиг. 74. Кривая размножения радужного вируса Sericesthis в тканевой культуре Antherea
eucalypti [52].
4 — клетки, окрасившиеся противовирусными флуоресцирующими антителами; II — титр вируса, со-
державшегося внутри клеток; III — титр вируса, вышедшего из клеток в культуральную жидкость.
W — титр вируса (выражен числом инфекционных единиц вируса на 1 мл); А — число окрасившихся
клеток в 1 мл.
либо окраску акридиновым оранжевым. При множественном заражении
в одной клетке может образоваться несколько очагов размножения, при-
чем размножение вируса в них протекает в этом случае синхронно. Каж-
дые 80 адсорбировавшихся на клетке вирионов образуют приблизительно
один очаг размножения, что соответствует примерно величине степени
инфекционности, получаемой при титровании того же вируса на интакт-
ных животных. Во внутриклеточных очагах размножения содержатся
вирусные частицы. Кроме того, свободные вирионы обнаруживаются так-
же и в цитоплазме клеток и в «почках», образующихся на поверхности
клеток. При отделении вирусных частиц от этих «почек» у них образует-
ся внешняя мембрана, имеющая, вероятно, клеточное происхождение,
которая окружает икосаэдрические капсиды. Этот процесс напоминает
процесс выхода из клеток миксовирусов и других вирусов животных,
обладающих внешними оболочками, в состав которых входят липиды.
В одной клетке, зараженной радужным вирусом Sericesthis, может
содержаться до 500 инфекционных единиц вируса, что соответствует
40 000, а возможно, и большему числу вирионов. Большая часть их вы-
деляется по окончании одиночного цикла размножения, который длится
примерно одну неделю (фиг. 74). Несмотря на столь интенсивное обра-
зование вируса в цитоплазме, зараженная клетка продолжает синтези-
ровать и свою собственную ДНК.
360
Глава XVIII
ЛАТЕНТНЫЕ ИНФЕКЦИИ ВИРУСОВ НАСЕКОМЫХ
Одной из удивительных особенностей вирусов насекомых является
их способность сохраняться в организме насекомого в латентном состоя-
нии в течение многих генераций. У насекомых почти наверняка имеет
место трансовариальная передача вируса, хотя в ряде случаев трудно
полностью исключить возможность повторного заражения во время
выкормки. Находясь в латентном состоянии, вирус не вызывает каких-
либо выявляемых симптомов. Однако активирующее действие ряда внут-
ренних или внешних факторов приводит к вспышке синтеза инфекцион-
ного вируса и к появлению симптомов заболевания. Индуцирующее воз-
действие может оказать тепловой шок или смена пищи, например замена
листьев одной шелковицы на листья другой. Сходные результаты были
получены при использовании рентгеновских лучей или некоторых хими-
ческих соединений. Так, Ямафуджи {930] сообщил, что формальдегид,
гидроксиламин, перекиси, оксины и нитриты обладают стимулирующим
действием, вызывая симптомы полиэдроза у тутового шелкопряда.
Ямафуджи использовал эти наблюдения для развития теории про-
исхождения полиэдрических вирусов. Согласно его теории, эти вирусы
образуются из генетического материала хозяина как результат реакции
хромосомной ДНК на мутагенное воздействие этих соединений. Приме-
чательно, что этот вывод был сформулирован Ямафуджи еще до того,
как мутагенное действие многих из этих соединений было твердо уста-
новлено. Однако теория Ямафуджи не нашла широкой поддержки, ибо
известно, что намеренное введение гусеницам тутового шелкопряда ви-
руса полиэдроза часто приводит не к развитию заболевания, а к скры-
той, латентной, инфекции [865]. Отсюда следует, что тутовый шелкопряд,
у которого после воздействия химическими соединениями выявляется
вирус, может быть на самом деле носителем вируса. Тот факт, что поли-
эдроз у гусениц — носителей вируса можно вызвать путем воздействия
на них определенными химическими соединениями или облучением,
имеет очевидное сходство с образованием фага лизогенными бактериями,
как известно, индуцируемым воздействиями сходного типа. Поэтому
«провирусная» теория латентности вирусов полиэдроза представляется
более предпочтительной, чем теория конверсии de novo генетических эле-
ментов клетки хозяина в вирусные геномы.
АГЕНТ, ВЫЗЫВАЮЩИЙ У ДРОЗОФИЛЫ ЧУВСТВИТЕЛЬНОСТЬ К СО2
Важная серия исследований была посвящена изучению трансмис-
сивного агента, контролирующего чувствительность к СОг у некоторых
рас дрозофилы. При концентрации СОг, вызывающей у устойчивых
к этому фактору мух лишь обратимое состояние наркоза, у чувстви-
тельных мух наступает паралич, и они погибают. Генетический фактор,
ответственный за чувствительность мух к СОг, получил обозначение сг.
Он обладает трансмиссивностью, мутабильностью и специфичностью по
отношению к хозяину. По этому комплексу свойств, а также по разме-
рам он сходен с вирусами. По некоторым другим свойствам он напоми-
нает умеренные бактериофаги. Ниже кратко излагаются основные дан-
ные, полученные при изучении фактора а [518, 519].
В организме мух, чувствительных к СОг, содержится вирус, который
можно экстрагировать из их тканей и инъецировать устойчивым мухам,
в результате чего последние становятся чувствительными к СОг. Чувст-
вительность к СО2 наступает через несколько дней, причем продолжи-
тельность инкубационного периода зависит от величины инокулума.
Судя по результатам определения инфекционного титра экстрактов, полу-
Вирусы, патогенные для. насекомых
361
ченных из инокулированных мух, содержание вируса в организме такой
мухи сначала уменьшается до минимального значения, а затем быстра
возрастает до максимума, и именно в это время мухи становятся чувст-
вительными к СОз.
Самки, чувствительные к СОг, передают эту чувствительность своему
потомству одним из двух путей. Недавно зараженная самка передает
чувствительность только части своего потомства. Результат, по-видимому,,
зависит от того, попадет ли вирус в ооцит в момент его нахождения
в яичнике или нет. Некоторые из потомков, зараженных вирусом на этой
стадии, становятся стабилизирование чувствительными, т. е. сохраняют
чувствительность к СО2 в течение всей своей жизни и передают эту чув-
ствительность своему потомству значительно более эффективно. Дейст-
вительно, такие самки передают вирус всему потомству, тогда как при
скрещивании подобного типа самцов с нечувствительными к СОг сам-
ками не все потомство оказывается чувствительным к СО2, причем отно-
сительное количество чувствительного потомства варьирует. Мухи-потом-
ки, инфекция к которым передалась от самца, ведут себя подобно вновь
зараженным особям, вирус в которых еще не стабилизировался (неста-
билизированно чувствительные мухи). Содержание инфекционного ви-
руса о в организме стабилизированно чувствительных мух значительно
меньше, чем в организме мух, ставших чувствительными к СО2 вследст-
вие недавнего заражения. Вирус о оказывает и некоторое патогенное
действие на организм, уменьшая жизнеспособность яиц [749].
Вирус о может мутировать. Некоторые его мутанты являются де-
фектными; они не образуют инфекционного потомства, но в состоянии
вызывать иммунитет к заражению экзогенным вирусом. Обратные мута-
ции могут привести к восстановлению нормальной эффективности. Изве-
стны гены хозяина, контролирующие невосприимчивость к вирусу а,
а также мутанты этого вируса, отличающиеся друг от друга по спектру
чувствительных хозяев и способные заражать хозяев, устойчивых к обыч-
ному вирусу. Свойства некоторых мутантов вируса а приведены в
табл. 32.
Таблица 32
Мутации вируса а дрозофилы [627]
Ген Аллель Фенотип
g После заражения имеет место передача вируса по наслед- ству
g~ Зараженная муха вирус по наследству не передает
РГ рг+ Пролонгированная передача по наследству у мух pr+g+
рг~ Мухи pr~g” передают вирус по наследству лишь в течение ограниченного периода времени после заражения
Р Р+ Вирус может размножаться в организме невосприимчивых мух
Р— В организме невосприимчивых мух вирус не размножается
V Высокая частота передачи вируса самцами, стабилизиро- ванно чувствительными к СОг
V— Малая частота передачи вируса самцами, стабилизированно чувствительными к СОг
Тг Тг Вирус реплицируется при 30°
Ts Вирус не реплицируется при 30°
362
Глава XVIII
Эти и другие факты, по-видимому, могут быть интерпретированы
следующим образом [519]. Вслед за заражением устойчивых к СО2, но
восприимчивых к вирусу мух этот вирус после определенного периода
эклипса переходит в стадию вегетативного размножения и созревания,
в результате чего содержание вирионов-потомков в организме мухи до-
стигает определенного максимума. Когда количество вегетативного ви-
руса достигает пороговой величины, муха становится чувствительной
к СО2. Стабилизированное состояние соответствует более интимной ин-
теграции вируса с организмом хозяина, при которой он переходит в не-
инфекционное состояние и лишь изредка может вызвать возрастание
содержания зрелого вируса. Стабилизированная форма вируса может
передаваться самками всем потомкам, как самцам, так и самкам. При
переносе вируса мужской гаметой в зиготу он переходит в нестабилизи-
рованную вегетативную форму.
Стабилизированную форму по аналогии с умеренными фагами
можно считать провирусом, способным в результате индукции превра-
щаться в вегетативную форму. Индукция может произойти либо спон-
танно, либо при образовании зиготы. Чувствительность к СО2 напоми-
нает признак бактериальной клетки, контролируемый фагом и свойствен-
ный как клеткам-хозяевам, содержащим провирус, так и клеткам-хозяе-
вам, содержащим вегетативный вирус. Наличие иммунитета к вирусу а,
дефектных провирусов и другие присущие этому вирусу свойства еще
более усиливают привлекательность этой аналогии.
Наиболее важным различием между профагами и вирусом о явля-
ется отсутствие у последнего специфического хромосомного местополо-
жения. Однако следует иметь в виду, что место специфической локализа-
ции вируса о в хромосоме мухи может еще быть обнаружено в буду-
щем. В самом деле, вполне может оказаться, что вирус а существует в
виде множества копий, локализованных в различных участках хромосо-
мы. Кроме того, имеет смысл вспомнить, что у некоторых умеренных фа-
гов, по-видимому, отсутствует способность к локализации в точном и
определенном локусе хромосомы. Значение приведенных выше аналогий
между вирусом о и умеренными фагами станет более ясным в резуль-
тате дальнейших исследований этого вируса. Возможность же их осуще-
ствления должна резко облегчиться, если мы сможем работать с куль-
турами тканей дрозофилы.
Глава XIX
ПРОИСХОЖДЕНИЕ И ПРИРОДА ВИРУСОВ
ВИРУСЫ КАК НЕЗАВИСИМЫЕ ГЕНЕТИЧЕСКИЕ СИСТЕМЫ
Какое место занимают вирусы в биологическом мире? Каково их
происхождение и кто их ближайшие родственники? Наши знания о ви-
русах, изложенные в этой книге, четко проиллюстрировали положение,
выдвинутое в самом ее начале: вирусы нельзя уподоблять маленьким
клеткам. Вирусы — это элементы генетического материала, обладающие
своей собственной эволюционной историей, ибо в них заложена способ-
ность обеспечивать собственный перенос от одного хозяина к другому.
В этом смысле вирусы представляют собой независимые генетиче-
ские системы. Вирусы не похожи на случайно отделившиеся фрагменты
генома какой-то клетки. Им присуща генетическая непрерывность и спо-
собность мутировать; они содержат набор генов, в результате согласо-
ванного действия которых происходит увеличение количества частиц дан-
ного вируса. Они имеют свою эволюционную историю, если не вполне, то
во всяком случае в известной степени независимую от эволюции организ-
мов, в которых они репродуцируются.
В то же время вирусы нельзя считать совершенно обособленными от
эволюционной истории клеток и организмов. Их генетический материал
по химическому составу сходен с генетическим материалом всех клеток,
несмотря на то что генетическим материалом многих вирусов служит
РНК — кодирующий полимер, низведенный в процессе эволюции клеток
на подчиненное положение: он выполняет в клетках функцию перенос-
чика генетической информации, а не ее первичного носителя. Если срав-
нить ДНК с Солнцем, то клеточную РНК можно уподобить планетам,
светящимся отраженным светом; однако при этом можно сказать, что в
лице РНК-содержащих вирусов мы имеем такие планеты, которые сами
обладают способностью к излучению, так как они испускают характер-
ный, свойственный каждой из них свет.
Однако способность вирусов функционировать в качестве независи-
мых генетических систем не является каким-то статическим, неизменным
свойством, а также претерпевает эволюционные изменения. Так, напри-
мер, геном умеренного фага может претерпевать как физическую, так и
функциональную интеграцию с геномом бактерии. Он может существо-
вать в двух формах: в виде вируса и в виде набора генов хромосомы бак-
терии. В случае когда в результате мутации умеренный фаг теряет спо-
собность превращаться в профаг, он одновременно лишается способности
к существованию в одной из форм, свойственных исходному умерен-
ному фагу, т. е. как бы в большей степени становится вирусом, чем кле-
точным компонентом. Напротив, когда у профага возникает мутация,
превращающая его в дефектный профаг, т. е. в профаг, неспособный осу-
ществлять все функции, необходимые для реализации его собственной
репродукции и заражения другой бактериальной клетки-хозяина, этот про-
фаг как бы становится в меньшей степени вирусом и в большей — клеточ-
ным компонентом, ибо теперь его собственное существование либо опре-
- 263 -
364
Глава XIX
деляется тем, как долго он будет пребывать в клетках данной линии, ли-
бо зависит от того, проникнет ли в данные клетки другой, недефектный
вирус, способный осуществить по отношению к данному профагу функ-
цию вируса-помощника.
Хотя физическая интеграция генома вируса с хромосомой клетки-хо-
зяина продемонстрирована до сих пор лишь в отношении системы фаг —
бактерия, примеры вирусов, вступающих в прочную связь с клетками или
размножающихся только при наличии в системе вируса-помощника, из-
вестны и среди вирусов животных и среди вирусов растений. Такого рода
взаимосвязи не являются примерами случайного взаимодействия, наблю-
даемого лишь в условиях эксперимента, а существуют в естественных
условиях и безусловно имеют определенное значение в процессе эволю-
ции вирусов. В качестве примера можно привести вирус-сателлит вируса
некроза табака, который реплицируется только в том случае, если в за-
раженной им клетке одновременно содержится другой вирус, а также
вирус саркомы Рауса, ибо этот вирус созревает только при наличии в за-
раженной клетке вируса-помощника. Взаимодействие вируса полиомы с
клеткой иллюстрирует иную ситуацию, при которой, вероятно, необра-
тимая потеря вирусом способности к независимому размножению явля-
ется обычным результатом процесса, ведущего к установлению modus vi-
vendi между вирусом и клеткой. Изменившиеся под воздействием вируса
клетки, по-видимому, содержат вирусный геном, однако более неспособ-
ны продуцировать вирионы вируса полиомы.
Эти примеры показывают, что в результате генетических изменений
или вследствие взаимодействия с другими генетическими элементами ви-
рус может превратиться во что-то иное, уже не являющееся вирусом.
В связи с этим, однако, возникает и противоположный вопрос, имеющий
прямое отношение к проблеме происхождения вирусов: а не могут ли
какие-либо иные структуры или соединения, не являющиеся вирусами*
превратиться в вирус? А если да, то какие именно?
ТЕОРИИ ПРОИСХОЖДЕНИЯ ВИРУСОВ
При поиске ответа на этот вопрос мы, с одной стороны, должны ис-
ходить из наших знаний о вирусах как о генетических элементах, а с дру-
гой — из того, что мы знаем о клетках, т. е. их эволюции, генетических
компонентах и функциональной организации. Тот факт, что геном вируса
представляет собой либо ДНК, либо РНК, позволяет нам сконцентриро-
вать наше внимание на механизмах, под влиянием которых эти соедине-
ния могут приобрести свойства, присущие вирусам. Точнее говоря, мы
должны задаться вопросом, произошли ли вирусы из цельных клеток, от-
дельных клеточных компонентов или же доклеточных или бесклеточных
форм генетического вещества? При этом следует помнить, что нет ос-
нований a priori считать все вирусы обязательно происшедшими одним
и тем же путем. В самом деле, наличие РНК- и ДНК-содержащих виру-
сов уже является достаточным доказательством того, что в природе име-
ло место по крайней мере два главных направления эволюции вирусов.
ТЕОРИЯ РЕГРЕССИВНОГО ПРОИСХОЖДЕНИЯ ВИРУСОВ
Большая сложность некоторых из самых крупных ДНК-содержащих
вирусов, наличие в их геноме сотен различных генов, многоступенчатость
и координированность процесса их размножения послужили определен-
ным основанием для теории происхождения вирусов, согласно которой
они представляют собой результат регрессивной эволюции свободно жи-
вущих клеток.
Происхождение и природа вирусов
365
Данные, полученные путем сравнительных биохимических исследо-
ваний, показали, что во всех клетках, начиная от бактерий и кончая
«летками млекопитающих, имеет место ряд общих основных синтетиче-
ских и обменных процессов, для реализации которых все организмы ис-
пользуют в качестве строительных блоков сходные по составу и строе-
нию метаболиты. Некоторые организмы (автотрофы) могут синтезиро-
вать все необходимые им компоненты из неорганических веществ; другие
же не могут существовать без поступления извне некоторых органических
соединений, используемых ими либо в качестве источника энергии (гете-
ротрофные организмы), либо в качестве строительных блоков (ауксо-
трофные организмы).
Первичные самовоспроизводящиеся структурные единицы — прими-
тивные формы жизни, — по-видимому, представляли собой молекулы ну-
клеиновой кислоты, возникшие в результате химических реакций, источ-
ником энергии для которых служило ультрафиолетовое излучение или
электрические разряды, причем промежуточным соединением, возможно,
был цианистый водород [721, 722]. При этом могли синтезироваться и
такие молекулы нуклеиновой кислоты, которые обладали способностью
из содержавшихся в окружающей их среде органических соединений,
также образовавшихся в результате предбиологических химических ре-
акций, детерминировать синтез простейших ферментов, способных в свою
очередь катализировать их собственную репродукцию. Появление кле-
точной организации, вероятно, было одним из самых ранних событий,
приведших к значительно более эффективному использованию субстра-
тов. Первоначально возникшие клетки могли затем все более и более
увеличивать свои синтетические потенции благодаря мутациям [370]. При
истощении внешних источников органических веществ преимущество по-
лучили клетки, обладавшие более мощными синтетическими система-
ми, что в конечном счете привело к появлению автотрофных организмов.
В ходе дальнейшей эволюции некоторые типы клеток вновь теряли
часть своих синтетических потенций. В настоящее время большинство
животных и микроорганизмов, обитающих на нашей планете, а также не-
которые растения не могут существовать без постоянного притока гото-
вых органических веществ. Эта регрессивная «питательная» эволюция
[544] привела к тому, что большинство классов организмов оказались
зависимыми от других организмов в отношении их питания, а следова-
тельно, и продолжения жизни. Растения, а также фотосинтезирующие и
хемоавтотрофные бактерии — это те организмы, через которые происхо-
дит поступление энергии, используемой затем остальным биологическим
миром. Эти организмы образуют первичные питательные вещества для
всех остальных живых существ. В крайних случаях зависимость от ис-
точников питания привела к истинному паразитизму.
Вирусы как регрессировавшие паразиты
Некоторые авторы [113, 297] высказывали мысль о том, что возник-
новение вирусов явилось результатом проявления крайней степени ре-
грессивной эволюции. В пользу этой точки зрения приводились следую-
щие соображения. Можно себе представить, что свободно живущие мик-
роорганизмы, нуждавшиеся в ряде уже готовых питательных веществ,
могли стать паразитами других организмов, служивших для них постав-
щиками этих питательных веществ. Если питательные вещества, в кото-
рых нуждались такие микроорганизмы, относились к числу неспособных
диффундировать через клеточные мембраны, то единственной возмож-
ностью выжить для таких микроорганизмов должно было быть их пре-
вращение во внутриклеточных паразитов. Паразитизм вообще, а в осо-
366
Глава XIX
бенности внутриклеточный паразитизм, благоприятствует дальнейшей
утрате способности к синтезу, создавая среду, в которой имеется боль-
шинство необходимых метаболитов, и таким образом не препятствуя или
почти не препятствуя развитию мутантов, в значительной степени ли-
шенных способности к различным типам синтетических реакций. Такой
процесс может зайти настолько далеко, что паразит в конце концов по-
теряет большую часть своих ферментов и генетического материала, что'
сопровождается уменьшением его размеров и превращением его в вирус.
Вирус может в конце концов уменьшиться до такой степени, что будет
представлять собой лишь небольшую часть генетической системы исход-
ного свободно живущего организма.
Эта теория, по крайней мере в ее первоначальной форме, сейчас
имеет весьма мало сторонников. Хотя у факультативных паразитов —
бактерий, грибов и простейших — действительно наблюдается опреде-
ленный параллелизм между степенью паразитизма и потребностями в
питательных веществах, едва ли известны переходные формы между ви-
русами и такими облигатными паразитами среди простейших, как, на-
пример, малярийный плазмодий, или, скажем, между вирусами и такими:
бактерями, являющимися облигатными паразитами, как бацилла про-
казы.
Риккетсии и патогенные агенты, классифицирующиеся как Chlamy-
dozoaceae, являются внутриклеточными паразитами, которые раньше ча-
сто рассматривали как промежуточные формы между вирусами и бак-
териями. Теперь мы знаем, что риккетсии представляют собой мелкие
грамотрицательные бактерии, размножающиеся путем деления, обла-
дающие автономной, продуцирующей энергию системой и оболочкой, на-
поминающей клеточную стенку бактерий, в составе которой имеется
жесткий, состоящий из мукопептида слой. В чем конкретно состоит де-
фектность ферментных и синтетических систем, обрекающая риккетсии
на внутриклеточный паразитизм, пока остается неизвестным.
Патогенные риккетсии паразитируют в организме членистоногих и
лишь изредка оказываются патогенными для позвоночных. Вероятно, они
родственны группе подобных бактериям симбионтов, обнаруживающихся
в клетках многих членистоногих. Эти микроорганизмы, так же как и
симбионты, напоминающие дрожжи, содержатся в клетках особых орга-
нов, называемых мицетомами, и, по-видимому, передаются зараженными^
самками своему потомству вследствие заражения яиц. Некоторые из этих
паразитов выполняют функции, необходимые организму членистоногого-
хозяина, ибо в случае их удаления в результате воздействия антибиоти-
ками хозяин становится стерильным или погибает [811].
Патогенные агенты, классифицирующиеся как Chlamydozoaceae
[605], также представляют собой сходные с бактериями, но еще более
регрессировавшие паразиты. В течение длительного периода времени их
считали вирусами (имеется в виду группа лимфогранулёмы — пситтако-
за— трахомы). Они не обладают сплошной жесткой клеточной стенкой,
но все же в состав их оболочки входят некоторые соединения, являющие-
ся типичными компонентами бактериального мукопептида. Они содержат
как ДНК, так и РНК и размножаются путем деления надвое. Пока не
представлено доказательств того, чтобы эти микроорганизмы когда-либо
реплицировались в клетках их хозяев в форме свободной нуклеиновой
кислоты. По-видимому, они сохраняют клеточную структуру, напоминая
в этом отношении PPLO и L-формы бактерий [459]. Последние, однако,,
не коммиттированы к внутриклеточной паразитической жизни.
Наиболее веским аргументом против теории регрессивного проис-
хождения вирусов из клеточных паразитов является неклеточная органи-
зация вирусов. Капсиды вирусов морфогенетически подобны клеточным:
Происхождение и природа вирусов
36?
органеллам, состоящим из белковых субъединиц, как, например, жгути-
кам бактерий, нитям актина и сходным с ними структурам, но не кле-
точным мембранам. В тех случаях, когда у вирусов имеются внешние
оболочки, эти оболочки либо построены по типу, отличающемуся от типа
строения мембран, либо, если они и представляют собой истинную эле-
ментарную мембрану [683], то, вероятно, получают ее от своих клеток-
хозяев.
Разрыв между различными внутриклеточными паразитами и виру-
сами очень велик. Если допустить, что вирусы действительно возникли
вследствие регрессивной эволюции паразитов, то следует постулировать
существование ряда промежуточных стадий этого процесса, в которых
должны быть, например, стадии, соответствующие потере клеточной
организации и приобретению способности к автономной репликации за
счет действия части исходного генома, а также стадии, соответствующие
эволюции капсида и внешних оболочек. Хотя отрицать принципиальную,
возможность развития такой последовательности событий и нет основа-
ний, следует ясно отдавать себе отчет, что эти стадии никак не связаны
с паразитизмом. Иными словами, автономная репликация и компоненты
вириона могли возникнуть в процессе эволюции как из некоторых частей
генома независимых клеток, так и из генома паразитических клеток.
Итак, если мы согласимся с тем, что вирусы действительно представ-
ляют собой генетические элементы менее полные, чем геном клетки, то.
различия между теорией регрессивного происхождения вирусов и сле-
дующей группой теорий, полагающих, что вирусы являются субклеточ-
ными компонентами, родственными обычным составным частям клетки,
фактически стираются.
ВИРУСЫ И ГЕНЕТИЧЕСКИЕ КОМПОНЕНТЫ
эукариотических клеток
Клеточная наследственность воплощена в информационных структу-
рах-шаблонах двух типов. Структуры-шаблоны одного типа представля-
ют собой кодирующие макромолекулы нуклеиновых кислот, служащие
матрицами, детерминирующими синтез новых макромолекул. Структу-
ры-шаблоны другого типа представляют собой макромолекулы-затравки,
детерминирующие сборку различных содержащихся в клетке молекул-
предшественников в двумерные и трехмерные функциональные структу-
ры. Различие между этими двумя типами клеточной информации и его
значение для клеточной наследственности было четко подчеркнуто Зон-
неборном [801].
Наши знания о нуклеиновых кислотах как о генетических элементах
весьма обширны (часть из них была накоплена при изучении вирусов).
Напротив, о механизмах реализации информации, содержащейся в мак-
ромолекулах-затравках, мы знаем очень мало и поэтому весьма смутно,
представляем себе сущность их действия. В качестве примера молеку-
лярной модели, иллюстрирующей существование макромолекул-затра-
вок, можно привести синтез гликогена. Соответствующие ферменты, по-
видимому, могут катализировать синтез молекул гликогена лишь в том
случае, когда в реакционной среде содержится некоторое количество
предсуществующих молекул гликогена, служащих затравками (см. [681]).
В качестве другого примера подобного процесса можно привести образо-
вание жесткого слоя клеточной стенки бактерии. Клеточная стенка бак-
терии состоит из так называемого муреина [900] — вещества, обладающе-
го истинной макромолекулярной структурой. В случаях когда бактерии
полностью лишаются клеточной стенки, например при их инкубации в.
среде, содержащей пенициллин, эндогенный синтез клеточной стенки не.
368
Глава XIX
начинается даже в том случае, когда в инкубационной среде содержатся
все предшественники, которые необходимы для такого синтеза. Подоб-
ные бактерии могут выжить, только перейдя в L-форму, т. е. в форму,
в которой бактерия лишена оболочки. У таких бактериальных клеток
клеточная стенка заново образуется крайне редко. Подобно мутации,
это событие происходит случайно, с типичной для мутации малой ве-
роятностью, благодаря чему создается впечатление, что оно совершилось
лишь потому, что внутри клетки случайно произошло восстановление
-функционально активной затравки. Более часто у подобных бактерий
клеточная стенка образуется в том случае, когда их выращивают на
плотных питательных средах, ибо плотное вещество этой питательной
среды служит каркасом, на котором начинается процесс образования
клеточной стенки [485].
Эти наблюдения, видимо, следует интерпретировать в том смысле,
что сложные трехмерные структуры, например молекулы полисахаридов
или макромолекулы муреина, образуемые из достаточно большого чис-
ла малых молекул, соединенных друг с другом ковалентными связями,
могут синтезироваться в клетке, однако начиная не с одной исходной
молекулы мономера, ибо «секрет» их образования заложен в информа-
ции, необходимой для старта синтеза, т. е. в затравке и, следовательно,
в прошлой истории клетки.
Необходимо подчеркнуть, что действие затравки отличается от спо-
собности к самосборке, свойственной структурным белкам. Сборка бел-
ковых структур, вероятно, является «самозатравочным» процессом, де-
терминируемым молекулярной структурой самого белка. Реализация
этого процесса не зависит от наличия в системе какой-то предсущество-
вавшей затравки. В качестве примера процесса такого рода можно при-
вести сборку капсида вируса, ибо (внутри клетки) этот процесс может
идти и в отсутствие нуклеиновой кислоты, образующей сердцевину ви-
руса [675]. В качестве еще одного примера можно привести синтез моле-
кул некоторых мультимерных ферментов, образующихся путем сборки
из субъединиц. Аналогичный механизм лежит также, видимо, в основе
сборки одного из компонентов мышц—нитей актина, хотя в данном
случае пока нельзя исключить и действия в качестве затравки некоторых
клеточных структур, ибо in vitro этот процесс еще продемонстрировать
не удалось. По данным некоторых авторов [5], жгутики бактерий могут
образовываться из одних мономеров. Однако, согласно другим сообще-
ниям [33], этот процесс идет только в том случае, если в реакционной сре-
де содержатся фрагменты жгутиков, выполняющие роль затравки.
Информационные шаблоны, содержащиеся в организованных клеточ-
ных структурах, обладают более сложным строением. В качестве примера
таких сложноорганизованных информационных шаблонов можно при-
вести дифференцированные структуры ресничных простейших. Резуль-
таты, полученные при изучении подобных шаблонов, свидетельствуют
о том, что изменение смысла информации, содержащейся в предсущест-
вующих шаблонах, возникает не вследствие мутационных потерь, ибо оно
может быть вызвано в эксперименте путем продуцирования изменения
самого шаблона, например путем инверсии фрагмента эктоплазмы пара-
меции [58]. Уже имеющаяся ориентация ряда ресничек определяет ориен-
тацию возникающих затем новых рядов ресничек. А это означает, что
макромолекулы, синтез которых детерминируется геном, собираются
в трехмерные структуры согласно плану, находящемуся на месте сборки.
Вопрос о том, какого рода информационные шаблоны лежат в ос-
нове наследственности вирусов, является совершенно ясным. Вирусы не
являются шаблонами или затравками, определяющими последующую
сборку. Они представляют собой систему генетических детерминантов,
Происхождение и природа вирусов
369
состоящих из нуклеиновой кислоты. Если мы хотим найти в клетке ком-
поненты, родственные вирусам, нам следует обратить внимание на струк-
туры, содержащие нуклеиновые кислоты. Для вирусов, содержащих ДНК
и РНК, направление поисков должно быть различным. При этом надо
иметь в виду, что следует ожидать различного по смыслу ответа в зави-
симости от того, будем ли мы иметь дело с клетками организмов, относя-
щихся к группе Procaryota или Eucaryota.
В течение длительного времени полагали, что вся ДНК, содержа-
щаяся в эукариотических клетках, сосредоточена в хромосомах, хотя
в некоторых сообщениях приводились данные, свидетельствующие о
наличии ДНК и в других органеллах клетки. Однако впоследствии было
твердо установлено, что многие клеточные органеллы ведут себя как по-
луавтономные генетические системы, имеющие свою собственную исто-
рию мутирования. Важную роль в установлении этого обстоятельства
сыграли проявления цитоплазматической или материнской наследствен-
ности [134]. Вопрос об основе генетической специфичности этих органелл
независимо от того, определяется ли она кодирующими макромолекула-
ми или локальными саморегулирующимися взаимодействиями генных
продуктов, либо остается пока без ответа, либо ответственность за эту
специфичность возлагается на гипотетические генетические элементы, или
плазмиды [495].
Благодаря прогрессу цитохимии и знаниям, накопленным за послед-
нее время при изучении нуклеиновых кислот, удалось показать, что во
многих цитоплазматических органеллах — митохондриях, хлоропластах
и кинетопластах жгутиковых простейших — содержится ДНК. Эта ДНК
по своему химическому составу и физико-химическим свойствам отли-
чается от основной массы ядерной ДНК и может не иметь общих обла-
стей специфической гомологии с ядерной ДНК [265].
Содержащаяся в упомянутых органеллах ДНК обладает функцио-
нальной активностью. Она детерминирует синтез информационной РНК
(хотя, возможно, и не детерминирует синтез рибосомной и транспортной
РНК) и, по-видимому, кодирует синтез белка. В одной митохондрии
Neurospora содержится по крайней мере 13 • 106 дальтон ДНК [527].
В хлоропластах ДНК содержится во много раз больше (около 108 даль-
тон у Acetabularia [264]). Эти количества сравнимы с количеством ДНК,
содержащимся в вирусах. У митохондрий дрожжей [217] и плесневого
гриба Neurospora [593] были обнаружены мутации, результатом которых
явилось образование нефункционировавших форм митохондрий. У хло-
ропластов водорослей [264] и даже высших растений [676] известны му-
тации, которые приводят к возникновению бесцветных, недоразвитых
пропластид. Результаты генетического анализа говорят о том, что эти
мутации представляют собой изменения, происшедшие в самих органел-
лах, вероятнее всего в их ДНК (генах).
Хлоропласты и митохондрии репродуцируются путем увеличения в
размерах и последующего деления [264, 527]. Сам по себе подобный
способ репликации еще не является доказательством того, что эти струк-
туры обладают независимой системой генетических детерминантов, ибо,
как мы уже видели выше, предсуществующие органеллы могут попросту
служить центрами сборки веществ, образуемых в каких-либо других ча-
стях клетки. (И действительно, в хлоропластах и митохондриях содер-
жатся ферменты, синтез которых детерминируется ядерными генами.)
Например, кинетосомы, или базальные гранулы ресничных простей-
ших (эти органеллы морфологически родственны центриолям и содержат
ДНК), обладают генетической непрерывностью в том смысле, что каж-
дая из них образует новую кинетосому [545]. Тем не менее они не растут
и не делятся, а каждая новая кинетосома возникает вблизи предсущест-
24 Заказ № 1214
370
Глава XIX
вовавшей в результате сборки из тонких трубчатых структур [800]. Как
же происходит этот процесс? Быть может, при этом имеет место реплика-
ция ДНК кинетосомы, после чего реплика организует образование новой
органеллы? Если бы это оказалось так, то мы имели бы процесс размно-
жения, весьма напоминающий размножение вирусов, т. е. процесс, при
котором реплики вирусного генома служат центрами сборки новых ви-
рионов.
Описаны и другие весьма примечательные явления. Так, например,
было показано, что у растущих амеб Naegleria gruberi, находящихся в
амебоидной форме, центриоли не видны, однако, если эти клетки перене-
сти в такую среду, в которой клетки могут перейти в жгутиковую форму,
центриоли появляются [743]. Возможно, что центриоли содержат генети-
ческие элементы, морфогенетическая активность которых подавляется
при культивировании клеток в неадекватной среде, подобно тому как при
индукции подавляется функция профага. Более того, центриоли и родст-
венные им структуры претерпевают такие изменения, которые можно ин-
терпретировать как автономную неограниченную репликацию. Такой про-
цесс можно наблюдать у водного папоротника Marsilea на фазе послед-
него антеридиального митоза, когда полярные тельца расходятся и ге-
нерируют образование группы типичных центриолей, каждая из которых
служит базальной гранулой жгутика [253].
Иногда бесконтрольно реплицироваться могут даже ядерные гены.
Так, в ооцитах амфибий образуется несколько сот ядрышек, каждое из
которых содержит небольшой элемент ДНК [591]. Возможно, что подоб-
ное явление является следствием неограниченной репликации генов из
области организатора ядрышка хромосомы.
Таким образом, кроме ядерных генЪв в эукариотической клетке со-
держится целая группа генетических элементов, по отношению к которым
могут быть родственны ДНК-содержащие вирусы. Как и вирусы, эти ге-
нетические элементы обладают индивидуальностью и им также свой-
ственна генетическая непрерывность. Они характеризуются автономно
реплицирующейся системой, в свою очередь обладающей собственной ре-
гуляторной системой, но поддающейся также контролю со стороны клет-
ки, что опять-таки сходно с вирусами. Подобно некоторым ДНК-содер-
жащим вирусам, цитоплазматические органеллы, по-видимому, обладают
и ферментами, нужными для синтеза необходимых предшественников
ДНК, синтеза самой ДНК и транскрипции РНК с ДНК-матрицы.
Следует, однако, иметь в виду, что наиболее хорошо изученные орга-
неллы клеток — хлоропласты и митохондрии, не напоминают вирусы;
они напоминают достаточно сложные одноклеточные организмы. Их
возможное происхождение из эндосимбионтов длительное время было
предметом обсуждения (см. [495]). Морфологические данные привели
Риса и Плаута [678] к предположению о существовании родства между
хлоропластами и симбиотическими сине-зелеными водорослями. Некото-
рые авторы [615] полагают, что митохондрии произошли от бактериаль-
ных эндосимбионтов, обеспечивших клетки аппаратом дыхания, без ко-
торого они были бы по-прежнему обречены на образ жизни, зависящий
от использования брожения — более древнего и менее эффективного ме-
ханизма преобразования энергии.
Как в хлоропластах, так и в митохондриях происходит биосинтез
белка, однако этот биосинтез, вероятно, осуществляется механизмом, чув-
ствительным, как и у бактерий, к ингибирующему действию хлорамфе-
никола, тогда как на биосинтез основной массы белка, синтезирующейся
в эукариотических клетках, этот ингибитор не влияет [476, 781]. Эти дан-
ные и гипотезы означают, что два главных этапа в эволюции продуци-
рующих энергию механизмов — фотосинтеза и дыхания — эукариотиче-
Происхождение и природа вирусов 371
ские клетки прошли, использовав помощь со стороны прокариотических
симбионтов, напоминающих сине-зеленые водоросли и бактерии.
Может показаться, что эти явления не имеют прямого отношения к
проблеме происхождения вирусов. Однако это не так, ибо они ставят
вопрос о происхождении самой клетки как интегрированной генетической
системы. Мы вернемся к этому вопросу после рассмотрения некоторых
явлений, касающихся родства между бактериофагами и другими генети-
ческими элементами бактерий.
БАКТЕРИОФАГИ И ГЕНЕТИЧЕСКИЙ МАТЕРИАЛ
БАКТЕРИАЛЬНЫХ КЛЕТОК
Между ДНК-содержащими бактериофагами и организованным ге-
номом бактерий — так называемой бактериальной хромосомой [122] —
действительно имеется большое сходство. Умеренные фаги могут внед-
ряться в хромосому клетки-хозяина и, находясь в состоянии профага,
оставаться с ней в физической связи. Когда происходит индукция про-
фага и далее следует неограниченное вегетативное размножение генома
фага, то создается впечатление, что как будто размножается какой-то
фрагмент хромосомы, находящийся, так сказать, вне контекста. И дей-
ствительно, специфическая трансдукция влечет за собой именно такое
размножение бактериальных генов Поэтому представляется заманчивым
рассматривать фаги или по крайней мере умеренные фаги как фрагменты
бактериального генома, приобретшие или восстановившие ранее имев-
шееся у них свойство независимой репликации и способность создавать
вирионы.
Фаги, однако, не являются единственными дополнительными гене-
тическими элементами бактерий. Уже сейчас известно много ДНК-содер-
жащих плазмид, и число таких вновь открываемых генетических элемен-
тов непрерывно возрастает. Выше мы уже познакомились с факторами
бактериоциногенности (факторы col в случае Escherichia coli), ДНК
которых реплицируется вне связи с бактериальной хромосомой. К числу
бактериальных плазмид относится также и половой фактор бактерий
(фактор F), детерминирующий способность к генетическому обмену при
конъюгации [402]. К этой же группе принадлежат и факторы устойчи-
вости (/?) [168, 888], детерминирующие трансмиссивную устойчивость к
одному или нескольким токсическим агентам, а возможно также и фак-
торы пенициллиназы Staphylococcus aureus [626].
Некоторые из упомянутых выше плазмид обладают рядом общих
свойств. Так, например, F-факторы и некоторые факторы col способст-
вуют конъюгации бактерий и переносу генетического материала, ^-фак-
торы также обладают такой способностью, вследствие чего их часто
называют факторами переноса устойчивости. F-факторы, подобно уме-
ренным фагам, могут включаться в бактериальную хромосому, переносу
которой они способствуют при конъюгации [402].
Нередко наблюдается также ассоциация двух или более плазмид,
ведущая к образованию сложного генетического элемента. Так, напри-
мер, было обнаружено, что факторы F присоединяются к факторам col,
т. е. образуют единую структуру [612]. Известно, что подобные взаимо-
действия имеют место и между /?- и F-факторами. Когда ДНК плазмид
не включена в бактериальную хромосому, ее можно выявить по наличию
четких, соответствующих ей полос в материале, подвергшемся центри-
фугированию в градиенте плотности, что особенно хорошо наблюдать
в тех случаях, когда плазмиды локализованы в бактериях, суммарная
ДНК которых по своему составу отличается от ДНК плазмид.
24*
372
Глава XIX
В связи с обсуждаемой в настоящей главе проблемой особое значе-
ние имеют два свойства плазмид: их способность к независимой репли-
кации и участие в процессе переноса генетического материала. В этом
отношении плазмиды близки фагам, ибо фаги также обладают подобны-
ми свойствами. У различных плазмид способность к независимой репли-
кации выражена в разной степени. Например, у некоторых факторов ко-
лициногенности воздействием радиации можно индуцировать неконтро-
лируемую репликацию. Перейдя в подобное состояние, такие со/-факторы
вызывают образование колицинов [14]. Очевидно, что это явление напо-
минает связь, существующую между дерепрессией репликации фага, вы-
зываемой индукцией профага, и синтезом вирионов. Другие плазмиды,
подобные F-факторам, могут реплицироваться автономно, т. е. вне хро-
мосомы, но, по-видимому, не бесконтрольно. Факторы F содержатся в
бактериальных клетках в ограниченном количестве, т. е., вероятно, не
более одной или нескольких таких плазмид на каждую хромосому [193].
Подобно трансдуцирующим фагам, F-факторы, отрываясь от хромо-
сомы бактерии, могут захватить с собой некоторую часть ее хромосом-
ного материала. Хромосомные гены, содержащиеся в таком фрагменте
(а они могут составлять до 10 и более процентов генома бактерии), реп-
лицируются затем совместно с фактором F, который в подобном случае
называют фактором F' [402].
Необходимо подчеркнуть, что способностью к автономной реплика-
ции обладает не всякий фрагмент ДНК, проникающий в бактериальную
клетку. Напротив, фрагменты бактериальной хромосомы, сами проник-
шие в бактерию сквозь клеточную стенку, как это имеет место при транс-
формации бактерий (см. [667]), или введенные в нее трансдуцирующим
фагом, по-видимому, способны размножаться лишь в том случае, если
они включаются в гомологичную область хромосомы бактериальной
клетки.
Для осуществления автономной репликации необходимо наличие
специализированного механизма, названного репликатором [397], сущест-
вование и свойства которого были выявлены следующим образом. Было
известно, что мутантные факторы F' могут реплицироваться только при
пониженных температурах. При более высоких температурах они пере-
стают размножаться и при делении бактериальной клетки передаются
одной дочерней клетке. Некоторые из таких чувствительных к температу-
ре мутантов могут размножаться, если в бактериальной клетке содер-
жится другой, нормальный /‘’'-фактор (выявляемый по иным, связанным
с ним генам). Отсюда следует, что для функционирования репликатора
необходимо действие диффундирующей частицы — инициатора. Очевид-
но, что мутация может воздействовать на тот или иной компонент этой
системы, т. е. на инициатор или на репликатор.
Все плазмиды должны обладать своей собственной репликаторной
системой. Неограниченная автономная репликация наблюдается в том
случае, когда репликаторный механизм активирован полностью. Как реп-
рессия образования инициатора, так и репрессия функции репликатора
препятствует автономной репликации. Вероятно, именно подобное явле-
ние происходит при интеграции профагов и ^-факторов. Такие интегриро-
ванные эписомы репродуцируются только одновременно с дупликацией
хромосомы, контролируемой, по-видимому, своей собственной системой
репликации.
Имеются некоторые данные, наводящие на мысль, что факторы F и
F' ,'влстадии. плазмиды, подобно бактериальным хромосомам, представ-
ляю^ собой кольцевые структуры, а их автономная репликация физиче-
ек«1’координируется с репликацией хромосомы, вследствие чего дочерняя
клетка всегда наследует комплекс, состоящий из реплик хромосомы и
Происхождение и природа вирусов
373
плазмид [158]. Связь между плазмидами и хромосомой, видимо, осущест-
вляется некими структурными компонентами, возможно являющимися
частью цитоплазматической мембраны.
Фаги напоминают эти бактериальные плазмиды, ибо они обладают
автономной системой репликации. Они напоминают некоторые плазмиды
также и потому, что у них имеются гены, детерминирующие образование
специфических структур, управляющих процессом генетического пере-
носа. Можно привести ряд аргументов в поддержку тезиса, согласно ко-
торому многие плазмиды представляют собой генетические элементы, на
различных стадиях эволюции имевшие прямое или косвенное отношение
к процессам генетического переноса. На мысль о том, каковы же были
возможные переходные стадии этого процесса, наводят хорошо известные
факты из области генетики бактерий и фагов. Мы имеем в виду, с одной
стороны, вызываемое мутациями образование дефектных профагов и пе-
реплицирующихся фагов, а с другой — включение генов хромосом в сос-
тав фагов или других плазмид.
Мы можем предположить, что все виды переносимых генетических
элементов возникли в прокариотических клетках, причем некоторые из
них развивались в процессе эволюции более успешно, тогда как другие —
менее успешно. Фаги представляют собой одну из групп таких элемен-
тов. В результате перехода в клетки нового хозяина они могли приобре-
сти способность к паразитическому деструктивному характеру развития,
а затем эволюционировать своим собственным путем. Поэтому не удиви-
тельно, что в ДНК некоторых фагов вместо обычных оснований содер-
жатся необычные основания — урацил, оксиметилурацил и оксиметилци-
тозин. Возможно, что эти изменения, способствуя более успешной конку-
ренции, послужили основой адаптации к новому хозяину. В то же время
не исключена возможность того, что необычные основания, содержащие-
ся в ДНК фагов, могут являться как бы свидетелями ранних, менее ус-
пешных экспериментов, ставившихся природой в ходе эволюции генети-
ческого материала.
РНК-СОДЕРЖАЩИЕ ВИРУСЫ И КОМПОНЕНТЫ КЛЕТОК
Уже само существование РНК-содержащих вирусов ставит ряд тру-
дно разрешимых вопросов. За одним исключением, о котором мы упо-
мянем лишь кратко, ни у бактерий, ни у иных организмов нет генети-
ческих элементов, в отношении репликации которых можно было бы про-
вести удовлетворительную аналогию с репликацией РНК-содержащих
вирусов. Правда, данные, свидетельствующие о том, что РНК-содержа-
щие фаги, относящиеся к одной и той же группе, обладают различными,
специфичными для каждого фага механизмами репликации [323], наво-
дят на мысль, что в этой проблеме, вероятно, имеется еще обширная не-
изученная область. Если это так, то существование пока еще не выявлен-
ных клеточных РНК-реплицирующих систем следует считать вполне
вероятным. Интересно, что для объяснения некоторых аспектов образова-
ния антител была выдвинута гипотеза, постулирующая возможность ви-
русоподобной репликации РНК, транскрибированной с генов клетки
[795].
Если же это направление окажется неверным, мы будем вынуждены
вернуться к исходному состоянию, с тем чтобы избрать одну из следую-
щих возможностей. Во-первых, мы можем рассматривать РНК-содержа-
щие вирусы как уникальную группу генетических элементов, представ-
ляющих самостоятельное направление эволюции. Эта идея не кажется
привлекательной, так как вирусная РНК функционирует как информа-
ционная РНК не сама по себе, а в клеточных системах, используя синте-
374
Глава XIX
тический и транслирующий аппарат клеток. Конечно, не исключена воз-
можность, что адаптация РНК-содержащих вирусов к условиям, сущест-
вующим внутри клеток, могла явиться результатом естественного отбора.
В качестве альтернативы можно полагать, что РНК-содержащие ви-
русы произошли от ДНК-содержащих вирусов, информационная РНК ко-
торых приобрела способность к непосредственной репликации, вследст-
вие чего транскрипция ее с ДНК стала излишней. Если, однако, считать
такое событие вероятным, то нет оснований ограничивать возможность
возникновения РНК-содержащих вирусов лишь превращением в вирус
вирусной информационной РНК. Столь же серьезно, как мы рассматри-
вали возможность происхождения ДНК-содержащих вирусов из клеточ-
ной ДНК, мы обязаны рассмотреть и возможность происхождения РНК-
содержащих вирусов из клеточных информационных РНК. Необходимым
для такого превращения этапом должно быть приобретение клеточной
zn-PHK реплицирующего механизма и способности образовать вирион.
Метагон
Не так давно была обнаружена одна система, которая в том случае,
если представленные данные подтвердятся, может послужить моделью,
способной объяснить, каким образом из РНК, транскрибируемой с гена,
могла возникнуть самореплицирующаяся РНК. Мы имеем в виду си-
стему метагона [800].
В клетках некоторых штаммов Paramecium aurelia содержатся эндо-
симбионты— так называемые каппа-, мю- и лямбда-частицы, превра-
щающие такие парамеции в «убийц» других парамеций и ответственные
за иммунитет содержащих эти частицы животных к подобному воздей-
ствию других штаммов парамеций [799]. Эти эндосимбионты могут «за-
глатываться» парамециями и таким образом проникать внутрь их клетки.
По морфологическому строению и химическому составу эти частицы на-
поминают мелкие бактерии или риккетсии. Некоторые из них могут раз-
множаться в бесклеточной среде [885]. Возможность пребывания эндо-
симбионтов в клетке парамеции детерминируется хромосомными генами.
Так, например, для каппа-частиц необходимо наличие доминантного гена
К, а для мю-частиц (убийцы, действующие при скрещивании двух пара-
меций)— по крайней мере одного из двух несцепленных друг с другом
доминантных генов или М2. У животных с генотипом m{m\m2m2 мю-
частиц не имеется.
Если парамецию лишить гена М (а это достигается при помощи
скрещивания), то мю-симбионты продолжают оставаться в дочерних
клетках нескольких последующих генераций и даже размножаются в этих
клетках, но затем быстро разрушаются и исчезают. Результаты ряда
опытов позволили авторам этих исследований постулировать, что в пара-
меции, имеющей гены М, содержится большое число копий стабильного
генного продукта — метагона, наличие которого необходимо для мю-ча-
стиц. После утраты парамецией гена М количество метагона вследствие
разбавления при каждом последующем делении уменьшается. Мю-части-
цы исчезают, когда клетка парамеции больше не содержит метагона [267].
В клетках Р. aurelia, не имеющих генов Мх или Л12, метагон не об-
разуется. В том же случае, когда метагон содержится в клетке, его мож-
но экстрагировать и передать с пищей другим парамециям, содержащим
мю-частицы, но почти лишившимся этого генного продукта вследствие
истощения его запасов, предотвратив таким образом гибель мю-симбион-
тов. Было установлено, что метагон, содержащийся как в экстрактах, так
и внутри клетки, разрушается РНК-азой. Конечно, для индукции обра-
зования метагона и дальнейшего его сохранения мю-частицы не нужны.
П расхождение и природа вирусов
375
Метагон продуцируют парамеции, у которых имеются гены At, и наличие
у животных метагона можно обнаружить, «скармливая» им мю-частицы.
Интерпретация метагона как генного продукта, а не РНК-содержащего
вируса, функционирующего при наличии у парамеции гена М, основы-
вается на двух обстоятельствах. Во-первых, после воздействия РНК-азы
метагон появляется в клетке вновь, что можно наблюдать до тех пор,
пока там присутствует ген At. Во-вторых, в пользу этой интерпретации
говорят такие данные предварительных опытов, в которых изучали ре-
зультаты отжига смесей, содержавших РНК метагона и ДНК Р. aurelia.
В ходе дальнейших опытов авторами этих исследований было сде-
лано замечательное открытие. Оказалось, что, если живые парамеции
Р. aurelia, содержащие мю-частицы и метагон, скармливать другому
простейшему Didinium nasutum, питающемуся ими, то эти частицы начи-
нают там размножаться. Более того, скармливая простейшему Didinium
парамеции, имеющие ген М но не содержащие мю-частиц, можно пока-
зать, что в клетках Didinium метагон не только продолжает существо-
вать, но и независимо размножается. Его можно экстрагировать из таких
клеток и исследовать на парамециях. Данные о наличии у Didinium гена
At отсутствуют. Более того, некоторые данные свидетельствуют об обрат-
ном. Следовательно, метагон — продукт действия гена у парамеций —
ведет себя в клетке простейшего Didinium как автономно реплицирую-
щийся элемент РНК [266, 268].
Описанный выше комплекс явлений совершенно уникален и не имеет
аналогов в современной молекулярной биологии. Дополнительные иссле-
дования должны показать, действительно ли он имеет место и возникают
ли аналогичные ситуации у других генов и в других организмах. Если же
метагон действительно реплицируется в клетке Didinium, то возникает
вопрос, использует ли он при этом свои собственные ферменты, катали-
зирующие репликацию РНК, или утилизирует содержащиеся в клетке
РНК-реплицирующие механизмы, принадлежащие либо самой клетке,
либо индуцированные каким-то вирусом.
Происхождение вирусов и происхождение клетки
Дискуссия о происхождении вирусов — это по существу дискуссия о
независимости генетических элементов как в репродуктивном, так и в
эволюционном отношении. Основные вопросы, которые следует рас-
смотреть при обсуждении этой проблемы, таковы: 1) сколь длителен
был процесс независимой эволюции вирусов и 2) в какой точке разош-
лись линии эволюционного развития вирусов и эволюционного развития
генетических элементов, обнаруживаемых в настоящее время в клетках?
Известно, что вирус, проникнув в клетку, может оставаться в ней
либо в течение срока, составляющего лишь какую-то часть от полного
времени генерации, либо в течение большого числа генераций. Некоторые
вирусы, заражающие организмы, размножающиеся половым путем, мо-
гут передаваться следующему поколению гаметами. Вирус, пребывающий
в клетке в течение длительного периода времени, практически невозмож-
но отличить от компонента клетки. Такую частицу мы будем называть
вирусом, плазмидой или геном в зависимости от того типа воздействия,
благодаря которому ее удалось обнаружить.
Таким образом, проблема происхождения вирусов имеет два аспекта.
Одним из них является вопрос о родстве между вирусами и клеточными
компонентами, а вторым — вопрос о происхождении компонентов клеток.
Наиболее широко распространено мнение, что клетки являются мо-
нофилетическими по своему происхождению. Это означает, что набор
генов клетки, т. е. ее геном, образовался в результате дифференцировки
376
Г лава XIX
первоначального самовоспроизводящегося единичного элемента, копии
которого почему-либо не разделялись и благодаря мутациям приобре-
тали различную форму и функции. Из таких групп генов должны были
затем образоваться хромосомы, ибо наличие какого-то организованного
механизма, способного осуществлять равное распределение генетического
материала, является большим преимуществом при необходимости со-
хранения благоприятных комбинаций генов.
Появление полового процесса в дальнейшем ходе эволюции внесло
осложнения в эту схему, однако у организмов, у которых еще не суще-
ствовало полового процесса, все гены должны были возникнуть в пре-
делах линии клеток, имеющих общее происхождение. Согласно наиболее
простой гипотезе, цитоплазма целиком является продуктом деятельно-
сти гена. Таким образом, все генетические компоненты клеток, относя-
щихся к одной линии, имеют единое происхождение. Передача такого
компонента — гена или хромосомы — другой клетке представляет собой
слияние части генетического материала одной линии с генетическим ма-
териалом другой линии.
С другой стороны, не исключена возможность и полифилетического
происхождения нормальной клетки. Вполне можно себе представить, что
несколько примитивных самореплицирующихся молекул в какой-то мо-
мент времени могли соединиться друг с другом и что при таком соедине-
нии могла возникнуть благоприятная комбинация, при последующем раз-
витии которой и образовался геном клетки. В качестве альтернативы
можно предположить, что некоторые такие элементы могли проникнуть
в уже образовавшуюся клетку. Выше мы уже упоминали о том, что хло-
ропласты, а, возможно, также и митохондрии и иные содержащие плаз-
миды органеллы клетки, быть может, и являются такими поздними при-
шельцами. Слияние генетического материала различных линий, вероятно,
произошло на относительно ранней стадии эволюции клетки, и приобре-
тение геном, хромосомой или плазмидой способности к переходу от
одной клетки к другой представляет собой возвращение к исходной не-
зависимости и повторение исходного процесса слияния.
«Вироидная» гипотеза [12] является одной из многих теорий, посту-
лирующих именно такое проникновение в клетки на заре их эволюции
свободных зародышевых самовоспроизводящихся элементов. Согласно
этой точке зрения, зародышевые элементы, проникнув в клетку, сохра-
нили часть своих исходных свойств и способность вновь приобрести ин-
фекционные свойства в результате мутации, что в конце концов и дало
начало образованию вирусов. В результате мутаций вироидов могли воз-
никнуть также и нетрансмиссивные аномальные плазмиды, и, возможно,
они ответственны, например, за опухолевые трансформации клеток.
Более общая теория должна учитывать, что к числу потенциально транс-
миссивных компонентов клетки относятся ядерные гены, а также плаз-
миды.
Таким образом, можно видеть, что все теории происхождения виру-
сов в конечном счете сводятся к рассмотрению различных возможностей
слияния двух или большего числа генетических элементов, ведущего
к образованию функционирующей генетической системы. В отношении
вирусов, приводящих к быстрой деструкции клеток, возможность слия-
ния такого типа не является очевидной. Может быть, поэтому фундамен-
тальное значение этого процесса не было замечено вирусологами, зани-
мавшимися изучением вирусов на раннем этапе развития вирусологии
и без тени сомнения считавшими, что вирус, размножающийся в клетке,
подобен бактерии в культуре. На самом же деле даже клетка, заражен-
ная вирулентным вирусом и обреченная на быструю деструкцию, пред-
ставляет собой функциональную систему, чья конечная судьба — гибель
П роисхождение и природа вирусов
377
и дезинтеграция — является побочным результатом первичного события,
а именно генетической и биохимической интеграции вирусных и клеточ-
ных структур.
Слияние приводит к длительной интеграции с вирусами, которая со-
храняется в течение нескольких клеточных генераций даже при половом
процессе. Когда подобному слиянию подвергаются профаги, а возможно,
и некоторые опухолеродные вирусы, интеграция может стать почти по-
стоянной. Некоторые плазмиды и даже некоторые сегменты хромосом
могли эволюционировать именно таким путем. С другой стороны, эволю-
ция механизмов, реализующих процесс передачи генетического мате-
риала, могла привести к превращению отдельных генов и групп генов
в плазмиды и вирусы.
В конечном счете, каким термином мы обозначим тот или иной гене
тический элемент, т. е. назовем ли мы его геном, плазмидой или вирусом,
определяется тем, насколько длительным был период общности его эво-
люционной истории и эволюционной истории других компонентов тех же
клеток. Способность к возвращению независимости может быть функ-
цией не только мутабильности, свойственной данной структуре, но также
и длительности содружества, которое может обусловить возникновение
все возрастающей взаимозависимости между различными компонентами
клетки. Полагать, что вироидный компонент клетки навсегда сохранит
исходную примитивность свойств, тогда как остальные генетические ком-
поненты клеток будут эволюционировать, нет никаких оснований. Экзо-
генный элемент, введенный в клеточную линию, вероятно, подвергнется
столь же выраженным эволюционным изменениям, как и любой другой
генетический компонент клетки, и будет не более похож на своего при-
митивного предка, чем похожи на своих предков обычные генетические
компоненты.
Таким образом, принципиальное сходство между вирусами и дру-
гими генетическими элементами приводит нас к несколько унифициро-
ванной точке зрения, ибо мы видим, что различные теории происхожде-
ния вирусов отличаются друг от друга только в отношении интерпрета-
ции относительной продолжительности «общения» между различными
компонентами клетки. Очевидно, что слияние генетического материала
различных линий и интеграция на клеточном уровне являются, так ска
зать, общим знаменателем всех теорий происхождения вирусов. Вирусы
могли возникнуть из какого-то одного или из нескольких генетически
специфичных компонентов клетки либо путем регрессивной эволюции,
либо в результате передачи упомянутых компонентов от клетки к клетке
Можно полагать, что передаваемые генетические элементы, быстро
вызывавшие в клетках новой системы деструктивные изменения, должны
были исчезнуть, ибо единственной возможностью сохранения элемента,
обладающего такого рода действием, является доступность для него бес-
численного множества подходящих хозяев. Часто, однако, состояние
слияния сохранялось. При этом все же остается весьма важный вопрос,
па который в настоящее время нельзя ответить, а именно, является ли
такое слияние новой и необычной особенностью, ведущей главным обра-
зом к образованию аномальных комплексов малой эволюционной цен
ности, т. е. больных клеток, или оно является примером процесса, кото-
рый играл и все еще играет важную роль в эволюции.
Вирус может быть и регрессировавшим паразитом и клеточным ком-
понентом, ставшим инфекционным, в зависимости от того, на какой фазе
эволюционной истории генетического материала мы его наблюдаем
В различное время он может быть то тем, то другим.
Далее мы видим, что точно так же, как изучение структуры и раз-
множения вирусов в конце концов всегда приводит нас к клетке как
378 Глава Х1Х
К системе, в которой имеют место проявления жизни, так и проблема
происхождения вирусов возвращает нас к вопросу о происхождении
клеток как интегрированного целого. Вирус — это не что иное, как часть
клетки. Мы считаем вирусами те компоненты клетки, которые обладают
достаточной степенью независимости для того, чтобы передаваться от
клетки клетке, и сравниваем их с другими компонентами клетки, которые
более прочно связаны со всей системой. И именно эти свойства вирусов
делают их бесценными для биологов, предоставляя им уникальную воз-
можность наблюдать в изолированном виде активные детерминанты
биологической специфичности — структуры, поистине являющиеся теми
кирпичиками, из которых построено все живое.
ЛИТЕРАТУРА
1. Abel Р., Multiplicity reactivation and marker rescue with vaccinia virus, Virology,
17, 511—519 (1962).
2. A b e 1 P., T r a u t n e r T. A., Formation of an animal virus within a bacterium, Z. Ve-
rerbungslehre, 95, 66—72 (1964).
3. Abercrombie M., Contact-dependent behavior of normal cells and the possible
significance of surface changes in virus-induced transformation, Cold Spring Harbor
Symposium Quant. BioL, 27, 427—431 (1962).
4. Abercrombie M., Ambrose E. J., Interference microscope studies of cell
contacts in tissue culture, Exp. Cell Res., 15, 332—345 (1958).
5. A b r a m s D., Koffler H., In vitro formation of flagella-like filaments and other
structures from flagellin, J. Mol. Biol., 9, 168—185 (1964).
6. A d a G. L., Perry В. T., The nucleic acid content of influenza virus, Austral.
J. Exptl. Biol. Med. Sci., 32, 453—468 (1954).
7. A d a m s J. N., Luria S. E., Transduction by bacteriophage Pl. Abnormal phage
function of the transducing particles, Proc. Natl. Acad. Sci. U.S., 44, 590—594
(1958).
8. Adams M. H., Classification of bacterial viruses: Characteristics of the T5 species
and of the T2, C16 species, J. Bacteriol., 64, 387—396 (1952).
9. Adams M. H., Bacteriophages, Interscience, New York, 1959. (M. Адамс, Бакте-
риофаги, ИЛ, M., 1961.)
10. Adams М. Н., Lark G. К-, Mutation to heat resistance in coliphage T5, J. Immu-
nol., 64, 335—347 (1950).
11. Adams M. H., Park В. H., An enzyme produced by a phage-host cell system.
II. The properties of the polysaccharide depolymerase, Virology, 2, 719—736 (1956).
12. Altenburg E., The «viroid» theory in relation to plasma-genes, viruses, cancer and
plastids, Am. Naturalist, 80, 559—567 (1946).
13. Amati P., Abortive infection of Pseudomonas aeruginosa and Serratia marcescens
with coliphage PL, J. Bacterio!., 83, 433—434 (1962).
14. Amati P., Vegetative multiplication of colicinogenic factors after induction in
Escherichia coli, J. Mol. BioL, 8, 239—246 (1964).
15. A m e s B. N., D u b i n D. T., The role of polvamines in the neutralization of bacterio-
phage DNA, J. Biol. Chem., 235, 769—775 (1960).
16. A n d e r e r F. A., Uhlig H., Weber E., Schramm G., Primary structure of the
protein of TMV, Nature, 186, 922—925 (I960).
17. Anderson E. S., Armstrong J. A., Niven J. S. F., Fluorescence microscopy:
observations of virus growth with aminoacridines, Symp. Soc. Gen. Microbiol., 9,
224—255 (1959).
18. Anderson E. S., F e 1 i x A., The Vi-type determining phages carried by Salmonella
typhi, J. Gen. Microbiol., 9, 65—88 (1953).
19. Anderson T. F., Morphological and chemical relations in viruses and bacteriopha-
ges, Cold Spring Harbor Symposia Quant. Biol., 11, 1—13 (1946).
20. Anderson T. F., Stereoscopic studies of cells and viruses in the electron microsco-
pe, Am. Naturalist, 86, 91—100 (1952).
21. Anderson T. F., The morphology and osmotic properties of bacteriophage systems,
Cold Spring Harbor Symposia Quant. Biol., 18, 197—203 (1953).
22. Anderson T. F., Structure and genetic properties of bacterial viruses. In: Viruses,
Nucleic Acids, and Cancer, M. D. Anderson Hospital Symp. № 17, Houston, Texas,
pp. 122—135, 1963.
23. A n d г e w e s С. H., Interference by one virus with the growth of another in tissue
culture, Brit. J. Exp. Path., 23, 214—220 (1942).
24. Andrewes С. H., Nomenclature of viruses, Nature, 173, 620—621 (1954).
25. Andrewes С. H., E 1 f о r d W. J., Observations on antiphage sera. I. The «percen-
tage law», Brit. J. Exp. Path., 14, 367—376 (1933).
380
Литература
26. А п г а к u N., Tom i z a wa J., Molecular mechanisms of genetic recombination oi
bacteriophage. V. Two kinds of joining of parental DNA molecules, J. Mol. Biol., 12.
805—815 (1965).
27. A p о s h i a n H. V., A dTMPase found after infection of Bacillus subtilis with phage
SP5C, Biochem. Biophys. Res. Commun., 18, 230—235 (1965).
28. A p p 1 e у a r d G., H u m e V. В. M., We s t woo d J. C. N., The effect of thiosemicar-
bazones on the growth of rabbit pox virus in tissue culture, Ann. N. Y. Acad. Sci..
130, 92—104 (1965).
29. Arber W.. Transduction of chromosomal genes and episomes in Escherichia coli,
Virology, 11, 273—288 (1960).
30. Arber W., Host-controlled modification of bacteriophage, Ann. Rev. Microbiol., 19,
365—378 (1965).
31. Arber W., Host specificity of DNA produced by Escherichia coli. 9. Host-controlled
modification of bacteriophage fd, J. Mol. Biol., 20, 483—496 (1966).
32. A r b e r W. D u s s о i x D., Host specificity of DNA produced by Escherichia coli.
I. Host-controlled modification of bacteriophage X, J. Mol. Biol., 5, 18—36 (1962).
33. Asakura S., Eguchi G., lino T., Reconstitution of bacterial flagella in vitro.
J. Mol. Biol., 10, 42—56 (1964).
34. A s t i e г-M anifacier S., Cornuet P., Isolation of turnip yellow mosaic virus
RNA replicase and asymmetrical synthesis of polynucleotides identical to TYMV-RNA,
Biochem. Biophys. Res. Commun., 18, 283—287 (1965).
35. Avery О. T., Macleod С. M., McCarty M., Studies on the chemical nature of
the substance inducing transformation of pneumococcal types, J. Exp. Med., 79,
137—158 (1944).
36. В a b 1 a n i a n R., E g g e r s H. J., T a m m I., Studies on the mechanism of poliovirus-
induced cell damage. I. The relation between poliovirus-induced metabolic and morpho-
logical alterations in cultured cells, Virology, 26, 100—113 (1965).
37. В a c h t о 1 d J. G., В u b e 1 С. H., Gebhardt L. P., The primary interaction of po-
liomyelitis virus with host cells on tissue culture origin. Virology, 4, 582—«589 (1957).
38. Bader J., The requirement of DNA synthesis in the growth of Rous sarcoma and
Rous-associated viruses, Virology, 26, 253—261 (1965).
39. В a 1 a n d i n I. G., Franklin R. M., The effect of mengovirus infection on the
activity of the DNA dependent RNA polymerase of L-cells. II. Preliminary data on
the inhibitory factor, Biochem. Biophys. Res. Commun., 15, 27—32 (1964).
40. Bald J. G., The use of numbers of infections for comparing the concentration of
plant virus suspensions, Austral. J. Exptl. BioL Med. Sci., 15, 211—220 (1937).
41. Bald J. G., Cytological evidence for the production of plant virus ribonucleic acid
in the nucleus, Virology, 22, 377—387 (1964).
42. Baltimore D., Becker Y., Darnell J. E., A virus-specific double stranded
RNA in poliovirus-infected cells, Science, 143, 1034—1036 (1964).
43. Baltimore D., Franklin R. M., Preliminary data on a virus-specific enzyme
system responsible for the synthesis of viral RNA, Biochem. Biophys. Res. Commun.,
9, 388—392 (1962).
44. В a I t i m о г e D., Franklin R. M., A new ribonucleic acid polymerase appearing
after mengovirus infection of HeLa cells, J. Biol. Chem., 238, 3395—3400 (1963)
45. Baltimore D., Girard M., An intermediate in the synthesis of poliovirus RNA,
Proc. Natl. Acad. Sci. U. S„ 56, 741—748 (1966).
46. Baltimore D., Girard M., Darnell J. E., Aspects of the synthesis of polio-
virus RNA and the formation of virus particles, Virology, 29, 179—189 (1966).
47. Barricelli N. A., An analytical approach to the problems of phage recombination
and reproduction. I. Multiplicity reactivation and the nature of radiation damages.
Virology, 11, 99—135 (1960).
48. Barry R. D., Ives D. R., С r u i с к s h a n к J. G., Participation of DNA in the mul-
tiplication of influenza virus, Nature, 194, 1139—1140 (1962).
49. Basilico C., DiMay orca G., Radiation target size of the lytic and the trans-
forming ability of polyoma virus. Proc. NatL Acad. Sci. U. S., 54, 126—128 (1965).
50. Bauer D. J., Clinical experience with the antiviral drug Marboran (1 methylisatin
P-thiosemicarbazone), Ann. N. Y. Acad. Sci., 130, 110—117 (1965).
51. В a u tz E. K. F., H a 1 1 B. D., The isolation of T4-specific RNA on a DNA-cellulose
column., Proc. Natl. Acad. Sci. U. S., 48, 400—408 (1962).
52. В a u t z E. K. F., Freese E., On the mutagenic effect of ethylating agents, Proc.
Natl. Acad. Sci. U. S., 46. 1585-1594 (1960).
53. Bawden F. C., Plant viruses and virus diseases, 3rd ed., Chronica Botanica,
Waltham, Mass., I960.
54. Bawden F. C., Plant viruses and virus diseases, 4th ed., Ronald Press, New York,
1964.
55. Bawden F. С., К a s s a n i s B., Nixon H. L., The mechanical transmission and
some properties of potato paracrinkle virus, J. Gen. Microbiol., 4, 210—219 (1950).
56. В а у r e u t h e г К- E., Romig W. R., Polyoma virus: Production in Bacillus subti-
lis, Science, 146, 778—779 (1964).
Литература
381
57. Becker Y., Joklik W. K-, Messenger RNA in cells infected with vaccinia virus,
Proc. Natl. Acad. Sci. U.S., 51, 577—585 (1964).
58. Beisson J., Sonneborn T. M., Cytoplasmic inheritance of the organization of
the cell cortex in Paramecium aurelia, Proc. Natl. Acad. Sci. U. S., 53, 275—282
(1965).
59. Bellett A. J. D., The multiplication of Sericesthis iridescent virus in cell cultures
from Antheraea eucalypti Scott. III. Quantitative experiments, Virology, 26, 132—141
(1965).
60. Benda G. T. A., The introduction of tobacco mosaic virus into single hair cells of
Nicotiana langsdorffii leaves. I. The concentration of virus, Virology, 6, 49—54
(1958).
61. В e n j a m i n T. L., Relative target sizes for the inactivation of the transforming and
reproductive abilities of polyoma virus, Proc. Natl. Acad. Sci. U.S., 54, 121 — 124
(1965).
62. Benjamin T. L., Virus-specific RNA in cells productively infected or transformed
by polyoma virus, J. Mol. Biol., 16, 359—373 (1966).
63. Bennett C. W., Studies on properties of the curly top virus, J. Agr. Res., 50,
211—241 (1935).
•64. Benzer S., The elementary units of heredity. In: The Chemical Basis of Heredity
(eds. W. D. McElroy and B. Glass), Johns Hopkins Press, Baltimore, 1967.
(«Химические основы наследственности», стр. 56, HJI, М., 1960.)
65. В е n z е г S , On the topology of the genetic fine structure, Proc. Natl. Acad. Sci. U. S.,
45, 1607—1620 (1959).
66. Benzer S., On the topography of the genetic fine structure, Proc. Natl. Acad. Sci.
U.S., 47, 403—415 (1961).
67. Benzer S., Champe S. P., Ambivalent rll mutants of phage T4, Proc. Natl. Acad.
Sci. U.S., 47, 1025—1038 (1961).
68. Benzer S., Jacob F., Etude du developpement du bacteriophage au moyen d’irra-
diations par la lumiere ultraviolette, Ann. Inst. Pasteur, 84, 186—204 (1953).
69. В ergo Id G. H., Viruses of insects. In: Handbuch der Virusforschung (eds. C. Hal-
lauer and K- F. Meyer), Vol. 4, Springer, Vienna, pp. 60—142, 1958.
70. Bernal J. D., Fankuchen I., X-ray and crystallographic studies of plant virus
preparations, J. Gen. Physiol., 25, 111—165 (1941).
71. Berta ni G., Studies on lysogenesis. III. Superinfecting of lysogenic Shigella dy-
senteriae with temperate mutants of the same phage, J. Bacteriol., 67, 696—707 (1915*4).
72. Berta ni G., Lysogeny, Adv. Virus Research, 5, 151—193 (1958).
73. В e r t a n i G., On the interpretation of Boyd’s «multiplicity effect» in lysogenization,
Virology, 12, 132—136 (I960).
74. В e г t a n i L. E., The effect of the inhibition of protein synthesis on the establishment
of lysogeny, Virology, 4, 53—71 (1957).
715. Best R. L., Gallus H. P. C., Further evidence for the transfer of character-deter-
minants (recombmation) between strains of tomato spotted wilt virus, Enzymologia,
17, 207—221 (1965).
76. В e s t R. J., P a I k B. A., Electron microscopy of strain E of tomato spotted wilt virus
and comments on its probable biosynthesis. Virology, 23, 445—460 (1964)
77. Beukers R., Berends W., Isolation and identification of the irradiation product
of thymine, Biochim. Biophys. Acta, 41, 550—551 (1960).
78. Beveridge W. I. B., Burnet F. M., The cultivation of viruses and rickettsiae in
the chick embryo, Med. Res. Council Spec. Rep. № 256 (1946).
79. В i 1 1 i n g h a m R. E., Brent L., Med a war P. B., Qualitative studies on tissue
transplantation immunity. III. Actively acquired tolerance, Philosoph. Trans. Royal
Soc. London, 239, 357—414 (1956).
80. Bishop J. M., Summers D. F., Levintow L., Characterization of ribonuclease-
resistant RNA from poliovirus-infected HeLa cells, Proc. Natl. Acad. Sci. U.S., 54,
1273—1281 (1965).
81. В i 11 n e г J. J., Some possible effects of nursing on the mammary gland tumor inci-
dence in mice. Science, 84, 162 (1936).
82. Black L. M., A virus tumor disease of plants, Am. J. Botany, 32, 408—415 (1945).
83. В I a c k L. M„ Viruses that reproduce in plants and insects, Ann. N. Y. Acad. Sci.,
56, 398—413 (1953).
84. В 1 a c k L. M., Some recent advances on leafhopper-borne viruses. In: Biological
Transmission of Disease Agents, Academic Press, New York, pp. 1—9, 1962.
85. В 1 a c k L. M„ Physiology of virus-induced tumors in plants. In: Encyclopedia of
Plant Physiology (ed. W. Ruhland), Vol. 15, 237—266 (1965).
86. Black L. M., Markham R., Base pairing in the ribonucleic acid of wound-tumor
virus, Neth. J. Plant Pathol., 69, 215 (1963).
'87. Black L. M., M о s I e у V. M., W у с k о f f R. W. G., Electron microscopy of potato
yellow dwarf virus, Biochim. Biophys. Acta, 2, 121—123 (1948).
88. В 1 a c k L. M., S m i t h К. M., H i 11 s G. J., M a r k h a m R., Ultrastructure of potato
yellow dwarf virus, Virology, 27, 446—448 (1965).
382
Литература
89. Black Р. Н., R о w е W. Р., Ап analysis of SV40-induced transformation of hamster
kidney tissue in vitro. I. General characteristics, Proc. Natl. Acad. Sci. U.S., 5(k
606—613 (1963).
90. В о с к s t a h 1 e r L. L,K a esberg P., Infectivity studies of bromegrass mosaic viru^
RNA, Virology, 27, 418—425 (1965).
91. Bode V. C., Kaiser A. D., Changes in the structure and activity of л DNA in
a superinfected immune bacterium, J. Mol. BioL, 14, 399—417 (1965).
92. В о d i a n D., Emerging concept of poliomyelitis infection, Science, 122, 105—108
(1965).
93. В о e у e A., Melnick J. L., Rapp F., S V40-Adenovirus hybrids: Presence of two
genotypes and the requirement of their complementation for viral replication. Viro-
logy, 28, 56—70 (1966).
94. Borrel A., Sur les inclusions de I’epithelioma contagieux des oiseaux, C. r. soc. biol.,
57, 642—643 (1904).
95. В о у c e R. P., H о w a r d-F landers P., Release of ultraviolet light-induced thymine
dimers from DNA in E. coli K-12, Proc. Natl. Acad. Sci. U.S., 51, 293—300 (1964).
96. Brachet J., Biological role of pentose nucleic acids. In: The Nucleic Acids, Vol. II
(eds. E. Chargaff and J. N. Davidson), Academic Press, New York, pp. 475—519
(1955). («Нуклеиновые кислоты», стр. 320, ИЛ, М., 1957.)
97. Brakke М., Density gradient centrifugation and its application to plant viruses,
Adv. Virus Research, 7, 193—224 (1960).
98. В reed is C., Berwick L., Anderson T. F., Fractionation of Shope papilloma,
virus in cesium chloride density gradients, Virology, 17, 84—94 (1962).
99. Breeze D. C., Cohen P. S., Evidence for the exponential reproduction of the ge-
nome of EMC virus, Virology, 27, 227—229 (1965).
100. Breitenfeld P. M., Schaefer W., The formation of fowl plague virus antigens
in infected cells, as studied with fluorescent antibodies, Virology, 4, 328—345
(1957).
101. Brenner S., Barnett L., Genetic and chemical studies on the head protein of
bacteriophages T2 and T4. In: Structure and Function of Genetic Elements, Brookha-
ven Symp. in Biology, 12, 86—94 (1959).
102. Brenner S., Champe S. P., Streisinger G., Barnett L., On the inte-
raction of adsorption cofactors with bacteriophages T2 and T4, Virology, 17, 30—39
(1962).
103. Brenner S., Horne R. W., A negative staining method for high resolution electron
microscopy of viruses, Biochim. Biophys. Acta, 34, 103—110 (1959).
104. Brenner S., Jacob F., Meselson M., An unstable intermediate carrying infor-
mation from genes to ribosomes for protein synthesis, Nature, 190, 576—581
(1961).
105. В r i n t о n С. C., Jr., G e m s k i P., Jr., Carnahan J., A new type of bacterial pilus
genetically controlled by the fertility factor of E. coli K12 and its role in chromosome
transfer, Proc. Natl. Acad. Sci. U.S., 52, 776—783 (1964).
106. Bryan W. R., Beard J. W., Estimation of purified papilloma virus protein by in-
fectivity measurements, J. Infectious Diseases, 65, 306—321 (1939).
107. Bryan W. R., Beard J. W., Host influence in the characterization of response to
the papilloma protein and to vaccinia virus, J. Infectious Diseases, 67, 5—24 (1940).
108. Bryan W. R., Caiman D., Moloney J. B., Biological studies on the Rous sar-
coma virus. III. The recovery of virus from experimental tumors in relation to the
initiating dose, J. Natl. Cancer Inst., 16, 317—33o (1955).
109. Buonassisi V., Sato G., Cohen A. I., Hormone-producing cultures of adrenal
and pituitary tumor origin, Proc. Natl. Acad. Sci. U.S., 48, 1184—1190 (1962).
110. Burgi E., Hershey A. D., A relative molecular weight series derived from the
nucleic acid of bacteriophage T2, J. Mol. Biol., 3, 458—472 (1961).
111. Burnet F. M., A method for the study of bacteriophage multiplication in broth,
Brit. J. Exp. Path., 10, 109—115 (1929).
112. Burnet F. M., The serological classification of coli-dysentery phages, J. Path. Bact,
36, 307—318 (1933).
113. Burnet F. M., Virus as organism, Cambridge, Harvard University Press, 1945.
(Бернет, «Вирус как организм», ИЛ, М., 1947.)
114. Burnet F. М., The clonal selection theory of acquired immunity, Vanderbilt Univ.
Press, Nashville, Tennessee, 195i9.
115. Burnet F. M., Immunological recognition of self, Science, 133, 307—311 (1961).
116. Burnet F. M., Keogh E. V., Lush D., The immunological reaction of the filte-
rable viruses, Austral. J. Exptl. Biol. Med. Sci., 15, 231—368 (1937).
117. Burnet F. M., Stone J. D., The receptor destroying enzyme of V. cholerae,
Austral. J. Exptl. Biol, and Med., 25, 227—233 (1947).
118. Cadman С. H., Evidence for association of tobacco rattle virus nucleic acid with
a cell component. Nature, 193, 49—52 (1962).
119. Cadman С. H., Biology of soil-borne viruses, Ann. Rev. Phytopathol., 1, 143—172
(1963).
Литература
383
120. Cairns Н. J. F., The asynchrony of infection by influenza virus Virology, 3, 1—14
(1951).
121. Cairns J., The initiation of vaccinia infection, Virology, 11, 603—623 (1960).
122. Cairns J., The chromosome of E. coli, Cold Spring Harbor Symposia Quant. Biol
28, 43—46 (1963).
123. С a 1 e f E., L i с c i a r d e I I о G., Recombination experiments on prophage host re-
lationships, Virology, 12, 81 — 103 (1961).
124. Cale f E., Marchell i C., Guerrini F., The formation of superinfectiondouble
lysogens of phage X in Escherichia coli K12, Virology, 27, 1—10 (1965).
125. Campbell A., Sensitive mutants of bacteriophage X, Virology, 14, 22—32 (1961)
126. Campbell A., Episomes, Adv. in Genetics, 11, 101 —145 (1962).
127. Campbell A., 1 he steric effect in lysogenization by bacteriophage X, Virology, 27.
319—345 (!%5).
128. Cann J. R., С 1 а г к E. W., On the kinetics of neutralization of bacteriophage T2 by
specific antiserum, J. Immunol . 72. 463—477 (1954).
129. Capecchi M., Initiation ol E. coli proteins, Proc. Natl. Acad. Sci. U.S., 55, 1517—
1524 (1966).
130. С a r t w r i g h t T. E., Ritchie A. E., Lauffer M. A., The reaction of tobacco
mosaic virus with formaldehyde. III. Kinetics of the loss of infectivity, Virology, 2.
689—702 (1956).
131. С a r u s i E. A., S i n s h e i m e r R. L., The protein subunit of bacteriophage q?X174,
Federation Proc., 20, 438 (1961)
132. Casals J., The arthropod-borne group of animal viruses, Trans. N. Y. Acad. Sci.
Series II, 19, 219—235 (1957).
133. Caspar D. L. D., Klug A., Physical principles in the construction of regular vi-
ruses, Cold Spring Harbor Symposia Quant. BioL, 27, 1—24 (1962).
134. Caspari E., Cytoplasmic inheritance, Adv. Genetics, 2, 1—66 (1948).
135. Champe S. P., Benzer S., An active cistron fragment, J. Mol. Biol., 4, 288—292
(1962).
136. C h a p p e v i 11 e F., Lipman F., von Ehrenstein G., Weisblum B..
R a у W. J., В e n z e r S., On the role of soluble RNA in coding for amino acids, Proc
Natl. Acad. Sci. U.S., 48, 1086—1092 (1962).
137. Ch ar gaff E., Structure and function of nucleic acids as cell constituents, Federa-
tion Proc., 10, 654—659 (1951).
138. Charney J., Machlowitz R., Ту tell A. A., Sagin J. F., Spicer D. S.,
The concentration and purification of poliomyelitis virus by the use of nucleic acid
precipitation, Virology, 15, 269—280 (1961).
139. Chin B., Reddy D. V. R., Black L. M., Inoculation and infection of leafhopper
tissue cultures with a plant virus, Virology, 30, 562—566 (1966).
140. Choppin P W., Multiplication of a myxovirus (SV5) with minimal cytopathic ef-
fects and without interference, Virology, 23, 224—233 (1964).
141. Clark A. J., Margulies A. D., Isolation and characterization of recombination-
deficient mutants of Escherichia coli, Proc. Natl. Acad. Sci. U. S., 53, 451—459
(1965).
142. Clark J. M., Chang A. Y., Spiegelman S., Reichman E. M., The in vitro
translation of a monocistronic message, Proc. Natl. Acad. Sci. U.S., 54, 1193—1197
(1965).
143. Clowes R. C., Transfer! genetique des facteurs colicinogdnes Ann. Inst. Pasteur
107, 74—92 (1964).
144. Cohen S. S., Growth requirements of bacterial viruses, Bacteriol. Rev., 13, 1—24
(1949).
145. Cohen S. S., Virus-induced acquisition of metabolic function, Federation Proc., 20,
641—649 (1961).
146. Cohen S. S., The biochemistry of viruses, Ann. Rev. Biochem., 32, 83—154 (1963).
147. Cohen S. S., Flaks J. G., Barner H. D., Loeb M. R., Lichtenstein J.,
The mode of action of '5-fluorouracil and its derivatives, Proc. Natl. Acad. Sci. U. S..
44, 1004—1012 (1958).
148. Commoner B., Linear biosynthesis of tobacco mosaic virus: development and test
of a model, Proc. Natl. Acad. Sci. U.S., 48, 2076—2083 (1962).
149. Commoner B., Dietz P. M., Changes in non-protein nitrogen metabolism during
tobacco mosaic virus biosynthesis, J. Gen. Physiol., 35, 847—856 (1952).
150. Coons A. H., The morphological aspects of virus infection of cells as revealed by
fluorescent antibody. In: The Nature of Viruses (eds. G. E. W. Wolstenholme and
E. С P. Millar), Ciba Fndn. Symposium, Churchill, London, pp. 203—207 (1957).
151. Cooper S., Zinder N. D., The growth of an RNA bacteriophage: the role of pro-
tein synthesis, Virology, 20, 605—612 (1963).
152. Craigie J., Felix A., Typing of typhoid bacilli with Vi-bacteriophages, Lancet,
252, 823—826 (1947).
153. Crawford L. V., A study of the Rous sarcoma virus by density gradient centrifu-
gation, Virology, 12, 143—153 (1960).
384
Литература
154. Crawford L. V., A minute virus of mice, Virology, 29, 605—612 (1966).
155. Crick F. H. C., Barnett L., Brenner S., Watts-Tobin R. J., General natu-
re of the genetics code for proteins, Nature, 192, 1227—1232 (1961).
156. С r i с к F. H. C., W a t s о n J. D., The structure of small viruses, Nature, 177, 473—475
(1956).
1'57 . C u z i n F., Un bacterioohage specifique du type sexuel F~d'Escherichia coli K12,
С. r. Acad. Sci., 260, 6482—6485 (1965).
158. CuzinF., Jacob F., Existence chez Escherichia coli d’une unite genetique de segre-
gation formee de differents replicons, C. r. Acad. Sci., 260, 5411—5414 (1965).
159. Dales S., Association between the spindle apparatus and reovirus, Proc. Natl. Acad.
Sci. U.S., 50, 268—275 (1963).
160. Dales S., Choppin P. W., Attachment and penetration of influenza virus. Virolo-
gy, 18, 489—492 (1962).
161. Dales S., Franklin R. M., A comparison of the changes in fine structure of
L-cells during single cycles on viral multiplication following their infection with the
viruses of Mengo and encephalomyocarditis, J. Cell. Biol., 14, 281—302 (1962).
162. Dales S., Kajioka R., The cycle of multiplication of vaccinia virus in Earle’s
strain L cells. I. Uptake and penetration, Virology, 24, 278—294 (1964).
163. Darnell J. E., Early events in poliovirus infection, Cold Spring Harbor Symposia
Quant. Biol., 27, 149—158 (1962).
164. Darnell J. E., Baltimore D., Girard M., Summers D. F., M a i z e 1 J. V.,
The synthesis and translation of poliovirus RNA. In: The Molecular Biology of Viru-
ses (ed. J. S. Colter), Academic Press, New S'ork, 1967.
165. Darnell J. E., L e v i n t о w L., Poliovirus protein: source of amino acids and time
course of synthesis, J. Biol. Chem., 235, 74—77 (1960).
166. Darnell J. E., Levintow L., Thoren M. M., Hooper J. L., The time course
of synthesis of poliovirus RNA, Virology, 13, 271—279 (1961).
167. Darnell J. E., S a w у e г T. K-, The basis for variation in susceptibility to polio-
virus in HeLa cells. Virology, 11, 665—675 (1960).
168. Datta N., Infectious drug resistant, British Med. Bull., 21, 254—259 (1965).
169. Davern С. I., Isolation of the DNA of the E. coli chromosome in one piece, Proc.
Natl. Acad. Sci. U.S., 55, 792—796 (1966).
170. Davidson R. G., Nitowsky H. M., Childs B., Demonstrations of two popu-
lations of cells in the human female heterozygous for glucose-6-phosphate dehydro-
genase variants, Proc. Natl. Acad. Sci. U.S., 50, 481—485 (1963).
171. Da v ies W. L,Gru nert R. R., H af f R. F., McGahen J. W., N euma yer E. M.,
Paulshock M., W a 11 s J. C., Woo d T. R., Herrmann E. С.. H о f f m a n С. E.,
Antiviral activity of 1-adamantanamine (amantadine), Science, 144, 862—863
(1964).
172. Davison P. F., F r e i f e 1 d e r D., H e d e R., L e v i n t h a 1 C., The structural unity
of the DNA of T2 bacteriophage, Proc. Natl. Acad. Sci. U.S., 47, 1123—1129
(1961).
173. Davson H., Daniel li J. F., The permeability of natural membranes, Cambridge
University Press, 1943.
174. De D u v e C., Lysosomes, a New Group of Cytoplasmic Particles. In: Subcellular
Particles (ed. T. Hayashi), Ronald Press, New York, pp. 128—159, 1959.
175. De fen di V., Manson L. A., Analysis of the life cycle in mammalian cells, Na-
ture, 198, 359—361 (1963).
176. De lb ruck M., Adsorption of bacteriophages under various physiological conditions
of the host, J. Gen. Physiol., 23, 631—642 (1940).
177. De lb ruck M., The growth of bacteriophage and lysis of the host, J. Gen. Physiol.,
23, 643—660 (1940).
178. Delbriick M., Interference between bacterial viruses. III. J. Bacteriol., 50, 151—170
(1945).
179. Delbriick M., Biochemical mutants of bacterial viruses, J. Bacteriol., 56, 1—16
(1948).
180. De 1 b г u с к M., Bailey W. T., Jr., U Induced mutations in bacterial viruses, Cold
Spring Harbor Symposia Quant. Biol., 11, 33—37 (1946).
181. DeMars R. I., The production of phage-related material when bacteriophage deve-
lopment is interrupted by proflavine, Virology, 1, 83—99 (1955).
182. DeMars R. I., The inhibition by glutamine of glutamyl transferase formations in
cultures of human cells, Biochim. Biophys. Acta, 27, 435—436 (1958).
183. DeMars R. I., Luria S. E., Fischer H., Levi nth al C., The production of
incomplete bacteriophage particles by the action of proflavine and the properties of the
incomplete particles, Ann. Inst. Pasteur, 84, 113—128 (1953).
184. Denh a rd t D. T., S i n s h e i m e r R. L., The process of infection with bacteriophage
<pX174. VI. The inactivation of infected complexes by ultraviolet irradiation. J. Mol.
Biol., 12, 674—694 (1965).
185. Dintzis H., Assembly of the peptide chains of hemoglobin, Proc. Natl. Acad. Sci.
U.S., 47, 247—261 (1961).
Литература
385
186. Dirksen М. L., Wiberg J. S., Koerner J. F., Buchanan J. M., Effect of
ultraviolet irradiation of bacteriophage T2 on enzyme synthesis in host cells, Proc.
Natl. Acad. Sci. U.S., 46, 1425—1430 (1960).
187. Doermann A. FI., Lysis and lysis inhibition with Echerichia coli bacteriophage,
J. Bacteriol., 55, 257—276 (1948).
188. Doermann A. H., Boehner L., An experimental analysis of bacteriophage T4
heterozygotes. I. Mottled plaques from crosses involving six rll loci, Virology, 21,
351—567 (1963).
189. Doermann A. H., Chase M., Stahl F. W., Genetic recombination and replica-
tion in bacteriophage, J. Cell. Comp. Physiol., 45, Suppl., 2, 51—74 (1955).
190. Doty P., Steiner R. F., Light scattering and spectrophotometry of colloidal colu-
tions, J. Chem. Physics, 18, 1211—1220 (1950).
191. Dove W. F., Weigle J. J., Intracellular state of the chromosome of bacteriophage
lambda. I. The eclipse of infectivity of bacteriophage DNA, J. Mol. Biol., 12, 620—629
(1965).
192. Drake J. W., Interference and multiplicity reactivation in polioviruses, Virology, 6,
244—264 (1958).
193. Driskell-Zamenhof P. J., Adelberg E. A., Studies on the chemical nature
and size of sex factors of Escherichia coli К12, J. Mol. Biol., 6, 483—497 (1963).
194. D u e s b e r g P. H., Robinson W. S., Isolation of the nucleic acid of Newsactle
disease virus, Proc. Natl. Acad. Sci. U.S., 54, 794—800 (1965).
195. Dulbecco R., Experiments on photoreactivation of bacteriophages inactivated with
ultraviolet irradiation, J. Bacteriol., 59, 329—347 (1950).
196. Dulbecco R., Production of plaques in monolayer tissue cultures by single particles
of an animal virus, Proc. Natl. Acad. Sci. U.S., 38, 747—752 (1952).
197. Dulbecco R., Mutual exclusion between related phages, J. Bacteriol., 63, 209—217
(1952).
198. Dulbecco R., Virus-cell interactions in latent infections. In: Symposium on Laten-
cy and Masking in Viral and Rickettsial Infections (eds. D. L. Walker, R. P. Hanson,
and A. S. Evans), Burgess, Minneapolis, 1958.
199. Dulbecco R., Hartwell L. H., Vogt M., Induction of cellular DNA synthesis
by polyoma virus, Proc. Natl. Acad. Sci. U.S., 53, 403—410 (1965).
200. Dulbecco R., Vogt M., Some problems of animal virology as studied by the pla-
que technique, Cold Spring Harbor Symposia Quant. Biol., 18, 273—279 (1953).
201. Dulbecco R., Vogt M., Study of the mutability of d lines of polioviruses, Viro-
logy, 5, 220—235 (1958).
202. Dulbecco R., Vogt M., Significance of continued virus production in tissue cul-
tures rendered neoplastic by polyoma virus, Proc. Natl. Acad. Sci. U.S., 46, 1617—
1623 (1960).
203. Dulbecco R., Vogt M., Evidence for a ring structure of polyoma virus DNA,
Proc. Natl. Acad. Sci. U.S., 50, 236—243 (1963).
204. Dulbecco R., Vogt M., Strickland A. G. R., A study of the basic aspects of
neutralization of two animal viruses, Western equine encephalitis virus and polio-
myelitis virus, Virology, 2, 162—205 (1956).
205. Eagle FL, Metabolic studies with normal and malignant human cells in culture,
Harvey Lectures, 54, 156—175 (I960).
206. Eagle H., Metabolic controls in cultured mammalian cells, Science, 148, 42—51 (1965).
207. Easterbrook К- B., Interference with the maturation of vaccinia virus by isatin
0-thiosemicarbazone, Virology, 17, 24’5—251 (1962).
208. Edgar R. S., The bacteriophage chromosome, Natl. Cancer Inst. Monograph, 18,
67—77 (1965).
209. Edgar R. S., Wood W. B., Morphogenesis of bacteriophage T4 in extracts of mu-
tant-infected cells, Proc. Natl. Acad. Sci. U.S., 55, 498—505 (1966).
210. E garni R., Takahashi K-, Uchida T., Ribonucleases in Taka-diastase: Proper-
ties, chemical nature and applications, Prog. Nucleic Acid Res., 3, 59—103 (1964).
211. E i g n e r J., S t о u t h a m e r A. H., van der S h u p L, С о h e n J. A., A study of the
70S component of bacteriophage cpX174, J. Mol. BioL, 6, 61—84 (1963).
212. Eisen H. A., Fuerst C. R.r S imino vitch L., Thomas R., Lambert L.,
Pereira Da Silva L., Jacob F., Genetics and physiology of defective lysogeny
in E. coli K12 (X): Studies of early mutants, Virology, 30, 224—241 (1966).
213. Elford W. J., The sizes of virus and bacteriophages and methods for their deter-
mination. In: (eds. R. Doerr and С. H a 11 a u e r) Handbuch der Virusforschung.
Wien, Springer, 1938.
214. Ellerman V BangO., Experimentelle Leukamie bei Huhnern, Zentr. Bakt. Pa-
rasit. Abt. 1, Orig., 46, 595—609 (1908).
215. Ellis E. L., De lb ruck M., The growth of bacteriophage, J. Gen. Physiol., 22,
365—384 (1939).
216. Enders J. F., Weller T. FL, Robbins F. C., Cultivatoin of the Lansing strain
of poliomyelitis virus in cultures of various human embryonic tissues, Science, 109,
85—87 (1949).
25 Заказ № 1214
386
Литература
217. Ephrussi В., Hottinguer Н., On an unstable cell state in yeast, Cold Spring
Harbor Symposia Quant. Biol., 16, 715—85 (1951).
218. Ephrussi B., Temin H. M., Infection of chick iris epithelium with the Rous sar-
coma virus in vitro, Virology, 11, 547—552 (1960).
219. Epstein R. H., Bolle A., Steinberg С. M., Kellenberger E., Boy de
la Tour E., Cheval ley R., Edgar R. S., Susman M., Denhardt G. H.,
L i e 1 a u s i s A., Physiological studies of conditional lethal mutants of bacteriopha-
ge T4D, Cold Spring Harbor Symposia Quant. Biol., 28, 375—394 (1963).
220. Eron L. J., McAuslan B. R., The nature of poxvirus-induced deoxyribonucleases,
Biochem. Biophys. Res. Cofnmun., 22, 518—-523 (1966).
221. Esau K-, An anatomist’s view of virus diseases, Amer. J. Bot., 43, 739—748
(1956).
222. Farkas G. L., К i r a 1 у Z., S a 1 у m о s z F., Role of oxidative metabolism in the
localization of plant viruses, Virology, 12, 408, 1960 (1960).
223. Fazekas de St. Groth S., Watson G. S., Reid A. F., The neutralization of
animal viruses. I. A model of virus-antibody interaction. II. A critical comparison of
hypotheses, J. Immunol., 80, 215—224 and 225—236 (1958).
224. Fenner F., Conditional lethal mutants in the study of the genetics of animal viru-
ses. In: Perspectives in Virology, Vol. IV (ed. M. Pollard), Hoeber New York,
pp. 34—45 (1965).
225. Fenwick M. L., Cooper P. D., Early interactions between-poliovirus and ERK
cells: Some observations on the nature and significance of the rejected particles, Vi-
rology, 18, 212 -223 (1962).
226. Fiers W., Sinsheim er R. L., The structure of the DNA of bacteriophage <pX174,
J. Mol. Biol., 5, 408—434 (1962).
227. Finch J. T., К lug’A., Arrangement of protein subunits and the distribution of
nucleic acid in turnip yellow mosaic virus. II. Electron microscopic studies, J. Mol.
Biol., 15, 344—364 (1966).
228. F i s c h e r-F a n t u z z i L., С a 1 e f E., A type of X prophage unable to confer immu-
nity, Virology, 23, 209—216 (1964).
229. Fraenkel-Conrat H., Singer B., Williams R. C., Infectivity of viral
nucleic acid, Biochim. Biophys. Acta, 25, 87—4)6 (1957).
230. F r a e n к e 1-C о n r a t H., Williams R. C., Reconstitution of active tobacco mosaic
virus from its inactive protein and nucleic acid components, Proc. Natl. Acad. Sci.
U.S., 41, 690—698 (1955).
231. Francis T. Jr., Vaccination against influenza, Bull. World Health Organiz., 8,
725 (1953).
232. Francis T., Jr., On the doctrine of the original antigenic sin, Proc. Am. Philosoph.
Soc., 104, 572—578 (1960).
233. Francis T., Jr., et al, Evaluation of the 1954 field trial of poliomyelitis vaccine
(final report), University of Michigan, Poliomyelitis Vaccine Evaluation Center,
1957.
234. Frankel F. R., Studies on the nature of replicating DNA in T4-infected Escherichia
coli, J. Mol. Biol., 18, 127—143 (1966).
235. Franklin N. C., Dove W. F., Y a n о f s к у C., The linear insertion of a prophage
into the chromosome of E. coli shown by deletion mapping, Biochem. Biophys. Res.
Commun., 18, 910—923 (1965).
236. Franklin R. E., К 1 u g A., Holmes К. C., The structure and morphology of to-
bacco mosaic virus. In: The Nature of Viruses (eds. G. E. W. Wolstenholme and
E. С. P. Millar), Churchill, London, 1957.
237. Franklin R. M., Baltimore D., Patterns of macromolecular synthesis in normal
and virus-infected mammalian cells, Cold Spring Harbor Symposia Quant. Biol., 27,
175—198 (1962).
238. Franklin R. M., Breitenfeld P. M., The abortive infection of L-cells by fowl
plague virus, Virology, 8, 293—307 (1959).
239. Franklin R. M., Rosner J., Localization of RNA synthesis in Mengovirus in-
fected L cells, Biochim. Biophys. Acta, 55, 240—241 (1962).
240. Franklin R. M., Rubin H., Davis C. A., The production, purification, and pro-
perties of Newcastle disease virus labeled with radiophosphorus, Virology, 3, 96—114
(1957).
241. Franklin R. M., We ске r E., Henri C., Some properties of an infectious ribo-
nucleic acid from mouse encephalomyelitis virus (Appendix), Virology, 7, 220—235
(1959).
242. Fraser D. K-, Host range mutants and semitemperate mutants of bacteriophage T3,
Virology, 3, 527—553 (1957).
243. Fredericq P., Colicins, Ann. Rev. Microbiol., 11, 7—22 (1957).
244. Freeman V. J., Studies on the virulence of bacteriophage-infected strains of Cory-
nebacterium diptheriae, J. Bacteriol., 61, 675—688 (1951).
245. Freese E., The difference between spontaneous and base-analogue induced muta-
tions of phage T4, Proc. Natl. Acad. Sci. U.S., 45, 622—633 (1959).
Литература
387
246. Freese Е., The molecular mechanism of mutations. In: Proceedings of the 6th In-
tern. Congr. Biochemistry, Moscow, Vol. I (ed. V. A. Engelhardt), Oxford, Pergamon
Press, pp. 204—229 (1961). (См. Труды V-го Международного биохимического
конгресса, 10—16 августа 1961 г., изд-во АН СССР, 1962—1963.)
247. Freifelder D., Mechanism of inactivation of coliphage T7 by X-rays, Proc. Natl.
Acad. Sci. U.S., 54, 128—134 (1965).
248. Freifelder D., Effect of NaC104 on bacteriophage: release of DNA and evidence
for population heterogeneity. Virology, 28, 740—748 (1966).
249. Freitag J. H., Interaction and mutual suppression among three strains of aster
yellows virus, Virology, 24, 401—413 (1964).
250. F u d e n b e г g H. H., The immune globulins, Ann. Rev. Microbiol., 19, 301—338
(1965).
251. Fujinaga K-, Green M., The mechanism of viral carcinogenesis by DNA mam-
malian viruses: viral-specific RNA in polyribosomes of adenovirus tumor and transfor-
med cells, Proc. Natl. Acad. Sci. U.S., 55, H567—1574 (1966).
252. Fu rumo t о W. A., W i I dm a n S. G., Studies on the mode of attachment of tobacco
mosaic virus, Virology, 20, 415—52 (1963).
253. Gall J., M i j u k a m i I., Centriole replication in the water fern Marsilea, J. Cell.
Biol., 19, 26A (1963).
254. Gard S., Purification of poliomyelitis viruses, Experiments on murine and human
strains, Acta Medica Scand., Suppl., 143 (1943).
265. Gard S., Chemical inactivation of viruses. In: The Nature of Viruses (eds.
G. E. W. Wolstenholme and E. С. P. Millar), Ciba Fndn. Symp., London, Churchill,
pp. 123—141 (1956).
256. Garen A., Physiological effects of rll mutations in bacteriophage T4, Virology, 14,
151 — 163 (1961).
257. Garen A., Zinder N. D., Radiological evidence for partial genetic homology bet-
ween bacteriophage and host bacteria, Virology, 1, 347—376 (1955).
258. GeiduschekE. P., Snyder L., С о 1 v i 11 A. J. E., S a r n a t M., Selective synthe-
sis of T-even bacteriophage early messenger in vitro, J. Mol. Biol., 91, 541—547
(1966).
259. Geiduschek E. P., Tocchin i-V a 1 e n t i n i G. P., S a r n a t M. T., Asymmetric
synthesis of RNA in vitro: dependence on DNA continuity and conformation, Proc.
Natl. Acad. Sci. U.S., 52, 486—493 (1964).
260. G e m m e 1 A., Cairns J. F., Linkage in the genome of an animal virus, Virology, 8,
381—383 (1959).
261. Gemmel A., Fenner F., Genetic studies with mammalian poxviruses. III. Whi-
te (u) mutants of rabbitpox virus, Virology, 11, 219—235 (1960).
262. Gerber P., Studies on the transfer of subviral infectivity from SV40-induced hamster
tumor cells to indicator cells, Virology, 28, 501—509 (1966).
263. Gey G. O., Coffman W. D., К u b i с e k M. T., Tissue culture studies of the proli-
ferative capacity of cervical carcinoma and normal epithelium, Cancer Res., 12,
264—265 (1952).
264. Gibor A., Chloroplast heredity and nucleic acids, Arm Natural., 99, 229—239
(1965).
265. Gibor A., Granick S., Plastids and mitochondria: Inheritable systems, Science,
145, 890—897 (1964).
266. Gibson L, The replication of metagons and mu particles from Paramecium in
another cell — Didinium. Genet. Res. (Cambr.), 6, 398—410 (1965).
267. Gibson L, Beale G. H., Infection into paramecia of metagons derived from other
make-killer paramecia, Genet. Res., 5, 85—106 (1964).
268. Gibson I., Sonneborn T. M., Is the metagon an m-RNA in Paramecium and
a virus in Didinium? Proc. Natl. Acad. Sci. U. S., 52, 869—876 (1964).
269. Gierer A., Grosse und Struktur der Ribonucleinsaure des Tabakmosaikvirus, Z. Na-
turforsch., 13b, 477—484 (1958).
270. Gierer A., Resent investigations on mosaic tobacco virus, Progress in Biophysics, 10,
299-342 (1960).
271. Gierer A., Function of aggregated reticulocyte ribosomes in protein synthesis,
J. Mol. Biol., 6, 148—157 (1963).
272. Gierer A., Schramm G., Infectivity of ribonucleic acid from tobacco mosaic vi-
rus, Nature, 177, 702—703 (1956).
273. Gilbert W., Polypeptide synthesis in E. coli, J. Mol. Biol., 6, 374—403 (1963).
274. Ginsberg H. S., Dixon M. K-, Deoxyribonucleic acid (DNA) and protein altera-
tions in HeLa cells infected with type 4 adenovirus, J. Exp. Med., 109, 407—422
(1959).
275. Ginsberg H. S., Pereira H. G., Valentine R. C., Wilcox W. C., A propo-
sed terminology for the adenovirus antigens and virion morphological subunits, Vi-
rology, 28, 782—783 (1966).
276. Girard M., Latham H., Penman S., Darnell J. E., Entrance of newly for-
med mRNA and ribosomes into HeLa cell cytoplasm, J. Mol. Biol.. 11, 187—201 (1966).
25*
388
Литература
277 Girardi A. J., McMichael H., Henle W., The use of HeLa cells in suspen-
sion for the quantitative study of virus propagation, Virology, 2, 532—544 (1956).
278. G 1 a s s t о n e S. K-, L a i d 1 e r K. L., E у r i n g FL, The Theory of Rate Processes,
McGraw-Hill Book Co., New York, 1941.
279. Gold M., Hurwitz J., The enzymatic methylation of nucleic acids, Cold Spring
Harbor Symposia Quant. Biol., 28, 149—156 (1963).
280. Goldberg E. B., The amount of DNA between genetic markers in phage T4, Proc.
Natl. Acad. Sci. U.S., 56, 1457—1463 (1966).
281. Goma to s P. J., Tamm I., The secondary structure of reovirus RNA, Proc. Natl.
Acad. Sci. U.S., 49, 707—714 (1962).
282. Gomatos P. J., Tamm I., Animal and plant viruses with double helical RNA
Proc. Natl. Acad. Sci. U.S., 50, 878—885 (1963).
283. Gomatos P. J., T a mm I., Dales S., Franklin R. M., Reovirus Type 3: Physi-
cal characteristics and interaction with L cells, Virology, 17, 441—454 (1962).
284. Good R. A., Kelly W. D., R о t s t e i n J., V а г с о R. L., Immunological deficiency
diseases, Progress in Allergy, 6, 234—237 (1962).
285. Goodner K-, Collodion fixation: a new immunological reaction, Science, 94,
241—242 (1941).
286. G о r t e r E., G r e n d e 1 F., On bimolecular layers of lipoids on the chromocytes of
the blood, J. Exp. Med., 41, 439—443 (1925).
287. Gottschalk A., Chemistry of Virus Receptors. In: The Viruses, Vol. Ill (eds.
F. M. Burnet and W. M. Stanley), Academic Press, New York, pp. 51—61, 1959.
288. Grace T. D. C., The development of a cytoplasmic polyhedrosis in insect cells grown
in vitro, Virology, 18, 33—42 (1962).
289. Graham A. F., The fate of the infecting phage particle, Ann. Inst. Pasteur, 84,
90—98 (1953).
290. G r a n о f f A., Heterozygosis and phenotypic mixing with Newcastle disease virus,
Cold Spring Harbor Symposia Quant. Biol., 27, 319—326 (1962).
291. G r a t i a A., Des relations numeriques entre bacteries lysogenes et particules de bacte-
riophage, Ann. Inst. Pasteur, 57, 652—694 (1936).
292. Green D. M., Krieg D. R., The delayed origin of mutants induced by exposure of
extracellular phage T4 to ethyl methane sulfonate, Proc. Natl. Acad. Sci. U. S., 47,
64—72 (1961).
293. Green M., Studies on the biosynthesis of viral DNA, Cold Spring Harbor Symposia
Quant. Biol., 27, 219—2315 (1962).
294. Green M., Biosynthetic modification induced by DNA animal viruses, Ann. Rev.
Microbiol., 20, 189—222 (1966).
295. Green M., Lacy S., Adenovirus multiplication: Genetic relatedness of tumorigenic
human adenovirus types 7, 12, and 18, Science, 150, 1296—1298 (1965).
296. Green M. H., Strand selective transcription of T4 DNA in vitro, Proc. Natl. Acad.
Sci. U.S., 52, 1388—1395 (1964).
297. Green R. G., On the nature of filterable viruses, Science, 82, 443—445 (1935).
298. Greene H. S. N., Heterologous transplantation of mammalian tumors, J. Exp. Med.,
73, 475—486 (1941).
299. G r e e n s t e i n J. P., Biochemistry of Cancer, Academic Press, New York, 1947.
300. Grom an N. B., The relation of bacteriophage to human disease: A review' of con-
version to toxigenicity in Corynebacterium diphtheriae. In: Immunity and Virus In-
fection (ed. V. A. Najjar), John Wiley and Sons, New York, pp. 196—205
(1959).
301. G r u n e г t R. R., D a v i e s W. L., M c G a h e n J. W., H о f f m a n С. E., Y a t e s R. A.,
The antiviral activity of labile carbamyl compounds and cyanate against the pseudo-
rabies virus in vivo, J. Infectious Diseases, 116, 346—352 (1966).
302. Gurdon J. B., Nuclear transplantation in Amphibia and the importance of stable
nuclear changes in promoting cellular differentiation, Quart. Rev. BioL, 38, 54—78
(1963).
303. Guthrie G. D., S i n s h e i m e r R. L., Infection of protoplasts of Escherichia coli
by subviral particles of bacteriophage фХ174, J. Mol. Biol., 2, 297—305 (1960).
304. H a b e 1 K-, Immunological determinants of polyoma virus oncogenesis, J. Exp. Med.,
115, 181 — 193 (1962).
305. Hall B. D., Nygaard A. P., Green M. H., Control of T2-specific RNA synthesis,
J. Mol. BioL, 9, 143—Г53 (1964).
306 Hall B. D., S p i e g e 1 m a n S., Sequence complementarity of T2-DNA and T2-spe-
cific RNA, Proc. Natl. Acad. Sci. U.S., 47, 137—146 (1961).
307. Hamada C., Kaplan A. S., Kinetics of synthesis of various types of antigenic
proteins in cells infected with pseudorabies virus. J. Bacteriol., 89, 1328—1334 (1965).
308. H a m e r s-C a s t e r m a n C., J e e n e r R., An initial ribonuclease-sensitive phase in
the multiplication of tobacco mosaic virus, Virology, 3, 197—206 (1957).
Ю9. Hamre D., Bernstein J., Donovick R., Activity of p-aminobenzaldehyde
3-thiosemicarbazone on vaccinia virus in the chick embryo and in the mouse, Proc,
Soc Exptl. Bjol. Mod. 73, 275-278 (1950)
Литература
389
310. Hanafusa Н., Factors involved in the initiation of multiplication of vaccinia vi-
rus, Cold Spring Harbor Symposia Quant Biol., 27, 209—217 (1962).
311. Hanafusa H., Hanafusa T., Rubin H., The defectivenes of Rous sarcoma
virus, Proc. Natl. Acad. Sci. U.S., 49, 572—580 (1963).
312. Hanafusa H., Hanafusa T., Rubin H., Analysis of the defectiveness of Rous
sarcoma virus, II. Specification of RSV antigenicity by helper virus, Proc. Natl. Acad.
Sci. U.S., 51, 41-M8 (1964).
313. Harm W., Repair of lethal ultraviolet damage in phage DNA. In: Repair from gene-
tic radiation damage and differential radiosensitivity in germ cells (ed. F. H. S o-
bels), Pergamon Press, New York, pp. 107—124 (1963).
314. Harm W., Mutants of phage T4 with increased sensitivity to ultraviolet, Virology,
19, 66—71 (1963).
315. Harm W., Hillebrandt B., A non-photoreactivable mutant of E. coli B, Photoch.
and Photobiol., 1, 271—272 (1962).
316. Harriman P. D., Stent G. S., The effect of radiophosphorus decay on cistron
function in bacteriophage T4. I. Long-range and short-range hits, J. Mol. Biol., 10,
488—507 (1964).
317. H a r r i s J. I., H i n d 1 e у J., The protein subunit of turnip yellow mosaic virus,
J. Mol. Biol., 3, 117—120 (1961).
318. Harris J. I., Knight C. A., Action of carboxypeptidase on tobacco mosaic virus,
Nature, 170, 613—614 (1952).
319. Hart R. G., Electron-microscopic evidence for the location of ribonucleic acid in the
particles of tobacco mosaic virus, Proc. Natl. Acad. Sci. U. S., 41, 261—264
(1955).
320. Hart R. G., P e r e z-M e n d e z G. E., A simple nonparametric method for evaluating
the results of half-leaf local lesion assays, Virology, 4, 130—134 (19157).
321. Hartman P. E., G о о d g a 1 S. H., Bacterial genetics (with particular reference to
genetic transfer), Ann. Rev. Microbiol., 13, 465—504 (1959).
322. Haruna I., Spiegelman S., Recognition of size and sequence by an RNA repli-
case, Proc. Natl. Acad. Sci. U.S., 54, 1189—1193 (1965).
323. Haruna I., Spiegelman S., Specific template requirements of RNA replicases,
Proc. Natl. Acad. Sci. U.S., 54, 579—587 (1965).
324. Hattman S., Fukasawa T., Host-induced modification of T-even phages due to
defective glucosylation of their DNA, Proc. Natl. Acad. Sci. U. S., 50, 297—300
(1963).
325. Havens W. P., Jr., Properties of the etiologic agent of infectious hepatitis, Proc.
Soc. Exptl. Biol. Med., 58, 203—204 (1945).
326. Hayashi M., Hayashi M. N., Spiegelman S., DNA circularity and the
mechanism of strand selection in the generation of genetic messages, Proc. Natl. Acad.
Sci. U.S., 51, 351—359 (1964).
327. Hay flick L., Decontaminating tissue cultures infected with pleuropneumonia-like
organisms, Nature, 185, 784 (1960).
328. Henle G., Henle W., Studies on the toxicity of influenza viruses, J. Exp. Med., 84,
623—660 (1946).
329. Henle W., Henle G., The effect of ultraviolet irradiation on various properties of
influenza viruses, J. Exp. Med., 85, 347—364 (1947).
330. H e n г у C., Y о u n g n e r J. S., Studies on the structure and replication of the nucleic
acid of poliovirus, Virology, 21, 162—173 (1963).
331. H e p p e 1 L. A., H i 1 m о e R. J., Spleen and intestinal phosphodiesterases. In: Methods
in Enzymology, Vol. II (eds. S. P. Colowick and N. Kaplan), Academic Press, New
York, p. 565, 1955.
332. D’H ё r e 11 e F., Sur un microbe invisible antagoniste des bacilles dysenteriques, C. r.
acad. sci., 165, 373—375 (1917).
333. Herriott R. M., Nucleic-acid-free T2 virus «ghosts» with specific biological action,
J. Bacteriol., 61, 752—754 (1951).
334. Herriott R. M., Barlow J. L., Preparation, purification, and properties of E. co-
li virus T2, J. Gen. Physiol., 36, 17—18 (1952).
335. Hershey A. D., Spontaneous mutations in bacterial viruses, Cold Spring Harbor
Symposia Quant. Biol., 11, 67—77 (1946).
336. Hershey A. D., Nucleic acid economy in bacteria infected with bacteriophage T2.
II. Phage precursor nucleic acid, J. Gen. Physiol., 37, 1—23 (1953).
337. Hershey A. D., Some minor components of bacteriophage T2 particles, Virolo-
gy, 4, 237—264 (1957).
338. Hershey A. D., The production of recombinants in phage crosses, Cold Spring Har-
bor Symposia Quant. Biol., 23, 19—46 (1958).
339. Hershey A. D., В u r g i E., Ingraham L., Sedimentation coefficient and fra-
gility under hydro-dynamic shear, as measures of molecular weight of the DNA of
phage T5, Biophys. J., 2, 423—431 (1962).
340. Hershey A. D., В u r g i E., Ingraham L., Cohesion of DNA molecules isolated
from phage lambda, Proc. Natl. Acad. Sci. U.S., 49, 748—755 (1963).
26 Заказ № 1214
390
Литература
341. Hershey A. D., Chase M., Genetic recombination and heterozygosis in bacte-
riophages, Cold Spring Harbor Symposia Quant BioL, 16, 471—479 (1951).
342. Hershey A. D., Chase M., Independent functions of viral protein and nucleic acid
in growth of bacteriophage, J. Gen. Physiol., 36, 39—56 (1952).
343. Hershey A. D., Kamen M. D., Kennedy J. W., Gest H., The mortality of
bacteriophage containing assimilated radioactive phosphorus, J. Gen. Physiol., 34^
305—319 (1951).
344. Hershey A. D., Rotman R., Linkage among genes controlling inhibition of lysis
in a bacterial virus, Proc. Natl. Acad. Sci. U.S., 34, 89—96 (1948).
345. Hershey A. D., Rotman R., Genetic recombination between host-range and pla-
que-type mutants of bacteriophage in single bacterial cells, Genetics, 34, 44—71
(1949).
346. Hertel K-, Gene function of heterozygotes in phage T4, Z. Vererbungslehre, 96, 105
(1965).
347. Herzenberg L. A., Herzenberg L. A., Association of H-2 antigens with the
cell membrane fraction of mouse liver, Proc. Natl. Acad. Sci. U. S., 47, 762—766
(1961).
348. Hewitt W. B., Raski D. J., Goheen A. C., Nematode vector of soil borne fan-
leaf virus of grapevines, Phytopath., 48, 586—595 (1958).
349. Hirst G. K., The agglutination of red blood cells by allantoic fluid of chick embryos
infected with influenza virus, Science, 94, 22—23 (1941).
350. Hirst G. K-, Adsorption of influenza hemagglutinins and virus by red blood cells,
J. Exp. Med., 76, 195—209 (1942).
351. Hirst G. K-, Receptor destruction by viruses of the mumps-NDV-influenza group,
J. Exp. Med., 91, 161—175 (1950).
352. Hirst G. K-, Genetic recombination with Newcastle disease virus, polioviruses and
influenza, Cold Spring Harbor Symposia Quant. Biol., 27, 303—309 (1962).
353. H о f f m a n-B e r 1 i n g H., Maze R., Release of male-specific bacteriophages from
surviving host bacteria, Virology, 22, 305—313 (1964).
354. Holland J. J., Altered base rations in HeLa cell RNA during poliovirus infection,
Biochem. Biophys. Res. Commun., 6, 196—200 (1961).
355. Holland J. J., Receptor affinities as major determinants of enterovirus tissue tro-
pisms in humans, Virology, 15, 312—326 (1961).
356. Holland J. J., Depression of host-controlled RNA synthesis in human cells during
poliovirus infection, Proc. Natl. Acad. Sci. U.S., 49, 23—27 (1963).
357. Holland J. J., Hoyer В. H., Early stages of enterovirus infection, Cold Spring’
Harbor Symposia Quant. Biol., 27, 101—112 (1962).
358. Holland J. J., McLaren L. C., The location and nature of enterovirus receptors-
in susceptible cells, J. Exp. Med., 114, 161—171 (1961).
359. Holland J. J., McLaren L. C., S у v e r t о n J. T., The mammalian cell-virus re-
lationship. IV. Infection of naturally insusceptible cells with enterovirus ribonucleic
acid, J. Exp. Med., 110, 65r-80 (1959).
360. Holley R. W., Apgar J., Everett G. A., Madison J. T., Marquisee M.,
Merrill S. H., P e n s w i с к J. R., Zamir A., Structure of a ribonucleic acid'
Science, 147, 1462—1465 (1965).
361. Ho Hings M., Viruses associated with a die-back disease of cultivated mushroom^
Nature, 196, 962—965 (1962).
362. Holmes F. O., Local lesions in tobacco mosaic, Bot. Gaz., 87, 39—55 (1929).
363. Holmes F. O., Local lesions of mosaic in Nicotiana tobacum L., Contrib. Boyce
Thompson Inst., 3, 163—172 (1931).
364. Holmes F. O., A masked strain of tobacco-mosaic virus, Phytopath., 24, 845—873
(1934).
365. Holmes F. O., Inheritance of resistance to tobacco-mosaic disease in the pepper,
Phytopath., 27, 637—642 (1937).
366. Holmes F. O., Order Virales: The filterable viruses. In: Bergey’s Manual of Deter-
minative Bacteriology, 6th ed., Williams and Wilkins, Baltimore, 1948.
367. Holubek V., The composition of tobacco mosaic virus protein after the incorpora-
tion of 5-fluorouracil into the virus, J. Mol. Biol., 6, 164—166 (1963).
368. Horiuchi K-, Lodish H. F., Zin de r N. D., Mutants of the bacteriophage f2.
VI. Homology of temperature-sensitive and host-dependent mutants, Virology, 28,
438—447 (1966).
369. Horne R. W., Brenner S., W a t e r s о n A. P., W i 1 d у P., The icosahedral form
of an adenovirus, J. Mol. Biol., 1, 84—86 (1959).
370. Horowitz N. H., On the evolution of biochemical synthesis, Proc. Natl. Acad. Sci.
U.S., 31, 153—157 (1945).
371. Hotchin J., The biology of lymphocytic choriomeningitis infection: Virus-induced
immune disease, Cold Spring Harbor Symposia Quant. Biol., 27, 479—499 (1962).
372. Howard B. D., T e s s m a n I., Identification of the altered bases in mutated single-
stranded DNA II. In vivo mutagenesis by 5-bromodeoxyuridine and 2-aminopurine..
J. Mol. Biol., 9, 364—371 (1964).
Литература
391
373. Howard В. D., Tessman I., Identification of the altered bases in mutated single-
stranded DNA. III. Mutagenesis by ultraviolet light, J. Mol. Biol., 9, 372—375
(19614).
374. Howatson A. F., Whitmore G. F., The development and structure of vesicular
stomatitis virus, Virology, 16, 466—478 (1962).
375. Howes D. W,. The growth cycle of poliovirus in cultured cells. II. Maturation and
release of virus in suspended cell populations, Virology, 9, 96—109 (1909).
376. Hoyle L. Structure of the influenza virus, J. Hygiene, 50, 229—245 (1952).
377. Hoyle L., The release of influenza virus from the infected cell, J. Hygiene, 52е,
180-188 (1954).
378. Hoyle L., The entry of myxoviruses into the cell, Cold Spring Harbor Symposia
Quant. Biol., 27, 113—121 (1962).
379. Huang A. S., Greenawalt J. W., Wagner R. R., Defective T particles of vesi-
cular stomatitis virus. I. Preparation, morphology, and some biological properties, Vi-
rology, 30, 161—172 (1966).
380. Huebner R. J. et al., Viruses in search of disease. Spec, publication, N. Y. Acad-
Sci., 67, 209-446 (1956).
381. Huebner R. J., Pereira H. G., Allison A. C., Hollinshead A. C., Tur-
ner H. C., Production of type-specific C antigen in virus-free hamster tumor cells in-
duced by adenovirus type 12, Proc. Natl. Acad. Sci. U.S., 51, 432—439 (1964).
382. Huebner R. J., R о w e W. P., Turner H. C., Lane W. T., Specific adenovirus
complement fixing antigens in virus free hamster and rat tumors, Proc. Natl. Acad
Sci. U.S., 50, 379—389 (1963).
383. Hughes К. M., Development of the inclusion bodies of a granulosis virus, J. Bacte-
riol., 64, 375-^380 (1952).
384. Hurlburt H. S., Thomas J. I., The experimental host range of the arthropod-
borne animal viruses in arthropods, Virology, 12, 391—407 (1960).
385. Hurwitz J., Bresler A., Diringer R., The emzymic incorporation of ribo-
nucleotides into polyribonucleotides and the effect of DNA, Biochem. Biophys. Res.
Commun., 3, 15—19 (1960).
386. Hutchinson F., Use of charged particles to measure skin thickness and other sur-
face properties, Ann. N. Y. Acad. Sci., 59, 494—502 (1965).
387. Ikeda H., Tomizawa J., Transducing fragments in generalized transduction by
phage Pl., J. Mol. Biol., 14, 85—129 (1965).
388. Ingram V. M., Abnormal human haemoglobins. I. The comparison of normal hu-
man and sickle-cell haemoglobins by «fingerprinting», Biochim. Biophys. Acta, 28,.
539—545 (1958).
389. Isaacs A., Interferon, Adv. Virus Res., 10, 1—38 (1963).
390. Isaacs A., Baron S., Antiviral action of interferon in embryonic cells, Lancet, 2,.
946-947 (1960).
391. Isaacs A., Lindenmann J., Virus interference: I. The interferon. II. Some pro-
perties of interferon, Proc. Royal Soc. London, 147B, 258—267; 268—273 (1957).
392. I s a c s о n P., Koch A. E., Association of host antigens with a parainfluenza virus,
Virology, 27, 129—138 (1965).
393. Iseki S., Sakai T., Artificial transformation of О antigens in Salmonella E group.
I. Transformation by antiserum and bacterial autolysate, Proc. Japan Acad., 29,.
121 — 126 (1953).
394. Ishii S., Nishi Y.. E garni F., The fine structure of a pyocin, J. Mol. Biol., 13,
428—431 (1965).
395. I v a n о v i c s G., A 1 f б 1 d i L., Nagy E., Mode of action of megacin, J. Gen. Micro-
biol., 21, 51—60 (1959).
396. Ивановский Д., Uber die Mosaikkrankheit der Tabakspflanze, Z. Pflanzenkr., 13,.
1—41 (1903).
397. Jacob F., Brenner S., C u z i n F., On the regulation of DNA replication in bacte-
ria, Cold Spring Harbor Symposia Quant. Biol., 28, 329—348 (1963).
398. Jacob F., Campbell A., Sur le systeme de repression assurant I’immunite chez.
les bacteries lysogenes, C. r. acad. sci., 248, 3219—3221 (1959).
399. Jacob F., F u e r s t C. R., W о 11 m a n E. L., Recherches sur les bacteries lysogenes
defectives, Ann. Inst. Pasteur, 93, 724—753 (1957).
400. Jacob F., Mo nod J., Genetic regulatory mechanisms in the synthesis of proteins,
J. Mol. Biol., 3, 318—356 (1961).
401. Jacob F., Siminovitch L., W о 11 m a n E. L., Sur la biosynthes*» d'une ^olicine
et sur son mode d’action, Ann. Inst. Pasteur, 83, 295—315 (1952)
402. J a co b F. W о 11 m a n E. L., Sexuality and the genetics of bacteria, Асааенис Press,
New York, 1961. (Ф. Жакоб, Э. Вольман, Пол и генетика бактерий, ИЛ, М.,
1962.)
403. J е е n е г R., Biological effects of the incorporation of thiouracil into the ribonucleic
acid of tobacco mosaic virus, Biochim. Biophys. Acta, 23, 351—361 (1957).
404. J e e n e r R., Effects on the antigenic determinants of tobacco mosaic virus of a small
number of base replacements in the ribonucleic acid, Virology, 26. 10—15 (1965).
26*
392
Литература
405. Jenner Е.» An inquiry into the causes and effects of the variolae vaccina, a disease
discovered in some of the western counties of England, particularly Gloucestershire,
and known by the name of cowpox, Reprinted by Cassell and Co., Ltd., 1896. Available
in pamphlet vol. 4232, Army Medical Library, Washington, D. C., 1798.
406. Jensen D. D., A plant virus lethal to its insect vector, Virology, 8, 164—175
(1959).
407. J e r n e N. K-, The presence in normal serum of specific antibody against bacteriopha-
ge T4 and its increase during the earliest stages of immunization, J. Immunol., 76,
209—216 (1956).
408. Jerne N. K-, Ave g no P., The development of the phage-inactivating properties of
serum during the course of specific immunization of an animal: reversible and irre-
versible inactivation, J. Immunol., 76, 200—206 (19156).
409. Jerne N. K„ S к о v s t e d L. S., The rate of inactivation of bacteriophage T4R in
specific, anti-serum. L Salt effect. II. Cofactor, Ann. Inst. Pasteur, 84, 73—89
(1953).
410. Johnson F., Transmission of plant viruses by dodder, Phytopath., 31, 649—656
(1941).
411. Johnson M. W., Markham R., Nature of the polyamine in plant viruses, Viro-
logy, 17, 276—281 (1962).
412. Joklik W. K-, The multiplication of poxvirus DNA, Cold Spring Harbor Symposia
Quant. Biol., 27, 199—208 (1962).
413. Joklik W. K-, Some properties of poxvirus DNA, J. Mol. Biol., 5, 265—274
(1962).
414. Joklik W. K., The purification of four strains of poxvirus, Virology, 18, 9—18
(1962).
415. Joklik W. K-, The poxviruses, Bacteriol. Rev., 30, 33—66 (1966).
416. Joklik W. K-, Becker Y., The replication and coating of vaccinia DNA, J. Mol.
Biol., 10, 452—474 (1964).
417. Joklik W. K-, Be.cker Y., Studies on the genesis of polyribosomes. II. The asso-
ciation of nascent mRNA with the 40S subribosomal particles, J. Mol. Biol., 13, 511—
520 (1965).
418. Joklik W. K-, Darnell J. E., The adsorption and early fate of purified poliovirus
in HeLa cells, Virology, 13, 439—447 (1961).
419. J о к 1 i к W. K-, Holmes I. H., Briggs M., The reactivation of poxviruses. II. Pro-
perties of the reactivable particles, Virology, 11, 202—218 (1960).
420. Joklik W. K-, Woodroofe G. M., Holmes I. H., Fenner F., The reactivation
of poxviruses. I. Demonstration of the phenomenon and techniques of assay, Virology,
11, 168—184 (1960).
421. Josse J.-, Kaiser A. D., Kornberg A., Enzymatic synthesis of DNA. VIII. Fre-
quencies of nearest neighbor base sequences in deoxyribonucleic acid, J. Biol. Chem.,
236, 864—875 (1961).
422. Jungwirth C., Joklik Wr. K-, Studies on «early» enzymes in HeLa cells infected
with vaccinia virus, Virology, 27, 80—93 (1965).
423. Kabat E., Experimental Immunochemistry, Thomas, Springfield, Illinois, 1961.
424. К A d о С. I., К n i g h t C. A., Location of a local lesion gene in tobacco mosaic virus
RNA, Proc. Natl.-Acad. Sci. U.S., 55, 1276—1283 (1966).
425. Kaiser A. D., Mutations in a temperate bacteriophage affecting its ability to lyso-
gemsze Escherichia coli, Virology, 3, 42—61 (1957).
426. Kaiser A. D., On the internal structure of bacteriophage lambda, J. Gen. Physiol.,
49 (№ 6, part 2), 171—178 (1966).
427. Kaiser A. D., H о g n e s s D. S., The transformation of Escherichia coli with deoxy-
ribonucleic acid isolated from bacteriophage Xdg, J. Mol. Biol., 2, 392—415
(1960).
428. К a i s e r A. D., Inman R. B., Cohesion and the biological activity of bacteriophage
lambda DNA, J. Mol. Biol., 13, 78—91 (1965).
429. К a i s e r A. D., Jacob F., Recombination between related temperate bacteriophages
and the genetic control of immunity and prophage localization, Virology, 4, 509—521
(1957).
430. К a n n e r L. С., К о z 1 о f f L. M., The reaction of indole and T2 bacteriophage, Bio-
chemistry, 3, 215—223 (1964).
431. К a p 1 a n A. S., A study of the herpes simplex virus-rabbit kidney cell system by the
plaque technique, Virology, 4, 435—457 (1957).
432. Kaplan A. S., Be пФ о r a t T., The pattern of viral and cellular DNA synthesis in
pseudorabies virus-infected cells in the logarithmic phase of growth, Virology, 19,
205—214 (1963).
433. Kaplan A. S., Be n-P о r a t T., Mode of replication of pseudorabies virus DNA,
Virology, 23, 90—95 (1964).
434. Kaplan H. S., E a r 1 e J. D., Hows den F. L., The role of purine and pyrimidine
bases and their analogues in radiation sensitivity, J. Cell. Comp. Physiol., 64, suppl. 1,
69-90 (1964b
Литература
393
435. Kaplan Н. S., Moses L. E., Biological complexity and radioserisitivity, Science»
145, 21—25 (1964).
436. Kaplan S., Stretton A. O. W., Brenner S., Amber suppressors: efficiency of
chain propagation and suppressor specific amino acids, J. Mol. Biol., 14, 528—533
(1965).
437. К a s s a n i s B., Interactions of viruses in plants, Adv. Virus Research, 10, 219—255
(1963).
438. Kassanis B., Macfarlane I., Interaction of virus strain, fungus isolate, and
host species in the transmission of tobacco necrosis virus, Virology, 26, 603—612
(1965).
439. Kates M., Allison A. C., Tyrell D. A. J., James A. T., Origin of lipids of
influenza virus, Cold Spring Harbor Symposia Quant. Biol., 27, 293—302 (1962).
440. Katz L., Penman S., The solvent denaturation of double-stranded RNA from po-
liovirus infected HeLa cells, Biochem. Biophys. Res. Commun., 23, 557—560 (1966).
441. Kaufman H. E., Clinical cure of herpes simplex keratitis by 5' iodo-2'-deoxyuridi-
ne, Proc. Soc. Exptl. Biol. Med., 109, 251—252 (1962).
442. Kellenberger E., Vegetative bacteriophage and the maturation of virus particles.
Adv. Virus Research, 8, 1—61 (1962).
443. Kellenberger E., Arber W., Die Struktur des Schwarzes der Phagen T2 und
T4 und der Mechanismus der irreversiblen Adsorption, Z. Naturforsch., 10b, 698—704
(1955).
444. Kellenberger E., Arber W., Electron microscopical studies of phage multipli-
cation. I. A method for quantitative analysis of particle suspensions, Virology, 3,
24o 2o5 (19o7).
445. Kellenberger E., E i s e r 1 i n g F. A., Boy de la Tour E., Studies on the mor-
phopoiesis of the head of phage T-even. III. The cores of head related structures,
J. Ultrastructure Res. (1967).
446. Kellenberger G., Zichichi M. L., Weigle J., A mutation affecting the DNA
content of bacteriophage lambda and its lysogenizing properties, J. Mol. Biol., 3,
399—408 (1961).
447. Kellenberger G., Zichichi M., Weigle J., Exchange of DNA in the recom-
bination of bacteriophage X, Proc. Natl. Acad. Sci. U. S., 47, 869—8771(1961).
448. Kelly A. R., Hartman F. W., Rupe С. E., The toxicology of betapropiolactone.
In: Henry Ford Hospital Inti. Symposium, № 6, <Hepatitis. Frontiers» (eds.
F. W. Hartman, G. A. Logrippo, J. G. Mate er, and J. Barron), Little,
Brown Co., Boston, Chap. 32, pp. 387—406 (19157).
449. Kelner A., Effect of visible light on the recovery of Steptomyces griseus conidia
from ultraviolet irradiation injury, Proc. Natl. Acad. Sci. U: S.» 35, 73—79 (1949).
450. Keogh E. V., Titration of vaccinia virus on the chorioallantoic membrane of the
chick embryo and its application to immunological studies of neurovaccinia, J. Path.
Bact., 43, 441—454 (1936).
451. King T. J., Briggs R., Serial transplantation of embryonic nuclei, Cold Spring
Harbor Symposia Quant. Biol., 21, 271—290 (1956).
452. Kit S., Dubbs D. R., P i e к a r s к i L. J., Inhibitory effects of puromycin and
fluorophenylalanine on induction of thymidine kinase by vaccinia-infected L cells,
Biochem. Biophys. Res. Commun., 11, 176—181 (1963).
453. К i t S., P i e к a r s к i L. J., D u b b s D. R., Induction of thymadine kinase by vaccinia-
infected mouse fibroblasts, J. Mol. Biol., 6, 22—23 (1963).
454. К i t a j i m a E. W., Costa A. S., Morphology and developmental stages of Gomphre-
na virus, Virology, 29, 523—539 (1966).
455. К 1 e c z о w s к i A., The transformation of local lesion counts for statistical analysis,
Ann. Appl. Biol., 36, 139—142 (1949).
456. Klein G., Klein E., Antigenic properties of experimental tumors, Cold Spring Har-
bor Symposia Quant. Biol., 27, 463—470 (1962).
457. Kleinschmidt A. K., Lang D., Jacherts D., Zahn R. K-, Darstellung des
gesamtes Deoxyribosenukleinsaure-Inhalts von T2 Bakteriophagen, Biochim. Biophys.
Acta, 61, 857—864 (1962).
458. Kleinschmidt W. J., Murphy E. B., Investigations on interferon induced by
statolon, Virology, 27, 484—489 (1965).
459. KHeneberge r-N о b e 1 E., Pleuropneumonia-like organisms (PPLO): Mycoplasma-
taceae, Academic Press, London, 1964.
460. Klug A., Caspar D. L. D., The structure of small viruses, Adv. Virus Res., 7,
225—325 (1960).
461. Klug A., Longley W., Leberman R., Arrangement of protein subunits and the
distribution of nucleic acid in turnip yellow mosaic virus. I. X-ray diffraction studies,
J. Mol. Biol., 15, 315—343 (1966).
462. Knight C. A., Precipitin reactions of highly purified influenza viruses and rela-
ted materials, J. Exp. Med., 83, 281—294 (1946).
463. Knight C. A., The chemical constitution of viruses, Adv. Virus Res., 11, 153—182
(1954).
394
Литература
464. Koch G., H e г s h e у A. D., Synthesis of phage precursor protein in bacteria infected
with T2, J. Mol. BioL, 1, 260—276 (1959).
465. Koch G., Jordan E. M., Killing of E. coli В by phage-free T2 lysates, Biochim.
Biophys. Acta, 25, 437 (1957).
466. Kondo E., Mitsuhashi S., Drug resistance of enteric bacteria. IV. Active trans-
ducing bacteriophage P1CM produced by the combination of R factor with bacterio-
phage Pl, J. Bacteriol., 88, 1266—1276 (1964).
467. Konigsberg I. R., Clonal analysis of myogenesis, Science, 140, 1273—1284
(1963).
468. Koprowski H., Jervis G. A., Norton T. W., Immune responses in human vo-
lunteers upon oral administration of a rodent adapted strain of poliomyelitis virus,
Am. J. Hyg., 55, 108—126 (1952).
469. Korn D., Weissbach A., The effect of lysogenic induction on the deoxyribo-
nucleases of Escherichia coli К12%. I. Appearance of a new exonuclease activity,
J. Biol. Chem., 238, 3390—3394 (1963).
470. Kornberg A., Enzymatic synthesis of DNA, John Wiley and Sons, New York,
1961.
471. Kornberg S. R., Zimmerman S. B., Kornberg A., Glucosylation of deoxy-
ribonucleic acid by enzymes from bacteriophage-infected Escherichia coli, J. Biol.
Chem., 236, 1487—1493 (1961).
472. К о z i n s к i A. W., Fragmentary transfer of P32-labeled parental DNA to progeny
phage, Virology, 13, 124—134 (1961).
473. К о z 1 о f f L. M., Biochemistry of viruses, Ann. Rev. Biochem., 29, 475—502
(1960).
474. К о z 1 о f f L. M., Lute M., Folic acid, a structural component of T4 bacteriophage,
J. Mol. BioL, 12, 780—792 (1965).
475. Krieg D., A study of gene action in ultraviolet-irradiated bacteriophage T4, Viro-
logy, 8, 80—98 (1959).
476. Kroon A. M., Protein synthesis in mitochondria. III. On the effects of inhibitors on
the incorporation of amino acids into protein by intact mitochondria and digitonin
fractions, Biochim. Biophys. Acta, 108, 275—284 (1965).
477. Krooth R. S., Weinberg A. N., Studies on cell lines developed from the tissues
of patients with galactosemia, J. Exp. Med., 113, 1155—1172 (1961).
478. Krug R. M., Franklin R. M., Studies on the time of synthesis of Mengovirus ri-
bonucleic acid and protein, Virology, 22, 48—58 (1964).
479. Krywienczyk J., Bergold G. H., Serological relationships of viruses from
some lepidopterous and hymenopterous insects, Virology, 10, 308—315 (1960).
480. Kunkel L. O., Heat treatments for the cure of yellows and other virus diseases of
peach, Phytopath., 26, 809—830 (1936).
481. Kunkel L. O., Heat cure of aster yellows in periwinkles, Am. J. Bot., 28, 761—769
(1941).
482. Lafferty K. J., The interaction between virus and antibody, Virology, 21, 61—90
(1963).
483. Lafferty K. J-, Or tel is S., The interaction between virus and antibody. III. Exa-
mination of virus-antibody complexes with the electron microscope, Virology, 21,
91—99 (1963).
484. Lampson G. P., Ту tell A. A., Nemes M. M., Hi lieman M. R., Purification
and characterization of chick embryo interferon, Proc. Soc. Exptl. BioL Med., 112,
468—478 (1963).
485. Landman О. E., Halle S., Enzymatically and physically induced inheritance chan-
ges in Bacillus subtilis, J. Mol. BioL, 7, 721—738 (1963).
486. Landsteiner K-, The Specificity of Serological Reactions, Harvard University
Press, Cambridge, 1945.
487. Langridge R., Gomatos P. J., The structure of RNA, Science, 141, 694—698
(1963).
488. L a n n i F., L a n n i Y. T., Antigenic structure of bacteriophage, Cold Spring Harbor
Symposia Quant. BioL, 18, 159—167 (1953).
489. L a n n i Y. T., DNA transfer from phage T5 to host cells: dependence on intercurrent
protein synthesis, Proc. Natl. Acad. Sci. U.S., 53, 969—973 (1965).
490. Laskowski M., Hagerty G., L a u r i 1 a V. R., Phosphodiesterase from rattlesna-
ke venom, Nature, 180, 1181—1182 (1957).
491. Lauffer M. A., Price W. C., Infection by viruses, Arch. Biochem., 8, 449—468
(1945).
492. Laver W. G., The structure of influenza virus. 3. Disruption of the virus particle
and separation of neuraminidase activity, Virology, 20, 251—262 (1963).
493. Lea D. E., Actions of Radiations on Living Cells, Cambridge University Press,
1946.
494. Leder P., Nirenberg M., RNA codewords and protein synthesis. II. Nucleotide
sequence of a valine RNA codeword, Proc. Natl. Acad. Sci. U. S., 52, 420—427
(1964).
Литература
395
495. L ed^e г b e г g J., Cell genetics and hereditary symbiosis, Physiol. Revs., 32, 403—430
496. Lederberg J., Linear inheritance in transductional clones, Genetics, 41, 845—871
(1956).
497. Lederberg S., Suppression of the multiplication of heterologous bacteriophages in
lysogenic bacteria, Virology, 3, 496—513 (1957).
498. L e d i n к о N., Genetic recombination with poliovirus type I. Studies of crosses bet-
ween a normal horse serum resistant mutant and several guanidine resistant mu-
tants of the same strain, Virology, 20, 107—119 (1963).
499. Led in ко N., Hirst G. K-, Mixed infection of HeLa cells with polioviruses types 1
and 2, Virology, 14, 207—219 (1961).
500. Lehman I. R., The nucleases of E. coli, Prog. Nuc. Acid. Res.. 2, 84—124 (1963).
501. Lehman I. R„ Bessman Я J., Simms E. S., Kornberg A., Enzymatic synthe-
sis of DNA. I. J. Biol. Chem., 233, 163—170 (1958).
502. Lehman I. R., P г a 11 E. A., On the structure of glucosylated hydroxymethylcytosi-
ne nucleotides of coliphages T2, T4, and T6, J. Biol. Chem., 235, 3254—3259
(1960).
503. Lehman I. R., Zimmerman S. B„ Adler J., В e s s m a п M. J., Simms E. S.
Kornberg A., Chemical composition of enzymatically synthesized DNA, Proc.
Natl. Acad. Sci. U.S., 44, 1191—1196 (1958).
504. Lennette E. H., General principles underlying laboratory diagnosis of viral and
rickettsial infections. In: Diagnostic Procedures for Viral and Rickettsial Diseases,
3rd ed., American Public Health Association, New York, 1964.
505. Lennox E. S., Transduction of linked genetic characters of the host by bacteriopha-
ge Pl, Virology, 1, 190—206 (1955).
506. L er m a n L., Acridine mutagens and DNA structure, J. Cell. Comp. Physiol., 64,
Suppl. 1, 1—18 (1964).
507. Levine L., Barlow J. L., Van V u n a к i s H., An internal protein of T2 and T4
bacteriophages, Virology, 6, 702—717 (1957).
508. Levine L., M u г a к a m i W. T., Van Vunakis H., Grossman L., Specific anti-
bodies to thermally denatured deoxyribonucleic acid of phage T4, Proc. Natl. Acad.
Sci. U.S., 46, 1038—1043 (1960).
509. Levine M., Mutations on the temperate phage P22 and lysogeny in Salmonella,
Virology, 3, 22-41 (1957).
510. L e v i n e S., P u с к T. T., S a g i к В. P., An absolute method for assay of virus hem-
agglutinins, J. Exp. Med., 98, 521—531 (1953).
511. Levinthal C., Recombination in phage T2: its relationship to heterozygosis and
growth, Genetics, 39, 169—184 (1954).
512. Levinthal С., H о s о d a J., S h u b D., The control of protein synthesis after phage
infection. In: Molecular Biology of Viruses (ed. J. S. Colter), Academic Press, New
York, 1967.
513. Levinthal C., Visconti N., Growth and recombination in bacterial viruses, Ge-
netics, 38, 500—511 (1953).
514. Levin tow L., Darnell J. E., A simplified procedure for purification of large
amounts of poliovirus: Characterization and amino acid analysis of Type I poliovi-
rus, J. Biol. Chem., 235, 70—73 (P960).
515. Levin tow L., Eagle H., Biochemistry of cultured mammalian cells, Ann. Rev.
Biochem., 30, 605—640 (1961).
516. Levintow L., Thoren M. M., D a r n e 11 J. E., H о о p e г J. L., Effect of p-fluoro-
phenylalanine and purcmycin on the replication of poliovirus, Virology, 16, 220—229
(1962).
517. Lewis E. B., Leukemia and ionizing radiation, Science, 125, 965—972 (1957).
518. L’H ё r i t i e r Ph., The CO2 sensitivity problem in Drosophila, Cold Spring Harbor
Symposia Quant. Biol., 16, 99—111 (1951).
519. L’H eri tier Ph., The hereditary virus of Drosophila, Adv. Virus Res., 5, 195—245
(1958).
520. Lieb M., Studies of heat inducible X mutants. II. Production of Ci product by superin-
fecting Л+ in heat-inducible lysogens, Virology, 29, 367—376 (1966).
521. Lindegren С. C., Bang Y. N., The zymophage, Antonie van Leewenhoek, 27,
1—18 (1961).
522. L о с к a r t R. Z., Jr., The necessity for cellular RNA and protein synthesis for viral
inhibition resulting from interferon, Biochem. Biophys. Res. Commun., 15, 513—518
(1964).
523. L о с к a r t R. Z., Jr., Sreevalsan T., Horn B., Inhibition of viral RNA synthe-
sis by interferon, Virology, 18, 493—494 (1962).
524. Loh'P. C., Riggs J. L., Demonstration of the sequential development of vaccinial
antigens and virus in infected cells: observations with cytochemical and differential
fluorescent procedures, J. Exp. Med., 114, 149—160 (1961).
525. Luca s-L e n a r d J., L i p m a n n F., Separation of three microbial amino acid poly-
merization factors, Proc. Natl. Acad. Sci. U.S., 55, 1562—1566 (1966).
396 Литература
526. Luck D. J. L., Genesis of mitochondria in Neurospora crassa, Proc. Natl. Acad. Sci.
U.S., 49, 233—240 (1963).
527. Luck D. J. L., Formation of mitochondria in Neurospora crassa, Am. Natural., 99,
241—253 (1965).
528. Lucke B., Carcinoma in the leopard frog: its probable causation by a virus, J. Exp.
Med., 68, 457—468 (1938).
529. Lucy J. A., G 1 a u e r t A. M., Structure and assembly of macromolecular lipid com-
plexes composed of globular micelles, J. Mol. BioL, 8, 727—748 (1964).
530. L u d e r i t z O., Staub A. M., Westphal O., Immunochemistry of О and R anti-
gens of Salmonella and related Enterobacteriaceae, Bacteriol. Rev., 30, 192—255
(1966).
531. Luria S., Methodes statistiques appliquees a 1’etude du mode d’actions des ultravi-
rus, Ann. Inst. Pasteur, 64, 415^436 (1940).
532. Luria S. E., Mutations of bacterial viruses affecting their host range, Genetics, 30,
84—99 (1945).
533. Luria S. E., The frequency distribution of spontaneous bacteriophage mutants as
evidence for the exponential rate of phage reproduction, Cold Spring Harbor Sympo-
sia Quant. Biol., 16, 463—^470 (19151).
534. Luria S. E., Host-induced modification of viruses, Cold Spring Harbor Symposia
Quant. Biol., 18, 237—244 (1953).
535. Luria S. E., Radiation and viruses. In: Radiation Biology, Vol. II (ed. A. H о 1 la-
end er), McGraw-Hill Book Co., New York, pp. 333—364, 1955.
536. Luria S. E., Viruses as infective genetic materials. In: Immunity and virus infection
(ed. V. Najjar), John Wiley and Sons, New York, 1959.
537. Luria S. E., Adams M. J., Ting R. C., Transduction of lactose utilizing ability
among strains of E. coli and S. dysenteriae, Virology, 12, 348—390 (1960).
538. Luria S. E., Delbriick M., Anderson T. F., Electron microscope studies of
bacterial viruses, J. Bacteriol., 46, 57—77 (1943).
539. Luria S. E., Dulbecco R., Genetic recombination leading to production of active
bacteriophage from ultraviolet inactivated bacteriophage particles, Genetics, 34,
93—125 (1949).
540. Luria S. E., E x n e r F. M., The inactivation of bacteriophages by X-rays. Influence
of the medium, Proc. Natl. Acad. Sci. U.S., 27, 370—375 (1941).
541. Luria S. E., La tar jet R., Ultraviolet irradiation of bacteriophage during intra-
cellular growth, J. Bacteriol., 53, 149—163 (1957).
542. Luria S. E., Williams R. C., Backus R. C., Electron micrographic counts of
bacteriophage particles, J. Bacteriol., 61, 179—188 (1951).
543. L u z z a t i V., H u s s о n J., The structure of liquid crystalline phases of lipid-water
systems, J. Cell. Biol., 12, 207—219 (1962).
544. L w о f f A., L’evolution physiologique. Etude des pertes de fonctions chez les micro-
organismes, Hermann, Paris, 1943.
545. L w о f f A., Problems of morphogenesis in ciliates, John Wiley and Sons, New York,
1950.
546. Lwoff A., Lysogeny, Bacteriol. Rev., 17, 269—337 (1953).
547. Lwo'ff A., The concept of virus, J. Gen. Microbiol., 17, 239—253 (1957).
548. Lwoff A., Factors influencing the evolution of viral diseases at the cellular level
and in the organism, Bacteriol. Rev., 23, 109—124 (1959).
549. Lwoff A., Horne R., Tournier P., A system of viruses, Cold Spring Harbor
Symposia Quant. Biol., 27, 51—55 (1962).
550. Me Aus lan B. R., Control of induced thymidine kinase activity in the poxvirus in-
fected cell, Virology, 20, 162—168 (1963).
551. McAuslan B. R., The induction and repression of thymidine kinase in the poxvirus
infected HeLa cell, Virology, 21, 383—389 (1963).
552. McCarthy B. J., Hoyer В. H., Identity of DNA and diversity of mRNA molecu-
les in normal mouse tissues, Proc. Natl. Acad. Sci. U.S., 52, 915—922 (1964).
553. McClain M. E., The host range and plaque morphology of rabbitpox virus (RPU)
and its U mutants on chick fibroblast, PK-2a and L929 cells, Austral. J. Exptl. Biol.
Med. Sci., 43, 31--44 (1965).
554. M c Q u i 11 e n K-, Roberts R. B., Britten R. J., Synthesis of nascent protein by
ribosomes in E. coli, Proc. Natl. Acad. Sci. U.S., 45, 1437—1447 (1959).
555. MacLeod R., Black L. M., Moyer F. H., The fine structure and intracellular
localization of potato yellow dwarf virus, Virology, 29, 546—552 (1966).
556. Macpherson I., Montagnier L., Agar suspension culture for the selective
assay of cells transfotmed by polyoma virus, Virology, 23, 291—294 (1964).
'557 . M a h 1 e r H. R., F r a s e r D., Studies in partially resolved bacteriophage-host systems.
IV. Some properties of the protoplast-infecting agent derived from T2 bacteriophage,
Virology, 8, 401—424 (1950).
558. M a i z e 1 J. V., Evidence for multiple components in the structural protein of ty-
pe I poliovirus, Biochem. Biophys. Res. Commun., 13, 483—489 (1963).
Литература
397
559. М а и а к е г R. A., G г о и р ё V., Discrete foci of altered chicken embryo cells asso-
ciated with Rous sarcoma virus in tissue cultures, Virology, 2, 838—840 (1956).
560. Mandel B., Studies on the interactions of poliomyeiitis virus, antibody and host
cells in a tissue culture system, Virology, 6, 424—447 (1958).
561. Mandel B., Early stages of virus-cell interaction as studied by using antibody, Cold
Spring Harbor Symposia Quant. Biol., 27, 123—131 (1962).
562. Maramorosch K-, Mechanical transmission of curly top virus to its insect vector
by needle inoculation, Virology, 1, 286—300 (1955).
563. Maramorosch K., Arthropod transmission of plant viruses, Ann. Rev. Entomolo-
gy, 8, 369—414 (1963).
564. Maramorosch K., Harmful and beneficial effects of plant viruses in insects, Ann.
Rev. Microbiol., 17, 495—530 (1963).
565. Marcus P. I., Single cell techniques in tracing virus-host interactions, Bacteriol
Rev., 23, 232—249 (1959).
566. Markham R., The biochemistry of plant viruses. In: The Viruses, Vol. II (eds.
F. M. Burnet and W. M., Stanley), Academic Press, New York, pp. 33—125
(1959).
567. Markham R., Frey S., Hills G. J., Methods for the enhancement of image de-
tail and accentuation of structure in electron microscopy, Virology, 20, 88—102
(1963).
568. Markham R., H i t c h b о r n J. H., Hills G. J., Frey S., The anatomy of the
tobacco mosaic virus, Virology, 22, 342—359 (1964).
569. Markham R., Smith К. M., Studies on the virus of turnip yellow mosaic, Para-
sitology, 39, 330—342 (1949).
570. M a г m и r J., Greenspan С. M., P a 1 e с к E., К a h a n F. M., L e v i n e J., M a n-
d e 1 M., Specificity of the complementary RNA formed by B, subtilis infected with
bacteriophage SP8, Cold Spring Harbor Symposia Quant Biol., 28, 191—199
(1963).
571. MarmurJ., Rownd R., Schildkraut C. L., Denaturation and renaturation of
DNA, Progr. Nuc. Acid Res., 1, 231-^300 (1963).
572. Marquardt J., Holm S. E., L у с к e E., Immuno-precipitating factors of vacci-
nia virus, Virology, 27, 170—178 (1965).
573. Matheson A. T., Thomas C. A., Jr., The indirect effect accompanying P32 suici-
de of bacteriophage, Virology, 11, 289—291 (1960).
574. Matsuda M., Barksdale L., Phage directed synthesis of diptherial toxin in non-
toxinogenic Corynebacteriutn diphtheriae, Nature, 210, 911—912 (1966).
575. Matsushiro A., Specialized transduction of tryptophan markers in Escherichia
coli K12 by bacteriophage q)80, Virology, 19, 475—482 (1963).
576. Mattern С. T., Du Buy H., Purification and crystallization of Coxsackie virus,
Science, 123, 1037—1038 (1956).
577. Matthews R. E. F., Properties of nucleoprotein fractions isolated from turnip
yellow mosaic virus preparations, Virology, 12, 521—539 (1960).
578. Matthews R. E. F., Bolton E. T., Thompson H. R., Kinetics of labelling of
turnip yellow mosaic virus with P32 and S35, Virology, 19, 179—189 (1963).
579. M a у D. S., К n i g h t C. A., Polar stripping of protein subunits from tobacco mosaic
virus, Virology, 26, 502—507 (1965).
580. Me da war P. B., Immunological tolerance, Science, 133, 303—306 (1961).
581. Medical Research Council (Britain). The hazards to man of nuclear and allied ra-
diations, H. M. Stationery Office, London, 1956.
582. M e 1 e c h e n N. E., S к a a r P. D., The provocation of an early step of induction by
thymine deprivation, Virology, 16, 21—29 (1962).
583. Melnick J. J., Khera K. S., Rapp F., Papova virus SV40: Failure to isolate in-
fectious virus from transformed hamster cells synthesizing SV40 induced antigens,
Virology, 23, 403—432 (1964).
584. M e n n i g m a n n H. D., Electron microscopy of the antibacterial agent produced by
E. coli 15, J. Gen. Microbiol., 14, 151—154 (1965).
585. M e r i g a n T. C., Purified interferons: Physical properties and species specificity,
Science, 145, 811—813 (1964).
586. M e s e 1 s о n M., The molecular basis of genetic recombination. In: Heritage from
Mendel (ed. R. A. Brink), University of Wisconsin Press, pp. 81—104, 1967.
587. Meselson M., Stahl F. W., The replication of DNA in Escherichia coli, Proc.
Natl. Acad. Sci. U.S., 44, 671—682 (1958).
588. Meselson M., Stahl E. W., V i n о g r a d J., Equilibrium sedimentation of
macromolecules in density gradients, Proc. Natl. Acad. Sci. U. S., 43, 581—588
(1957).
589. Meselson M., W e i g 1 e J. J., Chromosome breakage accompanying genetic recom-
bination in bacteriophage, Proc. Natl. Acad. Sci. U.S., 47, 857—868 (1961).
590. M e у n e 11 E. M., A phage <p% which attacks motile bacteria, J. Gen. Microbiol., 25r
253—290 (1965).
398 Литература
591. Miller О. L., Jr., Extrachromosomal nucleolar DNA in amphibian oocytes, J. Cell
Biol., 23, 60A (1964).
592. Mirsky A. E., Osawa S., The Cell, Vol. II (eds. J. Brachet and A. E. Mir-
sky), Academic Press, New York, pp. 699—709, 1960.
593. Mitchell M. B., Mitchell H. K-, Tissieres A., Mendelian and non-Men-
delian factors affecting the cytochrome system in Neurospora crassa, Proc. Natl.
Acad. Sci. U.S., 39, 606—613 (1953).
594. Miura K-, Kimura I., Suzuki N., Double-stranded ribonucleic acid from rice
dwarf virus, Virology, 28, 571—579 (1966).
5915. Moffett H. L., С r a m b 1 e 11 H. G., Viral isolations and illnesses in young infants
attending a well-bady clinic, New England J. Med., 267, 1213—1218 (1962).
596. Montagnier L., Sanders F. K., Replicative form of encephalomyocarditis vi-
rus ribonucleic acid, Nature, 199, 664—667 (1963).
597. Moody M. F., The shape of the T-even bacteriophage head, Virology, 26, 567—576
(1965).
598. Morgan C., Jones E. P., Holden M., Rose H. M., Intranuclear crystals of
herpes simplex virus observed with the electron microscope, Virology, 5, 568—571
(1958).
599. Morgan C., Rifkind R. A., Rose H. M., The use of ferritin-conjugated antibo-
dies in electron microscopic studies of influenza and vaccinia viruses, Cold Spring
Harbor Symposia Quant. Biol., 27, 57—65 (1962).
600. Morgan C., Rose H. M., Holden M., Jones E. P., Electron microscopic obser-
vations on the development of herpes simplex virus, J. Exp. Med., 110, 643—656
(1959).
601. Morse M. L., Lederberg E. M., Lederberg J., Transduction in Escherichia
coli K12, Genetics, 41, 142—156 (1956).
602. M о s i g G., Genetic recombination in bacteriophage T4 during replication of DNA
fragments, Cold Spring Harbor Symposia Quant. Biol., 28, 35—42 (1963).
603. Mosig G., Distances separating genetic markers in T4 DNA, Proc. Natl. Acad. Sci.
U. S., 56, 1177—1183 (1966).
604. Moulder J. W., The biochemistry of intracellular parasitism, University of Chicago
Press, 1962.
605. Moulder J. W., The psittacosis group as bacteria, John Wiley and Sons, New York,
1964.
606. MOller-Jensen К., H о f s c h n e i d e r P. H., Infectious substructures of E. coli
bacteriophages.- IV. The nature of infectious urea-T2 particles, Biochim Biophys. Acta,
80, 422—430 (1964).
607. Mun dry K-, The effect of nitrous acid on TMV: Mutation, not selection, Virology,
9, 722—726 (1959).
608. Mun dry K. W., Interactions between plant viruses and host cells, Symp. Soc. De-
velopmental Biol., 24, 65—94 (1905).
609. Murphy J. B., Transplantability of tissues to the embryo of foreign species, J. Exp.
Med.,. 17, 482—493 (1913).
610. M u r p h у J. S., An agent derived from B. megaterium phage G which dissolves the
bacterial cell wall, Virology, 11, 510—513 (1960).
611. Nagaraj A. N., Immunofluorescence studies on synthesis and distribution of to-
bacco mosaic virus antigen in tobacco, Virology, 25, 133—142 (1965).
612. Nagel de Zwaig R., Association between colicinogenic and fertility factors, Ge-
netics, 54, 381—390 (1966).
613. Nagel de Zwaig R., Anton D. N., Puig J., The genetic control of colicinoge-
nic factors E2, I and V, J. Gen. Microbiol., 29, 473—484 (1962).
614. Nagington J., Horne R. W., Morphological studies of Orf and vaccinia viruses,
Virology, 16, 248—260 (1962).
615. N ass M. M. K-, Nass S., Af ze lius B. A., The general occurrence of mitochondrial
DNA, Exp. Cell Res., 37, 516—539 (1965).
616. Nathans D., Cell-free protein synthesis directed by coliphage MS2 RNA: Synthe-
sis of intact viral coat protein and other products, J. Mol. Biol., 13, 521—531
(1965).
617. Nirenberg M., Leder P., Bernfield M., Brimacombe R., Trupin J.,
R о t tm a n F., O’N e a 1 C., RNA codewords and protein synthesis, VII. On the gene-
ral nature of the RNA code, Proc. Natl. Acad. Sci. U.S., 53, 1161—1168 (1965).
‘618 . Nirenberg M., Matthaei H., The dependence of cell-free protein synthesis in
E. coli upon naturallv occurring or synthetic polyribonucleotides, Proc. Natl. Acad.
Sci. U.S., 47, 1588—1602 (1961).
619. N i s h i m u r a S., Extracellular ribonucleases from Bacillus subtilis. I. Crystalliza-
tion and specificity, Biochim. Biophys. Acta, 45, 15—25 (1960).
620. Nisonoff A., Winkler M. H., Pressman D., The similar specificity of the
combining sites of an individual antibody molecule, J. Immunol., 82, 201—208
(1959).
Литература
399
'621. Nixon Н. L., An estimate of the number of tobacco mosaic virus particles in a
single hair cell, Virology, 2, 126—128 (1*956).
622. Nomura M., Mode of action of colicines, Cold Spring Harbor Symposia Quant.
Biol., 28, 315—324 (1963).
623. Norman A., Ultraviolet inactivation of poliovirus ribonucleic acid, Virology, 10,
384—387 (1960).
624. North A. С. T., Rich A., X-ray diffraction studies of bacterial viruses. Nature,
191, 1242—1245 (1961).
625. Novick A., Szilard L., Virus strains of identical phenotype but different genoty-
pe, Science, 113, 34—35 (1951).
626. Novick R. P., Richmond M. H., Nature and interactions of the genetic elements
governing penicillinase synthesis in Staphylococcus aureus, J. Bacteriol., 90, 467—480
(1965).
•627. О h a n e s s i a n-G u i 11 e m a n A. Etude genetique du virus hereditaire de la Dro-
sophile (o). Mutations et recombinaison genetique, Ann. de Genetique, 1, 59—68
(1969).
628. Okada Y., Terzaghi E., Streisinger G., Emrich J., Inouye M., Tsu-
g i t a A., A frame shift mutation involving the addition of two bases in the lysozyme
gene of phage T4, Proc. Natl. Acad. Sci. U.S., 56, 1692—1698 (1966).
•629. Okubo S., Strauss B., Stodolsky M., The possible role of recombination in
the infection of competent Bacillus subtilis by bacteriophage nucleic acid. Virology,
24, 552—562 (1964).
630. Onodera К., Kom ano T., Himeno M., Sakai F., The nucleic acid of nuclear-
polyhedrosis virus of the silkworm, J. Mol. Biol., 13, 532—539 (1965).
631. О г г C. W. М., Н е г г i о 11 S. Т., В е s s m a n М. J., The enzymology of virus-infected
bacteria. VII. A new deoxyribonucleic acid polymerase induced by bacteriophage T5,
J. Biol. Chem., 240, 4652—4668 (1966).
632. Oster G., McLaren A. D., The ultraviolet light and photosensitized inactivation
of tobacco mosaic virus, J. Gen. Physiol., 33, 215—228 (1950).
633. О z e к i H., Abortive transduction in purine-requiring mutants of Salmonella typhi-
murium. In: Genetic Studies with Bacteria, Carnegie Institution of Washington Publ.
№ 612, 97—106 (1956).
•634. Paranchych W., Stages in phage R17 infection: the role of divalent cations, Vi-
rology, 28, 90—99 (1966).
635. Park В. H., An enzyme produced by a phage-host cell system. I. The properties of
a Klebsiella phage, Virology, 2, 711—718 (19156).
636. Parker R. F., Statistical studies on the nature of the infectious unit of vaccine vi-
rus, J. Exp. Med., 67, 725—738 (1938).
637. Parker R. F., Rivers T. M., Immunological and chemical investigations of vacci-
ne virus, J. Exp. Med., 64, 439—452 (1966).
638. Pasteur L., Methode pour prevenir la rage apres morsure, С. r. Acad. Sci., 101,
765—772 (1885).
639. Penman S., RNA metabolism in the HeLa cell nucleus, J. Mol. Biol., 17, 117—130
(1966).
640. Penman S., Becker Y. Darnell J. E., A cytoplasmic structure involved in the
synthesis and assemblv of poliovirus components, J. Mol. Biol., 8, 541—555
(1964).
641. Penman S., Scherrer K-, Becker Y., Darnell J. E., Polyribosomes in nor-
mal and poliovirus infected HeLa cells and their relationship to messenger RNA,
Proc. Natl. Acad. Sci. U.S., 49, 654—662 (1963).
642. Penman S., Summers D. F., Effects on host cell metabolism following synchro-
nous infection with poliovirus, Virology, 27, 614—620 (1965).
643. P e г о 1-V a u c h e z Y., Tournier M. P., Lwoff M., Attenuation de la virulence
du virus de 1’encephalomyocardite de la souris par culture a basse temperature. Influ-
ence de 1’hypo- et de rhyperthermie sur revolution de la maladie experimentale, С. r.
Acad. Sci., 253, 2164—2166 (1961).
644. Peterson E. A., Sober H. A., Chromatography of proteins. I. Cellulose ion-
exchange adsorbants, J. Am. Chem., Soc., 78, 751—755 (1956).
645. P f e f f e г к о г n Е. R., Clifford R. L., The origin of the protein of Sindbis virus,
Virology, 23, 217—223 (1964).
646. Pfefferkorn E. R., Hunter H. S., The source of the ribonucleic acid and
phospholipid of Sindbis virus, Virology, 20, 446—456 (1963).
647. Phil ipso n L., Alberts son P. A., Frick G., The purification and concentra-
tion of viruses by aqueous polymer phase systems, Virology, 11, 553—571 (1960).
648. P i r i e N. W., The criteria of purity used in the study of large molecules of biologi-
cal origin, Biol. Rev., 15, 377—404 (1940).
649. Pollard E., The action of ionizing radiation on viruses, Adv. Virus Res., 2,
109—151 (1954).
650. Pollard E. C., Radiation inactivation of enzymes, nucleic acids, and phage par-
ticles, Rev. Mod. Physics, 31, 273—281 (19159).
400
Литература
651. Polson A., Fractionation of protein mixtures on columns of granulated agar, Bio
chim. Biophys. Acta, 50, 565—567 (1961).
652. Porter K. R., The ground substance; observations from electron microscopy. In:
The Cell, Vol. II (eds. J. Brachet and A. E. Mirsky), Academic Press, New
York, Chapter 9, pp. 621—676, 1961.
653. Pratt D.,Tzagoloff H., ErdahlW. S., Conditional lethal mutants of the small
filamentous phage M13. I. Isolation, complementation, cell killing, time of cistron
action, Virology, 30, 397—410 (1966).
654. Prescott D., Kimball R. F., Carrier R. F., Comparison between the timing of
micronuclear and macronuclear DNA synthesis in Euplotes eurystomus, J. Cell. Biol.,.
13, 175—176 (1962).
655. Price W. C., Acquired immunity from plant virus diseases, Quart. Rev. Biol., 15»
338—361 (1940).
656. Prince A. M., Quantitative studies on Rous sarcoma virus. IV. An investigation
of the nature of «поп-infective» tumors induced by low doses of virus, J. Natl. Can-
cer Inst., 23, 1361—1381 (1959).
657. Provisional Committee for Nomenclature of Viruses, Proposals and Recommenda-
tions, 1965.
658. Puck T. T., Studies in the life cycle of mammalian cells, Cold Spring Harbor Sym-
posia Quant. Biol., 29, 167—176 (1964).
659. Puck T. T., Garen A., Cline J., The mechanism of virus attachment to host
cells. I, J. Exp. Med., 93, 65—88 (1951).
660. Puck T. T., Marcus P. I., Cieciura S. J., Clonal growth of mammalian cells
in vitro. Growth characteristics of colonies from single HeLa cells with and without
a feeder layer, J. Exp. Med., 103, 273—284 (1956).
661. Puck T. T., S a gik B., Virus and cell interaction with ion exchangers, J. Exp. Med.,.
97, 807—820 (1953).
662. Putnam F. W., Molecular kinetics and electrophoretic properties of bacteriophages»
Science, 111, 481—488 (1950).
663. R a d d i n g С. M., Kaiser A. D., Gene transfer by broken molecules of X DNA:
activity of the left half-molecule, J. Mol. Biol., 7, 225—233 (1963).
664. Ralph R. K., Matthews R. E. F., Matus A. I., Mandel H. G., Isolation and
properties of double-stranded viral RNA from virus-infected plants, J. Mol. Biol., 11,
202—212 (1965).
665. Randall J., D i о b г e у C., Evidence for the presence of DNA at basal body sites
in Tetrahymena pyriformis, Proc. Royal Soc. B, 162, 473—491 (1965).
666. Rapp F., Melnick J. L., К i t a h а г a I., Tumor and virus antigens of simian vi-
rus 40: Differential inhibition of synthesis by cytosine arabinoside, Science, 147,
625—627 (1965).
667. Ravin A. W., The genetics of transformation, Adv. Genetics, 10, 61—163 (1961).
668. R e d d i К. Km Studies on the formation of tobacco mosaic virus ribonucleic acid.
II. Degradation of host ribonucleic acid following infection, Proc. Natl. Acad. Sci.
U.S., 50, 75—81 (1963).
669. Reed W., С а г г о 11 J., The etiology of yellow fever; a supplementary note, Am.
Med., 3, 301—305 (1902).
670. Reed W., Carroll J., Agramonte A., Lazear J. W., Yellow fever: a compi-
lation of various publications. U. S. 61st Congress, Docum. № 822, Washington, D. C.,
1911.
671. Reed L. J., Muench H., A simple method of estimating fifty per cent endpoints.
Am. J. Hyg., 27, 493—497 (1938).
672. Reich E., Franklin R. M., Shatkin A. J., Tatum E. L., Effect of actinomy-
cin D on cellular nucleic acid synthesis and virus production. Science, 134, 556—557
(1961).
673. Reich ma nn M. E., The satellite tobacco necrosis virus: a single protein and its
genetic code. Proc. Natl. Acad. Sci. U.S., 52, 1009—1017 (1964).
674. Reid M. S., Matthews R. E. F., On the origin of the mosaic induced by turnip
yellow mosaic virus, Virology, 28, 563—570 (1966).
675. R e i s s i g M., Kaplan A. S., The morphology of noninfective pseudorabies virus
produced by cells treated with 5-fluorouracil, Virology, 16, 1—8 (1962).
676. Rhoades M. M., Interaction of genic and non-genic hereditary units and the phy-
siology of non-genic inheritance, Handbuch der Pflanzenphysiologie, 1, 19—57,
1955.
677. R i s H., C h a n d 1 e r B. L., The ultrastructure of genetic systems in prokaryotes and
eukaryotes, Cold Spring Harbor Symposia Quant. Biol., 28, 1—8 (1963).
678. R i s H., P 1 a u t W., Ultrastructure of DNA-containing areas in the chloroplasts of
Chlamydomonas, J. Cell. Res., 13, 383—391 (1962).
679. Rivers T. M., Viruses and Koch’s postulates, J. Bacteriol., 33, 1—12 (1937).
680. Roane P. R., Jr., Roizman B., Studies on the determinant antigens of viable
cells. II. Demonstration of altered antigenic reactivity of HEp-2 cells infected with
herpes simplex virus, Virology, 22, 1—8 (1964}.
Литература
401
681. Robbins Р. W., Wright A., Dankert M., Polysaccharide biosynthesis, J. Gen.
PhysioL, 49, 331—346 (1966).
682. Robbins P. W., U c h i d a T., Determinants of specificity in Salmonella: changes
in antigenic structure mediated by bacteriophage, Federation Proc., 21, 702—710
(1962).
683. Robertson J. D., The molecular structure and contact relationships of cell mem-
branes. In: Progress in Biophysics (eds. B. Katz and J. A. V. Butler), Pergamon
Press, New York, pp. 343—418, 1960.
684. R о b i n s о n W. S., P i t к a n e n A., Rubin H., The nucleic acid of the Bryan strain
of Rous sarcoma virus: Purification of the virus and isolation of the nucleic acid,
Proc. Natl. Acad. Sci. U.S., 54, 137—144 (1966).
685. R о i z m a n B., Polykaryocytosis, Cold Spring Harbor Symposia Quant. Biol., 27,
327—342 (1962).
686. Roizman B., Borman G. S., Rousta M., Macromolecular synthesis in cells in-
fected with herpes simplex virus, Nature, 206, 1374—1375 (1965).
687. Roizman B., Mayer M. M., Rapp H. J., Immunological studies of poliovirus.
Ill, J. Immunol., 81, 419—425 (1958).
688. Romig W. R., Infection of Bacillus subtilis with phenol-extracted bacteriophages,
Virology, 16, 452-459 (1962).
689. Rorsch A., Van der Kamp C., A dem a J., Dark reactivation of ultraviolet irra-
diated bacteriophage DNA in vitro, Biochim. Biophys. Acta, 80, 346—648 (1964).
690. Rose J. A., Reich R. R., Weissman S. M., RNA production in adenovirus-in-
fected KB cells, Virology, 27, 571—579 (1905).
691. Ross A. F., Systemic acquired resistance induced by localized virus infections in
plants, Virology, 14, 340—358 (1961).
692. Rothman J. R., Transduction studies on the relation between prophage and host
chromosome, J. Mol. Biol., 12, 892—912 (1965).
693. Rott R., Saber S., S c h о 11 i s s e к C., Effect on myxovirus of mitomycin C, acti-
nomycin D and pretreatment of the host cell with UV light, Nature, 205, 1187—1190
(1965).
694. Rous P., A sarcoma of the fowl transmissible by an agent separable from the tumor
cells, J. Exp. Med., 13, 397—411 (1911).
695. Rous P., Murphy J. B., On the causation by a filtrable agent of three distinct
chicken tumors, J. Exp. Med., 19, 52—69 (1914).
696. Rowe W. P., The epidemiology of mouse polyoma virus infection, Bacteriol. Rev.,
25, 18—31 (1961).
6947. Rubin H., An analysis of the assay of Rous sarcoma in vitro by the infective
center technique. Virology, 10, 29—419 (1960).
698. Rubin H., Response of cell and organism to infection with avian tumor viruses,
Bacteriol. Rev., 26, 1—13 (1962).
699. Rubin H., Genetic control of cellular susceptibility to pseudotypes of Rous sarcoma
virus. Virology, 26, 270—276 (1965).
700. Rubin H., Baluda M., H о t c h i n J. E., The maturation of Western equine
encephalomyelitis virus and its release from chick embryo cells in suspension,
J. Exp. Med., 101, 205—212 (1955).
701. Rubin H., Franklin R. M., On the mechanism of Newcastle disease virus neutra-
lization by immune serum, Virology, 3, 84—95 (1957).
702. R u e с к e r t R. R., D u e s b e r g P. H., Non-identical peptide chains in mouse ence-
phalitis virus, J. Mol. Biol., 17, 490—502 (1966).
703. R u e с к e r t R. R., Z i 11 i g W., Biosynthesis of virus protein in Escherichia coli C
in vivo following infection with bacteriophage q)X174, J. Mol. Biol., 5, 1—9 (1962).
704. R u i z-G omez J., Isaacs A., Optimal temperature for growth and sensitivity to
interferon among different viruses, Virology, 19, 1—7 (1963).
705. Rupert C. S., Photoenzymatic repair of ultraviolet damage in DNA. I. Kinetics of
the reaction. II. Formation of an enzyme-substrate complex, J. Gen. Physiol., 45,
703—741 (1962).
706. Russel W. G., Gold E., К eir H. M., Omur a H., Watson D. H., Wil dy P.,
The growth of herpes simplex virus and its nucleic acid, Virology, 22, 103—110
(1964).
707. Sabin A. B., Nature of inherited resistance to viruses affecting the nervous system,
Proc. Natl. Acad. Sci. U.S., 38, 540—546 (1952).
708. Sabin A., Properties of attenuated poliovirus and their behavior in human beings,
Spec. Publ. N.Y. Acad. Sci., 5, 113—127 (1957).
709. Sabin A., Present position of immunization against poliomyelitis with live virus
vaccines, Brit. Med. J., 7, 663—680 (1959).
710. Sabin A. B., Koch M. A., Evidence of continuous transmission of noninfectious
SV40 viral genome in most or all SV40 hamster tumor cells, Proc. Natl. Acad. Sci.
U.S., 49, 304—311 (1963).
711. Safferman R. S., Morris M.-E., Algal virus: isolation. Science, 140, 679—680
(1963).
402
Литература
712. S a g i к В. Р., A specific reversible inhibition of bacteriophage T2, J. Bacteriol., 68^
430-436 (1956).
713. S a 1 к J. E., with the collaboration of Bennett B. L., Lewis L. J., Ward E. N.,
Y о u n g n e r J. S., Studies in human subjects on active immunization against po-
liomyelitis. I. A preliminary report of experiments in progress, J. Am. Med. Assoc.,
151, 1081—1098 (1953).
714. S a 1 к J. E., Considerations in the preparation and use of poliomyelitis virus vaccine,
J. Am. Med. Assoc., 158, 1239—1248 (1955).
7Г5. Salzman N. P., The rate of formation of vaccinia DNA and vaccinia virus, Viro-
logy, 10, 150—152 (1960).
716. Salzman N. P., Lock art R. Z., Sebring E. D., Alterations in HeLa cell me-
tabolism resulting from poliovirus infection, Virology, 9, 244—259 (1959).
717. Salzman N. P., Sebring E. D., The source of poliovirus RNA, Virology, 13,
258—260 (1961).
718. Salzman N. P., S h a t к i n A. J., S e b r i n g E. D., On the replication of vaccinia
virus, Cold Spring Harbor Symposia Quant. Biol., 27, 237—244 (1962).
719. Salzman N. P., Shat kin A. J., Sebring E. D., The synthesis of a DNA-like
RNA in the cytoplasm of HeLa cells infected with vaccinia virus, J. Mol. Biol., 8,
405-^16 (1964).
720. Sambrook J. F., McClain M. E., Easterbrook К- B., McAuslan B. R.,.
A mutant of rabbitpox virus defective at different stages of its multiplication in three
cell type, Virology, 26, 738—745 (1965).
721. Sanchez R., Ferris J., Or gel L. E., Conditions for purine synthesis: did pre-
biotic synthesis occur at low temperatures? Science, 153, 72—73 (1966).
722. Sanchez R. A., Ferris J. P., О r g e 1 L. E., Cyanoacetylene in prebiotic synthesis,
Science, 154, 784—785 (1966).
723. Sander E., Evidence of the synthesis of a DNA phage in leaves of tobacco plants,
Virology, 24, 545—551 (1964).
724. Sanford К. K-, Earle W. R., Likely G. D., The growth in vitro of single
isolated tissues cells, J. Natl. Cancer Inst, 9, 229—246 (1948).
725. S a n f о г d К. K-, Me r w i n R. M., H о b b s G. L., Y о u n g J. M., E а г 1 e W. R., Clo-
nal analysis of variant cell lines transformed to malignant cells in tissue culture,.
J. Natl. Cancer Inst., 23, 1035—1069 (1959).
726. Sanger F., The arrangement of amino acids in proteins, Adv. in Protein Chem., 7,
1—67 (1952).
727. Sanger F., The structure of insulin. In: Currents in Biochemical Research (ed.
D Green), Interscience Publishers, New York, pp. 434—459, 1956.
728. Sarabhai A. S., Stretton A. O. W., Brenner S., Bo lie A., Со-linearity of
the gene with the polypeptide chain, Nature, 201, 13—17 (1964).
729. S а г к a r S., The amount and nature of ribonuclease sensitive infectious material
during biogenesis to tobacco mosaic virus, Z. Vererbungslehre, 97, 166—185
(1965).
730. Sato G., Activation of bacteriophage by urea. Science, 123, 891—892 (1956).
731. Schachman H., Considerations on the tertiary structure of proteins, Cold Spring
Harbor Symposia Quant. Biol., 28, 409—430 (1963).
732. Schafer W., Some observations concerning the reproduction of RNA-containing
animal viruses, Symp. Soc. Gen. Microbiol., 9, 61—81 (1959).
733. Schaffer F. L., Physical and chemical properties and infectivity of RNA from ani-
mal viruses, Cold Spring Harbor Symposia Quant. Biol., 27, 89—99 (1962).
734. Schaffer F. L., Hackett A. J., Early events in poliovirus-HeLa cell interaction:
Acridine orange photosensitization and detergent extraction, Virology, 21, 124—126
(1963).
735. Scharff M. D., Levin tow L., Quantitative study of the formation of poliovirus
antigens in infected HeLa cells, Virology, 19, 491—500 (1963).
736. Scharff M., M a i z e 1 J. V., L e v i n t о w L., Physical and immunological proper-
ties of a soluble precursor of the poliovirus capsid. Proc. Natl. Acad, Sci. U.S., 51,
329—337 (1964).
737. Scharff M. D., Shatkin A., Levin tow L., Association of newly formed viral
protein with specific polyribosomes. Proc. Natl. Acad. Sci. U.S., 50, 686—694
(1963).
738. Scherer W. F., Sy ver ton J. T., Gey G. O., Studies on the propagation in
vitro of poliomyelitis viruses. IV. Viral multiplication in a stable strain of human
malignant epithelial cells (strain HeLa) derived from an epidermoid carcinoma of
the cervix, J. Exp. Med., 97, 695—709 (1953).
739. Scherrer K-, Latham H., Darnell J. E., Demonstration of an unstable RNA
and of a precursor to ribosomal RNA in HeLa cells, Proc. Natl. Acad. Sci. U.S., 49,
240—248 (1963).
740. Schlesinger W., Interference between animal viruses. In: The Viruses. Vol. 3-
(eds. F. M. Burnet and W. M. Stanley), Academic Press, New York, pp. 157—194
(1959).
Литература
403;
741. Schmitt F. О., Bear R. S., С 1 а г к G. L., X-ray diffraction studies on nerve, Ra-
diology, 25, 131—151 (1955).
742. Scholtissek C., Rott R., Hausen P., Hausen H., Schafer W., Compara-
tive studies of RNA and protein synthesis with a myxovirus and a small polyhedral
virus, Cold Spring Harbor Symposia Quant. Biol., 27, 245—257 (1962).
743. Schuster F., An electron microscope study of the amoeboflagellate, Naegleria gru-
beri (Schardinger). I. The ameboid and flagellate stages, J. Protozool., 10, 297—313
(1963).
744. Schuster H., The ribonucleic acids of viruses. In: The Nucleic Acids, Vol. Ill (eds.
E. Chargaff and J. N. Davidson), Academic Press, New York, pp. 245—303 (I960).
745. Schuster H., Schramm G., Bestimmung der biologisch wirksamen Einheit in
der RNA des TMV auf chemischen Wege, Z. Naturforschung, 13b, 697—704 (1958).
746. Schuster L., К h о r a n a H. G., H e p p e 1 L. A., The mode of action of ryegrass
ribonuclease, Biochim. Biophys. Acta, 33, 452—461 (1959).
747. Schwerdt С. E., Fogh J., The ratio of physical particles per infectious unit obser-
ved for poliomyelitis viruses, Virology, 4, 41—{5Q (1957).
748. Sechaud J., Streisinger G., Emrich J., Newton J., Lanford H., Rein-
hold H., Stahl F. M., Chromosome structure in phage T4. II. Terminal redundancy
and heterozygosis. Proc. Natl. Acai. Sci. U.S., 54, 1333—1339 (1965).
749. S e e с о f R. L., Deleterious effects on Drosophila development associated with the
sigma virus infection, Virology, 22, 142—148 (1964).
750. Sela I., H а г f a z I., Birk Y., Suppression of virus infectivity in diseased plant
tissue following treatment with an antiviral factor from virus-infected plants, Viro-
logy, 25, 80—82 (1965).
751. Sela I., Harf az I., Birk Y., Identification of the active component of an antivi-
ral factor isolated from virus-infected plants. Virology, 28, 71—78 (1966).
752. S e m a n c i к J. S., Bancroft J. B., Further characterization of the nucleoprotein-
component of bean pod mosaic virus, Virology, 22, 33—39 (1964).
753. S e r t i с V., Origine de la lysine d’une race de bacteriophage, C. R. Soc. Biol., 10,
477—479 (1929).
754. S e 11 о w R. B., Physical changes and mutagenesis, J. Cell. Comp. Physiol., 64,
Suppl. 1, 51—68 (1964).
755. S h a 11 a T. A., Amici A., The distribution of viral antigen in cells infected with
tobacco mosaic virus as revealed by electron microscopy. Virology, 31, 78—91
(1967).
756. Sharp D. G., Quantitative use of the electron microscope in virus research. Methods
and recent results of particle counting, Lab. Invest, 14, 831—863 (1965).
757. S h a t к i n A. J., The formation of vaccinia virus protein in the presence of 5-fluoro-
deoxyuridine, Virology, 20, 292—301 (1963).
758. Shein H., Enders J. F., Transformation induced by Simian virus 40 in human
renal cell cultures. I. Morphology and growth characteristics. Proc. Natl. Acad. Sci.
U.S., 48, 1164—1172 (1962).
759. S h e 1 о к о v A., Vogel J. E., Chi L., Hemadsorption (adsorption-hemagglutina-
tion) test for viral agents in tissue culture with special reference to influenza. Proc.
Soc. Exp. Biol. Med., 97, 802—809 (1958).
760. Sherwood L. M., Potts J. T., Me lick R. A., Auerbach G. D., Parathyroid
hormone production by bronchogenic carcinomas, Proc. '48th Endocrine Soc., p. 29
(1966).
761. Shimizu T., Rubin H., The dual origin of non-infective Rous sarcomas, J. Natl.
Cancer Inst., 33, 79-91 (1964).
762. Shipp W., Haselkorn R., Double stranded RNA from tobacco leaves infected
with TMV, Proc. Natl. Acad. Sci. U.S., 52, 401—408 (1964).
763. Shope R. E., A filtrable virus causing a tumor-like condition in rabbits and its
relationship to virus myxomatosum, J. Exp. Med., 56, 803—822 (1932).
764. Shope R. E., Swine influenza. In: Virus Diseases, Cornell University Press, Ithaca,
pp. 85—109, 1943.
765. Shope R. E., «Masking», transformation, and interepidemic survival of animal vi-
ruses. In: Viruses (ed. M. Delb ruck), Pasadena, California Inst. Technol. Booksto-
re, pp. 79—92, 1950.
766. Siegel A., Mutual exclusion of strains of tobacco mosaic virus, Virology, 8,
470—477 (1959).
767. Siegel A., Wildman S. G., The inactivation of the infectious centers of tobacco
mosaic virus by ultraviolet light, Virology, 2, 69—82 (1956).
768. Siegel A., Wildman S. G., G i n о z a W., Sensitivity to ultraviolet light of in-
fectious tobacco mosaic virus nucleic acid, Nature, 178, 1117—1118 (1956).
769. Siegel A., Z a i 11 i n M., S e h g a 1 О. P., The isolation of defective tobacco mosaic
virus strains. Proc. Natl. Acad. Sci. U.S., 48, 1845—1851 (1962).
770. Signer E., Beckwith J., Transposition of the lac region of E. coli. III. The^
mechanism of attachment of coliphage q)80 to the bacterial chromosome, J. Mol. BioU
22, 33—52 (1966).
404
Литература
771. Silverstein S. C., Marcus P. I., Early stages of NDV-HeLa cell interaction:
An electron microscopic study, Virology, 23, 370—380 (1964).
772. Simon E. H., Transfer of DNA from parent to progeny in a tissue culture line of
human carcinoma of the cervix (strain HeLa), J. Mol. Biol., 3, 101—109 (1961).
773. Simon E. H., Evidence for the nonparticipation of DNA in viral RNA synthesis,
Virology, 13, 105—118 (1962).
774. Simpson R. W., Hirst G. K-, Genetic recombination among influenza viruses.
I. Cross reactivation of the plaque-forming capacity as a method for selecting recom-
binants from the progeny of crosses between influenza A strains, Virology, 15, 436—
451 (1961).
775. Sinha R. C., Sequential infection and distribution of wound-tumor virus in the in-
ternal organs of a vector after ingestion of virus, Virology, 26, 673—686 (1965).
776. S i n h a R. С., В 1 а с к L. M., Studies on the smear technique for detecting virus anti-
gens in an insect vector by use of fluorescent antibodies, Virology, 17, 582—587
(1962).
777. Sinsheimer R. L., The action of pancreatic desoxyribonuclease. I. Isolation of mo-
no- and dinucleotides, J. Biol. Chem., 208, 445—459 (1954).
778. Sinsheimer R. L., A single-stranded DNA from bacteriophage q>X174, Brookha-
ven Symp. in Biol., 12, 27—34 (1959).
779. Sinsheimer R. L., Purification and properties of bacteriophage <pX174, J. Mol.
Biol., 1, 37—42 (1959).
780. Sinsheimer R. L., Starman B., Nagler C., Guthrie S., The process of in-
fection with bacteriophage <pX174, J. Mol. Biol., 4, 142—160 (1962).
781. Сисакян H. M., Филипович И. И., Светайло Е. Н., Алиев К. A., On
the protein-synthesizing system of chloroplasts, Biochim. Biophys. Acta, 95, 474—485
(1965).
782. Six E., The rate of spontaneous lysis of lysogenic bacteria, Virology, 7, 328—346
(1959).
783. Six E., Specificity of P2 for prophage site I on the chromosome of Escherichia coli
strain S., Virology, 29, 106—12l5 (1966).
784. Sjogren H. O., Hellstrom I., Klein G., Transplantation of polyoma virus
induced tumors in mice. Cancer Res., 21, 329—337 (1961).
785. S m a d e 1 J. E., Rivers T. M., Pickles E. G., Estimation of the purity of prepa-
rations of vaccinia elementary bodies, J. Exp. Med., 70, 379—385 (1939).
786. Smith H. O., Levine M., Two sequential repressions of DNA synthesis in the
establishment of lysogeny by phage P22 and its mutants, Proc. Natl. Acad. Sci. U.S.,
52, 356—363 (1964).
787. Smith H. O., Levine M., The synthesis of phage and host DNA in the establish-
ment of lysogeny, Virology, 25, 585—5190 (1965).
788. Smith К. M., Arthropods as vectors and reservoirs of phytopathogenic viruses. In:
Handbuch der Virusforschung (eds. C. Hallauer and K. F. Meyer), Springer,
Vienna, pp. 143—176, 19158.
789. Smith К. M., The insect viruses. In: The Viruses, Vol. 3 (eds. F. M. Burnet and
W. M. Stanley), Academic Press, New York, pp. 369—392, 1959.
790. Smith К- M., Brown R. M., Jr., A study of the long virus rods associated with
insect granuloses. Virology, 27, 512—519 (1965).
791. Smith К. M., Brown R. M., Jr., G о 1 d s t e i n D. A., V a 1 n e P. L., Culture
methods for the blue-green alga Plectonema boryanum and its virus, with an electron
microscope study of virus-infected cells, Virology, 28, 580—591 (1966).
792. Smith P. F., Comparative physiology of pleuropneumonia-like and L-type organisms,
Bacteriol. Rev., 28, 97—125 (1964).
793. Smith S. H., Schlegel D. E., The incorporation of ribonucleic acid precursors in
healthy and virus-infected plants, Virology, 26, 180—189 (1965).
794. Smith S. M., Ozeki H., Stocker B. A. D., Transfer of colEl and colE2 during
high-frequency transmission of coll in Salmonella typhimurium, J. Gen. Microbiol.,
33, 231—242 (1963).
795. Smithies O., Antibody induction and tolerance. Science, 149, 151—156 (1965).
796. S n e a t h P. H. A., The construction of taxonomic groups. Symp. Soc. Gen. Micro-
biol., 12, 289—332 (1962).
797. Sober H. S., Gutter F. J., Wyckoff M. M., Peterson E. A., Chromatography
of proteins. II. Fractionation of serum protein on anion-exchange cellulose, J. Am.
Chem. Soc., 78, 756—763 (1956).
798. Soli D., Ohtsuka E., Jones D. S., Lohrmann R., Hayatsu H., Nishi-
mura S., К h о r a n a H. G., Studies on polynucleotides, XLIX, Proc. Natl. Acad. Sci.
U.S., 54, 1378—1385 (1965).
799. Sonneborn T. M., Kappa and related particles in Paramecium, Adv. Virus Res.,
6, 229—356 (1959).
800. Sonneborn T. M., The metagon: RNA and cytoplasmic inheritance, Am. Natura-
list, 99, 279—307 (1965).
Литература
405
801. Sonneborn Т. М.. The evolutionary integration of the genetic material into gene-
tic systems. In: Heritage from Mendel (ed. R. A. Brink), Univ. Wisconsin Press.
Chap. 19, pp. 3'75—401, 1967.
802. Spendlove R. S., Lennette E. H., J e h n A. C., The role of the mitotic appa-
ratus in the intracellular location of reovirus antigen, J. Immunol., 90, 554—560
(1963).
803. Spiegelman S., Haruna I., A rationale for an analysis of RNA replication,
Proc. Natl. Acad. Sci. U.S., 55, 1539—1554 (1966).
804. Spiegelman S., Haruna I., Holland I. B., Beaudreau G., Mills D.,
The synthesis of a self-propagating and infectious nucleic acid with a purified enzy-
me, Proc. Natl. Acad. Sci. U.S., 54, 919—927 (1965).
805. Stanier R. Y., Toward a definition of bacteria. In: The Bacteria, Vol. 5 (eds.
I. C. Gunsalus and R. Y. Stanier), Academic Press, New York, 1964.
806. Stanley W. M., Isolation of a crystalline protein possessing the properties of the
tobacco-mosaic virus, Science, 81, 644—64*5 (1936).
807. Stanley W M., Chemical structure and the mutation of virus. In: Virus Diseases,
Cornell University Press, Ithaca, pp. 35—59, 1943.
808. Stanners С. P Studies on the transformation of hamster embryo cells in culture
by polyoma virus. II. Selective techniques for the detection of transformation cells,
Virology, 21, 464—476 (1963).
809. Steinberg C., Stahl F., The theory of formal phage genetics, Cold Spring Har-
bor Symposia Quant. Biol., 23, 42—45 (1958).
810. Steinberg C., Stahl F., The clone-size distribution of mutants arising from a
steady-state pool of vegetative phage, J. Theoret, Biol., 1, 488—497 (1961).
811. Stein haus E. A., Insect Microbiology, Comstock, Ithaca, 1946.
812. Steinhaus E. A., Leutenegger R., Icosahedral virus from a scarab (Seri-
cesthis), J. Insect Pathol., 5, 266—270 (1963).
813. Stent G. S., Fuerst C. R., Genetic and physiological effects of the decay of in-
corporated radioactive phosphorus in bacterial viruses and bacteria, Adv. Med. Biol.
Phys., 7, 1—75 (1960).
814. Stent G. S., Wollman E. L., Studies on activation of T4 bacteriophage by co-
factor. II. Biochim. Biophys. Acta, 6, 307—316 (1950).
815. Stevens A., Incorporation of adenine ribonucleotide into RNA by cell fractions
from E. coli B, Biochem. Biophys. Res. Commun., 3, 92—96 (1960).
816. Stewart S. E., Eddy В. E., The polyoma virus (Sections A and B), Adv. Virus
Res., 7, 61 — 102 (1960).
817. Stewart S. E., Eddy В. E., Stanton M. F., Induction of neoplasms in mice
and other mammals by a tumor agent carried in tissue culture, Proc. Canad. Cancer
Conf., 3, 287—305 (1969).
818. Stich H. F., Hsu T. C., Rapp R., Viruses and mammalian chromosomes. I. Loca-
lization of chromosome aberrations after infection with herpes simplex virus, Virolo-
gy, 22, 439—445 (1964).
819. Stoker M., Regulation of growth and orientation in hamster cells transformed by
polyoma virus, Virology, 24, 165—174 (1964).
820. Stoker M. G. P., Newton A., The effect of herpes virus on HeLa cells dividing
parasynchronously, Virology, 7, 438—448 (1959).
821. Stone J. D., Prevention of virus infection with enzyme of V. cholerae. I. Studies
with viruses of mumps-influenza group in chick embryos. II. Studies with influenza
virus in mice. Austral. J. Exptl. Biol, and Med., 26, 49—64; 287—298 (1948).
822. Storey H. H., Investigations of the mechanism of the transmission of plant viruses
by insect vectors. I, Proc. Roy. Soc. (London) B, 113, 463—485 (1933).
823. S tr ack H. B.. Ka iser A. D., On the structure of the ends of lambda DNA, J. Mol.
Biol., 12, 36—49 (1965).
824. S t r e i s i n g e r G., Edgar R. S., D e n h a r d t G. H., Chromosome structure in
phage T4. I. Circularity of the linkage map, Proc. Natl. Acad. Sci. U.S., 51, 775—779
(1964).
825. Streisinger G., Mukai F., Dreyer W. J., Miller B... Horiuchi S., Mu-
tations affecting the Ivsozyme of phage T4, Cold Spring Harbor Symposia Quant.
Biol., 26, 25—30 (1961).
826. Streisinger G., Okada Y., Emrich J., Newton J., Tsugita A., Ter-
zaghi E., Inouye M., Frame shift mutations and the genetic code. Cold Spring
Harbor Symposia Quant. Biol., 31, 77—84 (1966).
827. S u b a k-S h а г p e H., Shepherd W. M., Hay J., Studies on sRNA coded by her-
pes virus, Cold Spring Harbor Symposia Quant. Biol., 31, 583—594 (1966).
828. S u e о к a N., Mitotic replication of DNA in Chlamydomonas reinhardi, Proc. Natl.
Acad. Sci. U.S., 46, 83—91 (1960).
829. Sueoka N.. Kan o-S u e о к a T., A specific modification of leucyl-sRNA of Esche-
richia coli after phage T2 infection, Proc. Natl. Acad. Sci. U.S., 52, 1535—1'540
(1964).
406
Литература
830. S u g i у a m a T., Tobacco mosaic viruslike rods formed by «mixed reconstitution»
between MS2 ribonucleic acid and tobacco mosaic virus protein, Virology, 28, 488—
492 (1966).
831. Summers D. F., Lev in tow L., Constitution and function of polyribosomes of
poliovirus-infected HeLa cells, Virology, 27, 44—53 (1965).
<432. Summers D. F., Maizel J. V., Darnell J. E., Evidence for virus-specific non-
capsid proteins in poliovirus-infected HeLa cells, Proc. Natl. Acad. Sci. U.S. 54,
505—513 (1965).
833. Sutter R. P., Moldave K-, The interaction of aminoacyl transferase II and ribo-
somes, J. Biol. Chem., 241, 1698—1704 (1966).
834. Sv eha g S., The formation and properties of poliovirus-neutralizing antibody.
Ill, J. Exp. Med., 119, 225—240 (1964).
835. Svehag S., Mandel B., The formation and properties of poliovirus-neutralizing
antibody, J. Exp. Med., 119, 1—39 (1904).
836. Sweet B. H„ H i 11 e m a n M. R., The vacuolating virus, SV40, Proc. Soc. Exp. Biol.
Med., 105, 420—427 (1960).
837. Syverton J., Present status of studies on tumor-producing viruses, Natl. Cancer
Inst. Monograph, 4, 345—353 (1959).
838. Takahashi W. N., Ishii M., The formation of rod-shaped particles resembling
tobacco mosaic virus by polymerization of a protein from mosaic-diseased tobacco
leaves, Phytopathol., 42,’690—691 (1952).
839. Tamm L, E g g e г s H. J., Specific inhibition of replication of animal viruses. (A re-
view), Science, 142, 24—33 (1963).
840. Temin H. M., Separation of morphological conversion and virus production in Rous
sarcoma virus infection, Cold Spring Harbor Symposia Quant. Biol., 27, 407—414
(1962).
841. Temin H. M., The participation of DNA in Rous sarcoma virus production, Virolo-
gy, 23, 486—494 (1964).
842. Temin H. M., Homology between RNA from Rous sarcoma virus and DNA from
Rous sarcoma virus-infected cells, Proc. Natl. Acad. Sci. U.S., 52, 323—329 (1964).
843. Temin H. M., Rubin H., Characteristics of an assay for Rous sarcoma virus and
Rous sarcoma cells in tissue culture, Virology, 6, 669—688 (1958).
844. Temin H. M., Rubin H., A kinetic study of infection of chick embryo cells in
vitro by Rous sarcoma virus, Virology, 8, 209—222 (1959).
845. Terzaghi E., Okada Y., Streisinger G., Emrich J., Inouye M., Tsu-
g i t a A., Change of a sequence of amino acids in phage T4 lysozyme by acridine-in-
duced mutations, Proc. Natl. Acad. Sci. U.S., 56, 500—507 (1966).
846. Terzi M., Radiosensitivity and genetic complexity, J. Theoret. Biol., 8, 233—243
(1965).
847. Tessman L, Some unusual properties of the nucleic acid in bacteriophages S13
and q)X174, Virology, 7, 263—275 (1959).
848. Tessman I., Genetic ultrafine structure in the Т4/7/ region, Genetics, 51, 63—75
(1965).
849. Thach R. E., Cecere M. A., Sundarajan T. A., Doty P., The polarity of
messenger translation in protein synthesis. Proc. Natl. Acad. Sci. U.S., 54, 1167—1173
(1965).
850. Thomas C. A., Jr., The arrangement of information in DNA molecules, J. Gen. Phy-
siol., 49 (№ 6, part 2), 143—169 (1966).
851. Thomas C. A., Jr., MacHattie L. A., Circular T2 DNA molecules, Proc. Natl.
Acad. Sci. U.S., 52, 1297—1301 (1964).
852. Thomas C. A., Jr., Rubenstein L, The arrangements of nucleotide sequences in
T2 and T5 bacteriophage DNA molecules, Biophys. J., 4, 93—106 (1964).
853. Thompson A. D., Interaction between plant viruses. I. Appearance of new strains
after mixed infection with potato virus X strains, Virology, 13, 507—514 (1961).
854. Thompson R. L., Minton S. A., Officer J. E., H i t c h i n g s G. H., Effect of
heterocyclic and other thiosemicarbazones on vaccinia infection in the mouse, J. Im-
munol., 70, 229—235 (1953).
855. Tissieres A., Watson J. D., Schlessinger D., H oilingworth B. R.,
Ribonucleoprotein particles from E. coli, J. Mol. Biol., 1, 221—233 (1959).
856. To Im a ch L. J., Attachment and penetration of cells by viruses, Adv. Virus Res.,
4, 63—110 (1957).
857. Traub E., Epidemiology of lymphocytic choriomeningitis in a mouse stock observed
for four years, J. Exp. Med., 69, 801—817 (1939).
858. T r e n t i n J. J., Ya be Y., T а у 1 о r G., The quest for human cancer viruses, Science,
37, 835—841 (1962).
859. Tsugita A., Studies on the N-terminal sequence of tobacco-mosaic virus protein,
Biochim. Biophys. Acta, 38, 145—146 (1959).
860. Tsugita A., Gish D. T., Young J., F r a e n к e 1-C о n r a t H., Knight C. A.,
S t a n 1 e у W. M., The complete amino acid sequence of the protein of TMV, Proc. Natl.
Acad. Sci. U.S., 46, 1463—1469 (1960).
Литература
407
861. Т s u t s u i E., Srinivasan P. R., В о г e к E., tRNA methylases in tumors of ani-
mal and human origin, Proc. Natl. Acad. Sci. U.S., 56, 1003—1009 (1966).
862. Twort F. W., An investigation on the nature of ultramicroscopic viruses, Lancet (2).
189, 1241—1243 (1915).
863. Tyrrell D. A. J., Ch a nock R. M., Rhinoviruses: A description, Science, 141,
152—153 (1963).
864. Uetake H., Luria S. E., Burrous J. W., Conversion of somatic antigens in Sal-
0958)^ PhaSe infection leading to lysis or lysogeny, Virology, 5, 68—91
866. V a g о C., The phenomenon of latency in a disease caused by the ultravirus of in-
sects, Rev. Canad. Biol., 10, 299—307 (1951).
866. Valentine R. C., Pereira H. G., Antigens and structure of the adenovirus,
J. Mol. Biol., 13, 13—20 (1965).
867. Van Rysselberge C., Jeener R., Plant virus synthesis and the abnormal pro-
tein constituents of infected leaves, Biochim. Biophys. Acta, 23, 18—23 (1957).
868. V i n о g r a d J., Bruner R., Kent R., W e i g 1 e J., Band-centrifugation of macro-
molecules and viruses in self-generating density gradients. Proc. Natl. Acad. Sci. U.S.,
49, 902-910 (1963).
869. Vinograd J., Lebowitz J., Radloff R., Watson R., Laipis P., The
twisted circular form of polyoma viral DNA, Proc. Natl. Acad. Sci. U.S., 53, 1104—
1110 (1965).
870. Visconti N., De lb ruck M., The mechanism of genetic recombination in phage,
Genetics, 38, 5—33 (1963).
871. Vogel J., She Iakov A., Adsorption-hemagglutination test for influenza virus in
monkey kidney tissue cultures, Science, 126, 338—359 (1957).
872. Vogt M., Dulbecco R., Virus-cell interaction with a tumor-producing virus, Proc.
Natl. Acad. Sci. U.S., 46, 365—370 (1960).
873. Vogt M., Dulbecco R., Properties of cells transformed by polyoma virus, Cold
Spring Harbor Symposia Quant. Biol., 27, 367—374 (1962).
874. Vogt M., Dulbecco R., Studies on cells rendered neoplastic by polyoma virus.
The problem of the presence of virus-related materials, Virology, 16, 41—61 (1962).
875. Vogt M., Dulbecco R., Steps in the neoplastic transformation of hamster embryo
cells by polyoma virus, Proc. Natl. Acad. Sci. U.S., 49, 171—179 (1963).
876. V о g t P. K , R u b i n H., The cytology of Rous sarcoma virus infection, Cold Spring
Harbor Symposia Quant. Biol., 27, 395—405 (1962).
877. V о g t P. K , S а г m a P. S., Huebner R. J., Presence of avian tumor virus group-
specific antigen in nonproducing Rous sarcoma cells of the chicken, Virology, 27,
233—236 (1965).
878. V о I к i n E., A s t г a c h a n L., Phosphorus incorporation in Escherichia coli ribo-
nucleic acid after infection with bacteriophage T2, Virology, 2, 149—161 (1956).
879. V о 1 к i n E., A s t r a c h a n L., Intracellular distribution of labelled ribonucleic acid
after phage infection of Escherichia coli, Virology, 2, 433—437 (1956).
880. De W a a r d A., Paul A. V., Lehman I. R., The structural gene for deoxyribo-
nucleic acid polymerase in bacteriophages T4 and T5, Proc. Natl. Acad. Sci. U.S., 54,
1241—1248 (1965) .
881. Wacker A., Molecular mechanisms of radiation effects, Progr. Nucleic Acid Res.,
1, 369—399 (1963).
882. Wagner R. R., Viral interference: Some considerations of basic mechanisms and
their potential relationship to host resistance, Bacteriol. Rev., 24, 151—166 (1960).
883. Wagner R. R., Biological studies of interferon. I. Suppression of cellular infection
with Eastern equine encephalomyelitis virus, Virology, 13, 323—337 (1961).
884. Wagner R. R., Cellular resistance to viral infection with particular reference to
endogenous interferon, Bacteriol. Rev., 27, 72—86 (1963).
885. Van Wagtendonk W. J., Clark J. A. D., Godoy G. A., The biological status
of lambda and related particles in Paramecium aurelia, Proc. Natl. Acad. Sci. U.S.,
50, 835—838 (1963).
886. Wahl R., Kozloff L. M., The nucleoside triphosphate content of various bacterio-
phages, J. Biol. Chem., 237, 1953—1960 (1962).
887. Warner J., Knopf P., Rich A., A multiple ribosomal structure in protein synthe-
sis, Proc. Natl. Acad. Sci. U.S., 49, 122—129 (1963).
888. Watanabe T., Infective heredity of multiple drug resistance in bacteria, Bacteriol.
Rev., 27, 87—115 (1963).
889. Watanabe Y., Watanabe К., H i n u m a Y., Synthesis of poliovirus-specific
proteins in HeLa cells, Biochim. Biophys., Acta, 61, 976—*977 (1962).
890. Watson J. D., The properties of X-ray inactivated bacteriophage. I, J. Bacteriol.,
60, 697—718 (1950).
891. W a t s о n J. D., Crick F. H. C., A structure for desoxvribose nucleic acids. Nature,
171, 737—738 (1953).
892. Watson J. D., Crick F. H. C., Genetical implications of the structure of desoxy-
ribose nucleic acid, Nature, 171, 964—969 (1953).
408
Литература
893. Watson J. D., Littlefield J. W., Some properties of DNA from Shope papillo-
ma virus, J. Mol. Biol., 2, 161—165 (1960).
894. Week er E., Die Verteilung von 32P in Virus der klassischen Gef f lugclpest bei
verschiedenen Markierungsverfahren, Z. Naturforsch., 12b, 208—210 (1957).
895. Wecker E., The extraction of infectious virus nucleic acid with hot phenol, Viro-
logy, 7, 241—243 (1968).
896. Wecker E., Lederhilger G., Genomic masking produced by double infection of
HeLa cells with heterotypic polioviruses, Proc. Natl. Acad. Sci. U.S., 52, 705—709
(1964).
897. Wecker E., Richter A., Conditions for the replication of infectious viral RNA,
Cold Spring Harbor Symposia Quant. Biol., 27, 138—148 (1962).
898. Wecker E., Schonne E., Inhibition of viral RNA synthesis by parafluoropheny-
lalanine, Proc. Natl. Acad. Sci., U.S., 47, 278—282 (1961).
899. Wei del W., Bacterial viruses (with particular reference to adsorption/penetration),
Ann. Rev. Microbiol., 12, 27-^48 (1958).
900. W e i d e 1 W., Pelzer H., Bagshaped macromolecules — A new outlook on bacterial
cell walls, Adv. Enzymology, 26, 193—232 (1964).
901. Weigert M. G., Lanka E., Garen-A., Amino acid substitutions resulting from
suppression of nonsense mutations. II. Glutamine insertion by the Su-2 gene; tyro-
sine insertion by the Su-3 gene, J. Mol. Biol., 14, 522—1527 (1965).
902. Weigle J., Assembly of phage X in vitro, Proc. Natl. Acad. Sci. U.S., 55, 1462—
1466 (1966).
903. Weil R., The subviral infective agent from polyoma virus, Cold Spring Harbor Sym-
posia Quant. Biol., 27, 83—88 (1962).
904. Weil R., Michel M. R„ Ruschman G. K-, Induction of cellular DNA synthesis
by polyoma virus, Proc. Natl. Acad. Sci. U.S., 53, 1468—1475 (1965).
905. Weiler E., A cellular change in hamster kidney cultures: loss of tissue specific an-
tigen, Exptl. Cell Res., 7, (Suppl.), 244—262 (1959).
906. Weiss S. B., Enzymatic incorporation of ribonucleoside triphosphates into the in-
terpolynucleotide linkages of ribonucleic acid, Proc. Natl. Acad. Sci. U.S., 46, 1020—
1030 (1960).
907. Weissman C., Replication of viral RNA. VII. Further studies on the enzymatic
replication bf MS2 RNA, Proc. Natl. Acad. Sci. U.S., 54, 202—207 (1965).
908. W e i s s m a n С., В i 11 e t e r M. A., Schneider M. G., Knight C. A , Ochoa S.,
Replication of viral RNA. VI. Proc. Natl. Acad. Sci. U.S., 53, 653—656 (1965).
909. Wheelock E. F., Tamm I., Mitosis and division in HeLa cells infected with
influenza or Newcastle disease virus, Virology, 8, 532—536 (1959).
910. Whitcomb R. F., Jensen D. D., Richardson J., The infection of leafhoppers
by Western X-disease virus, Virology, 28, 454—458 (1966).
911. White D. O., Day H. AL, Batchelder E. J., Cheyne I. M., W a i n-
sb rough A. J., Delay in the multiplication of influenza virus, Virology, 25, 289—
302 (1965).
912. W i b e r g J. S., D i г к s e n M.-L., Epstein R. M., Luria S. E., Buchanan J. M.,
Early enzyme synthesis and its control in E. coli infected with some amber
mutants of bacteriophage T4, Proc. Natl. Acad. Sci. U.S., 48, 293—302 (1962).
913. Wildy P., Watson D. H., Electron microscopic studies on the architecture of ani-
mal viruses, Cold Spring Harbor Symposia Quant. Biol., 27, 25—47 (1962).
914. Wilkins M. H. F., Stocker A. R., Seeds W. E., Oster G., Tobacco mosaic
virus crystals and tri-dimensional microscopic vision, Nature, 166, 127—139 (I960).
915. Wilkins M. H. F., Stockes A. R., Wilson H. R., Molecular structure of de-
soxypentose nucleic acids, Nature, 171, 738—740 (1953).
916. Williams R. C., A method of freeze-drying for electron microscopy, Exptl. Cell.
Res., 4, 188—201 (1953).
917. Williams R. C., Backus R. C., Macromolecular weights determined by direct
particle counting. I. J. Am. Chem. Soc., 71, 4052—4057 (1949).
918. Williams R. C., Wyckoff R. W. G., Applications of metallic shadow-casting to
microscopy, J. Appl. Phys., 17, 23—33 (1946).
919. Wilson J. N., Cooper P. D., Photodynamic demonstration of two stages in the
growth of poliovirus, Virology, 17, 195—196 (1962).
920. W i n о с о u г E., Kaye A. M., S t о 11 а г V., Synthesis and transmethylation of DNA
in polyoma-infected cultures, Virology, 27, 159—169 (1965).
921. Wittman H. G., W i 11 m a n-L i e b о 1 d B., Tobacco mosaic virus mutants and the
genetic coding problem, Cold Spring Harbor Symposia Quant, Biol., 28, 589—595
(1963).
922 Wo liman E. L., Transduction specifique du marqueur biotine par le bacteriopha-
ge 1, C. r. Acad. Sci., 257, 4225—4226 (1963).
923. W о 11 m a n E. L., Jacob F., Sur le processus de conjugaison et de recombinaison
chez E. coli. II. La localisation chromosomique du prophage X et les jeonsequences
genetiques de 1’induction zygotique, Ann. Inst. Pasteur, 93, 323—334 (1957).
Литература
409
924. Wood Н. A., Bancroft J. В., Activation of a plant virus by related incomplete
nucleoprotein particles, Virology, 27, 94—102 (1965).
925. Woodroofe G. M., Fenner F., Serological relationships within the poxvirus
group: An antigen common to all members of the group, Virology, 16, 334—341
(1962).
926. Woodson B., J о к 1 i к W. К., The inhibition of vaccinia virus multiplication by isa-
tin p-thiosemicarbazone, Proc. Natl. Acad. Sci. U.S., 54, 946—953 (1966).
927. Wyatt G. R., Cohen S. S., The bases of the nucleic acids of some bacterial and
animal viruses: The occurrence of 5-hydroxymethylcytosine, Biochem. J., 55, 774—782
(1953).
928. Wyatt S. S., Culture In vitro of tissues from the silkworm Bombix mori, J. Gen.
Physiol., 39, 841—852 (19156).
929. Xeros N., A second virus disease of the leather jacket, Tipula paludosa, Nature, 170,
1073 (1954).
930. Y a m a f u j i K., Metabolic virogens having mutagenic action and chromosomal pre-
viruses, Enzymologia, 27, 217—274 (1964).
931. Y a n о f s к у C., St. Lawrence P., Gene Action, Ann. Rev. Microbiol., 14, 311—340
(1960).
932. Y о u d e n W. J., Use of incomplete block replications in estimating tobacco mosaic
virus, Contrib. Boyce Thompson Inst., 9, 41—48 (1937).
933. Y о u d e n W. J., В e a 1 e H. P., A statistical study of the local lesion method for esti-
mating tobacco mosaic virus, Contrib. Boyce Thompson Inst, 6, 437—454 (1934).
934. Young E. T., S i n s h e i m e r R. L., Novel intra-cellular form of lambda DNA,
J. Mol. Biol., 10, 562—564 (1964).
935. Y о u n g n e r J. S., Noll H., Virus-lipid interactions. I. Concentration and purifica-
tion of viruses by adsorption to a cholesterol column studies of the biological proper-
ties of lipid adsorbed virus, Virology, 6, 157—180 (1958).
936. Z a m e c n i к P. C., Historical and current aspects of the problem of protein synthe-
sis, Harvey Leet., 54, 256—281 (1960).
937. Zimmerman E. F., Heeter M., Darnell J. E., RNA synthesis in poliovirus
infected cells, Virology, 19, 400—408 (1963).
938. Zimmerman T., Schafer W., Effect of p-fluorophenylalanine on fowl plague
virus multiplication, Virology, 11, 676—698 (1960).
939. Zinder N. D., RNA phages, Ann. Rev. Microbiol., 19, 455—472 (1965).
940. Zinder N. D., L e d e r b e r g J., Genetic exchange in Salmonella, J. Bacteriol., 64,
679-699 (1952).
941. Zissler J., Integration-negative (int) mutants of phage X, Virology, 31, 189
(1967).
27 Заказ № 1214
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Абортивный цикл репродукции вируса 30
Автотрофы 365
I-адамантанамин солянокислый 320
Адансона принцип 24
Аденин 77, 78, 96
Аденовирус (ы) 20
— антигены 114
<— капсомеры 66
— помощь вирусу SV-40, 144, 334
— трансформирующая активность 333
— цикл размножения 267, 290
— цитопатический эффект 301
8-азагуанин 344
Азотистая кислота 122
---мутагенное действие 87, 88
Азотистые основания 74
---метилированные производные 74
Акридины, инактивация вируса 136
Актин 368
Актиномицин D 274, 275, 278, 305
— влияние на ВТМ 342
— и репликация миксовирусов 285
— при заражении вирусом осповакцины
290
Алкилирующие агенты 122
Аминокислоты 82
бис- (3-аминопропил) -амин 101
Антиген (ы) ,102
— группоспецифические 113
— конверсия 226
— полисахаридной природы 106
— связанные с клеткой 106
— штаммоспецифические 113
О-антиген у Salmonella 226
S-антиген 284, 285
Антигенная мозаичность вирусов 113
Антигенные детерминанты 105
Антикодон 89
Антитела 102
— анамнестическое образование 103
— антифаговые 108, ПО
— противовирусные 102
Арбовирус (ы) 19, 30, 286
— вызываемые ими заболевания 313
— гемагглютинация 254
— репликация 284
Ауксотрофы 365
Бактерии, жгутики 159
— лизогенные; индукция ультрафиоле-
том 219, 220
— половые ворсинки 159
— рецепторные участки 157
— L-формы 11
Бактериофаг (и) 16
— адсорбция бактериями 155
— бляшки 29, 31
Бактериофаг (и) вирулентные 149
— выход 150
— выявление 28
— глюкозилирование ДНК 169
— ДНК 95
---- конденсация 167
— инактивация рентгеновскими лучами
129, 130
— и РНК хозяина 175
— как источники материала, используе-
мого при биосинтезе 163
— коиммунный 219
— кофакторы адсорбции 157
— модификации, вызванные хозяином
145, 208, 209
— мутанты и мутации 177
----выделение 177, 178
---- типы 177
----условно летальные 182
— нуклеиновая кислота инфекционная
171
— облучение 211
----чувствительность функции того или
иного локуса 212
— проникновение в клетку-хозяина 161г
162
— размножение 154
— регуляция последовательности считы.-
вания генов 170
— рекомбинация 185, 191, 193
— репродукция 159
— рецепторные участки 157
— РНК 91
— РНК-содержащие, зависимые от тем-
пературы мутанты 174
---- репродукция 173
— серология 106
— скрещивания ди- и трифакториальные
187
— специфичность по отношению к муж-
ским штаммам бактерий 159
— Т4 109, ПО
— Т5 162
---- инактивация нагреванием 125
----ферменты 170
— Т-четные, АТФ 162
---- биосинтез 165
---- влияние перекиси 122
---- внутренний белок 100
----ДНК 163, 169, 196
---- строение 66, 67
----ферменты 168
----Het-частнцы 197
----л-частицы 171
— типы взаимодействия с бактериями
149
— титрование 37
410
Предметный указатель
411
Бактериофаг (и) умеренные 149
— чувствительность к облучению 135
— эффект депрессии 185
— Е. coli, свойства 151
— f2 96
— Р22 223
— Pl, трансдукция 228
— Р1СЛ1, геном 233
— Pldi, геном 232
— PLT22 и Л 222
— S13, ДНК 93
— А 171
--- генетическая карта 221
---ДНК 94, 95
---мутанты 220, 224
--- трансдукция 230
— Adg 230
- X 159
— фХ174, капсид, структура 64
---ДНК 93, 171
Бактериоциногенности факторы 233, 235,
371, 372
Бактериоцины 234
Бациллы проказы 11
Белки, аминокислотная последователь-
ность 83
— вирусные 95, 275
— синтез и структура 82, 83, 90, 275, 282
Бензера система 202
Берри — Дедрика феномен 295
Бляшки 31
— морфология 29
— подсчет числа 45
Бляшкообразующие единицы 37
Бромдезоксиуридин 319
5-бромурацил 134
Вакцина Солка 316
Вакцинация 116, 315
Вакцины живые и убитые 117
— инактивированные воздействием на
вирус формальдегида 122, 123
Вегетативное размножение 149
Вирион (ы) 10, 12, 16, 35, 120
— влияние ферментов 120
---физических факторов 124
— измерение плотности 55
— и инфекционные единицы 48
— молекулярные веса 93
— очистка 7, 50
— повреждения 120
— свойства 50—70
— сформированные неполностью 69
— типы организации 61
— чувствительность к облучению 130, 131
«Вироидная» гипотеза 376
Вирус(ы) 9—12, 15, 16, 33
— бактерий 17
— везикулярного стоматита 68
— выявление и идентификация 26—35
— геном 16
— герпеса 20
---и ДНК хозяина 303
--- капсид 64
---мутанты 292
---оболочки внешние 291
---образование поликариоцитов 240
---размножение 146, 267, 290
---химиотерапия 319
---хромосом разрывы 302
27*
Вирус(ы) герпеса, цитопатический эф-
фект 301
— гравировки табака 345
— гриппа 30
----агглютинирование эритроцитов 71,
254
---- влияние актиномицина 285
--------ультрафиолета 133
---- ингибирование 320
----мутанты 292
— — нейротропный штамм 306
----оболочка внешняя 256
---- очистка 71
---- проникновение в клетку 252
— гриппа А, скорость седиментации 56
— группы оспы 19
-------- антигены 114
--------Берри — Дедрика феномен 295
--------гемагглютинация 254
--------генетика и рекомбинация 294
--------ДНК, состав оснований 286
-------- изменения в цитоплазме зара-
женных клеток 301
--------морфология 68
--------проникновение в клетку-хозяи-
на 261
--------«раздевающий белок» 306
--------размножение 146, 272
--------реактивация и рекомбинация
294
— действие излучения 126
— ДНК и белок 95
— ДНК-содержащие 19, 93
— желтой карликовости картофеля 355
---- лихорадки 31, 313
----мозаики турнепса 65, 346
----------капсомеры и кристаллогра-
фические единицы 64, 65
----------кристаллы 72
— желтухи астр 124, 354
----свеклы 345
— животных 17
----выделение из клегок 270
----выявление 29
----гемагглютинация 254
---- генетика 291—296
---- инвазия 251
----индуктивное действие на клетку
298
----мутанты 291, 292
----присоединение к клетке-хозяину
261—263
----размножение 265—296
--------кривые 266, 267
--------параметры 269
---- репликация 284
---- серология 111
---- созревание 281
---- титрование 38
----трансформация 298
---- характеристика и представители
основных групп 18
----цитолитический эффект 297
— западного энцефаломиелита лошадей
112
— икосаэдрические, репликация 275
— инактивация тепловая 124—126
— как организм 13, 14
----регрессировавшие паразиты 365
— капсидный белок 97, 98
412
Предметный указатель
Вирус (ы) классификация и номенклатура
21
---- критерии 24
— классической чумы пгиц 284, 285
— Коксеки 18, 318
— кольцевой пятнистости табака, пере-
носчики 355
— контагиозного пустулезного дерматита
68
— кори, гемагглютинация 254
---- образование поликариоцитов 240
----цитопатический эффект 300
— костра 49
— крапчатости бобов фасоли 348
— кристаллизация 16
— курчавости верхушки свеклы 34
— латентные 28
— лимфоцитарного хориоменингита 31,
119, 315
— Менго 302, 304
— морщинистой курчавости листьев кар-
тофеля 35, 352
— насекомых 356—362
----капсулы 68
— — латентные инфекции 360
----морфология 68
---- полиэдрозы 356
----полиэдры 69
----размножение 359
— ньюкаслской болезни 20, 253
--------гемагглютинация и гемадсорб-
ция 253, 254
--------гетерозиготы 294
--------мутанты 292
--------присоединение к клетке 256
--------размножение 267
--------РНК 91
— огуречной мозаики 344
— определения 9—11
— опухолеродные 240, 321—338
----маскированное состояние 326
----содержание в вакцинах 317
----центры (очаги) пролиферации 31,
39
— осповакцины, антигены 114
----биосинтез 288, 289
----влияние на ДНК хозяина 303
----------рибосомы 305
--------ультрафиолета 262
----инфекционные единицы 47
----инфекция, начальные стадии 261
----мутанты 292
----полирибосомные системы и синтез
белка 288
----проникновение в клетку-хозяина
140, 262
---- «раздевание» 261
----размножение 266, 267, 269
----титрование на коже 47, 48
----ферменты 288
-------- индукция 289
— оспы коровьей, вакцинация 159, 315
— папилломы Шоупа 326
--------ДНК 94
---------- кольцевая 335
— парагриппа 285
— патогенность 11
— переносчики 313, 352—355
— полиомиелита 30, 112, 247, 291
----антигены 333
Вирус(ы) полиомиелита, антитела 115
----влияние на ДНК и РНК хозяина
302, 304
---- генетика 292
---- инактивация 118, 132, 259
----капсид, субъединицы 99
----кристаллы 72
----мутанты 291
---- пептидных цепей образование 283
---- потеря чувствительности к дейст-
вию антител 258
----проникновение в клетку-хозяина
257
---- путь в организме 313
----размножение 269, 292
---- реактивация 293
----рекомбинация 293
---- репликация 275
----РНК, инфекционность 145
----синтез РНК и белка 276, 277
----фенотипическое смешивание 292
----чувствительность к нагреванию 117
— полиомы 31
----гемагглютинация 254
----действие на хромосомы 302
----ДНК 94, 95
----ДНК кольцевая 335
----трансформирующая активность 332
----ферменты синтеза ДНК 335
— полиэдрические 360
— природа 12
— происхождение 363, 364, 375
— псевдобешенства 290
----мутанты 292
— пятнистого увядания томатов 348, 355
— размеры 12
— размножение 281
— раневых опухолей 33, 64
--------кристаллы и включения 346
-------- переносчики 354
--------РНК 92
— растений 17
----в организме насекомых 354
----выявление 32
----генетический контроль 32
----заражение 349
---- изменчивость 346
----некротические поражения 43
----основные группы 22
----передачи механизм 352
----перекрестная защита 350, 351
----размножение 340
---- рекомбинация 348
---- серология 111
---- титрование 42
----РНК 90, 91
— РНК-содержащие 18, 93, 275, 281,
373
----чувствительность к ультрафиолету
134
— саркомы Рауса 327,
--------ингибирующий фактор 328
--------интеграция 331
--------как дефектный вирус 328
--------роль ДНК 331, 332
--------РНК, 91
-------- созревание 337
--------трансформация 336
--------эффект вируса-помощника 331
— свинки 310
Предметный указатель
413
Вирус(ы) Сендай 337
— серологические свойства 102—119
— Синдбис 286, 292
— табачной мозаики (ВТМ) 16
-------- Х-белок 343
-------- белок капсида 96, 98
-------- влияние карбоксипептидазы 121
—---------тиоурацила 111
--------вызываемые им поражения 32,
34
-------- инактивация 126, 132
-------- капсид 62
--------плюс- и минус-цепи 342, 343
--------мутанты 347
--------размножение 341
--------регенерация 62, 63, 121
-------- реконструкция 89
-------- серология 111
-------- титрование 44
—-------хлоропласты зараженной клет-
ки, изменения 346
--------цитоплазматические включения
345
— трансформация 321
— умеренные 240
— фильтрующиеся 12
— химия 71—101
— энцефаломиелита мышей 47
— энцефаломиокардита, мутанты 291
— Gomphrena 355
— «rattle» табака 347, 355
— SV-40 144, 325
----трансформирующая активность 334
— X картофеля 341, 348
— а 361, 362
----мутации 361
Вирусная инфекция, латентный период 30
Вирусные заболевания 309
---- диагностика 310
----иммунитет 116
----насекомых 356—358
----передача, механизм 312
---- переносчики 313
— инфекции, влияние температуры 33, 34
---- спонтанное излечение 314
---- химиотерапия 318
— поражения 33
— частицы, морфология 59
----подсчет 60
----размеры, методы определения 54
Вирусология как наука 9, 15
— связь с другими науками 12
Вирусоспецифичные компоненты, синтез,
механизм 277
Вирус-сателлит вируса некроза табака
141, 347
Вирусы-помощники 144, 331
Висконти — Дельбрюка теория 189
Внутриклеточные включения 345
Гаптены 102
Гаустории 34
Гексоны 65
Гель-фильтрация 72
Гемагглютинация 252—255
Гемагглютинин(ы) 114, 253, 254, 284
Гем адсорбция 39, 114, 253
Генетические карты 216, 217, 221
— маркеры 186
Генетический код 85, 86
Генетический код бессмысленный, трип-
леты 86, 87
Геном фагов 232, 233
Гепатит эпидемический 312
Гетерогеноты 231
Гетерозиготы 196
Гетеротрофы 365
Гидроксиламин 179
у-Глобулин 82, 103
Глутаминсинтетаза 249
Градоколовые мембраны 53
Гранулёзы 356, 358
Грипп, вакцинация 316
Групповое спаривание, модель 190
Гуанидин 291
Гуанин 78, 96
— этилированный 122
Дезоксирибонуклеиновая кислота 73; см.
также ДНК
Димеры, образование при воздействии
ультрафиолетом 133
Диффузия и диффузии коэффициент 57
ДНК 73—82; см. также Дезоксирибонук-
леиновая кислота
— вируса осповакцины 288
— вирусная, основания 96
----в трансформированных клетках 334
----кольцевая форма и интеграция с
геномом клетки 335
организация 66
свойства 92
состав 95
— вирусов насекомых 357
— внеядерная 369
— гибридизация с РНК 84
— глюкозилирование 169
— инфекционная 171, 357
— клеточная, синтез при вирусной инфек-
ции 302
— кольцевая 94
— метилирование 210
— метод ближайших соседей 80
— необычные основания 373
— одноцепочечная 94
— пары оснований 76
— плавление 80
— поврежденная, восстановление 135
— ренатурация 80
— репликация 78, 173
---- пслуконсервативная 164
— родительская 164
— синтез в лизогенных бактериях 222
— структура 77, 79
— суперспираль 94
— транскрипция 166
— трансформация 14
— фаговая 164, 169
---- репликация 173
— ферментативный синтез 80
ДНК-аза панкреатическая 77
— при заражении вирусом 303
ДНК-вирусы 20
ДНК-полимераза 80
— при вирусной инфекции 303
ДНК-полимеразы и синтез вирусов 289
Дрозофила, фактор о 360
Жгутики бактерий 159
Желтуха 33
414
Предметный указатель
Закон процентного отношения 107
Заражение, множественность 155
— смешанное 222, 348
Изатин-Р-тиосемикарбазон 318
Иммунитет 115, 116
— к фагу 214
— приобретенный 350, 351
Иммунитетный репрессор 214, 220, 224
Иммунная реакция 143
Иммуногенность вакцины, определение
117
Иммунологическая толерантность 118
Иммунофлуоресценция 104
— ВТМ 341
Индикаторные штаммы 149
Индикаторы мутантных фагов 178
Индол 157
Индуктивное действие 298
Индукция зиготная 215, 221
Инициатор 372
Инсулин, строение 82, 83
Интеграция профага с хромосомой бак-
терии 217, 218
Интерференция 184, 225
— коэффициент 189
— отрицательная 188
Интерферон 306
ингибирование активности актиноми-
цином D 308
— при вирусных заболеваниях 315
Инфекционная единица 36
— — связь с вирионами 49
---статистическая интерпретация 44
Иоддезоксиуридин 319
Иод-крахмальная проба 33
Ионизация 127
Ионизирующие излучения 128
каппа-частицы 374
Капсид(ы) 16
— белки 96—98
— изометрические (квазисферические)
61—63, 66
— — организация 'нуклеиновой кислоты
66
— сборка белков 99
— сложные 66
— спиральные 61, 63
— структура 61
— субъединицы белковые 63, 97
Капсомеры 63
Карбоксипептидаза 121
Картирование 189
Карты генетические 188, 193, 195, 201
— — бактериофагов 193—195
---кольцевые 193—195
Карциномы 323
Кинетосомы 369, 370
Клетки животных, мембраны 299
--- митоза цикл 249
— — состав 295
— — структура и организация 242
— — трансформация вирусом 321
— — устойчивость к вирусу полиомиели-
та 260
— происхождение 375
— HeLa 241
---заражение вирусом полиомиелита,
синтез РНК и белка 276
Клетки HeLa полисомы 281
L-клетки 285
Клонирование 248
Кодон(ы) 89
— бессмысленные 208
Колицин(ы) 234, 235, 272
Колициногенности фактор 235
Коллинеарность 201
Кольцевая пятнистость 33
Комплемент 104
Комплементация 222
— генетическая 144
— in vitro 184
Конверсии явления 226
Конверсия свойств бактерии при помощи
фага 225
Контактное ингибирование 336
Концевая избыточность 198
Копирование с переменной матрицы 190
Кроссинговер 190
Куриный эмбрион ПО, 311
Кэмпбелла гипотеза 217, 218
Латентный вирус 35
— период 150, 159
Лизин (ы) 167, 175
Лизис извне 159
— индукция 214
— клетки-хозяина 175
— преждевременный 160
Лизогекизация, частота 215
Лизогения 214—236
— ДНК синтез 222
— множественная 219
Лизосомы 298
Дизоцим(ы) 167, 176, 178, 208
Ли'пополисахариды 158, 226
Лямбда-частицы 374
Лямбдоиды 221
Малярийный плазмодий 11
Маркера спасение 212
Мегацин А 234
Мезельсона и Сталя опыты 78—80
Мембрана элементарная 68, 242, 367
Метагон 374
Метилеигликоль 122
5-Метилтриптофан 157
Метод конечных разведений 45
— «отпечатков пальцев» 83
— фаготипирования 158
Микроорганизмы группы PPLO 11, 366
Миксовирусы 18, 256, 257
— S-антиген 285
— белки и РНК, образование 285
— белковые компоненты 100
— вириона строение 68
— гемагглютинация 254
— генетика и рекомбинация 293
— нейраминидаза (сиалидаза) 100
— проникновение в клетку 252
— размножение 269
— репликация 284
— РНК 91
— цитопатический эффект 300
Минус-непи ДНК 173
Митомицин С, индуцирующее действие
220, 234
Митохондрии, ДНК 369
Предметный указатель
415
Митохондрии, разрушение при зараже-
нии вирусом полиомиелита 302
Минетомы 366
Множественная реактивация 212
Множественность заражения 155
Мозаичность 33
Мочевина, влияние на вирусы 121, 122
Муколитические ферменты вирусов 252
Муреин 367
Мутагенез 87, 88
Мутанты 291, 292
— лишенные способности к генетической
рекомбинации 136
— профагов неиндуцибельные 220
— фагов, дефектные 182
----типы и их выделение 177
----условно летальные 182
----h 177
----г 177
----rll 202, 206
---- sus 182
---- ts 182
Мутации, горячие точки 203
— индуцированные и спонтанные 179
— сдвиг считывания 207, 208
— супрессорные 179
— точковые в области rll, карты 204
— условно летальные 144, 182
— частота и мутационный процесс 179—
182
— amber (амбер, а/п-мутации, янтарные)
87, 183
— Ochre 183
— rll, карты 204, 205
Мю-частицы 374
Насекомые, переносчики вирусов 352, 355
------- культура тканей 353, 358
Наследственность цитоплазматическая
(материнская) 369
Негри тельца 30
Нейраминидаза 100, 225; см. также Сиа-
лидаза
Некротические поражения 351
Нематоды 355
Непермиссивные хозяева 182
Ниацин (никотиновая кислота) 451
Нуклеазы 76
Нуклеиновая кислота вирусная, молеку-
лярный вес 92
------- организация 66
-------репликативная форма 141, 173
----выделение из вирионов 89
----- инфекционная 171
----инфекционность 49, 51, 273, 357
----свойства, строение и химия 73, 74
Одиночный цикл размножения фага 150
2- (а-Оксибензил) -бензимидазол 292
5-Оксиметилцитозин 95, 96, 164
Опухоли 322
— вызванные вирусами 324
Организм, определение 13
Осмотический шок 160
Оспа коровья 315
— у мышей 318
Ланаин 120
Папилломы вирус, титрование 41, 42
Парамеции 368
— штаммы «убийцы» 374
Пенициллиназы факторы 371
Пентоны 65
Пептидная связь 82
Перекись водорода 122
Перекрестные серологические реакции 357
Пермиссивные хозяева 182
Перхлорат натрия 122
Псстицины 234
Пиноцитоз 245
Пиоцины 234
Плазмиды 229, 369, 372
— общность с вирусами 233
Плюс- и минус-цепи ДНК 173, 174
Повилика 352
Пслиамины 100, 101
Поликариоцитоз 299
Псликариоциты 240
Полиомиелит, вакцинация 316
Полирибосомные системы 288
Полирибосомы 250, 281
Полисомы 89, 250, 281
— вирусов 277
Полифенолоксидаза 349
Полиэдрозы 356
— цитоплазматические и ядерные 356,
357
Полиэдры 356, 357
Половой фактор (Г-фактор) 233, 371
Половые ворсинки 159
Волосатость 33
Поляризованное расщепление 197
Постулаты Коха 26
Провирус вируса а 362
Продуктивный цикл 142, 149
р-Пропиолактон 122
Профаг(и) 215
— дефектные 224, 225
— интеграция с хромосомой бактерии
217, 218
— мутанты неиндуцибельные 220
— положение в хромосоме 215
Профлавин 167, 206
Пуассона распределение 45
Пуромицин 278
— действие при заражении вирусом ос-
повакцины 290
Путресцин 100
Радиоактивный распад 136
Радужный вирус долгоножки 64, 358
Рассеяние света 58
Рауса открытие 16
Раус-ассоциированный вирус 31, 328
Реактивация множественная 212
— перекрестная 212, 293
— под влиянием клетки-хозяина 134
Реакции гомологичные и гетерологичные
102
— перекрестные серологические 105, 106
Реакция агглютинации 103
— антиген — антитело 102, 103
— иммунофлуоресценции 104
— нейтрализации 104, 112
— преципитации 103, 104
— связывания комплемента 104
Редуктивная инфекция 222
Рекомбинация вирусов 348
416
П редметный указатель
Рекомбинация генетическая 185, 191, 193
----разрывы и воссоединения 191
---- у вирусов 293
---- частота 186, 188
— при взаимодействии нескольких роди-
тельских фагов 189
Рентгеноструктурный анализ 61
Реовирус 18
— гемагглютинация 254
— кривые одиночного цикла размноже-
ния 267
— РНК двухцепочечная 92
— сродство к веретену 302
— цитопатический эффект 300
Репаративные механизмы 134
Репликаторы 372
Репликация 139
— бесконтрольная 370
— дисперсивная, консервативная и полу-
консервативная 191
— типы 191
Репликон 172
Репрессор 214
Реснички 368
Ретикулоциты, синтез белков 249
Рецепторразрушающий фермент 255
Рибонуклеаза, длина полипептидной це-
пи 82
— панкреатическая 76
— при вирусной инфекции 341
Рибонуклеазы 76; см. также РНК-азы
Рибонуклеиновые кислоты 73; см. также
РНК
----двухспиральные, устойчивость к
РНК-азе 76
Рибосомы 83. 84
— и синтез белка 87
Рида и Менча метод титрования 40
Риккетсии 11, 366
Риновирусы 116, 318
РНК 73—77; см. также Рибонуклеиновая
кислота
— аденовируса в трансформированных
клетках 334
— вирусная 373
----биосинтез, динамика 275
---- двухцепочечная 92
-------матрица при ферментативном
синтезе 278, 279
---- организация 66
----размножение 279
---- репликация 281
---- свойства 89
----синтез 278, 279
---- состав оснований 91
---- строение 92
— ВТМ 343
— — и перенос генетической информа-
ции 85
— гибридизация с ДНК 84
— двухцепочечная 92
— информационная (/п-РНК) 84
---- полицистронная 284
---- синтез 166
— клеточная, синтез при вирусной ин-
фекции 304
— транспортная (растворимая, s-PHK)
84, 85
— фаговая, двухцепочечная форма 174
----синтез 166, 173
РНК щелочной гидролиз 74, 75
РНК-аза 76; см. также Рибонуклеаза
РНК-полимераза 85
— РНК-зависимая 278
РНК-репликазы 141
Саркома (ы) 323
— Рауса 327
Седиментации константа 54
Седиментационное равновесие 58
Серологическая антигенная детерминанта
226
Серологические реакции 102
Сиалидаза 100, 252, 256; см. также Ней-
раминидаза
Сине-зеленые водоросли 370
Скручивание листьев 33
Созревание вириона вируса 139, 142
Спермидин 100
Стабилизованная чувствительность 361
Статолон 308
Стокса формула 54, 55
Стрейзингера модель 198
Суперинфекция 184
Суперспирализованная кольцевая струк-
тура 219
«Суперспирализованное» состояние 95
Супрессоры саллель-специфичные» 182
Сферопласты 171
Сцепление 187
Сыворотки гипериммунные 103
— противовирусные 103
Т-антиген 334
Тела X 345
Тельца Гварниери 286
Тельца-включения 299
Теория мишени 130, 131
— регрессивного происхождения вирусов
364
Тимидилатсинтетаза 169
Тимидинкиназа 289
Тимин 78, 96
Тимина димеры 133
Тимин-цитозиновые димеры 133
Тиомочевина 129
2-тиоурацил 344
Титр вируса 60
— вирусной суспензии 49
Титрование вирусов 36—49
Тканевые культуры 237, 247, 248
Точка эквивалентности 103
Транзиции 87
Трансверсии 87
Трансдукция 277, 228
— абортивная и полная 229
— общая (неспецифическая) 228
---и специфическая, связь 232
— специфическая 230
Транскрипция 85
Трансляция 85, 282
Трансформация 14, 221, 298, 321
— клеток вирусом саркомы Рауса 331
---ДНК-содержащими вирусами
332—338
— сущность 335—338
Триптофан 157
Трихлсрфторэтан 72
Тутовый шелкопряд 356, 357
Предметный указатель
417
Удена и Оухтерлони методы 104
Улыравирус 12
Ультрафильтрация 53
Ультрафиолет, влияние на вирус осповак-
цины 262, 289
— инактивация вирусов 132
— индукция профага 220
— при заражении ВТМ 341
Ультрафиолетовые спектры поглощения
128
Ультрацентрифуги 55
Уотсона и Крика модель 77, 79
Урацил 96
Урацила димеры 134
Уридиндифосфатглюкоза 210
«Фабрики вируса» 287, 346
Фаг-помощник 171
Фагоцитоз 245
Фактор, ингибирующий вирус саркомы
Рауса 328
— молока 327
— устойчивости (R) 371
Фактор col 371
— F; см. Половой фактор
— R 371, 372; см. Фактор устойчивости
— о 360, 361
Фенотипическое смешивание 142, 167
--- вируса полиомиелита 292
Ферменты, индуцированные фагом 168
— «ранние» 170
Ферритин и ферритиновые антитела 105
Фильтрация 52
Флоэма, некроз 349
Флуоресцентная микроскопия 59
Фолиевая кислота у фагов 162
Формальдегид, влияние на вирусы 122,
123
L-формы бактерий 11
Фосфодиэстераза змеиного яда 77
Фотодинамическое действие 136
Фотореактивация 134
5-фтордезоксиуридин 274
Фторуглеродные соединения 72
5-фторурацил 344
п-Фторфенилаланин 278
Херши и Чейз опыты 160
Химиотерапия вирусной инфекции 318
Хлороз 33
Хлоропласты, ДНК 369
— при вирусной инфекции 346
Холмса метод 44
Хориоаллантоисная мембрана 30
Хромосомные мостики 302
Центриоли 369, 370
Центрифугирование в градиенте плотно-
сти 55, 57
— зональное и изопикническое 72
----- скоростное 55
Циклическая перестановка маркеров 198
Циклогексимид 318
Цистеин, защитное действие 136
------- при облучении 131
Цис-транс-тъст 202
Цистроны 181, 202
Цитозин 78, 96
Цитозинрибозид 285
Цитозин-цитозиновые димеры 133
Цитолитический эффект 297
Цитопатические изменения в клетках, за-
раженных вирусом 300, 301
Цитопатический эффект 31
Цитоцидальная реакция 239
дЦМФ-оксиметилаза 168
Членистоногие 366
— как переносчики вирусов 313, 353, 354
Het-частицы 196—200
Шлирен-метод 55
Эвери открытие 77
Экзогенота 231
Экзонуклеазы 76
Эклипс 139, 160
— необратимый 260
Электронная микроскопия 59, 60
Электрофорез 58
Эндогенота 231
Эндонуклеазы 76
Эндоплазматическая сеть 243
Эндосимбионты 370, 374
Энтеровирусы 18
— гемагглютинация 254
Эписомы 233
Этилметилсульфонат 179
Эукариотические клетки 367
ОГЛАВЛЕНИЕ
Предисловие к русскому изданию 5
Из предисловия авторов ко второму английскому изданию 7
Глава I. Введение. Наука вирусология 9
Вирусология как биологическая наука 9
Различные определения вирусов .... 9
Связь вирусологии с другими биологическими науками 12
Природа вирусов . ||
Развитие учения о вирусах 15
Основные группы вирусов 1®
Вирусы бактерий 17
Вирусы животных 17
Вирусы растений . 17
Номенклатура и классификация вирусов 21
План книги 24
Глава II. Выявление и идентификация вирусов 26
Общие вопросы методологий 26
Выявление бактериофагов 28
Выявление вирусов животных 29
Выявление вирусов растений 32
Глава III. Титрование вирусов 36
Инфекционная единица . 36
Титрование бактериофагов 37
Титрование вирусов животных 38
Локальные поражения, бляшки и «фокусы» трансформации или пролифе-
рации 38
Метод конечных разведений ....................... .... 39
Метод титрования, в основе которого лежит определение длительности ин-
кубационного периода 41
Титрование вирусов растений......................... . . 43
Статистическая интерпретация понятия «Инфекционная единица» 44
Подсчет числа бляшек 45
Метод конечных разведений . 45
Связь между инфекционными единицами и вирионами 48
Глава IV. Свойства вирионов
Цель очистки . ............. ... ... . .
Методы очистки вирусных частиц и критерии чистоты вирусных препаратов
Методы очистки
Ультрафильтрация ............................................
Физико-химические методы определения размеров вирусных частиц
Осаждение сферических частиц
Измерение плотности .....................
Центрифугирование в градиенте плотности
Диффузия
Несферические частицы .
Электрофорез и рассеяние света
Морфология вирусных частиц
Электронная микроскопия .................... ...................
Подсчет числа вирусных частиц с помощью электронного микроскопа
Рентгеноструктурный анализ
Типы организации вирионов .
Вирусы со спиральными капсидами
50
50
50
52
53
54
54
55
55
57
58
58
58
59
60
61
61
62
419
420
Оглавление
Изометрические (квазисферические) капсиды 63
Организация нуклеиновой кислоты у вирусов с изометрическими капсидами 66
Сложные капсиды 66
Внешние оболочки . 68
Полиэдры и капсулы . . 68
Неполностью сформированные вирионы 69
Заключение 70
Глава V. Химия вирусов 71
Методология 71
Очистка вирионов ... 71
Критерии оценки химической чистоты . . 73
Основные свойства нуклеиновых кислот и белков 73
Структура нуклеиновых кислот ... 73
Химическая стабильность нуклеиновых кислот ... . 74
Ферменты, гидролизующие нуклеиновые кислоты (общие сведения) 76
Структура и функция ДНК 77
Репликация ДНК ... .... 78
Изучение разделения и воссоединения нитей ДНК при помощи физиче-
ских методов . . 80
Ферментативный синтез ДНК . . 80
От ДНК к РНК и далее от РНК к белку 81
Структура и синтез белков ..... 82
Механизм синтеза белка и определение типов РНК . 83
Природа и функция концевых групп молекул /п-РНК . 86
Использование мутагенеза для расшифровки генетического кода 87
Роль рибосом и конечные этапы биосинтеза белка 87
Вирусные нуклеиновые кислоты........................................... 89
Выделение нуклеиновой кислоты из вирионов 89
Свойства вирусных РНК 89
Свойства вирусных ДНК ................................................ 92
ДНК, имеющая форму одиночной нити или замкнутого кольца 93
Химический состав вирусных ДНК . . 95
Вирусные белки и другие компоненты вирусов 95
Белки капсида . ............. 96
Сборка белков, образующих капсид вируса............................... 99
Структурные компоненты вириона, не входящие в состав его капсида 109
Глава VI. Серологические свойства вирусов 102
Вирусы как антигены....................... . . . . .
Реакции антиген — антитело, возникающие при взаимодействии вирионов
с антителами
Перекрестные серологические реакции
Серология бактериофагов
Серология вирусов растений
Серология вирусов животных
Реакция нейтрализации
Антигенная мозаичность вирионов . . . .
Антигены хозяина и вирусные антигены, входящие в состав вирионов
Клеточные вирусоспецифичные антигены
Медицинские аспекты серологии вирусов животных
Вакцинация ....
Иммунологическая толерантность при вирусной инфекции
Глава VII. Действие физических и химических факторов на вирионы
Повреждение вирионов
Влияние химических факторов на вирионы
Ферменты
Агенты и факторы, вызывающие денатурацию белка
Окисляющие агенты
Формальдегид
Влияние физических факторов на вирионы
Нагревание
Механические и другие воздействия
Действие излучений
Ионизирующие излучения
Ультрафиолетовый свет
102
103
105
106
111
111
112
113
115
115
115
116
118
120
120
120
120
121
122
122
124
124
126
126
128
132
Оглавление
421
Репаративные механизмы
Фотодинамическое действие
Радиоактивный распад
Глава VIII. Взаимодействие вируса с клеткой-хозяином. Основные проблемы
и явления
Методология
Эклипс, репликация и созревание
Регулярные явления
Закономерности, определяющие специфичность вирусов по отношению к клет-
кам-хозяевам
Действие вирусов на клетки
Глава IX. Взаимодействие бактериофага с бактерией. Продуктивный цикл
Типы взаимодействия . . . ...
Литический тип взаимодействия фага с клеткой-хозяином
Адсорбция бактериофага бактериями
Кинетика адсорбции фага
Химические вещества, необходимые для адсорбции
Кофакторы адсорбции
Природа рецепторных участков фагов и бактерий
Латентный период внутриклеточного развития фага
Основные проблемы репродукции фага
Преждевременный лизис и эклипс
Проникновение в клетку
Процессы биосинтеза, происходящие в зараженных фагом клетках
Источники материала, используемого при биосинтезе фага
Биосинтез вирионов
Ферментативные процессы, происходящие при синтезе фага
Инфекционная фаговая нуклеиновая кислота
Репродукция фагов, содержащих одноцепочечную ДНК
Репродукция РНК-содержащих фагов
Фаговая инфекция и организация бактериальной клетки
Лизис клетки-хозяина и выход фага
Глава X. Генетика и радиобиология бактериофагов
Вирусология и генетика .
Мутации у бактериофагов
Типы мутантов и их выделение
Частота мутаций и мутационный процесс..................
Физиологическая генетика фага — условно летальные мутации
Взаимодействие между фагами при смешанном заражении
Смешанное заражение родственными фагами
Генетическая рекомбинация . .
Экспериментальные основы формальной генетики фагов
Функция картирования и природа акта спаривания .
Разрывы и воссоединения молекул ДНК и роль этого процесса в генетиче-
ской рекомбинации
Кольцевые генетические карты .
Гетерозиготы и концевая избыточность
Модель Стрейзингера ... . . . . .
Трансформация, вызываемая ДНК фага %, и коллинеарность генетической
карты фага X и молекулы его ДНК
Генетика фагов и молекулярная генетика
Мутанты rll. Система Бензера
Анализ тонкой структуры
Выделение /n-РНК мутантов rll
Мутанты rll и генетический код
Модификации фага, вызванные хозяином
Изучение развития фага радиобиологическими методами
Облучение фага, находящегося внутри клетки
Множественная реактивация, перекрестная реактивация (спасение марке-
ров) и чувствительность гена
Глава XI. Лизогения
Основные черты лизогенного состояния бактерий
Профаг
Положение профага в хромосоме
Способ присоединения профага
134
136
136
138
138
139
143
145
146
149
149
150
155
155
156
157
157
159
159
160
162
163
163
164
167
171
172
173
174
175
177
177
177
177
179
182
184
185
185
186
189
191
193
196
198
201
202
202
203
206
206
208
210
210
212
214
214
215
215
216
422
Оглавление
Множественная лизогения . . 219
Репрессор, иммунитет и индукция лизогенных бактерий 219
Зиготная индукция . . 221
Фаза, определяющая переход к лизогении 222
Дефектные профаги . . . 224
Коверсия свойств бактерий при помощи фага 225
Генетическая трансдукция, осуществляемая фагом 227
Общая трансдукция . . 228
Специфическая ’ трансдукция .... 230
Связь между общей и специфической трансдукцией 232
Фаги и плазмиды . . . 233
Бактериоцины и бактериофаги . 234
Факторы бактериоциногенности 235
Глава XII. Введение в биологию клеток животных 237
Роль тканевых культур в изучении вирусов животных 237
Характеристика взаимоотношений между вирусом и клеткой животного 239
Особенности структуры и роста животных клеток 240
Состав клеток животных .... 241
Структура и организация животной клетки 242
Рост и функция животных клеток . 245
Использование культур тканей при изучении роста и дифференциров-
ки клеток 246
Глава XIII. Вирусы животных. Адсорбция, проникновение в клетку и освобож-
дение нуклеиновой кислоты 251
Методы экспериментального изучения взаимодействия вируса с клеткой 251
Вирус гриппа и другие миксовирусы .... . 252
Гемагглютинация и муколитические ферменты миксовирусов 252
Взаимоотношения между вирусом гриппа и поверхностью клетки 255
Вирус полиомиелита. Начальные стадии взаимодействия с культивируемы-
ми клетками ... .... 257
Первичное присоединение вируса к клетке . 257
Проникновение вируса в клетку и разрушение капсида 257
Начальные стадии инфекции, вызываемой вирусом осповакцины 260
Общие выводы 263
Глава XIV. Размножение вирусов животных 265
Циклы размножения 265
Образование молекул-предшественников вирусов 271
Химические методы . 271
Инфекционная нуклеиновая кислота 273
Иммунологические измерения . 273
Использование специфических ингибиторов . . . . . 274
Репликация вируса полиомиелита и других мелких икосаэдрических РНК-со-
держащих вирусов ... ... 275
Динамика биосинтеза вирусных белков и РНК . 275
Механизмы синтеза вирусоспецифичных компонентов . . 277
Образование морфологически завершенных вирусных частиц . . . ^81
Использование вируса полиомиелита для изучения процесса трансляции,
ведущего к синтезу белка . . 282
Репликация миксовирусов и арбовирусов . . 284
Вирус осповакцины и другие вирусы группы оспы 286
Репликативный цикл вируса осповакцины . . . 286
Синтез белков вируса осповакцины и контролирование этого процесса 288
Аденовирусы и вирусы группы герпеса 290
Генетика вирусов животных . . 291
Генетика вируса полиомиелита 292
Генетика миксовирусов . . . 293
Генетика вирусов группы оспы 294
Глава XV. Действие вирусов животных на клетку и организм 297
Образование вируса и поражение хозяина . 297
Влияние вирусной инфекции на клеточном уровне 297
Деструктивное действие вирусов на клетки 298
Морфологические наблюдения 298-
Биохимические процессы .... 302
Синтез, клеточной ДНК при вирусной инфекции 302
Оглавление 423
Синтез РНК и белка клетки при вирусной инфекции 304
Индуктивное действие 306
«Раздевающий» белок вирусов группы оспы 306
Интерферон . . .... 306
Образование интерферона и установление состояния интерференции 308
Заболевания, вызываемые вирусами животных 309
Вирусные болезни человека 309
Диагностика вирусных заболеваний 310
Механизмы передачи вирусных заболеваний 312
Механическая передача 312
Передача вирусов переносчиками 313
Спонтанное излечение при вирусных инфекциях 314
Борьба с вирусными инфекциями 315
Вакцинация Трудности, с которыми приходится встречаться при получении и приме- 315 316
нении вакцин
Химиотерапия вирусных инфекций 318
Глава XVI. Опухолеродные вирусы . 321
Трансформация клеток вирусами 321
Опухоли: что это такое? 321
Этиология опухолей 323
Канцерогенные вещества 324
Опухоли, вызванные вирусами 324
Саркома Рауса . ... События, происходящие на молекулярном уровне, при трансформации клет- 327 331
ки вирусом саркомы Рауса
Трансформация клеток ДНК-содержащими вирусами и доказательства ин-
теграции вирусного генома 332
Природа интеграции вирусной ДНК 335
В чем сущность трансформации и каков ее механизм? 335
Глава XVII. Взаимодействие между вирусами растений и их хозяевами 339
Экспериментальные системы 339
Размножение и синтез . . ... 340
Цитологические данные, полученные при изучении вирусных инфекций 345
Изменчивость вирусов растений 346
Смешанное заражение и рекомбинация 348
Распространение вирусов по растению и их воздействие на клетки растений 348
Выздоровление, приобретенный иммунитет и перекрестная защита 350
Механизмы передачи вирусов растений 352
Передача вирусов растений членистоногими-переносчиками 352
Перенос вирусов растений нематодами и грибами 355
Глава XVIII. Вирусы, патогенные для насекомых 356
Включения и их связь с вирусной инфекцией 356
Ядерные полиэдрозы 356
Цитоплазматические полиэдрозы 357
Гранулёзы 358
Вирусные заболевания насекомых, при которых включения не образуются 358
Размножение вирусов насекомых 358
Латентные инфекции вирусов насекомых 360
Агент, вызывающий у дрозофилы чувствительность к СОг 360
Глава XIX. Происхождение и природа вирусов
Вирусы как независимые генетические системы
Теории происхождения вирусов .
Теория регрессивного происхождения вирусов
Вирусы как регрессировавшие паразиты ....
Вирусы и генетические компоненты эукариотических клеток
Бактериофаги и генетический материал бактериальных клеток .
РНК-содержащие вирусы и компоненты клеток
Метагон , ...
Происхождение вирусов и происхождение клетки
Литература
Предметный указатель
Указатель латинских названий
363
363
364
364
365
367
371
373
374
375
379'
410
418
С. Лурия, Дж. Дарнелл
ОБЩАЯ ВИРУСОЛОГИЯ
Редактор Н. А. Сисина
Художник А. Д. Смеляков
Художественный редактор Ю. Л. Максимов
Технический редактор Г. Б. Алюлина
Корректор Т. П. Пашковская
Сдано в производство 28/V 1970 г. Подписано к печати 21/VIII 1970 г. Бумага № 1 70X108’/i6= 14,25
бум. л. 39,90 печ. усл. л. в т/ч вкл. 2,80 п. л. Уч.-изд. л. 39,11. Изд. № 4/5213.
Цена 3 р. 14 к. Зак. 1214.
ИЗДАТЕЛЬСТВО „МИР“
Москва, 1-й Рижский пер., 2
41-я типография Главполиграфпрома Комитета по печати при Совете Министров СССР. Москва,
Нагатинская улица, д. 1.
СПИСОК ОПЕЧАТОК
Стра- ница Строк Напечатано Следует читать
187 Вторая сноска к табл. 20 2) Дефекты в отно- шении синтеза ури- диндифосфатглюко- зы; при заражении фагами Т2 или Тб 2) Для дифактори- альных скрещиваний частоты рекомбина- ций приняты равными удвоенной ча-
Лурия С., Дарнелл Дж.,
ОБЩАЯ ВИРУСОЛОГИЯ