Автор: Сергеев В.А. Непоклонов Е.А. Алипер Т.И.
Теги: ветеринария медицинская микробиология и паразитология инфекционные и паразитарные болезни медицина микробиология инфекционные болезни
ISBN: 5-98685-012-2
Год: 2007
В.А. Сергеев
Е.А. Непоклонов
ТИ. Алипер
ВИРУСЫ
И ВИРУСНЫЕ
ВАКЦИНЫ
Москва
«Библионика»
DRAFT
ББК 48.73+52.6+55.14
С32
Рецензенты:
Клименко Сергей Минович, действительный член РАМН, профессор,
доктор медицинских наук.
Орлянкин Борис Григорьевич, доктор ветеринарных наук, профессор.
Фёдоров Юрий Николаевич, заслуженный деятель наук РФ,
доктор биологических наук, профессор, член-корреспондент РАСХН.
Сергеев, В.А.
Вирусы и вирусные вакцины / В.А. Сергеев, Е.А. Непоклонов,
Т.Н. Алипер - М.: Библионика, 2007. - 524 с.
I. Непоклонов, Е.А.
П. Алипер, Т.Н.
ISBN 5-98685-012-2 I
Монография посвящена, в основном, одной из наиболее актуальных проблем
вирусологии — специфической профилактике вирусных болезней человека и животных.
В ней в краткой форме приведены наиболее важные научные и практические
достижения. Показаны основные тенденции развития исследований в этой быстро
развивающейся области биологической науки. Решение многих важных проблем
здравоохранения и ветеринарии на основе специфической профилактики рассмотрены
на конкретных примерах, имеющих прототипное значение. Данная монография
адресована широкому кругу специалистов, интересующихся теорией и практикой
вакцинопрофилактики, вопросами разработки, производства и применения вирусных
вакцин. Она будет полезной для работников науки, преподавателей и студентов
сельскохозяйственных и медицинских ВУЗов.
© Издательство «Библионика», 2007
© Сергеев В.А., Непоклонов Е.А.,
Оглавление
Предисловие....................................................9
1. Развитие учения о вирусах п
2. Классификация и номенклатура вирусов
ПОЗВОНОЧНЫХ 24
3. Репликация вирусов 31
3.1. Цикл размножения вирусов......................................32
- прикрепление (адсорбция) вируса.............................33
- проникновение вируса в клетку...............................34
- раздевание вирионов (обнажение вирусного генома)............35
- синтез вирусных компонентов (эклипс-период).................36
3.2. Стратегия репликации вирусов..................................38
- РНК-вирусы..................................................41
- ДНК-вирусы..................................................45
- транскрипция................................................48
- трансляция..................................................49
- репликация вирусных ДНК.....................................50
- репликация вирусных РНК.....................................51
3.3. Формирование и выход из клетки вирионов.......................52
4. Крупномасштабное культивирование вирусов 61
4.1. Клеточные субстраты...........................................67
4.2. Контаминация клеточных культур................................73
4.3. Выращивание вирусов...........................................79
- факторы, влияющие на размножение вирусов в культуре клеток.80
- размножение вирусов в однослойной культуре..................93
- размножение вирусов в суспензии постоянных линий клеток....103
5. Вирусные антигены......................................ш
6. Противовирусный иммунитет 119
6.1, Организация иммунной системы.........................121
6.2. Клетки иммунной системы..............................123
6.3. Субклеточные компоненты иммунной системы.............126
6.4. Синтез антител.......................................129
6.5. Клеточный иммунитет..................................135
- эффекторные и регуляторные Т-клетки...............136
- иммунологическая память...........................141
6.6. Иммунная система слизистых оболочек..................144
6.7. Некоторые особенности патогенеза и иммунитета
при вирусных инфекциях..............................159
6.8. Нейтрализация вирусов................................172
7. Материнский иммунитет !..............................177
8. Иммунологические адъюванты 186
8.1. Механизм действия адъювантов.........................187
8.2. Адъюванты на основе природных субстратов.............193
8.3. Действие адъювантов на орально вводимые антигены.....198
8.4. Безопасность адъювантов..............................199
9. Вирусные вакцины 202
9.1. Инактивированные вакцины.............................206
9.2. Живые вакцины........................................223
9.3. Гетерологичные вакцины...............................248
9.4, Вакцины из очищенных нативных вирусных белков....... 253
9.5, Реассортантные вакцины...............................261
9.6. Рекомбинантные живые векторные вакцины...............263
9.7. Рекомбинантные субъединичные вакцины.................269
9.8. Вакцины на основе вирусоподобных частиц
и трансгенных растений..............................274
9.9. ДНК-вакцины..........................................276
9.10. Синтетические пептидные вакцины.....................280
10. Семейства вирусов, патогенных
для человека и животных.....................................2вз
10.1. Вирусы оспы...........................................283
10.2. Асфаровирусы..........................................291
10.3. Иридовирусы...........................................293
10.4. Герпесвирусы..........................................294
10.5. Аденовирусы...........................................321
10.6. Полиомавирусы.........................................329
10.7. Папиломавирусы........................................330
10.8. Цирковирусы...........................................333
10.9. Парвовирусы...........................................334
10.10. Гепаднавирусы........................................345
10.11. Ретровирусы..........................................348
10.12. Реовирусы . . .......................................359
10.13. Бирнавирусы..........................................378
10.14. Парамиксовирусы......................................381
10.15. Рабдовирусы..........................................398
10.16. Филовирусы...........................................410
10.17. Борнавирусы .........................................413
10.18. Ортомиксовирусы......................................414
10.19. Буньявирусы..........................................424
10.20. Аренавирусы..........................................429
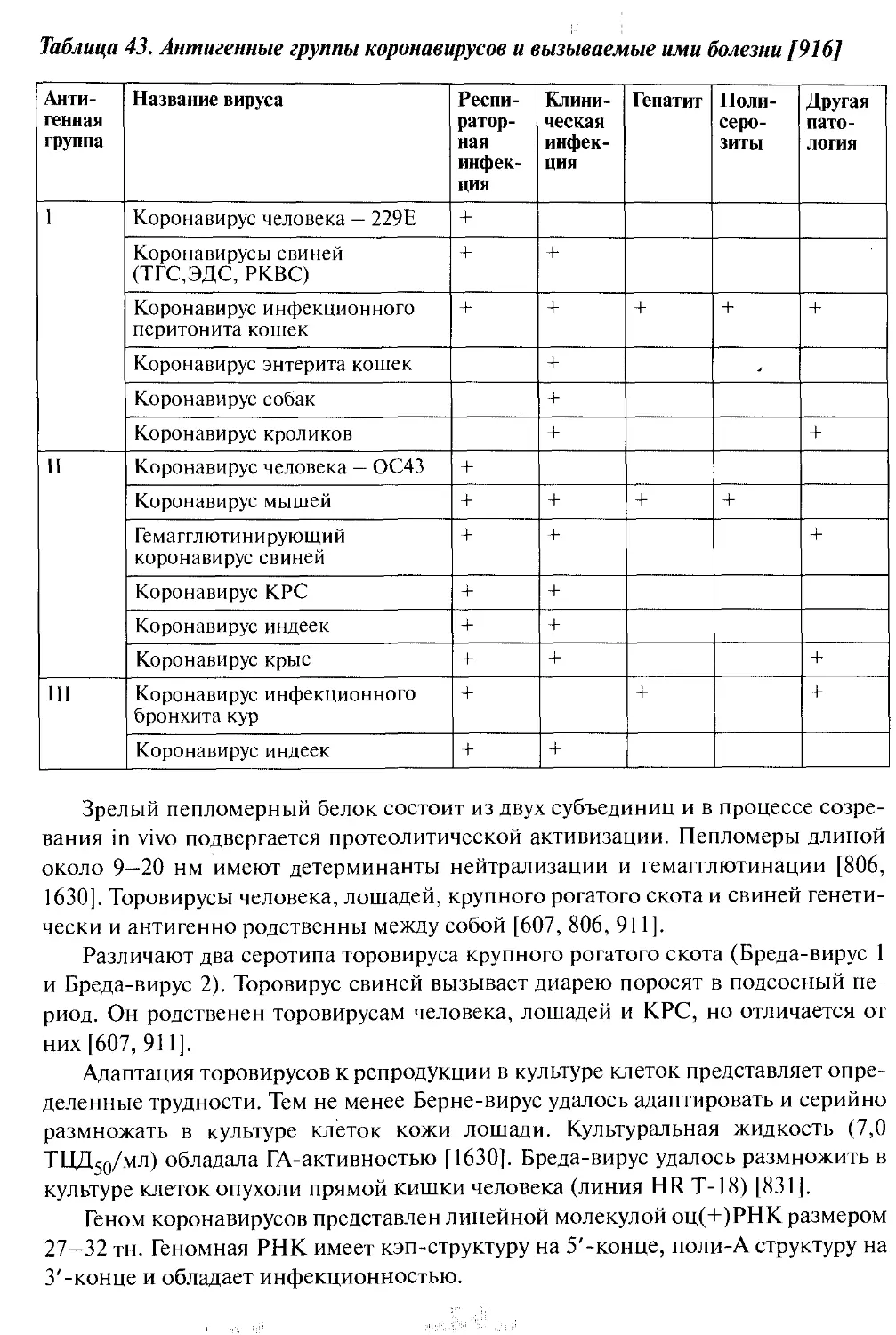
10.21. Коронавирусы.........................................430
10.22. Артеривирусы.........................................444
10.23. Пикорнавирусы........................................448
10.24. Калицивирусы.........................................462
10.25. Астровирусы..........................................467
10.26. Флавивирусы..........................................469
10.27. Тогавирусы...........................................480
Список литературы 486
СПИСОК СОКРАЩЕНИЙ
1. оц(+)РНК - одноцепочечная РНК позитивной полярности
2. оц(-)РНК - одноцепочечная РНК негативной полярности
3. дцРНК - двуцепочечная РНК
4. опДНК — одноцепочечная ДНК i
5. дцДНК - двуцепочечная ДНК
6. т.н. — тысячи нуклеотидов
7. т.п.н. — тысячи пар нуклеотидов
8. ММ — молекулярная масса
9. кД — тысячи Дальтон
10. мД — мегадальтон
11. нм — нанометр
12. ГА — гемагглютинин
13. NA — нейраминидаза
14. 1g - иммуноглобулины
15. ИФА — иммуноферментный анализ
16. МФА — метод флюоресцирующих антител
17. PH - реакция нейтрализации
18. тцд — доза вируса, вызывающая цитопатогенное действие в культуре клеток
19. ткид — доза вируса, инфицирующая культуру клеток
20. ЦПД — цитопатогенное действие I
21. цпэ — цитопатический эффект
22. ПЦР — полимеразная цепная реакция
23. МНС — главный комплекс гистосовместимости
24. NK — естественные киллерные клетки ।
25. РГА — реакция гемагглютинации
26. РТГА - реакция торможения гемагглютинации
27. ДИЧ - дефектные интерферирующие частицы
28. КЭ - куриный эмбрион
29. ЭЛД — летальная доза для КЭ
30. КРС — крупный рогатый скот
31. ПЭГ - полиэтиленгликоль
32. ИФ — интерферон
33. ИЛ - интерлейкин
34. МАТ - материнские антитела
35. МКА — моноклональные антитела
Предисловие
Мировой опыт борьбы с вирусными болезнями человека и животных убеди-
тельно показал, что наиболее эффективным способом защиты является вакци-
нация. Вакцинация была предложена Эдвардом Дженнером в 1798 г. для профи-
лактики оспы людей. В конце 19 века идея вакцинопрофилактики как способа
борьбы с инфекционными заболеваниями была теоретически и эксперимен-
тально обоснована Луи Пастером. Заложенные им основополагающие принци-
пы вакцинопрофилактики получили дальнейшее развитие. С открытием пер-
спективности метода клеточных культур для вирусологии и развитием способов
массового выращивания клеток животных вне организма в 50-х годах прошлого
века началась вторая эра вакцинопрофилактики вирусных болезней человека и
животных. Хотя с появлением различных направлений технологии рекомби-
нантной ДНК наметилась третья эра развития вакцинопрофилактики, практи-
ческая медицина и ветеринария фактически пользуются вакцинами, созданны-
ми во второй половине XX века и продолжают их совершенствовать на основе
современных достижений биологической науки. Создание высокоэффективных
вакцин и широкомасштабных методов их производства позволили разработать
национальные и международные программы контроля и искоренения ряда ви-
русных заболеваний человека и животных.
Триумфом вакцинопрофилактики стала ликвидация оспы людей во всем ми-
ре (1979 г.). Достигнут большой успех в специфической профилактике многих
опасных вирусных заболеваний человека (полиомиелит, корь и др.) и животных
(ящур, чума жвачных и др.).
В вакцинопрофилактике вирусных заболеваний человека и животных, несмо-
тря на общие принципы и методы, имеется ряд существенных различий. Прежде
всего это касается ее экономической ценности, которая имеет гораздо большее
значение в ветеринарии, чем в медицине. К безопасности и эффективности вак-
цин, применяемых в медицине, предъявляются более высокие требования, чем в
ветеринарии. Руководящую роль в использовании медицинских вакцин на меж-
дународном уровне играет Всемирная организация здравоохранения (ВОЗ). Она
же поддерживает многочисленные программы, такие как «Глобальная программа
по вакцинам и иммунизации». Рекомендациями по использованию вакцин для
иммунизации животных занимается Международное эпизоотическое бюро
(МЭБ) в составе Пищевой и сельскохозяйственной организации.
Кроме рекомендаций и требований ВОЗ и МЭБ во многих странах существу-
ют национальные требования по изготовлению, контролю и применению вакцин,
а также разработаны и реализуются национальные Программы по вакцинопрофи-
лактике отдельных вирусных заболеваний. Ассортимент вакцин для животных во
много раз превосходит ассортимент вакцин, применяемых в медицине.
Профилактика многих вирусных болезней животных достигла исключитель-
но широких масштабов и стала неотъемлемой частью технологии ведения жи-
вотноводства, особенно на индустриальной основе.
В настоящее время профилактика вирусных инфекций осуществляется в ос-
новном с применением живых и инактивированных вакцин.
Каждая из этих категорий вакцин имеет свои преимущества и недостатки. Ог-
ромное значение придается стандартности вирусных вакцин, в связи с чем посто-
янно совершенствуются методы контроля и ужесточаются требования к готовому
препарату. Расширяется спектр вирусных заболеваний, против которых создают-
ся вакцины. Несмотря на очевидный прогресс в разработке живых и инактивиро-
ванных вирусных вакцин и огромный практический эффект от их применения,
актуальной задачей остается их дальнейшее совершенствование и создание вак-
цин нового поколения на основе технологии рекомбинантной ДНК.
Разработкой вакцин с учетом новых научных достижений и направлений
занимаются ведущие специалисты и крупные исследовательские центры наибо-
лее развитых стран. Этой области науки посвящены тысячи публикаций и патен-
тов, в том числе первостепенной научной важности и особого практического
значения.
Область вирусных вакцин, включающая в себя несколько научных направле-
ний, настолько расширилась, что стало очень трудно представить общую картину
ее современного состояния. Эта проблема настолько многообразна и сложна, что
в кратком изложении невозможно даже коснуться некоторых важных аспектов.
Целью данной монографии является ознакомление читателей с основными
достижениями в области вирусных вакцин. Значительное внимание уделено до-
стижениям в разработке средств активной профилактики наиболее опасных ви-
русных болезней животных. Так как в данной монографии предпринята попыт-
ка систематического изложения во всей их сложности и разнообразии, вопросов
изготовления и применения вирусных вакцин, то она, вероятно, не лишена не-
достатков. Это может объясняться также и тем, что сведения, относящиеся к
указанной теме, накапливаются так быстро и поступают из такого множества
разнообразных источников, что уследить за всеми достижениями в этой области
становится все труднее. Поэтому критические замечания читателей окажутся
весьма полезными и будут приняты авторами с благодарностью.
in
Глава 1
РАЗВИТИЕ УЧЕНИЯ
О ВИРУСАХ
Вирусология как новая область инфекционной патологии возникла в конце
XIX-го века, когда стало ясно, что многие распространенные заразные болезни
человека, животных и растений вызываются иными возбудителями, чем бакте-
рии и простейшие. Этими возбудителями оказались вирусы, впервые открытые
Д.И. Ивановским (1892 г.) при изучении причины мозаичной болезни табака.
Пастер был первым, кто начал (1881 г.) систематически использовать лабора-
торных животных в работах по изучению вируса бешенства. Его исследования
положили начало введению вирусных агентов в восприимчивый организм, а так-
же в наиболее чувствительные к заболеванию органы или ткани.
В 1884 г. ученик Пастера Шамберлан изобрел керамические фильтры, позво-
лившие освобождать от бактерий проходящие через них жидкости. В открытии
вирусов особую роль сыграла мозаичная болезнь табака. В 1886 г. Майер обнару-
жил, что ее можно вызвать путем механического переноса сока больных растений
здоровым растениям. В 1892 г. Д.И. Ивановский сообщил о возможности перено-
са мозаики табака соком больных растений, пропущенных через бактериальные
фильтры Шамберлана. Позже Бейеринк (1899 г.) подтвердил эти наблюдения.
В 1897 г. Лёффлер и Фрош, используя принцип фильтруемости, применен-
ный Ивановским, показали, что ящур передается от одного животного другому
агентом, проходящим через фильтры, задерживающие самые мелкие микроор-
ганизмы. Вскоре после этого были открыты многие вирусы человека и живот-
ных: миксомы (Санарелли, 1898), африканской чумы лошадей (Фадиан, 1900),
желтой лихорадки (Риид и Кэрол, 1901), чумы птиц (Центанни, Лоде и Грубер,
1901), классической чумы свиней (Швейнитц и Дорсе, 1903), бешенства (Рем-
лингер и Риффат-Бей, 1903), лейкемии кур (Эллерман и Банг, 1908) полиомие-
лита (Ландстейнер и Поппер, 1909). В 1911 г. Раус открыл вирус, вызывающий у
кур злокачественные опухоли. Открытие вируса саркомы Рауса и другие анало-
гичные наблюдения послужили основанием считать вирусы важными фактора-
ми онкогенеза.
С развитием представлений о фильтрующихся возбудителях их стали назы-
вать «ультравирусами», позже - «фильтрующимися вирусами» и, наконец, с на-
чала 40-х годов прошлого столетия, просто вирусами.
Туорт (1915 г.) и д’Эрелль (1917 г.) независимо друг от друга открыли вирусы
бактерий (бактериофаги). Далее открытия посыпались как из рога изобилия. В
40-х годах удалось обнаружить вирусы насекомых, а еще позже — вирусы грибов,
синезеленых водорослей, свободноживущих микоплазм и простейших. Таким
образом, уже во втором десятилетии XX века стали известны представители трех
основных групп вирусов - вирусы растений, животных и бактерий. Круг хозяев
вируса в ряде случаев не ограничивается лишь каким-либо одним видом орга-
низма. Один и тот же вирус может встречаться у представителей разных видов,
родов и даже типов. Более того, известны вирусы, способные передаваться от
растений насекомым и размножаться в клетках тех и других. Вирус, обладающий,
соответствующей приспособляемостью, может использовать самые разнообраз-
ные эволюционные ниши.
Еще на заре своего существования человечество, ничего не зная о микроор-
ганизмах, умело практически использовать их жизнедеятельность (сбраживать
вино, печь хлеб, делать масло и сыр), а также разработало элементарные основы
лечения многих заболеваний, вызываемых микробами. В известной мере сход-
ная ситуация имела место и с вирусами, которые были открыты лишь в конце
XIX века. Но еще до этого Дженер приготовил вакцину против оспы, а Пастер —
против бешенства. История борьбы с оспой вступила в новую эру, когда англий-
ский врач Эдвард Дженнер (1796 г.) проверил сделанное крестьянами наблюде-
ние, что человек, переболевший коровьей оспой, не заражается натуральной. В
1798 году он опубликовал свой первый научный труд «Изучение причин и дейст-
вия оспенной вакцины». Однако обстоятельно описанный в нем метод натолк-
нулся на ожесточенное сопротивление, прежде чем начать победоносное шест-
вие по всему миру. С помощью глобальной вакцинопрофилактики к 1979 году во
всем мире искоренена натуральная оспа.
В начале 80-х годов XIX века Пастер открыл возможность ослабления виру-
лентности различных возбудителей (сибирская язва, бешенство и др.) и их ис-
пользования для защиты от соответствующих болезней. В честь открытия Джен-
нера Пастер предложил именовать все прививки общим термином «вакцина-
ция» (от латинского слова vacca — корова). С тех пор под вакцинацией понимают
введение различных биологических препаратов с целью создания специфичес-
кого активного иммунитета.
Значительный вклад в развитие вирусологии внесли клеточные культуры.
Однако, несмотря на то, что возможность культивирования клеток животных
вне организма (Каррель, 1912) и размножения в них вирусов (Шейнгард и др.,
1913) были установлены давно, для изготовления вакцин вирусы длительное вре-
мя размножали в организме животных и куриных эмбрионах. Только с развити-
ем однослойных клеточных культур (Дульбеко, 1952) началась эра культураль-
ных вирусных вакцин.
В 50-е годы XX столетия отмечено резкое увеличение заболевания полиоми-
елитом в ряде стран Америки и Европы. По данным 1956 года в США зарегист-
рировано более 300 тысяч инвалидов после паралитических осложнений полио-
миелита. Разработка метода размножения полиовируса в культуре клеток прима-
тов к этому времени (Эндерс и др., 1949 г.) явилась необходимым условием для
создания вакцины. Сначала была разработана инактивированная вакцина Сол-
ка (1954), затем живая вакцина Сэбина (1957). В результате массовой вакцина-
ции заболеваемость полиомиелитом в 1965 году по сравнению с 1958 годом сни-
зилась в 50 раз. В дальнейшем заболевание встречалось в виде спорадических
случаев. Начались поиски путей полного искоренения этой инфекции. Эпопея
борьбы с полиомиелитом явилась яркой иллюстрацией быстрого развития и
эффективного использования новых методов исследования в решении актуаль-
ных практических задач и особенно в разработке и производстве вакцин.
История борьбы с полиомиелитом во многом сходна с историей борьбы с
ящуром животных, протекавшей в то же самое время с широким использовани-
ем метода клеточных культур и других достижений общей вирусологии. Успеш-
ное решение этих двух глобальных проблем оказало благотворное влияние на
развитие вирусологии в целом и явилось прекрасной школой для ряда поколе-
ний вирусологов.
Справедливости ради следует отметить, что первой культуральной вакциной
для практического применения была инактивированная вакцина против ящура
(Френкель, 1947). Вирус выращивали в суспензии эксплантатов эпителия языка
крупного рогатого скота в полусинтетической среде в металлических реакторах.
Эпителиальную ткань получали при убое скота на мясокомбинатах. Такую вакци-
ну с успехом применяли в ряде стран в течение многих лет. В дальнейшем в про-
цессе создания более совершенных средств специфической профилактики ящура
родилась новая промышленная технология культивирования клеток — суспензи-
онное выращивание линий клеток в реакторах большой емкости. Данная техно-
логия имеет прототипное значение и может быть использована при изготовлении
многих вакцин, так как проблема производства вируса для вирусных вакцин пре-
вратилась, в основном, в проблему производства клеток. Многолетний опыт при-
менения инактивированной вакцины против ящура из вируса, размноженного
таким способом, показал ее высокую эффективность и полную безопасность.
Культуры клеток прочно заняли место не только в приготовлении вирусных
вакцин, но и в лабораторной диагностике вирусных заболеваний. С их помощью
выделены сотни патогенных вирусов. Например, вирусная природа кори доказа-
на еще в 1911 году, а выделить вирус в культуре ткани удалось лишь в 1954 году.
Аналогичная ситуация имела место и с другими вирусами. Одним из практичес-
ки важных результатов развития учения о вирусах является современная лабора-
торная диагностика вирусных болезней человека и животных с использованием
новейших молекулярно-биологических методов исследования.
В заключение следует отметить, что вакцинопрофилактика справедливо счи-
тается крупнейшим достижением биологии. Характерная черта развития биоло-
гии на современном этапе — стремительное преодоление расстояния, отделяю-
щего фундаментальные открытия от их практического применения. Этот про-
цесс наиболее отчетливо проявляется в области разработки средств специфиче-
ской профилактики вирусных заболеваний. Благодаря этому в последние годы
достигнуты большие успехи в области вакцинопрофилактики многих опасных
вирусных заболеваний человека и животных. Существует эффективный кон-
троль таких грозных заболеваний как корь, бешенство, чума свиней, чума круп-
ного рогатого скота, чума плотоядных, ньюкаслская болезнь, болезнь Марека и
многих других вирусных болезней. Наиболее ярким примером может служить
борьба с оспой, полиомиелитом и ящуром. ।
Природа вирусов
Несмотря на вековую историю развития учения о вирусах, до сих пор нет
общепринятого определения вирусов. Вирусы оказались одной из величайших
загадок биологии. Д.И. Ивановский выявил два кардинальных свойства вирусов:
они проходят через фильтры, задерживающие бактерии, и не растут на искусст-
венных питательных средах. Однако, как оказалось в дальнейшем, этими свойст-
вами обладают не только вирусы. Например, проходить через фильтры с диамет-
ром пор < 300 нм могут бактерии, находящиеся на некоторых стадиях развития
(L-формы), и микоплазмы. Были открыты наиболее мелкие микроорганизмы —
риккетсии и хламидии, которые не растут, подобно вирусам, на искусственных
питательных средах, а размножаются лишь внутриклеточно. Первые вызывают
сыпной тиф и риккетсиозы у млекопитающих и птиц, вторые — трахому, паховую
лимфогранулему и другие заболевания человека и животных. Также внутрикле-
точное размножение присуще некоторым простейшим (малярийный плазмодий,
тейлерии и др.). Ответить на вопрос, что такое вирусы, кратко охарактеризовав
как свойства вирусных частиц (вирионов), так и свойства вирусов на внутрикле-
точной стадии размножения, оказалось сложной задачей. При ответе на этот во-
прос обычные критерии, применяемые для определения животных и растений,
оказались неприемлемыми. Определение вирусов само по себе несколько произ-
вольно, и в разное время было предложено много его вариантов (А. Львов, С. Лу-
рия, Ф. Феннер, Б. Филдс и др.). Согласно одному из них, «вирусы — реплициру-
ющиеся микроорганизмы, одни из мельчайших представителей существующего
многообразия форм жизни» (Б. Филдс, Д. Найп, 1986).
Положение А. Львова о том, что «вирусы — это вирусы», имело важное тео-
ретическое и практическое значение. С одной стороны, оно подчеркивало сход-
ство всех вирусов, несмотря на большое разнообразие, с другой — выделяло их в
самостоятельное царство живой природы. Главная особенность этих наиболее
просто устроенных, не имеющих клеточной организации мельчайших существ,
состоит в том, что они размножаются только внутри клеток хозяев и находятся в
исключительной зависимости от их структуры и метаболизма. Вирусы, подобно
другим живым существам, способны размножаться, они циркулируют в природе
как виды, обладающие наследственностью и изменчивостью.
Первоначально А. Львов (1957 г.) предложил определять вирусы как «строго
внутриклеточные, потенциально патогенные агенты с инфекционной фазой
развития: 1) содержащие нуклеиновую кислоту только одного типа 2) репроду-
цирующиеся в форме генетического материала 3) неспособные к росту и бинар-
ному делению 4) лишенные «системы Липмана» (т.е. одной из ферментных сис-
тем, участвующих в производстве энергии). В другом определении (С. Лурия,
Дж. Дарнелл, 1967) вирусы рассматриваются как «объекты, геномы которых со-
стоят из нуклеиновой кислоты и репродуцируются в живых клетках, используя
их синтетический аппарат, они вызывают синтез специализированных структур,
способных переносить геном вируса в другие клетки».
В первом определении сделан акцент на внутриклеточной природе вирусов,
их исключительной зависимости от метаболизма клетки-хозяина и на том, что
на определенной стадии репродуктивного цикла специфический материал виру-
са представлен генетическим материалом — нуклеиновой кислотой. Во втором
определении подчеркнуто два существенных качества вируса: 1) наличие у виру-
са собственного генетического материала, использующего биохимический аппа-
рат клетки-хозяина 2) существование у вирусов внеклеточной инфекционной
формы, представленной вирионами, которые служат для введения генома виру-
са в другие клетки или в другой организм.
Таким образом, в отличие даже от самых мелких микроорганизмов, таких как
риккетсии, хламидии и микоплазмы, вирусы не имеют клеточной организации,
хромосомных генов, рибосомальной системы и митохондриального аппарата
(или его эквивалента для производства энергии). Способность риккетсий и хла-
мидий размножаться только внутри клеток, вероятно, связана скорее с потреб-
ностью поступления готовых питательных веществ из клетки-хозяина, нежели с
использованием его биохимического аппарата для экспрессии генома паразита.
Микоплазмы являются свободно живущими внеклеточными паразитами и пред-
ставляют собой бактерии, лишенные жесткой клеточной стенки.
Приведенные выше определения подчеркивают существенные различия
между внутриклеточными и внеклеточными формами существования вирусов.
Проникая внутрь клетки-хозяина, вирионы разрушаются, освобождая вирусную
нуклеиновую кислоту, которая включается в метаболический аппарат клетки,
приводя в конечном счете к репликации вирусного генома. Херши и Чейз
(1953 г.) впервые показали, что в бактериальную клетку при заражении проника-
ет только нуклеиновая кислота бактериофага, которая является единственным
носителем генетической информации вируса.
Решающая роль вирусного генома в процессе вирусной инфекции была до-
казана Гирером и Шраммом (1956 г.) на примере вируса табачной мозаики. Они
первыми доказали способность вирусной РНК вызывать инфекцию. Правиль-
ность этого вывода впоследствии подтверждена установлением инфекционное -
ти РНК и ДНК многих вирусов.
Образование зрелых вирионов стало рассматриваться как завершающий этап
цикла репродукции вируса, определяемый вирусным геномом. Некоторые гены
вирусов кодируют синтез вирусспецифических белков, из которых формируется
капсид, заключающий внутри себя вирусный геном. У некоторых вирусов кап-
сид покрывается оболочкой, по составу и строению сходной с клеточными мем-
бранами, но содержащей также и некоторые вирусспецифические белки. Несмо-
тря на простоту организации, вирусы отличаются от животных и растений боль-
шим разнообразием генома. Животные и растения содержат одновременно две
формы нуклеиновой кислоты: двухцепочную ДНК и одноцепочную РНК. Виру-
сы содержат только одну форму нуклеиновой кислоты — ДНК или РНК, которые
могут быть представлены одно- или двухцепочными молекулами. В случае с
РНК-содержащими вирусами вся генетическая информация содержится в РНК,
что является уникальным явлением в биологии. Все вирусы животных, за исклю-
чением ретровирусов, гаплоидны, т.е. содержат наследственную информацию в
одном экземпляре.
Вирусные ДНК или РНК могут иметь линейную или кольцевую форму. Ге-
ном РНК-содержащих вирусов может быть представлен одной единой молеку-
лой или молекулой, разделенной на 2—12 фрагментов (фрагментированный ге-
ном), а также двумя идентичными молекулами нуклеиновой кислоты (диплоид-
ный геном). Вирусы также значительно различаются между собой по стратегии
реализации генетической информации и репродукции вирусных частиц.
Вирусные нуклеиновые кислоты реплицируются с помощью полимераз, ко-
торые синтезируются в инфицированной клетке и кодируются вирусным гено-
мом или привносятся в клетку в виде вирионных компонентов. В некоторых слу-
чаях в процессе репликации вирусного генома принимают участие предсущест-
вующие клеточные полимеразы.
Репродукция вирусов состоит из репликации вирусного генома с образова-
нием многочисленных копий родительской ДНК или РНК и индуцированного
ими синтеза вирусных белков. Из вновь синтезированных вирусных компонен-
тов путем самосборки формируются вирусные частицы (вирионы). В основе са-
мосборки вирусных частиц лежит процесс, связанный с уменьшением свобод-
ной энергии системы, ибо упорядоченный капсид обладает меньшей свободной
энергией, чем вирионные пептиды. Самосборка вирусных частиц, как и всякий
процесс, ведущий к уменьшению свободной энергии системы, протекает само-
произвольно. Строгая упорядоченность в формировании капсида является след-
ствием взаимодействия вирусной нуклеиновой кислоты и вирионных полипеп-
тидов с образованием максимального количества стабильных нековалентных
связей между субъединицами. Нуклеиновая кислота (вирусный геном) выполня-
ет роль морфопоэтического фактора, направляющего процесс самосборки в сто-
рону образования капсида и формирования вирусных частиц.
Если попытаться расположить вирусы по степени их сложности в гомоло-
гичный ряд, то они, по существу, могут легко заполнить пропасть между нежи-
вой органической материей и клеточными формами жизни. В самом начале это-
Таблица 1. Отличительные свойства одноклеточных микроорганизмов и вирусов
Свойство Микоплазмы Риккетсии Хламидии Вирусы
Диаметр <300 нм + - ± +
Рост на искусственных средах + — — —
Бинарное деление + + + -
Содержание ДНК и РНК + + +
Инфекционность нуклеиновой кислоты — — +а
Рибосомы + + + -
Метаболизм + + + -
Чувствительность к антибиотикам + + + —
а — некоторые вирусы, содержащие ДНК или РНК.
го ряда будут стоять простые минимальные вирусы, состоящие только из белка и
нуклеиновой кислоты одного типа (ДНК или РНК). Далее следуют сложные ви-
русы, содержащие кроме этого углеводы и липиды. За ними следуют однокле-
точные микроорганизмы — хламидии, в составе которых, как и у клеточных
форм жизни, присутствуют одновременно оба типа нуклеиновой кислоты и име-
ется рибосомальный аппарат. Наконец, группа хламидий плавно смыкается с
другими одноклеточными микроорганизмами из царства бактерий — микоплаз-
мами и риккетсиями. Последних роднит с вирусами отсутствие собственного
синтетического аппарата и облигатный внутриклеточный паразитизм. Риккет-
сии всего лишь вдвое больше самых крупных вирусов. Подобно вирусам, они
способны размножаться только в живых клетках. Они отличаются от вирусов бо-
лее сложным химическим строением и способностью синтезировать некоторые
простые питательные вещества. Отличительные свойства мельчайших однокле-
точных микроорганизмов и вирусов приведены в таблице 1.
Структура и состав вирусов
Основным структурным компонентом вирионов (полных вирусных частиц)
является нуклеокапсид, т.е. белковый чехол (капсид) в котором заключен вирус-
ный геном (ДНК или РНК). Нуклеокапсид большинства семейств вирусов окру-
жен липопротеиновой оболочкой. Между оболочкой и нуклеокапсидом у неко-
торых вирусов (орто-, парамиксо-, рабдо-, фило- и ретровирусов) находится
негликозилированный матриксный белок, придающий дополнительную жест-
кость вирионам. Вирусы большинства семейств имеют оболочку, которая играет
важную роль в инфекционности. Наружный слой оболочки вирионы приобретя-
ют, когда нуклеокапсид проникает через клеточную мембрану почкованием.
Белки оболочки кодируются вирусом, а липиды заимствуются из мембраны
клетки. Гликопротеины обычно в виде димеров и тримеров образуют пепломеры
(выступы) на поверхности вирионов (орто-, парамиксовирусы, рабдо-, фило-,
корона-, бунья-, арена-, ретровирусы). Гликозилированные белки слияния свя-
заны с пепломерами и выполняют ключевую роль в проникновении вируса в
клетку. Капсиды и оболочки вирионов образуются множеством копий одного
или нескольких видов белковых субъединиц в результате процесса самосборки.
Взаимодействие в системе белок-белок, благодаря слабым химическим связям,
ведет к объединению симметричных капсидов.
Различия вирусов по форме и размеру вирионов зависят от формы, размера
и количества структурных белковых субъединиц и природы взаимодействия
между ними.
Капсид состоит из множества морфологически выраженных субъединиц
(капсомеров), собранных из вирусных полипептидов строго определенным об-
разом, в соответствии с относительно простыми геометрическими принципами.
Белковые субъединицы, соединяясь друг с другом, образуют капсиды двух видов
симметрии: изометрические и спиральные. Структура нуклеокапсида оболочеч-
ных вирусов сходна со структурой нуклеокапсида безоболочечных вирусов. На
поверхности оболочки вирусов различают морфологически выраженные глико-
протеиновые структуры — пепломеры.
В состав суперкапсидной оболочки входят липиды (до 20—35%) и углеводы
(до 7—8%), имеющие клеточное происхождение. Она состоит из двойного слоя
клеточных липидов и вирусспецифических белков, расположенных снаружи и
изнутри липидного биослоя. Наружный слой суперкапсидной оболочки пред-
ставляют пепломеры (выступы) одного или более типов, состоящие из одной
или нескольких молекул гликопротеинов. Нуклеокапсид у оболочечных вирусов
часто называют сердцевиной (core), а центральную часть вирионов, содержащую
нуклеиновую кислоту, называют нуклеоидом.
Капсомеры (пепломеры) состоят из структурных единиц, построенных из
одной либо из нескольких гомологичных или гетерологичных полипептидных
цепей (белковых субъединиц).
Изометрические капсиды представляют собой не сферы, а правильные мно-
гогранники (икосаэдры). Их линейные размеры идентичны по осям симметрии.
Согласно Каспару и Клугу (1962), капсомеры в капсидах расположены в соответ-
ствии с икосаэдрической симметрией. Такие капсиды состоят из идентичных
субъединиц, образующих икосаэдр. Они имеют 12 вершин (углов), 30 граней и 20
поверхностей в виде равнобедренных треугольников. В соответствии с этим пра-
вилом капсид полиовируса и вируса ящура образован 60 белковыми структурны-
ми единицами, каждая из которых состоит из четырех полипептидных цепей.
Икосаэдр оптимально решает проблему укладки повторяющихся субъеди-
ниц в строгую компактную структуру при минимальном объеме. Только некото-
рые конфигурации структурных субъединиц могут сформировать поверхности,
образовать вершины и грани вирусного икосаэдра. Например, структурные
субъединицы аденовируса на поверхностях и гранях формируют шестигранные
капсомеры (гексоны), а на вершинах - пятигранные капсомеры (пептоны). У
одних вирусов оба вида капсомеров образуются одними и теми же полипептида-
ми, у других — разными полипептидами. Так как структурные субъединицы раз-
ных вирусов различаются между собой, то одни вирусы кажутся более гексаго-
нальными, другие — более сферическими.
Все известные ДНК-содержащие вирусы позвоночных, за исключением ви-
русов оспы, а также многие РНК-содержащие вирусы (7 семейств) имеют куби-
ческий тип симметрии капсида. i
Реовирусы, в отличие от других вирусов позвоночных, имеют двойной кап-
сид (наружный и внутренний), причем каждый состоит из морфологических
единиц.
Вирусы, обладающие спиральным типом симметрии, имеют вид цилиндри-
ческой нитевидной структуры, их геномная РНК имеет вид спирали и находит-
ся внутри капсида. Все вирусы животных спиральной симметрии окружены ли-
попротеиновой оболочкой.
Спиральные нуклеокапсиды характеризуются длиной, диаметром, шагом
спирали и числом капсомеров, приходящихся на один оборот спирали. Так, у ви-
руса Сендай (парамиксовирус) нуклеокапсид представляет собой спираль длиной
около 1 мкм, диаметром 20 нм и шагом спирали 5 нм. Капсид состоит примерно
из 2400 структурных единиц, каждая из которых является белком с молекулярной
массой 60 кД. На каждый виток спирали приходится 11—13 субъединиц.
У вирусов со спиральным типом симметрии нуклеокапсида укладка белко-
вых молекул в спираль обеспечивает максимальное взаимодействие между нук-
леиновой кислотой и белковыми субъединицами. У икосаэдрических вирусов
нуклеиновая кислота находится внутри вирионов в скрученном состоянии и вза-
имодействует с одним или несколькими полипептидами, расположенными вну-
три капсида.
Химический состав вирусов отличается от других форм жизни необычайной
простотой. Кроме геномной ДНК или РНК вирусы позвоночных содержат бел-
ки, масса которых составляет 57—90% массы вириона. Количество вирионных
белков может колебаться в широких пределах в зависимости от сложности стро-
ения вируса. Среди белков, кодируемых вирусным геномом, различают струк-
турные и неструктурные вирусспецифические белки. Первые входят в структуру
вириона, вторые не входят. Структурными белками являются капсидные белки,
белки оболочки и в некоторых случаях белки тегумента и ферменты.
У многих вирусов некоторые структурные вирусные белки не являются пер-
вичными продуктами генов, а образуются в результате посттрансляционного
расщепления полипептида-предшественника вирусспецифическими и клеточ-
ными протеазами.
Неструктурными вирусными белками являются белки, кодируемые вирусным
геномом, но не являющиеся составными частями вириона. Одни из них участву-
ют в репликации вирусных компонентов, другие — в сборке вирионов, третьи на-
рушают нормальный клеточный синтез. Они включают различные типы репли-
каз, связанные с репликацией ДНК, транскриптазы, транскрибирующие мРНК
на геномной дцДНК или дцРНК или (—)оцРНК, вирусные протеазы, геликазы и
лигазы. У ретро- и гепаднавирусов найдена обратная транскриптаза, транскриби-
рующая ДНК на матрице РНК. У ретровирусов найден уникальный фермент,
участвующий в интеграции ДНК-продукта в хромосомальную ДНК клетки. Ви-
русы оспы, которые размножаются в цитоплазме и имеют много уникальных
ферментов для процессинга РНК-транскриптов и репликации вирусной ДНК,
мало зависят от метаболизма клетки. Вирусные белки имеют молекулярную мас-
су 5—200 кД. Наиболее просто устроенные вирусы (вирусы-сателлиты, дефектные
вирусы) кодируют синтез только одного белка, многие патогенные вирусы коди-
руют синтез 5—10 белков, крупные вирусы, такие как вирусы оспы, герпесвирусы,
кодируют синтез до 200 белков. Хотя это немного по сравнению с клетками про-
и эукариотов (кодируют соответственно более 5000 и 100000 белков).
Разные вирусы демонстрируют различные варианты стратегии экспрессии
своих генов и репликации геномов.
Вирусные геномы
Все вирусные геномы являются гаплоидными, т.е. содержат одну копию каж-
дого гена. Исключение составляют ретровирусы, которые обладают диплоидным
геномом. Геномы ДНК-вирусов позвоночных представлены одной двуспираль-
ной молекулой за исключением парво- и цирковирусов.
Геномы полиома-, папиллома-, гепадна- и цирковирусов представлены
кольцевой ДНК. ДНК гепаднавирусов частично двуспиральная, частично одно-
спиральная. ДНК вирусов полиомы и папилломы является суперспиральной.
Большинство линейных вирусных ДНК обладает способностью приобрести
циркулярную конфигурацию, которая требуется для репликации по вращающе-
муся кольцевому механизму. Две цепи ДНК вируса оспы ковалентно связаны
своими концами и при денатурации образуют большое одноцепочечное кольцо.
У некоторых ДНК-вирусов (так же как у РНК-ретровирусов) имеются концевые
повторяющиеся последовательности. Инвертированные концевые повторы об-
наружены у адено- и парвовирусов. У адено-, гепадна- и парвовирусов, так же
каку некоторых РНК-вирусов (пикорна- и калицивирусов), с 5'-концом генома
ковалентно связан белок, играющий важную роль в его репликации.
Все РНК-вирусы позвоночных за исключением рео- и бирнавирусов имеют
одноцепочечные геномы. Геном некоторых РНК-вирусов состоит из нескольких
(2—12) уникальных фрагментов, каждый из которых кодирует, как правило, один
белок. РНК-вирусы с односпиральным геномом могут иметь различную поляр-
ность. Если они имеют ту же полярность, что и мРНК, то они могут прямо инду-
цировать синтез вирусного белка и считаются положительно (+) полярными.
Если геномная нуклеотидная последовательность комплементарна мРНК, то
они считаются отрицательно (—) полярными. К ним относятся: парамиксо-, раб-
до-, фило-, ортомиксо-, арена- и буньявирусы. Все они имеют вирионную РНК-
зависимую полимеразу (транскриптазу), которая в инфицированной клетке
транскрибирует положительно-полярную РНК на матрице геномной вирусной
РНК. У аренавирусов, по крайней мере, у одного рода буньявирусов, один из
РНК-сегментов является двуполярным. Обычно у (+)полярных РНК-вирусов
З'-конец имеет polyA-последовательность, а 5'-конец имеет кэп-структуру.
Размер геномов РНК-вирусов (одноцепочечных 1,7—21 т.н.; двуцепочеч-
ных — 18—27 т.п.н.) значительно меньше размера генома многих ДНК-вирусов.
Поэтому РНК-вирусы, как правило, кодируют меньше белков, чем ДНК-виру-
сы. Масса генома различных вирусов находится в пределах от 1 % (орто- и пара-
миксовирусы) до 32% (парвовирусы) от массы вириона.
Различные семейства вирусов позвоночных значительно различаются по
структуре и функции генома. Основные типы вирусных геномов можно предста-
вить следующим образом:
1) двуцепочечной линейной молекулой ДНК с открытыми (герпесвирусы, аде-
новирусы, иридовирусы) или ковалентно связанными концами (вирусы оспы,
асфаровирусы);
2) одноцепочечной линейной молекулой ДНК (парвовирусы);
3) одноцепочечной кольцевой молекулой ДНК (цирковирусы);
4) двуцепочечной кольцевой молекулой ДНК (папилломавирусы, полиомавирусы);
5) частично двуцепочечной кольцевой незамкнутой молекулой ДНК (гепадна-
вирусы);
6) одноцепочечной молекулой РНК, являющейся мРНК (положительно-геном-
ные вирусы: пикорнавирусы, тогавирусы, флавивирусы, астровирусы, калици-
вирусы, коронавирусы, артеривирусы, нодавирусы);
7) одноцепочечной единой (рабдовирусы, парамиксовирусы, филовирусы, бор-
навирусы) или фрагментированной (ортомиксовирусы) линейной молекулой
РНК, комплементарной мРНК — отрицательно-геномные вирусы;
8) одноцепочечной фрагментированной кольцевой ковалентно несвязанной
отрицательной или двуполярной РНК (буньявирусы, аренавирусы);
9) двуцепочечной линейной фрагментированной молекулой РНК (реовирусы,
бирнавирусы);
10) двумя идентичными линейными молекулами плюс-РНК, являющимися ма-
трицами для синтеза ДНК (ретровирусы).
Молекулярная масса ДНК различных вирусов позвоночных варьирует в ши-
роких пределах: от 0,7—1,5 МД у цирковирусов и парвовирусов, до 150—200 МД
у вирусов оспы. Молекулярная масса генома у РНК вирусов колеблется менее
значительно - от 2,0 до 20,0 МД.
Типы вирусных ДНК
ШШШШШПШ] Линейная двуцепочечная с открытыми концами Герпесвирусы Аденовирусы Иридовирусы
ШШ1П1111111111111) Линейная двуцепочечная с ковалентносвязанными концами Вирусы оспы Асфарвирусы
— Линейная одноцепочечная Парвовирусы
Кольцевая одноцепочечная замкнутая Цирковирусы
Кольцевая двуцепочечная замкнутая Полиомавирусы Папилломавирусы
Кольцевая частично двуцепочечная незамкнутая Гепаднавирусы
Типы вирусных РНК
(+) Линейная одноцепочечная плюс-РНК Пикорнавирусы Калицивирусы Тоговирусы Флавивирусы Коронавирусы Артеривирусы Астровирусы Нодавирусы
(-) Линейная одноцепочечная минус-РНК Рабдовирусы Парамиксовирусы Филовирусы Борнавирусы
(-) Линейная одноцепочеч- ная фрагментированная минус-РНК (6—8 фрагментов) Ортомиксовирусы
Кольцевая ковалентно- несвязанная одноцепо- чечная фрагментиро- ванная минус- или двуполярная РНК (2—3 фрагмента) Буньявирусы Ареновирусы
Линейная двуцепочечная фрагментированная (2 и 10 фрагментов) Реовирусы Бирнавирусы
— Две идентичные линей- ные обратнотранскриби- руемые плюс-РНК Ретровирусы
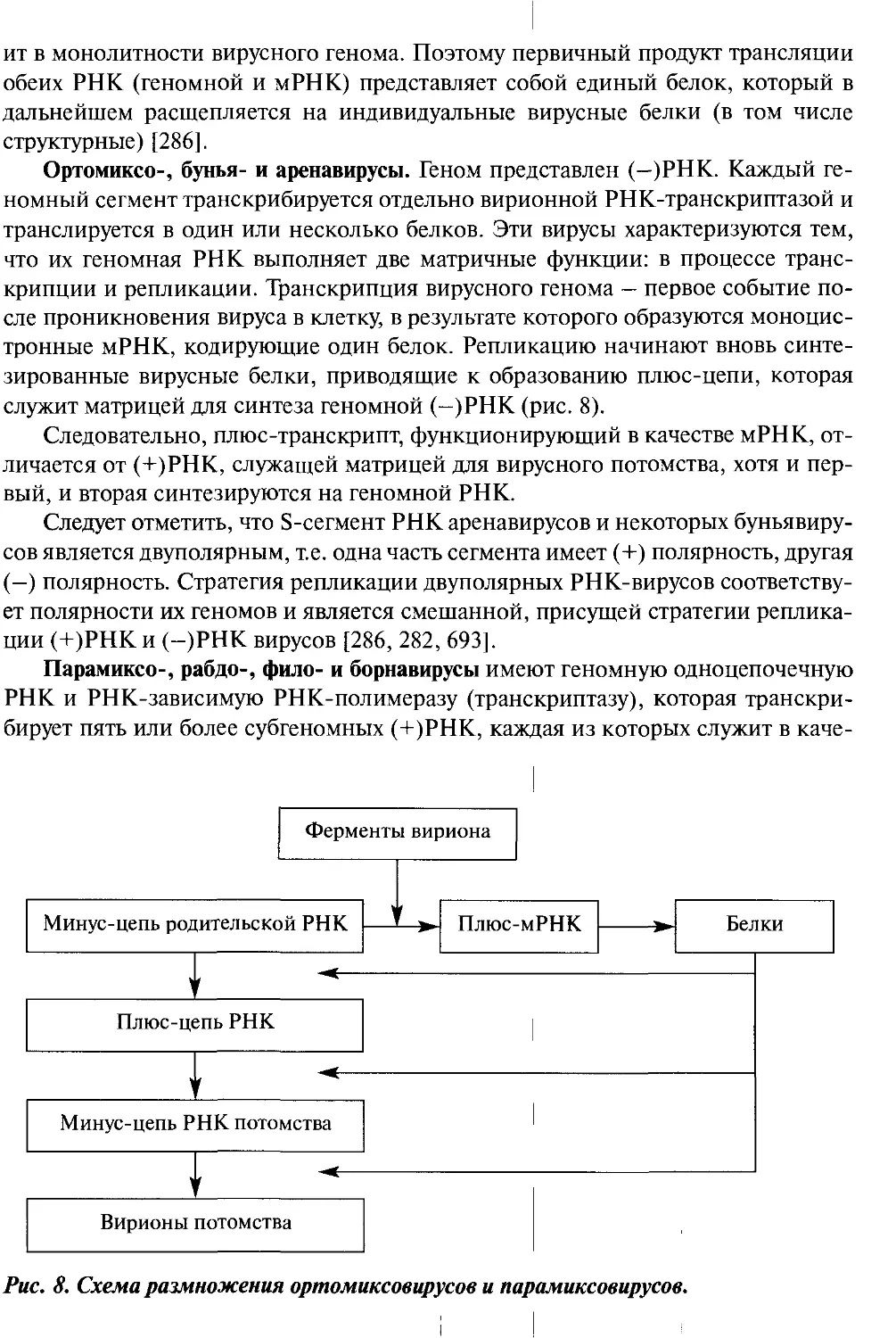
Рис. 1. Структура генома вирусов позвоночных.
ДНК
Иридовирусы
Ranavirus
Lymphocystivirus
дцДНК(от)
Гепадна-
вирусы
Полиомавирусы
Папиллома-
оцДНК
Ф
Цирковирусы
Ф
Парвовирусы
Parvovirinae
дцРНК
Реовирусы
Orthoreovirus
Orbi virus
Coltivirus
Rotavirus
Бирнавирусы
Aquabirnavirus
Avibirnavirus
i__i—i
100 нм
вирусы
РНК
Парамиксовирусы Борнавирусы Аренавирусы
Буньявирусы
Bunyavirus
Hantavirus
Nairovirus
Phlebovirus
Филовирусы
оцРНК(+)
® e
Калицивирусы ВИЧ-
ф подобные
Пикорнавирусы
Астровирусы Флавивирусы
е
Нодавирусы
Betanodavirus
Коронавирусы
Тогавирусы
Рис. 2. Схемы строения и относительные размеры вирусов позвоночных.
КЛАССИФИКАЦИЯ
И НОМЕНКЛАТУРА
ВИРУСОВ
Установлено, что все изученные организмы поражаются вирусами. Множе-
ство различных вирусов вызывают заболевания или латентно инфицируют по-
звоночных и беспозвоночных животных, а также простейших, растения, грибы и
бактерии. Известно более 4000 разных вирусов, из которых несколько сотен ин-
фицируют людей и животных. Международным комитетом по таксономии виру-
сов (ICTV, 2000) разработана единая система классификации и номенклатуры
вирусов, которая основана на изучении различных свойств вирусов, таких как
размер, морфология и структура вириона, его устойчивость к воздействию раз-
личных факторов и антигенные свойства.
Классификация вирусов
На сегодня главным критерием в таксономии вирусов являются: 1) тип и
структура вирусного генома 2) стратегия репликации вируса 3) структура вирио-
на. Полное или частичное секвенирование вирусного генома увеличивает таксо-
номическую информацию и очень часто используется с целью идентификации
вируса. Сведения о нуклеотидной последовательности для всех таксономических
групп вирусов имеются в опубликованной базе данных (Генбанк, Национального
Центра биотехнологической информации, Национальной медицинской лабора-
тории, Национального Института здоровья, Бетезда, Мериленд, США). Это до-
стижение в большинстве случаев укорачивает таксономическую идентифика-
цию, хотя традиционные методы все еще часто используются по экономическим
соображениям. Универсальная система таксономии вирусов включает несколько
уровней: порядок, семейство, подсемейство, род и вид. Патогенные вирусы по-
звоночных (человека и животных) в соответствии с современной системой клас-
сификации вирусов объединены в 2 (Mononegavirales и Nidovirales) порядка и 28
семейств, из которых 10 являются ДНК-вирусами и 18 РНК-вирусами.
Таблица 2. Семейства вирусов, патогенных для человека и животных
Семейство Подсемейство Род Типовой вид
ДНК-вирусы
Вирусы оспы Вирусы ОСПЫ хордовых Ортопоксвирусы Вирус вакцины
Парапоксвирусы Вирус орф (контагиозного пустулезного дерматита овец-эктимы)
Авипоксвирусы Вирус оспы кур
Лепорипоксивирусы Вирус миксомы кроликов
Суипоксвирусы Вирус оспы свиней
Каприпоксвирусы Вирус оспы овец
Ятапоксивирусы Вирус опухолей обезьян Яба
Молюсцивирусы Вирус контагиозного моллюска
Асфаро- вирусы Асфивирусы Вирус африканской чумы свиней
Иридовирусы Рановирусы Вирус лягушек 3
Лимфоцистивирусы Вирус лимфоцитоза рыб
Герпесвирусы Альфагерпес- вирусы Простые герпесвирусы Вирусы герпеса человека 1
Варицелловирусы Вирусы герпеса человека 3
Вирусы, подобные вирусу болезни Марека Вирус болезни Марека
Вирусы, подобные виру- су ларинготрахеита птиц Герпесвирус птиц 1
Бетагерпес- вирусы Цитомегаловирусы Герпесвирус человека 5
Муромегаловирусы Цитомегаловирус мышей 1
Розеоловирусы Герпесвирус человека 6
Гаммагерпес- вирусы Лимфокриптовирусы Герпесвирус человека 4 и*
Радиновирусы Герпесвирус обезьян 2
Герпесподоб- ные вирусы Герпесподобные вирусы L
Аденовирусы Мастаде- вирусы Аденовирус человека 2
Авиадено- вирус Аденовирус птиц 1
Неклассифи- цированные аденовирусы 1
Полиома- вирусы Полиомавирусы Вирус обезьян SV40
Таблица 2. Продолжение
Семейство Подсемейство Род Типовой вид
Папиллома- вирусы Папиломавирусы Вирус папилломы кроликов
Цирковирусы Цирковирусы Вирус анемии цыплят
Парвовирусы Парвовирусы Парвовирусы Мелкий вирус мышей
Эритровирусы Вирус В19
Депендовирусы Адено-ассоциированные вирусы человека и обезьян 2
Гепадно- вирусы Ортогепаднавирусы Вирус гепатита В человека
Авигепаднавирусы Вирус гепатита В уток
РНК-вирусы
Ретровирусы Ал ьфаретро вирус ы (морфология вирионов С-типа) Вирус лейкоза птиц
Бетаретровирусы (морфология вирионов В и Д-типа) Вирус опухоли молочной железы мышей
Гаммаретровирусы (морфология вирионов С-типа) Вирус лейкемии мышей
Дельтаретровирусы (мор- фология вирионов С-ти- па). Вирус лейкоза К PC и Т-лимфотропные виру- сы человека и обезьян. Вирус лейкоза крупного рогатого скота
Эпсилонретровирусы (ре- тровирусы рыб; морфо- логия вирионов С-типа) Вирус дермальной саркомы окуневых рыб
Лентивирусы (вирусы иммунодефицита чело- века и животных; вирио- ны цилиндрической или конической формы) Вирус иммунодефицита человека 1
Спумавирусы Пенящий вирус обезьян
Реовирусы Ортореовирусы Ортореовирус млекопитающих
Орбивирусы Вирус синего языка овец
Ротавирусы Ротавирус А
Колтивирусы Вирус колорадской клещевой лихорадки
Аквареовирусы Реовирусы рыб А
Таблица 2. Продолжение
Семейство Подсемейство Род Типовой вид
Бирнавирусы Авибирнавирусы Вирус бурсальной болезни птиц
Аквабирнавирусы Вирус некроза поджелудоч- ной железы лососевых рыб
Парамиксо- вирусы Парамиксо- вирусы Респировирусы Вирус Сендай
Морбилливирусы Вирус кори
Рубулявирус Вирус паротита
Возможно новый вид Австралийский морбилливирус лошадей
Пневмо- вирусы Пневмовирусы Респираторно-синцитиаль- ный вирус человека
Метапневмовирусы Вирус ринотрахеита индеек
Рабдовирусы Везикуловирусы Вирус везикулярного стоматита Индиана
Лиссавирусы Вирус бешенства
Эфемеровирусы Вирус эфемерной лихорадки крупного рогатого скота
Новирабдовирусы Вирус некроза гемопоэти- ческой системы рыб
Филовирусы Марбург-подобные вирусы Вирус Марбурга
Эболаподобные вирусы Вирус Эбола
Борнавирусы Борнавирусы Вирус болезни Борна
Ортом иксо- вирусы Грипп А Вирус гриппа А
Грипп В Вирус гриппа В
Грипп С Вирус гриппа С
Тоготовирусы Вирус Тогота
Буньявирусы Буньявирусы Вирус Буньямвера
Хантавирусы Вирус Хантаан
Наировирусы Вирус болезни Найроби овец
Флебовирусы Вирус лихорадки долины Рифт
Аренавирусы Аренавирусы Вирус лимфоцитарного хориоменингита
Корона- вирусы Коронавирусы Вирус инфекционного бронхита кур
Торовирусы Вирус Берне
Таблица 2. Продолжение
Семейство Подсемейство Род Типовой вид
Артери- вирусы Артеривирусы Вирус артериита лошадей
Пикорна- вирусы Энтеровирусы Полиовирус человека 1
Риновирусы Риновирус человека 1А
Гепатовирусы Вирус гепатита А человека и обезьян
Кардиовирусы Вирус энцефаломиокардита
Афтовирусы Вирус ящура 0
Парэховирусы Парэховирус человека
Клицивирусы Везивирусы Вирус везикулярной экзантемы свиней
Лаговирусы Вирус геморрагической болезни кроликов
Норволк-подобные вирусы Вирус Норволк
Саппоро-подобные вирусы Вирус Саппоро
Астровирусы Астровирусы Астровирус человека
Флавивирусы Флавивирусы Вирус желтой лихорадки
Пестивирусы Вирус диареи крупного рогатого скота
Гепацивирусы Вирус гепатита С
Тогавирусы Альфавирусы Вирус Синдбис
Рубивирусы Вирус краснухи
Нодавирусы Бетанодавирусы Вирусы некроза нервной ткани морских рыб
«Плавающий» род Дельтавирусы Вирус гепатита Дельта
«Плавающий» род вирусов, подобных | вирусу гепатита Е Вирус гепатита Е
Таблица 3. Свойства вирусов разных семейств
Семейство Вирион Нуклеокапсид Геном
Диаметр (нм) Обо- лоч- ка Симметрия Структур- ных субъ- единиц Природа (кон- формация, кол- во сегментов) Размер (тн, тпн)
Вирусы оспы 250x200x200 + сложная ни? дц, линейная 170-250
Асфаровирусы 175-215 + икосаэдр >1892 дц, линейная 170-190
Иридовирусы 130-300 + икосаэдр 1892 дц,линейная 150-350
Герпесвирусы 150 + икосаэдр 162 дц,линейная 125-235
Аденовирусы 80-100 - икосаэдр 252 дц,линейная 36-44
Полиома- в и русы 45 — икосаэдр 72 ди, циркулярная 5
Папиллома- вирусы 55 икосаэдр 72 дц, циркулярная 8
Парвовирусы 25 — икосаэдр 32 ОЦ(-), линейная 5
Цирковирусы 17-22 — икосаэдр 32 оц(+), циркулярная 1,7-2,3
Гепадна- вирусы 42 — икосаэдр 9 ДЦ, циркулярная 3,2
Ретровирусы 80-100 + икосаэдр ? оц(+), линейная 7-11
Реовирусы 60-80 — икосаэдр 92 дц, линейная, 10, 11 или 12 сегментов 16-27
Бирнавирусы 60 — икосаэдр 92 дц, линейная, 2 сегмента 7
Парамиксо- вирусы 150-300 + спиральная ни оц(-), линейная 15-16
Рабдовирусы 180x75 + спиральная ни ОЦ(-), линейная 13-16
Филовирусы 790-970x80 + спиральная ни ОЦ(-), линейная 19
Борнавирусы 50-60 + икосаэдр ? оц(—), линейная 8,9
Ортомиксо- вирусы 80-120 + спиральная ни оц(-), линей- ная, 6, 7 или 8 сегментов 10-13,6
Буньявирусы 80-120 + спиральная ни оц(—), линей- ная, 3 сегмента 11-21
Аренавирусы 100-300 + спиральная ни оц(—), линей- ная, 2 сегмента 10-14
Таблица 3. Продолжение
Семейство Вирион Нуклеокапсид Геном
Диаметр (им) Обо- лоч- ка Симметрия Структур- ных субъ- единиц Природа (кон- формация, кол- во сегментов) Размер (ти, тпи)
Корона- вирусы 80—220 + спиральная ни оц(+), линейная 20-32
Артеривирусы 50-70 + икосаэдр ни оц(+), линейная 15
Пикорна- вирусы 28-30 икосаэдр 60 оц(+), линейная 7,2-8,4
Калици- вирусы 30-38 — икосаэдр 32 оц(+), линейная 7,4-7,7
Астровирусы 28-30 — икосаэдр 32 оц(+), линейная 7,2-7,9
Тогавирусы 70 + икосаэдр 60 оц(+), линейная 9,7-11,8
Флавивирусы 45-60 + икосаэдр ? оц(+), линейная 9,5-12,5
Нодавирусы 36-43 + ? ? оц(-), циркулярная 1,7
Глава 3
РЕПЛИКАЦИЯ
ВИРУСОВ
Вирионы представляют собой инертные формы, которые сами по себе не
размножаются, а лишь существуют для передачи от одного организма другому и
для перехода из одной клетки хозяина в другую и сохранения во внешней среде.
В последнем случае они как бы напоминают роль споровых форм микроорганиз-
мов. Размножение вирусов является результатом репликации их генома и репро-
дукции других структурных компонентов вириона. Эти процессы происходят
внутри инфицированной клетки. Для того, чтобы вирус мог размножиться, он
должен вначале заразить клетку; чтобы заразить клетку, вирус должен связаться
с клеточной поверхностью, проникнуть в клетку и «раздеться» до такой степени,
чтобы его геном стал способен реализовать свои генетические функции, в ре-
зультате чего появится новое потомство вируса. Спектр хозяев разных вирусов
значительно варьирует, он определяется как видами животных, так и типами
клеток, в которых данный вирус может размножаться. Одни вирусы имеют ши-
рокий спектр хозяев, другие заражают лишь клетки одного типа определенных
видов животных. Способность клеток и организма заражаться вирусом называ-
ют, соответственно, чувствительностью и восприимчивостью. Когда восприим-
чивый организм вступает в контакт с вирусом, первоначально заражаются лишь
чувствительные клетки у входных ворот инфекции (например, миндалины). Од-
нако для клинического проявления инфекции этого может оказаться недоста-
точно, так как болезнь возникает вследствие заражения клеток-мишеней (на-
пример, нейронов, гепатоцитов) после того, как вирус размножился на месте
внедрения в организм. В ряде случаев клетки-мишени располагаются у входных
ворот инфекции (например, кишечные, респираторные инфекции).
События, происходящие в инфицированной клетке, могут существенно раз-
личаться и конечный результат их также может быть различным — от размноже-
ния вируса (продуктивная инфекция) с разрушением или/без разрушения кле-
ток до трансформации клеток, которые приобретают способность к неограни-
ченному делению.
Многие цитопатогенные вирусы обладают способностью к установлению
персистентной инфекции в чувствительных клетках. Молекулярные механизмы
персистенции вирусов в клеточных культурах окончательно не выяснены.
Репликация вирусов занимает центральное место в молекулярной биологии.
Основные закономерности репликации вирусов первоначально были изучены в
опытах с бактериофагами, а с появлением культур клеток млекопитающих эти
методы были адаптированы к вирусам животных.
В начале инфекций в клетку проникает вирусный геном (PH К или ДНК), ча-
сто вместе с необходимыми вирионными белками. Несмотря на существенные
различия в стратегии размножения разных семейств ДНК- и РНК-вирусов, осо-
бенно в отношении транскрипции и репликации их геномов, этот процесс име-
ет общие характерные особенности, свойственные всем вирусам. Главная из них
состоит в том, что способность вирусов к размножению и судьба зараженных
клеток зависят от синтеза и функции продуктов вирусных генов - белков, кото-
рые обеспечивают: а) репликацию вирусного генома и синтез вирусных белков,
б) упаковку генома в вирусные частицы (вирионы) и в) изменение структуры и
(или) функции зараженных клеток.
Стратегия, применяемая вирусами для обеспечения этих функций, варьиру-
ет. Иногда вирусные белки (папиллома и полиомавирусы) просто помогают фер-
ментам клетки хозяина реплицировать вирусный геном. В большинстве случаев
вирусные белки сами обеспечивают репликацию вирусного генома, но даже на-
иболее независимые вирусы , как правило, используют при этом по крайней ме-
ре несколько белков хозяина.
3.1. Цикл размножения вирусов
।
Цикл репродукции вирусов при продуктивной инфекции представляет собой
специфическую последовательность событий, приводящих к образованию нового
потомства вирионов. Его можно разделить на несколько стадий: адсорбция вирио-
нов на поверхности клетки, проникновение вируса или вирусного нуклеопротеида
внутрь клетки, депротеинизация генома, синтез вирусных компонентов, формиро-
вание и выход из клетки зрелых вирионов (рис. 3). Иногда не все стадии протека-
ют последовательно и полностью даже при продуктивной инфекции. При зараже-
нии вирусной нуклеиновой кислотой отсутствует стадия депротеинизации. Цикл
репродукции вируса может прерываться на какой-либо промежуточной стадии, и в
этом случае инфекционные вирионы не образуются (абортивная инфекция).
Классическое изучение кривой роста вируса в одном цикле репродукции
предполагает одновременное инфицирование клеток культуры с использовани-
ем высокой множественности заражения (М=10—100) и определение накопле-
ния вируса через определенные промежутки времени.
1W- I
Рис. 3. Схема цикла размножения вирусов животных.
Прикрепление (адсорбция) вируса
Прикрепление (адсорбция) вирионов к поверхности клетки - первая стадия
вирусной инфекции. Для того, чтобы началась инфекция, вирионы должны
быть способны прикрепляться к клетке. Безусловно, этот процесс в организме
является более сложным, чем в культуре клеток.
Детальное изучение процесса адсорбции вирусов показало, что он состоит из
двух быстро следующих друг за другом периодов - обратимого и необратимого.
В период обратимой адсорбции вирус можно удалить с поверхности клетки при
обработке версеном, хемотрипсином и другими химическими веществами. При
необратимой адсорбции вирус удалить с поверхности клетки не удается.
Первичный контакт с клеткой происходит в результате случайных столкно-
вений вирионов с поверхностью клетки. Количество стабильных прикреплений
вириона к клетке во много раз меньше количества случайных столкновений.
В основе прикрепления вируса к клетке лежат два механизма — неспецифи-
ческий и специфический. Первый из них определяется силами электростатиче-
ского взаимодействия, возникающими между разноименно заряженными груп-
пами, расположенными на поверхности клетки и вируса. В этом процессе, преж-
де всего, могут участвовать положительно заряженные аминные группы
вирусного белка и отрицательно заряженные группы клеточной поверхности. В
пользу электростатического взаимодействия между клеткой и вирусом свиде-
тельствуют данные о зависимости присоединения вирионов к клеткам от ион-
ной силы раствора и его pH, наличия в среде одно- и двухвалентных катионов и
присутствия отрицательно заряженных групп на поверхности клетки [198].
Наиболее важным механизмом прикрепления вируса является специфичес-
кое взаимодействие рецепторов вируса с комплементарными рецепторами клетки.
Прикрепление происходит за счет связи между вирионными прикрепитель-
ными белками на поверхности вирионов и рецепторами на плазматической мем-
бране клеток.
На поверхности вирионов многих семейств вирусов (все РНК-содержащие
оболочечные вирусы и аденовирусы) имеются пепломеры (выступы и шипы)
длиной от 10 до 30 нм, которые принимают непосредственное участие в при-
креплении вируса к клетке. Отщепление пепломеров с помощью протеолитиче-
ских ферментов приводит к потере вирионами способности адсорбироваться на
клетках. На поверхности вирионов, не имеющих пепломеров, находятся участки
связывания с клеточной поверхностью, которые отличаются сложным строени-
ем и, вероятно, состоят из нескольких полипептидов.
Спектр чувствительности клеток к вирусам в значительной мере определяет-
ся наличием соответствующих рецепторов. Рецепторный барьер может быть
преодолен при заражении инфекционной нуклеиновой кислотой.
На поверхности клетки может находиться большое количество различных ви-
дов рецепторов. Полагают, что каждая клетка может адсорбировать от десятков до
нескольких тысяч вирионов. На поверхности одной клетки находится около
10000 рецепторов для полиовируса [169]. Каждый рецептор специфичен для одно-
го или нескольких вирусов, как родственных между собой, так и относящихся к
различным таксономическим группам. Например, аденовирус типа 2 и вирус Кок-
саки ВЗ связываются с одними и теми же клеточными рецепторами [110, 164].
У герпесвирусов прикрепительными белками могут служить гликопротеины
оболочки, которые соединяются с некоторыми рецепторами клетки. Клеточным
рецептором для многих ортомиксовирусов являются концевые сиаловые кисло-
ты олигосахаридов, входящих в структуру гликопротеринов или гликолипидов,
экспонированных на поверхности клетки. Рецепторами для многих риновирусов
являются иммуноглобулины. У вируса ВИЧ в прикреплении первоначально уча-
ствуют молекулы СД4, расположенные на поверхности клеток, особенно макро-
фагов и Т-хелперных лимфоцитов. Подобные взаимодействия рецептор-лиганд
свойственны другим лентивирусным инфекциям [663].
Рецепторы для одних вирусов имеются на клетках нескольких или многих
тканей, тогда как для других вирусов они обнаружены на клетках одного вида
тканей или в один из периодов онтогенеза (новорожденные или взрослые жи-
вотные).
Рецепторы клеток способны к регенерации после удаления их протеолитиче-
скими ферментами [110, 1600].
Проникновение вируса в клетку
После адсорбции вируса следует стадия проникновения его в клетку. Вирио-
ны могут проникать в клетку одним из двух главных путей: опосредованным ре-
цепторами эндоцитозом или слиянием.
Большинство клеток млекопитающих непрерывно осуществляют рецептор-
опосредованный эндоцитоз при поглощении макромолекул посредством специ-
фических рецепторов. Многие оболочечные и безоболочечные вирусы использу-
ют эту ценную клеточную функцию для начала инфицирования. Вирионы при-
крепляются к рецепторам, которые находятся в покрытых клатрином
углублениях и вследствие эндоцитоза оказываются в покрытых клатрином ваку-
олях. Вакуоли проникают в цитоплазму и после удаления клатринового покры-
тия сливаются с эндосомами (кислые прелизосомальные вакуоли). Ацидофика-
ция внутри везикул вызывает изменения в вирионных белках и поверхностных
структурах. Изменения конфигурации капсидного белка VP4 пикорнавирусов,
например, ведет к освобождению вирусной РНК из вириона в цитозоль. Подоб-
ным образом в кислой среде эндосом молекулы гемагглютинина (ГА) вируса
гриппа претерпевают конформационные изменения, создавая возможность сли-
яния между вирусной оболочкой и эндосомальной мембраной, ведущего к осво-
бождению вирусного нуклеокапсида в цитоплазму. Многие другие оболочечные
и безоболочечные вирусы претерпевают подобные изменения [558, 663].
Вирусы с двойным капсидом (реовирусы) проникают в клетку путем фагоци-
тоза и в лизосомах превращаются в активные субвирусные частицы.
В основе проникновения в клетку оболочечных вирусов (пара- и ортомиксо-
вирусы, ретровирусы и, возможно, рабдовирусы и герпесвирусы) лежит процесс
сплавления (слияния) липопротеиновой оболочки вируса с плазматической
мембраной клетки, в результате чего внутрь клетки проникает только нуклео-
протеин вириона [198].
Гликопротеин F, расположенный на поверхности вирионов парамиксовиру-
сов, принимает участие в проникновении вируса в клетку, причем активностью
обладает только расщепленный полипептид. Расщепление гликопротеина НА
ортомиксовирусов на большую и малую субъединицы необходимо для проник-
новения вирионов внутрь клетки.
Другие оболочечные вирусы также способны сливаться с цитоплазматичес-
кой мембраной, благодаря собственной оболочке, обеспечивая вхождение нук-
леиновой кислоты в клетку [663].
При данном способе проникновения функционально активный вирусный
нуклеопротеин освобождается из вириона в период прохождения его внутрь клет-
ки через мембрану, т.е. одновременно происходит проникновение и «раздевание»
вириона. В составе вирусного нуклеопротеина некоторых вирусов внутрь клетки
проникает и вирионная полимераза, которая обеспечивает синтез мРНК [164].
Раздевание вирионов (обнажение вирусного генома)
Для того чтобы вирусные гены стали доступными для транскрипции, необ-
ходимо, чтобы вирионы были хотя бы частично раздеты. В случаях с оболочеч-
ными вирусами РНК, у которых оболочка целиком сливается с цитоплазматиче-
ской мембраной или эндоплазматической мембраной, нуклеокапсид освобожда-
ется прямо в цитоплазму и транскрипция вирусной нуклеиновой кислоты начи-
нается, когда она все еще связана с этой структурой. У безоболочечных реовиру-
сов после проникновения вирионов в клетку происходит разрушение наружного
капсида клеточными ферментами. Однако сердцевина вириона не разрушается
на протяжении всего инфекционного процесса, и двуспиральная геномная РНК
консервируется внутри субвирусной частицы.
Для большинства других вирусов, однако, процедура раздевания завершается
полным обнажением вирусного генома. Для некоторых вирусов, размножающихся
в ядре, последняя стадия раздевания происходит быстрее, чем в цитоплазме [663].
Синтез вирусных компонентов (эклипс-период)
Вскоре после обнажения вирусного генома происходит уменьшение или
исчезновение инфекционности, поскольку вирионов как таковых уже не суще-
ствует, а инфекционность нуклеиновой кислоты намного меньше инфекцион-
ности полных вирионов. Данное явление было названо эклипсом (затмением), а
фаза вирусной инфекции с момента адсорбции и до появления в клетке новых
инфекционных вирионов — эклипс-фазой, или латентным периодом. При высо-
кой множественности заражения клеток некоторая часть вирионов сохраняет
инфекционные свойства в течение всей эклипс-фазы, что зачастую затрудняет
определение ее продолжительности [ПО, 198].
В течение этого периода происходят все существенные процессы вирусной
репродукции, приводящие к образованию вирусных компонентов и формирова-
нию нового потомства вирионов. С появлением в клетке первых вновь синтези-
рованных вирионов завершается эклипс-период размножения вируса.
Процессы, происходящие в эклипс-фазе, схематично показаны на рис. 4, где
в качестве примера представлены основные этапы репликации аденовирусов.
Из представленной схемы видно, что после прикрепления вирион входит в
клетку и частично или полностью лишается оболочки, обнажая вирусный геном.
Некоторые ранние вирусные гены транскрибируются с образованием мРНК, ко-
торые могут затем изменяться различными путями, включая сплайсинг. Ранние
мРНК транслируются с образованием трех главных продуктов: белков, которые
подавляют или останавливают синтез белков и нуклеиновых кислот; белков, ко-
торые регулируют экспрессию вирусного генома; ферментов, необходимых для
репликации вирусных нуклеиновых кислот. Вслед за репликацией вирусной
нуклеиновой кислоты транскрибируются поздние вирусные гены, продуктами
трансляции которых являются в основном структурные вирусные белки, ис-
пользуемые при сборке новых вирионов. Некоторые из них претерпевают пост-
трансляционные изменения перед включением в структуру вирионов. В каждой
инфицированной клетке образуются сотни и тысячи вирионов, которые, осво-
бождаясь, заражают другие клетки.
Проникновение
«Раздевание»
Сборка вирионов
Выход вируса из клетки
Транскрипция
ранней мРНК
Транскрипция
поздней мРНК
Репликация
вирусной ДНК
Трансляция
поздних белков
Трансляция ранних
белков
Рис. 4. Схема репликации вирусов (на примере аденовирусов) [1135].
У большинства ДНК-вирусов транскрипция и репликация ДНК происходит в
ядре клетки, с использованием клеточной РНК-полимеразы II и других клеточных
ферментов. Большинство РНК-вирусов размножается в цитоплазме, где отсутству-
ют ферменты, копирующие РНК на РНК-матрице, поэтому вирусный геном дол-
жен сам по себе функционировать как мРНК или вирус должен нести свою РНК-
полимеразу чтобы транскрибировать РНК на РНК-геноме [164, 198, 663].
Синтез вирусных белков происходит только в цитоплазме клетки. В инфици-
рованных клетках вирусные нуклеиновые кислоты и вирусспецифические белки
синтезируются в значительно большем количестве, чем включаются в вирионы.
Избыточный синтез структурных компонентов при репродукции вирусов явля-
ется своеобразной платой за паразитизм на генетическом уровне [663].
Потомство вирионов проявляется спустя определенный период после того,
как начал осуществляться синтез составляющих их компонентов. Продолжи-
тельность периода от момента инфицирования до появления дочерних вирионов
довольно вариабельна и отражает глубокое различие между разными вирусами.
Латентный период мелких вирусов, не имеющих оболочки и содержащих одно-
спиральную РНК, длится примерно 2 часа и является наиболее коротким среди
всех известных вирусов животных. ДНК-содержащие вирусы имеют более про-
должительный латентный период. Длительный латентный период отмечен так-
же у реовирусов и вируса саркомы Рауса [169]. У простых мелких РНК-содержа-
щих вирусов быстрее протекает не только латентный период, но и весь цикл раз-
множения вируса. Вирусы, геном которых выполняет функции мРНК, имеют
более короткий репликативный цикл, чем вирусы, у которых функции мРНК
выполняет не вирионная РНК, а комплементарная ей минус-нить.
Размножение ДНК-содержащих вирусов может продолжаться даже через 24
часа после заражения. Причины, определяющие длительность цикла размноже-
ния разных вирусов, не выяснены. Возможно, что это связано с более сложной
последовательностью событий при репродукции крупных, сложно устроенных
вирусов.
Укорочение латентного периода при высокой множественности заражения
было обнаружено у различных РНК и ДНК вирусов и, возможно, связано с уско-
рением процесса образования ферментов, участвующих в синтезе нуклеиновой
кислоты. При высокой множественности заражения не исключается также роль
капсидных белков в ускорении начала цикла репродукции [221].
Число инфекционных вирусных частиц, образуемых в одной клетке, зависит
от типа вируса, и количество их варьирует очень широко. Интересно, что на
долю вирусспецифических продуктов приходится от 0,1 до 5% массы клетки жи-
вотного.
3.2 Стратегия репликации вирусов
В ходе эволюции вирусов сложилось несколько стратегий, обеспечивающих:
а) организацию вирусных геномов и их кодирующую функцию; б) экспрессию
вирусных генов; в) репликацию вирусных геномов и г) сборку и созревание
вирусного потомства. Прежде чем рассмотреть данные положения, следует на-
помнить, что фундаментальные биологические особенности вирусов делают ре-
ализацию их генетической информации процессом, не имеющим себе аналогов
среди других форм жизни, включая микоплазмы, риккетсии и хламидии. Во-
первых, это обусловлено тем, что вирусы содержат один тип нуклеиновой кисло-
ты — РНК или ДНК. Во-вторых, у вирусов отсутствует собственный аппарат для
реализации своей генетической информации. Вирусы не имеют ферментов, уча-
ствующих в производстве энергии, и белоксинтезирующих систем. Поэтому ви-
рус должен представить информационную РНК, которую клетка должна распоз-
навать и транслировать. Пути образования мРНК в процессе репликации РНК-
вирусов представлены на рис. 5. В клетке нет ферментов для транскрипции
Рис. 5. Пути первичного синтеза мРНК в процессе репликации РНК-вирусов жи-
вотных. [282]. (РзРп — РНК-зависимая РНК-полимераза).
мРНК с вирусного РНК-генома, а в цитоплазме нет ферментов для транскрип-
ции вирусной ДНК.
В связи с этим клеточную транскриптазу для синтеза вирусных мРНК могут
использовать только вирусы, содержащие ДНК и способные проникать в ядро.
Все другие вирусы вынуждены создавать собственные ферменты для синтеза
мРНК.
Так как эукариотические клетки могут транслировать только моноцистрон-
ные мРНК, вирусы вынуждены синтезировать либо отдельные мРНК для каждо-
го гена (функционально моноцистронная мРНК), либо мРНК, включающую не-
сколько генов и кодирующую большой «полипротеин», который затем разреза-
ется на индивидуальные белки.
I
Организация вирусного генома
Вирусные гены кодированы либо в РНК, либо в ДНК, которые могут быть ли-
бо одно-, либо двуцепочечнымн. Кроме того, геномы могут быть либо монолит-
ными, когда все гены вируса содержатся в одной молекуле (хромосоме), либо со-
стоять из раздельных блоков, когда все гены вируса распределены среди несколь-
ких молекул (хромосом), которые все вместе и составляют геном вируса. Нукле-
иновую кислоту, которая заключена в вирионах, обозначают как «геномную».
Почти все PH К-геномы относят к линейным молекулам. Некоторые из них,
например, геномы пикорнавирусов, содержат на 5'-конце РНК ковалентно свя-
занные полипептиды. Геномы одноцепочечных РНК-вирусов могут быть либо
монолитными (пикорна-, тога-, парамиксо-, рабдо-, корона-, ретровирусы),
либо сегментированными (ортомиксо-, арена- и буньявирусы). Среди РНК виру-
сов с двухцепочечным сегментированным геномом наиболее изучены реовирусы.
Все известные ДНК-вирусы позвоночных имеют монолитный геном. Все
они, за исключением парвовирусов, имеют полностью или частично двухспи-
ральный геном. Отдельные представители парвовирусов содержат линейную
оцДНК; у других (например, у аденоассоциированных вирусов) комплементар-
ные цепи ДНК находятся в разных вирионах. ДНК папиллома- и полиомавиру-
сов — кольцевая и сверхспиральная, в то время как ДНК герпесвирусов, адено-
вирусов и осповирусов — линейная.
ДН К вируса гепатита В представляет собой кольцевую двуспиральную моле-
кулу, на обеих цепях которой в разных областях обнаружены большой и малый
одноцепочечные участки.
Репликация большинства ДНК-вирусов включает механизмы, которые хо-
рошо известны в клеточной биологии: транскрипция мРНК на двуцепочечной
ДНК и репликация ДНК. Для РНК-вирусов ситуация является уникальной и
связана с генетической информацией, кодируемой РНК. РНК-вирусы с различ-
ным типом генома связаны с необходимостью использовать различные пути
синтеза мРНК. Кроме (+) оцРНК вирусов, у которых геномная РНК функцио-
нирует как мРНК, все другие типы вирусной РНК, прежде всего, должны быть
транскрибированы в мРНК. Так как клетки эукариотов не содержат РНК-зави-
симой РНК-полимеразы, (—) оцРНК вирусы и дцРНК вирусы должны содер-
жать вирионную РНК-зависимую РНК-полимеразу.
Эукариотические клетки не могут транслировать полицистронные мРНК ча-
стями в виде нескольких индивидуальных белков. ДНК-вирусы расщепляют
свои полицисторные РНК-транскрипты на моноцисторные мРНК, используя
клеточный механизм.
Большинство РНК-вирусов, размножающихся в цитоплазме, не имеют до-
ступа к ферментам, осуществляющим РНК-процессинг и сплайсинг в ядре, и
вынуждены по-разному решать эту проблему. У вирусов с сегментированным ге-
номом каждый фрагмент является отдельным геном. Другие вирусы имеют по-
лицистронный геном, но образуют моноцистронные РНК-транскрипты, разде-
ляя окончание и реинициацию транскрипции.
Некоторые вирусы имеют полицистронную РНК, которая транслируется в
полипротеин, который затем расщепляется протеолитически с образованием
конечных продуктов [135—282].
Экспрессия и репликация вирусного генома
Анализ данных о молекулярных механизмах репликации вирусов позвоноч-
ных позволил установить сходство и различия в способах реализации генетичес-
кой информации вирусов, относящихся к различным таксономическим груп-
пам. Благодаря этому оказалось возможным выделить основные типы стратегии
экспресии и репликации вирусных геномов. Семейства вирусов, реплицирую-
щиеся по сходному пути, объединены в один тип. Репликация вирусов каждого
типа начинается с инициирующих единиц, которыми являются проникшие в
клетку вирусные геномы: вирионные РНК или ДНК или вирионные нуклеопро-
теины.
Вирусы, геном которых может служить в качестве мРНК, принято называть
вирусами с позитивным (+) геномом. Вирусы с негативным (—) РНК геномом
неспособность функционировать в качестве мРНК компенсируют наличием ви-
рионной транскриптазы [282].
РНК-вирусы
Пикорна-, калици-, астро-, тога- и флавивирусы реплицируются наиболее ко-
ротким путем: их (+)РНК геном функционирует непосредственно как мРНК.
Геномы пикорна- и флавивирусов функционируют как единая полицистрон-
ная мРНК, транслирующаяся прямо в единый полипротеин, который впослед-
ствии расщепляется с образованием индивидуальных структурных и неструктур-
ных белков. Одним из них является РНК-зависимая PH К-полимераза, которая
реплицирует вирусный геном. Вирусная (+)РНК транскрибируется в компли-
ментарную (—)РНК-копию, которая служит матрицей для синтеза новых цепей
(+)РНК (рис. 6), или может использоваться в качестве мРНК-матриц для синте-
за новых минус-цепей и геномной РНК вирусного потомства.
Рис. 6. Схема размножения пикорнавирусов.
Тога-, корона- и калицивирусы отличаются от пикорнавирусов тем, что на
начальном этапе инфекции экспрессируется лишь часть геномной РНК с обра-
зованием белков. Последние осуществляют синтез минус-цепи, являющейся ма-
трицей для синтеза различных по размеру классов молекул плюс-РНК. Поли-
протеины, образующиеся на коротких молекулах мРНК, расщепляются на
структурные вирионные белки. Полноразмерные плюс-РНК упаковываются в
вирионы.
У тогавирусов транслируется только около 2/3 вирусной РНК (5'-конец); об-
разующийся полипротеин расщепляется на неструктурные белки, которые необ-
ходимы для транскрипции и репликации РНК. Вирусная РНК-полимераза син-
тезирует полноразмерную (—)РНК, на которой затем синтезируются два вида
(+)РНК: полноразмерная вирионная РНК, предназначенная для включения в
вирионы, и РНК, длина которой равна 1/3, и которая является колинеарной с
3'-концом вирусной РНК и транслируется в полипротеин, который расщепляет-
ся на структурные белки (рис. 7). У калицивирусов образуются полигеномные и
субгеномные мРНК [282, 286].
Корона- и артеривирусы демонстрируют необычную стратегию транскрип-
ции: первоначально часть вирионной (+) РНК функционирует как мРНК и
транслируется с образованием РНК-полимеразы, которая затем синтезирует
полногеномную (—)РНК. На этой (—)РНК транскрибируется гнездо субгеном-
ных мРНК с общими 3'-концами. Транслируются только 5'-концевые последо-
вательности каждого члена этого гнезда транскриптов.
Главным отличием вирусов с позитивным геномом является их способность
синтезировать ферменты, ответственные за репликацию вирусного генома. По-
этому РНК, выделенная из таких вирусов, инфекционна. Второе отличие состо-
Рис. 7. Схема размножения тогавирусов.
ит в монолитности вирусного генома. Поэтому первичный продукт трансляции
обеих РНК (геномной и мРНК) представляет собой единый белок, который в
дальнейшем расщепляется на индивидуальные вирусные белки (в том числе
структурные) [286].
Ортомиксо-, бунья- и аренавирусы. Геном представлен (—)РНК. Каждый ге-
номный сегмент транскрибируется отдельно вирионной РНК-транскриптазой и
транслируется в один или несколько белков. Эти вирусы характеризуются тем,
что их геномная РНК выполняет две матричные функции: в процессе транс-
крипции и репликации. Транскрипция вирусного генома — первое событие по-
сле проникновения вируса в клетку, в результате которого образуются моноцис-
тронные мРНК, кодирующие один белок. Репликацию начинают вновь синте-
зированные вирусные белки, приводящие к образованию плюс-цепи, которая
служит матрицей для синтеза геномной (—)РНК (рис. 8).
Следовательно, плюс-транскрипт, функционирующий в качестве мРНК, от-
личается от (+)РНК, служащей матрицей для вирусного потомства, хотя и пер-
вый, и вторая синтезируются на геномной РНК.
Следует отметить, что S-сегмент РНК аренавирусов и некоторых буньявиру-
сов является двуполярным, т.е. одна часть сегмента имеет (+) полярность, другая
(—) полярность. Стратегия репликации двуполярных РНК-вирусов соответству-
ет полярности их геномов и является смешанной, присущей стратегии реплика-
ции (+)РНК и (—)РНК вирусов [286, 282, 693].
Парамиксо-, рабдо-, фило- и борнавирусы имеют геномную одноцепочечную
РНК и РНК-зависимую РНК-полимеразу (транскриптазу), которая транскри-
бирует пять или более субгеномных (+)РНК, каждая из которых служит в капе-
Рис. 8. Схема размножения ортомиксовирусов и парамиксовирусов.
стве моноцистронной мРНК. В противоположность транскрипции в результате
репликации (с помощью той же самой полимеразы, действующей в качестве
репликазы) образуются полноразмерные (+)цепи РНК, которые служат матри-
цей для синтеза новых вирионных (-)цепей РНК. Стратегия репликации борна-
вирусов в некоторых деталях является более сложной [286].
Рео- и бирнавирусы имеют сегментированный двуцепочечный РНК-геном.
Негативные цепи каждого сегмента (2—12 сегментов) транскрибируются раздель-
но в цитоплазме вирионной транскриптазой с образованием мРН К. Эти позитив-
но полярные (+)РНК служат матрицей для репликации. Образовавшиеся двуспи-
ральные РНК в свою очередь служат матрицей для дальнейшей транскрипции
мРНК. Транскрипция генома реовирусов происходит внутри субвирусной части-
цы с помощью вирионной транскриптазы, причем копируется только одна нить
каждого фрагмента двуцепочечной РНК (асимметричная транскрипция). Синте-
зирующиеся мРНК выходят из сердцевины вириона через 12 полых вершин час-
тично разрушенного капсида. Таким образом, молекулы мРНК реовирусов вы-
полняют две функции. Во-первых, они транслируются, обеспечивая синтез ви-
русных белков, и, во-вторых, они включаются (по одной молекуле мРНК каждого
из 10--12 генов) в состав частиц-предшественниц вирионов. Каждая мРНК слу-
жит в этих частицах матрицей для синтеза комплементарной цепи, что ведет к
образованию двуцепочечных сегментов вирусного генома (рис. 9).
Молекулы (+)РНК, синтезированные на родительской двуспиральной РНК,
связываются с белками и образуют субвирусные частицы, в которых содержится
10—12 фрагментов (+)РНК. Фрагменты (+)РНК в составе субвирусных частиц
служат матрицами для синтеза (—)РНК, которые в свободном виде в инфициро-
ванных клетках не обнаружены. Полагают, что транскрипция и репликация РНК
Рис. 9. Схема размножения реовирусов.
реовирусов осуществляется одним ферментом, который модифицируется в про-
цессе репликации вируса [164, 286, 1135].
Ретровирусы. Геном представлен двумя идентичными молекулами (+)РНК.
Вместо того чтобы функционировать как мРНК, геном транскрибируется с по-
мощью вирионной обратной транскриптазы, с образованием гибридной молеку-
лы РНК-ДНК. Затем на (-)ДНК синтезируется (+)ДНК и образуется двуспи-
ральная ДНК (другой активностью того же самого фермента) и непрерывно
включается в клеточную ДНК. Интегрированная вирусная ДНК (провирус)
транскрибируется клеточной РНК-полимеразой II с последующим сплайсингом
РНК-транскриптов и расщеплением образующихся белков. Часть вновь синте-
зированных полноразмерных (+)РНК транскриптов соединяется в пары и обра-
зует диплоидные геномы новых вирионов (рис. 10).
Геном ретровирусов состоит из трех генов: (5' — 3') gag, pol и env, которые ко-
дируют, соответственно, внутренние белки вируса, обратную транскриптазу и бел-
ки оболочки. Вирус саркомы Рауса имеет в своем геноме четвертый ген - онкоген
(src), продукт которого играет ключевую роль в трансформации клеток, но не явля-
ется необходимым для размножения вируса [110, 282, 286].
ДНК-вирусы
Оспо-, асфаро- и иридовирусы имеют вирионную транскриптазу (ДНК-зави-
симую РНК-полимеразу) и размножаются в цитоплазме. Их очень большие ге-
номы кодируют многочисленные ферменты, которые делают их репликацию не-
зависимой от клеточного ядра. Моноцистронные мРНК транскрибируются не-
посредственно на вирусной ДНК.
Рис. 10. Схема размножения ретровирусов.
После разрушения наружной оболочки вириона клеточными ферментами на
вирусной ДНК с помощью вирионной ДНК-зависимой РНК-полимеразы син-
тезируются ранние мРНК. Они транслируются в вирусные белки с помощью ко-
торых вирионная ДНК полностью освобождается от белка и реплицируется по
полуконсервативному механизму. Вначале синтезируются фрагменты ДНК
(фрагменты Оказаки), которые затем соединяются с образованием зрелых ви-
русных ДНК. Поздние моно- и полицистронные мРНК транскрибируются по-
сле начала репликации вирусной ДНК и кодируют синтез структурных белков
вириона. Иридовирусы и асфаровирусы, по-видимому, обладают сходной с ви-
русами оспы стратегией репликации [286, 1109, 1135].
Герпес-, адено-, папиллома и полиомавирусы в одном отношении имеют об-
щую стратегию репликации: вирусная ДНК транскрибируется в ядре клеточной
ДНК-зависимой РНК-полимеразой II. В течение определенного промежутка
времени проходит два или более циклов транскрипции различных генных еди-
ниц (групп генов под контролем одного промотора). Субгеномные полицис-
тронные РНК-транскрипты подвергаются расщеплению и сплайсингу, превра-
щаясь в моноцистронные мРНК. У папиллома- и полиомавирусов транскрипци-
онная программа состоит по крайней мере из двух циклов (ранние и поздние
мРНК), а у герпес- (рис. 11) и аденовирусов по крайней мере из трех (сверхран-
ние, ранние и поздние мРНК). В каждом случае вирионные полипептиды син-
тезируются на мРНК, появляющейся в последнем цикле транскрипции (позд-
ние мРНК). ДНК аденовирусов, папиллома- и полиомавирусов может встраи-
ваться в геном клетки-хозяина, реплицироваться вместе с ним, передаваться
дочерним клеткам и транслироваться с образованием вирусных белков [286,
1323,1403,1135].
Рис. 11. Схема размножения герпесвирусов (вируса простого герпеса).
Парво- и цирковирусы, обладающие оцДНК, реплицируются в ядре. Эти ви-
русы используют клеточные ДНК-полимеразы для синтеза двуспиральной ДНК,
которая затем транскрибируется в ядре клеточной ДНК-зависимой РНК-поли-
меразой II. Синтезированные транскрипты подвергаются сплайсингу и превра-
щаются в мРНК.
Вирионная ДНК служит матрицей для синтеза (+) и (-)ДНК. Последние
включаются в вирионы в качестве генома.
Различают недефектные (автономные) и дефектные парвовирусы. Первые
размножаются самостоятельно, тогда как вторые реплицируются только в при-
сутствии вируса-помощника, которым является любой аденовирус или вирус
простого герпеса. В связи с этим дефектные парвовирусы называют аденоассо-
циированными вирусами (ДАВ). В вирионах недефектных парвовирусов содер-
жится односпиральная линейная (+)ДНК. Дефектные парвовирусы являются
уникальными в мире вирусов, поскольку комплементарные плюс- и минус-ДНК
входят в различные вирионы [286, 1403, 1135].
Гепаднавирусы. Частично двуцепочечная ДНК генома гепаднавирусов с по-
мощью вирионной ДНК-полимеразы превращается в суперспирализованную
двуцепочечную ДНК. Затем с помощью клеточной РНК-полимеразы II образу-
ются мРНК для вирусных белков, в том числе для обратной транскриптазы, и
полноразмерная (+)РНК, которая служит матрицей для обратной вирусной
транскрипции с образованием (—)ДНК, на которой в свою очередь синтезирует-
ся частично двуцепочечная ДНК. мРНК транскрибируется на двуцепочечной
ДНК, стартуя от различных промоторов (рис. 12) [693].
Рис. 12. Схема репликации гепаднавирусов.
Транскрипция
У оц(+)РНК-вирусов репликация начинается с полной или частичной
трансляции генома без промежуточных этапов. У всех других классов вирусов
процесс экспрессии вирусного генома начинается с транскрипции мРНК.
В случае с ДНК-вирусами, реплицирующимися в ядре, эту функцию выпол-
няет клеточная ДНК-зависимая РНК-полимераза II. Все другие вирусы нужда-
ются в уникальной и специфичной транскриптазе, которую кодирует вирус, и
она является структурным компонентом вириона. Двуцепочечные ДНК-вирусы,
которые размножаются в цитоплазме, имеют ДНК-зависимую РНК-полимеразу,
тогда как двуцепочечные РНК-вирусы имеют РНК-зависимую РНК-полимера-
зу, специфичную для двуцепочечных РНК, а негативно полярные односпираль-
ные РНК-вирусы носят РНК-зависимую РНК-полимеразу, специфичную для
одноцепочечных РНК.
Транскрипция вирусных ДНК и РНК контролируется сложными регулятор-
ными механизмами и, прежде всего, продуктами экспрессии регуляторных
генов.
Примером некоторых механизмов регуляции экспрессии вирусных геномов,
имеющих принципиальное, но не исключительное значение, могут служить аде-
новирусы.
У аденовирусов имеются несколько транскрипционных единиц. На различ-
ных стадиях репликативного цикла имеются «предранние», «ранние», «проме-
жуточные» и «поздние» транскрипционные единицы, которые транскрибируют-
ся в разные периоды.
Транскрипты, которые образовались особенно в ранней стадии инфекции,
считываются полностью на поздней стадии инфекции с образованием ряда
длинных транскриптов с различными функциями.
Общими закономерностями транскрипции некоторых вирусов с дцДНК-ге-
номом являются: транскрипция ранних и поздних генов с разных цепей ДНК,
наличие перекрывающихся генов, разных рамок считывания и интронов.
У РНК-вирусов регуляция транскрипции в общем происходит менее слож-
но, чем у ДНК-вирусов. Временные различия транскрипции разных генов выра-
жены не так отчетливо. У большинства семейств вирусов с оц(+)РНК геномная
РНК служит мРНК, и для транскрипции-репликации РНК требуется только об-
разование негативной цепи. Однако для ретровирусов и вирусов с несегментиро-
ванным негативным РНК-геномом существут другие механизмы регуляции
транскрипции.
Различные виды мРНК имеют различный период полураспада, что может
также служить одним из возможных уровней регуляции вирусной репликации.
Первичные РНК-транскрипты, образующиеся на ДНК-геномах в ядре перед
выходом в цитоплазму, претерпевают серию посттрансляционных изменений
(копирование, аденилирование, метилирование, делегирование и сплайсинг).
[282, 286, 1135].
Трансляция
Измененные вирусные моноцистронные мРНК связываются с рибосомами
и транслируются в белки в основном с 5'-конца так же, как клеточные мРНК. У
некоторых вирусов транскрибируется полицистронная мРНК, которая может
транслироваться прямо в несколько генных продуктов. Имеется несколько меха-
низмов перекрывания рамок считывания, что значительно расширяет кодирую-
щий потенциал вирусов.
Это особенно важно для вирусов с небольшим геномом и еще раз указывает
на экономичность экспрессии вирусных геномов, кодирующих сложные функ-
ции минимальными нуклеотидными последовательностями. Примером сказан-
ному могут служить лентивирусы, содержащие всего 9 генов, но обладающие
сложным контролем транскрипции и циклом репликации, а также удовлетворя-
ющими требованиями установления латентной инфекции.
Большинство вирусных белков претерпевают посттрансляционные измене-
ния, такие как: фосфолирование (для связывания нуклеиновой кислоты), ацил-
лирование жирных кислот (для включения в мембрану), гликозилирование, ми-
ристилирование или протеолитическое расщепление.
Вирусы используют клеточный метаболизм для синтеза боковых цепей гли-
копротеинов вирусной оболочки.
Посттрансляционное расщепление вирусных белков имеет место у многих
вирусов, у которых полицистронная вирусная (+)РНК транслируется непосред-
ственно в один полипротеин, который несет протеазную активность, расщепля-
ющую полипротеин в определенных местах на мелкие белки. Первое расщепле-
ние происходит, когда полипротеин еще связан с рибосомой. Некоторые боль-
шие фрагменты существуют только быстротечно, тогда как другие
функционируют короткий период и в последующем расщепляются дополни-
тельно протеазами, кодируемыми вирусом, на мелкие белки с различными
функциями.
Некоторые вирусы кодируют несколько различных протеаз, большинство из
которых является трипсиноподобными. Клеточные протеазы присутствуют в та-
ких органеллах как аппарат Гольджи или транспортные вакуоли, которые прини-
мают участие в сборке и созревании многих вирусов. Например, расщепление
гемагглютинина ортомиксовирусов или гликопротеина сплавления (F белок) па-
рамиксовирусов имеет важное значение для инфекционности вирионов.
В таблице 4 приведены белки, кодируемые вирусными геномами. В общем,
белки, транслируемые с ранних транскриптов ДНК-вирусов, включают фер-
менты и другие белки, необходимые для репликации вирусных нуклеиновых
кислот белков, подавляющих синтез клеточных РНК и белков. Крупные ДНК-
вирусы (оспо- и герпесвирусы) также кодируют многочисленные ферменты,
связанные с метаболизмом нуклеотидов. Поздние вирусные белки транслиру-
ются на поздних мРНК, большинство из которых транскрибируется на молеку-
лах потомства вирусных нуклеиновых кислот. Большинство поздних белков
Таблица 4. Белки, кодируемые вирусными геномами [663]
1. Структурные белки вирионов (капсидные, коровые, оболочечные)
2. Ферменты, связанные с вирионами, особенно полимеразы (транскриптазы) и др.
3. Неструктурные белки, главным образом ферменты, необходимые для тран- скрипции, репликации вирусной нуклеиновой кислоты и расщепления белков
4. Регуляторные белки, контролирующие временную последовательность экспрессии вирусного генома
5. Белки, понижающие экспрессию клеточных генов (транскрипцию, иногда трансляцию)
6. Онкогенные (продукты) белки и инактиваторы клеточных белков, подавляющих трансформацию клеток (герпес-, адено-, папиллома-, полиома- и ретровирусные инфекции)
7. Белки, влияющие на вирулентность вируса, хозяинный спектр, тканевой тропизм и т.д. (наиболее сложные ДНК-вирусы)
8. Вирокины, модифицирующие неинфицированные клетки, тем самым способствуя распространению инфекции в организме
являются вирусными структурными белками и часто образуются в избыточном
количестве.
Некоторые вирусные белки обладают другими важными функциями. К ним
относятся регуляторные белки, изменяющие транскрипцию или трансляцию
клеточных генов или ранних вирусных генов. Крупные ДНК-вирусы также ко-
дируют многие дополнительные белки, называемые вирокинами (подобие кле-
точных цитокинов), которые не регулируют цикл вирусной репликации, как та-
ковой, но влияют на ответ хозяина на инфекцию [НО, 282, 693, 1135].
Репликация вирусных ДНК
Синтез геномной вирусной ДНК в принципе не отличается от синтеза кле-
точной ДНК. У разных вирусов это происходит с использованием разных меха-
низмов. Известно, что клеточные ДНК-полимеразы могут начинать синтез но-
вой цепи ДНК только с короткого праймера.
Для решения этой проблемы ДНК-вирусы разных семейств пользуются раз-
личной стратегией. Одни из них имеют циркулярный ДНК-геном, другие —ли-
нейный геном с комплементарными концами, у третьих имеется белковый прай-
мер на 5'-конце.
Для репликации вирусной ДНК необходимы некоторые кодируемые виру-
сом ферменты: геликаза (с АТФазной активностью), чтобы расплести двойную
спираль; белок, дестабилизирующий двойную спираль до тех пор, пока каждая
из нитей не будет скопирована; ДНК-полимераза для копирования каждой цепи
в направлении от 5'-конца к З'-концу; РНКаза для разрушения РНК-праймера
после его функционирования; ДНК-лигазы для соединения ДНК-фрагментов,
если она синтезируется не целиком. Часто один большой фермент обладает дву-
мя и более активностями.
Геном парвовирусов использует для своей репликации клеточные ферменты,
включая ДНК-полимеразу А. Ранний вирусный белок присоединяется к месту
регуляторной последовательности вирусного генома и начинается репликация
ДНК. Происходит непрерывный и прерывистый синтез, соответственно, двух
растущих цепей ДНК: главной и ответвляющейся. Прерывистый синтез ответв-
ляющейся цепи связан с повторяющимися короткими олигонуклеотидными
праймерами, поочередно рождающими короткие цепи ДНК (фрагменты Оказа-
ки), которые затем соединяются ковалентно индуцированной вирусом ДНК-ли-
газой в одну растущую цепь.
Инициирующими единицами репликации папиллома- и полиомавирусов
являются ковалентно связанные циркулярные (±)ДНК и линейные (±)ДНК аде-
но- и герпесвирусов. Праймером синтеза аденовирусной ДНК служит предшест-
венник белка, ковалентно связанный с вирионной ДНК. Репликация ДНК про-
исходит непрерывно от 5'-конца к 3'-концу с использованием вирионной ДНК
полимеразы. Синтез фрагментов Оказаки не происходит. Герпесвирусы кодиру-
ют большинство (если не все) белков, необходимых для репликации ДНК, вклю-
чая ДНК-полимеразу, геликазу, праймазу, белок, соединяющий одноцепочечные
ДНК, и белок, различающий начало репликации. Вирусы оспы и асфаравирусы,
которые размножаются целиком в цитоплазме, являются самодостаточными по
механизму репликации. Гепаднавирусы, подобно ретровирусам, используют по-
ложительно полярные одноцепочечные РНК транскрипты в качестве посредни-
ков в синтезе ДНК с помощью обратной транскрипции. Синтез вирусной ДНК
может происходить как в цитоплазме, так и в ядре зараженной клетки. Напри-
мер, ДНК вирусов оспы синтезируется в цитоплазме, а ДНК герпес-, адено-, па-
пиллома-, полиома- и парвовирусов — в ядре.
Делеция значительного количества генов (~ 40%) у оспо- и герпесвирусов не
оказывает существенного влияния на их размножение в культуре клеток, воз-
можно, что они важны для выживания этих вирусов в природе [1135].
Репликация вирусных РНК
Репликация вирусных РНК является уникальным феноменом. Существен-
ное отличие механизма синтеза вирусных РНК от механизма синтеза клеточных
РНК состоит в том, что в качестве матрицы в первом случае используется РНК,
а во втором — ДНК.
Для транскрипции РНК на РНК-матрице необходима вирионная РНК-зави-
симая РНК-полимераза. Репликация вирусной РНК требует, прежде всего, син-
теза комплементарной РНК, которая затем служит матрицей для производства
большого количества вирусной РНК.
Когда вирусная РНК имеет отрицательную полярность (орто-, парамиксо-,
рабдо-, фило-, борна-, арена- и буньявирусы), комплементарная РНК будет
иметь положительную полярность и РНК-полимераза, подобно вирионной
транскриптазе, используется для первичной транскрипции мРНК. Так как боль-
шинство транскриптов, синтезируемых на каждой вирусной (-)цепи РНК, явля-
ются молекулами субгеномной РНК, некоторые полноразмерные цепи служат
матрицами для синтеза (репликации) вирусной РНК. Некоторые вирусы для
транскрипции и репликации используют различные РНК-полимеразы, тогда как
в других случаях одни и те же ферменты могут выполнять различные функции.
У многих РНК-вирусов, (пикорна-, калици-, астро-, тога-, флави-, корона-,
артери-, нодавирусы) комплементарная РНК является отрицательно полярной.
На одной комплементарной РНК-матрице может транскрибироваться одновре-
менно несколько молекул вирусной РНК, а на каждом РНК-транскрипте начи-
нается продукция полимеразы. Образуется структура, известная как реплика-
тивный посредник, — частично двуцепочечная структура с одноцепочечными
хвостами. Для начала репликации РНК пикорнавирусов и калицивирусов, а так-
же ДНК аденовирусов требуется небольшой белок, связанный ковалентно с 5'-
концом вновь синтезированных (+) или (—) цепей РНК, так же как с родитель-
ской вирионной РНК, но не с мРНК.
Вновь синтезированные (+)РНК могут иметь разное назначение: включать-
ся в репликативный комплекс и служить матрицей для синтеза комплементра-
ных (—)РНК; выполнять функции мРНК; включаться в качестве генома в новые
вирионы. Механизм, определяющий судьбу вновь синтезированных (+)РНК, не
известен.
Ретровирусы имеют геномную (+) одноцепочечную РНК. В отличие от дру-
гих РНК-вирусов, они реплицируются посредством ДНК-посредника. Вирион-
ная обратная транскриптаза, используя РНК-молекулу как праймер, создает од-
носпиральную ДНК-копию. Затем, функционируя как рибонуклеаза, тот же са-
мый фермент удаляет родительскую молекулу РНК из ДНК-РНК-гибрида и
копирует одноцепочечную ДНК-цепь, чтобы образовать линейную двуцепочеч-
ную ДНК, которая содержит дополнительную последовательность, известную
как длинный концевой повтор (LTR) на каждом конце. Эта двуцепочечная ДНК
затем циркулирует и интегрирует с клеточной хромосомальной ДНК. Вирусная
РНК транскрибируется с интегрированной (провирусной) ДНК [282, 286, 1135].
3.3. Формирование и выход
из клетки вирионов
Процесс репродукции вируса завершается формированием и освобождением
вирионов из клетки. Зрелые вирионы образуются из синтезированных в клетке
вирусных компонентов: нуклеиновой кислоты и белков. Как только их концен-
трация достигнет определенного уровня, начинается процесс самосборки вири-
онов, в основе которого лежит специфическое узнавание-взаимодействие вири-
онных компонентов.
В инфицированных клетках вирусные нуклеиновые кислоты и вирусспеци-
фические белки синтезируются в значительно большем количестве, чем включа-
ются в вирусные частицы. Синтез вирусных нуклеиновых кислот и вирусспеци-
фических белков происходит почти одновременно и не менее чем на 1 ч опере-
жает начало созревания вирусных частиц.
Разнообразие структуры вирусов отражается на способе их формирования и
выходе из клетки. У просто устроенных вирусов формируются провирионы, ко-
торые затем в результате модификаций белков превращаются в вирионы.
Все безоболочечные вирусы позвоночных имеют кубическую симметрию.
Структурные белки просто устроенных вирусов связываются спонтанно, образуя
капсомеры, которые благодаря самосборке образуют капсиды, в которые упако-
вывается вирусная нуклеиновая кислота.
В процессе морфогенеза пикорнавирусов образуются различные вирусные
структуры с последовательно возрастающими коэффициентами седиментации.
Комплектование вириона часто связано с протеолитическим расщеплением од-
ного или более капсидных белков, что хорошо изучено на примере полиовируса
и вируса ящура. Перед образованием зрелых вирионов из трех структурных по-
липептидов VPO, VP1 и VP3 (по 60 копий каждого) формируется прокапсид. За-
тем белок VPO расщепляется на два структурных белка (VP2 и VP4), и образуют-
ся зрелые частицы пикорнавирусов (табл. 5).
Механизм укладки вирусной нуклеиновой кислоты в переформированный
прокапсид был выяснен у аденовирусов [1403]. Особый белок, прикрепленный к
нуклеотидной последовательности на одном конце вирусной ДНК-известный
как упаковывающая последовательность, помогает ДНК входить в прокапсид,
прикрепляясь к базовым белкам ядра, после чего некоторые капсидные белки
расщепляются и вирион становится зрелым. Большинство безоболочечных ви-
русов накапливается в цитоплазме или ядре и их можно обнаружить, как внутри-
клеточные инфекционные вирионы перед освобождением путем цитолиза.
Вирионы могут освобождаться из клетки при ее разрушении в результате ли-
зиса или медленного, контролируемого процесса. По первому типу выходят из
клетки вирусы, лишенные оболочки. Второй тип выхода из клетки характерен
для оболочечных вирусов.
У оболочечных вирусов сначала формируются нуклеокапсиды, или сердце-
вины, которые затем покрываются белками наружных оболочек. Вирусы, имею-
щие оболочку (кроме вирусов оспы и реовирусов), формируются на клеточных
мембранах (табл. 6).
Все оболочечные вирусы млекопитающих со спиральным нуклеокапсидом,
так же как некоторые вирусы с икосаэдрическим нуклеокапсидом (герпесвиру-
сы, тогавирусы и ретровирусы), созревают при почковании через плазматичес-
Таблица 5. Механизм объединения вирусных структурных субъединиц [670]
Механизм Вирус Структурные единицы
Объединение индивидуальных белковых молекул Аденовирус Белок IV—тример (фибер), белок III—пентамер (основа пептона) формируют пептон
Гепадновирус (НВ-вирус) С (капсидные) белковые димеры
Полиомавирус (SV-40) VP1 пентамер, с 1 молекулой VP2 или VP3
Реовирус (тип 1) X, 82 (внутренние капсидные белки) гомоолигомеры; 83-ц (наружный капсидный белок) гетероолигомеры
Белковые субъединицы — помощники объединения Аденовирус (тип 2) Гексоновые триммеры белка II обра- зуются с помощью L4 (100 кДа) белка
Герпесвирус (ВПГтип 1) VP5 пентамеры и гексамеры образуются с помощью VP22a
Сборка из полипротеиновых предшественников Альфавирус (вирус Сендай) Капсидный С-белок образуется при расщеплении народившегося полипротеина, содержащего гликопротеиновые участки
Пикорнавирус (полиовирус) Незрелые 5S структурные единицы VP0 - VP3 - VP1
Ретровирус (вирус саркомы птиц) Nc-, СА- и MA-белки оболочки объединяются с помощью Gag полипротеина
кую мембрану, через внутреннюю цитоплазматическую мембрану или через
мембрану ядра.
Выход этих вирусов из клетки является одновременно и завершающей стади-
ей формирования зрелого вириона. Образование зрелых вирионов у оболочеч-
ных вирусов осуществляется при почковании их нуклеопротеинов через моди-
фицированные участки цитоплазматических или ядерных (герпесвирусы) мемб-
ран, в которых клеточные белки заменены вирусспецифическими.
Внутриклеточные и внеклеточные (полные) вирионы вируса оспы различа-
ются между собой в антигенном отношении [643]. Вирус выходит из ядра только
через те участки мембраны, которые образовались после заражения. Именно
этим и объясняется наличие вирусспецифических белков в вирусной оболочке.
Включение вирусных гликопротеинов в липидную двуслойную оболочку
зараженной клетки происходит в результате замещения клеточных белков. Ви-
русные гликопротеины, объединенные в олигомеры, образуют типичные палоч-
кообразные или булавообразные пепломеры с гидрофильными участками, экс-
понируемые над наружной поверхностью мембраны, а гидрофобный трансмем-
бранный якорный домен и короткий гидрофильный цитоплазматический домен
проецируется слабо в цитоплазме. В случае с икосаэдрическими вирусами, каж-
Таблица 6. Взаимодействие вирусов с внутриклеточными мембранами [670]
Семейства вирусов Интегральные мембранные белки Механизм одевания
Буньявирусы Gl, G2 Почкование через мембрану аппарата Гольджи
Коронавирусы М, S Почкование через эндоплазматичес- кую сеть и мембрану аппарата Гольджи
Гепадновирусы L, М, S Почкование через эндоплазматичес- кую сеть
Герпесвирусы UL31, UL34 gE-gl Первоначально одеваются: путем почкования капсидов через внутреннюю мембрану ядра Почкование через мембрану аппарата Гольджи
Вирусы оспы: — незрелый вирус осповакцины — зрелый внутриклеточный вирус А141, А131, 4171 A56R (НА), F131, B5R Поглощение частицей Поглощение с образованием структуры с четырьмя мембранами
Ротавирусы VP7, N528 Почкование через эндоплазматичес- кую сеть
Рубеллавирусы Е1-Е2 Почкование через мембрану аппарата Гольжди
дая молекула белка нуклеокапсида соединена непосредственно с цитоплазмати-
ческим доменом олигомера мембранного гликопротеина, окружающего нуклео-
капсид. Вирусы со спиральными нуклеокапсидами в большинстве случаев име-
ют матриксный белок, который прикрепляется к цитоплазматическому участку
гликопротеинового пепломера; а противоположным концом к матриксному
белку и это инициирует почкование. Освобождение отдельного вириона и мас-
сы вирионов не сопровождается образованием бреши в плазматической мембра-
не и ее заметным повреждением. Многие, но не все вирусы, которые почкуются
через плазматическую мембрану, являются цитопатогенными и могут быть свя-
заны с персистентной инфекцией.
Флавивирусы, коронавирусы, артеривирусы и буньявирусы созревают, поч-
куясь через мембрану комплекса Гольджи или гладкой эндоплазматической се-
ти; везикулы, содержащие вирус, затем мигрируют к плазматической мембране,
с которой они сливаются, освобождая вирионы экзоцитозом. Уникальным для
герпесвирусов является то, что их оболочка формируется при почковании через
внутренний слой ядерной мембраны (табл. 7). Такие вирионы выходят из клетки
через каналы цитоплазматического ретикулума, соединяющие ядерную оболоч-
ку с наружной мембраной клетки. Благодаря такому механизму выделения, эти
Таблица 7. Характеристика репликации вирусов позвоночных
Семейство Место репликации генома Продолжи- тельность эклипс- периода, ч Место почкования
Вирусы оспы цитоплазма 4 Мембрана аппарата Гольджи
Асфаровирусы цитоплазма 5 Плазматическая мембрана
Иридовирусы ядро/цитоплазма 9 9
Герпесвирусы ядро 4 Мембрана ядра
Аденовирусы ядро 10 нет
Папилломавирусы ядро 12 9
Полиомавирусы ядро 12 ?
Парвовирусы ядро 6 нет
Цирковирусы ядро 9 9
Гепаднавирусы ядро ? ?
Ретровирусы ядро/цитоплазма 10 Плазматическая мембрана
Реовирусы цитоплазма 5 нет
Бирнавирусы цитоплазма 4 нет
Парамиксовирусы цитоплазма 4 Плазматическая мембрана
Рабдовирусы цитоплазма 3 Плазматическая мембрана
Филовирусы цитоплазма 2 Плазматическая мембрана
Борнавирусы ядро 9 нет
Ортомиксовирусы ядро 4 Плазматическая мембрана
Аренавирусы цитоплазма 5 Плазматическая мембрана
Коронавирусы цитоплазма 5 Эндоплазматическая сеть
Артеривирусы цитоплазма 5 Эндоплазматическая сеть
Пикорнавирусы цитоплазма 2 нет
Калицивирусы цитоплазма 3 нет
Астровирусы цитоплазма 3 нет
Тоговирусы цитоплазма 2 Плазматическая мембрана
Флавивирусы цитоплазма 3 Эндоплазматическая сеть
Буньявирусы цитоплазма 4 Мембрана аппарата Гольджи
вирусы могут передаваться от клетки к клетке, несмотря на наличие антител в
экстрацеллюлярном пространстве. Таким образом, возможна передача вируса от
клетки к клетке без выхода во внешнюю среду [507].
Особую проблему представляет механизм формирования зрелых вирусных
частиц, содержащих несколько различных молекул РНК (ортомиксо-, рео-, бир-
на- и аренавирусы). Трудно представить, каким образом из пула нуклеиновых
кислот в данный вирион попадает строго определенный комплект молекул РНК.
Вероятно, важную роль в отборе нужных молекул играет специфическое взаимо-
действие нуклеиновой кислоты с определенными структурными белками вири-
онов [898, 1135].
Дефектные интерферирующие вирусные частицы (ДИ-частицы)
При обычной цитолитической инфекции значительную часть вирусного по-
томства представляют неинфекционные вирусные частицы, которые утратили
способность к автономной репликации из-за дефектности их генома. Поврежде-
ния в важных для репликации генах чаще всего связаны с делеционными мута-
циями, хотя они могут быть и точечными. ДИ-частицы содержат дефектный ге-
ном, более короткий, чем геном стандартного инфекционного вируса. Величина
утраченной части родительского генома может достигать 90%. Обладающие
большим разнообразием ДИ-частицы для своей репликации нуждаются в гомо-
логичном инфекционном вирусе-помощнике, так как размножаются в заражен-
ных им клетках, проявляя специфическую интерференцию.
Способность к интерференции заключается в том, что ДИ-частицы препят-
ствуют размножению инфекционного гомологичного вируса, который для них
служит вирусом-помощником. ДИ-частицы используют для своей репродукции
продукты генов инфекционного вируса и тем самым специфически подавляют
его репродукцию. Способность ДИ-частиц к самообогащению особенно отчет-
ливо проявляется при серийном пассировании вируса с высокой множественно-
стью заражения. Использование неразведенного вирусного инокулята при се-
рийных пассажах in vivo или in vitro является лучшим методом для накопления
ДИ-частиц, а применение разведенных инокулятов позволяет снизить их кон-
центрацию до минимального уровня и повысить выход инфекционного вируса.
ДИ-частицы обнаружены практически у всех вирусов животных (кроме вирусов
оспы). Следует отметить, что аутоинтерференция, обусловленная ДИ-частица-
ми, у пикорнавирусов выражена слабо. Интерферирующая способность ДИ-ча-
стиц может зависеть от типа клеточных культур. ДИ-частицы играют определен-
ную роль в инфекции и иммунитете. Они могут ослабить естественную вирусную
инфекцию в результате интерференции с гомологичным инфекционным виру-
сом и влияют на установление и поддержание персистентной инфекции in vivo и
in vitro. Высокое содержание ДИ-частиц в живых вакцинах может влиять на их
эффективность. В некоторых случаях большая доля неинфекционных частиц
также может быть превращена в инфекционные при помощи различных обрабо-
ток, что свидетельствует об их потенциальной инфекционности. Например, в
препаратах пикорнавирусов концентрация вирионов может в 100—1000 раз пре-
вышать концентрацию инфекционных частиц. На 107—108 частиц вируса папил-
ломы кролика приходится примерно одна опухолеобразующая единица [169].
Часто природа дефекта, делающего эти частицы неинфекционными, неизвест-
на. Такие частицы могут вызывать абортивную инфекцию, при которой осуще-
ствляется ряд вирусспепифических, функций, но новый инфекционный вирус не
образуется. Однако, даже инфекционные вирусные частицы с полным геномом
могут быть дефектными для одной клеточной культуры и вызывать нормальную
или абортивную инфекцию в клетках другого типа. Такие вирусы могут рассмат-
риваться как мутанты, зависящие от хозяина. Они размножаются только в клет-
ках, обладающих определенной генетической функцией, которой нет у самого
вируса.
Вирусы-сателлиты относятся к вирусам, размножающимся за счет генных
продуктов, образованных другими, часто неродственными им вирусами.
Очень часто РНК- или ДНК-геном вируса-помощника не имеет гомологии с
геномом вируса-сателлита. Примером сателлитных вирусов человека могут слу-
жить аденоассоциированные вирусы (AAV), которые реплицируются только в
ядрах клеток, одновременно зараженных аденовирусами. Сателлитоподобный
вирус обнаружен у пчел, инфицированных вирусом хронического паралича
пчел. Вирусы-сателлиты широко распространены у вирусов растений с разде-
ленными геномами [172, 898, 1135J.
Типы взаимодействия вирусов с клетками
Взаимодействие вируса с клетками хозяина может иметь различные проявле-
ния. Вирусная инфекция может протекать с разрушением и без разрушения кле-
ток. Не все вирусные инфекции являются продуктивными. Вирусные инфекции,
не сопровождающиеся образованием нового потомства вирусов, называются
абортивными инфекциями. Непродуктивная инфекция может быть персистент-
ной или латентной инфекцией. В первом случае инфекция продолжается дли-
тельное время, во втором она имеет место, но не проявляется, хотя вирусный ге-
ном интегрирован в ДНК клетки, или существует в виде эписомы. Персистент-
ная или латентная инфекция могут вести к трансформации клеток.
Наиболее распространенными морфологическими изменениями, вызывае-
мыми вирусами, являются:
1) округление и отделение клеток от твердого субстрата;
2) лизис клеток;
3) образование синцития;
4) образование телец-включений.
Цитопатические вирусы убивают инфицированные клетки, что является ре-
зультатом повреждающего кумулятивного действия многих физиологических
функций клетки. К ним относятся подавление синтеза нуклеиновых кислот и
белка, транскрипции РНК, процессинга мРНК, изменение клеточных мембран,
токсичность вирусных белков. Цитопатический эффект вызывают также токси-
ческие вирусные белки, которые накапливаются в конечной стадии инфекции.
Цитопатические изменения связаны с изменением клеточных мембран. Клетки
могут сливаться и формировать синцитий.
Морфологические изменения в клетках, инфицированных некоторыми виру-
сами, сопровождаются образованием телец-включений, которые обнаруживают-
ся под световым микроскопом после фиксации и окрашивания. В зависимости от
вируса они могут находиться в цитоплазме (оспо-, рео-, парамиксовирусы и ви-
рус бешенства) или ядре (герпес-, адено- и парвовирусы), быть единичными или
множественными, большими или мелкими, округлыми или полиморфными,
ацидофильными или базофильными. Вирус чумы плотоядных и цитомегаловирус
свиней могут вызывать образование телец-включений в ядре и цитоплазме. Тель-
ца-включения могут представлять собой скопление вирусных компонентов
(тельца Негри при бешенстве) или место синтеза вируса-вироплазма (вирусы ос-
пы). Другие включения представлены кристаллическими агрегатами вирионов
(аденовирусные включения в ядре или реовирусные - в цитоплазме). Кроме то-
го, они могут представлять собой результат дегенеративных изменений клеток.
Вирусы, почкующиеся через плазматическую мембрану (тога-, орто- и пара-
миксовирусы), способны адсорбировать эритроциты на клетках инфицирован-
ной культуры (вызывать гемадсорбцию). Гликопротеины некоторых вирусов от-
ветственны за гемагглютинацию in vitro [898]. Нецитопатические вирусы обыч-
но не убивают клетки, в которых они размножаются. Они часто вызывают
персистентную инфекцию с образованием и выделением вирионов, минималь-
но повреждая клеточный метаболизм. Во многих случаях такие клетки продол-
жают расти и делиться. Такой способностью обладают некоторые РНК вирусы
(пести-, арена-, ретро- и парамиксовирусы) [898].
Интерференция вирусов проявляется, когда инфицированные вирусом клет-
ки становятся устойчивыми к суперинфицированию тем же самым или другим
вирусом. Это явление может быть обусловлено двумя причинами: 1) дефектив-
Таблица 8. Свойства интерферонов [346]
Свойства Интерфероны
а 7
Основной источник Лейкоциты, многие другие клетки Фибробласты, эпи- телиальные клетки Т-лимфоциты, NK-клетки
Инфицирую- щий агент Вирусная инфекция Вирусная инфекция Антиген или митоген
Количество субтипов Более 20 (мономеры) 1 (димер) 1 (тетромер)
Основная активность Антивирусная Антивирусная иммуномодулирующая
Механизм действия Подавление синтеза белка Подавление синтеза белка Повышение МНС анти- генов; активация цито- токсических Т-клеток, макрофагов и NK-клеток
ними интерферирующими частицами (против гомологичного вируса) и 2) ин-
терфероном. Сейчас у человека известно более 20 интерферонов. Они являются
членами большого семейства нормальных регуляторов синтеза клеточных бел-
ков (цитокины). Их разделяют на три химически определенных типа а, В и -у
(табл. 8).
После синтеза в инфицированных вирусом клетках они выделяются и связы-
ваются со специфическими рецепторами плазматической мембраны других кле-
ток. Вероятно, имеется один рецептор для а- и [3- интерферона и другой для у-
интерферона. Многие индуцированные белки, каждый своим путем, прямо или
косвенно подавляют репликацию вируса.
КРУПНОМАСШТАБНОЕ
КУЛЬТИВИРОВАНИЕ
ВИРУСОВ
Массовое выращивание клеток в культуре является центральным звеном лю-
бого технологического процесса, основанного на использовании клеток живот-
ных, и, в первую очередь, производства вирусных препаратов. Эта стадия опре-
деляет массу и качество клеток и, тем самым, в целом технологию получения ви-
русного сырья. Выбор способа культивирования вируса в значительной мере
определяется способностью клеток размножаться на поверхности плотного суб-
страта или в суспензионной культуре. Трудно определить верхние и нижние гра-
ницы крупномасштабного или промышленного выращивания вирусов в клеточ-
ных культурах. Все зависит от масштабов производства вирусных препаратов. В
одних случаях речь идет о получении сотен литров, в других — десятков и даже
сотен тысяч литров культурального вируса в год. Это зависит от вида вакцин и
масштабов их применения. Изготовление живых вакцин при прочих равных ус-
ловиях всегда требует меньших объемов вирусного сырья, нежели приготовле-
ние инактивированных, в особенности концентрированных вакцин.
Отсутствие эффективных вакцин для профилактики некоторых заболеваний
объясняется, прежде всего, отсутствием экономичного способа получения им-
муногенного материала в достаточном количестве.
В отличие от инактивированных вакцин против ящура и полиомиелита, вы-
пускаемых в больших количествах, при многих заболеваниях человека и живот-
ных применяют живые вакцины, для изготовления которых не требуется боль-
шого количества вирусного сырья. Это, прежде всего, относится к тем вакцинам,
которые перед применением разводят. Ежегодно производство таких вакцин,
связанное с получением сотен литров культурального вируса, удовлетворяется
использованием статических или вращающихся культуральных сосудов. Однако
такие методы культивирования вирусов не могут удовлетворить крупномасштаб-
ное производство ряда вирусных вакцин. Например, при изготовлении противо-
ящурной вакцины перевиваемые клетки выращивают в суспензии в реакторах с
рабочим объемом более 1000 л. Крупные научно-производственные центры
Южной Америки ежегодно вырабатывали до 600 млн. доз моновалентной инак-
тивированной противоящурной вакцины [1114]. Для этой цели необходимо еже-
недельно получать около 20 000 л суспензионной культуры клеток ВНК-21.
До недавнего времени производство большинства вирусных препаратов ос-
новывалось на использовании первичных культур клеток из нормальных тканей
различных видов домашних и лабораторных животных. Кроме того, в качестве
клеточных субстратов для производства вакцин, применяемых в медицине, ис-
пользовали немногие линии диплоидных клеток с ограниченной жизненной по-
тенцией. Широкое применение таких препаратов в медицине и ветеринарной
практике дало возможность достичь больших успехов в борьбе со многими опас-
ными вирусными болезнями человека и животных. Однако первичные культуры
клеток во многих отношениях не являются перспективными клеточными субст-
ратами. Их приготовление связано с периодическим убоем животных и необхо-
димостью выделения клеток из тканей.
Первичные культуры отличаются нестандартностью, таят в себе опасность в
отношении эндогенной контаминации различными вирусами и микроорганиз-
мами. Наконец, их сложно выращивать в условиях крупносерийного производ-
ства. Отмеченные трудности значительно возрастают в связи с тенденцией по-
стоянного увеличения масштабов изготовления противовирусных препаратов.
Кроме того, в последнее время все более широкое развитие получает разработ-
ка концентрированных и субъединичных вакцин, при изготовлении которых
требуется большое количество вирусного материала. Естественно, что стоящая
задача может быть решена лишь путем использования постоянных (перевивае-
мых) линий клеток, отличающихся способностью к бесконечной пересеваемо-
сти вне организма, высокой стандартностью, низкой стоимостью, относитель-
ной простотой трансфекции рекомбинантной ДНК и последующего клониро-
вания высокоэффективных продуцентов, высокой вероятностью правильного
посттрансляционного процессинга вновь синтезируемых белков, кодируемых
трансфецирующей ДНК. Ветеринарная наука в течение последней четверти ве-
ка накопила большой опыт в изготовлении вирусных вакцин с использованием
в качестве субстрата для размножения вирусов культур постоянных линий кле-
ток животных. Особый успех достигнут в изготовлении инактивированной про-
тивоящурной вакцины. Производство вакцин против ящура имеет наиболее
цитируемую технологию. Она основана на использовании линии трансформи-
рованных клеток новорожденного хомяка, выращиваемых в суспензии. Эта тех-
нология достаточно экономична, ее выполняют в биореакторах большой емко-
сти [1114]. Накоплены определенные доказательства безопасности некоторых
постоянных клеточных линий, используемых в качестве субстрата в производ-
стве ряда биологических препаратов. Например, инактивированную противо-
ящурную вакцину готовят из вируса, выращенного в культуре постоянной ли-
нии клеток почки новорожденного хомяка (линия ВНК-21). Более чем за 20-
летний период этой вакциной привито свыше 100 млн. голов крупного рогатого
скота и не обнаружено каких-либо нарушений у привитых животных, по край-
ней мере, в течение 2—4 лет после введения вакцины. Имеется много других
примеров безопасности применения инактивированных и даже живых вакцин
против ряда болезней животных, приготовленных из вирусов, размноженных в
культурах различных постоянных линий клеток. Применение биологических
препаратов, полученных на основе перевиваемых клеточных линий, в медици-
не началось намного позже, чем в ветеринарной практике. Несмотря на очевид-
ные преимущества постоянных линий клеток, медицинская практика до недав-
него времени воздерживалась от их применения в производстве вирусных
вакцин [102]. Причина заключалась в том, что, согласно существовавшему мне-
нию, для изготовления медицинских вирусных вакцин можно было использо-
вать клетки из тканей только клинически здоровых животных. Производство
таких вакцин ограничивалось использованием первичных и диплоидных куль-
тур клеток. В диплоидных линиях клеток человека никогда не были обнаруже-
ны латентные вирусы или спонтанная трансформация клеток. Основное возра-
жение против использования постоянных клеточных линий для репликации
вирусов и векторных рекомбинатов в производстве вирусных вакцин медицин-
ского назначения заключалось в их возможной онкогенности [48] из-за конта-
минации вакцин клеточной ДНК или генными продуктами (регуляторными
белками). Интеграция гетерогенной ДНК может привести к предзлокачествен-
ным изменениям в результате активации протоонкогенов, запуску онкогенов и
инактивации генов опухолевой супрессии. В процессе репродукции вакцинных
штаммов для живых вакцин с использованием клеточных линий, латентно кон-
таминированных другими вирусами, могут появляться вирусные гибриды с не-
ожиданными свойствами [1721].
Этот вопрос рассматривался неоднократно на различных научных форумах в
Европе и Северной Америке. Ценность постоянных клеточных линий в качест-
ве субстратов стала особенно очевидной благодаря успехам, достигнутым в по-
следнее время в области фундаментальных биологических исследований, а так-
же в связи с перспективой их использования в рекомбинантной ДНК-техноло-
гии и получении генно-инженерных биопрепаратов. Общая тенденция к
применению постоянных клеточных линий в производстве медицинских имму-
нобиологических препаратов наметилась на рубеже 70—80-х годов. Так, в 1978 г.
в Лейк-Плесиде (США) было предложено использовать лимфобластоидные
клетки человека для крупномасштабного производства альфа-интерферона. В
1981 г. Комитет экспертов ВОЗ по стандартизации биологических препаратов
одобрил применение неопухолевых и неконтаминированных вирусами постоян-
ных клеточных линий для производства инактивированной полиомиелитной
вакцины, а затем также для инактивированной вакцины против бешенства. Та-
кое решение дало возможность в короткий срок разработать методы крупномас-
штабного выращивания вирусов с использованием микроносителей и создать
высокоэффективные вирусные вакцины.
В истории создания биологических препаратов ключевая роль всегда при-
надлежала выбору приемлемо безопасных вариантов. Решение о применении
людям биопрепаратов, полученных с использованием постоянных клеточных
линий, основывалось на оценке различными комитетами выгод и риска, связан-
ных с созданием новых препаратов, по сравнению с существующими. Важней-
шие потенциальные факторы риска, связанные с биологическими препаратами,
производимыми на постоянных клеточных линиях, можно разделить на три ка-
тегории: примесь гетерогенной ДНК, вирусы и трансформирующие белки.
Одним из основных вопросов, требующих самого пристального внимания,
является потенциальная долгосрочная опасность, связанная с присутствием в
препаратах примесей гетерогенных ДНК, особенно в тех случаях, когда послед-
ние могли содержать потенциально онкогенные кодирующие или регуляторные
последовател ьности.
Однако, вероятность того, что ДН К из постоянных клеточных линий способ-
на вызывать опухоли у людей, считается крайне низкой. Даже подкожное введе-
ние людям больших количеств клеток HeLa не сопровождалось канцерогенным
действием. Анализ имеющихся экспериментальных данных показывает, что кон-
центрация ДНК в культуральных жидкостях постоянных линий клеток гораздо
ниже возможных трансформирующих уровней [14]. Совещание экспертов ВОЗ в
Лондоне в 1989 г. определило, что предельное содержание гетерогенной ДНК (из
клеточных систем и сконструированных векторов) в одной парентеральной дозе
вакцин медицинского назначения не должно превышать 100 пкг. Подкожное вве-
дение 2 мкг ДНК вируса полиомы вызывает образование опухолей у 50% чувстви-
тельных животных. 100 пкг гетерогенной ДНК составляет 0,5хЮ’4 туморогенной
дозы. Контаминирующая ДНК способна подавлять супрессорные гены или акти-
вировать протоонкогены после интеграции в клеточный геном. Риск мало зави-
сит от происхождения контаминирующей ДНК. Все последовательности ДНК,
обладающие характеристиками сильных промоторов, могут после рекомбинации
создавать одинаковый риск. Вероятность присутствия опасной активности на 1
молекулу ДНК составляет 10'16—КГ19. Особую опасность могут представлять мно-
гокопийные плазмиды, амплифицированные сильные премоторные последова-
тельности. Белковые контаминанты с коротким сроком жизни представляют
меньший риск [788]. Таким образом, принято считать, что риск, связанный с
примесью гетерогенной клеточной ДНК, ничтожен, если ее количество не пре-
вышает 100 пкг в одной дозе препарата, вводимого парентерально. При оральном
применении вакцины этот риск еще более снижается [1684]. Агенты, применяе-
мые для инактивации вирусов в вакцинах, могут снижать или устранять биологи-
ческую активность гетерогенной клеточной ДНК, повышая тем самым их безо-
пасность даже в тех случаях, когда количество ДНК в дозе вакцины, вводимой па-
рентерально, превышает 100 пкг [154]. Кроме того, современные методы очистки
вирусных препаратов позволяют снизить содержание клеточной ДНК до уровня,
при котором ее присутствие даже теоретически не представляет опасности. Высо-
кая степень очистки от клеточной ДНК (10 пкг/мл) достигнута при изготовлении
лимфобластоидного интерферона, вакцины против полиомиелита на клетках
Vero и поверхностного антигена вируса гепатита В в клетках СНО [14].
Риск, обусловленный вирусной контаминацией постоянных линий клеток,
может быть связан с полными вирусами, механизм репликации которых извес-
тен, вирусными частицами, напоминающими ретро-вирусы типа А, а также ви-
русными генами, интегрированными в ДНК таких клеток. При использовании
постоянных клеточных линий для снижения или устранения риска вирусной
контаминации следует, прежде всего, применять систему посевных клеток.
Создание резервных запасов постоянных линий клеток, проверенных в соот-
ветствии с требованиями ВОЗ (1982, 1987 гг.), является необходимым условием
производства лицензированных вакцин. Предполагаемый риск, связанный с
белками, кодируемыми онкогенами постоянных линий клеток, ограничен лишь
факторами роста, действие которых транзисторно и обратимо. В обнаруживае-
мых концентрациях они не представляют серьезной опасности и, кроме того,
многие из них быстро разрушаются [154].
Методы контроля должны гарантировать отсутствие в конечном препарате
биологически активных количеств потенциально онкогенных примесей (гетеро-
генная ДНК, трансформирующие белки, эндогенные вирусы). Исследователь-
ские группы, рассматривавшие проблему приготовления медицинских иммуно-
биологических препаратов, пришли к заключению, что несмотря на существова-
ние потенциального риска, данные, подтверждающие безопасность препаратов,
оправдывают их применение [154].
В 1985 г. Комитетом экспертов по стандартизации биологических препаратов
были приняты «Требования к непрерывным линиям клеток, используемым в
производстве биологических продуктов». Отмена запрета на использование по-
стоянных клеточных линий в качестве субстрата в производстве медицинских
биологических препаратов открыла новые возможности в деле расширения про-
изводства вирусных препаратов, повышения их качества и снижения стоимости.
В настоящее время в ряде стран широко используют постоянные линии кле-
ток для изготовления медицинских биопрепаратов. Использование постоянных
линий клеток в качестве субстрата в производстве вирусных вакцин имеет ряд
преимуществ. Они не требуют сложных условий культивирования, их можно вы-
ращивать в промышленных культиваторах и ферментерах, хорошо изучить и
охарактеризовать, а маточные расплодки, свободные от контаминации эндоген-
ными и экзогенными вирусами, длительно хранить при низкой температуре.
Многие ученые считают, что приготовление вакцин с использованием клеток
Vero по сравнению с первичными культурами клеток почек обезьян, представля-
ет меньший риск вирусной контаминации. Накапливается все больше данных,
что клетки Vero и ВНК-21 - безопасные субстраты для производства медицин-
ских биопрепаратов. Клетки Vero не обладали туморогенными свойствами, а
клетки ВНК-21 (клон 13) оставались кариологически стабильными в течение 52
пассажей. Изучение чистоты и биологической безопасности белка клеток пока-
зало отсутствие посторонних вирусов, а также следов вирусных последователь-
ностей в геноме клеток Vero. Клетки Vero используют в производстве вакцин
против полиомиелита и бешенства человека. Инактивированная полиовакцина
улучшенного качества лицензирована в 1982 г., в последующие 5 лет ею было
привито более 20 млн. детей без побочного эффекта. В 1988 г. ее производство
составило 60 млн. доз. Инактивированная вакцина против бешенства лицензи-
рована в 1985 г. В последующий период были использованы сотни тысяч доз вак-
цины при низком уровне клинических реакций. Успешно завершились широко-
масштабные клинические испытания живой полиовакцины для орального при-
менения из вируса, размноженного в клетках Vero.
В 1987 г. во Франции лицензирована компонентная вакцина против гепати-
та В, изготавливаемая на основе рекомбинантной линии клеток СНО. В Велико-
британии, Японии и Китае получали интерферон в культуре постоянной линии
клеток Namalva.
В связи с возможностью клинического применения моноклональных анти-
тел [154], актуальность приобретает культивирование таких клеток в больших
масштабах. Предварительные результаты [72] показывают, что непрерывное
крупномасштабное культивирование гибридом в свободной суспензионной
культуре в сочетании с непрерывным диализом культуральной среды может дать
хороший урожай секретируемых антител (100—140 мг/л). При крупномасштаб-
ном производстве один работающий 1000-литровый ферментер фирмы Celltech
может обеспечить получение килограммовых количеств моноклональных анти-
тел [254]. Кроме того, гибридные клеточные линии сами по себе могут быть ис-
пользованы в качестве субстрата для репродукции вирусов.
Таким образом, только пересмотр существующих ограничений по примене-
нию тканевых культуральных систем для производства вирусных вакцин позво-
ляет использовать индустриальные методы массового выращивания вирусов на
основе суспензионного культивирования - подобно тому, как это делают в мик-
робиологической промышленности. Ученых, работающих в этой области, не
обескураживают даже очевидные успехи генной инженерии. Многие ученые
считают, что генная инженерия с использованием микроорганизмов может уп-
разднить проблемы, связанные с развитием и использованием массового куль-
тивирования клеток животных, и поэтому технология, основанная на их приме-
нении, не имеет будущего. Однако в конкуренции традиционной и новой техно-
логий изготовления вирусных препаратов, где решающее значение имеет
качество конечного продукта, обнаружились непредвиденные обстоятельства.
Во-первых, при попытке экспрессии вирусных генов в прокариотических орга-
низмах не всегда получены удовлетворительные практические результаты. Во-
вторых, с тех пор как стало возможным клонировать в клетках животных гены,
кодирующие вирусные белки, важность крупномасштабного производства кле-
точных культур еще более возросла. Данные обстоятельства позволили выразить
надежду, что биотехнология клеток животных сохранит свою авангардную роль
[181].
4.1. Клеточные субстраты
В течение многих лет разрабатывались методы выращивания небольших ко-
личеств клеток животных в лабораторных условиях. Однако наладить массовое
культивирование таких клеток оказалось не простой задачей. Способ выращива-
ния, характер используемой среды, методы управления и контроля в значитель-
ной степени зависят от типа выращиваемых клеток. Все культивируемые клетки
первоначально получают от животных путем механической или ферментативной
дезагрегации нормальных или малигинизированных тканей либо с помощью
перфузии in vivo. Тканевые эксплантаты или клетки, помещенные в подходящую
среду, развиваются в первичные культуры с «нормальным» (диплоидным) или
«ненормальным» (трансформированным или происходящим из опухоли) карио-
типом. Классификация культивируемых клеток представляет определенные труд-
ности. Различают первичные культуры клеток и клеточные линии [1375]. В про-
изводстве вакцин используют, главным образом, три типа клеток; первичные;
диплоидные клеточные линии; непрерывные (постоянные) клеточные линии.
Первичная культура — это культура, происходящая от клеток тканей или органов,
взятых непосредственно из организма. Культура считается первичной до тех пор,
пока ее не субкультивируют, после чего она становится клеточной линией.
Первичные культуры обычно получают трипсинизацией тканей куриных эм-
брионов или тканей (чаще всего почек), взятых от других видов здоровых живот-
ных. Возраст используемых эмбрионов может значительно различаться и влиять
на выход и жизнеспособность клеток. Для более полного контроля доноров тка-
ни их следует брать из SPF-хозяйств.
Первичные культуры клеток почек зеленых мартышек обычно используют для
приготовления полиовирусной вакцины. Поскольку обезьяны являются очень
дорогим объектом для увеличения выхода клеток почки дезагрегируют методом
перфузионной трипсинизации in vivo, а затем первичную культуру выращивают на
микроносителях. Для изготовления других медицинских вакцин широко приме-
няют первичную культуру клеток почки кроликов, телят и других животных. Для
изготовления вакцин, используемых в ветеринарной медицине, чаще всего при-
меняют первичные культуры клеток куриных эмбрионов и почек естественного
хозяина или восприимчивых животных. Первичные культуры в зависимости от
типа ткани и условий выращивания значительно различаются. Некоторые из них
погибают через несколько дней после посева, тогда как другие могут длительно
сохраняться в культуре без заметных морфологических и биохимических измене-
ний. С момента приготовления первичной культуры до остановки роста клеток и
гибели культуры после серийных пересевов проходит от нескольких недель до не-
скольких месяцев. Клетки эмбрионального происхождения при культивировании
обычно сохраняют жизнеспособность более продолжительное время.
Линия клеток — первичная культура, со времени получения субкультуры кле-
точные линии могут иметь ограниченный срок жизни in vitro (например, дипло-
идные фибробласты человека и животных), а могут размножаться in vitro неогра-
ниченно долго. В последнем случае их называют постоянными, стабильными
или непрерывными клеточными линиями.
Линия диплоидных клеток - клеточная линия, в которой, по крайней мере,
75% клеток обладает кариотипом нормальных клеток исходного вида. Следует
отметить, что диплоидный набор хромосом не обязательно эквивалентен дипло-
идному кариотипу, поскольку существуют ситуации, при которых клетка может
терять один тип хромосом и приобретать другой. Следовательно, кариотип клет-
ки изменился, а диплоидный набор хромосом сохранился. Такие клетки следует
считать «псевдодиплоидными». Диплоидные культуры фибробластов человека
могут пассироваться многократно. Такие культуры часто называют штаммами.
Некоторые из них могут сохранять диплоидный статус в течение 80 и даже более
популяционных делений.
В связи с трудностями получения соответствующих количеств первичных
культур клеток почки зеленой мартышки (по причине стоимости) и преиму-
ществами использования предварительно изученных клеточных культур для
производства вакцины против полиомиелита и других вакцин были лицензиро-
ваны диплоидные линии клеток WI-38 и MRC-5. Существуют сомнения в том,
что ростовые свойства и продуктивность диплоидных клеток варьируют. Даже
хорошо охарактеризованные диплоидные линии клеток ведут себя неодинаково
при работе с ними различных исследователей.
Штамм клеток — популяция однородных клеток (по одному или нескольким
маркерам), сохраняющая специфические свойства в течение ограниченного пе-
риода культивирования. Штамм клеток может происходить из первичной куль-
туры либо от линии клеток, получающих специфические свойства путем селек-
ции или клонирования.
Линия гетероплоидных клеток. Этот термин означает, что клеточная линия име-
ет менее 75% клеток с диплоидным набором хромосом. Этот термин не означает,
что клетки являются злокачественными или способны расти до бесконечности.
Постоянная (непрерывная) клеточная линия — это клетки, способные субкуль-
тивироваться вне организма в течение неограниченного количества пассажей.
На уровне знаний о поведении культивируемых клеток невозможно определить
точку, когда культура становится стабильной, т. е. приобретает способность рас-
ти до бесконечности. Только на основе опыта с фибробластоподобными клетка-
ми человека показано, что культура должна субкультивироваться, по крайней
мере, 70 раз с интервалом примерно в три дня, прежде чем ее можно будет счи-
тать постоянной (непрерывной) линией клеток.
Все культуры с неограниченной способностью к размножению («бессмерт-
ные культуры») следует называть постоянными (непрерывными) или стабиль-
ными линиями. В вирусологической литературе широко распространен термин
«перевиваемые линии клеток», под которым имеются в виду линии клеток, спо-
собные к бесконечному росту вне организма [2].
Под трансформацией клеток подразумевают необратимые генетические из-
менения, характеризующиеся изменением ростовых свойств культивируемых
клеток. Трансформация делает клетки бессмертными и менее зависимыми от
питательных факторов и геометрических параметров роста. Изменение росто-
вых свойств связано с изменением транспортировки питательных веществ через
клеточную мембрану и является одной из адаптивных особенностей, позволя-
ющих клеткам размножаться в условиях, неблагоприятных для не трансформи-
рованных родительских клеток. Изменение клеточной мембраны сопровождает-
ся потерей поверхностного белка (150 кД) и изменением антигенных свойств.
Основное достоинство трансформированных клеток - способность к бесконеч-
ному размножению и улучшенные ростовые свойства. Трансформированные
клетки могут образовывать опухоли у иммунологически толерантных животных.
По этой причине трансформацию иногда неправомерно приравнивают к злока-
чественным изменениям [101]. Первичные культуры клеток, линии диплоидных
и трансформированных клеток получили широкое применение в вирусологиче-
ской практике и явились основой создания крупномасштабных систем культи-
вирования клеток и производства вакцин. Это, в свою очередь, потребовало усо-
вершенствования методов культивирования, организации коммерческого про-
изводства сред и аппаратуры для культур клеток.
Получение постоянных линий намного расширило исследования в области
клеточной биологии и вирусологии. На их основе появилась возможность полу-
чения мутантных и гибридных линий клеток, что открыло перспективу создания
новых субстратов, пригодных для культивирования вирусов. Нормальные клет-
ки удается субкультивировать вне организма в течение ограниченного количест-
ва пассажей, после чего их размножение прекращается и они, как правило, по-
гибают [78]. Это обычно происходит примерно после 50 генераций, если клетки
получены из тканей взрослого организма. Лишь иногда они способны продол-
жать размножаться в культуре неограниченно долго, превращаясь в так называ-
емые трансформированные постоянные клеточные линии [525]. Трансформация
клеток в культуре имеет полиэтиологическую природу. Спонтанная трансформа-
ция культур клеток нормальных тканей — относительно редкое событие. Часто-
ту таких трансформаций можно увеличить, обработав клетки мутагенами или
некоторыми вирусами.
Все постоянные клеточные линии, в отличие от культур нормальных клеток
с ограниченным сроком жизни, являются трансформированными, т. е. изменен-
ными по ряду признаков, главным из которых является «бессмертие». Способ-
ность к неопределенно длительному размножению в культуре, как правило, свя-
зана с анеуплоидным кариотипом. Некоторые линии клеток (например, фиб-
робластов хомячка — ВНК-21) хотя и обладают правильным диплоидным
числом хромосом, но их кариотип, по-видимому, изменен. Другие критерии
трансформации (онкогенность, контактное торможение требования к среде)
проявляются у различных линий неодинаково [78]. Все они получены в резуль-
тате спонтанной или индуцированной трансформации клеток в организме или в
культуре. Многие происходят из опухолей животных, хотя не всегда при экс-
плантации опухолевых клеток in vitro образуются клеточные линии. Линии кле-
ток, полученные непосредственно из опухолевых тканей (т.е. трансформирован-
ных в организме), часто сохраняют специализированные функции, например,
способность продуцировать некоторые ферменты в течение более продолжи-
тельного периода, чем клетки, трансформированные в культуре различными ме-
тодами (физическими, химическими, вирусными агентами). Частота получения
постоянных линий у различных видов млекопитающих неодинакова. Клетки
мышей подвергались спонтанной трансформации значительно чаще, чем клетки
человека или других млекопитающих. Указанные различия, по-видимому, связа-
ны с неодинаковой стабильностью кариотипа разных видов животных [168].
Субкультивирование клеток, а затем и становление постоянной клеточной
линии, были более успешными, когда первичную однослойную культуру полу-
чали путем посева механически измельченной ткани, чем из суспензии трипси-
низированных клеток. Возможно, это связано с уменьшением количества белка
в поверхностных структурах клеток в результате обработки трипсином. Для
трансформации клеток часто используют вирусы. Клетки почки новорожден-
Рис. 13. Схематическое изображение «ответвления» (дивергенции) при культиви-
ровании in vitro соматических клеток [52].
ного хомяка (ВНК), например, легко трансформируются вирусом полиомы
[1458] или вирусом SV-40, а клетки эмбриона хомяка — герпесвирусом типа 3
лошадей [1468]. В последнем случае клеточные линии экспрессировали вирус -
специфические белки, но не продуцировали вирусного потомства. Трансфек-
ция культуры клеток почки эмбриона человека онкогеном вируса SV-40 увели-
чивала период размножения in vitro от 15-20 до 70-90 поколений. Из популя-
ции таких клеток удалось выделить две постоянные линии, практически не
имеющие признаков трансформации [209]. В результате трансфекции гепато-
цитов нормальных крыс ДНК вируса SV-40 получена серия клеточных линий
SV-40 гепатоцитов [952]. С помощью рекомбинантного вектора SV-40-аденови-
руса получены различающиеся по свойствам постоянные линии клеток стромы
костного мозга человека, экспрессирующие большой Т-антиген вируса SV-40
[223]. Т-штамм вируса ретикулоэндотелиоза кур вызывал трансформацию куль-
тур клеток печени, селезенки, костного мозга, а также тимуса куриных эмбрио-
нов и молодых цыплят. Подавляющее большинство трансформированных ли-
ний клеток секретировало вирус, вызывающий летальный ретикулоэндотелиоз
у 1—2-дневных цыплят [1371].
Предпочтительными сайтами интеграции вирусного генома оказались лом-
кие участки в геноме млекопитающих, что обусловлено, по-видимому, их струк-
турными и функциональными особенностями. Результатом взаимодействия ви-
русного и клеточного геномов могут явиться хромосомные аномалии и приобре-
тение клетками способности к неограниченному размножению.
При длительном культивировании клеточные линии могут изменять те или
иные свойства, поэтому для поддержания исходных свойств расплодки клеток,
их хранят при низкой температуре и периодически берут для размножения и
практического использования. Например, в процессе многих циклов выращива-
ния клеток ВНК-21 в однослойной культуре могут значительно изменяться их
первоначальные свойства. Нормальный равномерный рост фибробластоподоб-
ных клеток может смениться ростом эпителиоподобных клеток, образующих
слои и грозди. От свойств сыворотки также зависит скорость роста клеток и
чувствительность к разным типам и штаммам вируса ящура [1610].
Большинство таких изменений характерно для трансформированных клеток
других линий.
В отличие от первичных культур клеток и штаммов диплоидных клеток,
спектр вирусной чувствительности вновь полученных постоянных линий часто
непредсказуем. В настоящее время в мировой практике используется большое
количество постоянных линий и создаются новые.
В американской коллекции типовых культур хранятся сотни клеточных ли-
ний более чем 50 видов животных. Только из ткани клещей получено более 20
постоянных линий клеток, представляющих интерес для культивирования арбо-
вирусов.
Некоторые минимально трансформированные линии иногда называют
псевдонормальными, поскольку по всем основным ростовым характеристикам
(выраженная зависимость пролиферации от ростовых факторов и от плотности
популяции) эти клетки не отличаются от нормальных. Такие культуры, по-види-
мому, могут представлять особый интерес в качестве субстратов для выращива-
ния вирусов при изготовлении живых вакцин.
Специфической разновидностью стабильных клеточных линий являются
культуры лимфобластоидных и миеломных клеток. Они, как правило, являются
суспензионными. Клетки имеют округлую форму, размножаются, не прикрепля-
ясь к стенкам культуральных сосудов, в стационарной культуре не образуют аг-
регатов [2, 78]. Длительной селекцией по признаку адгезивности из линии кле-
ток плазмоцитомы (линия МОРС 173) получены две линии, представленные фи-
бробластоподобными и эпителиовидными клетками [78]. С момента первого
сообщения о получении стабильной линии лимфобластоидных клеток количе-
ство таких линий быстро возрастало и в настоящее время исчисляется многими
сотнями. Некоторые из них нашли применение в клеточной биотехнологии.
Вирус Эпштейна-Барр легко вызывает трансформацию В-лимфоцитов чело-
века, превращая их в стабильные линии клеток. Трансформирующая активность
отдельных штаммов вируса исключительно высока и достигает 90—100% [121].
Лимфобластоидные клетки отличаются некоторыми особенностями они
просты в обращении, сохраняют диплоидный или псевдодиплоидный кариотип,
размножаются с высокой скоростью, в том числе, в крупномасштабных культу-
рах. Их линии могут обладать выраженной фагоцитарной активностью [605]. До
недавнего времени почти все лимфобластоидные линии клеток человека харак-
теризовались как клетки В-типа и содержали генетическую информацию вируса
Эпштейна-Барр, даже если не продуцировали его антигенов. В дальнейшем бы-
ли получены лимфобластоидные клетки Т-типа. Ряд лимфобластоидных линий
клеток был получен из лимфом цыплят и индюшат. Их, в отличие от лимфобла-
стоидных клеток человека, получали с большими трудностями, они имели ха-
рактеристику клеток Т-типа. Они обнаруживали нормальный кариотип, присут-
ствие генома вируса болезни Марека, большинство из них продуцировало этот
вирус (в небольшом количестве) и при введении цыплятам вызывало развитие
типичных лимфом [163]. Вирус болезни Марека хорошо размножался в линии
лимфобластоидных клеток MS Bl-41 С, полученной от инфицированных кур
[783]. Из культуры клеток костного мозга индеек путем трансформации вирусом
миелоцитоматоза (штамм МС-31) получена постоянная линия клеток LSTC-
SF2, которая после 450 пассажей продуцировала вирус МС-31 [839]. Лимфобла-
стоидная клеточная линия была получена из клеток лимфомы селезенки кроли-
ков, зараженных вирусом герпеса Саймири [211], а также из клеток тимуса круп-
ного рогатого скота при спорадическом лейкозе [308]. Несколько линий
лимфобластоидных клеток получены из тимуса и лимфоцитов цереброспиналь-
ной жидкости крупного рогатого скота и оленя, зараженных вирусом злокачест-
венной катаральной лихорадки овечьего типа. Линия лимфобластоидных клеток
оленя продуцировала инфекционный вирус и вызывала заболевание кроликов.
Линии клеток, полученные от крупного рогатого скота, этим свойством не обла-
дали. Линия лимфобластоидных клеток SBLC-1, полученная из опухоли кожно-
го лейкоза коровы, имела Т-клеточное происхождение, не содержала интегриро-
ванного провируса лейкоза и не экспрессировала вирусный антиген. Т-лимфоб-
ластоидная линия клеток кошки (МУА-1) оказалась высокочувствительной к ви-
русу иммунодефицита кошек [1000]. Культуры лимфобластоидных клеток
человека обнаруживали чувствительность ко многим вирусам. Их часто исполь-
зовали в качестве субстрата при культивировании вирусов иммунодефицита че-
ловека (ВИЧ-1, ВИЧ-2). Т-лимфобластоидные клетки человека (линия Н9) со-
хранили чувствительность к вирусу (ВИЧ-1, ВИЧ-2) и ростовые свойства роди-
тельских клеток после адаптации к бессывороточной среде Chilton, вместо среды
RPMI 1640 с 10% сыворотки эмбрионов крупного рогатого скота [1691]. Гемато-
поэтические клеточные линии человека использовались для размножения гер-
песвируса-6 человека и других вирусов. Наконец, клеточные линии, происходя-
щие из миелом и сохранившие способность синтезировать иммуноглобулины,
могут служить основой быстро развивающегося биотехнологического способа
получения моноклинальных антител.
4.2. Контаминация клеточных культур
Существенным недостатком клеточных культур, осложняющим их примене-
ние, особенно в производстве живых вакцин, является опасность их загрязнения
вирусами, бактериями, грибами, дрожжами, микоплазмами и паразитами. При
крупносерийном производстве вирусных препаратов загрязнение клеточных
культур различными микроорганизмами может встречаться относительно часто.
Наиболее трудно выделить контаминацию латентными вирусами, которые дли-
тельное время могут оставаться незамеченными в культуре. Своеобразным
видом контаминации является загрязнение клеток одной линии клетками дру-
гой. С тех пор как появились культуральные вирусные вакцины, проблемы их
изготовления и контроля рассматривались индивидуально и решались по мере
выявления.
Обычная практика приготовления культуральных вакцин связана с получе-
нием клеточных культур и размножением в них в достаточном количестве виру-
са. Гарантия чистоты конечного продукта — использование чистых материалов.
Материалами, используемыми при производстве вирусных вакцин, с которыми
связаны случайные эндогенные загрязнения, являются: исходный клеточный
материал, сыворотка, питательная среда, трипсин и посевной вирус. Большин-
ство из них заранее можно проверить на чистоту.
При использовании линий клеток в производстве вирусных препаратов их
чистота и безопасность применения также могут быть определены заранее. Труд-
нее контролировать клеточный материал, используемый при изготовлении пер-
вичных культур, когда нет времени для оценки чистоты тканевого сырья. Несмо-
тря на возможность длительного хранения свежеизолированных клеток в замо-
роженном состоянии, этим приемом обычно не пользуются при изготовлении
первичных культур.
Загрязнение бактериями, дрожжами и грибами. Несмотря на применение ан-
тибиотиков, бактериальные загрязнения встречаются в большинстве лаборато-
рий. При исследовании 73 клеточных культур из 22 лабораторий наличие бакте-
рий обнаружено в 20 (27%). Среди них идентифицированы коринебактерии, ми-
крококки, бациллы и кишечная палочка. Они не вызывали помутнения
культуральной жидкости и не оказывали ЦПД на клетки. Поэтому их обнаруже-
ние с использованием специальных методов было неожиданным для исследова-
телей и показало, что контаминация клеточных культур на самом деле широко
распространена. Псевдомонады и фекальный щелочеобразователь, в отличие от
эшерихий и стафилококков, подобно вирусам могут образовывать «бляшки» в
культуре. Некоторые дрожжи, как и бактерии, могут расти медленно и не оказы-
вать цитопатического эффекта, особенно в присутствии антибиотиков. Плесени
растут медленно и во многих случаях могут быть подавлены фунгизоном или
нистатином.
С целью уменьшения воздушного загрязнения питательных сред, растворов
и культур клеток применяют стерилизацию воздуха.
Стабильные линии клеток при длительном субкультивировании в обычных
условиях, как правило, оказываются загрязненными микоплазмами. Основной
источник такого загрязнения — сыворотка. В противоположность перевиваемым
культурам, для первичных культур загрязнение микоплазмами — весьма редкое
явление. В клеточных линиях обнаруживают различные виды микоплазм, кото-
рые могут накапливаться в высокой концентрации (>106—107 КОЕ/мл). Конта-
минация микоплазмами не всегда сопровождается заметными изменениями
роста культуры. Микоплазмы клеточных культур в основном относятся к четы-
рем видам: М. orale, М. hyorhinis, М. arginini и М. laidlawii. При контроле живых
вакцин следует иметь в виду возможность присутствия вариантов М. hyorhinis,
не растущих в бесклеточной среде. Микоплазмы-контаминанты клеточных
культур эффективно (98%) выделяли в коммерческой среде FC с предпочтитель-
ным выращиванием в анаэробных условиях. Деконтаминация постоянных ли-
ний клеток от микоплазм — весьма трудная задача и крайняя мера, применение
которой оправдано лишь при невозможности возврата к неконтаминированной
маточной культуре. Многочисленные попытки в этом направлении оканчива-
лись безрезультатно. Обнадеживающие результаты получены при обработке кле-
ток в течение трех недель антибиотиками (тиамулин 10 мкг/мл или моноциклин
5 мкг/мл) с последующим клонированием. После деконтаминации клетки в те-
чение длительного периода наблюдения (75 пассажей) оставались свободными
от микоплазм. Клетки удавалось освободить от микоплазм при одновременной
обработке моноциклином, антисывороткой И КОМШММ ta UUlAlfainm
клеток в течение шести дней с 0,4 мкг/мл квинолона микоплазмы исчезли. Ана-
логичные результаты получены от одновременного применения спектриноми-
цина (10 мкг/мл) и линкомицина (20 мкг/мл). Для деконтаминации от мико-
плазм предложено пассировать клетки на бестимусных мышах. Линию эритро-
лейкемических клеток человека (К-562) удалось освободить от быстрорастущих
в анаэробных условиях М. fermentas однократным введением мышам с последу-
ющим рекультивированием клеток in vitro.
Культуральные вакцины исследуются на наличие бактерий и грибов на жид-
ких, а также плотных питательных средах в аэробных условиях. Микоплазмы вы-
являются культуральными и некультуральными методами.
Вирусная контаминация. Проблема контаминации клеточных культур различ-
ными вирусами возникла с момента применения культур клеток для производст-
ва вирусных вакцин. Источником случайных вирусных агентов в вирусных вак-
цинах могут быть инфицированные доноры ткани, а также материалы и условия
культивирования (сыворотка, трипсин, загрязнения в процессе производства).
В настоящее время для производства живых вирусных вакцин против многих
вирусных болезней широко применяют первичные культуры клеток различных
животных. Однако первичные культуры клеток могут быть контаминированы
различными посторонними вирусами, патогенность которых для человека и жи-
вотных не всегда известна. Контаминация вирусами тканей и полученных из них
культур клеток доказана практически для всех животных. Наиболее часто загряз-
ненными оказывались культуры клеток почек обезьян. В тканях обезьян обнару-
жено более 50 вирусов, которые могут контаминировать клеточные культуры.
Накопленный опыт показывает, что большинство вирусов, загрязняющих куль-
туры клеток животных, оказались непатогенными для человека. Ряд вакцин
(желтая лихорадка, корь, грипп) готовили с применением коммерческих кури-
ных эмбрионов, содержащих вирусы лейкозосаркоматозного комплекса кур.
Несмотря на длительное применение таких вакцин, не отмечено возрастание
онкогенных заболеваний среди привитых [1303].
С целью уменьшения риска эндогенного загрязнения исходного клеточного
материала различными вирусами и другими патогенными возбудителями для
приготовления первичных культур часто используют ткани животных, выращен-
ные в контролируемых условиях. Так, методом, гарантирующим чистоту живых
эмбриональных вакцин в отношении вирусов лейкосаркоматозного комплекса
птиц, является использование в производстве этих препаратов эмбрионов без-
лейкозных линий кур. Хотя выращивание животных-доноров тканей в специ-
альных питомниках ведет к значительному снижению количества вирусов-кон-
таминантов, однако не решает проблемы контаминации в целом.
Клетки почек некоторых домашних животных являются хорошим субстра-
том для изготовления медицинских вирусных препаратов в связи с предположе-
нием, что они менее инфицированы вирусами, потенциально патогенными для
человека, нежели ткани приматов, и потому еще, что указанные животные могут
быть выращены в контролируемых условиях, при которых можно предотвратить
контакт со многими вирусами.
В качестве примера можно привести вакцину против кори, вирус для которой
выращивают в первичной культуре клеток куриных эмбрионов, получаемых от кур,
свободных от вирусов лейкоза птиц. Для этой цели используют также первичную
культуру клеток почек собак, выращенных в контролируемых условиях. Вакцину
против краснухи готовят в культурах клеток почек собак и тканей эмбрионов уток.
Преимущество использования гетерологичных первичных культур (и, воз-
можно, клеточных линий) для приготовления вирусных вакцин состоит не толь-
ко в уменьшении риска, связанного с загрязнением патогенными микроорга-
низмами, но и оправдано с точки зрения предотвращения непредвиденного по-
вышения реактогенности или реверсий вакцинного штамма в случае
изготовления живых вакцин. Например, в медицине в течение многих лет гото-
вят ряд вакцин с использованием куриных эмбрионов (КЭ), содержащих вирусы
лейкоза птиц, однако за долгую историю применения этих препаратов для имму-
низации людей не выявлено каких-либо неблагоприятных эффектов. Нет дока-
зательств передачи людям болезней с препаратами, полученными с использова-
нием культур клеток животных [154].
Контаминантами первичных культур клеток являются вирусы, обнаружива-
емые у данного вида животных в естественных условиях. Существует прямая за-
висимость между частотой инфицированное™ животных данным вирусом и ча-
стотой его обнаружения в первичных культурах. Вирус диареи, широко циркули-
рующий среди крупного рогатого скота, часто обнаруживают в первичных
культурах клеток этого вида животных, а также в качестве контаминанта некото-
рых вакцин. PC-вирус крупного рогатого скота часто удавалось обнаруживать в
культурах клеток этого вида животных. В постоянной линии клеток почки сви-
ньи при электронно-микроскопическом исследовании обнаружены эндогенные
онкорнавирусы типа А, В и С, тога-, адено- и парамиксовирусы. В культуре кле-
ток куриного эмбриона обнаружены рео- и аденовирусы.
Из клеточных культур вирусные контаминанты могут попасть в живые ви-
русные вакцины. Таким образом, например, вакцина против ньюкаслской бо-
лезни была загрязнена вирусом инфекционного бронхита кур, а вакцина против
болезни Ауески — вирусом пограничной болезни овец.
Первичные культуры клеток животных проверяют на вирусную контамина-
цию, используя различные вирусологические, серологические, физические и
молекулярно-биологические методы.
Теоретически все вирусы, встречающиеся у данного вида животных, могут
загрязнять клеточные культуры, приготовленные из их тканей. Однако на осно-
вании практических наблюдений определены наиболее часто встречаемые виру-
сы, загрязняющие первичные клеточные культуры, а в итоге и культуральные ви-
русные препараты.
В таблице приведены наиболее вероятные вирусные контаминанты клеточ-
ных культур шести видов домашних животных.
Хотя получение исходного клеточного материала от животных, выращенных
в контролируемых условиях, — шаг вперед, однако эта мера не является исчер-
пывающей гарантией чистоты клеточного субстрата. Вирусная контаминация
выявлена у многих линий клеток. Клетки ВНК-21 были контаминированы пар-
вовирусом или короноподобным вирусом. Парвовирус обнаружен во многих
клеточных линиях. Линия клеток почки поросенка (IBP-2) оказалась персис-
тентно инфицированной авирулентным штаммом вируса классической чумы
свиней, который попал в первичную культуру, вероятно, с клетками ранее вак-
цинированного животного-донора клеток для культивирования. Различные ли-
нии клеток почек свиней оказались инфицированными онкорнавирусом типа С.
Частицы онкорнавирусов типа С и В были обнаружены также во многих линиях
клеток человека и животных [66]. Практически в каждой постоянной линии кле-
ток можно обнаружить эндогенные ретровирусы или ретровирусоподобные час-
тицы. Однако экспрессия их генетической информации зависит от типа клеток.
Потенциальная опасность таких вирусов связана с их сходством с онкогенными
ретровирусами. Оценка экспрессии ретровирусов — трудная задача, требующая
комплексного решения. В постоянной линии клеток яичника китайского хомя-
ка с встроенным фрагментом ДНК, кодирующим HBs-антиген вируса гепатита В
(CHO/HBsAg), обнаружено небольшое количество эндогенных ретровирусо-по-
добных частиц типа С при отсутствии их биологической активности. Постоян-
ная линия клеток, полученная из злокачественной лимфомы свиньи, продуци-
ровала ретровирус свиней. В основе системы контроля постоянной линии кле-
ток, исключающей случайную контаминацию при изготовлении вирусных
вакцин, лежит создание банка хорошо проконтролированных клеточных линий
Таблица 9. Наиболее вероятные эндогенные вирусные контаминанты первичных
культур клеток домашних животных
Происхождение клеток
крупный рогатый скот свиньи куры собаки овцы кошки
вирус пара- гриппа-3 вирус клас- сической чумы свиней вирус ньюкаслской болезни вирус чумы плотоядных вирус пара- гриппа-3 вирус пан- лейкопении кошек
реовирус-1 реовирус-1 вирус ин- фекцион- ного брон- хита птиц вирус ин- фекцион- ного гепа- тита собак реовирус-1 реовирус-1
вирус рино- трахеита аденовирус вирус лейкоза птиц герпес-вирус вирус катаральной лихорадки пикорна- вирус кошек
вирус диареи вирус болезни Ауески вирус энце- фаломиелита птиц реовирус-1 вирус пограничной болезни синцитиаль- ный вирус кошек
аденовирус парвовирус CELO-вирус аденовирус лентивирусы овец вирус лей- кемии и сар- комы кошек
и расплодок клеток, используемых в производственных целях в течение не более
20 пассажей. Все линии клеток проверяют на бактериальные, грибковые и ви-
русные загрязнения.
Известно, что сыворотка крови животных является потенциальным источ-
ником вирусной контаминации. Особенно хорошо изучена контаминация сыво-
ротки крови крупного рогатого скота. Вирусы довольно часто обнаруживали в
сыворотке крови эмбрионов телят и взрослого скота. Наиболее частые контами-
нанты сыворотки — микоплазмы и вирус диареи крупного рогатого скота.
По этой причине линии клеток различного происхождения оказались хрони-
чески инфицированными вирусом диареи крупного рогатого скота. В их числе
были перевиваемые клетки крупного рогатого скота (линии MDBK, GBK, BKD,
ВК4 и др.), лошадей, свиней, овец, кроликов, кошек и обезьян. Методом имму-
нофлюоресценции установлено инфицирование вирусом диареи крупного рога-
того скота многих культур клеток американской коллекции, полученных от
крупного рогатого скота, свиней, обезьян, кошки и москитов. Различные пер-
вичные культуры и постоянные линии клеток в некоторых случаях оказались
контаминированы полиомавирусом, источником которого была сыворотка ин-
фицированного крупного рогатого скота. У людей, тесно контактировавших с
таким скотом, обнаружены специфические антитела.
Вновь приготовленные серии сыворотки крупного рогатого скота обычно
контролируют на отсутствие вирусного загрязнения в первичных культурах кле-
ток куриных эмбрионов, почек телят и культуре клеток HeLa. Кроме исследова-
ния под микроскопом, культуры проверяют на гемадсорбирующие свойства с
эритроцитами человека, кур и морских свинок. С целью повышения эффектив-
ности проверки коммерческих партий сыворотки на наличие микоплазмы реко-
мендована предварительная инкубация проб перед высевом на элективную сре-
ду. Образцы сыворотки центрифугировали при 100000 g, осадокресуспендирова-
ли в небольшом объеме среды и вносили в культуры клеток, а также исследовали
под электронным микроскопом. Наиболее часто контаминированной оказалась
сыворотка крупного рогатого скота (13%). Значительно реже микоплазмы обна-
руживают в партиях сыворотки овец (3,2%) и эмбрионов коров (3,1%). Для сте-
рилизации сыворотки предложена специальная ультрафиолетовая обработка, а
также инактивация бетапропиолактоном, которые не ухудшают ее ростовых
свойств [1444]. Положительные результаты получены при стерилизации сыво-
ротки перуксусной кислотой. Прогревание сыворотки при температуре 56 °C в
течение 30 мин может служить эффективной мерой инактивации микоплазм и
некоторых вирусов, присутствующих в ней в качестве контаминантов. Однако
при этом снижаются ростовые свойства сыворотки.
Профилактика контаминации сыворотки заключается в тщательном отборе
сыворотки и облучении ее гамма-лучами при — 40°С в дозе 2,5—3,5 мегарад. Гам-
ма-облучение эффективно инактивирует и микоплазмы, причем при использо-
вании 10% облученной сыворотки в питательной среде не отмечается нежела-
тельного воздействия на рост клеток или их чувствительность к вирусам. Для со-
хранения ростовых факторов эмбриональной сыворотки применяют специаль-
ные приемы, к числу которых относится сохранение сыворотки в замороженном
состоянии до облучения, во время него и после него. Причиной контаминации
клеточных культур парвовирусом свиней явились коммерческие партии трипси-
на Дифко. Сухой трипсин можно деконтаминировать гамма-облучением без по-
тери его протеолитической активности.
В связи с возможностью латентного инфицирования клеточных линий пато-
генными вирусами, представляющими большую потенциальную опасность, в
США введены ограничения на ввоз культивируемых клеток (особенно гибри-
дов). Прежде всего, имеется в виду возможность заноса в страну вируса ящура,
источником которого может служить сыворотка, применяемая при культивиро-
вании клеток.
4.3. Выращивание вирусов
Развитие специфической профилактики инфекционных заболеваний чело-
века и животных создало необходимость разработки методов массового получе-
ния вирусного сырья.
В течение многих лет заражение животных оставалось единственным мето-
дом культивирования вирусов, что служило серьезным препятствием для полу-
чения высококачественных вирусных вакцин и в достаточном количестве. До
сих пор не удалось культивировать in vitro некоторые вирусы (папилломы чело-
века и др.).
Использование куриных эмбрионов — важный шаг на пути разработки ви-
русных вакцин. В силу высокой производительности и отличного накопления
некоторых вирусов этот метод не потерял своей актуальности. Его и сейчас с ус-
пехом применяют для изготовления вакцин против ряда заболеваний человека и
животных.
Большое накопление некоторых вирусов в организме составляет серьезную
конкуренцию методам их размножения в клеточных культурах. Это, прежде все-
го, относится к вирусу гепатита В, который накапливается в плазме крови чело-
века в высоком титре (1012—1013 частиц/мл) и является прекрасным источником
вирусного антигена для приготовления инактивированной вакцины. Другим
примером может служить вирус миелобластоза птиц, который при эксперимен-
тальном заражении цыплят накапливается в плазме крови в титре 5х1012 вирус-
ных частиц/мл и является хорошим источником препаративного получения ре-
вертазы [162].
Значительные успехи в области выращивания вирусов животных вне орга-
низма прежде всего связаны с открытием возможности выращивания полиови-
руса в экстраневральных тканях (Эндерс и сотр., 1949) и усовершенствованием
метода тканевых культур (Дульбекко и др., 1952). Этому в огромной степени спо-
собствовало также открытие антибиотиков и создание синтетических и полусин-
тетических питательных сред. Указанные достижения обеспечили возможность
обновить методы получения ранее существовавших препаратов и создать новые
эффективные вакцины против ряда вирусных болезней.
В производстве вирусных препаратов широкое применение нашли первич-
ные культуры и линии клеток. Для приготовления живых и инактивированных
вакцин человека, а также животных, часто используют вирус, выращенный в
первичных культурах клеток животных. В последнее время инактивированные
вакцины, предназначенные для вакцинации людей, все чаще готовят с исполь-
зованием клеточных линий. Для некоторых вакцин, применяемых в животно-
водческой практике, вирус выращивают в культурах постоянных клеточных ли-
ний. Перспектива использования постоянных линий клеток особенно заманчи-
ва в плане крупномасштабного суспензионного культивирования. Выбор метода
получения вирусного сырья в каждом конкретном случае определяется специ-
фическими требованиями, предъявляемыми к готовому препарату.
Получение большого количества вирусного сырья с выраженной антигенной
активностью особенно необходимо для инактивированных вакцин. Изготовле-
ние некоторых из них, применяемых в животноводческой практике, достигло
огромных масштабов. С точки зрения технологии крупномасштабного произ-
водства вирусных препаратов, метод культивирования вируса должен основы-
ваться на потреблении доступных, недорогих, максимально стандартизирован-
ных клеточных субстратов и питательных сред, обеспечивать достаточное на-
копление вируса или вирусного антигена и иметь высокую производительность.
В настоящее время разработаны и широко применяются методы производствен-
ного выращивания ряда вирусов человека и животных с целью изготовления ви-
русных препаратов. Однако, учитывая исключительную практическую важность
исследований и разработок в этой области, они постоянно направлены на поис-
ки новых принципов и технологических решений.
Факторы, влияющие на размножение вирусов в культуре клеток
Увеличение продукции вируса представляет собой большой практический
интерес, особенно при массовом производстве вирусных препаратов. Изучению
влияния различных факторов на репродукцию вирусов и накопление вирусных
антигенов в культуре клеток посвящены многие исследования. Оказалось, что
это зависит от ряда условий, оптимизация которых имеет важное технологичес-
кое значение.
Успех культивирования вирусов прежде всего зависит от удачного выбора
клеточного субстрата. Основными критериями при этом являются высокий вы-
ход вируса и вирусного антигена, относительная неприхотливость к условиям
культивирования и безопасность вакцины. Одни вирусы хорошо размножаются
в культурах клеток различного происхождения, другие - предпочитают клетки
естественного хозяина или дифференцированные, либо требуют специфических
условий культивирования (пониженную температуру, обработку трипсином, вы-
сокую или низкую множественность заражения), третьи — вообще пока не уда-
лось размножить вне организма. При культивировании вирусов выявлен ряд
особенностей, характерных для отдельных семейств и их представителей. Так,
большинство пикорнавирусов, так же как и парвовирусов размножаются в куль-
турах клеток естественного хозяина. Основная трудность в работе с ними — вы-
бор чувствительной культуральной системы. Однако даже при оптимальном ре-
шении этой задачи, урожай различных представителей семейства пикорнавиру-
сов различается очень сильно. Одни из них (полиовирус, вирус ящура)
накапливаются в высоком титре (7,0—9,0 ТЦД50/мл), что соответствует выходу,
примерно равному 10—1000 инфекционных единиц на одну клетку. В то же вре-
мя другие представители семейства (риновирусы, некоторые энтеровирусы, ви-
рус гепатита А) накапливаются в более низком титре (4,0—6,0 1g ТЦД50/мл). Ви-
рус гепатита А хорошо размножается в культуре клеток печени обезьяны, а вирус
гепатита В впервые in vitro удалось размножить в культуре клеток гепатомы че-
ловека HepG = 2. В культуральную жидкость выделялись полные частицы виру-
са, содержащие три оболочечных белка. Рабдовирусы обладают широким хозя-
инным спектром in vitro. Вирус везикулярного стоматита, например, хорошо и
быстро размножается практически во всех использованных для этой цели кле-
точных культурах, хотя некоторые представители этого семейства (вирус бешен-
ства) размножаются медленно и накапливаются в меньшем титре.
Представители семейства парамиксовирусов значительно различаются меж-
ду собой по широте хозяинного спектра клеточных культур. Одни из них (пара-
миксовирусы) обладают широким, другие (морбилливирусы) — узким хозяин-
ным спектром. Респираторно-синцитиальный вирус (PC-вирус), как и другие
представители семейства, размножается во многих клеточных культурах (но не в
культуре куриного эмбриона), хотя накапливается в значительно более низких
титрах. Например, разница в максимальном накоплении инфекционных частиц,
если сравнить его с вирусом ньюкаслской болезни, достигает 5—61g. Вместе с тем
следует отметить, что соотношение инфекционных и физических частиц у
PC-вируса может достигать высоких значений (1:1000—1:10 000) [94]. Вирус диа-
реи крупного рогатого скота обладает узким клеточным тропизмом и, так же как
PC-вирус, накапливается в чувствительных культурах в невысоком титре
(4,0—6,0 1g ТЦД50/мл). Первичная культура клеток почки телят оказалась более
чувствительной к полевым изолятам вируса диареи, чем постоянная линия этих
клеток [977]. Реовирусы размножаются в культурах клеток различного проис-
хождения, но лучше, когда выращивание проводят при пониженной температу-
ре (34°С). Однако представители одного рода этого семейства (ротавирусы) про-
являют исключительную щепетильность в отношении клеточного субстрата. Од-
на из лучших культур для выделения и размножения ротавирусов — постоянная
линия клеток почки эмбриона макаки резус (линия МА 104). Для аденовирусов
предпочтительным субстратом являются культуры эпителиальных клеток есте-
ственного хозяина. В эпителиоподобных клетках постоянных линий HeLa и КВ
они накапливаются в более высоком титре, чем в диплоидных линиях фибробла-
стоподобных клеток (WI-38 или MRC-5).
Культуры клеток беспозвоночных по сравнению с позвоночными во многих
случаях оказались более продуктивными в отношении альфа- и флавивирусов.
Первичные культуры клеток, приготовленные из различных тканей одного
вида животных или даже одного донора клеток, могут значительно различаться
по чувствительности к данному вирусу. Большинство вирусов хорошо накапли-
ваются в культуре клеток паренхиматозных органов, тогда как некоторые пред-
почитают клетки гемопоэтической системы (лимфопролиферативные вирусы,
вирусы африканской чумы свиней, инфекционной анемии лошадей) или нерв-
ной ткани. Наиболее широким спектром чувствительности обладают первичные
культуры, представленные преимущественно эпителиоподобными клетками.
Такие культуры, как правило, получают из почечной ткани различных живот-
ных. Аденовирусы свиней серотипа 2 и 3 хорошо размножались в первичной
культуре клеток почки (6,25—8,0 1g ТЦЦ50/мл), и значительно хуже в первичной
культуре клеток тестикулярной ткани поросят [782]. Для вируса контагиозной
эктимы овец и коз более чувствительной оказалась культура тестикулярной тка-
ни овец и коз [1030]. Аналогичные результаты получены в опытах с вирусом вис-
на-мэди. Вирус энцефаломиелита свиней размножается в культуре клеток почки
свиньи с образованием синцития. В культурах клеток из других тканей свиньи
вирус размножается без ЕЩЭ.
Разработаны методы получения эпителиоподобных культур клеток из хорио-
аллантоисной оболочки куриных эмбрионов. Они оказались более чувствитель-
ными и продуктивными для ряда вирусов, чем культуры фибробласто-подобных
клеток из тканей куриного эмбриона. Например, клетки хориоаллантоисной
оболочки более репродуктивны для вируса ньюкаслской болезни, чем клетки те-
ла куриного эмбриона. Кроме того, клетки одной и той же ткани могут сильно
отличаться друг от друга по репродукции вируса. Исследование репродукции ви-
руса ньюкаслской болезни единичными клетками куриного эмбриона показало,
что из числа продуцирующих вирус клеток только 20% синтезируют инфекцион-
ный вирус в большом количестве. Указанное соотношение клеток сохранялось в
культуре из различных тканей эмбриона в течение трех пересевов.
В первичной культуре клеток почки эмбриона человека способностью под-
держивать репродукцию цитомегаловируса человека обладают клетки, которые,
вероятно, являются клетками-мишенями в организме хозяина [766]. Культуры
клеток астроцитов из мозга плода человека обеспечивают размножение нейрот-
ропного полиомавируса человека JCV и могут быть многократно пассированы
без потери фенотипа астроцитов и снижения чувствительности к вирусу. Для ре-
активации вируса простого герпеса 1 (ВПГ-1) использовали эксплантаты кожи и
подкожной ткани подушечек задних лап мышей, взятых через 6 мес после инфи-
цирования. В процессе культивирования эксплантатов происходила реактива-
ция вируса. Фокусы реактивации латентного вируса обнаруживали гибридиза-
цией in situ, начиная с 5—6-го дня. По мере культивирования количество клеток
и содержание в них вирусспецифических нуклеиновых кислот возрастали [504].
Культуры гепатоцитов, являясь элективным субстратом для размножения
вирусов, вызывающих гепатиты, оказались чувствительными к другим вирусам.
Так, в культуре клеток печени эмбриона кур хорошо размножались некоторые
вирусы кур: инфекционного ларинготрахеита, бронхита, бурсита, ЕД8 и CELO.
Первичные культуры гепатоцитов лесного северо-американского сурка оказа-
лись чувствительными к инфицированию вирусами гепатита сурка и суслика
[221], а культуры гепатоцитов пекинских уток — к вирусу утиного гепатита В. Ге-
патоциты печени сурка, полученные перфузией раствором коллагеназы, форми-
руют монослой, сохраняющийся в течение 3 мес. [486].
Постоянные линии клеток, так же как первичные культуры, обладают раз-
личной чувствительностью к вирусам. Выбор наиболее чувствительного клеточ-
ного субстрата проводят на основе литературных данных или эксперименталь-
ным путем. Одни линии клеток являются хорошим субстратом для репродукции
целого ряда вирусов. К ним прежде всего следует отнести постоянную линию
клеток ВНК, высокочувствительную к таким возбудителям, как вирусы ящура,
бешенства, катаральной лихорадки овец, болезни Ауески и др. Широкое приме-
нение для производственного культивирования вирусов получили постоянные
линии клеток обезьян (Vero), свиней (СПЭВ, ППС, IBRS-2), крупного рогатого
скота (МДВК) и других видов животных. Вирус бешенства, адаптированный к
размножению в культурах клеток ВНК-21 и Vero, через 24 ч инфицировал прак-
тически все клетки, однако в продуктивную инфекцию включалось лишь около
10 % клеток обеих линий. На пятые сутки концентрация вируса достигала 7,2 1g
ТЦД50/мл или ЛД59/мл (для 3—5-недельных мышей). Линия клеток легких хомя-
ка HmLu-1 оказалась чувствительной для репликации вирусов эфемерной лихо-
радки, Ибараки и Акабане. Указанные вирусы размножались в этой культуре с
выраженным ЦПЭ через 48—72 ч. Вирусы парагриппа человека типов 2 и 3 раз-
множались с ЦПЭ в постоянной линии клеток почки африканской зеленой мар-
тышки CV-1, достигая через 48—72 ч титра 7,0 1g БОЕ/мл.
Вирус гепатита В уток удалось размножить в линии клеток LMH гепатомы
цыпленка. В этой линии клеток выход инфекционного вируса в 10—20 раз был
выше, чем в линиях клеток гепатомы или гепатобластомы человека. Линия кле-
ток рабдомиосаркомы человека (клон ИД-9Н8) эффективно поддерживала раз-
множение респираторного коронавируса человека. Из-за строгого тропизма
парвовируса В19 к эритроидным клеткам-предшественникам его размножали
лишь в эксплантатах костного мозга и печени плода человека. Его удалось раз-
множить в линии клеток ИТ-7, полученной от больного мегакариоцитобласто-
идной лейкемией [1410]. Высокое накопление вирулентного штамма вируса
классической чумы свиней (8,01g ТЦД50/мл) наблюдали в статической культуре
постоянной линии клеток почек свиньи (линия МРК). Вирус достигал высокого
титра через 72 ч культивирования.
Полевой изолят вируса оспы овец адаптировали к постоянной линии клеток
почек овцы. В первом пассаже вирус вызывал очаговый ЦПЭ на 6-7-й день, а в
четвертом пассаже - выраженный ЦПЭ через 5-7 дней.
Постоянные линии клеток оказались эффективными культуральными систе-
мами для репродукции кишечных вирусов, клетками-мишенями для которых in
vivo являются в основном эпителиальные клетки апикальной области ворсинок
тонкого отдела кишечника. Сказанное прежде всего относится к рота-, корона-
и астровирусам человека, а также животных.
Линия клеток карциномы прямой кишки человека (НТ-29) оказалась высо-
кочувствительной системой для выращивания ротавирусов, особенно человека
[1474]. К астровирусам человека оказалась чувствительной постоянная линия
клеток СаСО2, выведенная из карциномы толстого отдела кишечника человека
[1662].
Изучали чувствительность различных линий клеток свиного происхождения
к вирусу трансмиссивного гастроэнтерита свиней (ТГС). Все девять изученных
штаммов вируса ТГС хорошо размножались в линии клеток СРК и первичной
культуре клеток почки поросят. Пять штаммов размножались с ЦПЭ в линии
клеток IBRS-2. Ни один из штаммов не вызывал ЦПЭ в линиях клеток FSK и
РК-15. Однако шесть штаммов приобрели способность размножаться и вызы-
вать ЦПЭ после пассажа в клетках СРК. Трипсин оказывал стимулирующее дей-
ствие на размножение вируса ТГС [798].
При изготовлении вакцин, предназначенных для человека, наиболее часто
используют линии диплоидных клеток WI-38 и MRC-5.
Культуры диплоидных клеток тестикулярной ткани ягнят используют в про-
изводстве живой вакцины против классической чумы свиней, а тканей легкого
эмбриона крупного рогатого скота — для размножения вакцинных штаммов, ви-
русов чумы крупного рогатого скота и оспы овец. Полевой изолят вируса гемор-
рагической болезни кроликов размножался в штамме клеток почки кролика
(DJRK), вызывая ЦПЭ после двух пассажей.
Для выделения и репродукции некоторых вирусов используют специальные
линии клеток. Например, для вирусов диареи и ринотрахеита крупного рогатого
скота высокочувствительными оказались линии клеток слизистой оболочки но-
са крупного рогатого скота и легких норок, для многих вирусов свиней — гомо-
логичные линии клеток, а для ротавирусов — линия клеток обезьян (МА-104).
Постоянные линии клеток, полученные из одних и тех же тканей одного вида
животного, так же как их сублинии (клеточные клоны), могут значительно раз-
личаться между собой спектром чувствительности и вирусной репродукцией.
Продукция вируса лейкоза крупного рогатого скота в хронически инфици-
рованных однослойной и суспензионной культурах в зависимости от используе-
мой сублинии клеток FLK (foetal lamb kidney) может различаться в 10 раз. Кло-
нированные сублинии клеток ВНК-21 значительно различались между собой
чувствительностью к некоторым типам и штаммам вируса ящура. В суспензион-
ной культуре клеток ВНК-21 по мере длительного пассирования (200 пассажей)
наблюдается снижение выхода вируса ящура вследствие нарушения морфогене-
за на стадии прокапсида [779]. Адаптированные к размножению вне организма
штаммы вируса размножаются в культурах, как правило, быстрее и с большим
выходом, чем неадаптированные «дикие» штаммы. Лучше всего размножаются
штаммы, адаптированные к данной культуре, хотя их размножению часто спо-
собствует первоначальная адаптация к другим клеточным культурам. Многие
вирусы, элективной системой для которых являются культуры клеток гемопоэ-
тической системы естественного хозяина, хорошо размножаются в них без адап-
тации. При адаптации вирусов, размножающихся медленно и не вызывающих
или вызывающих слабый ЦПЭ, целесообразно однослойные инфицированные
культуры инкубировать длительно (2—4 недели) и использовать пересев инфи-
цированных клеток. В качестве примера может служить вирус иммунодефицита
кошек (штамм Петалюма), который вызывал ЦПЭ в культуре клеток кошачьей
Т4-тимус-лимфомы 3101 через 22 дня после заражения [1525].
Адаптация некоторых вирусов и вирусных штаммов к размножению в куль-
туре клеток — трудный процесс, который требует нетрадиционных подходов. Для
адаптации вируса гриппа к новой хозяинной системе предложено использовать
метод форсированных пассажей, при котором проводят серию одноцикловых
репликаций вируса. Для серийных пассажей применяют «ранний» урожай виру-
са без разведения. Положительные результаты получали при сокультивировании
инфицированных клеток и тех, к которым желательно адаптировать вирус. Спо-
собный к размножению в организме кроликов штамм L вируса чумы крупного
рогатого скота адаптировали в культуре клеток Vero путем культивирования сме-
си лимфоцитов селезенки зараженного кролика и клеток Vero в присутствии
ПЭГ. Внеклеточный вирус не обнаруживали в течение трех пассажей. К 11 пас-
сажу вирус накапливался в титре 5,5 1g ТЦД50/мл и кроме клеток Vero приобрел
способность размножаться в клеточных линиях ВНК-21, С-1, К-13 непермис-
сивных для исходного штамма вируса [834]. Линия клеток (FLK — BLV), хрони-
чески инфицированная вирусом энзоотического лейкоза крупного рогатого ско-
та (ВЛКРС), получена при сокультивировании клеток почки плода овцы и лим-
фоцитов крупного рогатого скота, инфицированного ВЛКРС.
Вирус иммунодефицитоподобного заболевания крупного рогатого скота вы-
деляли от естественно и экспериментально инфицированных телят сокультиви-
рованием клеток крови с клетками селезенки плода коров [1182, 1647]. Индуци-
рованное вирусом образование синцития реже наблюдали в культурах клеток
почки и легкого плода коров [1182]. Вирус иммунодефицита кошек (FIV) удает-
ся выделить путем инокуляции периферической крови или спинномозговой
жидкости больных животных в первичную культуру клеток глии, лимфоцитов
или мононуклеарных клеток крови кошек. Цитопатический эффект наблюдали
через 8—14 дней после сокультивации (клеточные агрегаты синцитий, цитоплаз-
матические вакуоли).
При культивировании вне организма одни вирусы обладают широким хозя-
инным спектром (герпес-, рабдовирусы), другие — узким (napBos коронавиру-
сы). В последнем случае адаптация вируса к некоторым культурам обычно при-
нятыми методами не удается. Попытки адаптировать вирус трансмиссивного га-
строэнтерита свиней к постоянной линии клеток почек поросят (линия LL
С-PKI) оказались безуспешными в отличие от культуры клеток щитовидной же-
лезы свиньи.
При культивировании in vitro важное значение могут иметь изменения виру-
сов, обусловленные клетками хозяина. Вирус ньюкаслской болезни, пассируе-
мый в первичной культуре клеток КЭ, по морфологии, плавучей плотности и ус-
тойчивости при градиентном центрифугировании значительно отличался от ви-
руса, размноженного в КЭ.
При смене хозяина наиболее часто происходит маскирование антигенных
сайтов в процессе гликозилирования. В молекуле гемагглютинина вирусов грип-
па А и В выявлено около 30 сайтов гликозилирования, поэтому селекция различ-
ных биологических вариантов вируса, отличающихся от исходной популяции,
неизбежна при каждой смене хозяина. Индуцируемые клетками хозяина разли-
чия в гликопротеинах отмечены у вируса простого герпеса [989]. В гликопротеи-
нах ВГП-1, размноженного в культурах NBL L или Vero и ВНК-21, выявлены су-
щественные количественные и качественные различия. Это дало основание за-
ключить, что олигосахаридный процессинг гликопротеинов ВПГ-1 может
варьировать в культурах клеток различных млекопитающих [229]. Кроме того,
при серийном размножении в различных линиях клеток наблюдали диверген-
цию дочерних популяций ВПГ-1 по меньшей мере по одному параметру (анти-
генность, нейровирулентность, способность к латенции и реактивации) в ре-
зультате селективного отбора [640]. Популяции вируса гриппа, адаптированные
к размножению в постоянной линии клеток МДСК и на куриных эмбрионах, от-
личались между собой антигенными свойствами. Адаптация вируса гепатита А к
культуре клеток сопровождается нуклеотидными делениями в гене, кодирую-
щем белок VP1. После 60 пассажей в культуре клеток обнаружено 18 нуклеотид-
ных делений, обусловливающих замещение минимум шести аминокислот в бел-
ке [1314]. Заметное влияние на продукцию вирусов оказывает фаза роста клеток
и возраст культур. Зависимость размножения от фазы роста клеток наиболее вы-
ражена у парвовирусов, которые в силу особенностей репликации размножают-
ся эффективно лишь в культурах делящихся клеток. Для этого необходимы, по-
видимому, средняя и поздняя стадия S-фазы клеточного цикла. При создании
оптимальных условий удалось наблюдать образование бляшек парвовирусом
свиней в постоянной линии клеток почки эмбриона свиньи. Вирус вносили во
флаконы с культурой через 3 ч после высева клеток (400—600 тыс. в 1 мл) и спу-
стя восемь дней инкубации наблюдали образование бляшек диаметром
0,5-3,5 мм. Максимальное количество бляшек появилось при адсорбции вируса
в течение 90 мин и дозе вируса около 30 БОЕ в 0,2 мл. Добавление декстрана
(50 мкг/мл) в среду покрытия способствовало образованию бляшек. Эклипсфа-
за размножения парвовируса свиней составляла 8—10 ч. Экстрацеллюлярный ви-
рус обнаруживали через 16 ч. Гемагглютинин появился через 10 ч, а вирусный ан-
тиген в ядре и цитоплазме был выявлен МФА через 8—12 ч. В растущих культу-
рах выход многих вирусов больше, чем в культурах в стационарной фазе роста.
Например, в активной растущей культуре репродукция респираторно-синцити-
ального вируса возрастала в 20—60 раз по сравнению с выросшей, тогда как ви-
рус парагриппа накапливался одинаково в обеих культурах. Продукция ВИЧ в
неразмножающейся культуре с высокой плотностью популяции клеток (линия
Molt-4) была значительно выше, чем в растущей с низкой плотностью.
Некоторую специфику представляют культуры дифференцирующихся кле-
ток. Чувствительность лейкоцитов, претерпевающих бласттрансформацию в
процессе выращивания, может изменяться в отношении некоторых вирусов. На-
пример, лейкоциты телят через 5—7 дней культивирования оказались наиболее
чувствительными к вирусу чумы крупного рогатого скота. Лейкоциты человека
после культивирования приобретали чувствительность к вирусу ньюкаслской
болезни, тогда как в свежевыделенных клетках вирус не размножался. Эндотели-
альные клетки человека были пермиссивными для полиовируса человека после
четырех суток культивирования, что во многом зависело от экспрессии полиови-
русных рецепторов на клеточной поверхности [543]. Чувствительность полипо-
тентных стволовых клеток костного мозга человека к парвовирусу В19 возраста-
ет по мере их дифференциации в культуре [1482]. Однако первичная культура
клеток гепатоцитов утят была компетентной к заражению вирусом гепатита В
уток только в первые четыре дня культивирования. Для усиления репродукции
вирусов в культурах гемопоэтических клеток прибегали к стимуляции бласттран-
сформации. В качестве митогена чаще всего использовали фитогемагглютинин
(ФГА), стимулирующий размножение некоторых вирусов в лейкоцитарных
культурах [168]. Аналогичным действием обладал ди метил сульфоксид в линии
клеток лейкоцитов человека (HL-60), инфицированной вирусом гриппа, и в
культуре клеток почки кролика (PKI3), инфицированной вирусом ринотрахеита
крупного рогатого скота. Накопление вируса в культуре может зависеть от осо-
бенностей клеточной сублинии, а также используемого вирусного штамма и сте-
пени его адаптации.
При инфицировании вирусом выросших культур часто используют поддер-
живающие питательные среды, отличающиеся от ростовых сред тем, что не со-
держат сыворотки или, кроме того, имеют более простой состав.
Кроме неорганических солей существенным компонентом для максималь-
ного накопления вируса является глюкоза.
Относительно влияния источников азотистого питания и других факторов
на урожай вирусов имеются противоречивые сведения. Известно, что вирус мо-
жет размножаться в клетках при полной остановке синтеза клеточных компо-
нентов путем исключения необходимых субстратов из состава среды. Однако для
максимального накопления вирусов в культуре могут требоваться различные ор-
ганические добавки к солевому раствору.
Присутствие глютамина (0,03%) и глюкозы (0,2%) в сбалансированном соле-
вом растворе обеспечивало высокое накопление вируса ящура в клетках ВНК-21
(108 БОЕ/мл), тогда как добавление сыворотки и других органических компо-
нентов не увеличило выход вируса. Максимальный урожай полиовируса в куль-
туре клеток почек обезьян получен в присутствии глюкозы и цистина [341], а в
культуре клеток HeLa — при наличии в среде глюкозы и глютамина [562]. Воз-
можно, что разные клетки могут иметь различные потребности в питании для
максимального синтеза одного и того же вируса. Это также может быть связано
со скоростью размножения вируса. Казалось, что чем сложнее вирусы и чем мед-
леннее они размножаются, тем они более требовательны к питательным субстра-
там среды, чем мелковирионные, просто устроенные и быстро реплицирующие-
ся вирусы.
Добавление смеси аминокислот к раствору Хенкса увеличивало титр вирусов
ньюкаслской болезни и болезни Ауески на 1,5—2,0 1g, но не оказывало влияния
на накопление вируса ящура [168]. Обогащение поддерживающей среды пита-
тельными субстратами на 1,0—1,5 1g повышало выход вируса клещевого энцефа-
лита и везикулярного стоматита. Для нормального синтеза инфекционных час-
тиц вирусов герпеса и осповакцины необходимо присутствие в среде аргинина,
а для вируса чумы собак — метионина [784]. Исключение различных аминокис-
лот из среды Игла (МЕМ) сопровождалось различным снижением уровня на-
копления вируса ньюкаслской болезни. Однако синтез инфекционных вирио-
нов полностью прекращался лишь в отсутствие в среде аргинина. При этом син-
тез вирусспецифических компонентов не останавливался, хотя гемадсорбция
заметно подавлялась. Возможно, что аргинин играет важную роль в синтезе бел-
ка, участвующего в сборке и созревании этого вируса.
Температурные границы и температурный оптимум размножения вирусов
контролируется вирусным геномом, хотя в известной степени они зависят и от
клеточной системы. Принято считать, что оптимальная температура для размно-
жения большинства вирусов 36—37°С. Однако из этого правила имеются исклю-
чения. Например, для риновирусов температурный оптимум размножения равен
33—34°С. Герпесвирус 2 крупного рогатого скота максимально накапливается в
первичной культуре клеток телят при 32°С. Вирус гриппа С, в отличие от виру-
сов гриппа А и В, лучше размножается при 32—33°С, хотя накапливается медлен-
нее [72]. Ряд альфавирусов накапливается в постоянной линии клеток комаров
при 34,5°С в значительно большем титре, чем при оптимальной температуре,
требующейся для размножения этих клеток.
Оптимальный температурный режим размножения вируса может зависеть от
температуры предшествующего выращивания. Известно, например, что так на-
зываемые «холодные» варианты вирусов лучше размножаются при пониженных
температурах, а оптимум размножения у аттенуированных штаммов, как прави-
ло, ниже, чем у патогенных штаммов того же вируса.
Накопление вируса в культуре зависит от множественности заражения, кото-
рая главным образом влияет на продолжительность накопления вируса, а не на
его урожай. Для заражения однослойных культур с целью накопления вируса
обычно применяют 0,001—0,1 ТЦД50 на одну клетку (М = 0,001—0,1). При этом
накопление вируса в культуре является суммарным результатом многоцикловой
репродукции. В случаях, когда имеют дело с культурами клеток, жизнеспособ-
ность которых снижается быстро, а вирусы не обладают коротким циклом ре-
продукции, множественность заражения имеет более важное значение. Эти
культуры заражают таким образом, чтобы как можно больше клеток включить в
первичный инфекционный процесс. Имеются сообщения о повышении урожая
вирусов при использовании высокой множественности заражения (М= 10—100).
Кроме того, использование высокой множественности заражения способствова-
ло получению «раннего» вируса везикулярного стоматита (спустя 4,5 ч после
заражения), с повышенным содержанием вирионного белка, ответственного за
иммуногенную активность. Однако высокая множественность заражения в про-
цессе серийного пассирования может привести к изменению соотношения гете-
рогенных частиц в вирусной популяции и, тем самым, изменить ее фенотипиче-
ские свойства [1044]. В случаях, когда при высокой множественности заражения
наблюдается торможение репродукции вируса за счет аутоинтерференции (фе-
номен Магнуса), прибегают к удалению дефектных интерферирующих частиц
(ДИЧ) или других ингибирующих субстанций. Применительно к безоболочеч-
ным вирусам хорошие результаты получают с помощью простой обработки ви-
русного инокулята фреоном или хлороформом.
При медленном накоплении вируса и невозможности обеспечения высокой
множественности заражения вирус часто вносят в культуру одновременно с по-
севом клеток.
Иногда с целью повышения выхода применяют повторные сборы вируса пу-
тем смены среды в период выраженного накопления. Этот прием особенно эф-
фективен при культивировании постоянных клеточных линий, хронически ин-
фицированных вирусом (например ВЛ КРС) и экскретирующим его в культу-
ральную среду. Кроме сохранения зрелого внеклеточного вируса, такая операция
может способствовать его репродукции за счет уменьшения концентрации инги-
биторов в культуре. Заметное влияние на репродукцию вирусов оказывает pH
поддерживающей среды. Так, вирус бешенства гораздо интенсивнее размножал-
ся в культуре клеток КЭ при повышении pH поддерживающей среды от 7,4 до
8,2. Как показало изучение структуры вирусной популяции, при щелочном pH
не происходит накопления ДИЧ и отсутствует аутоинтерференция [1710].
Репродукция альфавирусов также заметно усиливалась при инкубации зара-
женных клеточных культур в щелочной среде с pH 7,5—7,9 [71]. Имеется ряд со-
общений о благоприятном влиянии трипсина на размножение некоторых виру-
сов и проявлении их свойств. Феномен протеолитической активации хорошо из-
вестен у орто- и парамиксовирусов. Вирусы гриппа, выращенные в курином
эмбрионе, обладали высокой инфекционностью. У тех же вирусов, выращенных
в культуре клеток куриного эмбриона, инфекционность была на 2—31g ниже. Это
явление связывают с протеолитическим расщеплением полипептида гемагглю-
тинина (ГА). Аллантоисный вирус содержит «расщепленный» ГА (ГА1—50 кД и
ГА2—30 кД), тогда как культуральный вирус - «нерасщепленный» ГА (75 кД). Ви-
рионы с нерасщепленным ГА адсорбировались, но не проникали в клетки, по-
скольку содержали белок (F) слияния оболочки вируса с клеточной мембраной в
неактивированной, форме. Оказалось, что расщепление ГА-предшественника на
фрагменты ГА1 и ГА2 могут вызывать различные протеазы, однако только рас-
щепление трипсином и трипсиноподобными ферментами приводит к образова-
нию высокоинфекционного вируса гриппа [894]. Обработка вируса гриппа А
трипсином до заражения клеток и добавление трипсина в культуральную среду в
процессе репликации повышали его инфекционность. Исключение составил
вирус гриппа птиц, у которого отмечено расщепление ГА и высокая степень ин-
фекционное™ как после размножения в эмбрионах, так и в культуре клеток. Об-
работка трипсином в этом случае не оказывала положительного эффекта. Вирус
Сендай не продуцировал инфекционных частиц в культурах клеточных линий.
Обработка инфицированных клеток трипсином восстанавливала его биологиче-
скую активность благодаря расщеплению гликопротеина F (65 кД) на две субъе-
диницы FI (51 кД) и F2 (15 кД). Для изоляции и культивирования парамиксови-
русов человека весьма эффективной оказалась линия клеток NCI-H292 при ис-
пользовании поддерживающих сред с добавлением трипсина (1,5 мкг/мл) [457].
Установлено, что вирус ньюкаслской болезни содержит два предшественника
гликопротеинов HNo и Fo, которые в результате протеолиза превращаются со-
ответственно в гликопротеины HN и F. С ними связана гемолитическая, гемаг-
глютинирующая, нейраминидазная и инфекционная активность вируса. Суще-
ственные различия штаммов вируса ньюкаслской болезни по патогенности оп-
ределяются структурными особенностями гликопротеинов наружной оболочки
вириона, которые отличаются способностью активироваться протеолитически-
ми ферментами. Наличие трипсина в поддерживающей среде стимулировало ре-
продукцию вируса осповакцины. Протеолитический процессинг вирусных гли-
копротеинов зависит от природы вируса, а также от клеточных факторов культу-
ральной системы. В наибольшей степени от протеолитической активизации
зависит репродукция оболочечных вирусов, клетками-мишенями которых in
vivo являются энтероциты. К таким вирусам прежде всего относятся ротавирусы
млекопитающих и птиц, кишечные коронавирусы свиней и некоторые аденови-
русы. Классическим примером протеолитической активации могут служить ро-
тавирусы, выделение и культивирование которых стало возможным благодаря
применению трипсина. Обработка трипсином значительно способствует выде-
лению и репродукции вируса трансмиссивного гастроэнтерита свиней, и обеспе-
чивает размножение в культуре клеток Veto вируса эпизоотической диареи поро-
сят [787]. Вирус эпизоотической диареи свиней (ВЭДС) размножался в культуре
клеток Vero только в присутствии трипсина (10 мкг/мл) в поддерживающей сре-
де. ЦПЭ проявлялся образованием синцития. После ряда пассажей в клетках
Vero в присутствии трипсина удалось адаптировать вирус к культурам клеток МА
104, СРК и ESK при добавлении трипсина. Попытка адаптировать вирус к шес-
ти типам первичных культур клеток эмбриона свиньи не увенчалась успехом.
Использование этой, ставшей теперь рутинной, методики позволило размно-
жить астровирус человека в первичной культуре клеток почки эмбриона челове-
ка и обезьян. После 11 пассажей вируса в культуре его размножение оставалось
трипсинзависимым. Аналогичным образом удалось адаптировать астровирус
крупного рогатого скота (штамм US2, серотипа 2) к размножению в культуре
клеток новорожденного теленка. Вирус размножался в серийных пассажах толь-
ко в присутствии трипсина. На ранних пассажах вирус накапливался в культу-
ральной среде через семь суток, а в последующем — через трое. Количество
инфицированных клеток в культуре было невысоким и не превышало 10—20%.
Значение штамма, клеточного субстрата и протеолитической активации в репро-
дукции вирусов можно проследить на примере ротавирусов птиц и кишечных
аденовирусов человека. Ротавирус птиц с трудом культивируется в присутствии
трипсина, вызывая ЦПЭ в культуре клеток печени и почек КЭ. После трех пас-
сажей вирус терялся в культуре клеток печени, но полностью адаптировался к
клеткам почек. После шести пассажей вирус приобрел способность реплициро-
ваться без обработки трипсином, а после 10 пассажей в почечных клетках — лег-
ко культивировался в печеночных клетках и фибробластах КЭ. Однако размно-
жение ротавируса сопровождалось ЦПЭ только в культуре почечных клеток КЭ.
Протеолитическая активация была необходима для выделения и репродукции в
культуре клеток КВ только некоторых серотипов кишечных аденовирусов чело-
века. Добавление трипсина повышало выход инфекционного вируса гриппа С
[72]. Имеются и другие сообщения о том, что обработка клеток трипсином бла-
гоприятно сказывается на размножении ряда вирусов.
Протеолитическая активация вирусов тесно примыкает к проблеме зависи-
мой от хозяина модификации вирусных полипептидов. Репродукция вируса
Сендай зависела от длительности субкультивирования клеток почки обезьян.
Первичная и вторичная культуры поддерживали многоцикловую репродукцию
вируса. После нескольких субкультивирований клетки теряли эту способность,
что коррелировало со снижением протеолитического расщепления поверхност-
ного гликопротеида вируса (Fo) за счет снижения (потери) трипсиноподобной
активности клеток. Многоцикловая репродукция вируса в таких клетках вос-
ставнавливалась при внесении в культуральную среду трипсина (0,3 мкг/мл).
Причина снижения протеолитической активности клеток при субкультивиро-
вании не выяснена. Относительное содержание гликопротеинов (62 и 71 кД)
оболочки вируса краснухи зависело от типа клеток, использованных для его
выращивания, что, по мнению авторов, связано с различным уровнем активно-
сти клеточных протеаз. Степень стимуляции репродукции коронавируса круп-
ного рогатого скота трипсином была различной в разных культурах и наименее
интенсивной в постоянной линии клеток ректальной опухоли человека
(НРТ-18), в которой вирус мог размножаться и при отсутствии трипсина [554].
В его присутствии коронавирус свиней накапливался в высоком титре
(108—109 ТЦД50/мл) в двух постоянных линиях клеток свиней (СПЭВ и ППС).
Однако только вирус, размноженный в одной из них (ППС), обладал гемагглю-
тинирующей активностью (ГА), не влияющей на иммуногенность. Вирус инфек-
ционного ларинготрахеита кур, выращенный в первичной культуре клеток поч-
ки цыплят, имел гемагглютинирующую активность, выделяемую в РТГА с эрит-
роцитами мышей, но не других видов животных. Тот же вирус, размноженный в
куриных эмбрионах, обладал ГА-активностью. Эти данные свидетельствуют о
важных хозяинных различиях эндогенного процессинга гликопротеинов вируса,
не связанных с его инфекционностью или иммуногенностью.
Таким образом, протеолитический процессинг вирионных полипротеинов
имеет место у представителей многих семейств вирусов. В нем принимают учас-
тие вирусспецифические и клеточные протеазы. Можно предположить, что все
вирусы в процессинге протеинов, в которых принимают участие протеазы кле-
ток, должны усиливать репродукцию в присутствии трипсина в ростовой среде.
Степень усиливающего эффекта при этом будет находиться в обратной зависи-
мости от протеолитической активности внутриклеточных ферментов данной
культуральной системы.
Для выявления вируса классической чумы свиней, размножающегося в куль-
турах клеток без ЦПЭ и нецитопатогенных штаммов вируса диареи крупного ро-
гатого скота, использовали стимуляцию ими репликации вируса ньюкаслской
болезни.
Скорость накопления вирусов болезней Марека или Гамборо изучали при
раздельном и смешанном инфицировании культуры клеток куриного эмбриона.
Максимальный урожай обоих вирусов отмечали при внесении вируса болезни
Гамборо через 2-3 дня после инфицирования вирусом болезни Марека. Такой
вирус использовали для изготовления ассоциированной вакцины.
Обнаружено, что чувствительность перевиваемых культур клеток и клеточ-
ных линий к некоторым вирусам может изменяться под влиянием липидных сы-
вороточных ингибиторов, присутствующих в ростовой или поддерживающей
средах. Неспецифическая резистентность различных клеточных культур, обус-
ловленная сывороточными ингибиторами, была обнаружена в опытах с арбови-
русами, вирусами катаральной лихорадки овец, гепатита уток, лейкоза крупного
рогатого скота и др.
Присутствие 1% эмбриональной сыворотки крупного рогатого скота подав-
ляло размножение аденовируса человека в первичной или диплоидной культуре
клеток, но не влияло на его накопление в постоянных линиях клеток.
Контаминация линий клеток микоплазмами не оказывала существенного
влияния на их чувствительность к вирусам. При этом к одним вирусам она не-
значительно снижалась, к другим — повышалась [168].
Из приведенного выше видно, что степень размножения вирусов — много-
факторный процесс, зависящий от культуральной клеточной системы и самого
вируса. Выяснение этих особенностей имеет важное значение для оптимизации
условий его выращивания с целью изготовления вакцин.
Размножение вирусов в однослойной культуре
Наибольшее применение в вирусологической практике получили однослойные
культуры. В производстве вирусных вакцин, особенно медицинского назначения,
до недавнего времени использовали преимущественно однослойные первичные
культуры и реже культуры диплоидных клеток. Многие вакцины, используемые в
животноводстве, давно готовят с применением постоянных линий клеток.
Для производства живых и инактивированных вакцин во многих странах на-
лажено крупномасштабное производство однослойных культур.
В 1954—1967 гг. в США произведено около 1000 т вирусной суспензии в од-
нослойной первичной культуре клеток почек обезьян. Ее в основном использо-
вали для приготовления инактивированной вакцины против полиомиелита и в
меньшей степени для коревой и аденовирусной вакцин.
С технологической точки зрения при промышленном производстве вирус-
ных вакцин наибольший интерес представляет высокая эффективность выра-
щивания клеток и максимальный выход вируса или вирусного антигена. В слу-
чае приготовления первичных культур особое внимание следует уделять состоя-
нию животных — доноров ткани.
Известен ряд критических факторов, которые следует учитывать при произ-
водстве культуральных вирусных вакцин на основе первичных культур.
Приготовление однослойных культур — трудоемкий процесс. Большие мас-
штабы производства многих культуральных инактивированных вакцин привели
к необходимости совершенствования технологии их приготовления.
Технологическая линия для массового выращивания вируса ящура в первич-
ной однослойной культуре клеток почек телят в матрасах Ру емкостью 1 л, смон-
тированная в 1958 г. в Италии, позволяла получить в неделю 300—400 л вирусной
суспензии с титром 107—107,5. Многие технологические процессы были механи-
зированы и дали возможность повысить производительность метода. Однако
масштабы производства вирусного сырья и повышение качества инактивиро-
ванных вакцин требовали дальнейшего совершенствования аппаратуры и техно-
логии промышленных способов выращивания вирусов.
Важным шагом в усовершенствовании метода однослойных культур явилось
выращивание клеток во вращающихся круглостенных сосудах. При этом значи-
тельно увеличилось соотношение поверхности культивирования (см2) к объему
среды (мл), которое достигало примерно 10. Высокая концентрация клеток
(8х106 клеток ВНК и 2,4х106 клеток почки теленка) на 1 мл поддерживающей
среды неизбежно сказалась на повышении активности вирусных антигенов
[143]. Благодаря аппаратурно-технологическим разработкам производитель-
ность метода выращивания однослойных культур достигала высокого уровня.
Все операции, связанные с подготовкой посуды, выращиванием клеток и полу-
чением вируса, были механизированы. Вращающиеся литровые сосуды с культу-
рой помещали в цилиндрические проволочные кассеты (по 18 в каждую). Кассе-
ты укладывали на стеллажи с вращающимися вальцами. Одна пятиярусная рол-
лерная установка одновременно вмещала 400 проволочных кассет с 7200 враща-
ющимися сосудами. В институте зоопрофилактики в Брешия (Италия) было
смонтировано четыре таких установки на 2800 1-литровых бутылей [143].
До сих пор этот метод с успехом применяют в ряде стран в исследовательских
и производственных целях. Для выращивания вируса ящура первоначально при-
меняли первичную культуру клеток почек телят, выращенную в 1-литровых вра-
щающихся флаконах. Это дало возможность увеличить урожай клеток в 3—3,5
раза по сравнению со статическими культурами в 1—1,5-литровых матрасах. Од-
новременно возрасли титр вируса, активность комплементсвязывающего анти-
гена и иммуногенность инактивированной вакцины [1555].
В дальнейшем для получения вируса ящура указанным способом широко ис-
пользовали клетки ВНК.-21, выращенные во вращающихся флаконах. Успех во
многом зависел от модификации питательной среды. Густые культуры клеток
удалось вырастить без смены среды [294]. Введение трисбуфера в период роста
культуры обеспечило стабильность pH среды. Высокоочищенные аминокисло-
ты, содержащиеся в среде Игла, были заменены гидролизатом лактальбумина с
добавлением гистидина. К этой среде добавляли 10% триптозофосфатного буль-
она (Дифко) и 10% сыворотки крупного рогатого скота (табл. 10).
Выращивание клеток. Из 7-дневных культур удаляли среду и в каждый сосуд
вносили по 20 мл 0,25%-ного раствора трипсина на фосфатнобуферном раство-
ре (pH 7,5).
В период отделения клеток от стекла сосуды вращали при комнатной темпе-
ратуре в течение 20 мин. Клетки ресуспендировали в питательной среде таким
образом, чтобы их концентрация в 1 мл приблизительно равнялась 3x105. Полу-
ченную суспензию вносили по 100 мл в 2-литровые сосуды. Клеток, выросших в
одном сосуде, было достаточно для засева 20 сосудов. В течение первых двух ча-
сов для обеспечения равномерного распределения и прикрепления клеток к по-
верхности стекла сосуды вращали со скоростью 3 об/мин, а в течение последую-
щих семи дней — при 2 об/ч. Посев 30—40x106 клеток в один сосуд позволял по-
лучать через шесть дней 50—75х107-клеток жизнеспособностью выше 95%.
Выращивание вируса. Одновременно заражали 2000 флаконов с 6-дневной
культурой. В каждый сосуд вносили по 40 мл вируссодержащей ростовой среды
(0,01- 0,05 БОЕ на 1 клетку) с 1,5% сыворотки и инкубировали при 37°С в тече-
ние 24 ч при постоянном вращении (2 об/ч). Вирус ящура накапливался в титре
около 5x108 БОЕ/мл, а выход его составлял 30—50 БОЕ на 1 клетку [299].
В Италии клетки ВНК-21 предварительно выращивали (в течение 48 ч) в пе-
ремешиваемой суспензии в реакторе (емкостью 50 л), разбавляли питательной
средой и высевали в 1 -литровые вращающиеся флаконы. В зависимости от посе-
янной дозы клеток культуры выращивали 3—5 дней. В каждый флакон (около
2,5x108 клеток) вносили 70 мл среды ГЛА с вирусом ящура (0,05 ТЦД50 на клет-
ку). Вирусную суспензию собирали через 20—24 ч при достижении максимально-
го титра (IO7,5—108’5 ЛД50/мл). В 1968 г. для изготовления инактивированной вак-
цины против ящура было использовано 832 170 флаконов с однослойной культу-
Таблица 10. Среда для выращивания клеток ВНК-21 и вируса во вращающихся
культурах
Компонент Концентрация, г/л
NaCl 6,85
КС1 0,4
СаС12 0,2
MgSO4x7H2O 0,2
NaH2PO4 х Н2О 0,12
Fe(NO3)3 х 9Н2О 0,0001
глюкоза 4,5
1-глютамин 0,292
NaHCO3 0,35
Трисбуфер (pH 7,5; 0,16 М) 125 мл
Гидролизат лактальбумина 5,0
1- гистидин НС1 0,05
Витамины (необходимые для клеток HeLa) 0,02
Феноловый красный (10%-ный) 0,15 мл
рой клеток ВНК-21. В течение более 20 лет на промышленных роллерных уста-
новках Италии выпущены миллиарды доз вакцин против ящура, инфекционно-
го ринотрахеита крупного рогатого скота, парагриппа-3 и болезни Ауески [143].
Вращающиеся культуры различных клеток также широко использовали для про-
изводственного выращивания вирусов герпеса, бешенства, кори, осповакцины,
краснухи и др.
Для приготовления инактивированной вакцины против восточного энцефа-
ломиелита лошадей был разработан метод выращивания вируса в однослойной
первичной культуре клеток куриных эмбрионов во вращающихся флаконах. В
каждый флакон с полезной площадью 840 см2 вносили 170 мл среды Игла, 1%
глютамина и 10% сыворотки телят и 4—106 клеток/мл трипсинизированных тка-
ней 9-дневных куриных эмбрионов. Сплошной слой клеток формировался через
18-24 ч выращивания при 35°С. В этот период производили смену среды и зара-
жение вирусом. Во флаконы с культурой вносили по 300 мл среды с 0,25 % сыво-
роточного альбумина и 0,005 — ЛД50 вируса на клетку. Через 18—24 ч выращива-
ния при 35°С концентрация вируса была максимальной и нередко достигала
Ю10 ЛД50/мл. Приготовленная из этого вируса формолвакцина обладала высо-
кой иммуногенностью [515].
В статической однослойной культуре постоянной линии клеток РК.-15 вирус
классической чумы свиней накапливался в титре 6,3 1g ТЦД^д/мл, тогда как в
культуре на микроносителе он достигал 9,0 1g ТЦД50/мл [434].
Аттенуированный штамм вируса трансмиссивного гастроэнтерита свиней
размножали в роллерной культуре постоянной линии клеток почки эмбриона
свиньи (линия СПЭВ). Для выращивания вируса использовали культуры, обра-
зовавшие монослой клеток через 40—48 ч. Вирус перед заражением обрабатыва-
ли трипсином (5 мкг/мл, при 37°С, в течение 30 мин) и вносили в культуру из
расчета 10 ТЦД50 на 1 клетку. Инфицированные культуры инкубировали при
37°С в течение 16—20 ч и замораживали при — 20°С. При серийном пассировании
в указанных условиях вирус регулярно накапливался в титре 108— 109 ТЦД50/мл.
Аналогичная методика, примененная ранее для культивирования ротавируса
свиней, а затем и респираторного коронавируса свиней, позволила получить
культуральные препараты этих вирусов с высоким титром.
Ротавирус крупного рогатого скота серийно размножали в постоянной ли-
нии клеток свиньи (линия СПЭВ) в присутствии трипсина. Размножение его со-
провождалось слабым ЦПЭ. Репродукция вируса была больше выражена в рол-
лерной культуре, чем в статической.
Для производства вакцины против болезни Марека используют фиброблас-
ты эмбрионов кур или перепелов, которые обычно культивируют в круглостен-
ных сосудах на роллерных установках.
Приведенные данные свидетельствуют о высокой эффективности метода
вращающейся культуры клеток в приготовлении вирусных биопрепаратов. Боль-
шим шагом вперед в технологии выращивания однослойных культур стала раз-
работка таких аппаратов как многопластинчатые или многотрубчатые культива-
торы, применение которых обеспечило одновременное выращивание большого
количества клеток на твердом субстрате в одном культуральном сосуде (рис. 14).
В однослойной культуре, выращенной в многопластинчатом культиваторе, ви-
русы гриппа и другие накапливались в таком же титре, как и в однослойной ста-
д
1
Рис. 14. Схематическое изображение многопластинчатых (1 - 5) и многотруб-
чатых (6 и 7) культиваторов клеток.
1, 2, 3 — статистические культиваторы; 4—7— динамические культиваторы;
4 — вращающиеся пластины внутри культиватора; 5— 7 — вращается весь куль-
тиватор; Р — резервуар со средой; Н— перекачивающий насос.
тической культуре в матрасах Ру. После образования монослоя в культиватор
вносили поддерживающую среду с вирусом. При инкубировании проводили
медленное перемешивание и аэрацию поддерживающей среды. Культуральную
жидкость собирали в период максимального накопления вируса. Во время выра-
щивания вируса обработанную газовую смесь обеззараживали с помощью спе-
циальной установки. Разработанные культиваторы с титановыми пластинами с
успехом заменили вращающиеся бутыли при производстве вакцин против эпи-
демического паротита (свинки), кори и краснухи.
Для производственного выращивания клеток и вирусов были предложены
многотрубчатые культиваторы, представляющие собой цилиндрический гори-
зонтально расположенный сосуд из нержавеющей стали, заполненный массой
стеклянных трубок, расположенных параллельно продольной оси культиватора.
Последний устанавливается на специальной механизированной подставке в тер-
мостатированном помещении. В рабочем положении цилиндрический культи-
ватор медленно вращается вокруг продольной оси.
Однослойные культуры клеток, выращенные в многотрубчатом культивато-
ре [1368], оказались весьма эффективными для получения различных вирусов в
больших количествах (табл. 11). В качестве прототипа ниже приведено схемати-
ческое описание выращивания вируса в культуре клеток во вращающейся ко-
лонне.
Клетки трипсинизированной ткани куриного эмбриона суспендируют в пи-
тательной среде Игла, содержащей сыворотку крупного рогатого скота. Культу-
ральный аппарат ставят в вертикальное положение таким образом, чтобы ввод
находился на нижней распределительной пластинке. Воздушный фильтр остав-
Таблица 11. Продукция вируса в однослойных культурах, выращенных в стационар-
ных флаконах и в многотрубчатом культиваторе «вращающаяся колонна» [1368]
Вирус Культура клеток Способ выращивания Средний титр (1g)
Ящура, тип С первичная, клетки почки свиньи Вращающаяся колонна 7,42 ТЦД50/мл
Стационарные флаконы 7,34 ТЦД50/мл
То же линия клеток ВНК-21 Вращающаяся колонна 7,61 ТЦД50/мл
Стационарные флаконы 7,50 ТЦД50/мл
Болезни Ауески первичная, клетки куриного эмбриона Вращающаяся колонна 7,20 ТЦД50/мл
Стационарные флаконы 7,15ТЦД50/мл
Ньюкаслской болезни (штамм Ла-Сота) То же Вращающаяся колонна 7,95 ЭЛД60/мл
Стационарные флаконы 7,72 ЭЛД60/мл
Гриппа (Гонконг А2) То же Вращающаяся колонна 8,50 ЭЛД60/мл
Стационарные флаконы 8,00 ЭЛД60/мл
ляют открытым. В культуральные сосуды (стеклянные трубки) на 1 см2 поверх-
ности вносят по 0,2 мл питательной среды и 5х 104 клеток. Стеклянные трубки за-
полняют на 1/5, что обеспечивает благоприятное соотношение газа и жидкости
(4:1). После этого аппарат с суспензией клеток быстро переворачивают в гори-
зонтальное положение и вращают вокруг продольной оси со скоростью 5 об/ч.
При такой угловой скорости клетки равномерно распределяются на поверхнос-
ти сосуда. Выращивание клеток длится 4-5 дней при температуре 37°С. При
этом образуется монослойная культура, которую можно видеть при микроскопи-
ческом исследовании. После формирования сплошного слоя культуральное уст-
ройство вновь ставят в вертикальное положение и удаляют ростовую питатель-
ную среду, а культуру промывают изотоническим солевым раствором.
Вирус ньюкаслской болезни в среде 199 (10 ТЦД50/мл), вносят в культураль-
ный аппарат (приблизительно 0,01 мл на 1 см2 поверхности), возвращают аппа-
рат в горизонтальное положение и вращают 1—3 ч для адсорбции вируса. Затем
монослой промывают поддерживающей средой, вносят ее по 0,2 мл на 1 см2 и
аппарат с инфицированной культурой инкубируют в течение необходимого вре-
мени для максимального размножения вируса.
Внеклеточный вирус получают путем однократного или повторного слива
питательной среды из культурального аппарата в приемник, а связанный с клет-
ками — с помощью раствора трипсин-версена. С этой целью культуральный ап-
парат вращают в течение нескольких минут, чтобы клетки отделились от стенок
стеклянных трубок.
Аналогичный трубчатый лабораторный культиватор использовали для выра-
щивания стабильных линий клеток Vero, BS-C-1, IMH-P и первичной культуры
клеток куриного эмбриона с целью продукции вирусов кори, краснухи, полно- и
герпесвирусов.
Вирусы при изготовлении инактивированной вакцины против болезни Ма-
река выращивали с использованием культиваторов со вставленными в них ци-
линдрическими стеклянными трубками.
Многодисковые и многотрубчатые культиваторы можно с успехом использо-
вать для массового выращивания различных вирусов на различных клеточных
субстратах. С той же целью могут быть применены многолотковые системы фир-
мы Nunc (Дания) площадью 6000 см2 и батарейные многолотковые системы,
объединяющие 40 лотков с общей рабочей поверхностью 24 000 см2. Многолот-
ковые системы можно соединять в любых комбинациях.
Для выращивания вируса краснухи в больших объемах использовали реактор
со стеклянными бусами диаметром 3 мм, на которых выращивали клетки Vero.
Циркуляция питательной среды (МЕМ с 10% сыворотки эмбрионов коров)
обеспечивалась насосом, газовой фазой служил воздух с 5% COj. При инфици-
ровании вирусом содержание сыворотки в среде снижали до 2%. Вирусную жид-
кость сливали через каждые 24 ч, заменяя свежей, и хранили при температуре
—70°С. Выход вируса составлял 10,0 1g ТЦД50/мл. Титрование вируса по ТЦД50
хорошо коррелировало с определением его концентрации по тесту ИФА.
При изготовлении живых вакцин для ветеринарной практики используют
преимущественно однослойные первичные культуры. Такие препараты часто об-
ладают высокой экономичностью (в 1 мл содержится 10—100 и более иммунизиру-
ющих доз). Для их производства не требуется больших количеств вирусного мате-
риала, вирусы размножают в однослойных статических или роллерных культурах.
В таблице приведены основные культуральные вакцины для людей и живот-
ных, испытанные в экспериментальных условиях или применяемые в практике.
В ветеринарной практике ряда стран широко применяют культуральные жи-
вые вакцины против чумы плотоядных, чумы свиней, ринотрахеита и диареи
крупного рогатого скота, болезни Ауески, ньюкаслской болезни, болезни Маре-
ка, катаральной лихорадки овец и ларинготрахеита птиц и др.
Кроме урожая вируса, его антигенности и приживляемости в организме, с
клеточным субстратом может быть связана безопасность применения вакцины.
Для широкого применения методов групповой иммунизации животных не-
обходимо значительное увеличение расхода живых вакцин и, соответственно,
расширение масштабов их производства. В таком случае, существующие спосо-
бы размножения вакцинных штаммов следует существенно модернизировать.
Выращивание вируса инфекционной анемии лошадей обычно проводят в
культурах лейкоцитов или клеток костного мозга лошади, селезенки эмбриона
лошади или постоянной линии клеток кожи лошади (CCL-57), что дает возмож-
ность получить антиген, пригодный для диагностики этого заболевания. Про-
дуктивно инфицированные постоянные линии клеток часто используют для по-
лучения вируса лейкоза крупного рогатого скота и лейкемии кошек.
С целью повышения активности культуральных антигенов для серологичес-
ких реакций часто уменьшают объем среды при заражении культур или исполь-
зуют только клетки инфицированных культур в период выраженного цитопати-
ческого эффекта, обрабатывая их соответствующим образом.
Культуры клеток на микроносителях (МН) оказались весьма перспективны-
ми при производстве вирусных вакцин, а также других продуктов клеточного и
вирусного происхождения. Этот метод широко применяют в биологической
промышленности многие высокоразвитые страны. Культуры различных клеток
на микроносителе оказались достаточно эффективными для выращивания мно-
гих опасных вирусов человека и животных.
Этим методом размножают вирус полиомиелита в первичной культуре кле-
ток почки обезьяны и в клетках Vero, вирусы бешенства и кори в первичной
культуре клеток почки собаки, вирус краснухи в клетках ВНК-21, ящура в клет-
ках IBRS-2 и ВНК-21, вирус гриппа и Синдбис в клетках МДСК и ВНК-21, ви-
рус простого герпеса в клетках HeLa, MRC-5, Vero и RK-13. Поданным некото-
рых авторов, выход вируса (на одну клетку) одинаков в культурах клеток, вырос-
ших в статических условиях или на микрогранулах. Коллагеновые микросферы
активируют клеточную дифференциацию, синтез белков и их секрецию.
При выращивании вирусов в культуре клеток с микроносителем необходимо
учитывать способность их к цитолизу. Если вирус быстро разрушает клетки, то
Таблица 12. Культуры клеток, наиболее часто используемые в качестве субстра-
та при изготовлении вирусных вакцин
Культуры клеток Вакцины
Живые Инактивированные
Куриный эмбрион бешенство, корь, ньюкаслская болезнь, болезнь Ауески, энцефа- ломиелит лошадей, чума плотояд- ных, болезнь Марека, чума уток Корь, клещевой энцефалит, болезнь Ауески, энцефало- миелиты лошадей, японский энцефалит
Почка обезьяны Полиомиелит Полиомиелит
Почка свиньи Бешенство, классическая чума свиней, болезнь Тешена, ньюкаслская болезнь Ящур, болезнь Тешена, бешенство
Почка эмбриона свиньи Классическая чума свиней
Почка крупного рогатого скота Чума, ринотрахеит и диарея крупного рогатого скота Ящур
Почка овцы Катаральная лихорадка овец Катаральная лихорадка овец
Кожа эмбриона овцы Контагиозная эктима овец
Тестикулы ягнят Классическая чума свиней
Почка собаки Корь, паротит, гепатит собак, чума плотоядных
Почка кролика Миксома кроликов Болезнь Ауески
Почка морской свинки Классическая чума свиней
Почка хомяка Бешенство, японский энцефалит Японский энцефалит
Эмбрион утки Краснуха, бешенство Бешенство
Линии ДИПЛОИДНЫХ клеток человека Полиомиелит, аденовирус-4, корь, краснуха Полиомиелит, аденови- рус-4, корь, краснуха
Постоянные линии клеток Чума плотоядных, бешенство, трансмиссивный гастроэнтерит свиней, ротавирусная болезнь свиней Ящур, африканская чума лошадей, болезнь Ауески, катаральная лихорадка овец, парвовирусная болезнь свиней, бешенство, болезнь Тешена, полиомие- лит и др.
заражение следует производить в период максимальной плотности жизнеспо-
собных клеток, если он медленно или совсем не разрушает клетки, то его реко-
мендуют вносить за несколько суток до этого срока. Метод культивирования
клеток на микроносителях применяют при изготовлении ряда вакцин против
полиомиелита, краснухи, бешенства, герпеса простого (тип 2), гриппа, ящура.
Некоторые из них, например, вакцины против полиомиелита, бешенства, ящу-
ра готовили в промышленных масштабах для широкого практического исполь-
зования. Вакцину против полиомиелита первоначально готовили с использова-
нием первичной культуры клеток почки обезьян, выращенной на микроносите-
ле ДЭАЭ-сефадекса А-50 в культиваторах емкостью 40— 135 л. За 7—8 суток выра-
щивания численность клеточной популяции увеличивалась в 8—10 раз, а
концентрация достигала 106 клеток/мл. В таких культурах вирус полиомиелита
накапливался в высоком титре (8,1—8,3 1g ТЦД50/мл). Положительные результа-
ты получены при выращивании полиовируса в субкультурах клеток почек обезь-
ян с использованием цитодекса в качестве микроносителя и культиваторов ем-
костью до 650 л. Проведение 2-3 пассажей клеток почек обезьян экономило до-
рогостоящее первичное сырье и упрощало технологию выращивания вируса.
В дальнейшем была изыскана возможность замены первичных культур кле-
ток почки обезьян постоянными линиями клеток. Представилась возможность
размножения различных типов вируса полиомиелита в трех постоянных линиях
клеток почек обезьяны: LLC-MK2, Vero и CV-1, выращенных в культуре на ми-
кроносителе. На основе таких вирусов изготовлена инактивированная полио-
вакцина. В ферментерах получали культуру клеток с концентрацией 106 кле-
ток/мл. Выход вируса был не ниже, чем в однослойной первичной культуре кле-
ток почек обезьяны, и выше, чем в однослойной статической культуре
гомологичных клеток. В дальнейшем было установлено отсутствие вирусной
контаминации или туморогенных свойств клеток Vero. Разработан метод культи-
вирования клеток Vero на цитодексе-1 (1,5 г/л) в объеме 1000 л для размножения
полиовируса I, II и III типов [1086]. В настоящее время клетки Vero считают на-
иболее перспективными и экономичными при крупномасштабном производст-
ве полиовакцины вакцины на микроносителях. Для производства инактивиро-
ванных полиовирусных и других вакцин во Франции клетки на микроносителе
выращивали в реакторах емкостью 2000 и 6000 л. При культивировании со сме-
ной среды плотность популяции достигала 2,2x107 клеток/мл [715].
Вирус бешенства для изготовления инактивированной антирабической вак-
цины выращивали в первичной культуре клеток почки собаки на микроносите-
ле. Поскольку вирус бешенства медленно разрушает клетки, то на одной культу-
ре получали несколько урожаев вируса при замене среды через каждые 4—5 су-
ток. Титр инфекционности указанного вируса составил 6,0+1,0 1g ИД50/мл. При
крупномасштабном производстве инактивированной вакцины против бешенст-
ва используют постоянную линию клеток Vero, которую размножают на микро-
носителе в суспензии с использованием возрастающего объема 150—500—1000 л.
При заражении вирусом используют среду без сыворотки. Сбор вируса произво-
дят многократно через каждые 3—4 дня. Вирус концентрируют, инактивируют
бета-пропиолактоном (БПЛ) и очищают.
Вирус ящура выращивали в постоянной линии клеток почки свиньи (IBRS-2)
на микроносителе в ферментерах емкостью 150—235 л. Выход клеток был в 3 ра-
за большим, чем в статической культуре во флаконах. Аналогичным образом ви-
рус ящура выращивали в клетках ВНК-21 на микроносителе. Инфекционная и
комгтлементфиксирующая активность вируса ящура типов А и О была выше при
выращивании клеток на микроносителях, чем во вращающихся флаконах. При
культивировании вируса ящура в клетках ВНК-21 на микроносителе отмечено
повышение выхода клеток и вирусного антигена, а также повышение иммуно-
генности инактивированной вакцины. В культуре клеток ВНК-21 (клон 13) на
микроносителе выход вируса ящура был выше (9,5 1g ТЦД50/мл), чем в роллер-
ной культуре (8,5 1g ТЦД50/мл) [699]. Хорошее накопление вируса краснухи по-
лучено в культуре клеток ВНК-21 на микроносителе.
Вирус панлейкопении кошек выращивали в культуре перевиваемых клеток
легких эмбриона кошки. Инфицированную культуру инкубировали до полного
разрушения клеток на микроносителе под действием вируса. Приготовленная из
него инактивированная вакцина обладала выраженной иммуногенностью
[1310].
Пролиферативная активность многих клеток (фибробласты куриного эмб-
риона, клетки яичника китайского хомяка — СНО, клетки почки обезьяны и
диплоидные W-1-38) была выше при культивировании на микроносителях, чем
в роллерных флаконах. Опыты, проведенные с полиовирусом и вирусом Синд-
бис, показали, что выход последнего в расчете на одну клетку куриного эмбрио-
на в роллерной культуре был выше, чем в культуре на микроносителе. Однако
титр обоих вирусов во всех культурах клеток на микроносителе неизменно был
выше, чем в культурах тех же клеток во вращающихся флаконах. Это связано с
большей концентрацией клеток на единицу объема среды в первом случае, чем
во втором.
Клетки линии FLK, инфицированные вирусом лейкоза крупного рогатого
скота, выращенные на микроносителе, длительно сохраняли жизнеспособность
и поддерживали продукцию вирусного антигена [194].
Респираторно-синцитиальный (PC) вирус крупного рогатого скота хорошо
размножался в первичной культуре тестикулярной ткани телят на микроносите-
ле (6,0 1g ИД50/мл). В результате периодической смены среды можно получить
несколько урожаев вируса. PC-вирус крупного рогатого скота выращивали в
культуре перевиваемых клеток слизистой оболочки носа крупного рогатого ско-
та (линия М-57) в однослойной статической культуре и на микроносителе. Уро-
жай клеток в культуре на микроносителе (цитодекс 3; 1,5 г/мл) был в 3 раза вы-
ше, чем в однослойной пристеночной культуре. В конечном счете в первом слу-
чае культуральная система оказалась значительно продуктивнее и экономичнее
для получения вируса, чем во втором. Микроносители были использованы для
выращивания клеток насекомых и репродукции арбовирусов.
Технология крупномасштабного производства гликопротеина 160 кД (gp 160)
ВПГ-1 разработана с использованием клеток Vero, выращенных на микроноси-
теле в культиваторах емкостью 40 л. Максимальный выход gp 160 наблюдали че-
рез 40 ч после заражения клеток (106/мл) рекомбинантным вирусом вакцины. Из
одного ферментера после очистки получали 50 мг белка gp 160, обладающего вы-
раженной иммуногенностью [295].
Коронавирус мышей выращивали в культуре клеток мышей (линия ДВТ),
используя в качестве микроносителя Цитодекс 1 в концентрации 5 г на 1 л сре-
ды L=15 с 5% сыворотки плодов крупного рогатого скота. В течение семи дней
культивирования концентрация клеток повышалась примерно в 10 раз
(3x106 мл). Выход вируса на одну клетку был таким же как и в статической одно-
слойной культуре.
Вирус болезни Ауески размножали в постоянной линии клеток (NLST) тес-
тикулярной ткани свиней, выращенной на микроносителе в реакторе емкостью
500 л. Накопление клеток вируса и его антигена было более высоким в суспензи-
онной, чем в статической однослойной культуре.
При массовом использовании продуктов, полученных с применением про-
изводных декстрана (ДЭАЭ-сефадекса А-50, цитодексов), необходимо знать, ос-
таются ли в них какие-то количества ДЭАЭ-декстрана. Масс-спектроскопичес-
кими исследованиями не установлено наличие ДЭАЭ-декстрана в суспензии по-
лиовируса, выращенного на микроносителе.
Размножение вирусов в суспензии постоянных линий клеток
Для одних целей предпочтительнее использовать клетки, растущие на по-
верхности субстрата, для других — клеточные суспензии. Даже первые несовер-
шенные исследования по культивированию вирусов в суспензиях постоянных
линий клеток показали перспективность этого метода для получения вирусов в
больших количествах.
За сравнительно короткий период выращивание вирусов животных в суспен-
зиях клеток достигло впечатляющих успехов. Большие достижения в этой обла-
сти связаны, прежде всего, с технологией выращивания вируса ящура в суспен-
зии клеток ВНК-21. Ввиду высокой чувствительности ко многим вирусам и по-
тенции роста клетки ВНК-21 получили широкое применение. Внимание многих
исследователей было обращено на разработку методов массового выращивания
этих клеток. Возможность автоматического регулирования pH, аэрации, темпе-
ратуры, а также усовершенствование питательных сред создали предпосылки
для суспензионного культивирования клеток ВНК-21 в реакторах большой
емкости.
В 1962 г. Кэпстик и сотрудники [445] впервые сообщили о выращивании кле-
ток ВНК-21 в суспензии без ослабления их чувствительности к вирусу ящура. За-
тем было установлено, что вирус ящура, размноженный в суспензии клеток
ВНК-21, вполне пригоден для получения инактивированной вакцины [446].
Полученные результаты стали основанием для разработки промышленной
технологии культивирования клеток ВНК-21 с целью изготовления инактивиро-
ванной противоящурной вакцины [447, 1499].
Дальнейшие исследования [447] показали, что вирус максимально накапли-
вался при 35°С. С повышением температуры ускорялась гибель клеток, а при ее
снижении до 34—25°С ослаблялась репродукция вируса. Максимальный титр на-
блюдался при pH 7,2, снижение или повышение pH до 6,8 и 7,8 подавляло раз-
множение вируса. Повышение концентрации клеток в пределах 1,0—9,0 млн/мл
заметно не влияло на титр вируса, хотя при этом активность КС-антигена повы-
шалась. Концентрация клеток в пределах 2,0—2,5 млн/мл обеспечивала накопле-
ние вирусного антигена, необходимого для изготовления эффективной вакци-
ны, что было подтверждено в опытах на крупном рогатом скоте. Для получения
максимального выхода вируса множественность заражения (М) должна быть не
менее 0,003. Время достижения пика инфекционности вируса при М = 0,003— 1,0
существенно не изменялось. Добавление к питательной среде 5% сыворотки
крупного рогатого скота вело к увеличению выхода вируса и КС-антигена в 3—10
раз, чего не наблюдали при выращивании вируса ящура в однослойной культуре
клеток ВНК-21. Однако некоторые партии сывороток содержали неспецифиче-
ские ингибиторы, снижающие накопление вирусного антигена на 50%. Приме-
нение сыворотки лошади давало возможность избежать подавления размноже-
ния вируса.
Для производства противоящурной вакцины [1499] клетки ВНК-21 выращи-
вали в металлических аппаратах в течение 50 ч до концентрации 2-2,5 млн/мл.
После осаждения клеток методом отстоя (в течение 18—24 ч при 15°С) 90% рос-
товой среды заменяли средой с 5% сыворотки телят. Для заражения клеточной
суспензии в объеме 100 л (численность популяции 2х 1011 клеток) было достаточ-
но внести 1 л адаптированного культурального вируса с титром Ю8,5—Ю9,0
БОЕ/мл. В процессе культивирования большинство клеток разрушалось в ре-
зультате ЦПД вируса. При изготовлении вакцины вирусную суспензию осветля-
ли фильтрованием вначале через крупнопористый фильтр, затем через нитро-
целлюлозную мембрану (диаметр пор 0,2 мкм). Вирус инактивировали 0,05%-
ным ацетилэтиленимином в течение 30 ч при 25°С (pH 7,6). Приготовленная
таким образом вакцина обладала выраженной иммуногенностью.
Французские исследователи выращивали клетки ВНК-21 в реакторах из не-
ржавеющей стали емкостью 100 л. Автоматическое поддержание pH на опти-
мальном уровне способствовало росту культуры, популяция которой увеличива-
лась в 7-8 раз в течение 72—96 ч. В выросшей культуре заменяли 90% ростовой
среды поддерживающей средой (среда Игла, гидролизат лактальбумина и дрож-
жевой экстракт), вносили вирус и суспензию, перемешивали (400 об/мин). Они
установили, что повышение концентрации клеток в суспензии выше 2x106 мл не
повышает титра вируса. Наивысшее накопление КС-антигена отмечено при
концентрации клеток в суспензии 107 мл. Хранение суспензии клеток при 6°С в
течение семи дней практически не отражалось на их способности к репродукции
вируса ящура. Инактивированные вакцины, приготовленные из вируса ящура,
выращенного в суспензии клеток ВНК-21 (концентрация клеток 2,5 млн/мл) и
по методу Френкеля, оказались аналогичными по иммуногенности.
В 1971 г. восемь ящурных лабораторий, расположенных в Англии, Кении,
Аргентине, Уругвае, Бразилии, Парагвае, Испании и Германии использовали су-
Рис. 15. Типовая схема процесса циклического производства вируса в суспензионной
культуре
спензию клеток ВНК-21 для промышленного изготовления противоящурной
вакцины. Ежегодно эти лаборатории производили свыше 200 млн доз монова-
лентной вакцины. Клетки и вирус выращивали в реакторах емкостью 2000 л при
контролируемых условиях (температура, pH и аэрация). Для изготовления вак-
цины использовали коллекцию из 100 адаптированных штаммов, представляю-
щих 33 иммунологических варианта вируса ящура. Большинство из этих штам-
мов обладали высокой иммуногенностью и хорошо размножались в суспензион-
ной культуре клеток ВНК-21 (рис. 15).
Многолетние исследования по оптимизации условий выращивания клеток
ВНК-21 в суспензии увенчались еще одним важным достижением. Радлетт и со-
трудники [1288] предложили среду 7М, которая обеспечивала исключительно
высокое накопление клеток ВНК-21 (6,5-7,0х106/мл) в суспензии (табл. 13).
При начальной концентрации клеток около 5x105 мл культура вступала в
экспоненциальную фазу роста через 10—12 ч. В этот период продолжительность
генерации составляла около 14 ч (константа скорости роста 0,05 ч). Наиболее
критическими факторами, ограничивающими рост клеток, оказались глютамин
и глюкоза, содержание которых в новой среде было повышено до оптимального
уровня. Добавление гидролизата лактальбумина (5 г/л) повышало концентра-
цию глютамина в среде до 10—12 мМ. Поскольку глютамин в концентрации
более чем 10 мМ (1,46 г/л) оказывает цитотоксический эффект, авторы считают
целесообразным добавлять его в среду дозировано, периодически, по мере ее ис-
тощения.
При промышленном выращивании различных типов вирусов ящура в сус-
пензии клеток ВНК-21 с успехом применяли среду Игла с добавлением 0,3%
триптозофосфатного бульона и 8% сыворотки крупного рогатого скота, обрабо-
танной ПЭГ-6000. В 300-литровом ферментере при 37 °C, pH 7,3 и скорости пе-
ремешивания 100 об/мин через 24—48 ч концентрация клеток повышалась с
0,4—0,9 млн/мл до 1,6—2 млн/мл. Заражение таких культур позволило регулярно
получать качественное сырье (229 партий из 231) для изготовления вакцины.
Несмотря на высокую производительность, культивирование вируса ящура в
суспензии клеток ВНК-21 имеет два недостатка: необходимость смены среды пе-
ред заражением вирусом и включение в ее состав сыворотки. Первый обременя-
ет технологический процесс, второй может быть причиной анафилактических
осложнений при вакцинации [1499].
Таблица 13. Среда «Пирбрайт 7М» для выращивания клеток ВНК-21 в суспензии
[1288]
Компонент Концентрация, мг/л Компонент Концентрация, мг/л
1-аргинин 8,4 Рибофлавин 0,32
1-цистин 4,8 Холинхлорид 3,2
1-гистидин 3,84 Фолиевая кислота 3,2
1-изолейцин 10,48 Никотинамид 3,2
1-лейцин 10,48 Тиамин НО 3,2
1-лизин НС1 14,62 Пантотенат кальция 3,2
1-фенилаланин 6,6 Пиридоксаль- НО 3,2
1-треонин 9,52 Инозитол 0,7
1-триптофан 1,6 NaCl 5120
1-тирозин 7,24 КО 321
1-валин 9,36 MgSO4x7H2O 160
1-метионин 3,0 NaH2PO4 х Н2О 112
1-глютамин 9,32 СаО2 160
Гидролизат лактальбумина 5000 Fe(NO3)3 х 9Н2О 0,08
Триптозо-фосфатный бульон (порошок) 2000 NaHCO3 2200
Фенолрот 8 Глюкоза 6200
Pluronic F 68* 1000 Эмульсия для гашения пены 0,4 мл
Сыворотка круп- ного рогатого скота 100 мл
* Полимер, ограничивающий образование белковых преципитатов, препятствую-
щих размножению клеток в суспензии.
Кроме клеток ВНК-21 для культивирования вируса ящура в последнее время
была использована постоянная линия клеток почки поросят IBRS-2, адаптиро-
ванная к суспензионному культивированию. Клетки выращивали при pH 7,4,
температуре 36,5°С и непрерывном перемешивании суспензии (350 об/мин). Че-
рез 48 ч культивирования концентрация клеток повышалась более чем в 3 раза.
Эти клетки оказались высокочувствительными к вирусу ящура. Максимальное
накопление вируса (7,7—8,7 1g ТЦД^/мл) в суспензии клеток IBRS-2 наблюдали
через 18—24 ч после заражения, а КС-антигена — через 32—48 ч. Инактивирован-
ная вакцина, приготовленная из такого вируса, имела хорошую иммуногенность
[474] и не уступала инактивированной вакцине из вируса ящура, размноженно-
го в суспензии клеток ВНК-21 (при равном титре инфекционности и активнос-
ти КС-антигена). В силу выраженной способности вируса ящура к мутациям, его
популяция в процессе репликации в культуре клеток (ВНК-21 или IBRS-2) в те-
чение небольшого количества пассажей представляет собой смесь генетических
вариантов.
Суспензию клеток 1BRS-2 использовали для размножения вируса везикуляр-
ной болезни свиней. Клетки выращивали в среде Игла с триптозо-фосфатным
бульоном (0,2%) и 10% сыворотки телят. При заражении вирусом концентрацию
сыворотки снижали до 5%. В суспензию клеток (106 клеток/мл) вносили вирус
(М=10) и инкубировали при 35°С, pH 7,2. Вирус максимально накапливался
(108’8 БОЕ/мл) через 16-24 ч.
Технология культивирования клеток ВНК-21 в реакторах емкостью 1000 л,
разработанная для получения вируса ящура, оказалась весьма перспективной
для промышленного производства инактивированной вакцины против бешен-
ства из штамма Lep Flyry.
Клейн и сотрудники [169] описали размножение вируса лихорадки долины
Рифт в суспензионной культуре клеток L. Клетки хранили при —175°С и выра-
щивали поэтапно, вначале во встряхиваемых колбах и стеклянном ферментере
емкостью 7,5 л, затем в 50-литровом металлическом реакторе. Клетки выращи-
вали в модифицированной минимальной среде Игла с 10% сыворотки крупного
рогатого скота; pH 7,0±0,1 поддерживали на этом уровне добавлением кислоты
или щелочи, а ОВП 75 mV — автоматически с помощью аэрации (95% О2 + 5%
СО2 или 95% воздуха + 5% СО2). Газ подавали под мешалку турбинного типа
(100 мл/мин) или над поверхностью жидкости (500 мл/мин). Двойная аэрация
сопровождалась лишь небольшим образованием пены и устраняла необходи-
мость применения пеногасителя. При разбавлении суспензии клеток свежей
средой (1:10) через пять дней их концентрация достигала максимального значе-
ния — 2,5х106 мл. Поскольку вирус наиболее интенсивно размножался в деля-
щихся клетках, то их рассевали, когда плотность популяции приближалась к
2x106 клеток/мл. При этом поступали следующим образом. Ростовую среду вно-
сили в реактор, устанавливали температуру 25°С, добавляли клетки (Зх1О5/мл),
вносили вирус (М=1), устанавливали pH 7,4±0,1; ОВП на 75 mV и повышали
температуру до 37°С постепенно, в течение 4—6 ч (для лучшего сохранения жиз-
неспособности клеток). Через 48—72 ч после заражения вирус накапливался в
максимальном титре 8,0—9,0 1g ЛД50/мл.
Суспензионная культура постоянной линии клеток простаты человека
(MAI 60) обеспечивала репликацию штамма Эдмонстон вируса кори на высоком
уровне. Выход его составлял 150—800 БОЕ на клетку и примерно в 25 раз превы-
шал выход вируса в однослойной культуре.
Вирус трансмиссивного гастроэнтерита свиней (ТГС) выращивали в цикли-
ческой суспензионной культуре постоянной линии клеток почки поросенка
ППК-66. При оптимальных условиях (концентрация клеток 1,5—2,5 млн/мл;
множественность заражения 1— 10 ТЦД50/мл; продолжительность культивиро-
вания после инфицирования 24—30 ч; содержание сыворотки в среде — 5—10%;
pH - 7,2-7,4; скорость перемешивания суспензии 120-200 об/мин и аэрация со
скоростью 0,2—1 л/ч на литр среды) вирус накапливался в титре
IO8,5—1О9,0 ТЦД50/мл и в 100 раз превышал накопление вируса в однослойной
статической культуре тех же клеток. Титры антител в крови кроликов, двукратно
иммунизированных инактивированной вакциной, были значительно выше при
ее приготовлении из вируса, размноженного в суспензионной, чем в однослой-
ной культуре клеток. Установлено, что суспензионная культура клеток ППК-66
является высокопродуктивной системой для крупномасштабного производства
вакцинного штамма вируса ТГС.
Аналогичные данные получены при выращивании вируса болезни Ауески в
суспензионных культурах клеток ППК-666 и ВНК-21. Накопление вируса в сус-
пензии (108,5— Ю9 0 ТЦД50/мл) было выше, чем в монослое. В обоих случаях для
выращивания вирусов трансмиссивного гастроэнтерита и болезни Ауески в сус-
пензии клеток использовали среду с ФГМ и 10% сыворотки крупного рогатого
скота [169].
Накопление вируса венесуэльского энцефаломиелита лошадей в клетках L,
выращенных в суспензии, было таким же, как и в однослойной культуре. Одна-
ко выход вируса на одну клетку в суспензии был ниже, чем в монослое, и в сред-
нем достигал 1000 ЛД50/мл. Респираторно-синцитиальный вирус размножали в
суспензии клеток НЕр2 и МА-160. Вирусную суспензию смешивали с клеточным
осадком (М-5), добавляли среду Игла с 10% сыворотки телят до концентрации
клеток 2—Зх 105 мл. Через 48 ч вирус достигал титра 7,01g ТЦД50/мл. Высокая им-
муногенность препарата, инактивированного формалином (1:2000), явилась ос-
нованием для разработки метода выращивания вируса в суспензионной культу-
ре в ферментерах. Вирусы полиомиелита трех типов хорошо размножались в су-
спензии лимфобластоидных клеток человека в бессывороточной среде. Данная
клеточная система открывает новые возможности получения больших количеств
вируса для промышленного изготовления вакцины. Линии лимфоидных клеток
(JMV-I и MSB-1), полученные от зараженных вирусом болезни Марека цыплят,
поддерживали репликацию вируса ньюкаслской болезни, что сопровождалось
цитолитическим действием.
Хемостатные суспензионные культуры представляют возможность для уве-
личения производительности при репродукции вирусов по сравнению с обыч-
ными циклическими суспензионными культурами. Выбор системы непрерывно-
проточного культивирования зависит от особенностей вируса и чувствительного
клеточного субстрата. Вирусы, реплицирующиеся без цитопатического эффекта
и без выраженного снижения скорости роста клеток, могут размножаться в сис-
теме одноступенчатого хемостата. Вирусы, вызывающие литическую инфекцию,
необходимо культивировать во второй ступени хемостата, а клетки-продуцен-
ты — в первой. Преимущество хемостатной системы состоит также в непрерыв-
ном удалении образовавшегося продукта. В одноступенчатом хемостате культи-
вировали вирус краснухи в клетках HeLa и ВНК-21. Отмечено, что в течение 40
дней непрерывной работы хемостата поддерживался титр продуцируемого виру-
са и комплементсвязывающего антигена. С увеличением скорости роста клеток
увеличивалась репродукция вируса. Полиовирус, вызывающий литическую ин-
фекцию, размножали в клетках HeLa в одноступенчатом хемостате (лизостате),
а аденовирус - в двухступенчатой системе. Однако эти попытки не дали четких
результатов.
Для культивирования клеток в суспензии предложен (1998 г.) качающийся
биореактор (Wave bioreactor), представляющий собой пластиковую эластичную
емкость (мешок), содержимое которого перемешивается с помощью плавного
покачивания в вертикальной плоскости на специальной качалке (рис. 16).
Пластитковый биореактор стерилизуется гамма-лучами. При культивирова-
нии клеточной суспензии в объеме > 10 л, используют аэрацию с автоматизиро-
ванным контролем pH, О2 и СО2.
Перспектива использования постоянных линий клеток для выращивания
вирусов с целью изготовления вакцин привела к необходимости выяснить опас-
ность таких препаратов. Прежде всего, это было связано с клетками ВНК-21 и
противоящурной вакциной. Онкогенность клеток ВНК-21 для хомяков хорошо
известна. Предстояло выяснить онкогенность их для домашних животных, при-
виваемых против ящура. Во-первых, было установлено, что у хомяков опухоли
вызывают только нативные клетки ВНК-21, тогда как различные культуральные
бесклеточные субстраты этой способностью не обладают. Во-вторых, у других
видов животных (крупный рогатый скот, овцы, свиньи, крысы, кролики, мор-
ские свинки и мыши) клетки ВНК-21 не вызывали опухолей.
Постоянный технический комитет экспертов Европейской комиссии по
борьбе с ящуром ФАО рекомендовал клетки ВНК-21 для изготовления вакцины,
признав их безопасными для сельскохозяйственных животных. Многолетняя
практика применения ВНК-вакцины против ящура подтвердила правильность
этой рекомендации. Возможность применения других линий клеток в изготов-
лении противовирусных вакцин, предназначенных животным, должна основы-
ваться на соответствующих экспериментальных данных.
Анализ имеющихся данных показывает, что выращивание вирусов в суспен-
зии постоянных линий перевиваемых клеток все более привлекает внимание ис-
следователей в связи с решением различных научных и практических вопросов.
Для некоторых вирусов разработаны технологические режимы массового раз-
Рис. 16. Схематическое изображение качающегося биореактора.
множения в клеточных линиях с использованием металлических реакторов
большой емкости. Одни и те же клеточные субстраты можно с успехом приме-
нять для размножения разных вирусов. Например, технология культивирования
клеток ВНК-21, разработанная в связи с изготовлением противоящурной вакци-
ны, имеет прототипное значение и может быть применена для размножения
многих вирусов человека и животных. Разработка таких технологий массового
культивирования постоянных линий клеток многоцелевого назначения пред-
ставляет огромный практический интерес. Актуальной задачей является созда-
ние банка охарактеризованных постоянных линий клеток, отличающихся высо-
кой ростовой потенцией, стабильностью свойств при серийном суспензионном
культивировании в промышленных условиях и высокой продуктивностью для
различных вирусов.
Глава 5
ВИРУСНЫЕ
АНТИГЕНЫ
Совершенствование или создание новых вакцин требует знаний структур-
ных и функциональных особенностей вирусных антигенов, различаемых им-
мунной системой организма.
Вирусными антигенами называются продукты вирусспецифического синте-
за, несущие признаки чужеродной генетической информации и вызывающие им-
мунный ответ. К ним относятся структурные и неструктурные вирусные белки.
Защита от вирусной инфекции зависит от выраженности иммунного ответа
на антигены, расположенные на поверхности вирионов или инфицированных
клеток. Иммунный ответ на неструктурные вирусные антигены играет меньшую
роль в защите от инфекции.
Однако у герпесвирусов, например, клеточный иммунный ответ индуцирует-
ся множеством вирусспецифических белков, не входящих в структуру вирионов.
Белки герпесвирусов эксперссируются каскадно (а, [3, у) и большинство нестук-
турных белков синтезируется на ранней стадии репликации вируса. После про-
цессинга они презентируются МНС классом I (главным комплексом гистосов-
местимости, класс I) на плазматической мембране инфицированных клеток и
распознаются специфическими цитотоксическими Т-клетками. Поэтому инфи-
цированные клетки могут различаться эффекторными цитотоксическими
Т-лимфоцитами до завершения цикла вирусной репликации.
Каждый вирус представляет собой сложную смесь антигенов, определяемую
в первую очередь структурными белками. Являясь сложными корпускулярными
антигенами вирусы обычно вызывают выраженный иммунный ответ и большая
часть их белков способна вызывать синтез специфических антител. Вирусные
белки неравнозначны по своей антигенной активности. Наиболее явные и до-
ступные мишени для иммунного ответа — белки, расположенные на поверхнос-
ти вирусных частиц. Это прежде всего относится к вирусным гликопротеинам,
расположенным на поверхности вирусных частиц, и экспрессированным на по-
верхности зараженных клеток.
Гликопротеины поверхности оболочечных вирусов и капсидные белки без-
оболочечных вирусов являются главными протективными антигенами [169
ИЗО].
Под специфичностью вирусного антигена подразумевают его способность
избирательно реагировать с антителами или сенсибилизированными лимфоци-
тами, являющимися ответом на введение данного антигена. Участок антигена,
который узнается специфическим лимфоцитом, и с которым впоследствии вза-
имодействует специфическое антитело, называется антигенной детерминантой.
Иммунологическая специфичность определяется не всей молекулой антиге-
на, а лишь входящими в ее состав антигенными детерминантами (эпитопами).
Участки вирусного белка, индуцирующие образование антител и специфически
связывающиеся с ними, принято называть антигенными участками (доменами)
[1667]. Антитела соответствующей специфичности образуются к каждой анти-
генной детерминанте. Антитела к определенной детерминанте реагируют только
с ней или с другой очень сходной структурой. Специфичность антигена опреде-
ляется совокупностью детерминант, а его валентность — количеством однород-
ных антигенных детерминант. Антигенность детерминант зависит от их прост-
ранственной структуры и размера молекулы антигена.
Антигенные детерминанты состоят обычно из 10—20 аминокислотных остат-
ков и содержат гидрофильные группы. Наиболее гидрофильными аминокисло-
тами являются лизин, аргинин, аспарагиновая кислота и глютаминовая кислота.
Считается, что те участки молекулы белка, в которых их содержание относитель-
но велико, предпочитают водное окружение и поэтому располагаются на по-
верхности. Различают линейные (непрерывные) и конформационные (прерыви-
стые) детерминанты. Антитела образуются преимущественно к конформацион-
ным детерминантам, расположенным, как правило, на поверхности вирионов, и
зависят от третичной структуры молекулы антигена. Антигенная и иммуноген-
ная активность вирусов определяется, главным образом, конформационными
эпитопами. Разные антитела различают специфические антигенные участки ви-
русных антигенов. Например, прикрепительный гликопротеин (HN) вируса па-
рагриппа имеет, по крайней мере, 6 антигенных сайтов, три из которых различа-
ются нейтрализующими антителами [510].
Денатурация белков приводит к потере некоторых конформационных детер-
минант, обнажая ранее экранированные детерминанты. В результате денатура-
ции белки частично или полностью изменяют антигенную специфичность, что
может отразиться на иммунном ответе.
Вирионные белки разных вирусов различаются типоспецифичностью и ва-
риабельностью. Одни из них обладают высокой вариабельностью, другие харак-
теризуются консервативностью. Группоспецифические антигены являются вы-
сококонсервтивными, находятся обычно внутри вирионов и могут быть сходны-
ми у нескольких представителей рода данного семейства вирусов. Например,
субвирусные частицы 12S вируса ящура содержат высококонсервативный белок,
который выявляется моноклональными антителами одной специфичности у ше-
сти из семи известных типов вируса [1428]. Однако иммунизация ими не сопро-
вождалась образованием ВН-антител.
Типоспецифические антигены связаны с вариабельными областями белков,
обычно расположенными в наружных частях вирионов, и обладают узкой специ-
фичностью, присущей одной группе вирусов.
У антигенных вариантов полиовируса устойчивость к нейтрализующим ан-
тителам сопровождалась аминокислотными заменами во всех трех наружных
капсидных белках. Основным результатом «иммунологических» мутаций виру-
са ящура во время эпизоотических вспышек (антигенный дрейф) является из-
менение аминокислотной последовательности в одном капсидном белке VP1
[1129].
Развитие выраженного иммунного ответа против нескольких антигенов, в
том числе группоспецифических, еще не гарантирует устойчивости к зараже-
нию. Подобное явление имеет место при инфекционной анемии лошадей
вследствие вариабельности белка оболочки (env) несмотря на выраженный им-
мунный ответ на более консервативный внутренний антиген (gag) [1577].
С точки зрения участия Т-хелперов в образовании антител различают тиму-
сзависимые и тимуснезависимые антигены. К первым относится большинство
антигенов, ко вторым — антигены более простого строения с повторяющимися
последовательностями. Тимуснезависимые антигены взаимодействуют непо-
средственно с В-клетками, поэтому для образования антител взаимодействия В-
клеток с Т-хелперами не требуется [96, 107, 165, 200]. Большинство изученных
вирусов оказалось Т-зависимыми антигенами. Их иммуногенность в значитель-
ной степени определяется количеством антигенных детерминант, распознавае-
мых Т-хелперами.
В вирусологической практике антигенностью обычно принято называть спо-
собность антигена вызывать иммунный ответ, а иммуногенностью — сообщить
организму специфическую устойчивость к определенному возбудителю [116].
Имеется, однако, иная, более широкая трактовка этих понятий. Способность
антигенов вступать в реакцию с антителами называют антигенностью, а способ-
ность их вызывать иммунный ответ (гуморальный или клеточный) — иммуно-
генностью.
Антигены, играющие основную роль в противовирусном иммунитете, при-
нято называть протективными антигенами [1131]. Под протективной активнос-
тью антигена понимается его способность защищать иммунизируемый организм
от инфицирования или заболевания (при ограничении размножения и распро-
странения вируса). За иммунологическую специфичность и особенно за индук-
цию протективного иммунитета ответственно небольшое количество потенци-
ально антигенных участков. К протективным антигенам относят белки поверх-
ности вирионов и вирусспецифические антигены, экспрессирующиеся на
поверхности инфицированных клеток. Протективные антигены, как правило,
представлены более чем одним белком или гликопротеином. Они имеют поли-
мерную структуру и играют основную роль в развитии иммунитета.
В связи с многомишенной антигенной структурой многих вирусов для их эф-
фективной нейтрализации необходимы антитела различной специфичности и
соответствующие антигены для создания протективного иммунитета.
В инфицированном организме не все индивидуальные антитела имеют до-
ступы ко всем антигенным сайтам вируса. Они обычно не имеют прямого досту-
па ко многим функциональным сайтам вирусных протективных антигенов, та-
ких как: рецептор — связывающий сайт; сайты, обладающие ферментативной
активностью, и домены слияния. Эти участки в большинстве спрятаны внутри
структуры белка протективного антигена. В этих случаях антитела обычно дей-
ствуют другим способом, чем прямая инактивация функциональных сайтов на
поверхности антигенов. Антитела действуют прямо или косвенно, препятствуя
прикреплению вируса к клетке, или его раздеванию после прикрепления или
проникновению в клетку. Кроме структурных белков вируса, протективный им-
мунный ответ может быть направлен на неструктурные белки, расположение на
поверхности инфицированных клеток. Например, таких как NS1 вируса денге
или Т-антиген вируса обезьян 40 (SV40) [1130].
Согласно концепции Р. Лернера [938, 942], в составе вирусных белков име-
ются антигенные участки, не проявляющие активности в процессе вакцинации
или инфекции, которые, будучи представленными в виде коротких пептидов,
способны индуцировать выработку специфических антител. Из этого следует,
что представляя антиген иммунной системе «по кусочкам», можно значительно
расширить спектр иммунного ответа на данный антиген. В опытах с ротавирусом
было установлено, что, если VP7, обычно локализованный в эндоплазматичес-
ком ретикулуме и обладающий слабой антигенностью, экспрессировать на кле-
точной поверхности, то его способность индуцировать гуморальный и клеточ-
ный иммунитет возрастает во много раз [145].
Детерминанты вирионных белков, к которым прикрепляются нейтрализую-
щие антитела, называют нейтрализующими антигенными участками. Нейтрали-
зующий антигенный участок может быть представлен несколькими нейтрализу-
ющими эпитопами, различающимися между собой [1667]. Например, модель ан-
тигенной структуры парамиксовирусов птиц выглядит следующим образом:
каждый вирион содержит определенное число идентичных молекул HN, каждая
молекула HN содержит 2 домена НА и NA, каждый домен содержит идентичные
или отличные друг от друга антигенные детерминанты (эпитопы) [755]. На моле-
куле гемагглютинина (НА) вируса гриппа находятся два типа нейтрализующих
антигенных детерминант: непрерывный (линейный) антигенный участок и кон-
формационная детерминанта. Антигемагглютинирующая активность и способ-
ность к нейтрализации инфекционное™ не обязательно связаны с одним и тем
же типом моноклональных антител, но способность защищать мышей от смер-
тельной инфекции флавивирусами обнаружена только у нейтрализующих анти-
тел [440]. Различные белки одного и того же вируса различаются по антигенной
активности, например, гликопротеин HN вируса парагриппа-3 вызывал более
выраженный гуморальный ответ, чем гликопротеин Е При некоторых вирусных
инфекциях иммунитет связан, главным образом, с сенсибилизированными ци-
тотоксическими Т-лимфоцитами. Мишенями для таких клеток чаще всего явля-
ются вирионные гликопротеины, а также ранние неструктурные белки, экспрес-
сируемые на поверхности инфицированных клеток. Иммунизация неструктур-
ным белком вызывала развитие протективного иммунитета [1566].
Гликопротеины оболочечных вирусов выполняют ряд важных функций в ин-
фекционном процессе. Они определяют клеточный тропизм (прикрепление к
чувствительным клеткам), слияние вирусной и клеточной мембран (проникно-
вение в клетку вирусного генома), участвуют в сборке и почковании дочерних
вирионов и, наконец, являются основными детерминантами иммунного ответа
в случае инфицирования или вакцинации. Взаимодействие между компонента-
ми иммунной системы и вирусными гликопротеинами сложное и является, ско-
рее всего, определяющим фактором исхода инфекции. Формируя пепломеры на
поверхности оболочечных вирусов, гликопротеины являются важнейшими, если
не единственными антигенами вирионов, отвечающими за образование нейтра-
лизующих антител. А так как гуморальный иммунитет при инфекциях, вызыва-
емых оболочечными вирусами, как правило, является решающим фактором не-
восприимчивости, их роли придается большое значение. Информация о поли-
пептидном скелете гликопротеинов закодирована в вирусных генах. Эти белки
после синтеза экстенсивно гликозилируются клеточными ферментами (глико-
зилтрансферазами). Композицию углеводных остатков контролируют как клет-
ки хозяина так и вирусный белок, т. е., в конечном счете, вирус. Гликопротеины,
в отличие от внутренних белков оболочечных вирусов, обогащены Cys-остатка-
ми, обусловливающими образование дисульфидных мостиков и стабилизацию
конформационной структуры.
Гликопротеины оболочечных вирусов относятся к обширному классу так на-
зываемых трансмембранных белков эукариот, объединяемых на основе фор-
мального признака специфической асимметрической ориентации, при которой
часть молекулы погружена в липидный биослой [17]. В структуре вирусных гли-
копротеинов различают три домена: экто-, трансмембранный и цитоплазмати-
ческий. Большая часть молекул гликопротеина (примерно около 90% длины,
N-концевая область) формирует пепломеры, расположенные на внешней сторо-
не билипидного слоя (эктодомен). Небольшая часть молекулы (С-конец) распо-
ложена под липидным слоем и взаимодействует с нуклеокапсидом (цитоплазма-
тический домен).
Часть молекулы, примыкающая к С-концу и представленная приблизитель-
но 20-25 гидрофобными аминокислотами, пронизывает липидный бислой и
обеспечивает якорный эффект (трансмембранный домен). Различные структур-
ные домены обладают специфическими функциями. Эктодомен связан с рецеп-
торной и фузогенной функциями, с взаимодействием субъединиц и антител,
нейтрализацией вируса. Трансмембранный домен обеспечивает взаимодействие
с мембраной, а цитоплазматический — с нуклеокапсидом. Такова структура и ор-
ганизация гемагглютинина вируса гриппа, гликопротеинов G-вирусов везику-
лярного стоматита, бешенства, обоих гликопротеинов альфавирусов, гликопро-
теина В-вируса герпеса и многих других вирусных белков. Однако имеются ис-
ключения из общего правила, например, полипептиды нейраминидазы вируса
гриппа и белок HN парамиксовирусов «заякориваются» в липидном бислое
N-концевыми (также короткими) доменами. Кроме того, в эту модель также не
вписываются такие белки, как EI коронавирусов и интенсивно О-гликозилиро-
ванные гликопротеины.
Относительно роли углеводного компонента в антигенности и иммуноген-
ности вирусных гликопротеинов нет единого мнения. Гликопротеины S и М
вируса леса Семлики как в гликозилированной, так и в негликозилированной
формах равным образом защищали мышей от летальной инфекции при последу-
ющем заражении вирулентным штаммом гомологичного вируса. Дегликозили-
рование gpl герпесвируса типа 1 КРС сказывалось отрицательным образом на его
антигенной активности, тогда как дегликозилирование gpIV того же вируса су-
щественно не влияло на способность индуцировать синтез ВН-антител и анти-
телозависимую цитотоксичность [1572]. Корректное гликозилирование реком-
бинантного белка Е1 вируса краснухи не являлось непременным условием его
антигенности. Введение такого антигена кроликам вызывало образование нейт-
рализующих антител, которые не подавляли гемагглютинацию вируса [1513]. Ре-
комбинантный аналог gpl20 вируса иммунодефицита человека, экспрессирован-
ный в Е. сой, не содержал углеводов, но индуцировал синтез антител, подавляю-
щих репликацию гомологичного штамма вируса. Из этих данных следует, что
гликозилирование этого белка не является необходимым для протективного им-
мунного ответа [292]. В опытах с коронавирусом трансмиссивного гастроэнтери-
та свиней не установлено разницы в индукции ВН-антител и выраженности про-
тективного иммунитета при использовании вируса с выраженной ГА-активнос-
тью и без нее, полученного в результате репродукции в различных клеточных
системах. Возможно, что первичное (котрансляционное) гликозилирование
вносит больший вклад в формирование конформационных антигенных сайтов
гликопротеинов, чем вторичное гликозилирование [576].
Система репродукции оказывает различное влияние на антигенные и имму-
ногенные свойства вирусов. В одних случаях она имеет критическое значение, в
других — популяция изменяется постепенно и практически без значительного
изменения антигенной структуры, особенно в течение относительно короткого
периода пассирования in vitro. Примером этого может служить вирус гриппа,
иммуногенность которого снижалась при размножении в куриных эмбрионах по
сравнению с культурой клеток млекопитающих (линия MDCK) в течение не-
скольких пассажей. Различия в популяции вируса, обусловленные хозяинной
системой, заключались в замене двух аминокислотных остатков в молекуле ге-
магглютинина [1313]. Такие изменения могут сопровождаться потерей сайта
гликозилирования [51]. При репликации различных РНК-содержащих вирусов
(пикорна-, альфа-, флави-, ротавирусов и др.) синтезируются высокомолекуляр-
ные вирионные полипротеины, которые подвергаются посттрансляционному
процессингу (расщеплению) вирусспецифическими протеазами, кодируемыми
вирусным геномом или предсуществующими в клетках [1632]. Например, при
репликации пикорнавирусов сначала образуется один белок (полипротеин), ко-
торый затем расщепляется на четыре вирионных полипептида VP1-VP4. Основ-
ным индуктором синтеза вируснейтрализующих антител является VP1. В про-
цессе естественной инфекции и после оральной вакцинации живой вакциной
полиовирус подвергается воздействию протеолитических ферментов кишечни-
ка, в результате чего могут изменяться его антигенные свойства. Поэтому может
оказаться целесообразным изготовлять инактивированную полиовакцину из ви-
руса, обработанного трипсином [1322]. Протеолитическая активизация сопро-
вождается значительным усилением репликации реовируса I [305] и повышени-
ем инфекционности вирусов оспы. Исследования, проведенные с вирусом оспо-
вакцины, показали, что это связано с модификацией трех белков (54, 34 и
17—25 кД) поверхности вириона, которые вместе с двумя другими поверхност-
ными полипептидами (29 и 32 кД) ответственны за нейтрализацию вируса. Рас-
щепление наружного капсидного белка VP2 вируса катаральной лихорадки овец
сопровождалось образованием однокапсидных частиц с высокой инфекционно-
стью, но утратившим гемагглютинирующую активность [1061]. Протеолитичес-
кое расщепление gp!20 (остатки аминокислот 315—316) является необходимым
процессом для проявления инфекционное™ ВИЧ-1. Имеются данные, свиде-
тельствующие об активизации вирусных фузогенных гликопротеинов клеточны-
ми протеазами. Для первичной индукции вирусспецифических Тц лимфоцитов
необходима протеолитическая активизация гликопротеина F, хотя этого не тре-
бовалось для индукции синтеза антител [1532].
Все вирусы гриппа млекопитающих и большинство птичьих штаммов репро-
дуцируются в куриных эмбрионах в основном в неинфекционной форме с нерас-
щепленной молекулой ГА. После обработки их in vitro бактериальными протеаза-
ми или трипсином значительно повышалась инфекционность. Структура вирус-
ных белков в участке расщепления и наличие подходящей протеазы играют
существенную роль в тканевом тропизме, репликации и распространении вируса
в организме, то есть инфекционное™ и патогенезе [305], а также в иммуногенезе.
Протеолитическое расщепление in vitro может происходить не только внут-
ри клетки, но и на ее поверхности или вне ее за счет плазмина сыворотки пита-
тельной среды либо искусственно внесенным в среду трипсином. НА вируса
гриппа может расщепляться обоими путями. В первом случае, удаляемый при
разрезании соединительный пептид содержит до пяти остатков основных ами-
нокислот, во втором, — один или два. Расщепление НА вируса гриппа сопровож-
дается трансконформацией и, вероятно, изменением антигенных свойств. Рас-
щепление белка F вируса Сендай также сопровождается конформационными
изменениями, приводящими к повышению его гидрофобности [25]. Таким обра-
зом, регулируемый ограниченный протеолиз полипептидов-предшественни-
ков — один из основных процессов в формировании биологически активных
структурных белков многих вирусов.
Топографическое и функциональное картирование наиболее важных анти-
генных участков вирусных белков, ответственных за иммунологическую специ-
фичность и особенно за индукцию протективного иммунитета, представляет ис-
ключительно важное значение для конструирования современных средств спе-
цифической профилактики вирусных инфекций.
Наряду с общими представлениями о вирусных антигенах накоплены сведе-
ния, характеризующие индивидуальные особенности различных антигенов мно-
гих конкретных вирусов, знание которых важно как для лучшего понимания па-
то- и иммуногенеза при отдельных заболеваниях, так и для разработки вакцин-
ных препаратов.
При изготовлении культуральных вакцин существует потенциальная про-
блема селекции антигенных вариантов вируса. Фенотипическая модификация
вирусной популяции, ведущая к изменению антигенных свойств, может возни-
кать и требовать постоянного контроля антигенности в процессе производства.
Глава 6
ПРОТИВОВИРУСНЫЙ
ИММУНИТЕТ
Ответ, направленный на ликвидацию вирусной инфекции, зависит от опре-
деленных механизмов, называемых обобщено иммунной системой. Иммунная
система позвоночных животных — это сложный гомеостатический механизм, за-
щищающий целостность «своего», распознавая и отвергая «чужое» с помощью
специализированных клеток (лимфоцитов) и молекул (антител). Основная
функция иммунной системы — распознавание антигенов и специфическое реа-
гирование на них. При попадании в организм вирусы нарушают гомеостаз, вы-
зывают ответную реакцию иммунной системы, направленную на нейтрализа-
цию, инактивацию и выведение из организма чужеродного агента.
Способность организма распознавать, обезвреживать и удалять чужеродный
антиген (иммунореактивность) может значительно колебаться в зависимости от
индивидуальных, возрастных и видовых особенностей организма [16]. При
встрече с вирусом иммунная система определяет вирусные антигены (белки,
гликопротеины) как чужеродные, которые вызывают у нее ответы разного рода
с целью удаления вируса и предотвращения реинфекции.
Механизмы, контролирующие различные типы иммунного ответа на вирус-
ные антигены, весьма сложные. Лимфоциты, способные распознавать антиге-
ны, являются главными клетками иммунной системы. Их можно разделить на
два основных класса: В- и Т-клетки. Как полагают, они происходят из стволовых
клеток, находящихся в костном мозгу. Стволовые клетки, пройдя ряд последова-
тельных превращений либо в тимусе, либо в фабрициевой сумке у птиц, либо в
ее эквиваленте у млекопитающих, приобретают способность распознавать чуже-
родные антигены.
Стволовые клетки, прошедшие «обучение» в тимусе, превращаются в Т-лим-
фоциты, обеспечивающие клеточный тип иммунных реакций. Те же клетки, но
созревающие в условиях, подобных условиям фабрициевой сумки птиц, стано-
вятся В-лимфоцитами и обеспечивают гуморальный тип иммунного ответа [96,
284, 285]. Точный эквивалент фабрициевой сумки млекопитающих неизвестен.
Т-клетки можно разделить на несколько субпопуляций, каждая из которых вы-
полняет различные эффекторные или регуляторные функции. Например, цито-
токсические Т-клетки (Тц) лизируют клетки, инфицированные вирусами. Регу-
ляторные Т-клетки могут усиливать (хелперные Т-клетки, Тх) или угнетать (су-
прессорные Т-клетки, Тс) иммунные реакции, в которых участвуют различные
популяции лимфоидных клеток. Эти субпопуляции Т-клеток отличаются друг от
друга по фенотипической экспрессии определенных поверхностных белков.
Имеются данные, подтверждающие существование нескольких функционально
отличных субпопуляций В-клеток, различающихся реактивностью на особые
антигены. Функция В-клеток проявляется непосредственно или при участии
Т-клеток.
Известно, что антитела могут угнетать выработку эффекторных Т-клеток и
осуществлять контроль по типу обратной связи.
Антигены являются специфическими митогенами, вызывающими ответные
реакции лимфоцитов. После антигенной стимуляции начинается деление и
дифференцирование Т- и В-клеток, в результате чего возникают популяции
антигенреактивных клеток памяти, также появляются зрелые клетки, осуществ-
ляющие эффекторные функции, например, секрецию антител или лизис инфи-
цированных клеток.
Выраженность приобретенного иммунитета определяется Ir (immune
response) генами иммунного ответа, расположенными в главном комплексе гис-
тосовместимости. Сила иммунного ответа зависит от структурного соответствия
вирусного антигена и продуктов этих генов.
Помимо лимфоидных Т- и В-клеток, ответственных за распознавание «сво-
его» и «чужого», существуют и вспомогательные клетки, такие как макрофаги и
естественные киллеры, играющие важную роль в переработке антигенов, во вза-
имодействии с лимфоидными клетками, в контроле функции Т- и В-клеток и в
элиминации вирусов в присутствии антител. Таким образом, иммунный ответ
представляет собой многогранный процесс, в котором все реакции на различных
этапах ответа, очевидно, образуют единый комплекс.
В норме иммунная система тонко сбалансирована и обеспечивает индукцию
различных типов иммунного ответа и образование Т- и В-клеток памяти. Фор-
мирование иммунологической памяти является основной целью иммунизации.
Однако, несмотря на развитие иммунного ответа, ряд вирусов вызывает персис-
тентные инфекции и использует механизмы, позволяющие избегать иммунного
ответа организма.
В процессе эволюции у вирусов выработались различные способности, поз-
воляющие в той или иной степени избегать ответных реакций со стороны им-
мунной системы. Эти механизмы специфичны для каждой отдельной группы
вирусов. Для защиты от вирусной инфекции организм, в свою очередь, исполь-
зует различные типы иммунитета, и поэтому необходимо как можно полнее изу-
чить разновидности иммунного ответа, требуемые для защиты от разных вирусов
[32]. Иммунный ответ организма млекопитающих определяется сложным взаи-
модействием различных компонентов. Всестороннее изучение его природы —
важнейшая предпосылка понимания механизмов действия вакцин и одно из ус-
ловий их дальнейшего совершенствования. Однако для выработки соответству-
ющих положений иммунизации необходимо точно знать защитные звенья им-
мунного ответа на каждый конкретный вирус и его иммуногенные компоненты.
6.1. Организация иммунной системы
Среди компонентов типичных иммунных систем различают клетки, ткани и
органы. Исполнители иммунологических реакций — лимфоидные клетки, кото-
рые находятся во всех тканях организма и в циркулирующей крови. Однако об-
разование клеток иммунной системы сосредоточено в основном в лимфоидных
органах. Органы и ткани иммунной системы подразделяют на первичные, или
центральные, и вторичные, или периферические. К первичным органам иммун-
ной системы млекопитающих относят костный мозг и тимус, у птиц — тимус и
фабрициеву сумку. Первичными или центральными они называются потому, что
в них образуются клетки иммунной системы, которые в дальнейшем заселяют
вторичные или периферические органы иммунной системы.
К вторичным лимфоидным органам относятся лимфатические узлы, селе-
зенка и система лимфоэпителиальных образований, объединяющая диффузные
или плотные скопления лимфоидной ткани в слизистых оболочках пищевари-
тельных, дыхательных и мочеполовых органов [107, 208, 165].
К лимфоидным органам, ответственным за иммунитет, относятся костный
мозг, тимус, селезенка, лимфатические узлы и организованная лимфоидная
ткань желудочно-кишечного тракта, к которой относятся миндалины, пейеровы
бляшки, отдельные фолликулы, аппендикс, а у птиц, кроме того, — фабрициева
сумка [39]. В настоящее время у млекопитающих не выявлено органов, подоб-
ных фабрициевой сумке (bursa) у птиц, ответственных за созревание тимуснеза-
висимых лимфоцитов. Предшественники В-лимфоцитов у человека и, вероятно,
млекопитающих образуются из стволовой клетки в костном мозге [16, 96].
В первичных лимфоидных органах происходит образование и созревание
клеток иммунной системы, во вторичных — эти клетки реализуют иммунный от-
вет на чужеродные антигены [39, 208].
Лимфоидная ткань в тимусе, селезенке и лимфатических узлах окружена со-
единительно-тканной капсулой и морфологически автономна (органы лимфо-
идной системы). Лимфоидная ткань слизистых и кожи не инкапсулирована и
представлена отдельными фолликулами (пейеровы бляшки), единичными лим-
фоцитами собственной пластинки (lamina propria) и подслизистого слоя, а так-
же внутриэпителиальными лимфоцитами [39, 139]. Главными клетками иммун-
ной системы являются Т- и В-лимфоциты.
Общая масса лимфоидных клеток взрослого человека, функционирующих
как единое целое, достигает 1,5—2,0 кг [107].
Лимфоциты активно мигрируют между лимфоидными органами и нелимфо-
идными тканями и готовы к встрече с чужеродным антигеном. Считается, что
антиген является лишь фактором отбора определенного предсуществующего
клона лимфоцитов, а не выступает в качестве участника формирования специ-
фичности [39, 208].
Тимус и фабрициева сумка необходимы для обеспечения иммунологической
реактивности, но сами они, вероятно, не участвуют в гуморальном или клеточ-
ном иммунном ответе организма. Особое положение в иммунной системе при-
надлежит костному мозгу. Он является источником самоподдерживающейся ма-
лодифференцированной популяции мультипотентных стволовых клеток лимфо-
и миелопоэза, из которых в дальнейшем развиваются В- и Т-лимфоциты, макро-
фаги, моноциты и другие клетки. Лимфоциты, образовавшиеся из стволовых
клеток, заселяют тимус и фабрициеву сумку, где они превращаются соответст-
венно в Т- и В-лимфоциты. Кроме того, костный мозг играет важную роль в об-
разовании антител [39]. У человека и млекопитающих в процессе дальнейшего
созревания в костном мозгу предшественники В-лимфоцитов превращаются в
В-лимфоциты. В результате каскадного антигеннезависимого процесса проли-
ферации и дифференциации клеток (лимфонеогенеза) лимфоциты приобретают
распознающие структуры — рецепторы для антигенов [1333]. На основании спе-
цифичности рецепторов лимфоциты объединяются в клоны. Общее количество
клонов, представляющих собой потомство одной клетки, достигает 10, числен-
ность каждого клона составляет ~105 клеток [107].
Большинство органов иммунной системы в эмбриогенезе образуется из эн-
тодермы (тимус, фабрициева сумка) или мезодермы (селезенка), и ни один - из
эктодермы [96]. Стволовые клетки (предшественники лимфоцитов) покидают
костный мозг и заселяют первичные лимфоидные органы, в которых происходит
дифференциация и пролиферация лимфоцитов, а иммунный ответ на антигены
реализуется во вторичных лимфоидных органах [39, 208]. Клетки, покинувшие
тимус или фабрициеву сумку, полностью иммунокомпетентные [203].
Независимо от происхождения, эпителий является первой линией защиты
организма и, если она преодолена возбудителем, в борьбу вступают лимфоциты.
Они имеются в коже, в подэпителиальных слоях внутренних органов, особенно
вокруг отверстий пищеварительного и дыхательного трактов, где находятся
мощные скопления клеток иммунной системы. Кроме того, такими же уязвимы-
ми для патогенов, как и наружные покровы, являются участки дыхательной и
пищеварительной систем.
Не исключено, что именно лимфоциты, тесно связанные с эпителием, осо-
бенно у позвоночных, получают сигналы и действуют в других местах согласно
полученным «инструкциям». Представление о такой тесной связи между эпите-
лием и лимфоидными структурами — весьма важное для понимания развития
иммунитета [96]. В нормальных условиях лимфоциты рециркулируют по систе-
ме лимфатических и кровеносных сосудов. Однако после антигенной стимуля
ции антигенреактивные лимфоциты задерживаются во вторичных лимфоидных
органах, где происходит их пролиферация.
Способность В- и Т-лимфоцитов перемещаться в определенных В- и Т-зави-
симых зонах лимфоидных органов носит название «Хоминг». Лимфоциты, син-
тезирующие IgA, содержатся в основном в лимфоидной ткани слизистых оболо-
чек и превращаются в плазмоциты вблизи Lamina propria. В Lamina propria соот-
ношение клеток — продуцентов IgA и IgG равно 20:1, тогда как в селезенке и
периферических лимфоузлах 1:3 [200].
Постоянный обмен между клетками различных лимфоидных органов обес-
печивает функционирование лимфоидной ткани как единого целого, обуслов-
ливает генерализацию иммунного ответа организма. Феномен рециркуляции
лимфоцитов имеет важное значение в процессах резорбции антигенов в кишеч-
нике и обеспечении локальных факторов защиты.
Следует отметить, что функционирование лимфоцитов невозможно без уча-
стия клеток нелимфоидной природы. Они представляют антиген лимфоцитам,
обеспечивают микроокружение в органах, необходимое для созревания и диф-
ференциации лимфоцитов.
6.2. Клетки иммунной системы
Клетки иммунной системы включают В- и Т-лимфоциты, клетки моноцит-
макрофагального ряда, дендритные клетки и натуральные киллеры (NK клетки)
[16, 39]. В функциональном отношении эти клетки можно разделить на две кате-
гории: регуляторные и эффекторные. Функцию регуляторных клеток осуществ-
ляют Т-лимфоциты и макрофаги, эффекторных - В-лимфоциты, цитотоксиче-
ские Т-лимфоциты и NK-клетки (натуральные клетки-киллеры), макрофаги,
полиморфно-ядерные гранулоциты и тучные клетки. Антиген-специфичный
иммунный ответ вместе с врожденными механизмами ограничивают многие ви-
русные инфекции, снижают или предотвращают их вредоносность и создают ус-
тойчивость к реинфицированию.
Индукция иммунного ответа начинается с поглощения антигена и презента-
ции его лимфоцитам. Важную роль в этом процессе играют макрофаги. Наряду
со способными к презентации макрофагами существует специализированный
класс антигенпрезентирующих клеток. К ним относятся клетки Лангерганса ко-
жи, интердигитальные, вуалевые афферентных лимфатических сосудов и денд-
ритные [39, 203]. Вскоре после инфицирования они перерабатывают вирусные
антигены, превращая их в низкомолекулярную форму, доступную для взаимо-
действия с рецепторами эффекторных клеток и способную передать антигенную
информацию в геном Т- и В-лимфоцитов. После связывания антигена с плазма-
тической мембраной макрофага наступает эндоцитоз и расщепление антигена
гидролазами лизосом на короткие пептиды, которые экспонируются на поверх-
ности макрофагов или выделяются в межклеточное пространство.
Небольшая часть неизмененного антигена, отличающаяся высокой иммуно-
генностью, остается связанной с плазматической мембраной макрофагов [200].
Вирусные антигены различаются соответствующими клонами лимфоцитов, ко-
торые отвечают клональной пролиферацией и освобождением лимфокинов. По-
следние привлекают моноциты крови к месту инфицирования и вызывают их
пролиферацию и дифференциацию в активированные макрофаги — основу вос-
палительного ответа, а также помогают соответствующим клонам В-клеток свя-
зываться с вирусным антигеном, с последующим делением и дифференциацией
в плазматические клетки.
Лимфоциты имеют на своей поверхности антиген-специфические иммуног-
лобулиновые рецепторы, которые служат основой иммунологической специ-
фичности. Любой Т- и В-лимфоцит обладает специфическими рецепторами для
одного эпитопа антигена. Связывание Т- или В-лимфоцитов с антигеном слу-
жит сигналом этим клеткам для деления, в результате чего формируется клон ан-
тиген-стимулированных клеток (клональная экспансия). Рецепторы В-клеток
различают антигены в их природном и растворимом состоянии быстрее, чем Т-
клетки различают комплексы пептиды-МНС на поверхности клеток. Следова-
тельно, В-клетки взаимодействуют непосредственно с вирусными белками или
вирионами. Т-клеточные рецепторы различают небольшие пептиды, образую-
щиеся в результате расщепления вирусных белков; они делают это только тогда,
когда чужеродные пептиды представляются связанными с мембранными глико-
протеинами, известными как белки главного комплекса гистосовместимости
(МНС) [16, 39, 208, 1135].
Хотя Т-клеточные детерминанты и В-клеточные эпитопы вирусных белков
часто перекрываются, иммунодоминантные Тц-детерминанты часто связаны с
консервативными белками внутри вириона или неструктурными белками внут-
ри инфицированных клеток. После получения соответствующих сигналов от
хелперных Т-лимфоцитов В-клетки размножаются и дифференцируются в плаз-
матические клетки, секретирующие антитела. Каждая плазматическая клетка се-
кретирует антитела одной специфичности. Т-клеточный ответ обычно обладает
более широкой специфичностью, чем антитела, и создает перекрестную защиту
от серотипов одного вируса или даже от антигеннородственного вируса, особен-
но после бустер-иммунизации. Такое явление отмечено при гриппе, а также у
афто-, энтеро-, рео-, парамиксо- и тогавирусов.
Т-клетки СД8 обычно обеспечивают более высокую защиту, чем Т-клетки
СД4.
Результат каскадного взаимодействия клеток иммунной системы с участием
цитокинов выражается в интенсивности и продолжительности иммунного отве-
та на вирусную инфекцию и установлении иммунологической памяти (способ-
ности отвечать более быстро на реинфекцию тем же вирусом).
В-лимфоциты. Полипотентные стволовые клетки происходят из печени эмб-
риона и позже — из костного мозга и дифференцируются в В-лимфоциты в фаб-
рициевой сумке птиц или ее эквиваленте — костном мозге у млекопитающих.
Они представляют собой клетки, которые в результате антигенной стимуля-
ции и при содействии макрофагов и Т-хелперов размножаются и превращаются
в плазматические клетки, которые являются конечными клетками, образующи-
ми и секретирующими антитела.
Антитела в основном синтезируются в селезенке, лимфоузлах, в лимфоид-
ной ткани GALT и BALT систем. Однако лимфоидная ткань подслизистой пище-
варительного (GALT) и респираторного (BALT) трактов, так же как миндалин и
пейеровых бляшек, получающих антиген прямо от сверхлежащих эпителиаль-
ных клеток, производят антитела главным образом класса IgA.
Т-лимфоциты. Полипотентные гематопоэтические стволовые клетки, созре-
вающие в тимусе, являются основными эффекторами клеточного иммунитета:
разрушают клетки, экспрессирующие вирусные антигены (клетки-мишени), вы-
полняют функцию «помощника» (хелперную) при образовании антител и другие
функции иммунного реагирования. Т-лимфоциты секретируют растворимые
факторы, называемые лимфокинами или интерлейкинами (гормоноподобные
молекулы, цитокины), которые активируют клетки, вовлеченные в иммунный
ответ. Некоторые Т- и В-клетки превращаются в долгоживущие небольшие лим-
фоциты, ответственные за иммунологическую память. Функционально Т-лим-
фоциты разделяются на два вида: Т-хелперы (Тх) и цитотоксические Т-клетки
(Тц). Цитотоксические Т-лимфоциты являются главным Т-клеточными эффек-
торами антивирусной активности. Т-хелперные клетки помогают В-клеткам
синтезировать антитела. Тх-клетки могут также непосредственно способство-
вать антивирусной активности in vivo, хотя в меньшей степени, чем Тц-клетки.
Моноциты, макрофаги и дендритные клетки являются инициаторами иммун-
ного ответа против вирусной инфекции (альвеолярные макрофаги в легких,
клетки Купффера в печени, дендритные клетки Лангерганса в коже). Они рано
вовлекаются в иммунный ответ организма. Моноциты инфильтрируют ткани и,
дифференцируясь, становятся макрофагами; макрофаги часто становятся пре-
имущественными клетками в месте внедрения вируса в первые 24 часа; дендрит-
ные клетки выполняют афферентные функции на всех поверхностях тела и в
ключевых органах, таких как: лимфоузлы, селезенка и печень, где в результате
фагоцитоза удаляются чужеродные частицы. Все три типа клеток образуют им-
муноглобулиновые рецепторы Fc и СЗв на своей поверхности, с которых начи-
нается фагоцитоз иммунных комплексов, т.е. вирионов или антигенов, покры-
тых антителами. Они служат как «профессиональные» антигенпрезентирующие
клетки, которые оказывают контролирующее влияние на иммунный ответ очень
быстро и динамично. В некоторых случаях они могут приобрести цитотоксичес-
кие свойства в отношении клеток, инфицированных вирусом. Будучи регулятор-
ными клетками, макрофаги и другие антиген-презентирующие клетки секрети-
руют различные растворимые медиаторы, активизирующие лимфоциты. Одним
из главных медиаторов является интерлейкин-1 (ИЛ-1), активизирующий реак-
тивность Т-хелперов [16, 165, 203, 208]. Важная роль в защите млекопитающих
от вирусной инфекции принадлежит нейтрофилам [13].
Натуральные клетки-киллеры (NK) представляют собой гетерогенную группу
больших гранулярных лимфоцитов неизвестного происхождения, обладающих
способностью уничтожать вирусинфицированные клетки. Они не относятся ни
к В-, ни к Т-лимфоцитам, и в их созревании не принимают участия ни первич-
ные, ни вторичные лимфоидные органы.
Основой для их селекции относительно вирусинфицированных клеток явля-
ется снижение регуляции синтеза и экспрессии белков МНС класса 1, которое
является ранним событием для многих вирусинфицированных клеток. NK-клет-
ки не проявляют иммунологической специфичности, особенно для вирусных
антигенов, не вызывающих иммунологическую память, нет МНС ограничения и
нет зависимости от антител. Они являются важным ранним механизмом, так как
их активность повышается заметно в течение первых 1—2 дней вирусной инфек-
ции. Индуцированная вирусом активность NK-клеток опосредована интерферо-
нами, действующими синергично с NK-клетками, секретирующими некоторые
цитокины, включая интерферон и фактор некроза опухолей [16, 203, 208].
6.3. Субклеточные компоненты
иммунной системы
Среди различных белков, принимающих участие в иммунологических про-
цессах, имеется значительное количество таких, которые по основным структур-
ным характеристикам могут быть объединены в единую молекулярную систему
иммуноглобулинподобных гомологов. В нее включены молекулы Т-клеточного
антигенраспознающего комплекса, молекулы I и II классов МНС, корецепторы
Т-клеток СД4 и СД8, адгезины, рецепторы к иммуноглобулинам и др. [39].
Клеточный иммунитет при вирусных инфекциях направлен на удаление ви-
руса и инфицированных клеток и основывается на взаимодействии главного
комплекса гистосовместимости (МНС) и Т-лимфоцитов. МНС класса I включа-
ет СД8+Тц-лимфоциты и МНС класса II включает СД4+Тх-лимфоциты. Оба
механизма могут функционировать одновременно или независимо друг от друга,
внося свой вклад в ликвидацию первичной вирусной инфекции, а наличие анти-
тел играет главную роль в устойчивости к реинфекции [1130].
Рецепторы цитотоксических Т-лимфоцитов различают короткие пептидные
дериваты эндогенно продуцируемого вирусного белка, связанного с микрогло-
булином МНС класса I, экспрессированного на поверхности инфицированных
клеток. МНС класса I различает элементы, присутствующие в высокой концен-
трации на поверхности почти всех клеток, исключая нейроны. Гликопротеины
МНС класса II экспрессируются «профессиональными» антиген-презентирую-
щими клетками.
Антиген-презентирующие клетки включают дендритные клетки, моно-
цит/макрофаги, а на более поздней стадии иммунного ответа — В-лимфоциты.
Дендритные клетки включают клетки Лангерганса кожи и дендритные клетки
лимфоузлов, красной пульпы и краевой зоны селезенки.
В отличие от дендритных клеток макрофаги экспрессируют относительно
низкий уровень белка МНС класса II, который увеличивается после активации,
особенно интерфероном 7. После первичной активации В-лимфоциты стано-
вятся антигенпрезентирующими клетками, они особенно важны в последней
стадии инфекции и возможной реинфекции.
Вирусный антиген или вирионы, прикрепляясь к специфическому иммуног-
лобулиновому рецептору на В-лимфоците и подвергаясь эндоцитозу, расщепля-
ются на пептиды, которые презентируются на поверхности В-клетки в ассоциа-
ции с белками класса II МНС. Эти пептиды обычно представляют различные
эпитопы антигена, различаемого В-клеткой для продукции антител. СД4 Тх-
клетки, которым В-клетки презентируют антиген, отвечают секрецией цитоки-
нов, которые стимулируют В-клетки производить антитела. Такое тесное взаи-
модействие Т- и В-клеток обеспечивает очень эффективную доставку цитоки-
нов от Тх-клеток к соответствующим праймированным В-клеткам.
Вирус или вирусные белки, взятые из внешнего источника антиген-презен-
тирующими клетками, проходят сложный путь эндогенных превращений, в том
числе протеолитическое расщепление. Некоторые вирусные пептиды способны
соединяться с полипептидами у- и [3-класса II МНС, образуя трехмерные ком-
плексы, которые затем переносятся к плазматической мембране, где они узна-
ются СД4 Т-клетками, что ведет к Тх-клеточному ответу [39, 208].
у/S Т-лимфоциты найдены в эпителии кожи, кишечника и легких. Это цели-
ком отличный класс Т-клеток, отличающийся Т-клеточными рецепторами,
представленными полипептидными гетеродимерами. У человека и мышей этот
класс лимфоцитов составляет около 5% Т-клеточной популяции; у свиней,
жвачных и цыплят — около 30%. Они проявляются в зоне ворот инфекции и мо-
гут различать антиген в отсутствии МНС. Эти свойства указывают на важную
роль таких клеток в вирусной патологии и иммунитете [39, 203].
Цитокины являются медиаторами клеточного иммунитета. Они представля-
ют собой низкомолекулярные гормон-подобные белки, которые стимулируют
или угнетают пролиферацию, дифференциацию и/или созревание иммунных
клеток. Они отличаются от истинных гормонов во многих отношениях и прежде
всего тем, что производятся не специализированными клетками. Цитокины мо-
гут влиять на вирусный патогенез разными путями: через образование интерфе-
рона, увеличение продукции антител, подавление репродукции вируса, повыше-
ние экспрессии вирусных генов. Особый интерес представляют интерлейкины,
обеспечивающие пролиферацию лимфоидных клеток. Один из них — интерлей-
кин-1 (ИЛ-1) - представляет собой полипептид (15-25 кД), продуцируемый в
больших количествах стимулированными макрофагами. Интерлейкин-1 спо-
собствует пролиферативному ответу Т-клеток на антиген. В свою очередь, ин-
терлейкин-1 индуцирует в Т-хелперах синтез и продукцию другого медиатора -
интерлейкина-2 (ИЛ-2), в присутствии которого предшественники Тц-лимфо-
цитов пролиферируют и дифференцируются в цитотоксические эффекторы.
Считают, что регуляция В-лимфоцитов интерлейкинами осуществляется при
участии гамма-интерферона, синтез которого Т-хелперами стимулирует ИЛ-2
[39, 95]. Для выработки лимфокинов необходимы не только сенсибилизирован-
ные антигенами Т-лимфоциты, но и их взаимодействие с макрофагами. Моно-
циты стимулируют синтез цитокинов [1576].
В последнее время растет интерес к так называемым ранним цитокинам,
продуцируемым в участках инфекции, и которые ассоциируются с клиническим
и патологическим проявлением болезни. К ранним цитокинам относят: б-ин-
терферон, б-фактор некроза опухолей, б- и в-интерлейкин-1, интерлейкин-6 и 8.
Вирусная интерференция проявляется, когда инфицированные вирусом клет-
ки становятся устойчивыми к суперинфицированию тем же самым или другим ви-
русом. Это явление может быть обусловлено двумя механизмами: 1) дефективны-
ми интерферирующими частицами (против гомологичного вируса) и 2) интерфе-
роном. К данному моменту у человека известно более 20 интерферонов. Они
представляют большое семейство нормальных регуляторов синтеза клеточных
белков (цитокины). Их разделяют на три химически определенных типа: а, р и у.
После синтеза в инфицированных вирусом клетках они выделяются и связы-
ваются со специфическими рецепторами плазматической мембраны других кле-
ток. Вероятно, имеется один рецептор для а- и p-интерферона и другой для у-
интерферона. Многие индуцированные белки, каждый своим путем, прямо или
косвенно подавляют репликацию вируса.
Таблица 14. Свойства интерферонов (339)
Свойства Интерфероны
а 3 7
Основной источник Лейкоциты и мно- гие другие клетки Фибробласты, эпи- телиальные клетки Т-лимфоциты, N К-клетки
Инфицирующий агент Вирусная инфекция Вирусная инфекция Антиген или митоген
Количество субтипов Более 20 (мономеры) 1 (димер) 1 (тетрамер)
Основная активность Антивирусная Антивирусная Иммуномодули- рующая
Механизм действия Подавление синтеза белка Подавление синтеза белка Повышение МНС- антигенов; актива- ция цитотоксичес- ких Т-клеток, макрофагов и N К-клеток
6.4. Синтез антител
Конечным результатом активизации и созревания В-лимфоцитов является
образование антител, которые реагируют специфически с эпитопами, иденти-
фицированными первоначально его рецепторами. Плазматические клетки син-
тезируют и секретируют антитела. Они распространены во всех лимфоидных ор-
ганах и тканях, а также в основании ворсинок слизистой оболочки кишечника,
вокруг кровеносных капилляров, в сальнике и соединительной ткани [116].
Индуцированные вирусами антитела играют важную роль в профилактике
вирусных болезней. В некоторых случаях совершенно очевидно, что болезнь
предупреждают нейтрализующие антитела (например, при полиомиелите, ящу-
ре, ньюкаслской болезни, кори, гриппе и др.). Не исключено, что антитела игра-
ют важную роль в ограничении распространения вируса из ворот инфекции, но
они не всегда могут подавить уже развившуюся системную инфекцию или пре-
дотвратить реактивацию латентной инфекции (герпетический везикулярный
дерматит, ветряная оспа, герпесвирусные болезни животных) [32].
В синтезе и секреции антител или иммуноглобулинов участвует множество
лимфоцитов и плазматических клеток. Считается, что первой клеткой, вовлекае-
мой в иммунный ответ, является клетка, чувствительная к антигену, распознаю-
щая его, или рецепторная, разрушающая антиген и каким-то образом передаю-
щая закодированную в нем специфическую информацию эффекторной, то есть
другому лимфоциту или плазматической клетке, которые в конечном итоге син-
тезируют и секретируют антитела [96]. На пути к синтезу антител особенно важ-
ны макрофаги, распространенные во всем организме и способные захватывать и
перерабатывать антиген. К таким клеткам, прежде всего, относятся моноциты и
нейтрофилы. В первые дни после инфицирования, когда антитела еще отсутству-
ют, борьба организма с вирусной инфекцией ведется с использованием механиз-
мов резистентности. Катаболическая элиминация антигена предшествует иммун-
ной, являющейся результатом соединения антигена с антителами. Индуктивная
фаза иммунного ответа — это такой период, когда в сыворотке крови антител не
обнаруживается. Однако в это время в лимфоидных тканях можно легко найти
одиночные клетки, способные к секреции антител. Длительность латентного пе-
риода значительно зависит от многих факторов: типа вирусной инфекции, анти-
генности, дозы и пути введения вакцины, от возраста, вида и общего физиологи-
ческого состояния реципиента. После завершения латентного периода в организ-
ме появляются антитела. Часто первые антитела появляются в крови еще до
полного устранения антигена из кровотока. Если это происходит, и антиген со-
единяется с антителом, то комплексы антиген-антитело быстро выводятся из ор-
ганизма еще до появления несколькими днями позже легко определяемых сво-
бодных антител [96, 116]. Если антиген попадает в организм впервые, то возника-
ет так называемый первичный иммунный ответ. Антитела в этом случае
накапливаются в низкой концентрации и, если антиген не будет введен вновь,
появляются ненадолго. В случае, когда антиген вводят повторно, вскоре начина-
ется более быстрое и сильное, чем при первичном ответе, повышение титра анти-
тел. Вторичный, или анамнестический, ответ отличается также длительностью
сохранения высокого уровня антител. Возникновение гуморального и клеточно-
го иммунитета сопровождается формированием так называемой иммунологичес-
кой памяти, проявляющейся тем, что повторный контакт со специфическим ан-
тигеном вызывает ускоренный и усиленный иммунный ответ. Считают, что такой
ответ зависит от наличия «клеток памяти» — особой субпопуляции лимфоцитов,
ранее активизированных тем же антигеном [208]. Количество клеток, продуциру-
ющих антитела в селезенке инфицированных или вакцинированных кур, при па-
рамиксовирусной инфекции достигало максимального уровня (0,1 % к количест-
ву спленоцитов) на третий день после заражения или вакцинации.
Приблизительно через два дня после первичного введения антигена появля-
ются IgM-продуцирующие клетки, количество которых достигает максимума к
4—6-му дню. Затем их численность снижается, и появляются IgG-продуцирую-
шие клетки. Синтез IgG происходит в течение более продолжительного периода,
чем IgM. Если антиген вводят второй раз, то через 1—3 дня начинается мощный
подъем уровня антител, через некоторое время достигающий максимума. Содер-
жание антител при этом намного (в 10—50 раз) превышает значения, характер-
ные для первичного ответа. Пробудить иммунологическую память можно даже
спустя несколько лет после первичной иммунизации, когда показатели иммуно-
логических реакций снижаются до нуля. Однако по мере угасания интенсивнос-
ти первичного ответа уменьшается и интенсивность вторичного иммунного от-
вета. Существует физиологический предел, ограничивающий количество воз-
можных повторных анамнестических ответов; организм обычно исчерпывает
свой лимит после 3—5 реиммунизаций, если они проведены со сравнительно не-
большими интервалами.
Инактивированная полиовирусная вакцина подобно естественному инфи-
цированию вызывала развитие иммунологической памяти без значительной
продукции гуморальных антител. Этот эффект находился в прямой зависимости
от концентрации вирусного антигена в вакцине [1360]. Иммунологическая па-
мять дает человеку и животным большие преимущества в борьбе с вирусными
инфекциями и лежит в основе иммунитета и вакцинопрофилактики.
Специфичность и память, присущие как гуморальному, так и клеточному
иммунному ответу, могут зависеть от вирусного антигена. Так, гликопротеин
D-вируса простого герпеса более активно индуцировал вирусспецифическую па-
мять, чем гликопротеин-В [352]. В случае Т-зависимых антигенов пролиферация
В-клеток и образование антител являются результатом взаимодействия с макро-
фагами и Т-клетками. При введении Т-независимых антигенов образование ан-
тител происходит без участия Т-хелперов. После встречи с антигеном В-клетки
дифференцируются либо в зрелые плазматические клетки, которые секретируют
иммуноглобулины только одного класса, либо в В-клетки памяти.
Первичный иммунный ответ предполагает обязательное участие макрофа-
гов. При вторичном ответе стадия взаимодействия антигена с макрофагами ис-
ключается. Иммунологическая память, по-видимому, связана с долгоживущей,
самовоспроизводимой популяцией лимфоцитов [39, 96, 116, 200].
Говоря о специфичности иммунного ответа, необходимо отметить, что при
вторичном иммунном ответе отчетливо проявляются антитела, реагирующие на
близкородственные антигены. Чем выше уровень вторичного иммунного ответа
и чем теснее родство антигенов, тем выраженнее ответ на родственные антиге-
ны. Это явление имеет важное практическое значение в деле вакцинопрофилак-
тики ряда вирусных болезней, характеризующихся антигенной вариабельностью
возбудителя.
Согласно существующим представлениям, организм животного способен
синтезировать и секретировать >107 разнообразных антител. А так как популя-
ция лимфоидных клеток клонирована, и каждый В-лимфоцит синтезирует анти-
тело только одного типа, взаимодействующее с одной антигенной детерминан-
той, то в организме допускается существование не менее 108 различных клонов
В-лимфоцитов [16, 39].
Типы гуморального иммунного ответа
Иммунная система организма на вирусные инфекции или иммунизацию ви-
русными вакцинами отвечает выработкой антител, обладающих специфичнос-
тью к различным вирусным компонентам и принадлежащих к разным классам
иммуноглобулинов.
Важнейшая биологическая функция иммуноглобулинов - специфическое
связывание с антигеном. Антитела против некоторых эпитопов на поверхности
вирионов нейтрализуют инфекционность, они могут также действовать как оп-
сонины, облегчая поглощение и разрушение макрофагами. Кроме того, антите-
ла могут прикрепляться к вирусным антигенам на поверхности инфицирован-
ных клеток, вызывая их разрушение вследствие активации классического или
альтернативного действия комплемента или с помощью активации Fc-рецептор-
связывающих клеток, таких как NK-клетки, полиморфноядерные лейкоциты и
макрофаги (антителозависимая цитотоксичность).
Различают четыре основных класса антител: два мономера IgG и IgE и два
полимера IgM и IgA. Все иммуноглобулины имеют подобную структуру, но ши-
роко варьируют по аминокислотной последовательности антигенсвязывающего
сайта, который определяет их специфичность для данной антигенной детерми-
нанты. N-концевая последовательность L- и Н-цепей образует антигенсвязыва-
ющий центр, то есть антидетерминанту. Чем больше антидетерминант на по-
верхности иммуноглобулина, тем выше его активность.
Авидность характеризует прочность связи антитела с соответствующим ан-
тигеном. Афинность — прочность связи между отдельными антидетерминантами
и детерминантами.
IgG является основным классом антител в крови. Он состоит из двух Н- и
L-цепей, каждая из которых содержит постоянные и вариабельные участки. Мо-
лекулы IgG содержат два идентичных антигенсвязывающих Fab-фрагмента и Fc-
фрагмент, выполняющий эффекторные функции (связывание комплемента,
прикрепление к фагоцитам и плацентарному или колостральному трансферу).
В результате системной вирусной инфекции IgG синтезируется в течение
длительного периода и является главным фактором защиты от реинфекции.
Субклассы IgG отличаются константной областью их V-цепей и, соответствен-
но, биологическими свойствами, такими как фиксация комплемента и прикреп-
ление к фагоцитам [ 165, 208].
Первоначально антитела относятся к классу IgM, но соматические рекомби-
нации (транслокации) затем рождают класс, обусловленный связыванием V-ген-
ных сегментов различными постоянными участками Н-цепей. В изменении изо-
типов (переход изотипов на другой путь) важная роль принадлежит различным
цитокинам. Таким образом, через несколько дней IgG , IgA и иногда lgE-антите-
ла той же самой специфичности становятся доминантными в иммунном ответе.
Тц-клетки достигают своего пика обычно через неделю после инфекции, а
антитела — через 2—3 недели. NK-клетки максимально активируются через два
дня, а активность интерферона совпадает с пиком концентрации вируса.
Динамика гуморального иммунного ответа проявляется, в первую очередь, в
смене синтеза антител различных классов. В начальной фазе иммунного ответа
синтезируется преимущественно IgM с относительно слабым сродством к анти-
гену (авидный класс антител). IgM является пентамером с 10 Fab-фрагментами.
Синтез IgM сменяется синтезом IgG, а затем IgA. IgM-антитела находятся в
большинстве случаев в плазме крови и лимфе, обладая способностью преципи-
тировать, агглютинировать и лизировать антигены. Они очень активно связыва-
ются с комплементом, не проходят через плаценту, поэтому обнаружение IgM-
антител у плода свидетельствует о внутриматочной инфекции (например, при
краснухе, цитомегаловирусной инфекции, парвовирусной болезни свиней и
др.). Они обычно находятся в крови недолго, период полураспада их - 8-10
дней. Выработка IgM-антител обычно сменяется синтезом IgG-антител через
3—4 недели после заражения или иммунизации. Выработка IgG-антител носит
длительный характер, особенно после естественной инфекции или иммуниза-
ции живой вирусной вакциной (оспа, полиомиелит, чума крупного рогатого ско-
та, классическая чума свиней и др.)
Устойчиво высокие титры антител могут отражать также персистенцию ви-
русной инфекции (например, вирусов герпеса, кори) или повторную стимуля-
цию вирусным антигеном, однако антитела к некоторым вирусам могут персис-
тировать и без явных признаков заболевания. IgG -антитела содержатся в сыво-
ротке крови в наиболее высокой концентрации (~ 12г/л), откуда они поступают
в тканевую жидкость. В отличие от других иммуноглобулинов, у человека и при-
матов они способны проникать через плаценту и снабжать плод материнскими
антителами. Период полураспада их равен 10-35 дням.
Иммуноглобулин A (IgA) является димером с 4 Fab-фрагментами. Проходя
через эпителиальные клетки, IgA приобретает J-фрагмент (секреторный фраг-
мент), становясь секреторным slgA, который секретируется через эпителий рес-
пираторного, кишечного и урогенитального трактов. Секреторный IgA более ус-
тойчив к протеазам, чем другие иммуноглобулины, и является основным имму-
ноглобулином на слизистых поверхностях, в молозиве и молоке многих видов
млекопитающих. Поэтому IgA-антитела играют важную роль в защите от инфек-
ции респираторного, кишечного и урогенитального трактов. Иммунизация че-
рез слизистые при некоторых инфекциях является более эффективной, чем сис-
темное введение вакцины.
Секреторные антитела появляются на 4-7-й день после инфицирования и
представлены в основном IgA, IgG и IgM. Они считаются менее специфичными,
чем сывороточные. Динамика накопления антител в сыворотке крови и секретах
практически одинакова.
В отличие от сывороточного IgA, большая часть которого является мономе-
ром, молекула секреторного IgA представляет собой димер. Мономерный IgA
синтезируется плазматическими клетками костного мозга, периферических
лимфатических узлов, селезенки и других органов. Димерные формы slgA с со-
единительной j-цепью синтезируются лимфоидной тканью желудочно-кишеч-
ного, респираторного и урогенитального трактов.
Добавочный структурный компонент секреторного IgA, вероятно, функцио-
нирует как поверхностный рецептор клеток секреторного эпителия и придает
устойчивость slgA к действию протеаз. Биологическая функция slgA состоит в
основном в местной защите слизистых оболочек от инфекции. Формирование
местных секреторных IgA на поверхности слизистых оболочек имеет особое зна-
чение для формирования устойчивости организма к вирусам, обычно проника-
ющим через дыхательный, кишечный или урогенитальный эпителий. Для ин-
дукции секреторных IgA в кишечнике вирус должен вступить в контакт с лимфо-
идной тканью кишечника. После формирования местного ответа В-клетки
памяти, образующие IgA, мигрируют в другие участки кишечника. Аналогичный
механизм индукции IgA функционирует в респираторном тракте.
Система секреторного иммунитета функционирует и регулируется иначе,
чем иммунная система в целом. Она может коррелировать с общей иммунной
реакцией или быть независимой от нее [16]. Кроме секреторного IgA, сущест-
венное значение для иммунитета слизистых оболочек имеют содержащиеся в се-
кретах у человека IgM и IgG. IgM также представляет секреторный иммуногло-
булин, однако он не так прочно, как slgA, связывает секреторный компонент. В
пищеварительном тракте IgM играет более важную роль, чем IgG, а в носоглот-
ке - наоборот [39, 165].
Иммуноглобулины D и Е являются минорными иммуноглобулинами, со-
ставляющими менее 1 % от общего количества иммуноглобулинов. Их роль в им-
мунитете не выяснена или незначительна [1135].
IgD, вероятно, служит рецептором В-клеток, а антитела класса IgE принима-
ют участие в связывании антигена на слизистой оболочке [303]. При внутривен-
ном введении антиген задерживается в печени и селезенке, при подкожном — в
регионарных лимфоузлах. В лимфоидных органах антиген реагирует с иммуно-
компетентными клетками (макрофагами, лимфоцитами). При подкожном или
внутрикожном введении антигена с адъювантом на месте инъекции развивается
гранулема, в которой образуются сначала IgM-антитела, затем IgG. Попадание
антигена на слизистые оболочки ведет к преимущественному образованию IgA
[200, 203, 208].
Инфицирование или иммунизация через слизистые оболочки могут приво-
дить и к местной выработке антител, которые способны эффективно предотвра-
щать локальную колонизацию, например, кишечника полио- или ротавирусом,
а дыхательного тракта — вирусами парагриппа. Местная выработка антител клас-
сов IgG и IgA при гриппе лучше всего стимулируется аэрозольной иммунизаци-
ей. У детей с тяжелой инфекцией, вызванной респираторно-синцитиальным ви-
русом, обнаружена местная выработка вирусспецифических IgE-антител. При
инфекциях, вызванных вирусами паротита и японского энцефалита, соотноше-
ние титра IgG и IgM в спинномозговой жидкости часто выше, чем в сыворотке,
что, вероятно, свидетельствует о синтезе во время болезни антител в централь-
ной нервной системе.
Многочисленные серологические маркеры одного и того же вируса дают воз-
можность следить за состоянием хронической вирусной инфекции. При гепати-
те-В определение циркулирующих антигенов, таких как HBsAg и HBeAg, а так-
же антител к различным компонентам вируса, например, анти-НВс, анти-НВе и
анти-HBs, дает возможность различать острый гепатит, состояние персистирую-
щего носительства, период выздоровления и полное излечивание [169].
Система комплемента представлена белками сыворотки (около 30), которые
могут служить активаторами иммунного ответа. Классический путь активации
проявляется при наличии комплексов антиген-антитело, а также может прояв-
ляться независимо от антител. Например, может усиливать разрушение вирио-
нов, инфицированных вирусом клеток, а также воспаление. Вирионы разруша-
ются в результате опсонизации, усиления нейтрализации или лизисе вирионной
оболочки. Активация комплемента ведет к взаимодействию с вирусным антиге-
ном в тканях вскоре после начала инфекции, тогда как антитела проявляют ак-
тивность в основном через 2—3 недели. NK-клетки максимально активируются
через 2 дня, а активность интерферона совпадает с пиком концентрации вируса.
Антитела в основном синтезируются в селезенке, в лимфоузлах, в лимфоид-
ной ткани GALT и BALT систем. Лимфоидная ткань подслизистой пищевари-
тельного и респираторного трактов, так же как миндалин и пейеровых бляшек,
получающих антиген прямо от сверхлежащих эпителиальных клеток, произво-
дит антитела главным образом класса IgA [16, 2003].
Защитную функцию специфических антител связывают в первую очередь с
вируснейтрализующими антителами и их концентрацией. Однако вакциниро-
ванные с неопределяемыми или низкими титрами нейтрализующих антител не
обязательно восприимчивы к симптоматической инфекции [1076].
Нейтрализация вируса, по крайней мере, как она определяется в тестах in
vitro, может не играть существенной роли в механизме иммунитета, например,
индуцируемого цельновирионными инактивированными вакцинами против
ящура [613].
Имеется сообщение о существовании нового класса антител — внутрикле-
точных вируснейтрализующих антител, способных подавлять репликацию виру-
са [1327].
В обеспечении устойчивости к вирусной инфекции могут участвовать не
нейтрализующие антитела, хотя менее эффективно, чем нейтрализующие анти-
тела [1116].
Антитела, не обладающие нейтрализующей активностью, проявляют анти-
вирусную активность непосредственно против вирусных антигенов на поверхно-
сти вирусных частиц или против вирионов или неструктурных белков, экспони-
рованных на поверхности инфицированных клеток. In vivo не нейтрализующие
антитела проявляют антивирусную активность с помощью разных механизмов.
Во-первых, вирионы, покрытые такими антителами, могут легко уноситься кро-
вотоком. Во-вторых, они, влияя на нейраминидазу вирусов гриппа или на гемаг-
глютинирующий Е-белок коронавирусов могут снижать их репликацию в орга-
нах-мишенях, подавляя выделение вируса из клеток [1705]. В третьих, они могут
лизировать клетки с помощью IgG Fc-зависимого механизма [1382].
6.5. Клеточный иммунитет
Антитела могут нейтрализовать вирус на месте внедрения и, тем самым, пре-
дотвратить возникновение инфекции. Однако при уже развивающейся инфек-
ции для ее прекращения и элиминации вирусов, кроме специфических антител
необходим клеточный иммунитет, под которым понимают иммунную актив-
ность самих клеток иммунной системы, тогда как под гуморальным — актив-
ность их продуктов. Однако при вирусных инфекциях у млекопитающих и птиц,
как правило, имеет место интегрированный клеточный и гуморальный иммун-
ный ответ [39, 96, 208].
Клеточные иммунные реакции на инфицированные вирусом клетки могут
опосредоваться антиген-специфическими субпопуляциями Т-клеток, а также
клетками, неспособными распознавать специфические вирусные антигены.
Следует отметить, что в выздоровлении от вирусных инфекций первым принад-
лежит более важная роль, чем вторым. Иными словами, основу клеточного им-
мунитета составляют сенсибилизированные лимфоциты. Известно, что при от-
сутствии клеточного иммунитета инфекции часто имеют персистирующий и
прогрессирующий характер, что свидетельствует о дефекте долговременных за-
щитных механизмов.
Цитотоксические и NK-клетки узнают клетки-мишени, прочно к ним при-
крепляются и выделяют на их поверхность молекулы специального белка (пер-
форина), которые внедряются в наружную мембрану, полимеризуются и вызы-
вают в ней образование пор, через которые вытекает цитоплазма, и инфициро-
ванная клетка вскоре погибает. Перфорин, обладающий серин-эстеразной
активностью (granzymes), напоминает компонент (С9), ответственный за ком-
племент-опосредованный лизис [39, 208].
Возможно, что образование пор в плазматической мембране клеток-мише-
ней, — не единственный механизм цитотоксического действия Т-лимфоцитов,
однако этот механизм весьма эффективен [39].
Установлено, что опосредуемый антигеном апоптоз клеток приводит к более
эффективной доставке антигена к антиген-представляющим клеткам, напри-
мер, к дендритным клеткам [1136].
Эффекторные и регуляторные Т-клетки
После антигенной стимуляции, индуцирующей преимущественно клеточ-
ный иммунитет, в тимусзависимых областях лимфоидных органов наблюдается
созревание и пролиферация антиген-специфических Т-лимфоцитов.
Т-эффекторы, осуществляющие клеточно-опосредованные формы иммун-
ного ответа, характеризуются, прежде всего, цитотоксической активностью. Ци-
тотоксические реакции весьма неоднородны по своим механизмам и могут опо-
средоваться клетками, антителами, комплементом.
Среди лимфоцитов, обладающих киллерной активностью, основную роль в
элиминации вирусов из пораженных ими клеток играют вирусспецифические
цитотоксические Т-лимфоциты (Тц-лимфоциты) и естественные киллеры (NK-
лимфоциты). Хотя последние проявляют защитное действие на ранней стадии
инфекции, тем не менее, ведущее значение в разрушении инфицированных кле-
ток и освобождении организма от возбудителя принадлежит Тц-лимфоцитам.
Антигенспецифические Тц-лимфоциты при вирусных инфекциях взаимо-
действуют с клетками-мишенями и разрушают их при помощи рецепторного ап-
парата в отсутствии антител и комплемента. Они имеют двойную специфич-
ность: к вирусным антигенам на поверхности инфицированных клеток и к глав-
ному комплексу гистосовместимости клеток хозяина. Для индукции Тц-клеток
необходимы Т-хелперы (Тх-лимфоциты), активизированные вирусным антиге-
ном. При ряде вирусных инфекций клетки распознают иные антигенные струк-
туры вирусов, чем В-клетки и антитела. Это связано с рецептором Тц-клеток,
распознающим вирусные антигены на клеточной поверхности, природа которо-
го неизвестна. Следовательно, Т-клетки и антитела распознают вирусные анти-
гены посредством различных механизмов. При этом они, как правило, распоз-
нают различные эпитопы. На молекуле НА вируса гриппа Тц-лимфоциты и ан-
титела реагируют, соответственно, с НА2 и НА1. Вирусные антигены,
являющиеся индукторами и мишенями Тц-клеток при различных вирусных ин-
фекциях человека и животных, исследованы недостаточно. Для многих вирусов
конкретные вирусные антигены, являющиеся индукторами и мишенями Тц-
клеток, не идентифицированы, а имеющиеся данные зачастую противоречивы.
Основная мишень для Тц-клеток при гриппе — нуклеопротеин (NP) [181], а
при РС-инфекции — белок N-вируса, тогда как гликопротеин G не распознает-
ся этими клетками. При гепатите-В основную роль в распознавании клеток-ми-
шеней цитотоксическими клетками играет нуклеопротеин вируса, который мо-
жет одновременно функционировать в качестве Т-независимого антигена. При
цитомегаловирусной инфекции Т-зависимым антигеном является неструктур-
ный вирусный белок (РР89), экспрессируемый в ранней фазе инфекции на по-
верхности клеток [1566]. Вирусспецифические Тц-лимфоциты лизируют инфи-
цированнные ротавирусом клетки до образования инфекционного вируса, и да-
же выраженный синтез вирусных белков не был необходимым условием для
цитолиза. Гликопротеин G вируса простого герпеса, по-видимому, является ос-
новным антигеном, ответственным за индукцию вирусспецифических Тц-лим-
фоцитов. У вируса SV-40 за иммунный цитолиз ответственен Т-антиген, а у ве-
зикулярного стоматита и бешенства — белки G и N [169]. Тц-клетки обладают
большей перекрестной иммунореактивностью в отношении антигенродствен-
ных вирусов, чем иммуноглобулины. Например, при инфицировании мышей
вирусом гриппа образуются две популяции Тц-клеток. Основная из них — типо-
специфическая, способная лизировать клетки, индуцированные любым штам-
мом вируса гриппа А. Главным индуктором таких клеток является белок NP ви-
руса гриппа. Штамм-специфические Тц-клетки узнавали главным образом НА-
белок вируса гриппа [384]. Иммунизация мышей белком NP сопровождалась
образованием перекрестно реагировавших антител и иммунитета ко всем виру-
сам гриппа типа А.
Перекрестная реактивность Тц-клеток обнаружена также в опытах с различ-
ными серотипами вируса катаральной лихорадки овец, ротавирусов, вируса ве-
зикулярного стоматита и альфавирусов [32].
Типоспецифический иммунитет в отношении антигеннородственных виру-
сов существует и в отсутствие соответствующих вируснейтрализующих антител,
что свидетельствует о важной роли Тц-клеток в защите от вирусов. Широкая ре-
активность Тц-клеток имеет важное значение в иммунопрофилактике вирусных
болезней. Продукция Тц-клеток во многом зависит от другого вирусиндуциро-
ванного типа Т-клеток: Т-хелперов, которые, по-видимому, обладают сходной с
Тц-клетками перекрестной реактивностью и способствуют продукции антител.
Иммунитет, опосредованный Тц-клетками, играет различную роль при разных
вирусных инфекциях. Считается, что индукция вирусспецифических Тц-клеток
при гриппе [673] и бешенстве [50] — важный защитный компонент иммунного
ответа. Адоптивный перенос Тц-лимфоцитов защищал мышей от летальной
гриппозной инфекции. Тц-клетки играют важную роль в элиминации клеток,
трансформированных вирусом Эпштейн-Барра [32] и вирусом болезни Марека,
а также инфицированных цитомегаловирусом [1566], вирусами ветряной оспы
[411] и гепатита мышей. Роль Тц-клеток в защите организма при многих вирус-
ных инфекциях предстоит еще выяснить.
Цитотоксические клетки, зависимые от антител, вносят существенный
вклад в противовирусную защиту. Они не сенсибилизированы и поэтому не мо-
гут быть отнесены к эффекторам специфического иммунного ответа.
Клеточная цитотоксичность, зависящая от антител, является своеобразным
связывающим звеном между клеточным и гуморальным иммунитетом и опосре-
дуется NK-клетками, а также нейтрофилами, несущими рецепторы к Fc-фраг -
ментам иммуноглобулинов. Специфичность данного вида цитотоксичности оп-
ределяется антителами, покрывающими клетки-мишени, и не зависит от ком-
племента.
К NK-клеткам относятся лимфоциты, не несущие ни Т-, ни В-маркеров.
Поэтому их также называют «нулевыми» клетками. Специфичность лизиса ин-
фицированных вирусом клеток определяется антителами. Этот лизис требует
присутствия гораздо меньших количеств антител, чем лизис инфицированных
клеток, зависимый от комплемента [107, 200]. Значение цитотоксических кле-
ток, зависящих от специфических антител, в противовирусном иммунитете
можно иллюстрировать на ряде примеров. В иммунитете при катаральной лихо-
радке овец важная роль принадлежит зависящим от антител цитотоксическим
лимфоцитам. Гуморальные, вируснейтрализующие антитела носят типоспеци-
фический характер, хотя между их титром и иммунитетом не всегда установлена
корреляция. Важным защитным механизмом против вируса простого герпеса и
болезни Ауески также является антителозависимая клеточная цитотоксичность.
Однако в последнем случае выраженность вакцинального иммунитета не корре-
лировала с уровнем локальных или системных противовирусных антител. В не-
котором смысле с этими наблюдениями согласуется протективный эффект ан-
тител, не обладающих вируснейтрализующей активностью, при вирусном гепа-
тите мышей и альфавирусной инфекции (вирус Синдбис) [1131].
NK-клетки не являются сенсибилизированными лимфоцитами и относятся
к факторам неспецифической защиты, способными действовать против зара-
женных вирусом клеток еще до формирования специфических механизмов
защиты.
NK-клетки, очевидно, представляют собой группу клеток, различающихся
по способности разрушать различные клетки-мишени в зависимости от экс-
прессии поверхностных вирусных белков.
Пока не образовались вирусспепифические Тц- и Тх-лимфоциты и антитела,
решающее значение в предотвращении и Ограничении распространения вируса
в организме принадлежит клеткам, обладающим естественной киллерной актив-
ностью. Их активность в инфицированном организме быстро возрастает. Они
первыми (в течение первых трех дней) вступают в борьбу, затем (через 4—7 дней)
действуют Тц-клетки и антитела. Иными словами, на ранних стадиях инфекции
функционируют универсальные — неспецифические защитные механизмы, по-
зднее вступают в действие факторы специфического иммунного ответа. Имму-
нологические механизмы цитолиза основаны на включении вирусных белков в
плазматическую мембрану клетки, которые являются мишенями для специфи-
Таблица 15. Роль клеток белой крови во врожденном и приобретенном иммуните-
те [670]
Клетки Источник/функция
Лимфоциты Ответственны за специфический иммунный ответ; различают и связывают чужеродные антигены; происходят из костного мозга
Т-клетки Различают: Т-хелперные клетки (Тх), которые секретируют цитокины; цитотоксические Т-клетки (Тц). Регуляторные или суппрессорные Т-клетки являются Тх-клетками. Все они имеют Т-клеточные рецепторы
В-клетки Производят антитела
NK-клетки Естественные (природные) киллерные клетки (NK): крупные гранулярные цитотоксические клетки; большинство из них не имеет Т-клеточных рецепторов
Одноядерные фагоциты Ответственны за фагоцитоз и презентацию антигена; происходят из костного мозга; семейство моноцитов; макрофаги. Клетки Купфера в печени, альвеолярные макрофаги в легких
Дендритные клетки Ответственны за индукцию иммунного ответа; представляют антиген Тх-клеткам; клетки мигрируют в разные ткани (органы), но не в мозг
Межпальцевые дендритные клетки Происходят из костного мозга; присутствуют в большинстве органов, лимфоузлах и селезенке, в коже (клетки Лангерганса)
Фолликулярные дендритные клетки Не происходят из костного мозга; находятся в герминальных слоях лимфатических фолликулов селезенки, лимфоузлов, лимфоидной ткани слизистых; являются трапом для представ- ления В-клеткам антигенов или комплексов антиген-антитело
Плазмоцитоидные дендритные клетки Зрелые дендритные клетки найдены в крови и Т-клеточных зонах лимфоузлов; способны синтезировать большое количество интер- ферона, защищающего иммунные клетки от вирусной инфекции
Гранулоциты Содержат множество цитоплазматических гранул; клетки воспаления
Нейтрофилы Полиморфноядерные лейкоциты; отвечающие на хемотакси- ческие сигналы; фагоцитируют чужеродные частицы; главные лейкоциты воспаления
Эозлиофилы Функционируют в борьбе против некоторых патогенов, индуци- рующих IgE; не играют важной роли в антивирусной борьбе
Базофилы Медиаторы гиперчувствительности, вызванной IgE ответом
ческого гуморального и клеточного иммунного ответа, следствием чего является
лизис инфицированных клеток [898, 1135].
Вирусная инфекция или иммунизация могут вызвать развитие реакций ги-
перчувствительности замедленного типа на вирусные антигены. Это состояние
сенсибилизации, выявляемое кожной пробой, опосредуется Т-клетками и пред-
ставляет одну из форм клеточной иммунореактивности. Ее роль в противовирус-
ном иммунитете еще не выяснена.
Рис. 17. Схема иммунного ответа на вирусы.
Центральная затемненная часть представляет иммунный ответ,
который может быть разделен на антигенспецифические ответы
(левая половина) и врожденный или неспецифический иммунитет
(правая половина) [1658].
МФ-макрофаги;
NK — естественные киллерные клетки;
ПМН — полиморфноядерные нейтрофилы.
Поскольку каждый вирус обладает уникальными антигенными свойствами,
роль каждого типа клеток чрезвычайно сложной иммунной системы в защите и
иммунопатологии при различных заболеваниях требует индивидуальной оцен-
ки. Т-клетки, по-видимому, эффективнее всего угнетают репликацию вирусов,
антигены которых экспрессируются на поверхности клеток на ранних стадиях
инфекции, например, вирусов гриппа, герпес- или альфавирусов. Тц-клетки иг-
рают менее важную роль в иммунитете против тех инфекций, возбудители кото-
рых экспрессируют антигены на поверхности клеток в поздней стадии реплика-
ции (флавивирусные инфекции) или вовсе не экспрессируют их на поверхности
инфицированных клеток (пикорна-, парвовирусные и другие инфекции).
Иммунологическая память
Вслед за праймированием антигеном и клональной экспансией лимфоцитов
образуется популяция долгоживущих клеток иммунологической памяти, перси-
стирующей неопределенно долго без деления до стимуляции последующей ре-
инфекцией или реиммунизацией. Т-клетки памяти характеризуются особыми
поверхностными маркерами (СД4/5КО) и хоминг-молекулами, связанными с
определенным путем рециркуляции. При повторной встрече с тем же антигеном,
даже много лет спустя, Т- и В-клетки отвечают более быстро и более интенсив-
но, чем при первичной встрече. Клетки памяти на повторное введение того же
антигена также реагируют анамнестическим (вторичным) ответом с продукцией
большого количества специфических антител.
Немного известно о механизме продолжительной иммунологической памя-
ти Т- и В-лимфоцитов в отсутствии выраженной хронической инфекции. Воз-
можной причиной иммунологической памяти является продолжительная анти-
генная индукция, исходящая от фолликулярных дендритных клеток-ловушек в
герминальных центрах лимфатических узлов, где происходит индукция В-кле-
ток памяти [321, 1578]. Опыты на кроликах, вакцинированных против бешенст-
ва, убеждают, что соматическая мутация В-клеток является результатом антиген-
специфического иммунного ответа [1565].
Так как соматические мутации не происходят в генах, кодирующих Т-кле-
точные рецепторы, а роль персистенции вирусного антигена не подтверждена,
развитие иммунологической памяти Т-клеток зависит от размера клональной
экспансии на первую встречу с антигеном [809]. В этой связи при разработке но-
вых, более эффективных вакцин следует обращать внимание на длительное под-
держание Т-клеточной памяти [1221].
Важно знать возникновение памяти у различных компонентов иммунной
системы, а также ее персистенцию после иммунизации инактивированными и
живыми вирусными вакцинами при различных путях введения.
Известны примеры, когда Тц-клетки памяти способны длительно персисти-
ровать в организме иммунизированных животных. После энтеральной иммуни-
зации мышей реовирусом Тц-лимфоциты и клетки памяти, продуцирующие IgA,
способны длительное время персистировать в лимфоидной ткани, особенно в
пейеровых бляшках. В легких мышей, инфицированных вирусом гриппа, клет-
ки, секретирующие специфические IgG и IgA, сохранялись в течение 11 мес, а
время полужизни Тц клеток иммунологической памяти при гриппе человека со-
ставляет 2—3 года. Введение повышенной дозы вирусных антигенов способство-
вало ранней индукции Тц-клеток, оказывающих протективный эффект in vivo
при бешенстве [50] и ускоренному наступлению иммунитета при гепатите В.
Клон Тц-клеток памяти, способных реагировать на повторную иммунизацию,
формируется к 30-му дню после введения антигена вируса бешенства [50]. У мы-
шей-реконвалесцентов Тц-клетки могут сохраняться в течение года, а у челове-
ка — в течение нескольких лет [32]. Антитела к вирусу гепатита В после бустери-
зации сохраняются в течение трех лет, а после иммунизации вакциной 17D про-
тив желтой лихорадки нейтрализующие антитела сохранялись 30—35 лет [153].
Существует мнение, что живые и инактивированные вакцины индуцируют
В- и Тц-лимфоциты и клетки иммунологической памяти не столь эффективно,
как естественное инфицирование. Так, иммунитет у переболевших корью людей
сохраняется пожизненно, а после первичной иммунизации живой вакциной —
около 15 лет [332].
Хотя инактивированные вирусные вакцины обычно индуцируют выработку
антител и В-клеток памяти, тем не менее, они по-разному влияют на индукцию
двух типов эффекторных клеток. Препараты инактивированного вируса гриппа
вызывали у мышей длительную память Т-хелперов, но слабовыраженную память
цитотоксических клеток. В то же время инактивированные препараты вируса па-
рагриппа-1 типа Сендай, антигены которого эффективно включаются в структу-
ру клеточных мембран, индуцируют образование Тц-клеток [32].
При одних заболеваниях (оспа человека, оспа животных, полиомиелит, чума
крупного рогатого скота, классическая чума свиней) имеются живые вакцины,
создающие длительный или пожизненный иммунитет, при других — разработа-
ны высокоэффективные инактивированные или компонентные вакцины (ящур,
болезнь Ауески, гепатит В и др.). Вакцинальный иммунитет во многих случаях
по всем или основным компонентам иммунного ответа практически не уступает
или немногим уступает состоянию реконвалесценции.
Таким образом, можно констатировать, что время появления, интенсивность
образования антиген-стимулированных В- и Тц-клеток и персистенция клеток
иммунологической памяти при прочих равных условиях зависит не столько от
вида примененной вакцины (живой или инактивированной), сколько от ее ан-
тигенного воздействия на различные компоненты иммунной системы привито-
го организма. Реализация потенциальной антигенной активности вакцинных
препаратов в значительной мере может зависеть от способа их введения, схемы
применения, а в случае использования инактивированных вакцин также и от ка-
чества иммунологических адъювантов.
В зависимости от степени устойчивости вакцинированных особей к зараже-
нию вирулентным штаммом соответствующего возбудителя, следует различать
клинический и биологический иммунитет. В первом случае, вирус проникает и
размножается в организме без манифестации признаков болезни. Во втором -
организм противостоит инфицированию, то есть способен остановить размно-
жение вируса в воротах инфекции [169].
Характерным примером, демонстрирующим индукцию клинического имму-
нитета, могут служить вакцинные препараты против простого герпеса, предот-
вращающие заболевание, но не персистентную вирусную инфекцию. Указанная
особенность присуща вакцинальному иммунитету при ряде других инфекций и,
прежде всего, вызванных герпесвирусами.
Трехкратная парентеральная иммунизация обезьян инактивированной вак-
циной против полиомиелита предотвращала заболевание и экскрецию вируса с
фекалиями после контрольного заражения. Однако у таких обезьян в ответ на
введение вируса наблюдали бустерный антительный ответ, свидетельствующий о
приживляемое™ вируса на вакцинальном фоне. У поросят с материнским имму-
нитетом ротавирус размножался в кишечнике и выделялся с фекалиями при от-
сутствии клинических признаков болезни. Подобные явления имеют место в
случаях, когда переболевание, а тем более вакцинация, сопровождаются разви-
тием относительно слабовыраженного иммунитета. Инфекции, при которых ре-
конвалесценция сопровождается напряженным и длительным иммунитетом,
теоретически могут контролироваться биологическим вакцинальным иммуни-
тетом. К ним, прежде всего, относятся остропротекающие инфекции, с выра-
женным системным иммунитетом, такие как корь, классическая чума свиней,
чума крупного рогатого скота и др. Поросята, вакцинированные живой культу-
ральной вакциной против классической чумы свиней, вскоре после паренте-
рального контрольного заражения были свободны от вирулентного штамма ви-
руса. При контакте с больными у вакцинированных животных не отмечали по-
явления вторичных антител.
В заключение следует сказать, что эффективный гуморальный или клеточ-
ный иммунитет имеет поликлональную природу. В подтверждение сказанного
можно привести два примера. Адоптивный перенос 4х107 Т-лимфоцитов двух
субпопуляций (CD4 и CD8) от иммунизированных вирусом Раушера мышей
полностью защищал реципиентов от виремии и спленомегалии после заражения
вирусом. Перенос клеток одной из этих субпопуляций обеспечивал лишь час-
тичную защиту мышей. Протективный иммунитет к вирусу японского энцефа-
лита у мышей, коз и обезьян значительно усиливался после смешивания различ-
ных моноклональных вируснейтрализующих антител [2020].
Существуют тесные взаимоотношения между резистентностью, клеточным
и гуморальным иммунитетом. В реакциях клеточного иммунитета принимают
участие как Тц-лимфоциты, так и антитела (например, в зависимой от антител
клеточной цитотоксичности). Главные эффекторы резистентности — макрофа-
ги - также играют важную роль эффекторов клеточного иммунитета. Актив-
ность их в известной мере зависит от комплемента, антител и лимфокинов.
Следует отметить, что иммунокомпетентные клетки не всегда играют поло-
жительную роль. Способность цитотоксических лимфоцитов разрушать зара-
женные вирусом клетки также может быть причиной развития иммунопатологи-
ческих поражений органов и тканей. Кроме того, дендритные и макрофагальные
клетки способны захватывать иммунные комплексы и сохранять их длительное
время, что способствует развитию персистентной инфекции, обусловленной
лентивирусами и вирусом алеутской болезни норок. А лимфоциты, являясь мес-
том первичной латентной инфекции вирусом Эпштейн-Барр, способствуют рас-
пространению его в организме.
6.6. Иммунная система слизистых
оболочек
Поверхность слизистых оболочек является первоначальными входными во-
ротами для большинства инфекционных агентов, среди которых важнейшее зна-
чение имеют респираторные и кишечные вирусы. Для борьбы с этими инфекци-
ями иммунная система использует как неспецифические, так и специфические
механизмы.
Кроме индукции системного иммунитета, индукция местного иммунитета
играет важную роль в защите от патогенных вирусов, которые инфицируют или
находятся на поверхности слизистых. Основную роль в предупреждении заболе-
вания или в выздоровлении играют секреторные IgA. Специфическая профилак-
тика вирусных инфекций, при которых важное значение имеет иммунитет слизи-
стых, должна учитывать, что нейтрализующие IgA, присутствующие на слизис-
тых, могут происходить из сыворотки крови путем транссудации или
секретироваться клетками подслизистой ткани. Преимущественная стратегия
должна основываться на индукции секреторных IgA на слизистой в местах репли-
кации вируса. Менее эффективно стимулировать образование сывороточных IgA
в высоком титре с последующей транссудацией по градиенту в легких > чем в но-
соглотке > чем в кишечнике [ИЗО]. Циркулирующие ВНА при высокой концен-
трации могут обеспечивать защиту нижнего отдела респираторного тракта, тогда
как защита верхнего отдела респираторного тракта и нижнего отдела кишечника
является, главным образом, функцией нейтрализующих секреторных IgA.
Секреторный IgA кишечника играет решающую роль в защите от полиомие-
лита. Парентеральная вакцинация только инактивированной вакциной оказы-
вает несущественный эффект на выработку IgA в слизистых оболочках. Однако
сильный IgA-ответ развивается у людей, предварительно иммунизированных
орально - живой, а затем инактивированной вакцинами [773].
Иммунная система слизистых основана на лимфоидной ткани, связанной со
слизистыми оболочками (MALT), включающей лимфоидные ткани кишечника
(GALT), бронхов (BALT) и носоглотки (NALT), а также молочной, слюнных,
слезных желез и мочеполовых органов. Лучше всего изучена система GALT, ко-
торая представлена организованными лимфоидными образованиями, включаю-
щими пейеровы бляшки, аппендикс, мезентериальные лимфоузлы и солитар-
ные лимфоузлы. Пейеровы бляшки содержат зародышевые центры, представ-
ленные преимущественно В-клетками, продуцирующими IgA, и зоны, содержа-
щие преимущественно Т-клетки. Другие системы MALT организованы
подобным образом.
Вакцины против вирусов, инфицирующих слизистые оболочки и вызываю-
щие местный иммунитет, имеют важное значение. Большинство вакцин вызыва-
ют не местный, а системный иммунитет при парентеральном введении. Однако
некоторые адъювантные вакцины индуцируют локальный иммунитет после ме-
стного и системного применения.
В предотвращении инфицирования организма некоторыми вирусами, и осо-
бенно вирусами гриппа, важную роль играет индукция местного иммунитета и,
прежде всего, синтез IgA-антител. Вместе с тем большинство вирусных вакцин —
инактивированные и вводятся парентерально. Эти вакцины способны индуци-
ровать системный иммунитет, однако почти или совсем не вызывают местный
иммунитет в слизистой оболочке [43].
Специфическая профилактика желудочно-кишечных и респираторных ин-
фекций требует знания механизмов местного иммунитета, обеспечивающих за-
щиту слизистых оболочек от инфекционных агентов.
В начале прошлого века была сформулирована теория местного иммунитета,
давшая первый импульс к использованию перорального способа иммунизации
против брюшного тифа. В последующем были накоплены данные, свидетельст-
вующие о важной роли факторов местной защиты при ряде вирусных инфекций,
однако истинная природа этих процессов оставалась невыясненной. Возобнов-
ление интереса к указанной проблеме произошло в связи с открытием иммуног-
лобулина А и доказательством его секреции плазматическими клетками слизис-
той оболочки.
Эти фундаментальные исследования явились началом новой эры в развитии
прикладной иммунологии и получили блестящее подтверждение и дальнейшее
развитие. В частности, было установлено, что IgA — наиболее важный иммуно-
глобулин внешних секретов, главная биологическая функция которого состоит в
защите слизистых оболочек от инфекционных агентов. Дальнейшие исследова-
ния подтвердили ведущую роль IgA в функционировании системы секреторного
иммунитета.
Наиболее вероятный механизм нейтрализации вируса IgA заключается в пре-
дотвращении связи вируса с клетками-мишенями слизистой, хотя возможны дру-
гие механизмы нейтрализации вируса антителами. Этот процесс в значительной
степени зависит от эпитопной специфичности, изотипности и концентрации ан-
тител и вируса, а также от типа клеток-мишеней [3872]. Существует альтернатив-
а подобно другим антителам, IgA могут не препятствовать присоединению виру-
са к клеточным рецепторам, но могут подавлять проникновение его в клетку или
репликацию, как это было установлено с вирусом гриппа [257, 799]. Механизм,
который был недавно установлен, включает внутриклеточную нейтрализацию
вируса в процессе прохождения промежуточного секреторного компонента IgA
через эпителиальные клетки [1029]. Это может быть результатом взаимодействия
трансклеточных везикул, содержащих IgA, с везикулами, в которых размножает-
ся вирус. Если этот механизм внутриклеточной нейтрализации имеет место in
vivo, то это означает, что IgA может способствовать не только защите от вирусной
инфекции слизистых, но и прекращению ее.
Масштабы вакцинопрофилактики, учитывающей механизмы местного им-
мунитета достаточно велики. Это обусловлено тем, что инфекционные болезни
пищеварительного и респираторного трактов новорожденных животных стали
одной из главных проблем современной медицины и ветеринарии, решению ко-
торой придается большое значение [16, 203].
Концепция общей иммунной системы слизистых оболочек. Под общей иммун-
ной системой слизистых оболочек подразумевают компоненты специфической
защиты, реализуемые на внешних слизистых покровах и функционирующие в
известной степени независимо от системной иммунологической реактивности.
Эта система включает лимфоидную ткань кишечника (GALT-gut associated lym-
phoid tissue), лимфоидную ткань бронхов (BALT-bronchus associated lymphoid tis-
sue), иммунокомпетентные клетки глотки, слюннных желез, респираторного
тракта, молочной железы и гениталий. Замечательная особенность иммунной
системы слизистых оболочек — наличие больших количеств секреторного IgA,
что является уникальной характеристикой слизистых покровов. Сывороточные
иммуноглобулины и компоненты также присутствуют на различных слизистых
покровах и во внешних секретах, но их роль в обеспечении локального защитно-
го механизма менее существенна.
Суть концепции общности иммунной системы слизистых оболочек состоит в
том, что выработка секреторных антител происходит не только в местах антиген-
ного воздействия на слизистый покров, но и в отдаленных секреторных участках.
Бронхиальный лимфоэпителий, пейеровы бляшки и другие организованные
лимфоидные фолликулы изобилуют антиген-реактивными предшественниками
В-клеток, коммитированных, главным образом, к синтезу секреторного IgA [16].
Непосредственное антигенное раздражение — необходимое условие для первона-
чальной активации и пролиферации таких клеток. Сенсибилизированные анти-
геном клетки при повторном контакте с тем же антигеном быстро дифференци-
руются в lgA-иммунобласты, пролиферирующие и мигрирующие сначала в реги-
онарные лимфоузлы, а затем, через грудной лимфатический проток, в
кровеносное русло. Во время нахождения в системе кровообращения эти клетки
оседают на слизистых оболочках глаз, глотки, гениталий, слюнных и молочных
желез, субэпителиальном участке слизистой оболочки верхнего и нижнего отде-
лов респираторного тракта и в lamina propria кишечника.
Специфическая рециркуляция лимфоцитов, стимулированных в лимфоид-
ной ткани слизистых, объясняется тем, что они имеют на своей поверхности мо-
лекулы, которые взаимодействуют со специфическими молекулами, размножен-
ними только на поверхности клеток эндотелия венул лимфоидной ткани слизис-
тых, что обеспечивает избирательную рециркуляцию лимфоцитов [43, 203].
Здесь репопулировавшие клетки начинают активный синтез специфическо-
го секреторного IgA, играющего ведущую роль в функционировании общей им-
мунной системы слизистых оболочек [1243].
Эта концепция имела многочисленные экспериментальные подтверждения.
Было установлено, что клетки пейеровых бляшек кролика при введении их об-
лученным аллогенным реципиентам избирательно распределялись в lamina pro-
pria и продуцировали антитела преимущественно класса IgA, тогда как клетки,
полученные из периферических лимфоузлов доноров, осуществляли специфи-
ческий homing в периферических лимфоузлах реципиентов и продуцировали ан-
титела преимущественно класса IgG. Сходные исследования выявили, что hom-
ing бронхиальных лимфоцитов у реципиентов происходил в BALT [139]. Ораль-
ная иммунизация защищала лабораторных животных от интраназального
заражения PC-вирусом. Интраназальное введение дендритных клеток лошадей,
праймированных инактивированным герпесвирусом, приводило к появлению
иммунитета у мышей [1589].
Иммунизация мышей аналогичным образом инактивированной вакциной
против гриппа сообщала устойчивость к интраназальному заражению. Двукрат-
ное введение в желудок мышей цельновирионной инактивированной сорбиро-
ванной вакцины сопровождалось образованием специфических IgA и IgG в лег-
ких. При парентеральном введении вакцины в смывах легких IgA не обнаружены.
Энтеральная иммунизация против респираторно-синцитиальной инфекции
индуцировала антитела в респираторном тракте, но полную защиту его обеспе-
чивала интраназальная иммунизация. Однако, несмотря на иммунологическую
реакцию отдаленных слизистых, наиболее выраженный иммунный ответ обра-
зуется в том месте, где слизистая оболочка непосредственно контактирует с ви-
русным антигеном. Важность локального антигенного стимулирования была
убедительно продемонстрирована в экспериментах с вирусом полиомиелита.
Уровень специфических секреторных IgA был максимальным в тех участках ки-
шечника, где происходил непосредственный контакт вирусного антигена со сли-
зистой оболочкой [1173]. Живую вакцину Роковак против рота- и коронавирус-
ных энтеритов новорожденным телятам вводили орально перед приемом моло-
зива. После вакцинации заболеваемость и гибель телят от вирусных энтеритов
сократились примерно в 4 раза [55].
В ряде опытов у животных, вакцинированных интраназально, наблюдали
образование местных IgA-антител не только в носоглотке, но также в кишечни-
ке и во влагалище. Однако при перректальной вакцинации в кишечнике появля-
лись IgA- и IgG-антитела в высоких титрах, но не обнаруживались во влагалище.
Эти данные указывают, что для индукции местных IgA-антител во влагалище
или кишечнике необходима вакцинация именно через эти органы [43].
Несмотря на то, что исследования по иммунитету слизистых покровов были
сосредоточены в основном на изучении секреторных иммуноглобулинов и их
роли в функционировании указанной системы, в ряде исследовательских работ
указано на участие факторов клеточного иммунитета и, в первую очередь, Т-
лимфоцитов в локальном иммунном ответе. Так, установлена миграция и homing
Т-лимфоцитов после их антигенной сенсибилизации, а также показана роль Т-
хелперов в регуляции местного IgA-ответа.
Представляют интерес данные интравагинальной иммунизации мышей жи-
вой вакциной против герпеса. Развивающийся при этом иммунитет может быть
перенесен сингенным животным лимфоцитами генитальных лимфоузлов, но не
лимфоцитами других лимфоидных органов иммунизированных доноров. Транс-
плантированные лимфоциты мигрировали преимущественно в ткани половых
органов реципиентов, что свидетельствует о важной роли в местном иммунитете
вирусиндуцированных Тц-клеток.
Однако имеются наблюдения, когда не были отмечены различия в защите
животных от инфекции несмотря на наличие или отсутствие местных IgA-анти-
тел после вакцинации [573, 1247].
Секреторный IgA как ведущий Кооператор иммунной системы слизистых
оболочек
Известно, что степень защиты от локальных вирусных инфекций респира-
торного и желудочно-кишечного трактов прежде всего зависит от содержания в
организме специфического секреторного IgA, а не от наличия сывороточного
IgG к энтеропатогенным или пневмотропным вирусам [43, 139].
Стабильная структура, выраженный аффинитет к поверхности слизистых
оболочек, преобладающее содержание в секрете молочной железы обусловлива-
ют биологическую роль секреторного IgA в защите организма от неблагоприят-
ного воздействия различных патогенных агентов, в том числе вирусов.
IgA синтезируется в димерной форме в клетках lamina propria и после связы-
вания с иммуноглобулиновым рецептором, синтезированным в эпителиальных
клетках, транспортируется на поверхность слизистой оболочки. В момент выхо-
да IgA в просвет кишечника рецептор частично расщепляется, в результате чего
в составе IgA остается фрагмент рецептора, который называют секреторным
компонентом (рис. 18). Таким образом, секреторный IgA является продуктом ко-
операции двух типов клеток — плазматических и эпителиальных.
Секреторный IgA образуется не только в димерной, но и в тетрамерной фор-
ме, что усиливает его вируснейтрализующую способность. Секреторный компо-
нент предохраняет IgA от расщепления протеолитическими ферментами, что
обусловливает его значительные преимущества перед антителами других клас-
сов. Секреторный IgA нейтрализует вирус не только в просвете кишечника, но и
при транспортировке его внутрь клетки. Димер IgA может нейтрализовать вирус
в подслизистой оболочке кишечника, а затем, связавшись с рецептором, транс-
портировать его в просвет кишечника [139].
Димерные иммуноглобулины класса А (11S IgA), соединенные посредством
j-цепи в единую структуру с секреторным компонентом, представляют собой
уникальный пример эволюционной адаптации иммуноглобулинов на слизистых
покровах для эффективного функционирования в условиях постоянного воздей-
ствия антигенов различной природы.
Исходя из способности к локальному синтезу молекул секреторного компо-
нента, а также димерной формы IgA-местно расположенными плазматическими
клетками, ткани слизистых покровов можно разделить на три основных класса:
Класс 1. Выраженный местный синтез IgA и секреторного компонента
Желудочно-кишечный тракт Желчный проток
Верхний отдел респираторного тракта Шейка матки
Носовая полость Железы:
Среднее ухо слюнная
Желчный пузырь молочная
слезная
предстательная
Класс 2. Местный синтез секреторного компонента при отсутствии местного
синтеза IgA
Кожа (потовые железы)
Почки
Мочевой пузырь
Паренхиматозные клетки печени
Амнион
Фаллопиевы трубы
Слизистая оболочка матки
Тимус
Класс 3. Отсутствие местного синтеза IgA и секреторного компонента
Мочеточник Влагалище
Пищевод Слизистая оболочка рта
В слизистых оболочках индуктивная и продуктивная фазы гуморального им-
мунного ответа разобщены пространственно в большей степени, чем в других
отделах иммунной системы.
Клеточные и гуморальные превращения, связанные с появлением IgA во
внешних секретах, представлены на рисунке 18.
В молоко и, по-видимому, в другие внешние секреты молекулы IgA поступа-
ют из двух главных источников. Большая часть IgA, выделяемого со слюной, се-
кретами слезной и молочной желез, а также пищеварительного и респираторно-
го трактов, образуется плазматическими клетками. Однако IgA, обнаруживае-
мые в различных внешних секретах, могут иметь и системное происхождение.
Продуцируясь клетками слизистых оболочек одних органов, они поступают в
кровь и переносятся в слизистые покровы других органов.
Антиген после проникновения внутрь пейеровой бляшки активирует Т- и В-
лимфоциты, которые по лимфатическому протоку поступают в мезентериаль-
ный лимфатический узел, а затем в кровь, селезенку, снова в кровь и селективно
локализуются в лимфатических образованиях всех слизистых оболочек и экзо-
Плазматическая
клетка
Секреторный IgA
Рис. 18. Синтез и транспорт IgA через эпителий слизистой оболочки.
*ПИР — полииммуноглобулиновый рецепт [1523]
кринных секреторных железах — молочных, слюнных и слезных (рис. 19). При
этом Т-лимфоциты локализуются преимущественно между эпителиальными
клетками слизистой оболочки, обеспечивая клеточный иммунный ответ, а В-
лимфоциты — в lamina propria, где они дифференцируются в плазматические
клетки и синтезируют IgA. Около 90% плазматических клеток в lamina propria
продуцируют IgA, в то время как в лимфатических узлах доля таких клеток со-
ставляет всего 2—5% [139].
Уникальна в этом отношении роль печени. Имеются убедительные данные,
свидетельствующие о том, что гепатоциты избирательно связывают и в последу-
ющем транспортируют IgA в желчь, тем самым усиливая систему секреторного
IgA кишечника [420].
Возможной функцией печени также является удаление комплексов анти-
ген - IgA из циркулирующей крови с желчью в кишечник. Изучение противови-
русного иммунитета убедительно продемонстрировало, что степень защиты рес-
пираторного и желудочно-кишечного трактов от локальных вирусных инфекций
прямо коррелирует с уровнем специфических секреторных IgA, а не с уровнем
Рис. 19. Пути преодоления эпителиального барьера кишечника «алиментарными»
антигенами [Mayer L., Shaul L. Nature Rev. Immunol. 2004, 4, 409]:
а — с помощью МНС-комплекса эпителия кишечника;
b — абсорбцией капиллярами;
с — поглощением макрофагами;
d — поглощением дендритными клетками с последующим поступлением
в лимфатические узлы.
антител сыворотки крови. В основе противовирусного действия секреторного
IgA лежит инактивация вируса [420].
Роль отдельных органов в функционировании иммунной
системы слизистых оболочек
Кишечник
Многие общие закономерности иммунитета слизистых оболочек были выяв-
лены и детально изучены на примере кишечного иммунитета. По массе иммуно-
компетентных клеток кишечнику принадлежит ведущее место в иммунной сис-
теме слизистых покровов, и в этом отношении он значительно превосходит им-
мунную систему респираторного тракта.
Кишечник - важный иммунологический орган, в собственной пластике
(lamina propria) которого содержится столько же лимфоидных клеток, сколько в
селезенке. Среди этих клеток идентифицированы Т-, В-клетки, малые лимфо-
циты и плазматические клетки. Последние синтезируют иммуноглобулины пре-
имущественно класса А и являются источником антител, секретируемых слизи-
стой оболочкой кишечника. Многочисленные малые лимфоциты контролируют
выработку антител и, кроме того, осуществляют реакции клеточного иммуните-
та [420]. Иммунологическая функция кишечника опосредована действием,
прежде всего, лимфоцитов, расположенных в пейеровых бляшках и в слизистой
оболочке. Популяция лимфоцитов пейеровых бляшек состоит из предшествен-
ников В-(80%) и Т-(20%) клеток. Лимфоциты эпителиального слоя кишечной
стенки представлены исключительно Т-клетками, тогда как в подслизистом слое
преобладают В-клетки, большинство из которых синтезируют IgA. Исключение
составляют жвачные животные, у которых в подслизистом слое преобладают
IgG, продуцирующие клетки [420].
Иммунитет против энтеропатогенных агентов в основном осуществляется
посредством антител, секретируемых в просвет кишечника. Антитела, защища-
ющие слизистую оболочку кишечника, могут поступать из двух источников: из
сыворотки крови и плазматических клеток, расположенных в lamina propria. Сы-
вороточные антитела, очевидно, менее эффективны, поскольку достаточное для
местной защиты количество их накапливается в кишечнике только при наличии
высоких уровней в сыворотке крови. Сывороточные антитела, участвующие в
создании местного иммунитета, проникают в просвет кишечника в результате
экссудации и относятся преимущественно к классу IgG.
Защитный эффект при гриппе обеспечивается главным образом продукцией
циркулирующих антител и других факторов системного иммунитета, которые
защищают от инфекции легкие, но слабо ограничивают размножение вируса в
верхней части респираторного тракта. Подобным образом циркулирующие ан-
титела (IgG) могут переноситься из крови в желудочно-кишечный тракт и защи-
щать телят от ротавирусной инфекции.
Однако антитела, синтезируемые местно плазматическими клетками ки-
шечника, обычно относятся к IgA и в силу устойчивости к протеолитическим
ферментам в большей степени приспособлены к защите поверхности слизистой
оболочки, чем IgG. Иммунная система кишечника во многом функционирует
независимо от системных иммунных механизмов. Это прежде всего относится к
иммунной системе кишечника свиней [139]. Антигенная стимуляция В- и
Т-клеток происходит в пейеровых бляшках, представленных отдельными скоп-
лениями лимфоидных клеток, расположенных в подслизистом слое тонкого от-
дела кишечника. Эпителий слизистой оболочки кишечника, покрывающий
пейеровы бляшки, видоизменен: он образует лишь рудиментные ворсинки и
обладает повышенной способностью к пиноцитозу. Эти эпителиальные клетки
обладают специализированной функцией «захвата» антигена из просвета ки-
шечника и представляют его лимфоидным элементам бляшек. Они утратили ха-
рактерную цилиндрическую форму, содержат много цитоплазматических ваку-
олей и называются мембранными или М-клетками, так как имеют микросклад-
ки [165, 208].
Частота формирования ротавирусспецифичных Тц-лимфоцитов в пейеро-
вых бляшках после перорального инфицирования в 25—30 раз превышала часто-
ту образования соответствующих клеток после инокуляции вируса в лапу мы-
шей. Эффективность энтеральной иммунизации ротавирусом связывают со спо-
собностью его проникать в ткань пейеровых бляшек. Полагают, что реовирусы
преодолевают кишечный эпителий благодаря М-клеткам, играющим ведущую
роль в доставке чужеродных антигенов и, в том числе, вирусов во внутреннюю
среду организма и к его иммунной системе [1676]. Эпителиальные клетки, по-
добные М-клеткам кишечника, обнаружены и среди клеток BALT, их рассматри-
вают как респираторные эквиваленты клеток GALT [420].
Первичное воздействие антигена вызывает пролиферацию В-клеток, часть
которых превращается в иммунобласты и покидает бляшки. Большая часть кле-
ток остается в бляшках в виде чувствительных к данному антигену В-клеток.
При повторном контакте с тем же антигеном эти клетки превращаются в IgA-
иммунобласты, которые пролифелируют и мигрируют сначала в брыжеечные
лимфатические узлы, а затем через грудной лимфатический проток в кровенос-
ное русло. Часть таких клеток может оседать в отдаленных IgA-секретирующих
участках тела. Однако большинство клеток уже в качестве зрелых плазмоцитов
осуществляет специфический homing в lamina propria, что обусловлено присут-
ствием антигена и свидетельствует о его определяющей роли в данном процессе.
Вторичный иммунный ответ — сильный и быстрый. Он развивается в течение
48—60 ч, достигает максимума на 4—5-й день, а затем быстро снижается.
Мигрирующие Т-клетки также осуществляют homing в эпителиальном слое
слизистой оболочки кишечника. Большинство из этих лимфоцитов обладают
Т-хелперным фенотипом. Эти клетки, вероятно, могут вовлекаться в реакции
клеточного иммунитета, иммунотолерантности, а также в регуляцию гумораль-
ного иммунитета.
Стимулированные местно или осевшие из кровяного русла lgA-продуцирую-
щие клетки в собственной пластинке секретируют IgA в виде димера 9S, прони-
кающего в эпителиальные М-клетки, соединяются с образующимся в них секре-
торным компонентом и выделяются на поверхность слизистой оболочки в виде
иммуноглобулина. Одновременно на поверхность эпителиальных мембран вы-
деляется секреторный компонент в виде свободных молекул [39, 420]. Слизь,
обогащенная нековалентно связанными секреторными иммуноглобулинами,
выстилает поверхность эпителиальных клеток наподобие ковра. Тем самым
обеспечивается протективный эффект, предотвращающий адгезию и инвазию
инфекционных агентов.
IgM также продуцируются местно и проявляют свойства, сходные со свойст-
вами секреторного IgA. Показано, что пентамерные 19S молекулы IgM содержат
секреторный компонент, хотя эта связь менее прочная [16, 39].
Продолжительная защита слизистых оболочек местными антителами может
быть обусловлена длительной, хотя и умеренной выработкой антител после
окончания специфического антигенного воздействия или быстроактивизируе-
мой иммунологической памятью. Обнаружение в системе слизистых оболочек
первичного и вторичного иммунного ответа свидетельствует о наличии в ней ме-
стной иммунологической памяти, однако ее длительность и уровень вторичного
ответа могут зависеть от многих факторов. Например, мыши, иммунизирован-
ные интраназально коронавирусом гепатита, имели более продолжительный
иммунитет, чем привитые орально [302]. На примере ротавирусной инфекции
цыплят доказано, что IgA кишечника являются важным, но не единственным
фактором защиты [1138]. IgA молозива не адсорбируются в кишечнике новорож-
денных и остаются там, проявляя местный защитный эффект, нейтрализуя вирус
[1301].
Респираторные органы
Специфическая защита их сопряжена главным образом с функционирова-
нием секреторных IgA. Лимфоидная ткань респираторного тракта является час-
тью единой иммунной системы слизистых. В подслизистом слое бронхов имеют-
ся лимфатические фолликулы, которые покрыты клетками, подобными М-клет-
кам пейеровых бляшек [16, 139].
Преобладание IgA-синтезирующих клеток отмечено в слизистой носа, тра-
хеи, бронхов и легких у человека и свиней. Аэрозольное и интраназальное введе-
ние различных агентов, как правило, сопровождается локальной выработкой ан-
тител класса IgA, при этом аппликация инактивированных антигенов оказыва-
ется менее эффективной. Инактивированная и живая вакцины вызывали
иммунитет к полиовирусу, соответственно, при парентеральной и энтеральной
вакцинации, однако лишь последняя вызывала IgA-ответ, хотя защитный эф-
фект был практически одинаков [43].
Инактивированную вакцину против гриппа вводили мышам с питьевой во-
дой, орально — в желатиновых капсулах или инокулировали в просвет двенадца-
типерстной кишки. Во всех случаях антительный ответ был дозозависимым и
менее выраженным, чем после внутримышечного введения вакцины в меньшей
дозе. Респираторная иммунизация инактивированной вакциной против нью-
каслской болезни защищала цыплят. Защитный эффект и антительный ответ за-
висели от дозы вакцины [1573].
Интраназальная иммунизация свиней живой вакциной против болезни Ауе-
ски обеспечивала более выраженный иммунитет, чем парентеральная вакцина-
ция. Живая вакцина против парагриппа-3 при интраназальном применении
обеспечивает защиту телят от инфекции. Интраназальная иммунизация субъе-
диничной вакциной (гликопротеины HN и F) против парагриппа-3 обеспечива-
ла полную защиту и синтез локальных и системных антител. Подкожная имму-
низация вызывала лишь частичную устойчивость и синтез системных антител.
Аналогичные данные получены с компонентной вакциной против гриппа [781].
Эффективность живой и инактивированной эмульгированной вакцин про-
тив ньюкаслской болезни сравнивали на 20-недельных индюшатах. Аэрозольная
иммунизация живой вакциной сопровождалась образованием антител в более
высоком титре, чем подкожное введение инактивированной вакцины. После
интраназального контрольного заражения вирус из трахеи выделяли только от
вакцинированных инактивированной вакциной, хотя заражение птиц обеих
групп сопровождалось серологическим ответом, свидетельствующим о прижив-
ляемости вирулентного вируса [878].
Живая холодоадаптированная гриппозная вакцина вызывала иммунитет
только после двукратного интраназального применения.
При интраназальной вакцинации животных препаратами ВИЧ наблюдали
образование IgA-антител не только в носоглотке, но и во влагалище и кишечни-
ке [43].
Для усиления иммунного ответа вакцинацию часто проводят различными
способами, сочетая при этом живые и инактивированные вакцины. Так, перо-
ральная иммунизация мышей инактивированными препаратами вируса Сендай
не вызывала локальной защиты респираторного тракта; интраназальная — час-
тично защищала только нижний отдел. Наиболее эффективной оказалась назо-
оральная иммунизация. Усиление иммунного ответа к гриппу у людей отмечали
при сочетании интраназального применения живой вакцины с последующим
парентеральным введением инактивированной вакцины [43]. Наибольший им-
мунизаторный эффект при PC-инфекции у взрослых серопозитивных пациен-
тов с использованием живого аттенуированного штамма вируса достигался при
сочетании интраназального и внутрикожного введений [104].
Парентеральная вакцинация инактивированной полиовирусной вакциной
усиливает системный и местный IgA-ответ у людей только после предваритель-
ной оральной вакцинации живой вакциной [773].
Интраназальное введение мышам белка F респираторно-синцитиального
вируса вызывало образование сывороточных IgG и местных IgA-антител к белку
F, причем IgA-антитела выявлялись не только в носовой полости, но и во влага-
лище [1504]. Известно, что при парентеральном введении инактивированных
вакцин образования IgA практически не происходит. В исследованиях на людях
титр IgG-антител при дву- и трехкратной интраназальной вакцинации был срав-
ним с титром при однократной парентеральной иммунизации, хотя в последнем
случае IgA антитела не выявлялись [43].
Кроме иммунологической связи BALT и GALT, реализуемой в рамках общей
иммунной системы слизистых, не менее важное значение имеет иммунологиче-
ская кооперация BALT — молочная железа. В результате антигенной сенсибили-
зации предшественники IgA-продуцирующих клеток из BALT могут мигриро-
вать в молочную железу и давать начало новым клонам клеток, синтезирующим
специфические антитела класса IgA. Однако для эффективной иммунологичес-
кой кооперации с бронхоальвеолярной лимфоидной тканью и молочной желе-
зой, по-видимому, необходим контакт антигена с иммунокомпетентными клет-
ками нижнего отдела респираторного тракта, то есть с клетками BALT.
В пользу этого предположения свидетельствуют данные иммунизации сви-
номаток против трансмиссивного гастроэнтерита респираторным коронавиру-
сом свиней. Высокий уровень вируснейтрализующих антител в молозиве и мо-
локе ассоциирован в равной мере с IgA и IgG [139].
В аналогичных опытах с вирусом болезни Ауески получены менее демонст-
ративные результаты. Это можно объяснить тем, что основное место репликации
вируса болезни Ауески — верхний отдел респираторного тракта.
Вирус иммунодефицита кошек вводили интраназально, интраректально или
парентерально. Гуморальный или клеточный иммунитет образовывался при всех
способах, однако был более выражен при введении антигена непосредственно в
лимфоузлы [1459].
Молочная железа
Несмотря на многообразие защитных факторов, содержащихся в секрете мо-
лочной железы, включая клеточные компоненты (Т- и В-лимфоциты, макрофа-
ги, нейтрофилы), неспецифические растворимые факторы (липиды, лизоцим,
лактоферрин и др.), а также полезную микрофлору (например, lactobaccilus
bifidum), решающую роль в предотвращении инфекционных заболеваний ново-
рожденных животных играют колостральные и молочные иммуноглобулины.
Молочная железа является неотъемлемой частью общей иммунной системы сли-
зистых покровов. В молозиве и молоке содержится значительное количество се-
креторного IgA.
Исследования с использованием различных экспериментальных моделей
показали, что перорально заданные антигены могут индуцировать IgA-антитель-
ный ответ в молочной железе. Эти данные служат прямым доказательством на-
личия иммунологической взаимосвязи кишечник - молочная железа. Рассмат-
риваемая система включает в себя антигенную сенсибилизацию клеток пейеро-
вых бляшек кишечника с последующим транспортом IgA в молочную железу.
Было установлено, что лимфоидные клетки мезентериальных лимфоузлов, веду-
щие свое происхождение из пейеровых бляшек, осуществляют специфический
homing в молочной железе и, по-видимому, там синтезируют антитела класса
IgA. Возможно, что циркулирующие в крови димерные IgA, образованные в ки-
шечнике, могут транспортироваться в молочную железу и связываться там с се-
креторным компонентом на железистом эпителии, а затем выделяются с моло-
ком. Однако этот механизм не является абсолютным для всех видов животных.
Например, у крыс сывороточный IgA в молоке отсутствует. Гепатоциты крыс на-
столько эффективно улавливают сывороточные IgA, что их не обнаруживают на
других секреторных поверхностях, в том числе и в молочной железе. Аналогич-
ный феномен имеет место, скорее всего, и у овец, у которых в период лактации
также отмечали усиленную конкуренцию между гепатоцитами и секреторными
клетками молочной железы в отношении сывороточного 9S—IgA [169].
Несмотря на несколько меньшую изученность, иммунологическая взаимо-
связь лимфоидной ткани системы BALT и молочной железы подтверждена экс-
периментально.
Изучение молочной железы свиней и других моногастричных млекопитаю-
щих показало преобладание IgA плазматических клеток в соединительной тка-
ни, примыкающей к молочным протокам и альвеолам, однако количество имму-
ноглобулинпродуцирующих клеток в молочной железе значительно варьирует в
зависимости от физиологического состояния организма, достигая максимума к
заключительному периоду беременности. Можно провести интересную парал-
лель между этими данными и результатами изучения миграции IgA иммуноцитов
из лимфоидной ткани кишечника в молочную железу мышей на позднем этапе
беременности и на протяжении лактации. Данный процесс находится под гор-
мональным контролем и, по-видимому, обусловлен воздействием гормонов,
влияющих на ход беременности и лактации.
Возможно, что лактогенные гормоны стимулируют локальный синтез 1g или
активируют расположенные на железистой поверхности молочной железы моле-
кулы секреторного компонента, улавливающие димерную форму IgA из системы
кровообращения.
В отличие от большинства видов млекопитающих, у крупного рогатого ско-
та и других жвачных IgA, по-видимому, не играет доминирующей роли ни в ак-
тивном, ни в пассивном иммунитете. Преобладающим классом иммуноглобули-
нов молозива и молока этих видов является IgG. Можно предположить, что IgG2
у жвачных выполняет функцию, аналогичную IgA у других видов животных.
Имеются данные, свидетельствующие, что изотиповая специфичность анти-
тельного ответа в лактирующей молочной железе может определяться природой
антигена, контактирующего со слизистыми поверхностями респираторного или
кишечного трактов [169].
Существующая иммунологическая взаимосвязь между отдельными секре-
торными поверхностями, реализуемая в рамках общей иммунной системы сли-
зистых покровов, в известной степени определяет стратегию вакцинопрофилак-
тики так называемых локальных вирусных инфекций. В этой связи наиболее ин-
тересной представляется иммунологическая кооперация GALT-молочная
железа. Установлено, что перорально заданные антигены могут индуцировать в
молочной железе IgA-антительный ответ. Рассматриваемый механизм включает
антигенную сенсибилизацию клеток пейеровых бляшек кишечника с последую-
щим транспортом IgA иммунобластов в молочную железу; лимфоидные клетки,
происшедшие от пейеровых бляшек, осуществляют специфический homing че-
рез мезентериальные лимфоузлы в молочную железу и здесь, по-видимому, син-
тезируют антитела класса IgA.
Важное значение имеет еще один вид иммунологической взаимосвязи
BALT — молочная железа. В результате антигенной сенсибилизации предшест-
венники IgA-продуцирующих клеток из BALT могут мигрировать в молочную
железу и дать начало новым клонам клеток, синтезирующим специфические ан •
титела класса IgA.
Таким образом, практически во всех исследованиях на животных и людях ус-
тановлено, что иммунизация на слизистые сопровождается образованием IgA- и
IgG-антител и, в ряде случаев, развитием клеточного иммунитета. Однако для
образования специфических антител в высоких титрах требуется, как правило,
дву- и даже трехкратная вакцинация. Иммунизация через слизистые является
актуальной при ряде вирусных заболеваний человека (полиомиелит, грипп, РС-
инфекция, ротавирусный энтерит) и животных (желудочно-кишечные и респи-
раторные болезни молодых животных, особенно птиц). Ее эффективность зави-
сит от многих факторов: вид вакцины (живая, инактивированная), способа и
кратности применения, особенности патогенеза вирусной инфекции, возраста и
наличия иммунного фона у пациентов. Несмотря на практически одинаковую
эффективность парентеральной и местной (оральной, назальной) вакцинации,
при некоторых инфекциях (полиомиелит, грипп) местный иммунитет, связан-
ный с образованием IgA-антител, возможно, играет важную роль в предотвраще-
нии и ограничении вирусной инфекции.
В заключение следует отметить, что иммунный ответ представляет собой
сложный многогранный процесс, в котором все реакции на различных этапах
иммунного реагирования функционируют как единая взаимосвязанная система.
В норме иммунная система тонко сбалансирована и обеспечивает тесную коопе-
рацию факторов местного и системного гуморального, а также клеточного им-
мунитета.
Возникновение и продолжительность иммунного ответа на масштабную ви-
русную инфекцию и установление продолжительной способности (памяти) от-
вечать более быстро (вторичный или анамнестический ответ) на реинфекцию
тем же вирусом является результатом каскадного взаимодействия клетка-клетка
и секреции цитокинов.
Отдельные типы Т-лимфоцитов выполняют регуляторную и эффекторную
функции и секретируют различные лимфокины. Тх-лимфоциты, несущие
поверхностный маркер СД4, различают вирусные пептиды в ассоциации с бел-
ком МНС II на поверхности антигенпрезентирующих клеток. Они затем секре-
тируют цитокины, которые в дальнейшем активируют другие клетки, включая
Тх-, Тц- и В-лимфоциты. Усиливаясь, Тц-лимфоциты становятся цитотоксичес-
кими, а В-клетки продуцируют антитела.
Некоторые Тх-лимфоциты, экспрессирующие СД4, секретируют лимфоки-
ны, которые останавливают воспаление и значительно усиливают иммунный от-
вет привлечением моноцитов макрофагов и других Т-клеток к месту вирусной
инфекции.
Цитотоксические Т-лимфоциты, несущие поверхностный маркер СД8, раз-
личают вирусные пептиды, экспонированные на поверхности клеток мишеней в
ассоциации с молекулами МНС класса 1. Активация и последующий цитолиз
клеток мишеней Тц-клетками требует прямого контакта между ними («поцелуй
смерти»).
Иммунный цитолиз инфицированных вирусом клеток является существен-
ным фактором в избавлении от вирусной инфекции и представляет собой сум-
марный результат действия четырех различных механизмов, включающих Тц-
клетки, антителозависимую комплемент-опосредованную цитотоксичность, ан-
тителозависимую клеточно-опосредованную цитотоксичность и NK-клетки.
Последние активируются интерфероном или прямо вирусными гликопротеина-
ми. Они не обладают иммунологической специфичностью и преимущественно
лизируют клетки, инфицированные вирусом. Активация комплемента не требу-
ет антител и проявляет действие немедленно после инфицирования. В присутст-
вии антител макрофаги могут поглощать и разрушать инфицированные вирусом
клетки. Активация комплемента не требует антител и проявляет действие немед-
ленно после инфицирования.
Эффекторный Т-клеточный ответ обычно является преходящим: при неко-
торых острых инфекциях пик Тх- и Тц-активности наблюдается спустя 1 неделю
после возникновения вирусной инфекции и исчезает через 2-3 недели. Обычно
Т-клетки СД8 обеспечивают более высокую защиту, чем Т-клетки СД4. Т-кле-
точный ответ, как правило, обладает более широкой специфичностью, чем ви-
руснейтрализующие антитела и создает перекрестную защиту между антигенны-
ми вариантами вируса.
Таким образом, вирусная инфекция стимулирует различные типы иммунно-
го ответа, направленного на инактивацию свободного вируса и уничтожение ин-
фицированных клеток. В нем участвуют как специфические факторы защиты
(гуморальный и клеточный иммунитет), так и неспецифической резистентности
(NK- и другие клетки, цитокины, комплемент, сывороточные ингибиторы). По-
следние предсуществуют в организме и действуют без промедления. Для выра-
ботки специфических факторов требуется определенный период, поэтому их за-
щитное действие наиболее эффективно проявляется при реинфицировании или
после вакцинации.
6.7. Некоторые особенности патогенеза
и иммунитета при вирусных инфекциях
Эффективная иммунизация организма против вирусных инфекций тесно
связана с их пато- и иммуногенезом. Поэтому рациональное проведение вакци-
нации, а также максимальная ее эффективность требуют изучения иммунологи-
ческих и патогенетических основ инфекционного процесса.
Выздоровление от вирусной инфекции обеспечивают, по крайней мере, три
феномена:
1) подавление репродукции вируса и нейтрализация инфекционности вирионов;
2) разрушение инфицированных клеток;
3) образование интерферона.
Иммунный цитолиз инфицированных вирусом клеток является существен-
ным фактором в выздоровлении от вирусной инфекции, в основе которого ле-
жат различные процессы, включающие Тц-клетки (антителозависимая, компле-
ментзависимая цитотоксичность). Циркулирующие антитела играют важную
роль в выздоровлении от многих генерализованных инфекций (пикорна-, тога-,
флави-, парвовирусной и других инфекций). Менее важная роль Т-лимфоцитов
связана с тем, что иммунодоминантные Тц-детерминанты часто находятся на
консервативных белках, локализованных внутри вириона или на неструктурных
вирусных белках, которые находятся только в инфицированных клетках. При ге-
нерализованных инфекциях вирус могут нейтрализовать только те антитела, ко-
торые связываются с рецепторами поверхности вириона, которыми они при-
крепляются к клетке и блокируют адсорбцию и проникновение вируса в клетку.
Некоторые моноклональные антитела, не обладающие нейтрализующей актив-
ностью, могут способствовать выздоровлению — предположительно, благодаря
антитело-зависимой клеточной цитотоксичности, комплемент-зависимому ли-
зису антителами. В присутствии антител макрофаги могут поглощать и перева-
ривать инфицированные вирусом клетки.
NK-клетки активируются интерфероном или непосредственно вирусными
гликопротеинами. Они не обладают иммунологической специфичностью, но
преимущественно лизируют клетки, инфицированные вирусом.
Изучение патогенеза вирусных инфекций выявило различные стратегии, ис-
пользуемые вирусами для того, чтобы избежать защитной реакции организма.
Организм, в свою очередь, использует различные иммунные механизмы для пре-
одоления «изощрений» в реализации патогенного потенциала вирусов.
Ниже приведены основные примеры стратегии вирусов, направленные на
преодоление или снижение иммунологического прессинга со стороны хозяина
[1135, 1178, 1427].
1. Репликация без цитопатогенного действия
Аренавирусы и хантавирусы, например, вызывают хронические инфекции у
грызунов без гибели клеток, в которых они размножаются. Инфекция, как пра-
вило, не сопровождается заметными изменениями в организме. Ретровирусы
также не вызывают изменений в клетках-мишенях, тканях и органах естествен-
ных хозяев.
2. Распространение от клетки к клетке путем сплавления мембран
Лентивирусы, морбилливирусы и герпесвирусы (цитомегаловирусы) вызы-
вают слияние клеток, обеспечивая передачу вирусного генома от клетки к клет-
ке и избавляя его от влияния гуморальных иммунных механизмов хозяина.
3. Латентная непродуктивная инфекция непермиссивных клеток
Вирус может размножаться продуктивно в клетках одного типа и вызывать
непродуктивную латентную инфекцию в клетках другого типа. Многие герпес-
вирусы находятся в латентном состоянии в нервных ганглиях или В-лимфоци-
тах, но размножаются продуктивно и вызывают острые поражения эпителиаль-
ных клеткок слизистых. Пермиссивность клеток может зависеть от стадии диф-
ференциации или активации. Например, папилломавирусы поражают
базальные клетки эпителия в начале дифференцировки, но образуют инфекци-
онные вирионы только в полностью дифференцированных клетках вблизи по-
верхности тела.
4. Частичная экспрессия вирусных генов
Латенция вирусов может поддерживаться ограниченной экспрессией генов,
которая может убивать клетки. В течение латентной инфекции некоторые виру-
сы, такие как герпесвирусы, экспрессируют только ранние гены, которые необ-
ходимы для поддержания латенции. В течение реактивации, которую часто сти-
мулирует иммуносупрессия и/или действие цитокинов или гормонов, полный
вирусный геном транскрибируется снова. Эта стратегия в течение латентного со-
стояния защищает вирус от всех иммунных механизмов организма.
5. Разрушение эффекторных клеток иммунитета и макрофагов
Многие вирусы размножаются продуктивно или абортивно в клетках лимфо-
идной или ретикуло—эндотелиальной системы, которые, тем самым, участвуют
в создании персистентной инфекции. Лимфоциты и макрофаги являются иску-
шающими мишенями для любых вирусов, они разносят вирусы по организму, а
также играют ключевую роль в иммунном ответе. Исключительным примером
разрушения иммунной системы является вирус иммунодефицита человека, раз-
множающийся в СД4 Т-лимфоцитах и клетках моноцит-макрофагального ряда
и вызывающий глубокую иммунную депрессию и гибель от вторичных инфек-
ций или от неоплазий.
Геном цирковируса анемии цыплят кодирует небольшой белок (13 кД), полу-
чивший название апотин, который сам по себе вызывает гибель Т-лимфоцитов
и рассматривается как важный фактор патогенеза при данной инфекции у цып-
лят [1527].
6. Подавление МНС-регуляции антигенной экспрессии
Т-клетки СД8 и СД4 различают вирусные пептиды во взаимодействии соот-
ветственно с МНС I, МНС II, а в присутствии вируса концентрация молекул
МНС на клеточной поверхности уменьшается. Аденовирусы кодируют ранний
протеин, который связывается с вновь синтезированным антигеном МНС I,
препятствуя его нормальному процессингу и, тем самым, уменьшает его экс-
прессию на поверхности клеток.
Бетагерпесвирусы в дополнение к снижению регулирующей экспрессии
МНС I исключают лизис хозяинных клеток Тц-лимфоцитами, синтез молекул-
подобных МНС I, которые действуют как ловушки, защищая от лизиса NK-
клетки, которые сами лизируют клетки, не экспонирующие нормальные ком-
плексы с МНС I.
7. Устранение действия цитокинов
Интерфероны играют важную роль как антивирусные агенты и как иммуно-
модуляторы. Однако некоторые вирусы содержат гены, которые блокируют ан-
тивирусное действие эффекторных молекул.
8. Избегание нейтрализации антителами (маскирование эпитопов и иммун-
ные ловушки)
Все еще непонятно, каким образом филовирусы, аренавирусы и асфаровиру-
сы устойчивы к нейтрализации сывороткой инфицированных людей и живот-
ных. Одной из особенностей вируса Эбола является использование иммунных
ловушек для избежания нейтрализации; вирус образует 2 гликопротеина, один
из которых формирует пепломеры на поверхности вириона, другой, а может
быть, тот же самый, производится в большом количестве и секретируется из кле-
ток. Этот белок, вероятно, связывает антитела и тем самым защищает вирус.
9. Индукция не нейтрализующих антител
Для многих персистентных инфекций (табл. 16) характерно присутствие ви-
рус-специфических антител в низком титре при высоком титре антител против
не нейтрализуемых эпитопов вируса. В последнем случае комплекс вирус-анти-
тела и вирусный антиген могут накапливаться на базальных мембранах почеч-
ных клубочков или в других местах, вызывая различную иммунную патологию
или неопластические заболевания.
Например, при многих ретровирусных инфекциях, в том числе при Алеут-
ской болезни норок, не нейтрализующие антитела часто, соединяясь с вириона-
ми, блокируют присоединение нейтрализующих антител. Поэтому при создании
новых вакцин против инфекционного перитонита кошек, PC- болезни, вирус-
ной диареи КРС, инфекционной анемии лошадей, артрита-энцефалита коз и др.
необходимо учитывать экспрессию естественных недоминантных нейтрализую-
щих эпитопов.
Таблица 16. Вирусы человека, вызывающие персистентную инфекцию [670]
Вирус Заболевание или состояние
Цитомегаловирус Ринит, пневмония, энцефалит
Энтеровирус Хронические возрастные менингоэнцефалиты
Вирус Эпштейн-Барра Лимфопролиферитивные нарушения
Вирус гепатита В Хронический гепатит, гепатоклеточная карцинома
Вирус гепатита С Хронический гепатит, гепатоклеточная карцинома
Вирус простого герпеса тип 1 и 2 Возвратная слизистокожная инфекция, энцефалит
ВИЧ Иммунодефи цит
Т-лимфотропный вирус человека Лейкемия
Вирус кори Панэнцефалит
Папилломавирус Цервикальная карцинома, бородавки, папилломатоз
Парвовирус В19 Агранулоцитоз, гранулоцитная аплазия
Варицелла — зостер вирус Возвратная инфекция (опоясывающий лишай или ветрянка)
10. Индукция иммунологической толерантности
Вероятность превращения острой инфекции в персистентную обычно связа-
на с возрастом; конгенитальное инфицирование наиболее вероятно индуцирует
иммунологическую толерантность. Аренавирусные и некоторые ретровирусные
инфекции, вирусная диарея КРС и классическая чума свиней представляют осо-
бую проблему, связанную с транспланцентарным инфицированием и длитель-
ным выделением вируса новорожденными при отсутствии эффективного имму-
нитета. Во многих случаях толерантность связана не с В-клетками, а с тем, что Т-
клетки в значительной степени не реагируют на вирус. Такое явление
установлено при лимфоцитарном хариоменингите мышей. Внутриутробное
заражение потомства не сопровождается Т-клеточным ответом на вирус. Обра-
тимость этого явления указывает на то, что оно не связано с потерей клонов ви-
русреактивных Т-клеток в эмбриональный период, а обусловлена клональной
анэргией или образованием супрессора Т-клеток.
Приведенные данные наглядно свидетельствуют о том, что в процессе эво-
люции у вирусов вырабатывались различные механизмы, позволяющие в той
или иной степени избегать ответных реакций со стороны иммунной системы.
Эти механизмы специфичны для каждой отдельной группы вирусов. Для защи-
ты от вирусной инфекции организм, в свою очередь, использует различные ти-
пы иммунитета и поэтому необходимо как можно полнее изучить разновиднос-
ти иммунного ответа, необходимые для защиты от разных вирусов.
Такие знания нужны при создании эффективных средств специфической
профилактики вирусных болезней, которые должны защищать от инфицирова-
ния или, по крайней мере, существенно ограничивать репликацию вируса в те-
чение длительного времени после вакцинации (иммунологическая память).
Патогенез вирусных заболеваний человека и животных разнообразен, одна-
ко вирусы по их дифференцированному тропизму можно разделить на три ос-
новные категории: первая — вирусы, поражающие слизистые оболочки респира-
торных органов или желудочно-кишечного тракта (ортомиксо-, корона-, рота-,
тоговирусы, вирусы парагриппа, респираторно-синцитиальный вирус и обшир-
ная группа мелких энтеропатогенных вирусов); вторая - вирусы, реплицирую-
щиеся на слизистых поверхностях, а затем системно распространяющиеся через
кровоток или нервную систему и вызывающие поражение висцеральных орга-
нов-мишеней, кожи или центральной нервной системы (пикорна-, парамиксо-,
гепрес-, парво-, калици-, аденовирусы); третья — вирусы, проникающие непо-
средственно в кровяное русло инъекционным путем через укус насекомого — пе-
реносчика вирусного агента или в результате травмы, а затем мигрирующие к
своим органам-мишеням (альфа-, флави-, бунья-, рабдо-, орби-, лентивирусы,
вирус гепатита В) [1131]. Необходимо отметить, что такое разделение во многом
условно и не является исчерпывающим.
В отличие от вирусов второй и третьей категорий, эффективную защиту от
которых осуществляют в основном включением системного иммунного ответа,
механизмы иммунитета к вирусам первой категории характеризуются несколь-
Таблица 17. Стратегии вирусов, позволяющие избежать зависимости от хозяина
[1178, 1427]
Проявления Механизм Примеры
Нецитопатогенное инфицирование Без остановки нуклеинового и белкового синтеза клетки Аренавирусы, хантавирусы, ретро- вирусы у естественного хозяина
Распространение от клетки к клетке Слияние клеточных мембран Лентивирусы (вирус ИНАН и др.), морбилливирусы (вирус чумы собак и др.), герпесвирусы (цитомегаловирусы)
Инфицирование непермиссивных, покоящихся или недифференциро- ванных клеток Отсутствие повышенной регуляции экспрессии генов Герпесвирусы в нервных ганглиях, папилломавирусы в базальном слое эпителия, лентивирусы в лимфоцитах
Слабая экспрессия или отсутствие вирусного антигена на клеточной мембране Инфекция с ограниченной экспрессией генов Лентивирусы в лимфоцитах и макрофагах, герпесвирусы в нервных ганглиях
Потеря вирусного антигена путем «обдирания» или эндоцитоза Вирус болезни Марека в Т-клет- ках, вирус чумы собак в нейронах, цитомегаловирус в эпителии
Разрушение иммунных эффекторных клеток и макрофагов Инфицирование лимфоцитов Вирус иммунодефицита человека, вирус инфекционной болезни бурсы птиц, цитомегаловирус, вирус панлейкопении кошек, вирус иммунодефицита кошек
Инфицирование макрофагов Вирус, повышающий уровень лактатдегидрогеназы, вирус африканской чумы свиней
Снижение регуля- ции МНС-анти- генной экспрессии Угнетение продукции вирусных белков или созревания МНС-белков Аденовирусы, ретровирусы
Избегание действия цитокинов Вирусные белки подавляют интерферон и действие других ЦИТОКИНОВ Аденовирусы, герпесвирусы
Избегание действия нейтрализующих антител Продукция большого количества растворимых вирусных белков, которые связывают антитела Вирусы Эбола и Марбург; Ласа- вирус и другие аренавирусы
Маскирование вирусных эпитопов углеводами гликопротеинов Вирус лихорадки долины Рифт, аренавирусы, Эбола и Марбургвирусы
ко иной природой и требуют обязательного вовлечения компонентов местной
защиты.
Некоторые энтеропатогенные вирусы (рота-, коронавирусы и др.) вызывают
заболевание с коротким инкубационным периодом, поражая слизистые желудоч-
но-кишечного тракта. Диарею чаще вызывают рота- и коронавирусы. К другим
Таблица 17. Продолжение
Проявления Механизм Примеры
Индукция антител, не нейтрализую- щих вирус Продукция низкоаффинных антител или антител, реаги- рующих с второстепенными эпитопами на иммунных ловушках Вирус лимфоцитарного хориоменингита, вирус африканской чумы свиней, вирус алеутской болезни норок
Усиление антителами Антитела прикрепляются к вирусу и усиливают инфи- цированность макрофагов Цитомегаловирусы, вирус, повы- шающий уровень лактатдегидро- геназы, вирус инфекционного перитонита кошек, вирус денге человека
Отсутствие продукции антител Не иммуногенный агент Скрепи
Индукция иммунологической толерантности Индукция клональной анергии или специфическая супрессия Т-клеток Вирус вирусной диареи крупного рогатого скота, вирус классичес- кой чумы свиней, аренавирусы, некоторые ретровирусы
Секвестрирование иммунологически привилегирован- ных тканей Репликация вирусов в местах, недоступных иммунному ответу Вирус бешенства в мышечных клетках, вирусы бешенства и псевдобешенства в нейронах
Интеграция вирусного генома в геном клетки Процесс, напоминающий рекомбинацию Ретровирусы
Генетический антигенный дрейф Мутации, ведущие к антигенным вариантам Вирусы гриппа, ящура, Мэди- висна, инфекционной анемии лошадей
Генетический полиморфизм Вирус иммунодефицита человека
вирусам, вызывающим диарею, особенно у животных, относятся торо-, калици-
и астровирусы, а также некоторые адено-, и парвовирусы. Корона- и особенно
ротавирусы поражают энтероциты на верхней части ворсинок, вызывая заметное
укорочение и слияние их, что ведет к уменьшению абсорбционной поверхности
кишечника. Инфекция обычно начинается в верхней части тонкого отдела ки-
шечника и распространяется на тощую и подвздошную, а иногда на слепую киш-
ку. Интенсивность болезни зависит от вирулентности вируса, вида, возраста и
иммунологического статуса организма. По мере развития болезни абсорбтивные
клетки замещаются незрелыми кубоидальными эпителиальными клетками со
сниженной абсорбтивной и энзиматической активностью, но более устойчивыми
к вирусу. Ведущая роль в защите от этих агентов принадлежит факторам местно-
го иммунитета и прежде всего секреторному IgA. Более того, даже если вирусы
вызывают общее заболевание (полиомиелит, корь, ящур и др.), то и в этом случае
инфекция развивается только при беспрепятственном размножении вируса в ме-
сте его проникновения в организм. Секреторные IgA могут подавить размноже-
ние вируса и предотвратить инфекцию. Наиболее ярким примером может слу-
жить пероральная иммунизация против полиомиелита живой вакциной, вызыва-
ющей образование секреторных антител, препятствующих репликации вируса в
слизистой оболочке кишечника. Парентеральная иммунизация инактивирован-
ной вакциной способствует образованию сывороточных антител, защищающих
от системной инфекции, но практически не оказывающих влияния на реплика-
цию полевого вируса в кишечнике [43]. Хотя парвовирус свиней тоже инфициру-
ет кишечник, однако основной характеристикой патогенетического процесса в
данном случае является репликация вируса в лимфоидных клетках кишечника с
дальнейшим распространением в организме, и это определяет доминирующую
роль системного иммунного механизма при данной инфекции [138]. Вирусы, рас-
пространяющиеся гематогенно, как правило, имеют продолжительный период
инкубации и могут быть нейтрализованы и элиминированны механизмами гумо-
рального иммунитета. В этом случае инфицирование органа-мишени можно пре-
дотвратить или подавить без развития заболевания. Известно, например, что вы-
раженный синтез антител против поверхностного (HBs) антигена вируса гепати-
та В практически адекватен иммунитету против заражения этим вирусом.
Таким образом, для защиты организма от вирусов второй и третьей катего-
рий достаточно присутствия сывороточных вируснейтрализующих антител.
Гуморальный противовирусный иммунный ответ в основном рассматривают
как благоприятный для организма процесс, который в сочетании с клеточными
иммунными механизмами, как правило, способствует выздоровлению. Однако
существуют вирусы (герпесвирусы, гепатита В и др.), которые, несмотря на им-
мунный статус, длительно персистируют в организме хозяина. При некоторых
вирусных инфекциях возможны иммунопатологические реакции. Так, антитела
против вируса денге способствуют повышению его вирулентности у частично
иммунных особей. Опосредованное антителами усиление репликации вируса
денге в макрофагах объясняется повышенным связыванием иммунных ком-
плексов с Fc-рецепторами клеточной поверхности. Иммунокомплексная пато-
логия лежит в основе патогенеза ряда вирусных инфекций, в том числе при лим-
фоцитарном хориоменингите и алеутской болезни норок [1422]. Следовательно,
одним из важных аспектов защиты от данных инфекций является разработка вы-
сокоиммуногенных вакцин.
Проникновение вирусов в организм, как правило, сопровождается образова-
нием вируснейтрализующих антител. Исключение составляют ряд вирусов и
прежде всего, вирус африканской чумы свиней. Инфицирование этим вирусом
не индуцирует синтез вируснейтрализующих антител, хотя в сыворотке крови
выявляют комплементсвязывающие, преципитирующие и задерживающие ге-
мадсорбцию антитела. Отсутствие вируснейтрализующих антител обусловливает
неспособность организма связывать и элиминировать циркулирующий вирус,
что сопровождается высокой летальностью и сводит на нет попытки создания
эффективной вакцины [242].
Важное значение антител в защите от заболевания можно продемонстриро-
вать следующим примером. Дети с тяжелой агаммаглобулинемией выздоравли-
вают нормально от кори, но очень плохо защищены от паралитического полио-
миелита, несмотря на прививку живой полиовирусной вакциной. Такие дети
имели нормальный, опосредованный клетками и интерфероном иммунитет,
нормальный фагоцитоз и нормальную систему комплемента, но не могли обра-
зовывать антитела, которые особенно важны, чтобы вирус с током крови не по-
пал в нервную систему [1135]. Следует отметить, что полиовирус имеет два орга-
на-мишени: кишечник и центральную нервную систему, которые поражаются в
указанной последовательности.
Наряду с гуморальными факторами, играющими важную роль в ограниче-
нии распространения вирусов в организме, существенное значение при различ-
ных вирусных инфекциях имеет клеточный иммунитет. Так, убедительно доказа-
но значение цитотоксических Т-клеток в формировании специфического им-
мунного статуса при многих системных инфекциях, особенно вызываемых
вирусами «второй категории». Об этом свидетельствует, например, необычайно
тяжелое течение болезни, обусловленное вирусом герпеса у детей с иммуноде-
фицитом, связанным с дефектом Т-клеточной системы. Известно, что реплика-
ция аттенуированного вируса необходима прежде всего для развития выражен-
ного клеточного иммунитета, в то время как инактивированные вакцины инду-
цируют, главным образом, гуморальный иммунный ответ [1131]. Кроме того,
иммунизация живыми вакцинами через слизистые покровы может приводить и
к выраженному местному синтезу антител, которые способны эффективно пре-
дотвращать локальную колонизацию (например, кишечника энтеропатогенны-
ми вирусами, а дыхательного тракта респираторными вирусами), блокируя та-
ким образом развитие инфекции уже на уровне места проникновения и репли-
кации вируса. С учетом указанной взаимосвязи, несомненный интерес
представляют вирусы со строго дифференцированным тропизмом в отношении
клеток слизистого покрова, в защите которых главенствующая роль принадле-
жит факторам иммунной системы слизистых покровов.
К широко распространенным вирусным инфекциям респираторного тракта
человека и животных относятся грипп, парагрипп и респираторно-синцитиаль-
ная инфекция. Они считаются «локальными» инфекциями: клетки эпителия ды-
хательных путей представляют не только «входные ворота» возбудителя, но и ос-
новное место его репликации. Разрушение цилиарного эпителия воздухоносных
путей часто сопровождается активацией нормальной микрофлоры респиратор-
ного тракта и развитием секундарной инфекции. При гриппе и других респира-
торных вирусных инфекциях на поверхности эпителиальных клеток дыхатель-
ных путей прочно фиксируются секреторные антитела класса IgA (11S), которые
являются первым и главным звеном защиты организма. Однако следует отме-
тить, что нижние отделы респираторного тракта человека содержат большее ко-
личество IgG, чем носоглоточная область. Секреторные IgA отличаются от сыво-
роточных антител меньшей специфичностью, поскольку они способны нейтра-
лизовать инфекционную активность гетерологичных штаммов в пределах
подтипа [1489].
Среди секреторных и сывороточных антител наибольшее значение имеют
вирусспецифические антитела к поверхностным гликопротеинам и, главным об-
разом, к НА. Если антитела к НА нейтрализуют инфекционность вируса, то ан-
титела к NA в основном ограничивают распространение инфекции, снижая ее
интенсивность.
Помимо антител к гликопротеинам при респираторной инфекции образуют-
ся антитела к внутренним белкам вируса, в основном к нуклеопротеину (NP) и
матриксному (М) белку. В отличие от поверхностных штаммоспецифических
гликопротеинов, внутренние белки являются типоспецифическими антигена-
ми, то есть индуцируют синтез антител, образующих иммунные комплексы со
всеми штаммами вируса одного типа. Несмотря на индукцию гуморального и
клеточного ответа, NP-белок вируса гриппа не создавал протективного иммуни-
тета. Протективный эффект при пассивном переносе сывороточных IgG (осо-
бенно анти-НА) подтверждает их главную роль в гуморальном иммунитете при
гриппе и других респираторных вирусных инфекциях.
Устойчивость к респираторным вирусным инфекциям при отсутствии анти-
тел в сыворотке крови приписывают действию специфически сенсибилизиро-
ванных цитотоксических Т-лимфоцитов. Адаптивный перенос таких клеток за-
щищал мышей даже от летального инфицирования вирусом гриппа. С их при-
сутствием связывают относительно высокую (50%) частоту субклинических
инфекций в период пандемий гриппа. Такие клетки обнаруживали в перифери-
ческой крови иммунных доноров и в легких привитых мышей. Они взаимодей-
ствуют в основном с перекрестно-реагирующими детерминантами внутренних
белков вируса гриппа одного типа. Несмотря на то, что некоторые из них «узна-
ют» НА вируса, тем не менее для большинства перекрестно реагирующих Тц-
лимфоцитов основной «мишенью» является вирионный белок NP.
Полагают, что свойством различать антигенные детерминанты обладает осо-
бый клон Тц-лимфоцитов, наделенный иммунологической памятью, которая
усиливается при естественном инфицировании организма. Время полужизни
вирусспецифических Тц-лимфоцитов у человека составляет 2-3 года. К специ-
фическим факторам клеточного иммунитета относят также Тц-клетки с гипер-
чувствительностью замедленного типа. Антителозависимая цитотоксичность
определяется всецело наличием антител и является своеобразным связующим
звеном между клеточным и гуморальным иммунитетом. Это же положение под-
тверждается на примере Т-хелперов, которые способствуют продукции как
Тц-лимфоцитов, так и антител.
При первичном инфицировании, когда еще не развились специфические
факторы защиты, в борьбу с возбудителем включаются клеточные и гумораль-
ные факторы неспецифической резистентности. Индуцируемая вирусом гриппа
активность естественных киллеров (NK) обусловлена главным образом НА- и
NA-антигенами.
Таким образом, иммунитет при гриппе ассоциируется с развитием гумораль-
ного ответа, а также формированием вирусспецифического клеточного иммуни-
тета. Основные факторы гуморального иммунитета — вируснейтрализующие ан-
титела секретов и сыворотки - обеспечивают защитный эффект в основном при
реинфекции вирусом, проявляющейся даже спустя много лет после первичного
инфицирования. Наибольшее значение для защиты имеют штаммспецифичес-
кие антитела к НА вируса.
Иммунитет, индуцированный инактивированными гриппозными вакцина-
ми, связывают с действием сывороточных антител. Живые вакцины обеспечива-
ют длительный местный иммунитет слизистых оболочек с синтезом секретор-
ных антител и, кроме того, транзиторный ответ сывороточных антител [43]. Ус-
тойчивость организма к респираторным вирусам, как, впрочем, и ко многим
другим вирусам, представляет собой многофакторный феномен, обусловленный
как специфическими факторами иммунитета, так и неспецифической резис-
тентностью.
В пато- и иммуногенезе при респираторно-синцитиальных (PC) инфекциях
человека и крупного рогатого скота имеется большое сходство. Заболевание про-
текает наиболее тяжело у детей и телят в возрасте 1—3 мес на фоне материнских
антител. Инфицирование сопровождается появлением в респираторном тракте
противовирусных антител, принадлежащих к IgM, IgA и IgG. Ускоренная их
продукция отмечается при повторном заражении или иммунизации. На поверх-
ности эпителиальных клеток верхних дыхательных путей при РС-инфекции
идентифицированы антитела всех изотипов, но преимущественно IgA [146, 887].
Однако не выявлено корреляции между уровнем вирусспецифических IgA и
приживляемостью вируса в носоглотке [198].
Важная роль клеточного иммунитета как фактора защиты от респираторно-
синцитиальной инфекции была доказана экспериментально. Перенос мышиных
донорских иммунных Т-лимфоцитов зараженным мышам с нарушенным кле-
точным иммунитетом предупреждал развитие инфекции. Вирусспецифические
Тц-лимфоциты разрушают клетки-мишени, инфицированные гомологичным и
гетерологичным (А и В) вариантами РС-вируса [146]. Существенный вклад в
предотвращение болезни и выздоровление от РС-инфекции вносят клеточные
механизмы, опосредованные специфическими антителами. Инфицированные
вирусом моноциты лизируются лимфоцитами в присутствии иммунной сыво-
ротки. Только живой PC-вирус и рекомбинантный вирус вакцины, экспрессиру-
ющий белок F PC-вируса, индуцировали образование вирусспецифических
Т-лимфоцитов у мышей. Инактивированный PC-вирус или его гликопротеины
F и G таким действием не обладали [1158]. Главным антигеном-мишенью для
Тц-лимфоцитов являлся F-белок и в меньшей степени белок G РС-вируса [887,
1158]. В молозиве рожениц и молоке кормящих иммунных матерей IgA были ад-
ресованы в основном к F белку вируса [1546]. Полученные данные о важной ро-
ли Т-лимфоцитов в элиминации вируса из организма, свидетельствуют о том,
что разрабатываемые вакцины для достижения надежной защиты должны инду-
цировать у привитых индивидумов формирование Т-клеточного иммунитета.
Более того, оказалось, что нуклеопротеид РС-вируса распознается лучше
Т-клетками-эффекторами, чем поверхностный G-гликопротеин. Эти данные в
целом согласуются с данными, полученными в результате изучений механизма
антигенного распознавания при гриппозной инфекции, когда внутренние ви-
русные антигены являются основными структурами, распознаваемыми Тц-лим-
фоцитами [146]. При PC-инфекции имеет место антителозависимая клеточная
цитотоксичность, в которой основной мишенью является F-белок вируса, экс-
прессируемый на поверхности инфицированных клеток. Эта иммунологическая
реакция играет важную роль в защите организма и его выздоровлении от РС-ин-
фекции.
Вирусные инфекции различаются между собой выраженностью гуморально-
го и клеточного иммунитета, участием параиммунных механизмов защиты. При
острых вирусных инфекциях возбудитель довольно быстро исчезает из организ-
ма. При большинстве вирусных болезней доминирует гуморальный иммунитет.
Роль клеточного иммунитета значительна при ряде инфекций, вызываемых обо-
лочечными вирусами (оспа, герпес, ретровирусные инфекции и др.), особенно
когда они передаются непосредственно из клетки в клетку. Вируснейтрализую-
щие антитела не обнаружены при африканской чуме свиней и алеутской болез-
ни норок. Коронавирусы перитонита кошек и инфекционного бронхита кур мо-
гут длительно персистировать при наличии большого количества противовирус-
ных антител.
Многие вирусные инфекции, поражающие органы дыхания и пищеварения,
относятся к «локальным» инфекциям, поскольку клетки, выстилающие слизис-
тые оболочки этих органов, являются не только входными воротами инфекции,
но и основным местом репликации вирусов. В этом случае основная роль в за-
щите принадлежит гуморальным и клеточным факторам местного иммунитета.
Для защиты организма от вирусов, вызывающих заболевание путем переноса
возбудителя через кровоток к органам-мишеням, главное значение имеют сыво-
роточные нейтрализующие антитела и системный клеточно-опосредованный
иммунитет. Известно, что возбудители большинства вирусных инфекций прони-
кают в организм через слизистые оболочки, поэтому изучение механизмов мест-
ного иммунитета приобретает особую актуальность.
Аппликацию живых вакцин на слизистые оболочки при ряде инфекций (по-
лиомиелит, трансмиссивный гастроэнтерит, ротавирусная болезнь свиней и др.)
можно рассматривать как наиболее естественный контакт организма с вирусом,
закрепившийся эволюционно и обусловливающий быстрое развитие местной и
общей защитных реакций. Поскольку иммунный статус слизистых оболочек оп-
ределяется главным образом локальным образованием специфических антител и
Тц-лимфоцитов, разработка и совершенствование средств специфической про-
филактики многих заболеваний (особенно желудочно-кишечных и респиратор-
ных) должны вестись с учетом этих особенностей. Данное требование в полной
мере относится и к лактогенному иммунитету новорожденных. Иммунизация
животных через слизистые покровы живыми вакцинами в ряде случаев оказа-
лась более эффективной по сравнению с парентеральной иммунизацией. Поэто-
му для создания выраженного местного иммунитета необходимо разрабатывать
преимущественно живые вакцины и соответствующие способы их применения.
Инактивированные вакцины для местной иммунизации практически не разра-
ботаны. Исследования по созданию адъювантов для таких вакцин только начи-
наются. Создание выраженного местного иммунитета при парентеральной
иммунизации теоретически возможно, но для этого, по-видимому, потребуется
создание инактивированных препаратов с высокой антигенной активностью.
Учитывая взаимосвязь механизмов системного и местного иммунитета, перс-
пективным представляется сочетание местной и парентеральной иммунизации,
а также комбинированное использование живых и инактивированных вакцин.
Последовательное применение живой, а затем инактивированной вакцины
против полиомиелита было рекомендовано в США вместо трёхкратного введе-
ния живой вакцины. Живая вакцина очень редко вызывает паралитический по-
лиомиелит у вакцинированных и контактировавших с ними людей. Инактиви-
рованную вакцину использовали для предотвращения редких случаев инфици-
рования центральной нервной системы, вызванных живой вакциной. Живую
вакцину использовали для повышения иммунитета слизистой желудочно-ки-
шечного тракта и создания популяционного иммунитета. На сегодня в США ре-
комендовано использовать только инактивированную вакцину.
Одновременное интаназальное применение живой вакцины и парентераль-
ное введение инактивированной вакцины используют при иммунизации людей
против гриппа А. Первая стимулирует образование иммунитета слизистой рес-
пираторного тракта, вторая — системный иммунитет.
Иммунизация живой вакциной с последующей бустеризацией инактивиро-
ванной вакциной оказалась полезной против Венесуэльского энцефалита [1245].
Репликативно-дефектная вакцина против вируса простого герпеса 2 (HSV-2)
при комбинированном введении на слизистую и парентерально создавала хоро-
шую защиту [1101]. Сочетанное использование различных вакцинных препара-
тов, схем и способов их применения может способствовать стимуляции многих
компонентов иммунной системы, тем самым повышая защитный эффект.
При профилактике массовых вирусных заболеваний КРС (ИРТ, ВД и ПГ-3)
хорошие результаты получены в случае сочетанного применения живых, а затем
инаткивированных комбинированных вакцин [149].
Иммунизация против вирусов в ранний период жизни представляет специ-
альную проблему. Одной из причин является недостаточная возрастная имму-
нокомпетентность организма в ранний период жизни. Иммунная система в
поздний эмбриональный и начальный неонатальный период ещё не сформиро-
вана и не завершена полная структурная организация вторичных иммунных
органов.
Другой причиной является подавление иммунного ответа на вакцинацию
нейтрализующими материнскими антителами. Подавляющего действия мате-
ринских антител в случае с живыми вакцинами можно избежать, применяя их
орально или на слизистые оболочки. Например, вакцинный штамм полиовиру-
са после орального введения вакцины хорошо размножается в кишечнике, вы-
зывая выраженный иммунитет [1130].
6.8. Нейтрализация вирусов
Нейтрализующие антитела являются одними из основных средств защитно-
го иммунитета, развивающегося в результате вакцинации или инфицирования.
Во взаимодействии нейтрализующих антител с вирусными антигенами много
неясного. Вместе с тем, каков бы ни был механизм нейтрализации, несомненно
то, что прикрепление нейтрализующих антител к вирусным частицам ведет к по-
тере инфекционное™. Однако для достижения нейтрализации требуется нечто
большее, чем просто связывание антитела с поверхностью вируса. Применитель-
но к некоторым вирусам можно различить нейтрализующие и не нейтрализую-
щие антитела, направленные на различные белки. Более того, имеются антите-
ла, связывающиеся с вирусными антигенами, ответственными за нейтрализа-
цию (например, вируса гриппа или полиовируса), но не вызывающие потери
инфекционное™.
Оказалось, что для нейтрализации оболочечных и безоболочечных вирусов
достаточно относительно небольшого количества молекул антител. Так, для ней-
трализации 50% вируса гриппа требовалось около 50 молекул антител к НА-ан-
тигену а для достижения такого же эффекта нейтрализации полиовируса оказа-
лось достаточным присоединения одной молекулы на одну вирусную частицу
[1645]. Если учесть, что на поверхности вируса гриппа имеется около 1000 отро-
стков, содержащих НА, а в капсиде полиовируса — 60 идентичных антигенных
субъединиц, то окажется, что нейтрализация вируса достигается достаточно не-
большим количеством молекул антител [1359]. Вирус гепатита А, в отличие от
полиовируса, по-видимому, обладает одним доминантным нейтрализующим
участком [1445]. Для нейтрализации вирусов достаточно, чтобы к каждой вирус-
ной частице прикреплялась более чем одна молекула антител, но гораздо мень-
ше, чем требуется для полного насыщения эпитопов нейтрализации антителами.
Относительно связывания нейтрализованного вируса с клетками хозяина суще-
ствуют разноречивые данные. Некоторые нейтрализованные вирусы эффектив-
но связываются с чувствительными клетками (полиовирус, вирусы оспы кроли-
ков, гриппа А), так как места связывания вируса с клеткой отличаются от мест,
ответственных за нейтрализацию [1359].
Аденовирусные частицы после нейтрализации антисывороткой к гексону
или пентону адсорбировались на клетках HeLa с такой же скоростью, как и не-
обработанные, хотя при этом становились чувствительными к ДНКазе. Антите-
ла к отросткам вириона вызывали агрегацию вирусных частиц и ускоряли в 3-5
раз адсорбцию на клетках [1675]. Нейтрализующие антитела лишь частично по-
давляли прикрепление вируса бешенства к клеткам и его интернализацию [586].
Нейтрализация вируса гепатита В оказалась связанной с блокированием участка
прикрепления вируса (npe-Sl-антиген) к гепатоцитам. Связывание нейтрализо-
ванного вируса с клетками зависит от класса антител. Секреторные IgA и IgM
нейтрализуют вирус, препятствуя его прикреплению к клеткам [589].
Вирус гриппа, обработанный IgG или мономерным IgA, адсорбируется и про-
никает в клетки с такой же скоростью, как и нативный вирус. Нейтрализация ви-
руса завершается внутриклеточно. Секреторные IgA и IgM полностью блокируют
прикрепление вирионов к клеткам. Нейтрализация в этом случае происходит, по-
видимому, за счет стерического изменения в структуре вирусного капсида [1500].
Полагают, что в основе нейтрализации вируса гриппа антителами лежит перест-
ройка поверхностных структур НА, приводящая к нарушению транскрипции ге-
нома вируса гриппа в клетках. Нейтрализация вирусов протекает как двухфазный
процесс в виде температуронезависимой фазы соединения вируса с антителами и
температурозависимой собственно нейтрализации вируса [480]. Она зависит,
кроме того, от концентрации антител и их альтернативной антигенной специ-
фичности. Опыты с коронавирусом свиней показали, что с повышением концен-
трации нейтрализующих антител усиливался антивирусный эффект. Так, низкие
концентрации антител в основном нейтрализовали вирус, средние и высокие, кро-
ме того, подавляли связывание его с клеткой и предотвращали интернализацию.
Для эффективной нейтрализации флавивирусов необходимо связывание ан-
тител более чем с одной антигенной детерминантой [1111]. Бивалентное связы-
вание антител оказалось важным условием нейтрализации полиовируса и виру-
са гриппа [589].
Одновременная обработка вируса ньюкаслской болезни двумя монокло-
нальными антителами к белку HN вызывала более выраженную нейтрализацию
по сравнению с действием каждого из них в отдельности. Синергический эф-
фект выявлен при нейтрализации вируса трансмиссивного гастроэнтерита сви-
ней комбинацией двух моноклональных антител, специфичных по отношению к
разным антигенным сайтам вирусного гликопротеина.
Антитела к гликопротеину Н вируса простого герпеса нейтрализуют его, пре-
пятствуя проникновению адсорбированного вируса в клетку [688].
Взаимодействие моноклональных и поликлональных антител с полиовиру-
сом, приводящее к нейтрализации инфекционной активности вирионов, сопро-
вождается агрегацией вирусных частиц.
Нейтрализация поликлональными антисыворотками, по-видимому, являет-
ся суммарным результатом действия различных механизмов нейтрализации,
благодаря кооперативному действию антител на различные нейтрализующие де-
терминанты. Если вирусы имеют немного различных иммунодоминантных де-
терминант, то в реакции нейтрализации поликлональные сыворотки и монокло-
нальные антитела не будут значительно различаться между собой.
Немалый интерес представляет выяснение механизма потери инфекционно-
сти при нейтрализации вирусов. Большинство из них после взаимодействия с
нейтрализующими антителами в клетки не проникают. Поскольку прикрепле-
ние к клетке по крайней мере некоторых вирусов не подавлялось, то потеря ими
инфекционности происходила на какой-то последующей стадии взаимодейст-
вия с хозяинной клеткой.
Нейтрализованный и не нейтрализованный вирусы гриппа проходят одина-
ковый путь от плазматической мембраны до ядра. Однако, несмотря на кажущу-
юся нормальность инфекции, клетки, инфицированные нейтрализованным ви-
русом гриппа, не синтезировали выявляемые вирусные РНК или белки.
Таким образом, нейтрализующие анти-НА антитела к вирусу гриппа не ин-
гибируют прикрепления, проникновения, декапсидацию и транспортировку ви-
русной РНК в ядро, но подавляют функцию транскриптазного комплекса. При
нейтрализации вируса Синдбис потеря инфекционности, по-видимому, связана
с конформационными изменениями в белках капсида, результатом которых яв-
ляется диссоциация пептидного комплекса [688]. Полагают, что нейтрализую-
щее действие антител к вирусу бешенства заключается в подавлении стадии
слияния эндосом и депротеинизации вируса [586].
Важность конформационных изменений в капсидных белках при нейтрали-
зации была отчетливо показана на примере полиовируса. В частности, было ус-
тановлено, что, действуя на интактный вирион, поликлональные антитела изме-
няют изоэлектрическую точку (pH) вируса примерно от 7 до 4. Эти результаты
были подтверждены опытами с моноклональными антителами против капсид-
ного белка VP1, которые показали, что изменения в VP1 полиовируса обусловле-
ны специфическим взаимодействием с нейтрализующими антителами. Связы-
вание не нейтрализующих антител изменяло VP 1 вируса. Поэтому оказалось, что
конформационные изменения, вызываемые связыванием нейтрализующих ан-
тител, играют важную роль в процессах нейтрализации полиовируса [637].
Однако нейтрализация полиовируса антителами к VP3 не сопровождалась
изменением VP1, не требовала бивалентного связывания и не претерпевала ре-
версии при обработке папаином. Приведенные данные показывают, что меха-
низм нейтрализации полиовируса различается в зависимости от того, к какому
капсидному белку прикрепляется антитело (анти-VPl или анти-УРЗ) [688,
1667].
Исследования, проведенные с вирусом Западного Нила, дали основание
предположить, что нейтрализация вируса иммунным IgG происходит на стадии
слияния мембраны вируса с эндосомами при кислом pH и проникновения в ци-
тозоль, что предотвращает депротеинизацию вируса с последующим гидролизом
его лизосомальными ферментами. В этой связи предполагается, что будущее
принадлежит вакцинам, способным индуцировать синтез антител, специфиче-
ски связывающих функционально важные области вирусных рецепторов, ответ-
ственных за pH-зависимую фузогенную депротеинизацию вируса [720].
Приведенное выше дает возможность сделать вывод о существовании более
чем одного механизма нейтрализации вирусов. Например, при этом антитела
предупреждают или не предупреждают прикрепление вируса к клетке, вызывают
или не вызывают конформационные изменения белков или гликопротеинов ви-
русного капсида и т. д.
Известно, что связывание АТ с вирусом может приводить к потере инфекци-
онное™ (нейтрализации), однако механизм этого процесса до конца не изучен.
Это может быть следствием того, что нейтрализация — сложный мультифактор-
ный феномен, зависящий от природы вируса, его антигенных свойств, разнооб-
разия антител и отношения вируса к ним. По-видимому, различные вирусы мо-
гут иметь различные механизмы нейтрализации [1191]. Следует иметь в виду так-
же различную реакцию клеток организма на иммунные комплексы.
Простейший тип нейтрализации наблюдается между просто устроенными
пикорнавирусами и антителами высокой авидности. Взаимодействие оболочеч-
ных вирусов, имеющих более важные и второстепенные антигены, с соответст-
вующими антителами низкой авидности, нуждающихся в опосредовании ком-
плементом, вероятно, характеризуется более сложным механизмом нейтрализа-
ции. Остается неясным участие различных типов антител в нейтрализации
вирусов, а также причины образования иммунных комплексов, в которых не
происходит нейтрализации вируса.
Таким образом, в настоящее время, по-видимому, нет достаточных экспери-
ментальных данных для создания общей теории нейтрализации вирусов. Можно
лишь сказать, что связывание антител с определенными антигенными детерми-
нантами вирусов является весьма сложным специфичным процессом.
Кроме нейтрализующих антител, существуют не нейтрализующие антитела,
обладающие протектавным действием. Антитела, не обладающие вирусной ней-
трализацией, но обладающие защитным действием против летальных инфек-
ций, обнаружены при инфицировании животных вирусами Синдбис [1384], ве-
зикулярного стоматита [1095], западного энцефаломиелита лошадей [1694] и ле-
са Семлики [360].
Вывод о том, что имеются нейтрализующие антигенные детерминанты, дает
возможность определить не нейтрализующие антитела как антитела, которые
связываются с любой другой детерминантой, расположенной на той же молеку-
ле антигена (например, на НА вируса гриппа). Таким образом, можно объяснить
тот факт, что заражение или иммунизация вирусом африканской чумы свиней
(вирус АЧС) вызывает образование лишь не нейтрализующих антител. Суть за-
ключается в том, что у вируса АЧС отсутствуют специфические детерминанты,
через которые происходит нейтрализация. Неспособность антител нейтрализо-
вать вирус АЧС в иммунном комплексе, возможно, обусловлена специфически-
ми свойствами моноцитов-макрофагов как своеобразных эффекторов нейтрали-
зации [1694]. Неспособность антител инактивировать лентивирус энцефалита-
артрита коз, возможно, является следствием их низкой авидности из-за
содержания в оболочке вирионов сиаловых кислот [860]. Неполная нейтрализа-
ция вируса гепатита А, вероятно, обусловлена клеточными липидами, ассоции-
рованными с вирионами [937]. Однако большинство вирусов не утратило нейт-
рализующие антигенные участки [589].
Необходимо отметить, что иммунный ответ не только способствует выздо-
ровлению и обеспечивает защиту от последующего заражения вирусом, но и мо-
жет вызывать в организме патологические изменения. В присутствии антител, не
обладающих нейтрализующей активностью, вирус денге размножается более ак-
тивно и это иммунное усиление репликации вируса может быть причиной более
тяжелого течения инфекции. Есть данные о том, что при небольшой концентра-
ции нейтрализующих антител инфекционность ряда вирусов усиливалась в
отношении клеток с Fc-рецепторами на поверхности. Иммунопатологические
реакции по этой причине наблюдались при иммунизации против кори и респи-
раторно-синцитиальной инфекции. Естественное инфицирование на фоне не-
достаточного иммунитета вследствие применения слабоантигенных инактиви-
рованных вакцин сопровождалось более тяжелым течением болезни, чем у не-
вакцинированных особей. Из этого следует необходимость разработки и
применения высокоэффективных вакцин.
Глава 7
МАТЕРИНСКИЙ
ИММУНИТЕТ
(ССТССТВСНЫЙ пассивный
иммунитет)
Ведущая роль в защите новорожденных животных от инфекционных заболе-
ваний принадлежит пассивному материнскому иммунитету, медиаторами кото-
рого главным образом являются антитела, поступающие с молозивом и молоком
матери [139, 671] или желтком яиц птиц [1417]. Поэтому в некоторых случаях
вакцины используют в большей мере для защиты потомства, чем самих вакци-
нированных животных. Смертность в неонатальный период, особенно от вирус-
ных желудочно-кишечных и респираторных заболеваний, выше, чем в другие
периоды жизни, и имеется строгая корреляция с недостаточностью колостраль-
ного иммунитета. Целенаправленная вакцинация матерей — эффективный спо-
соб создания иммунной защиты у новорожденных млекопитающих. Это особен-
но ценно потому, что подобная вакцинация перекрывает период формирования
собственной иммунной системы новорожденных, когда они не способны адек-
ватно отвечать на введение антигена. Новорожденные с первых минут постна-
тального существования подвергаются воздействию множества патогенов, в то
время как их организм еще не достаточно иммунокомпетентен. Для того, чтобы
они могли выдержать переход из сравнительно безопасной внутриутробной жиз-
ни в окружающий мир с его многочисленными инфекционными агентами, осо-
бенно опасными для новорожденных, им нужно оказывать пассивную, то есть
исходящую от материнского организма, защиту от инфекций. В данном случае,
иммуноглобулины молозива и молока, а также желтка яиц следует рассматри-
вать как «концентрат иммунологических познаний» матерей, который они при-
обретают в течение жизни, контактируя с многочисленными патогенными виру-
сами окружающей среды [1306]. Факторы материнского иммунитета в защите
новорожденных могут реализоваться еще в период пренатального развития пло-
да, а также непосредственно после его рождения.
Материнские антитела (МАТ) могут передаваться с желтком у птиц, через
плаценту у приматов или через молозиво и/или молоко у других млекопитающих.
Различные виды млекопитающих существенно различаются способом передачи
МАТ, зависящим от строения плаценты. У одних видов она тонкая, имеет 1-3
плацентарных слоя и способна пропускать IgG (но не IgM), и материнский имму-
нитет передается главным образом этим путем. У человека антитела, например
IgG к полиовирусу, могут передаваться трансплацентарно [115]. Однако плацента
большинства домашних животных (крупный и мелкий рогатый скот, свиньи, ло-
шади) более сложная (5-6 слоев) и, вероятно, служит барьером для IgG. У них
МАТ передаются новорожденным через молозиво и значительно меньше с моло-
ком. Различные виды млекопитающих различаются по классам и субклассам им-
муноглобулинов, которые они передают с молозивом новорожденным (табл. 18).
У человека в молозиве содержатся в основном IgA, а у основных видов сель-
скохозяйственных животных - IgG. У крупного рогатого скота и овец в молози-
ве содержится в основном IgG 1, который проникает из сыворотки крови через
альвеолярный эпителий молочной железы в последние недели беременности. Се-
лективный транспорт IgG из сыворотки крови через альвеолярный эпителий вы-
мени является функцией Fc-фрагмента молекулы IgG. Большое количество IgG
молозива захватывается и перемещается в больших внутрицитоплазматических
(пузырьках) везикулах специализированных клеток, расположенных в верхней
части тонкого отдела кишечника для передачи в циркулирующую систему ново-
рожденного в неизменном виде. Период, в течение которого происходит переда-
ча антител потомству, очень короткий и длится около 48 часов у большинства до-
машних животных. У птиц также имеется селективная передача IgG от матери по-
томству. Уровень IgG в желтке яиц составляет 25 г/л. Куры-несушки производят
и передают потомству с желтком яиц около 100 г IgG в год. IgG вителлина вклю-
чаются в циркуляцию с 12 дня инкубации яиц, некоторое количество IgG посту-
пает также в амниотическую жидкость. Период полураспада колостральных ан-
тител составляет примерно 21 день у КРС и лошадей, 8—9 дней у собак и кошек.
Через сутки после рождения концентрация иммуноглобулинов в сыворотке
крови поросят примерно такая же, как и у их матерей, а иногда и выше. Пассив-
Таблица 18. Передача естественного пассивного иммунитета у некоторых видов
млекопитающих [1135]
Вид Количество слоев плаценты Передача антител Концентрация иммуно- глобулинов в молозиве (г/л)
мать плод через плаценту * через кишечник IgG IgA IgM
Человек 0 3 + — 0,3 12,0 1,2
КРС 3 3 0 2 36-77 4-5 3,2-4,9
Свиньи 3 3 0 2 62 10 3,2
Лошади 3 3 0 2 80 9 4
Собаки 1 2 + 2 2,0 13,5 0,3
* продолжительность — дни
ный иммунитет обеспечивают IgG, период полураспада которых составляет
14—21 день [139]. У людей, приматов, грызунов, собак и кошек основным имму-
ноглобулином молозива и молока является IgA (~90%) при низкой концентра-
ции IgG. Общее содержание иммуноглобулинов в постколостральную лактацию
значительно снижается, однако при этом секреторный иммуноглобулин IgA по-
прежнему остается основным [274].
Практически у всех видов новорожденных млекопитающих пассивный ло-
кальный иммунитет в кишечнике обеспечивается иммуноглобулинами класса А
(за исключением крупного рогатого скота и других жвачных). У них, по-видимо-
му, IgA не доминирует ни при активном, ни при пассивном.иммунитете. Суще-
ственное значение приобретает IgG 1, происходящий из сыворотки крови. Неиз-
вестно, в какой степени у жвачных формируется иммунологическая кооперация
GALT — молочная железа, однако логично предположить, что она существует, но
не так ярко выражена, как у других видов животных и человека.
Известно, что с молозивом и молоком выделяется большое количество раз-
личных клеток. Среди них идентифицированы В- и Т-лимфоциты, а также ней-
трофильные лейкоциты. Их функция, особенно у домашних животных, во мно-
гом не ясна. Имеются данные, свидетельствующие о возможности передачи кле-
точных факторов иммунитета новорожденным. Однако пассивная защита телят
от ротавирусной инфекции при скармливании в течение первых пяти дней им-
мунного молозива, свободного от лимфоцитов, была более выраженной, чем пе-
роральное введение 107 мононуклеарных клеток, полученных от тех же вакци-
нированных коров [255].
С целью профилактики неонатальных вирусных инфекций матерей иммуни-
зируют парентерально или локально. В первом случае применяют преимущест-
венно инактивированные, во втором - живые вакцины. Иммунизация матерей за-
частую оказывается более эффективной, чем вакцинация новорожденного потом-
ства. Так, парентеральная иммунизация коров инактивированной ротавирусной
вакциной серотипа 1 и 2 [1545] или живой рота-, коронавирусной вакциной обес-
печивала лактогенную защиту телят от ротавирусной инфекции. В то же время пе-
роральное применение телятам той же вакцины не гарантировало их защиты [425].
Перспективным является оральное введение живой вакцины (за исключени-
ем жвачных). Колонизация в кишечном тракте аттенуированных вирусов приво-
дит к локальному стимулированию предшественников, антителопродуцирую-
щих клеток, которые в заключительную стадию беременности и во время лакта-
ции мигрируют из лимфоидной ткани кишечника в молочную железу. Такой
способ иммунизации пригоден для индукции высокого титра антител в молози-
ве и молоке. Тем самым в равной степени достигается развитие как системного,
так и местного иммунитета у новорожденных [169].
На различных экспериментальных моделях убедительно показано, что апп-
ликация антигенов в молочную железу индуцирует синтез специфических имму-
ноглобулинов класса А и G. При этом антитела образуются наиболее интенсив-
но у предварительно праймированных животных.
Парентеральное введение антигена матерям стимулирует, как правило, обра-
зование и повышение титра сывороточных антител класса IgG и обеспечивает
только пассивный системный иммунитет у новорожденных при условии, что
они потребляют достаточное количество «иммунного» молозива в первые 12—36
часов жизни.
Продолжительность колострального иммунитета зависит от многих факто-
ров, и прежде всего, от уровня антител у матери, видовой принадлежности по-
томства, вида инфекции [274]. Уровень колострального иммунитета можно су-
щественно повысить повторной парентеральной иммунизацией матерей или ис-
пользовать парэнтеральную иммунизацию в сочетании с иммунизацией на
слизистые новорожденного потомства. Такая вакпинопрофилактика имеет важ-
ное значение при желудочно-кишечных и респираторных вирусных инфекциях.
Эффективной защиты плода in utero можно достичь созданием специфичес-
кого иммунного статуса организма матери против конкретных инфекций. Такой
подход дает возможность избежать трансплацентарного проникновения возбу-
дителя, а в случае инфицирования плода предотвратить его гибель, приводящую
к мумификации или абортам, и патологию постнатального развития. Такой спо-
соб защиты потомства применяют при профилактике многих вирусных заболе-
ваний телят, ягнят и поросят. Такая иммунизация оказалась эффективной при
профилактике вирусного аборта лошадей, болезни Ауески, трансмиссивного га-
строэнтерита, парвовирусной инфекции свиней и панлейкопении кошек [274].
Особо важную роль он играет в птицеводстве. С этой целью кур вакцинируют
против болезни Гамборо, инфекционного бронхита, энцефаломиелита, вирусно-
го артрита, уток — против гепатита [274, 922] и чумы, а гусей — против парвови-
русного энтерита. Если материнская особь вакцинирована перед оплодотворе-
нием, в период плодоношения или до яйцекладки, ее иммунитет может пассив-
но передаваться потомству. Пассивный перенос иммуноглобулинов происходит
через желточный мешок (у птиц) или плаценту и молозиво (у млекопитающих).
Эффективный материнский иммунитет требует наличия высокого титра антител
у матерей против соответствующего возбудителя. Материнский иммунитет у
млекопитающих более продолжительный, чем у птиц.
Принято считать, что у большинства видов млекопитающих потеря материн-
ских антител наступает в 6-недельном возрасте. Однако некоторые животные
могут к этому времени полностью сохранить пассивный иммунитет или теряют
его значительно раньше. Трансовариальная передача антител у птиц во многих
случаях обеспечивает эффективную защиту цыплят в течение 3—5 недель после
вылупления. Продолжительность материнского иммунитета важно знать, по-
скольку он может подавлять вакцинальный иммунитет, особенно в случае при-
менения живых вакцин. Материнские антитела к коронавирусу крупного рога-
того скота обнаруживают в сыворотке крови телят в возрасте до 5 мес [232]. Ана-
логичной продолжительностью характеризуется пассивный иммунитет при
парвовирусной инфекции свиней. Дети, родившиеся от матерей, вакцинирован-
ных против кори, становятся чувствительными к этой инфекции к 10-месячно-
му возрасту. При ряде инфекций материнский иммунитет менее продолжителен
и эффективен. Материнские антитела не полностью защищали цыплят против
болезни Гамборо, даже после ревакцинации кур-несушек инактивированной
эмульгированной вакциной. В то же время материнские антитела препятствуют
развитию активного иммунитета у таких цыплят, привитых живой вакциной
[322]. Иммунизация суточных цыплят инактивированной эмульгированной вак-
циной против болезни Гамборо, несмотря на наличие материнских антител, со-
провождалась развитием выраженного иммунитета [1687].
Устойчивость телят к интраназальному заражению полевым вирусом диареи
прямо связана с титром пассивно приобретенных антител. Кроме защиты от ре-
спираторной инфекции, материнские антитела защищали телят от виремии.
Животные, имевшие колостральные вируснейтрализующие антитела в титре
1:240—1:480, не имели виремии после заражения, вирус из назофаренгиальных
проб не выделен. При титре антител 1:60 виремии не установлено, но вирус вы-
делялся из носовой полости в течение 10 дней. Максимальный титр нейтрализу-
ющих антител после вакцинации наблюдали у серонегативных животных. У те-
лят с антителами 1:280 повышения титра антител после заражения не отмечено.
Колостральные антитела представлены преимущественно IgGl, титр которых
снижается в течение первых 4 недель жизни. Заражение вирусом вызывает повы-
шение титра антител IgG2 даже у телят, имевших материнские антитела IgG 1. Та-
ким образом, пассивно получаемые с молозивом антитела подавляют развитие
респираторной инфекции, вызываемой вирусом диареи, хотя и не обеспечивают
полной защиты от вируса, так как после заражения происходит образование
IgG2. Потребление телятами молозива от иммунных матерей важно не только
для предупреждения респираторной инфекции, но и для снижения горизонталь-
ного распространения вируса с назофаренгиальными выделениями [811].
Трансплацентарная передача антител плоду зависит, прежде всего, от типа
плаценты и играет большую роль у человека, приматов и грызунов, имеющих ге-
мохориальную плаценту, у других видов млекопитающих механизм передачи ан-
тител зависит от других факторов.
Следует отметить, что у собак и кошек с эндотелиохориальной плацентой
трансплацентарно передается только 5—10% всего количества иммуноглобу-
линов. Эпителиохориальная плацента лошадей и свиней и синдесмохориальная
плацента жвачных вообще непроницаемы для иммуноглобулинов, то есть в этом
случае передача антител с молозивом - единственный путь пассивной имму-
низации.
Интересна взаимосвязь между структурой плаценты и иммуноглобулиновым
составом молозива, а также молока. У животных, не обладающих трансплацен-
тарной передачей иммуноглобулинов, в молозиве содержится большое количе-
ство антител IgG (80% всех колостральных иммуноглобулинов), в то время как
концентрация IgA низкая (15%). Колостральный иммуноглобулин IgG при пере-
ходе в секрет молочной железы концентрируется из сыворотки крови. Этот про-
цесс начинается уже в постколостральной фазе и, очевидно, контролируется
гормонами. Следует отметить, что 90% IgA и 70% IgM синтезируются в молочной
железе локально плазматическими клетками. У этих видов животных (без транс-
плацентарной передачи) иммуноглобулины эффективно всасываются через ки-
шечник в течение первых 2—36 ч жизни, и формируется (при достаточном по-
треблении молозива) пассивно приобретенный системный иммунитет против
тех инфекций, в отношении которых матери были иммунны. Однако через не-
сколько суток после родов концентрация иммуноглобулинов, прежде всего IgG,
в секрете молочной железы резко снижается. Например, у свиней в этот период
IgA становится основным иммуноглобулином молока [139, 169]. Поступающие с
молозивом и молоком иммуноглобулины формируют у поросят пассивный сис-
темный и местный иммунитет.
Основным классом иммуноглобулина в сыворотке крови и молозиве свино-
маток является IgG, доля которого составляет более 80% от суммы иммуногло-
булинов всех классов. В молозиве концентрация IgG и IgA примерно в 2,5—4,5
раза выше, чем в сыворотке крови (табл. 19 ).
Через 3 суток после опороса концентрация IgG в молозиве снижается при-
мерно в 30 раз. В молоке свиноматок доминирующим классом является IgA
(53—57%), и его концентрация остается практически неизменной до конца лак-
тационного периода. В первые 24-36 часов после рождения поросят иммуногло-
булины молозива проникают через незрелые эпителиальные клетки в кишечные
капилляры, а затем поступают в кровь. Наибольшее поступление антител в кровь
поросят наблюдается при приеме молозива сразу после рождения. Содержащие-
ся в молозиве ингибиторы протеолитических ферментов предохраняют имму-
ноглобулины от расщепления. Созревая, эпителиальные клетки кишечника те-
ряют способность пропускать иммуноглобулины в кровь.
Дефицит автономного иммунитета новорожденных компенсируется в неко-
торой степени IgG-антителами, трансплацентарно передаваемыми из сыворот-
ки крови матери во внутриутробную циркуляцию, но главным образом специ-
фическими факторами лактогенного иммунитета, поступающими в организм
новорожденных с молозивом. Разработка и применение нетрадиционных при-
емов вакцинации против ряда вирусных инфекций человека и животных по схе-
ме: «активная иммунизация матерей — пассивная защита новорожденных» при-
обретает особый интерес и имеет специфические проблемы.
Таблица 19. Концентрация иммуноглобулинов в сыворотке крови, молозиве и моло-
ке свиноматок [139]
Кровь, секрет молочных желез Концентрация иммуноглобулинов различных классов, мг/мл (%)
IgM IgG IgA
Сыворотка крови 2,9(10) 24,3 (83) 2,1 (7)
Молозиво 3,2 (4) 61,8(83) 9,6(13)
Молоко (на 3—7-е сутки после опороса) 1,2(18) 1,9(29) 3,4 (53)
С целью защиты потомства от инфицирования матерей вакцинируют за 4-6
цеклалки Т береМеННОСТИ или за 3~6 «ь перед родами или началом яй-
цекладки. В первом случае защищают эмбрионы и плоды от внутриутробного
фицирования, во втором - защищают новорожденных антителами молозива
или антителами желтка яиц птиц. Такая защита потомства млекопитающих и
птиц в постнатальныи период важна при инфекциях, возникающих в раннем
возрасте, особенно в первые недели жизни, когда иммунизация новорожденных
не является эффективной [ 1518]. Так как многие живые вакцины обладают абор-
тогенным или тератогенным действием, беременных матерей рекомендуют при-
вивать преимущественно инактивированными вакцинами.
Например, многие вакцины против инфекционного ринотрахеита КРС яв-
ляются абортогенными, а вакцины против панлейкопении кошек, классической
чумы свинеи, диареи КРС, лихорадки долины Рифт и синего языка обладают те-
тратогенным действием. Эти нежелательные эффекты обычно наблюдают при
первичной вакцинации неиммунных беременных животных.
Основным недостатком естественной пассивной иммунизации является ин-
терференция колостральных антител с индукцией активного иммунитета. Опти-
мально молодых животных следует вакцинировать, когда исчезнут или почти ис-
чезнут материнские антитела. Однако ожидание может привести к появлению
восприимчивости к данной инфекции у некоторой части людей или животных,
что особенно опасно при высокой инфицированности окружающей среды или
выраженной активности членистоногих переносчиков. Имеется много путей, но
нет полностью удовлетворительного решения проблемы, поэтому большинство
вакцин применяют в первые 6 месяцев жизни с учетом времени снижения и ис-
чезновения материнских антител.
Другая проблема заключается в том, что молодые животные реагируют на
вакцинацию менее выраженным иммунным ответом. Иммуногенность многих
вакцин повышается с увеличением возраста прививаемых животных до достиже-
ниея периода иммунокомпетентности, который, например, у свиней равняется
70—80 дням.
Материнские антитела у млекопитающих и птиц подавляют иммунный ответ
новорожденных на вакцинацию, особенно при использовании живых вакцин. На
фоне пассивных антител репликация вакцинного вируса может быть значитель-
но подавлена или вовсе не произойдет. Поэтому иммунизация живой вакциной
на фоне материнских антител не даст желаемого эффекта. В таких случаях ее сле-
дует проводить после исчезновения или значительного ослабления материнского
иммунитета. При использовании инактивированных вакцин материнские анти-
тела не являются столь критическим фактором развития активного иммунитета.
Существующая коревая живая вакцина вызывает иммунитет у серонегатив-
ных детей, однако, в случае присутствия материнских антител, иммунитет может
не развиваться. Трансплацентарный иммунитет у новорожденных более выра-
жен, если матери перенесли корь, а не были вакцинированы [112]. Подавление
материнскими антителами иммуногенности живой вакцины против кори явля-
Таблица 20. Вирусные инфекции, поражающие плоды или эмбрионы животных
[1135]
Вид животных Семейство/род вирусов Вид вирусов Симптомы
Крупный рогатый скот (КРС) Герпесвирусы/ варицелловирусы Вирус инфекци- онного ринотра- хеита КРС Гибель эмбрионов, аборты
Ретровирусы/ дельтаретровирусы Вирус лейкоза КРС Инапарантная инфекция, лейкемия
Реовирусы/ орбивирусы Вирус синего языка Гибель эмбрионов, аборты, мертворождение, конгенитальные дефекты
Флавивирусы/ пести вирусы Вирус вирусной диареи КРС Гибель эмбрионов, аборты конгенитальные дефекты, инапарантная инфекция с длительным нбсительством и выделением вируса
Лошади Герпесвирусы/ вар и цел л о вирус ы Герпесвирус лошадей 1 Гибель эмбрионов, аборты, неонатальная болезнь
Артеривирусы/ артеривирусы Вирус артериита лошадей Гибель эмбрионов, аборты
Свиньи Герпесвирусы/ вариелловирусы Вирус псевдо- бешенства Гибель эмбрионов, аборты
Парвовирусы/ парвовирусы Парвовирус свиней Гибель эмбрионов, аборты, мумификация, мертворож- дение, рассасывание плодов, бесплодие
Флавивирусы/ флавивирусы Вирус японско- го энцефалита Гибель плодов, аборты
Флавивирусы/ пестивирусы Вирус классической чумы свиней Гибель плодов, аборты, конгенитальные дефекты, инапарантная инфекция с длительным носительством и выделением вируса
Овцы Реовирусы/ орбивирусы Вирус синего языка Гибель эмбрионов, аборты, конгенитальные дефекты
Буньявирусы/ флебовирусы Вирус лихорад- ки долины Рифт Гибель эмбрионов, аборты
Буньявирусы/ нейровирусы Вирус болезни Найроби овец Гибель эмбрионов, аборты
Флавивирусы/ пестивирусы Вирус погра- ничной болезни овец Конгенитальные дефекты
Таблица 20. Продолжение
Вид животных Семейство/род вирусов Вид вирусов Симптомы
Куры Пикорнавирусы/ энтеровирусы Вирус энцефа- ломиелита ПТИЦ Конгенитальные дефекты, гибель эмбрионов
Ретровирусы/ альфаретровирусы Вирусы лей- коза/саркомы ПТИЦ Инапарантная лейкемия, другие признаки
Собаки Герпесвирусы/ неклассифициро- ванные Герпесвирус собак Перинатальная гибель
Кошки Парвовирусы/ парвовирусы Вирус панлейкопении кошек Церебральная гипоплазия
Ретровирусы/ ретровирусы Вирус лейкемии кошек Инапарантная лейкемия, гибель плодов
ется серьезной проблемой в ряде стран Африки, где вакцинацию против кори
необходимо начинать с 6-месячного возраста, т.е. на фоне материнских антител.
Аналогичная ситуация имеет место при применении живых вакцин в промыш-
ленном животноводстве и особенно в птицеводстве. Наличие материнских анти-
тел существенным образом затрудняет специфическую профилактику классиче-
ской чумы свиней.
Отрицательное влияние колостральных антител является менее выражен-
ным при иммунизации живыми вакцинами на слизистые оболочки по сравне-
нию с парентеральным введением. Имеются данные, что оральная вакцинация
новорожденных способна индуцировать системный и местный иммунитет, не-
смотря на наличие материнских антител к вирусу [43].
Учитывая актуальность данного явления, было начато изучение возможнос-
ти преодоления неблагоприятного действия материнских антител с использова-
нием живых генноинженерных вакцин.
В одной из них в качестве вектора использовали вирус везикулярного стома-
тита, в геном которого был включен ген вируса кори, кодирующий гемагглюти-
нин. У вакцинированных крыс на фоне введенных антител к вирусу кори наблю-
дали специфическую сероконверсию, чего не происходило при введении обыч-
ного вируса кори. Аналогичный результат получен при использовании
рекомбинантного вируса осповакцины или оспы канареек, в геном которых бы-
ли вставлены гены вируса чумы собак, кодирующие белки Н (гемагглютинин) и
F (белок слияния). Хорьков, содержащих или не содержащих антитела к вирусу
чумы собак, вакцинировали рекомбинантными вирусами или обычной вакци-
ной против чумы собак. Наиболее высокие титры у хорьков с материнскими ан-
тителами наблюдали при комбинированной интраназальной и парентеральной
иммунизации рекомбинантным вирусом [1634].
Глава 8
ИММУНОЛОГИЧЕСКИЕ
АДЪЮВАНТЫ
Под иммунологическими адъювантами подразумевают любые вещества,
действующие неспецифически и повышающие специфический иммунный ответ
на антигены. Поскольку многие вирусные вакцины (особенно компонентные)
вызывают слабые иммунные реакции, стали использовать адъюванты, добавле-
ние которых дало возможность в различной степени возместить этот недостаток.
Адъюванты функционируют как депо антигена, как иммуностимуляторы, и
как иммуномодуляторы или как организаторы антигена в дискретные частицы.
Многие адъюванты сочетают комбинированное действие двух и более из этих
функций.
Об иммуностимулирующей и иммуномодулирующей функции адъювантов
свидетельствует повышение титра антител, возрастание активности Тц- и/или
Тх-клеток. Различные цитокины действуют так же как адъюванты.
В 1925 г. Гастон Рамон [1291] впервые доказал возможность искусственного
повышения активности дифтерийного или столбнячного анатоксинов путем до-
бавления к антигенам различных веществ (агар, тапиока и др.). Он был первым,
кто ввел концепцию адъювантов и субстанций, стимулирующих иммунитет, вве-
дение которых в организм вместе с вакцинным антигеном повышает уровень им-
мунитета по сравнению с теми же вакцинами, введенными в чистом виде [1292].
В 1926 г. А. Гленни и другие [717] установили, что алюмопреципитация диф-
терийного токсина значительно повышает его антигенные свойства. С тех пор
для увеличения антигенности токсоидов применяли преципитацию белков раз-
личными металлами, однако наилучший эффект был достигнут с использовани-
ем алюминия. Крупный вклад в изучение адъювантов и иммуномодуляторов
принадлежит Фрейнду, с именем которого связано введение в иммунологию
полных и неполных адъювантов. Однако настоящая эра адъювантов началась с
открытия иммуностимулирующих свойств у мурамиловой кислоты, содержа-
щейся в стенке бактерий, и получения синтетического препарата мурамилди-
пептида (МДП).
Повышенный интерес к адъювантам объясняется рядом причин. Оказалось,
что эффективность большинства вакцин можно значительно повысить добавле-
нием к ним множества разнообразных неантигенных веществ. Однако лишь не-
которые из них нашли применение при изготовлении вакцин для людей и жи-
вотных. Такие адъюванты как гидроокись алюминия (ГОА) или фосфат алюми-
ния в течение многих десятилетий применяли для увеличения образования
антител против бактериальных токсоидов у людей. Эти адъюванты, а также са-
понин широко использовали с целью повышения иммуногенности различных
инактивированных вирусных вакцин для животных. Добавление адъювантов
усиливает первичный иммунный ответ. Значение их в последнее время приобре-
ло большой интерес в практической иммунологии. Заметные успехи достигнуты
на пути улучшения адъювантов либо путем их фракционирования, либо с помо-
щью химических модификаций. Известно, что некоторые низкомолекулярные
растворимые антигены обладают слабой иммуногенностью, поэтому в них необ-
ходимо добавлять адъюванты. Проблема адъювантов приобрела особую актуаль-
ность в связи с перспективой получения антигенов на основе технологии реком-
бинантных ДНК. Такие антигены, как правило, вызывают образование антител
и протективный иммунный ответ только при совместном введении с адъюванта-
ми. Необходимость присутствия адъювантов в зависимости от вида антигена
приведена в таблице:
Антигены Адъюванты
вирионные белки +
инактивированные вирусные вакцины +
живые вирусные вакцины -
8.1. Механизм действия адъювантов
Акценты адъювантного действия рассматривались по-разному. Одни авторы
отдавали приоритет действию адъюванта непосредственно на организм, другие
усматривали причину, прежде всего, в изменении самого антигена, третьи — при-
знавали роль обоих факторов, относительное значение которых зависело от
структуры антигена, характера адъюванта и видовой иммунореактивности орга-
низма. Понимание неоднозначности действия адъювантов пришло сравнитель-
но недавно с пониманием надмолекулярной организации и презентации антиге-
нов [1092, 1093]. Концепция, используемая для объяснения различия между ин-
тенсивной и менее интенсивной иммуногенностью, состоит в различной
адъювантности молекул. Было установлено, что иммуноген содержит антиген-
ную часть (эпитоп) и адъювантную часть. Иными словами, иммуноген является
эффективным, если его собственная адъювантность усиливает иммунный ответ.
В белковой молекуле он может модифицировать электрический заряд эпитопа
или его конформацию, таким образом делая его более антигенным. Есть основа-
ния полагать, что адъювантность соответствующей части антигена пропорцио-
нальна ее молекулярной массе.
Согласно ранее существующим представлениям, действие адъювантов своди-
лось главным образом к удержанию антигена на месте введения, благодаря чему
последующее освобождение антигена вело к вторичному иммунному ответу пос-
ле первичного стимулирования, обусловленному ранее освобожденной частью
антигена. Однако механизм адъювантного действия оказался более сложным и во
многом еще остается невыясненным [36]. На смену ранним представлениям о
действии адъювантов исключительно в качестве механических «депо антигенов»
в местах введения пришли новые идеи, обосновавшие попытки стимуляции кле-
точной системы распознавания и ответа на чужеродные антигены [150].
Действие адъювантов осуществляется несколькими путями в зависимости от
звеньев иммунной системы, на которую оно направлено. Так, минеральные сор-
бенты и масляные эмульсии способствуют лучшему поглощению антигенов мак-
рофагами. Другие адъюванты усиливают пролиферацию иммунокомпетентных
клеток или секрецию активизирующих факторов, третьи — активизируют про-
цессы дифференциации иммунокомпетентных клеток (способствуют появле-
нию цитотоксических клеток). Основные взгляды на механизм действия адъю-
вантов подробно рассмотрены в ряде работ [21, 36].
Механизм усиления иммунного ответа при введении сорбированного или
эмульгированного антигена в основном состоит в его корпускулировании. В та-
кой форме он эффективно захватывается макрофагами и стимулирует образова-
ние фактора, активизирующего лимфоциты [116]. Например, каждый из тести-
рованных адъювантов, используемый совместно со структурным компонентом
сильного или слабого иммуногена, вызвал более выраженную и продолжитель-
ную пролиферацию лимфоцитов и лимфоидной ткани, чем иммуноген без адъ-
юванта. Частицы эмульсии переносятся с места инъекции в дренирующие лим-
фоузлы, а затем в более отдаленные участки лимфатической системы. В месте
введения и в дренирующих лимфатических узлах развиваются грануломатозные
процессы [21].
Известно, что если вещество легко растворимо и не фагоцитируется, то оно
вызывает толерантность [ 116], а при введении с адъювантом способствует обра-
зованию антител. Тот факт, что все адъюванты преодолевают толерантность и
усиливают иммунитет, свидетельствует, о том что этот эффект обусловлен опти-
мизацией контакта между антигеном и иммунокомпетентными клетками.
Отмечено, что чем выше структурная организация презентируемых антиге-
нов, тем выше иммунологический эффект.
Баланс клеточного и гуморального ответов может также зависеть от вида адъ-
юванта. Фрейнд [685] установил, что применение белковых антигенов с непол-
ным адъювантом вызывает образование антител, тогда как введение с полным
адъювантом — клеточно-опосредованный иммунитет. При одних инфекциях до-
статочно индукции клеток памяти и образования антител, при других - этого
недостаточно. Циркулирующие антитела, главным образом IgG, создают эффек-
тивную защиту против некоторых групп вирусов, например, таких как пикорна-,
арбо- и аденовирусы. Тогда как против герпесвирусов защита обеспечивается
клеточно-опосредованным иммунитетом. Таким образом, для каждой вакцины
необходимо выбирать адъювант в соответствии с необходимостью вовлечения
определенных звеньев иммунной системы.
В настоящее время различают типы клеток, первично и вторично вовлекае-
мые в адъювантный эффект. Первичными клетками-мишенями являются мак-
рофаги, вторично вовлекаемыми — лимфоциты. Накапливаются данные, под-
тверждающие, что основным медиатором, индуцированным адъювантом и вы-
деляемым макрофагами, является интерлейкин-1. В пользу участия
Т-лимфоцитов в адъювантном эффекте свидетельствуют наблюдения, согласно
которым адъюванты усиливают, как правило, иммунный ответ на тимус-зависи-
мые антигены. Однако существует мнение, что адъюванты оказывают комплекс-
ный эффект с вовлечением в процесс множества разнообразных клеток. К ним
относятся наиболее важные антигенпрезентирующие клетки (макрофаги, клет-
ки Лангерганса, дендритные клетки), многочисленные варианты регуляторных
Т-клеток (хелперы, супрессоры), эффекторные (плазматические клетки, NK-
клетки), клетки воспаления (полиморфо-ядерные базофилы, эозинофилы). Под
действием различных адъювантов, а также при различных способах введения
каждый тип клеток может вести себя по-разному (пролиферировать, дифферен-
цироваться, менять клеточные рецепторы и т. п.). Различные адъюванты могут
влиять на индукцию и регуляцию синтеза различных классов антител, образова-
ние В-клеток памяти и развитие клеточного иммунитета. Это комплексное вза-
имодействие иммунокомпетентных клеток с адъювантами находится под час-
тичным или полным генетическим контролем организма. Выяснение механизма
иммунного ответа затрудняется сложностью и гетерогенностью строения анти-
генов и адъювантов. Даже при использовании таких простых адъювантов, как
мурамилдипептид, были обнаружены многокомпонентные варианты иммунно-
го ответа. Все это свидетельствует о чрезвычайно сложной разгадке тайны им-
мунного ответа, поэтому вероятно еще долго применение адъювантов во многом
будет носить эмпирический характер.
Наиболее распространенные адъюванты [1078]:
— гидроокись или фосфат алюминия;
— продукты микобактерий, включающие мурамилдипептид и его производные
сапонины, включающие квил-А и иммуностимулирующие комплексы
ISCOM’bi;
- сквалаон/сквален с эмульсифицирующим агентом (арласел А);
— другие водно-масляные эмульсии, в том числе с минеральными маслами;
— многослойные липосомы;
— медленно подвергающиеся биодеградации капсулы;
— блок-полимеры;
— SAF-1: блок-полимер + сквален + твин-80 + мурамилдипептид;
— Липополисахариды, Bordetella pertussis, Corynebacterium parvum IMREG-1,
лимфокины.
Минерально-солевые адъюванты
В качестве адъювантов наиболее широкое распространение в медицине и ве-
теринарии получили соли алюминия (гидроокись алюминия, фосфат алюминия,
алюмокалиевые квасцы). Наиболее часто используют смешивание антигена с за-
ранее сформированными гелями А1(ОН)3 или А1 Р04. Антиген адсорбируется на
них посредством ионного взаимодействия, поэтому вакцины, приготовленные с
такими традиционными адъювантами, принято называть адсорбированными
или сорбированными. Они оказались умеренно эффективными и безопасными,
благодаря чему им отдается предпочтение в медицинской практике. Однако та-
кие вакцины иногда вызывают стерильные персистирующие узелки, особенно в
случае быстрого проведения инъекции [116]. Алюминиевые соли стимулируют
синтез антител в регионарных лимфоузлах и вызывают скопление плазматичес-
ких клеток в местах образования поствакцинальных гранулем. Многие сорбиро-
ванные вакцины обладают достаточной антигенностью у людей при первичной
иммунизации. При повторной (бустерной) иммунизации отмечали незначитель-
ные различия между нативной и адъювантной вакцинами по времени наступле-
ния, силе и продолжительности вторичного иммунного ответа. На сегодняшний
день в медицинской и ветеринарной практике большинство противовирусных
вакцин содержит гидрат окиси алюминия. При иммунизации людей используют
только ГОА. Это относительно слабый, но безопасный адъювант. Свойствами
адъювантов обладает большое количество других адсорбентов (латекс, бентонит,
акрилат, полиэлектролиты и др.), однако они не нашли широкого применения.
Масляные адъюванты (эмульсии)
В последнее время в практику вошел новый тип адъюванта, приготовленный
на основе минеральных и неминеральных масел и их смесей. При использовании
такого адъюванта предварительно растворенный или суспендированный в воде
антиген очень тонко диспергируют в масле, в результате чего получают эмульсию
типа «вода в масле», то есть капельки воды с антигеном находятся в масляной фа-
зе. Если такую эмульсию эмульгировать в воде, содержащей гидрофильный эмуль-
гатор, например, твин-80, то получится водно-масляная-водная эмульсия. При
этом дискретные капли «вода в масле» будут находиться в водной фазе. Эмульсии
типа «вода-масло-вода» были предложены как средство решения проблемы вязко-
сти, которая дает себя знать в случае приготовления эмульсий типа «вода в масле».
Фрейнд [685] впервые отметил значительное увеличение синтеза антител
при иммунизации эмульгированными антигенами. Минерально-масляные адъ-
юванты Фрейнда представляют собой эмульсию водного адъюванта в минераль-
ном масле с низким удельным весом и вязкостью. В качестве компонентов клас-
сического неполного адъюванта применяют минеральные масла (например,
«маркол»), в которых растворяют до 10% (объем/объем) липофильного эмульга-
тора — маннида моноолеата (например, «арлацел А» или «монтанид»). Эти ком-
поненты эмульгируют с водным раствором антигена при соотношении масла и
воды примерно от 70:30 до 50:50. С целью снижения токсичности предложены
другие эмульгирующие системы, в том числе содержащая «Маркол 52» с добав-
лением «Спана 85» в качестве липофильного эмульгатора и твина-85 как гидро-
фильного эмульгатора. Кроме токсичности, значительными недостатками
эмульгированных адъювантов являются высокая вязкость и недостаточная ста-
бильность. Эти недостатки были преодолены благодаря включению в рецептуру
гидрофильного эмульгатора — твина-80, добавляемого в раствор антигена в ко-
личестве 1—5% (объем/объем). Эмульгатор повышает дисперсность водных ка-
пель вакцины в масляной фазе и обеспечивает стабильность эмульсии [21]. В
противном случае капли водной фазы будут соединяться вместе и отделяться от
масла [44]. Полный адъювант Фрейнда отличается от неполного, то есть простой
водно-масляной эмульсии, тем, что содержит убитые клетки микобактерий. По
стимуляции образования антител полный адъювант Фрейнда не имеет себе рав-
ных. Однако из-за острой боли, формирования абсцессов, лихорадки, возмож-
ности повреждения органов его используют только в экспериментальных целях
для иммунизации лабораторных животных, но не для вакцинации людей и жи-
вотных. Механизм действия масляных адъювантов, вероятно, не очень отлича-
ется от механизма действия минеральных сорбентов, то есть адъювантное дейст-
вие масляных эмульсий может быть приписано в основном медленному высво-
бождению антигена [21]. Для усиления иммунного ответа антиген должен
находиться внутри капель воды, диспергированных в липидной фазе. Эмульсии
типа «вода в масле» освобождают антиген в течение более длительного времени,
чем сорбированные вакцины, и это частично может объяснить более мощную
иммунную стимуляцию после первой дозы препарата. Полный механизм влия-
ния масляных адъювантов на иммунокомпетентные системы организма недо-
статочно понятен. Вакцина против злокачественной лихорадки крупного рога-
того скота с неполным адъювантом Фрейнда не обеспечивала защиты от экспе-
риментальной и естественной инфекции, несмотря на индукцию ВН-антител в
высоком титре. Из этих и других данных следует, что при данной инфекции ре-
шающая роль принадлежит клеточным факторам иммунитета, практически не
стимулирующимся данным адъювантом.
После введения антиген-адъювантной эмульсии животному на месте инъек-
ции образуется гранулема, стимулирующая активность макрофагов и лимфоци-
тов. Ввиду длительного сохранения таких гранулем подобные адъюванты проти-
вопоказаны человеку [96].
Широкое использование некоторых масляно-адъювантных вакцин, содер-
жащих арласел А, было прекращено в связи с обнаружением канцерогенности
адъювантного субстрата.
Животным водно-масляную эмульсию обычно вводят внутримышечно. Ми-
неральное масло не метаболизируется, поэтому капли эмульсии с находящимся
внутри них антигеном удерживаются в месте введения длительное время. После
распада эмульсии вследствие расщепления эмульгатора антиген медленно выде-
ляется из этих капель. Учитывая недостатки минеральных масел, сделаны по-
пытки использовать растительные и животные масла, полностью метаболизиру-
емые в организме. С целью преодоления недостатков минеральных адъювантов
применяли адъюванты на основе растительных масел. Адъювант на основе вы-
сокоочище иного арахисового масла с использованием глицерина и лецитина в
качестве эмульгатора оказался относительно нереактогенным и достаточно эф-
фективным в вакцинах для животных. Имеются сообщения о перспективности
приготовления двойных эмульсий (вода-масло-вода), созданных путем повтор-
ного эмульгирования простых эмульсий (вода в масле) в растворах детергента
твин-80. По сравнению с простой эмульсией двойная эмульсия, обладающая
тако же антигенностью, менее вязкая и более стабильная; вызывает менее выра-
женные пролиферативные образования в месте инъекции. Сорбированный на
А1(ОН)3 антиген можно также эмульгировать в масле [116].
Прививка людей инактивированными вакцинами против гриппа и полио-
миелита с неполным адъювантом Фрейнда подтвердила их эффективность
[1361]. Аналогичные адъюванты с успехом использовали для усиления иммуно-
генности вирусных вакцин против ящура, парагриппа-3, болезни Ауески, чумы
плотоядных, инфекционного гепатита собак, болезни Гамборо, ньюкаслской бо-
лезни [44, 1041], гриппа лошадей, ротавирусной диареи телят и других болезней.
Такие вакцины вызывают выраженный и продолжительный иммунный ответ.
Благодаря этому, значительно повышается эффективность вакцинации и сокра-
щается количество ежегодных прививок.
Однако имеются единичные сообщения, свидетельствующие о более высо-
кой эффективности сорбированных вакцин. Так, иммунизация обезьян очищен-
ным гликопротеиновым антигеном (gp 350/220) вируса Эпштейн-Барр, сорбиро-
ванным на ГОА, защищала их от экспериментального заражения, тогда как пре-
парат с адъювантом Фрейнда не защищал [638].
Основной недостаток водно-масляных эмульсий - высокая реактогенность
и нестабильность эмульсий. Водно-масляную вакцину с незначительной вязко-
стью можно получить, добавляя детергентный эмульгатор в дисперсионную сре-
ду [44, 116]. Для максимального проявления иммуногенности вакцин с масля-
ным адъювантом необходимо, чтобы водные антигены находились в дисперсной
фазе. Качество эмульгированных вакцин зависит от величины частиц дисперс-
ной фазы. Если их диаметр более 5 мкм — получается грубая эмульсия, при диа-
метре частиц менее 1 мкм — тонкая.
Вязкость эмульсионных вакцин можно значительно снизить добавлением
эмульгаторов, таких как твин-80 и твин-40, но они оказывают неблагоприятное
влияние на антиген и организм. В этом отношении перспективны монтаниды,
применение которых значительно снижает вязкость (250 сп) и повышает ста-
бильность (более одного года при 4°С и более 3 мес. при 37°С). Несмотря на не-
которые недостатки, масляные адъюванты, благодаря значительному повыше-
нию иммуногенности вирусных вакцин, представляют большой практический
интерес. Установлено, что они по адъювантным свойствам превосходят ГОА. Та-
кой факт был отмечен при проверке иммуногенных свойств инактивированных
эмульгированных вакцин против ящура, везикулярной болезни, болезни Тешена
и Ауески по сравнению с вакцинами, содержащими ГОА. Например, для изго-
товления инактивированной ГОА-вакцины против ящура требовалось больше
вирусного антигена (146S + 75S частиц), чем для изготовления эмульгированной
вакцины: соответственно 6,0 и 2,0 мгк/мл [123]. В качестве адъюванта при изго-
товлении инактивированной вакцины против ящура использовали минеральное
масло Маркол-52 и эмульгатор Монтанид-888. После первичного применения
иммунитет у крупного рогатого скота длился 6 мес, а после ревакцинации —
12 мес. Эмульгированные вакцины против ящура крупного рогатого скота и сви-
ней имели преимущества по сравнению с сапониновыми (квил-А) и сорбиро-
ванными вакцинами [300]. Аналогичные результаты получены при иммуниза-
ции птиц против ньюкаслской болезни, а также при вакцинации против гемор-
рагической болезни кроликов.
8.2. Адъюванты на основе природных
субстратов
Как оказалось, адъювантным действием обладают многие природные со-
единения (белки, гликопротеины, пептиды, полисахариды, нуклеиновые кис-
лоты и др.) различного происхождения. Они не создают депо антигенов, их
можно вводить в различные места и в разное время. Эти вещества способны не-
посредственно стимулировать антителообразующую систему и называются адъ-
ювантами прямого действия. Введение интерлейкина-2 значительно повышало
протективный эффект инактивированной вакцины против бешенства для мы-
шей без заметного повышения титра циркулирующих вируснейтрализующих
антител. Введение гамма-интерферона мышам за 2 ч перед введением инакти-
вированной антирабической вакцины во много раз повышало титр нейтрализу-
ющих антител и защитный эффект от интрацеребрального заражения [1378].
Вещества, обладающие адъювантным действием, часто обнаруживают в составе
различных бактерий.
Наиболее характерными представителями адъювантов подобного типа явля-
ются О-антигены, или липосахаридные эндотоксины грамположительных бак-
терий. Они содержатся также в каждой вакцине из сальмонелл и действуют как
адъюванты для других антигенов, одновременно присутствующих в данной вак-
цине [44]. Усиливающий эффект одного из антигенов (например, возбудителя
коклюша) часто учитывают при вакцинации детей комбинированными вакци-
нами против наиболее распространенных заболеваний.
Синтетические адъюванты. В последнее время большой интерес вызвало но-
вое направление в области вакцинных адъювантов - поиск низкомолекулярных
относительно нетоксичных синтетических иммуностимуляторов. Они имеют
ряд преимуществ по сравнению с адъювантами с невыясненной химической
структурой.
Синтетические РНК-комплексы, примененные без добавок или в сочетании
с другими адъювантами, повышали антигенность инактивированных вакцин
против венесуэльского энцефаломиелита лошадей, бешенства, ящура, гриппа. В
качестве синтетических адъювантов с различной степенью эффективности могут
быть использованы различные вещества. Однако, нетоксичных синтетических
адъювантов, обладающих выраженным иммуностимулирующим действием, по-
ка еще мало. Одними из представителей такого рода адъювантов являются про-
изводные мурамиловой кислоты.
Мурамилдипептиды
Фрейнд [685] обнаружил адъювантное действие убитых микобактерий, а Ле-
дерер с сотрудниками идентифицировали компоненты клеточной стенки мико-
бактерий, обладающие адъювантным действием. Этим веществом оказался три-
пептидный моносахарид. Есть синтетический аналог мурамил-дипептид-МДП
(М-ацетил-мурамил-Е-аланин-О-изоглютамин), обладающий сходной эффек-
тивностью. Он относительно нетоксичен и его можно вводить парентерально
или оральным путем, проявляет адъювантное действие не только в масляных
эмульсиях, но и в водных растворах [21]. Добавление МДП к различным антиге-
нам и вакцинам усиливает гуморальный антительный ответ. Вероятно, он дейст-
вует непосредственно на В-клетки, упраздняя функцию Т-хелперов в усилении
антительного ответа. Химическая модификация МДП позволила создать анало-
ги, обладающие различными адъювантными свойствами. Наиболее активными
оказались треонил-МДП и З'-п-пропил-МДП. Некоторые продукты распада
МДП также усиливают клеточный иммунитет. Адъювант Синтекс, стимулирую-
щий гуморальный и клеточный иммунитет, по эффективности не уступал полно-
му адъюванту Фрейнда. Он состоит из треонилового аналога МДП и эмульсии
Сквалена с неионным детергентом. Антительный ответ к gp 120 ВИЧ-1 при ис-
пользовании в качестве адъюванта производных мурамилпептида в масляной
эмульсии усиливался примерно в 10 раз по сравнению с тем же антигеном, сор-
бированном на гидроокиси алюминия [1535].
Гидрофильные и гидрофобные блок-полимеры (плюроник-полимеры)
В качестве адъювантов предложены неионные поверхностноактивные блок-
полимеры. Их молекулы представлены единой неразветвленной цепью. Цент-
рально расположенный гидрофобный полимер полиокси-пропилен с обоих
концов фланкирован гидрофильным полиоксиэтиленом. Они являются неион-
ными и нетоксичными адъювантами среди поверхностно активных веществ. Та-
кие вещества не являются эмульгаторами или растворителями, а лишь способст-
вуют распространению масла на поверхности воды. Они обладают способностью
связывать растворимые макромолекулы. Один из блок-полимеров (L=121) ока-
зался эффективным адъювантом, стимулирующим синтез антител, особенно
когда в составе водной эмульсии использовали 1% минерального масла. Разра-
ботан синтетический адъювант, стимулирующий синтез антител, клеточный им-
мунитет и формирование Т- и В-клеточной памяти. Основные компоненты адъ-
юванта — синтетические МДП и трехблочный полимер L= 121, состоящий из ок-
сипропилена и двух частей полиоксиэтилена. В качестве добавок используют
сквалон и твин-80. Адъювант не оказывает местного и системного повреждаю-
щего эффекта. Его адъювантные свойства показаны на примере иммунизации
животных вирусами лейкоза кошек, гриппа и гепатита В.
Синтетические полиэлектролиты, такие как: поли-4-винилпиридин, поли-2-
метил-5-винилпиридин и полиакриловая кислота, являются иммуностимулято-
рами [116]. Их введение вместе с белком увеличивает в 5—15 раз выход антитело-
образующих клеток. Предполагают, что действие полиэлектролитов основано на
специфической активизации В-лимфоцитов и Т-хелперов [82]. Комплексация
белкового антигена с сополимерами акриловой кислоты и N-винилпирролидо-
ном повышает образование специфических антителообразующих клеток по
сравнению с иммунизацией чистыми антигенами. Этот путь своеобразного кор-
пускулирования антигена не уступает адсорбции на минеральных носителях.
Ди- и трисульфиды, полисульфиды, пиридины, пиримидины и их производные
также обладают адъювантным действием.
Углеводородные адъюванты — малотоксичны и действенны, особенно если их
углеродная цепь содержит около С16. Два таких адъюванта привлекли значи-
тельный интерес: диметилдиоктадецилалеин (ДДА) и N, М-диоктандецил-N',
N'-бис (2-гидроксиэтил) пропандиамин (авридин). Авридин обнаружил адъю-
вантные свойства при применении с субъединичной вакциной против транс-
миссивного гастроэнтерита свиней [727]. Это наблюдение может иметь большое
значение, поскольку касается стимуляции секреторного иммунитета. Положи-
тельный заряд ДДА способствует взаимодействию с антигенами, образуя более
организованные структуры с высокой молекулярной массой. Возможно, в осно-
ве их иммуностимулирующего действия лежит активация макрофагов и осво-
бождение интерлейкина-1.
Липосомы
С целью замены минерального масла в адъюванте Фрейнда были предложе-
ны липосомы [238]. Это микроскопические структуры, состоящие из одного и
более концентрических липидных бислоев, окруженных водной оболочкой. Их
использовали для изучения природы клеточных мембран и приняли в качестве
фармакологических микрокапсул для доставки терапевтических агентов к клет-
кам-мишеням. Позже их стали использовать в качестве иммунологических адъ-
ювантов. Липосомы представляют собой искусственные липидные мембранные
сферы, содержащие вирусный антиген. Когда используют очищенные оболочеч-
ные белки, получают «виросомы» («иммуносомы»), напоминающие оболочку
вириона без нуклеиновой кислоты. Для приготовления липосом применяют не
пирогенные липиды с адъювантным действием.
Когда гликопротеины оболочки вириона смешивают с холестерином и гли-
козидом Квил-А, образуются сферические структуры («розетки») 40 нм в диаме-
тре. Введение водорастворимых и липидорастворимых молекул в липосомы
защищает их от разрушающего воздействия и обеспечивает доставку их к имму-
нокомпетентным клеткам, таким как макрофаги, с которыми они взаимодейст-
вуют. На основе количества слоев и размера липосомы делят на три класса: мно-
гослойные, большие и малые однослойные. Однослойные липосомы состоят из
одной двухслойной липидной оболочки с заключенной внутри водной фазой.
Липосомы размером около 1 мкм слаботоксичны и способны увеличивать им-
мунный ответ к большому количеству различных антигенов. По индукции анти-
тельного ответа они превосходили вакцину с адъювантом Фрейнда и выгодно от-
личались тем, что не вызывали гранулем на месте введения [157]. Простая смесь
солевого раствора антигена с липосомами не увеличивала иммуногенности. Аде-
новирусный антиген, включенный в многослойные липосомы, вызывал у кроли-
ков такой IgG-ответ, как и аналогичная доза антигена с полным адъювантом
Фрейнда.
Поверхностные антигены вируса гриппа А в составе липосом вызывали зна-
чительно более выраженное образование антител и повышали резистентность у
привитых мышей к экспериментальному заражению. Липосомы, содержащие
гликопротеины вирусов гриппа, Сендай, лесов Семлики, эффективнее индуци-
руют продукцию антител, чем компонентные вакцины с адъювантом [157].
Развитие технологии липосомных вакцин способствовало созданию Ново-
сом - нового типа микрокапсулированных вакцин. Они не вызывают образова-
ния гранулем на месте введения, а местная реакция обычно исчезает в течение
двух недель. Положительные результаты получены с липосомными вакцинами
против ньюкаслской болезни и других вирусных болезней птиц. Гликопротеин
вируса бешенства прикрепляли к поверхности преформированных липосом,
имитируя природную структуру поверхности вириона. Приготовленные таким
образом иммуносомы индуцировали строгоспецифичный гуморальный и кле-
точный ответ и обладали высокой протективной активностью. Антигены, ассо-
циированные с липосомами, оказались особенно эффективными в Т-независи-
мом иммунитете [695]. Липосомы нетоксичны и подвергаются биодеградации.
Они обладают низкой собственной антигенностью, обусловленной в основном
фосфатидилхолином — главным компонентом большинства липосом. Липосо-
мы, с включенными в них антигенами, вводят различными путями: внутривен-
но, интраперитонеально, подкожно и внутримышечно. Эффективность их зави-
сит от способа введения. На месте введения липосом гранулемы не образуются и
они могут быстро достигать дренирующих лимфоузлов. Включение вируса по-
лиомиелита в липосомы придавало ему устойчивость к действию специфических
антител и позволяло инфицировать резистентные клетки [1665]. Расширение
тканевого спектра и увеличение количества клеток-мишеней при использова-
нии живых липосомальных вакцин может оказаться весьма полезным в иммуни-
зации против многих вирусных болезней.
Поверхностноактивные адъюванты. Сапонин, экстрагируемый из коры
южно-американского дерева Guillaja saponaria Molina, давно применяется в ка-
честве адъюванта в ветеринарной иммунологии. Очищенный препарат сапони-
на, получивший название Квил-А, как и другие сапонины относится к гликози-
дам и, будучи поверхностно активным веществом, может солюбилизировать ги-
дрофобные молекулы. Проявляя выраженную адъювантную активность в
низких дозах (800 мкг для крупного рогатого скота), он хорошо переносится жи-
вотными, его применяют в составе некоторых инактивированных вирусных вак-
цин в качестве адъюванта. Установлено, что сапонин (Квил-А) является типич-
ным представителем адъювантов — организаторов надмолекулярной структуры
белковых антигенов. Оказалось, что в основе адъювантного действия Квил-А ле-
жит образование иммуностимулирующего комплекса (ИСКОМ) нового типа.
Суть этого явления сводится к следующему. Квил-А хорошо растворяется в воде
и при критической концентрации (300 мг/л) образует мицеллы, которые, благо-
даря гидрофобному взаимодействию, связывают мономерные формы поверхно-
стных вирусных белков (2 мкг мицелл способны связать 10 мкг вирусного белка).
При этом образуются структуры типа пчелиных сот, обладающие иммуностиму-
лирующим действием, намного превышающим эффективность исходных вирус-
ных белков, не организованных в надмолекулярные структуры [1093]. Известно
также, что в отсутствие детергента гликопротеины оболочечных вирусов способ-
ны образовывать мицеллярные структуры вследствие гидрофобного взаимодей-
ствия трансмембранных доменов. Способностью к мицеллообразованию обла-
дают также молекулы Квил-А. Это является предпосылкой к образованию ми-
целл гликопротеинов и гликозида Квил-А при удалении детергента.
Мультимолярные комплексы гликопротеинов с гликозидом Квил-А (сферичес-
кие сетчатые структуры диаметром 20—30 нм) существенно отличаются от ти-
пичных «розеток» очищенных гликопротеинов (5-8 пепломеров, агрегирован-
ных гидрофобными доменами) [19].
ИСКОМЫ с гликопротеином вируса парагриппа-3 в 10 раз были более имму-
ногенными, чем интактные вирионы. Аналогичные комплексные препараты на
основе гликопротеинов вирусов кори и бешенства оказались значительно более
иммуногенными, чем исходные антигены [1093]. Подобные результаты получе-
ны в опытах с различными вирусными антигенами. Иммуногенная активность
субъединичной вакцины, содержащей гемагглютинин (90 кД) и гликопротеин
(130 кД) герпесвируса первого типа крупного рогатого скота и ИСКОМ оказа-
лась выше, чем нативные вирусные гликопротеины [1540] или сорбированная
вакцина [362]. Субъединичная вакцина из гликопротеинов ретровирусов в со-
ставе частиц типа ИСКОМ была более активной по сравнению с вирионным
препаратом. ИСКОМ, содержащий Н- и N-антигены вируса гриппа, представ-
лял симметричные структуры диаметром 40 нм с гексогональными и пентаго-
нальными субъединицами размером 12 нм и коэффициентом седиментации 19S
[1470]. Препараты ИСКОМ, содержащие белок F или белок F с гемагглютини-
ном вируса кори, предохраняли мышей от коревого энцефалита при экспери-
ментальном заражении. Для защиты 50% мышей от летальной инфекции виру-
сом бешенства требовалось приблизительно 70 нг белка G в мицеллярной фор-
ме, 40 нг белка G, адсорбированного на гидроокиси алюминия, и менее 16 нг
белка G в комплексе с гликозидом Квил-А. Сходные данные получены в опытах
с миксовирусами [19]. Комбинированная ИСКОМ - субъединичная вакцина,
приготовленная на основе гликопротеинов слияния и нуклеопротеинов РС-ви-
руса человека и крупного рогатого скота, при двукратном введении морским
свинкам вызывала такой же иммунный ответ, как и живые вакцины [1543]. Им-
муногенность белков оболочки вирусов ПГ-3 и леса Семлики значительно воз-
растала с изменением надмолекулярной структуры в составе ИСКОМа. Квил-А
обнаружил адъювантный эффект в опытах с пептидным антигенам VP 1 вируса
ящура, который вызывал образование ВН-антител у морских свинок. Преиму-
щества вакцин, приготовленных по типу ИСКОМ, заключается в возможности
приготовления эффективных вакцин, их стандартизации и стабилизации. Они
сохраняют морфологию и иммуногенность в живом или лиофилизированном
состоянии в течение трех лет. Их эффективность была продемонстрирована при
многих вирусных болезнях: гриппе, герпесе простом, кори, бешенстве, вирусной
диарее крупного рогатого скота, инфекционном ринотрахеите, псевдобешенст-
ве, чуме плотоядных, лейкозе кошек [153].
8.3. Действие адъювантов на орально
вводимые антигены
Оральная иммунизация живыми вакцинами оказалась весьма эффективной
при ряде инфекций. В качестве примера можно привести живые оральные вак-
цины против полиомиелита и брюшного тифа. Способность неживых антигенов
вызывать местный иммунный ответ обычно незначительна.
Для индуцирования секреторного иммунного ответа, как правило, необхо-
димы большие дозы антигена. Введение антигена на слизистые покровы оказа-
лось более эффективным для стимулирования секреторных антител, чем парен-
теральное введение. Хотя парентеральное введение больших доз антигена может
вызывать специфическую стимуляцию лимфоидной ткани слизистых оболочек,
тем не менее сильный местный иммунный ответ развивается лишь при непо-
средственном контакте с ними антигена. Кролики, орально иммунизированные
пневмококковым антигеном, продуцировали высокие уровни специфических
колостральных IgA, которые практически отсутствовали в сыворотке крови
[1425].
Обнадеживающие результаты получены при использовании в качестве адъю-
вантов липосом и мурамилдипептида. Усиливающий эффект связывают со сти-
муляцией Т-клеток интерлейкинами, индуцированными адъювантами. Об
оральном применении липосом в качестве адъювантов сообщений мало. Однако
известно, что комплекс антигена с липосомами может взаимодействовать с эпи-
телиальными клетками кишечника и обеспечивать местный иммунный ответ.
Стабильность в условиях желудочно-кишечного тракта, всасывание в ин-
тактном виде из содержимого кишечника и способность к переводу антигенов из
Т-зависимых в Т-независимые делают липосомы перспективными в качестве
оральных адъювантов для стимуляции иммунной системы слизистых оболочек.
Липосомы, содержащие антиген вируса гриппа, вызывали иммунитет у мышей
при интраназальном введении.
8.4. Безопасность адъювантов
Наиболее важное преимущество любых адъювантных вакцин — то, что их
применение более эффективно, чем водных вакцин, и что польза от них превы-
шает риск. Вакцинные препараты, в первую очередь, должны быть биологически
безвредными. Но ни одна из существующих адъювантных вакцин не является аб-
солютно безопасной. Суждение о безопасности адъювантов в настоящее время
базируется на проведении на токсичность, проводимых на лабораторных и других
животных. Тем не менее, чтобы значительно сократить риск в применении адъю-
вантов к ним предъявляется ряд требований, которые могут повысить безопас-
ность либо за счет адъюванта, либо за счет комбинации адъюванта и антигена.
Адъюванты должны быть свободными от посторонних примесей, не содер-
жать антигены, сходные с антигенами хозяина, не обладать онкогенными, тера-
тогенными и аллергенными свойствами, а также токсичностью для миелолим-
фоидных клеток, легко метаболизироваться в организме [116]. Выбирать адъю-
вант и способ введения адъювантной вакцины необходимо с учетом
избирательного действия на звенья гуморального или клеточного иммунитета, а
также видовой и возрастной иммунореактивности.
Создание эффективных средств вакцинопрофилактики инфекционных за-
болеваний обусловило заметное возрастание интереса к адъювантам. В настоя-
щее время применяют разные природные и синтетические адъюванты.
Интерес к поиску новых адъювантов значительно возрос в связи с перспек-
тивой иммунизации людей генноинженерными субъединичными вакцинами и
синтетическими пептидами. Вакцины нового типа, в отличие от существующих
традиционных, не столь иммуногенны, поэтому их применение особенно нуж-
дается в использовании эффективных адъювантов. Большое значение имело ус-
тановление возможности разделения адъювантной активности и токсичности.
Таблица 21. Вакцинные системы и иммунологические адъюванты [670]
Соли алюминия Гидроокись или фосфат алюминия. Образуют преципитаты с растворимыми антигенами, создавая депо более иммуногенных антигенов на месте введения; активируют комплемент
Эмульсии Полный адъювант Фрейнда или мурамил-дипептид или мурамил- трипептид стимулируют главным образом Т- клеточный ответ. Неполный адъювант Фрейнда — антиген, эмульгированный в водно-масляной эмульсии
Микро капсулы Антиген, заключенный в полимеры или в органические кислоты. Они распадаются в организме, медленно освобождая антиген
ИСКОМЫ Иммуностимулирующие комплексы представляют собой гликозиды в адъюванте, именуемом Quil А (очищенный сапонин из растения Quilla saponaria), фосфолипиды, холестерол и антигены. Образуются частицы (сферы) диаметром 30—40 нм, включающие антиген
Нуклеиновые кислоты как вакцины (ДНК-вакцины) Гены, кодирующие экспрессию антигенов от строго определенных промоторов, введенные в мышцы или кожу физическими методами, вызывают образование внутриклеточного белка (антигена) и его презентацию иммунной системе
Рекомбинантные вирусы Гены, кодирующие чужеродный антиген, вводят в вирусный геном (вектор) таким образом, чтобы новый белок синтезировался в результате инфекции. Обычно принятыми векторами служат вирусы оспы, аденовирусы и бакуловирусы. Многие другие вирусы также могут быть изменены с целью экспрессии чужеродных генов
Это дало возможность создать нетоксичные безаллергенные адъюванты, способ-
ные значительно повысить иммунный ответ у привитых. Это можно достичь
смешиванием антигена с адъювантом, включением антигена в липосомы или в
иммуностимулирующий комплекс (ISCOM). Создание иммуностимулирующих
комплексов подтверждает возможность сочетания высокой иммуногенности и
безопасности.
По химической природе и образу действия адъюванты условно можно разде-
лить на три категории: замедляющие освобождение антигена; активизирующие
макрофаги, с секрецией лимфокинов и лимфоцитов; и оказывающие митогене-
тическое действие на лимфоциты.
При изготовлении вакцин для животных наиболее широко применяют ГОА
и минеральные масла. Одним из наиболее перспективных новых адъювантов яв-
ляется мурамилдипептид, который может добавляться к синтетическим антиге-
нам и включаться в липосомы. Коммерческие адъювантные вакцины должны
быть стабильными при хранении и сохранять антигенную активность без прояв-
ления выраженных реактогенных свойств.
Цитокины, которые могут быть использованы для усиления иммунного от-
вета, включают интерфероны гиб, интерлейкины 4, 10 и 12 [1341, 1380, 1381].
Таблица 22. Основные характеристики адъювантов
Адъювант Способ введения Тип иммунного ответа Побочный эффект
ГОА парентерально преимущественно IgG 1 (иногда IgE) Тх2-лимфо- циты (секреция ИЛ-5), нет индукции Тц-лимфоцитов обычно незначительная реакция, контактная гиперчувствительность; гранулематозное воспаление
Мур амил- дипептид парентерально антительный ответ пирогенность, передний увеит, артрит
Липосомы парентерально антительный ответ, Тц-лимфоциты нет реакции
ИСКОМЫ, сапонины парентерально локальный/системный антительный ответ: IgA; IgG (сапонины: IgG2), Тц-лимфоциты сапонин: местная реакция, гемолиз; ИСКОМы - реакция отсутствует
Адъювант Фрейнда (полный, неполный) парентерально антительный ответ, Тх-лимфоциты, Тц-лимфоциты (полный адъювант) полный адъювант: абсцес- сы, гранулема, лихорадка, аутоиммунная реакция, артриты.
Таблица 23. Примеры использования адъювантов в вакцинах для животных
Адъювант Инактивированные вакцины Вид животных
гидрат окиси алюминия бешенство собаки
парагрипп собаки
лейкемия кошек (рекомбинантная) кошки
парвовирус свиней свиньи
грипп лошади
инфекционный ринотрахеит КРС
вирусная диарея КРС
гидрат окиси алюминия + сапонин ящур КРС,овцы,свиньи
вирусные болезни КРС (комбинированная вакцина) КРС
эмульсия, вода в масле грипп свиньи
болезнь Ауески свиньи
парвовирус свиней свиньи
герпесвирус лошадей лошади
иммуностимулирующий комплекс (ISCOM) грипп лошади
Глава 9
ВИРУСНЫЕ ВАКЦИНЫ
Вакцинопрофилактика по праву считается одним из крупнейших достиже-
ний биологии. Характерная черта развития биологии на современном этапе —
стремительное преодоление расстояния, отделяющего фундаментальные
открытия от их практического применения. Этот процесс наиболее отчетливо
проявляется в области разработки средств специфической профилактики
вирусных заболеваний. В настоящее время трудно назвать область биологичес-
кой науки, где бы столь быстро и эффективно использовались новейшие дости-
жения.
Благодаря этому в последние годы достигнуты большие успехи в области
вакцинопрофилактики многих опасных вирусных заболеваний. С помощью гло-
бальной вакцинопрофилактики во всем мире искоренена натуральная оспа
человека (1979 г.) существует эффективный контроль ряда опасных вирусных за-
болеваний людей (полиомиелит, корь, грипп, бешенство, гепатиты и др.) и жи-
вотных (ящур, чума свиней, чума жвачных и плотоядных, болезнь Марека, нью-
каслская болезнь и др.).
Подобно вакцинации против оспы, вакцинация против бешенства сыграла
очень важную роль в истории вакцинопрофилактики и является хорошим при-
мером развития в этой области науки с момента зарождения до наших дней, яр-
ко демонстрируя достижения, особенно в обеспечении безопасности. Первая
публикация Луи Пастера, посвященная бешенству, относится к 1881 году [1214].
В ней он описал содержание вируса в слюне и чувствительность кроликов к экс-
периментальному заражению вирусом бешенства. Четырьмя годами позже
Л. Пастер и Э. Ру сообщили, что при пассировании на кроликах вирус снижает
вирулентность и может быть использован для вакцинации [1213]. Вирус бешен-
ства, выделенный из мозга больной коровы, они пассировали интрацеребрально
на кроликах в течение 90 пассажей, отметив сокращение инкубационного пери-
ода с 15 до 7 дней, после чего он оставался постоянным («фиксированный ви-
рус»). Такой вирус в сухой атмосфере при комнатной температуре терял виру-
лентность и создавал иммунитет у собак к уличному вирусу бешенства. Откры-
тые Л. Пастером основополагающие принципы легли в основу создания вакцин.
Достаточно сказать, что на сегодняшний день практически нет эпидемий и
эпизоотий вирусной этиологии. Создание высокоэффективных вакцин и широ-
комасштабных методов их производства позволили разработать национальные и
международные программы контроля и искоренения ряда вирусных заболева-
ний человека и животных.
Профилактика многих вирусных болезней животных достигла исключитель-
но широких масштабов и стала неотъемлемой частью технологии ведения живот-
новодства, особенно на индустриальной основе. Например, инактивированную
вакцину против ящура и живую вакцину против ньюкаслской болезни изготовля-
ют в количестве, исчисляемом многими миллиардами доз. Предотвращенный
экономический ущерб, благодаря применению вакцин, достигает огромных раз-
меров. Только отмена прививок против оспы людей в связи с ликвидацией болез-
ни позволило сэкономить многие миллиарды долларов США.
В настоящее время в медицинской и ветеринарной практике широко приме-
няют живые и инактивированные вакцины, производство которых основывается
на современных достижениях биологической науки и технологических разработ-
ках. Производство и методы контроля таких препаратов стали достаточно слож-
ными и трудоемкими, значительно возросло их качество и безопасность приме-
нения. У живых вакцин основные трудности связаны с получением стабильного
иммуногенного вакцинного штамма вируса и разработкой методов его контроля.
При изготовлении инактивированных вакцин основной проблемой является по-
лучение большого количества безопасного вирусного антигена, по возможности
в неденатурированном и концентрированном виде. Существует большое разно-
образие в способах изготовления живых и инактивированных вакцин. Важное
значение придается стандартности вирусных вакцин, в связи с чем постоянно со-
вершенствуются методы контроля и ужесточаются требования к готовому препа-
рату. В живой вакцине вирус сохраняет потенциальную способность изменяться в
сторону снижения антигенности или повышения реактогенности или даже виру-
лентности. В культуре клеток и куринных эмбрионах, используемых в качестве
субстратов для размножения вакцинных вирусных штаммов, могут присутство-
вать другие, трудно обнаруживаемые вирусы, загрязняющие вакцину. В инакти-
вированной вакцине вирус может быть обезврежен не полностью, а ее производ-
ство таит в себе опасность попадания возбудителя во внешнюю среду. Кроме ви-
русных частиц и продуктов вирусспецифического синтеза с инактивированной
вакциной в организм поступает масса иммунологически активных балластных
клеточных белков и чужеродных нуклеиновых кислот, что крайне нежелательно.
Успехи в области изучения функциональной роли вирусных структур откры-
вают принципиально новые возможности для создания и усовершенствования
вакцин. Установлено, что иммунный ответ при вирусных инфекциях направлен
не на вирус как таковой, и даже не на вирусный белок, а лишь на небольшое
количество антигенных детерминант, представляющих не всю белковую молеку-
лу, а только отдельные участки. С учетом этого разрабатываются вакцины из
вирусных компонентов, получаемых путем расщепления вирусных частиц или
выделением из инфицированных вирусом клеток, либо генно-инженерными ме-
тодами.
Достигнутый уровень разработки эффективных препаратов не снимет про-
блемы их совершенствования и создания вирусных вакцин нового поколения на
основе достижений биотехнологии.
Классификация и типы вирусных вакцин
Современной науке известны сотни видов патогенных вирусов, относящих-
ся к 26 семействам, избирательно поражающим различные системы организма
человека и животных. Природное многообразие вирусных болезней вызывало
необходимость наряду с санитарно-гигиеническими мерами прибегнуть к спе-
цифической профилактике с использованием широкого круга вакцинных пре-
паратов. Вакцинопрофилактика занимает ведущее место в борьбе со многими
вирусными заболеваниями человека и животных. Несмотря на большое разно-
образие вирусов и вызываемых ими заболеваний, имеются общие принципы
приготовления и применения вирусных вакцин. Однако в настоящее время не
все вирусные болезни в одинаковой степени удается контролировать с помощью
вакцинации.
Результаты вакцинации всегда оценивали по защите от последующего зара-
жения гомологичным вирулентным (полевым) штаммом вируса («золотой стан-
дарт»). Вакцинация считается эффективной, если она исключает приживление и
размножение вирулентного вируса или ограничивает его размножение в месте
внедрения и предотвращает распространение к органам-мишеням.
Вакцинация должна сопровождаться развитием иммунологической памяти.
В идеале, это поддержание специфических антител в высокой концентрации в
сыворотке крови и на месте внедрения вируса. В тоже время Т-клетки, ответст-
венные за специфический клеточный иммунитет, должны находиться в состоя-
нии готовности быстро синтезировать свои летальные продукты (т.е. гранзимы и
перфорины), когда происходит инфицирование. Все существующие на сегодня
вакцины можно разделить на три общие группы: инактивированные (убитые),
живые (аттенуированные) и компонентные (субъединичные) вакцины. Каждая
из этих категорий вакцин имеет свои преимущества и недостатки.
В зависимости от технологии изготовления различают несколько типов ви-
русных вакцин:
1. Живые реплицирующиеся вакцины:
— вакцины из природно ослабленных или гетерологичных вирусов;
— вакцины из вирусов, аттенуированных пассажами в гетерологичных организ-
мах или в культурах клеток при обычной или пониженной температуре, или ре-
ассортацией вирусных генов.
2. Нереплицирующиеся вакцины, содержащие природные вирусные антигены:
- вакцины из инактивированных целых вирионов и неструктурных вирусных
белков;
— вакцины из нативных вирусных субъединиц.
3. Вакцины, полученные с помощью рекомбинантной ДНК или других новых
технологий:
— вакцины, полученные путем делеции гена (генов) или точечного мутагенеза;
- вакцины на основе вирусных белков, экспрессированных in vitro в клетках эу-
кариотов или прокатиотов;
— вакцины из вирусных белков, собранных в вирусоподобные частицы;
— вакцины, экспрессирующие вирусные антигены с помощью вирусных векто-
ров;
— вакцины на основе вирусных химер;
— ДНК-вакцины.
4. Синтетические полипептидные вакцины.
Живые вакцины содержат авирулентные штаммы вирусов, аттенуированные
разными способами, и отличаются способностью размножаться в привитом ор-
ганизме (реплицирующиеся антигены). Остальные типы вакцин готовят из
инактивированных вирусов или их антигенных и иммуногенных компонентов
(нереплицирующиеся антигены).
Используя другие принципы классификации, вакцинные препараты можно
разделить на две большие группы: цельновирионные и компонентные (субъеди-
ничные). Причем к первой группе относятся как традиционные живые, так и
инактивированные вакцины. Живые гомологичные вакцины, в свою очередь,
могут различаться способом получения и быть представленными природно атте-
нуированными или искусственно ослабленными штаммами, включая рекомби-
нантные и реассортантные, а также штаммы, аттенуированные цельнонаправ-
ленными изменениями генома биотехнологическими методами. К компонент-
ным (субъединичным) вакцинам можно отнести все, которые не входят в
рубрику цельновирионных вакцин. Прежде всего, сюда относятся вакцины, по-
лученные из компонентов вирионов или вирус-инфицированных клеток после
их разрушения. Кроме них к этой категории относятся субъединичные вакцины,
приготовленные из вирусных белков, экспрессируемых клонированными вирус-
ными генами в эукариотических или прокариотических системах. Сюда же мож-
но отнести живые рекомбинантные вакцины, которые по своей сути являются
реплицирующимися субъединичными вакцинами. Клонированные гены, реп-
лицируясь в составе вирусного вектора, обеспечивают экспрессию белков, от-
ветственных за индукцию специфического иммунитета.
Вакцины на основе вирусспецифических пептидов, получаемых синтетичес-
ким путем, в известном смысле, тоже можно отнести к разряду субъединичных
(эпитопных) вакцин.
Анализ имеющихся данных свидетельствует о достаточно высокой эффек-
тивности многих вирусных вакцин, применяемых в медицинской и ветеринар-
ной практике. Это, прежде всего, относится к живым вакцинам, применяемым
для контроля таких массовых и опасных заболеваний человека, как полиомие-
лит, желтая лихорадка, корь, эпидемический паротит, краснуха и др. Аналогич-
ным примером из практики ветеринарной медицины могут служить живые вак-
цины против чумы свиней, крупного рогатого скота и плотоядных, против нью-
каслской болезни и другие. Примером инактивированных вакцин могут служить
вакцины против полиомиелита, гриппа, ящура и многих других болезней.
Некоторые из живых вакцин (оспа человека, полиомиелит, желтая лихорад-
ка, корь, чума крупного рогатого скота, классическая чума свиней и др.) отвеча-
ют требованиям безопасности (генетическая стабильность, отсутствие реверсии,
слабая реактогенность), обеспечивают длительный напряженный иммунитет и
могут служить образцом для вновь создаваемых вакцинных препаратов.
Возбудители многих вирусных заболеваний (полиомиелит, грипп, ящур, ка-
таральная лихорадка овец, чума лошадей и др.) существуют в виде нескольких
антигенных типов. Поскольку иммунизация против одного из этих типов не за-
щищает от заражения другими, эффективная профилактика возможна только
при вакцинации поливалентной вакциной, содержащей антигены нескольких
антигенных типов данного вируса. Вакцины, содержащие антигены более чем
одного вида возбудителя, называют комбинированными (ассоциированными).
Большинство применяемых в настоящее время вакцин содержит антигены,
идентичные или подобные антигенам вирулентного вируса, против которого
предполагается создать иммунитет. Такие вакцины называют гомологичными. В
некоторых случаях для приготовления вакцин используют гетерологичные виру-
сы, содержащие перекрестно-реагирующие антигены и создающие достаточный
иммунитет. Такие вакцины называются гетерологичными.
9.1. Инактивированные вакцины
Для профилактики вирусных заболеваний широко применяют инактивиро-
ванные вакцины, которые имеют ряд преимуществ перед живыми вакцинами.
Важным условием эффективности вакцин является количество и качество ви-
русного антигена, выбор инактиватора и оптимальных условий инактивации,
позволяющих полностью лишить вирус инфекционное™ при максимальном со-
хранении антигенности. Понятие «инактивированный» относится к жизнеспо-
собности вирусов, входящих в состав вакцины.
Инактивированные вирусные вакцины обычно готовят из вирулентных ви-
русов, разрушая вирулентность химическими или физическими методами при
сохранении иммуногенности. Такие вакцины должны быть безопасны и содер-
жать большое количество вирусного антигена, чтобы вызвать иммунный ответ и
образование антител. Нормальный курс первичной вакцинации включает 2 или
3 инъекции вакцины; в дальнейшем, может потребоваться бустеризация для
поддержания иммунитета.
Среди первых инактивированных вирусных вакцин были вакцины против
бешенства, желтой лихорадки, ящура, классической чумы свиней, чумы плото-
ядных, ньюкаслской болезни и оспы животных. Поскольку не все из созданных
вакцин оказались эффективными, а некоторые из них таили угрозу инфициро-
вания из-за недостаточной полноты инактивации вируса, многие исследователи
стали отдавать предпочтение живым вакцинам, приготовленным на основе атте-
нуированных штаммов. Лучшим примером живых вакцин служит вакцина про-
тив оспы людей.
Следствием недостаточной инактивации вируса явились случаи возникнове-
ния болезни, которые имели место при изготовлении инактивированной вакци-
ны против полиомиелита. Недостаточная инактивация вируса ящура вызывала
вспышки болезни у вакцинированных животных в Западной Европе [400]. По-
добные явления отмечали после применения формолвакцины против венесуэль-
ского ЭМЛ [1016].
Однако в последние годы тенденция использовать инактивированные вак-
цины вновь стала возрождаться. Этому способствовало совершенствование ме-
тодов получения, концентрирования и очистки вирусных антигенов, инактива-
ции вирусов и методов контроля, обеспечивающих полную безопасность и выра-
женную эффективность препаратов. С другой стороны, попытки получить
безопасную эффективную живую вакцину не всегда оканчивались успешно. Так
было, например, с многочисленными попытками получить живую вакцину про-
тив ящура. Кроме того, живые вакцины против ряда вирусных заболеваний
(грипп, инфекционный бронхит кур, трансмиссивный гастроэнтерит свиней и
др.) зачастую не обладают гарантированной безопасностью и достаточной эф-
фективностью.
В производстве инактивированных вакцин против вирусных инфекций име-
ется три критических этапа: производство антигена, инактивация, адъювант.
Методы инактивации вирусов
В промышленное производство вирусных препаратов с нарастающей скоро-
стью вовлекаются все новые и новые вирусные агенты. Подавляющее большин-
ство новых объектов относится к классу так называемых «оболочечных вирусов».
Наблюдается тенденция быстрого сокращения периода между открытием оче-
редного возбудителя и организацией лабораторных и промышленных произ-
водств инактивированных препаратов.
Требования по безопасности ужесточаются в связи с необходимостью во
многих случаях приготовления концентратов вирусных антигенов. Следует от-
метить, что инактивация должна быть не только эффективной, но и максималь-
но щадящей (селективной). Иными словами, сопутствующие изменения в
структуре вирусных частиц и их компонентов должны быть минимальными. Од-
нако механизм инактивирующих воздействий во многих отношениях недоста-
точно выяснен и их использование зачастую носит эмпирический характер.
Так как вирионы в центре агрегатов, образованных клеточными и сыворо-
точными компонентами, могут быть защищены от инактивации, разрушение и
удаление агрегатов различными методами очистки вирусной суспензии является
важным этапом перед инактивацией. При изготовлении цельновирионных не-
реплицирующихся вакцин используют химические и физические методы инак-
тивации вирусов.
Химические методы
Из химических соединений наиболее часто используют два главных типа
инактиваторов: ретикулирующие (разрыхляющие) агенты и алкилирующие
агенты.
К ретикулирующим агентам относятся альдегиды, в том числе формальде-
гид, глютаральдегид и глицидальдегид, из которых наиболее часто используют
формальдегид [1300]. К алкирующим агентам относятся бетапропиолактон, эти-
ленимин и другие азиридины [579].
Механизм действия инактивирующих агентов, вероятно, заключается в сле-
дующем: 1) взаимодействуя с нуклеиновыми кислотами, они делают невозмож-
ной их репликацию; 2) вызывают ретикуляцию белков.
Механизм действия инактивирующих агентов лучше изучен применительно
к белкам, чем к нуклеиновым кислотам, хотя в целом остается не полностью вы-
ясненным. Инактивация вирусов, кажется, основывается на двойном действии
ретикуляции белков, взаимодействующих с клеточными рецепторами, и блока-
де репликации нуклеиновых кислот. Необходимая концентрация инактивирую-
щих агентов зависит, главным образом, от относительной концентрации белков
Основные характеристики инактивирующих агентов.
формальдегид бетапропиолактон этиленимин
химическая структура реактивных групп н - СО 1 н сн2-сн2 О — со сн2 - сн2 NH
физические свойства 35-40% водный раствор вязкая жидкость вязкая жидкость или водный раствор
способ действия ретикулирующий агент алкилирующий агент алкилирующий агент
кинетика инактивации комплексная первого порядка первого порядка
изменение инакти- вирующего агента в инактивированном продукте устойчив быстро гидролизуется полимеризуется в полиэтиленимин или медленно гидролизуется
и нуклеиновых кислот в инактивируемой среде. Температура и гомогенность
инактивируемого субстрата также играют ключевую роль в кинетике инактива-
ции вируса. Возможность обратимости изменений реактивных групп (амино-
группа лизина, фенольные ядра тирозина) необходимо учитывать, особенно в
случае использования формальдегида.
Полнота инактивации вируса должна определяться сразу после изготовления
вакцины.
Наиболее общепринятыми инактивирующими агентами являются формаль-
дегид, бета-пропиолактон и этиленимин. Одним из преимуществ бета-пропио-
лактона, используемого для изготовления вакцины против бешенства, и этиле-
нимина, применяемого в изготовлении вакцины против ящура, является то, что
они полностью гидролизуются в течение нескольких часов с образованием не-
токсичных продуктов.
Формальдегид инактивирует вирусы благодаря высокой реакционной спо-
собности в отношении белков и нуклеиновых кислот. Он вступает в соединение
не только с вирусными частицами, но и с многочисленными компонентами сре-
ды, в которую его добавляют.
Механизм инактивации вирусов формальдегидом сложен и характеризуется
двумя типами реакций. Взаимодействие формальдегида с нуклеиновой кислотой
и белками вируса протекает, соответственно, по типу реакции первого и второго
порядка. Наиболее существенна для инактивации первая, которая, однако, в
значительной мере зависит от второй.
Взаимодействуя с нуклеиновыми кислотами и белками, формальдегид реа-
гирует в основном с аминогруппами. Присоединение формальдегида к амино-
группам пуринов и пиримидинов уничтожает матричную и информационную
активность нуклеиновых кислот.
Формальдегид с большей скоростью взаимодействует с аминогруппами ами-
нокислот и белков с образованием метилольных производных, чем с азотистыми
основаниями нуклеиновых кислот. Сложилось представление, что с белками и
нуклеиновыми кислотами вирусов формальдегид реагирует в две стадии. Внача-
ле, в результате взаимодействия формальдегида с амино- или иминогруппами,
быстро образуются весьма нестабильные метилольные производные, а затем, в
результате вторичных реакций — бисметиленовые производные [88, 197].
Продукты взаимодействия формальдегида с аминокислотами способны
вступать в реакцию с нуклеиновыми кислотами значительно быстрее, чем сам
формальдегид [88].
Во второй стадии происходит медленное взаимодействие первичных продук-
тов реакции с другими группами белков, в результате чего образуются ковалент-
но связанные димеры полипептидов. При этом уплотняется белковая оболочка
и уменьшается ее проницаемость. Вследствие этого снижается скорость инакти-
вации вируса [197]. Под влиянием формальдегида в вирионах клещевого энце-
фалита образовывались гликопротеиновые димеры и комплекс РНК с белками
нуклеокапсида. Последний отличался высокой стабильностью и разрушался
только РНКазой. Предполагается, что образование этого комплекса — основной
механизм инактивации вируса. Гликопротеин, экстрагированный из инактиви-
рованного вируса, обладал нормальной антигенной и иммуногенной активнос-
тью [908]. Следует отметить, что реакция формальдегида с аминогруппами обра-
тима, то есть при удалении избытка реагента или разбавлении раствора актив-
ность нуклеиновой кислоты может быть восстановлена. Процесс
взаимодействия вируса с формальдегидом зависит от таких факторов, как кон-
центрация реагента, температура, pH среды. При оптимальных условиях инак-
тивации взаимодействие формальдегида с белками многих вирусов не оказывает
значительного влияния на их антигенные свойства. Однако ряд вирусов теряет
значительную часть антигенной активности при инактивации формалином. Это
особенно касается оболочечных вирусов и, прежде всего, вирусов кори [351] и
респираторно-синцитиального (PC) вируса [1274]. Например, инактивирован-
ная формалином вакцина против РС-вируса вызывала образование антител к
белку F, которые не подавляли его инфекционную и сим пластообразующую
активность [1133]. Более того, вакцинация приводила к осложнению течения бо-
лезни при последующем ее возникновении. Вероятно, под действием формали-
на изменяются эпитопы гликопротеина, ответственные за индукцию вирусней-
трализующих антител. Это касается, прежде всего, поверхностного F белка, от-
ветственного за протективный иммунитет [1274]. Однако многие из вирусов,
которые относительно хорошо переносят инактивацию формалином, оказыва-
ются весьма чувствительными к изменениям ее условий. Повышение концент-
рации формальдегида в десять и более раз по сравнению с оптимальной
(0,1%-ной) приводило к морфологическим изменениям поверхностного антиге-
на вируса гепатита В и снижению его активности [1643], а увеличение продолжи-
тельности обработки очищенного полиовируса сопровождалось значительным
повреждением капсида некоторых вирионов. С целью смягчения повреждающе-
го действия формальдегида на антигенность и иммуногенность вирусов стали
применять стабилизирующие вещества. Установлено, например, что добавление
арилдона (5,4 М) не влияет на инактивацию аттенуированных и вирулентных
штаммов полиовируса формалином (1:4000, 37°С) и, в то же время, способствует
сохранению иммуногенности за счет стабилизации D-антигена [210].
В опытах с герпесвирусом типа I крупного рогатого скота установлено, что в
процессе инактивации формальдегидом эпитопы гликопротеинов g I, g II и g IV
на 80% теряют способность связывать соответствующие моноклональные анти-
тела. Однако это не коррелировало с их способностью вызывать антительный от-
вет [609]. Инактивация формальдегидом энтеровирусов не влияла на распозна-
вание группоспецифического антигена Т клетками. В изготовлении инактиви-
рованных вакцин, кроме формальдегида, нашел применение глютаровый
альдегид. Он вызывает агрегацию вирионов благодаря образованию межмолеку-
лярных связей в результате взаимодействия формальдегида с аминогруппами по-
верхностных белков вирионов. При сшивке белковых молекул альдегидом бло-
кируется до 2/3 остатков лизина. Инактивация глютаральдегидом не сопровож-
дается заметным снижением антигенных свойств вирусов, вероятно, благодаря
полимеризации белковых молекул.
Бета-пропиолактон представляет собой высокоактивный алкилирующий
агент, нестойкий в водных растворах и легко гидролизуемый с образованием без-
вредных веществ: гидроакриловой и бета-оксипропионовой кислот. В связи с
этим отпадает необходимость в нейтрализации избытка бета-пропиолактона и
продуктов его распада.
Бета-пропиолактон оказывает инактивирующее действие на многие вирусы.
При оптимальной концентрации бета-пропиолактона снижается инфекцион-
ность вируса ньюкаслской болезни без существенного изменения гемагглюти-
нирующей, нейраминидазной и гемолизирующей активности [169]. Бета-пропи-
олактон разрушает инфекционность вируса Сендай, не влияя на его антигенные
свойства. Высказано предположение, что потеря инфекционности вирусами
Сендай и ньюкаслской болезни обусловлена взаимодействием бета-пропиолак-
тона с вирусным геномом. С помощью бета-пропиолактона удалось получить
высокоактивные вакцины против бешенства [1304] и неинфекционные антиген-
ноактивные препараты вируса катаральной лихорадки овец [1206], а также ин-
фекционного бронхита птиц [259].
Инактивация вирусов бета-пропиолактоном зависит от концентрации инак-
тиватора, температуры взаимодействия и содержания белка в вирусной суспен-
зии. Повышение концентрации бета-пропиолактона может привести к нежела-
тельной реакции с вирусными белками и, вследствие этого, к снижению анти-
генной активности [ 1205].
Из других химических веществ для инактивации вирусов представляет ин-
терес гидроксиламин, который, как и бета-пропиолактон, полностью разлага-
ется в течение короткого периода. Инактивирующее действие гидроксиламина
определяется его взаимодействием с пиримидиновыми основаниями нуклеино-
вой кислоты, зависящим от величины pH. В слабокислой среде происходит,
главным образом, изменение цитозина, а в щелочной — урацила [373]. Обработ-
ка некоторых вирусов (полиомиелита, бешенства, западного и восточного энце-
фаломиелита лошадей, гриппа, ньюкаслской болезни, осповакцины и др.) гид-
роксиламином при оптимальном режиме инактивации не приводила к сущест-
венным изменениям их антигенной активности, что позволило использовать
это вещество для изготовления диагностических антигенов и инактивирован-
ных вакцин.
В последние годы внимание исследователей привлекли азиридины, и осо-
бенно этиленимин и его производные. Этиленимин — насыщенное, гетероцик-
лическое соединение, впервые было синтезировано из бромэтиламина в 1988 г.
[12]. Этиленимин, как и другие азиридины, относится к группе высокореакци-
онных алкилирующих соединений, обладающих токсичностью.
Этиленимин и его производные оказывают сильное инактивирующее дей-
ствие на вирусы, сохраняя их антигенные свойства. Инактивирующий эффект
этиленимина на вирусы, по-видимому, объясняется депуринизацией и последу-
ющей деполимеризацией нуклеиновых кислот [12]. Замена формальдегида
этиленимином основывалась на следующих преимуществах. В отличие от
формальдегида, вызывающего образование поперечных связей в вирусных бел-
ках, этиленимин оказывал влияние только на нуклеиновую кислоту. При 25°С
инактивация вируса представляла собой быстрый, легко контролируемый ли-
нейный процесс, а полученные при этом полностью неинфекционные анти-
гены оказались удобными в дальнейшей переработке — концентрировании и
очистке [299].
Изучение кинетики инактивации вируса леса Семлики ацетилэтиленими-
ном показало возрастание скорости инактивации с увеличением температуры
(до 40°С) и концентрации инактиватора (до 0,1%). Оптимальной оказалась
температура 37°С, так как при ее снижении ниже 23°С вирус полностью не
инактивировался, а при повышении — происходила термоинактивация вируса и
потеря протективных свойств. Отмечена перспективность применения аце-
тилэтиленимина для приготовления инактивированных вакцин против тогави-
русов [240].
Для инактивации вирусов чаще применяют ацетилэтиленимин (АЭИ) и осо-
бенно димер этиленимина (ДЭИ), который значительно менее токсичен по
сравнению с этиленимином. Использование азиридинов для приготовления
инактивированных противовирусных вакцин во многом обязано исследованиям
с вирусом ящура.
Одним из стимулов к проведению этой работы были часто наблюдаемые
«хвосты» инфекционного вируса в противоящурных вакцинах, инактивирован-
ных формалином. Так, в результате обработки 0,05%-ным формальдегидом в те-
чение 144 ч при температуре 26°С и pH 8,9 не получали полной инактивации,
тогда как 0,05%-ный ацетилэтиленимин оказался высокоэффективным при воз-
действии в течение всего 12 ч при 37°С [60].
Азиридины применяли и для инактивации других вирусов, в частности, бе-
шенства (0,05% АЭИ, 65 ч, 37°С), псевдобешенства (0,05% АЭИ, 4% 37°С), пар-
вовируса свиней (ЭИ-5 ММ, 48-72 ч, 26°С), везикулярной болезни свиней,
классической чумы свиней и гриппа А [60].
Имеются сообщения о большой эффективности производных этиленимина
по сравнению с другими инактивирующими агентами. Преимущество заключа-
лось в получении безопасных препаратов с выраженными антигенными свойст-
вами. Преимущества АЭИ по сравнению с бета-пропиолактоном доказаны на
примере вирусов ящура, везикулярной болезни свиней и других вирусов. При
инактивации вируса лейкоза крупного рогатого скота оптимальные результаты
получены с АЭИ и ДЭИ. Оба агента вызывали инактивацию инфекционности
вируса, не изменяя активности вирусного гликопротеина, тогда как при инакти-
вации формалином наблюдалось существенное снижение антигенной активнос-
ти. При инактивации вирусов с дцРНК этиленимин и его производные действо-
вали менее эффективно [60]. Инактивация некоторых вирусов в присутствии
CuSO4 происходила без потери иммуногенности [171, 204, 205].
Химическая инактивация вирионов технически проста. Однако надежное
подавление инфекционное™ нередко сопровождается существенным снижени-
ем других видов биологической активности, в том числе иммуногенности. К
тому же, в ряде случаев требуется нейтрализация инактивирующих агентов.
Можно сказать, что все инактивирующие агенты в той или иной степени вы-
зывают изменения как в нуклеиновой кислоте, так и в белковой оболочке. При
этом характер изменений вирусных частиц во многом определяется природой
инактивирующего агента и возбудителя.
Приготовление эффективных инактивированных вакцин из некоторых обо-
лочечных вирусов (вирус кори, респираторно-синцитиальный и др.) оказалось
трудной задачей, поскольку все оболочечные вирусы имеют сложную липопро-
теиновую оболочку (липидный бислой с встроенными белками), наружные бел-
ки которой играют основную роль в индукции протективного иммунитета и ча-
сто денатурируются в процессе инактивации и последующего хранения.
Изучение воздействия химических инактиваторов на эпитопы гликопротеи-
нов вируса лихорадки долины Рифт показало, что вскоре после начального пе-
риода инактивации этиленимин мало действует на эпитопы. Бета-пропиолактон
в значительной мере изменяет структуру семи эпитопов, а формальдегид частич-
но воздействует на конфирмационную структуру большинства из них. Эпитопы
всех инактивированных антигенов отличаются сниженной способностью реаги-
ровать со специфическими моноклональными антителами в случае хранения их
более 6 мес [351].
Опытным путем на различных вирусах установлено, что при щадящих усло-
виях инактивации, как правило, вначале теряется инфекционность, а затем ан-
тигенность. Считается, что чем больше разница во времени между утратой этих
свойств, тем перспективнее режим инактивации данного вируса.
Изучение механизма взаимодействия инактивирующих факторов с нуклеи-
новыми кислотами и белками вирусов, а также выяснение структурных и функ-
циональных модификаций этих макромолекул поможет сделать выбор опти-
мальных условий инактивации вирусов с учетом их групповых и индивидуаль-
ных особенностей.
Первым реагентом для изготовления многих вирусных инактивированных
вакцин был формальдегид. Около 50 лет назад была предложена инактивирован-
ная формалином сорбированная вакцина против ящура [ 1607], технологию изго-
товления которой совершенствовали в течение многих лет. На ранних этапах
широкого применения такой вакцины имели место случаи неполного обезвре-
живания вируса ящура, что нередко приводило к вспышкам заболевания в евро-
пейских странах [60, 398]. Все это создало необходимость изыскать новые мето-
ды инактивации, обеспечивающие полную потерю инфекционных свойств ви-
руса без снижения его антигенности, в результате чего предпочтение было
отдано ацетилэтиленимину [398]. Однако в последнее время представлены но-
вые доказательства в пользу пригодности формальдегида для приготовления бе-
зопасной противоящурной вакцины. Этому способствовало использование
фильтрованной вирусной суспензии, инактивация вируса перед добавлением
ГОА и соблюдение общепринятого режима инактивации (0,04% формалина; pH
8,5; 25°С). Исключение адсорбации вируса перед добавлением формалина зна-
чительно облегчает контроль кинетики инактивации вируса, а также позволяет
проводить очистку и концентрирование инактивированного вирусного антиге-
на. При длительном хранении иммуногенность формолвакцины была выше, чем
вакцины, инактивированной АЭИ [298]. Сохранность полных вирионов (1468-
частиц) через 1 год (4°С) после инактивации формальдегидом глицилальдегидом
и бета-пропионлоктоном соответственно составляла 30—50%, 80—90% и 10—20%
[674]. Д. Солк и сотрудники, используя культуральный вирус и формалин, впер-
вые в истории профилактики полиомиелита получили безопасную инактивиро-
ванную вакцину. Фильтрованный вирус инактивировали формалином (1:4000;
37°С; pH 7,0; 12 суток). В дальнейшем, инактивированная формалином трехва-
лентная вакцина против полиомиелита повышенной активности была приготов-
лена в институте Мерье (Франция) из вируса, выращенного в культуре клеток
Vero на микроносителе.
Вакцина против болезни Тешена, инактивированная бета-пропиолактоном,
оказалась более иммуногенной, чем формолвакцина, полученная аналогичным
образом, тогда как другие исследователи при создании инактивированных вак-
цин против африканской чумы лошадей и болезни Тешена отдавали предпочте-
ние формалину [169].
Вирус африканской чумы лошадей инактивировали бета-пропиолактоном
(30 мин, 25°С) или формалином (48 ч, 25°С). Иммуногенная активность обоих
антигенов, сорбированных на гидрате окиси алюминия, была одинаковой [1077,
1205]. Бета-пропиолактон оказался эффективным средством при изготовлении
инактивированных вакцин против ньюкаслской болезни и везикулярной болез-
ни свиней [559].
Вирус гепатита А, адаптированный к культуре клеток человека, концентри-
ровали преципитацией сульфатом аммония и инактивировали бета-пропиолак-
тоном. Вакцина обладала выраженной антигенностью, вызывая длительную
персистенцию антител у вакцинированных животных. Другие авторы при изго-
товлении вакцины против гепатита А вирус выращивали в культуре диплоидных
клеток человека MRC-5. Очищенный и концентрированный вирус инактивиро-
вали формальдегидом, консервировали 2-феноксиэтанолом, а в качестве адъю-
ванта добавляли ГОА. Одна доза (1 мл) вакцины, содержащая 720 ед. (ИФА) ви-
русного антигена, вызывала практически 100%-ную сероконверсию у взрослых,
а после бустеризации обеспечивала защиту сроком не менее 10 лет [245, 1237].
Аналогичная вакцина при испытании на обезьянах и морских свинках обладала
выраженной антигенностью и иммуногенностью [97]. Инактивированная вак-
цина против гепатита А была лицензирована в ряде европейских стран. Лицен-
зированная вакцина 5 КВ для взрослых содержала 1,440 единиц/мл вирусного
антигена (определение в стандартном ИФА), 0,5 мг. А1(ОН)3 в качесте адъюван-
та и 2-феноксиэтанол в качестве консерванта. Первичную иммунизацию прово-
дили внутримышечно одной дозой вакцины, бустеризация — через 6—12 месяцев
усиливала иммунитет. Для иммунизации детей использовали уменьшенную дозу
вакцины. При ускоренном методе старения при 37°С вакцина сохраняла актив-
ность 3 недели, а при 2-8°С - 15 месяцев [1237].
Другой аналогичной лицензированной вакциной является вакцина VAQTA.
Очищенный концентрированный частично аттенуированный вирус инактиви-
ровали формальдегидом и сорбировали на гидрате окиси алюминия. У вакцини-
рованных шимпанзе в течение 2 недель развивались ВНА и они были защищены
от внутривенного заражения вирулентным вирусом гепатита А. Обе инактивиро-
ванные вакцины были безопасны и иммуногены для людей [245].
Инактивированную сорбированную вакцину против кори применяли трех-
кратно. Иммунизация сопровождалась образованием различного уровня нейт-
рализующих антител и антител, подавляющих ГА. Вакцинированные пациенты
были защищены от заболевания в течение нескольких месяцев после иммуниза-
ции. Титр антител быстро снижался и они вновь становились чувствительными
к естественному заражению [736, 1561].
Вакцину против клещевого энцефалита готовили из культурального вируса,
инактивированного формалином после фильтрации, затем его очищали, кон-
центрировали градиентным центрофугированием. Полученный препарат не об-
ладал реактогенностью и обнаружил выраженную антигенность на добровольцах
[359] и иммуногенность на мышах [631].
В производстве инактивированных антирабических вакцин наиболее часто
применяют бета-пропиолактон. Высокоиммуногенным безопасным препаратом
является вакцина из концентрированного и очищенного культурального вируса
бешенства, инактивированного бета-пропиолактоном (в течение 18 ч при темпе-
ратуре 4°С, а затем 2 ч при 37°С). Такую вакцину производили в США, Франции,
Германии [117]. Аналогичная инактивированная вакцина получена из очищен-
ного вируса, выращенного в культуре клеток Vero [895]. Сорбированную вакци-
ну против бешенства для ветеринарной практики готовили из ткани мозга инфи-
цированных мышей, крыс или из культурального вируса. Вирус инактивировали
бета-пропиолактоном.
Инактивированные вакцины против эпидемического паротита менее эф-
фективны, чем живые. Формолвакцина вызывала образование антител к HN
гликопротеину и к денатурированному F-белку и по-видимому ограничивалась
индукцией IgG и слабым клеточным иммунным ответом [448].
Вирус восточного энцефаломиелита лошадей, выращенный в суспензии све-
жеизолированных клеток куринного эмбриона, инактивировали формалином
или бета-пропиолактоном. Наибольшим защитным эффектом для морских сви-
нок обладала бета-пропиолактоновая вакцина [169].
Вирус геморрагической болезни кроликов, инактивированный формальде-
гидом, вызывал у привитых животных выраженный протективный эффект.
Инактивация вируса бета-пропиолактоном сопровождалась менее выраженным
снижением гемагглютинирующей активности и отчетливой иммуногенностью.
Вирус чумы крупного рогатого скота, инактивированный формальдегидом в со-
четании с неполным адъювантом Фрейнда, индуцировал у крупного рогатого
скота иммунитет продолжительностью один год.
Высокоиммуногенная эмульгированная вакцина получена из вируса болезни
Ауески, инактивированного формальдегидом или глутаральдегидом [1530]. Не
менее эффективные культуральные вакцины получены с использованием для
инактивации вируса этиленимина или этилэтиленимина. По иммуногенной ак-
тивности они не уступали живой вакцине против болезни Ауески [226].
Инактивированную вакцину против PC-инфекции крупного рогатого скота
удалось приготовить из инфицированных вирусом клеток, обработанных глю-
таральдегидом. При испытании на телятах эта вакцина оказалась более иммуно-
генной, чем живая вакцина из аттенуированного штамма PC-вируса крупного
рогатого скота и ts-мутанта PC-вируса человека. Для изготовления вакцины
против лейкоза крупного рогатого скота использовали постоянную линию
клеток FLK, персистентно инфицированную этим вирусом. Клетки инактиви-
ровали формальдегидом или глютаральдегидом и добавляли адъювант. Только
препарат, инактивированный формальдегидом, обладал протективным дейст-
вием [744].
Инактивация вируса катаральной лихорадки овец КЛО димером этиленими-
на (0,04—0,06 %; 37°С; в течение 3—5 дней) позволила получить безопасный вы-
сокоиммуногенный препарат. Повышение концентрации ДЭИ и продолжитель-
ности обработки вируса в 2—3 раза не снижало заметно его иммуногенности и га-
рантировало получение безопасного препарата, что свидетельствует о мягком
инактивирующем действии ДЭИ на вирус КЛО.
Формолвакцина против артеривирусной инфекции лошадей оказалась до-
статочно эффективным препаратом. Выраженный иммунный статус поддержи-
вался ревакцинацией через каждые 6 мес. [687].
Вирусы, инактивированные сернокислой медью, сохраняли антигенные и
иммунногенные свойства, а также целостность вирионной ДНК [205].
При инактивации парвовируса свиней формальдегидом гемагглютинирую-
щая активность практически исчезла, тогда как при инактивации ДЭИ снижа-
лась незначительно. Однако по антигенности препараты в обоих случаях прак-
тически не различались между собой.
Один из способов повышения безопасности инактивированных вакцин на
случай неполной инактивации вируса — использование аттенуированных штам-
мов. Классический пример этого — изготовление инактивированных вакцин из
аттенуированных штаммов вируса бешенства. Иммуногенные инактивирован-
ные вакцины были получены также из аттенуированных штаммов вируса
ньюкаслской болезни, парвовирусов энтерита кошек и собак [492], вируса болез-
ни Ауески. Изготовление инактивированных вакцин из аттенуированных или
частично аттенуированных штаммов вируса усиливает безопасность производст-
ва вакцин, что представляет большой интерес при работе с возбудителями опас-
ных болезней.
При изготовлении инактивированных вакцин с учетом непредвиденного
распространения болезней и резкого возрастания потребности в средствах спе-
цифической профилактики целесообразна разработка методов длительного хра-
нения концентрированных вирусных антигенов при низких температурах. Со-
здание резерва такого вирусного сырья кажется более перспективным, чем со-
здание резерва готового продукта. Аналогичные соображения высказывались в
связи с рассмотрением перспективных направлений в специфической профи-
лактике ящура. Установлено, что инактивированная вакцина против ящура,
приготовленная из вирусных концентратов, хранившихся в жидком азоте на
протяжении года, обладала высокой протективной активностью [595].
Физические методы
Наиболее распространенными физическими методами инактивации вирусов
являются гамма- и ультрафиолетовые (УФ) лучи.
Гамма-лучи — вид ионизирующего излучения, обладающий большой прони-
кающей способностью. В основе действия их лежат два эффекта: прямое и не-
прямое воздействие. Первое заключается в непосредственном поглощении
энергии излучения биологическими молекулами. Наиболее уязвимыми мише-
нями являются пуриновые и пиримидиновые основания [1389]. Непрямое дей-
ствие — влияние на объект активных свободных радикалов Н, ОН, НО2 и моле-
кулярных продуктов, например, перекиси водорода, образующихся в среде
вследствие радиолиза воды. Перенос энергии радикалов в растворе осуществля-
ется путем диффузии. Действие радикалов может вызвать такие изменения в
ДНК, как дезаминирование оснований, дегидроксилирование, разрыв связей
между дезоксирибозой и основанием, разрывы нуклеотидных цепей, окисление
дезоксирибозы [73]. В результате реакций, происходящих под влиянием прямо-
го и непрямого действия излучения, возможны различные повреждения структу-
ры нуклеиновых кислот вирусов: разрыв водородных связей, появление сшивок,
двухцепочечных разрывов. Белковая оболочка под воздействием радиации по-
вреждается незначительно.
Инактивирующее действие гамма-лучей изучали на различных вирусах: ос-
повакцины, болезни Ауески, простого герпеса, ящура, гриппа, венесуэльского
энцефаломиелита лошадей, бешенства, классической чумы свиней и др.
Установлено, что при воздействии гамма-лучей инфекционность вирусов те-
ряется быстрее, чем антигенность. Так, при облучении вируса гриппа в дозе 30
кГр наблюдали полное разрушение инфекционности при сохранении гемагглю-
тинирующей и нейраминидазной активности. Инфекционность вируса кори ут-
рачивалась при дозе облучения 5 кГр, в то время как гемагглютинирующая ак-
тивность — при 20 кГр. Гемагглютинирующая активность вирусов японского эн-
цефалита, венесуэльского энцефаломиелита лошадей сохранялась в препаратах,
в которых не обнаруживали инфекционный вирус при облучении в дозе
50—60 кГр [31]. Аналогичную устойчивость к облучению обнаружил основной
группоспецифический белок VP7 вируса катаральной лихорадки овец [221].
Инактивирующий эффект гамма-лучей зависит от влажности препарата,
температуры, наличия защитных средств.
Установлено, что в водных растворах вирус инактивируется значительно бы-
стрее, чем в сухих препаратах. Более высокая скорость инактивации вирусов в
водных растворах по сравнению с сухими препаратами объясняется суммарным
действием прямого и непрямого эффекта. При облучении вируса в сухих препа-
ратах, ввиду отсутствия несвязанной воды, непрямое действие практически ис-
ключается. С повышением температуры при облучении возрастает радиочувстви-
тельность вируса, которую можно ослабить введением в среду различных веществ
(гистидина, цистеина, альбумина, сыворотки, желатина и др.) Для инактивации
вирусов Коксаки, гриппа и полиомиелита в среде Игла с 2% сыворотки требова-
лось увеличить дозу более чем в три раза по сравнению с облучением в воде.
Экспериментально доказана возможность применения гамма-лучей для
приготовления антигенов и инактивированных вакцин против бешенства, грип-
па, оспы, венесуэльского энцефаломиелита лошадей, гепатита В и других ин-
фекций [126, 1299]. Применение гамма-излучения позволяет одновременно
инактивировать и стерелизовать готовый препарат.
Эффективность УФ-лучей определяется их проницаемостью и адсорбцией
биологическими молекулами. Белки поглощают УФ-лучи в меньшей степени,
чем нуклеиновые кислоты, и поэтому более устойчивы к их действию.
Ультрафиолетовое облучение вызывает изменения структуры нуклеиновых
кислот, заключающиеся в образовании димеров между соседними пиримидино-
выми основаниями, а также ковалентных связей между нуклеиновой кислотой и
белковой оболочкой. Повреждения ДНК приводят к инактивации вируса герпе-
са [438].
Вызывая глубокие изменения в структуре нуклеиновых кислот вирусов, УФ-
лучи не оказывают существенного влияния на белковую оболочку, вследствие
этого инактивированные вирусы способны сохранять свою антигенную и имму-
ногенную активность.
Однако такие особенности УФ-излучения как трудность выбора и контроля
оптимальной дозы, обеспечивающей инактивацию вируса с сохранением анти-
генных свойств, а также эффекты экранирования и фотореактивации затрудня-
ют практическое получение безопасных инактивированных препаратов.
Основной причиной, вызывающей инактивацию вируса при нагревании, яв-
ляется нарушение структурной целостности его генома, вызванное разрывом и
образованием внутримолекулярных связей в нуклеиновой кислоте.
Инактивированная нагреванием вакцина против вирусной геморрагической
болезни кроликов оказалась достаточно иммуногенной. Она вызывала устойчи-
вость к экспериментальному заражению на 5-90-й день после однократного
введения [750а].
В процессе получения вакцины против гепатита В из плазмы крови вирусо-
носителей инактивацию вируса проводили в два этапа: полуфабрикат прогрева-
ли при 103°С в течение 90 секунд, а затем инактивированный сорбированный на
фосфате алюминия антиген прогревали при 65°С в течение 10 ч. При таком спо-
собе происходила инактивация вируса гепатита и сопутствующих вирусов, кото-
рые могли присутствовать в донорской крови [936].
К простым и доступным методам инактивации вирусов относится фотодина-
мическое воздействие некоторых красителей, таких как метиленовая синька, ак-
ридиновый оранжевый, толуидин синий, нейтральный красный и другие, к ко-
торым чувствительны многие вирусы. Наиболее вероятный механизм такой
инактивации — изменение или отщепление гуанина без разрыва полинуклеотид-
ной цепи геномов [133]. Фотодинамическую инактивацию применяли при изго-
товлении экспериментальных образцов инактивированных препаратов против
клещевого энцефалита, краснухи, болезни Ауески, классической чумы свиней и
других вирусов [372, 373]. Обработка вируса Сендай родамином-В, бриллианто-
вым зеленым и фиолетовым Гофмана сопровождалась частичной модификацией
РНК без изменения капсидных белков. Инактивированный препарат обладал
высокой иммуногенностью [1079].
Основные показатели качества инактивированных препаратов, предназна-
ченных для профилактической вакцинации, — безопасность и высокая иммуно-
генность.
При оценке качества ряда инактивированных препаратов первостепенное
значение приобретает контроль авирулентности, направленный на выявление
оставшихся жизнеспособных вирионов. Считается, что чем опаснее возбуди-
тель, тем надежнее должны быть условия инактивации и методы контроля ее эф-
фективности. Степень безопасности инактивированных вакцин находится в не-
разрывной связи с чувствительностью тест-системы, по которой оценивают пол-
ноту инактивации вируса. В связи с этим разработка наиболее чувствительных и
совершенных методов обнаружения минимальных количеств живого вируса в
инактивированных препаратах имеет большое значение. Следует иметь в виду,
что, несмотря на стремление достичь полной инактивации вирусных частиц,
всегда остается статистическая вероятность того, что какая-то часть из них мо-
жет выдержать соответствующую обработку. Риск существования очень неболь-
ших количеств остаточного инфекционного вируса повышается по мере увели-
чения масштабов применения вакцины [60].
Для определения полноты инактивации вируса в инактивированной вакци-
не используют чувствительные культуры клеток и восприимчивых животных. В
практике производства инактивированных вакцин методы контроля на авиру-
лентность особенно тщательно разработаны для вакцин против полиомиелита,
бешенства, ящура, клещевого энцефалита и других наиболее опасных инфекций
человека и животных.
Специфическую безвредность инактивированной вакцины против полио-
миелита определяют в культуре клеток и на обезьянах. Основным методом при
этом является контроль в культуре клеток почки обезьян. Экспериментальные
исследования по изучению условий, повышающих возможность обнаружения
минимальных количеств живого вируса в культуре клеток, показали, что сущест-
венное значение имеет способ обезвреживания свободного формальдегида, объ-
ем вакцины для исследования и срок наблюдения. Нейтрализация бисульфитом
натрия несвязанного формальдегида в вакцине было предпочтительнее удаления
его диализом. Выбор количества вакцины, наблюдаемой для испытания ее безо-
пасности, обосновывали, исходя из теории вероятности. Согласно американ-
ским требованиям, в культуре клеток должно быть исследовано не менее 1500 мл
каждой выпускаемой серии вакцин. Кроме культуры клеток, безопасность по-
лиомиелитной вакцины оценивают по результатам наблюдения в течение 28
дней за состоянием привитых обезьян и последующего изучения гистологичес-
ких изменений в центральной нервной системе [102].
Опыт производства вакцины против полиомиелита во многих странах пока-
зал, что комбинированный способ контроля в культуре клеток и на обезьянах в
сочетании с инактивацией фильтрованной вирусной суспензии гарантировал
высокую степень безопасности препарата.
Авирулентность инактивированных вакцин против ящура определяли на
крупном рогатом скоте, свиньях, лабораторных животных и в культуре клеток.
Наиболее чувствительным считали испытание вакцины на крупном рогатом
скоте. Критерий безопасности (авирулентности) вакцины — отсутствие призна-
ков ящура у животных в течение 10 дней после введения ее в слизистую оболоч-
ку языка. Этот метод использовали во многих странах мира [297]. Однако метод
контроля авирулентности противоящурных вакцин на крупном рогатом скоте
дорог, громоздок и не всегда гарантирует обнаружение минимального количест-
ва инфекционного вируса. В Италии и ряде стран Южной Америки контроль
авирулентности осуществляли на мышах-сосунах. Каждую серию вакцины вво-
дили внутрибрюшинно 40—50 животным, специфичность гибели мышат под-
тверждали в РСК.
Высокая чувствительность ряда культур клеток к вирусу ящура позволяла ис-
пользовать их для оценки безопасности противоящурных инактивированных
вакцин [297].
Метод*контроля авирулентности инактивированной вакцины против ката-
ральной лихорадки овец оказался довольно сложным. В итоге, присутствие ви-
руса в вакцине выявляют пассажами в чувствительной культуре клеток непо-
средственно из инактивированной вакцины и из крови вакцинированных овец в
момент предполагаемой вирусемии - через 7-9 дней после прививки. Кроме то-
го, кровью вакцинированных овец прививают группу овец, у которых, спустя 21
день, определяют сероконверсию и устойчивость к контрольному заражению го-
мологичным вирулентным штаммом вируса. Несмотря на некоторую сложность,
принятая схема испытания безопасности инактивированной вакцины против
КЛО является весьма надежной [170].
Инактивированные антирабические вакцины контролируют на белых мы-
шах. Готовый препарат вводят мышам (10 голов) интрацеребрально, а через 10
дней проводят слепой пассаж на мышах. Все мыши должны оставаться здоровы-
ми в течение 14 суток с момента инокуляции. Специфичность заболевания и
гибели животных подтверждают методом флуоресцирующих антител. Пассаж
вакцины в культуре клеток с последующим внутримозговым введением культу-
ральной жидкости белым мышам значительно повысил эффективность обнару-
жения остаточного вируса в препарате по сравнению с методом слепых пассажей
только на мышах. Этому способствовали высокая чувствительность культуры
клеток, а также большое количество (30-40 мл) исследуемой вакцины.
Для контроля авирулентности инактивированной вакцины против клещево-
го энцефалита наиболее надежным признан метод, сочетающий одновременное
испытание вакцины в культуре клеток и на мышах 1169].
Авирулентность инактивированных культуральных вакцин против многих
вирусных болезней человека и животных оценивают в течение нескольких пас-
сажей (не менее трех) в культуре клеток, которую использовали для выращива-
ния конкретного вируса при изготовлении вакцины.
При контроле «эмбриональных» инактивированных вакцин полноту инак-
тивации вируса определяют на эмбрионах соответствующих видов птиц.
Следует отметить, что наряду с очевидными достижениями в области инак-
тивированных вирусных вакцин иммуногенность ряда препаратов отвечает
лишь минимальным требованиям, а при некоторых заболеваниях (корь, респи-
раторно-синцитиальная инфекция) вообще не удалось получить сколько-нибудь
выраженного протективного эффекта за счет применения этого класса препара-
тов. Объясняется это тем, что во многих случаях трудно достичь сочетания га-
рантированной безопасности и высокой эффективности.
Это относится, прежде всего, к вакцинам против особо опасных возбудите-
лей, при изготовлении которых приоритет отдается безопасности, даже если это
идет в ущерб эффективности. Например, вирус гепатита А в культуральной сре-
де в присутствии формалина (1:4000) не выявляли через 97 ч инкубации при
35°С. Однако для полной гарантии инактивации вируса его инкубировали при
указанных условиях в течение 10 дней [333]. При изготовлении вакцин против
других особо опасных заболеваний продолжительность инактивации вируса
обычно превышает минимальную в 2 и более раз, что, естественно, сказывается
на снижении их иммуногенности.
Возникающие трудности удается в значительной мере преодолеть, если для
изготовления инактивированной вакцины используют аттенуированные штам-
мы вируса. Это обстоятельство позволяет несколько ослабить режим инактива-
ции вируса без существенного риска уменьшения безопасности препарата.
Классическим примером такого решения может служить изготовление много-
численных инактивированных вакцин против бешенства из аттенуированных
штаммов вируса. Даже полностью авирулентный для мышей штамм (TAG-1) ви-
руса бешенства оказался в равной мере пригодным для изготовления живой и
инактивированной вакцин [1521]. Показана возможность приготовления инак-
тивированной вакцины из аттенуированных штаммов полиовируса, сравнимой
по иммуногенности с вакциной из вирулентных штаммов [210]. В нашей лабора-
тории получены иммуногенные инактивированные препараты из аттенуирован-
ных вакцинных штаммов вирусов болезни Ауески, катаральной лихорадки овец
и других сложноустроенных вирусов.
Анализ приведенных данных показывает, что, несмотря на то, что основные
принципы контроля инактивированных вакцин на авирулентность одинаковы,
методы испытания конкретных вакцин могут существенно отличаться. Индиви-
дуальный подход определяется свойствами вируса, особенностями болезни, чув-
ствительностью биологических моделей. Наиболее универсальным и общеприз-
нанным методом является испытание инактивированных препаратов в чувстви-
тельных культурах клеток. Однако при оценке безопасности некоторых вакцин
пользуются сложным комплексным подходом.
Анализируя сказанное, можно заключить, что одной из проблем получения
инактивированных вакцин является изыскание безупречного способа инактива-
ции вирусов, обеспечивающего необратимое повреждение его репликативного
механизма при полном сохранении исходной антигенной структуры. Поскольку
решить эту задачу во многих случаях пока не удалось, иммуногенность инакти-
вированных вакцин повышают за счет использования концентрированных ви-
русных суспензий и адъювантов. Для приготовления инактивированных вакцин
против различных заболеваний применяют химические методы инактивации
вирусов. Внимание исследователей к формальдегиду по-прежнему не ослабева-
ет; несмотря на недостаточную иммуногенность формолвакцин против некото-
рых инфекций, существует необходимость изыскивать новые методы инактива-
ции, позволяющие полностью подавлять инфекционность вирусов без суще-
ственного изменения антигенных свойств вакцин. Перспективным является
использование азиридинов, глютаральдегида и бета-пропиолактона, а также
применение нетрадиционных способов инактивации вирусов.
Физические методы инактивации из-за трудности контролируемого дозиро-
вания особенно при крупномасштабном производстве пока не получили практи-
ческого применения. С помощью химических методов можно приготовить вак-
цины почти из любого вируса, однако они могут сильно различаться по иммуно-
генности. Причина такого разнообразия пока недостаточно ясна. В одних
случаях это может быть следствием повреждающего и денатурирующего дейст-
вия инактивирующих агентов на вирусные антигены, в других — слабой антиген-
ности вируса, когда даже естественное переболевание не сопровождается обра-
зованием выраженного иммунитета.
В повышении иммуногенности инактивированных вакцин важная роль при-
надлежит адъювантам. Несмотря на крупные успехи в создании инактивирован-
ных вакцин, многие из них пока не обеспечивают такой напряженной и длитель-
ной защиты, как живые. Несмотря на это, против некоторых болезней созданы
достаточно эффективные инактивированные вирусные вакцины, являющиеся
на сегодня единственно приемлемыми препаратами для специфической профи-
лактики.
Иммуногенность инактивированной вакцины в значительной степени зави-
сит от наличия и вида адъюванта. Включение ГОА в состав вакцин увеличило их
активность во много раз [307]. В вакцинах для человека в качестве адъюванта ис-
пользуют только ГОА. В вакцинах для животных используют различные адъю-
ванты. Для крупного и мелкого рогатого скота в качестве адъюванта чаще при-
меняют ГОА с сапонином [1112]. Для свиней чаще применяют эмульгированные
вакцины. Эмульгированные моно- и поливалентные вакцины оказались более
иммуногенными не только для свиней, но и для крупного рогатого скота [1294].
Вакцины с масляным адъювантом создавали у телят более выраженный и
продолжительный иммунитет, чем ГОА-вакцина [1294]. У 1-месячных телят с
колостральным иммунитетом отсутствовал иммунный ответ на введение водных
антигенов, тогда как аналогичные телята, привитые вакциной с масляным адъ-
ювантом, реагировали иммунологически так, как взрослые животные [1353].
Иммуногенность инактивированных вакцин для птиц подобным образом за-
висит от вида адъюванта.
9.2. Живые вакцины
Живые вирусные вакцины — это, как правило, искусственно ослабленные
посредством культивирования или природные авирулентные либо слабовиру-
лентные иммуногенные штаммы вируса, которые, размножаясь в естественно
восприимчивом организме, не проявляют повышения вирулентности и потеря-
ли способность к горизонтальной передаче.
Безопасные высокоиммуногенные живые вакцины являются лучшими из
всех существующих вирусных вакцин. Применение многих из них дало блестя-
щие результаты в борьбе с наиболее опасными вирусными болезнями человека и
животных. В основе эффективности живых вакцин лежит имитация субклини-
ческой инфекции. Живые вакцины вызывают иммунный ответ на каждый про-
тективный антиген вируса [ИЗО].
Основным преимуществом живых вакцин считается активизация всех звень-
ев иммунной системы, вызывающая сбалансированный иммунный ответ (сис-
темный и локальный, иммуноглобулиновый и клеточный). Это имеет особое
значение при тех инфекциях, когда клеточный иммунитет играет важную роль, а
также при инфекциях слизистых оболочек, где требуется как системный, так и
локальный иммунитет. Местное применение живых вакцин обычно является бо-
лее эффективным для стимулирования локального ответа у непраймированных
хозяев, чем инактивированные вакцины, вводимые парентерально [1131].
В идеале, вакцинация должна повторять иммунологические стимулы естест-
венной инфекции, сводя до минимума нежелательные эффекты. Она должна
вызывать напряженный продолжительный иммунитет при введении в неболь-
шой дозе. Ее введение, как правило, не должно сопровождаться слабой, кратко-
временной общей и местной реакцией. Хотя после введения живой вакцины
иногда допускается развитие у небольшой части реципиентов отдельных слабо-
выраженных клинических признаков, напоминающих легкое течение естествен-
ной болезни. Живые вакцины больше, чем другие, отвечают этим требованиям
и, кроме того, отличаются низкой стоимостью и простотой применения разны-
ми способами.
Вакцинные вирусные штаммы должны обладать генетической и фенотипи-
ческой стабильностью. Их приживляемость в привитом организме должна быть
выраженной, а способность к размножению ограниченной. Вакцинные штаммы
обладают значительно менее выраженной инвазивностью, чем их вирулентные
предшественники. Это связано в значительной мере с их частично ограниченной
репликацией в месте проникновения и в органах-мишенях естественного хозяи-
на [1131]. Репликация вакцинных штаммов в организме легче ограничивается
естественными неспецифическими защитными механизмами. Вакцинные
штаммы размножаются в привитом организме до тех пор, пока его защитные ме-
ханизмы не затормозят их развитие. В течение этого времени образуется такое
количество антигена, которое значительно превышает его при введении с инак-
тивированной вакциной.
Для аттенуации вирусов обычно применяют пассажи вируса в неестествен-
ном хозяине или культуре клеток, пассажи при пониженной температуре и мута-
генез с последующей селекцией мутантов с измененным фенотипом.
Большинство современных живых вакцин, используемых для профилактики
инфекционных болезней человека и животных, получены пассажами вирулент-
ного вируса в гетерологичном хозяине (животные, куриные эмбрионы, различ-
ные клеточные культуры). Аттенуированные в чужеродном организме вирусы
приобретают множественные мутации в геноме, препятствующие реверсии ви-
рулентных свойств.
В настоящее время в практике широко применяют живые вакцины против
многих вирусных заболеваний человека (полиомиелит, желтая лихорадка, грипп,
корь, краснуха, паротит и др.) и животных (чума крупного рогатого скота, сви-
ней, плотоядных, бешенство, герпес-, пикорна-, коронавирусные и другие бо-
лезни). Однако еще не удалось получить эффективных вакцин против ряда ви-
русных болезней человека (СПИД, парагрипп, респираторно-синциальная ин-
фекция, денгевирусная инфекция и другие) и животных (африканская чума
свиней, инфекционная анемия лошадей и другие).
Имеется много примеров тому, что традиционные методы аттенуации виру-
сов еще не исчерпали своих возможностей и продолжают играть существенную
роль в разработке живых вакцин. Однако их значение постепенно уменьшается
по мере увеличения масштабов использования новой технологии конструирова-
ния вакцинных штаммов. Несмотря на значительный прогресс в этой области,
принципы получения живых вирусных вакцин, заложенные Л. Пастером, до сих
пор не потеряли своей актуальности.
Аттенуация вирусов
Все вирусные популяции характеризуются генетическим полиморфизмом, в
основе которого лежат спонтанные мутации как результат ошибок при считыва-
нии вирусного генома в процессе репликации [511, 916].
Спонтанные мутации ответственны за фенотипические изменения различ-
ных свойств вируса, в том числе вирулентности. В природе вирусы в процессе
передачи от хозяина к хозяину совершают множество циклов репродукции. В
этот период постоянно генерируются спонтанные мутации, которые могут вы-
зывать изменения свойств вируса. В организме природного хозяина селекциони-
руются преимущественно вирулентные вирусные частицы, которые способны
передаваться серийно восприимчивым организмам.
Адаптация вирусов к неестественным условиям репродукции сопровождает-
ся прогрессирующей селекцией спонтанных мутантов адекватно новым услови-
ям размножения.
Вирулентность вируса может быть снижена разными путями, в том числе
пассированием в культурах клеток особенно неестественного хозяина. При этом
преимущественно накапливаются мутанты, которые размножаются быстрее,
чем полевой вирус. Затем такие мутанты селекционируют и определяют пригод-
ность для использования в качестве живой вакцины. Аттенуированные мутанты
часто являются пригодными в качестве живых вакцин потому, что они не долго
размножаются в организме естественного хозяина и в то же время часто вызыва-
ют выраженный иммунный ответ [670].
У РНК-вирусов защитный механизм считывания генетической информации
менее эффективен, чем у ДНК-вирусов. Они обладают значительно более высо-
кой скоростью мутации, не менее чем в 100 раз, чем ДНК-вирусы [511, 525]
ДНК-вирусы генетически более стабильны и труднее адаптируются. Частота
ошибок у РНК-зависимых полимераз значительно выше, чем у ДНК-зависимых
полимераз. На 10 000 оснований РНК-вирусов приходиться примерно одна му-
тация. РНК-полимераза коронавирусов может привести примерно к трем ред-
ким мутациям вируса на каждые 30 кЬ генома в процессе репродукции [916].
Нелетальные мутанты РНК-вирусов накапливаются достаточно быстро. Гены,
кодирующие разные белки, изменяются с разной скоростью [1135, 1149].
Классическая аттенуация вирусов связана с селекцией спонтанных мутантов
с пониженной вирулентностью. Идеально, аттенуация вирусных штаммов не
должна сопровождаться потерей способности удовлетворительно размножаться
в организме естественного хозяина, изменением антигенности и потерей про-
тективных свойств.
Генетические мутации наиболее часто сопровождаются заменой единичных
нуклеотидов (точечные, миссенс мутации). Реже мутации связаны с делецией
или инсерцией единичных нуклеотидов или блоков нуклеотидов. Фенотипичес-
кая экспрессия мутаций может проявляться изменением различных свойств ви-
руса [511].
Точечные мутации, сопровождающиеся специфическими аминокислотными
заменами, в кодируемых вирусом белках могут снижать их функцию in vivo и тем
самым вызывать аттенуацию вируса для хозяина. По уровню аттенуации и их по-
тенциальной полезности для живых вирусных вакцин различают три класса то-
чечных мутаций: чувствительные к температуре (ts мутанты); зависящие от про-
теолитического расщепления (Ра мутанты) и с измененным тканевым (клеточ-
ным) тропизмом.
Ts мутанты обычно являются условно летальными вирусами, которые эффек-
тивно размножаются при 32—34°С. Аттенуирующие ts мутации идентифицирова-
ны в большинстве, если не во всех генах вирусов; ts мутацию можно вызвать поч-
ти в любом гене. Ts мутанты особенно пригодны для иммунизации людей против
респираторных вирусных болезней. Они хорошо размножаются в верхнем отделе
респираторного тракта человека (32—34°С) и плохо — в нижнем (37°С) [ИЗО].
Обнаружение ts мутантов (неспособных удовлетворительно размножаться
при температуре несколько выше, чем нормальная температура тела) обычно от-
ражает снижение вирулентности и указывает на возможность их использования
в качестве живой вакцины. Однако, даже вакцины, содержащие более чем одну
мутацию, доставляют беспокойство, связанное с возможностью восстановления
вирулентности в процессе размножения в привитом организме [1135].
Вакцинные штаммы полиовируса являются температурочувствительными со
значительно сниженной способностью к размножению и нейровирулентностью
для обезьян при введении в спиной мозг. Однако такие штаммы хорошо размно-
жаются в кишечнике вакцинированных животных и могут вызывать виремию, и
создают иммунитет. Хотя вакцинный вирус выделяется с фекалиями, контактная
передача чувствительным организмом происходит очень редко [1130].
Аттенуация путем адаптации вируса к размножению при пониженной темпе-
ратуре приводит к получению холодоадаптированных (Са) мутантов. К Са му-
тантам относятся безопасные вакцинные штаммы для интраназального приме-
нения, т.к. они хорошо размножаются при пониженной температуре носовой
полости (около 33°С у большинства видов млекопитающих), но не при темпера-
туре низлежащих респираторных путей и легких. Холодоадаптированные вак-
цинные штаммы против гриппа, содержащие мутации почти в каждом гене, не
давали реверсии. В 1997 году вакцину против гриппа людей, основанную на та-
ких мутациях, использовали в США [1135]. Са мутанты успешно использовали
при создании живых вакцин против ряда вирусных болезней животных.
Ра мутанты играют важную роль в аттенуации вирусов, инфекционность ко-
торых зависит от протеолиза структурного белка.
Известно, что протеолитическое расщепление парамиксовирусов необходи-
мо для активации инфекционности и играет важную роль в проявлении тканево-
го тропизма и патогенности. Трипсин-подобные ферменты, присутствующие в
клетках хозяина, требуются для расщепления предшественника белка сплавле-
ния FO на две субъединицы F1 и F2. Ра мутанты устойчивые к активации трип-
сином, оказывались аттенуированными.
Протеолитическое расщепление ГА вируса гриппа клеточными протеазами
является важным для инфекционности вирусного потомства. В культуре клеток
куринного эмбриона не происходит расщепления гемагглютинина.
Точечные мутации могут сочетаться с делеционными мутациями.
Делеционные мутанты
Вирусы, имеющие полную или частичную делецию, оказались весьма полез-
ными для создания живых вакцин. Крупногеномные вирусы, например, могут
утратить один или более генов, которые не требуются для репликации in vivo, но
ведут к аттенуации вирулентности вируса для его хозяина. Делеционные мутан-
ты более стабильны, чем точечные мутанты. Полезность делеционных мутантов
для создания живых вакцин основана на ограничении репликации in vivo без
снижения их репродукции in vitro в процессе изготовления вакцины.
Получение безопасных высокоиммуногенных аттенуированных штаммов
обычными методами не всегда удается. Более того, даже если аттенуация достиг-
нута, не всегда известны связанные с этим изменения генома и не исключается
реверсия вирулентности. В этой связи, важное значение имеет идентификация
генов вирулентности с тем, чтобы изменить их путем направленной мутации или
удалить с помощью методов генной инженерии.
Проблема, связанная с восстановлением вирулентности у вакцинного виру-
са, может быть решена делецией несущественных генов, ответственных за виру-
лентность. Этот метод изменения генома с использованием эндонуклеаз может
быть применен только для ДНК геномных вирусов. Следовательно, вирусные ге-
номы, представленные РНК, должны быть транскрибированы в ДНК-копии, а
затем подвергнуты изменениям [1131].
Многие, особенно ДНК-вирусы, содержат значительное количество генов,
удаление которых из вирусного генома не влияет заметным образом на их репли-
кацию in vitro и in vivo, но сопровождается значительными изменениями виру-
лентности [959].
Важными объектами для разработки вакцин на основе селективной инакти-
вации генов прежде всего являются герпесвирусы. Аттенуация — это не единст-
венная задача при разработке живых герпесвирусных вакцин, поскольку склон-
ность вирусов этого семейства к персистенции и реактивации составляет глав-
ное препятствие на этом пути. Оно может быть преодолено с помощью
делеционных мутаций генов, ответственных за персистенцию и реактивацию
вируса при сохранении иммуногенности [1131]. Первые успехи в аттенуации
вирусов с использованием методов «хирургии нуклеиновых кислот» достигнуты
в опытах с герпесвирусами животных [ 1066, 1090]. Делеционные мутанты герпе-
свируса 1 КРС [1091] и герпесвируса 1 свиней [1066] хорошо размножались в
культуре клеток и в организме, обладали аттенуированным фенотипом и со-
храняли иммуногенность. На основании таких авирулентных делеционных му-
тантов созданы коммерческие маркированные вакцины против болезни Ауески
свиней [1067, 1096] и инфекционного ринотрахеита КРС, которые с успехом
применяются во многих странах для специфической профилактики этих за-
болеваний.
Делеционные мутанты также могут возникать у РНК-вирусов, гены которых
кодируют дополнительные функции. Эти делеции могут быть связаны с генами
некодирующей области вирусного генома, что сопровождается аттенуацией без
заметного ограничения репликации.
Вставки (инсерции) в геном вируса чужеродных генов, в том числе кодирую-
щих антивирусную или иммунорегулирующие функции (гены интерферонов
или интерлейкинов) могут сопровождаться аттенуацией вируса.
Точечные мутации или делеции в 5' или 3' или других, не кодирующих обла-
стях вирусного генома могут иметь аттенуирующий эффект. Эти не кодирующие
области, выдающие сигналы, необходимые для эффективной репликации,
транскрипции и трансляции, являются мишенями, изменяющими эти функции
в результате мутации. Аттенуирующие мутации в этих регуляторных областях ви-
русного генома могут изменять тканевой тропизм, чувствительность к интерфе-
рону и температуре, а также ограничивать репликацию вируса.
ДИЧ-мутации (образование дефектных интерферирующих частиц-ДИЧ)
ДИЧ образуются при серийном пассировании в культурах клеток или эмбри-
онах птиц. При высокой множественности заражения их концентрация возрас-
тает. Это обусловлено несколькими механизмами: 1) их укороченный геном раз-
множается быстрее; 2) они менее часто уклоняются от функционирования в ка-
честве матриц транскрипции мРНК и 3) они обладают повышенным
афинитетом для вирусной репликазы, дающим им преимущество перед их пол-
но-геномными аналогами. Этим также объясняется то, почему ДИЧ интерфери-
руют с репликацией инфекционных вирионов с полноразмерным РНК геномом,
прогрессивно повышая эффективность в серийных пассажах.
Морфологически ДИЧ подобны родительским вирионам и содержат все
структурные белки в той же пропорции, что и стандартный вирус. Однако у ви-
руса верикулярного стоматита ДИЧ короче (пулевидные частицы), образуются
путем множественных делеций генома и содержат от 60 до 25% вирусного гено-
ма. Они интерферируют только с гомотипичными штаммами вируса [1347]. Об-
разование дефектных частиц может зависеть от вакцинного штамма вируса.
Заражение культуры клеток вакцинным штаммом Эдмонстон-Шварц и Эд-
монстон-Эндерс вируса кори при небольшой множественности заражения не
индуцировали образования субгеномной РНК [435].
Генерация некоторых дефектных ДНК вирусных геномов может сопровож-
даться значительными модификациями ДНК. Например, ДИЧ парвовируса
обычно содержат копии оригинальной геномной ДНК, хотя иногда с примесью
ДНК клеточного происхождения.
ДИЧ могут снижать вирулентность стандартного вируса. Разведенный вирус
может оказаться вирулентным, а концентрированный — не вирулентным. Роль
ДИЧ при различных инфекциях все еще выясняется [511].
В последние годы секвенирование генома вирусов привело к пониманию ме-
ханизма аттенуации и позволило повысить эффективность и безопасность жи-
вых вакцин. У большинства вирусов за вирулентность и тропизм ответственны
несколько генов, которые действуют различными путями. Например, в отличие
от системной инфекции, вызванной вирулентным полевым вирусом, некоторые
вакцинные вирусы, обладающие тропизмом к респираторному тракту, размно-
жаются только в верхних дыхательных путях; в других случаях, вакцинный ви-
рус, введенный орально, размножается только в специфических эпителиальных
клетках кишечника.
Аттенуированный штамм 17-D вируса желтой лихорадки обладает понижен-
ным тропизмом к печени обезьян и это является признаком, с помощью которо-
го мутант может быть признан аттенуированным для человека. Это подтвержда-
лось при дальнейших исследованиях в клинических условиях.
Подобным образом штаммы полиовируса, аттенуированные естественным
путем или пассированием в культуре клеток, утратили нейровирулентность.
Аттенуация вируса серийными пассажами в неестественном хозяине
Большинство живых вирусных вакцин, применяемых сегодня, получены эм-
пирически серийными пассажами в гетерологичном организме или культуре
клеток естественного или гетерологичного хозяина. Адаптация вируса к более
интенсивному размножению в необычных условиях сопровождается прогресси-
рующим снижением и потерей вирулентности для естественного хозяина.
Серийные пассажи в гетерологичном хозяине были классическим способом
эмпирической аттенуации вируса. Например, вирусы чумы крупного рогатого
скота и классической чумы свиней были аттенуированы и использованы в каче-
стве соответствующих живых вакцин после длительного серийного пассирова-
ния в организме кролика. Значительно раньше таким способом получен аттену-
ированный вирус бешенства. Аттенуированные штаммы многих вирусов получе-
ны серийным пассированием в эмбрионах птиц [1130].
В процессе многочисленных пассажей в неестественном хозяине или культу-
ре клеток исходный вирулентный штамм вируса может накопить множество то-
чечных мутаций в геноме, которые лежат в основе аттенуации. Однако, несмот-
ря на многие весьма ценные практические результаты, аттенуация вирусов путем
пассирования в системе неестественного хозяина — в целом процесс неуправля-
емый, а результаты его непредсказуемы.
Получение удовлетворительных аттенуированных мутантов является результа-
том «генетической рулетки» вследствие случайной селекции мутантов с желаемой
степенью аттенуации и выраженной иммуногенностью. Это положение, в частно-
сти, подтверждается неудачными результатами повторного получения вакцинно-
го штамма 17Д вируса желтой лихорадки [1131]. Генетическая основа аттенуации
вакцинных вирусов кори, паротита, краснухи, желтой лихорадки, ротавируса и
осповакцины не известна, тогда как генетические детерминанты аттенуации двух
из трех вакцинных штаммов полиовируса достаточно изучены [1130, 1135].
Живые вакцины против чумы КРС (ЧКРС) являются одними из наиболее
безопасных и эффективных вирусных вакцин. Вирус ЧКРС аттенуирован разны-
ми способами и практически с одинаковым результатом. Три типа аттенуирован-
ных вакцин использовали десятилетиями для ликвидации ЧКРС: лапинизиро-
ванную, капринизированную и культуральную. Капринизированная вакцина
была первой живой вакциной против ЧКРС и использовалась до недавнего вре-
мени в Индии. Лапинизированный штамм (Накамура-Ш) адаптировали к куль-
туре клеток почки телят [122] или куриным эмбрионам [1144]. Лапинизирован-
но-авинизированную (LA) вакцину в основном применяли в Азии. В странах
стационарно неблагополучных по ЧКРС в основном применяли культуральную
вакцину RBOK из штамма Kabete «О», который не передается при контакте и со-
здает напряженный иммунитет длительностью не менее 10 лет [1252]. Культу-
ральные вакцины из других штаммов, в том числе созданных в СССР [122, 77],
обладали аналогичными свойствами [86].
Несмотря на достигнутые успехи в получении аттенуированных вирусных
вакцин эмпирическим путем, на современном этапе происходит замена «генети-
ческой рулетки» рациональным констуированием генно-инженерных вакцин. В
последнем случае, мутации, связанные с аттенуацией, известны, стабильны и
предсказуемы.
Аттенуация вирусов посредством длительного пассирования в клеточных
культурах в настоящее время является основным методом получения живых ви-
русных вакцин. Этот метод основан на селекции пассажных мутантов, отличаю-
щихся биологическими свойствами от исходных вирулентных штаммов. Полу-
ченные таким образом аттенуированные иммуногенные штаммы аккумулируют
в себе множество спонтанных мутаций, что гарантирует им генетическую и фе-
нотипическую стабильность, хотя генетическая основа аттенуации используе-
мых живых вирусных вакцин в большинстве случаев остается невыясненной.
Идентификация вирусных генов, определяющих вирулентность, представ-
ляет огромный интерес для получения авирулентных вакцинных штаммов, а
также их использования в качестве носителей чужеродных генов. Поэтому изу-
чению молекулярных основ аттенуации вирусов уделяется большое внимание.
Наиболее часто с этой целью сопоставляют первичную структуру геномов виру-
лентных и аттенуированных штаммов [343] и реже прибегают к изучению влия-
ния инактивации или делегирования различных генов на вирулентные свойства
вирусов [859].
Молекулярные основы аттенуации наиболее подробно были изучены у вак-
цинных штаммов трех серотипов вируса полиомиелита, полученных А. Сэби-
ным и широко применяемых для пероральной иммунизации людей. Были сдела-
ны попытки выяснить, какие изменения генома привели к аттенуации — потере
нейровирулентности вируса.
Около 50 лет тому назад А. Сэбин отметил, что штаммы полиовируса, выде-
ленные от здоровых людей, обладают пониженной нейровирулентностью. При-
мерно 1 /5 этих штаммов являются высоко аттенуироваными.
L'
Живая оральная вакцина против полиомиелита представляет собой три
аттенуированных штамма. Вакцинные штаммы 1 и 3 типа получены пассажами
в клеточных культурах различного происхождения. Вакцинный штамм типа 2
получен из природно аттенуированного изолята полиовируса [1130].
Аттенуацию полиовируса типа 3, выделенного от пациента, погибшего от па-
ралитического полиомиелита, проводили следующим образом [670].
21 пассаж на обезьянах (внутрицеребрально);
8 пассажей в культуре тестикулярных клеток обезьян;
39 пассажей в культуре клеток почки обезьян;
3 пассажа методом бляшек в культуре клеток почки обезьян;
3 препаративных пассажа в культуре клеток почки обезьян.
Каждый из трех аттенуированных серотипов вируса содержал различные то-
чечные мутации в 5'-некодирующей области генома, которые могли нарушить
трансляцию мРНК. Мутации в капсидных белках, по-видимому, влияли на сбор-
ку вирионов.
Сиквенс-анализ исходного родительского полиовируса типа 1 и его вакцин-
ного деривата показал, что у последнего содержится 55 мутаций, приводящих к
замене 21 аминокислоты [1285]. 12 аминокислот заменены в структурных белках
и 9 — в неструктурных, В кодирующей области на 3'-конце генома были обнару-
жены две точечные мутации, а в кодирующей области 5'-конца — пять [40]. Для
аттенуации полиовируса типа 1 существенной являлась замена аденина на гуа-
нин в позиции 480 в 5'-концевой некодирующей области генома [1013]. Обраща-
ет на себя внимание то обстоятельство, что 33% всех аминокислотных замен
(7 из 21) приходилось на VP1, ген которого составляет 12% вирусного генома.
Концентрация мутационных изменений в наружном белке вируса наводит на
мысль, что аттенуация — результат изменений его поверхностных свойств. Одна-
ко многочисленность изменений в геноме вакцинных штаммов полиовируса ос-
ложняет идентификацию сайта, отвечающего за аттенуацию нейровирулентнос-
ти. Возможно, что мутации других вирусных генов могли быть также вовлечены
в аттенуацию вирулентности вируса для человека [1131]. Анализ рекомбинантов
показал, что в определении нейровирулентности полиовируса главная роль при-
надлежит той половине генома, которая примыкает к 5'-концу и кодирует, в
основном, структурные белки, однако участок генома, кодирующий неструктур-
ные белки, тоже может оказывать влияние на нейровирулентность [40]. Оправ-
далось мнение, что молекулярная основа аттенуации вакцинного штамма по-
лиовируса типа-3 может отличаться от таковой вакцинного штамма полиовиру-
са типа 1. В геноме вакцинного штамма типа 3 выявлено 10 точечных мутаций,
которые привели к замене трех аминокислот (по одной в полипетидах VP3, VP1
и протеиназе-2А).
В некодирующей области генома обнаружены две точечные мутации. Из де-
сяти мутаций лишь две имеют отношение к потере нейровирулентности. Одна
находится в нуклеотиде-472 в 5'-концевой некодирующей области и легко ре-
версирует в организме человека. Другая мутация заключается в замене фенила-
ланина на серин в позиции 3091 белка VP3. Поскольку она определяет термочув-
ствительность вируса, то с ее потерей восстанавливалась нейровирулентность
[996]. Реверсия нейровирулентности аттенуированного полиовируса типа 3 со-
провождалась восстановлением одной последовательности в 5'-концевой неко-
дирующей области генома. Эта область является высококонсервативной у трех
серотипов полиовируса (74% гомологии) и аналогична по структуре другим пи-
корнавирусам. Ее первичная структура определяет вторичную структуру генома
этих вирусов и отвечает за сборку и морфогенез вирионов [40]. Поскольку имму-
низация аттенуированными вакцинными штаммами полиовируса сопровожда-
ется виремией, было высказано предположение, что ограничение репликации в
нейронах представляет собой основу их аттенуации у человека [343, 1131].
Ряд исследователей придерживаются мнения, что VP1 является основным
сайтом аттенуации полиовируса типа 1. Оно основывается на важной роли VP1 в
детерминировании клеточного тропизма и инфекционности вируса. Это наво-
дит на мысль, что изменения в протеине VP1 вакцинного штамма, прежде всего,
нарушает его адсорбцию на клетках органов-мишеней, то есть центральной
нервной системы [1131].
Мутации, отвечающие за аттенуацию вакцинного штамма полиовируса ти-
па-3, также, возможно, связаны с областью, VP1, несмотря на то что, разница
между родительским и вакцинным, вирусом заключалась лишь в замене одной
аминокислоты (лиз 274 -> арг) и не рассматривалась как значимая в структурном
отношении. У вакцинированных трехвалентной полиовакциной может иметь
место межтиповая рекомбинация вакцинных вирусов с сохранением определен-
ной степени аттенуации у рекомбинантов [996].
При полиомиелите имеются две эффективные вакцины: инактивированная
вакцина Солка для внутримышечного применения и живая аттенуированная
вакцина Сэбина для орального применения. Эти вакцины явились основой для
разработки программы глобального ис-
Таблица 24. Детерминанты аттенуации вакцинных штаммов А. Сэбина [670] коренения полиомиелита. Живая вакци- на получила универсальное применение и доказала свою высокую эффектив- ность, несмотря на имевшие место оди-
Вакцинные Мутации ночные случаи реверсии вакцинных
вирусы (положение нуклеотидов) штаммов. Так, например, полиовирус ти-
Р1 5'-UTR (480) VP1 (1106) VP1 (1134) VP3 (3225) VP4 (4065) па 3 (рЗ/119), выделенный от вакциниро- ванного пациента с признаками полио- миелита, при сиквенс-анализе генома оказался истинным ревертантом вакцин-
Р2 5'-URT (481) VP1 (1143) ного штамма РЗ Сэбина [670], а случаи полиомиелита в Испании связаны с ре-
РЗ 5'-URT (472) VP3 (3091) версией вакцинного штамма полиовиру- са Р1 [882].
Первая живая аттенуированная вакцина против кори получена из исходного
вирулентного штамма Эдмонстон, выделенного в 1954 г. и прошедшего 7 пасса-
жей в культуре клеток почки человека и 6 пассажей в культуре клеток Vero. По-
сле 24 пассажей в культуре клеток почки и 28 пассажей в культуре клеток амни-
она человека получен штамм Эдмонстон-Эндерс. В дальнейшем его аттенуиро-
вали следующим образом:
6 пассажей на куриных эмбрионах (в амниотическую полость);
13 пассажей в культуре клеток куриных эмбрионов;
6 пассажей на куриных эмбрионах (в амниотическую полость);
3 пассажа в культуре клеток куриных эмбрионов;
8 пассажей в культуре клеток куриных эмбрионов (при 36°С);
40 пассажей в культуре клеток куриных эмбрионов (при 32°С).
В результате этих пассажей получен современный аттенуированный вакцин-
ный штамм Moraten. Такой вирус слабо размножался в привитом организме и
вызывал слабо выраженные признаки болезни у приматов. Вакцинный штамм
имел множественные мутации, часть из которых была связана с изменением
прикрепительного белка. Успех вакцинации этим штаммом был обусловлен его
слабой репликацией, потомство вирионов часто оставалось на месте реплика-
ции, и вакцинация вызывала слабую или инапарантную инфекцию у отдельных
пациентов. В дальнейшем аттенуация этого штамма была продолжена разными
авторами, в результате чего получены новые вакцины (Загреб, ALK-C, САМ, Ле-
нинград 16, Шанхай-191). Уровень антител у вакцинированных зависел от возра-
ста пациента и наличия материнских антител. Полиморфизм генов, ответствен-
ных за иммунный ответ, также оказывал влияние на сероконверсию. Обычно од-
на доза (3,0—4,0 1g БОЕ) вакцины вызывала сероконверсию у 80-95% привитых
[670]. Когда дозу вакцины для детей 4—6 месячного возраста увеличивали в
10—100 раз, сероконверсия усиливалась [736]. Однако применение высокотит-
ражной вакцины в странах с высокой детской смертностью сопровождалось уве-
личением смертности девочек в последующие 2—3 года [791, 899].
Иммунный ответ на живую вакцину подобен иммунному ответу на естест-
венную инфекцию, хотя вакцинальный иммунитет более вариабельный и менее
продолжительный. Для предупреждения вспышки кори с учетом ее высокой
контагиозности необходимо, чтобы по крайней мере 98% населения было серо-
позитивными. Роль латентного инфицирования на фоне недостаточного имму-
нитета в поддержании вируса неизвестна. Корь остается наиболее распрост-
раненным заболеванием людей в разных частях света. В центре современной
стратегии борьбы с корью остается одновременная массовая вакцинация. Теоре-
тически, корь является идеальным объектом для ликвидации путем иммуниза-
ции живой вакциной. Вирус имеет один серотип, большинство случаев болезни
легко распознается клинически, не существует животных носителей вируса и су-
ществуют эффективные вакцины [736].
Живые вакцины Jery Lynn, Urabe, Am9 и Ленинград-3 против эпидермичес-
кого паротита получены путем аттенуации вируса серийным пассированием в
куриных эмбрионах (КЭ) и в культуре клеток КЭ. Каждая из этих вакцин пред-
ставляет собой смесь нескольких аттенуированных штаммов. Например, штамм
Jery Lin В аттенуирован пассажами в куриных эмбрионах (17 пассажей) и в куль-
туре клеток куриных эмбрионов. Вакцина из этого штамма представляет собой
смесь, по крайней мере, двух аттенуированных штаммов JL5 и JL2 в соотноше-
нии 5:1. После однократного парентерального применения живых вакцин ВНА
появляются в течение 2 недель у 95% привитых и могут сохраняться более 19 лет
[448]. Для профилактики паротита в России применяют живую вакцину Ленин-
град-3 из аттенуированного штамма (Л-3), размноженного в первичной культу-
ре клеток японских перепелов. Иммунитет развивается примерно у 60% приви-
тых (> 10 000 ТЦД50) и сохраняется не менее 8 лет [115].
Попытки аттенуировать вирус ветряной оспы увенчались успехом. С этой
целью его пассировали в культурах клеток эмбриона человека и морской свинки,
а затем в диплоидных клетках человека WI-38. Вакцина из аттенуированного
штамма «Ока» оказалась слабореактогенным безопасным препаратом, создаю-
щим иммунитет более чем у 90% детей сроком на один год [854]. Установлено,
что во время пассирования в культуре штамм «Ока» претерпел множество мута-
ций, о чем свидетельствует потеря, по крайней мере, шести сайтов рестрикции,
однако основа его аттенуации не выяснена [1131]. При использовании миллио-
нов доз этой вакцины в США очень редко отмечали незначительные осложне-
ния [448]. Вакцина из штамма «Ока» — первая живая вакцина против вирусов
герпеса человека.
Вирус краснухи аттенуировали серийными пассажами в различных культурах
клеток, в результате которых получено несколько вакцинных штаммов. Среди них
вакцина HPV77/DE5 из вируса размноженного в культуре клеток эмбриона уток,
широко используемая в Северной Америке. Вакцину из штамма Cendehill исполь-
зовали в Европе. Несколько аттенуированных штаммов получены в Японии [921].
Иммунитет у вакцинированных связан с циркулирующими антителами, ко-
торые появляются через 2—3 недели после вакцинации и сохраняются 20 лет
[115]. Эффективная иммунизация предусматривает двукратную вакцинацию на
втором году жизни и после 6 лет при вакцинации 95% детей. В России зарегист-
рированы живые вакцины против краснухи Рудивакс (Франция), SII (Индия) и
вакцина MMR (США) против кори, паротита и краснухи. Вакцину MMR приви-
вают лицам старше 15 лет. После однократного введения сероконверсия к трем
вирусам развивается не менее, чем у 95% привитых. Антитела сохраняются более
И лет [115].
С целью получения живой безопасной иммуногенной вакцины штамм Н2
вируса гепатита А серийно размножали в культуре клеток почки новорожденных
обезьян, а затем в культуре фибробластов человека (КМВ17). Этой вакциной в
Китае привито более 20 млн человек, и не было отмечено случаев вакцинально-
го гепатита или выделения вакцинного вируса с фекалиями [1004].
Аттенуированный вакцинный штамм ТС-83 вируса венесуэльского энцефало-
миелита лошадей получен в результате 45 пассажей вирулентного штамма в куль-
туре клеток сердца морской свинки [889]. Аналогичный штамм-15 этого вируса
получен серийным пассированием вируса в культуре клеток куриного эмбриона.
Испытания, проведенные на добровольцах, показали, что живая вакцина
против цитомегаловирусной инфекции человека из штамма Таун была безопас-
ной и защищала от заболевания, но не от инфицирования полевым штаммом ви-
руса. Вакцинный вирус не выделялся из организма привитых пациентов.
Единичные точечные мутации в геноме многих вирусов сопровождаются
аминокислотными заменами в поверхностных белках и аттенуацией. Так было с
вирусами лихорадки долина Рифт, Синдбис, клещевого и японского энцефали-
тов и другими вирусами [169]. У аттенуированного штамма ТС-83 вируса венесу-
эльского энцефаломиелита лошадей выявлены замены одной аминокислоты в
Е-1, пяти аминокислот в Е2 и делеция в З'-концевой некодирующей области ге-
нома [889].
Вакцинный штамм 17-D вируса желтой лихорадки содержит мутации в гене,
кодирующем протективный гликопротеин VP3. Нуклеотидная дивергенция вак-
цинного штамма составляла 1% [1081].
Тканевой тропизм и нейровирулентность реовирусов млекопитающих и
птиц определяются генными сегментами S-1, кодирующими поверхностный бе-
лок Q-1. Вирионный белок Q-1 реовирусов так же, как VP1 пикорнавирусов, от-
ветственен за тропизм к клеткам хозяина и представляет главную мишень для
нейтрализующих антител [1702].
Природно аттенуированные мутанты реовируса с измененным тропизмом к
клеткам центральной нервной системы могут быть изолированы эксперимен-
тально селекцией вируса с изменениями в капсидном протеине Q-1 [1131]. Рео-
вирусные мутанты проявляют пониженный тропизм к специфическим участкам
мозга, хотя размножаются нормально во внутренних органах экспериментально
инфицированных мышей.
Выявлена интересная зависимость между вирулентностью коронавирусов
кошек и клеточным тропизмом. Вирулентные штаммы в основном поражают
моноциты авирулентные - реплицируются в эпителии кишечника [1457].
В аттенуации вируса простого герпеса важная роль принадлежит гликопро-
теинам. Мутанты вируса с делециями в генах гликопротеинов G и Е оказались
аттенуированными для мышей. Гликопротеины D [1117] и Н [580] также играют
существенную роль в тканевом тропизме и инфекционности вируса. Делеция
аминокислотных остатков в положении 324—244 гликопротеина D полностью
исключает эти функции [1117]. Определенный вклад в инфекционность вируса
вносит гликопротеин С. Вирус, лишенный gC, в 10—20 раз имел меньшую ин-
фекционность по сравнению с исходным [770].
С целью выяснения роли отдельных генов в вирулентности вируса болезни
Ауески были получены мутанты с делециями 1—3 генов, кодирующих гликопро-
теины оболочки вириона. Делеционные мутанты по одному гену gl или gill об-
ладали пониженной вирулентностью для свиней и однодневных цыплят, тогда
как мутанты, дефектные по двум генам, кодирующим гликопротеины gill и gl
или gill и gp63, оказались полностью авирулентными для указанных животных.
Из этого следует, что вирулентность вируса болезни Ауески является синергид-
ной функцией отдельных экспрессируемых генов, а репродукция вируса в куль-
туре не коррелирует с вирулентностью [1065]. Полигонный контроль вирулент-
ности обнаружен также у вируса долины Рифт [1363].
Аттенуация для обезьян реассортантов вирусов гриппа птиц и человека де-
терминирована геном нуклеопротеина [1433].
Вирулентные штаммы вируса гриппа, в отличие от авирулентных, имеют
протеолитически расщепленный НА, что зависит, по-видимому, от наличия ос-
новных аминокислоту С' конца НА-1, которые распознаются клеточными про-
теазами. Инфекционная форма вируса гриппа с расщепленным НА при инфек-
ции млекопитающих образуется только в поверхностных клетках дыхательного
тракта [1624].
Аттенуация вируса гриппа А птиц также связана с изменением его НА. Ре-
продукция вирулентных штаммов вируса гриппа кур сопрождалась расщеплени-
ем НА, тогда как размножение авирулентных штаммов нуждалось в экзогенном
трипсине. В отличие от вирулентного штамма, вызывающего у кур системное
поражение органов, включая лимфоидные ткани, его аттенуированный вариант
не поражал лимфоидные ткани [441]. Мутации в гене, гемагглютинина вируса
гриппа А птиц сопровождались аттенуацией вируса, связанной с изменением его
клеточного тропизма [1242].
Различия авирулентных штаммов вируса ньюкаслской болезни связаны с из-
менениями в структуре HN-гена, кодирующего гемагглютинин-нейраминидазу.
Большинство аминокислотных замен располагалось в четырех участках N'-koh-
ца HN белка [1635]. Имеются данные, свидетельствующие о связи вирулентнос-
ти вируса ньюкаслской болезни и вируса Сендай с расщеплением гликопротеи-
на слияния (белок Fo) клеточными протеазами [718, 813] или изменением других
свойств белков F и HN [1376].
Нуклеотидная дивергенция в гене НА аттенуированного штамма вируса чу-
мы крупного рогатого скота в 3'-концевом некодирующем участке генома была
более выраженной, чем внутри кодирующей области [1695]. Вакцинный штамм
RA 27/3 вируса краснухи отличался от исходного вирулентного штамма заменой
31 аминокислотного остатка в капсидном белке и в гликопротеине Е-1 — 12 за-
менами, Е-2 — семью заменами [1147].
Негемагглютинируюший мутант парвовируса собак отличался от исходного
«дикого» штамма мутацией генов, кодирующих поверхностные белки VP1 и VP2.
Адаптация буньявирусов к клеткам комаров сопровождалась изменением глико-
протеинов оболочки вируса и чувствительности к нейтрализующему действию
моноклинальных антител [842]. Важная роль в определении спектра биологиче-
ских переносчиков арбовирусов принадлежит наружным белкам вириона, участ-
вующим в прикреплении вируса к поверхности клеток хозяина [1469].
С помощью нейтрализующих моноклональных антител из популяции виру-
лентного вируса бешенства удается селекционировать варианты с измененным
поверхностным гликопротеином и признаками аттенуации для центральной
нервной системы. Мутант вируса бешенства, характеризовавшийся двумя ами-
нокислотными заменами (лейцин-132 —>- фенилаланин; аргинин-333 —
глютамин), утратил нейровирулентность для взрослых мышей [1521].
Вирулентность штаммов ERA и GVS вируса бешенства для мышей зависела
от наличия аргинина или лизина в положении 333 вирусного гликопротеина
[113]. Замена аргинина в положении 333 на лейцин, изолейцин, метионин, цис-
тин или серии полностью лишала эти штаммы вирулентности [1551]. По всей ве-
роятности, такие варианты характеризовались минимальным количеством то-
чечных мутаций и, как следствие, — реверсибельностью.
Так как ts мутанты вирусов гриппа и респираторно-синциальной инфекции
оказались генетически не стабильными, аттенуацию многих вирусов стали про-
водить серийным пассированием в культурах клеток при постепенном снижении
температуры выращивания (37—22°С).
Поскольку Са-мутанты обладали большей стабильностью фенотипа при
репликации в организме, они получили преимущественное развитие и практи-
ческое использование, в том числе при получении реассортантных вакцин.
Первоначально созданные живые вакцины против кори и краснухи были не-
достаточно аттенуированы. Дальнейшее пассирование вируса в культуре клеток
и селекция холодоадаптированных (Са) мутантов позволили получить безвред-
ные вакцинные штаммы [1131].
Вирус парагриппа 3 человека после 45 пассажей при пониженной температу-
ре (22—20°С) приобрел аттенуированный фенотип. Он размножался у человека и
обезьян только в верхних дыхательных путях при интраназальном введении и
вызывал выраженную сероконверсию и устойчивость к заражению вирулентным
штаммом вируса [750]. Такой штамм частично терял ts фенотип размножаясь в
организме шимпанзе, хотя оставался достаточно аттенуированным. Каждый из
135 изолятов выделенных от вакцинированных детей сохранял Са и ts фенотип.
«Холодный» вариант вируса отличался от полевого исходного вируса 20 мутаци-
ями в том числе 10 заменами аминокислот в NP, С, М, F, HN и L белках [472].
Аттенуированный Са мутант вируса инфекционного бронхита кур (тип Ар-
канзас) получен путем серийного пассирования при пониженной температуре
(35—28°С). Вирус в основном размножался в верхних дыхательных путях и очень
слабо в других органах (40—42°С). Он оказался авирулентным для 3-, 7-дневных
цыплят-бройлеров. Доза вакцины, обеспечивающая 100%-ную защиту привитой
птицы, соответствовала 103—105 ЭИД50.
Аттенуированный штамм ТД-97 вируса кори получен путем длительного
пассирования (более 60 пассажей) в культурах клеток человека, обезьян, мор-
ских свинок, куриных эмбрионов при обычной и пониженной температуре (35;
30°С) в сочетании с УФ-облучением с целью мутационного повреждения РНК с
селекцией измененных вариантов методом бляшек [169].
Вакцина против инфекционного перитонита кошек разработана на основе
температурно-чувствительного мутанта вируса. При интраназальном введении
вирус реплицировался только в верхних дыхательных путях и инактивировался в
других органах. При испытаниях на кошках в экспериментальных условиях из 20
вакцинированных животных после контрольного заражения заболело три, а в
группе не-вакцинированных — все 12, из них погибли 10. У вакцинированных
животных образовались сывороточные и секреторные нейтрализующие антите-
ла, а также развился клеточный иммунный ответ. Полевые испытания подтвер-
дили безопасность и эффективность вакцинации [702].
Первый аттенуированный штамм вирус гепатита А получен путем серийно-
го пассирования в культуре клеток при пониженной температуре. Он прошел 15
пассажей в культуре клеток почек обезьяны при 35°С, пять пассажей при 32°С и
четыре пассажа — в диплоидных клетках почки человека. Штамм потерял спо-
собность заражать обезьян оральным путем, сохранив иммуногенность. Недо-
статком вакцины являлась потенциальная опасность реверсии с возможной пе-
редачей вакцинного штамма по контакту. Аттенуированный штамм отличался
от исходного вирулентного вируса заменой 25 нуклеотидов. В том числе в
5'-концевой некодирующей области генома обнаружено семь замен и пять де-
лений. Из 12 замен аминокислотных остатков только одна обнаружена в белке
VP1 [513].
Аналогичный штамм получен при пассировании полевого штамма вируса
(НМ 175) в культуре клеток AGMK при 35°С 32 раза [1421]. Вакцинный штамм
Н2 аттенуирован пассированием в культуре клеток почки новорожденных обезь-
ян, а затем в фибробластах легких человека (КМВ17). Вакциной из этого штам-
ма привито более 20 млн человек в Китае — с хорошей эффективностью. Вирус
не выделялся из организма привитых и не обнаружил реверсии.
Вакцинный штамм GPE— вируса классической чумы свиней (КЧС) — полу-
чен пассированием штамма ALD в разных клеточных культурах при 30°С. Он
прошел 142 пассажа в культуре клеток тестикул свиней и клонирован методом
предельных разведений, 36 пассажей в культуре клеток тестикул крупного рога-
того скота — и вновь клонирован тем же методом, затем 41 пассаж в культуре кле-
ток почки морской свинки. Вакцинный штамм GPE-, в отличие от исходного
вирулентного штамма, хорошо размножался в культуре клеток морской свинки
(G-маркер) при 30°С и плохо при 40°С (Т-маркер). Испытание на поросятах под-
твердило его безопасность и высокую иммуногенную активность [1407]. Геном
штамма GPE-отличался от родительского заменой 225 нуклеотидов [1409]. На
его основе создали GPE-вакцину которая успешно применяется в Японии [628].
Штамм Tiverval вируса КЧС получен из вирулентного штамма Альфор после
более чем 170 серийных пассажей в культуре клеток при 29—30°С и его можно
идентифицировать несколькими маркерами in vitro [269]. По безопасности и им-
муногенности он подобен другим вакцинным штаммам вируса КЧС.
В качестве живой вакцины против ящура испытывали «холодный» вариант
вируса тип О;, который прошел 120 пассажей в первичной культуре клеток поч-
ки телят при 24°С. При испытании в лабораторных условиях штамм (О] —
24°-120) обнаружил аттенуированный фенотип. Он оказался авирулентным для
КРС, морских свинок и 7-мидневных мышей, не передавался горизонтально и
вызывал иммунитет [67]. Сухая вакцина из этого штамма была испытана на се-
ронегативном КРС (более 7 000 голов) в двух республиках СССР в зоне с умерен-
ным климатом, в летний период (температура воздуха +20 +30°С). Результаты
этих испытаний полностью подтвердили результаты лабораторных исследова-
ний. Однако прививка этой вакциной КРС в зимний период при содержании
практически на открытом воздухе при температуре — 25—30°С вызывала ослож-
нения у 7 из 96 животных, связанные с реверсией вирулентности аттенуирован-
ного штамма. Причиной реверси, вероятно, явилось резкое понижение темпера-
туры конечностей, особенно в области копыт, где вирус ящура обычно размно-
жается в естественных условиях. Выделенный от вакцинированных животных
вирус сохранял некоторые исходные свойства: размножался при 24°С и не вызы-
вал гибели новорожденных мышей. Полученные результаты демонстрируют
пример реверсии in vivo, зависящий от температуры.
Продолжительность аттенуации
Установлено, что для разных вирусов требуется разная продолжительность
аттенуации. Примером короткого периода аттенуации могут служить вирусы чу-
мы уток и ринотрахеита индеек. Для аттенуации первого требовалось примерно
20 пассажей в первичной культуре клеток куриного эмбриона, второго — 17 пас-
сажей в культуре клеток Vero [ 1663]. Оба полностью авирулентных штамма обла-
дали выраженной иммуногенностью и вызывали резистентность у привитых жи-
вотных вскоре после однократного парентерального введения. В этом отноше-
нии они напоминали высокоиммуногенные живые вакцины против ряда других
заболеваний животных.
Высокоэффективные и безопасные вакцинные штаммы чаще и быстрее уда-
валось получить у оболочечных вирусов, чем у безоболочечных. Тип геномной
нуклеиновой кислоты, казалось, не имел значения.
Кроме обычного серийного культивирования, для ускорения аттенуации ви-
русов использовали метод быстрых пассажей, суть которого заключается в сле-
дующем. Уже на ранних этапах аттенуации в популяции вируса появляются но-
вые мутанты, отличающиеся более быстрым размножением в новой системе и
аттенуированным фенотипом. Если, применять большую заражающую дозу и
собирать «ранний» урожай вируса для очередного пассажа, то можно значитель-
но ускорить процесс аттенуации. В опытах с вирусом венесуэльского энцефало-
миелита лошадей, например, было установлено, что популяция вируса, размно-
женного в клетках ВНК, содержит две группы клонов: медленно проникающие
в клетки и вирулентные; быстро проникающие в клетки и авирулентные [857].
Используя данный принцип, был получен аттенуированный штамм А-14-2
для живой вакцины против японского энцефалита. Стабильная аттенуация ви-
руса наступила после 23 быстрых пассажей в первичной культуре клеток почки
хомяка [1614].
Недостатками живых вакцин являются:
1) потеря аттенуации вакцинным штаммом (реверсия или компенсаторная мута-
ция);
2) возможность содержания посторонних агентов (контаминация);
3) горизонтальное (контактное) распространение;
4) длительная персистенция в привитом организме.
Основным недостатком является возможность восстановления вирулентно-
сти вакцинным вирусом вследствие размножения в организме естественного хо-
зяина. Реверсию фенотипической экспрессии мутаций обычно отмечают у вак-
цинных штаммов, аттенуированных единичными точечными мутациями. Ревер-
сия некоторых из аттенуированных точечных мутантов обнаружена в процессе
репликации in vivo даже через 47 часов после вакцинации [ИЗО]. Реверсия виру-
лентности за счет обратных точечных мутаций была отмечена у аттенуированных
штаммов вирусов бешенства и полиомиелита [716]. В подобных случаях ревер-
сия вирулентности может произойти не только за счет обратной мутации «по-
врежденных» нуклеотидов (нуклеотида), но также за счет супрессорных мутаций
в тех же самых генах или в других генах, которые ведут к восстановлению исход-
ного фенотипа [511].
Множественные точечные мутации и особенно делеции делают практически
невозможной реверсию вирулентности вакцинного штамма в процессе его при-
менения.
Реверсибельность вакцинных штаммов привлекает внимание при внедрении
новых живых вакцин. Реверсия лицензированных вакцин не является пробле-
мой их практического применения, хотя она существует теоритически. При мас-
совом применении таких вакцин, если реверсия происходит, то происходит ис-
ключительно в редких случаях и остается, как правило, незамеченной.
И все таки, если случайная единичная реверсия состоялась, то вирулентный
вирус вначале должен преодолеть резистентность привитого организма, обус-
ловленную данной вакциной, а затем найти восприимчивые особи среди приви-
тых для своего распространения. Однако к этому времени основной контингент
вакцинированных станет иммунным. Действительно, при использовании живых
вакцин в практических условиях еще не зарегистрировано случаев распростра-
нения заболевания в результате реверсии вакцинного штамма вируса, если он
был надежно аттенуирован [44, 1131].
Так как пока отсутствуют надежные лабораторные маркеры дифференциа-
ции вирулентного и аттенуированного штаммов вируса, используют другие ме-
тоды. Реверсибельность вакцинных штаммов, используемых для изготовления
живых вакцин, применяемых в ветеринарии, проверяют на естественно воспри-
имчивых животных. Аттенуированные штаммы, не усилившие реактогенность и
не восстановившие вирулентность в течение пяти последовательных пассажей
на наиболее чувствительном к естественной инфекции виде животных, считают-
ся пригодными для изготовления живой вакцины. Проверка реверсибельности
вакцинных штаммов вирусов человека более затруднительна. Для оценки атте-
нуации вирусных штаммов используют генотипические и фенотипические мар-
керы, кроме того надежность аттенуации вирусных штаммов, предназначенных
для вакцинации людей, проверяют на экспериментальных животных, и в первую
очередь на обезьянах. Идентификация вакцинных штаммов против различных
вирусных болезней человека, и в первую очередь против желтой лихорадки и по-
лиомиелита, стала возможной с помощью таких животных.
Установлена возможность реверсии вакцинного штамма при серийном пас-
сировании в культуре элективных клеток хозяина. Так например, аттенуирован-
ный штамм Рокборн вируса чумы плотоядных давал реверсию как при серийном
пассировании на собаках, так и в культуре легочных макрофагов собак [248].
Горизонтальная передача и длительное носительство вакцинного штамма ви-
руса считаются нежелательными явлениями.
При лицензировании новых живых вакцин для животных во многих странах
(ЕС, США, Япония) их проверяют на отсутствие горизонтальной передачи вак-
цинного штамма. Проверку проводят на естественно восприимчивых животных
(10 вакцинированных и 10 контактных). При совместном содержании в течение
2—4 недель о наличии или отсутствии горизонтальной передачи судят по резуль-
татам тщательного лабораторного обследования этих животных. Однако при от-
рицательном результате таких исследований не исключается принципиальная
возможность контактной передачи вакцинного штамма при массовой вакцина-
ции в условиях влияния множества эндогенных и экзогенных факторов. Редкие
случаи такой передачи некоторых вакцинных штаммов известны, но они не ве-
дут к повышению вирулентности вакцинного вируса и не сопровождаются сни-
жением эффективности вакцинации. Исключением из этого правила является
живая вакцина против полиомиелита. Вакцинный штамм Сэбина полиовируса
типа 1 и 3 в редких случаях оказался способным вновь обрести нейровирулент-
ность и вызывать заболевание у вакцинированных или у контактировавших с
ними людей. Однако это происходит с исключительно низкой частотой (около
одного случая на 106—107 иммунизаций) и в общем не влияет на выраженную
эпидемиологическую эффективность данного препарата [1131]. Выяснена гене-
тическая основа этого довольно редкого повышения вирулентности полиови-
русных вакцинных штаммов при репликации в кишечнике привитых.
Другое исключение состоит в том, что некоторые аттенуированные вакцин-
ные штаммы могут довольно легко передаваться горизонтальным путем, не вы-
зывая при этом нежелательных последствий. Однако из-за их высокой эффек-
тивности приходится мириться с циркуляцией вакцинного вируса в популяции.
Таким примером могут служить некоторые вакцинные штаммы вируса нью-
каслской болезни, которые бессимптомно иммунизируют кур, находящихся в
контакте с привитыми в полевых условиях [1366]. Способность некоторых атте-
нуированных штаммов выделяться из организма вакцинированных животных и
иммунизировать контактирующих индивидуумов данной популяции считалась
положительным явлением, так как облегчала формирование группового имму-
нитета. Вероятно, данное положение может быть приемлемым только в случае
применения нереверсибельных вакцин.
Другая потенциальная опасность живых вакцин состоит в том, что вакцин-
ные штаммы могут длительно персистировать в организме привитых. Например,
известны случаи, когда вирус краснухи выделяли из лимфоцитов лиц с артрита-
ми через 6 лет после иммунизации [1130]. Известны также случаи длительной
персистенции (19 мес) вакцинного штамма вируса ветряной оспы в организме
привитых детей с последующей реактивацией и восстановлением вирулентнос-
ти [701]. Однако, в общем, вероятность такой ситуации очень низкая, а широкое
применение живой вакцины против кори устраняет редкое, но длительное носи-
тельство полевого вируса кори [1131].
Живые вакцины, применяемые в ветеринарии, должны использоваться
только для тех видов животных, для которых они предназначены. Например,
живая вакцина против чумы собак может вызывать летальную инфекцию у неко-
торых видов пушных зверей. Живая вакцина против болезни Ауески безопасна
для свиней, но высоко вирулентна для пушных зверей.
Противоположным явлением недостаточной аттенуации является чрезмер-
ная аттенуация вируса, при которой могут утрачиваться полезные свойства атте-
нуированных штаммов и практический смысл их получения. Чрезмерная атте-
нуация вируса кори при длительном пассировании в различных культурах клеток
могла быть возможной причиной ослабления иммуногенной активности вакци-
ны Эдмонстон-Загреб и Ленинград-16 [1420]. Однако такого не произошло в
опытах с вирусом осповакцины. После продолжительной персистентной инфек-
ции выделены аттенуированные для мышей мутанты, имеющие большую деле-
нию размером 8 МД на левом конце генома и изменение нуклеотидной последо-
вательности в другой части генома, что сопровождалось значительным измене-
нием структуры белков оболочки (14 и 21 кД) и нуклеоида (39 кД). Несмотря на
такие изменения, аттенуированные мутанты сохраняли иммуногенность и защи-
щали мышей от заражения летальными дозами вирулентного штамма вируса. Та-
ким образом, глубокая аттенуация вируса осповакцины сохранялась в процессе
персистенции и, несмотря на значительные изменения генома и поверхностных
белков, не сопровождалась потерей иммуногенных свойств [559]. Создается впе-
чатление, что вирус осповакцины является исключением из правил.
Во избежание потери полезных свойств при изготовлении живых вакцин ис-
пользуют вакцинные штаммы только в том диапазоне пассажей, который опре-
делен для каждого из них в предварительных опытах и является гарантией без-
вредности и активности вакцины (обычно в течение не более 20 пассажей от ма-
тричной расплодки вируса).
Теоретически одновременное введение двух или более живых вакцин может
вызывать снижение иммунного ответа за счет гетерологической интерференции
вакцинных штаммов вирусов. На практике оказалось, что это зависит от кон-
кретных вакцин. Так, одновременное применение комбинированной вакцины
против кори, краснухи и паротита безопасно и эффективно [ 1000]. Аналогичный
результат получен при одновременной иммунизации кур против болезни Маре-
ка, ларинготрахеита, ньюкаслской болезни и оспы. Однако пероральная вакци-
на против полиомиелита и вакцина против ротавирусной инфекции не сочета-
лась между собой. Также не рекомендуется использовать комбинацию живых
вакцин против инфекционного бронхита, ларинготрахеита и ньюкаслской бо-
лезни. Вероятно, все зависит от места репликации вакцинных вирусов в орга-
низме. Если места репликации вакцинных штаммов совпадают, значит будет ге-
тероинтерференция, и такие вакцины нельзя применять одновременно.
В некоторых случаях, встречающиеся в природе «дикие» вирусы могут угне-
тать репликацию вакцинного вируса и снижать эффективность вакцинации. Это
впервые было отмечено у вакцинных штаммов полиовируса, репликация кото-
рых в кишечнике подавлялась конкурентно инфицированием другими энтеро-
вирусами [169].
Вакцинация живыми вакцинами может сопровождаться рекомбинацией
между вакцинными и полевыми штаммами или между вакцинными штаммами
[767, 914]. Возможность рекомбинации вакцинных штаммов обнаружена у виру-
сов разных семейств.
В случае одновременной вакцинации двумя различными аттенуированными
штаммами с делециями в двух комплементарных генах потомство рекомбинант-
ного вируса может полностью восстановить вирулентность, как это имело место
в случае с вакцинацией против болезни Ауески [872].
Рекомбинация встречается главным образом у ДНК-вирусов, но может
иметь место и у РНК-вирусов. Например, установлена рекомбинация между тре-
мя серотипами вакцинных штаммов Сэбина полиовируса, изолированных из
кишечника вакцинированных; некоторые рекомбинанты содержали последова-
тельности трех серотипов [1286]. При одновременном введении двух авирулент-
ных штамов ВПГ-1 образуются вирулентные рекомбинанты, вызывающие ле-
тальную инфекцию у мышей [847]. Вирулентные рекомбинанты получены из
авирулентных штаммов аденовируса. Аналогичные рекомбинанты образовыва-
лись в организме овец при одновременном введении им нескольких аттенуиро-
ванных штаммов различных серотипов вируса катаральной лихорадки овец. По-
добное явление отмечено в опытах с ротавирусами. Внезапное возникновение
цитопатогенного штамма вируса диареи КРС из пула нецитопатогенного штам-
ма также обусловлено рекомбинацией. Возможность рекомбинации между поле-
вым вирусом и аттенуированным штаммом вируса обычно незначительна, т.к.
для этого необходимо, чтобы оба вируса размножались одновременно, в одних и
тех же клетках одного животного [379, 1216]. В случае массовой профилактичес-
кой вакцинации риск такой рекомбинации возрастает. Эти данные свидетельст-
вуют о том, что молекулярная природа аттенуации разных штаммов (серотипов)
одного и того же возбудителя может быть различной.
Живые вакцины могут быть загрязнены посторонними вирусами, попадаю-
щими в них вместе с биологическими субстратами, используемыми при изготов-
лении вакцины. Ранним примером, оставившим международный след в истории
вакцинации, был занос вируса ящура в США в 1908 г. в качестве контаминанта с
вирусом осповакцины, размноженным на телятах [ 1135]. В живых вакцинах, по-
лучаемых на куриных эмбрионах, может присутствовать вирус лейкоза птиц.
Известны случаи контаминации вакцины против болезни Марека вирусами ре-
тикулоэндотелиоза и аденовирусной инфекции кур. Некоторые контаминирую-
щие вирусы могут обладать онкогенным действием, то есть вызывать неоплазию.
Одним из них является полиомавирус обезьян SV-40, вызывающий развитие
опухоли у некоторых видов лабораторных животных. Контаминация этим виру-
сом некоторых ранних серий инактивированной вакцины против полиомиелита
была выявлена ретроспективно. К счастью, спустя длительное время у новорож-
денных и подростков, получивших парентерально контаминированную SV-40
вакцину, не удалось обнаружить видимого онкогенного эффекта [1131]. Особен-
но опасно загрязнение вакцин вирусами медленных инфекций, поскольку забо-
левание может проявляться спустя длительное время после вакцинации, а убеди-
тельно показать связь их с вакциной другим способом довольно трудно.
В качестве контаминантов живых вакцинных препаратов, применяемых в
животноводстве, были обнаружены вирусы синего языка овец [225, 1659], погра-
ничной болезни овец [978], лейкоза КРС [1319], диареи КРС [1639], ретикулоэн-
дотелиоза птиц [1711]. Особенно часто живые вакцины загрязняются вирусом
диареи КРС [1151].
Чтобы избежать контаминации живой вакцины RBOK против чумы КРС ви-
русом диареи (ВД), часто присутствующим в сыворотке крови, используемой
при культивировании, вакцинный штамм размножают в культуре клеток Vero,
непермиссивной для ВД [1008]. С целью предотвращения контаминации этим и
другим вирусами сыворотку КРС перед использованием рекомендуется стерили-
зовать гамма-лучами.
Стабильность живых вакцин при длительном хранении - серьезная пробле-
ма, особенно в работе с лабильными вакцинными вирусами, такими как вирус
болезни Марека, вирус кори и другие парамиксовирусы. Необходимость хране-
ния и транспортировки таких вакцин при нужной температуре затрудняет их
применение в некоторых южных регионах, где поддержание «холодовой цепи»
связано с определенными трудностями.
Проблема в известной мере решается добавлением стабилизирующих аген-
тов к вакцине, селекцией термостабильных вакцинных штаммов и оптимизаци-
ей режима лиофилизации [1008, 1009].
Ранняя защита после вакцинации
Некоторые высокоиммуногенные живые вирусные вакцины обладают тем
преимуществом, что создают раннюю «неспецифическую» защиту, развивающу-
юся через 2—3 дня после введения благодаря явлению гомологичной интерфе-
ренции. Способность к интерференции с «диким» типом вируса - желаемое ка-
чество любой живой вакцины. Она лежит в основе создания резистентности у
животных вскоре после их вакцинации, и усиливается с образованием специфи-
ческих антител. Индукция резистентности вскоре после вакцинации связана с
клеточными факторами защиты, а антитела усиливают и обеспечивают длитель-
ный иммунитет. Классическим, хорошо известным примером этого явления слу-
жит иммунитет при ньюкаслской болезни. Резистентность к контрольному зара-
жению появляется через 12 часов после интраназального или интратрахеального
введения вакцинного вируса и быстро усиливается. Через 48 часов после вакци-
нации наступает полная защита [950].
Живая вакцина против классической чумы свиней создает защиту свиней
при экспериментальном заражении вирулентным вирусом через 3-4 дня после
вакцинации.
Защита морских свинок после вакцинации аттенуированными штаммами
вируса Хунин наступала через три дня и постепенно усиливалась, достигая 100%
к 30 суткам. Не установлено связи ранней защиты с циркулирующим интерфе-
роном, вероятно, она обусловлена прямой интерференцией вакцинного штамма
вируса [169].
В ранней защите после вакцинации важная роль, по-видимому, принадле-
жит дефектным интерферирующим частицам (ДИЧ), обнаруженным у предста-
вителей большинства семейств вирусов, и особенно хорошо изученных у орто- и
парамиковирусов.
Ранняя защита в отсутствии антител связана с блокированием вирусспеци-
фических рецепторов на поверхности клеток-мишеней вирусными белками и
характеризуются специфичностью, присущей вирусной аутоинтерференции, ко-
торая хорошо известна у многих вирусов.
Пустые капсиды полиовируса, например, связываются с рецепторами кле-
ток-мишеней и делают их недоступными для инфекционного вируса [303].
Установлено, что одна дефектная интерферирующая частица предупреждает
в клетке цитопатические изменения, вызванные вирусом гриппа [1042]. Дефект-
ные интерферирующие частицы вируса инфекционного бурсита вызывали ран-
нюю защиту цыплят от летальной инфекции вирулентным штаммом гомологич-
ного вируса до наступления иммунитета [1120]. Некоторые инактивированные
вакцины, содержащие вирусные антигены в высокой концентрации, обладают
способностью быстро вызывать защиту.
Такой способностью обладала вакцина против ящура, содержащая 10—100
мкг/мл 146S вирусных частиц и обеспечивающая защиту естественно восприим-
чивым животным через 7 дней после вакцинации [64, 597]. Еще более быструю
защиту вызывала инактивированная вакцина против геморрагической болезни
кроликов благодаря высокому содержанию вирусного антигена. Ранняя защита
в случае применения некоторых живых вакцин вероятно обусловлена быстрым
размножением вакцинного вируса в клетках-мишенях привитого организма.
В заключение следует отметить, что молекулярные механизмы аттенуации
вирусов становятся понятными лишь в общих чертах. Аттенуация вирусов со-
провождается изменением ряда фенотипических свойств, хотя лишь некоторые
из них картированы на вирусном геноме. Несмотря на разноплановость исследо-
ваний и широкую вариабельность свойств изучаемых вирусов, полученные ре-
зультаты можно суммировать следующим образом:
- мутации, ответственные за аттенуацию вируса, могут локализоваться в различ-
ных участках генома; чем больше мутаций, тем прочнее аттенуация;
— мутации, затрагивающие структурные белки, более существенны для аттенуа-
ции, чем затрагивающие неструктурные белки, или мутации в некодирующей
области генома;
— мутации различных аттенуированных штаммов (серотипов) одного и того же
вируса могут иметь различную локализацию.
С точки зрения структурно-функционального принципа можно выделить по
крайней мере пять областей генома, мутации в которых связаны с аттенуацией
вируса:
— мутации в области гена, кодирующего белки, определяющие взаимодействие
вируса с клетками-мишенями (многие вирусы);
— мутации в области неструктурной лидерной последовательности (пикорнави-
русы и др.);
— мутации в области гена, кодирующего белки, претерпевающие протеолитиче-
скую активацию и определяющие инфекционность (парамиксовирусы, ротави-
русы);
— мутации в области гена, кодирующего тимидинкиназу (герпес- и поксвирусы);
— мутации в области гена, кодирующего потенциальный сайт гликозилирования
(ортомиксовирусы).
Если исходить из практических результатов применения живых вирусных
вакцин, то следует сделать два допущения, имеющих принципиальное значение.
Во-первых, все аттенуированные штаммы, используемые в качестве живых вак-
цин, должны размножаться в организме и практически не поражать клетки-ми-
шени, повреждение которых вирулентными штаммами определяет патогенез ес-
тественной инфекции. Во-вторых, все аттенуированные вакцинные штаммы
или вовсе не размножаются в клетках-мишенях, поражаемых вирулентными
штаммами гомологичных вирусов, или их репродукция в этих клетках блокиру-
ется на разных стадиях репликативного цикла.
В этом смысле ограничение любых важнейших функций вируса может при-
вести к его аттенуации. Из этого следует, что любой экспрессируемый ген может
содержать мутационные изменения, снижающие вирулентность.
Установлено, что главными фенотипическими детерминантами вирулентно-
сти вирусов являются гликопротеины или белки, расположенные на поверхнос-
ти вирионов, роль которых в патогенезе инфекции сводится не только к реали-
зации прикрепительных функций вируса на первом этапе его взаимодействия с
клетками, но и к проникновению вирусного генома в клетки, а также к опреде-
лению вирусного тропизма и распространению вируса в организме.
Устойчивость центральной нервной системы к инфекции аттенуированными
штаммами ряда нейровирулентных вирусов (полиомиелит, бешенство, болезнь
Ауески, гепатит мышей, вирус Синдбис и др.) опосредована как периферическим
механизмом, ограничивающим проникновение вируса в нее, так и внутриклеточ-
ным, срабатывающим в клетках-мишенях на послеадсорбционном уровне [ 1494].
У аттенуированных мутантов полиовируса полная потеря способности раз-
множаться в нервных клетках обезьян и не вызывать разрушений в мозге обус-
ловлена неспособностью вируса перемещаться по аксональным цилиндрам к
моторным клеткам переднего рога серого вещества спинного мозга, хотя при не-
посредственном контакте с такими клетками проявлялась редуцированная ней-
ровирулентность вакцинных штаммов вируса.
Имеется мнение, что вирусы со сложным патогенезом, включающим пер-
вичное место репликации с последующим проникновением в один или несколь-
ко органов-мишеней, могут быть аттенуированы с помощью селективного изме-
нения их тропизма [1131]. Вероятно этот механизм не единственный и не глав-
ный в аттенуации современных традиционных вакцинных штаммов, тем не
менее в большинстве случаев аттенуация вирусов прежде всего связана с измене-
нием их клеточного тропизма. В тех случаях, когда клетки-мишени являются
первичным и единственным местом репликации вируса, создание эффективной
и безопасной живой вакцины затруднено, поскольку зачастую невозможно до-
биться выраженной репликации вируса в клетках-мишенях с последующей ан-
тигенной стимуляцией организма без их повреждения, то есть проявления виру-
лентных свойств.
С этой особенностью патогенеза, вероятно, связаны неудачные попытки в
разработке живой вакцины против ящура. Живые вакцины против оспы людей
и животных можно считать счастливым исключением.
Одним из возможных путей преодоления этой трудности при других инфек-
циях является получение аттенуированных штаммов, характеризующихся само-
ограничивающейся репликацией в клетках-мишенях с выраженным образова-
нием ДИЧ. Однако в этом случае живую вакцину необходимо вводить в большой
дозе, что лишает ее главного преимущества по сравнению с инактивированным
препаратом.
Наиболее эффективный путь решения указанной проблемы, по-видимому,
состоит в разработке рекомбинантной вакцины.
Известно много примеров, когда новорожденные или молодые организмы и
взрослые особи одного вида резко различаются между собой чувствительностью
к ряду вирусов в естественных или экспериментальных условиях. Возможно, что
в основе этого явления лежит тот же механизм, что и при аттенуации вирусов, —
клеточная чувствительность, с той лишь разницей, что в первом случае она кон-
тролируется хозяином, во втором — вирусом. В качестве примера можно приве-
сти изменения нейротропизма вируса японского энцефалита для крыс в зависи-
мости от возраста. Все животные, зараженные в возрасте до 13 дней, погибали, а
старше 14 дней — выживали. Такая чувствительность в неонатальном периоде
связана с наличием незрелых нейронов [1172]. Высоко летальные инфекции,
обусловленные парвовирусом гусей и вирусом чумы уток, наблюдают лишь сре-
ди молодых птиц. Таким образом, вирулентность вируса в конечном счете опо-
средуется через повреждение (разрушение) клеток-мишеней и в зависимости от
масштабов этих процессов может иметь количественное выражение.
В проблеме вирулентности и аттенуации вирусов есть один важный аспект.
Имеется в виду полигонный контроль вирулентности и различия ее у одного и
того же вируса для разных хозяев. Оба эти явления имеют общую основу, суть ко-
торой состоит в отношении вируса к клеткам-мишеням организма хозяина. Дан-
ный аспект проблемы удобно рассмотреть на примере вируса болезни Ауески. В
результате делеционных мутаций этот вирус мог полностью утратить вирулент-
ность для свиней и овец, но оставаться высоковирулентным для кроликов и
пушных зверей - небольшие дозы вируса вызывали у них заболевание с леталь-
ным исходом. Следовательно, вирус утратил способность поражать клетки-ми-
шени в организме свиней и овец, но сохранил способность размножаться и вы-
зывать иммунитет. В этом случае, в процессе аттенуации вируса имеет место из-
менение клеточного тропизма, но изменение его не вообще, а для конкретных
видов животных. А это значит, что тканевой тропизм вируса в данном случае
имеет многофакторную основу и полигонный контроль.
Другим примером может служить нейровирулентность полиовируса при
прямом контакте с нейронами переднего рога спинного мозга циномольгусов и
авирулентность для тех же клеток шимпанзе. Если вирулентность для одного хо-
зяина отличается от таковой для другого, значит, это количественное свойство,
которое можно усилить или ослабить.
Остается неизвестным, где размножается вирулентный вирус в вакциниро-
ванном организме при клиническом иммунитете или вакцинный — при повтор-
ном его введении. Возможно, что в различной иммуногенности живых вакцин
важную роль играют количественные аспекты наработки вирусспецифических
антигенов в организме в результате репликации вакцинного штамма вируса.
Таким образом, при идеальном исходе аттенуации вирус должен практичес-
ки утрачивать способность поражать клетки-мишени, но сохранять способность
размножаться в других клетках, обеспечивая создание выраженного и напряжен-
ного иммунитета и иммунологической памяти при минимальной реактогеннос-
ти и полной безопасности.
Живая комбинированная вакцина против кори, свинки и краснухи (MMR)
применяется так же, как живая коревая вакцина.
9.3. Гетерологичные вакцины
Гетерологичная вакцина против оспы людей была первой вакциной в исто-
рии человечества, положившая начало специфической профилактике.
Первоначально вакцина (vacca — корова), предложенная Дженнером в 1798
году с целью защиты людей от оспы, представляла собой вирус коровьей оспы,
обладавший естественной патогенностью для этого вида животных. У людей
этот вирус вызывал лишь небольшие легко протекающие поражения, но, будучи
Таблица 25. Вакцины для людей лицензированные в США [670]
Болезнь илн вирус Тип вакцины Показания для применения Схема применения
Аденовирус Живая аттенуированная, оральная Армейские призывники Одна доза
Гепатит А Инактивированная, цельновирионная Путешественники, другие группы высокого риска 0, 1 и 6 мес.
Гепатит В Рекомбинантная, дрожжевая вакцина НВ5-антиген Универсальная для детей 0, 1, 6 и 12 мес.
Грипп Инактивированная, вирусные субъединицы Группы высокого риска Две дозы первая серия, затем одна сезонная доза
Японский энцефалит И нактивированная, цельновирионная Путешественники или проживающие в Азии 0, 7 и 30 дней
Корь Живая, аттенуированная Дети 12 мес.; 6—12 лет
Паротит (свинка) Живая, аттенуированная Дети 12 мес.; 6—12 лет
Полио- миелит Инактивированная, цельновирионная (тип 1, 2, 3) Обычно используется, когда невозможно при- менить живую вакцину 2, 4 и 12—18 мес.; 4—6 лет
Живая аттенуированная оральная вакцина (тип 1, 2, 3) В США применяется недавно 2, 4 и 6-18 мес.
Бешенство Инактивированная, цельновирионная С лечебно-профилакти- ческой целью 0, 3, 7, 14 и 28 дней после инфициро- вания
Краснуха Живая, аттенуированная Дети 12 мес.; 6—12 лет
Варицелла Живая, аттенуированная Дети 12—18 мес.
Желтая лихорадка Живая, аттенуированная Путешественники в зоны, неблагополуч- ные по болезни Одна доза каждые 10 лет
Оспа Живой вакцинный вирус Некоторые лаборатор- ные работники Одна доза
антигенно связанным с вирусом оспы человека, он создавал специфическую за-
щиту против него. Этот принцип в дальнейшем был использован в борьбе про-
тив других вирусных болезней. Широкомасштабная вакцинация людей сыграла
основную роль в окончательном искоренении натуральной оспы. Успех про-
граммы ликвидации оспы человека адекватен эффективности применения жи-
вой вакцины. Однако происхождение этого важнейшего вакцинного штамма ос-
тается невыясненным. Попытки определить происхождение вируса осповакци-
ны, используя современные молекулярно-биологические приемы, не дали
Таблица 26. Преимущества и недостатки живых и инактивированных вакцин
Свойства Живые вакцины Инактивированные вакцины
Путь введения Парентерально, назально, орально Парентерально
Количество вируса Небольшое Большое
Количество вакцинаций Обычно одна Обычно две или больше
Необходимость адъюванта Нет Да
Продолжительность иммунитета Обычно много лет Обычно не больше года
Особенности гуморального иммунитета Системный иммунитет (IgG) выражен, местный иммунитет (IgA), особенно выражен при вакцинации на слизистые Выражен системный иммунитет (IgG), иммунитет слизистых (IgA) слабо выражен
Клеточный иммунитет Клетки СД4 Клетки СД8 Выражен Выражен Выражен Умеренный Умеренный
Температурная реакция При некоторых вакцинах Нет
Возможность реверсии и горизонтальной передачи Редко Нет
Персистенция Возможна Отсутствует
Рекомбинация с полевым вирусом или другими вакцинными штаммами Возможна Отсутствует
Контаминация посторонними агентами Возможна Отсутствует
Подавление предшествую- щими антителами Да Обычно отсутствует
Противопоказания для вакцинации Иммунодефицит, иммуносупрессия Отсутствуют
Применение в период беременности Часто не рекомендуется Без ограничений
Сочетание с другими вак- цинами в составе комби- нированного препарата Затруднительно Осуществляется легко
Побочные эффекты Обычно местные или системные Обычно местные
Стабильность при хранении Подвержена колебаниям Выражена
Опасность производства Отсутствует Связана с использованием вирулентного вируса
Стоимость Низкая Высокая
положительных результатов. Вакцинный вирус оспы отличался как от вируса ва-
риолы, так и от вируса коровьей оспы.
В основе безопасности применения живых гетерологичных вакцин лежит ре-
дуцированная вирулентность для неестественного хозяина и отсутствие гори-
зонтальной передачи вируса. Эффективность применения таких вакцин основы-
вается на выраженной антигенной общности близкородственных вирусов.
Вирусы млекопитающих и птиц часто проявляют фенотипические признаки
аттенуации при пересечении видовых барьеров.
Хозяинный спектр вирусов детерминирован на генетическом уровне, хотя
пока отсутствует понимание генетической основы для этой формы хозяинного
ограничения [471].
В настоящее время известен ряд вирусов, которые можно использовать в ка-
честве гетерологичных вакцин у животных. Так, вирус оспы голубей используют
для иммунизации против оспы кур. Вирус фибромы Шоупа предохраняет кроли-
ков от миксоматоза и его длительно применяли с этой целью в практических ус-
ловиях. Парвовирусный энтерит собак профилактируют вирусом панлейкопе-
нии кошек, а инфекционный гепатит собак 1 и 2 типа аденовирусом типа-2 со-
бак. Указанные вирусы входят в состав коммерческих моно- и поливалентных
вакцинных перпаратов [955].
Тесную антигенную связь обнаружили у представителей рода морбилливиру-
сов семейства парамиксовирусов. Например, гомология гена матриксного белка
М вирусов чумы крупного рогатого скота и кори составляет 77,6%, а вируса чу-
мы крупного рогатого скота и чумы плотоядных — 78,2% [964].
Со времени открытия тесного антигенного родства между возбудителями чу-
мы плотоядных, кори человека и чумы крупного рогатого скота [ 1520], миллио-
ны доз противокоревой вакцины были с успехом применены для иммунизации
щенков собак против чумы плотоядных. Иммунитет, индуцированный коревой
вакциной к вирусу чумы у собак, длится 5 месяцев. Однако вирус чумы плотояд-
ных не вызывает иммунитета к вирусу кори [44].
Рекомбинантный вирус осповакцины, экспрессирующий белки F и Н виру-
са кори, защищал собак от чумы [1502].
Парвовирус собак и вирус панлейкопении кошек обладают антигенным род-
ством (гомология генома >90%). Аттенуированный вирус панлейкопении кошек
создает более выраженный и продолжительный иммунитет у собак, чем гомоло-
гичная инактивированная вакцина. Антитела (РТГА) в высоком титре у приви-
тых сохраняются не менее 5 лет [452].
До недавнего времени для профилактики чумы коз применяли вакцину про-
тив чумы крупного рогатого скота.
Наиболее известным и экономически значимым примером использования
гетерологичных вакцин в современной ветеринарной практике является приго-
товление вакцины из вируса герпеса индеек против болезни Марека кур сероти-
па 1 и 2. Антигенно родственный возбудителю болезни Марека вирус герпеса ин-
деек обладает природной апатогенностью для индеек и кур. Его с большим успе-
хом применяют во всем мире в качестве вакцины против этой инфекции. В за-
висимости от вирулентности полевого штамма используют комбинированную
вакцинацию гомологичной и гетерологичной вакцинами. Вакцинация суточных
цыплят резко снижает отход птицы, обусловленной вирусом болезни Марека,
причиняющей большой экономический ущерб промышленному птицеводству
[955, 1180].
Недостатком использования таких вакцин является опасность заражения
природно восприимчивых к этим возбудителям видов животных, а так же то, что
иммунная защита, обеспечиваемая такими вакцинами, как правило, слабее той,
которой достигают аттенуированными штаммами гомологичного вируса.
В последние годы в связи с изысканием нетрадиционных путей и средств
специфической профилактики желудочно-кишечных и респираторных заболе-
ваний людей вновь пробудился интерес к гетерологичным вакцинам. Это связа-
но прежде всего с профилактикой таких заболеваний, как ротавирусный энтерит
и парагрипп-3.
Ротавирусы — это наиболее важная группа этиологических агентов тяжелых
диарей новорожденных и детей младшего возраста. Эффективная ротавирусная
вакцина должна предотвратить тяжелую диарею у детей моложе двух лет [471].
Наиболее эффективным путем считалось применение гетерологичных вак-
цин. Теоретической предпосылкой являлось то, что ротавирусы человека и жи-
вотных имеют общий групповой капсидный белок VP6. Было испытано несколь-
ко вакцин, приготовленных на основе аттенуированных штаммов ротавируса те-
лят и обезьян. Вакцина RIT-4237 приготовлена из штамма Линкольн ротавируса
крупного рогатого скота (серотип 6) после 140 пассажей в культуре клеток почки
обезьяны. Вакцина WC-3 получена из ротавируса крупного рогатого скота (серо-
тип 6) аналогичным способом [495].
Вакцина из штамма RIT-4237 ротавируса телят хорошо переносилась мла-
денцами и обеспечила при клиническом испытании защиту у 88% привитых от
ротавирусной диареи во время одного зимнего эпидемического сезона [944].
Результаты испытания эффективности вакцины из бычьего ротавируса
WC-3, разработанной институтом Wistar в США, показали ее безопасность и вы-
сокую эффективность против ротавируса человека всех четырех серотипов. Она
успешно испытана в Бразилии, КНР, Франции, Израиле и США [944, 1652]. Им-
мунный ответ возрастал после введения бустер-дозы [495].
Вакцины из ротавируса обезьян обладали такой же или несколько меньшей
эффекивностью. Белок VP7, отвечающий за серотиповую принадлежность, ока-
зался иммунодоминантным в индукции вируснейтрализующих антител у детей,
вакцинированных ротавирусом крупного рогатого скота [617].
Вирус парагриппа-3 вместе с респираторно-синцитиальным вирусом челове-
ка несут основную ответственность за респираторные вирусные заболевания у
детей. Антигенное сходство вируса препагриппа-3 крупного рогатого скота с ви-
русом парагриппа-3 человека побудило испытать его в качестве живой гетеро-
генной вакцины для иммунизации детей. Оба вируса ПГ-3 крупного рогатого
скота и человека имеют на поверхности два гликопротеина: гемагглютинин-ней -
траминидазу (HN) и фузогенный белок (F), каждый из которых обладает свойст-
вами протективного антигена.
Вирусы ПГ-3 крупного рогатого скота и человека антигенно связаны между
собой. Их прототипные штаммы незначительно различаются между собой в пе-
рекресной РЗГА.
У обоих вирусов обнаружена значительная консервативность и гомология в
аминокислотной последовательности NP-, Р-, С- и М-белков [471].
В опытах на беличьих обезьянах вирусы ПГ-3 крупного рогатого скота и че-
ловека в одинаковой степени реплицировались в верхних и нижних дыхательных
путях (2,7—4,7 1g ТСР50/мл), продолжительность инфекции у обезьян, заражен-
ных обоими типами вируса, не отличались (8—10 дней). ВПГ-3 крупного рогато-
го скота и человека индуцируют примерно одинаковый иммунный ответ у этих
обезьян, особенно после бустер-дозы. В отличие от вируса ПГ-3 человека, вирус
ПГ-3 крупного рогатого скота у обезьян резус и шимпанзе в нижних дыхатель-
ных путях размножается в 100—150 раз медленнее, чем в верхних дыхательных
путях. Тем не менее вирус ПГ-3 крупного рогатого скота индуцирует у этих обе-
зьян ту же степень иммунного ответа, что и вирус ПГ-3 человека [1581].
Хотя вирус ПГ-3 крупного рогатого скота отличается от вируса ПГ-3 челове-
ка, он вызывает устойчивость к нему у хлопковых крыс. Исследования, прове-
денные на обезьянах показали, что на вирус ПГ-3 у них возникает умеренный
иммунный ответ и нижний отдел респираторного тракта проявляет значитель-
ную устойчивость к последующему заражению вирусом ПГ-3 человека [471].
PC-вирус крупного рогатого скота рассматривается как возможная живая
вакцина для иммунизации людей, с учетом антигенного подобия (особенно
F белка) с аналогичным белком РС-вируса человека. Считается особенно пер-
спективным получение на основе обратной генетики химерного вируса из
РС-вируса человека с заменой одного и более генов на аналогичные гены РС-ви-
руса КРС [521].
Таким образом, вирусы животных, адаптированные к их естественным хозя-
евам, при пересечении видового барьера сохраняют способность к ограниченно-
му размножению и создают гетерогичный иммунитет к антигенно родственным
вирусам.
9.4. Вакцины из очищенных нативных
вирусных белков
Разработку субъединичных вакцин начали в связи с необходимостью повы-
шения эффективности инактивированной вакцины против гриппа человека. Та-
кие вакцины обычно содержат очищенные или частично очищенные вирусные
белки, выделенные после разрушения вирионов. Наибольший успех в выделении
антигенноактивных компонентов достигнут в работе с оболочечными вирусами.
Жирорастворители, такие как деоксихолат натрия, используют для разруше-
ния оболочечных вирусов (вирионов) с целью освобождения их компонентов,
включая гликопротеины пепломеров оболочки. Для частичной очистки этих
гликопротеинов применяют дифференциальное центрифугирование, затем их
используют для изготовления так называемой расщепленной «split» вакцины.
Примером таких вакцин являются вакцины против вирусов герпеса, гриппа и
коронавирусов.
В медицинской практике применяли две субъединичные вакцины: против
гриппа, содержащую гемагглютинин, выделенный после разрушения вируса,
размноженного в куриных эмбрионах; против гепатита В, содержащую антиген
из плазмы крови вирусоносителей. Хотя последняя обладала протективными
свойствами, ее высокая стоимость и актуальность задачи побудили разработать
рекомбинантную субъединичную вакцину, особенно после того, как экспрессия
HBsAg в эукариотических системах была успешной.
Расщепленные вакцины, как правило, готовят из поверхностных структур
(капсидов, суперкапсидов и клеточных мембран), содержащих протективные ан-
тигены. Они вызывают образование специфических антител и цитотоксических
лимфоцитов. Хотя в основном иммунитет вызывают белки поверхности вирио-
нов, другие вирусные белки также являются мишенями для иммунной системы.
При некоторых вирусных инфекциях (герпес-, ретровирусы и др.) протек-
тивные антигены могут быть связаны с поверхностью инфицированных клеток
и быть вирусспецифическими невирионными компонентами.
Приготовление расщепленных вакцин включает в себя ряд основных этапов:
получение вирусного сырья, выделение и очистка протективных вирусных ком-
понентов и приготовление вакцинного препарата.
Для получения исходного вирусного материала используют те же методы
культивирования вирусов, что при изготовлении инактивированных вакцин.
Для дезинтеграции вирусных частиц могут быть использованы протеолити-
ческие и липолитичесике ферменты, органические растворители, щелочи, де-
тергенты. Органические растворители разрушают мембранные структуры и ос-
вобождают гликопротеины вирусной оболочки [17].
Другая цель дезинтеграции вирионной структуры состоит в удалении либо
инактивации вирусного генома [1131]. Обработка протеазами сопровождается
расщеплением полипептидной части гликопротеина по крайней мере в одной
позиции, что приводит к потере участка молекулы, погруженного в липидный
бислой (гидрофобного домена), и к снижению иммуногенной активности гли-
копротеина.
Наиболее подходящими агентами для освобождения вирусных гликопротеи-
нов оказались детергенты. Из неионных детергентов для получения вирусных
гликопротеинов чаще всего применяют тритон X-100 и нонидет Р-40. Они обла-
дают сравнительно мягким действием и не повреждают субъединиц. С их помо-
/лини у. вирусные вакцины
щью получены гликопротеины вирусов гриппа, парагриппа, бешенства, венесу-
эльского энцефаломиелита лошадей, леса Семлики и многих представителей
герпесвирусов [17,114].
Обработка вируса гриппа детергентом тритон N-101 позволила выделить
субъединицы интактными [141]. В водных суспензиях «палочки» гемагглютини-
на прикрепляются друг к другу с помощью «липких» концов, которые первона-
чально были погружены в липидную мембрану вириона. Нейраминидазные
субъединицы с лукообразными концевыми утолщениями также агрегируют
между собой. Эта способность образовывать агрегаты оказалась критической для
сохранения антигенности и получения эффективной вакцины.
Очистку вирусных субъединиц в основном проводят гельфильтрацией или
скоростным центрифугированием [17]. Простейший метод отделения субъеди-
ниц от нежелательных остатков вирусов — адсорбция на гидрате окиси алюми-
ния при необходимом значении pH. Надосадочную жидкость после центрифуги-
рования удаляют, а гидроокись алюминия с адсорбированными субъединицами
ресуспендируют в нужном разбавителе. Недостаток данного метода заключается
в том, что субъединицы находятся не в свободном виде и это затрудняет точный
количественный анализ антигена, а также стандартизацию продукта [163].
Субъединичные вакцины против гриппа были первыми высокоочищенными
вакцинами для практического применения и, по-видимому, — наиболее важным
примером практического применения гликопротеинов вообще.
Данные относительно эффективности применения таких (расщепленных)
вакцин были нередко противоречивы.
При разработке субъединичной гриппозной вакцины преследовали цель,
чтобы она имела такую же иммуногенность, как и обычная вакцина из цельного
вируса, но была бы менее реактогенна. Результаты сравнительных испытаний
вакцин двух видов показали, что поставленная цель может быть достигнута [17,
114, 1131].
Очищенная субъединичная вакцина против гриппа А и В («грипповак») ока-
залась достаточно эффективным препаратом в группах высокого риска. Экспе-
риментальная вакцина с адъювантом обладала высокой иммуногенностью для
мышей при подкожном и интраназальном применении [982] и отличалась выра-
женным синтезом секреторного IgA и развитием более напряженного иммуни-
тета [632]. Иммунизация гликопротеинами вируса простого герпеса сопровож-
далась специфическим гумморальным и клеточным ответом. Субъединичная
герпетическая вакцина была не менее эффективна в защите от последующего за-
ражения вирусом герпеса, чем живая или инактивированная цельновирионная
вакцина [163].
Одна иммунизирующая доза вакцины содержала 10- 40 мкг очищенного ан-
тигена вируса простого герпеса типа 1 и 2 и 1 мг гидрата окиси алюминия. Вак-
цина из гликопротеина-D вируса простого герпеса защищала мышей и морских
свинок при инфицировании их вирулентным штаммом, а также индуцировала
гуморальный и клеточный ответ у обезьян и грызунов [836].
(on 3401 ДерЖаЩая мембРанный гликопротеин вируса Эпштейна-Барр
(gP-340) и мурамилдипептид, вызывала у обезьян индукцию антител к gp-340
определяемых в ИФА и в реакции нейтрализации. У иммунизированных живот^
ных, зараженных 100%-ной канцерогенной дозой вируса, отмечали резкое сни-
жение количества мононуклеарных инфицированных клеток и отсутствие опу-
холей [1097].
Экспериментальную вакцину против болезни Ауески готовили из мембран
инфицированных клеток РК-15. Клетки собирали через 16 ч после инфицирова-
ния до развития выраженного ЦПЭ (Зх 107 в 1 мл). Эффективность субъединич-
ной и инактивированной цельновирионной вакцины сравнивали на свиньях. У
свиней, привитых дважды субъединичной вакциной, гуморальный, клеточный и
протективный иммунитет были более выраженными, чем у привитых инактиви-
рованной вакциной. Эти результаты позволили разработать промышленную тех-
нологию изготовления вакцины и наладить ее производство. Основные этапы
этого процесса выглядят следующим образом. Делеционный штамм КаН вируса
БА размножали в суспензионной культуре клеток ВНК-21 в ферментерах объе-
мом 100—2800 л и инактивировали этиленимином. Осветленную очищенную и
концентрированную ультрафильтрацией вируссодержагцую суспензию с целью
разрушения вирионов и освобождения гликопротеинов обрабатывали полио-
ксиэтиленовым спиртом, а гликопротеины осаждали ультрацентрифугировани-
ем. Суспензию очищенных вирусных гликопротеинов (10 мг/доза) эмульгирова-
ли в минеральном масле. Отсутствие в вакцинном штамме КаН gpl, gp63, так же
как и удаление капсидных белков в процессе приготовления субъединичной вак-
цины, существенно не отражалось на ее иммуногенности по сравнению с цель-
новирионными препаратами. Однако, в отличие от них, субъединичная вакцина
давала возможность по антителам различать вакцинированных и инфицирован-
ных животных [169].
Субъединичную вакцину против герпесвирусной инфекции КРС готовили
из вирулентного вируса типа 4. Телята, иммунизированные внутримышечно
дважды ИСКОМ-вакциной (50 и 100 мкг вирусных антигенов), имели высокий
титр ВНА (1:3500) и не заболели при контрольном заражении [1063].
Гликопротеины вируса инфекционного ларинготрахеита кур выделяли из
экстрактов вирусинфицированных клеток и очищали с помощью лектин-аф-
финной хроматографии. Препаратами, содержащими вирусные гликопротеины
(205, 160, 115, 90, 85, 74, 60 и 50 кД), вакцинировали цыплят. Гликопротеины
предохраняли 83% птицы от инфицирования патогенным вирусом, о чем также
свидетельствовало отсутствие вирусного антигена в трахее инфицированных
цыплят. Формирование вируснейтрализующих антител не коррелировало с на-
пряженностью иммунитета у вакцинированной птицы [1709].
ИСКОМ герпесвируса лошадей тип 1 содержал все основные гликопротеи-
ны в соотношениях, аналогичных их содержанию в интактном неразрушенном
вирусе. Иммунизация вызывала у хомяков антительный ответ к индивидуаль-
ным вирусным гликопротеинам и полипептидам. Хомяки, вакцинированные
двукратно с интервалом 6 недель, были полностью защищены от заражения 100
ЛД50 герпесвируса-1 лошадей [553].
Определенные успехи достигнуты в создании субъединичных вакцин против
парамиксовирусных инфекций человека и животных. ИСКОМ, приготовлен-
ный на основе мембранных Н- и F-белков, вируса кори, выделенного из лизатов
инфицированных клеток Vero, вызывал образование нейтрализующих и протек-
тивных антител, специфичных к Н-и F-антигенам у мышей, крыс, кроликов,
обезьян и собак. ИСКОМ, содержащий лишь F-антиген, не вызывал у животных
формирования нейтрализующих антител и антигемагглютининов, но индуциро-
вал антитела, идентифицируемые в ИФА тестами ингибирования гемадсорбции
F-антигенами либо вызываемого им сплавления. Оба комплекса вызывали Т-
клеточный ответ и защиту мышей от летального интрацеребрального заражения
вирусом кори. Для развития полноценного иммунитета против кори вакцина
должна содержать обе субъединицы вируса.
ИСКОМ, содержащий F- и Н-антигены вируса чумы плотоядных, вызывал у
привитых собак образование вируснейтрализующих антител и развитие имму-
нитета. Этот препарат также защищал тюленей от патогенного для них морбил-
ливируса. ИСКОМ, содержащий белки F- и Н-вируса кори, создавал частичную
защиту у собак к вирусу чумы плотоядных. В этом отношении живая коревая
вакцина была более эффективной [1166].
Гликопротеиновый гемагглютинин-нейраминидазный комплекс вируса
ньюкаслской болезни (штамм Ла-Сота) обнаружил выраженную антигенную ак-
тивностью при испытании на курах.
Смесь гликопротеинов F; G и матриксного белка М респираторно-синцити-
ального вируса использовали для иммунизации мышей. Иммунитет проверяли
интраназальным заражением мышей вирулентным штаммом вируса. Вакцину,
содержащую различное количество вирусного антигена, вводили подкожно с
полным адъювантом Фрейнда 1—3 раза. В дозе 5 мкг вакцина не защищала мы-
шей, тогда как в дозе 25 мкг у 93% зараженных мышей не отмечено легочных по-
ражений, хотя у них после вакцинации не обнаружено вируснейтрализующих
антител. Выявлялись только антитела к F-, G- и М-белкам в других реакциях.
Вируснейтрализующие антитела появлялись только у мышей, вакцинированных
двукратно в дозе 50 мкг каждого компонента. При этом все животные были пол-
ностью резистентны к заражению. Защитным эффектом обладали антитела к
белкам F и G, но не к М-белку [945]. Субъединичную вакцину против РС-ин-
фекции готовили из концентрированного вируса, разрушенного мягкими детер-
гентами. Белки F, G и М очищали сорбцией на ионообменнике с последующей
элюцией. Полученный препарат обладал выраженной иммуногенностью [459].
Экспериментальные иммуностимулирующие комплексы, содержащие субъ-
единицы оболочки вируса краснухи, были испытаны на кроликах. Оказалось,
что такая вакцина по антигенности и индукции нейтрализующих антител и ан-
тигемагглютининов, не отличается от живой вакцины [1542]. Она вызывала за-
щитный иммунитет у обезьян даже в присутствии пассивных антител [1568].
Гликопротеины пепломеров коронавируса гепатита мышей в дозе 1 мкг с
адъювантом Фрейнда защищали мышей от развития летального энцефалита при
заражении (10 ЛД50) гомологичным вирусом [560].
Гликопротеиновый комплекс вируса трансмиссивного гастроэнтерита сви-
ней выделяли из вирионов с помощью ультразвука и отделяли от остальных ви-
русных компонентов с помощью изопикнического центрифугирования. Субъе-
диничный препарат при внутримышечном введении в дозе 1 мкг гликопротеи-
нов защищал поросят при заражении вирулентным штаммом вируса. У
вакцинированных поросят развивался гуморальный иммунный ответ.
Гликопротеин G оболочки вируса бешенства — единственный белок, ответ-
ственный за индукцию вируснейтрализующих антител и формирование проек-
тивного иммунитета. Высокоочищенные препараты гликопротеина получали
при обработке вируса бешенства нонидетом Р-40, три-п-бутилфосфатом или
бромелином. Препараты очищенного гликопротеина G вызывали образование
нейтрализующих антител у кроликов и защищали мышей от летальной инфек-
ции при интрацеребральном введении вирулентного вируса.
Развитие протективного иммунитета при иммунизации очищенным белком
G происходило медленнее, чем при введении цельного вируса бешенства, хотя
степень защиты от летальной инфекции была одинаковой для обоих препаратов
[17]. В отличие от цельных вирионов, субвирионный препарат не обладал гемаг-
глютинирующей активностью [163].
Исследования с вирусом везикулярного стоматита показали, что при обра-
ботке вирионов трипсином разрушается их способность инцудировать образова-
ние нейтрализующих антител. Иммунизирующий антиген может быть извлечен
из вируса посредством обработки его твином или нонидетом Р-40, либо дезокси-
холатом натрия [163].
Однократная иммунизация гликопротеинами поверхности вируса венесу-
эльского энцефаломиелита лошадей защищала 70% мышей от летальной инфек-
ции вирулентным штаммом, а двукратная иммунизация гликопротеинами обес-
печивала 100%-ную защиту от заражения. Субъединичная вакцина, приготов-
ленная из очищенных гликопротеинов вируса клещевого энцефалита, была
сравнима по иммуногенности и протективным свойствам с цельновирионной
формолвакциной [17].
Вакцина из гликопротеина Е вируса японского энцефалита по иммуноген-
ности уступала цельновирионной инактивированной вакцине.
Субъединичные вакцины привлекли внимание исследователей, занимаю-
щихся специфической профилактикой лейкоза кошек. Вакцинация кошек с по-
следующей ревакцинацией субъединичной вакциной против лейкоза кошек
(Leucocell), включающей антигены подтипов А, В и С и мембранный антиген
онкорнавируса кошек, защищает животных от развития инфекции при последу-
ющем заражении их вирулентным штаммом вируса лейкоза кошек. Спустя 2—4
года после вакцинации и заражения еженедельная инъекция животным метил-
преднизалона (7,5 мг/кг) не вела к реактивации вируса в культуре клеток костно-
го мозга. Указанная вакцина предотвращала латентную инфекцию вирусом лей-
коза кошек даже на фоне иммуносупрессии. Она хорошо защищает кошек от
персистентной виремии и возникновения опухолей. Кошек иммунизировали
иммуностимулирующим комплексом, приготовленным на базе оболочечного
гликопротеина вируса лейкоза кошек gp70 и трансмембранного белка вируса
р15Е, или коммерческой субъединичной вакциной из вируса лейкоза кошек
Leucocell. Оба препарата содержали сопоставимые количества белка gp70. Жи-
вотных иммунизировали трижды и наблюдали в течение 200 дней. За этот пери-
од животные оставались здоровыми, а попытки выделить от них вирус были без-
успешными. По сравнению с коммерческой вакциной, вакцина на основе ИС-
КОМ во всех случаях индуцировала сероконверсию и более высокие титры
антител, выявляемых ИФА, или в нейтрализации. Методом иммуноблоттинга
подтверждено формирование специфических антител, реагирующих с белками
gp70HP15E [1188].
Флавивирусные инфекции сопровождаются образованием антител как к
структурным, так и к ассоциированным с клетками вирусспецифическим нест-
руктурным белкам; К последним относится gp48, известный как NSl-белок —
большой комплементсвязывающий антиген, существующий либо в связанном с
клетками виде, либо в растворимой форме.
Очищенный белок NS1 вируса желтой лихорадки получали из лизатов инфи-
цированных клеток Vero методом аффинной хроматографии с использованием в
качестве лиганда анти-NSl моноклональных антител. Интраперитониальное
введение мышам 15 мкг N S1 дважды с интервалом две недели вызывало образо-
вание антител и создавало 100%-ную защиту животных от внутрикожного зара-
жения летальной дозой вируса.
Иммунизация обезьян резус NS 1-белком дважды (100 мкг внутрикожно и 500
мкг подкожно) вела к появлению в крови антител в титре 1:64 — 1:256 и NSl-ан-
тител и предотвращала летальный исход после заражения вирулентным штаммом
вируса желтой лихорадки. Механизм защитного эффекта NS1-белка обусловлен
комплементопосредственным иммунным цитолизом клеток, несущих поверхно-
стный NS1-антиген. Этот механизм защиты возможен и у других флавирусов.
Иммуногенность очищенного структурного Е-белка (33 кД) вируса желтой лихо-
радки оказалась менее выраженной [386]. Интересным продолжением описан-
ных примеров может служить получение субъединиц из безоболочечных вирусов
и использование соответствующих препаратов для вакцинации. Субъединичные
вакцины, содержащие очищенные гексоны аденовируса типа-5, обладали выра-
женной антигенностью и оказались нереактогенными для людей [163].
Субъединичную (VP 1) и цельновирионную инактивированную вакцины
против ящура оценивали на морских свинках. Для создания одинакового эффек-
та в субъединичной вакцине, должно содержаться значительно больше антигена,
чем в цельновирионной. Заключенный в липосомы вирионный белок (VP 1) или
цельные инкативированные вирионы обладали большей антигенностью, чем те
же иммуногены с полным адъювантом Фрейнда [169].
Субъединичная вакцина, содержащая капсидные белки VP1,2, 3 и, по-види-
мому, VP4 вируса энцефаломиокардита в дозе >16 нг, защищала мышей от гибе-
ли при экспериментальном заражении [672].
Белок Р-2 вируса катаральной лихорадки овец в препаративных количествах
выделяли обработкой вирионов моновалентными или двухвалентными солями.
При такой обработке сохранялись иммунологическая специфичность Р-2.
50 мкг белка Р-2 было достаточно для индукции у овец преципитирующих и ней-
трализующих антител. Вакцинированные белком Р-2 овцы оказались защищен-
ными против вирулентного штамма вируса [822]. Однако неясно, почему пустые
капсиды ротавируса крупного рогатого скота, содержащие иммунодоминантный
белок VP7, были неспособны к индукции вируснейтрализующих антител у круп-
ного рогатого скота.
Субъединичная (плазменная) вакцина против гепатита В после трехкрат-
ного введения вызывала образование защитного уровеня анти-НВз-а'нтител у
87—95% вакцинированных. В дальнейшем эта вакцина была заменена реком-
бинантной субъединичной вакциной, HBsAg для которой синтезирован в
дрожжах.
Приведенные выше примеры позволили идентифицировать протективные
вирусные антигены и показали, что субъединичные вакцины обладают выра-
женной иммуногенностью. Результаты таких исследований явились хорошим
обоснованием и предпосылкой для разработки субъединичных (компонентных)
вакцин на основе рекомбинантной технологии.
Считается, что важное значение в обеспечении высокой иммуногенности
гликопротеинов играет форма их надмолекулярной организации в препарате.
Согласно этой точке зрения, мицеллярные формы белков обладают повышен-
ной иммуногенностью, тогда как мономерные формы белков не способны сти-
мулировать образование высокого уровня иммунитета.
Только крупные антигенные комплексы способны вызывать иммунный от-
вет, сопоставимый с индуцированным цельным вирусом. Таким образом, техно-
логия приготовления эффективных субъединичных вакцин должна предусмат-
ривать образование мультимерных агрегатов («мицелл», «розеток»).
Альтернативным способом повышения иммуногенной активности изолиро-
ванных гликопротеинов может служить встраивание в липосомы. Иммуности-
мулирующие свойства липосом описаны для многих секретируемых и трансмем-
бранных белков и подтверждены на ряде субъединичных вакцин. Реконструкция
трансмембранных белков в липосомы, по-видимому, в наибольшей степени
приближает их структуру к естественной. Липосомы и мицеллы гликопротеинов
одинаково эффективно связываются с клеточной поверхностью и, вероятно,
одинаково доступны для взаимодействия с клетками иммунной системы.
В некоторых сообщениях отмечается относительная слабость субъединич-
ных вакцин в индукции клеточного, а также гетеротипического иммунитета по
сравнению с инактивированными цельновирионными и живыми вакцинами.
Для усиления иммуногенной активности вирусных компонентов используют
адъюванты: масляные адъюванты, адсорбенты, мурамилдипептид и его произ-
водные и иммуностимулирующие комплексы (ИСКОМ).
Одной из главных проблем производства субъединичных вакцин является
источник вирусных компонентов. Облегчить решение этой задачи может приме-
нение суспензионного метода культивирования вирусов в постоянных линиях
клеток или нетрадиционных методов наработки вирусных антигенов.
Вне зависимости от того, появятся или не появятся какие-либо выгоды от
использования традиционных субъединичных препаратов, необходимость со-
здания высокоочищенных эффективных компонентных вакцин хотя бы против
некоторых заболеваний отдельных категорий людей, по-видимому, останется
актуальной задачей.
Высокая степень очистки субъединичных вакцин дает возможность стандар-
тизировать содержание вирусного антигена в прививной дозе и отказаться от не-
достаточно точных громоздких и дорогостоящих биологических методов кон-
троля иммуногенности. Например, согласно рекомендации Комитета экспертов
ВОЗ по гриппу, качество вакцины против гриппа определяли по концентрации
гетмаглютинина методом радиальной иммунодиффузии [1379].
Хорошо известным и широко апробированным методом оценки иммуноген-
ности инактивированной противоящурной вакцины является определение кон-
центрации полных вирионов (146S частиц). Этот метод применяют для оценки
специфической активности вакцины на различных этапах технологического
цикла ее изготовления [1190]. Контроль вакцины по количественному содержа-
нию вируса (175S частицы) проводят при изготовлении инактивированной вак-
цины против геморрагической болезни кроликов [961]. Для оценки качества
инактивированной вакцины против гепатита А предложено количественное оп-
ределение содержания вирусного антигена в готовом препарате [334].
Концентрацию вирусного антигена при изготовлении инактивированных
вакцин против клещевого энцефалита [187], простого герпеса типа 1 и 2, болез-
ни Гамборо определяют в ИФА. Этот метод выявления вирусного гликопротеи-
на обнаружил высокую степень корреляции с биологическим методом контроля
иммуногенности инактивированных вакцин против бешенства человека и жи-
вотных [301].
9.5. Реассортантные вакцины
Вирусы, имеющие сегментированный геном, могут быть аттенуированы пу-
тем генной реассортации. Реассортация является формой генетической реком-
бинации, наблюдаемой у РНК-вирусов с сегментатированным геномом. Реас-
сортация обнаружена у семейств с 2 (арена- и бирнавирусы), 3 (буньявирусы) 6,
7 или 8 (ортомиксовирусы) или 10, 11 или 12 (реовирусы) геномными сегмента-
ми. В клетках инфицированных двумя родственными вирусами внутри каждого
семейства может происходить обмен сегментами с образованием жизнеспособ-
ных стабильных реассортивов. Они встречаются в природе и являются важным
источником генетической вариабельности [511]. Цель получения аттенуирован-
ных реассортантов, пригодных для использования в качестве живой вакцины,
состоит в том, чтобы заранее полученным и охарактеризованным аттенуирован-
ным штаммам придать необходимую антигенность в соответствии с антигенно-
стью актуальных полевых изолятов вируса.
От доноров аттенуации берут гены, кодирующие внутренние белки и ограни-
чивающие репликацию, от актуальных эпидемических (эпизоотических) штам-
мов заимствуют гены, кодирующие поверхностные белки (гликопротеины). Эту
технологию используют длительный период, хотя до сих пор удачной вакцины
не было создано. Вирусные реассортанты были получены при рекомбинации ви-
рулентных штаммов вируса гриппа А человека с различными генетически моди-
фицированными штаммами этого вируса [1131, 1167]. Существует несколько
способов для достижения аттенуации вируса гриппа путем реассортации генов.
Первый заключается в аттенуации вируса донора генов последовательным
пасссированием вируса в куриных эмбрионах. Аттенуированные для человека
штаммы могут быть использованы для рекомбинации с эпидемическими штам-
мами. Этот способ применяли в СССР, Великобритании, Бельгии. Второй спо-
соб принципиально сходен с первым и отличается тем, что аттенуацию осуще-
ствляют пассированием вируса при пониженной температуре (25—30°С). Свой-
ство аттенуации передается от холодо-адаптированного донорского штамма
полевым изолятам вируса при рекомбинации. Этот метод впервые применили в
нашей стране (Г.И. Александрова), затем он получил развитие в США. Получен-
ные таким образом реассортанты при испытаниях на добровольцах оказались
стабильными и сохраняли признаки аттенуации и иммуногенность. Третий спо-
соб заключается в том, что для реассортации генов в качестве донора аттенуации
используют штаммы вируса гриппа птиц, не вирулентные для человека.
Ограниченную репродукцию вируса гриппа птиц в нижнем отделе респира-
торного тракта обезьян контролировали шесть генов, кодирующих внутренние
белки вируса. Аттенуированный фенотип реассортанта вируса гриппа А птица —
человек оказался стабильным в течение пяти пассажей на обезьянах. Однако ин-
фекция реассортантом индуцировала незначительную резистентность обезьян к
последующему их контрольному заражению вирулентным вирусом гриппа А че-
ловека [1131].
Четвертый способ основан на получении температурочувствительных (ts)
мутантов вируса с помощью химических агентов. Реассортантные аттенуирован-
ные штаммы вируса гриппа получены на основе таких доноров (ts-мутантов). Но
осталась нерешенной проблема усиления их вирулентности для человека. Наи-
более распространенным в настоящее время остается второй метод аттенуации.
Считается, что для обеспечения достаточного уровня аттенуации и ее стабильно-
сти необходимо, чтобы реассортантные штаммы получили от донора шесть ге-
нов. Молекулярно-генетическим анализом установлено наличие множествен-
ных мутаций во всех восьми генах, что свидетельствует о невозможности ревер-
сии ts-признака к дикому типу [1718].
В результате использования таких методов были сконструированы живые ре-
ассортантные вакцины против гриппа, включающие два гена, кодирующие по-
верхностные гликопротеины (НА и NA) современного вирулентного штамма, и
шесть генов, кодирующие внутренние белки донора аттенуации [1131].
В условиях широкого эпидемиологически контролируемого наблюдения на
группе из 30 000 детей установлена безвредность, высокая иммунологическая и
профилактическая эффективность этой вакцины, а также генетическая стабиль-
ность холодоадаптированных рекомбинантов.
Вакцина из холодоадаптированного реассортантного вируса гриппа В при
испытании на детях оказалась стабильным аттенуированным иммуногенным
препаратом. Холодоадаптированный реассортант вируса гриппа А имел весьма
полезные свойства для вакцинного штамма — способность к интерференции с
«диким» штаммом вируса [244].
Живые (реассортантные) вакцины против ротавирусной инфекции человека
были созданы на базе культуральных аттенуированных ротавирусов крупного
рогатого скота и обезьян [1167]. В случае с реассортантным вирусом, приготов-
ленном на базе вируса обезьян, от ротавируса человека был взят только один ген,
кодирующий главный протективный белок VP7. Для реассортации брали гены
ротавируса человека 1-, 2- и 4-серотипов. Вакцинация реассортантным вирусом
вызывала сероконверсию у 70% привитых индивидуумов [751].
Термочувствительные реассортанты вирусов гриппа человек/лошадь (H3N8)
создавали защиту у вакцинированных лошадей независимо от антител к ГА [795].
Реассортация является феноменом, редко встречеющимся в природных услови-
ях. Она ответственна, например, за антигенный шифт вируса гриппа. У КРС
найдены реассортанты вируса катаральной лихорадки овец [511]. В опытах in
vitro установлено, что реассортация двух штаммов с пониженной вирулентнос-
тью приводила к появлению высоковирулентного вируса [1338].
9.6. Рекомбинантные живые векторные
вакцины
В генетическом разнообразии вирусов в природе, особенно корона-, флави-
и тогавирусов, важную роль играет рекомбинация. Она может происходить не
только между близкородственными, но и отдаленно родственными вирусами
[1727].
Важным достижением технологии рекомбинантной ДНК явилось открытие
возможности замены удаленного гена чужеродным геном. Этот метод использу-
ет вирусы как векторы для переноса генов протективных антигенов других виру-
сов. В геном авирулентного вируса вставляют ген интересующего вируса, коди-
рующий антиген, вызывающий протективный ответ в привитом организме.
Модифицированный таким образом авирулентный вирус используют как
живую вирусную вакцину. Клетки, в которых векторный вирус реплицируется in
vivo, экспрессируют чужеродный белок, вызывающий гуморальный и опосредо-
ванный клетками иммунный ответ на данный белок [ 1130].
Вирусные химеры, как вакцины с репликативным механизмом одного виру-
са и протективными антигенами другого, являются быстрой формой векторных
вакцин. Прообразом таких вакцин можно считать реассортантные вакцины.
Вирус осповакцины был одним из первых вирусов, на примере которого бы-
ла показана возможность такой замены без потери жизнеспособности рекомби-
нантного вируса с экспрессией белка, кодируемого чужеродным геном и индук-
цией иммунитета на этот белок. Подход к получению безопасной эффективной
живой вакцины заключается в использовании стабильного вакцинного вирусно-
го штамма для создания рекомбинантов, которые экспрессируют протективные
антигены других вирусов, против которых желательно создать иммунитет.Члены
семейства вирусов оспы оказались удобными для получения рекомбинантных
гибридов, благодаря их большому геному, позволяющему удалять значительные
участки ДНК без потери способности к репликации.
Гены, кодирующие различные антигены многих вирусов, были включены в
геном вируса осповакцины. Прививка животных этими рекомбинантными век-
торными вакцинами каждый раз сопровождалась хорошим антительным отве-
том. Например, вирус осповакцины, использованный в качестве вектора вакци-
ны против бешенства, будучи включенным в приманку для скармливания, защи-
щал лис и хорьков от бешенства. Возможность включения нескольких генов,
кодирующих соответствующие иммуногены, позволяет создать новый тип ком-
бинированных (поливалентных) вакцин.
Потенциальными векторами являются многие ДНК-содержащие вирусы,
реплицирующиеся в ядре или цитоплазме. Первые во многих случаях могут быть
интегрированы в клеточную ДНК, что может привести к персистенции вируса и
клеточной трансформации. Этот факт — хороший аргумент в пользу выбора «ци-
топлазматических» вирусов, таких как вирусы оспы, которые являются наиболее
крупными вирусами животных.
Участок генома вирусов оспы, кодирующий тимидинкиназу, не является ге-
номом, функция которого жизненно необходима для размножения вируса, и его
можно заменять на чужеродные ДНК.
Чужеродные белки, экспрессирующиеся рекомбинантным вирусом оспы,
сохраняют свои антигенные свойства [41] и способность формировать вирион-
ную структуру.
Использование этого вируса в качестве вектора для вакцинации имеет ряд
преимуществ: способность размножаться в клетках многих видов животных,
экспрессировать несколько генов, индуцировать гуморальный и опосредован-
ный клетками иммунитет, термостабильность, экономичность производства и
легкость применения [1106].
В качестве векторов для создания живых рекомбинантных вакцин могут
быть использованы адено-, бакуло- и герпесвирусы. Они, как и вирусы оспы,
имеют крупный геном, — по крайней мере с одной несущественной областью для
репликации и несколькими участками, в которые могут быть встроены чужерод-
ные гены и экспрессированы без потери инфекционности. В качестве векторов
успешно используют вирусы оспы птиц.
Рекомбинантные живые вакцины по существу сочетают в себе свойства жи-
вых и компонентных вакцин. Проблема использования вектора живых вакцин в
основном аналогична. Основное различие с живыми вакцинами заключается в
том, что экспрессируется только один или несколько селективных генов, репли-
цируемых вместе с геномом вектора. В этом смысле, данные вакцины похожи на
традиционные субъединичные (компонентные), но отличаются от них лишь тем,
что являются «реплицирующимися антигенами». Рекомбинантные векторные
вакцины как бы сочетают в себе положительные качества живых и инактивиро-
ванных вакцин. При репликации в организме рекомбинантного вируса с встроен-
ным чужеродным геном, кодирующим синтез гликопротеина, который может
быть экспрессирован на поверхности клеток и может индуцировать развитие как
гуморального, так и клеточного иммунного ответа. Субъединичные вакцины мо-
гут индуцировать развитие только гуморального иммунного ответа [1167].
Использование вируса осповакцины или других аттенуированных векторов
для создания реплицирующихся субъединичных (компонентных) вакцин - но-
вое перспективное направление молекулярной биологии и генной инженерии. В
последнее время этот метод получил широкое применение в разработке нового
поколения вакцин против различных вирусных заболеваний. Естественно, что
становление принципиально нового направления создания вакцин сопряжено
со многими трудностями. Однако на главный и принципиальный вопрос — спо-
собны ли рекомбинантные вакцины вызывать выраженный и длительный имму-
нитет — получен положительный ответ. Накопилось много данных о получении
рекомбинантных вакцин, особенно на основе вируса осповакцины, содержащих
гены различных вирусов, об их антигенной и иммуногенной активности при ис-
пытании в лабораторных и практических условиях.
Рекомбинанты респираторно-синцитиального (PC) вируса получены встра-
иванием ДНК-копий РНК, кодирующих G- или F-белки, в тимидинкиназный
ген вируса осповакцины. Такие рекомбинанты, размножаясь в клетках живот-
ных, экспрессировали на их поверхности гликопротеины, аутентичные глико-
протеинам РС-вируса. У хлопковых крыс, привитых внутримышечно рекомби-
нантами, обнаружен высокий уровень специфических вируснейтрализующих
антител. Рекомбинантная вакцина PCB-F, экспрессирующая F белок, обладала
более выраженным протективным эффектом [146].
Испытания, проведенные на пяти видах низших приматов, показали безо-
пасность и иммуногенность таких рекомбинантных вакцин [471]. Рекомбинан-
ты, экспрессирующие другие семь вирусспецифических белков, оказались не-
иммуногенными или слабоиммуногенными.
Иммунизация крыс и обезьян рекомбинантным вирусом осповакцины, экс-
прессирующим белки HN и F вируса парагриппа-3, сопровождалась образова-
нием высокого уровня вируснейтрализующих антител и устойчивостью к зара-
жению вирусом парагриппа-3. Рекомбинантный вирус ПГ-3 крупного рогатого
скота и ПГ-3 человека (В/Н PIV3) с встроенными и экспрессирующимися гена-
ми белков G и F респираторно-синциального вируса хорошо размножался в ре-
спираторном тракте хомяков, с образованием антител, и создал защиту при экс-
периментальном заражении хомяков всеми тремя вирусами [1413].
Рекомбинантная осповакцина, экспрессирующая F- и НА-гены вируса чумы
КРС, оказалась иммуногенной для естественно восприимчивых животных
[1703]. Опыты на кроликах показали, что для защиты было достаточно экспрес-
сии только F-белка. Положительные результаты иммунизации получены при ис-
пытании аналогичной вакцины на зебу [1610].
Рекомбинантный вирус оспы кур содержал ген, кодирующий белок слияния
вируса кори. Иммунизация этим вирусом защищала мышей от летальной ин-
фекции при интрацеребральном заражении вирусом кори, хотя устойчивость к
заражению не сопровождалась выраженной сероконверсией [1656].
На основе вируса оспы кур получены рекомбинантные вирусы, экспрессиру-
ющие ген HN вируса ньюкаслской болезни. Такие рекомбинанты обладали вы-
раженными превентивными свойствами, вызывая иммунитет практически у
всей птицы, иммунизированной внутримышечно. Вакцинация смесью рекомби-
нантных вирусов, экспрессирующих гемагглютинин-нейраминидазу и глико-
протеин F, не усиливала защитного эффекта [623].
Аналогичными качествами обладал рекомбинантный вирус оспы голубей,
эскпрессирующий белок слияния F вируса ньюкаслской болезни. Этот белок
оказался гликозилированным и расщепленным (F1 и F2). Вакцинация кур ре-
комбинантным вирусом создавала выраженный иммунитет и образование анти-
тел к F-белку. Установлена корреляция между протективной активностью
и уровнем таких антител. Однако вакцинация не приводила к образованию ви-
руснейтрализующих антител [943].
При использовании обычных вакцин невозможно отличать вакцинирован-
ную птицу от птицы инфицированной. Применение рекомбинантной вакцины
позволяет это сделать путем выявления антител ко всем протеинам вируса (ин-
фицирование) или к отдельным протеинам (вакцинация) [650]. Рекомбинант-
ный вирус оспы птиц, экспрессирующий капсидный белок Р-2 вируса инфекци-
онной болезни бурсы, защищал кур от летальной инфекции, но не от поражения
бурсы Фабрициуса [310].
Рекомбинантные вакцины были созданы путем вставки Н и/или F генов ви-
руса чумы КРС (ЧКРС) в вирус осповакцины в качестве вектора [1590, 1696]. Ре-
комбинантный вирус с аналогичными свойствами (CPV) получен при использо-
вании вируса оспы канареек в качестве вектора.
Сконструирован химерный вирус, содержащий гены вакцинного штамма
SA-14-14-2 вируса японского энцефалита и гены инфекционного клона 17D ви-
руса желтой лихорадки. Химерный вирус размножался с высоким титром в куль-
туре клеток, был авирулентным при интрацеребральном введении мышам и об-
ладал выраженной иммуногенностью. Авирулентный фенотип химерного виру-
са сохранялся после 6 пассажей в головном мозге мышей [745а].
Рекомбинантный вирус оспы птиц, экспрессирующий ген гликопротеина В
вируса болезни Марека оказался безопасным и защищал цыплят от заболевания
[1230]. На основе вируса оспы птиц получена рекомбинантная вакцина против
геморрагического энтерита индеек (аденовирус птиц тип 2), экспрессирущая бе-
лок гексонов [449]. Рекомбинантная вакцина по антигенности и иммуногеннос-
ти не уступала коммерческой традиционной вакцине, но в отличие от нее не вы-
зывала иммуносупрессии [745а].
Рекомбинанты вируса осповакцины, экспрессирующие гликопротеины В,
D, Е, G, I вируса простого герпеса испытывали на мышах для сравнения имму-
ногенности индивидуальных гликопротеинов. Гликопротеины D и В индуциро-
вали выраженный синтез антител и повышали уровень элиминации вируса, а
также защищали от развития латентного носительства ВПГ-1 в чувствительных
ганглиях. Гликопротеин Е был слабым индуктором нейтрализующих АТ, а глико-
протены G, Н и I вовсе не вызывали образования нейтрализующих АТ и не пре-
дотвращали латентное инфицирование ганглиев [353].
Варианты рекомбинантной вакцины против японского энцефалита созданы
на основе вируса осповакцины. Они обеспечивали синтез гликозилированного
неструктурного белка NS-1 и гликозилированного белка Е оболочки вириона. Ре-
комбинанты, экспрессирующие тот и другой вирусные белки, обладали высокой
иммуногенностью. Две инъекции вакцины защищали мышей от 104ЛД50 вируса
японского энцефалита. Высокий уровень защиты коррелировал с высоким уров-
нем АТ, обладающих нейтрализующей активностью и активностью в РТГА [1019].
Рекомбинанты вируса осповакцины, содержащие в геноме различные соче-
тания генов С, М, Е, NS-1 вируса клещевого энцефалита, размножали в культу-
ре клеток CV-1. Двукратное введение мышам вируса, экспрессирующего белок Е
оболочки вируса клещевого энцефалита, защищало их при контрольном зараже-
нии гомологичным вирулентным вирусом [15].
Гены структурных белков вируса классической чумы свиней были встроены
в ген тимидинкиназы вируса осповакцины. В культуре клеток CV-1 рекомби-
нантный вирус экспрессировал все четыре структурных белка вируса чумы, ко-
торые по основным свойствам не отличались от соответствующих вирионных
белков. Иммунизация рекомбинантным вирусом надежно защищала свиней от
инфицирования вирулентным вирусом [1348]. Сконструирован рекомбинант-
ный вирус осповакцины, экспрессирующий основной белок оболочки вируса
лейкоза крупного рогатого скота. Иммунизация телят таким вирусом оказывала
лишь частичный защитный эффект. Аналогичные результаты получены в других
исследованиях при испытании рекомбинантного вируса на овцах.
Мыши, иммунизированные рекомбинантным вирусом осповакцины, коди-
рующим неструктурный белок NS-1 вируса денге, были полностью защищены от
летального энцефалита при последующем заражении вирулентным вирусом
[656]. В ген gill аттенуированного вакцинного штамма вируса инфекционного
ринотрахеита крупного рогатого скота встроены последовательности кДНК, ко-
дирующие мономерные и димерные формы эпитопов белка VP1 вируса ящура.
Такая вакцина вызывала иммунитет к вирусу ринотрахеита и выработку антител
против ящура [891].
Рекомбинантный бакуловирус экспрессировал капсидный белок VP 2 виру-
са катаральной лихорадки овец в иммуногенной форме. Добавление структурно-
го белка VP5 усиливало иммуногенный эффект [1345].
С целью создания эффективной, безопасной и экономичной антирабичес-
кой вакцины для профилактической иммунизации людей и животных получен
рекомбинантный аденовирус серотипа-5 человека, содержащий ген гликопроте-
ина вируса бешенства. Иммунизированные им мыши были защищены от леталь-
ной интрацеребральной инфекции [1272].
Получен рекомбинантный вирус осповакцины, содержащий одновременно
участки генома вирусов гепатита В, гриппа и герпеса простого, который экс-
прессировал HBsAg вируса гепатита В, гемагглютинин — вируса гриппа и глико-
протеин D вируса герпеса простого [41].
Таким образом, в качестве векторов для создания рекомбинантных вакцин
используют различные стабильные аттенуированные вирусы. Наибольший успех
был достигнут при использовании вируса осповакцины в качестве рекомбинант-
ного вектора. Такой рекомбинантный вирус мог экспрессировать протективные
антигены большого количества вирусов, в том числе его использовали для имму-
низации против бешенства. Вставка гена гликопротеина вируса бешенства в ген
тимидинкиназы вируса вакцины приводит к снижению его вирулентности. В си-
лу того, что геном вируса осповакцины способен включать много чужеродных
генов без потери способности формировать вирионную структуру, теоретически
возможно конструировать в качестве вектора один рекомбинантный вирус, спо-
собный защищать против нескольких вирусных болезней.
Использование вируса оспы птиц в качестве вектора при создании рекомби-
нантных вакцин для птиц представлялось весьма логичным. Однако большим
сюрпризом оказалось то, что вирус оспы птиц может служить вектором при имм-
мунизации млекопитающих. Допускается возможность, что этот вирус и тесно
связанный с ним вирус оспы канареек, также используемый в качестве вектора,
не реплицируются с образованием инфекционного вируса в клетках млекопита-
ющих, но включенные в их геном чужеродные гены экспрессируются и вызыва-
ют специфический иммунный ответ.
Возможно, что такие векторы вызывают абортивную инфекцию in vivo с экс-
прессией чужеродных антигенов, вызывая клеточный и гуморальный иммуни-
тет. Такие нереплицирующие векторы являются безопасными для иммуносу-
прессивных хозяев.
Необходимо иметь в виду, что введение рекомбинантных живых вакцин в ор-
ганизм может вызывать иммунный ответ как против вируса донора чужеродного
гена, так и против векторного вируса. Однако непохоже, чтобы рекомбинантные
субъединичные вакцины были эффективнее рекомбинантных векторных вак-
цин, ограниченных однократным применением из-за развития иммунитета к
векторному вирусу.
Отдельные векторные вакцины применяют в полевых условиях. Это вакцина
против бешенства лис, применяемая для профилактики бешенства в Европе, и
вакцина против бешенства хорьков, применяемая в США. Вакцина против чумы
КРС (основанная на вирусе осповакцины и вирусе оспы коз) применяется в Аф-
рике. Недавние исследования подтвердили, что адено-, герпес- и парвовирусы
могут также служить векторами и могут иметь преимущества в экспресии генов
гетерологичных вирусов.
9.7. Рекомбинантные субъединичные
вакцины
Прогресс в области получения большого количества протективных вирусных
антигенов достигнут благодаря использованию технологии рекомбинантной ДНК.
Рекомбинантные субъединичные вакцины готовят из очищенных вирусных
белков, экспрессируемых клонированными вирусными генами. Гены, кодирую-
щие протективные антигены, вводят в подходящую плазмиду, которую клониру-
ют в экспрессирующую клеточную систему. Используемыми эукариотическими
системами экспрессии являются дрожжи, клетки насекомых и клетки различных
млекопитающих. Преимуществом дрожжей является возможность крупномас-
штабного выращивания. Первой вакциной, приготовленной экспрессией кло-
нированного гена в дрожжах, была вакцина против гепатита В человека.
Если иммуногенный вирусный белок должен быть в гликозилированной
форме, необходимо использовать эукариотическую экспрессирующую систему.
Экспрессированный таким образом белок является гликозилированным и име-
ет соответствующую конформацию. Продукция вирусных белков в прокариоти-
ческой системе была менее успешной [958].
Преимущество клеток насекомых заключается в простой технологии, свя-
занной с культурами клеток мотылька (или гусеницы), способными дать боль-
шое количество вирусного белка в результате инфицирования бакуловирусами,
несущими ген (гены) протективного белка (белков) интересующего вируса. Про-
мотор гена, кодирующего белок бакуловирусного полиэдроза, является настоль-
ко сильным, что продукт интересующего вирусного гена, введенный внутрь гена
бакуловирусного полиэдрина, может составлять половину всего протеина инфи-
цированных клеток моли или гусеницы.
Преимущество клеток млекопитающих по сравнению с клетками низших
эукариотов заключается в том, что в них более точно (правильно) осуществляет-
ся посттрансляционный процессинг, включая гликозилирование и секрецию ви-
русных белков.
При выборе клеточной системы для экспрессии рекомбинантных вирусных
антигенов важную роль играют такие критерии, как эффективность, безопасность
и технологичность. Прежде всего необходимо определить идентичность экспрес-
сируемого протективного антигена и экономическую целесообразность его произ-
водства. В случае использования перевиваемых линий клеток, необходимо, чтобы
экспрессируемый вирусный белок легко отделялся от клеточной ДНК из-за ее воз-
можной онкогенной опасности. Секреция вирусных гликопротеинов в среду об-
легчает их очистку, которая не должна сопровождаться нарушением конформации
нейтрализующих эпитопов. Необходимо также определить целесообразность до-
бавления адъюванта с целью усиления иммуногенности очищенного белка.
В прокариотической системе E.coli были экспрессированы капсидный белок
VP1 вируса ящура, поверхностный антиген вируса гепатита В, гемагглютинин
вируса гриппа А, поверхностный гликопротеин G вируса бешенства, гликопро-
теин D вируса простого герпеса и белки, кодируемые различными сегментами
генома ротавируса [1131]. Количество рекомбинантного белка VP1 вируса ящу-
ра, синтезированного в E.coli, достигало 17% от общей массы белка. Такой белок
в сочетании с адъювантом вызывал иммунитет у животных [222, 1131, 1219].
Гликопротеин D вируса простого герпеса, экспрессированный в E.coli в негли-
козилированном виде, вызывал образование нейтрализующих антител у кроликов.
Это указывало на то, что гликозилирование поверхностных вирусных гликопроте-
инов данного вируса не является необходимым условием для выработки нейтрали-
зующих антител. Однако негликозилированный белок гемагглютинина вируса
гриппа А, синтезированный в той же системе, не вызывал у кроликов и мышей ан-
тител, нейтрализующих вирус, или задержку гемагглютинации. Гликопротеин ви-
руса бешенства, полученный подобным способом, не был гликолизированным и,
несмотря на полноразмерность, не индуцировал иммунитету мышей [1131].
Рекомбинантный гликопротеин Е и неструктурный белок NS-1 вируса япон-
ского энцефалита, синтезированные в E.coli и усиленные адъювантом, вызывали
образование ВН-антител и устойчивость к заражению у мышей после четырех-
кратного введения [1443]. Рекомбинантный белок, представленный С-концевой
частью гликопротеина Е и N-концевой частью NS-1 вируса денге, экспрессиро-
ванный в E.coli, защищал мышей от летальной инфекции гомологичным вирусом
[1442]. Скармливание мышам рекомбинантных сальмонелл, экспрессирующих
антигены вируса гепатита В, сопровождалось образованием специфических ан-
тител в высоком титре [1382]. Возможно, это был первый шаг на пути создания
энтеральной вакцины против гепатита В и других вирусных болезней.
Несмотря на отдельные положительные результаты при использовании про-
кариотической системы экспрессии, возник ряд проблем, основными из кото-
рых явились низкий выход и агрегация рекомбинантного белка [1167].
Накоплены данные, свидетельствующие о преимуществах использования
эукариотических систем экспресии, в частности дрожжей.
Производство вирусных антигенов в дрожжах представляет пример эффек-
тивного использования гетерологичной системы для разработки технологии из-
готовления противовирусных вакцин. Дрожжи не только обладают способнос-
тью к росту с высокой плотностью популяции в суспензионной культуре в фер-
ментарах, но и обеспечивают специфические модификации транслируемых
рекомбинантных белков, чего не происходит в прокариотической системе. В
итоге при использовании дрожжей оказалось возможным получить рекомби-
нантный вирусный белок с высокой специфической иммунологической актив-
ностью. Наглядным примером изготовления «дрожжевой» вакцины служит вак-
цина против гепатита В. Цель была достигнута трансформацией дрожжей реком-
бинантной экспрессионной плазмидой, содержащей ген поверхностного
антигена вируса гепатита В.
Современная технология рекомбинантной ДНК пришла на смену устарев-
шей рутинной технологии изготовления вакцины против одного из наиболее
опасных и широко распространенных заболеваний людей. Ранние вакцины про-
тив гепатита В были необычными и представляли собой очищенный поверхно-
стный антиген вируса (HBsAg), полученный из плазмы крови человека, хрони-
ческого носителя вируса. Это была уникальная в своем роде вакцина.
Рекомбинантные дрожжевые клетки продуцируют поверхностный антиген
вируса гепатита В, агрегированный в многомерные сферические частицы диаме-
тром 22 нм, идентичные натуральному поверхностному HBsAg антигену, обнару-
живаемому в плазме крови хронически инфицированных людей.
HBsAg синтезировался в дрожжах в количестве, достаточном для промыш-
ленного изготовления вакцины. Антиген, выделенный из разрушенных дрож-
жей, очищают скоростным центрифугированием в сочетании с иммунной хро-
матографией.
Сравнительный анализ физико-химических, морфологических и иммуно-
генных свойств HBsAg, полученного генно-инженерным способом и выделен-
ного из плазмы крови носителей вируса, продемонстрировал близость их харак-
теристик. Однако поверхностный антиген вируса гепатита В, продуцируемый
дрожжами, оказался негликозилированным. С целью усиления иммуногенности
в рекомбинантные вакцины были включены, помимо HBsAg, белки, кодируе-
мые зонами npe-S ДНК вируса гепатита В.
Рекомбинантные культуры дрожжей, в отличие от плазмы носителей антиге-
на вируса, практически представляют неограниченный источник вирусного ан-
тигена для изготовления вакцинного препарата. Протективная активность ре-
комбинантной вакцины не отличается от активности вакцины, полученной из
плазмы крови доноров [1196]. В дрожжах экспрессирован G-белок вируса бе-
шенства в нативном виде [1130].
Основной протективный белок VP2 вируса бурсальной болезни кур образо-
вывался в высокоиммуногенной форме в рекомбинантных дрожжах. Рекомби-
нантный белок VP2 после однократного внутримышечного введения (~50 мкг) в
составе эмульгированной вакцины вызывал у кур вируснейтрализующие антите-
ла в таком же титре, как после введения живого вируса. Трансовариальная пере-
дача антител обеспечивала выраженный иммунитет у потомства и вселяла на-
дежду на практическое применение такой вакцины [655]. Аналогичные резуль-
таты получены с рекомбинантной субъединичной вакциной, содержащей белок
VP2, экспрессированный в бакуловирусной системе [1244, 1701].
Создание эффективной вакцины против гепатита С связано с многими про-
блемами, и в первую очередь, с отсутствием возможности размножения вируса в
культуре клеток, а так же генетическим разнообразием и высоким уровнем мута-
бильности вируса. Вакцины, основанные на гликопротеинах Е1 и Е2, вызывали
кратковременное образование антител у обезьян к этим антигенам и требовали
частой бустеризации. Привитые животные были защищены против внутривен-
ного заражения малыми дозами вирулентного вируса гомологичной антигенно-
сти, но не против заражения большой дозой вируса или заражения гетерологич-
ным штаммом вируса. Возможно, что для усиления протективного эффекта
требуется индукция специфических цитотоксических лимфоцитов к консерва-
тивным эпитопам неструктурных белков [989].
Возрастающий интерес к изготовлению компонентных вакцин на основе
технологии рекомбинантной ДНК привлек внимание к использованию клеток
животных в качестве систем, экспрессирующих рекомбинантные вирусные бел-
ки. В качестве таких систем часто использовали трансформированные линии
клеток, в том числе яичника китайского хомяка (линия СНО), а также клетки
обезьян, трансформированные вирусом SV-40 (линия COS). Такую систему ис-
пользовали для наработки антигенов, вируса гепатита В и др. Продуцируемые в
рекомбинантных клетках СНО вирусоподобные частицы, содержащие поверх-
ностный антиген вируса гепатита В, имели диаметр 22 нм, плотность в хлориде
цезия 1,21 г/см3 и не отличались от частиц, обнаруживаемых в плазме крови ин-
фицированных носителей. Культуральные свойства клеток СНО позволяли рас-
считывать на их промышленное использование в качестве продуцентов иммуно-
генного материала [934].
Клетки гепатобластомы человека (линия HepG2), трансфицированные пол-
норазмерной ДНК вируса гепатита В, в большом количестве секретировали ан-
тигены Е, С и S [1320]. Мембранный гликопротеин (340/220) вируса Эпштейн-
Барр длительное время экспрессировался в фибрабластоподобных клетках мы-
шей, трансформированных вирусом папилломы крупного рогатого скота [528].
Белок Е1 вируса краснухи был экспрессирован в клетках COS после транс-
фекции клеток кДНК в составе вектора обезьяньего вируса SV-40. Этот белок
антигенно подобен белку, экспрессируемому в клетках, зараженных вирусом
краснухи [1146].
Генно-инженерным методом получена клеточная линия, продуцирующая
пустые капсиды парвовируса В-19 человека. Продукция полых капсидов была
равной или превышала формирование вирионов в инфицированных клетках ко-
стного мозга (1000—2000 капсидов на клетку). Трансфекция не влияла на ско-
рость роста клеток-продуцентов [867]. Капсиды парвовируса В-19, экспрессиро-
ванные в бакуловирусной системе, по антигенным и иммуногенным свойствам
были подобны нативным вирионам [868]. Испытание рекомбинантной вакцины
на серонегативных добровольцах дало положительные результаты [527]. Полу-
чен рекомбинантный вирус бешенства, стабильно экспрессирующий гликопро-
теин оболочки др 160 вируса иммунодефицита человека 1. Этот вирус вызывал у
мышей образование ВН-антител в высоком титре (1:800) и мог служить прообра-
зом рекомбинантной вакцины против ВИЧ-1 [1386].
Живые вакцины против краснухи весьма эффективны, однако их реактоген-
ность, особенно для беременных женщин, побудила к созданию новых средств
специфической профилактики краснухи. Новая стратегия основывалась на со-
здании компонентных вакцин на основе рекомбинантной ДНК-технологии.
Получена субъединичная вакцина, которая включает белок Е1, содержащий
главные нейтрализующие эпитопы [921].
Клетки куриного эмбриона, трансфицированные геном HN вируса Нью-
каслской болезни в составе вектора из вируса саркомы Рауса, стабильно экспрес-
сировали белок HN на клеточной поверхности; адсорбировали эритроциты кур
и проявляли нейраминидазную активность. Трансфицированные HN-клетки
проявляли резистентность к суперинфекции вирусами ньюкаслской болезни и
гриппа, связывающимися с рецепторами, содержащими сиаловую кислоту, но
были чувствительны к заражению вирусом везикулярного стоматита [1100].
Протективный поверхностный гликопротеин D вируса простого герпеса,
экспрессируемый и секретируемый клетками СНО, вызывал синтез нейтрализу-
ющих антител и защиту мышей от заражения летальной дозой вируса [1131]. Об-
работка морских свинок гликопротеином вместе с адъювантом предупреждала
развитие латентной инфекции ганглиев и оказывала терапевтический эффект,
снижая количество и тяжесть вирусиндуцированных повреждений.
Субъединичные вакцины, содержащие HN и F гликопротеины вируса ПГ-3,
получены из очищенного вируса или в культуре клеток насекомых, инфициро-
ванных рекомбинантным бакуловирусом, экспрессирующим HN и F белки, или
химерным вирусом.
Рекомбинантная субъединичная вакцина против лейкоза кошек в качестве
антигена содержала негликозилированный гликопротеин оболочки вируса лей-
кемии кошек подгруппы А. Такой рекомбинантный белок включал белок обо-
лочки (гликопротеин 70 кД) и первые 34 аминокислоты трансмембранного бел-
ка Р15Е. Вакцина представляла собой очищенный белок, адсорбированный на
гидроокиси алюминия, и содержала сапонин. У вакцинированных кошек обра-
зовывались вируснейтрализующие антитела и развивалась анамнестическая ре-
акция на введение вируса лейкемии кошек. Иммунизированные животные были
защищены от вирусной инфекции [1007].
Постоянные линии клеток имеют важные преимущества в качестве субстра-
тов для производства рекомбинантных субъединичных вакцин. Поскольку такие
клетки являются естественным хозяином вирусов млекопитающих и птиц, син-
тезируемые в них рекомбинантные вирусные белки во всех отношениях подоб-
ны природным вирусным антигенам. Выделение и очистка таких антигенов от-
личаются быстротой и экономичностью. Наработка протективных вирусных
антигенов в эукариотических системах, по-видимому, является наиболее прием-
лемым процессом, так как вирусные антигены экспрессируются на клеточной
поверхности в сочетании с антигенами гистосовместимости хозяина, обеспечи-
вая, тем самым, наряду с гуморальным иммунным ответом, и эффективный кле-
точный ответ [1131]. Основной недостаток таких клеточных систем — потенци-
ально существующая опасность их возможной онкогенности. По мнению авто-
ритетных специалистов, клиническая оценка безопасности антигенов,
полученных при использовании клеточных линий и рекомбинантных векторов,
содержащих фрагменты трансформирующих вирусов, является условной [1131,
1167]. Однако существующие методы очистки антигенов от клеточной и вирус-
ной ДНК, а также других продуктов метаболизма, дают возможность получить
препараты, отвечающие существующим требованиям, и практически снимают
ограничения с использования постоянных линий клеток.
Для экспрессии чужеродных вирусных белков широко используют перевива-
емые линии клеток насекомых под контролем бакуловируса в качестве вектора.
Таким путем были экспрессированы НА вируса гриппа, протективный антиген
вируса гепатита Е, а так же белки других вирусов. Клетки млекопитающих широ-
ко используют для получения протективных вирусных белков, которые пригод-
ны для приготовления субъединичных вакцин. Этот способ может быть исполь-
зован для приготовления вакцин, когда вирус не размножается в культуре клеток
(вирус гепатита В, парвовирус В19, вирус Норволк), или в случае, когда изготов-
ление цельновирионной инактивированной вакцины представляет биологичес-
кую опасность (некоторые лентивирусы, филовирусы, хантавирусы и аренавиру-
сы человека).
Для крупных вирусов, таких как вирусы герпеса, которые кодируют около 10
протективных антигенов, может оказаться необходимым использовать для вак-
цины смесь нескольких экспрессированных белков [326].
9.8. Вакцины на основе вирусоподобных
частиц и трансгенных растений
Протективные антигены многих оболочечных и безоболочечных вирусов об-
разуют вирусоподобные частицы, которые представляют собой капсидные бел-
ки, формирующие оболочечные структуры без вирусной нуклеиновой кислоты
внутри. Такие структуры не образуются индивидуальными очищенными капсид-
ными белками. Некоторые из эпитопов ВПЧ сформированы двумя капсидными
белками, что обеспечивает им некоторое преимущество функционирования в
качестве иммуногенов.
Первоначально было показано, что в процессе трансляции in vitro пикорна-
вирусной геномной РНК, в которой отсутствовала большая часть 5'-кодирую-
щей области генома, капсидные белки могут подвергаться неполной самосбор-
ке. Первым успехом на этом пути явилась вакцина против гепатита В из ВЧП,
полученных в дрожжах с помощью технологии рекомбинантной ДНК.
Когда клонированные в плазмиды гены, кодирующие синтез и процессинг
капсидных белков некоторых безоболочечных вирусов, экспрессируются, обра-
зуются индивидуальные капсидные белки, которые объединяются в вирусопо-
добные частицы [ 1130].
Такие «пустые» или не всегда пустые ВПЧ полностью лишены нуклеиновой
кислоты, а потому безопасны. В иммуногенном отношении они могут быть экви-
валентны цельновирионным инактивированным вакцинам, но в отличие от них,
не имеют повреждений эпитопных участков, которые могут произойти в процес-
се инактивации. Иммуногенность ВПЧ была показана у пикорна-, калици-, ро-
та- и орбивирусов. Однако вакцины на основе ВПЧ пока не получили коммерче-
ского использования. Возможной причиной явился низкий выход антигенного
продукта, высокая стоимость приготовления и менее выраженная иммуноген-
ность по сравнению с существующими вакцинами, в том числе с цельновирион-
ными инактивированными адъювантными вакцинами [1130, 1135].
Важным преимуществом ВПЧ является их эффективность при оральном и
назальном применении, что открывает новые перспективы в создании иммуни-
тета слизистых.
Неспособность некоторых вирусов размножаться в культуре клеток является
препятствием в создании живой и инактивированной вакцин. Однако, данная
проблема может быть решена наличием у них способности образовывать вирусо-
подобные частицы, которые являются обильным источником капсидного антиге-
на [645]. ВПЧ оказались безопасными и иммуногенными при испытании на ла-
бораторных животных и взрослых добровольцах [1307, 1534]. Обнадеживающие
результаты получены с компонентной рекомбинантной вакциной против вируса
Норволк на основе капсидного антигена для орального применения [281, 645].
Полные вирионы калицивируса кошек и 15S субвирусные частицы содержат
основной капсидный белок, а также общий эпитоп нейтрализации [1528]. Раз-
дельная иммунизация кроликов вирионами и 15S -частицами показала, что оба
антигена индуцируют синтез ВН-антител. Полученные данные позволили счи-
тать перспективным создание вакцины из субвирусных частиц 15S.
Специфический клеточный и антительный ответ наблюдали у мышей после
назального или орального введения ВПЧ вируса папилломы человека. При обо-
их способах иммунизации наблюдали синтез IgA на слизистых [615, 703].
Особый интерес в последнее время вызвала перспектива использования
трансгенных растений для изготовления субъединичных вирусных вакцин. Уста-
новление способности трансгенных растений к экспрессии антигена вируса ге-
патита В (HBsAg) открыло возможность создания съедобных компонентов рас-
тений в качестве оральных вакцин [128, 1020].
Помимо HBsAg, разработаны способы экспрессии антигенов вируса имму-
нодефицита человека, ящура, риновируса в листьях вигны. Продуктивность по-
липептида gp41 ВИЧ достигала 2 г на кг биомассы листьев вигны. Иммунизация
животных этим полипептидом сопровождалась образованием вируснейтрализу-
ющих антител. Показана возможность экспрессии протективного гликопротеи-
на вируса бешенства в трансгенных томатах [128].
Экспрессия генов капсидных белков вируса Норволк в трансгенных расте-
ниях сопровождалась образованием ВПЧ, которые вызывали иммунный ответ
при испытании на лабораторных животных и добровольцах [456, 1307, 1534]. Ре-
зультаты этих исследований указывали на возможность создания субъединичной
вакцины для профилактики гастроэнтерита, вызываемого этим вирусом преиму-
щественно у детей [456, 732].
Главный структурный белок VP60 вируса геморрагической болезни кроликов
экспрессировался в трансгенных растениях картофеля. Иммунизация кроликов
экстрактом листьев такого картофеля вызывала образование специфических ан-
тител в высоком титре и защищала кроликов от летальной инфекции при зара-
жении [456].
Получены трансгенные растения люцерны, экспрессирующие главный им-
муногенный белок VP1 вирусаящура. У мышей, парентерально иммунизирован-
ных экстрактом листьев и получавших с пищей свежесобранные листья транс-
генных растений, развивался специфичный иммунный ответ и создавалась за-
щита против экспериментального заражения вирусом ящура [1657].
Аналогичные исследования проведены с вирусом трансмиссивного гастро-
энтерита свиней (ТГС). Белок S или его фрагмент, содержащий четыре антиген-
ных сайта (А, В, С и Д), экспрессированные в бакуловирусной системе, вызыва-
ли образование вируснейтрализующих антител у свиней [1549]. Созданы транс-
генные картофель [722] и моцерна [1550], экспрессирующие гликопротеин S
вируса ТГС. Скармливание таких растений животным вызывало образование
специфических вируснейтрализующих антител.
Полученные результаты позволили высказать мнение, что, возможно, в бли-
жайшем будущем из белков генетически модифицированных растений будут го-
товить «пищевые» и «кормовые» вакцины [456, 732] против некоторых заболева-
ний преимущественно для иммунизации молодых организмов.
9.9. ДНК-вакцины
Новой потенциально полезной стратегией иммунизации явилось внутримы-
шечное или внутрикожное введение плазмидной ДНК, кодирующей вирусные
протективные антигены. Открытые возможности использования ДНК в качест-
ве вакцины явились наиболее революционным достижением стремительно раз-
вивающейся технологии рекомбинантной ДНК. Создание ДНК-вакцин стало
возможным благодаря разработке вирусных векторных систем. Повышению эф-
фективности доставки ДНК в клетки и установлению длительной экспрессии
чужеродной ДНК в трансфицированных клетках организма.
Новое направление в иммунопрофилактике называют «генетической имму-
низацией» или «иммунизацией нуклеиновыми кислотами» [1493, 1677].
Хотя способность ДНК и РНК вызывать синтез соответствующих белков по-
сле их проникновения в клетку известна давно, только недавно была осознана
возможность данной технологии для создания специфического иммунитета. Но-
вый принцип иммунизации состоит в том, что в организм вводят не вирусный
антиген, а ДНК, кодирующую синтез этого антигена (белка). Оказалось, что ви-
русная ДНК сама по себе может быть использована как вакцина. Детальный ана-
лиз развития исследований в этом направлении показал, что такое не является
сюрпризом. Было известно, что ДНК и РНК многих вирусов, инфицируя клет-
ки, могут осуществлять полный цикл репликации.
В 1990 г. Вульф и сотр. [1677] обнаружили, что плазмидная конструкция
ДНК, включающая ген галактозидазы, введенная в скелетную мышцу мыши,
длительно (до 60 дней) экспрессирует фермент. Вскоре после этого было показа-
но, что после ДНК-вакцинации у животных образуются специфические антите-
ла [1493], развивается клеточный иммунитет и защита от вирусной инфекции
[1558].
Экспрессия чужеродных генов in vivo может обходиться без сложных систем,
используя прямое введение плазмидной ДНК. ДНК-экспрессируюшие векторы
для этих целей могут быть реализованы несколькими путями. Простейшим и не-
ожиданно одним из наиболее эффективных методов является введение ДНК в
солевом растворе («голая» ДНК).
Введение плазмидной ДНК, содержащей репортерные гены, в солевом рас-
творе вызывает экспрессию белков in vivo [1677].
ДНК-вакцины обычно содержит плазмиду E.coli с сильным промотором и
репортерный ген. Плазмида амплифицируется обычно в E.coli, очищается, сус-
пендируется в буферном растворе, а затем просто вводится в организм.
Рекомбинантные плазмиды представляют собой конструкции, содержащие
гены, способные экспрессировать нужные вирусные антигены. Клетки организ-
ма, по крайней мере вначале, в месте инъекции трансформируются плазмидой,
ДНК транспортируется к ядру, где транслируется интересующий (репортерный)
белок. Экспрессия репортерных генов обнаружена в мышцах, селезенке, печени,
коже, легких и мозге. Однако наиболее выраженная экспрессия обнаружена в
мышцах. Ее можно было обнаружить в течение минуты после инъекции. Она
максимально проявлялась через 1—2 недели, а затем постепенно снижалась, но
могла быть обнаружена, по крайней мере, через 19 месяцев. Механизм интерна-
лизации ДНК клетками еще не выяснен и неизвестно, почему мышечные клет-
ки являются наиболее эффективной клеточной мишенью трансфекции при пря-
мом введении ДНК. Простое объяснение, состоящее в том, что ДНК просачива-
ется в клетки в результате повреждения при введении, не подтверждено экспе-
риментально. Скорее можно предположить, что в этом могут участвовать физи-
ологические процессы включения ДНК. Так как внутримышечная иммунизация
оказалась наиболее эффективной, вначале думали, что трансфицированные ми-
оциты ответственны за поддержание продукции антигена и функционируют как
антиген-презентирующие клетки. Сейчас считают, что для этого требуются
«профессиональные» антиген-презентирующие клетки, происходящие из кост-
ного мозга, эти клетки инфильтрируют место присутствия антигена и играют
роль местного лимфоузла. Также может иметь место прямая трансфекция анти-
ген-презентирующих клеток, особенно клеток лангерганса при внутрикожном
введении [1130].
Иммунизация ДНК имеет некоторые преимущества перед иммунизацией
очищенными вирусными антигенами. Наиболее важным преимуществом явля-
ется то, что вирусные антигены, такие как вирусные гликопротеины, могут экс-
прессироваться на поверхности трансфецированных клеток и представляться
иммунной системе в нативном виде. В процессе очистки вирусных белков, сбор-
ки и очистки ВПЧ или химической инактивации вирусов структура эпитопов на
протективных белках может быть нарушена и вызовет ослабление иммуногенно-
сти. ДНК-иммунизация устраняет эти проблемы и больше напоминает иммуни-
зацию живыми вирусными вакцинами, чем неживыми вирусными антигенами.
Вирусные антигены, кодируемые ДНК, эффективно презентируются и вместе с
антигенами МНС I вызывают индукцию Тх- и Тц-лимфоцитов. Таким путем они
способны вызывать сбалансированный иммунный ответ, более сходный с по-
стинфекционным иммунитетом, чем с иммунитетом на преформированные ви-
русные антигены. Другим преимуществом иммунизации ДНК является способ-
ность трансфицировать клетки без интерференции с вирусными антителами.
Наконец, чужеродные антигены могут экспрессироваться in vivo в течение не-
скольких месяцев после ДНК-иммунизации. Однако иммунный ответ при этом
может развиваться медленно. Этот метод иммунизации еще не оптимизирован,
хотя предложены различные усовершенствования [1493, 1677].
Значительное усиление ответа на вакцинацию достигнуто включением плаз-
мидной ДНК в микрочастицы диаметром 1—3 мкм, покрытые золотом и вводи-
мые путем «бомбардировки» с помощью гелевого газового «пистолета» (генный
пистолет). Введение таким образом 1 мкг ДНК является достаточным. В опытах
с другими рекомбинантными вакцинами включали гены, кодирующие иммуно-
стимулирующие белки, такие как интерлейкин-2, интерлейкин 12 и интерферон
гамма [1245].
Преимущества ДНК-вакцин заключаются в чистоте, физико-химической
стабильности, относительно низкой стоимости производства, простоте достав-
ки, включении в одну плазмиду генов, кодирующих множество антигенов, и экс-
прессии антигенов в их нативной форме (что облегчает процессинг и презента-
цию иммунной системе). Повторное введение не сопровождается интерферен-
цией, но сопровождается гуморальным и клеточным (Тц и Тх) ответом. Одна из
особенностей ДНК-иммунизации состоит в том, что она эффективна в присут-
ствии материнских антител. Главным недостатком ДНК-вакцин является воз-
можная опасность, связанная с введением чужеродной генетически измененной
ДНК, интеграпия которой в хромосомную ДНК может привести к связанному с
инсерцией мутагенезу или онкогенезу, индукцией аутоиммунного состояния или
толератности. Плазмиды используют из-за отсутствия репликации и, более того,
отсутствия саморепликации ДНК при использовании ее в качестве вакцины.
Плазмиды, содержащие вирусную ДНК, конструируются без последовательнос-
тей, которые способны интегрировать ее в хромосомальную ДНК.
В последнее время введением ДНК-вакцин различным видам животных экс-
прессирован широкий спектр антигенов, в результате чего установлено развитие
длительного гуморального и клеточного иммунитета. На различных животных
моделях с использованием метода контрольного заражения показано, что ДНК-
вакцины, кодирующие вирусные антигены, эффективно защищают от соответ-
ствующих инфекций [670].
Таблица 27. Показательные результаты испытания ДНК вакцин [670]
(В скобках указан вид животных, на которых использовали вакцины)
Вирус Белки Индукция антител Индукция Тц лимфоцитов Защита от экспе- риментального заражения
Вирус Ринотрахеита КРС gD + + + (КРС)
Вирус гепатита В Структурные антигены + (обезьяны) + (обезьяны) + (обезьяны)
Вирус гепатита С Нуклеокапсид + + + (мыши)
Вирус простого герпеса тип 1 gD, gB + + + (мыши)
ВИЧ тип 1 Env, Gag, Rev + + + (обезьяны)
Вирус гриппа HA, Ml,Np + + + (цыплята, мыши)
Вирус лимфоцитарного хориоменингита NP + + + (мыши)
Вирус бешенства NP, гликопротеин + + + (обезьяны)
Респираторно- сипцитиальный вирус гликопротеин + + + (мыши)
9.10. Синтетические пептидные вакцины
Синтетические пептидные вакцины — это препараты, содержащие искусст-
венно синтезированные короткие пептиды, имитирующие небольшие участки
протективных антигенов вируса, способные вызывать специфический иммун-
ный ответ организма и защитить его от конкретного заболевания. Идентифика-
ция основных антигеных детерминант протективных антигенов многих вирусов
позволила синтезировать антигенноактивные пептиды.
После того, как Лернер и др., (938) показали, что небольшие пептиды могут
вызывать защиту животных против вирусных болезней, появились многие рабо-
ты по созданию пептидных вакцин. Заманчивость этого направления исследова-
ний состояла в том, что создание пептидных вакцин могло бы решить многие
проблемы, связанные с производством и применением вакцинных препаратов.
На ряде примеров была показана их способность вызывать образование спе-
цифических антител и защиту животных.
Наиболее значительные исследования по созданию синтетических пептид-
ных вакцин проведены на модели вируса ящура. Такие препараты вызывали об-
разование ВН-антител у морских свинок и защиту у значительной части свиней
и КРС при экспериментальном заражении вирулентным вирусом.
Это стало возможным после того, как было установлено, что за индукцию
антител, нейтрализующих вирус ящура, ответственен белок VP1 и, в частности,
один доминантный нейтрализующий иммуногенный сайт (аминокислоты
141—160) и один дополнительный сайт вблизи С'-концевого участка этого поли-
пептида. В результате, был синтезирован пептид, содержащий аминокислотные
последовательности 141 —160 VP1, который был связан с гемоцианином и допол-
нен адъювантом Фрейнда. Вакцина вызывала образование вируснейтрализую-
щих антител у морских свинок, свиней и крупного рогатого скота и защищала их
от заболевания при заражении вирулентным штаммом вируса ящура. Однако ан-
тительный ответ после иммунизации пептидным препаратом был в 10—100 раз
ниже, чем после иммунизации цельными вирионами. Использование пептида в
виде димера или триммера усиливало специфическую активность синтетической
вакцины. Для иммунизации свиней против ящура требовалось 40 мкг синтетиче-
ского пептида [399]. Синтетические пептиды, соответствующие нейтрализую-
щим эпитопам VP-1 вируса ящура трех типов, обладали различной антигенной и
иммуногенной активностью. Пептиды, обладающие специфичностью типа А и
О, вызывали у морских свинок протективный иммунитет. Менее активным ока-
зался пептид серотипа С [594]. Пептиды с аминокислотной последовательнос-
тью VP-1 всех семи типов вируса ящура вызывали образование вируснейтрализу-
ющих антител у морских свинок. Антитела имели в основном типовую специ-
фичность. Установлена возможность приготовления двухвалентной пептидной
вакцины против ящура. Для этого синтезировали два пептида различных сероти-
пов в тандеме. Дипептидные вакцины вызывали синтез вируснейтрализующих
антител к двум типам вируса ящура [834]. Синтетический пептид, соответствую-
щий аминокислотному участку 142-158 VP-1 вируса ящура типа А, вводили мор-
ским свинкам (20 мкг), овцам (1 мг) и крупному рогатому скоту (1,5 мг) вместе с
адъювантом Фрейнда. У животных отмечали высокий уровень вируснейтрализу-
ющих антител и устойчивость к заражению гомологичным вирулентным штам-
мом вируса ящура. Обнаружена зависимость иммунитета от афинности антител,
индуцированных синтетическим пептидом [1452].
После первых успехов в получении иммуногенных пептидов вируса ящура ка-
залось, что такая же удача последует и с пептидами других вирусов. Однако на де-
ле этого не произошло, и эксперименты часто завершались неудачами. Так было в
опытах с пептидами протективных антигенов вирусов гриппа и гепатита-В и, как
ни странно, с синтетическим пептидом, представляющем главные антигенные
сайты белка VP-1 полиовируса типа 1 [1131]. В последующих исследованиях имму-
ногенные пептиды были получены к некоторым вирусам. Синтезирован линей-
ный вируснейтрализующий эпитоп гликопротеина вируса бешенства, который со-
здавал протективный иммунитет против летального бешенства у мышей [587].
Пептид, соответствующий аминокислотным остаткам 1—23 или 9—21 гико-
протеина D вируса простого герпеса, конъюгированный с белком, обладал им-
мунизирующим эффектом для мышей, будучи включенным в липосомы, но ус-
тупал по иммуногенности постинфекционному иммунитету [700].
Обнадеживающие результаты получены в опытах с пептидной вакциной
против парвовируса собак. Собаки, вакцинированные пептидными вакцинами,
оказались устойчивыми к заражению вирулентным вирусом, тогда как все «кон-
трольные» собаки погибли от парвовирусной инфекции. Аналогичные результа-
ты получены при иммунизации норок той же вакциной с последующим зараже-
нием вирулентным вирусом энтерита норок [925].
Декапептид, гомологичный аминокислотным остаткам 993—1002 пепломер-
ного гликопротеина Е-2 вируса гепатита мышей, конъюгированный с гемациа-
нином и в смеси с адъювантом Фрейнда, в дозе 50 мкг вызывал устойчивость у
мышей к заражению [1487]. Синтетический циклический пептид, соответствую-
щий аминокислотным остаткам 139—146 сайта А гемагглютинина вируса гриппа,
защищал 80% мышей от интрацеребрального заражения вирусом гриппа [1122].
Некоторые синтетические пептиды не способны вызывать иммунный ответ,
но могут его значительно усилить при последующем введении живой вакцины.
Проведенные исследования показали, что полученные синтетические пептиды
оказались слабыми антигенами и для усиления иммунного ответа они нуждались
в соединении с белком-носителем или синтетическим биополимером или в при-
сутствии адъюванта.
Лабораторные испытания синтетических пептидных вакцин в общем дали
весьма скромные результаты (таблица 28).
Несмотря на то, что синтетические пептиды вызывали нейтрализующие ан-
титела против некоторых вирусов, в целом полученые результаты были разоча-
ровывающими. Однако эти подходы заслуживают дальнейшего изучения. Их ог-
раничения связаны с тем, что большинство эпитопов, вызывающих гумораль-
Таблица 28. Синтетические пептидные вакцины
Вирус Нейтрализующие антитела Защитный эффект на лабораторных животных
гепатит мышей - +
грипп + +
полиомиелит + НИ
ЯЩУР + +
лейкемия кошек + ни
простой герпес 1 + +
бешенство + +
PC инфекция — +
ВИЧ-1 + +
корь - +
+ положительный результат; — отрицательный результат;
± сомнительный результат; ни — не исследовали.
ный иммунитет, являются конформационными. Эпитопы, сформированные не-
линейно расположенными первичными последовательностями, образуют склад-
чатые полипептидные цепи. Эффективные антигенные стимулы требуют чтобы
в вакцине содержались трехмерные эпитопы как в нативных вирусных белковых
молекулах. Так как большинство В-клеточных эпитопов не является линейны-
ми, а короткие синтетические пептиды не имеют конформационной структур-
ной организации большинство антител против них неспособны эффективно
связываться с вирусными эпитопами, потому что титр вызываемых ими нейтра-
лизующих антител ниже индуцированных инактивированной вакциной или
очищенными вирусными белками.
Считается, что для иммунного ответа конформация является более важной,
чем линейная последовательность аминокислот или последовательность анти-
генных детерминант. Циклизованные пептиды обнаружили большую иммуно-
генность, чем их линейные аналоги.
Кроме того известно, что один пептид не может быть достаточно эффектив-
ным для индукции резистентности, поскольку большая поверхность антигенов
обычно содержит несколько индивидуальных иммунологически активных об-
ластей, вызывающих защитный гуморальный и клеточный ответ. Пока не уда-
лось идентифицировать небольшие пептиды, обладающие протективным дейст-
вием [1131].
При констуировании синтетических вакцин внимание, вероятно, должно
быть уделено созданию гетерополимерных полипептидов, адресованных В и Т
клеточным эпитопам и связанных с носителем способствующем их поглощению
иммунокомпетентными клетками.
Глава 10
СЕМЕЙСТВА ВИРУСОВ,
ПАТОГЕННЫХ
ДЛЯ ЧЕЛОВЕКА
И ЖИВОТНЫХ
10.1. Вирусы оспы
Вирусы оспы (ВО) — самые крупные вирусы, содержащие ДНК, молекуляр-
ная масса которой больше, чем у любого другого вируса животных. Они широко
распространены в природе, вызывают заболевания позвоночных и беспозвоноч-
ных с летальным исходом или в виде легко протекающей продолжительной ин-
фекции с образованием доброкачественных опухолей. ВО передаются членисто-
ногими при прямом контакте, аэрозольно или механически. ВО обычно имеют
узкий круг хозяев, хотя некоторые из них представляют исключения, в том чис-
ле вирусы вакцины и оспы птиц. Вирусы оспы позвоночных включают восемь
родов (орто-, пара-, ави-, капри-, лепори-, суи-, моллюсци- и ятапоксвирусы).
Разделение вирусов оспы позвоночных на роды проведено с учетом массы и
структуры генома, размера и формы вириона, способности к генетической ре-
комбинации, антигенной связи и спектра патогенности.
Ортопоксвирусы. Типичный представитель - вирус осповакцины (ВОВ).
Спектр естественных хозяев узкий, обычно ограничен одним видом животных: ви-
русы агглютинируют эритроциты цыплят; варьируют по вирулентности для естест-
венных хозяев и лабораторных животных. Другие виды: вирусы оспы буйволов,
верблюдов, крупного рогатого скота, мышей, обезьян и вирус натуральной оспы.
Парапоксвирусы. Типичный представитель — вирус контагиозного пустулёз-
ного дерматита (эктимы) овец и коз (вирус орф). Представители рода серологи-
чески связаны между собой, но отличаются от представителей других родов; ге-
магглютинин не образуют. Другие виды: вирусы пустулёзного стоматита крупно-
го рогатого скота, контагиозной эктимы серн и сыпи доярок.
Авипоксвирусы. Естественные хозяева — птицы; типичный представитель —
вирус оспы кур. Члены рода серологически связаны между собой. Другие виды:
вирусы оспы канареек, голубей, перепелов, воробьев, скворцов, индеек и оспы
Юнко. Передаются членистоногими.
Каприпоксвирусы. Естественные хозяева — парнокопытные; типичный пред-
ставитель — ВО мелких жвачных (овец и коз). В данный род входит также вирус
кожной бугорчатки крупного рогатого скота.
Лепорипоксвирусы. Типичный представитель — вирус миксомы кроликов.
Передается механически членистоногими. Другие виды; вирусы фибромы зай-
цев, кроликов (вирус Шоупа) и белок. Вирус злокачественной фибромы кроли-
ков — летальный туморогенный поксвирус, возникший, по-видимому, вследст-
вие рекомбинации между вирусами фибромы и миксомы кроликов [1561].
Суипоксвирусы. Типичный представитель — вирус оспы свиней. В инфициро-
ванных клетках образуются несколько типов цитоплазматических включений и
наблюдается вакуолизация ядра. Другие члены рода не определены.
Моллюсципоксвирусы. Типичный представитель — вирус контагиозногоииол-
люска. Возможные члены рода — вирусы однокопытных и обезьян.
Ятапоксвирусы включают вирус опухолей обезьян Яба и вирус оспы Тана.
Вирусы оспы — наиболее крупные из всех вирусов животных. Под электрон-
ным микроскопом они выглядят как большие овальные (кирпичеобразные) час-
тицы размером около 250—350x200—270 нм.
Орто-, ави-, лепорипоксвирусы более вытянуты, а вирус оспы свиней шире,
чем другие ВО. Парапоксвирусы имеют овальную (коконообразную) форму и
размер 260x160 нм.
В структуре ВО различают три основных компонента: двояковогнутую серд-
цевину, овальные боковые тела и оболочку вириона. Сердцевину вириона состав-
ляют ДНК и связанные с нею белки. Сердцевина окружена гладкой мембраной
(толщиной около 5 нм), снаружи покрытой слоем вертикально уложенных и
плотно прилегающих друг к другу цилиндрических субъединиц (5x10 нм). Вогну-
тость сердцевины с обеих сторон занята овальными образованиями (неизвестной
природы), называемыми боковыми телами. Они как бы сдавливают сердцевину,
придавая ей форму двояковогнутого диска, имеющего на разрезе вид гантели.
Вирионы заключены в липопротеиновую супероболочку, которая имеет тол-
щину 20—30 нм и содержит липиды клетки и вирусспецифические белки.
Вирионы большинства ВО окружены слоем беспорядочно расположенных
трубчатых структур, придающих им характерный вид. Эти структуры состоят из
сферических субъединиц диаметром около 5 нм. Субъединицы построены из
молекул протеина или гликопротеина. В состав ворсинок длиной 20 нм покры-
вающих поверхность вируса осповакцины (ВОВ), входит белок с молекулярной
массой 58 кД, относящийся к главным полипептидам вириона. Поверхность па-
рапоксвирусов покрыта длинными нитеподобными трубочками, уложенными
крест-накрест, напоминающими клубок пряжи.
Вирус осповакцины содержит белки, липиды и ДНК, которые соответствен-
но составляют 90, 5 и 3,2% массы вириона (5х1015 г). В вирусе оспы птиц около
1/3 массы составляют липиды [1135].
Вирион образуется включением ДНК внутрь незрелых вирусоподобных час-
тиц, которые затем созревают, покрываясь дополнительно наружными оболоч-
ками. Репликация и сборка вирионов происходят в разных местах цитоплазмы (в
виропластах или вирусных фабриках), и вирионы освобождаются почкованием
или при лизисе клеток.
Вирионы, освободившиеся из клетки почкованием до ее разрушения, по-
крыты оболочкой, которая содержит клеточные липиды и несколько вирусспе-
цифических белков.
Геном ВО представлен одной линейной молекулой двуцепочечной ДНК с
ковалентно замкнутыми концами размером 130 тпн (парапоксвирусы) — 280 тпн
(авипоксвирусы). На обоих концах генома имеются идентичные, но противопо-
ложно ориентированные тандемы повторяющихся нуклеотидных последова-
тельностей. Геномы ВО способны кодировать около 200 белков, из которых не
менее 100 входят в структуру вириона. Однако функциональные особенности
определены лишь у небольшого количества вирусных белков. Наиболее важны-
ми из них являются ферменты, участвующие в синтезе вирусных нуклеиновых
кислот и структурных компонентов вирионов. Например, синтез ДНК-полиме-
разы, ДНК-лигазы, РНК-полимеразы, энзимов, связанных с кэппированием и
полиаденилированием мРНК и тимидинкиназы.
Инфекционные вирусные частицы содержат системы транскрипции, кото-
рые могут выполнять in vitro синтез РНК, а также способны полиаденилировать,
кэппировать и метилировать. В вирусных частицах содержится большое количе-
ство кодируемых вирусом энзимов и других биологически активных факторов.
Некоторые гены ВО кодируют белки, которые секретируются инфицирован-
ными клетками и вызывают ответ организма на инфекцию, в том числе и фор-
мирование иммунитета.
К таким вирокинам относятся гомологичный эпидермальный фактор роста,
белок, снижающий активность комплемента, вирокины, обеспечивающие ус-
тойчивость к интерферону, и другие супрессоры иммунного ответа, подавляю-
щие действие некоторых цитокинов организма хозяина.
ВО обычно характеризуются узким спектром хозяев. Они передаются чаще
респираторным путем и реже через поврежденную кожу. Вирусы оспы овец, сви-
ней, птиц и миксоматоза передаются также через укус членистоногими. Вирусы
оспы устойчивы в окружающей среде и могут сохраняться годами в высохших
струпьях кожи или других вируссодержащих материалах.
Большинство ВО хорошо размножаются в культуре клеток. Исключение со-
ставляют парапоксвирусы, вирус оспы свиней и вирус контагиозного моллюска.
Однако они, так же как и ортопоксвирусы, легко образуют оспины на хориоал-
лантоисной оболочке куриных эмбрионов [1135].
ВО размножаются в цитоплазме, и, в отличие от других ДНК-вирусов, их
размножение происходит независимо от ядра клетки, благодаря кодированию
всех ферментов, необходимых для транскрипции и репликации вирусного гено-
ма. Некоторые из этих функций выполняются вирионами как таковыми. После
слияния оболочки вириона с плазматической мембраной клетки или после эн-
доцитоза вирусная сердцевина освобождается в цитоплазму. Транскрипция ви-
русного генома характеризуется каскадностью, когда каждый временной класс
генов («ранние», «промежуточные» и «поздние» гены) требует наличия специ-
фических транскрипционных факторов, которые создаются предшествующим
временным классом генов. Факторы, обеспечивающие транскрипцию проме-
жуточных генов, кодируются ранними генами, тогда как факторы транскрип-
ции поздних генов кодируются промежуточными генами. Транскрипция начи-
нается вирионной транскриптазой и другими факторами, находящимися в
сердцевине вириона, которые способны образовывать мРНК спустя минуты
после инфицирования. Белки, образующиеся в результате трансляции этих
мРНК, включая ДНК-полимеразу, тимидинкиназу и несколько других фермен-
тов, необходимы для репликации вирусной ДНК. Репликация ДНК ВО связана
с синтезом конкатемерных промежуточных структур, которые затем разрезают-
ся с образованием единиц геномной длины. Детали этого процесса недостаточ-
но изучены. С началом репликации ДНК происходит резкий сдвиг в генной
экспрессии. Транскрипция «промежуточных» и «поздних» генов контролирует-
ся специфическими вирусными белками. Некоторые продукты транскрипции
ранних генов образуются на поздней стадии инфекции, упаковываются в вири-
оны и используются в следующем круге инфекции. Так как в состав вирусов ос-
пы входит большое количество белков, не является неожиданным, что сборка
вирионов есть комплексный процесс, который длится несколько часов и все
еще целиком не выяснен.
Образование вириона связано с вхождением ДНК внутрь незрелой сердце-
винной структуры, которое затем завершается включением наружных покрыва-
ющих слоев. Репликация и сборка вирионов происходят в разных местах цито-
плазмы в так называемых виропластах или вирусных фабриках. Вирионы выхо-
дят из клетки почкованием (оболочечные вирионы), или путем экзоцитоза, или
при лизисе клеток (вирионы без оболочки). Большинство вирионов освобожда-
ются при цитолизе и не имеют оболочки. Вирионы с оболочкой и без нее обла-
дают инфекционностью, но первые, вероятно, играют более значительную роль
в возникновении и распространении заболевания, а также в создании иммуни-
тета [408].
В очищенном вирусе осповакцины (ВОВ) выявлены белки с молекулярной
массой 10-250 кД. Многие из них сосредоточены в сердцевине вириона. Два
структурных гликопротеина располагаются между оболочкой и сердцевиной. В
оболочке ВОВ содержится около 10 белков, из которых иммунологически наи-
более активны крупномолекулярные белки с молекулярной массой 58—32 кД
(VP4c, VP6a, VP6b и VP7a) [169, 662]. Белок 32 кД определяет круг хозяев и важен
для репликации вируса [239].
В составе очищенного вируса оспы птиц обнаружено 29 полипептидов с мо-
лекулярной массой 14—138 кД. Наивысшей антигенной и иммуногенной актив-
ностью обладают полипептиды с молекулярной массой 35 и 37 кД [1280]. За ин-
дукцию вируснейтрализующих антител ВО ответственны антигены, располо-
женные на поверхности наружной оболочки вириона, и прежде всего белок
58 кД (VP4c), являющийся основным структурным компонентом трубочек (вор-
синок). Антисыворотка к этому белку нейтрализовала инфекционность вируса и
предотвращала образование синцития в культуре клеток. Этот белок ответстве-
нен за выработку иммунитета [662].
Внеклеточные вирионы покрыты дополнительной наружной оболочкой, от-
сутствующей у внутриклеточных вирионов. Она играет важную роль в индукции
синтеза ВН-антител. Инфекционность ВОВ и ВО крупного рогатого скота, име-
ющих наружную оболочку, нейтрализовалась антисывороткой к имеющему эту
оболочку ВОВ, но не нейтрализовалась антисывороткой к ВОВ, лишенному на-
ружной оболочки [662].
За гемагглютинирующую активность ортопоксвирусов ответственны поли-
пептид 85 кД и гликопротеид 41 кД. Во внеклеточном оболочечном ВОВ гемаг-
глютинирующие свойства связаны с полипептидом 85 кД. Внутриклеточные ви-
рионы (без дополнительной оболочки) практически не содержали этого поли-
пептида. Неструктурный гемагглютинин формируется на цитоплазматических
мембранах. С его образованием инфицированные клетки приобретают способ-
ность адсорбировать эритроциты. Вирусспецифические белки с молекулярной
массой 32 и 37 кД, экспрессируемые на поверхности клеток, инфицированных
ВОВ, делают их мишенями для специфических цитотоксических Т-лимфоцитов
[1002]. МАТ-реактивные против каждого из пяти (54; 34; 32; 29 и 17—25 кД) бел-
ков наружного слоя поверхности вируса осповакцины нейтрализовали его ин-
фекционность. В структуре полипептида 54 кД обнаружено два нейтрализующих
эпитопа (А и В) [662]. Анализ антигенных детерминант поверхностных полипеп-
тидов, проведенный с помощью МАТ, выявил в составе ортопоксвирусов, наря-
ду с видоспецифическими, группоспецифические эпитопы [927]. Связывание
ВОВ с нейтрализующими МАТ не препятствовало его прикреплению к клеткам-
мишеням, но блокировало депротеинизацию вирионов [1318].
Оспа овец
Оспа овец — острое контагиозное заболевание с папулёзно-пустулёзными
поражениями кожи и слизистых оболочек. В случаях генерализованного и ос-
ложненного течения гибель овец достигает 50% от количества заболевших. Ви-
рус передается животным в основном аэрогенным путем. Виремия наступает пе-
ред генерализацией процесса. Некоторые штаммы при экспериментальном за-
ражении могут вызывать местную реакцию у крупного рогатого скота и коз. У
больных животных вирус локализуется в основном в оспинах. Он не имеет анти-
генных вариантов. Переболевание сопровождается длительным иммунитетом
(не менее двух лет) и образованием антител, которые с молозивом и молоком пе-
редаются потомству. Для специфической профилактики применяют живые
культуральные вакцины. Аттенуированные нереверсибельные штаммы были по-
лучены различными способами. Для аттенуации вирус чаще всего пассировали в
культурах клеток почек ягнят. Заметной аттенуации вируса достигли после 30
пассажей. Однако иногда это сопровождалось потерей иммуногенности. Хоро-
шие результаты получены при использовании для этих целей первичной культу-
ры и субкультуры тестикулярных клеток ягнят. Аттенуация вируса наступала по-
сле 50—65 пассажей. Аттенуированные штаммы максимально накапливались че-
рез 5—6 дней, обладали незначительной реактогенностью, вызывали вирусемию,
не передавались горизонтально и защищали 83-100% вакцинированных овец
против 10000 ИД50 вирулентного штамма вируса оспы овец. Иммунитет длился
не менее 1 года.
Вакцинация сопровождалась выраженным образованием антител. Аналогич-
ным образом была получена живая вакцина из вирулентного штамма вируса оспы
коз. Вакцинный вирус не передавался горизонтально, не восстанавливал виру-
лентности после пяти серийных пассажей на козах. Внутрикожная и подкожная
вакцинация коз сухой вакциной через 6—8 дней создавала невосприимчивость к
заражению вирулентным штаммом. Продолжительность иммунитета — 1 год. Су-
хая живая вакцина на основе аттенуированного штамма НИСХИ (Иванющепков
В.Н. и др., 1979) после однократного введения защищала 96—99% овец при кон-
трольном заражении [58]. Аттенуированный иммуногенный штамм вируса оспы
овец получен в результате длительного серийного пассирования вируса на овцах
при подкожном методе заражения. Инактивированные культуральные вакцины
против оспы овец и коз оказались менее эффективными.
Оспа птиц
Оспой (дифтеритом) домашней птицы называют инфекционные болезни
кур, индеек, голубей, канареек, перепелок, которые клинически проявляются
типичной оспенной экзантемой кожи и слизистых оболочек. При поражении
слизистых оболочек отмечается большой отход птицы. Оспа птиц встречается во
всем мире и характеризуется энзоотическим течением. Заболевание передается
при контакте или через переносчиков.
Птица после переболевания оспой очень быстро приобретает прочный по-
жизненный иммунитет к заражению гомологичным вирусом. Так, куры в тече-
ние 8 дней после заражения приобретают гуморальный иммунитет, а клеточный
развивается полностью спустя 3-4 недели после заражения. Материнские анти-
тела (нейтрализующие, преципитирующие и гемагглютинирующие) передаются
от иммунных несушек через яйцо цыплятам, которые остаются пассивно защи-
щенными в течение первых трех недель жизни.
Вирусы оспы птиц могут пересекать видовые барьеры. Например, вирус ос-
пы кур может спонтанно инфицировать и иммунизировать индеек. При искусст-
венных пассажах вируса оспы кур на голубях он ведет себя, как вирус оспы голу-
бей. Вирус оспы индеек, близкородственный вирусу оспы кур, обладает выра-
женной патогенностью и иммуногенностью для кур. Для голубей он не
патогенен и не иммуногенен. Вирус оспы голубей малопатогенен для кур и ин-
деек и вызывает у них иммунитет против вирусов оспы кур и индеек. Штаммы
вируса оспы канареек могут быть слабопатогенными для кур и голубей, но не
иммунизируют их. Эти особенности вирусов используют в иммунопрофилакти-
ке оспы птиц. Специфическую профилактику оспы кур осуществляют с помо-
щью живых вакцин. Имеются два типа вакцин: живая — из вируса оспы голубей
и живая - из вируса оспы кур. В результате применения первой вакцины выра-
батывается иммунитет продолжительностью 3 мес., а вторая — обеспечивает бо-
лее надежную защиту продолжительностью 10 мес. [54]. Однако живая вакцина
из вируса оспы кур может обусловить системные реакции и противопоказана ку-
рам-несушкам и племенной птице.
Оба типа вакцин можно использовать также для иммунизации индеек. Вирус
обычно выращивают на куриных эмбрионах, хотя в некоторых случаях «голуби-
ные» вакцины против оспы изготавливают из пораженных тканей искусственно
зараженных голубей.
Чтобы вызвать местную реакцию, вакцины вводят внутрикожно. При груп-
повой иммунизации в крупных хозяйствах вакцину можно вводить перорально с
питьевой водой. Но для хорошего иммунитета в этом случае необходимо иметь
высококонцентрированную вакцину.
Контагиозный пустулёзный дерматит
Контагиозный пустулёзный дерматит (эктима) овец и коз характеризуется
образованием струпьев, везикул, пустул на губах, реже на копытах, вымени и по-
ловых органах. При поражении нижних частей конечностей часто возникают ос-
ложнения, обусловленные секундарной микрофлорой копытной гнили.
Болезнь распространена повсеместно и обычно протекает легко. Иногда ме-
стные поражения наблюдают у человека на коже кистей рук. Некоторыми штам-
мами удается заразить кроликов, котят, телят. Вирус накапливается в местах по-
ражений, носящих локальный характер. Он размножается в культурах клеток ов-
цы и может быть адаптирован к ряду культур клеток другого происхождения. В
куриных эмбрионах вирус не размножается. Антигенные варианты вируса не ус-
тановлены, хотя их существование не исключается. Обнаружена антигенная
связь с вирусами осповакцины и эктромелии. Вирус оспы овец и коз вызывает
частичную устойчивость к вирусу эктимы, но не наоборот. Переболевание со-
провождается образованием иммунитета, продолжительность которого зависит
от возраста животного и тяжести переболевания. У взрослых овец он, как прави-
ло, длится 6—9 мес. Ягнята, переболевшие вскоре после рождения, становятся
чувствительными к заражению после отъема. Вирусы осповакцины и эктимы не
дали перекрестной защиты при испытании на овцах. Переболевание и иммуни-
зация сопровождаются образованием различных антител. Однако ВН-антитела
образуются в низком титре, и защита от заболевания в основном обеспечивает-
ся клеточными факторами иммунитета. Гуморальные антитела сохраняются до 5
мес., тогда как клеточный иммунитет длится 6—8 мес. Материнские антитела не
защищают потомство от заболевания и практически не препятствуют развитию
вакцинального иммунитета. Для специфической профилактики болезни приме-
няют аттенуированные культуральные штаммы вируса. Попытки создания эф-
фективных инактивированных вакцин не дали положительного результата. Жи-
вые вакцины наносят на скарифицированную кожу внутренней поверхности бе-
дра или слизистую оболочку верхней губы либо вводят подкожно. Овцам и козам
старше 3 мес. вакцину вводят однократно. Ягнят и козлят до 3 мес. вакцинируют
дважды с интервалом 4-6 недель.
Миксоматоз — заболевание домашних и диких кроликов, характеризующее-
ся острым (со смертельным исходом) или подострым (доброкачественным) тече-
нием с отечными либо узелковыми поражениями кожи. К вирусу миксомы чув-
ствительны европейские и американские кролики. Естественным резервуаром
его считают тропических южноамериканских кроликов. В естественных услови-
ях заражение происходит главным образом в результате механического переноса
вируса комарами (A. aegipti). Кроме того, вирус может передаваться при прямом
контакте через поврежденную кожу и воздушно-капельным путем. Начиная с
1939 г. вирус миксомы применяли для борьбы с дикими кроликами в Австралии
и Европе. Переболевание сопровождается выраженным иммунитетом. Специ-
фическая профилактика миксоматоза основана на применении живых вакцин.
Первый успех был достигнут благодаря гетероиммунитету.
Исследователи воспользовались тесным антигенным родством вируса мик-
соматоза с относительно безвредным для кроликов вирусом фибромы Шоупа.
Двукратная прививка этим вирусом защищала 40—90% кроликов от миксомато-
за в течение 2—4 мес. С целью повышения иммуногенности в дальнейшем были
получены живые вакцины из аттенуированных штаммов вируса миксоматоза. С
этой целью вирус пассировали в первичной культуре клеток почки кроликов при
37, 34 и 33°С соответственно в течение 5, 2 и 79 пассажей. Вирус дважды клони-
ровали методом бляшек на 36 и 65 пассажах. Вторым этапом было пассирование
его в культуре клеток куриного эмбриона при 33°С в течение 25 пассажей в соче-
тании с перемежающимися пассажами и клонированием в культуре клеток поч-
ки кролика на уровне 6, 10 и 24 пассажей. После пассажей в культуре клеток КЭ
был получен аттенуированный штамм вируса миксомы. Он потерял патоген-
ность для кроликов разных возрастов, не передавался горизонтально любыми
способами, в том числе с помощью комаров. Аттенуированный штамм обладал
выраженной антигенной и иммуногенной активностью при внутрикожном, ин-
траназальном и аэрозольном применении. После внутрикожного введения вак-
цины иммунитет продолжается 6—12 мес. Аэрозольным методом можно имму-
низировать домашних и диких кроликов [1373].
Другие авторы аттенуировали штамм СК-82 вируса миксомы путем пяти пас-
сажей в КЭ и 20 - в первичной культуре клеток почки крольчонка. Такой вирус
при подкожном и внутримышечном введении вызывал у кроликов незначитель-
ное повышение температуры и образование вируснейтрализующих антител 1:20 -
1:320. Кролики с титром ВН-антител >1:80 оказались полностью устойчивыми к
экспериментальному заражению вирулентным штаммом вируса миксомы.
Живую гетерологичную вакцину готовят из вируса фибромы, размноженно-
го в культуре клеток и освобожденного из инфицированных клеток с помощью
повторного замораживания-оттаивания и обработки ультразвуком. Каждая доза
вакцины должна содержать около 500 ТЦД50 вируса. Лиофилизированная вак-
цина из вируса фибромы вызывает иммунитет на третий день. Двукратное внут-
рикожное введение создает иммунитет на 3—4 мес. Для его закрепления кроли-
кам вводят живую вакцину из вируса миксомы. Прививки этой вакциной повто-
ряют каждые 6 мес. Вирусом фибромы кроликов прививают не раньше чем в
3—4-недельном возрасте во избежание подавления его репликации матерински-
ми антителами. Спустя 1—3 мес. прививают гомологичной вакциной (штамм
Леон 126). Иммунитет наступает через 4 дня и продолжается 1 год.
Таким образом, для иммунизации кроликов применяют гетерологичные вак-
цины из вируса фибромы и гомологичные — из ослабленного вируса миксомы.
Первую вводят подкожно или с помощью дермоинъектора в кожу уха. Иммуни-
тет наступает на 3-5-й день и длится 2—3 мес. У молодых животных он выражен
меньше, чем у взрослых. Гомологичные вакцины более иммуногенны, но и более
реактогенны, поэтому их применяют, как правило, для повторной вакцинации
по фону гетерологичного иммунитета. Первую прививку гетерологичной вакци-
ной начинают с 4-недельного возраста, а спустя 6—8 недель кроликов прививают
гомологичной вакциной, и далее ее вводят через каждые 6 мес. Профилактичес-
кую вакцинацию проводят весной и осенью.
Для иммунизации диких кроликов, по-видимому, нужны аттенуированные
штаммы, способные передаваться горизонтально.
10.2. Асфаровирусы
Семейство представлено одним родом с одноименным названием асфарови-
русы, типовым представителем которого является вирус африканской чумы сви-
ней (АЧС). Этот вирус заражает только домашних и диких свиней семейства
Suidae. Кустарниковые свиньи и бородавочники являются естественными хозя-
евами вируса (АЧС) в природе. У них не проявляются клинические признаки
болезни при инфицировании высоковирулентными изолятами вируса АЧС, вы-
зывающими летальную, геморрагическую болезнь у домашних свиней. Инфици-
рование кустарниковых свиней приводит к слабой репликации вируса и незна-
чительному апоптозу лимфоцитов в печени, а также к относительно слабому
распространению вируса в других лимфоидных тканях [1193]. Попытки заразить
этим вирусом другие виды животных оказались безуспешными. Вирус АЧС раз-
множается в нескольких типах клеток ретикулоэндотелиальной системы свиней
и вызывает суровую лейкопению. Вирус африканской чумы (АЧС) в течение
многих лет относили к семейству иридовирусов, в которое входили главным об-
разом вирусы насекомых, рыб и амфибий. Вирус АЧС морфологически напоми-
нал иридовирусы, но отличался по структуре ДНК и стратегии репликации. Ког-
да были изучены детально эти свойства, вирус АЧС был классифицирован как
представитель рода асфаровирусы семейства асфаровирусы. Вирус АЧС переда-
ется при контакте, а также клещами рода Omithodoros. На этом основании счи-
тается единственной инфекцией, вызываемой ДНК вирусом в ряду арбовирус -
ных инфекций. Интересно, что ДНК вируса по структуре, размеру и последова-
тельности напоминает линейные плазмиды бактерий рода Borrelia. Borrelia
duttoni вызывают возвратную лихорадку в Африке с участием того же переносчи-
ка О. moubata. Подобие между вирусом АЧС и плазмидой Borrelia подтверждает-
ся некоторыми исследованиями общности происхождения и, возможно, более
весомо - общностью горизонтальной передачи геномов. Геном вируса АЧС в не-
которых отношениях напоминает геном вирусов оспы.
Рестрикционный нуклеотидный анализ выявил 5 групп вируса АЧС. Все ев-
ропейские и американские изоляты отнесены к одной группе, а африканские
имели большие различия. Они сильно различались также по вирулентности. Не-
которые штаммы вызывают тяжелое заболевание и смертность, близкую к 100%,
другие — легкопротекающее заболевание или даже бессимптомную инфекцию
[260]. Выявлены вариабельные участки генома, коррелирующие с гетерогеннос-
тью вирусной популяции и проявлением фенотипических свойств [167].
Асфаровирусы представляют собой оболочечные вирионы диаметром
175—215 нм, обладающие сложным икосаэдрическим капсидом ~ 180 нм в диаме-
тре. Капсид состоит из 1892-2172 гексогональных структурных единиц, которые
имеют вид гексогональных призм с отверстием в центре.
Геном вируса АЧС представлен одной линейной молекулой двухцепочечной
ДНК размером 170—190 тпн в зависимости от изолята. ДНК имеет ковалентно
замкнутые концы с инвертированными повторами и петлями. Геном кодирует до
200 белков, из которых 34 идентифицированы в структуре очищенных вирионов
и около 100 — в инфицированных клетках Vero. Определена полная нуклеотид-
ная последовательность генома вируса АЧС. Вирус АЧС, так же как и иридови-
русы позвоночных, чувствителен к нагреванию и растворителям жиров и устой-
чив к изменению pH в широком диапазоне (pH 4 — 13). Вирус АЧС может сохра-
няться в замороженном мясе месяцами и даже годами [542].
Первичные изоляты вируса АЧС размножаются в культуре моноцитов и ма-
крофагов свиньи. После адаптации некоторые изоляты могут размножаться в
перевиваемых линиях клеток почки свиньи (РК 15) и почки обезьян (Vero и др.).
Репликация вируса первоначально происходит в цитоплазме, хотя ядро клетки
необходимо для синтеза вирусной ДНК. Вирионы, прикрепившиеся к клетке с
помощью специфических рецепторов, проникают в клетку путем эндоцитоза.
Подобно вирусам оспы, вирионы асфаровирусов содержат гены, необходи-
мые для всех этапов транскрипции и репликации. После вхождения в цитоплаз-
му вирионы освобождаются от оболочки и их ДНК транскрибируется вирион-
ной ДНК зависимой РНК полимеразой (транскриптазой). Репликация ДНК ас -
фавирусов напоминает репликацию ДНК вирусов оспы. Родительская ДНК
служит матрицей для первого этапа репликации ДНК, а затем - матрицей для
синтеза большого репликативного комплекса, который расщепляется с образо-
ванием зрелой вирионной ДНК. На ранней стадии репликации вируса АЧС син-
тез вирусной ДНК выявляется в виде плотных очагов в ядре рядом с мембраной,
а на более поздней стадии вирусная ДНК находится исключительно в цитоплаз-
ме. На ранней стадии репликации в ядре находятся небольшие фрагменты ви-
русной ДНК (-6-12 S), а на более поздней стадии в цитоплазме содержатся бо-
лее длинные фрагменты (~37—46S). Эти фрагменты ДНК, вероятно, являются
предшественниками, которые, сшиваясь («голова — хвост»), превращаются в
полноразмерную геномную ДНК [1324].
Вирус АЧС образует паракристаллические скопления зрелых вирионов в ци-
топлазме инфицированных клеток. На поверхности инфицированных клеток
образуются микровыступы, через которые почкуются вирионы. Приобретение
вирионами оболочки не является обязательным для их инфекционности.
При генерализованной инфекции вирус АЧС в крови и тканях накапливает-
ся в титре около 9,0 1g ИД50/мл. Инфицированные животные выделяют большое
количество инфекционного вируса. Свиньи, перенесшие заболевание, остаются
длительными носителями вируса (не менее 1 года). Виремию у таких животных
можно вызвать введением кортикостероидов.
Одна из наиболее отличительных особенностей АЧС состоит в том, что сы-
воротка инфицированных свиней не нейтрализует вирус. Хотя такие животные
образуют вирусспецифические антитела, которые связываются с вирусом, но не
имеют какого либо протективного значения. Это явление связано, скорее, с при-
родой вируса, нежели с организмом, так как те же свиньи образуют нормальные
нейтрализующие антитела на антигены других вирусов. По этой причине до сих
пор не удалось создать вакцину против АЧС [737, 1197].
10.3. Иридовирусы
Семейство иридовирусы является обширным и сложным. Оно включает три
рода вирусов: ранавирусы (вирус лягушек 3), лимфоцистивирусы и род без на-
звания (вирус золотистых рыб 1).
Несколько представителей семейства иридовирусы связаны с болезнями рыб
и амфибий. Наиболее известный вирус лимфоцистита рыб вызывает опухолеоб-
разные изменения на коже. Он вызывает заболевание более чем у 90 различных
видов морских и пресноводных рыб и является важным патогеном.
Иридовирусы — оболочечные вирусы диаметром -300 нм. Иридовирусы по-
звоночных морфологически подобны вирусу АЧС. Иридовирусы имеют слож-
ный икосаэдрический капсид диаметром 130—170 нм. Геном представлен одной
линейной молекулой двухцепочной ДНК размером 95000—190000 пар основа-
ний. Иридовирус москитов имеет геном 440000 пар оснований и является наибо-
лее крупным геномом ДНК вирусов. Для транскрипции и репликации ДНК не-
обходимо ядро клетки, но некоторые ДНК синтезируются и включаются в вири-
оны в цитоплазме. Концы генома иридовирусов отличаются от концов генома
вируса АЧС циркулярными перестановками, концевой избыточностью и содер-
жанием метилированных оснований, подобно ДНК бактерий.
Иридовирусы позвоночных размножаются в различных культурах клеток ам-
фибий и млекопитающих при температуре 12—32°С. Их репликация подобна ви-
русу АЧС. Однако их геном не кодирует РНК полимеразу, а использует клеточ-
ную РНК полимеразу II, которая модифицируется структурными белками для
преимущественного синтеза вирусной мРНК. Другое отличие заключается в
том, что первая стадия репликации ДНК иридовирусов происходит в ядре, а вто-
рая — в цитоплазме с образованием конкатемеров в 10 и более превышающих
размер вирусного генома. Иридовирусы позвоночных, также как асфаровирусы,
образуют крупные параклисталлические структуры вирионов в цитоплазме ин-
фицированных клеток [260].
10.4. Герпесвирусы
Для вирусов этого семейства характерно исключительное разнообразие и
широкий круг естественных хозяев (от высших приматов до грибов).
Семейство герпесвирусов (ГВ) насчитывает более 100 представителей, объе-
диненных в одно семейство исходя из общности их структурных характеристик.
Их обнаруживают почти у всех исследуемых животных. Особенно многочислен-
ные представители герпесвирусов циркулируют в человеческой популяции. Гер-
пес (от греческого herpes — ползучий) - одна из самых распространенных вирус-
ных инфекций человека. Герпесвирусам принадлежит важная роль в патологии
сельскохозяйственных животных и птиц, а также промысловых рыб.
По крайней мере одно из главных заболеваний трех видов домашних живот-
ных вызывается герпесвирусом, в их числе инфекционный ринотрахеит круп-
ного рогатого скота, болезнь Ауески свиней и болезнь Марека кур. Многие гер-
песвирусы охарактеризованы частично, а у 19 из них, включая наиболее пато-
генные герпесвирусы, геном был полностью секвенирован. Очень немногие
семейства вирусов животных имеют такое разнообразие представителей, как
герпесвирусы [195].
Персистентная инфекция герпесвирусами сопровождается периодическим
или постоянным выделением вируса. При альфагерпесвирусных болезнях
множественные копии вирусной ДНК существуют как эписомы или, реже, ин-
тегрированы в хромосомальную ДНК латентноинфицированных нейронов. Ла-
тентные геномы исключительно «молчаливы», за исключением образования ла-
тентносвязанных транскриптов. Неизвестно, чтобы эти РНК-транскрипты ко-
дировали какой-либо протеин (герпесвирус 1 КРС является исключением).
Механизм установления и поддержания латентной инфекции еще не известен.
Реактивация обычно связана со стрессом, половыми инфекциями, транспорти-
ровкой, охлаждением, перенаселением. Реактивация ГВ домашних животных
обычно не наблюдается.
Герпесвирусы способны оставаться в латентном состоянии в организме есте-
ственных хозяев. В клетках, содержащих латентный вирус, вирусный геном на-
ходится в форме циркулярных молекул, и только небольшая часть вирусных ге-
нов экспрессируется.
Латентные геномы остаются способными к репликации и вызывают заболе-
вание после реактивации. Молекулярные механизмы, ведущие к реактивации
латентного состояния, полностью неизвестны и могут отличаться от механизма
реактивации других вирусов. Латентность отличается от хронической инфекции
отсутствием потомства инфекционного вируса. Наоборот, способность к реакти-
вации отличает латенцию от абортивной инфекции [1135].
Основным фактором, определяющим эпидемиологические или эпизоотоло-
гические особенности герпесвирусов, является способность оставаться в латент-
ной форме в чувствительных и вегетативных ганглиях. Вирусный геном может
длительное время персистировать в клетках без репликации вируса. Опасность
представляет реактивированный вирус, локализованный в клинически выра-
женных очагах поражения при возвратной инфекции или выделяемый из клини-
чески инапарантных очагов поражения [156]. После первичного инфицирова-
ния многие герпесвирусы могут длительно персистировать в организме естест-
венного хозяина, периодически давая рецидивы болезни. У теплокровных
животных реактивация вирусов происходит под воздействием различных факто-
ров (стрессы, гормональные сдвиги, травмы, интеркуррентные заболевания,
ультрафиолетовое облучение, лихорадка) и, вероятно, связана с подавлением Т-
клеточного иммунитета. Методом гибридизации in situ транскрипты специфиче-
ской вирусной РНК выявлены в ядрах нейронов латентноинфицированных жи-
вотных [920]. Однако у разных представителей герпесвирусов механизм латен-
ции и реактивации может быть различным. Некоторые герпесвирусы вызывают
неоплазмы у их естественных хозяев, экспериментальных животных или у тех и
других, а также иммортализацию клеточных культур. Несмотря на большое раз-
нообразие естественных хозяев, герпесвирусы объединяет поразительное сход-
ство. Принадлежность вирусов к этому семейству определяется на основе мор-
фологии вирионов и свойств ДНК. Несмотря на то, что различные герпесвиру-
сы не удается дифференцировать по морфологии, не существует других семейств
вирусов, представители которых характеризовались бы столь большой вариа-
бельностью. Герпесвирусы, однако, легко дифференцировать на основе биоло-
гических свойств, иммунологической специфичности, по размеру вирионов и
первичной структуре генома. Для этих вирусов характерно почкование созрев-
ших вирионов через внутреннюю мембрану клеточного ядра.
Герпесвирусы могут передаваться от одного поколения хозяев к другому бла-
годаря персистенции, часто латентной инфекции, при которой вирус периоди-
чески реактивируется и выделяется из организма. При некоторых герпесвирус-
ных инфекциях выделение вируса может быть фактически непрерывным. Моле-
кулярное филогенетическое изучение подтверждает, что, за небольшими исклю-
чениями, каждый вирус является уникальным, потому что он происходит от
своего видового хозяина. Латентность позволяет герпесвирусам быть пожизнен-
ными даже в очень небольшой изолированной группе хозяев.
Попытки разработать критерии классификации герпесвирусов внутри се-
мейства пока не увенчались успехом. Существующая классификация основана
на их естественном паразитизме.
В зависимости от биологических свойств герпесвирусы делятся на 4 подсе-
мейства, 3 из которых имеют названия альфа-, бета-, гаммагерпесвирусы и од-
но — без названия, объединяющие герпесподобные вирусы.
Подсемейство альфагерпесвирусы включает герпесвирусы 1 и 3 человека,
герпесвирус 1 кур и вирус болезни Марека. Большинство альфагерпесвирусов
размножаются быстро (цикл репликации меньше 24 ч) и вызывают латентную
Таблица 29. Основные патогенные герпесвирусы человека и животных
Обозначение вируса согласно классификации Общепринятое название вируса (болезни)
Вирусы: Герпеса человека 1 Герпеса простого: тип I
— // — 2 Герпеса простого: тип II
— // — 3 Ветряной оспы — зостер
— // — 4 Эпштейн-Барр
— // — 5 Цитомегаловирус
Герпеса крупного Инфекционного ринотрахеита (инфекционного
рогатого скота 1 пустулёзного вульвовагинита) КРС
— // — 2 Маммилита КРС (вирус Аллертон, ложной кожной
— // — 3 бугорчатки) Энцефалита КРС
Герпеса антилоп 1 Злокачественной катаральной лихорадки КРС
Герпеса свиней 1 Вирус псевдобешенства (болезни Ауески)
2 Цитомегаловирусной инфекции свиней
Герпеса лошадей 1 Аборты, респираторная патология
-— // — 2 Медленнорастущий цитомегалоподобный вирус
— // — 3 Герпесвирусная инфекция
— // — 4 Ринопневмонии лошадей
Герпеса козьих 1 Пневмоэнтериты, конъюнктивиты
Герпеса куриных 1 Инфекционного ларинготрахеита кур
— // — 2 Болезни Марека
Герпеса утиных 1 Чумы уток
Герпеса индеек 1 Герпеса индеек
Герпеса собак 1 Геморрагической болезни щенков
Герпеса кошек 1 Вирусного ринотрахеита кошек
инфекцию первоначально в сенсорных ганглиях. Подсемейство бетагерпесвиру-
сы представлено цитомегаловирусами многих видов млекопитающих. Прото-
типным вирусом является герпесвирус человека 5 — цитомегаловирус человека.
Вирусы этого подсемейства размножаются медленно (цикл репликации более
28 ч) и вызывают лизис клеток спустя несколько дней. Они могут оставаться ла-
тентными в секреторных железах, лимфоретикулярных тканях, почках и других
органах. Подсемейство гаммагерпесвирусы представляет лимфотропные виру-
сы. Прототипом является герпесвирус человека 4 — вирус Эпштейн-Барр. Гамма-
герпесвирусы обладают узким хозяинным спектром и находятся латентно в лим-
фоцитах (лимфома Беркитта и др.), некоторые представители вызывают инфек-
цию с разрушением клеток эпителия и фибробластоидных клеток.
Вирионы герпесвирусов имеют диаметр около 120—150 нм и состоят из 4
структурных компонентов: сердцевины (ядра), содержащей линейную двуцепо-
чечную ДНК размером 125-235 тпн, икосаэдрического нуклеокапсида диамет-
ром 100-110 нм, содержащего 162 капсомера; аморфного материала (тегумент),
окружающего капсид и оболочки с небольшими гликопротеиновыми выступами
(пепломерами) на поверхности.
ДНК-геном закручен вокруг волокнистого ядра, имеющего вид катушки, ко-
торая прикреплена волокнами к внутренней поверхности окружающего капси-
да. Вирусный геном в соответствующих экспериментальных условиях обладает
инфекционностью [1135].
Сердцевина вириона окружена икосаэдрическим капсидом, содержащим
162 частично полых капсомера (12 пентамеров и 150 гексамеров). Капсомеры
высотой 12,5 нм и диаметром 9,5 нм имеют внутренний осевой канал диаметром
4 нм, простирающийся внутрь на половину длинной оси капсомера.
Слой, лежащий между оболочкой вириона и нуклеокапсидом (тегумент), со-
держит глобулярный материал, часто распределяемый ассиметрично, и выражен
неодинаково у разных герпесвирусов. У вируса герпеса простого он развит сла-
бо, тогда как у вирусов болезни Марека (БМ) и чумы уток (ЧУ) он развит отчет-
ливо и его наличие обусловливает крупный размер вирионов. На поверхности
герпесвирусов находится двухслойная оболочка с многочисленными небольши-
ми гликопротеиновыми пепломерами, образованными главным образом за счет
«бляшек» измененной ядерной мембраны инфицированной клетки.
Количество гликопротеинов в оболочке герпесвирусов варьирует. В оболоч-
ке вируса простого герпеса их не менее 11. Число копий индивидуальных глико-
протеинов может превышать 1000 на вирион. Содержание полипептидов в вири-
оне точно не известно и различается у разных герпесвирусов. В общем, оно ко-
леблется в пределах 35—45 полипептидов.
Все герпесвирусы кодируют широкий набор ферментов, связанных с метабо-
лизмом нуклеиновых кислот, синтезом ДНК и процессингом белков. Синтез ви-
русных ДНК и сборка вирионов происходят в ядре клетки. Капсиды покрывают-
ся оболочкой, проходя через мембрану ядра. Образование инфекционного ви-
русного потомства сопровождается деструкцией зараженных клеток. Вероятно,
что некоторые кодируемые вирусом белки играют заметную роль в патогенезе и
иммунитете при герпесвирусной инфекции, не являясь необходимыми для реп-
ликации вируса в культуре клеток. Считают, что геномы герпесвирусов в латент-
ном состоянии в клетках хозяина существуют в циркулярной эписомальной
(экстрахромосомальной) форме.
Репликация герпесвирусов наиболее детально изучена на примере герпесви-
руса 1 человека (вирус простого герпеса 1). После прикрепления вириона путем
связывания пепломерных гликопротеинов оболочки с рецепторами клетки, од-
ним из которых является гепаринсульфатпротеогликан, нуклеокапсид входит в
цитоплазму путем слияния оболочки вириона с мембраной клетки путем эндо-
фагоцитоза. Затем ДНК-белковый комплекс освобождается от нуклеокапсида и
быстро останавливает синтез макромолекул клетки.
Геном ВПГ-1 (153 тпн) содержит три области инициации-репликации. Он
практически кодирует все гены, необходимые для репликации, кроме ДНК-ли-
газы и топоизомеразы. На первом этапе репликации функционирует ДНК-поли-
мераза а, а затем функционирует вирусная ДНК-полимераза [933].
Три класса мРНК — а, В и у-транскрибируются последовательно клеточной
РНК полимеразой II. Таким образом а (ранние) РНК в последующем функцио-
нируют как мРНК и транслируются в а-белки, которые вызывают транскрип-
цию В (ранних) мРНК, трансляция которых приводит к синтезу р (ранних) бел-
ков и подавляет дальнейшую транскрипцию а мРНК. Затем начинается репли-
кация вирусной ДН К с использованием тех же самых аир протеинов, так же как
протеинов клетки. Транскрипционная программа затем возобновляется, и в ре-
зультате появляются у (поздние) мРНК, которые транслируются в у протеины.
Более 70 белков, кодируемых вирусом, образуются в цикле его репродукции,
многие из а и р белков являются ферментами и белками, связанными с вирусной
ДНК, тогда как у белки являются структурными вирионными компонентами.
Сложный контроль регуляции экспрессии осуществляется на уровне транскрип-
ции и трансляции. Вирусная ДНК реплицируется в ядре, и вновь синтезирован-
ная ДНК упаковывается в преформированные незрелые капсиды. Созревание
вирионов связано с вхождением ДНК в нуклеокапсиды и связыванием нуклео-
капсидов с измененным внутренним слоем оболочки ядра и последующим обво-
лакиванием вирионов при почковании. Зрелые вирионы накапливаются внутри
вакуолей в цитоплазме и освобождаются экзоцитозом или при цитолизе. Вирус -
специфические белки обнаружены также в цитоплазматической мембране, где
они участвуют в клеточном слиянии и могут в качестве Fc-рецепторов выступать
мишенями в иммунном цитолизе. Герпесвирусная инфекция сопровождается
образованием внутриядерных телец включений, которые обычно обнаруживают
в фиксированных окрашенных препаратах [1323].
Геном вируса кодирует синтез по меньшей мере четырех гликопротеинов (gB,
gC, gD, gE). Имеет место посттрансляционное расщепление или другие модифи-
кации вирусных белков. Белок gB обладает фузогенной активностью и ответст-
венен за проникновение вируса в клетку; gD — основной протективный антиген.
Белки gC и gE не играют существенной роли в репродукции вируса, но помога-
ют ему ускользнуть от иммунной системы организма. В отсутствие репликации
вирус редко вызывает сплавление клеток, а при наличии специфических усло-
вий — агглютинацию эритроцитов. Оболочка вириона играет существенную
роль в антигенности и инфекционности вируса. Гликопротеины вирусной обо-
лочки ответственны за прикрепление вирусной частицы к клетке, проникнове-
ние вируса в клетку, за индукцию нейтрализующих антител и образование имму-
нитета. Нейтрализующие антитела реагируют с главными вирусными гликопро-
теинами, находящимися в оболочке вириона [1024]. Мембранные антигены,
индуцированные в зараженных клетках, содержат по крайней мере три глико-
протеина, обнаруженных в структуре вириона [963]. Эти данные послужили ос-
нованием для приготовления вакцин из вирусспецифических компонентов. Од-
нократное введение вакцины из субъединиц приводило к активизации гумо-
ральных и клеточных факторов иммунитета у мышей и кроликов, повышало их
резистентность к экспериментальному заражению и снижало количество клеток
ганглия тройничного нерва, несущих геном вируса [444].
Основным протективным антигеном вируса простого герпеса типа I и II
(ВПГ-1, ВПГ-2) является гликопротеин Д (gD), и в меньшей степени — глико-
протеин В (gB) [1094].
Очищенный gD ВПГ-1 или ВПГ-2 защищает мышей от летальной дозы как
ВПГ-1 , так и ВПГ-2; стимулирует образование ВН-антител, пассивное введение
которых защищает мышей от летальной инфекции ВПГ; стимулирует компле-
ментзависимую и опосредованную антителами цитотоксичность [135]. Комби-
нация обоих гликопротеинов (gD и gB) усиливает протективную активность пре-
парата [1094]. В четырех антигенных участках gD ВПГ-1 различают по крайней
мере шесть эпитопов. Антитела к большинству из них нейтрализуют вирус без
участия комплемента и подавляют проникновение вируса в клетку [777]. Нейт-
рализация вируса и индукция протективного иммунитета приводили к активиза-
ции гуморальных и клеточных факторов иммунитета у мышей и кроликов, по-
вышали их резистентность к экспериментальному заражению и снижали коли-
чество клеток ганглия тройничного нерва, несущих геном вируса [444].
Нейтрализация вируса и индукция протективного иммунитета связаны с амино-
кислотными остатками 233-259, а адсорбция вируса - с областью в пределах пер-
вых 182 аминокислот [512]. Точечные мутации в сайте нейтрализации gD могут
сделать его нечувствительным к действию ВН-антител [1118]. Слияние вирусной
и клеточной оболочек ВПГ-1 определяет gB [494]. За аналогичные функции ви-
руса Эпштейн-Барра ответственны два гликопротеина (220/200 и 350/300 кД),
расположенные на поверхности вириона. Эти белки вызывали у кроликов обра-
зование антител, реагирующих с одними и теми же белками на поверхности
вирионов и инфицированных вирусом клеток. Вакцина, содержащая гликопро-
теин 340 кД, вызывала иммунитет у обезьян [145]. В нейтрализации цитомегало-
вируса и выработке нейтрализующих антител основная роль принадлежит гли-
копротеинам 86 и 130/55 кД [1293].
В оболочке вируса псевдобешенства (ВПБ) различают три основных глико-
протеина (gE, gB, gX), кодируемых u-сегментом вирусного генома. При иммун-
ном ответе свиней на инфекцию защитные антитела формируются к двум гли-
копротеинам: gE и gB. Гликопротеин gE состоит из двух субъединиц с массой
около 80 кД. Он не является существенным для репликации, поскольку извест-
ны вакцинные штаммы с делениями в этой области генома. N-концевой фраг-
мент gE содержит высокоантигенный домен, способный вызвать образование
НВ-антител и защитный эффект [686]. Деления по гену gE может привести к
снижению иммунногенности, чего не наблюдается при удалении гена gX. Пред-
шественники gll и gill имеют соответственно молекулярную массу 110 и 60 кД.
За слияние вирусной и клеточной оболочек и проникновение вируса в клетку от-
ветственен gB [1311]. Антигенного дрейфа в gB и gE не обнаружено [320].
Однако основную роль в индукции синтеза нейтрализующих антител ВПБ,
проявляющих активность в отсутствие комплемента, играет gB [320]. Являясь
мультифункциональным белком, он, кроме того, играет важную роль в адсорб-
ции и эффективной репликации вируса в культуре клеток [1387]. Антитела к gl 11
обладали более выраженным защитным эффектом у мышей (90-100%) и свиней
(84-100%), чем к gll [1006]. Гликопротеин gill играет определяющую роль в кле-
точном иммунитете, поскольку является главным антигеном-мишенью для ви-
русспецифических цитотоксических Т-лимфоцитов |2028]. Кроме gill, заметная
роль в защите вакцинированных животных принадлежит g50 кД, который также
является основной мишенью ВН-антител [633]. Следует отметить, что пассивная
защита поросят не предотвращала репликацию и экскрецию ВПБ в назофарен-
гиальной области зараженных животных [1006]. Титр нейтрализующих антител
in vitro не всегда коррелировал с защитой животных.
Так как все полевые штаммы ВПБ содержат gE, а большинство аттенуиро-
ванных штаммов, используемых в качестве живых вакцин, не содержат gE, по-
явилась возможность использовать ИФА для дифференциации иммунных и ин-
фицированных животных и тем самым способствовать оздоровлению хозяйств
на основе вакцинопрофилактики. Указанная стратегия успешно реализуется в
практических условиях в Западной Европе.
За индукцию синтеза ВН-антител герпесвируса типа I крупного рогатого
скота (ГВ I) ответственны четыре гликопротеина оболочки. Главными из них яв-
ляются g70 и g97. Эти гликопротеины содержат основные эпитопы нейтрализа-
ции вируса [1500]. Гемагглютинирующая активность ГВ крупного рогатого скота
связана с мажорным g97, расположенным в шипиках вириона. Главные нейтра-
лизующие эпитопы расположены на гемагглютинирующем домене, что свиде-
тельствует о перспективности использования гемагглютинирующего антигена
ГВ 1 крупного рогатого скота для приготовления субъединичной вакцины [1397,
1538]. ГВ1 крупного рогатого скота так же, как герпесвирус типа I кошек (ГВК1),
агглютинирует эритроциты мышей, хотя гемагглютинирующие домены этих ви-
русов не идентичны [1538].
В структуре gIV ГВ1 крупного рогатого скота идентифицированы три нейт-
рализующих домена. Домен I содержит два перекрывающихся эпитопа, домен
III — четыре идентичных или перекрывающихся эпитопа, домен 11 — один эпи-
топ. Домен I имеет отношение к проникновению вируса в клетки-мишени [818].
Прикрепление вируса к клеткам in vitro опосредовано его главными гликопроте-
инами, которые в этом отношении можно расположить в ряду gill > gl > gIV.
Очищенный gill полностью блокирует адсорбцию полевого штамма ГВ1 круп-
ного рогатого скота [951].
В становление гуморального и клеточного иммунитетов свой вклад вносят
гликопротеины оболочки gl, gill и особенно gIV. Максимальную защиту телят в
экспериментальных условиях обеспечивал gIV, а также безвирусный лизат инфи-
цированных клеток [1571].
Нейтрализующие антитела к трем оболочечным гликопротеинам (gl, gill и
gIV) FBI крупного рогатого скота вводили телятам и определяли защитный эф-
фект при экспериментальном заражении гомологичным вирусом. У привитых
животных титры антител в носовом секрете и смывах с конъюнктивы были ана-
логичны таковым у реконвалесцентов. Несмотря на клинический эффект от вве-
дения антител, они не предотвращали размножение ГВ1 крупного рогатого ско-
та в слизистой оболочке носа и глаз, а также не сокращали его экскрецию [1012].
Цитотоксические Т-лимфоциты крупного рогатого скота, индуцированные ГВ1
крупного рогатого скота, проявляют специфичность, то есть реагируют только
на клетки, экспрессирующие гомологичный или родственный антиген [1438].
Мутант ГВ1 крупного рогатого скота с делецией гена gill не теряет способности
размножаться в культуре клеток. Его функциональная дефектность проявляется
в замедленной адсорбции и репликации, а также в снижении выхода внеклеточ-
ного вируса [951]. По аналогии с вирусом псевдобешенства идентифицированы
и делегированы несущественные гены с целью получения аттенуированных
«маркированных» вакцин.
В структуре вируса болезни Марека (ВБМ) различают два основных антиге-
на, условно обозначенные А и В. Антиген А представляет собой гликопротеин
57 кД, кодируемый средней частью U1-сегмента вирусного генома. В-антиген
ВБМ, так же как аналогичный антиген вируса герпеса индеек (ВГИ), представ-
лен набором из трех гликопротеинов с молекулярной массой 100, 60 и 49 кД.
Экспрессируясь на мембране инфицированных клеток, они являются мишеня-
ми для вирусспецифических Т-лимфоцитов [833]. Гликопротеины (100-120 кД),
выделенные из мембран инфицированных ГВИ, защищали цыплят от зараже-
ния ВБМ. Гомология нуклеотидных последовательностей генов гликопротеина
g57-65 ВГИ и ВБМ составляет 73%. Гликопротеины вируса инфекционного ла-
ринготрахеита кур (ИЛТ) имеют молекулярную массу 295, 160, 115, 90, 60 и 52
кД. Вероятно, они вносят свой вклад в развитие гуморальных и клеточных фак-
торов иммунитета [1708]. На основе перекрестной реакции нейтрализации все
герпесвирусы птиц можно разделить на 11 серотипов [869]. В оболочке вируса
злокачественной катаральной лихорадки насчитывают несколько гликопротеи-
нов (115, НО, 105, 78, 48 кД) и один негликозилированный полипептид. Глико-
протеины 78 и 48 кД являются продуктами расщепления gl 15 и представлены в
оболочке вириона в виде гетеродимера, объединенного дисульфидными связями
[220]. Три гликопротеина ГВК1 и герпесвируса собак индуцируют образование
гомо- и гетерологичных ВН-антител. Наибольшей антигенностью обладал гли-
копротеин g 145/112, содержащий нейтрализующий домен из трех перекрываю-
щихся эпитопов [963]. Многие герпесвирусы обладают рядом общих антигенных
детерминант, вследствие чего заражение одним из них приводит к появлению
антител и Т-лимфоцитов, реагирующих с вирусами гетерологичного типа [156].
Значительное иммунологическое сходство имеется между ВПГ-1 и ВПГ-2, gD
которых имеют 85% гомологии по аминокислотным последовательностям [135].
Большинство из гликопротеинов вируса ветряной оспы имеют свои гомологии в
соответствующих гликопротеинах ВПГ [740]. Ген, кодирующий gll ВПБ, имеет
50%-ную гомологию с геном, кодирующим gB ВПГ [1311]. ВПГ-1 и ВПГ-2 обна-
ружили антигенное родство с вирусами болезни Марека, псевдобешенства и ри-
нопневмонии лошадей. Главными перекрестнореагирующими белками герпес-
вирусов кошек и собак оказались соответственно gl43/l08, g60 и g 145/112, g41
[1337].
Выявлена значительная гомология гликозилированных gC-подобных белков
у различных представителей а-герпесвирусов [265, 545]. Установлено, что один
из участков g57-65 ГВИ и ВБМ протяженностью в 60 аминокислотных остатков
(соответственно 378-437 и 350-410) присутствует в gC-подобных белках шести
герпесвирусов [545]. Результаты этих наблюдений дают возможность предпола-
гать наличие общего предка у а-герпесвирусов и возможность пересечения видо-
вых барьеров герпесвирусами. В различной степени выраженные одно- и двусто-
ронние антигенные связи обнаружены у многих герпесвирусов животных. Осо-
бенно тесное родство у ГВИ и ВБМ, а также между герпесвирусом типа I антилоп
и неклассифицированным вирусом герпеса крупного рогатого скота [1335].
Заражение герпесвирусами ведет к развитию как гуморального, так и клеточ-
ного иммунитета, сохраняемого на протяжении многих лет [156]. Одной из ха-
рактерных особенностей герпесвирусной инфекции является относительный ха-
рактер иммунитета. Иммунизация, как правило, предотвращает клиническое
проявление и обострение инфекции, но не предупреждает инфицирования и не
устраняет персистенции вируса.
Герпесвирусы вызывают многие тяжелые заболевания человека и причиняют
существенный экономический ущерб продуктивному животноводству. Среди
этого семейства имеются широко распространенные вирусы, поражающие один
или несколько видов сельскохозяйственных животных. Каждый вид животных
поражается несколькими видами герпесвирусов. Например, среди герпесвиру-
сов крупного рогатого скота некоторые исследователи различают пять основных
биотипов: 1 — вирус инфекционного ринотрахеита (вульвовагинита); 2 — герпе-
тического маммилита; 3 — злокачественной катаральной лихорадки; 4 — канди-
даты в цитомегаловирусы (группа Movar); 5 - синцитийобразующий вирус
(штамм «Пенсильвания 47»); герпесвирус коз, антигенно сходный или идентич-
ный вирусу инфекционного ринотрахеита, относят к шестому типу [639, 1186].
Уникальными антигенными свойствами обладают биотипы 1 и 2. Остальные
имеют серологическое родство между собой [1186].
Инфекционный ринотрахеит крупного рогатого скота (ИРТ)
ИРТ поражает преимущественно молодняк в крупных хозяйствах и характе-
ризуется в основном острым воспалением верхних дыхательных путей и наруж-
ных половых органов. ИРТ проявляется в субклинической, легко и тяжело про-
текающих формах. Заболеваемость может достигать 100%, а смертность — 10%,
особенно в период комплектования стад [47, 124]. Заболевание может распрост-
раняться при искусственном осеменении инфицированной спермой [46, 1700].
Иногда наблюдают поражение (обычно у телят) центральной нервной системы.
Штаммы, выделенные от телят и обладающие нейропатогенными свойствами,
вероятно, представляют собой антигенный вариант вируса. Заболевание может
протекать в виде ринотрахеита или пустулёзного вульвовагинита. Две формы те-
чения заболевания вызываются разными подтипами (1 и 2) одного вируса и, по-
видимому, связаны с различиями их органного тропизма. Может быть, поэтому
обе эти формы не встречаются одновременно в одном и том же хозяйстве [195].
Подтипы 1 и 2 герпесвируса крупного рогатого скота типа 1, вызывающие соот-
ветственно поражения респираторного тракта (инфекционный ринотрахеит) и
гениталий (инфекционный вульвовагинит), не различаются по биологическим и
серологическим свойствам, но их можно различить методом рестрикционного
анализа генома. Циркуляция среди овец и коз вируса, близкородственного ГВ
крупного рогатого скота типа 1, свидетельствует о том, что овцы и козы, вероят-
но, могут быть естественными хозяевами этого вируса. Во время температурных
пиков животные быстро худеют, у лактирующих — резко снижается удой, у стель-
ных коров часто наблюдают аборты. Вторичные инфекции усугубляют течение
болезни. После острого периода болезни вирус длительное время сохраняется в
организме без каких-либо клинических признаков.
Вирус обычно персистирует в региональных ганглиях в виде ДНК-копий.
Факторами, способствующими переходу латентной инфекции в острую, могут
быть стрессы различной природы, отелы, а в некоторых случаях неправильно
проведенная вакцинация животных живой вакциной. Транспортировка живот-
ных после вакцинации может приводить к реактивации вакцинального вируса,
по-видимому, вследствие повышения концентрации кортикостероидов в крови.
Серонегативность при ИРТ не обязательно свидетельствует об отсутствии виру-
соносительства.
В состоянии латенции подавляется генетическая экспрессия вируса. Разви-
тие латенции и реактивация возбудителя регулируются иммунными и неиммун-
ными механизмами. Активизация инфекции под действием дексаметазона про-
исходит путем подавления иммунного механизма и прямого воздействия на ла-
тентноинфицированные клетки.
Препарат способен реактивировать как «дикий», так и вакцинный штаммы.
Реактивированные штаммы не отличаются от исходных. Реактивацию вируса
ИРТ в эксперименте наблюдали спустя более 600 дней после инфицирования
крупного рогатого скота [195, 215].
Переболевание сопровождается стойким и длительным иммунитетом, кото-
рый может передаваться потомству с антителами молозива. Однако даже выра-
женный гуморальный иммунитет не предотвращает персистенции вируса. В слу-
чае реинфекции вновь происходит размножение и выделение вируса, хотя бо-
лезнь протекает без видимых клинических признаков. При возникновении
повторного заболевания трудно бывает отличить реинфекцию от реактивации
персистирующего вируса. Всех животных, имеющих антитела к ГВ типа 1 круп-
ного рогатого скота, следует считать носителями вируса, находящегося в состоя-
нии латенции.
Слизистые оболочки респираторного и генитального трактов больных живот-
ных продуцируют IgA и интерферон [986]. Антитела в сочетании с комплементом
ограничивают, но не исключают распространение герпесвируса в организме. Вза-
имодействие антител с клетками иммунной системы является более эффектив-
ным механизмом ограничения инфекции. Наиболее важными эффекторными
клетками в антителозависимой цитотоксичности являются полиморфноядерные
нейтрофилы, которые при наличии комплемента проявляют активность в отсут-
ствие специфических антител. В подавлении инфекции клеточный иммунитет
при ИРТ более эффективный, чем гуморальный, и в основном связан с Т-лимфо-
цитами и макрофагами, хотя и те и другие могут поражаться вирусом.
В качестве средств специфической профилактики ИРТ в различных странах
применяют живые и инактивированные вакцины. Однако в большинстве стран
применяют в основном живые вакцины из аттенуированных штаммов вируса
[47, 93]. Созданы живые маркированные вакцины на основе рекомбинантной
ДНК, из которой удалены ген тимидинкиназы и другие гликопротеиновые «мар-
керные» гены. Вакцинация против ИРТ не предотвращает инфицирования, но
зато снижает частоту возникновения (проявления) и тяжесть заболевания. Поле-
вой вирус в организме таких животных размножается менее активно, и продол-
жительность его выделения короче [215].
Традиционные живые вакцины при ИРТ отличаются большим разнообрази-
ем. Например, в США применяют несколько живых вакцин. Большинство из
них — штаммы вируса, аттенуированные длительным пассированием в первич-
ных культурах или постоянных линиях клеток. При вакцинации живыми вакци-
нами необходимо использовать такие вакцинные штаммы, которые неспособны
к персистенции, ибо не исключается возможность возникновения рекомбинант-
ных вариантов при взаимодействии аттенуированного и вирулентного штаммов
вируса. Имеются вакцины, полученные другим способом. Бельгийская вакцина
представляет собой ts-мутант, который при 30°С размножается лучше, чем при
37°С, даже после реизоляции. Иными словами, вакцинный штамм обладает
«маркером», отличающим его от полевого вируса. Подобный термочувствитель-
ный мутант получен в Японии. Он сохранял свойства аттенуированного штамма
после пяти пассажей на крупном рогатом скоте [195, 215].
В качестве живой вакцины предложен дефектный по тимидинкиназе (ТК-)
мутант. Интраназальное и внутримышечное введение вакцины телятам не вызы-
вало развития у них признаков болезни, но способствовало образованию нейтра-
лизующих антител и устойчивости к последующему интраназальному заражению
вирулентным штаммом вируса, снижало его репродукцию в слизистой носа. Вак-
цинный (ТК-) штамм способен персистировать в организме привитых телят не
менее 3 мес. и передаваться телятам при контакте без перехода в ТК.+ генотип.
Персистенция и экскреция аттенуированного штамма вируса обнаружена
также при применении других живых вакцин. Особенно часто и длительно вак-
цинный штамм вируса выделяется с семенной жидкостью привитых быков. Вве-
дение живой вакцины во время астрального периода может сопровождаться по-
ражением яичников [995], а вакцинация в ранний период стельности — к преры-
ванию беременности [1072].
Считается, что интраназальная вакцинация более эффективна, чем подкож-
ная или внутримышечная. Повторное введение вакцины усиливает иммунитет.
Имеется ряд сообщений об успешном применении комбинированных вакцин
против 2—4 возбудителей. В состав таких вакцин, кроме аттенуированного
штамма вируса ИРТ, чаще всего входят аттенуированные штаммы вирусов пара-
гриппа-3 и вирусной диареи крупного рогатого скота. Имеются данные, свиде-
тельствующие об активизации носительства и выделении вируса ИРТ (вакцин-
ного и полевого штаммов) у телят после заражения вирусом парагриппа-3 [195].
При интраназальном введении вакцинный вирус быстро проникает в клетки
верхних дыхательных путей и глоточного кольца. Размножаясь в указанных
клетках, вирус может выделяться во внешнюю среду в течение двух недель. По-
сле парентерального введения вакцинный вирус из секретов выделяется не все-
гда и с трудом.
Преимущество интраназальной вакцинации состоит в том, что при этом уси-
ливается синтез IgA и локальное образование интерферона. Считается, что сухая
вакцина для парентерального или интраназального применения должна содер-
жать соответственно 105 и 104 ТЦД50/мл. Наряду с живыми вакцинами применя-
ют инактивированные, обладающие рядом преимуществ, хотя их изготовление
связано с дополнительными затратами. Инактивированные вакцины так же, как
и живые, применяют двукратно с 2—3-недельным интервалом. Они могут суще-
ствовать в виде моно- и комбинированных препаратов. Эффективность инакти-
вированных вакцин против ИРТ зависит от ряда факторов, и прежде всего от
концентрации протективных адъювантов.
Различные способы инактивации вируса оказывали неодинаковое влияние
на антигенные детерминанты — мишени вируснейтрализующих антител. По сте-
пени разрушения антигенных детерминант инактиваторы располагались следу-
ющим образом: ультрафиолетовое облучение, нагревание (56°С), |3-пропиолак-
тон и формальдегид. Согласно этим данным последнему должно отдаваться
предпочтение при изготовлении инактивированной вакцины [946], С целью по-
вышения иммуногенности вакцины вирусные антигены концентрировали поли-
этиленгликолем.
Инактивированная формолвакцина с масляным адъювантом из вируса ИРТ
с исходным титром 108 ТЦД50/мл после двукратного введения в дозе 2 мл с 4-не-
дельным интервалом индуцировала у телят выраженный иммунитет независимо
от предшествующего иммунного фона. У телят, перенесших спонтанную инфек-
цию с низким титром сывороточных и отсутствием секреторных антител, после
вакцинации формировались гуморальные (1:128 - 1:256) и секреторные
(1:2—1:8) антитела. Наблюдалась корреляция между уровнем сывороточных ан-
тител и устойчивостью телят к заражению. Иммуносупрессия дексаметазоном
показала, что вакцинация серонегативных телят не предупреждала от инфици-
рования и последующей латенции вируса.
В неблагополучном по ИРТ хозяйстве применяли вакцину с масляным адъ-
ювантом и ГОА. Сероконверсия наблюдалась уже после первого введения вак-
цины. Титр колостральных антител в сыворотке крови 6—8-дневных телят от
привитых матерей был высоким. В стадах, где клиническая картина ИРТ была
стертой, в сыворотке крови телят от привитых матерей титр антител составил
1:76 (у контрольных животных 1:13). Колостральный иммунитет длился 4—5 мес.
Вакцинация телят вызывала сероконверсию лишь тогда, когда уровень материн-
ских антител у них был очень низким [361].
Инактивированные вакцины против ИРТ [76] и против ИРТ и ПГ-3 [89] ока-
зались эффективными при испытании в производственных условиях. Вакци-
нальный иммунитет у телят развивался, несмотря на высокий уровень колост-
ральных антител [89]. Иммуногенность субъединичной и инактивированной
вакцин с масляным адъювантом оказалась сходной. Титр гуморальных антител у
крупного рогатого скота после однократного и двукратного применения субъе-
диничной вакцины был выше, чем при вакцинации инактивированной вакци-
ной. Секреторные антитела формировались лишь после двукратной вакцинации
и были равнозначными у животных, привитых обоими препаратами. Через 14
дней после второй прививки телята были устойчивы к интраназальному зараже-
нию вирулентным штаммом вируса ИРТ. Интенсивность размножения и про-
должительность экскреции вирулентного штамма у животных, вакцинирован-
ных обеими вакцинами, были сходными. Иммунизированные телята выделяли
меньше вируса и менее продолжительное время, чем непривитые.
Считают, что двукратное введение инактивированной вакцины сообщает
привитым животным иммунитет продолжительностью 2 года [195]. Имеется хо-
роший опыт сочетанного применения живой и инактивированной вакцины
ИРТ и ФРГ. Живую вакцину вводили двукратно с интервалом в 6 недель сразу
после установления диагноза. Спустя 7 мес. двукратно с тем же интервалом вво-
дили инактивированную вакцину. В результате такой вакцинопрофилактики но-
вые случаи заболевания не регистрировали. Спустя четыре года после прекраще-
ния вакцинации животные оказались серонегативными, за исключением неко-
торых телят, имевших материнские антитела перед вакцинацией. Авторы оцени-
вают предложенную схему применения живой и инактивированной вакцины
как эффективную для оздоровления поголовья [370]. Комбинированная инакти-
вированная вакцина, включающая высокоактивные антигены вирусов ИРТ, ви-
русной диареи и парагриппа-3, оказалась эффективным средством профилакти-
ки массовых патологических состояний, в том числе связанных с транспорти-
ровкой скота.
Испытание иммуногенности маркированной делеционной (gE“) вакцины
против ГВ-1 КРС на телятах показало, что внутримышечная или назальная им-
мунизация полностью не защищают от латентного инфицирования вирулент-
ным штаммом гомологичности вируса [1001, 1393]. Инактивированная маркиро-
ванная вакцина против ИРТ из негативного по гликопротеину Е штамма позво-
ляла дифференцировать вакцинированных и инфицированных животных.
Иммуногенность вакцины зависела от концентрации вирусного антигена [1403].
Поскольку вирус ИРТ может приживляться и длительно персистировать в
организме вакцинированных животных, трудно однозначно ответить на вопрос
о значении специфической профилактики в оздоровлении хозяйств от ИРТ, или
точнее: можно ли путем систематического применения вакцин освободить хо-
зяйство от носительства полевых штаммов вируса. Однако имеется сообщение о
том, что полного оздоровления можно достичь в результате систематического
(четырехлетнего) применения в хозяйстве инактивированной эмульгированной
вакцины.
Таким образом, существующие средства вакцинопрофилактики защищают
крупный рогатый скот от инфекционного ринотрахеита, но не от заражения по-
левым вирусом, установления его латенции и последующей реактивации, реэкс-
креции. Однако живые вакцины при интраназально-внутримышечном приме-
нении обусловливают хороший локальный иммунитет и защиту животных от
клинического проявления инфекции. Инактивированные высокоантигенные
вакцины после повторного введения также индуцируют локальный иммунитет и
предотвращают распространение вируса. Перспективным является разработка
высокоэффективных рекомбинантных субъединичных вакцин, основанных
главным образом на иммуногенности одного из главных гликопротеинов обо-
лочки вириона, особенно гликопротеина Д. Этот гликопротеин может быть экс-
прессирован в бакуловирусной системе или включен в геном векторного вируса
и использован в качестве живой вакцины.
Многие европейские страны для искоренения болезни используют интегри-
рованную программу, включающую иммунизацию маркированными вакцина-
ми, выявление и убой всех животных, имеющих антитела на полевой вирус.
Злокачественная катаральная горячка крупного рогатого скота
Злокачественная катаральная горячка крупного рогатого скота характеризу-
ется лихорадкой, пролиферацией лимфоидных клеток, депрессией, воспалени-
ем роговицы глаза, эрозиями и дифтеритом слизистой оболочки рта и пораже-
нием центральной нервной системы. Болезнь вызывается герпесвирусом-3
крупного рогатого скота, регистрируется в Австралии, на Британских островах,
в Канаде, США, Африке. В США летальнопротекающую болезнь регистрируют
среди крупного рогатого скота, бизонов и некоторых других диких жвачных. От-
мечено, что прямой контакт между больными и чувствительными животными не
ведет к распространению болезни. Заболеваемость обычно низкая — в стаде за-
болевают некоторые животные. Летальность высокая - погибает 95—100% забо-
левших животных. Способ передачи вируса неизвестен. Резервуар вируса в есте-
ственных условиях — очевидно, инаппарантно инфицированные животные. В
Африке носителями вируса являются антилопы (гну). Из домашних животных
носительство вируса установлено у овец, и часто болезнь возникает у крупного
рогатого скота после сезона окота овец. Установлено распространение вируса у
взрослых овец [957]. Носительство вируса у крупного рогатого скота может
длиться 80 мес. [370].
В Африке латентная инфекция зарегистрирована у голубого гну, коровьешан-
тилопы, топи и других видов, являющихся резервуаром вируса. Во всех странах
установлено, что резервуаром инфекции являются дикие и домашние овцы, а
также козы. Оказалось, что у молодых диких парнокопытных животных вирус на-
ходится в носовом и глазном секретах во внеклеточном состоянии и способен ин-
фицировать крупный рогатый скот. Вирус крупному рогатому скоту передается
аэрогенным путем, с кормом, питьевой водой. Перезаражение крупного рогатого
скота между собой происходит редко, поскольку больные животные выделяют
вирус, как правило, клеточносвязанный. Вирус хорошо размножается в первич-
ных культурах клеток почки, селезенки, легких, тимуса и надпочечников эмбри-
она коровы и овцы, в клетках Vero, вызывая образование синцития и округление
клеток. Снижение температуры культивирования до 32—34°С сопровождалось
повышением накопления инфекционного вируса. К экспериментальному зара-
жению чувствительны морские свинки, хомяки и кролики. При интраперитоне-
альном и интравенозном заражении у кроликов развивается летальная инфекция.
Перенос заболевания удавался при использовании цельных инфицированных
клеток. Мишенью для вируса, по-видимому, являются большие лимфоциты.
У немногих переболевших животных обнаруживают ВН-антитела и практи-
чески пожизненный иммунитет. Инактивированный формалином или ацетилэ-
тиленимином вирус с полным адъювантом Фрейнда использовали для вакцина-
ции кроликов. Прививка защищала кроликов от заражения внеклеточным виру-
сом, но оказалась неэффективной в отношении суспензии инфицированных
клеток из лимфоузлов, несмотря на высокий титр ВН-антител. Результаты этих
опытов показали относительное значение гуморальных факторов иммунитета
при злокачественной катаральной горячке [624]. Некоторые авторы считают, что
существует две болезни с идентичными клиническими симптомами, но вызыва-
емыми разными возбудителями. Имеются в виду: африканская злокачественная
катаральная горячка, при которой естественным резервуаром вируса (герпесви-
руса типа 3 крупного рогатого скота) является голубой гну, и просто злокачест-
венная катаральная горячка, встречающаяся на других континентах. Основным
переносчиком неизвестного возбудителя считают овец [ 195 J.
Болезнь Ауески (БА, ложное бешенство)
Болезнь Ауески (БА, ложное бешенство) — остропротекающая болезнь сви-
ней, особенно поросят, и реже других видов сельскохозяйственных животных, а
также пушных зверей. Это распространенное во всем мире заболевание вызыва-
ет герпесвирус свиней типа 1 и характеризуется признаками поражения головно-
го и спинного мозга, сильным зудом и расчесами (кроме свиней). Вирус часто
является первичной причиной возникновения пневмоний у свиней. Естествен-
ный резервуар возбудителя — свиньи, хотя заболеть могут также крупный рога-
тый скот, овцы, собаки, кошки, норки и лисы. В районах с небольшим количе-
ством свиней болезнь может возникать спорадически, а при высокой концент-
рации свиней и наличии контактов она приобретает характер энзоотий. Вирус
БА иммунологически однообразен, однако некоторые штаммы сильно отлича-
ются между собой по вирулентности.
Несмотря на дёлецию трех генов, мутант интенсивно реплицировался в
культуре клеток кожи кроликов при 30—39°С [891]. Мутантный вирус потерял
способность к реверсии, выделяться из организма и реплицироваться в цент-
ральной нервной системе. Его не удалось реактивировать из ганглиев вакцини-
рованных поросят путем эксплантации и сокультивирования с чувствительными
клетками. Эти свойства нового штамма вируса обеспечивают полную безопас-
ность вакцинного препарата. При заражении вакцинированных животных виру-
лентным вирусом значительно снижается колонизация ганглиев вирулентным
штаммом, и он не выделяется из организма. Полевые испытания новой вакцины
показали ее безопасность для свиней всех возрастных групп [891, 1067]. У живот-
ных, привитых вакциной «Омнивак», отсутствуют антитела к gp III, что дает воз-
можность дифференцировать их от инфицированных животных [891]. Живые и
инактивированные вакцины готовят из вируса, выращенного в различных куль-
туральных системах. С этой целью выращивают в однослойных и суспензионных
культурах различного происхождения. Суспензионные культуры постоянных
линий клеток оказались весьма продуктивными для промышленного получения
вирусного сырья. Вирус в этих системах накапливался в титре ТЕЩ при исполь-
зовании культуральных сосудов большой емкости.
Для инактивации вируса применяли формальдегид, глутаровый альдегид, [3-
пропиолактон, этиленимин и другие вещества. Иммуногенность вакцин, инак-
тивированных бетапропиолактоном, формальдегидом и глютаральдегидом, бы-
ла одинаковой. Вакцины с масляными адъювантами оказались более иммуно-
генными по сравнению с сорбированными, независимо от способа инактивации
вируса [1067].
Инактивированные вакцины не вызывали побочных реакций и обеспечива-
ли достаточно высокую защиту поросят. После 1—2-кратного внутримышечного
применения 87—100% поросят оказались защищенными от болезни при зараже-
нии вирулентным штаммом вируса. Во Франции разработана технология про-
мышленного изготовления субъединичной адъювантной вакцины «Гескипур»
против болезни Ауески. В прививочной дозе вакцины (2 мл) содержится 10 мкг
(±10%) вирионных гликопротеинов. Две инъекции вакцины с 3—4-недельным
интервалом обеспечивают полную защиту свиней против болезни Ауески.
Известны случаи оздоровления неблагополучных стад путем применения
вакцины с одновременным удалением из стад серопозитивных животных. У по-
росят с высоким титром материнских антител инактивированная вакцина не
стимулировала продукции нейтрализующих антител, однако ревакцинация та-
ких животных вызвала подъем уровня антител. Инактивированные вакцины им-
муногенны для чувствительных к экспериментальному заражению лаборатор-
ных животных и пушных зверей, особенно после двукратного применения.
Огромный международный опыт специфической профилактики болезни
Ауески свидетельствует, что ее нельзя или очень трудно искоренить с помощью
прививок традиционными вакцинными препаратами. Такие прививки затрудня-
ют, но не предотвращают инфицирование поголовья и распространение вируса
среди свиней [1067]. При этом снижается инфекционный фон и сокращаются
экономические потери. Ликвидация болезни возможна лишь путем сочетания
вакцинации с уничтожением инфицированных свиней. Иммунизация свиней
должна проводиться маркированными вакцинами с одновременным использо-
ванием диагностических тест-систем, различающих вакцинированных и инфи-
цированных свиней. Современные живые маркированные вакцины против БА в
основном готовят из штаммов вируса с делецией гена gpE [gE-вакцины], при
этом используют соответствующие диагностические тест-системы ИФА. На
этой основе во многих странах разработаны и успешно осуществляются нацио-
нальные программы ликвидации БА.
Особенностью БА и других герпесвирусных инфекций является относитель-
ная иммунологическая зашита. Реконвалесценция или вакцинация сопровожда-
ется только клиническим, а не биологическим иммунитетом, то есть при отсут-
ствии клинических признаков болезни может происходить размножение или
выделение вируса. Реактивация вируса из латентного состояния происходит в
иммунном организме под влиянием различных стрессовых ситуаций, таких как
роды, транспортировка, перевод в другие помещения и т.д. В первичной фазе
инфекции (24—48 ч) воротами инфекции и местом размножения вируса являет-
ся эпителий носовых раковин [823], область зева и дыхательные пути, а затем по
нервным путям вирус проникает в центральную нервную систему. Во второй фа-
зе болезни вирус распространяется лейкоцитами через кровеносную и лимфати-
ческую систему по всему организму. Вирус содержится в лимфоузлах верхних
дыхательных путей. Передается инфекция в основном за счет выделения вируса
через дыхательные пути в виде аэрозоля.
Главным резервуаром вируса в хозяйстве являются инфицированные свиньи
(особенно реконвалесценты), которые длительно, если не пожизненно, остаются
латентными носителями вируса, периодически выделяя его во внешнюю среду.
Выраженный колостральный иммунитет продолжается, как правило, не ме-
нее трех недель после рождения [828]. Материнские антитела препятствуют при-
живлению вакцинного вируса и снижают эффективность живой вакцины у по-
росят. Интерференцию между материнскими антителами и вакцинным вирусом
в значительной мере можно преодолеть интраназальным введением живой вак-
цины.
Не установлено корреляции между уровнем антител и устойчивостью вакци-
нированных животных к заражению. Уровень иммунитета зависел от цитотокси-
ческих лимфоцитов [1015].
Для приготовления живых вакцин используют аттенуированные штаммы
вируса различного происхождения. Их получали серийным пассированием в
первичных и перевиваемых культурах при различных температурах (37°С и 28°С)
или в присутствии мутагенов. Полученные аттенуированные штаммы различа-
ются между собой многими признаками, и в том числе патогенностью для лабо-
раторных животных. Все используемые вакцинные штаммы авирулентны для
свиней различного возраста [890], крупного рогатого скота и овец. Мутантный
штамм М-25 не патогенен, кроме того, для кроликов и мышей. Аттенуация ви-
руса может быть связана с делецией одного из генов, кодирующих один из вто-
ростепенных генов для репликации и иммуногенности вируса [1064]. Такая деле-
ния сопровождается стабильной аттенуацией вируса.
Иммунизация живой вакциной в большинстве случаев защищает животных
от гибели после контрольного заражения. Высокий уровень защиты от заболева-
ния при последующем заражении отмечен у поросят, привитых живой вакциной
начиная с 14-дневного возраста.
Интраназальная и парентеральная вакцинация не предотвращает латентного
носительства вирулентного штамма вируса в миндалинах, хотя сокращает сроки
его выделения во внешнюю среду особенно после двукратной или интраназаль-
ной иммунизации. При внутрикожном введении эффективной была только жи-
вая вакцина.
Увеличение максимальной прививочной дозы в 1000 и более раз так же, как
12-кратное введение живой вакцины поросятам, обработанным кортизоном, не
сопровождалось нежелательными явлениями. В стационарно неблагополучных
по болезни Ауески зонах основной проблемой применения живых вакцин явля-
ется материнский иммунитет. Поросята от вакцинированных свиноматок прояв-
ляют выраженную иммунореактивность на введение живой вакцины примерно
начиная с 12-недельного возраста. Поросята оказались лучше защищенными
после интраназальной вакцинации, чем после одно- или двукратной паренте-
ральной вакцинации.
Результаты вакцинации зависят от дозы и кратности введения вакцины.
Свиней вакцинировали двукратно, подкожно с интервалом четыре недели вак-
циной в дозе 106 и 108’5 ТЦД50. Спустя две недели перед контрольным заражени-
ем первая группа свиней имела титр ВН-антител 1:16 — 1:128, вторая — 1:256 —
1:1024. Приживление вирулентного штамма вируса на слизистой оболочке носа
Выраженный колостральный иммунитет продолжается, как правило, не ме-
нее трех недель после рождения [828]. Материнские антитела препятствуют при-
живлению вакцинного вируса и снижают эффективность живой вакцины у по-
росят. Интерференцию между материнскими антителами и вакцинным вирусом
в значительной мере можно преодолеть интраназальным введением живой вак-
цины.
Не установлено корреляции между уровнем антител и устойчивостью вакци-
нированных животных к заражению. Уровень иммунитета зависел от цитотокси-
ческих лимфоцитов [1015].
Для приготовления живых вакцин используют аттенуированные штаммы
вируса различного происхождения. Их получали серийным пассированием в
первичных и перевиваемых культурах при различных температурах (37°С и 28°С)
или в присутствии мутагенов. Полученные аттенуированные штаммы различа-
ются между собой многими признаками, и в том числе патогенностью для лабо-
раторных животных. Все используемые вакцинные штаммы авирулентны для
свиней различного возраста [890], крупного рогатого скота и овец. Мутантный
штамм М-25 не патогенен, кроме того, для кроликов и мышей. Аттенуация ви-
руса может быть связана с делецией одного из генов, кодирующих один из вто-
ростепенных генов для репликации и иммуногенности вируса [1064]. Такая деле-
ция сопровождается стабильной аттенуацией вируса.
Иммунизация живой вакциной в большинстве случаев защищает животных
от гибели после контрольного заражения. Высокий уровень защиты от заболева-
ния при последующем заражении отмечен у поросят, привитых живой вакциной
начиная с 14-дневного возраста.
Интраназальная и парентеральная вакцинация не предотвращает латентного
носительства вирулентного штамма вируса в миндалинах, хотя сокращает сроки
его выделения во внешнюю среду особенно после двукратной или интраназаль-
ной иммунизации. При внутрикожном введении эффективной была только жи-
вая вакцина.
Увеличение максимальной прививочной дозы в 1000 и более раз так же, как
12-кратное введение живой вакцины поросятам, обработанным кортизоном, не
сопровождалось нежелательными явлениями. В стационарно неблагополучных
по болезни Ауески зонах основной проблемой применения живых вакцин явля-
ется материнский иммунитет. Поросята от вакцинированных свиноматок прояв-
ляют выраженную иммунореактивность на введение живой вакцины примерно
начиная с 12-недельного возраста. Поросята оказались лучше защищенными
после интраназальной вакцинации, чем после одно- или двукратной паренте-
ральной вакцинации.
Результаты вакцинации зависят от дозы и кратности введения вакцины.
Свиней вакцинировали двукратно, подкожно с интервалом четыре недели вак-
циной в дозе 106 и 108’5 ТЦД50. Спустя две недели перед контрольным заражени-
ем первая группа свиней имела титр ВН-антител Г.16 — Г.128, вторая — Г.256 —
1:1024. Приживление вирулентного штамма вируса на слизистой оболочке носа
и носоглотки в первой группе животных было выраженным, тогда как у свиней
второй группы следы вируса обнаружены лишь в носоглотке. Аналогичные ре-
зультаты получены при интраназальной вакцинации. Авторы допускают воз-
можность создания биологического иммунитета при БА с помощью повторного
применения больших доз живой или высокоактивной инактивированной вакци-
ны [169].
С помощью методов направленного мутагенеза в США получена новая живая
вакцина «Омнивак». Вакцинный штамм Бухарест, имевший делецию renagpl ме-
тодом генной инженерии, лишили еще двух генов: тимидинкиназы и gpIII.
Болезнь Марека (БМ)
Болезнь Марека (БМ) — высококонтагиозное лимфопролиферативное забо-
левание кур. Главные характерные признаки — развитие лимфом и демиелиниза-
ция периферических нервов. Классическая форма течения сопровождается па-
резами и параличами, а иногда лимфомами гонад. Для острой формы характер-
ны лимфоидные опухоли в одном или нескольких органах (тканях). При острой
болезни гибель птицы варьирует в широких пределах и иногда превышает
10-15%. При классической форме поражается обычно 10-30% поголовья, а
смертность, как правило, ниже, чем при острой форме болезни. По механизму
онкогенного действия вирус болезни Марека (ВМБ) незначительно отличается
от других онкогенных вирусов. Вирус болезни Марека размножается в Т-лимфо-
цитах и вызывает образование внутриклеточных включений. Поскольку первич-
ные лимфомы содержат Т- и В-клетки, а полученные из них линии лимфоблас-
тоидных клеток представлены только Т-клетками, считают, что ВМБ трансфор-
мирует только Т-лимфоциты. В одной трансформированной клетке выявляют до
20 эквивалентов генома ВМБ.
Болезнь Марека, являясь одной из наиболее распространенных болезней
кур, встречается во всех странах мира. Наличие инфекции подтверждено во всех
промышленных стадах птицы, которые были обследованы во всех частях света.
До широкого применения вакцины в странах с хорошо развитым промышлен-
ным птицеводством из каждых 20 кур одна погибла от болезни Марека. Потери
США от этой болезни перед началом применения вакцин составляли около 160
млн долларов в год.
За последние 40 лет после изоляции вируса изменилось вызываемое им забо-
левание. Со временем инфекция становится все более генерализованной, более
острой, тяжелой. Расширяется хозяинный спектр. Основная причина изменения
патогенности вируса БМ заключается в мутациях специфических вирусных ге-
нов, вызывающих изменения времени индукции опухолей, потерю А-АГ, сниже-
ние скорости репликации in vitro, снижение цитолитической активности in vivo,
потерю способности размножаться в лимфоцитах и т.д. [1637]. Данная эволюция
ВБМ, возможно, является результатом иммунологического пресса, вызванного
систематической поголовной вакцинацией цыплят, а также возможной реком-
бинацией с другими вирусами. Химерные молекулы геномной ДНК вируса бо-
лезни Марека, содержащие длинные концевые повторы ретровирусов птиц, об-
разовывались in vivo при смешанной инфекции указанными вирусами [563].
Вирусом БМ цыплята инфицируются спонтанно в первые дни жизни. Раз-
множаясь, вирус вызывает поражение первичных органов лимфосистемы и им-
муносупрессию. С инфицированными лейкоцитами вирус попадает в эпителий
перьевых фолликулов, где интенсивно размножается и накапливается в больших
количествах. Отсюда с чешуйками шелушащейся кожи и выпавшими перьями
он выделяется во внешнюю среду [1492]. Возбудитель болезни сохраняется у
большинства инфицированных кур в течение всей жизни. Вирус болезни Маре-
ка не передается трансовариально, но материнские антитела передаются через
желток потомству, обеспечивая снижение заболеваемости и смертности, но не
абсолютную защиту от БМ. Материнские антитела обнаруживают у цыплят в те-
чение первых 2—3 недель жизни. Если цыплята при рождении или еще в период
эмбрионального развития инфицируются авирулентным штаммом вируса БМ
или герпесвирусом индеек, то они приобретают выраженную защиту от развития
БМ при последующем инфицировании патогенным штаммом вируса БМ. За-
щитное действие проявляется примерно в 90% случаях, то есть клиническая кар-
тина БМ отсутствует, хотя виремия имеет место. Механизм этого явления неиз-
вестен. Данный феномен, вероятно, обусловлен явлением интерференции виру-
сов в сочетании с гуморальными и клеточными факторами иммунитета.
Степень выраженности и формы болезни зависят от вирулентности вируса и
генетически обусловленной породой чувствительности кур. Одни штаммы виру-
са обладают высокой патогенностью и вызывают острую форму болезни Маре-
ка, другие — менее патогенны и вызывают классическую форму, третьи вообще
непатогенны. Такие штаммы вируса могут одновременно встречаться в одном
хозяйстве.
В группе антигенно-родственных вирусов болезни Марека, герпесвируса ин-
деек (ВБМ — ГВИ) различают три серотипа. К серотипу 1 относят патогенные
штаммы вируса, вызывающие острую и классическую, а также слабовыражен-
ную формы болезни. Тип 2 включает естественные авирулентные для кур штам-
мы ВБМ. К типу 3 относят антигенно-родственный герпесвирус индеек [20].
ГВИ можно обнаружить во многих, если не во всех промышленных хозяйствах,
разводящих индеек. ГВИ непатогенен для индеек и кур, в настоящее время ши-
роко применяется в качестве вакцины против болезни Марека. С помощью мо-
ноклональных антител установлено, что гетероиммунитет обусловлен общими
антигенными детерминантами трех гликопротеинов ВБМ (gp 115/100, 63 и 50
кД) и ГВИ (gp 150, 62 и 52 кД). Иммунизация кур и кроликов этими гликопроте-
инами индуцировала выработку антител, подавляющих репродукцию обоих ви-
русов [829].
Несмотря на тесное антигенное сродство, гомология ДНК ВБМ и ВГИ не
превышает 1—4% [350]. Иммунитет против БМ является тимусзависимым про-
цессом, поскольку вакцинация не защищала бестимусных цыплят от БМ [745].
Опосредованная клетками цитотоксичность носит вирусспецифический харак-
тер. Лимфоциты от инфицированных ВБМ кур лизировали клетки-мишени, ин-
фицированные ВБМ, но не ГВИ. В то же время иммунные и неиммунные лим-
фоциты кур лизировали клетки, инфицированные ВБМ в присутствии антисы-
вороток как против ВБМ, так и против ГВИ [904].
Иммунизация цыплят авирулентными штаммами ВБМ или природными
штаммами ГВИ надежно защищает их (в 90% случаев) от последующей спонтан-
ной инфекции вирулентным штаммом ВБМ, то есть клиническое проявление
болезни отсутствует, хотя виремия имеет место. Механизм такого защитного
действия неизвестен. Возможно, что в основе эффективности применения ГВИ
при БМ лежит не только антигенная общность этих вирусов, а также интерфе-
ренция между ними. В ответ на введение ГВИ у цыплят появляется устойчи-
вость, препятствующая развитию лимфопролиферативных процессов, индуци-
руемых ВБМ.
Основной мерой борьбы с БМ на сегодня остается специфическая профи-
лактика, осуществляемая с помощью различных живых вакцин. Вакцинируют,
как правило, суточных цыплят. Эффективность вакцинации повышается с уве-
личением интервала между прививкой и спонтанным инфицированием. Защит-
ный эффект (при вакцинирующей дозе > 1000 ФОБ) обнаруживают спустя 3—4
дня, он достигает пика через две недели [1259] и сохраняется в течение всей жиз-
ни. Хотя вакцинация не создает полной защиты, тем не менее она значительно
сокращает естественную инфицированность поголовья и выделение полевого
вируса во внешнюю среду.
Необходимо учитывать, что материнские антитела не защищают цыплят от
БМ, в то же время их высокий уровень может снижать эффективность примене-
ния гомологичной вакцины. С учетом этого обстоятельства для прививки цып-
лят целесообразнее использовать вакцинный вирус, ассоциированный с живы-
ми клетками, чем внеклеточный, — в виде лиофилизированного препарата. Для
снижения отрицательного влияния материнского иммунитета рекомендуется
использовать разные вакцины (ГВИ и ВБМ) для иммунизации родителей и по-
томства.
Для приготовления вакцины БМ используют все три серотипа вируса. Чаще
для этой цели применяют аттенуированный серотип 1 (штамм HPRS-16att и
CV1-988), естественный неонкогенный штамм SB-1 серотипа 2 и ВГИ штамм
FC-126 (серотип 3). Каждый из этих вирусов индуцирует достаточный защитный
эффект против БМ. Однако ВГИ слабо эффективен против очень вирулентных
вирусов БМ. Аттенуированные штаммы ВБМ (серотип 1) получают путем серий-
ного пассирования в культурах клеток. Искусственно или естественно аттенуи-
рованные штаммы ВБМ передаются от привитых кур непривитым, тогда как
ГВИ практически не способен к горизонтальной передаче в популяции кур. Хо-
тя аттенуация сопровождается снижением способности ВБМ инфицировать
лимфоциты цыплят in vivo и in vitro [1377], такие вакцинные штаммы, как CV-1 -
988 (серотип 1) и SB-1 (серотип 2), хорошо размножаются в организме и культу-
ре клеток, легко передаются горизонтально. Имеется корреляция между способ-
ностью аттенуированных штаммов ВБМ передаваться горизонтально и их имму-
ногенностью [1597]. Способность к такой передаче, вероятно, связана с выра-
женной репродукцией вакцинного штамма в эпителии перьевых фоликулов. По-
ствакцинальная виремия и особенно уровень размножения вируса в эпителиаль-
ных клетках перьевых фолликулов привитых цыплят являются хорошим тестом
иммуногенности вакцины. Штаммы, длительно пассированные в культуре кле-
ток, снижают способность к приживлению в организме привитых цыплят, а вме-
сте с ней и иммуногенность [1671].
Вакцинные штаммы размножают в первичных культурах эмбрионов птиц
(преимущественно куриных эмбрионов) и выпускают в виде жидких или сухих
препаратов. В первом случае они представляют собой вирус, связанный с клет-
ками, во втором — внеклеточный. Сухие вакцины имеют существенные преиму-
щества ввиду удобства перевозки, хранения и использования по сравнению с
жидкими вакцинами, которые хранят и транспортируют в жидком азоте.
В последние годы выявлена тенденция к снижению эффективности вакци-
нации [1673]. Циркуляция в природе высоковирулентных вариантов и существо-
вание антигенных вариантов ВБМ привели к необходимости совершенствова-
ния существующей системы специфической профилактики БМ.
Наряду с такими мерами, как получение аттенуированных штаммов с повы-
шенной иммуногенностью и увеличением дозы вакцины для уменьшения вспы-
шек БМ, ввели вакцинацию 18-дневных эмбрионов для защиты от раннего зара-
жения и применение поливалентных вакцин с целью противодействия зараже-
нию вариантными штаммами возбудителя.
Установлено, что наиболее высокие защитные свойства имеют поливалент-
ные вакцины, включающие штаммы вирусов группы ВБМ-ГВИ серотипов 1,2 и
3 [1377, 1598].
Испытание в производственных условиях трех вакцин против БМ показало,
что моно-, би- и поливалентная вакцины защищали соответственно 54,5; 74,5 и
91,5% цыплят [909, 1670, 1672]. Бивалентные и трехвалентные вакцины, включа-
ющие вакцинные штаммы ВБМ и ГВИ (серотипы 1 и 3; 2 и 3; 1,2 и 3), оказались
значительно эффективнее по сравнению с моновакцинами, особенно против
очень вирулентных штаммов, которые становятся преобладающими в зонах ак-
тивного птицеводства [909].
Трехвалентная вакцина была эффективной при заражении высоковирулент-
ным штаммом ВБМ даже на фоне материнских антител (защитный эффект
84%). Бивалентная вакцина из штаммов SB-1 (серотип 2) и FC126 (серотип 3)
была эффективнее других бивалентных вариантов. In vivo штаммы не проявляли
интерференции, но проявили протективный синергизм: эффективность одного
возрастала от очень низкой дозы другого, и даже частичные дозы двух штаммов
были эффективнее полной дозы одного штамма [1672].
Оказалось, что вакцинация куриных эмбрионов в последней стадии разви-
тия защищает цыплят от БМ. При заражении на 16-18-й день инкубации онко-
генные и неонкогенные штаммы ВБМ не проявляли значительной реакции в
тканях эмбрионов. ВБМ оставался неактивным в эмбриональный период до вы-
вода цыплят. Вакцинация эмбрионов ГВИ одновременно с заражением ВБМ да-
ла высокий защитный эффект против развития БМ, который значительно сни-
жался в случае вакцинации однодневных цыплят [1393]. У 170-дневных куриных
эмбрионов, вакцинированных ГВИ, вирус в высоких титрах накапливался толь-
ко в тканях легкого и практически не обнаруживался в лимфоидных органах.
Клетками-мишенями были фибробластоподобные или эпителиоподобные клет-
ки легких КЭ, но не лимфоидные или макрофагальные клетки, как это имеет ме-
сто в постэмбриональный период развития.
Вакцинопрофилактика кур против БМ может быть эффективной только при
отсутствии вторичных иммунодефицитов. В этом отношении особую опасность
представляет инфекционный бурсит птиц, а также инфекционная анемия цып-
лят [1189].
Имеются сообщения об изготовлении инактивированных вакцин БМ. Обра-
ботка глютаральдегидом устраняла инфекционность ВБМ, но сохраняла анти-
генность и иммуногенность вирусспецифических компонентов. Опухолевые
клетки и лимфоциты инфицированных цыплят, содержащие незначительное ко-
личество опухолевоспецифических антигенов, не оказали защитного эффекта,
несмотря на высокое содержание вирусного антигена. Вместе с тем клетки лим-
фобластоидной линии, содержащие почти в 100% случаях опухолевоспецифиче-
ские антигены и небольшое количество вирусного антигена, обеспечили высо-
кую резистентность птиц к ВБМ. В других аналогичных опытах с инактивиро-
ванными вакцинами вирусный антиген обладал более выраженной защитой
против БМ, чем опухолевой антиген. Результаты этих исследований показали,
что иммунитет при БМ может быть направлен или против репликации и распро-
странения вируса, или процессов, связанных с трансформацией и пролифераци-
ей лимфоидных клеток. Природа опухолевоспецифических антигенов и роль
ВБМ в их индукции остается невыясненной [ 1135]. В пользу важной роли опухо-
левоспецифических антигенов в иммунитете при БМ свидетельствуют также по-
ложительные результаты иммунизации цыплят клетками лимфобластоидной ли-
нии кур, трансформированной ВБМ, но не продуцирующей его [1547].
Ринопневмония лошадей (РПЛ)
РПЛ - острое респираторное заболевание лошадей. Вирус размножается и
накапливается в слизистой оболочке верхних дыхательных путей и в легких, вы-
зывая ринопневмонию. У беременных животных вирус проникает в матку, плод
и околоплодные оболочки, вызывая патологический процесс и аборт во второй
половине беременности. Герпесвирус, обозначавшийся в течение 50 лет как ви-
рус ринопневмонии — аборта лошадей, на самом деле представляет не один, а два
различних вируса [1068, 1465]. Герпесвирус 1 лошадей (ГВЛ-1) вызывает аборты
и респираторную патологию, а герпесвирус 4 лошадей (ГВЛ-4) — ринопневмо-
нию. Оба вируса вызывают сходную патологию респираторных органов. ГВЛ-1
вызывает аборты, как правило, в последние 4 мес. беременности. Плоды обычно
рождаются мертвыми. Аборты, гибель плодов в период беременности и реже эн-
цефалиты в неблагополучных стадах могут встречаться у 70% лошадей.
В связи с установлением этиологической роли двух герпесвирусов (ГВЛ-1 и
ГВЛ-2) в патологии двух клинически сходных заболеваний лошадей возникла не-
обходимость пересмотреть многие вопросы, в том числе специфическую профи-
лактику этих болезней, вызываемых двумя вирусами. Антигенное родство этих ви-
русов дает возможность использовать гетерологичные вакцины, например, вакци-
ну из ГВЛ-1 для профилактики инфекции ГВЛ-4, хотя более действенным
является применение гомологичных вакцин против каждого возбудителя. Вероят-
но, более эффективный контроль болезней, вызываемых ГВЛ-1 и ГВЛ-4, может
быть достигнут с помощью бивалентной вакцины, содержащей оба вируса [668].
Основные вспышки эпизоотических абортов у лошадей связаны с ГВЛ-1 [1465].
ГВЛ-4 удается выделить после гибели животного из пораженной нервной ткани.
Естественный иммунитет после переболевания ринопневмонией (ГВЛ-4) сохра-
няется не более 4 мес., а после аборта (ГВЛ-1) - несколько дольше [1091]. Для
профилактики болезни в основном применяют живые вакцины. Генетические из-
менения вируса особенно быстро происходят при культивировании в клетках не-
естественного хозяина [1466]. Живая вакцина из штамма RAC-H получена адапта-
цией вируса к сирийским хомякам, а затем длительным пассированием (360 раз) в
первичной культуре клеток почки телят. ГВЛ-1 выделяли из абортированных пло-
дов и от новорожденных жеребят, ГВЛ-4 выделяли при респираторных заболева-
ниях. ГВЛ-4, в отличие от ГВЛ-1, не репродуцировался в культурах клеток эмбри-
онов кошек и морских свинок, почки кролика и теленка, не выявлялся в лейкоци-
тах крови лошадей и не вызывал аборты у жеребых кобыл после интраназального
введения. Кроме того, наблюдали различия в степени нейтрализации ГВЛ-1 и
ГВЛ-4 гетерологичными антисыворотками. Установлено наличие не более 20% го-
мологии ДНК и различия восьми структурных белков ГВЛ-1 и ГВЛ-4.
Штамм ВС аттенуирован в течение 53-56 пассажей в первичной культуре
клеток тестикулярной ткани поросят [182]. Вакцинация беременных лошадей
аттенуированным штаммом СВ/69 сопровождалась умеренно выраженной реак-
цией и не влияла на плодоношение. Способ введения вакцины из штамма СВ/69
существенно не влияет на титр гуморальных антител, тогда как титр секреторных
антител был выше при интраназальном применении [207].
Аттенуированный штамм ГВЛ-4 получен путем размножения в первичной
культуре клеток почки поросенка в присутствии мутагена (5-йод-2-дезоксиури-
дин). Живая вакцина создавала напряженный иммунитет, сохранявшийся на
протяжении года. Мутант ГВЛ-4 был нереверсибельным. Случаев абортов, забо-
левания или вирусоносительства у привитых животных не наблюдали.
Лиофилизированная вакцина сохраняла биологические свойства при 4°С в
течение двух лет [186]. После контрольного заражения у ранее вакцинированных
животных отмечено значительное возрастание титра антител. У вакцинирован-
ных особей вирулентный вирус в смывах носоглотки обнаруживали в течение
одного дня, а у контрольных — три дня после заражения [547].
Результаты испытаний инактивированных вакцин показали, что по сравне-
нию с живыми вакцинами они менее иммуногенны. Иммуногенные препараты
получены с глютаральдегидом в качестве инактиватора и адъювантом СТС. Вак-
цина обладала защитным эффектом для новорожденных жеребят, особенно если
матерей реиммунизировали на 6—7-м мес. беременности [186]. Применение
инактивированных вакцин оказалось менее эффективным даже после двух-трех-
кратного введения. Так было, например, с вакциной Pneumabort-K из ГВЛ-1.
Вакцинация снижала тяжесть заболевания, продолжительность выделения и
титр выделяемого вируса (в 10-100 раз), но не создавала защиты от заражения
ГВЛ-1 [428]. Подобные результаты получены в другом исследовании с аналогич-
ной вакциной.
Двукратно привитые жеребята были чувствительными к заражению: темпе-
ратурная реакция и продолжительность экскреции вируса не отличались от на-
блюдаемых в группе контрольных животных, хотя количество экскретируемого
вируса было значительно снижено.
Таким образом, клинически выраженное заболевание лошадей, характеризу-
ющееся признаками ринопневмонии и сопровождающееся абортами, вызывает-
ся двумя тесно связанными вирусами: герпесвирусами лошадей 1 и 4. Естествен-
ный иммунитет при этих заболеваниях кратковременный. Вероятно, он связан в
основном с антителами. Имеются инактивированная (цельновирионная или
субъединичная) и живая вакцины. Живая вакцина из ГВЛ типа 1, аттенуирован-
ного в гетерологичной культуре клеток, применялась в ряде стран. Ее примене-
ние предупреждает развитие патологии органов дыхания и аборты [1124].
Инфекционный ларинготрахеит птиц (ИЛТ)
ИЛТ — респираторная болезнь кур, протекающая сверхостро, остро и хрони-
чески. Заболевание у других видов птиц встречается редко. Различают ларинго-
трахеальную и конъюнктивальную формы, последнюю чаще всего наблюдают у
цыплят. Заболевание регистрируют во всех странах с развитым промышленным
птицеводством. Антигенная вариабельность возбудителя не установлена. Вирус
размножается главным образом в верхних дыхательных путях, а также в слизис-
той клоаки, где его обычно обнаруживают. Он, как и другие гаммагерпесвирусы,
способен поражать ганглий тройничного нерва. Переболевание сопровождается
длительным или пожизненным вирусоносительством. Из трахеи переболевших
птиц вирус выделяли в течение двух лет. Переболевшие куры практически при-
обретают пожизненный иммунитет. Смывы трахеи обладали ВН-активностью на
7-8-й день после заражения [278]. С возрастом у цыплят значительно усиливает-
ся естественная резистентность. Например, в однодневном и 6-недельном воз-
расте 50%-ная летальная доза вирулентного вируса при интраназальном зараже-
нии возросла с 40 до 4500 БОЕ. Коммерческая живая вакцина, примененная оку-
лярно, не снижала защитного эффекта после устранения гуморального
антительного ответа (бурсоэктомия и циклофосфамидная терапия). Эти резуль-
таты показали важное значение клеточного иммунитета в защите против ИЛТ.
Специфическая профилактика ИЛТ основывается главным образом на при-
менении живых вакцин. Аттенуация вируса достигается его пассированием в КЭ
или культуре клеток почки КЭ. Эти же системы используют для размножения
вакцинных штаммов ИЛТ [840, 1618].
Испытание пяти коммерческих живых вакцин показало, что иммуноген-
ность вакцины зависит от ее реактогенности. Слабореактогенная вакцина при
окулярном применении вызывала выраженный иммунитет у 90-100% птицы в
течение первых 10 недель после вакцинации. В дальнейшем напряженность им-
мунитета снижалась и через 7 мес. составляла 50% от первоначального уровня.
Отмечена тесная корреляция между напряженностью иммунитета и титром ВН-
антител (в культуре клеток почек КЭ). В ряде случаев иммунитет наступал рань-
ше, чем появились антитела в крови. Аэрозольная вакцинация сопровождалась
более тяжелыми вакцинальными реакциями, особенно при наличии у птиц ми-
коплазменной инфекции.
Все вакцинные штаммы обладают выраженной иммуногенностью, вызыва-
ют реакцию у привитых птиц и передаются горизонтально. С целью ослабления
реактогенности и усиления иммуногенности испытывали различные способы
введения и дозы вакцины. Предпочтительный метод иммунизации — закапыва-
ние вакцины на конъюнктиву или применение в виде аэрозоля, менее эффек-
тивно внесение ее в питьевую воду. Практикуют также нанесение вакцины на
слизистую оболочку клоаки. Иммунитет развивается через 4—5 дней после вак-
цинации и сохраняется до года. Живая вакцина ВНИИБП после двукратного аэ-
розольного применения (5,0—7,5 ЭИД50) обеспечивала иммунитет у всех 5—6-
недельных цыплят яичных пород и примерно у 80% цыплят мясных пород кур. У
90% кур через 4,5 мес. после вакцинации сохранился напряженный иммунитет.
Вакцина ВНИИВВиМ из аттенуированного штамма «НТ» отличается от вакци-
ны ВНИИБП в основном менее выраженной реактогенностью при аэрозольном
применении, что имеет важное практическое значение, особенно при наличии
респираторного микоплазмоза.
Относительно эффективности инактивированной вакцины имеются проти-
воречивые данные. Одни авторы не получили удовлетворительных результатов,
тогда как другим удалось добиться значительных успехов. Для приготовления
вакцины вирус инактивировали бета-пропиолактоном, этилэтиленимином,
этиленимином и формалином. Вирус, инактивированный этиленимином, от-
личался наибольшей антигенной активностью. Эмульсин-вакцина в лаборатор-
ных и полевых опытах вызывала удовлетворительный серологический ответ у
цыплят и обеспечивала устойчивость к заражению вирулентным штаммом ви-
руса ларинготрахеита в течение 12 мес. [289]. Однако дальнейшие перспективы
развития специфической профилактики ИЛТ были связаны с созданием более
совершенных живых вакцин, в том числе рекомбинантных вакцин. Одна из та-
ких вакцин создана на основе вируса оспы птиц, экспрессирующего гликопро-
теин В (gB) вируса ИЛТ. По уровню безопасности, образованию антител, защи-
те цыплят, выделению вирулентного вируса после контрольного заражения ре-
комбинантная вакцина не уступала живой традиционной коммерческой вакци-
не Нобилис [1531].
Чума уток (вирусный энтерит уток)
Чума уток (вирусный энтерит уток) - остропротекающая болезнь водоплава-
ющих птиц, характеризующаяся лихорадкой, геморрагическим диатезом и
обильной диареей. Источником возбудителя, вероятно, являются дикие утки.
Болеют утки всех возрастов. При остром течении заболевания гибель наступает
внезапно. Болезнь регистрируется в странах Европы, Азии и Америке. Перебо-
левание сопровождается напряженным иммунитетом, передаваемым трансова-
риально потомству. Материнский иммунитет продолжается 2-3 недели. С целью
специфической профилактики применяют живые вакцины. Для получения атте-
нуированных штаммов вирус пассируют в утиных (УЭ) и куриных эмбрионах
(КЭ). Для полной аттенуации вируса при сохранении выраженной иммуноген-
ности обычно достаточно 5—10 пассажей в УЭ и 20 - в КЭ. Эмбриональные и
культуральные варианты аттенуированных штаммов вируса ЧУ используют для
вакцинации уток. Аттенуированные штаммы не реактогенны для уток различно-
го возраста, обладают выраженными протективными свойствами, не передают-
ся горизонтально и не обладают риверсибельностью. Они хорошо переносят ли-
офилизацию и при длительном хранении сохраняют активность. Однократное
внутримышечное введение вакцин (4,0 ^ТЦД50) через три дня защищает прак-
тически всех привитых уток от экспериментальной летальной инфекции виру-
лентным штаммом вируса. В организме вакцинированных утят через 20 дней по-
сле не удавалось обнаружить вирулентный штамм вируса. Длительность имму-
нитета зависит от возраста вакцинированной птицы и обычно составляет 3—5
мес. Напряженный иммунитет быстро восстанавливается после ревакцинации.
Материнские антитела подавляют активный иммунитет у утят в течение первых
2—3 недель жизни. Применение живой вакцины оказалось весьма эффективным
средством профилактики чумы уток. Аэрозольная иммунизация живой вакци-
ной против чумы уток оказалась неэффективной.
Ринотрахеит кошек
Ринотрахеит, вызываемый герпесвирусом типа 1 кошек (ГВК-1), — основное
респираторное заболевание кошек, встречающееся у 50-75% животных данного
вида. Заболевание клинически напоминает калицивирусную инфекцию. На-
блюдают некротические изменения эпителия верхних дыхательных путей и в от-
дельных случаях бронхопневмонию. Хотя аборты имеют место, но трансплацен-
тарное инфицирование плодов не происходит. Для профилактики заболевания
предложены живые и инактивированные вакцины. Первые готовят из аттенуи-
рованного штамма вируса, размноженного в культуре клеток почек котят. Для
аттенуации вирулентного штамма вируса требовалось не менее 50 пассажей при
температуре 33-35°С. Живая сухая вакцина, полученная из такого штамма, безо-
пасна и высокоэффективна. Аттенуированный штамм сохранял выраженную
антигенность и пригодность в качестве вакцинного после 300 и более пассажей
в культуре клеток. Кошки, привитые интраназально живой вакциной (Katavak-
СН) из термочувствительного штамма (0,5 ^ТЦД50), становились устойчивыми
к интраназальному заражению вирулентным штаммом (7,0 1§ТЦД50). Вакцина-
ция сопровождалась незначительной реакцией и выделением вакцинного виру-
са в течение шести дней. Устойчивость к экспериментальному заражению обна-
ружена через четыре дня. Экскреция вирулентного вируса была низкой [506].
Инактивированую вакцину получали из культурального ГВК-1 с помощью БПЛ.
Напряженный иммунитет и высокий титр гуморальных антител отмечали после
двукратного введения вакцин. Антитела сохранялись в крови в течение 10 мес. и
в это же время имел место бустерный эффект на повторную вакцинацию, а так-
же обнаружена антителозависимая цитотоксичность, обусловленная лейкоцита-
ми [1516].
10.5. Аденовирусы
Аденовирусы впервые были выделены в 1953 г. из аденоидов человека и по-
лучили соответствующее название. Семейство аденовирусов включает два рода
Mastadenovirus и Aviadenovirus. В состав рода мастаденовирусы входят аденови-
русы млекопитающих: человека (более 50 серотипов), обезьян (24 серотипа),
крупного рогатого скота (10 серотипов), лошадей (2 серотипа), овец (6 сероти-
пов), коз (2 серотипа), свиней (4 серотипа), собак (2 серотипа), мышей (1 серо-
тип), кроликов(1 серотип).
Род авиаденовирусы включает аденовирусы кур (12 серотипов), индеек (4 се-
ротипа), гусей (3 серотипа), уток (2 серотипа) и фазанов (1 серотип) [1084].
Патогенные аденовирусы известны у 13 видов домашних животных. Выска-
зано предположение, что млекопитающие и птицы могут заражаться аденовиру-
сом, относящимся к разным родам [288]. Аденовирусы вызывают заболевания,
характеризующиеся легким поражением органовдыхания, пищеварения и конъ-
юнктивы. Некоторые из них вызывают злокачественные опухоли у новорожден-
ных хомячков и трансформацию клеток, культивируемых in vitro, но не вызыва-
ют опухолей у естественных хозяев.
Аденовирусы птиц серотипа 11 вызывают геморрагический энтерит индюков
и мраморную болезнь селезенки фазанов, а серотипа 8 — острый вирусный гепа-
тит цыплят [1356].
Аденовирусы представляют собой частицы кубической симметрии диамет-
ром 70-100 нм. Вирионы содержат ДНК (13% массы) и белок (87% массы), не
имеют оболочки, липидов и содержат следовые количества углеводов в белке от-
ростка, модифицированном включением глюкозамина. Вирионы имеют белко-
вое покрытие, окружающее ДНК-содержащую сердцевину. Белковое покрытие
(капсид) состоит из 252 субъединиц (капсомеров), из которых 240 гексонов и 12
пентонов. В структуре вириона содержится, по-видимому, 11 белков (м.м.
2—120 кД). Наружный слой вириона (капсид) содержит 7 белков. В сердцевине
вириона находятся 4 белка (в том числе концевой белок 55 кД), который кова-
лентно связан с 5'-концами вирусной ДНК [1403].
240 гексонов образуют 20 поверхностей в виде равносторонних треугольни-
ков. На вершинах икосаэдра расположены 12 капсомеров (пентонов), каждый из
которых граничит с пятью соседними невершинными капсомерами (гексона-
ми). От вершин пентонов отходят булавовидные отростки диаметром 2 нм и дли-
ной 20—50 нм. На вершине отростка имеется утолщение диаметром 4 нм. Эти
капсомеры вместе с отростками (фибрами) называют пентонами. Сердцевина
вириона имеет сферическую форму диаметром 60—65 нм и представляет собой
правильно организованную структуру из 12 петель, вершины которых совпадают
с вершинами капсида и на срезе вириона образуют фигуру, подобную цветку.
Петли образованы ДНК и белками VII и V. В сердцевине находятся также белки
VI и X.
Геном аденовирусов представлен одной линейной молекулой двуцепочечной
ДНК размером 36-44 тпн с инвертированными концевыми повторами. Вирус-
ный геном кодирует около 40 белков и транскрибируется после сложного сплай-
синга РНК. Около 1/3 вирусных белков являются структурными белками. Ви-
русные частицы присоединяются к клетке рецепторами пентоновых отростков и
проникают внутрь ее путем эндоцитоза. Затем удаляется наружный белковый
слой (капсид) и сердцевина вириона (вирусный геном и связанные с ним гисто-
ны) проникает в ядро клетки, где происходит полный цикл репликации вируса
от транскрипции мРНК до образования зрелых вирионов. В ядре клетки вирус-
ный геном транскрибируется клеточной полимеразой II, в соответствии с ком-
плексной программой, закодированной в обеих цепях вирусной ДНК. В резуль-
тате образуется 5 продуктов ранней (Е) транскрипции: El А, Е1 В, Е2, ЕЗ и Е4, два
— промежуточной: IX и !Va2 и один — поздней (L) транскрипции. На матрице по-
следнего из них транскрибируется семейство из 5 поздних мРНК (L1-L5). Все
ранние кодирующие области вирусного генома транскрибируются от отдельных
промоторов, тогда как поздние области от одного - главного позднего промото-
ра. Ранние мРНК транслируются в ранние белки, которые изменяют клеточный
цикл, блокируют клеточный защитный механизм, выключают транспорт мРНК
и участвуют в репликации вирусной ДНК [1403].
Вирусная ДНК реплицируется, используя 5'-концевой белок 55кД в качест-
ве праймера, и продолжается от обоих концов с помощью замещающего меха-
низма. Вслед за репликацией ДНК транскрибируются поздние мРНК, которые
затем транслируются в структурные белки в избыточном количестве. Первичные
транскрипты имеют размер около 29 kb; по крайней мере 18 мРНК образуются
альтернативным сплайсингом поздних первичных транскриптов. Во второй по-
ловине репликативного цикла вируса происходит остановка макромолекулярно-
го синтеза клетки. Вирионы формируются в ядре, где они образуют кристалло-
подобные скопления. Продукты трансляции поздних мРНК участвуют в сборке
вирионов и лизисе клеток. Продукты генов Е1А и Е1В ответственны за клеточ-
ную трансформацию.
Область ЕЗ несущественна для репликации аденовируса in vitro и может быть
использована для вставки чужеродной ДНК при конструировании аденовирус-
ных векторов и рекомбинантных вакцин [919].
Основные структурные белки аденовирусов представлены в табл. 30. Поли-
пептид II с молекулярной массой 120 кД входит в состав гексонов, причем в каж-
дом из них содержится три молекулы этого белка. Таким образом, 240 гексоно-
вых капсомеров вириона содержат 720 молекул белка П. Гексонные белки со-
ставляют основную массу (53%) вирионных белков.
Основание пентона содержит пять молекул полипептида III, его отросток —
три молекулы полипептида IV, то есть всего соответственно по 60 и 36 копий на
вирион. Отросток вместе с основанием пентона формируют комплекс пентона
[1183]. Основная роль в антигенной активности аденовирусов принадлежит гек-
сонам, пентонам и их отросткам.
В структуре гексона обнаружены две антигенные детерминанты: группоспе-
цифическая (а) и типоспецифическая (е). Антитела против очищенных гексонов
нейтрализуют инфекционность вируса данного серотипа.
Таблица 30. Основные структурные белки аденовирусов
Обозначение белка Молекулярная масса, кД Количество молекул в аденовирусе типа 2(1713) Локализация и функция
I 120 720 Гексон; ответственен за синтез вируснейтрализующих антител и группоспецифическую КС-активность
III 85 60 Основание пентона; ответственен за цитотоксичность и подгрупповую КС-активность
Ша 66 74 Между пентонами и гексонами
IV 62 36 Отросток пентона; ответственен за адсорбцию вирионов, синтез вируснейтрализующих антител и типоспецифическую КС-активность
55 2 Сердцевина ковалентно связана с 5'-концами молекулы ДНК
V 45 157 Сердцевина
VI 24 342 Связан с гексоном
VII 17 833 Сердцевина
VIII 13 311 Связан с гексоном
IX И,2 247 Связан с группами из 9 гексонов
Многие аденовирусы обладают гемагглютинирующими свойствами. Вер-
хушки пентоновых отростков присоединяются к рецепторам клеток и соединя-
ют их между собой. Антигенная детерминанта отростка пентона, по-видимому,
идентична типоспецифическому гемагглютинину.
Вирусы внутри рода различают на основе антигенных и геномных
характеристик. При идентификации вирусных штаммов используют рестрикци-
онное эндонуклеазное картирование и секвенирование геномной ДНК.
Родоспецифические эпитопы расположены на пентонах, т.е. структурных
единицах, расположенных на поверхности капсида. Типоспецифические антиге-
ны, которые идентифицированы в реакциях нейтрализации и РТГА, находятся
на поверхности гексонов. Пентоновые отростки содержат другие типоспецифи-
ческие эпитопы, которые также играют важную роль в нейтрализации. Хотя
утолщения на пентоновых отростках содержат лиганды, ответственные за при-
крепление вируса к специфическим клеточным рецепторам, антитела к ним иг-
рают лишь слабую роль в нейтрализации вируса. Серологическая структуриза-
ция семейства в основном основана на относительной доминантности некото-
рых эпитопов в серологических тестах, нежели на их расположении в вирионах.
За индукцию типоспецифических ВН антител ответственны аминокислот-
ные последовательности 393—398 и 536—547 белка гексона. Пептид, образуемый
аминокислотными остатками 20—35 белка гексона, обладает комплементсвязы-
вающей активностью [185]. Антитела к гексону и отростку пентона обладают
нейтрализующей способностью. Смесь этих антител нейтрализует вирус при
меньшей концентрации. Отмечено участие в нейтрализации инфекционности
аденовируса антител к гексонам гетерологичных типов вируса. Комплемент уси-
ливает действие ВН-антител. Антитела к гексоновым и фиберным белкам нейт-
рализуют инфекционность и ассоциированы с устойчивостью организма к ин-
фекции [1131]. В составе аденовируса человека различают четыре комплемент-
связывающих антигена (КСА), которые обозначают буквами А, В, С и Р.
А-антиген связан с гексоном, В-антиген — с основанием пентона, С-антиген — с
отростками (пептона), Р-антиген является внутренним антигеном. А- и Р-анти-
гены — группоспецифические комплементсвязывающие антигены, общие для
всех аденовирусов человека. По В-антигену все аденовирусы человека разделены
на три подгруппы. С-антиген — типоспецифический комплементсвязывающий
антиген [24]. В опытах на животных установлена иммуногенность вакцин, полу-
ченных из очищенных гексонов и отростков пентонов. Однако вакцины из кап-
сидных белков аденовирусов обладают более низкой иммуногенностью, чем
цельновирионные вакцины. Иммуногенность белков гексонов и отростков пен-
тонов значительно повышалась после их включения в состав липосом.
Аденовирусы интенсивно использовали в качестве векторов для введения
чужеродных ДНК различных вирусов. Экспрессия чужеродных вирусных генов в
рекомбинантных аденовирусных векторах была продемонстрирована на много-
численных примерах. Таким образом были экспрессированы гликопротеин Д
вируса болезни Ауески, гликопротеин 340/220 вируса Эпштейн-Барр, структур-
ный гликопротеин вируса везикулярного стоматита, белок VP4 ротавируса, гли-
копротеин вируса бешенства, гликопротеин вируса парагриппа-3, гликопротеин
оболочки вируса иммунодефицита кошек, гликопротеин вируса респираторного
и репродуктивного синдрома свиней, поверхностный антиген вируса гепатита В
человека, Т-антиген вируса полиомы и белок слияния вируса кори [1135].
Аденовирусная инфекция крупного рогатого скота
Аденовирусная инфекция крупного рогатого скота вызывает у телят остро-
протекающие заболевания слизистых оболочек дыхательных путей и пищевари-
тельного тракта. Смешанные инфекции приводят к хроническому воспалению
легких. У взрослого крупного рогатого скота аденовирусная инфекция большей
частью протекает латентно. Выделение аденовируса из плодов свидетельствует о
возможности трансплацентарной передачи возбудителя. Выявлено девять серо-
типов аденовирусов крупного рогатого скота. На основании наличия общего
комплементсвязывающего антигена все аденовирусы крупного рогатого скота
подразделяют на две антигенные подгруппы. Первые три типа имеют общий
комплементсвязывающий антиген, отличающийся от такового остальных серо-
типов, также имеющих общий антиген.
Естественное или экспериментальное заражение аденовирусами вызывает у
животных образование специфических антител. В течение первых 14 дней забо-
левания вначале появляются типоспецифические нейтрализующие и тормозя-
щие гемагглютинацию антитела. Группоспецифические, комплементсвязываю-
щие и преципитирующие антитела образуются спустя 25—30 дней после начала
заболевания.
Пока еще неясно, в какой мере вакцинация против одного типа аденовируса
защищает от заражения другими типами и происходит ли подавление иммунно-
го ответа на фоне гетерологических антител. По-видимому, для защиты против
инфекции особое значение имеют секреторные антитела. Колостральные анти-
тела в сыворотке крови телят выявляют на протяжении 4 мес. после рождения.
Однако в практических условиях заражаются телята даже с высоким титром ма-
теринских антител.
В специфической профилактике аденовирусной инфекции телят предпочте-
ние отдается применению инактивированных вакцин. Вакцинация стельных ко-
ров — одно из направлений профилактики аденовирусной инфекции у новорож-
денных телят. Естественно, что выраженность пассивного иммунитета у телят за-
висит от исходного уровня антител в молозиве и его количества, потребленного в
первые 24 ч жизни. В то же время было установлено, что пассивные антитела пре-
пятствуют активной иммунизации телят. Учитывая важность секреторных анти-
тел для защиты телят от аденовирусной инфекции, большое значение приобрета-
ет назальная иммунизация живыми вакцинами. Формолвакцина, в отличие от ес-
тественного заражения и живой вакцины, не вызывает образования КС-антител.
Инактивированная вакцина вызывает гуморальный ответ у стельных коров и
телят, привитых в возрасте 10-15 дней и старше. У вакцинированных коров ан-
титела сохранялись в течение 6 мес после отёла, а у телят — 4 мес. после вакци-
нации. Колостральные антитела сохраняются у телят 2,5 мес. Колостральные ан-
титела подавляют иммунную реакцию на введение вакцины f201 ].
Аденовирусные инфекции птиц
Среди аденовирусов птиц различают: обычные аденовирусы, гемагглютини-
рующие, связанные с синдромом снижения яйценоскости кур и вызывающие ге-
моррагический энтерит индеек и мраморную болезнь селезенки.
Обычные аденовирусы птиц имеют один групповой антиген, отличающийся
от такового человека, выявляемого в РИД и ИФА. Пользуясь реакцией нейтра-
лизации аденовирусы кур можно разделить по крайней мере на 12 серотипов. У
аденовирусов индеек и гусей обнаружено по три серотипа, а уток — один. Обыч-
ные аденовирусы размножаются в пищеварительном тракте птиц и менее интен-
сивно — в слизистой оболочке носа и глаз. Виремию обычно наблюдают при на-
личии клинических признаков болезни. Однако неясно, являются ли обычные
аденовирусы первичной причиной болезни или играют роль вторичного агента.
Птица, инфицированная аденовирусом, является потенциальным вирусоноси-
телем в течение всей жизни и, возможно, периодически выделяет его с секрета-
ми и экскретами, а также через яйца. Вирус передается горизонтально и верти-
кально — трансовариально. Обычные аденовирусы широко распространены у
клинически здоровой птицы. Выделение аденовируса от больной птицы еще не
указывает на его этиологическую роль.
Синдром снижения яйценоскости (ССЯ 76). Заболевание характеризуется
тем, что птица не может достичь ожидаемого уровня яйценоскости или, достиг-
нув, удержать его. Первыми признаками являются потеря пигмента скорлупой и
снесение яиц с тонкой или мягкой скорлупой либо вовсе без нее. ССЯ обычно
наблюдается в период пика яичной продуктивности, с которым связана актива-
ция латентной вирусной инфекции. Вирусные антигены обнаруживали только в
яичниках и яйцеводах, а типичные поражения — в яйцеводах.
Возбудителем синдрома ССЯ является аденовирус ВС-14. Это природный
аденовирус уток, который заражает кур. Он значительно лучше размножается в
эмбрионах и культурах клеток утиного, чем куриного происхождения. Размно-
жается в пищеварительном тракте и выделяется с пометом, может передаваться
трансовариально.
Болезнь (ССЯ) регистрируют у кур, уток и гусей. Заболевание вызывается
тремя аденовирусами, которые агглютинируют эритроциты кур. Один из них вы-
зывает классический ССЯ во многих странах, другой — у уток в Англии, третий —
ССЯ в Австралии. Вирус размножается с высоким титром в КЭ и в культурах кле-
ток кур, уток и гусей (культуры клеток почек цыплят или печени эмбрионов).
Главный путь распространения вируса — зараженные яйца.
Обычно соотношение зараженных и незаряженных эмбрионов низкое. У
цыплят, выведенных из зараженных яиц, обычно не образуется антител, однако
они могут выделять вирус в течение нескольких дней, заражая других цыплят. Во
взрослом состоянии у них не наблюдается синдрома снижения яйценоскости.
Когда у таких особей начинается период яйценоскости, они становятся вирусо-
носителями и выделяют вирус. Клиническая картина болезни зависит от иммун-
ной прослойки. Если в стаде она мала, то возникает довольно острая вспышка
заболевания. Если в стаде у многих особей имеются антитела, то поголовье ока-
жется устойчивым к повторному возникновению заболевания.
Обычно куры болеют в течение 4—15 недель (некоторые особи 3—16 дней), а
затем выздоравливают и несут нормальные яйца. В борьбе с заболеванием при-
меняют эффективные вакцины. Птицу вакцинируют внутримышечно в 14—18-
недельном возрасте. Вакцинация сокращает сроки вирусоносительства, а также
продолжительность и интенсивность экскреции вируса с фекалиями после экс-
периментального заражения. Иммунизация птицы в хозяйстве препятствует рас-
пространению вируса и развитию заболевания. Яйценоскость у вакцинирован-
ной птицы увеличивалась на 20% по сравнению с непривитыми. Выраженной
антигенностью и иммуногенностью обладала инактивированная эмульгирован-
ная вакцина из вирулентного штамма НР-1, размноженного в утиных эмбрио-
нах. Разработана инактивированная эмульгированная вакцина против синдрома
снижения яйценоскости, ньюкаслской болезни и инфекционного бронхита кур.
Вакцина при однократном внутримышечном введении вызывала у 6-месячных
цыплят, свободных от патогенных возбудителей, образование высокого титра
антител и протективный эффект ко всем трем вирусам.
Инактивированную вакцину применяют до периода яйцекладки. Однако
она скорее снижает заболеваемость, но не ликвидирует болезнь. Иммуноген-
ность вакцины зависит от содержания ГА-антигена. Вакцина с ГА-активностью
10—13 log2 обладала выраженным протективным действием для 3,5 месячных
цыплят [90].
Геморрагический энтерит индеек (ГЭИ)
Заболевание поражает преимущественно индюков в возрасте 6—12 недель и
клинически проявляется в форме геморрагической диареи, смертность обычно в
пределах 1—3%, но иногда достигает 50—60%. Заболевание протекает эпизооти-
чески в США и ряде стран Европы [1236]. Ежегодный ущерб в США составляет
9—10 млн долларов. Возбудителем ГЭИ является аденовирус индеек. Он размно-
жается в лимфоидных клетках, обладает иммуносупрессивным действием и вы-
зывает поражение селезенки у кур и фазанов [1139].
Переболевание или латентное инфицирование сопровождается длительным
иммунитетом. Материнские антитела сохраняются у потомства в течение 4 не-
дель.
Для профилактики применяют аттенуированный вирус, размноженный в
первичной культуре клеток селезенки или в культуре лимфобластоидных клеток
индеек.
Инактивированную БПЛ эмульгированую вакцину готовили из вируса пято-
го пассажа (с титром 5,0 1g ИД50/мл). При подкожном введении вакцина вызы-
вала образование антител у 90% индюков и имела выраженную иммуногенность.
Наиболее перспективной оказалась живая вакцина из аттенуированного штамма
вируса.
Живую вакцину (2x104 ТИД/мл) вводили индюкам 4,5-5-недельного
возраста с питьевой водой с таким расчетом, чтобы каждая птица получила
100-160 ТИД вируса. Сероконверсия наступила у 88-90% вакцинированных ин-
дюшат. Вся вакцинированная птица была иммунна в экспериментальных и про-
изводственных условиях.
Инфекционный гепатит собак (ИГС)
Контагиозное заболевание, напоминающее чуму плотоядных, протекающее
с поражением печени и, реже, почек. Кроме собак, к ИГС восприимчивы лиси-
цы (энцефалит), волки и еноты.
Вирус проникает через слизистые, в том числе через конъюнктиву, и перво-
начально размножается в криптах миндалин и пейеровых бляшках.
Главным источником распространения болезни является выделение вируса с
мочой, фекалиями и слюной. Реконвалесценты выделяют вирус с мочой до 6 ме-
сяцев.
Иммунитет у реконвалесцентов сохраняется примерно в течение года. От
иммунизированных матерей новорожденные щенки с молозивом приобретают
пассивный иммунитет, обеспечивающий хотя и эффективную, но кратковре-
менную защиту против инфекции. Если мать одновременно с антителами выде-
ляет вирус, то это может обеспечить развитие активного иммунитета у новорож-
денного. Для активной иммунизации ИГС применяют инактивированные и жи-
вые вакцины. Первые готовят из вируса, размноженного в культуре клеток
почки собак, инактивированного формалином и адсорбированного на ГОА.
Живые вакцины готовят из вируса, аттенуированного серийными пассажами
в культуре клеток гетерологичных видов животных. Аттенуация приводит не
только к потере вирулентности, но и к потере тропизма к почкам. Иммунитет
после вакцинации длится около года. В практике применяют исключительно
комбинированные вакцины против наиболее опасных заболеваний собак и ли-
сиц (ИГС, чума, бешенство, лептоспироз и др.).
В течение многих лет используют инактивированные и живые вакцины из
аденовируса собак серотипа 2, который в силу тесного антигенного родства с ви-
русом серотипа 1 одинаково хорошо защищает собак против вируса обоих серо-
типов. Ревакцинацию проводят ежегодно. Материнские антитела интерфериру-
ют с активным иммунитетом у щенков в течение 3—4 месяцев.
Одним из примечательных феноменов в практике специфической профи-
лактики ИГС явилось исчезновение болезни в регионах, где иммунизацию собак
проводили живой вакциной в течение многих лет. Это было связано с выделени-
ем вакцинного вируса привитыми собаками, повторной контактной ревакцина-
цией многих собак в естественных условиях и созданием высокого уровня груп-
пового иммунитета.
10.6. Полиомавирусы
Семейство полиомавирусы включает вирусы полиомы, обезьян (SV40, SA12),
кроликов (RKV), мышей (К) и человека (ВК, JC). Вирионы полиомавирусов
представляют собой безоболочные частицы кубической симметрии диаметром
45 нм. Капсид имеет двадцатигранную структуру, состоящую из 72 капсомеров,
расположенных на вершинах икосаэдра, из которых 60 являются гексонами и
12 — пентонами. Липидов и углеводов в составе вирионов не обнаружено. По-
лиомавирусы содержат одну циркулярную суперспирализованную ДНК разме-
ром 5 тпн.
Белки составляют 88—90% массы вириона. В вирионах SV40 и других полио-
мавирусов обнаружено три полипептида с молекулярной массой 21—48 кб (табл.
30).
Полиомавирусы обладают высокой хозяинной специфичностью, и многие
из них способны вызывать опухоли как в естественных условиях, так и при экс-
периментальном заражении.
Капсиды полиомавирусов содержат три белка VP1, VP2 и VP3, которые окру-
жают одну молекулу ДНК. Основным белком полиомавирусов является поли-
пептид VP1, на долю которого приходится примерно 70% всех белков вириона;
он тесно связан с вирусной ДНК. Структурные белки VP2 и VP3 находятся в ви-
рионе в небольшом количестве: VP3 составляет шестую-седьмую часть молеку-
лярного количества VP1, a VP2 — четвертую часть молекулярного количества
VP3. Установлено, что VP3 является С-концевой частью белка VP2. Белки VP2,
VP3 вируса SV40 гомологичны соответствующим белкам вируса полиомы на
34%, а основной белок капсида (VP1) — на 54%.
Вирусная ДНК объединена с клеточными гистонами Н2А, Н2В, НЗ и Н4 в
форме хроматина. Икосаэдральный капсид, содержащий 360 молекул главного
капсидного белка VP1, организован в 72 пентаметра, одиночные молекулы VP2
или VP3 связаны с каждым пептаметром. Полиомавирусы известны как мелкие
ДНК опухолевые вирусы. Эти вирусы могут трансформировать клетки первичной
культуры, превращая их в перевиваемые линии и вызывать опухоли у животных.
Синтез ДНК полиомавирусов начинается с одного уникального места репли-
кации и продолжается двунаправленно, вдоль циркулярной родительской ДНК.
Двунаправленная репликация, пройдя пол-
ный круг циркулярной геномной ДНК, за-
вершается образованием потомства цирку-
лярной ДНК, которое отделяется.
Вирионы формируются в ядре и осво-
бождаются с гибелью клеток. Некоторые
клетки проявляют характерный цитопати-
ческий эффект с вакуолизацией цитоплаз-
мы. В инфицированной клетке могут син-
тезироваться 10 000-100 000 вирионов.
Таблица 31. Структурные белки
полиомавирусов
Белки Молекулярная масса, кД
SV40 Вирус полиомы
VP1 43-48 45-46
VP2 30-39 31-35
VP3 23-27 21-23
Около 60% сывороток КРС, включая сыворотки эмбрионов и новорожден-
ных телят, содержат палиомавирус КРС, который хорошо размножается в куль-
туре клеток почки обезьян. В Голландии около 60% ветеринарных работников
имели антитела к этому вирусу [1135].
10.7. Папилломавирусы
Мелкие ДНК вирусы, которые индуцируют бородавки у различных высших
позвоночных, включая человека. Папилломавирусам свойственна латенция.
Спонтанная регрессия папиллом является необычным явлением. Она не пред-
сказуема, и папилломы могут появиться вновь. Папилломавирусы различаются
по спектру хозяев и нуклеотидной последовательности ДНК. Папилломавирусы
включают вирусы папилломы кроликов (папиллома Шоупа, прототипный ви-
рус), папиллом человека, крупного рогатого скота, лошадей, оленей, овец, коз,
собак и хомяков. Новым типом вируса считается вирус, у которого гомология
ДНК с другими вирусами того же вида <50%. Если гомология >50%, но <100%,
вирус считается новым подтипом и обозначается порядковым номером. Соглас-
но этому критерию идентифицировано 6 типов папилломавирусов КРС, 2 типа у
лошадей и 77 типов у человека. Папилломавирусы обнаружены у других видов
животных (обезьян, собак, оленей, слонов, мышей и др.). ДНК папилломавиру-
сов различных видов животных обладает лишь небольшой степенью гомологии.
Различают две группы ПВ КРС: вирусы 1, 2 и 5 связаны иммунологически, име-
ют одинаковый размер генома и сходную нуклеотидную последовательность
ДНК; вирусы 3, 4 и 6 имеют небольшие геномы и сходную нуклеотидную после-
довательность ДНК и связаны лишь отдаленно.
За немногими исключениями, папилломавирусы не размножаются в культу-
ре клеток, но могут вызывать трансформацию клеток in vitro. Частота трансфор-
мации клеток обычно не превышает 2—3%.
Таблица 32. Хозяинный ответ на инфицирование папилломавирусами животными
[1203]
Характер ответа хозяина Вирус
Группа I Кожная неоплазия (кожная папиллома) Папилломавирусы 3 и 6 КРС, лошадей и кроликов
Группа 2 Гиперплазия нормального эпителия или метаплазия слущивающегося эпителия Папилломавирус КРС 4 или вирус оральной папилломы собак
Группа 3 Кожная папиллома с фибромой подлежащей соединительной ткани Папилломавирусы КРС 1,2 и 5
ДНК многих ПВ инфицирует животных. Инфекционные вирионы образу-
ются только в эпителиальных клетках на конечной стадии их дифференциации.
ПВ — безоболочные сферические вирионы икосаэдрической симметрии ди-
аметром 45 нм. Капсид состоит из двух структурных белков. Основной капсид-
ный белок L1 (~55 КД) составляет около 80% массы вирионного белка. Минор-
ный белок L2 имеет массу ~70 КД. Геном представлен циркулярной двухцепо-
чечной суперспирализованной ДНК размером 8 тпн с ковалентно замкнутыми
концами, обладающей инфекционностью. Вирулентная ДНК связана с клеточ-
ными гистонами, образуя хроматинподобный комплекс. Папилломавирусы мо-
гут образовывать дефектные интерферирующие частицы (Диг) [2597].
Репродукция вируса происходит в ядре клетки. В процессе репликации
транскрибируется только одна цепь вирусной ДНК. Интегрированная эписо-
мальная ДНК вируса может быть онкогенной.
Репликация папилломавирусов тесно связана с ростом и дифференциацией
клеток кожи или слизистой оболочки. Вирусиндуцированная гиперплазия, вы-
званная продуктами ранних вирусных генов, ведет к усилению деления базаль-
ных клеток и задерживает их созревание. Они составляют основную массу па-
пиллом. Поздние вирусные гены кодируют капсидные белки. Вирионы образу-
ются в стадии клеточной дифференциации клеток и, накапливаясь в большом
количестве, вызывают цитопатологию.
Вирионы связываются с клеточными рецепторами, проникают в клетки пу-
тем эндоцитоза, транспортируются в ядро клетки, где освобождается вирусный
геном. При продуктивной инфекции транскрипция генома разделяется на ран-
нюю и позднюю стадии, которые кодируются областями, контролируемыми от-
дельными промоторами, расположенными на одной из цепей ДНК. Половина
генома, содержащая поздние гены, транскрибируется с образованием мРНК, на
которых синтезируются ферменты, связанные с репликацией вируса. Поздние
мРНК, на которых синтезируются вирионные белки, транскрибируются на дру-
гой половине вирусного генома после начала его синтеза. Потомство вирусной
ДНК служит дополнительными матрицами, увеличивающими продукцию
структурных белков.
Среди папилломавирусов животных наиболее изучен вирус папилломы кро-
ликов. В естественных условиях он вызывает образование доброкачественных
опухолей эпителиального происхождения в различных участках тела диких аме-
риканских и домашних кроликов. Членистоногие — механические переносчики
вируса. Экспериментальную инфекцию легко вызывать у домашних кроликов и
зайцев. У зараженных животных развиваются сходные опухоли, которые чаще,
чем у диких американских кроликов, превращаются в злокачественные. Различ-
ные изменения содержат сходные антигены. Антигенное родство между вирусом
папилломы кроликов и папилломавирусами крупного рогатого скота, собак, а
также человека не установлено. Вирус папилломы кроликов имеет выраженную
антигенную активность и индуцирует синтез нейтрализующих и комплементсвя-
зывающих антител. С помощью МАТ в белке вируса папилломы 1 типа крупного
рогатого скота выявлены конформационные и линейные эпитопы. Белок L1 яв-
ляется потенциальным иммуногеном, так как содержит иммунодоминантные,
нейтрализующие эпитопы. Жизненный цикл вируса совершается в созревающих
кератиноцитах, и вирионы освобождаются со слущивающимися клетками. Веро-
ятно, поэтому иммунный ответ на вирусные антигены в инфицированном орга-
низме является минимальным. Т-клеточный ответ кажется наиболее важным,
тогда как антитела помогают предотвращать распространение инфекции и сни-
жают возможность реинфицирования. Регрессия инфекции и устойчивость к ре-
инфицированию, вероятно, являются типоспецифическим явлением [984].
Папилломы развиваются после проникновения вируса в кожу. Развивается
гиперплазия с последующей дегенерацией и гиперкеритозом. Эти изменения
обычно начинаются через 4—6 недель после заражения.
Фибропапилломы, как правило, сохраняются 4—6 месяцев перед спонтан-
ной регрессией; множественные бородавки обычно регрессируют одновремен-
но. Эта стадия характеризуется цитопатологией размножения вируса и образова-
нием кристаллических агрегатов вирионов в местах кожных поражений.
Папилломавирусы КРС 1 и 2 и ДНК, выделенная из них, могут трансформи-
ровать клетки in vitro. В отличие от других трансформирующих вирусов, ДНК
папилломавирусов остается эписомальной и редко включается в геном клетки.
Гены, экспрессируемые в таких клетках, кодируют белки, связанные с реплика-
цией и регуляцией транскрипции вируса, так же как белки, которые непосредст-
венно влияют на трансформацию клеток. Совместно с кофакторами, папилло-
мавирусы могут вызывать карципомы у КРС, кроликов и человека [1203].
Уровень ВН-антител, по-видимому, коррелирует с регрессией кожных изме-
нений и защитой против реинфекции.
Специфическая профилактика папилломавирусных инфекций не разработа-
на. Вакцинация белками вирусного капсида, полученными на основе рекомби-
нантной ДНК технологии, была обнадеживающей. Трудность состоит в том, что
вакцина должна содержать много типов вируса, т.к. перекрестная (межтиповая)
защита отсутствует.
Антитела к капсидным вирусным белкам L1 и L2 могут нейтрализовать вне-
клеточный вирус и защитить чувствительных животных от первичной инфек-
ции. Идеальная вакцина, однако, должна вызывать регрессию патологических
изменений, т.е. обладать терапевтическим действием и предохранять от любого
проявления инфекции.
Решение задачи специфической профилактики осложняется отсутствием
типоспецифических диагностических серологических тестов и невозможностью
размножения папилломавирусов в культуре клеток.
ПВ КРС включают различные типы, инфицирующие кожные покровы
(BPV1 и BPV2) или слизистые (BPV4). По структуре генома ПВ КРС подобен ПВ
человека.
Иммунитет к ПВ КРС может быть вызван введением очищенного вируса или
экстракта бородавок КРС [442, 845]. Он коррелирует с высоким титром нейтра-
лизующих антител и является в основном типоспецифическим [845, 846]. Для
того чтобы вакцина имела широкий защитный спектр, она должна включать ан-
тигены нескольких типов вируса.
Парэнтеральное, но не внутрикожное введение папилломавируса Шопа кро-
ликам защищает их от развития папиллом, но не вызывает их регрессии у пора-
женных кроликов. Защитный эффект связан с белками L1 и L2, экспрессирован-
ными в разных системах, и сопровождается образованием нейтрализующих ан-
тител [489, 967]. Такой иммунитет защищает против инфекционного вируса, но
не оказывает влияния на инфицированные клетки. Однако кролики, у которых
папилломы спонтанно регрессировали полностью, устойчивы к реинфекции ви-
русом или его ДНК. Кроме того, «теропевтический» эффект такого иммунитета
может быть вызван или усилен экстрактом папиллом [650, 651].
10,8. Цирковирусы
Включают один одноименный род, в который входят вирус анемии цыплят
(типовой вид), цирковирус свиней и попугаев. Эти вирусы не связаны между со-
бой антигенно и не имеют нуклеотидной гомологии. Некоторые вирусы расте-
ний имеют те же свойства, что и цирковирусы животных [248, 1047]. Цирковирус
свиней, вначале обнаруженный как нецитопатогенный вариант, спонтанно кон-
таминировавший линию клеток РК-15, получил название цирковирус свиней 1
(ЦВС-1). Позже был выделен цирковирус от поросят, который получил название
цирковирус свиней 2 (ЦВС-2). Члены семейства имеют сходное строение вири-
онов и генома, но различаются между собой по гомологии генома, биологичес-
ким и антигенным свойствам [1527]. ЦВС 2 преимущественно ассоциирован с
синдромом мультисистемного истощения поросят отъемного возраста. Патоген-
ность ЦВС2 проявляется на фоне других вирусных заболеваний, таких как пар-
вовирусная инфекция и репродуктивно-респираторный синдром [236]. ЦВС2
может передаваться вертикально.
Цирковирусы представляют собой безоболочечные, сферические, икосаэнд-
ральной симметрии вирионы диаметром 17—22 нм (вирус анемии цыплят имеет
более крупные вирионы — 22 нм). Капсид вирионов состоит из 32 капсомеров и
имеет один главный структурный белок. Вирионы устойчивы к жирорастворите-
лям и кислой среде (рН=3,0). Геном цирковирусов представлен одной молекулой
циркулярной одноцепочечной ДНК размером 1,7—2,3 тн. Геномы ЦВС-1 и
ЦВС-2 представлены соответственно 1759 и 1768 нуклеотидами, гомология их
последовательности составляет 76% [248]. Геномная ДНК цирковирусов репли-
цируется, по-видимому, по кругу от петлеобразной структуры [1135]. Вирус ане-
мии цыплят, в отличие от других цирковирусов, обладает однонапревленной
стратегией транскрипции вирусного генома. Вся генетическая информация
этого вируса кодируется позитивной цепью. В его геноме различают три откры-
тые рамки считывания, которые кодируют главный структурный белок (52 кД) и
минорный белок (13 кД), названный апотином. Последний вызывает апоптоз
Т-лимфоцитов и рассматривается как важный фактор в патогенезе анемии цып-
лят [1527]. В геноме ЦВС-2 имеются две основные рамки считывания и обнару-
жен только один капсидный белок 30 кД, состоящий из 233 аминокислот [248].
Вирус анемии цыплят имеет один серотип. Продуктом трансляции генома
является полипротеин, который расщепляется с образованием зрелых белков.
Цирковирусы размножаются в ядре, и вероятно, подобно парвовирусам, этот
процесс зависит от S-фазы клеточного цикла. Размножение цирковирусов со-
провождается образованием в цитоплазме или ядре полиморфных включений,
иногда напоминающих паракристаллические структуры. Эти включения, веро-
ятно, являются местами синтеза структурных вирусных компонентов или фор-
мирования вирионов [1456].
Двухцепочечная репликативная форма ДНК цирковируса свиней и циркови-
руса анемии цыплят обладает инфекционностью (2596). Цирковирусы размно-
жаются в основном в макрофагах и моноцитах и вызывают подавление иммун-
ной системы, что отчетливо установлено при изучении анемии цыплят. Наруше-
ние иммунной системы наиболее выражено при инфицировании молодых
животных и часто способствует развитию вторичных инфекций.
Методы специфической профилактики цирковирусных инфекций свиней и
цыплят практически не разработаны. Хотя имеется живая вакцина против ане-
мии цыплят [450]. Профилактика заболеваний основана на охране животных от
заноса возбудителей инфекции. Из неблагополучных хозяйств заболевших и се-
ропозитивных животных удаляют, однако эффективность этих мероприятий
очень низка, так как цирковирусы устойчивы к различным дезинфектантам и
длительно сохраняются в окружающей среде [1527].
10.9. Парвовирусы
Семейство парвовирусов (parvus - маленький) включает в себя три рода: пар-
вовирусы, депендовирусы и эритровирусы.
К роду парвовирусы относятся: вирус крыс, или вирус Килхема (прототип-
ный вирус), парвовирусы свиней, крупного рогатого скота, лошадей, собак,
кроликов, кур, вирусы энтерита норок и гусей, алеутской болезни норок, пан-
лейкопении кошек, мелкий вирус мышей, а также вирусы, происхождение ко-
торых не выяснено. В род эритровирусы включен парвовирус человека (В 19),
вызывающий апластические кризы при хронической анемии и являющийся
этиологическим агентом инфекционной эритемы детей. Возможными предста-
вителями рода являются парвовирусы обезьян и бурундуков. Род депендовиру-
сов объединяет аденоассоциированные вирусы (ААВ) человека и обезьян (пять
типов), крупного рогатого скота, собак и птиц. Типовой вид — ААВ типа I. Воз-
можными представителями рода являются ААВ лошадей и овец. Депендовиру-
сы, в отличие от других парвовирусов — дефектны, то есть размножаются толь-
ко в присутствии вирусов-помощников, роль которых выполняют аденовирусы
или герпесвирусы [138].
Недефектные парвовирусы вызывают у животных энтериты, гепатиты, мио-
кардиты, геморрагическую энцефалопатию, панлейкопению, гибель эмбрионов
и плодов, отставание в росте, подавляют гемопоэз, лимфопоэз и иммунный от-
вет. Дефектные парвовирусы не оказывают какого-либо клинически выражен-
ного эффекта.
Вирионы парвовирусов представляют собой безоболочечные изометричес-
кие частицы с кубической симметрией диаметром 25 нм. Это довольно мелкие
вирусы животных. Капсид парвовирусов состоит из 32 капсомеров диаметром
3—4 нм. Парвовирусы содержат одноцепочечную линейную ДНК размером 5,2
тн (19—32% массы вирионов).
Парвовирусы содержат 63—81% белков. Сравнительным анализом некото-
рых автономных парвовирусов обнаружено различие в их структурных белках.
Парвовирусы собак (ПВС), свиней (ПВСв), кошек (ПВК) и мышей (ПВМ) со-
держат по три структурных полипептида VP1, VP2, VP3 с молекулярной массой
соответственно 79—82; 65—66 и 62—63 кД. Парвовирус крупного рогатого скота
содержит четыре полипептида VP1, VP2, VP3 и VP4 с молекулярной массой со-
ответственно 74,5; 67, 62 и 57 кД [1242]. Следует отметить, что у парвовируса сви-
ней, выделенного при диарее (штамм Н-45), также обнаружено четыре структур-
ных полипептида (81, 70, 66 и 62 кД) [1698]. Основным белком у парвовирусов
млекопитающих является VP3, на долю которого приходится около 80% массы
вирионных белков.
Капсид содержит 60 молекул белка VP2 (65 кД) и небольшое количество мо-
лекул VP1 (84 кД). VP1 и VP2 образуются альтернативным сплайсингом одной
мРНК и полной последовательности VP2. Третий структурный белок VP3 обра-
зуется в полных (ДНК-содержащих) капсидах путем отщепления 15—20 амино-
кислот от аминоконца VP2. Зависимость размножения парвовируса от стадии
клеточного цикла указывает на зависимость его репликации от репликации кле-
точной ДНК. Вирионы не содержат полимеразы, но способны кодировать такой
фермент. Вместо этого используется клеточная полимераза II для транскрипции
вирусной ДНК в двухспиральную промежуточную структуру, которая затем ис-
пользуется как матрица для других клеточных ферментов, катализирующих
транскрипцию вирусных мРНК. Альтернативный сплайсинг структур приводит
к увеличению отдельных видов мРНК, которые транслируются в большое коли-
чество различных белков. Наиболее обильный пул представлен мРНК, кодируе-
мыми З'-половиной генома, управляющей синтезом структурных белков. Нест-
руктурный белок NS1, кодируемый 5'-половиной генома, также образуется в
очень большом количестве и выполняет многие функции:
1) он связан с ДНК и требуется для репликации вирусной ДНК;
2) выполняет роль геликазы;
3) служит эндонуклеазой;
4) интерферирует с репликацией клеточной ДНК.
Эта активность ведет к остановке деления клеток в S фазе. Механизм репли-
кации генома является удивительно комплексным. З'-конец геномной (—) ДНК
служит полупраймером для начала синтеза двуцепочечной циркулярной ДНК в
качестве репликативного предшественника.
Одной из особенностей репликации геномной ДНК являлось образование
димерной формы репликативного предшественника с последующим синтезом
тетрамерной структуры, состоящей из двух полностью позитивных и двух полно-
стью негативных цепей вирусной ДНК, которые с помощью эндонуклеазы пре-
вращаются в одноцепочечные молекулы, в том числе в потомство вирусной ДН К.
Парвовирусы размножаются в ядре клеток, находящихся в поздней S фазе
или ранней G2 фазе цикла клеточного деления. Такая особенность репликации
парвовирусов является основой многих аспектов патогенеза. Это прежде всего
поражение тканей в период эмбрионального развития и у молодых животных, а
также клеток лимфоидных органов и эпителия кишечника, которые постоянно
находятся в стадии деления. Авирулентный штамм вируса алеутской болезни но-
рок легко адаптировался к размножению в клеточной линии FS (клетки селезен-
ки кошки) [196].
Парвовирус собак может размножаться в клетках собак и кошек, но парвови-
рус кошек — только в клетках кошек. Парвовирусы кошек и норок не различают-
ся антигенно в РТГА и PH, но отличаются от парвовируса собак. Эти три вируса
различаются нуклеиновой последовательностью геномной ДНК.
Антигенная структура парвовирусов недостаточно изучена. Большинство из
них обладают ГА-активностью. Общие представления об антигенной структуре
разных видов парвовирусов основаны на сравнительном изучении степени их
родства в PH, РСК, РТГА методом флуоресцирующих антител и иммунопре-
ципитации. У многих парвовирусов выявлено антигенное сходство вирионных
белков вследствие наличия протяженных гомологичных участков в структуре их
геномов.
По данным МФА и иммунопреципитации, антигенные связи выявлены у
ПВМ, ПВСв, ПВС, ПВК [1057, 1058]. При анализе в PH антигенное родство бы-
ло выраженным у ПВС и ПВК, а у остальных парвовирусов менее отчетливым
[1057].
Слабое антигенное родство обнаружено у ПВС и ПВСв [138]. Белки ПВКРС
(три серотипа) антигенно отличались от белков остальных парвовирусов [1058].
Установлено генетическое и биологическое родство между вирусами панлейко-
пении кошек (ПВК) и вирусом энтерита норок (ВЭН) [1209], а также между пар-
вовирусами собак, норок и енотов. Высказано предположение, что ПВС, ВЭН и
парвовирус енотов являются хозяинными вариантами вируса панлейкопении
кошек [1416].
Антисыворотка к каждому вирионному белку ПВСв нейтрализует инфекци-
онность полных вирионов и взаимодействует со всеми тремя структурными бел-
ками данного вируса. Эти результаты свидетельствуют о том, что вируснейтрали-
зующие антигенные детерминанты имеются во всех структурных белках ПВСв
[1058]. Тесная антигенная взаимосвязь между структурными белками обнаружена
также у вируса алеутской болезни норок [1460] и, возможно, является характер-
ной особенностью других парвовирусов. Полагают, что капсидные белки парво-
вирусов обладают не менее чем двумя антигенными участками, представленными
несколькими перекрывающимися эпитопами [1416]. Однако в опытах с парвови-
русом человека В19 отмечена иная ситуация. Продукция ВН-антител наблюда-
лась лишь при иммунизации животных капсидными препаратами, содержащими
одновременно VP1 и VP2. Капсиды, содержащие только VP2, не вызывали обра-
зования таких антител, несмотря на то, что уникальный участок VP2 экспониро-
ван на поверхности капсида и содержит эпитопы нейтрализации [1331].
Парвовирус собаки вирус панлейкопении кошек (ПЛ К) имели лишь неболь-
шие различия в структуре генома (гомология 99%). Тем не менее вирус ПЛК раз-
множался только в культуре клеток кошек, тогда как парвовирус собак — в боль-
шинстве культур клеток собак и кошек. Выявлены специфические для клеток
кошек детерминанты, определяющие круг хозяев. Введение двух нуклеотидных
остатков парвовируса собак в область гена капсидного белка VP1 вируса ПЛК
придало ему способность размножаться в культуре клеток собак.
До недавнего времени было принято считать, что вирус алеутской болезни
норок не нейтрализуется специфическими антителами естественного хозяина in
vivo и in vitro. Однако после обработки вируса н-бутанолом, фильтрации через
мелкопористые мембраны (диаметр пор 0,05 мкм) основная масса его (>95%)
быстро нейтрализуется антителами при 37°С, хотя резистентная фракция вируса
сохраняет инфекционность. С помощью моноклональных антител эпитопы ней-
трализации вируса обнаружены на вирионных белках 75 и 85 кД [1460].
Парвовирусы в естественных условиях поражают животных многих видов и
птицу. Парвовирусы, патогенные для одного вида животных, как правило, не вы-
зывают заболевания у животных других видов. Исключение составляют ПВ пло-
тоядных и птиц. Заболевания парвовирусной этиологии широко распростране-
ны в мире и наносят существенный ущерб здоровью животных. К таким болез-
ням прежде всего следует отнести парвовирусную инфекцию свиней (ПВИСв),
собак (ПВИС), вирусный энтерит гусей (ВЭГ), вирусный энтерит норок (ВЭН),
алеутскую болезнь норок (АБН) и панлейкопению кошек. Против большинства
из этих болезней разработаны достаточно эффективные средства активной про-
филактики.
Парвовирусная инфекция свиней (ПВИСв)
Парвовирусная инфекция свиней (ПВИСв) характеризуется нарушением
воспроизводительной функции свиноматок: малочисленные пометы, гибель эм-
брионов и плодов с рассасыванием и мумификацией, рождение мертвых плодов,
бесплодие, повторный приход в охоту, гибель новорожденных и, реже, аборты.
Свиньи, инфицированные в постнатальный период, практически не проявляют
клинических признаков заболевания, хотя в течение 7—14 дней выделяют вирус
с мочой, фекалиями и слюной, после чего сохраняют иммунитет пожизненно.
Трансплацентарная передача вируса плодам и эмбрионам происходит во время
виремии у неиммунных матерей после первичного инфицирования. Вирус раз-
множается в основном в пролиферирующих тканях, и в первую очередь в пла-
центе и плодах.
Эмбрионы, инфицированные в возрасте до 36 дней, погибают и рассасыва-
ются. Заражение плодов между 36—70-м днями беременности ведет к их гибели
и мумификации, а иногда у них развивается иммунотолерантность с пожизнен-
ным выделением вируса без продукции антител. Когда плоды инфицируются в
более поздней стадии беременности, большинство из них реагирует лишь обра-
зованием антител. Основную роль в защите против парвовирусной инфекции
свиней играет гуморальный иммунитет, и для полной защиты требуется доволь-
но высокий уровень антител [138].
В настоящее время основное средство борьбы с ПВИСв — специфическая
профилактика, проводимая главным образом с помощью инактивированных
вакцин, которыми иммунизируют молодых свиноматок не позже 30-го дня до
первого оплодотворения.
Инактивированные вакцины готовят из вирулентных штаммов вируса, раз-
множенных в различных культурах клеток свиней.
В США инактивированную вакцину готовили из вируса, выращенного в пер-
вичной культуре клеток почек эмбриона свиньи, которую заражали вирусом с
активностью 108 ТКИД50/мл (512 ед. ГА/0,5 мл).
Вирус инактивировали АЭИ (0,3%, 4 ч, 37°С), а затем добавляли ГОА. Инак-
тивация вируса не сопровождалась заметным снижением ГА и антигенной ак-
тивности. Вакцинация молодых супоросных свиней создавала выраженный им-
мунитет, предохраняла от трансплацентарной передачи вируса плодам и наруше-
ния репродукции после заражения. Из 69 поросят живыми остались 68. Ни один
из них не имел ни вируса, ни антител. Защита обеспечивалась, несмотря на низ-
кий уровень антигемагглютинирующих антител у некоторых животных (>1:10) в
момент заражения. Значительное нарастание антител после контрольного зара-
жения и отсутствие трансплацентарной инфекции свидетельствовали о размно-
жении вируса только на месте аппликации (нос, рот).
В Дании при изготовлении аналогичной вакцины вирус инактивировали
этиленимином (5 гпМ, 26°С, 48 ч). Антигенность вакцины, по мнению авторов,
была обусловлена главным образом пустыми вирусными частицами.
Молодых свиноматок прививали подкожно в дозе 2 и 1 мл дважды с интер-
валом 3 недели. Примерно на 40-й день беременности свиноматок заражали вну-
тривенно вирулентным штаммом вируса. После первой и второй прививок титр
антител в РТГА соответственно составлял 1:64 — 1:128 и 1:512 — 1:1024. На 90-й
день беременности все 53 плода семи вакцинированных свиноматок оказались
живыми и свободными от вируса. Хотя у пяти из семи вакцинированных свиней
после заражения наблюдали 2—8-кратное повышение титра антител, свидетель-
ствующее о размножении вируса, однако трансплацентарной передачи его и ги-
бели плодов не отмечали. Испытание вакцины в полевых условиях показало ее
безопасность и антигенную активность.
В Австралии вирус для инактивированной вакцины выращивали в первич-
ной культуре клеток почки свиньи (256 ед. ГА/мл), инактивировали формалином
(0,5%, 25°С, 120 ч) или бета-пропиолактоном (0,2%, 2 ч, 37°С и 4 ч при 25°С). Ан-
тигенность вакцины после добавления ГОА повышалась в 8 и более раз [972]. В
полевых опытах через 4 недели после прививки ГОА-формолвакциной в дозе
5 мл у молодых свиноматок титр антител в РТГА был в пределах 1:128 — 1:512.
Повторная вакцинация через две недели вызвала 2—16-кратный прирост титра
антител в течение последующих двух недель. Ревакцинация через 6 мес. сопро-
вождалась повышением титра антител в РТГА от 1:128 до 1:2048.
В Великобритании применяют инактивированную культуральную вакцину,
которой прививают свиноматок и молодых свиней за 2—8 недель перед осемене-
нием. Хряков прививают в 6—7-месячном возрасте, а затем два раза в год. Вак-
цину вводят в дозе 2 мл внутримышечно. Ревакцинация свинок перед вторым
осеменением сопровождается более продолжительным иммунитетом, чем перед
первым [138].
В России инактивированную эмульгированную вакцину готовят из высоко-
антигенного сырья (>512 ед. ГА/мл), полученного в культуре постоянной линии
клеток почки свиньи с использованием простой питательной среды и коммерче-
ской сыворотки крупного рогатого скота. Вакцину вводят свиноматкам одно-
кратно внутримышечно в дозе 3 мл за 3—4 недели до осеменения. Ревакцинацию
проводят перед каждым осеменением. Вакцинация создает у свиноматок выра-
женный иммунитет и предупреждает передачу вируса эмбрионам и плодам. Ан-
тигенная активность вакцины не уступала аналогичным вакцинам зарубежных
фирм [138].
Вакцины против ПВИС, инактивированные формалином или производны-
ми этиленимина, обладали сходной антигенной активностью. Эмульгированная
вакцина обладала большей активностью, чем сорбированная. При 2—4°С вакци-
на сохраняла исходную антигенность в течение двух лет [319]. При двукратном
применении инактивированной эмульгированной вакцины постоянный уро-
вень антител сохранялся 13 мес. [1585]. Свиноматки, привитые инактивирован-
ной эмульгированной вакциной, обеспечивали высокий уровень колострально-
го иммунитета у поросят в трех последовательно полученных пометах.
Материнские антитела несколько подавляют образование антител в ответ на
введение вакцины, но практически не влияют на выработку иммунитета. Испы-
тания трех инактивированных вакцин на свиньях первого опороса показали, что
неспособность некоторых инактивированных вакцин вызывать образование ан-
тигемагглютининов в высоком титре не обязательно свидетельствует об их сла-
бой иммуногенности [625].
Важным направлением в профилактике парвовирусной инфекции свиней
явилась разработка живой вакцины. С целью получения аттенуированного
штамма американские исследователи серийно пассировали парвовирус в пер-
вичной культуре клеток почки эмбриона свиньи (36 пассажей), а затем в культу-
ре постоянной линии клеток тестикулярной ткани свиньи (18 пассажей). Вирус
NADL-2 (54 пассажа, 6,0 1g ТЦД50/мл, ГА 1:64) использовали в качестве живой
вакцины. Безопасность аттенуированного штамма была доказана на серонега-
тивных свинках (44±2 дня супоросности). Исследования эмбрионов, проведен-
ные через 40—45 дней после введения вакцинного вируса, показали, что вирус не
проходит через плаценту, поскольку эмбрионы были живыми и не содержали ви-
руса. Спустя две недели после вакцинации титр антител в РТГА составлял в ос-
новном 1:320 — 1:640 [138]. Наиболее высокий иммунный ответ у свиней отмеча-
ли при введении штамма NADL-2 в дозе 5,0 1g ИД50. При внутримышечном вве-
дении он размножася в селезенке, лимфатических узлах и других органах, хотя
не менее интенсивно, чем вирулентный штамм. Распространяясь горизонталь-
но, он не пересекал плацентарный барьер. Хотя при внутримышечном введении
размножался в ткани плодов, вызывая их гибель.
Из этого следует, что живая вакцина NADL-2 эффективна для защиты сви-
номаток от парвовирусной инфекции. Однако ее не рекомендуют применять бе-
ременным особям из-за возможной реверсии вирулентности при серийных пас-
сажах на свиньях [138].
Для получения аттенуированного штамма японские исследователи применя-
ли серийные пассажи неразведенного вируса в перевиваемой культуре клеток
почки эмбриона свиней с постепенным снижением температуры выращивания с
37 до 30°С. С 50-го до 55-й пассаж вирусную популяцию четыре раза клонирова-
ли методом предельных разведений при 32°С. Каждый пассаж длился 7—41 день
при общей продолжительности культивирования 492 дня.
Получен штамм (HT-/SK), адаптированный к размножению при 32°С, но
практически потерявший эту способность при 37 и 40°С. Аттенуированный
штамм HT-/SK накапливался в культуре в титре 4,9 1g ТИД50/мл и агглютиниро-
вал эритроциты в разведении 1:128. Он не вызывал виремии и не выделялся из
организма привитых свиней, не передавался горизонтально и вертикально, но
вызывал образование иммунитета у 2-месячных поросят, привитых однократно
подкожно, титр антигемагглютининов к моменту контрольного заражения через
И и 15 недель составлял соответственно 1:320 и 1:1280. После заражения пато-
генным штаммом у вакцинированных поросят вирус не обнаруживали в крови и
органах, не отмечали повышение титра антигемагглютининов. Трудность приме-
нения живой вакцины в неблагополучном хозяйстве состоит в том, что вакцин-
ный вирус нейтрализуется в организме свиней даже с низким уровнем пассивно-
го иммунитета.
В США применяют живую и инактивированную вакцины. Обе вакцины эф-
фективны и безопасны. Живую вакцину вводят в дозе 2 мл за 2-8 недель до осе-
менения; инактивированную — в дозе 5 мл двукратно за семь и девять недель до
осеменения. Ревакцинацию обеими вакцинами проводят однократно перед каж-
дым осеменением [138].
Кроме моновалентных вакцин, готовят и применяют комбинированные
инактивированные вакцины против парвовирусной инфекции, болезни Ауески
и лептоспироза. Такие вакцины применяли с положительными результатами в
различных странах. Так, в США успешно применяли вакцины против лептоспи-
роза и ПВИСв — «Лептопар» [138]. В России разработана комбинированная вак-
цина против парвовируса, лептоспироза, вируса болезни Ауески (вакцина ПЛА)
и хламидиоза (вакцина ПЛАХ), которые более 20 лет применяются в практике
промышленного свиноводства.
Данные по вакцинопрофилактике ПВИСв позволяют сделать следующее за-
ключение. Так как молодые свиньи наиболее чувствительны к инфицированию,
их рекомендуют вакцинировать перед осеменением (при необходимости дважды
с 2-4-недельным интервалом). Ревакцинацию проводят через каждые 6—12 ме-
сяцев. Желательно вакцинировать также серонегативных свиноматок и хряков.
При систематической вакцинации можно снизить ущерб и, в конечном итоге,
освободить хозяйство от инфекции.
Вирусный энтерит норок (ВЭН)
Вирусный энтерит норок (ВЭН) — острая контагиозная болезнь, характери-
зующаяся фибринозно-геморрагическим энтеритом, распространенная во мно-
гих странах. В естественных условиях болеют норки всех возрастов, однако бо-
лее часто — щенки, особенно в период отъема. Заражение происходит в основ-
ном фекально-оральным путем. Реконвалесценты длительно остаются
вирусоносителями.
После переболевания у норок образуется иммунитет, который сохраняется
всю жизнь. Антитела от беременных самок через систему плацентарного крово-
обращения поступают к эмбрионам и, кроме того, в организм щенят с молози-
вом. Материнские антитела обеспечивают пассивный иммунитет в течение ше-
сти недель.
Для активной профилактики болезни в ряде стран (Дания, Норвегия, Голлан-
дия, США) применяют инактивированные вакцины из культурального вируса
[ 1208]. Норки приобретают иммунитет через семь дней после вакцинации, сохра-
няемый не менее двух лет. Колостральный иммунитет у потомства длится не-
сколько недель. Для иммунизации зверей предложены бивалентные вакцины
против ВЭН и ботулизма и трехвалентные - против ВЭН, ботулизма и псевдомо-
ноза. В США используют комбинированную вакцину против чумы плотоядных,
ВЭН и ботулизма. Препарат вводят с помощью безыгольного инъектора. Такая
вакцинация обеспечивает устойчивость к контрольному заражению вирулентны-
ми вирусами и токсину, антигены которых входят в ее состав [138]. В качестве жи-
вых вакцин применяют культуральные — из аттенуированных штаммов вируса
энтерита норок или панлейкопении кошек. Между этими вирусами имеется тес-
ное антигенное родство [1208], поэтому живая вакцина против панейкопении ко-
шек создает прочный иммунитет против вирусного энтерита норок. Иммунитет
при применении живых вакцин наступает быстрее, чем в случае применения
инактивированных вакцин. При ликвидации инфекции с учетом длительного но-
сительства вируса в неблагополучных хозяйствах необходимо обеспечить доста-
точный уровень группового вакцинального иммунитета в течение трех лет.
Панлейкопения кошек (ПК)
Панлейкопения кошек (ПК) — остропротекающая болезнь кошек, проявля-
ющаяся панлейкопенией, лихорадкой, диареей, рвотой, кахексией и обычно за-
канчивающаяся гибелью. Болезнь распространена во многих странах мира.
Кроме домашних кошек, болеют другие представители семейства кошачьих,
а также куньих, енотовых и виверровых. У кошек-реконвалесцентов вирус выде-
ляется с фекалиями и мочой в течение нескольких недель, несмотря на наличие
вируснейтрализующих антител.
У переболевших, по-видимому, развивается пожизненный иммунитет. Он
развивается также после латентного инфицирования или вакцинопрофилактики.
Материнский иммунитет продолжается 8 недель. Период полураспада материн-
ских ВН-антител равен 9,5 дня [138]. Для профилактики ПК применяют живые
вакцины. Их готовят из аттенуированных штаммов вируса. Вирус размножают в
первичной культуре или культуре постоянной линии клеток эмбриона кошки. В
процессе длительного выращивания в статической или роллерной культуре полу-
чали несколько сборов вируса. При таких условиях культивирования вакцина бы-
ла безаллергенной, применение ее сопровождалось быстрым развитием иммуни-
тета. Более технологичным и эффективным для производства вакцины оказалось
выращивание вируса в культуре клеток на микроносителях [324]. Кроме живой,
можно применять инактивированную ГОА-вакцину. Она вызывает гуморальный
(ВН-антитела и антигемагглютинины) и клеточный (вирусспецифические цито-
токсические Т-лимфоциты) иммунитет [1516]. Моновалентная вакцина оказа-
лась в такой же степени эффективной, как и комбинированная против панлейко-
пении, ринотрахеита и калицивирусной инфекции кошек [524].
Парвовирусный энтерит собак (ПЭС)
Парвовирусный энтерит собак (ПЭС) — острая контагиозная болезнь, харак-
теризующаяся катарально-геморрагическим энтеритом и миокардитом. Леталь-
ность щенят в возрасте 4—5 мес. обычно 25— 30%, но может достигать и 80%
[524]. На основании анализа вспышки заболевания в Швеции в 1979-1980 гг. вы-
двинуто предположение, что оно принимает массовый характер при плотности
популяции собак > 12 на 1 км2.
В последние годы обнаружена эволюция возбудителя ПЭС. Считают, что ви-
рус ПЭС (CPV-2), ранее циркулировавший в ряде стран Европы, США и Япо-
нии, в основном после 1980 г. замещен генетическим и антигенным вариантом
(CPV-2a). Оба вируса различаются между собой минимум по шести нуклеотидам
генома и соответствующим аминокислотам капсидного белка. Однако иммуни-
зация собак против ПЭС-2 защищала их от заболевания при последующем ин-
фицировании ПЭС-2а. Несмотря на это, последний продолжает распространя-
ться в популяции вакцинированных србак [1211].
В сыворотке крови инфицированных собак на 5—7-й день появляются ВН- и
подавляющие гемагглютинацию антитела. После достижения максимума их
титр не снижается в течение двух лет. Установлена корреляция между уровнем
антител и устойчивостью собак к заражению. Собаки с титром антител >1:80 не
заболевают и не выделяют вирус с фекалиями после заражения. Материнские
антитела сохраняются в сыворотке крови потомства до 13 недель. Если титр ан-
тигемагглютининов >1:20, то щенки могут серологически не отвечать на вакци-
нацию [422]. Активную иммунопрофилактику проводят с помощью живых и
инактивированных вакцин, полученных из гомологичного и гетерологичного
вируса (панлейкопении кошек или вирусного энтерита норок).
Живые вакцины готовят из аттенуированных штаммов парвовируса собак
или вируса панлейкопении кошек. Вирусы аттенуировали последовательным
пассированием в первичных или перевиваемых культурах клеток [138].
Гомология генов у этих вирусов >98%. Инактивированная вакцина создает
кратковременный иммунитет, тогда как живая — быстро создает длительный им-
мунитет. Антитела в РТГА имеют титр >1:370 и сохраняются не менее 5 лет. За-
щитный титр антител в РТГА >1:80 [452].
Аттенуированный штамм парвовируса собак не реверсировал в течение шес-
ти пассажей на серонегативных собаках. Однократное введение вакцины серо-
негативным собакам вызывало иммунитет продолжительностью 1 год. У щенков
с колостральным иммунитетом сероконверсия развивалась только после повтор-
ного введения вакцины. Живая вакцина из модифицированного вируса панлей-
копении кошек обеспечивает у собак устойчивый иммунитет продолжительнос-
тью не менее 1,5 года [138].
Инактивированную вакцину готовили из парвовируса собак, выращенного в
культуре постоянной линии клеток почки котенка (линия CRFK) [448, 1263].
Вирус собирали в период выраженного ЦПЭ (разрушение >90 % клеток). Вирус
с активностью в РГА >1:4000 инактивировали формальдегидом. Вакцинация
обеспечивала выраженную устойчивость собак против клинического проявле-
ния болезни при последующем экспериментальном инфицировании. При титре
антител в РГА >1:256 оральное инфицирование вирулентным штаммом вируса
не сопровождалось его размножением у вакцинированных собак. При титре ан-
тител 1:128 вирус кратковременно размножался в организме вакцинированных
собак и выделялся с фекалиями, однако без развития клинических признаков
болезни. У вакцинированных собак антитела обнаруживали через двое суток, а
бустерный эффект — через 24 ч. Вакцинация, вероятно, обеспечивала пожизнен-
ный иммунитет, хотя материнские антитела в значительной степени подавляли
его развитие. На иммуногенность инактивированной вакцины большое влияние
оказывало присутствие адъюванта. Особенно иммуногенной оказалась культу-
ральная формолвакцина, содержащая ГОА совместно с адъювантом L80 [1263].
Инактивированная ГОА-формолвакцина из вируса панлейкопении кошек,
введенная собакам подкожно дважды, вызывает образование специфических ан-
тител в высоком титре (до 1:5120) и защищает от клинического проявления бо-
лезни при заражении вирулентным штаммом парвовируса собак. Оптимальный
срок между первой и второй вакцинациями - четыре недели [138].
Кроме моновалентных вакцин, разработаны и широко применяются в прак-
тике комбинированные вакцины, создающие иммунитет одновременно против
2—5 заболеваний собак, таких как парвовирусный энтерит, лептоспироз, бешен-
ство, инфекционный гепатит и чума плотоядных.
Вирусный энтерит гусей (ВЭГ)
Вирусный энтерит гусей (ВЭГ) — острая высококонтагиозная болезнь гусей
и муксусных уток, характеризующаяся поражением желудочно-кишечного трак-
та, печени и высокой летальностью. В естественных условиях болеют гусята и
муксусные утята в возрасте от 1 до 30 дней. Заражение в основном происходит
алиментарным и аэрогенным путем, возможна трансовариальная передача виру-
са. Переболевшая птица может оставаться вирусоносителем в течение несколь-
ких лет. Болезнь широко распространена в мире и вызывает гибель 30—90% забо-
левших гусят. У реконвалесцентов ВН-антитела обнаруживали в течение 80 мес.
В желтке яиц, снесенных гусями через 68—72 мес. после переболевания, также
обнаружены антитела. Вылупившиеся из них гусята в течение двух недель оста-
вались резистентными к заражению вирулентным штаммом вируса.
Для активной иммунизации в ряде стран Европы разработаны живые и
инактивированные вакцины. Аттенуированный штамм, полученный после 22
пассажей вируса на 9-дневных утиных эмбрионах, оказался авирулентным для
гусят, но вызывал у них образование ВН-антител, которые сохранялись в тече-
ние 20 недель. Вакцинный вирус выделялся с фекалиями иммунизированной
птицы в течение трех недель. У гусят, находившихся в контакте с вакцинирован-
ными, специфические антитела появлялись в низких титрах спустя шесть не-
дель. Подкожная прививка обеспечивала защиту от экспериментального зараже-
ния через 48 ч. Выпаивание вакцины с водой не приводило к образованию им-
мунитета. Способность такого штамма к реверсии осталась невыясненной. Зато
известно, что он передается трансовариально потомству. Инактивированную
вакцину готовят из тканей зараженных эмбрионов или гусят либо вируса, выра-
щенного в культуре клеток гусиных или утиных эмбрионов. Вирус инактивиру-
ют БПЛ (конечная концентрация 1:2000) и в качестве адъюванта добавляют ГОА
[1556]. Живыми и инактивированными вакцинами прививают взрослых гусей и
муксусных уток перед каждым периодом яйцекладки. Эти вакцины вызывают
образование гуморальных антител у взрослой птицы и обеспечивают трансова-
риальную передачу потомству материнских антител, защищающих их от болез-
ни в течение 3-4 недель. Молодняк от вакцинированных родителей иммунизи-
руют в 21—28-дневном возрасте [138].
10.10. Гепаднавирусы
Это семейство относительно малочисленное и включает в себя вирусы гепа-
тита В человека, гепатитов североамериканских лесных сурков, земляных белок
и гепатита В уток.
Гепаднавирусы имеют необычную структуру, отличающую их от других се-
мейств ДНК вирусов животных. Вирус гапатита В человека (ВГБ) является про-
тотипным вирусом семейства гепаднавирусов (гепатотропных ДНК-вирусов).
Все гепаднавирусы обладают общими свойствами: 1) небольшие двухоболо-
чечные частицы диаметром 42-47 нм содержат циркулярную в основном двуце-
почечную ДНК (3,0-3,3 тин.); 2) вирионную полимеразу, способную исправлять
брешь в вирионной ДНК-матрице; 3) чрезмерную продукцию субвирусных ли-
попротеиновых частиц, содержащих белки оболочки; 4) узкий хозяинный
спектр; 5) вызывать персистентную инфекцию и проявлять, как правило, гепа-
тотропизм.
Отличительная особенность гепаднавирусов — компактность организации и
эффективность реализации вирусного генома. При небольшом размере генома
вирусы способны экспрессировать четыре мажорных белка (коровый, оболочеч-
ный, полимеразу, Х-белок) и минорные (прекоровый, преоболочечный и белок
слияния X (коровый)) [1073]. По признаку включения в цикл репликации обрат-
ной транскрипции прегеномной РНК гепаднавирусы напоминают ретровирусы.
Сведения, характеризующие гепаднавирусы, практически целиком получены
при изучении вируса гепатита В (ВГБ) [692].
ВГБ является необычным среди вирусов животных тем, что в инфицирован-
ных клетках образуются разные типы вирусных частиц. При электронной мик-
роскопии частично очищенных препаратов обнаружено три типа частиц: а)
42-47 нм двухоболочечные частицы (частицы Дейна); б) сферические частицы
20 нм в диаметре, концентрация которых в 104—106 раз превышает концентра-
цию частиц Дейна; в) небольшое количество нитевидных частиц 20 нм в диаме-
тре различной длины. Все три формы частиц имеют общий антиген на поверхно-
сти, именуемый поверхностный антиген вируса гепатита В (HBsAg). Этот анти-
ген присутствует в большом количестве в сыворотке инфицированных
индивидов, концентрация его достигает 50—300 мкг/мл и в основном приходит-
ся на сферические частицы, которые могут достигать титра 1012 мл [692].
Частицы Дейна являются инфекционными вирионами ВГБ, их концентра-
ция в крови находится в пределах от < 104 мл до >109 мл. Их наружный слой пред-
ставлен липопротеиновой оболочкой, содержащей вирусные гликопротеины,
выявляемые серологически как HBsAg. Они не содержат детерминанты, против
которых направлены нейтрализующие антитела (анти- HBs). После удаления
оболочки (7 нм) обнажается сердцевина (нуклеокапсид) диаметром 27 нм. Глав-
ным белком сердцевины является С-белок - основной фосфопротеин 21 КД,
который выявляется серологически и часто называется коровым антигеном
(HBcAg). Внутри сердцевины находятся вирусная ДНК и полимераза (Р), игра-
ющая главную роль в репликации генома. Сферические частицы (20 нм) и ните-
видные формы содержат HBsAg и липиды клеток (около 30%). Эти частицы не
содержат нуклеиновой кислоты и не обладают инфекционностью. Они облада-
ют высокой иммуногенностью и вызывают выраженное образование нейтрали-
зующих анти-HBs антител. Такие 20 нм частицы, выделенные и очищенные из
сыворотки крови вирусоносителей, служили в качестве вакцины до создания ре-
комбинантных (HBsAg) вакцин [793].
Геном ВГБ представлен циркулярной, частично двуцепочечной разновидно-
стью ДНК (3,2 тн), циркулярность которой поддерживается связью 5'-концов.
Структура генома отличается тем, что две цепи ДНК не вполне симметричны.
Негативная цепь имеет полноразмерную длину, и ее 5'-конец ковалентно связан
с белком. Позитивная цепь имеет меньшую длину и олигонуклеотидную после-
довательность (кэп-структуру на 5'-конце). Таким образом, вирионная ДНК
имеет односпиральный участок (пробел) фиксированной полярности, но раз-
личной длины. Кодирующая организация вирионной ДНК характеризуется вы-
сокой компактностью: каждый нуклеотид генома находится внутри кодирующей
области и более половины последовательностей транслируется более чем с од-
ной из четырех рамок считывания. Вирусная полимераза, играющая централь-
ную роль в репликации генома, а также концевой белок негативной цепи ДНК
кодируются Р геном. С-область генома кодирует структурный белок нуклеокап-
сида, а S-область — поверхностные гликопротеины. Одной из особенностей
структуры ДНК ВГБ является наличие открытой рамки считывания X, продук-
том считывания которой является комплекс регуляторных белков, необходимых
для проявления инфекционности in vivo и модификации экспрессии гетероло-
гичных и гомологичных генов, по крайней мере в культуре клеток. Субгеномные
транскрипты функционируют исключительно как мРНК для трансляции белков
оболочки пре-Sl, npe-S2 и S (соответственно L, М и S белки) и X белка. Субви-
русные частицы содержат преимущественно S белок и различное количество М
белка, и следовые количества L белка. Частицы Дейна содержат относительно
большое количество L белка. Соотношение субъединиц L к М к S выражалось
примерно как 1:1:4. Вирусы гепатита млекопитающих почти идентичны по
структуре вирионов и генома со езначительной ДНК-гомологией (около 60%).
Вирусы гепатита В пекинских уток и лесных североамериканских сурков отлича-
ются от других гепаднавирусов отсутствием гена X, и они кодируют только 2 бел-
ка оболочки L и S [692].
HBsAg синтезируется в цитоплазме гепатоцита, где часть его используется
для образования ВГВ, а оставшаяся большая часть секретируется в межклеточ-
ное пространство и поступает в кровь. Все три морфологические формы вируса
содержат поверхностный S-антиген (HBsAg), представляющий собой сложный
комплекс, в состав которого входит общая антигенная детерминанта «а» и четы-
ре субгрупповые детерминанты: у, d, w и г. Причем в состав HBsAg конкретного
вируса входит типоспецифическая детерминанта «а» и по одной из двух пар ис-
ключительно субтиповых детерминант d или у, w или г. Соответственно, имеют-
ся четыре субтипа HBsAg: adw, adr, ayw, ayr. В составе высокоочищенных частиц
HBsAg обнаружено от семи до девяти полипептидов с молекулярной массой от
25 000 до 100 000 кД, которые связаны друг с другом межмолекулярными дисуль-
фидными связями. Малый белок вирусной оболочки P24/GP27 является основ-
ным компонентом, кодируемым S-геном. Два других белка оболочки - большой
(P39/GP42) и средний (P33/GP36) — являются продуктами соответственно пре-
S1 и npe-S2 генов. На их долю приходится 10-20 и 5-15% белка HBsAg. Эти два
белка обладают большей антигенной активностью, чем P24/GP27. Домен пре-
S1 белка оболочки содержит участок прикрепления вируса к поверхности гепа-
тоцита и вызывает образование ВН-антител [228]. Строгая видовая специфич-
ность вирусного и клеточного рецепторов обеспечивает вирусам гепатотроп-
ность и ограниченный круг хозяев. В этой связи способность вируса гепатита В
уток размножаться во многих органах, кроме печени (мозг, легкие, сердце, ки-
шечник, желудок, почки, селезенка), оказалась более чем неожиданной [905]. С
помощью МАТ в области npe-S белков вируса гепатита В уток идентифицирова-
но четыре нейтрализуемых и два ненейтрализуемых эпитопа. Эпитопы, вовлека-
емые в нейтрализацию, были представлены областью из 7—9 аминокислотных
остатков. Иммунодоминантный нейтрализуемый эпитоп картирован в средней
части npe-S белка. Эти данные свидетельствуют, что некоторые области поли-
пептида npe-S могут играть важную роль в иммуногенезе В-вирусных гепатитов
[1712]. Имеется сообщение о случаях заболевания кроликов гепатитом, вызыва-
емым ДНК-содержащим вирусом, который не передавался человеку [1099].
Таблица 33. Номенклатура вируса гепатита В [793]
Название Сокращенное обозначение Характеристика
Вирус гепатита В HBV Двухоболочечные частицы 42 нм в диаметре, именуемые частицами Дейна, которые имеют наружный слой 7 нм и сердцевину 27 нм. Сердцевина содержит небольшую циркулярную, частично двуцепочечную молекулу ДНК и эндогенную ДНК полимеразу.
Поверхностный антиген вируса гепатита В HBsAg Комплекс антигенных детерминант, находящийся на поверхности вируса гепатита В, частиц 22 нм и трубчатых форм. Он получил название австралийский антиген, или антиген, связанный с гепатитом.
Антиген сердцевины вируса гепатита В HBcAg Антиген, специфически связанный с вирусной сердцевиной 27 нм.
Е антиген вируса гепатита В HBeAg Антиген, тесно связанный с нуклеокапсидом, а также циркулирующий в сыворотке крови как растворимый белок.
Антитела к HBsAg; HBcAg и HBeAg Anti-HBs Anti-H Вс Anti-HBe Специфические антитела, образующиеся в ответ на соответствующие антигены.
Парадокс состоит в том, что естественная гепаднавирусная инфекция, со-
провождавшаяся массовой продукцией высокоиммуногенных частиц, способ-
ных вызывать образование ВН-антител в инфицированном организме, не завер-
шается быстрым выздоровлением. Данное явление, вероятно, обусловлено тем,
что избыточное количество частиц, содержащих HBsAg, адсорбирует ВН-анти-
тела и тем самым помогает вирусу ускользнуть от хозяинной зависимости [692].
Однако образование антител ограничивает распространение вируса и в дальней-
шем ведет к удалению циркулирующего вируса из организма.
Образование ВН-антител к белкам оболочки зависит от Т-лимфоцитов. У
некоторых людей ВН-антитела к белкам оболочки вируса не образуются, и раз-
вивается персистентная инфекция. Антительный ответ на белки сердцевины ви-
риона зависит и не зависит от Т-клеточного ответа. Ответ на HBcAg является
первым серологическим доказательством иммунного ответа, который сохраня-
ется годами или даже всю жизнь. Антитела к HBeAg часто сопровождает выздо-
ровление от острого течения заболевания.
Для специфической профилактики гепатита В первоначально использовали
плазму крови инфицированных пациентов. Сыворотку крови, содержащую ВГБ
(107,5 ИД для шимпанзе), разводили 1:10 и нагревали при 98°С в течение 1 ми-
нуты. Вирус инактивировали формолгликолем или формалином и нагреванием.
В 1981 г. в США лицензирована вакцина из высокоочищенных инактивирован-
ных формалином субвирусных частиц (HBsAg) с использованием в качестве адъ-
юванта гидрата окиси алюминия (ГОА). HBs-антиген не содержал обнаруживае-
мых количеств нуклеиновой кислоты. С конца 80-х годов прошлого века
Hepatovax-B в США заменена рекомбинантной дрожжевой вакциной —
Recombivax-HB. HBs антиген не содержал ДНК дрожжей и содержал менее 2%
белка дрожжей. Перед адсорбцией на ГОА антиген инактивировали формальде-
гидом. В отличие от вакцины из плазмы крови, вирусный антиген не был глико-
зилированным, но вызывал защитный эффект у вакцинированных людей [793].
Трехкратное введение (0, 7 и 21 дни) вакцины Engerix с бустеризацией через 12
месяцев обеспечивает наступление иммунитета в течение трех недель продолжи-
тельностью 5 лет [660]. Аналогичная вакцина лицензирована и используется во
многих странах. Кроме дрожжей, для изготовления рекомбинантной вакцины
используют линию клеток яичника китайского хомяка (СНО) [793].
10.11. Ретровирусы
Ретровирусы содержат две идентичные молекулы геномной РНК и РНК-за-
висимую ДНК-полимеразу (обратную транскриптазу, ревертазу). Ретровирусы
выделены от множества видов животных и проявляют разнообразный спектр па-
тогенного потенциала. Семейство включает вирусы 7 родов: альфа-, бета-, гам-
ма-, дельта-, эпсилонретровирусы, лентивирусы и спумавирусы. Семейство
включает вирусы, патогенные для человека и многих видов животных.
Большинство ретровирусов обладают выраженным тропизмом к клеткам
лимфоретикулярной и гемопоэтической системы. Ретровирусы у специфических
для них видов животных встречаются повсеместно. В борьбе с ретровирусными
инфекциями основной мерой является предотвращение передачи вируса [954].
Вирионы ретровирусов представляют собой округлые оболочечные частицы
диаметром 80-100 нм, обладающие уникальной трехслойной структурой. Цент-
ральная часть вириона представлена нуклеопротеиновым комплексом, который
включает около 30 молекул ревертазы и имеет спиральную симметрию. Эта
структура окружена икосаэдрическим капсидом диаметром около 60 нм, покры-
тым оболочкой, происходящей из мембраны клетки, от которой отходят глико-
протеиновые пепломеры. Лентивирусы имеют на поверхности примерно 72
шишкоподобных пепломера длиной около 10 нм с яйцевидным концевым уп-
лотнением.
Ретровирусы имеют диплоидный геном, представляющий инвертированный
димер из двух молекул линейной позитивной полярности, оцРНК; каждая моле-
кула содержит 7-11 тн и имеет полиА последовательность на З'-конце и К.ЭП-
структуру на 5'-конце. Детальная организация геномов разных ретровирусов
широко варьирует.
Геном ретровирусов уникален в следующих отношениях:
1) является единственным диплоидным;
2) вирусная РНК синтезируется и изменяется с помощью механизма, изме-
няющего клеточную мРНК;
3) это единственный геном, связанный со специфическим переносом функ-
ции РНК целиком к первичной репликации;
4) это единственная оц(+)РНК, которая не является мРНК вскоре после ин-
фекции;
5) это единственный геном, кодирующий обратную транскриптазу, которая
сама по себе уникальна.
Среди многих своих функций обратная транскриптаза служит в качестве
РНК-зависимой ДНК полимеразы, а ДНК-зависимая ДНК полимераза, интег-
раза и РНКаза, каждая в меру своей определенной функции, представляют раз-
личную часть белковой молекулы. Геном недефектных ретровирусов содержит
три разных гена, каждый из которых кодирует два и более белка. Gag ген коди-
рует вирионные коровые белки, pol ген кодирует обратную транскриптазу, a env
ген кодирует вирионные пепломерные белки. Геном кодирует также несколько
определенных вирионных компонентов.
Геном быстро трансформирующих ретровирусов содержит четвертый ген —
вирусный онкоген (v-onc). Присутствие онкогена обычно связано с делецией в
другом месте генома, обычно в env гене, так что большинство v-onc содержащих
вирусов не способны синтезировать полностью оболочку и поэтому являются
дефектными по репликации. Они всегда находят связь с недефектными вируса-
ми, которые реплицируются полностью и функционируют в качестве помощни-
ков. Вирус саркомы Рауса является исключением. Его геном содержит вирусный
онкоген v-src и также полные gag, pol и env гены, и поэтому является реплика-
тивнокомпетентным.
Кроме генов gag, pol и env, общих для всех ретровирусов, лентивирусы коди-
руют еще несколько других «дополнительных» генов. К ним относятся:
1) tat ген, который кодирует трансактиватор, связанный с клеточными фак-
торами, повышающими эффективность трансляции клеточной РНК полимера-
зы, главным образом за счет преждевременной остановки транскрипции;
2) rev ген кодирует белок, который связан с удлинением РНК транскриптов
и их перемещением из ядра в цитоплазму, обеспечивая полный путь мРНК для
трансляции;
3) nef ген, который не требуется для репликации вируса в культуре лимфоци-
тов, но важен для репликации в макрофагах и для развития болезни, вызванной
вирусом иммунодефицита обезьян у обезьян резус; nef белок регулирует экспрес-
сию клеток СД4 и образование ИЛ-2 и может изменять активацию клеток мише-
ней в организме;
4) vif ген кодирует белок (фактор инфекционное™ вирусов), который необ-
ходим для некоторых стадий вирусного морфогенеза, связанных с инфекцион-
ностью.
Vpu, vpr и vpx найдены в лентивирусах приматов. Vpu способствует созрева-
нию вирусных гликопротеинов и освобождению вирионов почкованием; Vpr -
слабый активатор транскрипции; Vpx, по-видимому, способствует репликации в
Т-лимфоцитах и макрофагах.
При продуктивной инфекции вирионы формируются и освобождаются поч-
кованием через плазматическую мембрану. Некоторые ретровирусы вызывают
образование опухолей.
Спумавирусы являются необычными ретровирусами во многих отношениях.
Они выделены от человека, обезьян, КРС, кошек, морских львов и хомяков. Они
представляют проблему, когда контаминируют клеточные культуры, но их связь
с заболеваниями неизвестна. Существует мнение, что пенящие вирусы ближе
стоят к ДН К гепаднавирусам [969].
Эндогенный ретровирус свиней (PERV) найден у всех исследованных пород
свиней. Известны три субгруппы этого вируса: А, В и С [641]. Все свиньи содер-
жат множественные провирусы (около 50) в своем геноме. PERVлатентно инфи-
цирует многие культуры клеток свиньи и, реже, человека. Патогенность этого
вируса не установлена [1488, 1584].
Онковирусы, в отличие от лентивирусов, реплицируются в делящихся клет-
ках. В составе ретровирусов обнаружено 11—13 белков. Часть из них локализо-
вана в сердцевине, а главный внутренний белок Р27 - РЗО - в мембране, окру-
жающей РНК. В составе липопротеиновой оболочки 2—5 гликопротеинов, из
которых более крупный образует головку шипика и является главным компо-
нентом оболочки, а более мелкие белки образуют отросток, погруженный в
билипидный слой. Различные белки ответственны за групповую и типовую спе-
цифичность. Подгрупповые и типоспецифические антигены связаны с наруж-
ными гликопротеинами и выявляются в PH, РСК, ИФ и РИД. Группоспецифи-
ческие антигены связаны с белками сердцевины. Их обнаруживают в РСК, ИФ
и РИД. Главный внутренний белок Р27 — РЗО — основной группоспецифический
антиген, общий для всех ретровирусов птиц или млекопитающих, относящихся
к одной группе [24].
Согласно предложенной ранее номенклатуре структурные белки ретровиру-
сов обозначали следующим образом: МА — матриксный, СА — капсидный, NC —
белок нуклеокапсида, SU — поверхностный, ТМ — трансмембранный, PR — про-
теаза, RT - ревертаза, IN — белок интеграции [934а].
Гликопротеины ретровирусов обладают антигенными детерминантами, ко-
торые определяют индивидуальную специфичность каждого вируса. Белки на-
ружной оболочки участвуют в различных взаимодействиях вируса и клетки. С
ними связаны такие феномены, как круг хозяев, тканевая специфичность, ад-
сорбция вириона и его проникновение в клетку, специфичность интерферен-
ции, индукция синтеза нейтрализующих антител и протективные свойства. Ан-
титела к поверхностным гликопротеинам обладают нейтрализующей активнос-
тью. Структурной организацией гликопротеины ретровирусов принципиально
не отличаются от гликопропротеинов других оболочечных вирусов. Особенно
большое сходство обнаружено в случаях, когда N-концевой домен гликопротеи-
на экспонирован на поверхности вириона.
В состав наружного слоя оболочки вирионов онковирусов птиц входят два
гликопротеина (gp85, gp37), соединенные друг с другом дисульфидной связью и
присутствующие в виде гетеродимера на вирусной оболочке. Образуются они в
результате протеолиза белка предшественника 95 env [1240]. Круг хозяев вируса
саркомы Рауса определяет gp85. В оболочке вирионов онковирусов мышей обна-
ружен один основной гликозилированный полипептид (gp70) и два минорных
полипептида — р15 и р12, образующиеся в результате протеолиза первичного
продукта трансляции с молекулярной массой 90 кД.
В структуре вируса лейкоза крупного рогатого скота (ВЛКРС) обнаружено
шесть основных белков с молекулярной массой от 10 до 51 кД (рЮ, р12, pl 5, р24,
gp30 и gp51) [1556]. Четыре негликозилированных белка (р 10, р 12, р15 и р24) со-
ставляют сердцевину вириона, причем белок р24 присутствует в наибольшем ко-
личестве. Два наиболее крупных белка являются гликопротеинами, один из ко-
торых (р51) расположен на поверхности вириона, другой (gp30) является транс-
мембранным. Вирус обладает выраженной антигенной активностью и
индуцирует синтез нейтрализующих и комплементсвязывающих антител. Он аг-
глютинирует эритроциты мышей. За инфекционность и гемагглютинирующую
активность ответственен gp51 [1515]. В gp51 выявлено три эпитопа, ответствен-
ных за нейтрализацию вируса, что представляет интерес при изготовлении субъ-
единичной вакцины. Наиболее важным, нейтрализующим эпитопы гликопроте-
ина gp51, является участок, соответствующий аминокислотным остаткам 78—92
[1258]. Поли- и моноклональные антитела против gp51 обладают вируснейтрали-
зующей активностью [1181], подавляют синцитий, образующую активность ви-
руса, препятствуют его выходу из клеток и вызывают лизис инфицированных
клеток в присутствии комплемента. Антитела к р24 такими свойствами не обла-
дают [1181]. Возможно, что фузогенная активность вируса является совместной
функцией белков gp51 и трансмембранного gp30.
Ретровирус аденоматоза легких овец (АЛО), в отличие от многих других рет-
ровирусов, трансформирует эпителиальные клетки — секреторные пневмоциты
и бронхиолярные эпителиальные клетки. Различают два генотипа вируса: афри-
канский (тип 1) и северо-американский/европейский (тип 2). Ген env вируса
АЛО обладает способностью трансформировать фибробласты КЭ и грызунов в
культуре клеток. В геноме овцы обнаружены эндогенные ретровирусные после-
довательности, очень сходные с нуклеотидными последовательностями генома
вируса АЛО [57].
Внеклеточный вирус лентивирусов овец не заражал фиброэндотелиальные
клетки овец, которые легко заражались при контакте с инфицированными мак-
рофагами [1419].
В структуре вирусов лейкоза кошек различают белки, связанные с сердцеви-
ной (plO, р12, pl5 и р27), и два оболочечные - гликозилированный — 70 кД
(gp70) и негликозилированный — 15 кД (р 15) [1715]. Кроме того, различают ви-
русспецифические антигены, экспрессируемые на поверхности инфицирован-
ных клеток. Гликопротеин gp70 содержит единственный нейтрализующий эпи-
топ [1715]. Нейтрализующие антитела к этому гликопротеину контролируют ла-
тентное инфицирование вирусом лейкоза, вызывая его элиминацию из
организма кошек. Вирусы лейкоза кошек подгрупп А, В и С различают по струк-
туре главного гликопротеина оболочки gp70.
Лентивирусы относятся к неонкогенным ретровирусам. Они сходны между
собой по морфологии вирионов, антигенным свойствам, организации генома,
последовательности нуклеотидов, клеточному тропизму и патогенезу. Клетками-
мишенями в организме хозяина в основном являются моноциты-макрофаги.
Ограниченное размножение вируса происходит даже при отсутствии клиничес-
ких признаков [1169].
Лентивирусы могут вызывать как литическую, так и персистентную форму
инфекции с длительным латентным периодом. Особенностью инфекции являет-
ся образование ВН-антител с низкой активностью (или они вообще не образу-
ются). Другие вирусспецифические антитела формируются нормально. Для лен-
тивирусов характерна быстрая вариабельность генома. При серийном размноже-
нии вируса инфекционной анемии лошадей в культуре макрофагов мутации
происходят во многих генах [1716].
Прототипом подсемейства является вирус мэди-висна овец, вызывающий
заболевание с инкубационным периодом до одного года. Различают два вариан-
та вируса мэди-висна.
Штаммы мэди характеризуются высоким тропизмом к тканям легких и вы-
зывают пневмонию овец, а штаммы висна с высоким тропизмом к нервной тка-
ни вызывают энцефаломиелит. Однако эти различия не абсолютны. Филогене-
тический анализ лентивирусов мелких жвачных показал возможность межвидо-
вой трансмиссии этих вирусов 11714]. Вирус мэди-висна содержит четыре
основных белка: gpl 35, рЗО, р16 и р14 [1283].
В структуре вируса инфекционной анемии лошадей (ИАЛ) обнаружено
шесть основных белков с молекулярной массой от 9 до 90 кД и четыре минорных
полипептида. В состав наружного слоя оболочки вирионов входят два гликопро-
теина — gp90 и gp45 [837], не связанные между собой дисульфидными связями.
С-концевой участок gp90 и N-концевой участок gp45 вируса ИАЛ являются вы-
сококонсервативными и иммунодоминантными областями. Антигенные детер-
минанты для индукции ВН-антител расположены в гипервариабельной области
gp90 [1225]. Основная иммунная реакция хозяина направлена против высокоан-
тигенного домена, представленного 83 аминокислотными остатками на С-конце
главного сердцевинного белка р26 [487].
Поверхностный гликопротеин gp 135 вируса артрита-энцефалита коз фор-
мируется в результате посттрансляционной модификации гликозилированного
gpl55 [4796]. Клеточный тропизм вируса артрита-энцефалита не ограничивается
лимфоцитами и макрофагами [1720]. Установлена частичная гомология генома
вируса иммунодефицита человека (ВИЧ) с геномами лентивирусов домашних
животных: мэди-висна, артрита-энцефалита коз и ИАЛ. Наиболее выраженная
гомология обнаружена с геномом вируса мэди-висна [723]. Вирус иммунодефи-
цитоподобного заболевания крупного рогатого скота генетически и антигенно
родственен ВИЧ-1 [1014], а вирус иммунодефицита кошек (FIV) вызывает забо-
левание кошек, напоминающее СПИД.
Для ретровирусов характерна высокая изменчивость генома. Она может быть
связана как с иммунологическим давлением на антигенные участки белков, так
и с высокой частотой спонтанных мутаций в геноме вируса.
Это касается и лентивирусов, у которых ген, кодирующий нейтрализующие
эпитопы поверхностных белков, подвержен частым мутациям. По частоте мута-
ций лентивирусы превосходят в 100—1000 раз другие РНК-содержащие вирусы,
что позволяет им преодолевать иммунную защиту организма. Низкий аффини-
тет нейтрализующих антител к лентивирусам и персистенция их в макрофагах —
главное препятствие в вакцинопрофилактике вызываемых ими заболеваний.
Природа механизма антигенных вариаций при персистентной ретровирус-
ной инфекции хорошо прослеживается на модели вируса ИАЛ. Большое разно-
образие антигенных вариантов вирусов ИАЛ может генерироваться в организме
инфицированных животных [1224]. Существенная изменчивость генов поверх-
ностных гликопротеидов gp90 и gp45 вируса ИАЛ обнаружена в процессе инфек-
ции одного животного. Изоляты, выделенные с интервалом в две недели, анти-
генно различались между собой [825], белки сердцевины при этом не измени-
лись [1224]. Изменения в гене env в процессе персистирующей инфекции
приводят к изменению антигенных свойств белков оболочки вируса ИДЯ и его
вариабельности [837]. Антигенный дрейф вируса был связан с потерей двух эпи-
топов на gp90 [1351]. Учитывая, что гены поверхностных белков лентивирусов
обладают гипервариабельными участками, при создании вакцин против этих ви-
русов необходимо иметь иммуногены, индуцирующие образование широкого
спектра нейтрализующих антител. Большие надежды в этом плане связывают с
биотехнологией.
Лейкоз крупного рогатого скота (ЛКРС)
В естественных условиях болезнь проявляется опухолевым заболеванием
кроветворной ткани крупного рогатого скота, характеризующимся главным об-
разом системным размножением незрелых кроветворных клеток в различных
органах и тканях. Считают, что лимфоцитоз — результат поликлональной проли-
ферации В-лимфоцитов, постоянно стимулированных антигенами вируса ЛКРС
[426]. Возбудителем ЛКРС является ретровирус, который может длительно пер-
систировать в организме, даже несмотря на наличие нейтрализующих антител
[1202]. Отсутствие экспрессии генома ВЛКРС при наличии провирусов в опухо-
левых клетках дало возможность предположить, что причиной опухолевой
трансформации клеток вирусом ЛКРС является нарушение структуры клеточно-
го генома. Экспериментальную инфекцию удается вызвать у овец. Заболевание
широко распространено во многих странах с развитым скотоводством. Инфици-
рование скота происходит в основном при контакте. В течение первых недель
жизни животные защищены от инфекции за счет материнских антител.
С целью специфической профилактики ЛКРС были предприняты попытки
создания инактивированной или компонентной вакцины. Вирус ЛКРС выра-
щивали в персистентно инфицированной культуре клеток почки плода овцы
(линия FLK) и инактивировали АЭИ (0,05%) или ДЭН (0,02%) в течение 8 ч при
37°С. Инактивированные препараты сохраняли антигенность оболочечного гли-
копротеина и теряли инфекционность (синцитийобразующую активность). По-
сле двукратного введения с ГОА они вызывали у телят образование антител и ус-
тойчивость к заражению. Инактивация вируса формалином сопровождалась
значительным снижением антигенной активности вирусного гликопротеина.
Наибольшей антигенной активностью обладал препарат, который у привитых
телят индуцировал образование антител к гликопротеиновому и внутреннему
антигенам вируса. После контрольного заражения вирусом ЛКРС у вакциниро-
ванных телят в течение года не отмечено размножения вируса и развития при-
знаков лейкозного процесса. У большинства невакцинированных животных раз-
вилась вирусемия и характерные гематологические признаки болезни.
Другие исследователи оценку иммуногенной активности инактивированных
препаратов проводили на овцах. После инактивации вируса культуральную ви-
русную жидкость концентрировали в 100 раз 50%-ным сульфатом аммония и по-
сле диализа выделяли вирусные белки. Активность полипептидов в концентри-
рованных препаратах в РСК для gp 51 и р 24 соответственно составляла 1:32 и
1:64. Препараты, содержащие 0,4 мг/мл белка (gp 51 и р 24), вводили овцам по
1 мл. Латентно инфицированные клетки (линия FLK или SF28) фиксировали
глютаральдегидом (3%, 30 мин при комнатной температуре) и вводили овцам. В
одной дозе содержалось 50 млн клеток. Каждый препарат вводили трем овцам
три раза с интервалом в 2 и 4 недели. Первую прививку проводили смесью анти-
гена с адъювантом Фрейнда. На 9-й неделе после вакцинации овец заражали
лимфоцитами (105) коровы, инфицированной вирусом ЛКРС. Овцы, привитые
gp51 или клетками FLK, были защищены от ЛКРС, тогда как овцы, привитые
р24 или клетками SF-28, так же как непривитые, оказались инфицированными.
Препарат, содержащий gp51, вызывал устойчивость крупного рогатого скота
к заражению вирусом лейкоза [1181]. Животные, иммунизированные экспери-
ментальной вакциной, содержащей только gp51, могли быть дифференцированы
от инфицированных вирусом лейкоза с помощью антигена, содержащего р24
[1062]. После трехкратного введения гликопротеинов вируса ЛКРС устойчивы-
ми к заражению оказались овцы, у которых титр антител к gp51 в РИД был не ни-
же 1:64 [906]. Повторное введение препарата с адъювантом сопровождалось на-
иболее выраженным иммунным ответом. Овец прививали трижды гликопротеи-
нами оболочки вируса ЛКРС, а затем заражали гомологичным вирулентным
вирусом. Все 8 вакцинированных овец оказались устойчивыми к заражению, и у
5 из них обнаружен выраженный Т-клеточный ответ. У невакцинированных
овец, в отличие от вакцинированных, отмечено разное подавление экспрессии
гамма-интерферона и интерлейкинов [865].
Из лабораторных животных к экспериментальному заражению вирусом
ЛКРС чувствительными являются кролики. Обычно при заражении бесклеточ-
ным или внутриклеточным вирусом у кроликов развивается синдром, сходный с
иммунодефицитом и они погибают в течение 1 года после заражения. Испытана
на кроликах живая векторная вакцина, содержащая и экспрессирующая гены
gag, pol, env и другие гены структурных белков вируса ЛКРС. У трансфицирован-
ных векторным вирусом кроликов наблюдали сероконверсию в отношении
структурных белков при отсутствии иммунодепрессии. Полученная векторная
вакцина при испытании на кроликах оказалась безвредной и антигенно актив-
ной [912]. Результаты этих исследований, а также наблюдения на лентивирусных
моделях [759] указывают на перспективность создания живых генно-инженер-
ных вакцин против ретровирусных инфекций.
Лейкемия кошек (ЛК)
Лейкемия кошек (ЛК) проявляется в основном развитием лейкемии с обра-
зованием лимфом и фибросарком в результате вирусной трансформации лимфо-
ретикулярных и, реже, гематопоэтических клеток. Заболевание является следст-
вием иммуносупрессии и всегда протекает прогрессивно, то есть без обратного
развития. Возбудитель ЛК относится к ретровирусам и, в частности, к экзоген-
ным онкорнавирусам кошек. Вирус ЛК широко распространен в популяции ко-
шек и может передаваться горизонтально.
В мире инфицированы приблизительно 5-10% кошек. Главным источником
распространения вируса является инфицированная слюна, в I мл которой может
содержаться 5х103—2х106 вирусных частиц. Более половины инфицированных
кошек погибают от вторичных инфекций, в результате иммунодефицита, а не от
неопластической болезни. Основная масса (85%) инфицированных кошек поги-
бают в возрасте 3,5 лет [1369]. Поражая гемолимфо-ретикулярные клетки, вирус
часто вызывает форму СПИД кошек. Обработка культуры клеток костного моз-
га больных животных кортикостероидами ведет к реактивации латентной ин-
фекции [747].
Вирусы ЛК подразделяют на 3 субгруппы: А, В и С [1369]. Вирус субгруппы
А является экотропным прототипным вирусом, передающимся горизонтально, и
связан с длительно латентно-развивающейся лимфомой. Вирусы субгруппы В и
С всегда присутствуют в ассоциации с вирусом Л К-А (соответственно в 50 и 1%
случаев). Субгруппа ВЛК-В является генетическими рекомбинантами гена env
ВЛК-А и эндогенных провирусных элементов [1198, 1454]. Эндогенйый ВЛК,
хотя подобен ВЛК-А по структуре генома, но никогда не экспессировался как
инфекционный вирус. ВЛК-С в сочетании с ВЛК-А вызывает летальную ане-
мию, подобную эритроциторной аплазии человека [844].
Как и все ретровирусы типа С, вирус ЛК состоит из трех структурных еди-
ниц: нуклеокапсида, сердцевины и оболочки. Нуклеокапсид представлен двумя
молекулами (+) оцРНК и тремя кодированными gag-геном белками: р 10, р15С и
р27. Три белка формируют оболочку, окружающую нуклеопротеин (РНК и не-
сколько копий ревертазы). Оболочка нуклеокапсида затем окружается кислым
белком р12, кодируемым также gag-геном. Оболочка вириона, образованная
мембраной клетки при почковании вириона, содержит два env-генных продукта:
gp70 в качестве основного и gpl5E в качестве минорного компонента. Gpl5E яв-
ляется мембранным белком, который способствует трансмембранным отрост-
кам закрепляться в липидном бислое. Gp70 образует выступы, связывающие 15Е
«реснички» бисульфидными связями [371].
Зависимость активации латентной инфекции от активности нейтрализую-
щих антител, а также возможность латентного инфицирования ВЛК без разви-
тия лейкоза у кошек, но с формированием выраженного иммунитета, явились
основанием для разработки средств специфической профилактики.
Котят вакцинировали живым и инактивированным формалином ВЛК, вы-
деленным из лимфобластоидной линии клеток FL74, а также инактивированны-
ми формалином клетками FL74. Линия клеток FL74 получена от кошки с Т-кле-
точным лейкозом. Она продуцирует подтипы А, В и С ВЛК и комплекс вирусно-
го антигена, ассоциированного с мембранами клеток (FOSMA).
Инактивированные препараты не предотвращали заражения котят виру-
лентным вирусом, хотя снижали заболеваемость, несмотря на отсутствие нейт-
рализующих антител. Живая вакцина оказалась безопасной и эффективной. У
половины вакцинированных котят вакцинный вирус обнаружен в костном моз-
ге со 2-й по 4-ю неделю, но отсутствовал в периферической крови и не выделял-
ся со слюной, мочой и калом. Он не передавался горизонтально невакциниро-
ванным котятам. В течение нескольких месяцев у вакцинированных котят не
выявлено никаких нарушений, а в сыворотке крови обнаружен высокий уровень
связанного с ВЛК мембранного антигена и ВН-антител. Вакцинированные ко-
тята оказались устойчивыми к заражению вирулентным штаммом вируса.
В другом исследовании вакцина, приготовленная из клеток FL74, обрабо-
танных формалином, защищала котят против виремии и образования опухолей.
Оказалось, что для развития напряженного иммунитета необходимы три внутри-
мышечные инъекции препарата. Ежегодная ревакцинация обеспечивала под-
держание напряженного иммунитета.
Вакцинация кошек оболочечными гликопротеинами ВЛК (gp 70/85) сопро-
вождалась образованием антител, выявляемых в ИФА, но не в реакции нейтра-
лизации. При заражении вакцинированных котят ВЛК наблюдали персистент-
ную вирусемию. Инактивированная цельновирионная вакцина имела более вы-
раженное протективное действие при контрольном заражении котят ВЛК.
Протективные свойства цельновирионной вакцины не были связаны с образо-
ванием ВН-антител, хотя вакцинация сопровождалась выработкой антител, вы-
являемых в ИФА, как против вирионов, так и их гликопротеинов. Следует отме-
тить, что оба препарата обнаружили аналогичное, хотя и менее выраженное за-
щитное действие при заражении вакцинированных котят вирусом саркомы
кошек (ВСК). У котят, вакцинированных инактивированным цельновирион-
ным препаратом, развивались опухоли меньшего размера, чем у контрольных, а
персистентная виремия встречалась значительно реже [1226]. Субъединичная
вакцина, приготовленная из клеток FL74 и содержащая, кроме gp 70, другие бел-
ки ВЛК [1021], не обладала преимуществами по сравнению с гликопротеиновой
вакциной.
Выраженный защитный иммунитет у кошек обеспечивал иммуностимулиру-
ющий комплекс (ИСКом), содержащий гликопротеин (gp 70/85) ВЛК, выделен-
ный из клеток линии FL74. При заражении вакцинированных и контрольных
котят ВЛК виремия развивалась только у непривитых животных [1187].
Вакцинация кошек с последующей ревакцинацией через 2 и 11 недель субъ-
единичной вакциной против ВЛК (Leucocell), включающей антигены подтипов
А, В и С ВЛК, а также мембранный антиген (FOSMA) онкорнавируса кошек, за-
щищает животных от развития инфекции при последующем заражении их виру-
лентным штаммом ВЛК. Спустя 2—4 года после вакцинации и заражения, еже-
недельная инъекция животным 7,5 мг/кг метил преднизалона не вела к реактива-
ции вируса в культуре клеток костного мозга, хотя и индуцировала снижение
количества лимфоцитов в крови и антител к gp70 в сыворотке крови. Вакцина
Leucocell предотвращала латентную инфекцию ВЛК даже на фоне иммуносу-
прессии. Она хорошо защищает кошек против персистентной виремии и воз-
никновения опухолей [747]. Компонентная вакцина Leucocell (фирма Норден,
США), содержащая атигены ВЛК, выделенные из хронически инфицированной
линии клеток FL74 (изолят Каваками), в отличие от живого аттенуированного
штамма и инактивированного вирулентного штамма ВЛК, индуцирует иммун-
ный ответ без иммуносупрессии. Вакцина защищает от установления латентной
инфекции ВЛК при контакте с больными животными f948].
Вирус, продуцированный лимфобластоидной линией клеток FL74, обладал
исключительно низкой инфекционностью и при использовании в качестве жи-
вой вакцины мог защитить вакцинированных кошек от заражения высокопато-
генным штаммом ВЛК [844].
Некоторые инактивированные вакцины создавали иммунитет, защищаю-
щий от инфицирования [799, 1227]. Сравнение нескольких инактивированных
вакцин, приготовленных только из ВЛК-А или из трех субгрупп вируса, не вы-
явило разницы между ними. Наиболее успешной была вакцинация, которая со-
провождалась образованием ВНА, индуцированными главным образом gp70, и
сопровождающаяся протективным иммунитетом. Трансформированные ВЛК
клетки FL74 секретировали вирусные полипептиды, включая gpl7 и gp70. Имму-
ногенность инактивированных вакцин определялась концентрацией gp70 и его
нативностью [844].
В последнее время разработаны два вида рекомбинантных вакцин, которые
обеспечивают полную или почти полную защиту кошек от лейкоза. Один из по-
лезных рекомбинантов получен клонированием гена gp70 FeLV-A в плазмидный
вектор и экспрессированием в Е. coll MZ-1 под контролем промотора фага лямб-
да pl [1007]. Рекомбинант «gp70» кодировал целый оболочечный белок gp70 и
первые 34 аминокислоты трансмембранного белка р15Е. В результате экспрес-
сии образовывался негликозилированный белок 50 кД (р50), который накапли-
вался в E.coli в виде нерастворимых телец включений. Белки (rgp70) растворяли
и очищали в присутствии денатурирующих агентов и после добавления ГОА и
сапонинового адъюванта (Q521) использовали в качестве вакцины. У кошек, им-
мунизированных 3 раза, независимо от способа введения развивались выражен-
ный гуморальный иммунитет с образованием ВНА, анти-FOCMA (feline oncorna
virus-associated cell membrane antigen) антител и защита от виремии после пери-
тонеального заражения вирусом ЛК-А (105 БОЕ). Широкое применение субъе-
диничной рекомбинантной вакцины в разных странах показало ее высокую эф-
фективность. Она обеспечивала защиту около 100% кошек после двух вакцина-
ций с интервалом в 21 день [499, 1249]. Такая вакцина в Европе получила
название Leicogen®, а в США — GenetyVac™ и явилась первой генноинженерной
ветеринарной вакциной, имеющей коммерческую ценность.
Эти вакцины практически ареактогенны и безопасны для кошек [499]. Ока-
залось, что для создания протективного иммунитета антиген gp70 ВЛК может не
иметь природную гликозилированную конформацию.
У большинства вакцинированных кошек отмечен низкий уровень ВНА пе-
ред заражением и высокий титр ненейтрализующих вирусспецифических анти-
тел. У кошек, устойчивых к виремии, через 4 недели после заражения образуют-
ся ВНА в высоком титре. Немедленное появление не нейтрализующих антител
временно задерживает последующее образование ВНА. Развитие качественного
иммунитета и удаление вируса, опосредованного СД8+ Т-клетками, наблюдает-
ся при острой инфекции [1201]. Использование адъюванта играет важную роль в
развитии иммунитета. Неполный адъювант Фрейнда (EFA) оказал относительно
слабое влияние на иммуногенность rgp70 для кошек, тогда как сапониновый
адъювант QS-21 хорошо усиливал продукцию антител IgG2a, IgG2B и завися-
щий от Тх клеточный иммунитет [881].
Рекомбинантные векторные вакцины представляли собой полноразмерные
env и gag гены ВЛК-А, клонированные в вирус оспы канареек в качестве векто-
ра [1496]. Вирус размножался только в организме птиц, но вызывал полную экс-
прессию поверхностного гликопротеина и защиту кошек против персистентной
вирусемии при двукратном введении 108 БОЕ. Применение векторных вакцин
против ЛК показало, что: 1) защита не коррелирует с уровнем ВНА; 2) паренте-
ральное введение рекомбинантной живой вакцины защищает от заражения на
слизистые (ороназально); и 3) основную роль в иммунизации играет gp70, a gag
ген, вероятно, играет хелперную роль.
10.12. Реовирусы
В семейство реовирусы включены все вирусы с сегментированным дцРНК
геномом, за исключением бирнавирусов. Поэтому оно является весьма слож-
ным. Вирусы, входящие в состав семейства, объединены в пять родов: орторео-
вирусы, орбивирусы, ротавирусы, колтивирусы и аквареовирусы.
Первые три рода объединяют основные вирусы млекопитающих и птиц и не
связаны между собой антигенно. Ортореовирусы в основном включают три ви-
руса млекопитающих (реовирусы 1, 2 и 3) и 11 вирусов птиц.
На основе серологических свойств и генотипирования орбивирусы разделе-
ны на 14 субгрупп, из которых 5 включают вирусы, которые вызывают болезни
домашних животных. В отдельные субгруппы входят вирусы синего языка 1-25;
африканской чумы лошадей 1—9; эпизоотический геморрагической болезни
оленей 1 и 2; вирус Ибараки; вирус энцефалоза лошадей 1 и 2; и другие вирусы,
поражающие различные виды животных.
Вирусы каждой субгруппы имеют общий антиген, выявляемый серологичес-
ки, или обнаруживают родство при частичном секвенировании.
Классификация ротавирусов также основана на генотипическом и серологи-
ческом анализе. Главные группы определяют по группоспецифическому капсид-
ному антигену VP6 и обозначают А, В, С, D, Е и Е Группа А включает ротавиру-
сы, патогенные для человека и других видов животных; В - включает вирусы,
патогенные только для людей; С и Е — включают вирусы, патогенные для сви-
ней; D и F — включают вирусы, патогенные для птиц. Идентификацию вирусов
внутри серотипа проводят с помощью pH, используя антитела к наружным типо-
специфическим капсидным белкам (VP4 и VP7). Например, в группе А по анти-
гену VP7 выявлено 14 серотипов, а по антигену VP4 — 8 серотипов.
Только немногие представители, за исключением вируса колорадской кле-
щевой лихорадки, составили род колтивирусы. Такие вирусы были выделены в
Калифорнии, Индонезии и Китае.
Род аквареовирусы содержит множество вирусов, патогенных для рыб и дру-
гих животных и растений, обитающих в воде.
Наиболее важную роль в патологии человека и животных играют рота- и ор-
товирусы.
Реовирусные вирионы представляют собой безоболочечные частицы округ-
лой формы диаметром около 80 нм. Вирионы содержат наружный и внутренний
капсид икосаэдральной симметрии и сердцевину.
Геном представлен линейной дцРНК, разделенной на 10 (ортореовирусы и
орбивирусы), 11 (ротавирусы и аквареовирусы) или 12 (колтивирусы) сегментов.
Размер генома у орторео-, орби-, рота-, колти- и аквареовирусрв соответственно
составляет 23, 18, 16—21, 27, 15 тпн. Позитивные цепи каждого двуцепочечного
сегмента имеют КЭП-структуры на 5'-конце, а негативные цепи имеют фосфо-
рилированные 5'-концы. На З'-концах обеих цепей отсутствуют полиА структу-
ры. Патогенность ротавирусов свиней связана с четвертым генным сегментом
[392]. Особенностью строения реовирусов является наличие двойного капсида —
наружного и внутреннего. Капсомеры наружного капсида видны недостаточно
отчетливо, чтобы точно определить их количество и пространственную укладку.
Наружный капсид можно удалить обработкой трипсином. Внутренний капсид
состоит из капсомеров диаметром около 4 нм.
Кроме полных вирионов имеются две стабильные субвирусные частицы. У
одной из них отсутствует только наружный слой капсида (отсутствует белок стЗ и
присутствует расщепленный белок pl). Такие частицы называются инфекцион-
ными субвирусными частицами (ИСЧ). Второй вид субвирусных частиц не со-
держит наружного и среднего капсида (коровые частицы). Белок <т1, которыми
вирионы прикрепляются к клеткам, формирует отростки, проникающие через
наружный капсид у каждой из 12 вершин вириона. Когда наружный капсидный
слой удаляется, эти нитевидные отростки остаются и обеспечивают связь с чув-
ствительными клетками. Коровые частицы содержат РНК-полимеразу, три ма-
жорных (XI, Х2, ст2) и два минорных белка (ХЗ, ц2). 10 геномных сегментов пред-
ставлены крупными, срединными и малыми сегментами. Каждый сегмент коди-
рует один белок, а в результате котрансляционного расщепления могут
образоваться два белка.
Значительное генетическое разнообразие естественной популяции реовиру-
сов животных, вероятно, связано с внутривидовой реасортацией сегментов гено-
ма. Обмен сегментами генома в полевых условиях установлен у вируса катараль-
ной лихорадки овец [1028]. Показана возможность внутривенных рекомбинаций
в гене VP7 между штаммами ротавирусов различных серотипов. Возможно, это
один из механизмов защиты ротавирусов от иммунной системы хозяев [1478].
Инфекционные субвирусные частицы реовирусов прикрепляются к сиало-
фильным гликопротеиновым рецепторам клеток с помощью отростков, распо-
ложенных на 12 вершинах вириона. Тканевой тропизм каждого реовируса опре-
деляется вариациями белка <т1, образующего отростки. Проникшие в цитоплаз-
му путем эндоцитоза вирионы разрушаются с образованием коровых частиц.
Внутри каждой такой частицы находятся РНК-полимераза (транскриптаза) и
кэппирующие ферменты, повторяющие транскрипцию 5'-кэппированных
мРНК, которые выходят в цитоплазму через каналы коровых частиц. РНК-по-
лимераза использует негативные цепи каждого двуспирального генного РНК-
сегмента в качестве матрицы. Первоначально транскрибируются только некото-
рые генные сегменты с образованием четырех мРНК, затем транскрибируются
другие. Соотношение различных мРНК в инфицированных клетках, так же как
эффективность их трансляции, значительно варьирует. Механизм регуляции
этого процесса не известен. После начала синтеза мРНК начинается синтез ге-
номной РНК внутри нового поколения субвирусных частиц.
Механизм этого процесса сложен и не полностью выяснен. Вновь синтези-
рованные дцРНК служат матрицами для транскрипции большого числа мРНК,
которые еще не имеют кэп-структур. Эти мРНК преимущественно транслиру-
ются с образованием большого пула структурных вирусных белков, которые ис-
пользуются в формировании вирионов. Механизм, регулирующий вхождение
отдельных генных сегментов в каждый вирион, не известен.
Вскоре после инфицирования синтез клеточных белков замедляется. Это
происходит потому, что механизм трансляции клеточных кэпзависимых мРНК
менее эффективен, чем механизм трансляции некэппированных вирусных
мРНК. В цитоплазме образуются структуры, именуемые вироплазмой и вирусны-
ми фабриками. Во многих случаях они представляют собой внутрицитоплазмати-
ческие тельца-включения, которые могут достигать большого размера и быть свя-
занными с формированием и скоплением нового потомства вирионов.
Потомство вирионов проявляет тенденцию оставаться в клетке, но иногда
освобождается при лизисе клетки. Например, цитотоксичность вируса синего
языка с экспрессией белка VP5 [761].
До тех пор, пока репликация орби- и ротавирусов не была изучена так де-
тально, как ортореовирусов, казалось, что эти процессы являются подобными.
Однако, прежде чем прикрепиться к чувствительным клеткам, наружный кап-
сидный белок VP4 ротавирусов должен быть расщеплен хемотрипсином тонкого
отдела кишечника. Частицы потомства ротавируса, созревающие в цистерне эн-
доплазматического ретикулума инфицированных клеток, нуждаются во времен-
ном покрытии, которое затем разрушается, замещаясь образованием наружного
капсида за счет белка VP7.
Ортореовирусы
В вирионах обнаружены девять полипептидов, которые по молекулярной
массе разделяются на три класса: крупные (X), средние (р) и мелкие (ст)
(табл. 34). Наружный капсид четко выражен и представлен гекса- и пентагональ-
ными субъединицами, состоящими из трех полипептидов (ц1С, <т1 и <тЗ), причем
два из них (ц1С и сгЗ) составляют более 60% от массы вириона. Белок р1С -
очень важный компонент вириона, ответственен за его прикрепление к поверх-
ности клетки, нейротропизм, обусловливает гемагглютинацию и индуцирует
синтез вируснейтрализующих антител [858, 1628, 1702].
Возможно также, что с ним связано образование Тц-лимфоцитов. У некото-
рых реовирусов белок <т1 может находиться в мультимерной форме (200 кД) и со-
стоит из четырех субъединиц (44 кД) [306]. Поли- и моноклональные антитела к
белку сг 1 защищали мышей от летальной инфекции реовирусом типа 3 при экс-
периментальном заражении, несмотря на накопление вируса в головном мозгу.
Интересно отметить, что защитным действием обладали нейтрализующие и не
нейтрализующие вирус антитела [769]. Этот вирусный белок является также ин-
дуктором и мишенью для Тц-клеток [1131] и участвует в связывании вирионов с
клеточными рецепторами [612].
Белки сгЗ и ц1С являются основными белками наружного капсида. На две
молекулы белка <тЗ приходится одна молекула ц1С. Последние образуют димеры,
связанные дисульфидными мостиками. Белок ц1С отличается от других белков
наружного капсида консервативностью. Он определяет энтеротропность при пе-
роральном введении и последующую нейровирулентность. Белок сгЗ подавляет
синтез клеточных макромолекул и ответственен за установление персистентной
инфекции [858].
В состав сердцевины входят шесть полипептидов, из которых три являются
основными (XI, Х2, <т2) и три минорными (КЗ, <т!, <т2) компонентами. Функцио-
нальная роль минорных компонентов сердцевины и их расположение пока не-
известны. Полипептид К2 — основной компонент 12 полых выступов, которые
проникают через наружный капсид и достигают поверхности вириона [858]. На-
ряду с белком К2 (основной компонент) ст 1 входит в состав 12 выступов икосаэ-
Таблица 34. Структурные белки реовирусов [1105]
Обозначение белка Молекулярная масса, кД Содержание в вирионе, % Количество молекул в вирионе
XI 155 15 105
Х2 140 11 90
ХЗ 135 <2 <12
Ц1 80 <2 20
pic 72 35 550
Ц2 70 <2 <12
о1 42 1 24
<т2 38 7 200
<тЗ 34 28 900
дра вирусной частицы (по две молекулы на каждый выступ) и, по-видимому, ло-
кализуется в вершине выступа оболочки.
Капсомеры внутреннего капсида предположительно состоят из полипепти-
дов Х.1 и <т2 [858]. В культуре клеток почки КЭ ротавирусы птиц вызывают ЦПЭ
синцитиального типа.
Орбивирусы
Этот род объединяет группу арбовирусов, имеющих общие физико-химиче-
ские свойства с ортореовирусами, но отличающихся от них по структуре и мор-
фологии вирионов. Нуклеокапсид орбивирусов окружен диффузным слоем (на-
ружный капсид), состоящим из двух белков VP2 и VP5.
Главный второй капсидный слой образован молекулами белка VP7, органи-
зованными в кольцеподобные структуры. VP2 и VP5, прикрепляются к VP7, ко-
торый становится связанным с VP3 и геномными РНК-сегментами. Так же, как
ортовирусы, ядро орбивирусов содержит РНК-полимеразу и другие белки, свя-
занные с транскрипцией. 10 геномных сегментов являются моноцистронными.
Наиболее изученный представитель рода — вирус катаральной лихорадки
овец или так называемого синего языка (Bluetongue) овец.
Вирусы, имеющие общий комплементсвязывающий антиген, объединены в
одну группу, названную во многих случаях по имени первого вируса, отнесенно-
го к данной группе. Вирусы внутри каждой антигенной группы или антигенные
варианты одного вируса разделены на основе реакции нейтрализации и обозна-
чены порядковыми номерами.
Вирус катаральной лихорадки овец (КЛО) имеет 25 серотипов, африканской
чумы лошадей (АЧЛ) — девять, эпизоотической геморрагической лихорадки оле-
ней (ЭГЛО) - семь, энцефалоза лошадей - пять серотипов [1559]. Генетическая
реасортация при смешанной инфекции может происходить в организме позво-
ночного хозяина, хотя и реже, чем в организме переносчика [ 1364].
Наружный капсид орбивирусов рыхлый и легко удаляется при центрифуги-
ровании в хлористом цезии, в результате чего полные вирионы (L-частицы 470S)
превращаются в однокапсидные вирионы (D-частицы, 390S) с хорошо различи-
мыми капсомерами. Внутренний капсид структурирован и представлен 32 кап-
сомерами [537]. Пентамеры и гексамеры имеют вид полых, далеко отстоящих
друг от друга цилиндрических структур длиной 8 нм и шириной 8—11 нм, с цен-
тральной полостью диаметром 4 нм. Капсомеры этих вирусов в поперечном се-
чении имеют вид кольца или обруча, что послужило основанием для их названия
«орбивирус» (от лат. orbis - кольцо). Орбивирусы наиболее сильные индукторы
интерферона и в этом отношении превосходят ортореовирусы. Это объясняется
неполным экранированием РНК белком в составе однокапсидных вирионов.
На примере вируса КЛО установлено, что наружный капсид приобретается
при выделении вирионов из клетки путем почкования. Если же частицы осво-
бождались, они оказывались без наружного капсида. Внутри- и внеклеточные
вирусные частицы в антигенном отношении различались между собой [826].
У большинства исследованных орбивирусов обнаружено семь структурных
полипептидов (VP1 - VP7), из которых четыре основных (VP2, VP3, VP5 и VP7)
и три минорных. Два полипептида составляют наружный капсид, остальные вхо-
дят в состав сердцевины. На долю четырех основных полипептидов приходится
94% белка вириона. Удаление двух полипептидов наружного капсида сопровож-
дается активизацией РНК-транскриптазы. У вируса КЛО два полипептида (VP2
и VP5) формируют наружный диффузный слой (наружный капсид) вириона, а
полипептиды VP1, VP3, VP4 находятся в поверхностном слое нуклеокапсида
[537, 1593].
Полипептид VP2 определяет серотиповую специфичность, a VP7 ответстве-
нен за групповую специфичность вируса. Эти полипептиды отвечают за индук-
цию соответственно вируснейтрализующих и комплементсвязывающих антител
[251, 821].
Полипептид VP2 орбивирусов является главной антигенной мишенью, на
которой образуются и с которой связываются нейтрализующие антитела [997,
949]. На антигенном домене VP2 (98000 Д) вируса катаральной лихорадки овец
различают по крайней мере четыре эпитопа нейтрализации. Мутации в двух из
них ведут к появлению варианта вируса, ускользающего от нейтрализации теми
же антителами [780]. Эпитопы нейтрализации различаются между собой пове-
дением в системе клеток насекомых и млекопитающих. В полипептиде VP7 ви-
руса катаральной лихорадки овец идентифицированы два иммунодоминантных
эпитопа. Один из них представлен 11 аминокислотными остатками (339-349),
расположенными на С-концевом участке белка, второй — 18 аминокислотными
остатками (122-139). Оба эпитопа характеризуются высокой консервативнос-
тью. Очищенный VP7 реагировал в ИФА с антисыворотками к 24 серотипам
вируса КЛО и другим орбивирусам. Несмотря на наличие серотипоспецифиче-
ских вариабельных участков, в целом структура VP2 достаточно консервативна.
Белок VP2 в дозе 50 мкг вызывал у овец образование нейтрализующих и преци-
питирующих антител и устойчивость к заражению вирулентным штаммом
[822]. Прививка овец полипептидом VP7 не привела к образованию ВНА и им-
мунитета.
У вируса африканской чумы лошадей (АЧЛ) наружный капсидный слой ви-
риона образован полипептидами VP3 и VP5, остальные полипептиды (VP1, VP2,
VP3, VP7) находятся в структуре нуклеокапсида [537].
В составе вируса ЭГЛО обнаружено восемь полипептидов: четыре основных,
четыре минорных. Кроме полипептидов VP2 и VP5, дополнительный минорный
полипептид (90 кД) обнаружен в наружном капсидном слое [537, 1593]. Извест-
ны два серотипа вируса, которые по белку VP3 (103 кД) на 94,7% гомологичны
между собой и на 77% - с соответствующим белком вируса КЛО [1666]. Вирус
энцефалоза лошадей, геном которого представлен 10 фрагментами двунитевой
РНК, имеет белковый капсид, состоящий по меньшей мере из семи структурных
белков (36-120 кК). Различают пять серотипов вируса, выявлено его родство с
вирусами КЛО и ЭГЛО [1599].
Синцитиальный вирус кроликов отнесен к орбивирусу субгруппы Кемерово
[1517].
Ротавирусы
Типичным представителем рода является вирус диареи телят Небраски
(NCDV). В состав рода входят ротавирусы человека, поросят, ягнят, жеребят, оле-
ней, собак, кошек, кроликов, мышей, обезьян и птиц. Ротавирусы являются эти-
ологическими агентами острых гастроэнтеритов новорожденных животных раз-
личных видов и детей раннего возраста. Считают, что возрастная чувствительность
связана с наличием вирусспецифических рецепторов на энтероцитах. Антиген ро-
тавирусов первоначально обнаруживают в эпителии пейеровых бляшек [1557], за-
тем - в локальных или регионарных лимфатических узлах. Вирионы ротавирусов
состоят из сердцевины и двойного капсида — наружного и внутреннего. Наруж-
ный капсид состоит из капсомеров с плохо различимой субъединичной структу-
рой. Внутренний капсид имеет икосаэдральный тип симметрии и состоит из кли-
новидных капсомеров, которые плотно прилегают к сердцевине вириона. В состав
сердцевины входит внутренний белковый слой и нуклеоид. Под электронным ми-
кроскопом вирионы напоминают колесо с широкой ступицей, короткими спица-
ми и тонким наружным ободком. Поэтому они получили название ротавирусы (от
лат. rota - колесо). В препаратах ротавирусов встречаются обычно дву- и однокап-
сидные, а также лишенные нуклеоида частицы («пустые» вирионы). Диаметр дву-
капсидных частиц составляет 70-83 нм, однокапсидных — 60—70 нм. Инфекцион-
ностью обладают только двукапсидные вирионы [62].
11 геномных сегментов ротавирусов кодируют 13 белков, 2 из которых обра-
зуются в результате посттрансляционного расщепления.
Данные по характеристике белковой композиции ротавируса (табл. 35) в ос-
новном получены на модели ротавирусов животных, в частности обезьян, круп-
ного рогатого скота и свиней, которые адаптированы к культуре клеток и накап-
ливаются в высоких титрах.
Таблица 35. Структурные белки вируса катаральной лихорадки овец [537]
Обозначение белка Молекулярная масса, кД Содержание в вирионе Локализация
% Число молекул
VP1 140 2,2 7 Сердцевина
VP2 ПО 22,8 98 Наружный капсид
VP3 101 16,2 76 Сердцевина
VP4 82 1,0 6 Сердцевина
VP5 61 20,1 156 Наружный капсид
VP6 42 2,8 32 Сердцевина
VP7 29 34,9 570 Сердцевина
В вирионах ротавирусов обнаружено шесть полипептидов (VP1, VP2, VP3,
VP4, VP6 и VP7) с молекулярной массой от 37 до 125 кД, один из которых (VP7)
гликозилирован.
Два белка VP4 (90 кД) и VP7 (36—38 кД) являются компонентами наружного
капсида и не обнаруживаются в однокапсидных частицах. Другие белки образу-
ют внутренний капсид или ассоциированы с сердцевиной вируса. Мажорным
белком вириона является полипептид внутреннего капсида VP6 (42 кД). Три бел-
ка VP1, VP2 и VP3 входят в состав сердцевины [644].
Изучение промежуточных продуктов синтеза ротавируса обезьян показало,
что вначале образуются «предсердцевинные» частицы (45 нм, 220S), содержащие
белки VP1, VP3 и неструктурные (NS 53; 35 и 34); после включения VP2 они ста-
новятся сердцевинными частицами (60 нм, 310S), а затем, после присоединения
VP6, становятся однокапсидными частицами [1599]. Завершается формирование
полных вирионов включением VP4 и VP7.
Полипептиды наружного капсида ротавирусов представляют особый инте-
рес, поскольку играют основную роль в возникновении инфекционного процес-
са и развитии иммунитета. Они ответственны за осуществление ранних этапов
взаимодействия вирионов с чувствительными клетками — адсорбцию и проник-
новение, с ними связывают вирулентность ротавирусов. Эти же белки (VP7 и
VP4) вызывают образование специфических вируснейтрализующих антител.
Они ответственны за иммуногенность ротавирусов. Вирусоподобные частицы
Таблица 36. Структурные белки ротавирусов
Обозна- чение белка Молеку- лярная масса, кД Содержание в вирионе белков, % от всей их массы Локализация Основные функции
VP1 125 2 Сердцевина Репликация вирусной РНК
VP2 102 15 Сердцевина Морфогенез и стабилизация структуры генома
VP3 98 0,5 Сердцевина Репликация вирусной РНК
VP4 87 1,5 Наружный капсид Инфекционная и ГА-активность, индукция протективного иммунитета и ВН-антител; участие в ограничении круга хозяев
VP6 45 51 Внутренний капсид Стабилизация морфологической целостности и функциональной активности однокапсидных вирионов, группоспецифическая антигенная активность
VP7 37 30 Наружный капсид Основной протективный антиген, индукция ВН-антител, типоспеци- фическая антигенная активность, ограничение круга хозяев
ротавирусов, содержащие основные иммуногенные белки, могут служить свое-
образными компонентными вакцинами [493].
Белок VP7 является основным протективным антигеном ротавирусов, ответ-
ственным за образование ВН-антител. С помощью моноклональных антител
(МАТ) в его составе обнаружен большой домен нейтрализации, включающий
несколько перекрывающихся эпитопов [706]. Гликозилирование VP7 - необхо-
димое условие для взаимодействия с клетками-мишенями и проявления инфек-
ционности.
Другим важным белком наружного капсида является VP4. Он ответственен
за адаптацию ротавирусов к росту in vitro, контролирует их вирулентность на
уровне организма, к тому же является вирусным гемагглютинином и, по-види-
мому, осуществляет некоторые функции, что и гемагглютинин вируса гриппа, то
есть является вирусным белком, обеспечивающим проникновение вируса в
клетку. Гемагглютинирующий и нейтрализующий домены находятся в N-конце-
вой половине VP4 ротавируса [974].
В отличие от гемагглютинина орто- и парамиксовирусов, гемагглютинин ро-
тавирусов не является гликопротеином, хотя в первичной структуре этого белка
обнаружены потенциальные сайты гликозирования. В результате протеолиза от
полипептида VP4 отщепляется фрагмент — VP8, в котором обнаружено пять ней-
трализующих эпитопов [769].
Нейтрализующие моноклональные антитела к VP7 и VP4 сообщали протек-
тивный иммунитет против гомологичного и некоторых гетерологичных сероти-
пов ротавируса [1026]. Способность VP4 и VP7 к независимой и гетеротипичес-
кой индукции синтеза протективных антител может иметь важное значение при
конструировании современных ротавирусных вакцин.
Сравнительное изучение антигенных свойств ротавирусов различными ме-
тодами показало наличие у них общих групповых антигенов. Групповое сходст-
во определяется антигенной общностью внутреннего капсида, а антигенная спе-
цифичность связана с белками наружного капсида [62]. Ротавирусы разделяют
на группы, субгруппы и серотипы. Белки наружного капсида содержат типоспе-
цифические антигенные детерминанты, а внутреннего — группоспецифические
и субгруппоспецифические антигенные детерминанты. Групповая принадлеж-
ность определяется антигенной общностью белка VP6, субгрупповая — его анти-
генными различиями. Гликопротеин VP7 (главный белок нейтрализации) явля-
ется типоспецифическим антигеном ротавирусов и определяет их серотиповую
принадлежность [731]. Серотиповая специфичность отличается высокой кон-
сервативностью [1099]. Критерием антигенного различия вирусов принята 20-
кратная или большая разность титров вируса в PH с гомологичными и гетероло-
гичными антителами.
Исходя из наличия общего группоспецифического антигена (VP6), все рота-
вирусы, независимо от вида естественного хозяина, разделены на шесть анти-
генных групп: А, В, С, D, Е и Е Наиболее многочисленна группа А, представи-
тели которой играют существенную роль в патологии человека и животных.
Большинство ротавирусов человека и животных относят к группе А, включа-
ющей так называемые типичные ротавирусы. Ротавирусы других групп называ-
ют атипичными, или параротавирусами. Они изучены недостаточно, поскольку,
за небольшим исключением, их пока не удалось размножить in vitro [136]. Каж-
дая группа ротавирусов на основании типоспецифических антигенов делится на
серотипы. Так, ротавирусы группы А разделены на 11 серотипов, получивших
название G-серотипы (табл. 37).
В другие антигенные группы также входят ротавирусы, поражающие различ-
ных хозяев. Вирусы, имеющие одного хозяина, могут настолько сильно разли-
чаться между собой в антигенном отношении, что представляют различные анти-
генные группы. Штаммы ротавирусов, относящиеся к одному серотипу, но выде-
ленные от различных видов животных, часто имеют более тесную антигенную
связь, чем штаммы различных серотипов, выделенные от одного вида животных.
Таблица 37. Классификация ротавирусов группы А
Серотип Субгруппа Хозяин Прототипный штамм
G1 11 Человек Wa
G2 1 Человек DS-1
Обезьяна SA-11
Собака СИ-1
Кошка ТаКа
G3 11 Человек Р
Свинья С1
Лошадь Н-2
Кролик С-11
G4 1 Свинья Sb-2
II Человек St-3
11 Свинья Gottfried
G5 *НИ Человек 69М
G6 1 Свинья OSu
I Лошадь H-l
G7 I Крупный рогатый скот NQUV
G8 НИ Крупный рогатый скот B223
G9 ни Куры Ch-2
Индейки Tu-1
G10 ни Куры Ch-1
G11 ни Свинья YM
*НИ — неизвестно.
В группу В входят ротавирусы человека, крупного и мелкого рогатого скота,
в группу С — человека и свиней, группы Е и F — свиней, группу D — птиц. В на-
стоящее время различают не менее четырех серотипов ротавируса человека. Из-
вестно о существовании не менее трех серотипов ротавирусов группы А свиней
[1140]. Кроме того, известны ротавирусы свиней, относящиеся к серогруппам В,
С, Е. Серогрупповая серотиповая вариантность имеет место у ротавирусов круп-
ного рогатого скота [200] и других животных. В перекрестной реакции нейтрали-
зации тесное антигенное родство выявлено между ротавирусами обезьян и сви-
ней, а также между ними и ротавирусами крупного рогатого скота. Гомология
первичной структуры VP7 различных серотипов достигает 71—85%. Различная
степень антигенного родства по VP4 обнаружена между ротавирусами, выделен-
ными от свиней, человека, обезьян и собак. Штамм (АН-1), выделенный от че-
ловека, характеризовался высокой гомологией с ротавирусом, выделенным от
кошек (FRV-1) [1143]. От крупного рогатого скота с диареей выделен ротавирус,
геномная РНК которого была аналогична ротавирусу птиц [415]. Ротавирусы че-
ловека и свиней имели высокую степень гомологии нуклеотидных последова-
тельностей и, возможно, могли иметь общего предка [477].
Ротавирусы обезьян, свиней и кроликов легко инфицировали телят в экспе-
риментальных условиях [458]. Ротавирус человека вызывал летальную инфек-
цию у новорожденных поросят при оральном заражении. Существуют ротавиру-
сы, обладающие двойной субгрупповой специфичностью. Такая уникальная
способность обнаружена, например, у ротавируса лошадей (штамм FI-14), кото-
рый взаимодействовал с антителами первой и второй субгрупп [807]. Известен
штамм ротавируса свиней с двойной серотипоспецифичностью (G3 и G5) [1141].
Природа антигенного полиморфизма у ротавирусов пока не выяснена. Приве-
денные выше данные свидетельствуют о возможности пересечения ротавируса-
ми видовых барьеров и их миграции между различными классами и видами мле-
копитающих в естественных условиях [415].
В последнее время у кур, свиней и человека были обнаружены атипичные
ротавирусы, не имеющие группоспецифического антигена, несмотря на типич-
ную для ротавирусов морфологию. Они были названы параротавирусами. Ати-
пичные штаммы были обнаружены в 5% случаев при ротавирусных инфекциях у
свиней и в 1% — ротавирусных диареях у крупного рогатого скота. При изучении
с помощью ЭФ в ПААГ выявлены различия в профиле геномов этих штаммов и
типичных ротавирусов [1262]. Параротавирусы свиней, в отличие от ротавиру-
сов, вызывают образование синцития из энтероцитов в тонком кишечнике. Хе-
мопротеин в тонком отделе кишечника удаляет наружный капсид ортореовиру-
сов и ротавирусов и повышает их эффективность.
Колтивирусы и аквареовирусы по структуре и свойствам практически не от-
личаются от свойств, присущих семейству.
Катаральная лихорадка овец (синий язык)
Катаральная лихорадка овец (синий язык) — неконтагиозная вирусная бо-
лезнь овец, реже крупного рогатого скота, протекающая в виде эпизоотии или
энзоотии, которая переносится кровососущими насекомыми, в основном мок-
рецами. Болезнь у овец характеризуется лихорадкой, язвенным воспалением
слизистых оболочек рта и носовой полости, опуханием языка, отеком лицевой
части головы, пододерматитом и дегенерацией мышечных волокон.
Вирус КЛО способен проникать через плаценту, что приводит к различным
последствиям: мумификации эмбрионов, нарушению развития плодов, рожде-
нию нежизнеспособных ягнят. Известно более 25 серотипов вируса. Многие из
них могут циркулировать одновременно. При одновременном инфицировании
различными серотипами вируса и даже различными штаммами одного серотипа
может происходить генетическая рекомбинация. Антигенный шифт является
результатом реассортации сегментов генома при смешанном инфицировании
[1170].
Переболевшие овцы приобретают длительный, возможно, пожизненный
иммунитет к тому типу вируса, который вызвал заболевание. В крови накапли-
ваются комплементсвязывающие и вируснейтрализующие антитела, передавае-
мые потомству с молозивом. Ягнята, родившиеся от иммунных овец, в течение 3
месяцев остаются невосприимчивыми к заболеванию. У переболевших овец
нейтрализующие антитела достигают максимального титра к 30-му дню и сохра-
няются не менее года. КСА появляются через 10 дней, максимально накаплива-
ются через 30 дней и сохраняются в высоком титре в течение нескольких меся-
цев после начала заболевания. Важное значение в прекращении вирусоноси-
тельства у овец играют клеточные факторы иммунитета. Отмечена корреляция
между интенсивностью реакций клеточного иммунитета и устойчивостью овец к
контрольному заражению [1462].
Для специфической профилактики КЛО применяют живые и инактивиро-
ванные вакцины. При иммунизации овец широко использовали живые моно- и
поливалентные вакцины, вирус для которых аттенуировали серийными пассажа-
ми в куриных эмбрионах при пониженной температуре (33,5°С). Вакцину успеш-
но применяли при ликвидации эпизоотии в Португалии и Испании. Антигенный
спектр поливакцины меняли в зависимости от антигенной особенности циркули-
рующих штаммов вируса. В ЮАР готовили вакцину из 14 антигенно различных
типов вируса. Позже аттенуированные в КЭ штаммы вируса размножали в пер-
вичных культурах клеток почки ягнят и эмбриона крупного рогатого скота. Жи-
вые вакцины овцам вводят однократно подкожно. Иммунитет наступает через 10
дней и продолжается не менее 1 года. Однако в связи с высокой реактогенностью
живых вакцин, реверсией вирулентности аттенуированных штаммов в организме
переносчиков и возможным появлением рекомбинантных штаммов (реассорта-
ция генов), особенно в случае применения поливакцин, предпочтение стали от-
давать инактивированным вакцинам. Безопасная высокоиммуногенная вакцина
против КЛО впервые была разработана в бывшем СССР. С этой целью оптимизи-
рована технология промышленного изготовления препарата, разработаны мето-
ды контроля вакцины и определены условия ее практического применения.
Особое внимание уделяли разработке промышленного метода получения ка-
чественного сырья, надежного щадящего метода инактивации вируса и получе-
нию иммуногенного препарата. Наиболее технологичным и продуктивным (7—8
1g ТЦД50/мл) способом получения вирусного сырья оказалось выращивание ви-
руса КЛО в суспензии клеток ВНК-21. В качестве инактивирующих агентов
сравнивали формалин, ДЭН и гамма-лучи. Для контроля полноты инактивации
вируса использовали три метода: пассажи инактивированного препарата в куль-
туре клеток ПЯ; пассажи крови вакцинированных овец на неиммунных ягнятах,
которых затем исследовали на наличие вируснейтрализующих и комплементсвя-
зывающих антител и иммунитета. Все серии инактивированной вакцины (0,06%
ДЭИ, 37°С, 72 ч) оказались свободными от инфекционного вируса КЛО. Имму-
ногенность вакцины определяли на овцах методом контрольного заражения че-
рез 21—30 дней после прививки и по титру ВНА.
Антигенные и иммуногенные свойства вакцины значительно повышались в
присутствии адъюванта. Сорбированная вакцина с ГОА 3 мг/мл, сапонин
1 мг/мл по эффективности не уступала эмульгированному препарату. Титрова-
ние девяти серий вакцины на овцах показало, что ИмД50 во всех случаях была
меньше 0,5 мл. Ягнята 2—2,5-месячного возраста приобретали выраженный им-
мунитет только после двукратного введения вакцины. Ягнята 4—5-месячного
возраста приобретали выраженный иммунитет после однократной прививки.
При 2—6°С вакцина сохраняла иммуногенные свойства в течение 21—24 мес.,
а при комнатной температуре (20—25°С) — 12 мес. (срок наблюдения).
Инактивированная вакцина в дозе 2 мл вызывала у привитых овец выражен-
ный иммунитет продолжительностью не менее 12 мес. (срок наблюдения). В
крови этих животных обнаруживали вируснейтрализующие антитела (в основ-
ном в разведениях 1:8 — Г. 16), которые сохранялись на одном уровне в течение
года (период наблюдения). Комплементсвязывающих антител у этих животных
не обнаружили, что дает возможность отличать больных овец от вакцинирован-
ных. Инактивированная эмульгированная вакцина против четырех серотипов
вируса при однократном введении овцам в дозе 5 мл создавала иммунитет про-
должительностью не менее 9 месяцев [169].
По данным других авторов [1462], полная инактивация вируса наступала в
присутствии 0,02 М ДЭИ при 37°С через 42 ч. Инактивированный вирус не вы-
зывал образования каких-либо антител у овец, после добавления адъюванта об-
разовывались преципитирующие, реже комплементсвязывающие, но не нейтра-
лизующие антитела. У овец, привитых адъювантным препаратом, виремия после
контрольного заражения не развивалась, что указывает на преимущественное
развитие клеточного иммунитета после вакцинации.
Инактивированная эмульгированная вакцина против двух серотипов вызы-
вала образование антител и создавала защиту у овец при заражении гомологич-
ными вирулентными вирусами в экспериментальных условиях [11].
В препаратах вируса КЛО, обработанных гамма-лучами в дозе 60G, остаточ-
ный инфекционный вирус обнаружен при испытании на овцах, но не в культуре
клеток или на белых мышах. В препарате, инактивированном гамма-лучами в
дозе 100G, вирус не обнаружен. Такой препарат вызывал у овец иммунитет и об-
разование преципитирующих, а также ВН-антител, но не защищал от виремии
после контрольного заражения. Имеется сообщение о получении высокоактив-
ной вакцины, вирус в которой инактивировали солями платины.
Профилактические прививки хорошо зарекомендовали себя во многих стра-
нах. Однако это касается в основном живых вакцин, поскольку инактивирован-
ные вакцины широко не применяли.
Африканская чума лошадей (АЧЛ)
Африканская чума лошадей (АЧЛ) - заболевание однокопытных животных,
протекающее в подострой легочной, острой отечной или сердечной, смешанной
формах, а также в виде легкопротекающего лихорадочного заболевания. Возбу-
дитель передается кровососущими насекомыми. Заболеваемость и летальность
лошадей и мулов могут достигать высоких показателей. Известно девять анти-
генных типов возбудителя, который обладает гемагглютинирующими свойства-
ми и вызывает образование ВНА-, КСА- и преципитирующих антител. Типоспе-
цифичность выявляют в PH и РТГА. Реконвалесценты приобретают иммунитет
продолжительностью в несколько лет.
Для специфической профилактики АЧЛ применяют живые и инактивиро-
ванные вакцины. Аттенуацию вируса проводят путем серийного внутримозго-
вого пассирования на белых мышах или морских свинках. Для размножения и
аттенуации вируса в последнее время широко используют культуры перевивае-
мых клеток. Вирус сравнительно быстро теряет вирулентность, но сохраняет
иммуногенность. В практических условиях чаще всего используют живую поли-
валентную вакцину против девяти серотипов вируса. У вакцинированных жи-
вотных создается прочный иммунитет продолжительностью не менее 1 года
[915].
В благополучных по АЧЛ странах для профилактической вакцинации пред-
почитают использовать инактивированные вакцины, обеспечивающие иммуни-
тет на период не менее 6 месяцев.
Ротавирусная диарея у детей
Ротавирусы ежегодно вызывают 600 тыс. смертельных исходов у детей по
всему миру, главным образов в развивающихся странах. Естественный защит-
ный иммунитет развивается в течение первых 2—3 лет жизни. Большинство тя-
желых случаев ротавирусной диареи предотвращаются оральной иммунизацией.
Совершенствование вакцин шло по линии использования гетерогенных ротави-
русов обезьян и КРС. Реассортанты экспрессируют поверхностные антигены
VP7 ротавируса человека. В 1998 г. в США разрешена резус-человеческая реас-
сортантная тетравалентная ротавирусная вакцина (RRV-TV) и рекомендована
для универсальной иммунизации здоровых детей. Намечено ее лицензирование
в Европе. В Финляндии эта вакцина предотвратила 90% тяжелых эпизодов рота-
вирусных гастроэнтеритов. Защитная эффективность вакцины RRV-TV в разви-
вающихся странах ниже, и там необходима более интенсивная иммунизация.
Исследуется другой кандидат ротавирусной вакцины, включающий «бычьи-че-
ловеческие» реассортанты.
Ротавирусная диарея у поросят (РДП)
Ротавирусная диарея у поросят (РДП) клинически характеризуется развити-
ем диарейного синдрома 3—6-недельных поросят. Поэтому РДП часто называют
поносом 3-недельных поросят. Клетками-мишенями ротавируса являются энте-
роциты апикальной части ворсинок тонкого отдела кишечника.
Заболеваемость при РДП может достигать 50%, а летальность обычно не пре-
вышает 5%. Ротавирусный энтерит поросят широко распространен во всех стра-
нах с развитым свиноводством. У взрослых свиней инфекция протекает бес-
симптомно. Эти животные являются основными носителями и распространите-
лями вируса. Антитела обнаруживают у многих или у всех свиноматок фермы.
Разница состоит в титре антител. Если естественная инфицированность маточ-
ного стада высока, то и защищенность поросят от РДП в течение первых 2—3 не-
дель жизни будет обеспечена за счет колостральных антител.
У 90—100% поросят до 5-6-недельного возраста можно обнаружить ротави-
русы в фекалиях без каких-либо признаков заболевания.
Продолжительность экскреции вируса, как правило, не превышает одной
недели. Механизм защиты поросят от РДП основан на антивирусном действии
IgA в кишечнике так же, как и при ТГС [776]. В популяции свиней в основном
циркулирует один серотип. Для специфической профилактики РДП иногда при-
меняют живые вакцины. Аттенуированные штаммы вируса получают путем се-
рийного размножения в чувствительных культурах клеток.
Титры сывороточных, молозивных и молочных антител у вакцинированных
свиноматок были в три раза выше, чем у невакцинированных. Поросята-сосуны
от вакцинированных свиноматок лучше росли и имели более длительную защи-
ту за счет колостральных антител [667]. Колостральные антитела могли снижать
эффективность оральной иммунизации поросят.
Двукратная внутримышечная иммунизация поросят защищала их от экспе-
риментального заражения гомологичным вирулентным штаммом.
Получена живая вакцина против двух основных серотипов ротавирусов сви-
ней типа А. Аттенуированные штаммы A] (OSU) и А2 (Айова) ротавируса свиней
не реверсировали при 6-кратном пероральном пассировании на поросятах-гно-
тобиотах. Внутримышечное введение вакцины 3-дневным поросятам вызывало
у них устойчивость к последующему (через 14 дней) пероральному заражению
гомологичными вирулентными штаммами вируса. Свиноматок прививали внут-
римышечно в дозе 2 мл за четыре и две недели до опороса. Поросят от таких сви-
ней прививали внутримышечно и перорально в дозе по 1 мл в возрасте 7 дней и
при отъеме. В результате заболеваемость поросят снизилась на 58% от всех при-
чин в течение подсосного периода и 10 дней после отъема.
Ротавирусная инфекция крупного рогатого скота (РВИК)
Ротавирусная инфекция крупного рогатого скота (РВИК) — широко распро-
странена во всем мире. Инфекция клинически проявляется только у телят в ви-
де рецидивирующей диареи. Заболеваемость может достигать 90%, смертность -
5—25%. Ротавирусу крупного рогатого скота присуща значительная вариабель-
ность вирулентности и антигенности. Известно три серотипа возбудителя и,
кроме того, у крупного рогатого скота выявлены антитела к трем серотипам ро-
тавируса человека [1432].
Отмечено, что в естественных условиях ротавирусная диарея у телят проте-
кает гораздо тяжелее, чем при экспериментальном заражении. В эволюции
естественного заболевания, по-видимому, участвуют и другие факторы. При экс-
периментальном заражении телят большой дозой культурального вируса выяв-
лено явление аутоинтерференции. Ротавирус размножается в дифференциро-
ванных эпителиальных клетках ворсинок (в апикальной части ворсинок) всего
тонкого отдела кишечника. Слизистая оболочка тонкого отдела кишечника не
повреждается. Поражение эритроцитов приводило к нарушению пищеваритель-
ной и всасывающей функции кишечника. На вершинах ворсинок происходили
ускоренная миграция и преждевременное слущивание энтероцитов. Ускоренная
регенерация поверхности апикальной части ворсинок за счет незрелых, резис-
тентных к вирусной инфекции эпителиальных клеток из крипт являлась причи-
ной нарушенного пищеварения уже после окончания инфекционного процесса.
В дальнейшем происходит восстановление нормальной структуры ворсинок и
пищеварения [853]. Вирус в фекалиях появляется через 1 —2 дня после заражения
и выделяется в течение месяца. ВНА появляются в крови на 7-й день и достига-
ют максимума через четыре недели после заражения [1127]. У некоторых телят
спустя 2 месяца после выздоровления выделение вируса повторялось 2—3 раза.
Иногда выделенные от одних и тех же телят штаммы отличались между собой.
По-видимому, это было результатом реинфицирования одних и тех же телят раз-
ными штаммами или связано с антигенным дрейфом вируса в процессе персис-
тентной инфекции [724]. С другой стороны, стабильность отдельных серотипов,
циркулирующих на фермах, сохранялась в течение года. Только на одной ферме
выявлена инфекция двумя антигенно различными возбудителями [666]. Зараже-
ние разными серотипами ротавируса крупного рогатого скота не сопровождает-
ся перекрестной защитой. Реинфекция телят даже через четыре недели после пе-
ренесенной диареи другим серотипом вируса приводит к повторному заболева-
нию [1396].
Кроме существования известных серотипов вируса, не исключается возмож-
ность циркуляции атипичных ротавирусов (параротавирусов) крупного рогатого
скота [ 1602], что значительно затрудняет решение и без того сложной проблемы
специфической профилактики ротавирусной диареи телят.
Наряду с системным иммунным ответом при ротавирусной диарее телят
важную роль играет местный кишечный иммунитет. Антитела в тощей кишке
появились через 3— 12, а в фекалиях — через 4-18 дней после инфицирования те-
лят ротавирусом. В содержимом тощей кишки выявили антитела классов IgA,
IgG и IgM. У большинства телят преобладали антитела изотипа IgG,.
Предполагают, что иммунная система крупного рогатого скота распознает
нейтрализующие антигены, общие для разных ротавирусов. Например, повтор-
ная иммунизация коров одним из четырех серотипов ротавируса человека,
ротавирусом обезьян или крупного рогатого скота ведет к индукции нейтрали-
зующей активности против всех указанных ротавирусов. При этом отмечается
повышение в 10—100 раз нейтрализующей ротавирусы активности в молоке в
первые восемь дней. Молоко коров, гипериммунизированных ротавирусами
животных, может быть использовано для пассивной пероральной иммунизации
детей [412]. Гомо- и гетерологичная защита телят через молозиво и молоко
бустеризированных коров представляется более надежной, чем вакцинация
самих телят. Кормление телят молозивом от матерей, ранее иммунизированных
инактивированной вакциной, может предотвратить появление диареи ново-
рожденных.
Изучение защиты при перекрестном заражении телят различными ротавиру-
сами крупного рогатого скота показало, что одни штаммы обладают гомологич-
ной и гетерологичной защитой, другие только гомологичной, третьи — никакой,
хотя индуцируют образование гомо- и гетерологичных гуморальных ВН-анти-
тел. Титр копроантител существенно повышался после заражения телят вторым
вирусом. Высказано предположение, что перекрестная защитная активность
разных штаммов (серотипов) ротавируса у телят обусловлена не ВН-антителами,
а другими невыясненными факторами [1679].
Специфическая профилактика РВИК находится в стадии разработки и ис-
пытания. Создаются и проверяются живые и инактивированные вакцины. Атте-
нуированные штаммы получают серийным пассированием вируса в чувстви-
тельных культурах клеток. Необходимую степень аттенуации достигали после
114 пассажей в культуре клеток почки телят при 37 °C. Живую комбинированную
вакцину против рота- и коронавирусной инфекции вводили телятам перорально
в первые часы жизни. Через шесть дней такая вакцинация телят при отсутствии
специфических антител в молоке матерей создавала устойчивость к заражению
вирулентными штаммами рота- и коронавирусов. Однако при наличии антител
в молозиве эффективность вакцинации снижалась.
В специфической профилактике РВИК предпочтение, как правило, отдает-
ся разработке инактивированных вакцин и способам их применения. За неболь-
шим исключением применение таких вакцин сопровождалось в различной сте-
пени положительным эффектом.
Культуральную инактивированную эмульгированную вакцину вводили ко-
ровам двукратно в область подгрудка по 10 мл за месяц до отела и перед самым
отелом. Иммунное молоко собирали с 3-го по 24-й день лактации и хранили при
-20°С. Аналогичные результаты получены от коров, привитых двукратно инак-
тивированной вакциной за 40 и 20 дней до отела. В результате вакцинации у
стельных коров приблизительно в 10 раз повышался титр специфических анти-
тел в молозиве и молоке. Скармливание таких препаратов защищало телят от за-
болевания и снижало экскрецию ротавируса в случае инфицирования.
Комбинированную вакцину готовили из рота- и коронавирусов крупного ро-
гатого скота, инактивированных БПЛ, и вводили коровам подкожно дважды по
5 мл с интервалом 21 день. Вакцинация сопровождалась нарастанием титра сы-
вороточных антител, который достигал максимума спустя 3—4 недели, а затем
постепенно снижался. Однако испытание такой вакцины в полевых условиях не
дало положительного эффекта [1612]. Инактивированную вакцину против рота-
вирусной инфекции готовили с различными адъювантами. Коров вакцинирова-
ли двукратно подкожно в конце стельности. Наиболее высокие титры антител и
наиболее продолжительную их секрецию с молоком наблюдали после введения
вакцины, содержащей ГОА и сапонин в качестве адъюванта. Титр специфичес-
ких антител в молозиве после вакцинации увеличился в 10—12 раз [275]. Вакци-
нация коров таким препаратом за 1—3 мес. до отела в значительной степени пре-
дохраняла телят от ротавирусной инфекции [1046]. Аналогичные данные полу-
чены при вакцинации стельных коров эмульгированной вакциной против рота-
и коронавирусной инфекций [1110].
Живую вакцину из аттенуированных штаммов рота- и коронавирусов круп-
ного рогатого скота вводили стельным коровам в заднюю четверть вымени в до-
зе 2 мл. У родившихся от них телят в 2 и более раз снижались случаи и продол-
жительность диарей по сравнению с контрольными группами животных. Вакци-
нация телят в суточном возрасте дала сходные результаты [202].
Тендосиновит кур (ТСК)
Тендосиновит кур (ТСК), или вирусный артрит, проявляется хромотой, отеч-
ностью сухожилий и суставов, высокой ранней смертностью, плохим ростом,
снижением яйценоскости и выводимости цыплят. Заболеваемость составляет
5-20%.
Различают несколько серотипов реовирусов птиц (в США — четыре, в Япо-
нии — пять). На основании сравнительного исследования штаммов реовирусов
птиц, выделенных в различных странах, установлено существование не менее 11
серотипов вируса. Реовирусы, выделенные от кур, имеют групповой антиген,
выявляемый в реакции иммунофлюоресценции, связывания комплемента и им-
мунодиффузии. Однако реакции между гетерологичными штаммами не бывают
полными. Реовирусы птиц антигенно не связаны с таковыми млекопитающих.
Реовирусы птиц хорошо размножаются в культуре клеток почек цыплят, в КЭ, но
не в культуре фибробластов КЭ. Установлена трансовариальная передача вируса.
Присутствие вируса в клинических пробах не может служить доказательством
его этиологической роли. Серологические результаты трудно учитывать из-за
широкого вирусоносительства.
Для специфической профилактики ТСК применяют живые и инактивиро-
ванные вакцины. Иммунизируют главным образом кур-несушек. Создание на-
пряженного иммунитета в родительском стаде преследует цель снижения тран-
совариальной передачи вируса и создания достаточного уровня пассивного им-
мунитета у цыплят с первого дня жизни. Однако реовирусы могут размножаться
и в кишечнике при достаточно высоком уровне гуморальных антител. Остается
неизвестным, вирус какого серотипа играет основную роль в возникновении за-
болевания и значение гетерологичного иммунитета в защите. Поэтому неудиви-
тельно, что сообщения об эффективности вакцин неоднозначны. Инактивиро-
ванную эмульгированную вакцину готовят из вирулентного штамма S-1133 [98],
живую - обычно из того же штамма, прошедшего около 200 пассажей в КЭ
[1678]. Штамм ИМ 1-203 после 19 дополнительных пассажей в культуре клеток
КЭ сохранил вирулентность для однодневных цыплят и потерял ее для шести-
дневных цыплят, сообщая последним устойчивость к заражению вирулентным
штаммом вируса. Аттенуированный штамм ИМ 1-203, в отличие от аттенуиро-
ванного штамма S-1133, не размножался в культуре макрофагов и не вызывал
иммунологической супрессии в отношении других вакцинных препаратов. Им-
муногенность вакцины оценивают по устойчивости к экспериментальному зара-
жению однодневных цыплят от вакцинированных кур-несушек.
Иммунизация кур-несушек только живой вакциной из аттенуированного
штамма S-1133 оказалась недостаточно эффективной. Она примерно в два раза
снижала заболеваемость цыплят по сравнению с цыплятами от невакцинирован-
ных кур. Однако выживаемость вируса в суставах зараженных цыплят обеих
групп практически не различалась. Рекомендуют использовать аттенуированные
вакцины для иммунизации молодых птиц с последующим введением инактиви-
рованных препаратов курам для защиты потомства с помощью материнских ан-
тител [861]. Установлена прямая зависимость между кратностью и схемой при-
вивок кур-несушек инактивированными вакцинами, уровнем материнских
антител, передаваемых цыплятам, и их устойчивостью к клиническому проявле-
нию болезни после контрольного заражения вирулентным штаммом вируса.
Однократное введение курам живой вакцины с последующим двукратным вве-
дением инактивированной вакцины обеспечило более высокую защиту потом-
ства, чем двукратное введение живой вакцины, а затем однократное — инактиви-
рованной.
Эффективность вакцинации кур против гетерологичных штаммов вируса
изучали с помощью живой и инактивированной вакцин, полученных из штамма
S-1133. Кур-несушек прививали подкожно вначале инактивированной вакци-
ной двукратно с интервалом пять недель, а через 12 недель - живой. ВН-антите-
ла обнаружили в сыворотке крови у всех кур, хотя их титр варьировал в широких
пределах (1:2 - 1:2048). При контрольном заражении у однодневных цыплят об-
наружили иммунитет к гомологичному и гетерологичным штаммам вируса
[1678]. Из этих данных следует, что при достаточном уровне пассивного иммуни-
тета возможна защита цыплят от гетерологичного штамма вируса.
10.13. Бирнавирусы
Это семейство объединяет несколько видов вирусов, геном которых пред-
ставлен двумя сегментами двуспиральной РНК. Вирусы, входящие в семейство,
составляют два рода: авибирнавирусы (прототипный вирус инфекционного бур-
сита птиц) и аквабирнавирусы (прототипный вирус инфекционного некроза
поджелудочной железы лососевых рыб). В род аквабирнавирусы входят также
другие бирнавирусы рыб моллюсков и насекомых.
Бирнавирусы представляют собой безоболочечные частицы (икосаэдры) ди-
аметром 58—60 нм, плавучей плотностью 1,33 г/см3 [883] и молекулярной массой
55—81 мД. Однослойный капсид образован 132 капсомерами. Геномные сегмен-
ты двуцепочечной РНК вируса ИБ имеют молекулярную массу 2,06 и 1,76 мД.
Меньший сегмент кодирует один полипептид, а больший — три главных поли-
пептида [270]. Обнаружен полипептид VPg, ковалентно связанный с геномом
[593]. В составе бирнавирусов различают четыре полипептида: VP1 (80 кД), VP2
(41—44 кД), VP3 (32—33 кД) и VP4 (30 кД) [884]. Белок VP2 является результатом
протеолитической модификации белка 50 кД в составе зрелых вирионов [883].
Белок VP2 является главным иммуногеном. Аминокислотные замены в вариа-
бельной области белка VP2 ведут к изменению антигенности вируса [1692]. Вы-
явлено несколько типов вирионов, различающихся плавучей плотностью. Час-
тицы с плавучей плотностью 1,33 г/см3 представляют собой полные, инфекци-
онные вирионы. Они содержат два мажорных полипептида с молекулярной
массой 32 и 40 кД, а также минорные полипептиды 28, 33, 48, 49, 90 и 95 кД. Ви-
рионы с меньшей плавучей плотностью формируются в культурах клеток. Они
содержат меньше РНК и полипептиды с незавершенным процессингом. Де-
фектные интерферирующие частицы (ДИЧ), имеющие укороченный большой
сегмент генома, интенсивно образуются в культуре при высокой множественно-
сти заражения. Неполные частицы (ДИЧ) вируса ИБ интерферируют со стан-
дартным вирусом, подавляют его репродукцию в культуре, защищают цыплят от
летальной инфекции до формирования специфического протективного имму-
нитета [1120]. Полипептид с молекулярной массой 32 кД вируса ИБ обладает
протективными свойствами [816] и является важным иммуногеном. Методом
иммуноблотинга установлено, что первичный иммунный ответ адресован к бел-
ку 32 кД. На более поздних стадиях появляются антитела к белкам 28 и 41 кД
[653]. Групповая реактивность вируса связана с эпитомами на VP2 и VP3 [883].
Экспрессия большого сегмента генома бирнавируса (вирус ИБ) в Е. coll со-
провождается образованием полипротеина (N'- VP2-VP4- VP3-C'), подверга-
ющегося посттрансляционному расщеплению с образованием вирионных поли-
пептидов. Полученные данные свидетельствуют о моноцистронности большого
сегмента РНК бирнавирусов. Белки 32 кД (VP3) и 28 кД, синтезированные в Е.
coli, обладают протективными (иммуногенными) свойствами [272]. Конформа-
ционный иммуноген на VP2 (40 кД) вируса И Б индуцирует ВН-антитела, при
введении которых цыплятам создается пассивный иммунитет, защищающий их
от заражения вирулентным штаммом вируса ИБ [654]. Антитела к белку 32 кД не
имели такого эффекта. Два серотипа вируса ИБ были в тесном антигенном род-
стве по белку 32 кД, но различались между собой нейтрализующими МАТ к бел-
ку 40 кД [313]. В белке VP2 имеются три эпитопа нейтрализации. Вирус, выде-
ленный от индюка при инфекционном бурсите, в антигенном отношении не от-
личался от вируса ИБ, выделяемого от кур [1297]. Наиболее многочисленную
группу в семействе составляют «водные» бирнавирусы, поражающие рыб и мол-
люсков. Известны две серогруппы этих вирусов. В серогруппу А входят девять
серотипов, к серогруппе В пока отнесены изоляты, антигенно отличающиеся от
представителей группы А [970].
Инфекционный бурсит (болезнь Гамборо)
Инфекционный бурсит (болезнь Гамборо) — широко распространенное во
всем мире заболевание домашней птицы. Вирус разрушает лимфоциты, в первую
очередь в фабрициевой сумке, а также в тимусе, селезенке и бляшках кишечника,
вследствие чего развивается иммуносупрессия. Обычно болеют куры в возрасте
2-9 недель. Заболевание клинически проявляется депрессией, тремором, тяжелой
диареей (4-7 дней); летальность составляет 2-15%. Заболевание взрослой птицы
сопровождается некоторым снижением жизнеспособности эмбрионов. Наиболь-
шие экономические потери вызывает субклиническая инфекция у бройлеров мо-
ложе четырех недель, она выражается в замедлении роста. Вирус проникает через
пищеварительный тракт и через 24—48 ч обнаруживается в фабрициевой сумке.
Основной мишенью для вируса являются В-лимфоциты, имеющие на по-
верхности рецепторы IgM. Вирус поражает преимущественно незрелые В-лим-
фоциты [ 1121 ]. У заболевшей птицы ослаблен иммунный ответ на вакцинацию и
повышена чувствительность к интеркуррентным заболеваниям, в том числе к
болезни Марека, ньюкаслской болезни, инфекционному бронхиту и ларинго-
трахеиту. И Б впервые зарегистрирован в США в 1957 г. в округе Гамборо штата
Деловар. Вирус может сохраняться месяцами во внешней среде. Известны два
серотипа вируса. В Англии в подавляющем большинстве стад кур антитела обна-
ружены одновременно к обоим серотипам вируса. У индеек не обнаружены ан-
титела к вирусу серотипа 1. Между вирусами двух серотипов существует лишь не-
большое антигенное родство, что необходимо учитывать при разработке и при-
менении средств специфической профилактики [1072].
В борьбе с ИБ применяют живые и инактивированные вакцины. В настоя-
щее время широко применяют живые вакцины из природно ослабленных штам-
мов, а также ослабленных путем пассирования на КЭ или в культуре клеток [59].
Однако высоко вирулентные штаммы вируса не удалось адаптировать к раз-
личным культурам клеток, в том числе к культурам клеток КЭ [209а]. Аттенуация
вируса ИБ в процессе пассирования на КЭ наступала довольно быстро. После 10
пассажей он терял вирулентность и иммунодепрессивные свойства, но сохранял
иммуногенность. Для приготовления живой вакцины использовали вирус, пас-
сированный в КЭ 50—60 раз [1669].
После 50-55 пассажей в КЭ вирус не вызывал изменений в фабрициевой
сумке и сообщал привитым цыплятам выраженный иммунитет. Для аттенуации
вируса использовали пассирование вируса в культуре клеток Vero. Культураль-
ный аттенуированный штамм хорошо приживлялся в организме 21-дневных
цыплят, размножался в бурсе (>6,0 1g ИД/мл) и выделялся с фекалиями, если
цыплята не имели антител до вакцинации [1483].
Реактогенность, иммуногенность и стабильность четырех культуральных
коммерческих живых вакцин (Burcell, Bursine, D-78 и S-706) испытывали на од-
нодневных цыплятах, привитых подкожно. В возрасте 35 дней все цыплята ока-
зались устойчивыми к контрольному заражению вирулентным штаммом вируса
ИБ (4,0 1g ИД50). Все вакцинные штаммы обладали способностью передаваться
птице при контакте. Вакцины D-78 и S-706 были более инвазивными, вызывали
небольшую атрофию бурсы и формирование антител в более высоком титре, в
том числе и у контактной птицы, по сравнению с двумя другими препаратами.
Все вакцины обладали стабильностью: после четырех пассажей через организм
чувствительных цыплят восстановления вирулентности не наблюдали, а птица,
на которой пассировали вакцинный вирус, была устойчива к инфекции. Имму-
нодепрессивный потенциал вакцинных препаратов против ИБ определяли по
способности вакцинированных цыплят реагировать серологически на вакцина-
цию против ньюкаслской болезни; при этом ни одна из испытанных четырех вак-
цин не вызывала иммунодепрессии. Культуральные вакцины D-78 и S-706 при
крупнокапельном распылении дали такие же результаты, как и при закапывании
в нос и на слизистую оболочку глаз [710]. Напряженность и длительность пост-
вакцинального иммунитета неодинакова у разных возрастных групп животных.
Уровень специфических антител у цыплят соответствует концентрации вирус-
нейтрализующих антител у взрослых кур в период яйцекладки. Куры-несушки,
привитые живой вакциной в возрасте 18 недель, имели высокий титр ВН-антител
в течение периода яйцекладки (30-35 недель). Цыплята, вылупившиеся из таких
яиц, имели выраженный пассивный иммунитет, который длился 10-15 дней.
Для изготовления инактивированной вакцины вирус размножают в КЭ или
в культуре клеток птицы. Его инактивируют формалином или БПЛ, добавляют
ГОА или масляный адъювант и вводят подкожно или внутримышечно. При до-
статочной концентрации антигена (не меньше 6,01g БОЕ/мл) инактивированная
вакцина обладала выраженной иммуногенностью. Комбинированная инактиви-
рованная эмульгированная вакцина против ИБ, ССЯ и ньюкаслской болезни по
эффективности не уступала живой моновакцине против ИБ. Материнский им-
мунитет у цыплят после прививки кур-несушеек инактивированной вакциной
продолжался 2-3 недели. Материнские антитела имеют период полураспада
шесть дней и могут сохраняться до 30 дней. Иммунопрофилактика основывает-
ся на применении живой вакцины для цыплят и инактивированной эмульгиро-
ванной вакцины для кур-несушек перед яйцекладкой.
В таких хозяйствах цыплят вакцинируют в 3-недельном возрасте [883]. При
вакцинации суточных цыплят наиболее выраженный иммунитет (не менее чем у
90% привитых) наступает при введении живой вакцины, а спустя 2ч — инакти-
вированной [1468]. Прививка кур в 8—12-недельном возрасте живой вакциной
усиливает иммунный ответ на введение инактивированной в более поздний пе-
риод [652]. Лучшие результаты получены при выпаивании живой вакцины цып-
лятам в 2- и 5-недельном возрасте, а в 20-недельном - иммунизации инактиви-
рованной эмульгированной вакциной.
Иммуногенность живых вакцин пропорциональна степени аттенуации виру-
са, а лучшая инактивированная вакцина приготовлена из фабрициевой сумки
инфицированных цыплят [59]. Рекомбинантная субъединичная вакцина против
ИБ создана на основе бакуловируса, в геном которого встроен ген структурного
белка VP2 вируса ИБ. Эта вакцина вызывала у цыплят такой же гуморальный им-
мунитет, как коммерческая вакцина Provac [1701].
10.14. Парамиксовирусы
Семейство составляют два подсемейства и пять родов: респиро-, рубула-,
морбилли-, пневмо- и метапневмовирусы. Парамиксовирусы (ПМВ) вызывают
более тяжелые и наиболее распространенные болезни человека и животных, чем
представители других семейств вирусов. К числу наиболее опасных болезней,
возбудителями которых являются паромиксовирусы, следует отнести корь, па-
ротит, чуму КРС, чуму плотоядных и ньюкаслскую болезнь. Однако эти болезни
вызываются только частью вирусов семейства. Патогенный потенциал ПМВ
проявляется главным образом в патологии органов дыхания. Например, вирусы
парагриппа и респираторно-синциальнй вирус вызывают широко распростра-
ненную патологию респираторного тракта новорожденных.
В 1994 г. в Австралии описан новый зооноз, причиной которого явился вирус
Хендра, вызывающий летальную респираторную болезнь у лошадей и человека и
использующий в качестве естественного хозяина летучих мышей [663]. Им мож-
но экспериментально инфицировать кошек, морских свинок и мышей. Вирус
также заражает виды семейства Megachiroptera, главным образом субклиничес-
ки, и такие животные служат для вируса природными хозяевами. Вирус легко пе-
редается между видами семейства Megachiroptera, но значительно труднее — от
лошади к лошади или от лошади к человеку. Путь передачи от летучих мышей к
лошади не прояснен [ 1640]. Морбиливирус лошадей имеет лишь низкий уровень
гомологии с рубулавирусами [1616].
В 1998—1999 гг. в Малайзии зарегистрирована новая болезнь свиней, харак-
теризующаяся выраженным респираторным и неврологическим синдромами и
сопровождающаяся в некоторых случаях внезапной гибелью свиноматок и
боровов. Болезнь, как оказалось, тесно связана с эпидемией вирусного энцефа-
лита среди рабочих свиноферм [1165]. Было зарегистрировано много случаев
заболевания людей, из них 105 летальных случаев в Малайзии и один — в Син-
гапуре [491]. При вспышке выделен неизвестный парамиксовирус, который
родственен, но не идентичен вирусу Хендра. Новый вирус назван вирусом Ни-
нах (по названию деревни, где он первоначально выделен), а соответствующая
болезнь — «респираторный и неврологический (энцефалитный) синдром»
[1165]. Электронно-микроскопические, серологические и генетические иссле-
дования позволили установить, что вызвавший вспышку вирус Нинах является
представителем семейства парамиксовирусов. Полагают, что эти два вируса Ни-
нах и Хендра составляют новый род семейства парамиксовирусов. Оба вируса
отличаются от других парамиксовирусов способностью инфицировать и вызы-
вать потенциально летальное заболевание у различных хозяев, включая челове-
ка [491]. Анализ нуклеотидной последовательности гена матриксного белка
выявил тесное родство между вирусом чумы мелких жвачных и морбилливиру-
сом дельфинов [264].
Идентифицированный недавно энзоотичный для Мексики парамиксовирус
свиней, вызывающий энцефаломиелит, помутнение роговицы глаза (голубой
глаз) и высокую летальность у поросят, вероятно, является новым представите-
лем рода и семейства парамиксовирусов [1471].
Структура и свойства парамиксовирусов наиболее подробно изучены на та-
ких модельных вирусах, как вирус ньюкаслской болезни (ВНБ), Сендай (вирус
парагриппа 1) и парагриппа обезьян (SV5). Вирионы парамиксовирусов состоят
из нуклеокапсида спиральной симметрии и липопротеиновой оболочки, покры-
той характерными колосообразными пепломерами длинной 8—20 нм. По разме-
ру и форме вирионы парамиксовирусов неоднородны. Плеоморфные сферичес-
кие или овальные частицы имеют диаметр 100—300 нм. Длина нуклеокапсида
нитевидных форм 600—800 нм, диаметр 13 нм (пневмовирусы) — 18 нм. ПМВ
размножаются в цитоплазме и почкуются через плазматическую мембрану. Ви-
рионы парамиксовирусов содержат 70% белка, 20—25% - липидов и 6% углево-
дов. Примерно 70% углеводов в вирионах находятся в виде гликопротеинов и
30% — гликолипидов. Липиды образуют двойной центральный слой вирусной
мембраны и являются ее структурным каркасом. Белки расположены снаружи и
изнутри двойного липидного слоя. Наружный слой состоит из гликопротеинов,
внутренний - из негликозилированного мембранного (М) белка, который назы-
вают внутренней белковой мембраной или матриксным белком. Липопротеино-
вая мембрана вирионов парамиксовирусов представляет собой измененную
часть клеточной поверхностной мембраны, в которой белки клетки хозяина пол-
ностью заменены на вирусспецифические.
Геном представлен одной линейной молекулой негативной полярности од-
ноцепочной РНК размером 15—16 тн. Имеется 6—10 генов, разделенных консер-
вативными некодирующими участками, которые являются сигналами начала и
окончания полиаденилирования.
Порядок генов у вирусов семейства консервативен, но их количество и экс-
прессионность не одинакова у представителей разных родов. Парамиксовирусы
и морбилливирусы содержат по 6 генов, рубулавирусы - 7, а пневмовирусы - 10
генов. Однако 10 генов пневмовирусов кодируют 10 белков, а 6 или 7 генов виру-
сов других родов кодируют 10-12 белков. Большинство генных продуктов явля-
ются структурными белками вирионов. В составе парамиксовирусов обнаруже-
но семь белков: NP (или N), Р, М, F, L и HN (или Н или G). Они являются об-
щими для всех родов.
Пепломеры содержат 2 гликопротеина: белок слияния (F-белок) и гемагглю-
тинин-нейраминидазу (HN-белок). Последний у пневмовирусов обозначается,
как G-белок из-за отсутствия нейрамидазной активности. Этим двум белкам
принадлежит ключевая роль в патогенезе ПМВ инфекции.
HN-белок обеспечивает прикрепление вирионов к клеткам и вызывает обра-
зование ВНА, препятствующих адсорбции вируса на клеточных рецепторах.
F-белок участвует в проникновении вируса в клетку.
У вновь сформировавшихся вирионов F-белок представлен в виде неактив-
ного предшественника (Fo), который активируется в результате расщепления
клеточными протеазами. После расщепления на две субъединицы (Fj и F2) об-
разуются новые концевые аминокислотные последовательности белка, имею-
щего гидрофобный участок, который непосредственно приводит к сплавлению
(слиянию) вируса с клеткой.
Размножение ПМВ происходит в цитоплазме, что было доказано реплика-
цией вируса в энуклеиновых клетках. Вирионы с помощью HN-белка прикреп-
ляются к сиалогликопротеиновым или гликолипидным рецепторам клетки. За-
тем F-белок осуществляет сплавление вирусной оболочки с плазматической
мембраной клетки. В результате нуклеокапсид оказывается в клетке с тремя свя-
занными с ним белками (N, Р и L), после чего начинается процесс транскрип-
ции, осуществляемый вирионой РНК-зависимой РНК полимеразой (транс-
криптазой). Геном транскрибируется с образованием 6—10 дискретных непро-
цессированных мРНК в результате последовательного прерывистого синтеза от
одного промотора. Полноразмерная копия геномной РНК (+РНК) также синте-
зируется и служит матрицей для синтеза геномной РНК (-РНК). Эти процессы
контролируются главным образом на уровне транскрипции.
В отличие от большинства генов, кодирующих один белок, P-ген представи-
телей подсемейства паромиксовирусов кодирует 2—5 различных белков.
Вновь синтезированные геномные РНК, связанные с N-белком и транс-
криптазой, формируют нуклеокапсиды. Созревание вирионов включает:
1) внедрение вирусных гликопротеинов в измененные участки клеточной
плазматической мембраны;
2) связывание матричного белка (М) и других негликозилированных белков
с измененной мембраной клетки;
3) размещение нуклеокапсидных субъединиц под М-белком;
4) формирование и освобождение зрелых вирионов путем почкования.
Расщепление F-белка играет важную роль в инфекционности ПМВ; когда
клетки хозяина не содержат соответствующих протеаз, вирус не проявляет ин-
фекционность. Более того, вирулентность вируса коррелировала с присутствием
или отсутствием специфической протеазы. Поэтому F-белок является сущест-
венным для инфекционности вируса и прямой передачи вируса из клетки в клет-
ку посредством слияния. Этот путь играет ключевую роль в патогенезе ПМВ ин-
фекции, включая персистентную инфекцию. Например, белок F играет основ-
ную роль в вирулентности вируса ньюкаслской болезни [1155]. Вакцины против
ПМВ инфекций должны вызывать выраженный синтез антител против F и HN
гликопротеинов [1135].
Фузогенные белки парамиксовирусов ориентированы N-концом наружу, а
С-концом — внутрь вириона. Нефузогенные белки тех же парамиксовирусов
ориентированны противоположным образом. Примером этого может служить
белок G РС-вируса.
Негликозилированный мембранный, или матриксный (М) белок парамик-
совирусов — наиболее консервативный белок, образующий внутренний слой ви-
русной оболочки. Он обладает высокой гидрофобностью и принимает участие в
заключительной стадии морфогенеза вируса в зараженной клетке. В вирионах
парамиксовирусов содержатся 2000—2500 молекул белка М. В составе нуклео-
капсида обнаружено три белка: один мажорный - NP (2500—3500 моль/вирион)
и два минорных Р и L (соответственно несколько сотен и десятков молекул на
вирион). Гликопротеин HN вызывает образование антител, подавляющих ин-
фекционную нейраминидазную и гемагглютинирующую активность [1560]. Бе-
лок слияния (F) играет ключевую роль в вирулентности вируса и является глав-
ной мишенью в иммунных реакциях [1155]. Основной иммунодоминантный
сайт нейтрализации вируса образуется обоими фрагментами (F, и F2) белка сли-
яния F. Гликопротеины HN и F, образующие наружный поверхностный слой па-
рамиксовирусов, — наиболее важные в антигенном отношениях. Моноклональ-
ные антитела против белка F ВНБ имели более высокую активность in vitro и in
vivo, чем против белка HN.
МАТ против белка HN ВБН имели выраженную нейтрализующую актив-
ность in vitro, но не защищали цыплят от гибели при заражении. Антитела про-
тив двух антигенных участков белка F при меньшей ВН-активности в культуре
клеток полностью защищали цыплят. Совместное введение антител против этих
двух белков усиливало защитный эффект. Антисыворотки к белкам HN и F ви-
руса НБ, примененные одновременно, давали такой же защитный эффект, как и
антивирусная сыворотка [1560]. Синергизм действия HN и F антигенов в разви-
тии защитного иммунного ответа против ВНБ обнаружен также и в опытах с ви-
русом ПГ-3 человека [1295].
Все нейтрализующие эпитопы вируса Сендай локализованы в белке F, [968].
Антитела к белкам HN и F вируса ПГ-3 обладали нейтрализующей и протектив-
ной активностью (in vivo), однако только антитела к F-белку проявляли антифу-
зогенную активность [1131]. Вирусы ПГ-3 человека и крупного рогатого скота
заметно отличались по белку HN. Штаммы ПГ-3 крупного рогатого скота оказа-
лись гомогенными по белку HN, но вариабельны по гликопротеину F [1404].
Изучение внутривидового антигенного родства ряда парамиксовирусов по-
казало, что вирусы паротита, Сендай, парагриппа-2 и -4 следует объединить в от-
дельную группу от вирусов парагриппа 1 и 3 [905].
Морбилливирусы характеризуются высокой степенью гомологии одноимен-
ных белков у разных представителей рода. Наиболее выраженное антигенное
сходство морбилливирусов связано с белком F. Высокая степень гомологии вы-
явлена в N-концевых участках полипептида F, вирусов чумы плотоядных и ко-
ри, чего не обнаружено при сравнении с пятью представителями рода парамик-
совирусов [1588]. Степень гомологии белка Fj вирусов чумы крупного рогатого
скота и кори составляет 78,9%. Белок F вируса чумы крупного рогатого скота со-
держит область, состоящую из основных аминокислот (104— 108), которая может
подвергаться протеолизу с образованием F, и F2 [ 1544]. По данным других авто-
ров, гомология аминокислотных последовательностей белка F вирусов чумы
крупного рогатого скота и кори составляет 81,3%, а вирусов чумы крупного ро-
гатого скота и плотоядных — 68,2% [814].
Высокой степенью гомологии характеризовались М-белки морбилливиру-
сов. У вирусов чумы крупного рогатого скота и кори она составила 77,6%, а у ви-
русов чумы крупного рогатого скота и плотоядных — 78,2% [964]. Обнаружено
антигенное родство Н- и особенно NP-белков вирусов чумы крупного рогатого
скота, кори и чумы плотоядных [331].
Белок L вируса кори имеет значительное структурное сходство со своими
аналогами в вирусах Сендай и ньюкаслской болезни [358]. Подобную законо-
мерность обнаружили при сравнении белков М вирусов ПГ-3 человека, Сендай,
кори и чумы плотоядных [689]. Однако в структуре белков М представителей ро-
да парамиксовирусов гомологии не обнаружено [1038]. Моноклональные анти-
тела к белку F-вируса кори нейтрализовали инфекционность и фузогенную ак-
тивность вируса, а также защищали мышей при инфицировании гомологичным
Таблица 38. Вирионные белки ПМВ, их обозначения и функции [1135]
Белок и его функции Респировирусы и рубулавирусы Морбилли- вирусы Пневмо- вирусы
Прикрепительный белок: гемаггютинация, индукция иммунитета HN Н G
Нейраминидаза: освобождение вириона, разрушение ингибиторов муцина HN —
Белок слияния: слияние клеток, проникно- вение вируса, распространение из клетки в клетку, роль в индукции иммунитета F F F
Нуклеопротеин: защита генома NP N N
Транскриптаза: транскрипция геномной РНК Ей Р ки Р ки Р
Матриксный белок: стабильность вириона М М М
Белок с неизвестными функциями (SH) __ SH, 22 к
вирусом [1003]. Введение крысам гликопротеинов Н и F вируса кори обеспечи-
вало такой же иммунитет, как и введение цельновирусного препарата [1113]. Эти
данные свидетельствуют о важной роли обоих гликопротеинов в создании имму-
нитета при морбилливирусных инфекциях, для возбудителей которых характер-
но тесное структурное и молекулярно-биологическое сходство. Одной из осо-
бенностей вируса кори является способность его к длительной персистенции в
нейронах и глиальных клетках мозга реконвалесцентов. Это явление связывают
с гипермутацией вируса, которая, как полагают, является одноступенчатым про-
цессом [460].
Вирус мелких жвачных (овец и коз) не является вариантом вируса чумы
крупного рогатого скота и по степени родства в пределах рода морбилливирусов
далек от него так же, как от вируса кори [953]. Морбилливирусы, вызывающие
массовое заболевание, а также гибель тюленей [188], дельфинов [599] и морских
свинок [1123], оказались идентичными или близкородственными вирусу чумы
плотоядных.
Среди представителей рода пневмовирусов особое место занимают респира-
торно-синцитиальные (PC) вирусы, вызывающие широко распространенные
поражения нижних дыхательных путей у детей, телят, овец и коз.
PC-вирус отличается от других парамиксовирусов большим количеством
идентифицированных структурных белков, порядком генов, отсутствием гемаг-
глютинина и нейраминидазы, а также диаметром нуклеокапсида (12—13 нм) и
длиной поверхностных шипиков (10—12 нм). PC-вирусы имеют 10 генов, которые
транскрибируются с образованием 10 мРНК [940]. В структуре PC-вирусов иден-
тифицировано 9 или 10 полипептидов, два из которых G и F гликозированны и
располагаются на поверхности вириона. Белок F состоит из двух субъединиц и
выполняет функцию слияния, белок G — прикрепительную функцию [146].
В белке слияния F PC-вируса крупного рогатого скота один из двух антиген-
ных участков ответственен за нейтрализацию [1633]. Гликопротеины G и F ока-
зались ответственными за индукцию ВН-антител и образование протективного
иммунитета. МАТ к белкам оболочки вириона нейтрализовали инфекционную и
синцитийобразующую активность PC-вируса крупного рогатого скота и выявля-
ли (МФА) оболочечные гены вируса, эксперессированные на поверхности ин-
фицированных клеток [897], а также вызывали их лизис в присутствии компле-
мента [880].
Неструктурный белок NS2 PC-вируса крупного рогатого скота не существе-
нен для его репликации in vitro, но его присутствие способствует этому [416,
1507]. Мутант, лишенный гена NS2, не реверсирует и представляет интерес в ка-
честве вакцинного штамма [1507].
Мыши, иммунизированные белками F и G PC-вируса, приобретали полную
устойчивость к суперинфицированию гомологичным вирусом. Иммунизация
белками N и М2 создавала частичную защиту, тогда как другие белки (HN, Р, SH,
М, 1В или 1С) не обладали протективными свойствами. При сравнении белков
РС-вирусров человека и крупного рогатого скота основные антигенные разли-
чия выявлены в гликопротеине G [940]. Белки слияния этих вирусов гомологич-
ны на 83—84%. Наибольшая дивергенция связана с субъединицей F2 в области,
предшествующей протеолитическому расщеплению белка Е По белкам N гомо-
логия составила 93,3% [1365].
Выявлены две подгруппы А и В PC-вирусов человека и крупного рогатого
скота [318], различающиеся между собой структурой белков. Более тесным анти-
генным родством характеризовались вирусы подгруппы А [941]. Поскольку при-
крепительный гликопротеин G обеспечивал протективный эффект только про-
тив гомологичной подгруппы PC-вирусов, для обеспечения надежной защиты
требовалось ввести в вакцинный препарат G белок обеих (А и В) антигенных
субгрупп [1467]. Сыворотки крови морских свинок, привитых вакцинами из су-
бединиц PC-вирусов человека и крупного рогатого скота, обладали хорошей пе-
рекрестной реактивностью и нейтрализовала PC-вирусы как человека, так и
крупного рогатого скота [ 1543].
Кроме антител, в защите от PC инфекции важная роль принадлежит Т-кле-
точному иммунитету [880, 1159]. Идентифицированы эпитопы, индуцирующие
Т- и В-клеточные реакции иммунитета при респираторно синцитиальной ин-
фекции [1159]. С-концевой фрагмент белка 1А содержит два участка, стимулиру-
ющих Т-лимфоциты. Белки F и G при разных способах введения вызывали об-
разование локальных и системных ВН-антител, а также антителозависимых ци-
тотоксических Т-лимфоцитов. 1
Преставитель рода метапневмовируса — вирус ринотрахеита индеек — ока-
зался антигеннородственным с вирусом пневмонии мышей [968]. Значительная
гомология белков HN и F у некоторых представителей парамиксовирусов — хон
рошая предпосылка для их использования в качестве гетерологичных живых
вакцин. П'Ч)
Для размножения ПМВ используют клеточные культуры различного проис-
хождения. Для размножения морбилливирусов и пневмовирусов обычщйДвд.
пользуют культуры клеток гомологичных видов, но и при этом они размножала
ся с трудом даже после адаптации. Размножение вирусов обычно сопровождаете
ся лизисом клеток. Образование синцития наблюдают как в культуре,* ДЛЮ и в
организме с образованием ацидофильных включений в цитоплазме. Морбиллш
вирусы вызывают образование ацидофильных включений в ядре. Вирусы лара-t
гриппа и некоторые морбилливирусы (но не пневмовирусы) вызывай®]гем,аде
сорбцию. : ыынантяА
,qox онанэтпэои
Ньюкаслская болезнь (НБ) иээтээ эгюои мае
Ньюкаслская болезнь (НБ) — высококонтагиозное заболевание птищ/кото-
рое распространено во всем мире. Болезнь проявляется в виде сешгйцемически^
респираторных, желудочно-кишечных симптомов, а также нарушениями функт-
ции центральной нервной сиситемы и снижением яйценоскости./Болеетйтипа
многих видов, но наиболее часто поражается домашняя, в основном/куры ;И:в
меньшей степени индейки и фазаны. Водоплавающая птица и солуби нс.забояе/
вают или болеют легко, но могут быть носителями вируса. Инфицированная
птица выделяет вирус в секретах и экскретах дыхательных и пищеварительных
путей. У кур гибель может достигать 100%.
Штаммы широко варьируют по вирулентности, зависящей от протеолитиче-
ской расщепляемости и активации HN-белка и F-белка. Различают высоко,
средне- и низковирулентные штаммы (вело-, мезо- и лентогенные).
Вирус не имеет антигенных вариантов, имеющих практическое значение. Од-
нако ряд вспышек в Западной Европе и на Дальнем Востоке были вызваны но-
вым генотипом вируса НБ [1697]. Высоковирулентные штаммы вируса НБ вызы-
вают летальную инфекцию у отдельных видов, в том числе уток и другой водопла-
вающей птицы, которая обычно малочувствительна к вирусу и менее подвержена
заболеванию. По-видимому, у водоплавающей птицы имеются сбалансирован-
ные механизмы носительства вируса, поскольку систематически выделяли вирус
в полевых условиях без признаков вспышек выраженной инфекции. Переболева-
ние обычно сопровождается прочным пожизненным иммунитетом.
Антитела образуются быстро. Например, антитела, подавляющие ГА, можно
обнаружить на 4—6 день и в течение 2 лет после заражения. По уровню этих Ат
можно судить об иммунитете. Материнские антитела передаются через желток и
защищают потомство в течение 3-4 недель. IgG препятствуют циркуляции виру-
са (виремии), но не прекращают респираторную инфекцию. IgA защищают рес-
пираторный и желудочно-кишечный тракт.
Материнские антитела быстро разрушаются, продолжительность периода их
полураспада составляет 4,5 дня. Пассивные антитела могут оказать отрицатель-
ное влияние на последующую вакцинацию цыплят, так как они не в состоянии
полностью реагировать на живые вакцины, если титр антител в крови выше 1:8
(РТГА). Поэтому цыплят лучше вакцинировать в возрасте не раньше 18 дней.
В инфицированных стадах носительство вирулентного вируса может длиться
до 40 дней после начала вакцинации. У выздоровевших птиц вирус выделяется с
секретами и экскретами не менее 4 недель. Распространению болезни способст-
вует относительная стабильность вируса и широкий круг хозяев [1135].
Обычно используют живые аттенуированные штаммы и инактивированные
эмульгированные вакцины. Кур-несушек ревакцинируют через 4 месяца. Защи-
та наступает через 2 недели. Вакцинированная птица экскретирует вакцинный
вирус до 15 дней после вакцинации.
Активный иммунитет, приобретаемый после вакцинации, обеспечивает от-
носительно хорошую защиту, но его длительность и напряженность меньшие,
чем после естественного переболевания.
Существуют два типа живых вакцин, которые соответственно готовят из
природоослабленных авирулентных (лентогенных) или слабовирулентных (ме-
зогенных) вакцинных штаммов.
Живые вакцины могут вызывать значительные осложнения, особенно если
они содержат мезогенные штаммы вируса. У цыплят это ведет к летальному ис-
ходу, а у несушек — к снижению яйценоскости. Вакцинный вирус в значитель-
ной степени нейтрализуется при высокой концентрации антител; если птица
свободна от антител, то реакция может быть чрезмерно сильной. Хотя вакцина,
изготовленная на основе штамма Ла-Сота, является наиболее эффективной лен-
тогенной вакциной, она может быть причиной отрицательных реакций при пер-
вичном применении. Если имеет место серьезная опасность осложнений при
первичной иммунизуции, предпочтительно применять вакцины, изготовленные
на основе лентогенных штаммов (В,, «F» и др.). Это особенно касается тех слу-
чаев, когда параллельно наблюдается инфекционный бурсит и микоплазмоз.
При повторной вакцинации бройлеров вакцина из штамма Ла-Сота обеспечит
напряженный иммунитет. Для молодняка требуется повторная вакцинация в
возрасте 10—12 недель.
Вакцины из мезогенных штаммов обеспечивают хорошую реакцию на ревак-
цинацию при условии правильного применения и достаточного интервала меж-
ду первой и второй прививками. Вакцина из штамма Бор-74 ВГНКИ безвредна
и иммуногенна. Вакцинный вирус может передаваться горизонтально от вакци-
нированной птицы невакцинированной [91]. Аналогичными качествами обла-
дает вакцина из вирулентного штамма V-4, которую можно применять для
оральной иммунизации в составе пищевых концентратов. У птицы, содержа-
щейся совместно с вакцинированной, иммунитет наступал через 10 дней [1439].
Живые вакцины чаще всего применяют путем добавления к питьевой воде
или в виде аэрозолей. Однако при аэрозольном применении чаще встречаются
осложнения и провоцируются заболевания верхних дыхательных путей, особен-
но микоплазмозы и инфекционный бронхит.
Проявление респираторной формы колибактериоза, пастереллеза и других
бактериальных болезней у индюшат после применения живой вакцины против
НБ в 2—3-недельном возрасте связывают с подавлением вакцинным вирусом фа-
гоцитарной активности альвеолярных макрофагов. Для избежания осложнений
предложена новая схема иммунизации индюшат. В первый день жизни им вво-
дят подкожно инактивированную вакцину в дозе 0,1 мл, а через две недели аэро-
зольно вакцинируют живой вакциной из штамма В]. Такая обработка обеспечи-
вает длительный иммунитет. Вся вакцинированная птица была устойчива к ин-
фекции, в то время как у невакцинированной летальность составляла 78%.
Высокий уровень вакцинального иммунитета у матерей не препятствовал имму-
низации суточных цыплят инактивированной вакциной. В неблагополучных то-
варных хозяйствах индеек рекомендуют прививать аэрозольно с интервалом
пять недель в течение всего производственного периода.
При применении живых вакцин, в зависимости от дозы и способа введения,
иммунитет наступает через 2—5 дней после вакцинации. Напряженный продол-
жительный иммунитет (более 1 года) наступает после повторных прививок. Од-
нако, несмотря на это, некоторая птица в естественных условиях может бес-
симптомно инфицироваться полевыми штаммами вируса НБ [642]. Инактиви-
рованные вакцины готовят из вируса, размноженного в куринных эмбрионах.
Одна доза вакцины обычно содержит не менее 8,0 1g ЭИД50 инактивированного
вируса. Концентрация его оказывает существенное влияние на титр сывороточ-
ных антител. Однако повышение концентрации вирусного антигена выше опре-
деленного уровня (2000 ГАЕ в дозе вакцины) нецелесообразно, поскольку не вы-
зывает дальнейшего нарастания титра антител [407].
При изготовлении инактивированных вакцин чаще используют бета-пропи-
олактон и формалин. В результате сравнения различных адъювантов выявлены
преимущества масляных вакцин над сорбированными. Лучший результат полу-
чен при использовании сложной эмульсии, представляющей собой гидроокись-
алюминиевую масляно-эмульсионную вакцину. Полевые испытания показали,
что такой препарат не уступает лучшим инактивированным вакцинам и превос-
ходит живую вакцину из штамма Н [1429].
Хорошими адъювантными свойствами обладал авридин. В отличие от эмуль-
гированных вакцин, приготовленных на основе минеральных масел, вакцина с
авридином не вызывала реакций на месте выделения [1352]. Инактивированной
эмульгированной вакциной типа «вода в масле» прививали кур в возрасте 8 не-
дель, когда полностью исчезали материнские антитела. Вакцину вводили 2—3
раза с 4-недельными интервалами. Титр сывороточных антител в РТГА макси-
мально составлял 1:1280 — 1:2560. Антитела сохранялись в течение 30 или 35 не-
дель соответственно после 2- и 3-кратной вакцинации. Высокие титры антител
обнаруживали и в желтке яиц от вакцинированных кур даже через 5 мес. после
прививки. Устойчивость к заражению вирулентным вирусом сохранялась свыше
одного года. Эффективность вакцины не снижалась при 4°С более 18 мес. При
однократной вакцинации кур в возрасте 16 недель титр антител начинал сни-
жаться через 12 недель [1429].
Инактивированные вакцины обычно применяют в сочетании с живыми. Хо-
роший защитный эффект получали, если однодневных цыплят прививали жи-
вой вакциной, а через 3 и 8 недель — инактивированной [642]. Разработаны схе-
мы одновременной иммунизации птицы против НБ, инфекционного бронхита,
болезни Марека и других болезней с применением живых и инактивированных
коммерческих вакцин. При этом возникает ряд проблем, таких как материнские
антитела и эффективность иммунизации живыми вакцинами, а также возмож-
ность интерференции в случае применения живых вакцин против 3—4 заболева-
ний. Сочетанное применение живых и инактивированных вакцин дало лучшие
результаты, чем применение только одной из них. Цыплят прививали живой
вакциной (Ла-Сота или Бор-74), а затем инактивированной вакциной.
Эмульгированная вакцина (вода-масло-вода), содержащая HN-белок вируса
НБ, экспрессированный в бакуловирусной системе, оказалась безопасной и до-
статочно эффективной [416].
Инактивированная комбинированная вакцина против ньюкаслской болез-
ни, инфекционного бронхита и синдрома снижения яйценоскости создавала вы-
раженный иммунитет к трем болезням после однократного применения.
Вакцина против НБ оказалась неэффективной против парамиксовируса
птиц типа 3, вызывающего снижение продуктивности у индеек. Хороший имму-
нитет создавала вакцина из гомологичного вируса, вводимая двукратно. Вакци-
на из парамиксовируса-3 защищает птицу от вируса НБ, но не наоборот, то есть
имеет место одностороннее антигенное родство [ 1406].
В условиях большой концентрации поголовья птицы поддержание выражен-
ного иммунного статуса с помощью иниактивированных вакцин — практически
нереально, особенно в случае необходимости их повторного применения. Отсю-
да неизбежность использования живых вакцин и методов массовой иммуниза-
ции. В настоящее время потери от БН в странах, где проводят широкую програм-
му вакцинации, сведены до минимума.
ПАРАГРИПП-3 крупного рогатого скота (ПГ-3)
ПАРАГРИПП-3 крупного рогатого скота (ПГ-3) (транспортная лихорад-
ка) — респираторное заболевание. Особенно широко распространено среди те-
лят и молодняка в условиях высокой концентрации поголовья животных. Ос-
новной причиной возникновения транспортной лихорадки остается вирус ПГ-3
из вторичных бактериальных инфекций, основной является Р. hemolitica.
ПГ-3 представляет собой важную проблему особенно для крупных откор-
мочных хозяйств. Вирус ПГ-3 может инфицировать другие виды животных,
включая, собак, лошадей, обезьян, а также людей. Вирус обнаруживали в содер-
жимом кишечника, молоке и абортированных плодах, хотя основной путь рас-
пространения — аэробный.
Более тяжелое течение болезни наблюдают при осложнениях бактериальны-
ми или другими вирусными инфекциями. Парагрипп-3 часто является причи-
ной респираторных нарушений у ягнят. Антигенная структура всех штаммов ви-
руса, выделенных в разных странах от телят, коров и буйволов, идентична и со-
ответствует прототипному штамму SF-4. Установлено антигенное сходство
между штаммами вируса ПГ-3 крупного рогатого скота и овец. Прототипный
штамм SF-4 имеет близкое антигенное родство с вирусом парагриппа человека
третьего серотипа. Вирус ПГ-3 обладает выраженной антигенной активностью.
Переболевшие животные становятся невосприимчивыми к повторному заболе-
ванию в течение 6—12 месяцев, хотя реинфицирование в этот период может
иметь место. У реконвалесцентов образуются нейтрализующие, комплемент-
связывающие и подавляющие гемагглютинацию антитела. Для оценки иммуни-
тета определяют титр сывороточных антител в РТГА. Хотя считается, что наибо-
лее важная роль в иммунитете принадлежит не сывороточным, а секреторным
антителам (IgA) респираторного тракта. Их обнаруживают после переболевания,
а также интрназального введения живой вакцины. При ПГ-3 колостральный им-
мунитет достаточно выражен, продолжительность его не менее 2 месяцев.
Для специфической профилактики ПГ-3 применяют в основном живые вак-
цины из аттенуированных штаммов вируса. Эффект иммунизации зависит от
уровня колострального иммунитета и возраста животных. При интрназальном
(аэрогенном) введении живой вакцины колостральные антитела оказывают
лишь незначительное влияние на развитие активного иммунитета у телят в пер-
вые недели жизни. Все чаще применяют живые комбинированные вакцины, со-
держащие аттенуированные штаммы вирусов ПГ-3, ринотрахеита, диареи и PC
вируса. Следует отметить, что интрназальная вакцинация живой вакциной не
всегда создает достаточно выраженный иммунитет.
Инактивированная вакцина из вируса с высокой гемагглютинирующей ак-
тивностью обеспечивала выраженную протективную защиту телят и ягнят после
двукратного применения с интервалом 14 дней. В практике для иммунизации те-
лят часто используют интрназальное применение живой вакцины в первые не-
дели жизни и парентеральную ревакцинацию через 3-4 мес., а также вакцина-
цию коров в период стельности.
Чума крупного рогатого скота
Чума крупного рогатого скота — остропротекающая контагиозная болезнь,
характеризующаяся высокой лихорадкой, катарально-геморагическим и крупоз-
но-дифтерическим воспалением слизистых оболочек и гибелью до 90—100% жи-
вотных. В естественных условиях к вирусу чувствительны крупный рогатый скот,
зебу и буйволы. Дикие жвачные животные болеют в легкой форме и распростра-
няют болезнь на огромные пространства. Домашние свиньи могут проявлять
признаки болезни и являются важным резервуаром вируса в Азии. Из диких жи-
вотных восприимчивы олени, антилопы и гиппопотамы.
Чума крупного рогатого скота продолжает оставаться бедствием для многих
стран Африки и тропической Азии. Вирус размножается в лимфоузлах, а после
развития виремии, длящейся 2—3 дня, обнаруживается в лимфоузлах, селезенке,
костном мозге, дыхательных и пищеварительных органах. В результате размно-
жения вируса и разрушения клеток в лимфоидных органах развивается лейкопе-
ния и иммунодефицит.
Антигенная вариабельность у вируса чумы крупного рогатого скота не уста-
новлена. Все его штаммы иммунологически идентичны.
Животные-реконвалесценты приобретают пожизненный иммунитёт. ВНА
появляются через 6—7 дней и достигают максимума через 3—4 недели после ин-
фицирования. Вирус чумы крупного рогатого скота имеет выраженную антиген-
ную активность и индуцирует синтез нейтрализующих, комплементсвязываю-
щих, преципитирующих и подавляющих гемагглютинацию антител. Колост-
ральный иммунитет у телят от коров, иммунизированных активно или
вследствие переболевания, сохраняется 6-8 мес. Поскольку колостральные ан-
титела тормозят образование иммунитета, телят нельзя вакцинировать раньше
этого срока [1276].
Вирус чумы крупного рогатого скота имеет близкое антигенное родство с ви-
русами чумы мелкого рогатого скота, чумы плотоядных и кори.
Вакцину против чумы крупного рогатого скота можно использовать для им-
мунизации овец и коз, которые могут иметь субклиническую инфекцию. Сыво-
ротка против вируса чумы плотоядных или против кори человека нейтрализует in
vitro вирус чумы крупного рогатого скота, а сыворотка против вируса чумы круп-
ного рогатого скота нейтрализует вирусы чумы плотоядных и кори. Однако им-
мунизация крупного рогатого скота против чумы дает эффект только при введе-
нии высоких доз вируса чумы плотоядных и не дает результатов при введении
вируса кори. Гемагглютинирующий антиген у вируса чумы крупного рогатого
скота выявляют только после специальной обработки. Антисыворотка к вирусу
чумы крупного рогатого скота нейтрализует гемагглютинируюгцую активность
вируса кори.
Для специфической профилактики ЧКРС в настоящее время используют
живые культуральные вакцины, которые по безопасности и иммуногенности от-
вечают современным требованиям.
Вакцины против ЧКРС являются одними из наиболее эффективных вирус-
ных вакцин. Три типа аттенуированных вакцин использовали для ликвидации
ЧКРС: лапинизированную, капринизированную и культуральную. Лапинизиро-
ванную вакцину размножали на кроликах — штамм Накамура-III. Затем его
адаптировали к куриным эмбрионам [1144]. Лапинизированно-авинизирован-
ную (LA) вакцину в основном применяли в Азии. Капринизированная вакцина
из штамма Муктесвар была первой вакциной против ЧКРС и использовалась до
недавнего времени в Индии.
В странах стационарно неблагополучных по ЧКРС наиболее широко ис-
пользуют культуральную вакцину RBOK из аттенуированного штамма Kabete
«О» с помощью многочисленных пассажей (90—100 пассажей в культуре клеток
почки телят). Данная вакцина безопасна и эффективна, обеспечивает полную
защиту от чумы КРС при однократном введении [ 1249]. Эта вакцина не переда-
ется при контакте, создает напряженный иммунитет длительностью не менее 10
лет [1252]. Кампания массовой вакцинации в течение 1 месяца позволила со-
здать 90%-ный уровень иммунитета у 70-90% животных всех возрастов.
При сравнительном анализе нуклеотидной последовательности геномов вак-
цинного штамма RBOK и вирулентного изолята вируса чумы КРС выявлено 87
замен, расположенных в областях кодирующих белки, а также в нетранслируемых
участках, которые являются значимыми в проявлении вирулентных свойств.
С целью снижения возможной спонтанной контаминации вакцины RBOK
вирусами КРС для размножения вакцинного вируса используют перевиваемую
линию клеток Vero (не пермиссивную для вируса диареи КРС). Отрицательным
качеством вакцины является ее термолабильность. Она может длительно хра-
ниться лишь при — 20°С. Используя более совершенную лиофилизационную тех-
нику и среду высушивания, удалось получить термостабильную вакцину [1008],
которая оставалась активной в течение месяца при 37°С [1009].
После однократной прививки (100 ИД100) иммунитет наступает через 72 ча-
са. Быстрый защитный эффект после вакцинации обеспечивается за счет интер-
ференции, поскольку нейтрализующие антитела проявляются через семь дней и
достигают максимума через три недели. У вакцинированных животных, в отли-
чие от больных, в органах не выявляют преципитирующего антигена, что дает
возможность дифференцировать вакцинированных от больных животных. С
увеличением дозы вакцины в 100 раз титр ВНА у крупного рогатого скота повы-
шался всего в 5 раз. Прививка в дозе 100 ИД100 вызывала образование ВНА у всех
животных, титр которых сохранялся на максимальном уровне в течение 64 мес.,
что соответствовало также продолжительности напряженного иммунитета.
У крупного рогатого скота зараженного через 7 дней после вакцинации, не
отмечено клинических признаков заболевания, не обнаружен вирус в крови и не
отмечена его экскреция во внешнюю среду. Однако у некоторых животных отме-
чено выраженное повышение титра специфических антител [1250].
Определяющее значение в борьбе с чумой КРС придается вакцинации.
Обычно считается, вакцинация не менее 90% популяции скота прекращает забо-
левание. Однако наиболее эффективной будет 100%-ная иммунизация скота с
учетом продолжительности колострального иммунитета у телят (3—8 мес.).
Рекомбинантные векторные вакцины были созданы путем вставки Н и/или
F генов вируса ЧКРС в вирус осповакцины в качестве вектора [1590, 1696]. Лио-
филизированная рекомбинантная вакцина (RRV), так же как сухая осповакци-
на, сохраняла активность 1 месяц при 45°С, а после восстановления (растворе-
ния) — 1 неделю при 37°С или 1 день при 45°С [1696]. RRV вакцина не вызывала
реакции у привитых животных и не передавалась контактно КРС при совмест-
ном содержании в течение года. Привитые животные были полностью защище-
ны от заболевания и гибели при экспериментальном заражении. RRV (рекомби-
нантный вирус) обладал генетической стабильностью в течение 5 пассажей на
КРС. Вставка Н гена вируса ЧКРС в область гена гемагглютинина вируса оспо-
вакцины вызвала его инсерционную инактивацию. Эта потеря ГА стала своеоб-
разным фенотипическим маркером рекомбинантного вируса RRV [1696]. Реком-
бинантный вирус с аналогичными свойствами (CPV) получен при использова-
нии вируса оспы канареек в качестве вектора.
Чума мелких жвачных (ЧМЖ)
Чума мелких жвачных (ЧМЖ) — тяжелое заболевание, поражающее овец и
коз в Западной Африке. Она сходна с чумой крупного рогатого скота. Наиболее
чувствительны к заболеванию козы, смертность среди них доходит до 95%. ЧМЖ
проявляется в сверхострой, острой и хронической формах. Инкубационный пе-
риод пять дней. Первым признаком заболевания является повышение темпера-
туры тела до 42°С, затем развивается ларингофарингит, язвенный гингивит и ди-
арея с гнойно-слизистыми выделениями.
Биологические и физико-химические характеристики вируса ЧМЖ свиде-
тельствуют, что он близкородственен вирусам кори, чумы крупного рогатого
скота и чумы плотоядных, составляющим род морбилливирусов, что дает осно-
вание считать вирус ЧМЖ четвертым представителем рода. Вирус не патогенен
для крупного рогатого скота, в то время как вакцина против чумы крупного ро-
гатого скота предохраняет овец и коз от клинических проявлений ЧМЖ, не пре-
пятствуя персистированию вируса среди мелких жвачных. У ягнят иммунитет
длится не менее 4 мес.
Оптимальная температура культивирования вируса ЧМЖ - 40°С; при 37°С
патогенность его утрачивается. Вакцина против чумы крупного рогатого скота
создает иммунитет против ЧМЖ длительностью 1 год. Установлена возможность
изготовления живой вакцины из вируса, культивируемого в клетках почки эмб-
риона овцы при 37°С в течение 51 пассажа. Обследование мелких жвачных в Ни-
герии с помощью реакции нейтрализации показало, что 30—40% животных ин-
фицировано вирусом ЧМЖ.
Респираторно-синтициальная инфекция крупного рогатого скота
(PC-инфекция КРС)
В большинстве случаев PC-вирус вызывает инапарантную инфекцию. Хотя у
новорожденных и молодых телят вызывает пневмонию, отек легких и эмфизему.
Заболеваемость высокая, смертность низкая.
Заболевание наиболее сильно проявляется у телят в возрасте 1—3 мес. и ха-
рактеризуется повышением температуры, сильным кашлем, серозным ринитом,
пневмонией или бронхопневмонией.
PC-инфекция широко распространена в мире. Она часто осложняется вто-
ричной бактериальной инфекцией, особенно пастереллёзом. В этиологии мас-
совых пневмоний молочных телят видная роль принадлежит респираторно-син-
циальному (PC) вирусу, который в ряде случаев обнаруживали гораздо чаще, чем
инфекционный ринотрахеит, вирусную диарею и парагрипп-3 [280].
В стадах крупного рогатого скота с респираторными заболеваниями ВН-ан-
титела к PC-вирусу выявляли чаще (41%), чем к ПГ-3 (17%). У телят РС-вирус
выделяли из носоглотки на 2— 11 -й день после заражения. Методом иммунофлю-
оренсценции вирус обнаруживали в клетках бронхиального эпителия и альвео-
лярного экссудата в течение 11 дней после заражения; антитела в сыворотке кро-
ви — на 7—11 день. Эпителиальные клетки легких, очевидно, являются клетками-
мишенями для вируса, индуцирующего образование эпителиально-клеточного
синцития во многих участках легких [520]. Интратрахеальное заражение 4-не-
дельных ягнят PC-вирусом сопровождалось легким респираторным заболевани-
ем с кратковременным повышением температуры у некоторых животных [230].
Продолжительность и напряженность иммунитета у переболевших живот-
ных не определены. Материнские антитела слабо предохраняют потомство от
инфекции, но частота и тяжесть болезни обратно пропорциональны уровню
специфических материнских антител [886]. Для PC-инфекции характерны по-
вторные заболевания даже при наличии в крови антител, что свидетельствует о
второстепенной роли сывороточных антител в иммунитете. Важное значение в
иммунитете принадлежит секреторным антителам слизистой оболочки респира-
торного тракта и клеточным факторам, в частности зависимому от антител им-
мунному лизису инфицированных клеток.
Для специфической профилактики используют живые вакцины; эффектив-
ные инактивированные вакцины не разработаны. Телят вакцинируют внутри-
мышечно двукратно с интервалом три недели. Вакцинный вирус не экскретиру-
ется привитыми животными. Реинфекция вакцинированных телят возможна, но
она протекает обычно бессимптомно. Живая вакцина из аттенуинованного не-
реверсибельного штамма после двукратного введения (3,3 1g ТЦД50) с интерва-
лом 21 день вызывала сероконверсию у всех телят и снижала клиническое про-
явление болезни после заражения вирулентным штаммом вируса.
Серологические исследования и клинические наблюдения показали безо-
пасность и эффективность живой вакцины, особенно при двукратном примене-
нии. Среди вакцинированных животных заболеваемость была значительно ни-
же. В результате вакцинации животных в течение ряда лет экономические поте-
ри снизились в несколько раз.
Живую комбинированную вакцину против РС-инфекции и вирусной диареи
крупного рогатого скота испытывали на телятах 2—14 месячного возраста. Вакци-
ну вводили внутримышечно с 3-недельным интервалом. На некоторых фермах у
небольшой части привитых телят наблюдали кратковременные респираторные
или лихорадочные симптомы. Сероконверсия к PC-вирусу установлена у 98%
животных, а к вирусу диареи - у 96%. Иммуноинтерференции между аттенуиро-
ванными штаммами обоих вирусов не установлено. Защитный эффект вакцина-
ции против тяжелых респираторных симптомов, обусловленных полевым штам-
мом РС-вируса, составил 81%. Уровень сероконверсии был обратно пропорцио-
нален уровню колостральных антител [684]. Одновременное введение живых
вакцин против РС-инфекции, вирусной диареи, ринотрахеита и ПГ-3 сопровож-
далось напряженным гуморальным иммунитетом на каждую из вакцин [584].
Создана рекомбинантная вакцина, вектором которой служит вирус инфек-
ционного ринотрахеита КРС, несущий ген G-белка РС-вируса КРС, вызываю-
щий образование иммунитета слизистых и защиту телят [1135]. Мутант, лишен-
ный гена NS2, не обладает реверсией и представляет особый интерес в исполь-
зовании в качестве живой вакцины [1507].
На основе ДНК-технологии получен химерный вирус, одновременно экс-
прессирующий гликопротеины РС-вируса подгрупп А и В [851].
В НПО НАРВАК (Москва) создана инактивированная комбинированная
вакцина (Комбовак) против 6 вирусных заболеваний крупного рогатого скота:
инфекционного ринотрахеита, вирусной диареи, парагриппа-3, рота- и корона-
вирусных болезней и РС-инфекции. Эта вакцина широко применяется с поло-
жительным результатом в России.
Следует отметить, что, кроме РС-вируса, у крупного рогатого скота обнару-
жен синтициальный вирус. Между этими двумя вирусами отсутствует антиген-
ное родство. Синтициальный вирус выделен от клинически здорового скота, и
его роль в патологии не установлена. Он передается потомству через молозиво и
молоко, а также in utero и при контакте с инфицированными животными.
Чума плотоядных (ЧП)
Чума плотоядных (ЧП) - остропретекающая контагиозная болезнь собак,
волков, лисиц, норок, соболей, енотов и других плотоядных, характеризующаяся
лихорадкой, острым катаральным воспалением слизистых оболочек, пневмонией,
кожной экзантемой и поражением нервной системы. Заболевание характеризует-
ся вирусемией, и после выздоровления у животных наступает продолжительный
почти пожизненный иммунитет. Однако он не является абсолютным, поскольку
наблюдаются случаи повторного переболевания даже с летальным исходом.
ВН-антитела появляются спустя 6 дней после заражения и сохраняются не
менее 6 мес. Позже образуются КС-антитела. Вирус ЧП, так же как вирус кори,
вызывает подострые и хронические болезни центральной нервной системы. У
переболевших животных вирусоносительство длится 1—2 мес. Иногда вирус уда-
валось выделить от старых собак с явлениями энцефалита.
Для специфической профилактики используют живые и инактивированные
культуральные вакцины. Аттенуированные штаммы вируса ЧП получают путем
серийного пассирования в неестественном хозяине или культуре клеток.
Однако некоторые полученные таким образом аттенуированные штаммы
обладали реверсибельностью. Например, вакцинный штамм Рокборн, аттенуи-
рованный длительным пассированием в культуре клеток почки собак, восстано-
вил вирулентность после шести пассажей на собаках. Реверсия вирулентности
аттенуированного штамма имела место также in vitro после 10 пассажей в куль-
туре легочных макрофагов собак [248].
Аттенуированный штамм Ондестепурт не давал реверсии вирулентности и
вызывал иммунитет на 3—6 лет у 75% собак [1135].
При введении живых вакцин, начиная с 3-дня наблюдается устойчивость к
заражению вирусом ЧП, обусловленная интерференцией, тогда как антигенный
эффект обнаруживается через 7—10 дней. Материнский иммунитет длится 6—8
недель, а период полураспада ВН-антител равен 8,5 дня [250].
С открытием антигенного родства между вирусами чумы плотоядных и кори
во многих странах коревую вакцину использовали для ранней профилактики чу-
мы собак. Однако применение гомологичной живой вакцины для профилакти-
ки ЧП оказалось более эффективным средством. Живая вакцина против ЧП
обеспечила выраженный гуморальный и клеточный ответ и полную защиту от
болезни. У собак, иммунизированных вакциной против кори, не обнаружено
клеточного иммунного ответа (слабая сероконверсия). После контрольного за-
ражения у них развились умеренные признаки болезни и выраженный клеточ-
ный и гуморальный ответ. Имеется несколько типов живых и инактивированных
вакцин, которые комбинируют в виде би- или многокомпонентных вакцин про-
тив чумы, парвовирусного энтерита, инфекционного гепатита, бешенства, леп-
тоспироза и ботулизма. Имеются данные об иммуносупрессивном действии пар-
вовирусной инфекции на иммунизацию против ЧП. Щенков необходимо при-
вивать в возрасте 10—12 недель, когда угасает колостральный иммунитет.
Ревакцинацию следует проводить ежегодно.
В целях профилактики чумы плотоядных все поголовье звероводческих
ферм (норки, лисицы) необходимо регулярно вакцинировать. Маточное поголо-
вье зверей вакцинируют в зимние месяцы инактивированной или живой вакци-
ной, а молодняк - аэрозольно после отсадки от матерей в возрасте около 10 не-
дель. При аэрозольной вакцинации наряду с гуморальным образуется также ме-
стный иммунитет. Щенков, лисиц вакцинируют подкожно, как и собак.
Эпизоотия среди тюленей на озере Байкал осенью 1987 г., а затем на Балтий-
ском море [1152] была вызвана вирусом, близким или идентичным вирусу чумы
плотоядных [26]. Инактивированная и компонентная вакцины против ЧП защи-
щали тюленей при экспериментальном инфицировании полевым изолятом ви-
руса [1152].
Ринотрахеит (кориза) индеек (РТИ)
Ринотрахеит (кориза) индеек (РТИ), обнаруженный впервые в 1978 г. в Юж-
ной Африке, в последующем был установлен во многих странах. РТИ поражает
в основном молодых индеек и характеризуется катаральным воспалением верх-
них дыхательных путей. Заболевание часто осложняется вторичной микрофло-
рой. Заболеваемость может достигать 100%, смертность молодой птицы колеб-
лется в широких пределах: 0,4—90%. Легкую форму болезни, наблюдаемую у
цыплят, называют «синдром опухания головы». У несушек наблюдают снижение
яйценоскости и слабовыраженные респираторные нарушения, депрессию. Ви-
рус РТИ выделяется с трудом пассированием в 6—7 дневных эмбрионах индеек
или кур или культуре трахеи КЭ. Антитела выявляют методом ИФА.
Имеются коммерческие живые вакцины против РТИ [1405].
Парагрипп-2 собак (ПГС)
Парагрипп-2 собак (ПГС). Вирус тесно связан, если не идентичен вирусу
обезьян (SV5). Он вызывает инапарантную инфекцию или легкопротекающее
респираторное заболевание. Наличие специфических антител указывает на ши-
рокое распространение заболевания у собак в разных странах. Для профилакти-
ки ПГС обычно используют комбинированные вакцины против ряда вирусных
заболеваний собак [1405].
10.15. Рабд овирусы
Семейство рабдовирусов включает более 175 вирусов позвоночных, беспо-
звоночных и растений, в том числе опасные патогенные вирусы животных, такие
как вирусы бешенства человека и животных, везикулярного стоматита и эфемер-
ной лихорадки крупного рогатого скота.
На основе генетических и серологических свойств различают 4 рода рабдо-
вирусов животных: лиссавирусы, везикуловирусы, эфемеровирусы и новирабдо-
вирусы. Имеются также несколько важных рабдовирусов основных видов рыб,
которые еще не отнесены к какому-либо роду.
Род лиссавирусы содержит вирус бешенства и тесно связанные с ним виру-
сы, включая Моколо вирус, вирусы летучих мышей Лагоса, Европы 1 и 2, Авст-
ралии и вирус Дювнхаджи в Африке. Каждый из этих вирусов способен вызвать
заболевание, подобное бешенству, у человека и животных. Летучие мыши явля-
ются для этих вирусов естественным хозяином и резервуаром.
Род везикуловирусы содержит около 35 серологически различных вирусов,
наиболее опасным является вирус везикулярного стоматита серотипов Индиана
и Нью-Джерси, так же как 6 других вирусов, вызывающих везикулярную болезнь
лошадей, крупного рогатого скота, свиней и людей. В этот род также входят не-
сколько вирусов рыб, в том числе рабдовирусы зеркального карпа и весенней ви-
ремии карпа.
Род эфемеровирусы включает вирус эфемерной лихорадки крупного рогато-
го скота и другие серологически отличные вирусы, вызывающие подобное забо-
левание у этого вида животных.
Род новирабдовирусы содержит вирус инфекционного гематопоэтического
некроза рыб и вирус геморрагической септицемии лосося.
Вирионы рабдовирусов 65-70 нм в диаметре и 170-380 нм длиной имеют обо-
лочку с большими пепломерами, внутри которой находится спирально-кольце-
вой цилиндрический нуклеокапсид, придающий вирионам отчетливую пулеоб-
разную или коническую форму. Вирионы состоят из наружной мембраны, про-
исходящей из клеток, в которых вирус размножается, и сердцевины. Сердцевина
содержит одноцепочечную РНК, окруженную главным N белком и минорными
полимеразными белками L и Р и двухслойной мембраной, содержащей транс-
мембранный гликопротеин G и периферический матриксный белок М, который
связан с внутренней поверхностью мембраны и с рибонуклеопротеином-РНП
[1329]. Геном представлен одной линейной молекулой одноцепочной РНК нега-
тивной полярности размером 11—15 тн. Геном вируса бешенства содержит 11932
нуклеотида, образующих 5 генов, расположенных в следующем порядке: 3' — N
— NS — М — G — L — 5'. Некоторые представители семейства содержат дополни-
тельные гены.
По организации генома рабдовирусы подобны парамиксовирусам и филови-
русам и во многих отношениях сходны с ними по транскрипции и репликации.
Вирус проникает в клетку путем сплавления вирусной оболочки с клеточной
мембраной; все стадии репликации проходят в цитоплазме. Репликация начина-
ется с транскрипции мРНК на геномной РНК с помощью вирионной РНК по-
лимеразы; в дальнейшем используются белковые продукты этой транскрипции
и образуются полимеразные позитивной полярности транскрипты, которые ис-
пользуются для синтеза геномной мРНК. Используя вирионную РНК в качестве
матрицы, вирусная транскриптаза транскрибирует 5 видов субгеномной мРНК.
Имеется только один промоторный сайт, находящийся у З'-конца вирусного ге-
нома; полимераза прикрепляется к матрице геномной РНК у этого сайта и про-
двигается вдоль вирусной РНК, она встречает старт/стоп сигналы на границе
каждого вирусного гена, сохраняя непрерывность процесса транскрипции. Этот
механизм, называемый ослабленной транскрипцией (или стоп/старт транскрип-
цией), начинается от гена, расположенного на З'-конце генома, и приводит к
синтезу большого количества мРНК.
Синтез мРНК уменьшается по мере продвижения транскрипции N > Р > М >
G > L. В результате этого в дальнейшем образуется большое количество структур-
ных белков. Таких белков, как нуклеокапсидный N белок, продуцируется значи-
тельно больше, чем белка L (РНК полимераза). Объединение молекул нуклеопро-
теина с вновь образованными молекулами геномной РНК ведет к образованию
нуклеокапсидов. Благодаря М белку нуклеокапсиды прикрепляются к клеточной
мембране в местах, где включены вирусные пепломеры. Вирионы формируются
при почковании нуклеокапсида через такие участки мембраны клетки.
На поверхности липопротеиновой оболочки рабдовирусов имеются харак-
терные пепломеры длиной 5—10 нм, диаметром около 3 нм с утолщением на кон-
це. Рабдовирусы содержат 65-70% белка, 15-25% липидов, 3% углеводов и 1-2%
РНК. Липиды и углеводы имеют клеточное происхождение и содержатся в на-
ружной оболочке вириона. Липиды образуют двойной слой, окруженный бел-
ком с двух сторон. Наружный белковый слой липопротеиновой оболочки пред-
ставлен гликопротеином, внутренний слой — образован негликозилированным
мембранным белком. Рабдовирусы обычно содержат пять белков N, Р, М, G, L с
молекулярной массой 20—200 кД.
L белок является РНК-зависимой РНК полимеразой, которая участвует в
транскрипции и репликации вирионной РНК. Гликопротеин G, подобно альфа-
вирусам, образует тримеры и входит в структуру пепломеров. Нуклеопротеин N
является главным компонентом нуклеокапсида. Р белок (NS или Ml белок)
представляет собой компонент вирусной полимеразы. М белок (или М2 белок у
вируса бешенства) способствует почкованию вирионов прикреплением нуклео-
капсида к цитоплазматическому участку, содержащему вирусный гликопротеин.
Нуклеокапсид рабдовирусов представляет собой спиральные тяжи, состоящие
из РНК и трех белков N, NS, и L, составляющих 96% его массы.
В состав наружного слоя оболочки рабдовирусов входит один гликопротеин
G (65-80 кД), негликозилированная гидрофобная часть которого погружена в
липидный бислой. Гликопротеин G на поверхности вириона образует шипы, ко-
торые можно удалить с помощью протеаз. Каждая молекула белка содержит две
олигосахаридные цепи (3,4 кД), присоединенные к внешней гидрофильной час-
ти белка. Однако отсутствие углеводов в белке G не влияет на инфекционность
вируса. В вирионе рабдовирусов содержится 500—1700 молекул белка G, что со-
ставляет около 25% от общего содержания белка. Он играет ведущую роль в при-
креплении вирионов в клетке, определяет типовую специфичность рабдовиру-
сов и обусловливает гемагглютинирующую активность вируса бешенства. Транс-
мембранный домен гликопротеина G представлен 20 аминокислотами близ
С'-конца. Цитоплазматический домен представлен С-концевыми аминокисло-
тами. Серотипы Нью-Джерси и Индиана вируса везикулярного стоматита (ВВС)
различаются заменой цистеина на серин в цитоплазматическом домене.
Белок N — основной белок нуклеокапсида — тесно связан с вирионной РНК
и защищает ее от действия РНКазы. Высокомолекулярный белок L и небольшой
белок NS также связаны с нуклеокапсидом, но содержатся в вирионе в неболь-
шом количестве. Внутренним белком вирусной оболочки является негликозили-
рованный мембранный или матриксный (М) белок рабдовирусов. Вероятно, не-
которые молекулы белка М контактируют с гидрофобной частью белка G сквозь
липидный бислой. Белок М обладает высокой гидрофобностью и принимает
участие в заключительной стадии морфогенеза вируса в зараженной клетке.
Кроме белка М, у вируса бешенства в состав внутреннего слоя оболочки входит
белок А, или клеточный актин с молекулярной массой 43 кД, содержание кото-
рого достигает 1—5% массы вирионных белков. На гликопротеине вируса вези-
кулярного стоматита серотипа Нью-Джерси идентифицировано четыре эпито-
па, участвующих в гомологичной нейтрализации. Главный эпитоп нейтрализа-
ции является конформационным, поскольку образован двумя антигенными
участками белка G. Он, по-видимому, соответствует участку прикрепления ви-
рионов к клеткам-мишеням [585].
Антитела к G-протеину вируса бешенства, в отличие от антител к N- или
М-белкам, нейтрализовали вирус и защищали от летальной инфекции. Глико-
Таблица 39. Структурные белки рабдовирусов [1329]
Обозначение белка Количество аминокислот в белке Молеку- лярная масса, кД Количество молекул в вирионе Локализация и функция
N 450 50-62 1000-2000 Основной белок нуклеокапсида
P(NS) 297 37-45 100-650 Нуклеокапсид; компонент вирионной транскриптазы
М 202 20-30 1600-4000 Внутренний слой оболочки вириона; способствует почкованию вириона
L 2142 150-200 20-100 Нуклеокапсид; вирионная транскриптаза
G 505 65-80 500-1700 Наружный слой оболочки вири- она; ответственен за адсорбцию вируса на клетках, синтез нейтра- лизующих антител и иммунитет
Таблица 40. Структурные белки вируса везикулярного стоматита [1329]
Белки Молекулярная масса Количество молекул в вирионе
N 47355 1258
P(NS) 29878 466
М 26064 1826
G 63416 1205
L 240707 50
протеин G является структурным белком, индуцирующим образование вирус-
нейтрализующих антител и определяющим развитие иммунитета у животных.
Гликопротеин G и нуклеопротеин имеют эпитопы, вызывающие клеточно-опо-
средованный иммунитет [1329].
В связи с возможной антигенной вариабельностью поверхностного глико-
протеина (G-белок) вируса бешенства из различных географических зон в каче-
стве протективного антигена использовали также рибонуклеопротеин, характе-
ризующийся консервативностью антигенной структуры. У мышей и енотов, им-
мунизированных таким антигеном, образовались ВН-антитела и 90-100% из них
были защищены от летальной инфекции вирусом бешенства. Таким образом, не
только G-белок, но и РНП вируса бешенства обладает протективной активнос-
тью. Нуклеокапсидный антиген вызывает образование комплементсвязывающих
и преципитирующих антител. Он является группоспецифическим антигеном для
всех лиссавирусов и, вероятно, для рода везикуловирусов, что можно обнаружить
с помощью иммунофлюоресценцин. Очищенный гликопротеид G создает у жи-
вотных устойчивость к заражению вирусом бешенства [287]. Однако не обнару-
жено строгой корреляции между титром ВН-антител после введения очищенно-
го гликопротеина вируса бешенства и защитой мышей. Защитная активность
компонентной вакцины, так же как и инактивированной вакцины, связана с ее
способностью индуцировать иммунологическую память [585].
После адаптации аттенуированные штаммы вируса бешенства и вирус вези-
кулярного стоматита хорошо размножаются во многих культурах клеток. Клетки
Vero и ВНК-21 обычно используют в производстве вакцин для животных. Эти
вирусы, так же как адаптированный вирус эфемерной лихорадки, накапливают-
ся в высоком титре в мозге новорожденных мышей и хомяков. Репликация раб-
довирусов обычно сопровождается образованием дефектных интерферирующих
частиц. Это является результатом влияния делеционных мутантов, которые ин-
терферируют с репликацией нормального вируса.
Вирус бешенства почкуется через цитоплазматические мембраны инфици-
рованных нейронов, но главным образом через плазматические мембраны эпи-
телиальных клеток слюнных желез. Вирус везикулярного стоматита почкуется
через базальные плазматические мембраны. Он обычно быстро вызывает цито-
патологию, возможно быстрее, чем другие вирусы. Вирусы бешенства и эфемер-
ной лихорадки крупного рогатого скота размножаются медленнее и обычно не
вызывают изменения клеток, потому что не препятствуют синтезу белка и нук-
леиновых кислот клеток. Вирус бешенства вызывает образование цитоплазмати-
ческих телец-включений (тельца Нерги) в инфицированных клетках.
Бешенство
Бешенство — остропротекающая болезнь теплокровных животных, характе-
ризующаяся поражением центральной нервной системы. Оно относится к числу
наиболее опасных заболеваний человека и животных, которое регистрируется на
пяти континентах. Вирус передается главным образом со слюной при укусах.
После размножения в экстраневральных тканях он вскоре достигает спинальных
ганглиев и головного мозга, где реплицируется только в определенных группах
нейронов. Заболевание, как правило, завершается летальным исходом.
Основную роль в иммунитете у вакцинированных против бешенства играют
ВНА, направленные против G белка, который вызывает выраженный В клеточ-
ный ответ. Нейтрализующие IgG появляются на 6-8 дни после вакцинации. ВНА
достигают титра 1:16— 1:32 на 9-12 дни, а максимального уровня через 3 недели
и сохраняются более 6 месяцев. После переболевания у лошадей, КРС и свиней
антитела могут сохраняться более 7 лет. Т-клеточный иммунный ответ сохраня-
ется в течение длительного периода [577].
Несмотря на высокую антигенность белков вируса бешенства, его размноже-
ние в инкубационный период заболевания, т.е. в период продвижения вируса от
места внедрения до центральной нервной системы, практически остается безот-
ветным со стороны иммунной системы организма. Вероятно, в этот период
очень мало вирусного антигена достигает иммунной системы, так как основная
масса его задерживается в мышечных клетках или в нервных аксонах. Однако
ранние стадии инфекции чувствительны к антителам, поэтому эффективна
классическая пастеровская вакцинация, особенно в сочетании с применением
гипериммунного глобулина. Иммунологическое вмешательство является эф-
фективным в течение первого этапа длительного инкубационного периода меж-
ду началом репликации вируса в мышечных клетках и проникновением вируса в
защищаемое окружение нервной системы.
Блестящим примером применения живой антирабической вакцины для че-
ловека явилась вакцина Ферми [664]. Эту вакцину готовили из суспензии мозга
овец или коз, инфицированных фиксированным штаммом вируса бешенства.
Вирус частично инактивировали добавлением небольшого количества фенола. В
дальнейшем для размножения фиксированного штамма вируса использовали
мозг зараженных кроликов, новорожденных мышей, а также утиные эмбрионы
и культуры клеток (первичные культуры клеток почек новорожденных хомяков,
собак, поросят, телят, фибробласты эмбрионов кур; диплоидные клетки обезьян;
линию клеток Vero). С использованием различных систем для пассирования и
размножения получены разные варианты фиксированного штамма вируса бе-
шенства (CVS, ERA, SAD, PM, HEP, LEP, Kelev, Kissling, Внуково 32). Поданным
ВОЗ (1992 г.), культуральные вакцины для иммунизации людей являются безо-
пасными и более иммуногенными, чем вакцины из нервной ткани. С целью ис-
ключения возможных осложнений по причине использования живого вируса в
вакцине для человека, вакцинный вирус стали полностью инактивировать фено-
лом, формалином или ₽- пропиолактоном. В дальнейшем аналогичная рекомен-
дация сделана в отношении вакцин против бешенства животных.
Вакцины, применяемые для профилактики бешенства животных (преиму-
щественно собак и кошек), принципиально не отличаются от вакцин, применя-
емых людям. Отличие заключается в том, что в ряде стран по экономическим со-
ображениям для иммунизации животных используют живые вакцины из безо-
пасных аттенуированных штаммов вируса бешенства. Для иммунизации собак и
кошек в основном применяют инактивированные комбинированные вакцины
против нескольких заболеваний [1217].
Современные инактивированные культуральные вакцины и иммуноглобу-
лин против бешенства являются основой борьбы с бешенством людей. Специ-
фическая профилактика бешенства у животных основана на применении безо-
пасных и эффективных живых и инактивированных вакцин [1329]. Хотя антира-
бические вакцины начали применять еще в 1885 г., однако до сих пор остается
нерешенным ряд проблем, касающихся профилактики бешенства и борьбы с
ним среди животных. Вакцинация векторных домашних и диких животных на-
правлена в первую очередь на охрану здоровья человека. Антирабические вакци-
ны особенно нужны в районах, где бешенство является эндемическим заболева-
нием диких и домашних плотоядных. Основным резервуаром вируса бешенства
в природе являются собаки, лисицы, еноты, скунсы и летучие мыши.
В мире ежегодно более 4 млн людей подвергаются вакцинопрофилактике и
около 50000 погибают преимущественно от покусов инфицированными собака-
ми. Специфическая профилактика бешенства людей в основном приходится на
Африку, Азию и Южную Америку [ 1329].
В европейских странах, где преобладает лесной цикл передачи этой болезни, с
1981 г. зарегистрированы единичные случаи смерти среди людей [147]. В странах
Южной Америки для иммунизации собак широко применяли вакцину из фикси-
рованного штамма вируса, размноженного в культуре клеток мозга мышей-сосу-
нов. Там ежегодно производили до 20 млн доз такой вакцины. Систематическое ее
применение на протяжении 10 лет в ряде стран привело к резкому снижению слу-
чаев бешенства среди собак [147]. По данным ВОЗ, при массовой вакцинации в
1992 г. было привито 36 млн собак (в основном в Америке). Количество собак,
подлежащих вакцинации против бешенства в мире, может достичь 500 млн.
Специфическую профилактику необходимо проводить не только среди со-
бак, но в ряде регионов и среди сельскохозяйственных животных. В Бразилии,
например, ежегодные потери крупного рогатого скота от бешенства составляют
30 000 голов [93], что свидетельствует о широких масштабах циркуляции вируса
у векторных животных.
В настоящее время для специфической профилактики бешенства применя-
ют инактивированные и живые вакцины. В медицине используют только инак-
тивированные, слабоаллергенные или безаллергенные вакцины. Они в основ-
ном различаются по способу размножения вируса, концентрации и степени очи-
стки вирусного антигена. Вирус размножают в культуре диплоидных клеток
человека или в культуре клеток эмбриона птиц, или в культуре клеток почки обе-
зьян. В качестве адъюванта применяют ГОА. Однако наиболее перспективным
субстратом для производства медицинской вакцины оказались клетки Vero, ко-
торые обеспечивают более высокий выход вирусного антигена, чем первичные
или диплоидные культуры клеток человека или животных. Клетки Vero можно
выращивать на микроносителях, получая клеточные популяции высокой плот-
ности. Культивирование этих клеток в ферментах большой емкости обеспечива-
ет возможность крупномасштабного промышленного производства вакцины,
что снижает ее стоимость. При изготовлении вакцины для человека на клетках
Vero путем соответствующей очистки снижают до приемлемого уровня содержа-
ние ДНК клеточного происхождения [1340].
Аналогичным образом готовят вакцину для животных, используя различные
клеточные субстраты, в том числе ВНК-21, обеспечивающие высокое накопле-
ние вирусного антигена [394]. Для изготовления инактивированной вакцины
для животных вирус выращивают в культуре клеток ВНК-21, в том числе суспен-
зионным методом с использованием ферментов, что позволило значительно
снизить стоимость вакцины.
Систематически вакцинация собак и крупного рогатого скота значительно
уменьшает случаи бешенства у животных и предотвращает заражение от них че-
ловека. Для иммунизации животных применяли живые и инактивированные
вакцины. Живые вакцины из аттенуированных штаммов ERA, SAD, Flury и
Roxane защищали 100% вакцинированных животных в течение не менее одного
года. В Латинской Америке широкомасштабную вакцинацию собак проводили с
использованием разных вакцин. Сейчас для иммунизации животных рекомен-
довано применять культуральную инактивированную адъювантную вакцину.
Хорошие результаты получены при иммунизации диких плотоядных, в том чис-
ле диких собак, с помощью вакцины из вируса, размноженного в клетках
ВНК-21 на микроносителе [141].
При изготовлении живых вакцин чаще всего использовали культуру клеток
ВНК-21, в которой вакцинные штаммы накапливаются в титре 6,5—7,0 1g
ТЦД50/мл. Два штамма фиксированного вируса бешенства были адаптированы к
культурам клеток \fero и ВНК-21 [421]. Живые вакцины были высокоэффектив-
ны и полностью безопасны [355]. Даже после интрацеребральных пассажей на
собаках реверсии вирулентных свойств не отмечено. Безвредность штамма
Flury-HEP/BHK-21 подтверждена в опытах на 207 диких животных 15 видов,
обитающих в Европе. Антиген вакцинного штамма обнаружили в центральной
нервной системе методом иммунофлуоресценции у 9,7% животных через 100
дней после прививки. Слабая репликация вируса в центральной нервной систе-
ме обнаружена у небольшой части (11,6%) животных. Живая вакцина из штамма
SAD/BHK-21 (7,3 1g ТЦД50/мл) оказалась безвредной при введении собакам,
кошкам и лисицам. Через семь дней после вакцинации вирус обнаружен в мин-
далинах у 2 из 36 лисиц и в подчелюстных железах некоторых кошек. После од-
нократной вакцинации выраженную сероконверсию отмечали у 75% собак и
71% лисиц [494]. Живой вакциной ERA прививали крупный рогатый скот в Юж-
ной Америке. Испытания, проводимые в экспериментальных и практических
условиях, показали эффективность живых вакцин при парентеральном и ораль-
ном способах иммунизации домашних и диких плотоядных животных [355, 494].
Живые вакцины при оральной иммунизации диких плотоядных в естествен-
ных условиях оказались незаменимыми. Установлена полная безопасность и эф-
фективность оральной вакцинации лисиц живой вакциной из штамма SAD В-
19, адаптированного к культуре клеток ВНК-21 [394].
В 1978 г. в Швейцарии было начато крупномасштабное испытание живой
оральной вакцины. В различных районах страны на площади 2277 км2 было рас-
пределено более 82 000 приманок (куриных голов), содержащих живой вакцин-
ный вирус. В феврале и октябре каждого года раскладывали примерно по 20 при-
манок на 1 км2. Антитела выработались примерно у 50% лисиц. В ряде районов
распространение бешенства было приостановлено, а в некоторых это заболевание
вообще исчезло. Не отмечено ни одного случая бешенства среди диких и домаш-
них животных, который можно было бы отнести за счет применения вакцины
[113]. Аналогичные данные получены при оральной иммунизации лисиц в Герма-
нии. Установлено, что 78% лисиц поедали приманки с вакциной (25 приманок на
1 км2). У 63% лисиц в крови обнаружены нейтрализующие антитела к вирусу бе-
шенства. В результате наблюдали снижение случаев бешенства или даже его лик-
видацию на обширных территориях [1661]. Опыты, проведенные в Швейцарии и
Германии, показали, что положительные результаты могут быть получены при им-
мунизации не менее 50% лисиц [113, 1661]. Приманка должна содержать не менее
7,0 1g ИД вакцинного вируса [1661]. Опыт Швейцарии показывает, что иммуниза-
цией популяции лисиц в районах возможного распространения бешенства удает-
ся поддерживать состояние благополучия. Повторная вакцинация во всех небла-
гополучных областях страны дает возможность ликвидировать бешенство в зара-
женных районах. Подобные результаты контроля «лесного» бешенства с помощью
оральной вакцинации лис получены в ряде других стран.
В Европе и Северной Америке ведется работа по вакцинации диких живот-
ных против бешенства. Два основных типа вакцин используют в настоящее вре-
мя для вакцинации диких животных: живые вирусные вакцины и живые реком-
бинированные вакцины для орального применения. Все используемые живые
вакцины происходят из оригинального штамма SAD. Четыре из них (ERA, SAD-
Bern, SAD-B19 и Внуково-32) патогенны для взрослых мышей при введении в
мозг, мышцы и орально. SAG-вакцина из делеционного мутанта штамма SAD
(потеря аргинина в 333 положении) патогенна только для новорожденных мы-
шей при интроцеребральном и оральном введении.
Для оральной иммунизации диких плотоядных, кроме традиционных живых
вакцин, предложены реплицирующиеся рекомбинантные вакцины с использо-
ванием вируса осповакцины в качестве вектора гена G гликопротеина вируса бе-
шенства.
Для оральной иммунизации лисиц использовали рекомбинантный вирус ос-
повакцины (WTGgR АВ). В качестве приманки использовали куриные головы,
содержащие 8,0 1g БОЕ рекомбинантного вируса. Иммунизация лисиц таким
способом сопровождалась образованием высокого титра ВН-антител и обеспе-
чивала их устойчивость к контрольному заражению [356] в течение 18 мес.
[1215]. Аналогичные результаты получены на енотах при оральном и паренте-
ральном методах введения рекомбинантного вируса осповакцины бешенства.
С 1990 г. рекомбинантная вакцина на основе вируса осповакцины в виде
приманки из рыбной муки широко применялась в Бельгии и Франции. В Кана-
де с 1980 г. аналогичным образом иммунизируют красных лис живой вакциной
ERA — ВНК. Отмечено наличие иммунитета у 74% лис. Для контроля бешенст-
ва диких животных в Европе и Северной Америке используют рекомбинантную
вакцину VRG, которая содержала ген гликопротеина штамма ERA в тимидинки-
назном гене вируса осповакцины. В дозе 108 ТЦД50 вакцина вызывала образова-
ние ВНА и выраженную защиту. Вакцина VRG не патогенна для 19 видов птиц и
35 видов млекопитающих. В 1988—1990 гг. 1 млн доз вакцины (приманок) было
распределено на территории Бельгии и Франции [1217]. Вакцина VRG обладала
выраженной эпизоотологической эффективностью при испытании в полевых
условиях в Бельгии, Франции и США [577].
Хотя живые вакцины нашли широкое применение в ветеринарии, в настоя-
щее время отмечается тенденция отдавать предпочтение инактивированным
вакцинным препаратам, обладающим большой эффективностью и легкостью
применения. С профилактической целью прививают сельскохозяйственных жи-
вотных, наиболее часто поражаемых бешенством. Инактивированные вакцины
лучше поддаются стандартизации. Минимальная антигенная доза составляет
0,3—1 ME. Если их применяют с адъювантом, они создают иммунитет такой же
продолжительности, как и живые вакцины. Благодаря получению высокоактив-
ного культурального вирусного сырья и концентрированию вирусных антигенов
инактивированные вакцины последнего поколения стали превосходить живые
антирабические вакцины. Например, получены вакцины с повышенной анти-
генностью, равной 3—5 ME в 1 дозе [355].
Антигенную активность живой (аттенуированный штамм ERA) и инактиви-
рованной вакцин сравнивали по титру ВН-антител на крупном рогатом скоте.
Вирус инактивировали БПЛ и добавляли ГОА и сапонин в качестве адъюван-
та. Живую вакцину вводили внутримышечго однократно в дозе 2 мл. У привитых
однократно инактивированной вакциной титр ВН-антител через 6 и 10 мес. был
выше, чем у привитых живой вакциной. Наиболее выраженная и продолжитель-
ная иммунологическая реакция отмечена в группе животных, привитых дважды
инактивированной вакциной [1275].
Фирма Мерье (Франция) изготовила и сравнила три варианта инактивиро-
ванной вакцины: лиофилизированную без адъюванта (в основном для собак и
кошек), жидкую с ГОА и сапонином (для жвачных и свиней) и жидкую только с
ГОА (для пушных зверей). Концентрация вирусного антигена в вакцине в 10 раз
превосходила минимально требуемый уровень. Испытание всех вариантов вак-
цины на лабораторных животных, собаках, кошках, крупном рогатом скоте, ов-
цах, свиньях и лошадях показало, что в результате иммунизации у животных всех
видов создается прочный иммунитет длительностью 1,5—3 года. Ее можно ис-
пользовать в комбинации с противоящурной вакциной у крупного рогатого ско-
та и свиней, противочумной и лептоспирозной — у собак и вакциной против
панлейкопении у кошек [1270].
Молодняк от вакцинированных матерей необходимо прививать с 3-месяч-
ного возраста. Вакцина сохраняла свою активность в течение трех лет при 5°С.
Вакцина, хранившаяся 3 года, вызывала устойчивость к заражению вирулент-
ным вирусом у 100% овец и кошек, а также у 97,4% собак. При заражении улич-
ным вирусом двукратно вакцинированного крупного рогатого скота защита со-
ставляла 90—100%. Прививка КРС и овец смесью вакцин против бешенства и
ящура давала такой же эффект, как и моновалентный препарат против бешенст-
ва. Для молодняка, родившегося от вакцинированных животных, необходима
бустер-вакцинация в первые 12 мес.
Однократная вакцинация сопровождалась развитием иммунологической па-
мяти, которая сохранялась не менее 16 мес. Устойчивость к заражению сочета-
лась с высоким титром ВН-антител [354]. Вакцина из очищенного вируса, раз-
множаемого в клетках Vero, после двукратного применения с интервалом 12 мес.
вызывала напряженный иммунитет продолжительностью до пяти лет [1359].
Пастеровский штамм вируса бешенства, выращенный в культуре клеток
ВНК-21, инактивировали ДЭИ в щелочной среде. К одной части вакцины до-
бавляли А1(ОН)3, другую использовали без адъюванта. Вакцину вводили крупно-
му рогатому скоту подкожно в дозе 5 мл.
Через 1—2 года после прививки вакциной с адъювантом все животные были
устойчивы к контрольному заражению, а через 3 года — 92%. Вакцина без адъю-
ванта через 1 год защищала лишь 67% животных. Вакцина с адъювантом сохра-
няла иммуногенность при 4°С в течение 24 мес., при 25°С — 18 мес., при 37°С —
6 мес. [927].
Штамм HEP-S AD (6,9—8,0 1g ТЦД50/мл) хорошо размножался в культуре
псевдодиплоидной линии (NL-ST-1) клеток тестикул свиней. Моно- и комби-
нированные вакцины (против бешенства, ринотрахеита кошек, калицивируса
кошек и панлейкемии) создавали у кошек напряженный иммунитет продолжи-
тельностью не менее 1 года.
Для изготовления инактивированной вакцины против бешенства приемлема
технология, используемая при производстве противоящурной вакцины в ряде
развитых стран на основе суспензионного культивирования клеток ВНК-21 [927].
Ведутся исследования по разработке рекомбинированных вакцин на основе
нереплицирующихся векторов, экспрессирующих G белок вируса бешенства.
Наиболее перспективным считается получение антигенного материала на осно-
ве векторов вирусов оспы птиц, абортивно реплицирующихся в культуре клеток
млекопитающих. Такие рекомбинанты синтезируют на поверхности инфициро-
ванных клеток гликопротеин G вируса бешенства без образования потомства
инфекционного вируса. Были созданы рекомбинанты вируса бешенства и виру-
сов оспы птиц и оспы канареек, которые экспрессировали гликопротеин G ви-
руса бешенства под контролем промоторов вирусов оспы. Такие рекомбинанты
индуцировали ВНА к вирусу бешенства у 6 видов млекопитающих (мыши, кры-
сы, кролики, собаки, кошки и КРС). Иммунитет у всех вакцинированных
(108 ТЦД50) мышей, собак и кошек установлен методом заражения высоковиру-
лентным вирусом бешенства через 3 месяца после вакцинации. Полная защита у
кошек и собак наступала после введения небольшой дозы вакцины, равной
105 ТЦД50. ИмД50 для кошек и собак соответственно была равна 3,3 и 4,19 1g
ТЦД50. Такие рекомбинантные вакцины оказались неэффективными при ораль-
ном применении [1503].
Профилактика бешенства у инфицированных людей заключается в приме-
нении гипериммунного глобулина и курса вакцинации. Иммунный глобулин
против бешенства обычно применяют в дозе 20 UE/кг массы тела, половину вво-
дят вокруг места укуса, половину — внутримышечно. В США и многих развитых
странах используют две лицензированные адъювантные вакцины из вируса, раз-
множенного в культуре диплоидных клеток (HDCV вакцина) и первичной куль-
туре клеток почки обезьян резус (RVA вакцина). Вакцину в дозе 1 мл вводят вну-
тримышечно в дельтоидную область 5 раз в следующие дни — 0, 3, 7, 14 и 28; ес-
ли пациент был вакцинирован ранее, то иммунный глобулин не используют, а
применяют двукратную вакцинацию в 0 и 3 дни. Эти режимы специфической
профилактики сводят на нет смертность от бешенства [1135].
Для лиц высокого риска рекомендованы три внутримышечные дозы культу-
ральной вакцины с иммуногенной активностью не менее 2,5 IU в одной дозе,
введенной в 0, 7 и 28 дней. Иммунитет у привитых контролируют каждые 6 ме-
сяцев по титру ВНА. Бустеризацию проводят при снижении титра ВНА ниже 0,5
IU/мл. С лечебной целью используют культуральные вакцины или очищенные
вакцины из вируса, размноженного в эмбрионах уток.
Иммунизация стандартными антирабическими вакцинами защищает чело-
века и животных от заражения разными вирусами, родственными вирусу бешен-
ства, но не вирусом Мокола [113].
Эфемерная лихорадка крупного рогатого скота
Эфемерная лихорадка крупного рогатого скота — остропротекающее заболе-
вание, проявляющееся внезапным кратковременным повышением температуры
тела до 41 —42°С, воспалением слизистых оболочек головы и ригидностью мышц.
Заболевание в основном регистрируют в тропической Африке, Южной Азии и
Австралии. В естественных условиях вирус передается кровососущими насеко-
мыми (преимущественно комарами). Количество инфицированных животных в
некоторых стадах может достигать 80%, однако лишь у небольшой части из них
проявляется болезнь. ЭЛ характеризуется низкой смертностью (около 1%). Ви-
рус, по-видимому, размножается в эндотелии сосудов и накапливается в высо-
кой концентрации в лейкоцитах. Иммунитет у реконвалесцентов продолжается
1,5-2 года, а пассивный иммунитет у потомства — несколько месяцев.
Для специфической профилактики ЭЛ применяют живые и инактивирован-
ные вакцины. Инактивированные вакцины стоят дорого, а живые быстро теря-
ют иммуногенность в процессе аттенуации вируса.
Культуральная вакцина из аттенуированного штамма 1919, содержащая са-
понин и ГОА, после двукратного введения вызывала у крупного рогатого скота
образование ВНА (>1:45) и устойчивость к экспериментальному заражению. У
животных, вакцинированных в полевых условиях двукратно с интервалом 1 мес.,
иммунитет сохранялся в течение 1 года. В присутствии сапонина вирус быстро
терял инфекционность, и, по существу, применяемая вакцина являлась инакти-
вированным препаратом [1587].
Разработана рекомбинантная вакцина, экспрессирующая G белок вируса
эфемерной лихорадки.
Везикулярный стоматит (ВС)
Везикулярный стоматит (ВС) — остропротекающее заболевание крупного
рогатого скота, лошадей и свиней, проявляющееся лихорадкой и образованием
везикул на слизистой оболочке ротовой полости и безволосой части кожи (носо-
вое зеркало, соски, вымя и т. п.). Существуют два антигенно различных типа ви-
руса: Нью-Джерси и Индиана, у которых, в свою очередь, имеются соответст-
венно два и три антигенных подтипа. Перекрестный иммунитет между двумя се-
ротипами вируса выражен слабо. Вирус ВС хорошо размножается в различных
клеточных культурах, а также в КЭ. В качестве средства специфической профи-
лактики применяют инактивированную вакцину. Культуральный вирус, имею-
щий достаточно высокий титр (не ниже 7,0 1g БОЕ50/мл), инактивируют форма-
лином и добавляют адъювант. При введении вакцины коровам внутримышечно
двукратно в дозе 2 мл с интервалом 30 дней максимальный уровень гуморальных
антител (1:530) отмечали через три недели после второй прививки. Спустя 4 мес.
уровень гуморального иммунитета снижался до минимума [697].
Крупный рогатый скот с высоким титром ВН-антител часто подвергается ре-
инфицированию, что указывает на относительную роль антител. Это, возможно,
объясняется тем, что вирус в основном размножается в эпителии.
10.16. Филовирусы
Семейство филовирусов содержит два рода, которые не имеют названия.
Один включает вирус Марбург и подобные ему вирусы, другой — вирус Эбола и
подобные ему вирусы. Филовирусы, являясь возбудителями зоонозов, вызывают
вспышки тяжелых заболеваний людей с высокой смертностью и поэтому рас-
сматриваются как особо опасные возбудители. Однако экологические ниши и
природный хозяинный спектр филовирусов неизвестен.
Филовирусы, подобно всем (—)РНК вирусам с несегментированным гено-
мом, имеют общие характерискики: сходную организацию генома и один поря-
док генов; вирионную РНК полимеразу; спиральный нуклеокапсид; транскрип-
цию мРНК последовательным прерывистым синтезом от одного промотора; со-
зревание вирионов почкованием нуклеокапсидов через плазматическую
мембрану в местах, содержащих скопления вирусных гликопротеиновых пепло-
меров. Несмотря на сходство в организации генома и особенностей репликации
с другими представителями порядка Mononegavirales, они отличаются морфоло-
гически.
Вирионы филовирусов отличаются плеоморфностью и могут иметь нитевид-
ную, иногда разветвленную, или u-образную, или «6»-образную, или кольцевую
форму. Вирионы имеют диаметр 80 нм и варьируют в основном по длине (до
14 000 нм), но имеют один нуклеокапсид длиной -800 нм (Марбург) и -1000 нм
(Эбола). Длина вирионов коррелирует с инфекционностью. Пик инфекционно-
сти Марбург вируса связан с вирионами длиной около 790 нм, Эбола вируса —
970 нм (2561). Вирионы, размноженные в разных культурах клеток, имели в
среднем длину 860 нм (Марбург) и 1200 нм (Эбола).
Вирионы содержат спиральный рибонуклеопротеин, сложный нуклеокап-
сид с тесно примыкающей оболочкой (происходящей из плазматической кле-
точной мембраны), покрытой пепломерами длиной 10 нм. Нуклеокапсиды диа-
метром 50 нм с осевым пространством 20 нм в диаметре и спиральной периодич-
ностью 5 нм. Плавучая плотность вирионов равна 1,14 г/мл. Вирионы содержат
одну молекулу линейной одноцепочечной (—) РНК размером 19,1 тн, которая яв-
ляется неинфекционной и наиболее крупной из всех РНК вирусов с геномом не-
гативной полярности.
Геном филовирусов кодируют синтез 7 белков и имеет следующий порядок
генов от З'-конца до 5'-нетранслируемой области: КР(нуклеопротеин), VP35
(часть нуклеокапсида), VP40 (связанный с мембраной матриксный белок), GP
(гликопротеин), VP30 (часть нуклеокапсида), VP24 (связанный с мембраной бе-
лок), L (РНК-полимераза) [1135, 1367].
Гены разделены межгенными последовательностями или перекрывают друг
друга короткими участками 17—20 (оснований), где транскрипция получает
стартовый сигнал и, продвигаясь до концевого транскрипционного стоп-сигна-
ла, завершается. Эбола вирус имеет 3 перекрытия, которые альтернативны меж-
генным последовательностям, вирус Марбург имеет одно перекрытие [1367].
Филовирусы хорошо размножаются в клеточных культурах, таких как Vero,
быстро вызывают цитопатологию с образованием больших цитоплазматических
телец-включений. Вирионы проникают в клетку эндоцитозом и размножаются в
цитоплазме. Транскрипция начинается с одного промоторного сайта, располо-
женного на 3'-конце вирусного генома. В результате образуются моноцисторные
мРНК, т.е. отдельные мРНК для каждого белка. Это сопровождается консерва-
тивными транскрипциональными стоп- и старт-сигналами, расположенными на
границе каждого вирусного гена. Так как вирусная полимераза движется вдоль ге-
номной РНК, эти сигналы вызывают паузы, иногда замедляют и в конечном сче-
те прекращают транскрипцию (запинающаяся или стоп/старт-транскрипция). В
результате большинство мРНК кодируются генами, расположенными ближе к
промотору и в меньшей степени — более отдаленными генами. В результате экс-
прессии генов образуется большое количество структурных белков, таких как
Таблица 41. Гены филовирусов (от 3'-конца) и функция генных продуктов
Порядок расположения генов Генные продукты Функция белков М. масса (кф
1 Нуклеопротеин (NP) Окружение РНК 90-104
2 VP35 Кофактор в полимеразном комплексе 35
3 VP40 Матриксный белок, сборка вириона и почкование 35-40
4 Гликопротеин (GP) СРа=проникновение в клетку (поверхностный пепломер) SGPB, функция неизвестна 150-170 50-60
5 VP30 Инкапсикация РНК 27-30
6 VP24 Неизвестна 24-25
7 Полимераза (L) Транскрипция и репликация 270
а — гетеродимер GP1 — GP2
в — экспрессируется только вирусом Эбола (первичный генный продукт)
нуклеопротеин, и меньшее количество таких белков, как РНК-полимераза. Реп-
ликация генома опосредована синтезом полноразмерной комплиментарной
РНК, которая затем служит матрицей для синтеза вирионной РНК. Стоп/старт-
сигналы, необходимые для транскрипции, подавляются из-за бездействия вирус-
ной полимеразы, так как нуклеопротеин немедленно окружает вновь синтезиро-
ванные вирусные РНК. Созревание вирионов происходит при почковании сфор-
мированных нуклеокапсидов через плазматическую мембрану в местах, где
содержатся скопления вирусных гликопротеиновых пепломеров [1135, 1367].
Исследования по разработке инактивированной вакцины дали противоре-
чивые результаты. По данным одних авторов, вирус, инактивированный форма-
лином или теплом, при испытании на морских свинках или обезьянах не вызы-
вал иммунитета, несмотря на образование специфических антител у привитых
животных. Включение инактивированного у-лучами вируса Эбола в липосомы,
также не сопровождалось индукцией Т-клеточного ответа. Аттенуация вируса
традиционными методами не дала положительного результата из-за потенциаль-
ной возможности реверсии вирулентности. Попытки создания протективного
иммунитета препаратами, полученными на основе рекомбинантной ДНК-тех-
нологии также пока не дали обнадеживающих результатов [1367]. По данным
других авторов экспериментальная культуральная формолвакцина против виру-
сов Эбола и ласа после трехкратного введения защищала 50—100% низших обе-
зьян при экспериментальном заражении [22].
10.17. Борнавирусы
Вирус болезни Борна (ВББ) является единственным представителем рода и
семейства борнавирусы. Вирус болезни Борна распространен во всем мире и по-
ражает лошадей, овец, КРС, кошек, собак и страусов. Основными естественны-
ми хозяевами ВББ являются лошади и овцы, у которых он может вызывать не-
вралгические симптомы или даже летальную инфекцию. В большинстве случаев
заражение приводит к длительному носительству вируса без клинического про-
явления. У лошадей возможна вертикальная передача вируса. В естественных ус-
ловиях заболевание установлено у крупного рогатого скота и кошек. Спорадиче-
ские случаи заболевания отмечены у собак, мулов и других видов животных. В
экспериментальных условиях к вирусу чувствителен широкий круг филогенети-
чески различных животных: от птиц до грызунов и человекообразных приматов.
Серологические и молекулярно-эпидемиологические исследования показали,
что ВББ может инфицировать людей, вызывая нейропсихические нарушения. С
тех пор как было установлено, что ВББ вызывает заболевание ЦНС у многих ви-
дов позвоночных, он стал моделью при изучении персистентной вирусной ин-
фекции ЦНС [312, 374]. Так называемые ближневосточные энцефалиты неизве-
стной этиологии, возможно передающиеся клещами, во многих отношениях
сходны с борнанской болезнью [374]. Хотя межвидовая передача этого вируса не
доказана, следует иметь в виду, что он может быть зооантропонозом [987].
ВББ размножается в различных линиях клеток, полученных из невральных и
экстраневральных тканей без цитолиза клеток [574].
В культуре клеток вирус распространяется главным образом путем контакта
от клетки к клетке, вирус остается тесно связанным с инфицированными клет-
ками. Вирус может быть адаптирован к культуре клеток почки собаки и клеткам
Vero. Репликацию вируса в персистентно инфицированной культуре клеток
можно обнаружить методом ПЦР и меченых антител. Вирусный антиген выяв-
ляется внутри ядра [374, 574].
Вирионы представлены сферическими частицами диаметром 70—130 нм, ко-
торые содержат сердцевину (50—60 нм), покрытую оболочкой, обрамленной
пепломерами длинной около 7 нм. Вирионы устойчивы при рН=5,0—12,0 [574].
Геном ВББ представлен одной молекулой одноцепочной РНК негативной
полярности размером 8,9 тн, молекулярной массой ~Зх106 D. Он содержит 6 в
основном открытых рамок считывания и кодирует 6 белков. Гены обозначают в
соответствии с расположением с указанием молекулярной массы кодируемых
полипептидов (кД): р40, р24, pl 8, р16, р56 и р180. Полипептиды р40, р24 и р 16
соответственно представляют фосфопротеин (N), активатор транскрипции (Р) и
матриксный белок (М), которые входят в состав нуклеопротеина. Белок G 56 кД
является гликопротеином оболочки, белок М 180 кД является РНК зависимой
РНК полимеразой, белок 18 кД является гликопротеином [374, 574].
В отличие от других вирусов, входящих в порядок Мононегавирусы, транс-
крипция и репликация ВББ проходят в ядре клетки. Вирус обладает также нео-
бычной стратегией транскрипции. Геном транскрибируется в 6 первичных
транскриптов, два из которых модифицируются посттранскрипционным
сплайссингом, в результате чего образуется два дополнительных вида мРНК.
ВББ является уникальным среди РНК вирусов животных с нефрагментирован-
ным негативной полярности геномом тем, что его транскрипция и репликация
происходят в ядре клетки. Молекулы геномной и антигеномной РНК существу-
ют в ядре инфицированных клеток в виде инфекционных РНП. В отличие от
белка G вирусные белки N и Р синтезируются в больших количествах. Белки М
и G гликозилируются посттранскрипционно.
G-белок расщепляется посттранскрипционно клеточной протеазой с обра-
зованием белка GP-43, который участвует в образовании синцития при слиянии
клеток [374].
Инфекция не сопровождается четким иммунным ответом. Хотя имеет место
клеточная иммунологическая реакция. Антитела, индуцированные гликопротеи-
нами G и М, не обладают выраженной вируснейтрализующей способностью [574].
Были предложены инактивированные сорбированные формолвакцины про-
тив восточного, западного и венесуэльского энцефаломиелита для лошадей и
против венесуэльского энцефаломиелита для птиц. Аналогичные эксперимен-
тальные вакцины были предложены для людей, работающих в лабораториях с
этими вирусами.
Инактивированная вакцина против венесуэльского энцефаломиелита лоша-
дей (ВЭЛ), предназначенная для применения людям, создавала хороший имму-
нитет к североамериканскому, но не южноамериканскому варианту вируса.
Живая экспериментальная вакцина была испытана на лошадях и овцах, но
оказалась небезопасной [374]. Живая вакцина против ВЭЛ (ТС-83), предназна-
ченная для иммунизации людей и лошадей, является безопасной и умеренно
эффективной [737].
Существует мнение, что вакцинация при этом заболевании не является целе-
сообразной стратегией [987].
10.18. Ортомиксовирусы
Название семейства (от греч. orthos — правильный, глуха — слизь) предложе-
но в связи с родством его представителей к муцину.
Семейство ортомиксовирусы содержит 4 рода: вирусы гриппа А, В и С и то-
готовирусы. Вирусы гриппа А, В и С можно различить по антигенности нуклео-
капсидных (NP) и матриксных (М) белков. Вирусы гриппа А подразделяются на
субтипы на основе антигенной структуры и их гликопротеинов: гемагглютинина
(НА) и нейраминидазы (NA). Эти антигены весьма изменчивы, например, в на-
стоящее время у вирусов гриппа А птиц известно 15 вариантов антигена НА и 9
вариантов антигена NA. Число возможных вариантов этих двух антигенов может
достигать 135. Другими отличительными признаками вирусов гриппа А, В и С
является их природный хозяинный спектр. Вирусы гриппа А в естественных ус-
ловиях широко распространены среди птиц, людей и ряда других видов млеко-
питающих, включая свиней и лошадей. Неосложненный грипп у людей, лоша-
дей или свиней характеризуется интенсивной репликацией вируса в эпителиаль-
ных клетках респираторных путей, воспалением и внезапным проявлением
общей и респираторной болезни. Вирусы гриппа В инфицируют только людей.
Вирусы гриппа С были выделены в основном от людей, реже — от свиней и не
вызывали серьезных нарушений. В отличие от вирусов гриппа А и В, они не об-
ладают нейраминидазной активностью и содержат не два, а один гликопроте-
ин — белок слияния (гемагглютинин — эстераза, HEF). Вирусы гриппа А и В со-
держат по 8 РНК-сегментов, а вирус гриппа С — 7 (отсутствует ген NA). Виру-
лентность и антигенная изменчивость вирусов гриппа А, В и С снижаются в
алфавитном порядке их обозначения [1024].
Тоготовирусы переносятся клещами и размножаются в клещах и млекопита-
ющих.
Типичный представитель ортомиксовирусов — вирус гриппа типа А. Он име-
ет сферическую форму, диаметр вирионов 80—120 нм. В препаратах свежевыде-
ленных штаммов обнаруживают преимущественно нитевидные формы длиной
до 4 мкм. Высказано предположение, что филаментозные формы являются
мультигеномными образованиями [94].
Вирионы ортомиксовирусов состоят из фрагментированного нуклеокапсида
спиральной симметрии и липопротеиновой оболочки, представляющей собой
центральнорасположенный двойной липидный слой, окруженный снаружи и
изнутри белками. Белки наружного слоя образуют пепломеры длиной 10—12 нм.
Вирионы содержат около 1—2% РНК, 70% белка, 20% липидов, 5—8% углеводов.
Липиды оболочки происходят из липидов плазматической мембраны клеток.
Вирионы гриппа А и В морфологически неразличимы друг от друга, тогда как
вирионы гриппа С отличаются от других представителей семейства тем, что их
поверхностные пепломеры организованы в шестигранные фигуры. Вирусные
штаммы вирусов гриппа А и В, выделенные от человека или животных и размно-
женные в течение 1 пассажа в культуре клеток, обнаруживают высокую гетеро-
генность и плеоморфизм. Морфологические характеристики вируса гриппа А
носят генетический след, а также зависят от типа клеток, в котором они размно-
жены. Лабораторные штаммы вирусов гриппа А и В, размноженные в КЭ или
культурах клеток, приобретают вид сферических частиц и могут изменяться ан-
тигенно в результате мутации в ГА (замена трех аминокислот в ГА). Вирус, раз-
множенный в КЭ или в культуре клеток, защищает против культурального виру-
са более эффективно, чем против вируса, выделенного от человека [1154, 1664].
В составе вирусов гриппа А обнаружено семь полипептидов с молекулярной
массой 21—96 кД. Два гликопротеина (НА и NA) образуют наружный слой обо-
лочки: один негликозилированный белок (М) — внутренний слой оболочки; че-
тыре белка входят в состав нуклеокапсида. Пепломеры вирусов гриппа А и В,
представляющие наружный белковый слой вириона, образованы двумя глико-
протеинами — гемагглютинином (НА) и нейраминидазой (NA). Пепломеры ге-
магглютинина образованы тремя молекулами белка (210—240 кД), пепломеры
нейраминидазы образованы четырьмя молекулами белка (250 кД). В свою оче-
редь каждая молекула НА состоит из двух субъединиц (НА1 - 45-450 кД, НА2 —
30-35 кД).
Большинство вирионов гриппа А покрыто слоем примерно из 500 пепломе-
ров, радиально обрамляющих вирионы и выступающих на 10-14 нм над поверх-
ностью липидной оболочки. Различают пепломеры двух видов: палочкообраз-
ные — НА и грибообразные — NA. Соотношение НА и NA обычно равно 4:1—5:1.
Вирусы гриппа А, В и С кодируют также другой интегральный белок — соответ-
ственно М2, NB и СМ2- Матриксный белок (МД тесно примыкает к двойному
липидному слою и связан рибонуклеопротеиновой сердцевиной вируса. М] яв-
ляется наиболее массовым вирионным белком.
РНП состоит из 4 видов белка и РНК. Нуклеопротеин представлен преиму-
щественно белковыми субъединицами, покрывающими РНК: около 20 нуклео-
тидов приходится на 1 субъединицу НП. Связанный с РНП РНК-зависимый
РНК-полимеразный комплекс состоит из трех полимеразных белков РВ1, РВ2 и
РА, которые содержатся в количестве 30—60 копий на вирион. РНК вирусов
гриппа в РНП остается чувствительным к РНК-азе, чем отличается от РНК в
РНП вирусов парагриппа.
Сегменты генома вируса гриппа А кодируют следующие белки: сегмент 1 ко-
дирует белок РВ2; сегмент 2 — РВ1; сегмент 3 — РА; сегмент 4 — НА; сегмент 5 —
NP; сегмент 6 — NA; сегмент 7 — М( и М2; сегмент 8 — NS, и NS2 [919].
Участок связывания с клеточным рецептором представляет собой трехмер-
ную структуру в виде складки на поверхности НА у верхнего конца шипа в субъ-
единице НА1. Белок НА синтезируется изначально как молекула из 566 амино-
кислот, которая затем претерпевает ряд изменений. Важным моментом в про-
цессинге является протеолитическое расщепление НА с образованием двух
субъединиц НА1 и НА2. Образовавшийся димер НА1 — НА2 стабилизируется с
помощью «-спиральных участков и солевых мостиков, расположенных в стебле.
Расщепление НА с образованием двух цепей сопровождается конформационны-
ми изменениями белка и изменениями его антигенных и других свойств, в част-
ности способствует проявлению фузионной активности.
Вблизи С-конца НА вируса гриппа выявлена гидрофобная область, содержа-
щая около 25 аминокислот, которая погружена в билипидный слой. 10 амино-
кислот на С-конце НА проникают в нуклеокапсид вириона из билипидного
слоя. Пять из последних высококонсервативны и играют важную роль в функци-
онировании НА. Участок, проникающий из билипидного слоя внутрь вириона,
служит местом прикрепления жирных кислот.
В энзиматически активном тетрамере NA можно выделить четыре домена.
Цитоплазматический домен необычен среди трансмембранных гликопротеинов
тем, что представлен N-концевой аминокислотной последовательностью всего
лишь из шести аминокислот. Трансмембранный домен представлен неконсерва-
тивной последовательностью приблизительно из 28 гидрофобных аминокислот.
Основная часть нейраминидазы выступает над поверхностью вириона и состоит
из двух доменов: короткого спирального стебля возле мембраны и большой гло-
булярной головки, лежащей на расстоянии от поверхности вириона. Каталити-
ческий участок этого белка расположен возле поверхности глобулярного домена.
Типичная NA имеет четыре сайта гликозилирования, расположенных в «стебле».
NA разрушает клеточные рецепторы, освобождая таким образом вирусное по-
томство с поверхности клетки, и препятствует самоагрегации вирионов. NA так-
же облегчает прохождение вируса сквозь муцин при естественной инфекции.
Вирулентность вируса гриппа определяется последовательностью основных
аминокислот в сайтах протеолитического расщепления гемагглютинина, т.е. его
первичной и вторичной структурой [1233].
Вирулентные штаммы вируса гриппа, в отличие от невирулентных, обяза-
тельно активизируются за счет расщепления протеазами. Гемагглютинины виру-
са гриппа расщепляются внутриклеточно и потому способны инфицировать
клетки различных тканей и вызывать системную инфекцию [1450]. Ортомиксо-
вирусы с нерасщепленным НА имеют низкую инфекционную активность. Ин-
фекционная форма вируса с расщепленным НА в организме млекопитающих об-
разуется только в клетках, выстилающих дыхательный тракт [1624]. При отсутст-
вии трипсина в культуре клеток расщепляется НА только вирулентных штаммов
вируса [875]. Для вируса гриппа птиц установлена строгая корреляция между
расщепляемостью НА, способностью размножаться в культуре клеток и патоген-
ностью для кур. Расщепление НА на субъединицы не является обязательным для
сборки и выхода вирионов из клетки и проявления гемагглютинирующей актив-
ности. Полагают, что фактором, детерминирующим патогенность вируса гриппа
птиц, является чувствительность НА к протеолитическому расщеплению.
В сайте расщепления НА у вирулентных штаммов содержится несколько ос-
новных аминокислот, а у невирулентных — только один остаток аргинина. Та-
ким образом, только участок из нескольких основных аминокислот у С-конца
НА образует сайт узнавания для ферментов, ответственных за расщепление
[875, 1624].
Основные функции НА: гемагглютинирующая активность вируса; прикреп-
ление вирионов к клеткам-мишеням путем связывания с сиалосодержащими ре-
цепторами; слияние вирусной и клеточной мембран. НА является основным
специфическим антигеном вируса, определяющим (наряду с NA) подтип и вы-
зывающим образование антител, нейтрализующих инфекционность вируса и его
ГА-активность. НА играет главную роль в индукции протективного иммунитета
при гриппе. В молекуле НА имеются 3—4 антигенных домена, изменения в кото-
рых определяют антигенный дрейф [81]. NA является ферментом, катализирую-
щим отщепление сиаловой кислоты от субстрата. Удаление сиаловой кислоты с
НА облегчает его расщепление клеточными протеазами. Антитела к белку NA
имеют вспомогательное значение в защите и нейтрализуют вирус лишь при вы-
соком титре. Матриксный белок М — самый низкомолекулярный структурный
белок. Он принимает участие в морфогенезе вириона и стабилизации его струк-
туры. Нуклеопротеид (NP) — основной внутренний белок, формирующий субъ-
единицы капсида. Белки NP и М являются типоспецифическими антигенами,
общими для всех вирусов гриппа одного типа, и в этом отношении резко отли-
чаются от высокодивергентных поверхностных белков [1132]. Они не вызывают
образования протективных антител. Однако нуклеопротеин вируса гриппа — ос-
новной антиген, узнаваемый цитотоксическими Т-лимфоцитами. Аминокис-
лотные последовательности 260—283 нуклеопротеина вируса гриппа А являются
индукторами Т-клеточного ответа [694]. Изменение антигенных свойств вируса
гриппа — результат двух генетических процессов: антигенных дрейфа и шифта.
Антигенный дрейф происходит в основном через накопление аминокислотных
замен (точечных мутаций) в НА1. Замена одного аминокислотного остатка в
эпитопе нарушает его связывание с соответствующими МАТ. Основные меха-
низмы антигенного шифта — реассортация отдельных генов, возвращение в по-
пуляцию старых генов, прямые мутации, изменяющие специфичность к хозяи-
ну. NA может измениться независимо от НА. Вариабельность НА вируса гриппа
А значительно выше вариабельности НА вируса гриппа В.
В процессе адаптации вируса гриппа к различным системам наблюдают из-
менение антигенной структуры НА, в основе которой лежит селекция мутантов
с измененной рецепторсвязывающей специфичностью. Вирусы гриппа А и В че-
ловека, размноженные в КЭ, могут изменяться антигенно и претерпевать мута-
ции в ГА (замена трех аминокислот в ГА). Вирус, размноженный в КЭ или в куль-
туре клеток, защищает против культурального вируса более эффективно, чем
против полевого вируса, выделенного от человека [1154, 1664].
Один и тот же клинический изолят вируса гриппа при размножении в куль-
туре клеток животных (МДСК) или в КЭ имеет разные антигенные свойства, что
связано с заменой одной-двух аминокислот в разных участках молекулы НА.
Особенно заметные изменения антигенности в молекуле НА наблюдали при за-
мене аминокислотных остатков 187 и 189 в процессе адаптации вируса к КЭ
[1312]. Изменение сайта гликозилирования может сопровождаться изменением
антигенности и вирулентности вируса. Состав углеводов гемагглютинина виру-
сов и гриппа птиц может изменяться в различных хозяйских клетках даже в те-
чение одного пассажа. У вирусов гриппа птиц типа А идентифицировано девять
нейраминидазных N-антигенов, обозначенных 1—9, и 13 гемагглютинирующих
антигенов Н, обозначенных 1-13. Состав Н- и N-антигенов полевых изолятов
зависит от вида птиц, места и времени вспышек гриппа. Свиньи восприимчивы
к различным подтипам вируса гриппа А и, возможно, вместе с водоплавающей
птицей являются главным резервуаром вируса гриппа в природе.
В пермиссивных клетках вирусный НА активируется путем расщепления на
две части НА1 и НА2, которые остаются связанными дисульфидными связями.
Вирионы прикрепляются к клеткам, активированным НА, соединяются с рецеп-
торами сиаловой кислоты плазматической мембраны и входят в клетку эндоци-
тозом. После сплавления оболочки вируса и эндоплазматической мембраны
транскрипционный комплекс освобождается и транспортируется в ядро, где
происходит транскрипция и репликация РНК.
Так же, как у всех других вирусов с негативно-полярным РНК-геномом, ге-
ном ортомиксовирусов выполняет две функции: 1) матричную для синтеза
мРНК и 2) матричную для синтеза позитивно-полярной промежуточной формы
РНК, которая служит матрицей для синтеза потомства геномной РНК. Из 8 пер-
вичных транскриптов, синтезированных на 8 генных сегментах вирусов гриппа
А и В, 6 являются моноцисторными и транслируются прямо в белки. Два дру-
гих — подвергаются сплайсингу с образованием двух мРНК, которые транслиру-
ются с различных рамок считывания с образованием двух белков. Вирусные бел-
ки синтезируются, используя клеточный механизм трансляции. Ортомиксови-
русы используют несколько механизмов для увеличения кодирующей
способности: сплайсинг мРНК, спаренную стоп-старт-трансляцию тандемных
генов и сдвиг рамки считывания.
Репликация геномных РНК сегментов требует синтеза полноразмерных, по-
ложительной полярности РНК посредников, которые, в отличие от соответству-
ющих мРНК транскриптов, не имеют КЭП-структуры на 5'-конце и поли (А)
последовательности на З'-конце. Вновь синтезированный нуклеопротеин при-
соединяется к этим РНК, облегчая их использование в качестве матрицы для
синтеза геномной РНК. Вирионы формируются почкованием, включая М белок
и нуклеокапсид, которые встроены на плазматической мембране, в которую
включены НА и NA. Механизмы копирования каждого РНК сегмента и включе-
ние их в каждый вирион неизвестны [919].
Хотя в результате реассортации генов теоретически могут возникать вирусы
с любой комбинацией Н и N генов, однако только ограниченное число вирусов
с определенной комбинацией Н и N генов оказались важными патогенами, име-
ющими право на существование. В том числе вызывающие респираторную пато-
логию у людей: H1N1, H2N2, H3N2, H5N1 и, возможно, H3N8; у лошадей H7N7
и H3N8; у норок H10N4; у котиков H7N7 и H4N5; вирусы, часто выделяемые от
свиней - H1N1 и H3N2. Главными возбудителями гриппа птиц являются виру-
сы с H5N2 и H7N1, хотя встречаются и другие варианты вируса гриппа А. Так как
установлена резистентность диких видов птиц к вирусу гриппа А, им отводили
роль резервуара вируса, прежде всего для домашней птицы. При эксперимен-
тальном заражении вирусом H1N5 дикие утки, как правило, не проявляли кли-
нических признаков болезни, хотя вирус в их организме размножался и выделял-
ся во внешнюю среду. Латентное инфицирование вирусом гриппа может иметь
место у других домашних и диких животных.
С целью специфической профилактики гриппа человека и животных пред-
ложены различные вакцины. В практике борьбы с гриппом человека широко
применяли три вида инактивированных вакцин [189]: вирионные, представляю-
щие собой взвесь цельных вирионов; расщепленные - взвесь структурных ком-
понентов после разрушения детергентами; субъединичные вакцины, содержа-
щие только протективные антигены — гемагглютинин и нейраминидазу.
Многие коммерческие вакцины фактически относят к смешанному типу, по-
скольку они содержат и цельные вирионы, и их структурные компоненты. Про-
мышленным способом получают две вирионные вакцины, различающиеся спо-
собом очистки и концентрирования вируса: с использованием для этой цели ме-
тодов хроматографии и центрифугирования.
Результаты испытания инактивированных вакцин против гриппа человека
весьма разноречивы. Если оценивать по уровню индукции гуморального имму-
нитета, то наиболее иммуногенны высокоочищенные цельновирионные кон-
центрированные инактивированные вакцины.
К основным недостаткам цельновирионных инактивированных вакцин,
применяемых в медицине, относится определенная реактогенность, связанная с
примесными компонентами аллантоисной жидкости куриных эмбрионов и вну-
тренними антигенами вириона (М- и NP-белки). Субъединичные вакцины ока-
зались слабоантигенными [145].
Инактивированные вакцины по сравнению с живыми вызывают более выра-
женное образование гуморальных антител, но значительно слабее стимулируют
развитие местного иммунитета. По этой причине многие исследователи отдают
предпочтение применению живых вакцин против гриппа, полагая, что они зна-
чительнодешевле и вызывают как гуморальный, так и местный (клеточный и се-
креторный) иммунитет. Живые вакцины наиболее пригодны для иммунизации
детей, у которых нет антител, способных нейтрализовать вакцинный вирус.
При введении вакцинированным добровольцам вирулентного вируса живая
вакцина защищала от заболевания всех, а инактивированная — только 72% приви-
тых. Приживление вирулентного штамма вируса после контрольного заражения
обнаружено у 13% лиц, привитых живой, и у 63% - инактивированной вакциной.
Гуморальные и секреторные антитела обнаружены соответственно у 94 и 38%
привитых инактивированной вакциной и у 59 и 82% - живой. При заражении
людей гомологичным вирулентным вирусом через 6 мес. после иммунизации
живой и инактивированной вакцинами защитный эффект отмечен соответст-
венно в 91 и 75% случаев.
Установлено, что в иммунитете при гриппе важная роль принадлежит стиму-
ляции Т-лимфоцитам, распознающим вирусспецифические белки на поверхно-
сти инфицированных клеток. Установлено, что белок М-2 вируса гриппа обна-
руживают на поверхности инфицированных клеток, этот белок является наибо-
лее консервативным белком, характерным для всех вирусов гриппа. Учитывая,
что этот белок может быть главной мишенью для перекрестно реагирующих ци-
тотоксических Т-клеток, сконструирована рекомбинантная вакцина против ви-
русов гриппа и гепатита В.
В последнее время большое внимание уделяют разработке и оценке живых
рекомбинантных вакцин, полученных на основе вирусов гриппа А птиц и чело-
века. Вирусы гриппа А птиц использовали в качестве доноров аттенуации.
От вируса гриппа А человека брали гены, кодирующие гемагглютинин и ней-
раминидазу. Такие рекомбинанты обнаружили удовлетворительную степень ат-
тенуации, генетическую стабильность и выраженную иммуногенность, они не
размножались в нижних отделах респираторного тракта обезьян и птиц. Реас-
сортантный штамм не обладал энтеротропизмом и в опытах на обезьянах не пе-
редавался горизонтально. Аттенуированный фенотип сохранялся в течение пяти
серийных пассажей на обезьянах.
Реассортантные холодоадаптированные вакцины, разработанные в бывшем
СССР и США, оказались безопасными, генетически стабильными и высокоэф-
фективными. Одновременное введение вакцин H1N1 и H3N2, полученных в про-
цессе реассортации разных эпидемических вирусов с одним и тем же донором ат-
тенуации, не сопровождалось интерференцией и в то же время обеспечивало об-
разование антител и защиту от обоих типов вируса. Такие вакцины обладают
выраженной эффективностью для детей. Для защиты взрослых людей необходимо
использовать иммунизацию живой, а затем инактивированной вакцинами [42].
А. А. Смородинцев и сотрудники [178] разработали способ сочетанной вак-
цинации людей живой и инактивированной вакцинами, при котором происхо-
дит одновременная стимуляция местного и общего клеточного и гуморального
иммунитета. Высокая иммунологическая реактивность при сочетанной иммуни-
зации всегда соответствовала высокому защитному эффекту. Иммунизация се-
ронегативных людей вначале живой вакциной, а затем нереплицирующимися
антигенами в сочетании с иммуностимуляторами, вероятно, является наиболее
эффективным способом профилактики гриппа.
Резервуаром вирусов гриппа А являются водоплавающие птицы, особенно
утки, у которых вирус размножается в эпителии кишечника и экскретируется в
высокой концентрации с фекалиями. Мигрирующие водоплавающие птицы пе-
реносят вирус на большие расстояния, что может играть ключевую роль в эволю-
ции вируса. Периодически происходит обмен вирусными генами или вирусами
между разными видами: домашней птицей, особенно утками и млекопитающи-
ми, такими как свиньи, лошади, норки и человек. Вирусы гриппа патогенны для
животных, но очень редко становятся зоонотичными, т.е. прямо от животных
передаются человеку.
Все вирусы гриппа млекопитающих, возможно, произошли от вирусов, цир-
кулирующих среди водоплавающих птиц. Вирусы, передаваемые млекопитаю-
щим и птицам от диких водоплавающих птиц, послужили причиной вспышек
заболевания в последние годы. Однако в экспериментальных условиях вирусы,
полученные от одних видов животных, нереплицируются у других видов. Напри-
мер, вирусы гриппа человека не размножаются у уток и лошадей, а вирусы грип-
па птиц не размножаются у человека и других приматов. Это показывает, что раз-
множение вирусов ограничивается кругом хозяев. Главная роль в этом процессе
принадлежит гемагглютинину, а также наличию вируса на клетках хозяина [838].
В последнее время эпидемии гриппа были связаны с вирусами гриппа подти-
па H1N1, H3N2 или вирусом гриппа В. С 1996 г. вирусы подтипов H7N7, H5N1 и
H9N2 были переданы от птиц человеку, но не смогли распространиться в попу-
ляции людей. Вирус гриппа птиц A H5N1 был выделен от ребенка, погибшего с
патологией респираторных органов [670]. Такие события происходят редко. Ре-
ассортация вирусов человека и птиц может осуществляться в их общих хозяевах,
в частности свиньях. Полагают, что последние участвуют в межвидовой переда-
че вирусов гриппа и таким образом в популяцию человека попадает вирус подти-
па H1N1[233],
Грипп кур отмечен в США в 1983 и 1984 гг. [874]. Во второй половине прошло-
го века вспышки гриппа кур имели место в России [206]. Вспышка гриппа норок
была зарегистрирована в Швеции примерно в тот же период. Возбудителем ее
оказался вирус гриппа A H10N4. Случаи заболевания людей вирусом гриппа птиц
A H5N1 в Гонконге поставили задачу защиты людей от вируса гриппа птиц [206].
Грипп птиц (чума птиц)
Грипп птиц (чума птиц) — остропротекающая контагиозная болезнь, харак-
теризующаяся поражением органов дыхания и пищеварения. Заболевание мо-
жет проявляться, начинаясь с незначительных клинических симптомов до ис-
ключительно острой формы с высокой заболеваемостью и летальностью. Кроме
кур, грипп поражает индеек. Утки и другие виды водоплавающей птицы устой-
чивы даже к самым высокопатогенным штаммам вируса, хотя могут быть виру-
соносителями. Предполагается, что дикие утки не только являются переносчи-
ками инфекции, но и ее резервуаром. Сезонные миграции диких птиц вызывают
сезонные вспышки заболевания среди домашней птицы [780].
Вирус гриппа птиц обладает выраженной антигенной активностью и инду-
цирует синтез нейтрализующих, преципитирующих комплементсвязывающих и
подавляющих гемагглютинацию антител. Специфическую профилактику грип-
па птиц осуществляют с помощью живых и инактивированных вакцин.
Основная проблема, с которой сталкиваются при необходимости вакцина-
ции против гриппа птиц, — разнообразие существующих антигенных вариантов
вируса.
Вирус гриппа птиц H5N2 оказался причиной эпизоотии гриппа кур в неко-
торых штатах США в 1983—1984 гг. [874].
Вспышки даже сравнительно слабой формы гриппа индеек в США вызыва-
ли огромные потери. Для вакцинации цыплят и индюшат применяли моно- и
поливалентные эмульгированные вакцины. Применение инактивированной
вакцины наряду с другими мерами дало возможность ликвидировать эпизоотию
гриппа птиц в промышленных стадах кур и индеек ряда штатов США. Эффек-
тивность инактивированной эмульгированной вакцины повышалась с возрас-
том прививаемой птицы. Для получения выраженного иммунного ответа у 20-
недельных кур требовалась однократная вакцинация, а у 12-недельных — дву-
кратная. Прививка 1—3-дневных цыплят сопровождалась менее напряженным
иммунитетом. При увеличении дозы вакцины у однодневных цыплят можно бы-
ло получить такой же иммунитет, как у 4-недельных цыплят [1464].
Инактивированная вакцина против гриппа птиц Н5 создавала хорошую за-
щиту у цыплят (ИД50=0,06 мкг вирусного антигена) при заражении вирулент-
ным гомологичным вирусом, но полностью не предотвращала его размножения
и выделения с секретами и экскретами [1479]. Широкое применение в Мексике
и Пакистане инактивированных гомологичных вакцин показало, что они пре-
дотвращают развитие у привитой птицы заболевания и снижают интенсивность
выделения возбудителя во внешнюю среду из организма [1481].
Авирулентные штаммы вируса гриппа птиц испытывали на цыплятах. В ка-
честве живых вакцин использовали нейраминидазо-специфические вакцины.
При разработке таких вакцин исходили из положения о более длительном посто-
янстве антигена нейраминидазы по сравнению с гемагглютинином.
Птица, иммунизированная живыми вакцинами, содержащими подтипы
нейраминидаз N1 и N8, оказалась устойчивой к заражению вирулентным штам-
мом вируса, имеющим аналогичную структуру нейраминидаз, независимо от
подтипа гемагглютинина. Преимущество использования N-специфических вак-
цин состоит в том, что они не мешают серологической диагностике с помощью
РТГА. Наличие перекрестного иммунитета между вирусами подтипов Н1 и Н5
весьма ценно, поскольку высоковирулентные вирусы гриппа птиц, выделенные
в мире, относятся к подтипу Н5 или Н7.
Против гриппа птиц разработаны рекомбинантные вакцины, в которых в ка-
честве вектора использованы вирусы инфекционного ларинготрахеита или оспы
кур [991]. В них встроены гены гемагглютининов Н5 и Н7. К сожалению, данной
вакциной можно прививать только кур, т.к. в организме индюшек эти вирусы
размножаются. Кроме того, наличие у прививаемой рекомбинантной вакциной
птицы антител к вирусам-векторам снижает ценность таких вакцин. Достоинст-
вом рекомбинантных вакцин против гриппа птиц является отсутствие индукции
антител к нейраминидазе, что обеспечивает дифференциацию инфицированных
вакцинированных птиц [206].
Сравнивали иммуногенность трех вакцин: инактивированную цельновири-
онную и две рекомбинантных вакцины на основе бакуловируса или вируса оспы
птиц, экспрессирующие ГА Н5. Вакцины готовили и проверяли из вирулентных
гомологичных вирусов с четырех континентов от 6 видов птиц. Все вакцины за-
щищали 30—70% цыплят от болезни и 60—87% от гибели, а также снижали коли-
чество вирусоносителей [1480].
Грипп свиней
Грипп свиней причиняет значительный экономический ущерб, особенно в
период тяжелопротекающей болезни. Болезнь вызывает вирус типа А или один
из вирусов гриппа человека H3N2. Вирус гриппа человека H3N2 легко передает-
ся свиньям, а вирус гриппа H1N1 свиней представляет большую опасность для
человека. Для иммунизации свиней предложено несколько инактивированных
вакцин, обеспечивающих умеренный иммунитет. Свиньи, привитые дважды,
приобретали устойчивость к экспериментальному заражению.
Свиньи, экспериментально иммунизированные вирусом H1N1, были устой-
чивы к реинфицированию гомологичным вирулентным вирусом, тем не менее
это сопровождалось повышением титра антител в носовых секретах. Число кле-
ток, секретирующих IgG и IgA в слизистой оболочке носа, было значительно вы-
ше, чем в других тканях. Однако клетки, секретирующие гаммаинтерферон, в
основном находились в селезенке и трахеобронхиальных лимфоузлах [928]. В
случае возникновения заболевания рекомендуют проводить поголовную вакци-
нацию свиней.
Грипп лошадей
Грипп лошадей широко распространен в разных странах, за исключением
Австралии. Заболевание вызывает вирус гриппа A: H7N7 и H3N8. Заметная за-
щита получена при использовании инактивированной вакцины с адъювантом
ISCOM. Иммунитет связан с антителами против ГА [1125, 1699].
Однако термочувствительные реассортанты вируса гриппа человек/лошадь
создавали защиту у вакцинированных лошадей независимо от антител к ГА [795].
Инактивированная вакцина может включать два вируса A: H7N7 и H3N8, а
также полевые изоляты вируса. В качестве адъюванта используют минеральное
масло, полимеры или сапонин. Схема вакцинации зависит от риска. Например,
в ряде случаев лошадей ревакцинируют каждые 3—9 месяцев.
10.19. Буньявирусы
Семейство буньявирусов включает четыре рода: бунья-, флебо-, наиро- и
ханта-вирусы. В состав семейства входят более 300 вирусов, передаваемых кро-
вососущими членистоногими, преимущественно комарами. Буньявирусы вызы-
вают заболевание у животных и человека. Так, вирусы лихорадки долины Рифт и
болезни Найроби являются этиологическими агентами остропротекающих
трансмиссивных болезней овец, коз, крупного рогатого скота в Восточной и
Южной Африке.
Род буньявирусы содержит 18 серогрупп и не меньше 160 вирусов. Прото-
типным является вирус Акабане. Род включает более чем 30 вирусов, патогенных
для домашних животных и людей.
Род хантавирусы содержит 22 вируса, которые передаются персистентно ин-
фицированными грызунами.
Род флебовирусы содержит две серогруппы, включающих более 50 вирусов,
передающихся песчанками или комарами. Прототипным вирусом является ви-
рус долины Риф.
Род наировирусы включает семь серогрупп и по крайней мере 33 вируса.
Прототипным является вирус болезни Найроби овец.
Вирионы буньявирусов — сферические оболочечные образования диаметром
80—120 нм. Они состоят из нуклеокапсида спиральной симметрии и липопроте-
иновой оболочки толщиной 10—12 нм. На поверхности оболочки имеются ха-
рактерные гликопротеиновые выступы длинной 5—10 нм, которые пронизывают
двуслойную липидную оболочку толщиной 5—7 нм.
В центре вириона находятся три циркулярных спиральных нуклеокапсидных
сегмента, которые соединены между собой нековалентными связями между 3' и
5'-концами каждого PH К-геномного сегмента. Концевые последовательности
идентичны для всех трех РНК сегментов у всех членов каждого рода, но различа-
ются у разных родов.
На один вирион приходиться 270—1400 пепломеров, которые состоят из ге-
теродимеров вирусных гликопротеинов G1 и G2, хотя небольшая часть поверх-
ностных субъединиц флебовирусов состоит из гомодимеров. Гомодимеры, воз-
можно, содержатся в вирионах других родов. Флебовирусы покрыты округлыми
тесноуложенными морфологическими единицами 10—11 нм в диаметре с цент-
ральной полостью диаметром ~5 нм.
В отличие от других РНК-содержащих оболочечных вирусов, и представите-
лей семейства буньявирусов нет мембранного (матриксного) белка и белок нук-
леокапсида непосредственно прилегает к внутренней поверхности двойного ли-
пидного слоя.
В вирионах буньявирусов содержится 58—70% белка, 20—33% липидов, 7%
углеводов и 1—3% РНК. У них обнаружено три основных белка, два из которых
гликопротеины (табл. 42). Гликопротеины G1 и G2 располагаются на поверхно-
сти вирионов и образуют выступы, которые можно удалить с помощью обработ-
ки протеолетическими ферментами. Инфекционность вирионов с разрушенны-
ми выступами резко снижается. Полагают, что гликопротеины буньявирусов
принимают непосредственное участие в адсорбции вируса на чувствительных
клетках. Основной белок нуклеокапсида буньявирусов — негликозилированный
полипептид N, который тесно связан с РНК. В вирионах буньявирусов и укуви-
русов обнаружено незначительное количество высокомолекулярного белка L,
ассоциированного с нуклеокапсидом вирионов, который, возможно, является
компонентом транскриптазы. В вирионах вируса Лакросс определено содержа-
ние каждого структурного белка. На один вирион приходится 2000—2500 моле-
кул белка N, 20—40 — белка L, по 600—700 молекул гликопротеинов G1 и G2.
Гликопротеины G1 и G2 являются специфическими антигенными детерми-
нантами, вызывающими образование нейтрализующих антител [1438]. Эпито-
пы, индуцирующие ВН-антитела, содержатся в Gin G2, однако защитным
действием in vivo обладали лишь антитела к G2 [1687]. На каждом из гликопро-
теинов идентифицировано по четыре антигенных домена. Домены I, II и IV бел-
ка G1 и домен II белка G2 участвуют в процессах нейтрализации и гемгглю-
тинации. Эпитопы 1а белков G1 и G2 обладают сильной комплементнезависи-
мой нейтрализацией. Эпитопы 1а, Пв на G1 и 1а, Па на G2 проявляли
протективное действие у иммунизированных мышей при заражении их виру-
лентным вирусом лихорадки долины Рифт [329]. Антигенные участки, актив-
ные в РИГА, являются группоспецифическими, а активные в PH — видоспеци-
фическими. Изоляты вируса лихорадки долины Рифт, выделенные во время
эпидемий в Египте в 1977 г. и в Мавритании в 1987 г., отличались между собой в
антигеном отношении.
Вирионы содержат три одноцепочечных РНК-геномных сегмента: боль-
шой - L (6,3—12 тн), средний — М (3,5—6,0 тн) и малый — S (1,0—2,2 тн). Все три
генных сегмента вируса имеют одинаковые комплементарные нуклеотиды на 3'
и 5'-концах. Концевые нуклеотидные последовательности высоко консерватив-
ны у вирусов одного рода и отличаются от таковых у вирусов другого рода.
РНК сегменты соединяются с N-белком и формируют индивидуальные L, М
и S нуклеокапсиды, которые, по-видимому, являются спиральными. По крайней
мере, один из L, М и S рибонуклеокапсидов должен содержаться в инфекцион-
ном вирионе.
L РНК кодирует один большой белок РНК-зависимую РНК полимеразу
(транскриптазу). РНК кодирует полипротеин, который расщепляется на два гли-
копротеина (G1 и G2) и неструктурный протеин (NSm). S РНК кодирует нукле-
окапсидный (N) белок и неструктурный (NSS) белок - стратегия трансляции ко-
торого отличается у представителей различных родов. N и NSS белки образуют-
ся в результате котрансляционного процессинга.
По стратегии кодирования S РНК флебовирусы отличаются от вирусов с не-
гативной РНК. S РНК кодирует N и NSs белки, которые транслируются с от-
дельных субгеномных мРНК. N-протеин кодируется половиной 3' участка S
РНК, обычно эта мРНК транскрибируется с геномной PH К в качестве матрицы;
однако NSS белок, занимающий половину 5' участка той же самой S РНК,
транскибируется в комплиментарную РНК и транслируется только после синте-
за полноразмерной S РНК (круговая кодирующая стратегия). Вирусы, относя-
щиеся к разным родам, различаются размером 4 главных вирусных белков: L-бе-
лок (РНК-зависимая РНКполимераза) имеет молекулярную массу 150—200 кД;
N-белок (нуклеопротеин) — 25—50 кД; G1 и G2 — 40—120 кД. Состав вирионных
липидов отражает состав мембран клеток, используемых для их размножения.
Буньявирусы хорошо размножаются во многих культурах клеток млекопита-
ющих (ВНК-21, Vero и др.) и москитов (A. albopictus). Хантавирусы не размножа-
Таблица 42. Структурные белки буньявирусов [342]
Род Молекулярная масса белков, кД
L G1 G2 N
Буньявирус 145-200 108-120 29-41 19-25
Флебовирус 150-200 55-70 50-60 20-30
Наировирус 200 85-95 30-40 48-60
Хантавирус 145-200 75 65 20-25
ются в культуре клеток москитов. Буньявирусы обладают цитолитическим дей-
ствием в культуре клеток млекопитающих (исключение составляют хантавирусы
и некоторые наировирусы), но не в культуре клеток беспозвоночных. Большин-
ство вирусов также размножаются с высоким титром в мозге мышей-сосунов.
Вирус внедряется в клетки путем эндоцитоза, а все последующие стадии репли-
кации происходят в цитоплазме. Так как вирусный геном представлен одноцепо-
чечной негативной РНК, первым этапом репликации после внедрения в клетку,
депротеинизации вирионов и активации РНК полимеразы является транскрип-
ция вирионных мРНК на каждой из трех вирионных РНК. Так как у флебовиру-
сов 5' половина S РНК не транскрибируется непосредственно, мРНК для NSS
белка транскрибируется вслед за синтезом полноразмерной комплементарной
РНК. РНК полимераза обладает также эндонуклеазной активностью, отщепляет
5' метилированные КЭП-структуры от хозяинных мРНК, добавляя их к вирус-
ным мРНК для первичной транскрипции (так называемое срывание КЭП-
структуры). После первичной транскрипции и трансляции вирусной мРНК про-
исходит репликация вирионной РНК и второй раунд транскрипции, амплифи-
кации (особенно структурных белков для сборки вирионов). Вирионы созревают
почкованием через внутрицитоплазматические везикулы, связанные с комплек-
сом Гольджи, транспортируются через цитоплазму и освобождаются экзоцито-
зом через базолтеральную плазматическую мембрану. Вирусы внутри рода связа-
ны антигенно, но не с вирусами других родов. Генетическая реассортация имеет
место, когда культура клеток или москиты инфицируются одновременно тесно
связанными буньявирусами, что, вероятно, играет роль в эволюции вирусов се-
мейства в природе [1135].
Лихорадка долины Рифт (ЛДР)
Лихорадка долины Рифт (ЛДР) — (энзоотический гепатит крупного рогатого
скота) — преимущественно остропротекающая болезнь, сопровождающаяся ви-
ремией, сильной лихорадкой, некротическим гепатитом, гиперемией слизистых
оболочек. Заболевание поражает овец и крупный рогатый скот. У молодых жи-
вотных оно сопровождается высокой летальностью, у взрослых — абортами. Рас-
пространено главным образом в странах Африканского континента и периоди-
чески протекает в виде эпизоотий с поражением людей. Например, в 1977 г. во
время вспышки заболевания в Египте заболело 200000 людей, из которых 600
погибли [1311]. Переболевание или скрытое инфицирование сопровождается
развитием выраженного иммунитета.
Попытка иммунизировать овец и крупный рогатый скот против ЛДР впервые
была предпринята более 60 лет назад, когда вирулентный штамм вируса был атте-
нуирован внутримозговыми пассажами на мышцах. Нейротропный штамм виру-
са (92-й пассаж) был авирулентным для мышей, обезьян и овец в случае подкож-
ного введения, но при внутримозговом введении вызывал гибель овец и обезьян.
В связи с тем, что нейротропный мышиный штамм у некоторых овцематок
вызывал аборты, его дополнительно пассировали 50 раз в куринных эмбрионах
и 16 раз на мышах. Однако это привело к ослаблению иммуногенности вакцин-
ного штамма. В дальнейшем вакцину готовили из вируса 102-го пассажа на мы-
шах, размноженного в культуре клеток ВНК-21. Практически все овцы и скот,
привитые этой вакциной, приобрели иммунитет к естественному заражению.
Живую лиофилизированную вакцину готовили в больших количествах (десятки
миллионов доз). Она экономична и вызывает длительный иммунитет у овец и
крупного рогатого скота после однократного введения. Частичный иммунитет
образуется через 6—7 дней, потомство вакцинированных животных сохраняет ус-
тойчивость к заражению вирусом ЛДР примерно в течение 5 месяцев. У янгят,
привитых в возрасте до 6 недель, иногда развивался энцефалит.
Вакцинация в редких случаях вызывала аборты у овцематок или аномальное
развитие плодов [37].
В целях дальнейшего совершенствования живых вакцин использованы дру-
гие подходы получения аттенуированных штаммов.
Аттенуации вирулентных штаммов вируса ЛДР достигали серийным пасси-
рованием в культуре клеток MRC-5 в присутствии 5-фторурацила. Штамм ZH-
548 утратил патогенность для мышей после восьми пассажей, но защищал их от
последующего заражения вирулентным штаммом вируса [443]. Аналогичный
мутант — аттенуированный штамм MV-P12 получен после 12 пассажей в культу-
ре клеток в присутствии 5-фторурацила, который оказался апатогенным для
овец, не вызывал абортов у суягных овцематок и сохранил выраженную антиген-
ность и иммуногенность. Ягнята, родившиеся от вакцинированных матерей,
приобретали пассивный иммунитет [1102].
В связи с тем, что существует теоретическая опасность реверсии аттенуиро-
ванных штаммов вируса, живые вакцины рекомендуют применять в эпизоотич-
ных регионах. Отсутствуют доказательства восстановления вирулентности у вак-
цинных штаммов в практических условиях.
Следует также иметь в виду, что живая вакцина способна вызывать вирусе-
мию у вакцинированных овец, а это может привести к инфицированию крово-
сосущих членистоногих, нападающих на овец, и к передаче болезни домашним
животным или человеку. Однако у овец и крупного рогатого скота наблюдали
низкие уровни вирусемии и в полевых условиях инфицирования комаров отме-
чено не было.
Учитывая теоретические возражения против применения живых вакцин в
благополучных по ЛДР зонах в ЮАР и США, были разработаны инактивирован-
ные вакцины. Для этого пантропные вирулентные штаммы вируса выращивали
в культуре клеток (ВНК-21 и др.), инактивировали формалином и добавляли
ГОА в качестве адъюванта. Инактивированная вакцина оказалась эффективной
только при двукратном введении. 92% стельных коров, вакцинированных дву-
кратно, дали жизнеспособный приплод после заражения вирулентным вирусом.
Хотя большинство вакцинированных коров были клинически здоровыми, у них
была обнаружена слабая непродолжительная вирусемия, а из тканей некоторых
животных и их плодов выделили вирулентный вирус. Разработанная в Израиле
инактивированная вакцина с новым адъювантом имела выраженные антиген-
ные свойства. Титр антител в РТГА у овец, привитых вакциной с адъювантом, со-
ставлял 1:2048, а у привитых вакциной без адъюванта 1:40 — 1:320 [37]. Потомст-
во от иммунизированных матерей следует вакцинировать с 3-месячного возраста.
Таким образом, разработанные в настоящее время живые вакцины, имеют
ряд явных преимуществ по сравнению с инактивированными вакцинами. Они
обладают большой эффективностью, экономичны и хорошо переносят длитель-
ное хранение.
10.20. Аренавирусы
Семейство аренавирусы представлено одним родом с одноименным назва-
нием, который на основе генетических и серологических свойств разделен на две
субгруппы. Первая субгруппа включает вирус лимфоцитарного хориоменингита,
Ласса вирус и другие аренавирусы Старого света. Вторая субгруппа включает
аренавирусы Нового света, вирусы так называемого Такарибе-комплекса.
Вирионы аренавирусов предстваляют собой плеоморфные частицы диамет-
ром 60-300 нм, хотя большинство из них имеют диаметр 110—130 нм. Вирионы
имеют оболочку с гликопротеиновыми пепломерами длинной 8—10 нм, пред-
ставляющие собой тетрамеры гликопротеинов GP1 и GP2. Центральная часть
вириона представлена двумя циркулярными нуклеокапсидными образования-
ми, напоминающими нити с нанизанными бусами. РНК геномные сегменты со-
единены между собой консервативными комплементарными последовательнос-
тями на 3' и 5' концах. Внутри вирионов находятся нефункциональные рибосо-
мы клеток, напоминающие песчинки. Геном представлен двумя сегментами
оцРНК, обозначенными L (7,2 тн) и S (3,4 тн) фрагментами. В вирионах они на-
ходятся в соотношении 1:2. Генетическая реассортация встречается между тесно
связанными вирусами.
Вирионы могут содержать множественные копии двух геномных сегментов,
чаще обнаруживают копии S РНК сегмента. Большая часть генома имеет негатив-
ную полярность, но 5'-конец L сегмента имеет позитивную полярность. Термин
окружающий (обволакивающий) используют для описания необычного геномно-
го окружения, которое обнаружено у некоторых членов семейства буньявирусы.
Особенность трансляции состоит в том, что нуклеопротеин кодируется 3'-полови-
ной генома S РНК, тогда как вирусный гликопротеиновый предшественник коди-
руется 5'-половиной вирусной S РНК. L-белок кодируется З'-концом L РНК, а
цинксвязанный белок кодируется 5'-концом вирусной L РНК [417, 1135].
Вирусные белки представлены нуклеопротеином (NP), РНК — зависимой
РНК полимеразой, двумя гликопротеинами, цинк-связанным белком и минор-
ными белками.
Аренавирусы размножаются в цитоплазме, как правило, без ЦПД и накапли-
ваются в высоком титре во многих культурах клеток. Так как геном представлен
одноцепочечной РНК негативной полярности, он не может транскрибироваться
непосредственно. На геномной РНК с помощью вирионной РНК-зависимой
РНК полимеразы транскрибируется комплементарная геному мРНК. Гены NP и
РНК-зависимой РНК полимеразы находятся соответственно на 3' концах L и S
РНК — сегментов экспрессируются через транскрипцию мРНК. Гены локализо-
ванные на 5'-концах L и S сегментов РНК, кодирующих соответственно GPC и
Z белки, экспрессируются через транскрипцию мРНК на антигеномных, полно-
размерных комплементарных копий геномных РНК, которые функционируют
как репликативные промежуточные формы [417]. Зрелые вирионы освобожда-
ются из клетки путем почкования через плазматическую мембрану.
Векторная вакцина, несущая гены гликопротеина и нуклеопротеина вируса
Ласса, защищала экспериментальных животных [1135].
10.21. Коронавирусы
Семейство включает два рода — коронавирусы и торовирусы.
Род коронавирусы включает многие важные патогенные вирусы млекопитаю-
щих и птиц, вызывающие респираторные болезни, энтериты, полисерозиты, ми-
окардиты, гепатиты, нефриты и иммунопатологию. У человека коронавирусы
вместе с другими вирусами вызывают синдром обычной простуды (common cold).
Род торовирусы включает два вируса, ранее выделенных от лошадей и КРС,
соответственно вирус Берне (прототип рода) и вирус Бреда. В дальнейшем торо-
вирусы были обнаружены у человека, а также у других видов животных.
Семейство коронавирусы включает многочисленных представителей оболо-
чечных вирусов, объединенных на основе молекулярно-генетических, структур-
номорфологических и серологических свойств.
Большинство коронавирусов обладают выраженным тропизмом к клеткам
эпителия дыхательных путей и кишечного тракта. Некоторые коронавирусы вы-
деляются с трудом и лишь с применением органных культур.
Представители рода коронавирусы имеют вирионы округлой формы диаме-
тром 80—220 нм. Вирионы коронавирусов состоят из нуклеокапсида спиральной
симметрии и гликопротеиновой оболочки, на поверхности которой имеются ха-
рактерные далеко отстоящие друг от друга булавовидные выступы длиной
~20 нм, образующие подобие солнечной короны.
Некоторые коронавирусы, кроме того, имеют укороченные пепломеры дли-
ной 5 нм.
Коронавирусы содержат три или четыре основных структурных белка: нук-
леокапсидный белок N; главный пепломерный гликопротеин S; трансмембран-
ные гликопротеины М и Е. Некоторые вирусы, кроме того, содержат НЕ-белок.
Торовирусы содержат те же белки, что и коронавирусы, но не содержат Е белок.
Торовирус КРС содержит белок НЕ (М, 65000).
Среди представителей рода коронавирусы различают три антигенные группы.
У представителей рода коронавирусов обнаружены следующие структурные
белки. Гликопротеин S (150—180 кД) образует большие выступы на поверхности
вирионов. Гликопротеин S может быть разделен на 3 структурных сегмента.
Большой наружный трансмембранный и цитоплазматический сегменты. Боль-
шой наружный сегмент, в свою очередь, состоит из двух субдоменов S1 и S2. Му-
тации в S1 сегменте связаны с изменением антигенности и вирулентности виру-
са. S2 сегмент является более консервативным. S белок коронавируса КРС (180
кД) в течение или после созревания вирионов расщепляется клеточными проте-
азами на S1 и S2, оставаясь нековалентно связанным в вирионных пепломерах.
Расщепление S белка у разных коронавирусов зависит от клеточной системы. S
белок вызывает образование ВНА и ответственен за слияние вирусной оболочки
с мембраной клетки. S белок является многофункциональным.
НЕ гликопротеин присутствует в структуре некоторых коронавирусов. НЕ
антиген представляет собой димер (65—70 кД), который формирует короткие от-
ростки на поверхности вириона. Его отсутствие у многих коронавирусов указы-
вает на то, что он не участвует в репликации этого семейства вирусов.
М гликопротеин отличается от других гликопротеинов коронавирусов толь-
ко коротким доменом, экспонированным на оболочке вириона. Моноклональ-
ные антитела против этого домена нейтрализуют вирус только в присутствии
комплемента. Небольшой Е белок (9—12 кД) также находится в оболочке вирио-
на. М и Е белки участвуют в формировании вириона и выходе его из клетки поч-
кованием. Нуклеокапсидный белок N (50—60 кД) взаимодействует с геномной
РНК, формируя нуклеокапсид вируса.
В 1972 г. в Швейцарии из содержимого кишечника лошади с признаками ди-
ареи был выделен ранее неизвестный вирус, получивший название вирус Берне,
который при последующем изучении признан прототипным представителем но-
вого рода — торовирусов в составе семейства коронавирусов. Спустя 10 лет от те-
лят, больных диареей, был выделен вирус Бреда (г. Бреда на северо-западе штата
Айова, США), морфологически сходный с вирусом Берне. Позже торовирусы
обнаружены в фекалиях детей, страдающих диареей, а также у многих видов жи-
вотных: свиней, коз, кроликов и мышей [806, 911].
Торовирусы представляют собой полиморфные оболочечные частицы, окру-
женные пепломерами. Вирионы имеют диаметр 120—140 нм, плотность 1,16—
1,18 г/мл [1630]. Форма вирионов — двояковогнутый диск или почкообразная.
Они содержат удлиненный тубулярный нуклеокапсид спиральной симметрии,
имеющий тороидальную форму. Вирусы имеют четыре основных структурных
белка: фосфопротеин нуклеокапсида - белок N (20 кД), мембранный гликопро-
теин М (37 кД), мелкий мембранный белок Е (20 кД) и пепломерный гликопро-
теин S (180 кД).
Таблица 43. Антигенные группы коронавирусов и вызываемые ими болезни [916]
Анти- генная группа Название вируса Респи- ратор- ная инфек- ция Клини- ческая инфек- ция Гепатит Поли- серо- зиты Другая пато- логия
1 Коронавирус человека — 229Е +
Коронавирусы свиней (ТГС,ЭДС, РКВС) + +
Коронавирус инфекционного перитонита кошек + + + + +
Коронавирус энтерита кошек +
Коронавирус собак +
Коронавирус кроликов + +
II Коронавирус человека — ОС43 +
Коронавирус мышей + + + +
Гемагглютинирующий коронавирус свиней + + +
Коронавирус КРС + +
Коронавирус индеек + +
Коронавирус крыс + + +
111 Коронавирус инфекционного бронхита кур + + +
Коронавирус индеек + +
Зрелый пепломерный белок состоит из двух субъединиц и в процессе созре-
вания in vivo подвергается протеолитической активизации. Пепломеры длиной
около 9—20 нм имеют детерминанты нейтрализации и гемагглютинации [806,
1630]. Торовирусы человека, лошадей, крупного рогатого скота и свиней генети-
чески и антигенно родственны между собой [607, 806, 911].
Различают два серотипа торовируса крупного рогатого скота (Бреда-вирус 1
и Бреда-вирус 2). Торовирус свиней вызывает диарею поросят в подсосный пе-
риод. Он родственен торовирусам человека, лошадей и КРС, но отличается от
них [607,911].
Адаптация торовирусов к репродукции в культуре клеток представляет опре-
деленные трудности. Тем не менее Берне-вирус удалось адаптировать и серийно
размножать в культуре клеток кожи лошади. Культуральная жидкость (7,0
ТЦД50/мл) обладала ГА-активностью [1630]. Бреда-вирус удалось размножить в
культуре клеток опухоли прямой кишки человека (линия HR Т-18) [831].
Геном коронавирусов представлен линейной молекулой оц(+)РНК размером
27-32 тн. Геномная РНК имеет кэп-структуру на 5'-конце, поли-А структуру на
3'-конце и обладает инфекционностью.
Таблица 44. Свойства и функции структурных белков коронавирусов [916]
N - нуклеокапсидный фосфопротеин Вместе с РНК вируса образует нуклеокапсид. Вызывает клеточный иммунитет
М — мембранный гликопротеин Определяет место сборки и почкования вириона и взаимо- действие с вирусным нуклеокапсидом.Формирует слой во- круг нуклеокапсида. Вызывает образование а-интерферона
Е — мелкий мебранный белок Запускает механизм сборки вирионов, связан с вирусной оболочкой, может вызывать апоптоз
S — гликопротеин оболочки Образует большие отростки на поверхности вириона, вступает в связь с рецепторами клетки, вызывает слияние вирусной оболочки с клеточной мембраной, может вызывать слияние клеток, связывается с Fc фагментом иммуноглобулина, вызывает образование ВНА и клеточный иммунитет
НЕ — гемагглютинин- эстеразный гликопротеин (имеется у некоторых коронавирусов) Образует небольшие отростки на поверхности вириона, вызывает гемагглютинацию, может вызывать гемадсорбцию
Независимо от различий в структуре вирионов, размере генома корона-, то-
ро- и артеривирусы сходны по организации генома и стратегии репликации. Все
они используют гнездовую стратегию транскрипции, т.е. экспрессия их генов
происходит через стадию образования нескольких З'-котерминальных субге-
номных мРНК.
Коронавирусы обладают сложной стратегией экспрессии генома. Вирионная
РНК служит в качестве мРНК для синтеза РНК-зависимой РНК полимеразы. Две
крупных открытых рамки считывания (общий размер около 20 тн), кодирующие
полимеразу, транслируются последовательно посредством сдвига рибосомальной
рамки в виде одного полипротеина, который затем расщепляется. Из этих проте-
инов затем формируется активная полимераза, которая транскрибирует геномную
(+)РНК с образованием полноразмерной комплементарной (—)РНК.
На этой копии с помощью обратной транскрипции образуется не только
полноразмерная геномная (+)РНК, но также гнезда З'-концевых субгеномных
мРНК. Эти гнезда содержат от 5 до 7 (у разных вирусов) перекрывающихся
мРНК, которые определяют длину от З'-конца и долю участия общей 5'-лидер-
ной последовательности. Они генерируются лидер-праймерным механизмом
прерывистой транскрипцией: полимераза в первую очередь транскрибирует не-
кодирующую лидерную последовательность с З'-конца комплементарной
(-)РНК. Затем, кэппирированная лидерная РНК отделяется от матрицы и вос-
соединяется с комплементарной последовательностью на старте любого гена,
чтобы продолжать правильно копировать матрицу вплоть до 5'-конца. Трансли-
руется только уникальная последовательность.
Такая последовательность дает урожай различных вирусных белков в регули-
руемых количествах. Межгенные последовательности служат промоторами и
ослабляют транскрипцию.
Торовирусы транскрибируются и реплицируются подобно коронавирусам, за
исключением отсутствия общих 5'-лидерных последовательностей на мРНК. За-
гадочная находка состоит в том, что субгеномные (—)РНК, комплементарные
гнездовым мРНК, также присутствуют в клетках, инфицированных коронавиру-
сом. Факт, что субгеномные РНК содержат 5'- и З'-концевые последовательнос-
ти, идентичные геномным РНК, означает, что они могут функционировать как
репликоны.
Синтез, процессинг, олигомеризация и транспорт некоторых гликопротеи-
нов оболочки коронавирусов демонстрируют некоторые необычные картины.
Например, оболочечный белок М, который у некоторых коронавирусов содер-
жит О-связанные, а не N-связанные гликаны, направляется исключительно к
цистернам эндоплазматического ретикулюма.
В результате этого вирионы почкуются только здесь, а не от плазматической
мембраны. Вирионы затем транспортируются в везикулах к плазматической
мембране и освобождаются экзоцитозом. После освобождения многие зрелые
оболочечные вирионы остаются прикрепленными к клетке снаружи. Реплика-
тивный цикл целиком совершается в цитоплазме и может происходить в клетках
с удаленным ядром. При размножении с высокой множественностью заражения
появляются ДИЧ с укороченным РНК геномом, которые имеют селективные
преимущества по сравнению со стандартными вирионами [796].
Генетическая рекомбинация происходит с высокой частотой между генома-
ми различных, но родственных между собой коронавирусов. Это может быть
важным механизмом появления генетически измененных вирусов в природе.
Кроме относительно частых спонтанных мутаций (примерно 3 мутации в про-
цессе репликации на каждые 30 тн) в генотипическом разнообразии коронави-
русов важную роль играет рекомбинация [385, 916]. Она приводила к изменению
антигенности вируса инфекционного бронхита птиц (ИБП) [465]. Рекомбина-
цию между вакцинными и вирулентными штаммами вируса ИБП наблюдали у
цыплят в полевых условиях [615]. Рекомбинация между геномами коронавиру-
сов собак и кошек, вероятно, привела к появлению коронавируса, передающего-
ся кошкам горизонтально [774]. Имеются доказательства, что вирус инфекцион-
ного перитонита кошек является мутантом эпизоотического коронавируса энте-
рита кошек, что способствовало системному распространению и персистенции
вируса [1589].
Исследования, проведенные главным образом на модели вируса гепатита мы-
шей, показали, что большой поверхностный пепломерный гликопротеин S пред-
ставляет собой первичный продукт трансляции. Он имеет N-концевую сигналь-
ную последовательность и С-концевой гидрофобный мембранный домен. У не-
которых, хотя и не у всех, коронавирусов гликопротеин S расщепляется на две
субъединицы: SI (gpl20) и S2 (gplOO). С-концевая субъединица (S2) несет фузоген-
ный участок, активность которого усиливается после протеолитического расщеп-
ления [1706]. В отличие от орто- и парамиксовирусов, фузогенный сайт, вероят-
но, локализован не в месте расщепления, а там, где лежит длинная последова-
тельность гидрофобных аминокислот. Второй особенностью белка S является то,
что в цитоплазматическом домене содержатся кластеры цистеина (трицистеин и
два дицистеина). Нечто подобное обнаружено в цитоплазматическом домене аль-
фавирусов. Большая часть белка S находится снаружи вириона и обеспечивает его
прикрепление к клеткам. Он экспонируется на поверхности инфицированных
клеток и определяет их чувствительность к Тц лимфоцитам. Интегральный мем-
бранный гликопротеин М погружен довольно глубоко в оболочку вириона, на
поверхности которого выступает лишь небольшой участок этого белка. N-конец
с гидрофобным участком расположен снаружи вириона, а гидрофильный С-ко-
нец — с внутренней стороны липидной мембраны. Наиболее важная особенность
гликопротеина М — та, что он является основным индуктором интерферона. В
отличие от других вирусных гликопротеинов, он не экспонируется на плазмати-
ческой мембране инфицированных клеток. М-гликопротеин коронавирусов не
следует отождествлять с матриксным белком других вирусов. По своей структуре
этот белок существенно отличается от матриксных белков пара- и ортомиксови-
русов. Коронавирусы с хорошо выраженной гемагглютинирующей активностью
содержат НЕ-белок, хотя его наличие в структуре вириона не обязательно свиде-
тельствует о способности вируса вызывать гемагглютинацию эритроцитов. Анти-
генные свойства коронавирусов изучены недостаточно детально. Имеющиеся
данные дают возможность считать, что пепломерный гликопротеин S является
наиболее важным в антигенном и иммуногенном отношении структурным ком-
понентом коронавирусов, поскольку в основном этот белок индуцирует синтез
вируснейтрализующих антител [850]. В образовании напряженного иммунитета к
вирусу ИБП, кроме основного белка S, принимает участие также белок М, кото-
рый в меньшей степени участвует в индукции синтеза ВН-антител, но ответстве-
нен за синтез антител, тормозяших ГА [463].
На белке S вируса ИБП выявлено восемь эпитопных групп. Шесть из них об-
ладали выраженной ВН-активностью [901].
В гликопротеине S вируса гепатита мышей (ВГМ) выявлено четыре антиген-
ных сайта, участвующих в слиянии клеток, вирулентности и нейтрализации ви-
руса [1626]. Антитела к гликопротеину М ВГМ обладали протективным действи-
ем, хотя эта способность не коррелировала с ВН-активностью in vitro. Учитывая
неполную клиническую защиту, можно полагать, что антитела к белку М способ-
ны если не предотвратить, то хотя бы смягчить течение заболевания [786].
Консервативный нейтрализующий эпитоп ВГМ, индуцирующий синтез
протективных ВН-антител, представлен аминокислотами в позиции 848—856
гликопротеина S. Полагают, что участок этого белка, ответственный за слияние,
также вовлечен в обеспечение протективного иммунитета [994]. Главные нейтра-
лизующие эпитопы вируса локализованы в N-концевом участке субъединицы S1
пепломерного белка S [1484].
На белке S вируса трансмиссивного гастроэнтерита свиней (ТГС) имеется по
крайней мере два главных антигенных участка, ответственных за синтез ВН-ан-
тител [797].
В N-концевой части гликопротеина S вируса ТГС выявлено четыре антигенных
сайта (А, В, С, D) и идентифицировано 11 эпитопов, восемь из которых вирусней-
трализующие. Главный эпитоп нейтрализации формируется, вероятно, аминокис-
лотными остатками 380—387 с участием последовательностей из других частей бел-
ка S и представляет собой сложную конформационную структуру [1260].
Нейтрализация вируса ТГС моноклональными антителами против gpS не за-
висела от комплемента, тогда как антитела против гликопротеина М тоже нейт-
рализовали вирус ТГС, но исключительно в присутствии комплемента [1680].
Нейтрализующие антитела к S и М-белкам выявили антигенную гетерогенность
изолятов вируса ТГС [1719].
Вирус ТГС обладает слабовыраженной гемагглютинирующей активностью,
которая связана, вероятно, с М-гликопротеином вириона [1164] и зависит от хо-
зяинной системы. Вирусный нуклеопротеин (N) не обладает способностью ин-
дуцировать синтез вируснейтрализующих антител [1680]. Однако, как и в случае
с другими оболочечными вирусами животных, этот белок может служить мише-
нью для цитотоксических Т-клеток и определять перекрестную антигенную ре-
активность между различными коронавирусами.
В структуре респираторного коронавируса человека (РКВЧ) выявлено не
три, а четыре мажорных полипептида: 200 кД (S), расщепляющийся трипсином
на 110 и 90 кД; 130 кД (НЕ) гемагглютининэстераза, состоящая из двух субъеди-
ниц 65 кД, связанных дисульфидным мостиком; фосфорилированный (N) белок
55 кД; гликозилированный (М) белок 26 кД. Эти белки представлены в вирионе
соответственно в количестве 88, 22, 726 и 726 молекул [789]. По данным МФА,
полевые изоляты (РКВЧ) не отличались от прототипного штамма 229Е, но отли-
чались от него в перекрестной PH [1484].
В составе оболочки коронавируса крупного рогатого скота также обнаруже-
но три гликозилированных белка (S, М, НЕ). Инфекционность вируса in vitro
нейтрализовали только МАТ к белкам S и НЕ, но не к М [572]. Белок НЕ (47 кД,
424 аминокислотных остатка) ответственен за гемагглютинацию [1207].
Представления об антигенной и геномной гомологии разных коронавирусов
основаны на сравнительном изучении с использованием различных методов.
Определена типовая (для вируса одного вида), групповая (для группы антигенно
родственных вирусов: ТГС и РКВС) и межвидовая (коронавирусы собак, кошек,
свиней) антигенная общность. В отличие от многих коронавирусов животных,
вирус ТГС имеет один серотип.
Вирусы ТГС, инфекционного перитонита кошек и коронавирус собак обла-
дают общими антигенами. В то же время вирус ТГС, гемагглютинирующий ви-
рус свиней и вирус эпизоотической диареи свиней не имеют антигенного родст-
ва [140, 569]. Выделенный недавно респираторный коронавирус свиней (SRCV),
получивший широкое распространение в ряде западноевропейских стран, ока-
зался в антигенном отношении тесно родственным с вирусом ТГС. Главным би-
ологическим отличием нового коронавируса является его исключительная пнев-
мотропность при отсутствии энтеропатогенности [1355]. Оба вируса сходны
между собой в антигенном отношении и имеют одинаковые нейтрализующие
эпитопы в основных вирионных белках (N, S и М).
У кишечного коронавируса кроликов выявлено небольшое антигенное род-
ство с вирусом инфекционного перитонита кошек, коронавирусом собак и виру-
сом ТГС. Прививка этими вирусами вызывала слабовыраженную защиту кроли-
ков от коронавирусной инфекции.
Вирус эпизоотической диареи свиней по всем свойствам является типичным
коронавирусом, хотя и не обладает антигенным родством с другими представи-
телями данного семейства [1231]. Коронавирусы человека серологически связа-
ны с коронавирусами крупного рогатого скота и мышей, гемагглютинирующим
вирусом энцефаломиелита свиней. Три коронавируса грызунов (вирус гепатита
мышей, коронавирус крыс, вирус сиалодакриоаденита крыс) имеют родство друг
с другом и с коронавирусами человека. Коронавирус индеек, так же как вирус
энцефаломиелита свиней, представлен одной антигенной разновидностью и
имеет антигенное родство с другими коронавирусами. Тесная антигенная связь
установлена между кишечными коронавирусами индеек и крупного рогатого
скота [568]. Двусторонняя антигенная связь установлена между коронавирусом
индеек и коронавирусами кур и мышей [593].
Сравнивали антигенные свойства двух коронавирусов кошек: инфекционно-
го перитонита (ИПК) и энтерита кошек (ЭК). Особенно большие различия в ан-
тигенной структуре выявлены с антителами к белку S в реакции нейтрализации
вируса [832].
Выявлена интересная зависимость между вирулентностью коронавирусов
кошек и клеточным тропизмом. Вирулентные штаммы в основном поражают
моноциты, авирулентные — реплицируются в эпителии кишечника [1457]. Воз-
можно, эти два коронавируса кошек являются биотипами одного и того же виру-
са. Моноклональные антитела к вирусу инфекционного перитонита кошек
(ИПК) типа II нейтрализовали коронавирусы энтерита кошек, собак и вирус
ТГС, но не реагировали с вирусом инфекционного перитонита кошек типа I
[790]. Иными словами, межвидовое антигенное родство оказалось более тесным,
нежели типоспецифическая дивергенция. На примере вируса гепатита мышей
показано, что основным местом персистенции вируса является передняя часть
верхнего отдела спинного мозга. Реактивация персистирующей вирусной РНК
приводила к возникновению клинически выраженного заболевания [1235] . По-
добный механизм может иметь место при персистенции других коронавирусов в
животном организме.
Инфекционный бронхит птиц (ИБП)
Инфекционный бронхит птиц (ИБП) — острое высококонтагиозное, глав-
ным образом респираторное заболевание кур всех возрастных групп. Вызывает
снижение яйценоскости и большой отход цыплят.
Заболеваемость молодых цыплят обычно составляет 25—30%, но в отдельных
случаях может достичь 75%. Менее вирулентные штаммы могут вызывать слабо-
протекающую инфекцию. Высокая смертность бройлеров обусловлена вторич-
ной инфекцией Е. сой или патогенными микоплазмами.
Вирус первоначально размножается с высоким титром в клетках цилиарного
эпителия респираторного тракта, затем наступает 1—2-дневная виремия. После
инфицирования респираторного тракта вирус ИБП локализуется и размножает-
ся в эпителиальных клетках яйцевода и остается в яйцеводе в течение 6—24 дней
после инфекции. Инфицированный яйцевод становится инфантильным или ки-
стозным.
Инфекционность вируса снижается быстро, и выделение вируса от заболев-
ших спустя 10 дней случается редко. В отдельных случаях вирус может сохра-
няться в организме 50 дней после первичной инфекции. Его чаще выделяют из
клоаки, чем из трахеи.
Отмечены случаи циркуляции нефропатогенных штаммов вируса, поражаю-
щих в основном почки цыплят [532].
Различают четыре серотипа вируса, обладающих гемагглютинирующей актив-
ностью и групповым антигеном [530]. Типоспецифические эпитопы локализова-
ны в основном в первых 300 аминокислотных остатках пепломерного белка S.
Переболевание сопровождается образованием антигемагглютининов, нейт-
рализующих и преципитирующих антител и практически пожизненным иммуни-
тетом к гомологичному типу вируса. Не установлено тесной корреляции между
напряженностью иммунитета и содержанием в сыворотке крови вируснейтрали-
зующих и тормозящих гемагглютинацию антител, уровень которых достигал мак-
симума через четыре недели после иммунизации [463]. Введение живой вакцины
в зоб цыплятам создавало у них устойчивость к заражению без образования цир-
кулирующих антител. Эти данные свидетельствуют о важной роли местного им-
мунитета при ИБП. Материнские антитела через яйцо передаются от иммунных
несушек цыплятам, которых они защищают в первые 2—4 недели жизни от ИБП,
хотя не всегда достаточно эффективно. Период полужизни материнских антител
составляет около пяти дней. Со второй недели жизни их титр начинает снижать-
ся. Оптимальный возраст для вакцинации цыплят — 2—3 недели.
Яйца иммунных кур содержат IgG, если они были иммунны хотя бы за пять
дней до яйцекладки. У родившихся цыплят уровень циркулирующих антител по-
добен материнскому.
Разнообразие серотипов вируса ИБП необходимо учитывать при производ-
стве вакцин. Выбор того или иного вакцинного препарата зависит от эпизооти-
ческой ситуации. Аттенуацию вируса проводят серийными пассажами на КЭ.
Однако авирулентных и достаточно иммуногенных вакцинных штаммов вируса
ИБП не получено. Штаммы, полностью утратившие вирулентность, практичес-
ки не иммуногены. Поэтому живые вакцины готовят из аттенуированных штам-
мов, обладающих различной степенью остаточной вирулентности. Для первой
прививки применяют более аттенуированные и менее иммуногенные штаммы,
для второй — более вирулентные. Живые вакцины применяют орально (с питье-
вой водой), путем закапывания на конъюнктиву или аэрозольно. В связи с тем,
что инактивированные вакцины сами по себе недостаточно иммуногенны, их
применяют в сочетании с живыми. Инактивированная вакцина, приготовленная
из антигенного варианта Массачусетс вируса инфекционного бронхита, защи-
щала кур только при заражении гомологичным серотипом вируса.
Достаточно эффективной оказалась эмульгированная вакцина из концент-
рированного вируса. Для изготовления живых вакцин чаще всего используют ат-
тенуированный штамм Массачусетс, хотя можно и другие. Живые вакцины
Bronchovac I и II (В-I и В-П) при различных способах введения у 2—8-недельных
цыплят вызывали нарушение функции органов дыхания соответственно в лег-
кой и умеренной формах в течение 3—7 дней. Прививка обеими вакцинами со-
провождалась выраженным иммунитетом не менее чем у 87% цыплят [285], тог-
да как даже двукратное введение инактивированной вакцины обеспечивало ме-
нее напряженный иммунитет у 20—60% цыплят. В случае ревакцинации цыплят
инактивированной вакциной после первичной иммунизации В-I или В-П на-
блюдали значительное усиление иммунного ответа. Вирус ИБП инактивировали
БПЛ (0,05%, 5 ч, 37°С) [463]. Введение инактивированной эмульгированной вак-
цины цыплятам в 3- и 16-недельном возрасте дало такой же эффект, как и при-
вивка живыми вакцинами: первый раз вакциной Н-120 (120 пассажей вируса в
КЭ) и второй — Н-52 (52 пассажа вируса в КЭ). Наиболее выраженный иммун-
ный ответ у 100% цыплят получали при вакцинации их в 3-недельном возрасте
живой вакциной Н-120, а в 16-недельном возрасте инактивированной эмульги-
рованной вакциной [382]. Возможен и другой вариант вакцинопрофилактики
ИБП у цыплят: в 3 и 8-недельном возрасте прививать вакциной Н-120, а в 18-не-
дельном — инактивированной эмульгированной вакциной. Чем выше уровень
антител в крови птиц после вакцинации, тем меньше снижение уровня яйцено-
скости при заражении их вирулентным вирусом инфекционного бронхита [531].
В связи с опасностью распространения вируса ИБП живые вакцины следует
применять только при крайней необходимости. Повышение эффективности
инактивированных вакцин может быть достигнуто прежде всего путем резкого
повышения антигенности исходного вирусного сырья, использования полевых
вирулентных штаммов и приготовлении поливалентных вакцин [23].
Трансмиссивный гастроэнтерит свиней (ТГС)
Трансмиссивный гастроэнтерит свиней (ТГС) — остропротекающая высоко-
контагиозная болезнь, главным образом поросят 2-недельного возраста, прояв-
ляющаяся рвотой, диареей и дегидратацией. Заболеваемость и летальность ново-
рожденных поросят при остром течении болезни могут достигать 100%. У поро-
сят более старшего возраста клинические признаки болезни, как правило,
отсутствуют и не отмечается летального исхода. У больных свиноматок часто на-
блюдают лихорадку, диарею и снижение или потерю продукции молока. Болезнь
регистрируют во многих странах с интенсивно развитым свиноводством, и в свя-
зи с отсутствием эффективных средств профилактики она наносит серьезный
экономический ущерб. Основной особенностью ТГС является то, что он отно-
сится к числу ярко выраженных высоколетальных локальных инфекций. Наибо-
лее уязвимы при ТГС поросята в первые 10 дней жизни. Они часто рождаются за-
раженными или заражаются в первые часы и дни после рождения. При остром
течении болезни в неиммунном стаде между инфицированием и клиническим
проявлением болезни проходит не более 24—48 ч.
В этих условиях поросята могут быть защищены только антителами матери,
полученными с молозивом и молоком. Лактогенный иммунитет оказывается эф-
фективным в случае, если антитела в достаточно высоком титре постоянно при-
сутствуют в просвете кишечника поросят, по крайней мере в течение первой не-
дели жизни [1Н5].
При прочих равных условиях эффективность лактогенного иммунитета на-
ходится в прямой зависимости от специфической активности количества по-
требляемого молозива и молока. Заболеваемость и гибель поросят от ТГС, как
правило, будет меньше под высокомолочными матками или в немногочислен-
ных пометах. Кроме энтероцитов, поражение которых сопровождается атрофи-
ей ворсинок тонкого отдела кишечника, клетками-мишенями для вируса могут
служить альвеолярные макрофаги [930], а также клетки миндалин и, возможно,
других органов. В клетках миндалин больных поросят антиген вируса ТГС выяв-
ляли даже чаще, чем в клетках тощей кишки. Переболевание сопровождается
иммунитетом и образованием ВНА, относящимся к IgA и IgG. В молозиве, а за-
тем в молоке свиноматок-реконвалесцентов такие антитела присутствуют в те-
чение нескольких недель. Поросята от переболевших или ранее инфицирован-
ных в естественных условиях свиноматок устойчивы к заболеванию за счет коло-
стральных антител. Специфическая профилактика ТГС все еще остается
актуальной проблемой. Многочисленные исследования в этой области пока не
увенчались разработкой эффективных средств активной профилактики, хотя
было предложено множество инактивированных и живых вакцин и способов их
применения. Причина этого связана с особенностями пато- и иммуногенеза при
ТГС, а также с трудностями создания выраженного продолжительного иммуни-
тета слизистых при локальных инфекциях вообще.
Инактивированные вакцины готовят из вируса, выращенного в однослой-
ных первичных или перевиваемых культурах клеток свиного происхождения,
используя, как правило, масляный адъювант. Для инактивации вируса чаще все-
го используют формалин. Антигенные свойства вируса одинаково хорошо сохра-
нялись в вакцине, если для инактивации вируса применяли формальдегид или
димер этиленимина. Антигенность эмульгированной вакцины была выше сор-
бированной. Вакцинация супоросных свиноматок сопровождалась выраженной
сероконверсией (ВНА Г.230), а защита трехдневных поросят при эксперимен-
тальном заражении составила 70,9% [6].
Многочисленные икактивированные вакцины различаются между собой,
главным образом продолжительностью пассирования вируса в культуре клеток и
концентрацией входящего в их состав вирусного антигена. Обычно инактивиро-
ванные вакцины свиноматкам вводят внутримышечно двукратно за 7—10 и 2-4
недели до опороса. Такие вакцины применяли в Америке, Европе и Азии. Инак-
тивированная эмульгированная вакцина после двукратного внутримышечного
введения в дозе 2 мл вызывала у супоросных свиноматок выраженную серокон-
версию. В день опороса титр ВН-антител составлял 7,5-9,0 log2. В сыворотке
крови 1 — 15-дневных поросят титр материнских антител был в пределах
6,0—6,5 log2. Высокая иммуногенность вакцины подтверждена в производствен-
ных условиях [157]. Так как внутримышечная иммунизация свиноматок стиму-
лирует слабовыраженный защитный эффект в результате развития главным об-
разом системного иммунитета с преимущественным синтезом IgG, применение
инактивированных вакцин стали ограничивать, а предпочтение отдавать живым
[4]. Аттенуированные штаммы вируса ТГС получали серийным пассированием
вирулентных штаммов в первичных культурах и постоянных линиях клеток сви-
ного происхождения [130, 659]. Для заметного ослабления вирулентности требу-
ется примерно 40 пассажей вируса. Четырехкратная разница в продолжительно-
сти аттенуации путем серийного пассирования в перевиваемой культуре клеток
свиного происхождения не влияла заметно на антигенные и иммуногенные
свойства двух аттенуированных штаммов вируса ТГС [5].
Живую вакцину фирмы «Форт Додж» испытывали при двукратном внутри-
выменном и внутримышечном введениях супоросным свиноматкам. Сохран-
ность поросят при экспериментальном заражении составила около 80%. При
первом способе введения вакцины титр ВНА в молозиве и молоке был в 2—3 ра-
за выше, однако этим способом вакцинации нельзя воспользоваться в широкой
практике. Живую вакцину применяли перорально двукратно: первый раз на 6-й
неделе супоросности, второй — за 3 недели до опороса. У вакцинированных жи-
вотных развивался иммунитет, о чем свидетельствовала зашита новорожденных
поросят от ТГС во время вспышки заболевания.
В связи с низкой эффективностью внутримышечной вакцинации начались
поиски нетрадиционных способов иммунизации супоросных свиноматок. Мно-
гие исследователи вводили живые вакцины орально, интраназально и в вымя.
Хотя при этом в ряде случаев получали удовлетворительные результаты, тем не
менее перспективным оказался комбинированный способ иммунизации [4].
Живая вакцина из штамма РИМС при двукратном внутримышечном введении
супоросным свиноматкам обеспечивала менее выраженную зашиту поросят, чем
при оральном применении. Наиболее высокий уровень отмечен при комбини-
рованном введении вакцины свиноматкам за 4—6 недель до опороса перорально
и внутримышечно — за 2 недели до опороса с целью получения оптимального бу-
стер-эффекта [659].
Фирма Рон-Мерье (Франция) предложила вакцину (GASTERIFFA) из атте-
нуированного штамма в двух формах для двух способов применения. В угрожае-
мом хозяйстве свиней на 2—3 мес. супоросности вакцинируют орально, а спустя
15 дней - внутримышечно. В неблагополучном хозяйстве первый и второй раз
свиней прививают внутримышечно. Вакцинация сопровождается высоким
уровнем лактогенного иммунитета.
Фирма Nisseiken (Япония) также изготовляет вакцину в двух формах для двух
способов применения. Готовят ее из штамма h-5 вируса ТГС, размноженного в
культуре постоянной линии клеток почки поросят (линия МРК-Ша). Живую
сухую вакцину свиноматкам вводят интраназально в дозе 1 мл по истечении ше-
сти недель супоросности. Инактивированную формалином концентрированную
эмульгированную вакцину применяют внутримышечно в дозе 1 мл за 2-3 неде-
ли до опороса. Во время последующей супоросности вакцинацию повторяют
полностью. Вакцина обеспечивает защиту новорожденных поросят от ТГС на
протяжении подсосного периода за счет высокоэффективной иммунизации их
матерей.
Оба приведенные выше решения, несмотря на различные пути праймирова-
ния, основаны на одном принципе — общности иммунной системы слизистых
оболочек, т.е. существовании тесной иммунологической взаимосвязи между ки-
шечником, бронхоальвеолярной тканью и молочной железой. После первичной
местной стимуляции (в первом случае кишечник, во втором — респираторный
тракт) повторная внутримышечная иммунизация перед опоросом вызывала по-
вышенный синтез и секрецию IgA с молозивом и молоком. Субъединичная рас-
щепленная вакцина, представляющая собой, по-видимому, пепломерный глико-
протеин в смеси с адъювантом, вызывала активный иммунитет у матерей и пас-
сивный иммунитет у потомства.
НПО НАРВАК разработало достаточно эффективную инактивированную
эмульгированную вакцину. Свиноматок прививают внутримышечно в дозе 3 мл
на 70—75 и 90—100 дни супоросности. Ремонтных свинок, кроме того, привива-
ют перед осеменением. Вакцинация вызывает высокий уровень колострального
иммунитета и защищает не менее 90% поросят от заболевания и гибели при ос-
тром течении ТГС в крупных свиноводческих хозяйствах.
В 80-х годах прошлого века широкое распространение получил природно-ат-
тенуированный респираторный вариант вируса ТГС [1232], который легко пере-
давался горизонтально, вызывая персистенцию у свиней. Благодаря этому в Ев-
ропе исчезла проблема специфической профилактики ТГС. Однако в США при
циркуляции в популяции свиней аналогичного вируса специфическая профи-
лактика ТГС остается актуальной проблемой [1355]. Подобная ситуация сохра-
няется в России и Азии. Новый вариант вируса ТГС, получивший название рес-
пираторный коронавирус свиней (РКВС), стали использовать в некоторых стра-
нах для иммунизации свиней против ТГС.
Эпизоотическая диарея свиней (ЭДС)
Заболевание, клинически сходное с ТГС, зарегистрировано во многих стра-
нах Западной Европы. ЭДС вызывает коронавирус, антигенно не связанный с
другими коронавирусами свиней. Главными клиническими признаками болезни
у поросят являются водянистая диарея, иногда сопровождающаяся рвотой. У
взрослых свиней заболевание может протекать асимптоматически или ограни-
читься депрессией, потерей аппетита и рвотой. Смертность у поросят обычно со-
ставляет примерно 50%, но может достигать 90%. Взрослые свиньи выздоравли-
вают примерно через неделю. Гибридизацией in situ наличие вируса ЭДС обна-
ружено в энтероцитах тощей и подвздошной кишок.
Вирус ЭДС выделяли из тонкого отдела кишечника больных поросят в куль-
турах клеток Veto, эпителиальных клеток мочевого пузыря и почек поросят в
присутствии трипсина в поддерживающей среде. На 2—4 дни появилось слияние
клеток — образовывался синцитий. Патогенность вируса для поросят зависела от
возраста. Наиболее чувствительными оказались поросята 2—7-дневного возрас-
та, которые погибли на 3—4 день после заражения. У поросят более старшего
возраста (> 2 недели) заболевание протекало легко (или не проявлялось) и закан-
чивалось выздоровлением. Специфическая профилактика ЭДС не разработана.
Коронавирусная инфекция крупного рогатого скота
Коронавирус крупного рогатого скота обычно является возбудителем диареи
у 3—21-дневных телят, заболевание нередко имеет летальный исход. Протекает в
виде энзоотических вспышек, чаще в холодный период года (зимняя дизенте-
рия), и может поражать до 60% телят в хозяйстве [1536]. Особенность данной ин-
фекции состоит в том, что коронавирус размножается как в кишечнике, так и в
респираторном тракте телят, хотя вызывает диарею. Вирус преимущественно раз-
множается в дистальной части тонкого и в толстом отделе кишечника, в эпители-
альных клетках слизистой оболочки носовой полости, трахеи и легких. При коро-
навирусной диарее телят он с одинаковой частотой выделяется как из желудочно-
кишечного, так и из респираторного трактов. В перекрестной PH установлено,
что кишечные и респираторные изоляты коронавируса крупного рогатого скота
принадлежат к одному серотипу независимо от источника выделения [485].
Несмотря на размножение в респираторном тракте, коронавирус крупного
рогатого скота сам по себе не может вызвать респираторных заболеваний телят.
Интраназальное и интратрахеальное экспериментальное заражение телят этим
вирусом сопровождалось лишь незначительными респираторными нарушения-
ми. Он обладает ГА-активностью, которая связана с гликопротеином 140 кД, со-
стоящим из двух молекул 65 кД, соединенных дисульфидным мостиком [888].
Клинически здоровые взрослые животные могут быть хроническими носителя-
ми вируса, выделяя его с фекалиями в течение 3 мес. [549].
Переболевание сопровождается выработкой иммунитета. Для специфичес-
кой профилактики коронавирусной диареи телят применяют живую и инакти-
вированную вакцины. Первую получали серийным пассированием вирулентно-
го штамма вируса в первичных культурах или постоянной линии клеток почки
эмбриона коровы. Аттенуация вируса наступала быстро. Для приготовления вак-
цины брали вирус на уровне 27—35 пассажей с активностью 5,0—6,01g ТЦД50/мл.
Инактивированную вакцину из культурального вируса готовили с помощью
формалина, антиген сорбировали на ГОА. Живую вакцину применяли телятам
орально (по 1-5 мл); инактивированную вводили стельным коровам (1-5 мл) за
30—90 дней до отела. Оба типа вакцин имели слабовыраженную эффективность.
Иммунизация коров в последней трети стельности живой вакциной против
корона- и ротавирусной инфекции влияла на экскрецию коронавируса. Среди
вакцинированных количество вирусовыделителей в период отела не увеличилось,
тогда как в контрольной группе животных возросло с 20-30 до 65-70% [519].
Инфекционный перитонит кошек (ИПК)
Инфекционный перитонит кошек (ИПК) является наиболее динамичным из
всех коронавирусных заболеваний. Его патогенез вовлекает иммунопатологиче-
ские механизмы, такие как зависимое от антител повышение инфекционности и
образование иммунных комплексов, вызывающих потологические изменения.
Коронавирус энтерита кошек играет основную роль в патогенезе этой болезни.
Спорадическое появление ИПК-результат мутации кишечного коронавируса
кошек in vivo в результате приобретения тропизма к макрофагам. Идентифици-
рованы 2 типа кишечного коронавируса кошек, способных вызывать ИПК путем
указанного механизма. Тип 2 является рекомбинантом с генетической информа-
цией, приобретенной от коронавируса собак, который обычно вызывает диарею
у щенков.
Коронавирусный перитонит — летальное заболевание домашних и диких ви-
дов семейства кошачьих. Ключом патогенеза ИПК является заражение моноци-
тов и макрофагов. Установлена прямая зависимость между вирулентностью изо-
лята кишечного коронавируса кошек и интенсивностью его размножения в
культуре макрофагов кошек.
Убиквитарность авирулентного кишечного коронавируса кошек не свиде-
тельствует об его тропизме к пищеварительному тракту. Вероятно, он распрост-
раняется между эпителием пищеварительного тракта и региональными лимфо-
узлами. Поэтому трансформация этого вируса в результате мутации и превраще-
ние в вирус ИПК может произойти в разных органах и тканях, что является
основой для разнообразия клинического проявления болезни.
Для профилактики пригодны коммерческие вакцины, содержащие темпера-
турно-чувствительный мутантный вирус. Вакцину применяют на слизистую но-
са, где условия благоприятствуют для слабой репликации вируса без образова-
ния антител. При этих условиях развивается клеточный иммунитет и достигает-
ся защита. Вакцинация инфицированных, серопозитивных взрослых кошек
неэффективна [1228].
10.22. Артеривирусы
Название семейства происходит от названия болезни, вызываемой у лоша-
дей вирусом артерита. Кроме лошадей, подобные вирусы вызывают заболевания
у свиней, мышей и обезьян. Все артеривирусы способны вызывать бессиптом-
ные персистентные инфекции у естественных хозяев, при некотрых обстоятель-
ствах — тяжелые заболевания. Артеривирусы по организации генома и стратегии
репликации подобны коронавирусам. Главным отличием артеривирусов являет-
ся то, что их геном и вирионы примерно вдвое меньше, чем у коронавирусов. Ар-
теривирусы имеют изометрический капсид, тогда как коронавирусы — геликои-
дальный (спиральный), у артеривирусов пепломеры варажены и более длинные,
нежели у любых других вирусов. Общим для этих семейств является стратегия
гнездовой транскрипции, что послужило основанием объединить их в один по-
рядок — нидовирусы. Семейство артеривирусов содержит один род вирусов с од-
ноименным названием.
Вирионы диаметром 40—60 нм содержат изометрический (вероятно, кубиче-
ский) нуклеокапсид 25-35 нм в диаметре, окруженный тесно прилегающей обо-
лочкой с сотообразной структурой. В процессе инфекции синтезируется 7—9
структурных и 8-13 неструктурных белков [1430].
Вирионы содержат нуклеокапсидный белок N (12 кД), негликозированный
внутренний мембранный белок М (16 кД) и по крайней мере два N-гликозили-
рованных пепломерных белка Gs (25 кД) и G, (42 кД) [1135].
Двойной липидный слой, окружающий нуклеиновую кислоту, содержит 5—6
белков в необычно большом количестве по сравнению с другими одноцепочеч-
ными (+)РНК вирусами. Два из этих белков белок М и главный гликопротеин
являются основными структурными компонентами [1430].
Геном представлен одной молекулой линейной одноцепочечной (+)РНК
размером 13—15 тн. Вирионная РНК имеет кэп-структуру на 5'-конце и поли-А
последовательность на 3'-конце и обладает инфекционностью. Ген РНК-поли-
меразы занимает около 75% 5'-конца генома. Гены, кодирующие структурные
белки расположены в 3'-конце генома. Геном транскрибируется в виде полиоме-
разной копии РНК (негативной полярности), на которой транскрибируются 3'-
концевые гнездовые мРНК; транслируются только уникальные последователь-
ности 5'-конца каждой мРНК. Полноразмерная геномная РНК синтезируется
на полноразмерной промежуточной матрице негативной полярности. Транс-
крипция приводит к синтезу гнездовых наборов (комплексов) из 7 или 8 3'-кон-
цевых мРНК, которые отражают одну рамку считывания. Эти субгеномные РНК
составляют общую лидерную последовательность, в которой участвуют все ин-
дивидуальные мРНК, связанные в единую последовательность. Таким образом,
каждый белок не кодируется смежно на вирусном геноме — лидерная последова-
тельность каждой мРНК является идентичной и берет начало от крайнего З'-
конца генома. Консервативная последовательность играет определяющую роль
в соединении, где лидерная последовательность присоединяет уникальную часть
каждой субгеномной мРНК. Неизвестно, происходит ли уникальная часть каж-
дой мРНК от субгеномной негативной цепи матрицы или транскрибируется ин-
дивидуально на полноразмерной негативной цепи генома в качестве матрицы.
Некоторые примыкающие гены, обладающие кодирующими функциями в каж-
дой субгеномной мРНК, имеют различные рамки считывания; перемещение ри-
босомальных рамок происходит для того, чтобы гарантировать, что 5'-конец, ко-
дирующий белок, транслируется с каждой субгеномной мРНК.
Геном прототипного артеривируса лошадей содержит 8 открытых рамок счи-
тывания. Три четверти 5'-конца генома вируса занимают две большие открытые
рамки считывания, которые вместе кодируют вирусную репликазу. Продуктом
обеих открытых рамок считывания является мультидоменный полипротеин, ко-
торый расщепляется вирусными и клеточными протеазами на субъединицы зре-
лой репликазы. Открытые рамки считывания 2; 5 и 6, эксперссируемые субге-
номными мРНК, кодируют соответственно большой и малый гликопротеины и
трансмембранный белок. Открытая рамка считывания 7 кодирует фосфорилиро-
ванный нуклеокапсидный белок.
Артеривирусы реплицируются в перинуклеарной зоне цитоплазмы клеток
хозяина, которыми обычно являются макрофаги. Вирионы образуются почкова-
нием через мембрану эндоплазматической сети во внутриклеточных везикулах,
они перемещаются к поверхности клетки и освобождаются при экзоцитозе. Ви-
рус артерита лошадей размножается с высоким тиром в клетках лошади, а вирус
лактатдегидрогеназы — в организме мышей, накапливаясь в плазме крови в тит-
ре 11 1g ИД50/мл в первые дни после заражения [1135].
Вирусный артерит лошадей
В большинстве случаев инфекция протекает бессимптомно, что подтвержда-
ется широкой серопозитивностью лошадей. Клиническое проявление болезни в
отдельных случаях может сильно варьировать. После инкубационного периода,
длящегося 3-14 дней, температура тела может достичь 4 ГС. Развивается лейко-
пения, депрессия, слезоточение, коньюктивит, ринит, носовое течение, пневмо-
ния и другие признаки. Аборты могут достичь 40—80% от числа беременных ло-
шадей. Наиболее часто инфицирование происходит с контаминированной спер-
мой. При остром течении вирус выделяется со спермой и оказывает
отрицательное влияние на оплодотворение. У хронических вирусоносителей ви-
рус в сперме содержится годами и, возможно, даже пожизненно. Инфицирова-
ние сопровождается образованием ВН-антител, которые могут сохраняться по-
жизненно. Опыты по вакцинации подтвердили тесную зависимость между ВН-
антителами и устойчивостью к инфекции. Колостральные антитела обладают
защитным действием.
Живая или инактивированная культуральные вакцины создают длительный
иммунитет. Жеребят прививают в возрасте 6—8 месяцев после исчезновения ма-
теринских антител. С целью предотвращения абортов матерей вакцинируют пе-
ред или после беременности [1512].
Репродуктивный и респираторный синдром свиней (РРСС)
Репродуктивный и респираторный синдром свиней (РРСС) — контагиозная
болезнь, характеризующаяся абортами в конце срока супоросности, рождением
мертвого и слабого приплода, погибающего в первые 2—3 недели жизни, и пора-
Таблица 45. Структурные белки артеривирусов [1430]
Вирус атрерита лошадей Размер* (ак) Вирус РРСС (синего уха свиней) Размер* (ак)
Е 67 GP2a(GP2) 249
GP2b (Gs) 227 Е 70
GP3 163 GP3 265
GP4 152 gp4 183
GP5 255 gp5 201
М 162 м 173
N НО N 128
+ Количество аминокислот.
жением органов дыхания поросят. Основным местом размножения вируса явля-
ются макрофаги [141], а основным резервуаром вируса считаются миндалины
[490].
РРСС широко распространен во многих странах мира с развитым свиновод-
ством и причиняет отрасли большой экономический ущерб. Заболевание чаще
протекает в энзоотической (хронической) форме. Вирус распространяется быст-
ро в благополучной популяции свиней. В течение 2—3 месяцев после заноса ви-
руса в хозяйство количество серопозитивных свиней может достигать 95%. Из-
вестны два генотипа вируса РРСС — европейский и американский. Установлено,
что европейский генотип вируса РРСС циркулирует в странах Европы, а амери-
канский — в странах Северной Америки и Азии. Однако европейский генотип
вируса обнаружен в США и Канаде, а американский — в Словакии. Специфиче-
ская профилактика РРСС оказалась трудной задачей, не получившей удовлетво-
рительного решения. В лабораторных условиях вирус чаще размножают в куль-
туре легочных макрофагов и линии клеток Marc-145 [141].
Для специфической профилактики РРСС в ряде стран, в том числе и России,
разработаны культуральные живые и инактивированные вакцины, которые ис-
пользованы в практических условиях. Однако при детальном изучении некото-
рых живых вакцин они оказались недостаточно безопасными. Установлено, что
вакцинный вирус длительно сохраняется в организме, проходит через плаценту
и инфицирует плоды, а также может длительно выделяться со спермой хряков.
Кроме того, доказана возможность реверсии вирулентности вакцинных штам-
мов в организме привитых свиней.
Наряду с живыми вакцинами, против РРСС в некоторых странах (Россия,
Испания, Франция, США) созданы инактивированные вакцины. Они обладают
умеренной эффективностью и полностью безопасны. С их помощью в какой-то
мере можно контролировать заболевание в хозяйстве.
В НПО НАРВАК разработаны и производятся инактивированная вакцина про-
тив РРСС и инактивированная ассоциированная вакцина против парвовирусной
болезни, лептоспироза, болезни Ауески и РРСС (ПЛАР). Вакцина ПЛАР предназ-
начена для профилактики основных инфекционных болезней свиней, сопровож-
дающихся поражением органов репродукции. В последнее время за рубежом для
специфической профилактики РРСС разрабатываются вакцины на основе методов
генной инженерии. Аналогичные исследования проводят совместно сотрудники
НПО НАРВАК и Национального центра болезней животных США [141].
10.23. Пикорнавирусы
Данное семейство включает более 200 вирусов, которые объединены в 6 ро-
дов: энтеро-, афто-, кардно-, рино-, гепато- и парэховирусы. Вирусы, вызываю-
щие заболевания человека, входят в 4 рода, а вызывающие заболевания живот-
ных - в 6 родов. Важным признаком дифференцирующим родовую принадлеж-
ность является стабильность при низком pH. Афтовирусы нестабильны при pH
ниже 7,0; риновирусы — при pH ниже 5,0; энтеро-, гепато-, кардио- и парэхови-
русы стабильны при рН=3,0. 5'-нетранслируемая область генома кардио- и аф-
товирусов содержит длинный поли (С) участок, отсутствующий у представите-
лей других родов. Афтовирусы уникальны по наличию в геноме трех подобных,
но не идентичных участков, кодирующих белок VPg.
Вирионы представляют собой безоболочечные частицы, округлой формы с
гладкой поверхностью диаметром 27 нм.
Геном представлен одной молекулой одноцепочечной (+)РНК размером
7,2—8,4 тн. Геномная РНК полиаденилирована на З'-конце и имеет белок VPg,
связанный ковалентно с 5'-концом. Геномная РНК обладает инфекционностью,
т.е. функционирует как мРНК, имеет одну открытую рамку считывания и транс-
лируется в полипротеин, который затем расщепляется на 11 индивидуальных
белков. Пикорнавирусы содержат 60 копий каждого из 4 капсидных белков: VP1,
VP2 и VP3 (м.м. каждого -30000) и VP4 (м.м. 7000-8000) и 1 копию небольшого
белка VPg (м.м. варьирует; афтовирусы кодируют 3 варианта VPg). Кроме того, в
вирионах многих пикорнавирусов были обнаружены минорные белки, функция
которых неизвестна [792, 1135].
Три белка VP1, VP2 и VP3, структурноподобных друг другу, образуют наруж-
ную поверхность вириона, а белок VP4 расположен внутри капсида и, вероятно,
связан с геномной РНК. Белок VPg участвует в репликации РНК и, вероятно,
выполняет сигнальные функции при инкапсидации.
В вирионах полно- и риновирусов, VP1, VP2 и VP3, упакованные вместе, об-
разуют «каньон», обрамляющий 5-гранник. Аминокислоты внутри каньона и
особенно в основании, являются вариабельными. Консервативные аминокисло-
ты, расположенные в основании каньона, вероятно, формируют точки прикреп-
ления вирусов к рецепторам на поверхности клетки и, предположительно, защи-
щают их от иммунных механизмов.
В этом отношении риновирусы подобны вирусу ящура, который имеет отно-
сительно гладкую поверхность без структуры каньона; места прикрепления к кле-
точным рецепторам локализованы на верхушке выступов поверхности вириона.
Эти участки являются весьма антигенными и определяют серотиповую специфич-
ность вируса ящура. Установлены общие закономерности в антигенной структуре
пикорнавирусов. Инфекция или иммунизация (146 S-частицами, но не 12-14
S-субъединицами) сопровождаются образованием вируснейтрализующих антител
(ВНА). Главный иммуногенный сайт локализован в VP1, хотя нейтрализующие
эпитопы локализованы в двух других капсидных белках - VP2 и VP3. [395, 583]
Обнаружена многокомпонентность эпитопов, учавствующих в нейтрализации ви-
руса. Замена только одной аминокислоты в эпитопе в процессе мутации может
привести к изменению антигенной структуры пикорнавирусов [583]. Ренгеност-
руктурный анализ позволил локализовать нейтрализующие антигенные участки
энтеровирусов. У вируса полиомиелита идентифицировано три основных нейтра-
лизующих участка: первый находится в VP1 и включает область аминокислот
89-100; второй - аминокислот 220-222 полипептида VP1 и аминокислот 270 или
164—172 полипептида VP2; третий - области аминокислот 58—60 и 70-74 поли-
пептида VP3 или аминокислот 286—290 полипептида VP1 и 58-59 полипепттида
VP3. таким образом, вирус полиомиелита содержит три основных антигенных уча-
стка, в которые вовлечены три капсидных белка. Первый нейтрализующий учас-
ток - непрерывный (области 89-100 аминокислот VP1), второй и третий — нейт-
рализующие состоят из двух областей: второй — из участков аминокислот белков
VP1, VP2, третий - из участков аминокислот полипептида VP3 или VP1 и VP3. [40]
Антигенные участки, связывающие антитела, не участвуют во взаимодейст-
вии полиовируса с клеточными рецепторами. У антигенных вариантов полиови-
руса устойчивость к нейтрализующим антителам сопровождалась аминокислот-
ными заменами во всех трех наружных капсидных белках. На VP1 полиовируса
типа 1 идентифицирован антигенный участок нейтрализации 1В. Он представ-
лен эпитопом, который формируется двумя петлями VP1, а также включает ами-
нокислотные остатки 69—104 и 141 — 152. Моноклональные антитела, реагирую-
щие с VP1 полиовируса типа 1, связывались с областью аминокислот 93—104 ука-
занного полипептида [1655]. Антигенные сайты сохраняли иммуногенную
активность в инвактивированной вакцине. Протеолитическая активизация VP1
полиовируса повышала его антигенность для мышей. Вирус гепетита А, в отли-
чие от полиовируса, по-видимому, обладает одним доминантным нейтрализую-
щим участком [1445]. Хотя у энтеровирусов отсутствует групповой антиген, тем
не менее, выявлены перекрестные реакции с антисыворотками на денатуриро-
ванные антигены [1668].
У энтеровирусов парнокопытных животных, кроме того, обнаружены общие
эпитопы в полипептидах VP1 [1562]. Вирус везикулярной болезни свиней содер-
жит три белка: VPI, VP2 и VP3 с молекулярной массой соответственно - 33, 29 и
32 кД. Белки VP1 и VP2 ответственны за индукцию ВН-антител [1548]. Энтеро-
вирусы энцефаломиелита и нефрита птиц антигенно не связаны между собой
[570].
У вируса ящура VP1 является иммунодоминантным полипептидом [1023].
Он ответственен за индукцию ВНА, а Т- и В-клеточные эпитопы находятся, ве-
роятно, в целой вирусной частице [272]. Кроме VP1, важные антигенные облас-
ти находятся в структуре VP2 и VP3 [932]. Три капсидных белка, экспонирован-
ных на поверхности вируса ящура, формируют четыре антигенных участка. Пер-
вый из них представлен аминокислотными остатками 140-160 белка VP1,
второй, третий и четвертый соответственно - VPI, VP2 и VP3 [892]. На поверх-
ности вируса ящура обнаружено три участка нейтрализации. Один выявлен
только на интактных вирионах (140S), второй — на инактивированных вирионах
и субединицах (12 S) и третий на 140S, 12S - структурах и полипептиде VP1
[1494]. Главный антигенный сайт вируса ящура - это участок соответствующий
141 — 160 аминокислотным остаткам белка VP1, образующий петлю G-Р, высту-
пающую на поверхности вириона |892, 1212, 1344]. За антигенную специфич-
ность вируса ответственны два вариабельных участка, включающие аминокис-
лотные остатки 42—60 и 134—158. Основным результатом «иммунологических»
мутаций вируса ящура во время эпизоотических вспышек (антигенный дрейф)
является изменение аминокислотной последовательности в VP1 [1129].
Эпитопы, расположенные в VPI, в отличие от эпитопов, расположенных в
VP2, чувствительны к трипсину.
Субвирусные частицы 12S вируса ящура содержат высококонсервативный
белок, который выявляется моноклональными антителами одной специфично-
сти у шести из семи известных типов вируса [1428]. Однако иммунизация ими не
сопровождалась образованием ВН-антител [479а]. Возможно, в создании специ-
фической защиты существенную роль играют Т-хелперы и антителозависимые
факторы иммунитета [1033]. Введение инактивированной противоящурной вак-
цины крупному рогатому скоту сопровождается образованием антител к капсид-
ным белкам и полимеразе ЗД, тогда как при репликации инфекционного вируса
дополнительно образуются антитела к неструктурным вирусным белкам (2В, 2С,
ЗАВ I и/или ЗС). Репликация инфекционного вируса вызывает синтез последних
независимо от предварительной вакцинации или клинического проявления за-
болевания. Данное явление дает возможность выявлять репликацию вируса
ящура и различать иммунных и инфицированных животных [323].
Нейтрализующий эпитоп риновируса человека типа 2 включает аминокис-
лотные остатки 153-164 2Р2 [1423]. Зрелые вирионы пикорнавирусов по антиген-
ности значительно превосходят собственные субвирусные частицы, образуемые
как в процессе синтеза и морфогенеза вирионов, так и при их дезинтеграции.
Это, по-видимому, в основном связано с конформационными изменениями
структурных полипептидов. При денатурации различными факторами полиови-
рус, например, может потерять сердцевину. Такая ДС-антигенная конверсия со-
провождается потерей способности индуцировать образование ВН-антител. У
вируса ящура образование ВН-антител практически вызывали только полные ви-
рионные (140S частицы), а не их компоненты. На этом основании об иммуноген-
ности инактивированных вакцин против данных заболеваний можно судить по
концентрации соответственно D- или 140S антигена.
Репликация вирусов
Полиовирус явился моделью для расшифровки репликации всех РНК-виру-
сов, в том числе и пикорнавирусов. Кроме полиовируса, существенный вклад в
этот процесс внесло изучение репликации вируса ящура.
Клеточными рецепторами для полиовируса, коксаки В вирусов, эховирусов
и некоторых риновирусов человека являются иммуноглобулины. Для других пи-
корнавирусов рецепторами клеточной поверхности служат другие молекулы,
включая гепаринсульфат, липопротеины низкой плотности, экстрацеллюмер-
ные протеины и интегрины. После проникновения в клетку и разрушения обо-
лочки вириона VPg отделяется от вирионной РНК клеточными ферментами.
Пикорнавирусы обладают КЭП — независимым механизмом трансляции. Рибо-
сомы связываются с 5'-нетранслируемой областью генома вируса, известной как
рибосомальный входной сегмент [IRES], Этот сегмент вирусной геномной РНК
связывается специфически с клеточными белками, которые играют ключевую
роль в начале синтеза вирусных белков и РНК. Геномы всех пикорнавирусов
имеют З'-поли (А) участок, который кодируется скорее вирусом, чем добавляет-
ся полиаденилирующими ферментами клетки-хозяина. Функция этих поли(А)
сегментов неизвестна, но их длина, казалось, прямо коррелировала с инфекци-
онностью вируса — РНК геном пикорнавирусов содержит одну открытую рамку
считывания, которая транслируется в один полипротеин. Полипротеин расщеп-
ляется посттрансляционно кодируемой вирусом протеиназой с образованием 11
или 12 белков. 5'-концевая область генома кодирует структурные белки
VP4, VP2, VP3 и VP1 в указанном порядке. Средняя область кодирует неструктур-
ные вирусные белки, включая одну вирусную протеазу. 3'-конец генома кодиру-
ет другие неструктурные белки, включая вторую протеазу и РНК-зависимую
РНК полимеразу.
Синтез вирусной РНК происходит в репликативном комплексе, который
включает РНК матрицы, кодируемую вирусом РНК полимеразу и несколько
других вирусных и клеточных белков, тесно связанных с вновь собранными
гладкими цитоплазматическими структурами. Синтез комплиментарных цепей
начинается на З'-концах вирионной РНК с использованием белка VPg в качест-
ве праймера. Основную массу репликативных продуктов в репликативном ком-
плексе составляют полноразмерные комплиментарные (—)РНК, среди которых
встречаются плюс-цепи, транскрибированные одновременно вирусной РНК-
полимеразой.
Из-за отсутствия КЭП-структуры на 5'-конце у пикорнавирусных мРНК эти
вирусы способны вовлекать необычный механизм прекращения трансляции
клеточных мРНК; одна из протеаз пикорнавирусов инактивирует КЭП-струк-
турный комплекс, который необходим для присоединения клеточных мРНК к
рибосомам. Таким образом, репликация пикорнавирусов характеризуется не
только цитоцидным эффектом, но также очень эффективной продукцией новых
вирионов. После эклипс периода и менее чем за 3 часа урожай может достичь 103
вирионов на 1 клетку.
Вирус гепатита А обычно трудно адаптируется к размножению в культуре
клеток. Во многих культурах клеток устанавливается персистентная инфекция
без ЦПД. Максимальный выход вируса (6,0—9,0 ТКИД50/мл) получают при ме-
ханическом разрушении клеток с целью освобождения вируса.
При заражении культуры клеток цитопатическим мутантом НМ175А синтез
вирусной РНК обнаруживали через 6 часов, а максимальное накопление виру-
са — через 12—27 часов. ЦПЭ развивается через 2—3 дня, урожай вируса достига-
ет 8,7 1g БОЕ/мл (20 инфекционных единиц на клетку). Характерной особенно-
стью репродукции вируса гепатита А является синтез небольшого количества не-
гативно полярной РНК и быстрая инкапсидация почти всего пула вновь
синтезированной (+)РНК во все периоды репликативного цикла [792].
Род афтовирусы
Ящур — высококонтагиозное, в большинстве случаев остропротекающее за-
болевание парнокопытных животных, сопровождающееся образованием вези-
кул и эрозий на слизистых оболочках пищеварительного тракта, в межкопытной
щели и венчике, а также на других безволосых участках кожи.
Ящур пока еще остается проблемой для многих стран. Раньше профилакти-
ка его основывалась главным образом на вакцинации крупного рогатого скота.
Вакцинацию мелкого рогатого скота и свиней хотя и проводили, но часто недо-
статочно эффективно.
Вирус ящура характеризуется большой вариабельностью антигенной струк-
туры. Различают семь антигенных типов вируса: О, А, С, SAT1, SAT2, SAT3 и
Азия 1. Иммунизация или переболевание одним из них не создает защиты про-
тив других типов вируса ящура. Кроме того, существуют несколько десятков
подтипов и вариантов вируса, существование которых затрудняет специфичес-
кую профилактику данного заболевания.
После переболевания вирус ящура может быть обнаружен у КРС спустя бо-
лее года, у овец — спустя 6 месяцев. Персистенция вируса не обнаружена у сви-
ней. Вирус ящура удалось выделить из глоточно-пищеводной области крупного
рогатого скота через 539 дней после заражения. Однако клинически здоровые
вирусоносители не являются эффективными распространителями вируса [1181].
Во время персистентной инфекции наблюдается быстрая эволюция вируса. То-
чечные мутации могут сопровождаться изменением вирулентности и антигенно-
сти [698].
РНК вируса ящура, как и РНК других вирусов, мутируют на несколько по-
рядков чаще, чем клеточное ДНК. Полагают, что с этим связано отсутствие точ-
ного считавания в процессе копирования генома [1449]. Поэтому в организме
инфицированного животного популяция вирусных геномов существует как «ви-
довое» явление [598]. Эта способность к быстрой геномной и антигенной измен-
чивости ответственна за существование 7 серотипов и множества антигенных ва-
риантов внутри серотипов.
Из четырех структурных белков VPI, VP2, VP3 и VP4, образующих капсид
вируса ящура, иммунодоминантным белком является VP1 [926]. Оказалось, что
иммуногенность вакцины связана с полными вирионами (1408-частицами). Ан-
тигенность вируса — значительно варьирует в зависимости от типовой и вариант-
ной принадлежности. При испытании трехвалентной инактивированной вакци-
ны установлено, что антиген А22 в 30 раз более иммуногенен, чем антиген Ор
Антиген типа СЗ занимал промежуточное положение [349]. Для создания одина-
кового защитного эффекта требовалось 220 нг 1408-антигена типа О; 4,36 нг —
типа С и 2,4 нг типа А. Продолжительность колострального иммунитета также
зависит от типа вируса. Ревакцинация индуцирует более выраженный иммун-
ный ответ, чем первичная вакцинация, при этом также отмечается расширение
антигенной специфичности. Например, у животных, вакцинированных одно-
кратно, развивается выраженный типоспецифический иммунитет на введение
только цельновирионного антигена (1408-антигена). В отличие от первичного
иммунного ответа, ревакцинация гетеротипичными антигенами меньшей актив-
ности стимулирует образование гомо- и гетеротипических антител. У вакцини-
рованных животных после реиммунизации цельновирионными (1408-антигена-
ми), инактивированными гомо- и гетеротипичными вакцинами наблюдается
повышение уровня ВНА, выработанных на первичное введение антигена, а так-
же появляются ВНА на вновь введенный антиген [454].
Основное значение в защите животных от заболевания принадлежит гумо-
ральным факторам иммунитета. Местный клеточный иммунитет проявляется в
перые дни после заражения и ярко выражен к моменту генерализованного афто-
образования. Возможную роль на этом этапе играет опсонизация макрофагов
[1035].
Антигенспецифические Т-клетки играют важную регуляторную роль в раз-
витии гуморального иммунитета. ВНА у КРС можно обнаружить через 3—4 дня
Таблица 46. Географическое распространение ящура
Регион Тип вируса
Южная Америка О, А, С
Европа О, А, С
Африка О, А, С, SAT1, SAT2, SAT3
Азия О, А, С, Азия 1
Северная и Центральная Америка Свободны от вируса
Океания Свободна от вируса
после заражения. Они достигают максимума через 10—14 дней и удерживаются
на этом уровне 30—40 дней, а затем их уровень постепенно снижается.
Клиническое выздоровление коррелирует с образованием антител. К концу
первой недели вырабатываются ВНА, а спустя еще несколько дней — компле-
ментсвязывающие антитела (КСА), и затем преципитирующие антитела (ПА).
ВНА сохраняются в течение нескольких месяцев, а КСА и ПА — 2—3 месяца. IgM
нейтрализуют гомо- и гетерологичные типы вируса, IgG — только гомологичный
тип вируса или его субтипы.
У переболевших животных, в отличие от привитых инактивированной вак-
циной, присутствуют антитела к полимеразе. Иммунитет обычно длится около
года и реже дольше. Он еще сохраняется после исчезновения нейтрализующих
антител и зависит от свойств инфицирующего штамма вируса, а также от реак-
тивности животного. Он всегда направлен против гомологичного типа вируса.
Против вариантов данного типа, как правило, также образуется хороший имму-
нитет. При очень напряженном иммунитете может проявляться некоторая ус-
тойчивость к заражению другими типами вируса [596].
С развитием методов культивирования вируса был создан ряд высокоэффек-
тивных инактивированных вакцин, отличающихся способом размножения,
инактивацией вируса и качеством адъювантов. Для крупного и мелкого рогатого
скота, как правило, применяют сорбированные вакцины, а для свиней — эмуль-
гированные. Современные инактивированные вакцины против ящура произво-
дят из вируса, выращенного в суспензии клеток. Вирус инактивируют N-ацети-
лэтиленимином и в качестве адъюванта добавляют ГОА или готовят двойную
масляную эмульсию. Систематическое применение инактивированной вакцины
во многих европейских странах привело к ликвидации болезни. Первоначально
вакцину готовили из вируса больных животных. Затем выращивали в экплантах
эпителия языка КРС, а позже в клеточных культурах. В начале использовали
первичную культуру клеток почки телят, а затем линию клеток почки молодого
хомяка [1458]. Последняя клеточная система была адаптирована к производству
инактивированной противоящурной вакцины [1436, 715]. Наконец появилась
самая современная технология крупномасштабного культивирования в суспен-
зии клеток. В основном используют линию клеток ВНК 21 [296] или, реже, ли-
нию клеток эмбриона хомяка NIL-2 [661] или IFA3 [1186].
Выбор производственного штамма вируса зависит от эпизоотической ситуа-
ции в соответствии с циркулирующими типами вируса. Актуальные эпизоотиче-
ские штаммы вируса ящура предварительно размножали в однослойных культу-
рах клеток почек крупного рогатого скота или свиней, а затем адаптировали к
размножению в суспензионной культуре клеток. После размножения в суспен-
зионной культуре вирус подвергают осветлению, фильтрации, инактивации,
очистке и концентрированию. Все операции проводят при рН=7,0—8,0 [401].
Содержание целых вирусных частиц (146S) является главной характеристи-
кой вирусного сырья, определяющей иммуногенную активность вакцины [1223].
При составлении вакцины необходимое количество антигена в прививной дозе
определяют исходя из концентрации 146S компонента. Необходимо иметь в
виду, что VP1 чувствителен к разрушению протеазами [462], которые могут сни-
жать его иммуногенность в процессе инактивации вируса [1660].
Инактивация вируса является одним из наиболее критических этапов изго-
товления противоящурной вакцины. Многие вспышки ящура в Европе в 1980-х
годах были связаны с применением инактивированной вакцины [316]. Первона-
чально использовали формальдегид для инактивации вируса адсорбированного
на ГОА. По мере совершенствования эта система в основном была заменена ис-
пользованием веществ, обладающих кинетикой инактивации первого порядка
из группы азиридинов, и в первую очередь диаметром этиленимина [276]. В иде-
але эта процедура выполняется дважды в различных сосудах.
Процесс инактивации контролируют титрованием вируса в чувствительной
культуре клеток, спектрофотометрическим анализом и серологически [1683].
С целью уменьшения объема и повышения эффективности вакцины исполь-
зуют концентрированный и частично очищенный вирусный антиген. После
инактивации вирус в производственных условиях концентрируют ультрафильт-
рацией, или полиэтиленгликолем, или полиэтиленоксидом, что дает возмож-
ность повысить концентрацию антигена в десятки и сотни раз [1183].
Безопасность готовой вакцины определяют на естественно восприимчивых
серонегативных животных, а элюированный из нее антиген — в чувствительной
культуре клеток. При 40°С вакцина сохраняет специфическую активность в тече-
ние 1 года.
Адъювант добавляют к инактивированной забуференной вирусной суспен-
зии. В жидком виде (после адсорбции инактивированного вируса на ГОА —
А1(ОН)3 и добавления сапонина) вакцину широко используют в мире для имму-
низации жвачных. В связи с недостаточным иммунитетом после применения
такой вакцины у свиней им стали применять концентрированную вакцину с
масляным адъювантом. Такую же вакцину применяли для КРС в Южной Аме-
рике [445]. Совершенствование такой вакцины было направлено на снижение
реактогенности. Эмульгированная вакцина была необходима для зон, где тре-
бовался длительный иммунитет у КРС и преодоление материнского иммуните-
та. Простая эмульсия вода в масле получена эмульгированием жидкого раство-
ра антигена с легким минеральным маслом и эмульгирующим агентом. Более
легко вводимый препарат получают путем дальнейшего эмульгирования во вто-
рой водной фазе до получения стабильной эмульсии вода в масле в воде (двой-
ная масляная эмульсия — DOE). DOE вакцина против ящура успешно применя-
лась для иммунизации КРС и свиней [597]. Ежегодно в мире методом суспензи-
онного культивирования в перевиваемых клетках с использованием
автоматизированных реакторов большой емкости производили 800—1000 млн
доз вакцины [296, 1112].
Однократное введение инактивированной вакцины сопровождается кратко-
временным иммунитетом продолжительностью 3—6 мес. С целью более надеж-
ной иммунизации животных обычно первоначально вакцинируют дважды с ин-
тервалом 2—4 недели. Ревакцинацию проводят через 4—12 месяцев в зависимос-
ти от эпизоотической обстановки, качества вакцины и возраста животных.
Концентрированная ГОА-сапониновая вакцина при однократном введении в
дозе 1 мл обеспечивала практически 100%-ную защиту скота при эксперимен-
тальном заражении общепринятым способом. Выраженный иммунитет наступа-
ет на 10—14 день и достигает максимума через 3-4 недели после вакцинации. Им-
мунитет у взрослых животных длится 6—12 месяцев. Ревакцинация значительно
усиливает иммунитет. При широкой профилактической вакцинации крупный
рогатый скот обычно ревакцинируют 1 раз в год, свиней — два раза. ВНА в сыво-
ротке крови появляются к концу первой недели, достигают максимального титра
в 3-5 недель, затем их концентрация постепенно снижается. ВНА быстрее появ-
ляются и достигают пика после введения сорбированных вакцин, однако после
применения эмульгированных вакцин титр антител выше и они сохраняются
дольше. Колостральный иммунитет хорошо выражен, антитела у телят сохраня-
ются в течение 5 мес., хотя пассивная защита продолжается до 3 мес.
Материнский иммунитет может подавлять эффект вакцинации у молодняка,
поэтому вакцинацию телят при систематической вакцинации коров начинают с
3—4 месячного возраста. Однако имеются доказательства, что телята отвечают на
вакцинацию в месячном возрасте или раньше [266].
Возникновение и течение ящура в неблагополучной зоне в значительной ме-
ре определяются групповым иммунитетом. Если уровень иммунитета в популя-
ции естественно восприимчивых видов животных превышает 75%, заболевание
будет под контролем, хотя такие меры, как контроль за импортом скота, каран-
тин и локальный убой скота в неблагополучном пункте являются эффективными.
Инактивированные вакцины могут быть моно- или поливалентными, то есть
содержать антигены одного или нескольких типов, подтипов и вариантов виру-
са. При изготовлении поливалентных вакцин количественное соотношение ви-
русных антигенов необходимо определять с учетом их иммуногенности.
Одновременная вакцинация крупного рогатого скота против ящура и чумы
оказалась возможной. Если инактивированную поливалентную ГОА-вакцину
против ящура и живую — против чумы вводить одновременно подкожно в об-
ласть шеи с разных сторон, то образуется такой же иммунитет, как и при раздель-
ной вакцинации против каждого заболевания. Исследования и разработки в об-
ласти специфической профилактики ящура достигли высокого уровня.
Инактивированные противоящурные вакцины являются высокоэффектив-
ными препаратами, а технология их изготовления основывается на самых совре-
менных достижениях биологической науки. Успех и изготовление инактивиро-
ванных противоящурных вакцин могут быть использованы в качестве прототип-
ных решений в исследованиях и разработках инактивированных вакцин против
других заболеваний человека и животных.
Остается неясным вопрос, могут ли современные инактивированные вакци-
ны защищать животных от латентного инфицирования в эндемичных по ящуру
регионах. Если нет, то какими они должны быть для достижения указанной цели.
Большой интерес представляют сведения о том, что у вакцинированных сви-
ней после экспериментального заражения при отсутствии клинических призна-
ков болезни вирус обнаруживали в достаточно высокой концентрации в полос-
ти рта в течение нескольких недель. Наличие его в ротовой полости находится в
прямой зависимости от уровня иммунитета. О приживлении вируса в организме
вакцинированных животных свидетельствовало также резкое нарастание титра
ВНА. Большой научный и практический интерес представляет выяснение места
размножения вируса у таких животных.
Живые вакцины против ящура не разработаны. Многочисленные попытки в
этой области не дали положительных результатов. Аттенуированные штаммы,
как правило, оказывались или слабоиммуногенными, или реверсибельными. В
этом отношении вирус ящура существенно отличался от вируса полиомиелита,
аттенуированные штаммы которого успешно применяют для пероральной им-
мунизации человека. Причина этих различий неизвестна. Возможно, что она за-
ключается в различном патогенезе этих заболеваний. Полиомиелит, как и мно-
гие вирусные заболевания, имеет сложный патогенез. Для их возбудителей ха-
рактерно первичное место репликации с последующим проникновением в один
или несколько органов-мишений. У полиовируса первичным местом размноже-
ния является кишечник, вторичным — центральная нервная система. Такие ви-
русы, по-видимому, относительно легко могут быть аттенуированны с помощью
селективного изменения тропизма в отношении вторичных органов-мишений.
В отличие от них, вирус ящура, как, впрочем, возбудители ряда других топикаль-
ных инфекций, практически не имеют вторичного органа-мишени. Получение
аттенуированных иммуногенных штаммов против таких заболеваний, вероятно,
требует иных подходов и представляет более сложную задачу.
Риновирус лошадей 1 по ряду свойств ближе стоит к афтовирусам, чем к дру-
гим пикорнавирусам [1686]. Некоторые штаммы этого вируса могут вызывать
виремию системное заболевание лошадей с респираторным синдромом. Вирус
может выделяться с фекалиями. Средства специфической профилактики не раз-
работаны.
Род энтеровирусы
Энтеровирусы являются убивкирарными и, вероятно, встречаются у всех по-
звоночных. Однако только некоторые из них вызывают выраженные заболева-
ния у человека, свиней и птиц. Многие энтеровирусы, выделенные у животных
разных видов, вызывают бессистемное инфицирование естественных хозяев.
Везикулярная болезнь свиней (ВБС) — остропротекающая болезнь, характери-
зующаяся лихорадкой с невысокой температурой и везикулярными поражения-
ми. Заболевание во всех отношениях напоминает ящур и практически отличает-
ся от него лишь тем, что поражает только свиней. Известны антигенные вариан-
ты вируса. Вирус размножается в местах кожных поражений. Переболевание
сопровождается иммунитетом и образованием ВНА, которые сохраняются в те-
чение 1 года. Колостральный иммунитет длится 2—3 недели. Для активной про-
филактики болезни предложен ряд инактивированных вакцин, различающихся
между собой методами культивирования и инактивации вируса, а также приме-
няемыми адъювантами. Вирус для изготовления вакцины выращивают в культу-
рах клеток свиного происхождения. Наиболее широко применяют перевивае-
мые линии клеток, такие как IBRS-2, которые выращивают в виде монослоя или
суспензии. Вирус в таких культурах накапливается в высоком титре
(8,0-9,0 1g ТЦД50 /мл), что дает возможность получить эффективные вакцинные
препараты без предварительного концентрирования вирусного антигена.
Технология изготовления достаточно эффективных вакцин разработана в
различных странах. Во Франции разработана эмульгированная формолвакцина,
которая в дозе 1 мл через 21 день защищала не менее 95% свиней от эксперимен-
тального внутрикожного заражения. В Англии (Пирбрайт) разработана доста-
точно эффективная вакцина, в которой для инактивации вируса использован
АЭИ, а в качестве адъюванта ГОА. В Румынии разработана эмульгированная
вакцина типа «масло в воде», сырьем для которой служит вирус, размноженный
во вращающихся однослойных или суспензионных культурах клеток IBRS-2 с
титром не ниже 7,7 1g ТЦД50 /мл. Однократное применение вакцины защищало
свиней от заболевания.
Изучение иммуногенности вакцины показало, что из 309 поросят, привитых
различными сериями вакцины, 268 (86,7%), были невосприимчивы к контроль-
ному заражению вирулентным штаммом вируса ВВС. У остальных свиней
(13,3%) отмечено более легкое клиническое проявление ВВС. Данные эпизоото-
логического эксперимента свидетельствуют, что в зараженном стаде вследствие
неконтролируемого заражения ВВС титр антител повышался у 45% вакциниро-
ванных свиней. Таким образом, иммунизация свиней инактивированной вакци-
ной создает достаточно высокий уровень защиты поголовья, обеспечивающий
ограничение размножения вируса и распространение ВВС.
В бывшем СССР разработана эмульгированная формолвакцина, которую
применяли однократно внутримышечно в дозе 2 мл. У привитых свиней имму-
нитет продолжался 8 мес. Вакцина сохраняет иммуногенность при 2—60°С в те-
чение 12 мес. [172].
Этеровирусный полиоэнцефаломиелит свиней (болезнь Тешена — БТ) — высо-
коконтагиозное заболевание свиней, характеризующееся признаками пораже-
ния центральной нервной системы: гиперстезия кожи, клонические и тоничес-
кие судороги, параличи передней и задней части тела. Болезнь чаще поражает
животных 1—3-месячного возраста, летальность может достигать 50%. Вирус БТ
свиней, подобно полиовирусу человека, вначале размножается в кишечнике, а
после развития вирусемии поражает клетки центральной нервной системы.
Только поражение последних вызывает заболевание как таковое. Животные ин-
фицируются гораздо чаще, чем проявляется болезнь. Латентное инфицирование
сопровождается образованием антител и иммунитета. В естественных условиях
инфицирование происходит через пищеварительный и дыхательный тракт. Пе-
реболевание свиней сопроводается развитием продолжительного иммунитета и
образованием ВНА. Иммунитет передается потомству с молозивом. Для специ-
фической профилактики болезни используют инактивированные и живые вак-
цины [169]. Аттенуированные штаммы вируса получают путем серийного пасси-
рования в первичной или перевариваемой культуре клеток почки свиньи. Так,
аттенуированный штамм Тюбинген получен после 130 пассажей вирулентного
штамма Конратис в первичной культуре клеток почек поросят. После двукратно-
го орального или подкожного введения штамм Тюбинген вызывал иммунитет у
80—85% животных. Живая вакцина, введенная в дозе не менее 6,0 ТЦД50 /мл
подкожно двукратно с интервалом три недели, вызывала иммунитет у 80—95%
свиней. Однократная вакцинация была неэффективной. У поросят, привитых в
возрасте <3 мес., образуется недостаточно напряженный иммунитет. Оказалось,
что живая вакцина небезопасна и, кроме того, практически не имеет преиму-
ществ перед инактивированной. Культуральная инактивированная эмульгиро-
ванная вакцина после однократного внутримышечного введения вызывала та-
кой же иммунитет, как и аттенуированный штамм после двукратного введения.
Глубокоаттенуированные и полностью авирулентные штаммы слабоиммуноген-
ны для свиней.
В России разработана (НПО НАРВАК) и применяется инактивированная
эмульгированная вакцина. Вакцину готовят из вируса, выращенного в одно-
слойной перевиваемой культуре клеток почки поросенка (8,0—9,0 1g ТЦД50/мл)
и инактивированного формалином. После однократного внутримышечного
применения в дозе 2 мл иммунитет наступает через две недели и продолжается
11 мес. Вакцина сохраняет активность при 2—80°С в течение 1 года. Поросята,
родившиеся от вакцинированных свиноматок, приобретают пассивный имму-
нитет на срок не менее 1 мес. Живую вакцину не применяют.
Вирусный гепатит утят (ВГУ) — остропротекающая болезнь, поражающая
утят в первые 3—4 недели жизни, характеризующаяся поражением печени и вы-
сокой летальностью (>50%). В более старшем возрасте у утят наступает выражен-
ная естественная резистентность, однако такая птица может инфицироваться,
выделять вирус и заражать утят. В сыворотке крови инфицированной птицы
присутствуют ВНА, титр которых особенно высок после клинического перебо-
левания. Антитела передаются потомству через яйцо. Желточный иммунитет
практически достаточен для защиты потомства от болезни в естественных усло-
виях. Известны два антигенных типа вируса. Большинство вспышек в различных
странах обусловлены вирусом типа 1 [728].
Для специфической профилактики ВГУ применяют живые и инактивиро-
ванные вакцины, иммунизируют племенных уток или 1—3-дневных утят. Пле-
менных уток прививают в расчете на то, что передаваемые ими трансовариально
антитела защитят утят в течение первых трех недель жизни. Утят с первых дней
жизни прививают живыми вакцинами, а племенных уток — живыми или инак-
тивированными вакцинами. Учитывая ослабление иммуногенности в процессе
аттенуации и принимая во внимание возрастную устойчивость к заболеванию,
иногда для иммунизации используют менее аттенуированные штаммы вируса,
чем для утят.
Аттенуированные штаммы вируса получают путем серийного пассирования
вирулентных штаммов в куриных (КЭ) или утиных (УЭ) эмбрионах. Вирус в ос-
новном накапливается в теле и хорион-аллантоисной оболочке эмбриона.
Обычно выраженная аттенуация наступает через 50—80 пассажей. Вирус стано-
вится авирулентным и не вызывает каких-либо патологических изменений у
однодневных утят. Только у отдельных особей в клетках печени обнаруживали
специфические включения [696]. Вакцинный штамм (Р-50) выделяли из печени,
селезенки и фекалий утят в течение 8—9 дней после прививки.
Аттенуированные штаммы могут передаваться горизонтально [283]. ИмДЮО
вакцины для однодневных утят зависит от наличия материнского иммунитета и
способа применения (энтерально, подкожно, аэрозольно) и соответсятвует при-
мерно 1000—10 000 ЭИД50 [283, 1681]. В практических условиях не отмечено раз-
ницы в эффективности иммунизации утят при подкожном введении вакцины и
выпаивании с питьевой водой.
Выраженной аттенуации вируса при серийном пассировании на утиных эм-
брионах (УЭ) также достигали после 50—55 пассажей. Аттенуированные таким
образом штаммы 050 и Н55 при подкожном введении в дозе 2000 ЭЛД50 2-днев-
ным утятам вызывали выраженную устойчивость к заражению вирулентным
штаммом через 24 часа. Однако эти аттенуированные штаммы восстанавливали
вирулентность после 2—4 пассажей на утятах [564]. Более выраженная аттенуа-
ция вируса оказалась возможной после 85 пассажей на УЭ, хотя при этом ослаб-
лялась иммуногенность. Такая вакцина, введенная 2-дневным утятам, в анало-
гичной дозировке защищала их от заражения только спустя 96 часов [1681]. ВНА
в высоком титре сохранялись до 30 недель.
Инактивированную эмульгированную вакцину готовили из вируса, размно-
женного на УЭ и КЭ. Иммунный ответ оценивали по титру ВНА у взрослых уток
и иммунитету, переданному трансовариально утятам. Вирус, размноженный в
УЭ и инактивированный БПЛ оказался более иммуногенным, чем инактивиро-
ванный вирус из эмбрионов кур. Удовлетворительный иммунный ответ наблю-
дали при трехкратной вакцинации уток в возрасте 8, 16 и 22 недель. Уровень ан-
тител у племенных уток был достаточным для защиты потомства в течение пер-
вых трех недель жизни [726].
В неблагополучных хозяйствах племенным уткам живую вакцину первый раз
вводят в возрасте 3 мес., во второй раз - за 4-2 недели до яйцекладки, а спустя 8
недель можно сделать третью прививку (в случае длительной яйцекладки). В
борьбе с ВГУ вакцинацию утят и племенных уток можно проводить раздельно
или совместно, исходя из конкретных условий.
С вирусом гепатита уток антигенно связан вирус гепатита индеек, обнару-
женный в 1959 г. в Канаде и США ]1135].
реболевание свиней сопроводается развитием продолжительного иммунитета и
образованием ВНА. Иммунитет передается потомству с молозивом. Для специ-
фической профилактики болезни используют инактивированные и живые вак-
цины [ 169]. Аттенуированные штаммы вируса получают путем серийного пасси-
рования в первичной или перевариваемой культуре клеток почки свиньи. Так,
аттенуированный штамм Тюбинген получен после 130 пассажей вирулентного
штамма Конратис в первичной культуре клеток почек поросят. После двукратно-
го орального или подкожного введения штамм Тюбинген вызывал иммунитет у
80—85% животных. Живая вакцина, введенная в дозе не менее 6,0 ТЦД50 /мл
подкожно двукратно с интервалом три недели, вызывала иммунитет у 80—95%
свиней. Однократная вакцинация была неэффективной. У поросят, привитых в
возрасте <3 мес., образуется недостаточно напряженный иммунитет. Оказалось,
что живая вакцина небезопасна и, кроме того, практически не имеет преиму-
ществ перед инактивированной. Культуральная инактивированная эмульгиро-
ванная вакцина после однократного внутримышечного введения вызывала та-
кой же иммунитет, как и аттенуированный штамм после двукратного введения.
Глубокоаттенуированные и полностью авирулентные штаммы слабоиммуноген-
ны для свиней.
В России разработана (НПО НАРВАК) и применяется инактивированная
эмульгированная вакцина. Вакцину готовят из вируса, выращенного в одно-
слойной перевиваемой культуре клеток почки поросенка (8,0—9,0 1g ТЦД50/мл)
и инактивированного формалином. После однократного внутримышечного
применения в дозе 2 мл иммунитет наступает через две недели и продолжается
11 мес. Вакцина сохраняет активность при 2—80°С в течение 1 года. Поросята,
родившиеся от вакцинированных свиноматок, приобретают пассивный имму-
нитет на срок не менее 1 мес. Живую вакцину не применяют.
Вирусный гепатит утят (ВГУ) — остропротекающая болезнь, поражающая
утят в первые 3—4 недели жизни, характеризующаяся поражением печени и вы-
сокой летальностью (>50%). В более старшем возрасте у утят наступает выражен-
ная естественная резистентность, однако такая птица может инфицироваться,
выделять вирус и заражать утят. В сыворотке крови инфицированной птицы
присутствуют ВНА, титр которых особенно высок после клинического перебо-
левания. Антитела передаются потомству через яйцо. Желточный иммунитет
практически достаточен для защиты потомства от болезни в естественных усло-
виях. Известны два антигенных типа вируса. Большинство вспышек в различных
странах обусловлены вирусом типа 1 [728].
Для специфической профилактики ВГУ применяют живые и инактивиро-
ванные вакцины, иммунизируют племенных уток или 1—3-дневных утят. Пле-
менных уток прививают в расчете на то, что передаваемые ими трансовариально
антитела защитят утят в течение первых трех недель жизни. Утят с первых дней
жизни прививают живыми вакцинами, а племенных уток — живыми или инак-
тиварованными вакцинами. Учитывая ослабление иммуногенности в процессе
Энцефаломиелит птиц — остропротекающее заболевание цыплят, реже индю-
шат, характеризующееся дрожанием головы и шеи, нарушением координации
движений, парезом конечностей, а также высокой заболеваемостью и смертнос-
тью (-50%). Типичная клиника поражения центральной нервной системы раз-
вивается у цыплят в период между 1—4 неделями жизни. В более поздний пери-
од цыплята не заболевают, но происходит бессимптомное инфицирование. У не-
сушек может наблюдаться снижение яйценоскости. Вирус передается
горизонтально и вертикально — через яйцо цыпленку. Инфицирование кур со-
провождается образованием антител и развитием прочного и длительного имму-
нитета (около 1 года). Материнские антитела защищают цыплят в течение пер-
вых шести недель жизни. На фоне пассивного иммунитета они могут заражаться
инапарантно, что вызывает развитие активного иммунитета. Инфицированная
птица выделяет высококонтагиозный вирус с пометом. Несушки передают вирус
трансовариально в течение трех недель после заражения. Имеется 1 антигенный
вирус. Вирус может вызывать легкопротекающий энцефаломиелит у индеек и
фазанов.
Для профилактики болезни применяют живые и инактивированные вакци-
ны. Вакцинацию проводят для предупреждения передачи вируса через яйцо и
чтобы заболевание не было передано потомству. Живую вакцину следует приме-
нять в таком возрасте, когда она не окажет отрицательного влияния и обеспечит
создание иммунитета.
Поскольку при отсутствии материнских антител применение живой вакци-
ны в течение первых шести недель выращивания может вызвать заболевание, а
наличие материнских антител за первые восемь недель выращивания может по-
давить образование иммунитета, то вакцинацию проводят обычно в возрасте 8
недель и старше. Живые вакцины можно применять, добавляя их в питьевую во-
ду, что обеспечивает длительный иммунитет и достаточно высокую степень за-
щиты птицы.
Род кардиовирусы
Вирус энцефаломиокардита. Естественным хозяином являются грызуны.
Вирус передается от грызунов человеку, обезьянам, лошадям, крупному рогато-
му скоту и свиньям. Вспышки энцефаломиокардита с летальным исходом отме-
чали у свиней. Случаи заболевания наблюдали у других животных, в том числе и
слонов.
Род риновирусы
У крупного рогатого скота известны три серотипа, у человека — более 100 се-
ротипов. Риновирусы вызывают легкопротекающие респираторные симптомы.
10.24. Калицивирусы
Семейство Caliciviridae объединяет большую группу сходных по морфологии
и отличных по антигенным свойствам РНК-позитивных однонитевых вирусов,
вирионы которых имеют характерную морфологию с чашеобразными углубле-
ниями на сферической поверхности капсида, откуда происходит их название
(calyx, или chalice - чаша).
В составе семейства 4 рода: везивирусы, лаговирусы, Норфолк-подобные ви-
русы (норовирусы) и Саппоро-подобные вирусы (саповирусы). Первые два рода
включают вирусы, патогенные для животных, последние два рода включают в
основном вирусы, патогенные для человека [131]. Совсем недавно считали, что
калицивирусы имеют ограниченный круг хозяев и поражают только свиней, ко-
шек и морских львов. Однако за последнее время получены изоляты от моржей,
людей, обезьян, телят, цыплят, норок, рептилий, амфибий и насекомых. Пато-
генность одних калицивирусов для естественного хозяина доказана, для дру-
гих — требует выяснения. Некоторые из них еще недостаточно изучены.
Прототипным вирусом семейства является вирус везикулярной болезни сви-
ней (ВЭС). Вызываемое им заболевание впервые обнаружено в 1932 г. в Южной
Калифорнии и ликвидировано в США в 1956 г. В настоящее время ВЭС считает-
ся экзотической болезнью, хотя вирус все еще присутствует у морских млекопи-
тающих и представляет потенциальную угрозу для свиней, о чем свидетельству-
ет возникновение заболевания в 1972 г. в одном свиноводческом хозяйстве на ос-
трове Сахалин.
Известны калицивирусы, которые связаны с системными заболеваниями.
Например, энтеритный калицивирус крупного рогатого скота и энтеритный ка-
лицивирус свиней вызывают диарею и анорексию сооответственно у телят и по-
росят. Калицивирус кур вызывает у цыплят остановку роста и высокую смерт-
ность. Калицивирус приматов (Pan!) вызывает персистентную инфекцию и об-
разование везикул. Калицивирусы человека вызывают диарею, обезвоживание,
лихорадку, колики и недомогание. Один вирус связан с везикулярными пораже-
ниями гениталий собак [1135]. Известны калицеподобные вирусы. Так, напри-
мер, из содержимого кишечника поросят с признаками диареи выделен вирус,
сходный с калицивирусами. Клетками-мишенями его были эпителий ворсинок
тонкого отдела кишечника поросят. Вирус антигенно отличался от возбудителя
ВЭС [671]. Калицивирусы легко идентифицируются в PH и методом перекрест-
ного иммунитета.
Род везивирусы, кроме вируса ВЭС (13 серотипов), включает вирусы мор-
ских львов Сан Мигель (17 серотипов), калицивирус кошек, калицивирус кито-
вых (Тиг-1), калицивирус приматов ( Рап-1) и калицивирус рептилий (Сго-1).
Род лаговирусы представлен вирусом геморрагической болезни кроликов и
вирусом, вызывающим синдром коричневой печени европейских зайцев [1135].
Калицивирус морских львов обнаружен в 1972 г. на острове Сан-Мигель и на-
зван вирусом морских львов Сан-Мигель. По основным свойствам он не отлича-
ется от ранее хорошо известного вируса везикулярной экзантемы свиней и бли-
зок по спектру хозяев, а также антигенным свойствам. Патогенный для свиней
калицивирус был выделен также от океанской рыбы. Этим установлено, что мор-
ские львы, а также другие ластоногие могут служить естественным резервуаром
калицивируса, что явилось первым сообщением о выделении от морских живот-
ных вируса, способного вызвать заболевание сухопутных животных [61, 172].
В 2000 г. принята современная классификация норовирусов, в основе кото-
рой лежит филогенетический анализ участка гена, кодирующего белок капсида
размером 283 пн и аминокислотной последовательности размером 94 амино-
кислот, соответствующей данной области генома. В соответствии с предложен-
ной классификацией норовирусы разделяются на 3 генотипа. В отличие от но-
ровирусов генотипов 1 и 2, патогенных для человека, норовирусы генотипа 3
вызывают заболевания только у крупного рогатого скота и характеризуются
меньшей вариабельностью генома. Вирусы генотипа 1 обнаружены у людей, ге-
нотипа 2 - у людей и свиней. Недавно был выделен норовирус мышей (Murine
Norovirus-1).
Саповирусы являются вторым патогенным для человека родом семейства и
характеризуются более высокой консервативностью генома по сравнению с но-
ровирусами. Согласно последней классификации саповирусов, основанной на
филогенетическом анализе нескольких участков генома, выделяют 3 генотипа
саповирусов. Только генотипы 1 и 2 саповирусов патогенны для человека. Гено-
тип 3 саповирусов (porcine enteric calicivirus — PEC) поражает желудочно-кишеч-
ный тракт свиней и в отличие от других сапо- и норовирусов способен репроду-
цироваться в культурах клеток in vitro. Имеется предположение о способности
калицивирусов образовывать рекомбинанты.
Сведения, накопленные за последние 20 лет, показали, что кальцивирусная
инфекция у людей является широко распространенным заболеванием, поража-
ющим преимущественно детское население. Кальцивирусная инфекция челове-
ка выявлена во всех странах мира, где проводились исследования: США, Вели-
кобритании, Японии, России, Франции, Швеции, Китае и др. [131].
Многие известные на сегодня калицивирусы млекопитающих, птиц и чело-
века, в том числе вирус гепатита Е, входят в состав семейства, но пока не опре-
делена их родовая принадлежность.
Вирионы представляют собой безоболочечный нуклеокапсид кубической
симметрии диаметром 35-40 нм. Они содержат 180 идентичных молекул белка
(м. 60 000), собранных в димеры, формирующие 90 дугообразных структурных
единиц, которые образуют 32 чашеобразных поверхностных углублений, прида-
ющих вирионам уникальный вид. На проекции вириона видны 10 выступов,
представляющих собой края чашеобразных углублений [172, 732]. Обычно при-
нятое понятие о капсомерах считается неприемлемым для калицивирусов.
Некоторые изоляты клицивирусов, вызывающие энтериты (Норфолк-виру-
сы), теряют характерную поверхностную структуру и приобретают вид пушинок,
получившие название «мелкие круглые структурированные вирусы» (SRSV).
't а srfiastaiaii^eiiliiiiUihiit'S ай: h'h н.,: на
Структурные белки составляют 82% массы вириона. В вирионе находятся
один главный и один минорный полипептиды. Кроме того, имеется один не-
большой полипептид (VPg), играющий важную роль в инфекционное™ и кова-
лентно связанный с вирионной РНК. Молекулярная масса этих белков соответ-
ственно составляет 60—70, 15—19, 10—15 кД. На долю минорного полипептида
приходится около 2% массы всего капсидного белка. Не исключается, что этот
полипептид является клеточным компонентом. В вирионе содержится 180 моле-
кул главного и, по-видимому, 12 молекул минорного полипептида.
Геном представлен одной молекулой линейной, одноцепочечной РНК, раз-
мером 7,4—7,6 пн. 5'-конец генома кэппирован ковалентно связанным белком
VPg, а З'-конец полиаденилирован. Геномная РНК и несколько субгеномных
РНК образуются в процессе репликации; зрелые белки образуются двумя путя-
ми расщеплением полиопротеина и трансляцией субгеномных мРНК. Геномная
РНК инфекционна. Вирусы относительно устойчивы к нагреванию и детерген-
там, но чувствительны к низким pH (>99% инактивируются при рН=3,0).
Калицивирусы размножаются в цитоплазме. Вирусы везикулярной экзанте-
мы свиней и калицивирус кошек хорошо размножаются с ЦПЭ в культурах кле-
ток естественных хозяев и в некоторых перевиваемых линиях клеток. Однако не-
которые калицивирусы млекопитающих плохо размножаются или не размножа-
ются in vitro [732, 1135].
Три открытые рамки считывания (ОРС) кодируют структурные и неструк-
турные белки, которые являются предшественниками структурных белков, фер-
ментами и факторами регуляции инфекционного процесса в зараженной клетке.
К структурным белкам относятся геликаза, протеаза, полимераза (ОРС 1) и бе-
лок капсида (ОРС 2) [131]. ОРС 2 кодирует белок из 116 аминокислот неизвест-
ной функции, который транслируется с 2400 по мРНК и, возможно, является
капсидным белком.
Различные калицивирусы используют две различные схемы транскрипции.
В качестве примера могут служить калицивирус кошек и вирус геморрагической
болезни кроликов (ГБК). У последнего неструктурные и структурный белок ко-
дируются одной ОРС, образуя единый полиопротеин, который расщепляется
посттранскрипционно. Транскрипция калицивируса кошек и, вероятно, кали-
цивируса ВЭС является результатом функционирования двух видов мРНК: одна
соответствует целому геному, другая — субгеномному участку размером 2400 по.
Последняя является бицистронной, кодирующей считывание фрагментов 2 и 3.
Подобные разновидности РНК (7500 и 2200 по) различают у вируса ГБК. Неиз-
вестно, где оба вида РНК расположены в одних или разных вирионах.
VPg белок (м. 10 000-15 000) связан с 5'-концом РНК обоих видов. Неструк-
турные белки 2С геликаза ЗС трипсиноподобная сериновая протеаза и ЗД поли-
мераза подобны тем, которые обнаружены у пикорнавирусов. Индивидуальные
неструктурные белки освобождаются из полипротеина специфическими вирус-
ными протеазами каскадно подобно пикорнавирусам. Геномная РНК реплици-
руется посредством синтеза промежуточной (—)РНК.
Вирионы накапливаются в цитоплазме в виде аморфных или паракристалли-
ческих образований или характерных линейных структур, связанных с цитоске-
летом. Вирионы освобождаются при лизисе клеток [782, 1135].
Везикулярная экзантема свиней (ВЭС)
Везикулярная экзантема свиней (ВЭС) — заболевание, клинически сходное с
ящуром. Вирус ВЭС имеет 13 антигенных типов. Общий антиген у различных се-
ротипов вируса ВЭС выявлен в РСК. Небольшие перекрестные реакции между
различными серотипами обнаружены в PH [172].
В 1972 г. от морских котиков, обитающих на острове Сан-Мигель (Калифор-
ния) выделили вирус, который вызывал у них аборты и везикулярные поражения
плавников. Вирус получил название вирус морских львов Сан-Мигель (МЛСМ).
Хотя этот вирус серологически отличался от 13 серотипов вируса ВЭС, он вызы-
вал везикулярную болезнь у свиней и, вероятно, является разновидностью виру-
са ВЭС. Об этом свидетельствует выделение вируса МЛСМ от клинически здо-
ровых свиней и наличие антител к антигенным вариантам вируса (ВЭС и
МЛСМ) у морских млекопитающих, диких и домашних свиней. Эти данные так-
же свидетельствуют, что ВЭС как вирусная болезнь не может считаться искоре-
ненной, даже если она не встречалась у свиней более 20 лет.
В естественных условиях поражаются свиньи и, возможно, ластоногие.
Штаммы вируса МЛСМ были выделены от рыб и беспозвоночных, паразитиру-
ющих на морских львах.
К экспериментальному заражению некоторыми штаммами вируса ВЭС вос-
приимчивы обезьяны, лошади, хомяки, собаки. Спектр чувствительности куль-
тур клеток оказался ограниченным. Наиболее чувствительны первичные и пере-
виваемые культуры клеток свиного происхождения. Известно 13 серотипов ви-
руса ВЭС и 17 у вируса, выделенного от морских львов. Переболевание
сопровождается развитием выраженного иммунитета к гомологичному серотипу
вируса и образованием различных антител. Типовую специфичность вируса оп-
ределяют в PH и РСК.
ВЭС в США была ликвидирована в 1956 г. ветеринарно-санитарными мера-
ми. В связи с появлением ВЭС в 1972 г. на о. Сахалин в СССР была разработана
инактивированная эмульгированная вакцина, которая после однократного вну-
тримышечного введения в дозе 2 мл вызывала иммунитет продолжительностью
6 месяцев. С применением этой вакцины заболевание свиней удалось быстро
ликвидировать.
Ринотрахеит кошек (РТК)
Ринотрахеит кошек (РТК) является одним из двух основных респираторных
заболеваний этого вида животных. Заболевание распространено широко в мире
и характеризуется повышением температуры, развитием ринита, конъюктивита,
бронхита, трахеита и реже — пневмонии. Вирусные штаммы значительно разли-
чаются между собой по вирулентности, особенно для котят, у которых деталь-
ность может достигать 30%. В неосложненных случаях заболевание длится 5-7
дней. Реконвалесценты являются длительными носителями и выделителями ви-
руса. Состояние носительства может продолжаться несколько лет.
У кальцивируса кошек отсутствуют антигенные варианты. Обнаружены не-
большие антигенные связи между некоторыми серотипами вирусов ВЭС,
МЛ СМ и калицивирусом кошек [172].
У калицивируса кошек выявлено семь эпитопов нейтрализации, четыре из
которых располагались на капсидном белке массой ~67 кД. Полные вирионы и
15S субвирусные частицы содержат основной капсидный белок, а также общий
эпитоп нейтрализации [1528]. Раздельная иммунизация кроликов вирионами и
158-частицами показала, что оба антигена индуцируют синтез ВН-антител. По-
лученные данные позволяют считать перспективным создание вакцины из 15S
компонента [172]. Для специфической профилактики широко применяют жи-
вые и инактивированные вакцины. Живые вакцины готовят из искусственно
[344] и естественно [74] аттенуированных штаммов вируса. Обычно кошек вак-
цинируют против калицивируса и герпесвируса 1 кошек [1135].
Геморрагическая болезнь кроликов
Остропротекающее высококонтагиозное лихорадочное заболевание заячьих.
Характеризуется выраженной виремией, геморрагическими изменениями в лег-
ких и печени, высокой заболеваемостью и смертностью (до 100%).
В 1984 г. в Китае появилось ранее неизвестное высокоинфекционное забо-
левание европейских кроликов, которое характеризовалось геморрагичсескими
изменениями, особенно в легких и печени. Это заболевание получило название
геморрагическая болезнь кроликов (ГБК). Вирус геморрагической болезни
кроликов, впервые обнаруженный в КНР, а затем в Европе и ряде других стран,
оказался калицивирусом. [1176]. Причина появления нового вируса остается за-
гадкой.
Вирионы ГБК обладают гемагглютинирующей активностью и вызывают об-
разование соответствующих антител у инфицированных кроликов или иммуни-
зированных животных.
Вирус в основном передается фекально-оральным путем. Инкубационный
период длиться 48—72 часа. Болезнь чаще всего протекает без клинических при-
знаков и заканчивается внезапной гибелью кроликов.
Многочисленные попытки размножить вирус в различных первичных, дип-
лоидных и перевиваемых культурах клеток многих видов млекопитающих завер-
шились неудачей. Опасность быстрого и значительного распространения болез-
ни требует профилактической вакцинации. Используют инактивированную вак-
цину из тканей инфицированных кроликов, содержащих вирус в высокой
концентрации. Первая инактивированная формолвакцина была разработана в
Китае в 1985 г. [973].
Другие авторы вирус инактивировали бета-пропиолактоном, а в качестве
адъюванта применяли гидроокись алюминия (ГОА). На 4—7 день после вакцина-
ции у всех животных отмечена сероконверсия. Иммунитет продолжался 15 мес.
после вакцинации, а антигемагглютинины сохранились 18 мес. [256].
Тканевая (ГОА) вакцина, инактивированная формалином, создавала имму-
нитет с 3—4 дня после вакцинации, который сохранялся не менее 6 месяцев.
Масляно-эмульсионная тканевая вакцина обладала более выраженной иммуно-
генностью. Индукция резистентности вскоре после вакцинации связана с кле-
точными факторами защиты, а антитела обеспечивают длительный иммунитет.
Отмечена корреляция между степенью вакцинального иммунитета и титром ан-
тигемагглютининов. Быстрое наступление невосприимчивости и продолжитель-
ный иммунитет делают вакцины против ГБК необычными в ряду инактивиро-
ванных вакцин против других вирусных заболеваний.
10.25. Астровирусы
Впервые обнаружены в 1975 г. при электронной микроскопии фекалий детей
с признаками диареи. Позже тем же методом они были обнаружены у широкого
круга домашних животных: крупного и мелкого рогатого скота, свиней, собак,
кошек, мышей, индеек и уток. Астровирусы, вероятно, являются обычными
обитателями пищеварительного тракта молодых животных и, как правило, свя-
заны с гастроэнтеритами, но, в отличие от некоторых других вирусов, не вызы-
вали или редко вызывали тяжелое заболевание или гибель, за исключением уток
[1135, 1415].
Семейство астровирусов включает один род с одноименным названием Аст-
ровирусы с отчетливыми видо-специфическими различиями. Известны вирусы:
человека (7 серотипов), КРС (3 серотипа), свиней (1 серотип), овец, собак, ко-
шек, оленей, мышей, индеек и уток (по 1 серотипу). Астровирусы человека и раз-
ных видов животных не связаны между собой антигенно [1025, 1135]. Название
астровирусы происходит от того, что поверхность некоторых вирионов имеет
вид 5- или 6-конечных звезд (astron, star). Астровирусы по некоторым свойствам
подобны калицивирусам и пикорнавирусам, но отличаются от них размером и
структурой вирионов, а также кодирующей емкостью генома и стратегией реп-
ликации (2500). Безоболочечные вирионы икосаэдрической симметрии диамет-
ром 28—30 нм. Поверхность (при негативном контрастировании) некоторых ви-
рионов (-10%) имеет вид 5- или 6-конечных звезд. Капсид диаметром 33 нм по-
крыт 30 димерными отростками, выступающими над поверхностью вириона на
5 нм. Вирионы устойчивы при рН=3,0, а также к хлороформу, различным детер-
гентам и растворителям липидов.
Астровирусы человека содержат 3 белка Pl (~33 th), Р2 (-33 кД) и РЗ
(25—28 кД). Вероятно, существует предшественник капсидных белков (87 кД),
который расщепляется на 3 белка (34; 29 и 26 тн), при этом вирионы приобрети-
ют инфекционность. В структуре астровирусов овец и свиней обнаружено соот-
ветственно 2 (~35 кД) и 4 полипептида (13-19 кД) (2611).
Геном представлен одной молекулой линейной положительной полярности
одноцепочечной РНК размером 6,8 тн. Геномная РНК на 5'-конце ковалентно
связана с белком VPg, полиаденилированная на З'-конце и обладает инфекцион-
ностью. Вирион содержит 2—3 главных капсидных белка (90 и 27—30 кД) и не-
сколько минорных или неструктурных белков. Субгеномная мРНК образуется в
процессе репродукции; структурные вирусные белки образуются в процессе
трансляции субгеномной РНК с образованием и последующим расщеплением
полипротеина.
Астровирусы человека и разных видов животных (КРС, овец, свиней и уток)
не связаны антигенно между собой.
Астровирусы обладают уникальным геномом среди позитивно-полярных од-
ноцепочечных РНК вирусов животных, что проявляется в использовании сдви-
га рибосомальной рамки считывания при экспрессии РНК полимеразы и коди-
ровании сериновой протеазы. В этом отношении астровирусы подобны только
лютеовирусам растений.
Имеются некоторые доказательства, что вирусная РНК и белок астровирусов
КРС и, возможно, других видов в процессе репликации локализуются в ядре.
Доказательства этого факта может стать другим признаком, дифференцирую-
щим эти вирусы от пикорна- и калицивирусов.
Геном астровирусов содержит три открытых рамки считывания: две (ORF-la
и ORF-lb) расположены на 5'-конце и связаны со сдвигом рибосомальной рамки
считывания и кодируют последовательный синтез неструктурных вирусных бел-
ков, сериновую протеазу и РНК-тзависимую РНК полимеразу. Рамка считывания
на З'-конце (ORF-2) кодирует структурные белки в виде полипротеинового пред-
шественника. Другие кодирующие последовательности, найденные у пикорнави-
русов и калицивирусов, указывают на РНК-геликазу, метил-трансферазу, папа-
инподобную протеазу и VPg белок, хотя они не идентифицированы в геноме аст-
ровирусов. В течение инфекции образуются два вида РНК, полногеномная и
меньшая (до 2,4 тн) субгеномная РНК, которая кодирует главные капсидные бел-
ки, продуцируемые в большом количестве. Открытые рамки считывания являют-
ся общими для двух видов РНК. Нет доказательств, что субгеномная РНК вклю-
чается в вирионы, как у калицивирусов. В результате трансляции образуются два
полипротеина, один включает неструктурные белки, другой - структурные бел-
ки, образующиеся в результате пострансляционного расщепления [1025].
Астровирусный гастроэнтерит встречается у молодых животных и протекает
в основном субклинически и напоминает ротавирусную инфекцию. Астровирус
у ягнят разрушает зрелые эритроциты поверхности сосочков, ведущий к их атро-
фии и гипертрофии крипт. У телят инфекция локализуется в специфических М-
клетках и абсорбтивных энтероцитах. У утят до 6-недельного возраста развива-
ется гепатит с обширным гепатоцеллюлярным некрозом, смертность может до-
стигать 50%.
Животные более старшего возраста являются иммунными. Иммунитет, веро-
ятно, длится годами. Астровирусы разных видов млекопитающих не связаны ан-
тигенно между собой.
Астровирусы человека, КРС и свиней обычно размножаются в первичных
культурах клеток почки эмбрионов гомологичных видов животных. В каждом
случае для активации инфекционности вирионов требуется присутствие трипси-
на (10 мкг/мл). Местом размножения является цитоплазма, зрелые вирионы на-
капливаются в цитоплазме, формируя кристалло-подобные образования, и вы-
деляются при лизисе клеток. В фекалиях астровирусы могут присутствовать в
концентрации Ю10 частиц/г (а калицивирусы <106 частиц/г) [1135].
10.26. Флавивирусы
Семейство флавивирусы включает 3 рода: флавивирусы, пестивирусы и гепа-
цивирусы. Несмотря на то, что вирусы семейства имеют подобные геномы и
сходные физико-химические свойства, они значительно различаются между со-
бой биологически. Род флавивирусов включает более 60 вирусов, из которых
около 30 связаны с членистоногими переносчиками вирусов патогенных для че-
ловека. Эти вирусы вызывают различные заболевания от эфемерной лихорадки
до геморрагической лихорадки и энцефалитов. Около 10 альфавирусов патоген-
ны для животных, вызывая малораспространенные заболевания (менингоэнце-
фалит индеек, шотландский энцефалит овец, болезнь Вессельсборна). Прото-
типным вирусом рода флавивирусов является вирус желтой лихорадки.
Род пестивирусы включает 4 вируса. Кроме вируса классической чумы сви-
ней (КЧС), в него входят еще три вируса, представляющих 6 антигенных групп:
2 вируса диареи КРС (BVDV-1 и BVDV-2), 3 вируса пограничной болезни овец
(BDV-1, BDV-2, BDV-3), и одну антигенную группу представляет штамм Н138,
выделенный от жирафа в Кении [311]. Прототипным вирусом рода является ви-
рус диареи КРС 1 (штамм Орегон C24V).
Род гепацивирусы представлен вирусом гепатита С (6 генотипов) и вирусами
гепатитов G.
Вирионы флави- и пестивирусов имеют форму сферических частиц диамет-
ром 40—50 нм. В центре расположен нуклеокапсид, вероятно, кубической сим-
метрии (диаметр ~30 нм), который окружен тесноприлегающей липидной обо-
лочкой с неразличимыми пепломерами на поверхности. Зрелые вирионы содер-
жат 6% РНК, 66% белка, 9% углеводов и 17% липидов [1349].
Геном состоит из одной линейной молекулы одноцепочечной (+)РНК раз-
мером 10,6 (флавивирусы), 12,5 (пестивирусы) или 9,5 (гепацивирусы) тн. 5'-ко-
нец, за исключением немногих флавивирусов, передающихся членистоногими,
имеет КЭП-структуру. З'-конец обычно не полиаденилирован и имеет короткий
нетранслируемый участок.
Вирусный геном содержит одну длинную открытую рамку считывания, ко-
дирующую около 10 белков, которые образуются в результате расщепления по-
липротеина в процессе или вскоре после трансляции.
Репликация вируса сопровождается синтезом комплиментарных (—)РНК,
которые затем служат матрицей для синтеза геномной (+)РНК. Преобладающий
синтез (+)РНК предполагает наличие комплекса регуляторных механизмов в
клетках хозяина. Только вирусные мРНК представляют геном, транслирующий-
ся с образованием единого полипротеина, который расщепляется с образовани-
ем структурных и неструктурных белков. Сборка вирионов происходит на мемб-
ранах эндоплазматической сети (на плазматической мембране клеток членисто-
ногих), но наличия преформированных капсидов и почкования при этом не
отмечено. Полностью сформированные вирионы появляются в цистернах эндо-
плазматической сети и освобождаются путем экзоцитоза или при цитолизе (без
очевидного почкования) [1135].
Вирионы содержат 3 (флавивирусы) или 4 (пестивирусы) белка, которые коди-
руются 5'-концом генома, неструктурные белки кодируются 3'-концом генома.
Структурными белками являются: нуклеокапсидный белок С, трансмемб-
ранный белок М, который образуется из гликозилированного предшественника
ргМ расщеплением в процессе вирусного созревания; и Е белок (Е1 и Е2 у пес-
тивирусов) — главный пепломерный гликопротеин. Е белок (~50 кД) является
главным белком оболочки, содержащим вирусные рецепторы и участвующим в
слиянии вирусной и клеточной оболочек. Антитела, нейтрализующие инфекци-
онность вируса, связываются с этим белком [765].
Развитие прочного иммунитета к альфавирусам обеспечивается наличием Е
белка и, возможно, белка NS1, что сопровождается образованием анти-Е анти-
тел и цитотоксических Т-лимфоцитов [424]. Изменения в Е белке в процессе му-
тации могут отражаться на вирулентности вируса. Трансмембранный М белок
(~26 кД) является небольшим фрагментом протеолитически-расщепленного
гликозилированного предшественника М белка, который играет важную роль в
созревании вируса и приобретении инфекционности. Нуклеокапсид состоит из
С белка (~11кД) и геномной РНК.
Флавивирусы кодируют синтез 7 неструктурных белков: NS1 (~46кД), NS2A
(~22кД), NS2B (~14кД), NS3 (~70кД), NS4A (~16кД), NS4B (~27кД), NS5
(~103кД) (2846). В том числе РНК-зависимую полимеразу и NS3, который функ-
ционирует как геликаза и протеаза и как часть РНК-полимеразного комплекса.
Белок NS3 ответственен за расщепление протеина, тогда как клеточные протеа-
зы ответственены за его остановку.
Флавивирусы не очень стабильны во внешней среде и легко инактивируются
нагреванием и обычными дезинфектантами. Однако вирус классической чумы
свиней может неделями сохраняться в мясных продуктах, полученных от инфици-
рованных свиней, и представлять источник распространения болезни [965, 1135].
В состав оболочки пестивирусов входят три белка El, Е2 и Erns, ответствен-
ные за антигенные и иммуногенные свойства. Иммунодоминантным белком яв-
ляется гликопротеин Е2. У вируса классической чумы свиней важную роль в об-
разовании иммунитета также играет белок Erns [1575]. Организацией генома пе-
стивирусы сходны с флавивирусами [517]. Для пестивирусов характерна
пантропность и узкий хозяинный спектр.
Выраженные перекрестные иммунологические реакции характеризуют пес-
тивирусы. Тесная антигенная связь установлена между вирусами классической
чумы свиней (КЧС) и вирусом диареи крупного рогатого скота [1238]. Белки ви-
руса пограничной болезни овец имеют много общих эпитопов с белками вируса
диареи крупного рогатого скота, особенно с его нецитопатогенным биотопом
[227, 616]. Данные о структурном родстве согласуются с близким генетическим
родством этих вирусов [879]. Вирус пограничной болезни овец (ПБ) подобен ви-
русу диареи крупного рогатого скота.
Общие антигенные детерминанты у вирусов диареи и классической чумы
свиней лежат в основе защиты поросят вирусом диареи от заражения вирулент-
ным штаммом вируса чумы свиней. Кроме того, последний оказывал выражен-
ный бустер-эффект в отношении образования ВН-антител к вирусу диареи [556].
Наиболее выраженный гуморальный ответ (IgG) наблюдали у телят на гли-
копротеины Е1 и Е2 вируса диареи. Нейтрализующие моноклональные антите-
ла к вирусу диареи связывали гликопротеин Е2 [601]. В структуре Е2 этого виру-
са выявлено три антигенных участка, один из которых оказался высококонсер-
вативным нейтрализующим эпитопом [366]. Только моноклональные антитела к
консервативному эпитопу вируса диареи крупного рогатого скота, необходимо-
му для его репликации, узнают все изоляты этого вируса и не реагируют с изоля-
тами вирусов КЧС и ПБ [1039].
Представители рода флавивирусов размножаются хорошо и вызывают цито-
патический эффект во многих культурах клеток, а также в несущих Fc рецепто-
ры макрофагах и линиях этих клеток, в которых урожай вируса повышается в
присутствии специфических антител. Вирусы также размножаются в культурах
клеток комаров (линии клеток С6/36 и АР-61), но без ЦПЭ. Представители рода
флавивирусов инфицируют и убивают новорожденных мышей. Пестивирусы хо-
рошо размножаются в первичных и перевиваемых культурах клеток естествен-
ных хозяев. Размножение этих вирусов, как правило, не сопровождается ЦПЭ. В
двух случаях в культуре клеток, зараженных рекомбинантным вирусом КЧС,
развился цитопатаческий эффект (ЦПЭ). Субгеномная РНК из этих клеток бы-
ла лишена тех же вирусных генов, что и субгеномные РНК, обнаруженные во
всех известных цитопатогенных штаммов вируса КЧС. Гены, кодирующие белки
Npro, С, Erns, El, Е2, Р7 и NS2, оказались необязательными для репликации РНК.
С потерей гена NS2 геном вируса КЧС реплицировался более эффективно и вы-
зывал ЦПЭ [1103]. Химерный вирус вакцинного штамма КС вируса КЧС, содер-
жащий ген белка Е2 вируса диареи КРС, сохранил исходную иммуногенность и
приобрел цитопатическую активность.
Вирус прикрепляется к клеткам за счет рецепторов гликопротеина Е (Е1 и
Е2), проникает в клетку путем эндоцитоза и реплицируется в цитоплазме. Вирус
только частично выключает нуклеиновый и белковый синтез клетки млекопита-
ющего-хозяина, но не останавливает функционирование клеток членистоногих.
Инфекция сопровождается пролиферацией перинуклеарных мембран.
Изучение роли структурных и неструктурных вирусных белков показало, что
Е белок оболочки играет главную роль в индукции нейтрализующих антител и
защитного иммунитета, что было доказано иммунизацией животных субвирус-
ными компонентами и рекомбинантными белками и пассивной защитой моно-
клональными антителами к Е белку.
Неструктурный белок NS1, экспрессируемый на поверхности инфицирован-
ных клеток, вызывает иммунный ответ, однако его участие в создании защитного
иммунитета не доказано. Иммунологическая функция других неструктурных
белков, вероятно, сводится к роли мишеней для цитотоксических Т-клеток [424].
Аттенуация флавивирусов наступает, как правило, быстро и объясняется вы-
соким уровнем мутации РНК вирусов. Например, флавивирусы передающиеся
комарами, становились аттенуированными после 6 пассажей в клетках Hela
[614], что объяснялось высокой скоростью мутаций и стабилизацией мутирован-
ного вируса в специфическом и гомогенном типе клеток. Применительно к ви-
русу желтой лихорадки считается, что основными фенотипическими признака-
ми аттенуации являются снижение нейротропности и висцеротропности (спо-
собности вызывать гепатит), что связано с изменениями в генах кодирующими
белки Е, NS1 hhhNS3[424],
Вирус, выделенный от персистентно инфицированных животных, обладает
фенотипическими изменениями, такими как потеря гемагглютинина, снижение
нейровирулентности и термочувствительности, указывая на то, что персистент-
ная инфекция связана с аттенуацией вирусного фенотипа, генерацией ДИЧ или
изменением антигенности вируса, результатом чего является уход от иммунного
контроля [614].
Вирусная диарея (ВД), или болезнь слизистых крупного рогатого скота
Вирусная диарея (ВД), или болезнь слизистых крупного рогатого скота вы-
зывается одним вирусом. Острое течение болезни называют вирусная диарея;
хроническое течение, связанное с персистентной инфекцией, называют болезнь
слизистых. Заболевание крупного рогатого скота и других жвачных, характери-
зующееся неяркими клиническими признаками, главными из которых являют-
ся диарея и поражение слизистых оболочек желудочно-кишечного тракта. В ес-
тественных условиях к заболеванию восприимчивы также буйволы и олени.
Восприимчивы животные всех возрастов, но чаще болеют животные в возра-
сте 8—24 месяца. Уровень материнских антител у телят исчезает к 3—8 месяцам,
и они могут быть инфицированы. Заболевание у телят может осложняться вто-
ричными респираторными и кишечными инфекциями. Вирус патогенен для
овец, коз и диких жвачных.
Вирус распространен во всем мире. Антитела к нему выявляются в сыворот-
ке крови у 50—90% КРС. У взрослого крупного рогатого скота инфекция может
протекать субклинически. Несмотря на то, что инфицирование чувствительных
взрослых коров обычно имеет небольшие последствия, передача вируса плодам
происходит с высокой частотой. Результат такого заражения зависит от возраста
(иммунологической зрелости плода) и от штамма вируса. В большинстве случа-
ев инфицирование плодов происходит в первые 40 дней беременности и сопро-
вождается гибелью эмбриона, его рассасыванием, мумификацией плода или
абортом. Заражение коров при осеменении может вызывать раннюю гибель эм-
брионов.
Инфицирование на 80—120 дне беременности (перед развитием иммуноло-
гической компетентности плода — около 125 дней) часто сопровождается нару-
шениями развития, гибелью плода или рождением потомства с низкой массой
тела. Телята, инфицированные трансплацентарно, остаются инфицированными
на всю жизнь. Они выделяют вирус, оставаясь серонегативными.
Эмбрионы, инфицированные после 125 дней беременности, обычно выжи-
вают, у них могут быть патологические изменения. Они образуют ВНА и осво-
бождаются от вируса.
Различают два биотипа вируса диареи крупного рогатого скота: цитопатоген-
ный и нецитопатогенный (биотипы I и II). Все цитопатегенные и нецитопато-
генные изоляты вируса ВД обладают общим антигеном, который несет основной
эпитоп нейтрализации [1080]. У цитопатогенного биотипа вируса диареи круп-
ного рогатого скота в области гена неструктурного белка р 125 обнаружена встав-
ка, напоминающая последовательность, кодирующую убиквитин. Полагают, что
она приобретается в результате рекомбинации вирусного и клеточного геномов
и сообщает вирусу цитопатогенные свойства [1070].
Нецитопатогенный биотип вызывает латентную персистентную инфекцию
крупного рогатого скота без образования антител, что предрасполагает к разви-
тию тяжелого клинического заболевания после заражения цитопатогенными би-
отипами вируса ВД [334]. Предложена гипотеза, согласно которой для проявле-
ния клинически выраженной ВД требуется персистентная инфекция нецитопа-
тогенным, а затем и цитопатогенным биотипом вируса диареи. Персистентное
инфицирование нецитопатогенный биотипом происходит при первичном появ-
лении инфекции в стаде или при трансплацетарном заражении плода до разви-
тия иммунокомпетентности (первые 125 дней стельности). Если в постнаталь-
ный период жизни такие животные суперинфицируются цитопатогенными био-
типами вируса, то это приводит к появлению клинически выраженной болезни,
что обычно сопровождается гибелью [405, 1408].
Цитопатогенные штаммы вируса попадают в организм персистентно инфи-
цированных животных извне или в результате превращения эндогенного неци-
топатогенного биотипа вируса в цитопатогенный биотип [534, 810].
Первоначально нецитопатогенный вирус заражает плод и приводит к разви-
тию персистентной виремии у телят. Болезнь слизистых оболочек у таких телят
может возникнуть при супериинфицировании эндогенным цитопатогенным ви-
русом, образовавшимся в результате мутации [406] или включения клеточных
последовательностей в геном вируса в результате рекомбинации [1069]. В конеч-
ном счете генетические модификации вируса сказываются на продукции вирус-
ного белка, который ответственен за цитопатогенность в культуре клеток и бо-
лезни слизистых у телят, которые иммуннотолерантны к нецитопатогенному би-
отипу вируса [1135].
Учитывая особенности биологии вируса и патогенеза болезни, одной из
главных задач специфической профилактики ВД является защита плода от зара-
жения в течение первой трети беременности [962].
Обнаружена тесная антигенная связь вируса диареи с вирусом КЧС и погра-
ничной болезни, вероятно, за счет сходства антигенной структуры гликозиро-
ванного полипептида 55 кД [1279].
Переболевание ВД сопровождается развитием иммунитета и образованием
ВН-антител. Однако у некоторых животных возможны рецидивы, которые свя-
зывают с недостаточностью иммунитета.
Иммунитет с молозивом и молоком передается потомству. Специфическая
профилактика ВД основана на применении живых и инактивированных вакцин.
Инактивированные вакцины лишены недостатков живых вакцин, но и со-
здаваемый ими иммунитет менее напряженный и непродолжительный. Инакти-
вированная вакцина через семь дней после повторного введения вызывала у те-
лят образование ВН-антител в высоких титрах и защищала их от развития выра-
женной инфекции при контрольном заражении вирулентным штаммом.
Вакцинация глубокостельных коров инактивированной вакциной против ВД
обеспечивала создание колострального иммунитета у их потомства: пассивные
антитела сохраняются на высоком уровне до 40—45-дневного возраста и обеспе-
чивают защиту животных от экспериментального заражения [723]. Инактивиро-
ванная вакцина с адъювантом при двукратном применении в дозе 2 мл с интер-
валом 21 день вызывала образование ВН-антител у всех вакцинированных телят
и иммунитет к контрольному заражению продолжительностью 1 год [1520].
Наиболее широкое применение получили живые вакцины из аттенуирован-
ных штаммов.
Идеальные аттенуированные вакцинные штаммы, наряду с высокой иммуно-
генностью, не должны проникать через плацентарный барьер и не должны вызы-
вать состояние толерантности у новорожденных телят, иммунодепрессию и гипер-
чувствительность к последующему заражению вирулентным штаммом вируса [246].
Живая вакцина из аттенуированного штамма Орегон С-24 (фирма Мерьё) не
вызывала каких-либо осложнений у стельных коров, создавала напряженный
продолжительный иммунитет у взрослых животных после однократного внутри-
мышечного введения. В полевых условиях через 10 дней после вакцинации но-
вые случаи болезни не регистрировали.
Температурочувствительный аттенуированный штамм RIT 4350 получен в
результате химического мутагенеза. Проверка этого штамма на иммуносупрес-
сивных телятах и стельных коровах показала его безопасность и соответствие ос-
новным требованиям, предъявляемым к вакцинным штаммам вируса диареи
[976]. Попытки реизолировать вирус от привитых телят не имели успеха [389].
Вакцина из этого штамма после двукратного введения (41g ТЦД50) с интервалом
три недели вызывала сероконверсию более чем у 90% коров независимо от пред-
шествующего наличия ВН-антител к вирусу диареи. От привитых коров получен
здоровый молодняк, свободный от антител к вирусу ВД до приема молозива.
Естественного заражения вакцинированных животных не установлено [979].
Относительно применения живых вакцин против ВД существуют различные
рекомендации. Некоторые авторы считают, что нетели должны быть привиты до
ввода в репродуктивное стадо и не должны подвергаться вакцинации в период
между 40—100-м днями стельности. Для первичной иммунизации стад, в кото-
рых ранее вакцину не применяли, желательно использовать инактивированную
вакцину [419].
С целью контроля болезни, животных, как правило, вакцинируют в 6-10 ме-
сячном возрасте, когда колостральный иммунитет уменьшается или исчезает.
Живые вакцины применяются широко, но вакцинация персистентно инфици-
рованных иммунотолерантных животных может в некоторых случаях вызывать
тяжелопротекающую болезнь слизистых.
В последнее время для профилактики ВД и других массовых вирусных болез-
ней КРС во многих странах широко используют комбинированные живые и
инактивированные вакцины. В России, например, в течение многих лет приме-
няют инактивированную вакцину КОМБОВАК против шести наиболее распро-
страненных вирусных заболеваний КРС, в том числе против ВД. Применяют
также живые комбинированные вакцины против 2 и 3 вирусных заболеваний
(ВД, ИРТ и ПГ-3).
Пограничная болезнь
Пограничная болезнь распространена во всем мире у овец. Она проявляется
как конгенитальное заболевание ягнят и характеризуется низкой массой тела
при рождении, слабой жизнеспособностью, тремором и ненормальным шерст-
ным покровом. Подобные признаки могут проявляться у инфицированных коз-
лят и телят. Инфицированность ягнят может достигать 50%. Болезнь у взрослых
овец проявляется субклинически, но у беременных маток завершается гибелью
или мумификацией эмбрионов или деформацией плодов. Пережившие транс-
плацентарное инфицирование ягнята могут становиться длительными носите-
лями и выделителями вируса со всеми секретами и экскрементами, включая
сперму. Для специфической профилактики пограничной болезни используют
вакцины, применяемые против вирусной диареи КРС [1135].
Классическая чума свиней (КЧС)
Классическая чума свиней (КЧС) - наиболее опасная вирусная болезнь сви-
ней, причиняющая серьезный экономический ущерб многим странам с разви-
тым свиноводством. КЧС — высококонтагиозная мультисистемная гемаррагиче-
ская вирусная болезнь свиней, которая может протекать в острой, подострой,
хронической (длительно текущей) и латентной формах с высокой летальностью
(до 100%). Характерной особенностью эпизоотии КЧС в Европе в конце про-
шлого века является легкая и хроническая форма болезни.
По классификации МЭБ КЧС относится к группе А болезней животных. Ее
регистрируют в Европе, Азии, Центральной и Южной Америке.
Местом первичного размножения вируса являются миндалины, затем лейко-
циты периферической крови. В полевых условиях все чаще стали встречаться
слабовирулентные штаммы, вызывающие хроническое течение болезни, нару-
шения воспроизводительной функции и длительное вирусоносительство.
Низковирулентные штаммы вируса вызывают типичное течение болезни'
Свиноматки-вирусоносители рождают клинически здоровых, но инфицирован-
ных и иммунотолерантных поросят, которые могут длительно выделять вирус в
больших количествах [1508]. Трансплацентарная передача вируса сопровождает-
ся тератогенным действием и высокой перинатальной смертностью. При экспе-
риментальном инфицировании свиноматок слабовирулентным штаммом транс-
плацентарная передача вируса плодам достигала 90% [172] и на 40-й день супо-
росности была более эффективной, чем на 90-й. Уровень летальности среди
новорожденных поросят находится в прямой зависимости от инфицированнос-
ти плодов. Все виремичные поросята в конечном счете погибают.
Переболевание и иммунизация свиней сопровождается образованием вирус-
нейтрализующих и преципитирующих антител и развитием иммунитета, дли-
тельность и напряженность которого зависят от возрастной иммунореактивнос-
ти свиней. Считают, что выраженный иммунный ответ развивается у свиней на-
чиная с 6-8 недельного возраста. ВН-антитела появляются на 7-10 день после
инфицирования или иммунизации, достигают максимума через 3-4 недели и
сохраняются более 1 года. У реконвалесцентов образуется пожизненный имму-
нитет. Материнский иммунитет при КЧС достаточно выражен. Пассивные анти-
тела у поросят могут сохраняться 2—3 мес., однако защитный эффект практиче-
ски продолжается 1 —2 месяца.
Инактивированные вакцины против КЧС оказались малоэффективными,
поэтому особое внимание было уделено разработке живых вакцин. Новая эра в
специфической профилактике КЧС связана с получением 3 аттенуированных
вакцинных штаммов: китайского лапинизированного С (синонимы LC, LPC) и
2 культуральных — японского (GPE) и французского (Tiverval). Все они характе-
ризуются безопасностью для свиней разного возраста и физиологического со-
стояния, выраженной иммуногенностью, которая проявляется устойчивостью
вакцинированных животных к экспериментальному заражению вирулентным
штаммом вируса КЧС [1575].
При усовершенствовании технологии изготовления живой вакцины из ки-
тайского штамма С последний адаптировали к размножению в различных куль-
турах клеток. В результате на его основе в разных странах создали серию культу-
ральных вакцин с фирменными названиями: ВГНКИ (Россия); Suvac (Венгрия);
Cellpest (Польша); Pestiffa (Merial, Франция); TVM (Чехия); Egermann (Riems,
Германия); Norden; Minnesota Anchor; Colvasan Sanocon Porcivac (Мексика)
[ 1596]. Живые культуральные вакцины на основе штамма С по безопасности и
иммуногенности подобны оригинальной лапинизированной вакцине и отлича-
лись от нее более совершенной технологией и большей производительностью
[665, 1514].
В разработке и производстве живых вакцин против КЧС наметилось 3 неза-
висимых пути: оригинальная вакцина из штамма С, размноженная в организме
кроликов; модифицированные вакцины из штамма С, адаптированного и раз-
множенного в различных культурах клеток; оригинальные вакцины, полученные
из других штаммов: Tiverval [267] и GPE [ 1407], с самого начала аттенуированных
и размноженных в различных культурах клеток. Все указанные вакцинные
штаммы соответствовали требованиям OIE [1693].
Первые исследования по получению и размножению вакцинных штаммов
вируса КЧС в клеточных культурах для изготовления живой вакцины были про-
ведены в СССР и завершены в 1967 г. С тех пор налажено серийное промышлен-
ное изготовление 2 живых вакцин с использованием культуры клеток тестикул
ягнят — вакцина ЛК-ВНИИВВиМ [174]; первичной культуры клеток почки эм-
брионов свиньи — вакцина ВГНКИ [106, 125].
Вакцинный штамм ЛК-КС получен длительным пассированием вируса КЧС
в первичной культуре и субкультуре клеток тестикул ягнят (ТЯ). Эти культуры
также использовали для массового выращивания вируса при изготовлении сухой
вакцины. Лабораторные и полевые испытания показали, что вакцина ЛК-КС по
безопасности и иммуногенности подобна вакцине из штамма С. Фенотипичес-
ки штамм ЛК-КС отличался от штамма С отсутствием способности вызывать ги-
пертермическую реакцию у кроликов при внутривенном введении. На основе
филогенетического анализа и в соответствии с Европейской классификацией
[883] штамм С отнесен к подгруппе 1.1. (референтный штамм Alfort), а Л К-КС —
к подгруппе 1.2. (референтный штамм Breshia) [49].
За последние 30 лет изготовлено и использовано в практике более миллиар-
да доз вакцины ЛК-ВНИИВВиМ. С 1997 г. аналогичную вакцину (КС) выпуска-
ет НПО НАРВАК. Вакцина КС из клонированного штамма ЛК отличается от
вакцины ЛК-ВНИИВВиМ лишь более высоким содержанием вакцинного
штамма.
Японский вакцинный штамм GPE— получили пассированием слабовиру-
лентного полевого штамма ALD в разных клеточных культурах при 30°С. В отли-
чие от исходного вирулентного штамма он хорошо размножался в культуре кле-
ток морской свинки (G-маркер) при 30°С. Геном штамма GPE— отличался от ро-
дительского заменой 225 нуклеотидов [835].
Штамм Tiverval получили из вирулентного штамма Альфор после более чем
170 серийных пассажей в культуре клеток при 29-30°С, и его можно было иден-
тифицировать несколькими маркерами in vitro [269, 931].
Живые вакцины ЛК-КС, GPE и Tiverval, приготовленные из штаммов виру-
са КЧС, аттенуированных изначально пассированием в культурах клеток, по бе-
зопасности и иммуногенности принципиально не различались между собой, а
также от оригинальной лапинизированной вакцины (С, CL) и ее культурных ва-
риантов.
С появлением безопасных и высокоиммуногенных живых вакцин с 60-х го-
дов прошлого века специфическая профилактика легла в основу борьбы с КЧС
во многих странах.
Однако стратегия борьбы с КЧС в разных странах была и остается различ-
ной. Одни полностью исключают вакцинацию, другие прибегают к ней в случае
крайней необходимости как к вынужденной и временной мере, третьи использу-
ют вакцинацию как основную меру борьбы и профилактики КЧС. Меры борьбы
с КЧС часто определяются эпизоотической ситуацией и социально-экономиче-
скими факторами. Положительный опыт борьбы с КЧС с помощью вакцинации
накоплен во многих странах.
Широкое применение живых вакцин во многих странах с развитым свино-
водством привело к существенному сокращению заболеваемости свиней КЧС и
улучшению эпизоотической обстановки по данному заболеванию, но не приве-
ло к ликвидации болезни.
Как показал международный опыт борьбы с КЧС, недостаточная эффектив-
ность применения безопасных и высокоиммунногенных живых вакцин связана
с рядом причин: генетически обусловленной недостаточностью иммунного от-
вета у части вакцинированных свиней [578], низкой иммунореактивностью по-
росят, особенно до отъемного возраста [539, 1509], подавлением вакцинального
иммунитета у поросят колостральными антителами [966].
Кроме того, вакцинация свиней в полевых условиях оказалась менее эффек-
тивной, чем в экспериментальных условиях [1098, 1575], благодаря чему в хозяй-
ствах, особенно промышленного типа, часть животных (10-15%) разных техно-
логических групп остаются недостаточно иммунными или неиммунными [99].
Следует отметить, что индивидуальная иммунная защита свиней отличается от
иммунной защиты всего поголовья (стадный иммунитет), особенно в крупных
хозяйствах промышленного типа, где она в значительной мере зависит от гене-
тических и популяционно-технологических факторов. Считается, например, что
эффективность специфической профилактики КЧС обратно пропорциональна
плотности популяции свиней в данном регионе или численности свиней в од-
ном хозяйстве [175].
Наиболее коварным звеном в поддержании КЧС в крупных хозяйствах
репродуктивного типа, несмотря на систематическую вакцинацию, является на-
личие слабоиммунных латентно инфицированных свиноматок, способных к
трансплацентарной передаче вирулентного вируса потомству на любой стадии
супоросности. В таких хозяйствах часть поросят рождаются латентно инфициро-
ванными, способными выделять вирус в течение длительного времени. Таков в
основном механизм стационарности КЧС в хозяйствах промышленного типа
или в зонах с высокой концентрацией свиней, несмотря на систематическую
вакцинацию.
Особая ситуация сложилась с развитием промышленного свиноводства и за-
носом КЧС в крупные свиноводческие хозяйства (комплексы). В таких хозяйст-
вах возникновение КЧС на фоне вакцинального иммунитета приводило к появ-
лению стационарных очагов болезни. В них больных животных и вирулентный
вирус обнаруживали в течение многих лет, несмотря на систематическую вакци-
нацию и строгие ветеринарно-санитарные меры [99]. Опыт борьбы с КЧС в
странах ЕС привел к выводу, что существующие в мире живые вакцины против
КЧС и традиционные схемы их применения «способны защитить свиней от за-
болевания и гибели, но не от инфицирования» [627]. Наиболее ярким примером
недостаточной эффективности систематической вакцинации в ликвидации
КЧС в условиях высокой плотности популяции свиней явилась ситуация, кото-
рая сложилась в 1996—1998 гг. в Голландии и других странах Европы, что послу-
жило причиной отказаться от вакцинации в борьбе с КЧС, заменив ее убоем всех
свиней в неблагополучных и угрожаемых хозяйствах. По этой причине с 1993 по
1998 гг. в странах ЕС было уничтожено более 14 млн свиней. Экономические по-
тери составили 5 млрд долл, (симпозиум МЭБ по КЧС, Бирмингем, 1998 г.). По-
добная стратегия борьбы с КЧС была принята в США еще с 1962 г. и позволила
в 1976 г. стать первой страной, ликвидировавшей КЧС. Кроме США, в настоя-
щее время еще более 15 стран являются свободными от КЧС.
В зонах с высокой плотностью популяции свиней, а также в крупных хозяй-
ствах промышленного типа ликвидация КЧС с помощью существующих средств
и схем специфической профилактики (без депопуляции свиней) оказалась не-
разрешимой задачей.
Для многих стран с развитым свиноводством, в том числе и России, страте-
гия ликвидации КЧС, принятая странами ЕС, на основе массового убоя и унич-
тожения свиней оказалась неприемлемой по экономическим и технологическим
соображениям.
Негативный опыт специфической профилактики КЧС в развитых странах, в
том числе в СССР и РФ, традиционными методами привел к выводу о необходи-
мости разработки беспрецендентной стратегии вакцинопрофилактики, полу-
чившей название гипервакцинация [173, 174]. Данная стратегия, по мнению ав-
тора этой идеи, является единственно возможным решением проблемы ликви-
дации КЧС в странах с интенсивным свиноводством без депопуляции свиней.
Основанием для реализации новой стратегии борьбы с КЧС прежде всего яви-
лась высокая иммуногенность и безопасность применения больших доз живой
вакцины КС.
Основная цель гипервакцинации с применением вакцины КС состоит в пре-
кращении циркуляции вирулентного вируса КЧС в неблагополучных хозяйствах
путем создания максимально выраженного вакцинального иммунитета практи-
чески у всего поголовья, и в первую очередь, у свиноматок и новорожденных по-
росят. Кроме того, гипервакцинация преследует цель возможного прекращения
циркуляции вирулентного вируса КЧС в популяции свиней за счет замещения
вакцинным вирусом [173].
Гипервакцинацию свиней вакциной КС в течение последних 7 лет проводи-
ли в ряде крупных свиноводческих комплексов России, неблагополучных по
КЧС. С этой целью в НПО НАРВАК изготовлено более 20 млн доз сухой кон-
центрированной вакцины КС.
Свиноматок прививали перед каждым осеменением в дозе > 105 ТКИД50, а
поросят - на 40-50 и 85-95 дни в дозе > 5х104 ТКИД50. Наличие КЧС в хозяйст-
вах после гипервакцинации определяли всеми существующими методами иссле-
дований. В качестве одного из свидетельств эффективности гипервакцинации
против КЧС в хозяйствах содержали группы свиней (0,5—1,0% поголовья), не
вакцинированных против КЧС с момента рождения до убоя (индикаторные
группы). Учитывая важность и высокую вероятность трансплацентарного инфи-
цирования, исследовали с диагностической целью кровь новорожденных пор'о-
сят методом ПЦР. Итоги проведенных исследований подтвердили правильность
выбора в пользу гипервакцинации как единственного радикального средства
ликвидации КЧС в промышленном свиноводстве без депопуляции свиней [174].
В последнее время для специфической профилактики КЧС были предложе-
ны различные генно-инженерные вакцины: рекомбинантные живые, субъеди-
ничные маркированные и химерные вакцины. Однако по иммуногенности они
уступали или не имели преимуществ по сравнению с традиционными живыми
вакцинами против КЧС [176].
10.27. Тогавирусы
Название тогавирусы (от лат. toga — плащ) впервые было предложено для
обозначения оболочечных РНК-содержащих вирусов, имеющих нуклеокапсид с
кубической симметрией.
Семейство тогавирусов (ТГВ) включает два основных рода вирусов альфави-
русы и рубивирусы, которые различаются между собой по строению и серологи-
ческим свойствам. Кроме того, существуют 2 «плавающих» рода: дельтавирусы
(вирус гепатита дельта) и вирус гепатита Е и ему подобные вирусы. Ареал распро-
странения ТГВ ограничен определенными географическими зонами, которые
определяются зонами обитания членистоногих-переносчиков и естественных
хозяев-позвоночных.
Род альфавирусов объединяет более 20 антигене связанных между собой ви-
дов, передающихся членистоногими. Рубивирусы представлены одним видом —
вирусом краснухи, патогенным только для человека.
Прототипным видом рода альфавирусов является вирус Синдбис. В состав
рода входят вирусы венесуэльского, восточного и западного американских энце-
фаломиелитов лошадей. К естественному и экспериментальному заражению
чувствительны многие виды позвоночных и беспозвоночных животных. Для
альфавирусов характерна пантропность. Основной путь передачи вируса — био-
логический. При венесуэльском энцефамиелите лошадей (ВЭЛ) в случае массо-
вой вспышки заболевания отмечена транспланцентарная передача вируса и воз-
душно-капельное заражение.
Тогавирусы — наиболее мелкие оболочечные вирусы животных, представля-
ющие собой мономорфные сферические вирионы, покрытые оболочкой и име-
ющие диаметр 70 нм. Нуклеокапсид имеет форму икосаэдра диаметром 40 нм и,
кроме РНК, содержит один белок С (30—33 кД). Нуклеокапсид окружен двух-
слойной липидной оболочкой, проходящей из плазматической мембраны клет-
ки хозяина, содержащей вирусспецифические полипептиды. Вирионы покрыты
гликопротеиновыми отростками, выступающими над поверхностью на 10 нм.
Они представляют собой 80 тримеров, каждый из которых содержит 3 гетероди-
мера гликопротеинов Е1 и Е2. Нуклеокапсид тогавирусов состоит из 240 копий
каждого белка [1383].
Оболочка некоторых вирусов содержит не два, а три белка: Е1 (45—53 кД), Е2
(53—59 кД) и ЕЗ (10 кД). На долю капсидного белка приходится около 20% мас-
сы структурных белков.
В зависимости от места нахождения белков вирионе их обозначают так: у
альфавирусов С — белок нуклеокапсида, El, Е2, ЕЗ — белки оболочки. В супер-
капсидной оболочке рубивируса содержится 2 гликозированных белка Е1 (50 кД)
и Е2 (65 кД) [172].
Геном представлен одной молекулой линейной, одноцепочечной (+)РНК
размером от 9,7 (рубивирусы) до 11,8 тн (альфавирусы). На 5'-конце РНК име-
ется метилированная кэп-структура. З'-конец полиаденилирован. 2/3 5'-конца
кодируют неструктурные белки. З'-конец транслируется с геномной РНК как та-
ковой.
В вирусе Семлики, кроме того, содержится еще один гликопротеин ЕЗ с мо-
лекулярной массой 10 кД [172]. Два основных гликопротеина (Е1 и Е2), кодиру-
емых альфавирусами (Синдбис и леса Семлики), первоначально синтезируются
как полипротеин. В ходе первичного протеолиза образуются Е1 и Е2 (Р62). Бе-
лок Е1 состоит из 439 аминокислот с двумя протяженными гидрофобными уча-
стками, Р62 - из 487 аминокислот, 64 из которых удаляются при протеолитиче-
ском превращении в Е2; Е1 и Е2 и формируют относительно плотный некова-
лентносвязаный гетеродимер. Три таких гетеродимера собраны в треугольный
кластер на поверхности вириона [184].
Трансмембранные домены альфавирусов состоят из 20—30 гидрофобных
аминокислот, лежащих вблизи С-конца полипептида, и имеют основные амино-
кислоты с цитоплазматической стороны липидного бислоя. Только один альфа-
вирусный гликопротеин (Р62/Е2) имеет выраженный цитоплазматический до-
мен, включающий 31 аминокислоту и, вероятно, связывающийся с нуклеокап-
сидом во время формирования вириона [70].
Репликация тогавирусов происходит в цитоплазме. Вирусы размножаются с
высоким титром в различных клеточных культурах и вызывают отчетливо выра-
женный ЦПЭ во многих культурах клеток. Они также размножаются в культурах
клеток москитов (линия С6/36 клетки Aedes albopictus и др.), но без ЦПЭ. В
клетках млекопитающих и птиц инфекция вызывает остановку синтеза белково-
го и нуклеинового синтеза клетки. В клетках комаров, инфицированных альфа-
вирусами, этого не происходит.
При взаимодействии вируса с клеткой хозяина первоначально происходит
связывание Е1 с фосфолипидным рецептором поверхности клетки; при вхожде-
нии вириона в клетку происходит связывание Е2 с белками клетки. Вхождение
вирусного нуклеокапсида в цитоплазму клетки происходит в результате слияния
вирусной оболочки с эндосомальной мембраной.
После вхождения в цитоплазму вирионная РНК подвергается двум раундам
трансляции. В начале 5'-конец геномной РНК, служащий в качестве мРНК,
транслируется с образованием полипротеина, который затем расщепляется на 4
неструктурных белка, два из которых формируют вирусную РНК-зависимую
РНК полимеразу. Этот фермент транскрибирует полноразмерную негативную
копию геномной РНК, которая является матрицей для последующего синтеза
геномной (+)РНК. Синтезируется 2 вида (+)РНК:
1) полноразмерная геномная РНК для продолжения инфекции в клетке и
для включения в потомство вирионов;
2) 26S субгеномная мРНК с идентичной последовательностью З'-конца ге-
номной РНК.
В результате трансляции субгеномной РНК образуется большое количество
полипротеина, который расщепляется с образованием индивидуальных струк-
турных белков, включая нуклеокапсидный белок С [1 135, 1383].
Таким образом, геномная РНК вначале служит как месенджер РНК для
трансляции неструктурных вирусных белков, а затем как матрица для синтеза
комплементарной цепи (—)РНК. Последняя, наоборот, служит матрицей для
синтеза двух видов РНК: новой геномной (+)РНК и субгеномных РНК [1383].
Нуклеокапсиды формируются в цитоплазме на эндоплазматических мембра-
нах и продвигаются к плазматической мембране, где они выстраиваются под уча-
стки скопившихся вирусных гликопротеиновых пепломеров. Наконец, вирионы
Таблица 47. Структурные белки тогавирусов [1135]
Белок Расположение в вирионе Гликозилирование Молекулярная масса, кД
С Нуклеокапсид - 30-33
Е1 Оболочка + 45-58
Е2 » + 53-59
ЕЗ* » + 10
* Обнаружен не у всех альфавирусов.
формируются почкованием нуклеокапсидов через плазматическую мембрану, на-
фаршированную включениями пепломерных гликопротеинов. Вирионы не обла-
дают выраженной устойчивостью и легко инактивируются дезинфектантами.
В структуре альфавирусов выявлено три антигенных домена, ответственных
за видовую специфичность, внутригрупповые и внутриродовые связи. Два из
них локализованы в структурных белках оболочки, один — связан с белком нук-
леокапсида. Белки оболочки и нуклеокапсида антигенно не связаны между со-
бой. За нейтрализующую активность альфавирусов ответственны гликопротеи-
ны Е1 и Е2 [1693].
На гликопротеинах Е1 и Е2 идентифицированы соответственно четыре и три
эпитопа нейтрализации. Моноклональные антитела к нейтрализующим эпито-
пам Е2 обладали более выраженным профилактическим действием, чем антите-
ла к нейтрализующим эпитопам Е1 [1059].
Нейтрализующие антитела к белку Е2 вируса леса Семлики не реагировали в
РТГА и РСК. Установлено участие Е1 вируса Синдбис в клеточном иммунном
ответе. Так, антитела к белку Е1 не нейтрализовывали вирус, но оказывали про-
тективное действие в результате зависимого от антител цитолиза инфицирован-
ных клеток [1131]. Пепломеры вируса леса Семлики, ответственные за сплавле-
ние оболочки вириона с клеточной мембраной, состоят из двух трансмембран-
ных белков Е1 и Е2, а также белка ЕЗ, расположенного на поверхности вириона
[885].
В гликопротеинах Е1 и Е2 вируса ВЭЛ идентифицировано по пять сайтов
связывания МАТ.
Сайт Е1-1 обеспечивает индукцию протективных антител и участвует в фор-
мировании иммунитета. Антигенные и иммуногенные свойства субъединиц аль-
фавирусов изучены на примере вируса леса Семлики. Гликопротеин шипиков
оболочки получали в трех формах: в виде мономеров (4,5S), октамеров (29S) и
«виросом». 10 мкг фракции 29S обеспечивали выраженный иммунитет у мышей.
Аналогичной активностью обладал препарат из «виросом», тогда как 4,5S струк-
туры оказались слабоиммуногенными. Выработка ВН-антител на указанные
компоненты соответствовала их иммуногенной активности. Вакцина из белко-
вых субъединиц оболочки вируса ВЭЛ обладала иммуногенными свойствами.
Изучение гомологии нуклеиновых кислот различных альфавирусов показало,
что у антигенно тесносвязанных вирусов она составляет 13%, у других вирусов
этого рода — не менее 1%. Наличие серологического родства при ограниченной
гомологии генома можно объяснить исходя из допущения, что антигенные детер-
минанты ограничены небольшим количеством аминокислот [172]. Действитель-
но, как показали исследования с моноклональными антителами, большинство
альфавирусов сходны по участкам консервативного эпитопа на нуклеокапсидном
белке. К немногим исключениям из этого правила относится вирус ВЭЛ.
Между вирусами энцефаломиелита лошадей (ЭМЛ) существует перекрест-
ный иммунитет. Лошади, иммунные к вирусу восточного ЭМЛ, оказались пол-
ностью устойчивыми к вирусу ВЭЛ, а иммунные к вирусу западного ЭМЛ —
частично защищенными против ВЭЛ [1613]. За антигенный перекрест вирусов
ВЭЛ и восточного ЭМЛ ответственны сайты El-1, Е1-3 и Е1-5. Эпитопы глико-
протеина Е1 ВЭЛ антигенно сходны с эпитопами белка Е вируса клещевого эн-
цефалита.
Вирус краснухи (рубивирус) антигенно не связан ни с одним из вирусов се-
мейства и классифицируется как тогавирус исключительно на основе структуры.
Сферические частицы диаметром 60—70 нм. Нуклеокапсид 30—35 нм в диа-
метре окружен оболочкой клетки хозяина. Все штаммы слабо температурочувст-
вительны, урожай вируса при 35°С больше, чем при 37°С. Вирус краснухи раз-
множается более медленно, чем альфавирусы: эклипс фаза длится 10—12 часов,
максимальное накопление через 30—48 часов и составляет 10 ИД50 на 1 клетку,
тогда как у вируса Синдбис эти показатели соответственно равны 4 и 8 часам и
104 ИД50 на 1 клетку [473].
Структурные белки оболочки вируса краснухи транслируются в виде поли-
протеина (р 110), в результате расщепления которого образуются капсидный бе-
лок (33 кД) и два гликопротеина Е1 (58 кД) и Е2 (42-47 кД).
В гликопротеине Е1 вируса краснухи обнаружено три эпитопа, связанных с
ГА-активностью и нейтрализацией вируса антителами. Они расположены в об-
ласти аминокислот 245—285 белка Е1 [1512].
Для краснухи характерен длительный иммунитет после первичной вакцина-
ции.
На Тайване при заболевании людей гепатитом Е изучали возможную прича-
стность свиней к данному заболеванию. Штаммы вируса гепатита Е, выделен-
ные от человека и свиней, относились к одной филогенетической группе и поз-
волили заключить, что свиньи могут служить резервуаром данного вируса [848].
Энцефалиты лошадей
Несколько альфавирусов вызывают энцефалиты у лошадей и могут также
инфицировать людей.
Заражение лошадей вирусами восточного, западного и венесуэльского энце-
фалита сопровождается различными клиническими проявлениями — инфекция
может протекать субклинически или может проявляться только лихорадкой, по-
терей аппетита и депрессией. Прогрессирующая системная болезнь, ведущая к
гибели с небольшими неврологическими проявлениями, наиболее присуща ве-
несуэльскому энцефалиту лошадей.
После проникновения через укус комара вирус размножается на месте внед-
рения или в регионарном лимфоузле, вызывая первичную веремию. Затем вирус
размножается в экстраневральных тканях с высоким титром, вызывая вторич-
ную веремию, которая является ключом к дальнейшему инфицированию кома-
ров и проникновению вируса в центральную нервную систему зараженного ор-
ганизма и развитию энцефалита. Иммунитет после переболевания или субкли-
нической инфекции, вероятно, пожизненный. Частичная защита наблюдается
против антигенно родственных вирусов.
Смертность при восточном, западном и венесуэльском энцефалите лошадей
может достигать соответственно 50-90, 20-40 и 50-80% [1135].
Для профилактики энцефалитов лошадей разработаны культуральные вак-
цины, инактивированные формалином, которые обладали выраженной имму-
ногенностью. Вакцина против восточного энцефалита лошадей оказалась эф-
фективной для иммунизации птиц.
Имеются экспериментальные вакцины для иммунизации лиц, работающих в
лабораториях с вирусами энцефалитов лошадей. Инактивированные вакцины
против западного энцефалита лошадей, предназначенные для иммунизации лю-
дей, оказались эффективными против североамериканских, но не южноамери-
канских вариантов вируса. Имеется живая вакцина (ТС-83) против венесуэль-
ского энцефалита и вируса Чикунгунья [737].
список
ЛИТЕРАТУРЫ
1. Агол В.И. Мол., генетика, микробиология, вирусология. 1988, №1,3.
2. Адамс Р. Методы культуры клеток для биохимиков. М., 1983, 264 с.
3. Александрова Г.И. и др. Вопросы вирусологии. 1986, №4, 411.
4. АлиперТ.И. и др. Ветеринария, 1988, №10, 69.
5. Алипер Т.И. и др. Ветеринария, 2002, №3, 21.
6. Алипер Т.И. и др. Ветеринария, 2002, №8, 18.
7. Анджапаридзе О.Г. и др. Персистенция вирусов. М., 1984.
8. Анджапаридзе О.Г. и др. Вопросы вирусологии, 1987, №1, 113.
9. Байков В.И. Биотехнология, 1989, 5, 61.
10. Бакулин В.А. и др. Ветеринария, 1985, №11, 38.
11. Балышева В.И. и др. Ветеринария, 2004, №11, 27.
12. Бартошевич Ю.Э. Супермутагены. М., 1966, 211.
13. Бахов Н.И. и др. Успехи современной биологии, 2000, №1, 120.
14. Бектимиров ТА. Вопросы вирусологии, 1987, №5, 519.
15. Беляев А.С. и др. Генно-инжен. синтетич. вакцины. Пущино, 1990, 54.
16. Беляков И.М. Иммунология. М., 1997.
17. Березин В.Э. и др. Вопросы вирусологии, 1986, №3, 362.
18. Березин В.Э. и др. Вопросы вирусологии, 1986, №4, 475.
19. Березин В.Э. Вопросы вирусологии. 1987, №3, 312.
20. Болезни птиц. М., 1985.
21. Бомфорд Р. Биотехнология клеток животных. 1989, 2.
22. Борисевич И.В. и др. Вопросы вирусологии, 2006 №5, 8 - 16.
23. Бочков Ю.А. и др. Аграр. Россия, 2002, №2, 11.
24. Букринская А.Г. Вирусология. М., 1986.
25. Букринская А.Г. и др. Вопросы вирусологии, 1986, №1, 45.
26. Бутинь и др. Мол. генет. микробиол. вирусол., 2003, №4, 27.
27. Бутенко ГМ. и др. Прикладная иммунология. Киев, 1984.
28. Васильев В. и др. Вет.-мед. науки, 1982, 19, 3, 40.
29. Васильев Ю.М., Гельфанд И.М. Взаимодействие нормальных и неопластических
клеток со средой. М., 1981.
30. Ван ВезельА.Л. Биотехнология клеток животных. М., 1989.
31. Вашкова В.В. и др. Радиобиология. 1972, 12, 910.
32. Вирусные вакцины и противовирусные препараты. Докл. ВОЗ, №693. Женева,
1985.
33. Витакер А. Новые методы культуры животных тканей. М., 1976.
34. Вишняков И.Ф. и др. Ветеринария, 1995, №11, 25.
35. Вишняков И.Ф. и др. Ветеринария, 1998, №11, 16.
36. Воробьев А.А., Васильев Н.Н. Адъюванты. М., 1969.
37. Выводы и рекомендации совещания ВОЗ/ФАО. Бюл. ВОЗ, 1983, №2, 16.
38. Выводы и рекомендации совещания ВОЗ/ФАО. Бюл. ВОЗ, 1983, №3, 31.
39. Галактионов В.Г. Иммунология. М., 1998.
40. Гендон Ю.З. Вопросы вирусологии. 1988, №4, 389.
41. Гендон Ю.З. Вопросы вирусологии. 1989, №4, 396.
42. Гендон Ю.З. Вопросы вирусологии. 2001. №5, 46
43. Гендон Ю.З. Вопросы вирусологии. 2003, №4, 3 — 10.
44. Герберт У.Дж. Ветеринарная иммунология. М., 1974.
45. Глобенко Л.А. и др. Иммунология. 1991, №1, 66.
46. Глотов ГА. и др. Ветеринария. 2003, №2, 17.
47. Глотов А.Г. и др. Инфекционный ринотрахеит КРС. Новосибирск, 2006.
48. Грачев В.П., Петричиани Д.С. ЖМЭИ, 1987, №2, 46.
49. Гребенникова ТВ. и др. Молек. генетика. 2000, №2, 34 — 40.
50. Грибенча С.В., Баринский И.Ф. Вопр. вирусологии. 1989, №3, 325.
51. Гринев А.А. и др. Мол. генетика, микробиолог., вирусология. 1988, 9, 43.
52. Гриффитс Дж.Б. Биотехнология клеток животных. М., 1989.
53. Грудина Н.В. и др. С.-х. биология. 1985, №2, 85.
54. Гуненков В.В. и др. Ветеринария. 1991, №6, 22.
55. Гуненков В.В. и др. Ветеринария. 2002, №12, 21.
56. Гурбанов С.М. и др. С.-х. биология. 1987, №2, 112.
57. ДеМартини Дж.К. Российский вет. журнал. 2005, №1, 9.
58. Диев В.И. и др. Ветеринария. 2003, №11, 3.
59. Джавадов Э.Д. и др. Ветеринария, 2002, №5, 22.
60. Доел Т.Р Биотехнология клеток животных. М., 1989.
61. Дроздов С.Г. ЖМЭИ, 1983, №7, 13.
62. Дроздов С.Г. и др. Ротавирусный гастроэнтерит. М., 1982.
63. Дудников А.И. и др. Проблемы вет.иммунологии. М., 1985.
64. Дудников А.И. и др. Аграр. Россия. 2001, №3, 24.
65. Дудникова А.С. и др. Ветеринария. 2002, №6, 23 — 25.
66. Жданов В.М. и др. Вопр. вирусологии. 1973, №4, 411.
67. Жидков С.А. Бюлл. ВИЭВ, 1989, 71, 22.
68. Жидков С.А. и др. Тр. ВНИИВВиМ. 1969, №1, 65.
69. Жилова Г.П., Смородинцев А.А. Вопр. вирусологии. 1967, №6, 668.
70. Жирнов О.П. Вопр. вирусологии. 1986, №1, 14.
71. Жирнов О.П. Вопросы вирусологии. 1986, №6, 723.
72. Закстельская В.М., Говоркова Е.А. Вопр. вирусологии. 1987, №2, 133.
73. Засухина Г.Д. Мутагенез вирусов человека и животных. М., 1971.
74. Зезеров В.Г. и др. ЖМЭИ. 1983, №10, 82.
75. Зеленин и др. Реконструированная клетка. М., 1982.
76. Закутский Н.И. и др. Вестн. Рос. академии с.-х. наук. 1999, №5, 66.
77. Иванющенков В.Н. и др. ТУ 9384-008-00495527-00, 2004 г.
78. Игнатова Т.Н. Биология клетки в культуре. Л., 1984.
79. Икаева М.Н. и др. Вопр. вирусологии. 1990, №2, 169.
80. Ирза В.Н. и др. Ветеринария. 2002, №4, 21 - 23.
81. Исаева Е.И. и др. Вопр. вирусологии. 1986, №2, 153.
82. Кабанов В.А. и др. Инженерная энзимология. Киев, 1983.
83. Кастрикина Л.Н. и др. Вопр. вирусологии. 1990, №1, 68.
84. Кастрикина Л.Н., Лонская Н.И. Вопр. вирусологии. 1990, №3, 362.
85. Катингер X., Шейрер В. Биотехнология клеток животных. М., 1989.
86. Коломыцев А.А. и др. Ветеринария. 1992, №9, 12.
87. Коломыцев А.А. и др. Тез. докл. конф. ВНИИВВиМ, Покров, 1999, 149.
88. Костина Г.И. ЖМЭИ. 1981, №8, 25.
89. Костыркин Ю.А. и др. Сб. науч. конф. Владимир, 2002, 49.
90. Кочеткова Е.С. и др. Ветеринария. 2002, №10, 24.
91. Креймер Ю. Птицеводство. 1985, №11, 33.
92. Крутилина Д.В. и др. Вопр. вирусологии. 1977, №5, 586.
93. Крюков Н.Н. Инфекц. болезни КРС. М., 1974, 83.
94. Кузнецова М.А. и др. Вопр. вирусологии. М., 1990, №1, 20.
95. Кульберг А.Я. Молекулярная иммунология. М.,1985.
96. Купер Э. Сравнительная иммунология. М.,1980
97. Кусов Ю.Ю. и др. Вопр. вирусологии. 1991, 36, 206.
98. Куприянов А.И. и др. Аграр. Россия. 2001, №3, 56.
99. Куриннов В.В. и др. Ветеринария. 1993, №11 — 12, 6.
100. Куриннов В.В. и др. Ветеринария. 2005, №1, 19.
101. Ламберт К.Дж., Берч Дж. Биотехнология клеток животных. М., 1989.
102. Лашкевич В.А., Дзагуров С.Г. Научно-экспериментальные основы производства
и контроля полиомиелитных вакцин. М., 1973.
103. Лещинская Н.П. Вопр. вирусологии. 1986, №5, 517.
104. Лещинская Н.П. и др. ЖМЭИ. 1989, №10, 49.
105. Лихачев Н.В., Жидкова Л.А. Докл. ВАСХНИЛ. 1972, №11, 20.
106. Лихачев Н.В., Мищенко Н.К. Ветеринария. 1974, №2, 35.
107. Логинов А.С. и др. Иммунная система и болезни органов пищеварения. М.,
1986.
108. Луговской А.А. и др. Биоорган, химия. 1992, 18, 942.
109. Лукашевич И.С., Стельмах ТА. Вопр. вирусологии. 1988, №6, 651.
НО. Лурия С., Дарнелл Дж., Балтимор Д., Кэмбелл Э. Общая вирусология. М., 1981.
111. Лященко В.А., Воробьев А.А. Молекулярные основы иммуногенности антиге-
нов. М., 1982.
112. Максимов Н.Л. и др. Вопр. вирусологии. 2005, №1,4.
113. Массовая иммунизация диких животных против бешенства. Бюлл. ВОЗ, 1984,
62, №2, 19.
114. Медведев С.А. и др. Биоорган, химия. 1985, №2, 248.
115. Медуницин Н.В. Вакцинология. М., 1999.
116. Мертвецов Н.П. и др. Современные подходы к конструированию молекулярных
вакцин. Новосибирск,1987.
117. Методы лабораторных исследований по бешенству. Женева, 1975, 192.
118. Милев Н. и др. Вет.-мед. науки, 1987, №4, 7.
119. Миллер Г.Г. и др. Методы культивирования клеток. Л., 1988.
120. Миронова Л.Л. и др. Вопр. вирусологии. 1987, 32, 740.
121. Миронова Л.Л. и др. Вопр. вирусологии. 1990, №1, 80.
122. Митин Н.И. и др. Матер, научн. конф. ВНИИВВиМ. Покров, 1992, 146.
123. Михалишин В.В. и др. Пат. 2143921. Россия. Заявл. 21.04.1999.
124. Мищенко В.А. и др. Ветеринария. 2000, №9, 5.
125. Мищенко Н.К. Труды ВГНКИ. 1972, 18, 55.
126. Михайлов М.И. и др. Вопр. вирусологии. 1987, №1, 68.
127. Михайлов М.И. Вопр. вирусологии. 1990, №4, 268.
128. Михайлов В.В. и др. Вопр. вирусологии. 2001, №1, 4.
129. Морозова О.В. и др. ВИНИТИ. 2001. №1, 44.
130. Мотовски А. и др. Вет.-мед. науки. 1985, №4, 3.
131. Мухина А. и др. Инфекц. бол. 2004, 2, №2, 64.
132. Мэрфи Ф.А.Ж. Микробиолог. 1990, №11, 83.
133. Мэтью Р. Вирусы растений. М., 1973.
134. Недосеков В.В. Ветеринария. 2003, №8, 23.
135. Новицкий В.А. и др. Вопр. вирусологии. 1987, №3, 261.
136. Орлянкин Б.Г. С.-х. биология. 1991, №2, 131.
137. Орлянкин Б.Г. С.-х. биология. 2002, №6, 29 - 37.
138. Орлянкин Б.Г. и др. Парвовирусные инфекции и их влияние на продуктивность
животных. М., 1985.
139. Орлянкин Б.Г., Алипер Т.И. Сельхоз. биология. 2001, №2, 10 — 19.
140. Орлянкин Б.Г. и др. Сельхоз. биология. 2002, №2, 8.
141. Орлянкин Б.Г. и др. Ветеринария. 2004, №11, 3 — 5.
142. Осидзе Д.Ф. и др. Ветеринария. 1988, №6, 25.
143. Панина Г.Ф. Биотехнология клеток животных. М., 1989.
144. Парфанович М.И. и др. Диагностика, профилактика и борьба с лейкозом круп-
ного рогатого скота. Персиановка, 1986, 10.
145. Перадзе ТВ., Фридман Э.А. ЖМЭИ. 1982, №9, 28.
146. Первинов Ю.В., Литвинов С.К. Вопр. вирусологии. 1988, №5, 523.
147. Передача технологии антирабической вакцины. Бюлл. ВОЗ, 1985, 63, 4.
148. Перт С.Д. Основы культивирования микроорганизмов и клеток. М., 1978.
149. Петрова О.Г. и др. Ветеринария. 2002, №2, 11.
150. Петров Р.В. и др. Иммуногенетика и искусственные антигены. М., 1983.
151. Петров Р.В. и др. Бюлл. эксперим. биологии и медицины. 1985, №2, 184.
152. Петров Р.В., Хаитов Р.М. Искусственные антигены и вакцины. М., 1988.
153. Поланд Дж. и др. Бюлл. ВОЗ. 1981, 59, 706.
154. Пригодность клеточных субстратов для производства биологических препара-
тов. Бюлл. ВОЗ, сер. тех. докл. №747, Женева, 1988.
155. Придыбайло Н.Д. и др. Ветеринария. 1986, №7, 36.
156. Профилактика герпесвирусных болезней и борьба с ними. Бюлл. ВОЗ, 1985, 63,
№3.
157. Пузанкова О.С., Байбиков ТЗ. Дост. молод, ученых. Владимир,2000, 67.
158. Пшеничников В.А. и др. // Вопр. вирусологии, 1990, №1,4.
159. Равилов А.З., Сметанин М.А. Грипп животных. М., 1989.
160. Разумов И.А. и др.//Молекулярная генетика, микробиология и вирусология,
1991, №6,21.
161. Разумов И.А. и др. //Вопр. вирусологии, 1991, №1, 34.
162. Ратькин Э.В. и др. // Изв. РАН. Сер. Биология, 1992, №2, 303.
163. Робертс В. Биотехнология клеток животных. М., 1989.
164. Ройзман Б. Вирусология. М., 1989.
165. РойтА., Бростофф Дж., МейлД. Иммунология. Москва, 2000.
166. Сафонов Г.А., Калинина Т.А. // Ветеринария, 1987, №5, 36.
167. Селянинов Ю.О. и др. Вестн. Рос. акад. с-х. наук. 2000, №5, 75.
168. Сергеев В.А. Репродукция и выращивание вирусов животных. М., 1976.
169. Сергеев В.А. Вирусные вакцины. Киев, 1993.
170. Сергеев В.А. и др. Ветеринария. 1980, 12, 3.
171. Сергеев В.А. и др. Труды ВИЭВ. 1983, 58, 63.
172. Сергеев В.А., Орлянкин Б.Г. Структура и биология вирусов животных. М., 1983.
173. Сергеев В.А. Всероссийский ветеринарный конгресс. Москва, 2005, 35.
174. Сергеев В.А. и др. Ветеринария, 2001, №9, 10.
175. Сергеев В.А. и др. Ветеринарная вирусология. М., 2001.
176. Сергеев В.А. и др. Ветеринария, 2005, №4, 6.
177. Сизов И. и др. // Вет.-мед. науки, 1985, 22, 1, 25.
178. Смородинцев А.А. и др. // Там же, 1978, №5, 602.
179. СмородинцевА.А. //ЖМЭИ, 1984, №7,33.
180. Спиер Р.Е. Биотехнология клеток животных. М.,1989, 1, 260.
181. Спиер Р.Е., Гриффитс Дж.Б. Биотехнология клеток животных. М., 1989, 1.
182. Сюрин В.Н., Фомина Н.В. Частная ветеринарная вирусология. М., 1979.
183. Сюрин В.Н. и др. // Вестн. с.-х. науки, 1983, №1, 91.
184. Тайлер К.Л., Филдс Б.Н. Вирусология. М.,1989.
185. Тарасишин Л.А.//Докл. АН Украины, 1991, №12, 133.
186. Татаров Г, Диловски М. // Ветер.-мед. Науки. 1986, №7, 33.
187. Тимофеев А. В. и др. //ЖМЭИ, 1987, №9, 89.
188. Титенко А.М. и др. // Вопр. Вирусол., 1991, 36: 511.
189. Чумаков М.П. // Вестн. АМН СССР, 1980, №12, 71.
190. Чумаков М.П. и др. // Вопр. вирусологии, 1984, №6, 701.
191. Чумаков М.П. и др. // Вестн. АМП СССР, 1989, №3, 23.
192. Чумаков М.П. и др. // ЖМЭИ, 1992, №3, 55.
193. Шарова Н.К., Букринская А.Г.// Вопр. вирусологии, 1987, №2, 173.
194. Шишков В.П. и др.//Вест. с.-х. науки, 1986, №11, 118.
195. Штрауб О.Х. Инфекции крупного рогатого скота, вызываемые вирусами герпе-
са. М., 1981.
196. Файзулоев Е.Б. и др. Ветеринария, 2002, №11, 17.
197. Фельдман М.Я. // Вопр. мед. химии, 1963, №3, 232.
198. Феннер Ф. и др. // Биология вирусов животных. М., 1977.
199. Филатенков А.Г. и др. // Вопр. вирусологии, 1991,36, 229.
200. Фримель X., Брок Й. Основы иммунологии. М., 1986.
201. Фролов В.С., Белоусова Р.В. // Вестн. с.-х. науки, 1985, №5, 150.
202. Харламбиев Е.Х. и др. // Вет.-мед. Науки, 1986, №10, 26.
203. Хаитов Р.М., Пинегин Б.В. Иммунология, 1997, 5, 4.
204. Цыбанов С.Ж. и др. Патент России № 208793, 10.09.97.
205. Цыбанова Л. и др. Мат. научн. конф. Щелково ВНИИТБП, 1998, 232.
206. Шуляк Б.Ф. Росс. вет. журнал. 2005, №1, 19.
207. Юров К.П., Амирбеков М.А. //Тр. ВИЭВ, 1984, 61, 72.
208. Ярилин А.А. Основы иммунологии. М., 1999.
209. Abcouwer S. et al., Biotechnology, 1989, 7, 939.
209 a. Abdel-Alim G.A., Saif Y.M. Avian Dis, 2001,45, 92.
210. Abe S. et al., Jap.J. Med. Sci. and Biol., 1987, 40, 3.
211. Ablashi D.V. etal. J. Virol., 1985, 55, 623.
212. Abraham S. etal. Virology, 1990, 176, 296.
213. Abu-Reesh I., Kargi F. J. Biotechnol., 1989, 9, 167.
214. Achmed R., Grey D. Science 1996, 272, 54.
215. AcKerman M. et aL, Vet. Microbiol. 1996, 53, 1.
216. Ada G. Vaccine, 1986, 6, 77.
217. Ada G. Mol. Immunol., 1991,28, 225.
218. Ada G. Enciclopedia of Virology, 1994, 1503.
219. Adair B. McFerran J. B. Vet. Microbiol., 1987, 13, 87.
220. Adams S. Hutt-Fletcher L.M. J.Virol., 1990, 64, 3382.
221. Afshar A. et al. Acta virol., 1991,35,292.
222. Agterberg M. et al. Vaccine, 1990, 8, 438.
223. Aizawa Sh. Et al. J. Cell. Physiol., 1991, 148, 245.
224. Ajjan N., Pilet Ch. Vaccine, 1989, 7, 125.
225. Akita G. et al. Vet. Rec. 1994, 135, 283.
226. Akkermans J. et al. Zbl. Xfeterinarmed., 1979, 26, 49.
227. Akkina R., Raisch K.P. Virus Res., 1990, 16, 95.
228. Alberti A. et al. Hepatology, 1990, 12, 199.
229. Al-Ahdal M. et al. Microbiol. 1989, 58, 234.
230. Al-Darraji A. Amer. J. Vet. Res., 1982, 43, 236.
231. Aldrihc C. et al. Virology, 1989, 172, 247.
232. Alenius S. et al. Acta Vet. Scand., 1991, 32, 163.
233. Alexander D.J., Bown I.H. Rev. Sci et techn/Off. Int. Epizoot., 2000, 19, 197.
234. Alexander L. et al. J. Virol. 2000, 74, 4361.
235. Alexandersen S. et al. J. Virol., 1988, 62, 1495.
236. Allan G.M., Ellis J.A. J. \fet. Diagnost. Invest. 2000, 12, 3.
237. Allison AC. Nature, 1965, 205, 141.
238. Allison A.C. Gregoriadis G. Nature, 1974, 233, 330.
239. Altenburger W. Arch. Virol., 1989, 105, 15.
240. Amor S., Webb H. J. Med. Virol., 1986, 19, 367.
241. Amadori M. et al. Vaccine, 1987,5,219.
242. Anderson E. Rev. Sci. Off. Int. Epizoot., 1986, 5, 477.
243. Anderson L. J. et al. J. Virol., 1988, 62, 4232.
244. Anderson E.L. et al. J. Clin. Mocrobiol., 1992, 30, 2230.
245. Andre F.E. et al. Vaccine, 1992, 10, 160.
246. Antoine H. Ann. Med. Xfct., 1986, 130, 393.
247. Antoni F. et al. Magyar allator. Lapja., 1988, 43, 561.
248. Appel M. J. Gen. Virol., 1978, 41, 385.
249. Appel M. et al. Arch. Virol., 1984, 82, 73.
250. Appel M., Harris W.V J.Amer.Xfct.Med.Assoc., 1988, 193, 332.
251. Appleton J.A., Letchworth G.J. Virology, 1983, 124, 286.
252. Arathoon W.R., Telling R.C. Dev. Biol. Stand., 1981, 50, 145.
253. Arathoon W.R., Birch J. R. Science, 1986, 232, 1390.
254. Arathoon W, Birch J. Science, 1986, 232, 56.
255. Archambault D. et al. Amer. J. Vet. Res., 1988, 49, 1084.
256. Arguello VJ.L. Rev. Sci. et techn. Off. int. epozoot., 1991, 10, 459, 471.
257. Armstrong Cr., Dimmock N. J.Virol. 1992, 66, 3823.
258. Arnold J., Miskimins D. Iowa State Univ. Veter., 1986, 48, 6.
259. Arvidson Y. et al. Arch. Virol., 1990, 111, 227.
260. Asfarviride and Iridoviridae. Vet. Virology, 1999, 293.
261. Assoian R. K. et al. Nature, 1984, 309, 804.
262. Assoian R. K. et al. Anal. Biochem., 1989, 177, 95.
263. Atanasiu P, Tsiang H. Comp. Immunol., Microbiol, and Inf. Dis., 1979, 1, 197.
264. Athman H. et al. Virus Ras., 1999, 64, 69.
265. Audonnet J.-Ch. et al. J. Gen. Virol., 1990,71,2969.
266. Auge de Mello P. et al. Bol. Centr. Panam. Fieb. Aftosa, 1989, 55.
267. Aynaud J.M. et al. Proc. IPVS. Cong. Ames., 1976,7.
268. Aynaud J.M. et al. Ann, rech. Vet., 1984, 15, №3, 347.
269. Aynaud J.M. Principles of vaccination. Boston, 1988, 165.
270. Azad A.A. Virology, 1985, 143, 35.
271. Azad A.A. et al. Virology, 1987, 161, 145.
272. Bachrach H. etal., J. Immunol., 1975, 115, 1636.
273. Bachmann P., Hess R. Ann. Rech, vet., 1983, 14, 502.
274. Bachmann P. Vet. Med., 1983, 37, 40.
275. Bachmann P. et al. Zbl. Veterinarmed, 1984, 31, 660.
276. Bahnemann H. Bull. Off. Int. Epiz., 1974, 81, 1335.
277. Baczko K., Lazzarini R. Virol., 1979, 31, 854.
278. Bagust TJ. et al. Avian Diseases, 1986, 30, 1, 179.
279. Bahnemann H. Arch. Virol., 1975, 47, 47.
280. Baker J. et al. J. Amer, Vet. Med. Assoc., 1986. 189, 66.
281. Ball J. et al. Gastroenterology, 1999, 117, 40.
282. Ball L. Fields Virology, 2001, 105.
283. Balia L., Veress T. Magyar allotor. Lapja, 1984, 39, №7, 395.
284. Balia L. et al. Magyar allotor. Lapja, 1984, 39, 401.
285. BaliaL. etal. Magyarallotor. Lapja, 1986, 41, 525.
286. Baltimor D. Bacteriol. Rev. 1971,35,235.
287. Bansal R. et al. Bull. Office Int. Epizoot., 1980, 92, 57.
288. Barbezange C. et al. Virus. Res. 2000, 66, 79.
289. Barhoom S. et al. Avian Pathol., 1986, 15, 2, 213.
290. Barnes D., Sato G. Cell, 1980, 22, 649.
291. Barnes D., Sato G. Annal. Biochem., 1980, 102, 255.
292. Barnes D.M. Science, 1986, 233, 1149.
293. Barnes D., Sato G. Cell, 1980, 22, 649.
294. Barnett P et al. J. Gen. Virol., 1989, 70, 1483.
295. Barrett N. et al. AIDS Res. and Hum. Retroviruses, 1989, 5, 159.
296. Barteling S. et al. Bull. Ofice int. epizoot., 1979, 91, 101.
297. Barteling S. et al. J. Biol. Stand., 1983, 11, 297.
298. Barteling S., Woortmeyer R. Arch. Virol., 1984, 80, 103.
299. Barteling S., Anemaet D.A. Develop. Biol. Stand., 1987, 66, 531.
300. Barteling S., Vreeswijk J. Vaccine, 1991,9, 75.
301. Barth R. et al. Vaccine, 1990, 8, 41.
302. BartholdS., Smith A. Arch. Virol., 1989, 107, 171.
303. Basavappa R. et al. J. Virol., 1998, 72, 7551.
304. Bashi T. et al. J. Virol., 1985, 55, 307.
305. Bass D. et al J. Virol., 1990, 64, 1830.
306. Bassel-Duby R. et al. J. Virol., 1987, 61, 1834.
307. Bauer K., Straub O. Berl. Munch. Tierarztl. Wochenschr., 1985, 98, 247.
308. Bause I. et al. Zbl. Bakteriol. Mikrobiol. und Hyg., 1985, A260, 461.
309. Baxt B. et al. J. Virol., 1984, 51, 298.
310. Bayliss C. et al. Arch. Virol., 1991, 120, 193.
311. Becher R et al. Virology, 2003, 311, 96.
312. Becht H., Richt J. Virus Infections of \fertebrates, 1996,6,235.
313. Becht H. et al. J. Gen. Virol., 1983, 69, 631.
314. Beck M. et al. J. Biol. Stand., 1989, 17, 85.
315. Beck M., Tracy S. J. Clin. Microbiol., 1990, 28, 1822.
316. Beck E., Strachmaier K. J. Virol., 1987, 61, 1621.
317. Beck Th. et al. Experientia, 1989, 39, 1428.
318. Becker J. etal. J. Clin. Microbiol., 1992, 30, 1120.
319. Bengelsdorf H. Berlin und Munch. Tierarztl. Wochenschr., 1987, 100, 162.
320. Ben-Porat T. et al. Virology, 1985, 154, 325.
321. BerekC., Zigner M. Immunol. Today, 1993, 14, 400.
322. Berg T. P., Maulemans G. Avian Pathol., 1991, 20, 409.
323. Berger H.-G. et al. Vaccine, 1990, 8, 213.
324. Bergman R. et al. Dev. Biol. Stand., 1983, 55, 77.
325. Berman P.W. et al. Science, 1985, 227, 1490.
326. Bernstein D., Stanberry I. \hccine. 1999, 17, 1681.
327. Berta E Riv. Coniglicolt., 1985, 22, 6, 38.
328. BesredkaA. Local Immunization, Baltimore, 1927.
329. BesselaarT, Blackburn N. Arch Virol, 1991, 121, 111.
330. Bettger W. et al. Proc. Nat. Acad. Sci. USA. 1981,78, 5588.
331. Bhavani K. et al. Virus Res., 1989, 12, 331.
332. Bin D. et al. Bull. World Health Organ, 1991, 69, 415.
333. Binn L. et al. J. Infect. Diseases, 1986, 153, 749.
334. Binn L. et al. Med. et chir. diag., 1992, 21, N 2, 9.
335. Biotechnol, News, 1987, 7, N 19, 6.
336. Biotechnol, News, 1989, 9, N 23, 6.
337. Birch J., Pirt S. J. Cell Sci., 1970, 7, 661.
338. Birch J. Dev. Biol. Stand., 1979, 40, 21.
339. Biron Ch., Sen G. Fields Virology, 2001,321.
340. Biront P. et al. Amer. J. Vet. Res., 1982, 43, 760.
341. Bishop D. et al. Virol., 1971,8, 74.
342. Bishop D. etal. Intervirology, 1980, 14, 125.
343. Bishop D. Appl. Biotechnol., 1986, 1, 225.
344. Bittie J., Rubic W. Amer. J. Wt. Res., 1976, 37, 275.
345. Bittie J. et al. Nature, 1982, 298, 30.
346. Bittie J., Muir S. Adv. Vet. Sci. Comp. Med., 1989, 33, 1.
347. Bittie S. J. AVMA., 1982, 181, 332.
348. Bjare U. J. Virol. Meth., 1984, 9 259.
349. Black L. et al. Res. in veter. Sc., 1986, 40, 303.
350. Black L., Francis M. Epidemiol, and Infec., 1988, 101,477.
351. Blackburn N., Besselaar T. J. Virol., Meth. 1991, 33, 367.
352. Blacklaws B., Nash A. J. Gen. Virol., 1990, 71, 863.
353. Blacklaws B. et al. Virology, 1990, 177, 727.
354. Blancou J. et al. Ann. rech. vet., 1984, 15, 543.
355. Blancou J. Rev. scient. Off. Intern. Epizoot. 1985, 4, 235.
356. Blancou J. etal. Nature, 1986, 322, 373.
357. Bloom M., Young N. Fields Virology, 2001, 2361.
358. Blumberg B. et al. Virol., 1988,164, 487.
359. Bock H. et al. Viccine, 1990, 8, 22.
360. Boere W. et al. J. Virol., 1985, 54, 546.
361. Bognar K. et al. Magyar allator. lapja, 1986, 41, 647.
362. Bognar G. et al. Acta microbial, hung., 1991, 38, 172.
363. Bohl E. H., SaifL. Mucos. Immun. Sistem, 1981,259.
364. Bolin S. et al. Amer. J. Vet. Res., 1985, 46, 573.
365. Bolin S. et al. Amer. J. Vet. Res., 1985, 46, 2385, 2467.
366. Bolin S. et al Arch. Virol.,1988, 99, 117.
367. Bolin S. Amer. J. Vet. Res., 1988, 49, 1040.
368. Bolin S. et al. Arch. Virol., 1988, 99, 117.
369. Bolin S., Ridpath J. F. Amer. J. Xbt. Res., 1990, 51,703.
370. Bolle H., Schmidt B. Tierarztl. Umsch., 1986, N 3, 167.
371. Bolognesi D. etal. Science, 1978, 199, 183.
372. Booth J. C., Stern H. J. Med. Microbiol., 1972, 5, 515.
373. Borgen H., Espensen L. Zbl. Bakt., 1970, 214, 13.
374. Bornaviridae. Vet. Virol., 1999, 455.
375. Borysenko J. Z., Worlds W. Exp. Cell Res., 1979, 118, 215.
376. Botero H., Staples W. Poultry Guide, 1983, 20, 53.
377. Bouillant A. M. P. Canad. Vet., 1986, 27, 448.
378. Boulanger D. et al. Ann. Med. Vet., 1992, 136, 33.
379. Boulanger D. et al. Vaccine, 1995, 13, 215.
380. Boursnell M. et al. Virology, 1990, 178, 297.
381. Bowen R. A., Amer. J. Vet. Res., 1987, 48, 1449.
382. Box P. G., Ellis K. R. Avian Pathol., 1985, 14, 1,9. ;
383. Box P. G., Holmes H. Turkeys, 1983, 33, 23.
384. Braciole T. J. et al. J. Exp. Med., 1984, 159, 341.
385. Brain D., Spaan W. Semin. Virol., 1998, 8, 101.
386. Brandriss M. et al. J. Infec. Diseases, 1990, 161,1134.
387. Brandtzaeg P. Recent Advances in Mucosal Immunity, N. Y, 1982.
388. Braun P. et al. Appl. Microbiol., 1970, 19, 62.
389. Bricker B. J. et al. Virology, 1987, 161, 533.
390. Bridger J., Pocock D. H. J. Hyg., 1986, 96, 257.
391. Bridger J. etal. Infec. and Immun., 1984, 43, 133.
392. Bridger J. et al. J. Virol., 1998, 72, 6929.
393. Bridges C., Edington N. Clin, and Exp. Immunol., 1987, 70, 276.
394. BrochierB. et al. Ann. Med. Vet., 1987, 131,463.
395. Brown E Nature, 1983, 304, 395.
396. Brown E Ann. Inst. Pasteur: Virol., 1985, 136E, 547.
397. Brown E Appl. Biotechnol., 1986, 1, 219.
398. Brown F. Rev. Sei. etTech. Off. Int. Epizoot., 1986, 5, 265.
399. Brown E Vaccine, 1988, 6, 180.
400. Brown E Dev. Biol. Stand., 1991, 75, 37.
401. Brown E Vaccine, 1992, 10, 1022.
402. Brown M., Kiehn D. Proc. Nat. Acad. Sci. USA, 1977, 74, 2874.
403. Brown P. J. et al. J. Anat., 1975, 120, 329.
404. Brown P. J., Bourne F. J. Amer. J. Vet. Res., 1976, 37, 9.
405. Brownlie J. et al. Vet. Rec., 1984, 114, 535.
406. Brownlie J. Arch. Virol., 1991, Suppl. N 3, 79.
407. Brugh M., Siegel H. S. Poultry Sci., 1978, 57, 892.
408. Brugh M. et al. Amer. J. Vet. Res., 1979, 40, 162.
409. Brun A. et al. Riv. Suinicolt., 1987, 28, 33.
410. Brunei! Ph. A. et al. J. Infec. Diseases, 1987, 156, 430.
411. Brussow H. et al. Zbl. Bacteriol., Microbiol, und Hyg., 1987, 264, 249.
412. Brussow H. et al. J. Gen. Virol., 1988, 69, 1647.
413. Brussow H. et al. J. Virol., 1990, 64, 3635.
414. Brussow H. et al. J. Clin. Microbiol., 1992, 30, 67.
415. Brynestad K. et al. J. Virol., 1990, 64, 680.
416. Buchholz U. et al. J. Virol., 1991,73, 251.
417. Buchmeier M. et al. Fields Virology, 2001, 1635.
418. Buddle В. M., Pulford H. D. Vet. Microbiol., 1984, 9, 515.
419. Bulgin M. S. Mod. Vet. Pract., 1985, 66, 609.
420. Bull. World Health Org., 1979, 57, 719.
421. Bull. Wld Health Org., 1987, 65, 941.
422. Buonavoglia C. et al. Clin. Vet., 1985, 108, 19.
423. Buonavoglia C. J. Vet. Med. Ser. B., 1988, 35, 397.
424. Burke D., Monath T. Fields Virology, 2001, 1043.
425. Burki. E Wien. Tieraztl. Monatsschr., 1986, 73, 109.
426. Burny A. et al. Wt. Microbiol., 1988, 17,197.
427. Burroughs A. L. et al. Can. J. Comp. Med., 1982, 46, 264.
428. Burrows R. et al. Vet. Rec., 1984, 114, 369.
429. Butchaiah G. et al. Zbl. Veterinarmed., 1984, 31,760.
430. Butchaiah G. et al. Indian. Vet. J., 1985, 62, 635.
431. Butchaiah G., Rao B. Curr. Sci., 1987, 56, 346.
432. Butchaiah G., Rao B. U. Rev. Sci. et Tech. Off. Int. Epizoot., 1988, 7, 347.
433. Buthner M. et al. Tieraztl. Prax., 1989, 17, 39.
434. Caij A. et al. Arch. Virol., 1989, 105, 113.
435. Calain P, Roux 1. J. Virol., 1988, 62, 2859.
436. Callebaut P. et al. J. Gen. Virol., 1988, 69, 1725.
437. Callebaut P. et al. J. Gen. Virol., 1996, 77, 309.
438. Cameron K. J. Gen. Virol., 1973, 18, 51.
439. Cameron C. et al. Onderstepoort J. Vet. Res., 1987, 54, 157.
440. Cammack N., Gould E. A. Virology, 1986, 150, 33.
441. Campen H. et al. Poultry Sci., 1989, 68, 150.
442. Campo M. Cancer Cells, 1991, 3, 421.
443. Caplen H. et al. J. Gen. Virol., 1985, 66, 2271.
444. Cappel R. Arch. Virol., 1980, 65, 15.
445. Capstick P. et al. Nature, 1962, 195, 1163.
446. Capstick P. et al. Nature, 1965, 205, 1135.
447. Capstick P. et al. J. Hyg., 1967, 65, 273.
448. Carbone K., WolinskyJ. Fields Virology, 2001, 1381.
449. Cardona C. et al. Avian Dis., 1999, 234.
450. Cardona C. et al. Avian Dis., 2000, 44, 661.
451. Carman W. et al. Lancet, 1990, N 8711, 325.
452. Carmichael L. Vet. Vaccinology, 1997, 326.
453. Carpenter S. et al. J. Virol., 1987, 61, 3783.
454. Cartwright B. et al. Res. Vet. Sci. 1982, 32, 338.
455. Casas Olascoaga R. Bull. Off. Int. Epiz., 1978, 89, 1015.
456. Castanon S. et al. J. Virol., 1999, 73, 4452.
457. Castells E. et al. Arch. Virol., 1990, 1 15, 277.
458. Castrucci G. et al. Comp. Immunol. Microbiol. Infect. Dis., 1988, N 2, 71.
459. Castes G. A. et al. Pat. 6020182 USA, MFIK7C12N, 7/00.
460. Cattaneo R. et al. Cell, 1988, 5, 155.
461. Cauda R. et al. Virus Res., 1986, 4, 337.
462. Cavanagh D. et al. J. Gen. Virol., 1977, 35, 149.
463. Cavanagh D. et al. J. Gen. Virol., 1986, 67, 1435.
464. Cavanagh D., Davis P. J. Avian Pathol., 1987, 16, 1.
465. Cavanagh D., Davis P. J. Gen. Virol., 1988, 69, 621.
466. Cavanagh D. et al. Virology, 1990, 176, 306.
467. Cepica A., Derbushire J. Canad. J. Comp. Med., 1984, 48, 258.
468. Chalmers K., Wolcock P.R. Avian Pathol. 1984, 13, 727.
469. Chandler J. Amer. Biotechnol. Lab. 1990, 8, 18.
470. Chang I-D.T. et al. Poultry Sci. 1985, 64, 78.
471. Chanock R. et al. Vaccine. 1988, 6, 129.
472. Chanock R. Fields Virology, 2001, 1341.
473. Chantier J. et al. Fields Virology, 2001, 963.
474. Chapman W., Ramshaw J. A. Appl. Microbiol., 1971, 22, 1.
475. Chapsal J., Pereira L. Virology, 1988, 164, 427.
476. Charley B., Laude H. J. Virol., 1988, 62, 8.
477. Charlier G. et al. Comp. Immunol. Microbiol. Infect. Dis., 1981,4, 279.
478. Charlier G. et al. Arch. Exp. Vet. Med., 1984, 38, 894.
479. Charpilienne A. etal. Ann. Inst. Pasteur, Virol., 1986, 137, 71.
479 a. Chasey D., Davies P. Vet. Rec., 1984, 114, 16.
479 b. Cheevers W. et al. J. Gen. Virol., 1988, 69, 675.
480. Chen K., Johonson D. Comp. Immunol. Microbiol, and Infect. Dis., 1986, 9, 37.
481. Chen K.S. et al. J. Virol., 1987, 61, 2150.
482. Chen K.S., Quinnan G. J. Gen. Virol., 1988, 69, 2779.
483. Cheung A. etal. J. Virol., 1983, 48, 451.
484. Childers N. et al. Ann. Rev. Microbiol., 1989, 43, 503.
485. Cho K. et al. Am. J. Vet. Res., 2001,62, 1436.
486. Choi S.S. et al. Virology, 1988, 167, 451.
487. ChongYH. etal. Virol.,1991, 65, 10007.
488. Christensen L. et al. Vet. Rec., 1990, 127, 471.
489. Christensen N. et al. Virology, 1991, 181, 572.
490. Christofer-Hennings J. et al. J. Vet. Diagnost. Invest., 2001, 13, N 2, 133.
491. Chua K.B. et al. Science, 2000, 288, N 5470, 1432.
492. Churchill A. J. Biol. Stand., 1982, 10, 1.
493. Ciarlet M. et al. J.ViroL, 1998, 72, 9233.
494. Ciuchini F. et al. Clin.Vet., 1985, 108, 219.
495. Clark H. et al. Vaccine, 1990, 8, 327.
496. Clark J., Hirtenstein M. Ann. N. Y. Acad. Sci., 1981, 369, 33.
497. Clark J. et al. Dev. Biol. Stand., 1982, 79, 1158.
498. Clarck L. et al. J. Amer. Vet. Med. Assoc., 1984, 185, 1535.
499. Clark N.et al. JAVMA, 1991, 199, 1433.
500. Clarke I. J.Gen.Virol., 1997, 78, 291.
501. Clarke J. B., Spier R.E. Dev. Biol. Stand., 1977, 35, 61.
502. Clarke J. B., Spier R.E. Vet. Microbiol., 1983,8, 259.
503. Clements J.E. Annu. Rev. Immunol., 1988,6,139.
504. Clements G.B., Jamieson F.E. Arch. Virol., 1989, 104, 95.
505. Clements J.E. et al. Virus Res., 1990, 16, 175.
506. Cocker F. M. et al. Vet. Rec., 1984, 114, 353.
507. Coelingh К et al. J: Virol., 1986, 60, 90.
508. Coelingh K., Tierney E. J. Virol., 1989, 63, 375.
509. Coelingh K, Tierney E. J. Virol., 1989, 63, 375.
510. Coelingh K. et al. J. Virol. 1990, 64, 3833.
511. Coen D., Ramig R. Fields Virology, 1996, 113.
512. Cohen G.H. et al. J. Virol., 1986, 60, 157.
513. Cohen J. I. etal J. Med. Virol., 1987, 21, №4, 21.
514. Cole C., Conzen S. Fields Virology, 2001, 2175.
515. Cole E.E. Appl. Microbiol., 1971,22, 842.
516. Collen T. et al. J. Gen. Virol., 1989, 70, 395.
517. Collett M. et al. Virology, 1988, 165, 200.
518. Collett M. et al. J. Gen. Virol., 1989, 70, 253.
519. Collins J. et al. Amer. J. Vet. Res., 1987, 48, 361.
520. Collins J. etal. Amer. J. Vet. Res., 1988, 49, 1045, 1316.
521. Collins P. et al. Fields Virology, 2001, 1443.
522. Colucci G. et al. Virology, 1988, 164, 238.
523. Combiescu A. Padiat und Grenzgeb., 1987, 26, 44.
524. Compagnucci M., Tempesta M. Boll. Assoc. Ital. Vet. Picollianim, 1985, 24, 215.
525. Condit R. Fields Virology, 2001, 19.
526. Condreay L.D. et al. J. Virol., 1990, 64, 3249.
527. Connor E. et al. Blood, 1995, 86, 135.
528. Conway M. et al. J. Gen. Virol., 1989, 70, 729.
529. Cook A. New Sci., 1987, 116, 32.
530. Cook J. Avian Pathol., 1984, 13, 733.
531. Cook J. Poultry World, 1986, 140, 20,6.
532. Cook J. et al. Avian Pathol. 2001, 30, 423.
533. Cook R. Vaccine, 1990, 8, 491.
534. Corapi W. et al. J. Virol., 1988, 62, 2823.
535. Corbiel M. et al. J.Clin. Microbiol., 1979, 10, 91.
536. Coria M.F. et al. Amer. J. Vet. Res., 1984, 45, 2129.
537. Corman B. J.Gen. Virol., 1979, 44, 1.
538. Correa J. et al. Virus Res., 1988, 10, 77.
539. Correa J. etal. Proc. 12-th 1PVS Cong., 1992, 1, 145.
540. Corthier G., Charley B. Ann. rech. Vet., 1978, 9, 245.
541. Cortessis G. et al. Lab. Pract., 1988, 37, N 11, 63.
542. CostraJ. Biol. Iridoviruses, 1983, 64,693.
543. Couderc T. et al. Virology, 1990, 174, 95.
544. Coulon P. et al. J. Gen. Virol., 1983, 64, 693.
545. Coussens P. M. et al. Virus Genes., 1991, 3,291.
546. CramentiE, Rossi G. Atti. soc. ital. sci, veterin., 1969, 22, 900.
547. Crandel R. Amer. J. Vet. Res., 1980, 41, 994.
548. Criffits B. Trends Biothechnol., 1986, 4, 268.
549. Crough C.F. et al. J.Gen. Virol., 1985, 66, 1489.
550. Croughan M. S. et al. Biotechnol. Bioeng., 1989, 33, 862.
551. Cubitt W. D. et al. J. Infec. Diseases, 1987, 156, 806.
552. Culture medium. American Biotechnol. Genet. Eng. News, 1989, 4, 24.
553. Cunliffe H. Appl. Microbiol., 1973, 26, 747.
554. Cyr-Coats K. St. et al. Vet. Med., 1988, 35, 752.
555. Dahlgren U. et al. Scand. J. Immunol., 1981, 14, 95.
556. Dahte J. et al. J. Vet. Med., 1987, 34, 729.
557. Dahte J. et al. Pestivirus infections of ruminants, 1987, 195
558. Dales S. Bakteriol. Rev., 1973, 37, 103.
559. Dallo S., Esteban M. Virolodgy, 1987, 159, 408.
560. Daniel C. Tablor P. J. Virolodgy, 1990, 174, 87.
561. Dantes J. etal. Virolodgy, 1986,151,379.
562. Darnell J. E., Eagle H. Virolodgy, 1958, 6, 556.
563. Davidson L, Bozenshtain R., Avian. Dis., 2001, 45, 102.
564. Davis D. Res. in veter. Sc., 1987, 43, 44.
565. Davis N. et al. Virolodgy, 1987, 161, 108.
566. Dea S. etal. Can. J. Vet. Res., 1986, 50, 130.
567. Dea S., Ttjssen P. Arch. Virol., 1988, 99, 173.
568. Dea S., Tijssen P. Amer. J. Vet. Res., 1989, 50, 226.
569. Dea S. et al. J. Virol., 1990, 64, 3112.
570. Dekaesstecker M., Meulemans G. Avian Pathol., 1989, 18, 715.
571. De Clercq E., Adv.Virus Res., 1993. 42, 1-56.
572. Degert D. et al. J. Gen. Virol., 1989, 70,993.
573. De Haan L. et al. Vaccine 2001, 19, 2898.
574. De la Tozze J. Fields Virolodgy, 2001, 1669.
575. Delmas B. et al. J. Gen. Virol., 1990,71,1313.
576. Delmas B., Laude H. Virus Res., 1991, 20, 107.
577. De Mattos C. Fields Virolodgy, 2001,1245.
578. Depner K.R. et al. Vet. Microbiol., 2001, 83, 107.
579. Dermer O., Ham G. Ethyleneimine and Other Aziridines. Acad. Press, New York,
1969.
580. Desai P. J. et al. J. Gen. Virol., 1988, 69,1147.
581. Desmettre Ph., Marinod S. Vet. Vaccinology, 1997, 175.
582. Desrosiers R. Fields Virology, 2001, 2095.
583. Diamond D.C. et al. Science, 1985, 229, 1090.
584. Dickie C.W. et al. Ut. Med., 1987, 82, 178.
585. Dietzschold B. et al. J. Infec. Diseases, 1987, 156, 815.
586. Dietzschold B. et al. Virology, 1987, 161, 29.
587. Dietzschold B. et al. J. Virol., 1990, 64, 3804.
588. DiMaio D., Coen D. Fields Virology, 2001, 119.
589. Dimmock N. J. Gen. Virol., 1984, 65, 1015.
590. Dimmock N. J. Rev. Med. Virol. 1995, 5, 165.
591. Dion A.S. et al. Virology, 1990, 179, 474.
592. Discussion: Nat. Cancer Inst. Monogr., 1978, 49, 25.
593. Dobos P., Roberts ТЕ. Can. J. Microbiol., 1983, 29, 377.
594. Doel T. et al. J. Virol., 1990, 64, 2260.
595. Doel T, Pullen L. Vaccine, 1990, 8, 473.
596. Doel T. Sci. Tech. Rev. Off. Int. Epizoot. 1996, 15, 883.
597. Doel T. et al. Vaccine, 1994, 12, 592.
598. Domingo E. et al., Curr. Top. Microbiol. Immunol., 1992, 176, 33.
599. Domingo M. et al. Nature, 1990, 348, 6296.
600. Donis R.O., Dubovi E.J. Amer. J. Vet. Res., 1987, 48, 1549.
601. Donis R.O. etal. J. Gen. Virol., 1988, 69, 77.
602. Donis R.O. et al. Arch. Virol, 1991, Suppl. №3, 29.
603. Donnelly S. Annu. Rev. Immunol., 1997, 15, 617.
604. Doudnikov A.I. et al. Bull. Office Int. Epizoot., 1978, 89, 987.
605. Driesch P. et al. Immunobiology, 1988, 178, 43.
606. Duchatel J., Vindevogel H. Ann. Med. Xbt., 1987, 131, 63.
607. Duckmanton L. et al. Virus. Res. 199, 64, №2, 137.
608. Duffell S.J., Harkness J.W. V?t. Rec., 1985, 117, 240.
609. Duque H. et al. Vaccine, 1989, 7, 513.
610. Dulbecco R., Freemen G. Virology, 1959, 8, 396.
611. Du Nian-Xing. Rev. Sci. et tech.off. int. epizoot., 1991, 10, 325.
612. Duncan R. et al. Virology, 1990, 174, 399.
613. Dunn C. et al. Virology, 1998, 247, 1,51.
614. Dunster L.M. et al. Virology, 1999, 261, 309.
615. Dupuy C. et al. J. Virol., 1999, 73, 9063.
616. Dutia В. M. etal. J. Gen. Virol., 1990, 71, 1227.
617. Eagle H. Science, 1955, 122, 501.
618. Eagle H. Science, 1959, 130, 432.
619. Eagle H. J. Cell. Physiol., 1973, 82, 1.
620. Eagle H. et al. J. Biol. Chem., 1961, 236, 2039.
621. Earle W.R. et al. Ann. N.Y. Acad. Sci., 1953/1954, 58, 1000.
622. Earle W.R. etal. J. Nat. Cancer Inst., 1951, 12, 179.
623. Edbauer C. et al. Virology, 1990, 179, 901. ,
624. Edington N., Plowright W. Res. Vet. Sci., 1980, 28, 384.
625. Edwards K. et al. Vet. Rec., 1986, 119, 203.
626. Edwards S., Sands J. Dtsch. Tiettarzil. Wochenschr., 1990, 97, 79.
627. Edwards S. Abstr. O.I.E. Sympos. Classical Swine Fever. Birmingham, 9-10 July, 1998.
628. Edwards S. et al. Vet. Microbiol., 2000, 73, 103.
629. Eidson C. S. et al. Poultry Sci., 1980, 59, 54.
630. Eisinger M. et al. Pros. Nat. Acad. Sci. USA, 1979, 76, 5340.
631. Elbert L.B. et al. Vaccine, 1989, 7, 477.
632. ElGuink N. et al. Vaccine, 1989, 7, 147.
633. Eliot M. et al. Arch. Virol., 1988, 99, 45.
634. Eliot M. et al. J. Gen. Virol., 1990,71, 2425.
635. Ellis R. W, Gerety R. J. Amer. J. Infec. Contr., 1989, 17, 181.
636. Emini E. A.et al. Virol., 1983, 48, 547.
637. Emini E. A.et al. Virology, 1983, 124, 144.
638. Emini E. A.et al. J. Med. Virol., 1989, 27, 120.
639. Engels M. et al. J. Gen. Virol., 1983, 64, 2237.
640. Epstein A. L. et al. Arch. Virol., 1990, 111, 133.
641. Ericsson T. et al. J. Virology, 2001, 75, 2765.
642. Emawati R. Vet. Rec., 1984, 115, 352.
643. Esposito J., Fennez F. Fields Virology, 2001, 2885.
644. Estes M. et al. Curr. Top. Microbiol. Immunol., 1983, 105, 123.
645. Estes M. et al. Adv. Exp. Med. Biol., 1997, 412, 387.
646. Estes M. Fields Virology, 2001, 1747.
647. Esteves K. Bull. World Health. Organ., 1988, 66, 739.
648. Eugster A. K. Amer. J. Vet. Res., 1980, 41,2020.
649. Eurobiologiste, 1992, 26, 130.
650. Evans C. et al. J. Nat. Cancer Inst., 1962, 29, 277.
651. Evans C. A. et al. Nature, 1962, 193, 288.
652. Fagar-Mahmod F.I. et al. Vaccine, 1988, 6, 262.
653. Fahey K.J. et al. J. Gen. Virol., 1985, 66, 1479.
654. Fahey K.J. et al. J. Gen. Virol., 1989, 70, 1473.
655. Fahey K.J. et al. Avian Pathol., 1991,20,447.
656. Falgout B. et al. J. Virol., 1990, 64, 4356.
657. Fasekas de St. G. S. Immunol. Methods, 1983, 57, 121.
658. Ferrari M. et al. Microbiologica, 1990, 13, 161.
659. Fichtner D. et al. Mln Vet. Med., 1985, 40, 19, 669.
660. Fast hepatitis В vaccine. Occup. Safety and Health., 2000, 30, 6, 9.
661. Favre H. etal. Bull. Off. Int. Epizoot., 1975, 81, 1201-1229.
662. Fenner F. Fields Virology, 1996, 2673.
663. Fenner F. Intern. Med. J. 2001, 31, 188.
664. Fermi C.Z. Hig. Infektkrankh. 1908, 58, 233.
665. Ferrari M. Comp. Immunol. Microbiol. Inf. Dis. 1992, 15, 221.
666. Fijtman N.L. et al. Arch. Virol., 1987, 96, 275.
667. Fitzerald FR. et al. Veter. Med., 1986, 81, 188.
668. Fitzpatrick D.R., Studdert M.J., Am. J. Vet. Res. 1984, 45, 1947.
669. Flehming B. et ah Lancet, 1989, № 8646, 1039.
670. Flint S. et al. Principles of Virology ASM Press., 2004, 916p.
671. Flynn WT. et al. Amer. J.Wt.Res., 1988, 49, 819.
672. Fohiman J. et al. Vaccine, 1990, 8, 381.
673. Folkman J., Moskona A. Nature, 1978, 273, 345.
674. Fontaine J. et al. Bull. Office int. epizoot., 1974, 81, 1089.
675. Fontaine J. Sci. Vet. Med. Comp., 1985, №5-6, 47.
676. Fourel I. et al. Hepatology, 1989, 10, 186.
677. Francis M.J., Black L. Res.in \fet. Sci., 1986, 41, 33. I
678. Francis M.J. et al. Immunology, 1990, 69, 171.
679. Frankel S. et al. J. Virol. 1998, 72, 9788.
680. Frankel H.S. Bull. Off. Int. Epiz., 1947, 28, 155.
681. Frenkel H.S. Amer. J. Vet. Res., 1950, 11, 371.
682. Frenkel H.S. Amer. J. Vet. Res., 1951,12,187.
683. Freihorst J., Ogra P. Ann. Med. 2001, 33, 172.
684. Frennet J. Cl. Et al. Ann. Med. Vet., 1984, 128, 5, 375.
685. Freund J. Adv. Tub. Res., 1956, 7, 130.
686. Fuchs W. et al. J. Gen. Virol., 1990,71,1141.
687. Fukunaga Y. et al. J. Vet. Med., 1990, 37, 135.
688. Fuller A.O. et al. J. Virol., 1989, 63, 3435. !
689. Galinski M.S. et al. Virology, 1987, 157, 24.
690. Gallegos C.O., Patton J.T. Virology, 1989, 172, 616.
691. Gallegos G., et al. Arch. Med. Res. 1995, 26, 59.
692. Ganem D., Schneider R. Fields Virology, 2001, 2923.
693. Ganem D., Coen D. Fields Virology, 2001, 2849.
694. GaoX.-M. et al. J. Immunol., 1989, 143, 3007.
695. Garcon N.M., Six H.R. J. Immunol., 1991, 146, 3697.
696. Gazdzinski P. Bull. Vet. Inst. Pulawy, 1979, 23, N 3-4, 80, 89.
697. Gearhart M.A. et al. J. Amer. \fet. Assoc., 1987, 191, 819.
698. Gebauer F. et al. J. Virol., 1988, 62, 2041.
699. Geen K.Y. et al. Fields Virology. 2001, 841. :i
700. Geerligs H.J. et al. J. Immunol. Meth., 1989, 124, 95.
701. Gelb L. et al. J. Infec. Diseases, 1987, 155, 633.
702. Gerber J.D. et al. Vaccine, 1990, 8, 536.
703. Gerber S. et al. J. Virol. 2001, 75, 1752.
704. Genco R.F. et al. Ann. New York Acad. Sci., 1983, 409, 650.
705. Gentsch J.R. Virology, 1980, 102, 190.
706. Gema G. et al. J. Gen. Virol., 1988, 69, 937.
707. Gershwin I. Et al. Am. J. Vet Res. 2000, 61, 291.
708. Ghiasi H. et al. Virology, 1987, 160, 100.
709. Giambrone J.J., Clay R., Avian Diseases, 1986, 30, 557.
710. Giambrone J.J., Clay R., Poultry Sci., 1986, 65, 807, 1287.
711. Giambrone J.J., Clay R., Poultry Sci., 1986, 65, 457.
712. Gielkens A.J. et al. J. Gen. Virol., 1985, 66, 69.
713. Girard H.G. et al. Bull. Off. Int. Epiz., 1973, 79, 805.
714. Girard H.C. et al. Biol. Stand., 1978, 42, 127.
715. Girard H.C. et al., Biotechnol. Bioeng., 1980, 22, 477.
716. Girard M. et al. Mol. Biol. Infect. Dis. Paris., 1988, 49.
717. Glenny A.T. et al. J. Pathol. Bacteriol., 1926, 29, 38.
718. Glickman R. et al. J. Virol., 1988, 62, 1, 354.
719. Goff S.P. Retroviridae. Fields Virology, 2001, 1871.
720. Gollins S., Porterfield J. Nature, 1986, 321,6067.
721. Gomez Y.A., Palma E.L. \fet. Microbiol., 1986, 12, 329.
722. Gomez N. et al. Arch. Virol. 2000, 145, 1725.
723. Gonda M.A. et al. Proc. Nat. Acad. Sci. USA, 1986, 4007.
724. Goto Y. et al. \fet. Microbiol.,1986, 11, 177.
725. Gough R.E. Avian Pathol., 1987, 16, 327.
726. Gough R.E., Spackman D. Avian Pathol., 1981, 10, 471.
727. Gough P.M. et al.Vaccina, 1983, 1, 37.
728. Gough R.E. et al. Avian Pathol., 1985, 4, 227.
729. Goyal S. M. et al. J. Vet Diagn. Invest.,2000, 12, 166.
730. Grahn T.C. et al. J. Amer. Vet. Med. Assoc., 1984, 185, 429.
731. Green K.Y. et al. Virology, 1989, 168, 429.
732. Green K.Y. et al. Fields Virology, 2001, 841.
733. Greider F.B., Schultz K.J. Invertebr. Pathol., 1991, 57, 37.
734. Greiser-Wilke I. et al. J. Gen. Virol., 1989, 70, 743.
735. Greiser-Wilke I. et al. J. Arch. Virol., 1990, 11, 213.
736. Griffin D. Fields Virology, 2001, 1401.
737. Griffin D.E. Fields Virology, 2001,917.
738. Grinell F. Exp. Cell Res., 1976, 97, 265.
739. Grinell F. Int. Rev. CytoL, 1978, 53, 65.
740. Grose Ch. Rev. Infec. Diseases, 1991, 13, Suppl. N 1,960.
741. Gross L., Dreyfuss J. Proc. Nat. Acad. Sci. USA, 1978, 75, 3989.
742. Grubman MJ., Morgan D. O. Virus Res., 1986, 6, 33.
743. Grubman MJ. et al. Virology, 1987, 158, 133.
744. Grundboeck M. et al. Med. wet., 1991, 47, 22.
745. Gupta S.K. et al. Avian Diseases, 1982, 26, 7.
745a. Guizakhoo F. et al. Virology, 1999, 257, 363.
746. Haffer K. Avian Dis., 1984, 28, 669.
747. Haffer K.N. et al. Vaccine, 1987, 5, 133.
748. Hagiwara K. et al. \fet. Microbiol., 2000, 72, 207.
749. Hall W.W. et al. Virology, 1980, 100, 433.
750. Hall S.L. et al. Virus Res. 1992, 22, 173.
750a. Halsey J.F. et al. J.Exp.Med. 1980, 151, 767.
751. Halsey N., A. J. Imfec. Diseases, 1988, 158, 1261.
752. Ham R.G. Proc. Nat. Acad. Sci. USA, 1965, 53, 288.
753. Handa-Corrigan A. Biotechnol., 1988, 6, 784.
754. Hanke T. et al. J. Virol., 1991, 65, 1177.
755. Hao O., Lam K.M. Avian. Diseases, 1987, 31,649.
755a. Haralambiev H. et al. Monatsh. Veterinarmed., 1990, 45, 788.
756. Hardy W.D. et al. J. Cell Biochem., 1986, Suppl. N 10a, 207.
757. Harkness J.W \fet. Rec., 1985, 116, 288.
758. Harland R et al. Can. W. J., 1992, 33, 734.
759. Harmache A. et al. J. Virol. 1998, 72, 6796.
760. Harrisson J. Fields Virology, 2001, 53. '
761. Hassan S.H. J. Virol., 2001, 75, 8356.
762. Harty J.T., Plagemann P. J. Virol., 1988, 62, 3210.
763. Haung H.-B. Rev. Sci. et Techn. Off. Int. Epizoot., 1991, 10, 481.
764. Heidner H.W et al. Virology, 1990, 176, 658.
765. Heinz F.X. Adv. Virus Res., 1986, 31, 103.
766. Heiren M.H. et al. Proc. Nat. Acad. Sci., USA, 1988, 85, 1642.
767. Henderson L.M. et al. Am. J. Vet. Res., 1990, 51, 1656.
768. Henrikcson K., Portner A. Vaccine, 1990, 8, 75.
769. Herbert W et al. J. Virol., 1988, 62, 4594.
770. Herold B.C. et al. J. Virol., 1991, 65, 1090.
771. Herlocher M. et al. Virus Res., 1992,22,281.
772. Herout Ch. Rec. Med. Vet. 1985, 161, 1267. :
773. Herremans T. et al. J. Immunol., 1999, 162, 5011.
774. Herrewegfh A. et al. J. Virol. 1998, 72, 4508.
775. Herring C. et al. J. Virology, 2001, 75 (24), 12252.
776. Hess R.G., Bachmann P. Amer. J. Vet. Res., 1981, 42, 1149.
777. Highlander S. et. al. J. Virol., 1987, 61, 3356.
778. Hilgess I. et. al. J. Vet. Immunol. Immunopathol. 1998, 66, 159.
779. Himmelfarb P. et. al. Science, 1969, 164, 555.
780. Hinashaw V.S. et. al. Avian Dis., 1986, 30, 1, 207.
781. Hirabayashi Y. et. al. Vaccine, 1990, 8, 243.
782. Hirahara T. et. al. Jap. J. Vet. Sci., 1990, 52, 1089.
783. Hirai K. et. al. Arch. Virol., 1990, 114, 153.
784. Hirayama N. et. al. J. Gen. Virol., 1985, 66, 149.
785. Hirtenstein M. et. al. Dev. Biol. Stand., 1980, 46, 109.
786. Hleming J.O. et. al. Virology, 1989, 168, 162.
787. Hofmann M., Wyler R. Vet. Micribiol., 1989, 20, 131.
788. Hofschneider P.H. J. Med. Virol., 1990, 31, 65.
789. Hogue B., Brian D. Virus Res., 1986, 5, 131.
790. Hojdatsu T. et. al. Arch. Virol. 1991, 117, 85.
791. Holf E.A. et. al. J. Infect. Dis., 1993, 168, 1087.
792. Hollinger F.B., Emerson S.U. Fields Virology, 2001, 799.
793. Hollinger E, Liang T. Fields Virology, 2001, 2971.
794. Holmes H.C. et. al. Vet. Rec., 1989, 124, 309.
795. Holmes D. et. al. Equine Infect. Dis. 1991, 253.
796. Holmes K. Fields Virology, 2001, 1187.
797. Honda E. et. al. J. Vet. Med., 1990, 37, 659. I
798. Honda E. et. al. Jap. J. Vet. Sci., 1990, 52, 217.
799. Hoover E.A. et. al. JAVMA, 1991, 199, 1392.
800. Horng C., McLimans W. Biotechnol. Bioeng., 1975, 17, 713.
801. Horwitz M. Fields Virology, 2001, 2301.
802. Horwitz M. Fields Virology, 2001, 2301.
803. Horzinek M.C. Arch. Virol., 1991, N 3, Suppl., 1.
804. Horzinek M. Vet. Vacinology, 1997, 131.
805. Horzinek M.C., Van Berio M.F. Ann. rech. vet., 1987, 18, 115.
806. Horzinek M.C. et. al. Intervirology, 1987, 27, 17.
807. Hoshino V. et. al. Virology, 1987, 157, 488.
808. Hosodo K. et. al. Hepatology, 1990, 11, 44.
809. Hou S. et al. Nature, 1994, 369, 652.
810. Howard C.J. et al. Vet. Microbiol., 1987, 13, 361.
811. Howard C.J. et al. Vet. Microbiol., 1989, 19, 195.
812. Howley P.M., Lowy D.R. Fields Virol., 2001, 2197.
813. Hsu M. et al. Virology, 1987, 156,84.
814. Hsu D. et al. Virology, 1988, 166, 149.
815. Hubbard K.A. et al. Amer. J. Vet. Res., 1991, 52, 50.
816. Hudson P.J. et al. FEBS Letters, 1986, 201, 1, 143.
817. Hughes C.S., Jones R.C. Avian Pathol., 1988, 17, 295.
818. Hughes G. et al. Arch.Virol., 1988, 103, 47.
819. Hughes R.C. etal. Exp. Cell Res., 1979, 121, 307.
820. Huismans H. Nucl. Activ., 1981,24, 23.
821. Huismans H., Erasmus B.J., Onderstopoort J. Vet. Res., 1981,48, 51.
822. Huismans H. et al. Virology, 1987, 157,172.
823. Hull M.R. et al. Curr. Microbiol., 1987, 15, 277.
824. Hunt A.R et al. Virology, 1990, 179,701.
825. Hussian K.A. et al. J. Virol., 1987, 61,2956.
826. Hyatt A. et al. Virology, 1989, 173, 21.
827. Ichihashi Y., Ole M. Virology, 1988, 163, 133. i
828. Iglesias G., Trujano M. J. Vet. Med., 1989, 36, 57.
829. Ikuta K. et al. J. Virol., 1984, 49, 1014.
830. Ikuta K. et al. J. Cancer Res. Gann., 1987, 78, 643.
831. Imouliatte F. etal. Vet. Microbiol., 1987, 15, 261.
832. Ingersoll J.D., Wylie D.E. Amer. J. Vet. Res., 1988, 49, 1467.
833. Isfort R. et al. J. Virol., 1987,61,2614.
834. Ishii H. et al. J. Gen. Virol., 1986, 67, 275.
835. Ishkawa K. et al. Arch. Virol., 1995, 140, 1385.
836. Ishizaka S.T., Mishkin E.M. Viral Immunol., 1991, 4, N 3, 187.
837. Issel C.J. etal. Vet. Microbiol., 1988,17,251.
838. Ito T., Kawaoka Y. Vet. Microbiol., 2000, 74, 71.
839. Ivanov I. et al. Folia boil. (CSSR), 1990, 36, 165.
840. Izuchi T. et al. Avian Dis., 1983, 27, 918. '
841. Jacobs J. P. Dev. Biol. Stand., 1978,42, 13.
842. James W. S„ Millcan D. J. Gen. Virol., 1986, 67, 2803.
843. Janke В. H. et al. Canad. J. Vet. Res., 1988, 52, 364.
844. Jarrett O. et al. Int. J Cancer., 1984, 34, 283.
845. Jarrett WF. et al. Vet. Rec., 1990, 126, 449.
846. Jarrett W.F. et al. Vet. Rec., 1990, 126, 473.
847. Javier R.T. et al. Science, 1986, 234, 746.
848. Jaw-Ching Wu et al. J. Med. Virol, 2000, 60, 1.
849. Jennin H.M. et al. Pros. Soc. Exp. Biol. Med., 1979, 160, 59.
850. Jimenez G. et al. J. Virol., 1986, 60, 131.
851. Jin H. et al. Virology, 1998, 251, 2006.
852. Jo E.-Ch. et al. Biotechnol. and Bioeng., 1990, 36, 717.
853. Johannsen U. et al. Arch. Exp. Veterinarmed., 1984, 38, 629.
854. Johnson C.E. etal. Pediatrics, 1988, 81, 512.
855. Johnson R.H., Nunn M. J. Austral. Adv. Vet. Sci., 1979, 41.
856. Johnson R.H. etal. Prev. Vet. Med., 1987, 371.
857. Johnson R.H., Smith J.F. Virology, 1988, 162, 437.
858. Joklik W.K. Microbiol. Rev., 1981, 45, 483. ..
859. Joklik W.K. et al. Vaccine, 1988, 6, 123.
860. Jolly P.E. et al. J. Gen. Virol., 1989, 70, 2221.
861. Jones R.C. Rev. Sci. et Techn. Off. Int. Epizoot. 2000, 19, 614.
862. Jordan J.A. et al. Virology, 1989, 169, 137.
863. Ju Lu-K., ArmigerW.B. Biotechnol. Progr., 1990, 6, 262.
864. Kaashoek M. et al., Vaccine, 1995, 13, 342.
865. Kabeya H. et al. \fet. Immunol Immunopathol, 1999, 68, 255.
866. Kaji T, Shimizu Y. Nat. Inst. Animal Health Quart., 1978, 18, 43.
867. Kajigaya S. etal. Proc. Nat. Acad. Sci. USA, 1989, 86, 19, 7601.
868. Kajigaya S. et al. Proc. Nat. Acad. Sci. USA, 1991,88, 4646.
869. Kaleta E.F. Avian Pathol., 1990, 19, 193.
870. Kapikian A.Z. et al. J. Infec. Diseases, 1986, 153, 815.
871. Kapikian A.Z. et al. Fields Virology, 2001, 1787.
872. Katz J.B. et al. Vaccine, 1990, 8, 286.
873. Kawaguschi Y. et al. Arch. Virol., 1990, 111, 269.
874. Kawaoka Y, Webster R.G. Virology, 1985, 146, 130.
875. Kawaoka Y. et al. Virology, 1987, 158, 218.
876. Keay L. Biotechnol. Bioeng., 1977, 19, 399.
877. Keeling M. etal. Nature, 2003, 421, 136.
878. Kelleher C.J. et al. Avian. Dis., 1988, 32, 342.
879. Kelling C.L. et al. Amer. J. Vet. Res., 1990, 51, 2019.
880. Kennedy H.E. et al. J. Gen. Virol., 1988, 69, 3023.
881. Kensil C. etal. JAVMA, 1991, 199, 1423.
882. Kew O. et al. Scince, 2002, 296, 356.
883. Kibenge F.S. et al. J. Gen. Virol., 1988, 69, 1757.
884. Kibenge F.S. et al. Avian Pathol., 1988, 17, 679.
885. Kielian M. et al. J. Virol., 1990, 64, 4614.
886. Kimman T.G. et al. Vet. Rec., 1988, 123, 104.
887. Kimman T.G., Westenbrink F. Arch. Virol., 1990, 112, 1.
888. King B. et al. Virus Res., 1985, 2, 53.
889. Kinney R.M. et al. Virology, 1989, 170, 19.
890. Kit S. et al. Amer. J. Vet. Res., 1985, 46, 1359.
891. Kit S. et al. Arch. Virol., 1991, 120, 1.
892. Kitson J.D. et al. Virology, 1990, 179, 26.
893. Klagsburn M., J. Cell Biol., 1980, 84, 808.
894. Klenk H.-D. et al. J. Gen. Virol., 1977, 36, 151. .
895. Klietmann W. et al. Vaccine, 1988, 6, 39.
896. Klippmark E. et al. J. Gen. Virol., 1990, 71, 1577.
897. Klucas C.A., Anderson G.A. Vet. Immunol. Immunopathol., 1988, 18, 307.
898. Knipe D. et al. Fields Virology, 2001, 133.
899. Knudsen K. et al. Int. J.Epidemiol., 1996, 25, 665.
900. Kobayashi N. et al. J. Gen. Virol., 1990, 71, 2615.
901. Koch G. et al. J. Gen. Virol., 1990,71, 1929.
902. Kohn A. Adv. Virus. Res., 1979, 24, 223.
903. Kohler G„ Milstein C. Nature, 1978, 256, 495.
904. Kodama H. et al. Avian Pathol., 1979, 8, 1, 33.
905. Komada H. et al. Arch. Virol., 1991, 116, 277.
906. Kono Y. et al. Jap. J. Vet. Sci., 1986, 48, 117.
907. Kono Y. Arch. Virol., 1988, 98, 91.
908. Krasilnikov I. et al. Arch. Virol., 1984, 79, 241.
909. Kreager K. Poultry, 1985, 2, 1, 8.
910. Krebs O. et al. Arch. Virol., 1991, 120, 135.
911. Kroneman A. et al. J. Virol., 1988, 72, 3507.
912. Kucerova L. et al. J. Virol., 1999, 73, 8160.
913. Kumar M. Turkey World, 1988, 64, 48.
914. Kusters J. et al. Vaccine, 1990, 8, 605.
915. Laegrid W. Virus Infections of Vertebrates, 1996, 4, 101.
916. Lai M., Holmes K. Fields Virology, 2001, 1163.
917. Lam K.M., Hao Q. Vet. Microbiol., 1987, 15, 41.
918. Lamb R., Kolakovsky D. Fields Virology, 2001, 1305, 2690.
919. Lamb P., Krug M. Fields Virology, 2001, 1487.
920. Lancet, 1988, N 8631, 194.
921. Land K„ ChantleK J. J. Virol., 2000, 74, 796.
922. Landgraf H., Wyeth P. Poultry Intern., 1986, 25, 24.
923. Langlois A. et al. J. Virol., 1998, 72, 8, 6950.
924. Lanquet B. et al. Comp. Immunol. Microbiol. Infect. Dis., 1985, 8, 285.
925. Langeveld J.M. et al. J. Virology, 1994, 68, 4506.
926. Laporte J. et al. C.R. Acad. Sci. (Paris), 1973, 276, 3399.
927. Larghi O.P., Nebel A.E. Zbl. Wt. Med., 1985, 32, 609.
928. Larsen D.L. et al. Vet. Microbiol., 2000, 74, 117.
929. Lattera J. et al. Proc. Nat. Acad. Sci. USA, 1980, 77, 6662.
930. Laude H. et al. J. Gen. Virol., 1984, 65, 327.
931. Launais M. et al. Rev. Med. Vet., 1972, 123, 1537.
932. Lea S. et al. Structure, 1994, 2, 123.
933. Lehman L., Boehmler P. J. Biol. Chem., 1999, 274, 28059.
934. Lee T. et al. Arch. Virol., 1989, 106, 151.
934.a Leis J. et al. J. Virol., 1988, 69, 675.
935. Lelie P.N. et al. Hepatology, 1986, 6, 971.
936. Lelie P.N. et al. J. Med. Virol., 1987, 23, 297.
937. Lemon S., Binn L. J. Gen. Virol., 1985, 66, 2501.
938. Lerner R. et al. Proc. Nat. Acad. Sci. USA, 1981, 78, 3403.
939. Leopoldt D. et al. Arch. Exp. Veterinarmed., 1985, 39, 781.
940. Lerch R. et al. J. Virol., 1989, 63, 833.
941. Lerch R. et al. J. Virol., 1990, 64, 5559.
942. Lerch R. et al. Nature, 1982, 299, 592.
943. Letellier C. et al. Arch. Virol., 1991, 118, 43.
944. Levine M.M. Lancet, 1990, 8695, 958.
945. Levine S. et al. Proc. Soc. Exp. Biol, and Med., 1989, 90, 349.
946. Levings R.L. et al. Vet. Microbiol., 1984, 9, 313.
947. Levintow L., Eagle H. Ann. Rev. Biochem., 1961, 30, 605.
948. Levis M.G. et al. Vet. Microbiol., 1988, 17, 297.
949. Lewis S.A., Grubman M. J. Arch. Virol., 1991, 121, 233.
950. LiX., Hanson R.P. Arch.Virol., 1989, 108, 229.
951. Liang X. et al. J. Virol., 1991, 65, 1124.
952. Liao W.S.L. et al. Mol. and Cell Biol., 1989, 9, 2779.
953. Libeau G., Lefevre P. Veter. Microbiol., 1990, 25, 1.
954. Lieberman H., Wittmann W. Monatsh. Veterinarmed., 1987, 42, 855.
955. Lieberman H., Selbit H.-J. Monatsh. Veterinarmed., 1989, 44, 217.
956. Li F. et. al. Proc. Nat. Acad. Sci. USA, 1996, 93, 990.
957. Li H. et. al. Vet. Microbiol., 2000, 71, 27.
958. Li M. et. al. J. Virol. 1997, 71,2988.
959. Liang X. et. al. Virology, 1993, 1993, 195, 42.
960. Lieberman H. et. al. Acta Virol., 1993, 37, 181.
961. Liebermann H. et.al. J. Vet. Med., 1991, 38, 621.
962. Liess B. Dt. Tierarztl. Wschr., 1988, 95, 264.
963. Limcumpao J.A. et. al. J. Vet. Med. Sci., 1991, 53, 423.
964. Limo M., Yilma T. Virology, 1990, 175, 323.
965. Lindenbach B., Rice Ch. Filds Virology. 2001, 991.
966. Lin T. et. al. Proc. IPVS, 1980.
967. Lin V. et.al. Virology 1992, 187, 612.
968. Ling R., Pringle C. J. Gen. Virol., 1989, 70, 1427.
969. Linial M. J. Virol. 1999, 73, 1747.
970. Lipipun V. et. al. Fish Pathol., 1989, 24, 155.
971. Littlefield J. Science, 1964, 145, 709.
972. Litwin J. Dev. Biol. Stand., 1979, 42, 37.
973. Liu S. et. al. Estk. Sei. Vet. 1986, 30, 461.
974. Lizano M. et. al. J. Virol., 1991,65, 1383.
975. Lo C.F. et. al. Fish. Pathol., 1991, 26, N 3, 119.
976. Lobmann M. et. al. Amer. J. Vet. Res., 1984, 45, 2498.
977. Loken T. Arch. Virol., 1991, N 3, Suppl., 67.
978. Loken T. et. al. J. Comp. Path. 1991, 104, 195.
979. Lobman M. et. al. Amer., J. Vet. Res., 1986, 47, 557.
980. Lomniczi B. et. al. J. Virol., 1984, 52, 198.
981. Lomniczi B. et. al. J. Virol., 1987, 61, 796.
982. Lovgren K. et. al. Clin, and Exp. Immunol., 1990, 82, 435.
983. Lowings P. et. al. J. Gen. Virol. 1996, 77, 1311.
984. Lowy D., Howley P. Fields Virol., 2001, 2231.
985. Lubiniecki A., May L. Dev. Biol. Stand., 1985, 60, 141.
986. Ludwing H., Gregersen J. Rev. Sci. ettechn. off int. epizoot., 1985, 5, 869.
987. Ludwig H., Bode L. Rev. Sci. et Techn. Off. Int. Epizoot. 2000, 19, 259.
988. Lum M., Reed D. E. Vet. Microbiol. 1986, 11, 3, 213.
989. Lundstrem M. et. al. Virology, 1987, 161, 395.
990. Luo M. et. al. J. Mol. Biol., 1984, 180, 703.
991. Luschow D. et. al. Vaccine, 2001, 19, 4249.
992. Lusting S. et. al. J. Virol., 1988, 62, 7, 2329.
993. Lutz H. Schweiz. Tierheck., 1986, 128, 255.
994. Luyties W. et. al. J. Virol., 1989, 63, 1408.
995. Maaten M.J. et. al. Amer. J. Vet. Res, 1985, 46, 1996.
996. Macadam A.J. et. al. Virology, 1989, 172, 408.
997. Mackow E.R. et. al. Proc. Nat. Acad. Sci. USA, 1988, 85, 645.
998. Maitland H.B., Maitland M.C. Lancet, 1928, 11,596.
999. Major M.E. et. al. Filds Virology. 2001, 1127.
1000. Makino S. et. al. Kissato Arch. Exp. Med., 1991,64, 279.
1001. Makoschey B., Keil G. Vet. Rec. 2000, 147. 189.
1002. Mallon V.R. et. al. Virology, 1985, 145, 1.
1003. Malvoisin E., Wild F. J. Virol., 1990, 64, 5160.
1004. Mao J. et al. Vaccine, 1997, 15, 944.
1005. Marchall J.J., Roy P. Virus Res., 1990, 15, 189.
1006. Marchioli C. et al. Amer. J. Vet Res., 1988, 49, 860.
1007. Marciani D. et al. Vaccine, 1991, 9, 89.
1008. Mariner J. et al. Vet. Microbiol., 1990, 21, 195.
1009. Mariner J. et al. Vet. Microbiol., 1990, 22, 119.
1010. Markowitz L. et al. Pediat. Infec. Disease J., 1990, 9, 101.
1011. Mamell R. et al. In Vitro, 1978, 14, 350.
1012. Marshall R., Letchworth G.J. Vaccine, 1988, 6, 343.
1013. Martin A. et al. Virology, 1991, 180, 648.
1014. Martin S. J. Immunol. Lett., 1991, 27, N 2, 81.
1015. Martin S„ Wardley R. Res. in Vet. Sci., 1987,42, 170.
1016. Martinod S. Vet. Virol., 1997, 574.
1017. Marx J. Science, 1984, 223, 801.
1018. Mason P. etal. J. Gen Virol., 1989, 70, 2037.
1019. Mason P. et al. Virology, 1991, 180, 294.
1020. Mason H., Arntzen Ch. Trends Biotechnol., 1995, 13, 388.
1021. Mastro J.M. et al. Vet. Immunol. And Immunopathol., 1986, 11, 205.
1022. Mateu M.G. et al. Virology, 1988, 167, 113.
1023. Mateu M.G. et al., Virology, 1995, 206, 298.
1024. Mathews R. E. F. Intervirology, 1979, 12, 129.
1025. Matsui S., Greenberg H. Fields Virology, 2001, 875.
1026. Matsui S.M. et al. J. Clin Microbiol., 1989, 27, 780.
1027. Matsumoto I., Kawana R. J. Jap. Assoc. Infec. Diseases, 1992, 66, 319.
1028. Mattos C.C. et al. Amer. J. Vet. Res., 1991, 52, 1794.
1029. Mazanec M. et al. Proc. Natl. Acad. Sci. USA. 1992, 89, 6901.
1030. Mazur C., Diogo M.R. Rev. Microbiol., 1990, 21, 127.
1031. McAleer M.J. et al. J. Biol. Stand., 1975, 3, 381.
1032. McCollum WH. Amer. J. \fet. Res., 1986, 47, 1931.
1033. McCullough K.C. et al. Immunology, 1986, 58, 421.
1034. McCullough K.C. et al. Rev. Sci. et Tech. Off. Int. Epizoot., 1986, 95, 411.
1035. McCullough K.C. et al., J. Virol., 1992, 66, 1835.
1036. McFerran J.B. Diseases of Poultry. 1977, 607.
1037. McFerran J.B. et al. Avian Pathol., 1980, 9, 395.
1038. McGinnes L.W, Morrison T.G. Virology, 1987, 156, 322.
1039. McHugh P.H. et al. J. Vet. Med. Ser. B. 1988, 35, 207.
1040. McKercher P.D., Bachrach H.L. Can. J. Comp. Med., 1976, 40, 67.
1041. McKercher P.D., Graves J.H. Dev. Biol. Stand., 1977, 35, 107.
1042. McLain L. et al. J. Gen. Virol., 1988, 69, 1415.
1043. MacMichael G. Amer. Biotechnol. Lab., 1986, N 4, 30.
1044. McMillan B.C. et al. Avian Diseases, 1986, 30, 122.
1045. McNulty M.S. et al. Avian Pathol., 1986, 15, 107.
1046. McNulty M.S., Logan E.F. Vet. Rec., 1987, 120, N 11, 250.
1047. Meechan B.M. et al. J.Gen. Virol., 1997, 78, 221.
1048. Mei Y. et al. Chin. J. Virol., 1990, 6, 305. i
1049. Meignier B. et al. Dev. Biol. Stand., 1980, 46, 249.
1050. Meignier B. et al. Virology., 1988, 162, 251.
1051. Meionter B. et al. Dev. Biol. Stand., 1979, 46, 249.
1052. Melling J. Appl. Biotechnol., 1986, 1,239.
1053. Melnick J., Riordan J. Pros. Soc. Exp. Biol. Med., 1952, 81, 208.
1054. Melnick J. L. Bull. WHO, 1989, 87, 105.
1055. Meloen R. Vet. Virology, 1997, 273.
1056. Men R. et al. J. Virol., 1996, 70, 3930.
1057. Mengeling W.L. et al. J. Gen. Virol., 1986, 67, 2839.
1058. Mengeling W.L. et al. J. Gen. Virol., 1988, 69, 825.
1059. Mendoza Q.P. et al. J. Gen. Virol., 1988, 69, 3015.
1060. Merten O. etal. Cytotechnology, 1999, 30, 191.
1061. Mertens P.P.C. et al. Virology, 1987, 157, 375.
1062. MerzaM. etal. J. Virol. Meth., 1991,33, 345.
1063. Merza M. et al. J. Vet. Med. 1991, 38, 306.
1064. Mettenleiter T.C. et al. Virology, 1987, 158, 141.
1065. Mettenleiter T.C. et al. J. Virol., 1988, 62, 2712.
1066. Mettenleiter T. et al. Virology, 1990, 178, 498.
1067. Mettenleiter T.C. Vet. Immunol. Immunopathol. 1997, 54, 221.
1068. Meyer H. et al. J. Vet. Med., 1987, 34, 545.
1069. Meyers G. et al. Nature, 1989, 341 N 6242, 491.
1070. Meyers G. et al. Arch. Virol., 1991, N 3, Suppl., 133.
1071. Meylan P.R. et al. J. Cell. Biochem., 1990, Suppl. 14D, 144.
1072. Miller J.M. etal. Amer. J. Vet. Res., 1989, 50, 551. ,
1073. Miller R. H. et al. Hepatology, 1989, 9, 322.
1074. Milovanovic M. V. J. Med. Virol., 1987, 21, N 4, A63.
1075. Minor P. et al. J. Gen. Virol., 1986. 67, 693.
1076. Min-Shi L. et al. J. Virol. 2000, 62, 511.
1077. Mirshamsy H., Taslimi H. Immunol., 1968, 14, 81.
1078. Mitchell G. E Vaccine, 1988, 6, 202.
1079. Miyamae T. Jap. J. Vet. Sci., 1987, 49, 1097.
1080. Mogar R. et al. Canad. J. Vet., Res., 1988, 52, 42.
1081. Monath T. P. et al. J. Gen. Virol, 1983, 64, 627.
1082. Mondelli M. U. et al. Clin. Exp. Immunol., 1987, 68, 242.
1083. Monica N. L. A. et al. J. Virol., 1987, 61, 2917.
1084. Monreal G. Berlin, und munch, tierarztl. Wochenschr., 1987, 100, 37.
1085. Montagnon B. J. et al. Dev. Biol. Stand., 1981, 47, 55.
1086. Montagnon B. et al. Dev. Biol. Stand., 1983, 55, 37.
1087. Montagnon B. J. et al. Acta microbial. Hung. 1991, 38, 168.
1088. Montefion D., Moore J. Science, 1999, 283, N 5400, 336.
1089. Moorehead P. J. Biol. Stand., 1979, 7, 397.
1090. Moormann R. J. et al. J. Gen. Virol., 1990, 71, 1591.
1091. Moraillon A., Pastoret P.P. Ann. Med. Vet. 1984, 328, 625.
1092. Morein В. et al. J. Gen. Virol., 1983, 64, 1557.
1093. Morein B. et al. Nature, 1984, 308, N 5958, 457.
1094. Morein B., Merza M. Scand. J. Infec. Diseases, 1991, 80, Suppl., 110.
1095. Morein B. et al. Vet. Immunol. Immunopathol. 1996, 54, 373.
1096. Mozenkov O. S. et al. Virus. Res. 1997, 51, 65.
1097. Morgan A. J. et al. J. Med. Virol., 1989, 29, 74.
1098. Morilla-Gonzales A. Proc. IPVS, 2002, 147.
1099. Morisse J.P. et al. Rev. Sci. et Tech. Off. Int. Epizoot., 1991, 10, 269.
1100. Morrison T. G., McGinnes L. W. Virology, 1989, 171, 10.
1101. Morrison L. et al. Virology, 1998,243, 178.
1102. Morrill J. C. et al. Amer. J. Vet. Res., 1987, 48, 1042.
1103. Mozer C. et al. J. Virol. 1999, 73, 7787.
1104. Moses L., Tilahum V. Virology, 1990, 175, 323.
1105. Moscowitz M. et al. J. Nat. Cancer Inst., 1980, 64, 639.
1106. Moss B. et al. Vaccine, 1988, 6, 161.
1107. MossE.G. etal. J. Virol., 1989,63, 1884.
1108. Moss B. Fields Virology, 1996, 2637.
1109. Moss B. Fields Virology, 2001, 2849.
1110. Mostl K., Burki F. J. Vet. Med., 1988, 35, 186.
1111. Motohide Y. Jap. J. Vet. Res., 1985, 33, 626.
1112. Mougeot H. et al. Bull. Off. Int. Epizoot., 1979, 91, 3.
1113. Mougin B. et al. Vaccine, 1988, 6, 445.
1114. MowatC. N. etal. Vet. Rec., 1978, 102, 190.
1115. Moxley R. A. etal., Amer. J. Vet. Res., 1989, 250, 119.
1116. Mozdzanowska K. et al. Virology, 1999, 254, 138.
1117. Muggeridge M. J. Virol., 1990, 64, 3617.
1118. Muggeridge M. J. et al. Virology, 1990, 174, 375.
1119. Mulkey K., Anderson G. J. Clin. Mickrobiol., 1991, 29, 2038.
1120. Muller H. et. al. Zbl. Bakt. Mikrobiol. und Hyg., 1985, 260, 496.
1121. Muller H. Arch. Virol., 1986, 87, 191.
1122. Muller S. et al. Vaccine, 1990, 8, 308.
1123. Muller G. et al. Vet. Microbiol. 2000, 75, 17.
1124. Mumford J. A., Hannant D. Vaccines for Vet. Appl. 1993, 117.
1125. Mumford J. A. et al. Vaccine, 1994, 12, 857.
1126. Muneer M. A. et al. Res. in Vet. Sci., 1988, 45, 22.
1127. Muracami Y. et al. Vet. Microbiol., 1986, 12, 7.
1128. Murakami H. etal. Proc. Nat. Acad. Sci. USA, 1982, 79, 1158.
1129. Murhammer D., Gooches Ch. Biotechnol. Progr., 1990, 6, N 5, 391.
1130. Murphy B. R., Chanock R. M. Fields Virology, 2001, 435.
1131. Murphy B.R., Chanock R.M. Virology, 1985, 349.
1132. Murphy B.R. et. al. Vaccine, 1989, 7, 533, 557. л
1133. Murphy B.R., Walsh E.E. J. Clin. Microbiol., 1988, 26, 1595.
1134. Murphy F.A. The Toguviruses. N.Y. Acad. Press, 1980, 241.
1135. Vet. Virology, Academic Press, 1999.
1136. Mutwiri G. et. al. Vaccine, 2000, 19, 1284.
1137. Myers B.A. et. al. J. Cell. Biochem., 1992, Suppl. 16D, 19.
1138. Myers T.J., Schat K.A. Avian Pathol., 1990, 19, 697.
1139. Nagaraja K.V. et. al. Poultry Sci., 1985, 64, 588.
1140. Nagesha H.S., Holmes I.H. J. Clin. Microbiol., 1988,26, 171.
1141. Nagesha H.S. et. al. Virology, 1990, 175, 319.
1142. Nagesha H.S., Holmes J.H. Arch. Virol., 1991, 116, 106.
1143. Nakagomi O., Nakagomi T. Arch. Virol., 1991, 120, 43.
1144. Nakamuza J., Myamoto T, Am. J. Vet. Res., 1953, 14, 307.
1145. Nakanaga K. et. al. J. Virol., 1986, 59, 168.
1146. Nakhasi H.L. et. al. J. Biol. Chem., 1986, 261, 16616.
1147. Nakhasi H.L. et. al. Nucl. Acids Res., 1989, 17, 4393.
1148. Nandapalan N. et. al. J. Med. Virol., 1987, 22, 277.
1149. Natanson N., Murphy F.A. Virol. Pathogenesis. 1997, 353.
1150. Neri P. et. al. Biopolymers, 1991, 31, 631.
1151. Netteton P., Entrican G. Proc. Soc. Simp. Pestiviruses. 1992, 185.
1152. News Sci, 1989, 121, 19.
1153. New vaccines on better adjuvants. Pract. Biotechnol., 1986, 7, 526.
1154. Newman R. et. al. Vacine 1993, 11,400.
1155. Neyt C. et. al. J. Virol., 1989, 63.
1156. Nibert M., Schiff L. Fields Virology. 2001, 1679.
1157. Nicol S. Fields Virology. 2001, 1603.
1158. Nicholas J.A. et al. J. Virol., 1990, 64, 4232.
1159. Nicholas J.A. et al. J. Virol., 1988, 62, 4465.
1160. Niewiesk S.Vaccine, 2001, 19, 2250.
1161. Nishikawa K. et al. Virus. Res., 1987, 7, 83.
1162. Nishikawa K. et al. Virology, 1989, 171,503.
1163. Niu M.T. et al. Clin. Infect. Dis. 1998, 26, 1475.
1164. Noda M. et al. Arch. Virol., 1988, 99, 163.
1165. Nor M.N. et al. Rev. Sci. et Tech. Off. Int. Epiz. 2000, 19, 160.
1166. Norrby E. et al. J. Virol., 1986, 58, 536.
1167. Norrby E. Adv. Virus Res., 1987, 32, 1.
1168. November FJ. et al. Arch. Virol., 1989, 107, 273.
1169. Oaks J. et al. J. Virol., 1998, 72, 7263.
1170. Oberst R.D. et al. Vet. Microbiol., 1987, 15, 11.
1171. OffitP.A., DudzikK.LJ. Virol.,1988, 62, 127.
1172. Ogata A. et al. J. Virol., 1991, 65, 880.
1173. Ogra P.L. et al. Rev. Infect. Dis., 1980, 2, 352.
1174. Ogra P.L. and Garofalo R. Prog. Med. Virol., 1990, 37, 156.
1175. Ohlinger VE et al. J. Virol., 1990, 64, 3331.
1176. Ohlinger V.F, Thiel H.J. Rev. Sci. etTech. Off. Epizoot., 1991, 10, 311.
1177. Oirschot J.T et al. J. Vet. Med., 1991, 38, 391.
1178. Oldstone M.B. Virology 1997, 234, 179.
1179. Olmsted R.A. et al. J. Virol., 1989, 63, 411.
1180. Okazaki W. et. al. Avian. Dis., 1970, 14, 413.
1181. Onuma M. et al. Am. J. Vet. Res.,1984, 45, 1212.
1182. Onuma M. et al. Jap. J. Vet. Sci., 1990, 52, N 5, 1131.
1183. Oostrum J., Burnett R. M. J. Virol., 1985, 56, 439.
1184. Orlans E. et al. Ann. N.Y. Acad. Sci., 1983, 409, 411.
1185. O’Rourke K. et al. J. Gen. Virol., 1988, 69, 667.
1186. Osorio E A. et al. Am. J. vet. Res., 1985, 46, 2104.
1187. Osterhaus A. et al. J. Immunol., 1985, 135, 591.
1188. Osterhaus A. et al. Vaccine, 1989, 7, 137.
1189. Otaki Y. et al. Avian Psthol., 1988, 17, 333.
1190. Ouldridge E.J. etal. J. Boil. Standardiz., 1984, 12, 339.
1191. Outlaw M. C., Dimmock N. J. Epidemiol, and Infec., 1991, 106, 205.
1192. Outlaw M.C., Dimmock N. J. Virology, 1993, 195, 413.
1193. Oura C. et al. J. Gen. Virol., 1998, 79, 1439.
1194. Oxford J.S. Epidemiol, and Infec., 1987, 99, 1.
1195. Ozel M. et al. Zbl. Bakt. Microbiol. Hyg., 1984, 258, 525.
1196. PandaS. K. etal. J. Med. Virol., 1991, 35, 297.
1197. Pallansch M.A., Poss R.P. Fields Virology. 2001, 723.
1198. Pandey R. et al. J. Virol. 1991, 65, 6495.
1199. Panigrahhi P. et al. Vet. Microbiol., 1987, 13, 205.
1200. Panjevic D. Vet. Glasmilk., 1986, 40, 131.
1201. Pantaleo G. et al. Nature, 1994, 370, 463.
1202. Papier C.E. et al. J. Nat. Cancer Inst., 1979, 62, 165.
1203. Papovaviridae. Vet. Virology. Academic Press. 1999, 335.
1204. Paradis K. et al. Science., 1999, 285 (5431), 1236.
1205. Parker J. Arch. Virol., 1975, 357.
1206. Parker J. et al. Vet. Rec., 1975, 96, 284.
1207. Parker M.D. et al. J. Gen. Virol., 1989, 70, 15.
1208. Parrish C.R. et al. Amer. J. Vet. Res., 1984, 45, 2591.
1209. Parrish C.R. et al. Amer. J. Vet. Res., 1987, 48, 1429.
1210. Parrish C.R. et al. Virology, 1988, 163, 230.
1211. Parrish C. etal. J. Gen. Virol., 1988, 69, 1111.
1212. Parry N. et al. Nature, 1990, 347, N 6293, 569.
1213. Pasteur L.C.R. Hebd. Seanc. Acad. Sci. Paris. 1885, 101, 765.
1214. Pasteur L., Roux E., C.R. Held. Seanc. Acad. Sci. Paris. 1881, 98, 1229.
1215. Pastoret P.P. et al. Ann. Med. Vet., 1988, 132, 251.
1216. Pastoret P. et al. Curr. Opin. Biotechnol. 1994, 5, 239.
1217. Pastoret P.P. et al. Vet Vaccinology. 1997, 616.
1218. Pastoret P., Blancou J., Vannier P, Vet. Vaccinology. 1997. p.853.
1219. Patil P. etal. Microbiol. Immunol. 1999, 43, 765.
1220. Paul P.S., Mengeling W.L. J. Amer. Vet. Med. Assn., 1986, 188, 410.
1221. Paul W., Ben-Sasson S. Immunologist. 1998, 6, №3, 100.
1222. Pay T. W.F., Hingley P.J. Vaccine, 1987, 5, 60.
1223. Pay T.W.F., Hingley P.J. Vaccine, 1992, 10, 699.
1224. Payne S.L. et al. J. Virol., 1987, 61, 1266.
1225. Payne S.L. et al. Virology, 1989, 172, 609.
1226. Pedersen N.C. et al. Vet. Immunol. Immunopathol., 1986, 11, 123.
1227. Pedersen N.C. et al. Vet. Immunol. Immunopethol. 1986, 11, 123.
1228. Pedersen N. et al. Feline Pract. 1995, 23, 108.
1229. Pejsak. Z. et al. Med. Wet., 1991, N 10, 461.
1230. Peng Dax-in. Chin.J. Vet. Sci. 1999, 19, 523.
1231. Pensaert M.B., CoxE. Agri-Pract., 1989, 10, 17.
1232. Pensaert M. et al. Vet. Quart. 1986, 8, 257.
1233. Perdue M.I., Suarez D.L. \fct. Microbiol. 2000, 74, 77.
1234. Periano C. et al. Science, 1970, 169, 204.
1235. Perlman S. et al. Virology. 1990, 175, 418.
1236. Perrin G. et al. Bull. Acad. Vet. France, 1981,54, 231.
1237. Petermans J. Vaccine, 1992, 10 (suppl. 1), 99.
1238. Peters W. et al. Vet. Microbiol., 1986, 12, 195.
1239. , Petricciani J.C. Dev. Biol. Stand., 1985, 59, 149.
1240. Pezez L.G. Hunter E. J. Virol., 1987, 61, 1609.
1241. Pfeifer A., Verma M. Fields Virology, 2001, 469.
1242. Philpott M. et al. J. Virol., 1990, 64, 2941.
1243. Pierce N.F. Bull. WHO, 1979, 57, 452.
1244. Pitkovski J. et al. Avian Dis., 1999, 43, 8.
1245. Pittman P. et al. Vaccine, 1996, 14, 337.
1246. Pitzerald G.R. et al. Vet. Med., 1986, 81, 184.
1247. Plante M. et al. Vaccine, 2002, 20, 218.
1248. Plotkin S.A. Pediat. Infect. Disease J., 1991, 10, 979.
1249. Plowright W. World Anim. Rev. 1972, 1, 14.
1250. Plowright W. J. HYg., 1984, 92, 285.
1251. Plowright W. et al. Res. Vet. Sci., 1975, 19, 159. ' ’
1252. Plowright W. J. Hyg. Camb., 1984, 92, 285.
1253. Poethner A. et al. Virology, 1987, 158, 61.
1254. Polley J.A. etal. In Vitro, 1978, 14, 405.
1255. Pollonsch M.A. Ross R.P. Fields Virology, 2001, 723.
1256. Poole C.A. etal. In Vitro, 1982, 18, 755.
1257. Popular culture, Nature, 1989, 338, N 6215, 524.
1258. Portetelle D. et al. Virology, 1989, 169, 34.
1259. Pospisil Z. et al. Monatsh.. Vet. Med. 1987, 42, 668.
1260. Posthumus WP.A. et al. J.Virol., 1990, 64, 7, 3304.
1261. Potts BJ. et al. J. Virol. Meth., 1989, 26, 119.
1262. Poultry intern., 1989, 28, 62.
1263. Povey C. Canad. Veter. J., 1982, 23, 15.
1264. Povey R.C., Carman P.S. Vet. Vaccinology, 1997, 520.
1265. Provost P.G., Hilleman M.R. Proc. Soc. Exp. Biol. Med., 1979, 160, 213.
1266. Powell P.C. et al. Nature, 1974, 251, 79.
1267. Powell P.C. Nature, 1975, 257, N 5528, 684.
1268. Powell P.C. et al. Avian. Pathol., 1984, 13, 201.
1269. Powers D.C. et al. J. Clin. MircobioL, 1991, 29, 498.
1270. Precaustra P. et al. Tierarztl. Umsch. 1982, 37, 4, 274.
127E Prennet J.C. et al. Proc. World Congr. on dis. of cattle, 1986, 1, 685.
1272. Prevec L. et al. J. Infec Diseases, 1990, 161, 27.
1273. Prince G.A. et al. Virus Res., 1985, 3, 193.
1274. Prince G.A. et al. J. Virol., 1986, 57, 721.
1275. Prosperi S. et al. Vet. Res. Commun., 1984, 8, 181.
1276. Provost A. Rev. sci. techn. Off. Int erizoot., 1982, 1, 589.
1277. Prune! P. et al. Rep. Mtg. Res. Group FAO. Tubingen, Oktober 1971, 1.
1278. Pumper R.W Tissue culture methods and application. New York, 1983, 674.
1279. Purchio A.E et al. J. Virol., 1984, 50, 666.
1280. PutnakJ.R., Schlesinger J.J. J. Gen. Virol., 1990,71, 1697.
1281. Pye D. J. Biol. Stand., 1977, 5, 307.
1282. Qian Y. etal. Arch. Virol., 1991, 118,269.
1283. QueratG. et al. Virology, 1987, 158, 158.
1284. Quint W. et al. J. gen. Virol., 1987, 68, 525.
1285. Racaniello V, Baltimore D. Science, 1981,214, 916.
1286. Racaniello W. Fields Virology, 2001,685.
1287. Radlett PJ. et al. Biotechnol. Bioeng., 1972, 14, 437.
1288. Radlett PJ. et al. Dev. Biol. Stand., 1985, 60, 163.
1289. Radostits O.M., Littlejohns J.R. Can. Vet. J., 1988, 29, 513.
1290. Rajakumar A. et al. Proc. Nat. Acad. Sci. USA, 1990, 87, 4154.
1291. Ramon G. Bull. Soc. Med. \6t., 1925, 101, 227.
1292. Ramon G. Ann. Imst. Pasteur, 1926, 40, 1.
1293. Rasmussen L. et al. Virology, 1988, 163, 308.
1294. Raul C.O. Bull. Office int. epizoot., 1978, 89, 1015.
1295. Ray R. et al. J. Virol., 1988, 62, 783.
1296. Ray N. et al. Biotechnol. Bioeng., 1989, 33, 724.
1297. Reddy S.K., Silim. Arch. Virol., 1991, 117, 287.
1298. Rein A., Rubin H. Exp. Cell Res., 1968, 49, 666.
1299. Reitman M. et al. App. Microbiol., 1970. 19, 763.
1300. Relyveld E., Ben-Efraim S. Methods Enzimol., 1983, 93, 24.
1301. Renegar K., Small P. Mucosal Immunology, San Diego, 1994, 347.
1302. Renegar K., Small P.A. J. Immunol., 1991, 146, 1972.
1303. Reuveny S. et al. Dev. Biol. Stand., 1985, 60, 185.
1304. Rev. scient. Techn. Off. Intern. Epizoot., 1989, 199.
1305. Reynolds D. J. Ann. Rech. Xfet., 1983, 14, 4,445.
1306. Richter H., Urbaneck D. Mh. Vet.-med., 1983, 38, 489.
1307. Richter L. et al. J. Travel. Med., 1996, 3, 52.
1308. Rimmelzwann G., Osterhaus A. The immune Response. Vet. Vaccinology, 1997, 55.
1309. Rishe N., Lipkind M. Arch. Virol., 1987, 92, 243.
1310. Rivera E. et al. Vet. Microbiol., 1987, 13, 371.
1311. Robbins A. etal. J. Virol., 1987,61,2691.
1312. Robertson J. et al. Virology, 1987, 160,31.
1313. Robertson J. et al. Virology, 1990, 179, 35.
1314. Robertson B. etal. Virus Res., 1989, 13, 207.
1315. Robinson A., Mercela A. Arch. Virol., 1988, 101,255.
1316. Rock D.L. et al. Arch. Virol., 1988, 98, 99.
1317. Rodrigues da Silva et al. Rev. Inst. Med. Trop, 2000, 42, N2, 95.
1318. Rodrigues J. et al. J. Virol., 1985, 56, 482.
1319. Rogers R. et al. Aust. Vet. J. 1988, 65, 285.
1320. Roingeard P. et al. Virology, 1990, 179, 113.
1321. Roivainen M. et al. J. Virol., 1990, 64, 559.
1322. Roivainen M., HoviT. Virol., 1987, 61, 3749.
1323. Roizman B., Pellett P. Fields Virology, 2001, 2381.
1324. Rojo G. et al. Virology, 1999, 257, 524.
1325. Rombaut B. etal. Virology, 1985, 146, 111.
1326. Romero C.H. et al. Virology, 1994, 204, 425.
1327. Rondon I. et al. Ann. Rev. Microbiol., 1997, 51,257. h
1328. Rosales A. G. Poultry Dis., 1989, 48, 120.
1329. Rose G., Whitt M. Fields Virology, 2001, 1221.
1330. Rose N. et al. Cell, 2001, 106, 539.
1331. Rosenfeld S. J. etal. Blood, 1991, 78, 386.
1332. Rosenthal A. et al. Cell, 1986, 406, 301.
1333. Ross L.N. et al. J. Gen. Virol., 1972, 16, 299.
1334. Ross B. et al. J. gen. Virol., 1986, 67, 1741.
1335. Rossier P.B. et al. Vet. Microbiol., 1988, 16, 21 1.
1336. Rossler H. Folia boil., 1985, 31, 273.
1337. Rota P.A., Maes R.K. Arch. Virol., 1990, 115, 139.
1338. Rott R. Vet. Microbiol., 1992, 33, 303.
1339. Roumiantzeff M. et al. Comp. Immunol., Microbiol, and Inf. Dis., 1986, 9, 10.
1340. Roumiantzeff M., Teulieres L. Acta microbial. Hung., 1991,38, 169.
1341. RouSett F. et al. Proc. Natl. Acad. Sci. USA, 1992, 89, 1890.
1342. Roustai M.H. et al. Rev. Sci. et Tech. Off. Int. Epizoot., 1985, 4, 803.
1344. Rowlands D.J. et al. Nature, 1983, 306, N 5944, 694.
1345. Roy P. et al. J. Virol., 1990, 64, 1998.
1346. Roy P. Fields Virology, 2001, 1835.
1347. Rud E.W. et al. Virology, 1986, 155, 61.
1348. Rumenapf T. et al. J. Virol., 1991, 65, 589.
1349. Russell P. et al. The Togaviruses. N. Y. Acad. Press, 1980, 503.
1350. Russell R., Turner A.J. Can. J. Comp. Med., 1983, 47, 2, 163.
1351. Rwambo R. etal. Arch. Virol., 1990, 111, 275.
1352. Rweyemamu M. Am. J. Vet. Res., 1986, 47, 1243.
1353. SadirA. etal. Epidemiol. Infect., 1988, 100, 135.
1354. Saha S., Sen A. Vet. Res. Commun., 1989, 13, 89.
1355. Saif L.G., Wesley R.D. Diseases swine, 1999, 295.
1356. Saifuddin Md., Wilks C. Arch. Virol., 1991, 116, 33.
1357. Saiz J. etal. Virus Res., 1989, 13,45.
1358. Saiz J. etal., J. Virol., 1991,65,2518.
1359. Saliou P. Abstr. 23th World vet. Congr. Monreal, 1987, 410.
1360. Salk D. et al. Lancet, 1984, N 8415, 1317.
1361. Salk J., Salk D. Science, 1977, 195,834.
1362. Salk J. Vaccine, 1990, 8, 419.
1363. Saluzzo J.F., Smith J.F. Vaccine, 1990, 8, 369.
1364. Samal S.K. et al. J. Virol., 1987, 61, 1086.
1365. Samal S. et al. Virology, 1991, 180, 453.
1366. Samuel J.L., Spradbrow P. B. Veter. Rec., 1989, 124, 193.
1367. Sanche Aet al. Fields Virology, 2001, 1279.
1368. Santero G.G. Biotechnol. Bioeng., 1972, 14, 753.
1369. Sarma P., Log T. Virology, 1973, 54, 160.
1370. Sasaki O. et al. Microbiol, and Immunol., 1990, 34, 401.
1371. Saski T, Koyama H. Avian Pathol., 1988, 18, 307.
1372. Sato T. et al. Exp. Cell. Res., 1982, 138, 127.
1373. Saurat P. et al. Rev. Med. Vet., 1978, 129, 415.
1374. Sauter G. Experientia, 1989, 45, 594.
1375. Schaeffer W.l. In Vitro, 1978, 15, 649.
1376. Schaper U. etal. Virology, 1988, 165, 1, 291.
1377. Schat K.A. et al. Avian Pathol., 1985, 14, N 1, 127.
1378. Schijns V. et al. J. Interferon Res., 1991, 11, Suppl. N 1, 193.
1379. Schild G.C. et al. Wld. Hlth Org., 1975, 52, 369.
1380. Schijns V. et al. J. Gen. Virol., 1994, 75, 55.
1381. Schijns V. et al. J. Immunol., 1995, 155, 2525.
1382. Schlesinger J. etal. Virology, 1993, 192, 132.
1383. Schlesinger S., Schlesinger M. Fields Virology, 2001,895.
1384. Schmaljohn A.L. et al. Nature, 1982, 297, N 5861, 70.
1385. Schmaljohn C., Hooper J. Fields Virology, 2001, 1581.
1386. Schnell M. et al. Proc. Nat. Acad. Sci. USA, 2000, 97, 3544.
1387. Schreurs C. et al. J. Virol., 1988, 62, 2251.
1388. Schodel F„ Will H. Res. Microbiol., 1990, 141, 831.
1389. Schooles G. Progr. Biophys., 1963, 13.
1390. Schreurs Ch. et al. Zbl. Bakteriol., Microbiol, und Hyg., 1987, 267, 140.
1391. Schudel A. et al. J veter. Med. Ser. B.1986, 33, 4, 303.
1392. Schultz A. et al. Virology, 1984, 135, 417.
1393. Schynts F., et al. Vet. Microbiol. 2001, 82, 211.
1394. Seder R., Hill V. Nature, 2000, 406, N 6797, 79.
1395. Seppa N. Sci. News, 1999, 156, 228.
1396. Schwers A. et al. Ann. Rech. Vet., 1983, 14, 265.
1397. Scott N. A. etal. Vet. Microbiol., 1988, 16, 109.
1398. Sharma J.M. et al. Amer. J. Vet. Res., 1984, 45, 1619.
1399. Sharma J.M. Avian Dis., 1987, 31, 570.
1400. Shaw J.E. et al. J. Virol., 1987,61,4033.
1401. Shaw J.E. et al. J. Virol., 1988, 62, 3415.
1402. Shelkovaya N., Kupchinski L. Acta Virol., 1989, 33, 588.
1403. Shenk T.E. Fields Virology, 2001, 2265.
1404. Shibuta H. et al. Virology, 1986, 155, 688.
1405. Shibuta H. Enciclopedia of Virology. Acad. Press London, 1998.
1406. Shihmantez E. et al. J. Vet. Diagnost. Invest. 2000, 12, 67.
1407. Shimizu Y. Trop. Agr. Res. Ser. Yatabe., 1980, 13, 167.
1408. Shimizu M. et al. Jap. J. Vet. Sci., 1989, 51, 157.
1409. Scimizu Y, et al. Vet. Microbiol. 1995, 47, 395.
1410. Shimomura S. et al. Blood, 1991,78, N 10, 101.
1411. Shirai J. et al. Ann. Rech. Vet., 1988, 19, 267.
1412. Seitz L. et al. J. Gen. Virol., 1990, 71,1169.
1413. Shmidt A. etal. J. Virol., 2001, 75, 4594.
1414. SholtissekC. Arch. Virol., 1986, 90, 159.
1415. Shultz-Cherry S. et al. Avian. Dis. 2001, 45, 76.
1416. Siegl G. Parvoviruses. New York, London, 1984, 363.
1417. Silim A., Venne D. Avian Dis., 1989, 33, 643.
1418. Sinclair R. et al. Nature, 1963, 197, 982.
1419. Singh D. et aL J. Gen Virol., 1999, 80, 1437.
1420. Sinitsyna O.A. etal. Res. Virol., 1990, 141, 517.
1421. Siogren M. etal. Vaccine, 1992, 10, 135.
1422. Sissons J.G., Oldstone M.B. Virology, 1985, 265.
1423. Skem T, et al. J. Gen. Virol., 1987, 68, 315.
1424. Smith A.W. et. al. Amer. J. Vet. Res., 1983, 44, 851.
1425. Smith. D.J. et. al. Ifect. Immunol., 1979, 26, 82.
1426. Smith J. et. al. Virus Res., 1985, 3, Suppl., 121.
1427. Smith J. Trends microbiol. 1994, 2, 81.
1428. Smitsaart E.N. et. al. Vet. Immunol, and Immunopathol., 1990, 26, 251.
1429. Smitsaart T.E. Rev. Med. Vet. 1985, 66, 314.
1430. SnijderE., Meulenberg J. Filds Virology. 2001, 1205.
1431. Snijder EJ. et. al. Virology, 1990, 178, 355.
1432. Snodgrass D. et. al. J. Clin. Microbiol. 1984, 20, 342.
1433. Snyder M. et. al. J. Virol., 1987, 61, 2857.
1434. Sobrino F. et. al. Virology, 1983, 128, 310.
1435. Sobrino F. et. al. Virus Res., 1989, 14, 273.
1436. Spier R., Whiteside J. Biotechnol. Bioeng. 1976, 18, 649.
1437. Spiring Ch. et al. Schweiz. Arch. Tierheilk., 1989, 131, 195.
1438. Splitter G.A. et. al. Immunology, 1988, 63, 145.
1439. Spradbrow P.B. et. al. Vet. Microbiol., 1988, 16, 255.
1440. Sprecher E., Becker Y. Arch. Virol., 1988, 103, 1.
1441. Spriggs D.R. et. al. Science, 1983, 220, 505.
1442. Srivastava A. et. al. Пат. 6117640 США.02.05.1995.
1443. Srivastava A.К. et. al. Microbiol, and Immunol., 1991, 35, 863.
1444. Staerz U.D. et. al. Eur. J. Immunol., 1989, 19, 2199.
1445. Staplemon J., Lemon S.M. J. Virol., 1987, 61, 491.
1446. Stave J.W. et. al. J. Cell. Biochem., 1986, Suppl. 10D, 229.
1447. Stave J.W. et. al. Virology, 1988, 162, 21.
1448. Steinbach F. et. al. J. Gen. Virol., 1998, 79, № 12, 3005.
1449. Steinhauer D. et. al. Genne, 1992, 122, 281.
1450. Steinhauer D. Virology, 1999, 258, 1.
1451. Stephan W. et. al. J. Med. Virol., 1987, 21, N 4, 12.
1452. Steward M.W. et. al. Immunology, 1991, 72, 99.
1453. Steward R.S., Gershwin L.J. Amer. J. Vet. Res., 1990, 51, 1596.
1454. Stewart M. et. al. J. Virol., 1986, 58, 825.
1455. Sreward-Tull D. Appl. Biotechnol., 1986, 1, 232.
1456. Stewenson G.W. et. al. Vet. Pathol., 1999, 36, 368.
1457. Stoddart C.A., Scott F.W. J. Virol., 1989, 63, 436.
1458. Stoker M., Macpherson I.A. Nature. 1964, 203, 1355.
1459. Stokes G. et. al. Biotechnol., 1999, 73, 213-221.
1460. Stolze B., Kaaden O.R. Virology, 1987, 158, 174.
1461. Stone H. Aviav Diseases, 1987, 31,483.
1462. Stott J. et. al. Amer. J. Vet. Res., 1985, 46, 1043.
1463. Straus J. et. al. J. Cell Biochem., 1986, Suppl. 10D, 272.
1464. Strauss E. et. al. Fields Virology, 1996, 153.
1465. Studdert M. Arch. Virol., 1983, 77, N 2-4, 248.
1466. Studert M.J. et. al. Arch. Virol., 1986, 91, 375.
1467. Sullender W. et. al. Virology, 1990, 178, 195.
1468. Sullivan D.C. et. al. Virus Res., 1986, 5, 201.
1469. Sundin D.R. et. al. Science, 1987, 235, 591.
1470. Sundquist B. et. al. Vaccine, 1988, 6, 44.
1471. Sundqvist A. et. al. J. Gen. Virol., 1990, 71, 609.
1472. Suntharasamai P. et. al. Lancet, 1986, 8499, 129.
1473. Suntharasamai P. et. al. J. Hyg., 1986, 96, 483.
1474. Superti F. et. al. Arch. Virol., 1991, 116, 159.
1475. Sureau P. et. al. Dev. Biol Stand., 1985, 60, 133.
1476. Suzu S. Nucl. Acids. Res., 1987, 15, 2945.
1477. Suzuki K. et. al. J. Med. Virol., 1990, 32, 194.
1478. Suzuki Y. et. al. FEBSlett. 1998, 427, 183.
1479. Swayne D.E. et. al. Avian Pathol. 1999, 28, 245.
1480. Swayne D.E. et. al. Vet. Microbiol., 2000, 74, 165.
1481. Swayne D.E., Suarez D. L. Rev. sci. Tech. Offlnt. Epiz., 2000, 20, 463.
1482. Takanashi K. et. al. Blood, 1990, 75, 603.
1483. Takase K. et. al. Jap. J. Vet. Sci., 1982, 44, 207.
1484. Takase-Yoden S. et. al. Virus Res., 1991, 18, 99.
1485. Takehara K. et. al. Virilogy, 1989, 169, 452.
1486. Takingroot. Nature, 1972, 235, 130.
1487. Talbot P.J. et. al. J. Virol., 1988, 62, 3032.
1488. Takeuchi Y. et. al. Virology, 1998, 72, 9986.
1489. Tamura Sh. et. al. Eur. J. Immunol., 1991, 21, 1337.
1490. TanC.H.C. et. al. J. Gen. Virol., 1990,71,745.
1491. Tanaka . et. al. J. Immunol., 1991, 147, 354.
1492. Taneja B.S. Poultry Guide, 1986, 23, N 1, 29.
1493. Tang D. et. al. Nature, 1992, 356, 152.
1494. Tardieu M. et. al. J. Virol., 1986, 60, 574.
1495. Tartaglia J. et. al. Virology, 1992, 188, 217.
1496. Tartaglia J. et. al. J. Virol., 1993, 67, 2370.
1497. Tashiro M. et. al. Nature, 1987, 325, 536.
1498. Taub M., Livingston D. Ann. N.Y. Acad. Sci., 1981,372, 406.
1499. Taylor G.W. et. al. Appl. Microbiol., 1971, 21,928.
1500. Taylor H.R., Dimmock N.J. Virus Res., 1985, 3, Suppl. N 1, 115.
1501. Taylor H.P. et. al. Virology, 1987, 159, 288.
1502. Taylor J. et. al. Virol., 1991, 65, 4263.
1503. Taylor J. et. al. Vacine 1991, 9, 190.
1504. Tebbey P. et. al. Virol. Immunol. 1999, 12, 41.
1505. Telling R.C., Radlett P.J. Adv. Appl. Mocrobiol., 1971, 13, 91.
1506. Telling R.C. et. al. 2-th Intern. Cong. Virol, Budapest, 1971, FMDV section, 14.
1507. Teng M.N., Collins P.L. J. Virol. 1999, 73, 466.
1508. Terpstra C., Veter Q., 1987, 9, 50.
1509. Terpstra C., Wensvoort G. Vet. Microbiol., 1987, 13, 143.
1510. Terpstra C., Wensvoort G. Res. In Vet. Sc., 1988,45, 137.
1511. Terpstra C. et. al. Dtsch. Tierztl. Wochenschr., 1990, N 2, 77.
1512. Terry G. M. et. al. Arch. Virol., 1988, 98, 189.
1513. Terry G. M. et. al. Arch. Virol., 1989, 104, 63.
1514. TerzicS.et. al. Proc. IVPS. Cong. 1998, 357. i
1515. Tham K.M., Studdert M.J. Arch. Virol., 1985, 84, 261.
1516. Tham K.M., Studdert M.J. Vet. Med., 1987, 34, 585, 701.
1517. Theil K.W. et. al. J. Clin. Microbiol., 1991, 29, 2059.
1518. Thizy E. Vet. Vaccinoligy. 1997, 346.
1519. Thomas A. J. Virol., 1986, 59, 479.
1520. Thomas P.C. et. al. Vet. Med., 1986, 81, 974.
1521. Tidke R. et. al. Xhccine, 1987, 5, 229.
1522. Timoney P.J. et. al. Rev. Sci. Tech. 1996, 15, 1203.
1523. Tizard I.R. Vet. Immunol. Phyladelphia, 2000, 222.
1524. Tobler L., Imagawa D. T. Intervirology, 1984, 21, 77.
1525. Tochikura T.S. et. al. Virology, 1990, 179, 492.
1526. Todd D. et. al. Arch. Virol., 1985, 86, 167.
1527. Todd D. Avian. Pathol. 2000, 29, 373.
1528. Tohya Y. et. al. Arch. Virol., 1991, 117, 173.
1529. Tolou H. et. al. Bull. Inst. Pasteur, 1992, 90, 11.
1530. Toma B. et. al. Bull. Off. Int. Epiz., 1975, 84, 223.
1531. Tong G-Z., et. al. Avian. Pathol., 2001, 30, 143.
1532. Toshiro M. et. al. J. Virol., 1988, 62, 2490.
1533. ToyodaT. et. al. Virology, 1989, 169, 273.
1534. Tracket C.O. et. al. J. Infect. Dis. 2000, 192, 302.
1535. Traquina P. et. al. J. ell. Biochem., 1990, Suppl. 14D, 162.
1536. Traven M. et. al. Xfet. Micribiol. 2001, 81, N 2, 127.
1537. Trepanier P. et. al. J. Virol., 1986, 60, 302.
1538. Trepanier P. et. al. Vet. Microbiol., 1988, 18, 219.
1539. Tritsch G. L. E[p. Cell Res., 1967, 48, 244.
1540. Trudel M. et. al. Vaccine, 1987, 5, 239.
1541. Trudel M. et. al. Can. J. Microbiol., 1987, 33, 933.
1542. Trudel M. et. al. Can. J. Microbiol., 1988, 34, 1351.
1543. Trudel M. et. al. Vaccine, 1989, 7, 12.
1544. Tsukiama K. et. al. Virology, 1988, 164, 523.
1545. Tsunemitsu H. et. al. Jap. Vet. Sci., 1989, 51, 300.
1546. Tsusumi H. et. al. J. Clin. Microbiol., 1989, 27, 1949.
1547. Tseng C.K. et al. Avian. Pathol., 1986, 15, 557.
1548. Tsuda T. et al. Jap. J. Vet. Sci., 1987, 49, 129.
1549. Tuboly T. et al. Arch. Virol., 1994, 137, 55.
1550. Tuboly T et al. Vaccine, 2000, 18, 2023.
1551. Tuffereau C. et al. Virology, 1989, 172, 206.
1552. Tuttleman I.S. et al J. Virol., 1986, 58, 17.
1553. Tuler K.L. et al. Science, 1986, 233, 4765, 770.
1554. Tyler K. Fields Virology. 2001, 1729.
1555. Ubertini B. et al. Techn. comm. Inst. Zooprofilassi Brescia Italy Rome FAO, 1970, 16.
1556. UckertW. et al. Virus Res., 1986, 4, 343.
1557. Uhoo 1. et al. Immunol, and Cell Biol., 1988, 66, 135.
1558. UlmerG.B. etal. Science, 1993, 259, 1745.
1559. Umino Y. et al. Arch. Virol., 1987, 94, 97.
1560. Umino Y. et al. J. Gen. Virol., 1990, 71, 1199.
1561. Upton C. et al. Virology, 1988, 166, 229.
1562. UrakawaT., Shingu M. Microbiol, and Immunol., 1987, 31,771.
1563. Uttenthal A. et al. J. Virol., 1990, 64, 2768.
1564. Uittenbogaart C.H. et al. In Vitro, 1983, 19, 67.
1565. Uytdeltaag F. et al. Immunol. Today. 1991, 12, 439, 2517.
1566. Vai D. et al. Zbl. Bakter., Mikrob. und Hyg., 1988, 269, 561.
1567. Van Bekkum J.G. Ann. Med. Vet., 1986, 130, 267.
1568. Van Binnendijk R. et al. J. Infect. Dis. 1997, 175, 524.
1569. Vandepol S.B. et al. Virology, 1986, 148, 312.
1570. Van Drunen L., Babiuk L.A. J. Virol. 1986, 59.
1571. Van Drunen L.H. et al. Vaccine, 1990, 8, 358.
1572. Van Drunen L.H. et al. J. Gen. Virol., 1990,71,2053.
1573. Van Eck J.H. Avian Pathol, 1990, 19, 313.
1574. Van Houte A. J. et al. Immunol., 1979, 37, 505.
1575. Van Oirschot J.T. Vet. Microbiol. 2003, 96, 367.
1576. Van Reeth K. Vet. Microbiol. 2000, 74, 109.
1577. Van Regenmortel M. et al. Vet. Vaccinology. 1997, 23.
1578. Van Rooijen N. Immunol. Today. 1990, 11, 154.
1579. Van Wezel A.L. Nanure. 1967, 216, 64. f
1580. Van Wezel A.L.et al. Dev. Biol. Stand., 1985, 60, 229.
1581. Van Wyke C.K.L. et al. J. Infec. Diseases, 1988, 157, 655.
1582. Van den Berg T. Avian Pathol. 2000, 29, 175.
1583. Van den Broeke A. et al. Proc. Nat. Acad. Sci. USA, 1988, 85, 9263.
1584. Van der Laan L. et al. Nature, 2000, 407 (6800), 90.
1585. Vannier P. et al. Ann. Rech. Vet., 1986, 17, 425.
1586. Vannier P. et al. Ann. Rech. Veter., 1988, 19, 289.
1587. Vanselow B. A. et al. Vet. Rec., 1985, 117, 2, 37.
1588. Varsanyi T. etal. Virology, 1987, 157, 241.
1589. Vennema H. et al. Virology, 1998, 243, 150.
1590. Verardi P. et al. J. Virol., 2002, 76, 484.
1591. Versteeg-van O. J. P. et al. J. Cell. Biochem., 1989, Suppl. 13A, 316.
1592. Verdin E. M. et al. Science, 1987, 236, 439.
1593. Verwoerd D.W. et al. Compr. Virol., 1979, 14, 285.
1594. Vesikari T. Ann. Med., 1999, 31, 79.
1595. Vickers M. L., Hanson R. P. J. Wildlife Diseases, 1982, 18, 149.
1596. Vilcek S., Belak S. Acta Vet. Scand., 1998, 39, 395.
1597. Vielitz E. Poultry Guide., 1986, 23, 58.
1598. Vielitz E., Landgraf H. Poultry Intern., 1987, 26, N 12, 48..
1599. Viljoen G. J., Huismans H. J. Gen. Virol., 1989, 70, 2007.
1600. Virus receptors. Animal viruses. 1981, Part 2.
1601. Volkman L. E., Goldsmith P.A. Virology, 1985, 143, 185.
1602. Vonderfecht S. L. et al. Amer. J. Vet. Res., 1986, 47, 1913.
1603. Vries P. et al. J. Gen. Virol., 1988, 69, 549.
1604. Vries P. et al. J. Gen. Virol., 1988, 69, 2071.
1605. Vries P. et al. Vaccine’s 90: Gold Spring Harbor (N. Y.), 1990. 139.
1606. Wakenell P. S., Sharma J. M. Am. J. Vet. Res., 1986, 47, 933.
1607. Waldmann O. et al. Zentbl. Bart I. Orig., 1941, 48, 1.
1608. Walravens K. et al. J. Gen. Virol., 1990, 71, 3009.
1609. Walsh E. et al. J. Gen. Virol., 1986, 67, 505.
1610. Walsh E. et al. J. Gen. Virol., 2000, 81, 709.
1611. Walthall В. I., Ham R. G. Exp. Cell Res., 1981, 134, 301.
1612. Waltner-Toews D. et al. Can. J. Comp. Med., 1985, 49, 1.
1613. Walton T.E. et al. Amer. J. Vet. Res., 1989, 50, 1442.
1614. Wang S. et al. Chin. J. Virol., 1990, 6, 38.
1615. Wang L. et al. Virology, 1993, 192, 710.
1616. Wang Lin Fa. et al. J. Virol. 1998, 72, 1482.
1617. Ward R.L. et al. J. Virol., 1990, 64, 2686.
1618. Wark M. C. et al. J. Biol. Stand., 1979, 7, 73.
1619. Warrington R.E. et al. Amer. J. Vet. Res., 1973, 34, 1087.
1620. Watson W.A. Can. Vet. J., 1981, 22, 10, 311.
1621. Watson WA. Rev. Sci. et Tech Off Int. Epizoot., 1986, 5, 363.
1622. Waymouth C. Cell culture methods for molecular and cell biology, 1984, 1,23.
1623. Weber J. Nature, 1990, 345, N 6276, 573.
1624. Webster R.G., Rott R. Cell, 1987, 50, 665.
1625. Weekly Epidemiol. Rec., WHO, 1992, 67, 261.
1626. Wege H. et al. J. Gen. Virol., 1988, 69, 87.
1627. Weiland E. et al. J. Virol., 1990, 64, 3563.
1628. Weiner H.L. et al. J. Infec. Diseases, 1980, 141, 609.
1629. Wfein-Shon Hu, Trends Bjotechnol., 1988, 6, 83.
1630. Weiss M., Horzinek M. C. Arch. Virol., 1987, 92, 1.
1631. Weiss R. E., Schleicher I.B. Biotechnol. Bioeng., 1968, 10, 601.
1632. Wellink J., Kammen A. Arch. Virol., 1988, 98, 1.
1633. Welliver R.C. et al. J. Clin, Microbiol., 1989, 27, 295.
1634. Welter J. et al. J. Virol. 2000, 74, 6358.
1635. Werners C.D. et al. Arch. Virol., 1987, 97, 101.
1636. Wensvoort G. et al. J. Gen. Virol., 1990, 71, 531.
1637. Wensvoort G. et al. Vet. Microbiol., 1986, 12, 2, 101.
1638. Wensvoort G. J. Gen. Virol., 1989, 70, 2865.
1639. Wensvoort G., Terpstra C. Res. Vet. Sci. 1988, 45, 143.
1640. Westbury H.A. Rev. Sci. et Technol. Off. Int. Epizoot. 2000, 19, 151.
1641. Westenbrink F. et al. Vet. Rec., 1989, 125, 262.
1642. Westaway F. G. et al. Intervirology, 1985, 24, 4, 183.
1643. Westermann F. et al. Zbl. Bakt. Hyg., I. Abt Orig., 1978, 240, 143.
1644. Westrop G.D. et al. J. Virol., 1989, 63, 1338.
1645. Wetz K. et al. Arch. Virol., 1986, 91,2007.
1646. Whetstone C. A. et al. Am. J. Vet. Res., 1986, 47, 8, 1789.
1647. Whetstone C. A. et al. J. Virol., 1990, 64, 3557.
1648. Whipple A. P. et al. Exp. Cell Res., 1978, 116, 457.
1649. Whitaker-Dowling P. et al. Virology, 1991, 180, 81
1650. White A. et al. Arch. ges. Virusforsch., 1972, 36, 13.
1651. Whiteside 1. P. et al. Dev. Biol. Stand., 1985, 60, 283.
1652. WHO, 1989, 3, 6.
1653. Wickelgren L. News Sci., 1989, 135, 39.
1654. Wiegers K.J., Dernich R. Virology, 1987, 157, 248.
1655. Wiegers K. et al., Virology, 1989, 170, 583.
1656. Wild F. et al., Vaccine, 1990, 8, 441.
1657. Wigdorovitz A. et al., Virology, 1999, 255, 347.
1658. Whitton J. L., Oldstone B. A., Fields Virology. 2001, 285.
1659. Wilbur L. et al., JAVMA, 1994, 11, 1762.
1660. Wild T. E, Brown E, J. Gen. Virol., 1967, 1, 247.
1661. Wilhelm U., Schneider L. G. Bull. WHO, 1990, 68, N 1,61.
1662. Willcocks M. M. et al., Arch. Virol., 1990, 113, 73.
1663. Williams R. A. et al., Avian Pathol., 1991, 20, 585.
1664. Willians S., Robertson. J. Virology, 1993, 196, 660.
1665. Wilson T. et al. Proc. Nat. Acad. Sci. USA, 1977, 74, 3471.
1666. Wilson W. C. Virus Res., 1991, 21, 225.
1667. Wimmer E. et al. Nature, 1984, N 5954, 19.
1668. Wimmer E. et al. Biol. Chem. Hoppe-Seyler, 1986, 367, Suppl. 474.
1669. Winterfield R.W, Thacker H. L. Avian Diseases, 1978, 22, 721.
1670. Witter R. L. Avian Pathol., 1984, 13, N 2, 133.
1671. Witter R. L., Offenbecker L. J. Nat. Cancer Inst., 1979, 62, 143.
1672. Witter R. L., Lee L. E Avian Pathol., 1984, 13, N 1, 75.
1673. Witter R. L. Avian Pathol. 1998, 27, Suppl. 1, 46.
1674. Wittmann V.G. Berlin und Munchen. Tierarztl. Wochenschr., 1980, 93, 33.
1675. Wohlfart C.G. et. al. J. Virol., 1985, 56, 896.
1676. Wolf J. D. et. al. Science, 1981, 212, 471.
1677. Wolf J. et. al. Science, 1990, 247, 1465.
1678. Wood G.W. et. al. J. Comp. Pathol., 1986, 96, 2, 125.
1679. Woode G. et. al. J. Clin. Microbiol., 1987, 25, 1052.
1680. Woods R.D. et. al. Amer. J. Vet. Res. 1988, 49, 300.
1681. Woolcock P.R., Crighton G.W. Vet. Rec., 1979, 105, N 2, 30.
1682. Woolhouse M., Bundy D. Vet. Vaccinilogy. 1997, 565.
1683. Woolhouse M., Donaldson A. Nature, 2001, 410, 515.
1684. Worobey M., Holmes E. J. Gen. Virol. 1999, 80, 2535.
1685. Wright P„ Webster R. Fields Virology. 2001, 1533.
1686. Wutz G. et.al. J. Gen. Virol., 1996, 77, 1719.
1687. Wyeth P.J., Chettle N.J. Vet. Rec., 1990, 126, 577.
1688. Wysocka M., Bennink J.R. Cell Immunol., 1988, 112, 425.
1689. Xie O.C. J. Gen. Virol., 1987, 68, 1637.
1690. Xue W. et. al. J. Clin. Microbiol., 1990, 28, 1688.
1691. YahiN. et.al. J. Virol. Meth., 1991,34, 193.
1692. Yamaguchi T. et. al. Avian Dis. 2000, 44, 284.
1693. Yamamoto K. et. al. J. Virol., 1985, 55, 840.
1694. Yamamoto K. et. al. Microbiol, and Immunol., 1986, 30, 343.
1695. Yamanaka M. et. al. Virology, 1988, 166, 1, 251.
1696. Yamanouchi K., Barrett T. Rev. Sci. Tech. Off. Int. Epiz. 1994, 13, 721.
1697. Yan Wei-Wei et. al. J. Yangzho Univ. Natur. Sci. 2000, 3, № 1, 27.
1698. Yasuhara H. et. al. J. Vet. Sci., 1989, 51, 337.
1699. Yates P., Mumford J. Vet. Microbiol. 2000, 74, 173.
1700. Yavtu S. et. al. Rev. Med. Vet. 2001, 152, 633.
1701. Yehuda H. et. al. Avian Pathol. 2000, 29, 15.
1702. Yeung M.C. et.al. Virology, 1987, 156, 377.
1703. Yilma T. Rev. Mond. Techn., 1991, N 69, 2.
704. Yoden S. et. al. Arch. Virol., 1985, 85, 209.
705. Yokomon K. et. al. J. Virol. 1992, 66, 2865.
706. Yoo D. et. al. Virology, 1991, 180, 395.
707. York J.J., et. al. Virology, 1987, 161, 340.
708. YorkJ.J., Fahey K.J. Arch. Virol., 1990, 115, 289.
709. York J.J., Fahey KJ. Avian Pathol., 1991,20, 693.
710. Yoshino K. et. al. Arch. Virol., 1975, 47, 31.
711. Yuasa N. et. al. Avian Dis. 1998, 23, 366.
712. Yuasa S. et. al. Virology, 1991, 181, 14.
713. Zaberezhny et. al. Proc. 1PVS Cong. 2006, 1, 225.
714. Zanoni R.G. J. Gen. Virol. 1998, 79, 1951.
715. Zelikman I. et. al. Biotechnol. and Appl. Biochem., 1989, 11, 209.
716. Zeng Yong-Hui. et. al. Virus. Res. 2000, 68, 93.
717. Zhang Ch. et. al. Amer. J. Vet. Res., 1991,52, 1137.
718. Zhdanov VM. Options Contr. Influenza. Proc. Symp. N. Y, 1986, 193.
719. Zhu X.L. et. al. Amer. J. Vet. Res., 1990, 51, 323.
720. Zink M.Ch. et. al. Amer. J. Pathol., 1990, 136, 843.
721. Zuckerman A.J., Deinhardt F. Bull. World Health Organ., 1990, 68, 293.
722. Zuckermann F. A. et. al. J. Virol., 1990, 64, 802.
В.А. Сергеев
E.A. Непоклонов
Т. И. Алипер
Вирусы и вирусные вакцины
Подписано в печать 02.04.07.
Формат 70x100/16. Гарнитура NewtonC.
Печать офсетная. Бумага офсетная.