Автор: Белецкий Ю.Д.
Теги: общая генетика общая цитогенетика иммуногенетика эволюционное учение видообразование филогенез asterales биология ботаника
ISBN: 5-7507-0197-2
Год: 1989
РОСТОВСКИЙ ОРДЕНА ТРУДОВОГО КРАСНОГО ЗНАМЕНИ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Ю.Д. БЕЛЕЦКИЙ
Искусственные мутации хлоропластов у высших растений
Ответственный редактор кандидат биологических наук Е. К. Разорителева
Ростов-на-Дону
ИЗДАТЕЛЬСТВО РОСТОВСКОГО УНИВЕРСИТЕТА
1989
Б 43
УДК 575.24:582.998.2
Печатается по решению редакционной комиссии по биологическим наукам редакционно-издательского совета Ростовского государственного университета
Рецензенты:
член-корреспондент АН СССР, лауреат Ленинской премии, доктор биологических наук И.А. Рапопорт, доктор биологических наук С.И. Демченко, доктор биологических наук М.С. Одинцова
Редактор О.Е. Шкодкина
Б 43
Белецкий Ю.Д.
Искусственные мутации хлоропластов у высших растений. Издательство Ростовского университета, 1989. — 80 с.
В монографии обобщены данные, относящиеся к проблеме искусственного получения пластидных мутаций у высших растений. Показана возможность индукции пластомных мутаций при помощи N-нитрозо-N-метилмочевины. Выявлено регулирующее влияние мутантных пластид на функциональную активность ядерных генов. Особый интерес представляют результаты успешного использования мутагенеза пластид в практических целях для получения форм с повышенной устойчивостью к некоторым экстремальным воздействиям.
Монография рассчитана на генетиков, селекционеров, физиологов растений.
Б
2004000000-086
-46-88
М175(03)-89
ISBN 5-7507-0197-2
© Издательство Ростовского университета, 1989
Введение
В своих основополагающих работах Г. А. Надсон и Г. С. Филиппов [57], Г. Меллер [224] и Л. Стадлер [268] установили, что при помощи ионизирующих излучений можно значительно увеличивать частоту и размах наследственной изменчивости у самых различных организмов. Позднее, главным образом усилиями И. А. Рапопорта, был открыт ряд химических мутагенов, которые по возможностям индукции разнообразных мутаций, в том числе и редких типов, превзошли ионизирующие излучения [75-78].
Попытки искусственного получения мутаций хлоропластов у высших растений долгое время оставались безуспешными или приводили к невоспроизводимым результатам [159, 288]. Однако пластидные мутации являются прекрасными моделями для исследования структуры и функции генома хлоропластов, различных сторон пластидно-ядерных взаимоотношений [58, 159, 161, 162, 164—166, 187], поэтому увеличение ассортимента мутаций хлоропластов в результате индуцированного мутагенеза заметно ускоряет решение многих проблем пластидной генетики. Кроме того, нельзя недооценивать роль пластидных мутаций в решении задач генетики фотосинтеза [1, 21, 58, 63] и генетики устойчивости растений к абиотическим факторам [18, 90, 151]. Исследование индуцированной мутационной изменчивости пластид дает возможность также выявлять механизмы образования мутаций хлоропластов, кстати, практически неизученные, разрабатывать эффективные способы искусственного получения пластидных мутаций.
В течение ряда лет в отделе генетики Научно-исследовательского института биологии Ростовского университета проводились исследования индуцированной мутационной изменчивости хлоропластов у подсолнечника. Впервые в мире была доказана возможность индукции мутаций пластид при помощи N-нитрозо-N-метилмочевины (НММ). Эти работы получили высокую оценку крупного специалиста в области пластидной генетики Р. Хагеманна [161, 164]. В дальнейшем свойство НММ реагировать с наследственным материалом хлоропластов было подтверждено рядом исследователей ГДР [160-161, 245-246].
Много внимания было уделено нами выявлению механизмов образования пла- стомных мутаций. Индуцированные пластидные мутанты подсолнечника были использованы в решении многих теоретических проблем, в частности, такой важной, как проблема пластидно-ядерных взаимоотношений, и в практических целях, например в повышении устойчивости растений к стрессовым факторам (засоление, засуха, химические соединения и т. д.).
Автор настоящей монографии поставил задачу — подвести некоторые итоги многолетней работы, наметить пути дальнейших исследований. В процессе написания книги был использован ряд литературных источников, которые помогли автору обосновать свои выводы и предположения. Таким образом, содержание монографии вышло за рамки рассмотрения собственных экспериментальных данных и дает, на наш взгляд, общее представление о состоянии проблемы искусственного мутагенеза пластид у высших растений, о ее важном теоретическом и практическом значении. В связи с тем, что данное направление разработано слабо, автор считал своим долгом привлечь внимание генетиков, физиологов растений и селекционеров к этой обширной и интересной проблеме и в меру своих сил и возможностей стимулировать развитие исследований в области индуцированного мутагенеза хлоропластов.
3
Глава I. ПЛАСТИДНЫЕ МУТАНТЫ КАК ГЕНЕТИЧЕСКИЕ МОДЕЛИ
В клетке эукариотов, кроме ядра, генетической функцией обладают другие органеллы [41, 58, 65, 66, 151, 165, 166, 187]. Некоторая часть генетического материала типичной растительной клетки (2—3%) сосредоточена в пластидах. Известны три типа пластид: хлоро-, хромо- и лейкопласты. Генетические исследования проводятся в основном на хлоропластах, хотя и остальные типы можно рассматривать в качестве носителей генетической информации, поскольку все три типа имеют общую начальную стадию развития и могут взаимно превращаться друг в друга [187, 258, 278]. Однако о механизмах такого превращения практически ничего не известно, кроме общих положений, объясняющих причины разнообразия пластид дифференцировкой клетки, влиянием окружающей среды и т. п. [89, 258].
Явление пластидной наследственности было открыто при изучении наследования спонтанно возникшей пестролистности у Pelargonium zonale L. и Antirrhinum majus L. Э. Бауром [120] и у Mirabilis jalapa L. К. Коррен- сом [137]. Впервые же пластиды как самостоятельная наследственная система были выделены О. Реннером в 1934 г. [250] и обозначены им термином «пластом». С тех пор эта наследственная система исследовалась и исследуется с помощью самых разнообразных приемов. В последнее время достигнуты большие успехи в исследовании пластома, которые обусловлены проникновением в генетику молекулярно-биологических методов.
Особое значение имеет углубленный анализ пластомных мутантов. Использование пластидных мутаций как моделей для исследования структуры и особенно функции генома хлоропластов дало возможность получить ряд выдающихся результатов. В настоящей главе автор попытался показать состояние развития пластидной генетики сегодня, уделив основное внимание тем аспектам, которые связаны с использованием метода мутантов.
§ 1. Непрерывность пластид
Одним из свойств структуры, определяющих ее генетическую функцию, является непрерывность этой структуры. Представления о непрерывности пластид хорошо обоснованы. Эти органеллы никогда не возникают заново, а образуются из себе подобных путем деления [187, 293]. Наиболее убедительные доказательства получены на водорослях, содержащих небольшое количество пластид. Например, у Chlamydomonas каждая клетка имеет один, а у Zygnema — два хроматофора, деление которых протекает параллельно делению ядра [293]. При конъюгации содержимое « — »-клетки переходит в « +»-клетку, и образуется зигота, в которой удается обнаружить наличие цитоплазматической ДНК « — »-клетки. Затем происходит редукция генети¬
ческого материала пластид. В большинстве случаев элиминируются пластиды « — »-родителя, причем протекает это чрезвычайно быстро, в течение первых 40—50 мин развития зиготы [198].
Детальное рассмотрение механизмов и причин этого явления не входит в нашу задачу. Можно лишь отметить, что для объяснения материнского наследования выдвинута гипотеза, имеющая определенное экспериментальное обоснование, в том числе и на молекулярном уровне [90]. Эта гипотеза исходит из того, что генетический материал хлоропласта «-(-»-клетки более защищен от энзиматического действия, деградирующего пластиды « — »-клетки в зиготе. В редких случаях могут передаваться потомству пластиды и «-»-клетки.
У высших растений установить непрерывность пластид значительно труднее потому, что число хлоропластов на клетку составляет в среднем несколько десятков [58, 89]. В большинстве случаев это слабовариабельное число является видоспецифичным и тканеспецифичным, что было постулировано еще в 1962 г. П. Михаэлисом [221], предложившим обозначать его р. Относительное постоянство этого числа является косвенным подтверждением непрерывности пластид.
Число р может служить признаком вида в полиплоидном ряду. Особенно убедительны данные Н. Франдсена на картофеле [145]. Ему удалось показать, что при удвоении числа хромосом п число пластид р увеличивается в 1,8—1,9 раза. Следовательно, имеется определенная связь между п и р. В последнее время эта связь подтверждена на молекулярном уровне — число пластид зависит от количества ДНК в ядре [130]. Интересно, что хлорофильная мутация, определяемая изменением одного ядерного гена, может приводить к снижению (в 2 раза) числа пластид в клетке, особенно на свету [158].
Следует отметить, что хлоропласты проходят сложный путь развития от пропластиды к зрелому хлоропласту, причем для образования дифференцированной органеллы необходим свет [240]. У высших растений, как правило, размножение этих органелл происходит на уровне пропластид, хотя в некоторых случаях удавалось наблюдать деление зрелых пластид.
Таким образом, у цветковых растений более важным являются генетические аспекты непрерывности пластид. Имеется громадное количество тщательно исследованных примеров наследования у высших растений, где непрерывность гарантирована тем, что мутантные пластиды передаются как через яйцеклетку, так и через пыльцу [36, 58, 160, 161, 164, 187, 188, 293].
Пластидные пестролистные мутанты содержат во всех клетках одинаковое клеточное ядро, но в различных участках имеются генетически неравноценные пластиды — нормальные зеленые и мутантные (белые, желтые, светло-желтые, желто-зеленые). Распределение различных сортов пластид в пестром растении в ходе митотических делений в большинстве случаев осуществляется при помощи рассортировки, что предопределяет появление узорчатости. Обязательной предпосылкой процесса рассортировки является допущение, что в некоторых случаях клетки, в том числе и яйцеклетки, содержат пластиды двух типов и что пластиды автономны и передаются потомству. Наличие гетеропластидных клеток, в которых присутствуют оба типа пластид, является доказательством пластидной наследственности [36, 81, 187, 189, 219, 220, 226, 245, 288].
Кроме гетеропластидности, на морфологическом уровне обнаружены 5
биохимические различия между пластидами одной клетки, заключающиеся в различной степени фиксации углерода или в варьировании содержания и активности ферментов малатде гидрогеназы [53, 149].
Генетическую автономию пластид очень четко удалось показать О. Реннеру [251]. Реципрокные скрещивания двух зеленых энотер Oenothera 1а- marckiana и Oenothera hookeri вскрыли отчетливые различия в потомстве. Оказалось, что существенное влияние на фенотип пластид может оказывать гибридное ядро. Было отмечено отсутствие видимого действия ядра на пластиды Oenothera hookeri и его тормозящее влияние на окраску пластид Oenothera lamarckiana.
Самое удивительное состояло в том, что пластиды Oenothera lamarckiana сохранили способность к позеленению. Эта способность реализовывалась при создании им обычных условий в виде соответствующего ядра, несмотря на то, что в течение длительного времени (20 поколений) они размножались и передавались потомству фенотипически измененными.
§2. Генетическая функция пластидной ДНК
В пластидах содержится собственная ДНК, по ряду свойств отличная от ядерной [65, 66, 151, 165, 166, 187, 269, 288]. Эти различия касаются плавучей плотности в CsCl>способности к ренатурации, отношения пуринов к пиримидинам, конформации молекулы и т. д. ДНК пластид водорослей имеет меньшую плотность, чем ядерная ДНК, у высших растений особой разницы между двумя типами ДНК не обнаруживается, что затрудняет их разделение [65, 165, 166, 187, 288]. Способность к ренатурации после термического воздействия у пластидной ДНК выражена сильнее, чем у ядерной. Характерной особенностью пластидной ДНК является отсутствие в ней такого основания, как 5-метилцитозин, содержание которого в ДНК ядра может достигать 2,6% [65, 165, 166, 288].
Общее содержание ДНК в пластидах близко к содержанию ДНК в бактериальной клетке и составляет 10“14 —10“15 г, что в 1000 раз меньше, чем содержание ДНК в клеточном ядре. Но оно не является постоянным, меняясь в процессе дифференцировки клетки в зависимости от условий роста и физиологического состояния клетки. Так, при индукции светом развития хлоропластов у Ochromonas количество хлоропластной ДНК увеличивается в 4 раза [148], а при развитии листа гороха относительное содержание ДНК пластид меняется от 1,3% в молодых листьях до 7,3% в полностью позеленевших [200]. Напротив, в популяции вегетативных клеток Acetabularia у некоторой части хлоропластов ДНК отсутствует, причем такие органеллы образуются при помощи деления [205].
В настоящее время доказано, что ДНК хлоропластов обладает кольцевым строением, с контурной длиной у большинства видов 40—45 мкм, что соответствует 120—150 тыс. пар оснований и молекулярной массе около 90*106 дальтон [65, 66, 165, 166]. Одна кольцевая молекула содержит весь кодирующий потенциал органеллы, который соответствует 180—200 полипептидам с молекулярной массой 20 тыс. дальтон. Хлоропласт цветковых растений содержит около 50 гомогенных молекул ДНК, хлоропласт Chlamydomonas— уже 50—80 молекул [166, 177]. Если учесть, что у покрытосеменных число хлоропластов на клетку равно нескольким десяткам, неудивительно, что число копий хлоропластной ДНК в одной клетке достигает нескольких ты6
сяч. Например, у гороха оно составляет 9575 [200].
Молекулы хлоропластной ДНК имеют короткие рибонуклеотидные вставки длиной до 20 нуклеотидов. В ДНК хлоропластов гороха, например, обнаружено 19 таких вставок, определенным образом расположенных по длине молекулы [66]. Различными методами удалось показать, что ДНК пластид обладает способностью к саморепликации. Сам процесс репликации носит полуконсервативный характер и не зависит от синтеза ДНК в ядре [65, 180]. Имеются факты, которые показывают, что репликация ДНК хлоропластов не влияет на деление самих органелл [172]. Хлоропласты содержат все формы РНК — информационные, транспортные, рибосомальные. Их синтез осуществляется на хлоропластной ДНК [166, 294]. Рибосомы хлоропластов отличаются по ряду свойств от цитоплазматических рибосом [67]. Прежде всего они меньше по размерам и имеют константу седиментации 70S, в то время как для цитоплазматических рибосом всех эукариот характерна константа, равная 80S.
Важно отметить идентичность некоторых параметров ДНК хлоропластов и других типов пластид. Выяснено, что содержание ДНК в амилопластах клубней картофеля составляет 0,12—1,3-10-15 г на органеллу [49], а молекулярная масса ДНК хромопластов нарцисса равна 98,6 *106 дальтон [277]. Это свидетельствует в пользу того, что между различными типами пластид существуют лишь структурно-функциональные различия. Эти различия, как полагают, обусловлены особенностями биогенеза этих органелл в процессе дифференцировки клеток под действием ядерных генов.
Пластидная ДНК несет только часть необходимой для развития и функционирования пластид наследственной информации. Это значит, что только некоторые компоненты хлоропласта кодируются собственной ДНК, что биогенез и функционирование пластид определяются как ядерной, так и органелльной ДНК, их гармоничным взаимодействием [58, 159, 161]. Это в полной мере справедливо и для митохондрий [18, 41, 60]. Трудно не согласиться с С. А. Нейфахом [60], считающим проблему клеточной интеграции различных наследственных систем одной из самых важных во внеядер- ной генетике.
Остановимся лишь на состоянии и путях выяснения генетической функции пластидной ДНК. Для решения этого вопроса используется ряд методов. Мы укажем на основные из них, уделив главное внимание роли мутантов.
1. Изолированные пластиды в состоянии при наличии соответствующих условий осуществлять синтез белка. Имеются сообщения, показывающие, что в этих органеллах может синтезироваться 80—90 различных белков {143]. Совершенно очевидно, что вновь синтезированные в изолированных хлоропластах белки имеют органелльное происхождение.
2. Некоторые антибиотики, например хлорамфеникол, блокируют орга- нелльный белковый синтез на рибосомах 70S, в то время как циклогексемид ингибирует синтез белка на рибосомах 80S. Использование таких ингибиторов дает возможность получать информацию о месте синтеза специфических пластидных компонентов или исследовать нарушения пластидно-ядерного взаимодействия [58, 143].
3. У многих видов растений описаны мутанты, затрагивающие структуру и функцию хлоропластов. Прежде всего это разнообразные по фенотипу хлорофилльные мутации. Имеется два типа хлорофилльных мутаций— 7
ядерные и пластомные. Исследование характера наследования таких мутантов показывает, где локализована мутация — в ядерной или пластидной ДНК.
На основании исследования ядерных хлорофилльных мутаций обнаружено большое количество генов ядра, контролирующих биосинтез пигментов и других компонентов пластид. Мутационные изменения таких генов препятствуют развитию функционально нормальных пластид, что приводит к развитию хлорофилльной аномалии [173, 187, 285, 286]. Особенно впечатляющими в этом плане являются работы Д. Веттштейна и соавт. [285, 286]. Они смогли идентифицировать у ячменя 86 ядерных генов, контролирующих развитие хлоропластов. Из них: 29 генов — albina, 20 генов — xantha, 30 генов — viridis и др. Большинство генов являются структурными, но некоторые оказались регуляторными.
Ядерные хлорофилльные мутанты других видов растений также широко используются для установления связи между геном и признаком. В Советском Союзе, например, обширные работы по всестороннему исследованию ядерных хлорофилльных мутантов гороха провел С. А. Гостимский [29, 30]. Он показал, что большинство ядерных мутаций, затрагивающих функцию фотосинтетического аппарата, имеет природу рецессивных мутаций. Ядерные гены, контролирующие формирование, функции и стабильность хлоропласта, различаются временем, характером и проявлением своего действия. Существенный вклад в генетику хлорофилльных мутаций внесли исследования П. Д. Усманова [99]. Достаточно отметить, что ему удалось локализовать во всех 5 группах сцепления арабидопсиса 30 различных мутаций.
Пластидные хлорофилльные мутанты обнаружены и описаны более чем у 40 видов растений [160]. Мутации хлоропластов представляют собой прекрасную модель для исследования структуры и функции генетического материала пластид [159, 162, 164, 165]. По утверждению Р. Сэджер [90], пластидные мутации являются мощным аналитическим инструментом для выяснения процессов биогенеза органелл и установления функций их ДНК. Именно анализ пластидных мутантов стал одним из путей исследования, который определил бурный прогресс пластидной генетики [162].
Всестороннее исследование мутантов с генетическим блоком, вызванным мутацией в пластидной ДНК, проведено у Antirrhinum majus [176, 188, 190], Hordeum vulgare [189], Lycopersicon esculentum [82, 83], Mimu- lus cardinalis [280], Nicotiana tabacum [289, 295], Oenothera [170, 199], Pelargonium zonale [127, 188, 190, 191].
Существует еще один тип хлорофилльных мутаций — это гениндуци- рованные пластомные мутации. Они известны у кукурузы [252, 270], арабидопсиса [249], энотеры [144], ячменя [167] и многих других растений. Сущность этих мутаций можно показать одним примером. Так, у кукурузы ген iojap, локализованный в VII хромосоме, вызывает в гомозиготном состоянии бело-зеленую полосатость листьев, которая затем сохраняется и наследуется как пластидная мутация, несмотря на возможное изменение генетической конституции ядра.
Кроме фотосинтетических наследственных изменений, еще одним основным классом пластидных мутаций у растений являются мутации устойчивости к антибиотикам. Подобно хлорофилльным, мутации устойчивости имеют двойную природу [18, 90, 151, 215]. Выявлено четыре гена стрепто- 8
мицинустойчивости, два — эритромицинустойчивости и один — неамин- спектиномицинустойчивости [128, 257]. Мутации резистентности были использованы как генетические маркеры для картирования генома хлоропластов у Chlamydomonas [90, 151]. Это удалось благодаря тому, что некоторые особенности объекта (один хлоропласт, наличие «исключительных» зигот) дают возможность выявлять результаты генетической рекомбинации между различными пластомами.
Описаны пластомные мутанты эвглены, устойчивые к стрептомицину, спектиномицину, канамицину [230]. Резистентность к стрептомицину проявляется в том, что антибиотик в концентрации, превышающей летальную дозу для клеток дикого типа в 10 раз, не влияет на развитие пластид мутанта. Из каллусной культуры табака получены растения, устойчивые к стрептомицину, с хлоропластной локализацией признака [206]. Зеленые неустойчивые к антибиотику ткани при его содержании 0,25 мг на 0,1 мл среды становились белыми, в то время как устойчивые ткани при концентрации стрептомицина в среде вчетверо большей оставались зелеными.
Резистентные клоны табака проявляли устойчивость и по способности формировать граны, крахмальные зерна. Используя соматическую гибридизацию и рестрикционный анализ хлоропластной ДНК, удалось четко показать пластидную природу антибиотикоустойчивости [214].
У высших растений достаточно часто встречаются температурно-чувствительные хлорофилльные мутации [54, 96]. Хотя данных о генетической природе таких мутантов явно недостаточно, отмечается, что среди них попадаются формы с цитоплазматическим характером наследования. В качестве примера можно привести результаты работ с ячменем, где из 34 температурно-чувствительных мутантов 15 оказались пластидными [96]. Выращивание таких мутантов при экстремальных температурах приводит к депигментации растений, к нарушению ультраструктуры хлоропластов.
Генетический анализ температурно-чувствительных при 35 °C мутантов овсяницы луговой показал, что хлорофилльная недостаточность часто наследуется по материнской линии. Адаптивная ценность таких мутаций состоит в том, что они в определенной мере защищены от давления отбора и что в потомстве таких мутантов наблюдается гетерозисный эффект [54]. Описан пластидный мутант табака, летальный при температуре 8—13 °C. Установлено, что в этих условиях интенсивно протекает процесс деградации хлоропластов [228].
В ряде работ исследовалась генетика устойчивости растений к гербицидам. Оказалось, что местом действия современных гербицидов — производных мочевины, триазина, фенолов, пиридильных соединений — является хлоропласт [125]. В основном все эти вещества подавляют перенос электронов на уровне акцепторов фотосистемы II.
У Chlamydomonas индуцировано несколько мутаций устойчивости к производным мочевины, которые характеризуются однородительским материнским наследованием. Например, мутантный штамм водоросли d2-416 активно растет при концентрации диурона 1*10-6 М, в то время как в этих условиях развитие родительского штамма подавляется [274]. Пластидную природу имеют резистентные к атразину мутанты Chenopodium album [283], крестовника, амаранта [138, 239], мятлика [146], паслена [154], устойчивые мутанты Senecio vulgaris. Подчеркивается, что этот тип наследования резистентности обеспечивает возможность очень быстрого отбора растений, устой9
чивых к гербицидам [260]. С хлоропластами связана устойчивость растений к высушиванию. Пластиды сухих листьев Talbotia elegans сохраняют свою потенциальную жизнеспособность. Через 24 ч после гидратации они восстанавливают свои функции [168].
Приведем несколько примеров, показывающих выдающуюся роль пластидных мутантов в исследовании генетической функции хлоропластов. Наиболее часто используются мутанты, у которых отсутствуют пластидные рибосомы 70S [162]. При исследовании подобных мутантов у кукурузы, ячменя, конских бобов, пеларгонии было выявлено наличие пластидных ДНК в белых мутантных пластидах. Отсюда следует, что репликация ДНК пластид не зависит от синтеза белка в этих органеллах [127, 191, 264]. Данные, полученные с использованием ингибиторов, также показали, что ДНК- полимеразы пластид синтезируются на цитоплазматических рибосомах и кодируются ядром [273]. Этот вывод является исключительно важным: он показывает, что ядро держит под своим контролем одну из основных функций органелльной ДНК — ее репликацию.
У Ghlamydomonas генетические нарушения одной из фотосистем приводят к потере части (15—20%) хлорофилла. Установить связь определенных форм хлорофилла с той или иной фотосистемой на диком типе оказалось очень сложным. Только изучение мутантов позволило выявить все формы хлорофилла, входящего в состав хлорофилл-белковых комплексов фотосистем [46, 47]. Оказалось, что в фотосистеме I (ФС I) преобладают длинноволновые формы хлорофилла «а» с максимумом поглощения 690, 697 и 708 нм, а в фотосистеме II (ФС II)— коротковолновые с максимумом 684 нм. Таким же образом удалось установить три типа антенного хлорофилла [46].
Выяснено, что нарушение механизма, контролирующего репликацию пластидной ДНК у Chlamydomonas, приводит к появлению мутантного фенотипа. Пигментные мутации U3N и U3A характеризуются увеличенным содержанием ДНК хлоропластов на 60% и рибосом — на 80% и одновременно сниженным содержанием зеленых пигментов и глубокими нарушениями ультраструктуры пластид [290].
Пигментные мутации водорослей используются для установления цепи биосинтеза хлорофилла. Для этого определяются промежуточные пигменты, которые накапливаются в клетках мутантных штаммов. Таким путем среди 15 мутаций хлореллы выявлены изменения в генах, контролирующих различные этапы образования хлорофилла [48].
Сочетание различных методов дало возможность выяснить, что пластидной ДНК кодируются и в пластидах синтезируются:
1. Большая субъединица рибулозо-1,5-бифосфаткарбоксилазы (РБФК) [58, 66, 143, 162, 267, 287].
2. Три субъединицы а, ß и е из 5 субъединиц сопрягающего фактора CFi, пластидного белка, обладающего АТФ-азной активностью [143, 179, 202].
3. Цитохромы f и b 559 [202, 243].
4. Два фактора элонгации пластидного белкового синтеза BF-Tu и EF-G1 [135].
5. Часть субъединиц реакционного центра ФС I [147] и белок реакционного центра ФС II с молекулярной массой 32 кД [202, 267].
6. Часть рибосомальных белков пластид, например 11 белков гороха [66].
7. Часть мембранных белков [181, 284].
10
Большая часть структурных компонентов хлоропласта кодируется ядерной наследственной информацией. Это прежде всего малая субъединица РБФК {134, 287], две субъединицы CFj [143], значительная часть субъединиц реакционных центров ФС I и ФС II, большая часть мембранных и рибосомальных белков, все ферменты цикла Кальвина и синтеза хлорофиллов и каротиноидов [162, 187], пластидные ДНК- и РНК-полимеразы [273].
Нельзя не упомянуть еще об одном методе, широко используемом для выяснения пластом-ядерных взаимодействий. Это выявление и анализ несоответствия между геномами ядра и пластид. Наиболее часто этот метод применяется на Oenothera, где имеется 5 типов пластомов, сочетание которых с несоответствующими им ядерными геномами приводит к появлению летальности, пестролистности, снижению интенсивности роста эмбриональных тканей, скорости размножения пластид и т. д. [199].
Известно явление гибридного дисгенеза, или комплекса нарушений, наблюдаемых при определенных направлениях скрещивания, что обусловливается несовместимостью детерминантов цитоплазмы и ядра [103]. Несовместимость ядра и пластид может приводить к появлению летальности, мужской стерильности и другим отклонениям в развитии растения [218]. Однако при этом могут возникать не только негативные явления. Как показал О. Г, Семенов [87] на примере аллоцитоплазматического гибрида, совмещающего ядро Triticum aestivum и цитоплазму Aegilops ovata, ядерно- пластидное взаимодействие может обусловливать появление хозяйственно ценных признаков, отсутствующих у родителей.
Еще в работах О. Реннера [250] и П. Михаэлиса [218] было показано глубокое и существенное влияние пластид на ряд признаков ядерной природы, таких, как рост растения, форма листьев, строение различных частей цветка. В последнее время обнаружены четкие реципрокные различия при скрещивании Oenothera berteriana и Oenothera odorata, касающиеся скорости образования хлорофилла. Поскольку ДНК хлоропластов наследуется по материнской линии, реципрокные различия являются отражением функции пластидных генов [157].
Обстоятельные работы по изучению пластом-ядерных взаимодействий на ультраструктурном уровне проводятся О. Г. Давыденко и др. При анализе 21 аллоплазматической линии пшеницы показано достоверное влияние пластидных генов на 25 количественных признаков из 27, взятых в анализ, и среди них площадь хлоропласта, площадь, размеры и число гран и ламелл и т. д. [33].
Пластиды могут оказывать глубокое влияние на другие, кроме ядра, клеточные органеллы. При исследовании мутантов Chlamydomonas с дефектами органелльной белоксинтезирующей системы обнаружены определенные нарушения митохондрий. Предполагается, что некоторые белки, кодируемые пластидной ДНК и синтезируемые в хлоропластах, функционируют в митохондриях [244]. Создается ситуация, когда продукт белкового синтеза хлоропластов обеспечивает устойчивость митохондрий.
§ 3. Молекулярная организация генома пластид
В последние годы благодаря широкому применению рестрикционного анализа достигнуты большие успехи в установлении молекулярной организации пластидного генетического материала у фотосинтезирующих эука11
риот. Построены физические карты хлоропластной ДНК для ряда видов высших растений и водорослей (пшеница, горох, табак, томаты, энотера, кукуруза, шпинат, хламидомонада, эвглена и др.). Выявлены общие принципы организации пластидного генома [66, 166, 169]. Выдающиеся результаты получены японскими исследователями, которым удалось определить полную нуклеотидную последовательность хлоропластных ДНК печеночника и табака [153].
Генетический материал пластид в виде отдельной молекулы ДНК состоит из четырех районов. В двух так называемых «инвертированных повторах» локализованы гены пластидной рибосомальной РНК 23S, 16S, 5S и 4,5S, которые разделены спейсерами. У большинства видов «инвертированные повторы» являются зеркальным (Сражением друг друга. У некоторых бобовых — гороха и маша — один из районов отсутствует, но у сои имеются оба района размером 21 — 23 тыс. пар оснований [267]. У эвглены гены пластидной рРНК организованы тремя тандемами [169].
Остальная часть пластидной хромосомы (около 70%) предстйвлена двумя длинными уникальными последовательностями, где удалось локализовать гены большой субъединицы РБФК, мембранного полипептида с молекулярной массой 32 кД. К 5'-концу гена большой субъединицы РБФК прилегают гены ß и е субъединиц сопрягающего фактора [179]. Позднее на карте хлоропластной ДНК был локализован ген а субъединицы CFi, который расположен у пшеницы на расстоянии 20 тыс. пар оснований от генов ß и е субъединиц [179], а у табака — на расстоянии 34 тыс. пар оснований. Кроме того, в геноме хлоропластов табака и шпината выявлены гены цитохромного b/f комплекса и цитохрома f [202].
К настоящему времени в геноме хлоропластов идентифицировано более 120 генов [153] и среди них, кроме вышеназванных, гены тРНК, белков ФС I и ФС II, белков пластидных рибосом, а также 30 неопределенных открыто читаемых рамок считывания, гомологичных генам митохондриальной ДНК. Схема организации хлоропластного генома печеночника представлена на рис. 1 (на ней не показаны открытые рамки считывания и гены тРНК).
Ген большой субъединицы РБФК секвенирован [211]. Интересно, что в хондриоме кукурузы обнаружен участок, гомологичный этому гену [269]. Секвенирован и MS pl-фрагмент из 850 пар нуклеотидов, содержащий ген полипептида комплекса b/f. Этот ген из хлоропластной ДНК гороха кодирует белок с молекулярной массой 15, 226 кД [243]. Обнаружена гомология гену ß субъединицы АТФ-азы в митохондриальном геноме кукурузы и маша [269]. Относительное расположение уникальных последовательностей и «инвертированных повторов» в молекуле пластидной ДНК может быть разным, что является причиной появления двух типов молекул ДНК [235].
По всему геному разбросаны гены тРНК. У пшеницы локализовано 35 генов тРНК, у кукурузы —25, у фасоли — около 20 генов [20]. Общая закономерность проявляется в том, что между генами 16S и 23S рРНК находятся гены изолейциновой и аланиновой тРНК [20], причем это характерно не только для фотосинтезирующих организмов, но и для кишечной палочки.
В последнее время в генах пластид обнаружены интроны [20, 169]. Например, ген тРНКвал расщеплен довольно длинным интроном. Ген большой субъединицы РБФК содержит 9 интронов, которые имеют общую длину 4,4 тыс. пар оснований, в то время как длина экзонов составляет всего 1,9 тыс. пар [194]. Наиболее детально к настоящему времени в этом плане 12
изучен хлоропластный геном эвглены. Показано, что все транскрибируемые районы хлоропластной ДНК, кроме генов рРНК, содержат интроны. Их общее количество составляет более 50, а суммарная длина —32 тыс. пар нуклеотидов [193].
Интроны обнаружены также в генах митохондрий дрожжей и растений, что свидетельствует об отсутствии различий по этому признаку между эукариотическим и прокариотическим уровнями организации генетического материала. Интроны, как показано при исследовании митохондриального генома, имеют большое значение прежде всего для осуществления сплай-
Рис. 1. Организация генома хлоропластов печеночника [153]: SSC и LSC — малая и большая уникальные последовательности; IRah IRb — инвертированные повторы; 16S, 23S, 4,5S и 5S — гены рРНК; rpo A, rpo B, rpo C1, rpo C2 — гены PHK-полимеразы; rpl и rps — гены белков рибосом; rbcL — ген большой субъединицы рибулозо-1,5-бифосфаткарбоксилазы; psa A и psa B — гены апобелка P700 хлорофилл a-белкового комплекса ФС I ; psb A — ген белка с молекулярной массой 32 кД; psb B и psb C — гены апобелка P680 хлорофилл a-белкового комплекса ФС II; psb E и psb F — гены цитохрома b-559; atp F, atp H, atp J — гены субъединиц CF0; atp A, atp B, atp E — гены субъединиц CF1; pet A — ген цитохрома f; pet B — ген цитохрома b6; pet D — ген субъединиц цитохромного комплекса b6/f
13
синга [59]. Синтез цитохромоксидазной субъединицы I не идет в отсутствие интронов Ы 4 и Ы 5.
Совершенно неожиданно в интроне одного гена могут заключаться кодирующие последовательности другого гена. У Schizosaccharomyces ген oxi I имеет в составе интронов гены для рРНК. Кроме того, интроны одного гена оказываются важными для экспрессии другого. Как видно из приведенных данных, расположение генов на хлоропластной ДНК большинства видов растений совпадает. Дивергенция генома хлоропластов все же происходит. Сравнивая генетическую организацию хлоропластной ДНК у 21 вида табака — Nicotiana tabacum, Nicotiana otophora, Nicotiana acuminata и других,— удалось выявить некоторые различия, связанные с делециями и' точковыми мутациями. Наиболее мутабильная точка находится вблизи гена большой субъединицы РБФК [197]. Эти различия хотя и являются незначительными, но отражают родственные связи между исследуемыми группами растений.
Исследования изменений хлоропластной ДНК с целью установления филогенетических связей были проведены на различных видах растений. Наиболее обширные работы подобного рода выполнены Дж. Пальмером и Д. Замиром [238] на 12 видах рода Lycopersicon. На основе полученных данных уточнены филогенетические отношения. В некоторых случаях такой метод дал большие результаты, чем обычные генетический и морфологический методы.
Все же различия могут быть весьма значительны — хлоропластные ДНК сои и вигны отличаются двумя делециями размером почти в 5 тыс. пар оснований, располагающимися у концов большой уникальной последовательности [237]. Значительные вариации хлоропластной ДНК обнаружены у рода Pelargonium [216]. Пластом у этого рода разделен авторами на три группы. Причины такой вариабельности пластома объясняются двуродительским наследованием, интенсивной гибридизацией представителей этого рода и мутациями пластома.
Благодаря использованию молекулярно-биологических методов достигнуты большие успехи в исследовании хлоропластного генома. Может сложиться впечатление, что роль мутантов в данных условиях значительно уменьшается. Однако это далеко не так. Р. Хагеманн [162, 166] подчеркивал неоднократно, что большие успехи в генетике и молекулярной биологии пластид достигнуты и будут достигаться кооперацией различных методов исследований. Например, проведено сравнительное определение нуклеотидной последовательности гена большой субъединицы РБФК у дикого типа и мутанта 10—6С Chlamydomonas. Обнаружено, что у мутанта в положении 515 произошла замена пары оснований Г — Ц на А — Т, в результате чего глициновый остаток заместился остатком аспарагиновой кислоты в районе аминокислотной последовательности 171 около первого активного центра большой субъединицы РБФК [141]. Таким образом, можно не сомневаться, что широкое использование мутантов в молекулярной генетике пластид еще впереди.
Геном хлоропластов интенсивно транскрибируется. У Chlamydomonas, например, транскрипционная активность зависит от стадии клеточного цикла и условий культивирования. На разных стадиях функционально активно от 39 до 60% генома пластид [208]. Интенсивность транскрипции достигает максимума в первой половине цикла, а затем постепенно сни14
жается. Интересно, что транскрибируемые районы есть в обеих цепях хлоропластной ДНК и что направление транскрипции меняется на противоположное 6 раз [193]. Некоторые пластогены транскрибируются непрерывно. К ним относятся гены рРНК. Другие, например ген большой субъединицы РБФК,— периодически [208].
Механизмы регуляции активности пластидных генов неизвестны. Одним из факторов, контролирующих транскрипцию, является свет [66]. Вообще световой фактор просто необходим для завершения развития функционально и структурно зрелых пластид [89, 240]. Большинство генов хлоропласта транскрибируется и на свету, и в темноте. Однако имеются 3—4 гена, экспрессия которых индуцируется светом. К ним относится ген мембранного белка с молекулярной массой 32 кД [66]. Транскрипция пластогенов, вероятно, по принципу обратной связи может регулироваться глюкозой и ее аналогами [86], причем этот процесс является светозависимым.
Транскрипция пластидных генов может зависеть от дифференцировки и специализации клетки. Так, в хлоропластах кукурузы ген большой субъединицы РБФК экспрессируется в клетках обкладки сосудистых пучков, но не в клетках мезофилла, в то время как ген белка с молекулярной массой 32 кД транскрибируется в обоих типах клеток [203].
Интересно, что обнаружены различия в транскриптах специфических хлоропластных генов. У большинства видов имеется один транскрипт гена большой субъединицы РБФК размером 1,6 тыс. пар оснований. Однако у маша и некоторых других представителей бобовых число транскриптов этого гена достигает трех. Два дополнительных транскрипта имеют размеры в 2,4 тыс. и 2,6 тыс. пар оснований. Такая же ситуация обнаружена и в отношении фотогена белка с молекулярной массой 32 кД [236].
Как видно, существует еще много невыясненных вопросов. Можно не сомневаться, что важное значение для прогресса в этом направлении, и особенно в направлении выяснения механизмов регуляции пластогенов, будет иметь анализ таких пластидных мутантов, появление которых определяется мутациями регуляторных генов. Например, образование фермента синтетазы транспортной РНК индуцируется светом. У пластидного мутанта эвглены GiBU образование фермента в отличие от дикого типа происходит как на свету, так и в темноте [152]. Подобные пластидные мутации не должны являться редкостью, так как имеющиеся литературные данные показывают, что среди генов, детерминирующих признаки хлоропласта, доля регуляторных генов может быть довольно значительной [44].
§ 4. К проблеме генетического управления фотосинтезом
Известно несколько путей регуляции фотосинтеза — световой, гормональный, метаболический и генетический [21]. В последнее время возникла и интенсивно развивается отрасль генетики, которая получила название генетики фотосинтеза [1, 29, 58, 63]. Как подчеркнул еще А. А. Ничипоро- вич [63], генетические основы функционирования фотосинтетического аппарата далеко не изучены. Поэтому им была поставлена задача улучшения генетической природы самих хлоропластов.
Ни у кого не вызывает сомнения, что фотосинтетическая активность хлоропластов есть наследственно закрепленный признак, хотя генетический анализ его очень затруднен [1]. Заканчивая свою книгу, Дж. Кирк и Р. Тиль- 15
ней-Бассетт [187] пророчески предсказали, что «селекционные программы будущего будут преследовать цель создания хлоропластов более эффективных типов». Такое время наступило. Ставится задача изучения фотосинтетической активности хлоропластов как селекционно-генетического признака, проведения селекции на интенсивность фотосинтеза [45, 58, 64]. Тдкая задача вполне выполнима, так как существует положительная корреляция между фотохимической активностью хлоропластов и продуктивностью растений [19, 100]. Важным и необходимым этапом в понимании механизмов фотосинтеза является выяснение организации и функционирования хлоропластов [29, 30, 162]. В этом плане неоценимое значение имеют исследования самыми различными методами хлорофилльных мутантов высших растений.
Однако более важным в изучении проблемы является генетическое изучение самого процесса фотосинтеза. Здесь успехи более скромны, хотя и получены некоторые результаты по наследованию фотосинтетической активности хлоропластов [1, 25, 58]. Надо сказать, что и в данном случае мутанты могут оказать неоценимую, если не решающую помощь. Имеющиеся пока немногочисленные литературные данные указывают на возможность генетического повышения фотосинтетической активности пластид. Так, описан хлорофилльный мутант хлопчатника с высокой активностью фотосинтеза [122]. Несмотря на недостаток хлорофилла, мутант табака типа аигеа при высокой интенсивности света и температуре выше 30 °C проявляет эффективность фотосинтеза в 7 раз большую, чем у дикого типа [234].
Получены мутантные линии томатов, несущие положительные мутации по показателю фотосинтетической активности хлоропластов [19]. Высокопродуктивные мутанты хлопчатника Дуплекс и Триплекс характеризуются большим количеством реакционных центров в ФС I и ФС II [115]. Конечно, выявление мутаций с повышенной фотосинтетической активностью является сложным процессом и требует специальной экспериментальной оценки мутантной формы.
§ 5. Искусственное получение мутаций хлоропластов
Итак, пластидные мутации широко используются для изучения структуры и особенно функции генетического материала хлоропластов, для выяснения различных сторон пластидно-ядерных взаимоотношений. В естественных условиях мутации хлоропластов возникают с частотой 0,02—0,06% [159, 161, 187], за исключением энотеры, где частота спонтанных мутаций пластид составляет около 0,3% [199]. Именно на возникших таким путем пестролистных формах ряда высших растений были открыты и изучены законы пластидной наследственности.
Долгое время четких и воспроизводимых способов искусственного получения мутаций пластид у высших растений не существовало [164, 218, 288], несмотря на неоднократные попытки, предпринимавшиеся в этом направлении. Так, при помощи радиоактивных фосфора и серы удалось повысить частоту возникновения пластидных мутаций у кипрея с 0,13 до 0,77% [219, 220], а у арабидопсиса, используя рентгеновские лучи,— с 0,007 до 0,195% [253]. В незначительных количествах пластидные мутации были получены при помощи у-излучений у ячменя [167], хлопчатника [192], при помощи этилметансульфоната — у табака [142], при помощи 5-бромдезоксиури- 16
дина — у Agératum [300] и при помощи акридиновых красителей — у кукурузы [68].
Наряду с этим многие опыты вообще оказались безуспешными. Так, у энотеры при помощи ряда мутагенов не удалось индуцировать подобных изменений [165, 288]. Отрицательные результаты были получены и у Antirrhinum [207]. Следует отметить, что у водорослей, например у Chlamydomonas, индукция пластидных мутаций не вызывала особых затруднений [90, 288].
Сложившаяся ситуация тормозила развитие теоретических исследований в области пластидной генетики высших растений и делала невозможным широкое использование в практике пластидных мутантов с повышенными фотосинтетической активностью и устойчивостью к экстремальным воздействиям.
Это касается и механизмов образования пластидных мутаций. Известно, что процесс формирования ядерных мутаций является многоступенчатым и включает в себя в качестве обязательного компонента репарацию повреждений генетического материала [50, 94]. Еще в 1972 г. сам факт восстановления повреждений внеядерных ДНК не был известен [41]. Спустя почти 10 лет появилось лишь несколько исследований, указывающих на возможность репарации пластидных генов [165]. Отсутствие способов искусственного получения пластомных мутаций у высших растений не давало оснований надеяться на быстрый прогресс в данном направлении.
Начиная с 1969 г. нашей рабочей группой были опубликованы данные, показывающие, что N-нитрозо-N-метилмочевина (НММ) является эффективным индуктором пластидных мутаций у подсолнечника [4, 11 — 14, 73, 74]. На детальном рассмотрении этих работ мы остановимся ниже. Позднее пластомные мутации с помощью НММ были индуцированы у ряда других высших растений [160, 161, 164, 245, 246].
В последнее время было сообщено об успешном использовании этил- метансульфоната в хлоропластном мутагенезе у гороха, сои, чечевицы, редиса и моркови [222]. Однако генетический анализ индуцированной пестро- листности в М| не был проведен. Исследовалась лишь ультраструктура хлорофилльных химер. В случае с морковью наследования пестролистности М| в последующих поколениях наблюдать не удалось.
Глава II. N-HHTPO3O-N-METHJIMO4EBHHA—
ЭФФЕКТИВНЫЙ ИНДУКТОР ПЛАСТИДНЫХ МУТАЦИЙ
Как было отмечено выше, большие трудности в индукции пластидных мутаций у цветковых растений тормозили развитие пластидной генетики. В связи с этим очень важно было найти агент, который был бы в состоянии эффективно индуцировать пластомные мутации у высших растений. Таким агентом оказалась N-нитрозо-N-метилмочевина (НММ) [4, И, 14, 72, 74], используя которую, нам удалось получать до 60% пластидных мутаций у подсолнечника.
В настоящей главе мы приводим доказательства пластидной природы индуцируемых этим агентом мутаций и рассматриваем вопрос о специфичности мутагенного действия НММ на хлоропласты подсолнечника.
17
§ 1. Генетическая природа индуцированных НММ хлорофилльных мутантов подсолнечника
Количественные и, самое главное, качественные эффекты НММ в Mi и Мг наиболее удобно рассмотреть на примере одного эксперимента, поскольку вскрытые в нем закономерности оказались общими для всех последующих опытов. Семянки подсолнечника (инбредная линия 3629) обрабатывались водными растворами НММ в концентрациях 0,01 и 0,02% при 25 °C в условиях, приближенных к анаэробным, при pH 7,0—7,2. Время обработки — 20 ч. Обработанные и контрольные семянки отмывали в проточной воде в течение часа, подсушивали и хранили при комнатной температуре в течение 12 сут. Хранение является необходимым методическим приемом, позволяющим повышать выживаемость растений Mi и увеличивать тем самым объем Мг. Этот прием применялся во всех последующих опытах. При изучении Мг была обнаружена довольно высокая мутагенная активность НММ. Частота мутаций, если судить о ней по числу семей с наследственными изменениями, составила 68,93±4,6% при действии мутагена в концентрации 0,02%. Количество мутаций, определенное по числу мутантов на 100 растений Мг, достигло при этой же концентрации 8,68±0,4%.
Известно, что НММ является супермутагеном, вызывающим с высокой частотой разные мутации у животных, растений, микроорганизмов и вирусов. Простое перечисление выполненных в этом плане исследований заняло бы очень много места, поэтому ограничимся лишь цитированием основополагающих работ. Генетическое действие НММ было открыто И. А. Рапопортом [77, 78], получившим на дрозофиле 102,66% сцепленных с полом рецессивных мутаций. Высокий выход мутаций, индуцируемых этой группой соединений, был получен на пшеницах [42], горохе [109] ,.арабидопсисе [225], табаке [84] и других высших растениях, микроорганизмах [31], вирусах [40] и культуре клеток млекопитающих [108].
Несмотря на довольно высокий процент мутаций подсолнечника, индуцируемых НММ, их спектр оказался сравнительно узким — были отмечены лишь различные хлорофилльные аномалии и в незначительном количестве доминантные мутации ветвистости. При этом наиболее существенный вклад в общую частоту мутаций в Мг внесли пестролистные формы (6,14±0,34%) и мутации chlorina (1,23±0,16%). Полученные типы мутаций далеко не исчерпывают того разнообразия наследственных изменений, которое может возникать у подсолнечника.
Пестролистные растения фенотипически характеризуются наличием на листьях белых, желтых или желто-зеленых участков самых различных размеров и форм. Граница между зеленой и мутантной тканью выражена всегда четко. Появление пестролистности еще не является свидетельством пластидной природы этого признака. В основе появления бесхлорофилльных секторов на зеленом растении может лежать несколько причин.
Прежде всего известны случаи, когда пестролистность определяется генными мутациями. Ранее, например, были описаны два пестролистных рентгеномутанта подсолнечника с бело-желтыми и золотисто-желтыми участками [8]. При генетическом анализе удалось установить, что данные формы являются простыми рецессивами. Их появление было обусловлено мутациями различных, независимо наследующихся генов.
Сравнительно недавно у Dieffenbachia обнаружена пестролистность, 18
которая контролируется одним доминантным геном [174]. Причиной соматической мозаичности могут являться хромосомные аберрации. Показано, что пестролистность у некоторых растений связана с фрагментацией хромосомного материала [155]. Р. Рана [248] описал пестролистную химеру хризантемы, связанную с изменением числа хромосом. Если зеленая ткань имела нормальной число хромосом 2п= 18, то бесхлорофилльный сектор был образован клетками с 2п=16.
Бесхлорофилльные секторы на зеленом растении могут возникать вследствие парамутаций [163]. Известны многочисленные примеры подобного рода, особенно парамутации в локусе sulfurea у томатов. Поскольку основным условием появления парамутации является наличие гетерозиготности, эта причина не может быть принята для объяснения появления пестролист- ности в нашем случае. Кроме того, пестролистность может определяться пластидными мутациями и морфозами. Так, по данным Ю. Ф. Сарычева [84], НММ индуцировала у табака в Mi модификации подобного типа.
Доказательство пластидной природы мутации является трудоемким и проводится в два этапа. Вначале на основе ряда критериев — неменделев- ского расщепления в потомстве, различий между реципрокными гибридами — устанавливают внеядерное наследование мутантного признака [36, 187]. Оказалось, что выделенные нами в Мг пестролистные формы расщеплялись я потомстве на три типа проростков: зеленые, пестрые, летальные (белые, желтые или желто-зеленые). Последние погибали на стадии развития первой пары настоящих листьев. Никаких менделевских закономерностей при этом не наблюдалось (табл. 1).
Таблица 1
Расщепление в потомстве пестролистных растений
Год наблюдения
Число изученных семей
Число растений в потомстве
Число мутантных растений, %
зеленых
пестрых
белых (желтых)
1967
50
432
199
88
39,9
1968
60
1128
536
491
47,7
1969
53
1404
584
537
44,4
1970
59
1126
457
310
40,5
1972
69
1006
385
347
42,1
1973
61
1145
325
268
34,1
1974
72
1154
428
259
37,3
1976
51'
1404
431
778
46,3
1977
66
927
261
772
52,6
Характерно, что расщепление в потомстве пестролистных растений носило устойчивый, регулярно повторяющийся в течение ряда лет характер. Правда, числовые отношения при расщеплении колебались. К примеру, доля мутантных проростков в 1973 г. составляла 34,1%, а в 1977 г. —52,6%. По-видимому, эти различия являются отражением условий развития растений в предшествующие годы. Так, в 1972 г. было очень сухое и жаркое лето, что не способствовало относительному росту мутантных участков в пределах пестролистного растения, а в 1976 г. летние месяцы были мягкими и дожд-
19
ливыми, что благоприятно сказалось на накоплении вегетативной массы растений, и в первую очередь мутантных участков.
Вторым критерием внеядерного наследования является появление различий между реципрокными гибридами. При генетическом анализе в F| наблюдалось однородительское материнское наследование мутантного признака (табл. 2). Использование при гибридизации пестролистного растения в качестве матери приводило к расщеплению, характерному для самоопыления, причем числовые отношения были практически идентичными, за исключением опыта 1974 г. При обратном направлении скрещивания все потомство было зеленым и не расщеплялось в последующих поколениях. Впрочем, константными оставались и зеленые растения, выщепляющиеся в потомстве пестролистных форм.
Таблица 2
Гибридизация пестролистных растении с зелеными
Год опыта
Скрещивание
Число растений в потомстве
Число мутантных растений, %
зеленых
пестрых
белых (желтых)
1969
Пестролистное × зеленое
688
283
278
44,9
Зеленое × пестролистное
432
—
—
0,0
1972
Пестролистное × зеленое
327
118
127
42,8
Зеленое × пестролистное
264
—
—
0,0
1974
Пестролистное × зеленое
1078
181
151
23,5
Зеленое × пестролистное
582
—
—
0,0
Одним из многочисленных достоинств подсолнечника как объекта исследований является возможность генетического анализа летальных хлорофилльных мутаций при помощи прививок. Проведенный генетический анализ нежизнеспособных выщепенцев во многих отношениях оказался более глубоким, чем изучение мутантных тканей на уровне пестролистного растения [9].
Априорно казалось, что чем меньше степень поражения фотосинтетического аппарата, тем лучше должны приживаться привои и тем больше следует ожидать новых выживших прививок. Однако такой корреляции не наблюдалось. Желтые проростки в шести использованных семьях хорошо приживались и давали сравнительно высокую выживаемость (2,6—16,9%). Наилучший результат получен при работе с семьей 2—64 (53,0%). Попытка же привить желто-зеленые проростки из семей 1 — 82, 2—12, 2—57, 2—85, 2 — 103 и 2—104 оказалась безуспешной, а проростки с таким же фенотипом 2—69 и 2 — 75 обладали очень низкой прививаемостью (0,6—0,7%). Наивысший показатель среди желто-зеленых мутантов составил 25,4% (семья 2-87).
В подавляющей массе привои погибали в первые дни после осуществления прививки, когда они находились в условиях влажной камеры. Мы предположили, что вскрытое разнообразие по выживаемости отражает различную норму реакции используемых мутантов на повышение влажности. Следует отметить, что в ряде случаев наблюдалась отдаленная гибель привоев, несмотря на срастание тканей мутанта и подвоя. По-видимому, решающее 20
значение имеет несовместимость мутантных и нормальных тканей, обусловленная несоответствием их белковых спектров.
В табл. 3 приведены данные гибридологического анализа, из которых
Таблица 3
Гибридизация мутантных привоев с зелеными растениями
Скрещивание
Число растений в потомстве
зеленых
пестрых
мутантных
1-17 × зеленое
0
0
3
Зеленое × 1-17
61
0
0
1-28 × зеленое
0
0
1
Зеленое × 1-28
17
0
0
1-48 × зеленое
0
0
5
Зеленое × 1-48
47
0
0
2-7 × зеленое
0
1
3
Зеленое × 2-7
93
0
0
2-8 × зеленое
6
0
0
Зеленое × 2-8
28
0
0
2-25 × зеленое
0
0
1
Зеленое× 2-25
97
0
0
2-42 × зеленое
0
0
2
Зеленое × 2-42
92
0
0
2-64 × зеленое
0
0
12
Зеленое × 2-64
45
0
0
2-87 × зеленое
0
0
8
Зеленое × 2-87
14
0
0
2-98 × зеленое
0
0
14
Зеленое × 2-98
15
0
0
видно, что в подавляющем большинстве случаев при использовании привоев в качестве материнского родителя в Fi появляется мутантный фенотип. При обратном направлении скрещивания все потомство оказалось зеленым. Исключение составляют семьи 2—7 и 2—8. В варианте скрещивания 2—7Х X зеленое в Fi из 4 растений одно оказалось пестрым, а в варианте 2—8Х зеленое все потомство было зеленым. Несмотря на это, все растения Fi в последнем варианте скрещивания погибли, чего не наблюдалось при обратном варианте скрещивания. Вероятно, цитоплазма зеленого родителя в данном случае противодействует влиянию мутантных плазмагенов, не устраняя их летального действия. Различия в поведении гибридов Fi в зависимости от направления скрещивания служат доказательством внеядерной природы мутантов, в том числе 2—7 и 2—8. Таким образом, полученные результаты позволили нам прийти к заключению, что индуцированная НММ пестролист- ность подсолнечника имеет внеядерную природу.
Частота индукции внеядерной пестролистности в данном опыте оказалась довольно высокой (табл. 4). Такой уровень эффективности искусственного пластидного мутагенеза до появления наших работ не отмечался [73]. Следует заметить, что у других инбредных линий НММ (концентрация 0,02%) также индуцирует значительное количество внеядерных пестролистных мутаций. В Мг у линии 922 они обнаружены в 40 семьях из 105, что составляет 38,1=ь4,8%, а у линии к-2011— в 19 семьях из 88, или 21,6±4,4%.
Второй по численности группой жизнеспособных хлорофилльных мута-
21
ций после пестролистных химер были желто-зеленые формы, или chlorina, по классификации А. Густафссона [156]. Частота возникновения этих мутаций в пересчете на число семей Мг приведена в табл. 5. Поскольку НММ индуцировала у подсолнечника большое количество внеядерной пестролистности, естественно было предположить, что определенная часть растений с фенотипом chlorina также могла иметь цитоплазматическое происхождение.
Таблица 4
Частота внеядерных пестролистных мутаций, индуцированных НММ у подсолнечника (линия 3629)
Концентрация мутагена, %
Число семей M2
Число семей с мутациями
абсолютное
%
0,01
149
16
10,7±2,5
0,02
103
43
41,7±4,8
0
95
0
0,0
Таблица 5
Частота возникновения мутаций chlorina
Концентрация мутагена, %
Число семей M2
Число семей с мутациями
абсолютное
%
0,01
149
6
4,05±1,6
0,02
103
21
20,4±4,0
Следует отметить, что растения типа chlorina, несмотря на общую черту, касающуюся окраски листьев, при детальном рассмотрении оказались неоднородной группой. Встречались семьи с мутантными экземплярами, сохраняющими желто-зеленую окраску в течение всего периода развития. Формы из других мутантных семей зеленели к началу цветения, иногда по окраске они в это время почти не отличались от нормальных зеленых растений. У отдельных chlorina проявление мутантного признака наблюдалось на более поздней, чем первая пара листьев, фазе развития.
Жизнеспособность некоторых мутантов была очень понижена, основная масса растений гибла до цветения, отдельные же выжившие экземпляры оказались полностью стерильными. Вследствие этого из 27 мутаций chlorina, индуцированных НММ, было изучено генетически только 14.
Анализ мутаций chlorina вскрыл их различную генетическую природу [74]. Так, при скрещивании мутантов 2—41 и 2—65 с зеленой исходной линией в Fi доминировала зеленая окраска независимо от направления скрещивания, что указывает на ядерную природу этих мутаций. В Ег было получено расщепление: в варианте с мутантом 2—41 наблюдалось 574 зеленых растения и 136 желто-зеленых, а в варианте с мутантом 2—65 на 267 зеленых растений приходилось только 36 мутантных. В обоих случаях отклонения от теоретически ожидаемых чисел 3:1 велико. Вероятно, значительный дефицит мутантных растений Ег определяется резко пониженной жизнеспособностью обоих рассматриваемых мутантов.
22
Дефицит хлорофилльных мутантов в F2 — довольно частое явление. Сошлемся хотя бы на обширные исследования С. Бликста [123, 124]. Остальные мутации chlorina существенно отличаются друг от друга по характеру наследования мутантного фенотипа, в связи с чем мы разделили их на 4 типа (табл. 6).
Таблица 6
Гибридизация мутантов chlorina с зелеными растениями
Тип мутации
Скрещивание
Число растений F1
зеленых
промежуточных
мутантных
I
1-24 × зеленое
0
0
32
Зеленое × 1-24
27
0
0
1-138 × зеленое
0
0
54
Зеленое × 1-138
72
0
0
2-25 × зеленое
0
0
44
Зеленое × 2-25
53
0
0
2-32 × зеленое
0
0
76
Зеленое × 2-32
68
0
0
2-43 × зеленое
0
0
49
Зеленое × 2-43
55
0
0
2-68 × зеленое
0
0
27
Зеленое × 2-68
38
0
0
2-71 × зеленое
0
0
61
II
Зеленое × 2-71
70
0
0
1-107 × зеленое
0
52
0
Зеленое × 1-107
63
0
0
2-23 × зеленое
0
39
0
Зеленое × 2-23
44
0
0
III
2-9 × зеленое
29
0
16
Зеленое × 2-9
61
0
0
2-13 × зеленое
7
0
15
Зеленое × 2-13
33
0
0
IV
1-58 × зеленое
19
18
17
Зеленое × 1-58
48
0
0
К I типу отнесены 7 цитоплазматических мутаций. Когда эти мутанты использовались в качестве материнского растения при скрещивании с исходной линией, в Fi был представлен только мутантный фенотип. При реципрокном скрещивании в Fi все растения были зелеными. Когда в скрещиваниях с мутантами остальных трех типов исходная линия служила материнским растением, в Fi всегда обнаруживались только зеленые растения. При обратном направлении скрещивания в Fi или наблюдалось потомство промежуточного типа (II тип), или происходило расщепление на мутантные и зеленые растения (III тип), или же расщепление усложнялось наличием промежуточных форм (IV тип).
Полученные результаты указывают на внеядерный характер наследования мутаций chlorina, отнесенных к I типу. В связи с этим в дальнейшем они получили новые обозначения в соответствии с номенклатурой, предложенной Р. Хагеманном [159]. Мутации II, III и IV типов имеют сложную природу, обусловленную взаимодействием ядра и цитоплазмы. В главе I отмечалось, 23
что нарушение этого взаимодействия может определять появление мутантного фенотипа.
Возникает естественный вопрос о закономерности появления ядерных мутаций chlorina. Частота появления таких мутаций в пересчете на число семей составила 1,94% (табл. 7). Применяя метод <р [70], получаем Fd=3,95.
Таблица 7
Частота возникновения мутаций chlorina различной генетической природы
Концентрация мутагена, %
Всего семей
M2
Число семей с мутациями
ядерными
с ядерно-цитоплазматическим взаимодействием
цитоплазматическими
абсолютное
%
абсолютное
%
абсолютное
%
0,01
149
0
0,00
2
1,33
2
1,33
0,02
103
2
1,94
3
2,91
5
4,85
0
95
0
0,00
0
0,00
0
0,00
Стандартный показатель Fst для Р=0,95 равен 3,9, что свидетельствует о том, что индукция ядерных мутаций подсолнечника НММ не является случайным событием. Однако мутаген доходит до ядра только при концентрации 0,02%.
Таким образом, НММ, несмотря на высокую мутагенную эффективность, индуцирует у подсолнечника в основном внеядерные хлорофилльные мутации. Ядерные мутации chlorina и мутации ветвления получены в незначительных количествах при использовании концентрации мутагена 0,02%.
§ 2. Доказательства пластидной природы внеядерных хлорофилльных мутаций
Доказательство внеядерной природы мутации является начальной и отправной точкой генетического анализа. К сожалению, углубленный генетический анализ цитоплазматических мутаций у высших растений из-за однородительского материнского наследования мутантного признака на уровне организма становится невозможным. Между тем выяснение локализации мутации или выявление органелл, наследственные изменения которых приводят к появлению мутантного фенотипа, является очень важным.
Различают пластидные, или пластомные, мутации и мутации цитоплазмона [218, 252]. В последнем случае наиболее вероятны митохондриальные наследственные изменения. Существует несколько критериев пластидной наследственности. К ним относятся: 1) дефекты строения и функции хлоропластов; 2) наличие гетеропластидных клеток; 3) физико-химические различия ДНК нормальных и мутантных пластид.
Прежде всего индуцированные нами мутанты характеризуются сниженным содержанием зеленых пигментов. Степень этого снижения различна в зависимости от фенотипа мутации (табл. 8). В белых участках обнаружи24
ваются лишь следы зеленых пигментов (0,01—0,24 мг/г), в желтых участках содержание хлорофилла несколько выше (0,18—0,42 мг/г). В желто- зеленых участках пестролистных растении оно равно 1,79—3,00 мг/г, что, однако, не устраняет летальности. У жизнеспособных chlorina количество хлорофилла колеблется от 3,94 мг/г у мутанта en-chlorina-5 до 6,47 мг/г у en-chlorina-1 при 7,75—8,24 мг/г у исходной линии 3629. В зеленых участках пестролистных растений содержание пигментов не уступает контрольному показателю или даже несколько выше его (9,29—9,97 мг/г у линии 2— 24, например), что можно объяснить возможной повышенной функциональной активностью зеленых участков.
Таблица 8
Содержание зеленых пигментов у внеядерных мутантов (1979 г.)
Мутантная линия
Фенотип ткани
Содержание хлорофиллов a+b, мг/г абсолютного сухого веса
в фазе 3-5 пары листьев
в фазе бутонизации
3629
Зеленый
8,24
7,75
2-22
Белый
0,01
0,19
Зеленый
8,33
7,30
2-24
Белый
0,11
0,24
Зеленый
9,29
9,97
1-48
Желтый
0,18
0,09
Зеленый
9,41
7,33
2-25
Желтый
0,20
0,42
Зеленый
8,48
5,58
1-49
Желто-зеленый
1,98
3,00
Зеленый
7,09
7,79
2-8
Желто-зеленый
1,79
1,83
Зеленый
9,00
7,75
en-chlorina-1 (1-24)
Зелено-желтый
7,82
6,47
en-chlorina-5 (2-25)
»
3,12
3,94
en-chlorina-6 (2-32)
»
5,64
6,11
en-chlorina-7 (2-43)
»
4,34
4,76
Для пластид в мутантных тканях характерны глубокие изменения ультраструктуры [71]. Внутреннее строение хлоропласта инбредной линии 3629 (рис. 2) подобно внутреннему строению хлоропластов других высших растений. Хлоропласты подсолнечника имеют овальную форму и окружены двойной мембраной. Внутри органеллы видны хорошо развитая система мембран, состоящая из тилакоидов стромы и тилакоидов гран, и большое количество органелльных рибосом. Встречаются также осмиофильные глобулы, которые имеют липидную природу и являются неотъемлемой частью структуры хлоропласта [89].
Довольно часто система тилакоидных мембран заполняет все внутреннее пространство хлоропласта, что, вероятно, отражает высокую функциональную активность органеллы. Об этом же свидетельствует наличие в пластиде довольно значительных крахмальных зерен (см. рис. 2). В белой пластиде 2 — 22 никаких тилакоидных структур не обнаруживается. В органеллах
25
из желтых тканей (2—42) можно наблюдать отдельные тилакоиды стромы, в то время как в пластидах из желто-зеленых участков (1—49) длина тилакоидов стромы увеличивается и появляются иногда неярко выраженные граны. Ультраструктура пластид жизнеспособных chlorina характеризуется появлением тилакоидов гран, мощность которых, правда, уступает таковой из хлоропласта контрольной линии (рис. 3 — 6).
Рис. 2. Ультраструктура пластид зеленой линии 3629. Ув. 72600
Таким образом, между содержанием пигментов и степенью развитости внутренней мембранной системы пластиды имеется определенная связь. Это положение доказано большим числом исследований [98, 199, 285, 286]. Очевидно, что хлорофилл является наиболее важным веществом, определяющим морфогенез хлоропласта. К. Уоддингтон [98] считает это хорошим примером обратной связи — наличие хлорофилла необходимо для образования специфической мембранной структуры, а эта структура необходима для непрерывного синтеза хлорофилла.
Для индуцированных с помощью НММ внеядерных хлорофилльных мутаций подсолнечника характерно сниженное в той или иной степени, в зависимости от типа мутации, содержание зеленых пигментов и соответствующее этому снижению нарушение мембранной системы пластид. Вообще, электронно-микроскопическое исследование растений с хлоро26
филльной недостаточностью находит широкое применение при выявлении структурных основ мутации, а иногда используется в качестве единственного доказательства пластидной природы мутации [222].
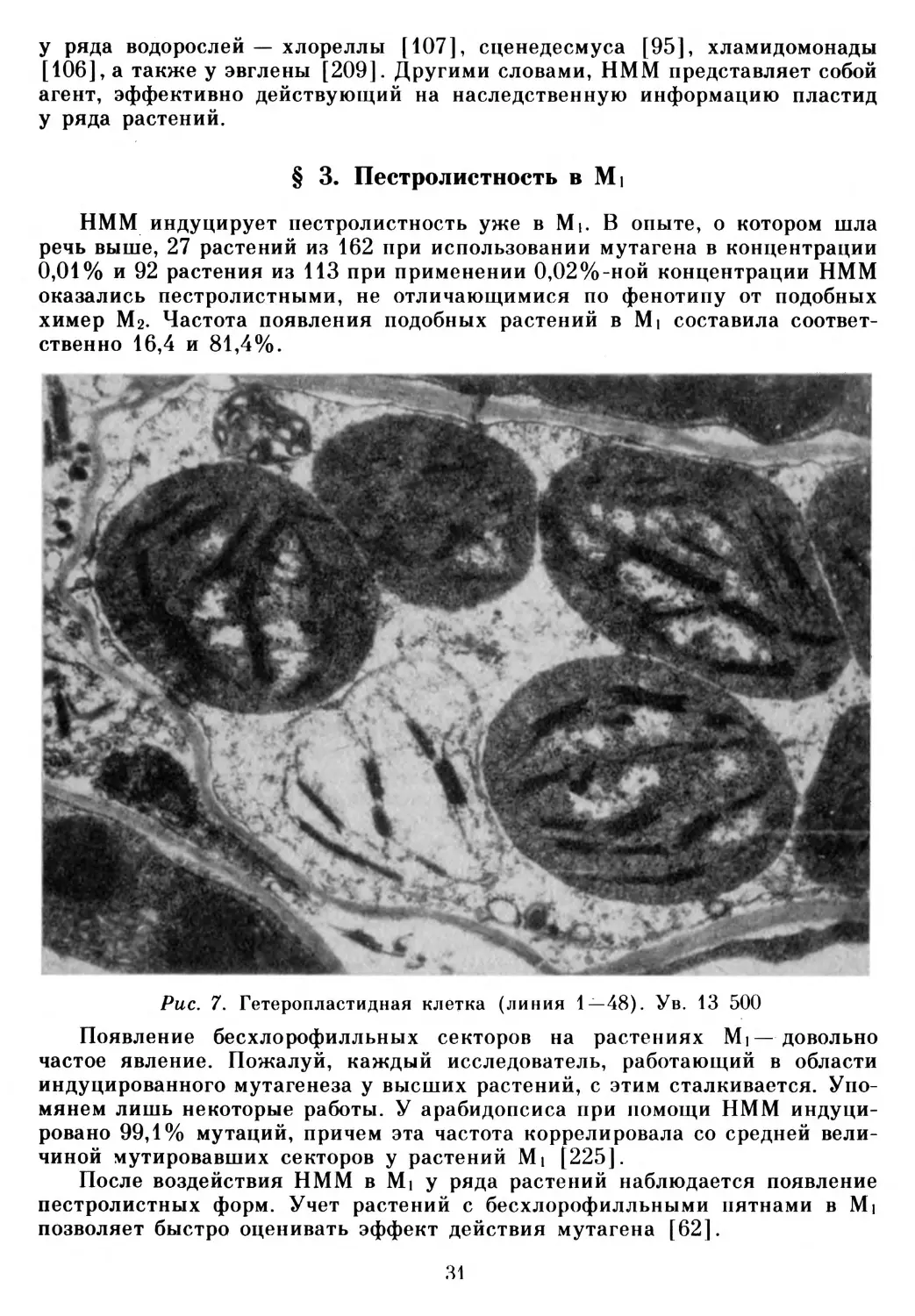
Доказательством пластидной наследственности считается также наличие гетеропластидных клеток [81, 187, 189, 219, 226, 245, 288]. Присутствие в одной клетке генетически различных пластид является необходимым условием рассортировки этих органелл в ходе митотических делений и, как следствия такой рассортировки, появления мозаичности. При цитологическом изучении как под световым, так и под электронным микроскопом 42 пестролистных линий у 12 из них на границе между мутантными и нормальными тканями были обнаружены гетеропластидные клетки (рис. 7).
На снимке достаточно хорошо видно наличие в одной клетке пластид различного типа. Мутантная пластида 1—48 существенно отличается от расположенных в этой же клетке нормальных хлоропластов. Эта пластида имеет светлый матрикс, пластидные рибосомы практически отсутствуют, что отмечалось, впрочем, и ранее, например при исследовании белых пластид у пеларгонии [127].
Рис. 3. Ультраструктура мутантной белой пластиды (линия 2-22). Ув. 35000
В мутантной пластиде видны и тилакоиды стромы, и тилакоиды гран, хотя и менее развитые, чем в нормальных органеллах. При исследовании других объектов было доказано [190], что в пластидах, лишенных рибосом, тилакоидная система не образуется.
Поскольку пластидный белковый обмен существенно нарушен, можно полагать, что образование компонентов мутантных пластид 1 — 48 обусловлено ядерной наследственной информацией. Данные многих исследований 27
свидетельствуют о том, что генетический контроль над формированием внутренней структуры пластид осуществляется как ДНК ядра, так и ДНК пластид, причем первые стадии образования структуры хлоропласта находятся исключительно под ядерный контролем [284].
Несмотря на то, что гетеропластидные клетки найдены нами не у всех пестролистных линий, полученные результаты могут рассматриваться как доказательство того, что индуцированные внеядерные мутации имеют пластидную природу. Упомянем, что в ряде случаев пластидной наследственности гетеропластидные клетки так и не удалось обнаружить [36]. Иногда в случае невозможности проведения гибридологического анализа критерий гетеропластидности является главным и решающим в доказательстве пластидной природы мутации [245].
Рис. 4. Ультраструктура мутантной желтой пластиды (линия 2-42). Ув. 19900
Большое значение для установления пластидной природы мутации имеют случаи лабильного состояния пластидной наследственности. Ступенчатые мутации пластид описаны у желтушника [81], у которого наблюдали клетки с несколькими типами пластид. II. Михаэлису [220] у кипрея удавалось в пределах одного растения различать до 8 цитоморфологически различных типов изменений пластид. Мы наблюдали клетки подсолнечника с тремя типами пластид — бесцветными, желто-зелеными и зелеными. Такие клетки найдены в 8 пестролистных семьях из 12.
Можно допустить, что в некоторых случаях, особенно при отсутствии 28
гетеропластидных клеток, внеядерная пестролистность определяется мутационным изменением митохондрии. Это допущение основывается на общих положениях, например, что клетка представляет собой упорядоченную систему, где отдельные ее органеллы находятся в тесном взаимодействии и мутационное изменение одной из них, допустим митохондрии, должно определенным образом влиять на структурно-функциональные особенности других, например пластид. Однако неоднократные попытки увязать появление бесхлорофилльных участков с мутационными изменениями митохондрий не увенчались успехом [129, 296].
Рис. 5. Ультраструктура мутантной желто-зеленой пластиды (линия 1—49).
Ув. 39 900
Нам не известно ни одного случая, чтобы митохондриальная мутация приводила к появлению хлорофилльного дефекта. Так, при помощи акрифлавина, являющегося митохондриальным мутагеном, у хламидомонады со 100%-ной частотой были индуцированы внеядериые мутанты, образующие миниатюрные колонии. Эти мутации очень напоминали мутации petite у дрожжей [117]. У арахиса, используя некоторые митохондриальные мутагены, удалось индуцировать с незначительной частотой (в 1 семье из 1804) плазмонные мутации, затрагивающие высоту растения. Хлорофилльные мутации отсутствовали. Следует отметить, что эффективность у-лучей и этилметансульфоната в индукции плазмонных мутаций была в 7—8 раз более высокой [201].
29
На основании полученных результатов мы сделали вывод о пластидной природе индуцируемых НММ внеядерных хлорофилльных мутаций подсолнечника. Конечно, решающим доказательством пластидной природы мутации является установление определенных изменений в пластидной ДНК. Однако работы, где бы появление мутантного фенотипа связывалось с молекулярными изменениями в пластидном геноме, пока крайне редки. Так, дефекты пластид у пестролистного растения табака определяются делецией в ДНК хлоропластов [295]. При анализе пластидной ДНК у нефотосинтезирующих мутантов Chlamydomonas было обнаружено, что около половины из них имели одиночные делеции в одном из районов, где расположены гены рРНК [227].
Большую уверенность в правильности сделанного нами вывода придает то обстоятельство, что полученные нами данные подтверждаются другими
Рис. 6. Ультраструктура пластиды жизнеспособного пластидного мутанта en- chlorina-5. Ув. 70000
исследователями на других объектах. Начиная с 1974 г. при помощи НММ удалось индуцировать пластомные мутации у узумбарской фиалки [245, 246], львиного зева, томатов и подсолнечника [160, 161]. Кроме того, под действием этого агента были получены внеядерные пигментные мутации 30
у ряда водорослей — хлореллы [107], сценедесмуса [95], хламидомонады [106], а также у эвглены [209]. Другими словами, НММ представляет собой агент, эффективно действующий на наследственную информацию пластид у ряда растений.
§ 3. Пестролистность в М,
НММ индуцирует пестролистность уже в М|. В опыте, о котором шла речь выше, 27 растений из 162 при использовании мутагена в концентрации 0,01 % и 92 растения из ИЗ при применении 0,02%-ной концентрации НММ оказались пестролистными, не отличающимися по фенотипу от подобных химер Мг. Частота появления подобных растений в М, составила соответственно 16,4 и 81,4%.
Рис. 7. Гетеропластидная клетка (линия 1-48). Ув. 13500
Появление бесхлорофилльных секторов на растениях М|—довольно частое явление. Пожалуй, каждый исследователь, работающий в области индуцированного мутагенеза у высших растений, с этим сталкивается. Упомянем лишь некоторые работы. У арабидопсиса при помощи НММ индуцировано 99,1% мутаций, причем эта частота коррелировала со средней величиной мутировавших секторов у растений М, [225].
После воздействия НММ в Mi у ряда растений наблюдается появление пестролистных форм. Учет растений с бесхлорофилльными пятнами в М, позволяет быстро оценивать эффект действия мутагена [62].
31
Подсчитано, что в некоторых случаях число бесхлорофилльных пятен растет экспоненциально дозе. Это дало основание считать причиной их появления аберрации хромосом [299]. Однако в нашем случае эта причина полностью исключается. Цитогенетическая активность НММ проявляется лишь при использовании мутагена в концентрации 0,04% [10], в то время как пестролистные формы индуцируются при действии 0,02%-ной и даже 0,01%-ной концентраций мутагена.
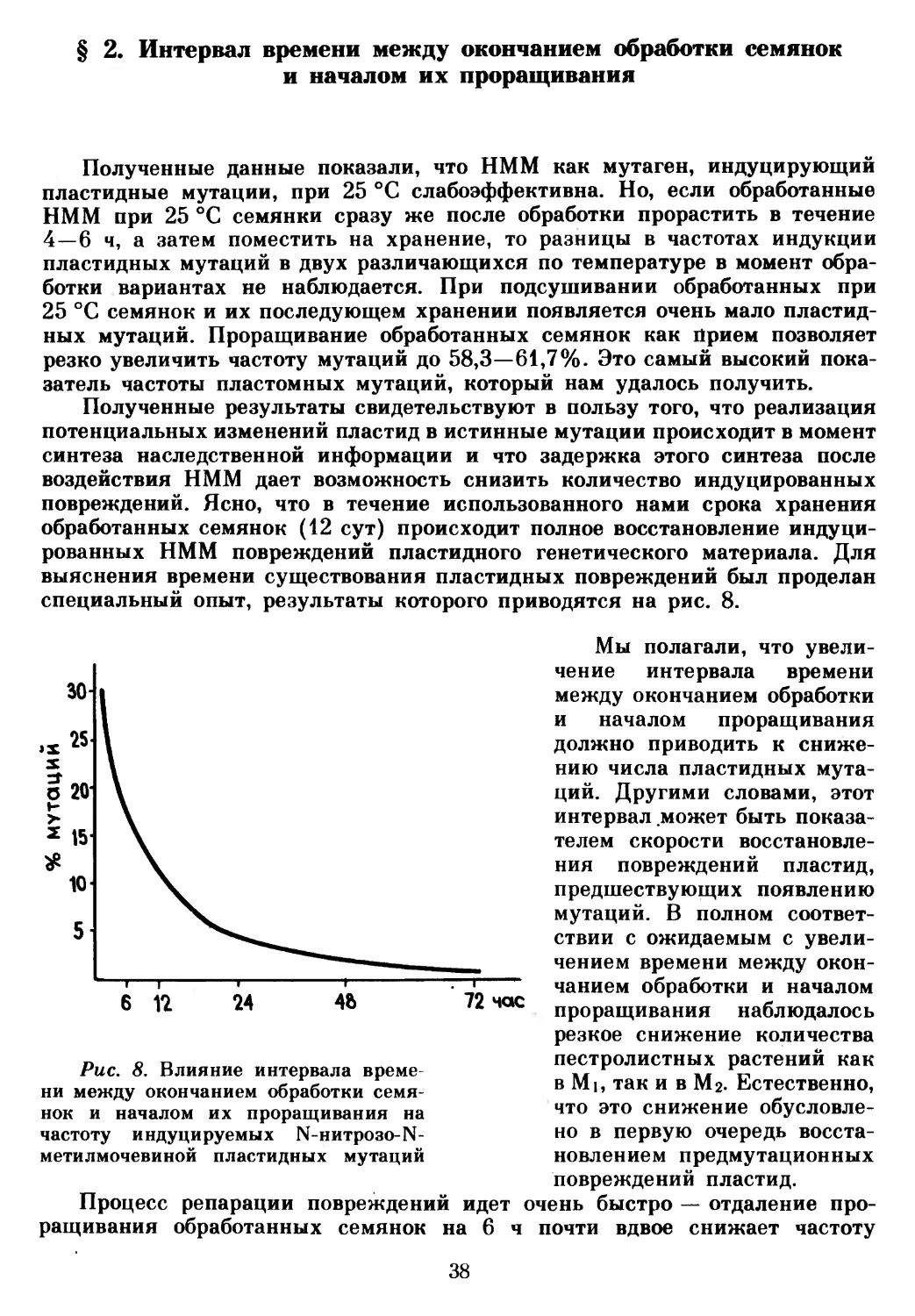
Интересно, что аберрационная активность НММ в значительной мере зависит от условий обработки. Наибольшее количество клеток с перестройками хромосом (10,0±0,8% при уровне естественной изменчивости 1,8± ±0,46%) наблюдали при обработке семянок в аэробных условиях при 25 °C. При анаэробном способе воздействия так же, как при низких температурах (7—14 °C) в аэробных условиях обработки, не наблюдалось аберрационной активности НММ или обнаруживалось несущественное повышение уровня перестроек [10]. Сходные с нашими результаты получены на корешках конских бобов [217].
Возникновение соматической мозаичности в Mi может обусловливаться генными мутациями, поскольку высокая эффективность НММ дает возможность одновременного мутирования гомологичных локусов, влияющих на биосинтез хлорофилла. Однако хлоропласты подсолнечника настолько эффективно связываются с НММ, что мутаген почти не достигает ядра и вследствие этого индуцирует небольшое количество ядерных мутаций. Высокая избирательность НММ в отношении хлоропластов подсолнечника была подтверждена при электронно-микроскопическом изучении первой пары листьев растений Мь Обработка НММ вызывает различные изменения ультраструктуры хлоропластов.
Прежде всего под действием мутагена существенно нарушается образование тилакоидной системы. Торможение образования этой системы приводит к тому, что тилакоиды не заполняют всего внутреннего пространства органеллы. На некоторых срезах внутренние мембраны вообще не обнаруживаются. Иногда гранообразование усиливается, но в этом случае тилакоидная система в органелле не имеет определенной ориентации. Довольно часто встречаются пластиды с уплотненным матриксом, в которых тилакоиды просматриваются с большим трудом. Мутаген вызывает также изменения формы органелл и вакуолизацию пластид [15]. В общей сложности было просмотрено более 600 пластид и не обнаружено ни одного неизмененного хлоропласта.
Как правило, появление измененных участков на растении Mi наблюдается начиная с 3—5 пары настоящих листьев. Интересно, что ультраструктура пластид в зеленых участках мозаичного растения не отличается от нормы. Поскольку все пластиды в первой паре листьев растений Mi изменены, это значит, что часть изменений хлоропластов имеет модификационную природу, при которой генетический материал органелл не затрагивается. На такую возможность указывалось ранее. Имелось в виду, что НММ в силу своих свойств может действовать на всю многоступенчатую систему «ген — признак».
Индукция морфозов у хлоропластов не является исключительным явлением. При действии гербицида SAN 6706 на протопласты картофеля наблюдается их обесцвечивание. Однако этот процесс является обратимым, так как из обесцвеченных протопластов образуются зеленые каллусы [281].
32
В наших опытах НММ действует на пропластиды, которые всегда находятся в клетках меристемы листьев и точек роста и из которых в дальнейшем развиваются хлоропласты. Пропластиды с неизмененной под влиянием мутагена генетической информацией в последующих пластидных поколениях должны развиваться в хлоропласты нормального вида, что в сочетании с процессами рассортировки органелл определит феномен мозаичности в М|. Такие рассуждения приводят нас к необходимости признать, что появление измененных участков на пестролистном растении Mi определяется мутационным изменением органелл. В этом случае частоту появления мозаичности в Mi можно принять как критерий эффективности и специфичности мутагена.
Из приведенных нами данных можно сделать вывод, что пестролистность подсолнечника в Mi, индуцированная НММ, в основном имеет пластидную природу. Подобное было обнаружено и на других объектах [161, 164], что дало основание Р. Хагеманну судить о частоте мутаций пластома уже по Mi.
§ 4. Специфичность мутагенного действия НММ на хлоропласты подсолнечника
Способность НММ взаимодействовать с генетическим материалом пластид показана пока в единичных работах на ограниченном числе растительных объектов [12, 95, 106, 107, 161, 209, 245, 246]. Наиболее чувствительным к действию данного мутагена из числа тех высших растений, у которых удалось получить пластомные мутации, оказался подсолнечник [164]. Схожая ситуация сложилась при исследовании эффекта НММ на крысах, где выявлено преимущественное алкилирование НММ митохондриальной ДНК только в печени животного [297].
Попытаемся объяснить причины высокой чувствительности хлоропластов подсолнечника к НММ. Еще в 1938 г. В. В. Сахаров поставил и обосновал вопрос о специфике мутагенного действия внешних факторов [85]. Суть этой работы вкратце сводится к тому, что внешние факторы в сочетании с внутренними особенностями организма определяют качественное и количественное своеобразие мутационного процесса.
Исходя из этого, можно было предположить, что специфическая особенность НММ индуцировать большое количество пластидных мутаций определяется целиком особенностями объекта. Для выяснения этого предположения были изучены индуцированные этиленимином (ЭИ) и диэтилсульфатом (ДЭС) мутационные процессы и генетическая природа полученных при этом хлорофилльных мутантов подсолнечника.
Использованные мутагены относятся к супермутагенам, их действие было открыто И. А. Рапопортом [75, 76]. Обработка семянок линии 3629 проводилась в анаэробных условиях в течение 20 ч при 25 °C ДЭС в концентрации 0,3% и ЭИ в концентрации 0,01%. Из 216 семей Мг при использовании ДЭС в 92 были обнаружены хлорофилльные мутации, что составило 42,6±3,4%. ЭИ индуцировал подобные мутации в 112 семьях из 267, или в 42,0±3,0% всех семей.
Хлорофилльные мутанты были представлены как летальными формами albina, xantha, так и желто-зелеными chlorina, среди которых имелись и жизнеспособные, и летальные мутации. ЭИ индуцирует больше жизнеспособ33
ных хлорофилльных мутаций (11,1%), чем ДЭС (1,4%). Пестролистных растений ни в Mi, ни в Мг не наблюдалось.
Используя ЭИ и ДЭС, мы смогли получить у подсолйечника только ядер- ные хлорофилльные мутанты, из чего был сделан вывод, что существует специфическая способность НММ взаимодействовать с пластидным генетическим материалом. Очевидно, что НММ как химический агент обладает такими свойствами, которые обеспечивают в некоторых случаях преимущественное связывание мутагена с внеядерными детерминантами.
Молекулярные механизмы мутагенного действия НММ достаточно хорошо изучены. Этот агент вступает в самые разнообразные мутации алкилирования, дезаминирования и карбомоилирования с азотистыми основаниями нуклеиновых кислот [88, 94, 256, 261], а также с самой молекулой ДНК [94, 111]. Однако знание этих механизмов не вскрывает причин специфичности НММ, заключающейся в способности мутагена эффективно индуцировать пластидные мутации у подсолнечника и некоторых других растений.
Одна из трудностей в индукции пластомных мутаций у высших растений определяется множественностью компонентов пластома [36, 218, 288]. Наследственное изменение одной или небольшого числа органелл проявляется не сразу, а спустя некоторое время, необходимое для перехода мутации в случае ее селекционной ценности в гомопластомное состояние. Может быть, по этой причине индукция пластидных мутаций у водорослей, зачастую имеющих один-два хроматофора, не вызвала особых затруднений.
Наиболее оптимальный вариант для получения пластомных мутаций у высших растений возникает в том случае, если химический агент в силу своих свойств в состоянии реагировать одновременно с достаточно большим количеством внеядерных детерминантов. НММ, на наш взгляд, отвечает этим требованиям. Она является производным природного соединения — мочевины, которая присутствует не только в животных, но и в растительных клетках. Хотя мочевина представляет собой химически инертное соединение, она играет важную биологическую роль, которая определяется ее способностью реализовывать свои уникальные физические свойства в различного рода комплексах с нуклеиновыми кислотами, белками и мембранами [28]. Именно это свойство НММ мы имели в виду, когда в 1972 г. сделали предположение, что данный мутаген в состоянии эффективно индуцировать цитоплазматические мутации у высших растений [4].
Гипотетически можно представить себе, что, проникнув в клетку, НММ, прежде чем достичь ядра, встречает на своем пути внеядерные наследственные детерминанты, с которыми она образует комплексы. Наличие в молекуле НММ алкильного радикала и нитрозогруппы определяет возможность химического изменения этих внеядерных элементов.
Решающую роль в индукции хлоропластных мутаций играет нитрозогруппа. Установлено на водорослях и эвглене, что различные алкилмоче- вины проявляют свою «обесцвечивающую» способность только при наличии нитрозогруппы [61, 209]. Алкильный радикал также имеет определенное значение: по данным Р. Хагеманна, замена метильной группы на этильную примерно вдвое снижает частоту пластомных мутаций [161].
В последнее время показано, что липиды, их количество и качество играют важную роль в способности ДНК реагировать с нитрозосоединениями, что они представляют собой компоненты, усиливающие или ослабляю34
щие мутагенную активность или изменяющие специфичность мутагена. Так, количество внутриклеточных липидов в клетках штамма Escherichia coli Д-2 влияет на частоту мутационной изменчивости при действии N-нитрозо- алки л мочевин [34].
Мутагенная активность нитрозосоединений может, следовательно, существенно меняться в зависимости от содержания липидов в клетке. Вероятно, по этой причине подсолнечник как масличное растение обладает такими высокочувствительными к НММ хлоропластами. Количественная и качественная характеристика липидов мембран органелл может существенно изменять свойства этих мембран и, следовательно, степень связываемости их с НММ. По данным [112], содержание липидов в мембранах органелл колеблется и составляет в мембранах хлоропластов около 36%, а в мембранах хроматофор — до 67%.
Кроме того, масличные растения могут обладать другими структурнофункциональными особенностями, затрудняющими доступ НММ к ядру клетки. Так, выделен новый тип мембран толщиной около 20 нм, наиболее часто встречающихся в клетках масличных растений [276].
В заключение еще раз подчеркнем, что НММ представляет собой агент, действующий как на ядерную, так и на внеядерную наследственные системы клетки. Такими же свойствами обладает и N-метил-N-нитрозогуанидин, который индуцирует как ядерные, так и цитоплазматические мутации у Chlamydomonas [150], у Mimulus [280] и у дрожжей [131], а также этил- метанмульфонат, индуцирующий мутации двух типов у растений [142, 222] и у дрожжей [229].
В традиционном понимании специфичность выражается в различных количественных отношениях разных типов мутаций в пределах общего спектра мутаций [43]. Мутагенная специфичность определяется не реакцией мутагена с ДНК, а теми вторичными процессами, которые лежат в основе многоступенчатости образования мутаций [43]. Следует оговориться, что в последнее десятилетие разработаны и используются молекулярногенетические методы, позволяющие индуцировать мутации в определенных локусах ДНК. Эти методы получили наименование сайт-специфического мутагенеза [266].
В нашем случае специфичность НММ проявляется в ее способности индуцировать пластидные мутации у подсолнечника и ряда других высших растений и водорослей. Эта специфичность определяется как физико-хйми- ческими свойствами мутагена, так и некоторыми особенностями объектов. Такими особенностями могут быть число единиц пластома, состояние обмена клетки и определяемые этим обменом свойства мембран органелл.
Глава III. НЕКОТОРЫЕ ФАКТОРЫ В ИССЛЕДОВАНИИ МЕХАНИЗМОВ ОБРАЗОВАНИЯ ПЛАСТИДНЫХ МУТАЦИЙ
В предыдущей главе были приведены данные, показывающие, что N- нитрозо-N-метилмочевина (НММ) эффективно индуцирует пластидные мутации у подсолнечника и ряда других высших растений. Индуцированный 35
мутагенез дает возможность решать ряд теоретических и практических задач, в том числе исследовать механизмы образования мутаций. В качестве подхода к изучению формирования мутаций пластид использовалась модификация частоты пластомных пестролистных мутаций, индуцируемых НММ, при помощи ряда факторов и веществ, особенно с известным механизмом действия. Обработанные НММ семянки проращивались при 25 °C в течение 6 ч на водопроводной воде или на растворах модификаторов. Как правило, применяли такие концентрации веществ, которые не оказывали тормозящего влияния на прорастание семян.
§ 1. Температура
Вначале было изучено влияние температуры на частоту пластидных мутантов, индуцируемых НММ у подсолнечника. Результаты проведенных исследований показали, что данный фактор существенно модифицирует мутагенное действие НММ на хлоропласты (табл. 9). Наивысшая частота пестролистных мутаций получена при использовании мутагена при 15 °C. С повышением и понижением температуры эффективность НММ значительно снижается. Отсюда следует, что снижение температуры в момент обработки до определенного предела, в данном случае до 15 °C, можно рекомендовать как прием, позволяющий значительно увеличивать частоту индуцируемых НММ внеядерных хлорофилльных мутаций подсолнечника [И]. Интересно было бы проверить эту зависимость на других объектах.
Таблица 9
Влияние температуры на частоту индуцированной НММ внеядерной пестролистности
Температура, °C
Число семей M2
Число семей с внеядерной пестролистностью
Число растений M2
Число пестролистных растений
абсолютное
%
абсолютное
%
НММ 0,015%
7-8
100
2
2,0±1,4
3063
2
0,07±0,05
15
131
11
8,4±2,4
4091
19
0,46±0,10
20
120
0
0
3643
0
0
25
232
0
0
5892
0
0
НММ 0,02%
15
150
56
37,3±3,9
5682
350
6,20±0,30
20
159
22
13,8±2,7
5932
66
1,10±0,10
25
140
3
2,1±1,2
5652
5
0,09±0,04
Обработка мутагеном при 15 °C и хранение обработанных селянок при этой же температуре дают наивысший выход пестролистных мутаций — 61,7±4,4% семей Мг с пластидными мутациями и 6,3±0,4% пестролистных мутаций в Мг [13]. Хранение при 15 °C семянок, обработанных при 36
25 °C, приводит почти к тому же эффекту, что и обработка при 20 °C—10,5± ±2,3% семей Мг с внеядерной пестролистностыо и 0,8±0,1% пестролистных мутаций в Мг. В контрольных вариантах в течение ряда лет было проанализировано около 700 семей Мг и более 15000 растений и не наблюдалось ни одного отклонения от нормы.
Приведенные в табл. 9 данные получены при анаэробной обработке семенного материала. Однако существенной разницы между аэробными и анаэробными условиями обработки, если судить по частоте индукции пестролистных растений Мг, не обнаружено. Так, при аэробной обработке НММ в.концентрации 0,02% при 20 °C получено в Мг 8,7±3,4% семей с пестролистными мутациями и 0,6±0,16% пестролистных растений, а при 15 °C — 32,4±3,5% семей в Мг с внеядерной пестролистностью и 5,2 ±0,4% пестролистных растений. Среди пестролистных форм, индуцированных при аэробной обработке, наблюдается больше летальных и стерильных растений. Другими словами, повреждающий эффект мутагена при этом способе обработки выше. В связи с этим анаэробные условия обработки мы считаем более предпочтительными, и все результаты, приводимые ниже, получены с использованием только этого способа.
Известно, что температура является одним из факторов, модифицирующих генетический эффект физических и химических мутагенов [93]. Из большого количества исследований выделим лишь часть из тех, в которых показано влияние температуры на индукцию изменений, наследующихся по материнской линии.
Доказано, что цитоплазматические мутации у сахаромицетов могут индуцироваться при культивировании их при температуре 15 °C [233]. Авторы объясняют это явление несбалансированностью роста при этой температуре, ведущей к потере и (или) инактивации фактора, необходимого для биосинтеза органелл. Отмечен также материнский эффект температуры 16 °C, который заключается в усилении мозаичности по гену white в потомстве дрозофилы при выращивании при данной температуре только самок [104].
В настоящее время является общепризнанным, что модифицирующее действие температуры в индуцированном мутагенезе определяется главным образом ее влиянием на процессы восстановления предмутационных состояний генетического материала [93]. Накопленный обширный фактический материал свидетельствует о том, что ядерные мутации проходят стадию потенциальных изменений [38, 54, 91, 184, 186], которые в зависимости от внутриклеточных и внешних условий могут или реализовываться в мутации, или восстанавливаться до исходного состояния.
Возможность модификации мутагенного эффекта НММ на пластиды подсолнечника дает основание предположить, что образование пластидных мутаций также не является одноактным процессом и включает в качестве необходимого этапа стадию потенциальных изменений. Очевидно, что при 25 °C происходит наиболее энергичное восстановление повреждений генетического материала пластид, так что наблюдаемый эффект в виде пестролистных форм незначителен. Если же учесть, что НММ в примененных нами концентрациях почти не доходит до ядра, выявляется парадоксальная картина очень слабого мутагенного действия при 25 °C такого мощного супермутагена, как НММ.
37
§ 2. Интервал времени между окончанием обработки семянок и началом их проращивания
Полученные данные показали, что НММ как мутаген, индуцирующий пластидные мутации, при 25 °C слабоэффективна. Но, если обработанные НММ при 25 °C семянки сразу же после обработки прорастить в течение 4-6 ч, а затем поместить на хранение, то разницы в частотах индукции пластидных мутаций в двух различающихся по температуре в момент обработки вариантах не наблюдается. При подсушивании обработанных при 25 °C семянок и их последующем хранении появляется очень мало пластидных мутаций. Проращивание обработанных семянок как Прием позволяет резко увеличить частоту мутаций до 58,3—61,7%. Это самый высокий показатель частоты пластомных мутаций, который нам удалось получить.
Полученные результаты свидетельствуют в пользу того, что реализация потенциальных изменений пластид в истинные мутации происходит в момент синтеза наследственной информации и что задержка этого синтеза после воздействия НММ дает возможность снизить количество индуцированных повреждений. Ясно, что в течение использованного нами срока хранения обработанных семянок (12 сут) происходит полное восстановление индуцированных НММ повреждений пластидного генетического материала. Для выяснения времени существования пластидных повреждений был проделан специальный опыт, результаты которого приводятся на рис. 8.
Рис. 8. Влияние интервала времени между окончанием обработки семянок и началом их проращивания на частоту индуцируемых N-нитрозо-N- метилмочевиной пластидных мутаций
Мы полагали, что увеличение интервала времени между окончанием обработки и началом проращивания должно приводить к снижению числа пластидных мутаций. Другими словами, этот интервал может быть показателем скорости восстановления повреждений пластид, предшествующих появлению мутаций. В полном соответствии с ожидаемым с увеличением времени между окончанием обработки и началом проращивания наблюдалось резкое снижение количества пестролистных растений как в Mi, так и в Мг. Естественно, что это снижение обусловлено в первую очередь восстановлением предмутационных повреждений пластид.
Процесс репарации повреждений идет очень быстро — отдаление проращивания обработанных семянок на 6 ч почти вдвое снижает частоту
38
пестролистности, а увеличение интервала до 12 ч приводит к снижению эффективности мутагена уже в 2,5 раза. Задержка проращивания обработанных семянок на сутки устраняет 4/5 всех индуцируемых мутагеном повреждении пластид. Полное же устранение предмутационных изменении происходит через 72 ч после окончания действия мутагена.
§ 3. Кинетин и кофеин
В качестве возможных модификаторов мутагенного действия НММ на хлоропласты подсолнечника нами были испытаны кинетин и кофеин. Кинетин относится к числу растительных гормонов. Известно, что цитокинины стимулируют деление хлоропластов, их рост и синтез генетического материала этих органелл [241]. Исходя из этого и принимая во внимание приведенные выше результаты, свидетельствующие о фиксации потенциальных изменений пластид в истинные мутации в момент синтеза их ДНК, можно было бы ожидать увеличения частоты индуцируемых НММ пестролистных мутаций после дополнительного воздействия кинетина. В полном соответствии с ожидаемым кинетин в концентрации 1 • 10~6М увеличил частоту внеядерной пестролистности, индуцируемой НММ, с 8,5±2,9% до 25,0±4,2% (использовалась концентрация мутагена 0,015%).
Действие кофеина как модификатора индуцированного мутационного процесса весьма противоречиво. Как отмечено Б. Килманом [183], это вещество может изменять течение репаративных процессов — при дополнительном его действии на клетки эукариот обнаружено усиление генетических эффектов. Увеличение эффективности мутагенеза определяется тем, что кофеин способен подавлять репаративные процессы, а именно — пострепликативную репарацию, связанную с процессами рекомбинации [254].
Обнаружено и антимутагенное действие кофеина в отношении индуцированных нитрозо гуанидином мутаций у некоторых объектов [54]. В опытах К. Кларка [136] данный агент не влиял на мутагенный эффект НММ и азотной кислоты у дрожжей. Дополнительная обработка кофеином (концентрация 5«10~3М) в нашем опыте осталась без видимых последствий — частота пестролистных мутаций, индуцируемых НММ, не изменилась.
§ 4. Ингибиторы окислительного и белкового обмена
При исследовании модифицирующего влияния 2,4-динитрофенола (ДНФ) и рифампицина (Р) на мутагенный эффект НММ на хлоропласты подсолнечника удалось получить результаты, согласующиеся с вышеприведенными. Дополнительное воздействие как ДНФ (концентрация 1 • 10~5М), так и Р (концентрация 0,15%) существенно снизило частоту пестролистности с 58,7±7,1% до соответственно 18,8±4,8% и 23,5±5,9% по числу семей Мг с пестролистными мутантами [14]. ДНФ и Р в примененных концентрациях и времени воздействия не вызывают никаких генетических эффектов. Было проанализировано 52 семьи Мг и 867 растений Мг (ДНФ) и 57 семей Мг и 1024 растения Мг (Р), при этом не было зарегистрировано ни одного хлорофилльного изменения.
Действие ДНФ как фактора, разобщающего дыхание и окислительное фосфорилирование, в конечном итоге сводится к подавлению образования 39
АТФ [80], энергия которого необходима для нормального протекания важнейших метаболических процессов, в том числе и репликации генетического материала. Проведенный обстоятельный анализ литературных данных о действии большого числа ингибиторов дыхания на деление ядра [52] четко показал, что процесс деления можно предотвратить путем блокирования окислительного обмена.
ДНФ ингибирует ДНК-зависимый синтез РНК, и в этом плане он аналогичен актиномицину D. Показано, что ДНФ блокирует синтез ДНК, РНК и белка у нигеллы, в результате чего возникают хромосомные аномалии [132]. Установлено, что ДНФ ингибирует также репликацию внеядерной наследственной информации [101]. По данным, полученным на хламидомонаде [272], Р, ингибируя хлоропластную PHK-полимеразу, тормозит белковый синтез в пластидах. Таков же механизм действия антибиотика и на высшие растения, что приводит к ингибированию белкового синтеза в хлоропластах Marchantia [204].
Известно, что синтез белка необходим для начала синтеза ДНК [175], являясь, следовательно, процессом, без которого невозможен запуск репликации генетического материала. Естественно, что ингибиторы белкового синтеза в некоторой степени должны являться и ингибиторами репликации. В связи с этим наблюдаемое после дополнительного действия ДНФ и Р снижение частоты пластомных мутаций, индуцируемых НММ, определяется тем, что эти вещества тормозят синтез наследственной информации хлоропластов, т. е. отдаляют событие, при котором происходит реализация потенциальных изменений пластид в истинные мутации.
Таким же образом можно объяснить снижение частоты индуцируемой НММ пестролистности после дополнительного воздействия циклогексе- мида (Ц). Частота пестролистности в Mi при использовании Ц (концентрация 0,2—0,25%) уменьшается с 53,8±4,8% до 34,7 — 38,2%. Доказано, что этот антибиотик предотвращает индукцию митохондриальных мутаций rho- у дрожжей [291].
Ц ингибирует белковый синтез на цитоплазматических рибосомах 80S, которые являются местом трансляции ядерной генетической информации. Однако следует учесть, что ферменты, принимающие участие в репликации ДНК органелл, кодируются ядром и синтезируются на рибосомах 80S [101, 272, 273]. Вероятно, таким путем торможение цитоплазматического белкового синтеза может блокировать репликацию ДНК органелл.
§ 5. Азотнокислый аммоний и пара-аминобензойная кислота
Принципиальная возможность восстановления предмутационных состояний пластид открывает широкие перспективы не только для выяснения механизмов образования пластомных мутаций у высших растений, но и для решения проблемы пластидного антимутагенеза. Явление антимутагенеза было открыто А. Новиком и Л. Сциллардом [232]. К настоящему времени обнаружен целый ряд соединений, обладающих свойством снижать частоту естественных и индуцированных ядерных мутаций и перестроек хромосом у различных организмов [2]. Следует подчеркнуть, что до сих пор не имелось никаких сведений о пластидных антимутагенах, т. е. веществах, способных подавлять мутационный процесс в хлоропластах.
40
Известно, что нитраты и соли аммония оказывают глубокое физиологическое влияние на хлоропласты высших растений, на адаптивные перестройки фотосинтеза, а соли аммония к тому же способны устранять структурные изменения данных органелл [3]. Исходя из этого, мы решили испытать в качестве потенциального пластидного антимутагена азотнокислый аммоний (АА).
Выживаемость растений Mi при дополнительной обработке АА в концентрации 0,024% снизилась с 87,0 до 67,7%. Вероятно, поражающее действие НММ проявляется сильнее при физиологической стимуляции, которую могут вызывать ионы NH^h N0^7 Эти ионы, как известно, стимулируют фик- сацию углекислоты в результате активации рибу л030-1,5-бифосфаткарбокси- лазы [121]. Активность фермента увеличивается более чем в три раза, причем ион аммония активирует фермент сильнее, чем ион NO3- [282]. Многое определяется структурой соединения. Доказано, что хлорид аммония, напротив, ингибирует фотосинтетические процессы.
Под влиянием АА значительно (в 10 раз) уменьшилось количество пестролистных растений в Mi. Подобная картина обнаруживается и в Мг— АА снижает частоту пестролистных мутаций, индуцируемых НММ, с 61,7± ±4,4% до 6,5±2,5%. При обработке семянок подсолнечника одной лишь аммонийной солью не выявлено никаких генетических эффектов — в каждом варианте было просмотрено по 25 семей Мг и более 500 растений Мг. Полученные результаты свидетельствуют о том, что явление антимутагенеза распространяется и на пластидный мутагенез и что АА является химическим соединением, способным эффективно снижать частоту индуцированной мутационной изменчивости хлоропластов.
Эффективность действия антимутагена, по У. Алекперову [2], определяется как величина отношения частоты мутаций после воздействия антимутагена к контрольному уровню мутирования, выраженному в процентах. Для большинства антимутагенов эти величины находятся в пределах 32— 61%. Эффективность же действия АА как пластидного антимутагена составляет около 10%. Интересно, что высокое антимутагенное действие АА наблюдается при такой концентрации соли, которая используется в питательной смеси Д. Н. Прянишникова, т. е. является оптимальной для жизнедеятельности растений.
Репарагенный эффект пара-аминобензойной кислоты (ПАБК) был открыт И. А. Рапопортом. Это природное соединение показало высокую генетическую активность, восстанавливая повреждения, индуцированные УФ- облучением, у-лучами и НММ [22, 79]. Выяснение возможного репараген- ного влияния ПАБК на генетический материал хлоропластов представляло само по себе большой и принципиальный интерес и, кроме того, имело важное значение для установления вероятной цепи процессов, лежащей между появлением повреждений пластидной ДНК и образованием пластидной мутации.
Было проведено два опыта. В одном из них обработанные НММ семянки проращивались на растворах ПАБК различных концентраций. Полученные результаты (табл. 10) показали, что ПАБК существенно снижает количество пестролистных растений М|. Появление пестролистности в Mi служило в данном случае показателем частоты изменений пластид.
Видно, что ПАБК в концентрации 1*10~3М значительно снижает выживаемость растений Mi (в каждом варианте обрабатывалось по 100 семянок).
41
Таблица 10
Влияние пара-аминобензойной кислоты на частоту индуцированной НММ (0,02%) пестролистности в M1
Вариант опыта
Число растений M1
Число пестролистных растений в M1
абсолютное
%
НММ
64
40
62,5±6,0
НММ+ПАБК 1∙10-3М
30
10
33,3±8,6
НММ+ПАБК 2∙10-4М
58
10
17,2±4,9
НММ+ПАБК 1∙10-4М
96
9
9,4±3,0
В связи с этим наблюдаемое в данном варианте уменьшение частоты пестролистных растений не поддается однозначной интерпретации. Обработка ПАВК в концентрации 2-10-4М при отсутствии влияния на выживаемость приводит к существенному уменьшению частоты пестролистности. Но наиболее убедительны результаты, полученные при использовании ПАВК в концентрации 1*10-4М, где уменьшение частоты пестролистных растений происходит на фоне повышения выживаемости. Во втором опыте проводилась совместная одновременная обработка ПАВК и НММ, поскольку прямого взаимодействия между этими соединениями не обнаружено [22] (табл. И).
Таблица 11
Совместное действие НММ и пара-аминобензойной кислоты (1∙10-4М) на индукцию пластидных мутаций
Вариант опыта
Число растений M1
Выживаемость в M1 %
Число семей
M2
Число семей M2 с мутациями
Мутации, %
НММ 0,02%
4
2,7
1
0
0
НММ 0,02%+ПАВК
25
16,6
21
0
0
НММ 0,04%+ПАВК
8
5,4
8
0
0
НММ 0,05%+ПАВК
12
8,0
11
0
0
Обращает на себя внимание та роль, какую играет хранение обработанных НММ семянок в индукции достаточно большого количества пластидных мутаций. Так, выживаемость растений M1 при использовании НММ в концентрации 0,02% без хранения равна 2,7%, что совершенно недостаточно для анализа Мг, тем более, что часть растений M1 оказывается стерильной.
При хранении же обработанных семянок (см. табл. 10) выживаемость значительно увеличивается, при этом сохраняется достаточно высокий процент пестролистных изменений. Дополнительная обработка ПАВК, как следует из табл. 11, до некоторой степени компенсирует отсутствие хранения, повышая выживаемость растений M1 до 16,6%.
Замечательные репарационные свойства ПАВК позволили получить 42
жизнеспособные и плодовитые растения Mi при использовании обычно летальных концентраций НММ —0,04 и 0,05%. Более того, в Мг не зарегистрировано ни одного растения с хлорофилльной недостаточностью. Полученные результаты дают основание заключить, что ПАБК устраняет индуцируемые НММ потенциальные изменения в геноме хлоропластов подсолнечника.
§ 6. Предполагаемые механизмы образования пластидных мутаций
Возможность модифицирования эффекта НММ на пластиды подсолнечника свидетельствует о том, что образование пластидной мутации не является одноактным процессом, что ему предшествует предмутационное состояние и что повреждения генетического материала пластид способны репариро- ваться. На основании результатов своих исследований Р. Кимбалл [184— 186] выделил два типа потенциальных изменений. Для перехода одних в истинные мутации необходима репликация ДНК, другие превращаются в мутации вне связи с синтезом ДНК. Многочисленные данные, полученные в дальнейшем, подтвердили правильность такого деления [38, 54].
Можно полагать, что потенциальные изменения ядерных и пластидных генов должны иметь общие черты, вследствие чего проведение аналогий и сравнений, предпринятое нами, вполне оправдано. Полученные результаты можно интерпретировать только в том плане, что образованию пластидных мутаций предшествует в качестве необходимого этапа репликация ДНК и что этот процесс фиксирует переход предмутационных состояний пластид в истинные мутации. Примененные нами модификаторы или приемы, задерживающие или отдаляющие синтез ДНК, уменьшали частоту пластидных мутаций. Напротив, кинетин как агент, стимулирующий синтез ДНК в хлоропластах, увеличил частоту индуцируемых НММ пестролистных мутаций.
Наивысшая эффективность НММ при 15 °C может объясняться тем, что при пониженной температуре возрастает содержание нуклеиновых кислот за счет активации их синтеза [92]. Синтез ДНК начинается на 15-м часу прорастания семян пшеницы при 22 °C. Однако, если семена предварительно инкубировать при 2 °C в течение 8 ч, то начало синтеза ДНК отмечается уже через 4 ч [92]. Пониженная температура усиливает биосинтез растительных гормонов, в том числе и цитокининов, вызывает освобождение их связанных форм. Активация процессов синтеза нуклеиновых кислот и определяется в этих условиях увеличением содержания гормонов в клетке.
Кроме того, низкая температура способствует увеличению отношения липид — белок в различного вида мембранах или вызывает нарушения в содержании фосфолипидов. У Triticum aestivum снижение температуры приводит, например, к увеличению содержания липидов в мембранах. При 8 °C их содержание в 1,9 раза выше, чем при 18 °C [35]. Повышение содержания липидов при пониженной температуре может быть одной из причин большей эффективности НММ при этих условиях, если принять во внимание данные, о которых говорилось выше.
Вывод, который мы только что обосновали, подтверждается рядом литературных данных. У дрожжей и у хламидомонады цитоплазматические мутации, индуцируемые N-нитрозо-N'-нитро-N-метилгуанидином и другими агентами, фиксируются в момент репликации пластидных и митохондриальных генов [140, 150]. Временное разделение процессов удвоения генетиче43
ского материала ядра и цитоплазмы служит в связи с этим основой отбора различных типов мутаций.
Выявлено, что ингибитор синтеза митохондриальной ДНК, каким является ион Mg+ + , устраняет индукцию цитоплазматических мутантов при помощи хлористого марганца [247]. Ион Mg+ + проявляет свои антимутагея- ные свойства, предотвращая фиксацию митохондриальных мутаций в момент репликации. Очевидно, в момент репликации возникают пластидные мутации томатов и львиного зева [161]. В этом можно убедиться, ознакомившись с методикой экспериментов по индукции мутаций: за проращиванием семян на воде в течение нескольких часов следует их проращивание на растворах НММ. Доказано также, что необходимым условием индукции фотосинтетических пластомных мутаций Chlamydomonas при помощи 5- фтордезоксиуридина является рост водорослей на среде, содержащей мутаген [298].
Следующий вывод, который вытекает из представленных нами данных, состоит в том, что индуцируемые НММ повреждения пластид очень быстро восстанавливаются. Как отмечено в литературе, нитрозоамиды индуцируют специфический вид быстровосстанавливающихся предмутационных состояний [184]. В связи с этим можно было предположить, что наблюдаемое нами быстрое устранение повреждений пластид определяется в первую очередь спецификой мутагена. Однако проведенные в нашей лаборатории опыты показали, что потенциальные изменения ядерных генов ячменя, индуцированные НММ, сохраняются до 40 сут хранения [26].
Не исключено, что способность пластид, а вернее предмутационных состояний их генетического материала, к быстрому восстановлению является одной из причин, определяющих высокую устойчивость пластома к мутагенным воздействиям. Возможно, поэтому в индукции пластидных мутаций у высших растений имеются очень большие трудности, которые до сих пор не преодолены [159, 161, 288].
Устойчивость пластома к мутагенным воздействиям показана с использованием теста обратных мутаций [82, 83]. У пластидной мутации томатов Pl-alb-1 спонтанные реверсии возникают с частотой 6,5« 10“11. Из ряда использованных мутагенов достоверно повышает частоту реверсий только этилметансульфонат, да и то в 1,4—2,8 раза, в то время как число ядерных мутаций увеличивается в 100—1000 раз.
Трудности индукции пластидных мутаций у высших растений обусловлены также множественностью элементов пластома [218—220]. Мутационное изменение одной или небольшого числа цитоплазматических органелл проявляется не сразу, а спустя некоторое время, необходимое для достижения гомопластомного состояния в случае селекционной ценности мутации. Кроме того, хлоропласты полиплоидны, так как в каждом из них находится несколько десятков наборов ДНК [177]. Эти причины чрезвычайно затрудняют фенотипическое проявление мутационного события в отдельной молекуле ДНК.
Какова же наиболее вероятная цепь процессов, лежащая между актом взаимодействия мутагена с ДНК хлоропласта и появлением мутации? В качестве первого этапа индуцированного мутационного процесса выделяют первичное действие мутагенного фактора на генетический материал, в результате чего возникает первичное повреждение [38, 54, 94, 184, 186].
Основной вклад в мутагенный эффект НММ вносит процесс метилирова44
ния, так как свыше 80% всех индуцированных НММ повреждении ДНК возникает вследствие алкилирования азотистых основании [94, 256]. Более того, установлено, что одним из наиболее частых повреждений в ДНК, вызываемых метилирующими агентами, является образование О6-метилгуанина. Именно реакция с кислородными атомами нуклеиновых кислот определяет наивысшую мутагенную и канцерогенную активность нитрозосоединений [261, 265]. Кроме алкилирующих, НММ обладает карбомоилирующими свойствами [88]. Однако процесс карбомоилирования вызывает прежде всего цитотоксический эффект НММ [213].
Существует несколько путей или механизмов устранения разнообразных изменений структуры ДНК, наиболее полно изученных у бактерий [38, 50, 94]. Репарация ДНК, являясь фундаментальным процессом, обеспечивает генетическую стабильность клетки. У высших эукариот явление репарации изучено недостаточно. Но менее всего известно о механизмах восстановления генетического материала цитоплазматических органелл. Небольшое пока число исследований показывает, что повреждения ДНК митохондрий и пластид репарируются [55, 101, 223, 231].
Одним из молекулярных механизмов, обеспечивающих устранение различных изменений структуры ДНК, является эксцизионная репарация [38, 50, 94]. Она включает в себя отыскание, вырезание поврежденного участка и последующий его синтез на основе нормальной матрицы. Этот процесс является ферментативным.
Отсутствие пластидных мутаций в результате хранения обработанных НММ семянок можно было бы объяснить безошибочной работой эксцизионной репарации, но это вряд ли возможно, особенно в условиях хранящегося семени, когда интенсивность всех ферментативных процессов сведена к минимуму. Кроме того, можно сослаться на факты, показывающие, что этот тип репарации не имеет места при темновом устранении повреждений митохондриальной ДНК [223].
Поэтому в нашем случае наиболее вероятен другой механизм устранения повреждений ДНК — прямое деметилирование азотистых оснований. Этот физико-химический процесс довольно часто встречается при репарации повреждений генетического материала [94]. Более того, при использовании алкилнитрозосоединений с небольшой длиной цепи именно этот механизм восстановления играет главную роль [256]. Репарация в этом случае может осуществляться специфическим белком — метилтрансферазой, который переносит метильную группу из О6-метилгуанина на собственный цистеиновый остаток с образованием S-метилцистеина [261]. Этот процесс не зависит от ДНК-полимераз и протекает очень быстро. Интересно, что мутаген индуцирует синтез белка, требующегося для репарации.
В условиях хранящегося семени деметилирование осуществляется без участия метилтрансферазы, возможно, за счет нестойкости продукта реакции. Большое значение имеет уровень организации генетического материала. В пластидах деметилирование протекает чрезвычайно быстро. Первичные повреждения ядерных генов, что было отмечено выше на примере ячменя [26], сохраняются значительно дольше.
Появление повреждений в генетическом материале стимулирует ряд биологических процессов, в том числе репликацию генетического материала. Способность к синтезу ДНК на матрице, несущей повреждения, существенно увеличивается [94]. В результате репликации в дочерних нитях ДНК на45
против дефектных участков в материнской цепи возникают бреши [38, 50, 94]. Брешь может оставаться открытой в течение нескольких часов. За это время может произойти несколько событий. Бреши могут устраняться в результате характерных для пострепликативной репарации процессов рекомбинации или дополнительного синтеза ДНК. Учитывая значимость и важность процесса устранения брешей, некоторые исследователи [171] рекомендуют вместо термина « пострепликативная репарация» употреблять термин «репарация пробелов в дочерних нитях».
Рассмотрим возможность устранения брешей в результате рекомбинации. Существуют данные, показывающие, что пострепликативная репарация, связанная с процессами рекомбинации, подавляется кофеином [254]. В нашем случае кофеин не оказал никакого модифицирующего влияния на индукцию пластидных мутаций. Может быть, процессы рекомбинации не играют никакой роли в формировании индуцируемых пластидных мутаций. Правда, рекомбинационная репарация редуцируется кофеином у грибов, но не у бактерий [210]. Поэтому можно предполагать, что отсутствие эффекта кофеина может определяться особенностями объекта. Правда, рекомбинационный путь репарации обнаружен у некоторых растений [254].
Основной путь устранения брешей как предмутационных изменений состоит, по-видимому, в их застройке в ходе дополнительного синтеза ДНК. Не исключено, что в ходе этого процесса на месте бреши может оказаться необычное основание. В результате такой ошибки произойдет замена пар оснований, что является одним из основных молекулярных событий, приводящих к появлению мутаций.
Именно в ускорении застройки пробелов и увеличении точности этого процесса, на наш взгляд, и состоит одна из причин пластидного антимутагенеза, обнаруженного при действии АА и ПАБК. Пока попытки выявить механизм действия большинства антимутагенов на основе анализа их структуры и физико-химических свойств не позволили сделать четких выводов. Тем не менее установлена ферментативная природа антимутагенеза и показано, что антимутагены индуцируют дополнительный синтез ДНК [2].
Высокая репарагенная активность ПАБК может определяться тем, что это соединение избирательно влияет на индукцию ДНК-полимеразы-1 репаративного синтеза ДНК, повышает полимеразную активность ДНК-поли- мераз в 2 раза [24]. В наших опытах ПАБК, увеличивая активность ДНК- полимераз, обеспечивает застраивание брешей за счет дополнительного синтеза ДНК в процессе пострепликативной репарации. Вероятно, таков же или очень близок к нему механизм антимутагенного действия АА.
Не исключено, что в основе антимутагенной активности АА и ПАБК может лежать их способность подавлять развитие в клетке sos-репаративной системы, тормозить репликацию поврежденной ДНК как процесса, при котором в дочерних молекулах происходит образование брешей. Такая возможность в отношении ПАБК показана экспериментально [23].
Ясно, что отдаление акта репликации в той или иной степени в зависимости от времени уменьшает количество возникающих пробелов, во-первых, за счет уменьшения количества метилированных оснований; и, во-вторых, за счет их застройки в ходе дополнительного синтеза ДНК. В этой связи хотелось бы обратить внимание на противоречивость в действии ингибиторов белкового синтеза. С одной стороны, торможение белкового синтеза предотвращает образование брешей, но с другой — приводит к уменьшению 46
содержания белка, участвующего в деметилировании азотистых оснований. Не успевшие застроиться к моменту репликации бреши фиксируются в мутации, которые должны представлять собой различной протяженности делеции.
Образующиеся делеции должны вызывать изменение хода считывания генетической информации. Мутации со «сдвигом рамки» ревертируют к дикому типу с очень низкой частотой. Среди индуцированных НММ пестролистных мутаций подсолнечника пока не было обнаружено ни одного случая реверсии, хотя за все время наблюдений было просмотрено более 15000 растений, относящихся к 33 пестролистным линиям. Среди 7 мутантных линий типа chlorina лишь в одной из них за 12 лет воспроизводства и наблюдений однажды возникла спонтанная реверсия [15]. Это свидетельствует о том, что главный путь образования пластидных мутаций — фиксация брешей с образованием делеций. Однако для окончательного решения вопроса требуется проведение специальных работ по выяснению молекулярной природы индуцированных НММ пластидных мутаций подсолнечника.
Подобные исследования индуцированных пластидных мутаций пока единичны. В единственной обнаруженной нами работе показано, что около половины всех нефотосинтезирующих мутантов хламидомонады, индуцированных 5-фтордезоксиуридином, имели в хлоропластном геноме одиночные делеции [227].
Думается, делеции в пластидной хромосоме мутантов должны иметь широкое распространение. Именно делеции должны обеспечить супрессивность мутантных пластид, несмотря на то, что скорость репликации мутантной ДНК пластид может быть значительно ниже, чем в норме [191].
Предложена модель, объясняющая явление супрессивности митохондриальных мутантов [242]. При конъюгации гомологичных участков между мутантной и нормальной молекулами ДНК в случае делеции у последней образуются петли. По мнению авторов, петли уязвимы для процессов экс- цизии, в результате чего каждое рекомбинационное событие приводит к потере части информации у молекулы дикого типа. Происходит быстрое распространение появившейся делеции на все остальные молекулы митохондриальной ДНК клетки.
Наличие процессов рекомбинации пластидных генов после публикации результатов работы Р. Сэджер и 3. Раманис [255] ни у кого не вызывает сомнений, так что объяснение причин супрессивности мутантных митохондрий может быть вполне приемлемо и для пластид.
Необходимо обратить особое внимание на целесообразность исследования модифицирующего влияния солнечного света на индукцию пластидных мутаций. Действие света на пластиды многогранно. Этот фактор представляет собой обязательное условие, без которого невозможна дифференцировка пластид [89, 240]. Свет оказывает существенное влияние на репликацию хлоропластов. При интенсивности света 50 люкс скорость возрастания числа хлоропластов на клетку вдвое ниже, чем при 3000 люкс [119]. Свет энергично фотореактивирует повреждения хлоропластной ДНК, индуцированные УФ- лучами [231]. После содержания облученных УФ-лучами клеток Chlamydomonas в темноте наблюдается деградация хлоропластной ДНК.
Солнечный свет оказывает существенное влияние на наследование хлоропластных генов [116]. Известно, что у хламидомонады только 5% зигот несут гены хлоропластов обоих родителей. При облучении солнечным све47
том в течение 1—2 ч образование «исключительных» зигот возрастает в 6,7 раза и отцовских — в 15 раз. Увеличение времени облучения до 4 ч не дает жизнеспособных зигот. Кроме того, свет приводит к изменению содержания липидов в хлоропластах [275], что в связи с фактами, показывающими возможность модификации мутагенного эффекта НММ липидами, может иметь определенное значение при индукции пластидных мутаций.
Глава IV. ПЛАСТИДНЫЕ МУТАНТЫ
И НЕКОТОРЫЕ ФУНКЦИОНАЛЬНЫЕ СВОЙСТВА ПЛАСТОМА
Пластидные мутанты, как известно, широко используются для выявления закономерностей внеядерного наследования, для выяснения роли пластома в биогенезе и функционировании хлоропластов, различных сторон пластидно-ядерных взаимоотношений и т. д. Предпринятое нами генетическое изучение нежизнеспособных леталей, выщепляющихся в потомстве пестролистных растений, оказалось более глубоким, чем исследование пластидной мутации на уровне пестролистного растения, и позволило получить результаты, которые представили несомненный интерес для решения некоторых общих проблем пластидного наследования. Эти данные рассматриваются в настоящей главе.
Сюда же включены результаты определения у пластидных мутантов спектра пероксидазы и активности β-галактозидазы, которые заслуживают внимания прежде всего в плане выяснения возможного влияния пластид на функциональную активность ядерных генов.
В настоящее время проблема адаптации организма к экстремальным факторам среды и непривычным воздействиям приобретает особое значение. Ни у кого не вызывает сомнения, что устойчивость организма к экстремальным воздействиям определяется его генетическими особенностями [5]. Речь идет не только о наследственных адаптациях к тому или иному фактору, но и об онтогенетических изменениях модификационного характера, которые определяются нормой реакции организма. Наследственная обусловленность резистентности к различным неблагоприятным факторам предоставляет на основе отбора устойчивых форм возможность адаптации к этим воздействиям. Экспериментально такая возможность была показана на примере гречихи посевной. Авторам этой работы В. В. Сахарову и P. Н. Платоновой при помощи отбора удалось повысить критическую дозу облучения с 20 до 60 кВ [69]. К сожалению, эти исследования не были продолжены.
Важная роль в определении устойчивости организма к неблагоприятным воздействиям принадлежит внеядерной наследственной системе, несмотря на ограниченность ее информационной емкости [18, 90]. Приведенные в настоящей главе данные показывают селективную ценность пластидных мутаций, которые могут иметь большое значение в процессе приспособления к различным неблагоприятным факторам.
§ 1. Стерильность мутантных тканей и расщепление в потомстве пестролистных растений
Многие летали, привитые на зеленые подвои, оказались стерильными. Поскольку в большинстве случаев из-за низкой прививаемости леталей число 48
дошедших до цветения привитых растений было небольшим (в среднем 1 — 3), решить вопрос о генетической обусловленности их стерильности оказалось невозможным. Однако в семье 2—33 все 4 привоя, в семье 2—48 все 6 привоев, в семье 2—22 все 6 привоев и в семье 2—77 все 8 привоев оказались стерильными [9]. Более того, не получено ни одной семянки при скрещивании этих мутантов с зелеными растениями. Вряд ли в данном случае мы имеем дело со стерильностью, обусловленной условиями развития.
Еще М. Родс [252] убедительно продемонстрировал, что пластидные мутации могут быть причиной цитоплазматических нарушений, ведущих к пыльцевой стерильности. При помощи молекулярно-биологических методов удалось на примере ряда сортов табака показать связь между мужской стерильностью и изменениями в хлоропластной ДНК [196].
Очень часто стерильность есть результат гибридного дисгенеза, обусловленного нарушением взаимодействия между ядром и цитоплазмой, в том числе и пластидами [103]. В последнее время это очень убедительно продемонстрировано на примере двух видов хлопчатника с использованием такого маркера, как рибулозо-1,5-бифосфаткарбоксилаза [133].
На основании исследования мутантных плазмонов кипрея сделан вывод о том, что внеядерные изменения могут вызывать как женскую, так и мужскую стерильность. Полученные нами отрицательные результаты в опытах по гибридизации названных мутантов свидетельствуют о наличии у них двух типов стерильности.
В табл. 1 были приведены суммарные данные по расщеплению в потомстве пестролистных растений. Однако в некоторых пестролистных семьях имели место отклонения от нормального расщепления, заключающиеся прежде всего в полном отсутствии в потомстве летальных растений.
По современным представлениям, в основе расщепления пестролистных растений лежит рассортировка нормальных и мутантных пластид [36, 187, 252]. Исходя из этого, П. Михаэлис разработал теоретическую модель соматического расщепления для того, чтобы как-то объяснить случаи неменде- левского наследования у кипрея [218, 221]. Он нарисовал предполагаемую картину расщепления 5—5000 цитоплазматических гомологов в течение ряда последовательных клеточных делений после мутации одного из них. При случайном характере распределения плазмагенов для появления клеток только с мутантными элементами должна соблюдаться прямо пропорциональная зависимость между числом детерминантов и количеством клеточных делений. Однако при экспериментальной проверке этой модели оказалось, что она верна только при определенных допущениях.
Очень часто нормальное распределение цитоплазматических органелл нарушается в силу различных обстоятельств. В отличие от ядерного наследования при пластидном расщеплении не существует строго определенных числовых отношений. Отклонения от нормального расщепления могут выглядеть как отсутствие одного класса выщепенцев или как несоответствие между числовыми отношениями различных классов проростков и относительными размерами зеленых и мутантных тканей пестролистного растения.
При изучении пестролистного табака были отмечены необычные числовые закономерности — пестролистное растение продуцировало 1 зеленое и 500 белых проростков [129]. В опытах Р. Тильней-Бассетта [279] при скрещивании химерных растений пеларгонии с зелеными доля пестролистных проростков в некоторых случаях была гораздо ниже ожидаемой. Эти примеры свидетельствуют о том, что рассортировка органелл не случайна.
49
Между нормальными и мутантными пластидами существует конкуренция. Особенно убедительны результаты Ф. Шетца, Полученные при скрещивании 27 видов и рас энотеры с двумя мутантными формами [259]. Обычно мутантные цитоплазматические детерминанты супрессивны, т. е. более активны и подавляют развитие нормальных гомологов. Описан случай «доминантной» мутации пластид, когда одна или несколько мутировавших органелл вызывают фенотипическое изменение всех остальных [218]. М. Родс [252] предположил, что отношение мутантных пластид к нормальным может определять фенотип клетки. Клетки с критически высоким процентом мутантных пластид содержат недоразвитые зеленые пластиды.
В меристематических клетках наблюдается равновесие между процентом делений нормальных и мутантных пластид и митотическим коэффициентом, что и обусловливает появление мозаичности [129, 296]. Таким образом, соматическое расщепление зависит от дифференциального деления нормальных и мутантных пластид и от подавления нормальных пластид мутантными. Все факторы, нарушающие равновесное состояние мозаичности, будут в той или иной степени вызывать отклонения от нормального расщепления.
По мнению Р. Тильней-Бассетта, выщепление зеленых или мутантных проростков происходит тогда, когда только один тип пластид сохраняет способность к размножению. В тех же случаях, когда оба типа сохраняют такую способность, появляется пестролистность. Нарушение расщепления в потомстве пестролистных растений может быть следствием повышенной летальности гомопластомных или близких к тому мутантных эмбриональных клеток, что, например, наблюдалось у пеларгонии и выражалось в повышении стерильности [279].
Вполне естественно возник вопрос — нельзя ли связать отклонения от нормального расщепления со стерильностью мутантов? Оказалось, что расщепление в семьях 2—22, 2—33, 2—48, 2—64 и 2—77, где генетическая обусловленность стерильности не вызывает сомнений, за некоторыми исключениями, характеризуется или отсутствием мутантных проростков, или их дефицитом [9]. О последнем можно судить на основании того, что мутантные ткани пестролистных растений составляют от 1/4 до 1/2 всей площади листьев, а числовые отношения при расщеплении не дают такой пропорции.
Обращают на себя внимание отрицательные результаты, полученные при гибридизации мутантов 2—22, 2—33, 2—48 и 2—77 с зелеными растениями. Если мутантная ткань у этих пестролистных растений в конечном итоге стерильна и не дает потомства не только при самоопылении, но и при гибридизации с зелеными растениями, то непонятно, почему все же при самоопылении в потомстве растений из этих линий появляются хлорофилльные летали. Приходится допустить, что мутантные клетки пестролистного растения, дающие начало генеративным, отличаются от таковых в мутантных тканях привоя.
Данные табл. 12 позволяют внести некоторую ясность в этот вопрос. У мутантов 2—64 и 2—87, где получено достаточное число цветущих привоев, обнаружено расщепление по признаку стерильности. Около 40% привоев 2—64 и более 60% всех привоев 2—87 оказались полностью стерильными. Остальные существенно варьируют по плодовитости, что обусловлено частичной стерильностью в пределах одного соцветия. Необходимо отметить, что соцветия мутантных привоев состоят из 60—80 трубчатых цветков. Другими словами, вариабельность этого признака не столь велика, так что 50
мы не допустили большой ошибки, представив в таблице абсолютные, а не относительные значения числа семянок на привой. Во всяком случае закономерность просматривается достаточно четко — мутантные растения по плодовитости, а следовательно по проявлению стерильности, образуют подобие вариационного ряда.
Таблица 12
Плодовитость мутантных привоев 2-64 и 2-87
Число семянок на привой
Число привоев 2-64
Число привоев 2-87
абсолютное
%
абсолютное
%
0
21
39,6
И
61,1
1-10
12
22,6
3
16,6
11-20
12
22,6
2
11,1
21-30
2
3,8
1
5,6
31-40
2
3,8
0
0,0
41-50
3
5,7
1
5,6
51-60
0
0,0
0
0,0
61-70
0
0,0
0
0,0
71-80
1
1,9
0
0,0
Факты расщепления плазмона отмечались ранее [218]. П. Михаэлис, исследовав это явление на кипрее, отметил две важные причины расщепления — неравное распределение цитоплазматических органелл в течение митоза и различную частоту репродукции разных частиц плазмона. Вероятно, из-за сниженной степени размножения мутантных пластид в пределах гомопластомного растения их число в ряду последовательных клеточных делений может уменьшаться. На такую возможность указывают некоторые факты. Число пластид в белых мутантных тканях пеларгонии ниже (26± ±1,2), чем в нормальных зеленых тканях, где оно равно 38±2,3 [126].
Число мутантных пластид может снижаться настолько, что достигает уровня, при котором проявляется стерильность. Если учесть, что механизма точного и равного распределения цитоплазматических органелл по дочерним клеткам не существует, то станет очевидным, что клетки одного растения, в данном случае мутантного привоя или мутантной ткани, могут различаться по числу органелл и, следовательно, обладать различными наследственными потенциями. Ранее П. Михаэлис указал на ступенчатый и градуированный характер расщепления плазмона [218]. Данные табл. 12 убедительно подтверждают это положение. Полученное расщепление напоминает расщепление при полигенном наследовании.
Кроме того, одной из причин, уменьшающих число мутантных органелл, а иногда и вовсе их устраняющих, является усиление автолитических процессов в мутантных тканях [39]. Доказано, что интенсивная вакуолизация цитоплазмы может происходить не только в соматических тканях, но и в период первой профазы мейоза в материнской клетке мегаспор [212].
Известно, что при истощении питательной среды у растений наблюдается интенсификация этих процессов, выражающаяся в громадном увеличении вакуолярного аппарата, который функционально эквивалентен лизосомам животных [16]. В центральной вакуоле растительной клетки обнаружены 51
многие гидролитические ферменты. Доказано, что в мутантных участках пестролистных растений содержание редуцирующих сахаров является очень низким — в 3—23 раза ниже, чем в соседних зеленых тканях, и в 5—35 раз ниже по сравнению с исходной зеленой линией 3629 [39]. Дефицит питательных веществ, обусловленный внутренними причинами, приводит к усилению автолитических процессов. В мутантных тканях наблюдается очень сильная вакуолизация, крайнего выражения этот процесс достигает в случае, когда вакуоль занимает всю клетку, а находящиеся в ней органеллы подвергаются лизису.
Биологический смысл усиления автолитических процессов заключается в попытке поддержания на должном уровне внутриклеточного метаболизма путем расщепления собственных структурных компонентов и последующего использования продуктов расщепления в качестве строительного и энергетического материала [37]. Можно утверждать, что хлорофилльные мутанты высших растений вполне могут использоваться для исследования процессов внутриклеточного автолиза и механизмов их регуляции.
Таким образом, стерильность мутантных тканей может быть одной из возможных причин, извращающих картину расщепления при внеядерном наследовании.
§ 2. О возможном влиянии пластид на функциональную активность ядерных генов
У пластомных пестролистных мутантов исследовали изоферменты пероксидазы [6]. Известно, что пластиды являются составной частью общей окислительной системы клетки. В хлоропластах обнаружены многие окислительные ферменты, в них происходит перенос электронов, сопряженный с образованием макроэргических связей [80].
Очень часто нарушения окислительного обмена сопровождаются изменением пероксидазной активности [80]. Мы предположили, что вследствие пластидной мутации окислительный обмен клетки в той или иной степени нарушается, что должно сопровождаться соответствующими изменениями активности пероксидазы. Поскольку фермент представлен в клетке набором изоферментов, т. е. белков с идентичной функцией, но с разными макромолекулярными характеристиками [97], не исключено, что предполагаемая биохимическая особенность мутантного пластома могла быть связана с качественными изменениями пероксидазного спектра.
Вначале изучался изоферментный спектр у летальных проростков, вы- щепляющихся в потомстве пестролистных растений. Было включено в исследование два мутанта —2—33 и 2 — 69. Первый из них, интенсивно желтого цвета, погибает через 4 — 5 дней после всходов. Мутант 2—69, хотя и является летальным (срок жизни 7 — 9 дней), имеет желто-зеленую окраску и непосредственно перед гибелью обесцвечивается.
Установлено, что изозимные спектры в корнях как мутантов, так и исходной линии 3629 качественно не отличаются друг от друга и состоят из четырех интенсивно окрашенных, различной мощности полос. В первой паре настоящих листьев зеленой линии пероксидазная зимограмма выглядит иначе, чем в корнях,— исчезают две полосы и появляется новый, довольно четко фиксируемый изозим [6]. Одно из основных положений генетики 52
развития, утверждающее, что каждая ткань имеет свой набор изоферментов [51], проявляется в данном случае очень наглядно.
Пероксидазные спектры листьев мутантов также существенно отличаются от набора изоферментов корней. Значительные различия имеются и между мутантами. Если зимограмма листьев мутанта 2—69 очень близка к контрольной, то таковая в листьях мутанта 2—33 характеризуется большим числом изоферментов (рис. 9). Это происходит за счет того, что наряду с появлением новых полос, характерных для листьев контроля, сохраняют активность изозимы, имеющиеся в корнях.
Рис. 9. Изоферментный спектр пероксидазы у пластомных мутантов: I — линия 2-33; II — линия 3629; III — линия 2-69
Проведенный анализ показал, что мутантный пластом 2 — 33 может оказывать существенное влияние на изоферментный спектр пероксидазы. По53
скольку мутанты 2—33 и 2 — 69 являются леталями с различными сроками жизни, естественно, что в них по-разному протекают предшествующие гибели растения деструктивные процессы, которые, вероятно, могут видоизменять действие мутантных пластид.
В этом плане определение изозимного спектра в мутантных участках листьев пестролистных растений является более четким. На рис. 10 представлена схема электрофореграмм изозимов пероксидазы мутантных участков листьев пестролистных семей 2 — 24, 2—32, 2—69 и 2 — 77, определенных в различные фазы развития растений.
Рис. 10. Схема электрофореграмм изозимов пероксидазы в мутантных тканях: а — 5-6 пара листьев; б — 7-8 пара листьев (бутонизация); в — 9-10 пара листьев (цветение)
В процессе развития растения происходят строго определенные изменения клеточного метаболизма, касающиеся прежде всего активности ферментов и направленности их действия [32]. В справедливости этого лишний раз можно убедиться, если рассмотреть зимограммы пероксидазы листьев линии 3629 на различных фазах развития. Изофермент с относительной электрофоретической подвижностью (ОЭП) 0,05—0,06 обнаруживается в момент цветения. Заметим, что этот изозим наблюдался в корнях и отсутствовал в первой паре настоящих листьев. В фазу бутонизации начинают проявлять активность изозимы с ОЭП 0,13—0,14 и ОЭП 0,49—0,50.
Пероксидазный спектр мутантных тканей листа отличается, и порой довольного резко, от набора изоферментов у исходной линии — появляются новые полосы и увеличивается их число. В зеленой части листа пестролистного растения подобной картины не наблюдалось. По набору изоферментов эти ткани незначительно — не более чем одной полосой — отличаются от линии 3629. Вероятно, эти небольшие отличия обусловлены воздействием мутантной части листа на нормальную. Интересно, что они сохраняются 54
в зеленых проростках, выщепляющихся в потомстве пестролистных растений (см. рис. 9).
Полученные результаты показали, что пластидная мутация вызывает изменения спектра пероксидазных ферментов. Следует отметить, и это особенно важно, что пероксидазные белки кодируются ядерной наследственной информацией [263]. Отсюда вполне вероятно, что пластогены могут оказывать существенное влияние на активность ядерных генов, что пластиды могут выступать как регуляторы внутриклеточного метаболизма.
Известно, что отличия изоферментов друг от друга полностью определяются четвертичной структурой [97]. Ферменты являются полимерами, варьирующими по молекулярной массе из-за различной степени агрегации фермента в клетке и вследствие присоединения к ферменту низкомолекулярных веществ и т. д. Внутриклеточные условия могут обусловливать различные эпигенетические изменения структуры фермента, вследствие чего число полос в спектре может увеличиваться [51].
Таким образом, наблюдаемые по изозимному составу различия между мутантными и нормальными тканями могут определяться как генетическими причинами (изменением активности генов), так и эпигенетическими причинами (влиянием внутриклеточных условий на четвертичную структуру фермента).
Можно предположить, что появление некоторых полос в ряде случаев обусловлено эпигенетическими причинами. Так, в листьях мутантного проростка 2 — 33 и в мутантных тканях листа семьи 2 — 77 в момент цветения изозим с ОЭП 0,05—0,06 дробится, образуя две полосы, а изозимы с ОЭП 0,40 и с ОЭП 0,49—0,50 у 2—77 и 2 — 32 в момент цветения обнаруживают большую электрофоретическую подвижность, что может быть связано с изменением их молекулярной массы [6].
Несмотря на трудности в интерпретации полученных данных, нам хотелось бы обратить внимание на следующее очень важное обстоятельство. Изозим с ОЭП 0,05—0,06, появляющийся у линии 3629 в момент цветения, обнаруживается у мутанта 2 — 24 раньше — в период образования корзинки, а у мутанта 2 — 77 еще раньше — в фазу 5 — 6 пары листьев. Изозимы с ОЭП 0,13—0,14 и ОЭП 0,49—0,50 у мутантов 2 — 2,4, 2 — 32 и 2 — 69 появляются также в более ранние этапы развития, чем у исходной линии. И наконец, наиболее наглядный случай — полное совпадение пероксидазных спектров в листьях линии 3629 в момент образования корзинки и в стадии 5—6 пары листьев у мутанта 2 — 32.
Эти факты дали основание предположить, что мутантный пластом может выступать как фактор, ускоряющий ход закономерных изменений клеточного метаболизма, наблюдаемый в процессе развития растения. Естественно, что высказанное предположение требовало дальнейших экспериментальных подтверждений. Для обоснования этого предположения мы обратились к такому известному ферменту, как β-галактозидаза.
Этот выбор не был случайным. Во-первых, мы исходили из того, что изменения хлоропластов, где в качестве первичных фотосинтетических продуктов образуется глюкоза, должны существенно влиять на углеводный обмен всей клетки, в том числе отразиться на уровне активности этого фермента. Во-вторых, β-галактозидаза явилась тем ферментом, с использованием которого на Escherichia coli были открыты механизмы регуляции генной активности [56]. Третье достоинство фермента выяснилось в процессе про55
ведения работы. Оказалось, что в отличие от пероксидазы, которая у подсолнечника имеет несколько изоферментов, β-галактозидаза не разделяется на изоформы, а локализуется только в одной зоне с ОЭП 0,31—0,32 в щелочной системе (pH 6,9) и ОЭП 0,25—0,26 в кислой системе (pH 4,3).
Подвижность растворимой β-галактозидазы как в мутантных тканях, так и нормальных на всех этапах развития растения полностью совпадает [7]. Наличие одной молекулярной формы этого фермента дает возможность по увеличению активности однозначно судить об изменении функциональной активности ядерных генов, кодирующих субъединицы галактозидазного белка-фермента.
Результаты определения β-галактозидазной активности в мутантных тканях пестролистного растения приведены на рис. 11. Достаточно хорошо видно, что активность фермента обнаруживается по всем изученным фазам развития растения как в контрольной линии, так и в мутантных тканях. Обращает на себя внимание то, что уровень удельной активности фермента в мутантных участках пестролистных растений, исключая фазу цветения, значительно выше, чем у исходной линии. Этот факт полностью согласуется с данными, полученными при изучении пероксидазной активности в мутантных участках пестролистного растения.
Рис. 11. Активность β-галактозидазы в тканях пластидных мутантов: 1 — линия 3629; 2 — мутант 2-7; 3 — мутант 2- 24; I — 3-4 пара листьев;
II — 5-6 пара листьев;
III — 7-8 пара листьев;
IV — поздняя бутонизация; V — цветение
Изменение активности изучаемого фермента в процессе вегетации носит волнообразный характер, особенно четко наблюдаемый в мутантных участках пестролистных растений. Здесь в 3—4 и 7—8 парах листьев обнаружена наибольшая активность фермента, в то время как в 5—6 парах и бутонизации отмечен спад ферментативной активности. Точки наивысшей и наименьшей активности фермента у мутантов и у контрольных растений не совпадают. Это свидетельствует о том, что изменение ферментативной активности не определяется погодными условиями, а является внутренним свойством растения.
Сейчас общепринято, что волнообразные колебания метаболических процессов во времени являются не исключением, а правилом [105]. Однако, 56
как показывают результаты, изменения галактозидазной активности во времени у нормы и в мутантных тканях происходят по-разному. Если у линии 3629 наивысшая активность фермента обнаруживается в фазе цветения, то в мутантных тканях пик активности достигается раньше. Мы считаем, что эти данные подтверждают высказанное выше предположение о способности мутантных пластид ускорять закономерный ход развертывания метаболических процессов в онтогенезе.
Исходя из общих положений о целостности клетки как функциональной системы, мы предположили возможное влияние пластид на функциональную активность ядерных генов. Примечательно, что пестролистные пластомные мутанты подсолнечника оказались исключительно удобной моделью для доказательства этого положения. В самом деле, химерный лист, находящийся на одном растении, состоит из различных типов тканей, различающихся пластомом и имеющих одинаковый генетический материал ядра.
Предпринятое нами изучение активности пероксидазы и β-галактозидазы и их изозимного спектра в мутантных бесхлорофилльных тканях показало, что ферментативная активность в результате мутации пластид может увеличиваться, а спектр изоферментов изменяться. Следует учесть, что данные ферменты кодируются ядром [263, 271]. Это значит, что функциональная активность ядерных генов в ином пластидном окружении может меняться.
В последнее время стали появляться работы, показывающие наличие цитоплазматического контроля экспрессии генов у высших растений. Наличие такого контроля обнаружено в отношении структурных генов фосфодиэстеразы у пшеницы [292]. Авторы ставят вопрос о существовании контролирующих факторов в цитоплазме.
Поскольку в мутантных тканях нарушен синтез глюкозы [39], мы полагаем, что для объяснения повышения активности ферментов в бесхлорофилльных участках можно привлечь широко известный феномен репрессии генов β-галактозидазы продуктами метаболизма, в частности глюкозой [56]. Известно, что чем ниже количество глюкозы в клетке, тем выше активность ферментов, участвующих в расщеплении углеводов. Вероятно, уменьшение содержания глюкозы оказывает определенное влияние и на состояние окислительного обмена клетки, что проявляется в изменении спектра пероксидаз.
Полученные данные — появление некоторых изоферментов пероксидазы в более ранние фазы развития у мутантов, более раннее достижение пика активности β-галактозидазы в мутантных тканях — свидетельствуют о том, что мутантный пластом может ускорять закономерное течение процессов метаболизма в ходе развития растения.
Дать какое-либо объяснение вскрытому факту очень трудно. Можно лишь отметить, что в литературе описаны цитоплазматические мутации, ускоряющие наступление старения у ряда организмов [90]. Вероятно, роль цитоплазмы в ускорении развития организма довольно значительна. Как указывает Г. Д. Бердышев [17], цитоплазматические факторы могут регулировать различные генетические процессы, в том числе и репликацию генетического материала со всеми вытекающими отсюда последствиями.
§ 3. Устойчивость пластидных мутантов к НММ
Совместно с Е. К. Разорителевой мы провели исследование сравнительной устойчивости к НММ инбредной зеленой линии 3629, ряда пластидных мутантов chlorina, одного ядерного мутанта такого же фенотипа и зеленой 57
линии 2—32, выщепляющейся в потомстве соответствующей пестролистной формы (табл. 13). Выяснилось, что НММ индуцирует у всех используемых линий небольшое количество аберраций, достоверно отличающееся от частоты естественной изменчивости. Для en-xantha-1 t=2,3, Р=0,97, для еп- chlorina-1 t= 2,8, Р=0,99, во всех остальных вариантах t>>3,2 и Р= 0,999.
Таблица 13
Частота аберраций хромосом, индуцируемых НММ (0,04%) у различных мутантных линий (аэробные условия обработки при 25°С)
Линия
Вариант
Число анафаз
Количество перестроек, %
всего
с перестройками
3629
Опыт
1521
91
6,0±0,6
Контроль
803
6
0,7±0,3
en-chlorina-1
Опыт
873
19
2,2±0,5
Контроль
767
5
0,6±0,3
en-chlorina-7
Опыт
991
29
2,9±0,5
Контроль
742
6
0,8±0,3
en-xantha-1
Опыт
739
16
2,2±0,5
Контроль
461
3
0,7±0,3
n-chlorina-1
Опыт
959
53
5,5±0,7
Контроль
592
9
1,5±0,5
2-32, зеленая
Опыт
706
52
7,4±1,0
Контроль
656
6
0,9±0,4
Вскрыты резкие различия в чувствительности к мутагену использованных в опыте мутантов. В отличие от исходной линии 3629, где уровень перестроек достиг 6,0%, при обработке пластомных мутантов en-chlorina-1, en- chlorina-7, en-xantha-1 НММ показала значительно меньшую аберрационную активность. Статистическая значимость снижения активности не вызывает сомнений (t=3,9 и более, Р= 0,999). Особенно поразительные данные получены для мутанта en-xantha-1, который является летальным и в гомо- пластомном состоянии может разводиться лишь при помощи прививок.
Мутант n-chlorina-1 по частоте индуцированных перестроек не отличается от линии 3629. Однако надо обратить внимание на более высокий уровень естественной мутабильности у данного мутанта, при котором следовало бы ожидать и более высокого числа индуцированных перестроек. Вероятно, у мутанта n-chlorina-1 имеется какой-то механизм, обеспечивающий хотя и не в такой степени, как у пластидных мутантов, защиту от НММ. Этот механизм также может быть связан с пластомом, так как генетический анализ взаимодействия ядра и пластид показывает, что ядерные гены существенно влияют на структуру и функции хлоропластов [187]. Линия 2—32, зеленая, оказалась неустойчивой к НММ (см. табл. 13), хотя она выщепи- лась, как это следует из ее названия, из соответствующей пестролистной формы, полученной в результате обработки НММ.
Таким образом, приведенные данные свидетельствуют в пользу того, что обнаруженная устойчивость мутантов en-chlorina-1, en-chlorina-7 и en- xantha-1 к мутагену обусловлена именно мутационными изменениями пла- 58
стогенов. Еще более убеждают в этом данные по выживаемости растений Mi после обработки НММ.
Выживаемость пластомных мутантов при действии 0,02%-ной НММ значительно выше (67,0—85%), чем зеленой линии 3629 и ядерного мутанта (0,0—3,0%). Семянки инбредной линии 3629, обработанные НММ в концентрации 0,04%, погибают полностью. Выживаемость же пластомных мутантов в аналогичных условиях достигает 2% (en-chlorina-1) и 16% (en-chlo- rina-7).
§ 4. Пластом и адаптация растений к засухе и засолению
Проблема засухо- и солеустойчивости в настоящее время приобретает особое значение в связи с возросшей необходимостью использования засоленных почв и земель, лежащих в зоне недостаточного увлажнения. Для решения проблемы как в теоретическом, так и в прикладном аспектах очень важно выявление или получение форм, характеризующихся повышенной резистентностью к этим факторам. На их основе можно было бы создавать засухо- и солеустойчивые сорта, и они могли бы использоваться как модели для выяснения механизмов устойчивости.
Известно, что большое значение в определении засухоустойчивости придается хлоропластам, их водоудерживающей способности [27, 89]. На этом были основаны исследования по оценке устойчивости пластидных мутантов подсолнечника к засухе. Пользуясь тем, что' в последние 6—7 лет на территории Ростовской области наблюдалось чередование засушливых и обычных по метеоусловиям лет, мы провели сравнительный анализ устойчивости двух мутантов, один из которых, а именно en-chlorina-5, показал повышенную резистентность к данному фактору. Оценка засухоустойчивости, что особенно ценно, проведена в полевых условиях, так как, согласно П. А. Генкелю [27], только в этом случае можно получить наиболее объективные результаты.
Как видно из табл. 14, под действием засухи наблюдается снижение высоты растений как мутантов en-chlorina-З и en-chlorina-5, так и исходной линии. Независимо от генетической природы растения выявлена однозначная реакция, поскольку высота растений во всех трех вариантах в неблагоприятные годы достоверно (Р>0,999) снижалась примерно на 10%.
Определение содержания зеленых пигментов было проведено в течение вегетации дважды. Известно, что этот показатель в процессе развития растения изменяется [262]. Как и ожидалось, количество пигментов в обычные годы во всех вариантах в фазу бутонизации возрастает. Особенно это заметно у мутанта en-chlorina-5, где повышение является более чем двукратным (с 2,5—2,57 мг/г до 5,56—5,99 мг/г).
Иное положение складывается в засушливые годы. У линии 3629 в фазу бутонизации происходит снижение содержания зеленых пигментов. Так, в 1983 г. оно уменьшилось с 8,69 мг/г в фазе 3—5 пары листьев до 5,5 мг/г. Такая же картина отмечается у мутанта en-chlorina-3. У мутанта же en-chlorina-5 в засушливых условиях количество хлорофилла в процессе развития растения или продолжает возрастать (1981 г.), или существенно не меняется (1983 г.). Тем не менее общее содержание хлорофилла у мутанта en-chlo- rina-5 в фазу бутонизации, определявшееся в экстремальных условиях, все же ниже, чем у линии 3629.
59
Кроме того, при сравнении данных контрастных лет видно, что в засуху количество зеленых пигментов у мутанта en-chlorina-5 все-таки снижается. Степень этого снижения различна — в 1983 г. оно было более значительным, чем в 1981 г. В 1981 г. у мутанта en-chlorina-3 снижения содержания пигментов в фазу бутонизации не наблюдалось, в то время как в 1983 г. оно уменьшилось на 30%. Это объясняется тем, что условия засухи 1983 г. были более жесткими, чем в 1981 г. Достаточно отметить, что в 1983 г. в период с 7 мая по 14 июля не выпало ни одного дождя при средних температурах мая —18,2 °C, июня —20,4 °C, июля —24,8 °C. Всего же за период вегетации подсолнечника в этом году выпало 103,6 мм осадков. В 1981 г. количество осадков составило 142,3 мм при средних температурах мая —16,3 °C, июня- 24,1 °C, июля —25,1 °C. Для сравнения, в оптимальном 1982 г. за период вегетации подсолнечника выпало 258,9 мм осадков при средних температурах мая —16,1 °C, июня —18,8 °C, июля —21,2 °C.
Таблица 14
Влияние засухи на некоторые показатели жизнедеятельности пластидных мутантов
Год опыта
Линия
Высота растений, см
Содержание зеленых пигментов, мг/г сухого веса
Масса семянок на растение, г
в 3-5 паре листьев
в бутонизацию
1980
3629
138,2± 1,4
8,35
9,46
41,9±1,5
en-chlorina-5
103,7±l,0
2,50
5,56
22,8±1,6
en-chlorina-3
113,6±0,9
3,64
4,03
16,4±0,7
1981, засуха
3629
123,2±1,2
7,89
5,68
24,6±1,8
en-chlorina-5
91,7±1,3
2,81
4,59
21,4±2,0
en-chlorina-3
98,8±1,3
6,90
4,66
13,1±0,7
1982
3629
132,3±1,4
6,51
9,02
42,6±1,6
en-chlorina-5
105,6±l,l
2,57
5,99
23,7±1,7
en-chlorina-3
112,7±0,9
3,36
3,90
17,8±0,6
1983, засуха
3629
120,7±l,3
8,69
5,50
22,7±1,7
en-chlorina-5
93,2 ±1,2
3,43
3,68
18,4±1,4
en-chlorina-3
96,4±1,2
3,81
2,86
9,1±1,4
Главным итоговым показателем устойчивости растений к засухе является их урожайность в этих условиях. Мутант en-chlorina-5 лишь в 1983 г. примерно на четверть снизил свою продуктивность, в то время как в 1981 г. масса семянок с одного растения почти не отличалась от такого же показателя в обычные годы. Между тем урожайность инбредной линии 3629 в засушливые годы снижается почти вдвое, что не является удивительным, так как известно, что от перенесенной засухи подсолнечник может терять до 50% своего урожая [27]. У мутанта en-chlorina-3 в 1983 г. продуктивность также снижается почти вдвое, а в 1981 г.— на 20%.
Таким образом, по продуктивности растений мутант en-chlorina-5 характеризуется более высокой по сравнению с линией 3629 и мутантом en-chlo- 60
rina-3 устойчивостью к засухе. Несмотря на это, по абсолютному показателю продуктивности en-chlorina-5 в засуху в лучшем случае лишь приближается к продуктивности инбредной линии, что говорит о невозможности непосредственного использования мутанта в практических целях.
Среди пластидных хлорофилльных мутантов подсолнечника Н. И. Шевяковой были выделены мутантные линии, и в первую очередь en-chlorina-3, характеризующиеся повышенной сульфатоустойчивостью [110]. Для оценки использовались следующие критерии: интенсивность накопления растениями биомассы, степень аккумуляции в тканях солей и изменения в содержании натрия и серы.
Мутант en-chlorina-З в условиях засоления превысил по продуктивности исходную линию. Мутация в пластидном геноме en-chlorina-З привела к изменению механизмов, регулирующих поступление в растение натрия и серы. Значение этой работы невозможно недооценить. Вполне вероятно, что повышенная устойчивость подобных мутантов к НММ определяется изменением проницаемости клеточных и органелльных мембран.
Полученные данные показали, что хлоропластный мутагенез вполне может использоваться в практических целях для индукции форм с повышенной устойчивостью к экстремальным воздействиям.
§ 5. Механизмы резистентности к стрессовым факторам
Мутанты для генетиков всегда представляли прекрасную модель для решения проблемы «ген — признак». В этом плане не составляют исключения и цитоплазматические мутации устойчивости. Однако их ценность возрастает в связи с тем, что биогенез и функционирование пластид и митохондрий находятся под двойным ядерно-органелльным контролем. Поэтому анализ таких наследственных изменений дает возможность выявлять, кроме механизмов устойчивости, различные стороны органелльно-ядерных взаимоотношений, устанавливать структурные компоненты органелл, кодируемых собственной наследственной информацией [58, 164].
Оказалось, что антибиотикоустойчивость у хламидомонады определяется состоянием белоксинтезирующей системы хлоропластов [90, 151, 215, 257]. Выяснено, что резистентность к стрептомицину, неамицину и спектиноми- цину зависит от структуры малой субъединицы пластидных рибосом, а к эритромицину — большой субъединицы [151].
Наличие устойчивых к антибиотикам мутантов различной генетической природы свидетельствует о том, что биогенез рибосом органелл находится под двойным контролем. Углубленное изучение белков рибосом мутантов различных типов даст возможность решить вопрос о генетической определенности того или иного белкового компонента. Если же учесть, что одним из механизмов солеустойчивости растения является изменение белкового состава рибосом [102], не исключено выявление цитоплазматических мутантов устойчивости к засолению.
Доказано, что мишенью и центром связывания большинства гербицидов в мембранах хлоропластов является полипептид с молекулярной массой 32 кД [138]. Этот пептид кодируется пластидной ДНК, и место Гена, определяющего его структуру, точно определено на пластидной хромосоме [165, 166]. Изменение структуры данного пептида, наследуемое по материнской линии, определяет устойчивость к гербициду.
61
Изменение проницаемости клеточной и органелльной мембран может также обеспечивать устойчивость организма к химическим соединениям. Таким путем обусловливается цитоплазматическая устойчивость к антибиотикам у эвглены [230]. Индуцированный нами мутант en-chlorina-3 показал повышенную сульфатоустойчивость за счет изменений механизмов, регулирующих поступление в растение натрия и серы [110].
Вообще мембраны, их белково-липидный состав играют важную роль в обеспечении устойчивости организма к стрессовым факторам [91]. Так, солеустойчивость часто определяется повышением кислотности белков клеточной стенки и мембран [102]. В регуляции ионной проницаемости клеточных мембран в специфических условиях засоления немаловажна роль липидов [195]. Мутации же, вызывая сдвиг в структуре липидно-белкового комплекса мембран, могут обеспечивать модификацию мембранной проницаемости. Доказано, что мембраны устойчивых и чувствительных к атразину растений ряда видов (при материнском характере наследования устойчивости) характеризуются различным качественным и количественным составом липидов [239].
Выяснено, что чувствительность клетки повышается при увеличении в мембранных липидах числа двойных связей, т. е. ненасыщенности этих компонентов [239]. Поскольку в хлоропластах происходит синтез липидов, естественно, что мутация, в том числе и пластидная, может приводить к изменению количества и качества этих соединений в мембранах. Так как ферменты синтеза липидов локализованы в строме хлоропласта, нарушение его ультраструктуры и уровень липидного синтеза тесно связаны между собой [118].
Заслуживает внимания аспект, не имеющий непосредственного отношения к проблеме устойчивости. Приведенные факты показали, что вне- ядерная наследственная система играет важную роль в организации мембран органелл и клеточной стенки. Без использования мутантов выяснить это влияние очень трудно [139].
Остановимся вкратце на одной общей причине, которая может лежать в основе устойчивости, независимо от того, определяется это свойство ядер- ной или цитоплазматической наследственной системой. Существует теория «неполной среды», которая удовлетворительно объясняет ряд случаев устойчивости к инфекционным заболеваниям. Суть ее состоит в том, что мутация, выключающая синтез любого вещества, входящего в состав необходимой для жизнедеятельности паразита минимальной среды, обеспечивает иммунитет организма к заболеванию, вызываемому этим возбудителем. Эта теория прекрасно иллюстрирует противоречивость мутаций — теряя одно, организм приобретает другое [ИЗ]. Нетрудно убедиться, что этот принцип зачастую имеет место и при определении устойчивости к экстремальным воздействиям.
Устойчивость к антибиотику есть результат отсутствия или изменения специфических белков рибосом пластид, в результате чего соединение химического агента с рибосомой становится невозможным [151]. При этом изменяется способность к белковому синтезу, но клетка может остаться жизнеспособной и даже без видимых фенотипических последствий. Так, у стрепто- мицинустойчивого мутанта табака, внешне не отличимого от нормы, обнаружено изменение подвижности некоторых рибосомальных белков [182].
Известно немало случаев, когда мутации устойчивости являются одно62
временно и фотосинтетическими. Это показано для стрептомицинустойчи- вых мутантов эвглены [151], устойчивых к диурону мутантов Chlamydomo- nas [274]. Связь между изменениями в составе белков пластидных рибосом и нарушением пигментации показана на примере желтых мутантов хламидомонады у-27 и у-28 [114].
Устойчивые к гербициду растения крестовника имеют уменьшенную на 20% скорость фотосинтеза по сравнению с чувствительными. Выделение кислорода изолированными хлоропластами при освещении непрерывным светом в два раза выше у неустойчивых растений. Модификация пептида, связывающего гербициды, придавая устойчивость к ним, делает транспорт электронов в окислительной цепи ФС II менее эффективным [178].
Замечено, что засухоустойчивые растения менее продуктивны, чем неустойчивые. Компенсировать это снижение урожайности засухоустойчивых растений в обычных условиях их большей продуктивностью в условиях засухи не всегда удается. Поэтому экономически выгоднее получать выигрыш в урожайности неустойчивых сортов, реализуемый в благоприятные годы [45].
Устойчивость к НММ, засухе и засолению у пластомных мутантов подсолнечника, индуцированных этим же агентом, сопровождается пониженным по сравнению с исходной линией содержанием зеленых пигментов и низкой продуктивностью. Эти данные являются хорошей иллюстрацией противоречивости мутаций. Наследственные изменения пластид, вызывая их структурно-функциональные дефекты, приводят к снижению продуктивности растений и одновременно определяют повышение устойчивости.
Таким образом, устойчивость может определяться наследственно обусловленной утратой или таким изменением структурных компонентов клетки, которое снижает уровень ее функциональной активности. Такова «плата» организма за возможность адаптации.
Однако мы далеки от мысли сводить все случаи устойчивости к одному принципу. Степень адаптации к неблагоприятным воздействиям может определяться, например, интенсивностью репарационных процессов в период последействия или быстрой перестройкой метаболизма в стрессовых ситуациях. Но и в этом случае роль пластид и митохондрий достаточно важна. Эти органеллы являются главными составными частями общей окислительной системы клетки [80].
Известно, что в стрессовых ситуациях наблюдается повышение активности процессов окисления с целью обеспечения клетки энергией [91]. Очевидно, высокая способность цитоплазматических органелл сохранить свои специфические функции вопреки действию экстремальных факторов может также определить устойчивость организма. На это указывают, в частности, особенности засухоустойчивых пшениц, приспособленных к жесткой почвенной засухе, сопровождающейся высокой температурой и низкой относительной влажностью воздуха. Для таких пшениц характерно сохранение высокой эффективности фотосинтетических процессов в условиях засухи [27].
Заключение
Полученные нами результаты доказали, что N-нитрозо-N-метилмочевина (НММ) является мутагеном, используя который можно получать до 60%, а в некоторых случаях и больше, пластидных мутаций у подсолнечника. Возможность индукции пластидных мутаций у высших растений показана пока на сравнительно небольшом количестве растительных объектов. Тем не менее открытие агента, действующего на геном хлоропластов, представляется нам очень важным. В связи с этим актуальны, несмотря на их трудоемкость, исследования с целью индукции пластидных мутаций у возможно большего количества видов растений.
Ряд физико-химических свойств НММ (способность к комплексообразованию, склонность к связыванию липидами) обусловливает мутагенную специфичность агента, проявляющуюся в индукции пластидных мутаций у ряда растительных объектов. Вероятно, наиболее полно способность НММ индуцировать пластомные мутации может реализовываться у растений, особенности которых предоставляют возможность проявления в Ьолном объеме тех свойств мутагена, которые определяют его специфичность. В связи в этим, по нашему мнению, индукция пластомных мутаций у масличных растений не должна представлять особых затруднений.
Важно то, что первичные повреждения генетического материала пластид очень быстро репарируются и что превращение потенциальных изменений пластогенов в истинные мутации происходит в момент синтеза генетического материала. Это имеет неоспоримое значение для индукции пластидных мутаций, позволяя при помощи ряда модификаторов добиваться лучших практических результатов.
Как отмечалось выше, в результате действия мутагена возникают первичные изменения, для превращения которых в потенциальные необходима репликация генетического материала. В процессе репликации в дочерних участках ДНК напротив первичных повреждений образуются пробелы, которые, являясь потенциальными изменениями, в дальнейшем могут либо застраиваться, либо реализовываться в мутации в ходе последующей репликации.
Полученные данные доказывают, что первичные повреждения эффективно и быстро репарируются. Полное устранение повреждений, и в этом нет никаких сомнений, осуществляется механизмами дорепликативной репарации. Достаточной же четкости в доказательстве того, что репарация пластидного генетического материала происходит на уровне застройки пробелов, пока нет. В связи с этим использование ингибиторов пострепликативной репарации, задерживающих или предотвращающих заполнение пробелов, как модификаторов пластидного мутагенеза представляется нам очень важным.
Конечно, решающую роль в установлении молекулярной природы индуцированных мутантов должно сыграть изучение физико-химических свойств ДНК мутантных пластид. Но эта работа, безусловно, очень сложна в техническом отношении и может сразу не дать каких-либо ощутимых результатов из-за отсутствия крупных преобразований в пластидной ДНК мутантов.
Индуцированные нами пластидные мутанты подсолнечника характеризуются сниженным, иногда значительно, содержанием зеленых пигментов, приводящим в худшем случае к летальности, в лучшем — к резкому уменьшению продуктивности — этого интегрального показателя жизнедеятельности растения. Накопленный в области индуцированного мутагенеза опыт показывает, что наряду с летальными мутациями или мутациями, понижающими жизнеспособность, должны, хотя и в значительно 64
меньшей степени, появляться мутации, приводящие к улучшению или усилению тех или иных признаков и свойств растения. Поскольку речь идет о хлоропластах, предполагается индукция форм с повышенной фотосинтетической активностью, с более высоким содержанием зеленых пигментов, более приспособленных к определенному агрофону и т. д.
Наследственные изменения такого рода выделить очень трудно. В данном случае визуальными наблюдениями не обойтись. Нужны разработка и использование трудоемких способов соответствующей оценки каждого растения и его потомства. Конечно, такая pà6oTa требует больших затрат времени и определенных усилий, но ее проведение необходимо не только в практических целях. Вне всякого сомнения, она расширит наши представления о мутационных возможностях НММ, даст более полную характеристику индуцированному НММ мутационному процессу в хлоропластах.
Полученные нами данные показали, что пластиды оказывают влияние на функциональную активность ядерных генов. Более того, было установлено, что некоторые изозимы пероксидазы (например, с ОЭП 0,5—0,06), которые появляются в зеленых тканях в момент цветения, в мутантных тканях обнаруживаются раньше — в фазу бутонизации или даже в условную фазу развития 5—6 пары листьев. Пик активности β-галактозидазы, которая не имеет у подсолнечника изоформ, в мутантных тканях достигается раньше, чем в нормальных. Это дало основание считать, что мутантный пластом может выступать как фактор, ускоряющий ход закономерных изменений метаболизма растения в процессе его развития.
Поскольку в мутантных тканях нарушен синтез глюкозы, мы полагаем, что для объяснения повышения активности ферментов в бесхлорофилльных участках можно привлечь широко известное явление глюкозного эффекта. Возможная роль глюкозы в регуляции многих процессов жизнедеятельности растения до конца еще не раскрыта. В последнее время появилось мнение, что эндогенная регуляция фотосинтетической активности хлоропластов и их адаптивных реакций в значительной мере определяется влиянием метаболитов на экспрессию генома хлоропластов.
Заслуживает внимания дальнейшее изучение автолитических процессов в тканях хлорофилльных мутантов. Кроме автофагии, осуществляющейся при помощи вакуо- лярного аппарата, существует микроавтофагия, которая предполагает лизис клеточных структур и органелл вне вакуолей. Этот тип фагии имеет, по-видимому, очень широкое распространение в органическом мире. Можно предполагать, что деградация пластид отцовского организма, обеспечивающая однородительское материнское наследование, происходит таким путем. Усиление автолитических процессов в мутантной ткани дает основание надеяться, что этот тип фагии будет в них обнаружен.
Еще одним направлением дальнейших исследований, имеющим как практическое, так и теоретическое значение, является улучшение хозяйственно ценных свойств устойчивых мутантов. Определенные результаты уже получены. При проведении этой работы нами и Е. К. Разорителевой было обнаружено, что ядерные гены могут супрессировать фенотипическое проявление пластидной мутации. У фенотипически зеленых гибридов устойчивость к стрессовому фактору сохраняется. Вероятно, ядерные гены-супрессоры восстанавливают поломку, вызванную пластидной мутацией, но не в полной степени. Выяснить механизм супрессии — задача будущих исследований.
Намеченная программа исследований очень трудоемка, но является перспективной и заслуживает внимания как естественное развитие и продолжение уже проделанной работы. Ее выполнение, на наш взгляд, будет иметь важное значение не только для пластидной генетики, но и для некоторых разделов физиологии растений и селекции.
65
Литература
1. Авратовшукова Н. Генетика фотосинтеза. М., 1980. 104 с.
2. Алекперов У. К. Особенности действия антимутагенов и перспективы их практического применения//Успехи современной генетики. М., 1979. Вып. 8. С. 168-181.
3. Б е з у г л о в В. К. Влияние внешних условий на первичные процессы транспорта электронов в фотосинтезе//Реактивность фотосинтетического аппарата. Казань, 1975. С. 10—34.
4. Белецкий Ю. Д. К проблеме искусственного получения нехромосомных мутаций//2-й съезд ВОГиС им. Н. И. Вавилова: Тез. работ. М., 1972. С. 35.
5. Белецкий Ю. Д. Роль внеядерной наследственной системы в определении устойчивости растений к экстремальным факторам среды//Изв. СКНЦ ВШ. Естеств. науки. 1985. № 1. С. 6 — 10.
6. Б е л е ц к и й Ю. Д., Карнаухова Т. Б. Изозимы пароксидазы у неядерных хлорофилльных мутантов подсолнечника//Генетика. 1975. Т. И. С. 19—23.
7. Белецкий Ю. Д., К е с с л е р P. М., Колоколова H. С. идр. Активность β-галактозидазы и β-глюкозидазы у внеядерных хлорофилльных мутантов под- солнечника//Там же. 1978. Т. 14. С. 1378—1392.
8. Белецкий Ю. Д., Лященко И. Ф. Генетическая природа некоторых жизнеспособных хлорофилльных мутаций подсолнечника//Там же. 1968. Т. 4. С. 180-181.
9. Белецкий Ю. Д., Разорителева Е. К. Неядерные мутации подсолнечника II. Летальные мутации из потомства неядерной пестролистности//Там же.
1974. Т. 10. С. 25-29.
10. Белецкий Ю. Д., Разорителева Е. К. Устойчивость к N-HHTpo3O-N- метилмочевине цитоплазматических хлорофилльных мутаций подсолнечника, индуцированных этим агентом//Там же. 1975. Т. И. С. 23—27.
11. Белецкий Ю. Д., Разорителева Е. К. Модификация мутагенного действия N-нитрозо-N-метилмочевины на пластиды подсолнечника. I. Влияние тем- пературы//Там же. 1978. Т. 14. С. 1799—1803.
12. Белецкий Ю. Д., Разорителева Е. К., Жданов ЮчА. Цитоплазматические мутации подсолнечника, индуцированные N-нитрозометилмочевиной// ДАН СССР. 1969. Т. 186. С. 1425-1426.
13. Белецкий Ю. Д., С и з о в а Л. И. Влажность хранимых после обработки N-нитрозо-N-метилмочевиной семянок подсолнечника и частота внеядерной пестролистности//ДАН СССР. 1977. Т. 237. С. 998-1000.
14. Белецкий Ю. Д., Сизова Л. И. Модификация цитоплазматического мутагенного эффекта N-нитрозо-N-метилмочевины у подсолнечника. II. Влияние 2,4-динитрофенола и рифампицина//Генетика. 1979. Т. 15. С. 506—509.
15. Белецкий Ю. Д., Щербакова Л. Б., Федоренко Г. М. Влияние N- нитрозо-N-метилмочевины на ультраструктуру пластид подсолнечника в М|//Цитология и генетика. 1981. Т. 15. С. 3—6.
16. Белицер Н. В. Вакуолярная система как лизосомальный аппарат растительной клетки//ДАН СССР. 1972. Т. 203. С. 211—213.
17. Бердышев Г. Д., Гал кин А. П. Роль обратных связей в системе ядерно- цитоплазматических отношений//Молек. генет. биофиз. 1984. № 9. С. 83—91.
18. Бил Дж., Ноулз Дж. Внеядерная наследственность. М., 1981. 168 с.
66
19. Бободжанов В. А., Красичкова Г. В., Сатторов А. и др. Фотохимическая активность хлоропластов и продуктивность мутантных форм томатов// ДАН Тадж. ССР. 1980. Т. 23. С. 398-401.
20. Вайль Ж. А., Мубумбила М., Кунц М. и д р. Картирование генов и определение структуры транспортных РНК хлоропластов различных фотосинтезирующих организмов//Молекулярная биология. 1983. Т. 17. С. 1147—1153.
21. Вак ли нова С. Г. Фотосинтез. Механизмы и регуляция. София, 1981. 163 с.
22. Васильева С. В., ДавниченкоЛ. С., Луцкова Е. В. и др. Репарационный эффект генетически активного природного соединения п-аминобензойной кислоты в опыте с N-нитрозометилмочевиной//ДАН СССР. 1979. Т. 247. С. 226—230.
23. Васильева С. В., Тонка ль T. Е. Пара-аминобензойная кислота ингибирует проявление индуцибельных sos-функций в Escherichia coli К-12//Генетика. 1983. Т. 19. С. 1778-1785.
24. Васильева С. В., ТонкальТ. Е., Городецкий С. И. и др. Генетическая активность пара-аминобензойной кислоты. Усиление ДНК-полимераза-1-за- висимой репарации, индуцированной химическими мутагенами в толуолизированных клетках Escherichia соК//Там же. 1982. Т. 18. С. 392—398.
25. Газиянц С. М. Диаллельный анализ фотосинтетической активности у хлопчатника//Там же. 1983. Т. 19. С. 1720—1726.
26. Гапоненко А. К., Белецкий Ю. Д. Изменение частоты и спектра хлорофилльных мутаций у ячменя при хранении семян, обработанных при различных условиях N-нитрозо-N-метилмочевиной//Химические супермутагены и селекция. М., 1975. С. 91-98.
27. Генкель П. А. Физиология жаро- и засухоустойчивости растений. М., 1980. 280 с.
28. Г е р ш е н о в и ч 3. С., К р и ч е в с к а я А. А., Л у к а ш А. И. и д р. Мочевина в живых организмах. Ростов н/Д, 1970. 82 с.
29. Гостимский С. А. Генетический контроль фотосинтеза у высших расте- ний//Автореф. дис. ... докт. биол. наук. М., 1981. 38 с.
30. Гостимский С. А. Генетический контроль формирования структуры хлоропластов у высших растений//4-й съезд ВОГиС им. Н. И. Вавилова: Тез. симпоз. докл. М., 1982. С. 161.
31. Туманов Л. Л., Норенко Н. П. Изучение мутагенного действия нитро- зоалкилмочевин на антиномицеты//Генетика. 1966. Т. 2. С. 82—88.
32. Г у п а л о П. И. Возрастные изменения растений и их значение в растениеводстве. М., 1969. 180 с.
33. Давыденко О. Г., Палилова А. Н., Щетинина М. И. Дивергенция структуры митохондрий и хлоропластов у Aegilops и Triticum. III. Морфометрический анализ ультраструктуры хлоропластов//Генетика. 1984. Т. 20. С. 448—456.
34. Даниленко И. И. Роль липидов в мутагенной активности нитрозоалкил- мочевин//Там же. 1982. Т. 18. С. 1910—1912.
35. Д ж а н у м о в Д. А., Б о ч а р о в Е. А., К л и м о в С. В. Влияние температуры на содержание хлоропластных липидов в первом листе проростков озимой пшеницы// Физиология растений. 1982. Т. 29. С. 1067 — 1074.
36. Джин кс Дж. Нехромосомная наследственность. М., 1966. 152 с.
37. Дин Р. Процессы распада в клетке. М., 1981. 120 с.
38. Дубинин Н. П. Потенциальные изменения в ДНК и мутации. М., 1978. 246 с.
39. ’ Жданов Ю. А., Колоколова H. С., Кесслер P. М. и др. О взаимосвязи β-галакто- и β-глюкозидазной активностей с уровнем редуцирующих сахаров у хлорофилльных мутантов подсолнечника//Физиология растений. 1981. Т. 28. С. 987-994.
40. Засухи на Г. Д., Рапопорт И. А. Мутации апатогенности и мелких бляшек вируса клещевого энцефалита, вызванные N-нитрозометилмочевиной//Су- пермутагены. М., 1966. С. 203—210.
67
41. Захаров И. А. Генетическая система митохондрий и хлоропластов//Гене- тические функции органоидов цитоплазмы. Л., 1974. С. 19—28.
42. Зоз H. Н. Химический мутагенез у высших растений//Супермутагены. М.,
1966. С. 93-104.
43. Зоз H. Н. Специфичность химического мутагенеза на растениях//Специ- фичность химического мутагенеза. М., 1968. С. 162 — 171.
44. Квитко К. В., Тугаринов В. В. Генетико-биохимическое изучение действия генов, детерминирующих признаки хлоропласта у зеленых водорослей// 4-й съезд ВОГиС им. Н. И. Вавилова: Тез. симпоз. докл. М., 1982. С. 162 — 163.
45. Кумаков В. А. Фотосинтетическая деятельность растений в аспекте се- лекции//Физиология фотосинтеза. М., 1982. С. 283—293.
46. Ладыгин В. Г. Получение гибридного штамма Chlamydomonas с неактивными фотосистемами I и II и установление трех типов антенного хлорофилла в клетках in угуо//Генетика. 1980. Т. 16. С. 994—1001.
47. Ладыгин В. Г., Биль К. Я., Божок Г. В. Формы хлорофилла и структура хлоропластов мутантов Pisum sativum с потерей активности фотосистемы I или фотосистемы II//Физиология растений. 1982. Т. 29. С. 479—487.
48. Л и х а ч е в а Л. И., К о р д ю м В. А. Особенности распределения генетических блоков в цепи биосинтеза хлорофилла у ряда пигментных мутантов хлореллы// Молекулярные механизмы генетических процессов. М., 1976. С. 160—164.
49. Лобов В. П., Бондарь П. И., Остаплюк А. Н. и др. Молекулярные механизмы функционирования аминопластов//Там же. С. 94—98.
50. Мазурик В. К. Биологические системы репарации//Общая генетика. Вып. 4. Итоги науки и техники. М., 1978. С. 58—104.
51. Маркерт К., У р ш п р у н г Т. Генетика развития. М., 1973. 135 с.
52. М е з и я Д. Митоз и физиология клеточного деления. М., 1963. 337 с.
53. Микичур Н. И., СандахчиевЛ. С., Щелкунов С. Н. Обнаружение функциональной гетерогенности хлоропластов прямыми биохимическими метода- ми//Цитология. 1974. Т. 16. С. 1372—1375.
54. Митрофанов Ю. А., Олимпиенко Г. С. Индуцированный мутационный процесс эукариот. М., 1980. 264 с.
55. Михайлов В. С., Липолдова М., Фельгенгауэр T. Е. и др. Репарация митохондриальной ДНК после рентгеновского облучения яйцеклеток вьюна Misqurnus fossilisZ/Мол. биология. 1981. Т. 15. С. 154 — 160.
56. Моно Ж., Жакоб Ф. Телеономические механизмы в процессах клеточного обмена, роста и дифференцировки//Регуляторные механизмы клетки. М., 1964. С. 477-506.
57. Надсон Г. А., Филиппов Г. С. О влиянии рентгеновских лучей на половой процесс и образование мутантов у низших грибов (Мисогасеае)//Вестник рентген, и радиол. 1925. Т. 3. С. 305—310.
58. Насыров Ю. С. Фотосинтез и генетика хлоропластов. М., 1975. 143 с.
59. Невзглядова О. В. Нестабильность митохондриального генома//Мол. биология. 1984. Т. 18. С. 293—312.
60. Н е й ф а х С. А. Механизмы клеточной интеграции в процессе биогенеза митохопдрий//Генетические функции органоидов цитоплазмы. Л., 1974. С. 58—70.
61. Николов H. Н., Хубавенска Н. Б., Велев Ч. К. Роль NO-группы в проявлении высокого мутагенного эффекта N-нитрозо-N-алкилмочевин у Scene- desmus аси1п8//Генетика. 1978. Т. 14. С. 673—677.
62. Н и к о л о в X р., Г е о р г и е в а С. Хлорофилльные химеры в Mi и их значение при учете индуцированных хлорофилльных мутаций у ячменя//Там же. 1975. Т. И. С. 47-52.
63. Ничипорович А. А. Основы фотосинтетической продуктивности расте- ний//Современные проблемы фотосинтеза. М., 1973. С. 17—43.
64. Ничипорович А. А. Физиология фотосинтеза и продуктивность расте- ний//Физиология фотосинтеза. М., 1982. С. 7—33.
65. Одинцова М. С. ДНК хлоропластов и митохондрий//Итоги науки и тех68
ники, биологическая химия. М., 1976. Вып. 10. 178 с.
66. Одинцова М. С., Малеина А. А. Структура и функции хлоропластной ДНК//Геном растений. Структура и экспрессия. Уфа, 1983. С. 64 — 78.
67. Одинцова М. С., Юрина Н. П. Рибосомы хлоропластов//Биохимия.
1976. Т. 41. С. 1915-1927.
68. Палилова А. Н., Люлькина Е. И., Д а в ы д е н к о О. Г. Генетический эффект акридиновых красителей в отношении ультраструктуры хлоропластов//ДАН БССР. 1972. Т. 16. С. 763-766.
69. Платонова P. Н., Сахаров В. В. Отбор на радиоустойчивость диплоидных и аутотетраплоидных форм гречихи посевной (Fagopyrum esculentum)// Радиобиология. 1962. Т. 2. С. 627 — 632.
70. Пл ох и некий Н. А. Биометрия. М., 1970. 305 с.
71. Прихоженко Э. Я., Белецкий Ю. Д. Электронно-микроскопическое изучение структурных изменений пластид у некоторых пластомных пестролистных мутантов подсолнечника//Цитология и генетика. 1979. Т. 13. С. 467—470.
72. Разорителева Е. К., Белецкий Ю. Д. Взаимодействие генома и пластома у подсолнечника. II. Мутантный пластом в различной генотипической среде и его влияние на эффект гетерозиса//Генетика. 1979. Т. 15. С. 1420—1426.
73. Разорителева Е. К., Белецкий Ю. Д., Жданов Ю. А. Генетическая природа мутаций подсолнечника, индуцированных N-нитрозо-N-метилмочевиной. I. Пестролистные формы//Там же. 1970. Т. 6. С. 102—107.
74. Разорителева Е. К., Белецкий Ю. Д., Жданов Ю. А. Генетическая природа мутаций подсолнечника, индуцированных N-нитрозо-N-метилмочеви- ной. II. Мутации chlorina//Там же. Т. 6. С. 43—48.
75. Рапопорт И. А. Наследственные изменения, происходящие под влиянием диэтилсульфата и диметилсульфата//Докл. ВАСХНИЛ. 1947. Т. 12. С. 12—15.
76. Рапопорт И. А. Действие окиси этилена, глицида и гликолей на генные мутации//ДАН СССР. 1948. Т. 60. С. 469-472.
77. Рапопорт И. А. Преодоление универсального мутационного барьера с мутациями х-хромосомы выше 100%//Там же. 1963. Т. 148. С. 696—699.
78. Рапопорт И. А. Особенности и механизм действия супермутагенов. Супермутагены. М., 1966. С. 9—22.
79. Рапопорт И. А., Васильева С. В., ДавниченкоЛ. С. Роль п-ами- нобензойной кислоты в репарации повреждений, индуцированных УФ- и у-излуче- ниями//ДАН СССР. 1979. Т. 247. С. 231-235.
80. Рубин Б. А., Ладыгина М. Е. Физиология и биохимия дыхания растений. М., 1974. 512 с.
81. Рыжков В. Л. Пластиды как мутирующие единицы//ДАН СССР. 1965. Т. 162. С. 1177-1180.
82. Самсонова И. А., Беттхер Ф. Исследование мутабильности пластома. IV. Влияние рентгеновых лучей, этилметансульфоната, этиленимина и нитрозоэтил- уретана на частоту обратных мутаций у пластомного мутанта томата Pl-alb 1//Генетика. 1976. Т. 12. С. 41—46.
83. Самсонова И. А., Беттхер Ф. Исследование мутабильности пластома. VI. Влияние акридиновых соединений на частоту обратных мутаций у пластомного мутанта томата Pl-alb 1//Там же. 1978. Т. 14. С. 1928—1934.
84. Сарычев Ю. Ф. Экспериментальный мутагенез у табака//Там же. 1967. Т. 3. С. 16-26.
85. Сахаров В. В. Специфичность действия мутационных факторов//Био- логический журн. 1938. Т. 7. С. 595—618.
86. Семененко В. Е. Механизмы эндогенной регуляции фотосинтеза и адаптивные свойства хлоропластов//Физиология фотосинтеза. М., 1982. С. 164—187.
87. Семенов О. Г. Индуцирование новых хозяйственно ценных признаков у аллоцитоплазматических гибридов пшениц как результат плазмо-ядерного взаимодействия//14-й Междунар. генет. конгр.: Тез. докл. М., 1978. Ч. 1. С. 434.
88. Серебряный А. М. К механизму мутагенного действия N-нитрозо-N-ме- 69
тилмочевины//Молекулярные механизмы генетических процессов. М., 1972. С. 135—
138.
89. Силаева А. М. Структура хлоропластов и факторы среды. Киев, 1978. 203 с.
90. Сэджер Р. Цитоплазматические гены и органеллы. М., 1975. 423 с.
91. Т а и р б е к о в М. Г. Структурные и функциональные аспекты устойчивости растительной клетки//Успехи соврем, биологии. 1973. Т. 75. С. 406—418.
92. Т а о К.-Л., К а н А. А. Гормональная регуляция белково-нуклеинового обмена прорастающих семян//Физиология и биохимия покоя и прорастания семян. М., 1982. С. 469-491.
93. Тарасов В. А. Физические модификаторы действия ионизирующих излу- чений//Успехи соврем, генетики. М., 1967. С. 106 — 132.
94. Тарасов В. А. Молекулярные механизмы репарации и мутагенеза. М., 1982. 226 с.
95. Темпер Э. А. Мутационная изменчивость Scenedesmus obliquus, индуцированная 1\-нитрозометилмочевиной//Генетика. 1971. Т. 7. С. 42—45.
96. Титов А. Ф. Температурно-чувствительные хлорофилльные мутации у высших растений//Успехи соврем, биологии. 1979. Т. 87. С. 125—132.
97. Уилкинсон Дж. Изоферменты. М., 1968. 220 с.
98. Уоддингтон К. Морфогенез и генетика. М., 1964. 260 с.
99. Усманов П. Д. Генетика, фенанализ и феногенез фотосинтетических мутаций//4-й съезд ВОГиС им. Н. И. Вавилова: Тез. симпоз. докл. М., 1982. С. 167.
100. Филатов Г. В., Су нонина С. Л. Генетические аспекты формирования и функционирования фотосинтетического аппарата гетерозисных растений//14-й Междунар. генет. конгр.: Тез. докл. М., 1978. Ч. 1. С. 437.
101. X а н с о н К. П., К о м а р В. Е. Современные данные о структуре и механизмах воспроизведения внеядерных ДНК животной клетки//Успехи соврем, биологии.
1975. Т. 80. С. 166-184.
102. Хачачка П., Сомеро Дж. Стратегия биохимической адаптации. М.,
1977. 398 с.
103. Хесин Р. Б. Некоторые неканонические механизмы наследования//Гене- тика. 1981. Т. 17. С. 1159-1171.
104. Хесин Р. Б., Башкиров В. Н. Влияние направления скрещивания, дополнительного гетерохроматина в геноме родителей и температуры их развития на эффект положения гена white у потомства Drosophila melanogaster//TaM же. 1979. Т. 15. С. 261-272.
105. Хлебович В. В. Акклимация животных организмов. Л., 1981. 136 с.
106. X о Ф. Т. Действие N-нитрозометилмочевины на возникновение нестабильных пигментных мутантов хламидомонады и хлореллы//Генетика. 1971. Т. 7. С. 134 —
136.
107. Хропова В. И. Нестабильные пигментные мутанты хлореллы, индуцированные N-нитрозо-N-метилмочевиной//Химический мутагенез и создание селекционного материала. М., 1972. С. 140—147.
108. Ш а п и р о Н. И., П е т р о в а О. H., X а л и з е в А. Е. Индукция генных мутаций в клетках млекопитающих in vitroZ/Генетика. 1969. Т. 5. С. 170—172.
109. Шарма Б. Влияние некоторых физических и химических факторов на мутационный процесс у гороха (Pisum sativum)//Там же. 1966. Т. 2. С. 45—52.
110. Шевякова Н. И. Солеустойчивость пластомных хлорофилльных мутантов подсолнечника//Физиология растений. 1982. Т. 29. С. 317—324.
111. Цейтлин П. И., Круглякова К. Е., Зоз H. Н. и др. Физико-химические изменения в ДНК и ДНП под действием Х-нитрозо-Ь1-метилмочевинь1//ДАН СССР. 1975. Т. 222. С. 232-234.
112. Ч и г и р е в В. С. Изучение липоаминокислотных соединений ламелл хлоропластов//Автореф. дис. ... канд. биол. наук. М., 1971. 22 с.
ИЗ. Э ф р о и м с о н В. П. Общая теория иммунитета растений и некоторые принципы радиоселекции на устойчивость к инфекционным заболеваниям//Проблемы 70
кибернетики. М., 1961. Вып. 5. С. 199—217.
114. Юрина H. IL, Дюрян И. А., Одинцова М. С. Электрофоретическое исследование рибосомных белков желтых мутантов Chlamydomonas reinhardi//On- зиология растений. 1981. Т. 28. С. 144 — 149.
115. Якубова М. М., Назарова 3. А., Кренделева T. Е. Структурные и функциональные особенности фотосинтетического аппарата мутантов Arabidopsis ШаИапа//Биохимия. 1980. Т. 45. С. 864—872.
116. A d a m s М. Effect of sunlight on inheritance of chloroplast genes in Chlamydomonas reinhardi//Genetics. 1975. V. 80. P. 8—9.
117. Alexander N. J., Gillham N. W., Boynton J. E. The mitochondrial genome of Chlamydomonas. Induction of minute colony mutations by acriflavin and their inheritance//Molec. and Gen. Genet. 1974. V. 130. P. 275—290.
118. Appelqvist L. A., Stumpf P. K., Wettstein D. Lipid synthesis and ultrastructure of isolated barley chloroplasts//Plant. Physiol. 1968. V. 43. P. 163—187.
119. Asahi L, Toyama S. Some factors affecting the chloroplast replication in the moss Plagiomnium trichomanes//Protoplasma. 1982. V. 112. P. 9—16.
120. Baur E. Das Wesen und die Erblichkeitsverhältnisse der «Varietates albo- marginatae hort» von Pelargonium zonale//Z. indukt. Abstamm, und Vererbungsl. 1909. В. 1. S. 330-351.
121. Benedetti E., Forti G., Gar läse hi F. M. e. a. On the mechanisms of ammonium stimulation of photosynthesis in isolated chloroplast//Plant. Sei. Lett. 1976. V. 77. P. 85-90.
122. Benedick C. R., Me Cree K. J., Koh el R. J. High photosynthesis rate of a chlorophyll mutant of cotton//Plant Physiol. 1972. V. 49. P. 968—971.
123. B 1 i x t S. Studion of induced mutations in peas. XIII. Segregation of an albina mutant//Agri. hort, genetics. 1966. V. 24. P. 48—55.
124. Blixt S. Studion of induced mutations in peas. XIV. Segregation of xantha mutant//Ibid. P. 56—61.
125. Böger P. Der Chloroplast als Angriffsort moderner Herbizide//Prax. Na- turwiss. Biol. 1980. V. 29. S. 106-113.
126. Bör ner Th., Förster H. Zum Einfluss des Plastoms auf Plastidenzahl und Zellform bei der Sorte «Mrs. Parker» von Pelargonium zonale Hort//Wiss. Z. M.-Luther- Univer. Halle-Wittenberg, Math.-naturwissen. R. 1983. B. 30. S. 77—81.
127. Börner Th., Knoth R., Herrmann F. u. a. Struktur und Funktion der genetischen Information in der Plastiden. V. Das Fehlen von ribosomaler RNS in den Plastiden der Plastommutante «Mrs. Parker» von Pelargonium zonale Ait//Theor. and Appl. Genet. 1972. B. 42. S. 3-11.
128. Boynton J. E., Gillham N. W., T i n g 1 e C. L. e. a. Mapping of chloroplast genes in the green alga Chlamydomonas reinhardii//Genetics. 1975. V. 80. P. 2—11.
129. Burk L. G., Stewart R. N., Derme n H. Histogenesis and genetics of a plastid-controlled chlorophyll variegation in tobacco//Amer. J. Botany. 1964. V. 51. P. 713-724.
130. Butterfass Th. A nucleotypic control of chloroplast reproduction//Pro- toplasma. 1983. V. 118. P. 71-74.
131. Calderon I. L., Cerda О. E. Induction by N-methyl-N-nitro-N-nitroso- guanidine of nuclear and cytoplasmic mutations in Saccharomyces cerevisiae//Mutat. Res. 1983. V. 108. P. 133-146.
132. C h a n d S., R о y S. G. Effects of herbicide 2,4-dinitrophenol on mitosis, DNA, RNA and protein synthesis in Nigella sativa L.//Biol. plant. 1981. V. 23. P. 198—202.
133. Chen K. M e y e г V. G. Mutation in chloroplast DNA coding forthe large subunit of fraction I protein correlated with male sterility in cotton//.!. Heredity. 1979. V. 70. P. 431-433.
134. Chen K., Sand S. A. Nicotiana chromosome coding for a specific polypeptide of the small subunit of fraction I protein//Science. 1979. V. 204. P. 179 — 180.
135. G i f e r r i O., Di Pasquale G., T i b о n i O. Chloroplast elongation factors are synthesized in the chloroplast//Europ. J. Biochem. 1979. V. 102. P. 331 — 335.
71
136. С 1 а г к е С. Н. Differencial effects of caffeine in mutagen treated Schizosaccha- romyces pombe//Mutat. Res. 1968. V. 5. P. 33—40.
137. Correns G. Vererbungsversuche mit blass (gelb), grünen und buntblättrigen Sippen bei Mirabilis jalapa, Urtica pilulifera und Lunaria annua//Z. indukt. Abstamm, und Vererbungsl. 1909. B. 1. S. 291—329.
138. Darr S., Machado V. S., Arnelzen Ch. J. Uniparental inheritance of a chloroplast photosystem II polypeptide controlling herbicide binding//Biochem. et biophys. acta. 1981. V. 634. P. 219-228.
139. Davies D. R. Cell wall organisation in Ghlamydomonas reinhardii. The role of extra-nuclear systems//Mol. and Gen. Genet. 1972. V. 115. P. 334 — 348.
140. Dawes J. W., Carter B. L. A. Nitrosoguanidine mutagenesis during nuclear and mitochondrial gene replication//Nature. 1974. V. 250. P. 709—712.
141. D г о n M., R a h i r e M., R о c h a i x J. D. e. a. First DNA sequence of a chloroplast mutation: a missense alteration in the ribulose-bisphosphate carboxilase large subunit gene//Plasmid. 1983. V. 9. P. 321-324.
142. Du 1 i eu H. Sur les differents types de mutations extranucleaires induites par le methane sulfonate d’etyle chez Nicotiana tabacum.//Mutât. Res. 1967. V. 4. P. 177 — 189.
143. Ellis R. J: Chloroplast proteins: synthesis, transport and assembly//Annu. Rev. Plant. Physiol. Calif. 1981. V. 32. P. 11-137.
144. E p p M. D. An example of nuclear gene-induced plastome mutations in Oenothera hookeri//Genetics. 1972. V. 71. P. 17.
145. Frandsen N. O. Die Plastidenzahl als Merkmal bei der Kartoffel//Theor. and Appl. Genet. 1968. V. 38. P. 153-167.
146. Gasquez Ja., Darmency H. Variation of chloroplast properties between two triazine biotypes of Poa annua L.//Plant. Sei. Lett. 1983. V. 30. P. 99—106.
147. Geetha V., Gnanam A. Identification of p700-chlorophylla-protein complex as a product of chloroplast protein synthesis//FEBS Lett. 1980. N 111. P. 272—276..
148. Gibbs S. P., M a к R., S l a r к i s T. The chloroplast nucleoid in Ochromonas darica. IV. Evidence for an increase in plastid DNA during greening//]. Cell. Sei. 1974. V. 16. P. 579.
149. Gibor A. Phenotypic variations among chloroplasts of a single cell//Science.
1967. V. 155. P. 327-330.
150. Gillham N. W. Induction of chromosomal and non-chromosomal mutations in Chlamydomonas reinhardii with N-methyl-N-nitro-N-nitrosoguanidine//Genetics. 1965. V. 52. P. 529—537.
151. Gillham N. W. Organelle heredity. N. Y., 1978. P. 602.
152. G о i n s D. J., R e у n о 1 d s R. J., Schiff J. A. e. a. A cytoplasmic regulatory mutant of Euglena: constitutivity for the light-inducible chloroplast transfer RNAs// Proc. Nat. Acad. Sei. USA. 1973. V. 70. P. 1749-1752.
153. Gray J. Wonders of chloroplast DNA//Nature. 1986. V. 322. P. 501—502.
154. Gressel J., Cohen N., Binding H. Somatic hybridization of an atrazine resistant biotype of Solanum nigrum with Solanum tuberosum. II. Segregation of plasto- mes//Theor. and Appl. Genet. 1984. V. 67. P. 131 — 134.
155. GuptaS. B. Chlorophyll variegation caused by somatic elimination of an alien chromosomal fragment on Nicotiana tabacum//Canad. J. Genet, and Cytol. 1968. V. 10. P. 106-111.
156. Gustafsson A. The mutation system of the chlorophyll apparatus//Lunds Univ. Arsskrift. N. F. Adv. 2. 1940. V. 36. P. 1-40.
157. H achtel W. Control of chlorophill biosynthesis by the plastid genome// Europ. J. Cell. Biol. 1980. V. 22. P. 129.
158. HadakJ., Somsakova V. Number of plastids in the xantha mutant of Abies alba Mill//Acta Fac. rerum. natur. Univ. Comen. Physiol, plant. 1979. N 16. P. 33—36.
159. Hagemann R. Struktur und Funktion der genetischen Information in den Plastiden. I. Die Bedeutung von Plastommutanten und die genetischen Nomenklatur 72
extranucleärer Mutationen//Biol. ZBL. 1971. B. 90. S. 409—418.
160. Hagemann R. Plastid distribution and plastid competition in higher plants and the induction of plastom mutations by nitroso-urea-compounds//Genetics and Biogenesis of chloroplasts and mitochondria. Amsterdam, 1976. P. 331—338.
161. Hagemann R. Genetics and molecular biology of plastid of higher plants// Stadler Symp. Columbia, 1979. V. 11. P. 91 — 116.
162. Hagemann R. Plastome mutants of higher plants in the study of chloroplast biogenesis//Problems in general genetics. Proc. XIV Intern. Congress Genet. Moscow,
1980. V. И. В. 11. P. 182-194.
163. Hagemann R., Berg W. Vergleichende Analyse der Paramutationssysteme bei höherer Pflanzen//Biol. Zbl. 1977. B. 96. S. 257-301.
164. Hagemann R., Börner Th. Genetische, cytologische und molekularbiologische Analyse der Rlastiden höherer Pflanzen//Wiss. Z. Univ. Halle. 1979. B. 28. S. 49-60; 137-142.
165. Hagemann R., Börner Th. Plastid genetics//Progr. Bot. 1981. V. 43. P. 159-173.
166. Hagemann R., Metzlaff M. Genetik und Molekularbiologie der Plastiden. I. Die genetische Information der plastiden-DNA//Biol. Rdsch. 1980. B. 18. S. 121 — 132.
167. Hagemann R., Scholz F. Ein Fall geninduzierter Mutationen des Plasmo- typus bei Gerbste//Der Züchter. 1962. B. 32. S. 50—59.
168. Hallam N. D., Gaff D. F. Regeneration of chloroplast structure in Talbo- tie alegans: a desiccation-tolerant plant//New Physiol. 1978. V. 81. P. 657 — 662.
169. На 11 ick R. B., Rushlow K. E., Orosco R. M. Organization and expression of Euglena gracilis, chloroplast DNA//Europ. J. Cell Biol. 1980. V. 22. P. 126.
170. H a 11 i e r U. W. Untersuchungen des Photosynthese — apparates bei Plastom- mutanten von Oenothera//Ber. Dtsch. bot. Ges. 1966. B. 79. S. 69—71.
171. H a n a w a 11 P h. S. Respectives on DNA repair and inducible recovery pheno- men//Biochemie. 1982. V. 64. P. 847—851.
172. Hashimoto H., Murakami S. Chloroplast replication and loss of chloroplast DNA induced by nalidixic acid in Euglena gracilis//Cell Struct, and. Funct. 1982. V. 7. P. 111-120.
173. Henningsen K. W., Boynton J. E., Wettstein D. V. e. a. Nuclear genes controlling chloroplast development in barley//Biochem. Gene Express High Organisms. Dordreent; Boston, 1972. P. 457—478.
174. Henny R. J. Inheritance of foliar variegation in two Dieffenbachia cultivars//!. Heredity. 1982. V. 73. P. 384.
175. Hereford L. M., Hartwell L. H. Role of protein synthesis in the replication of yeast DNA//Nature, New Biology. 1973. V. 244. P. 129—131.
176. Herrmann F. Struktur und Funktion der genetischen Information in den Plastiden. II. Untersuchungen der Photosynthesedefekten Plastommutante alba-1 von Antirrhinum majus L.//Photosynthetica. 1971. V. 5. P. 258—266.
177. Herrmann R. G. Number and arrangement of genomes in chloroplasts// Genetics. 1973. V. 74. P. 114.
178. Holt J. S., Stemler A. J., Radosevich S. R. Differential light responses of photosynthesis by triazineresistant and triazine — susceptible Senecio vulgaris bio- types//Plant Physiol. 1981. V. 67. P. 744-748.
179. Howe C. J., Bowman C. M., D y e r T. A. e. a. The genes for the and proton-translocation subunits of wheat chloroplast ATP synthase are close together on the same strand of chloroplast DNA//Mol. and Gen. Genet. 1983. V. 190. P. 51 — 55.
180. Iwamura T., Katch K., Nishimura T. Semi-conservative replication of chloroplast DNA in synchronized chlorella//Cell Struct, and Funct. 1982. V. 7. P. 71 — 86.
181. Joy K. W., Ellis R. J. Protein synthesis in chloroplasts. IV. Polypeptides of the chloroplast envelope//Biochim. et Biophys. Acta. 1975. V. 378. P. 143—151.
182. Jurina N. P., Odintsova M. S., M a 1 i g a P. An altered chloroplast ribosomal protein in a streptomycin resistant — tobacco mutant//Theor. and Appl. Genet.
73
1978. V. 52. P. 125-128.
183. Ki h Iman B. A. Effects of caffeine on genetic material//Mutat. Res. 1974. V. 26. P. 53-71.
184. Kimball R. F. Studies on the mutagene action of N-methyl-N-nitro-N-nitro- soguanidine in Paramecium aurelia with emphasis on repair processes//Mutat. Res. 1970. V. 9. P. 261-271.
185. Kimball R. F., Hirsch B. F. Fixation and loss of hydrazine-induced pre- mutational damage in Haemophilis influenzae//Mutat. Res. 1976. V. 36. P. 39—48.
186. Kimball R. F., Perdue S. W. Comparison of mutagenesis by X-rays and triethylene melamine in Paramecium with emphasis on role of mitosis//Mutat. Res. 1967. V. 4. P. 37-46.
187. Kirk J. T. О., T i 1 n e y-B a s s e 11 R. A. E. The plastids. Their chemistry, structure, growth and inheritance. London, San Francisco, 1967. 604 p.
188. Knoth R. Struktur und Funktion der genetischen Information in den Plastiden. XIV. Die Auswirkungen der Plastommutationen en: alba-1 von Antirrhinum majus und en: gilva-1 von Pelargonium zonale auf die Feinstruktur der Plastiden//Biol. Zbl. 1975. B. 94. S. 681-694.
189. Knoth R., Hagemann R. Struktur und Funktion der genetischen Information in den Plastiden. XVI. Die Feinstruktur der Plastiden und der elektronenmikroskopische Nachweis echter Mischzellen in Blättern der Plastommutationen suslösenden Genmutante albostrians von Hordeum vulgare L.//Biol. Zbl. 1977. B. 96. S. 141 — 150.
190. Knoth R., H e г r m a n n F., В ö r n e r T h., Struktur und Funktion der genetischen Information in den Plastiden. XV. Beziehungen zwischen Chlorophyllgehalt. Photosyntheseverhalten und Plastidenfeinstruktur in kerngen-bedingten Atfreamutanden von Antirrhinum majus und Pelargonium zonale//Biochem. Physiol. Pflanzen. 1976. B. 170. S. 433-442.
191. Knoth R., Herrmann F., Böttger M. u. a. Struktur und Funktion der genetischen Information in den Plastiden. XI. DNA in normalen und mutierten Plastiden der Sorte «Mrs. Parker» von Pelargonium zonale//Ibid. 1974. B. 166. S. 129—148.
192. Ko hei R. J. Variegated mutants in cotton Gossypium hirsutum//Crop. Sei. 1967. V. 7. P. 490-492.
193. Koller B., Delius H. Intervening sequences in chloroplast genomes//Cell. 1984. V. 36. P. 613-622.
194. К о 1 1 e г В., G i n g r i c h J. C., S t i e g 1 e r G. L. e. a. Nine introns with conserved boundary sequences in the Euglena gracilis chloroplast ribulose-l,5-biphosphate carboxylase gene//Cell. 1984. V. 36. P. 545—553.
195. Kuiper P. J. C. Lipid metabolism of higher plants in saline environments// Physiol, veget. 1980. V. 18. P. 83-88.
196. K u n g S. D., Z h u Y. S., C h e n K. e. a. Nicotiana chloroplast genome. II. Chloroplast DNA alteration//Mol. and Gen. Genet. 1981. V. 183. P. 20—24.
197. K u n g S. D., Z h u Y. S., S h e n G. F. Nicotiana chloroplast genome. III. Chloroplast DNA evolution//Theor. and Appl. Genet. 1982. V. 61. P. 73—79.
198. KuroiwaT., KawanoS h., NishibayashiS. e. a. Epifluorescent microscopic evidence for maternal inheritance of chloroplast DNA//Nature. 1982. V. 298. P. 481-483.
199. Kutzelnigg H., Stubbe W. Investigations on plastome mutants in Oenothera. I. General considerations//Sub-Cell Biochem. 1974. V. 3. P. 73—89.
200. Lamp pa G. K., Bendich A. J. Changes in chloroplast DNA levels during development of pea (Pisum sativum L.)//Plant Physiol. 1979. V. 64. P. 126 — 130.
201. Levy A., Ashri A. Induced plasmon mutations affecting the growth habit of peanuts A. hypogaea L.//Mutât. Res. 1978. V. 51. P. 347 — 360.
202. Lin C. M., Kung S. D. Nicotiana chloroplast genome. 8. Localization of genes for subunits of ATP synthase, the cytochrome b-f complex and the 32kD protein// Theor. and AppL Genet. 1984. V. 68. P. 213—218.
203. Link G., Bogorad L. Sizes, location and directions of transcription of two genes on a cloned maize chloroplast DNA sequence//Proc. Nat. Acad. Sei. USA. 1980.
74
V. 77. P. 1832-1836.
204. Loi sea ux S., M a c h e R., Rozier C. Rifampicin inhibition of the plastid rRNA synthesis of Marchantia polymorpha//J. Cell Sei. 1975. V. 17. P. 327 — 335.
205. Lüttke A., Hoursiango u-N eubrun D., Pu issu x-D a о S. e. a. Chloroplast DNA of Acetabularia mediterranea: heterogenous distribution and synthesis// Europ. J. Cell Biol. 1980. V. 22. P. 127.
206. Maliga P., Xuan L T., Dix Ph. J. e. a. Antibiotic resistance of Nicotiana// Plant Cell Cult.: Result and Perspectives. Amsterdam e. a., 1980. P. 161 — 166.
207. Maly R. Die Mutabilität der Plastiden von Antirrhinum majus L. Sippe 50// Z. indukt. Abstamm, und Vererbungsl. 1958. B. 89. S. 692 — 696.
208. Matsuda J., Surzycki S. J. Chloroplast gene expression in Chlamydomo- nas reinhardii//Mol. and Gen. Genet. 1980. V. 180. P. 463 — 474.
209. McCalla D. R. Chloroplast mutagenesis: Effect of N-methyl-N-nitro-N- nitrosoguanidine and some others on Euglena//Science. 1965. V. 148. P. 497—499.
210. M с С и 1 1 e y C. M., Johnson R. C. The absence of caffeine inhibition of postreplication repair in excision deficient strains of Escherichia coli В and K-12//Mutat. Res. 1976. V. 38. P. 207-214.
211. McIntosh L., Pouleen C., Bogorad L. Chloroplast gene sequence for the large subunit of ribulose bisphosphate carboxylase of maize//Nature. 1980. V. 288. P. 556-560.
212. Medina F. J., R i s и e n о M. C., R о d r i q и e z-G a r c i a M. J. Evolution of the cytoplasmic organelles during female meiosis in Pisum sativum L.//Planta. 1981. B. 151. S. 215-225.
213. M e 1 z e r M. S., C h r i s t i a n R. T., D о о 1 e y J. F. e. a. Mutagenicity of cyanate a decomposition product of MNU//Mutat. Res. 1983. V. 116. P. 281—287.
214. Menczel L., Nagy F., K i s s J. R. e. a. Streptomycin resistant and sensitive somatic hybrids of Nicotiana tabacum-|-Nicotiana knightiana: correlation of resistance to N. tabacum plastids//Theor. and Appl. Genet. 1981. V. 59. P. 191 — 195.
215. Mets L. J., Bogarad L. Mendelian and uniparental alterations in erythromycin binding by plastid ribosomes//Science. 1971. V. 174. P. 707 — 709.
216. Metzlaff M., Borner Th., Hageman n R. Variations of chloroplast DNAs in the genus Pelargonium and their biparental inheritance//Theor. and Apl. Genet.
1981. V. 60. P. 37-41.
217. Michaelis A., Schöneich J., Rieger R. Chromosomenaberrationen bei Vicia faba und Ascitestumoren der Maus nach Einwirkung von N-nitroso-N-methyl- harnstoff//Chromosoma. 1965. B. 16. S. 101 — 112.
218. Michaelis P. Cytoplasmic inheritance in Epilobium and its theoretical significance//Adv. Genet. 1954. V. 6. P. 287—401.
219. Michaelis P. Untersuchungen zur Mutation plasmatischer Erbträger, besonders der Plastiden. Teil 1//Planta. 1958. B. 51. S. 600—634.
220. M i c h a e 1 i s P. Untersuchungen zur Mutation plasmatischer Erbträger, besonders der Plastiden. Teil II//Ibid. S. 722-756.
221. Michaelis P. Über Zahlengesetzmässigkeiten plasmatischer Erbträger, insbesondere der Plastiden//Protoplasma. 1962. B. 55. S. 177 — 231.
222. Miller P. D., V a n g h n K. S., Wilson K. G. Ethylmethanensulfonate — induced chloroplast mutagenesis in crops. Induction and ultrastructure of mutants// J. Heredity. 1984. V. 75. P. 86-92.
223. Moustacchi E., Heude M. Mutagenesis and repair in yeast mitochondrial DNA//Moi. and Cell Meeh. Mutagenes. Proc. Symp., Gatlinburg, Tenn., 5—9 April 1981. N. Y.; London, 1982. P. 273-301.
224. Muller H. J. Artificial transmutation of the gene//Science. 1927. V. 66. P. 84-87.
225. Müller A. Mutationsauslösung durch Nitrosomethylharnstoff bei Arabidop- sis//Der Züchter. 1964. B. 34. S. 102-120.
226. Muszynski S. Mutations in Petunia. II. Plastid mutations//Acta soc. bot.
75
Polon. 1967. V. 36. P. 317-320.
227. Myers A. M., Grant D. M., Rabert D. K. e. a. Mutant of Chlamydomonas reinhardii with physical alterations in their chloroplast DNA//Plasmid. 1982. V. 7. P. 133-151.
228. Nessler C. L., Long R. C., Wernsman E. A. Physiological observation of extranuclear temperature — sensitive lethalitv in Nicotiana tabacum L.//Z. Pflanzen- physiol. 1980. B. 99. S. 27-35.
229. Nesvera J. Nuclear and extranuclear mutations in yeast induced by ethyl methanesulfonate//Folia microbiol. 1973. V. 18. P. 353—360.
230. Nicolas P. Sensitivity of Euglena gracilis to chloroplast inhibiting antibiotics and properties of antibiotic-resistant mutants//Plant Sei. Lett. 1981. V. 22. P. 309— 316.
231. Nicolas P., Hussein C., H e i z m a n n P. e. a. Comparative studies of chloroplastic and nuclear DNA repair abilities after ultraviolet irradiation of Euglena gracilis//Mol. and Gen. Genet. 1980. V. 178. P. 567-572.
232. Novick A., S z i 1 1 a r d L. Antimutagens//Nature. 1952. V. 170. P. 926 — 928.
233. O g u r M., OgurS., John R. Temperature dependence of the spontaneous mutation rate to respiration deficiency in Saccharomycos//Genetics. 1960. V. 45. P. 189— 194.
234. Ok a be K., Schmid G., Straub J. Genetic characterization and high efficiency photosynthesis of ar Aurea mutant of tobacco//Plant Physiol. 1977. V. 60. P. 150-156.
235. Palmer Je. Chloroplast DNA exists in two orientations//Nature. 1983. V. 301. P. 92-93.
236. P a 1 m e r Je. D., Edwards H., Jorgensen R. A. e. a. Novel evolutionary variation in transcription and location of two chloroplast genes//Nucl. Acids Res. 1982. V. 10. P. 6819-6832.
237. P a 1 m e r Je. D., S i n g h G. P., P i 11 a y D. T. N. Structure and sequence evolution of three legume chloroplast DNAs//Mol. and Gen. Genet. 1983. V. 190. P. 13—19.
238. P a 1 m e r Je. D., Z a m i r D. Chloroplast DNA evolution and phylogenetic relationships in Lycopersicon//Proc. Nat. Acad. Sei. USA. 1982. V. 79. P. 5006 — 5010.
239. Parthasarathy P., Judith S. J. Lipid composition of chloroplast membranes from weed biotypes differentially sensitive to triazine herbicides//Plant Physiol. 1981. V. 68. P. 585-587.
240. Parthier B. Light-induzierte Transformation von Proplastiden zu Chloroplasten in Algen und höheren Pflanzen//Zelldiefferenzierung. Mol. Grundlagen und Problemen. Jena, 1978. S. 210—259.
241. Parthier B. The role of phytohormonea/cytokinins in chloroplast develop- ment//Biochem. Physiol. Pflanzen. 1979. B. 174. S. 173—214.
242. Perlman Ph. S., B i r k y C. W. Mitochondrial genetics in backers yeast: a molecular mechanism for recombinational polarity and suppressiveness//Proc. Nat. Acad. Sei. USA. 1974. V. 71. P. 4612-4616.
243. Phillips A. L., Gray J. C. Location and nucleotide sequence of the gene for the 15,2 kD polypeptide of the cytochrome b/f complex from pea chloroplasts//Mol. and Gen. Genet. 1984. V. 194. P. 477-484.
244. Pierre B. Does the chloroplast control mitochondrial function?//FEBS Lett. 1981. V. 136. P. 1-2.
245. Po h I h e i m F. Nachweiss von Mischzellen in variegaten Adventivsprossen von Saintpaulia entstanden nach Behandlung isolierter Blätter mit N-nitroso-N-methylharn- stoff//Biol. Zbl. 1974. B. 93. S. 141-148.
246. Pohlheim F. Genetischer Nachweiss einer NHH-induzierten Plastommuta- t.ion bei Saintpaulia ionantha H. Wendl//BioL Rdsch. 1981. B. 19. S. 47 — 50.
247. P u t r a m e n t A., Baranowska H., E j c h a r t A. e. a. Manganese mutagenesis in yeast. VI. Mn + 2 uptake mit DNA Replication and ER induction comparison with other divalent cations//Mol. and. Gen. Genet. 1977. V. 151. P. 67 — 76.
248. Rana R. S. A radiation-induçed chimera in annual Chrysanthemum//Natur- 76
wiss. 1964. В. 51. S. 642-643.
249. Red el G. P., Plu rad S. B. Hereditary structural alterations of plastid induced by a nuclear mutator gene in Arabidopsis//Protoplasma. 1973. V. 77. P. 361—381.
250. Renner O. Der pflanzlichen Plastiden als selbstständige Elemente der genetischen Konstitution//Ber. Sachs. Akad. Wiss., math.-phys. kl. 1934. B. 86. S. 241 — 266.
251. Renner 0. Zur Kenntnis der nichtmendelndem Buntheit der Laubblätter// Flora. 1936. B. 130. S. 218-290.
252. Rhoades M. M. Plastid mutations//Cold Spring Harbor. Symp. Quant. Biol. 1946. V. 11. P. 202-207.
253. Röbbelen G. Plastommutationen nach Röntgenbestrahlung von Arabidopsis thaliana (L.) Heynh//Z. indukt. Abstamm, und Vererbungsl. 1962. B. 93. S. 25—34.
254. Rosen H., Rehn M. M., Johnson B. A. The effect of caffeine on repair in Chlamydomonas reinhardii. I. Enhancement of recombination repair//Mutat. Res. 1980. V. 70. P. 301-309.
255. Sager R., Ramanis Z. Recombination of nonchromosomal genes in Chla- mydomonas//Proc. Nat. Acad. Sei. USA. 1965. V. 53. P. 1053—1056.
256. Sehe n d el P. T., Ed i n gton В. V., McCa r th y J. G. e. a. Repair of alkylation damage in E. coli//J. Cell Biochem. 1983. Suppl. 7B. P. 162.
257. Schianger C., Sager R. Localization of five antibiotic resistance at the subunit level in chloroplast ribosomes of Chlamydomonas//Proc. Nat. Acad. Sei. USA. 1974. V. 71. P. 1715-1719.
258. Schnepf E. Types of plastids: Their development and interconversions// Chloroplast. Berlin e. a., 1980. P. 1 — 27.
259. Schot z F. Über Plastidenkonkurrenz bei Oenothera//Biol. Zbl. 1968. B. 87. S. 33-61.
260. Scott K. R., Pu twain P. D. Maternal inheritance of simazine resistance in four populations of Senecio vulgaris L.//Prot. Ecol. 1983. V. 5. P. 359—367.
261. Sedqwick B., Lindahl T. A common mechanism for repair of O6-methyl- guanidine and O6-ethylguanidine in DNA//J. Mol. Biol. 1982. V. 154. P. 169-175.
262. Ses ta к Z. Photosynthetic characteristics during ontogenesis of leaves. I. Chlo- rophylls//Photosynthetics. 1977. V. 11. V. 367—443.
263. Sheen S. J. Polyphenol content, polyphenoloxidase and peroxidase activity in certain Nicotiana species varieties and interspecific hybrids//Theor. and Appl. Genet. 1970. V. 40. P. 45-49.
264. Shumway K. L., W e i e r T. E. The chloroplast structure of iojap maize// Amer. J. Bot. 1967. V. 54. P. 773-780.
265. Singer B. Mutagenesis from a chemical perespective: nucleic acid resections, repair, translation and transcription//Mol. and Cell Meeh. Mutagenes. Proc. Symp. Gatlinburg, Tenn., 5-6 Apr. 1981. N. Y.; London, 1982. P. 1-41.
266. Smith M. Site-directed mutagenesis//Trends Biochem. Sei. 1982. V. 7. P. 440-442.
267. Spielmann A., Ortiz W., Stutz E. The soybeen chloroplast genome: construction of a circular restriction site map and location of DNA regions encoding the genes for rRNAs, the large subunit of the ribulose-1, 5-bisphosphate carboxylase and the 32 kD protein of the photosystem II reaction center//Mol. and Gen. Genet. 1983. V. 190. P. 5-12.
268. Stadler L. J. Mutations in barley induced by X-rays and radium//Science. 1928. V. 68. P. 186—187.
269. Stern D. B., Palmer Je. D. Extensive and widespread homologies between mitochondrial DNA and chloroplast DNA in plants//Proc. Nat. Acad. Sei. USA. 1984. V. 81. P. 1946-1950.
270. Stroup D. Genic induction and maternal transmission of variegation in Zea majus//J. Heredity. 1970. V. 61. P. 139-142.
271. Stubor C. W., Goodman M. M., Johnson F. M. Genetic control and racial variation of β-glucosidase isozymes in maize (Zea majus L.)//Biochem. Genet.
77
1977. V. 15. P. 383-394.
272. Surzycki S. J. Genetic functions of the chloroplast of Chlamydomonas rein- hardii: effect of rifampicin on chloroplast-DNA-dependent RNA polymerase//Proc. Nat. Acad. Sei. USA. 1969. V. 63. P. 1327-1334.
273. Surzycki S. J., Goodenough U. W., Levine R. P. e. a. Nuclear and chloroplast control of chloroplast structure and function in Chlamydomonas reinhardii// Control of organelle development. V. 24. London; Cambridge, 1970. P. 13—37.
274. Tellenbach M., Boschetti A. Isolation and characterization of photosynthetic mutants of Chlamydomonas reinhardii//Experentia. 1981. V. 37. P. 633—634.
275. Tevini M. Light, function and lipids during plastid development//Lipids and lipids polymers higher plants. Berlin e. a., 1977. P. 121 — 145.
276. Theimer R. R., Ros ni tsc her J., Wanner G. A distinct tipolytic membrane fraction from oil seed cotyledons//Plant Organelles. N. Y. e. a., 1979. P. 191.
277. Thompson J. A. Apparent identity of chromoplast and chloroplast DNA in the daffodil Narcissus pseudonarcissus//Z. Naturforsch. 1980. V. C35. P. 1101 —1103.
278. Thomson W. W., W h a 11 e y J. M. Development of nongreen plastids//Ann. Rev. Plant Physiol. California, 1980. V. 31. P. 375-394.
279. T i 1 n e y-B a s s e 11 R. A. E. The control of plastid inheritance in Pelargo- nium//Genet. Res. Comb. 1970. N. 16. P. 49-61.
280. Travis D. M., Stewart K. D., W i 1 s o n K. G. Nuclear and cytoplasmic chloroplast mutants induced by chemical mutagens in Mimulus cardinalis: genetics and ultrastructure//Theor. and Appl. Genet. 1975. V. 46. P. 67 — 77.
281. Uh rig H. Regeneration of protoplasts of dihaploid potato plant bleached by a herbicide SAN 6706//Mol. and Gen. Genet. 1981. V. 181. P. 403-405.
282. Vaklinova S., Vasileva V., Fedina I. e. a. Changes in the activity of certain enzymes of photosynthesis and photorespiration under the influence of ammonia and nitrate nitrogen in barley seedling//Proc. Acad. Sei. Bol. 1976. V. 29. P. 869—872.
283. Warwick S. L., Black L. Uniparental inheritance of atrazine resistance in Chenopodium album//Cah. J. Plant Sei. 1980. V. 60. P. 751 — 753.
284. Wehrmeyer W. Entwicklung, Bau und Funktion der Crana in Chloropla- sten//Biol. in unserer Zeit. 1972. B. 2. S. 113—119.
285. Wettstein D. V., Henningsen K. W., D o y n t o n J. E. e. a. The genetic control of chloroplast development in barley//Autonomy and biogenesis of mitochondria and chloroplasts. Amsterdam, 1971. P. 205—223.
286. Wettstein D. V., Kristiansen K. Stock list for nuclear gene mutants affecting the chloroplast//Barley Genet. Newsl. 1973. V. 3. P. 113—117.
287. Wettstein D. V., Poulsen C., Molder A. A. Ribulose-l,5-bisphosphate carboxylase as a nuclear and chloroplast marker//Problem in general genetics. Proc. XIV Intern, congress of genetics. Moscow, 1980. V. 11. B. 11. P. 224—230.
288. Wild A., Schwahn M. Die Plastiden als Trager genetischer Information// Biol. Zbl. 1973. B. 92. S. 273-305.
289. W i 1 d m a n S. G., L u-L i s o C., W o n g-S t a a 1 F. Maternal inheritance, cytology and macromolecular composition of defective chloroplasts in a variegated mutant of Nicotiana tabacum//Planta. 1972. V. ИЗ. P. 293—312.
290. W i 1 s o n R. E., S w i f t H., C h i a n g K.-S. Pigment mutant of Chlamydomonas with deformed plastids and increased levels of chloroplast nucleic acid//J. Cell Biol. 1980. V. 42. P. 127-152.
291. Wittaker P. A., Wright M. Prevention by cyclohexemide of petite mutation in yeast//Biochem. Biophys. Res. Comm. 1972. V. 48. P. 1455—1459.
292. Wolf G., Rim pa y J. Evidence for cytoplasmic control of gene expression in higher plant//Nature. 1977. V. 265. P. 470—472.
293. Wollgiehn R. Plastiden als genetischen System//Molekulare Biologie der Zelle. Jena, 1969. S. 600-609.
294. Wollgiehn R., Parthier B. RNA and protein synthesis in plastid diffe- rentation//Chloroplast. Berlin e. a., 1980. P. 97 — 145.
295. Wong-Stahl F., Wildman S. G. Identification of a mutation in chloro- 78
plast DNA correlated with formation of defective chloroplasts in a variegated mutant of Nicotiana tabacum//Planta. 1973. V. ИЗ. P. 313—326.
296. Wood N. W., Du Buy H.-C. The action of mutant chondriogene and viruses on plant cell with special reference to the plastids//Amer. J. Bot. 1951. V. 38. P. 419—434.
297. Wunderlich V., Schutt M., Böttger M. e. a. Preferential alkylation of mitochondrial deoxyribonucleic acid by N-methyl-N-nitrosourea//Biochem. J. 1970. V. 118. P. 99-109.
298. Wurtz E. A., Sear B. B., Rabert D. K. e. a. A specific increase in chloroplast gene mutations following growth of Chlamydomonas in 5-fluorodeoxyuridine// Mol. and. Gen. Genet. 1979. V. 170. P. 235-242.
299. Zacharias M., Ehrenberg L. Induction of leaf spots in loguminous plant by nucleatoxic agents//Hereditas. 1962. V. 48. P. 284 — 296.
300. Zamecnik M. V., Zamecnik P. C. Mutation of chloroplasts in Agératum, following treatment with 5-bromodeoxyurine//Exp. Cell Res. 1967. V. 45. P. 218—229.
ОГЛАВЛЕНИЕ
Введение 3
Глава I. Пластидные мутанты как генетические модели 4
§1. Непрерывность пластид 4
§2. Генетическая функция пластидной ДНК 6
§3. Молекулярная организация генома пластид 11
§4. К проблеме генетического управления фотосинтезом 15
§5. Искусственное получение мутаций хлоропластов 16
Глава II. N-нитрозо-N-метилмочевина — эффективный индуктор пластидных мутаций 17
§1. Генетическая природа индуцированных НММ хлорофилльных мутантов подсолнечника 18
§2. Доказательства пластидной природы внеядерных хлорофилльных мутаций 24
§3. Пестролистность в М1 31
§4. Специфичность мутагенного действия НММ на хлоропласты подсолнечника 33
Глава III. Некоторые факторы в исследовании механизмов образования пластидных мутаций 35
§1. Температура 36
§2. Интервал времени между окончанием обработки семянок и началом их проращивания 38
§3. Кинетин и кофеин 39
§4. Ингибиторы окислительного и белкового обмена 39
§5. Азотнокислый аммоний и пара-аминобензойная кислота 40
§6. Предполагаемые механизмы образования пластидных мутаций 43
Глава IV. Пластидные мутанты и некоторые функциональные свойства пластома 48
§1. Стерильность мутантных тканей и расщепление в потомстве пестролистных растений 48
§2. О возможном влиянии пластид на функциональную активность ядерных генов 52
§3. Устойчивость пластидных мутантов к НММ 57
§4. Пластом и адаптация растений к засухе и засолению 59
§5. Механизмы резистентности к стрессовым факторам 61
Заключение 64
Литература 66
Белецкий Юрий Дмитриевич
ИСКУССТВЕННЫЕ МУТАЦИИ ХЛОРОПЛАСТОВ У ВЫСШИХ РАСТЕНИЙ
Редактор О.Е. Шкодкина
Технические редакторы Н.И. Соловьева, Л.В. Дохненко
Корректор Г.А. Бибикова
Обложка Л.Г. Белова
Иб 1172
Изд. № 86/1985. Сдано в набор 11.01.89. Подписано к печати 30.03.89. ПК 59039. Формат 60×84 1/16. Бумага тип. № 2. Гарнитура обыкновенная новая. Печать высокая. Физ. п. л. 5,0. Усл. п. л. 4,65. Уч.-изд. л. 8,7. Тираж 800. Заказ № 14. Цена 1 р. 75 к.
Издательство Ростовского университета, 344700, Ростов-на-Дону, Пушкинская, 160.
Типография им. М.И. Калинина Ростовского областного управления но делам издательств, полиграфии и книжной торговли, 344081, Ростов-на-Дону, Советская, 57.