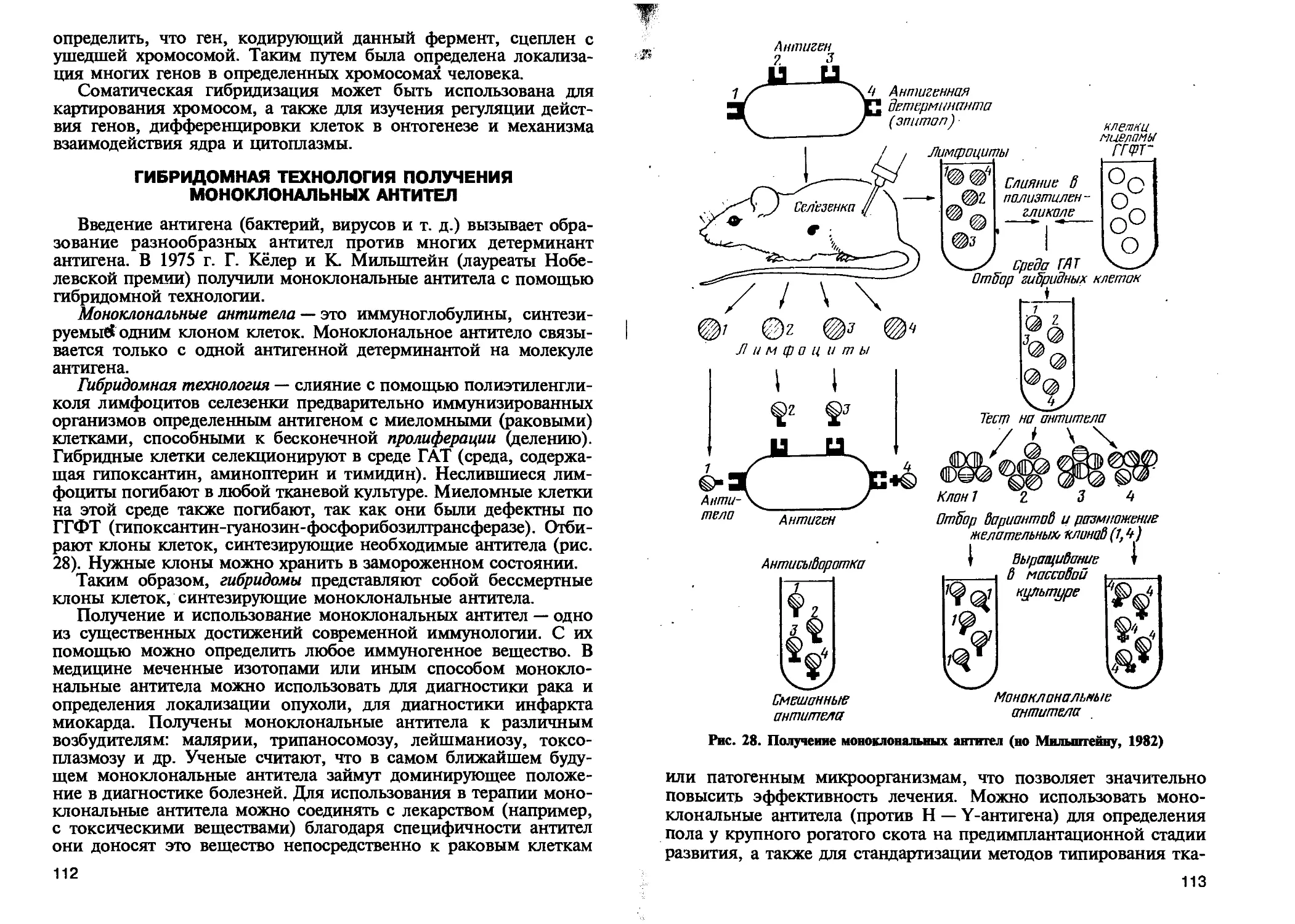
Автор: Петухов В.Л. Жигачев А.И. Назарова Г.А.
Теги: медицинские науки общие вопросы животноводства разведение и племенная работа генетика ветеринария
ISBN: 5-10-002498-4
Год: 1996
Текст
ББК 45.3я73
П31
УДК 619:636.082(075.8)
Редактор В. Н. Сайтаниди
Рецензент член-корреспондент РАСХН В. Ф. Красота
*
Петухов В. Л. и др.
П31 Ветеринарная генетика /В. Л. Петухов, А. И. Жигачев,
Г. А. Назарова. — 2-е изд., перераб. и доп. — М.: Колос,
1996. — 384 с.: ил. — (Учебники и учеб, пособия для студен-
тов высш. учеб, заведений).
ISBN 5-10-002498-4.
Рассматриваются цитологические основы наследственности, закономер-
ности наследования признаков при половом размножении, молекулярные
основы наследственности, биотехнология, мутационная изменчивость, ме-
тоды изучения изменчивости, генетика онтогенеза, иммунитета, биохими-
ческий полиморфизм, генетические аномалии, болезни с наследственной
предрасположенностью и методы селекции на резистентность к болезням.
Во второе издание (первое вышло в 1985 г.) вошли вопросы биотехнологии.
Для студентов вузов по специальности «Ветеринария».
3706000000 - 049
П----------------Без объявления ББК 45.3я73
035(01) - 96
ISBN 5—10—002498—4 © ВО «Агропромиздат», 1985
© Издательство «Колос», 1996, с дополнениями
Глава 1
ПРЕДМЕТ, МЕТОДЫ И ЗНАЧЕНИЕ ГЕНЕТИКИ
Предмет генетики. Генетика (от греч. genesis — происхожде-
ние) — наука о наследственности и изменчивости организмов.
Термин «генетика» предложил в 1906 г. У. Бэтсон. Наследствен-
ность — свойство живых существ обеспечивать материальную и
функциональную преемственность между поколениями, а также
обусловливать специфический характер индивидуального разви-
тия в определенных условиях внешней среды. Наследствен-
ность — это воспроизведение жизни (Н. П. Дубинин). Изменчи-
вость — это возникновение различий между организмами по
ряду признаков и свойств.
Наследственность, изменчивость и отбор — основа эволюции.
Благодаря им возникло огромное разнообразие живых существ
на Земле. Мутации поставляют первичный материал для эволю-
ции. В результате отбора сохраняются положительные признаки
и свойства, которые благодаря наследственности передаются из
поколения в поколение. Знание закономерностей наследствен-
ности и изменчивости способствует более быстрому созданию
нбвых пород животных, сортов растений и штаммов микроорга-
низмов.
С. М. Гершензон выделяет четыре основные теоретические
Проблемы, изучаемые генетикой:
1) хранения генетической информации (где и каким образом
закодирована генетическая информация);
2) передачи генетической информации от клетки к клетке, от
поколения к поколению;
3) реализации генетической информации в процессе онтоге-
неза;
4) изменения генетической информации в процессе мутаций.
Бурное развитие генетики связано с тем, что она открывает
возможность познания явлений жизни и намечает пути управле-
ния ею. В настоящее время генетика занимает центральное место
В Биологии. Наблюдается все более тесная интеграция генетики,
селекции, ветеринарии, биохимии и других наук. В результате
Интеграции генетики и ветеринарии возникла ветеринарная гене-
тика.
Ветеринарнаягенетика— наука, изучающая наслед-
3
ственные аномалии и болезни с наследственным предрасположе-
нием, разрабатывающая методы диагностики, генетической про-
филактики и селекции животных на устойчивость к болезням.
Задачи ветеринарной генетики следующие:
1) изучение наследственных аномалий;
2) разработка методов выявления гетерозиготных носителей
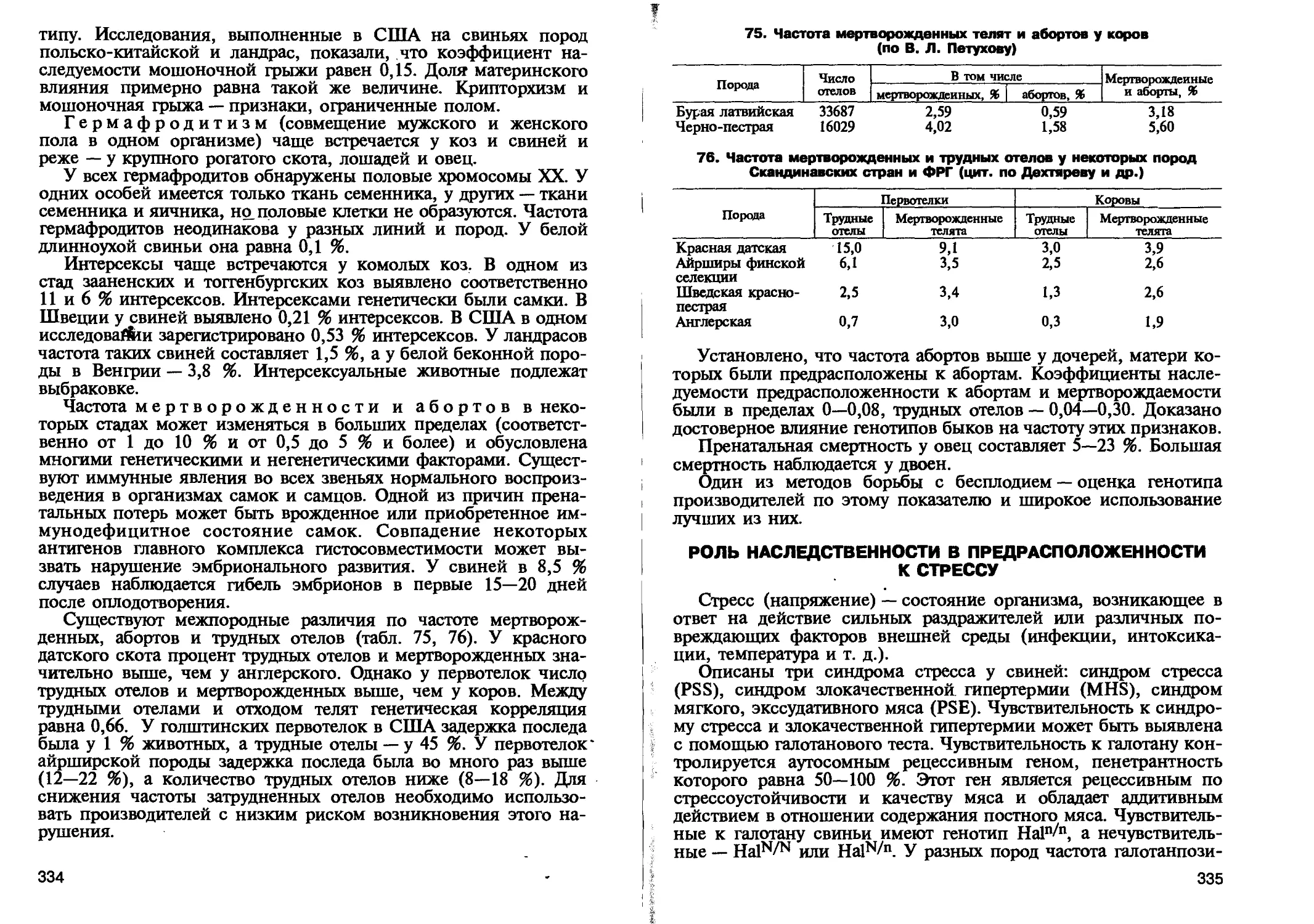
наследственных аномалий;
3) контролирование (мониторинг) распространения вредных
генов в популяциях и их элиминация;
4) цитогенетический анализ животных в связи с заболевания-
ми;
5) изучение генетики иммунитета;
6) изучение генетики патогенности и вирулентности микроор-
ганизмов, а также взаимодействие микро- и макроорганизмов;
7) изучение болезней с наследственным предрасположением;
8) разработка методов раннего выявления (т. е. маркеров) ус-
тойчивостили восприимчивости организма к болезням, в том
числе при отсутствии инфекционного фона;
9) изучение влияния вредных экологических веществ на на-
следственный аппарат животных;
10) изучение генетически детерминированных реакций живот-
ных на лекарственные препараты;
11) создание устойчивых к болезням, с низким генетическим
грузом и приспособленных к определенным условиям среды
стад, линий, типов, пород. Последние две проблемы — предмет
изучения селекционно-ветеринарной генетики;
12) использование методов биотехнологии для повышения ре-
зистентности животных к болезням и т д.
•/Методы генетики. Явления наследственности и изменчивости
на молекулярном, клеточном, организменном и популяционном
уровнях изучают, используя следующие основные методы.
Гибридологический анализ основан на использо-
вании системы скрещивания в ряде поколений для определения
характера наследования признаков и свойств. Гибридологичес-
кий анализ — основной метод генетики.
Генеалогический метод заключается в использова-
нии родословных для изучения закономерностей наследования
признаков, в том числе наследственных болезней. Этот метод в
первую очередь применяется при изучении наследственности че-
ловека и медленно плодящихся животных.
Цитогенетический метод служит для изучения
строения хромосом, их репликации и функционирования, хро-
мосомных перестроек и изменчивости числа хромосом. С помо-
щью цитогенетики выявляют разные болезни и аномалии, свя-
занные с нарушением в строении хромосом и изменением их
числа.
Популяционн о-с татистический метод приме-
4
няется при обработке результатов скрещиваний, изучении связи
между признаками, анализе генетической структуры популяций,
распространении генетических аномалий в популяциях и т. д.
Иммуногенетический метод включает серологи-
ческие методы, иммуноэлектрофорез и др., которые используют
для изучения групп крови, белков и ферментов сыворотки крови
тканей. С его помощью можно установить иммунологическую
несовместимость, выявить иммунодефициты, мозаицизм близне-
цов и т. д.
Онтогенетический метод используют для анализа
действия и проявления генов в онтогенезе при различных усло-
виях среды. Для изучения явлений наследственности и изменчи-
вости используют биохимический, физиологический и другие
методы.
Этапы развития генетики. Датой рождения генетики принято
считать 1900 г., когда Г. де Фриз, К. Корренс и Э. Чермак пере-
открыли законы Г. Менделя (1865). В развитии генетики можно
выделить три этапа:
первый (с 1900 по 1925 г.) — этап классической генетики,
в этот период были переоткрыты и подтверждены на многих
видах растений и животных законы Г. Менделя, создана хромо-
сомная теория наследственности (Т. Г. Морган);
второй (с 1926 по 1953 г.) — этап широкого развертывания
работ по искусственному мутагенезу (Г. Меллер и др.). В это
время было показано сложное строение и дробимость гена, зало-
жены основы биохимической, популяционной и эволюционной
5
генетики, доказано, что молекула
ДНК является носителем наслед-
ственной информацйи (О. Эвери
и др.), были заложены основы ве-
теринарной генетики;
третий (начиная с 1953 г.)
этап современной генетики, для
которого характерны исследова-
ния явлений наследственности на
молекулярном уровне. Была от-
крыта структура молекулы ДНК
(Ф. Крик, Дж. Уотсон), расшиф-
рован генетический код
(Ф. Крик, М. Ниренберг,
С. Очоа, Д. Маттеи и др.), хими-
ческим путем синтезирован ген
(Г. Корана).
В настоящее время успешно
развивается генетическая инжене-
рия, давшая возможность перено-
сить гены из одного организма в другой. Значительные достиже-
ния имеются в области генетики микроорганизмов, растений.
Большой вклад в развитие генетики внесли отечественные
ученые. Научные генетические школы созданы Н. К. Кольцо-
вым, Ю. А. Филипченко, Н. И. Вавиловым, А. С. Серебров-
ским. Г. А, Надсон и Г. С. Филиппов получили искусственным
путем мутации. Н. И. Вавилов сформулировал закон гомологи-
ческих рядов наследственной изменчивости. Г. Д. Карпеченко
предложил метод преодоления бесплодия у отдаленных гибридов.
А. С. Серебровский и др. показали сложное строение и дроби-
мость гена. С. С. Четвериков — основатель учения о генетике
популяций. Б. Л. Астауров на тутовом шелкопряде доказал воз-
можность искусственного регулирования пола. Большой вклад в
становление ветеринарной генетики в нашей стране внес акаде-
мик Л. К. Эрнст. В Новосибирске создан первый НИИ ветери-
нарной генетики и селекции.
Значение генетики для практики. Большое значение имеют
теоретические исследования по проблемам генетической инже-
нерии в селекции растений, микроорганизмов и животных, раз-
работке более эффективных методов и средств предупреждения
болезней и лечения животных. В большой степени от успешного
развития генетики зависят решение проблемы пищевых ресур-
сов, охрана здоровья человека и животных, борьба с наследст-
венными болезнями, охрана окружающей среды.
Фундаментальные открытия в современной генетике реализу-
ются в селекции растений, животных и микроорганизмов. За
последние годы созданы гибриды ячменя и пшеницы, ячменя и
6
ржи, выведены сорта пшеницы, способные давать более 100 ц
зерна с 1 га, высокомасличные сорта подсолнечника с содержа-
нием жира в семенах до 55 %, сорт подсолнечника, масло кото-
рого по составу сходно с оливковым. Выведены фитофтороу-
стойчивые и ракоустойчивые сорта картофеля, триплоидная са-
харная свекла и много других сортов растений. В
растениеводстве широко используется явление тотипотентнос-
ти, т. е. способности любой соматической клетки дать начало
растению. Разработан метод микроклонального размножения но-
вого сорта винограда, устойчивого к филлоксере.
Методы генетической инженерии широко применяются в био-
технологии (область научно-технического прогресса, использую-
щая биологические процессы для промышленных целей). Мето-
дом генетической инженерии во ВНИИ генетики и селекции
промышленных микроорганизмов создан промышленный штамм
кишечной палочки, продуцирующий аминокислоту I-треонин
(до 30 г/л раствора), а также штамм — продуцент витамина В2 —
рибофлавина. В Институте биоорганической химии создан
штамм кишечной палочки, синтезирующий интерферон челове-
ка. Созданы штаммы бактерий, продуцирующие аминокислоту
лизин, гормон роста человека соматотропин, бактерии, превра-
щающие целлюлозу в сахар, и т. д. Ведутся работы по введению
в пекарские дрожжи генов, кодирующих такие белки, как оваль-
бумин (белок куриного яйца) и миозин (белок мышц). Получены
штаммы бактерий, синтезирующие инсулин человека. Успешно
разрабатываются методы микробиологического синтеза вакцин и
сывороток.
В животноводстве методы генетики используют:
1) при выведении линий и пород животных, устойчивых к
болезням;
2) для уточнения происхождения животных;
3) при оценке производителей по качеству потомства;
•4) при цитогенетической аттестации производителей;
5) в пушном звероводстве;
6) для изучения влияния экологически вредных веществ на
наследственный аппарат животных и т. д.
В настоящее время генетика занимается изучением следую-
щих основных проблем:
1) проводятся обширные исследования в области генетичес-
кой инженерии с целью получения в достаточном количестве
инсулина, интерферона, антибиотиков, витаминов, незаменимых
аминокислот, кормовых и пищевых белков, биологических
средств защиты растений и т. д.;
2) решается одна из стратегических задач генетики — регуля-
, дня и управление действием генов в онтогенезе. Необходимо
выяснить пути реализации генетической информации в призна-
ках в процессе онтогенеза. Создание методов управления дейст-
7
вием генов позволит повысить продуктивность животных, резис-
тентность к болезням, подавить проявление нежелательных при-
знаков;
3) ставится задача разработать методы управления процессами
мутаций, что даст возможность получать нужные наследственные
изменения при создании новых штаммов микроорганизмов, сор-
тов растений, линий и пород животных;
4) изучается проблема регуляции пола у животных. Она пока
решена в отношении регуляции пола у шелкопряда;
5) ведутся перспективные исследования по генокопированию
у животных, т. е. пересадка в яйцеклетку, из которой удален
собственный генетический материал, ядра, взятого из соматичес-
кой клетки. Такие манипуляции уже проводят у амфибий, рыб,
мышей. Разрабатываются методы получения генетических копий
выдающихся по продуктивности и устойчивости к болезням жи-
вотных;
6) решается проблема защиты наследственности человека и
животных оу лутагенного действия радиации и химических мута-
генов среды;
7) исследуются вопросы борьбы с наследственными болезня-
ми у человека и животных, создания линий, пород, устойчивых
к болезням.
В учебнике изложены основы общей генетики, биотехноло-
гии, биометрии и ветеринарной генетики.
Контрольные вопросы. 1. Что является предметом генетики? 2. Что изучает
ветеринарная генетика? 3. Каковы основные методы изучения генетики? 4. Что
вы знаете об этапах развишм генетики? 5. Какое значение имеет генетика для
практики?
Г л а в a 2
ЦИТОЛОГИЧЕСКИЕ ОСНОВЫ
НАСЛЕДСТВЕННОСТИ
Организм животных состоит из миллиардов клеток, и все они
ведут начало от двух половых клеток {гамет) — отцовского спер-
мин и материнской яйцеклетки. При слиянии гамет — оплодо-
творении начинаются сложные процессы размножения, деления
клеток и их структур, дифференциации тканей, формирования
органов, становления видовых, породных и индивидуальных осо-
бенностей будущих телят, жеребят, поросят и т. д. Эти процессы
реализуются под строгим генетическим контролем. Существуют
материальные носители наследственности, которые локализова-
ны главным образом в ядрах клеток. Важную роль в реализации
генетической программы выполняют органоиды клетки: рибосо-
мы, митохондрии (рис. 1).
Анализ генетических структур клеток, их количественной и
качественной изменчивости составляет предмет исследований
цитогенетики. В последнее время возникло новое направле-
ние — ветеринарная цитогенетика, основная задача которой —
изучение распространения хромосомной патологии в породах
животных.
РОЛЬ ЯДРА И ЦИТОПЛАЗМЫ В НАСЛЕДСТВЕННОСТИ
Ядро — основной компонент клетки, несущий генетическую
информацию. Оно может находиться в двух состояниях: покоя —
интерфазы и деления — митоад иди мейоза. Интерфазное ядро
Представляет собой круглое образование' с многочисленными
улыбками белкового вещества, названного хроматинам. Выделя-
ют два типа хроматина: гетерохроматин и эухроматин. Первый из
них можно наблюдать в интерфазном ядре под световым, вто-
рой — только под электронным микроскопом. Гетерохроматин и
Эухроматин выполняют разные функции в генетическом контро-
'Йе биосинтеза белков.
Детальное изучение ядра под электронным микроскопом по-
казало, что хроматин состоит из очень тонких нитей, получив-
ших название хромосом. Именно в них заложена основная часть
генетической информации индивидуума.
В ядрах клеток обнаруживаются округлые тельца, называемые
9
Рис. 1. Схема строения животной клетки по данным электронной
микроскопии
ядрышками. Количество их в зависимости от типа клеток неоди-
наково. Ио современным данным, на ядрышках осуществляется
синтез рибосомной рибонуклеиновой кислоты (рРНК), а также
ядерных белков (гистонов). Участки, или районы, хромосом, где
происходит синтез рРНК, называют организаторами ядрышка.
Например, у свиней организаторы ядрышка найдены на 8^й и
10-й хромосомах. Учеными обнаружены изменчивость в ядрыш-
кообразующих районах хромосом свиней и связь этого явления с
отдельными болезнями, в частности с прогрессирующей атак-
сией и синдромом нарушения координации движений.
10
J
МОРФОЛОГИЧЕСКОЕ СТРОЕНИЕ ХРОМОСОМ
При микроскопическом анализе хромосом прежде всего
видны различия их по форме и величине. Строение каждой
хромосомы сугубо индивидуальное. Можно заметить также, что
хромосомы обладают общими морфологическими признаками.
Они состоят из двух нитей — хроматид, расположенных парал-
лельно и соединенных между собой в одной точке, названной
центромерой или первичной перетяжкой. На некоторых хромосо-
мах можно видеть и вторичную перетяжку. Она является харак-
терным признаком, позволяющим идентифицировать отдельные
хромосомы в клетке. Если вторичная перетяжка расположена
близко к концу хромосомы, то дистальный участок, ограничен-
ный ею, называют спутником. Хромосомы, содержащие спутник,
обозначаются как АТ-хромосомы. На некоторых из них в тело-
фазе происходит образование ядрышек.
Концевые участки хромосом имеют особую структуру и назы-
ваются теломерами. Теломерные районы обладают определенной
полярностью, препятствующей их соединению друг с другом при
разрывах или со свободными концами хромосом. Участок хрома-
тиды (хромосомы) от теломеры до центромеры называют плечом
хромосомы. Каждая хромосома имеет два плеча. В зависимости от
соотношения длин плеч выделяют три типа хромосом: 1) мета-
центрические (равноплечие); 2) субметацентрические (неравно-
плечие); 3) акроцентрические, у которых одно плечо очень корот-
кое и не всегда четко различимо.
На Парижской конференции по стандартизации кариотипов
вместо морфологических терминов «метацентрики» или «акро-
центрики» в связи с разработкой новых методов получения «по-
лосатых» хромосом предложена символика, в которой всем хро-
мосомам набора присваивается ранг (порядковый номер) по по-
рядку убывания величины и в обоих плечах каждой хромосомы
(р — короткое плечо, q — длинное плечо) нумеруются участки
плеч и полосы в каждом участке по направлению от центромеры.
Такая система обозначений позволяет детально описывать ано-
малии хромосом.
Наряду с расположением центромеры, наличием вторичной
перетяжки и спутника важное значение для определения отдель-
ных хромосом имеет их длина. Для каждой хромосомы опреде-
ленного набора длина ее остается относительно постоянной. Из-
мерение хромосом необходимо для изучения их изменчивости в
онтогенезе в связи с болезнями, аномалиями, нарушением вос-
производительной функции.
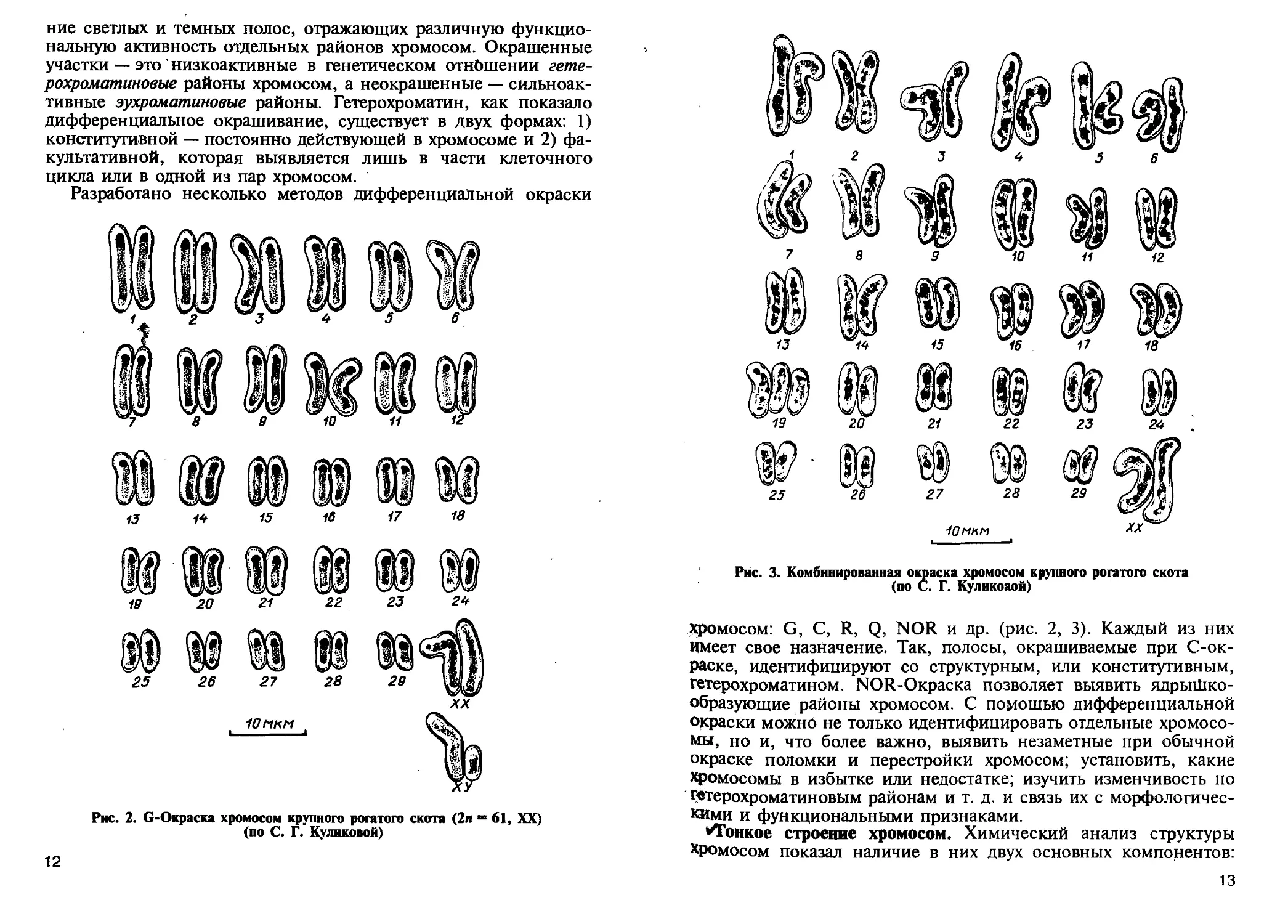
/Дифференциальная окраска хромосом. В последние годы для
более точной идентификации хромосом применяют специальные
методы обработки и окрашивания хромосом. Каждая хромосома
при этом приобретает свой специфический рисунок — чередова-
11
ние светлых и темных полос, отражающих различную функцио-
нальную активность отдельных районов хромосом. Окрашенные
участки — это низкоактивные в генетическом отношении гете-
рохроматиновые районы хромосом, а неокрашенные — сильноак-
тивные эухроматиновые районы. Гетерохроматин, как показало
дифференциальное окрашивание, существует в двух формах: 1)
конститутивной — постоянно действующей в хромосоме и 2) фа-
культативной, которая выявляется лишь в части клеточного
цикла или в одной из пар хромосом.
Разработано несколько методов дифференциальной окраски
13 /4 15 16 17 18
Рис. 2. G-Окраска хромосом крупного рогатого скота (2л = 61, XX)
(по С. Г. Куликовой)
12
Рис. 3. Комбинированная оюраска хромосом крупного рогатого скота
(по С. Г. Куликоаой)
хромосом: G, С, R, Q, NOR и др. (рис. 2, 3). Каждый из них
имеет свое назначение. Так, полосы, окрашиваемые при С-ок-
раске, идентифицируют со структурным, или конститутивным,
гетерохроматином. NOR-Окраска позволяет выявить ядрыШко-
образующие районы хромосом. С помощью дифференциальной
окраски можно не только идентифицировать отдельные хромосо-
мы, но и, что более важно, выявить незаметные при обычной
окраске поломки и перестройки хромосом; установить, какие
Хромосомы в избытке или недостатке; изучить изменчивость по
гетерохроматиновым районам и т. д. и связь их с морфологичес-
кими и функциональными признаками.
/Гонкое строение хромосом. Химический анализ структуры
хромосом показал наличие в них двух основных компонентов:
13
дезоксирибонуклеиновой кислоты (ДНК) и белков типа гистонов и
протаминов (в половых клетках). Исследования тонкой субмоле-
кулярной структуры хромосом привели ученых к выводу, что
каждая хроматида содержит одну нить — хромонему. Каждая хро-
монема состоит из одной молекулы ДНК. Структурной основой
хроматиды является тяж белковой природы. Хромонема уложена
в хроматиде в форму, близкую к спирали. Доказательства этого
предположения были получены, в частности, при изучении мель-
чайших обменных частиц сестринских хроматид, которые распо-
лагались поперек хромосомы.
КАРИОТИП И ЕГО ВИДОВЫЕ ОСОБЕННОСТИ
Анализ хромосом в клетках животных и растений разных
видов позволил выявить ряд общих закономерностей, имеющих
важное значение при изучении явлений наследственности и из-
менчивости^ Установлено, что количество хромосом в клетках
разных тка^ й одного вида одинаково. Например, у домовой
мыши подсчитывали число хромосом в клетках костного мозга,
селезенки, лимфатических узлов, печени, почек, зобной железы,
пейеровых бляшек, роговицы, эпителия кишечника; все они со-
держали по 40 хромосом. Форма и размеры хромосом в пределах
вида также постоянны. Каждая хромосома в клетке отличается от
других хромосом по внешнему строению и функциональным
особенностям, т. е. индивидуальностью, которая сохраняется от
одной генерации клеток к другой и передается от родителей к
потомкам.
В соматических клетках хромосомы парные, а набор хромо-
сом в них диплоидный (1п). Пары одинаковых по форме и вели-
чине хромосом называют гомтшгшшыми. Парность хромосом
возникает при слиянии (оплодотворении) мужской и женской
половых клеток, которые содержат гаплоидный набор хромосом
(и). Таким образом, к закономерностям строения хромосомных
наборов можно отнести постоянство числа хромосом, парность,
индивидуальность и непрерывность хромосом. Изучение хромо-
сомных наборов у самцов и самок одного вида показывает, что
различаются они только по одной паре хромосом. Их обозначают
X (икс) и Y (игрек). Другими словами, хромосомы, по-разному
представленные у двух полов и противоположно участвующие в
генетическом контроле половой дифференциации и половых
функций, называют половыми хромосомами или гоносомами; хро-
мосомы, одинаковые у разных полов, — аутосомами.
При анализе наборов хромосом в клетках разных видов были
выявлены различия по числу хромосом или их строению либо те
и другие одновременно. Совокупность количественных и струк-
турных особенностей диплоидного набора хромосом вида полу-
чила название кариотипа. По определению С. Г. Навашина, ка-
14
риотип — это структура — своеобразная формула вида. В карио-
типе заложена генетическая информация особи, изменения кото-
рой влекут за собой изменения признаков и функций организма
душной особи или ее потомства. Поэтому так важно знать осо-
бенности нормального строения хромосом,, чтобы при возмож-
ности суметь выявить изменения в кариотипе.
Для анализа хромосом важное значение имеет микрофотографи-
рование. Оно позволяет детально изучить морфологию, подсчитать
число хромосом в метафазной пластинке, измерить каждую из них.
После визуальной оценки, измерений хромосомы можно вырезать
и разложить по парам гомологов (идиограмма) в порядке убываю-
щей величины (рис. 4). В таблице 1 дана характеристика кариоти-
пов основных видов сельскохозяйственных животных.
1. Диплоидные наборы хромосом у сельскохозяйственных и некоторых
видов домашних, прирученных и лабораторных животных
1 Вид животного Число хромо- сом (2л) В том числе по форме
Аутосомы Половые хромосомы
мета- центри- ческого и субмета- центричес- кого типов акро- центри- ческого типа мета- центри- ческого и субмета- центричес- кого типов акро- центри- ческого типа
Европейский крупный рогатый 60 58 XY
скот (Bos taurus L.)
Азиатский крупный рогатый скот 60 58 X Y
Шов indicus) Каза (Carpa hircus) 60 58 Y X
Овца (Ovis aries) 54 6J 24^ 46 Y X
ДйДштяя свинья (Sus scrofa do- ЯВЯЮв) 38 12 XY
ЛЙвдь (Equus caballus) 64 26 36 X Y
Кавказский буйвол (Bubalus bubalis) 50 10 38 X, Y
Як (Bos grunniens) 60 58 XY
Верблюд двугорбый (Camelus bac- trianiM) 74 12 60 XY
Осел (Equus asinus) 62 40 20 XY
3>6p (Bison bison) 60 58 XY
ДмКпА кабан (Sus scrofa scrofa) 36 26 8 XY
Северный олень (Rangifer tarandus) 70 68 XY
Клика (Felis catus) 36
Собака (Canis) 78
(Gallus gallus domesticus) 78
•“Дейки (Meleagris gallopago) 80
(Anas platyrhynchus domesti- ff») 80
•Уем (Anser anser) 82
15
двугорбый верблюд; б — коза; в — овца; г — крупный рогатый скот; д — як; е — буйвол; ж — свинья; з — лошадь; и
плечие; А — акроцентрические хромосомы
митоз
В основе роста и дифференцировки органов и тканей живот-
ных лежит размножение клеток, смена одного клеточного поко-
ления на другое. Клетки тела, или соматические клетки, разных
поколений содержат одинаковое количество генетического мате-
риала, что обеспечивается особым механизмом деления, полу-
чившим название митоз. В процессе митоза выделяют две основ-
ные стадии — интерфазу и собственно митоз.
Интерфаза предшествует митозу. В ней выделяют три периода:
1) пресинтетический (Gi); 2) синтетический (S) и 3) постсинтети-
ческий (G2). В Gi-периоде в клетке происходит накопление белка,
РНК и других продуктов, необходимых для образования клеточных
структур и последующего деления. В течение S-периода синтезиру-
ется ДНК и происходит ауторепродукция (самоудвоение) хромо-
сом, что приводит к возникновению второй хроматиды. В (аг-пе-
риоде продолжается синтез ДНК и белков, накапливается энергия.
Время прохождения клетками разных периодов интерфазы не-
одинаково. Так, по данным Л. В. Трофимовой, клетки костного
мозга кур проходят периоды Gi, S, G2 и митоза соответственно
за 6, 7, 8 и 23 ч. ДНК в хромосомах также синтезируется с
разной скоростью. Например, у коров наибольшей^ скоростью
репликации характеризуется 14-я хромосома. Задержка в репли-
кации (синтезе) ДНК на отдельных хромосомах может быть при-
чиной возникновения патологии у животных.
Вслед за интерфазой начинается деление клетки — митоз. Вы-
деляют четыре стадии митоза: профазу, метафазу, анафазу, тело-
фазу. При изучении митоза основное внимание уделяется поведе-
нию хромосом. В профазе хромосомы представляют собой клубок
длинных тонких хроматиновых нитей. К концу этой фазы митоза
длина их уменьшается за счет спирализации примерно в 25 раз,
наблюдается также разрушение ядрышка. Предполагают, что ве-
щество ядрышка участвует в образовании веретена деления. Нити
веретена прикрепляются к центриолям, которые в этот период
уже разделились и находятся на противоположных полюсах клет-
КИ. Завершается профаза разрушением ядерной оболочки клетки.
В метафазе утолщенные спирализованные хромосомы пере-
мещаются в экваториальную плоскость клетки. В этот момент
они имеют характерную для каждой из них форму, удобную для
Цитогенетического анализа.
Началом анафазы считают момент разделения удвоенных хро-
мосом на хроматиды, которые затем расходятся к противополож-
ным полюсам клетки.
Во время телофазы сестринские хроматиды достигают проти-
воположных полюсов и деспирализуются. Так формируются два
Дочерних ядра. Наряду с делением материнского ядра происхо-
дит деление цитоплазмы, образование оболочек клеток.
17
Таким образом, в процессе митоза из одной материнской
клетки возникают две дочерние, содержащие такой же набор
хромосом, как и у исходной клетки (рис. 5). Основное биологи-
ческое значение митоза состоит в точном распределении хромо-
Рис. 5. Схема митотического деления животной клетки (по К. Вилли
и В. Детье, 1975):
А — интерфаза (стадия «покоя»); Б — ранняя профаза (центриоль разделилась); В и Г — более
поздняя профаза; Д— метафаза; Е и Ж— ранняя и поздняя анафазы; 3 — телофаза (ядерная
оболочка исчезла, началось деление цитоплазмы); / — хромосома; 2 — центромера; 3—яд-
рышко; 4 — ядро; 5 — ядерная оболочка; 6 — центриоль; 7 — звезда; 8 — веретено
18
сом между двумя дочерними клетками; тем самым сохраняются
преемственность хромосомного набора в ряду клеточных поколе-
ний и полноценность генетической информации каждой клетки,
что необходимо для осуществления общих и специфических
функций живого организма.
Патология митоза. При делении соматических клеток могут
возникать различные нарушения, связанные с повреждением
зфомосом, митотического аппарата, цитоплазмы. К числу
этих нарушений относятся задержка митоза в профазе,
нарушения спирализации и деспирализации хромосом, раннее
разделение хроматид, фрагментация и пульверизация хромосом,
задержка митоза в метафазе и др. Эти нарушения возникают
ПОД действием отдельных химических веществ, радиации,
вирусных инфекций. Так, при заражении свиней вирусом
чумы, наблюдали пульверизацию и фрагментацию (множест-
венные разрывы) хромосом.
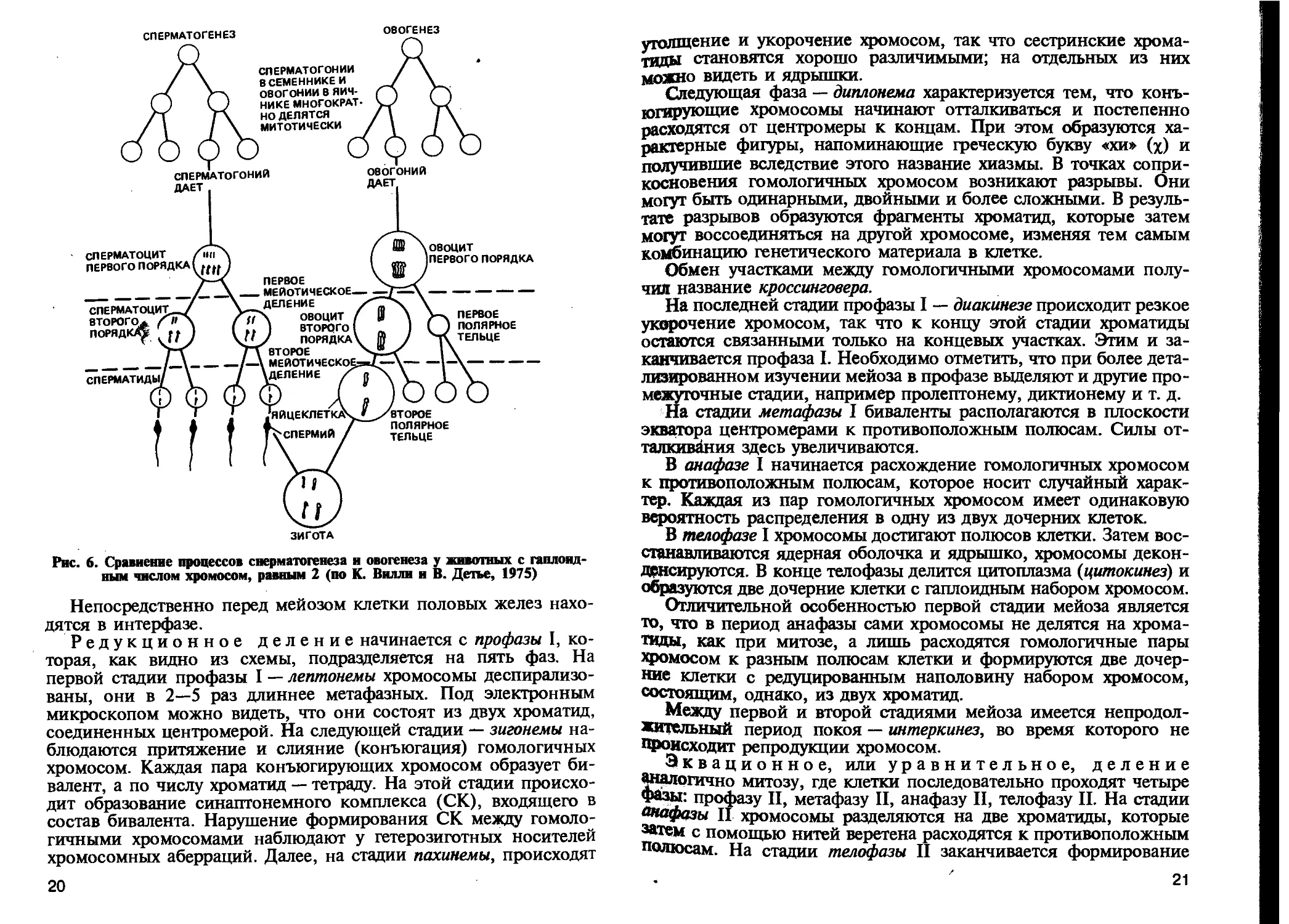
ГАМЕТОГЕНЕЗ И МЕЙОЗ
Процесс развития половых клеток носит название гаметогене-
за. У самцов этот процесс называется спермиогенезом, а у
самок — овогенезом (рис. 6). Половые клетки в развитии после-
довательно проходят следующие стадии: размножения, роста, со-
зревания и формирования. В стадии размножения клетки интен-
сивно делятся митотическим путем. В стадии роста клетки на-
капливают питательные вещества, особенно при овогенезе.
Наиболее ответственный момент с точки зрения генетики при
образовании половых клеток — мейоз — процесс редукционного
и эквационного деления ооцитов и сперматоцитов, в результате
которого образуются половые клетки с гаплоидным набором
хромосом. Рассмотрим наиболее важные моменты поведения
хромосом в мейозе. В этом процессе выделяют две стадии деле-
Йиг (см. схему): 1) редукционную и 2) эквационную.
!1Срвое редукционное деление
фазы:
* Профаза I — лептонема
Схема мейоза
Второе эквационное деление
фазы:
профаза II
зигонема
пахинема
Лч диплонема
диакинез
метафаза I
анафаза I
1 телофаза I
Образование из одной материнской
₽КИ с диплоидным набором хромо-
Я* Двух дочерних с гаплоидным набо-
РСМ Удвоенных хромосом
метафаза II
анафаза II
телофаза II
Деление хромосом на хроматиды и
образование из двух дочерних еще
двух новых клеток с гаплоидным
набором хромосом
19
ОВОГЕНЕЗ
СПЕРМАТОГЕНЕЗ
СПЕРМАТОГОНИИ
В СЕМЕННИКЕ И
ОВОГОНИИ В ЯИЧ-
НИКЕ МНОГОКРАТ-
НО ДЕЛЯТСЯ
МИТОТИЧЕСКИ
СПЕРМАТОГОНИИ
ДАЕТ
овогоний
ДАЕТ
Рис. 6. Сравнение процессов сперматогенеза и овогенеза у животных с гаплоид-
ным числом хромосом, равным 2 (по К. Вилли и В. Детье, 1975)
Непосредственно перед мейозом клетки половых желез нахо-
дятся в интерфазе.
Редукционное деление начинается с профазы I, ко-
торая, как видно из схемы, подразделяется на пять фаз. На
первой стадии профазы I — лептонемы хромосомы деспирализо-
ваны, они в 2—5 раз длиннее метафазных. Под электронным
микроскопом можно видеть, что они состоят из двух хроматид,
соединенных центромерой. На следующей стадии — зигонемы на-
блюдаются притяжение и слияние (конъюгация) гомологичных
хромосом. Каждая пара конъюгирующих хромосом образует би-
валент, а по числу хроматид — тетраду. На этой стадии происхо-
дит образование синаптонемного комплекса (СК), входящего в
состав бивалента. Нарушение формирования СК между гомоло-
гичными хромосомами наблюдают у гетерозиготных носителей
хромосомных аберраций. Далее, на стадии пахинемы, происходят
20
утолщение и укорочение хромосом, так что сестринские хрома-
тиды становятся хорошо различимыми; на отдельных из них
можно видеть и ядрышки.
Следующая фаза — диплонема характеризуется тем, что конъ-
югирующие хромосомы начинают отталкиваться и постепенно
расходятся от центромеры к концам. При этом образуются ха-
рактерные фигуры, напоминающие греческую букву «хи» (х) и
получившие вследствие этого название хиазмы. В точках сопри-
косновения гомологичных хромосом возникают разрывы. Они
могут быть одинарными, двойными и более сложными. В резуль-
тате разрывов образуются фрагменты хроматид, которые затем
могут воссоединяться на другой хромосоме, изменяя тем самым
комбинацию генетического материала в клетке.
Обмен участками между гомологичными хромосомами полу-
чил название кроссинговера.
На последней стадии профазы I — диакинезе происходит резкое
укорочение хромосом, так что к концу этой стадии хроматиды
остаются связанными только на концевых участках. Этим и за-
канчивается профаза I. Необходимо отметить, что при более дета-
лизированном изучении мейоза в профазе выделяют и другие про-
межуточные стадии, например пролептонему, диктионему и т. д.
На стадии метафазы I биваленты располагаются в плоскости
экватора центромерами к противоположным полюсам. Силы от-
талкивания здесь увеличиваются.
В анафазе I начинается расхождение гомологичных хромосом
к противоположным полюсам, которое носит случайный харак-
тер. Каждая из пар гомологичных хромосом имеет одинаковую
вероятность распределения в одну из двух дочерних клеток.
В телофазе I хромосомы достигают полюсов клетки. Затем вос-
станавливаются ядерная оболочка и ядрышко, хромосомы декон-
Дрнсируются. В конце телофазы делится цитоплазма (цитокинез) и
образуются две дочерние клетки с гаплоидным набором хромосом.
Отличительной особенностью первой стадии мейоза является
то, что в период анафазы сами хромосомы не делятся на хрома-
тиды, как при митозе, а лишь расходятся гомологичные пары
хромосом к разным полюсам клетки и формируются две дочер-
ние клетки с редуцированным наполовину набором хромосом,
состоящим, однако, из двух хроматид.
Между первой и второй стадиями мейоза имеется непродол-
жительный период покоя — интеркинез, во время которого не
Происходит репродукции хромосом.
Эквационное, или уравнительное, деление
аналогично митозу, где клетки последовательно проходят четыре
Фазы: профазу II, метафазу II, анафазу II, телофазу II. На стадии
анафазы II хромосомы разделяются на две хроматиды, которые
затем с помощью нитей веретена расходятся к противоположным
Полюсам. На стадии телофазы II заканчивается формирование
21
еще двух клеток. В результате после двух последовательных ста-
дий мейоза из каждой клетки образуются четыре новые с гапло-
идным набором хромосом. Для более наглядного представления
всех этих событий можно воспользоваться схемой мейоза, приве-
денной на рисунке 7.
г
Рис. 7. Схема последовятелных стадий мейоза (по К. Свенсону и П. Уэбстеру, 1980):
А — лептоиема, предшествующая конъюгации хромосом; Б — начало конъюгации на стадии
зигонемы; В— пахинема; Г— диплонема; Д— метафаза I; Е— анафаза I; Ж— телофаза I;
3 — интерфаза между двумя делениями мейоза; И— профаза II; К— метафаза II; Л — тело-
фаза II
22
Таким образом, в результате двух мейотических делений из
одной клетки с диплоидным набором хромосом образуются че-
тыре клетки с гаплоидным набором хромосом и в 2 раза мень-
шим, чем в соматических клетках, содержанием ДНК. Вероят-
ностный характер распределения материнских и отцовских гомо-
логичных хромосом в разные клетки позволяет создать новые
комбинации негомологичных хромосом в яйцеклетках и сперми-
ях, чем достигается огромное число новых сочетаний наследст-
венной информации.
Новые сочетания генетической информации возникают вслед-
ствие кроссинговера. Каждая из хромосом в метафазе I содержит
участки, происходящие от отцовских и материнских хромосом.
Рекомбинации хромосом при кроссинговере и вероятностное
распределение их по клеткам — причины наследственной измен-
чивости организма. Мейоз, оплодотворение и митоз обеспечива-
ют поддержание постоянства числа хромосом в смежных поколе-
ниях видов. В этом их биологическое значение.
Патология мейоза. Основная патология мейоза — нерасхожде-
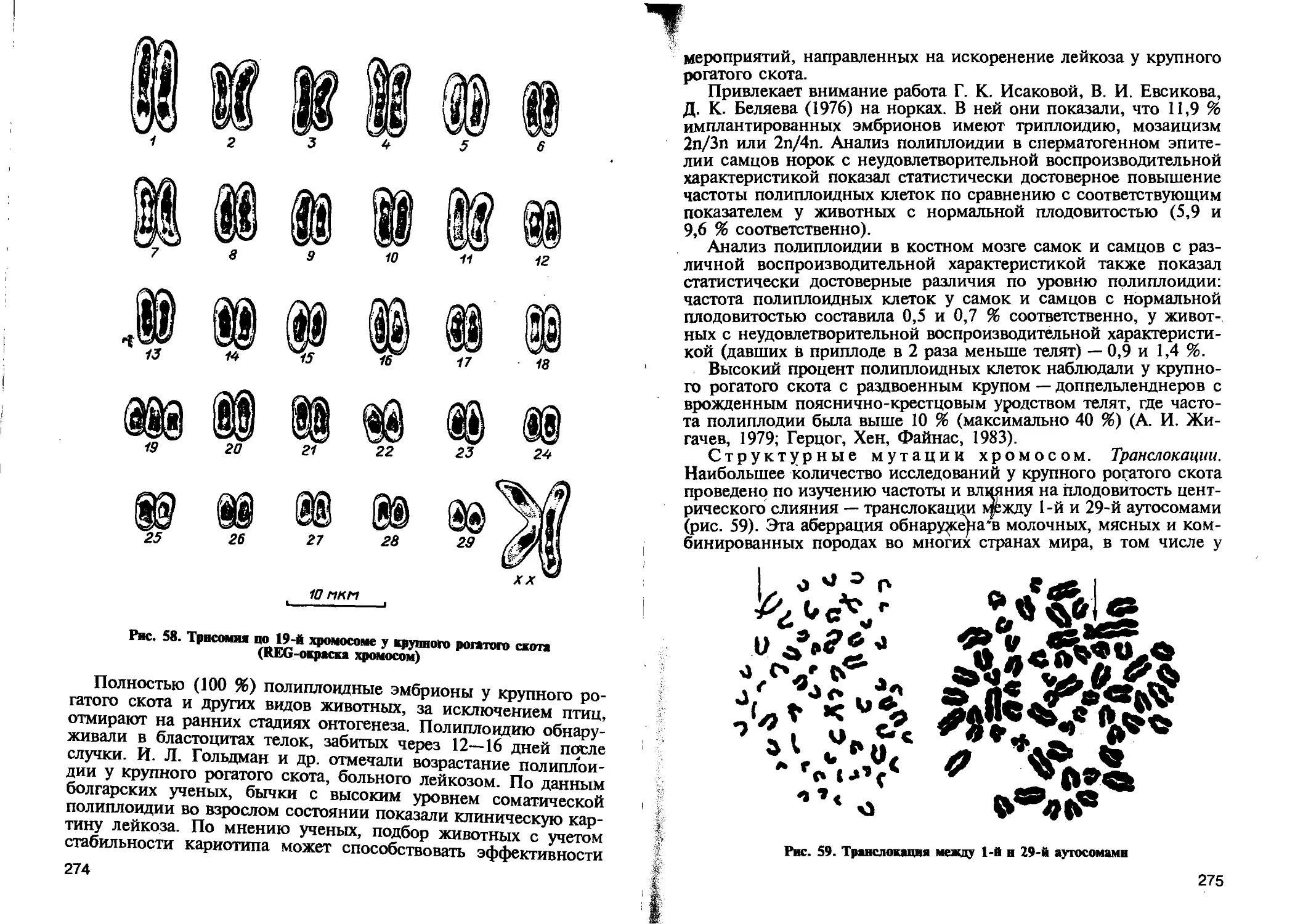
ние хромосом- Оно может быть первичным, вторичным и тре-
тичным. Первичное нерасхождение возникает у особей с нор-
мальным кариотипом. При этом на стадии анафазы I нарушается
разделение бивалентов и обе хромосомы из пары гомологов
переходят в одну клетку, что приводит к избытку хромосом в
данной клетке (л + 1) и недостатку в другой (л—1). Вторичное
нерасхождение возникает в гаметах у особей с избытком (трисо-
мией) одной хромосомы в кариотипе. В результате этого в про-
цессе мейоза образуются и биваленты, и униваленты. Третичные
нерасхождения наблюдают у особей, имеющих структурные
перестройки хромосом, например транслокации. Нерасхождение
хромосом отрицательно влияет на жизнеспособность организма
животных. Подробно об этом будет изложено в последующих
главах.
Отличительная особенность мейоза у самок — образование в
первом и втором мейотических делениях так называемых поляр-
ных телец, которые впоследствии дегенерируют и в размножении
не участвуют. Неравные деления в овогенезе обеспечивают яйце-
клетке необходимое количество цитоплазмы и запасного желтка,
чтобы она могла выжить после оплодотворения. В отличие от
спермиогенеза, который у самцов происходит как во внутриут-
робный (пренатальный) период, так и после рождения (постна-
тальный период), у самок яйцеклетка после рождения не образу-
ется. Однако к концу пренатального периода у самок накаплива-
ется огромное количество овоцитов (у коров, например, десятки
тысяч), а созревают и дают начало развитию потомства лишь
немногие из них. Этот резерв генетического материала, особенно
у малоплодных животных, таких, как крупный рогатый скот, в
настоящее время начинают использовать для искусственного
23
стимулирования созревания многих яйцеклеток, последующего
их оплодотворения и пересадки (трансплантации) специально
подготовленным коровам-реципиентам. Таким образом от одной
ценной коровы в год можно получить не одного, а несколько
телят.
Оплодотворение наступает после слияния гаплоидных сперма-
тозоида и яйцеклетки и образования диплоидной клетки — зиго-
ты, дающей начало развитию эмбриона. При делении клеток
эмбриона, содержащих хромосомы матери и отца, генетическая
информация поступает во все клетки нового организма.
Морфологические и функциональные различия хромосомных
наборов — основные причины эмбриональной смертности после
оплодотворения при скрещивании разных видов или бесплодия
гибридов. Так, при скрещивании зайца и кролика не происходит
имплантации и развития оплодотворенной яйцеклетки. Эмбрио-
нальная смертность наступает при скрещивании козы и овцы.
Мужские гибпиды осла (2 л = 62) и лошади (2л = 64), как из-
вестно, не д^к т потомства, они стерильные, или бесплодные.
Стерильность гибридов-самцов наблюдается при скрещивании
европейского крупного рогатого скота с бизоном, зубром, яком,
а также гауром и гаялом.
Это связано с тем, что у гибридов нарушаются процессы
спермиогенеза. Однако при скрещивании европейского крупного
рогатого скота с азиатским горбатым зебу, дикого кабана
(2л = 36) и домашней свиньи (2л = 38) потомство рождается
плодовитое. В результате сложных вариантов скрещиваний в
последнее время удалось получить плодовитых гибридов крупно-
го рогатого скота с зуСРом, бизоном, яком. Гибриды отличаются
такими ценными качествами, как крепкое телосложение, высо-
кая жизнеспособность, хорошие мясные признаки.
Контрольные вопросы. 1. Каковы морфологическое строение и химический
состав хромосом? 2. Что такое кариотип и каковы его особенности у разных
видов животных? 3. Что такое митоз и каково его биологическое значение?
4. Что такое гаметогенез и каковы его особенности у самцов и самок? 5. Что вы
знаете о мейозе и его биологическом значении? 6. Каковы основные формы
патологий митоза и мейоза?
Глава 3
ЗАКОНОМЕРНОСТИ НАСЛЕДОВАНИЯ ПРИЗНАКОВ
ПРИ ПОЛОВОМ РАЗМНОЖЕНИИ
Закономерности наследования признаков впервые установил
Грегор Иоганн Мендель (1822—1884). Начиная с 1856 г. в тече-'
ние восьми лет он проводил свои знаменитые, опыты по скрещи-
ванию разных сортов гороха. В 1865 г. на заседании Общества
естествоиспытателей в г. Брно Мендель выступил дважды с до-
кладами о результатах проведенных опытов, и в 1866 г. в трудах
этого Общества была напечатана его работа «Опыты над расти-
тельными гибридами». Академик Н. И. Вавилов писал: «Малень-
кая книжка Менделя является, бесспорно, одной из замечатель-
нейших биологических работ, на которой должен учиться каж-
дый биолог, каждый селекционер и исследователь. Она ценна
для нас как блестящий метод исследования важнейшего явления
жизни — наследственности».
Работа Менделя была непонята его современниками и прошла
в свое время незамеченной. Биология в тот период не была
готова к восприятию его идей. Только в 1900 г. три ботаника
(Г. де Фриз в Голландии, Э. Чермак в Австрии и К. Корренс в
Германии) на основании проведенных ими опытов почти одно-
временно пришли к законам, установленным Менделем 35 лет
назад. Ими была обнаружена работа Менделя, и с тех пор откры-
тие Менделя стало достоянием широкой научной общественнос-
ти. Закономерности, установленные Менделем, были подтверж-
дены на тысячах растительных и животных объектов.
Современное учение о наследственности покоится на откры-
тиях Менделя, и исторически возникновение генетики неизбеж-
но связывается с его именем. Мендель разработал свой гибридо-
логический метод исследования, названный впоследствии зако-
ном Менделя, который позволил ему установить четкие
закономерности в наследовании признаков.
ОСОБЕННОСТИ ГИБРИДОЛОГИЧЕСКОГО МЕТОДА МЕНДЕЛЯ
Сущность гибридологического метода заключается в следующем:
1) для скрещивания выбирают родительские формы, четко
различающиеся по одной, двум или трем парам контрастных,
альтернативных признаков. Например, у одного растения окрас-
25
ка семядолей зрелых семян желтая, у другого — зеленая, форма
семян — круглая или морщинистая и т. д. Скрещивание, в кото-
ром родители отличаются друг от друга одним признаком, в
последующем получило название моногибридного, двумя — дигиб-
ридного, многими признаками — полигибридного;
2) выбранные для скрещивания родительские формы должны
быть генетически чистыми. После двухлетнего предварительного
испытания Мендель отобрал 22 сорта гороха, которые за время
опытов ежегодно высевали и все без исключения сохраняли свою
константность;
3) Мендель ввел точный математический учет наследования
каждого отдельного признака. Наблюдению подвергают все без
исключения растения в каждом отдельном поколении. Как пра-
вило, для определения наследования признака используют гиб-
риды первого, второго и иногда третьего поколений;
4) гибриды и их потомки в каждом из следующих друг за
другом поколений не должны обнаруживать заметных наруше-
ний в плбдовитости;
5) Мендель ввел буквенное обозначение наследственных за-
датков (генов) различных признаков. Например, А — ген доми-
нантного признака, а — ген рецессивного признака.
При гибридологическом анализе довольно часто используют
реципрокное скрещивание. Реципрокным называют два скрещи-
вания, в одном из которых доминантным признаком отличается
отцовская форма, в другом — материнская: например, в одном
скрещивании отец черной масти, мать красной, в другом, наобо-
рот, мать черной масти, отец красной.
Одна из главных причин, обеспечивших успех в работе Мен-
деля, — удачный выбор объекта исследования. Горох — однолет-
нее растение, имеет много сортов с четко различающимися при-
знаками, легко культивируется, строгий самоопылитель, стро-
ение его цветка таково, что почти невозможен занос чужой
пыльцы, но при необходимости можно производить искусствен-
ное опыление.
При анализе закономерностей наследования признаков поль-
зуются некоторыми терминами и понятиями, введенными уже
после переоткрытия законов Менделя. Датский ученый В. Ио-
ганнсен в 1909 г. ввел понятия «ген», «генотип» и «фенотип».
Ген — наследственный задаток. Генотип — совокупность наслед-
ственных задатков (генов) организма. Фенотип — совокупность
всех признаков и свойств организма, доступных наблюдению и
анализу. Английский зоолог У. Бетсон ввел понятия «гомозиго-
та» и «гетерозигота». Гомозиготными называют особей, получив-
ших от отца и матери одинаковые наследственные задатки
(гены) по какому-то конкретному признаку. Гетерозигптными
называют особей, получивших от отца и матери разные гены.
Таким образом, по генотипу особи могут быть гомозиготными
26
(АА или аа) или гетерозиготными (Аа). Фенотип формируется
под влиянием генотипа и условий среды. Фенотип можно выра-
зить по определенному признаку такими словами, как рогатый
или комолый, высокий или низкий, черный или красный. На-
следственные задатки (гены) альтернативных признаков были
названы аллелями. Аллели (аллельные гены) расположены в одина-
ковых точках (локусах) парных гомологичных хромосом. Один
аллельный ген (А или а) зигота получает с яйцеклеткой от мате-
ри, другой (А или а) — со сперматозоидом от отца.
При изучении наследования признаков составляются схемы
скрещивания; скрещивание обозначают знаком умножения (х),
который ставится между родителями. При написании схем роди-
тельские формы обозначают буквой Р (от слова parentes — роди-
тели), женский пол обозначают знаком ? (символ планеты Вене-
ры), мужской — (/(символ планеты Марс). Рядом со знаками ?
и </ проставляют генотип родителя, а ниже записывают типы
производимых ими гамет (половых клеток). Затем в результате
соединения гамет родителей определяют генотип потомства. По-
лученное в результате скрещивания потомство называют гибри-
дами и обозначают буквой F (от слова filii — дети), внизу буквы
ставят цифру, указывающую, к какому поколению оно относит-
ся, например, Fj — гибрид первого поколения, F2 — второго,
F3 — третьего поколения и т. д. Мендель вел учет наследования
отдельно по каждой паре альтернативных признаков, отвлекаясь
от других различий между родительскими формами. На основа-
нии опытов Мендель установил три закона: единообразия гибри-
дов первого поколения, расщепления, независимого наследова-
ния признаков, а также правило чистоты гамет.
ЗАКОН ЕДИНООБРАЗИЯ ГИБРИДОВ ПЕРВОГО ПОКОЛЕНИЯ
Мендель избрал для анализа семь пар четко различающихся
признаков: форма семян — круглая или морщинистая, окраска
семядолей — желтая или зеленая, окраска цветков — пурпурная
или белая, рост растения — высокий или низкий, форма бобов —
выпуклая или с перехватом, окраска незрелых бобов — зеленая
или желтая, расположение цветков — пазушное или верхушеч-
ное. Мы можем сказать, что взятые для скрещивания сорта
гороха различались по фенотипу. По генотипу растения были
гомозиготными, так как принадлежали к чистым сортам и полу-
чили от своих родителей одинаковые наследственные задатки
(АА или аа). Скрещивая между собой горох с альтернативными
признаками, Мендель обнаружил, что гибриды первого поколе-
ния все одинаковы. При этом потомки были сходны только с
одним из родителей, хотя гены данного признака они получили
от обоих. Признак одного из родителей как бы исчезал.
Признак, проявившийся у потомков (гибридов) первого поко-
27
ления, Мендель назвал доминантным и наследственный задаток
(ген) этого признака обозначил большой буквой алфавита (А или
В и т. д.) Признак, оставшийся у гибрида скрытый, был назван
рецессивным и наследственный задаток его был обозначен такой
же, но малой буквой алфавита (о или b и т. д.). Таким образом,
было открыто два важнейших явления — доминантности и рецес-
сивности. Так, при скрещивании гороха с круглыми и морщи-
нистыми семенами все потомки первого поколения оказались с
круглыми семенами. Значит, круглая форма семян доминирует и
ген круглой формы можно обозначить буквой А. Морщинистая
форма не проявилась, она является рецессивной, и ген морщи-
нистой формы семян обозначается буквой а (аллельные гены
обозначаются одинаковыми буквами).
После того как было установлено, что круглая форма доми-
нантна, а морщинистая рецессивна, можно обозначить генотип
исходных родителей: с круглой формой — АА, с морщинистой —
аа. В половые клетки растений попадает только один из этих
генов. У сорта с круглой формой семян все гаметы несли ген А, у
сорта с морщинистой формой — ген а. В результате потомки Fi
получили разные гены: от одного родителя — А, от другого — а,
т. е. они были по генотипу гетерозиготны (Аа). По фенотипу по-
лученные гибриды были все одинаковы — с круглыми семенами,
независимо от того, какому растению принадлежали доминирую-
щие признаки — отцовскому или материнскому.
Р <j) АА круглые х аа морщинистые
Гаметы
Fl
Аа круглые
На основании результатов опыта было установлено, что
в первом поколении проявляются доминирование и едино-
образие потомков первого поколения. В последующем ока-
залось, что полное доминирование признаков наблюдается
не всегда. В связи с этим открытая Менделем закономерность
получила название закона единообразия гибридов первого по-
коления. Он заключается в том, что при скрещивании
гомозиготных родительских форм, различающихся по своим
признакам, первое поколение получается единообразным по
фенотипу и генотипу.
Установленная Менделем закономерность применима как
к растениям, так и к животным. Разберем это на примере
скрещивания между собой свиней белой и черной масти
28
Рис. 8. Наследование белой и черной масти у свиней при полном доминировании:
А — ген белой масти, а — ген черной масти
(рис. 8). Допустим, что гены белой (А) и черной (а) масти
расположены в одной из гомологичных пар хромосом свиньи.
Тогда белая чистопородная свиноматка, получившая от обоих
родителей гены белой масти, будет иметь обе хромосомы
с такими же генами (АА). Черный чистопородный хряк,
получивший от обоих родителей гены черной масти, будет
иметь обе хромосомы с геном черной масти (аа). В первом
поколении в соответствии с первым правилом Менделя
наблюдается единообразие — все потомки по фенотипу белые,
по генотипу гетерозиготные (Аа).
29
ЗАКОН РАСЩЕПЛЕНИЯ
В следующем опыте путем скрещивания между'собой гибри-
дов первого поколения Мендель получил второе поколение, в
котором наряду с доминирующими признаками проявились и
рецессивные. Появление во втором поколении растений и с
доминантным, и с рецессивным признаками Мендель назвал
явлением расщепления. Соотношение потомков с доминантным и
рецессивным признаками оказалось очень близким 3:1. Так, по
окраске семядолей в Fa из 8023 горошин было желтых 6022,
зеленых — 2001 (соотношение 3,01:1). Результаты были аналогич-
ны по всем семи парам изученных признаков.
На основании того, что рецессивный признак скрыт у гибри-
дов в Fi и вновь появляется в Fa (выщепляется у потомков
гибридов), Мендель делает вывод, что наследственность дискрет-
на, любой признак, по которому организмы различаются, пред-
ставлен в наследственности отдельными наследственными задат-
ками. Он выдвинул гипотезу о парности наследственных задат-
ков в организме и предположил, что половые клетки получают
один из них.
Из первого опыта нам известно, что гибриды Fi по фенотипу
имеют круглую форму, по генотипу гетерозиготны (Ла). Гетеро-
зиготные особи Fi образуют по два сорта гамет: с доминантным
геном круглой формы семян (А) и с рецессивным геном морщи-
нистой формы (а). При скрещивании гибридов Fi между собой
происходит равновероятное сочетание гамет родителей с тем или
иным геном, что и обусловливает расщепление по фенотипу 3:1
во втором поколении. Наследование признаков идет по следую-
щей схеме:
Сорта гамет
Генотип F2
Фенотип F2
<j) Аа круглые х О Аа круглые
круглые круглые круглые морщинистые
Три части потомства получат доминантный признак круглой
формы семян, одна часть — рецессивный признак морщинистой
формы. Расщепление по генотипу будет 1:2:1. Такое расщепле-
ние по генотипу было подтверждено опытами Менделя. При
самоопылении растения с рецессивным признаком дали кон-
стантное (гомозиготное) потомство (аа). Из растений с доми-
нантным признаком (круглой формы) 1/3 была константной
(ЛА), а 2/3 потомков были гетерозиготными по генотипу (Ла),
30
так как давали расщепление по фенотипу 3:1. Было выяснено,
что в основе соотношения доминантных и рецессивных призна-
ков 3:1 лежит различие в генетической основе особей второго
поколения. На основании проведенных исследований установлен
закон расщепления. Закон расщепления заключается в том, что
во втором поколении моногибридного скрещивания наблюдается
расщепление по фенотипу в соотношении 3:1, по генотипу в соот-
ношении 1:2:1 (одна часть особей, гомозиготных по доминантно-
му признаку, две части гетерозиготных и одна часть гомозигот-
ных по рецессивному признаку).
Аналогичная картина наблюдается и при анализе наследова-
ния качественных признаков у животных, например белой и
черной масти у свиней. Возвратимся к рисунку 8. Вспомним, что
потомки первого поколения обладают двумя хромосомами той
же пары, что и родители, но от матери пришла хромосома с
геном белой, от отца — с геном черной масти. Эти животные по
фенотипу белые, по генотипу гетерозиготны, так как имеют раз-
ные аллельные гены (Аа). При образовании половых клеток в
результате мейоза гомологичные хромосомы разойдутся, образуя
два сорта гамет — с геном белой масти (А) и геном черной масти
(о). При спаривании двух особей из Fi эти сорта гамет вследст-
вие равных шансов для случайной встречи в процессе оплодо-
творения свободно перекомбинируются друг с другом. В резуль-
тате во втором поколении возникает расщепление по фенотипу в
количественном соотношении 3:1, т. е. на три части потомков с
доминантным признаком белой масти приходится одна часть
потомков с рецессивным признаком черной масти. Расщепление
по генотипу составляет 1.44:2 АаЛаа, т. е. 1/4 часть потомков
гомозиготна по доминантному признаку, 2/4 гетерозиготны, 1/4
гомозиготна по рецессивному признаку.
В основе расщепления 1:2:1 по генотипу лежат следующие
биологические явления: расположение генов в хромосомах, пар-
ность хромосом в клетках организма, мейоз, обеспечивающий
гаплоидный набор хромосом в половых клетках и случайный
характер соединения любой яйцеклетки с любым сперматозои-
дом, с тем или иным геном.
АЛЛЕЛИ. МНОЖЕСТВЕННЫЙ АЛЛЕЛИЗМ
Аллельными генами (аллелями) называют гены, расположенные
в одинаковых точках (локусах) парных гомологичных хромосом.
Аллели оказывают влияние на развитие одного и того же призна-
ка организма, но выражение признака может быть разным. Hi-
пример, признак семян — форма. Но семена могут быть круглы-
ми и морщинистыми. Такие признаки, развивающиеся под кон-1
тролем аллельных генов, называются альтернативными-, ген
круглой формы семян А обусловливает круглую форму, аллель-
31
ный ген морщинистой формы а семян обусловливает морщинис-
тую форму. Различия аллелей возникают путем мутации одного
из них. Ген может изменяться и не один раз, по-разному влияя
на развитие одного и того же признака. В результате возникает
серия аллелей. Это явление получило название множественного
аллелизма. Примером серии множественных аллелей может слу-
жить окраска волосяного покрова у кроликов. У кроликов ген С,
обусловливающий образование пигмента меланина и соответст-
венно черной окраски, может мутировать в с. В этом случае
происходит как бы инактивация гена, и при переходе гена с в
гомозиготное состояние (сс) кролики становятся альбиносами.
Но ген С может изменяться неоднократно и иным образом,
обусловливая другую окраску кроликов. В этом случае образуется
серия аллелей. Чтобы показать при анализе схем скрещивания,
что гены относятся к одной серии аллелей, их обычно обознача-
ют одинаково, но с дополнительной буквой, поставленной
сверху марким шрифтом. У кроликов установлены следующие
аллели, влияющие на окраску волосяного покрова: С — черный,
с011 — шиншилла, ст — мардер, ch — гималайский, с — альбинос.
Так как каждая особь в норме имеет диплоидный набор хромо-
сом, то из серий аллельных генов у нее может быть представлен
один, если аллели одинаковы (СС, с^с011 и т. д.), или два, если
аллели разные (Сс011, Сс11, chc и т. д.). По порядку доминирова-
ния аллели в своем проявлении располагаются в последователь-
ный ряд. Знаком Обозначают доминирование стоящего перед
ним признака над всеми последующими: черный > шиншилла
> мардер > гималайский > альбинос. Серии аллелей основного
гена окраски С установлены у многих млекопитающих — мышей,
крыс, кошек, морских свинок и др. Мутация альбинизма (С->с)
обнаружена у всех млекопитающих. Целый ряд серий аллелей
генов групп крови установлен у разных видов сельскохозяйствен-
ных животных и человека.
АНАЛИЗИРУЮЩЕЕ СКРЕЩИВАНИЕ. ПРАВИЛО ЧИСТОТЫ ГАМЕТ
Мендель провел опыт по скрещиванию гибридов первого по-
коления с растениями гороха исходных родительских сортов.
Скрещивание гибридов первого поколения (Аа) с особями, сход-
ными по генотипу с родительскими формами (АА или аа), назы-
вается возвратным.
При скрещивании растений Fi (Аа) с формой, гомозиготной
по доминантному признаку (АА), все потомство по фенотипу
получилось однотипным. В этом случае все гаметы родительской
формы несли доминантный ген А, у гибридов же образовались
гаметы с генами А и а. В результате в потомстве наблюдалось
расщепление по генотипу в отношении lAa-lAA, или 1:1, в то
32
время как по фенотипу при полном доминировании все потомки
были с доминантным признаком.
При скрещивании гибридов Fi (Аа) с родительской формой с
рецессивным признаком (аа) у гибрида образовалось также два
сорта гамет с генами А и а, у родительской формы — один сорт
гамет с геном а. В потомстве получилось 50 % форм с доминант-
ным признаком (Аа) и 50 % с рецессивным (аа). Наблюдалось
расщепление по фенотипу и генотипу 1:1. Мендель обнаружил,
что в этом случае потомство как бы повторяет состав гамет
гибрида первого поколения. Это происходит потому, что фено-
тип потомка зависит от типа гамет родителя с доминантным
признаком. Если от него в зиготу к рецессивному гену а попада-
ет ген А, определяющий доминантный признак, то проявляется
его влияние и потомство будет с доминантным признаком. Если
же к гену а, определяющему рецессивный признак, присоединя-
ется такой же (а), то потомок будет с рецессивным признаком.
Скрещивание с рецессивной родительской формой (аа) полу-
чило название анализирующего. Анализирующее скрещивание
широко применяется при гибридологическом анализе, когда
нужно установить генотип интересующей нас особи. Например,
при необходимости определить гомозиготным (АА) или гетерози-
готным (Аа) является белый хряк крупной белой породы, его
скрещивают с черными свиноматками (аа). Если хряк гомозигот-
ный, то все потомки будут белыми, если он гетерозиготный, то ,
появятся и белые, и черные поросята.
На основании опытов по анализирующему скрещиванию и
скрещиванию гибридов первого поколения Мендель пришел к
выводу о том, что рецессивные наследственные задатки в гетеро-
зиготном организме остаются неизменными и вновь проявляют-
ся при встрече с такими же рецессивными наследственными
задатками. Позднее на основании этих наблюдений У. Бетсон
сформулировал правило чистоты гамет (иногда его называют
законом). Сущность правила чистоты гамет состоит в том, что у
гетерозиготной особи наследственные задатки не смешиваются
друг с другом, а передаются в половые клетки в «чистом» (неизмен-
ном) виде.
33
ОТКЛОНЕНИЯ ОТ ОЖИДАЕМОГО РАСЩЕПЛЕНИЯ,
СВЯЗАННЫЕ С ХАРАКТЕРОМ ДОМИНИРОВАНИЯ
ПРИЗНАКА И ЛЕТАЛЬНЫМИ ГЕНАМИ
Типы доминирования. Вскоре после переоткрытия законов
Менделя на животных и растениях разных видов было установ-
лено, что не все признаки проявляют полное доминирование.
Были выявлены случаи промежуточного наследования, неполно-
го доминирования, сверхдоминирования и кодоминирования.
При промежуточном наследовании потомство в
первом поколении сохраняет единообразие, но оно не похоже
полностью ни на одного из родителей, как это было при полном
доминировании, а обладает признаком промежуточного характе-
ра. Например, известно, что среди овец наряду с нормальноухи-
ми имеются и безухие. Скрещивание безухих овец (аа) с нор-
мальноухими (АА), имеющими длину уха около 10 см, дает в
первом поколении потомство (Аа) исключительно с короткими
ушами -4- около 5 см.
Иногда признак принимает не среднее выражение, а уклоня-
ется в сторону родителя с доминирующим признаком, тогда
говорят о неполном доминировании. Например, при
скрещивании коров с белыми пятнами на туловище, белыми
брюхом иконечностями с быками со сплошной окраской
получается потомство со сплошной окраской, но с небольшими
пятнами на ногах или других частях туловища.
При сверхдоминированииу гибридов первого поко-
ления проявляется гетерозис — явление превосходства потомства
над родительскими формами по жизнеспособности, энергии
роста, плодовитости и продуктивности. Сверхдоминированием в
определенной мере объясняется эффект гетерозиса, наблюдае-
мый при получении в птицеводстве трех- и четырехлинейных
гибридов.
При кодоминировании у гибридной особи в равной
мере проявляются оба родительских признака. По типу кодоми-
нирования наследуется большинство антигенных факторов до-
вольно многочисленных систем групп крови у домашних живот-
ных разных видов и человека. Так же наследуются разные типы
белков и ферментов: гемоглобин, амилаза и т. д.
Расщепление по фенотипу 3:1 во втором поколении моногиб-
ридного скрещивания наблюдается при полном доминировании
признака.
При промежуточном наследовании, неполном доминировании
и кодоминировании в результате разного характера взаимодейст-
вия аллельных генов гибриды первого поколения (Аа) отличаются
по фенотипу от родителя с доминантным признаком (АА). Отсюда
и в потомстве F1 гетерозиготные особи будут иметь свойственный
для них фенотип. В результате расщепление по фенотипу и гено-
34
типу будет одинаковым: 1:2:1. Так, при скрещивании длинноухих
и безухих овец в F1 все потомки появляются короткоухими
(рис. 9). При скрещивании их между собой (Ла х Аа) во втором
поколении одна часть потомков (АА) будет иметь уши длинные,
две части (Аа) — короткие и одна часть (аа) рождается безухими.
Таким образом, на расщепление по фенотипу во втором поколе-
нии влияет характер доминирования признака.
Летальные гены. Изменение расщепления по фенотипу в от-
ношении 3:1 во втором поколении моногибридного скрещивания
бывает связано с разной жизнеспособностью зигот Fi- Разная
Жизнеспособность зигот может быть обусловлена наличием ле-
тальных генов. Летальным называется ген, вызывающий на-
рушения в развитии организма, что приводит его к гибели или
уродству.
Рис. 9. Схема наследования безухости у овец:
А — ген длинных ушей; а — ген безухости
35
Изучение врожденных аномалий показало, что при разных
летальных генах гибель особей бывает различной и может проис-
ходить на разных стадиях развития.
По классификации, предложенной Розенбауэром (1969), гены,
вызывающие гибель 100 % особей до достижения ими половой
зрелости, называются летальными, более 50 % —субле-
тальными (полулегальными) и менее 50 % — субви-
тальными. Однако следует отметить, что разделение это до
некоторой степени условно и иногда не имеет четких границ.
Примером может служить сцепленная с полом голость у кур.
Почти половина голых цыплят гибнет в последние 2—3 дня
инкубации. Из числа вылупившихся около половины цыплят
гибнет до 6-недельного возраста, если их выращивают при тем-
пературе 32—35 °C. Но если температура в брудерах будет по-
вышена на 5,5 °C, то погибнет значительно меньше голых цып-
лят. В 4—5 мес у голых цыплят вырастает редкое оперение и они
уже в состоянии переносить довольно низкие температуры. В
естественных условиях эта мутация, по-видимому, будет леталь-
ной и приведет к 100%-ной гибели птиц. Приведенный пример
показывает, что характер проявления полулегального гена в зна-
чительной мере может зависеть от условий среды.
Летальные гены могут быть доминантными и рецессивными. В
числе первых летальных факторов был открыт аллель, обуслов-
ливающий желтую окраску мышей. Ген желтой окраски является
доминантным (У). Его рецессивный аллель (у) в гомозиготном
состоянии обусловливает появление черной окраски. Скрещива-
ние желтых мышей между собой давало в потомстве две части
особей желтых и одну часть черных, т. е. получалось расщепле-
ние 2:1, а не 3:1, как следовало из правила Менделя. Оказалось,
что все взрослые мыши гетерозиготны (Yy). При скрещивании
между собой они должны были дать одну часть гомозиготного
потомства по желтой окраске (YY), но оно погибает еще в эмб-
риональном периоде, две части гетерозигот (Yy) будут желтыми и
одна часть гомозигот по рецессивному признаку (уу) будет чер-
ной. Схема скрещивания выглядит так:
р J Yy желтые х cf Yy желтые
Гметы
YY погибает Yy желтые Yy желтые'уу черные
Таким же образом наследуется серая окраска шерсти у кара-
кульских овец (сокольских, малич и др.), платиновая окраска у
лисиц, распределение чешуи у линейных карпов и т. д.
36
Летальные гены в большинстве случаев рецессивны и поэтому
долгое время могут находиться в скрытом состоянии. Совершен-
но здоровое и нормальное по фенотипу животное может быть
носителем летального гена, действие которого обнаруживается
только при переходе в гомозиготное состояние. В гомозиготное
состояние летальные гены чаще всего переходят при родствен-
ном спаривании. В практике животноводства при разведении
лошадей был случай гибели 25 жеребят на 2—4-й день после
рождения от уродства прямой кишки — отсутствия заднепроход-
ного отверстия (Atresia ani). Оказалось, что все жеребцы и кобы-
лы, от которых рождались такие ненормальные жеребята, проис-
ходили от одного жеребца. Он был гетерозиготен по летальному
гену (LI). Вначале этот жеребец при скрещивании с нормальны-
ми кобылами (LL) дал потомство, по фенотипу нормальное, но
по генотипу половина потомков была благополучной (LL), а
половина — гетерозиготной (LI), несущей рецессивный задаток
(/) летального гена. При родственном спаривании гетерозиготных
животных (LI х Lt) появилась часть жеребят, гомозиготных по
летальному гену (It), с уродством прямой кишки. Они все погиб-
ли. (Более подробно об аномалиях при летальных генах будет
сказано в соответствующей главе.)
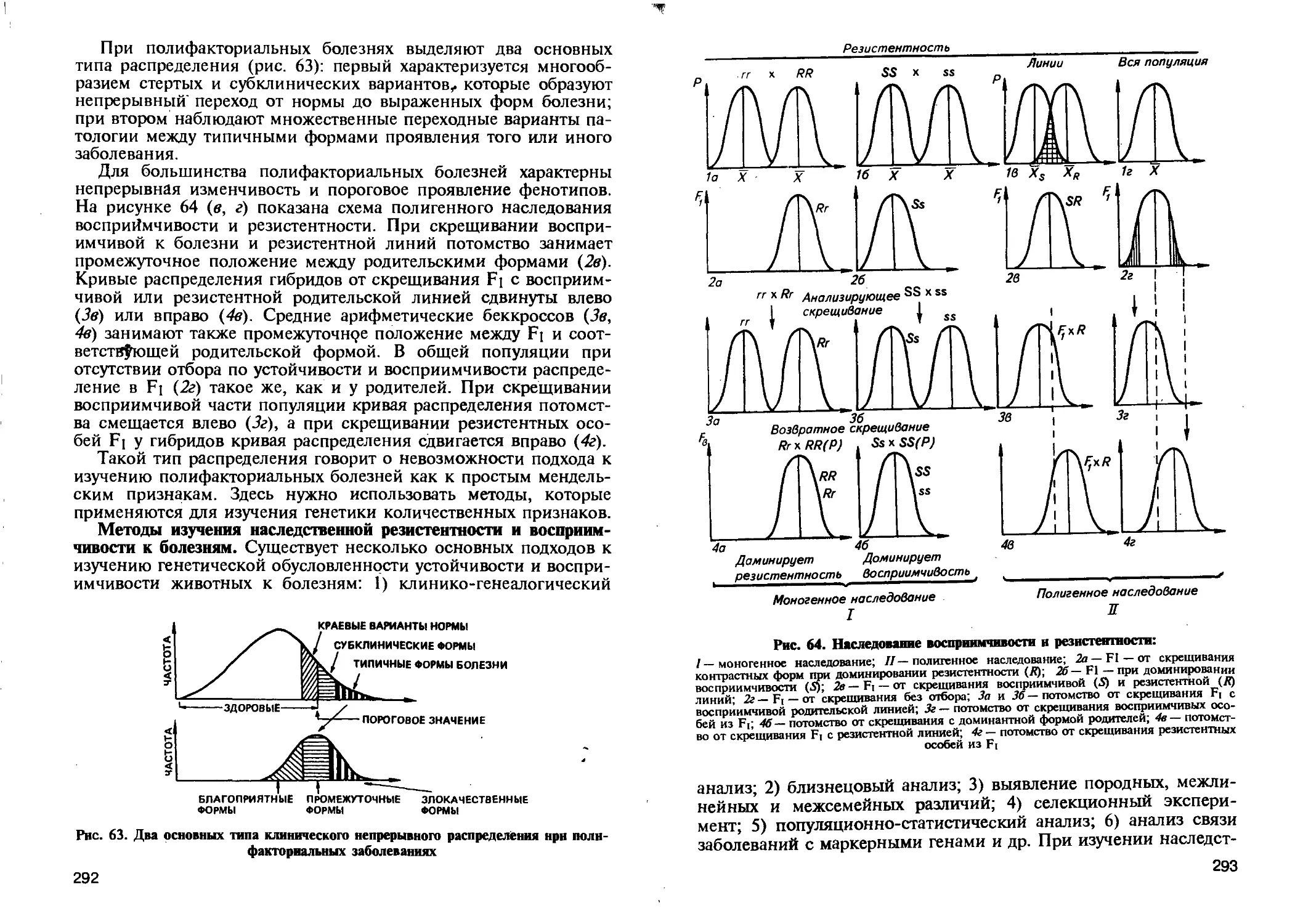
ЗАКОН НЕЗАВИСИМОГО НАСЛЕДОВАНИЯ ПРИЗНАКОВ
Установив закономерности наследования признаков при моно-
гибридном скрещивании, Мендель приступил к проведению ди-
гибридного скрещивания. Он отобрал два сорта гороха, которые
отличались по двум парам альтернативных признаков. Одна из
них определяла форму семян: круглая (АА) или морщинистая (аа),
другая — окраску: желтая (ВВ) или зеленая (bb). При опылении
растений с круглыми желтыми семенами (ААВВ) пыльцой сорта с
морщинистыми зелеными семенами (aabb) все семена гибридов
первого поколения оказались круглыми и желтыми (АаВЬ)-.
р О ААВВ круглые желтые х ааЬЬ морщинистые зеленые
Доминировали та же форма и тот же цвет семян, что и при
моногибрвдном скрещивании. При самоопылении 15 гибридных
растений из Fi с круглыми желтыми семенами (АаВЬ х АаВЬ) во
втором поколении было получено 556 семян, которые по парам
37
признаков распределились в следующем количественном соотно-
шении: круглых желтых —315, круглых зеленых — 108, морщи-
нистых желтых—101, морщинистых зелены»—32. Мендель
Принял число 32 за единицу и получил формулу расщепления по
фенотипу в F2 при дигибридном скрещивании — 9 круглых жел-
тых : 3 круглых зеленых : 3 морщинистых желтых : 1 морщинис-
тую зеленую. Подсчет отдельно по каждой паре признаков пока-
зал, что по форме 423 растения были с круглыми, 133 с морщи-
нистыми семенами, отношение, близкое 3:1; по окраске 416
растений было с желтыми и 140 с зелеными семенами, отноше-
ние также 3:1.
Расщепление по каждой паре признаков шло так же, как и
при моногибридном скрещивании. Мендель делает вывод о том,
что при дигибридном скрещивании в Fi наблюдается сочетание
двух моногибридных расщеплений. При сочетании двух моно-
гибридных расщеплений у Fi (АаВЬ) должно происходить неза-
висимое*,распределение в половые клетки аллельных генов по
одному из каждой пары. Это приведет к образованию четырех
типов гамет (АВ, Ab, аВ, ab) в равном числе.
Ниже приводится решетка, предложенная Р. Пеннетом, где
вверху по горизонтали и слева по вертикали помещены гаметы
родителей, а в центральной части — генотипы потомков F2.
Гаметы АВ М аВ ab
?
АВ ААВВ ААВЬ АаВВ АаВЬ
ЛЬ ААВЬ ААЬЬ АаВЬ Aabb
аВ АаВВ АаВЬ ааВВ ааВЬ
ab АаВЬ Aabb ааВЬ aabb
Расщепление гибридов F2 по генотипу дает 9 классов: 1Л4Й&2
АаВВ’.2ААВЬ:4АаВЬ:}ААЬЬ:2АаЬЬЛааВВ:2ааВЬЛааЬЬ. По фенотипу
образуется четыре класса в отношении: 9 частей круглых Желтых
(\AABB, 2АаВВ, 2ААВЬ, 4АаВЬ), три части круглых морщинистых
(lAAbb, 2Aabb), три части морщинистых желтых (ХааВВ, 2ааВЬ),
одна часть морщинистых зеленых (aabb).
Анализ по фенотипу показывает, что по форме семян на 12
частей круглых наблюдается 4 части морщинистых (3:1), по ок-
раске на 12 частей желтых —4 зеленых (3:1). Следовательно, во
втором поколении дигибридного скрещивания наследование по
одной паре признаков (форме семян) идет независимо от насле-
дования по другой паре (окраске семян).
У гибридов F2 наблюдается сочетание признаков во всех воз-
можных комбинациях. Появляются потомки, имеющие признаки
38
обеих родительских форм, например растения с желтыми мор-
щинистыми и зелеными гладкими семенами.
Мендель проверил путем самоопыления генотип всех расте-
ний F2 и подтвердил, что расщепление по генотипу при дигиб-
ридном скрещивании является результатом независимого комби-
нирования двух отдельных расщеплений по генотипу при моно-
гибридном скрещивании. Получение формулы расщепления
показано в таблице 2, где вверху по горизонтали дано расщепле-
ние по генотипу, определяющее форму семян, а по вертикали —
определяющее окраску семян.
2. Вывод формулы расщепления по генотипу при дигибридном
скрещивании
Расщепление По одной паре аллелей
по генотипу АЛ _1 2Лл | аа
По другой паре
аллелей
вв 1ААВВ 2АаВВ laaBB
2ВЬ 2ААВЬ 4АаВЬ 2ааВЬ
bb lAAbb 2Aabb laabb
Примечание. В центральной части таблицы показано расщепление по
генотипу одновременно по двум парам признаков. Оно имеет такой вид: 1ААВВ +
+ 2АШ + lAAbb + МаВВ + AAaBb + lAabb + laaBB + laaBb + laabb.
Мендель показал, что независимое наследование признаков
обусловлено независимым наследованием разных пар аллелей. В
основе независимого наследования разных пар аллелей (наслед-
ственных задатков) лежит независимое комбинирование хромо-
сом при образовании гамет.
Правильность своих выводов о независимом комбинировании
генов и признаков Мендель подтвердил путем проведения анали-
зирующего скрещивания. Он скрестил гибридные растения Fi с
круглыми желтыми семенами {АаВЬ) с отцовским растением,
гомозиготным по рецессивным признакам морщинистой формы
семян и зеленой их окраски {aabb). У гибрида Fi при независи-
мом комбинировании генов равновероятно образование четырех
сортов гамет {АВ, Ab, аВ, ab), у отцовского растения образуются
гаметы только одного сорта {ab). Наследование идет по следую-
щей схеме:
р О АаВЬ круглые желтые х aabb морщинистые зеленые
Гометы
39
Было получено потомство четырех фенотипов: круглые жел-
тые (АаВЬ), круглые зеленые (Aabb), морщинистые желтые
(ааВЬ), морщинистые зеленые (aabb). Потомков 'каждого типа
было получено одинаковое число — по 25 %. Так как у отцов-
ского растения половые клетки были одинаковые — ab, то рав-
ное число особей с каждым фенотипом является результатом
того, что гибриды Fi (АаВЬ) образовали половые клетки каждого
типа (АВ, Ab, аВ, ab) в равном количестве. Это возможно только
при независимом комбинировании генов.
На основании опытов по дигибридному скрещиванию был
установлен закон независимого наследования признаков (назы-
вают также — независимого наследования аллелей разных генов).
Закон независимого наследования признаков состоит в том, что
во втором поколении каждая пара аллельных генов и признаков,
определяемых ими, ведет себя независимо от других пар аллельных
генов и признаков. При этом возникают всевозможные сочетания
в определенных числовых соотношениях по фенотипу и геноти-
пу. При дигибридном скрещивании, при полном доминирова-
нии, соотношение по фенотипу будет 9:3:3:1, при тригибридном
скрещивании будет свое определенное соотношение и т. д.
Разберем пример дигибридного скрещивания применительно
к животным. Скрестим свиноматку породы ландрас белую с
висячими ушами с хряком беркширской породы черным со сто-
ячими ушами. Одна пара признаков характеризует масть (белая
или черная), другая пара — форму ушей (висячие или стоячие).
Ген доминантного признака белой масти обозначим прописной
буквой А, а аллельный ген рецессивной черной масти — строч-
ной буквой а. Ген доминирующих висячих ушей обозначим бук-
вой В, ген стоячих ушей — Ь. Допустим, что аллельные гены по
указанным парам признаков находятся в разных парах хромосом’
(рис. 10). Оба родителя гомозиготны: мать по доминантным при-
знакам белой масти и висячих ушей (ААВВ), отец по рецессив-
ным признакам черной масти и стоячих ушей (aabb). В период
образования половых клеток при мейозе из каждой пары гомо-
логичных хромосом в гамету придет только одна. Поскольку
родители гомозиготны, то у каждого из них будут все гаметы
одного типа: у свиноматки АВ, у хряка ab.
В первом поколении в соответствии с первым законом Мен-
деля все свиньи по фенотипу будут одинаковыми: белыми, с
висячими ушами, по генотипу дигетерозиготны, т. е. гетерози-
готны по обеим парам признаков (АаВЬ).
В гибридах Fi, которые получают путем спаривания животных
Fi между собой, наблюдается расщепление. Предположим, что
одна пара аллельных генов А и а находится в более длинных
гомологичных хромосомах, другая пара В и b — в более корот-
ких. В результате мейоза из каждой пары гомологичных хромо-
сом в каждую половую клетку пойдет только одна. Аллели Лиа
40
р
Ж АВ АЬ аВ ab
АВ ААВВ БЕЛЫЙ ВИСЛ. ААВЬ БЕЛЫЙ ВИСЛ. АаВВ БЕЛЫЙ ВИСЛ. АаВЬ БЕЛЫЙ ВИСЛ.
АЬ ААВЬ БЕЛЫЙ висл. ААЬЬ БЕЛЫЙ СТОЯЧЕУХ. АаВЬ БЕЛЫЙ ВИСЛ. Aabb БЕЛЫЙ СТОЯЧЕУХ.
аВ АаВВ БЕЛЫЙ ВИСЛ. АаВЬ БЕЛЫЙ ВИСЛ. ааВВ ЧЕРНЫЙ ВИСЛ. ааВЬ ЧЕРНЫЙ ВИСЛ.
ab АаВЬ БЕЛЫЙ ВИСЛ. Aabb БЕЛЫЙ СТОЯЧЕУХ ааВЬ ЧЕРНЫЙ ВИСЛ. aabb ЧЕРНЫЙ СТОЯЧЕУХ.
Рис. 10. Схема скрещивания белой с висячими ушами саиноматки с черным
со стоячими ушами хряком
разойдутся, то же самое произойдет и с аллелями В и Ь. Расхож-
дение в гаметы хромосом из каждой пары происходит независи-
мо, поэтому аллель А может уйти с равной вероятностью как в
те гаметы, куда ушел аллель В, так и в те, куда ушел аллель Ь.
Аллель а также с равной вероятностью может попасть в гаметы
41
как с аллелем В, так и с аллелем Ь. В результате как хряки, так
и свиноматки из F[ образуют по четыре сорта гамет: АВ, АЬ, аВ,
ab в равном количестве.
Каждый из спермиев может оплодотворить любую из яйце-
клеток с одинаковой вероятностью. Получается 16 возможных
сочетаний гамет отца и матери. Результаты этой случайной
встречи гамет хорошо видны при использовании решетки Пен-
нета. В верхней горизонтальной строке как заголовки записаны
типы гамет одного родителя, а слева вертикально, как заголовки
строчек, расположены типы гамет другого родителя. В каждый
квадрат на пересечении столбца и строчки записаны генотип и
фенотип потомка, определяемые исходя из сочетаний гамет, сто-
ящих в заголовках. В заголовках располагают сначала гаметы с
доминирующими генами, затем с доминирующим и рецессив-
ным и в конце с рецессивными. При записи генотипа каждого
потомка сначала располагают гены одной аллельной пары, затем
другой, радом указывают фенотип. Затем подсчитывают особей с
разными фенотипами и генотипами.
Из данных решетки видно, что в Fi среди особей с разным
фенотипом наблюдается следующее количественное соотноше-
ние: 9 частей белых с висячими ушами; 3 части белых со стоячи-
ми ушами; 3 части черных с висячими ушами; 1 часть черных со
стоячими ушами. Рассматривая каждую пару признаков отдель-
но, находим, что на 12 белых свиней приходится 4 черные
(отношение 3:1) и, с другой стороны, на 12 свиней с висячими
ушами — 4 со стоячими (отношение 3:1).
Таким образом, каждая пара признаков при наследовании
ведет себя независимо от другой пары, и только в результате их
свободного комбинирования наблюдается характерное для ди-
гибридного расщепления соотношение фенотипов в Fj — 9:3:3:1,
которое можно рассматривать как результат сочетания двух мо-
ногибридных расщеплений (3:1 и 3:1).
Расщепление по генотипу во втором поколении точно такое
же, как установил Мендель на растениях гороха.
ПОЛИГИБРИДНОЕ СКРЕЩИВАНИЕ
Положение о независимом наследовании разных пар аллелей
и признаков было подтверждено Менделем при изучении насле-
дования трех пар признаков у гороха. Он скрещивал сорт расте-
ния с круглыми семенами (Л), желтыми семядолями (5) и серо-
коричневой кожурой семян (Q с сортом, форма семян которого
морщинистая (а), семядоли зеленые (Ъ), семенная кожура белая
(с). Материнское растение имело генотип ААВВСС, отцовское —
aabbcc. Поскольку родители гомозиготны по всем трем парам
признаков, у них образуется по одному типу гамет: АВС и abc.
Гибриды Fi будут иметь генотип АаВЬСс (тригетерозигота). При
42
тригетерозиготности три пары разных аллелей находятся в трех
разных парах гомологичных хромосом. В результате независимо-
го сочетания хромосом (значит, и аллелей) из разных пар у
гибрида Fi образуется восемь сортов гамет: АВС, АВс, АЪС, аВС,
Abc, аВс, abc, abc. При самоопылении в результате случайного
сочетания гамет в F2 получается 64 комбинации, включающие 8
фенотипов.
Мендель установил, что расщепление по фенотипу при три-
гибридном скрещивании представляет собой сочетание трех не-
зависимых моногибридных расщеплений. Чем больше призна-
ков, по которым отличаются взятые для скрещивания особи, тем
сложнее расщепление и сильнее возрастает комбинативная из-
менчивость. Число возможных комбинаций гамет и число клас-
сов по фенотипу можно определить, пользуясь таблицей 3.
3. Количество фенотипов и генотипов в F2 при скрещивании родителей,
отличающихся разным числом пар признаков
(при полном доминировании)
Число пар признаков Число гамет, образующихся в Fj Число ВОЗМОЖНЫХ комбинаций гамет Число классов в Fj Пропорция полных рецессивов в f2
по фенотипу по генотипу
1 2*=2 4*=4 2*=2 3*=3 1/4
2 22=4 42=16 22=4 32=9 1/16
3 23=8 43=64 23=8 З3=27 1/64
4 24=16 44=256 24=16 34=81 1/256
п 2" 4" 2" 3" 1/4"
Для того чтобы понять, почему в пределах популяции каждого
вида животных наблюдается такое большое разнообразие в типе
телосложения, размерах, продуктивности и т. д., можно произ-
вести простые расчеты при помощи формулы 2Л. Цифра 2 пока-
зывает, что набор хромосом диплоидный, п — гаплоидное число
хромосом у определенного вида животных. Если отец и мать
гетерозиготны только по одной какой-то паре аллельных генов,
расположенных в каждой паре хромосом, то при полном доми-
нировании каждого из признаков число определяемых этими
аллелями возможных различных фенотипов у их потомков будет:
у крупного рогатого скота 230, или более миллиарда, у свиней
219, или более 500 тыс., и т. д. Но животные, очевидно, могут
отличаться друг от друга и по большему числу пар аллелей.
Поэтому потенциальные возможности комбинативной изменчи-
вости огромны, и становится понятным, почему в природе не
встречается абсолютно похожих особей, за исключением одно-
яйцевых близнецов.
Огромной заслугой Менделя является то, что в процессе
своей работы он не только установил закономерности наследова-
43
ния признаков, но и открыл основные принципы (законы) наслед-
ственности-.
1) дискретной (генной) наследственной детерминации признаков.
Этот принцип лежит в основе теории гена;
2) относительного постоянства наследственной единицы (гена)-,
3) аллельного состояния гена (доминантность и рецессивность).
,j ВЗАИМОДЕЙСТВИЕ НЕАЛЛЕЛЬНЫХ ГЕНОВ
Иногда на формирование признака влияют две или несколько
пар неаллельных генов. Проявление признака в этом случае за-
висит от характера их взаимодействия в процессе развития орга-
низма. В первом поколении появляется новый признак, которого
не было у исходных родительских форм, и соотношение феноти-
пов во втором поколении будет иным. Рассмотрим несколько
примеров различных типов взаимодействия генов.
Новообразование. Новообразованием называется такой тип
взаимодействия генов, когда при их сочетании в одном организ-
ме развивается совершенно новая форма признака. Известна,
что у кур гены розовидного и стручковидного гребня не являют-
ся аллельными. И стручковидный, и розовидный гребень доми-
нирует над листовидным. При скрещивании кур породы виан-
дот, имеющих розовидный гребень (RRcc), с петухами породы
брама со стручковидным гребнем (rrCQ у потомков первого
поколения (RrCc) в результате взаимодействия двух доминантных
генов R и С развивается новая форма гребня — ореховидная
(рис. 11). Скрещивание потомков Fi между собой ведет к полу-
чению в Fi четырех разных фенотипов в соотношении: 9 — с
генами R и С с гребнем ореховидной формы, 3Rcc — с гребнем
розовидной формы, ЗггС — со стручковидным гребнем и \rrcc —
с листовидным. Расщепление по фенотипу 9:3:3:1. В этом случае
взаимодействие неаллельных генов R и С обусловливает образо-
вание новой формы гребня, в то время как каждый из этих генов
в отдельности проявляет свой собственный эффект. Особь с
листовидным гребнем является двойным рецессивом.
Комплементарное взаимодействие генов. В том случае, когда
признак образуется при наличии двух доминантных неаллельных
генов, каждый из которых не имеет самостоятельного фенотипи-
ческого выражения, гены обозначают как комплементарные. На-
пример, при скрещивании белых минорок с белыми шелковисты-
ми курами первое поколение получается окрашенным. Для разви-
тия окраски необходимо, чтобы в организме синтезировались
тирозин — предшественник меланина и фермент тирозингидрок-
силаза, без которого пигмент не образуется. Обычно способность
синтезировать какое-либо вещество доминирует над неспособнос-
тью к его образованию. Белые минорки имеют генотип ССоо. Они
способны синтезировать тирозин, необходимый для образования
44
f2
ГАМЕТЫ
F1
ГАМЕТЫ F,
ОРЕХОВИДНЫЙ RRCC ОРЕХОВИДНЫЙ RRCc ОРЕХОВИДНЫЙ RrCC ОРЕХОВИДНЫЙ RrCc
ОРЕХОВИДНЫЙ РОЗОВИДНЫЙ ОРЕХОВИДНЫЙ РОЗОВИДНЫЙ
RRCc RRcc RrCc Rrcc
ОРЕХОВИДНЫЙ ОРЕХОВИДНЫЙ стручковидный СТРУЧКОВИДНЫЙ
RrCC RrCc ггСС ггСс
ОРЕХОВИДНЫЙ РОЗОВИДНЫЙ СТРУЧКОВИДНЫЙ листовидный
RrCc Rrcc ггСс ГГСС
U —«у
Рис. 11. Наследование формы гребня у кур при взаимодействии двух пар генов
(новообразование)
пигмента, но не способны синтезировать фермент тирозингид-
роксилазу, превращающий это вещество в пигмент. Белые шелко-
вистые куры имеют генотип ссОО. Они не способны синтезиро-
вать тирозин, но обладают способностью синтезировать фермент.
При спаривании таких кур между собой (ССоо х ссОО) Fi (СсОо)
получается окрашенным. В этом случае произошло образование
45
пигмента в результате включения в генотип птиц F1 обоих доми-
нантных генов — С (обусловливающего синтез тирозина) и О
(обусловливающего синтез фермента). Во втором поколении ок-
рашенных птиц ожидается 9 частей {С..О..), а белых — 7 частей
{C..oo—З, ccO..—З и ссоо— 1).
Белые Белые
минорки шелковистые
окрашенные
*
Гаметы^ СО Со сО СО
со ССОО окраш. ССОо акраш. СсОО окраш. СсОо окраш.
Со ССОо окраш. ССоо СсОо окраш. Ссоо 1бел1
сО СсОО окраш. СсОо окраш. ссОО l£g&] ссОо 1бел.1
со СсОо окраш. Ссоо 1бел.1 ссОо 1&&J ссоо lfeg-l
Комплементарным взаимодействием генов обусловлен, оче-
видно, особый тип паралича задних конечностей у помесных
собак, полученных от скрещивания датского дога с сенбернаром.
Генетический анализ, проведенный Стокардом, показал, что при
чистопородном разведении как у датских догов, так и у сенбер-
наров паралич не наблюдается. В то же время из 57 помесей Fi,
полученных от реципрокных скрещиваний указанных пород и
доживших до 3-месячного возраста, только 3 или 4 не имели
такого дефекта. Среди помесей Fi из 66 щенков, доживших до
3 мес, была парализована почти треть. Болезнь проявляется вне-
запно в возрасте около 3 мес. Тяжесть болезни может быть раз-
личной: от слабой парализованности до полной утраты способ-
ности к самостоятельному передвижению. Аналогичное заболе-
вание встречается у некоторых помесных собак-ищеек.
Эпистаз. При этом типе взаимодействия доминантный ген
одной пары аллелей, например ген С, подавляет действие друго-
го неаллельного доминантного гена В. При генотипе ССВВ про-
являются признаки, обусловленные геном С. Ген, подавляющий
развитие другого признака, называется эпистатичным, а подав-
ляемый — гипостатичным. Например, у лошади серая домини-
рующая масть, связанная с ранним поседением, перекрывает все
другие масти. При скрещивании серой лошади генотипа ССВВ с
46
масти. При скрещивании серой лошади генотипа ССВВ с рыжей
генотипа ccbb в Fi все потомки будут серыми с генотипом СсВЬ.
При скрещивании Fi между собой в Fi наблюдается расщепле-
ние по фенотипу: 12 серых, 3 вороные и 1 рыжая. Аллель серой
масти (Q перекрывает действие других независимых генов ок-
раски. Все лошади, имеющие в генотипе аллель С, будут серыми.
Если аллель С отсутствует, при наличии в генотипе аллеля В
лошадь будет вороной (ссВВ, ссВЬ), и лошадь с генотипом ccbb,
двойным рецессивом будет рыжей окраски (рис. 12).
Полимерия. При полимерии, или полимерном (полигонном)
наследовании, на один и тот же признак влияют несколько
разных, но сходно действующих неаллельных генов. Каждый из
них усиливает развитие признака. Такие однозначно действую-
щие гены называются аддитивными. Впервые этот тип взаимо-
действия генов установлен Нильсоном-Эле при изучении насле-
дования окраски чешуи овса и зерен пшеницы.
Рассмотрим пример наследования окраски зерен пшеницы
при взаимодействии двух пар полимерных генов. Различают две
основные окраски зерен: красную и белую. Полимерные гены,
действующие на один и тот же признак, обозначают одинаковой
буквой. Разные аллельные пары обозначают цифрами внизу
букв. Исходя из этого, генотип пшеницы с темно-красным зер-
ном будет А1А1А2А2, с белым зерном — 01010202- У первого родите-
ля образуются гаметы А1А2, у второго — аш. В результате потом-
ки Fi будут иметь генотип AiajAxh (двойная гетерозигота) и
промежуточную окраску зерен — светло-красную, так как имеет-
ся два доминантных гена (Ai и А?), влияющих на проявление
признака. Потомки первого поколения образуют по четыре сорта
гамет (А1А2, Aia2, а]Аг, aia2) и при спаривании между собой дадут
F2, в котором расщепление по фенотипу и генотипу будет таким:
из 16 частей 1 часть темно-красных (А1А1А2А2), четыре красных
(2А1А1А2О2, 2AiaiA2A2), 6 светло-красных (4AiaiA2a2, lAiAia2a2,
laiaiA2A2), 4 бледно-красных (2Aiaia2a2, 20101X202) и 1 часть белых
(01010202). В этом легко убедиться, составив решетку Пеннета.
Как видим, степень развития окраски зависит от количества
доминантных генов, влияющих на формирование этого призна-
ка. При отсутствии доминантных генов окраска зерна пшеницы
белая.
Полимерный тип взаимодействия генов имеет большое значе-
ние для понимания наследования количественных признаков.
Эти признаки не обладают фенотипической дискретностью, и их
невозможно распределить по четким фенотипическим классам.
Их оценивают с помощью количественных методов учета. К
количественным относятся признаки, характеризующие продук-
тивность животных: удой за лактацию, масса животного, настриг
шерсти, масса яйца. В некоторых случаях полигенно наследуется
резистентность к неблагоприятным условиям внешней среды.
47
св СВ сВ сВ
св серая ссвв Серая ССВВ avgSaM) Серая СсВВ Серая Сс ВВ
св Серая СсВВ Серая ССВВ Серая СсВВ Серая СсВВ
сВ Серая СсВВ -i-. . &< 4&tt & вв Вороная сс ВВ
сВ Ж Hir-TiTI Серая ССВВ Jib Серая СсоВ Вороная сс ВВ сс ВВ
Рнс. 12. Эпистаз при наследовании серой, вороной и рыжей масти у лошадей
Все эти признаки формируются под влиянием многих генов,
каждый из которых усиливает развитие признака.
Гены-модификаторы. Гены, не проявляющие собственного
действия, но усиливающие или ослабляющие эффект действия
других генов, называются генами-модификаторами. Гены-моди-
фикаторы играют, по-видимому, определенную роль в формиро-
вании у животных резистентности к инфекционным болезням.
Например, скот герефордской породы имеет белую голову, и при
пастбищном содержании в условиях сильной солнечной инсоля-
ции животные с непигментированными и слабопигментирован-
ными веками болеют раком глаз. При усилении пигментации век
частота заболевания уменьшается, а при интенсивной пигмента-
ции в тех же условиях болезнь не возникает. Оказалось, что
интенсивность пигментации кожи вокруг глаз у белоголовых жи-
вотных наследственна. Это говорит о существовании генов —
модификаторов основного гена, обусловливающего белую окрас-
ку головы. Таким образом, путем селекции можно избавиться от
заболевания глаз раком.
Экспрессивность и пенетрантность. Под экспрессивностью по-
нимают степень выраженности определенного признака. Внеш-
няя среда и гены-модификаторы могут изменить экспрессию
гена, т. е. выражение признака. Изменчивость проявления му-
тантного гена у разных особей — довольно частое явление. На-
пример, у потомства дрозофилы — мутантных «безглазых» мух с
сильно редуцированным количеством фасеток — содержание их
варьирует от почти полного отсутствия до половины нормы.
Пенетрантность гена — это доля особей, у которых проявля-
ется ожидаемый фенотип. При полной пенетрантности (100 %)
мутантный ген проявляет свое действие у каждой особи. При
неполной пенетрантности (меньше 100 %) ген проявляется фе-
нотипически не у всех особей. Экспрессивность и пенетрант-
ность гена в значительной степени зависят, по-видимому, от
влияния генов-модификаторов и условий развития особей.
Плейотропия. Эго влияние одного гена на развитие двух и
более признаков (множественное действие гена). Так, Д. К. Бе-
ляев и А. И. Железнова установили, что у норок большинство
мутаций, сопровождающихся изменением окраски волосяного
покрова, рецессивно и в силу плейотропии при этом снижаются
плодовитость и жизнеспособность животных.
Явление плейотропии объясняется тем, что гены плейотроп-
ного действия контролируют синтез ферментов, которые участ-
вуют в многочисленных обменных процессах в клетке и в орга-
низме в целом и тем самым одновременно влияют на проявле-
ние и развитие других признаков.
На основании рассмотренного действия генов-модификато-
ров, взаимодействия генов и плейотропного действия генов
можно видеть, что формирование признака — очень сложное яв-
49
ление, в котором участвует не один ген, а в определенной степе-
ни весь генотип особи. Влияние в целом генотипа на развитие
признака привело к формированию понятий «генотипическая
среда» и «генный баланс». Под генотипической средой понимают
комплекс генов организма, в котором происходит действие изу-
чаемого гена. Генный баланс — соотношение и взаимоотношение
между собой всех генов, влияющих в той или иной степени на
развитие признака.
Контрольные вопросы. 1. В чем состоят особенности гибридологического ме-
тода Менделя? 2. Что означают термины «фенотип», «генотип», «аллели», «гомо-
зиготность» и «гетерозиготность», «доминантность» и «рецессивность»? 3. В чем
сущность законов единообразия и расщепления? 4. Что такое правило чистоты
гамет? 5. С какой целью проводится анализирующее скрещивание? 6. Какое
скрещивание называется дигибридным? 7. В чем заключается закон независимого
наследования признаков? 8. Что такое летальные гены и как они наследуются?
9. Какое расщепление по фенотипу наблюдается при разных типах взаимодейст-
вия генов? 10. Что означают понятия «гены-модификаторы», «экспрессивность» и
«пенетрантность», «плейотропное действие гена»?
Глава 4
ХРОМОСОМНАЯ ТЕОРИЯ
НАСЛЕДСТВЕННОСТИ
СЦЕПЛЕННОЕ НАСЛЕДОВАНИЕ ПРИЗНАКОВ
Мы познакомились с дигибридным скрещиванием и уяснили,
ЧТО независимое комбинирование признаков объясняется тем,
что расщепление одной пары аллельных генов, определяющих
соответствующие признаки, происходит независимо от другой
дары. Однако это наблюдается только в том случае, когда гены
разных пар находятся в разных парах хромосом и при образова-
нии половых клеток гибрида в мейозе отцовские и материнские
хромосомы независимо комбинируются. Но количество хромо-
сом очень ограниченно по сравнению с количеством признаков,
каждый из которых развивается под контролем определенного
гена. Так, у дрозофилы известно около 7000 генов при четырех
парах хромосом. Предполагается, что у человека не менее
50 тыс. генов при 23 парах хромосом, и т. д. Отсюда следует, что
ц каждой паре хромосом должны быть локализованы сотни алле-
лей. Естественно, что между генами, которые находятся в одной
хромосоме, наблюдается сцепление и при образовании половых
клеток они должны передаваться вместе.
Сцепленное наследование открыли в 1906 г. английские гене-
тики У. Бэтсон и Р. Пеннет при изучении наследования призна-
ков у душистого горошка, но они не смогли вскрыть причины
этого явления. Природу сцепленного наследования в 1910 г. вы-
яснили ученые Т. Морган и его сотрудники К. Бриджес и
А. Стертевант. В качестве объекта исследования они избрали
плодовую муху дрозофилу, которая оказалась очень удобной для
генетических опытов. В клетках тела дрозофилы находится 4
пары хромосом. Она отличается очень высокой плодовитостью —
одна пара дает более ста потомков. У нее большая скорость
развития — в течение 12—15 дней после оплодотворения из яйца
развиваются личинка, куколка и взрослая особь, которая почти
сразу же способна давать потомство. Можно исследовать в тече-
ние года более двадцати поколений. Мухи серого цвета, с крас-
ными глазами, имеют маленькие размеры (около 3 мм), легко
разводятся в биологических пробирках; для изучения их призна-
ков можно пользоваться лупами. При просмотре сотен тысяч
особей Морган обнаружил множество разных мутаций: встреча-
51
лись мухи с черным и желтым телом, с белыми и другого цвета
глазами, с измененной формой и положением крыльев и т. д.
Иногда попадались особи, имеющие сразу несколько мутаций,
например черное тело, зачаточные крылья, киноварные глаза.
Изучая наследование разных пар признаков при дигибридном
и полигибридном скрещиваниях, Морган и его сотрудники обна-
ружили большое число примеров сцепленного (совместного) их
наследования. Все изученные признаки распределились на четы-
ре группы сцепления в соответствии с числом и размерами хро-
мосом у дрозофилы. На этом основании Морган сделал вывод о
том, что гены, определяющие эти признаки, находятся в хромо-
сомах. Гены, расположенные в одной хромосоме, представляют
собой группу сцепления.
Сцепление генов — это совместное наследование генов, располо-
женных в одной и той же хромосоме. Количество групп сцепления
соответствует гаплоидному числу хромосом. Например, у дрозо-
филы 4 группы сцепления, у человека 23, у крупного рогатого
скота 30, у свиней 19 и т. д.
Мысль о расположении генов в хромосомах высказал Сеттон
еще в 1902 г. Он обнаружил параллелизм в поведении хромосом
в мейозе и наследовании признаков у одного из видов кузнечика.
Дальнейшие исследования, проведенные Морганом, показали,
что сцепление генов, расположенных в одной хромосоме, может
быть полным или неполным.
Наиболее четко разница в поведении сцепленных и независи-
мо наследующихся генов выявляется при проведении анализиру-
ющего скрещивания. При независимом наследовании двух пар
признаков у гибрида Fi {АаВЬ) с равной вероятностью образуется
4 сорта гамет: АВ, Ab, аВ, ab. При скрещивании с полным
рецессивом {aabb) количество сортов гамет у гибрида обусловли-
вает число типов потомков и одинаковую вероятность их появ-
ления, так как гаметы рецессивной особи {ab) не могут изменить
проявления доминантных и рецессивных генов гамет гибрида. В
результате соотношение фенотипов потомства будет равно
1:1:1:1. Если же обе пары аллельных генов расположены в одной
паре хромосом, то при образовании половых клеток гены этих
аллелей не смогут свободно комбинироваться. В этом случае
наблюдается сцепленное наследование.
ПОЛНОЕ СЦЕПЛЕНИЕ
Т. Морган скрещивал черных длиннокрылых самок с серыми
с зачаточными крыльями самцами. У дрозофилы серая окраска
тела доминирует над черной, длиннокрылость — над зачаточны-
ми крыльями. Обозначим ген серой окраски тела В, аллельный
ему ген черной окраски тела />; ген длиннокрылое™ V, аллель-
ный ему ген зачаточных крыльев v. Обе пары этих генов нахо-
52
дятся в одной и той же второй паре хромосом. По обеим парам
признаков родительские формы были гомозиготны: самка по
рецессивному признаку черного тела (bb) и доминантному при-
знаку длиннокрылости (KF), самец по доминантному признаку
серой окраски. (ВВ) и рецессивному признаку зачаточных кры-
льев (vv). Гаметы родителей при редукционном делении получа-
ют у материнской формы хромосому с генами b и V, у отцов-
ской"— с генами В и v. Все потомство первого поколения (Fi)
имело серое тело и длинные крылья (рис. 13) и было гетерози-
готно по обеим парам признаков (bV/Bv). Затем из Fi были
отобраны самцы, которых скрестили с гомозиготными по обоим
рецессивным генам самками, черными зачаточнокрылыми
(bv/bv), т. е. было проведено анализирующее скрещивание, в
результате которого при независимом комбинировании призна-
ков должны были бы получить потомство четырех фенотипов в
Рис. 13. Наследование окраски тела и формы крыльев у дрозофилы при иодном
сцеплении:
В—серая окраска; Ь~ черная окраска; И—длинные крылья; v —короткие крылья
53
равных соотношениях: серых длиннокрылых, серых с зачаточны-
ми крыльями, черных длиннокрылых, черных с зачаточными
крыльями, но были получены потомки только-двух фенотипов,
похожих на исходные родительские формы: черные длиннокры-
лые и серые короткокрылые. В этом случае наблюдается полное
сцепление признаков. Это связано с тем, что у гетерозиготного
самца в одной и той же хромосоме из гомологичной пары распо-
ложены и ген черной окраски, и ген длинных крыльев, в дру-
гой — ген серой окраски и ген зачаточнокрылости.
При спермиогенезе в период мейоза гомологичные хромосо-
мы расходятся в разные половые клетки. Образуется только два
сорта гамет: один с хромосомой, которая несет гены b и V,
другой с хромосомой, в которой расположены гены Лиг. При
сочетании указанных гамет с гаметами особи с рецессивными
признаками и образуется потомство только двух типов. При пол-
ном сцеплении гены, расположенные в одной хромосоме, всегда пере-
даются вместе. Полное сцепление пока установлено только у
самцов дрозофилы и самок тутового шелкопряда.
НЕПОЛНОЕ СЦЕПЛЕНИЕ
В следующем опыте, так же как и в предыдущем, Морган
скрещивал черных длиннокрылых самок с серыми зачаточно-
крылыми самцами. В первом поколении получил все потомство
серое длиннокрылое. Затем снова произвел анализирующее скре-
щивание, но из первого поколения отобрал не самца, а самку и
скрестил ее с черным с зачаточными крыльями самцом (рис. 14).
В этом случае появилось потомство не двух типов, как при
полном сцеплении, а четырех: серое ст зачаточными крыльями,
черное длиннокрылое, серое длиннокрылое и черное с зачаточ-
ными крыльями, но не в равных соотношениях, как при незави-
симом комбинировании признаков, а со значительным преобла-
данием фенотипов, сходных с родительскими формами. 41,5 %
мух было серых с зачаточными крыльями, как у одного исходно-
го родителя, и 41,5 % особей черных длиннокрылых, как у дру-
гого исходного родителя. Только 17 % потомков родилось с
новым сочетанием признаков: 8,5 % черных с зачаточными кры-
льями и 8,5 % серых длиннокрылых. Таким образом, 83 % по-
томков имели сочетание признаков, как у исходных родитель-
ских форм, но появились особи и с новым сочетанием призна-
ков. Следовательно, сцепление является неполным.
! Встал вопрос: почему появились особи с новой комбинацией
родительских признаков? Для объяснения этого явления Морган
использовал и развил теорию хиазмотипии бельгийского цитолога
Янсенса. В 1909 г. Янсене наблюдал, что при спермиогенезе у
саламандры в профазе мейоза гомологичные хромосомы конъ-
югируют, а затем, при начале расхождения, образуют фигуры в
54
т
ЧЕРНЫЕ СЕРЫЕ С
ДЛИННО- ЗАЧАТОЧНЫМИ
КРЫЛЫЕ КРЫЛЬЯМИ
ЧЕРНЫЕ С
ЗАЧАТОЧНЫМИ
КРЫЛЬЯМИ
СЕРЫЕ
ДЛИННО-
КРЫЛЫЕ
41,5%
В,5%
В,5%
415%
Рис. 14. Наследование окраски тела и формы крыльев у дрозофилы
при неполном сцеплении:
В — серая окраска; Ь — черная окраска; И—длинные крылья; v —короткие крылья
виде греческой буквы «хи» (х), откуда это явление и получило
название хиазмотипии, а фигуры перекреста хромосом — назва-
ние хиазм. Морган на основании этих наблюдений Янсенса вы-
сказал гипотезу о том, что при образовании хиазм гомологичные
55
хромосомы обмениваются участками. Если сцепленные гены лежат
в одной хромосоме и у гетерозигот при образовании гамет проис-
ходит рекомбинация этих генов, значит, гомологичные хромосо-
мы во время мейоза обменялись своими частями. Обмен гомоло-
гичных хромосом своими частями называется перекрестом или крос-
синговером (английское слово crossingover означает образование
перекреста). Особей с новыми сочетаниями признаков, образо-
вавшимися в результате кроссинговера, называют кроссоверами.
Вернемся к рисунку 14. У самки Fi, гетерозиготной по обеим
парам признаков, в одной из гомологичных хромосом располо-
жены гены b и V, в другой — аллельные им гены В и v. В
профазе редукционного деления, когда две гомологичные хромо-
сомы соединились в один бивалент, каждая из хромосом удвоена
и состоит из двух хроматид. Всего будет 4 хроматиды. Между
двумя хроматидами гомологичных хромосом и происходит обмен
их частями. В результате ген Ь, расположенный в хроматиде
одной гомологичной хромосомы, может соединиться с геном v,
расположенным в хроматиде другой гомологичной хромосомы, и
как результат одного события образуется вторая хроматида, где
соединятся гены Л и И В дальнейшем хроматиды разойдутся и
образуются кроссоверные гаметы с хромосомами с новым соче-
танием генов (bv и BV).
Две другие хроматиды из пары гомологичных хромосом не
участвуют в перекресте и сохраняют в первоначальном сочетании
материнские (bV) и отцовские (Bv) гены. Образование новых
кроссоверных гамет обеспечило появление дрозофил с новым
сочетанием признаков: черных с зачаточными крыльями и серых
длиннокрылых. Одна!::. большая часть потомков будет сходна с
исходными родителями (черные длиннокрылые и серые коротко-
крылые). Морган приходит к выводу, что количество появления
новых форм зависит от частоты перекреста, которая определяет-
ся по следующей формуле:
Частота перекреста —
Число кроссоверных форм 100
Общее число потомков
Если, например, общее число потомков 900, а новых кроссо-
верных форм 180, то частота перекреста будет составлять 20 %.
Морган установил, что частота перекреста между определенной
парой генов — относительно постоянная величина, но различная для
разных пар генов. На основании этого был сделан вывод о том,
что по частоте перекреста можно судить о расстояниях между
генами. За единицу измерения перекреста принята его величина,
равная 1 %. Иногда ее называют морганидой. Величина перекреста
зависит от расстояния между изучаемыми генами. Чем больше
отдалены гены друг от друга, тем чаще происходит перекрест;
чем ближе они расположены, тем вероятность перекреста мень-
ше. Установлено, что количество кроссоверных особей к общему
56
числу потомков никогда не превышает эи 7с, так как при июпь
больших расстояниях между генами чаще происходит двойной
кроссинговер и часть кроссоверных особей остается неучтенной.
Их можно учесть при изучении не двух пар сцепленных призна-
ков, а трех или четырех. В этом случае, учитывая двойные и
тройные перекресты, можно точнее судить о расстояниях и час-
тоте перекреста между генами.
СОМАТИЧЕСКИЙ (МИТОТИЧЕСКИЙ) КРОССИНГОВЕР
Сущность соматического кроссинговера заключается в том, что
он осуществляется при митотическом делении соматических кле-
ток главным образом эмбриональных тканей. Кроссинговер проис-
ходит между двумя несестринскими хроматидами гомологичных
хромосом.
У гетерозиготных особей наблюдаются отклонения в проявле-
нии нормальных признаков. Явление соматического кроссинго-
вера было предсказано А. С. Серебровским в 1922 г. при анализе
причин появления исключительных перьев у кур. В 1936 г. сома-
тический кроссинговер обнаружил К. Штерн у дрозофилы. Он
исследовал самок серых с нормальными щетинками, но гетеро-
зиготных (АаВЬ) по рецессивным генам желтой окраски тела (а)
и опаленных щетинок (Ь). На теле некоторых серых с нормаль-
ными щетинками мух наблюдались двойные пятна. Половина
пятна желтая с нормальными щетинками и половина серая, но с
опаленными щетинками. Появление двойных пятен К. Штерн
объяснил митотическим кроссинговером, в результате которого
образуется часть клеток, гомозиготных по желтой окраске тела
(аа), и часть, гомозиготных по опаленным щетинкам (ЬЬ). Эти
клетки становятся родоначальницами при образовании участков
тела с желтой окраской и нормальными щетинками и с нормаль-
ной серой окраской и опаленными щетинками. В этом случае
проявляется действие рецессивных генов, оказавшихся в гомози-
готном состоянии. Таким образом, осуществление кроссинговера
в соматических клетках ведет к появлению мозаиков.
Кроссинговер иногда происходит и на стадии размножения
при образовании половых клеток, когда гонии еще имеют дипло-
идное число хромосом. В этом случае процент кроссоверных
гамет может быть очень высоким.
Частота митотического кроссинговера ниже мейотического,
однако его также можно использовать для генетического карти-
рования. Соматический кроссинговер имеет место у животных,
растений и человека.
Факторы, влияющие на кроссинговер. На кроссинговер могут
заметно влиять условия внешней среды и генотипические факто-
ры. Обнаружены гены, выполняющие роль запирателей кроссин-
говера, и гены, повышающие его частоту. В третьей хромосоме
57
дрозофилы выявлена мутация, которая прекращает процесс крос-
синговера во всех парах хромосом. В качестве запирателей крос-
синговера могут выступать некоторые перестройки хромосом.
Чаще всего это бывает связано с инверсией (переворачиванием)
того или иного участка в одной из гомологичных хромосом.
На частоту кроссинговера могут влиять радиация, химические
мутагены, концентрация солей, гормоны, лекарства. В большин-
стве случаев при воздействии этих факторов частота перекреста
повышается.
Нормальный перекрест хромосом может изменяться в зависи-
мости от температуры, возраста, пола особи. Так, у тутового шел-
копряда кроссинговер идет только у самцов и не бывает у самок.
У дрозофилы кроссинговер наблюдается только у самок, однако
оказалось, что при рентгеновском облучении можно вызвать его и
у самцов. У мыши кроссинговер бывает у обоих полов, но интен-
сивнее у самок; у голубей — у обоих полов, но чаще у самцов.
В гетерохроматических, в частности прицентромерных, райо-
нах хрбмосом частота перекреста снижена, и истинное расстоя-
ние между генами на этих участках может быть изменено.
КАРТЫ ХРОМОСОМ
После того как была установлена связь генов с хромосомами
и обнаружено, что частота кроссинговера всегда вполне опреде-
ленная для каждой пары генов, расположенных в одной группе
сцепления, встал вопрос о пространственном расположении
генов в хромосомах. На основе анализа генетических исследова-
ний Т. Морган и его ученик А. Стертевант выдвинули гипотезу
линейного расположения генов в хромосоме. Изучение взаимо-
отношений между тремя генами при неполном сцеплении пока-
зало, что частота (процент) перекреста между первым и вторым,
вторым и третьим, первым и третьим генами равна сумме или
разности между ними. Так, в одной группе сцепления располо-
жены 3 гена — А, В, С. Оказалось, что процент перекреста между
генами АС равен сумме процентов перекреста между генами АВ
и ВС, частота перекреста между генами АВ оказалась равной
АС — ВС, а между генами ВС = АС — АВ. Приведенные данные
соответствуют геометрической закономерности в расстояниях
между тремя точками на прямой. На этом основании был сделан
вывод: гены расположены в хромосомах в линейной последователь-
ности на определенных расстояниях друг от друга.
На основании анализа частоты кроссинговера между генами к
настоящему времени для многих видов животных и растений
построены карты хромосом. Картой хромосом называется план
расположения генов в хромосоме.
Кестл провел опыт анализирующего тригибридного скрещива-
58
ния кроликов с тройными рецессивами с целью выяснения сцеп-
ления между такими генами:
сплошная окраска — С, гималайская окраска — с*;
белый жир — У, желтый жир — у;
черная окраска — В, коричневая окраска — Ь.
В результате анализирующего скрещивания было получено
908 кроликов восьми разных фенотипов соответственно количе-
ству разных сортов гамет (табл. 4). Численное соотношение осо-
бей разных фенотипических классов указывало на отсутствие
независимого наследования по этим трем парам аллелей. Нужно
было установить порядок расположения этих генов в хромосоме.
Поскольку известно, что численность гамет родительских форм
должна значительно превышать численность кроссоверных
гамет, то можно прийти к выводу, что родительские комбинации
генов были c^YB и СуЬ (276 + 275 = 551). Они составляли от
общего числа 60,7 %. Далее при анализе исходим из того, что
двойных перекрестов должно быть значительно меньше, чем
одинарных. Меньше всего было комбинаций <*уВ и CYb (7 + 16 =
= 23) — 2,5 %. Генотипы этих кроликов отличались от родитель-
ских только тем, что У и у поменялись местами. Так могло
произойти только при двойном перекресте, и это является под-
тверждением того, что расположение генов было именно таким.
Вычисляем частоту одиночных перекрестов. От одиночного
перекреста на первом участке образовались гаметы CYB и &уЬ
(рис. 15). Случаев одиночного перекреста на первом участке
было 101 (55 + 46), или 11,1 %. В результате одиночного пере-
креста на втором участке образовались гаметы c^Yb и Су В и
получено особей 233 (125 + 108), или 25,7 %. Для того чтобы
определить более правильно частоту одиночных перекрестов, мы
должны к каждому из них прибавить величину двойного пере-
креста — 2,5 %, так как двойной перекрест проходил по обоим
участкам хромосомы. Следовательно, частота кроссинговера на
НА 1-м УЧАСТКЕ НА 2-и УЧАСТКЕ ПЕРЕКРЕСТОМ
Рис. 15. Типы гамет, образующихся у крольчихи, гетерозиготной по трем парам
аллелей, находящихся в одной паре хромосом
59
первом участке между генами с* и у составит 13,6 % (11,1 + 2,5).
На втором участке между генами у и b — 28,2 % (25,7 + 2,5).
Отсюда общая протяженность обоих участков, или процент пере-
креста между генами с* и b составит 41,8 (13,6 + 28,2).
4. Фенотипические классы кроликов, полученные при анализе
на сцепление трех генов
Фенотипы Соответствующие фенотипам гаметы Величина группы
Распределение окраски Окраска жира Окраска тела
Гималайская Белая Черная 276
» Желтая » Л-5 7
» Белая Коричневая с*И> 125
» Желтая » <*уЬ 46
Сплошная Белая Черная CYB 55
» Желтая » СуВ 108
» Белая Коричневая СП 16
» Желтая » СуЬ 275
908
Расстояние между генами с* и b можно определить и путем
учета общего числа одиночных перекрестов (без включения
двойных перекрестов). Оно составляет 36,8 %. Прибавив к этому
удвоенный процент двойных перекрестов, т. е. 5,0 % (2,5 • 2),
получим 41,8 %, что совпадает с результатами уже сделанного
расчета по сумме перекрестов на каждом из участков. Теперь
можно проверить, насколько фактическая величина двойного
перекреста совпадает с теоретически ожидаемой. Теоретически
ожидаемую величину рассчитывают путем перемножения про-
центов перекреста между генами на первом и втором участках,
т. е. (13,6 : 100)(28,2 : 100)100 = 3,83 %. Фактически их было
2,5 %. Уменьшение числа ожидаемых двойных кроссоверов по-
казывает, что кроссинговер на одном участке влияет на прохож-
дение обмена на соседнем участке.
Явление торможения кроссинговера на одном участке кроссинго-
вером на другом получило название интерференции. Чем меньше
будет расстояние, разделяющее три гена, тем больше интерфе-
ренция.
Принимая во внимание линейное расположение генов в хро-
мосоме, взяв за единицу расстояния частоту кроссинговера,
Морган с сотрудниками составили первую карту расположения
генов в одной из хромосом дрозофилы. Затем были составлены
карты других ее хромосом. Оказалось, что установленное распре-
деление генов в хромосоме является общебиологической законо-
мерностью. К настоящему времени составлены карты хромосом
для животных и растений многих видов. Если для какого-то вида
установлена группа сцепления, которая содержит три и более
гена, можно составить план их расположения в хромосоме. Так,
60
в разобранном выше примере кроссинговер между генами с* и у
обнаружен у 13,6 % кроликов, между генами у и b — у 28,2, а
между генами с1 и b с учетом двойного перекреста —у 41,8 %
животных. Ген b не может быть расположен между генами с* и
у, так как расстояние его от гена с* значительно больше, чем
между генами с* и у (41,8 % против 13,6 %). Следовательно, три
изученных гена расположены в хромосоме в таком порядке:
ch У ь
I_______I___________I
13,6 28,2
Внизу цифрами указано расстояние между генами. Далее уста-
навливают сцепление хотя бы одного из этих генов с каким-то
четвертым геном и снова проводят анализирующее скрещивание,
выявляя частоту кроссинговера между вновь изучаемым геном и
прежними хотя бы двумя уже изученными. На основании вели-
чины кроссинговера определяют его место в отношении к из-
вестным генам. При построении карт в хорошо изученных хро-
мосомах указывают не расстояние между генами, а расстояние до
каждого гена от нулевой точки начала хромосомы.
Для лучшего усвоения материала нами везде доминантный
аллель обозначается прописной буквой, рецессивный — строч-
ной. В специальной литературе и при построении карт хромосом
название (символ) гена может включать от 1 до 4 букв. Берется
такое минимальное количество букв, чтобы сокращенное обо-
значение не совпало с любым другим обозначением генов данно-
го вида организмов. При сокращении символа гена, как правило,
берут первую букву названия признака и в случае необходимости
добавляют буквы из середины или конца слова либо из других
слов, входящих в название. Для обозначения генов рекомендует-
ся использовать прилагательные или существительные латинско-
го или английского языка. Например, гены курицы обозначают:
Barring — В (оперение полосатое); Crest — Сг (черепно-мозговая
грыжа); Prenatal — рп (гибель на поздней стадии инкубации).
После построения генетических карт встал вопрос о том, от-
вечает ли расположение генов в хромосоме, построенное на ос-
новании частоты кроссинговера, истинному расположению. С
этой целью генетические карты нужно было сравнить с цитоло-
гическими. В 30-х годах нашего столетия Пайнтер открыл в
слюнных железах дрозофилы гигантские хромосомы, строение
которых можно было изучать под микроскопом. Хромосомы эти
имеют характерный для них поперечный рисунок в виде дисков
разной толщины, которые окрашиваются кармином. Каждая
хромосома по длине имеет специфические рисунки дисков, что
позволяет отличать разные ее участки друг от друга. Появилась
61
возможность сверить генетические карты с фактическим распо-
ложением генов в хромосомах. Материалом для проверки служи-
ли хромосомы, у которых вследствие мутации возникали различ-
ные хромосомные перестройки: или не хватало отдельных дис-
ков, или они были перевернуты, или удвоены и т. д. Диски
служили маркерами, с их помощью определяли характер хромо-
сомных перестроек и место расположения генов, о существова-
нии которых было известно на основании данных генетического
анализа. При сопоставлении генетических карт хромосом с цито-
логическими было установлено, что каждый ген находится в
определенном месте (локусе) хромосомы и что гены в хромосо-
мах расположены в определенной линейной последовательности.
В то же время было обнаружено, что физические расстояния
между генами на генетической карте не вполне соответствуют
установленным цитологически. Однако это не снижает ценности
генетических карт хромосом для предсказания вероятности появ-
ления фсобей с новыми сочетаниями признаков.
На основании анализа результатов многочисленных экспери-
ментов с дрозофилой Т. Морган сформулировал хромосомную
теорию наследственности, сущность которой заключается в сле-
дующем: 1) гены находятся в хромосомах, располагаются в них
линейно на определенном расстоянии друг от друга; 2) гены,
расположенные в одной хромосоме, относятся к одной группе
сцепления. Число групп сцепления соответствует гаплоидному
числу хромосом; 3) признаки, гены которых находятся в одной
хромосоме, наследуются сцепленно; 4) в потомстве гетерозигот-
ных родителей новые сочетания генов, расположенных в одной
паре хромосом, могут возникать в результате кроссинговера в
процессе мейоза. Частота кроссинговера зависит от расстояния
между генами; 5) на основании линейного расположения генов в
хромосоме и частоты кроссинговера как показателя расстояния
между генами можно построить карты хромосом.
Контрольные вопросы. 1. В чем заключается сцепленное наследование призна-
ков и как оно устанавливается? 2. Сколько групп сцепления у разных видов
сельскохозяйственных животных? 3. Как наследуются признаки при полном и
неполном сцеплении? 4. Что такое кроссинговер? Когда и как он происходит и
от чего зависит его частота? 5. Как определяется частота кроссинговера? Почему
она принята за единицу расстояния между генами? 6. В чем состоит биологичес-
кое значение кроссинговера? 7. Как было доказано, что гены в хромосоме распо-
ложены линейно? 8. Что такое карта хромосомы и как она составляется? 9. Что
такое соматический кроссинговер? 10. В чем заключается хромосомная теория
наследственности?
Глава 5
ГЕНЕТИКА ПОЛА
ДЕТЕРМИНАЦИЯ ПОЛА
И МЕХАНИЗМ ЕГО НАСЛЕДОВАНИЯ
В ходе эволюции у большинства раздельнополых ор-
ганизмов сформировался механизм детерминации пола, обес-
печивающий образование равного количества самцов и
самок, что необходимо для нормального самовоспроизве-
дения вида. Детерминация пола может происходить на
разных этапах размножения. Различают три основных типа
детерминации:
1) эпигамный, когда пол особи определяется в процессе рнто-
ген§за. Детерминация пола в данном случае значительно зависит
от внешней среды; /
^^прогамный, когда пол будущего дочернего организма опре-
деляется в ходе гаметогенеза у родителей особи;
3) сингамный, той котором пол дочерней особи определяется
в момент слйямйя гамет. Это наиболее распространенный
тип детерминации пола, характерный для животных всех
видов.
При прогамном и сингамном типах детерминации пол зави-
сит от определенных половых хромосом.
У самок млекопитающих в диплоидном наборе хромосом
выделяют пару одинаковых по форме гоносом (половых
хромосом), обозначаемых ХХ-хромосомами. Самцы в кариотипе
содержат X- и Y-хромосомы. Самки птиц содержат две
разные (XY), а самцы одинаковые (XX) половые хромосомы.
В период редукционного деления (мейоза) у самок млеко-
питающих образуется один тип гамет с Х-хромосомой, поэтому
женский пол называют гомогаметным. У самцов образуется
два типа гамет с X- и Y-хромосомами, поэтому мужской
пол называют гетерогаметным. Определение пола млекопи-
тающих зависит от того, каким спермием будет оплодотворена
яйцеклетка. Если яйцеклетка оплодотворена спермием, со-
держащим Х-хромосому, то происходит закладка особи жен-
ского пола, если спермий несет Y-хромосому — закладывается
особь мужского пола.
Схема образования гамет в мейозе самцов и самок, определе-
ния пола при оплодотворении следующая:
63
Гэметы
Потомство
р
Существует равная вероятность закладки особи мужского или
женского пола, так как число сперматозоидов у самцов (яйце-
клеток у птиц) с X- и Y-хромосомами одинаково.
Самцов обычно рождается на несколько процентов больше,
чем самок, но в ходе эволюции выработался механизм сохране-
ния числового соотношения полов, поэтому к возрасту половой
и физиологической зрелости это соотношение выравнивается
вследствие более высокой смертности самцов.
НАРУШЕНИЯ В РАЗВИТИИ ПОЛА
В процессе индивидуального развития (онтогенеза) происхо-
дит дифференциация пола — формирование первичных и вто-
ричных половых признаков, которые приводят к возникновению
полового диморфизма, т. е. различию между особями противопо-
ложных полов по внешним признакам (пропорции телосложе-
ния, масса, окраска шерсти, перьев, наличие или отсутствие
вымени, различие в строении половых органов и т. д.). Так,
самцы сельскохозяйственных животных всех видов крупнее
самок, имеют более мужественный вид — массивную голову, пе-
редняя часть туловища у них развита сильнее задней и т. д. У
самок лучше развита задняя часть туловища, выражены органы,
связанные с осуществлением детородной функции и выкармли-
ванием приплода.
У животных нередко нарушено развитие признаков пола.
Важный вклад в объяснение причин такого рода патологии внес-
ли исследования Бриджеса и Гольдшмидта. Изучая явления пер-
вичного и вторичного нерасхождения половых хромосом у мухи-
дрозофилы, Бриджес обнаружил у них изменения первичных и
вторичных половых признаков, что зависело от числа половых
хромосом и их отношения к числу аутосом в кариотипе (табл. 5).
Интерсексуальные особи имели переходные формы между сам-
цами и самками; «сверхсамки» и «сверхсамцы» характеризова-
лись резко выраженными женскими или мужскими признаками.
На основании результатов этих исследований Бриджес пришел к
выводу, что пол особи определяется отношением числа Х-хромо-
64
сом к числу аутосом (А). У нормальных самок отношение числа
X : А равно 1, а у самцов 0,5. Эксперименты Бриджеса показали,
что у дрозофил Х-хромосома не содержит генов, определяющих
пол. Исходя из этих данных, Бриджес сформулировал теорию
пола, суть которой состоит в том, что развитие половых признаков
зависит от баланса генов, контролирующих их развитие.
5. Зависимость пола дрозофилы от отношения числа Х-хромосом
к числу наборов аутосом (Бриджес, 1932)
Набор хромосом Фенотипическое проявление пола Отношение числа Х-хромосом к числу наборов аутосом
2А + ЗХ Сверхсамка 1,5
4А + 4Х Нормальная самка 1
ЗА + ЗХ То же 1
ЗА + ЗХ + 1Y » 1
2А + 2Х 1
2А + 2Х + 1Y 1
ЗА + 2Х + 1Y Интерсекс 0,67
ЗА + 2Y Летальный 0
ЗА + 2Х Интерсекс 0,67
2А + IX + 1Y Нормальный самец 0,5
2А + IX + 2Y 0,5
2А + IX 0,5
ЗА + IX Сверхсамец 0,33
Нарушения в системе половых хромосом. В процессе изучения
кариотипов животных были выявлены аномалии в системе поло-
вых хромосом, связанные в основном с нарушениями расхожде-
ния в мейозе, а также в результате обмена клетками разных
индивидуумов. В таблице 6 дана сводка таких нарушений и их
связь с фенотипом. Как видно из ее данных, нарушения в систе-
ме половых хромосом приводят к резко выраженным нарушени-
ям воспроизводительных функций у животных.
Половой хроматин. В ядрах интерфазных клеток у нормальных
особей женского пола очень часто обнаруживают небольшую
глыбку хроматина, лежащую у ядерной оболочки или представ-
ленную в форме барабанной палочки, прикрепленной тонкой
нитью к ядру. Барр и Бертрам, впервые обнаружившие это тель-
це, назвали его «сателлитом ядра». Лайон установила, что эта
глыбка хроматина представляет собой одну из двух Х-хромосом,
которая находится во время интерфазы в гетеропикнотическом
состоянии. Положительный гетеропикноз, по гипотезе Лайон,
свидетельствует о генетической инактивации одной из Х-хромо-
сом кариотипа женского пола. Ввиду того что это тельце встре-
чается только в ядрах клеток самок, его рассматривают как при-
знак, отличающий клетки самок от клеток самца, и называют
половым хроматином или тельцем Барра.
65
6. Нарушения в системе половых хромосом
и их фенотипическое проявление
Половые хромосомы 1 Виды | Главный фенотипический эффект
ХО Свинья, лошадь Интерсексуальность, гипоплазия яичников
ХО/ХХ Кошка, лошадь Смерть до рождения, гипоплазия яичников
XO/XX/XY XXX Свинья, корова Интерсексуальность, гипоплазия яичников
XXY Лошадь, крупный рогатый скот, овцы, свиньи, собаки, кошки Стерильность, гипоплазия семенников
XXY/XY Крупный рогатый скот То же
XXY/XX То же Свинья Лошадь Кошка Интерсексуальность Тестикулярная гипоплазия
XXY/XX/XY Крупный рогатый скот То же
XXY/XY/X0 То же
XXY/XY/XX/XO Лошадь Крипторхизм
XXXY Интерсексуальность
XXXY/XXY Свинья Не установлен
XYY/XY Крупный рогатый скот
Этот признак можно использовать для изучения нарушений в
системе половых хромосом, в диагностике пола при интерсексу-
альности. Количество телец Барра всегда на единицу меньше
числа Х-хромосом. Так, если у самок обнаруживается два тельца
Барра, то они являются носителями трисомии по Х-хромосоме.
Если половой хроматин отсутствует, то у особи женского пола
имеется только одна Х-хромосома. Если у самца обнаруживают
тельце Барра, это значит, что у него в кариотипе не одна, а две
Х-хромосомы.
Для исследования полового хроматина используют клетки
лейкоцитов, слизистых полостей и др.
Интерсексуальность у животных. Влияние внутренней среды
организма на изменение признаков пола в онтогенезе прослежи-
вается при изучении интерсексуальности. У домашних животных
существуют разные формы интерсексуальности, которые объеди-
няются под названием гермафродитизм. Кроме того, обнаружены
отдельные формы, очень сходные с известными синдромами
Клайнфельтера и Тернера.
Образование гермафродитов — особей, имеющих гонады и
(или) половые органы противоположного пола, рассматриваются
как результат нарушения мейоза в период развития бластоцисты.
Синдром Клайнфельтера характеризуется недораз-
витием гонад, повышением выделения гонадотропина и другими
изменениями. Классической формой кариотипа синдрома
Клайнфельтера является 2л (аутосом) + XXY. Однако часто в
66
кариотипе обнаруживают мозаицизм по половым хромосомам:
XXY/XY/XX и трисомию XXX (синдром «трипло-Х»). У крупно-
го рогатого скота XXY-синдром наблюдали в сочетании с Х-три-
сомией. Характерными признаками животных были нарушения
роста и развития, двусторонняя гипоплазия семенников с олиго-
и некроспермией и другими изменениями.
Возникновение синдрома Клайнфельтера связано с нерасхож-
дением половых хромосом в мейозе. Примечательной особеннос-
тью фенотипа при этом синдроме является то, что животные при
наличии даже двух Х-хромосом и одной Y-хромосомы имеют
признаки мужского пола, хотя и стерильные. При отсутствии
Y-хромосомы животные имеют женский фенотип. Это указывает
на то, что Y-хромосома у животных содержит гены, контроли-
рующие развитие мужского пола и плодовитость.
СиндромТернера характеризуется женским фенотипом
с дисгенезией гонад и другими генитальными дефектами. Цито-
генетически синдром Тернера определяется формулой 2п (ауто-
сом) + ХО (отсутствует вторая Х-хромосома).
Животных с признаками гермафродитизма, а также носителей
синдромов Клайнфельтера и Тернера следует своевременно вы-
делять в группы откорма.
Фримартинизм — особая форма интерсексуальности,
выявляемая у крупного рогатого скота. Наблюдения показывают,
что бесплодные телки — фримартины рождаются в двойне с быч-
ком. Установлено, что в среднем 95 % телок из разнополых
двоен имеют признаки фримартинизма. У них часто обнаружива-
ют мужской тип экстерьера, недоразвитие матки и др.
Для объяснения причин бесплодия телок-фримартинов уче-
ные выдвигают разные теории. Основные из них — гормональная
и клеточная. Гормональная теория предполагает возникновение
фримартинизма вследствие слияния плодного мешка при бере-
менности двойней и образования анастомозов между плацентар-
ными сосудами разнополых плодов, по которым осуществляется
обмен мужскими гормонами — андрогенами (тестостерон) и
женскими — эстрогенами. Поскольку мужской гормон тестосте-
рон начинает продуцироваться раньше, то длительное воздейст-
вие на женские половые органы приводит к вирилизации (недо-
развитию) последних, отклонениям в сторону мужского пола и
рождению, наконец, бесплодных телок. Клеточная теория исхо-
дит из того, что при плацентарных анастомозах происходит
обмен не только гормонами, но и другими элементами. Так, у
телок-фримартинов был обнаружен химеризм по эритроцитар-
ным антигенам и по половым хромосомам (рис. 16).
Химеризм по половым хромосомам наблюдается и у быков из
разнополых двоен. У бычков на племпредприятиях частота химе-
?изма в среднем составляла 1,5 %, у отдельных из них — свыше
% (А. И. Жигачев и др., 1989). Эти животные часто имеют
67
a
Рис. lf>. Химеризм XX/XY у крупного рогатого скота (2n 60XY/60XX):
а — метафазная пластинка с XX хромосомами; б — метафазная пластинка с XY хромосомами
нарушения воспроизводительной функции — от снижения коли-
чества спермиев в эякуляте и пониженной оплодотворяющей
способности до полного бесплодия. Степень нарушения плодо-
витости связана, очевидно, с временем образования сосудистых
анастомозов во время внутриутробного развития быков-химери-
ков. Химеризм по половым хромосомам наблюдается не только в
двойнях, но и в отелах коров с большим числом телят разного
пола. Присутствие Y-хромосомы в кариотипе телок-фримарти-
нов и изменение у них признаков в сторону мужского пола —
явное свидетельство ее влияния на половые признаки. Цитогене-
тический анализ — надежный метод ранней диагностики фри-
мартинизма у телок. Выявление химеризма XY/XX-хромосом у
быков — это критерий малопригодное™ их в воспроизводстве.
Химеризм по половым хромосомам обнаружен также у коз,
овец, свиней, норок. В некоторых породах коз (зааненская, тог-
денбургская) интерсексуальность встречается довольно часто —
6-,5—8,4 %. Этот признак связан с комолостью животных.
По данным Г. И. Исаевой и Д. К. Беляева, химеризм наибо-
лее часто регистрировали у норок, гомозиготных или гетерози-
готных по генам алеутской окраски или хедлунд.
НАСЛЕДОВАНИЕ ПРИЗНАКОВ, СЦЕПЛЕННЫХ С ПОЛОМ
Причины более высокой смертности среди самцов млекопита-
ющих можно объяснить исходя из особенностей наследования
признаков, сцепленных с полом. Явление сцепленного с полом
наследования впервые открыл Т. Морган при скрещивании мух-
дрозофил с красной и белой окраской глаз. Если в скрещивании
68
участвовали красноглазые самки и белоглазые самцы, все потом-
ство рождалось красноглазым. Во втором же поколении наблюда-
лось расщепление в соотношении 3:1. Но в отличие от мендель-
ского моногибридного скрещивания расщепление было только
среди самцов: одна половина из них была с белыми глазами и
другая — с красными; все самки были красноглазыми. При обрат-
ном (реципрокном) скрещивании белоглазых самок с красногла-
зыми самцами картина была иной: все самки имели красные
глаза, самцы — белые. При скрещивании этих особей во втором
поколении половина самцов и самок рождалась красноглазыми.
Признаки, расщепление по которым при скрещивании связано с
полом, называют сцепленными с полом. Эти признаки обусловлива-
ются генами, локализованными в половых хромосомах. Установ-
лено, что наследование их зависит в основном от Х-хромосомы.
Y-Хромосома имеет небольшие размеры, состоит преимуществен-
но из гетерохроматина и является генетически инертной, за ис-
ключением, возможно, некоторых генов, контролирующих вос-
производительную функцию и признаки пола. У самцов млекопи-
тающих гены, локализованные в Х-хромосоме, не имеют
доминантных или рецессивных партнеров (аллелей) на У-хромо-
соме. Рецессивные гены у них проявляют свое действие уже в
одинарной дозе (гемизиготном состоянии) по типу доминантного.
Практическое использование сцепленного с полом наследова-
ния признаков. В птицеводстве оказалась полезной рецессивная,
сцепленная с Х-хромосомой мутация карликовости. Карликовые
куры отличаются от нормальных лучшей оплатой корма продук-
цией, для них требуется меньшая площадь содержания. Они
резистентны к отдельным болезням.
В шелководстве получил распространение метод использова-
ния сцепленных с полом деталей для получения гусениц только
мужского пола, дающих более крупные коконы, содержащие
Шелка на 25—30 % больше, чем коконы гусениц самок. Для
этого В. А. Струнников вывел линию, сбалансированную по
двум Z-деталям с помощью транслокации (переноса) фрагмента
половой Z-хромосомы на W-хромосому. При скрещивании сам-
цов с одной неаллельной деталью в каждой из двух хромосом (а
и Ь) с самками без транслокаций рождаются только самцы:
р х
Наследственные аномалии животных, сцепленные с полом. У
сельскохозяйственных животных установлено несколько форм
врожденных аномалий, обусловленных генами, локализованны-
69
ми в половой хромосоме. Как правило, они имеют рецессивный
характер проявления, и при этом поражаются преимущественно
особи гетерогамного пола: у млекопитающих — самцы, у птиц —
самки. Сцепленные с полом летальные и сублетальные аномалии
изменяют численное соотношение полов при рождении или
после него вследствие гибели или браковки у млекопитающих
самцов, у птиц — самок. Например, А. И. Жигачевым установле-
но, что такая аномалия, как врожденная деформация передних
конечностей в сочетании с анкилозом суставов, изученная у
животных черно-пестрой, сычевской и костромской пород, про-
является, как правило, у бычков, родственных между собой, что
указывает на сцепленное с полом наследование.
НАСЛЕДОВАНИЕ ПРИЗНАКОВ, ОГРАНИЧЕННЫХ ПОЛОМ
Наследование признаков, контролируемых генами, локализован-
ными в аутосомах, но фенотипически проявляющихся исключитель-
но или'преимущественно у одного пола, — есть наследование, огра-
ниченное полом. Расщепление по таким признакам соответствует
правилам Менделя. Выделяют также признаки, контролируемые
полом. Они обусловлены генами, локализованными в половых
хромосомах, но проявляются у обоих полов по-разному. К числу
патологических, или нежелательных, признаков, ограниченных
полом, у животных можно отнести гипоплазию вымени и со-
сков, гипоплазию гонад (семенников и яичников), крипторхизм,
недоразвитие разных частей половых органов у телок (наблюдае-
мое преимущественно у животных белой масти), сужения пря-
мой кишки и матки у коров, аплазию сегментных протоков
Вольфа, затянувшуюся беременность у самок, аномалии сперма-
тозоидов у самцов и др. Большинство из указанных аномалий
вызывает частичное или полное нарушение воспроизводительной
функции.
ПРОБЛЕМА РЕГУЛЯЦИИ ПОЛА
Проблема регуляции пола вытекает из необходимости увели-
чения продукции животноводства за счет преимущественного
получения особей одного вида, дающих более высокий выход
молока, мяса, шерсти, яиц и т. д. Так, в молочном скотоводстве
более желательно рождение телочек, а в мясном — бычков, так
как они быстрее растут. От высокоценных племенных быков и
коров целесообразно получать мужских потомков для более бы-
строго размножения их генотипов. В яичном птицеводстве эко-
номически более выгодно получение курочек. В связи с этими
практическими потребностями исследователи не только стремят-
ся познать механизмы определения пола, но и изучают возмож-
ности искусственного регулирования пола.
70
Необходимо отметить, что в отношении крупных животных с
внутриутробным развитием плодов эта проблема еще не решена.
Регуляция соотношения полов у млекопитающих может быть
достигнута путем разделения спермы на две фракции: первую —
содержащую в спермиях Х-хромосому и вторую — содержащую
Y-хромосому. Оплодотворение самок одной из этих фракций
будет давать приплод одного пола. Проводились эксперименты
по разделению спермы на указанные фракции центрифугирова-
нием, электрофорезом и седиментацией (осаждением) с помо-
щью аминокислого гистидина. Осеменение самок крольчих, на-
пример, более легкой и более подвижной фракцией приводило к
сдвигу в сторону мужского пола. Однако полного сдвига в соот-
ношении полов сделано не было. Разрабатывается метод количе-
ственного определения ДНК в спермиях путем измерения интен-
сивности флуоресценции ядер. Полученные результаты, как счи-
тают авторы этого метода, могут стать предпосылкой для
успешного разделения спермиев у млекопитающих на несущие X-
или Y-хромосому.
4 Партеногенез. Это развитие организма без оплодотворения.
Получение особей одного пола может быть достигнуто при раз-
витии эмбрионов из отцовских (андрогенез) или материнских
(гиногенез) гамет. Так, под руководством Б. Л. Астаурова были
проведены эксперименты по андрогенезу у тутового шелкопряда.
Неоплодотворенные яйца шелкопряда подвергали тепловому
шоку и облучали рентгеном, тем самым разрушали их ядра, не
повредив цитоплазму. Затем эти яйца осеменяли. Зигота форми-
ровалась путем слияния ядер двух проникших в яйцо спермиев,
развившиеся из нее особи имели признаки только отцовского
вида.
В другом варианте экспериментов неоплодотворенные и еще
не прошедшие редукционного деления яйца нагревали, останав-
ливая тем самым мейоз и сохраняя диплоидность набора хромо-
сом. Из таких яиц без оплодотворения (партеногенетически) раз-
вивались только самки, унаследовавшие признаки матери. Девст-
венное развитие (партеногенез) в естественных или спонтанных
условиях встречается у птиц. И. В. Кудрявцев, 3. А. Ощепкова,
А. К. Голубев и др. на основании экспериментов, проведенных
на курах разных пород, пришли к выводу, что существуют гене-
тические предпосылки селекции на получение жизнеспособных
особей — партеногенов и создание линий с высокой предраспо-
ложенностью к партеногенезу. При этом все вылупляющиеся
цыплята оказываются петушками. Отбор на повышение частоты
партеногенеза, проведенный в двух линиях индеек, дал следую-
щие результаты. Способность яиц к партеногенезу возросла с 1,1
до 18,6 % в первой линии и с 4 до 21,1 % во второй. Значение
партеногенеза не только в том, что он позволяет получить потом-
ство одного пола, но и в том, что использование этого явления
71
дает возможность получить особей, идентичных генотипу одной
из родительских форм.
Генетические методы раннего определения пбла. Определение
пола в раннем периоде онтогенеза в отдельных случаях весьма
целесообразно. Так, при производстве бройлерных (мясных)
цыплят используют только петушков. Однако в раннем возрасте
различить петушков и курочек трудно. Для решения этого вопро-
са еще в 20—30-х годах нашего столетия использовали сцеплен-
ную с полом окраску кур для различения пола у суточных цып-
лят. Скрещивали, например, золотистых петухов с серебристыми
курами. Из яиц вылуплялись цыплята — одни желтые, другие
зеленовато-белые: первые — курочки, вторые — петушки.
Используя явление сцепленного с полом наследования, Пен-
нет в Англии создал породу кур камбар. Вылупившиеся петушки
этой породы гораздо более светлой окраски, чем курочки, у
которых светлый фон пуха имеет темноватый пятнистый рису-
нок.
А. С.чСеребровский изучил признак полосатости у кур и уста-
новил, что он детерминирован геном, локализованным в поло-
вой хромосоме. Поэтому при определенных скрещиваниях у ге-
мизиготных петушков он встречается очень редко. В других вари-
антах скрещиваний все цыплята-петушки имели светлое пятно на
затылке, а курочки были лишены его, или на пухе петушков
имелись темные пятна, у курочек — нет. Эти различия обусловли-
ваются доминантным геном В, локализованным в половой Х-хро-
мосоме.
Наследственный детерминизм в окраске был найден у гусей —
один пол белый, другой — серый.
В настоящее время разработан способ распознавания пола
цыплят по строению клоаки.
У крупных малоплодных животных (крупный рогатый скот,
лошади) разработаны методы раннего определения пола, осно-
ванные на микрохирургическом получении клеток трофобласта у
эмбрионов или взятии амниотической жидкости с последующим
цитогенетическим анализом состава половых хромосом. В пос-
леднее время предложено еще несколько методов. Среди них
особого внимания заслуживает метод молекулярного зондирова-
ния. Он был, в частности, применен для определения пола у
эмбрионов коровы. Суть метода такова. С использованием фер-
ментов рестриктаз расщепляют молекулу ДНК Y-хромосомы и
включают ее фрагменты в состав молекулы ДНК плазмиды.
Затем плазмиду вводят в бактерии, где они реплицируются, по-
лучают клоны необходимых фрагментов ДНК, содержащие Y-
специфичные участки. Таким образом, был выделен фрагмент
ДНК Y-хромосомы и на его основе получен молекулярный зонд.
Для обнаружения зонда при его объединении с идентичными
участками Y-хромосомы в его состав включили молекулу биоти-
72
на или радиоактивную метку. Для выявления присутствия биоти-
на используют метод иммуноферментного анализа. Для опреде-
ления пола зародыша от него отсекают 10—15 клеток трофоблас-
та на 7—8-м дне развития, обрабатывают их молекулярным зон-
дом с биотином и соответствующими антителами. Ядра
эмбриональных клеток самцов приобретают при этом бурую ок-
раску, четко видимую в микроскоп. При аналогичной обработке
цвет ткани самок не меняется.
Контрольные вопросы. 1. Каков механизм генетической детерминации пола у
млекопитающих? 2. Какие известны формы генетического нарушения развития
пола у разных видов животных? Каков их главный фенотипический эффект? 3. В
чем состоят особенности наследования признаков, сцепленных с полом, и каково
их практическое значение? 4. Какими методами можно добиться раннего опреде-
ления пола и каковы возможности регуляции пола у животных?
Г л а в a 6
МОЛЕКУЛЯРНЫЕ ОСНОВЫ
НАСЛЕДСТВЕННОСТИ
До 40-х годов нашего столетия большинство ученых считали,
что гены имеют белковую природу. Выдающийся русский иссле-
дователь Н. К. Кольцов высказал мысль о том, что хромосома —
это гигантская биологическая молекула, обладающая свойством
самоудвоения, и что все признаки и свойства организма обуслов-
лены строением белка и взаимодействием его молекул. В 1927 г.
Н. К. Кольцов подготовил базу для понимания ауторепродукции
хромосом, что составляет в настоящее время основу молекуляр-
ной генетики. Казалось вероятным, что именно в белках заключе-
на наследственная информация о развитии всех признаков и
свойств организма. Однако проведенные в последующем экспери-
менты на микроорганизмах с применением новейших методов
исследований, рентгеноструктурного анализа, электронной мик-
роскопии, меченых атомов и т. д. позволили установить, что гене-
тическая информация сосредоточена в нуклеиновых кислотах.
ДОКАЗАТЕЛЬСТВА РОЛИ ДНК В НАСЛЕДСТВЕННОСТИ
В 1928 г. Ф. Гриффит впервые получил доказательства воз-
можной передачи наследственных задатков от одной бактерии к
другой. Ученый вводил мышам вирулентный капсульный и ави-
рулентный бескапсульный штаммы пневмококков. При введении
вирулентного штамма мыши заболевали пневмонией и погибали.
При введении авирулентного штамма мыши оставались живыми.
При введении вирулентного капсульного штамма, убитого нагре-
ванием, мыши также не погибали. В следующем опыте он ввел
смесь живой культуры авирулентного бескапсульного штамма со
штаммом убитого нагреванием вирулентного капсульного и по-
лучил неожиданный результат — мыши заболели пневмонией и
погибли. Из крови погибших животных были выделены бакте-
рии, которые обладали вирулентностью и были способны обра-
зовать капсулу. Следовательно, живые бактерии авирулентного
бескапсульного штамма трансформировались — приобрели свой-
ства убитых болезнетворных бактерий. В дальнейшем другими
учеными были подтверждены результаты опытов Ф. Гриффита в
условиях пробирки. Основываясь на этих опытах, в 1944 г.
74
О. Эвери и его сотрудники Мак-Леод и Мак-Карти изучили роль
разных веществ клетки в явлениях трансформации и получили
убедительные доказательства того, что трансформирующим фак-
тором является дезоксирибонуклеиновая кислота (ДНК). Было
установлено, что под действием дезоксирибонуклеазы — фермен-
та, специфически разрушающего ДНК, активность трансформи-
рующего фактора исчезла. В то же время рибонуклеаза и протео-
литические ферменты не изменяли биологической активности
трансформирующего фактора.
Следующим доказательством генетической роли ДНК были
эксперименты А. Херши и М. Чейза, проведенные с бактериофа-
гом в 1952 г. Основные компоненты фага — ДНК и белок. ДНК
фага была помечена радиоактивным фосфором (32Р), который
включается только в ДНК. Белок фага пометили с помощью ра-
диоактивной серы (35S), которая включается только в белок.
После заражения бактерий мечеными фагами было установлено,
что в клетку бактерии проникает только молекула ДНК, а белко-
вая оболочка фага остается снаружи. Тем не менее в клетках
зараженных бактерий образовалось множество зрелых частиц
фага. Это говорило о том, что в ДНК заключена наследственная
информация о всех признаках и свойствах фага. Опыты А. Херши
и М. Чейза еще раз подтвердили, что наследственная информация
заключена в молекулах ДНК и передается ими по наследству. В
последующем было установлено, что у некоторых прокариот на-
следственная информация зашифрована в молекулах РНК.
БИОЛОГИЧЕСКАЯ РОЛЬ НУКЛЕИНОВЫХ КИСЛОТ
Генетическая информация реализуется в процессе биосинтеза
белков. Все основные свойства живых существ определяются
структурой и функцией белковых молекул. В последние 40 лет в
ряде лабораторий разных стран мира было выяснено, что синтез
специфических белков предопределен генетически. Материаль-
ным субстратом наследственности является ДНК. В молекулах
ДНК зашифрована наследственная информация о строении каждого
белка. ДНК обеспечивает хранение и передачу генетической ин-
формации из поколения в поколение. Участок молекулы ДНК,
кодирующий первичную структуру полипептида, молекулы транс-
портной или рибосомной РНК, называется геном. Реализация на-
следственной информации осуществляется с участием рибонук-
леиновых кислот (РНК).
Белки — структурная основа всех клеток, органов и тканей
организма. В сочетании с другими веществами они участвуют в
формировании различного рода клеточных структур.
Многочисленными исследованиями установлено, что белки
различаются как у отдельных видов микроорганизмов, растений
и животных, так и в пределах одного вида. Главные структурные
75
элементы белковых молекул — 20 аминокислот. Специфика
строения белковой молекулы определяется наличием определен-
ных аминокислот и порядком их расположения в полипептидных
цепях. К настоящему времени достигнуты значительные успехи в
раскрытии химической структуры различных белков и полипеп-
тидов. Рассмотрим, как влияет содержание аминокислот и их
чередование в полипептидных цепях гормонов гипофиза оксито-
цина и вазопрессина на их биологическую роль. Эти гормоны
включают по 9 аминокислотных остатков:
окситоцин: цистеил — тирозил — изолейцил — глутамил — ас-
парагил — цистеил — пролил — лейцил — глицин;
вазопрессин: цистеил — тирозил — фенилаланил — глутамил —
аспарагил — цистеил — пролил — аргинил — глицин. Как видим,
разница состоит только в том, что в окситоцине на третьем месте
стоит аминокислота изолейцин, на восьмом лейцин, а у вазо-
прессина соответственно фенилаланин и аргинин. Эти неболь-
шие изменения обусловили разную биологическую роль гормо-
нов: оксйтоцин вызывает сокращение матки во время родов, а
вазопрессин увеличивает кровяное давление.
Обнаружено, что виды, породы и отдельные индивидуумы имеют
незначительные специфические отличия в строении ферментов и
других белковых молекул, выполняющих одинаковые функции.
Однако имеется много случаев, когда незначительные измене-
ния в структуре белка приводят к серьезным последствиям. Так,
известно, что от 5 до 20 % коренного населения Африки, Индии
и Средиземноморских стран имеют аномальный гемоглобин S,
который отличается от нормального гемоглобина А только по
одной аминокислоте. Ниже приведено чередование аминокислот
на определенном участке гемоглобина А и S:
гемоглобин А —лей-тре-про-глу-глу-лиз;
гемоглобин S —лей-тре-про-вал-глу-лиз.
Незначительные изменения в строении гемоглобина являются
причиной тяжелого наследственного заболевания — серповидно-
клеточной анемии. Эритроциты больных серповидноклеточной
анемией имеют форму серпа, а не округлую, как в норме.
ХИМИЧЕСКИЙ СОСТАВ И СТРУКТУРА
НУКЛЕИНОВЫХ КИСЛОТ
Нуклеиновые кислоты впервые открыл И. Ф. Мишер в 1868 г.
Он выделил из ядер клеток особое вещество кислотной природы
и назвал его нуклеином. Впоследствии ему дали название «нук-
леиновая кислота». Было обнаружено два типа нуклеиновых кис-
лот. Их назвали в зависимости от углеводного компонента, вхо-
дящего в состав. Нуклеиновую кислоту, в состав которой входит
углевод дезоксирибоза, назвали дезоксирибонуклеиновой кислотой
(ДНК), а в состав которой входит углевод рибоза, — рибонуклеино-
76
вой кислотой (РНК). В период с 1900 по 1932 г. был определен
химический состав нуклеиновых кислот. Они включают следую-
щие компоненты:
Пуриновые основания
Пиримидиновые основания
Углеводный компонент
ДНК
Аденин, гуанин
Цитозин, тимин
Дезоксирибоза
РНК
Аденин, гуанин
Цитозин, урацил
Рибоза
Обе нуклеиновые кислоты включают остатки фосфорной кисло-
ты. Различие заключается в том, что в состав РНК входит азотистое
основание урацил вместо тимина и рибоза вместо дезоксирибозы.
В 1936 г. на кафедре биохимии растений Московского уни-
верситета А. Н. Белозерский с И. И. Дубровской впервые выде-
лили ДНК в чистом виде из растительного материала. К середи-
не 40-х годов было выяснено, что ДНК и РНК одновременно
присутствуют в каждом живом организме.
В конце 40-х — начале 50-х годов при изучении нуклеиновых
кислот стали использовать новые физические и химические мето-
ды исследования. В 1950 г. Э. Чаргафф установил правила нукле-
отидных отношений, лежащие в основе строения всех ДНК.
Правила Чаргаффа заключаются в том, что в ДНК содержание
аденина равно содержанию тимина (А = Т), а содержание гуанина
равно содержанию цитозина (Г = Ц), отсюда А + Г/Т + Ц = 1;
сумма пуриновых нуклеотидов равна сумме пиримидиновых нуклео-
тидов. В соответствии с этим правилом нуклеотидный состав
разных организмов может варьировать только по величине
А + Т/Г + Ц.
К 1952 г. Р. Франклин и М. Уилкинс добились получения
высококачественных рентгенограмм ДНК, показавших, что она
имеет форму спирали и двойственную структуру.
В 1953 г. Дж. Уотсон и Ф. Крик, опираясь на данные рентге-
ноструктурного анализа и правила Чаргаффа, установили струк-
туру ДНК Согласно их модели молекула ДНК имеет двойную
спираль, состоящую из двух полинуклеотидных цепей с общей
осью (рис. 17). Диаметр двойной спирали ДНК равен 2 нм, а
расстояние между витками 3,4 нм. На каждый виток спирали
приходится 10 пар нуклеотидов, отсюда расстояние между азо-
тистыми основаниями равно 0,34 нм.
Структурными единицами полинуклеотидных цепей являются
нуклеотиды. В состав нуклеотида входят: одно из азотистых ос-
нований — пуриновое (аденин или гуанин) или пиримидиновое
(тимин или цитозин), дезоксирибоза, фосфатный остаток. Эти
компоненты соединены друг с другом в следующем порядке:
азотистое основание — дезоксирибоза — фосфатный остаток. Со-
единение одного из оснований с дезоксирибозой приводит к
образованию нуклеозида. В случае присоединения фосфатной
группы к углеводной части нуклеозида образуется нуклеотид.
77
Дезоксирибоза в нуклеотидах соединяется с основаниями гли-
козидной связью, а с фосфорной кислотой — эфирными связя-
ми. Следовательно, по химическому составу лю’бой нуклеотид —
это фосфорный эфир нуклеозидов. В соответствии с этим нукле-
отиды называются дезоксиадениловой, дезоксигуаниловой, дезокси-
цитидиловой и тимидиловой кислотами.
Наряду с главными азотистыми основаниями ДНК содержит
также метилированные основания, такие, как 5-метилцитозин,
5-оксиметилцитозин и др. У животных количество 5-метилцито-
зина в ДНК обычно не превышает 1,5—2 %.
В каждой из цепей ДНК нуклеотиды последовательно соедине-
ны друг с другом с помощью остатка фосфорной кислоты и моле-
кулы дезоксирибозы. Дезоксирибоза связывается с одной молеку-
лой фосфорной кислоты через углерод в положении 3', а с дру-
гой — через углерод 5', образуя углеводно-фосфатный остов
(рис. 18).
Обе цепи в молекуле ДНК имеют противоположную поляр-
ность. Э^о означает, что межнуклеотидная связь в одной цепи
имеет направление 5'->3', а в другой
3'->5'.
Азотистые основания нуклеотидов
обеих цепей ДНК заключены внутри
между витками спирали и соединены
водородными связями. В соответствии
с правилами Чаргаффа аденин одной
цепи связан только с тимином другой
цепи, а гуанин — только с цитозином.
Пара аденин — тимин соединена
двумя водородными связями, а пара
гуанин — цитозин — тремя. Такой по-
рядок соответствия азотистых осно-
ваний (А и Г ^Ц) называется
комплементарностью, и, следовательно,
цепи в ДНК комплементарны, они
взаимно дополняют друг друга.
Углеводно-фосфатный остов по
всей длине во всех молекулах ДНК
имеет однотипную структуру и не
может нести генетической информа-
ции. В противоположность этому рас-
Рис. 17. Схема строения молекулы ДНК из
двух спирально закрученных пеней (по Д. Уотсо-
ну в Ф. Крику) (Цифры указывают на расстоя-
ния в А между разными точками молекулы)
78
Рис. 18. Схема отрезка двухцепочной молекулы ДНК (по С. М. Гершензону)
положение пуриновых и пиримидиновых оснований нуклеотидов
вдоль цепи ДНК очень изменчиво и характерно для каждого
данного типа молекул ДНК. Значит, наследственная информация
зашифрована различной последовательностью оснований.
Нуклеотидный состав ДНК значительно варьирует в зависи-
мости от принадлежности организма к той или иной системати-
ческой группе (табл. 7). Специфичность ДНК выражается соот-
ношением А + Т/Г + Ц, получившим название коэффициента ви-
довой специфичности.
7. Нуклеотидный состав ДНК из различных источников
(по А. Ленинджеру, 1976)
Объект Нуклеотидный состав, мол. % Коэффициент специфичности А + Т/Г + Ц
A г Ц Т
Человек Животные: 30,9 19,9 19,8 29,4 1,52
овца 29,3 21,4 21,0 28,3 1,36
курица 28,8 20,5 21,5 29,2 1,38
Растения, грибы, зерна пшеницы 27,3 22,7 22,8 27,1 1,19
Дрожжи 31,3 18,7 17,1 32,9 1,79
Aspergillus niger Бактерии: 25,0 25,1 25,0 24,9 1,00
Е. coli 24,7 26,0 25,7 23,6 0,93
Staphylococcus ayreus 30,8 21,0 19,0 29,2 1,50
Clostridium perfnngens 36,9 14,0 12,8 36,3 2,70
Brucella abortus 21,0 29,0 28,9 21,1 0,72
Sarcina hitea 13,4 37,1 37,1 12,4 0,35
79
В ДНК животных наблюдается избыток А + Т по отношению
к Г + Ц. У грибов и бактерий встречаются формы как богатые
А + Т, так и с преобладанием Г + Ц, в то же время есть близкие
по коэффициенту специфичности к животным. Это говорит о
том, что изменчивость в расположении оснований уже достаточ-
на для того, чтобы обеспечить различия между генами этих
организмов.
Молекулы ДНК состоят примерно из 2-Ю3—1-Ю8 и более
нуклеотидов и имеют большую относительную молекулярную
массу.
Репликация (удвоение) ДНК. ДНК находится в хромосомах, и
репликация ее происходит перед каждым удвоением хромосом и деле-
нием клетки. Дж. Уотсон и Ф. Крик предложили схему удвоения
ДНК, согласно которой спиралевидная двухцепочная ДНК снача-
ла раскручивается (расплетается) вдоль оси. При этом водородные
связи между азотистыми основаниями рвутся и цепи расходятся.
Одновременно к нуклеотидам каждой цепи пристраиваются ком-
плементарные азотистые основания нуклеотидов второй цепи, где
против аденина встает тимин, против тимина — аденин, против
гуанина — цитозин и т. д., которые с помощью ферментов ДНК-
полимераз связываются в новые полинуклеотидные цепи. В ре-
зультате из одной образуются две новые дочерние молекулы ДНК.
Каждая дочерняя молекула, наследуя структуру одной цепи мате-
ринской молекулы, строго сохраняет специфичность заключенной в
ней информации. Поскольку матрицей для репликации служит
одна из двух цепей молекулы, такой тип синтеза ДНК носит
название полуконсервативной ауторепродукции.
Дальнейшие исследования показали, что репликация бактери-
альных и других молекул ДНК начинается в определенной точке
старта. В хромосомах эукариот обнаружено по нескольку таких
начальных точек. Цепи ДНК в точке инициации репликации
разъединяются под влиянием особого белка геликазы (рис. 19).
Возникают одноцепочные участки ДНК, которые становятся
матрицами для репликации-притяжения комплементарных нук-
леотидов. Эти одноцепочные участки связываются с особыми
белками, которые их стабилизируют (препятствуют их компле-
ментарному взаимодействию). Особый фермент топоизомераза (у
прокариот называется ДНК-гиразой) способствует расщеплению
спирали ДНК в области репликационной вилки.
Репликация на материнской цепи, идущей от точки старта в
направлении 5'->3', идет в виде сплошной линии. Эта цепь полу-
чила название лидирующей. Синтез на второй цепи 3'->5' идет
отдельными фрагментами в противоположном направлении (тоже
5'->3')- Эта цепь получила название запаздывающей. Фрагментами
являются небольшие участки ДНК (у кишечной палочки около
2000 нуклеотидов, у эукариот около 200). Они называются по
80
Рис. 19. Синтез лидирующей (вверху) и запаздывающей (внизу) цеией ДНК
в вилке репликации (по В. Alberts, R. Stemglanz)
имени открывшего их японского ученого Р. Оказаки. После за-
вершения синтеза фрагменты Оказаки соединяются при помощи
фермента лигазы в общую полинуклеотидную цепочку. У эукари-
от репликация ДНК и соединение различных ее репликационных
участков происходят в фазе S-периода интерфазы. После заверше-
ния этой фазы в каждой хромосоме имеется две молекулы ДНК,
которые становятся двумя идентичными хроматидами.
Структура, способная к репликации (хромосома, плазмида,
вирусный геном), называется репликоном.
Самоудвоение молекул ДНК — основа устойчивости генети-
ческой информации данного вида и обеспечивает материальную
непрерывность наследственного вещества клетки.
СТРОЕНИЕ И ТИПЫ РНК
Многочисленными исследованиями было установлено, что
синтез белка в клетке происходит не в ядре, где находится
ДНК, а в цитоплазме. Следовательно, сама ДНК не может слу-
жить матрицей для синтеза белка. Вставал вопрос о молекуляр-
ных механизмах переноса информации, закодированной в ДНК
(генах), из ядра в цитоплазму к месту синтеза белка. Сравнитель-
но недавно выяснилось, что молекулами, ответственными за
считывание и перенос информации, а также за преобразование
этой информации в последовательность аминокислот в структуре
белковой молекулы, являются рибонуклеиновые кислоты (РНК).
Молекулы рибонуклеиновой кислоты имеют одну полинуклео-
тидную цепь. Нуклеотиды молекулы РНК называются адениловой
гуаниловой, уридиловой и цитцдиловой кислотами. На долю РНК
приходится около 5—10 % общей массы клетки.
81
Существует три основных вида РНК: информационная (иРНК),
или матричная (мРНК), рибосомная (рРНК) и транспортная
(тРНК). Они различаются по величине молекул и функциям. Все
типы РНК синтезируются на ДНК при участии ферментов —
РНК-полимераз. Информационная, или матричная, РНК состав-
ляет 2—3 % всей клеточной РНК, рибосомная — 80—85, транс-
портная — около 15 %.
Информационная РНК (иРНК) впервые была
обнаружена в 1957 г. Роль ее в том, что она считывает наследст-
венную информацию с участка ДНК (гена) и в форме скопиро-
ванной последовательности азотистых оснований переносит ее в
рибосомы, где происходит синтез определенного белка. Каждая
из молекул иРНК по порядку расположения нуклеотидов и по
размеру соответствует гену в ДНК, с которого она была транс-
крибирована. В среднем иРНК содержит 1500 нуклеотидов (75—
3000). Каждый триплет (три нуклеотида) на иРНК называется
кодонощ. От кодона зависит, какая аминокислота встанет в дан-
ном месте при синтезе белка/ Информационная РНК может
обладать относительной молекулярной массой от 250 до
1000 тыс. Д (дальтон).
Существует большое разнообразие иРНК как в отношении
состава, так и величины молекулы. Это связано с тем, что в
клетке находится большое количество разнообразных белков, а
строение каждого белка обусловлено своим геном, с которого
иРНК считала информацию.
Т р а н с п о р т"н ая РНК (тРНК) обладает относительно
невысокой молекулярной массой порядка 24—29 тыс. Д и содер-
жит в молекуле от 75 до 90 нуклеотидов. До 10 % всех нуклеоти-
дов тРНК приходится на долю минорных оснований, что, по-ви-
димому, защищает ее от действия гидролитических ферментов.
Роль тРНК заключается в том, что они переносят аминокис-
лоты к рибосомам и участвуют в процессе синтеза белка. Каждая
аминокислота присоединяется к определенной тРНК. Ряд ами-
нокислот обладает более одной тРНК. К настоящему времени
обнаружено более 60 тРНК, которые отличаются между собой
первичной структурой (последовательностью оснований). Вто-
ричная структура у всех тРНК представлена в виде клеверного
листа с двухцепочным стеблем и тремя одноцепочными петлями
(рис. 20). На конце одной из цепей находится акцепторный
участок — триплет ЦЦА, к аденину которого присоединяется
специфическая аминокислота. Аминокислота присоединяется к
тРНК под действием фермента аминоацил-тРНК-синтетазы, ко-
торый «узнает» одновременно и аминокислоту, и тРНК. В голов-
ке средней петли тРНК находится антикодон — триплет, состоя-
щий из трех нуклеотидов. Антикодон комплементарен опреде-
ленному кодону мРНК. При помощи антикодона тРНК «узнает»
соответствующий кодон в иРНК, т. е. определяет место, куда
82
Рис. 20. Вторичная структура тРНК (по Ричу п Киму)
должна быть поставлена данная аминокислота в синтезируемой
молекуле белка.
Предполагается, что петли тРНК, не вовлеченные в связыва-
ние и выполнение декодирующей функции аминокислоты, ис-
пользуются для связывания тРНК с рибосомой и со специфичес-
кой аминоацил-тРНК-синтетазой.
Рибосомная РНК (рРНК). Размер рибосомных
РНК эукариот составляет 5—28S (S — единица Сведберга,
характеризующая скорость осаждения, седиментации частиц
при ультрацентрифугировании), молекулярная масса 3,5104—
1,5106 Д. Они содержат 120—3100 нуклеотидов. Рибосомная
РНК накапливается в ядре, в ядрышках. В ядрышки из
цитоплазмы транспортируются рибосомные белки, и там
происходит спонтанное образование субчастиц рибосом путем
объединения белков с соответствующими рРНК. Субчастицы
рибосомы вместе или врозь транспортируются через поры
ядерной мембраны в цитоплазму.
Рибосомы представляют собой органеллы величиной 20—
30 нм. Они построены из двух субчастиц разного размера и
формы. На определенных стадиях белкового синтеза в клетке
происходит разделение рибосом на субчастицы. Рибосомная РНК
служит как бы каркасом рибосом и способствует первоначальному
связыванию иРНК с рибосомой в процессе биосинтеза белка. Суб-
частицы обозначают у эукариот как 60 и 40S. Целые рибосомы
83
осаждаются при 80S. 40Б-субчастица содержит 18S РНК и при-
мерно 30 белков; бОБ-субчастица содержит 28S РНК, 5S РНК и
5,8S РНК. В состав этой частицы входит примерно 50 различных
белков. У прокариот функциональная рибосома имеет константу
седиментации 70S. 70Б-рибосомы состоят из малой (30S) и боль-
шой (50S) субчастиц. SOS-рибосомы содержат примерно равное
количество рРНК и белка, у 70Б-рибосом соотношение РНК и
белка составляет 2:1. Число рибосом в клетке прокариот равно
примерно 104, у эукариот — около 105. В период синтеза белка
рибосомы могут объединяться в полисомы, образуя более высоко-
организованные комплексы.
ГЕНЕТИЧЕСКИЙ КОД
Представление о том, что генетическая информация о струк-
туре белковых молекул зашифрована в ДНК путем определенно-
го расцрложения нуклеотидов, конкретизировал Ф. Крик в гипо-
тезе последовательности, согласно которой последовательность
элементов гена определяет последовательность аминокислотных
остатков в полипептидной цепи. Было установлено, что наслед-
ственную информацию с ДНК считывает иРНК, которая образу-
ется комплементарно одной из цепей ДНК. Однако не было
известно, каким образом переводится нуклеотидная последова-
тельность иРНК в аминокислотную последовательность поли-
пептидной цепи. Можно было предположить, что генетический
код не может состоять из одного или двух нуклеотидов, так как
их только четыре и сочетаний из двух (43) может быть только 16,
а аминокислот 20. Г. Гамов в 1954 г. впервые высказал мысль о
том, что генетический код должен быть триплетным. В этом
случае получается (43) 64 сочетания, и их вполне достаточно для
кодирования всех аминокислот.
Начало экспериментальному анализу природы генетического
кода положили М. Ниренберг и Дж. Маттеи в 1961 г. Они созда-
ли простейшие синтетические полимеры типа иРНК. Искусст-
венно полученный полимер, содержащий только уридиновые
нуклеотиды, в которых основанием является урацил, вводили в
бесклеточную среду, полученную из кишечной палочки. В ре-
зультате был получен полипептид, состоящий только из фенил-
аланина — полифенилаланин. Кодон для фенилаланина был рас-
шифрован как УУУ.
К расшифровке генетического кода активно подключился
С. Очоа с corp. В течение 3—4 лет в лабораториях М. Ниренбер-
га и С. Очоа был определен состав большинства кодонов. Одна-
ко требовалось определить последовательность нуклеотидов в ко-
донах. Это удалось сделать при помощи двух методов. Г. Корана
с corp, разработал метод химического синтеза ДНК-подобных
полимеров с заданной последовательностью нуклеотидов, что
84
позволяло получить РНК также с заранее известной последова-
тельностью нуклеотидов и использовать ее в бесклеточной систе-
ме белкового синтеза. Второй метод предложили М. Ниренберг и
П. Ледер, исходя из того, что промежуточными продуктами при
синтезе белка являются аминокислоты, связанные с тРНК. Убе-
дившись в том, что одного триплета иРНК (трех нуклеотидов)
достаточно для связывания с рибосомой и тРНК, ученые исполь-
зовали тринуклеотидные матрицы с известным чередованием ос-
нований для того, чтобы изучить, какую аминокислоту доставит
тРНК.
В результате использования методов, разработанных Г. Кора-
ной, М. Ниренбергом и П. Ледером, к 1966 г. были определены
все триплеты, кодирующие ту или иную аминокислоту. Триплет
иРНК получил название кодона. Генетический код был полнос-
тью расшифрован (табл. 8), значит, была выяснена природа
связи между структурой гена и соответствующего белка. Было
установлено, что 61 триплет кодирует аминокислоты, 3 триплета
не соответствуют никакой аминокислоте и определяют конец
трансляции. .
Выявлены следующие особенности генетического кода: 1) ге-
нетический код триплетный (каждая аминокислота кодируется
тремя нуклеотидами); 2) неперекрывающийся (соседние триплеты
не имеют общих нуклеотидов); 3) вырожденный (за исключением
метионина и триптофана все аминокислоты имеют более одного
кодона); 4) универсальный (в основном одинаков для всех живых
организмов); 5) в кодонах для одной аминокислоты первые два
нуклеотида, как правило, одинаковы, а третий варьирует; 6)
имеет линейный порядок считывания и характеризуется колине-
арностью, т. е. совпадением порядка расположения кодонов в
иРНК с порядком расположения аминокислот в синтезирующей-
ся полипептидной цепи.
Сравнительно недавно выяснилось, что в митохондриях нару-
шается универсальность генетического кода. Четыре кодона в
митохондриях изменили свой смысл: кодон УГА отвечает трип-
тофану, АУА — метионину, а кодоны АГА и АГГ стали термини-
рующими. В митохондриях синтезируется небольшое количество
белков, которые используются ими же. Открытие новых кодонов
у митохондрий может служить доказательством того, что код
эволюционировал, что он не сразу стал таким, каким мы его
знаем теперь.
СИНТЕЗ БЕЛКА В КЛЕТКЕ
В настоящее время можно считать установленным, что на-
следственность реализуется в процессе биосинтеза белка. Синтез
ферментов и других белков, необходимых для жизнедеятельности
и развития организмов, происходит в основном на первой стадии
85
интерфазы, до начала репликации ДНК. В процессе синтеза
белка различают этапы транскрипции и трансляции.
Транскрипция заключается в том, что наследственная
информация, записанная в ДНК (гене), точно транскрибируется
(переписывается) в нуклеотидную последовательность иРНК.
Синтез иРНК начинается с участка инициации транскрипции,
называемого промотором. Промотор расположен перед геном и
включает около 80 нуклеотидов. У вирусов и бактерий этот
участок включает около 10 нуклеотидов (один виток спирали).
Транскрипция осуществляется с помощью ферментов РНК-
полимераз. РНК-полимераза прочно связывается с промотором и
«расплавляет» его, разъединяя нуклеотиды комплементарных
/цепей. Затем этот фермент начинает двигаться вдоль гена и по
мере разъединения цепей ДНК на одной из них, которая являет-
V ся смысловой, ведет синтез иРНК, согласно принципу компле-
ментарности присоединяя аденин к тимину, урацил к аденину,
цитозин к гуанину и гуанин к цитозину. Те участки гена, на
которых полимераза образовала иРНК, вновь соединяются, а
синтезируемая молекула иРНК постепенно отделяется от ДНК.
Конец синтеза иРНК определяется участком остановки транс-
крипции — терминатором. Нуклеотидные последовательности
промотора и терминатора узнаются специальными белками, ре-
гулирующими активность РНК-полимеразы.
В 1977 г. было обнаружено, что у эукариот в последователь-
• ности нуклеотидов ДНК имеются отрезки, не содержащие ин-
формации, которые были названы интронами. Участки ДНК,
несущие информацию, называются экзонами.
При считывании информации с определенного участка ДНК
(гена) сначала образуется транскрипт всей последовательности
(про-мРНК), а затем происходит процесс созревания иРНК, на-
зываемый процессингом. При процессинге происходит сплайсинг,
который заключается в том, что в ядре интроны из РНК как бы
4. «выпетливаются» и удаляются, а информативные участки — экзо-
ны соединяются при помощи ферментов лигаз в одну непрерыв-
ную последовательность иРНК. Перед выходом из ядра к началь-
{ ной части иРНК (5'-концу) присоединяется остаток метилиро-
•ч ванного гуанина, называемый «колпачком», а к концу иРНК
(З'-концу) присоединяется примерно 200 остатков адениловой
j кислоты. В таком виде зрелая иРНК (матричная РНК) проходит
•> через ядерную мембрану в цитоплазму, где соединяется с рибо-
' сомой. Считают, что у эукариот «колпачок» иРНК играет роль в
связывании с малой субчастицей.
Трансляция заключается в том, что последовательность
расположения нуклеотидов в иРНК переводится в строго упоря-
доченную последовательность расположения аминокислот в мо-
лекуле синтезируемого белка. Процесс трансляции включает два
К
этапа: активирование аминокислот и непосредственно синтез
белковой молекулы.
Активирование свободных аминокислот и присоединение их к
тРНК осуществляются при помощи ферментов аминоацил-тРНК-
синтетаз. Точность процесса трансляции зависит, по-видимому,
в значительной мере от того, с какой точностью каждая синтета-
за выберет одну определенную аминокислоту и присоединит ее к
соответствующей тРНК. Считается, что в молекуле каждой ами-
ноацил-тРНК-синтетазы имеется по крайней мере три центра
связывания: для аминокислоты, тРНК и АТФ. Сначала осущест-
вляется связь аминоацил-тРНК-синтетазы с определенной >ами-
нокислотой, а затем активированная аминокислота присоединя-
ется к акцепторному участку (ЦЦА) транспортной РНК. В ре-
зультате образуется аминоацил-тРНК (аа-тРНК). Нагруженная
аминокислотой тРНК взаимодействует с одним из белковых
факторов, который в комплексе с ПФ необходим для транспор-
та тРНК к рибосоме и связывания с ней.
В период трансляции происходит реализация генетической
информации в процессе синтеза белковой молекулы определен-
ной структуры. Синтез подразделяется на три стадии: инициа-
ции, элонгации и терминации.
Инициация. В период стадии инициации рибосома сначала
представлена двумя отдельными субчастицами, так как для нача-
ла процесса необходима рибосома диссоциированная.
Инициация синтеза полипептидной цепи начинается с присо-
единения малой субчастицы рибосомы к соответствующему цент-
ру связывания на иРНК. Сигналом инициации трансляции слу-
жит кодон для метионина АУТ, который расположен в начале
иРНК (рис. 21). К кодону АУТ своим антикодоном УАЦ присо-
единяется тРНК, нагруженная аминокислотой метионином (у
бактерий инициаторной является тРНК, которая переносит фор-
милметионин). Затем к комплексу, состоящему из малой субъеди-
ницы, иРНК и тРНК, присоединяется большая субъединица ри-
босомы. В результате образуется полностью собранная рибосома
(80S), включающая одну молекулу иРНК и инициаторную тРНК с
аминокислотой. В большой субъединице имеется аминоацильный
и пептидильный центры. Сначала первая аминокислота (метио-
нин) попадает в аминоацильный центр. В процессе присоединения
большой субчастицы рибосомы иРНК продвигается на один
кодон, тРНК из аминоацильного центра перемещается в пепти-
дильный центр. В аминоацильный центр поступает следующий
кодон иРНК, который может принять следующую аминоацил-
тРНК. С этого момента начинается вторая стадия трансляции.
Элонгация. В эту стадию многократно повторяется цикл при-
соединения аминокислот к растущей полипептидной цепи. Так,
в аминоацильный центр рибосомы строго в соответствии с кодо-
ном иРНК поступает вторая нагруженная тРНК, которая своим
88
Рис. 21. Схема синтеза белка в клетке:
вверху — инициация; внизу — элонгация
антикодоном соединяется с комплементарным кодоном иРНК.
Сразу же при помощи фермента пептидилтрансферазы предше-
ствующая аминокислота (метионин) своей карбоксильной груп-
пой (СООН) соединяется с аминогруппой (NH2) вновь пришед-
шей аминокислоты. Между ними образуется пептидная связь
(—СО—NH—). В результате тРНК, принесшая метионин, осво-
бождается, а в аминоацильном центре к тРНК присоединен уже
дипептид. Для дальнейшего процесса элонгации требуется осво-
бодить аминоацильный центр. И он освобождается.
В результате процесса транслокации дипептидил-тРНК про-
двигается из аминоацильного центра в пептидильный. Это про-
исходит благодаря перемещению рибосомы на один кодон при
участии фермента транслоказы и белкового фактора элонгации.
Освободившаяся тРНК и кодон иРНК, который был связан с
ней, выходят из рибосомы. В освободившийся аминоацильный
центр следующая тРНК приносит аминокислоту в соответствии с
поступившим туда кодоном. Эта аминокислота при помощи пеп-
тидной связи соединяется с предыдущей. При этом рибосома
снова продвигается еще на один кодон, и процесс повторяется.
Полипептидный синтез в рибосоме идет до тех пор, пока в
аминоацильный центр не поступит терминирующий кодон.
Терминация. После того как в аминоацильный центр рибосо-
мы поступит терминирующий кодон иРНК (УАА, УАГ или УТА),
к нему присоединяется один из белковых факторов терминации
89
и блокируется дальнейшая элонгация цепи. Полипептидная цепь
отделяется от тРНК и рибосомы, освобождаются тРНК и иРНК.
Рибосомные субъединицы диссоциируют и могут принять учас-
тие в синтезе следующей полипептидной цепи.
На одной молекуле иРНК работает не одна рибосома, а мно-
гие (до 100). На каждой из рибосом строится полипептидная
цепь. У бактерий транскрипция и трансляция связаны между
собой и трансляция начинается до завершения синтеза иРНК на
ДНК. Образующиеся при синтезе белка полипептидные цепи
претерпевают посттрансляционные преобразования и в конеч-
ном итоге выполняют специфические функции, принимая учас-
тие в определении признаков организма.
Ингибиторы синтеза белка. В последние годы был выявлен
целый ряд ингибиторов, вызывающих нарушение реализации ге-
нетической информации у микроорганизмов. Примером могут
служить антибиотики. Одним из мощных ингибиторов является
пуромицин. Он имеет структурное сходство с концевым остат-
ком адеймловой кислоты в аминоацил-тРНК, легко взаимодейст-
вует с A-участком пептидил-тРНК с образованием пептидилпу-
ромицина. Пептидилпуромицин нарушает элонгацию, вызывая
обрыв реакции. Предполагается, что стрептомицин и неомицин
вызывают ошибки в трансляции иРНК, приводящие к наруше-
нию соответствия между кодонами и включаемыми аминокисло-
тами. Например, кодон УУУ вместо фенилаланина начинает ко-
дировать лейцин, в результате образуется аномальный белок, что
ведет к гибели бактерий. Тетрациклины являются ингибиторами
синтеза белка в 708-рибосоме. Считается, что тетрациклины тор-
мозят связывание аминоацил-тРНК с аминоацильным центром
рибосом. Синтез клеточной иРНК тормозит антибиотик рифа-
мицин, йспользуемый при лечении туберкулеза. Этот препарат
тормозяще действует на ДНК-зависимую РНК-полимеразу путем
связывания с ней. Наиболее чувствительна к нему бактериальная
РНК-полимераза. Недавно обнаружено и противовирусное дей-
ствие рифамицина. Его используют при лечении трахомы, кото-
рая вызывается ДНК-содержащим вирусом. Известно ингиби-
рующее действие на синтез белка у микроорганизмов и целого
ряда других антибиотиков.
Контрольные вопросы. 1. В чем состоит биологическая роль нуклеиновых
кислот? 2. Как была доказана роль ДНК в наследственности? 3. Как построена
ДНК? 4. Каким образом происходит репликация ДНК? 5. Каковы различия
молекул иРНК, рРНК, тРНК? 6. Что такое транскрипция? 7. Что означает
термин «трансляция»? 8. Как осуществляется синтез полипептида в рибосомах?
Глава 7
ГЕНЕТИКА МИКРООРГАНИЗМОВ
С середины 40-х годов нашего века объектом генетических
исследований становятся вирусы и бактерии. Много сделали для
рождения генетики микроорганизмов С. Лурия, М. Дельбрюк и
другие ученые того времени. Они разработали системы для изуче-
ния литических взаимодействий бактериофага и клетки, а также
методы проведения опытов с микроорганизмами, показали, как
проводить учет их признаков и анализ полученных результатов.
Преимущество микроорганизмов как генетических объектов за-
ключается в простоте их культивирования, коротком периоде ге-
нерации, огромной численности потомства. Жизненный цикл
бактерий длится меньше часа. Можно вырастить миллиарды бак-
терий за короткое время в небольшом объеме питательной среды.
Это позволяет регистрировать генетические изменения, происхо-
дящие с частотой одно на 1 млн клеток и реже. Кроме того,
бактерии имеют гаплоидный набор хромосом и совмещают в себе
функции гаметы и особи. Вирусы и бактерии оказались незамени-
мым объектом для изучения тонкой структуры гена и его дейст-
вия. К классическим объектам генетических исследований среди
бактерий относятся кишечная палочка (Escherichia coli), бактерии
рода Salmonella, нейроспора, а среди вирусов — бактериофаги,
поражающие эти виды бактерий, и вирус табачной мозаики. На
основании результатов исследований заражения бактерий бакте-
риофагами были сформулированы многие принципы, на которых
основана современная молекулярная биология.
СТРОЕНИЕ И РАЗМНОЖЕНИЕ БАКТЕРИЙ
Химический состав клеток бактерий в основном такой же, как
и клеток высокоорганизованных организмов. Клетки бактерий
окружены оболочкой, внутри которой находятся цитоплазма,
ядерный аппарат, рибосомы, ферменты и другие включения. В
отличие от клеток эукариот у них отсутствуют митохондрии,
аппарат Гольджи и эндоплазматическая сеть. В центральной
части цитоплазмы бактерий расположены ядерный аппарат —
нуклеоид и плазмиды. Ядро прокариот называется нуклеоидом
потому, что оно в отличие от эукариот не изолировано от цито-
91
плазмы мембраной и представлено одной очень длинной молеку-
лой ДНК (хромосомой). Хромосома бактерии Е. coli включает
около 510° пар оснований, имеет относительную молекулярную
массу 3-109 Д. В хромосоме кишечной палочки ДНК замкнута в
кольцо и состоит из дискретно расположенных генов. Длина
вытянутой молекулы ДНК в расправленном состоянии достигает
1 мм, что значительно превышает среднюю длину самой бакте-
рии. ДНК бактерий по своему строению не отличается от ДНК
высших организмов.
Кроме нуклеоида в цитоплазме большинства бактерий содер-
жатся так называемые внехромосомные факторы, получившие
название плазмид. Плазмиды представляют собой кольцевые моле-
кулы ДНК, обладают свойствами репликона — могут реплициро-
ваться с помощью ферментов клетки бактерии независимо от
основной хромосомы. Плазмида включает последовательность из
одного или нескольких генов. У некоторых видов бактерий обна-
ружены факторы резистентности к лекарственным веществам —
R-факторы. К другому типу плазмид относятся колициногенные
факторы. Колициногены включают гены, которые обусловлива-
ют синтез особых белковых веществ — колицинов. Колицины
даже в низких концентрациях способны убивать бактерий того
же вида, не имеющих соответствующего колициногена. Клетки,
включающие колициноген, иммунны к соответствующему коли-
цину. Плазмиды реплицируются в цитоплазме автономно и пере-
даются при делении дочерним клеткам.
При размножении клетки бактерии наиболее ответственным
является процесс воспроизведения нуклеоида. В нуклеоиде ДНК
суперспирализована и плотно уложена. Электронно-микроскопи-
ческое исследование показало, что один конец ДНК прикреплен
к клеточной мембране. Связь с клеточной мембраной, по-види-
мому, необходима как для процесса репликации ДНК, так и для
четкого разделения вновь образовавшихся дочерних молекул
ДНК. Репликация ДНК у микроорганизмов происходит так же,
как и у высших организмов, — полуконсервативным способом. В
репликации участвуют ферменты ДНК-полимеразы. Непрерыв-
ная репликация в направлении 5->3' идет только на одной из
комплементарных цепей. Она называется лидирующей. На вто-
рой цепи г (запаздывающей) синтез ДНК идет также в направле-
нии 5'—>3', но на коротких фрагментах Оказаки. Каждый фраг-
мент инициируется коротким полирибонуклеотидом. Эти РНК
служат затравкой для дальнейшего роста цепи ДНК. Затем РНК
удаляется, брешь заполняется при помощи ДНК-полИмеразы и
фрагменты Оказаки соединяются при помощи ферментов лигаз.
К моменту завершения цикла репликации ДНК точки при-
крепления дочерних ДНК отодвигаются благодаря активному
росту участка бактериальной мембраны между ними. В результа-
92
те сложного комплекса процессов образуется межклеточная
дерегородка. В период репликации ДНК и образования перего-
родки клетка непрерывно растет, идет формирование рибосом и
других соединений. На определенной стадии дочерние клетки
отделяются друг от друга. Каждая дочерняя клетка имеет такой
да набор генетической информации, какой был в исходной бак-
териальной клетке.
СТРОЕНИЕ И РАЗМНОЖЕНИЕ ВИРУСОВ
Вирусы относятся к микроорганизмам, хотя резко отличаются
ОТ всех известных клеточных форм жизни. Частицы вирусов
очень малы (от 20 до 450 нм). С помощью электронного микро-
скопа обнаружено, что они имеют палочковидную, шарообраз-
ную, а в большинстве случаев многогранную форму. Строение
частицы вируса намного проще, чем клетки любого организма.
Вирусная частица содержит одну из нуклеиновых кислот (ДНК
ИЛИ РНК), которая окружена белковой оболочкой (капсидом).
Геном вирусов представлен одной из возможных форм нуклеи-
новых кислот: двухцепочной или одноцепочной ДНК, одноце-
почной или двухцепочной РНК. Молекулярная масса вирусных
нуклеиновых кислот колеблется в широких пределах: у ДНК-со-
держащих вирусов от 1,5-106 до 1,6-10*, у РНК-содержащих виру-
сов от 1,6-106 до 9,0-106. Молекулы нуклеиновых кислот могут
быть линейными и кольцевыми.
< Вирусы репродуцируются только внутри клетки какого-то орга-
низма и используют для этого ее ферментные системы и другие
необходимые компоненты. Круг хозяев для определенного вируса
может быть ограничен. Вирусы могут инфицировать одноклеточ-
ные микроорганизмы — микоплазмы, бактерии и водоросли, а
также клетки высших растений и животных.
К настоящему времени с генетической точки зрения лучше
всего изучены вирусы, паразитирующие в бактериях. Их называ-
ют бактериофагами. Всюду, где размножаются бактерии, обнару-
живаются и паразитирующие в них фаги. Они находятся в ки-
шечнике человека и животных, в сточных водах, почве. Разные
фаги имеют различную форму частиц. Наиболее изучены фаги,
Паразитирующие на штамме В Е. coli (колифаги). Колифаги ну-
меруются от Т1 до Т7. Фаги Т-четной группы состоят из головки
гексагональной формы и хвостового отростка (рис. 22). В голов-
ке плотно упакована ДНК, окруженная белковой оболочкой.
Хвостовой отросток состоит из полого стержня диаметром около
2,5 нм, окруженного чехлом, способным к сокращению. Один
Конец стержня прикреплен к головке, другой — к шестиугольной
базальной пластинке, от которой отходят короткие зубцы с
Длинными нитями на концах. У Т-четных фагов ДНК включает
Примерно 200 тыс. пар нуклеотидов, образующих около
93
700А
Рис. 22. Строение Т-четных фагов, инфицирующих Е. coli
100 генов. Ее Длина 34 мкм, что в сотни раз превышает длину
головки. Размер фага с конца хвостового отростка до вершины
головки равен около 200 нм, ширина головки 50—60 нм.
ВЗАИМОДЕЙСТВИЕ ФАГА С БАКТЕРИАЛЬНОЙ КЛЕТКОЙ
К клеточной стенке бактерий фаги прикрепляются концевы-
ми нитями отростков. Затем оболочка бактерии растворяется с
помощью фермента лизоцима, белковый чехол хвостового от-
ростка сокращается и через канал хвостового отростка нуклеино-
вая кислота вводится (впрыскивается) в цитоплазму клетки.
После проникновения нуклеиновой кислоты внутрь клетки бак-
терии следует Си-фаза, или фаза смены информации. В этот
период фаговые частицы не обнаруживаются, однако в клетке
развиваются процессы, обусловленные фаговым геномом. Начи-
нается синтез иРНК и ранних белков, необходимых для синтеза
ДНК фага и других структурных компонентов зрелого фага. Син-
тез ДНК фага осуществляется с помощью клеточной ДНК-поли-
меразы и сопровождается полным распадом ДНК бактерии и ее
утилизацией. Если ДНК бактерии не хватает, фаговая ДНК син-
тезируется из компонентов среды. ДНК фага можно обнаружить
в клетке через 8—9 мин после заражения. С 9-й минуты начина-
ют синтезироваться специфичные фаговые белки. На последнем
94
этапе взаимодействия фага с бактерией происходит самосборка
фаговых частиц, которая состоит в необратимом объединении
фаговой ДНК и сформировавшейся белковой оболочки. После
этого происходит лизис бактерии и зрелые фаги выходят в окру-
жающую среду. Полный цикл развития фага составляет 30—
90 мин. За этот период образуется 200 и более фаговых частиц,
которые способны заражать новые клетки.
По характеру взаимодействия с клеткой бактерии бактериофа-
ги делятся на вирулентные и умеренные. Вирулентные фаги всег-
да лизируют клетку бактерии. Умеренные фаги могут вызвать
лизис клетки бактерии, но могут перейти и в неинфекционную
форму. В этом случае молекула ДНК фага прикрепляется к ДНК
бактерии и передается с нею дочерним клеткам. Фаг, существую-
щий в такой форме, называется профагом. Сравнительно недавно
стало известно, что включение вирусной ДНК в бактериальную
происходит путем кроссинговера между хромосомами бактерии и
вируса. Хромосома вируса принимает кольцевую форму и при-
крепляется к определенному локусу хромосомы бактерии. Затем
хромосомы бактерии и вируса разрываются, концы их соединя-
ются крест-накрест и профаг оказывается включенным в хромо-
сому клетки хозяина. В этом случае профаг является как бы
частью ДНК бактерии и вместе с ней реплицируется. Клетки
бактерий, имеющие в своей хромосоме профаг, называются лизо-
генными, а явление совместного существования ДНК бактерии и
профага называется лизогенией.
Профаг может сосуществовать с бактериальной клеткой дли-
тельное время, но при определенных условиях может отделиться
от ДНК бактерии, перейти в вирулентную форму и вызвать
лизис бактериальной клетки с помощью фермента лизоцима.
Освобождение хромосомы вируса происходит один раз прибли-
зительно на 10 000 делений лизогенной бактерии. РНК-вирусы,
так же как и ДНК-вирусы, могут вызывать лизогенное состояние
клеток бактерий. Установлено, что на РНК вируса может синте-
зироваться комплементарная ей ДНК. На ней синтезируется вто-
рая цепь ДНК. Таким образом, образуется полноценная молеку-
ла ДНК, способная соединиться с ДНК клетки хозяина. В каче-
стве провируса эта ДНК может передаваться потомству, и
вызываемая данным вирусом болезнь может стать как бы наслед-
ственной. Наличие профага в составе бактериальной хромосомы
не мешает репликации ДНК бактерии. Однако гены профага,
встроенные в ДНК клетки, не транскрибируются. Это связано с
образованием в клетке бактерии репрессора — низкомолекулярно-
го белка, блокирующего считывание наследственной информа-
ции, записанной в фаговой ДНК. Умеренные фаги могут быть
дефектными, т. е. не способными к образованию зрелых фаго-
вых частиц. Такие фаги осуществляют трансдукцию и использу-
ются в генной инженерии.
95
ПОНЯТИЕ О ГЕНОТИПЕ И ФЕНОТИПЕ МИКРООРГАНИЗМОВ
Генотип — совокупность генов бактериальной клетки; фено-
тип — совокупность всех признаков и свойств, проявляемых
данной культурой. В отличие от особей высших организмов, у
которых исследуются признаки и свойства каждой особи, у мик-
роорганизмов изучаются признаки и свойства в целом всей куль-
туры (штамма), т. е. совокупности клеток, включающих миллио-
ны и миллиарды особей. Культуры микробов могут отличаться
морфологическими, физиологическими и биохимическими при-
знаками. К морфологическим признакам относятся окраска, раз-
мер, форма, характер края и поверхности отдельно растущих
колоний и т. д.; к физиологическим и биохимическим — способ-
ность или неспособность расти при пониженной или повышен-
ной температуре, устойчивость к антибиотикам, различным
ядам, облучению, отношение к питательным средам.
Пй способу питания бактерии делятся на прототрофные и аук-
сотрофные. Прототрофные могут жить на минимальной питатель-
ной среде (содержащей минеральные соли и углеводы) и необхо-
димые им вещества способны синтезировать сами. В то же время
получено много штаммов грибов и бактерий, которые в отличие от
исходного штамма (так называемого дикого типа) лишены способ-
ности синтезировать одну или несколько аминокислот или другие
факторы роста из более простых предшественников. Такие штам-
мы называют ауксотрофными. Ауксотрофный штамм можно иден-
тифицировать по его неспособности расти и размножаться на син-
тетической среде, которая не содержит какого-то специфического
фактора роста. Но если в синтетическую среду добавить компо-
нент, который ауксотрофный штамм не способен самостоятельно
синтезировать, то он начинает расти так, что его уже невозможно
отличить от прототрофного. Таким образом, культура микроорга-
низма может быть изучена в отношении многих признаков.
Гены, ответственные за синтез определенного соединения,
обозначают тремя строчными буквами, соответствующими на-
чальным буквам этого соединения. Гены исходного дикого типа
обозначают со знаком «+», например, his+ — гистидиновый ген,
1еи+ — лейциновый ген, arg+ — аргининовый ген и т. д. Гены чув-
ствительности или резистентности к лекарственным препаратам,
фагам и ядам обозначают буквами s (sensitive — чувствительный) и
г (resistant — резистентный). Например, чувствительность к стреп-
томицину обозначают str®, а резистентность — strr. Фенотип бак-
терий обозначают теми же символами, что и генотип, но с про-
писной буквы. Так, генотипам his+, leu+, arg+, strr соответствуют
фенотипы His+, Leu+, Arg+, Strr. Символы His+, Leu+, Arg+ указы-
вают на способность синтезировать гистидин, лейцин, аргинин, а
символ Strr — на резистентность к стрептомицину. Альтернатив-
ные им признаки обозначают символами His-, Leu-, Arg-, Str®.
96
Генотип микроорганизмов представлен совокупностью генов,
обусловливающих потенциальную возможность формирования
любого их признака. Но формирование признака происходит в
определенных условиях окружающей среды, которые не всегда
способствуют проявлению генотипа. Так, два штамма Е. coli с
генотипами lac* и 1ас— на среде с лактозой будут иметь разные
фенотипы: бактерии с генотипом 1ас+ образуют колонии красного
цвета, а бактерии с генотипом 1ас— образуют бесцветные колонии,
так как они не ферментируют лактозу. При выращивании этих
штаммов на среде без лактозы фенотип их будет одинаковым.
Патогенный генотип одного штамма бактерий можно отличить от
другого непатогенного штамма только при заражении восприим-
чивого животного. В организме невосприимчивого животного ге-
нотип патогенного штамма не появится.
Исследования по генетике микроорганизмов показывают, что
им присуща большая изменчивость. Изменения, возникающие
под влиянием окружающей среды и не сохраняющиеся при пере-
носе клеток в исходные условия, носят название модификацион-
ных. Модификации не наследственны, они не затрагивают геноти-
па микроба и исчезают в первом или последующих поколениях.
Микроорганизмам, как и всем прочим живым организмам, свойст-
венно проявление комбинативной изменчивости, которая является
наследственной. В силу того что прокариоты имеют гаплоидный
набор хромосом и им несвойственно половое размножение, гене-
тические рекомбинации у них имеют свои особенности. Рекомби-
нация у бактерий происходит путем переноса генетического мате-
риала из клетки донора в клетку реципиента при помощи конъ-
югации, трансдукции и трансформации. Эти процессы отличаются
главным образом способом переноса генетического материала.
КОНЪЮГАЦИЯ
Конъюгация — перенос генетического материала от одной бак-
териальной клетки (донора) к другой (реципиенту) при их непо-
средственном контакте. Процесс конъюгации у бактерий обнару-
жили Дж. Ледерберг и Э. Татум в 1946 г. Они провели следую-
щий эксперимент. Были отобраны два ауксотрофных мутантных
штамма Е. coli К-12: не способный синтезировать метионин и
биотин штамм Met- Bio- и не способный синтезировать трео-
нин и лейцин штамм Thr- Leu-. Оба штамма в течение ночи
выращивали вместе на полноценной среде. Затем смешанную
культуру центрифугировали, отмывали от полноценной среды и
высевали на минимальную питательную среду. На минимальной
питательной среде без метионина, биотина, треонина и лейцина
появились прототрофные колонии Met+ Bio* Thr* Leu* с часто-
той около 1 на каждые 107 клеток. Дополнительные опыты пока-
зали, что ни трансформации, ни трансдукции в данном случае не
97
происходило. Из этого следовало, что образование рекомбинант-
ных геномов происходило в результате контакта родительских
клеток. Вскоре были получены микрофотографии конъюгирую-
щих бактерий кишечной палочки, которые свидетельствовали о
том, что между бактериями при конъюгации образуется цито-
плазматический мостик.
В 1952 г. Хейс установил неравноценную роль родительских
штаммов при конъюгации. Выяснилось, что один штамм являет-
ся донором (мужским), другой — реципиентом (женским). Клетки-
доноры обладают половым фактором F. Он является конъюгатив-
ной плазмидой и представляет собой циркулярно замкнутую мо-
лекулу ДНК. Половой фактор F автономно существует в
цитоплазме. Бактериальные клетки с фактором F обозначают F+,
а не имеющие его — F^“. В составе генома конъюгативной плаз-
миды имеется tra-оперон, гены которого контролируют образова-
ние половых ворсинок (пилей) донорской клетки, необходимых
для осуществления контакта с реципиентной клеткой, конъюга-
тивнйй перенос собственной плазмиды или хромосомной ДНК,
а также репликацию автономной плазмиды.
Механизм переноса генетического материала при конъюгации
из бактерии донора в бактерию реципиента показали В. Вольман
и Ф. Жакоб. При конъюгации фактор F может перейти из муж-
ской в женскую клетку и превратить ее в F+. Доноры F*" пере-
носят довольно эффективно F-плазмиду во все клетки F-, а
гены хромосомы — с низкой частотой (10-5).
Половой фактор F обладает способностью включаться в геном
бактерии и тогда из цитоплазматической структуры превращается
в фрагмент хромосомы. Клетки, в которых возникает этот процесс,
образуют Hfr-штамм. Доноры Hfr переносят бактериальную хромо-
сому с фиксированной точки — сайта интеграции плазмиды, ори-
ентированным образом и с высокой частотой (10-2—10—3). Интег-
рированный F-фактор переносится последним. Генетическим
методом идентифицировано около 25—30 сайтов интеграции
фактора F в хромосому. При конъюгации клетки-доноры F1" или
Hfr соединяются с Клетками-реципиентами F~ при помощи
конъюгационного мостика — особой протоплазматической труб-
ки, образуемой клеткой F4". В клетке донора Hfr под влиянием
фермента эндонуклеазы в точке внедрения фактора F происхо-
дит разрыв цепи ДНК. Свободный конец одной из цепей ДНК
постепенно начинает передвигаться через конъюгационный мос-
тик в клетку реципиента (F-) и сразу же достраиваться до двух-
цепочной структуры. На оставшейся в клетке-доноре цепи ДНК
синтезируется вторая цепь.
Так как фактор F у разных штаммов Hfr включается в хромо-
сому и разрывает ее в разных местах, переход хромосом в реци-
пиентную клетку начинается с разных участков. Для переноса
всей цепи ДНК в клетку реципиента требуется при 37 °C
98
•100 мин, но конъюгационный мостик очень хрупкий, легко раз-
рывается, и, как правило, вся цепь не успевает перейти. Поэтому
С' более высокой частотой передаются гены, расположенные
около начальной 0-й точки хромосомы донора. Затем ДНК доно-
ра в гомологичных участках вступает в контакт с ДНК. реципи-
ента, и в результате кроссинговера некоторые участки одной
цепи ДНК реципиента заменяются фрагментами ДНК донора.
Искусственное прерывание конъюгации через определенное
время после начала скрещивания и выявление рекомбинантов
дали возможность определить последовательность перехода раз-
ных генов донора в клетку F-. На основании определения вре-
мени передвижения фрагментов разной длины из клеток Hfr в
клетки F- было установлено расстояние между генами в мину-
тах, что позволило построить карты хромосом.
В основе построения карт хромосом лежат последователь-
ность расположения генов в хромосоме и расстояние между
ними в минутах. Вся окружность хромосомы Е. coli составляет
100 мин. К настоящему времени на карту Е. coli К-12 нанесено
более 1000 генов, что составляет около 30 % ее генетической
емкости (рис. 23). Иногда включенный в хромосому Hfr половой
Рис. 23. Неполная кольцевая карта хромосомы Е. coli К-12
99
фактор освобождается и при этом (подобно профагу) может за-
хватить с собой прилегающий к нему участок ДНК. бактерии.
При конъюгации половой фактор вместе с .фрагментом ДНК
иногда переходит в женскую клетку, превращая ее в мужскую и
передавая ей свойства, контролируемые фрагментом хромосомы
донора. Процесс переноса генетической информации при помо-
щи полового фактора называется сексдукцией.
ТРАНСДУКЦИЯ
Рис. 24. Схема опыта по
трансдукции
Трансдукция — перенос генов из одной бактериальной клетки
в другую при помощи бактериофага. Впервые это явление уста-
новили в 1952 г. Н. Зиндер и Дж. Ледерберг. Они проводили
исследования на патогенных для мышей бактериях Salmonella
typhimurium. Были отобраны два штамма этих бактерий: штамм
22А ауксотрофный, не способный синтезировать триптофан (Т—),
и штамм 2А, способный синтезировать триптофан (Т+). Эти
штамшя засевали в U-образную трубку, разделенную внизу бак-
териальным фильтром (рис. 24). В одно колено трубки засевали
штамм 22А (Т~), в другое — штамм 2А (Т+). После определенно-
го периода инкубации бактерии штамма 22А при посеве на ми-
нимальную питательную среду дали небольшое количество коло-
ний (частота появления трансдуцированных клеток была равна
110—*). Это свидетельствовало о том, что некоторые клетки
приобрели способность синтезировать триптофан. Каким же об-
разом бактерии могли приобрести это свойство? Исследования
показали, что штамм 22А был
лизогенен по фагу Р-22. Этот
фаг освобождался из лизоген-
ной культуры, проходил через
фильтр и лизировал штамм 2А.
Присоединив часть генетичес-
кого материала штамма 2А, фаг
возвращался обратно и переда-
вал этот генетический материал
штамму 22А. Штамм 22А при-
обретал специфические наслед-
ственные свойства штамма 2А,
в данном случае свойство син-
тезировать триптофан. Анало-
гичным образом могут быть
трансдуцированы и другие при-
знаки, в том числе способность
к сбраживанию, устойчивость к
антибиотикам и т. д.
Явление трансдукции уста-
новлено также у кишечной па-
100
лочки и актиномицетов. Как правило, трансдуцируется один ген,
реже два и очень редко три сцепленных гена. При переносе
генетического материала заменяется участок молекулы ДНК
фага. Фаг при этом теряет свой собственный фрагмент и стано-
вится дефектным. Включение генетического материала в хромо-
сому бактерии реципиента осуществляется механизмом типа
кроссинговера. Происходит обмен наследственным материалом
между гомологичными участками хромосомы реципиента и мате-
риала, привнесенного фагом.
Различают три вида трансдукции: общую, или неспецифичес-
кую, специфическую и абортивную. При неспецифической транс-
дукции в период сборки фаговых частиц в их головку вместе с
фаговой ДНК может включиться любой из фрагментов ДНК
пораженной бактерии. В результате в реципиентные клетки
могут переноситься различные гены бактерии донора. Неспеци-
фическую трансдукцию могут осуществлять фаги Р-1 и Р-22 у
эшерихий, шигелл и сальмонелл. При специфической трансдукции
профаг включается в определенное место хромосомы бактерии и
трансдуцирует определенные гены, расположенные в хромосоме
клетки донора рядом с профагом. Например, фаг X (лямбда) в
состоянии профага всегда включается в одно и то же место в
хромосоме кишечной палочки и трансдуцирует локус, обуслов-
ливающий способность к сбраживанию галактозы. При отделе-
нии профагов от ДНК хозяина прилегающие к профагу бактери-
альные гены вместе с ним выщепляются из состава хромосомы,
а часть генов профага остается в ее составе. Частота общей
трансдукции составляет от 1 на 1 млн до 1 на 100 млн. Специ-
фическая трансдукция происходит чаще.
Установлено, что фрагмент хромосомы донора, перенесенный
в% клетку реципиента, не всегда включается в хромосому реципи-
ента, а может сохраняться в цитоплазме клетки. При делении
бактерий он попадает только в одну из дочерних клеток. Такое
состояние получило название абортивной трансдукции.
ТРАНСФОРМАЦИЯ
Трансформация — поглощение изолированной ДНК бактерии до-
нора клетками бактерии реципиента. Явление трансформации
кратко освещено при изложении доказательств роли ДНК в на-
следственности. В процессе трансформации принимают участие
две бактериальные клетки: донор и реципиент. Трансформирую-
щий агент представляет собой часть молекулы ДНК донора,
которая внедряется в геном реципиента, изменяя его фенотип. В
процессе трансформации клетки донора и реципиента не сопри-
касаются друг с другом. Механизм переноса генетического мате-
риала заключается в том, что из клеток донора выделяются в
окружающую среду молекулы или фрагменты молекул ДНК.
101
Сначала эта ДНК адсорбируется на оболочке клетки реципиента.
Затем через определенные рецепторные участки ее стенки при
помощи специальных клеточных белков ДНК втягиваются
внутрь клетки. Проникающая донорская ДНК должна быть двух-
цепочной. В реципиентной клетке она становится одноцепоч-
ной. В ДНК реципиента включается одна из цепей трансформи-
рующего фрагмента. Эта цепь вступает в синапсис с гомологич-
ным участком хромосомы реципиента и встраивается в нее
посредством кроссинговера. При этом участок ДНК реципиента
замещается фрагментом донора. Молекула ДНК со вставкой
трансформирующего участка оказывается гибридной. При следу-
ющем удвоении возникают одна нормальная дочерняя молекула
ДНК, другая — трансформированная. Установлено, что способ-
ность бактерий-реципиентов к трансформации определяется их
физиологическим состоянием. Такое физиологическое состояние
было названо компетентностью. Состояние компетентности
краткосрочно и приурочено к определенному времени клеточно-
го цикла. Было обнаружено, что трансформирующей способнос-
тью обладают только крупные молекулы ДНК с молекулярной
массой не менее 5-105 Д. У бактерий трансформация имеет место
чаще в пределах одного вида, но наблюдается и между разными
близкими видами. Это указывает на то, что у них сохранилась
гомологичность некоторых участков ДНК
Изучение процессов рекомбинации у бактерий имеет важное
значение для ветеринарного врача, так как ведет к пониманию
причин высокой изменчивости бактерий, их способности к при-
обретению свойств патогенности, устойчивости к лекарственным
веществам.
Контрольные вопросы. 1. Каково строение бактерий и вирусов? 2. Как раз-
множаются вирусы и бактерии? 3. Что такое профаг, умеренные фаги и лизоге-
ния? 4. Что такое генотип и фенотип у микроорганизмов? 5. Как происходит
обмен генетическим материалом у бактерий при конъюгации, трансдукции и
трансформации?
Глава 8
БИОТЕХНОЛОГИЯ
Термин «биотехнология» получил широкое распространение в
70-е годы нашего столетия. Биотехнология опирается, с одной
стороны, на древнейшие традиции бродильных и микробиологи-
ческих производств, с другой — на новейшие открытия биологи-
ческих наук. Биотехнология — это наука об использовании живых
организмов и биологических процессов в производстве. Это ком-
плексная многопрофильная область научно-технического про-
гресса, включающая многообразный микробиологический синтез,
генетическую и клеточную инженерию, инженерную энзимоло-
гию. Биотехнология возникла на стыке микробиологии, биохимии
и биофизики, генетики и молекулярной генетики, цитологии и
иммунологии. Уровень развития ее во многом определяет научно-
технический потенциал страны. Стоимость мировой биотехноло-
гической продукции к концу XX в., по прогнозам специалистов,
достигнет 20 млрд долларов. Прогресс биотехнологии в животно-
водстве в предстоящие 10—15 лет будет определяться развитием
генной, клеточной и эмбриогенетической инженерии.
ГЕННАЯ ИНЖЕНЕРИЯ
Генная инженерия — раздел биотехнологии, связанный с целена-
правленным конструированием in vitro новых комбинаций генетичес-
кого материала, способного размножаться в клетке и синтезиро-
вать определенный продукт.
Генная инженерия решает следующие задачи:
1) получение генов путем их синтеза или выделения из кле-
ток;
2) получение рекомбинантных молекул ДНК;
3) клонирование генов или генетических структур;
4) введение в клетку генов или генетических структур и син-
тез чужеродного белка.
Получение генов. Известны два способа искусственного син-
теза генов вне организма — химический и ферментативный. Хи-
мическим путем в 1969 г. американский ученый Г. Корана с
сотр. синтезировали ген аланиновой тРНК дрожжей. Этот ген
включал 77 пар нуклеотидов, последовательность которых была
103
уже ранее расшифрована. Ученые сначала синтезировали фраг-
менты ДНК длиной от 5 до 12 нуклеотидов, затем соединили их
в определенном порядке при помощи открытого к тому времени
фермента лигазы. Однако ген аланиновой тРНК при введении в
клетку кишечной палочки или бесклеточную среду не функцио-
нировал. Оказалось, что он не имел регуляторных элементов —
промотора, где локализована точка инициации синтеза, и терми-
нальных кодонов, которые дают сигнал о завершении синтеза
иРНК В 1976 г. Г. Корана с corp, осуществили синтез гена
супрессорной тирозиновой тРНК протяженностью 126 пар нук-
леотидов. Были также синтезированы примыкающие к гену регу-
ляторные участки: промотор (52 пары нуклеотидов) и термина-
тор (21 пара нуклеотидов) и прикрепленные к концам полимера
тетрануклеотиды ААТТ и ТТАА. В этом случае искусственно
синтезированный ген, встроенный в геном мутантного фага Т4,
при введении в живую кишечную палочку оказался работоспо-
собным. В 1979 г. в нашей стране под руководством Ю. А. Ов-
чинникова и М. Н. Колосова химическим путем с помощью
ферментов были синтезированы гены гормонов человека и жи-
вотных — энкефалина и брадикинина.
Химико-ферментативный синтез довольно широко применя-
ют в генной инженерии для получения мелких генов. Для полу-
чения генов животных, растений и человека, размер которых
составляет 1000—3000 нуклеотидов, этот метод слишком сложен
и пока неосуществим. Ученые нашли более простой способ по-
лучения таких генов.
В 1970 г. Г. Темин с сотр. обнаружили фермент обратную
транскриптазу (ревертазу). В 1972 г. было открыто, что некото-
рые онкогенные вирусы при помощи обратной транскриптазы
могут синтезировать ДНК, используя в качестве матрицы иРНК.
Дальнейшие исследования показали, что матрицами для образо-
вания копий ДНК могут служить не только РНК онкогенных
вирусов, но и другие иРНК. Это открывало принципиальные
возможности ферментативного синтеза любых индивидуальных
генов (ДНК), используя их РНК-копии. Под ферментативным
синтезом гена имеют в виду транскрибирование комплементар-
ной нити ДНК (гена) на молекулах РНК в пробирке. Система
для синтеза представляет собой раствор, в котором содержатся
все четыре нуклеотида, входящих в состав ДНК, ионы магния,
фермент обратная транскриптаза (ее получают из онкогенных
вирусов) и матричная (информационная) РНК, кодированная
геном, копию которого ставится задача снять. На иРНК обрат-
ная транскриптаза синтезирует комплементарную ей цепь ДНК,
а затем на ней при помощи этого же фермента синтезируется
вторая цепь ДНК. В результате получается ген по структуре
такой же, как и тот, на котором была синтезирована иРНК.
Этим способом в лабораториях многих стран создан целый
104
ряд генов. В нашей стране йод руководством В. А. Энгельгардта
был разработан проект «Ревертаза» — программа синтеза генов с
помощью этого фермента. В осуществлении проекта участвовали
ведущие отечественные и зарубежные институты. В итоге с 1974
по 1978 г. были синтезированы гены глобина голубя, кролика и
человека, а также гены митохондрий печени крыс, часть гена,
кодирующего иммунные белки мышей, и др.
Гены, синтезированные при помощи обратной транскрипта-
зы, не имеют регуляторных участков и функционально неактив-
ны. Поэтому транскрибирование копий ДНК рекомендуется
проводить с про-мРНК, которые имеют все необходимые копии
регуляторных частей гена.
Кроме изложенных способов ген можно получить путем выде-
ления с помощью трансдуцирующих фагов. Таким путем в
1969 г. был впервые выделен лактозный ген кишечной палочки.
Однако такой способ получения генов не всегда пригоден, так
как предусматривает строгие места локализации фагов. Поэтому
используются и другие приемы выделения фрагментов ДНК с
нужными для переноса генами.
Рестриктирующие эндонуклеазы (рестриктазы). Важным собы-
тием для развития генной инженерии было открытие в клетках
бактерий ферментов, способных разрезать молекулу ДНК в стро-
го определенных местах. Ферменты эти называются рестрикти-
рующими эндонуклеазами или рестриктазами, а процесс «разреза-
ния» молекулы ДНК называется рестрикцией. С рестриктазами
связаны дальнейшие успехи в молекулярной биологии. Они
стали одним из главных элементов генной инженерии. Участок
ДНК, узнаваемый определенной рестриктазой, включает специ-
фическую последовательность из 6—8 пар оснований, являющих-
ся палиндромом. Палиндромом называется последовательность
ДНК, которая считывается одинаково в обоих направлениях,
начиная от З'-конца каждой цепи. Например, рестриктаза E.coli
под названием EcoRI узнает последовательность
--------------------Г I ААТТ Ц----------
----------------------------------------Ц ТТАА t Г-
и, прикрепляясь к ней, делает по одному однонитевому надрезу
с обеих сторон, т. е. разрезает ее в симметричных участках,
указанных стрелками. В результате двухцепочная молекула ДНК,
если была кольцевой, вследствие разрыва приобретает линейное
строение. На краях молекулы образуются липкие концы,
представленные однонитевыми участками из четырех нуклеоти-
дов: на одном конце будет последовательность ААТТ, на дру-
гом — ТТАА. При наличии липких концов молекула ДНК из
линейной формы вновь способна замкнуться в кольцо без до-
полнительной обработки. Были обнаружены рестриктазы, узнаю-
щие самые разнообразные последовательности нуклеотидов. На-
пример, рестриктаза EcoRII узнает последовательность ЦЦТГГ.
105
К настоящему времени известно бвыше 200 рестриктаз, харак-
терных для разных видов микроорганизмов. Это открывает новые
возможности для экспериментаторов. Огромные молекулы выс-
ших организмов включают большое число мест разрезания для
ферментов рестрикции. При обработке ДНК рестриктазами обра-
зуются многочисленные фрагменты ДНК, в которых представле-
ны отдельные гены. Затем гены можно соединять в определенные
структуры. Остающиеся в такой структуре разрывы нитей ДНК
воссоединяются лигазой. Имеется и другой способ получения
фрагментов ДНК с липкими концами. Он состоит в том, что
выделенные или искусственно синтезированные участки ДНК об-
рабатывают эндонуклеазой, укорачивающей участки ДНК с обоих
концов, после чего при помощи фермента полинуклеотидтран-
сферазы пристраивают к этим концам последовательности адени-
ловых и тимидиловых нуклеотидов. Длина липких поли-А и поли-
Т составляет 50—100 нуклеотидов. При встраивании гена в вектор
используются оба рассмотренных метода и часто совместно.
Рекомбинантные ДНК. Рекомбинантная ДНК —это искусст-
венно полученная молекула ДНК. Она имеет форму кольца,
включает ген (гены), составляющий объект генетических манипу-
ляций, и так называемый вектор, обеспечивающий размножение
рекомбинантной ДНК и синтез в клетке хозяина определенного
продукта, кодируемого внесенным геном. Векторами являются те
компоненты рекомбинантных ДНК, которые способны акцепти-
ровать чужеродные гены и обеспечивать их репликацию в клетках
хозяина. Векторы должны обладать следующими особенностями:
1) иметь свойства репликона; 2) нести субстратные участки для
рестриктаз, иначе невозможна встройка ДНК; 3) содержать один
или несколько маркирующих генов, чтобы по фенотипу можно
было определить факт его передачи. Исследования показали, что
эффективными векторами являются плазмиды. Из них в качестве
векторов используются Col El, pSC 101 и др. Из вирусов в каче-
стве векторов используют фаги A., SV 40 и их производные. Векто-
ры придают рекомбинантной молекуле способность воспроизво-
диться независимо от хромосомы клетки бактерии.
Соединение вектора с фрагментом ДНК может производиться
следующими путями: при помощи липких концов, образующихся в
ДНК под действием эндонуклеаз рестрикции; дополнительного син-
теза полинуклеотидных фрагментов каждой из цепей ДНК (поли-А
и поли-Т); соединения тупых концов при помощи Т4-лигазы.
На рисунке 25 показаны ферментативный синтез гена и
встраивание его в векторную плазмиду. Слева на иРНК при
помощи обратной транскриптазы синтезируется цепь ДНК
(кДНК), затем иРНК удаляют щелочью и при помощи ДНК-
полимеразы достраивают вторую цепь кДНК, экзонуклеазой уко-
рачивают обе цепи ДНК и концевой трансферазой пришивают к
их концам поли-Т-последовательности. На этом же рисунке
106
мРНК
ОБРАТНАЯ
ТРАНСКРИПТАЗА
мРНК
кДНК
ДНК - ПОЛИМЕРАЗА
ДВУХНИТЕВАЯ
кДНК
ПЛАЗМИДА
РЕСТРИКТАЗА
__] ЛИНЕЙНАЯ
__| ДНК
' ПЛАЗМИДЫ
ЭКЗОНУКЛЕАЗА
ЭКЗОНУКЛЕАЗА —
— КОНЦЕВАЯ
-------- ТРАНСФЕРАЗА
АААА
КОНЦЕВАЯ ****---------
ТРАНСФЕРАЗА
--------------------------ТТТТ------.
ТТТТ--------------------------------
ГИБРИДНАЯ МОЛЕКУЛА
СО ВСТРОЕННЫМ ГЕНОМ
РАЗРЫВЫ УСТРАНЯЮТСЯ
ЛИГАЗОЙ
Рис. 25. Ферментативный синтез гена н встраивание его в векторную плазмиду
(по С. М. Гершензону)
справа показано, что кольцевую ДНК векторной плазмиды раз-
резают рестрикгазой и превращают ее в линейную форму, затем
экзонуклеазой цепи укорачивают и концевой трансферазой при-
шивают к ним поли-А-последовательности. На последнем этапе
соединяют оба типа молекул ДНК и получают гибридную моле-
кулу — векторную плазмиду со встроенным в нее синтезирован-
ным геном. Разрывы в цепях ДНК воссоединяют лигазой.
В данном случае было известно, какой ген включен в вектор-
ную плазмиду. Но в работах по трансгенозу чаще имеют дело со
многими фрагментами ДНК, и среди них только единичные
включают ген, который подлежит переносу. Для получения фраг-
ментов ДНК с определенным геном применяют так называемый
способ дробового ружья, который заключается в том, что ДНК
механически или ферментами дробится на множество мелких
фрагментов, после чего их вслепую гибридизируют с молекулами
ДНК вектора. Перед этим ДНК вектора обрабатывают рестрик-
тазой для придания им линейной формы и образования липких
концов. После введения рекомбинантных молекул в кишечную
палочку при помощи селективных сред выделяют те бактерии, в
которые попал фрагмент ДНК с нужным геном. Включенный
ген обнаруживают по продукту его действия в виде определенно-
го вещества (фермент, гормон и т. д.). Размножение в бактериях
107
идентичных рекомбинантных ДНК называется клонированием.
Каждый клон бактерий содержит свою рекомбинантную ДНК.
Разрабатываются методы, позволяющие производить замены
нуклеотидов в ДНК клонированного гена и тем самым изменять
свойства кодируемого этим геном белка.
Введение в клетку рекомбинантных молекул и синтез чужерод-
ного белка. Чаще всего рекомбинантные молекулы вводятся в
клетки бактерий методом трансформации. Сначала клетки бакте-
рий с целью повышения их способности поглощать плазмидную
ДНК обрабатывают хлористым кальцием или хлористым барием.
После этого в клеточную взвесь вводят раствор с рекомбинантны-
ми молекулами. Некоторые из этих молекул проникают внутрь
клетки, и часть из них, прикрепись к мембранам клетки, начинает
размножаться и функционировать (рис. 26).
ТРАНСФОРМИРОВАННЫЕ ДОЧЕРНИЕ КЛЕТКИ
Рис. 26. Типичный опыт генетической инженерии (по Beckingeham—Smith, 1975)
108
ДНК лактозного оперона
Генетический код
£ос£^О*Р^гал
ДНК плазмиды pBR 322
р-гал
NH2
| Химический синтез ДНК
Ген соматостатина
1|лАТТЦ|лТг| ГЦТ ГГТ ТГТ ЛАГ АЛИ ТГЦ ПТ Т f
—|цтаг | ГАТ АГТ | ТГТ ГЦТ П1А шт тал Г
I in vivo
У Som
4—Мет-Ала-Гли-Цис-Лиз -Асн-Фен -фен—
S Трп
S Лиз
НО-Цис-Сер-Тре -Фен -Тре—
обработка
., цианогенбромидом
фрагменты Р -гал + NHj -Ала-Гли-Цис-Лиз -Асн -фен -Фен-^^
S Трп
S Лиз
НО-Цис-Сер -Тре - Фен -Тре —
Активный соматостатин
Рис. 27. Функционирование химически синтезированного гена соматостатина
человека в клетках Е. coli (по К. Итакуре и др.)
Одно из наиболее важных для практики направлений генной
инженерии — конструирование микроорганизмов-продуцентов
нужных веществ. Первыми в этом направлении были исследова-
ния К. Итакуры и Г. Боейра с соавт. (1977). Им удалось добить-
ся экспрессии гена, кодирующего гормон соматостатин в клетках
кишечной палочки (рис. 27). Затем в разных странах клетки
кишечной палочки использовались для синтеза ряда белков и
гормонов человека и животных: инсулина, интерферонов, гормо-
на роста, урокиназы, кальцитонина, альбумина, тимозина и др. В
лабораториях А. А. Баева, Ю. А. Овчинникова, М. Н. Колосова,
Е. Д. Свердлова и др. осуществлена экспрессия генов, кодирую-
щих энкефалин, лейкоцитарный интерферон, брадикинин, сома-
тотропин и др.
В последние годы уделяется много внимания созданию генно-
инженерных вакцин. Получают антигены из рекомбинантных
микроорганизмов или культур клеток, в которые введен опреде-
ленный ген возбудителя болезни. Этим методом получен матери-
ал для вакцинации против гепатита В, гриппа А, малярии,
ящура, бешенства, паравируса свиней и др. В нашей стране
произведена обратная транскрипция РНК вируса гепатита А.
ДНК, кодирующая вирусный белок гепатита, была пришита к
109
ДНК вируса оспы. В результате ослабленная культура оспы вы-
зывает иммунитет против опасной болезни — гепатита. Вакцина
проходит производственное испытание.
Штаммы бактерий, продуцирующие вещества, активные в ор-
ганизме человека и животных, могут быть использованы для
промышленного производства лекарственных препаратов.
В нашей стране ведутся работы по получению методами ген-
ной инженерии суперпродуцентов продуктов, свойственных
клеткам, таких, как аминокислоты, витамины, ферменты, а
также по созданию культур, активно разлагающих нефть, пласт-
массы, разрушающих нафталин, фиксирующих азот, и т. д.
КЛЕТОЧНАЯ ИНЖЕНЕРИЯ
Под клеточной инженерией понимают метод конструирования
клеток нового типа на основе их культивирования, гибридизации и
реконструкции.
К у*л ьтура клеток — метод сохранения жизнеспособ-
ности клеток вне организма в искусственно созданных условиях
жидкой или плотной питательных сред. Использование культуры
клеток начато в 50-е годы нашего столетия, когда была показана
возможность выращивания вирусов в культивируемых клетках.
Затем развитие вирусологии и методов культивирования клеток
животных и человека позволило ученым приступить к созданию
вирусных вакцин.
Для культивирования могут быть использованы клетки опухо-
левых тканей, клетки различных органов, лимфоциты, фибро-
бласты, эмбрионы, клетки почек животных и человека, раковые
клетки человека и т. д. Культуры, приготовленные непосредст-
венно из тканей организма, называются первичными. В большин-
стве случаев клетки первичной культуры можно перенести из
культуральной чашки и использовать для получения вторичных
культур, которые можно последовательно перевивать в течение
недель и месяцев. Многие клетки при этом сохраняют признаки
дифференцировки тех тканей, из которых они были получены.
Например, фибробласты продолжают секретировать коллаген,
клетки скелетных мышц эмбриона сливаются и образуют гигант-
ские мышечные волокна, которые спонтанно сокращаются в
чашке для культуры тканей, и т. д. Так как все это происходит в
культуре, то является доступным для изучения с помощью при-
емов, которые неприемлемы при работе с интактными тканями.
Клетки животных и человека выращивают на специальных
средах в виде суспензии или монослоя на стекле. Технология
культивирования некоторых клеток животных настолько хорошо
отработана, что может быть использована в производственных
целях для получения различных продуктов. В настоящее время
клонировано много генов, кодирующих синтез белков разной
110
биологической ценности. Некоторые из таких генов удалось
перенести в клетки животных, и они стали продуцентами биоло-
гически активных белков. В промышленных масштабах в биоре-
акторах с использованием клеток животных налажено производ-
ство таких белков. Они используются как медицинские препара-
ты. Например, эритропоэтин (гормон, стимулирующий
образование красных кровяных тел), активатор плазминогена
(используется для предотвращения образования тромбов), фак-
тор свертывания крови III (используется при гемофилии), инсу-
лин (для лечения диабета), поверхностный белок вируса гепатита
В, интерлейкины и др.
Соматическая гибридизация. Одним из важных направлений
клеточной инженерии является гибридизация соматических кле-
ток. Сущность ее заключается в соединении клеток с хромосом-
ными наборами систематически далеких форм.
Впервые гибриды соматических клеток обнаружил в I960 г.
французский биолог Ж. Барский. В культуре ткани клеток двух
линий мышей он выявил третий тип клеток. Клетки эти оказа-
лись гибридными. Они содержали хромосомы клеток обеих ис-
ходных линий. Морфологические и биохимические признаки
гибридных клеток были промежуточными между признаками ис-
ходных. Однако спонтанное слияние клеток наблюдается редко.
В связи с этим разработана техника гибридизации соматических
клеток с использованием вируса Сендай. Вирус инактивируют
ультрафиолетовыми лучами или алкилирующим мутагеном.
Инактивированный вирус вносят в смешанную культуру двух
типов клеток. Некоторые клетки при этом сливаются с образова-
нием одной с двумя ядрами. После митотического деления из
двухъядерной клетки формируются две одноядерные гибридные
соматические клетки. В каждой гибридной клетке содержится по
одному набору хромосом каждого типа родительских клеток.
При помощи вируса Сендай к настоящему времени получены
гибриды клеток многих далеких видов (мыши и курицы, мула и
мыши, кролика и обезьяны, человека и курицы, коровы и норки
и др.). Гибридные клетки могут размножаться в течение длитель-
ного времени, но межвидовая несовместимость имеет место и
при соматической гибридизации. Так, в культуре клеток с тече-
нием времени образуются клоны, которые почти совсем или
совсем утрачивают хромосомы второго вида. Это явление откры-
вает возможности для изучения локализации и характера дейст-
вия тех или иных генов.
Можно изучить клеточный клон, в котором сохранилась толь-
ко одна хромосома другого вида, и по наличию или отсутствию
в клетке определенных соединений решить вопрос, имеется ли в
той или иной хромосоме определенный ген. Можно установить,
какой, например, фермент прекращает вырабатывать клетка при
утрате той или иной хромосомы. На этом основании можно
111
определить, что ген, кодирующий данный фермент, сцеплен с
ушедшей хромосомой. Таким путем была определена локализа-
ция многих генов в определенных хромосомах человека.
Соматическая гибридизация может быть использована для
картирования хромосом, а также для изучения регуляции дейст-
вия генов, дифференцировки клеток в онтогенезе и механизма
взаимодействия ядра и цитоплазмы.
ГИБРИДОМНАЯ ТЕХНОЛОГИЯ ПОЛУЧЕНИЯ
МОНОКЛОНАЛЬНЫХ АНТИТЕЛ
Введение антигена (бактерий, вирусов и т. д.) вызывает обра-
зование разнообразных антител против многих детерминант
антигена. В 1975 г. Г. Кёлер и К Милыптейн (лауреаты Нобе-
левской премии) получили моноклональные антитела с помощью
гибридомной технологии.
Моноклональные антитела — это иммуноглобулины, синтези-
руемый одним клоном клеток. Моноклональное антитело связы-
вается только с одной антигенной детерминантой на молекуле
антигена.
Гибридомная технология — слияние с помощью полиэтиленгли-
коля лимфоцитов селезенки предварительно иммунизированных
организмов определенным антигеном с миеломными (раковыми)
клетками, способными к бесконечной пролиферации (делению).
Гибридные клетки селекционируют в среде ГАТ (среда, содержа-
щая гипоксантин, аминоптерин и тимидин). Неслившиеся лим-
фоциты погибают в любой тканевой культуре. Миеломные клетки
на этой среде также погибают, так как они были дефектны по
ГГФТ (гипоксантин-гуанозин-фосфорибозилтрансферазе). Отби-
рают клоны клеток, синтезирующие необходимые антитела (рис.
28). Нужные клоны можно хранить в замороженном состоянии.
Таким образом, гибридомы представляют собой бессмертные
клоны клеток, синтезирующие моноклональные антитела.
Получение и использование моноклональных антител — одно
из существенных достижений современной иммунологии. С их
помощью можно определить любое иммуногенное вещество. В
медицине меченные изотопами или иным способом монокло-
нальные антитела можно использовать для диагностики рака и
определения локализации опухоли, для диагностики инфаркта
миокарда. Получены моноклональные антитела к различным
возбудителям: малярии, трипаносомозу, лейшманиозу, токсо-
плазмозу и др. Ученые считают, что в самом ближайшем буду-
щем моноклональные антитела займут доминирующее положе-
ние в диагностике болезней. Для использования в терапии моно-
клональные антитела можно соединять с лекарством (например,
с токсическими веществами) благодаря специфичности антител
они доносят это вещество непосредственно к раковым клеткам
112
Антиген
?. 3
Антигенная
детерминанта
(зпитоп)
клетки
миеломы
тела
Антиген
Антисыворотка
Omffop Вариантов и размножение
желательный клинив (1,4)
Смешанные
антитела
Выращивание
в массовой
Моноклональные
антитела
Рис. 28. Получение моноклональных антител (но Мильпггейну, 1982)
или патогенным микроорганизмам, что позволяет значительно
повысить эффективность лечения. Можно использовать моно-
клональные антитела (против Н — Y-антигена) для определения
пола у крупного рогатого скота на предимплантационной стадии
развития, а также для стандартизации методов типирования тка-
113
ней при трансплантации органов, при изучении клеточных мем-
бран (так были изучены антигены Т-лимфоцитов), для постро-
ения антигенных карт вирусов, возбудителей болезней.
ЭМБРИОГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ
Эмбриогенетическая инженерия — это активная перестройка
генома животных путем вмешательства в их развитие на самых
ранних стадиях онтогенеза. Перестройка генома — это рекон-
струкция эмбрионов путем клонирования, слияния или непо-
средственной инъекции в их ядра чужеродной ДНК. Однако
получение эмбриональных клонов, химер или трансгенных жи-
вотных возможно лишь в результате успешной трансплантации
реконструированного эмбриона.
Трансплантация — метод ускоренного воспроизводства высо-
копродуктивных животных путем получения и переноса одного
или цескольких эмбрионов от высокоценных животных (доно-
ров) менее ценным животным (реципиентам). Использование
трансплантации позволяет получать от одной генетически цен-
ной самки в десятки раз больше потомства.
Технология трансплантации опирается на крупные достиже-
ния в области биологии размножения животных и включает
следующие приемы: 1) гормональное вызывание суперовуляции;
2) осеменение доноров семенем производителей, оцененных по
качеству потомства; 3) извлечение и оценку качества эмбрионов,
сохранение и пересадку йли криоконсервирование эмбрионов в
жидком азоте, оттаивание и пересадку.
Трансплантацию эмбрионов применяют для следующих
целей:
1) размножения генетически ценных особей; с помощью этого
метода может быть решен вопрос быстрого создания высокопро-
дуктивных линий и семейств, резистентных к болезням;
2) получения идентичных животных путем разделения ранних
эмбрионов. Это дает возможность изучить взаимодействие гено-
тип — среда, выяснить влияние наследственности на хозяйствен-
но полезные признаки. Технология разделения эмбрионов позво-
ляет одну половину полученной бластоцисты подвергнуть глубо-
кому охлаждению, а из другой вырастить животное. Если
производитель (из одной половины бластоцисты) окажется гене-
тически ценным, то имеется возможность воспроизвести его
копию через определенный промежуток времени;
3) сохранения мутантных генов, малых популяций и генофон-
да пород;
4) получения потомков от бесплодных, но генетически цен-
ных по генотипу животных;
5) выявления вредных рецессивных генов и хромосомных
аномалий;
114
6) повышения устойчивости животных к болезням;
7) борьбы с болезнями путем замены импорта и экспорта
животных на импорт и экспорт криоконсервированных эмбрио-
нов;
8) акклиматизации импортных животных иностранных пород;
9) определения пола эмбриона и получения животных опреде-
ленного пола;
10) межвидовых пересадок;
11) получения химерных животных, которые развиваются из
ранних эмбрионов, сконструированных из бластомеров разных
животных.
КЛОНИРОВАНИЕ ЭМБРИОНОВ МЛЕКОПИТАЮЩИХ
Истинные клоны позвоночных животных — амфибий были
получены путем пересадки ядер соматических клеток в энуклеи-
рованные яйцеклетки. Получение эмбриональных клонов осно-
вано на свойстве тотипотентности эмбриональных клеток.
В 1952 г. Р. Бриггс и Т. Кинг разработали метод пересадки
ядер соматических клеток зародышей в энуклеированные яйце-
клетки лягушек. Дж. Гердон в 1962 г. усовершенствовал технику
пересадки. Он разрушал ядра яйцеклеток лягушки ультрафиоле-
товыми лучами, затем в каждое из яиц вводил ядро из диффе-
ренцированной клетки кишечного эпителия плавающего голо-
вастика (рис. 29). В ряде случаев такие ядра вызывали развитие
генетически идентичных эмбрионов и взрослых лягушек. Впе-
рвые были получены истинные клоны позвоночных животных.
Затем был использован метод культивирования in vitro клеток
кожи взрослых лягушек. Пересадка ядер из таких клеток привела
к получению генетических клонов головастиков, но вероятность
успеха при трансплантации ядер из клеток кожи взрослых лягу-
шек очень мала. При использовании ядер соматических клеток
взрослых животных развитие клонов ограничивалось стадией го-
ловастиков. Ядра взрослых организмов и даже поздних эмбрио-
нов по каким-то причинам утрачивают свои потенции. В послед-
ние годы установлено, что в ядрах эритроцитов взрослых амфи-
бий имеются гены, контролирующие развитие эмбриона до
стадии головастика, включение таких ядер в цитоплазму ооцитов
Ведет к реактивации репрессированных участков генома.
В последние 10 лет разработан метод пересадки ядер, соче-
тающий приемы микрохирургии и технику слияния клеточных
Фрагментов, начато проведение опытов по трансплантации ядер
У овец и крупного рогатого скота.
Несмотря на сложность проведения работ по трансплантации
ядер соматических клеток в энуклеированную зиготу, проблема
эта является актуальной, так как открывает возможности копи-
115
-----------r———
l КС3
Рис. 29. Серийные вдерные
пересадки (по Дж. Гердону):
ЯР — яйцо-реципиент; ГД ЯСК — голо-
вастик — донор ядер соматических кле-
ток; ЭЯР — энуклеированное яйцо-реци-
пиент; ЯСК — ядра соматических клеток;
Бл — бластула; КСЭ — клон серийных Ц КСЗ ЯСК дЛЯ
эмбрионов
ШКСЗ
рования выдающихся по продуктивности животных и создания
стад с высоким генетическим потенциалом.
Клоны можно получить путем разделения эмбрионов
на ранней стадии развития. Установлено, что, если
количество клеток эмбриона (бластомеров) не превышает 16, они
еще не дифференцированы. Это позволяет разъединять эмбрио-
ны (бластулы) на 2 и большее число и получать однояйцевых
близнецов. К настоящему времени получены монозиготные
близнецы телят, жеребят, ягнят и поросят. В перспективе пред-
полагается, что обеспечение оптимальных условий для культиви-
116
Y
рования ранних эмбрионов in vitro создаст возможность выращи-
вать половинки эмбрионов с последующим неоднократным их
разделением, что позволит в значительной степени увеличить
число годных для трансплантации зародышей, происходящих от
одного эмбриона, и получить более многочисленные клоны эмб-
рионов у сельскохозяйственных животных, что будет способство-
вать более успешной их селекции.
ХИМЕРНЫЕ ЖИВОТНЫЕ
Одно из перспективных направлений биотехнологии — искус-
ственное получение химер (аллофенных животных). Понятие хи-
мера означает составное животное. Сущность метода получения
химер заключается в искусственном объединении эмбриональ-
ных клеток двух и более животных. Животные могут быть как
одной породы, так и разных пород и даже разных видов. Совре-
менная микрохирургия позволяет получать химер, имеющих 3—4
и более родителей. Химеры обладают признаками животных раз-
ных генотипов.
Существует два основных метода получения химер искусст-
венным путем: 1) агрегационный — объединение двух и
более морул или бластоцист в один эмбрион; 2) инъекцион-
ный — микроинъекция клеток внутриклеточной массы (ВКМ)
бластоцисты доноров в бластоцель эмбриона-реципиента. В
обоих случаях получают особей, ткани и органы которых постро-
ены из клонов клеток объединенных (двух или более) эмбрионов
(рис. 30). Первыми созданы химеры лабораторных мышей между
линиями агути (кремовые) и не агути (черные). Они выглядели
крапчатыми. Их окраска сочетала признаки обоих родителей:
полосы пигментированной шерсти чередовались со светлыми,
каждая полоса представляла клон клетки-родоначальницы. Их
использование помогает изучению фундаментальных проблем
дифференцировки клеток в процессе онтогенеза, многих вопро-
сов механизма клеточного развития и происхождения отдельных
тканей, иммунологического взаимодействия в развитии и т. д.
В настоящее время имеются внутривидовые и межвидовые
химеры не только лабораторных животных (мышей, хомяков,
крыс), но и сельскохозяйственных животных (коров, коз, овец).
Изучение химер позволит понять процесс реализации генома
в фенотипе животных. В Великобритании и ФРГ были получены
межвидовые химеры между овцой (2п = 54) и козой (2п = 60),
названные овцекозами. В крови химер обнаружены красные кро-
вяные тельца и овцы, и козы. Их шерсть представляла собой
смесь волос того и другого вида. Экстерьер соответствовал одно-
му из родителей. Интересным является факт рождения ягненка
от козы и козленка от овцы. В США в 1987 г. были получены
химеры овец и коз и химеры овцы между породами рамбулье и
117
1
s
Рис. 30. Два способа получения генетических химер:
а — по Тарковскому-Минцу; б — по Гарднеру
финский ландрас. В нашей стране получен химерный бычок от
животных черно-пестрой и красной пород. Он в фенотипе соче-
тал черно-пеструю масть с красными пятнами (Л. К. Эрнст,
1987).
Приведенные материалы свидетельствуют о возможности по-
лучения химер (генетических мозаиков) в животноводстве. Одна-
ко в потомстве химерных животных не сохраняется родитель-
ский генотип, происходит расщепление и нарушаются ценные
генетические комбинации.
Несмотря на это, предполагается, что при усовершенствова-
нии методов получения химер они могут представлять большой
118
интерес для практики животноводства. Таким путем можно по-
лучить животных с более высокой резистентностью к ряду болез-
ней и с признаками, которые обычно плохо сочетаются в одном
организме.
ТРАНСГЕННЫЕ ЖИВОТНЫЕ
Трансгеноз — экспериментальный перенос генов, выделенных
из определенного генома или искусственно синтезированных, в
другой геном. Животные, в геном которых интегрируют чуже-
родные гены, называют трансгенными. В ряде экспериментов
было установлено, что мыши, развивающиеся из зиготы, в кото-
рую была введена чужеродная ДНК, содержат в своем геноме
фрагменты этой ДНК, а иногда у них происходит и экспрессия
чужеродных генов. В 1980 г. Дж. Гордон с сотр. впервые показа-
ли возможность трансформации мыши путем введения в пронук-
леус оплодотворенной яйцеклетки мыши рекомбинантных моле-
кул, содержащих ген тимидинкиназы (ген ТК) вируса герпеса.
Лучшие результаты были получены при микроинъекции реком-
бинантной ДНК в мужской более крупный пронуклеус. Метод
микроинъекции чужеродной ДНК в мужской пронуклеус зиготы
используется в настоящее время у всех млекопитающих, включая
сельскохозяйственных животных. Созданы линии трансгенных
мышей, которые различались между собой структурой чужерод-
ной ДНК. Мышам были введены гены: гемоглобина кролика,
Р-глобина человека, лейкоцитарного интерферона человека, гор-
мона роста крысы и человека.
Особого внимания заслуживает опыт Пальмитера и сотр., в
котором осуществлена пересадка мышам гена гормона роста
крысы. В этом случае промотор бактерий был непригоден. Для
микроинъекции была создана рекомбинантная ДНК, состоящая
из соединенных фрагментов различных генов: промоторной
части гена — металлотионеина МТ-1 мыши и структурной
части — гена гормона роста крысы, в котором собственные про-
мотор и инициатор были удалены. В зиготы мыши инъецировали
по 600 копий рекомбинантной ДНК. Получен 21 потомок. У
семи мышей был обнаружен чужеродный ген — ген гормона
роста крысы. Живая масса трансгенных мышат была в 1,8 раза
больше, чем контрольных. Таких трансгенных животных назвали
супермышами. В среднем у трансгенных мышей интегрируется
25—30 % копий введенной ДНК.
Успешные опыты с мышами способствовали проведению
работ по получению трансгенных кроликов и сельскохозяйствен-
ных животных. Схема получения трансгенных животных в ос-
новном такая же, как и при работе с мышами. Она состоит из
следующих этапов: 1) выбор, получение и клонирование чуже-
родного гена; 2) получение зигот и выявление пронуклеусов; 3)
119
микроинъекция определенного числа копий генов в видимый
пронуклеус; 4) трансплантация зиготы в половые пути гормо-
нально подготовленной самки; 5) оценка родившихся животных
по генотипу и фенотипу: интеграция чужеродной ДНК, экспрес-
сия ДНК, влияние на признак (например, высокая интенсив-
ность роста), установление наследования гена.
Наиболее трудной проблемой в опытах по переносу генов в
ткани или организмы животных оказалась экспрессия внесенных
генов. Выяснилось, что только четыре промотора (генов метал-
лотионеина, трансферрина, иммуноглобулина, эластазы) из мно-
гих исследованных способны активировать присоединенные к
ним гены.
Трансгенные кролики были получены Р. Хаммером и Г. Бре-
мом с сотр. Они производили микроинъекцию в пронуклеусы
кроликов гена гормона роста человека. В нашей стране в отделе
биотехнологии ВИЖа получена трансгенная крольчиха с интег-
рацией и экспрессией гена гормона роста крупного рогатого
скота (^. К. Эрнст и др., 1990).
В Австралии получили первых в мире трансгенных овец. В
возрасте 2—4 лет трансгенные овцы в 1,5 раза превосходили по
массе сверстников той же породы. Австралийские ученые пред-
полагают ввести овцам и другие гены, которые должны привести
к ускорению роста шерсти, усилению резистентности к болез-
ням.
Трансгенные свиньи впервые были получены в лабораториях
Р. Хаммера (1985) и Г. Брема (1986) на основе инъекции гормо-
на роста человека. У некоторых таких свиней в плазме крови
отмечался высокий уровень гормона роста человека. В нашей
стране получены трансгенные свиньи на основе инъекции в
зиготы гена гормона роста крупного рогатого скота.
При работе с крупным рогатым скотом, для того чтобы обна-
ружить пронуклеусы, применяют ДНК-специфические флуорес-
центные окраски и центрифугирование зигот. В 1987 г. родился
первый трансгенный теленок молочно-мясного типа.
В порядке совершенствования процесса трансгеноза разраба-
тывается метод оплодотворения яйцеклеток in vitro с помощью
микроинъекции одного сперматозоида с включенной в него чу-
жеродной ДНК.
В перспективе предполагается получение трансгенных живот-
ных для производства новых продуктов, которые можно будет
производить в промышленном масштабе, если они будут полез-
ны с медицинской точки зрения. С этой целью будет использо-
ваться рекомбинантная ДНК, с помощью которой от трансген-
ных животных будут получать, например, из коровьего молока,
крови или печени такие белки, как инсулин человека, интерфе-
рон и гормоны. Разрабатывается биотехнология производства
фактора свертывания крови из молока трансгенных овец. Пред-
120
- полагается, что фактор свертываемости, необходимый для лече-
ния гемофилии, будет синтезироваться в клетках молочной желе-
зы овец и переходить в молоко.
Внедрение современных биотехнологий — гибридизации со-
матических клеток, клеточной и генной инженерии в сочетании
с эмбриогенетической инженерией — определяет новые подходы
в деле создания более устойчивых к болезням высокопродуктив-
ных пород животных с признаками, которых не было у исходных
пород или они были слабовыражены. Открываются новые пер-
спективы для получения лекарственных веществ: гормонов, вак-
цин, аминокислот, витаминов и т. д. Синтез генов и совершен-
ствование методов их введения позволяют ввести в клетку на
место поврежденных генов нормальные гомологи, что обеспечит
лечение наследственных болезней. Широкое распространение
получат способы нейтрализации действия вредных генов с помо-
щью введения репрессоров.
•
Контрольные вопросы. 1. Что такое биотехнология и какова ее роль в ветери-
нарии, животноводстве, медицине? 2. Что такое генная инженерия, какие задачи
она решает? 3. Какие известны методы получения генов? 4. Как создаются
рекомбинантные ДНК и с какой целью они вводятся в реципиентную клетку?
5. Что такое клеточная инженерия? 6. Какие задачи решает эмбриогенетическая
инженерия? 7. В чем заключается клонирование эмбрионов? 8. Каких животных
называют химерами и как их получают? 9. Как и с какой целью осуществляется
трансгеноз?
Г л а в a 9
ИЗМЕНЧИВОСТЬ И МЕТОДЫ ЕЕ ИЗУЧЕНИЯ
Изменчивость свойственна всем живым существам и является
одним из основных факторов эволюции. В настоящее время
известно около миллиона видов животных и около полумиллио-
на видов растений. Изменчивость организмов — основа для вы-
ведения новых пород животных, сортов растений и штаммов
микроорганизмов.
ВИДЫ ИЗМЕНЧИВОСТИ
Выделяют следующие виды изменчивости: мутационную, ком-
бинативную, коррелятивную и модификационную.
Мутационная изменчивость. Мутация — стойкое изменение в
структуре ДНК и кариотипе. Мутационный процесс — первоис-
точник наследственной изменчивости. В результате его у потом-
ков появляются новые признаки и свойства, которых не было у
предков. Различная окраска меха у норок и лисиц, полиморфизм
белков и ферментов, наследственные дефекты (ахондроплазия,
пупочная грыжа, врожденное отсутствие конечностей и т. д.) —
это примеры мутационной изменчивости.
Мутации — один из главный факторов эволюции и создания
новых пород животных и сортов растений.
Комбинативная (комбинационная) изменчивость. Это наследст-
венная изменчивость, возникающая в потомстве в результате
новых сочетаний признаков и свойств при скрещиваниях. Она
не ведет к возникновению новых наследственных признаков, а
происходят лишь комбинация и рекомбинация генов, имеющих-
ся у родительских форм. На основе комбинативной изменчивос-
ти выведено много пород животных: орловская рысистая порода
лошадей, костромская порода крупного рогатого скота, алтай-
ская тонкорунная порода овец и т. д. Например, в результате
скрещивания зебу с европейскими породами скота был создан
австралийский молочный зебу. В новой породе сочетаются ус-
тойчивость к клещам, жаре, как у зебу, и высокая молочная
продуктивность, как у европейского скота.
Зная характер наследования признаков и свойств, можно со-
здать желаемое их сочетание. Если селекционер ставит перед
122
собой цель получить сапфировую окраску меха у норок, то он
должен скрестить алеутских норок (генотип ааРР) с платиновы-
ми (А4др). Первое поколение норок имеет коричневый мех. При
скрещивании гибридов первого поколения между собой в F2
получают 1/16 сапфировых норок (аарр). При разведении сапфи-
ровых норок появляются только сапфировые норки.
Коррелятивная изменчивость. Организм развивается как еди-
ное целое под влиянием наследственности и условий среды.
Поэтому изменение одних органов и тканей может вести к изме-
нению других органов, тканей или функции организма. Так,
недоразвитие передней доли гипофиза ведет к задержке роста и
половозрел ости.
В зоотехнической и ветеринарной практике изучение корре-
ляционной изменчивости имеет большое значение. Известно,
что между высокой молочностью и высокой способностью к
откорму существует отрицательная корреляция. Поэтому не вы-
ведены породы, сочетающие высокую молочную продуктивность,
как у молочных пород, и мясные качества, как у мясных пород.
Между устойчивостью к болезням и признаками продуктивности
может быть положительная или отрицательная связь. Например,
между устойчивостью к эймериозу (кокцидиозу) у кур и массой
тела существует положительная корреляция.
Модификационная изменчивость. Это ненаследственная фе-
нотипическая изменчивость, возникающая под влиянием ус-
ловий среды и не изменяющая генотип. Модификационная
изменчивость широко распространена в природе, так как
на развитие организма влияют условия среды. Однояйцовые
близнецы, находящиеся в разных условиях среды, различаются
по своим признакам, несмотря на одинаковый генотип. У
медоносной пчелы самки развиваются из оплодотворенных
яиц, но в зависимости от качества пищи в личиночной
стадии могут стать или рабочими пчелами, или маткой.
При питании маточным молочком женская особь превращается
в матку. Количественные признаки (удой, масса, настриг
шерсти и т. д.) подвержены сильному влиянию условий
среды и характеризуются большой модификационной измен-
чивостью. Качественные признаки (группы крови, масть и
т. д.) в основном контролируются наследственностью.
Условия среды иногда сглаживают генетические различия
между животными. Тогда худшие и лучшие по генотипу особи
могут иметь одинаковую продуктивность. Поэтому в плохих ус-
ловиях среды отбор по фенотипу по многим признакам малоэф-
фективен. Недостаточный уровень кормления матерей может
привести к недоразвитию потомков не только в первом, но и в
последующих поколениях. В таких случаях мы имеет дело с
длительными модификациями.
123
МЕТОДЫ ИЗУЧЕНИЯ ИЗМЕНЧИВОСТИ
Биометрия (вариационная статистика, биологическая статисти-
ка). Это наука о способах применения математических методов в
биологии. Предметом биометрии служит группа биологических
объектов. Группа определенных объектов составляет совокуп-
ность. Совокупностями являются породы, стада животных,
линии, семейства, дочери определенного производителя, группа
овец, на которых проводится опыт, количество эритроцитов в
каком-то объеме крови животного и т. д. Совокупность состоит из
единиц или членов. Для стада овец единицей будет каждая овца.
Число единиц, входящих в совокупность, называется объек-
там совокупности и обозначается буквой п. Единица совокупнос-
ти может характеризоваться определенными признаками. Напри-
мер, коровы характеризуются удоями за некоторый отрезок вре-
мени, жирномолочностью и белковомолочностыо, живой массой,
промерами, мастью, рогатостью и комолостыо, числом эритро-
цитов Hjffe процентом гемоглобина в крови и т. д. Сумма отдель-
ных измерений или наблюдений также является совокупностью.
Величину изучаемого признака для какой-то единицы сово-
купности называют вариантой и обозначают И, Иг, Из,..., а в
общем виде Vi, где I — порядковый номер варианты. Например,
при изучении удоя (ц) за первую лактацию у трех коров получе-
ны следующие данные: 40, 43, 39. Эти величины и будут вариан-
тами, т. е. Ki = 40, Иг = 43, Vi = 39.
Различия между отдельными вариантами называются изменчи-
востью или вариацией. В этих случаях говорят, что удой или
признак варьирует.
Количественные и качественные признаки. Количественные при-
знаки измеряются, подсчитываются и выражаются цифрами, на-
пример титр антител, живая масса, настриг шерсти, яйценос-
кость и т. д. Качественные признаки описываются словами, на-
пример масть черная, черно-пестрая, красная, рыжая и т. д.
Если имеются два взаимоисключающих варианта, то такие каче-
ственные признаки называются альтернативными, например пол
животных — мужской или женский, скот — комолый или рога-
тый, состояние животных — здоровые или больные.
Соответственно делению признаков на количественные и ка-
чественные различают количественную и качественную изменчи-
вость. Количественная изменчивость бывает двух типов: непре-
рывная и прерывная (дискретная). При непрерывной изменчивос-
ти между вариантами нет резких границ и переходов, все
определяется точностью измерений (удой, живая масса и т. д.).
Если различия между вариантами определяются целыми числа-
ми, то это будет прерывная (дискретная) изменчивость. Так, число
поросят у каждой свиноматки выражается целым числом 9, 10,
11 и т. д.
124
Генеральная и выборочная совокупность. Генеральная совокуп-
ность — это группа животных, составляющих вид, породу, на-
пример все коровы или овцы данной породы или вида. К ней
относится и общее число эритроцитов и лейкоцитов в крови
одного животного. Все теоретически возможное потомство, кото-
рое может быть получено от одного производителя, также со-
ставляет генеральную совокупность. В генеральную совокупность
(породу) входит иногда несколько миллионов животных. Порода
распадается на много совокупностей — стада отдельных хо-
зяйств, а в пределах одного стада может быть несколько сово-
купностей: линии, семейства и т. д. Конечно, охарактеризовать
всю генеральную совокупность, например, по количеству лейко-
цитов, проценту белка в молоке, удою, живой массе и т. д.
практически невозможно. Поэтому изучают не всю генеральную
совокупность, а только ее часть, которая называется выборкой
или выборочно# совокупностью. Из выборки можно выбрать еще
меньшую выборку. Каждый член выборки из определенной сово-
купности должен быть отобран случайно. Только в этом случае
выборка дает довольно точное представление о генеральной со-
вокупности, т. е. она является репрезентативной (представитель-
ной). Если в выборку входит до 30 членов, она называется малой
(п < 30), а свыше 30 единиц — большой (п > 30).
ВАРИАЦИОННЫЙ РЯД И ЕГО ПОСТРОЕНИЕ
При анализе совокупности часто полученные данные нужно
сгруппировать и представить их в виде таблицы или ряда. При
характеристике количественных признаков и большом числе ва-
риант производят группировку данных и их разноску по классам,
т. е. строят вариационный ряд.
Вариационный ряд — это упорядоченное изображе-
ние реально существующего распределения особей в группе по
величине признака. Вариационный ряд — это двойной ряд чисел,
состоящий из обозначения классов и соответствующих частот.
Он показывает, как изменяется признак от минимальной до
максимальной величины, какая частота вариант в каждом классе.
Класс, в котором встречается наибольшее число вариант, назы-
вается модальным.
Для построения вариационного ряда необходимо: 1) из всей
выборки (в нашем задании п = 64) найти максимальную (в дан-
ном примере шах = 11,4), минимальную (min = 3,2) варианты и
разность между ними (max—min = 11,4—3,2 = 8,2); 2) опреде-
лить число классов, которое зависйт от объема выборки:
Число вариант 25—40 40—60 60—100 100—200
Число классов 5—6 6—8 7—10 8—12
125
Найти классный промежуток (к) путем деления
разности на предполагаемое число классов (к = 8,2 : 8 ® 1,0);
3) установить начало классов, для чего к минимальному значе-
нию признака 3,2 (лучше округленному в меньшую сторону до
3,0, но не больше, чем на величину к) прибавляют классный
промежуток (к = 1,0), пока не включится максимальное значе-
ние (11,4) признака (3,0; 4,0;... ;11,0); 4) установить верхние
границы классов, которые должны быть меньше начала последу-
ющих классов на величину, равную точности измерения призна-
ка (3,0—3,9; 4,0—4,9;... ;11,0—11,9); 5) последовательно, начиная
с первой, разнести варианты по классам (табл. 9).
9. Распределение сухостойных корон черно-пестрой породы
Вершининского комплекса по количеству лейкоцитов н крови
(по данным П. Н. Ннконорова)
Показатель Классы по количеству лейкоцитов в 1 мм3 крови (тыс.) Всего
3,0- 3,9 4,0- 4,9 5,0- 5,9 6,0- 6,9 7,0- 7,9 8,0- 8,9 9,0— 9,9 10,0— 10,9 11,0— 11,9
1 2 3 4 5 6 7 8 9
Шифр час- и п и и п г:
тот Число коров 1 4 17 24 7 6 2 2 1 64
По вариационному ряду можно судить о распределении при-
знака в данной группе. В крайних классах находится наименьшее
число вариант, а в средних — большее. Причем видно смещение
распределения вариант от середины вариационного ряда в сторо-
ну больших значений классов. Наибольшее число вариант (48)
относится к 3—5-му классам.
- Модальным классом (обладающим наибольшей час-
тотой — 24) является 4-й класс (границы 6—6,9).
При рассмотрении вариационного ряда можно приблизитель-
но определить среднее значение признака, находящееся между 6
и 6,9, вероятно, недалеко от 6,5, а также лимиты — 3,5—11,5 = 8
(взяты средние значения крайних классов). Среднее квадратичес-
кое отклонение, исходя из лимита, равно 8 : 6 = 1,3, потому что
весь размах изменчивости охватывается шестью сигмами. Факти-
чески полученные величины были близки к предсказанным
х = 6,65; ст = 1,51.
Графическое изображение вариационного ряда дает наглядное
представление о характере распределения признака в изучаемой
совокупности. Вариационный ряд можно представить в виде сту-
пенчатой кривой, называемой гистограммой. Для этого на гори-
зонтальной линии (ось абсцисс) наносятся классы, а на верти-
кальной (ось ординат) — частоты. Основанием каждого столбика
является соответствующее значение класса, а высотой — число
126
Рис. 31. Распределение коров по количеству лейкоцитов в 1 мм3 крови:
' 1 — гистограмма; 2 — полигон
особей в нем. Если соединить прямыми линиями середины всех
столбиков, получается вариационная кривая, или полигон распре-
деления. Полигон распределения своими ветвями должен касать-
ся на' оси абсцисс середины соседних классов.
При анализе графика (рис. 31) можно видеть: 1) около сере-
дины вариационной кривой располагается наибольшее число ва-
риант; 2) распределение вариант по обе стороны от вершины
1 Вариационной кривой примерно симметрично; 3) число вариант
(коров) убывает к краям вариационного ряда. Вышеназванные
Закономерности характерны для большинства вариационных
рядов. Для сравнения на одном графике нескольких распределе-
ний удобно пользоваться не гистограммой, а полигоном распре-
1 Деления.
* Если взято малое количество животных, то в некоторых клас-
сах вариационного ряда варианты могут отсутствовать, тогда ва-
риационная кривая бывает разорванной. При малом числе осо-
и растянутых вариационных рядах часто наблюдается двух-
Вершин ноет ь или многовершинност ь. Если выборка
ГвЗДта достаточно большой, то двухвершинность указывает на
^смешение двух различных совокупностей (двух пород, линий и
т. д.) или на выращивание и содержание животных в разных
условиях и т. д.
Встречаются асимметричные вариационные кривые со смеще-
Кием влево или вправо, т. е: положительная или отри-
, ’ Нательная асимметрия. Это объясняется неоднород-
, костью условий развития животных данной совокупности, нали-
чием в изучаемой группе большого количества особей с лучшими
Или худшими наследственными задатками,, отбором. В нашем
примере (см. рис. 31) наблюдается небольшая положительная
асимметрия, т. е. вершина смещена влево. Если в средних клас-
сах вариационного ряда наблюдается преобладание вариант, то
получается островершинная кривая, называемая эксцессом.
СТАТИСТИЧЕСКИЕ ПОКАЗАТЕЛИ
ДЛЯ ХАРАКТЕРИСТИКИ СОВОКУПНОСТИ
Средние величины и показатели вариации признака — основ-
ные параметры для характеристики совокупности. К первым от-
носятся средняя арифметическая, средняя геометрическая, сред-
няя гармоническая, мода и медиана, ко вторым — лимиты, сред-
нее квадратическое отклонение, варианса, коэффициент
вариации.
Средние величины. Средняя арифметическая (х)
показывает, какое значение признака наиболее характерно в
целом '•рдя данной совокупности. Она используется для
сравнения пород, стад, линий, семейств и т. д. по какому-либо
признаку.
Средняя геометрическая (G) используется для
изучения среднего прироста живой массы, увеличения числен-
ности стада и т. д. Этот показатель вычисляют по формуле
<?= п^2...Уп,
где Pi... Vn — варианты, т. е. варьирующий признак; п — число членов в выборке.
Средняя квадратическая (5) используется для оп-
ределения средних площадей, диаметров, радиусов (диаметр эрит-
роцитов, объем клеточного ядра и т. д.). Формула для расчета
где Е — знак суммирования.
Средняя гармоническая (Я) используется при ус-
реднении меняющихся скоростей (скорость молоковыведения,
скорость бега лошадей). Определяют по формуле
Мода (Мо) — наиболее часто встречающаяся варианта в со-
вокупности.
Медиана (Me) — варианта, расположенная в середине
(центре) ряда и делящая его на две равные части.
128
у
Л Показатели вариации. Средняя арифметическая указывает на
> среднее значение признака в совокупности и не может характе-
5 ризовать его_ изменчивость. Например, в одном стаде средний
it удой коров *1 = 3500 кг, во втором х? = 3600. По значениям х
f невозможно что-либо сказать об изменчивости удоя. Важно
J знать не только средние показатели по стаду, но и вариацию
i признака.
* Для характеристики разнообразия признаков в совокупности
служат лимиты, среднее квадратическое отклонение, варианса,
коэффициент вариации.
Лимиты (lim) — это максимальное и минимальное значе-
ния признака в совокупности. Чем больше разность между мак-
симальной (max) и минимальной (min) вариантой, тем, в общем,
выше изменчивость признака. Если у сухостойных коров лимит
по содержанию количества лейкоцитов в 1 мм3 крови
lim = 11,4—3,2, а у больных некробактериозом коров
lim = 13,6—3,6, то признак сильнее варьирует у коров второй
группы (разность в первом случае составляет 8,2, а во втором —
10). Однако при одинаковых лимитах изменчивость в сравнивае-
мых группах может различаться, так как лимиты не учитывают
распределения отдельных вариант в совокупности.
Среднее квадратическое или стандартное,
отклонение привлекается как более точный показатель для
характеристики изменчивости. Среднее квадратическое отклоне-
ние обозначается буквой ст (сигма). Эта величина именованная,
т. е. выражается в тех же единицах, что и х (кг, см, % и т. д.).
Чем больше величина ст, тем выше изменчивость.
Вся изменчивость-признака лежит от средней арифметичес-
кой в пределах ±3ст (х±3ст). Это называетсяпраеилол «плюс-минус
трех сигм». Поэтому средняя арифметическая, увеличенная и
уменьшенная на три сигмы, дает практически крайние значения
признака.
Варианса (ст2) также является показателем изменчивости
признака. Варианса — это сумма квадратов отклонений отдель-
ных вариант от средней арифметической, деленной на число
степеней свободы:
ст2 =
Z(J7-x)2
V
где у —число степеней свободы, т. е. количество всех вариант совокупности,
уменьшенных на единицу (v = л—1).
Для выборки из 64 особей (и = 64) число степеней свободы
равно 63 (v = п—1 = 64—1 = 63). Среднее квадратическое отклоне-
ние можно получить из вариансы, так как ст = "'/ст2.
129
Коэффициент вариации (Су) показывает, какой
процент от х составляет ст. С помощью среднего квадратическо-
го отклонения можно сравнить изменчивость двух и более групп
животных в отношении одинаковых признаков. Однако им нель-
зя воспользоваться для сравнения изменчивости двух и более
признаков, выраженных в разных единицах, например молочнос-
ти, жирномолочности, живой массы, количества лейкоцитов в
крови и т. д.
Для коров по первой лактации (племзавод «Первомайский»)
получены следующие данные: для жира — х = 3,8 % и ст = 0,17 %,
а для удоя —х = 4240 кг и ст = 748 кг. Как видно, сравнить величи-
ны 0,17 % и 748 кг невозможно. С помощью ст также нельзя
сравнивать изменчивость, например, живой массы, если она вы-
числена в первом случае для взрослых коров, а во втором для
телят при рождении или в 1, 2, 3 мес и т. д. Поэтому для
сравнения изменчивости двух и более признаков, выраженных в
разных единицах, применяют коэффициент вариации (Су).
Сравнивая коэффициенты вариации для удоя и процента жира,
можно сказать, что изменчивость удоя у коров первой лактации
значительно выше (18,6 %), чем процента жира (4,5 %). При
характеристике совокупности коэффициент вариации является
дополнительным показателем и должен применяться с основны-
ми параметрами х и ст.
Вычисление средней арифметической и показателей мриации.
Для больших выборок (п > 30) применяют непрямой способ вы-
числения средней арифметической и других статистических по-
казателей. Здесь мы рассмотрим способ произведений. Для этого
строят вариационный ряд (табл. 10) и среднюю арифметическую
вычисляют по формуле
х=А+Ь-А+к
п
где А — условная средняя; Ь — поправка к условной средней; к — классный про-
межуток; f — число вариантов в классе; а — условное отклонение отдельных клас-
сов (выраженное в классных промежутках) от среднего условного класса (А); п —
число вариантов в выборке.
За условную среднюю А обычно принимается среднее значе-
ние класса с наибольшей частотой вариант или находящееся
приблизительно в середине вариационного ряда. В нашем при-
мере за условную среднюю взято среднее значение 4-го класса.
Этот класс для наглядности выделим двумя жирными линиями.
Для вычислений средних значений классов и условной средней А
нужно к началу каждого класса приплюсовать половину классно-
го промежутка (к): А = 6 +к: 2 = 6 + 1:2 = 6,5.
130
10. Определение основных статистических величин способом
произведений длв содержания количества лейкоцитов
в крови сухостойных коров (тыс. в 1 мм3)
№ клас- са Класс Час- тота f Условное отклонение Wt-A к fa /а2
границы среднее значение Wi
1 2 3 4 5 6 7
1 3,0—3,9 3,5 1 -3 -3 9
2 4,0-4,9 4,5 4 -2 -8 16
3 5,0-5,9 5,5 17 -1 —17/52—28 17
4 6,0—6,9 А = 6,5 24 0 0 0
5 7,0-7,9 7,5 7 +1 7 7
6 8,0-8,9 8,5 6 +2 12 24
7 9,0-9,9 9,5 2 +3 6 18
8 10,0-10,9 10,5 2 +4 8 32
9 11,0-11,9 11,5 1 +5 5/538 25
Классный промежуток п = 64 к = 1,0 Па = -28 + 38 = 10 Па2 = 148
_ ZJa in
х=А + к------= 6,5+ 1т7 = 6,65 тыс.
п 64
а = к 2 = 1,0 - feY = l,(h/2,31 - 0,024 = 1,51 тыс.
П \ П / 64 \64/
Cv = ° 100% = 1|5!J°° = 22,7 %;
х MS
т = — = ^- = 0,19 тыс.
Vn 8
Определяем условное отклонение для каждого класса:
В четвертой строке вариационного ряда и пятой колонке ста-
вят нуль (а = = 6,5 ~ б>.5 - 0), далее в сторону уменьшения
средних значений классов ставят —1, —2, —3, а в сторону увели-
чения классов +1, +2, +3, +4, +5. Заполняем шестую и седьмую
колонки. Среднее количество эритроцитов в 1 мм3 крови сухо-
стойных коров равно х = 6,65 тыс. Средняя арифметическая ве-
личина именованная, т. е. выражается в тех единицах, что и
признак, для которого она вычислена.
Среднее квадратическое отклонение равно ст = 151 тыс. лей-
коцитов в 1 мм3. В границах Зст находится 99,7 % всех членов
совокупности. Максимальное количество лейкоцитов в 1 мм3
131
крови будет х+Зст = 6,65 + 31,51 = 11,18 тыс., а минималь-
ное — х— Зег = 6,65 — 31,51 = 2,12 тыс. Поэтому в стаде имеет-
ся 99,7 % коров с количеством лейкоцитов от 11,18 до 2,12 тыс.
В пределах ± 2ст содержится 95,5 % всех вариант, а в пределах
± 1ст - 68,3 %.
Принято считать, что если отклонение от средней арифмети-
ческой превышает Зег, то данная особь не относится к изучаемо-
му вариационному ряду, а, видимо, является представительницей
другого вариационного ряда.
Нормированное отклонение (/) используют для
изучения изменчивости при нормальном распределении. Оно
представляет отклонение той или иной варианты (или группы
вариант) от средней арифметической, выраженное в ст:
t =
* а
С помЙщью таблицы 11, зная х и ст, можно построить теоре-
тическую кривую распределения и установить долю особей с
определенной величиной признака.
11. Значение нормального интеграла вероятностей
'=^ Р ‘ = ^ Р Р 1'--^ Р
ОД 0,0398 0,9 0,3159 1,7 0,4554 2,5 0,4938
0,2 0,0793 1,0 0,3413 1,8 0,4641 2,6 0,4953
0,3 0,1179 1,1 0,3643 1,9 0,4713 2,7 0,4965
0,4 0,1554 1,2 0,3849 2,0 0,4773 2,8 0,4974
0,5 0,1915 1,3 0,4032 2,1 0,4821 2,9 0,4981
0,6 0,2258 1,4 0,4192 2,2 0,4861 3,0 0,4987
0,7 0,2580 1,5 0,4332 2,3 0,4893 3,5 0,4998
0,8 0,2831 1,6 0,4452 2,4 0,4918
Если известны х и ст, то, используя таблицу 11, можно опре-
делить долю (%) коров с количеством лейкоцитов, например,
свыше 8 тыс. Определяют
t = = 8;5у5 = 0,89 « 0,9.
По таблице 11 находим, что в пределах от х до х + t = 0,9ст
содержится 0,3159 варианты, или 31,59 %. Поэтому коров с ко-
личеством лейкоцитов свыше 8 тыс. будет 50 — 31,59 = 18,41 %.
Коэффициент вариации (Су) количества лейкоци-
тов в нашем примере равен 22,7 %. Можно сказать, что измен-
чивость количества лейкоцитов в 1 мм3 крови коров выше, чем,
например, изменчивость содержания белка и жира в молоке
(Су =4 — 8 %), общего белка в сыворотке (Су = 3 — 8 %) и
альбуминов (Су= 5—13 %).
132
Оценка достоверности статистических показателей. В практичес-
кой работе основные параметры совокупности х и ст вычисляют не
по генеральной совокупности, а по выборке; вследствие этого возни-
кают ошибки, называемые ошибками выборочности
(ошибки репрезентативности). Так, племенную ценность
производителя определяют не по всем возможным, а по небольшому
количеству дочерей и на основании этого делают заключение о
дальнейшем его использовании. В связи с этим величины.х и ст,
вычисленные при изучении выборки, в некоторой степени отлича-
ются от тех их значений, которые были бы получены для генераль-
ной совокупности. Поэтому приходится оценивать степень точности
выводов, основанных на анализе выборочных данных, вычисляя для
этого ошибки статистических показателей.
Ошибка средней арифметической (ти). Ошиб-
ку средней арифметической определяют по формуле т = ст/^й.
Размер ее зависит от изменчивости признака и размеров выборки.
Чем меньше изменчивость и больше объем выборки, тем меньше
ошибка. Для нашего примера т = 0,19 тыс. Обычно среднюю
арифметическую записывают с ее ошибкой: х ±пг, т. е. 6,65+0,19.
Ошибка среднего квадратического отклонения
тп = — = = 0,13 тыс.
ст 72л
Ошибка коэффициента вариации
тс =-^ = ^L = 2 %.
-PTZ -/<> £.л
I
Если увеличить или уменьшить среднюю арифметическую на
З/и, то мы получим границы, в которых находится х генеральной
совокупности. В нашем случае х_+ З/и = 6,65 + 3 • 0,19 =
= 7,22 тыс. (максимальное значение) и х— Зт = 6,65 — 3 • 0,19 =
=6,08 тыс. (минимальное значение).
ВЫЧИСЛЕНИЕ СТАТИСТИЧЕСКИХ ПОКАЗАТЕЛЕЙ
ДЛЯ МАЛЫХ ВЫБОРОК
При малом числе животных или наблюдений (п < 30) варианты
(У) не группируются в вариационный ряд. Среднюю арифмети-
ческую и среднее квадратическое отклонение (ст) можно вычис-
лить по формулам
eV гс~
— И ст = У-^-,
п л—1
где С — сумма квадратов; С = Ей2--------—
п
133
Статистические показатели по этим формулам с исполь-
зованием ЭВМ вычисляют по любой (большой и малой)
совокупности.
Известно, что между активностью фагоцитоза и резистентнос-
тью организма имеется связь: чем выше активность фагоцитоза,
тем больше резистентность. Интенсивность фагоцитоза можно
определить по суммарному эффекту фагоцитоза крови (поглоще-
ние микробных тел в 1 мм3). Определим статистические показа-
тели суммарного эффекта фагоцитоза (тыс. м.т/мм3) у лактирую-
щих коров (табл. 12).
12. Статистические показатели суммарного эффекта фагоцитоза
V V1
1,11 1,23 х = ^ = 0,77 тыс. м.т.
0,45 0,20 С = 4,37 -1^ = о, 85
0,1б 0,31
0,91 0,83 а = = •>10,17 = 0,41 тыс. м.т.
1,32 1,74
0,25 0,06 т = = 0,17 тыс. м.т.
Е И= 4,60 Е И2 = 4,37 Си= ^ 100= 53,2 %
Здесь следует отметить большую изменчивость суммарного
эффекта поглощения микробных тел.
Уровни значимости и уровни вероятности. В статистике резуль-
тат, случайно получаемый в одном случае из 20, принято назы-
вать статистически достоверным, случайно получаемый в одном
случае из 100 — высокодостоверным, а случайно получаемый в
одном случае из 1000 — очень высокодостоверным. Обозначают-
ся эти уровни значимости таким образом: Р = 0,05, Р = 0,01,
Р = 0,001. В качестве первой границы достоверности принят
уровень вероятности р = 0,95, которому соответствует уровень
значимости Р = 0,05. Всего выделяют три уровня вероятности,
обозначенные pi = 0,95; р2 = 0,99; рз = 0,999, которым соответ-
ствуют три уровня значимости: Pi = 0,05; Рг = 0,01; Рз = 0,001.
Уровень значимости обозначает вероятность получения слу-
чайного отклонения от установленных с определенной вероят-
ностью результатов. С его помощью можно установить, в каком
проценте случаев возможна ошибка в результатах. Если уровень
значимости Р = 0,05 (5%-ный), это значит, что в силу случай-
ности ошибка будет в 5 % случаев. Вероятность р = 0,95 (95 %)
показывает, что из 100 повторений в 95 будут получены ожидае-
мые результаты.
134
ОЦЕНКА ДОСТОВЕРНОСТИ РАЗНОСТИ МЕЖДУ
СРЕДНИМИ АРИФМЕТИЧЕСКИМИ ДВУХ ВЫБОРОЧНЫХ
СОВОКУПНОСТЕЙ
При сравнении средних арифметических двух генеральных со-
вокупностей любая разность между ними будет достоверна. В ве-
теринарии, зоотехнии и т. д. приходится сравнивать между собой
средние величины не генеральных совокупностей, а выборочных
(породы, линии, семейства, опытная и контрольная группы и
т. д.). Поэтому необходимо установить достоверность разности
между средними двух групп. Недостаточно, например, знать, что
20 дочерей какого-то производителя превосходят по удою своих
матерей. Следует, кроме того, вычислить критерий достоверности
разности, чтобы с определенной вероятностью судить о том, что
следующие 100, 200 и т. д. дочерей этого производителя также
будут превосходить по молочности своих матерей в аналогичных
условиях. Для оценки достоверности разности между средними
арифметическими двух выборочных совокупностей применяется
критерий достоверности (fa), который вычисляют по формуле
X, — X, я
где mi, mj — ошибки сравниваемых выборочных среднтрс арифметических xi, xj;
d — разность между средними арифметическими xi, xj; пц — средняя ошибка
выборочной разности; — стандартное значение критерия, определяемое по таб-
лице Стьюдента (табл. 13) с учетом числа степеней свободы (v) для трех уровней
вероятности; Л], П2 — численность сравниваемых групп.
13. Стандартные значения критерия Стьюдента (tst) при трех уровнях
вероятности (р)
Число степеней свободы (v) Уровень вероятности Число степеней свободы (V) Уровень вероятности
0,95 0,99 0,999 0,95 0,99 0,999
1 12,71 63,66 637,0 16 2,12 2,92 4,02
2 4,30 9,93 31,60 17 2,11 2,90 3,97
3 3,18 5,84 12,94 18 2,10 2,88 3,92
4 2,78 4,60 8,61 19 2,09 2,86 3,88
5 2,57 4,03 6,86 20 2,09 2,85 3,85
6 2,45 3,71 5,96 21 2,08 2,83 3,82
7 2,37 3,50 5,41 22 2,07 2,82 3,79
8 2,31 3,36 5,04 23 2,07 2,81 3,77
9 2,26 3,25 4,78 24 2,06 2,80 3,75
10 2,23 3,17 4,59 25 2,06 2,79 3,73
11 2,20 3,11 4,44 26 2,06 2,78 3,71
12 2,18 3,06 4,32 27 2,05 2,77 3,69
13 2,16 3,01 4,22 28 2,05 2,76 3,67
14 2,15 2,98 4,14 29 2,05 2,76 3,66
15 2,13 2,95 4,07 30 2,04 2,75 3,65
00 1,96 2,58 3,29
135
Пример. Нужно установить, различаются ли дочери двух быков по титру
лизоцима в крови, если получены следующие показатели:
Л1 = 30; Х1±Л11 = 1,61210,021g 5
яг — 28; Х2±тг = 1,53810,031g х
Для этого определяем
td _ 1,612—1,538 _ 0,074 _ 0,074 _ 2 06
з/о,О22 + О,О32 ^6,0013 °-03в
По таблице 13 с учетом числа степеней свободы
v = Л1 + П2 — 2 = 30 + 28 — 2 = 56 находим значения /д (нижняя строка), которые
равны: при р = 0,95 fe = 1,96; при р = 0,99 = 2,58 и при р = 0,999= 3,29.
Сравниваем величину fa с 1st- Здесь возможны два вывода: 1) если fa
равен или больше значения tst для первого уровня вероятности (fa > /й), то раз-
ность между средними арифметическими двух групп статистически достоверна; 2)
если fa меньше значения tst для первого уровня вероятности, то разность между
средними арифметическими двух групп статистически недостоверна. В нашем
примере fa = 2,06 больше значения tst — 1,96 для первого уровня вероятности
(0,95), цо меньше tst — 2,58 для второго уровня вероятности (0,99). Поэтому
нужно сделать следующий вывод: разность между потомством двух производите-
лей по титру лизоцима в крови достоверна с вероятностью р > 0,95. У дочерей
Первого быка более высокий титр лизоцима в крови.
Статистический анализ изменчивости по качественным призна-
кам. Средняя арифметическая для качественных признаков отра-
жает долю или процент особей, имеющих данный признак. На-
пример, в одном хозяйстве из 1030 коров заболело лейкозом 28
голов и 1002 остались здоровыми. В этом случае совокупность
состоит из двух групп: первая — больные животные, вторая —
здоровые. Численность первой группы обозначим р\, числен-
ность второй — ро, общую численность — п. Тогда долю больных
(т. е. имеющих изучаемый признак) животных (р) определяют по
формуле
'’-т-и-0-027,»™2.7 «•
Здесь р соответствует средней арифметической (х) при коли-
чественной изменчивости. Доля здоровых животных (q) состав-
ляет
q = $ = °’973’ 117111 97’3 %’
Среднее квадратическое отклонение вычисляют по формуле
ст = ^pq = ^0,027- 0,973 = 0,163, или 16,3 %.
Средняя ошибка. Частота качественного признака, вы-
раженная в долях единицы или в процентах, также имеет свою
ошибку:
136
т = л/Xl-rt = л/й = = 0 005 ндн 0 5 %
п п 1030
Ошибка является одинаковой для доли больных и здоровых
животных: р + т = 0,027 + 0,005; q + m = 0,973 + 0,005, или
2,7 ±0,5 и 97,3 ±0,5 %.
Определение достоверности разности между выборочными до-
лями или процентами. В одном стаде из 82 дочерей быка № 25588
заболели бруцеллезом 39, а из 80 дочерей быка № 1406— И.
Необходимо установить, различаются ли производители по вос-
приимчивости дочерей к бруцеллезу. Для этого воспользуемся
формулой
Определим долю больных дочерей: рх = 39 : 82 = 0,476 и
Ру = 11 : 80=0,138. Вычислим тх и ту.
= ^°,476(i-o,47^ = ^о,476-оДм ^о оозо = 0 055.
х 82 82
_ _ уодаж=Д5515 = о Ю9
У 80 80
t = 0,476-0,138 = 0,338 = 0,338= 14 о
d ^О.ОбЗМ.ОЗ!)2 V0,0045 0,06? ’
По таблице 13 с учетом числа степеней свободы v = пх +
+ пу — 2 = 82 + 80 — 2 = 160 находим значения tst (последняя
строка), которые равны 1,96; 2,58; 3,29. Так как величина
td = 14,9 больше tst = 3,29 для третьего уровня вероятности,
можно сделать вывод: разность между быками-производителя-
ми по частоте заболевания дочерей бруцеллезом достоверна с
вероятностью р > 0,999. Это значит, что дочери быка № 25588
отличаются большей восприимчивостью к бруцеллезу, чем по-
томство производителя № 1406.
ТИПЫ РАСПРЕДЕЛЕНИЯ
Нормальное распределение. Большинству количественных
признаков и свойств сельскохозяйственных и биологических
объектов с непрерывным характером варьирования присуще нор-
мальное распределение.
Сущность нормального распределения заключается в том, что
наибольшее число вариант расположено в центре распределения
около среднего значения признака. Чем больше отклоняются
значения отдельных вариант от среднего значения признака, тем
137
реже они встречаются, т. е. вероятность встречаемости той или
иной варианты уменьшается по мере ее удаления от средней
величины. В любом стаде животных особей со Средним значени-
ем признака (удой, процент жира, процент белка, живая масса,
настриг шерсти и т. д.) больше, чем с очень низкой или высокой
величиной признака. Нормальное распределение полностью ха-
рактеризуется средней арифметической и средним квадратичес-
ким отклонением.
С увеличением объема совокупности вариационная кривая
приближается к идеальной кривой, называемой кривой нормаль-
ного распределения или нормальной вариационной кривой (рис. 32).
Если из наивысшей точки кривой нормального распределения
опустить перпендикуляр, то получится ее ось симметрии. Осно-
вание этого перпендикуляра совпадает со средним значением
признака (х), медианой (Me) и модой (Мо). Весь диапазон из-
менчивости признака от средней арифметической охватывается
шестью .сигмами (х ± За). Отклонение в обе стороны от средней
на ± 1 ст‘ содержит 68,3 % всех вариант данного ряда, на±2ст —
95,5 и на ± Зст — 99,7 %.
Биномиальное распределение. Если вероятности появления от-
дельных вариант выражаются величинами, соответствующими
коэффициентам разложения бинома Ньютона, то такое распре-
деление называется биномиальным. Оно относится к признакам,
варьирующим дискретно, прерывисто (количество больных осо-
бей, количество самок и самцов в помете и т. д.). В этом случае
частоты отдельных классов пропорциональны коэффициентам
разложения бинома Ньютона:
(Р + Q)k,
где ри q — вероятности появления каждого признака; к — число классов, отлича-
ющихся по появлению признака.
Рис. 32. Стандартизованная форма нормальной вариационной кривой
138
Если р = 0,5, q = 0,5, а к увеличивается, то биномиальная
кривая приближается к нормальной кривой, которая является
пределом биномиального распределения. Чем больше различают-
ся значения р и q, тем значительнее асимметрия биномиальной
кривой. Средняя арифметическая и среднее квадратическое от-
клонение характеризуют биномиальное распределение.
Пример. В одном хозяйстве изучено распределение семейств по количеству
больных туберкулезом коров (табл. 14). Каждое семейство состояло из 5 особей.
14. Распределение семейств по количеству больных туберкулезом коров
Число больных (у)|5|4|з|2|1|о|^ = 5
Число семейств (/) 1 1 3 12 5 3 5/=л = 25
vf 5 4 9 24 5 0 Evf= 47
Среднее количество туберкулезных коров в семействе х = (Eyf): п = 47 25 =
= 1,88. По формуле х=кр доля больных коров в семействе равна р = х: к =
= 1,88 : 5 = 0,38, а здоровых — g = 1 — р ° 1 — 0.38 = 0,62. Находим среднее
квадратическое отклонение а = ~-lkpq = V50,38 0,62 = Vl,18 = 1,08. Так как данный
ряд является рядом разложения бинома Ньютона (0,38 + 0,62)5 при п = 25, то
можно вычислить теоретическую частоту распределения семейств по количеству
бальных туберкулезом коров. По треугольнику Паскаля коэффициенты бинома
для к ~ 5' 1, 5. 10, 5, 1. Получаем следующие показатели вероятное-™:
(0,38 + 0,62)5 = 1-0,385 + 50,38-0,62 + 100,384),6Г 1- 10-0,384),6? + >0,38-0,62* +
+ 1-0.625 = 0,0079 + 0,0645 + 0,2106 + 0,3441 + 0,2808 + 0,0916. Чтобы получить
теоретическое распределение семейств, нужно умножить полученные показатели
вероятности на число исследованных семейств (л = 25): рпюр. “
= vn:0,0079-25 = 0,2; 0,0645-25 = 1,6; 0,2106-25 = 5,3; 0,3441-25 = 8,6;
0,2808-25 = 7,0; 0,0916-25 = 2,3.
Фактическое распределение 1 1 3 12 5 3
Теоретически ожидаемое 0,2 1,6 5,3 8,6 7,0 2,3
распределение
Степень соответствия фактического распределения теоретически ожидаемому
определяют с помощью метода хи-квадрат.
Распределение Пуассона. Это распределение относится к дис-
кретной изменчивости, к редким событиям. Такими событиями
являются мутации, наследственные дефекты, рождение троен у
крупного рогатого скота и т. д. Поэтому при распределении Пу-
ассона значение р очень мало (так как событие совершается
редко), а значение q приближается к единице.
Распределение Пуассона характеризуется одним параметром —
средней арифметической (х), потому что ст2 равна или мало отли-
чается от х. С помощью распределения Пуассона можно рассчи-
тать вероятность появления в стаде или породе наследственных
дефектов. Для этого используют формулу
139
Pm
Оя -
~^е~х, или Pm =
ml ’
х"1
m!2,7183*
где т — число появлений редко встречающегося события в п независимых по-
вторных испытаниях; е = 2,7183... — основание натуральных логарифмов; х —
среднее число появлений редкого события (х = прУ, ! — факториал частоты, или
произведение натуральных чисел (1 2 З...т).
Если в популяции вероятность появления наследственного
уродства р = 0,002, то можно определить вероятность появления
3, 2, 1, 0 уродов среди, например, 200 телят. Среднее число
появления уродов х = пр = 200 • 0,002 = 0,4 головы в изучаемой
совокупности. Вероятность рождения трех уродов
__ 0,43__________0,064______ 0,064 ___л
3 " 3!-2,71830’4 " 1-2-3-2.71830'4 ~ 61,491 ~ ’
15. Значеййе вероятности появления редких событий при распределении
Пуассона
Число редких событий (/п) Среднее число редких событий (5)
0,1 0,2 0,3 0,4 0,5 1,0 1,5 2,0
0 9048 8187 7408 6703 6065 3679 2231 1353
1 0905 1637 2222 2681 3033 3679 3347 2707
2 0045 0164 0333 0536 0758 1839 2510 2707
3 0002 ООП 0033 0072 0126 0613 1255 1804
4 0000 0001 0003 0007 0016 0153 0471 0902
Примечание. В таблице нуль целых и запятая опущены.
Когда известны х и т, то по таблице 15 находим, что при х —
= 0,4 и т = 3 вероятность появления трех уродов Ртз = 0,0072.
Вероятность появления двух уродов — Ртз = 0,0536, одного —
Риц = 0,2681 и отсутствие уродов — Рто = 0,6703.
Трансгрессивные ряды. Они характеризуются тем, что две или
несколько кривых вариационных рядов лежат не отдельно, а
заходят в большей или меньшей части друг на друга. Если два
трансгрессивных ряда объединить и построить вариационную
кривую, то обычно образуется двухвершинная кривая (рис. 33). В
данном примере она указывает на то, что бурые латвийские и
джерсейские помесные коровы различаются по содержанию
жира в молоке, но часть животных имеет одинаковую жирномо-
лочность.
Бывают случаи, когда сильно различающиеся трансгрессив-
ные ряды не обнаруживают двухвершинности. Чем больше
трансгрессия, тем более сходны два вариационных ряда. Если
140
Рис. 33. Двухвершинная кривая распределения
по содержанию жира в молоке коров одного
хозяйстве, построенная без учета их породы, и
кривые распределения но каждой нз двух
иород в отдельности (по О. А. Ивановой,
1974):
1 — по всему стаду; 2 — помеси с джерсейской поро-
дой; 3 — коровы бурой латвийской породы
трансгрессия отсутствует, то кривые
не соприкасаются друг с другом.
При изучении изменчивости нель-
3,4 3,6 4,0 4,6 БД 5,4 БД
ЖИРНОСТЬ МОЛОКА, %
зя объединять в одну группу животных разных пород, неодинако-
вого возраста, выращенных в различных условиях среды и т. д.
КРИТЕРИЙ ХИ-КВАДРАТ (х2)
При анализе результатов скрещивания организмов исследова-
тель почти всегда сталкивается с положением, когда фактическое
расщепление в большей или меньшей степени отличается от тео-
ретически ожидаемого. Поэтому возникает необходимость оце-
нить степень соответствия фактических данных теоретически
ожидаемым. Это достигается путем вычисления критерия соответ-
ствия х2 и сравнением полученной величины с табличным значе-
нием (с учетом числа степеней свободы). Критерий х2 является
положительной величиной и изменяется от нуля до бесконечнос-
ти. Если х2 = О, то наблюдается полное соответствие фактическо-
го расщепления теоретически ожидаемому. С увеличением раз-
ности между эмпирическими и теоретическими частотами возрас-
тает величина х2, и при превышении определенного табличного
значения различия, между фактическим и теоретическим расщеп-
лением будут достоверными. При сравнении достоверности раз-
ности между двумя и более группами для изучения влияния опре-
деленных факторов в изменчивости признаков наряду с дисперси-
онным и другими методами применяется и более простой
критерий хи-квадрат. Критерий х2 также используют для изучения
связи между признаками (особенно имеющими качественные гра-
дации). Однако х2 указывает не на степень связи, а только на ее
наличие или отсутствие. Критерий х2 вычисляют по формуле
где О — фактически наблюдаемая величина; Е — теоретически (гипотетически)
ожидаемая величина.
Число степеней свободы при использовании хи-квадрата. При
оценке нормального и биномиального распределения из числа
141
классов вариационного ряда вычитается 2 или 3. Если фактичес-
кое итеоретическое распределение совпадают ио двум парамет-
рам (х и л), то v = л-2, а если по трем (х, п, о), то v = п — 3.
При четырех (2 х 2) и многопольных таблицах (2 х 3, 2 х 4 и
т. д.) используют формулу
v = (г-1)(с-1),
где г— число горизонтальных строк; с — число вертикальных столбцов.
При распределении Пуассона v = п — 2. При изучении поли-
морфизма белков число степеней свободы равно числу феноти-
пических классов минус число аллелей. При скрещиваниях
число степеней свободы равно числу фенотипических классов
минус единица. Так, если расщепление по фенотипу 3 : 1 или
9:7, то v = 2 — 1 = 1, если расщепление 1 : 2 : 1, то v = 3 —
1 = 2, при расщеплении 9 : 3 : 3 : 1 v = 4 — 1 = 3.
Определим степень соответствия фактического распределения
семейств по количеству больных туберкулезом коров теоретичес-
ки ожидаемому, которое было вычислено при рассмотрении би-
номиального распределения. Данные приведены в таблице 16.
16. Соответствие фактического распределения семейств теоретически
ожидаемому (биномиальному)
Распределение Количество больных в семействе Число классов №3
5 4 3 2 1 0
Фактическое (0) J 1 3 12 .5 3 л = 25
Теоретическое (£) 0,2 5 1.6 5,3 8,6 7,0 8 2,3 л = 25
7?1 9,3
При использовании х2 для оценки соответствия распределе-
ния вариант в вариационном ряду биномиальному или нормаль-
ному нужно, чтобы число вариант в крайних классах было не
менее 5. Более точные результаты получаются также тогда, когда
в выборке имеется 50 вариант и более. В связи с тем что число
вариант в крайних классах нашего вариационного ряда меньше
5, мы объединим три первых класса и два последних. Критерий
X2 оказался равным 2,14:
„3 - У (0-£)2 (5~7’1)2 (>2—8,6)2 , (8-9,3)2 ? .
Х Е 7,1 ~ 8,6 9,3
Так как имеется три фенотипических класса, то число степе-
ней свободы v = п — 2 = 3 — 2=1. По таблице 17 находим зна-
чение х2. которое при v = 1 и р = 0,95 составит 3,8. Поскольку
142
фактическая величина х2 (2,14) меньше табличной (3,8), то раз-
личия между фактическим распределением и теоретически ожи-
даемым недостоверны. Поэтому можно сделать вывод: факти-
ческое распределение семейств по количеству больных туберку-
лезом коров соответствует теоретически ожидаемому (в данном
случае биномиальному).
Пример. Изучена связь антигена На Н-системы групп крови свиней с
синдромом злокачественной гипертермии (см. табл. 17). Среди свиней с антиге-
ном На было 20,8 % чувствительных к синдрому злокачественной гипертермии, а
среди животных, не имеющих этого антигена, — 7,9 %.
2 (ad-bcpn________________(25-175—95-15)231О _
z " (о+бХ<*4Х<н<ХМ) " (25+95X15+175X25+15X95+175) " 1Е
Находим число степеней свободы v = (г— 1)(с — 1) = (2 — 1)(2 — 1) = 1.
Табличное значение х при v = 1 составляет 3,8 — 6,6 — 10,8 (табл. 18). Так как
фактическая величина (11) больше табличного значения (10,8), нулевая гипотеза
отвергается с высоким уровнем вероятности (р > 0,999).
17. Синдром злокачественной гипертермии (MHS) у свиней с различными генотипами
Генотип Чувствительность к MHS Всего
чувствительные | нечувствительные
НЧР, НЧГ в = 25 6 = 95 а + Ь = 120
Н~Н~ с= 15 d = 175 с + d = 190
Всего в + с = 40 b + d = 270 n = a + b + c + d= 310
р
18. Стандартные значения критерия х
Число степе- ней свободы (v) Вероятность (р) Число степе- ней свободы (v) Вероятность (р)
0,95 0,99 0,999 0,95 0,99 0,999
1 3,8 6,6 10,8 11 19,7 24,7 31,3
2 6,0 9,2 13,8 12 21,0 26,2 32,9
3 7,8 н,з 16,3 13 22,4 27,7 34,5
4 9,5 13,3 18,5 14 23,7 29,1 36,1
5 11,1 15,1 20,5 15 25,0 30,6 37,7
6 12,6 16,8 22,5 16 26,3 32,0 39,3
7 14,1 18,5 24,3 17 27,6 33,4 40,8
8 15,5 20,1 26,1 18 28,9 34,8 42,3
9 16,9 21,7 27,9 19 30,1 36,2 43,8
10 18,3 23,2 29,6 20 31,4 37,6 45,3
Вывод. Животные, имеющие антиген На, более чувствительны к синдрому
злокачественной гипертермии.
Можно рассчитать и относительный риск (к) возникновения
MHS по формуле
143
£ _ a(c+d) _ 25(15+175) _ » /
с(а+6) “ 15(25+95) “
Л
Следовательно, относительный риск возникновения син-
дрома злокачественной гипертермии у свиней с антигеном На
равен 2,6, что значительно выше, чем у животных без этого
антигена.
ИЗУЧЕНИЕ СВЯЗИ МЕЖДУ ПРИЗНАКАМИ
Признаки и свойства животных находятся в определенной
взаимосвязи. Например, существует связь между устойчивостью
и восприимчивостью матерей и их дочерей к маститу, лейкозу и
т. д., между фагоцитарной активностью и резистентностью,
уровнем кормления и молочной продуктивностью, длиной туло-
вища и живой массой. Особенность корреляции (связи) между
признаками живых организмов состоит в том, что каждому зна-
чению одного признака соответствует не одно, а несколько зна-
чений другого. Так, животные одинаковой высоты могут быть
разными по массе, но в среднем масса низких животных меньше
более высоких.
Различают положительную и отрицательную корреляции. При
положительной корреляции с увеличением одного
признака увеличивается и другой. Например, с увеличением
массы коров-первотелок возрастает и удой; чем выше процент
жира в молоке, тем выше и процент белка в нем. При отрица-
тельной корреляции с увеличением одного признака вто-
рой уменьшается. Например, с увеличением удоя у коров снижа-
ется жирность молока; чем больше длина туловища у свиней, тем
меньше толщина сала; куры с высокой яйценоскостью имеют
более мелкие яйца и т. д.
Для оценки силы и направления взаимосвязи между призна-
ками вычисляют коэффициент корреляции (г). Он колеблется от
О до ±1. При положительной корреляции его величина может
изменяться от 0 до +1, а при отрицательной — от 0 до —1. Когда
коэффициент корреляции равен нулю, то изменение одного при-
знака происходит независимо от другого. Если коэффициент
корреляции ниже 0,5, то связь считается слабой; при величине г,
равной 0,5—0,6, — средней; если коэффициент 0,7 и выше, —
связь высокая.
Вычисление коэффициента корреляции (г) для большой выборки
(л > 30). Вычислим величину корреляции между количеством
эритроцитов (млн в 1 мм3) и лейкоцитов (тыс. в 1 мм3) у 79 коров
черно-пестрой породы. Для этого определяют классы для вариа-
ционного ряда по количеству эритроцитов и отдельно по количе-
ству лейкоцитов. Потом составляют корреляционную решетку
(табл. 19) и записывают в ней вверху по горизонтали значения
144
145
классов по количеству эритроцитов (х) от минимального к макси-
мальному, а по вертикали располагают классы по количеству лей-
коцитов (у) от больших к меньшим. Заносят данные о 79 живот-
ных в клетки корреляционной решетки с учетом одновременно
значений двух признаков. Так, если в крови коровы содержится
6,6 млн эритроцитов и 7,4 тыс. лейкоцитов, то ее отмечают одной
точкой в клетке на пересечении класса 6,5—6,9 по количеству
эритроцитов и класса 7,0—7,9 по количеству лейкоцитов. Подсчи-
тывают частоту вариант fxvtfy. Выделяют жирными линиями клас-
сы условной средней Ах (6,5—6,9) и Ау (7—7,9).
В решетке образуется четыре квадранта. Определяют ряд ус-
ловных отклонений ах и ау. Находят ряды произведений fxax,
fyOy, fxax,fydy и их суммы. Вычисляют произведение fa^fly по
каждому из четырех квадрантов [для этого частоту if) каждой
клетю^умножают на соответствующее значение
ахи ау].
I квадрант II квадрант III квадрант IV квадрант
fafly fafly f<Wy f<kfly
1(—2)5 = -10 1-11 = 1 5(-2)(-1) = 10 7 1(—1) = —7
1(—2)4 = -8 4-21=8 6(-1)(-1) = 6 1 • 2(—1) = -2
2(—2)2 = -8 2-31=6 1(-3)(-2) = 6 1 • 3(—1) = -3
4(-1)2 = -8 1-41 = 4 1(-1)(-2) = 2 1 • 2(—2) = -4
2(-3)1 = -6 2(-1)(-3) = 6 Xfa^o,, = —16
3(—2)1 = -6 ~ 30
2(—1)1 = -2
= —48
= -48 + 19 + 30 + (-16) = -15
Коэффициент корреляции вычисляют по формуле
__ ' a &№х * 'xSfrV'»
Сигмы берутся без классного промежутка:
> pj&Y -J204 f- 12Y 1 (.
, д/ЗД _ л/179_(5.у _ 1 5
°У~ 1 п k а ) ~ У 79 (797 " ’
146
_ (-15:79)—(-12:79)(5:7Я> -0,18 п пя
Г------------ЩЛ------------" ~2А = ~°’08’
Ошибка коэффициента корреляции. Так как
коэффициент корреляции вычислен не по генеральной, а по
выборочной совокупности, он имеет ошибку выморочности:
/пг
= 1-? _ 1-(-0,08)2 _ 0 и
4п V79
Достоверность коэффициента корреляции.
Когда известна ошибка, можно определить степень достоверности
г. При этом исходят из нулевой гипотезы, т. е. предполагают,
что в генеральной совокупности связь между изучаемыми
признаками отсутствует. Только при значении tr, равном таб-
личному значению или больше его (при вероятности 0,95;
0,99 или 0,999), нулевая гипотеза отвергается и значение г
будет достоверным. В примере
/г = — = £?Т = 0,73.
г тг 0,11 ’
С учетом числа степеней свободы v = п — 2 = 79 — 2 = 77,
находим значения tst (см. табл. 13). Они равны: 4) 95 = 1,96,
А),99 = 2,58 и /о,999 = 3,29. Так как наше значение tr = 0,73 мень-
ше tst= 1,96, то нулевая гипотеза не отвергнута и мы не можем
сказать, что у исследованных коров существует слабая отрица-
тельная корреляция между количеством эритроцитов и лейкоци-
тов.
Вычисление коэффициента корреляции для малых выборок
(л < 30). Существует несколько рабочих формул для вычис-
ления г,
г =
-тт—----, ИЛИ
Сх+Су~С(1
где Сх = 2л2—(2л)2 п\ Су = 2У—(ZX)2 ’ л
Вычислим коэффициент корреляции между относительным
числом активных нейтрофилов у коров — матерей и дочерей
(табл. 20). С помощью ЭВМ этим методом вычисляют г для
любой по размеру совокупности. Нейтрофилы — одна из форм
зернистых лейкоцитов, обладающих хорошо выраженной актив-
ностью.
147
20. Определение г для малых выборок
Номер коровы Нейтрофилы, % ху л?
матери (х) дочери (у)
1 36 40 1440 1296 1600 2 29 22 638 841 484 3 38 32 1216 1444 1024 4 20 32 640 400 1024 5 39 34 1326 1521 1156 6 28 33 924 784 1089 7 30 24 720 900 576 8 38 40 1520 1444 1600 9 32 35 1120 1024 1225 10 31 36 1116 961 1296 £х=321 £у=329 £ху = 10660 £**= 10615 £/=11074. * Сх = 10 615 - 3212 : 10 = 10 615 - 10 304,1 = 310,9. Су= 11 074 - 3292 : 10 = 11 074 - 10 824,1 = 249,9 . г = 10 660—(321-329): 10 _ 10 660-10561 = 99 = 0 35 л/310,9-249,9 >/77693,9 278>7 т - 0.93 пзз тг - - 9 о, - 0,33. >/л=2 'Я 2>83
fr = -^=£g=l,06.
г тг 0,33
Находим значение fa (см. табл. 13), которое с учетом числа
степеней свободы v = и — 2 = 10 — 2 = 8 равно *о,95 = 2,31. В
связи с тем что фактически полученный tr = 1,06 меньше значе-
ния fa = 2,31, коэффициент корреляции недостоверен. Для того
чтобы коэффициент корреляции г = 0,35 был достоверен (при
р = 0,95), нужно было взять не менее 32 пар значений признака.
Имеются специальные таблицы (Г. Лакин. Биометрия. М., 1990,
с. 344), по которым можно узнать количество пар значений при-
знака, достаточное для достоверности выборочного коэффициен-
та корреляции.
В исследованиях, проведенных на больших выборках, уста-
новлена положительная связь между относительным числом ак-
тивных нейтрофилов у матерей и дочерей. Если удвоить коэффи-
циент корреляции, вычисленный по какому-нибудь признаку
между матерями и дочерями, то получим коэффициент
наследуемости (Л2 = 2гм/д), который указывает на долю
генетической изменчивости в общей фенотипической изменчи-
вости признака.
Коэффициент регрессии. Коэффициент корреляции указывает-
только на степень связи между признаками. Иногда необходимо
148
знать характер изменения одного признака в зависимости от
изменения другого. Для этих целей используется регрессионный
анализ. Коэффициент регрессии показывает, насколько изменяется
один признак при изменении другого на единицу. Он вычисляется
по формуле
fyy= и Ry/x = rS?
Регрессия является двухсторонней, т. е. можно определить из-
менение х по изменению у и изменение у по изменению х. В
формуле среднее квадратическое отклонение берется с учетом
классного промежутка. Например, коэффициент корреляции
между удоем за первую (х) и вторую (у) лактации равен 0,6,
ох = 700 кг, су = 900 кг. Отсюда Ry/X = 0,6(900:700) = 0,77 кг. Это
значит, что с увеличением удоя по первой лактации на 1 кг удой
по второй лактации увеличивается на 0,77 кг. Вычисляем
Rx/y = 0,6(700:900) = 0,47 кг. В этом случае с увеличением удоя по
второй лактации на 1 кг удой по первой лактации увеличивается
на 0,47 кг. В одном хозяйстве удой первотелок равен хх = 4240 кг,
а у коров за вторую лактацию ху = 4870 кг. Если мы отберем пер-
вотелок с удоем, например, на 100 кг выше среднего — 4340 кг, то
у этих коров по второй лактации при Ry/X = 0,77 удой составит
4870 + 0,77-100 = 4947 кг. Поэтому, зная коэффициент регрессии,
можно определить величину одного признака при заданной вели-
чине другого признака по уравнению прямолинейной регрессии:
Х=Хх+ Rx/y (У—Ху),
где X— искомая величина признака х; У — заданная величина признака у; хх и
ху — соответствующие средние арифметические признаков.
По этому уравнению можно, например, предсказать, какой
удой будет у коров по второй лактации, если по первой он
составлял 5000 кг: У = ху + Ry/x(X— Хх) = 4870 + 0,77 (5000 —
— 4340) = 4870 + 0,77 • 660 = 5378 кг. Следовательно, если у
группы коров удой по первой лактации был 5000 кг, то по вто-
рой лактации он составит 5378 кг.
Коэффициент корреляции между альтернативными признаками
(гв). Для установления связи между альтернативными признака-
ми строят четырехклеточную корреляционную решетку
(табл. 21). Коэффициент корреляции вычисляют по формуле
{ad— be) — %
Г=-Т...... ' .... ,
V(fl + b) (с + d) (a + c) {b + d)
где a, b, c, d— частоты, распределившиеся в четырех клетках корреляционной
решетки.
149
21. Корреляция частоты заболеваемости лейкозом матерей и дочерей
Дочери (у) Матери (х) Л Всего
больные здоровые
Больные а = 46 Ь = 70 а + b = 116
Здоровые с = 114 rf = 391 с + d = 505
Всего а + с = 160 b + d= 461 n=a+b+c+d= 621
Нужно определить коэффициент корреляции между частотой
заболеваемости лейкозом коров — матерей и дочерей.
(46-391—70-114) -
га = ;--- — —— 2-----------------= 0,147.
V(46 + 70) (114 + 391) (46 + 114) (70 + 391)
Ошибка коэффициента корреляции mr + = 0,039.
V621
Достоверность коэффициента корреляции tr= = 3,77.
Так как t = 3,77 больше табличного значения tst — 3,29 (см.
табл. 13), коэффициент корреляции высокодостоверен
(р > 0,999).
Таким образом, можно сделать вывод, что между частотой
заболеваемости лейкозом матерей-коров и их дочерей существует
невысокая положительная связь, т. е. у больных матерей дочери
чаще заболевают лейкозом, чем у здоровых.
Коэффициент регрессии вычисляют по формулам
в V/у = ad—bc _ 46-391—70-114 _«
7 (о + с)(6+ф_(46 + 1И(70 + 391)_
о у/p _ ad—bc_______________46-391 70-114 _ л 171
y (a + b-)(c+d) (46 + 70) (114 + 391) ’
ДИСПЕРСИОННЫЙ АНАЛИЗ
Сущность дисперсионного анализа состоит в установлении
роли отдельных факторов в изменчивости признаков.
Известно, что многие признаки и свойства живых организмов
находятся под влиянием наследственности и условий среды. Так,
устойчивость животных к болезням зависит от наследственности
матери и отца, возраста, пола, уровня кормления и содержания.
Это приводит к возникновению огромной изменчивости призна-
ков. С помощью дисперсионного анализа можно установить досто-
верность и силу влияния, а также относительную роль одного или
нескольких факторов в общей изменчивости признака.
150
Общая изменчивость признака, выраженная общей вариансой
о^ может быть разложена на изменчивость, зависящую от изуча-
емых факторов (<& ст|), и изменчивость, обусловленную неучтен-
ными (случайными) факторами (а^). Если учитывается один
фактор А, то общая варианса nJ = о^ + с& Если учитываются два
фактора — А и В, то общая варианса может быть разложена на
компоненты: nJ =
В зависимости от числа учитываемых факторов дисперсион-
ный анализ может быть однофакторным, двухфакторным и т. д.
Обычно каждый изучаемый фактор представлен в виде несколь-
ких групп (классов), называемых градациями. Если изучается
влияние породы (фактор А) на устойчивость животных к болез-
ни, то градациями будут отдельные породы. Изменчивость внут-
ри каждой градации носит случайный характер (зависит от неуч-
тенных факторов), а между градациями (факториальная) обу-
словлена влиянием учтенных факторов. Дисперсионный
комплекс может быть равномерным (в градациях одинако-
вое число вариант) инеравномерным(в градациях разное
число вариант).
Использование однофакторного дисперсионного анализа при одинаковой
численности вариант в группах рассмотрим на следующем примере. Для выявле-
ния устойчивости животных в возрасте 31 мес искусственно заражали одинако-
вым количеством личинок Boophilus microplus и через 20 дней подсчитывали
число самок клещей. Результаты эксперимента были следующими:
Градации» Порода Число клещей на одном животном
Л Африкандер х герефорд 20 40 70 120 260
Л Шортгорн 50 170 210 450 610
Аз Герефорд 100 400 570 840 1200
Нужно определить, влияет ли порода на устойчивость скота к клещам. Дис-
персионный анализ обычно проводят при наличии различий между средними
арифметическими. На одном животном у гибридов африкандер х герефорд в
среднем было 102 клеща, у шортгорнов — 398 и у герефордов — 622 (табл. 22).
Для упрощения расчетов каждую варианту разделили на 100, поэтому при вычис-
лении х проводили умножение на 100. После всех вычислений заполняем сво-
бодную таблицу дисперсионного анализа.
Заключительным этапом дисперсионного анализа является сравнение средне-
го квадрата в}, характеризующего межгрупповую изменчивость, т. е. влияние
изучаемого фактора (породы), и среднего квадрата а?, характеризующего внутри-
групповую изменчивость, т. е. влияние случайных отклонений. Вычисляем крите-
рий F, который равен 4,36 (табл. 23). Сравниваем фактически полученное значе-
ние F с табличным критерием Фишера (табл. 24), который находится с учетом
числа степеней свободы vi = 2hvz = 12 (пересечение вертикальной vi и горизон-
тальной V2 строк). Табличное значение F = 3,9—6,9. Следовательно, полученная
величина F = 4,36 больше табличного значения F = 3,9 при р = 0,95.
151
22. Число самок-клещей на животных разных пород (каждая варианта уменьшена в 100 раз)
152
24. Стандартные значения критерия Фишера F = соответствующие
<Tz
двум степеням вероятности pi = 0,99 (верхний ряд),
рг = 0,95 (нижний ряд)
Число степеней свободы (vz) Число степеней свободы (vi)
1 2 з 4 5 10 20 30
3 34,1 30,8 29,5 28,7 28,2 27,2 26,7 26,5
10,1 9,6 9,3 9,1 9,0 8,8 8,7 8,6
4 21,2 18,8 16,7 16,0 15,5 14,7 14,0 13,8
7,7 6,9 6,6 6,4 6,3 6,0 5,8 5,7
5 16,3 13,3 12,1 11,4 н,о 10,1 9,5 9,3
6,6 5,8 5,4 5,2 5,1 4,7 4,6 4,5
6 13,3 10,9 9,8 9,2 8,8 7,9 7,4 7,2
6,0 5,1 4,8 4,5 4,4 4,1 3,9 3,8
7 12,3 9,6 8,5 7,9 7,5 6,6 6,2 6,0
5,6 4,7 4,4 4,1 4,0 3,6 3,4 з,з
8 11,3 8,7 7,6 7,0 6,6 5,8 5,4 5,2
5,3 4,6 4,1 3,8 3,7 3,3 3,2 3,1
9 10,6 8,0 7,0 6,4 6,1 5,3 4,8 4,6
5,1 4,8 3,6 3,6 3,5 3,1 2,9 2,8
10 10,0 7,9 6,6 6,0 5,6 4,9 4,4 4,3
5,0 4,1 3,7 3,5 3,3 3,0 2,7 2,7
12 9,3 6,9 6,0 5,4 5,1 4,3 3,9 3,7
4,8 3,9 3,5 3,3 3,1 2,8 2,5 2,5
20 8,1 5,8 4,9 4,4 4,1 3,4 2,9 2,8
4,3 3,5 3,1 2,9 2,7 2,3 2,1 2,0
30 7,6 5,4 4,5 4,0 3,7 3,0 2,5 2,4
4,2 3,3 2,9 2,7 2,5 2,2 1,9 1,8
50 7,2 5,1 4,2 3,7 3,4 2,7 2,3 2,1
4,0 3,2 2,8 2,6 2,4 2,0 1,8 1,7
100 6,9 4,8 4,0 3,5 3,2 2,5 2,1 1,9
3,9 3,1 2,7 2,5 2,3 1,9 1,7 1,6
200-300 6,8 4,7 3,9 3,4 3,2 2,4 2,0 1,8
3,9 3,0 2,6 2,4 2,3 1,9 1,6 1,5
Вывод. Породная принадлежность животных влияет на их устойчивость к
клещам.
Критерий F указывает на влияние изучаемого фактора (если /факт S /табл) в
общей изменчивости признака. Однако в этом случае он не указывает, между
какими х разность достоверна, а между какими — недостоверна.
Показатель силы влияния rw. Когда доказано влияние фактора
породы, можно определить и силу этого влияния:
153
154
Если в градациях разное число вариант, то по определяется по
формуле
1 no = -^(.N~
где а — число градаций фактора A; N = Sn,- — общее число вариант.
t Тогда
I r*-=ISe °’402’ и™ 4°’2 %-
I Это означает, что влияние породы на варьирование устойчи-
| вости животных к клещам составляет 40,2 %, а 59,8 % определя-
I ется другими факторами.
Дисперсионный анализ качественных признаков. Например,
t нужно определить влияние быков-производителей на резистент-
ность дочерей к бруцеллезу. Заболеваемость дочерей трех быков
была 13,8; 27,7 и 47,6 %. Составляют статистический комплекс
(табл. 25), а потом данные заносят в сводную таблицу 26. Вычис-
ляют F, находят табличные значения F (см. табл. 26), которые
при vi = а— 1 = 3—1 = 2 и vj = N— а = 263—3 = 260 равны 3,0—4,7.
Полученная величина F = 12,6 больше табличной F = 4,7 при
р = 0,99.
Вывод. Быки-производители влияют на резистентность до-
черей к бруцеллезу.
Чтобы определить показатель силы влияния (rw), вычисляют
по:
1 /АГ 1 /'•>£-1 SfP+ioP + ei* о-
------------------------S3---’-87-
_______°г____________2,4—0,19_______2,21 _ л 117 11 7
w~ <^ + (л0-1)<^ “ 2,4 +(87—1)0,19 “ 18,74 10111 11>7
Таким образом, различия в устойчивости дочерей к бруцелле-
зу на 11,7 % зависят от генотипа их отцов и на 88,3 % — от
других причин.
Контрольные вопросы. 1. Какие вы знаете виды изменчивости? 2. Что такое
биометрия? 3. Какие статистические показатели характеризуют совокупность?
4. Какие показатели характеризуют изменчивость? 5. Как можно оценить взаимо-
связь между признаками? 6. Как оценить достоверность разности между средни-
ми арифметическими двух выборочных совокупностей? 7. Для чего используется
дисперсионный анализ?
Гл ава 10
МУТАЦИОННАЯ ИЗМЕНЧИВОСТЬ
В предыдущих главах отмечено одно из основных свойств
кариотипа, ДНК и ее участков (генов) — сохранять постоянство
внешнего и внутреннего строения. Морфофункциональная ус-
тойчивость генетического материала обеспечивает передачу всей
совокупности наследственных признаков каждой особи последу-
ющим поколениям и является основой для сохранения видовых
признаков на протяжении многих сотен лет. Однако такая ста-
бильность относительна. В силу действия внутренних и внешних
факторов в генетическом материале возникают изменения — му-
тации, определяющие мутационную изменчивость.
Мутациями называют стойкие изменения в структуре ДНК и
кариотипе. Этот термин впервые предложил ботаник Гуго де Фриз
для обозначения внезапно возникающих наследуемых изменений у
растений. Большой вклад в развитие теории мутаций внесли отече-
ственные ученые С. И. Коржинский, Н. В. Тимофеев-Ресовский,
А. С. Серебровский, Н. П. Дубинин, М. Е. Лобашов и др.
Мутации у животных происходят постоянно с определенной час-
тотой и скоростью. Процесс образования их получил название му-
тагенеза. Мутации, возникающие в естественных условиях, называ-
ют спонтанными, искусственно вызванные — индуцированными. Те и
другие могут возникать как в генеративных, так и в соматических
клетках. Мутации, возникающие в половых клетках, передаются в
последующие поколения. Соматические мутации не наследуются.
Они влияют только на признаки самого мутантного животного.
КЛАССИФИКАЦИЯ МУТАЦИЙ
Основные типы мутаций — изменения в числе или структуре
хромосом — хромосомные мутации, в структуре ДНК — генные
(точковые) мутации.
Хромосомные и генные мутации, как правило, вызывают у
животных нарушения жизнеспособности, плодовитости, сниже-
ние устойчивости к болезням, продуктивности и другие вредные
последствия. Это связано с тем, что они приводят к нарушению
процессов деления клеток, нормального распределения хромосом
между ними, изменяют ход синтеза белков, ферментов и т. д.
156
I ХРОМОСОМНЫЕ МУТАЦИИ
Изменения кариотипа могут быть количественными, струк-
турными и одновременно теми и другими. Рассмотрим отдель-
ные формы изменения хромосом (см. схему).
Числовые мутации кариотипа. Эта группа мутаций связана с
изменением числа хромосом в кариотипе. Количественные изме-
нения в хромосомном составе клеток называют геномными мута-
циями. Они подразделяются на гетероплоидию, анеуплоидию,
1 полиплоидию.
Гетероплоидия обозначает общее изменение числа хромосом
по отношению к диплоидному полному набору.
Об анеуплоидии говорят в тех случаях, когда число хромосом в
клетке увеличено на одну (трисомия) или более (полисемия) или
уменьшено на одну (моносомия). Употребляют также термины
«гиперплоидия» и «гипоплоидия». Первый из них означает уве-
личенное число хромосом в клетке, а второй — уменьшенное.
Полиплоидией называют увеличение числа полных хромосом-
ных наборов в четное или нечетное число раз. Полиплоидные
клетки могут быть триплоидными, тетраплоидными, пентаплоид-
ными, гексаплоидными и т. д.
Структурные мутации хромосом. Эта группа мутаций связана с
изменением формы, размеров хромосом, порядка расположения
генов (изменение групп сцепления), утратой или добавкой от-
дельных фрагментов и т. д. Изменения структуры одной или
нескольких хромосом называют хромосомными мутация-
ми. Установлено несколько типов структурных мутаций хромо-
сом.
Транслокации — перемещения отдельных фрагментов хромосом
из одного участка в другой, обмены фрагментами между разными
хромосомами, слияния хромосом. При взаимных обменах фраг-
। ментами между гомологичными или негомологичными хромосо-
’ мами возникают транслокации, называемые реципрокными. Если
целое плечо одной хромосомы присоединяется к концам другой
хромосомы, такой тип транслокаций называют тандемным. Слия-
ние двух акроцентрических хромосом в области центромер фор-
мирует транслокацию робертсоновского типа и образование мета-
и субметацентрических хромосом. При этом обнаруживается эли-
минация блоков прицентромерного гетерохроматина.
Инверсии — внутрихромосомные аберрации, при которых
фрагменты хромосом разворачиваются на 180°. Различают пери-
и парацентрические инверсии. Если перевернутый фрагмент со-
держит центромеру, инверсия называется перицентрической.
Делеции — потеря срединного фрагмента хромосомы, в резуль-
тате чего она укорачивается.
Нехватки — потеря концевого фрагмента хромосомы.
Дупликация — удвоение фрагмента одной хромосомы (интра-
157
Изменения в кариотипе
158
хромосомные дупликации) или разных хромосом (интерхромо-
сомные дупликации).
Кольцевые хромосомы формируются при наличии двух конце-
вых разрывов (нехваток).
Изохромосомы возникают, если в противоположность нормально-
му делению хроматид в длину происходит горизонтальное (попере-
чное) деление хромосомы в центромере с последующим слиянием
гомологичных плеч в новую хромосому — изохромосому. Ее про-
ксимальные и дистальные участки идентичны по строению и составу
генов. В зависимости от того, сколько хроматид изменено (одна или
две), структурные аномалии подразделяются на хромосомные и хро-
матидные. На рисунке 34 приведены схемы образования различных
типов структурных изменений хромосом или аберраций.
МШВшш
ПЕРЕМЕЩЕНИЯ
РЕЦИПРОКНАЯ
ТРАНСЛОКАЦИЯ
П АР АЦЕНТРИ - ПЕРИЦЕНТРИ-
ЧЕСКАЯ ЧЕСКАА
ИНВЕРСИИ
ВСТАВКА
। i-j а-|
ТАНДЕМНОЕ СЛИЯНИЕ
ЦЕНТРИЧЕСКОЕ СЛИЯНИЕ
ДЕЛЕЦИЯ
ДУПЛИКАЦИЯ
КОЛЬЦЕВАЯ ХРОМОСОМА
НОРМАЛЬНОЕ РАСХОЖДЕНИЕ
ХРОМАТИД
ОБРАЗОВАНИЕ ИЗОХРОМОСОМ
Рис. 34. Схема образования различных типов структурных аберраций хромосом
(по Харе, 1978)
159
МЕХАНИЗМ ОБРАЗОВАНИЯ ЧИСЛОВЫХ И СТРУКТУРНЫХ АНОМАЛИЙ
КАРИОТИПА
В основе всех числовых аномалий кариотипа лежит нерасхож-
дение хромосом в мейозе. Чаще это происходит у особей жен-
ского пола. Так, трисомия и моносомия возникают вследствие
нерасхождения хроматид во время мейотического деления. В
результате в одной дочерней клетке появляется лишняя хромосо-
ма, в другой ее недостает. Полисомия, как и моносомия, возни-
кает, очевидно, из-за нерасхождения во время мейоза или ранне-
го дробления. В большинстве случаев трисомные и моносомные
эмбрионы появляются в результате новых мутаций в половых
клетках родителей. Наиболее часто у животных обнаруживают
трисомию и моносомию половых хромосом. Вероятность нерас-
хождения хромосом увеличивается с возрастом животных.
Полиплоидия может возникать в результате ошибок при
мейозе^или во время оплодотворения. Так, при делении хромо-
сом на хроматиды без деления цитоплазмы в клетке может обра-
зовываться тетраплоидный набор. Такие клетки могут возникать
при слиянии двух соматических клеток. У животных обнаружи-
вали диплоидные гаметы, которые формировались в результате
нерасхождения хромосом в мейозе. Эти случаи полиплоидии
связаны с нарушением образования веретена или тянущих нитей
в анафазе.
Полиплоидия может быть следствием оплодотворения одной
яйцеклетки с гаплоидным набором хромосом двумя или более
спермиями (полиспермия или полиандрия). При оплодотворении
одной яйцеклетки двумя спермиями формируется триплоидный
эмбрион. Триплоидный набор может возникнуть тогда, когда в
процессе оплодотворения наряду с яйцеклеткой участвует и вто-
рое полярное тело (рис. 35). В других случаях полиплоидные
индивидуумы возникают при задержке первого деления дробле-
ния зиготы.
Тетраплоидия может возникать благодаря подавлению первого
дробления диплоидной зиготы, когда хромосомы дуплицируются
и делятся, но остаются в той же клетке.
Предрасполагающие к появлению полиплоидии факторы: ста-
рение гамет при задержке овуляции, длительность хранения
спермы, задержка оплодотворения самок. Слияния клеток могут
индуцироваться вирусами. На образование веретена деления
(разрыва нитей) могут влиять лекарственные препараты.
Мозаицизм и миксоплоидия, а также химеризм относятся к кате-
гории соматических мутаций. Мозаицизм — присутствие в орга-
низме клеток (точнее, клонов) разного генотипа, что может при-
вести к возникновению в процессе соматического развития кле-
точных популяций с отличающимся генотипом. Частным
случаем мозаицизма является гинандроморфизм и мозаицизм по
160
НЕРАСХОЖДЕНИЕ
Рис. 35. Механизм образования трисомии и моносомии в мейозе (но Харе, 1978)
группам крови, белкам и др. Миксоплоидия, полисоматия —
форма клеточного мозаицизма — наличие у одной особи клеток
с различным уровнем плоидности (три-, тетра-, пента-, гекса-
плоидные и т. д.). Миксоплоидные клетки возникают в результа-
те нарушения митоза во время раннего дробления при делении
зиготы (нерасхождение хромосом). Химеризм возникает в ре-
зультате обмена клетками крови между плодами при двух или
более плодной беременности, в случае слияния бластоцист или
зигот. В частности, диплоидно-триплоидные химеры могут фор-
мироваться при слиянии второго полярного тела с одним из
бластомеров на первой стадии дробления.
Структурные изменения в кариотипе (аберрации) возникают
как результат спонтанной или индуцированной ломки, разрывов
и последующих воссоединений хромосом новым способом. Если
разрывы затрагивают обе хроматиды, аберрации называют хро-
мосомными, если только одну — хроматидными. Если в резуль-
тате структурной перестройки нет потери или прибавления гене-
тического материала, аберрации считаются сбалансированными.
К ним относятся в основном транслокации, инверсии. Несба-
лансированные аберрации представлены главным образом деле-
ниями, дупликациями, изохромосомами и кольцевыми хромосо-
мами. После разрывов хромосом или хроматид оторвавшиеся
фрагменты обычно утрачивают. Это приводит к потере части
генов (делении и нехватки) или дополнению хромосом фрагмен-
тами (дупликации), что связано с появлением избыточного гене-
161
тического материала в клетках. Следствием делеций и нехваток
может быть отсутствие генетического контроля ддя самых разных
признаков организма. Рецессивные гены, содержащиеся в тех же
локусах нормальной гомологичной хромосомы, проявляют свой
эффект в одинарной дозе. Следует иметь в виду, что животные,
гетерозиготные по сбалансированным транслокациям, могут
производить генетически несбалансированные гаметы, которые,
в свою очередь, могут формировать несбалансированные зиготы,
отмирающие на ранних стадиях эмбриогенеза (рис. 36).
В связи с широким распространением центрических слияний
(транслокаций Робертсона) у животных ученые активно изучают
механизмы их образования. Полагают, что робертсоновские
транслокации представляют собой частный вариант теломерного
слияния, вовлекающего теломерные концы двух различных тело-
центрических (акроцентрических) хромосом, у которых вследст-
вие задержки репликации ДНК в области палиндрома либо точ-
ковых мутаций в этой области рестрикционные эндонуклеазы
утрачивают способность узнавать место рестрикции, что ведет к
сохранению прочного соединения между хромосомами. При
этом возникает метацентрическая или субметацентрическая хро-
мосома, несущая две центрометры, которые либо функциониру-
ют как одно целое, либо одна центромера инактивируется.
Реципрокные транслокации у родителей — одна из основных
причин возникновения трисомий и моносомий у эмбрионов.
Частичные трисомии могут быть связаны как с транслокациями
и инверсиями у родителей, так и с новыми мутациями —
спорадические транслокации, дупликации и т. д. Необходимо
отметить, что в данном случае терминами «частичные три-
сомии» и «моносомии», обозначаются потери части хромосом,
т. е. делении и нехватки. При транслокациях число плеч
хромосом в клетках остается таким же, однако в измененных
хромосомах образуются новые группы сцепления между генами,
что нарушает процессы конъюгации гомологичных хромосом
в мейозе и является причиной формирования несбаланси-
рованных зигот.
Хромосомная нестабильность. В процессе ци-
тогенетического анализа можно выделить животных, не имею-
щих в кариотипе каких-либо изменений, и особей, у которых
находят разрывы и пробелы хромосом, полиплоидные клетки,
другие структурные и числовые аберрации. По специальным
методикам у одних индивидуумов обнаруживают нарушения
формирования синаптонемного комплекса в мейозе, повы-
шенную частоту сестринских хроматидных обменов и высокий
процент клеток с микроядрами. Повышенная частота числовых
и структурных аномалий хромосом, наблюдаемая у отдельных
особей, определяется термином «хромосомная нестабиль-
ность».
162
3 ш Z L- С 5 ТРАНСЛОКАЦИЯ-' J ТРИСОМИЯ 2n=60,t1/29+1 12 ТРАНСЛОКАЦИЯ— U ТРИСОМИЯ иОпо 2n»60,t1/29+29 18 ГЕТЕРОЗИГОТА 2na59,t1/29 моносомия ! ооп ! 2п«59,-29 30 моносомия Опп | 2п=59,-1 36 норма (Юпп 2п-50
с 5 ГЕТЕРОЗИГОТА 2n»59,t1/29 11 2-ТРАНСЛОКАЦИЯ- UU ТЕТРАСОМИЯ ООпп 2п=60,«1/29+29+29 117. ТРАНСЛОКАЦИЯ— U МОНОСОМИЯ |)п | 2ne58,t’1/29-1 ;23 моносомия- Q МОНОСОМИЯ 2п=58,-1-29 29 нуллисомия пл 2п=58,-1-1 35 моносомия Опп 2п»59,-1
с 4 ТРАНСЛОКАЦИЯ— Ч. у.ТРИСОМИЯ 2п»59, И/29+1 10 .ГЕТЕРОЗИГОТА 2п=59,11/29 И 6 ТРАНСЛОКАЦИЯ- (J МОНОСОМИЯ 00 | 2^58.(1/29-29 22 нуллисомия 00 2п*58г29-29 |28 моносомия - 1 Q моносомия 2п==58,-1-29 34 моносомия ООп 2п=59,-29
□сз 3 2-ТРАНСЛОКАЦИЯ- ТРИСОМИЯ 2п=59,«1/29+1 9 2 -ТРАНСЛОКАЦИЯ- ТРИСОМИЯ 2n==59,ttl/29+29 115 гомозигота 00 | 2n=58,tt1/29 |21 транслокация- моносомия 2n=59,t1/29-29 I 27 ТРАНСЛОКАЦИЯ- Ч МОНОСОМИЯ (Io 2п*58Л1/29-1 33 ГЕТЕРОЗИГОТА Ило 2n=59,t1/29
с 2 2 -ТРАНСЛОКАЦИЯ- UU ДВОЙНАЯ ЛООптрисомия 2п«60,«1/29+1+29 8 2 -ТРАНСЛОКАЦИЯ- UU ТЕТРАСОМИЯ (Х/ло 2п=60, «1/29+29+29 ^4 2 -ТРАНСЛОКАЦИЯ- {J(J ТРИСОМИЯ । ООп ! 2n»59,tt1/29+29 20 ГЕТЕРОЗИГОТА 2n=59,t1/29 26 ТРАНСЛОКАЦИЯ- w моносомия- ()по ТРИСОМИЯ 2n=59,t1/29-1+29 32 ТРАНСЛОКАЦИЯ— U. ТРИСОМИЯ (л/оо 2п«60,11/29+29
Но 1 2 -ТРАНСЛОКАЦИЯ- (Jly ТЕТРАСОМИЯ (Ш) 2п=60,«1/29+1+1 7 2 -ТРАНСЛОКАЦИЯ- 'уи ДВОЙНАЯ ии0пТРИСОМИЯ 2п=60, «1/29+1+29 [13 2-ТРАНСЛОКА- иц ция- ТРИСОМИЯ ! 2п»59,П1/29+1 19 ТРАНСЛОКАЦИЯ- |U__ ТРИСОМИЯ- '1 К У1 МОНОСОМИЯ 2п=59, «1/29+1-29 25 ГЕТЕРОЗИГОТА fog 2n=59,t1/29 31 транслокация- tan™ 2п=60,«1/29+1
(АРИОТИП Ж □С С с 0п
/UHlOHdVM •Я 1 3 W V J
Рис. 36. Кариотипы потомства, образуемые при скрещивании быков и коров гетерозиготных носителей робертсоновской
транслокации 1/29 хромосом (2л = 59.Д/29)
ГЕННЫЕ МУТАЦИИ
По характеру действия генные мутации могут быть доминант-
ными или рецессивными. Чаще мутантный ген обладает рецессив-
ным эффектом. Нормальный аллель подавляет при этом дейст-
вие измененного гена. По характеру влияния мутантных генов на
контроль биосинтеза белков и ферментов выделяют пять типов
мутаций: литоморфные, гиперморфные, антиморфные, неоморф-
ные и аморфные.
Если ген мутирует в рецессивное состояние, то для мутантно-
го аллеля чаще всего характерно уменьшение количества того же
самого биохимического продукта, синтез которого определяется
исходным доминантным аллелем данного гена. Такие мутации
называют гипоморфными. При гиперморфных генных мутациях в
отличие от гипоморфных количество биохимического продукта,
синтезируемого под контролем данного гена, не уменьшается, а
увеличивается. К антиморфным генным мутациям относятся му-
тации, при которых мутантный аллель вызывает образование
продукта, тормозящего синтез или действие продукта исходного
аллеля этого гена. Неоморфные генные мутации характеризуются
тем, что мутантный аллель определяет синтез в организме биохи-
мического продукта, отличающегося от продукта, специфичного
для исходного немутантного аллеля и не взаимодействующего с
этим продуктом. Иногда в организме в результате данной мута-
ции перестает вырабатываться продукт, характерный для данного
гена, т. е. ген полностью инактивируется. Такая мутация называ-
ется аморфной.
Генные мутации могут представлять дефекты репликации,
спирализации, репарации ДНК, постгрансляционные нарушения
синтеза структурных белков и т. д.
Молекулярный механизм и причины возникновения генных му-
таций. Изучение молекулярной природы генных мутаций пока-
зало наличие в структуре ДНК следующих типов изменений,
соответствующих участкам отдельных генов: 1) замена (транзи-
ции и трансверсии) одних нуклеотидов на другие; 2) вставка или
добавление отдельных нуклеотидов в цепочку ДНК; 3) деления
(потеря) отдельных нуклеотидов; 4) делеции групп оснований; 5)
инверсия — поворот на 180° отдельных оснований; 6) транспози-
ции — перенос пар оснований внутри гена на новое место.
По характеру влияния на процессы транскрипции и трансля-
ции выделяют три основные категории генных мутаций:
1)миссенс-мутации (транзиции, трансверсии). Возни-
кают при замене нуклеотида внутри кодона. Это приводит к
вставке на определенном месте в цепи полипептида иной амино-
кислоты. В результате может измениться физиологическая роль
белка, что создает фон для действия естественного отбора;
2) нонсенс-мутации (транзиции, трансверсии) — по-
164
явление внутри гена концевых кодонов за счет замены отдель-
ных оснований в пределах кодонов. В результате процесс транс-
ляции обрывается в месте появления терминального кодона;
3) мутации сдвига рамки чтения. Возникают
при появлении внутри гена вставок оснований и делеций. Это
приводит к изменению смыслового прочтения информации гена
в процессах синтеза белка вследствие новых комбинаций основа-
ний в триплетах, так как триплеты после выпадения или вставки
приобретают новый, состав кодона из-за сдвига на одно основа-
ние. В результате вся цепь полипептида после генной мутации в
ДНК получает иные аминокислоты. Мутации, возникающие у
животных, имеют разную судьбу. Часть прямых мутаций может
нивелироваться обратными изменениями генов. В результате об-
ратных мутаций полностью или частично восстанавливается ак-
тивность мутантного гена. Обратные мутации возникают редко.
Распространение мутации в породе или популяции животных
определяется характером ее действия на биологические или хо-
зяйственные признаки животных. Мутации могут быть полез-
ными, нейтральными и вредными. Так, у овец кара-
кульской породы основной окраской шерсти является черная.
Однако в результате мутаций появляются животные с целой
гаммой расцветок. Шкурки ягнят цветной окраски на мировом
рынке ценятся высоко. Поэтому ученые и специалисты стремят-
ся создать целые стада с цветной окраской шерсти. В зверовод-
стве за счет мутаций получены разных окрасок норки, песцы и
лисицы.
Мутации могут затрагивать участки ДНК, ответственные как за
качественные, так и за количественные признаки. Однако мута-
ции генов, ответственных за проявление количественных призна-
ков, труднее улавливать, так как одинарный ген количественного
признака обладает слабовыраженным эффектом в отличие от
гена, обусловливающего качественный признак. Некоторые мута-
ции существенно не влияют на хозяйственные признаки, их отно-
сят к категории нейтральных; например у черно-пестрого скота
иногда рождаются красно-пестрые телята.
В основном мутации — явление вредное. Они вызывают урод-
ства и различные аномалии у животных (подробно примеры
таких мутаций приведены в последующих главах).
Понятие о мутабильности генов. Гены-мутаторы. Исследова-
ния, проведенные на мухе-дрозофиле и других объектах, указы-
вают на различия по частоте мутаций в разных хромосомах. По
данным Н. П. Дубинина, частота возникновения летальных му-
таций в Х-хромосомах дрозофилы составляет в среднем 0,15 % за
поколение; в Y-хромосоме — 0,5 %. Мутация гена, обусловли-
вающая желтый цвет мухи, возникает с частотой 0,29 на 10 тыс.
гамет, а мутации вырезки на крыльях — 1,5. Таким образом,
способность к мутациям у отдельных генов различна.
165
На дрозофиле, бактерии кишечной палочки и других организ-
мах показано наличие генов, ускоряющих спонтанную частоту
мутаций в других генах. Эти гены получили название генов-му-
таторов. Впервые существование гена-мутатора широкого дейст-
вия обнаружил у мухи-дрозофилы Г. Г. Тиняков в 1939 г. Пола-
гают, что гены-мутаторы воздействуют на определенные этапы
репликации ДНК, например на нарушение нормального синтеза
азотистых оснований, изменение свойств ДНК-полимеразы.
Причины и факторы спонтанного мутагенеза. В обычных или
естественных условиях среды возникновение мутаций носит как
бы случайный характер. Действительно, и у самых опытных ма-
шинисток иногда обнаруживают ошибки при перепечатывании
текстов, которые могут быть растиражированы в миллионах эк-
земпляров газет или книг. Подобно этому не исключается «опе-
чатка» при самокопировании или репликации ДНК в одной
клетке, которая может стать достоянием целого клона дочерних
клеток4иш, если мутантная клетка половая, унаследована всеми
клетками потомка.
Спонтанный мутационный процесс зависит как от внутрен-
них, так и от внешних (абиотических и биотических) факторов.
Среди абиотических факторов наибольшее значение имеют есте-
ственный фон радиации, различные химические соединения, по-
павшие в биосферу.
Замечено, что мутации чаще встречаются у растений и живот-
ных в районах с повышенной естественной и искусственной
(техногенной) радиоактивностью.
Частота возникновения спонтанных мутаций зависит от гено-
типа, возраста, физиологического состояния организма и т. д. У
старых самок ожидаются более частые случаи нерасхождения,
хромосом при созревании яйцеклеток. При длительном хранении
гамет с большей частотой могут происходить изменения в ДНК.
Это вероятно при нарушении сроков осеменения животных.
ИНДУЦИРОВАННЫЙ МУТАГЕНЕЗ
Раньше считали, что мутации возникают только под действи-
ем внутренних факторов (внутренней среды организма), имею-
щих место при синтезе ДНК, репродукции хромосом, делении
клеток. Ошибки, или «опечатки», в строении генетического ма-
териала, казалось бы, не зависели от условий внешней среды.
Действительно, первые попытки вызвать мутацию искусственно
были безуспешными. Однако уже в 1925 г. Г. А. Надсон и
Г. С. Филиппов наблюдали широкий спектр мутаций у грибов,
вызванных воздействием лучами радия.
Широкий интерес у биологов вызвали сообщения Г. Меллера
(1927), обнаружившего мутационное действие рентгеновых лучей
у дрозофилы. В дальнейшем у нее при облучении стали получать
166
самые разнообразные мутации, что способствовало изучению
строения генетического материала, взаимодействия мутантных
генов и др. В начале 30-х годов В. В. Сахаров, М. Е. Лобашов
открыли мутагенное действие отдельных химических веществ.
И. А. Рапопорт в России и Ш. Ауэрбах в Англии обнаружили хи-
мические соединения с сильным мутагенным действием. В ряде
работ, начало которых, очевидно, положено С. М. Гершензоном,
открывшим мутагенный эффект при включении экзогенной ДНК
в геном дрозофилы, показана возможность индуцирования ген-
ных и хромосомных мутаций у животных биологическими агента-
ми, среди которых вирусы, бактерии и другие объекты.
Роль репарирующих систем в мутационном процессе. Повреж-
дения в ДНК, возникающие спонтанно или индуцирование, не
всегда реализуются в виде мутаций. Часть из них устраняется
или исправляется с помощью специальных репарирующих фер-
ментов, содержащихся в клетках. Известно несколько основных
механизмов репарации:
1) фоторепарация (фотореактивация). Процесс протекает под
влиянием видимого света и фотореактивирующего фермента;
2) репарация в молекуле ДНК путем механизма «вырезание —
застройка» (темновая репарация);
3) эксцизионная (пререпликативная) репарация;
4) репарация однонитевых разрывов в ДНК при действии
лигаз;
5) пострепликативная, или рекомбинационная, репарация.
Наиболее изучены первые два механизма репарации. Так, ме-
ханизм фоторепарации заключается в устранении видимым све-
том димеров тимина, часто возникающих под действием ультра-
фиолетовых лучей. Это происходит с помощью особого фоторе-
активирующего фермента. Видимый свет активирует молекулу
фермента, она отделяется от димера тимина и разъединяет его на
два отдельных тимина. Так восстанавливается нормальная струк-
тура ДНК.
Темновая репарация протекает с помощью нескольких фер-
ментов, под действием которых последовательно происходят
надрезание, выщепление, расширение бреши, репаративная реп-
ликация и сшивание концов молекулы ДНК (рис. 37). Эти два
механизма репарации устраняют дефекты в ДНК в основном до
стадии репликации.
Изучен механизм удаления (эксцизии) измененных участков
ДНК у мутантов с дефектами систем репарации. Это происходит
следующим образом (В. А. Ратнер, 1983):
1) при утрате основания. Утрата основания может быть вос-
полнена по комплементарной матрице либо ферментом инверта-
зой, либо путем разрыва дефектной цепи (инцизия), вырезания
фрагмента репарационной застройки бреши и замыкания связи;
2) при замене, модификации основания и структурном дефек-
167
5’ З'ОН
I | I I I I I I I I I I I ГГ I I I I I I I ITT г
I n L1.I I 1 1 11 I I I 1 I I I L-1 1 I I I 1 I
hv
. | I I l| I I I Г I I Ж I I I I I 1 I 1 I I I
’ I I I I I I I I I_I I I I IL I I I I .-U.
f ЭНДОНУКЛЕАЗА
—i i i i i i ж-1 i rn i । । । ,_
i । i i i i_______। i । । । । i i i
ЭНДО- ИЛИ ЭКЗОНУКЛЕАЗА
ЭКЗОНУКЛЕАЗА ---------
Рис. 37. Схема темноаой ре-
парации (по В. Н. Сойферу):
« — исходная ДНК; б— повреж-
денная ДНК; в — репарированная
ДНК; /—надрезание; //—вы-
щепление; /// — расширение
бреши; /И—репаративная репли-
кация; И—сшивание концов
те. Дефект основания
и структурный дефект
репарируются одина-
ковыми механизмами:
а) одноцепочным раз-
рывом вблизи дефект-
ного фрагмента специ-
фичной эндонуклеа-
зой; б) эксцизией
дефекта экзонуклеа-
зой; в) "застройкой
бреши репарационной
ДНК-полимеразой и г)
замыканием фосфоди-
эфирной связи лига-
зой.
Поврежденные, на-
пример, ультрафиоле-
товыми лучами моле-
кулы ДНК могут реп-
лицироваться и производить такие же поврежденные участки
ДНК. Однако после репликации количество поврежденных
участков ДНК уменьшается вследствие замены их фрагментами,
взятыми от неповрежденных молекул.
Процесс пострепликативной репарации выражен не только
после облучения ультрафиолетовыми лучами, но и после воздей-
ствия химическими мутагенами.
Спонтанные и индуцированные мутации фиксируются в клет-
ках в случаях повреждений в системах репарирующих ферментов.
Первичные мутационные повреждения систем репарации и свя-
занных с ними систем репликации и рекомбинации, возникшие
в результате ошибок ферментов, получили название ошибок ре-
параций. Этот источник составляет существенную долю спонтан-
ных первичных повреждений. Многие мутагены действуют не
прямо на ДНК, а через компоненты систем репарации, реплика-
ции и рекомбинации (В.А. Ратнер, 1983).
Установлены генетические различия в активности репарирую-
щих систем ферментов, направленных против разрушающего
действия мутагенов.
168
Однократное действие мутагенов может быть зафиксировано в
ряде поколений клеток. Такое явление продленного мутагенеза
носит название реплицирующей нестабильности. Причинами гене-
тической нестабильности, по мнению Н. П. Дубинина, могут
быть структурные мутации хромосом, действие генов-мутаторов
и др.
Естественные механизмы защиты живых организмов от дейст-
вия мутагенных факторов можно усилить искусственно создан-
ными человеком специальными протекторами, или антимутаге-
нами.
ПРОБЛЕМЫ ЭКОЛОГИЧЕСКОЙ ГЕНЕТИКИ ЖИВОТНЫХ
Открытие явления индуцированного мутагенеза привело к об-
наружению целого ряда факторов, веществ и агентов, способных
изменять наследственный материал клеток. В соответствии с их
природой их подразделяют на три класса мутагенов: физические,
химические и биологические.
1. Физические мутагены. Основными мутагенами
этого класса являются ионизирующие излучения, ультрафиолето-
вые лучи и повышенная температура. К группе ионизирующих
излучений относят рентгеновы лучи, у-лучи и р-частицы, прото-
ны, нейтроны и другие факторы.
Ионизирующие излучения, проникая в клетки, на своем пути
вырывают электроны из молекул, что приводит к образованию
положительно заряженных ионов. Освободившиеся электроны
присоединяются к другим молекулам, которые становятся отри-
цательно заряженными. В результате облучения клеток образу-
ются свободные радикалы водорода (Н) и гидроксила (ОН), ко-
торые тотчас дают новые соединения, в том числе активный
пероксид водорода (Н2О2). Такие превращения в молекулах ДНК
и кариотипе в итоге приводят к изменению функций генетичес-
кого аппарата клеток, аберрациям хромосом и возникновению
точковых мутаций. Экспериментально установлено, что частота
мутаций, индуцированных ионизирующими излучениями, прямо
пропорциональна дозе радиации. Под действием ионизирующих
излучений чаще всего возникают структурные перестройки хро-
мосом и реже — генные мутации. Так, при облучении морских
свинок и домашних свиней И. Л. Гольдман и С. Фотиева обна-
ружили различный спектр аберраций хромосом.
Транслокации и инверсии наблюдали в соматических клетках
поросят, полученных при осеменении свиноматок облученной
спермой. Опыты показывают, что при облучении половых клеток
часть их оказывается совсем нежизнеспособной или с умеренны-
ми нарушениями. Из последних образуются зиготы, которые
обычно скоро отмирают вследствие сильных изменений в гено-
типе («доминантные летали»).
169
В опыте Фриса и Странцингера у свиноматок, осемененных
облученной спермой при дозе 600 Р, было в среднем 7,7 поро-
сенка, а при дозе 800 Р — 5,4 против 9,7, полученных при осеме-
нении нормальной спермой.
Ионизирующие облучения могут нарушить процессы деления
в соматических клетках, вследствие чего возникают нарушения и
злокачественные образования. Сильное облучение может вызвать
смерть.
Источником радиации могут быть прежде всего излучения,
возникающие при взрывах атомных и водородных бомб.
2. Химические мутагены. Это вещества химической
природы, способные индуцировать мутации. Выраженными му-
тагенными свойствами обладают отдельные химические вещест-
ва, используемые в промышленности и сельском хозяйстве. К
наиболее сильным из них относят алкилирующие соединения
(диметил- и диэтилсульфат, иприт и его производные, нитрозо-
метил и нитрозоэтилмочевину, этилметансульфонат, фотрин,
фосфемид). Мутагенный эффект алкилирующих соединений свя-
зан с введением в ДНК метиловых, этиловых, пропиловых и
других радикалов, в результате чего происходят реакции метили-
рования, этилирования. Сильно выраженным мутагенным эф-
фектом обладают аналоги азотистых оснований и нуклеиновых
кислот (5-бромурацил, 5-бромдезоксиуридин, 5-фтордезоксиури-
дин, 8-азогуанин, аминопурин, кофеин и др.), акридиновые кра-
сители (акридин желтый и оранжевый, 5-аноакридин, профла-
вин и др.), а также азотистая кислота, гидроксиламин, формаль-
дегид, пероксиды, уретан и т. д.
Мутагенным действием обладают пестициды, гербициды, ис-
пользуемые в агрономии для борьбы с сорными растениями и
вредными насекомыми. Мутации могут быть индуцированы ми-
неральными удобрениями, прежде всего нитратами, которые
превращаются сначала в нитриты, а затем в активные нитрозо-
амины.
Химические мутагены индуцируют как генные, так и хромо-
сомные мутации. Особенности их — аккумуляция и передача при
делении клеток в последующей генерации, более высокая частота
индуцирования генных мутаций, чем аберраций хромосом. Хими-
ческие мутагены дают широкий спектр видимых хромосомных
аберраций. Например, в экспериментах С. Ш. Исамухамедова по
изучению действия фотрина, фосфемида и проспидина на карио-
тип свиней обнаружены хроматидные и изохроматидные делеции,
а также хроматидные обмены и гэпы (бреши). Гэп —хромосомная
аберрация, заключающаяся в частичном разрушении хроматиды и
образовании ахроматического пробела, а также в отсутствии одно-
го или нескольких нуклеотидов в одной из цепей ДНК.
3. Биологические мутагены. Простейшие живые
организмы, вызывающие мутации у животных, составляют класс
170
» биологических мутагенов. К ним относятся вирусы, бактерии, а
• также гельминты, акгиномицеты, растительные экстракты и др.
f Мутагенное действие вирусов открыто генетиком Н. И. Шапиро.
Мутагенными свойствами обладают живые вакцины. Мутагенное
действие этих организмов связано с проникновением в клетки
чужеродной ДНК. Биологические мутагены вызывают широкий
• спектр мутаций в клетках животных. Например, при изучении
кариотипа клеток телят, ягнят и поросят, зараженных вирусом
свиной лихорадки, были обнаружены различные типы аберра-
ций — делении, хромосомные разрывы, фрагментация, пульвери-
зация, полиплоидия и эндоредупликация хромосом. Установле-
но, что уровень аберраций хромосом зависел от дозы и продол-
жительности действия вируса.
Исследования показывают, что многие лекарственные пре-
параты, используемые в медицине и ветеринарии (сульфанила-
миды, производные тиазинового ряда, нитрофураны и др.), обла-
дают мутагенными свойствами. Такой же эффект возможен
, вследствие использования антибиотиков, а также некоторых кор-
мовых добавок и консервантов, особенно при их передозировке.
ГЕНЕТИЧЕСКИЕ ПОСЛЕДСТВИЯ ЗАГРЯЗНЕНИЯ ОКРУЖАЮЩЕЙ СРЕДЫ
И ЗАЩИТА ЖИВОТНЫХ ОТ МУТАГЕНОВ
Последние десятилетия характеризуются интенсификацией
производственных процессов в промышленном и сельском хо-
зяйстве. В результате этого в окружающей среде — воздухе,
почве, воде — накапливаются огромные количества веществ,
часть из которых обладает мутагенной и тератогенной активнос-
тью. Среди них особое значение имеют химические мутагены —
ДДТ, гексахлорбензол и другие пестициды из класса хлорирован-
ных углеводородов, которые способны накапливаться в живых
организмах. В районах интенсивного сельского хозяйства источ-
ником мутагенов являются нитраты.
Перевод животноводства на промышленные технологии в
нашей стране сопровождался концентрацией поголовья живот-
ных на ограниченных территориях ферм и комплексов, что вы-
зывает повышение концентрации микрофлоры, в том числе воз-
будителей различных болезней.
Вирусы, непосредственно внедряясь своим генетическим ап-
паратом в геном клеток животных или через свои биологические
субстраты, обладающие антигенными свойствами, могут стать
сильным фактором индуцированного мутагенеза. Для профилак-
тики и лечения бактериальных и вирусных инфекций, инвазий
используют .инактивированные, а также живые вакцины, сыво-
ротки, широкий арсенал синтезированных фармакологических
средств, что, безусловно, дает положительный эффект. Однако
следует оценивать и побочные результаты ветеринарной терапии,
171
что может проявляться в повышении частоты нарушений хромо-
сом и ДНК в половых и соматических клетках ^самих животных,
изменениях программы развития их эмбрионов.*
Вместо повышения жизнеспособности из-за такого рода мута-
ций будут происходить ослабление резистентности, снижение
продуктивности животных и т. д.
Особенно серьезную опасность представляют химические за-
грязнения среды разведения животных. Если всего три десятиле-
тия назад основным удобрением полей был перегнивший навоз,
то сейчас в основном используют химические удобрения. Это
приводит к концентрации в кормах нитритов и нитратов, вред-
ное действие которых на организм известно. Второй фактор —
борьба с вредителями полей, садов и огородов. Она основана
также на применении химических соединений — пестицидов, ко-
торые обладают очень сильными мутагенными свойствами. От-
мечается, что большинство пестицидов устойчивы к химическо-
му и биологическому разложению и имеют высокий уровень
токсичности. Перечень вредных химических веществ, с которы-
ми контактируют животные, огромен.
В этой связи важное значение имеет экологический мониторинг
среды разведения животных, предусматривающий определение ха-
рактера и уровня химических веществ в почве, воде, кормах и теле
животных. Необходимо создание экологических карт хозяйств и ре-
гионов, на которые наносится соответствующая информация.
Авария на Чернобыльской АЭС привела к радиоактивному
загрязнению огромных территорий РФ, Украины и Белоруссии.
Возникла глобальная проблема оценки генетических последствий
этой катастрофы на различные биологические объекты, в том
числе сельскохозяйственных животных.
Нами проведен анализ хромосом у коров швицкой породы в
совхозе «Труд» Клинцовского района Брянской области. Хозяйство
относится к зоне сильного загрязнения окружающей среды радио-
нуклидами. В исследованных метафазах обнаружено 38,94 % аберра-
ций. Соотношение разных типов аберраций было следующим:
Аберрации хромосомного типа, % 63,96
В том числе парные фрагменты 31,54
ацентрические кольца 9,90
кольцевые хромоеомы 19,81
дицентрические хромосомы 2,71
Аберрации хроматидного типа, % 36,04
В том числе одиночные фрагменты 7,25
межхромосомные обмены 23,42
межхроматидные обмены 5,37
Радионуклиды, как отмечено выше, сами по себе являются
мощным фактором индукции мутаций, прежде всего повреждая
целостность хромосом и вызывая аберрации.
172
Но оказалось, что они при взаимодействии с химическими му-
тагенами способны усугублять ситуацию. Во НИИ ветеринарной
генетики и селекции (НИИВГиС) проводятся комплексные иссле-
дования по эколого-ветеринарной генетике. Это раздел ветеринар-
ной генетики, изучающий влияние различных экологических фак-
торов на наследственность животных, устойчивость к заболевани-
ям, сопряженную эволюцию микро- и макроорганизмов,
генетическую обусловленность накапливать или выводить из орга-
низма вредные вещества, генетически детерминированные реакции
животных на лекарственные препараты и т. д. Одна из задач эко-
лого-ветеринарной генетики — селекция животных на устойчивость
к вредным физическим, химическим и биологическим факторам.
Сотрудники НИИВГиС установили негативное влияние радиации
и химических загрязняющих веществ на хромосомную нестабиль-
ность, иммунный ответ к некоторым антигенам, гормональный
статус и накопление химических элементов в тканях крупного
рогатого скота. Проводится цитогенетический, иммуногенетичес-
кий, иммунологический, химический и биохимический монито-
ринги популяций сельскохозяйственных животных в экологически
чистых и загрязненных районах Западной Сибири.
Неблагоприятная экологическая среда, характеризующаяся
возрастанием уровня ионизирующей радиации, интенсивным
ультрафиолетовым излучением и особенно действием токсичес-
ких химических соединений, которыми сейчас в ряде регионов
перенасыщены воздух, вода, почва и растения, повышенная кон-
тактность животных с ретровирусами приводят к снижению
уровня иммунитета и увеличению нестабильности генетического
аппарата животных. Это может проявляться в форме образова-
ния мобильных генетических элементов, способных к трансфор-
мации в вирусы иммунодефицита — СПИДа у человека и анало-
гичные им у животных.
Ученые подчеркивают, что проблема СПИДа (и родственных
ему заболеваний, вызываемых ретровирусами — автономными
генами, которые во многом сходны с вирусом иммунодефицита
у человека) — это совершенно новая биологическая ситуация, с
которой начинается широкое распространение приобретенной
генетической патологии. При этом резкое ухудшение экологи-
ческой ситуации можно считать ведущей причиной того, что
именно во второй половине XX в. стали выходить из-под кон-
троля процессы образования подвижных генов.
Методы эколого-генетического мониторинга в животноводстве.
Увеличение частоты ранее известных или появление новых мутаций
в последующих поколениях животных — показатель возрастающего
действия мутагенов среды. В условиях конкретной экологической
среды разведения животных важное значение имеет определение
мутагенной активности как отдельных факторов, так и всего их
комплекса. Здесь речь может идти о генетической активности лекар-
173
ственных препаратов, применении нетрадиционных кормовых до-
бавок, гормональных обработок животных. Главное внимание,
очевидно, должно уделяться анализу влияния на стабильность ге-
нома того или иного уровня загрязнения окружающей среды.
В настоящее время рекомендуется использовать следующие
тесты генетической активности веществ: 1) генные мутации; 2)
хромосомные аберрации; 3) обмены между сестринскими хрома-
тидами; 4) микроядерный тест и др.
Для оценки частоты новых и старых возникших ранее (гене-
тический груз) мутаций рекомендуется использовать цитогенети-
ческий метод, анализ мономорфных систем белков, учитывать
частоту врожденных аномалий, спонтанных абортов и мертво-
рождений, соотношение полов в потомстве животных. Образова-
ние хромосомной аберрации или необычного типа белка, кото-
рых не было у родственных животных, служит доказательством
вновь образовавшейся мутации.
Анализ, частоты сестринских хроматидных обменов в лимфо-
цитах крови дает возможность установить наличие генетической
активности при воздействии на организм того или иного химичес-
кого агента. Этот метод в 1972 г. предложили А. Ф. Захаров и
Н. А. Еголина. Сущность его состоит в том, что в культивируемые
in vitro лимфоциты, стимулированные для прохождения митозов
фитогемагглютинином, вводят аналог тимидина 5-бромдезокси-
уридин (БДУ). В зависимости от времени его добавки в среду
(первый или второй клеточный цикл) он включается в одну или
обе сестринские хроматиды. При соответствующей обработке пре-
паратов и использовании красителя Гимзы под микроскопом
можно видеть хромосомы с одной окрашенной (БДУ включился)
и с другой неокрашенной хроматидами. В отдельных хромосомах
наблюдают дифференциальную окраску хроматид — чередование
темных и светлых участков. Это значит, что произошли измене-
ния, т. е. обмены между сестринскими хроматидами (СХО). Вы-
сокая частота СХО свидетельствует о мутагенном действии изуча-
емого вещества, с которым контактировали клетки крови.
Этот метод дополняют анализом частоты разрывов хромосом,
других аберраций, полученных от тех же животных, но лучше
при сплошной окраске.
В последнее время предложен еще один чувствительный
метод выявления мутагенности факторов среды — так называе-
мый микроядерный тест. Дело в том, что дополнительные ма-
ленькие ядра (микроядра) на окрашенных мазках крови образу-
ются за счет целых хромосом или их фрагментов, которые при
делении не включаются в основное ядро из-за повреждений.
Наблюдается возрастание числа микроядер в эритроцитах млеко-
питающих при воздействии мутагенов. Для этих же целей аде-
кватные результаты может дать анализ частоты нерасхождений
хромосом в клетках костного мозга на стадии анафазы.
174
Возрастание частоты злокачественных новообразований, в том
числе и лейкозов у человека и животных, ученые обоснованно
связывают с загрязнением окружающей среды. Установлено, что
многие мутагены одновременно являются и канцерогенами —
факторами, ведущими к злокачественной трансформации клеток.
Следовательно, распространение в среде разведения животных
генетически активных агентов может приводить не только к
повышению частоты мутаций, но и к возрастанию частоты зло-
качественных новообразований.
Эта проблема в ветеринарии — одна из актуальных и очень
непроста для решения. Исследования ученых показали существо-
вание РНК-содержащих или ретровирусов, способных при ин-
фекции встраиваться в геном клеток животных и нарушать их
генетическую программу. С другой стороны, в нормальных клет-
ках млекопитающих признано существование участков ДНК,
сходных по строению с РНК ретровирусов. Это так называемые
протоонкогены, принимающие участие в контроле клеточного
цикла. Последние, как полагают ученые, превращаются в онкоге-
ны, что приводит к нарушению их экспрессии и развитию раково-
го процесса. Толчком этого события могут быть вирусные инфек-
ции, действие на организм физических и химических мутагенов.
Генетическая резистентность организмов при этом имеет зна-
чение. Одни животные остаются только инфицированными рет-
ровирусами, что обнаруживают по реакции иммунодиффузии или
с помощью ДНК-зондирования, у других вскоре развивается лей-
коз или другая форма рака. Для выявления устойчивости живот-
ных к лейкозам важное значение имеет оценка стабильности ге-
нома. Одними из таких критериев могут быть частота полиплои-
дии, разрывов хромосом, изменчивость хромоцентров. По нашим
данным, последний показатель у крупного рогатого скота, пред-
расположенного к лейкозу, достоверно отличается от нормы.
АНТИМУТАГЕНЫ
Важная особенность антимутагенов — стабилизация мутацион-
ного процесса до естественного уровня. Вещества с антимутаген-
ными свойствами характеризуются способностью с различной
степенью эффективности снижать уровни мутабильности. Им при-
суща такая характеристика, как физиологичность действия. Дело в
том, что, проявляя антимутагенные свойства в низких концентра-
циях, некоторые из этих веществ в высоких дозах могут действо-
вать как мутагены, например аргинин, глутаминовая кислота, си-
линит натрия, стрептомицин, производные галловой кислоты.
Как показали наши исследования, передозировка витамина
Di при добавке его быкам привела к нарушению спермиогенеза.
Генотоксическое действие выражалось в азоспермии и некро-
спермии. Нами также установлено, что гипервитаминоз D стал
175
причиной развития врожденной аномалии у крупного рогатого
скота, получившей название «синдром гиены». У этих животных
отмечено повышение уровня аберраций хромосом и сестринских
хроматидных обменов. Вместе с тем повышение концентрации
других антимутагенов (токоферола, каротина, филлохинона и
др.) не изменяет их действия.
Отдельные мутагены характеризуются специфичностью дейст-
вия — они эффективны только по отношению к аберрациям хро-
мосом или генным мутациям.
Механизм действия антимутагенов связывают с нейтрализа-
цией мутагена до его взаимодействия с ДНК; предотвращением
образования в процессе метаболической активности мутагенных
продуктов из нетоксичных предшественников; активацией фер-
ментных систем детоксикации поступающих из среды загрязни-
телей; предотвращением ошибок в процессе репликации ДНК;
активацией репарации и других внутриклеточных систем поддер-
жания целостности генетического аппарата.
Установлено, что способностью снижать частоту мутаций обла-
дают более 200 природных и синтетических соединений. Одна из
наиболее изученных групп антимутагенов — витамины и провита-
мины. Так, витамин Е (токоферол) в значительной степени снижа-
ет мутагенное действие ионизирующих излучений и химических
соединений, а также блокирует генотоксическое действие вирусов.
Хорошо изучен другой жизненно важный антимутаген — вита-
мин С (аскорбиновая кислота). Введение этого витамина в раци-
он способствует уменьшению частоты аберраций хромосом, вы-
званных ионизирующими излучениями.
Витамин А (ретинол) и его предшественник — каротин, со-
держащийся в растениях, снижают естественное и искусственное
мутирование в клетках у животных, особенно вызванных дейст-
вием промышленных загрязнений.
Известны также антимутагенные свойства витамина Ki (фил-
лохинона). Животные, получающие в дополнение к обычному
рациону филлохинон, лучше противостоят генотоксическому
действию различных мутагенов промышленного происхождения.
Экспериментально показано антимутагенное действие пара-
аминобензойной кислоты — предшественника фолиевой кислоты
(витамина В), введение которой приводило к снижению дейст-
вия алкилирующих соединений, ультрафиолетового и гамма-об-
лучения путем усиления репарации.
Вторая группа соединений с выраженными антимутагенными
свойствами — это отдельные аминокислоты (аргинин, гистидин,
метионин, цистеин и др.).
Третью группу антимутагенов составляют некоторые ферменты
(пероксидаза, НАДФ-оксидаза, глутатиолпероксидаза, каталаза и
ДР-)-
К четвертой группе антимутагенов можно отнести отдельные
176
фармакологические средства (интерферон, сульфаниламиды, гек-
самидин, препараты фенотиазивного типа и др.).
Среди антимутагенов выделяют большую группу веществ, об-
ладающих антиокислительными свойствами (производные галло-
вой кислоты, ионол, оксипиридины, дигидропиридины и др.), а
также группы комплексных соединений, входящих в состав раз-
личных продуктов растительного и животного происхождения.
Таким образом, накопление мутагенов в биосфере поставило
перед человечеством серьезную задачу разработки методов и под-
ходов по защите генетического аппарата (ДНК) как самого чело-
века, так и многочисленных форм и сообществ живой материи,
обитающих на Земле. В противном случае мутационные измене-
ния могут привести к самым тяжелым последствиям, вплоть до
полного вымирания видов. Основные пути снижения концентра-
ций вредных веществ в биосфере следующие: создание безотход-
ных технологий, замкнутых циклов производства в промышлен-
ности; переход от химических средств борьбы в сельском хозяйст-
ве на безвредные биологические; создание устойчивых сортов
растений, не требующих химических средств защиты, или без-
опасных с генетической точки зрения пестицидов; повышение
естественной резистентности животных путем биологизации тех-
нологий кормления и содержания, выращивания молодняка; пле-
менная работа, направленная на создание генетически устойчи-
вых к болезням пород, линий, гибридов. Это будет ограничивать
применение фармакологических средств, а также вакцин и сыво-
роток. В перспективе все более широкую основу могут иметь
узконаправленные вакцины, полученные генно-инженерным
путем; выявление мутагенов в окружающей среде и их изъятие
(компонентный подход). Хотя это и непросто, однако этот путь
тоже будет применяться для снижения их воздействия на геном
животных. Использование антимутагенов для снижения темпов
мутирования, так называемый компенсационный подход, — наи-
более реальное средство для защиты ДНК от необратимых изме-
нений.
В селекционном плане актуальными задачами становятся вы-
явление животных с нестабильными геномами и их браковка и
отбор для воспроизводства особей со стабильными малочувстви-
тельными к экстремальным факторам среды геномами.
Контрольные вопросы. 1. Что такое мутации и мутагенез? 2. Какие мутации
наследуются и какие нет? 3. Каковы классификация и определения разных типов
числовых и структурных аберраций хромосом? 4. Каковы возможные причины и
механизмы образования хромосомных мутаций? 5. В чем состоит молекулярный
механизм генных мутаций и характер их влияния на биосинтез белка? 6. Что
такое спонтанные и индуцированные мутации? 7. Какова роль репарирующих
систем в мутационном процессе?
Г л а в a 11
ГЕНЕТИЧЕСКИЕ ОСНОВЫ ОНТОГЕНЕЗА
Онтогенез — непрерывный процесс количественных и качествен-
ных изменений, происходящих в организме в течение всей жизни при
постоянном взаимодействии генотипа и условий среды.
Термины «онтогенез» и «филогенез» ввел в биологию немец-
кий зоолог Е. Геккель. Он же сформулировал и обосновал (1866)
биогенетический закон. Термин «онтогенез» означает процесс
индивидуального развития особи, «филогенез* — история разви-
тия вида. Согласно биогенетическому закону индивидуальное
развитие особи (онтогенез) является как бы кратким повторени-
ем (рекапитуляцией) филогенеза. А. Н. Северцов считает, что
под филогенезом следует понимать ряд исторически отобранных
онтогенезов. Филогенез реализуется в онтогенезе через наследст-
венность, составляет основу онтогенеза и направляет онтогенез
по пути, пройденному предками. В зиготе (оплодотворенной
яйцеклетке) содержится записанная в структуре молекул ДНК
генетическая информация о развитии будущего организма. В
процессе онтогенеза происходит реализация генетической ин-
формации в определенных условиях среды.
Онтогенез животных включает два основных взаимосвязанных
процесса — рост и развитие. Под ростом понимают процесс увели-
чения размеров организма, его массы, происходящий за счет на-
копления в нем активных, главным образом белковых, веществ. В
основе роста лежит увеличение числа и размеров клеток и некле-
точных образований. Под развитием понимают качественные из-
менения — процессы усложнения структуры организма, специали-
зацию, дифференциацию и интеграцию его органов и тканей.
Одна из основных проблем биологии — выяснение вопроса:
каким образом из одной-единственной клетки возникает множе-
ство разнообразных типов клеток, значительно различающихся
между собой строением, функцией, и как в процессе онтогенеза
идет становление признаков и свойств организма? Проблема
изучения механизма генетического контроля онтогенеза имеет не
только теоретическое, но и практическое значение для успешно-
го решения таких вопросов, как селекция животных и растений,
профилактика и лечение генетически обусловленных болезней у
животных и человека.
178
РАСКРЫТИЕ СЛОЖНОЙ СТРУКТУРЫ ГЕНА
В соответствии с представлениями классической генетики
долгое время считалось, что ген — неделимая единица функции,
рекомбинации и мутирования. Гены представлялись как бусин-
ки, механически соединенные каким-то материалом в хромосо-
ме. Вопрос о пересмотре представлений о гене как неделимой
единице впервые был поставлен в 1929—1930 гг. А. С. Серебров-
ским с corp. Они изучили мутации гена scute (скьют), влияюще-
го на развитие щетинок на теле дрозофилы, и обнаружили явле-
ние ступенчатого аллелизма. Было выявлено 14 мутаций гена
scute: SCi, SC2, SC3. и т. д. Мутации отличались друг от друга
редукцией щетинок на определенных участках тела: в одном
случае не было щетинок на голове и предгруди, в другом — на
предгруди и груди и т. д. Мы уже знаем, что при скрещивании
особей с разными аллельными генами у потомков имеет место
доминирование одного из них. В случае же серии аллелей гена
scute у гетерозиготных особей был обнаружен частичный возврат
к норме. У гетерозиготных потомков не развивались только те
щетинки, которых не было у обоих родителей. Щетинки разви-
вались нормально, если изменение наблюдалось только в одном
из аллельных генов. Если, например, мутация SCi вызывала
редукцию щетинок АВС, а мутация SC2 — редукцию щетинок
BCD, то у гетерозиготы отсутствовали щетинки В и С и развива-
лись нормально А и D. При графическом изображении взаимо-
действия несколько пар аллеломорфов получается как бы лест-
ница, ступенями которой служат отдельные аллели гена scute
(скьют): SCi - ABC; SC2 - BCD; SC3 - CDE.
Это явление получило название ступенчатого аллеломорфизма.
Было показано, что ген не является единицей мутации, он дро-
бим и имеет сложную структуру.
На основании проведенных исследований была сформулиро-
вана центровая теория гена. Согласно ей ген состоит
из отдельных функциональных участков — центров, которые
могут независимо изменяться при мутациях.
Глубокие исследования тонкой структуры генов фага Т4, по-
ражающего кишечную палочку, были проведены американским
генетиком С. Бензером. Дикий тип фага Т4 лизирует разные
штаммы кишечной палочки, в том числе штаммы В и К. При
этом в бактериальных культурах наблюдается появление мелких
стерильных пятен. При посеве фага на штамм В были обнаруже-
ны и отобраны мутанты фага, названные rl 1 (г — от англ, rapid,
lysis — быстрый лизис), образующие крупные стерильные пятна
(по сравнению с фагом дикого типа) и не способные размно-
жаться на штамме К (не образуют стерильных пятен). Для ана-
лиза выявленных мутантов С. Бензер разработал тест на компле-
ментарность, который заключается в следующем: если бактерии
179
штамма К заразить смесью двух разных мутантов rl 1 и это не
приведет к лизису клеток штамма К, значит,* мутации у обоих
фагов затрагивают одну и ту же функцию и произошли в одном
и том же гене. Если же при совместном заражении восстанавли-
вается дикий тип, т. е. произойдет лизис клеток штамма К,
значит, мутации комплементарны и произошли в разных генах.
С. Бензер исследовал попарно очень большое число мутантов rl 1
и установил, что они принадлежат к двум функциональным
группам: А и В. Любой из мутантов группы А комплементарен
любому из мутантов группы В, в то же время два мутанта,
относящиеся к одной и той же группе А или В, некомплементар-
ны, они затрагивают одну и ту же функциональную единицу, и в
этом случае сохраняется мутантный фенотип. Наличие двух
классов мутантов привело к выводу о существовании двух функ-
циональных единиц в пределах г11 генома фага Т4. Каждая из
этих единиц связана, очевидно, с синтезом специфического
полипептида, необходимого для роста на штамме К. Генетичес-
кая единица функции, выявленная с помощью теста на компле-
ментарность, была С. Бензером названа цистроном. В настоящее
время термин «цистрон» используется как синоним гена.
Геном называется участок молекулы ДНК (у некоторых вирусов
РНК), кодирующий первичную структуру полипептида, молекулы
транспортной или рибосомной РНК или взаимодействующий с регу-
ляторным белком.
Структурной единицей мутации и рекомбинации гена являет-
ся одна пара нуклеотидов (или один нуклеотид в случае геномов,
состоящих из одноцепочных ДНК или РНК). Для обозначения
локализации мутаций в пределах гена применяется термин
«сайт». Сайт может включать одну пару нуклеотидов, а в неко-
торых случаях, возможно, и больше. Размер генов в разных
организмах различен, однако в среднем ген включает 1500 пар
нуклеотидов. Самые короткие — гены, кодирующие тРНК. Они
включают приблизительно 190 пар нуклеотидов. Но имеются и
очень длинные гены. Например, ген фиброина шелка тутового
шелкопряда включает 16 тыс. пар нуклеотидов. Таким образом,
ген — очень сложная структура.
Установлено, что молекулярное строение генов эукариот
отличается от генов прокариот. У последних гены представляют
собой непрерывную последовательность триплетов, обеспечи-
вающих кодирование колинеарной последовательности ами-
нокислот в определенной полипептидной цепи. У эукариот
многие гены имеют мозаичную структуру. Оказалось, что
они составлены из кодирующих участков — экзонов, разде-
ленных некодирующими участками — интронами. Например,
в генах тяжелой цепи иммуноглобулинов не менее пяти
экзонов и четырех интронов, в гене овальбумина (яичного
белка) восемь экзонов и семь интронов.
180
В последние годы у прокариот обнаружены перекрываю-
щиеся гены. Так, у некоторых РНК-содержащих бактериофа-
гов Е. coli (R17 и др.) считались установленными три гена —
репликазы, белка оболочки и созревания вирусной частицы. Од-
нако был обнаружен четвертый ген, кодирующий белок L, вклю-
чающий 75 аминокислотных остатков и блокирующий лизис за-
раженной клетки. Места для этого гена на РНК не было. Слева
у гена обнаружили кодон-инициатор (АУГ), а справа — термина-
тор (УАА). Между ними расположено 75 триплетов. Оказалось,
что ген локализован частично в гене белка оболочки (47 нуклео-
тидов), 36 нуклеотидов — в межгенном интервале и 142 нуклео-
тида расположены в гене РНК — репликазы. Перекрывающиеся
гены обнаружены также в некоторых одноцепочных ДНК фагов
Е. coli и в ДНК вируса млекопитающих SV 40. Таким образом,
используются одни и те же последовательности нуклеотидов для
кодирования разных белков.
В конце 40-х годов XX в. Б. Мак-Клинток на основе генети-
ческих экспериментов на кукурузе предсказала наличие в геноме
организмов подвижных элементов — «прыгающих» генов. В
конце 60-х годов у бактерий обнаружено два основных класса
мобильных («п р ы г а ю щ и х») генов, которые различались
по длине и сложности организации: 1-й — инсерционные после-
довательности, или IS-элементы. Длина их около 1000 пар нук-
леотидов. Они содержат только один ген, ответственный за их
перемещение; 2-й — транспозоны с длиной 3000—20 000 пар нук-
леотидов. Транспозоны кроме системы транспозиции содержат
дополнительные гены, определяющие устойчивость к антибиоти-
кам, различным токсическим соединениям. В 70-х годах изучены
мобильные гены у дрозофилы, затем было выявлено, что у эу-
кариот они составляют не менее 5—10 % их генетического мате-
риала. Мобильные гены вносят в геном факторы нестабильности
и изменчивости, что может играть, по-видимому, существенную
роль в эволюции.
ВЛИЯНИЕ ГЕНОВ НА РАЗВИТИЕ ПРИЗНАКОВ
Проявление действия генов на биохимическом уровне начали
изучать в 1935 г. Бидл и Эфрусси с исследований двух рецессив-
ных мутаций окраски глаз у дрозофилы по генам vermilion
(яркие глаза) и cinnabar (киноварные глаза). У особей, гомози-
готных по этим генам, не образуется пигмент, определяющий
нормальную окраску глаз. В результате глаза отличаются от осо-
бей дикого типа. Сложные глаза дрозофилы развиваются из за-
чатка или диска, образование которого происходит на стадии
личинки. Глазной имагинальный диск можно пересадить в по-
лость тела другой личинки, где он продолжит свое развитие.
Бидл и Эфрусси произвели имплантацию эмбриональной ткани
181
дисков глаз из личинок мух с мутантными генами vermilion и
cinnabar в личинки нормальных мух-дрозофил и установили, что
после метаморфозы этих личинок в зрелых мух имплантирован-
ная ткань глаза развилась в дополнительные глаза нормальной
окраски. Отсюда был сделан вывод, что в тканях мутантных мух
не хватало какого-то вещества для синтеза нормальной окраски
глаз.
На основании опытов Бидл и Эфрусси пришли к выводу, что
образование пигмента идет по пути: предшественник — вещество
I— вещество II— пигмент. У мутанта по гену vermilion блокиро-
вана реакция, в результате которой предшественник преобразует-
ся в вещество I, а у мух с мутацией cinnabar блокирована реак-
ция, в результате которой вещество I преобразуется в вещество
II. В последующие годы было установлено, что вещество I (V+)
является кинуренином и мутация V блокирует его образование
из триптофана. Вещество II (Сп+) оказалось хромогеном — про-
дуктом февращения кинуренина. Мутация Сп блокировала ста-
дию образования кинуренина хромогена — предшественника
пигмента дикого типа. Исследования показали, что мутации в'
генах, кодирующих определенные ферменты, ведут к блокирова-
нию биохимических реакций, нарушая превращение определен-
ных веществ, что влияет на образование признака — окраски
глаз.
В 1940 г. Бидл и Татум избрали для своих исследований
новый объект — гриб хлебной плесени нейроспору. У нейроспо-
ры в результате последовательной цепи реакций из фенилалани-
на синтезируется никотиновая кислота. Было обнаружено шесть
мутаций, нарушающих нормальный ход ее синтеза. При помощи
культивирования на минимальной среде и добавлении веществ,
синтез которых был прерван мутацией, были установлены про-
межуточные продукты и порядок их образования при синтезе
никотиновой кислоты:
фенилаланин Д антраниловая кислота индол (+ серин)
триптофан \ кинуренин Д оксиантраниловая кислота никоти-
новая кислота.
Генетическое блокирование может происходить на любом из
шести этапов, для каждого из которых нужен определенный
фермент. Если у штамма нейроспоры произошла мутация на
второй стадии, то процесс синтеза заканчивался на образовании
антраниловой кислоты и шел дальше, если в среду вводили
индол, синтез которого был прерван мутацией. Если мутация
произошла на пятой стадии, то синтез обрывался на образовании
кинуренина и продолжался только при добавлении в среду окси-
антраниловой кислоты.
На основании полученных фактов Бидл и Татум предложили
теорию: один ген — один фермент — один признак. По этой теории
182
каждый ген имеет только одну первичную функцию — опреде-
лять синтез только одного фермента. Изменение в структуре
гена, кодирующего определенный фермент, ведет к его выключе-
нию. Если этот фермент не участвует в последовательной цепи
реакции, то синтез определенного вещества в организме приос-
танавливается на стадии, для которой этот фермент был необхо-
дим. При этом возникает новый признак.
Впервые связь между генами и ферментами у человека обна-
ружил Гаррод в 1902 г. При анализе родословных больных аль-
каптонурией он пришел к заключению, что эта болезнь связана
с обменом веществ и передается по наследству. Однако открытие
Гаррода было оценено только через много лет, когда было уста-
новлено, что целый ряд болезней у человека обусловлен наслед-
ственными пороками метаболизма. При изучении фенилаланин-
тирозинового обмена у человека было выявлено несколько забо-
леваний, связанных с нарушением превращения фенилаланина
до конечных веществ биосинтеза (рис. 38). Нарушения связаны с
мутацией генов, кодирующих ферменты, принимающие участие
на разных этапах метаболизма. Фенилкетонурия возникает в том
случае, когда блокируется превращение фенилаланина в тирозин.
Это ведет к увеличению фенилаланина в плазме крови, спинно-
мозговой жидкости и в моче. Исследования показали, что у
со2 ♦ н2о
Рис. 38. Схема фенилаланннтирозинового обмена у человека:
/ — фенилкетонурия (избыток фенилаланина). 2 — альбинизм; 3 — тирокетонхрия. 4 — аль-
каптонурпя (черный пигмент в моче)
183
большинства больных детей умственное развитие отстает на 70 %
и более. При альбинизме потеряна способность к образованию
меланина. Кретинизм возникает при нарушении в превращениях
тирозина. Заболевание сопровождается задержкой развития и ум-
ственной отсталостью.
Заболевание тирозинозом связано с мутацией гена, кодирую-
щего фермент, катализирующий образование гомогентизиновой
кислоты. При заболевании алькаптонурией наблюдается наруше-
ние синтеза фермента оксидазы, что ведет к накоплению гомо-
гентизиновой кислоты. Моча больных алькаптонурией на возду-
хе приобретает темную, почти черную окраску. На примере фе-
нилаланинтирозинового обмена мы видим, как одно и то же
исходное вещество (фенилаланин) под влиянием ферментов —
продуктов разных генов, претерпевает превращения в разных
направлениях, определяя в конечном итоге разные биохимичес-
кие признаки. У низших организмов путь от гена до признака
сравнительно короткий. У них наследственные признаки опреде-
ляются *Йенами, которые сосредоточены в одной клетке, и актив-
ность генов регулируется продуктами метаболизма этой же клет-
ки. У подавляющего большинства многоклеточных организмов
путь от гена до признака значительно сложнее и менее изучен.
Целый ряд исследований показывает, что характер индивидуаль-
ного развития высших организмов определяется взаимодействи-
ем многих генов, сложным взаимодействием ядра и цитоплазмы,
взаимодействиями различных клеточных систем, обладающих ак-
тивностью разных генов.
ДИФФЕРЕНЦИАЛЬНАЯ АКТИВНОСТЬ ГЕНОВ
НА РАЗНЫХ ЭТАПАХ ОНТОГЕНЕЗА
Дифференцировка клеток — процесс, при котором во время дроб-
ления оплодотворенного яйца клетки постепенно начинают отли-
чаться одна от другой, что приводит в конечном итоге к формиро-
ванию зародыша со многими специализированными тканями. Клет-
ки разных тканей одного и того же организма отличаются друг
от друга формой, размерами и строением. В то же время клетки
одинаковых тканей даже у животных разных видов имеют сход-
ство. Это связано с тем, что каждый из типов клеток специали-
зирован для выполнения только им свойственных функций. На-
пример, нервные клетки приобретают способность передать
нервные импульсы, железистые клетки — способность к секре-
ции соответствующих веществ и т. д.
Выяснение механизмов дифференцировки клеток — одна из
главных задач современной биологии. Поскольку дифференци-
ровка необратима, некоторые ученые в конце прошлого века
считали, что в ее основе лежит неравное распределение генов в
те или иные дифференцирующиеся клетки в ходе последователь-
184
ных клеточных делений. Это предположение было опровергнуто.
В начале нашего века было показано, что каждая соматическая
клетка имеет такой же набор хромосом, как и исходная оплодо-
творенная яйцеклетка. Доказательством являются специальные
опыты по пересадке ядер. Дж. Гердон (1962) разрушал ядра
яйцеклеток лягушки ультрафиолетовыми лучами и инъецировал
в энуклеированные яйцеклетки ядра дифференцированных кле-
ток кишечного эпителия плавающего головастика. Небольшой
процент таких ядер обеспечивал развитие головастиков и нор-
мальных лягушек. Опытами было показано, что ядра кишечных
клеток содержат все гены, необходимые для дифференцировки
всех типов клеток.
В последующей работе по пересадке ядер Дж Гёрдон показал,
что в течение первых десяти клеточных делений при развитии
эмбриона лягушки в ядрах не наблюдается синтеза РНК. Клетки
в этот период быстро делятся, реплицируют ДНК. Однако в
клетках идет синтез белка. Дело в том, что у животных в период
роста и созревания яйцеклетки в цитоплазме накапливается
большое количество молекул РНК, которые, соединившись с
белками-гистонами, образуют гранулы — информосомы.
Информосомы до оплодотворения яйцеклетки находятся в
неактивном состоянии. Сразу же после оплодотворения мРНК
освобождается от белков-гистонов, поступает в рибосомы цито-
плазмы яйцеклетки и начинается синтез определенных белков по
программе материнской ДНК. Поэтому начальный период разви-
тия зиготы осуществляется под контролем генов материнского
организма. С начала стадии гаструляции и в дальнейшем синтез
белка осуществляется под влиянием мРНК, образующейся в
ядрах клеток эмбриона, т. е. под контролем генов обеих роди-
тельских особей. На первых этапах исследований основными
экспериментальными объектами были иглокожие (морские ежи)
и земноводные (лягушки, саламандры), потому что у них легко
получать и оплодотворять яйцеклетки и следить за ходом эмбри-
онального развития. Лишь в последние годы разработаны при-
емы, при помощи которых появилась возможность изучать ран-
ние стадии эмбриогенеза у мышей. На рисунке 39 приведена
схема изменения активности генов в раннем эмбриогенезе ля-
гушки и мыши.
Одним из примеров дифференциальной активности генов в
период органогенеза может служить процесс формирования пуф-
фов в гигантских хромосомах дрозофилы. Гигантские хромосомы
слюнных желез являются политенными и включают до 1000
нитей. Они имеют по длине определенный рисунок. На хромосо-
мах видны диски, которые представляют собой соединение гомо-
логичных генов. Было установлено, что на определенных стадиях
отдельные диски деспирализуются и принимают форму вздутий,
получивших название пуффов. При помощи использования ра-
185
диоактивного уридина было установлено, что в пуффах происхо-
дит интенсивный синтез молекул иРНК. Разные стадии развития
личинок сопровождаются активностью определенных пуффов.
Это говорит о том, что на разных этапах развития вступают в
действие разные гены.
О неодновременной активности различных генов может сви-
детельствовать изменение состава белков организма в связи с
возрастом. На стадиях раннего эмбрионального развития у чело-
века идет образование гемоглобина F, который состоит из двух
цепей полипептидов — а и у. Приблизительно с 13 нед эмбрио-
нального развития начинается синтез гемоглобина А, характер-
ного для взрослого человека. У гемоглобина А цепь полипептида
у заменена на цепь 0 несколько иного строения. Цепь а у обоих
гемоглобинов одинакова, и ее синтез контролируется одним и
тем же геном. У новорожденного гемоглобин F составляет 70—
80 % общего количества. И только к году происходит полная
замена гемоглобина F гемоглобином А. По данным В. В. Пиль-
ко, Е. К. Меркурьевой и С. Мигле, полная замена гемоглобина
F гемоглобином А у телят происходит к 110—120-дневному воз-
расту.
Обнаружены существенные возрастные изменения в количе-
стве и составе белков сыворотки крови у телят в эмбриональный
период. По данным В. М. Холода, первый период эмбриональ-
ного развития характеризуется низким содержанием сывороточ-
ных белков (2,62 г%), затем количество их постепенно с возрас-
том плода увеличивается и к 9 мес достигает 4,44 г%. Отноше-
ние альбуминов к глобулинам возрастает с 0,40 у 2-месячного
Плода до 1,21 к моменту рождения. В постэмбриональный пери-
од также наблюдаются изменения белкового спектра сыворотки
крови. По данным А. С. Гурьяновой, у телок бурой латвийской
порода содержание общего белка сыворотки крови с 3- до 18-
месячного возраста увеличилось с 6,12 до 7,54 %, в том числе
глобулинов с 3,03 до 4,24 %.
Некоторые органы и ткани специализируются на синтезе
каких-то определенных белков, и количество РНК в них в от-
дельные периода возрастает или снижается. И. Я. Шихов изучал
содержание ДНК и РНК в вымени телок, нетелей и коров. Он
обнаружил, что отношение количества РНК к количеству ДНК
составляет в среднем у половозрелых телок 0,48, у нетелей и
коров в конце стельности 1,0, у коров в начале лактации 2,34 (с
большими колебаниями), в конце лактации 1,72. Наблюдалась
высокая степень связи (г = 0,71) между содержанием РНК в
вымени и удоем коров. Это показывает, что образование РНК
усиливается, когда в вымени коров синтезируется много белка
при высоких удоях, и снижается при уменьшении удоев.
187
ВЗАИМОДЕЙСТВИЕ ЯДРА И ЦИТОПЛАЗМЫ В РАЗВИТИИ
Б. Л. Астауров в экспериментах по межвидовому андро генезу
с тутовым шелкопрядом убедительно показал главенствующую
роль ядра в процессе индивидуального развития. Он получил
межвидовые гибриды путем осеменения яиц дикого шелкопряда
спермой домашнего шелкопряда и наоборот. Женские ядра
инактивировались с помощью теплового шока (путем прогрева-
ния). В этом случае в оплодотворении яйцеклетки участвовали
ядра двух сперматозоидов. Ядерно-цитоплазматические гибриды
получали цитоплазму от одного вида, а ядра — от другого. Раз-
вившиеся особи всегда были мужского пола и по всем изучен-
ным признакам похожи на вид, от которого они получали ядра.
Однако цитоплазма играет очень важную роль в реализации
наследственной информации и формировании некоторых при-
знаков организма. Известно, что основная часть цитоплазмы
поступает в зиготу с яйцеклеткой. Цитоплазма яйцеклетки отли-
чается dr цитоплазмы соматических клеток большим разнообра-
зием белков, РНК и других видов молекул, синтезированных в
оогенезе. Бовери, Конклин, Дриш и др. уже давно указывали на
то, что определенные участки цитоплазмы яйцеклетки могут со-
держать факторы, определяющие судьбу тех или иных дифферен-
цирующихся клеток. В результате неодинакового пространствен-
ного распределения веществ в цитоплазме яйцеклетки при дроб-
лении зиготы идет неравнозначное распределение веществ (РНК,
белков и др.) в бластомеры. На этом основании предполагалось,
что активность генов зависит от цитоплазмы, и это нашло свое
подтверждение в работах на молекулярном уровне за последние
10—15 лет. Дж. Гердон наглядно показал роль цитоплазмы в
регуляции активности генов. Он вводил ядра дифференцирован-
ных клеток в энуклеированные яйцеклетки амфибий. Функцио-
нальное состояние ядра оценивал по синтезу ДНК и РНК, что
определялось с помощью меченых предшественников. Обнару-
жено, что в ядре нейрона взрослой лягушки, введенном в акти-
вированную неоплодотворенную яйцеклетку, начинается синтез
ДНК, а синтез РНК прекращается. Отсюда следует, что в цито-
плазме яйцеклетки имеется активатор синтеза ДНК и репрессор
синтеза РНК, которые действуют независимо друг от друга. Если
ядра из клеток мозга взрослой лягушки пересадить в зрелый
ооцит, то в них синтезируется РНК и не синтезируется ДНК.
Если эти ядра пересадить в ооцит, находящийся на стадии деле-
ний созревания, то в них не происходит синтеза ни ДНК, ни
РНК. Харрис с помощью методов авторадиографии показал, что
ядро эритроцита курицы, введенное в клетку тканевой культуры
человека или мыши, реагирует на сигнал «чужой» цитоплазмы и
начинает синтез ДНК и РНК. Некоторые органоиды цитоплаз-
мы, имеющие свою систему белкового синтеза (митохондрии,
188
пластиды), могут влиять на развитие определенных признаков.
Наследование признаков через цитоплазму получило название
цитоплазматической или внеядерной наследственности. Так, у рас-
тений наследование пестролистности идет по материнской
линии и связано с передачей дочерним клеткам при делении
разных типов пластид: зеленых, способных синтезировать хлоро-
филл, и белых, не способных к его образованию.
Большое практическое значение имеет открытие цитоплазма-
тической мужской стерильности у кукурузы М. И. Хаджиновым
и М. Роде. Она обусловливается цитоплазматическим фактором
пит®. Но имеет место и контролирующая роль ядра. Стериль-
ность пыльцы наблюдается только при наличии в ядре гена rf в
гомозиготном состоянии (rfifi. При наличии доминантного гена
/у в генотипе (,R/J?f или Rfrf) стерильность пыльцы не развивает-
ся. К настоящему времени цитоплазматическая мужская стериль-
ность обнаружена у ряда сельскохозяйственных культур (пшени-
цы, сорго, лука, огурцов и др.). Таким образом, в процессе
развития имеет место сложное взаимодействие ядра и цитоплаз-
мы. В целом же у растений и особенно животных главная роль в
формировании признаков организма принадлежит ядру.
РЕГУЛЯЦИЯ СИНТЕЗА иРНК И БЕЛКА
Все клетки организма, как бы они ни были дифференцирова-
ны, как правило, тождественны по генотипу. В каждой клетке
имеются все хромосомы и весь набор свойственных данному
организму генов. Однако клетки разных тканей любого организ-
ма отличаются по качественному и количественному составу
белков. Различия наблюдаются даже в одной клетке в разное
время. Это говорит о том, что в клетке транскрибируются не все
гены сразу, а только те, которые кодируют белки и ферменты,
необходимые клетке в данный момент для выполнения ее функ-
ций. Отсюда следует, что в клетке должен существовать меха-
низм, регулирующий активность генов и обеспечивающий в
нужное время синтез необходимых ей белков в достаточном
количестве. На основании изучения синтеза ферментов у кишеч-
ной палочки французские генетики Ф. Жакоб и Ж. Моно пред-
ложили теорию индукции (возбуждения) и репрессии (подавления)
белкового синтеза.
По теории Ф. Жакоба и Ж. Моно, гены, влияющие на синтез
какого-то фермента или белка, расположены в молекуле ДНК
последовательно друг за другом в порядке их влияния на ход
реакции синтеза. Такие гены были названы структурными.
Перед группой структурных генов расположен общий для них
ген-оператор, а перед ним — промотор. В целом эта функцио-
нальная группа называется опероном. На структурных генах опе-
рона образуется одна общая молекула иРНК (полицистронная
189
иРНК), так как структурные гены находятся одновременно в
активном или неактивном состоянии. В той же молекуле ДНК
на некотором расстоянии расположен ген-регулятор, под контро-
лем которого вырабатывается белок, называемый репрессором.
Молекула репрессора имеет два специфических участка — один
для присоединения к оператору, другой для связывания индукто-
ра. Присоединяясь к оператору, репрессор блокирует транскрип-
цию. Когда ферменты на данном опероне не синтезируются,
репрессор соединен с геном-оператором. Синтез фермента начи-
нается под влиянием индуктора. Индуктором является опреде-
ленное химическое соединение, которое служит материалом для
данного фермента, или сходное с ним вещество. Индуктор со-
единяется с репрессором и инактивирует его. Оператор освобож-
дается, начинается синтез иРНК на структурных генах и соответ-
ственно синтез фермента.
Рассмотрим принципы функционирования оперона на приме-
ре регуляции синтеза ферментов, участвующих в усвоении лакто-
зы кишечной палочкой (рис. 40). В лактозном опероне три
структурных гена (гень генг, генз). Они занимают участок,
включающий около 6000 нуклеотидных пар. Первым идет ген,
определяющий структуру молекулы р-галактозидазы, вторым —
ген, кодирующий галактозидпермеазу, и третьим — ген, коди-
рующий галактозидтрансацетилазу. Все три гена транскрибиру-
ОПЕРОН
ОПЕРОН
Рис. 40. Регуляция транскрипции (по Э. Гюнтеру)
Пример: область лактозного оперона у Е. coli:
А —в присутствии лактозы; Б — без лактозы; Пр — промотор; О—оператор; / — регулятор-
ный ген; структурные гены — тень гену, генз; Р— репрессор; Л — молекула лактозы; волнис-
тая линия — иРНК
190
ются вместе. РНК-полимераза присоединяется к промотору и
продвигается вдоль оперона, транскрибируя его.
Активность структурных генов регулируется белком-репрессо-
ром, который кодируется геном-регулятором. Репрессор выраба-
тывается в небольшом количестве непрерывно и, если нет в
питательной среде лактозы, прикрепляется к оператору, препят-
ствуя продвижению РНК-полимеразы от промотора к структур-
ным генам. Гены оказываются репрессированными, и синтез
трех кодируемых ими ферментов не осуществляется. При по-
ступлении в клетку лактозы она быстро связывается с молекула-
ми репрессора, освобождая ген-оператор. Это ведет к тому, что
РНК полимеразы присоединяется к промотору и продвигается
вдоль оперона, поочередно транскрибируя все три гена. В ре-
зультате синтезируются ферменты, расщепляющие лактозу. Ин-
дукция вызывается тем, что белок-репрессор не прикрепляется к
оператору. После полной утилизации лактозы белок-репрессор
освобождается и вновь связывается с геном-оператором, и про-
цесс синтеза уже ненужных ферментов прекращается.
Опероны анаболических ферментов, аминокислот и азотистых
оснований функционируют по принципу обратной связи. В
этом случае синтез ферментов идет только до тех пор, пока
конечного продукта в клетке недостаточно. Избыток продукта
репрессирует синтез ферментов, участвующих в его образовании.
Механизмы регуляции у эукариот значительно сложнее и
менее изучены. Это связано со сложной дифференцировкой кле-
ток разных органов и тканей. У эукариот выявлены гены, прояв-
ляющие активность во всех клетках организма. Они ответствен-
ны за образование структур, общих для всех клеток. Имеются
гены, действие которых проявляется только в специализирован-
ных тканях. Кроме того, есть гены, ответственные за выполне-
ние ограниченных функций — синтез гемоглобина, кератина
волос и т. д. Это говорит о том, что и у эукариот должны быть
механизмы регуляции генов. Возможно, эукариоты используют
такой же механизм регуляции синтеза белков, как и Прокариоты,
но, кроме того, у них имеются и другие процессы регуляции,
характерные для этих организмов.
У эукариот возможно одновременное групповое подавление ак-
тивности генов: во всем ядре, в целой хромосоме или в большом ее
участке. Предполагается, что такая репрессия генов осуществля-
ется в значительной мере гистонами — основными белками, ко-
торые входят в состав хромосом эукариот. Примером групповой
регуляции активности генов является полное прекращение
транскрипции всех генов при спермиогенезе у животных. Счита-
ют, что такое выключение всех генов при образовании спермиев
и постепенная их дерепрессия при эмбриогенезе связаны с изме-
нениями белковых компонентов хромосом. Групповое выключе-
ние активности генов в одной из Х-хромосом наблюдается в
191
онтогенезе у самок млекопитающих, обладающих двумя Х-хро-
мосомами. В этих хромосомах находятся гены, детерминирую-
щие дифференцировку пола на ранних стадиях онтогенеза. Затем
одна из Х-хромосом инактивируется, превращаясь в так называе-
мое тельце Барра. Этим достигается сбалансированность эффек-
та генов из Х-хромосом у самок и самцов.
Имеется много примеров, указывающих на большую роль
гормонов в регуляции активности генов. Мы уже разбирали во-
прос о том, что в гигантских хромосомах двукрылых можно
обнаружить активно транскрибирующиеся участки, которые ста-
новятся разрыхленными и наблюдаются в виде пуффов. Пуффы
появляются на разных стадиях развития в разных участках хро-
мосом. Если вводить гормон экдизон особям, у которых выделе-
ние гормона еще не начиналось, то можно добиться появления
пуффов, как при естественной секреции гормона. Вначале на-
блюдается появление «ранних» пуффов, а через 3—10 ч имеется
уже okq^io 100 «поздних» пуффов.
Гормон щитовидной железы, очевидно, влияет на проявление
активности генов, обусловливающих процессы метаморфоза.
При добавлении этого гормона в среду совершается быстрое
превращение головастиков в лягушек. Известно, что гормон под-
желудочной железы инсулин нормализует содержание глюкозы в
крови. Вебер установил, что инсулин активирует три гена, кото-
рые кодируют ферменты, использующие глюкозу (гликолиз и
синтез гликогена), и в то же время он является репрессором для
четырех генов, которые кодируют ферменты, влияющие на гли-
конеогенез (синтез глюкозы из неуглеводистых веществ).
В последние годы исследуется роль гистонов и негистоновых
хромосомных белков в регуляции действия генов. Исследования
показывают, что гистоны, по-видимому, тормозяще действуют на
синтез РНК. Например, у бобовых белок глобулин in vivo обра-
зуется только в семядолях. Однако если удалить из хроматина
других частей растения гистоновые компоненты, то и в них in
vitro будет синтезироваться тот же глобулин. Это говорит о том,
что гистоны, по-видимому, блокируют гены. Негистоновые хро-
мосомные белки представлены большим многообразием, обнару-
жено разное их содержание в хроматине различных тканей на
разных стадиях развития. Предполагается, что они также участ-
вуют в регуляции синтеза белка — снимают блокирующее дейст-
вие гистонов. Однако регуляторная функция гистонов и негисто-
новых белков пока точно не выяснена. К механизмам регуляции
синтеза белка относится синтез дополнительной ДНК, которая
затем поступает в цитоплазму. В цитоплазме на ДНК синтезиру-
ется иРНК, а на ней белки, необходимые для клетки. В яйце-
клетках амфибий и цитоплазме рыб в период роста и созревания
ооцитов было обнаружено большое количество активной ДНК.
Таким образом, ДНК ядра может образовывать фракции,
192
переходящие в цитоплазму, и синтез белка может регулироваться
не только подавлением, но и усилением действия генов. Пробле-
ма регуляции действия генов у высших организмов имеет боль-
шое практическое значение в животноводстве и медицине.
Структура ДНК определяет химическое строение и функции бел-
ков, т. е. их качественный состав. Но в процессах развития и
жизни организма очень важное значение имеет и количество
синтезируемого белка, а это связано с регуляцией активности
генов. Установление факторов, регулирующих синтез белка, рас-
крыло бы широкие возможности управления онтогенезом, созда-
ния животных с более высоким уровнем продуктивности и луч-
шей устойчивостью к разного рода болезням.
ВЛИЯНИЕ СРЕДЫ НА РАЗВИТИЕ ПРИЗНАКОВ
Фенотип каждого организма формируется под влиянием гено-
типа и условий среды. Генотип определяет норму реакции организ-
ма — границы изменчивости выражения признака под влиянием из-
меняющихся условий окружающей среды. Те различия, которые
зависят только от условий среды, называются модификациями.
Роль генотипа и определенных факторов среды в образовании
разных признаков организма может быть очень различной. Есть
такие признаки, которые в основном обусловлены генотипом. К
ним относятся качественные признаки, такие как группы крови,
форма ушей у свиней, окраска тела и др. В то же время на
формирование целого ряда признаков, особенно хозяйственно
полезных (удой, содержание жира и белка в молоке, живая масса
и др.), во многом влияют условия внешней среды.
Иногда под воздействием определенных факторов могут изме-
няться и устойчивые признаки. Так, у кроликов, гомозиготных
по рецессивному гену горностаевой окраски, имеющих белую
окраску туловища и черные уши, хвост, конец морды и концы
лапок, рисунок окраски можно изменить под влиянием темпера-
туры. Н. А. Ильин выбривал у горностаевых кроликов участки
белых и черных волос и создавал условия пониженной или по-
вышенной температуры. В зависимости от температуры на вы-
бритых участках тела отрастали белые или черные волосы. Для
каждой части тела был установлен порог раздражения — темпера-
тура, выше которой развивалась белая шерсть, а ниже — черная.
Так, на боку кролика при температуре ниже 2 °C вырастала
черная шерсть, на ухе при температуре выше 30 °C — белая
шерсть и т. д. Таким образом, наследуется не рисунок кролика,
а способность или неспособность в зависимости от температуры
образовывать пигмент в волосе. При изменении условий среды
иногда признак изменяется так же, как и под влиянием действия
генов, но возникшие особенности не являются наследственны-
ми. Такие изменения называют фенокопиями. Например, у кур
193
врожденный дефект бесхвостости наследуется, но в некоторых
случаях обусловливается влиянием внешней среды в период на-
сиживания.
Среда особенно влияет на развитие хозяйственно полезных
признаков сельскохозяйственных животных. Неблагоприятные
условия кормления и содержания в первую очередь влияют на
высокопродуктивных животных.
В таблице 27 приведены данные по удою дочерей и внучек
трех быков-производителей симментальской породы.
27. Продуктивность коров — дочерей и внучек разных быков-
производителей в зависимости от условий кормления и выращивания
(по О. А. Ивановой)
Быки-произво- дигели — отцы и деды коров Удой коров за 300 дней лактации, кг
выращенных в посредственных условиях и лактировавших при кормлении выращенных и лактировавших при обильном кормлении
умеренном обильном
Цезарь 2882 4394 4941
Наследник 1 2899 4843 5201
Бис 2860 4898 5663
Как видим, у коров, выращенных в посредственных условиях
и лактировавших при умеренном кормлении, между потомками
разных быков имеются незначительные различия. При обильном
кормлении у потомков Цезаря удой оказался меньше по сравне-
нию с потомками Наследника на 449 кг и по сравнению с по-
томками Биса на 504 кг. Еще значительнее была разница в удое
потомков, выращенных и лактировавших при обильном кормле-
нии. В этом случае потомки Биса превзошли по удою дочерей
Цезаря на 722 кг и дочерей Наследника на 462 кг. При улучше-
нии кормления потомство Цезаря повысило удой на 2059 кг,
Наследника — на 2302, а Биса — на 2803 кг. Это показывает, что
реакция на улучшение условий среды у потомства разных быков
была различной. Из приведенного примера видно, что среда
может сгладить наследственные различия между животными, в
результате чего лучшие и худшие по генотипу особи по продук-
тивности оказываются одинаковыми. Правильно отобрать наибо-
лее ценных по генотипу животных можно только при оптималь-
ных условиях среды.
Имеются наблюдения эмбриологов, говорящие о том, что рез-
кое изменение среды в определенные периоды эмбрионального
развития организма может привести к гибели плода. Такие пе-
риоды называют критическими. Критические периоды обнаруже-
ны в онтогенезе рыб, птиц, млекопитающих и человека. Они
выявляются после поздней бластулы и предшествуют основным
процессам морфогенеза. У человека первый критический период
194
относится к 1-й — началу 2-й недели после зачатия, второй — к
3—5-й недели развития, когда происходит закладка отдельных
органов эмбриона человека. Третий критический период наблю-
дается между 8-й и 11-й неделями, когда формируется плацента.
В критические периоды наблюдается чувствительность эмбриона
к недостаточному снабжению кислородом и питательными веще-
ствами, ионизирующей радиации, перегреванию, охлаждению,
лекарственным и ядовитым веществам, попадающим в кровь
плода через плаценту. Указанные факторы могут вызвать замед-
ление и остановку развития, появление уродств, высокую смерт-
ность зародышей.
У кур критические периоды приходятся на 2—3-й день инку-
бации, когда начинает формироваться система кровообращения;
на 8—9-й день развития, когда начинается резко выраженная
дифференцировка характерных для птиц органов и тканей; на
19-й день инкубации, когда снова усиливаются процессы диффе-
ренцировки и начинает изменяться тип дыхания. В критический
период эмбрионы птиц особенно чувствительны к изменению
режима инкубации: температуры и влажности воздуха, а также
аэрации яиц.
Предполагают, что у крупного рогатого скота также существу-
ют критические периоды и первый период приходится на первые
три дня развития зиготы. В критические периоды происходит,
очевидно, смена матриц белкового синтеза и в связи с этим
ослабление физиологических процессов.
При изучении соотношения среды и наследственности боль-
шой интерес представляют особи человека и животных, совер-
шенно идентичные по генотипу, — однояйцовые близнецы. У
них генотипы тождественны, и они принадлежат к одному полу.
Близнецов широко используют для выяснения вопроса о влия-
нии различных факторов среды и наследственности на формиро-
вание признаков организма. Изучая близнецов, можно получить
данные о том, в какой степени среда может модифицировать
проявление патологических симптомов определенной болезни.
Контрольные вопросы. 1. В чем заключается центровая теория гена? 2. Что
такое ген, что вы знаете о строении гена? 3. Как проявляется влияние генов на
развитие признаков? 4. Что понимается под дифференциальной активностью
генов на разных этапах онтогенеза? 5. Что вы знаете о взаимодействии ядра и
цитоплазмы в развитии? 6. Как происходит регуляция синтеза иРНК и белка в
клетке? 7. Как влияет среда на развитие признаков? 8. Что вы знаете о критичес-
ких периодах в развитии?
Глава 12
ГЕНЕТИКА ПОПУЛЯЦИЙ'
Для улучшения племенных и продуктивных качеств животных
необходимо знать генотипы не только отдельных индивидуумов,
но и генетическую структуру всего стада или даже породы в
целом. Важное значение для селекции имеют знания закономер-
ностей наследственности и изменчивости в отсутствие и с учетом
искусственного отбора и подбора животных, факторов, их опре-
деляющих. Исследования генетических процессов, протекающих
в естественных условиях размножения животных, имеют боль-
шое значение для дальнейшего познания эволюции с целью
управления этими процессами при разведении сельскохозяйст-
венных животных.
ПОПУЛЯЦИЯ И «ЧИСТАЯ линия»
По Н. В. Тимофееву-Ресовскому, популяция — это совокуп-
ность особей данного вида, в течение длительного времени
(большого числа поколений) населяющая определенное про-
странство, состоящая из особей, могущих свободно скрещивать-
ся друг с другом, и отделенная от таких же соседних совокупнос-
тей одной из форм изоляции (пространственной, сезонной, фи-
зиологической, генетической). Например, олени острова Колгуев
изолированы от оленей, разводимых на материковой части Край-
него Севера, широкой полосой моря. В результате сформирова-
лась особая популяция колгуевских оленей, отличающаяся от
другой часта этого вида генотипическими и фенотипическими
признаками — они более крупные и обладают лучшей жизнеспо-
собностью.
В животноводстве под популяцией понимают группу живот-
ных одного вида, характеризующихся определенной численнос-
тью и ареалом распространения. Такая группа отличается от
других популяций генетической структурой, экстерьерными, ин-
терьерными и продуктивными качествами. Популяцией в живот-
новодстве может быть отдельное стадо животных, порода или
отродье. Обычно популяция — замкнутая группа. Ввоз в нее или
вывоз из нее животных из других популяций ограничен, поэтому
размножение в популяции осуществляется за счет подбора сам-
196
цов и самок, принадлежащих к данной популяции. В Ярослав-
ской области, например, разводится популяция крупного рогато-
го скота ярославской породы.
Каждая популяция характеризуется определенным генофон-
дом, т. е. совокупностью аллелей, входящих в ее состав.
Наряду с популяцией в генетике существует понятие
«чистая линия» — это потомство, полученное только от одного
родителя и имеющее с ним полное сходство по генотипу.
Чистые линии могут быть созданы в растениеводстве у
самоопыляющихся растений. В отличие от популяций они
характеризуются полной гомозиготностью. Вследствие полной
гомозиготности отбор в чистой линии невозможен, так как
все особи, входящие в нее, имеют идентичный набор генов.
Высокогомозиготных линейных мышей, крыс и других ла-
бораторных животных создают в целях проведения различных
экспериментов, например для проверки на мутагенность тех
или иных препаратов, оценки вакцин и т. д.
Популяция состоит из животных разных генотипов. Эффек-
тивность отбора в ней зависит от степени генетической изменчи-
вости — соотношения доминантных и рецессивных генов.
СТРУКТУРА СВОБОДНО РАЗМНОЖАЮЩЕЙСЯ ПОПУЛЯЦИИ.
ЗАКОН ХАРДИ - ВАЙНБЕРГА
Харди и Вайнберг провели математический анализ рас-
пределения генов в больших популяциях, где нет отбора,
мутаций и смешивания популяций. Они установили, что
такая популяция находится в состоянии равновесия по
соотношению генотипов, что определяется формулой р2А4 +
+ 2pqAa + q^-aa = 1, где р — частота доминантного гена А,
q — частота его рецессивного аллеля а. В соответствии с
этим был сформулирован закон, или правило, Харди — Вайнберга,
согласно которому при отсутствии факторов, изменяющих
частоты генов, популяции при любом соотношении аллелей
от поколения к поколению сохраняют эти частоты аллелей
постоянными. Несмотря на известные ограничения, по формуле
Харди — Вайнберга можно рассчитать структуру популяции и
определить частоты гетерозигот (например, по летальным
или сублетальным генам, зная частоты гомозигот по рецес-
сивным признакам и частоты особей с доминантным при-
знаком), проанализировать сдвиги в генных частотах по
конкретным признакам в результате отбора, мутаций и других
факторов.
Пользуясь формулой Харди — Вайнберга, мы рассчитали час-
тоту гетерозиготных носителей некоторых форм рецессивно обу-
словленных аномалий в стаде крупного рогатого скота племзаво-
да «Караваево» (табл. 28).
197
28. Частота гетерозиготных носителей разных рецессивных генов
в костромской породе (проанализировано 9608 животных)
Фенотипическое проявление аномалии Число случаев уродств (аа) Частота гетерозиготных носителей в популяции (Аа), %
Укорочение нижней челюсти 36 П,2
Мопсовидность 4 3,9
Водянка плода 5 4,3
Атрезия ануса 3 3,3
Слепота 3 3,3
Популяция находится в равновесии только тогда, когда в ней
не происходит отбора. При выбраковке же отдельных животных
в такой популяции изменяется соотношение гамет, что влияет на
генетическую структуру следующего поколения. Однако К. Пир-
сон показал, что, как только возникает состояние панмиксии
(свободное скрещивание), соотношение генотипов и фенотипов
в популяции в следующем поколении возвращается к тому, кото-
рое соответствует формуле Харди — Вайнберга, но уже при дру-
гом их соотношении. Скрещивание, восстанавливающее соотно-
шение генотипов в популяции, в соответствии с формулой
Харди — Вайнберга получило название стабилизирующего. Из
этого следует вывод: при использовании в популяции случайных,
неотобранных производителей или маток наблюдается стабили-
зация признаков продуктивности на одном уровне, и повышение
продуктивности животных в такой ситуации невозможно. Точно
так же при отсутствии браковки гетерозиготных носителей ре-
цессивных аномалий частота проявления аномальных животных
в популяции остается неизменной.
ОСНОВНЫЕ ФАКТОРЫ ГЕНЕТИЧЕСКОЙ ЭВОЛЮЦИИ
В ПОПУЛЯЦИЯХ
В популяциях сельскохозяйственных животных постоянно из-
меняются частоты генов, что можно наблюдать при анализе
смежных поколений. Такие изменения составляют суть генети-
ческой эволюции. Основные факторы эволюции: мутации, есте-
ственный и искусственный отбор, миграции, дрейф генов.
Одна из основных причин генетической изменчивости в попу-
ляции — мутации. Спонтанные мутации каждого гена происходят
с низкой частотой, однако общая частота мутаций всех генов,
которые содержат популяции, очень велика. Мутации, возникаю-
щие в половых клетках родительского поколения, приводят к из-
менению генетической структуры у потомства. В популяции по-
стоянной численности в отсутствие отбора большинство возник-
ших мутаций быстро утрачивается, однако некоторые из них
могут сохраниться в ряде поколений. Исчезновению мутантных
198
генов из популяции противостоит действие мутационного процес-
са, в результате которого образуются повторные мутации.
Генетическая структура популяций формируется и изменяется
под действием естественного и искусственного отбора. Действие
естественного отбора состоит в том, что преимущественное раз-
множение имеют особи с высокой жизнепособностью, скороспе-
лостью, плодовитостью и т. д., т. е. более приспособленные к
условиям окружающей среды. При искусственном отборе опре-
деляющее значение имеют признаки продуктивности.
В. И. Власов отмечает, что естественный отбор идет на всех
этапах онтогенеза популяции — от образования гамет до взросло-
го организма. При этом он существенно влияет на темпы искус-
ственного отбора вследствие противоположного действия при
селекции на высокий уровень развития продуктивных призна-
ков, несвойственный видовым биологическим границам. Исходя
из этого, при отборе животных необходимо учитывать не только
продуктивные признаки, но и признаки приспособленности К
условиям окружающей среды.
По С. М. Гершензону, критерием интенсивности естествен-
ного отбора служит разность приспособленности сравниваемых
групп, называемая коэффициентом отбора и выражаемая в долях
единицы. Например, если вероятность оставления потомства
особями с генотипом аа на 10 % меньше, чем особями с геноти-
пом АА или Аа, то приспособленность этих групп для особей АА
и Аа равна 1, для особей аа — 0,9.
С точки зрения ветеринарной генетики имеет значение эффек-
тивность отбора против вредных мутаций, прежде всего рецессив-
ного типа. Анализ показывает, что высокие частоты рецессивного
мутантного гена путем отбора могут быть быстро снижены до
низких значений. Чтобы снизить частоту летального гена, напри-
мер с 0,3 до 0,2, достаточно двух поколений (табл. 29).
29. Снижение чвстоты рецессивного аллелв а при полной элиминации
гомозигот аа (по Визнеру и Виллеру, 1979)
Частота рецессии- кого аллеля Частота фенотипов Отношение 2р?:<Г Уменьшение q на одно поколение &q Необходимое число поколений для qn-tqt
2р?
0,3 0,42 0,09 4,7 0,069
0,2 0,32 0,04 8 0,033 2
0,1 0,18 0,01 18 0,009 5
0,05 0,095 0,0025 138 0,002 10
0,01 0,0198 0,001 198 0,0001 80
0,001 0,001998 0,000001 1998 0,000001 900
Из данных таблицы 29 видно, что частота гомозигот (аа) по
мутантному гену зависит от частоты гетерозиготных животных в
популяции. Выявление этих гетерозигот и элиминация их соот-
199
ветственно будут снижать частоту генетических аномалий, обу-
словленных мутантным геном, что особенно важно при высокой
частоте мутаций.
Генетическая структура популяции может изменяться в силу
случайных генетико-автоматических процессов (по Н. П. Дуби-
нину) или дрейфа генов (по С. Райту). Наблюдения показывают,
что наиболее интенсивно дрейф генов протекает в малых попу-
ляциях. Например, известны случаи высокой концентрации ред-
ких мутаций в малочисленных изолированных популяциях круп-
ного рогатого скота и других видов животных, связанные, оче-
видно, с генетико-автоматическими процессами.
Распространение мутаций в разных популяциях животных
может произойти в результате миграций. На практике это озна-
чает завоз животных, особенно производителей или их спермы,
из других зон страны или стран. Известно много случаев, когда
импортные производители оказывались носителями мутаций и
распространяли генетические аномалии при использовании в
воспроизводстве местных популяций. Так, экспорт голштинов из
США в ФРГ, по данным Рика, способствовал распространению
пупочных грыж у немецкого черно-пестрого скота. В нашей
стране наблюдалась ситуация, когда из одного племзавода ре-
монтных быков с транслокацией 1/29 хромосомы продавали без
ограничений в разные области. Это могло бы привести к распро-
странению нежелательной мутации в других популяциях. По ре-
комендации ученых были приняты меры по элиминации носите-
лей транслокаций.
ВЛИЯНИЕ ИНБРИДИНГА НА ВЫЩЕПЛЕНИЕ РЕЦЕССИВНЫХ
ЛЕТАЛЬНЫХ И ПОЛУЛЕГАЛЬНЫХ ГЕНОВ
Спаривание животных, находящихся в родственных отно-
шениях, называют инбридингом. Родственное спаривание, или
инбридинг, — метод подбора, используемый в племенном
животноводстве для закрепления ценных наследственных при-
знаков того или иного животного в последующих поколениях.
У родственных между собой животных наблюдается сходство
по определенным парам аллелей, которые они получили от
общего предка. Это сходство тем больше, чем ближе степень
родства.
Каждое животное в генотипе имеет аллельные гены как
в гомозиготном, так и в гетерозиготном состоянии. В
гетерозиготе обычно находятся вредные мутантные рецессивные
гены. При инбридинге возрастает вероятность слияния тож-
дественных гамет, несущих мутантные гены в гетерозиготном
состоянии, и перехода их в гомозиготное состояние. Эта
вероятность пропорциональна степени родства спариваемых
животных (табл. 30).
200
30. Уровень возрастания гомозиготности при разных степенях инбридинга
Степень родства родителей | Уровень возрастания гомозиготности у потомства, %
П-1 п-п ш-ш ГУ-ГУ 25,0 12,5 6,25 3,125
Повышение гомозиготности у потомства при разных степенях
родственных отношений родителей определяют по несколько из-
мененной формуле С. Райта:
где Fx — коэффициент инбридинга потомка; п — ряд родословной с материнской;
Л1 — ряд родословной с отцовской стороны, где находится общий предок; fa —
коэффициент инбридинга общего предка.
Таким образом, в результате применения инбридинга проис-
ходит изменение генных частот, возрастает вероятность вьпцеп-
ления рецессивных гомозигот, что является причиной инбредной
депрессии, выражающейся в снижении жизнеспособности, пло-
довитости животных, рождении аномальных особей.
Таблица 31 иллюстрирует пример перехода при инбридинге
мутантных рецессивных генов в гомозиготное состояние и появ-
ление при этом различных форм уродств в потомстве быка ко-
стромской породы.
31. Формы уродств в потомстве быка Бурхана 6083
Форма уродства Число уродливых телят В том числе инбредных на быков
Салата Ладка Бурхана*
Укорочение нижней челюс- 2 2 2 1 —
ти
Водянка плода 1 1 — 1
Неклассифицированные 2 2 2 —
уродства
Искривление конечностей 1 1 1 —- —
Уродства конечностей 4 4 1 1 2
Анкилоз суставов 1 1 1 1 —
* Инбридинг, как правило, был комплексным — одновременно на двух (1-я циф-
ра) или на трех (2-я цифра) предков.
Ниже показано, что инбредная депрессия может проявляться
в форме снижения показателей продуктивности животных. Ин-
бредная депрессия на каждые 10 % повышения коэффициента
инбридинга следующая (по Ф. Хатту):
201
I
Показатели продуктивности Изменения при инбридинге
Свиньи:
число поросят в помете при рождении ‘ —0,20
число поросят в помете в возрасте 154 дней —0,44
средняя масса одного поросенка в 154 дня, кг —1,55
Куры:
выводимость, % от числа оплодотворенных яиц —4,4
возраст начала яйцекладки, дней +6,0
число яиц, снесенных в среднем одной кури- —9,0
цей к возрасту 500 дней
Имбредная депрессия по показателям, характеризующим про-
дуктивность и жизнеспособность животных, не является фаталь-
ным спутником родственного спаривания. Имеется множество
примеров того, когда при инбридинге разных степеней, в том
числе и близких, отрицательных последствий не наблюдали.
Н. П. Дубинин в этой связи отмечает, что «линия ухудшается,
пока в ней идут процессы последовательного накопления вред-
ных рецессивных генов, переходящих в гомозиготное состояние.
Когда же наступает более или менее выраженное завершение
этого процесса, линии по своим свойствам становятся относи-
тельно константными и могут в таком устойчивом состоянии
сохраняться длительно. Изменить генотип таких линий могут
лишь новые накапливающиеся в них мутации». Однако, подчер-
кивает академик, «многие линии при инбридинге, конечно, гиб-
нут, ибо в них в гомозиготное состояние переходят летальные и
полулетальные гены». Поэтому инбридинг применяется как
метод индивидуальной селекции для перевода в гомозиготное
состояние ценных генов выдающихся животных.
ГЕНЕТИЧЕСКИЙ ГРУЗ В ПОПУЛЯЦИЯХ ЖИВОТНЫХ
В ходе длительной эволюции животных наряду с полезными
мутациями, подхватываемыми отбором, в популяциях или поро-
дах накопился определенный спектр генных и хромосомных му-
таций. Каждое поколение популяции наследует этот груз мута-
ций, и в каждом из них возникают новые мутации, часть кото-
рых передается последующим поколениям.
Очевидно, что большая часть вредных мутаций отметается
естественным отбором или элиминируется в процессе селекции.
Это прежде всего доминантные генные мутации, фенотипически
проявляющиеся в гетерозиготном состоянии, и количественные
изменения наборов хромосом. Рецессивно действующие генные
мутации в гетерозиготном состоянии и структурные перестройки
хромосом, заметно не влияющие на жизнеспособность их носи-
телей, могут проходить сквозь сито селекции. Они формируют
генетический груз популяции. Таким образом, под генетическим
202
I
грузом популяции понимают совокупность вредных генных и
хромосомных мутаций. Различают мутационный и сегрегационный
генетический груз. Первый формируется вследствие новых мута-
ций, второй — в результате расщепления и перекомбинирования
аллелей при скрещивании гетерозиготных носителей «старых»
мутаций.
Частота летальных, полулегальных и субвитальных мутантных
генов, передающихся из поколения в поколение в форме мута-
ционного генетического груза, из-за трудности идентификации
носителей не поддается точному учету. Мортон и Кроу предло-
жили форму расчета уровня генетического груза в количестве
летальных эквивалентов. Один летальный эквивалент соответст-
вует одному летальному гену, обусловливающему смертность с
10%-ной вероятностью, двум летальным генам при 50%-ной ве-
роятности смерти и т. д. Величина генетического груза по фор-
муле Мортона
log eS = А + BF,
где 5—часть потомства, оставшаяся в живых; А — смертность, измеряемая ле-
тальным эквивалентом в популяции при условии случайных спариваний (F= 0),
плюс смертность, обусловленная внешними факторами; В — ожидаемое увеличе-
ние смертности, когда популяция становится полностью гомозиготной (F= 1);
F — коэффициент инбридинга.
Уровень генетического груза можно определять на основании
фенотипического проявления мутаций (уродства, врожденные
аномалии обмена и т. д.), анализа типа их наследования, частоты
в популяции.
Н. П. Дубинин предлагает определять генетический груз по-
пуляции путем сравнения частот мертворожденных в родствен-
ных и неродственных подборах родительских пар. При этом
следует иметь в виду, что при высокой частоте гетерозигот по
рецессивным летальным и полулегальным мутантным генам
рождение животных с аномалиями необязательно должно быть
связано с инбридингом близких и умеренных степеней. Общий
предок (источник мутации) может находиться и в отдаленных
рядах родословной. К примеру, бык Трувор 2918 — гетерозигот-
ный носитель мутантного рецессивного гена, находился в V, VI,
VII рядах предков в совхозе «Красная Балтика», но при исполь-
зовании его праправнука Автомата 1597 на родственных ему
коровах наблюдались массовые случаи рождения бесшерстных
телят (рис. 41).
Другой прапраправнук Трувора бык Док 4471 также оказался
гетерозиготным носителем гена бесшерстности. В совхозе
«Новое время» при умеренно родственных спариваниях и отда-
ленном инбридинге в потомстве Дока 4471 зарегистрировано
• примерно 5 % телят с этой генетической аномалией.
Эти данные в определенной мере характеризуют уровни гене-
203
Рис. 41. Схема родственных связей родителей телят черно-пестрой породы
с синдромом бесшерстности, укорочения верхней челюсти, «волчьей пасти»
тического груза по отдельным мутантным генам в конкретных
популяциях крупного рогатого скота.
Хромосомные мутации являются составной частью генетичес-
кого груза. Учет их ведется прямым цитологическим методом.
По результатам многочисленных исследований основной компо-
нентой груза аберраций хромосом у крупного рогатого скота
являются робертсоновские транслокации, а у свиней — реци-
прокные. Наиболее распространенной мутацией у крупного рога-
того скота оказалась транслокация 1/29 хромосомы. Размах из-
менчивости частоты этой аберрации, по нашим данным, в попу-
ляциях палево-пестрого скота составлял от 5 до 26 %.
Таким образом, концепция генетического груза в свете совре-
менных достижений цитогенетики должна быть расширена. Сей-
час, когда известен широкий спектр аберраций хромосом и уста-
204
новлено строгое наследование отдельных из них (транслокации и
инверсии), представляется целесообразным учитывать их наряду
с вредными мутациями генов как составляющую часть генети-
ческого груза.
ГЕНЕТИЧЕСКАЯ АДАПТАЦИЯ И ГЕНЕТИЧЕСКИЙ
ГОМЕОСТАЗ ПОПУЛЯЦИЙ
Существование в популяциях наследственной изменчивости,
прежде всего мутаций в гетерозиготном состоянии, позволяет им
быстро приспосабливаться к новым условиям среды за счет из-
менения генетической структуры. Мутационный процесс ведет
также к образованию в популяциях генетического полиморфиз-
ма — разнообразия частот аллелей, гомозигот по доминантным,
гетерозигот или гомозигот по рецессивным генам. Полиморфизм
является механизмом, поддерживающим существование популя-
ций. Если, например, гетерозиготность обеспечивает лучшую
приспособляемость к изменившимся условиям среды, то идет
отбор в пользу гетерозигот, что приводит к сбалансированному
полиморфизму — воспроизведению в популяции из поколения в
поколение определенного соотношения различных генотипов и
фенотипов. Процессы, обеспечивающие способность популяции
сохранять свою генетическую структуру, называют генетическим
гомеостазом.
ОСОБЕННОСТИ НАСЛЕДОВАНИЯ КОЛИЧЕСТВЕННЫХ
ПРИЗНАКОВ
В генетике выделяют два класса признаков — качественные и
количественные. Они различаются по характеру изменчивости и
особенности наследования. Качественные признаки характеризу-
ются прерывистой, а количественные — непрерывной изменчи-
востью. Первые из них дают четкие границы при расщеплении
на доминантные или рецессивные признаки. Это связано с тем,
что каждый из них обычно контролируется одним аллельным
геном. Количественные признаки не дают четких границ рас-
щепления при разных вариантах скрещивания, хотя отличаются
от качественных более высокой степенью изменчивости. Особен-
ностью количественных признаков является сложный характер
наследования. Каждый из них детерминируется не одним, а мно-
жеством локусов в хромосомах. Такой тип наследования, когда
один признак обусловливается многими генами, носит название
полигенного. Уровень развития количественного признака зависит
от соотношения доминантных и рецессивных генов, других гене-
тических факторов и степени модифицирующего действия фак-
торов внешней среды. Изменчивость по количественному при-
205
знаку в популяции складывается из генетической и паратипичес-
кой (внепшесредовой) изменчивости.
Понятие о наследуемости признаков и коэффициенте наследуе-
мости. Разные количественные признаки имеют неодинаковую
степень генетической изменчивости, и условия внешней среды
оказывают различное воздействие на уровень фенотипического
проявления того или иного признака. При отборе животных
важнейшее значение имеет знание того, в какой степени будет
совпадение уровней развития количественного признака у роди-
телей и потомства или в какой степени потомки унаследуют
количественные хозяйственно полезные признаки или патологи-
ческие признаки родителей.
Для оценки эффективности отбора по количественным при-
знакам в популяционной генетике введено понятие «наследуе-
мость». Под наследуемостью признака понимают степень его ге-
нетической детерминации в фенотипе. Другими словами, опреде-
ляют, в какой степени уровень развития признака зависит от
генотип^ родителей и в какой степени — от условий внешней
среды. Коэффициент наследуемости (й2) указывает на долю гене-
тической изменчивости признаков в общей изменчивости. Наи-
более распространенными методами вычисления й2 являются
следующие:
1) й2 = 2г д/м,
где г — корреляция по количественному признаку между прямыми родственника-
ми, например мать — дочь;
2) й2 = 2R д/м,
где R — коэффициент регрессии между фенотипами прямых родственников.
В последнее время получило распространение мнение 6 том,
что отдельные качественные признаки имеют сложный полигон-
ный характер наследования. К этим признакам относят и устой-
чивость к болезням.
Для качественных признаков используют метод вычисления
величины й2 через коэффициент регрессии.
Д. В. Карликов разработал полигонную модель наследования
устойчивости к лейкозу и рассчитал коэффициент наследуемости
по этому признаку по формуле
й2 = Ьг,
где г— коэффициент родства бальных животных с их родственниками; Ь — рег-
рессия, определяемая по отношению Ь = (R— б):(Л— б). Здесь R — средняя под-
верженность родственников больных животных; G — средняя подверженность по-
пуляции к лейкозу, А — средняя подверженность больных животных в популяции.
Наследуемость хозяйственно полезных признаков у животных.
К хозяйственно полезным признакам относят молочность,' со-
206
держание жира и белка в молоке коров, настриг шерсти у овец,
яйценоскость у кур, прирост живой массы, плодовитость и др.
Повышение уровня развития хозяйственно полезных признаков
достигается постоянным отбором лучших индивидуумов для вос-
производства. Эффективность отбора по этим признакам зависит
от степени их наследуемости, взаимосвязи между ними, разности
между средним значением признака отобранной группы и сред-
ним по стаду (селекционный дифференциал) и интервала между
поколениями.
Величины коэффициентов наследуемости зависят от природы
признака. Так, среднее значение й2 по удою равно 0,25,
жирномолочности — 0,38, живой массе у овец — 0,35, выходу
чистой шерсти — 0,55, плодовитости у крупного рогатого
скота — 0,08 и т. д.
ГЕНЕТИЧЕСКИЕ ОСНОВЫ ГЕТЕРОЗИСА
Селекционной практикой и специальными исследованиями
накоплены данные, свидетельствующие о том, что в некоторых
случаях уровень развития одного или нескольких признаков у
потомства превосходит степень выраженности этих признаков у
лучшего из родителей. Такое явление, названное гетерозисом, не
вписывается в обычные рамки наследования признаков. Для его
объяснения предложены разные гипотезы: 1) гетерозиготного со-
стояния по многим генам; 2) взаимодействия доминантных бла-
гоприятных генов; 3) сверхдоминирования, когда гетерозиготы
превосходят гомозиготы. Н. В. Турбин предложил теорию гене-
тического баланса, в основе которой лежит сложный характер
причинно-следственных связей между наследственными факто-
рами и признаками.
Н. Г. Дмитриев и И. Л. Гальперн отмечают, что главную при-
чину возникновения гетерозиса надо искать в особенностях эво-
люции вида, породы, линии. При этом следует иметь в виду, что
все в природе направлено на сохранение жизни. Проявление
гетерозиса зависит от генетической природы признака. Так, при
Межпородном или межлинейном скрещивании гетерозис в боль-
шей степени проявляется в отношении признаков, имеющих
Низкую степень наследуемости. Что касается признаков, имею-
щих среднюю или высокую наследуемость, то гетерозис по ним
Чаще всего проявляется слабо, и гибриды занимают обычно про-
межуточное положение.
Для расчета гетерозиса рекомендуется использовать формулу
К. Б. Свечина:
„Г ЕП100
ер ’
где ЕП — показатель признака у гибрида Fi; Ер — показатель этого же признака
У лучшей родительской формы.
207
Н. Г. Дмитриев и И. Л. Гальперн предлагают еще одну фор-
мулу вычисления- гетерозисного эффекта:
РХ-ИГ= ^100,
1 Мр
где F\ — средний показатель продуктивности гибридов; Мр — лучший показатель
родительской формы.
При наличии истинного гетерозиса величина индекса или
больше 100 %, или имеет знак «плюс». Если же величина гетеро-
зиса меньше 100 % или имеет знак «минус», то правильнее гово-
рить о лучшей или худшей комбинационной способности линий.
Скрещивание последних по определенной схеме обеспечивает в
гибридном потомстве лучшее развитие одного признака от отца,
а другого от матери, хотя этот признак у гибрида по своему
развитию не превосходит лучшую родительскую форму.
Контрольные вопросы. 1. Что такое популяция и «чистая линия»? 2. В чем
сущность и практическое значение закона Харди — Вайнберга? 3. Какие факторы
определяют генетическую эволюцию в популяциях? 4. Какова роль инбридинга в
появлении уродств у животных и других генетических аномалий? 5. В чем сущ-
ность концепции генетического груза? Как определить уровень генетического
груза в популяции? 6. Каковы особенности наследования количественных при-
знаков?
Глава 13
ГРУППЫ КРОВИ И БИОХИМИЧЕСКИЙ
ПОЛИМОРФИЗМ
Открытие лауреатом Нобелевской премии Ландштейнером в
1900 г. групп крови у человека (АВО) и объяснение в 1924 г.
Бернштейном типа их наследования стало отправной точкой для
иммуногенетических исследований.
Ирвин в 1936 г. использовал термин «иммуногенетика» при
описании антигенов у гибридов голубя. Соединение иммуноло-
гии (науки об иммунитете) и генетики оказалось плодотворным
в понимании фундаментальных основ иммунобиологии и в прак-
тическом их использовании. Сегодня иммуногенетика — одна из
интенсивно развивающихся комплексных наук, в арсенале кото-
рой методы иммунологии, молекулярной биологии и генетики.
Она изучает генетический контроль иммунного ответа, генетику
несовместимости тканей при пересадках, закономерности насле-
дования антигенной специфичности, проблему поддержания ге-
нетического постоянства (гомеостаз) многомиллионной популя-
ции соматических клеток организма и др. (см. схему).
Группы крови и биохимический полиморфизм — один из важ-
ных разделов этой науки. Еще в 1900 г. Эрлих и Моргенрот
установили индивидуальные различия в крови коз. Профессор
Ирвин был инициатором широкого изучения иммуногенетики у
сельскохозяйственных животных. Большой вклад в развитие
этого направления внесли Фергусон и Стормонт, которые впе-
рвые выявили более 30 антигенных факторов крови у крупного
рогатого скота, используя иммуноспецифические сыворотки, по-
лученные путем изо- и гетероиммунизации. В нашей стране
подобные исследования впервые провели В. Н. Тихонов,
П. Ф. Сороковой, В. П. Павличенко, 3. И. Вагонис и др. Сей-
час в мире десятки лабораторий занимаются иммуногенетичес-
кими исследованиями.
Основные понятия. В пределах вида особи различаются по
ряду биохимических генетически детерминируемых признаков,
которые могут быть выявлены иммуногенетически в виде систем
антигенов. Антигены — это генетически чужеродные вещества,
вызывающие при введении в организм развитие специфических
иммунологических реакций. Антигены, по которым особи одного
вида различаются между собой, называются алло антигенами.
209
Схема развития иммуногенетики (по Во Gahne, с дополнениями)
210
Антитела — иммуноглобулины (белки), образующиеся в орга-
низме под воздействием антигенов.
Различия в групповой принадлежности крови определяются
антигенами, расположенными на поверхности эритроцитов.
Антигенные факторы иногда называют кровяными факторами.
При описании групп крови животных термин «антиген» будем
рассматривать как наследственно обусловленную единицу,
имеющую антигенные свойства.
Совокупность антигенов (факторов крови), контролируемых
одним локусом, называют генетической системой групп крови, а
сумму всех групп крови одной особи — типом крови. После рож-
дения группы крови у животных не изменяются и не зависят от
условий кормления и содержания.
Номенклатура. До настоящего времени не разработана единая
международная номенклатура антигенов и систем крови. Генети-
ческие системы групп крови и антигены обозначаются пропис-
ными и строчными буквами латинского алфавита: А, В, С и т. д.
В связи с наличием большого количества антигенов буквы
пишут со значками А', В', С' и подстрочными индексами Ai, А2,
и т. д. (табл. 32).
32. Системы генетических групп крови
Системы (локусы) Антигены Число антигенов
Крупный рогатый скот
А А, Аь А2, D, Di, D2, Н, Z' 8
В В, Bi, В2, G, Gi,G2, G3, I, Ii, 12> К, О, О», Оь Ог, Оз. 04, Р, Рь Р2, Q, .Qi, ,Q2, Т, Т1, Т2, Yi, Y2, A', Ab Е', Е2, Ез, Ед >40
С Ci, С2, Сз, Е, Ri, R2, W, Wi, W2 и др. >10
F-V F(F1, F2), V 2
J Ji, J2 2
L L 1
М Mi, М2, М', m 4
S S(Sb S2), U(Ub U2), H', U'(U'i, U2), H", S", U" 10
Z Z(Zb Z2) 1
R'-S' R', S' 2
Г T 1
N' N' 1
Свиньи
А Ac, Ap, Ac, Aw, Ax 5
В Ba, Bb 2
С Cq, Cb, Cc 3
211
Продолжение
Системы (локусы) Антигены Число антигенов
D Da, Db, Dc 3
Е Еа> Еь» Ед, Ее, Efs Eg, Ejj, Ei, Ei, Ejt, El,Em» Ед, Eq, Ер» Er, Esf Et 18
F Fa, Fb, Fc, Fd 4
G Ga, Gb, Gc, Gd 4
Н Ha, Hb, He, Hd, He 5
I ^a» lb 2
J Ja» Jb 2
К Ka, Kb, Ke, Kd, Ke, Kf, Kg, Ka 8
L La, Lb» La, Ld, La, Lf, Lg, Lfo, Li, Lj, Lie, LI, Lm 13
М Ma, Mb, Me, Md, Me, Mf, Mg, Mh, Mi, Mj, Mk 11
N Na, Nb, Ne 3
О,, oa, Ob 2
Р Pa» Pq 2
Q Qa, Qo 2
Антигены некоторых систем наследуются в определенных
комбинациях — феногруппах. Например, сложная система Е у
свиней включает 18 антигенов. Феногруппа Ebdg определяется
присутствием антигенных факторов Еь, Ed, Eg. В этом случае
аллель записывают EMg. Антигенные факторы системы В у круп-
ного рогатого скота В, G и К могут встречаться в комбинациях
В, G, BG, BGK, а аллели обозначаются Вв, BG, BBG и BBGK. В
феногруппу может входить до 10 антигенов. Для упрощения
записи феногруппы кодируют. Так, феногруппу
BGKO2YiA'B'E'G'K'O'Y' обозначают В28.
НАСЛЕДОВАНИЕ ГРУПП КРОВИ
У всех видов животных большинство аллелей генетических
систем групп крови наследуется по типу кодоминирования, т. е. в
гетерозиготе фенотипически проявляются оба гена. Весьма редко
встречаются рецессивные аллели, подобные аллелю О системы
АВО у человека. В связи с этим возможен анализ частоты алле-
лей разных локусов в популяциях во времени и в пространстве,
что является главным инструментом для описания их генетичес-
кой структуры и позволяет приблизиться к пониманию эволюци-
онного процесса.
Все известные системы групп крови у сельскохозяйственных
животных локализованы в аутосомах. В сложных системах (у
скота В- и С-системы) антигенные факторы контролируются
несколькими тесно сцепленными сублокусами. С-система состо-
212
'Ж
ит из двух серий аллельных (или почти близко к аллельным)
генетических детерминант Ci, С2, Cj ,Cj и Xi, Х2, С', Рю- Ана-
лиз рекомбинаций между концевыми антигенами С-системы по-
казал, что длина участка ДНК этой системы составляет 0,3 сМ
(сантиморгана), тогда как В-системы — 0,7 сМ.
Можно выделить три основных правила наследования групп
крови: 1) каждая особь наследует по одному из двух аллелей от
отца и от матери в каждой системе групп крови; 2) особь с
антигенами, не обнаруженными хотя бы у одного из родителей,
не может быть потомком данной родительской пары (например,
р $ ff/f х c/F17/7 * FjN/N); 3) гомозиготная особь по одному
антигену, например F/F, не может быть потомком гомозиготной
особи с противоположным антигеном, например V/V.
Получение реагентов для определения групп крови. Иммуноло-
гическая специфичность белковых антигенов определяется: 1)
последовательностью аминокислот полипептидной цепи (иногда
изменение даже нескольких аминокислот ведет к изменению
антигена); 2) концевыми аминокислотами цепи; 3) вторичной
структурой белковой молекулы; 4) наиболее активными поверх-
ностно расположенными участками полипептидной цепи —
антигенными детерминантами (один антиген может иметь не-
сколько детерминантных групп).
Антигены выявляются при помощи реакции антиген — анти-
тело. Основой для определения взаимодействия антиген — анти-
тело служит у крупного рогатого скота и овец реакция гемолиза
(разрушение стромы эритроцитов с выделением из них гемогло-
бина), у свиней — полная и неполная агглютинация (склеивание
эритроцитов) и реакция гемолиза.
Схема получения моноспецифической сыворотки В приведена
на рисунке 42. Кровь от животного-донора, имеющего антигены
Ас, Ва и Са, вводят реципиенту с антигеном Ас, но не имеюще-
му антигенов Ва и Са. У реципиента вырабатываются антитела к
антигенным факторам Ва и Са. Антитела против антигена Ас не
образуются, так как у реципиента есть этот фактор. В сырой
сыворотке абсорбируют ненужные антитела, в данном случае
анти-Са, эритроцитами третьего животного, имеющего антиген
Са. Потом из сыворотки путем центрифугирования удаляют
эритроциты с абсорбированными на них антителами Са. Полу-
ченную моноспецифическую сыворотку можно использовать для
выявления антигена Ва в эритроцитах других животных.
Системы групп крови. В настоящее время у крупного рогатого
скота открыто 12 систем групп крови, у свиней — 17, у овец —
16, у лошадей — 9, у птиц — 14. Из всех этих систем наиболее
сложной является В-система у крупного рогатого скота, вклю-
чающая более 40 антигенов, которые в различных комбинациях
образуют более 500 аллелей. Если в системе имеется более трех
213
ОБОЗНАЧЕНИЯ:
ЭРИТРОЦИТЫ С АНТИГЕННЫМ ФАКТОРОМ Ас
ЭРИТРОЦИТЫ С АНТИГЕННЫМ ФАКТОРОМ Ва
ЭРИТРОЦИТЫ С АНТИГЕННЫМ ФАКТОРОМ Са
g антитела против антигена в в СЫВОРОТКЕ
АНТИТЕЛА ПРОТИВ АНТИГЕНА С В СЫВОРОТКЕ
Рис. 42. Схема получения моноснецифической сыворотки путем иммунизации
аллелей, то такие системы называют полиаллельными. К ним
кроме системы В относят системы С, S, А, у свиней — Е, L, М,
у овец — В, А, С.
J-система крупного рогатого скота имеет иммуногенетическое
сходство с антигеном А человека, свиней и антигеном R овец,
S-система гомологична М-системе овец. Система Р групп крови
у лошади аналогична АВО-системе человека. У крупного рогато-
го скота установлена связь J-системы с локусоМ| гемоглобина
(НЬ) и Р-лактоглобулина (pLg).
214
I
ЗНАЧЕНИЕ ГРУПП КРОВИ ДЛЯ ПРАКТИКИ
Контроль достоверности происхождения животных. Одна из
главных областей практического применения групп крови —
контроль происхождения животных. Такое их использование вы-
звано тем, что в некоторых стадах встречается 20 % и более
ошибок в происхождении животных. Это может быть следствием
не только недостатков в работе техников по искусственному
осеменению, потери номеров, неправильного их чтения, но и
результатом повторных осеменений животных спермой разных
производителей (в повторную охоту приходит до 50 % коров, а
продолжительность стельности в норме изменяется от 270 до 292
дней) и других случаев.
Контроль происхождения необходим и при испытании свино-
маток по качеству потомства, осемененных смешанной спермой
хряков (В. Н. Тихонов, 1967), для установления моно- и дизи-
готности двоен, при получении животных методом транспланта-
ции эмбрионов и т. д.
Контроль достоверности происхождения животных возможен
благодаря: 1) кодоминантному наследованию антигенных факто-
ров; 2) их неизменности в течение онтогенеза; 3) огромному
числу комбинаций групп крови, которые в пределах вида прак-
тически не бывают одинаковыми у двух особей, за исключением
монозиготных близнецов.
В таблице 33 приведен пример уточнения отцовства в случае,
когда корова в первый раз и повторно была осеменена спермой
разных быков. По системе А невозможно уточнить происхожде-
ние потомка, так как аллель DH есть у обоих быков. В системе В
теленок получил один аллель ВО2А от матери (такого аллеля нет у
предполагаемых отцов), а второй АВ — от быка № 2 (этого аллеля
нет у первого производителя). Поэтому уже можно сделать заклю-
чение, что отцом теленка является бык № 2 (исходя из второго
правила). Это заключение подтверждается и наличием у потомст-
ва аллеля W в системе С. Точно так же по системе F—V можно
сделать заключение, что первый производитель не может быть
отцом, так как он гомозиготен по аллелю F/F, а потомок гомози-
готен по противоположному аллелю V/V (третье правило).
33. Уточнение отцовства по группам крови
Система групп крови
А В 1 с F-V 1 М S
Бык Ns 1 Ai/DH B/I2AE3GG" С1Е/Х! F/F -/- и/-
Бык Ns 2 AiH/DH А'В'/ВО] w/rwx2 F/V -/- М/- -/-
Мать Аг/D В/ВОзА EWL/R2 F/V -/- -/-
Теленок DH/D А'В'/ВОгА w/r2 V/V -/- -/- -/-
Заключение. Бык № 2 — отец теленка.
215
Иммуногенетический анализ близнецов. Как известно, близне-
цов, развивающихся из одной зиготы, называют монозиготными
или однояйцовыми, а из двух оплодотворенных яйцеклеток
(зигот) — дизиготными или двуяйцовыми. Монозиготные близне-
цы всегда одного пола и имеют одинаковые группы крови. Раз-
нополые двойни всегда дизиготные и с разными группами крови.
В среднем у крупного рогатого скота рождается около 2—3 %
двоен, среди которых 50 % двуполых пар, 25 % пар бычков и
25 % телочек- Среди общего количества двоен только 10 % бы-
вает монозиготных (поровну мужского и женского пола).
В 90 % случаев у двоен крупного рогатого скота возникает
анастомоз (срастание) кровеносных сосудов, и, как следст-
вие этого, у дизиготных двоен наблюдается химеризм (моза-
ицизм) эритроцитов. Смесь двух различных типов эритроцитов
называется эритроцитарным химеризмом.
Впервые это явление открыл Оуэн в 1945 г. у двоен крупного
рогатого скота, что явилось важным вкладом в разработку теории
приобретенной иммунологической толерантности. В эмбрио-
нальный период при анастомозе сосудов образуется два типа
эритроцитов и антигенов, соответствующих их генотипам
(рис. 43). Но в связи с обменом эритроцитов на ранней стадии
онтогенеза у близнецов не образуются антитела на чужеродные
ОДНОЯЙЦОВЫЕ БЛИЗНЕЦЫ
ОБА ПЛОДА НАСЛЕДУЮТ
ФАКТОРЫ АИВ
ДВУЯЙЦОВЫЕ БЛИЗНЕЦЫ
ПЕРВЫЙ ППОД ВТОРОЙ плод
НАСЛЕДУЕТ НАСЛЕДУЕТ
ФАКТОР А ФАКТОР В
ВСЛЕДСТВИЕ АНАСТОМОЗА СОСУДОВ
ПРОИСХОДИТ ОБМЕН КРОВЕОБРАЗУЮ-
ЩИМИ КЛЕТКАМИ, НО ОБА ПЛОДА
ИМЕЮТ ОДИНАКОВЫЙ ТИП КРОВИ
ПЕРВЫЙ ПЛОД ПОЛУЧАЕТ ФАКТОР В,
ВТОРОЙ ПЛОД ПОЛУЧАЕТ ФАКТОР А
БЛИЗНЕЦЫ ИМЕЮТ ИДЕНТИЧНЫЙ
ТИП КРОВИ (АВ)
БЛИЗНЕЦЫ ИМЕЮТ СМЕСЬ КРОВИ
ДВУХ ТИПОВ: ТИП А (БЕЗ В)
И ТИП В (БЕЗА)
Рис. 43. Схема анастомоза сосудов у двуяйцевых близнецов (справа), вызываю-
щего мозаичность эритроцитов. У однояйцовых близнецов, несмотря на анасто-
моз сосков, тип крови всегда одинаковый (по И. Иогаисоиу и др., 1970)
216
антигены друг друга (явление толерантности), поэтому в
течение всей жизни можно проводить (как и у однояйцовых
близнецов) пересадку органов и тканей.
Около 90 % телок из разнополых двоен в результате анасто-
моза сосудов становятся бесплодными — фримартинами, и их,
естественно, приходится выбраковывать. Сейчас существует
точка зрения, что антиген Н—Y направляет развитие недиффе-
ренцированных гонад по мужскому (тестикулярному) типу. Бес-
плодие самок вызвано не передачей тестостерона от бычка-близ-
неца телочке, как предполагали раньше, а химерностью половых
хромосом у самки (XX/XY). Развитие в химерных яичниках кле-
ток XX по мужскому типу определяется антигеном Н—Y, кото-
рый вырабатывается клетками XY. С помощью групп крови
можно выявить до 98 % дизиготных пар. Химеризм эритроцитов
встречается у человека (очень редко), овец и свиней.
Межпородная и внутрипородная дифференциации. Группы
крови, как и другие биохимические полиморфные системы, по-
зволяют изучать историю эволюции домашних животных, проис-
хождение и родство пород, генетическую структуру их и внутри-
породную дифференциацию, проводить планирование и кон-
троль селекционного процесса.
Одна из самых жирномолочных пород мира — джерсейская
имеет ряд В-аллелей, которые не встречаются у других западноев-
ропейских пород скота, кроме гернсейской. У этой породы также
высока частота антигена Z', тогда как у западноевропейских пород
он редок, но зато встречается у зебу Африки, Азии и скота юга
Восточной Европы. Подтверждено с помощью групп крови генеа-
логическое родство голландского и холмогорского скота.
В. Н. Тихонов (1991) установил, что антиген Fa встречается
почти у всех животных вьетнамской черной, польско-китайской
и беркширской пород свиней (около 100 %), в меньшей степени
у кемеровской, миргородской и северокавказской (54 и 38 %),
низкая частота у украинской степной (3 %), тогда как у свиней
крупной белой, эстонской белой и других пород этот антиген
отсутствует или имеет очень низкую частоту. Эти исследования
объяснили филогенез многих современных пород от древних
свиней Юго-Восточной Азии и показали генетическое сцепление
локусов систем групп крови F с локусом белой масти. Выявлена
и внутрипородная дифференциация животных по группам крови
в пределах линий и семейств. Ряд ученых указывают на возмож-
ность поддержания генетического сходства животных линий с
родоначальником и выведения генетически маркированных
линий животных с использованием групп крови.
Построение генетических карт. Изучение сцепления локусов
групп крови и биохимических полиморфных систем и частоты
кроссинговера между ними дает возможность составить генети-
ческие карты хромосом. Карты хромосом позволяют следить за
217
наследственной передачей болезней, если они сцеплены с груп-
пами крови или другими полиморфными системами.
У свиней J- и С-локусы групп Крови сцеплены с генами
главного локуса гистосовместимости свиней (SLA). Частота
кроссинговера между J- и С-локусами равна 6 сМ, а между
J-локусом и SLA — 9,8 сМ. В. Н. Тихонов и др. (1982) впервые
картировали локус структурного гена аллотипа А=23 альфа-гло-
булина сыворотки крови в хромосоме № 16 свиньи.
В. Н. Тихоновым обобщены данные по картированию боль-
шой группы локусов у свиней (рис. 44). Определено расстояние
локусов от центромеры. По мнению других авторов, J-, С- и
SLA-локусы находятся в 7-й хромосоме, локус группы крови Н,
контролирующий ингибицию А- и О-факторов (S) и чувствитель-
ность к галотану (Hal), — в 6-й хромосоме (Р. Thomsen, 1990).
Связь групп крови с резистентностью к болезням. Известно, что
заболеваемость язвой двенадцатиперстной кишки у людей с груп-
пой крови О (I) в 1,3—1,5 раза выше, чем у лиц с другими группа-
ми. Ср|ди лиц с А (П)-группой частота пораженности туберкуле-
зом и раком желудка в 1,4 и 1,2 раза соответственно больше, чем
у лиц с О-группой.
К настоящему времени выполнено огромное количество работ
по изучению корреляции групп крови и биохимических поли-
морфных систем с резистентностью к болезням, а также с раз-
личными признаками продуктивности. Поиск подобных связей
основан на четырех (рис. 45) теоретических положениях:
Рис. 44. Генетическая карта 15-й хромосомы свиньи (по Тихонову, 1984). Все
расстояния от центромеры до локусов н между локусами указаны в сантиморганах
(сМ). (Использованы данные Андерсена, 1970; Расмусена н др., 1982; Йоргенсена
н др., 1981; Хрубана н др., 1976; Джунеа н др., 1982)
218
ПЛЕЙОТГОПИЯ
МАРКЕРНЫЙ ГЕН
ГРУППЫ КРОВИ,
БИОХИМИЧЕСКИЕ
ПОЛИМОРФНЫЕ
СИСТЕМЫ
РЕЗИСТЕНТНОСТЬ ИПИ
ВОСПРИИМЧИВОСТЬ к
БОЛЕЗНИ
ВНЕШНЯЯ СРЕДА
(ПИТАНИЕ. КЛИМАТ.
ИНФЕКЦИИ. ПРО-
ДУКТИВНОСТЬ И ТД)
ГЕНЫ
ХРОМОСОМЫ
ГЕН РЕЗИСТЕНТ-
НОСТИ ИЛИ ВОС-
ПРИИМЧИВОСТИ
МАРКЕРНЫЙ ГЕН
СЦЕПЛЕНИЕ
РЕЗИСТЕНТНОСТЬ ИЛИ
ВОСПРИИМЧИВОСТЬ к
БОЛЕЗНИ
ГЕНЫ
ГЕТЕРОЗИС
ВНЕШНЯЯ СРЕДА
МАРКЕРНЫЙ ГЕН
(ГЕТЕРОЗИГОТ А)
АА < Ал > м
РЕЗИСТЕНТНОСТЬ или
ВОСПРИИМЧИВОСТЬ к
БОЛЕЗНИ <
ВНЕШНЯЯ СРЕДА
ИММУНОЛОГИЧЕСКАЯ НЕСОВМЕСТИМОСТЬ "МАТЬ-ПЛОД~
МАТЬ АНТИГЕНЫ ПЛОД НОВОРОЖДЕННЫЙ
Рис. 45. Генетические причины взаимосвязи групп крови, биохимических поли-
морфных систем с резистентностью, восприимчивостью к болезням и продуктив-
ностью
1) плейотропном действии генов, т. е. когда гены,
обусловливающие группы крови или биохимические полиморф-
ные системы (маркерные гены), прямо или косвенно влияют на
резистентность к болезням и продуктивность;
2) сцеплении между локусами групп крови или биохими-
ческих полиморфных систем и локусами, влияющими на резис-
тентность или продуктивность;
3) гетерозисе, когда гетерозиготность по группам крови
или биохимическим полиморфным системам повышает резис-
тентность к болезням или продуктивность;
4) иммунологической несовместимости ма-
тери и плода, при которой вследствие разных генотипов у матери
й плода по группам крови возникают, например, гемолитическая
болезнь у жеребят, поросят, эритробластоз у человека.
219
Н-группа крови используется для определения чувствитель-
ности свиней к синдрому стресса (PSS), который характеризуется
внезапной смертью животных, вызванной транспортировкой,
высокой температурой и другими стрессорами. К PSS чувстви-
тельны гомозиготные НаНа особи. Локусы Н-системы группы
крови и PHI (фосфогексоизомеразы) связаны с чувствительнос-
тью к синдрому злокачественной гипертермии (MHS), который
вызывается лекарственными веществами, галотаном.
Аллель В21 группы крови у птиц коррелирует с повышенной
резистентностью к болезни Марека. Цыплята генотипа В2/В2
более резистентны к вирусу саркомы Рауса, чем особи с геноти-
пом Ва/В5.
Гемолитическая болезнь новорожденных. В 1940 г. Левин с
сотрудниками открыли гемолитическую болезнь новорожденных
у человека, обусловленную несовместимостью генотипов матери
и плода. В браках резус-положительных (Rh+) мужчин с резус-
отрицательными (Rh—) женщинами могут рождаться резус-поло-
жителНтые дети. На 2—3-м месяце беременности кровь резус-по-
ложительного плода, поступая в организм матери, вызывает об-
разование у нее антител против резус-антигена. Антитела,
проникая через плаценту в организм плода, вызывают эритроб-
ластоз (разрушение эритроцитов).
Во многом сходное заболевание встречается у поросят, жере-
бят и телят. Но в отличие от человека плацента указанных видов
непроницаема для антител и они накапливаются в молозиве
(рис. 46). Только после сосания матери в первые 24—48 ч у
молозиво с
АНТИТЕЛАМИ
Рис. 46. Развитие гемолитической болезни у жеребят:
А — эритроциты плода попадают через плаценту и кровоток матери; Б — образовавшиеся в
крови антитела поступают с молозивом в организм жеребенка, вызывая разрушение эритро-
цитов
220
новорожденного наблюдаются патологические изменения в виде
желтушности склеры глаз, слабости, учащенного дыхания, сни-
жения числа эритроцитов. Молодняк в таких случаях погибает в
течение нескольких дней.
У лошадей изогемолиз новорожденных наиболее часто возни-
кает, когда жеребята имеют А1- и Q-антигены соответствующих
систем групп крови, наследуемых от отца и отсутствующих у ма-
терей. Иногда иммунологический конфликт наступает при насле-
довании потомков от отца антигенов R и S. Своевременное неза-
долго до выжеребки выявление антител у матерей и поение жере-
бенка первые два дня жизни молозивом другой кобылы позволяют
избежать заболевания. В это время молозиво матери сдаивают.
Частота изогемолиза новорожденных у жеребят английской
чистокровной породы составляет около 1 %. Полагают, что эта
болезнь в основном встречается у лошадей арабской породы и
других, от нее происходящих.
Естественный изогемолиз новорожденных у крупного рогато-
го скота встречается редко, поэтому до 1970 г. не было зареги-
стрировано ни одного случая заболевания. В настоящее время
имеется много данных о том, что в стадах, вакцинированных
против анаплазмоза, частота изогемолиза (NI) достигает 3—20 %.
По данным Керр (1973), в одном стаде от 24 коров, за год до
отела вакцинированных против анаплазмоза, было 66,6 % пора-
женных NI телят, из которых 18 % погибло. Полагают, что в
большинстве случаев изогемолиз новорожденных у крупного ро-
гатого скота — следствие вакцинации против анаплазмоза.
У свиней, как и у лошадей, основная причина NI — несо-
вместимость по группам крови матери и плода.
Связь групп крови с продуктивностью. Селекционеры давно
мечтают найти маркеры для прогнозирования продуктивности в
раннем возрасте. Удобно было бы использовать в качестве гене-
тических маркеров группы крови и биохимические полиморфные
системы. Много сил потрачено на изучение этой проблемы, но и
сегодня она далеко не решена. —-
У шведского черно-пестрого и красно-пестрого скота выявле-
на положительная корреляция аллеля BO1Y2D' системы В с со-
держанием жира в молоке. Л. К. Эрнст и др. (1973) показали,
что аллель h В-системы связан с жирномолочностью коров ряда
линий черно-пестрой и ярославской пород. По данным
В. Ф. Красоты, коровы костромской породы с некоторыми алле-
лями (О, Р) В-системы отличались более высокой молочностью.
Аллели В1 и В3 у кур коррелируют с высокой яйценоскостью.
Повышение продуктивности может быть связано и с гетерози-
Готностью по группам крови. Так, увеличение гетерозиготности
По В-локусу у кур привело к повышению вылупляемости цып-
лят, интенсивности роста и яйценоскости.
Одна из гипотез, объясняющих гетерозис (превосходство гиб-
221
ридов над родительскими формами по степени развития того или
иного признака), — гипотеза сверхдоминантнрсти. Она основы-
вается на утверждении, что в гетерозиготе гены более полно
проявляются, чем в гомозиготе. В. Н. Тихонов установил, что
гетерозиготность по некоторым антигенам групп крови ведет к
гетерозису. При спаривании гомозиготных особей типа Gbb х
х Gbb в среднем от свиноматки получено 10,67 поросенка, при
спаривании гетерозиготных животных типа Gab х Gab — 11,47, а
при спаривании Gaa х Gbb — 12,34 поросенка (гетерозис по
плодовитости). В последнем случае масса гетерозиготных поро-
сят в 2-месячном возрасте выше на 11 %.
БИОХИМИЧЕСКИЙ ПОЛИМОРФИЗМ
В течение эволюции в результате мутаций изменяются гены,
поэтому в популяции они встречаются не в одной, а в двух и более
формах (множественные аллели). Полиморфизм — одновременное
присутствие двух или более генетических форм одного вида в
таком численном отношении, что их нельзя отнести к повторным
мутациям. Поэтому термин «генетический (биохимический)
полиморфизм» применяется в тех случаях, когда локус хромосомы
в популяции имеет два и более аллелей с частотой больше 0,01.
Ген, представленный более чем одним аллелем, называют поли-
морфным геном. Доля полиморфных локусов точно неизвестна, но
полагают, что в популяциях многих видов она достигает 25—50 %.
Так, у человека из 50 тыс. или более структурных локусов по
крайней мере 30 % могут быть полиморфными.
Основными методами изучения полиморфизма белков и фер-
ментов являются электрофорез в крахмальном или акриламид-
ном геле и иммуноэлектрофорез. Белки (в том числе ферменты)
находятся в растворе в виде частиц, несущих определенный
электрический заряд, которые под действием электрического
тока перемещаются к катоду или аноду.
Сейчас у сельскохозяйственных животных изучено более 150
полиморфных локусов белков (в том числе ферментов) крови,
молока, тканей (табл. 34), расположенных в аутосомах. Установ-
лено сцепление трех локусов казеина молока aSi-Cn, Р-Сп и
к-Сп (каппа-казеин).
34. Некоторые биохимические полиморфные системы
Система Символ локуса Число аллелей
рога^й скот Свиньи Овцы Лошади Куры
Гемоглобин НЪ 10 — 5 2 2 Альбумин Alb 9 3 7 3 3 Трансферрин Tf 12 '5 13 10 4
222
Продолжение
Система Символ локуса Число аллелей
ponS«от Свиньи Овцы Лошади Куры
Церулоплазмин Ср 3 2 — — — Эстераза Es 2 2 3 6 3 р-Лактоглобулин 0-Lg 4 _ _ _ _ asi-Казеин asj-Cn 4 р-Казеин Р-Сп 6 к-Казеин к-Сп 2 у-Казеин у-Сп 4
Аллели гемоглобинового локуса обозначаются так: НЬА, НЬВ и
т. д., а генотип — НЬАНЬА, НЬВНЬВ и т. д. В связи с кододоми-
нантным наследованием большинства биохимических систем фе-
нотип животного соответствует его генотипу, поэтому фенотип
, можно записать НЪАА или НЬА, НЪВВ или НЬВ.
J Замещение аминокислот в белке может вызвать функциональ-
. ные различия полиморфных форм. Например, у человека кроме
нормального гемоглобина НЬ^ известно более 50 патологических
' вариантов S, С, G и т. д., которые вызывают различные гемогло-
бинопатии (серповидно-клеточная анемия S, талассемия С).
Одним из первых был открыт гемоглобин серповидных эритроци-
тов, который от нормального отличается заменой в шестом поло-
жении глутаминовой аминокислоты на валин. В районах распро-
странения тропической малярии лица, гомозиготные по HbsHbs,
погибают в раннем возрасте от серповидно-клеточной анемии.
Гетерозиготы HbAHbs устойчивы к малярии, а люди с нормаль-
ным генотипом НЬАНЬА предрасположены к заболеванию.
Это неоспоримый пример сбалансированного полиморфизма,
когда приспособленность гетерозигот выше, чем гомозигот, а оба
аллеля сохраняются в популяции с промежуточной частотой. Это
доказывает существование однолокусного гетерозиса по устойчи-
вости к болезни. В. П. Эфроимсон (1968) выдвинул гипотезу о
^том, что иммунитет к малярии имеет адаптивное значение и
«обусловлен изменением молекулы гемоглобина НЬ, что препят-
Я ствует его использованию малярийным плазмодием.
| Гемоглобин выполняет важную для организма функцию пере-
’ носа кислорода из органов дыхания к тканям и переноса угле-
кислого газа от тканей в органы дыхания. У крупного рогатого
- скота открыто 10 типов гемоглобина, но у скота швицкой, ко-
1 стромской, джерсейской и других пород в основном встречаются
s аллели НЬА и НЬВ. У животных черно-пестрой, айрширской,
т герефордской и других пород имеется только один тип А.
|. Хорошо изучен полиморфизм трансферрина (Tf), кото-
! рый переводит железо плазмы в диионизированную форму и
223
переносит его в костный мозг, где оно используется вновь для
кроветворения. Трансферрин также подавляет размножение ви-
русов в организме. У человека недостаточность трансферрина
может быть следствием некоторых перенесенных заболеваний, в
частности наследственного гемохроматоза. Количество Tf снижа-
ется при циррозе печени, инфекционных болезнях. На рисунке
47 представлена схема расшифровки электрофореграммы типов
трансферрина. Известно 12 аллелей Tf, но среди европейских
пород наиболее часто встречаются аллели A, Di, D2 и Е.
Белок церулоплазмин (Ср) играет центральную роль в
обмене меди в организме, являясь основным переносчиком ее в
ткани. Нарушение функции церулоплазмина или снижение его
содержания в плазме крови ведет, например у человека, к воз-
никновению генетического заболевания нервной системы с не-
кротическими изменениями в печени.
Все больше появляется работ по иммуногенетическому
анализу белковых систем. Генетически детерминируемые анти-
генные^варианты сывороточных белков, по которым различают
особей одного вида, называют аллотипами. О. К. Баранов
(1981) у американской норки выявил 8 аллотипов липопротеина
(Lpm), обозначенных цифрами от 1 до 8. Липопротеины
транспортируют липиды. Предполагают, что аллотипы Lpm-
системы кодируются комплексом тесно сцепленных гомоло-
гичных генов. Аллотипы в основном наследуются аллогруппами,
Миграция __ (+)Фенотип Генотип
Ст?рт Трансфер^—---------------
к ' I I IBk jS®. TfA Tf*Tf*
10* III |\ /ЯШМ TfD< TfD'TfD’
I II It 'SDH)' TfD> Tf°2Tf^
i0j I 11 ahs® % Tf£ ”£Tf£
|0| III 115.1S ШВ i, TfAD> TfATfD<
}й| I II II I is TfAD2 TfATf°i
I II II о TfAE Tf'rt'
'0^ Illi TfD1D2 Tf^
1'0/ I III С \b®A rfD’E TfW
I I II I' ВШР TfD2E Tf*Tf‘
E D2 D, C BA
Рис. 47. Расшифровка электрофореграммы различных типов сывороточных
трансферринов крупного рогатого скота
224
например Lpm6-8, Lpm4>6> 8, Lpm3’4’6*8 и т. д. Аллогруппа —
совокупность аллотипов, наследуемых как одна группа. Со-
вокупность сцепленных генов одной хромосомы, контроли-
рующих аллогруппу, называют гаплотипом.
У свиней идентифицированные аллотипы липопротеина де-
терминируются генами пяти локусов, временно обозначенных р,
г, s, t, и. Закрытая система Lpb включает 8 аллелей, Lpr и Lpu —
по два аллеля, а открытые системы Lps и Lpt — один аллель. Все
аллотипы определяются аутосомными кодоминантными генами.
Локусы u, р, t тесно сцеплены, а г и s локализованы в разных
хромосомах. Имеются данные о связи некоторых типов Lpb с
артериосклерозом у свиней.
ЗНАЧЕНИЕ БИОХИМИЧЕСКОГО ПОЛИМОРФИЗМА
Биохимические полиморфные системы белков используются
для следующих целей:
1) изучения причин и динамики генотипической изменчивос-
ти, составляющей основу эволюционной генетики;
2) уточнения происхождения отдельных животных;
3) описания межпородной и внутрипородной дифференциа-
ции, изучения филогенеза и аллелофонда пород, линий и се-
мейств, а также генетических процессов, происходящих в попу-
ляциях животных, и изменения их генетической структуры в
процессе селекции;
4) определения моно- и дизиготных двоен;
5) построения генетических карт хромосом;
6) подбора гетерозисной сочетаемости;
7) выявления связи с резистентностью к заболеваниям, про-
дуктивностью;
8) использования биохимических систем в качестве генетичес-
ких маркеров в селекции животных.
Изучение 9 полиморфных систем белков у 10 главных групп
скота позволило подтвердить вывод о том, что зебувидный скот
Индии значительно отличается от европейских пород и принад-
лежит к другому виду (Bos indicus). Санга (тип африканского
горбатого скота) занимает промежуточное положение между ин-
дийским зебу и европейскими породами, но в то же время имеет
свои уникальные признаки. Часть из них — следствие обмена
генов в результате миграции зебувидного скота Индии в Африку.
Использование генных частот позволяет вычислить генетические
дистанции между породами и определить их эволюционную вза-
имосвязь. На рисунке 48 в качестве примера показаны эволюци-
онные взаимосвязи между 14 породами скота.
По данным С. А. Петрушки (1970), частота аллеля p-LgA была
в 2 раза выше у животных голландской и симментальской пород
(0,514 и 0,436) в сравнении с бурой латвийской (0,210). Многие
225
Герефордская
0,2
0,08
0,06
0,04
0,02
0,02
0,04
0,06
0,08
Красный ангус
Черный ангус
Гернсейная
Швицкая
--- Исландская
Джерсейская
Шароле,
Retinto
Delidia J
Mertobenga > Португальские
Alentejana J п0Р°^ы
Американская J
длиннорогая
Испанские
породы . Иберийский
скот
Рис. 48. Эволюционные взаимосвязи между 14 породами скота, вычисленные на
основании генетического расстояния но 14 локусам. Филогенетическое древо изо-
бражено в полярных координатах; расстояние оценивалось способом наименьших
квадратов радиальной длины каждого сегмента (по Kidd п др., 1980)
европейские породы имеют очень низкую частоту типов транс-
феррина TfB и Тг.
Использование полиморфных систем белков вместе с группа-
ми крови повышает точность определения происхождения жи-
вотных. Так, по группам крови отцовство можно установить в
81 % случаев, а дополнительные анализы только типов транс-
феррина повышают точность до 90 %.
По данным В. В. Пилько, Ю. О. Шапиро и А. С. Гурьяновой
(1970), в четырех хозяйствах Белоруссии у коров бурой латвий-
ской и костромской пород с TfDD удой был выше на 256—
270 кг, чем у животных с другими генотипами. Л. С. Жеброский
и др. (1979) на большом материале показали, что ген к-СпА во
всех стадах связан с повышенной молочностью. Таким же эф-
фектом обладает аллель ₽-LgA, но в то же время он снижал
содержание жира в молоке коров черно-пестрой породы.
Данные по красной датской породе свидетельствуют о том,
что только 3 % генетической изменчивости в содержании жира и
5 % в молочности обусловлены различиями по группам крови.
Видимо, есть большая вероятность установления более тесной
корреляции генетических полиморфных систем с резистентнос-
тью к некоторым заболеваниям вследствие менее сложной их
генетической детерминации, чем признаков продуктивности.
226
Анализ полиморфизма яичного белка овоглобулинового локу-
са G3 показал, что куры с типом АВ более устойчивы к пуллоро-
зу—тифу. Восприимчивость к этому заболеванию кур породы
леггорн была связана с аллелем G^, а породы корниш — с алле-
лем GB3.
В Австралии, а потом в Кении у породы овец ромни-марш с
типом гемоглобина НЬА найдена более высокая резистентность к
гемонхозу (заболевание, вызываемое нематодами, паразитирую-
щими в сычуге), чем у животных с гемоглобином типов НЬВ и
НЬАВ. Однако имеются сведения и об отсутствии связи типов
гемоглобина у местных флоридских овец с невосприимчивостью
к гемонхозу.
Устойчивость овец к лептоспирозу связана с гетерозиготнос-
тью по гемоглобиновому локусу (НЬАВ), тогда как особи с
типом А или В более восприимчивы. Эта инфекционная болезнь
проявляется у животных кратковременной лихорадкой, желту-
хой, гемоглобинурией, абортами и другими признаками. У сви-
ней найдена ассоциация лептоспироза с аллелем амилазы Аша.
Уровень антител к лептоспирозу увеличивался у животных с
этим аллелем, а с аллелем Апг8 — уменьшался.
У свиней установлена связь типов фермента фосфогексоизо-
мераза (PHI) с синдромом злокачественной гипертермии (MHS).
Коэффициент корреляции между чувствительностью к MHS и
генотипом РН1В/РН1В равен 0,19, а относительный риск возник-
новения MHS у особей этого генотипа по отношению к имею-
щим его животным был 18,8.
Изучение новых биохимических полиморфных систем позво-
лит глубже понять динамику генотипической изменчивости в
популяциях и механизмы поддержания этой изменчивости, изме-
нение генетической структуры популяций при селекции, плани-
рование и контроль с их помощью селекционного процесса.
Можно рассчитывать на выявление более однозначных связей
отдельных аллелей или их совокупности с резистентностью к
болезням, признакам продуктивности и использовать полиморф-
ные системы как генетические маркеры в селекции.
Контрольные вопросы. 1. Что такое генетическая система групп крови, тип
крови, феногруппа? 2. В чем заключаются особенности наследования групп
крови? 3. Как определяются группы крови у животных? 4. Какие теоретические
предпосылки лежат в основе связи групп крови с продуктивностью и устойчивос-
тью к болезням? 5. Какое значение группы крови имеют для практики? 6. Почему
возникает гемолитическая болезнь новорожденных? Какие методы профилактики
этой болезни вы знаете? 7. Что лежит в основе генетического полиморфизма?
8. Какое значение для практики имеет биохимический полиморфизм?
227
Г л а в a 14
ГЕНЕТИЧЕСКИЕ ОСНОВЫ ИММУНИТЕТА
Иммунитет — невосприимчивость организма к инфекцион-
ным агентам и генетически чужеродным веществам антигенной
природы. По Р. В. Петрову (1983), иммунитет — способ защиты
организма от живых тел и веществ, несущих на себе признаки
генетической чужеродности.
Главная функция иммунитета — иммунологический надзор за
внутренним постоянством (гомеостазом) организма. Следствие*
этой функции — распознование, а потом специфическое блоки-
рование, нейтрализация или уничтожение генетически чужерод-
ных веществ (бактерий, вирусов, раковых клеток и т. д.). За
сохранение генетически обусловленной биологической индиви-
дуальности отвечает иммунная система организма — совокупность
всех лимфоидных органов и скоплений лимфоидных клеток. Она
состоит из центральных и периферических органов. Централь-
ные органы иммунной системы включают тимус, сумку Фабри-
ция (у птиц) и ее аналог у млекопитающих, костный мозг,
пейеровы бляшки и миндалины. К периферическим органам
относят лимфатические узлы, селезенку и кровь. Иммунная сис-
тема и ее главные исполнители — лимфоциты обеспечивают спе-
цифическую реакцию организма на чужеродные антигены.
Кроме этой системы существуют механизмы, обеспечивающие
первичную ступень неспецифической сопротивляемости орга-
низма паразитам (бактериям, вирусам, гельминтам и т. д.).
К неспецифическим факторам защиты относят кожные и сли-
зистые покровы, фагоциты (нейтрофилы, тканевые макрофаги),
естественные иммуноглобулины, систему комплемента (вклю-
чающая около 20 белков), интерферон, лизоцим, пропердин,
лактоферрин и т. д. Неспецифические факторы защиты действу-
ют в широком спектре, хотя ряд из них может быть в большей
или меньшей степени направлен против некоторых групп микро-
организмов. Интерферон обладает противовирусным действием,
пропердин характеризуется выраженным антимикробным свой-
ством, комплемент осуществляет бактериологическое действие.
В то же время фагоциты и комплемент участвуют и в специ-
фических реакциях. Фагоциты, кооперируясь с Т- и В-лимфоци-
тами, принимают участие в иммунном ответе.
228
Большинство защитных механизмов организма находится под
генетическим контролем. Видимо, содержание лизоцима компле-
мента, пропердина и других веществ наследуется полигенно. На
генетическое разнообразие по этим признакам указывают меж-
породные, межлинейные и межсемейные различия. Имеются ге-
нетические дефекты, ведущие к потере способности нейтрофи-
лов к фагоцитозу. Один из них впервые открыт у человека и
назван синдромом Чедиака—Хигаши, а сейчас он известен и у
крупного рогатого скота (особенно герефордской породы),
норок, бизонов, мышей и др. Синдром характеризуется наличи-
ем в цитоплазме лейкоцитов больших гранул. У крупного рогато-
го скота это приводит к частичному альбинизму, светобоязни и
чувствительности к инфекциям. У алеутских голубых норок из-
вестна алеутская болезнь, вызываемая вирусом, при которой на-
блюдаются нарушения, как и при синдроме Чедиака—Хигаши.
Синдром у скота и норок наследуется как аутосомно-рецессив-
ный признак. Заболевают гомозиготные особи (аа).
Было также обнаружено у человека и собак генетически де-
терминируемое снижение числа нейтрофилов — синдром цикли-
ческая нейтропения. Эта болезнь встречается у колли с серым
окрасом, которые погибают до полового созревания. Рецессив-
ный ген серой окраски у колли обладает и плейотропным эф-
фектом в отношении этого летального дефекта.
Клеточная и гуморальная системы иммунитета. Стволовые
лимфоидные клетки, мигрировавшие в тимус, превращаются в
Т-лимфоциты (Т-клетки), которые ответственны за клеточ-
ную форму иммунного ответа, а сформированные в сумке Фаб-
риция (у птиц) или ее аналоге у млекопитающих становятся
В-лимфоцитами (В-клетки), которые ответственны за
реализацию гуморального иммунного ответа. Т- и В-системы
лимфоцитов состоят из субпопуляций клеток. Так, Т-клетки
образуют субпопуляцию Т-хелперов, Т-супрессоров,
Т-киллеров. Первые из них способствуют превращению
В-лимфоцитов в плазматические клетки, вторые блокируют
антителообразование В-лимфоцитами и участвуют в становлении
и поддержании иммунологической толерантности, третьи разру-
шают клетки чужеродных трансплантантов и злокачественные
клетки.
Многообразие иммунологических реакций является следстви-
ем кооперации Т- и В-лимфоцитов и макрофагов, в результате
чего образуются антитела (иммуноглобулины). Синтез антител
осуществляется в плазматическихклетках, происходя-
щих из В-лимфоцитов. Одна клетка после стимуляции антигена
за 1 с секретирует около 2 тыс. молекул одной специфичности и
определенного класса.
На поверхности В- и Т-лимфоцитов имеются рецепторы им-
муноглобулиновой природы, причем на В-лимфоцитах их в де-
229
сятки и сотни раз больше. Рецепторы — это макромолекулярные
структуры клеточной поверхности, с помощью которых клетки
узнают антигены. Поэтому проблема специфических рецепто-
ров — одна из центральных в иммунологии, так как благодаря
этому происходит распознавание генетически «своего» и «чужо-
го». Синтез и специфичность рецепторов контролируются гене-
тически.
В-система в большей степени ответственна за иммунитет при
многих бактериальных инфекциях, антитоксический иммунитет,
анафилаксию, аллергию немедленного типа, некоторые аутоим-
мунные заболевания (красная волчанка и др.). Т-система играет
главную роль в иммунитете против большинства вирусных ин-
фекций, туберкулеза, бруцеллеза, туляремии, в трансплантацион-
ном и противоопухолевом иммунитете, аллергии замедленного
типа, ряде иммунопатологий и др.
СТРУКТУРА ИММУНОГЛОБУЛИНОВ
4'
Иммуноглобулины — семейство белков, специфически реагиру-
ющих с антигеном, который индуцировал их образование. Тер-
мины «антитело» и «иммуноглобулин» — синонимы. У большин-
ства млекопитающих иммуноглобулины разделяют на 5 классов:
IgG, IgA, IgM, IgD, IgE. Например, у взрослых свиней есть 3
типа сывороточных иммуноглобулинов: IgG, IgA, IgM и 2 под-
класса IgG (19S и 7S), которые по физико-химическим свойст-
вам аналогичны соответствующим 1g человека. Кроме сыворотки
крови иммуноглобулины находятся в молозиве, молоке, слюне,
секретах кишечника и т. д.
У всех видов животных и человека молекулы 1g построены из
двух длинных тяжелых (Н) и двух коротких легких (L) полипеп-
тидных цепей, соединенных дисульфидными мостиками. Для
всех классов 1g легкие цепи являются общими, а тяжелые цепи
каждого из 5 классов отличаются по антигенным, иммунологи-
ческим и химическим особенностям. Тяжелые цепи иммуногло-
булинов обозначают буквами греческого алфавита.
Иммуноглобулин IgG IgA IgM IgD IgE
Тяжелые цепи у (гамма) а (альфа) ц (мю) 5 (дельта) е (эпсилон)
Легкие цепи подразделяют на два типа: каппа (к-тип) и
лямбда (Х-тип). N-концевые участки тяжелых и легких цепей
состоят из вариабельных (V) областей, а С-концевые участки
тяжелых и легких цепей являются константными (С). Цепи 1g
представлены не в виде прямых нитей, а образуют петли, возни-
кающие при соединении дисульфидными мостиками аминокис-
лотных остатков внутри цепи. Каждая петля называется доменом.
В молекуле 1g кролика 12 доменов — по 4 на тяжелых и по 2 на
230
легких цепях, которые обозначаются Vh, Сн1, Сн2, СнЗ и Vl.Cl
(рис. 49). Домены Vh и Vl выполняют функцию связывания
антигена. Иммуноглобулин G расщепляется ферментом папаи-
ном на три фрагмента: два Fab-фрагмента связывают антиген и
один Fc-фрагмент ответствен за связывание белка комплемента,
реакцию с макрофагами и др.
Реакция антиген — антитело. Основной момент в процессе
иммунного ответа — узнавание антителом химического маркера,
характерного «чужому» веществу в отличие от «своего». Поэтому
главная биологическая функция антител — их способность всту-
пать в специфическую и быструю реакцию с антигеном, в ре-
зультате чего образуется комплекс антиген — антите-
ло (иммунный комплекс). Иммунный комплекс образуется в
результате связывания активного центра антитела (п а р а т о п а)
с детерминантами антигена (эпитопа). Эти взаимодействия
могут проявляться в виде реакций агглютинации, преципитации,
лизиса, нейтрализации и др.
Антитела могут усиливать фагоцитарную активность макрофа-
гов (опсонизация). Специфичность иммунитета проявляет-
ся в том, что антитела действуют только на тот антиген, под
влиянием которого они образовались. Организм, имеющий анти-
тела, может оставаться в течение различного времени иммунным
О 40 120 200 280 360 440
>----1----1____I____I____I____ '_____।____I___I
НОМЕР АМИНОКИСЛОТНОГО ОСТАТКА
Рис. 49. Схема молекулы IgG кролика:
I —легкие и Я—тяжелые цепи; И—вариабельные области легких и тяжелых цепей (свет-
лые); С — константные области зачернены; s — s — дисульфидные связи; Vi и Cl — домены,
составляющие вариабельные и константные участки легких цепей, Гн, Сн1, Сн2, СнЗ —
.домены, составляющие вариабельные и константные участки тяжелых цепей; Fab (два) и Fc
(один) — фрагменты, образующиеся при расщеплении паЪаином; а, х, у, b, d, е — локализа-
ция известных аллотипических групп
231
против антигена. Следовательно, гуморальный, как и клеточный,
иммунитет обладает иммунологической памятью — способностью
при повторном контакте с антигеном узнавать и отвечать на него
иммунологической реакцией.
В определенных условиях возникает повышенная чувствитель-
ность организма (гиперчувствительность) на повторное попада-
ние данного антигена. Она проявляется в виде аллергии немед-
ленного типа (астма, анафилаксия), т. е. патологической повы-
шенной реакции на антиген, который у нормальных особей не
вызывает болезненных явлений. Существует и повышенная
чувствительность замедленного типа (при ту-
беркулезе, бруцеллезе) — это клеточно опосредованный иммуно-
логический способ повышенного реагирования на чужеродные
вещества. Антитела участвуют в первой форме иммунного реаги-
рования — гуморальном иммунитете. Вторая форма больше свя-
зана с клеточным иммунным ответом в виде гиперчувствитель-
ности замедленного типа.
Прфполагают, что иммуноглобулин может иметь несколько
антигенсвязывающих центров, комплементарных нескольким от-
личным по структуре антигенам, а многие типы антител компле-
ментарны к одной антигенной детерминанте. Антитело способно
функционировать и как антиген. Высокоспецифическая популя-
ция антител может состоять из иммуноглобулинов разной специ-
фичности. Очень небольшие изменения в первичной структуре
антител могут вызвать различия в их специфичности.
ГЕНЕТИКА ИММУНОГЛОБУЛИНОВ
Гены иммуноглобулинов аутосомны, кодоминантны. Струк-
турное разнообразие иммуноглобулинов определяется последова-
тельностью аминокислот.
В биологии существовал принцип «один ген — одна
полипептидная цепь», а также утверждалась неизменность
генома в онтогенезе организма. Однако в случае 1g видно, что
несколько генов кодируют одну полипептидную цепь.
Иммуноглобулины контролируются тремя семействами генов,
расположенными в разных хромосомах. Одно семейство кодиру-
ет синтез всех классов тяжелых цепей (Н), другое — синтез лег-
ких к-цепей, третье — синтез легких Х-цепей.
У мыши вариабельная область легкой Х-цепи кодируется
двумя V-генами, а константная область — четырьмя С-генами
(рис. 50). V- и С-гены называются также V- и С-сегментами.
Перед каждым С-геном находится короткий отрезок ДНК, кото-
рый называется J-сегментом. Любой V-ген может соединиться с
любой парой J-сегмент — С-ген. Следовательно, легкая Х-цепь
кодируется сегментами* V, J, С. В эмбриональном геноме эти
232
Гены легкой JL- цепи
Гены легкой И- цепи Интрон
ми
4 * "" " ' AJ Q
Гены тяжелой цепи 90-300 V-генов
Рис. 50. Гены 1g мыши (1 — легкая Х-цепь; 2 — легкая к-цепь; 3 — тяжелая
цепь; V—ген (сегмент); J—сегмент; D—сегмент; С—ген (сегмент)
сегменты удалены друг от друга, а в зрелых лимфоцитах в резуль-
тате соматической рекомбинации они сближаются.
Для легкой к-цепи имеется несколько сот V-генов, четыре
J-сегмента и один С-ген (см. рис. 50). В зрелом лимфоците
К-цепь кодируется сегментами V, J и С (по одному из многих
сегментов. V и J).
Для тяжелых цепей всех типов существует 100—500 V-генов,
20 D-сегментов, 4 J-сегмента и несколько тесно сцепленных
С-генов. В плазматической клетке тяжелая цепь кодируется сег-
ментами V, D, J, С (см. рис. 50).
Сбор генов 1g осуществляется в два этапа. В результате сома-
тической рекомбинации соединяются V- и J-сегменты легкой
цепи или V-, D- и J-сегменты тяжелой цепи. Часть V- и J-cer-
ментов при этом выбрасывается. Затем происходит транскрип-
ция, образуется пре-иРНК. При сплайсинге про-иРНК (удаляют-
ся интроны и соединяются экзоны) вырезаются интроны и V-, J-,
С-сегменты располагаются рядом. В цитоплазме происходит
трансляция и образуется легкая к-цепь (рис. 51). Такой же про-
цесс осуществляется и при образовании тяжелых цепей 1g. При
иммунном ответе предшественники зрелых лимфоцитов сначала
образуют филогенетически самый древний IgM, а потом в лим-
фоцитах происходит переключение на синтез 1g других классов.
Аллотипы иммуноглобулинов. Это генетически детерминиро-
ванные варианты белков (в данном случае иммуноглобулинов),
по которым особи внутри вида отличаются друг от друга. Алло-
типы представляют отдельные варианты генов иммуноглобули-
нов и обусловливают их генетический полиморфизм. Каждая
молекула иммуноглобулина имеет не один, а несколько аллоти-
пических детерминант (или аллотипических маркеров). Из сель-
233
Эмбриональная ДНК
Трансляция
Белок
Рис. 51. Сборка гена иммуноглобулина из отдельных фрагментов на примере
легких к-цепей (но Тонегава, 1985)
скохозяйственных животных наиболее изучены аллотипы кроли-
ка (табл. 35).
35. Аллотипы иммуноглобулинов кролика (по Кульбергу, 1985)
Локус | Детерминанта | Класс Ig | Локализация
а al, а2, аЗ Все классы V-область к-цепи
X, У х32, уЗЗ To же To же
b Ь4, Ь5, Ь6, Ь9 » С-область, к-цепи
С с7, с21 » С-область, Х-цепи
d dll, dl2 IgG С-область, у-цепи (участок «талии» молекулы Ig)
е el 4, el5 IgG С-область, у-цепи (Fc- участок молекулы Ig)
f fl59, f70, f71, f72, f73 IgA С-область, а-цепи
g g74, g75, g76, g77 IgA То же
Локус не- известен Msl, Ms2, Ms4, Ms5, Ms6 IgM С-область, ц-цепи
То же n81, n82 То же
Аллотипические детерминанты, указывающие аллотипичёскую
группу (локус), обозначают буквой (а, Ь, е и т. д.), а аллели —
цифрой (а1, b , е14 и т. д.). При написании фенотипа аллотипы
разных групп отделяют косой чертой, например а2аЗ/е14е15/Ь5, а
генотип обозначают а2а3е14е15Ь5Ь5.
234
Имеется еще две группы антигенных детерминант иммуногло-
булинов: изотипы и идиотипы.
Изотипы — это антигенная специфичность, общая для всех
особей одного вида. Пять классов иммуноглобулинов (А, М, С,
Е, D) являются изотипами.
Идиотипы — это антигенные различия между антителами,
принадлежащими к одному классу, субклассу и аллотипу у от-
дельных особей. Идиотипы одной особи определяются клонами
клеток, синтезирующими антитела.
В зависимости от числа замен различают простые и сложные
(комплексные) аллотипы. Простые аллотипы возникают при за-
мене одной, двух аминокислот, сложные аллотипы — при замене
многих аминокислот. Например, комплексные Ь4 и Ъ9 аллотипы
константного района к-цепи различаются по 35 % аминокислот.
Гены каждого вида цепи тесно сцеплены, поэтому их аллель-
ные варианты наследуются как единое целое, т. е. аллогруппами
(гаплотипами, группами сцепления). Например, три группы аллоти-
пов кролика (у, х, а) Ун-области и пять групп аллотипов (и, d, е,
f, g) Сн-области наследуются аллогруппами. Ниже показаны алло-
группы кролика, унаследованные потомками от отца и матери'.
VH Си CL
Ср. Су Са1 Са2 к-цепь
У |у" |х” |а3 | \п” \d" |е" \f70 \ д75 | | Ь5
? \У33 \х32 \°2 । \nt1 \d” Iе" \f73 \ д72 I I b4_____
Известно, что в молекуле иммуноглобулина или только к-цепь,
или только Z-цепь сочетается с любым типом тяжелых цепей. В
одной плазматической клетке вырабатываются антитела одной
-специфичности. В гетерозиготных плазматических клетках рабо-
тает только один из двух аллельных генов Ун- и Сн-цепей и один
ген из двух легкой цепи — аллельное исключение (рис. 52). Поэтому
фенотип клетки может не полностью соответствовать ее генотипу,
несмотря на кодоминантное наследование. Однако в связи с на-
личием большого числа плазматических клеток в организме
встречаются все типы антител в соответствии с его генотипом и
любые комбинации материнских и отцовских аллотипов.
Разнообразие антител. Одна из главных и интересных проблем
иммунологии — это объяснение природы происхождения громад-
ного разнообразия антител. Ведь организмы в течение жизни
могут встречаться с десятками тысяч антигенов и должны отли-
чать «чужеродные» агенты от «своих». Но существует ли тогда
235
Ss
эооеоса
в4
ЮО&йОО
а3
ООС
аг
в4
в4
б"
□осеоооооа ДЦК
--------------------------,—— ---------Jxmaoaoaa ДЦК
Гены У-области у----------^Гены С-области
л а* Транскрипция dtt
’ Процессинг
'~^\Тронсляци^^^
д' б,г / т
ОНННИ^Н Тяжелая цепь Ig.
Антитело у-область С-область
Легкая цепь Ц
Рис. 52. Схема синтеза плазматической клеткой тяжелых и легких цепей иммуног-
лобулина. Генотип клетки — Лг/<Г ^УПГ, фенотип клетки — or/d'1/^ — при-
мер алдельиого исключения; <г, a3, d, d, Л4, tr — аллотипы иммуноглобулина
кролика
огромное количество генов антител, передающихся из поколения
в поколение?
Установлено, что разнообразие антител может быть обеспече-
но следующими факторами:
1) наличием ограниченного числа гаметных генов;
2) сборкой и экспрессией генов в соматических клетках из
ограниченного набора зародышевых сегментов;
3) неточностью аппарата сплайсинга РНК, когда соединяются
сегменты V, D и J;
4) соматическими гипермутациями генов антител.
Вам уже известно (см. рис. 50), что набор зародышевых генов
для к-, А.-цеп ей и тяжелой цепи не столь велик: от 2 до 300
V-сегментов, 4 J-сегмента, около 20 D-сегментов и 1—4 С-сег-
мента.
Количество вариантов сборки гена иммуноглобулина, напри-
мер, легкой к-цепи равно произведению чисел V- и J—сегментов.
Соединение V-, D- и J-сегментов может произойти более
10 тыс. способами. Таким образом, число вариантов формирова-
ния активного центра 1g (паратопа) участками легкой и тяжелой
цепи превышает 10 млн.
Разнообразие антител может возникать вследствие нару-
шения соединения V-, D- и J-сегментов, а также вклинивайия
лишних нуклеотидов уже не в ДНК, а при сплайсинге
про-иРНК. В результате образуется несколько измененная
иРНК и при трансляции изменяется последовательность ами-
нокислот в иммуноглобулине.
Значительный источник разнообразия антител — это повы-
236
шенная частота соматических мутаций в вариабельных доменах,
особенно в гипервариабельных районах. Показано, что в V-райо-
не Ig происходит три мутации на 30 делений В-лимфоцитов, т. е.
на несколько порядков превышает обычную частоту мутаций.
Предполагают наличие в В-клетках специальных ферментов,
усиливающих темп мутирования.
Таким образом, при наличии различных вариантов сборки
г* зародышевых генов, неточности соединения сегментов, вставок
пар нуклеотидов и соматических мутаций может возникнуть
более 1 млрд типов антител.
ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ ИММУННОГО ОТВЕТА
Иммунный ответ, или иммунологическая ре-
активность, — высокоспецифическая форма реакции организ-
ма на чужеродные вещества (антигены). При иммунном ответе
^юисходят распознавание чужеродного агента и его элиминация,
ри введении антигена возникает первичный иммунный
ответ — приблизительно через 2 дня в крови образуются антите-
ла, титр которых возрастает, достигает максимума (к 4—6-му
дню), а затем падает. Вторичный иммунный ответ воз-
никает на повторное введение того же антигена и характеризуется
более высоким и быстрым нарастанием титра антител. Подобная
реакция более усиленного образования антител на повторное вве-
дение антигена, как вы знаете, называется иммунологйчес-
кой памятью, обусловлена наличием клеток иммунологичес-
кой памяти и может сохраняться в течение многих месяцев и даже
лет. Иммунный ответ зависит от генотипа организма.
Иммунный ответ на инфекцию в общем виде показан на ри-
сунке 53. Сначала антиген захватывается (/) представляющей
клеткой (макрофагом). Внутри макрофага антиген перерабатыва-
ется (процессинг антигена) и попадает на его поверх-
ность (2). Антиген на поверхности макрофага узнает активирован-
ный Т-хелпер (3). Т-супрессоры при иммунном ответе взаимодей-
ствуют с Т-хелперами и В-лимфоцитами. Т-хелпер активирует
В-лимфоцит, на поверхности которого находится процессирован-
ный антиген (4). В-лимфоциты на своей поверхности имеют ре-
цепторы-иммуноглобулины, которыми они узнают и связывают
циркулирующий в организме антиген (5). Активированные В-
лимфоциты пролиферируют и превращаются в клон плазматичес-
ких клеток (б), а некоторые из их потомков становятся клетками
памяти (7), обеспечивающими быстрый ответ на инфекцию в бу-
дущем. Клон плазматических клеток продуцирует антитела, кото-
рые связываются с антигеном, маркируют его (8), антигены узна-
ются и уничтожаются макрофагами (9).
При вирусной инфекции ДНК или РНК вируса попадает в
клетку, а вирусные белки остаются на клеточной мембране
237
(рис. 54). Цитотоксические Т-клетки (Т-киллеры) своими рецеп-
торами специфически узнают вирусные антигены только в ком-
бинации с белком -главного комплекса гйстосовместимости
(МНС) класса I, которые имеются почти на всех клетках орга-
низма. МНС класса I определяют иммунологическую индивиду-
альность клетки. В отличие от антител Т-рецепторы не узнают и
не связывают антиген, если тот не находится вместе с белком
МНС. После узнавания. антигенов цитотоксические Т-клетки
убивают зараженные вирусом клетки.
Мутации любых локусов, обусловливающие разные звенья
иммунной системы организма, в той или иной степени влияют
на иммунный ответ. У кроликов, свиней, птицы, мышей и т. д.
обнаружены индивидуальные и межлинейные различия по силе
иммунного ответа.
Гены иммунного ответа (1г-гены). При иммунизации инбред-
ных мышей различными антигенами выявлены линии с сильным
и слабым иммунным ответом. Гены, кодирующие иммунный
ответ,'‘Были названы генами иммунного ответа (immune response).
Рис. 53. Иммунный ответ на инфекцию (по Тонегава, 1985)
238
» Вирусный
л антиген
Белон МНС
класс I
Вирус
Рис. 54. Ответ на вирусную инфекцию (по Тонегава, 1985)
Высота иммунного ответа детерминирована многими генами
иммунного ответа, обозначаемыми Ir-1, 1г-2 и т. д. У мышей из-
вестно более 20 Ir-генов. Ir-гены контролируют ответ на тимуеза-
висимые антигены и реализуют свое действие на уровне Т-лимфо-
цитов. Контроль иммунного ответа осуществляется 1г-генами
путем контроля синтеза la-белков (продукты генов 1-района
МНС). Эти белки на мембране макрофага вступают в ассоциацию
с молекулами процессированного (переработанного в
макрофаге) антигена.
В I-районе главного комплекса гистосовместимости мышей
Н-2 существует три локуса Ir (Ir-1A, Ir-1B, 1г-1С). Кроме того,
известны Ir-гены, расположенные вне Н-2 комплекса. Это локу-
сы Ir-2, 1г-4, а также локус 1г, сцепленный с полом. Общее
количество Ir-генов неизвестно. Ir-гены контролируют также
<• клеточные реакции иммунитета. Во многйх случаях иммунный
ответ против антигенов наследуется полигенно.
Иммунизация свиней различными антигенами позволила
также открыть гены иммунного ответа, которые имеют сходство
с Ir-генами мышей. Иммунный ответ носит количественный ха-
рактер, а Ir-гены сцеплены с главным комплексом гистосовмес-
тимости свиней SLA.
Межлинейные и межпородные различия антителогенеза. Путем
’ селекции можно усилить иммунный ответ на различные антиге-
$Иьг. При иммунизации лептоспирами мышей 12 инбредных
| Линий и сублиний установлено, что титры антител у особей
, некоторых линий были в 2 раза выше, чем у других. При скре-
Щивании контрастных линий обнаружено доминирование высо-
кого иммунного ответа. Анализирующее скрещивание дало воз-
можность сделать заключение о детерминации иммунного ответа
более чем одной парой генов.
Обнаружены различия в титрах антител поросят разных
Пород, вакцинированных модифицированной живой вирус-вак-
Циной против псевдобешенства (табл. 36).
239
36. Средние титры ентител (1дг) поросят разных пород после вакцинации
против псевдобешенства (по Rothachlld м др.)
Порода | Число поросят | lg2 титра антител
Йоркширская 96 4,29 ± 0,12
Гемпширская 75 4,10 ± 0,25
Дюрок 132 3,64 ±0,11
Ландрас 152 3,46 ± 0,13
К. В. Жучаев и С. П. Князев (1990—1993) установили у свиней
значительную внутрипопуляционную дифференциацию по гумо-
ральному иммунному ответу на сальмонеллы и эритроциты бара-
на, по клеточной реакции на фитогемагглютинин: группы потом-
ков разных хряков-производителей различались на 25—40 %.
Установлено, что у монозиготных двоен крупного рогатого
скота наблюдается большее сходство в иммунном ответе на ряд
антигецрв, чем у дизиготных двоен.
Биози с соавт. (1973) в результате отбора инбредных мышей
одной линии по высоте иммунного ответа на эритроциты барана
в девятом поколении добились 30-кратных различий по титру
антител между высоко- и низкореагирующими группами. Биози
также проводил селекцию в течение 20 поколений и создал две
линии мышей (АВ/А и AB/L), которые имели 200-кратные раз-
личия по титру антител против эритроцитов барана (1:10 000 и
1:40). Животные этих линий различались по высоте иммунного
ответа ко многим, но не ко всем антигенам. Иммунологическая
реактивность на некоторые антигены у животных этих линий
оказалась одинаковой.
На основании вышесказанного можно сделать важный для
селекционера вывод о том, что общей высокой иммунологичес-
кой реактивности нет, а имеется конкретный иммунный ответ
(Петров, 1983). Поэтому невозможно создать линии и породы
животных, которые были бы в одинаковой мере резистентны ко
всем болезням.
Очень важно для селекции то, что генетические различия
между высокореагирующими и низкореагирующими особями на
какие-то антигены сохраняются не только в течение жизни орга-
низмов, но даже после воздействия ионизирующей радиации —
сильного иммунодепрессивного фактора. Так, воздействие субле-
тальных доз у-лучей на мышей, различающихся в 20 раз по
продукции антител к лептоспирам, приводит к снижению титра
антител в этих группах, но межлинейные различия сохраняются.
Можно сделать некоторые обобщения в отношении генов
иммунного ответа:
1) 1г-гены определяют количество синтезируемых антител
против определенных антигенов;
240
2) многие 1г-гены связаны с генами главного комплекса гис-
тосовместимости и отвечают за кооперацию Т- и В-лимфоцитов;
3) 1г-гены не сцеплены с локусами, кодирующими иммуног-
лобулины;
4) 1г-гены высокоспецифичны. У организмов с одним и тем
же генотипом может быть высокий иммунный ответ против
одного антигена и низкий — против другого. Не обнаружены
гаплотипы, определяющие общую высокую или низкую иммуно-
логическую реактивность;
5) генетически обусловленные различия в высоте иммунного
ответа сохраняются в разные возрастные периоды;
6) между генами, контролирующими высокий или низкий
иммунный ответ против различных антигенов, в основном не
существует никакой связи;
7) эффект генов, отвечающих за иммунологическую реактив-
ность, реализуется на уровне популяции лимфоидных клеток.
Теории иммунитета. В регуляции иммунитета на внутрикле-
точном уровне принимают участие 1г-гены. На межклеточном
уровне в регуляции участвуют различные вещества, выделяемые
Т-лимфоцитами и в меньшей мере В-лимфоцитами. Антитела
также выполняют регуляторные функции. На уровне организма
регуляция осуществляется нейрогуморальной системой.
Из многих теорий иммунитета наибольшее признание получи-
ла клонально-селекционная теория Ф. Бернета
(1959). Она основана на четырех основных принципах: 1) в орга-
низме имеется большое число лимфоидных клеток; 2) популяция
лимфоидных клеток гетерогенна, и в результате интенсивного
деления клеток образуется большое число клонов (популяция
клеток, происходящая от одного предшественника); 3) неболь-
шое количество антигена стимулирует клон клеток к размноже-
нию; 4) большое количество антигена элиминирует соответст-
вующий клон. Согласно этой теории антиген, взаимодействуя с
. рецептором клетки (В-клетки),
вызывает ее интенсивную про-
| лиферацию (деление), в резуль-
f тате чего образуется клон, син-
1 Тезирующий антитела одной
• Специфичности. Все клетки
Клона имеют один и тот же ге-
нотип. При соматических мута-
циях одного клона могут возни-
кать новые клоны (рис. 55).
Сетевую теорию регу-
ляции иммунитета предложил
Н. Ерне (1974). Согласно этой
теории антитела не только узна-
ют антиген, но и сами являются
Рис. 55. Клон В-клеток (7) а новый
клон клеток, возникший в результате
мутации (3
241
антигенами. Такая ситуация возникает потому, что в период диф-
ференцировки организм с антителами не встречался, поэтому они
выступают в роли антигена, на который вырабатываются анти-
антитела. Полагают, что антигенные детерминанты антител (идио-
типы) — важный фактор регуляции системы иммунитета. Во
время иммунологической реакции повышение концентрации
идиотипов стимулирует антиидиотипическую активность. Анти-
идиотипические реакции осуществляют ауторегуляцию иммунно-
го ответа.
Нарушение регуляции иммунного ответа приводит ко многим
болезням, и прежде всего аллергическим, предрасположенность
к которым зависит и от генотипа организма.
ГЛАВНЫЙ КОМПЛЕКС ГИСТОСОВМЕСТИМОСТИ (МНС)
При первой пересадке сердца человека, сделанной в 1967 г.
К. Барнардом, и сотнях последующих хирурги столкнулись с
проблемой отторжения трансплантата. Оказалось, что главная
трудность заключается не в технике операции, которая сейчас
разработана достаточно хорошо, а в несовместимости тканей,
обусловленной иммунологическими механизмами. Так, у челове-
ка выживание трансплантатов реципиентов, взятых от случайно-
го донора, составляет 10,5 дня, тогда как трансплантаты, обме-
ненные между однояйцовыми близнецами (изотрансплантаты),
приживаются. Это происходит благодаря наличию на поверхнос-
ти клеток антигенов, называемых трансплантационными антиге-
нами или антигенами гистосовместимости. Большинство транс-
плантационных антигенов расположены на лейкоцитах, но они
имеются и на всех других ядросодержащих клетках (клетках
кожи, легких, печени, почек, кишечника, сердца и т. д.). Гены,
кодирующие эти антигены, называются генами тканевой совмес-
тимости. Система генов, контролирующая трансплантационные
антигены лейкоцитов, названа главным комплексом гистосов-
местимости (англ. Major Histocompatibility complex — МНС).
Гены гистосовместимости кодоминантны.
Эффективность трансплантации зависит не только от лейко-
цитарных и эритроцитарных антигенов, но и от минорной систе-
мы гистосовместимости. Трансплантаты между монозиготными
близнецами приживаются. Однако у братьев и сестер при совпа-
дении по МНС-гаплотипам, но несовпадении по минорным сис-
темам гистосовместимости происходит отторжение транспланта-
тов кожи.
После иммуноглобулинов и рецепторов Т-клеток белки глав-
ного комплекса гистосовместимости самые разнообразные из
всех белков. Различают два класса белков МНС. Белки класса I
находятся на поверхности почти всех клеток. Молекула белка
состоит из двух полипептидных цепей: большой и малой. Белки
242
МНС класса II имеются на поверхности некоторых клеток (В-
лимфоциты, макрофаги, специализированные эпителиальные
клетки), а их молекула состоит из примерно равных полипептид-
ных цепей. Белки МНС имеют некоторое сходство с иммуногло-
булинами. Основная роль белков МНС состоит не
в отторжении чужой ткани, а в направлении
реакции Т-клеток на антиген. Цитотоксические Т-
клетки могут узнавать антиген, если он расположен вместе с
белками МНС класса I на поверхности одной клетки. Т-хелперы
узнают антиген в комбинации с белками МНС класса II. Такое
двойное стимулирование называется МНС-о граничением.
Впервые главную систему тканевой совместимости мыши Н-2
открыл П. Горер в 1936 г. Кроме Н-2 найдено много локусов
тканевой совместимости, расположенных во всех хромосомах.
В 1980 г. Д. Снелл, Ж. Доссе и Б. Бенацерафф получили Но-
белевскую премию за «различные аспекты исследования, привед-
шего к современному пониманию системы генов гистосовмести-
мости человека». Д. Снелл сформулировал основные генетичес-
кие законы совместимости тканей и получил данные о тонком
строении локуса Н-2 у мышей.
Система Н-2 довольно хорошо изучена, поэтому она служит
хорошей моделью для исследования МНС у других видов живот-
ных. Комплекс Н-2 включает несколько тесно сцепленных локу-
сов длиной 0,35 сМ, расположенных в 17-й хромосоме. Ком-
плекс Н-2 разделен на пять областей: К, I, S, G, D (рис. 56).
Расстояние
ХромосотаП
1Г
ЮсМ
5s Sip Понусы
!__! ।__| ( _______| Субобласти
5 С в , В . „ Области
D~L ob
0,05сМ Ц5 сМ
SLA
CAT la
6сМ
-i ।---
I—
__________£□
Локусы групп нрава
Рис. 56. Схема сцепления локусов главного комплекса гистосовместимости:
Л—Н-2 у мыши; В — В у кур; С — SLA у свиней (по Hruban, 1981)
243
Трансплантационные антигены кодируются локусами Н-2К и
H-2D и называются серологически выявляемыми или SD (Se-
rologically Defined). Эти локусы относятсй к классу I. Область I
относится к классу II и включает пять субобластей, в которой
расположены гены иммунного ответа (Ir-гены) и гены, кодирую-
щие 1а-антигены (англ. Immune associated). 1а-антигены играют
основную роль при взаимодействии В-, Т-лимфоцитов и макро-
фагов, а также принимают участие в действии Т-супрессоров.
Область G относится к III классу, ее гены контролируют синтез
С4 компонента комплемента.
В комплексе Н-2 есть антигены, выявляемые не серологичес-
ки, а определяемые в смешанной культуре лимфоцитов (англ.
Mixed lymphocyte culture — MLC, Mixed lymphocyte reaction —
MLR), которые называют LD (Lymphocyte Defined). Почти все
локусы комплекса Н-2 имеют многочисленные аллельные
формы.
^.Главный комплекс гистосовместимости открыт у многих
ввдов (табл. 37). У человека он обозначен HLA (Human leycocyte
antigen — антиген лейкоцитов человека), у крупного рогатого
скота — BoLA (Bovine leycocyte antigen), у свиней — SLA
(Susscrofa leycocyte antigen), у овец — OLA (Ovine leycocyte anti-
gen), у коз — GLA, у лошадей — ELA (Equine leycocyte antigen), у
кур — В (этот локус контролирует и систему групп крови В), у
кроликов — Н-1.
37. МНС у домашних животных, в том числе птицы
Признак Крупный рогатый скот Свиньи Овцы Козы Лоша- ди Соба- ки Куры
Название МНС BoLA SLA OLA GLA ELA DLA В
Класс I локусов А А,В,С А,В SD1, SD2 А А,В,С B-F, B-G
Класс II локусов D D — LD MLR D.E B-L
Класс III локусов — + — — — — +
Количество антигенов 11 — 16 — 18 — —
1г-гены + + — — — + +
Биохимическая ха- рактеристика МНС антигенов + + — — — — +
Сцепление МНС с другими локусами + + — — + + +
Ограничение функ- ции Т-клеток + — — — — + —
Связь МНС с заболе- ваниями + + — — + — +
Связь МНС с при- знаками продуктив- ности — + — — — — +
244
Главный комплекс гистосовместимости круп-
ного рогатого скота BoLA контролируется кодоминант-
ными аллелями классов I (SD) и II (LD) локусов. В классе I
выявлено 17 антигенов (W1 — 10 и т. д.), в классе II — 11 анти-
генов. Открыты также 1а-антигены, а в классе II идентифициро-
ваны 1г-гены. Установлено, что BoLA сцеплен с М-системой
групп крови, между которыми частота рекомбинации равна 0,04.
В нашей стране впервые исследования МНС BoLA были про-
ведены под руководством академика В. П. Шишкова.
МНС свиней SLA состоит из четырех тесно сцепленных
локусов (см. рис. 56). Три локуса (А, В, С) контролируют класс
трансплантационных 1-антигенов. Продукты этих генов сходны с
теми, которые детерминируются субобластями А, В, С у человека
и Н-2К и H-2D у мышей. Четвертый локус (D) включает гены,
которые кодируют серологически определяемые молекулы класса
II и реакцию смешанных лимфоцитов. Гены иммунного ответа
(1г) сцеплены с главным комплексом гистосовместимости. В на-
стоящее время ряд исследователей картировали главный ком-
плекс гистосовместимости на 7-й хромосоме. Предполагают, что
гены класса I находятся на 7-й хромосоме в районе р12-ql2.
Установлены высокодостоверные межпородные различия по
антигенам SLA. Так, частота гаплотипа d у свиней породы дюрок
равна 0,92, а у ландрасов — 0,11.
Система О L А овец включает три тесно сцепленных
локуса: А, В, С. Частота рекомбинаций между локусами А и В
составляет 0,6 %. Описано 16 антигенов OLA: OLA-A1, А2, А4,
А8, А10, А13; OLA-B3, В6, В7, В9, В12; OLA-C14, С15, С17;
антигены 8L и 16L еще не картированы. Всего идентифицирова-
но 26 гаплотипов комплекса OLA. Кроме того, имеется два, ми-
норных лимфоцитарных антигена, не входящих в OLA. Это ло-
кусы OL-Х и OL.
Система ELA лошадей классов I и II контролируется
двумя локусами. Не установлено, что антигенные специфичнос-
ти ELA W1-W10 и Lex8 наследуются аллогруппами. Выявлены
межпородные различия по частоте антигенов. В одном исследо-
вании у чистокровных лошадей наблюдали»эксцесс животных с
антигенами W5 и Lex8 и недостаток у кобыл с W2 и W3.
Главный комплекс гистосовместимости кур(В)
состоит из трех сублокусов BG, BF, BL, расположенных на
одной хромосоме. Между локусами BG и BF/BL рекомбинации
встречаются очень редко (1/2000), но не наблюдались между BF
и BL. Область BF кодирует антигены на эритроцитах, лейкоци-
тах и клетках других тканей. Область BL кодирует антигены на
макрофагах и В-лимфоцитах, которые у кур являются 1а-антиге-
иами. Ir-гены детерминируют иммунный ответ к различным
антигенам, включая, возможно, и некоторые антигены опухолей.
Область BG контролирует антигены только на эритроцитах.
245
СВЯЗЬ МНС И ДРУГИХ АНТИГЕНОВ
ГИСТОСОВМЕСТИМОСТИ С БОЛЕЗНЯМИ
Некоторые заболевания коррелируют с антигенами главного
комплекса гистосовместимости. У человека наиболее четкая вза-
имосвязь существует между анкилозирующим спондилитом (бо-
лезнь Бехтерева) и антигеном HLA В27. Это — хроническое сис-
темное заболевание суставов позвоночника, которое часто при-
водит к неподвижности (окостенению) всего позвоночного
столба. Предрасположены к болезни лица с антигеном HLA В27.
Антиген В27 встречается у 93 % больных анкилозирующим спон-
дилитом, а в контрольной популяции — у 8 %.
У мышей установлена повышенная восприимчивость к лейке-
могенному вирусу Гросса у особей с гаплотипом Н-2К, а резис-
тентность связана с Н-2В.
У кур наиболее четкая связь существует между болезнью Ма-
река (Мр) и аллелями системы В. Повышенная резистентность
к болезни Марека ассоциируется с аллелем В21 (табл. 38).
38. Взаимосвязь аллелей комплекса В с заболеваемостью кур
MD, % (по Намел и др.)
Куры п Аллели
В21 | В1’
С экспериментальной MD 854 16 29
С естественной зараженностью MD 3982 — —
С высокой пораженностью MD — 6,5 12,4
С низкой пораженностью MD — 2,6 4,5
Видно, что при экспериментальном заражении MD, а также в
популяциях с естественной высокой и низкой заболеваемостью
MD резистентность была выше у кур с аллелем В21, чем с
аллелем В19.
В дальнейшем во многих исследованиях эта закономерность
подтвердилась. Умеренная резистентность ассоциируется с алле-
лями В2,В6, В7 и В*4. Куры с аллелями В1, В3, В5, В13, В15, В19,
В27 отличаются восприимчивостью к MD.
Резистентность к саркоме Рауса и эритробластозу выше у кур
с аллелем В2, чем с аллелем В< У кур породы белый леггорн с
генотипом В5В5 частота метастазов, индуцированных вирусом
саркомы Рауса, значительно выше (66 %), чем у особей с гено-
типом В24В24 (12 %), а регрессия опухолей значительно ниже.
Установлено, что смертность взрослой птицы с генотипом
В'В1 выше, чем у гетерозигот (В1 В2, В'В19, В'В21). Предполага-
ют, что имеется связь аллеля В‘ с главным локусом «приспособ-
ленности» (fitness).
Иммунизация кур Salmonella pullorum вызвала у особей В'В1
246
образование^ более низкого титра антител, чем у гетерозигот
У свиней, гомозиготных по некоторым аллелям SLA, наблю-
дается повышенная смертность. У джерсейского скота установле-
но, что аллели W1 и W3 связаны с резистентностью к лейкозу.
Норвежский молочный скот с аллелем W2 более устойчив к
маститу, а с аллелем W12 восприимчив к нему. У овец предпола-
гают наличие связи комплекса OLA с одним из локусов устойчи-
вости или восприимчивости к скрепи.
Лимфоцитарный антиген лошадей ELY-1 не сцеплен с глав-
ным комплексом гистосовместимости. Выявлено два аллеля —
ELY-1+ и ELY-1-. Частота аллеля ELY-1+ была выше у лошадей,
больных бронхитом и хромотой, чем у здоровых. Предполагают,
что с ELY-1 связаны определенные иммунологические реакции.
Существует взаимосвязь МНС не только с болезнями, но и с
признаками продуктивности. Так, у свиней крупной белой поро-
ды пониженная скорость роста связана с гаплотипом SLA 5, 20,
4. Однако в настоящее время у животных еще недостаточно
изучена связь МНС с болезнями и признаками продуктивности.
Можно надеяться, что гены МНС и другие гены гистосовмести-
мости могут быть генетическими маркерами устойчивости и вос-
приимчивости к болезням.
ПЕРВИЧНЫЕ (ВРООДЕННЫЕ) ДЕФЕКТЫ
ИММУННОЙ СИСТЕМЫ
Нарушения в различных звеньях иммунной системы приводят
к многообразным патологическим иммунным реакциям. Гипер-
чувствительность (аллергия) возникает в результате чрезмерной
иммунной реакции на чужеродные антигены. Иногда иммунные
реакции направлены и против структур собственного организма
(аутоиммунные реакции). Нарушение иммунного ответа может
быть вызвано и в результате неполноценного развития и созрева-
ния клеток иммунной системы. Обычно поражение одного звена
иммунной системы не затрагивает функционирования других.
Выделяют первичные и вторичные иммунодефициты.
Первичные иммунодефициты — это генетически
Обусловленная неспособность организма реализовать то или иное
звено иммунного ответа.
Вторичные иммунодефициты являются приобре-
тенными при индивидуальном развитии организма (онтогенез).
Они возникают в результате недостаточного кормления, воздей-
ствия ионизирующего излучения, заболевания лейкозом и т. д.
В США в 1981 г. обнаружено новое заболевание иммунной
Системы — СПИД (синдром приобретенного иммунодефицита).
Болезнь вызывается вирусом (LAV), в основном поражающим
лимфоциты Т-хелперы, и характеризуется длительным инкубаци-
247
онным периодом — более 5 лет. Роль наследственности в реак-
ции организма на приобретенный иммунодефицит отчасти выра-
жается в том, что только около 10 % носителей вируса заболева-
ют СПИДом.
Недостаточность иммунной системы может быть обусловлена
недостаточностью фагоцитов, клеточного иммунитета, гумораль-
ного иммунитета, системы комплемента, а также комбинирован-
ным иммунодефицитом.
У сельскохозяйственных животных наследственные иммуно-
дефициты изучены недостаточно. Но в соответствии с законом
гомологических рядов в наследственной изменчивости Н. И. Ва-
вилова можно найти иммунодефициты, подобные тем, которые
описаны у человека.
Летальный фактор А-46. Известен у скота черно-пе-
строй, датской и фризской пород и является аутосомно-рецессив-
ным. Телята рождаются нормальными, а к 4—8 нед у них наблю-
даются поражение кожи, сыпь, алопеция (выпадение волос), пара-
Kepamoi (аномальное ороговение) вокруг рта, глаз, нижней
челюсти. Животные более чувствительны к вирусным инфекциям
вследствие снижения клеточного иммунитета. Синтез 1g всех
классов и иммунный ответ нормальны. Без лечения животные
погибают в 4-месячном возрасте. У больных животных возникает
гипоплазия тимуса, селезенки, лимфатических узлов. Предполага-
ют, что у гомозиготных по рецессивному гену телят необычайно
повышена потребность в цинке, который нужен для поддержания
нормального развития и функционирования Т-лимфоцитов.
Комбинированныйиммунодефицит (CID). Из-
вестен у человека, жеребят арабской породы и длинношерстной
таксы. Связан с генетическим нарушением образования и функ-
ционирования Т- и В-лимфоцитов. Наследуется по аутосомно-
рецессивному типу. Это подтверждается тем, что у пораженных
жеребят матери и отцы здоровы, однако ни один жеребенок не
доживает до репродуктивного возраста без трансплантации кост-
ного мозга.
Болезнь встречается у самок и самцов. У новорожденных
жеребят очень мало или нет циркулирующих лимфоцитов, а в
сыворотке крови почти отсутствуют иммуноглобулины. Наблю-
дается недоразвитие тимуса. Животные не способны отвечать на
иммунизацию. Жеребята остаются здоровыми до 2-месячного
возраста, а после уменьшения количества материнских 1g поги-
бают к 5-месячному возрасту от различных инфекций. У жеребят
арабской породы CID встречается с частотой 2,3—3,7 %.
Агаммаглобулинемия — дефект гуморальной систе-
мы (В-лимфоцитов). Встречается у человека и лошадей. Признак
сцеплен с полом (с Х-хромосомой). Болезнь описана у жеребят
пород американский рысак и английская чистокровная верховая.
Животные не способны синтезировать иммуноглобулины всех
248
классов, но функция Т-лимфоцитов нормальная. Больные осо-
бенно восприимчивы к бактериальным инфекциям, но чувстви-
тельность к вирусным инфекциям не повышена. Жеребята дожи-
вают до 17—18 мес, тогда как с комбинированным иммунодефи-
цитом (CID) — до 5 мес. Это указывает на важную роль
Т-лимфоцитов в резистентности животных.
Селективный дефицит IgM встречается у лошадей и
характеризуется частичным или полным отсутствием IgM в сы-
воротке крови. Общее количество лимфоцитов с поверхностно
расположенными 1g и количество Т-клеток нормальные. Это
значит, что отсутствуют IgM В-клеток или В-клетки не способны
секретировать IgM. Большинство жеребят погибают к 4—8 мес в
результате повторяющихся с месячного возраста респираторных
инфекций. Некоторые из них доживают до 2 лет, но плохо растут
из-за повторных респираторных инфекций. Генетическая приро-
да этой болезни не выяснена.
У кур также выявлена дисгаммаглобулинемия, при
которой наблюдаются низкое содержание IgG и повышенный
уровень IgM. Это приводит к высокой смертности птицы.
Известна большая группа генетически детерминируемых де-
фектов системы комплемента у человека (С2, СЗ). Дефицит ком-
племента С6 у кроликов сопровождается кровоточивостью и обу-
словлен аутосомно-рецессивным геном. У них легко выявить
гетерозиготные особи, что дает возможность избавиться от этого
дефекта.
Приведенные здесь примеры указывают на необходимость
учета врожденных дефектов иммунной системы. Недостаточно
изучены генетический контроль синтеза иммуноглобулинов,
главный комплекс гистосовместимости, гены иммунного ответа у
разных видов сельскохозяйственных животных и генетическая
детерминация силы иммунного ответа у них. Интересно и важно
для ветеринарной медицины дальнейшее изучение у животных
первичных дефектов всех звеньев иммунологической системы.
Контрольные вопросы. 1. Что такое иммунитет? 2. Что вы знаете о клеточной
и гуморальной системах иммунитета? 3. Какова структура иммуноглобулинов и
как они наследуются? 4. Чем определяется разнообразие антител? 5. Каков меха-
низм генетического контроля иммунного ответа? 6. Что вы знаете о главном
комплексе гистосовместимости? 7. Какова связь МНС с заболеваниями? 8. Какие
существуют врожденные дефекты иммунной системы?
Гл ава 15
ГЕНЕТИЧЕСКИЕ АНОМАЛИИ
У СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ
У всех видов сельскохозяйственных животных встречаются
наследственные дефекты, которые отрицательно влияют на жиз-
неспособность, хозяйственно полезные признаки и воспроизво-
дительную способность. Это генетические аномалии, обуслов-
ленные мутациями. По степени влияния на жизнеспособность
наследс^енные дефекты, или факторы, подразделяются на ле-
тальные/ полулегальные и субвитальные.
Летальными, или смертоносными, факторами называют такие,
которые вызывают смерть особи до достижения ею стадии поло-
вой зрелости. К полулетальным (сублетальным) факторам относят
такие мутации, при которых,погибает не менее 50 % особей с
летальными задатками. Если частота смертности аномальных
особей ниже 50 %, такой фактор называют субвитальным.
Понятия о генетических, наследственно-средовых и экзогенных
аномалиях. Исследования показали, что причина одних анома-
лий — в основном генетические факторы, других — сочетание ге-
нетических факторов с определенными условиями внешней
среды, третьих — внешнесредовые, или экзогенные (ненаследст-
венные), факторы. В соответствии с этим аномалии подразделяют:
1) на генетические; 2) наследственно-средовые; 3) экзогенные.
ГЕНЕТИЧЕСКИЕ АНОМАЛИИ
Генетические аномалии — это морфофункциональные наруше-
ния в организме животных, возникающие в результате генных и
хромосомных мутаций. Генные мутации могут нарушать морфо-
генез органов и тканей на разных этапах онтогенеза, отсюда
столь широкий спектр врожденных аномалий, связанных с изме-
нениями молекулы ДНК. Изменения числа хромосом в клетках
или их структуры приводят обычно к прекращению развития
эмбриона или рождению особей с тяжелыми пороками развития,
нарушению у животных воспроизводительной функции.
Основная роль в этиологии врожденных аномалий при-
надлежит летальным и сублетальным генам. Так, у человека
известно около 2000 аномалий, обусловленных мутантными
генами с летальным или сублетальным действием. Большое
250
а число таких же признаков изучено у животных. За последнее
I время значительно расширились знания о хромосомных абер-
Ж рациях и их связи с нарушениями жизненно важных функций
1 организма животных.
f Генетические аномалии представляют собой признаки, кон-
? тролируемые одной парой аллельных генов (главных генов по
Мазеру). Характерной особенностью наследования для этой ка-
тегории аномалий является мендельский тип распределения, со-
ответствующий доминантным и рецессивным качественным при-
! знакам. Для проявления генетической рецессивной аномалии до-
статочно наличия в обеих хромосомах двух одинаковых
• мутантных генов.
НАСЛЕДСТВЕННО-СРЕДОВЫЕ АНОМАЛИИ
В отношении определенной категории врожденных аномалий
можно говорить, что проявление их примерно в равной
степени зависит от эндогенных (генотипа) и экзогенных
'' (внешняя среда) факторов. Это так называемые наследст-
венно-средовые аномалии. Предполагается, что они контро-
лируются полилокусной системой генов. Фенотипическое про-
явление этих признаков зависит от количества мутантных
генов, обусловливающих аномалию. Существует понятие порога
действия таких генов, что соответствует их числу или силе
кумулятивного эффекта. Если число генов или сила их
действия превышают порог, аномалия проявляется. Если эти
показатели ниже порога, животное .остается нормальным.
Сила кумулятивного действия генов, а соответственно фе-
нотипическое проявление аномалии, очевидно, зависят от
условий среды. При изменении последней в худшую сторону
Вредный эффект генов проявляется, в оптимальных условиях
среды порог для проявления аномалии, очевидно, повышается.
В некоторых случаях фенотипически сходные аномалии имеют
разную генетическую детерминацию (генокопии). С одной сторо-
ны, это указывает на генотипическую гетерогенность аномалий. С
другой стороны, как это было впервые показано Гольдшмидтом
(1935), фенотип генетической аномалии может быть «скопирован»
факторами внешней среды у особей с определенным генотипом.
Такие аномалии Гольдшмидт называл фенокопиями. Впоследст-
вии было установлено, что образование фенокопий происходит
под действием одновременно генетических и средовых факторов.
Ландауэр, например, объясняет причину фенокопий более силь-
ной чувствительностью на тератогенные вещества гетерозиготных
носителей рецессивных мутаций, а также совместным влиянием
генов-модификаторов и факторов среды.
Результаты экспериментальных данных свидетельствуют о
том, что отсутствующий у гетерозиготных индивидуумов второй
251
мутантный аллель может восполняться определенными фактора-
ми внешней среды. Так возникает характерный для гомозигот
фенотип.
Аномалии могут возникать в результате действия на эмбрион
или плод определенных повреждающих факторов внешней
среды, называемых тератогенами. Эти нарушения могут диагнос-
тироваться уже после рождения, если тератогенный фактор воз-
действует в послеутробный период развития.
ЭКЗОГЕННЫЕ АНОМАЛИИ
Аномалии, или пороки развития, возникающие в результате
действия на организм факторов внешней среды, являются нена-
следственными, или экзогенными. Тератогенные факторы внеш-
ней среды можно разделить на физические, химические и биоло-
гические. Тератогены одновременно могут быть и мутагенами.
Если повреждающий фактор действует на генетический аппарат
половых клеток, он вызывает наследуемую мутацию. В другом
случае при воздействии на зрелые соматические клетки возника-
ет соматическая мутация, а в третьем варианте, когда мишенью
являются незрелые эмбриональные клетки, вредное вещество
проявляет тератогенное действие.
Для того чтобы установить причину врожденных аномалий,
необходимо провести комплексный анализ на наличие или от-
сутствие действия тератогенных факторов и влияния наследст-
венности.
Вот некоторые примеры такого анализа. В двух племенных хозяйствах Ленин-
градской и Мурманской областей с высоким уровнем кормления на протяжении
трех лет регистрировали появление необычного уродства: у телок, а затем и у
бычков к годовалому возрасту наблюдали отставание в росте и развитии крестцо-
во-бедренной части скелета, так что животные внешне напоминали гиен. У них
наблюдались сильное недоразвитие бедренных костей, нарушение гормонального
статуса и некоторые другие изменения. При проведении генеалогического анали-
за оказалось, что все животные с «синдромом гиены» происходили от разных
отцов, не связанных общим происхождением. Эти данные дают основание счи-
тать, что проявление указанной аномалии прямо не зависит от генотипа живот-
ных.
Еще пример. В хозяйстве, разводящем черно-пестрый скот, при использова-
нии спермы единственного быка участились случаи рождения телят с пупочными
грыжами. Наблюдения, проведенные нами, не выявили каких-либо нарушений
процесса отелов коров и содержания новорожденных телят. Поскольку использо-
вание одного быка в хозяйстве еще не давало полного основания говорить о
наследственном характере возникновения грыж у телят (хотя в литературе такре
данные имеются), был поставлен специальный эксперимент. Коров в этом хозяй-
стве осеменили спермой трех быков. Один из них Заказник 82 черно-пестрой
породы уже использовался в хозяйстве, и от него получали телят с грыжами;
другой бык Блок 107 голштино-фризской породы имел общие корни с черно-пе-
строй породой скота и третий бык Вяз 338 холмогорской породы не состоял в
родстве с двумя первыми. Результаты такого осеменения приведены в таблице 39.
Из данных таблицы можно сделать вывод о том, что появление пупочных грыж
Зависит от генотипа родителей.
252
39. Частота пупочных грыж в потомстве разных быков
(по А. И. Жигачеву)
Кличка и номер быка Получено телят Частота пупочных грыж, %
всего в том числе
с грыжами | без грыж
Заказник 82 30 13 17 44
Блок 107 22 4 18 18
Вяз 338 26 0 26 0
Всего 78 17 61 21
ГЕНЕТИЧЕСКИЙ АНАЛИЗ В ИЗУЧЕНИИ ЭТИОЛОГИИ
ВРОЖДЕННЫХ АНОМАЛИЙ
Вначале подчеркнем общую закономерность: проявление
наследственно обусловленных аномалий замыкается в пределах
определенных семейств и родственных групп животных. Исходя
из этого, основным методом генетического анализа аномалий
является семейно-групповой метод в пределах одного или
нескольких поколений животных. Важное значение в про-
ведении генетического анализа имеют данные патологической
анатомии, гистологии, цитологии, физиологии, биохимии,
рентгенологии и других наук. Например, было установлено,
что аномалия с клиническими признаками нарушения ко-
ординации движений, агрессивности и летального исхода у
. телят проявлялась в определенных типах спариваний. Механизм
ее возникновения и возможности профилактики открылись
благодаря биохимическому анализу. У аномальных животных
обнаружили почти полное отсутствие фермента кислой ман-
нозидазы вследствие рецессивной мутации. Гетерозиготные
носители мутантного гена содержали в сыворотке крови
половину нормы этого фермента.
В другом случае наблюдали гибель телят, полученных от трех
родственных между собой производителей, без видимых причин.
Только с помощью рентгеноскопии были обнаружены у нежиз-
неспособных телят щели в позвоночнике, как следствие действия
| мутантного гена. Так была доказана наследственная причина
t гибели телят.
j Нарушения воспроизводительных функций у животных могут
* иметь разные причины. С помощью цитогенетического анализа
можно установить, являются ли эти нарушения следствием
транслокаций или других аберраций хромосом.
Определение типа наследования аномалий. Это важно в целях
разработки селекционных методов для профилактики распро-
странения аномального приплода у животных. Тип наследования
аномалий обычно определяют на основании анализа генеало-
гии — родословных, в которых должны быть записаны сведения
253
о характере аномалий. Графическое изображение родственных
связей аномальных животных позволяет установить источник
распространения аномалий, тип наследования. «Родословные на-
чинают составлять обычно с аномального животного, называемо-
го пробандом. Животных одного поколения с пробандом распо-
лагают по горизонтальной линии, каждое предшествующее поко-
ление находится на схеме выше линии пробанда, а каждое
последующее — ниже линии пробанда. Особей мужского пола
обозначают квадратом, женского — кружком. Прямая линия
между квадратом и кружком обозначает скрещивание, линия,
идущая книзу, — потомство. При составлении родословных не-
редко показывают неполную родословную — только ту линию, в
которой имеются аномальные особи.
ПРОСТОЙ АУТОСОМНЫЙ РЕЦЕССИВНЫЙ ТИП
НАСЛЕДОВАНИЯ
Эти№ термином пользуются, когда аномалия обусловлена
одним рецессивным геном, локализованным в аутосоме. Иногда
употребляют термин моногенно-аутосомный тип наследования,
что является синонимом. Аномалия при этом выявляется в рав-
ном соотношении у самцов и самок. Аутосомные рецессивные
мутантные гены проявляют свой видимый эффект только в го-
мозиготном состоянии, когда животное получит его от каждого
из родителей. Вероятность такого события возрастает при скре-
щивании между собой родственных индивидуумов, имеющих
большое сходство по генотипам. Поэтому при анализе родослов-
ных аномальных животных необходимо прежде всего определить,
имеют ли их родители общих предков. Если имеют, то это уже
позволяет предположить причину аномалий, как наследственную
рецессивную.
Рассмотрим ход генетического анализа на конкретном примере. Так, в совхо-
зе «Новое время» Ленинградской области, где разводят скот черно-пестрой поро-
ды, вдруг стали рождаться телята, полностью лишенные шерстного покрова.
Количество их с каждым месяцем нарастало, и ветврачи хозяйства и района
вынуждены были обратиться к нам в ветеринарный институт за консультацией.
Приехав в хозяйство, мы попросили родословную быка Дока 4476, сперму кото-
рого использовали для получения приплода. Взяли племенные карточки коров —
матерей телят-уродов. В родословных этого производителя и коров обнаружили
общих предков — быков Кеймпе 37132, Атао 15 и Лукавого I8X Телята-уроды,
таким образом, оказались инбредными на них. Отметим, что от неродственных
спариваний быка Дока 4476 потомство рождалось нормальным. Следовательно,
можно сделать вывод о наследственном характере признака бесшерстности, у
телят. .
Для селекционно-ветеринарной профилактики этого летального дефекта, а он
проявлялся в сочетании с расщеплением нёба и укорочением верхней челюсти,
важно установить источник данного рецессивного мутантного гена. Этому спо-
собствовал наш предыдущий генетический анализ бесшерстности, зарегистриро-
ванный у телят в совхозе «Красная Балтика». При сопоставлении родословных
аномальных животных выявлен все тот же предок — бык Лукавый 183. Он-то и
оказался гетерозиготным носителем летального гена, который, очевидно, унасле-
254
S довал от своего деда быка Трувора 2918 и, в свою очередь, передал своим
® сыновьям, дочерям, внукам и т. д. Быки Док 4471, Гофрит 3117, Фиет 3222,
К Автомат 1597 были явными носителями мутантного гена, обладающего заметным
К плейотропным действием. За полтора года использования быка Дока 4471 в
ж совхозе «Новое время» зарегистрировано 138 аномальных телят, что составило
Ж примерно 5 % от общего числа родившихся животных. После смены этого быка
® и осеменения коров другим производителем рождение бесшерстных телят пре-
I кратилось. Это убедительно свидетельствует о наследственной причине данной
£ аномалии.
9 Аномальные животные в большинстве случаев рождаются от
I нормальных, но гетерозиготных родителей. В этом особенность
1 рецессивного типа наследования, когда признак как бы скрыва-
ется или перепрыгивает через поколение. Расщепление по рецес-
( сивным признакам с полным фенотипическим проявлением (пе-
нетрантностью) соответствует правилам Менделя, так что анализ
частоты нормальных и аномальных особей в потомстве того или
другого производителя позволяет определить тип наследования
аномалий. Так, при скрещивании гетерозиготного производителя
; (Аа) с гетерозиготными матками (Аа) 25 % потомков будут носи-
телями аномалий (аа). Если гетерозиготный производитель (Аа)
скрещивается с нормальными матками (АА), а затем на этих
; матках используют производителя, гетерозиготного по тому же
| рецессивному гену, один из восьми потомков окажется носите-
| лем аномалии (аа).
I Например, де Гроот для выяснения типа наследования син-
дрома «гладкий язык» у голландского скота выявил 146 предпо-
. латаемых гетерозигот и провел скрещивание между ними. Из
| полученных 120 телят 30 были носителями этого синдрома, что
полностью соответствует расщеплению 3:1. В эксперименте, про-
« веденном Мором и Вридгом, при скрещивании трех быков, от
• • которых рождались бесшерстные телята, с дочерями других
быков, передававших эту аномалию по наследству, были получе-
ны следующие результаты:
Бык Нормлльные телята Бесшерстные телята
I 32 4
II 37 2
t III 29 6
Итого 98 12
При рецессивном типе наследования в потомстве в этом
У случае следует ожидать 1/8, или 14, бесшерстных телят.
Фактически данные близки к теоретически ожидаемым, что
доказывает наследование бесшерстности как простого рецес-
сивного признака.
Частота рецессивных аномалий особенно повышается в попу-
ляциях, где нередко применяют родственное спаривание. Веро-
ятность рождения животных с генетической аномалией при род-
ственном подборе в случаях, когда каждый из родителей несет
255
мутантный рецессивный ген в скрытом состоянии, значительно
выше, чем при неродственном подборе, поскольку число одина-
ковых (в том числе мутантных) генов у родственников выше, чем
в общей популяции.
При рецессивном наследовании выражена закономерность:
чем ниже распространение рецессивного гена в популяции, тем
чаще аномалия, им обусловленная, проявляется в кровно-родст-
венных спариваниях. Однако в некоторых случаях родословная
может «принять вид» псевдодоминантного типа наследования.
Это может быть при следующих обстоятельствах:
в популяции высокая частота гетерозиготных носителей;
аномалия обусловлена редко встречающимися рецессивными
генами, но в популяции (стаде) высокий процент родственных
спариваний.
Примером первой ситуации может быть распространение пу-
почных грыж у черно-пестрого скота, если принять во внимание
рецессивный тип наследования (см. табл. 39). Этот случай инте-
ресен и'Ъ том плане, что мутантный ген обладает множествен-
ным (плейотропным) эффектом.
Основные выводы правил наследования аутосомно-рецессив-
ных признаков-аномалий сводятся к следующему:
1) от фенотипически нормальных, но гетерозиготных родите-
лей (Аа) рождаются потомки с аномальными признаками с час-
тотой 25 % (или 3:1);
2) все родители аномальных животных — гетерозиготные но-
сители рецессивного мутантного гена (Аа х Аа);
3) если один из родителей аномальный (аа) (например, с
пупочной грыжей), а другой вполне нормальный (АА), то потом-
ство будет нормальным (АА х аа);
4) если один из родителей аномальный (аа), а другой только
фенотипически нормальный (Аа), то одна половина (50 %) по-
томков будет фенотипически нормальной (Аа), а другая — ано-
мальной (аа);
5) аномалия с одинаковой частотой проявляется у особей
мужского и женского пола;
6) в родословных аномальных животных отмечается более
высокий процент близкородственных связей родителей,
Частота аномальных потомков у гетерозиготных производите-
лей может и не вписываться в эти классические схемы расщеп-
ления, что будет связано с числом (частотой) гетерозигот, -а
также гомозигот (если они плодовиты и жизнеспособны) среди
скрещиваемых с ними маток. Подтверждением рецессивного
типа наследования в этом случае будут наличие общего предка с
материнской и отцовской сторон родословной, а также проведе-
ние специальных скрещиваний, о которых будет сказано ниже.
256
АУТОСОМНЫЙ ДОМИНАНТНЫЙ ТИП НАСЛЕДОВАНИЯ
Признаки, обусловленные доминантными генами, как прави-
ло, проявляются в гетерозиготном состоянии. Возможный вари-
ант скрещивания и характер расщепления следующие (табл. 40).
40. Аутосомный доминантный тип наследования
Тип скрещивания Соотношение в потомстве
вв—нормальные рецессивные гомозиготы Лв—аномальные гетерозиготы ВВ—аномальные доминантные гомозиготы
ВВ х ев 0 100 0
Вв х вв 50 50 0
Вв х Вв 25 50 25
ВВ х Вв 0 50 50
ВВ х ВВ 0 0 100
ее х ее 100 0 0
При таком доминантном типе наследования пропуска поколе-
ний не будет (если только это не новая мутация); каждый ано-
мальный потомок имеет аномального родителя. В родословных
доминантно обусловленных аномалий общий предок, как прави-
ло, встречается с одной стороны. В некоторых породах животных
известны доминантно обусловленные аномалии с летальным
действием гена, проявляющимся только в гомозиготном состоя-
нии, но разводят их из-за наличия желательных признаков в
гетерозиготном состоянии (табл. 41). При скрещивании указан-
ных пород животных между собой (Аа х Аа) 25 % зигот будет
отмирать, в других случаях приплод будет погибать в конце
внутриутробного развития или вскоре после него.
41. Сводка доминантных признаков с летальным эффектом
в гомозиготном состоянии (по Мейеру и Вегнеру, 1973)
Вид животных Порода Фенотипическое проявление аллеля в гетерозиготном состоянии (Аа) Фенотипическое проявление аллеля в гомозиготном состоянии (XX) 1
Крупный ро- гатый скот Декстер Укороченные конеч- ности (тип декстер) Бульдогообразная карликовость, аборт на 7-м месяце
Овца Каракульская Серая окраска (ширази) Нарушение пищеварения, гибель через 2—3 мес после рождения
Лисица Платиновая Осветление пигмен- тации Эмбриональная смерт- ность
Норка — Светлая ость То же
» Хеггедальская Осветление пигмен- тации »
Куры Крипер Укорочение конеч- ностей Хондродистрофия, смерть на 6-й день инкубации
257
Итак, для классических вариантов аутосомно-доминантного
наследования аномальных признаков характерны:
1) прямое наследование по поколениям. Аномалия передается
из поколения в поколение без пропусков;
2) каждый аномальный потомок обычно имеет аномального
родителя;
3) от нормальных родителей потомки будут нормальными;
4) вероятность рождения аномального потомка, если аномаль-
ный один из родителей, равна 50 %;
5) поскольку ген локализован в аутосоме, то он проявляется в
равной степени у особей мужского и женского пола.
СЦЕПЛЕННЫЙ С Х-ХРОМОСОМОЙ ТИП НАСЛЕДОВАНИЯ
В дополнение к главе «Генетика пола» отметим следующее.
Гены, локализованные в Х-хромосоме, могут проявлять доми-
нантный или рецессивный эффект. Возможные варианты скре-
щиваний и расщеплений при сцепленном с Х-хромосомой типе
наследования показаны в таблице 42.
42. Сцепленный с Х-хромосомой тип наследования
Генотип Соотношение в потомстве
Самцы Самки
Самцы Самки нормальные аномальные А а нормальные гетерозиготные гомозиготные Аа Аа аа
А- АА 100 0 100 0 0 А— Аа 50 50 50 50 0 Л- аа 0 100 0 100 0 а- АА 100 0 0 100 0 а- Аа 50 50 0 50 50 а- аа 0 100 0 0 100
В этих случаях характерно то, что аномалия наблюдается пре-
имущественно у особей мужского пола, являющихся родствен-
ными по материнской линии. Если же аномалии подвержены
особи женского пола, то, очевидно, они ее унаследовали от
аномального отца и будут передавать эту аномалию сыновьям.
Потомство от спариваний аномальных производителей с нор-
мальными самками будет нормальным, но самки Fj могут дать
аномальных сыновей. И наконец, еще одна характерная особен-
ность Х-сцепленного рецессивного наследования аномалий со-
стоит в том, что при подборе нормальных производителей и
гетерозиготных самок вероятность рождения аномальных потом-
ков составляет 50 % среди самцов и 0 % среди самок.
Что касается наследования доминантного гена, локализован-
ного в Х-хромосоме, характерные особенности таковы:
258
от аномальных отцов все дочери будут тоже аномальными, а
все сыновья — нормальными;
аномальными потомки будут только в тех случаях, когда этот
признак имеется у одного из родителей;
у нормальных родителей все потомки будут нормальными;
аномалия проявляется в каждом поколении;
если аномалия у матери, то вероятность рождения аномально-
го потомка равна 50 % независимо от пола.
И наконец, последняя деталь Х-сцепленного доминантного
наследования аномалий: поражаются как самцы, так и самки, но
в среднем аномальных самок в такой родственной труппе должно
быть в.2 раза больше, чем самцов.
Как отмечалось выше, у сельскохозяйственных животных до
сих пор были известны в основном Х-сцепленные рецессивные
аномалии.
МУЛЬТИФАКТОРИАЛЬНОЕ НАСЛЕДОВАНИЕ
Развитие исследований в генетике, в том числе и ветеринар-
ной, привело к выводам о том, что далеко не при всех формах
или даже случаях патология — простой менделирующий признак.
Часто она обусловлена действием двух (или нескольких) пар
неаллельных генов, при сочетании которых возникает та или
иная аномалия. В этом случае речь идет об олигогенно-компле-
ментарном наследовании. Например, спастический парез у круп-
ного рогатого скота, как показывают расчеты, проявляется при
взаимодополняющем действии не менее пяти пар генов. Поли-
генное или мультифакториальное наследование может иметь
место во многих случаях врожденной патологии животных. Это
связано с тем, что развитие даже отдельного признака детерми-
нировано многими парами генов, мутации которых могут приво-
дить к той или иной аномалии развития. При этом патологичес-
кий фенотип проявляется тогда, когда суммарное действие гене-
тических и средовых факторов достигает определенного уровня,
или, как говорят, порога. Выраженность патологического при-
знака может меняться от нулевого до максимального в зависи-
мости от количества генов, подвергшихся мутации. С другой
стороны, полагают, что на фоне действия нескольких мутантных
генов аномалия может возникнуть в результате влияния одного,
так называемого главного, гена.
Полигенная модель наследования имеет следующие общие
характеристики:
высокая частота в популяции;
существование клинических форм, образующих непрерывный
ряд от скрытых субклинических до резко выраженных проявлений;
относительно низкий уровень конкордантности по манифест-
ным проявлениям аномалии у монозиготных близнецов (60 % и
259
ниже), тем не менее существенно превышающий соответствую-
щий уровень у дизиготных близнецов;
несоответствие закономерностей наследования простым мен-
дельским моделям;
сходство клинических и других проявлений аномалии у бли-
жайших родственников и пробанда, что отражает коэффициент
наследуемости (для полигенных аномалий он превышает 50—
60 %, для моногенных — 100 %).
Мультифакториальная модель наследования аномалии (так
же, как и выше рассмотренные моногенные) предполагает, что
вероятность проявления патологии среди родственников и уже ее
имеющих много выше, чем в общей популяции. Вероятность
проявления аномалии зависит от степени родства с аномальным
родственником.
Некоторые другие аспекты наследования мультифакториаль-
ных аномалий рассматриваются в следующих разделах учебника.
< ПЕНЕТРАНТНОСТЬ И ЭКСПРЕССИВНОСТЬ
\ ПРИ НАСЛЕДОВАНИИ АНОМАЛИЙ
При доминантном типе наследования наблюдаются случаи,
когда от аномального родителя рождается нормальный потомок,
который, в свою очередь, дает аномальный приплод. Из этого
ясно, что «нормальное» животное было гетерозиготным носите-
лем аномального гена, который, однако, не проявился в его
фенотипе. Доминантные признаки, которые не всегда проявля-
ются в фенотипе, получили название признаков с неполной
пенетрантностью.
Различают признаки с полной и неполной, средней или низ-
кой степенью пенетрантности, выраженные в процентах или
долях единицы. К доминантным аномалиям с неполной пенет-
рантностью гена можно отнести анкилоз всех суставов в сочета-
нии с «волчьей пастью», летальную аномалию «баранья голова» у
крупного рогатого скота и др. У коз комолость обусловлена
рецессивным геном рр и сочетается с нарушением плодовитости
вследствие закупорки придатка семенника. При скрещивании
комолых родителей рождается около 20 % козлов, полностью
непригодных для воспроизводства.
Пенетрантность стерильности колеблется от 0,42 до 0,62.
Как уже известно, существует понятие экспрессивности генов.
В качестве примеров разной экспрессивности генов можно при-
вести следующие. Так, адактилия у крупного рогатого скота ва-
рьирует от частичного до полного отсутствия фаланг конечнос-
тей. При исследовании пупочных грыж у телят мы обнаружили
значительные различия в диаметре грыжевого отверстия. При
изучении нарушения координации движений у телят черно-пе-
строй и симментальской пород мы наблюдали заметную разницу
260
во внешнем проявлении аномалии — от дрожания головы и по-
качивающейся ходьбы до резко выраженной несогласованности
движений головы и конечностей при попытке животных встать.
Патологоанатомическими и гистологическими исследованиями
установлена различная степень гипоплазии мозжечка у телят, что
сочеталось со степенью фенотипического проявления аномалии.
АНОМАЛИИ У СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ,
ОБУСЛОВЛЕННЫЕ МУТАЦИЯМИ ГЕНОВ
У сельскохозяйственных животных известны десятки анома-
лий, возникновение которых связано с рецессивными или доми-
нантными мутациями генов. Эти аномалии встречаются в от-
дельных популяциях с разной частотой, что зависит от скорости
мутационного процесса, системы разведения животных и др.
Знание конкретных форм врожденных аномалий у животных
каждого вида, а также частоты их проявления в отдельных поро-
дах необходимо ветеринарным специалистам для селекционной
профилактики распространения генетической патологии.
Аномалии у крупного рогатого скота. Биологические особен-
ности данного вида животных — малоплодие и относительная
позднеспелость. Корова обычно приносит одного теленка, кото-
рый достигает половой и физиологической зрелости только к
1,5 года, так что период между первым отелом матери и дочери
в среднем составляет 5 лет. Вследствие этого появление в стаде
аномального приплода может существенно снижать уровень вос-
производства и интенсивность племенного отбора поголовья. У
крупного рогатого скота изучен широкий спектр врожденных
аномалий, детерминированных летальными, полулегальными и
субвитальными генами. 46 аномалий включено в Международ-
ный список летальных дефектов под шифром А (табл. 43).
43. Список генетически обусловленных аномалий
у крупного рогатого скота
_____________________Признак аномалии____________________[Тип наследования
1. Укорочение нижней челюсти ар
2. Укорочение верхней и нижней челюстей (мопсовидность) ар
3. Отсутствие нижней челюсти ар
4. Укорочение верхней челюсти дни
5. «Волчья пасть», «заячья губа» и др. д
черепно-лицевые дефекты
6. Отсутствие носовых отверстий ар
7. «Баранья голова» — выгнутый, как у барана, лицевой про- днп
филь головы
8. Мозговая грыжа ар
9. Водянка головного мозга ар
10. Уменьшение размеров глазного яблока ар
И. Отсутствие глазных яблок ар
261
Продолжение
Признак аномалии,[Тип наследования
12. Помутнение хрусталика ар или д
13. Слепота ар или д
14. Альбинизм ар
15. Искривление и деформация передних конечностей, непо- спр
движность в запястных суставах
16. Контрактура задних конечностей, закрюченность их в сто- ар
рону брюха
17. Неподвижность конечности (мышечная контрактура) ар
18. Контрактура мышц конечностей и направленность их ар
назад
19. Неподвижность (анкилоз) всех суставов, «волчья пасть» ар или д
20. Искривление и анкилоз передних конечностей ар
21. Отсутствие задних конечностей ар
22. Отсутствие передних н задних конечностей ар
23. Редукция числа позвонков ар
24. Расщепление позвоночника ар
25. Бульдогообразная карликовость д
26. Пропорциональная карликовость ар
27. Коротконогость в сочетании с дефектами челюсти ар
28. Водянка плода ар
29. Мумификация плода ар
30. Бесшерстность ар
31. Отсутствие кожи на отдельных участках ар
32. Удлинение сроков стельности коров ар
33. Слияние копытец ар
34. Эпилепсия ар
35. Паралич задних конечностей ар
36. Хромота задних конечностей (спастический парез) ар
37. Нарушение координации движений ар
38. Порфирия (повышенная светочувствительность) ар
39. Гиперемия кожи и слизистых оболочек, одышка, наруше- ар, д
ние роста
40. Нарушение обмена цинка (дерматиты) ар
41. Отсутствие фермента маннозидазы (агрессивность, деталь- ар
ный исход)
42. Бесхвостость, отсутствие костей таза, аномалии прямой ар
кишки и урогенитальной системы
43. Пупочная грыжа ар или д
44. Хрупкость кожи и периферических кровеносных сосудов, ар
отеки кожи
45. Скручивание и деформация скелета ар
46. Дефекты морфологического строения спермиев (дефекты ар •<
акросомы, деформации хвоста и средней части, образова-
ние петель, эксцентричное прикрепление хвоста, дезинтег-
рация спермиев)
Обозначения: ар — аутосомный рецессивный; д — доминантный; днп —
доминантный с неполной пенетрантностью; спр — сцепленный с полом рецес-
сивный.
262
Относительная частота отдельных типов аномалий в каждой
породе или популяции может быть различной. В костромской
породе, по нашим данным, наиболее часто регистрируется гене-
тическая аномалия головы — укорочение челюсти (табл. 44), в
ярославской породе — синдактилия, в холмогорской — контрак-
туры мышц, в черно-пестрой — пупочные грыжи. У крупного
рогатого скота в Германии наиболее часто (21 %) встречались
аномалии центральной нервной системы.
Второе место по частоте регистрации (14 %) занимала ком-
плексная аномалия — сочетания пупочных грыж с расщеплением
брюха и плода в целом.
44. Частота отдельных форм врожденных аномалий у телят костромской
породы (по данным племенного хозяйства за 1969—1982 гт.)
Всего аномальных телят
Форма аномалии ЧИСЛО | % от общего поголовья
Укорочение нижней челюсти 36 31,30
Мопсовидность 4 3,47
Водянка плода 5 4,34
«Щучья голова» 1 0,86
Атрезия ануса 3 2,60
Уродства конечностей 10 8,69
Вывернутые лопатки 2 1,73
Искривление костяка 1 0,86
Искривление хвоста 3 2,60
Искривление конечностей 26 22,60
Слабость конечностей 7 6,08
Слепота 3 2,60
Неклассифицированные уродства 14 12,17
Всего 115 100,00
Частота аномалий, или процентное отношение аномального
приплода к общему его числу, в пределах конкретных популяций
также может быть самым различным и по средним оценкам не
превышать 1 %. Однако этот показатель зависит от полноты и
точности регистрации аномалий. Так, в Германии после органи-
зации четкого учета сделали вывод, что частота аномалий воз-
росла в несколько раз. Вопрос в другом: все ли аномалии подда-
ются визуальному наблюдению? Очевидно, не все. Так, в ко-
стромской породе средняя частота всех форм аномалий за
12-летний период составила 1,15 %. Частота же общей смертнос-
ти приплода (абортированные, мертворожденные, аномальные,
павшие без видимых дефектов телята) в этом хозяйстве состави-
ла 10,2 %. Определенная доля этой смертности также связана с
генными мутациями, вызывающими не морфологические дефек-
ты, а нарушение обмена и другие аномалии, выявление которых
возможно только специальными методами.
Особую роль в распространении генетических аномалий как у
263
крупного рогатого скота, так и у животных других видов могут
сыграть производители. От каждого производителя при искусст-
венном осеменении в год можно получить сотни и тысячи потом-
ков. Так, от одного быка за рубежом получили 100 тыс. телят.
Если такой производитель окажется носителем генной мутации,
то она быстро распространится в породе. Вот некоторые примеры
из многочисленных фактов, описанных в литературе. В результате
интенсивного использования быка Принца Адольфа, завезенного
в Швецию, и последующего стихийного инбридинга на него час-
тота бесшерстности в отдельных шведских стадах была свыше
5 %. Такая же ситуация сложилась в Швеции после импорта быка
Галлуса, который оказался гетерозиготным носителем гена, обу-
словливающего отсутствие конечностей.
В потомстве отдельных быков черно-пестрой породы и шароле в
США и Германии регистрировали случаи рождения карликовых
телят с частотой соответственно 23,3 и 22,2 %. В бывш. Чехослова-
кии при обследовании потомков 166 быков-производителей уста-
новлен^ что 43 из них были носителями летальных генов. У одного
быка — носителя доминантной аномалии «заячья губа» — дефект
проявился среди 44 % бычков и 71 % телочек из его потомства.
В костромской породе нами проанализировано распростране-
ние укорочения нижней челюсти и мопсовидности через быка
[Ц - ГЕТЕРОЗИГОТНЫЙ ПРОИЗВОДИТЕЛЬ
Q - ГЕТЕРОЗИГОТНАЯ КОРОВА
ГОМОЗИГОТНЫЙ АНОМАЛЬНЫЙ потомок
Рис. 57. Схема, иллюстрирующая рецессивное наследование укорочения нижней
челюсти н монсовидности в одной линии костромской породы
264
Бурхана, который сам имел в потомстве дефектных телят; его
сыновья, внуки, правнуки, женские потомки также давали ано-
мальный приплод (рис. 57). Большинство телят получено от
родственного спаривания и спаривания родителей с нормальным
фенотипом при наличии общего предка. Следовательно, можно
сделать вывод о рецессивном типе наследования данной анома-
лии. Из рисунка видно, что наибольшее количество дефектных
телят зарегистрировано в потомстве быка Жетона 3501 (внука
быка Бурхана) при использовании его в товарном хозяйстве, где
часть коров имела в генотипе такой же рецессивный ген.
Аномалии у свиней. В Международный список летальных де-
фектов свиней включено 18 генетических аномалий. Основная часть
их обусловлена аутосомными рецессивными генами (табл. 45).
45. Список генетически обусловленных аномалий у свиней
Фенотип аномалии I Тип наследования
1. Мозговая грыжа ар
2. Паралич задних конечностей ар
3. Отсутствие анального отверстия —
4. Расщепление нёба («волчья пасть») д
5. Толстоногость ар
6. Искривление и ригидность конечностей ар
7. Недоразвитие ушных раковин ар
8. Водянка головного мозга ар
9. Отсутствие конечностей ар
10. Дивертикулез подвздошной кишки ар
11. Порфирия д
12. Отеки на затылке. Зобообразная припухлость шеи ар
13. Гиперкератоз ар
14. Желтуха новорожденных д
15. Гемофилия ар
16. Укорочение позвоночника, черепно-лицевые дисплазии ар
17. Дефекты кожи ар
18. Агенезия мышц сфинктера заднего прохода ар
19. Укорочение верхней челюсти ар
20. Укорочение нижней челюсти —
21. Отсутствие нижней челюсти —
22. Уменьшение размеров глазного яблока —
23. Водянка глазного яблока —
24. Циклопия —
25. Альбинизм ар
26. Эпилепсия и судороги п
27. Короткохвостость в сочетании с гидроцефалией ар, нд
28. Трехногие поросята ар
29. Полное или частичное отсутствие фаланг —
30. Искривление задних конечностей кпереди и в сторону ар
31. Пупочная грыжа д
32. Дефекты акросомы спермиев ар
33. Крипторхизм ар
Обозначения: ар — аутосомный рецессивный; д — доминантный; нд — не-
полный доминантный; п — полигонный.
265
Генетические аномалии могут занимать значительное место в
патологии свиней. Рассмотрим несколько таких примеров. В Ис-
пании при исследовании 23 449 поросят из- 2399 пометов, полу-
ченных от хряков пород дюрок, йоркшир, гемпшир и белый
честер, выявили соответственно 6,21; 6,02; 9,66; 2?62 % аномаль-
ных пометов.
Согласно данным Оливье (1979), у свиней описано 7 генети-
ческих аномалий кожного покрова, 17 — скелета, 3 — глаз, 13 —
нервно-мышечных, 6 — крови, 6 — гормонально-обменных, 5 —
пищеварительной системы, 9 — мочеполовой. Основными ано-
малиями были крипторхизм, грыжи, псевдогермафродитизм и др.
Автор исследования считает, что эти аномалии — результат дей-
ствия одного гена на разных этапах формирования эмбриона.
В Дании для выяснения характера и частоты возникновения
врожденных аномалий в течение двух лет исследовали 6669 пав-
ших поросят из 2936 пометов. Различные аномалии выявлены у
1,4 % поросят к числу родившихся, или 6,2 % к числу павших до
отъема особей. При патологоанатомическом исследовании у
25,9 % аномальных поросят были обнаружены недоразвитие кла-
панов, незакрытие анального отверстия, субаортальные стенозы,
эктопия сердца и другие дефекты сердечно-сосудистой системы.
У 23,4 % поросят найдены различные нарушения развития дви-
гательной системы. Аномалии центральной нервной системы вы-
явлены у 5,9 % поросят, среди них раздвоенный мозг и водянка
мозга. Заращение прямой кишки, тонких кишок или их непол-
ное развитие обнаружены у 30 % поросят, а различные грыжи и
асцит — у 6,8 %. «Заячья губа», расщепление нёба, риноцефалит
и другие аномалии лицевой части головы найдены у 6,1 %; гер-
мафродитизм, незаращение мочеточника, водянка почек и урет-
ры—у 1,7 % поросят. Указанные аномалии проявлялись в по-
томстве отдельных производителей при инбридинге, что указы-
вает на наследственный характер их возникновения.
Весьма убедительные доказательства наследственной природы
крипторхизма у свиней получили Фридин и Ньюман. По их дан-
ным, в Канаде одно-, двухсторонний крипторхизм наблюдается
ежегодно у 1—2 % всех хрячков, поступающих на рынок. Авторы
скрещивали крипторхов с их матерями и полными сестрами. По-
томков от таких скрещиваний спаривали между собой. В резуль-
тате такого отбора и подбора частота крипторхизма у эксперимен-
тальных животных йоркширской породы возросла в среднем до
42,9 % и особенно при использовании двух производителей. Йри
обследовании поросят в США за один год было обнаружено около
400 тыс. животных с мошоночной грыжей.
Наблюдения показывают, что причиной нарушения плодови-
тости у хряков нередко бывает гипоплазия семенников. Частота
этой аномалии, по данным исследователей из Германии, соста-
вила 19,6 %. 30 таких хряков были оставлены для воспроизводст-
266
ва, каждым из них было покрыто от 4 до 40 маток (всего
439 голов), но лишь четыре из них дали потомство. Анализ по-
казал, что патологические формы спермиев у этих хряков состав-
ляют 80—100 %. Все 30 аномальных животных имели общих
предков, что указывает на наследственный характер гипоплазии
семенников и дефектов спермиогенеза.
Наличие кратерных сосков у свиней — один из серьезных де-
фектов, поскольку поросята не получают от них молока. По
данным Баварского института животноводства (Германия), час-
тота этой аномалии у немецких ландрасов составила 6,6 %. Как
отмечают П. Н. Кудрявцев и др. (MBA), количество свиней с
бездействующими кратерными сосками в последние годы увели-
чилось. Число таких сосков колеблется от 1 до 8. Поросята,
которым достаются кратерные соски, погибают.
Кратерность — признак, обусловленный одним аутосомным
рецессивным геном. Экспериментально это проверили
П. Н. Кудрявцев с сотр. Предварительно выделив хряков и сви-
нок — носителей аномалий (кчкч), нормальных, но гетерозигот-
ных особей (Кчкч), дающих в приплоде поросят с кратерностью,
и нормальных гомозиготных свиней (АчХч), авторы провели
скрещивания между этими группами животных; В первом вари-
анте скрещивали 27 нормальных гомозиготных маток с 15 хряка-
ми. Все 258 потомков были нормальными. Во втором варианте,
где один из родителей был гомозиготным (КчКч), а другой —
гетерозиготным (Кчкч), все поросята также были нормальными.
В третьем» варианте скрещивали 13 гетерозиготных хряков с
16 гетерозиготными матками. Из 168 родившихся поросят 39
(23,2 %) имели кратерные соски. И наконец, в четвертом вари-
анте один из родителей был гомозиготным, а другой — гетерози-
готным. От них было получено 170 поросят, из них 86 (50,5 %)
оказались с нормальными сосками и 84 (49,5 %) — с кратерны-
ми. Результаты этого опыта доказывают рецессивный тип насле-
дования кратерности сосков у свиней.
Аномалии у овец. У овец описано около 90 врожденных ано-
малий. По данным Денниса и Лейпольда, большинство извест-
ных генетических дефектов у овец обусловлено монотонным ау-
тосомным рецессивным типом наследования (табл. 46). Наибо-
лее часто у этого вида животных встречаются черепно-лицевые
дефекты, особенно агнатия, а также искривление передних ко-
нечностей, микроагнатия, гермафродитизм, крипторхизм, гипос-
падиаз, прогнатия, атрезия ануса, микротия, энтропия, тортико-
лис, полителия, артрогрипоз. Анализ показал, что 55,4 % дефек-
тов относились к мышечно-скелетной системе, 12,7 — к
пищеварительной, 9,7 — к сердечно-сосудистой, 7,1 — к урогени-
тальной, 6 — к центральной нервной системе, 3,5 — к аномалии
связок, 3,2 — к брюшной, 1,5 % — к эндокринной системе. Хотя
267
частота отдельных дефектов и невысока, однако кумулятивный
вклад всех аномалий может нанести ущерб хозяйствам.
46. Слисок генетически обусловленных аномалий у овец
_____________________Фенотип аномалии __________________| Тип наследования
1. Отсутствие нижней челюсти и непроходимость пищевода ар
2. Выпадение шерсти, облысение ар
3. Крротконогость ар
4. Мышечная контрактура — сильно согнутое положение мус- ар
кулатуры конечностей. Слабое развитие. Ягнята обычно
мертворожденные
5. Уменьшение размеров глазных яблок или их отсутствие — ар
слепота
6. Отсутствие мышечной координации. Некоторые ягнята еле- ар
пые и глухие
7. Неопущение семенников в мошонку (крипторхизм) ар
8. Карликовость ар
9. Недоразвитие ушной раковины и «волчья пасть» ар
10. Летйьная серая окраска д
11. Летальная мышечная дистрофия. Ягнята рождаются живы- ар
ми, но погибают вскоре после рождения
12. Паралич тазовых конечностей ар
13. Деформация скелета в сочетании с короткой шерстью и ар
грыжами
14. Частичное или полное отсутствие фаланг конечностей ар
15. Светочувствительность, красно-коричневая окраска кос- ар
тей и зубов
16. Непроходимость ануса ар
17. Врожденная водянка. Скопление жидкости в подкожной » ар
соединительной ткани грудной и брюшной полостей
18. Отсутствие дистальных отделов конечностей ар
19. Ватность. Отсутствие ости д
20. Узкоглазость ар
21. Дистрофия нервных волокон. Нарушение двигательных ар
функций
22. Избыток билирубина ар
23. Коллагенная дисплазия. Нарушение формирования колла- ар
гена
24. Искривление шеи ар
25. Недоразвитие и отсутствие ушей. Глухота д
26. Укороченные челюсти
27. Судороги головы и шеи, ягнята не могут двигаться
28. Одноглазие
29- Дефекты наружной кожи, язвы
30. Заворот век внутрь глаза
31. Пупочные грыжи
32. Бесшерстность
33. Недоразвитие мужских половых органов
34. Уменьшение размеров черепа и головного мозга
35. Нарушение развития костяка
36. «Волчья пасть» (расщепление нёба)
268
Продолжение
Фенотип аномалии (Тип наследования
37. Несформированный вырез мошонки —
38. Отсутствие задней части позвоночника —
39- Постоянные пупочные кровотечения —
40. Затянувшаяся беременность —
41. Ложный гермафродитизм. Бесплодие —
42. Однокопытность. Слияние копытного рога —
43. Уменьшение размеров одного или двух семенников —
Обозначения: ар — аутосомный рецессивный; д — доминантный.
В Новой Зеландии, в стране развитого овцеводства, частота
» летальных дефектов составила около I % павших ягнят. В США
летальные дефекты в первые 2 нед жизни наблюдались у 11,4 %
ягнят.
Средняя эмбриональная смертность у овец равна 20 %. Это
указывает на то, что в этот период могут проявлять свое дейст-
вие многие неидентифицируемые летальные гены.
Отдельные генетические аномалии у овец могут быть широко
распространены. Так, в Болгарии в стадах мериносовых овец
наблюдали высокую смертность ягнят в ранний постнатальный
период. Она наступала в результате того, что ягнята не получили
молока из-за дефектов вымени их матерей: от гипоплазии с
небольшими остатками железистой ткани до полного отсутствия
ее. Частота этой наследственной аномалии в разных стадах коле-
балась от 6 до 40 %.
У овец часто наблюдали крипторхизм, который сочетался с
таким вторичным половым признаком, как комолость. Комолые
бараны имеют низкую плодовитость. Путем жесткого племенного
отбора удалось создать тип комолых баранов с нормальной плодо-
витостью, однако и среди них встречаются аномальные особи.
Аномалии у птиц. Птицы, прежде всего куры, наиболее изуче-
ны в отношении генетики аномалий. В Международный список
летальных дефектов включено 45 аномалий у кур, 6 у индеек и 3
у уток. Наиболее часто встречаются аномалии клюва (клюв попу-
гая, перекрещивающийся клюв). Частота их, по данным Уильяма
и др., составляет 1,1 % потерь при инкубации яиц кур пород
. белый леггорн и род-айланд. Аномалии клюва часто встречаются
и у уток.
„ Макс Джиббон и Шейкелферд описали аномалию при скре-
X, щивании белых леггорнов с батеркампами и бентамками и пос-
i ледующем разведении «в себе» — полидактилию. Кроме нее у
J цыплят наблюдали синдактилию и оперенные ноги. Частота син-
? дрома составляла 16,8 %. При скрещивании аномального петуха
~ Fi с нормальными по фенотипу курами наблюдали расщепле-
f ние — половина нормальных и половина аномальных особей
269
(1:1). Установлено, что данный комплекс признаков контролиру-
ется одним аутосомным геном, обладающим полулегальным эф-
фектом, так как эмбриональная и постэмбриональная выживае-
мость аномальных цыплят очень низка.
Аномалии у лошадей. Из наследственных аномалий у лошадей
10 включены в Международный список летальных дефектов.
Среди них 3 аномалии скелета, 2 — воспроизводительной систе-
мы, 2 — почек и мышц, по одной аномалии кишечника, нервной
системы, органов зрения.
У лошадей тяжеловозных пород чаще встречается атрезия
ободочной кишки. Распространение этой аномалии было отме-
чено в потомстве жеребца Суперба першеронской породы. Опи-
сана она также у жеребят чистокровной верховой породы остф-
ризского происхождения. У тяжеловозных пород зарегистриро-
ван несовершенный эпителиогенез. У жеребят ольденбургской
породы в Германии обнаружена атаксия, названная ольденбург-
ской. Распространилась она в линии 9. Одна из наиболее часто
регистрируемых аномалий у лошадей — пупочная грыжа. Встре-
чается она у легких и тяжеловозных пород.
У лошадей известны некоторые другие генетические и наслед-
ственно-средовые аномалии. Так, в США у лошадей нескольких
пород наблюдается появление жеребят со своеобразной белой
пятнистостью, названной «оверо». При скрещивании лошадей
типа «оверо» рождаются жеребята с розовой кожей, у которых
наблюдают гипоплазию кишечного тракта и изоэритролиз, а
также колики, приводящие к гибели.
В Англии у лошадей -чистокровной верховой породы зареги-
стрированы и исследованы животные с нарушением координа-
ции движений — «болезнь вихляния». Установлена генетическая
предрасположенность к этой аномалии.
Доказана наследуемость дерматозов конечностей у лошадей.
Пороками с наследственной предрасположенностью являются
нередко встречающееся хроническое деформирующее воспаление
скакательного сустава — шпат, так называемая «костыльная
нога» у жеребят, а также хроническое асептическое воспаление
венечного блока копыт, наблюдаемое в основном у скаковых и
беговых лошадей.
ЗАКОН ГОМОЛОГИЧЕСКИХ РЯДОВ
В НАСЛЕДСТВЕННОЙ ИЗМЕНЧИВОСТИ
Выдающийся советский ученый академик Н. И. Вавилов при
изучении коллекций диких и культурных растений, собранных во
время экспедиций в разных странах мира, обнаружил в них
много общих наследственных изменений. На основании этих
исследований он сформулировал закон гомологических рядов
наследственной изменчивости:
270
1) генетически близкие виды и роды характеризуются сходны-
ми рядами наследственной изменчивости с такой правильнос-
тью, что, зная ряд форм в пределах одного вида, можно предви-
деть существование параллельных форм у других видов и родов.
Чем ближе генетически расположены в общей системе роды и
линнеоны, тем полнее сходство в рядах их изменчивости;
2) целые семейства растений в общем характеризуются опре-
деленным циклом изменчивости, проходящей через все роды и
виды, составляющие семейство.
Этот закон, как показали дальнейшие исследования ученых,
имеет универсальный характер. Обнаружено сходство мутаций не
только у растений, но и у животных. Так, были подмечены
появления аналогичных форм аномалий у разных видов живот-
ных, что указывает на сходство строения многих ферментов и
белков и соответственно на сходство генотипов у них. Эти дан-
ные подтверждают закон гомологических рядов. Зная формы
аномалий у одного вида животных, следует предполагать, что
они имеются или могут возникнуть и у другого вида, близкого с
первым по происхождению (табл. 47).
47. Наследственные дефекты, встречающиеся
а аналогичной форме у разных видов домашних животных
(по Хатту, 1969; Мейеру, Вегнеру, 1974)
Аномалии систем органов Лоша- ди Круп- ный рогатый скот Овцы Свиньи Соба- ки Кош- ки Ку- ры
Кожи:
дефектность эпителия Р Р р
отсутствие шерсти или перьев Р/Рп Д д X Дп/Р
ихтиоз (чешуйчатость кожи) Р Р
Скелета:
карликовость Р X X X р/п
бульдогообразная карликовость д/р Р X X д
укорочение позвоночника Р р р д
отсутствие конечностей Р Р Р р р
укорочение челюсти Р д/р X р X X р
расщепление нёба Р X р X X
«заячья губа» Р р
Нервной системы:
атаксия Р X р р р р
паралич задних конечностей р р р
контрактура мышц р р р р
водянка головы р р
мозговая грыжа р р
Внутренних органов:
урогенитальные дефекты Р р
крипторхизм Р р р
271
Продолжение
Аномалии систем органов Лоша- ди Круп- ный рогатый скот Овцы Свиньи Соба- ки Кош- ки Ку- ры
Обмена веществ и эндокринной
системы:
порфирия р р
Обозначения: р — рецессивный тип наследования; д — доминантный; х —
тип наследования точно не установлен.
РАСПРОСТРАНЕНИЕ АНОМАЛИЙ ХРОМОСОМ
В ПОПУЛЯЦИЯХ ЖИВОТНЫХ
Исследования, проведенные у человека, показывают, что изме-
нения в кариотипе приводят к различным формам нарушений
воспроизводительной функции, жизнеспособности и болезням.
Установлено, что геномные и хромосомные мутации, вызывая на-
рушения морфогенеза с самого начала развития зиготы, обуслов-
ливают до 90 % гибели зародышей в первые 2 нед их развития.
Весьма существенной и хорошо изученной причиной спонтанных
абортов, мертворождений являются аномалии хромосомного набо-
ра у плода при нормальном кариотипе родителей. Например, среди
спонтанных абортов у человека в первом триместре беременности
хромосомными нарушениями обусловлено 53 %, во втором —
около 28,3 %, т. е. хромосомные аномалии вызывают 45,6 % спон-
танных абортов и 6 % мертворождений. В перинатальной смерт-
ности доля хромосомных аномалий составляет 7,2 %.
У сельскохозяйственных животных этот вопрос изучен еще не
в полной мере. Однако имеющиеся данные указывают на то, что
между отдельными видами, породами, линиями и семействами
существуют различия по частоте и типам аберраций хромосом.
Следовательно, появление аберраций хромосом в значительной
степени зависит от генетических факторов.
Числовые нарушения хромосом, такие как полиплоидия, наи-
более часто обнаруживают в бластоцитах свиней и редко у круп-
ного рогатого скота. У эмбрионов птиц сравнительно часто (1,2 %
всех эмбрионов) наблюдают гаплоидный набор хромосом, а в двух
бройлерных линиях частота этого феномена составляет 4,4 %.
Частые случаи стерильности кобыл связаны с высокой часто-
той у этого вида моносомии по Х-хромосоме.
У свиней и коз часто наблюдают интерсексуальность, в боль-
шинстве случаев мужской псевдогермафродитизм, связанный с
химеризмом ХХ/ХУ хромосом и имеющий генетическую обу-
словленность. Интересно отметить, что химеризм XX/XY у сви-
ней сочетается с паховыми грыжами. Подсчитано, что у свиней
примерно 30 % ранней эмбриональной смертности связано с
аберрациями хромосом.
272
7
У птиц 10—11 % погибших эмбрионов оказываются гетероп-
лоидными. Профессор И. Густавссон (1980) отмечает, что такие
характеристики кариотипа, как поломки хромосом, нерасхожде-
ния, формирование полиплоидных клеток и структурных аберра-
ций, имеют генетическую основу, а их частота в_ популяциях
животных в большей степени обусловлена методами разведения
й интенсивностью селекции. Отсюда можно сделать вывод о том,
i что знание конкретных форм аномалий кариотипа и их влияния
на признаки животных — один из инструментов в руках ветери-
' парного врача, применяя который он может эффективно профи-
лактировать нарушения плодовитости, жизнеспособности и рас-
пространения болезней.
ЧИСЛОВЫЕ И СТРУКТУРНЫЕ МУТАЦИИ КАРИОТИПА
И ФЕНОТИПИЧЕСКИЕ АНОМАЛИИ ЖИВОТНЫХ
Крупный рогатый скот. В кариотипе его содержится 60 хромо-
сом. Впервые их подсчитал Краллингер в 1927 г. Обнаружены
разные формы числовых и структурных аномалий кариотипа,
которые сочетаются с нарушением плодовитости, эмбриональной
смертностью, интерсексуальностью, злокачественными процесса-
ми (лейкоз, саркома и др.), врожденными уродствами и некото-
рыми генетическими аномалиями обмена веществ, болезнями
животных.
Числовые аномалии кариотипа (анеуплоидия).
Числовые аномалии хромосом относят к вновь возникающим
мутациям. Однако имеются исследования, которые показывают,
что может быть семейная предрасположенность к анеуплоидии.
Так, Герцог, Хен и Олишлегер при описании шести случаев
трисомии по 17-й хромосоме (новой форме трисомии у крупного
рогатого скота), сочетающейся с синдромом общего недоразви-
тия телят (нанизм), гидроцефалией, микрофтальмией, аномалия-
ми сердца и крипторхизмом, указывают на генетическую пред-
расположенность к нерасхождению хромосом.
i С. Г. Куликова (1991) обнаружила трисомию по 19-й паре
хромосом, которая ассоциировалась с прогнатией нижней челюс-
I ти у теленка (рис. 58).
I Гаметы с трисомией, моносомией, нуллисомией и полисе-
мией обычно вызывают летальный исход уже на ранних стадиях
эмбрионального развития и являются продуктом нарушения
спермио- или овогенеза у носителей транслокаций. После рож-
дения наблюдают числовые нарушения только по мелким ауто-
сомам и половым хромосомам.
Полиплоидия. Увеличение числа наборов хромосом —
j полиплоидию наблюдали как в соматических, так и в половых
* клетках в мозаичной форме, т. е. как определенный процент
1 клеток с аномальным набором хромосом.
273
I
Рис. 58. Трисомия по 19-й хромосоме у крупного рогатого скота
(REG-окраска хромосом)
Полностью (100 %) полиплоидные эмбрионы у крупного ро-
гатого скота и других видов животных, за исключением птиц,
отмирают на ранних стадиях онтогенеза. Полиплоидию обнару-
живали в бластоцитах телок, забитых через 12—16 дней после
случки. И. Л. Гольдман и др. отмечали возрастание полиплои-
дии у крупного рогатого скота, больного лейкозом. По данным
болгарских ученых, бычки с высоким уровнем соматической
полиплоидии во взрослом состоянии показали клиническую кар-
тину лейкоза. По мнению ученых, подбор животных с учетом
стабильности кариотипа может способствовать эффективности
274
мероприятий, направленных на искоренение лейкоза у крупного
рогатого скота.
Привлекает внимание работа Г. К. Исаковой, В. И. Евсикова,
Д. К. Беляева (1976) на норках. В ней они показали, что 11,9 %
имплантированных эмбрионов имеют триплоидию, мозаицизм
2п/3п или 2п/4п. Анализ полиплоидии в сперматогенном эпите-
лии самцов норок с неудовлетворительной воспроизводительной
характеристикой показал статистически достоверное повышение
частоты полиплоидных клеток по сравнению с соответствующим
показателем у животных с нормальной плодовитостью (5,9 и
9,6 % соответственно).
Анализ полиплоидии в костном мозге самок и самцов с раз-
личной воспроизводительной характеристикой также показал
статистически достоверные различия по уровню полиплоидии:
частота полиплоидных клеток у самок и самцов с нормальной
плодовитостью составила 0,5 и 0,7 % соответственно, у живот-
ных с неудовлетворительной воспроизводительной характеристи-
кой (давших в приплоде в 2 раза меньше телят) — 0,9 и 1,4 %.
Высокий процент полиплоидных клеток наблюдали у крупно-
го рогатого скота с раздвоенным крупом — доппельленднеров с
врожденным пояснично-крестцовым уродством телят, где часто-
та полиплодии была выше 10 % (максимально 40 %) (А. И. Жи-
гачев, 1979; Герцог, Хен, Файнас, 1983).
Структурные мутации хромосом. Транслокации.
Наибольшее количество исследований у крупного рогатого скота
проведено по изучению частоты и влияния на плодовитость цент-
рического слияния — транслокации между 1-й и 29-й аутосомами
(рис. 59). Эта аберрация обнаруже^а'в молочных, мясных и ком-
бинированных породах во многих странах мира, в том числе у
Рис. 59. Транслокация между 1-й и 29-й аутосомами
275
голштино-фризской (США, Англия), немецкой черно-пестрой
(Германия), айрширской (Швеция), симментальской (Швейца-
рия, Германия, Австрия, Венгрия, Россия, Югославия, Новая Зе-
ландия и др.), монбельярдской (Франция), швицкой (США и дру-
гие страны), шароле (Франция), лимузин (Франция, Англия).
Еще в 1977 г. насчитывали 28 пород, в которых была обнаружена
транслокация 1/29 хромосом, а к 1991 г. уже было 50 пород.
Частота транслокаций при обследовании пород была неодина-
ковой и составила у швицкой, айрширской пород — 12,8 %, у
симментальской в Англии — 4,8, в бывшем СССР — 5 % у быков
на племпредприятиях, 10 — у коров и 18 — у ремонтных быков
(А. И. Жигачев и др.), у шароле в Англии — 12,8, у лимузинов
во Франции — от 4 до 14 %.
Транслокация 1/29 хромосом снижает плодовитость крупного
рогатого скота, по отдельным расчетам, на 3,5—10 % и выше.
Причины снижения плодовитости связаны с тем, что у гетерози-
готных носителей робертсоновской транслокации образуются га-
меты $ несбалансированным набором хромосом. Так, при носи-
тельстве транслокации 1/29 хромосом возможно образование
шести типов гамет. Из них 1-й и 2-й типы — это гаметы с
избытком, а 4-й и 5-й — с недостатком генетического материала.
Использование производителя с кариотипом 2n=59, XY Т 1/29
на коровах с нормальным набором хромосом 2n=60, XX может
привести к формированию нежизнеспособных эмбрионов с три-
сомией и моносомией по 1-й и 29-й аутосомам. Такие же резуль-
таты возможны и при других вариантах скрещиваний.
Коровы — носители транслокации 1/29 хромосом, по данным
Густавссона, имеют более низкую молочную продуктивность,
поэтому их раньше выбраковывают.
Во многих странах в законодательном порядке запрещено ис-
пользовать быков — носителей транслокации 1/29 хромосом на
станциях искусственного осеменения. Приняты ограничения или
требования о цитогенетической аттестации при импорте и экс-
порте животных или их гамет.
Кроме транслокации у крупного рогатого скота описаны
центрические слияния между другими парами аутосом (табл. 48).
48. Типы центрических слияний (транслокаций)
между различными парами аутосом у крупного рогатого скота
(по Густевссону, с нашими дополнениями)
Пара аутосом, вступившие в центрические слияния Порода Страна
1/29 Мозаика 13/21/норма 11/12/15/16, или 13/21, или 14/20 7/11/20/25 5/6/15/16 или 6/16 Разные Разные Голштино-фризская Венгрия Симментальская Новая Зеландия, Англия, Венгрия Белая аквитанская и лимузин Франция Декстерская США
276
Продолжение
Пара аутосом, вступившие в центрические слияния Порода Страна
2/4 Британская фризская Англия
27/29 Гернзейская Канада
1/25 Симментальская Германия
3/4 Лимузин Франция
8/9 Швицкая Швейцария
25/27 Альпийский скот
Сведений о влиянии этих типов слияний на фенотип накоп-
лено недостаточно, за исключением транслокации 25/27, которая
снизила плодовитость животных. Рассмотрим на двух конкрет-
ных примерах воздействие транслокаций 1/29 и 25/27 хромосом
на воспроизводительную функцию коров. Так, итальянские уче-
ные сравнивали показатели воспроизводительной функции и
продуктивность коров — полусестер по отцу — носительниц
транслокаций и нормальных особей серой альпийской породы
по средним показателям. Швейцарские ученые такой же анализ
провели на симментальской породе, при этом получили следую-
щие результаты (табл. 49).
49. Число осеменений на зачатие (по Ценеру и др.)
Порода и кариотип Число осеменений Число стельных животных Индекс осеменений Разница
Серая альпийская
2п=60, XX 51 43 1,18
2п=59, XX, Т 25/27 55 41 1,34
Симментальская (шифр быка)
Н2п=60, XX 104 69 1,51 Л 1S
H2n=59, XX, Т 1/29 109 65 1,66
2п=60, XX 149 99 1,51 0 19
2n=59, XX, Т 1/29 101 62 1,63 V,1Z
Для зачатия у коров — носительниц транслокации 25/27 хромо-
сом требовалось большее количество осеменений, чем у их нормаль-
ных полусестер. Число дней от отела до последующего плодотворно-
го осеменения (сервис-период) у коров — носительниц транслока-
ций было выше, чем у их нормальных полусестер (табл. 50).
50. Продолжительность сервис-периода
Порода и кариотип Число животных Сервис-период (дней) Разница (дней)
Серая альпийская 2п=60, XX 17 75,5 9,9
2n=59, XX, Т 25/27 25 85,4
Симментальская (шифр быка) H2n=60, XX 43 74,7 23,7
H2n=59, XX, Т 1/29 39 98,4
2п=60, XX 57 106,0 6,5
2п=59, XX, Т 1/29 41 112,5
277
Венгерский ученый Ковач (1982) указывает на то, что
различия по степени влияния разных типов центрических
слияний на воспроизводительную функцию могут обуслов-
ливаться неодинаковым уровнем смерти несбалансированных
гаплоидных клеток или эмбрионов. Эти различия также
могут быть связаны с утратой центромерных участков хро-
мосом, вступающих в транслокацию, или потерей их функ-
циональной активности.
Кроме транслокаций по типу центрических слияний у круп-
ного рогатого скота обнаружены также реципрокные транслока-
ции и тандемного типа. Так, Хансен (1970) зарегистрировал тан-
демную транслокацию 1-й и 9-й хромосом у датского молочного
скота. Эта аберрация была связана с повышенной эмбриональ-
ной смертностью и снижением плодовитости животных пример-
но на 10 %. 1
Герцог (1972) наблюдал тандемную транслокацию 1-й и 7-й
хромосом у животных немецкой красной породы с гипоплазией
левой «<асти большого полушария мозга, расщеплением позво-
ночника и сегментной аплазией спинного мозга.
Инверсии. Перицентрическая инверсия в 14-й паре хромосом
обнаружена Попеску у нормандской породы, шароле и гернзеев.
Аберрация заметно снижала плодовитость животных.
Интересные работы по изучению причин нарушения спермиоге-
неза и плодовитости быков провел Кнудсен. При анализе гермента-
тивного эпителия быков с уменьшенной плодовитостью ученый об-
наружил у трех животных транслокации, а у восьми — инверсии. На
микрофотографиях, изготовленных при помощи электронного мик-
роскопа, в стадии пахитены была видна петля инверсии, а в стадии
поздней анафазы мейоза был виден инверсионный мост, образовав-
шийся из децентрической хромосомы. Ненормальное поведение
хромосом первичных сперматоцитов во время мейоза вследствие
инверсии было причиной бесплодия быков.
Делеции, нехватки, поломки хромосом. Утраты средних участ-
ков хромосом (делеции) и концевых участков (нехватки) вызыва-
ют обычно летальный эффект на ранних стадиях онтогенеза. Их
находят также у животных с различной патологией.
Нередко в кариотипе обнаруживают поломки хромосом —
хроматидные и хромосомные разрывы с образованием фрагмен-
тов генетического материала. Из множества работ по данному
вопросу следует выделить исследования Хелнан (1982), который
показал, что мелкие делеции или вторичные перетяжки хромо-
сом и изохроматидные разрывы, как он затем их назвал, насле-
дуются и имеют связь с хромотой у крупного рогатого скота
вследствие тазобедренных артритов.
Высокая частота вторичных перетяжек обнаружена и в наших
исследованиях (А. И. Жигачев и др., 1983) у отдельных живот-
ных с врожденными аномалиями и у некоторых быков зарубеж-
278
I кого происхождения. Герцог, Хен и Рикк (1977) при обследова-
нии телят черно-пестрой немецкой породы, больных паракерато-
зом, установили, что у их отцов и матерей число хромосомных
разрывов аутосом было достоверно выше (11,1 и 9,5 %), чем в
среднем у взрослых животных (1,4 %). Авторы предлагают ис-
пользовать число хромосомных разрывов как маркер гетерози-
готности по наследственному паракератозу.
Высокую частоту хромосомных разрывов обнаружили у жи-
вотных, пораженных лейкозом. Делеции, затрагивающие поло-
вую Х-хромосому, наблюдали в кариотипе коров с низкой опло-
дотворяемостью.
В наших исследованиях у коров с многократными перегулами
также отмечены повышенная частота разрывов хромосом и дру-
гие аберрации по сравнению с их сверстницами, которые опло-
дотворялись после первого осеменения.
Из цитированных работ видно, что структурные изменения
хромосом — это дополнительная информация о роли генотипа в
патологии животных. Вместе с тем возникновение разрывов хро-
мосом может быть индуцировано вирусами и другими тератоген-
ными факторами, что необходимо учитывать при цитогенетичес-
ком анализе. Так, делеции, нехватки и пробелы хромосом с
высокой частотой отмечены Т. В. Богачевой при анализе влия-
ния на генетический аппарат быков супердоз витаминов А и D.
Хромосомные аномалии могут широко распространиться в
породе через производителей, используемых в воспроизводстве,
особенно если их спермой осеменяют коров племенных заводов,
которые продают ремонтных быков на племпредприятия по ис-
кусственному осеменению. Из этого следует вывод о необходи-
мости цитогенетического контроля за распространением хромо-
сомных аномалий в скотоводстве и браковки животных с нару-
шением кариотипа.
Свиньи. Нормальный кариотип свиньи состоит из 38 хромо-
сом. Впервые его описал Краллингер (1931).
♦ У свиней наблюдаются различные формы аберраций. Наибо-
1 лее часто у них обнаруживают реципрокные транслокации между
* различными парами аутосом (рис. 60). Анализ показал, что реци-
I, прокные транслокации снижают плодовитость свиней (табл. 51),
f а также продуктивные качества (среднесуточный прирост массы,
* признаки мясности и др., табл. 52).
Общее число реципрокных транслокаций у свиней более 20,
f они снижают жизнеспособность потомков от 25 до 50 %.
Причина уменьшения плодовитости у носителей транслока-
s ций — нарушение мейоза. В процессе мейоза у животных — но-
сителей транслокации образуются гаметы с несбалансированным
?. набором хромосом, которые участвуют в оплодотворении. Так, у
четырех гетерозиготных хрячков и свинок — потомков хряка
41
279
« fZ 18
Рнс. 60. Транслокация между 13-й и 14-й хромосомами свиньи
(но Хагельдорну н др.)
51. Частота вовлачания хромосом свинай в спонтанные раципрокные
транслокации
Хромосома Число транслокаций
1-я 8
2-я 0
3-я 1
4-я 2
5-я 2
6-я 3
7-я 4
8-я 2
9-я 1
10-я 0
11-я 3
12-я 0
13-я 3
14-я 6
15-я 3
16-я 3
17-я 2
Транслокации
,£Р (iP36q+)rcpJlp-;l4q*),rcp(lp-; 16р+), гсрх
(iq ; 15q ), rep (lq ; 17q+), rep (lq+; 14q~), rep (lq+-
7q~), rep (lp-; 8q ;
. rep (3p+; 7q~)
rep (4q ; 14p ), rcp (4q+; 13q), rep (4q; 15p+)
+rcp (5q ; 8q ), rep (5p—; 14p+)
rep (6p ; 15g ), rep (6p+; 14q-), rep (Ip-; 6q+)
rcp (7q ; llq ), rep (7pJ; 13q—), rep (3p7 7“), rep
dq ;_7q“)
rcp (Ip ; 8q+)
rcp (9p+; llq”)
rcp (1 lp+; 15q-), rcp (7q—; llq*), rcp (9p*; llq-) -
rcp (1 Ip , 15q—), rcp (7q“ 1 lq+), Гср (9p+; llq~)
rcp (13^ ; 14q ), rcp (Ip ; 14q7), rcp (4p+; 14q7), rcp
(lq ; 14q ), rcp (4q ; 14p+), rcp (5p“; 14p+)
rcp (1 lp_; 15q ), rcp (15q+; 16q-), rcp (16q+; 17q“)
rcp (Ip ; 16p ),_rcp (15q ; 16q“), rcp (16q ; 17q~)
rcp (lq ; 17q+), rcp (16q+; 17q~)
280
52. Сравнение снижения воспроизводительной способности
хряков-носителей реципрокных транслокаций и эмбриональной
смертности у их потомства
Транслокация Снижение размера помета, % Частота несбалансированных кариотипов, % Эмбриональная смертность, %
rcp (11р+; 15q“) 34 10,6 37,2
rcp(13q~; 14р+) 42 30,5 68,8
rcp (4q~; 14р+) 49 38,8 65,5
rcp (9р+; llq-) 50 29,9 67,7
шведской йоркширской породы, гетерозиготного по транслока-
ции (13q~; 14q+), на стадии диакинез — метафаза I наблюдали
17 бивалентов, по одному квадриваленту. У свинок наблюдали
хромосомы с кольцевой конфигурацией, что характеризует реци-
прокную транслокацию. У хрячков кольцевую конфигурацию на-
блюдали примерно в 20 % клеток на стадии диакинез — метафа-
за I. Образование квадривалентов приводит к формированию
несбалансированных гамет на стадии метафазы II, что является
причиной нарушений процессов эмбриогенеза после оплодотво-
рения. Получены четкие доказательства участия гамет с несба-
лансированным кариотипом в оплодотворении, что свидетельст-
вует о неэффективности или отсутствии презиготического отбора
(элиминации гамет с несбалансированным кариотипом до опло-
дотворения).
Исследовали предимплантационные эмбрионы, полученные
после случки гетерозиготных по реципрокной (13q~; 14q+)
транслокации хряков с 10 нормальными свинками. В 36 карио-
типированных эмбрионах 14 имели нормальный сбалансирован-
ный набор хромосом, 11 — сбалансированный, но гетерозигот-
ный по транслокации, 11 — несбалансированный. В последнем
случае у эмбрионов кроме структурной перестройки — трансло-
кации были выражены и изменения числа хромосом в кариоти-
пе — трисомия или моносомия как следствие нарушения их рас-
хождения в мейозе.
Во втором варианте исследования случали хряка с нор-
мальным набором хромосом с 10 гетерозиготными свинками.
Цитогенетический анализ проведен у 33 эмбрионов. Из них
10 оказались с нормально сбалансированным кариотипом,
14 гетерозиготных сбалансированных, 9 имели несбаланси-
рованный набор хромосом. В третьем варианте хряка случали
с тремя нормальными свинками. В результате анализа выявлено
17 нормальных сбалансированных и 12 сбалансированных,
но гетерозиготных эмбрионов. В четвертом варианте после
случки нормального хряка и четырех гетерозиготных свинок
281
изучено 17 эмбрионов, из которых 5 имели нормальный
кариотип, 10 оказались гетерозиготными сбалансированными
и 2 де генерированными. В последнем варианте гетерозиготного
хряка случали с гетерозиготной свинкой. Из четырех про-
анализированных эмбрионов 2 имели сбалансированный с
гетерозиготной формой транслокации кариотип и 2 эмбриона
были дегенерированные.
Эмбриональная смертность, вычисленная по числу желтых тел
и живых имплантированных эмбрионов, у гетерозиготных сви-
нок, слученных с нормальными хряками, а также у нормальных
и гетерозиготных свинок, слученных с гетерозиготными хряками,
составила соответственно 72,3; 68,0; 85,5 %. Таким образом, у
хряков и свинок — носителей транслокаций хромосом наблюда-
ются нарушения процессов мейоза и гаметогенеза. Такие спер-
мин и яйцеклетки, участвуя в оплодотворении, дают нежизне-
способных эмбрионов, что выражается в резком снижении коли-
чества поросят в пометах.
Реципрокную транслокацию Т (1 lp+; 15q—) в гетерозиготном
состоянии обнаружил Кинг у двух хряков — отца и сына — со
сниженной на 56 и 34 % оплодотворяющей способностью. Эта
транслокация в сбалансированной форме обнаружена у 41 %
живых потомков сына. Несбалансированный кариотип выявлен у
11 % эмбрионов, изученных в период от 10-го до 88-го дня
беременности. Эти эмбрионы, несомненно, погибают. 100%-ную
Эмбриональную смертность наблюдали Бойтерс и др. в потомст-
ве при использовании хряка — мозаика по реципрокной трансло-
кации между 6-й и 15-й хромосомами. Кариотип этого животно-
го был 38, XY/38, XY+ (6q+; 15q~). Высокую степень смертнос-
ти, включая мертворожденных поросят и потомков с
врожденными уродствами, зарегистрировали Попеску и Легатт у
хряка, в кариотипе которого обнаружено 24 % клеток со струк-
турными перестройками.
Подтверждением того положения, что снижение плодовитости
у свиней может быть связано с нарушением генома, является
сообщение Фогта и др. Два хряка-брата, дающих потомство с
50%-ным уменьшенным размером помета, в сравнении с други-
ми хряками и теми же свиноматками оказались миксоплоида-
ми - 37, XY- 18/38, XY/39, XY, +18 и 37, XY, - 18/38, XY.
При анализе кариотипа их потомков у двух свиней-дочерей с
пониженной плодовитостью был обнаружен аномальный набор
хромосом.
Норби с соавт. при анализе бластоцист у свиней в 10‘ %
случаев из 38 обнаружили количественные и структурные анома-
лии, в их числе 4 триплоида, 3 тетраплоида, 1 диплоид/триплоид
и одна делеция. При изучении 13 хряков с пониженной плодо-
витостью и 100%-ной эмбриональной смертностью потомства
Бойтерс установил, что основная причина нарушения эмбриоге-
282
неза — аномалии кариотипа: транслокации, палочковидные хро-
мосомы, которые наблюдались в 25 % из 40 % эмбрионов, со-
зревших до 25 дней.
В исследованиях М. Л. Кочневой и Н. А. Осиповой (1995)
показано увеличение соматической хромосомной нестабильности
у поросят с врожденными аномалиями и у свиноматок с низкой
плодовитостью.
Цитогенетический анализ у свиней дал возможность изучить
связь нарушений плодовитости с аномалиями в системе половых
хромосом. Так, на метафазных препаратах поросят-интерсексов
был обнаружен химеризм XX/XY и XX/XXY. Такая же аномалия
хромосом в лимфоцитах найдена у плодовитой свиноматки
(среднее число поросят в один помет — 14), у которой, по дан-
ным Кристенсена, 24 % клеток имели половые хромосомы ХУ,
остальные содержали ХХ-хромосомы. У свиней обнаружена ано-
малия кариотипа, сходная с синдромом Клайнфельтера у челове-
ка и ранее описанная на других видах (2n-39,XXY). Для характе-
ристики спермиогенеза у этого животного исследовали суспен-
зию эпидидимальных клеток и семенники. В содержимом
эпидидимуса спермин обнаружены не были. Гистологический
анализ, проведенный Ханкоком, показал отсутствие спермато-
генного эпителия.
У свиней зарегистрировано рождение поросят с одной поло-
вой хромосомой 37, ХО, что соответствует синдрому Тернера у
человека.
Значительное количество цитогенетических исследований
проведено у свиней истинных и псевдогермафродитов. При этом
в разных тканях (кровь, кожа, костный мозг) обнаружены раз-
личные хромосомные наборы, в том числе нормальные, химе-
ризм по половым хромосомам, иногда в сочетании с трисомией
или моносомией - 38, XX/39, XXY; 37, ХО/38, XX/38, XY, от-
дельно трисомия 39, XXY.
Представляют интерес сообщения Михельмана и соавт. о раз-
личиях частот структурных и морфологических изменений хро-
мосом в группах племенных хряков и свиноматок в сравнении с
откормочными выбракованными животными. В первой группе
структурные изменения обнаружены в 17,9 %, во второй — в 13,7
и в третьей — в 20,7 % метафаз. Морфологические изменения
хромосом наблюдали соответственно в 0,58; 0,61 и 0,72 % мета-
фаз. Аналогичные результаты получены и у крупного рогатого
скота. Это указывает на то, что снижение плодовитости и болез-
ни как основные причины выбраковки животных связаны не
только с действием факторов внешней среды. Первичная причи-
на нарушений функций организма может быть связана с измене-
ниями в генотипах животных.
Овцы. Нормальный кариотип овец состоит из 54 хромосом,
что впервые указано советским генетиком Живаго (1931). У
283
овец, как и у других видов животных, обнаружены различные
виды аберраций хромосом. Так, в Новой Зеландии, в стране
с развитым овцеводством, наблюдали три типа* робертсоновской
транслокации — между 5-й и 26-й, 8-й и 11-й, 7-й и 25-й
хромосомами, получившими название Массей I, Массей II
и Массей III. Однако, как показали Бруер и Чепман,
плодовитость у животных была нормальной. Это объясняется
естественной выбраковкой не сбалансированных по числу
хромосом гаплоидных клеток еще до вступления их в
оплодотворение. У овец описаны также отдельные варианты
реципрокных транслокаций, которые сопровождались пони-
женной плодовитостью животных.
В Институте экспериментальной биологии Казахстана уста-
новлено, что у каракульских баранов в очень молодом и старом
возрастах хромосомные аберрации в генеративной ткани встреча-
ются значительно чаще, чем в среднем возрасте. Хромосомные
аберрации были обнаружены у некоторых мертворожденных с
врожде^ыми аномалиями ягнят.
Лошади. Нормальный кариотип домашней лошади состоит из
64 хромосом. Точное число хромосом этого вида животных уста-
новили Сасаки и Макино только в 1962 г. Количество цитогене-
тических исследований у лошадей пока еще невелико, поэтому
установить истинную частоту аберраций хромосом не представ-
ляется возможным. Однако Виллер и Визнер (1981) считают, что
по крайней мере 5—10 % всех зигот у лошадей, как и у других
видов млекопитающих животных, могут содержать хромосомные
аномалии. 90 % этих зигот отмирают на первой стадии беремен-
ности.
Исследования кариотипа лошадей показывают, что наиболее
часто у этого вида встречаются аномалии в системе половых
хромосом, которые вызывают бесплодие у животных (табл. 53).
53. Классификация гоносомальных аберраций у лошади
Признак Цитогенетический статус (кариотип) Симптоматика Этиология/патогенез
Дисгене- 63, ХО с ати- Периферическая ин-
зия яични- пичной Х-хро- версия с последую-
ков мосомой щей транслокацией
63, ХО Нарушение цикла, руда- Простая моносомия
синдром ментарные яичники, апла- вследствие нерасхож-
Тернера зия или гипоплазия овоци- дений тов, гипо- или анеструс, гипоплазия гениталий, задержка роста
65, XXX Простая трисомия
синдром вследствие нерасхож-
сверхсамок дений
284
Продолжение
8 Признак Цитогенетический статус (кариотип) Симптоматика Этиология/латогенез
Ц 64, XY/63, ХО Переход к псевдогермафро- Мозаичность В или 64, ХХ/63, дитарной феминизации J хо ч В 64, XX/64, Y Обычно без клинических Постзиготический женская химера нарушений химеризм Дисгенезия 65, XXY Гипоплазия семенников, Трисомия вслед- синдром аплазия зародышевых ствие нерасхождений > Клайнфельтера гормональных клеток а (высокорослость) | 64, ХХ/65, Повышенная агрессии- Мозаичность 1 XXY или 64, ность, высокаяпрыгучесть I XX/64, XY/65, 1 XXY мозаика Трисомия вслед- 1 Клайнфельтера, ствие нерасхождения I 65, XYY син- 1 дром самцов « 66, XXYY; 66, Переход к мужскому Тетра- или пентасо- i XXXY псевдогермафродитизму мия вследствие | нерасхождения 1 66, XXYY; 66, I XXXY; 67, i XXXYY; 67, f XXXXY 1 Комплексный кариотип 64, • XX/64, XY мужской Зиготический , химеризм химеризм ’ Мужской 64, XX тестику- Гипоплазия гонад, сте- Гормональное нару- псевдогер- лярные рильность, аплазия заро- шение, нарушение i мафроди- ХХ-герма- дышевых клеток, частично во время гипотала- | тизм фродиты женские половые органы мической фазы / (тестикулярная феминиза- дифференциации > ция), часто гипоплазия пениса и крипторхизм 64, XY тести- Гормональное нару- | кулярные XY- шение, адренальное <, гермафродиты сверхпродуцирова- ние эстрагенов, тес- тикулярная фемини- зация 64, ХХ/65, Тетрасомия вслед- XXY или 64, ствие нерасхождения XX/64, XY/65, Мозаичность XXY мозаика Клайнфельтера 64, XX/65, XY Переход к тестикулярной Зиготический химе- тестикулярные дисгенезии ризм XX/XY-герма- / фродиты
285
Продолжение
Признак Цитогенетический статус (кариотип) Симптоматика » Этиология/патогенез
Женский псевдогер- мафроди- тизм 64, XY овари- альные XY- термафродиты 63, ХО/64, XY мозаика Тернера Гипоплазия яичников, сте- рильность вследствие отсут- ствия зародышевых кле- ток. Переход к овариаль- ной дисгенезии Гормональное нару- шение во время гипоталамической фазы дифференциа- ции Мозаичность
Нарушения в системе половых хромосом, как показали Бруер
с сотр. (1978), — общая причина стерильности у лошадей. При
обследовании 7 бесплодных кобыл у 6 из них авторы обнаружили
синдром Тернера (63, ХО); одна оказалась мозаиком (63, ХО/64,
XX). Синдром Тернера выявлен и в наших исследованиях у двух
бесплодных кобыл, используемых конноспортивными секциями
Ленинградской области.
Неструктурных мутаций у лошадей описаны следующие: де-
ления хромосомы второй пары у бесплодной кобылы; деления
хромосомы тринадцатой пары у бесплодного жеребца американ-
ской стандартбредной породы с аномальными спермиями; моза-
ицизм по Х-хромосоме с делецией длинного плеча у жеребца с
низкой степенью оплодотворения; аутосомная реципрокная
транслокация в гетерозиготном состоянии у жеребца с нормаль-
ной воспроизводительной системой; транслокация гоносомы и
аутосомы у кобылы с такими же признаками, как при синдроме
Тернера, и частичная трисомия одной аутосомы у жеребца с
тяжелым клиническим эффектом; транслокация дистальной
части длинного плеча Х-хромосомы на длинное плечо другой
Х-хромосомы у кобылы, 64,X/t(X). Buoen с соавт. предполагают
наличие изохромосом у двух лошадей. Еще одна структурная
мутация выявлена в системе половых хромосом. Rayne с соавт.
предполагают перицентрическую инверсию в Х-хромосоме у бес-
плодной, моносомной по половым хромосомам кобылы.
Птицы. В нормальном кариотипе кур, цесарок и перепелок
содержится 78 хромосом, индеек и уток — 80. Установлено, что
причина большей части раннего отмирания эмбрионов кур —
аберрации хромосом. Ялар и Фечхаймер считают, что, как мини-
мум, 25 % YVfovM эмбрионов обусловлено аномалиями в карио-
типе. 7
У эмбрионов обнаруживали структурные нарушения — транс-
локации, изохроматидный разрыв и др. Наиболее часто выявля-
ют гетероплоидные формы аномалий кариотипа — гаплоидию,
триплоидию, трисомию по аутосомным и половым хромосомам,
мозаицизм.
В экспериментах Фечхаймера показано, что гаплоидные эмб-
286
рионы кур развивались на основе андрогенеза. Триплоидные
клетки в 75 % случаев были результатом нарушений при образо-
вании второго полярного тельца. Тетраплоидные клетки форми-
ровались в основном за счет нарушения цитокинеза в митозе.
Ю. А. Эрматов и А Ф. Яковлев установили возрастание час-
тоты аберраций хромосом у эмбрионов, полученных от искусст-
венного осеменения спермой, хранившейся 4 мес в заморожен-
ном состоянии. Это указывает на необходимость цитогенетичес-
кого контроля при разработке технологии замораживания
спермы.
Для получения оплодотворенных инкубационных яиц важное
значение имеют сроки совместного содержания петухов и кур. В
эксперименте Попеску и Меррита (1977) установлено резкое
снижение оплодотворенности яиц после 12 дней с момента от-
садки петухов от кур, увеличение общего процента эмбрионов с
аномалиями хромосом. Таким образом, при длительном нахож-
дении спермиев в половом тракте у кур происходят патологичес-
кие процессы «старения», приводящие к развитию аномальных
эмбрионов. Это относится и к другим видам животных. Поэтому
определение момента осеменения самок — одно из условий пло-
дотворности зачатия.
При исследовании кариотипов кур в постэмбриональный пе-
риод установлены различия между популяциями и линиями по
частоте хромосомных аномалий (табл. 54).
54. Хромосомные аберрации в разных линиях кур (по Блому, 1974)
Линия Число исследованных несушек Число несушек, унаследовавших одну или более хромосомных аберраций Доля дефектных иесушек, %
1-я 57 7 12
2-я 42 5 12
3-я 120 17 14
4-я 33 7 21
5-я 9 2 22
6-я 10 13 30
7-я 47 17 36
8-я 18 12 67
9-я 336 70 21
По данным Фечхаймера, среди аномальных клеток у кур наи-
более часто встречается гаплоидия. Цыплята мясных пород
(бройлеры) имели в 7 раз больше гетероплоидных клеток, чем
цыплята яйценоских пород. Причиной повышенной частоты
хромосомных аномалий у кур мясного типа могут быть непра-
вильные овуляционные периоды. Установлено, что первое мейо-
тическое деление происходит у них на 2 ч раньше овуляции, а
второе — при оплодотворении.
287
Из приведенных материалов следует вывод: цитогенетический
анализ можно использовать в селекции птиц для браковки кур и
петухов с хромосомными аномалиями. Это Позволит повысить
выводимость птицы.
Контрольные вопросы. 1. Что включают в себя понятия генетические, наслед-
ственно-средовые, экзогенные аномалии? 2. Каков ход генетического анализа
при простом аутосомном рецессивном типе наследования аномалии? 3. Каковы
основные правила наследования аутосомно-рецессивных и аутосомно-доминант-
ных аномалий? 4. В чем заключаются особенности наследования сцепленных с
Х-хромосомой аномалий? 5. Что входит в понятие «мультифакториальное насле-
дование» и каковы его особенности? 6. Что понимают под терминами «пенет-
рантность» и «экспрессивность»? Какова их роль при наследовании аномалий?
7. Какие примеры генетических аномалий у крупного рогатого скота свиней,
овец и лошадей вы знаете? 8. Как прилагается закон гомологических рядов в
наследственной изменчивости для изучения генетических аномалий у животных?
9. Каково распространение аномалий хромосом у крупного рогатого скота? Какие
аберрации наиболее часто встречаются у этого вида? 10. Каков спектр аберраций
хромосом, обнаруженных у свиней? 11. Какие аберрации хромосом часто служат
причиной бесплодия кобыл и жеребцов? 12. В чем особенности спектра аберра-
ций хрслфосом птиц?
Глава 16
БОЛЕЗНИ С НАСЛЕДСТВЕННОЙ
ПРЕДРАСПОЛОЖЕННОСТЬЮ
Давно известно, что некоторые виды, породы, группы и от-
дельные животные устойчивы или восприимчивы к тем или иным
болезням. Наследственная резистентность или восприимчивость
возникает при сопряженной эволюции, микро- и макроорганиз-
мов в результате мутационного процесса. Яркий пример этого —
существование видовой, почти абсолютной устойчивости. Так,
лошади резистентны к ящуру и чуме крупного рогатого скота,
тогда как последний не болеет сапом и устойчив к чуме свиней, а
куры резистентны к сибирской язве. Взрослые люди обладают
наследственной устойчивостью к полиомиелиту, и 99 % из них не
заболевают, даже если не вакцинированы. При контакте с виру-
сом ящура поражается только 1 человек из 10 000.
Вы познакомились уже с генетически обусловленными болез-
нями и аномалиями сельскохозяйственных животных. Однако их
удельный вес, видимо, как и у человека, составляет около 6—8 %.
Имеется другая очень важная группа болезней, генетическая при-
рода которых пока мало изучена. Это болезни снаследствен-
ной предрасположенностью, или наследственно-
средовые, возникающие под воздействием наследственности и
факторов среды (лейкоз, мастит, туберкулез, болезни конечностей
и т. д.). Приблизительно они составляют 92 % среди всех болезней
животных и причиняют огромный экономический ущерб живот-
новодству, а некоторые из них (туберкулез, бруцеллез и др.) пред-
ставляют опасность и для здоровья человека.
Основные понятия. Резистентность — устойчивость организма
к действию физических, химических и биологических агентов,
вызывающих патологическое состояние. Это понятие несколько
шире, чем иммунитет, хотя их иногда используют как синонимы.
Восприимчивость — предрасположенность организма к дейст-
вию физических, химических и биологических факторов, приво-
дящих к патологическому состоянию.
Устойчивость и восприимчивость у животных одного вида,
как правило, не абсолютная, а относительная. Она может быть
высокой, средней и низкой.
Болезнь можно определить как нарушение нормальной деятель-
ности организма. Заболевание — возникновение болезни. Под за-
289
болееаемостью понимают частоту заболеваний в популяции или
болезненность, болезненное состояние. Возбудители болезней об-
ладают патогенностью (болезнетворностью), Д'. е. способностью
паразитировать в организме животного. Патогенность — наслед-
ственный признак возбудителя данного вида. Вирулентность —
степень патогенности в отношении животных определенного
вида. Вирулентность может различаться у разных штаммов одного
вида возбудителя.
Наследование резистентности и восприимчивости. Генетичес-
кая природа болезней с наследственной предрасположенностью
мало изучена. Для этой группы болезней характерны: 1) поли-
факториальное (обусловленное многими локусами) контролиро-
вание устойчивости и восприимчивости; 2) влияние условий
среды; 3) непрерывный переход от выраженных форм болезни до
нормы, т. е. от восприимчивости до устойчивости; 4) высокая
распространенность, незначительные генетические различия
между популяциями; 5) большая изменчивость возраста проявле-
ния брлезни; 6) часто незначительная конкордантность в парах
однояйцовых близнецов.
По фенотипу животных в отношении болезней с наследствен-
ной предрасположенностью можно разделить на два класса: здо-
ровые и больные (рис. 61). Заболевают животные при достиже-
нии соответствующего порога Т действия активных аллелей и
определенного уровня условий среды. Устойчивость или воспри-
Шкала подверженности (S единицах отклонении
от порога) Т
имчивость относится к порого-
вым признакам — это призна-
ки, распределение которых
при расщеплении происходит
прерывисто, но наследуются
они полифакториально. Сле-
дует помнить, что наследст-
венно восприимчивые живот-
ные не заболевают, если нет
вирулентного возбудителя.
Рис. 61. Две выборки с различной час-
тотой (р, pt) порогового признака н с
разными средними. Дисперсии порого-
вого признака (заболеваемости) одина-
ковы:
А — распределение в родительском поколе-
нии; Б— распределение потомства Пора-
женных особей; В — распределение тх/го же
потомства, включающее ^два класса — здо-
ровые (qi), больные (pi); х — средняя ариф-
метическая; к — отклонение порога T от
среднего, выраженное в единицах стандарт-
ного отклонения (о); i — среднее отклоне-
ние особей данного фенотипа от среднего
всей группы
290
РЕЗИСТЕНТНОСТЬ
ПЕРВОЕ ПОКОЛЕНИЕ
ПОТОМСТВО ОТ ВОЗВРАТНОГО СКРЕЩИВАНИЯ
ДОМИНИРОВАНИЕ ПОЛИГЕННОЕ
РЕЗИСТЕНТНОСТИ ВОСПРИИМЧИВОСТИ НАСЛЕДОВАНИЕ
Рис. 62. Распределение восприимчивости и резистентности в популяции, когда эти
признаки контролируются одним локусом (I, 2), н при полигонном контроле (5)
Устойчивость или восприимчивость к болезням иногда зави-
сит от одного или немногих генов, но чаще определяется множе-
ством локусов. Полигонный контроль устойчивости к болезням
не дает возможности разграничить фенотипы вследствие маски-
рующего действия условий среды и небольшого эффекта отдель-
ных генов. При полигонном наследовании в популяции наблю-
дается нормальное распределение по устойчивости или воспри-
имчивости у родителей и гибридов первого поколения.
Генетический контроль резистентности может быть изучен при
скрещивании родителей с контрастными фенотипами и анализе
гибридов Fi, а также потомства от скрещивания F| с родитель-
скими формами. На рисунке 62 показано распределение родите-
лей в случае эффекта доминирования резистентности (/?) и до-
минирования восприимчивости (5). Возвратное скрещивание
особей F, с рецессивной родительской формой (анализирующее
скрещивание) дает бимодальное распределение.
291
При полифакториальных болезнях выделяют два основных
типа распределения (рис. 63): первый характеризуется многооб-
разием стертых и субклинических вариантов,, которые образуют
непрерывный переход от нормы до выраженных форм болезни;
при втором наблюдают множественные переходные варианты па-
тологии между типичными формами проявления того или иного
заболевания.
Для большинства полифакториальных болезней характерны
непрерывная изменчивость и пороговое проявление фенотипов.
На рисунке 64 (в, г) показана схема полигенного наследования
восприимчивости и резистентности. При скрещивании воспри-
имчивой к болезни и резистентной линий потомство занимает
промежуточное положение между родительскими формами (2в).
Кривые распределения гибридов от скрещивания Fi с восприим-
чивой или резистентной родительской линией сдвинуты влево
(Зв) или вправо (4в). Средние арифметические беккроссов (Зв,
4в) занимают также промежуточн<?е положение между Fj и соот-
ветствующей родительской формой. В общей популяции при
отсутствии отбора по устойчивости и восприимчивости распреде-
ление в Fi (2г) такое же, как и у родителей. При скрещивании
восприимчивой части популяции кривая распределения потомст-
ва смещается влево (Зг), а при скрещивании резистентных осо-
бей Fj у гибридов кривая распределения сдвигается вправо (4г).
Такой тип распределения говорит о невозможности подхода к
изучению полифакториальных болезней как к простым мендель-
ским признакам. Здесь нужно использовать методы, которые
применяются для изучения генетики количественных признаков.
Методы изучения наследственной резистентности и восприим-
чивости к болезням. Существует несколько основных подходов к
изучению генетической обусловленности устойчивости и воспри-
имчивости животных к болезням: 1) клинико-генеалогический
БЛАГОПРИЯТНЫЕ ПРОМЕЖУТОЧНЫЕ ЗЛОКАЧЕСТВЕННЫЕ
формы формы формы
Рис. 63. Два основных типа клинического непрерывного распределения нрн полн-
факториальных заболеваниях
292
Резистентность
Линии
Вся популяция
1в X
гг 1 Т “ ’ ' I
гг х Rr Анализирующее х ss
| скрещивание | ss
За
Гв
Зг
Зв
Ss х SS(P)
36
Возвратное скрещивание
RrxRR(P)
46
Доминирует
восприимчивость
4а
Доминирует
резистентность
Полигенное наследование
И
Моногенное наследование
I
Рис. 64. Наследование восприимчивости и резистентности:
I — моногенное наследование; II— полигенное наследование; 2а — FI — от скрещивания
контрастных форм при доминировании резистентности (Я); 26— F1 — при доминировании
восприимчивости (5); 2в — Fi — от скрещивания восприимчивой (S) и резистентной (Я)
линий; 2г — Fi — от скрещивания без отбора; За и 36— потомство от скрещивания Fi с
восприимчивой родительской линией; Зг — потомство от скрещивания восприимчивых осо-
бей из Fi; 46— потомство от скрещивания с доминантной формой родителей; 4в— потомст-
во от скрещивания Fi с резистентной линией; 4г — потомство от скрещивания резистентных
особей из Fi
анализ; 2) близнецовый анализ; 3) выявление породных, межли-
нейных и межсемейных различий; 4) селекционный экспери-
мент; 5) популяционно-статистический анализ; 6) анализ связи
заболеваний с маркерными генами и др. При изучении наследст-
293
венной устойчивости и восприимчивости используют не один, а
совокупность указанных методов в различном сочетании.
Клинико-генеалогический ан-ализ. Для прове-
дения клинико-генеалогического анализа составляют генеалоги-
ческие схемы семейств и линий с указанием всех случаев заболе-
ваний. Вычисляют частоту заболеваемости в пределах родствен-
ных групп, по которой их сравнивают между собой и с
популяционной частотой. С помощью клинико-генеалогического
анализа можно выяснить природу наследственных болезней, тип
наследования, сцепление генов, картирование хромосом, взаимо-
действие генов, влияние инбридинга на частоту пораженности
животных. Этот метод позволяет выявить резистентные и вос-
приимчивые к болезни или группе болезней семейства и линии
и использовать данные при разработке селекционных программ.
Близнецовый метод. Этот метод дает возможность
определить соотносительную роль наследственности и среды в
этиологии болезни. Для этого определяют конкордантность и
дискврдантность. Конкордантность — присутствие или отсутст-
вие болезни у обоих близнецов, а дискордантность — явление,
при котором данный признак имеется лишь у одного близнеца.
Сходство между однояйцовыми близнецами при различных бо-
лезнях выше, чем между двуяйцовыми. Часто конкордантность у
первых проявляется не только в наличии болезни, но и в возрас-
те ее возникновения и клиническом проявлении. У человека
конкордантность однояйцовых близнецов по туберкулезу равна
74 %, рахиту—88, сахарному диабету —84 %, а у двуяйцовых
близнецов — соответственно 28, 22 и 37 %. Близнецовый метод
позволяет получить доказательство генетической детерминации
устойчивости к болезни, но не говорит о типе наследования
резистентности (монотонный, полигонный, аутосомный или
сцепленный с полом и т. д.).
Породные, межпородные и межлинейные раз-
личия. Анализ этих различий по устойчивости к болезням сви-
детельствует о роли генетических факторов в детерминации этого
признака. Известно, что шотландские черноголовые овцы в
общем более резистентны к гемонхозу, чем животные породы
финский дорсет. Джерсейский, красно-пестрый шведский скот
более чувствителен к гипокальциемии, чем фризский и айршир-
ский. В Африке блутанг (синий язык) животных в течение
100 лет приносит большой экономический ущерб. Это острая
неконтагиозная болезнь, характеризующаяся воспалением слизи-
стой оболочки рта, языка и поражением кожи конечностей.
Местные породы энзоотических зон более устойчивы, чем разво-
димые в зонах, благополучных по заболеванию. У овец более
резистентны к блутангу местные африканские и азиатские поро-
ды (каракульская, черноголовая персидская), чем европейские.
Селекционный эксперимент. Если в результате
294
отбора повышается резистентность к заболеванию, то это гово-
рит о генетической обусловленности резистентности и воспри-
имчивости. Например, в течение 11 поколений селекции крыс на
устойчивость к бактериям, вызывающим кариес зубов, была со-
здана линия, превосходящая в 7 раз исходную популяцию по
наследственной устойчивости к кариесу.
Чем успешнее селекция, тем с большей вероятностью можно
предполагать, что устойчивость или восприимчивость контроли-
руется небольшим числом локусов.
Скрещивание устойчивой и восприимчивой линий и возврат-
ные скрещивания позволяют сделать заключение о промежуточ-
ном наследовании и о доминировании резистентности или вос-
приимчивости.
Популяционно-статистический мет од. Прит
меняется для изучения генетики устойчивости и восприимчивос-
ти мультифакториальных болезней, как и при изучении хозяйст-
венно полезных признаков. В этом случае структура популяции
не может быть охарактеризована частотами отдельных генов и
соотношением генотипов. Поэтому используют такие статисти-
ческие параметры, как средняя арифметическая, среднее квадра-
тическое отклонение, вариансы. Вычисляют коэффициенты кор-
реляции и регрессии между родственниками. Некоторые иссле-
дователи считают, что коэффициенты наследуемости и
генетической корреляции — важные параметры при изучении не
только признаков продуктивности, но и устойчивости и воспри-
имчивости к болезням.
Связь генетических маркеров с предрасполо-
женностью к болезням. Анализ этой связи —еще один
путь доказательства наследственной детерминации устойчивости-
восприимчивости к болезням. Примеры таких ассоциаций были
приведены (связь аллеля В21 групп крови с болезнью Марека у
птиц и др.). Более перспективным может быть поиск генетичес-
ких корреляций с подверженностью к болезням не с одним, а с
несколькими маркерами. Следует использовать и биохимические
маркеры. Так, у человека коэффициент генетической корреля-
ции холестерина плазмы с подверженностью к ишемической бо-
лезни сердца равен 0,54.
Простое наследование устойчивости. Под этим термином по-
нимают, что резистентность к болезни контролируется одним
или немногими генами. Всего лишь несколько наследственно-
средовых болезней с простым наследованием известно в настоя-
щее время.
Вирусы. У кур описано аутосомно-доминантное наследова-
ние устойчивости к лимфоидному лейкозу. При этом выделяют
два уровня генетической резистентности: клеточную резистент-
ность к вирусной инфекции и резистентность к развитию опухо-
ли у инфицированных вирусом птиц. Отмечаются особенности
295
наследования к определенным субгруппам вирусов. Однако ус-
тойчивость к развитию опухоли проявляется комплексно и с
меньшей субгрупповой специфичностью.
Резистентность к вирусу гриппа у мышей также кодируется
аутосомно-доминантным геном, а устойчивость к вирусу мыши-
ного гепатита — рецессивным геном. Известен еще ряд примеров
простого наследования устойчивости к вирусам у лабораторных
животных.
Бактерии. Некоторые штаммы кишечной палочки (Е. coli)
вызывают у новорожденных свиней диарею (понос). Однако
часть поросят могут быть резистентными к штаммам кишечной
палочки, имеющим К-88-антигены. Эта резистентность обуслов-
ливается рецепторами, распознающими К-88-антигены. Наличие
рецепторов — простой наследственный признак. Поросята, обла-
дающие рецепторами и происходящие от матерей с такими же
рецепторами, защищены от вирулентных К-88-позитивных
Е. coli до тех пор, пока молозиво свиноматок с антителами про-
тив К-8$-антигенов поступает новорожденным.
Нематоды. Имеются данные о том, что устойчивость овец
к гемонхозу, вызываемому Н. contortus, наследуется как простой
доминантный признак.
В результате селекции мышей на устойчивость к нематодам
Trichuris muris получена линия, в которой 75 % особей были
восприимчивы, и линия со 100%-ной устойчивостью. В неотсе-
лекционированной популяции отсутствует способность к изгна-
нию нематод из организма, поэтому гельминты достигают поло-
вой зрелости. Восприимчивость зависит от нескольких генов и
наследуется как доминантный признак. Этот вывод сделан на
основании анализа Fi и потомства от возвратного скрещивания.
В других опытах было показано, что скорость изгнания из
организма гельминтов (Trichinella spiralis) является доминантным
признаком. В одних линиях изгнание взрослых гельминтов за-
канчивается к 11—12-му дню, в других — к 20-му дню.
ГЕНЕТИЧЕСКАЯ УСТОЙЧИВОСТЬ И ВОСПРИИМЧИВОСТЬ
К БАКТЕРИАЛЬНЫМ БОЛЕЗНЯМ
Мастит — воспаление молочной железы. Причинами болезни
могут быть биологические (стрептококки, стафилококки и т. д.),
механические, термические и химические факторы. У больных
коров удой за год снижается в среднем на 300 кг. В некоторых
странах заболеваемость достигает 30—50 %. Ежегодные потери от
маститов в США составляют более 2 млрд долларов.
Межпородные различия существуют не только по
заболеваемости маститом, но и по резистентности к отдельным
возбудителям болезни. У голштинского скота заболеваемость со-
ставляет до 58 %, у гернсейского — 33,6, айрширов — 5,6, поро-
296
ды хариан — 2 %. У буйволиц и зебу частота маститов меньше,
чем у коров молочных пород. Животные искырской породы
более устойчивы (13 %), чем коровы болгарской бурой и сим-
ментальской пород (25—28 %), а у буйволиц заболело 0,5 % осо-
бей. У эйрширского скота также отмечена более низкая заболе-
ваемость (4,1 %), чем у коров холмогорской (12,3 %) и бурой
латвийской (29 %) пород. В то же время коровы эйрширской
породы более восприимчивы к маститу, чем коровы финской.
Влияние производителей, линий и семейств.
Существуют большие различия по заболеваемости у дочерей раз-
ных отцов (А. И. Желтиков, 1992). У резистентных быков забо-
левают 3—15 % дочерей, а у восприимчивых — 20—50 % и выше.
Влияние производителей на устойчивость потомства к маститу
составляет 10—19 %. Одни исследователи обнаружили межли-
нейные различия по устойчивости и восприимчивости к маститу,
другие таких различий не установили. Коэффициент наследуе-
мости устойчивости и восприимчивости коров к маститу нахо-
дится в пределах 0,05—0,80. Коэффициент повторяемости масти-
та равен 0,36.
Между семействами выявлены большие различия в поражен-
ности животных маститом (0—50 %). В некоторых стадах от
больных маститом матерей получают в 1,5—2 раза больше боль-
ных дочерей, чем от здоровых матерей.
Форма вымени и сосков. Меньше заболевают мас-
титом коровы, имеющие чашеобразную и округлую формы вы-
мени и спокойный нрав. В некоторой степени на подвержен-
ность болезни влияют равномерность развития четвертей вымени
(заболеваемость задних четвертей выше), форма и величина со-
сков. Животные с отвислым выменем более чувствительны к
маститу. Коровы с цилиндрической формой сосков меньше по-
ражаются, чем с воронкообразной.
Дистальный участок (4—5 мм) соскового канала является пер-
вым защитным барьером против патогенов за счет механических
факторов и некоторых антимикробных веществ. Антибактериаль-
ные свойства эпителия канала соска определяются высокой кон-
центрацией в кератинсодержащих клетках эпителия жирных кис-
лот — лауриновой, миристиновой и пальмитиновой.
Высокое содержание стеариновой, линоленовой и олеиновой
жирных кислот увеличивает восприимчивость к маститу. Полага-
ют, что высокая наследуемость жирных кислот (0,38—0,58) дает
возможность использовать их в качестве критерия отбора на
резистентность к маститу. Во внутренних тканях у входа в соско-
вый канал выявлена концентрация плазматических клеток, при-
нимающих участие в защите вымени от инфекции.
Полимастия (добавочные соски) — также предраспола-
гающий к маститу фактор. Коэффициент наследуемости поли-
мастии равен 0,56.
297
Молочная продуктивность. Коровы с высокой
скоростью молокоотдачи более чувствительны к маститу, чем со
средней, но имеются данные о том, что тугодойность — предрас-
полагающий фактор. Между заболеваемостью маститом и молоч-
ной продуктивностью существует положительная корреляция
(г = 0,20 — 0,30). С увеличением суточного удоя на 1 кг наруше-
ния секреции молока возрастают на 1,8 %. Однако многие ис-
следователи не установили связи между уровнем молочной про-
дуктивности и маститом. В то же время у многих быков отсутст-
вует достоверная связь между маститом и молочностью дочерей.
Долгоживущие и высокопродуктивные коровы реже выбраковы-
ваются из-за мастита, чем животные с коротким периодом
жизни. С возрастом частота маститов увеличивается. По второму
и третьему отелу частота заболевания может увеличиваться в 2—3
раза в сравнении с первым.
Факторы защиты молочной железы от инфекции — поли-
морфно-ядерные лейкоциты, система лактопероксидазы, лизо-
цим, лактоферрин (Lf), система комплемента.
Наблюдаются значительные различия между коровами по
способности полиморфно-ядерных нейтрофилов молока фа-
гоцитировать стафилококки. Генетическая изменчивость фа-
гоцитарной активности доказана в опытах на мышах. Фа-
гоцитарная активность коррелирует с устойчивостью коров
к маститам (г = 0,40).
Число соматических клеток коррелирует с забо-
леваемостью маститом (г = 0,28). Коровы с низким числом кле-
ток в молоке за первую лактацию реже заболевали маститом в
последующие лактации. При содержании клеток до 500 тыс/мл
заболеваемость была 30—38 %, а при числе клеток выше
500 тыс/мл — 56 %.
Лизоцим молока обладает бактериостатическим и бактери-
цидным действием. При высокой концентрации его в молоке
происходит более быстрое снижение числа патогенных бактерий,
чем при низкой. Концентрация лизоцима в молоке при мастите
увеличивается в 3—7 раз. Выявлены межпородные и внутрипо-
родные различия между животными по содержанию лизоцима.
Бактериостатическая активность свойственна и лактофер-
рину. Тяжесть заболевания маститом связана с уровнем лакто-
феррина (г = 0,27). Между концентрацией Lf и числом сомати-
ческих клеток в молоке, а также между Lf и лизоцимом сущест-
вует положительная связь (соответственно г = 0,35 и г = 0,39).
Содержание лактоферрина при мастите возрастает во много раз.
Коэффициент наследуемости концентрации лактоферрина ко-
леблется от 0,15 до 0,44.
Важную роль в защите вымени от инфекции играют имму-
ноглобулины М, A, Gi, G2. Коровы с иммунодефицитом IgGz
имеют повышенную частоту пиогенных (гнойных) маститов.
298
Между максимальным титром антител против сывороточного аль-
бумина человека у молодых быков и клиническим маститом их
полусестер существует высокая положительная корреляция
(г =0,9).
Установлены статистически достоверные различия между ти-
пами BoLA и чувствительностью к маститу у норвежского скота.
Антиген BoLA W2 связан с высокой резистентностью к маститу,
тогда как W16 обусловливает восприимчивость. Выявлена связь
аллеля DQ1 МНС 11 с заболеваемостью маститом.
Устойчивость к маститу — сложный суперпризнак, который, в
свою очередь, состоит из ряда менее сложных суперпризнаков.
Эта устойчивость определяется механизмами естественной резис-
тентности. Кроме того, устойчивость к маститу определяется
гуморальными и клеточными механизмами защиты. В связи с
полиэтиологичностью мастита сила иммунного ответа к каждому
из многих патогенов определяется многими 1г-генами.
Устойчивость к маститу зависит от морфологических и функ-
циональных свойств вымени и других факторов. Поэтому наибо-
лее приемлемой характеристикой такого суперпризнака, как ус-
тойчивость к маститу, может быть оценка по средней частоте
заболеваемости семейств и потомства отдельных производителей
с учетом в будущем генетических и биохимических маркеров.
Бруцеллез — хроническая инфекционная болезнь животных и
человека, вызываемая бактериями группы Brucella. У многих жи-
вотных проявляется абортом, задерживанием прследа и рас-
стройством плодовитости. Болезнь регистрируется в 62 странах
мира. В некоторых из них зараженность скота составляет 10—
15 % и выше. В зараженных стадах валовая продукция животно-
водства может сокращаться на 15—20 %. Бруцеллез обычно пере-
дается человеку от животных.
Видовые и породные различия. Наиболее высо-
кочувствительны к бруцеллезу морские свинки, белые мыши,
суслики, а устойчивы белые крысы, гуси, голуби. Минимальная
доза, необходимая для подкожного заражения белых мышей,
составляет 5—10 микробных клеток, для овец — 10—15 тыс., для
i коров, свиней, коз — несколько сот тысяч, для гусей и голубей —
миллионы бруцелл.
’ В равных условиях заражения относительно устойчивы к бру-
,? целлезу зебу и буйволы в сравнении с крупным рогатым скотом.
‘ В Монголии зараженность местного крупного рогатого скота
меньше (3—4 %), чем яков (8—9 %). Бруцеллез, мастит, вибриоз
* могут быть широко распространены среди культурных европей-
f ских пород, тогда как у животных серой местной и родопской
| пород эти болезни не наблюдаются.
J Грубошерстные овцы романовской породы более устойчивы к
> бруцеллезу, чем овцы породы прекос и рамбулье. В неблагопо-
I лучных по бруцеллезу стадах пораженность овец породы совет-
I 299
ский меринос и Карабах выше и клиническое проявление болез-
ни более выражено, чем у овец пород азербайджанский горный
меринос и красный самух. У восприимчивых овец ниже уровень
пропердина, лизоцима и высокий титр агглютининов, что свиде-
тельствует о низкой неспецифической резистентности. Эти дан-
ные говорят о влиянии наследственности на устойчивость и
восприимчивость животных к бруцеллезу.
Влияние производителей, линий и семейств.
Частота заболеваемости дочерей разных быков черно-пестрой
породы изменялась от 8,9 до 51,9 % (табл. 55). В среднем в
неблагополучных по бруцеллезу хозяйствах выявлено около 21 %
отцов, давших относительно устойчивое к болезни потомство, и
у 23 % быков заболеваемость дочерей была выше 40 %. Влияние
производителей на заболеваемость потомства равно 8 %. Не ус-
тановлено различий между линиями по устойчивости и воспри-
имчивости животных к бруцеллезу.
Оценка генофонда семейств позволила обнаружить резистент-
ные и^осприимчивые семейства, в которых заболеваемость из-
менялась от 0 до 61,5 % (см. табл. 55). Влияние семейств на
пораженность животных равно 16 %.
55. Частота заболеваемости бруцеллезом потомства некоторых быков
и семейств (по В. Л. Петухову)
Номер быка Число дочерей % больных Родоначальница семейства Число животных % бальных
104 52 51,9 Камелия 299 13 61,5
25588 82 47,6 Ладная 350 25 48,0
1406 80 13,8 Юннатка 1240 13 15,4
2226 45 8,9 Артистка 915 11 0
Различия в частоте заболеваемости дочерей и внучек в зависи-
мости от состояния здоровья предков были незначительны, что
свидетельствует о малой эффективности массового отбора.
Конкордантность двоен по бруцеллезу равна 64 %. В
семействах однополых двоен больные близнецы происходили
в основном из семейств, в которых заболеваемость была
44 %, а здоровые близнецы — из семейств с заболеваемостью
на уровне 20 %.
Не выявлено различий в частоте заболеваемости бруцеллезом
аутбредных (31 %) и инбредных (33,2 %) животных со средним
коэффициентом инбридинга 3,68 %. Потомство аутбредных- и
инбредных быков не различалось по пораженности бруцеллезом
и туберкулезом. Заболеваемость не зависит от породности живот-
ных.
Селекционный эксперимент. О генетической ре-
зистентности к бруцеллезу свидетельствуют опыты Камерона
(цит. по: Хатт, 1963). После инфекции в 1929 г. в стаде свиней
300
беркширской породы было оставлено потомство от незаболев-
ших животных. В 1942 г. после искусственного заражения жи-
вотные, предки которых также не болели, дали отрицательную
реакцию. Резистентность свиней устанавливалась путем зараже-
ния поросят в 10—12-недельном возрасте, а в последующем про-
водились исследования крови на реакцию агглютинации. Реак-
ция агглютинации указывала на чувствительность животных к
бруцеллезу, ее отсутствие — на резистентность. В результате
скрещивания отрицательно реагирующих маток с такими же хря-
ками получено резистентное потомство (из 138 обследованных
поросят только у одного была положительная реакция).
Наследование устойчивости и восприимчи-
вости к бруцеллезу. Для многих инфекционных забо-
леваний характерно отсутствие больших родственных групп
животных с абсолютной устойчивостью. Это говорит об
относительном характере наследственной резистентности к
болезни. После попадания бруцелл в организм наблюдается
бурная клеточная реакция, образование агглютинирующих,
преципитирующих и комплементсвязывающих антител, раз-
вивается тканевая реактивность. Бруцеллы в основном ло-
кализуются в тканях плаценты. Для их развития необходим
ростовой фактор — углевод эритрит, который находится в
плаценте. Интенсивность размножения бруцелл коррелирует
с количеством в тканях плаценты эритрита. Интересно, что
эритрит содержится в плаценте восприимчивых к бруцеллезу
видов и отсутствует у невосприимчивых видов.
Распределение семейств и быков по частоте заболеваемости
дочерей соответствует нормальному. Все эти факты, видимо,
свидетельствуют о полигенном контроле устойчивости и воспри-
имчивости к болезни. Коэффициент наследуемости устойчивости
крупного рогатого скота к бруцеллезу равен 0,194 + 0,03. Види-
мо, длительность сопротивления организма обусловлена также и
генетическими факторами.
В опытах, проведенных на кроликах, установлено, что резис-
тентность к бруцеллёзу контролируется аутосомным доминант-
ным геном, а восприимчивость — рецессивным. Однако этот
вывод можно рассматривать только в качестве одной из гипотез.
Туберкулез — инфекционная болезнь. Возбудитель — мико-
бактерии. Болезнь млекопитающих, птиц и человека, характери-
зующаяся образованием в различных органах типичных бугор-
ков — туберкулов, подвергающихся казеозному некрозу. Это за-
болевание приносит огромный ущерб животноводству и
представляет опасность для здоровья человека. Туберкулез реги-
стрируется в 67 странах мира.
Межвидовые и породные различия. К туберку-
лезу наиболее восприимчивы крупный рогатый скот, свиньи,
301
норки, куры и олени. Реже болеют козы, собаки, утки, гуси.
Относительно устойчивы к инфекции лошади, овцы и кошки.
Все породы крупного рогатого скота в той или иной степени
восприимчивы к туберкулезу. Ф. Хатт (1963) приводит данные о
том, что в Уганде из 6185 посмертно обследованных животных
местной породы анколе болело туберкулезом 17 %, тогда как
среди 26 979 голов зебу было только 0,9 % больных.
Животные швицкой породы способны противостоять многим
болезням, в том числе относительно устойчивы к туберкулезу.
Скот холмогорской породы также отличается большой устойчи-
востью к этой болезни. Заболеваемость туберкулезом голланд-
ского скота иногда достигала 100 %, тогда как местного сибир-
ского — 2 %. В Индии на трех фермах изучена пораженность
туберкулезом зебу (породы хариана, сахивал, красный синдхи),
скота молочных европейских пород (голштинский, джерсейский)
и буйволов породы муррах (табл. 56). Высокой генетической
устойчивостью отличаются буйволы породы муррах (0,33 %) в
сравнении с другими группами скота.
56. Заболеваемость туберкулезом животных разных пород
(по Bela, Sidhu)
Генетические группы Число животных % больных
всего | бальных
Зебу 952 167 17,5
Гибриды зебу х европейские породы 508 93 18,3
Европейские породы 157 40 25,5
Буйволы муррах 302 1 0,33
Влияние производителей, линий и семейств.
Выявлены большие различия в частоте пораженности туберкуле-
зом дочерей быков черно-пестрой и бурой латвийской пород и
членов разных семейств (табл. 57). Частота заболевания туберку-
лезом дочерей разных отцов колеблется от 9,1 до 51,7 %, а
семейств — от 5 до 63,6 %.
57. Частота заболеваемости туберкулезом потомства некоторых
быков и семейств (по В. Л. Петухову)
Номер быка Число дочерей % больных Родоначальница семейства Число животных % больных
19615 29 51,7 Азартная 3734 11 63,6 -
106 79 43,0 Мирка 4909 13 -61,5
16481 33 15,1 Ладная 350 16 31,2
2029 22 9,1 Пенка 4865 13 15,4
Между частотой заболеваемости туберкулезом дочерей отцов и
дочерей их сыновей коэффициент корреляции равен 0,33. В
302
других популяциях в среднем было 13,2 % быков с относительно
низкой заболеваемостью дочерей (5—19 %) и 28,9 % отцов с
пораженностью потомства свыше 30 %.
Влияние производителей на заболеваемость туберкулезом по-
томства равно 6 %, а семейств — 25 %. От больных туберкулезом
коров черно-пестрой и бурой латвийской пород получено только
на 3—4 % больше больных дочерей, чем от здоровых.
Конкордантность туберкулеза у однополых двоен равна 60 %.
У крупного рогатого скота обнаружены межлинейные разли-
чия. Следует помнить, что эти различия характерны для конкрет-
ных хозяйств, потому что ранг линий в разных стадах может
меняться. Это объясняется тем, что селекция линий на устойчи-
вость к этой или другим болезням не проводилась. Поэтому без
отбора и подбора не могут возникнуть консолидированные по
резистентности к болезням линии. Однако в результате генети-
ческой обусловленности устойчивости и восприимчивости и не-
прямого отбора возникают родственные группы животных, более
или менее резистентные к болезни. Например, в относительно
устойчивой к туберкулезу линии свиней золотниковской породы
заболело 8,9 % животных, а в восприимчивой — 15,3 %.
Влияние инбридинга. Не выявлено достоверных раз-
личий в пораженности аутбредного (23,7 %) и инбредного
(27,9 %) крупного рогатого скота при среднем коэффициенте
инбридинга по стаду, равном 3,68 %. У бестужевского скота
также не выявлено четкого влияния инбридинга на проявление
реакции на туберкулин.
Наследование устойчивости и восприимчи-
вости. Механизмы устойчивости к туберкулезу и его наследова-
ние еще до конца не ясны. Тридцатилетние исследования Lurie
и Dannenberg (цит. по: Эфроимсон, 1971) показали, что наиболее
важным фактором, определяющим врожденную и приобретен-
ную наследственную устойчивость к туберкулезу, является спо-
собность макрофагов подавлять рост бактерий в своей цитоплаз-
ме. Они выделяли: 1) устойчивость к возникновению инфекции,
т. е. устойчивость в первоначальной стадии размножения мико-
бактерий в хозяине; 2) устойчивость к дальнейшему развитию
болезни, т. е. к удержанию инфекции в состоянии латентности.
Следует полагать, что резистентность к туберкулезу контролиру-
ется не менее чем двумя генетическими системами.
Резистентность к возникновению инфекции. В
основе ее лежит способность альвеолярных макрофагов кроликов
из устойчивых семейств в 2 раза больше фагоцитировать мико-
бактерий за данный период времени, чем кроликов из восприим-
чивых семейств.
Устойчивость к развитию болезни. Она определя-
ется тем, что в хилусных лимфатических узлах резистентных кро-
ликов размножение микобактерий затормаживалось, а в лимфати-
303
ческих уздах восприимчивых кроликов размножение происходит
быстро, приводит к казеозным поражениям и генерализации ин-
фекции. Поэтому жизнь кроликов резистентных семейств продол-
жительнее, чем кроликов восприимчивых семейств (табл. 58).
58. Сравнение устойчивости некоторых инбредных семейств кроликов
по длительности жизни после стандартного введение возбудителей
бычьего туберкулеза и после ингаляции человеческого туберкулеза
(по Lurie и Dannenberg)
Семейство Средняя продолжительность жизни, дней Среднее число ингалированных возбудителей, необходимых для образования одного бугорка
Т 422 1065 ± 138
AD 197 362 ± 103
PC 132 79 ±9
С 121 70 ± 14
При? ингаляционном заражении кроликов микобактериями
человеческого типа у резистентных особей образовалось около
5 % первичных бугорков от числа тех, которые возникли у вос-
приимчивых кроликов.
У крупного рогатого скота в резистентном организме при
локализации микобактерий в туберкулезных бугорках их инкап-
сулирование выражено сильнее, чем у организмов с пониженной
резистентностью. Здоровые животные по сравнению с больными
отличались более высокими показателями фагоцитарной актив-
ности.
При скрещивании резистентной линии кроликов (Т) с вос-
приимчивой (С) получено промежуточное потомство (ТС). Воз-
вратное скрещивание Fi с резистентной линией дало резистент-
ное потомство, а при скрещивании с восприимчивой линией
получено потомство, промежуточное между родительской и ли-
нией Fi-
Линии
родителей
Fi
F2
Следовательно, резистентность и восприимчивость у кроликов
наследуются полигенно.
304
Распределение семейств и быков черно-пестрой и бурой лат-
вийской пород по частоте пораженности потомства туберкулезом
соответствует нормальному. Исходя из этих и вышеприведенных
данных, можно предположить полигонную обусловленность ус-
тойчивости и восприимчивости скота к туберкулезу. Коэффици-
енты наследуемости устойчивости скота к туберкулезу колеблют-
ся от 0,1 до 0,3, а в отдельных линиях — от 0,01 до 0,49, причем
их величина выше в линиях с более высокой заболеваемостью.
С вязь с генетическими полиморфными систе-
мами. В некоторых исследованиях показано, что крупный рога-
тый скот с типом гемоглобина НЬВ более устойчив к туберкуле-
зу, а с НЬА — восприимчив. Гетерозиготные животные занимают
промежуточное положение.
Черно-пестрый скот с аллелем трансферрина Tf^ и амилазы
Ат® чаще заболевает туберкулезом. Однако у бестужевского
скота не обнаружено четкой связи групп крови и генотипов
коров по трансферриновому и постгрансферриновому локусам с
заболеваемостью туберкулезом (Бороздин и др., 1986). Можно
сказать, что пока нет надежных генетических маркеров устойчи-
вости и восприимчивости животных к туберкулезу.
Паратуберкулез (паратуберкулезный интерит, болезнь Ионе) —
хроническая инфекционная болезнь жвачных, протекающая в ос-
новном латентно. Характеризуется прогрессирующим истощени-
ем, периодической диареей и летальным исходом. Возбудитель
болезни Mucobacterium paratuberculosis. Заболевание снижает мо-
лочную продуктивность и прирост молодняка на 8—9 %.
Животные джерсейской и гернсейской пород более восприим-
чивы к паратуберкулезу. Имеются внутрипородные различия по
устойчивости и восприимчивости потомства отдельных быков и
семейств.
Лептоспироз — инфекционная природно-очаговая болезнь жи-
вотных и человека. Возбудитель — лептоспиры. У животных про-
является лихорадкой, анемией, гемоглобинурией, абортами. Бо-
лезнь встречается на всех континентах.
Домашний водяной буйвол и желтый скот о-ва Тайвань ус-
тойчив к лептоспирозу, тогда как скот многих молочных пород
восприимчив к болезни.
Роль наследственности в этиологии лептоспироза была пока-
зана в опытах Т. Пшитульского (1980). Из свиней крупной белой
породы были выделены животные, устойчивые (положительно
реагирующих потомков меньше 10 %, а в среднем около 3 %) и
восприимчивые к лептоспирозу (положительно реагирующих по-
томков свыше 25 %, а в среднем 51—54 %). При скрещивании
резистентных хряков и маток получено 2,2 % реагирующих по-
томков, а при скрещивании восприимчивых родителей — 67,1 %
(табл. 59). При скрещивании резистентных и восприимчивых
305
животных наблюдалось неполное доминирование резистентности
к лептоспирозу (11,1 %).
59. Результаты скрещивания резистентных и восприимчивых
к лептоспирозу животных, % (по Przytulski и др., 1980}
Тип скрещивания Число потомков Дочери и сыновья, реагирующие
отрицательно, % положительно, %
Г X Г 182 97,8 2,2
Г XS 36 88,9 ИЛ
S X 5 152 32,9 67,1
Среднее — 70,3 29,7
Обозначения: г — резистентные; s — чувствительные.
При скрещивании резистентных свиноматок и хряков получе-
ны потомки, у которых титры лептоспирозных антител были
низкими (1:100—1:200), а при скрещивании восприимчивых ро-
дителей получены потомки с высоким титром антител (в основ-
ном от 1:400-1:600 до 1:3200-1:12 800).
Коэффициент наследуемости устойчивости и восприимчивос-
ти свиней к лептоспирозу равен 0,20. Повышенный уровень
антител против лептоспироза у свиней связан с аллелем амилазы
АшА, тогда как у животных с Атв он понижен. У положительно
реагирующих на лептоспироз свиней чаще встречаются типы
TfAA + AmAA и TfAB + AmAA, чем в группе серологически от-
рицательно реагирующих животных.
Овцы с типом гемоглобина АВ более устойчивы к лептоспи-
розу, чем особи с типами А и В.
Выявлены генетические различия между линиями мышей по
силе иммунного ответа на лептоспиры. Обнаружена 20-кратная
разность между высоко- и низкореагирующими линиями. В ре-
зультате гибридологического анализа установлен доминантный
характер наследования высокого иммунного ответа к лептоспи-
рам. В то же время высота иммунного ответа у мышей на леп-
тоспиры определяется более чем одним локусом.
ГЕНЕТИЧЕСКАЯ УСТОЙЧИВОСТЬ И ВОСПРИИМЧИВОСТЬ
К ГЕЛЬМИНТОЗАМ
Гельминтозы — болезни, вызываемые паразитическими червя-
ми. В некоторых комплексах по производству молока может
быть выявлено до 22 % коров, инвазированных фасциолами,
15 — парамфистомидами и 39 % — стронгилятами. В комплексах
по откорму, животные могут быть инвазированы стронгилятами
(57 %), фасциолами (6 %), парамфистомидами (6 %) и трихоце-
фалюсами (5 %). В некоторых свиноводческих хозяйствах около
306
9 % поросят в возрасте 2 мес заражены аскаридами (И. Жариков
и др., 1981).
Фасциолезы — гельминтозы животных и человека, вызывае-
мые трематодами рода Fasciola, паразитирующими в печени. В
некоторых странах Африки в отдельные годы инвазия достигает
27-47 %.
Генетически контролируемая изменчивость инвазии фасцио-
лами в основном изучена на лабораторных животных. Так, у
крыс линии PVG наблюдалось более быстрое освобождение от
гельминтов, и они были устойчивы к повторному заражению, а
крысы линии SD медленно освобождались от гельминтов.
Иммунитет к F. hepatica — тимусзависимый и может включать
действие антипаразитарных антител. У черно-пестрого датского
скота с дефицитом клеточного иммунитета обнаружена воспри-
имчивость к фасциолезу (F. hepatica). В иммунном ответе преоб-
ладает IgGi.
В Нигерии у скота породы белый фулани обнаружена связь
типов гемоглобина с резистентностью. У зараженных телят с
типом гемоглобина НЬАА не обнаружено особей, имеющих
более 100 фасциол, тогда как 14,3—16,6 % животных с НЬВВ и
НЬАВ имели более 100 гельминтов. У 80 % телят с НЬАА была
слабая инвазия (до 50 фасциол), тогда как среди животных с
другими генотипами таких особей было только 50—44 %. Суще-
ствует отрицательная связь между концентрацией натрия в крови
и количеством фасциол (г= —0,37).
Нематодозы. Гельминтозы, вызываемые нематодами, встреча-
ются повсеместно у всех видов животных. Основная масса нема-
тод паразитирует в пищеварительном тракте.
У зебувидного скота фулани существует внутрипородная из-
менчивость по устойчивости к Strongyloidae. Потомство резис-
тентных быков имеет меныпее количество яиц гельминтов в 1 г
фекалий (147 яиц), большую живую массу, чем дочери воспри-
имчивых производителей (300 яиц). Число яиц служит показате-
лем устойчивости или восприимчивости к гельминтам.
У гибридов британских пород (герефордская х шортгорнская)
в 1 г фекалий было 410 яиц гельминтов, а у резистентных гибри-
дов от скрещивания британского скота с африкандер — 180 яиц.
Внутри пород существуют большие различия между быками по
устойчивости и восприимчивости потомства к гельминтам (ЮЗ-
727 яиц).
Влияние породы быков, условий содержания в течение года
составляет 28 % общей изменчивости числа яиц гельминтов. Ко-
эффициент наследуемости среднего количества яиц гельмин-
тов — 0,10—0,78, а коэффициент повторяемости — 0,31.
Некоторые линии датского фризского скота высокоустойчивы
к кишечным нематодам С. oncophora.
Барбадосские чернобрюхие овцы и их гибриды харакгеризу-
307
ются более высокой устойчивостью к смешанной инвазии, вы-
званной нематодами из подотряда Strongylata (табл. 60).
60. Среднее число нематод в 1 г фекалий чистопородных и гибридных овец (по JazwinBki и др.)
Овцы Барбадосские чернобрюхие (Б) Б х Д Комолый дорсет (Д) Д хЛ Р X Л
Годовалые — 236 2085 2078 1490
Взрослые 29 83 707 — —
Обозначения: Л — ландрас, Р — рамбулье.
Выявлены межпородные различия по резистентности к гемон-
хозу. Овцы шотландской черноголовой породы более устойчивы к
гемонхозу, чем финский дорсет. Способность овец противостоять
заражению определяется не только факторами, регулирующими
развитие^ созревание гельминтов, но и развитием реакций гипер-
чувствительности немедленного типа, что приводит к самоосво-
бождению организма от гемонхов. Самоосвобождение после по-
вторного заражения происходило у 75 % шотландских черноголо-
вых овец и только у 12 % особей финский дорсет. Наиболее
интенсивно выведение гельминтов из организма проявляется у
овец с типом гемоглобина НЬА. Многие исследователи считают,
что доминантные аллели контролируют резистентность к Н. соп-
tortus (гемонхозу) у овец и крупного рогатого скота.
Породы овец тарги и панама более резистентны к нематодам
Ostertagia, чем породы суффольк, гемпшир и рамбулье.
Связь типов гемоглобина с пораженностью нематодами Os-
tertagia обнаружена у шотландских черноголовых овец. Каждое
животное в 6—7-месячном возрасте было заражено 100 тыс. личи-
нок третьей стадии. Овцы с типом гемоглобина АА отличались
большей устойчивостью (на 16-й день после инвазии), чем живот-
ные с типом ВВ. Число взрослых паразитов у овец с НЬАА было
11 тыс., а у овец с типом НЬВВ — 19,5 тыс.; число ингибирован-
ных личинок у животных с НЬАА было также выше (табл. 61).
61. Генетическая устойчивость к нематодам овец с резными типами
гемоглобине (по Altaif и др.)
Тип гемоглобина Общее число нематод Число взрослых нематод Число ингибированных личинок 4-й стадии
АА 18350 11000 6420
ВВ 22557 19463 2788
У коз породы красный сокото в возрасте более одного года
обнаружены различия по числу яиц гельминтов у гетерозиготных
(меньше яиц) и гомозиготных по гемоглобиновому локусу особей.
На основании изучения типов гемоглобина у разных пород
308
сделано заключение, что лучшая устойчивость некоторых пород
может быть связана с высокой частотой гемоглобина А.
Коэффициенты наследуемости числа яиц гельминтов у овец
изменяются от 0,10 до 0,35.
При экспериментальном заражении поросят пород дюрок,
гемпшир и дюрок х гемпшир Strongyloides ransomi и Ascaris suum
сравнивали уровни инвазии. У поросят породы дюрок наблюдали
самое быстрое и более полное освобождение кишечника от ин-
вазии S. ransomi на 4—5-ю неделю после заражения. Кроссбред-
ные животные занимали промежуточное положение. Выдвинута
гипотеза, что такой ответ обусловлен аддитивными генами. Про-
тивоположная картина породной устойчивости была при аскари-
дозе (A. suum), но кроссбредные поросята также занимали про-
межуточное положение. Сделано заключение, что существуют
генетически контролируемые различия в пороговых уровнях и
степени реакции в ответ на заражение. Устойчивостью к аскари-
дозу отличались гетерозиготные куры с типом НЬАВ. Куры поро-
ды плимутрок с типом эстеразы Es—1АА также более устойчивы
к аскаридозу, чем особи с типом Es—1ВВ. Более восприимчивы
к болезни куры с генотипом по щелочной фосфатазе PpFF, чем
с типом PpFS.
Таким образом, высокая устойчивость одной породы к какой-
либо болезни может сочетаться с более низкой устойчивостью
животных этой же породы к другой болезни.
ГЕНЕТИЧЕСКАЯ УСТОЙЧИВОСТЬ И ВОСПРИИМЧИВОСТЬ
К ПРОТОЗООЗАМ
Протозоозы — болезни животных, вызываемые простейшими,
паразитирующими в различных клетках, тканях и органах живот-
ных (трипаносомы — в плазме крови, бабезии и пироплазмы — в
эритроцитах, кокцидии — в клетках эпителия кишечника, пече-
ни, почек).
Бабезиоз. Инвазионная трансмиссивная болезнь животных,
вызываемая простейшими рода Babesia. Протекает с явлениями
лихорадки, анемии, желтухи, гемоглобинурии.
Крупный рогатый скот Bos indicus более устойчив к бабезио-
зу, чем Bos taurus. В одинаковых условиях среды у животных
породы африкандер выявлено 33 % положительно реагирующих,
а у симментальской — 60 %. При инокуляции возбудителя болез-
ни у чистопородных африкандеров и зебу отмечались легкие
симптомы, а у скота английских пород — тяжелое течение болез-
ни. Порода скота мясного направления браман и ее гибриды
более резистентны к заражению бабезиозом и клещами. Порода
драфтмастер (droughtmaster) получена путем скрещивания поро-
ды браман и английских мясных пород скота. Пораженность
бабезиозом животных породы драфтмастер была 11,3 %, а гере-
309
фордской породы — 43,8 %. Искусственное заражение животных
пород браман, драфтмастер и герефордской показало, что более
устойчив к бабезиозу скот породы браман.
Относительной устойчивостью к бабезиозу отличаются поро-
ды собак бигль, фокстерьер, а более восприимчивы породы спа-
ниель, йоркширский терьер, доберман й др. В зоне, эндемичной
по бабезиозу, у собак отмечено образование высокого титра
антител к возбудителю болезни.
Зебувидный скот устойчив не только к бабезиозу, но и к
пироплазмозу.
Трипаносомозы. Трансмиссивные болезни животных и челове-
ка, вызываемые жгутиковыми простейшими из рода Try-
panosoma. Болезни проявляются периодическими повышениями
температуры, возникновением отеков, парезом конечностей и
параличами. В Восточной и Центральной Африке трипаносомоз
регистрируется в 18 странах, охватывая площадь в 4,67 млн км2.
Возбудители болезней передаются многими насекомыми, в том
числе цеце. Цеце поражает животных в 37 странах Африки. Около
37 % из 147 млн крупного рогатого скота поражено цеце. В Афри-
ке от болезней, переносимых цеце, ежегодно погибает около
3 млн голов скота. Трипаносомоз (сонная болезнь) у африканско-
го населения может длиться годами (без лечения) и в основном
заканчивается смертью. У европейцев болезнь длится 1—2 мес и
без лечения в начале заболевания заканчивается смертью.
Видовые и породные различия. Многие виды
млекопитающих Африки отличаются абсолютной невосприимчи-
востью к трипаносомозу (буйвол, антилопа-бейза, южноафри-
канская антилопа и др.).
Трипанотолерантность (устойчивость к трипаносомозу) харак-
терна и для карликового крупного рогатого скота. Крупный ро-
гатый скот европейских пород (вид Bos taurus) более восприим-
чив к трипаносомозу, чем зебу (вид Bos indicus).
Относительной устойчивостью к трипаносомозу отличаются
порода н’дама и западный африканский щортторнский скот, а
также мутури и нубийский черный скот.
Порода н’дама принадлежит к разновидности длиннорогого
скота. Считают, что трипанотолерантность этого скота и некото-
рых других пород возникла под сильным давлением естественного
отбора, осуществляемого трипаносомами в зоне обитания цеце в
Африке. У скота породы н’дама часто наблюдаются более высо-
кий уровень антител и длительная их выработка в ответ на зара-
жение, а также меньшее число трипаносом, а периферическая
кровь быстрее освобождается от паразитов. В начальной стадии
заболевания устойчивые животные имеют лучшую способность
контролировать уровень паразитемии, чем восприимчивые. Вто-
ричный иммунный ответ выше у животных н’дама. Механизмами
защиты при трипаносомозе могут быть активность системы фаго-
310
цитов, пропердин, система комплемента, толщина кожи и др.
Рыжие животные этой породы более устойчивы к трипаносомозу,
чем животные серой, черной и красно-пестрой мастей.
При совместном выпасе на пастбище с наличием пере-
носчиков трипаносом все коровы зебу (10 голов) после
первого нападения переносчиков трипаносом пали в среднем
через 107 дней, а из 10 коров н’дама пало только 3 через
370 дней после заражения. В то же время зебу превосходят
животных европейских пород по резистентности к трипано-
сомозу. Гибриды от скрещивания пород н’дама и зебу по
устойчивости занимают промежуточное положение. Однако
имеются данные о том, что устойчивость скота — частично
доминантный признак.
В одинаковых условиях среды смертность коров низкорослых
шортгорнов была ниже (5,4 %), чем гибридов западноафрикан-
ские шортгорны х белые фулани (12,2 %).
Овцы и козы некоторых местных пород в Кении более устой-
чивы к трипаносомозу, чем импортные животные.
Условия среды, возраст, пол животных, вирулентность штам-
мов трипаносом и другие факторы влияют на устойчивость к
трипаносомозу. Так, у телят до года позитивная реакция на
трипаносомоз была у 9—18 % животных, а у коров — 51—86 %.
При экспериментальном заражении мышей в возрасте 1 нед
уровень паразитемии ниже, и живут они дольше, чем мыши,
зараженные в возрасте 3, 6, 12 или 24 нед.
Существуют большие различия между линиями мышей по
резистентности к трипаносомозу. Выживаемость мышей линии
С57В1/6 после заражения составляет более 100 дней, а в высоко-
чувствительной линии А/J большинство особей погибает через
10—20 дней. При скрещивании линий А/J и С57В1/6 у потомства
проявляется частичное доминирование относительной резистент-
ности. Однако результаты возвратного скрещивания говорят о
полигенном контроле устойчивости и восприимчивости (рис.
65). У мышей первой линии увеличивается уровень сывороточ-
ного IgM до уровня, в 15 раз превышающего норму, а у живот-
ных второй линии повышается в основном уровень IgG. Предва-
рительные данные говорят о том, что иммунный ответ к трипа-
носомозу ассоциируется с IgM. У всех мышей резистентной
линии повышается уровень защитных антител, а в восприимчи-
вой линии — только у 1/3 особей.
Эймериозы (кокцидиозы) — инвазионная болезнь животных и
человека, вызываемая паразитическими простейшими класса
Sporozoa отряда Coccidiida. Болезнь особенно большой ущерб
наносит птицеводческим и кролиководческим хозяйствам.
Эймериоз кур — болезнь преимущественно цыплят в
возрасте от 10 до 80 дней. Характеризуется общим угнетением,
потерей аппетита, исхуданием.
311
Выживаемость после инфекции,дней
Рис. 65. Смертность линий мышей (A/J, С57В1/6) после заражения
Т. congolense (по Murray и др., 1979)
Выявлены межпородные различия по устойчивости кур к
эймериозу: цыплята породы род-айланд более устойчивы к бо-
лезни, чем пород леггорн и светлый Суссекс. Устойчивость про-
является меньшим падежом, выходом ооцист и лучшим прирос-
том живой массы.
В результате 3—4-летней селекции выведена резистентная к
эймериозу популяция кур, смертность цыплят которой составила
22,1 %, тогда как смертность в чувствительной группе была 60 %.
Коэффициент инбридинга в двух селекционируемых группах ко-
лебался от 12,5 до 18,5 %. В резистентной группе смертность по-
томства отдельных петухов изменялась от 20 до 23 %, а в воспри-
имчивой — от 50 до 77 %. В исходной популяции изменчивость
смертности отдельных производителей была 29—90 %.
Внутрипородные различия установлены при оценке цыплят
двух селекционируемых и семи неселекционируемых линий (Jef-
fers и др.). Выживаемость цыплят разных линий в течение 10
дней после инокуляции 100 тыс. ооцист Е. tenella изменялась от
6,2 до 73,2 %.
312
Линия Число цыплят Выживаемость, %
В 325 73,2 ± 3,1
Н 892 48,0 ± 3,0
L 637 26,5 ± 6,6
S 177 6,2 ± 2,9
При скрещивании устойчивых и восприимчивых родительских
форм часто получали потомство с промежуточной устойчивостью.
По-видимому, резистентность кур к эймериозу обусловлена мно-
гими генами, действующими аддитивно. Коэффициент наследуе-
мости устойчивости и восприимчивости к эймериозу равен 0,28.
Сердечная водянка (инфекционный гидроперикардит) — бо-
лезнь, вызываемая одной из форм риккетсий, переносчиками
которой являются клещи.
Относительно устойчивы к этой болезни зебу породы афри-
кандер в сравнении с завезенным скотом английских пород.
Смертность от сердечной водянки у животных породы африкан-
дер была 16—17 %, а у английских мясных пород — 41—42 %. На
участке тела площадью 1000 см2 было снято около 1600 клещей
у коров породы африкандер, а у коров английских пород —
около 6000. В летние месяцы от общего числа снятых клещей
7,4 % приходилось на животных породы африкандер и 92,6 % —
на коров английских пород. Смертность телят породы африкан-
дер была в 10 раз ниже (5,3—7 %), чем чистопородного англий-
ского мясного скота (60,7 %). У помесей Fi африкандер х анг-
лийские мясные породы наблюдается неполное доминирование
относительной резистентости к сердечной водянке. Телята поро-
ды африкандер также жили дольше в сравнении с животными
английских пород (табл. 62).
62. Смертность от сердечной водянки телят до 30-месячного возраста,
родившихся на станции Мара в Трансваале (по Bonsma)
Порода и породность Число телят Смертность, % Средний возраст павших телят, мес
Чистопородный афри- кандер 246 5,3 11
75 % африкан- дер х 25 % английские мясные породы 86 7,0 8
50 % африкан- дер х 50 % английские мясные породы 397 10,2 6
Чистопородные живот- ные английских мясных пород 28 60,7 5
Анаплазмоз. Трансмиссивная инвазионная болезнь мелкого и
крупного рогатого скота, характеризующаяся явлениями анемии
и истощения. У крупного рогатого скота болезнь вызывается
313
Anaplasma maiginale (непротозойной природы и близка к риккет-
сиям). Породы скота н’дама, браман и др. отличаются относи-
тельной устойчивостью к анаплазмозу. Анализ-числа неблагопо-
лучных пунктов у скота мясных пород Австралии показал, что
среди кроссбредного скота, полученного с участием породы бра-
ман, частота вспышек анаплазмоза была 7,9 %- В популяции
герефордского скота зарегистрировано 61,9 % вспышек анаплаз-
моза.
ГЕНЕТИЧЕСКАЯ УСТОЙЧИВОСТЬ И ВОСПРИИМЧИВОСТЬ
К КЛЕЩАМ
Паразитоморфные клещи переносят возбудителей протозой-
ных, вирусных, бактериальных и грибных болезней. Клещи рас-
пространены на всех континентах, преимущественно в странах с
теплым климатом.
Наиболее резистентны к иксодовым клещам Boophilus micro-
plus поводы браман и африкандер. Показано, что устойчивы к
клещам 95 % чистопородных животных породы браман, 45—
60 % браманских гибридов и породы, происходящие от них;
только 1 % герефордов и шортгорнов устойчивы к клещам. У
голландских коров не развиваются болезни, переносимые клеща-
ми, тогда как у скота многих других пород частота больных
высока. Резистентность животных определяется по числу клещей
на определенной площади тела. Число клещей на единицу по-
верхности тела (0,45 х 0,8 см) было в несколько раз больше у
браманских помесей, чем у помесей' герефорд х шортгорн (табл.
63). На поверхности тела коров драфтмастер в 10,5 раза меньше
клещей, чем у животных британских пород.
63. Число клещей после двух заражений (по J. Frish)
Дни после рождения Породы
браман х(Г х Ш) герефорд х шортгорн (Г х Ш)
8-24 198 397
25-31 68 238
Полагают, что реакция животных на первое заражение отра-
жает врожденную устойчивость, а на второе и последующие —
приобретенную.
Данные таблицы 64 говорят о том, что врожденная - и
приобретенная устойчивость выше у гибридов породы браман.
Из семи пород и гибридов наиболее чувствительны к клещам
герефордская и шортгорнская. Животные джерсейской породы
более резистентны к клещам, чем гернсейской и фризской.
Выявлены большие различия между быками по» устойчивости
их потомства к клещам и по пропорции жизнеспособных
314
I'
яиц, откладываемых самками клещей. Генетические различия
в большей степени проявляются при сильном заражении
животных, чем при слабом.
64. Устойчивость к клещам разных пород (по J. Frish)
Порода | 96 устойчивых j Порода ) % устойчивых
Браман 93 Брафорд 31
Браман х авсгра- 65 Герефорд (Г) 0
лийский шортгорн Санта-гертруда 36 Шортгорн (III) 0 3
Устойчивость к клещам выше у животных с хорошо развиты-
ми подкожными мышцами, с короткой светлой шерстью (клещи
летом плохо переносят прямые лучи солнца). За 10 лет разведе-
ния герефордов с короткой шерстью смертность от всех причин
уменьшилась с 34 до 14 %.
Коэффициенты наследуемости устойчивости и восприимчи-
вости к клещам в основном колеблются от 0,28 до 0,42, а коэф-
фициенты повторяемости — от 0,27 до 0,67. В хорошо контроли-
руемых условиях содержания коэффициенты наследуемости и
повторяемости резистентности к клещам изменяются от 0,4 до
0,8. У животных английских мясных пород h2 устойчивости к
клещам равен 0,48.
Некоторые исследователи установили связь типа гемоглобина
НЬС с устойчивостью к клещам. Аллель НЬС у скота связан с
повышенной резистентностью к тейлериозу, а также, видимо, к
другим болезням, переносимым клещами в Восточной Африке. В
зонах, свободных от этих болезней, аллель НЬС редко встречает-
ся у животных в сравнении с энзоотическими зонами.
Условия среды, сезон, возраст, пол, стельность и другие фак-
торы влияют на устойчивость к клещам. В основном мужские
особи более восприимчивы к клещам, чем женские. В летний
период резистентность к клещам выше, чем в зимний.
Актиномикоз — инфекционная болезнь животных и человека,
характеризующаяся образованием грануломатозных поражений в
различных тканях и органах. Возбудитель — лучистый гриб Acti-
nomyces bovis, относящийся к актиномицетам.
В одном исследовании из 16 249 животных молочных и мяс-
ных пород актиномикоз выявлен у 2,13 %. Установлены разли-
чия в заболеваемости животных мясного и молочного типов.
Пораженность быков гернсейской породы была в 7 раз выше,
чем быков других пород. Коровы гернсейской породы в 3 раза
чаще заболевали актиномикозом, чем голштинские. Такие же
большие различия в наследственной устойчивости и восприим-
чивости обнаружены между линиями и семействами.
315
ГЕНЕТИЧЕСКАЯ УСТОЙЧИВОСТЬ И ВОСПРИИМЧИВОСТЬ
К ВИРУСНЫМ ИНФЕКЦИЯМ
Лейкозы (лейкемия, белокровие) — опухолевые заболевания
кроветворной ткани. Характеризуются главным образом систем-
ным размножением незрелых кроветворных клеток в различных
органах и тканях.
Межвидовые и межпородные различия. Лей-
коз чаще встречается у крупного рогатого скота, чем у овец,
лошадей и свиней. У лошадей чаще регистрируются злокачест-
венные меланомы.
Среди 34 пород скота страны наиболее восприимчивы к лей-
козу животные красных (бурая латвийская, красная датская,
красная литовская и др.) и черно-пестрых пород (Нахамсон,
1989). У пород швицкого происхождения (костромская, Лебедин-
ская, бурая карпатская) лейкозы появляются редко. Среди севе-
ронемецких пород лейкоз регистрировался в 8 раз чаще, чем у
баварских. Предполагают, что красная горбатовская порода,
красный мегрельский, якутский, суксунский и бушуевский скот
относительно устойчивы к лейкозу (Дмитриев и др., 1986). Ин-
фицированность скотч молочных пород значительно выше, чем
мясных. Однако некоторые исследователи считают, что в одина-
ковых условиях среды между породами отсутствуют различия по
заболеваемости лейкозом.
Влияние производителей и линий. Во всех по-
родах между производителями выявлены большие различия по
заболеваемости потомства лейкозом. Так, частота пораженности
дочерей одних быков равна 0—5 %, других — 20—50 % и выше.
Сила влияния отцов на устойчивость дочерей к лейкозу равна
15 %, а в некоторых стадах доля влияния составляет 3—5 %. От
скрещивания резистентных отцов со здоровыми и лейкозными
матерями получено в 3 раза меньше больных дочерей, чем от
восприимчивых к лейкозу быков (табл. 65).
65. Заболеваемость лейкозом дочерей резистентных и восприимчивых
к лейкозу быков (по В. Л. Петухову)
Порода Признак Число быков Матери
здоровые лейкозные
Доч ери
всего % больных всего % больных
Бурая лат- Восприимчивость 26 663 34,5 115 47,8
вийская Резистентность 13 503 П,7 118 11,9
Черно-пе- Восприимчивость 6 380 16,9 49 42,8
стран Резистентность 6 214 3,7 26 > 15,4
316
Коэффициент ранговой корреляции быков, использовавшихся в
разных хозяйствах, изменялся от 0,40 до 0,75. От отцов, заболевае-
мость дочерей которых была в пределах от 0 до 10 %, получены
сыновья, давшие потомство также с относительно низкой заболева-
емостью (5,4 %). При высокой пораженности отцов (30 % и более)
дочери сыновей также характеризовались повышенной восприимчи-
востью к лейкозу (27,5). В хозяйствах может быть 21—28 % быков с
относительно низкой заболеваемостью (до 5—10 %) и 13—23 %
быков с высокой пораженностью потомства (больше 30 %).
В пределах отдельных хозяйств выявлены межлинейные раз-
личия по частоте заболеваемости лейкозом. Однако ранг линий в
разных хозяйствах и районах сильно изменяется. Только 0,8—
2,6 % дисперсии от общей изменчивости признака обусловлено
влиянием линии. У мышей выведены линии, резко различаю-
щиеся по заболеваемости лейкозом и другими злокачественными
новообразованиями.
Влияние семейств и матерей. Существуют боль-
шие различия между семействами по частоте заболеваемости
лейкозом. Имеются семейства, свободные от лейкоза, и с заболе-
ваемостью до 70 % (Эрнст и др., 1989). В некоторых популяциях
выявлено до 30 % свободных от лейкоза семейств и до 13 %
семейств с пораженностью свыше 40 %. На рисунке 66 приведе-
на генеалогическая схема восприимчивого к лейкозу семейства.
От больных лейкозом матерей получено в 2 раза больше боль-
ных дочерей, чем от здоровых (табл. 66). Заболеваемость внучек
в меньшей степени зависит от состояния здоровья бабушек. Ко-
эффициент корреляции частоты заболеваемости лейкозом мате-
рей и дочерей равен 0,2. Между возрастом проявления лейкоза у
матерей и дочерей существует положительная связь (г = 0,39).
Некоторые отцы также различаются по возрасту проявления лей-
коза у дочерей. Заболеваемость лейкозом до 3 лет ниже, чем
пораженность в более старшем возрасте.
66. Чистота заболеваемости потомства лейкозом в зависимости
от состояния здоровья родителей (по В. Л. Петухову)
Матери Дочери Внучки
всего | % бальных всего | % бальных
Здоровые 3625 и,з 1154 8,3
Бальные 776 29,3 244 12,2
Среднее — 14,4 — 9,9
Конкордантность однополых двоен по лейкозу равна 74 %.
Более близкие родственники лейкозных близнецов болеют чаще,
чем более далекие.
А. Г. Незавитин (1992) в племенных стадах выявил, что от
РИД (—) матерей получено в 2 раза меньше РИД (+) дочерей,
чем от инфицированных ВЛКРС матерей (табл. 67).
317
КОРОВЫ:
О - ЗДОРОВЫЕ
ф -БОЛЬНЫЕ
0 - НЕ ИССЛЕДОВАНЫ
БЫКИ:
Ц - БОЛЬНЫЕ
Ряс. 66. Генеалогическая схема предрасположенного к лейкозу семейства Азартной
3734 (первые цифры, написанные через таре, обозначают год рождения, вторые —
год выбытия, например 72—75)
67. Частота инфицированности ВЛКРС дочерей, полученных
от инфицированных и здоровых матерей (по А. Г. Незавитину)
Дочери
Матери Число пар РИД (+) РИ а_ь)
МоГЬ ДиЧЬ голов I % голов J _
РИД (+) 335 129 38,5±2,6 206 61,5±2,6
РИД (-) 857 140 16,3±1,3 717 83;7±1,3
Всего 1192 269 22,6±1,2 923 77,4±1,2
318
Связь с генетическими полиморфными систе-
мами. Доказана разная по величине ассоциация главного ком-
плекса гистосовместимости с некоторыми болезнями у человека
и животных. Показано, что у джерсейского скота антигены МНС
W1 и W3 связаны с устойчивостью к лейкозу. По мере инфици-
рования животных вирусом лейкоза в группе положительного по
гематологии скота увеличивается частота антигенов BoLA W8 и
W11.
У лейкозных коров чаще встречаются аллели групп крови
BG2O3Y2, Z, а у здоровых — BG2O3, ВОзГРЗг- Предполагают,
что восприимчивость к лейкозу связана с некоторыми антигена-
ми генетических систем групп крови.
Животные бурой латвийской породы с типом церулоплазмина
ВВ имеют более низкую заболеваемость лейкозом (1,27 %), чем
животные с другими типами (Карликов, 1976). Анализируя все
имеющиеся данные по ассоциации полиморфных систем с лей-
козом, можно сказать, что пока нет генетических маркеров ус-
тойчивости и восприимчивости скота к лейкозу.
Цитогенетика лейкоза. Во многих исследованиях
обнаружены изменения кариотипа при лейкозах. При всех фор-
мах лейкоза крупного рогатого скота часто выявляется повышен-
ный процент анеуплоидии. Изучение кариотипа костного мозга у
лейкозных и здоровых животных показало, что у больного скота
в 4 раза больше полиплоидных клеток. Однако в некоторых
работах отсутствуют различия по частоте хромосомных аномалий
у больных и здоровых животных. Пока четко не доказано, явля-
ются ли хромосомные аномалии одной из причин лейкоза.
Наследование устойчивости и восприим-
чивости к лейкозу. Показано, что моногенное наследо-
вание устойчивости и восприимчивости лейкоза маловероятно.
Распределение семейств и быков по заболеваемости потомства
лейкозом отличалось от нормального, тогда как в этих же стадах
по туберкулезу и бруцеллезу было нормальным. В некоторых
исследованиях установлен нормальный характер распределения
быков по заболеваемости дочерей лейкозом. Можно предполо-
жить, что устойчивость к лейкозу определяется многими генны-
ми локусами. Коэффициенты наследуемости устойчивости и вос-
приимчивости к лейкозу в разных стадах изменяются от 0,07 до
0,5 (Эрнст, Петухов, Карликов и др.).
Предполагают, что у кур восприимчивость к заражению виру-
сом лейкоза доминирует над резистентностью и является моно-
генным признаком. Локусы, определяющие устойчивость против
вирусов лейкоза подгрупп А и В, наследуются независимо друг
от друга.
Гипотезы и теории этиологии лейкозов.
Постоянно расширяются знания о злокачественных новообразо-
ваниях. Л. А. Зильбер создал вирусогенетическую теорию воз-
> 319
*
никновения опухолей, согласно которой нуклеиновая кислота
вируса частично или полностью включается в, геном клетки.
О. А. Иванова (1972) считала, что лейкоз обусловлен прови-
русом (V), ДНК которого входит в геном неблагополучного жи-
вотного. В геноме также имеется ген-репрессор (R), влияющий
на активность провируса. Заболевают особи, у которых имеются
провирус и неактивный рецессивный аллель репрессора Wn,
Vvrr и частично WRr.
Лейкемогенез — многостадийный процесс. Считают, что лей-
коз вызывается РНК-с эдержащим вирусом лейкоза крупного ро-
гатого скота (ВЛКРС или BLV), который относится к группе
ретровирусов. Этот вирус интегрирован с геномом кроветворной
клетки и способен к горизонтальной и вертикальной передаче.
В ретровирусах за индукцию рака ответствен онкоген. Онко-
гены ретровирусов имеют не вирусное, а клеточное происхожде-
ние. Предполагают, что онкоген (протоонкоген) — это изменен-
ный нормальный ген. При попадании в геном ретровируса про-
тоонкоген активизируется и превращается в онкоген, который
может трансформировать клетки. Известно 17 протоонкогенов.
Однако у группы ретровирусов лимфоидного лейкоза крупного
рогатого скота онкогены не обнаружены.
В. П. Шишков (1976) выдвинул вирусоиммуногенетическую
концепцию этиологии патогенеза и профилактики лейкозов и
ряда опухолевых заболеваний. Согласно этой теории наряду с
ведущей ролью РНК-содержащих вирусов в развитии лейкозов
крупного рогатого скота и птицы имеют значение иммунологи-
ческое состояние организма и генетическая предрасположен-
ность к этой болезни.
Для диагностики лейкоза широко применяют реакцию имму-
нодиффузии (РИД). Во многих стадах может быть большой про-
цент инфицированных животных. Далеко не всегда инфициро-
ванные ВЛКРС животные заболевают. У этих животных сохраня-
ется нормальный уровень продуктивности. Однако 90—100 %
заболевших лейкозом животных инфицированы ВЛКРС. Селек-
ция животных на устойчивость к лейкозу может проводиться
только в стадах с большой инфицированностью скота вирусом
лейкоза.
Рак глаз. Эта болезнь крупного рогатого скота распространена
в Австралии. Считают, что ультрафиолетовые лучи — главный
фактор в возникновении болезни. Наиболее чувствительны к
раку глаз породы герефорд, комолый герефорд и их помеси.
Болезнь у животных встречается в возрасте 8—10 лет и очень
редко — до 5 лет. У животных с полной пигментацией кожи
(породы абердин-ангус, гернсейская, джерсейская, швицкая и
др.) рак глаз не зарегистрирован. У животных с уменьшением
пигментации радужной оболочки заболевание встречается чаще
(табл. 68).
320
68. Рак глаз и пигментация радужной оболочки (по Nishimura и др.)
Порода Число животных Рак глаз, % Пигментация радужной оболочки
отсутствует | частичная | полная
Герефорд 353 2,83 13,1 16,5 70,4
(Г) х шароле (Ш) Браман х ГШ 459 0,22 4,3 5,5 90,2
Африкан- 524 0 0,6 1,0 98,4
дер х ГШ Африкандер 85 0 0 0 100
Браман 74 0 0 0 100
Среди 353 помесей герефорд х шароле у 13,1 % животных
пигментация полностью отсутствует, поэтому у них более высо-
кая частота рака глаз.
Ящур. Острая вирусная чрезвычайно контагиозная болезнь
парнокопытных. К болезни относительно устойчивы зебу. На
одной ферме из 1074 голов крупного рогатого скота заболело
ящуром 97,1 %. Частота заболеваемости животных симменталь-
ской и красной степной пород равна 100 %, кавказской бурой —
87,5, а зебу — только 20 %. Имеются данные о семейной устой-
чивости скота к болезни.
Болезнь Марека (MD) — инфекционная болезнь птиц (возбу-
дитель — ДНК-содержащий вирус), характеризующаяся контаги-
озностью, разрастанием лимфоретикулярной ткани во внутрен-
них органах, коже, мышцах, поражением периферических нерв-
ных стволов.
Некоторые породы кур различаются по устойчивости к
болезни Марека. Выявлены также и межлинейные различия
(табл. 69). Во многих породах созданы резистентные линии
кур. Так, английскими учеными создана линия кур породы
род-айланд со 100%-ной резистентностью к болезни. Резис-
тентные и восприимчивые линии различаются и по продукции
интерферона, выполняющего защитную функцию при вирусных
инфекциях.
69. Резистентность к болезни Марека инбредных линий кур и их кроссоа
после экспериментального заражения (по Gavora, Spenser)
Линия | % больных | Кросс линии | % больных
GF О GFxGH 9,8
GC 44,4 GHxGF 11,1
GH 94,1 - -
По мнению некоторых ученых, резистентность к болезни до-
минирует над восприимчивостью. При этом основную роль игра-
ют 2—4 аутосомных гена трех локусов. Установлено неполное
доминирование резистентности над восприимчивостью. Сцеп-
ленные с полом гены существенно не влияют на резистентность,
321
хотя смертность от болезни среди женских особей выше, чем
среди мужских.
Имеется довольно четкая взаимосвязь аллеля В21 группы
крови В с резистентностью к болезни Марека (табл. 70). Почти
все особи резистентной линии N были гомозиготны по антигену
В21, в то время как большинство особей из восприимчивой
линии Р имели антиген В19.
70. Зависимость резистентности кур к болезни Мврека от внтигенв В21
(по Hutt)
Тип скрещивания | Генотип | Число кур| % больньЬс} Генотип I Число кур | % больных
В пределах линий N и Р:
В19В2‘ х В19В19 В19Р19 81 8,6 В,9В19 99 69,7
В другой популяции:
В2,В-х В-В- В21В- 189 5,8 В~В- 191 77,0
Обозначение: В- — другие В-аллели, но не В21.
Существует точка зрения о наличии по меньшей мере двух
форм генетической резистентности. Одна из них связана с неко-
торыми аллелями В-системы групп крови, особенно В21, и выра-
жается повышенной иммуногенетической реактивностью и воз-
растной устойчивостью. Вторая форма устойчивости связана с
локусами Th-1 и Ly-4 и определяется резистентностью лимфоид-
ных клеток против инфекции.
Описано много хромосомных нарушений в клетках, инфици-
рованных вирусами. При MD анеуплоидия и разрывы хромо-
сом — наиболее часто наблюдаемые аномалии. Так, пропорция
анеуплоидных метафаз в лимфоцитах была 10 %, а в клетках
костного мозга — 12 % по сравнению с 1,7 % в контроле.
Некоторые исследователи считают, что нет значительной
связи между признаками продуктивности и резистентностью к
MD. В других исследованиях обнаружена отрицательная корре-
ляция между резистентностью к MD и живой массой птицы,
массой яиц, но положительная с яйценоскостью.
Ньюкаслская болезнь (псевдочума птиц) — высококонтагиоз-
ная вирусная болезнь главным образом куриных. Характеризует-
ся пневмонией, энцефалитом и множественными точечными ге-
моррагическими поражениями внутренних органов. При остром
течении смертность среди молодняка достигает 100 %. У кур
обнаружены генетические различия по устойчивости и воспри-
имчивости. В опытах Франкис (1955) после заражения смерт-
ность кур в семействе А была 30 %, а в семействе D — 78 %.
Кроме того, смертность после заражения более быстро увеличи-
валась у особей семейства D.
При иммунизации кур вакциной с инактивированным виру-
сом, вызывающим ньюкаслскую болезнь, выявлены высокодос-
322
товерные различия между семьями по отцу. Коэффициент насле-
дуемости силы иммунного ответа был 0,41.
Птицы, лишенные Т-лимфоцитов, очень восприимчивы к бо-
лезни. При агаммаглобулинемии цыплята также чувствительны к
болезни.
Японские перепелки использовались как модельный объект
селекции на резистентность к ньюкаслской болезни. В результате
пораженность перепелок в V—VI поколениях снизилась с 41,5 до
2,05 и 2,63 %. Реализованный коэффициент наследуемости равен
0,6. В селекционируемой на резистентность группе смертность
снизилась в несколько раз, повысились выводимость и живая
масса птицы.
Скрепи (почесуха) — медленно развивающаяся инфекционная
болезнь, ведущая к дистрофическим изменениям центральной
нервной системы. Вызывается вирусоподобным агентом, природа
которого не выяснена.
Пока не найдены антигены против возбудителей медленных
инфекций (скрепи, висна, куру и др.). Болеют овцы в возрасте
2,5—4,5 года. Характерный признак болезни — зуд. Овцы стирают
шерсть об изгороди, и на теле появляются голые места. Болезнь
встречается на всех континентах и во многих странах, особенно в
Австралии, Новой Зеландии, Южной Африке и США. В Западной
Европе скрепи регистрируется в течение 200 лет.
Овцы пород рамбулье, гемпшир и тарги более устойчивы к
скрепи (соответственно 14, 18 и 19 %), чем новозеландские овцы
породы суффольк (39 %) и шотландские черноголовые (28—
43 %). Козы молочных пород чаще заболевают скрепи (61 %),
чем ангорские (26 %).
Эффективен был отбор линий английских пород овец шевиот
и хердвик на увеличение (позитивная линия) и уменьшение (не-
гативная линия) заболеваемости скрепи в ответ на подкожное
введение агента скрепи, обозначаемого как SSBP/7 (табл. 71).
71. Скрепи у овец, вызванная заражением агентом SSBP//
(цит. по R. Kimbertin)
Заболеваемость, % I Инкубационный период, дней
Порода Линия
позитивная негативная | позитивная негативная
Шевиот 100 0 313±9 —
Хердвик 100 4 178±5 902±190
Инкубационный период у животных негативной линии во
много раз больше, чем у животных позитивной. Предполагают,
что ответ на заражение контролируется геном, обозначаемым sip
(скрепи, инкубационный период) и имеющим две аллеля. Доми-
нантный аллель контролирует восприимчивость к скрепи, а ре-
цессивный — устойчивость. Следует учитывать тот факт, что
323
ответ одной линии на разные агенты скрепи неодинаков. Напри-
мер, заболеваемость овец породы шевиот позитивной и негатив-
ной линий на агент скрепи SSBP/Z была равна соответственно
100 и 50 %. Заболеваемость этих линий при внутрикожном зара-
жении агентом скрепи СН 1641 была иной: соответственно 53 и
38 %. Все же заболеваемость животных негативной линии в
обоих случаях была ниже, чем животных позитивной. Это гово-
рит о возможности создания линий животных, устойчивых к
нескольким штаммам одного возбудителя. Генетический кон-
троль устойчивости к скрепи зависит отдптамма возбудителя.
Миксоматоз кроликов. Острая вирусная болезнь, характери-
зующаяся серозно-гнойным конъюнктивитом и образованием
опухолей в области головы, ануса и наружных половых органов.
У некоторых пород кроликов смертность достигает 100 %. Воз-
можность увеличения доли резистентности особей в популяции
видна из следующего примера. В 1859 г. в Австралии были выпу-
щены*! 3 кроликов, завезенных из Европы. В 1953 г. их насчиты-
валось около 0,5—1 млрд. Они стали приносить вред сельскому
хозяйству. В 1950—1951 гг. в некоторых областях Австралии кро-
ликов заразили вирусом миксоматоза, и через некоторое время
погибло до 90 % особей. Однако проблема не была решена, так
как среди кроликов возникли генетически резистентные особи и
их поголовье сильно возросло. Успешна селекция на резистент-
ность к миксоматозу и домашних пород кроликов. Коэффициент
наследуемости устойчивости к этой болезни равен 0,35—0,40.
ГЕНЕТИЧЕСКАЯ ОБУСЛОВЛЕННОСТЬ
РЕСПИРАТОРНЫХ БОЛЕЗНЕЙ
Из респираторных заболеваний у свиней преобладают пневмо-
ния, плевриты и атрофический ринит. У животных породы ланд-
рас реже встречается поражение легких, чем у животных йор-
кширской породы. В то же время свиньи йоркширской породы
более устойчивы к атрофическому риниту, чем ландрасы. Коэф-
фициент наследуемости устойчивости свиней к пневмонии равен
0,14, к плевриту — 0,13 и атрофическому риниту — 0,16—0,60.
Доказана наследственная предрасположенность к гемиплегии
гортани у лошадей. Обнаружены большие различия между потом-
ством жеребцов голландских тяжеловозов по частоте заболевания
(от 0 до 21,5 и 59 %). Эмфизема легких часто возникает у лоша-
дей из-за генетической предрасположенности.
Ягнята мериносных пород менее чувствительны к пневмонии,
чем породы бордер-лейстерской. Внутрипородная изменчивость
установлена при совместном содержании бордер-лейстерских
овец из трех стад (R, С и S). На пневмонию животных исследо-
вали в 5-месячном возрасте. У овец стада R за 6 лет наблюдений
324
зарегистрировано 28 % больных пневмонией, а в стадах С и S —
65 %.
Среди пяти изученных пород наибольшую чувствительность к
легочному аденоматозу наблюдали у герефордов. Генетическое
разнообразие по устойчивости к легочному аденоматозу обнару-
жено между отродьями и потомством баранов. В Исландии к
болезни более предрасположены овцы готгорпского отродья, чем
адалболкского. Смертность от аденоматоза среди потомков неко-
торых баранов изменялась от 10 до 94 %.
ГЕНЕТИЧЕСКАЯ ОБУСЛОВЛЕННОСТЬ БОЛЕЗНЕЙ
ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
Описан ряд наследственных аномалий желудочно-кишечного
тракта. К ним относятся: атрезия (непроходимость подвздошной
кишки у скота — рецессивный признак), атрезия ободочной
кишки у лошадей, приводящая к гибели жеребят спустя несколь-
ко недель после рождения (рецессивный признак), атрезия ануса
у свиней и у скота (рецессивное наследование) и т. д.
На свиноводческих комплексах падеж поросят от болезней
органов пищеварения может достигать 51 % от общего числа
отхода животных.
Диарея. Как говорилось выше, болезнь у поросят может быть
вызвана штаммом Е. coli, имеющим К-88-антиген. Этот антиген
обеспечивает прилипание (адгезию) возбудителя к тем эпители-
альным клеткам слизистой оболочки кишечника, которые имеют
соответствующие рецепторы. Наличие рецепторов вызывает вос-
приимчивость к инфекции и кодируется аутосомным доминант-
ным геном S. Отсутствие рецепторов обеспечивает устойчивость
и детерминировано рецессивным геном s. Гомозиготные доми-
нантные (55) и гетерозиготные (5s) свиньи восприимчивы к
заражению К-88-позитивных Е. coli (табл. 72). Рецессивные
особи (ss) устойчивы к заражению. У свиней описан еще один
фенотип, обозначенный как слабоадгезивный (±), который, ви-
димо, обусловлен третьим аллелем Sq.
72. Заболеваемость диареей и смертность потомства (по Seiwood)
Тип скрещива- ния } х сГ Число поросят Диарея, % Смертность, %
от диареи | всего
SSX SS 153 12,0* 2 7
ss х SS 32 100,0 69 69
SSx & 68 44,0 35 37
•Диарея, вызванная штаммом 987Р Е. coli.
У телят молочных пород скота диарея встречается чаще
325
(23,4 %), чем у мясных. Заболеваемость среди бычков несколько
выше, чем среди телочек.
Наследственная предрасположенность к язвенным воспалени-
ям тонких кишок обнаружена у свиней и других животных.
Селекция японских перепелов на повышенную склонность к
язвенным воспалениям позволила создать линии, в которых
смертность от этой болезни составила 26—32 %, тогда как в
неселекционируемой линии она равна 5 %. Выдвинута гипотеза
о полигенном контроле восприимчивости перепелов к язвенным
воспалениям. \
Тимпания рубца (вздутие рубца) — болезнь жвачных. Характе-
ризуется большим скоплением газов в рубце. Скот пород тропи-
ков (например, санта-гертруда и др.) менее чувствителен к тим-
пании, чем животные пород умеренного климата. У молочных
шортгорнов тимпания встречается значительно чаще, чем у жи-
вотных голштинской породы.
Доказано влияние производителей на устойчивость потомства
к тимпании. Так, у одного быка-улучшателя по молочной про-
дуктивности 1,6 % внучек имели повышенную чувствительность
к тимпании. Внучки двух других производителей, оцененных
посредственно по молочной продуктивности, характеризовались
повышенной восприимчивостью к тимпании (8,2—11 %). На
однополых двойнях показано, что h2 чувствительности к тимпа-
нии колеблется от 0,1 до 0,5. Среди основных источников из-
менчивости проявления симптомов тимпании 20 % обусловлено
индивидуальной изменчивостью коров. На различия между пара-
ми двоен приходилось 50 % изменчивости. Существует сходство
в чувствительности к болезни у однояйцовых двоен.
Метод определения предрасположенности к тимпании состо-
ит в том, что животных выпускают на 1 ч на пастбище, напри-
мер клевера, а затем определяют наличие симптомов болезни.
Пытаются использовать для оценки фенотипа высокой и низкой
чувствительности к болезни физиологические особенности
слюны, белки слюны, жидкость рубца и ее объем. При электро-
форезе белков слюны получено 8 полос, некоторые из которых
связаны с высокой или низкой чувствительностью к тимпании.
Полосы белков 4-я и 6-я положительно связаны с тимпанней, а
7-я и 8-я связаны с отсутствием болезни.
Предпринята попытка селекции животных на высокую и низ-
кую восприимчивость к болезни. Установлено, что большой
объем жидкости рубца связан с высокой чувствительностью к
тимпании. Исследователи считают, что этот признак может быть
основой для селекции на устойчивость к тимпании после разра-
ботки метода измерения объема жидкости.
Восприимчивость животных к тимпании можно оценивать в
баллах: 0 — отсутствует, 1 — слабая, 2 — средняя, 3— сильная,
4 — опасная. Предложена гипотеза, согласно которой два аллеля
326
одного локуса контролируют низкую или высокую восприимчи-
вость. Животные с баллом 0,75 и меньше имеют генотип аа,
высокая восприимчивость к тимпании оценена баллом 1,75 и
выше у животных с генотипом bb. Гетерозиготные особи имеют
оценку 0,76—1,74. Проведены различные варианты скрещива-
ний, которые в некоторых случаях подтвердили совпадение фак-
тического и теоретически ожидаемого расщепления.
Не обнаружено существенной связи предрасположенности к
тимпании с молочной продуктивностью и живой массой коров.
БОЛЕЗНИ ОБМЕНА ВЕЩЕСТВ
Обмен веществ обусловлен генетическими и средовыми фак-
торами. У человека известно много наследственно обусловлен-
ных нарушений обмена веществ. Большая часть из них — резуль-
тат мутации одного гена, ведущего к хорошо распознаваемому
клиническому эффекту. У животных эти нарушения мало изуче-
ны. К болезням обмена веществ относятся кетозы, родильный
парез, тетания и др. Эти болезни часто составляют большую
часть среди других заболеваний коров (8,0—32 %). У финского
молочного скота среди всех болезней доля родильного пареза
составила 17,1 %, неродильного — 1,5, кетоза— 10,5 %.
Кетозы. Болезни, характеризующиеся расстройством обмена
веществ и проявляющиеся появлением ацетоновых тел в крови
(кетонемия), моче (кетонурия), молоке (кетонолактия). Чаще бо-
леют высокопродуктивные коровы, суягные овцы, свиноматки.
Болезни возникают вследствие нарушения кормления и содержа-
ния животных. Коровы чаще заболевают зимой и в 5—8-летнем
возрасте. У больных коров снижается фагоцитарная активность
крови, бактерицидная активность сыворотки крови, активность
Р-лизинов и лизоцима, т. е. наблюдается снижение клеточной и
гуморальной защиты организма.
У норвежского молочного скота кетозы встречаются у 7,2—
8,3 % животных. В 1983 г. в Норвегии кетоз зарегистрирован у
15 % дойных коров. Среди всех болезней по распространенности
кетозы занимают второе (21 %) после мастита (33,5 %) место.
Кетозы встречаются чаще в Норвегии, чем в Дании и Швеции.
В некоторых хозяйствах Западной Сибири частота заболеваемос-
ти кетозом скота черно-пестрой породы достигает 32 %. Сущест-
вуют достоверные различия между производителями по заболева-
емости дочерей кетозами (от 0 до 61 %). Распределение быков по
заболеваемости кетозом нормальное. Коэффициент наследуемос-
ти кетозов составляет 0,02—0,08, а в некоторых исследованиях —
0,25 (Н. Н. Кочнев, 1993). Для сравнения следует сказать, что h2
мастита в этой популяции был равен 0,01, коэффициент повто-
ряемости кетоза — 0,50. В Норвегии быков испытывают по ус-
тойчивости потомства к маститу и кетозу. Эти признаки включа-
327
ются наряду с 11 другими, когда определяют общую племенную
ценность быков.
Субклинический кетоз чаще встречается у коров с признака-
ми мастита или наличием кисты яичников.
Родильный парез. Болезнь проявляется через несколько часов
после отела преимущественно у взрослых и часто высокопродук-
тивных коров. Причиной пареза может быть нарушение обмена
кальция, фосфора и магния. Родильный парез иногда наблюдает-
ся у 10—20 % животных. Существуют межпородные различия по
заболеваемости коров родильным парезом. Так, в Швеции кли-
нически диагностируемый родильный парез обнаружен у 4,5 %
коров шведского красно-пестрого скота и у 2,7 % коров швед-
ских фризов. Коэффициент наследуемости родильного пареза
колеблется от 0,01 до 0,13, коэффициент повторяемости — 0,37.
Существует невысокая положительная корреляция между удоем
и предрасположенностью к парезу. Высокая плодовитость может
сочетаться с низкой предрасположенностью к болезни.
Наследственно обусловленные аномалии обмена химических
элементов. Наследственно детерминированные аномалии обмена
меди, цинка, железа, марганца, йода, серы, кобальта и т. д.
выявлены у крупного рогатого скота и овец. Обнаружены разли-
чия между породами и линиями. Генетические различия объяс-
няются разной способностью животных абсорбировать микроэ-
лементы из корма и разной скоростью обменных процессов.
Селекция овец на высокую и низкую концентрацию меди ока-
залась эффективной. Коэффициент наследуемости этого призна-
ка был в пределах 0,2—0,4. Коэффициент наследуемости концент-
рации меди в плазме крови равен 0,45. У джерсейского скота
более высокий уровень содержания меди, чем у фризского. Суще-
ствуют большие межпородные различия овец по содержанию
меди (табл. 73). В биогеохимических провинциях, где в почве и
растительности содержится недостаточное количество меди или
имеется избыток молибдена и свинца при достаточном содержа-
нии меди, возникает энзоотическая атаксия ягнят, которая тесно
коррелирует с концентрацией меди в печени, цельной крови и
головном мозге. Низкая концентрация меди у шотландских черно-
головых овец связана с высокой заболеваемостью энзоотической
атаксией (40 %) в период от рождения до 4-месячного возраста.
73. Влияние породы на заболеваемость овец энзоотической атаксией
и содержание меди (по Wiener)
Порода или кроссы Число ягнят при рождении % заболевших Концентрация меди
в печени, мг/кг в цельной крови, мг/л В головном мозге, мг/кг
Шотландская черно- головая (ШЧ) 48 40 14 0,60 9,2
Шевиот (Ш) 35 11 45 0,67 10,7
328
Продолжение
Порода или кроссы Число ягнят при рождении % заболевших Концентрация меди
в печени, мг/кг в цельной крови, мг/л в головном мозге, мг/кг
Уэльская горная (УГ) 56 0 50 0,76 12,3
ШЧхШ 92 21 26 0,81 11,3
ШЧхУГ 106 15 23 0,79 10,7
ШхУГ 81 5 55 0,84 10,6
Овцы породы финский ландрас в цельной крови имеют почти
в 2 раза выше концентрацию селена и активность глютатион-
пероксидазы (GSH—Рх), чем животные шотландской черноголо-
вой и уэльской горной пород при содержании на одних и тех же
пастбищах. Выявлена генетическая предрасположенность к гипо-
и гиперселенемии у свиней. Селекционируемые на высокую кон-
центрацию селена свиньи в возрасте 150 дней имели живую
массу на 10 кг больше, чем животные с низким содержанием
селена. Предлагается учитывать в селекционных программах ге-
нетически обусловленные особенности нарушения обмена ве-
ществ в организме и потребности животных в микроэлементах.
РОЛЬ НАСЛЕДСТВЕННОСТИ В ПРЕДРАСПОЛОЖЕННОСТИ
ЖИВОТНЫХ К БОЛЕЗНЯМ КОНЕЧНОСТЕЙ
В условиях промышленного животноводства заболевания ко-
нечностей — наиболее распространенные болезни. От 3 до 7 %
потерь молока связано с болезнями копыт у коров. В некоторых
странах выбраковка из-за болезней конечностей составляет 2,4—
15,0 %. У голландского скота дефектам копыт, обусловливаю-
щим хромоту, подвержены 6—7 % молочных коров. Животные
чаще заболевают в возрасте 4—7 лет.
Десятки болезней конечностей часто объединяют под общим
названием «болезни конечностей». Условия среды играют глав-
ную роль в их возникновении, однако наследственность — часто
важный предрасполагающий фактор. Описан ряд моногенных
наследственных болезней конечностей, но болезни с наследст-
венным предрасположением занимают очень большое место.
Серая местная и болгарская породы скота отличаются креп-
кой конституцией и особенно крепкими ногами и копытами.
Заболеваемость коров черно-пестрой эстонской породы в 2 раза
выше, чем красной эстонской. Изучена крепость копыт черно-
пестрого скота и его помесей с голштинами. Помеси шведских
быков характеризовались наибольшей крепостью копыт. На-
именьшая крепость копыт была у помесей голштинских быков
из США, Новой Зеландии и Голландии.
Черно-пестрый скот Сибири менее подвержен воспалительно-
инфекционным осложнениям отдела конечностей (11,3 %), чем
329
импортный датский и голландский скот (21, 30,4 %) и их полу-
кровные помеси (табл. 74).
74. Чвстотв болезней и деформация копыт у коров различного
происхождения, % (по Косолвпикову)
Коровы Число голов Воспалительно- ~ инфекционные осложнения Деформация копыт
Датские и голланд- ские: импортные 381 30,412,4 22,612,1
рожденные в 100 21,014,1 23,014,2
ГПЗ «Первомай- ский» Черно-пестрого 1126 11,310,9 21,011,2
скота Сибири Полукровные помеси 73 23,314,9 23,314,9
Выявлены достоверные различия в частоте заболеваемости ко-
нечностей дочерей быков черно-пестрой породы. Так, в одном
из стад пораженность потомства отдельных отцов изменялась от
0 до 23 % при средней заболеваемости по стаду 9 %. Коэффици-
ент наследуемости общей крепости конечностей равен 0,13.
Меньше предрасположен к болезни скот черно-пестрой (молоч-
но-мясной тип) и герефордской пород.
Генетическое разнообразие по устойчивости к болезням ко-
нечностей разных форм неодинаково. Например, h2 паралича
задних конечностей равен 0,3, а опухоли межкопытной щели
(лимакс) — 0,2.
Частота лимакса у дочерей разных быков была в пределах
11—53 % при средней по стаду 23 %. Различия между линиями
недостоверны. Не обнаружено 'достоверных различий по частоте
деформаций и воспалительно-инфекционных осложнений между
инбредными и аутбредными животными. У коров с антигеном
групп крови J\ обнаружено меньше воспалительно-инфекцион-
ных осложнений (4,4 %), чем у животных с антигеном Oi
(19,5 %).
Определенную роль в скорости роста, устойчивости к стира-
нию, количестве роговых трубочек на единице площади копыт,
влагопоглощающей способности копытного рога и т. д. играет
наследственность. Так, наследуемость количества роговых трубо-
чек равна 0,38—0,75, диаметра трубочек — 0,63, степени стира-
ния копыт — 0,79, влагоемкости — 0,82. Поражения копыт связа-
ны с наследственной предрасположенностью к образованию
винтообразного рога и язв подошвы.
Постановка конечностей может также влиять на заболевае-
мость. Например, при саблевидной постановке наблюдаются
язвы и нагноения, образование остроугольных или плоских
330
копыт, при Х-образной постановке может возникать абаксиаль-
ный гнойный ламинит.
Спастический (сивдром) парез (поражение тазовых конечнос-
тей). Болезнь характеризуется рецессивным полигонным насле-
дованием с неполной пенетрантностью рецессивного фактора. В
большинстве случаев рецессивный фактор передается через
быков. У 10—30 быков станций искусственного осеменения
может встречаться спастический синдром. Особенно высокая
частота болезни у голштинских и абердин-ангусских быков. В
связи с широким использованием в нашей стране голштинских
быков необходимо учитывать в племенной работе ранние (3,5—
6 мес) и поздние (3—8 лет) формы спастического синдрома и
других болезней. В США 2,6 % из 12 387 быков пяти молочных
и трех мясных пород были выбракованы из-за спастического
синдрома. При этом частота заболевания была выше у быков
айрширской и голштинской пород (соответственно 3,9 и 3,5 %).
В некоторых странах 5—10 % быков были выбракованы из-за
этой болезни.
Существует мнение, что использование инбридинга увеличи-
вает заболеваемость до 12—17 %.
В трех поколениях быков венгерского пестрого скота линии
Султана клиническая форма спастического пареза зарегистриро-
вана у 7 из 10 производителей. Изучено 1028 потомков пяти
быков линии Султана в трех поколениях. Частота заболеваемости
потомства клинически больных быков в Fi равна 43,5 %, в F2 —
31,7 и F3 — 31,3 %. Заболеваемость потомства клинически здоро-
вых быков была в несколько раз ниже: в Fi — 29,1 %, в F2 — 14
и в F3 — 6,6 %. Заболеваемость спастическим парезом в некото-
рых семействах достигала 60 %. При стойловом содержании
спастический парез поздней формы (3—8 лет) наблюдался у 58 %
животных, а при пастбищном — у 42 % (Хамори, 1983).
У свиней изучено 13 признаков, вызывающих слабость ног.
Коэффициенты наследуемости этих признаков были от 0 до 0,56,
а в среднем h2 слабости ног равен 0,07. Рентгенографические
исследования беконных свиней позволили установить, что h2
остеохондрита конечностей равен 0,4. Существуют различия
межпометные и между потомством разных хряков по частоте
слабости ног и повреждения суставов.
Разные породы овец отличаются по восприимчивости к ко-
пытной гнили, вызываемой Fusiformis nodosus. Частота заболева-
емости чистопородных коимбаторов в Индии была 12,8 %, а
корриделей— 61,1 %. У гибридов Fi и 3/4-кровных по корриде-
лям копытная гниль зарегистрирована соответственно у 21,1 и
26,1 % овец. Во всех группах заболеваемость взрослых овец была
в несколько раз выше, чем у ягнят. Передние конечности пора-
жаются чаще, чем задние. Можно предположить, что устойчи-
вость к копытной гнили неполно доминирует над восприимчи-
331
востыо. Британские породы овец и их кроссы более резистентны
к болезни, чем мериносы.
Изучение распространения врожденной косолапости у свиней
пород ландрас, йоркширская и дюрок показало, что у ландрас-
ских хряков частота случаев врожденной косолапости была
выше, чем у животных других пород. Частота врожденной косо-
лапости среди потомства разных хряков колебалась от 0 до 22 %.
При этом частота косолапости у хряков в 1,7 раза выше, чем у
свинок. Масса тела у поросят с косолапостью при рождении
была ниже, чем у здоровых. Сделан вывод о полигенной обу-
словленности врожденной косолапости.
Организация дифференцированной диагностики болезней ко-
нечностей, оценка потомства производителей и семейств по ус-
тойчивости к этим болезням — необходимый элемент племенной
работы.
РОЛЬ НАСЛЕДСТВЕННОСТИ В ПРЕДРАСПОЛОЖЕННОСТИ
-t К БЕСПЛОДИЮ
Бесплодие — нарушение воспроизводства потомства.
Полное или частичное бесплодие зарегистрировано в Швеции
у 65 % быков. В США и Канаде из 8887 быков молочных
пород выбраковано 36 % из-за различных нарушений вос-
производительной способности. Различные формы бесплодия
встречаются у 20—40 % коров. В 32 стадах коров голштинской
породы в США метриты зарегистрированы у 18,2 % животных,
кисты яичников — у 10,4, задержка последа — у 8,6, аборты —
у 1,4 % животных. У норвежского красного скота фено-
типические корреляции задержки последа, метритов, молочной
лихорадки, маститов, кетоза с бесплодием соответственно
равны 0,77; 0,73; 0,69; 0,68; 0,57. Это значит, что все
указанные болезни в значительной степени влияют на воз-
никновение бесплодия.
Степень проявления воспроизводительной способности изме-
няется от нормальной плодовитости до абсолютного бесплодия.
Нарушение воспроизводительной способности обусловлено
многочисленными факторами среды и наследственностью. Одна-
ко невозможно четко разделить ненаследственные и наследст-
венные нарушения плодовитости.
Коэффициенты наследуемости бесплодия очень малы —
от 0 до 0,1 (Завертяев, 1986). Однако различия в частоте’
бесплодия потомства разных производителей колеблются от 0
до 30 %.
Воспроизводительные качества у голштинских коров несколь-
ко хуже, чем у черно-пестрых. Голштинским коровам на один
отел требуется 1,91 осеменения, черно-пестрым — 1,55 и красно-
пестрым — 1,59.
332
У белых телок (болезнь белых телок) шортгорнской породы и
родственных им пород часто встречается бесплодие. У белых
телок матка и влагалище недоразвиты, тогда как яичники и
наружные половые органы развиты нормально. Такая форма бес-
плодия встречается у 10 % белых шортгорнских телок. В одном
стаде шортгорнов частота бесплодия у красных, чалых и белых
телок соответственно равна 1,1; 3,5 и 39,1 %.
Средневерхнебельгийский скот белой и голубой масти про-
изошел от шортгорнов. Процент бесплодных телок у белого
скота (14,9) в 3 раза выше, чем у голубого (4,2).
Установлено также, что среди телок белой масти бесплодных
насчитывается 10—15 %, среди телок чалой масти — 1—1,75, а
среди черных телок — только 0,3 %.
Г ипоплазия (недоразвитие) яичников и семенников
раньше часто наблюдалась у комолого скота Северной Швеции
(около 17 %). Телки с двусторонней гипоплазией не приходят в
охоту, а у быков с двусторонней гипоплазией гонад не образует-
ся сперма.
У шведского фьелльского скота найдена связь между частотой
гипоплазии и распространенностью белой окраски по поверх-
ности тела. У животных с распространенностью белой окраски
на 0,9 части поверхности тела частота гипоплазии гонад была
13,5 %, а у животных с пигментацией больше 50 % поверхности
тела заболевания не было. Следовательно, качественный признак
в какой-то степени может быть маркером некоторых форм бес-
плодия.
Из дефектов органов половой системы следует указать на
крипторхизм, при котором один или два семенника лежат
в брюшной полости, и мошоночную грыжу, при кото-
рой из-за большого диаметра пахового кольца, соединяющего
брюшную полость с мошонкой, петли кишечника заходят в мо-
шонку. Крипторхизм у крупного рогатого скота встречается
реже, чем у лошадей, коз, свиней и овец. У жеребцов с односто-
ронним крипторхизмом оплодотворяемость кобыл была 23 %, а у
нормальных — 53 %. Крипторхизм наиболее часто встречается у
собак пород с укороченным черепом (у боксеров до 23 %). У
овец тонкорунной породы прекос доля крипторхов (больше дву-
сторонняя) среди баранов достигает 25 %. У свиней крипторхизм
встречается у 0,2—0,4 % особей, а в некоторых популяциях — до
3-5 %.
Крипторхизм может быстро распространяться в популяциях
овец. На некоторых фермах в Венгрии частота крипторхов до-
стигла 25—30 %. Среди комолых баранов крипторхизм регистри-
ровался у 75,6 % особей, а среди рогатых — 2,4 %. Гипоплазия
семенников отмечена у 9 баранов из 141. Среди комолых живот-
ных гипоплазия была у 77,7 %, среди рогатых — у 11,5 %. У коз
и свиней крипторхизм наследуется по аутосомно-рецессивному
333
типу. Исследования, выполненные в США на свиньях пород
польско-китайской и ландрас, показали, что коэффициент на-
следуемости мошоночной грыжи равен 0,15. Доля материнского
влияния примерно равна такой же величине. Крипторхизм и
мошоночная грыжа — признаки, ограниченные полом.
Гермафродитизм (совмещение мужского и женского
пола в одном организме) чаще встречается у коз и свиней и
реже — у крупного рогатого скота, лошадей и овец.
У всех гермафродитов обнаружены половые хромосомы XX. У
одних особей имеется только ткань семенника, у других — ткани
семенника и яичника, но половые клетки не образуются. Частота
гермафродитов неодинакова у разных линий и пород. У белой
длинноухой свиньи она равна 0,1 %.
Интерсексы чаще встречаются у комолых коз. В одном из
стад зааненских и тоггенбургских коз выявлено соответственно
11 и 6 % интерсексов. Интерсексами генетически были самки. В
Швеции у свиней выявлено 0,21 % интерсексов. В США в одном
исследовании зарегистрировано 0,53 % интерсексов. У ландрасов
частота таких свиней составляет 1,5 %, а у белой беконной поро-
ды в Венгрии — 3,8 %. Интерсексуальные животные подлежат
выбраковке.
Частота мертворожденности и абортов в неко-
торых стадах может изменяться в больших пределах (соответст-
венно от 1 до 10 % и от 0,5 до 5 % и более) и обусловлена
многими генетическими и негенетическими факторами. Сущест-
вуют иммунные явления во всех звеньях нормального воспроиз-
ведения в организмах самок и самцов. Одной из причин прена-
тальных потерь может быть врожденное или приобретенное им-
мунодефицитное состояние самок. Совпадение некоторых
антигенов главного комплекса гистосовместимости может вы-
звать нарушение эмбрионального развития. У свиней в 8,5 %
случаев наблюдается гибель эмбрионов в первые 15—20 дней
после оплодотворения.
Существуют межпородные различия по частоте мертворож-
денных, абортов и трудных отелов (табл. 75, 76). У красного
датского скота процент трудных отелов и мертворожденных зна-
чительно выше, чем у англерского. Однако у первотелок число
трудных отелов и мертворожденных выше, чем у коров. Между
трудными отелами и отходом телят генетическая корреляция
равна 0,66. У голштинских первотелок в США задержка последа
была у 1 % животных, а трудные отелы — у 45 %. У первотелок*
эйрширской породы задержка последа была во много раз выше
(12—22 %), а количество трудных отелов ниже (8—18 %). Для
снижения частоты затрудненных отелов необходимо использо-
вать производителей с низким риском возникновения этого на-
рушения.
334
75. Частота мертворожденных телят и абортов у коров
(по В. Л. Петухову)
Порода Число отелов В том числе Мертворожденные и аборты, %
мертворожденных, % | абортов, %
Бурая латвийская 33687 2,59 0,59 3,18
Черно-пестрая 16029 4,02 1,58 5,60
76. Частота мертворожденных и трудных отелов у некоторых пород
Скандинавских стран и ФРГ (цит. по Дехтяреву и др.)
Порода Первотелки Коровы
Трудные отелы Мертворожденные телята Трудные отелы Мертворожденные телята
Красная датская 15,0 9,1 3,0 3,9
Айрширы финской селекции 6,1 3,5 2,5 2,6
Шведская красно- 2,5 3,4 1,3 2,6
пестрая Англерская 0,7 3,0 0,3 1,9
Установлено, что частота абортов выше у дочерей, матери ко-
торых были предрасположены к абортам. Коэффициенты насле-
дуемости предрасположенности к абортам и мергворождаемости
были в пределах 0—0,08, трудных отелов — 0,04—0,30. Доказано
достоверное влияние генотипов быков на частоту этих признаков.
Пренатальная смертность у овец составляет 5—23 %. Большая
смертность наблюдается у двоен.
Один из методов борьбы с бесплодием — оценка генотипа
производителей по этому показателю и широкое использование
лучших из них.
РОЛЬ НАСЛЕДСТВЕННОСТИ В ПРЕДРАСПОЛОЖЕННОСТИ
К СТРЕССУ
Стресс (напряжение) — состояние организма, возникающее в
ответ на действие сильных раздражителей или различных по-
вреждающих факторов внешней среды (инфекции, интоксика-
ции, температура и т. д.).
Описаны три синдрома стресса у свиней: синдром стресса
(PSS), синдром злокачественной гипертермии (MHS), синдром
мягкого, экссудативного мяса (PSE). Чувствительность к синдро-
му стресса и злокачественной гипертермии может быть выявлена
с помощью галотанового теста. Чувствительность к галотану кон-
тролируется аутосомным рецессивным геном, пенетрантность
которого равна 50—100 %. Этот ген является рецессивным по
стрессоустойчивости и качеству мяса и обладает аддитивным
действием в отношении содержания постного мяса. Чувствитель-
ные к галотану свиньи имеют генотип Haln/n, а нечувствитель-
ные — Hal14/14 или HalN/n. У разных пород частота галотанпози-
335
тивных животных изменяется от 0 до 96 %. У свиней пород
бельгийский ландрас и пьетрен частота чувствительных к стрессу
свиней достигает 93—96 %.
У пород свиней, разводимых в Западной Сибири, частота
галотанположительных животных в некоторых популяциях до-
стигала 60 %. Выявлено изменение пенетрантноси Hal локуса и
экспрессивности у свиней под влиянием различных стресс-фак-
торов внешней среды. Показана наследственная обусловленность
мышечного тремора и реакций свиней на галотановый наркоз
(В. Л. Петухов, В. П. Кузнецов, О. С. Короткевич).
У многих животных, чувствительных к галотану, мясо бледное
и экссудативное, у них хуже воспроизводительная способность и
жизнеспособность. Ставится задача — разработать методы, в ре-
зультате которых можно разорвать нежелательную корреляцию
между более высоким процентом постного мяса у свиней, чувст-
вительных к стресс-синдрому, и низкой воспроизводительной
способностью и более высокой смертностью у этих же животных.
Селекция двух линий свиней породы швейцарский ландрас
(лучшей и худшей) в двух противоположных направлениях по
селекционному индексу, который включал толщину сала на
спине, среднесуточный прирост, трансформацию корма и про-
цент постного мяса, привела к изменению частоты аллелей На1п и
HalN. В VI поколении в лучшей линии положительная реакция на
галотан была у 42 % животных, тогда как в худшей линии таких
особей не выявлено. У свиней положительной линии был выше
процент постного мяса, лучшая скорость роста, но хуже показате-
ли качества мяса (pH и цвет мяса).
Однако в лучшей линии мясо плохого качества, с самым
высоким процентом постного мяса и самая короткая длина туши
были у гомозиготных свиней Halh, Ss, На, PhiB и 6-PGD^. В
худшей линии таких связей не установлено, так как там отсутст-
вовали животные с положительной реакцией на галотан. Сделано
заключение, что селекция свиней с учетом маркерных генов
локуса Hal, систем групп крови Н и S, а также системы Phi и
6-PGD позволит значительно улучшить качество мяса и устойчи-
вость к стресс-синдрому.
Один из показателей стресс-синдрома — симптомы врожден-
ного мышечного тремора, наследуемость которого равна 0,4.
Частота встречаемости симптомов тремора у свиней породы
ландрас составляет 5—18 %, тогда как у животных породы йор-
кшир, гемпшир и дюрок — менее 1 %. Свиньи с симптомами
тремора имеют более высокие среднесуточные приросты и длин-
нее туловище, более постное мясо в сравнении с животными, у
которых симптомы тремора отсутствовали.
Селекция свиней на устойчивость к галотану может увеличить
плодовитость свиноматок на 0,4 поросенка в помете при рожде-
нии и на 0,13 поросенка при отъеме.
336
ВЛИЯНИЕ ФАКТОРОВ СРЕДЫ НА УСТОЙЧИВОСТЬ
К БОЛЕЗНЯМ
Выше были рассмотрены наследственно-средовые болезни.
Соотношение наследственных и средовых факторов в проявлении
этих болезней различно. Неполноценное кормление, высокая и
низкая температура, скученность животных, воздействие радиа-
ции и т. д. ведут к снижению устойчивости организма к болезням.
Нарушение белкового обмена вызывает уменьшение выработки
антител. Недостаток витаминов и микроэлементов также ослабля-
ет защитные силы организма. Однако важен тот факт, что в отли-
чие от признаков продуктивности генетические различия между
линиями и породами по устойчивости к болезням часто сохраня-
ются и в плохих условиях среды, хотя частота заболеваемости
возрастает и у резистентных, и у восприимчивых животных. На-
пример, контрастные по резистентности к гельминтозам породы
н’дама и голтштинская сохраняли генетические различия по
этому признаку и в условиях скудного кормления.
Влияние среды на проявление болезни можно рассмотреть на
примере отвислого зоба у индеек бронзовой породы. Отвислый
зоб возникает у индюшат в возрасте 2—4 мес в результате чрез-
мерного потребления воды в жаркое лето (рис. 67). Необратимое
и прогрессирующее растяжение стенок зоба сопровождается заку-
поркой, брожением и образованием токсинов в этом органе. Мно-
гие птицы погибают от пневмонии. Если развитие индюшат про-
ходит в прохладное лето, то болезнь не проявляется. В одинако-
вых условиях среды отвислость зоба не наблюдается у индеек
других пород. Это указывает на генетическую предрасположен-
ность индеек бронзовой породы к отвисанию зоба.
Популяционно-генетические механизмы взаимодействия хозяи-
на и паразита. Длительная сопряженная эволюция макро- и мик-
роорганизмов приводит к возникновению определенного равно-
весия между популяциями паразита и хозяина. Возникновение
вирулентности в ходе эволюции позволяет паразиту занять по-
стоянную экологическую нишу. Но появление патогенного пара-
зитического вида ведет к отбору представителей вида-хозяина в
направлении развития относительной наследственной устойчи-
вости против паразитического вида.
Холдейн (1949) выдвинул гипотезу, что паразиты могут яв-
ляться мощным фактором отбора, приводящим к возникнове-
нию широко распространенного полиморфизма белков. Он пола-
гал, что особи с некоторыми биохимическими фенотипами
имеют селективное преимущество.
Кларк (1976) также считает, что паразитам принадлежит важ-
ная, если нерешающая роль в поддержании белкового полимор-
физма. Биохимический полиморфизм белков и ферментов, види-
мо, может приводить к изменению физиологических функций
337
ЖАРКОЕ СУХОЕ
ЛЕТО
Рис. 67. Генетически предрасположенность к отвисанию зоба у бронзовых индеек
(по СоПе, 1980)
хозяина и влиять на равновесие факторов взаимодействия между
хозяином и паразитом. Отношение хозяина и паразита, в резуль-
тате которого сохраняется полиморфизм в обеих популяциях,
может быть выражено следующим образом:
Фенотипы паразита
Генотипы хозяина
В1
В2
338
Восприимчивость хозяина на схеме обозначена знаком «+»,
устойчивость — знаком «—».
Сущность взаимодействия популяций паразита и хозяина, ви-
димо, составляют взаимодействия их генотипов, которые осу-
ществляют стабилизацию паразитарных отношений и служат ме-
ханизмами эволюции этих отношений. Однако популяционно-ге-
нетические механизмы взаимодействия между паразитом и
хозяином ввиду их большой сложности изучены недостаточно.
Генетическая резистентность патогенов к лекарствам. Ветери-
нарная фармакогенетика. Ветеринарная фармакогенетика — раз-
дел ветеринарной генетики, изучающей наследственно обуслов-
ленные реакции животных на лекарственные препараты. Суще-
ствуют генетические различия в реакции живых организмов на
лекарственные препараты. Широкое применение антибиотиков и
других лекарств привело к тому, что генетическая резистентность
патогенных бактерий возросла до такой степени, при которой
часто затруднено лечение инфекционных болезней. В Англии
среди изученных штаммов сальмонелл 61 % оказался резистент-
ным к одному или более антибиотикам. В этой стране в 1977 г.
62,6 % штаммов Е. coli, выделенных у крупного рогатого скота,
были резистентными к стрептомицину и 47 % — к тетрациклину,
а у свиней — соответственно 55,5 и 47,1 %.
У скота, павшего от респираторных болезней, выделено брлее
50 % культур пастерелл, устойчивых к сульфаниламидам и стреп-
томицину, а 75 % были нечувствительны к тетрациклину.
На некоторых фермах в Японии во время эпизоотии сальмо-
неллеза у телят выделили до 77 % устойчивых к хлорамфениколу
штаммов сальмонелл, среди которых 85 % были устойчивы к
тетрациклину, стрептомицину и сульфаниламидам. Резистент-
ность полностью передавалась последующим поколениям саль-
монелл.
Во многих странах повышение резистентности к различным
лекарствам обнаружено у гельминтов и клещей. Установлено,
что применение одного препарата ведет к возникновению устой-
чивости клещей к этому препарату в течение 5—10 лет.
Контрольные вопросы. 1. Что такое резистентность? 2. Что такое пороговые
признаки? 3. Что такое простое и полигонное наследование устойчивости к
болезням? 4. Что вы знаете о генетической устойчивости к бактериальным болез-
ням (маститу, бруцеллезу, туберкулезу)? 5. Какие болезни обмена веществ вам
известны? 6. Какие вирусные болезни вы знаете? 7. Какова наследственная
обусловленность устойчивости к лейкозам? 8. Каково влияние породы, линии,
производителей, семейств и матерей на устойчивость к болезням? 9. Какие фак-
торы вызывают бесплодие? 10. Как влияет среда на устойчивость к болезням?
Глава 17
МЕТОДЫ ПРОФИЛАКТИКИ РАСПРОСТРАНЕНИЯ
ГЕНЕТИЧЕСКИХ АНОМАЛИЙ
И ПОВЫШЕНИЯ НАСЛВДСТВЕННОЙ
УСТОЙЧИВОСТИ ЖИВОТНЫХ К БОЛЕЗНЯМ
В основе профилактики аномалий или болезней лежит
устранение причин, их обусловливающих. Причинами гене-
тических аномалий являются мутации главных генов (оли-
гогенов). Следовательно, для профилактики генетических ано-
малий необходимо предотвращать возникновение вредных
мутации в популяциях животных. Снижение частоты инду-
цированных мутаций можно обеспечить путем жесткого кон-
троля за состоянием окружающей среды, устранения контактов
животных и их гамет с мутагенами. Эффективность таких
мероприятий зависит, с одной стороны, от согласованной
деятельности специалистов сельского хозяйства, контролиру-
ющих использование пестицидов, удобрений, других ядохи-
микатов, лекарственных и биологических препаратов; с другой
стороны, от защиты окружающей среды от попадания в
нее вредных отходов промышленного производства, что на-
ходится в компетенции руководителей и специалистов заводов,
фабрик и государств в целом.
Наряду с индуцированными возникают и спонтанные
мутации. За тысячелетия существования животных у них
накоплен определенный груз мутаций, который, находясь в
скрытом гетерозиготном состоянии, передается от предыдущего
в последующие поколения. Часть этого груза теряется благодаря
тому, что не все гетерозиготы остаются для воспроизводства.
Часть потерь восстанавливается за счет новых мутаций.
Такое состояние как бы сбалансированного полиморфизма
по вредным рецессивным мутациям может быть нарушено
при определенной системе разведения животных, когда вместо
незначительного процента выщепления аномальных гомозигот
в популяции регистрируют массовые случаи рождения де-
фектного потомства или наблюдают заметное снижение ус-
тойчивости животных к болезням.
Для того чтобы этого не произошло, требуется постоянный
контроль (мониторинг) за генетической структурой популяции.
Необходимы фиксация в племенных документах (родословных
животных) каждого случая врожденной аномалии в приплоде,
регистрация болезней.
340
УЧЕТ ВРОЖДЕННЫХ АНОМАЛИЙ И БОЛЕЗНЕЙ.
МЕТОДЫ ГЕНЕТИЧЕСКОГО АНАЛИЗА
Ветеринарный врач должен обследовать весь приплод на на-
личие аномалий и регистрировать в журнале каждое дефектное
животное с подробным описанием характера аномалии, пола
индивидуума, даты его рождения, особенностей эмбрионального
развития. Особенно тщательно следует проверить происхождение
этого животного: правильно ли записана мать, соответствует ли
записям отец. Аномальные особи и их родители должны быть
подвергнуты анализу на предмет зараженности вирусами и бак-
териями и по другим параметрам внешней среды, которые могут
быть потенциальной причиной аномалии.
Учет аномального приплода и регистрация его в племенных
карточках родителей служат предпосылкой для проведения гене-
тического анализа с целью выявления роли наследственности в
этиологии аномалий.
Генетический анализ при этом осуществляют в следующей
последовательности:
1) определить происхождение аномальных животных по пле-
менным карточкам;,
2) определить достоверность происхождения по группам
крови и полиморфным системам белков и ферментов;
3) составить родословные на аномальных особей для опреде-
ления типа спаривания родителей (инбридинг, аутбридинг) и
родства между аномальными особями (поиск общих предков);
4) определить тип наследования аномалий (моногенный,
полигенный, аутосомный, сцепленный с полом, доминантный,
рецессивный);
5) изучить кариотип у аномальных особей и их родителей с
целью обнаружения хромосомных и геномных мутаций как при-
чины аномалий;
6) сделать анализ генотипов по аллелям групп крови, моно-
морфным системам ферментов и белков для поиска маркеров
мутации;
7) изучить уровень ферментов и их структуры у аномальных и
нормальных животных для обнаружения фенотипического про-
явления мутантного гена.
В перспективе для выявления носителей мутаций у животных
широко могут использоваться современные методы молекуляр-
ной генетики, генной инженерии и биотехнологии.
На практике наиболее простой и достаточно точный метод
изучения роли наследственности в этиологии аномалий — анализ
родословных, или генеалогии, животных. Наличие общего пред-
ка с одной (доминантность) или с обеих сторон родословной
(рецессивность) указывает на наследственный характер анома-
лии.
341
Генеалогический анализ необходимо подкреплять генетико-
статистическими расчетами случайности или редкости появления
аномалии и т. д. на основе закономерностей популяционной
генетики и биометрии.
В условиях крупномасштабной селекции животных, основным
содержанием которой прежде всего является интенсивное ис-
пользование отдельных производителей благодаря методу искус-
ственного осеменения, накоплению миллионов доз семени и
возможности длительного хранения его в замороженном состоя-
нии, необходима проверка генотипа каждого из производителей
не только по продуктивным признакам, но и на гетерозиготное
носительство вредных рецессивных генов. Это можно осущест-
вить следующими методами:
1) спариванием проверяемого производителя с аномальными
самками (анализирующее скрещивание);
2) спариванием проверяемого производителя с самками, о
которых известно, что они являются гетерозиготными носителя-
ми мутантного гена;
3) спариванием проверяемого производителя с собственными
дочерями (инцест-тест);
4) спариванием с дочерями известных гетерозиготных произ-
водителей;
5) спариванием производителя с самками неизвестного гено-
типа.
В условиях производства использование первых четырех мето-
дов целесообразно лишь в определенных ситуациях. Например,
анализирующее скрещивание можно допустить для проверки
хряков на носительство рецессивного гена кратерности сосков.
В большинстве случаев гомозиготные носители мутантных
генов — это нежизнеспособные аномальные особи. Экономичес-
ки невыгодно и трудно формировать гетерозиготное маточное
поголовье. Делать это имеет смысл в условиях широкого распро-
странения в породе той или иной аномалии. Тогда гетерозигот-
ные самки будут тем ситом, через которое просеиваются нор-
мальные производители, а остаются в нем, т. е. выявляются как
гетерозиготные, остальные производители.
Третий метод позволяет проверять производителей сразу на
все возможные мутации, поскольку сходство между генотипами
прямых родственников более полное, чем с остальной частью
популяции.
Применяют инцест-тест, исходя из нескольких предпосылок,
которые снижают практическое значение получаемых результа-
тов: проверяют на аномалии с монотонным аутосомным рецес-
сивным типом наследования и пренебрегают при этом анома-
лиями со сложным характером наследования, неполной пенет-
рантностью и экспрессивностью, а также фенокопиями. Для
получения достоверных результатов при спаривании отец — дочь
342
необходимо получить не менее 35 потомков, а при проверке на
известных гетерозиготных или гомозиготных носительницах
число животных меньше (табл. 77).
77. Количество нормального потомства при разных типах спаривания,
необходимое для проверки гетерозиготного носительства у животных
одноплодных видов
Тип спаривания Число нормального потомства, необходимое для проверки на уровне достоверности
95 % I 99 % | 99,9 %
Дочери 22 35 52
Гетерозиготные самки 10 16 24
Гомозиготные самки 5 7 10
Принято считать, что каждая гамета обладает 3—5 летальными
эквивалентами на каждую зиготу. Летальный эквивалент — это
один мутант, со 100%-ной вероятностью ведущий к смерти, и
т. д. Следуя этой предпосылке, полагают, что при инцест-тесте
трудно найти производителя, от спаривания с которым не на-
блюдали бы аномальных потомков. Однако Лесли приводит при-
мер, опровергающий это положение. Спермой быка Сэма 951
(порода шароле) осеменено более 200 дочерей. В приплоде не
было обнаружено каких-либо рецессивных дефектов. Сотрудни-
ки ВИЖа осуществили проверку на гетерозиготное носительство
вредных рецессивных генов одного из лидеров голштинской по-
роды, быка Мастера 0001 путем спаривания его с собственными
дочерями. Весь приплод был нормальным.
Четвертый метод проверки аналогичен второму, с тем лишь
различием, что частота гетерозигот здесь при прочих равных
условиях наполовину ниже и что для достоверной проверки по-
требуется соответственно вдвое большее количество самок.
Все четыре рассмотренных метода проверки в широкой прак-
тике не применяют, так как это связано с определенными эко-
номическими затратами, потерей продуктивности, а при инцест-
тесте и с возможной инбредной депрессией у потомства.
Однако в некоторых случаях, например при использовании
импортных производителей из тех стран, где в данной породе
распространена та или иная аномалия, желательно проверить их
генотип в родственных спариваниях.
Применение инбридинга в племенных хозяйствах для получе-
ния производителей и маток с консолидированной наследствен-
ностью — более высокой гомозиготностью по нормальным доми-
нантным генам — позволяет, как отмечалось раньше, выявлять и
гетерозиготных носителей вредных рецессивных генов.
Если в приплоде производителя, полученном от инбридинга,
будет зарегистрировано рождение хотя бы одного аномального
потомка, такого производителя необходимо взять на учет и целе-
343
сообразно проверить, является ли данная аномалия экзогенной
природы или генетической. Для этого можно воспользоваться
одним из четырех рассмотренных выше методов.-Выявление про-
изводителей — гетерозиготных носителей рецессивных генных
мутаций позволяет избежать распространения аномалий в товар-
ных стадах при интенсивном использовании их посредством ис-
кусственного осеменения.
Важное значение в деле профилактики генетических анома-
лий будет иметь разработка методов выявления гетерозиготных
животных в самом раннем возрасте по определенным тестам или
маркерам. Маркерами мутаций могут быть определенные типы
белков и ферментов. Как известно, для последних характерно
многообразие вариантов, полиморфизм, обусловленный мута-
циями. Однако имеется и группа ферментов, которые при
электрофорезе обычно не разделяются на фракции, т. е. являют-
ся мономорфными. Ученые (Н. П. Дубинин, Ю. П. Алтухов и
др.) считают, что мутации, возникающие у животных, можно
выявить»^ этой системе ферментов.
В результате исследований, например, обнаружена связь между
частотой редких вариантов эстераз и аномалиями развития.
У животных, в частности у крупного рогатого скота, гетерози-
готных носителей таких наследственных дефектов обмена веществ,
как маннозидоз, паракератоз, порфирия, выявляют путем опреде-
ления уровня активности соответственно фермента маннозидазы,
цинка в сыворотке крови и пропорфирина в эритроцитах. Гетеро-
зиготные животные (Аа) по этим показателям занимают промежу-
точное положение между нормальными (АА) и аномальными (аа).
Важное значение для профилактики распространения генети-
ческих аномалий имеет цитогенетический анализ. Он позволяет
выявлять как числовые, так и структурные мутации кариотипа,
снижающие жизнеспособность, плодовитость, продуктивность и
племенную ценность животных.
Эффективная профилактика вредных последствий хромосом-
ных и геномных мутаций может быть обеспечена отбором на
станциях по искусственному осеменению производителей без на-
рушений в кариотипе. Впервые такая работа в нашей стране
начата в Ленинградской области кафедрой животноводства и
проблемной лабораторией ветеринарной генетики Ленинградско-
го ветеринарного института.
В результате наших исследований обнаружено распростране-
ние транслокации 1/29 хромосом у быков на племпредприятиях
Нечерноземной зоны России. Выбраковка этих производителей
или их спермы — способ’профилактики дальнейшего увеличения
частоты транслокаций в породе, метод повышения выхода телят,
производства мяса и молока в хозяйствах.
Цитогенетическая аттестация производителей и маток — мате-
рей ремонтных животных необходима и у других видов, где
344
используют искусственное осеменение. Например, в свиноводст-
ве установлено распространение разных вариантов транслока-
ций, резко понижающих плодовитость свиней.
Интенсификация животноводства, внедрение в практику
крупномасштабной селекции, главным звеном которой является
возрастание нагрузки на каждого производителя, используемого
в воспроизводстве, а также потенциальная опасность увеличения
давления на генетический аппарат животных мутагенных факто-
ров ставят в ряд актуальных проблем организацию службы гене-
тического мониторинга — контроля за частотой вредных мутаций
в популяциях и породах.
Основные принципы такого контроля рассмотрены в начале
настоящей главы. Это учет и правильная классификация анома-
лий, определение роли наследственности в их этиологии, исполь-
зование цитогенетических и биохимических маркеров. Создание
специальных карточек аномальных животных — носителей хро-
мосомных мутаций в зоне деятельности районных и областных
ветеринарных станций, племпредприятий, селекционных цент-
ров — исходные данные для контроля за частотой вредных мута-
ций, на основании которых можно проводить эффективный
отбор — селекцию, направленную на снижение частоты рождения
аномальных особей, повышение уровня воспроизводительной
функции, жизнеспособности и продуктивности животных.
Селекция на снижение частоты аномалий в популяциях живот-
ных может быть весьма эффективной. Так, шведские фермеры стали
проводить жесткий отбор коров и быков по признаку гипоплазии
гонад. В результате частота этой аномалии снизилась с 28,1 % в
1937 г. до 7 % в конце 60-х годов. В наших исследованиях показано,
что выбраковка быка Красавчика 4874 красной горбатовской поро-
ды и быка Жетона 3501 костромской породы позволила избежать
дальнейшего распространения в первом случае врожденной слепоты
и во втором — мопсовидности. По данным И. Густавссона, выбра-
ковка быков — носителей транслокации 1/29 хромосом в красно-пе-
строй шведской породе позволила за 2,5 года повысить выход телят
на пять голов в расчете на 100 коров.
В ряде стран проводится анализ кариотипов хряков на реци-'
прокные транслокации. Носителей аберраций выбраковывают.
Интересная практическая реализация проблемы преодоления
признака летальности у серых каракульских овец предложена
монгольским ученым Думаажавом Баатаром (1982). Автор экспе-
риментально доказал, что при скрещивании серых каракульских
овец с серыми аборигенными монгольскими потомство не забо-
левает хроническим тимпанитом и обладает хорошими жизне-
способностью и плодовитостью. Таким образом, становится пер-
спективной разработка генетического метода получения гомози-
готных серых баранов с целью повышения производства серых
смушек на товарных фермах.
345
ПОВЫШЕНИЕ НАСЛЕДСТВЕННОЙ УСТОЙЧИВОСТИ
ЖИВОТНЫХ К БОЛЕЗНЯМ
л
Болезни наносят животноводству огромный ущерб. В разных
странах и районах удельный вес тех или иных болезней различен.
Так, из 267 тыс. больных коров в Норвегии маститом заболело
33,5 %, кетозом — 21, молочной лихорадкой — 11,6, задержка
последа отмечена у 4,5 % животных, тихая течка — у 3, киста
яичников — у 2,5, метриты — у 2,2, расстройство пищеварения —
у 1,8, ламиниты — у 1 % коров и т. д. Из всех коров ежегодно
выявляется: больных маститом — 18 %, кетозом — 11,2 и молоч-
ной лихорадкой — 6,5 %.
Данные о заболеваемости коров голштинской породы в 32
стадах США свидетельствуют о большом удельном весе мастита
и болезней, влияющих на воспроизводительную способность жи-
вотных. Кроме прямого ущерба, наносимого животноводству
вследствие снижения продуктивности, увеличения затрат на ле-
чение, обслуживание животных и т. д., болезни значительно
снижают темпы генетического прогресса при селекции. Поэтому
наряду с ветеринарными мерами борьбы с болезнями необходи-
мо разрабатывать и внедрять генетические методы повышения
устойчивости животных разных видов к заболеваниям. В связи с
этим верна мысль Н. И. Вавилова о том, что среди мер защиты
растений от разнообразных заболеваний, вызываемых паразити-
ческими грибами, бактериями, вирусами, а также различными
насекомыми, наиболее радикальным средством борьбы являются
введение в культуру иммунных сортов или создание таковых
путем скрещивания.
Однако селекция животных на резистентность к болезням
затрудняется рядом факторов:
1) сложной генетической обусловленностью устойчивости;
2) сложной генетической природой самих макро- и в меньшей
степени микроорганизмов и сложными взаимоотношениями
между ними;
3) невозможностью широкого использования заражения (как
у растений) для выявления резистентных и восприимчивых ин-
дивидуумов;
4) отсутствием надежных косвенных критериев (генетических
и биохимических маркеров) устойчивости или восприимчивости;
5) быстрой изменчивостью патогенов и возникновением
новых резистентных штаммов, преодолевающих устойчивость
животных;
6) часто большим интервалом между поколениями и необхо-
димостью длительной селекции;
7) невозможностью использования индуцированного мутаге-
неза;
346
8) наличием в некоторых случаях отрицательной корреляции
между устойчивостью и признаками продуктивности.
Установлено, что генетическая устойчивость к одному виду
патогенов не сопровождается резистентностью к другим видам.
Однако не выяснено существование отрицательной связи между
устойчивостью к разным болезням. Остается открытым вопрос:
может ли селекция на резистентность к одному заболеванию
привести к увеличению восприимчивости к другому?
Изменчивость паразитов усложняет выполнение селекцион-
ных программ, направленных на повышение устойчивости. В
растениеводстве известно много примеров, когда сорта с хоро-
шей устойчивостью, например к стеблевой ржавчине, впоследст-
вии сильно поражались новой расой гриба-возбудителя. Это вы-
зывает необходимость снова проводить селекцию на резистент-
ность. Тем не менее известны примеры длительной
устойчивости. Так, сорт яблони Северный разведчик оставался
устойчивым против кровяной тли более 100 лет и только недавно
был поражен новым биотипом кровяной тли в Австралии.
Подобная длительная устойчивость возможна и у животных. В
исходной популяции мышей-альбиносов внутрибрюшинное вве-
дение 1 • 107 клеток сальмонелл приводило к гибели почти всех
животных через 7—8 дней. Отбор мышей в течение 11 поколений
резко повысил устойчивость к сальмонеллам. Прежняя летальная
доза вызывала гибель только 40 % животных к 20-му дню. После
прекращения отбора достигнутая устойчивость сохранялась в те-
чение 63 поколений. Эти эксперименты указывают на возмож-
ность создания и поддержания длительной устойчивости к болез-
ням и у сельскохозяйственных животных.
ОЦЕНКА ГЕНОФОНДА ПОРОД
Оценка генофонда пород по устойчивости к десяткам и сотням
различных заболеваний — важная задача. Однако довольно полная
такая оценка, видимо, не проведена ни по одной породе. Тем не
менее известны многочисленные примеры породной устойчивости к
различным болезням. Эта устойчивость возникла в результате есте-
ственного отбора, так как целенаправленная селекция по этому при-
знаку в масштабе породы до настоящего времени практически не
проводилась. Знание генофонда пород позволяет более эффективно
их использовать в реализации селекционных программ.
Местный зебувидный скот Индии более резистентен
к чуме крупного рогатого скота, ящуру и сибирской язве, чем
британские породы. Зебу обладает комплексной устойчивостью к
ящуру, пироплазмидозам и некоторым болезням органов пище-
варения и дыхания.
Скот породы н’д а м а — один из наиболее устойчивых к пи-
роплазмозу. Поскольку пироплазмоз представляет серьезную
347
проблему для многих стран Африки, то породу н’дама планиру-
ют использовать для повышения устойчивости скота к этому
заболеванию. Скот породы н’дама во много раз-меньше поража-
ется трипаносомозом и анаплазмозом по сравнению со швица-
ми, голштинами и скотом других пород. Он более устойчив
также к нематодам семейства Trichostrongylidae (табл. 78).
78. Устойчивость скота разных пород к трипаносомозу, тейлериозу,
анаплазмозу и нематодам (по Алова)
Порода Трипаносомоз, тейлериоз, анаплазмоз Число
ЧИСЛО животных % бальных ЖИВОТНЫХ яиц стронгилид в 1 г фекалий у 3—12-месячных телят
Н’дама 30 6,6 19 16
Белый фулани 66 25,6 29 130
Швицкая 23 60,5 18 181
Голштинская 18 67,7 15 950
Н’дама х швицкая 4 24 37,3 9 0
Однако порода н’дама очень восприимчива к чуме крупного
рогатого скота. Поэтому животные этой породы были сильно
поражены в XIX в. во время пандемии чумы крупного рогатого
скота. Это один из примеров того, когда высокая устойчивость
породы или линии, к одной болезни сочетается с сильной вос-
приимчивостью к другой.
Можно привести еще один пример. Так, резистентная к лей-
козу линия кур породы белый леггорн (8,7 %) была восприимчи-
ва к моноцитозу (увеличение количества лимфоцитов в крови), а
восприимчивая к лейкозу линия (65 %) устойчива к моноцитозу
(табл. 79).
79. Устойчивость кур разных линий к лейкозу и моноцитозу (по Hatt)
Линия Смертность, %
Лейкоз | Моноцитоз
К-резистентная к лейкозу 6,5 1,0
С-резистентная к лейкозу 8,7 7,4
Восприимчивая к лейкозу 65,0 0
Выявлены большие различия в частоте актиномикоза челюсти
у животных разных пород: от 0,56 % у швицкого скота до 5,96 %
у гернсейского.
В Индии у крупного рогатого скота назальный шистосомоз
регистрируется в 20 раз чаще, чем у буйволов. Домашний водя-
ной буйвол и желтый скот о-ва Тайвань устойчивы к туберкуле-
зу, бруцеллезу, анаплазмозу и гриппу. Водяной буйвол устойчив
также к чуме крупного рогатого скота.
Западноафриканские аборигенные овцы относительно устой-
348
чивы к анаплазмозу и бабезиозу. Летняя экзема реже встречается
у овец бурула, чем у овец ромни-марш.
У лошадей известны межпородные различия по сальмонелле-
зу. Лошади исландской породы отличаются высокой чувстви-
тельностью к летней экземе.
Собаки боксеры, терьеры, эрдельтерьеры и бульдоги очень
устойчивы к чуме, тогда как немецкие овчарки, ньюфаундленды,
борзые и мопсы заболевают легко.
Таким образом, всесторонняя оценка генофонда пород позво-
ляет выявить их устойчивость и восприимчивость к различным
болезням.
НАСЛЕДУЕМОСТЬ И ПОВТОРЯЕМОСТЬ УСТОЙЧИВОСТИ
К ЗАБОЛЕВАНИЯМ
Знание доли генетической изменчивости в общей изменчи-
вости необходимо для выбора плана селекции на устойчивость к
заболеваниям. Генетическое разнообразие устойчивости к лейко-
зу, маститу, атрофическому риниту, остеохондрозу, болезни Ма-
река и другим болезням в некоторых стадах наряду с отбором
семейств и производителей достаточно для проведения массового
отбора на повышение резистентности к этим болезням (табл. 80).
Однако массовый отбор не дает эффекта при снижении беспло-
дия и пренатальной смертности у скота, смертности у кур и т. д.
вследствие малого генетического разнообразия этих признаков и
сильного влияния многочисленных факторов среды.
Для селекционера важно также изучение повторяемости в ге-
нетической взаимосвязи признаков. Коэффициент повторяемос-
ти (в течение нескольких лактаций) кетоза равен 0,50, мастита —
0,36, родильного пареза — 0,37. Генетическая корреляция между
трудными отелами у первотелок и взрослых коров довольно вы-
сокая и колеблется в пределах 0,5—0,94. Отрицательная высокая
генетическая корреляция существует между легкостью отелов у
коров и выживаемостью телят (—0,8). Коэффициент генетичес-
кой корреляции между содержанием иммуноглобулинов Gi, G2,
М и А колеблется от 0,5 до 0,9. Изучение корреляций необходи-
мо при поиске критериев отбора на резистентность. Так, у овец
между количеством яиц гемонхов и оценкой гематокрита коэф-
фициент корреляции равен 0,52. Высокая связь выявлена у кур
между иммунным ответом к ньюкаслской болезни и иммунным
ответом к Е. coli (г = 0,77).
80. Коэффициент наследуемости устойчивости (%) к некоторым болезням
Признак I h2 | Признак I h2
Крупный рогатый скот
Мастит 5—40 Кетоз 2—25
Лейкоз 5—58 Бруцеллез 19
349
Продолжение
Признак | 1 h2 | Признаю 1 h2
Восприимчивость к раку глаз 30 Родильный парез 10
Устойчивость к клещам 28-49 Тимпания 10
Интактная акросома 40 Болезни конечностей 13
Анормальные формы сперми- Частичная аплазия толстой 9
ев: КИШКИ
первичные 81 Гипокальциемия 6-10
вторичные 31 Общее нарушение здоровья:
Киста яичников 16-43 по 1-й лактации 2
Задержка последа 38 по 2-й » 11
Среднее число гельминтов 31 по 4-й » 26
Туберкулез 8-30 Бесплодие 0,0-10
Инфекционный конъюнктивит 25 Аборты 0-8
Клинический кетоз 31 Пренатальная смертность 4
Трудные отелы 14-30 Жизнеспособность телят 1
Свиньи
Атрофический ринит 13-60 Пневмония 4-14
Остеохондроз Мышечнш тремор 40 40 Плеврит Слабость ног 13 10
Лептоспироз 20
Овцы
Повреждение печени 60 Остеохондрит 40
Степень стирания зубов 46 Гемонхоз 30-44
Устойчивость к лицевой экземе 42 Шелудивость 20-40
Устойчивость к нематодам 40 Резистентность к холоду 30
Куры
Болезнь Марека 14-61 Ньюкаслская болезнь 7-77
Дегенеративная миопатия 48 Смертность к 6—10-й неделе 2
Саркома Рауса 28 Смертность взрослой птицы 0-9
Эймериоз (кокцидоз) 28
МАССОВЫЙ ОТБОР НА РЕЗИСТЕНТНОСТЬ
Генетический эффект (селекционный сдвиг) зависит от коэф-
фициента наследуемости, интенсивности отбора и интервала
между поколениями. Поэтому массовый отбор на устойчивость к
болезням, которые имеют низкую наследуемость, неэффективен.
Низкий относительный эффект массовой селекции получают и
при низкой частоте заболеваемости животных в стаде.
Д. В. Карликов (1984) приводит данные, что при частоте за-
болеваемости около 10 % и коэффициенте наследуемости по
нормальной шкале, равном 50 % (0,5), генетический эффект при
массовом отборе (выбраковка всех больных животных) не превы-
шает 2 % на одно поколение; при частоте заболевания 5 % гене-
тический эффект равен 0,5 % (заболеваемость потомства от ото-
бранных здоровых родителей составит 4,5 %). Если общая забо-
леваемость в стаде ниже 2 %, то эффект селекции за поколение
составит только 0,07 % (заболеваемость потомства будет 1,93 %).
При заболеваемости, например, лейкозом 30 % животных от
всего поголовья можно путем выбраковки больных коров и всех
их потомков за два поколения снизить пораженность до 8—10 %.
350
Эффективность селекции можно повысить путем использова-
ния отбора по косвенным признакам, которые коррелируют с
резистентностью.
КОМПЛЕКСНАЯ ОЦЕНКА ГЕНОФОНДА СЕМЕЙСТВ,
ЛИНИЙ И ПОТОМСТВА ПРОИЗВОДИТЕЛЕЙ
Массовый отбор, отбор семейств и оценка производителей —
прямая селекция на устойчивость к болезням. При низких значе-
ниях h2 устойчивости к тем или иным заболеваниям необходимы
отбор семейств и оценка производителей по резистентности по-
томства.
Комплексная оценка генофонда семейств
включает признаки продуктивности, длительность продуктивного
использования, устойчивость к десяткам различных болезней и
распространение наследственных аномалий в семействе.
Здоровые особи из двух семейств могут иметь разные
генотипы по устойчивости к болезням. Частота заболеваемости
животных семейства в сравнении со средней по стаду может
служить характеристикой среднего генотипа семейства и с
определенной вероятностью характеризует генотип каждой
особи этого семейства. Поэтому только о здоровых животных
из устойчивых семейств с большей вероятностью можно
сказать, что они обладают резистентностью. Если в отношении
каждого отдельного животного это заключение может быть
ошибочным, то в общем оценка всех особей этих семейств
окажется правильной.
Комплексная оценка позволяет выявить семейства с высокой
продуктивностью, крепкой конституцией, комплексной резис-
тентностью к нескольким болезням, стрессоустойчивостью, с
низким генетическим грузом, характеризующиеся длительностью
хозяйственного использования и спокойным нравом. Селекция
должна быть направлена на создание таких семейств. Матери
будущих производителей и продолжателей линий должны, как
правило, происходить из таких семейств. Коровы-доноры для
трансплантации эмбрионов должны также отбираться из этих
семейств, а к ним следует подбирать производителей-улучшате-
лей с комплексной устойчивостью к заболеваниям и проверен-
ных на носительство вредных рецессивных генов и хромосомных
нарушений.
В результате комплексной оценки генофонда семейств уста-
новлено, что, например, животные семейства № 2866 отличались
высокой продуктивностью, резистентностью к лейкозу, туберку-
лезу, отсутствием пренатальной смертности, наследственных
аномалий, долголетием и продолжительностью продуктивного
использования (табл. 81).
351
81. Комплексная оценка генофонда некоторых семейств (по В. Л. Петухову)
Номер родона- чальницы Число живот- ных Лейкоз, % Тубер- кулез, % Бру- целлез, % Всего больных, % Пренатальная смертность телят, % Долголетие, лет
3734 25 44,0 63,6 36,4 73,1 6,0 5,8
4374 14 28,5 37,5 30,0 71,4 14,3 6,1
2866 13 0 11,1 22,2 23,1 0 8,6
121 14 7,1 0 0 7,1 8,7 9,5
Нежелательно разведение таких семейств, как № 3734, особи
которого были восприимчивы к лейкозу (44 %) и туберкулезу
(63,о %), не отличались долголетием и имели среднюю продук-
тивность.
При комплексной оценке генотипа производи-
телей и генофонда линий необходимо учитывать: при-
знаки тфодуктивности; устойчивость и восприимчивость к десят-
кам болезней; длительность продуктивного использования и
общее здоровое потомство; носительство вредных рецессивных, а
также доминантных генов, проявляющихся в старшем возрасте;
стрессоустойчивость; хромосомные нарушения; способность на-
капливать или выводить из организма тяжелые металлы и другие
вредные вещества; иммунный ответ и клеточный иммунитет к
различным антигенам и т. д. Несомненно, в потомстве почти
любого производителя могут быть обнаружены нежелательные
признаки. Поскольку «полезные» гены сцеплены с «вредными»,
то возможно негативное плейотропное действие полезных генов
и т. д. Однако, зная всестороннюю характеристику генотипа
производителей, можно выбрать тех, у которых сочетание цен-
ных качеств наиболее благоприятно, а также использовать эту
более полную информацию при разработке программы селекции.
ПОКАЗАТЕЛИ ОТБОРА ПРИ СЕЛЕКЦИИ
НА УСТОЙЧИВОСТЬ К БОЛЕЗНЯМ
Для обеспечения селекции на устойчивость нужно выявлять
резистентных и восприимчивых особей. Без искусственного за-
ражения можно дифференцировать родственные группы и от-
дельных животных по устойчивости и восприимчивости к масти-
ту, лейкозу и другим болезням, потому что естественное зараже-
ние животных трудно исключить.
Устойчивость к туберкулезу, бруцеллезу, лептоспирозу и дру-
гим болезням можно определить только в неблагополучных по
заболеваемости стадах. Следует помнить, что по фенотипу от-
дельных животных трудно определить наследственную устойчи-
вость или восприимчивость из-за сложной генетической обу-
словленности этих признаков и влияния факторов среды,. Часто-
352
та заболеваемости животных в родственной группе в сравнении
со средней по стаду или по другим родственным группам может
быть критерием резистентности или восприимчивости. Поэтому
кроме массового отбора используют оценку семейств и генотипа
производителей по устойчивости и восприимчивости потомства
к болезням.
Для выявления устойчивости и восприимчивости проводят ис-
кусственное заражение животных клещами, гельминтами и т. д.
В Австралии устойчивость скота к клещам оценивают путем
надевания ошейника с 20 тыс. личинок и подсчета числа клещей
после определенного промежутка времени. Устойчивость оцени-
вают также путем подсчета клещей на определенной площади
(один или несколько участков) поверхности тела животных.
В качестве оценки устойчивости и восприимчивости к нема-
тодам предлагают использовать число яиц в 1 г фекалий, число
гельминтов, скорость выведения гельминтов, а также длину гель-
минтов (у резистентных животных гельминты короче). В качест-
ве дополнительной оценки можно привлекать уровень антител в
сыворотке крови.
Резистентность к туберкулезу, например, семейств кроликов
можно оценивать после введения стандартной дозы возбудителя
по продолжительности жизни и среднему числу возбудителей,
необходимых для образования одного бугорка.
Резистентность свиней к бруцеллезу можно определить после
искусственного заражения с помощью реакции агглютинации.
Отсутствие реакции агглютинации указывает на резистентность,
а наличие — на чувствительность к бруцеллезу.
Косвенные признаки могут быть показателями отбора на ре-
зистентность. Титр антител может быть одним из признаков,
селекция по которому позволяет повысить устойчивость к неко-
торым заболеваниям. Устойчивость к синдрому стресса у свиней
выявляют с помощью галотанового (фторотанового) теста.
К сожалению, для большинства болезней пока неизвестны
надежные показатели, по которым возможна успешная селекция
на резистентность, не требующая больших затрат.
СЕЛЕКЦИЯ ЖИВОТНЫХ
НА УСТОЙЧИВОСТЬ К БОЛЕЗНЯМ
В опытах на мышах и крысах была показана возможность
селекции на резистентность к различным болезням. Выведены
мыши, устойчивые к лейкозу, сальмонеллам и т. д. Созданы
линии со 100%-ной устойчивостью к возбудителю желтой лихо-
радки и линии со 100%-ной восприимчивостью. Следует обра-
тить внимание на тот факт, что достигнутая в результате отбора
резистентность может длительно сохраняться. Например, воз-
никшая во время эпидемии в Бомбее (Индия) устойчивость крыс
353
к возбудителю чумы оставалась высокой с 1931 по 1959 г., хотя
эпидемия чумы в Бомбее в этот период отсутствовала. У сельско-
хозяйственных животных высокая резистентность может поддер-
живаться путем отбора и подбора. Например, при спаривании
резистентных к лептоспирозу свиноматок и хряков заболевае-
мость потомства в 30 раз меньше, чем при подборе восприимчи-
вых родителей.
Большим достижением в подходе к проблеме селекции на
устойчивость к болезням является картирование у мышей генов
резистентности. Имеются данные о локализации в хромосомах
мышей некоторых генов, обусловливающих резистентность. Ген
Lsh, контролирующий рост Leishmania donovani внутри печени и
селезенки, расположен в проксимальном конце 1-й хромосомы.
Локус Ric контролирует летальную инфекцию, вызванную Reck-
ettsia tsutsugamushi, расположен в средней части 5-й хромосомы и
тесно сцеплен с геном деградации сетчатки глаз (rd). Локус Ity,
контролирующий резистентность к летальной инфекции, вызы-
ваемой Salmonella typhimurium, расположен в 1-й хромосоме
рядом с локусом Lsh. Чувствительность к Leishmania tropica у
мышей кодируется одним аутосомным доминантным геном. Эти
примеры свидетельствуют о возможности открытия некоторых
генов резистентности и у сельскохозяйственных животных.
Селекция скота на устойчивость к клещам и жаре. Первый и
пока единственный пример успешной селекции крупного рогато-
го скота на устойчивость к клещам и жаре — выведенная в тече-
ние 25-летней работы новая порода для тропиков австралийский
молочный зебу. Ее создание было продиктовано необходимостью
выведения скота, устойчивого к паразитам и условиям тропиков,
как зебу, и высокопродуктивного, как европейские породы, кото-
рые в условиях тропиков не могли быть высокопродуктивными.
Новая порода получена путем скрещивания зебу с европей-
скими породами и несет около 20—40 % крови зебу. Животные
породы отличаются выносливостью, крепостью, устойчивостью к
жаре и клещам, а продуктивность находится на уровне сверстниц
европейских пород.
На первом этапе создания австралийского молочного зебу
скрещивали джерсейских коров с быками породы скота В. in-
dicus (красный синдхи и сахивал).
На втором этапе (с 1962 г.) коров различных европейских
пород осеменяли спермой быков, полученных от высокопродук-
тивных коров с 50 % крови В. indicus. С 1964 г. ввели дополни-
тельно два селекционируемых признака. При селекции скота
оценку на устойчивость к жаре проводили в помещении с регули-
руемым климатом. В последующем испытания в таком помеще-
нии показали, что в течение месячного стрессового периода при
температуре 36 °C удой фризских коров упал на 30 %, а австра-
лийского зебу при температуре 40 °C — меньше чем на 5 %.
354
Для проверки на устойчивость к клещам каждому быку с
месячным интервалом надевали ошейник, содержащий 40 тыс.
личинок клещей. Перед созреванием самок клещей быков каж-
дое утро загоняли в помещение и подсчитывали насосавшихся
клещей. Быков с меньшим числом клещей проверяли по качест-
ву потомства. Использование только резистентных быков позво-
лило ежегодно улучшать резистентность к клещам на 2 %. Уста-
новлено, что быки с 1/4 крови зебу имели такую же устойчи-
вость к клещам, как и чистопородные зебу.
На третьем этапе (с 1968 г.) сперму быков, проверенных по
качеству потомства по селекционируемым признакам, использо-
вали в кооперативных стадах.
В настоящее время австралийский молочный зебу — единст-
венная в мире порода скота, которую селекционируют по молоч-
ной продуктивности, устойчивости к жаре, клещам.
Селекция на устойчивость к гельминтам. Гельминтозы травояд-
ных и птиц, вызываемые нематодами рода Trichostrongylus, пара-
зитирующими в сычуге и тонких кишках, называются трихос-
тронгилезами. Возможность селекции на устойчивость к трихос-
тронгилезам была доказана на модельном объекте — морских
свинках. Аутбредные морские свинки различаются по индивиду-
альной чувствительности к нематодам Trichostrongylus columbri-
formis. Каждое животное инвазировали 2000 личинок и вели
селекцию на устойчивость и восприимчивость в течение пяти
поколений. Резистентность определяли по относительной плодо-
витости гельминтов (число яиц в 1 г кала, умноженное на число
дней). У животных исходной популяции средняя относительная
плодовитость гельминтов была около 6350 яиц. Селекция оказа-
лась успешной (табл. 82). В V поколении у резистентной линии
было только 60 яиц, а у восприимчивой — 15 830. Резистент-
ность проявлялась малым числом гельминтов и более ранним их
изгнанием из организма.
82. Селекция морских свинок на устойчивость и чувствительность
к Т. columbriformls (по Rothwell)
Поколение Линия Относительная плодовитость гельминтов
Отцы | Матери | Потомство
I Резистентная (R) 120 300 330
Восприимчивая (S) 13800 17620 2070
II R 0 800 440
S 46200 8200 6650
III R 80 * 50 2910
S 204140 10570 33860
IV R 2910 260 150
S 38870 41390 13440
V R 80 240 60
S 3360 16320 15830
355
В восприимчивой линии в III и IV поколениях изгнание
гельминтов происходило на 14 и 21 день позже, чем в резистент-
ной линии. Показана роль иммунной системы в определении
устойчивости к гельминтам. После тимэктомии и обработки
антилимфоцитарной сывороткой в двух линиях наблюдалась по-
вышенная восприимчивость к гельминтам.
Выдвинуто предположение о том, что быстрый прогресс в
селекции морских свинок на восприимчивость к инвазии свиде-
тельствует о контролировании иммунных механизмов освобожде-
ния от гельминтов доминантными генами.
В опытах на мышах также показано, что высокая устойчи-
вость к Т. muris (более быстрое освобождение от гельминтов)
наследуется как доминантный признак. При этом самая устойчи-
вая линия мышей реагирует на более низкий порог инвазии. Это
говорит о том, что контроль уровня инвазии, при котором узна-
ется антиген, генетически обусловлен. Эти данные указывают на
воздержность селекции сельскохозяйственных животных на ус-
тойчивость к гельминтам.
Селекция кур на устойчивость к пуллорозу. В птицеводстве
большой экономический ущерб приносит пуллороз (тиф). Эта
инфекционная болезнь куриных, вызываемая бактериями Salmo-
nella pullorum, характеризуется поражением кишечника, паренхи-
матозных органов у молодняка и яичников у взрослой птицы.
Робертс и Кард (1935) в течение 4 лет проводили селекцию на
резистентность к пуллорозу путем искусственного заражения кур
двух линий породы белый леггорн. В селекционируемых линиях
выживаемость после заражения стандартной дозой возбудителя
была 61 и 70 %, а в контроле — 28 %. В линии, селекционируе-
мой 9 лет, выживаемость цыплят после заражения стандартной
дозой возросла до 74 %.
Селекция на резистентность возможна без заражения живот-
ных, если известны косвенные признаки (маркеры), указываю-
щие на устойчивость или восприимчивость животных к болезни.
Ф. Хатт с сотр. показали эффективность непрямой селекции кур
на устойчивость к пуллорозу. Устойчивость связана со скоростью
повышения температуры тела цыплят с 38,9 °C (при вылупле-
нии) до температуры тела взрослой птицы 41—42 °C (в возрасте
10 дней). Наиболее устойчивы цыплята, у которых температура
тела повышается быстро.
Предполагают, что повышение температуры тела ускоряет об-
разование антител. У цыплят породы белый леггорн температура
тела повышается более быстро, чем у плимутроков и род-айлан-
дов. Этот критерий был использован для создания двух линий. В
течение двух поколений одну линию селекционировали на бы-
строе, а другую — на медленное повышение температуры тела у
цыплят. В I поколении у цыплят линии, селекционируемой на
быстрое повышение температуры, средняя температура за первые
356
6 дней была выше на 0,23 °C, чем у цыплят линии, селекциони-
руемой на низкую температуру. Во II поколении различия воз-
росли до 0,33 °C. После экспериментального заражения цыплят
двух линий стандартной дозой S. pullorum выяснилось, что цып-
лята линии, селекционируемой на высокую температуру тела,
более устойчивы к болезни.
Пуллороз — хороший пример, показывающий влияние среды
на наследственную резистентность. Цыплята были здоровыми,
когда в первую неделю жизни выращивались при температуре
35 °C. Некоторые из них, генетически резистентные к S. pul-
lorum при 35 °C, заболевали, если выращивались при температу-
ре 30 °C. Наоборот, многие цыплята, восприимчивые к пуллоро-
зу при температуре 35 °C, были резистентными, когда выращи-
вались при 40 °C.
Селекция кур на устойчивость к эймериозу (кокцидиозу). Про-
ведено большое число экспериментов по селекции кур на устой-
чивость к эймериозу. В качестве критерия устойчивости исполь-
зовали способность цыплят раннего возраста к выживанию в
течение более 10 дней после заражения определенным числом
ооцист. Во всех случаях селекция была успешной, например, в
линии, отселекционированной на устойчивость к эймериозу, за-
болело 15 % особей, в линии, отселекционированной на воспри-
имчивость, — 72, а в неотселекционированной популяции —
34 %. В другом селекционном эксперименте за 3 года удалось
снизить заболеваемость с 62,1 до 14,1 %.
В одном из опытов по селекции на резистентность к эймерио-
зу заражали цыплят породы белый леггорн S. tenella. Смертность
потомства разных петухов колебалась от 29 до 90 %, а в среднем
была 60,7 %. В течение 3—4-летней селекции смертность в груп-
пе резистентных птиц снизилась до 22,1 % (табл. 83).
83. Результаты селекции цыплят на резистентность к эймериозу
(по Klimes, Orel)
Птица Смертность цыплят, % Разность между группами
резистентные | восприимчивые
Исходная популяция (1963 г.) 60,7 60,7 . 0
Селекционируемая (1964 г.) 38,6 72,5 33,9
Тестируемая (1965 г.) Размножение популя- ций (1966 г.) 21,6 50,0 28,4
Тестируемая (1967 г.) 22,1 60,0 37,9
Живая масса у резистентных цыплят была выше (115 г), чем у
восприимчивых (94 г). Выявлена положительная корреляция
357
между выживаемостью цыплят у отдельных несушек и средней мас-
сой цыплят (г = 0,43). В процессе селекции генетическая изменчи-
вость между группами возрастала, а внутри групп уменьшалась.
Селекция кур на устойчивость к болезни Марека. Некоторые
исследователи считают, что только три или четыре поколения
нужно для создания линий кур со 100%-ной устойчивостью или
со 100%-ной восприимчивостью к болезни Марека при средней
смертности в исходной популяции 51 %.
Селекцию двух линий кур породы белый леггорн на устойчи-
вость и восприимчивость к болезни Марека проводили следую-
щим образом. Цыплятам в возрасте 2 дней инокулировали стан-
дартную дозу вируса штамма JM, вызывающего болезнь Марека.
В линии N выявили семейства более резистентные, а в линии
Р — восприимчивые к болезни. Производителей, от которых
произошли эти семейства, вторично спаривали с большим коли-
чеством устойчивых или восприимчивых матерей. В результате
селекции в течение четырех поколений заболеваемость в резис-
тентной линии N составила 3,6 %, а в восприимчивой линии
Р — 96 %. Такая быстрая дифференциация двух линий свиде-
тельствует о том, что устойчивость и чувствительность к болезни
Марека контролируется немногими генами. В последующем
было установлено, что в VI поколении особи линии N были
гомозиготны по аллелю В21 системы групп крови В, - а в линии Р
большинство членов имели аллель В1’. Можно считать, что ал-
лель В21 является генетическим индикатором (маркером) резис-
тентности кур к болезни Марека. Известно, что кроме аллеля В21
аллели 2, 6, 7 и 14 определяют умеренную резистентность к
болезни Марека, а аллели 1, 3, 5, 13, 15 и 19 обусловливают
высокую восприимчивость.
На рисунке 68 представлены результаты 30-летних исследова-
ний Ф. Хатта и Р. Коуэлла по селекции кур на устойчивость и
восприимчивость к новообразованиям и другим болезням.
В одном из опытов селекция на скорость роста кур привела к
увеличению чувствительности к болезни Марека. Между массой
взрослых кур породы леггорн и резистентностью к этой болезни
обнаружена отрицательная генетическая корреляция (лэ = —0,40).
Селекция овец на устойчивость
к скрепи. Эффективность селекции
Рве. 68. Общая смертное» в трех линиях
белых леггорнов (в возрасте от 43 до 500
дней). Две линии (Си К) селекционировали на
резистентность к новообразованиям и другим
болезням. Третью линию (Я) селекционирова-
ли на восприимчивость к болезни Марека н
лейкозам. Резкое уменьшение смертности в
линии A ia 1961 г. объясняется уменьшением
опасности заражения в этот год (но Hutt,
Colle, 1982)
358
овец английской породы свейлдейл на снижение чувстви-
тельности к агенту скрепи была продемонстрирована в работе
D. Davies и др. (1985). Овец заражали путем подкожного
введения 5 мл суспензии 10%-ного гомогената головного
мозга, полученного от больных скрепи животных. В течение
7-летних наблюдений заболело 85 % овец из 294. Выявлено
80 % случаев раннего заболевания — через 287 дней (93—
495 дней) после заражения и 20 % случаев позднего про-
явления болезни — через 1207 дней (870—2115 дней).
Ягнят от незаболевших родителей снова заражали суспензией
головного мозга естественно-больных овец. Наблюдения вели в
течение 2120 дней. Заболеваемость ягнят составила 27 %, а в
контрольной группе — 64 %. Установлено, что от больных роди-
телей 100 % потомков также заболевало скрепи. Если был болен
один из родителей, то заболевало 33 % потомков.
В случае выживания обоих родителей после заражения
среди потомства не было больных скрепи. В результате
селекционного эксперимента была создана группа племенных
животных с пониженной чувствительностью к скрепи. В
дальнейшем планируется использовать баранов из созданной
отары в стадах с высокой заболеваемостью скрепи. В породах
овец хердвик и шевиот созданы линии, устойчивые против
агента скрепи штамма SSBP/1.
Селекция животных по поведению. Индивидуальные различия
в поведении животных обусловлены генетическими факторами и
условиями среды. Животные разных генотипов по-разному реа-
гируют на содержание в условиях промышленной технологии.
Существует высокая корреляция между типом нервной деятель-
ности и способностью животных к адаптации. Коровы с высокой
и средней стрессоустойчивостью характеризуются лучшей молоч-
ной продуктивностью и лучшей приспособленностью к машин-
ному доению.
Г. А. Стакан и др. показали генетическую обусловленность
типов поведения овец. Между типом поведения овец-матерей и
их дочерей существует положительная связь. Овцы спокойного
типа имеют большую продуктивность и устойчивы к стрессор-
ным факторам.
Под руководством академика Д. К. Беляева были проведены
длительные эксперименты по селекции серебристо-черных лисиц
на усиление агрессивности и спокойного по отношению к чело-
веку поведения (приручаемость). Степень приручаемое™ и аг-
рессивности оценивали в баллах (от 1 до 4). Исходная популяция
имела оценку 0,96 балла. Отбор на приручаемость в течение 18
поколений привел к созданию популяции вполне ручных лисиц.
Средняя оценка приручаемости равна 2,4 балла. В результате
отбора на агрессивность в F7 средняя агрессивности стала 2,2
балла.
359
НЕПРЯМАЯ СЕЛЕКЦИЯ НА РЕЗИСТЕНТНОСТЬ
Заражение животных возбудителями болезни для выявления
устойчивых и восприимчивых особей в большинстве случаев
неприемлемо. Поэтому изучается возможность использования
непрямой селекции по генетическим или биохимическим
маркерам (индикаторам) —для повышения резистентности к
болезням. Маркерные признаки должны характеризоваться:
1) достаточно высокой (для практического применения) ге-
нетической корреляцией с резистентностью к болезни; 2) вы-
сокой наследуемостью; 3) высокой повторяемостью; 4) ранним
проявлением — для оценки устойчивости животных в раннем
возрасте; 5) независимым от условий среды наследованием
(кодоминирование и т. д.). Некоторые генетические маркеры,
обладающие этими свойствами, вам уже известны. Это
антигены В21 и В19 В-системы групп крови у кур, корре-
лирующие с устойчивостью и восприимчивостью к болезни
Марека^ галотановый тест, с помощью которого можно
выявить свиней, чувствительных к злокачественной гипер-
термии.
Один из индикаторов устойчивости к раку глаз и глазных
век у скота герефордской породы — пигментация вокруг глаз.
В условиях интенсивной солнечной радиации животные с
пигментацией на веках и вокруг глаз меньше заболевают
раком глаз, чем белоголовые особи с непигментированными
веками. Генетическую устойчивость или восприимчивость по
пигментации можно определить в 3-месячном возрасте. Пред-
лагают вести селекцию у герефордского скота на тип животных,
имеющих пигментированное кольцо вокруг глаз. Если оба
родителя не поражены раком после 4 лет, то заболеваемость
их потомства в 3 раза ниже по сравнению с потомками
больных родителей.
Показана наследственная обусловленность реакции гиперчув-
ствительности замедленного типа на ФГА и показателя иммуно-
цитоприлипания у крупного рогатого скота. Предложено учиты-
вать эти показатели в селекционных программах (В. Г. Марен-
ков, 1994).
Маркерами резистентности к бактериальным болезням могут
быть интенсивность продукции антител, титр иммуноглобулинов
(общий или определенных классов), пик сывороточных антител
после стимуляции бактериальными антигенами.
Установлено, что концентрация сывороточных иммуноглобу-
линов выше у герефордских и герефорд х абердин-хангусских
телят, чем у симментальских и пинцгауских.
Выявлено значительное генетическое разнообразие некоторых
механизмов резистентности у быков. Коэффициенты наследуе-
мости этих признаков были от 0,14 до 0,56 (табл. 84).
360
84. Наследуемость некоторых механизмов защиты у молодых быков
(no Lie)
Признак Число животных Коэффициент наследуемости
Иммунный ответ на альбумин сыво- 137 0,14-0,56
ротки человека
Общий уровень Ig в сыворотке 137 0,26-0,54
Уровень IgGi 84 0,54
Уровень IgGi 73 0,45
Лизоцимная активность сыворотки 294 0,27
ИМПУЛЬСНО-ЦИКЛИЧЕСКИЙ СПОСОБ
РАЗВЕДЕНИЯ ПО ЛИНИЯМ
В племенной работе разведение по линиям имеет большое
значение. Однако перед селекционерами всегда стоит проблема
сохранения высокого генетического сходства потомства с выдаю-
щимся родоначальником. Единственным способом сохранения
сходства потомства с родоначальником является использование
инбридинга. Однако инбридинг оказывает и отрицательное вли-
яние на жизнеспособность, плодовитость, продуктивность, ус-
тойчивость к заболеваниям.
В настоящее время у некоторых видов сельскохозяйственных
животных уже достигнуто или в недалеком будущем будет до-
стигнуто биологическое «плато» по многим селекционируемым
признакам. Возможно, скоро будет пересмотрена и стратегия
селекции животных, в связи с чем становится актуальной про-
блема эколого-экономического «плато» продуктивности, которое
будет ниже биологического «плато».
Сейчас уже имеются и в дальнейшем будут получены
выдающиеся животные с уникальными генотипами, обуслов-
ливающими высокую продуктивность, жизнеспособность, ус-
тойчивость к заболеваниям, приспособленность к условиям
среды, а также с низким «генетическим грузом». И через
сотни лет эти генотипы могут быть в какой-то мере
повторены, но часто не превзойдены.
Для всех видов, для которых существуют или будут разработа-
ны способы длительной криоконсервации гамет, предложен
(В. Л. Петухов, Л. К. Эрнст, А. И. Желтиков, О. А. Короткевич)
метод сохранения в течение десятков поколений высокого гене-
тического сходства с родоначальником без применения тесного
инбридинга. Предлагаемая схема импульсно-циклического спо-
соба создания линий позволяет при отдаленных и умеренных
степенях инбридинга (Fx=3,31...7,05 %) поддерживать высркое
генетическое сходство потомков с родоначальником линии — на
уровне 33,2—57,12 % (рис. 69). Принципиальная сущность этого
361
Родоначальник
Рис. 69. Схема импульсно-циклического способа разведения по линиям: цифрами обозначен процент «крови» родо
способа заключается в том, что от выдающегося родоначальника
получают продолжателей линии (сыновей, внуков, правнуков),
которых оценивают по качеству потомства, по комплексу при-
знаков. В дальнейшем правнучек и праправнучек спаривают с
родоначальником линии, при этом у получаемого потомства ко-
эффициент генетического сходства с родоначальником составит
от 53,12 до 56,25 % вместо 3,12—6,25 % при разведении по лини-
ям без использования инбридинга.
При традиционном разведении по линиям генетическое сход-
ство с родоначальником в 50 % достигается при спаривании
полусестра х полубрат или сестра х брат. Такой подбор может
чаще сопровождаться отрицательными последствиями из-за
более тесного инбридинга, величина которого возрастает до
12,5-25 %.
К моменту использования спермы выдающегося произво-
дителя на правнучках и праправнучках можно получить
огромную информацию о его генотипе, продуктивности, жиз-
неспособности, продуктивном долголетии потомства, устой-
чивости потомков к различным заболеваниям, стрессам и
вредным экологическим факторам, носительстве летальных и
сублетальных генов. На основе этого возможно создание
банка ценных генов и его использование для генной и
хромосомной инженерии.
В дальнейшем потомство шестого и восьмого поколений
опять осеменяют спермой родоначальника линии. Коэффициент
инбридинга при этом составит от 3,31 до 7,03 %, и сохранится
высокое генетическое сходство с родоначальником — 53,32—
57,03 %. Такую цикличность использования глубокозаморожен-
ной спермы выдающегося родоначальника необходимо сохранять
и в последующих поколениях. При подобном ведении линий
проводят комплексную оценку производителей каждого поколе-
ния. В пределах конкретной линии возможно получение новых,
выдающихся родоначальников с таким же последующим их ис-
пользованием.
Импульсно-циклический способ необходим при создании
линий, резистентных к различным болезням, устойчивых к воз-
действию неблагоприятных факторов среды и со сниженным
«генетическим грузом». Модифицированный метод можно также
использовать для сохранения генофонда исчезающих пород и
видов животных.
В связи с высокой генетической дифференциацией линий
возможно получение внутрипородного гетерозиса. С этой
целью по приведенной схеме проводится работа в нескольких
неродственных между собой линиях. В дальнейшем осущест-
вляется кросс линий через животных, несущих более 50 %
генов родоначальника. Проведенная проверка на сочетаемость
линий позволит повторить наиболее удачные во всех отно-
363
шениях кроссы через 3—4 поколения уже на новых животных,
имеющих высокое генетическое сходство со своими родо-
начальниками.
В отсутствие инфекций в популяциях и линиях можно под-
держивать высокую концентрацию аллелей, контролирующих ус-
тойчивость к болезням. Это достигается путем использования
криоконсервированной спермы производителей, прошедших
много лет назад всестороннюю оценку в условиях инфекционно-
го фона и давших резистентное потомство.
МЕРОПРИЯТИЯ ПО ПОВЫШЕНИЮ УСТОЙЧИВОСТИ
К БОЛЕЗНЯМ
Знание роли наследственности в этиологии болезней необхо-
димо для разработки селекционных программ повышения устой-
чивости животных. В связи с невозможностью выведения абсо-
лютно резистентных животных необходим комплексный подход
к борете с болезнями, включающий методы ветеринарии, селек-
ции и обеспечения оптимального уровня кормления и содержа-
ния. Относительная наследственная устойчивость животных со-
здает благоприятные условия и для получения большего эффекта
от вакцинации.
Выдвинута концепция (В. Л. Петухов), что после достижения
биологического плато продуктивности, а скорее эколого-эконо-
мического уровня, основными селекционируемыми признаками
у животных будут резистентность к болезням, стрессам, экологи-
чески неблагоприятным факторам. Но уже сейчас все острее
становится проблема повышения устойчивости животных к бо-
лезням. Многие помнят сообщения в прессе (1996) о высоком
уровне заболеваемости коров трубчатым энцефалитом в Англии
(в прессе больных животных называли «бешеными коровами»),
когда был поставлен вопрос об убое нескольких миллионов
голов скота. Некоторые последствия этой трагедии сравнивали с
последствиями чернобыльской катастрофы. Все чаще мы слы-
шим- о повышении уровня заболеваемости человека туберкуле-
зом, злокачественными опухолями и т. д. Никогда не прекратит-
ся на планете сопряженная эволюция микро- и макроорганиз-
мов. Все вместе взятое свидетельствует о необходимости
расширения исследований в области селекционно-ветеринарной
генетики.
Для повышения устойчивости животных к болезням ветери-
нарные врачи и селекционеры должны выполнять следующие
мероприятия:
1) организовать диагностику болезней. Все данные о болезнях
и причинах выбытия животных должны учитываться в племен-
ных карточках, а также в закодированном виде в каталогах про-
364
В изводителей и государственных племенных книгах. При этом
учитываются и описываются все аномалии;
В 2) проводить генеалогический анализ стада и давать ком-
i плексную оценку генофонда семейств. Выявлять семейства, ус-
i ж тойчивые и восприимчивые к болезням. Необходимо размножать
резистентные и высокопродуктивные семейства (особенно с ком-
11 плексной устойчивостью). Прекращать разведение лейкозных се-
В мейств;
I 3) отбирать молодняк на племя по возможности от матерей,
В отличающихся устойчивостью к болезням и длительностью про-
' ж дуктивного использования;
4) постоянно оценивать производителей по устойчивости и
восприимчивости потомства к болезням и признакам продуктив-
I ности и т. д. Для точной оценки быков-производителей по ус-
Я тойчивости нужно иметь 100—150 потомков. Широко использо-
В вать производителей с комплексной резистентностью к болез-
ням. Результаты оценки производителей вносятся в каталоги и
.В госплемкниги;
5) получать производителей следующего поколения от высо-
Ж копродуктивных матерей из семейств, обладающих комплексной
Ж устойчивостью, и отцов, оцененных по резистентности потомст-
I
Я 6) применять трансплантацию эмбрионов как один из методов
Ш повышения эффективности селекции на устойчивость к болез-
В ням. Матки-доноры должны происходить из семейств с ком-
В плексной резистентностью. Наряду с продуктивностью крепкое
В здоровье должно быть одним из показателей при отборе доноров
а для трансплантации;
7) включать в планы племенной работы разделы, освещающие
а вопросы повышения устойчивости животных к болезням и меры
в профилактики распространения наследственных аномалий;
к 8) включать в селекционные индексы информацию о резис-
тентности животных к болезням;
В 9) применять в комплексе прямой и непрямой отбор, вклю-
чающий массовый отбор, отбор семейств и в пределах семейств,
оценку производителей по устойчивости потомства к болезням,
В использовать маркеры;
В 10) проводить комплексную оценку иммунной системы орга-
В низма, включающую показатели гуморального и клеточного им-
В мунитета и неспецифической резистентности;
В 11) обрабатывать информацию о заболеваниях и причинах
В выбраковки животных с помощью ЭВМ;
В 12) выявлять показатели отбора, в том числе генетические и
I биохимические маркеры устойчивости, позволяющие вести се-
I лекцию без заражения животных;
I 13) использовать в будущем методы биотехнологии, в том
I числе генетической и клеточной инженерии, что позволит ус-
I 365
пешно проводить селекцию на устойчивость к болезням, стрес-
соустойчивость и длительность продуктивного использования
животных.
Для осуществления программ селекции на устойчивость необ-
ходимо творческое сотрудничество селекционеров-зооинженеров,
ветеринарных врачей и генетиков.
Видимо, верна мысль Г. Э. Рассела (1982): «Никакие затраты
не принесут большего дохода, чем дальнейшее создание устойчи-
вых сортов культур». Следует добавить — и устойчивых пород
животных.
Контрольные вопросы. 1. В чем сущность генетического мониторинга анома-
лий? 2. Какова примерная последовательность генетического анализа для изуче-
ния роли наследственности в этиологии аномалий? 3. Какие методы проверки
генотипов производителей на носительство вредных рецессивных генов вы знае-
те? 4. Какое значение имеет селекция для повышения устойчивости к болезням?
5. Что затрудняет селекцию на устойчивость к болезням? 6. Для чего использует-
ся оценка генофонда пород, линий и семейств? 7. Какова зависимость эффектив-
ности селекции на устойчивость к болезням от величины коэффициента наследу-
емости? 8. Какие показатели отбора на устойчивость к болезням вам известны?
9. Какие примеры успешной селекции животных на устойчивость к болезням вам
известны? 10. Расскажите о мероприятиях, необходимых для повышения устойчи-
вости к болезням.
СЛОВАРЬ ТЕРМИНОВ
Аберрация — структурное изменение в кариотипе.
Аддитивные гены — гены с однозначным действием (их дейст-
вие суммируется).
Аллели — разные формы одного гена, возникшие в результате
мутаций и расположенные в одном локусе гомологичных хромо-
сом.
Аллоантигены — антигены, по которым особи одного вида
различаются между собой.
Аллогруппа — совокупность аллотипов, наследуемых как одна
группа.
Аллотип — генетически детерминируемые антигенные вариан-
ты сывороточных белков, по которым различаются особи одного
вида.
Анализирующее скрещивание — скрещивание с рецессивной
родительской формой (аа).
Анеупловдия — изменение числа хромосом, некратное гапло-
идному числу.
Антигены — генетически чужеродные вещества, вызывающие
при введении в организм развитие специфических иммунологи-
ческих реакций.
Антимутагены — вещества, в различной степени снижающие
уровень мутабильности.
Антитела — иммуноглобулины (белки), образующиеся в орга-
низме под воздействием антигенов.
Бактериофаги — вирусы, паразитирующие в клетках бактерий.
Бесплодие — нарушение воспроизводства потомства.
Биометрия — наука о способах применения математических
методов в биологии.
Биотехнология — наука об использовании живых процессов в
производстве.
Болезнь — нарушение нормальной деятельности организма.
Вариационный ряд —двойной ряд чисел, состоящий из обо-
значения классов и соответствующих частот.
367
Ветеринарная генетика — наука, изучающая наследственные
аномалии и болезни с наследственной предрасположенностью,
разрабатывающая методы диагностики, генетической профилак-
тики и селекции животных на устойчивость к болезням.
Вирулентность — степень патогенности в отношении живот-
ных определенного вида.
Возрастное скрещивание — скрещивание гибридов Fi (Аа) с
особями, сходными по генотипу с родительскими формами (АА
или аа).
Восприимчивость — предрасположенность организма к дейст-
вию физических, химических и биологических факторов, приво-
дящих к патологическому состоянию.
Гаметогенез — процесс развития половых клеток.
Гаплотип — совокупность сцепленных генов одной хромосо-
мы, контролирующих аллогруппу.
Ген,<- участок молекулы ДНК, кодирующий первичную
структуру полипептида, молекул тРНК и мРНК.
Генеральная совокупность — группа животных, составляющих
вид, породу.
Генетическая система групп крови — совокупность антигенов,
контролируемых одним локусом.
Генетические аномалии — морфофункциональные нарушения
в организме животных, возникающие в результате генных и хро-
мосомных мутаций.
Генетический груз — совокупность вредных генных и хромо-
сомных мутаций.
Генетический код — совокупность кодонов (триплетов), коди-
рующих аминокислоты.
Генетический полиморфизм — разнообразие частот аллелей го-
мозигот.
Генная инженерия — раздел биотехнологии, связанный с целе-
направленным конструированием in vitro новых комбинаций ге-
нетического материала, способного размножаться в клетке и
синтезировать определенный продукт.
Гены-модификаторы — гены, не проявляющие собственного
действия, но усиливающие или ослабляющие эффект действия
других генов.
Генные (толковые) мутации — изменения в структуре ДНК. -
Генный баланс — соотношение и взаимодействие всех генов,
влияющих в той или иной степени на признак.
Генотип — совокупность генов организма.
Генотипическая среда — комплекс генов организма, в котором
происходит действие изучаемого гена.
Генофонд — совокупность аллелей, входящих в состав популя-
ции.
368
Гермафродит — особь, имеющая гонады и (или) половые орга-
ны противоположных полов.
Гетерозис — превосходство потомства над родительскими
формами по жизнеспособности, продуктивности, плодовитости.
Гомеостаз — внутреннее постоянство организма.
Делеции — утрата средних участков хромосом.
Дигибридное скрещинание — скрещивание, при котором у ро-
дителей учитывается два признака, контролируемых двумя локу-
сами.
Дискордантность — проявление признака только у одного из
близнецов.
Доминирование — проявление действия лишь одной из алле-
лей у гетерозиготного организма.
Заболеваемость — частота заболеваний в популяции или бо-
лезненность, болезненное состояние.
Заболевание — возникновение болезни.
Идиотипы — антигенные различия между антителами, принад-
лежащими к одному классу, субклассу и аллотипу у отдельных
особей.
Изменчивость — возникновение различий между организмами
по ряду признаков и свойств.
Иммунитет — невосприимчивость организма к инфекционным
агентам и генетически чужеродным веществам антигенной при-
роды.
Иммунная система организма — совокупность всех лимфоид-
ных органов и скоплений лимфоидных клеток.
Иммуногенетика — наука, изучающая генетический контроль
иммунного ответа, генетику несовместимости тканей при пере-
садках тканей, закономерности наследования антигенной специ-
фичности, проблему поддержания генетического гомеостаза со-
матических клеток организма.
Иммунологическая память — способность при повторном кон-
такте с антигеном узнавать и отвечать на него иммунологической
реакцией.
Иммунный ответ — высокоспецифическая форма реакции ор-
ганизма на чужеродные вещества.
Инбридинг — спаривание животных, находящихся в родствен-
ных отношениях.
Интерференция — торможение кроссинговера на одном участ-
ке кроссинговером на другом.
Карта хромосом — план расположения генов в хромосоме.
Клеточная инженерия — метод конструирования клеток нового
369
типа на основе их культивирования, гибридизации и реконструк-
ции.
Клон — группа генетически идентичных клеток, происходя-
щая от одного общего предка путем митозов.
Клонирование — размножение в бактериях идентичных реком-
бинантных ДНК.
Кодоминирование — проявление в гетерозиготе двух аллельных
генов.
Кодон — триплет нуклеотидов, кодирующих одну аминокис-
лоту.
Комбинативная изменчивость — наследственная изменчивость,
возникающая в потомстве в результате новых сочетаний призна-
ков и свойств при скрещиваниях.
Конкордантность — присутствие болезни у обоих близнецов.
Конъюгация — перенос генетического материала от одной бак-
териальной клетки (донора) к другой (реципиенту) при их непо-
сре^ственном контакте.
Кроссинговер — обмен участками между гомологичными хро-
мосомами.
Легальные гены — гены, вызывающие гибель организма.
Локус — место расположения генов в хромосоме.
Мейоз — процесс редукционного и эквационного делений
ооцитов и сперматоцитов, в результате которого образуются по-
ловые клетки с гаплоидным набором хромосом.
Митоз — деление соматических клеток, при котором сохраня-
ется диплоидный набор хромосом.
Модификационная изменчивость — ненаследственная феноти-
пическая изменчивость, возникающая под влиянием условий
среды и не изменяющая генотип.
Мозаицизм — присутствие в организме клеток (точнее клонов)
разного генотипа.
Моногибридное скрещивание — скрещивание, при котором у
родителей учитывается один признак, контролируемый одним
локусом.
Моноклональные антитела — иммуноглобулины, синтезируе-
мые одним клоном клеток.
Мутагенез — процесс образования мутаций.
Мутация — стойкое изменение в структуре ДНК и кариотипе.
Наследственность — свойство живых существ обеспечивать
материальную и функциональную преемственность между поко-
лениями, а также обусловливать специфический характер инди-
видуального развития в определенных условиях внешней среды.
Наследуемость — относительная доля наследственной, измен-
чивости в общей фенотипической изменчивости популяции.
Нехватка — утрата концевых участков хромосом.
Новообразование — тип взаимодействия неаллельных генов,
когда при их сочетании в одном организме развивается новая
форма признака.
Норма реакции — границы изменчивости выражения признака
под влиянием изменяющихся условий окружающей среды.
Онтогенез — индивидуальное развитие организма.
Палиндром — последовательность нуклеотидов, читаемая оди-
наково в обоих направлениях, начиная с 3'-конца каждой цепи.
Панмиксия — свободное скрещивание.
Партеногенез — развитие организма без оплодотворения.
Патогенность — способность паразитировать в организме жи-
вотного.
Плазмвды — кольцевые молекулы ДНК.
Плейотропия — влияние одного гена на развитие двух и более
признаков.
Полигенный признак — признак, обусловленный многими ге-
нами.
Полимерия — тип взаимодействия неаллельных генов, при ко-
тором на один признак влияет несколько разных, но сходно
действующих генов.
Полиморфизм — одновременное присутствие двух или более
генетических форм одного вида в таком численном отношении,
что их нельзя отнести к повторным мутациям.
Полиплоидия — увеличение числа хромосом, кратное гаплоид-
ному набору (Зп, 4п, 5п).
Полифакториальный признак — признак, обусловленный мно-
гими локусами.
Популяция — совокупность особей одного вида, обитающих
на определенной территории и свободно скрещивающихся между
собой.
Пороговый признак — признак, распределение которого при
расщеплении происходит прерывисто, но наследуется он поли-
факториально.
Резистентность — устойчивость организма к действию физи-
ческих, химических и биологических агентов, вызывающих пато-
логическое состояние.
Рекомбинантная ДНК — искусственно полученная молекула
ДНК.
Рестрикция — процесс разрезания молекулы ДНК фермента-
ми — рестрикгирующими эндонуклеазами.
Рецепторы — макромолекулярные структуры клеточной по-
верхности, с помощью которых клетки узнают антигены.
Рецессивность — отсутствие проявления одной из аллелей в
гетерозиготе.
Реципрокное скрещивание — два скрещивания, в одном из ко-
торых доминантным признаком отличается отцовская форма, во
втором — материнская.
Сплайсинг — удаление у пре-иРНК интронов и соединение
экзонов.
Стабилизирующее скрещивание — скрещивание, восстанавли-
вающее соотношение генотипов в популяции в соответствии с
формулой Харди — Вайнберга.
Стресс — состояние организма, возникающее в ответ на воз-
действие сильных раздражителей или различных повреждающих
факторов внешней среды.
Сцепление генов — совместное сцепление генов, расположен-
ных в^>дной и той же хромосоме.
Тип крови — совокупность всех групп крови одной особи.
Тотипотентность — способность любой соматической клетки
дать начало организму.
Трансгеноз — экспериментальный перенос генов, выделенных
из определенного генома или искусственно синтезированных, в
другой геном.
Трансдукция — перенос генов из одной бактериальной клетки
в другую при помощи бактериофага.
Транскрипция — синтез мРНК на матрице ДНК.
Трансляция — синтез полипептидных цепей рибосомами с ис-
пользованием в качестве матрицы мРНК.
Трансплантация эмбрионов — метод ускоренного воспроиз-
водства высокопродуктивных животных (доноров) путем полу-
чения и пересадки эмбрионов менее ценным животным (реци-
пиентам).
Трансформация — поглощение изолированной ДНК бактерии
донора клетками реципиента.
Фармакогенетика ветеринарная — раздел ветеринарной генети-
ки, изучающий наследственно обусловленные реакции животных
на лекарственные препараты.
Феногруппа — совокупность антигенов, которые наследуются
как единое целое.
Фенокопия — изменение признака под влиянием внешних
факторов, ведущее к копированию признака, обусловленного ге-
нотипом.
Фенотип — совокупность всех признаков и свойств организма.
Филогенез — история развития вида.
372
Химера — животное, полученное путем слияния эмбриональ-
ных клеток двух и более животных.
Центровая теория гена — теория о том, что ген состоит из
отдельных функциональных участков — центров, которые могут
независимо изменяться при мутациях.
Числовые мутации — изменение числа хромосом в кариотипе.
Чистая линия — потомство, полученное только от одного ро-
дителя и имеющее с ним полное сходство по генотипу.
Эмбриогенетическая инженерия — активная перестройка гено-
ма животных путем вмешательства в их развитие на самых ран-
них стадиях онтогенеза.
Эпистаз — тип взаимодействия неаллельных генов, при кото-
ром один ген подавляет действие другого неаллельного гена.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Агаммаглобулинемия 248
Агглютинация 213
Аллельное исключение 235
Аллоантиген 209
Аллогруппа 225, 235
Аллотипы 224, 235
Алопеция 248
Анализирующее скрещивание 32, 291, 342
Анастомоз 216
Анеуплоидия 157, 273
Айдрогенез 71
Анкилозирующий спонделит 246
Аномалии генетические 250
— экзогенные 252
Антигенная детерминанта 213
Антигены 209
— гистосовместимости 242
Антикодон 82
Антимугагены 175
Антитела 211
— моноклональные 112
Ауксстрофные бактерии 96
Аутоиммунные реакции 247
Аутосомы 14
Бактериофаги 93
Бесплодие 332
Биноминальное распределение 138, 139
Биометрия 124
Биотехнология 103
Близнецы 216
— монозиготные 216
— дизиготные 216
Бруцеллез 299—301
В-лимфоциты 229
Варианса 129
Вариационный ряд 125—128
Вектор 106
Ветеринарная генетика 3, 4
Вирулентность 290
Возрастное скрещивание 19
Гаметогенез 19
Гаметы 9
Гаплоидный набор хромосом 14
Гаплотип 225
374
Гемоглобин 223
Гемолиза реакция 213
Гемолитическая болезнь 220—221
Гемонхоз 227
Гемохроматоз 224
Ген 26, 180
Генетическая система группы крови 211
Генетические аномалии 250
Генетический груз 202—203
— мутационный 203
— сегрегационный 203
Генная инженерия 103
Генетический код 84—86
Генный баланс 52
Геном 177
Генотип 26, 52, 96
Генотипическая среда 52
Гены 26, 34, 87, 104, 179, 180
— аллельные 31
— аддитивные 47
— летальные 35, 197, 250
— модификаторы 49
— субвитальные 36
— сублетальные 36, 197
Гермафродиты 66, 434
Гетероплоидия 157
Гетерозиготы 26
Гетерозис 207, 219
Гетерохроматин 12
Гибридомы 112
Гиногенез 71
Гипоплазия 333
Гистограмма 126
Гомеостаз 205, 209, 228
— генетический 205
Гомозиготы 26
Дезоксирибонуклеиновая кислота (ДНК) 13, 74, 75, 80
Делеция 157
Диарея 325
Дискордантность 294
Диплоидный набор хромосом 14
Дисперсионный анализ 150—153
Домен 230
Доминирование 28, 34
— неполное 34
Дрейф генов 200
Дупликация 157
Закон гомологических рядов в наследственной изменчивости 270
Идиотипы 235
Изогемолиз 221
Изменчивость 3, 122—123
— дискретная 124
— комбинативная 122
— коррелятивная 123
375
— модификационная 123
— мутационная 122
— непрерывная 124
Изотипы 235
Изотрансплантанты 242
Изохромосомы 159
Иммунитет 228
Иммунная система организма 228
Иммунный ответ 237
— первичный 237
— вторичный 237
Иммуногенетика 209
Иммуноглобулины 230
Иммунологичная память 232, 238
Иммунодефициты 247
— вторичные 247
— комбинированные 248
— первичные 247
Инбредная депрессия 201—202
Инбридинг 200
Инверсии 157, 278
Инициация 88
Интерсексуальность 66
Интроны 87
Кариотип 14
Карты хромосом 58
Качественные признаки 124, 136
Кетозы 327
Клеточная инженерия ПО
Клон 112, 113, 241
Клонально-селекционная теория иммунитета 241
Кодоминирование 212
Кодон 85
Компетентность 102
Комплементария 44
Количественные признаки 124
Конкордантность 294
Конъюгация 97
Корреляция 144
Коэффициент вариации 130, 132
— наследуемости 148, 206
— регрессии 148—149
Крипторхизм 70, 333
Критерий хи-квадрат 141
Кроссинговер 21, 56
Культура клеток 110
Лейкоз 316
Лептоспироз 305
Лизогения 95
Локус 27
Марека болезнь 321
Мастит 296—299
Мейоз 19
Миксоматоз кроликов 324
376
Миксоплоидия 160, 161
Митоз 17
Множественный аллелизм 32
Мозаицизм 160
Мутагены 169—171
— биологические 170
— физические 169
— химические 170
Мутации 122, 156
— индуцированные 156
— спонтанные 156
— хромосомные 157
— аморфные 164
— гипоморфные 164
— антиморфные 164
— неоморфные 164
— генные 164—165
Медиана 128
Модальный класс 125, 126
Модификация 123
Мозаицизм 160
Мониторинг 4, 173
Морганида 56
Наследственность 3
Наследуемость 206
Нематоды 307
Неспецифические факторы защиты 228
Нехватки 157, 258
Новообразование 44
Нормальное распределение 137—138
Нормированное отклонение 132
Нуклеоид 91
Нуклеотид 77, 79, 81
Ньюкаслская болезнь 322
Обратная транскриптаза 104
Онтогенез 64, 178
Оперон 189
Опсонизация 231
Палиндром 105
Панмиксия 198
Партеногенез 71
Патогенность 290
Пенетрантность 49, 260
Паракератоз 248
Паратоп 231
Плазматические клетки 229
Плазмиды 92
Плейотропия 49, 219
Повышенная чувствительность замедленного типа 232
Пол 63
— гомогаметный 63
— гетерогаметный 63
— сингамный 63
— эпигамный 63
377
Полигон 127
Полимерия 47
Полиморфизм 222—223
— сбалансированный 223
Полиплоидия 157, 160, 273
Популяция 196—197
Пороговые признаки 290
Пролиферация 112
Промотор 87, 104
Протоонкогены 175
Прототрофные бактерии 96
Профаг 95
Процессинг 87
— антигена 237
Пуассона распределения 139—140
Пуллороз 356
Ревертаза (эндонуклеаза) 104
Регрессия 148
Рекомбинантные ДНК 106
^•Репрезентативность 125
Рестриктазы 105
Рецепторы 230
Рецессивность 26
Реципрокное скрещивание 26
Рибосомы 83
РНК 77, 81, 83
— информационная 82
— рибосомная 83
— транспортная 82
Робертсоновская транслокация 1572
Родильный парез 328
Сайт 180
Сверхдоминирование 34
Секдукция 100
Селективный дефицит 249
Селекционный дифференциал 207
Сервис-период 277
Серповидно-клеточная анемия 223
Сетевая теория иммунитета 241
Синдром 66
— Клайнфельтера 66
— Тернера 67
— Чедиака-Хигаши 229
Скрепи 323
Скрещивание стабилизирующее 189
Совокупность 125
— генеральная 125
— выборочная 125
Соматическая гибридизация 111
Соматические клетки 17
Сплайсинг 87, 233
Средняя 128
— арифметическая 128
— квадратическая 128
Стресс 335
378
Сцепление генов 52—54
Т-киллеры 229
Т-лимфоциты 229
Т-хелперы 229
Теломеры 11
Тератогены 252
Терминация 89
Тимпания рубца 326
Тип крови 211
Толерантность 217
Тотипотентность 7, 115
Трансгеноз 119
Трансгенные животные 119
Трансгрессивные ряды 140
Трансдукция 100
— абортивная 101
— неспецифическая 101
— специфическая 101
Транскрипция 87
Транслокация 157, 275
— реципрокная 157
— танденная 157
Трансляция 87—88
Трансплантация 114
Трансферрин 223
Трансформация 101
Туберкулез 301—305
Уровень значимости 137
Фаги 93, 94
Фармакогенетика 339
Феногруппа 212
Фенокопии 251
Фенотип 26, 96
Ферментативный синтез 104
Филогенез 178
Фримартинизм 67
Фримартины 217
Харди — Вайнберга закон 197—198
Химера 117
Химеризм 160, 216
Хроматиды 11
Хроматин 9, 65
— половой 65
Хромосомная нестабильность 162
Хромосомная теория наследственности 51, 62
Хромосомы 9
— акроцентрические 11
— гомологичные 14
— метацентрические 11
— половые 14, 63
— субметацентрические 11
Центромера 11
379
Церулоплазмин 224
Циклическая нейтропения 229
Цистрон 180
Цитогенетика 9
Цитоплазматическая наследственность 189
Чаргаффа правила 77
Чистая линия 197
Эволюция 198
Эмбриогенетическая инженерия 114
Экзоны 87
Эймериоз (кокцидиоз) 311, 357
Экологическая генетика 169
Эколого-ветеринарная генетика 173
Экспрессивность 49, 260
Эксцесс 128
Элонгация 88
Эндонуклеаза 105
Эпистаз 46
Эпитоп 231
''(Эритробластоз 220
Эухроматиновые участки хромосом 12
Ядрышко 10
Ящур 321
ОГЛАВЛЕНИЕ
+ Г л ж в ж 1. Предмет, методы значение генетики. В. Л. Петухов.................3
Г л ж в ж 2. Цитологические основы наследственности. А. И. Жягтев......9
Роль ядра и цитоплазмы в наследственности...........................9
Морфологическое строение хромосом...................................11
Кариотип и его видовые особенности..................................14
Митоз...............................................................17
Гаметогенез и мейоз................................................19
'Глава 3. Закономерности наследования признаков при половом размно-
жении. Г. А. Назарова......./........................................25
Особенности гибридологического метода Менделя....................25
Закон единообразия гибридов первого поколения.................27
> Закон расщепления ............................................30
Аллели. Множественный аллелизм ’..............................31
Анализирующее скрещивание. Правило чистоты гамет..............32
Отклонения от ожидаемого расщепления, связанные с характером
доминирования признака и летальными генами.......................34
Закон независимого наследования признаков........................37
Политибридное скрещивание........................................42
\/ Взаимодействие неаллельных генов.................................44
Г л ж в ж 4. Хромосомная теория наследственности. Г. А. Назарова.....51
Сцепленное наследование признаков ...............................51
Полное сцепление.................................................52
Неполное сцепление...............................................54
Соматический (митотический) кроссинговер.........................57
Карты хромосом...................................................58
Г л ж ж ж 5. Генетика пола. А. И. Жигачев..............................63
Детерминация пола и механизм его наследования..................63
Нарушения в развитии пола......................................64
Наследование признаков, сцепленных с полом.....................68
Наследование признаков, ограниченных полом.....................70
Проблема регуляции пола........................................70
— Г л ж в ж 6. Молекулярные основы наследственности. Г. А. Назарова .... 74
Доказательства роли ДНК в наследственности.........................74
Биологическая роль нуклеиновых кислот .............................75
Химический состав и структура нуклеиновых кислот ..................76
Строение и типы РНК................................................81
Генетический код...................................................84
Синтез белка в клетке..............................................85
Г л ж в ж 7. Генетика микроорганизмов. Г. А. Назарова ........... 91
Строение и размножение бактерий ................................91
Строение и размножение вирусов..................................93
Взаимодействие фага с бактериальной клеткой ....................94
Понятие о генотипе и фенотипе микроорганизмов...................96
Конъюгация......................................................97
Трансдукция..................................................100
Трансформация................................................101
381
Глава 8. Биотехнология. Г. А. Назарова, В. Л. Петухов..............
Генная инженерия................................................
Клеточная инженерия...........................‘.................
Гибридомная технология получения моноклональных антител.........
Эмориогенетическая инженерия....................................
Клонирование эмбрионов млекопитающих.........................
Химерные животные............................................
Трансгенные животные ........................................
Глава 9. Изменчивость и методы ее изучения. В. Л. Петухов..........
Виды изменчивости...............................................
Методы изучения изменчивости....................................
Вариационный ряд и его построение ..............................
Статистические показатели для характеристики совокупности.......
Вычисление статистических показателей для малых выборок.........
Оценка достоверности разности между средними арифметическими двух
выборочных совокупностей........................................
Типы распределения..............................................
Критерий хи-квадрат (х2)........................................
Изучение связи между признаками ................................
Дисперсионный анализ............................................
/ Г л а в a*il0. Мутационная изменчивость. А. И. Жхгачев..............
Классификация мутаций...........................................
Хромосомные мутации..........................................
Механизм образования числовых и структурных аномалий кариотипа
Генные мутации...............................................
Индуцированный мутагенез........................................
Проблемы экологической генетики животных........................
Генетические последствия загрязнения окружающей среды и защита
животных от мутагенов........................................
Антимутагены.................................................
+ Глава 11. Генетические основы онтогенеза. Г. А. Назарова.............
Раскрытие сложной структуры гена................................
Влияние генов на развитие признаков.............................
Дифференциальная активность генов на разных этапах онтогенеза . . . .
Взаимодействие ядра и цитоплазмы в развитии.....................
Регуляция синтеза иРНК и белка..................................
Влияние среды на развитие признаков.............................
Глава 12. Генетика популяций. А, И. Жигачев........................
Популяция и «чистая линия» .....................................
Структура свободно размножающейся популяции. Закон Харди — Вайн-
берга ..........................................................
Основные факторы генетической эволюции в популяциях ............
Влияние инбридинга на выщепление рецессивных летальных и полу-
легальных генов.................................................
Генетический груз в популяциях животных
Генетическая адаптация и генетический гомеостаз популяций.......
Особенности наследования количественных признаков ..............
Генетические основы гетерозиса..................................
Глава 13. Группы крови и биохимический полиморфизм. В. Л. Петухов .
Наследование групп крови...........................................
Значение групп крови для практики...............................
Биохимический полиморфизм.......................................
Значение биохимического полиморфизма............................
Глава 14. Генетические основы иммунитета. В. Л. Петухов............
Структура иммуноглобулинов......................................
Генетика иммуноглобулинов.......................................
103
103
НО
112
114
115
117
119
122
122
124
125
128
133
135
137
141
144
150
156
156
157
160
164
166
169
171
175
178
179
181
184
188
189
193
196
196
197
198
200
202
205
205
207
209
212
215
222
225
228
230
232
382
Генетический контроль иммунного ответа............................237
Главный комплекс гистосовместимости (МНС).........................242
Связь МНС и других антигенов гистосовместимости с болезнями .... 246
Первичные (врожденные) дефекты иммунной системы ..................247
Глава 15. Генетические аномалии у сельскохозяйственных животных.
А. И. Жигачев........................................................250
Генетические аномалии.............................................250
Наследственно-средовые аномалии ..................................251
Экзогенные аномалии...............................................252
Генетический анализ в изучении этиологии врожденных аномалий . . . 253
Простой аутосомный рецессивный тип наследования...................254
Аутосомный доминантный тип наследования...........................257
Сцепленный с Х-хромосомой тип наследования........................258
Мультифакгориальное наследование..................................259
Пенетрантность и экспрессивность при наследовании аномалий........260
Аномалии у сельскохозяйственных животных, обусловленные мутациями
генов.............................................................261
Закон гомологических рядов в наследственной изменчивости..........270
Распространение аномалий хромосом в популяциях животных...........272
Числовые и структурные мутации кариотипа и фенотипические аномалии
животных..........................................................273
Глава 16. Болезни с наследственной предрасположенностью.
В. Л. Петухов........................................................289
Генетическая устойчивость и восприимчивость к бактериальным бо-
лезням ...................................*.......................296
Генетическая устойчивость и восприимчивость к гельминтозам........306
Генетическая устойчивость и восприимчивость к протозоозам.........309
Генетическая устойчивость и восприимчивость к клещам..............314
Генетическая устойчивость и восприимчивость к вирусным инфекциям .316
Генетическая обусловленность респираторных болезней...............324
Генетическая обусловленность болезней желудочно-кишечного тракта . . 325
Болезни обмена веществ............................................327
Роль наследственности в предрасположенности животных к болезням
конечностей.......................................................329
Роль наследственности в предрасположенности к бесплодию ..........332
Роль наследственности в предрасположенности к стрессу.............335
Влияние факторов среды на устойчивость к болезням.................337
Глава 17. Методы профилактики распространения генетических аномалий
и повышения наследственной устойчивости животных к болезням.
В. Л. Петухов, А. И. Жигачев.........................................340
Учет врожденных аномалий и болезней. Методы генетического анализа . 341
Повышение наследственной устойчивости животных к болезням .... 346
Оценка генофонда пород ...........................................347
Наследуемость и повторяемость устойчивости к заболеваниям.........349
Массовый отбор на резистентность..................................350
Комплексная оценка генофонда семейств, линий и потомства произ-
водителей ........................................................351
Показатели отбора при селекции на устойчивость к болезням.........352
Селекция животных на устойчивость к болезням .....................353
Непрямая селекция на резистентность...............................360
Импульсно-циклический способ разведения по линиям.................361
Мероприятия по повышению устойчивости к болезням...........- . . . 364
Словарь терминов. В. Л. Петухов......................................367
Предметный указатель.................................................374