Автор: Дуленко В.И. Комисаров И.В. Долженко А.Т. Николюкин Ю.А.
Теги: органическая химия лекарственные средства в соответствии с их активным веществом химия биология
ISBN: 5-12-003118-8
Год: 1992
Текст
НАУКОВА ДУМКА
УДК 547.752'821:615.21
ДКАРБОЛИНЫ. ХИМИЯ И НЕЙРОБИОЛОГИЯ / ДУЛЕНКО В.И., КОМИС-
САРОВ И.В., ДОЛЖЕНКО А.Т., НИКОЛЮКИН ЮЛ.; Отв. реп. Андронати СЛ.;
АН Украины. Ин-т физ.-орган. химии и углехимии. - Киев : Наук, думка, 1992. -
216 с. - ISBN 5-12-003118-8.
В монографии обобщены данные по синтезу и превращениям 0-карболинов
и их 1,2,3,4-тетра- и 3,4-дигидропроизводных. Приведены методики получения
конкретных соединений. Рассмотрены современные представления о (3-карболи-
нах как лигандах бенздиаэепиновых и других мембранных рецепторов нервных
клеток. Анализируется их влияние на регуляцию уровня тревожности, судорож
ного порога мозга, настроения, формирования алкогольной мотивации и зави-
симости.
Для специалистов в области химии гетероциклических соединений, физиоло-
гически активных веществ, а также нейрофизиологов, нейрохимиков, фармако-
логов и патофизиологов.
Ил. 16. Табл. 31. Библногр.: с. 192 213 (704 назй.).
Ответственный редактор СЛЛНДРОНАТИ
Утверждено к печати ученым советом
Института физико-органической химии и углехимии АН Украины
Все права принадлежат издательству ’’Паукова думка”. Любое использова-
ние этого издания или его элементов / фрагментов, те. копирование, тиражиро-
вание, распространение и т.д., возможно только при наличии предварительного
письменного соглашения с издателем.
Адрес издательства "Паукова думка”: Украина, 252601, Киев 4, ул.Репина,3.
All right reserved. No part of this issue may be reproduced by any mechanical, pho-
tographic or electronic process or in the form of a phonographic recording, nor may it be
stored in a retrieval system, transmitted or otherwise copied for public or private use wit-
hout written permission of the Naukova Dumka Publishers.
Address of the Publishers: Ukraine 252601, Kiev 4, Repin St., 3.
1705000000-258
К----------------
221-92
ISBN 5-12-003118-8
278-92
© В.ИДуленко, И.В.Комиссаров,
А.Т.Долженко, ЮЛ.Николюкин, 1992
ПРЕДИСЛОВИЕ
В органической химии трудно назвать класс соединений, который подобно
0-карболинам на протяжении многих десятилетий привлекал пристальное внима
ние как химиков, так и биологов. Интерес к (3-карболинам объясняется их широ-
ким распространением в природе. Многочисленные алкалоиды содержат (3-карбо-
линовую структуру или являются производными (3-карболинов.
В 80-е годы нашего столетия (3-карбопины стали изучаться специалистами раз-
ных областей нейробиологии [ 1), так как они оказались важным инструментом
нейрохимического исследования так называемых бензодиазепиновых рецепторов
(БДР). Последние являются участками аллостерического регулирования рецепто-
ров у-аминомасляной кислоты (Рд-ГАМК) , образующих функциональные ком-
плексы с хлорными ионофорами в мембранах нервных клеток. Как модуляторы
рецептор-ионофорных мембранных комплексов (Зкарболииы используются для
нейрофизиологических исследований ГАМК-ергического торможения на разных
уровнях центральной нервной системы позвоночных. Кроме того, наряду с други-
ми лигандами Б ДР и специфическими лигандами L4-серотониновых рецепторов
Дч<арболины служат для анализа клеточных и молекулярных (патофизиологичес-
ких и патохимических) механизмов тревоги и страха, которые представляют со-
бой важнейшие компоненты эмоционально-стрессовых реакций человека и жи-
вотных. Данные по молекулярной фармакологии и нейрофизиологии (3-карболи-
нов в последние годы привлекаются к обоснованию новых концепций патогенеза
распространенных психопатологических состояний. Наконец, (3-карболины — пер-
спективный класс веществ для изыскания лекарственных средств, известных под
названием транквилизаторы и обладающих противостраховой, противотревож-
ной (анксиолитической) активностью и стресс-протективными свойствами.
В настоящей монографии систематизированы имеющиеся сведения по химин
природных и синтетических (3 карболинов, об их возможном участии в регуляции
уровня тревожности и порога судорожной готовности мозга, детально рассмотре-
ны клеточные и молекулярные механизмы действия (3-карболинов на централь-
ную нервную систему животных и человека. В ией нашли отражение результаты
собственных исследований авторов по химии и нейробиологии (3-карболинов.
Авторы надеются, что монография будет полезной для исследователей, рабо
тающих над созданием биологически активных веществ, нейрофизиологов и ней-
рофармакологов, а также патофизиологов и психиатров, изучающих проблему
аффективных расстройств.
Глава 1
МЕТОДЫ ПОЛУЧЕНИЯ 1,2,3,4-ТЕТРАГИДРО-
ЕКАРБОЛИНОВ
1.1 ПОЛУЧЕНИЕ 1,2,3,4-ТЕТРА! ИДРО (ЗК АРБ О ЛИНОВ
КОНДЕНСАЦИЕЙ ТРИПТАМИНОВ И ТРИПТОФАНОВ
С КАРБОНИЛЬНЫМИ СОЕДИНЕНИЯМИ
Реакция Пикте—Шпенглера, впервые использованная для синтеза
1,2,3,4-тетрагидро-Р-карболииов более 60 лет назад [4], и поныне яв
ляется одним из наиболее распространенных методов получения соеди-
нений этого ряда [2, 3, 5,6] В основе реакции лежит взаимодействие
замещенных Ъ (индолил-3) этиламинов с алифатическими и аромати-
ческими альдегидами. Современные представления о механизме форми-
рования тетрагидро-/3-карболиновой системы [3] включают стадии об-
разования основания Шиффа (1), электрофильной атаки иминогруппы
по положению 3 индольного ядра и перегруппировки спироиндоленино-
вого интермедиата (2) [5]:
Присутствие спироиндолениновых интермедиатов в реакции Пик-
те-Шпенглера экспериментально доказано [7,8].
1.1.1. КОНДЕНСАЦИЯ С АЛЬДЕГИДАМИ
В зависимости от строения исходных веществ условия проведения
процесса могут изменяться в широких пределах, причем на выход ко-
нечных продуктов в основном влияют pH среды, природа растворителя
4
и температура реакционной смеси Триптамин и N-метилтриптамин
(4 а, б) в водно-спиртовой среде в зависимое», от величины pH реаги-
руют с формальдегидом с образованием 1,2,3,4-тетрагидро-/?-карболи-
нов (7 а б) (pH < 2) или карбииоламинов (5 а, б) (pH 7) [9 ]
а - R =R* =Н;б - R=Me, R* Н; в - R Ц, R* =ОМе; г R=Me, R’ =ОМе
В кислых условиях (разбавленная HjSO4) в присутствии избытка
формальдегида наряду с карболинами 7 а, б получены 9-оксиметилкар-
болины (8 а, б). 5-Метокситриптамины (4 в, г) как в нейтральной сре-
де, так и в присутствии кислоты превращаются в соответствующие
/3-карболины (7 ву). Промежуточные карбиноламины при этом не вы-
делены. Такой результат объясняют [9] повышенной реакционной спо-
собностью спироиндолениновых интермедиатов за счет участия мето-
ксигруппы в резонансе структур 9а «+ 96:
9а
Синтез тетрагидро-Р-карболинов (7а—г) в кислой среде сопровож-
дается образованием значительных количеств полимеров, вероятно,
вследствие протонирования промежуточных спироиндоленинов (6)
[9]. В случае триптамина (46) один из компонентов продуктов поли-
меризации выделен и идентифицирован как тример (10), что служит
косвенным доказательством участия спироиндоленинов (6) в форми-
ровании тетрагидро-^карболинов (7):
5
Не всегда нужно добавлять кислоту в реакционную смесь, достаточ-
но использовать соль исходного триптамина. Так, например, реагируют
с формальдегидом гидрохлориды триптофанолов (11а, б) [10]:
11 а 6 12а.б 13а
a-R=H,6 R=OMe.
Обработка гидрохлорида 11а формальдегидом при 90 °C приводит
к p-карболину (12а) с выходом 25 %, который, однако, можно поднять
до 57 %, если гидрохлорид Па перемешивать с эквимолярным коли-
чеством альдегида при комнатной температуре в течение 24 ч. В качест-
ве побочного продукта образуется оксазолокарболин (13 а) Он полу-
чен также нагреванием Р-карболина (12а) с формальдегидом в присут-
ствии соляной кислоты. 6-Метоксикарболин (126) синтезирован в тех
же условиях с выходом 56 %, однако соответствующий оксазолокар-
болин выделить ие удалось.
3-Оксиметил-1,2,3,4-тетрагидро-р карболин (10]. Раствор 1,31 г (5,8 ммоль)
гидрохлорида трнптофанола и 0,5 мл 40 %-го формальдегида в 20 мл Н3 О переме-
шивают при комнатной температуре 24 ч, затем подщелачивают 10 %-м раствором
NaOH и экстрагируют хлороформом. Органические вытяжки упаривают в ваку
уме. Выход 0,67 г (57 %) сырого карболина (12а), тля. 189 °C (из спирта).
Подходящей средой для проведения конденсации триптаминов
(14а-г) с формальдегидом оказалась уксусная кислота [11]:
а - R=Et, R* =Н; б - R=Et, R’ -Me, в - R=
=н Рг, R* =Н;г- R=h-Bu,R’=H.
2-Этил-8-метил-1ДЗД телрагидро-Р карболин [И]. Раствор 5,7 ммоль
М-этил-2-(7-метилиндолил-3)этиламина и 5,7 ммоль 40 %-го водного раствора
формальдегида в 60 мл уксусной кислоты перемешивают в атмосфере азота при
6
комнатной температуре в течение 20 ч, затем кипятят 2 ч, упаривают в вакууме
досуха, остаток обрабатывают 50 мл воды и 50 мл хл> юформа, подщелачивают
2н. NaOH. Органический слой отделяют, а водный экстрагируют хлороформом.
Органические вытяжки экстрагируют 10 %-й серной кислотой, водные вытяжки
охлаждают до 0 °C, подщелачивают концентрированным раствором NaOH, экстра
гируют эфиром. Эфирные вытяжки упаривают и остаток кристаллизуют из бен
зола. Выход 55 %, т.пл. 135-136 °C.
Конденсация натриевых солей триптофанов (15а, б) с эквимоляр-
ным количеством формальдегида в воде протекает с практически коли-
чественными выходами [12, 13];
3 Карбокси-1,2,3,4-тетрагидро-(?-карболин (13]. Смесь 102 г (0,5 моль) трип-
тофана, 20 г (0,5 моль) гидроксида натрия и 200 мл воды перемешивают до рас-
творения, добавляют 50 г (0,5 моль) 30 %-го формальдегида, перемешивают при
комнатной температуре 2 ч, затем кипятят 3 ч, нейтрализуют (pH 5) 6 н. соляной
кислотой (83 мл) и охлаждают. Осадок отфильтровывают, промывают водой, ме-
танолом, хлористым метиленом и сушат в вакууме (20 мм рт. ст., 100 °C). Вы-
ход 97 %, т. пл. 306 °C.
При проведении реакции в кислой среде в присутствии избытка
формальдегида триптофан дает два продукта: 3-карбокси-1,2,3,4-тетра-
гидро-Р- карболин (выход 59 %) и 9- оксиметил-3-карбокси-1,2,3,4-те-
трагидрокарболин (выход 8,5 %) [14]. Из £-триптофана, £-5-окситрип-
тофана и формальдегида синтезированы соответствующие Р-карбони-
лы, отнесенные к (—) (35)-ряду [15].
По данным [16, 17], замещенные эфиры триптофанов вступают в
реакцию с параформом с образованием 3-этоксикарбонил-1,2,3 4-тетра-
гидро-Р-карболинов, содержащих алкильные заместители в положениях
4 и 5, а также 5-хлор-, 5-циано-, 6-фтор-, 6-зтоксикарбонил- 7-нитро-
производных и др.
В одной из работ сообщалось о получении 1-метил-1,2,3,4-тетра-
гидр о-Р-карболина с выходом 85 % путем конденсации триптамина с
ацетальдегидом в присутствии эквимолярного по отношению к амину
количества серной кислоты [18]. Позднее [19] этот результат был взят
под сомнение, а для достижения высокого выхода продукта реакции
и облегчения его выделения рекомендовалось использовать избыток
кислотного катализатора. В качестве последнего обычно применяют
разбавленные растворы серной и соляной кислот [20—26].
5-Метокситриптамин конденсируется с ацетальдегидом как в кис-
лой, так и в нейтральной среде [9]. В присутствии фосфатног буфера
7
выход 6-метокси-1-метил-1,23,4-тетрагидро-]3-карболина составил
85 % (6 моль СН3СНО, 0,5 ч, 100 °C) [19] и 50 % (2 моль СН3СНО,
дня, 30 С) [20] В случае 5-бензилокситриптамина реакция при
pH 2 сопровождалась сильным осмолением. Выход соответствующего
3-карболина при этом составил всего 28 %, тогда как в нейтральной
среде чистый продукт получен с выходом 93 % [24]
Гидрохлорид 6-бензилокси-1-метил-1,2,3,4-тетрагидро-(3-карболина [241.
Смесь 0,25 г (0,83 ммоль) гидрохлорида 5-бензилокситриптамина, 6,0 мл 10 %-го
раствора ацетальдегида и 6 мл воды выдерживают (pH 6) 1 ч при 85 °C,затем ки-
пятят до образования прозрачного раствора. После охлаждения реакционной мас-
сы в бане с ледяной водой получают 0,254 г (93 %) белых кристаллов с т.пл.
235-237 °C (изводы); тля. основания 160-163 “С.
Триптофан [27, 28] 2-амино-З-(индолил-3) масляная кислота [29] ,
5-бром- [30] и 5-окситриптофаны [15] гладко конденсируются с аце-
тальдегидом в присутствии разбавленной серной кислоты:
меСно
HtS04/Ht0
R=H, Me R*=H. Br, ОН.
Реакцию проводили при температурах 40 °C (18 ч) [30], 60-100
(2,5 ч, выход 66 %) [27] и 25 ЙС (6-12 ч, выход 50-90 %) [15, 28].
В последних случаях в качестве исходных соединении использовались
Z-триптофаны, а продукты реакции выделяли в виде разделяемой сме-
си оптических изомеров.
При получении 4-арил-и гетерил-3-карболинов 16 катализатором
служила водная муравьиная кислота [31,32]:
месно
нсогн
R =н,сОгН;
R' = Ph. ЕД.
Формиат 1-метил-4-феяил-1,2,ЗД-тетрагидро-0-карболин-3-карбоиовой кисло-
ты [32]. К раствору 1 г (3,6 ммоль)2-амино-З-фенил-З-(иццолил-3)пропионо-
вой кислоты в 10 мл 50 ?^й муравьиной кислоты при охлаждении льдом прили
вают 1 мл (18 ммоль) ацетальдегида и оставляют на 75 мин при комнатной тем-
пературе. Реакционную смесь разбавляют равным объемом воды, охлаждают и
получают 0,74 г (59 %) формиата (16); тлл. 251 252 °C (из изо- РгОЦ)
8
Подобно ацетальдегиду с триптамином и триптофаном взаимодей-
ствуют его гомологи и альдегиды более сложного строения. Так, опи-
сана конденсация в разбавленной H2SO4 триптамина [33], 4-метокси-
[34] и 5-метокситриптаминов [20], 5-бром- и 5,7-Дибромтриптофанов
[30] с пропионовым альдегидом, 5-мет окситриптамина с масляным
альдегидом [20] и триптофана с гликолевым альдегидом [28]. Трип-
тамин с хорошим выходом реагирует в присутствии разбавленной со-
ляной кислоты с хлоруксусным альдегидом [35].
Гидрохлорид 1 хлорметил-1 Д3,4-тетрагндро-р-карболина [35] Растворяют
1,6 г (0,01 моль) триптамина в 100 мл НаО н 10 мл 1н. соляной кислоты, филь-
фуют н добавляют 6 мл 2 н. соляной кислоты. При перемешивании вносят 2 г
(0,02 моль) гидрата хлор ацетальдегида и греют 1 ч при 80 “С. После охлаждения
реакционной массы выпавший осадок отфильтровывают и кристаллизуют из во-
ды. Выход 2 г (76 %),т. пл. 235 °C.
В аналогичных условиях триптофанол с глицеральдегидом образует
с выходом 10 % цис 1 (1,2-диоксиэтил)-3-оксиметил-1,2,3,4-тетрагид-
ро-Д-карболин [36] Описано взаимодействие метилового эфира трип-
тофана. с некоторыми перацетилированными альдопентозами и аль-
догексозами, катализируемое трифторуксусной кислотой [37]. Эфиры
альдегидокислот 17 а, б конденсируются с N-зтилтриптамином в кипя-
щем бензоле или толуоле в присутствии уксусной кислоты [38, 39]
+ вено-------
17
16
а - R= -£Н-СНаСО3Ме б - R= -CHjCHjCH^OjEt),.
Выходы 0-карболинов 18а и 186 соответственно равны 79,5 [38] и
95 % [39]. В случае незамещенного триптамина конденсация с эфира-
ми 3-формилмасляных кислот 19 сопровождается циклизацией обра-
зующихся производных |3-карболинов 20 [40,41]:
>9
20
a R=H, R* СО, Et, R2 =Et;б R=Et, R* =Н, R’ =Ме.
Трифторуксусная кислота катализирует взаимодействие триптами-
на с 4,4-ди(фенилтио)-4-метоксикарбонилмасляным альдегидом [42].
9
Альдегиды, неустойчивые в кислой среде, конденсируются с гидрохло-
ридами триптаминов в присутствии фосфатного буфера. Так, например,
реагируют 5-метокситриптамин с изомасляным и фенилуксусным аль-
дегидами [20] и триптамин с секологанином (21) [43]. В последнем
случае с хорошим выходом получаются гидрохлориды в инк оз ид а (22)
и изовинкозида (23), используемые в синтезе гетероиохимбиновых
алкалоидов [44,45]:
Без кислотных катализаторов в водном диоксане протекает реак-
ция гидрохлорида триптамина с 1-формил-4-пентеном и 1-ф ср ми л-4-пен-
тином [46], а в водном метаноле с 1-формил-З-триметилсилил-З-пен-
теном [47]. Аналогично в кипящем бутаноле гидрохлорид 5-ацетил-
триптамина взаимодействует с фенилуксусным и 3-фенилпропионовым
альдегидами [25]. Количественный выход оптических изомеров 1-(п-£>-
арабинофуранозил)-1,2,3,4-тетрагидро-Р-карболина получен при дли-
тельном кипячении водного раствора гидрохлорида триптамина с 2,5-
ангидро-D-маннозой [48].
Условия конденсации триптамина с ароматическими и гетероцик-
лическими альдегидами также весьма разнообразны. Так, традицион-
ная разбавленная Н2 S04 катализирует взаимодействие а-метилтрипта-
мина с вератровым альдегидом [49]. 5-Метокситриптамин и бензаль-
дегид дают 1-фенил-6-метокси-1,2,3,4-тетрагидро-/3-карболин с выходом
76 % в присутствии фосфатного буфера [20].
1-Феннл-6-метоксн-1,2,3,4-тетрагидро-0-карболии [20]. Для приготовления
фосфатного буфера растворяют 2,8 г NaH,PO^H3O в 100 мл воды (раствор Л) и
7,2 г Na,HPO4- 12Н,0 в 100 мл воды (раствор Б~). Смешивают 40 мл раствора/!
и 9,2 мл раствора Б и добавляют воду ^о объема 100 мл. Смесь 0,6 г (3 ммоль)
5-метокситриптамина, 1 г 15 %-П НС1, 1 г (10 ммоль) бензальдегида, 16 мл фос-
фатного буфера выдерживают при 37°С в течение трех дней. Выход гидрохлорида
с тлл. 285 °C 0,75 г (75,5 %). Основание плавится при 164 °C (из спирта).
Иногда полезно проводить реакцию в две стадии с выделением про-
межуточного имина [25,50]:
24
10
Общий выход Д-карболина 24 составляет 64 % [50]
Большой интерес представляют синтез и фармакологические свой-
ства 1-пиридилзамещенных /3-карболинов 25.
Реакцию 2-, 3- и 4-формилпиридинов с гидрохлоридами принтами
на, 1-метшь и 5-метокситриптаминов проводили в кипящем бутаноле
(выход 47 94 %) [51] Конденсацию 5-метокситриптамина с пиридок-
салем осуществляли в условиях, близких к физиологическим (выход
71%) [24]
25
R = Н,Ме , R’ =н,омв, OCHjPh ;
Описано взаимодействие триптамина и эфиров триптофана с 5-аце-
токсиметил-2-формилфураном в кипящем бензоле в присутствии тол)
олсульфокислоты [52].
Гидр оксиламин 26 подобно триптамину конденсируется с алифа-
тическими и ароматическими альдегидами в кипящем метанольном
растворе соляной кислоты с образованием 2-окси-/3-карболинов 28 [53
В уксусной кислоте образуются промежуточные нитроны 27, кото-
рые в присутствии минеральных кислот медленно циклизуются в /3-кар-
болины 28.
Взаимодействие гидрохлоридов 29 с глутаровым альдегидом при
20 °C в течение пяти дней приводит к индолохинолизину 30 [36]:
н НС1
29
снг -сно
(Снг)г - сно
30
R=CH3OH, СО, Me.
11
При разработке методов синтеза природных алкалоидов исследо-
валась конденсация метиловых эфиров!- иD-триптофанов с альдегида-
ми 31а [54, 55],316 [56] и31в [57].
СОгме С0?Ме
I 1 if NH +r-C-CH,CHO —- Г Й Й X
* Me й снг
I
31 ме - с - ме
32 R
a R=H;6- R=SPh;B R=OH.
Образование смеси цис- и транс-изомеров Р-карболинов 32а без за-
метной рацемизации происходит при проведении реакции в хлористом
метилене в присутствии трифторуксусной кислоты [55]. В разбавлен-
ной Н2 S04 метиловый эфир триптофана гладко конденсируется с бен-
зальдегидом и 2-формилпиридином. Однако в случае о-нитр©бензаль-
дегида и салицилового альдегида выходы тетрагидро-Р-карболинов в
этих условиях составляют соответственно только 40 и 3,5 % [58].
Алифатические и ароматические альдегиды могут взаимодейство-
вать с триптаминами и триптофанами в виде ацеталей и полуацеталей
[59—63], циклических полуацеталей- [64, 65], кеталей [66] п-окси-
лактонов [67], енольных эфиров [64, 68], 2-алкил- и 2-арилимцдазо-
лцдинов [69—71]. Катализаторами при этом служат трифторуксусная
[60, 68], 90 %-я муравьиная [61, 62], разбавленная уксусная [59, 64,
66] кислоты и эфират трехфтористого бора [68]. Такой подход оказал-
ся весьма эфф ктивным для синтеза алкалоидов трипаргина [59],
эбурнамонина, квебрахамина, винкадина, зпивинкадина [64], дигид-
рокддамбина [61,62] и соединений ряда зудистомина [60].
Способность циклических тиокеталей расщепляться под действием
йодистого метила использована для получения (±)-коринантеидола
(35) из триптамина (33) [72]. Циклизация альдегида 34 катализиру-
ется выделяющейся в процессе иодистоводородной кислотой:
34
Скрытой формой диальдегида 37 можно считать диол 36, который
под действием НЮ4 расщепляется с одноврет снной циклизацией в
Р-карболин 38, применяемый в синтезе алкалоида метиладируби-
на [73].
При конденсации триптамина с диэтилзтоксиметиленмалонатом
неожиданно с высоким выходом получен 3,4-дигидро-Р-карболин (40)
в результате отщепления малонового эфира от промежуточного тетра-
гидро-Р-карболина 39 [68]:
+ (НОгС)гС =сн -он
С(СОгН)г
40
При кипячении гидрохлорида триптамина с трехкратным избытком
диметилацеталя ацетилацетальдегида 41 или 4-метоксибут-3-ен-2-она
в безводной уксусной кислоте вместо ожидаемого 1-ацетонилтетрагид-
ро-Р-карболина 42 образуются тетрациклические структуры 43 и
44 [74]:
(0[7]Онг + (мео)гсн снг-с -ме — QQ^Ih
К нее 0 снгсоме
41 «
13
12
41
R
46
R
EtOH/HCl
Выход индолохинолизина 43 составляет 39 %. Его можно повысить
до 69 %, если реакцию проводить в присутствии хлоранила. В послед-
нем случае ицдолохинолизин 44 в реакционной смеси не регистрируется.
1.1.2. КОНДЕНСАЦИЯ С сьКЕТОКИСЛОТАМИ
Наравне с альдегидами и практически одновременно с ними для
синтеза тетрагидро-Р-карболинов стали применяться о-кетокислоты Из-
вестны многочисленные примеры взаимодействия триптаминов и трип-
тофанов с глиоксиловой, пировиноградной, а-кетоглутаровой, фенил- и
арилпировиноградными кислотами [3, 75]. Реакция протекает при
комнатной температуре с образованием 1 замещенных 1карбокси-
1,2,3,4-тетрагидро-Р-карболинов Так, триптамин, серотонин и 5-меток-
ситриптамин с фенилпировиноградной кислотой при pH 6,5 в течение
48 ч превращаются в /3-карболины 45 с выходами 90-94 % [76]
R
R = н,оме .
Продукты декарбоксилирования можно получить в одну стадию,
если проводить реакцию при повышенных температурах. Например,
нагревание водного раствора гидрохлорида триптамина и 3,4-ди окси
фенилпировиноградной кислоты в течение 12 ч приводит к /3-карболину
48 с выходом 71 % [82]:
+ снгсосогн
W s Л
Он
ИНг + ₽ьснгсосо8н
R
45
HH
COjH
Ph
R=H, OH OMe.
Аналогично глиоксиловая кислота взаимодействует с 1-фенил- [77],
5-бром- [78], Р-карбокси- [79], 4-зтоксикарбонил- и 4-ацетилтрипта-
минами [80], пировиноградная — с триптамином [28], «-кетоглутаро
вая кислота - с триптамином [81] и 5-метокситриптамином [24]
1-Карбоксн-1- (2-карбоксиэтнл) -б-метокси-1 Д 3Л-тетрагидро-Р карболин] 24].
Раствор 0,8 г (5,5 ммоль) а-кетоглутаровой кислоты и 0,7 г (3,6 ммоль)
5-метокситриптамина в 15 мл этанола перемешивают при комнатной температуре
в течение ночи. Выпавший осадок отфильтровывают и сушат в вакууме. Выход I г
(100 %), тли. 183-185 °C.
Этиловый эфир глиоксиловой кислоты с триптамином дает 1-зто-
ксикарбонил-1,2,3,4-тетрагидро-0-карболин с выходом 70 % [36]
1 Карбокситетрагидро-Д-карболины при нагревании с соляной кислотой
[79] или метанольным раствором НС] [50] гладко декарбоксилируют-
ся. При этом в случае (З-карболннов 46 происходит внутримолекуляр-
ная циклизация с образованием индолонафтиридинов 47 [24, 81] :
14
48
В аналогичных условиях осуществляется взаимодействие 1-фенил-
[77] и 4-метокситриптаминов [83] с глиоксиловой кислотой, 4-мето-
кситриптамина с пировиноградной кислотой [83], 1-метил- и 1-метил-б-
метокситриптаминов с этоксикарбонилпировиноградной кислотой
[84, 85]
5-Метокси-1,2,3,4-тетрагндро-/3-карболив ]83]. Раствор 0,48 г (2.13 ммоль)
гидрохлорида 4-метокситриптаммна и 0,16 г (2,13 ммоль) глиоксиловой кислоты
в 50 мл воды кипятят при перемешивании 1 ч, охлаждают до 20 °C, подщелачи-
вают 20 %-м раствором NaOH и экстрагируют 250 мл этилацетата. Органическую
фазу сушат MgSO4 и упаривают. Выход 49 %, т.пл. 213 214 °C.
5-Ацетилтрипгамин конденсируется с 4-метокси- и 3,4-днметокси-
фенилпировиноградными кислотами в кипящем бутаноле [25]. Этот
же растворитель использован для получения (3-карболинов 49, прояв-
ляющих свойства транквилизаторов [86].
COjH
Г
О
R
R1
'I +
NHj
R=H.OMe, 0СН2П1, Cl; R* =OH. OMe. OCH,Ph, CL
15
Триптамин и его производные при нагревании с метиловым эфиром
пировиноградной кислоты в метаноле превращаются в 1-метил- 1-мето-
ксикарбонил-/3-карболины (50) [87, 88}:
50
a R=R‘=R’=H;6 - R-Me, R'=R’=H,b- RR’-H, R‘=OMe;
r-R=R*=H, R’ = OMe.
1-Метил-1-метоксикарбонил-133Л-тетрагццро-0-карболми [87]. Раствор 4 г
(20 ммоль) гидрохлорида триптамина и 2 мл (22 ммоль) метилового эфира пн-
ровинохрадной кислоты в 80 мл сухого метанола кипятят 21 ч, затем раствори-
тель упаривают в вакууме. Остаток растворяют в горячей воде, фильтруют и до-
бавляют 3 мл концентрированного гидроксида аммония. Кристаллический осадок
перекристаллизовывают из водного спирта. Выход 3,5 г (72 %), т.пл. 136-138 0С,
Триптамин и 5-метокситриптамин конденсируются с зтоксалилук-
сусным эфиром при'20 °C в этаноле в присутствии соляной кислоты
[89,90]:
R _________нет R хх
г j if 1 + COCOeEt — ... I jl—_
nh2 i мн
" СНгСОгЕ* S X COj£l
COjEt
51
iwaoH R
2HzS°4 Й ™
СНгСОгЕ1
52
Последовательная обработка образующихся диэтиловых эфиров
1-карбокси-1-карбоксиметил-0-карболинов (51) растворами щелочи и
кислоты приводит к эфирам 1-карбоксиметилтетрагидро-£-карболи
нов (52).
В новом подходе к синтезу производных алкалоида винкамина ис-
пользован дизфир дикетоадипиновой кислоты [91] Кетодизфир 53 при
нагревании с муравьиной кислотой и последующей обработке цианбо-
рогидридом натрия превращен в оксикислоту 54, циклизующуюся
при кипячении в спирте в тетрациклический оксиамид 55
CHCtj
65’С
53
16
Триптофан взаимодействует с глиоксалевой и пировиноградными
кислогами при комнатной температуре, эфир триптофана с а-оксоглу-
таровой кислотой при 80 °C [28] В последнем случае продуктом реак-
ции является индолоиндолизин 56:
^согме ° ' С02ме
UQ К + СОгН — ^\Nr°
Й нС1 СНгСНгСО2Н
56
1,3-Дикарбокси-1,2,3,4-тетрагидро-0 карболин [28]. К раствору 6 I
\^(29,4 ммоль) Х-триптофана в 100 мл 0,1н. серной кислоты добавляют 3 г
Х^ЗЗ ммоль) моногидрата глиоксиловой кислоты, и смесь перемешивают 12 ч Вы
\ павший осадок отфильтровывают, промывают водой и сушат. Выход 6,8 г (89 %),
j^-тлл. 269-271 °C.
При нагревании 5-метокситриптамина с 4-оксифенилглиоксиловой
кислотой в водной серной кислоте получается смесь стереоизомеров
1- (4-оксифенил)-3-карбокси-6-метокси-1,2,3,4-тетрагидро-/3-карболи-
на [92]
Эфиры триптофанов 57 с высоким выходом превращаются в 0-кар-
болины 58 [93, 94], однако при этом образуется значительное коли-
чество 3,4-дигидропроизводного 59 [93]:
a R=CH3OMe, R‘=OCH3Ph;6 - R=Me, R’=OPr-i
Продукты реакции без разделения применяются для получения аро-
матических 3-карболинов.
Конденсация метилового эфира триптофана с эфиром глиоксило-
вой кислоты протекает в кислой среде при умеренном нагревании [58].
В качестве побочного продукта образуется ароматический 1-зтоксикар-
бонил-З-метоксикарбонил-0-карболин (60):
1.1.3. КОНДЕНСАЦИЯ С КЕТОНАМИ
Алифатические и алициклические кетоны также можно использо
ватъ в реакции Пикте Шпенглера. Обычно процесс проводят в две ста-
дии. стандартными методами получают основание Шиффа 61, которое
циклизуют в 0-карболин 62 в присутствии кислоты:
61
R=Me; R+R=(CH2 )4. (СН,.
62
Продукты конденсации триптамина и 5-метокситринтамина с ацето-
ном с низкими выходами превращаются в соответствующие 1,1-диме-
тип-£-карбо л ины под действием хлорокиси фосфора [95]. Циклопен-
тилиндентриптамин при нагревании с 1н. серной кислотой при 110 °C в
течение 20 мин дает 1-спироциклопентано-Р-карболин с выходом 50 %
[96] Циклизация циклогексилиденпроизводного триптамина осущест
вляется под действием соляной кислоты с выходом 82 % [97]. 1,2-Цик-
логександион при нагревании с триптамином и 5-метокситриптамином
в хлороформе или толуоле в присутствии л-толуолсульфокислоты
превращается в кетимины 63, которые в хлороформе под действием
НС] или трифторуксусной кислоты (23 °C, 3 ч), а также в ме-
танольном растворе H2SO4 гладко циклизуются в спирокарбо-
лины 64 [97]:
о
Бобовский и Шавел [98] с целью поиска новых антигипертензив-
ных средств синтезировали ряд 1-спиропроизводных тетрагидро-0-кар-
болинов 68—70 по двухстадийной схеме с использованием циклических
Р-кетоэфиров и 0-дикетонов. Основания Шиффа 65 67 получены азео-
тропной отгонкой воды, при этом в случае дикетонов образуется
смесь иминов (66) и (67) в соотношении 4 1. Циклизация осущест-
18
влялась в присутствии трифторуксусной кислоты или раствора хлорис-
того водорода в хлороформе:
й' = ме Et СНцОме; х = Снг, (Снг)г , (Снг)3 .
Разработан также одностадийный метод получения (3-карболинов
62а-в в присутствии этилполифосфата в качестве катализатора [99].
1,1-Диметнл-1,2Д,4-тетрагадро-£-карболин [99]. Раствор 0,66 г триптамина
и 3 г этилполифосфата в 80 мл ацетона кипятят в течение 36 ч. Растворитель уда-
ляют в вакууме, остаток растворяют в воде и нейтрализуют 4н. NaOH. Осадок
(0,54 г, 66 %) кристаллизуют нэ циклогексанона; тлл. 140-141 °C.
Основания Манн их а на основе дибензилкетона (71а) и циклопен-
танона (716) конденсируются с гидрохлоридом триптамина под дей-
ствием 2н. серной кислоты в ацетатном буфере при выдерживании сме-
си реагентов в темноте при 25 °C в течение 12 дней [96].
19
R=-CH,-N О; a- R* =Ph;6-R*+R'=(€!!,),
Реакцию с 1-диэтиламинобутаноном-З, /3-днэтиламино- и (3-анили-
нопропиофенонами провести не удалось [96] Легко протекает конден-
сация ацетона с 6-окси- и 6-алкокситриптаминами [95]. Так, триптамин
72 превращается в (3-карболин 73 уже при перекристаллизации из аце-
тона:
72
+ мегс = о
73
6-Бензилокси- и 6-метокситриптамины взаимодействуют с ацето-
ном в среце ацетатного буфера (pH 4,7) при 25 °C в течение семи дней,
превращаясь в соответствующие 1,1-диметилзамещенные /3-карболины
с выходами 51 и 95 % [95].£-Триптофан кондейсируется с ацетоном и
оксиацетоном в присутствии серной кислоты с образованием оптичес-
ки активных 1,1-дизамещенных 3-карбокси-тетрагидро-(3-карболи-
нов [28]
1,1-Диметил-3-карбокси-1ДДД-тетрагндро-|3-карболии (28J. Раствор 15 мл
(327 ммоль) ацетона и 5 г (24,5 ммоль) /.-триптофана в 40 мп 1М серной кисло-
ты кипятят в течение ночи, нейтрализуют твердой NaOH и охлаждают. Ацетон упа-
ривают, осадок фильтруют и сушат. Выход 5,4 г (91 %),т.пл. 227 228°С (разл.),
ар - 118° (СО,5; O.ln.NaOH),
В результате длительного кипячения спиртовых растворов трипто-
фана с циклопентаноном и циклогексаноном в присутствии 1н. серной
кислоты с невысокими выходами выделены соответствующие тетра-
гидро-0-карболины [95]. Область применения реакции Пикте Шпенгле-
ра распространяется также на триптамиды и N-ацилтриптофаны Так,
кетоамиды 74 циклизуются в метанольном растворе соляной кислоты
с одновременным образованием двух циклов [100]:
R=Me, Et, i-Pr, Ph.
20
74
Карболины аналогичного строения получены на основе триптами-
нов 75, содержащих концевые дитиоцетальны^ группы [101 103]
Тетрациклические (3-карболипы 76 применяются при синтезе алка-
лоидов ряда антирина и аспидоспермы [101 103].
1.1.4. КОНДЕНСАЦИЯ С КАРБОНИЛЬНЫМИ СОЕДИНЕНИЯМИ
В АПРОТОННОЙ СРЕДЕ
Наиболее существенный вклад в развитие реакции Пикте—Шпенг-
лера в последние годы внесли Кук и сотрудники [104], которые обна-
ружили, что эфиры триптофана со многими алифатическими и арома-
тическими альдегидами в кипящем бензоле в отсутствие кислотных ка-
тализаторов не дают ожидаемых оснований Шиффа, а превращаются в
тетрагидро/З-карболины [104]. В дальнейшем было установлено, что
кроме эфиров триптофана подобным образом реагируют N-бензил-
триптамины [105, 106]. Незамещенные по алифатическому атому азота
триптамины в этих условиях образуют лишь имины 77 [105] Такая из-
бирательность объясняется тем, что сложноэфирная и бензильная груп-
пы повышают электрофильность двойной ON-связи в иминах 78 и 79
77 78 79
настолько, что их последующее превращение в (З-карбопины становится
возможным без участия кислотных катализаторов в апротонных раст-
ворителях
Очевидно, что наиболее благоприятные условия для протет зния ре-
акции реализуются в эфирах N-бензилтриптофанов, в которых согласо-
21
ванно действуют оба фактора, способствующие циклизации. Катализ,
по-видимому, все же имеет место и осуществляется он следами карбо-
новых кислот, образующихся из альдегидов путем окисления кислоро-
дом воздуха Действительно, проведение процесса в инертной
атмосфере существенно замедляет его протекание, а внесение в
реакционную смесь акцепторов протонов полностью подавляет цикли-
зацию [106].
В большинстве случаев проведение конденсации в апротонных
растворителях повышает выходы тетрагидро-0-карболинов по сравне-
нию с традиционной методикой с использованием кислотных катализа-
торов [29, 105, 107-113], Преимущество нового подхода особенно
наглядно при конденсации эфиров триптофана с салициловым альде-
гидом Как уже отмечалось, выход /3-карболина при проведении реак-
ции в среде разбавленной серной кислоты составил 3,5 % [58] При-
менение метилового эфира N-бензилтриптофана и толуола в качестве
растворителя повышает его до 97 % [105]. Бензильную группу можно
удалить затем путем каталитического гидрогенолиза.
1 (2-Оксифенил)-2-беизил-3-метоксик«рбонил-1,2,3>4-тетрагидро-(3-карболии
[ 105]. Раствор 14,5 г (47 ммоль) метилового эфира N-бензилтриптофана и 10 мл
(95 ммоль) салицилового альдегида в 150 мл толуола кипятят 16 ч с насадкой
Дина-Сгарка для удаления образующейся воды. При медленном охлаждении
раствора до комнатной температуры выпадает белый кристаллический осадок.
Выход 18,6 г (97 %), т.пл. 243 245 °C.
Не менее продуктивна модифицированная реакция Пикте-Шпен-
глера в тех случаях, когда альдегиды содержат лабильные по отноше-
нию к кислотам функциональные группы, такие, как ацетали и ацето-
ниды. Выходы тетрагидро-Р-карболинов при этом в три-четыре раза вы-
ше, чем в водных кислотах {105]
1-Диэтоксиметил-2-бенэил-1,2,3,4-тетрагидр<нЗ-кзрболинЦ05].Раствор4,35 г
(27 ммоль) N-бензилтриптамииа и 4 5 г (34 ммоль) диэтилацеталя глиоксаля в
100 мл бензола кипятят при перемешивании с насадкой Дина-Старка до прекра-
щения отделения воды, бензол упаривают, остаток кристаллизуют из метанола.
Выход 92 %, т.пл 130 °C.
Использование апротонной среды на стадии образования Р-карбо-
лина 80 позволило решить проблему синтеза ингибитора Р-галактоэи-
дазы пиридиндола 81 Схема его получения включает конденсацию ме-
тилового эфира триптофана с ацетонидом глицеринового альдегида
в кипящем бензоле с последующей ароматизацией тетрагидро-0-карбо-
лина 80 над палладием, восстановлением сложноэфирнои группы и сня
тием ацетонидной защиты [105] Общий выход рацемического пирид-
индола 81 составил 35 %:
СНОП
снгон
81
Неустойчивые в кислотах 4-оксогексаналь и эфир 3-формилпропио-
новой кислоты в апротонной среде гладко конденсируются с эфиром
N-бензилтриптофана [105, 107]. 2-Кетоглутаровая кислота при нагре-
вании в бензоле с триптофаном 82а дает индолоиндолизин 83 с выхо-
дом 80 % [105].
N-Бензилтриптофан 82в в этих условиях превращается в смесь
Р-карболинов 84 (R=H) и 85 в соотношении 1:2,5 [105]. В среде бен-
зол — диоксан основным продуктом реакции становится Р-карболин 84
(R=H) [111, 112]. Если блокированы оба атома азота 826, тоске
личественным выходом гс~-~------п .^копииттлпиилн.
L -w——----- । 826, то с ко-
образуется Р-карболинпропионовая кислота 84
(R=CH3) [105, 109]
84 б5
a - R=R*=H;6 - R=Me.
R'=CH2Ph;B — R=H,
H’=CIl2Pli.
22
Алифатические и алициклические кетоны конденсируются с мети-
ловым эфиром триптофана в кипящем толуоле [ИЗ]. Выходы /3-кар-
болинов 86 составляют 52-86 %:
R=R=Me, Et;R=Me, R‘=Et;R=Me, R"=CH2Ph, R'+R=(CH3)« , (CH3),.
При нагревании метилглиоксаля с триптофаном 87 в ксилоле в
течение 10 ч с выходом 89 % образуется ароматический /3-карболин
йй ГОО1
месосно
Проблему активации ON-двойной связи оснований Шиффа 77 мож-
но решить также проведением циклизации в присутствии хлорангидри-
дов кислот в среде пиридина или триэтиламина. Такой прием позволил
осуществить реакцию Пикте-Шпенглера с а,Р-непредельными альдеги-
дами. Так, из иминов 89а, б, синтезированных конденсацией триптами-
на и метилового эфира триптофана с 3,3-диметилакролеином, ни в кис-
лой среде, ни в условиях азеотропной циклиэавди получить соответ-
ствующие 0-карболины не удалось. В буферном растворе с pH 6,2 имин
89а превращается в 0-карболин 91 с гидратированной двойной связью,
и только при использовании в качестве конденсирующего агента тозигь
хлорида в пиридине выделены 2-тозил-0-карболины 90а. б [114]
( П ЫН + ме?с =сн-сно---[ й—-T-S-Ct.
" L ме
Вместо тозилхлорида можно взять хлорформиаты [115, 116]. При
этом в присутствии 1,1-диметил-2,2,2-трихлорэтилхлорформиата (92,
R=CHa) имин 896 дает смесь стереоизомеров 0-карболина 93, тогда
как при действии 2,2,2-трихлорэтилхлорформиата (92, R-H) образует-
ся исключительно транс-изомер [115]:
согме
895 + С13С - С - 0С0С1 -— Г ? j] I
О Чр Ч/ЧА/ЬС-О -с -СС1,
□2 -А 0 R R
уме
R =н ме. 93 ме
По реакции Пикте Шпенглера, инициируемой хлорформиатом,
синтезирован алкалоид боррерин [116]. При циклизации бензилиден-
триптамина 94 имеет значение порядок смешения реагентов [117]. По-
следовательное добавление к бензольному раствору имина 94 хлоран-
гидрцдов уксусной или фталимидоуксусной кислот и триэтиламина
приводит в основном к Д-карболинам 95. При изменении порядка сме-
шения реагентов получается лишь (3-лактам 96:
1.1.5. СТЕРЕОХИМИЧЕСКИЕ АСПЕКТЫ
РЕАКЦИИ ПИКТЕ-ШПЕНГЛЕРА
В синтезе природных алкалоидов, включающих систему 1,3-диза-
мещенных тетратидро-0-карболинов, важен стереохимический конт-
роль на стадии формирования гидрированного пиридинового кольца.
С этой целью разработаны приемы проведения реакции Пикте-Шпенг-
лера, приводящие преимущественно к цис- или транс-нзомерам. Исполь-
зование в качестве исходных веществ эфиров триптофана, имеющих
бензильную группу у атома азота аминокислотного фрагмента, приво-
дит в основном к транс-изомерам [118—121]. Конформационный ана-
лиз показал, что определяющим фактором здесь является стерическая
ситуация, создаваемая объемистым бензильным заместителем, при ко-
торой наиболее выгодно транс-расположение заместителей [119] При
необходимости бензильную группу можно легко удалить гидрогено-
лизом [118,119].
Предложен метод стереоспецифического превращения оптически
активных цис- 1,3-дизамещениых 1,2,3,4-тетрагидро-Д-карболинов в
25
транс-диастереомеры [122] При кипячении в 1 %-м растворе хлорис
того водорода в метаноле /щоизомеры 98 количественно превращают-
ся в соединения с транс-расположенными заместителями 97-
согме сн0 д
N NHCHjPh 4 сн? снг_снгсо2ме -нго"
й
98
_______1%-я на
Поскольку последние в указанных условиях не изменяются, метод
пригоден для обработки смесей стереоизомеров для получения в чис-
том виде транс -изомеров
В свою очередь цис-1,3-дизамещениые тетр агидр о-(3-карб олины
можно синтезировать с высокой степенью стерео- и энантиоселектив-
ности, проводя реакцию Пикте-Шпенглера при комнатной или более
низкой температуре [55, 123, 124] Конденсацию осуществляют обыч-
но в хлористом метилене в присутствии трифторуксусной кислоты как
катализатора. Предложен механизм образования цис и транс-тетра-
гидро-0-карболинов в зависимости от температуры [125].
Состав смесей стереоизомеров и их абсолютных конфигураций
удобно определять с помощью спектров ЯМР 13С. Сигналы атомов уг-
лерода С-1 и С-3 в транс- диастереомерах расположены в более сильном
поле по сравнению с соответствующими сигналами пнс-изомеров [ИО]
1.2. ВНУТРИМОЛЕКУЛЯРНАЯ ЦИКЛИЗАЦИЯ ЕНАМИНОВ
В основе большой группы синтезов 1,2,3,4-тетрагидро-|3-карболи-
нов лежит подход, включающий предварительное получение енами-
нов 99. Обработка последних кислотами приводит к иминиевым катио-
нам 100, циклизующимся в Р-карболины 101 по схеме реакции Пикте-
Шпенглера:
100
26
99
101
Разнообразие методов получения енаминов типа 99 обусловило ши-
рокое применение этого пути для синтеза природных алкалоидов. Так,
енамин 103, образующийся при конденсации N-метилтриптамина с про-
изводными пиридина 102, при обработке серной или муравьиной кис-
лотой с высоким выходом превращается в /3-карболин 104 — ключевое
соединение в синтезе мостовина 105 [126, 127]
Конденсацией производных триптамина и триптофана 106 и ПО с
активированными ацетиленами 107 [128—133] и 0-дикарбонильными
соединениями 111 [134, 135] получены енамины 108 и 112, циклизую-
щиеся в присутствии трифторуксусной кислоты в /3-к арб опины 109
и 113:
К-н,согме, CHjCN; я’-н,Е4,снгсогме,Снгрп, Кг-н,со2ме; R^cOjMe.COMe;
27
сг3согн
из
R Н, СО,Ме, СО2СН2СОРЬ; R1 =Н, Me, ОМе, СН,СО,Ме; R2 Me. OFt,
СН2СО,Ме, NH3,NEt3.
Замещенные 0-карболины 109 применяются в синтезе многих страх
ниновых алкалоидов [130 132] При взаимодействии триптамина и
имидазолина 114 образуется енамин 115, который циклизуется в зфир-
но-метаиольном растворе НС1 в течение 5 мин в карболин 116, исполь-
зующийся в синтезе производных иохимбина [136]:
На основе триптамина и изатового ангидрида разработан эффектив-
ный метод получения алкалоида рутеркарпина 119 [137, 138], в кото-
ром хиназолон 117 служит азааналогом енамина. Он с высоким выхо-
дом циклизуется в пентациклическое соединение 118, гидролизующе-
еся в рутекарпин с количественным выходом:
119
28
Весьма плодотворно направление рассматриваемой реакции, бази-
рующееся на применении в качестве енаминов ч тично гидрированных
I изводных пиридина. Так, замещенный индоло- [2,3-е] хинолизидин
121 можно синтезировать из 1,4-дигидропиридина 120, который по-
лучают конденсацией триптамина, этилпропиолата
уксусной кислоте [139]:
Ас ОН
и бензальдегида в
I 1
Е10гС CO2Et
PhCHO
Циклические епамины образуются и при действии некоторых вос-
становителей на 1- [0-(3-индол ил) этил] пиридиниевые соли. Дитионит
натрия в нейтральной или щелочной среде восстанавливает соли 122 до
малостабильных 1,4-дигидропиридинов 123, легко циклизующихся в
0-карболины 124 [140, 141]
122 '23
О
R= -(-Ph, -CN, CH = CH -CO2Me.
Можно получить енамин 126 восстановлением соли 125 водородом
над палладием в присутствии триэтиламина [142] В нейтраль-
ной среде происходит исчерпывающее гидрирование пиридиново-
го ядра [143].
126
Бенкерт с соавторами [144] при попытке щелочного гидролиза
сложноэфирной группы енамина 128, полученного восстановлением со-
ли производного никотиновой кислоты 127, обнаружил, что при этом
происходит отщепление карбоксильной группы и продукт декарбокси-
лирования спонтанно циклизуется в индолохинолизиднн 129:
29
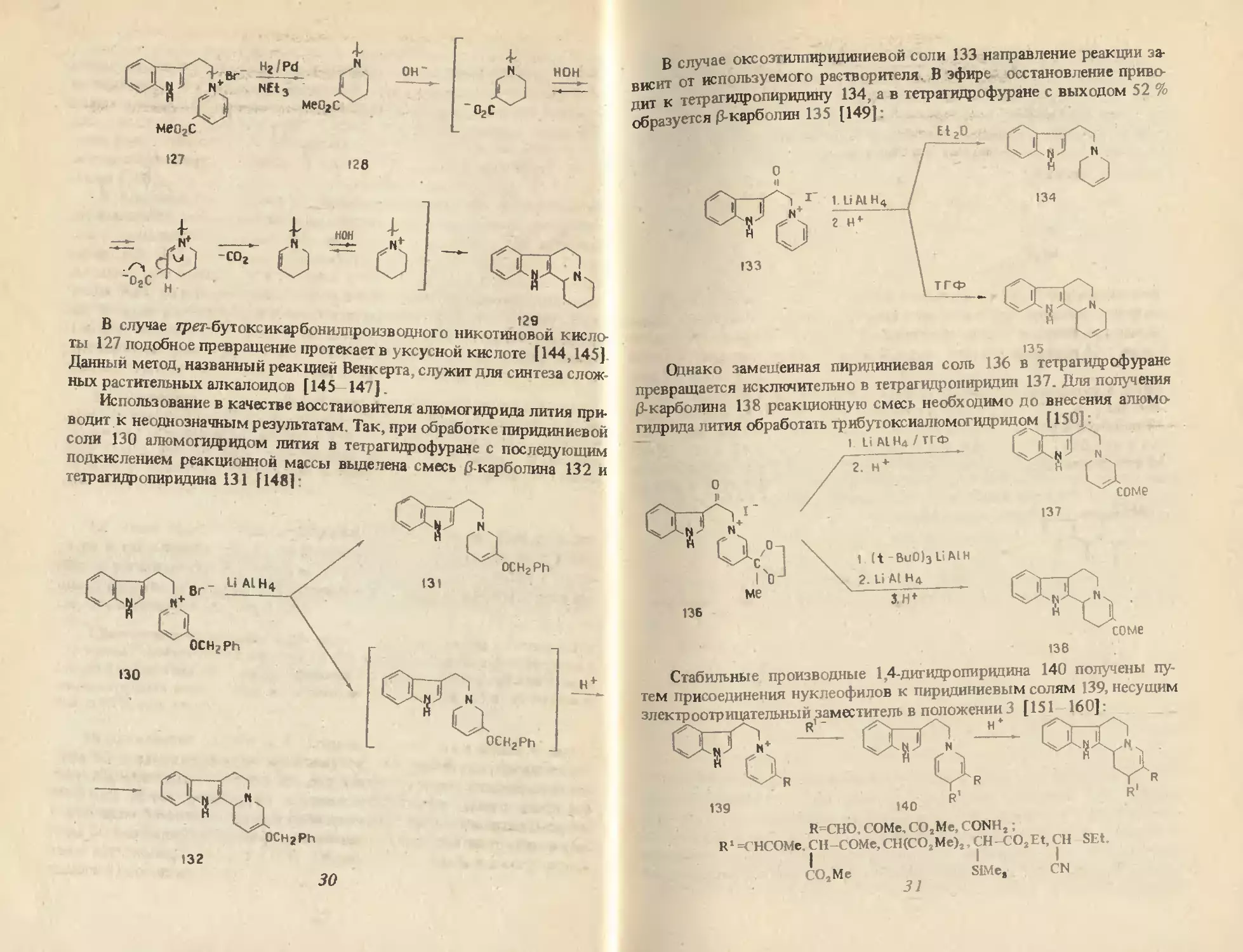
В случае оксоэтилпиридиниевой соли 133 направление реакции за-
висит от используемого растворителя. В эфире постановление приво-
пит к тетрагидропиридину 134, а в тетрагидрофуране с выходом 52 %
Д ~---а...-ПС Г1АО1-
129
В случае трег-бутоксикарбонилпроизводного никотиновой кисло-
ты 127 подобное превращение протекает в уксусной кислоте [144,145}
Данный метод, названный реакцией Бенкерта, служит для синтеза слож
ных растительных алкалоидов [145 147].
Использование в качестве восстановителя алюмогидрида лития при-
водит к неоднозначным результатам Так, при обработке пиридиниевой
соли 130 алюмогидридом лития в тетрагидрофуране с последующим
подкислением реакционной массы выделена смесь 0-карболина 132 и
тетрагидропиридина 131 [148]
Однако замещенная пиридиниевая соль 136 в тетрагидрофуране
превращается исключительно в тетрагидронирвдин 137. Для получения
(3-карболина 138 реакционную смесь необходимо до внесения алюмо-
гидрида лития обработать трибутоксиалюмогццридом [150]:
136
Стабильные производные 1,4-дигидропиридина 140 получены пу-
тем присоединения нуклеофилов к пиридиниевым солям 139, несущим
электроотрицательный заместитель в положении 3 [151 160]
----/Ч Н*
R=CHO, СОМе, СО2Ме, CONH, ;
R* =СНСОМе. СН-СОМе,СН(СО2Ме)2, CH-CO2Et, CH SEt
I I I
СО2Ме SiMe, CN
Приведенные превращения положены в основу общей концепции
синтеза некоторых тетра- и пентациклических алкалоидов [151]. В про-
цессе реакции обычно происходит внутримолекулярная циклиза-
ция функциональных заместителей. Так, были получены О-метил-
15,16,17,18,19,20-гексагидроиохимбин и его гегероаналоги [154], а
также нафтиридинокарболины 141 образующие скелет алкалоида на-
уклефина [155]
144
R.c-co?tt
Аналогичный процесс использован в синтезе алкалоида антирина
149 Образующийся при восстановлении лактама 147 а-оксиамин 148
дегидратируется и циклизуется под действием соляной кислоты [163]
Аминонитрилы 142 при взаимодействии с натриймалоновым эфи-
ром также превращаются в функционализированные циклические ена-
мины [161]. Реакция протекает в присутствии хлорида цинка, который
способствует отщеплению циангруппы:
н+/меон
R - Н, Et
Циклические имиды также превращаются в оксилактамы, которые
циклизуются в 3-карболчны при нагревании с соляной кислотой [164
165]:
При разработке метода получения алкалоида декарбометоксинаук-
лехина 146 провести циклизацию амида 143 в условиях реакции
Бишлера-Напиральского не удалось. В этом случае эффективным ока-
зался путь, включающий восстановление амида 143 диизобутилалюми-
нийгидридом до а-оксиамина 144, который без выделения дегидрати-
ровали в енамин 145, циклизующийся в присутствии муравьиной кис-
лоты [162]:
32
Имиды, синтезированные конденсацией триптамина с ангидридами
янтарной, глутаровой, циклогександикарбоновой и фталевой кислот,
восстанавливались борогвдридом натрия в условиях контроля pH сре-
ды [164] или в присутствии хлоридов различных металлов в качестве
катализаторов [165]
1.3. МЕТОД ОКИСЛИТЕЛЬНОЙ ЦИКЛИЗАЦИИ
В 1962 г Венкерт [166], используя способность ацетата ртути окис-
лять третичные амины в соответствующие иминиевые соли, разработал
33
стратегию иолучения тетра- и пентациклических /3-карболиновых алка-
лоидов на основе 3- (2-пиперидиноэтил) индолов (150):
1.4 МОДИФИЦИРОВАННАЯ РЕАКЦИЯ ПОЛОНОВСКОГО
Для получения иминов типа 158 используют модифицированную
еакцию Полоновского, которая в приложении к 3- (2-пипериди ю-
зтил)индолам (155) заключается в обработке последних перекисью во-
дорода с последующим взаимодействием N-оксидов (156) с трифтор-
уксусным ангидридом. Имины 158 циклизуются в 0-карболины 159
в присутствии минеральных кислот [179]
Z 0 Г
У,
Н2 112
R
156
<CF3C01г0
I OCOCF-J
N С
R
СГ3СОг
157
Для успешного проведения реакции необходим избыток ацетата
ртути. При этом часть тетрагидро-Д-карболина 151 окисляется до ими-
на 152, в связи с чем в процедуру выделения продукта реакции вклю-
чают обработку реакционной массы борогидридом натрия
Синтез обычно проводят в разбавленных водных растворах спирта
или уксусной кислоты в присутствии динатриевой соли этилендиамин-
тетрауксусной кислоты. Выходы могут достигать 50 %. Метод широко
используется для получения алкалоидов ряда иохимбина [167—170],
аймалицина [170-173], резерпина [174, 175], антирина [147], кори-
антеидола [176]. Окислительной циклизацией хиназолина (153) син-
тезирован алкалоид эводиамин (154) с выходом 82% [177]
Н (
R '
155
R=H, Et, СМе,,СН,СО,Е1, CH СИ, О Ас.
Таким путем получены ключевые соединения для синтеза многих
сложных алкалоидов [147,179-181] Выходы (Ткарболинов не превы-
шали 50 % из-за образования на стадии 157-Л58 эндоциклической двой-
ной связи В несимметрично замещенном насыщенном пиперидине 160
153 154
По данным [178], оптимальным условием получения индо-
ла [2,3-а] хин олизидина (151) является кипячение в течение 3 ч раство-
ра 3-(2-пиперидиноэтил) индола (150) в 33 *%>м водном спирте в присут-
ствии трехкратного избытка ацетата ртути и динатриевой соли зтилен-
диаминтетрауксусной кислоты. Затем реакционную смесь подщелачи-
вают до pH 9, добавляют борогидрид натрия, оставляют на 16 ч при
20° и выделяют продукт реакции 151с выходом 85 %.
данная реакция приводит к смеси двух экзоциклических имидов, вы-
деленных в виде аминонитрилов 161 и 162 после обработки реакцион-
ной массы цианидом калия [182]:
1. АдВРф
2 НС1
34
Аминонитрилы подобного типа легко отщепляют циангруппу под
действием солей серебра, вследствие чего могут применяться для полу
чения тетрагидро-Р-карболинов в качестве эквивалентов соответствую-
щих иминиев ых с олей [182—185].
15. РЕАКЦИЯ ФИШЕРА
Реакция Фишера представляет собой метод синтеза 1-оксо-1,2,3,4-те-
трагидро-Р-карболинов 164 путем кислотно-катализируемой пере-
группировки арилгидразонов 3,2-диоксопипервдинов 163 Арилгидра-
зоны 163 получают конденсацией арилгидразинов с 3-оксопиперидо-
ном-2 [186, 187] или реакцией Джаппа Клингемана 3-карбоксипипе-
ридона-2 с солями арилДиазония [3].
Данный метод используется для получения карболинов 164 с раз-
личными заместителями в ароматическом ядре, например производных
164, содержащих в положениях 5-8 в различных сочетаниях метильные
[188], метоксильные [188, 189], метилтиольные [190], галоидные
[188, 191], ацильные [191, 192] заместители и нитрогруппы [188]
J)
Катализаторами могут быть муравьиная [186-189, 191, 192], по-
лифосфорная [188, 192], серная, соляная и сульфосалициловая [188]
кислоты. В зависимости от природы и расположения заместителей в
бензольном кольце, а также выбора катализатора, выходы карболино-
нов варьируют от низких до близких к количественным [188, 192]
5-Ацетил-8-хлор-1-оксо 1,2,3,4-тетрагидро-/3-карболин {191]. Раствор 62 г
3-[(3-ацетил-6-хлорфснил) гидразона]-2 3 диоксопнперидина в 310 мл 88 %-й му-
равьиной кислоты кипятят 24 ч, затем концентрируют в вакууме. Осадок отфиль
тровывают и промывают холодной муравьиной кислотой. Выход 40 г (60 %),
т.пл. 234 236 °C (из абсолютного этанола).
Описан синтез алкалоида рутечарпина 166 и его производных пере-
группировкой фенилгидразона 165 в горячей полифосфорной кислоте
[193, 194]
о
При осуществлении реакции необходимо принимать во внимание
возможность получения в конечном итоге анома ,ьных продуктов. Так,
при циклизации гидразона 167 вместо ожидаемого 5,8-диметокси- 1-ок-
со- 1,2,3,4-тетрагцдро-Дкарболина получено с выходом 77 % 5-амино-7-
метоксипроизводное 170 [188]
Здесь перегруппировка енгидразина 168 протекает не по свобод-
ному положению бензольного кольца, а по месту, занятому орго-ме-
токсильной группой. В результате внутримолекулярного нуклеофиль-
ного присоединения иминогруппы образуется интермедиат 169, стаби-
лизирующийся путем отщепления молекулы метанола.
Циклизация-гидразона 171 также вдет по занятому орто- положению
с элиминированием метоксикарбонильной группы [188]:
ООО
N
I
NHPh
165
166
Новый метод синтеза 1 оксо-1,2,3,4-тетрагидро-0-карболинов разра-
ботан И И.Грандбергом с сотрудниками [195,196]
36
37
сно
173
Аналогичный метод разработан для производных N-метилсукцин-
мида 179 [198] Продуктами реакции являюк . 1,3-диоксо-1,2,3,4-те-
грагиДро-Д-карболины 180
Ph и - NHZ
।
R
<СН NH-N-Ph
<77 170
R=H Me, CH,Ph, Ph-
R=Me, n-Bu R' =H, Me, CH,Ph, Ph; R1 =H, 6-Me, 8-Me, 8-OMe.
При взаимодействии 3-формилпирролидона 172 или его эквива-
лента 3-(диметиламинометилен)пирролидона-2 173 с арилгидразина-
ми в присутствии кислот вначале образуются гидразоны 174, которые,
по Фишеру, циклизуются в спироиндолины 175 Последние после про-
тонирования аминогруппь теряют молекулу аммиака с образованием
катиона 176.
Перегруппировка с миграцией амидной части спиролактамного
горкла 176 с последующим депротонированием интермедиата 177
приводит к карболинонам 178 [195]
2-Метил-9-бензнл-1-оксо-1 Д,3/4-тетрагндро-(!-к>рболин (179]. Раствор 4,6 г
(0,03 моль) 3-диметнламнномегилеа-Н-метиллирролпдона-2 и 7,1 г (0,03 моль)
гидрохлорида а-беазил-а-фенилгидразииа в смеси 40 мл изопропилового спирта,
20 мл воды и 5 мл соляной кислоты кипятят 3 ч, охлаждают, осадок отфильтро-
вывают, Выход 6,9 г (80%),тлл. 149*С (избензола).
38
Глава 2
ПОЛУЧЕНИЕ 3,4-ДИГИДРО-^-КАРБОЛИНОВ.
РЕА КЦИЯ БИШЛЕРА-НАПИРАЛЬСКОГО
это происходит в реакции Пикте- Шпенглера. Данную концепцию под-
ждает выделение полициклических соединений типа 187, включаю
ВIX структуру спироиндоленина [205]. Реакция проводилась при на-
ревании N-ацилтриптаминов 185 с хлорокисью фосфора в ацетонитриле
Удобным методом получения 3,4-дигидро-(3-карболинов является
вариант реакции Бишлера— Напиральского, заключающийся в циклоде-
гидратации N-ацилтриптаминов и триптофанов Литература по этому во-
просу до 1963 г представлена в обзорах [2,3, 199J. Кроме того, опуб-
ликованы данные по использованию реакции Бишлера-Напиральского
в синтезе тетра- и пент циклических алкалоидов, включающих систему
{3-карболина [200-203]. В настоящей главе приведены некоторые ти-
пичные примеры получения 3 4-дигвдро-^-карболинов и рассмотрены
достижения в указанной области за последние годы.
Наряду с /3-карболинами реакция Бишлера-Напиральского приме-
няется для синтеза 3,4-дигидроизохинолинов циклодегидратацией со-
ответствующих N-ацилфенетиламинов [199]. Однако механизм форми
рования дигидропиридинового цикла в раду изохинолинов и /3-карбо-
линов, по-видимому3 различен Согласно [204], при обработке N-аце
тилфенетиламин в 181 кислотами Льюиса получается имидоильно
производное 182, которое через нитрилиевую соль 183 циклизуется в
3,4-дигидроизохинолин 184-
их
-н20
R=Me, (CHJjCOjMe
Основная масса продуктов реакции приходилась на соединения 187,
тогда как выход 3,4-дигидро-Р-карболинов 186 не превышал 15 %. Ана-
логичные результаты получены в работе [206]
Бобовский [207] после кратковременного нагревания N-пропио-
нилтриптамина в хлорокиси фосфора выделил и охарактеризовал ком-
плекс последнего с оксиамином 188. Гидролиз комплекса 188 в мяг-
ких условиях привел к неустойчивому оксиамину 189, который при по-
пытке его выделения дегидратировался в 0-карболин 190. Обработкой
эфирного раствора оксиамина 189 уксусным ангидридом получен ста-
бильный оксиамид 191
188
В случае N-ацилтриптаминов, вероятно, образование 3 4-дигидро-Д-
карболинов протекает через промежуточные спироиндоленины так как
40
роси
Ь, Эмин
41
191
На основании изложенного можно предложить следующий меха-
низм образования 3,4-дигидро-/З-карболинов в условиях реакции Биш-
лера Напиральского:
Образование спироиндоленинов объясняется тем, что при электро-
фильной атаке 3-замещенных индолов энергетически наиболее выгод-
ным процессом является вхождение нового заместителя в более элек
трононасыщенное положение 3 с последующей перегруппировкой одно-
го из заместителей в положение 2 [5]. Неожиданное получение 3-про-
пионилиндола из тиокеталя 192 в условиях реакции Ьишлера—Напи-
ральского также обусловлено образованием промежуточного спироин
доленина [208J
42
Для сравнения диоксолан 193 при обработке фосфорным ангидри-
дом гладко превращается в 3 4-дигидроизохинолин 194 [209]:
193 194
В препаративном плане в качестве дегидратирующего агента чаще
всего употребляют хлорокись фосфора Реакцию проводят в ацетони-
триле [210—214], бензоле [215 227], толуоле [228— 230], хлорофор-
ме [231] или избытке Р0С13 [232 241]. Для циклизации N-формиль-
ных производных триптамина и замещенных триптаминов кроме
Р0С13 [234, 242-244] используют также трифторуксусную кислоту
[245], полифосфорный эфир [246—249] и оксалилхлорид [250].
3,4-Дигцдро-0 карболин [243]. N-Формилтриптамин (6,95 г) обрабатывают
при охлаждении ледяной водой 25 мл хлорокиси фосфора, температура смеси
при этом поднимается до 67 °C. Через 1,5 ч при комнатной температуре избыток
Р0С1, отгоняют в вакууме, остаток перемешивают с 500 мл воды, фильтруют и
подщелачивают водным аммиаком 3,4-Дигидро-р-карболин (5,48 г, 94 %) выде-
ляется в виде желтого микрокристаллического осадка, тля. 175—176 °C (из
эфира). Образует сольват, теряющий растворитель при температуре 87 ° С.
7-Метокси 9-метил ЗД дигцдро-/3-карболии [245] Раствор 534мг (2,3ммоль>
М-формил-1-метил-6-метокситриптамина в 50 мл смеси дихлорметан^грифторук-
сусная кислота (3 2) перемешивают при комнатной температуре в атмосфере
аргона в течение 1 ч. Реакционную смесь упаривают, остаток растворяют в дихлор-
метане промывают водой, сушат над сульфатом магния, отгоняют растворитель.
Выход 433 мг (88%).
Использование в последнем случае трифторуксусной кислот i выз-
вано тем, что в присутствии Р0С13 искомый (3-карболин не образует-
ся [245].
43
Триптамины с остатками одноосновных алифатических кислот
гладко циклизуются под действием полифосфорного эфира [246,249]
хлорокиси и нентаоксида фосфора [238,242,251-255]. 3,4-Дигидро-0-
карболины с алкильными и арильными заместителями в положении
4 лучше всего получать обработкой соответствующих триптамидов пя-
тихлорнстым фосфором в нитробензоле [256, 257].
1 Метил-3,4 дигидро-р-карболии [238J. К раствору 5 г N-ацетилтриптамина в
50 мл сухого бензола добавляют по каплям при комнатной температуре 20 мл
РОС1,. Реакционную смесь кипятят 30 мин. охлаждают и упаривают в вакууме
досуха. Остаток обрабатывают 10 %-м водным раствором уксусной кислоты
(3x50 мл), и раствор по каплям добавляют к 200 мл 30 %-го гидроксида натрия.
Светло-желтый осадок отфильтровывают и сушат. Выход 33 г (72 7 %) тпл
179- 180 °C. • ’ ’ ‘
1-Этил-3,4-дигидро 0-карболии [251]. К кипящему раствору 2 г N-пронио
нилтриптамина в ксилоле добавляют порциями в течение 45 мин 25 г пентаоксида
фосфора. Смесь кипятят 1 ч, охлаждают до комнатной температуры, декантируют
растворитель, темный остаток промывают эфиром и переносят на 500 г толченого
льда. Затем приливают 20 мл 2н. соляной кислоты, экстрагируют эфиром и вод-
ный слой подщелачивают содой. Коричневый осадок отфильтровывают и крис
таллизуютиз дихлормстана. Выход 14г (78 %), т. пл. 168 170 °C.
Подобные методики с незначительными вариациями использова-
лись для циклизации продуктов конденсации триптамина с жирноаро-
матическими [206, 228, 234, 258], гетероциклическими [223, 259] и
ароматическими [240] кислотами. Для синтеза тетра- и пентацикличес-
ких структур, содержащих ядро /5-карболина, берутся триптаминовые
и трипт фановые производные 3-карбоксипропионовой [210, 220.
260— 262], тетрагидрогомофталевой [216], бензоциклобутанкарбоно-
вой [215, 225] и 2-зтил-5-хлор (бром) валериановой [211, 217, 226]
кислот. При этом одновременно с формированием гетерокольца или в
результате последующих превращений образуются новые конденсиро-
ванные гетеро- или карбоцик ты:
Аналогичные превращения претерпевают оксиамиды 195, получае-
ie натреванием триптамина с производным! валеролактона [212.
232*23 ,236,239]:
Перхлорат 1-этил-1,2,3,4,6,7-гексанидроиидоло[2,3-в]хинолизииа [236]. Раст-
вор 14 4 г (0,05 моль) N (2-этил-оксивалероил)триитамина в 135 мл хлорокиси
фосфора кипятят 8 ч. Отгоняют избыток РОС1, в вакууме, остатоюрастворяют в
дихлорэтане. К раствору при охлаждении и перемешивании добавляют 60 мл во-
да и 40 %-Й раствор NaOH до pH 11. Водный слой отделяют и экстрагируют 20 мл
дихлорэтана. Объединенные органические вытяжки сушат и упаривают. Оставше-
еся масло растворяют в 15 мл метанола, подкисляют 70 %-й хлорной кислотой до
pH 5 После охлаждения в течение ночи выпавший кристаллический осадок от-
фильтровывают и сушат. Выход14,2г (80.8%),т.пл. 175—177 °C.
Для синтеза оксиамидов 196 применяют также ацилирование трип-
таминов хлорангидридами ооксикарбоновых кислот [241, 263]:
Соединения ряда иохимбина 199 получают циклизацией оксиами-
дов 198, образующихся при нагревании триптамина с изохроманоном
197 [264]:
оме
44
45
Предварительная обработка изохроманона 200 бромистым водоро.
дом приводит к 2-бромметил-4,5-диметоксифенилуксусной кислоц
201, нагревание которой с триптамином дает изохинолон 202, цик-
лизующийся под действием РОС 13 [229]
РОСЦ
R=CO,Me.
В работе [227] лактам 212 синтезировали алкилированием лактим
<Ьира 210 3-(хлорацетил) ивдолом и восстановлением образующегося
кетоамида 211 водородом над палладием. Циклизацию проводили на-
греванием бензольного раствора лактама 212 с РОС13:
Примером альтернативного подхода является синтез гетероиохим-
ина 5 последовательной конденсацией триптамина с функционализи-
рованным пираном 203, нагреванием лактама 204 с РОС 3 и восстанов-
лением образующейся соли 3,4-дигидро-/3-карболина [218 222]-
I. P0Ct3
г навн4
сно
Кроме имвдов и лактамов в реакции Бишлера- Напиральского мо-
гут применяться пиридоны 213 [221] и имиды 214 [265]
Разработан метод синтеза замещенньп лактамов 208 конденсацией
триптамина с производными циклопентанона, окислением имина 206
м хлорнадбензоиной кислотой и фотолизом оксазирвдина 207 Цикли-
зация тактама 208 с последующим восстановлением соли 209 приводит
к алкалоидам ряда збурнана [214]
206
207
46
гое
При циклизации N-ацилтриптофанов и их эфиров необходимо при-
нимать во внимание, что образующиеся производные 3-карбокси-3,4-
дигидро-р-карболинов могут в процессе реакции самопроизвольно аро-
матизироваться [266-268]. В некоторых случаях ароматизация сопро-
вождается декарбоксилированием [269]. Тем не менее известны при-
меры таких циклизаций [246]. N-Формилтриптофан и его производные
по карбоксильной группе (пептиды) гладко циклизуются в соответ-
47
ствующие 3,4-дигидро-/3-карболины в присутствии трифторуксусно]
кислоты или водного раствора муравьиной и соляной кислот [270]
В последнем случае в отсутствие воды выход 0-карболина 217 снижает
ся за счет образования диформилпроизводного 216:
217
Гидрохлорид 3-карбокси-3,4 дигвдро-В-карболина [270]. Раствор 0,5 г N-фор
мил-Z'триптофана в смеси 9 мл муравьиной и 1 мл концентрированной соляной
кислот нагревают 3 ч при 50 °C. Раствор концентрируют в вакууме, к остатку
добавляют уксусную кислоту, выделившийся гидрохлорид отфильтровывав г
Выход 7 5 %, т.пл. 232 ° С.
1-Метил-3-карбометокси-3(4-дигидро-(3-карболин с удовлетвори
тельным выходом можно получить циклизацией соответствующего
амида под действием полифосфорного эфира [246} или пентаоксида
фосфора [271] Проведение реакции в мягких условиях, исключающих
побочные процессы, обеспечил новый подход, согласно которому N-
ацилтриптофаны и пептиды, содержащие триптофан в С-концевой по-
зиции, легко превращаются в 1-замещенные 3,4-дигидро-]3-карболин
карбоновые кислоты путем кислотно-катализируемой изомеризации
их азлактоновых производных 219 [272]. Последние получали дегидра-
тацией N-ацилтриптофанов 218 дициклогексилкарбодиимидом:
2i6 219
Приведено [272] девять примеров получения 3-карбокси-3,4-ди-
гИдро-/3-карболинов 220, содержащих в положении 1 пептидные цепи,
включающие от трех до семи аминокислот. Выходы составляют 58—
g8 %. Скорость образования 1-этил-З-карбокси-З 4-дигвдро-0-карболина
в трифторуксусной кислоте при 50 °C из азлактона 219 (R=C2HS) в
100 раз больше, чем из карбоксиамида 218 (R=C2H$).
Еше один эффективный метод синтеза 3,4-дигидро-]3-карболинов
в мягких условиях включает обработку N-тиокарбонильных производ-
ных триптамина и триптофана (221) алкилирующими или ацилирующи-
ми агентами [273-275]
221 222 223
R-H, C03Me, R'=Me, Et, Г-Bu, C4HU , Ph; R*X=MeI, PhCH,Btl AcCl,
PhCOCL
Реакция проводится в апротонных растворителях при комнатной
температуре или при нагревании. Производные триптофана реагируют
легче, чем тиоамиды на основе триптамина. Циклизация протекает через
промежуточные тиоминиевые соли 222, которые в некоторых случаях
выделены.
Гидроиодид Ьмегил-З-метоксикарбоиил-ЗД-дигидро-р-карболина [274]. Раст-
вор 5,52 г (20 ммоль) метилового эфира N-метилтиокарбонилтринтофаиа и
5,5 мп йодистого метила в 55 мл ацетона перемешивают 24 ч при комнатной тем-
пературе. Ацетон отгоняют в вакууме, остаток кристаллизуют из метанола. Вы-
ход 6,66 г (90 %), тли. 214 216 °C.
При восстановлении3,4-дигвдро-Л-карболинов 223 до тетрагидро-
производных образуются практически чистые цис-изомеры [274] Оп-
тически активные триптофаны превращаются в условиях данного мето-
да в соответствующие 3,4-дигидро-^-карболины и их тетрагидроаналоги
без рацемизации.
R-Me, Et, Ph, пептид.
48
Глава 3
ДРУГИЕ МЕТОДЫ СИНТЕЗА
ГИДРИРОВАННЫХ Р-КАРБОДИНОВ
Методы взаимных превращений 1,2,3,4-тетрагидро- и 3 4-дигидро-Р-
карбонилов путем окисления и восстановления изложены в обзоре [3],
поэтому подробно здесь не рассматриваются. Из последних достижений
следует отметить асимметричное восстановление 3,4-дигидро-0-карбо
линов хиральными ацилоксиборогидридами натрия, образующимися
при взаимодействии борогидрдда натрия с оптически активными ами-
нокислотами [276, 277]. Оптический выход тетрагидро-/3-карболина
224 достигает 86 %:
Электрохимическое восстановление иминиевой соли 225 в присут
алкилирования
ствии о-бромбензилбромцца приводит к продукту
226 [278]:
Разработана эффективная препаративная методика восстановления
гармалина (227) борогидридом натрия [279]:
227
7-Метокси-1,2,3,4-тетрагндро-0-карболин (279]. Вхолодную (О °C) первые
иваемую суспензию 4,05 г (14,12 ммоль) гидрохлорида дигидрата гармалина в
мл смеси изопропаноп - метанол - вода (1:1 1) добавляют по каплям раствор
а 0 мг (15 ммоль) борогидрида натрия в 20 мл воды. Через 1 ч смесь осторожно
подкисляют 2М соляной кислотой до образования прозрачного раствора, затем
одшелачивают 10 %-м раствором гидроксида натрия и экстрагируют хлорофор-
ом (3x50 мл). После упаривания растворителя остаток кристаллизуют из эта-
нола. Выход 2,93 г (96 %),тля. 198-200 °C.
Борогидрвд натрия наиболее удобный реагент для восстановле-
ния солей 2-замещенных ароматических /3-карболинов в соответствую-
щие 1,2,3,4-тетрагидропроизводные.
1 Фенил-2-метил 1,2,3,4-тетрагидро-(3-карболин [280], К перемешиваемому
раствору 2,3 г иодметилата 1-фенил-З-карболина в 100 мл 10 %-го водного эта-
нола добавляют за 20 мин при 0 °C 0,8 гборогидриданатрия. Смесь перемешива-
ют 1 ч при 20 °C, затем в течение 30 мин температуру поднимают до 80 °C. Раст-
вор упаривают в вакууме, остаток экстрагируют хлороформом (2x20 мл), эк-
стракт сушат сульфатом натрия и упаривают. Остаток кристаллизуют из эфира.
Выход 1,1 г (7 8 %), т.пл. 121 -122 ° С.
Предложен селективный метод окисления 1,2,3,4-тетрагидро-0-кдр-
болинов в 3,4-дигидропр изводные при помощи перманганата калия в
тетрагидрофуране при 0 ’ С [281]
R*=H, ОМе; R=Me Et, Pi, Ph, 2-C,H4N, 3-C,H4N, 4-C,H4N
2-Метил-1,2,3,4-тетрагвдро-/3-карболин при обработке оксидом рту-
ти дает димер 228, который хлорной кислотой разрушается с образова-
нием иминиевой соли 229 [282] :
нсю4
229
50
51
В настоящее время известны многочисленные методы синтеза (3-
карболинов, которые, однако, используются ограниченно. Так, 1,4-дио-
ксо-1,2,3,4-тетрагидро-/3-карболины 232 получают конденсацией хлор
ангидрида индол-2-карбоновой кислоты с эфирами аминоуксусны
кислот 230 с последующим гидролизом сложнозфирной группы и дик
лизацией аминокислот 231 в горячей полифосфорной кислоте [283]
231
пфк
R-H,CHjPh .
При синтезе 9-метил-2-ацетил-4-оксо-1,2,3,4-тетрагидро-0-карболина
236 этиловый эфир глицина конденсируют с М-метил-2-формилин
долом, имин 233 восстанавливают и после гидролиза эфира 234 кисло-
ту 235 циклизуют нагреванием со смесью уксусного ангидрида и ацета-
та натрия [284]-
233
Наряду с карболином 236 (вь ход 90 %) образуется его 3-ацетил-
оизводное 237. Полученные в результате mi. эгостадийного синтеза
^инокислоты 238 превращаются в тетра- и пентациклические карболи-
Э 239 под действием полифосфорной кислоты [285.]:
СОгН рфК
ноны
238
R
R
R=R=H; R+R~(CH,)4.
При последовательной обработке индолов
При последовательной обработке индолов 240 бутиллигием и
бромуксусным альдегидом образуются оксибромиды 241, которые в
кислой среде дают 0-карболины 242 [286,287]:
R1
R
240
PhO^
I. Bu Li
2. ВГ.СНгСНО
ОН
241
ОН
R=R‘=H; R=CO,H,
=(СН,).
R*=Et; R+R1 =
242 л-
Ацетали 244, синтезированные по реакции Манниха из 4-оксо-
4,5,6,7-тетрагвдроиндолов 243, диметилацеталя 2-метиламиноацеталь-
дегвда и формалина, при кратковременном нагревании в разбавленной
соляной кислоте циклизуются
ро-|3-карболины 245 [288]:
0
в 4-ОКСИ-5-ОКСО-1,2,3,4,5,6,7,8-октагид-
R J Ji
R
243
+ сно—— R
сн(оме)г
нме
+ меннснгсн(оме)г
R=H,Me R* Н, Me, СИ,Ph.
53
на
Этим же путем на основе индола был получен ацеталь 246 [288
Продукт его циклизации описан [288] как у-карболин 247 Однако
как выяснилось позже [289], в результате реакции образуется 2-метил-
4-окси-1,2,3,4-тетрагидро-/3-карболин 249:
/З-Карболины с заместителями в положении 3 образуются из соот-
ветствующих оксимов 225 (R’=H) нагреванием с тетраацетилдибора-
том в нитрометане [292]. /3-Замещенные оксимы 225 (R=H) превра-
щаются в 3,4-дигидро-|3-карболины 256 в более жестких условиях, а
именно при нагревании с пятихлористым фосфором в нитробензоле
[293,294].
4-Арилтетрагидро-р-карболины можно получить восстановитель-
ной циклизацией замещенных 2-карбокси-З-индолилацетонитрилов
257 алюмогидридом лития [295]:
Данное превращение протекает через спироиндоленин 248 пере-
группировка которого осуществляется с преимущественной миграцие й
аминометильного фрагмента пирролидинового цикла.
Аналогичная ситуация наблюдалась при циклизации аминонитри-
лов 252, полученных при взаимодействии граминов 250 с кетонами 251
в присутствии цианида калия [290]. При нагревании нитрилов 252 с по-
лифосфорной кислотой до 80 ' С или выдерживании на холоду в сер-
ной кислоте образуются 3,3-дизам ещенные 4-оксо-0-карболины 253
R=Ph, 2-С1СеН4, 3-CjH4N.
252
Выход /3-карболинов 258 не превышает 30 %, при этом N-незаме-
щенные индолы 257 не восстанавливаются.
Другой путь включает алкилирование хлоридом 259 натриевой со-
ли нитроуксусного эфира с последующим восстановлением нитрогруп-
пы индола 260 и циклизацией аминоэфира 261 [295]:
R
253
259
,C02Et
+ на сн
ног
r’
R COjEt
—
^COjEt
260
R, R‘ = Н, Me, R’=R’=Me, R’+R’ =
=(СН,),.
А.А.Семеяовым с сотрудниками разработан метод получения 3- и
4-замещенных 3(4-дигидро-|3-карболинов с помощью бекмановской пе-
регруппировки оксимов кетонов 254, синтезированных алкилирова-
нием замещенных ацетоуксусных эфиров Грамином [255] или конден-
сацией а, /З^енасыщенных кетонов с индолом [291]
54
261
R’=H, Me R=2-C1C4H„-
55
В некоторых новых методах синтезов 3,4-дигидро-/3-карболин
применяется соединения, содержащие нитрильные и изонитрильнь е
группы. Так, при взаимодействии хлорангидрида 3-индолилуксусн
кислоты с метилтиоцианатом в присутствии хлорида олова образуется
ацилнитрилиевая соль 262, циклизующаяся в 1 -метилтио-З-оксо-З 4- щ.
гидро-(3-карболин 263 [296] :
Инд о лил этилизоцианид (264), полученный при взаимодействи
литийметилизоцианида с иодметилатом грамина, при обработке хлор-
ангидридами алифатических кислот превращается в акетоимвдоил-
хлоридь: 265, Последние в присутствии соли серебра при температу-
ре —20 С гладко циклизуются в 1-ацил-З,4-дигидро-й-карболинь
266 [297] •
R= -CHjCHjCOjMe, -СМе,
Однако изонитрильная группа в присутствии кислот может и не-
посредственно участвовать в образовании гетероцикла. Так, при обра-
ботке гапалиндолов 267 разбавленной соляной кислотой на холод}'
в результате нуклеофильной атаки изонитрильной группы на С-2 индо-
ла с высоким выходом получены 0-карболины 268 [298]:
R =н,ci .
56
внутримолекулярная циклизация производных индола 269 под
“ствием полифосфорной кислоты, гидразина и алифатических ами-
дает р_карболины с функциональными заместителями, способными
дальнейшим превращениям [299]:
CN CN
J4tSMe
и
о
. бме
''Sue
со2ме
4
Me
269
PhCHzNH2
Ch
NHCHjPh
JI
0
ПФК
rnh2
CN
'L SME
^.NR
li
0
Наконец, возможен синтез 0-карболиновои системы путем рецик-
лизации ее кислородных аналогов. Карболиионы 272 получены нагре-
ванием до 200-210 °C тетрагидропираноиндолонов 271 с анилином,
бензил-, фенил- этил- и пропиламинами [300,301]:
270
R=H,F,Cl,Bi Me ОМе R’=Pi,CH1Ph,CHJCH1Ph,Ph-R3=Me,(CHJ)aNEt2
При использовании метил- и 3-(дизтиламино) пропиламина обра-
зуются лишь амиды 270 [300]. Пираноиндолон 273 под действием ам-
миака или метиламина рециклизуется в 3-метил-(3-карболиноны 274
[302]:
Исходный пиран 273 получают нагреванием 2-карбоксииндолил-З-
Уксусной кислоты с уксусным ангидридом в пиридине [302].
57
Глава 4
МЕТОДЫ ПОЛУЧЕНИЯ
АРОМАТИЧЕСКИХ ^-КАРБОЛИНОВ
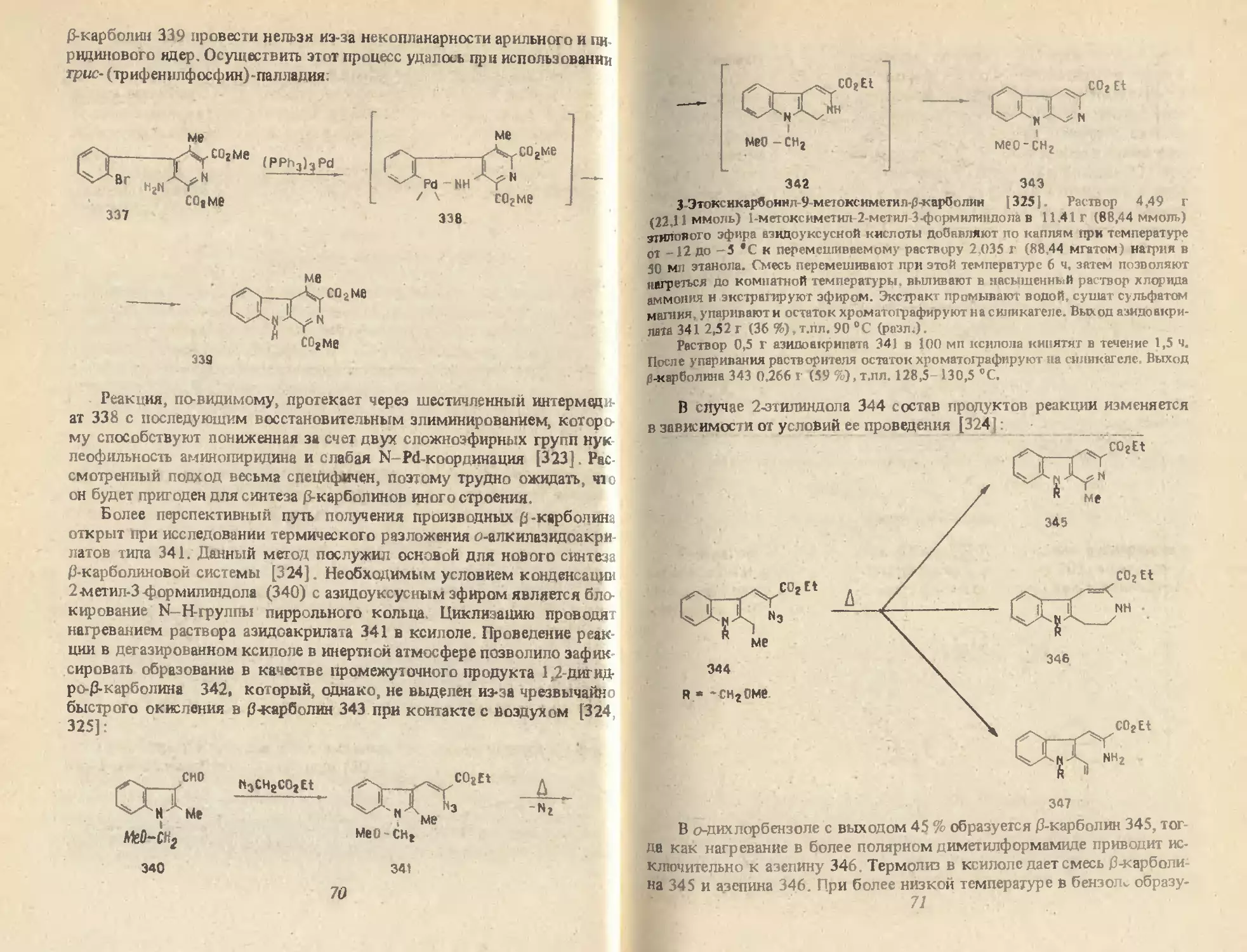
4.1. АРОМАТИЗАЦИЯ
1,2,3,4 ТЕТРАГИДРО 0-КАРБОЛИНОВ
Анализ данных по дегидрированию 1,2,3,4-тетрагидро-р-карболины
показал, что из большого числа окислителей невозможно выделить ка
кой-либо в качестве универсального средства, пригодного если не вс
всех, то хотя бы в большинстве исследованных случаев. Тетрагидро-1
карболины 275, полученные конденсацией триптамина с алифатичес
кими и ароматическими альдегидами, можно окислять без выделения
путем обработки реакционной смеси бихроматом калия [33, 303]
275 276
R=Et,Pr I-Pi, 3-МеОС4Н4. 3,4-(МеО),С«Н,, 3,4-(ОСН,О)С»Н,.
Общий выход карболинов 276 составил 20—50 %. Окисление тетра
г идро-0-карболин-3-карбоновых кислот и их эфиров 277 бихроматом
калия приводит к продуктам декарбоксилирования 278 [12, 30-32,
ПЛ 1П41
227 278
R = H,i-Pr; R=H,Me,Et, 4-0НС6Н4, Rг= РП. ЦД R=H.8r,MeO
й
1-Метил-4-феиил-0-карболии [32J. К кипящей суспензии 100 мг формиата
1 метил-4-фенил-1 Д,3,4-тетрагидро-)3-карбо шн-З-карбоновой кислоты в 17,5 м
воды добавляют одновременно 4.3 мл 10 %-Го водного раствора бихромата калия
мя уксусной кислоты. Смесь кипятят еше 20 мин, охлаждают, обрабатываю!
И Сжитом натрия, нейтрализуют поташом, экстрагируют этилацетатом и расгво
итель упаривают. Выход 63 мг (80 %), т. пл. гидрохлорида 270 - 271 0 С.
Карбоксильная группа в положениях 3 и 4 тетрагидро-Р-карболи-
ов сохраняется, если ароматизацию проводить нагреванием с серой в
ксилоле [27, 305, 306], нитробензоле [307] или диметилсульфоксиде
[17, 80, 94]
3-Метоксикарбоннл-0-карболин (306]. К раствору 21 г (91,3 ммоль) 3-ме
сксикарбонил-1,2,3,4-тетрагидро-Д-карболина в смеси 1 п ксилола и 1 л диокса-
на добавляют 25 г серы и смесь кипятят в течение четырех дней. Кипячение про-
должают еще два дня, добавляя каждый день по 10 г серы. Растворитель упари-
вают в вакууме, коричневый остаток суспендируют в 400 мл 1н. соляной кисло-
ты, фильтруют, остаток на фильтре промывают 400 мл воды. Фильтраты промы-
вают бензолом (3x100 мл) и подщелачивают 100 мл концентрированного водно
го аммиака. Выпавший осадок фильтруют и сушат 12 ч в вакууме при темпера
туре 40 °C. Выход 20г (97 %), т. пл. 245 • С.
Описан пример использования серы для получения 1-этил-4-окси-/3-
карболина [308]
Удобными дегидрирующими агентами являются палладиевая чернь
[240] и палладий, нанесенный на уголь. С последним реакцию прово-
дят в высококипящих ароматических углеводородах [16, 29, 52, 108,
306,309,310], диоксане [14,29,306] и дифениле [304].
З-Метоксикарб нил-4-метнл-1-(1тиридил-2)-0-карболин (29]. К раствору 1,31
(4,08 ммоль) 3-метоксикарбонил-4-метил-1-(пиридил-2)-1,23 4-тетрагидро-0-кар-
болина в 50 мл сухого ксилола добавляют 1,5 г 10 %-го палладия на угле и смесь
кипятят 3 ч в атмосфере азота. Реакционную смесь фильтруют, остаток на фильт-
ре промывают горячим ксилолом, фильтрат упаривают. Остаток после обработки
смесью бензол — метанол (1:50) кристаллизуется. Выход 1,21 г (94 %), т.пл. 168-
169 °C (метанол - этилацетат).
СНгОН
Pd/C
A
При нагревании тетрагидро-Р-карболина 279 с палладием в тетрали-
не до 210-230 °C происходит элиминирование заместителя в положе
НИИ 1 [36] - ----
bngun
пн
снон
I
снгон
279
Ароматизация хинаэолинокарболина 280 сопровождается транса-
мцдированием [311]. Вероятно, процесс проходит через интермедиат
279
58
59
81 в котором неподелениая пара электронов у Нметилзамещеннщ,
атома азота способствует образованию неустойчивого кетенимина 282
Последний в результате нуклеофильной атаки индольным атомом азг,
та дает Дкарболин 283:
Для получения 9-метокси-0-карболинов 285, являющихся аналога-
ми природных алкалоидов, тетрагидрокарболины 284 окисляли боль-
шим избытком активированного диоксида марганца [242]
Реакция протекает в кипящем бензоле в присутствии 49 зквивале ь
тов окислителя. Наличие заместителя в положении 1 карболинов 28е
резко снижает их стабильность, поэтому выход карболина 2856 соста-
вил всего 14 %, тогда как выход незамещенного карболина 285а равен
80 %. При использовании 11 эквивалентов окислителя образуется про
дукт промежуточной степени окисления — 9-метокси-3,4-днгидро-Дкар
болин. Хорошие результаты получены при окислении диоксидом мар
ганца амидов 1,2,3,4-тетрагидро-^-карболин 3-карбоновой кислоты 28’
[14]. Продолжительность реакции 10—12 ч, окислителем может слу
• жить и кислород воздуха, пропускание которого в кипящий раствор
я амиламида 286 в диоксане в течение 48 ч приводит к карболипу 287
выходом 70 % [14]
286 287
Me Ме
R=Et, 1-Bu, -СН-СНМе,. -CHEt, -CH-CHjCH^Me.
В отдельных случаях ароматизацию тетрагидро-Дкарболинов осу
ествляли при помощи тетраацетата свинца [13,305],хлоранила [13]
пет-бутилгипохлорига [312]. Диоксид селена оказался прекрасным
егидрируюшим агентом для тетрагидроД-карболинов 288, не имею-
щих заместителей в положении 1, а также для 1-ар ил- и 1-трифторме-
тилпроизводных [63,109, ИЗ]:
2В8 289
R=H, СО, Me, R1 =Н. CF,. Ph. 2-СГ4Н4 4-С1С.Н4.
4-FC4H4, 4-МеОС,Н4 3,4-(МеО)аС,Н,, 3-С,Н4Ы.
1-Феиил-З-метоксикарбонил- -карболин [113]. К раствору 30,6 г (0,1 моль)
1-фенил 3-метоксикарбонип-1,2,3,4-тетрагидро-р-карболина в 200 мл диоксана
добавляют 16,5 г (0 15 моль) диоксида селена и смесь при перемешивании кипя
тятдотех пор, пока методом тонкослойной хроматографии (этилацетат) не будет
показано отсутствие исходного материала. Горячую суспензию фильтруют через
цеолит для удаления селена, фильтрат упаривают остаток кристаллизуют из ме-
танола. Выход 25,4 г (84 %), т.пл. 257-260 °C.
1-Этил-3-метоксикарбонил-|3-карболин 290 после кипячения с диокси-
дом селена в диоксане в течение 14 ч дает смесь соединений 291—
61
60
Основным продуктом реакции является 1-ацетил-3-метоксикарбонил-р-
карболин 293, выделенный с выходом 32 %. Три остальных /3-карболи-
на (291, 292, 294) получены приблизительно в равных количествах с
общим выходом 39 %. Очевидно, что ароматизация пиридинового коль-
ца происходит на первой стадии процесса Карболины 291 и 292 окис-
ляются диоксидом селена с хорошим выходом в карболины 293
и 294.
С помощью диоксида селена осуществлен двухстадийный синтез
алкалоида кантин-6-она 295а и его метоксикарбонилпроизводного
2956 [109,313]
295
a R=H;6 R=CO,Me.
Бензильная группа на второй стадии отщепляется в виде бензальдегида
В 1,1-дизамещенных тетрагидро-(3-карболинах 296 окисляется метиле-
новое звено в положении 4, что приводит к 3-метоксикарбонил-1,4-ди-
гидро-4-оксо-(3-карболинам 297 (выход 50—70 %) и декарбоксилиро-
ванным кетоиам 298 (выход около 10%) [113]
R-R’ -Me, Et, R‘-Me, R’=Et; R+R‘=(CH,)4 R+R^CCH,),.
Тетрагидро-/3-карболин 299 с выходом 48 % превращается в 1-фор-
мил-3-метоксикарбонил-0-карболин (300) [113]
-СОгме
Н ме СНгРп
299
300
62
Здесь в первую очередь окисляется, по-видимому, метиленовая труп
Па бензильного заместителя, затем происходят ароматизация пирвди
нового цикла и окисление метильной группы. Наличие ацетильного за-
местителя у атома азота в положении 2 тетрагидро/3-карболинов делает
ароматизацию пиридинового кольца невозможной, поэтому окисли-
тельная атака на С-1 приводит к разрыву CN-связи и образованию кар-
бонильных соединений. Так, 2-ацетилтетрагидро-р-карболины 301 при
обработке диоксидом селена в кипящем диоксане в течение 1 ч дают
формилпроизводные 302 [113]. При увеличении продолжительности
реакции до 4 ч карболины 301 и формилиндолы 302 превращаются в
1-оксо-1,2,3,4-тетрагидро-/3-карболин 303 или 3-метоксикарбонил-
карболин 304;
304
a — R=H,6 -R=CO,Me
При нагревании соединений 302а и 3026 с уксусным ангидридом в
первом случае образуется ароматический /3-карболин 305, во втором —
смесь карболина 306 и 2,9-диацетил-3-метоксикарбонил-1,2-дигидро-0-
карболина 307 [ИЗ]:
В отличие от диоксида селена 2,3-дихлор-5,6-дициан-1,4-бензохи-
нон (ДЦХ) при взаимодействии с 2-ацилтетрагидро-|3-карбол1п<ами кро-
ме продуктов расщепления гидрированного кольца дает 4-оксотетра-
гидр окарболины:
63
308
о
309
а - R=H, б R=Et.
Проведение реакции при пониженных температурах способствует
преимущественному образованию соединений309-Так, 1-этил-2-бензоил
1,2,3 4-тетрагидро-/?-карболин 3086 при комнатной температуре прев-
ращается в смесь соединений 3096 и 3106 в соотношении 1:1, тогда как
при температуре -78 °C соотношение составляет 5:1 [308]. Неудачной
оказалась попытка использовать ДДХ для окисления 5-метоксипроиз-
водного карболина 3086. При этом образовалась смесь соединений, из
которой ожидаемый 5-метоксианалог 4-оксокарболина 3096 выделить
не удалось [34].
Оксокарболины 309 - весьма интересные интермедиаты для полу-
чения функциональнозамещенных ароматических /3-карболинов. Их на-
гревание с абсолютным гидразином в инертной атмосфере с высоким
выходом приводит к 4-амино-/3-карболинам 311 [308,314,315]:
311
В процессе реакции под действием гидразина амидная связь разры-
вается и образуется гидразон с последующим отщеплением аммиака.
С арилгидразинами направление реакции определяет индолизация по
Фишеру с образованием пента циклических конденсированных систем
312 [314,315]:
309а -» R
R ’ Н, Ct
312
64
При нагревании 4-оксокарболина 309а с аллиловым спиртом в при-
сутствии п-толуолсульфокислоты получается 4-аллилокси-/3-карбо-
лин [315]:
309а + снг = сн - снгон--------
в
о-снг-сн = снг
В данной реакции одновременно образуется енольный эфир, рас-
щепляется амидная связь и промежуточное 1,2-дигидропроизводное
окисляется в ароматический карболин. Аналогично оксокарболин 314,
полученный при взаимодействии лактама 313 с ДДХ, при обработке ме-
тилортоформиатом в присутствии n-толуолсульфокислоты в метаноле
превращается в I- (2-метоксикарбонил)-4-метокси-/3-карболин 315 с
выходом 51 % [208]:
3-Метоксикарбонил-1,2,3,4-тетрагидро-0-карболины, содержащие в
положении 1 остатки перацетилированных пентоз и гексоз, ароматизи-
руются под действием ДДХ в трифторуксусной кислоте при комнат-
ной температуре с выходом 50-60 % [37]. Производные 2-тозил-З-ме-
токсикарбонилтетрагидро-Р-карболинов дегидрируются в присутствии
оснований Так, при нагревании карболина 316 с метилатом натрия в
метаноле с количественным выходом получен ароматический карбо-
лин 317 [54]
снгснмег
318
Реакция протекает до конца лишь на воздухе В инертной атмосфе-
ре образуется 1,2-дигидропроизводное 318.
65
4.2. АРОМАТИЗАЦИЯ ЗД-ДИГИДРО 0 КАРБОЛИНОВ
Одним из наиболее эффективных методов ароматиз ции 3,4-дигид.
ро-0-карбоиинов является их нагревание с палладием в этиленгликоле
[256, 257] либо в отсутствие растворителей при температуре 200 °C
[240, 254]
1- (Хинолин-6-ил) -0-кярболин [234]. Смесь 57 мг 1-(хинолин-6-ил)-3,4-дигид
ро-0 карболина и 40 мг пиллвдиевой черни нагревают 45 мин при 180-200 *С
Охлажденную массу растворяют в смеси хлороформ метанол (1 1). Катализате
отделяют, фильтрат упаривают, остаток растворяют в 5 %-й серной кислоте, про-
мывают эфиром, подщелачивают раствором гидроксида калия, экстрагируют хло-
роформом. Выход 30 мт (53 %), т.пл. 238-240 °C.
Для соединений, неустойчивых при повышенных температурах
описано применение палладиевого катализатора, полученного восста-
новлением водною раствора хлорида палладия борогидридом нат
рия [294].
1-Метил-4 пролил р-карболин (294]. К перемешиваемому раствору 0,51 Г
(2,4 ммоль) ди идрата хпористо!о палладия в 45 мл воды при температуре 25 °(
в атмосфере азота добавляю! 0,27 г (7,2 ммоль) боргидрида натрия в 14 мл во
цы. Через 1 2 мин раствор подкисляют соляной кислотой, добавляют 1,32 г
(11,4 ммоль) малеиновой кислоты в 10 мл воды и 0,6 г (2,28 ммоль) гидрохло
р>ша 1-метнл-4-иропил-1.2,3 4-тстрагидро-0-карболипа в 30 мл воды. Отгоняют на
масляной б«нс воду с одновременным добавлением 45 мл этиленгликоля. По дос-
тижении Температуры реакционной смеси 140 °C нагревают еще 1,5 ч, охлаждают
катализатор отфильтровывают, разбавляют водой, подщелачивают поташом и эк
страгируют эфиром.
Для ароматизации 3,4-ди1идро-Д карболинов кроме палладия при
меняются также азотная кислота, селен, перманганаты и бихроматы
[3]. В последние годы с этой целью использовались N-бромсукцинимид
и 2,3-дихлор-5,6-дидинбензохинон [316]
Из сравнительно новых методов ароматизации следует отметить
фотоишуцируемое окисление, позволяющее успешно проводить реак-
цию в тех случаях, когда традиционные методы не дают ожидаемого
результата. Так в ряду 1,4-дизамещенных 3,4-дигидро-Дкарболинов
удалось ароматизировать 1 4-диметил- и 1-метип4бснзил-3,4-дигидро-/3
карболины при помощи диоксидов маргапца и палладия [257]. Для
карболинов 319, содержащих остатки производных пиридина, пиразола
и имидазола, эти методы оказались непригодными. Цель была достиг-
нута при облучении кислых растворов дигидрокарболинов 319 ртутной
лампой в присутствии кислорода воздуха'
31Р бб 320
Выход карболинов (320) составил 35- 50 %
1-Метнл-4-[(1-метнллиразйлил-4) метил] -j3 карболки [257]. Раствор 0,25 1 ци-
гидрохл°рида 1-метил-4-[(1-ме1'илпираэолил-4)-метил) -3 4 дигидро-‘3-карболниа в
250 мл 10 %-й НС в кварцевой колбе при интенсивном перемешивании облучают
с помоихыо лампы низкого давления 2 ч, подщелачиваю г твердым гидроксидом
натрия и экстрагируют эфиром. Экстракт сушат сульфатом натрия, эфир отго
няют, остаток кристаллизуют из ацетона. Выход 90 мг (48 %),т.пл. 218 219 °C
Протекание рассматриваемых реакций зависит ог концентрации
кислоты в реакционной смеси [317]. Например, в водных растворах
перхлоратов дигидрокарбопинов 321 превращение идет относительно
321 322
R=H, Me; НХ=НС1, НС1О,, Н, SO, НВг, СГ,СОа Н.
медленно. С повышением концентрации кислоты скорость реакции
резко возрастает. При облучении 1-метил-3-карбокси-3,4-дигидро-3-
карболина происходит декарбоксилирование и образуется 1-метил в-
карболин (гарман) [317, 318] Эффективность фотоиндуцируемой
ароматизации продемонстрирована при разработке нового общего ме-
тода получения алкалоида бревиколлина (324) [319]:
323 324
Попытки окислить дигидрокарболин 323 тетраацетатом свинца,
перманганатом калия, диоксидом марганца, оксидом серебра или соля-
ми меди в присутствии кислорода в лучшем случае приводили к гарма
ну (327). По мнению [319], под действием окислителей сильнооснов-
ный донорный центр в молекуле 323 образует катион-радикал 325, ко-
торый самопроизвольно превращается в квазибензилкатион 326 и да-
лее- в гарман (327):
326
32
325
67
Бревиколлин (324) удалось получить при фотоокислении кислого
раствора дигидрокарболина 323 в присутствии фотосенсИйилизаторов
В качестве побочных продуктов образуются также бревикарин 318 и
его ацетат [319]:
0
R'-C ««
R
331
COfEt
О
ИС1,нг0 , “
--- R’-C-HN
ДМСО, 6
R
332
CO2Et
АС ОН
323-------—
сг3со?н
миме
R=H, Me R' =H, Me.
Выход
ко, 3
5-, 6- и 7-ашшамино-/3-карболинов 332 не превышает, одна-
Чем больше разбавление, выше концентрация кислорода и выше темпе-
ратура реакционной смеси, тем больше выход бревиколлина (324),
который не является промежуточным продуктом для бревикарина
(328), «по установлено дополнительным опытом. Бревикарин (328)
образуется из дигидрокарболина 323 без облучения и в отсутствие
окислителей. Это чисто термический кислотнокатализируемый про-
цесс, протекающий, вероятно, по следующей схеме-
4.3. СИНТЕЗ
ИЗ НЕКАРБОПИНОВЫХ ПРЕДШЕСТВЕННИКОВ
323
При получении ароматических 0-карболянов на основе соединений,
не имеющих кврболиновой структуры, задача сводится либо к форми-
рованию пиррольного кольца, либо к решению проблемы аннелирова-
тия пиридиновою фрагмента к положениям 2 и 3 молекулы индола.
Примером первого подхода служит применение реакции I ребе-
Ульмана для получения б-замещенных 0-карболинов 334, образующих-
ся с выходами 26-95 % при термолизе или нагревании с ПФК триазоло-
пиридинов 333 [321]: ________
Аналогично производным 3-карбокся-1,2,3,4-тетрагидро-|3-карболи-
на [54] 3,4-дигидро-0-карболинЗ карбоновая кислота (329) легко аро-
матизируется в щелочной среде [320]. Реакция протекает в растворе
гидроксида натрия в течение 40 мин при температуре 50 °C, выход
/3-карболина 330 70 %:
R-H, Me, ОМе, F, С1.
идеи
нг0
330
Эфиры и амиды кислоты 329 гладко дегидрируются при нагрева-
нии со спиртовым раствором тризтиламина [320]. Для ароматизации
диэфира 331 использована реакция декарбэтокснлирования, заключаю-
щаяся в нагревании производных малоновой кислоты в диметилсуль-
фоксиде в присутствии хлоридов щелочных металлов [249]
68
Нагреванием нитропиридина 335 с триэтилфосфитом при 160 °C
в течение 15 ч синтезирован 1-метил-3-хлор-|3-карбол11Н (336) [322]'
335 336
При разработке полного синтеза алкалоида лавендамицина установ-
лено [323], что известными методами циклизацию арилпиридипа 337 в
69
0-карболин 339 провести нельзя из-за некопланарности арильного и пи
рицинового ядер. Осуществить этот процесс удалось при использовании
трис- (трифенилфосфин)-палладия
(PPh3),Pd
338
342 343
3-Этокс икарбонн л-9 метоксиметил-0-карболин [325]. Раствор 4,49 г
(22,11 ммоль) 1-мегоксиметил-2-метип 3-формилиндола в 11 41 г (88,44 ммоль)
этил яого эфира аэидоуксусной кислоты добавляют по каплям при температуре
от -12 ДО -3 *С к перемешиваемому раствору 2 035 г (88,44 мгатом) натрия в
50 мп этанола. Смесь перемешивают при этой температуре 6 ч, затем позволяют
агреться до комнатной температуры выливают в насышеннь й ра твор хлорида
аммония н экстрагируют эфиром. Экстракт промывают водой сушат сульфатом
магния упаривают и остаток хроматографируют на силикагеле. Вых.од азидоакри-
лата 341 2,52 г (36 %), т.пл. 90 °C (разл.).
Раствор 0,5 г азидо акрилата 341 в 100 мп ксилола кипятят в течение 1,5 ч.
После упаривания растворителя остаток хроматографируют на силикагеле. Выход
Д-карболииа 343 0,266 г (59 %),тля. 128,5-130,5 °C.
339
Реакция, по-видимому, протекает через шестичленный интермеди-
ат 338 с последующим восстановительным элиминированием, которо-
му способствуют пониженная за счет двух сложноэфирных групп нук
леофильность аминопиридина и слабая N Pd координация [323]. Рас
смотренный подход весьма специфичен, поэтому трудно ожидать, что
он будет пригоден для синтеза /3-карболинов иного строения.
Более перспективный путь получения производных р -карболина
открыт при исследовании термического разложения о-алкилазидоакри
патов типа 341. Данный метод послужил основой для нового синтеза
0-карболиновой системы [324], Необходимым условием конденсацтл
2-метил-З-формилиндола (340) с азидоуксусным эфиром является бло-
кирование N-H-грулпы пиррольного кольца Циклизацию проводят
нагреванием раствора азидоакрилата 341 в ксилоле. Проведение реак
ции в дегазированном ксилоле в инертной атмосфере позволило эафик
сировать образование в качестве промежуточного продукта 1,2-дигид-
ро-Р-карболина 342, который, однако, не выделен из-за чрезвычайн
быстрого окисления в 0-карболин 343 при контакте с Воздухом [324
325]:
В случае 2-зтилиндола 344 состав продуктов реакции изменяется
в зависимости от условий ее проведения [324]:
347
В о-дихлорбензоле с выходом 45 % образуется 0-карболин 345, тог
да как нагревание в более полярном диметилформамиде приводит ис-
ключительно к азепину 346 Термолиз в ксилоле дает смесь 0-карболи-
на 345 и азепина 346. При более низкой температуре в 6eH3onv образу-
77
ется новый продукт - енамин 347, идентифицированный как N-ацвт
производное. Енамин 347 очистить не удается, так как прихроматог j
фии на силикагеле он превращается в азепин 346, а при нагревали
различных растворителях - в 0-карболин 345 и (или) азепин 346 к
это наблюдается для исходного азидоакрилата 344.
При термолизе 2 и-пропильного производного 348 в ксилоле и
метилформамиде образуется только индолоазепин 349, а в бензоле
енамин 350, превращающийся в азепин 349 при контакте с сипикаге .
зво
На основании приведенных данных предложен следующий меха
низм реакции [325]:
3BI 35» 3t3
По-видимому, при термолизе индолилазидоакрилатов 351 обра-
зуются азиридины 352, аходящиеся в термическом равновесии с ви-
нилнитренами 353, которые в результате 1,6-перемещения протона
превращаются в иминь 354. Далее происходит пибо эпектроцикличес-
кое замькание кольца с образованием 1,2-дигидро-Р-карболинов
(355, R1 =RJ=H), пибо перемещение протона, приводна ее к енаминам
356 (Ra=CH2Rs). Поскольку енамины 356 получаются только при бо-
лее низких температурах, их можно отнести к кинетически контроли-
руемым продуктам. При повышении температуры в зависимости от
полярности среды и строения радикалов R и R1 возможны возвраще-
ние к иминам 354 и циклизация в карболины 355 или путем конъюги-
рованной атаки аминогруппы по концевому атому углерода винильнои
группы замыкание семичленного кольца индолоазепинов 358. Послед-
нее превращение, не наблюдаемое в других системах, можно объяснить
частичной поляризацией 3-замещенной системы индола, приводящей к
резонансной структуре 357.
При обработке азидоуксусиым эфиром частично защищенного
1-метил-2,3-диформилиндола 359 образуется азидоакрилат 360, вы-
делить который довольно трудно, так как в присутствии даже следов
кислоты он гидролизуется до альдегида 361, циклизующегося уже при
комнатной температуре в карболинои 363. Термолиз азидоакрилата
360 с количественным выходом приводит к 1-метоксикарбслину
362 [326]
—jf-CHO N3CH2CO2Et
'^сн(оме)г
ме
йе сн(0ме)г
360
361
3S9
В диформилиндоле 364, не имеющем защитных групп, более реак-
ционноспособной является формильная группа в положении 2. Полу-
чающийся при обработке десятикратным избытком азидоук^сного
эфира азидоакрилат 365 весьма нестабилен и циклизуется в момент об-
разования в 7-карбоциион 366 с общим выходом 60 % [326]
73
72
H7CH?C(btt
сно
ме tH0
365
r'. К-СОгЕ‘- Ph’
п
372
364
366
Неудачной оказалась также поньНка получения 3-зтоксикарбо
нил-Р-карболина 367 конденсацией дй'формилинлола 364 с эфиром
глицина При этом получен эфир у-карбопинкарбоновсй кислоты
368 [326J
367
Збв
R*=H;4-, 5-, 6-Ме 4- 5-, 6-ОСН,РЬ; 7 ,8-ОМе; 5-, 6-С1; 5-, 6 NO,.
Реакцию проводят в присутствии уксусной или трифторуксуснои
кислоты; в определенных условиях можно выделить промежуточные
продукты присоединения 371 Выходы /3-карболинов 372 Составляют
40-80 %.
5-Метил-3-этоксикарбонил-(1-карболин [328]. Смесь 3,1 г свежеперегнанного
этилового эфира аминоуксусной кислоты, 17,7 г диэтилацеталя диметилформа
МИДа и 0,3 г трет-бутилата калия нагревают вначале до 80 “С (температура бани),
затем постепенно до 160 °C, одновременно отгоняя образующийся этанол и дру-
гие легкокииящие компоненты. Через 5 ч остаток фракционируют в высоком
вакууме, затем перегоняют еще раэ. Выход азадиена 370 (R=CO,Et) 3,6 г (54 %),
т. пл. 150-160° (0,05 мм рт. ст).
К смеси 26 мл трифторуксусной кислоты и 90 мл уксусной кислоты при ох-
лаждении льдом и перемешивании приливают по каплям 22 г азадиена 370 (R =
=CO,Et), перемешивают 15 мин в атмосфере азота. После добавления 11,* г
4-метилиндола смесь перемешивают 17 ч при комнатной температуре и нагревают
2 ч при 150 °C (температура бани). Часть растворителей отгоняют, остаток вы л-
вают в раствор поташа. Кристаллический осадок отфильтровывают, промывают
водой, эфиром и сушат. Выход 17,3 5 г (79%), т.пл. 264 ° С (из этанола).
Во взаимодействии с триазином 373 индол выступает в >оли дие-
нофила [329]. При нагревании реагентов в диглиме ири 180 °C в тече-
ние 20 ч с выходом 50 % образуется /3-карболин 374:
Изящным подходом к синтезу ароматических /3-карболинов явит
ся метод, основанный на конденсации индолов с азадиенами 370, по-
дучаемыми взаимодействием ацеталей диметилформамида с производ-
ными метиламина 369 [327,328]:
нмег
име, 1
> R
RCH, нн, + HCIOAtk), ---------
2 2 г -Aik он
нмег
369 370
373
374
1-Меркапто-3-зтоксикарбонил-/3-карболин 378 неожиданно полу-
чен при обработке соединения 375 смесью тиоуксусной и трифтсрук-
сусной кислот [330]:
чмег
371
AcSH
CF3COaH
ЗТ5
376
74
75
377 378
Образующийся вначале дитиоацеталь 376 в условиях реакции, по-
вицимому, циклизуется в 1,2-дигидрокарболин 377, который сПонтан
по ароматизируется с отщеплением воды и дезацетилированием 1-аце-
тилмеркаптогруппы.
1 Меркапто-З-этокснкарбоиил-Д-карболин [330J. Раствор 1,79 г (9 ммоль)
этилового эфира 2-оксимипо З-бромиропиоНовой кислоты в 100 млхлористо1о
метилена добавляют по каплям к перемешиваемой смеси 1 23 г (8,5 Ммоль)
2-формилиндоиа и 1,65 г (16 ммоль) карбоната натрия в 100 мл хлористого ме
тилепа в атмосфере аргона. Смесь перемешивают при комнатной температуре под
аргоном 16 ч, затем фильтруют через тонкий слой силикагеля и фильтрат упари
вают досуха. Остаток хроматографируют На силикагеле и получают 1,6 г (69 %)
этилового эфира 2-оксимино-3-(2-формнлиидолил-3)пропионовой кислоты
(375); т.лл. 185 187 °C (дихлормстаи-гексан).
Раствор 274 мг (1 ммоль) соединения 375 в 5 мл тиоуксуспой кислоты ох
лаждают до О °C и добавляют 1 мл трифторуксусной кислоты. Реакционную
смесь перемешивают при охлаждении 18 ч, разбавляют хлорисТым Метиленом
промывают водой, 5 %-м раствором бикарбоната натрия, раствором хлорида Нат
рия и сушаг. Растворитель упаривают, остаток Кристаллизуют из метанола. Выход
220 мг (81 %), т.пл. 236 -230 °C.
4.4. РГЦИКЛИЗАЦИЯ СОЛЕЙ
ИНДОЛО1 2.3-с) ПИРИЛИЯ
В конце 60-х годов Г.Н.Дорофеенко и сотрудники [331-333] впер-
вые получили соли индсло[2,3-с] пиридин 379 и показали, что при об
работке их аммиаком образуются замещенные Р -карболииы:
379
Превращение солей пирилия в соответствующие пиридиновые ос-
нования представляет собой наиболее важное свойство соединений это-
го рода [334—336] Реакция, как правило, протекает с высоким выхо-
дом и часто применяется при получении труднодоступных пиридинов
Перхлораты индоло [2,3-с] пирилия 379 образуются при смеше-
нии индольного кетона общей формулы 380 с ацилирующей смесью, ча-
ще всего получаемой из иигидрида карбоновой кислоты и 70 %-й хлор-
ной кислоты:
76
Как будет показано дальше, перхлораты индоло [2,3-с] пирилия в
большинстве случаев можно выделить с высоким выходом, поэтому с
учетом легкости их превращения в карболиновые основания приведен-
ий метод синтеза 0-карболинов представляет определенный препара-
тивный интерес, так как в отличие от реакций Бишлера -Напиральско-
го и Пикте Шпенглера в нем отсутствует стадия дегидрирования Ана-
лог природного алкалоида гармана 1,3-диметил-|3-карболин (383) по-
ен таким путем из 3-ацетонилиндола (381) [332]
301
382
383
Выход перхлората 383 составил всего 10 %. Однако впоследствии
при использовании, по-ввдимому, более чистого кетона 381 [337] и
при изменении порядка смешения реагентов выход на первой стадии
был повышен настолько, что данный метод можно рекомендовать в ка-
честве наиболее удобного для синтеза 3-метилгармана 383 [338],
13-Диметил-р-карболин (338]. К смеси 10 мп уксусного ангидрида, 5 мп ук-
сусной кислоты И 0,8 мл 70 %-й хлорной кислоты при перемешивании и темпера-
туре 18-20 °C в течение 5-10 мин прибавляют 1,73 г (0,01 моль) 3-ацетонилин-
дола [337]. Через 3—5 мин начинается кристаллизация продукта, которая эавер
шается спустя 1,5 ч. Осадок перхлората 382 отфильтровывают, промывают 5 мл
уксусной кислоты, затем два-три раза эфиром по 10 мл. Выход 2,76 г (92 %),
т.пл. 264 ‘С (из спирта).
Полученный перхлорат (1,5 г) смешивают с 10 мл спирта, пропускают газо-
образный аммиак в продолжении 15-20 мил, нагревают до кипения 30 мин, ох-
лаждают и выливают в 100 мл холодной воды. Через 1,5 2 ч выпавший осадок
фильтруют, промывают водой, сушат. Выход 1.6 г (80 %), т.пл. 180-181 °C (из
смеси петролейного эфира и хлороформа, 2:1).
Из N-замещенных 3-ацетонилиндолов 384 синтезированы 1,3,9-
замещенные (3-карб опины 386 [331, 332]:
1,3,9-Триметил-0-карболин 1331, 332|. К 5,6 г ]-метил-3-ацетонилиндола прц
бавляют охлажденную до 0°С смесь 15 мл уксусно! о ангидрида и 2,4 мл 70 %-й
НСЮ4 при энергичном перемешивании. Реакционная смесь разогревается и срез
же закрисгаллизовывается. После охлаждения приливают 20 мл эфира, переме
шивают, осадок фильтруют, промывают эфиром и сушат. После перекристалли
зации из воды выделяют 6,3 г (67,7 %) перхлората 385 ст.пл. 250-251 °C (разл
Обработка его водным аммиаком приводит к 0-карболину 386. Выход 75-80
т.пл. 77 79° (из смеси бензола и петролейного эфира).
При ацилировании 6-метоксизамешенного 3-ацетонилиндола 38'
образуются перхлораты 388, из которых получены гомологи алкалои
да гармина 389 [339, 340]:
R=Me, Et.
1,3-Димет11л-7-метокси-Р-карболин [340]. К раствору 1 г З-ацетонил-6-мет
ксииндола в 5 мл ледяной уксусной кислоты прибавляют охлажденную до 0 °C
ацилирующую смесь, приготовленную из 7 мл уксусного ангидрида и 0,7 м
70 %-R хлорной кислоты. Реакционную смесь перемешивают и оставляют при
комнатной температуре. Через 30 мин фильтруют, промывают эфиром Выход
перхлората 388 1,43 г (88 %); т.пл. 225- 226 °C (этанол — нитрометан, 4:1)
К 1 г перхлората 389 приливают 10 мл этанола и насыщают газообразным
аммиаком в течение 30 мин, охлаждают и выливают в 100 мл воды. Через 1,5
2 ч осадок отфильтровывают, промывают водой и сушат. Выход 3 метилгармин
389 составляет 0,59 г (84 %), т.пл. 150-151 °C (из метанола).
Большое количество (24 соединения) арил (гетерил)замещен
ных индоло [2,3-с] пирилиевых солей 391 получено из кетонов
390 [341]:
R ci
(R2CO1jO nh,
I if9 ч ---------------- I d (+1 —1
о hcio4 1 N ^0
R Я £ СЮд
390 391 392
R - Me, Et ;
R' = Ph, 4-меОС6Н4, 3,4-(МеО)гС6Н3 , о » W
Rl>Me. Et, Pr, i-Pr
Выход перхлоратов 391 составляет 70—97 %. Они превращаются в
карболины 392 при нагревании со спиртовым раствором аммиака в
запаянной ампуле до 100 °C в течение 4 ч. Рассматриваемый метод ока
эался удобным для введения в молекулу гармана углеводных замести-
78
гелей Выход 0-карбопинов 395 равен 15 34 % в расчете на исходный
кетон 393 [333,342]:
Г-iTV (^°
о нсю4
Лае
393
394 395
R=D-(CH0Ac)4CH, ОАс, Л-(СНОАс),СН,ОАс, R‘ =Ме, Et, Pi
1,9-Диметил-3-(О-галактопеитаацетоксиамил)-0-карболин [333]. В 10 мл
уксусного ангидрида растворяют 4 г (0,007 моль) пента-О-ацетил-1-деэоксп-
1-(N-метилиндолил 3)-кето-Д-галактогелтулозы и ио каплям добав 1яют 0,8 мл
70 %-й хлорной кислоты Через 15- 20 мин сильно осмоленную смесь разбавляют
500 мл эфира. Выпавший темно-коричневый осадок перхлората С-гликозилиро-
ванного индоло [2,3-е] пнрилия (394) тщательно растирают в эфире, филируют н
мпоюкратно промывают на фильтре эфиром. Перхлорат индолопирнлия суспен-
зируют в эфире и обрабатывают избытком 20 %-го водного аммиака. Продукт эк-
страгируют 5-10 раз эфиром при энергичном встряхивании. Эфирную вытяжку
сушат сульфатом натрия и чистят активированным углем. После упаривания эфи
ра остается 0,94 г (22 %) продукта в виде желтого аморфного порошка. Дальней-
шая очистка производится переосаждением из хлороформа нетролейным эфиром
с отбрасыванием первых выпавших фракций.
Многочисленные тетрациклические /3-карболины синтезированы из
соответствующих пирилиевых солей с использованием в качестве ис-
ходных субстратов 2-(3-индолил) циклоалканонов. Так, из 2-(З-ивд су-
лил) димедона 396 получен ряд аннелированных производных и го-
мологов по 1-СНз-группе гармана 398 [343, 344
R=Me, Et, Pr, i-Pr, Bu, CH, Ph, Ph, CT,
Интерес к этим соединениям был вызван не только доступностью
кетона 396 [345], но и тем, что среди них обнаружены активные транк-
вилизаторы и антидепрессанты.
Общая методика получения перхлоратов 397 [343]. К смеси 25 мл карболо-
вой кислоты, 0,1 моль соответствующего ангидрида и 0,01 моль 70 %-й хлорной
кислоты при комнатной температуре и перемешивании добавляют 0,01 моль
2-(3-юшолил) димедона 396, Через 2 ч выпавший осадок фильтруют, промыва-
ют эфиром и сушат. Выход 87-92 %.
Для введения бензильного и фенильного заместителей используют хлоран-
гндрнды фенилуксусиой и бензойной кислот в нитрометане ] 343], атоифторме-
тильпого трифторуксусный ангидрид [343, 344].
Общая методика получения аниеляроваиных производных гармана и его
79
гомологов [343]. В суспензию 0,01 моль перхлората 397 в 50 мл спирта проиуе.
кают газообразный аммиак в течение 30 мин Раствор кипятят 30 мин ох паж.
ют и разбавляют 250 мл воды. Выпавший осадок карболииа 398 отфилыровц.
вают и сушат Выход 84-90 %.
3,3 Димегил-6-трифторметил-1-оксо-1,23,4-те1рагидроиндоло[2,3'С]хииолин
(398, R=CF,) [344]. К смеси 7 мл (0,05 моль) трифторуксусного ангидрид» я
3 мл трифторуксусной кислоты добавляют 2,55 г (0,01 моль) 2-(3-индолил)дц.
медона и оставляют на сутки при комнатной температуре. К образовавшему д
ярко-красному раствору при охлаждении до 5 6 * ВС последовательно добавляю!
0,8 mi (0,01 моль) 70 %-й хлориой кислоты к 00 мл абсолютного эфира Выпав
ший осадок фильтруют промывают эфиром и сушат. Выход перхлората 3,3-дн
метнл-6-трифторметип-1-оксо-1,2,3,4-тетрагцдроиидоло[2,3<] беизопирилия 2,9 г
(67 %), т.пл. 220 “С (разя.).
К смеси 3,8 г (0,05 моль) ацетата аммония и 50 мл уксусной кислоты добав
ляют 4,3 г (0,01 моль) полученного перхлората и кипятят раствор ЗОмии После
охлаждения добавляют 250 мл воды, выпавший осадок фильтруют и сушат. Вы
ход 3,2г (95 %),тлл. 157-158 °C (изэтанола).
Возможности 3,4-аннелирования молекулы 0-карболина и получе-
ния тетра- и пентациклических соединений 403 данного ряда продемон-
стрированы при использовании других исходных индолилниклоалкан
нов. 2-(3-индолил) циклогексанона 399 [346] и 2 (3 индолил) индан
6 Метнл-1,23Д-тетрагидронидоло[23<]хинолнн (401, RrCH,) [346] В при
готовленной при охлаждении смеси 6 мл уксусного ангидрида 6 мл уксусной
кьелоты и 0,6 мл 70 %-й хлорной кислоты растворяют 1,3 г (0,006 моль) 2-(ин
долил-3)циклогексанона [347]. Через 2-3 ч выпавший осадок перхлората 6-Mt
тип-1,2,3,4-тетрагидроиндоло[2,3-е]беизопирилия (400) фильтруют, промывают
эфиром и сушат в вакууме. Выход 1,6 г (77 %), тлл. 260- 262 °C. Суспензию
1,4 г попучениого перхлората в 30 мл спирта насыщают газообразным аммиаком
кипятят 1 ч и выливают в воду. Выпавший осадок фильтруют промывают водой
н сушат. Выход 0,8 г (80 %), т.пл. 194-195 °C.
/ 80
Глава 5
РЕАКЦИИ Р КАРБОЛИНОВ
Ароматические 0-карболины вступают в реакции электрофильного
замещения с образованием в основном производных по положению 6.
В зависимости от условий проведения реакции могут быть получены
также смеси 6-и 8-производных или 6,8дйзамещенные р-карболины.
Так нитрование З-метоксикарбонил-0-карболина 86 %й азотной кисло-
той при температуре 2-4 °C [259], 3-метилтио-0-карболина 65 %-й азот-
ной кислотой при комнатной температуре [80], 3-этоксикарбонил4-ме-
токсиметип-0-карбонила смесью 65 %-й и дымящей HNO3 при 0 °C
[348] или 3-этоксикарбонил-4-метил-0-карболина смесью дымящы и
концентрированной HNO3 при температуре не выше 10 °C [ 48 при-
водит к соответствующим 6-нитропроизводным с выходами более 80 %.
З-Метоксикарбоиил-6-иитро-р-карболин [249]. Добавляют при перемешива-
нии небольшими порциями в течение 1 ч 4 г (17,7 ммоль) 3-метоксикарбоинл-р-
карболина к 30 мл 86 %-Ъ азотной кислоты при температуре не выше 4 сС. Раст-
вор выдерживают при температуре 2 °C в течение 3 ч, выпивают на смесь толчено-
го льда и 75 мл концентрированного водного аммиака. Выпавший осадок от-
фильтровывают, промывают водой до нейтральной реакции и сушат в вакууме.
Выход 4,4 г (92 %),тлл. 314-315 °C (изДМФА).
Аналогично синтезированы 1-метил-3-метоксикарбони.л-6-иитро-Р-карболин
(выход 97 %, тлл. 313-316 °C), З-этоксикарбонил-6-нитро-Р-карболин (выход
97 %, т. пл. 333-335 °C) и 1-метил-3-этоксикарбонил-6-нитро-Р-карболин (выход
94 %,т.пл. 330 °C).
Проведение нитрования при повышенных температурах способству-
ет появлению в продуктах реакции 8-нитроизомеров. Например, нагре-
вание Р-карболина [310], 3-метилгармана, 1-алкил-0-карболинов с кон-
центрированной HNO3 при 80-90 °C [304] и 4-этоксикарбонил-0-карбо-
лина с 65 %-й HNO3 при 75 °C [80] дает смесь 6- и 8-нитропроизводных.
6-Нитро-и 8-иитроР-карболины [310]. Смесь 4,96 г (29 ммоль)/3-карболина
и 60 мл концентрированной HNO, перемешивают при охлаждении льдом в тече-
ние 2 ч и нагревают 15 мин на кипящей водяной бане. Горячий раствор выливают
на 30 г толченого льда, осадок отфильтровывают, промывают водой, растворяют
в 900 мл воды и нейтрализуют 10 %-м раствором гидроксида натрия. Получают
4,88 г (78 %) смеси нитрокарболинов, которую обрабатывают 4 л горяч - о хло-
роформа. Нерастворившийся остаток (2,64 г, 42 %) поспе трех кристаллизаций
из ацетона дает 0,85 г 6-нитро-р-карбопина, т.пл. 340 343 "С. Хлороформ упари-
вают, остаток (1,65 г , 26 %) перекристаллизовывают из минимального количест-
ва диметилформамида и получают 0,5 г 8-нитро-р-кирболииа с т.пл. 320 °C (разлД
1-Алкил- и 1-трифторметип-Р-карболины при обработке смесью
келпептрированных азогной и серной кислот превращаются в 6,8-ди.
нптропроизводные без примесей продуктов мононитрованпя [63, 349)
На процесс замещения значительное влияние оказывают заместите-
ли в бензольной части молекулы и у атома азота пиррольного цикла
Так, 6-метокси-(3-карболин (404, R=H) при взаимодействии с 80 %-й
НЬ'О3 превращается в 5,7-динигро^-карболин (405) [348] а N-аце-
Iильное производное (404, R=Ac) в смесь соединений 406, 407 и 408 в
соотношении 8: J: J:
406
407
40В
В случае 1-метпл-7-окси(метокси)-Р-карболшгов получаются 6-нит
роизомеры с выходом 55 85 % [350,351] Галогены взаимодействуют
с (3-карболинамп, ис имеющими заместителей в бензольном кольце
также с преимущественным образованием 6-производных Реакцию с
бромом проводят в 1етр:и идрофуране [352] или в смеси дихлормста-
на с пиридилом [348]. с хлором в дихлорметане [348], с подом
в смеси иодной, серной и уксусной кислот [80 353, 354]. Описано ио-
дирование 3-этокснкарбонигь4-метить|3-карболина пятикратным избыт
ком хлористого иода в хлористом метилене при комнатной темнерату
ре [348].
3-Эгокснкарболил-4-метил-6-иод-р-карбол1111 (354]. Смесь 10.2 г (40.2 ммоль)
З этоксикарбонил-4 метил-Р-карболпиа. 80 мл ( Н,СООН. 1.9 мл поды, 0,5 1I,SO4
1,38г (7.84 ммоль) иодной кислоты и 3,5 г (13.8 ммоль) иода перемешивают 3 ч
при 80 °C и после охлаждения выливают п смесь 50 мл поды и 50 мл этанола. Оса
док отфильтровывают. суспендируют в 600 мл этилаиемыа и экстрагируют 300 м
1н. раствора гидроксила пагрия. Opi эпический слой промывают водой, сушат и
упаривают. Остаток растирают с небольшим количеством зтилаистата. осадок оз
фильтровываюг. Ьыхоц 9 г (59 %), г. пл. 245 250 ’С.
82
АналО! ичио синтезируют З-этоксикарбопил 6 иод ^-карболин (выход 64 %,
Пи 310 315 °C) и 3-згоксикарбонил-4-метоксиметил-6 код р-карболпи (выход
57%,тлл.25°°С).
3-Этоксикарбонил-4-ме1ШР]3-карбоя1ш [348] и 1 трмфтормезил Д
карболин [63] с избытком брома дают 6,8-дибромпроизводные. При
обработке бромом 6-метокс и-Д карболин превращается в 5-бром-б-ме-
токси-Дкарболин (выход 71 %) [352], а 3-зтоксикарбонил-4-метил-6-
метокси-Дкарболин в этих условиях бромируется по положению 8
[348].
5-Бром-б-метокси-р-карболии [352). К раствору 0,2.5 г (1,26 ммоль) 6 ме
гокси р-карболина в 100 мл уксусной кислоты добавляют 0,202 г (1,26 ммоль)
брома в 5 мп уксусной кислоты, смесь перемешивают при комнатной reMnepaiy-
ре в течение ночи, растворитель удаляют в вакууме и остаток экстрагируют из
водного бикарбоната натрия хлороформом. Хлороформ упаривают, остаток крис-
таллкзуют из ксилола. Выход 0,25 г (71 %), т.пл. 218-219 °C.
Для бромирования Дкарболинов используется бромистый водо-
род в диметилсулъфоксиде [354] или в присутствии пероксида во,.о-
рода [63]. В этих условиях З-этоксикарбонил-6-амино-Дкарболин бро-
нируется в положение 5 [354], а 1-трифторметил-/3-карболин -- в
6,8-дибромироизводное с выходом, близким к количественно-
му [63],
Дигидробромид З-этоксикарбоиил-5-бром б-амнно-0-карболина [354]. К раст-
вору 2,8 г (11 ммоль) З-этоксикарбонил-6 амиио-Д-карболина в 210 мл днметил-
сульфоксида добавляют по каплям при комнатной температуре 140 мл 48 %-й
бромистоводородной кислоты. Выпавший после охлаждения реакционной смеси
осадок отфильтровывают и кристаллизуют из смеси метанол-диизопропиловый
эфир. Выход4,5 г (87 %), т.пл. 350 °C.
Исчерпывающее бромирование бензольного кольца 1-трифторме-
тил-Дкарболина происходит при использовании брома в иодной кис-
лоте [63]. Выход 5,6,7,8-тетрабромпроизводного 72 %.
Для галоидирования Дкарболинов применяются также галоидсук-
цинимвды [355]. Реакцию проводят в уксусной кислоте. При этом
6-метокси-Дкарболин с бромсукцинимидом дает смесь 5-бром-8-аце-
токси-(409) и 5,7-дибром-Дкарболинов (410) в соотношении 1:3.
В присутствии хлорсукцинимида образуется 5,7-дихлор-Дкапболин
(411), а в присутствиииодсукцинимида - 5-иод-8-ацетокси-Д карболин
(112) с выходом 31 %:
83
6-Иодпроиз водные (3-карболшюв взаимодействуют с монооксидом
углерода и бензиловым спиртом в присутствии палладиевых катализа-
торов и третичных аминов с образованием бензилоксикарбонилпроиз-
водных414 [353,354]:
Выделенный, из морских организмов эудистомин /V, представляю-
щий собой 6-бр*м-Р-кар45олин. получен бромированием /3-карболина
Нбромсукщлшмяом [3 161 .
6-Бром-д-карб 1ин 131 & J . К раствору 100 мг (0,60 ммоль) Р-карбопина в
4 мл уксусной килим добавляют 130 мг (0,73 ммоль) N-бромсукципимида и
смесь перемешинаж 2 ч пр я комнатной температуре. Растворитель упаривают в
вакууме, остаток рлзтворяю-т в хлористом метилене, промывают насыщенными
растворами бикарбоната натгрия и хлорида натрия, затем сушат. Растворитель
упаривают, остаток троматот'рафируют на силикагеле (20 г, этилацетат—гексан
(1:1) затем этилаыаг). Выход 1 00 мг (68 %), т.пл. 277 278 "С.
Х-Трифтормегия-З-карболип в этих условиях дает смесь 6-бром и
6,8-Дибромпронз?овпых [63], а 3-этоксикарбонил-4-метил-|3-карбо-
лил — смесь 6- и8-бромкарбол1шов [348] 1-Трифторметил-|3-карболин
с эквимолярный колгияеством хлорсукцинимИда превращается в
6-хлорпроизводнее. а с его избытком — в смесь 6-хлор- и 6,8-дихлор-|3-
карболинов [63]
Неожиданное влияние па характер взаимодействия бромсукцини--
мида с 3-этоксшрбо1П1гт-4-а.икпл-6-метокси-|3-карболином оказывает
ацетильная групсзу пиррюльиог о атома азота [348]. В этом случае бро-
мируется а-углерданый атом алкильной ipymibi в положении 4. Неко-
торые превращения 4-бромметил- и 4-бромзтил-|3-карболинов (413)
представлены насилующей схеме
84
414
R=H, Me, Et, СНаОМе.
Аналогично реагирует 3-этоксикарбоннл- 5-бром-|3-карболин (416).
полученный обработкой амина 415 изоамилнитригом [354]
i Am ОНО
Et ОН, А
СО.РПСНдОН
PdCl,(PPH3h
Бензильная группа эфиров 414 й 417 отщепляется в результате гид-
рогенолиза над палладием. 0-К. долины, содержащие аминогруппу в
бензольном ядре, синтезируют восстановлением соответствующих нит-
Ропроизводных [80, 249, ЗЮ, 350]
85
Дигидрохлорид 3-метокспкарбонпл-6амино-р-карболина [249]. К переме
шиваемой суспензии 0,5 г З-метоксикарбонид-б-нитро-0-карболина в 200 мл ме
танола в атмосфере азота при температуре 15 °C добавляют 0,2 г борогидрида
натрия и на кончике шпателя палладий, нанесенный на уголь. Перемешивают
смесь до прекращения выделения водорода, затем трижды повторяют эту опера
дню с гем же количеством восстановителя и катализатора, каждый раз дожида
ясь прекращения выделения водорода (всего примерно 3 ч). Смесь фильтруют,
упаривают в вакууме при температуре не выше 30 °C, к остатку добавляют
150 мл воды, водную суспензию экстрагируют этилацетатом (3x150 мл), упари
вают растворитель, новый остаток обрабатывают 10 мл кипящего бутанола и
отфильтровывают нерастворившийся материал. После добавления пяти капель
концентрированной соляной кислоты выпадает оранжевый осадок, который
фильтруют и кристаллизуют из 80 %-го водного этанола с добавлением иесколь-
ких капель соляной кислоты. Выход 350 мг (60 %), т.пл. 229- 232 °C.
3-Амино-|3-карболин (420) синтезируют из 3-зтоксикарбонил-(3-
карболина через гидразид 418 и азид 419 [356]:
419
АсОН
Л
420
Сообщается о получении 1-амино-/3-карболина с выходом 95 % ами-
нированием Р-карболина по Чичибабину [305]. 3-Амино-/3-карболин
(420) является удобным синтоном для синтеза других 3-замещенных
(3-карболинов [80, 357]:
При обработке /3-карболинов хпорсульфоновой кислотой образуют-
ся 6-сульфонил- и 6,8-дисульфопилпронзводные [80, 348].
В связи с обнаружением производных 0-карболина в ортанизмече-
ловека изучалась функционализация /3-кар болидов 421 микроорганиз-
мами Sporotrlelium sulfurescens АТСС 7195, Streplotnyces lavendulae
АТСС 8664, Streptomyces griseiis АТСС 10137 [358]:
o-R’H, б-R'Me,
B-R’Et, r-R = Pr .
Ферментатирование 3-этоксикарбонил-(3-карболина (421a) при помощи
АТСС 7195 приводит с выходом 62 % к 6-оксипроизводному 422 наря-
ду с небольшим количеством глюкозидов 423а и 424а. Введение азь
. килькой группы в положение 4 /3-карбопинового скелета влияет на ре-
гиоселективность микробиологической атаки. Так, карболин4216 прев-
ращается в смесь 6- и 8-оксипроизводных, выделенных в виде 4-0-ме-
ТИЛ-/3-глюкозидов 4236 и 4246. Функционализация положения 6 пол-
ностью подавляется у соединений 421в, г, которые с хорошими выхода-
ми дают глюкозиды 424в, г.
Микроорганизмы АТСС 8664 и АТСС 10137 обладают способ-
ностью гидроксилировать боковую цепь 4-алкильного заместителя кар-
болинов 421в, г с одновременным омылением сложноэфирных групп
и образованием лактонов 425 и 426. Эти превращения, однако, идут с
низкими выходами (7-8 %), исходный материал возвращается в неиз-
менном виде.
Глава 6
^-КАРБОЛИНЫ - ЛИГАНДЫ БЕНЗОДИАЗЕПИНОВЫХ
И ДРУГИХ МЕМБРАННЫХ РЕЦЕПТОРОВ
6.1. Б ЕНЗОДИАЗЕПИНОВЫЕ РЕЦЕПТОРЫ
НЕРВНЫХ КЛЕТОК
Бензодиазепиновым рецепторам посвящено много исследований
[1, 359—364]. Нами будут рассмотрены лишь вопросы, касающиеся
бензодиазепиновых рецепторов нервных клеток, которые существенны
для понимания нейробиологии Дкарболинов.
Термин ’’бензодиазепиновые рецепторы” (БДР) первоначально от-
носился к открытым в 1977 г. местам (участкам, сайтам) высокоаф-
финного насыщаемого специфического связывания бензодиазепиновых
транквилизаторов в мембранных фрагментах (синаптосомах) мозга
[365, 366]. Полное насыщение этих мест связывания достигалось при
концентрации меченного тритием 3Н-диазепама 50 нмоль/л, а концен-
трация попунасыщения, определяемая из изотермы абсорбции (или
графиков Скетчарда, Лайньюивера-Берка) и численно равная констан-
те диссоциации (А",?), составляла 2 нмоль/л [366].
БДР оказались широко представленными в центральной нервной
системе млекопитающих и большинства других позвоночных. У беспо-
звоночных и низших рыб БДР отсутствуют [364]. Наибольшее коли-
чество БДР в мозгу млекопитающих обнаружено в филогенетически
наиболее поздних структурах [364, 365]. В коре мозга человека их
плотность, определяемая по связыванию в гомогенатах мозга SH-диа-
зепама, превышает 100 фмоль/л 3Н-диазепама на 1 мг белка. Далее в
порядке уменьшения плотности БДР следуют мозжечок, миндалевид-
ное ядро, гиппокамп, гипоталамус (500-1000 фмоль/мг белка), приле-
жащее ядро перегородки, таламус, стриопаллидиум, черная субстанция
(250-500 фмоль/мг белка) и структуры среднего, продолговатого и
с* инного мозга (< 150 фмоль/мг белка).
Аналогичное описанному распределение БДР показано авторадио-
графическим и иммуноцитохимическим методами в мозгу животных и
человека [367]. При использовании 3 Н-флунитразепама, способного
необратимо связываться с белками под действием УФ-облучения и слу-
жащего фотоаффинной меткой бензодиазепиновых рецепторов, полу-
да
Бенздиаэепин, мола /л
Рис 6.1. Ингибирующее влияние 5-фепил 1,4-бензодиазепииов
на специфическое связывание ’ Н диазепама с мембранами ко-
ры мозга крыс [369]:
1 — клоназепам; 2 — лоразепам; 3 — бромазепам; 4 хлор-
диазепоксид
чены убедительные данные о нейронной их локализации. При этом <ро-
тоаффинная метка преимущественно выявляется на дендритах и аксо-
нах клеток: до 55 % в коре полушарий и до 74 % в коре мозжечка [368].
Связывание SH-диазепама с мембранами мозга конкурентно инги-
бируется в присутствии немеченого диазепама или другого 1,4-бенэо-
диазепина в зависимости от концентрации Из кривых, представленных
на рис. 6.1, легко определить р/С» = - 1g ICS0 и соответствующие зна-
чения концентраций немеченых лигандов, снижающих специфическое
связывание меченого на 50 Ч (ZCSO). Активность немеченых лигандов
можно выразить через константу ингибирования:
1С
К = .
‘ l+[L]IKd ’
где [£] — концентрация меченого лиганда, моль/л; К — константа его
диссоциации. Полученные в таких радиолигандных экспериментах зна-
чения /С50 или К/ для большинства 5-фенил-1,4-бензодиазепинов изме-
няются от единицы до нескольких десятков наномолей на 1 л (табл.
6.1), отражая высокий аффинитет к БДР. Сродство к последним корре-
лирует с фармакологической активностью бензодиазепинов [365, 369].
5-Фенил-1,4-бензодиазепины (табл. 6.2), известные под паз анием
бензодиазепиновых транквилизаторов (ЬДТ), обладают выраженным
противостраховым и противотревожным (анксиолитическим) действн-
89
Таблица 6.1. Активность 1,4-беизодиазепиновых траиквиляза
торов, юн ибирующнх специфическое связывание ’Н-диазепа
ма с мембранами коры мозга крыс
Соединение 1СК, нмоль/л [366) К), нмоль/л
По данным [365] По данным [426[
Нитразепам 34 1 —
Клоназепам 6 9 1.5 1,9
Лоразепам 10 2,7 3,3
Фи> нитразепам 5 2.8 2,8
Диазепам 34 6,3 8,9
Оксазепам 80 14 —
Хлоряназепоксид 1050 220 574
ем, понижают тонус скелетной мускулатуры (миорелаксирующее дей-
ствие), оказывают успокаивающее (седативное) и противосудорожное,
а некоторые — снотворное (гипнотическое) действие. Высокая фарма-
кологическая активность перечисленных соединений и особенно прису-
щее им анксиолитическое действие определили широкое их применение
в разных областях клинической медицины. Анксиолитическими и про-
тивосудорожными свойствами обладают и другие лиганды БДР: 1,5-бен-
зодиазепины, триазолопирвдазины, CGS-9896, зопиклон (см табл.6.2)
Среди производных 1,4-бензодиазепина обнаружена группа соеди-
нений, которые конкурентно ингибируют связывание 3 ГГ диазепама с
мембранами мозга, но не вызывают характерных для БДТ неврологи-
ческих и поведенческих реакций. Напротив, они являются антагонис-
тами БДГ, устраняя анксиолитический, миорелаксирующий, противо-
судорожный и нейрофизиологические эффекты последних [37 0, 371].
Наиболее активным и наименее токсичным из числа этих соединений
оказался этиловый эфир 8-фтор-5,6-дигидро-5-метил-6-оксо-4Н-имида-
зо[1,5-л] 1,4-бензодиазепин-3-карбоновой кислоты (см табл. 6.2,
Ro 15-1788). Аналогичными свойствами обладает 2-фенилпиразо-
ло-[4,3-с]хииолин-3-(5Н)-ОН (CGS-8216) [372]
Относительно механизма действия высокоаффинных к БДР бензо-
диазепиновых транквилизаторов имеется четыре гипотезы. Еще до
открытия БДР выяснилось, что БДТ изменяют содержание и метаболи-
ческий оборот в мозгу моноаминов, а анксиолитический эффект их
связан с дефицитом серотонинергических влиянии [373]. В 1975 г.
независимыми исследованиями [374, 375, 376] установлено, что дей-
ствие БДТ может опосредоваться путем изменения функции нейронов
мозга, медиатором которых служит у-аминомасляная кислота (ГАМК)
Когда было открыто существование в мембранах нервных клеток БДР,
локализация которых в разных областях мозга не совпадает с локали-
зацией рецепторов известных медиаторов, возникло предположение,
90
Класс соеди-
нения
Таблица 6.2. Важнейшие лиганды бензодиазепиновых рецешоров (без 3 «арб
пинов)
Структурная формула Заместитель Название или шифр
1,4-Бензодна-
зепииы
ЫНСНз
Хлор диазе-
поксид
К*-С1, R2=C4H,,R*= Диазепам
=Н, R4-CH,
R‘^NOa,Ra=C4H,, Нитразепам
r*-r4=h
R1 “NOa, R1 =o-CK, H4, Клоназепам
R*=R’=H
R‘ =Cl,Ra=C4H4, R’ = Оксазепам
-OH. R4=H
R‘ =O, Ra =о-С1С4 H4, Лоразепам
R‘=OH, R4=H
R‘=Br, Ra=o-€1C4H4, Феназепам
R*-R4=H
R* =N0a, Ra =o-FC, Ц,, Флунитра
R* =H R4 = CHt эепам
Триазоло-1,4-
бенэодиазе-
пины
Cl
R-C1
R=F
Триазолам
Мидазолам
Им идаз о-1,4-
бензо диазе-
пины
Ro 15-1788
1,5-Ьеизодиа-
зепнны
R=C1
R=CFj
Клобазам
Трифлубазам
91
Окончание, табл 6.2
Класс соеди-
нения
Заместитель
Название или
шифр
Триаэолопи-
ридазнпы
Структурная
формула
CL 218.872
Пиразоло-
хинолины
N —- N — R
CGS-9896
CGS 8216
Циклопир-
ролоны
Зопиклон
что БДР представляют собой самостоятельные виды мембранных ре-
цепторов и места первичного действия пока неизвестного эндогенного
лиганда со свойствами медиатора или нейромодулятора анксиолити-
ческой или анксиогепной системы мозга [377]. В последнее время эф-
фекты 1,4-бензодиазепинов связывают с их ингибирующим влиянием
на тканевое поглощение эндогенного аденозина и способностью усили-
вать угнетающее влияние последнего на нервные клетки мозга [378].
Вторая гипотеза получила наибольшее экспериментальное обосно-
вание. Уже вскоре было установлено [379], что in vitro ГАМК повы-
шает связывание SH-диазепама с мембранами мозга за счет увеличения
сродства 1,4-бензодназепина к рецепторам (уменьшения без изме-
нения максимума насыщения (Дтах)- Связывание 3Н-диазепама увели-
чивается агонистами ГАМК гем в большей степени, чем легче агонист
ингибирует связывание 3Л-ГАМК, т.е. пропорционально сродству аго-
нистов к рецепторам ГАМК [380]. Кроме того, в недостаточно тщатель-
но отмытых препаратах синаптосом диазепам повышает специфическое
связывание 311-ГАМК, увеличивая сродство ГАМК-рецепторов к ней
[381]. ГАМК также защищает БДР от тепловой денатурации [382], что
92
Хлордиазепоксид, моль/л ГАМК,моль/л
Рис. 6.2. Зависимость электротонических потенциалов вентральных (7) и дор-
сальных (2) корешков, вызываемых воздействием ГАМК (10‘* моль/л), от кон-
центрации хлор диазепоксида
Рис 6.3. Зависимость эффекта ГАМК, найденного по величине вызываемой ГАМК
деполяризации дорсальных корешков в отсутствие (7) и в присутствия хлорди-
азепоксида в концентрациях 10"’ (2), 10“* (5) и 10"’ моль/л (4) от концентра-
ции ГАМК
служит убедительным доводом в польз}' физического сопряжения БД!’
и рецепторов ГАМК.
Выявленное в радиолигандных экспериментах функциональное и
физическое сопряжение БДР и рецепторов ГАМК подтверждается в
опытах in vivo. Бензодиазепины усиливают ГАМК-ергической природы
торможение корковых нейронов [376] и первичных афферентов кли-
новидного ядра [375]. Они потенцируют влияние ГАМК на нейроны
дорсального ядра шва [383], культуру нервных клеток спинного мозга
[384,385], спинальные первичные афференты и мотонейроны.
Существенно, что индексы Хилла (пн), полученные в радиолиганд-
ных опытах как кривых насыщения [365], так и кривых, отражающих
ГАМК-потеицирующий эффект БДТ (рис. 6.2), равны единице. Усиле-
ние связывания 3Н-ГАМК под влиянием бензодиазепинов обусловлено
повышением сродства [381], и их ГАМК-потенцпрующий эффект осу-
ществляется в результате возрастания сродства ГАМК без изменения
максимального эффекта или кооперативности взаимодействия ГАМК
с ГАМК-рецепторами (рис. 6.3). Ионы СГ усиливают связывание не
только ЯН-бензодиазепинов с мембранами мозга [386], но и IAMK-
потенцирующий эффект хлордиазепоксида [387]. Зависимость ГАМК-
1 потенцирующего эффекта 1,4-бензодиазепинов от наружной кондентра-
I дни хлоридов свидетельствует о том что БДР сопряжены с ГАМК-ро
цепторами, управляющими функцией хлорных каналов.
№ 93
Как известно, активируемые уаминомас ляной кислотой рецепторы
(Р ГАМК) делятся на Рд ГАМК, которые избирательно активируют-
ся изогувацином и блокируются бикукуллином, и Рв ГАМК, не чув-
ствительные к бикукуллину. Последние избирательно активируются
баклофеном. Действие ГАМК и ее агонистов (изогувацина, мусцимола,
3-аминопиперцдинсульфоновой кислоты, ГЦ1Р) на нервные клетки за
висит оз наружной концентрации СГ и сопровождается повышением
хлорной проводимости синаптических мембран [359]. Представлены
строгие доказательства функциональной взаимосвязи ГАМКд-ренеп-
торов с хлорными каналами [388] Определено [385], что в культуре
нейронов спинного мозга мышей одиночный ГАМК-активируемыи
хлорный канал имеет элементарную проводимость 15 -20 пСм и сред
нее время жизни в открытом состоянии 18,3 мс. Предполагается [390],
что управляемые ГАМК-рецепторами хлорные каналы могут сущест-
вовать в трех конформационных состояниях с элементарной проводи-
мостью 24,14 и 4 пСм.
В присутствии диазепама (1—17 мкмоль/л) вызываемый ГАМК в
нейронах культуры спинного мозга ток увеличивается в три раза, хотя
проводимость одиночного канала не изменяется, а среднее время от-
крытого состояния каналов возрастает всего на 13 62 %. Следователь-
но, трехкратное увеличение ГАМК-тока диазепамом обусловлено воз-
растанием частоты открытий ГАМК-активируемых хлорных каналов
[385], что соответствует представлению о повышении бензодиазепино-
выми транквилизаторами сродства Рд-ГАМК к ГАМК. Влияние
ГАМКв-агониста баклофена на нервные клетки не потенцируется бен-
зодиазепинами, что отражает отсутствие связи БДР сРв—ГАМК [391]
Последние функционально не связаны с СГ-каналами, но контроли-
руют функцию потенциалозависимых Са2+-каналов в мембранах нерв-
ных клеток [392,393].
Приведенные результаты позволяют предположить, что БДР, слу-
жащие мембранным субстратом первичного действия их лигандов, яв-
ляются участками аллостерического регулирования сродства в ГАМКд-
рецепторах, связанных с хлорными каналами Данные, полученные ме-
тодами препаративной биохимии, подтверждают правильность этой мо-
дели и представляют возможность рассматривать БДР в качестве ком
понента надмолекулярных мембранных структур, физически и функ
ционально объединяющих субъединицу аллостерического регулирова-
ния (БДР), собственно ГАМКд-рецептор и хлорный канал.
В солюбилизированных детергентом белках, выделенных из си-
наптосом переднего мозга быков и крыс, метили [394] центры связы
вания ГАМК 3 И-мусцимолом, а центры связывания 1,4-бензодиазепи-
нов — 9 Н-флунитразепамом После аффинной хроматографии белков
обнаружено, что 3П-мусцимол- и 3Н-флунитразепамсвязывающие
белки характеризуются пиками одинаковой подвижности, т е, связы-
94
вающие любой из указанных лигандов центры принадлежат одному бед
• ку. Белок имеет констан гу седиментации 9,4 5 стокксовский радиус
7.3 нм и молекулярную масс)' 200—220 кД. Белок связывает мусцимол
(К{] =11 нмоль/л), клоназепам и флунитразепам (Ktj соответственно 4
и 10 нмоль/л) и 35Б-трег-бутилциклофосфоротионат (TBPS), избира-
тельно взаимодействующий с хлорным ионофором с /фу = 90 нмоль,'л.
Это лишь в два- пять раз больше соответствующих констант для мем-
браносвязанного Рд ГАМК (БДР) хлор к анального комплекса. Солю-
билизированный белковый комплекс содержит четыре субъединицы,
из которых две фотоаффинно метятся ’Н-флунтпразепамом и имеют
кажущуюся молекулярную массу 53 кД, а другие две связывают
’Н-ГАМК или 3Н-мусцимол и обладают молекулярной массой 57 кД
[394, 395].
Таким образом, Рд—ГАМК являются а2 р2-олигомерами. Амино-
кислотная последовательность составляющих его белков установлена
по комплементарное™ кодирующих а- и /3-субъ едини цы ДНК. Связы-
вающая 3 Н-бензодиазепины а-цепь содержит 456, а Л-цепь - 474 амино-
кислотных остатка. Полная идентичность цепей составляет 35 %, а го-
мология достигает 57 %. Каждая цепь содержит четыре гидрофобных
домена,' которые пронизывают мембрану, и 16 трансмембранных спи-
ралей тетрамера образуют в совокуштости стенку хлорного канала.
И N-, и С-концевые последовательности обеих цепей располагаются
экстраклеточио, но участки связывания ГАМК и бензодиазепинов ло
[ кализованы в большей N-концевой области соответствующей цепи.
Только ансамбль а- и 0-субъединиц функционально полноценный, по-
скольку' только инъекция в ооциты Xenopus обеих мРНК, кодирующих
зти субъединицы, делает мембрану' яйцеклеток чувствительной к воз-
действию физиологических концентраций (0,3—1 мкмоль/л) ГАМК
[396]. О том же свидетельствуют многочисленные факты взаимной
аллостерической регуляции субъединиц, образующих Рд ГАМК (БДР)
хлорканальные комплексы..
Аллостерическое взаимодействие ГАМК- и бснзодиазепинсвяэы-
вающих центров проявляется в повышении сродства ГАМК кРд-ГАМК
в присутствии бензодиазепинов [381] и в весьма значительном (в 1,5—
3,5 раза) увеличении сродства 1,4-бензодиазепинов к БДР в присут-
ствии ГАМК и ГАМКд-агонистов [379, 380, 397,398]. Взаимодействие
лигандов с ГАМК- и БДТ-связывающими центрами аллостсрически ре-
гулируется также веществами, взаимодействующими с канальным ком-
понентом Рд-ГАМК-ЬДР-хлорионофорных комплексов. Хотя хлори-
ды понижают сродство 3Н-ГАМК к рецепторам [399], ионы СГ увели-
чивают связывание меченых бензодиазепинов с мембранами мозга [386,
398]. Повышенное при действии ГАМК связывание 3В-флунитразепа-
ма еще больше возрастает в присутствии ионов СГ [397]. Связывание
3Н-флунитразепама растет при наличии ионов Вт", Г, NO2 и SC№, ко-
торне обеспечивают функционирование хлорных каналов. Взаимодец
ствуюший с хлорными каналамд пикротоксин, не влияющий на связ ь
ванне 3Н ГАМК, ингибирует в концентрации 10 мкмоль/л фоновое
активированное ГАМК и барбитуратом связывание SH-флунитразепама
[400]. Барбитураты, конкурентно ингибируя связывание лигандов
хлорных каналов (3Н-дигидропикротоксинина [386] и 35 S-грег-бутш
бициклофосфоротионата [401]), увеличивают связывание 3Н-ГАМК
с мембранами мозга и аффинитет БДР 3Н-Диазепаму [386,401]. А
тивность барбитуратов как ингибиторов связывания 35S-TBPS корре.
лирует с их активностью как активаторов связывания 3Н-диазепа-
ма [401].
Следовательно, бензодиазепиновые рецепторы функционируют в
качестве центров аллостерической регуляции в надмолекулярных мем
бранных Рд-ГАМК-БДР-хлорканальных комплексах. Через указан
ные центры регуляции 1,4-бензодиазепины, а возможно и зндогеннь е
модуляторы с бензодиазепиноподобными или антибензодиазепиновь
ми свойствами, изменяют соотношение высоко- и низкоаффинных
(к агонистам) форм Рд—ГАМК, т.е. модулируют сродство их к медиа-
тору и частоту открытий сопряженных с ГАМК-рецепторами хлорных
каналов.
Параллельно таким взглядам на природу БДР формировалос
представление [369, 409] о существовании БДР, не зависящих о
Р- ГАМК. В пользу данного представления свидетельствуют несовпа-
дающее распределение БДР и Р—ГАМК в разных областях мозга и
клегках одной мозговой структуры [403], изменение соотношения
приведенных рецепторов в онтогенезе [404] и неоднородность (гете
рогенность) БДР Серьезным доводом в пользу существования разно-
видностей БДР являются особенности специфического связывания с
мембранами мозга триаэолопиридазгша (см табл. 6.2, CL 218.872)
который обладает анксиолитической активностью и эффективно ин-
гибирует связывание меченых 1,4-6 снз одна зепинов с мембранами
мозга [382, 405], особенно в присутствии ГАМК [398, 406]. Однако
кривые, отражающие ингибирование триазолопиридазином связыва-
ния меченых бензодиазепинов с мембранами из разных областей моз-
га, имеют разный наклон [382, 405]. Так, CL 218.872 при температуре
0 °C ингибирует специфическое связывание 8Н-флунитразепама с мем
бранами мозжечка и гиппокампа крыс с величинами ICS0 37 и
330 нмоль/л и коэффициентами Хилла 0,9 и 0,6. Это свидетельству
ет о наличии двух популяций БДР: с высоким и низким сродством к
триазолопиридазину [406, 407]. Высокоаффинные к CL 218.872 БДР
составляют в мозжечке 95 % их общего количества, а в коре — лишь
50 % [407] Их наличие различно и в других отделах мозга, что видно
из авторадиографических данных [364], по вытеснению связанного с
мембранами мозга 3Н клоназепама (1 нмоль/л) триазолопиридазином
96
CL 218.872 (1 мкмоль/л) из сагштальных криоста тированных срезов
моз! а крыс.
Ооласп мозга
Вытеснение, %
Мозжечок 95
Зрительный буюр (медиальный отдел) 92
Бледный тар (вентральный отдел) 86
Обонятельный бугорок 85
Зрительный бугор (задний отдел)
Кора мозга (IV пластина) 83
Нижний бугорок 97
Кора мозга (II, V плаепшы) 75
Зубчатая извилина 64
Высокоаффинные к бензодиазепинам и CL 218 872 рецепторы наз-
ваны БДРЬ а имеющие высокое сродство к бензодиазепинам, но низ-
кое к триазолониридинам, БДР2 Два тина БДР неодинаково форми-
руются в онтогенезе сразу после рождения в мозгу крыс имеются
преимущественно БДР2; количество БДР1 резко возрастает во вторую
неделю жизни без существенного изменения числа БДР2 [409j. Пос-
кольку CL 218.872 обладает анксиолитической и противосудорожной
активностью, но в отличие от БДТ обнаруживает слабое седативное
и мышечнорасслабляющее действие, предполагалось, что анксиол п и-
веский и противосудорожный эффекты обусловлены воздействием ве-
ществ на EJIPj, а другие эффекты реализуются посредством БДР2
[409]. Однако в случае ниразолохинолина (см. табл. 6.2, CGS 9896),
который тоже характеризуется анксиолитической активностью, но не
вызывает атаксии и слабо устраняет действие судорожных ядов, не
наблюдается различное сродство к двум типам БДР [410].
Исследование гетерогенности мембрашшх рецепторов требует ре-
шения вопроса о том, являются ли их разновидности, отличающиеся
значениями Kj и -В.тах , разными молекулярными структурами либо
разными конформационными состояниями однотипных макромоле-
кул [361]. Показано [411, 412] наличие конформационных перехо-
дов БДР, обусловленных их взаимодействием со специфическими
лигандами Интересно, что связывание эН-флунитразепама с мембра-
нами из различных областей мозга эффективнее ингибируется
CL 218 872 и диазепамом при температуре 0, а не 37 °C. В первом слу-
чае ICSO этих веществ составляет 176+14 и 7 5±0,8, во втором 42б±
±37 и 31±2 нмоль/л т.е отличаются соответственно в 26 и 13 раз. Ин-
декс Хилла для CL 218.872 при 0 °C равен 0,52, а при физиоло: ической
температуре близок единице (0,97) . Тем не менее сохраняющееся зна-
чительным и при физиологической температуре различие в величинах
/C’so для С1, 218.872 и диазепама (в 13 раз) свидетельствует о тем,что
ею можно объяснить различием не только конформеров, но и подти-
пов БДР.
97
Такое заключение подтверждается другими независимыми метода-
ми. Например, установлено, чтр в мозжечке ’Н-флунитразепам связы-
вается с белками, молекулярная масса которых составляет 51 кД, а во
всех остальных областях мозга — также с белками, молекулярная мас-
са которых равна 53; 55 и 59 кД. Поскольку фотоаффинное связыва-
ние 3Н-флунитразепама с перечисленными белками подавляется в при-
сутствии Ro 15-1788 и стимулируется ГАМК, все четыре белка можно
квалифицировать как БДР Связывание В 9 Н-флунитразепама с Р5] из
мозжечка подавлялось в присутствии CL 218.872, а для подавления
связывания фотоаффинного лиганда с Р53, Ри и Р59 требовались на по-
рядок более высокие концентрации CL 218.872. Поэтому P$J иденти-
фицирован с БДР1, а остальные - с БДР2 [414].
БДР1 и БДР2 относятся к белкам, которые отличаются и отноше-
нием к протеолизу. Выделенный из гиппокампа крыс 3Н-флунитразе-
памсвязывающий белок Р51 гидролизуется трипсином полностью с об-
разованием РЭ9 и Р25, а выделенный из того же источника Р?5 гидроли-
зуется только на 70 % с получением Р42 иР45 [415].
Реальность существования двух типов БДР1 и БДР2 может озна-
чать, что только один из них сопряжен с Рд ГАМК. Избирательно вза-
имодействующий с БДР1 триазолопиридазин усиливает вызываемые
ГАМК реакции нейронов, как и неизбирательно действующие 1,4-бен
зодиазепины [416]. Функциональная роль не связанных с Рд-ГАМК
и хлорными каналами бензодиазепиновых рецепторов пока не известна.
6.2.0-КАРБОЛИНЫ КАК ЛИГАНДЫ
БЕНЗОДИАЗЕПИНОВЫХ РЕЦЕПТОРОВ
В поисках эндогенных лигандов БДР выделено из десятикратно
концентрированного экстракта мочи человека вещество, которое ин-
гибировало специфическое связывание 3Н-диаэепама с мембранами
мозга крыс при /С50 — 4 7 нмоль/л, что сопоставимо с величинами
ICS0 для 1,4-бензодиазепинов (см табл. 6.1) [417]. Это вещество
идентифицировано как этиловый эфир Дкарболин-3-карбоновой кис-
лоты, что подтверждено масс-спсктрометрией и синтезом. Этил-0-кар-
болин-3-карбоксилат (/3-ССЕ) получен также из мозга, где его содер-
жание равно 20 нг/г ткани. Хотя эндогенная природа 0-ССЕ оспарива-
лась, а позже выяснилось, что эфиры /3-к арб один- 3-карбоновой кисло-
ты образуются в процессе выделения из мочи и мозга и не обнаружи-
ваются in vivo [148], многие природные и синтетические /3-карболины
исследованы как лиганды БДР.
В работе [417] установлена высокая активность не только этило-
вого, но и метилового эфира Р-карболин-3-карбоновой кислоты и по-
казано, что их гидрированные и Гметилэамещештые производные ин-
95
к AiS к
X
Таблица 6.3 Активность 3-эемешенных. -карболняов нйгибнруюшлх специфическое связывание метеных бепэоапе
с мембраюними фрагментами мозга кры:
х х х XXX к г» X И X X х" 8® 5 XX X X
ЕЕ X К XX к XXX X 8 X X X X X X X
XXX XXX № XXX § X X X х и X '„XX ГС* Йи
SKE XXX X ®о® X X X х у § §®хх «X X о о 1 о
ХКЯ XXX X XXX X о* X х к* и ° л ет - ® и X X
X
X X
кдкд
с* СИ ►' *5
оооо
к ~
О®
‘Л
58
§« е
Е s-f.
&¥й
о
оооо
оо
о
N N
99
ft>
Ё
У
§
s
ж
ft)
*
гнбируют связывание 3 Н-диазепама с мембра-
„ нами мозга только в тысячекратных конпен-
£ традиях.
J2 Высокоактивными лигандами БДР явля-
Д ются 3-замешенные /3-карболины. 0-Карболин
1 । К (норгарман) и (3-карболин-3-карбоновая кис-
лота ингибируют связывание 3Н Б ДТ лишь в
микромолярных концентрациях, но 3-фор-
_Г’р-р;-57 мил-, 3-ацетил-р-карболины и особенно эфиры
/З-карболин-З-карбоновой кислоты (Р-ССМ,
Р-CCPr, 0-CCBu) высокоэффективны:
fCi связывания 3И-диазепама для формил- и
ацетил-р-карболинов составляют 62-58, для
кере । эфиров - 1 нмоль/л (табл, 6.3). Наличие кар-
бонила в положении 3, однако, не является
непременным условием большой активности,
поскольку 3-алкоксипроизводные также обла-
X х ® ж । дак>т высоким аффинитетом к БДР [357]. Ак-
тивность Р-карболгпг-З-карбоксилагов сущест-
венно не изменяется при их замещении в по-
ложениях 4 7 алкилами, алкоксильными или
иными труппами, но при замещении метилом
х х д х в положении 9 0-карболин-З-карбоксилат теря-
ет свойства лиганда БДР.
Эфиры /З-карболин-З-карбоновой кислоты,
х ж ж ж замещенные в позиции 1 этоксигруппой, ме-
тилом, этилом или фенилом, также менее ак-
тивны, чем незамещенные эфиры. Они инги-
бируют связывание 3Н-БДТ с мембранами
мозга лишь в микромолярных концентрациях
хехх । (табл. 6.4, 6.5). То же относится и к иезаме^
шейным в положении 3 (3-карболинам. Судя
по величинам /С,- (см. табл. 6.4), активность
„ 1-меггпг-Д-арбо.чигга (гармана) в 10 раз мень-
ше, чем иоргармапа, а 1-этил-Д карболки свой-
7 х ствами лиганда БДР не обладает. Активность
° V VV 3,4-дигидро- и 1,2,3,4-тетрагипро-Дкарболинов
। па один-два порядка меньше, чем гармана и
норгармана, и только некоторые тетрагидро-
гарманы по эффективности равны им (см.
табл. 6.5).
g Не только высокоаффшшые к БДР эфиры
(j S Дкарболин-З-карбоновой кислоты [369], но
V fS низкоаффинный гарман (рис. 6.4) и его ггро-
100
Таблица 6.4 Активность 1-замещснных (З-карболинов. ингибирующих специфичес- кое связывание меченых бензодиазепинов с мембра’ ыми фрагментами моз- га крыс .
Название J вин шифр Положение заместителя Активность, мкмоль/л
1 3 4 6 7 /С,о лгдзоб}
Норгарман Н НИИ Н 8.2*1.6(599] 1.62 М-карболин) 6,0(593] Гарман СН, В В В Н 7.2*0,8 [599); ,ЯР ’ 5.6 [593] 12,4 С. В. Н В В Я - >250 Гармол СВ, В П Я ОН 80 [596 , 111*17 (599); 64 [593] СН, В Н ОН В 5,4 1593] Гармин СН, В В В ОСН, 134 [5991; В 200[596] СН, СО О-С,Н, Н Н Н 4,9 (369] С,Н, TO-O-CH, И П В - 7,54 С,Н5 СО О-СН, Н ОН II - 5,78 С,Н5 СО О-СИ, В В II - 3,89
Таблица 6.5. Активность 3,4-дигидро- (ДГБК) и 1,2,3,4-тетрагидро-р-карболинов
(ТГБК), ингибирующих связывание меченых бензодиазепинов с мембранными
фра» ментамн мозга крыс
Название или шифр Положение заместтгтеля Изоме- Активность, мкмоль/л
1 ' 3 ) 6 ' 7 1 i рня /С,с *7(306)
ДГБК
[Тар мал о л св, н н он - 305*48(599]; 160 (593]
Гармалин СН, в в осн, - 380 (593]; 390*42 [599] —
СН, II он н ТГБК - 55[593] —
Тетрагидро- II н н н - 920*95 (599) > 100
;иоргарман в н он II - 3620*460 [593] —
II СО-О-СН, н и - 17 (369] —
н со-о-с,на , II н - 4.9 (369] —
[Тетрагидро- СН, н н в - 1450*260 (599] > 100
гарман СН, св, СО-0 СН, CO-O-CjB, II II II п - 400 (369 - 400(369] >50
сн3 OH CO O-CH , Н н ЦИС - транс — 5 0,51
С.Н, со-о-сн, н II цис - транс 54 174
С, В, , €8,011 II II транс 6.1
101
единое целое, Г-К-переход ГАМК-свяэывающего компонента coup
вождаетсй переходом сопряженного с ним аллостерического регупд
торного связывающего 1,4-бензодиазепнны участка тоже в знергетич
ки неустойчивое состояние (К форму), что должно проявляться новы,
шением сродства и усилением специфического взаимодействия бен:
диазепинов с БДР.
Действительно, сродство многих лигандов, в том числе некого
рых 3-карболиИов (см. табл. 6.3, ZK 9'* 123. ZK 93426), к БДР в при
сутствии ГАМК возрастает в 3.3- 1,4 раза (табл. 6.7). Вместе с тем свя
зывание 9Н-ССМ ‘с мембранами мозга, как это впервые установлю
в работе [428], ГАМК уменьшается в Cl-содержащем буфере пример
но на 20 %. ГАМК и ГАМКд-агонисты снижают связывание с мембра-
нами 3И—ДМСМ, уменьшая сродство радиоактивного лиганда к ЬД1
соответственно их ГАМК-миметической активности [430]. ГАМК по-
давляет также связывание с мембранами Д-ССЕ, FG 7142 (см. табл.6.7)
и 0-ССВи [425]. Менее определенные результаты в отношении вли
ния ГАМК на связывание р-ССР. Наряду с сообщениями об огсутстш
влияния ГАМК (10'7~ 10"3 моль/л) на связывание 3Н ССР [421,43
имеются данные о повышении взаимодействия 3Н-ССР в присутстди
I мкмоль/л-1 ммоль/л ГАМК на 6 21 % [426, 432] и понижении ei
связывания [397]. По-вццнмому, несовпадение результатов обуслов-
лено наличием или отсутствием в среде хлоридов [397]. Связывание
мембранами мозга некоторых других Р-карболинов (гарман-
ZK. 91296), а также Ro 15-1788 и CGS 8216, не изменяется или лиш
несколько возрастает в присутствии Г АМК.
Напротив, конкурентный антагонист ГАМК бикукуллин, стабюн
зирующий Рд-ГАМК-БДР-хлорканальиый комплекс в энергетиче -
ки устойчивой Т форме, снижает сродство 1,4-бензодиазелинов к БДР
(для диазепама, например, в 1,91 раза) и повышает сродство р-ССМ
сродство Ro 15-1788 в этих условиях не изменяется [433].
Эффективность взаимодействия лигандов с БДР зависит от функ
ционального состояния хлорпроводящего компонента Рд-ГАМК
БДР-хлорканального мембранного комплекса. Хлориды увеличиваю
связывание бентодиазепинов с мембранами мозга [386,398, 434], хотя
и не столь выражение, как при воздействии ГАМК, а сродство оксазе-
пама, иоразепама, CL 218.872 хлоридами не изменяется [398]. Вместе
с гем сродство 3Н-ДМСМ при наличии NaCl (200 ммоль/л) повышает
ся в четыре раза [чЗО]. Хлориды увеличивают сродство к БДР Д-ССЕ,
гармана, гармина и гармалтша [398]. Вызываемое 7-аминомаслянон
кислотой усиление связывания 1,4-бензодиазепинов возрастает при
увеличении концентрации NaCl [398, 399], причем связывание флуни
тразепама - в 2,5 раза, а 0-ССЕ- только на 20 % [397]. Обусловленное
хлоридами усиление связывания гармана и (3-ССЕ становится менее
выраженным при добавлении в среду инкубации ГАМК [398].
104
Таблица 6.7 Влияние активации ГАМКд-рецепторов на аффи-
нитет беизидиазепиновых рецепторов к их лигандам
Лиганд БДР ICts> в отсутствие//С„ в присутствии ГАМК* Литература
Агонисты (модуляторы-сенсибилизаторы)
Флунитразепам 3,310,4 2,45±0,2 [438] [437]
Оксазепам 2,710,4 [438]
2,35 [437]
1,9910,1 [398]
Диазепам 1,7310,12 [398]
2,9Ю,1 [438]
। 2,310,3 [437]
Хлордиазепоксид 2,2310,1 [437]
Клоназепам 2,1210,2 [437]
CL 218.872 2,3010,1 . [398]
1,610,2 [438]
1,9810,1 [437]
Нитразепам 1,7710,13 [398]
Лоразепам 1,75 [437]
Лорметазепам 1,71 [437]
ZK 93423 2,17 [491]
Антагонисты частичные и полные
(антимодуляторы)
ZK 93426 1,39** [525]
Гармалин 1,2510.1 ]398]
ZK 91296 1.2310,1 [491]
1.14 [493]
Гарман 1.1010,1 [398]
Ro 15^.1788 1,2210,1 [437]
1,1Ю,05 [438]
fc.CCPr 1,010,05 [438]
1 11 [437]
1,21 [432]
0,89 [397]
CGS 8216 0,710,1 [438]
' 1,15 [525]
Гармии 1,0610,14 [398]
Обратные (инверсивные) агонисты
(модуляторы ингибиторы)
FG 7142 0,8710,1 [437]
0,7±0,1 [438]
3-ССЕ 0,8610,1 [437]
0,7±0,1 [438]
0-ССМ 0,610,05 [438]
ДМСМ 0,61 [437]
0,510,1 [438]
— —— 0,4610,1 [437]
♦ Величины/С м определились ио ингибиции связывания.
’H-Ro 15-1788 или 3 Н-фл^иитразепама.
**В присутствии мусцимола.
105
Аффинитет СГ-проводящего компонента к специфическим лиган-
дам также неодинаков в случае разных лигандов БДР Специфическое
связывание S-бутилциклофосфоротионата увеличивается флунитра-
зепамом, диазепамом, CL 218.872, CGS9896, мало изменяется Ro-1788
и CGS 8216, но уменьшается при наличии ДМСМ и Р-ССЕ [435, 436].
Поскольку вызываемая у-амвдомасляиой кислотой активация
Рд-ГАМК-БДР-хлорканального комплекса сопровождается перехо-
дом БДР в высокоаффинную форму, лиганды, сродство которых к
БДР повышается в присутствии ГАМК, расцениваются как агонисты
(любой агонист взаимодействует с высокоаффинной к нему формой
рецептора — Rr). Эти лиганды облегчают сопряжение Рд—ГАМК с
хлорными каналами, т.е.обладают положительной эффективностью
[364,437]. Лиганды третьей группы (см. табл.6.7),связывание которых
уменьшается в присутствии ГАМК, обладают отрицательной эффектив-
ностью. Так как они вызывают фармакологические эффекты, проти-
воположные эффектам 1,4-бензодиазепинов, их называют обратными
агонистами [437]. Лиганды, сродство которых к БДР не зависит или
мало зависит от ГАМК, устраняют фармакологические эффекты лиган-
дов первой и третьей групп, что позволяет рассматривать их в качестве
антагонистов (полных или частичных, т е агонистов-антагонистов).
Следует подчеркнуть, однако, что термины агонист, обратный аго-
нист и антагонист не совсем удачны в применении к лигандам БДР.
Во-первых, не известен эндогенный лиганд БДР, агонистами, обратны-
ми агонистами или антагонистами которых являются синтетические
лиганды БДР (см. табл. 6.7). Во-вторых, фармакалогические эффекты
1,4-бензодиазепинов (агонистов) могут быть аналогичны эффектам
эндогенного лиганда, но могут возникать в результате конкуренции
1,4-бензодиазепинов с эндогенным лигандом, обладающим антибензо-
диазепиновыми свойствами, что весьма вероятно (см. раздел 9.5).
В-третьих, ни агонисты, ни обратные агонисты (эндогенного лиганда
БДР) не характеризуют свойственных агонистам изменений ионной
проницаемости клеточных мембран. Они лишь модулируют (усиливают
или ослабляют) ионную проводимость мембран нейронов, которые вы-
зываются медиатором — у-аминомасляной кислотой (см разделы 9.1 и
9.2). Как аллостерические модуляторы, влияющие на сродство Рд—
ГАМК и ГАМК, агонисты выступают в роли модуляторов-сенсибилиза-
торов, обратные агонисты — в роли модуляторов-ингибиторов, а лиган-
ды БД° типа Ro 15-1788 или Р-ССР— в роли антимодуляторов (полных
или частичных) [361]. Приведенные термины точнее отражают молеку-
лярный механизм действия лигандов БДР.
Три группы лигандов взаимодействуют, по-видимому, с разными
конформационными формами БДР, о чем свидетельствуют термодина-
мические различия процессов связывания с мембранами мозга 3Н-кло-
назепама (агониста), 3Н-ДМСМ (обратный агонист) и Ro 15-1788 (анта-
706
гонист) [438] и особенности связывания трех групп лигандов с мем-
бранами, часть БДР которых необратимо ингибирована флунитразепа-
мом при УФ-облучении. Предварительная фотоаффинная метка БДР
посредством флунитразепама уменьшает на 90—80 % число связываю-
щих ,Н-флунитразепам мест: Дтах снижается от 810 до 60 [439] или
от 863 до 171 фмоль/мг белка [440]. Та часть БДР, которая не под-
верглась фотоаффинному мечению флунитразепамом, обладает в
2,8-3 раза меньшим сродством к диазепаму и флунитразепаму (1СМ
соответственно 2313 и 308 нмоль/л),чем в нативных мембранах (lCi0-
=83Д±4,9 и 34,1—10,6 нмоль/л). Если предположить, что не подверг-
шаяся фотоаффинной инактивации часть БДР находится в Т-конфор-
мации (поскольку обладает низким сродством к бензодиазепинам-
агонистам), то антагонисты и обратные агонисты взаимодействуют
именно с данной формой БДР Это заключение следует из того, что
сродство SH-Ro 15-1788, sH-CGS 8216, а также 3Н-ССМ, 3Н-ССЕ,
4Н-ССР к БДР в фотоаффинно меченых мембранах не отличается
от сродства в нативных [441] или снижается всего на 25 % [432].
Аналогичное заключение следует из результатов опытов с этидб-
азидо-Р-карболин-З-карбоксилатом — фотоаффинным лигандом, связы-
вавшимся с Яу-формой БДР, чем он отличается от 3Н-флунитразепа-
ма, фотоаффинно метящего Яд-форму. Фотоаффинное связывание
6-азцдо-Р-ССЕ снижает в гомогенате коры мозга крыс число мест свя
зывания антагониста БДР 3Н—Ro 15-1788 на 22 %, существенно умень-
шает 5тах и Ка другого антагониста БДР — 3Н-/?-ССР (см. табл. 6.7),
но не влияет на Втах и Kj агониста 3Н-флунитразепама [442].
6.4. Д-КАРБОЛИНЫ КАК ЛИГАНДЫ
ДРУГИХ МЕМБРАННЫХ РЕЦЕПТОРОВ
Высокоаффинные к БДР эфиры /З-карболин-З-карбоновой кисло-
ты не ингибируют специфического связывания ’Н-лигандов многих
других мембранных рецепторов даже в более высоких (на 3—4 поряд
ка) концентрациях (табл. 6.8). Тетрагидро-Дкарболины обладают от-
носительно большим сродством (/С5о=4-15,6 мкмоль/л) к рецепто-
рам серотонина, тогда как негидрированные /3-карб опины к ним ела-
боаффинны. Сколько-нибудь выраженной избирательности в действии
на Pi-OT и Ра-ОТ они не обнаруживают, ингибируя связывание 3Н-
кетансерина (лиганд Pj-OT) в концентрациях 1,5—56,8 и’Н-спиперо-
на (лиганд Pi—ОТ) в концентрациях 1,81—23,7 мкмоль/л.
Наибольший аффинитет Дкарболины проявляют к рецепторам
триптамина (Р-ТА). Параметры, характеризующие связывая е 3Н-
триптамина с мембранами мозга (Xj=2,8±0,2 нмоль/л, #rnax=429±
±55 фмоль/мг белка), отличаются от таковых 3Н-серотонина. Высоко-
107
Средняя и ее доверительный интервал [445].
108
аффинное связывание 3Н-триптамина в опытах с синаптическими мем-
бранами коры полушарий, гиппокампа, полосам г о тела мозга крыс и
человека конкурентно подавляется триптамином (/Сзо“4,8 нмоль/л),
эффективно снижается тетрагидро-Дкарболином [443, 444], ненасы-
щенными (3-карболинами [445, 446], слабо - серотонином (JC5Q-
=876 имоль/л) и совсем не изменяется в случае спиперона и кетансери-
на, которые в наномолярных концентрациях противодействуют свя-
зыванию ’Н-серотонииа. Как видно из табл. 6.8, 0-карболины препят-
ствуют связыванию Н-трицтамина с мембранами мозга в наномоляр-
ных концентрациях (17—182 нмоль/л).
У гармана, его нсгидрированных (гармина) и дегидрированных
(гармалина) производных обнаруживается сродство к опиатным ре-
цепторам, но в микромолярных концентрациях (см. табл. 6.8). Прове-
дено [447] сравнение влияния Дкарболинов на специфическое свя-
зывание 3Н-дигидромррфина (д-лиганда опиатных рецепторов) и
3Н-лейэнкефалина (6-лиганда) с мембранами мозга. Найдено, что
/С50 Дкарболинов, при которых наблюдается ингибирование связыва-
ния 3 Н-лейэнкефалина, намного меньше значений 1С50, ингибирующих
связывание р-лиганда опиатных рецепторов, т.е. Дкарболины являют-
ся преимущественно 6 лигандами. Так как в присутствии Na*
(150 ммоль/л NaCl) сродство Дкарболинов к рецепторам опиатов су-
щественно уменьшается [447, 448], Дкарболины представляют собой
агонисты энкефалинов и морфина. С этой точки зрения важно, что
сродство к опиатным рецепторам более выражено у Дкарболинов,
имеющих СНз-группу в положении 1 (см. табл. 6 8), ибо именно 1-ме-
тил-Дкарболины образуются из триптофана путем конденсации с аце-
тальдегидом, избыток которого в тканях появляется при нагрузке ал-
коголем. Хотя /3-ССЕ не обладает аффинитетом к опиатным рецепто-
рам, он предотвращает в дозах 0,3-3 мг/кг (внутрибрюшинно) анти-
ноцицептивное действие сульфатированного октапептида холецисто-
кинина (ССК-8, 1 мкг в желудочки мозга) у мышей [449].
Имеется сообщение [450] о высокоаффинном специфическом свя-
зывании 3Н-норгармана (Х</=1,52нмоль/л,7?тах-758 фмоль/мгбелка),
которое не подавляется диазепамом и мсдазоламом даже в концен-
трациях 5 мкмоль/л, не изменялось ингибиторами моноаминоксидазы
и не более чем на 50 % уменьшалось Дкарболинами (гарманом, гарми-
ном, гармалоном, гармалином, тетрагидроноргарманом ДССЕ и
ДМСМ) и триптамином в концентрациях до 5 мкмоль/п.
Глава?
Р-КАРБОЛИНЫ КАК РЕГУЛЯТОРЫ
УРОВНЯ ТРЕВОЖНОСТИ
У ЖИВОТНЫХ И ЧЕЛОВЕКА
Тревога — распространенный психопатологический симптом, сопут
ствующий многим нервно-психическим и соматически^ болезням. Не-
редко тревога и страх усугубляют течение и исход заболевания, напри-
мер стенокардии, гипертонической болезни и т.д. Тревога и страх могут
быть вызваны разными причинами: соматическими (стенокардия), ин-
токсикационными (алкогольный психоз), психогенными (невроз стра-
ха, реакции страха), эндогенными (инволюционный психоз, эпилепсия
шизоаффективные психозы).
В психологическом отношении тревога является ожиданием неиз
вестной отрицательной перспективы. Страх может быть обусловлен точ
ным знанием угрожающей опасности на основе накопленного опыта
(страх наказания, болезни, смерти). Оба феномена имеют одинаковое
эволюционно-приспособительное значение в организации защиты н избе-
гании опасности и рассматриваются психиатрами как одно и то же кли
ническое явление разной степени выраженности [451].
7.1. ЭКСПЕРИМЕНТАЛЬНЫЕ МОДЕЛИ
ТРЕВОЖНЫХ СОСТОЯНИЙ У ЖИВОТНЫХ
Поскольку тревога имеет субъективную природу, для изучения тре-
вожных состояний у животных и экспериментальной (доклинической)
оценки влияния веществ на уровень тревожности используются модели
которые являются поведенческими аналогами тревоги [452]. Все моде-
ли [452-454] основаны на воздействии внешних или внутренних сти-
мулов, создающих новое эмоционально-поведенческое состояние, под-
дающееся объективной регистрации.
Одна из таких моделей базируется на выработке у животных ус-
тойчивого условного пищевого или оборонительного рефлекса и подав-
лении условно-рефлекторной реакции воздействием ранее не исполь
зуемого мощного раздражителя Вызываемое им внешнее торможение
условно-рефлекторной реакции устраняется 5-фенил-1,4-бензодиазе-
пинами
110
Наиболее распространены разные варианта конфликтных ситуации
или наказуемого поведения. Конфликт мотивац "i достигается у живот-
ных с пищевой иго- водной депривацией (2—3 дня), обученных получать
нишу или воду один раз в день в течение ограниченного времени в опре-,
целенной экспериментальной обстановке. Естественное поведение в
день опыта наказывается болевым электрическим раздражителем, что
резко ограничивает число приемов пищи или воды, а также количество
подходов к кормушке или поилке. Угнетение пищевого или питьевого
поведения устраняется бензодиазепиновыми транквилизаторами —
аитиконфликтный эффект. Поскольку этот эффект может быть ре-
зультатом вызываемого транквилизатором угнетения голода (жажды)
или двигательной активности, метод требует параллельной оценки со-
ответствующих функций.
Разновидностью конфликтной ситуации является болевое наказа-
ние естественного ориентировочного поведения животного, помещен-
ного в новую обстановку, знакомясь с которой животное обнюхивает
металлический стержень и получает удар током, что подавляет ориенти-
ровочную реакцию. Анксиолитики устраняют торможение ориентиро-
вочного поведения.
Модель наказания пассивного избегательного поведения основана
на естественном для грызунов (мышей, крыс) избегании освещенной
камеры. Животные, уходящие из освещенной в темную камеру, под-
вергаются болевому электрическому раздражению и 24 ч не предпри-
нимают попыток переходить из светлого в темный отсек. Предвари-
тельное введение транквилизаторов препятствует нарушению избега-
тельного поведения, но не ясно, в какой мере это обусловлено подав-
лением тревоги и в какой — стиранием следа болевого раздражения в
памяти животных. Такая неясность отсутствует в упрощенном вариан-
те модели, когда регистрируется количество переходов из одного отсе-
ка в другой в течение 10 мин без применения болевого раздраже-
ния [455].
Поведение пассивного избегания служит моделью для оценки уров-
ня тревожности и в условиях метода приподнятого лабиринта, в кото-
ром от центральной площадки отходят два закрытых и два открытых
рукава. Грызуны предпочитают закрытые рукава, но транквилизаторы,
барбитураты и этиловый алкоголь увеличивают число выходов в от-
крыты^ рукава и общее время пребывания в них. Вещества с анксио-
генной активностью (кофеин, пикротоксин) уменьшают данные пока-
затели [456].
В модели зоосоциального взаимодействия у пары животных, по-
мещенных на открытую арену, регистрируют количество и характер по-
веденческих реакций взаимодействия' подходов, обнюхиваний, обли-
зываний, вычесываний партнера или элементов агрессии [457]. Пред-
ложены инструментальные методы одновременной регистрации и
компьютерной оценки многих параметров зоосоциального поведения
[458, 459]. Частота и время отдельных компонентов зоосоциального
поведения изменяются анксиолитиками и анксиогенными веществами
Все описанные модели тревоги основаны на торможении поведения
вызываемого наказуюшими стимулами, неподкреплением ими нови,
пой обстановки Поэтому эффект анксиолитиков в этих моделях рас-
сматривается как эффект растормаживания. Однако специальный ана-
лиз поведенческих эффектов 1,4-бензодиазепинов у животных позво-
лил сделать заключение, что они обусловлены нарушением принятия
решения в результате влияния на оценку мозгом значимости стимулов
в конкретных жизненных или экспериментальных условиях [460]
Для оценки эффективности, отбора новых анксиолитиков и изуче-
ния их механизма действия в последние годы широко используется
давно известный дискриминационный тест. В двурычажной камере
Скиннера животных (крыс, обезьян) обучают за пищевое подкрепление
путем нажатий на соответствующий рычаг отличать бенэодиазетшновый
’’стимул”, создаваемый предварительным (за 15 мин) введением диа-
зепама (или другого бензодиазепина) в заведомо эффективной дозе,
от солевого раствора. Сеансы обучения проводят несколько раз (5 6)
в день, сколько необходимо (обычно 30-50) для достижения нужно-
го критерия обученности (обычно 80 % правильных нажатий). Бензо-
диазепин или солевой раствор вводят в произвольной последователь-
ности. По окончании обучения в зависимости от дозы бензодиазепина
происходит воспроизведение правильных реакций, что позволяет опре-
делить минимальную или среднюю эффективную (ЕД50) его дозу. Ме-
тод применяется и для выявления сигнальных свойств (дискримина-
тивпого стимула) у других веществ, действующих предположительно
аналогично 1,4-бензодиаэеппнам (замещение или генерализация сти-
мула) . Сигнальные свойства бензодиазепинов и подобных веществ не
проявляются у животных, которым одновременно вводят антагонисты
бензодиазепиновых транквилизаторов, например Ro 15-1788.
7.2. АНКСИОГЕННЫЕ И АНТИАНКСИОПИТИЧЕСКИЕ
СВОЙСТВА р-КАРБОЛИНОВ
Большинство 0-карболинов хорошо проникают через гематоэнце-
фалический барьер и взаимодействуют с БДР нейронов мозга, вытес-
няя In vivo связанные с их мембранами 3Н-бензодиазепины (табл. 7.1),
что служит важными предпосылками, определяющими возможность
влияния /J-карболинов на центральную нервную систему животных.
Д Карбопины не воспроизводят поведенческих эффектов 1,4-бензодиа-
зепинов, в частности анксиолитических свойств последних Напротив
0-карболииы, обладающие высоким сродством к БДР в опытах in vivo
112
Таблица 7.1. Эффективные дозы (ЕД,0, мг/кг) /Э-карбопиноь и дру
тих лигандов бензодиазепиновых рецепторов, в которых они пре-
дупреждают связывание с мембранами мозга вводимого внутривен-
но ’ Н-флунитразепама или ’ Н-лорметазепам а
Лиганд БДР Орально Внутри- брюшинно । Внутр н- 1 венно Литература
Норгарман Мыши 175121 [423]
Гарман — — > 25* [423]
й-ссм — 23 22 [437, 503]
(3-ССЕ 450 53,4 2,1 [419]
— 240 —. [437]
0-ССР — 4,3 0,5210,01 [423, 437]
— — 1,5310,2 [423]
дм см — — 4,0 [503]
— 2,0 — [491]
— 3,1 — [437]
FG 7142 — 10 — [491]
— 37 — [437]
ZK 93426 2,6 0.2 — [491]
ZK 91296 4,5 2,5 — [491]
ZK 93423 — 1,5 — [491]
Диазепам — 1,0 — [525]
— — 0,2110,03 [423]
Ro 15-1788 4,0 — — [525]
CGS 8216 — 1,1 — [525]
ZK 93426 . Крысы 0,5 [525]
Диазепам — — 6,0 [525]
Ro 15-1788 — 5,0 —
CGS 8216 — — 0,8 [525]
* В указанной дозе уменьшает связывание ’ Н-флунитразепама на 38 %.
и in vitro, обладают антианксиолитической активностью. Способность
устранять анксиолитический эффект 1,4-бензодиазепинов продемон-
стрирована для 3-оксиметил-0-карболина на модели исследователь-
ского поведения выбора светлой и темной камер [306, 461], для
/3-ССЕ [462], (J-CCE, FG 7142 [463] и трет-бутил-0-карболин-З-карбо-
ксилата [464] на модели конфликтной ситуации, FG 7142 в дискрими-
национном тесте [465]. Антианксиолитический эффект 0-ССЕ вызывал
в дозах 2-10 мг/кг (внутрибрюшинно), которые не влияют на двига-
тельную активность и не изменяют продолжительности потребления
и объема выпитой крысами воды [466],
Ro 15-1788 - лиганд со свойствами антимодулятора (антагониста)
БДР — у человека устраняет анксиолитический эффект диазепама
[467], а у крыс - антиконфликтное действие хлордиаэепоксида [462].
Поэтому (3-ССЕ и другие P-карболины с антианксиолитическим действи-
113
ем можно рассматривать в качестве антимодуляторов (антагонистов)
БДР. Однако оказалось, что многие эфиры Р-карболин-З-карбоновой
кислоты оказывают не только антианксиолитическое, но и анксиогеи
ное действие, проявляя свойства модуляторов-ингибиторов (обратных
агонистов) БДР. Их анксиогенное действие обнаружено в модели зоосо-
циального взаимодействия, продолжительность которого существенно
сокращается под влиянием /3-ССЕ [460], Хотя Ro 15-1788 (4—Юмг/кг,
внутрибрюшинно) тоже несколько снижает длительность активного
зоосодиалыгого взаимодействия, он устраняет аналогичный эффект
Р-ССЕ (1 мг/кг). Парное зоосоциальное взаимодействие снижается у
крыс при внутривенном введении 2—4 мг/кг р-ССМ [469] и при внутри-
брюшинном введении FG 7142 в дозах 5, 10 и 20 мг/кг, причем только
в дозе 20 мг/кг последний угнетает двигательную активность живот-
ных [470]. Анксиогенный эффект FG 7142 тесно коррелирует с кон-
центрацией его в крови [471] и сопровождается повышением уровня
кортикостероидов в плазме крови [472], что является биохимическим
признаком стрессового состояния.FG 7142 полностью подавляет выхо-
ды крыс в центр освещенного открытого поля [473].
Аналогично действует метиловый эфир N- (Р-карболин-З-карбо-
нил) глицина. Анксиогенный эффект FG 7142 ослабляется введением
Ro 15-1788 (Юмг/кг), хлордиазепоксида (5 мг/кг), но не изменяется
в случае CGS 8216 в тех же дозах [474]. Пропил-Р-карболин-З-карбо-
ксилат в дозе 2 мг/кг [475] и ZK 93426 в дозах 2,5—10 мг/кг внутри-
брюшинно [476] достоверно уменьшают время эоосоциального взаи-
модействия у крыс, не влияя на ориентировочную активность и локо-
моцию животных. л-Бутил-р-карболин-З-карбоксилат оказывает ан-
ксиогенное действие в модели приподнятого лабиринта [477].
Анксиотенный эффект Р-карболинов наблюдается и в условиях
метода конфликтной ситуации, что выражается в усилении наказуемо-
го питьевого или пищевого поведения (проконфликтный эффект).
Наиболее отчетливое проконфликтное действие обнаружено у Р-ССЕ,
Р-ССМ и этилового эфира 4-этил-5-метокси-Р-карболин-3-карбоновой
кислоты; FG 7142, ДМСМ и CGS 8216 менее активны [478]. Гарман и
3-метилгарман (5—10 мг/кг) также уменьшают число взятий воды и
подходов к поилке в условиях метода наказуемого поведения у крыс
с водной депривацией [479]. Снижение двигательной активности при
тех же дозах (рис. 7.1) не позволяет сделать заключение, что под дей-
ствием указанных гарманов изменения наказуемого поведения являют-
ся выражением их анксиогенного действия. Однако производные гар-
мана - гарман-3-карбоновая кислота, ее метиловый эфир (С-437) и
особенно метиловый эфир 1,3-диметил-Р-карболнн-8-карбоновой кис-
лоты (С-506) — в дозах 5 10 мг/кг (внутрибрюшинно) обладают не-
сомненным проконфликтным действием (см. рис. 7.1). Гармалин,
гармалол, тетрагидрогарман и некоторые другие производные гармана
114
характеризуются анксиогенной активностью в модели внутривидового
зоосоцлального взаимодействия [458, 459], /ЗССМ - в тесте перехода
из светлой в темную камеру [480] „
Внутривенное введение /3-ССЕ (2,5 мг/кг) макакам вызывает у
них острый поведенческий синдром тревоги, который сопровождается
вегетативными (учащение сердцебиений, повышение артериального дав-
ления) и биохимическими (увеличение концензрации кортизона и ка-
техоламинов в крови) сдвигами [481].
Экспериментальные данные, свидетельствующие об анксиогениои
активности /З-карболинов, подтверждаются наблюдениями на людях.
При исследовании на здоровых добровольцах установлено [482], что
назначение им внутрь 0,1—0,4 мг/кг FG 7142 вызывает тревожное со-
стояние, если концентрация /З-карболшга в сыворотке крови достигает
150 нг/мл или превышает этот уровень. Субъективные ощущения и
изменения поведения появлялись через 1 ч и продолжались примерно
2 ч. Они сопровождались повышением в крови уровня кортизона и
пролактина, концентрация которых затем уменьшалась парал зельно
снижению концентрации FG 7142. ZK 93426 тоже увеличивает тревож
ность у людей [483], но данные об анксиогенном влиянии (3-карбо-чи-
нов не всегда бесспорны [484].
Анксиогенный эффект /З-карболинов обусловлен изменением
функционального состояния Рд-ГАМК-БДР-хлорканальных
бранных комплексов, о чем свидетельствует, во-первых, наличие вы-
сокого аффинитета к БДР у анксиогенных /3-карболинов: /3-ССМ,
FG 7142, /3-ССЕ, /3-ССР, ZK 93426 (см. табл. 6.3) и гарманов (см.
табл. 6.4), хотя сродство последних к БДР менее выражено. Во-вто-
рых, антимодулятор (антагонист) БДР Ro 15-1788 устраняет не толь-
ко анксиолитический эффект 1,4-бензодиазепинов, но и анксиогенный
эффект Дкарболинов [469, 470, 480] Тем не менее очевидно, что ме-
ханизмы анксиолитического действия БДТ и анксищ енных эффектов
/3-карболинов не идентичны.
Причину этих различий первоначально объясняли тем, что БДР,
с которыми взаимодействуют /3-карболины (3Н—ССЕ), локализуются
исключительно постсинаптически, а места связывания 1,4-бензсдиазе-
пинов — пост- и пресинаптически [485]. Позднее было показано [486],
что и те и другие лиганды (3Н-ССМ и 3 Н-флунитразепам) взаимодей-
ствуют с пост- и пресинаптически локализованными БДР. По-видимо-
му, различия в действии анксиогенов и анксиолитиков относятся к
особенностям молекулярного механизма их действия.
Следует отметить, что /3-карболины (/3-ССЕ и FG 7142) устраняют
анксиолитический эффект не только 1,4-бензодиазепинов (подобно
Ro 15-1788), но и барбитуратов [463], молекулярной мишеге о дей-
ствия которых является хлорный ионофор [386]. В работах [465 487]
подчеркивается, что обладающие анксиогенными свойствами /3-карбо-
115
-----R4444~^t^X’s\X\\4^\\\^\\^V
‘Л\\\\\\\’Ж'>ЗД^\\ул\\\\^.\У
1 - --I' •— —1 я
SSSSSCTSSSSSSSSSSSSSSSSS
ssssssssssssssssssss^ssss
—
sssssssssssssssssss:
sssssssz
*tS_3
5 10 0 1 О 1 IO О S 10 0 5 10 О 5 10
♦ Дозсг, м»/га
® S^лхххх xxxxxxxxw.xw I
^\\xvx\x\xvx\vl
1-----------1-----------1-----------1----------1-----------L-
C> }? S> *9 & *O
П <\> Vj
I-------------------
( gg ) i^i/nou > eppoxpou n
( □ ) ллЪмоэс/ Х1чпал£юуон оехэдьтгс^
116
4Рис 7.1. Влияние 1-метил-0-карболинов на уровень -тревожности в условиях ме-
тода конфликтной ситуации у крыс с водной деприват' ей (знаком х обозначено
статистически достоверное (Р < 0,05) различие с контролем; стрелки внизу ука-
зывают направленность статистически значимых изменений двигательной актив
ности соответственно приведенным дозам веществ)
лины и другие анке иогены, например CGS 8216, ингибируют специфи-
ческое связывание 35S-TBPS с мембранами тем сильнее, чем более вы-
ражен их анксиогенный эффект. Кроме того, /3-карбопины с анксиоли-
тическими свойствами (ZK 93423 и ZK 91296) подобно 1,4-бенэодиаэе-
пинам усиливают связывание 35S-TBPS. Это позволяет предположить,
что анксиогенный эффект определяется преимущественно изменением
функционального состояния СГ-канального компонента, а анкси ли-
тический — состоянием бензодиазепинсвязываюшего участка Рд
ГАМК-БДР-канальных мембранных комплексов.
73. АНКСИОЛИТИЧЕСКИЕ СВОЙСТВА
0-КАРБОЛИНОВ
Анксиолитические свойства /3-карболинов впервые обнаружены
у гармана [479]. В малых дозах (1 мг/кг, внутрибрюшинно) гарман
подавляет наказуемое поведение у крыс с водной депривацией, су
щественно увеличивая количество наказуемых взятий воды и не изме-
няя двигательной активности животных (см. рис. 7.1). В этой дозе гар-
ман потенцирует антиконфликтный эффект диазепама [488], но в бо-
лее высоких дозах (5-20 мг/кг) он вызывает анксиогенный и анти-
анксиолитический эффекты: уменьшает число наказуемых взятий во-
ды у крыс с водной депривацией, понижает (10 мг/кг) и полностью
устраняет антикоифликтное действие диазепама [488].
У производных гармана не всегда сочетаются анксиолитическая и
анксиогенная активности. Например, 3-(2-имидазолил) гарман (С-496)
обладает исключительно антик онфликтпым действием в дозах 5—
10 мг/кг (см. рис. 7.1). Только анксиолитическая активность обнару-
жена методом конфликтной ситуации у 3,4-тетраметиленгармана
(С-412 [346]) и 2',2-диметил-3,4-тетраметиленгармЭна (С-394), а также
у их 4'-оксопроизводных (С-410, С-383). Двум последним /3-карбо ли-
пам присуща не только высокая анксиолитическая активность, но и
другие свойства 1,4-бенэодиазепинов: миорелаксирующее, противо-
судорожное, гексеналопотенцирующее действие [489]. Структура
4'-оксо-3,4-тетраметиленгармана оптимальна для проявления анксио-
литической активности. Замена метила в 1-м положении 2 ,2'-диметил-
4 '-оксо-3,4-тетраметиленгармана (С-383) иа трифторметил, этил, про-
пил или изопропил (С-390, С-511) сильно уменьшает анксиолитическую
. активность (рис. 7.2), а замена 4'-оксогруппы на гидроксил, остаток
117
Рис. 7.2. Зависимость антиконфликтной активности 4'-оксо-3,4-тетраметиленгар
манов от заместителя в положении 1 (обозначения см. на рис. 7.1)
гидр окси ламина или аминогруппу полностью лишает С-427, С-455,
С-415 антиконфликтных свойств (рис. 7.3). Антиконф ликтное дей-
ствие С-412 (5 мг/кг) устраняется предварительным (за 15 мин) вве-
дением CGS 8216 (табл 7.2)
Имеется единственное сообщение об анксиолитических свойствах
(3-ССЕ [490]. Вместе с тем некоторые 4-замещенные этшь/З-карболин-З
карбоксилата, синтезированные в 1983 г. [93], таким действием обла-
дают. Установлено [491-493], что у крыс, обученных в дискримина-
ционном тесте отличать хлордиаэепоксвд от солевого раствора
ZK 91296 и ZK 93423 замещают хлордиазепоксид, тогда как ZK 93426
подобно ДМСМ и FG 7142 подавляют обусловленный хлордиаэепокси-
дом дискриминационный стимул. Способность ZK 91296 замещать
диазепам или хлордиазепоксид в дискриминационном тесте устраняет-
ся предварительным введением Ro 15-1788 [493]. У крыс ZK 91296
при введении за 30 мин до опыта в дозе 5 мг/кг увеличивал длитель-
ность эоосониального поведения, но при повышении дозы (15 мг/кг)
эффект исчезал [494]. Это наблюдается и у других (3-карболинсв
118
С-383
С-427
С-455 С-415
С-394
Рис 7.3. Роль 4'-оксогруппы в антиконфликтном действии производных 3,4-тет-
раметиленгармана (обозначения см. на рис. 7.1)
(см. рис. 7.1, С-496). У обезьян Saimiri, обученных за пишевое подкреп-
ление оперантному поведению нажатия на рычаг в определенном ритме
при включении красного сигнала, частота нажатий уменьшалась при
электрическом раздражении хвоста от 0,11—0,55 до 0,06 -0,07/с. Такой
Таблица 7.2: Изменение антиконфликтного эффекта 3,4-тетраметилентармана
(С-412) после предварительного введения CGS 8216 в условиях метода кон
флвктиой ситуации [346]
Условие опыта п Показатель поведенческой реакции за 10 мин (Xi5jf)
ВЗЯТИЙ воды подходов к поилке горизонтальных перемещений
Контроль (вода) С-412, 5 мг/кг, внутрибрю- 8 6,0±0,5 14,6±3.9 23,112,7
ШИН НО 8 9,910,9* 22,914,5 34,313/5*
CGS 8216 (10 мг/кг) и С-412 (5 мг/кг), внутрибрюшинно 9 3,410,6** 6,2Ю,9** 24,215,0
* Статистически значимо различие с контролем (/’<0,05).
** Статистически значимо различие с эффектом С-412 (8 < 0,05) .
119
120
тормозящий условно-рефлекторную реакцию эффект электрическом
стимуляции понижался и устранялся предварительным введением
ZK 93423 (0,3-1 mi/кг) или ZK 91296 (3-10 мг/кг) [495].
Характерное свойство, которым отличаются /3-карболины с анксио-
литической активностью от 1,4-бензодиазепииовых транквилизаторов,
заключается в относительно менее выраженном у /З-карболинов обще-
угнетающем действии [47 9 489, 495] Более активные 3,4-тетрамети-
ленгарманы (табл. 7.3) отличаются по антиконфликтной активности от
диазепама в 2—12 раз, а по влиянию на спонтанную локомоцию, мио-
релаксирующему эффекту и способности потенцировать эффект суб-
наркотическои дозы гексенала в 4,5—10,5; 5—31 и 25-133 разасоот-
ветственно. Соединения ZK 93423 и ZK 91296 уступают диазепаму по
анксиолитической активности в четыре раза, а по влиянию на мышеч-
1-ный тонус и координацию движений - в 8-120 раз (см. табл. 7.3).
Причины диссоциации анксиолитической и других видов активнос-
ти у транквилизаторов /3-карболинового ряда различны. По аналогии
с триазолопиридазином CL 218.872,можно предположить преимущест-
венное связывание карболиновых анксиолитиков с БДРЬ хотя такое
толкование анксиоселективности транквилизаторов спорно, о чем уже
говорилось (см. раздел 6.1). Более вероятно, по-ввдимому, сочетание у
/З-карболинов свойств транквилизаторов и антидепрессантов [496].
Три- и тетрациклические антидепрессанты уменьшают седативный ги-
полокомоторныи) и снотворный эффекты бензодиазепиновых транк-
’ вилизаторов, почти не влияя на их анксиолитическую активность [497]
Наконец, можно предположить, что анксиолитические свойства /3-кар-
| болинов обусловлены влиянием не столько на ГАМК-ергические,
сколько на иные нейрохимические механизмы тревоги (см. главу 9).
Несовпадение анксиолитической и других видов транквилизирую-
щей активности имеет место в ряду анксиопитически действующих
/З-карболинов. Так,С-410 и С-383 в пять-шесть раз превосходят по ан-
тиконфликтной активности С-412 и С-394 (см. табл. 7.3), но угнетение
локомоции все эти вещества вызывают в совпадающих дозах Гексена-
ло-потенцирующая активность С-383, С-394 и С-425 одинакова, тогда
как анксиолитическая соотносится как 1:6:10.
В заключение необходимо отметить, что /3-карболины, как и многие
другие лиганды БДР, оказывают двустороннее влияние [498] на пове-
дение, отражающее уровень тревожности животных. Эта двусторон-
ностъ заключается в наличии у одних (З-карболинов исключительно анк-
сиогенной активности, у других — только анксиолитической. Некото-
рые /3-карболины обладают свойствами частичных агонистов (агонис-
тов антагонистов), проявляющих анксиолитический эффект в низких
Дозах ианксиогенный или антианксиолитический - в высоких.
I лава 8
СУДОРОЖНЫЕ, ПРОТИВОСУДОРОЖНЫЕ
И ПРОСУДОГОЖНЫЕ СВОЙСТВА
$ КАРБОЛИНОВ
Гарман известен как судорожный яд [499]. По судорожной актив-
ности у крыс гарман (ЕД5О=3>6 мг/кг, внутривенно) в четыре раза сла-
бее такого мощного конвульсапта, как пикротоксин (ЕД5о-0,8 мг/кг),
но во столько же превосходит коразол (СД50- 16,2 мг/кг). Активность
гармалина и норгармана меньше: ЕД50 соответственно составляют 19,5
и 24,5 мг/кг [500].
Судорожное действие норгармана коррелирует с его концентрацией
в гкани мозга, но лишь небольшая доля БД1’ мозга оказывается окку-
пированной норгарманом [501]. Аналогично действует гарман: даже в
относительно высоких судорожных дозах (30 мг/кг) понижает связы-
вание 3II-флунитразепама, вводимого внутривенно крысам через 5 мин
после него, всего на 31 % [502]. Судорожное действие гармана сопро-
вождается оккупацией части БДР мозга [502] и предупреждается ма-
лыми дозами диазепама (0,7-2,1 мг/кг), откуда можно сделать вывод,
что судорожное действие гармана обусловлено влиянием на БДР [500,
502].
Метиловые эфиры (З-карболины-З-карбоновой кислоты (/3-ССМ и
ДМСМ) также вызывают у грызунов клонико-тонические судороги,
феноменологически сходные с судорогами, обусловленными бикукул-
лином или коразолом [503 -505]. Эпилептиформные судороги воз-
никают у павианов (I’apio papio) через 30 с — 3 мин после внутривен-
ного введения ДМСМ (0,5 мг/кг) или (3-ССМ в дозах 0,1-0.2 мг/кг.
В половину меньших дозах эти (3-’ трболины облегчают возникновение
миоклонических судорог, провоцируемых у павианов мелькающим све-
том [506]. Пр осу дорожное действие ДМСМ, (3-ССМ и (3-ССЕ наблюдает-
ся при оккупации 10- 25 % БДР в мозге. Судорожные эффекты (3-ССМ
у мышей устраняются Ro 15-1788 (5 35 мг/кг),CGS 8216 (1— Юмг/кг)
и диазепамом, вводимым внутрибрюшинно в дозе 5 мг/кг [504]. Судо-
рожное действие ДМСМ (15 мг/кг, внутрибрюшинно) подавляется
1,4-бензодиазепинами: клоназепамом (0,1 мг/кг), лоразепамом
(0,5 мг/кг) и диазепамом (9 мг/кг). Другие противосудорожные сред-
ства также эффективны, но в более высоких дозах: натрия валытроат
в дозе 20 мг/кг, этосуксимгщ в дозе 100 мг/кг, а дифенин и карбама-
зепин в еще более высоких дозах. При судорогах, спровоцированных
ДМСМ, валытроат натрия и баклофен в пять раз эффективнее, чем в
случае коразола [507].
(З-ССМ (0,25-4 мг/кг) вызывает у мышеи клонико-тонические су-
дороги и в несудорожных дозах потенцирует судорожные эффекты
максимального электрошока, коразола, пикротоксина, кофеина (про-
судорожный эффект), а (3-ССЕ (0,25—10 мг/кг) провоцирует судороги
только у 2 % мышей и намною слабее потенцирует действие судорож
ных ядов. Пропил-Дкарболнн-З-карбоксилаг даже при внутривенном
введении в дозах 0,25-10 мг/кг не оказывает судорожного влияния и
не изменяет эффектов судорожных ядов [508]. Более того, подобно
Ro 15-1788,(3-карбояины — (3-ССЕ [508,509] и (3-ССР [505,508] ослаб-
ляют и устраняют судороги, вызываемые (3-ССМ, у мышей и павианов.
По данным [510], (3-ССЕ способствует развитию судорог у обезьян
(ЕД50- 0,6 мг/кг, внутримышечно), ио не у грызунов, поскольку
скорость распада (3-ССЕ в плазме грызунов намного выше, чем у
обезьян. Однако судорожное действие (3-ССЕ у обезьян не подтверж-
дается другими исследователями [511]. Гомологи (3-ССЕ (амиловый,
гексиловый, гептиловый и октиловый эфиры (3-карболин-3-карбоновой
кислоты) обладают только противосудорожными свойствами, подав-
ляя коразоловые судороги; ЕД50 (внутрибрюшинно) соответственно
составляют 1,5 и 1; 0,8 и 0,5 мг/кг.
Вызывая судорожную активность только у части животных, /3-ССЕ
обусловливают электроэнцефалографические изменения, аналогичные
тем, которые возникают под влиянием (3-карболинов с выраженным
судорожным действием. При внутривенном введении (3-ССМ (0,2 мг/кг)
или ДМСМ (0,4 мг/кг) у обезьян появляются множественные ЭЭГ-из-
менения в виде медленных волн в затылочной коре головного мозга,
волновых комплексов в сенсорной области коры, десинхронизации
ЭЭГ-активности в коре и усиления тета-ритма в гипокампе. Возникно-
вение высоковольтных сиайков в коре головного мозга предшествует
или сопутствует клонико-тоническим судорогам. Два других (3-кар-
болина — FG 7142 (2—20 мг/кг) и (3-ССЕ (0,2-2 мг/кг), напротив, не
вызывали судорог в указанных дозах, но аналогично изменяли ЭЭГ в
сенсомоторной коре и гиппокампе [511]. Наблюдаются множествен-
ные вспышки ритмических волн с амплитудой 100-250 мкВ на ЭЭГ
при внутривенном введении (3-ССЕ крысам в дозе 10 мг/кг [512].
В соответствии с ЭЭГ-изменениями, отражающими повышение
судорожной активности головною мозга, у (3-ССЕ обнаружена в опы-
тах на мышах, крысах и обезьянах просудорожная активность, выра-
женная в устранении противосудорожного эффекта диазепама [513],
снижении судорожного порога [514], облегчении возникновения и уси-
лении судорог разного происхождения- максимально! о электрошока
I 123
[515], коразоловых [514] или за счет введения изониазида, снижагоще.
го уровень ГАМК в мозге [516], химического повреждения лимбичес-
ких структур или в результате частого мелькания света [517, 518], воз-
действия сильного звука на некоторые генетические линии животных
(табл. 8.1). З-Оксиметил-, 3-формип- и 3-ацетил Дкарболины также
устраняют зашитый эффект диазепама при коразоловых судорогах
хотя сами не обладают судорожным действием в дозах до 30-50 мг/кг
[306]. Просудорожное действие в несудорожпых позах оказывают и
те /3-карболины, которые обладают судорожной активностью.
Степень выраженности судорожного действия Дкарболинов про-
порциональна числу оккупированных БДР. Так, /3-ССМ, оккупируя
40 % БДР нейронов гиппокампа, вызывает судороги, при 30 % занятых
рецепторов он обладает просудорожной активностью, а оккупация 5 %
БДР сопровождается облегчением обучения и памяти. Повторные
инъекции FG 7142 (по 40 мг/кг 3 раза за 6 дней) или норгармана
(20 дней ежедневно) вызывают у мышей ’’химическую раскачку”,
проявляющуюся в том, что несудорожные дозы конвульсантов, в том
числе FG 7142 или норгармана, способствуют возникновению клони-
котонических судорог. ’’Раскачка” сопровождалась уменьшением свя-
зывания (ВП1ах) 35 Ббутилбиниклофосфонотионата и снижением сти-
мулированного мусцимолом захвата 36 С1 синаптосомами мозга, на
основании чего сделано заключение, что просудорожное действие
FG 7142 обусловлено ухудшением функционирования ГАМК-регули-
руемых хлорных каналов [519,520] Однако, согласно [521], хими-
ческий киндлинг посредством FG 7142 не сопровождается изменением
количества и сродства БДР, а также способности ГАМК или диазепама
усиливать связывания 3 В-лоразепама и 35 S-трет-бутилбициклофосфо-
нотионата.
Некоторые Дкарболины обладают противосудорожными свойства-
ми Аудиогенные судороги у мышей линии DBA/2 (см. табл. 8 I) и
судороги, вызываемые ДССМ, устраняются пропиловым эфиром (3-кар-
болин-3-карбоновой кислоты [505, 508, 522]. Но р-ССР не влияет на
судороги, обусловленные максимальным электрошоком, крразолом,
пикротоксином, кофеином [508] и прерывистой световой стимуляцией
[522]. Миоклонические судороги возникающие у обезьян при стиму-
ляции мелькающим светом, устраняются внутривенным введением
ZK 93423 и ZK 91296 в дозах 1 16 мг/кг [518]. Последний устраняет
также аудиогенные, коразоловые и вызванные ДМСМ судороги, но не
судороги максимального электрошока или пикротоксина (табл. 8.2)
Хотя 3,4-тетраметилснгарман (С-412) противосудорожным действием
не обладает, его 4'-оксопроизводные (С-410, С-383 и др.) устраняют
пикротоксиновые судороги и несколько слабее — коразоловые (табл
8.2). Имеется сообщение [523] о противосудорожной активности
3-(метоксикарбонил)амино-Дкарболина, который в дозах 1—10 мг/кг
124
Таблица 8.1. Озособностъ лигандов БДР (ЕД<0, мг/кг) уси швать у
мышей 83 <1В(В) или подавлять у мышей III <1 В(Л) линии. DBA/2
аудиогенные судороги при внутрибрюшинном введении
Вещество Усиление ау- диогениых судорог Подавление аудиогенных судорог Ингибирование связи вания ’ Н-флунитра- зепама, %
Лоразепам — 0,002 <10
Клоназепам . — 0.005 <10
Диазепам — 0,04 <10
Хл ор диазепоксид — 0,5 <10
р-ССРг — 9,0 68
Ro 15-1788 — 6,0 85
FG 7142 50 — 57
CGS 8216 1,0 — 53
(3-ССМ 7,6 25
р ССЕ 49 — 17
ДМСМ ОД — <10
устраняет судороги, вызываемые /3-ССМ (1-3 мг/кг), но не влияет на
коразоловые судороги и не изменяет противосудорожных эффектов
диазепама.
При обсуждении природы судорожных, просудорожных и противо-
судорожных эффектов /3-карболинов в работе [509] подчеркивается
причинная связь перечисленных свойств и влияния на БДР, а также
возможность соотнесения судорожного (просудорожного) действия
Р-карболинов (3-ССМ, 0-ССЕ, ДМСМ, FG 7142) и их свойств обратных
агонистов (см табл. 6.7). Подобное заключение справедливо, но, по-
видимому, следует учитывать, что в некоторых случаях имеет место
дивергенция судорожных (просудорожных) и анксиогснных, противо-
судорожных и анксиолитических свойств Б-карболинов. Так, FG 7142
обладает анксиогенным (проконфликтным) эффектом и в три раза
более высокой дозе — эпилептогенным, выявляемым электроэнцефа-
лографически [524]. Напротив, ZK 93426 и FG 7142 характеризуются
анксиогепной активностью в дискриминащюнном тесте [492], однако
только FG 7142 вызывает судороги. ZK 93426 не оказывает даже про-
судорожного действия и у мышей линии ДВА/2 устраняет в дозе
40 мг/кг аудиогенные судороги [525].
Гарман является мощным конвульсантом, судорожное действие
которого подавляется диазепамом, но в малых (несудорожных) дозах
он оказывает антиконфликтное действие (см. рис. 7 1) Вместе с тем
3 4-тетраметиленгарман (С-412) с выраженным анксиолитическим эф-
фектом не обладает противосудорожным действием (см. табл. 8.2) да-
же в дозах, примерно равных 50 % ЛД50, усиливает коразоловые су-
дороги и сам вызывает судороги в высоких дозах.
Расхождения между влиянием Р-карболинов на уровень тревож-
ности и судорожный порог мозга могут зависеть от вовлечения в зф-
125
4-мв
Юме
’ г з
Рис. 8.1. Влияние гармана па потенциал действия в пучке волокон седалищного
нерва крысы {526]:
1 до воздействия гармана- 2 - через 10 мин после воздействия гармана в кон-
центрации 10-* моль/л; 3 - то же через 20 мин
фекты /З-карболинов других дополнительных молекулярных субстра-
тов, прямо не связанных с Ед-ГАМК -БДР- хлорканальными мембран-
ными комплексами. Например, высокая судорожная активность гарма-
на может быть обусловлена и антибензодиазепиновой его активностью,
которая, несомненно, имеет место при достаточно высоких дозах [500,
502], и наитием свойств блокатора потенциалзависимых калиевых ка-
налов [526]. Данное свойство гармана отчетливо проявляется в опытах
на изолированном пучке волокон седалищного нерва (крыс), при дей-
ствии на который в концентрациях 10“5 моль/л и выше гарман значи-
тельно удлиняет задний фронт потенциала /Действия (рис. 8.1).
Возможно также, что судорожные свойства некоторых /З-карболи-
нов частично зависят от изменений импульсного высвобождения в си-
напсах мозга возбуждающих дикарбоновых аминокислот. Это может
быть или следствием антибензодиаэепииовых свойств (З-карболинов,
которые реализуются на пресииаптическом уровне [527], или результа-
том независимого от БДР воздействия. Показано, например, что ДМСМ
(100 мкмопь/л) усиливает вызываемое иолами К* высвобождение
3Н-аспартата из срезов коры и гиппокампа, хотя (3-ССМ такими свой-
ствами не обладает. Блокаторы КМДД-рецепторов дикарбоновых ами-
нокислот как конкурентные (2-амино-7-фосфоногентаноевая кислота),
так и неконкурентные (МК-801), уменьшают судорожное дей-
ствие ДМСМ [528] и устраняют вызываемый FG 7142 кинд-
линг [521].
/З-Карболины с судорожной и просудорожной активностью (/3-ССМ,
ДМСМ, /3-ССЕ) противодействуют вызываемой аденозином депрессии
корковых нейронов у крыс. Их судорожные свойства, по крайней мере
отчасти, обусловлены антагонизмом с аденозином аналогично некото-
рым другим судорожным ядам (кофеину и теофиллину и др.) [529].
Внутрибрюшинное введение мышам избирательно действующих^! -аго-
нистов аденозина (PIA, СНА) или агонистов с высоким сродством к
121
126
А2 аденозиловым рецепторам (сРСА, МЕСА, NECA) препятствует раз-
витию судорог, вызываемых ДМСМ: ECJ0 агонистов аденозина соответ-
ственно составляет 1,00; 0,96; 0,14; 9,31 и 0,48 мг/кг Блокатор
Л1-аденозиновых рецепторов 8-циклопентилтеофиллин устраняет про-
тивосудорожный эффект Р1А (530].
Приметательно, что вызываемое повторными введениями FG 7142
снижение судорожного порога мозга не сопровождается изменением
поведения животных в конфликтной си- ации, в тестах зоосоциально-
го взаимодействия и приподнятого лабиринта (531]. Следова
тельно, изменения судорожного порога не зависят от уровня тре-
вожности.
Глава 9
НЕЙРОФИЗИОЛОГИЧЕСКИЕ И МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ
ДЕЙСТВИЯ ВКАРБОЛИНОВ
9.1. ГАМК ЕРГИЧЕСКИЕ МЕХАНИЗМЫ
ДЕЙСТВИЯ /3-КАРБОЛИНОВ
Связь между БД!’ и ГАМК-ергической передачей в мозгу, установ-
ленная с помощью разных методических подходов (см. раздел 6.1),
служит фактическим обоснованием современных представлений о ме-
ханизме действия 1,4-бензодиазепинов на уровень тревожности и су-
дорожную готовность мозга. Предполагаегся, что усиление ГАМК-ер-
гических свойств является важнейшим компонентом анксиолитичес-
кой и противосудорожной, а также миорелаксирующей активности
5-фен ил-1,4-бензодиазепинов [532—534]. Естественно допустить, что
другие лиганды БДР, в частности /3-карболины, изменяют уровень
тревожности и судорожный порог, влияя на ГАМК-ергичес кие синап-
сы мозга
Способность трансформировать эффекты экзогенной и эндогенной
(синаптической) ГАМК действительно является характерным свойст-
вом /3-карболинов. При суперфузии изолированного спинного мозга
крысят солевым раствором, содержащим ГАМК (10“4 моль/л), воз-
никает гиперполяризационный электротонический потенциал вентраль-
ного (рис. 9.1, кривая 4) и деполяризационный электротонический по-
тенциал дорзального (см. рис 9.1, г, кривая 4) корешков. Предвари-
тельная в течение 15 мин суперфузия мозга раствором, содержащим
гарман (10"’-10"s моль/л), усиливает как гиперполяризацию мото-
нейронов (см. рис. 9.1, д, кривые 5), так и деполяризацию первичных
афферентов (см. рис. 9.1, г, кривая 5) спинного мозга, несмотря на то
что гарман (10“5 моль/л) оказывает на первичные афференты и мото-
нейроны слабое деполяризующее действие (см рис 9 1, е, ж). Он так
же увеличивает амплитуду и продолжительность потенциала дорсаль-
ного корешка, вызванного электрической стимуляцией дорсального
корешка соседнего сегмента (см рис. 9.1, в, кривая 2), т.е. усиливает
ГАМК-ергическое торможение спинальных афферентов
ГАМК потенцирующий эффект гармана зависит от концентрации
ионов хлора в среде, при 165; 124 и 83 ммоль/л СГ прирост эффектов
129
1мВ
100 мс
Тис. 9.1. Влияние гармана на эффекты у-амнномасляной кислоты и вызванные
электрической стимуляцией дорсального Z., корешка потенциалы вентрального
Г, (о), вентрального Г.4 (б) и дорсального Lt (в) корешков; электротонические по-
тенциалы, возникающие в дорсальном (е) и вентральном 0) корешках при су
перфузии мозга раствором ГАМК (10 * моль/л), а также изменение поляризации
дорсального (е) и вентрального (ж) корешков под влиянием гармана при сулер
фузии изолированного спинного мозга:
1 — до суперфуэни; 2 - после 15-минутной суперфузин мозга раствором, содер-
жащим гарман (КГ’ моль/л); 3 - через 15 мин после отмывания; 4 - до воз-
действия гармана; 5 - после воздействия гармана (10~* моль/л); б воздей-
ствие обычным солевым раствором; 7 - воздействие раствором, содержащим
Mg м в избытке и Са и в недостатке
ГАМК (КГ4 моль/л) под влиянием 10-6 моль/л гармана соответствен
ио составляет 99; 46 и 29 % (см, рис. 9.2, а). Это свидетельствует о
том, что ГАМК-потеицирующий эффект гармана, как и аналогичный эф-
фект хлордиазепоксида (526], обусловлен влиянием на хлорные ионо-
форы, сопряженные в мембранах нервных клеток с БДР и Рд ГАМК.
Однако Г AM К-потенцирующий эффект гармана наблюдается только
при концентрациях 10" КГ5 моль/л, а при более высоких уменьшает
ся (см. рис. 9 2, б). Даже при концентрации КГ5 моль/л гарман в отли-
чие от 1,4-беизодиазепинов не уменьшает, а увеличивает амплитуду мо-
но- и полисинаптических рефлекторных ответов мотонейронов (см
рис. 9.1, а, б, кривые 2), что свидетельствует об ослаблении гарманом
ГАМК-ергического торможения спинальных мотонейронов Таким об-
130
а б
Рис. 9.2. Зависимость ГАМК-потенцируюшего действия гармана от содержания
хлоридов в среде (а) и от его концентрации (б).
а - ответные реакции первичных афферентов спинного мозга, обусловленные воз-
действием ГАМК (10* моль/л), в отсутствие (светлые столбики) и в присут-
ствии (заштрихованные столбики) гармана (КГ* моль/л) при разных концентра-
циях ионов хлора в среде; б - зависимость ГАМК-потенцирующего влияния гар
мана от концентрации
разом, гарман двойственно влияет на эффекты IАМК, усиливая их в
малых концентрациях (1СГ7—10“5 моль/л) и угнетая в более высоких
В отличие от гармана амбокарб (С-383) обладает исключительно
ГАМК-потенцирующим действием. С-383 понижает моио- и пояиси-
наптические рефлекторные ответы спинальных мотонейронов (см.
рис 9.3, а, б, кривые 2), повышает амплитуду и длительность потен-
циала дорзального корешка, вызванного электрической стимуляцией
дорзального корешка соседнего сегмента (см. рис 93, в, кривая 2),
усиливает деполяризующее влияние ГАМК на первичные афференты
(рис. 9.3, г) и гиперполяризующее ее влияние на мотонейроны (см.
рис 9 3) в широком диапазоне концентраций (от 10“7 до 10“ 4 моль/л).
При этом мембранный потенциал мотонейронов и первичных афферен
тов С-383 не изменяет (см. рис. 9.3, д, ж).
Подобное, хотя и менее выраженное (табл. 9.1), ГАМК-потенци-
рующее действие оказывают С-412 и С-394. ГАМК-потенцируюшая ак-
тивность С-394 сопоставима с активностью хлордиазепоксида, а актив-
ность гармана, С-412 и С-383 в 8-16 раз выше чем хлордиазепоксида.
Однако максимально достигаемый ГАМКпотенцирующий эффект всех
131
G <1 It I НИ I Пн ihlttl н tn
1
2
Таблица 9.1. Сопоставление I АМК-потенцирующей и аитнееротонииовой (Sj) ак
тмвиости гарманов с влиянием на поведение в конфликтной ситуации
Вещество ГАМ Кт от енцир ующая активность
EC,j±Sx, мкмоль/л а
Антисерото-
ннповая ак-
тивность,
рД,
0.002±0,0001 1
1,3 ±0,16 1 —
0,12±0,02 0,7 6,1 ±0,22
Не определяется 0,1 5,17
Уменьшает - 5,0
О,15±О,ОЗ 0.7 6,34
1,32±О,13 0,4 5,59
0,08±0,01 0,8 5,92
Антик онфпихт
пая /прокси фликт-
чая активность
(МЕЛ),мг кг
0,5/нет
5/пет
1/?
1/?
1/10
5/нет
6/нет
1/вет
Диазепам
Хлордиазепоксид
Гарман
З-Мстилгарман
Метиловый эфир гар-
ман-3-карбоновой кис-
лоты (С-437)
3,4 Тстпаметпленгарман
(С-412)
С-394
С-383
Примечание, а - внутренняя активность, определяемая как отношение мак-
симального ГАМК потенцирующего эффекта вещества к аналогичному эффекту
диазепама на спинальных мотонейронах при 124 ммоль/л NaCl. Антисеротонипо-
вая активность оценивалась по изменению веществом при 15-минутноЙ экспози-
ции. вызываемой серотонином (510 s моль/л), чувствительной к метисергиду
деполяризации спинальных мотонейронов.
Рис. 93. Влияние вибокарба (С-383) на рефлекторные ответы изолированного
спинного мола к(Ыс. Уровень поляризации спинальных корешков и эффекть
ГАМК (обозняенШ ем. на рис. 9.1 концентрация С-383 10 ’ моль/л)
перечисленных гарь#110® составляет лишь 40—80 % максимального
ГАМК-потеннир),юш<го эффекта диазепама и хлордиазепокевда, т.е.
внутренняя активность гарманов ниже единицы. Все они являются пар-
циалыпями агоппсг?ми 1,4-бензодиаэепииов (частичными модуляторами
сенсибилизаторами ’ГАМ С ЬДР-хлорканалыгых комплексов)
ГАМК-иотенапруюшее Действие оказывает также ZK 93423. В до-
зах 0,05—1 мг/кг (внутривенно) он утпегает спонтанную спайковую ак-
тивность нейронов ретикулярной зоны черной субстанции значительно
сильнее, чем дш-зеиыи, и подобно последнему усиливает вызываемое
агонистами ГАМК (мусцимолом, НИР) торможение спайковой актив-
ности этих нервны?: клеток. Его эффекты устраняются введением
Ro 15-1788 [535]
Другие эфиры 0-карболии-З-карбоновой кислоты, напротив, про-
тиводействуют эффектам ГАМК и устраняют ГАМК-потенцирующее
влияние 1,4-бензйЯ,|а5е,,ИП0В [536j. Впервые эти свойства обнаружены
у /3-ССЕ [536]. У наркотизированных крыс электрическое раздражение
(с частотой 1,5 Гн) волокон бахромы вызывает спайковую активность
нейронов зоны СА гиппокампа, которая подавляется при микропоно
форетической абдикации ГАМК. Вводимый внутривенно/3-ССЕ (0,3—
1,0 мг/кг) полнестьк устраняет угнетение спайковой активности. Тор-
мозящий эффект ГАМК усиливается предварительным введением ми-
дазолама (ОД мгкг) а /3-ССЕ устраняет ею ГАМК-потенцирующее дей-
ствие.
Метил-/3-карболин-3-карбоксилаты (/3-ССМ, ДМСМ) в концентра-
циях 10—100 нмоль/л уменьшают или полностью подавляют вызывав
мне микроаппликацией ГАМК ответы нейронов в культуре клеток
спинного мозга мышей [416] или куриных эмбрионов [537]. ДМСМ
устраняет эффекты ГАМКд-агонистов: THIP, пипераэин-4-сульфоновой
кислоты [538]. Наблюдаемая при действии ГАМК iиперполяризация
мотонейронов изолированного спинного мозга крыс ослабляется пред-
варительной суперфузией мозга раствором, содержащим метиловый
эфир гарман-3-карбоновой кислоты (см. табл 9.1).
В опытах in vitro на изолированном верхнем шейном ганглии крыс
установлено, что /3-ССМ (88-440 ммоль/л) и /3-ССЕ (0,2— 1 мкмоль/л)
тормозят реакцию нейронов ганглия на ГАМК примерно в одинаковой
степени [539]. На клеточных культурах нейронов спинного мозга мы-
шей in vitro найдено, что /3-ССЕ (100 нмоль/л) не изменяет, а /3-ССЕ
(100 нмоль/л) незначительно увеличивает вызываемые ГАМК реакции
нейронов Хотя (3-ССМ подавлял, а /3-ССЕ не изменял эффектов ГАМК
оба (3-карболйна устраняли ГАМ К-потенцирующее влияние диазепама
[416]. Такое же действие оказывает и ZK 91296, который в то же вре-
мя подавляет ингибирующее влияние ДМСМ на эффекты ГАМК в куль-
туре нейронов спинного мозга [540]
Не только эффекты экзогенной ГАМК, но и ГАМК ергическое тор-
можение подавляется эфирами /З-карболин-З-карбоновой кислоты. На-
пример, /3-ССМ и ДМСМ увеличивают частоту разрядов нейронов черной
133
132
Лиганд 6ДР моль/л
Рис. 9.4. Влияние лигандов БДР на вызывае-
мые 7-вминомасляиой кислотой изменения
проводимости мембран нейронов в культуре
клеток спинного мозга эмбрионов цыплят
(G - отношение величин, характеризующих
вызываемые ГАМК изменения проводимости
субстанции [541] У нарко-
тизированных крыс сни-
жалась частота разрядов
клеток Пуркинье мозжечка
при электрическом раздра-
жении поверхности его ко-
ры. Длительность этого
ГАМК-ергического тормо-
жения возрастает при внут
ривенном введении хлор-
диазепоксида (1-5 мг/кг),
диазепама (0,5-1 мг/кг),
но сокращается в случае
р-ССМ и 0-ССЕ в дозах 1—
4 мг/кг. ГАМК-ергическое
торможение нейронов гип-
покампа устраняет соеди-
нение FG 7142 [542], кото-
рое увеличивает амплитуду
их спайковых разрядов и
при одиночной стимуляции
вызывает множественные
спайки [543]. Тета-ритм,
запускаемый в гиппокампе
электрической стимуляци-
ей перегородки мозга на-
ходящихся в свободном
поведении крыс, возникает
при меньшей частоте стиму-
ляции после введения не
только хлордиазепоксида
или диазепама, но и ДССЕ
Однако последний одновре-
менно устраняет облегчаю-
в присутствии и в отсутствие лигандов БДР)
[384|:
J - диазепам; 2 - клоназепам; 3 - хлордиазе-
поксид; 4 - CL 218,872; 5 - Ro 15-1788; 6 -
/3-ССМ; 7 - DMCM (наиболее приближенные к
экспериментальным данным теоретические
кривые рассчитаны на основе регрессионного щее влияние диазепама на
анализа методом наименьших квадратов) генерацию тета-ритма [544],
Очевидно, что лиганды
БДР влияют на эффекты синаптической и экзогенной ГАМК неодно-
значно (рис. 9.4). /З-Карболины можно разделить на три группы. Пер-
вую составляют Дкарболины, потенцирующие эффекты 1 АМК: 3,4-те-
траметиленгарман (С-412, С-394, С-410 и C-3&J), ZK 93423 и Р-ССР
(табл. 9.2) Другая группа /3-карболинов устраняет или уменьшает
влияние ГАМК на нейроны (/3-ССМ ДМСМ, FG 7142, С-437). Третья
группа в зависимости от концентрации (дозы) по-разному влияет на
134
Таблица 9.2. Корреляции клеточных (ГАМК-ертических) и по-
веденческих эффектов р-карбо лилов
0-Карболки Способность изменять
ГАМК-эффекты уровень тревожности судорожный порог
0-ССМ — — -
ДМСМ — — —
С-437 — ±
FG 7142 — — ±
0-СС.Е 0 — 1:
ZK 91296 0 + +
ZK 93426 ± - — ±
Гарман ± * —
0-ССРг + —
ZK 93423 + + +
С-412 + 1 —
С-394 + —
С-410 + +
С-383 + + +
Обозначения: отсутствие влияния - 0, ГАМК-потенци-
руюшее — ГАМК-иигибирующее и смешанное — ”±”
действие; по уровню тревожности анксиолитическое -
анксиогеиное - ” и смешанное - действие в моделях
’’конфликтного” и (или) зоосодиального поведения, днскри-
минативиого теста; по судорожному порогу судорожное
просудорожное — и противосудорожное — ”+” дей-
ствие в тестах коразоловых и (или) аудиогенных судорог.
эффекты ГАМК (гарман, ZK 93426): либо существенно не изменяет ее
эффектов, либо противодействует ГАМК-потенцирующему влиянию
1,4-бензодиазепинов (ДССЕ, ZK 91296).
92. ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ КОРРЕЛЯТЫ
ПОВЕДЕНЧЕСКИХ ЭФФЕКТОВ р-КАРБОЛИНОВ
Способность облегчать или затруднять сопряжение Рд-ГАМК и
хлорных каналов, о чем можно судить по характеру ГАМ К-модулирую-
щего влияния веществ, отражает особенности эффектов /3-карболинов.
Карболины с ГАМК-позитивными свойствами обычно оказывают анк-
сиолитическое и часто противосудорожное, а /3-карболины с ГАМК-не-
гативной активностью — анксиогеиное и судорожное (просудорожное)
действие (см. табл. 9.2).
Более детальный анализ свидетельствует, однако, об отсутствии
I 135
тесной корреляции между клеточными и поведенческими эффектами
<3-карболинов. Так, гарман и 3,4-тетраметиленгармаи, ГАМК потенци-
рующая активность которых полностью совпадает (см. табл. 9.1), по-
разному влияют на уровень тревожности животных; первый в завис и
мости от дозы проявляет и анксиолитическую и анксиогенную актив-
ность (см. рис. 7.1), а второй — только анксиолитическую. Действие
гармана и Э-метнлгармана на уровень тревожности одинаково, но в
отличие от гармана 3-метилгарман не обладает ГАМК-потенцируюшими
свойствами. Несмотря на то что метильный эфир гарман-3-карбоновой
кислоты (С-437) обладает Г АМК-негативными свойствами, в малой
дозе (1 мг/кг) он оказывает антиконфликтный эффект. Кроме того,
С-412 и С-394, обладающие судорожной активностью и усиливающие
судорожные эффекты коразола, отчетливо потенцируют влияние ГАМК
на нервные клетки (см. табл. 9.2).
Отсутствие строгого соответствия характера и степени влияния
на функцию ГАМК-ергических синапсов (ГАМК-потенцирующего или
ингибирующего действия) и на поведение (анксиолитическому - про-
тивосудорожному или анксиогенному — судорожному) нельзя объяс-
нить различиями в аффинности /З-карболинов к БД?! или БДР2. Веро-
ятно, указанные несоответствия отражают участие в действии (3-карбо-
линов на судорожный порог мозга и уровень тревожности других, не
ГАМК-ергических, механизмов. Возможные дополнительные механиз-
мы судорожного действия /З-карболинов обсуждались в главе 8. В анк-
сиолитическом-анксиогенном действии /З-карболинов помимо ГАМК-
ергических участвуют, по-видимому, серотонинергические механизмы.
93. СЕРОТОНИНЕРГИЧЕСКИЕ МЕХАНИЗМЫ ДЕЙСТВИЯ
0-КАРБоЛИНОВ
Серотонинсодержащие нейроны, тела которых расположены в яд-
рах шва среднего мозга (ЯП1СМ), дают начало восходящей системе ак-
сонов, образующих два пути: от клеток дорсального ядра преимущест-
венно к структурам полосатого тела и от нейронов медиального ядра
к структурам гипоталамуса, септо-гиппокампальной области, ядрам
миндалевидного комплекса и коре полушарий мозга. Имеются много-
численные данные об участии этой системы мозга в анксиолитических
эффектах 1,4-бензодиазепинов. При подавлении функций ядер шва
путем введения л-хлорфенилапанина, ингибирующего синтез серотони-
на (окситриптамина, ОТ) в ОТ-содержащих нейронах, наказуемое
поведение сильно угнетается. Антагонисты ОТ, например метисергвд
и ДЛК, также увеличивают число наказуемых ответов в условиях мето-
да конфликтной ситуации подобно хлордиазепоксиду и диазепаму
[373]. Скорость метаболического оборота серотонина в мозге под
136
влиянием бензодиазепиновых транквилизаторов замедляется, что рас-
сматривается как доказательство угнетения ими функциональной ак
тивнос и ОТ-содержащих нейронов [532]. Указанные эффекты объяс-
няют я усилением бензодиазепинами тормозящего влияния ГАМК, ос-
вобождаемой ГАМК-ергическими интернейронами, образующими си
напсы на клетках ЯШСМ. В подтверждение этого показано [383], что
| диазепам усиливает тормозящее влияние ГАМК на нейрон) i дорзаль-
F ного ядра шва.
Однако анксиолитик нового поколения — буспирон (8- [4- (4- (2-ии-
। р ими ди л) -1 -пиперазинил) бутил] азоспиро(4,5) декан-7,9-дион гидрохло-
|рид), не обладающий свойствами лиганда БДР и влиянием на ГАМК-
(ергические синапсы [545], угнетает метаболический оборот серотонина
Г [546] и тормозит электрическую активность нейронов ЯШСМ [547].
Микроинъекция очень малых доз ДССМ (0,1—10 нг) в дорсальное
[ ядро щва, но не в другие структуры мозга, подавляет зооссциальное
• взаимодействие у крыс [469,548], а микроионофоретическое возней-
I ствие гармалина (0,05 ммоль/л), как и серотонина (0,0'2 моль/л), ут-
]|(негает спайковую активность большинства ОТ-содержащих нейронов
[ЯШСМ [549]. Очевидно что серотонинергические механизмы вовлек
I ются в анксвогенные-анксиолитические эффекты Дкарболинов либ<
11 косвенно путем изменения ГАМК-ергического контроля i
кЯШСМ, либо в результате влияния на чувствительную к серогсшлу
г мембрану этих нейронов.
Й Действие /З-карболинов на чувствительные к серотонину нейроны
I не сводится, однако, к воспроизведению его эффектов. Серотонин
||(Ю“в-103 моль/л) в опытах на изолированном спинном мозге крыс
I вызывает деполяризацию 60 % мотонейронов и гиперполяризацию ос-
I тальных, но он тою» ко деполяризует мотонейроны, если синаптическая
I передача в мозге выключена избытком Mg ‘t"r и косвенное влияние
I серотонина на мотонейроны исключено [550]. Гарман тоже прямо, хо-
тя и слабо, деполяризирует мотонейроны (см. рис, 9.1, ж), но в случае
серотонина деполяризация мотонейронов устраняется метисергидом
(5’ 10”’ моль/л), т.е. реализуется через серотониновые рецепторы вто-
рого типа (Р-2—ОТ), тогда как деполяризацию гарманом метисергидне
устраняет. Напротив, гарман (10~7—10~5 моль/л) противодействует
деполяризующему влиянию серотонина на мотонейроны (см. табл.9.1).
(3,4-Тетраметиленгарман (С-412), который в отличие от гармана не из-
меняет мембранного потенциала мотонейронов, и некоторые другие
производные гармана обладают аналогичной серотопинолитической
(метисергвдоподобной) активностью, которая воспроизводится и на
нейронах сенсорного ганглия.
1 • Нейроны сенсорного ганглия взрослых крыс — удобная - -одель
Е" для анализа нейронных эффектов серотонина, поскольку разные нейро-
I ны ганглия отвечают на подводимый к ним через микропипетку раст-
137
вор серотонина (0,05 моль/л) тремя типами реакции: медленно разви.
вающейся и быстрой деполяризацией, сопровождающейся повь
шением мембранного сопротивление и гиперполяризацией, прояв-
ляющейся одновременно с повышением мембранной проводи-
мости [551].
Все три эффекта ОТ обусловлены изменением К+-проводимости
мембран нейронов, поскольку потенциалы реверсии всех эффектов
определяются в пределах (от —70 до -80 мВ), близких к равновесному
калиевому потенциалу. Но только медленная деполяризация опосре-
дуется потенциалозависимыми К*-каналами М-тока, ингибируемыми
ионами Ва2+. Калиевые каналы, вовлекаемые в гиперполяризационные
и нечувствительные к Ва2 + быстрые деполяризационные ответы нейро-
нов, являются цЛМФ-зависимыми. Об этом свидетельствует измене-
ние вызываемой серотонином гиперполяризации и быстрой деполяри-
зации после воздействия на ганглии веществами (форсколином, тео-
филлином, имидазолом), изменяющими внутриклеточную концентра-
цию цАМФ, а также полное подавление эффектов серотонина в присут-
ствии коклюшного токсина, который ингибирует ГТФ-связываюший
белок (G-белок), сопрягающий рецепторы серотонина и аценилат
циклазу.
Медленная деполяризация подавляется метисергвдом, блокирую-
щим Р2—ОТ, а также гарманом и его производными, что подтверждает
наличие упомянутых серотонинолитических (метисергцдоподобных)
свойств |3-карболинов (см. табл. 9.1). Вызываемые серотонином ги-
лерполяризация и быстрая деполяризация не изменяются в присутствии
метисергид (КГ6 моль/л), кокаина (3-1СГ6 моль/л) или пропраноло-
ла (2-10-6 моль/л). Вместе с тем нейроны, отвечающие гиперполяри-
зацией или быстрой деполяризацией на воздействие 0,05 М раствора
серотонина, подводимого к нейрону через один ствол двуствольной
микропипетки, соответственно реагируют на подводимые через другой
ствол растворы буспирона (0,05 моль/л) или 1-(2-пиримидинил) пипе-
разина (0,1 моль/л), известных в качестве лигандов-агонистов Pj д—ОТ.
По-видимому, именно эти серотониновые рецепторы (Pja— 01) управ-
ляют функцией цАМФ-зависимых КЛканалов в мембранах нейронов
сенсорных ганглиев крыс [551].
Гарманы, которые подавляют наблюдаемую при воздействии серо-
тонина медленную деполяризацию, неоднозначно влияют на гиперполя-
ризующий эффект серотонина. Солевой раствор гармана (10"7 и
1(Г5 моль/л) при 15-минутной суперфузии с енс одного ганглия не из-
меняет мембранного потенциала нейронов, но в концентрации
10“ 7 моль/л усиливает гиперполяризующий эффект серотонина и мем
бранную проводимость, а в концентрации 10“5 моль/л, напротив,
уменьшает наблюдаемые реакции (рис. 9.5). 3,4-Тетраметиленгарман
(С-412) и метиловый эфир З-метилгарман-8-карбоновой кислоты
(С-506), не влияя на мембранный потенциал нейронов, изменяли эф-
755
Рис. 9.5. Изменение мембранного потенциала и входного сопротивления при дей-
ствии серотонина (1 и 3) и феянбута (4 и 5) до (1,4) ичерез 15 мин суперфузии
ганглия солевым раствором, содержащим 0,4 ёд/мл коклюшного токсина (3j,
5а), гарман в концентрации 10'* (36, 56) или 10"’ моль/л (Зв, 5в), С-506 в кон-
центрации 10"’ моль/л (Зг, 5г), С-412 в концентрациях 10 ’ (36) и W’ моль/л
(Зе, 5е), а также мембранного потенциала нейронов и гиперполяризующих толч-
ков в начале и в конце 15-минутной суперфуэин ганглия растворами гарма-
нов (2). Точками отмечен момент подведения к нейронам растворов серотонина
(0,05 моль/л) и фенибута (0,07 моль/л) из микропипеткн под давлением
фекты серотонина, но С-412 их только усиливал, а С-506 их только
уменьшал в широком диапазоне концентраций (табл. 9.3).
Следовательно, |3-карболины модулируют (усиливают или ослаб-
ляют) эффекты серотонина, которые реализуются посредствомР^д-ОТ
и цАМФ- (С^-зависимых К*-каналов, Такой модулирующий эффект мо-
жет быть обусловлен влиянием на любой компонент мембранной систе-
мы Р1Д-ОТ -Gy-белок-аденилатциклаза, а также К*-каналы, которые
управляются системой.
Для решения вопроса о месте ОТ-модулирующего действия Дкар-
болинов исследовалось их влияние на гиперполяризационные эффекты
активаторов ГАМКв рецепторов баклофена и фенибута. Примерно 15 %
нейронов сенсорного ганглия крыс отвечают на воздействие активато-
ров ГАМКв-рецепторов баклофена и фенибута гиперполяризацией и по-
вышением мембранной проводимости, как и на влияние серотонина
Равновесный потенциал вызываемых фенибутом гиперполяризацион-
ных ответов (от -70 до -80) сдвигается в положительную сторс iy при
повышении концентрации ионов К* в среде. Аналогично серотонину
гиперполяризация фенибутом нейронов ганглия подавляется коклюш-
ным токсином (см. рис. 9,5, табл. 9.3).
139
Таблица 9.3. Жменеиня вызываемых серотонином и фенибутом ги-
лерполяриэацпончых ответов (3) нейронов спинальных ганглиев крыс
под влиянием коклюшного токсина, теофиллина. /3-кярболииов и
триптамина (552, 556]
Вещество, концентра- ция (моль/л) Серотонин Феннбут
п |э.мВ(М±т) п Э,мВ (М±т)
Контроль Коклюшный токсин 45 3,17*0,11 43 3,04*0,12
(0,4 ЕД/мя) 6 0,31*0,07* 6 0,34*0,06*
Теофиллин, 10~* Г арман 5 1,52*0,24* 5 1,63*0,22*
Ю-’ 8 4,62*0,24* 7 3,11*0,25
10"’ 3,4-Теграметилснгар- мая (С.-412) 8 1,77*0,21* 8 3,21*0,16
10 ~7 6 4.11±0Д8* — —
10"’ Метиловый эфир 3-ме- тилгарман-8-карбоно- вой кислоты (С-506) 9 4,88*0,27* 8 3,07*0,29
10"’ 7 1,54*021* 7 3,31*0,27
10 5 Триптамин 7 131*022* 7 3,26*025
ю-’ 7 3,70*0,21* 4 2,97*0,63
10"* 8 3,04*0,22 —
10-’ 8 1,12*0,17* 4 3,37*0,64
* Р< 0,05.
Таким образом, гииерполяризующее действие серотонина и фени-
бута на нейроны сенсорного ганглия крыс опосредуется разными ре-
цепторами (PiA-OT и Рц—ГАМК соответственно), но в дальнейшем
реализуется посредством однотипных мембранных систем: Gj-белка/
аденилатциклазы и К+-каналов. Вместе с тем ни один из исследованных
[3-карболинов, изменяющих эффекты серотонина (гарман, С-506,
С-412), не влияет на аналогичные эффекты фенибута. Следовательно,
модуляция гиперполяргаующих эффектов серотонина [3-карболинами
обусловлена их воздействием на Г [д—ОТ и осуществляется по аллосте-
рическому механизму, поскольку гарманы не изменяют мембранного
потенциала нейронов и не воспроизводят эффектов серотонина [552].
Гарман- естественный метаболит в мозге млекопитающих [5531,
которой может выступать в роли эндогенного аллостерического моду-
лятора PiA-OT нервных клеток. Он образуется из триптамина, по-ви-
димому, экстраклеточно и не может рассматриваться как нейромоДуля-
тор. Однако триптамин мог бы играть роль нейромодулятора, так как,
вероятно, сосредоточен внутри специфической популяции триптамин-
содержащих нейронов. Существование их предполагается на том осно-
140
вании, что 6-оксидофамин, вводимый в черную субстанцию, понижает
содержание дофамина (на 74 %) и триптамина v.a 52 %), но не серото-
нина, а 5,7-диокситриптамин, понижая содержание дофамина и серото-
нина (на 22 % и 47 % соответственно), не изменяет уровня триптамина
в мозге [554].
Нейромодулирующие функции триптамина в мозге ранее не обсуж-
дались. Предполагалось, что триптамин (ТА) является ’’тормозным”
медиатором нейронов ядер шва в отличие от ’’возбуждающею” — серо-
тонина [555], но традиционно триптамин считается агонистом серото-
нина. Действительно, микроалпликация 0,1 М раствора триптамина на
нейроны сенсорного ганглия воспроизводит те же эффекты, которые
наблюдаются при микроаппликации 0,05 М раствора ОТ на соответ-
ствующие нейроны: медленную или быструю деполяризацию либо гк-
перполяризацию. Однако эффекты триптамина слабее выражены, и по
активности он уступает серотонину в 20-100 раз. При суперфузии ганг-
лия солевым раствором триптамина (10“5-10“ 7 моль/л) изменяется
не мембранный потенциал нейронов, а реакции некоторых нейронов на
серотонин. Вызываемая серотонином и 1- (2-пиримидиннл) пиперазином
гиперполяризация усиливается по величине и продолжительности после
предварительной суперфузии ганглия раствором, содержащим
10“7 моль/л триптамина. Возрастают также величина и продолжитель-
ность обусловленной серотонином быстрой деполяризации, но медлен-
но развивающаяся (чувствительная к метисергиду) деполяризация
триптамином не изменяется. Напротив, после суперфузии ганглия соле-
вым раствором, содержащим 10“5 моль/л триптамина, вызываемая се-
ротонином гиперполяризация (см. табл. 9.3) и быстрая деполяризация
понижаются; медленная деполяризация не меняется и в этом случае.
Триптамин не трансформирует эффектов фенибута, т.е. модулирующее
действие триптамина на чувствительные к серотонину мембраны нейро-
нов обусловлено аллостерическим изменением под влиянием триптами-
на рецепторов серотонина 1,4-типа, а не сопрягающего (G-белок) или
конечного эффекторного (К4-канал) компонента [556].
Аллостерическая природа взаимодействия триптамина и серотони-
на на уровне Pj а— ОТ подтверждается данными с несовпадающих участ-
ках связывания 3Н-триптамина и 3 Н-серотонина в мембранных фраг-
ментах мозга [436, 444 445, 449]. Если учесть, что некоторые /3-кар-
болины тоже являются аллостерическими модуляторами указанных ре-
цепторов, то понятно, почему они активно вытесняют 3Н-триптамин из
мест его специфического связывания в мембранах мозга и слабо про-
тиводействуют связыванию 3Н-серотоиина (см. табл. 6.8). Все изложен-
ное позволяет рассматривать триптамин как нейромодулятор, изменяю-
щий чувствительность мембран нервных клеток к серотонину путем
юнижения сродства к нему серотониновых 1<4-рецепгоров,а|3-карбалины —
как эндогенные и экзогенные агонисты триптамина с двойственными
I 141
Таблица 9.4. Спектр фармакологической активности анксиолитиков, являющих
ся производными 1,4-бенэодиазепина (диазепам), 1-(2-пиримндиинл) пиперазина
(буспнрои, ипсапирон) и ^-карболина (С-412, С-383)
Вещество Активность относительно диазепама
Ангиконф- Седативная Мнорелаксм- Гексеналопо- ликтная руюшая тен пирующая
Диазепам Буспирон Ипсапирон 3,4-Гетраметилен гарман (С-112) Амбокарб (С-383) 1(1) 1,0(0,8) 1,0(3,6) 1,0(03) 3 10,9 15 27,1 10 8,6 20 29,3 5 4,9 6,5 108 1 4Д 7,3 50
Примечание. Антик онфликтная активность выражена в МЕД вещества/МЕД
диазепама у крыс; седативная и другие - ЕД„ вещества/ЕД,0 диазепама у Мы-
шей; в скобках — то же в миллиграммах на 1 кг внутрибрюшинно.
(гарман) или однонаправленным (С-412, С-506) модулирующим
влиянием на Р1А — ОТ.
Способность триптамина и гарманов модулировать Р1А— ОТ и из-
менять чувствительность нервных клеток к серотонину имеет большое
значение ввиду широкого распределения сопряженных с (7-белком и
К*-каналамиР1А—ОТ в эмоциогенных структурах лимбического мозга.
Так как /3-ССЕ практически не обладает сродством к триптаминсвязы-
ваюгцим аллостерическим регуляторным центрам серотониновых 1А-
рецепторов (см. табл. 6.8), эфиры /3-карболин-3-карбоновой кислоты
не оказывают модулирующего влияния на PjaOT. Их анксиогенное и
анксиолитическое действие, вероятно, обусловлено модулированием
функции Ра-ГАМК-БДР-хлорканальных мембранных комплексов
Но способность некоторых /З-карболинов аллостерически модулировать
функции Ь4-серотониновых рецепторов является существенным ком-
понентом их действия на уровень тревожности. Действительно, 3,4-те-
траметиленгарман (С-412), потенцирующий гип ер поляризующее впия
ние серотонина на нервные клетки (сенсорного ганглия), — анксиоли-
тик в условиях метода конфликтной ситуации [557], а С-506, ингиби-
рующий нейронные эффекты серотонина, оказывает анксиогенное
влияние (см. рис. 7.1, табл. 9.3) Гарман двояко действует как на
эффекты серотонина, так и на уровень тревожности животных.
Известно, что селективные активаторы 1И-серотонИновых рецеп-
торов (буспирон, ипсапирон и др.)—активные анксиолитики у живот-
ных ичеловека [558] .действующие на постсинаптические Р]д- ОТней-
ронов лимбического мозга или (и) соматодендритные 1Л-ауторецепто-
ры ОТ-содержащих нейронов ЯШСМ [559]. Обладающие Ы-серотони-
носенсибилизирующими свойствами /3-карболины не активируют
Р1А-ОТ,но усиливают активирующее влияние эндогенного серотонина
142
на указанные рецепторы. Этим объясняется, почему такого рода /3-кар-
болины и буспироноподобные вещества обладеэт удивительно похо-
жим спектром фармакологической активности, который отличается от
спектра действия бензодиазепиновых транквилизаторов (табл 9.4)
Следует иметь в виду, что некоторым (З^карболинам, например С-383
(см. табл. 9.1), присущи выраженные ГАМК-потенцирующие свойства.
9 4. МЕХАНИЗМ АЛЛОСТЕРИЧЕСКОГО РЕГУЛИРОВАНИЯ
р-КАРБО ЛИНАМИ ГАМК-
И СЕРОТОНИНЕРГИЧЕСКОЙ СИНАПТИЧЕСКОЙ ПЕРЕДАЧИ
Не влияя на ионную проницаемость и мембранный потенциал нейро-
нов, /3-карболины модулируют те изменения мембранной проводимости
и потенциала мембран нервных клеток, которые вызываются у-амино-
масляной кислотой и (или) серотонином. Как модуляторы ГАМК-
ергической передачи /3-карболины являются частной, структурно очер-
ченной, но функционально неоднородной группой лигандов БДР.
В функциональном плане они делятся на 3 группы Вещества первой
группы (/3-ССР, ZK 93423, С-412, С-410, С-383) обладают ГАМК-потен-
цируюшим действием (см. табл. 9.2), увеличивают обусловленное
ГАМК повышение проводимости мембран нейронов и поступление
ионов 34 СГ в нервные клетки [560, 561]. Им свойственно анксиоли-
тическое и (или) противосудорожное действие. /З-Карболины второй
группы (/3-ССМ, ДМСМ, FG 7142, С-437) обладают ГАМК-ингибирую-
щими свойствами (см. табл. 9.2), уменьшают вызываемое ГАМК по-
вышение мембранной проводимости (см. рис. 9.4) и амплитуду ГАМК-
тока [562], снижая частоту обусловленных ГАМК открытий хлорных
каналов [562] и вхождение ионов СГ в нейроны [561]. Они оказывают
анксиогенное и (или) судорожное действие. Третья группа /З-карболи-
нов (/3-ССЕ, ZK 93426, гарман) оказывает обычно двухфазное влияние
на эффекты ГАМК (см. табл. 9.2) и Неоднозначное влияние на уровень
тревожности и судорожный порог мозга, но отчетливое антибензодиазе-
пиновое действие, заключающееся в способности устранять анксиоли-
тический эффект 1,4-бензодиазепинов.
Такое деление /3-карболинбв совпадает с известной классификаци-
ей пнгандов БДР на агонисты, обратные агонисты (контрагонисты) и
антагонисты [371, 437, 509, 562] или модуляторы-сенсибилизаторы,
модуляторы-ингибиторы и антимодуляторы [361, 563], что точнее от-
ражает свойства лигандов БДР. Лиганды БДР, в том числе /3-карболи-
ны, не изменяют стехиометрию взаимодействия ГАМК с РЛ-ГАМК.
Индекс Хилла (л//), измеренный на чувствительных к ГАМК нервных
и мышечных клетках, равен 1,7 [387], 2,0 [390, 564] и даже 3,0 [565],
т е. для открытия одного хлорного канала необходимо связывание
143
сг
БАР\
ГАМо
Рис. 9.6. Гипотетическая модель си-
наптического комплекса Рд-ГАМК
-БДР-хлорный канал [ 567] (хлорный
канал представлен как пора в барби-
: у ратсвязывающейг субъединице)
8
двух-трех молекул ГАМК. Связь
вание двух молекул ГАМК со-
ответствует представлению о
а2 -олигомерной природе ₽д
Г АМК -БДР- хлорканальных мем-
бранных комплексов.
Индекс Хилла больше единицы
не обязательно означает, что взаи
модействие ГАМК с Рд-ГАМК
кооперативный процесс, при кото-
ром взаимодействие с макромоле-
кулой Рд—ГАМК одной молекулы
ГАМК облет чает взаимодействие
другой. Взаимодействие ГАМК с
Рд-ГАМК квазикооперативный
процесс [5 4, 565], и высокое зна-
чение и// лишь свидетельствует о
том, что каждая из двух молекул
ГАМ К вступает в реакцию с Дсубъединицей Рд-ГАМК независимо, но
С! -канал открывается только тогда, когда все связывающие ГАМК
участки образующих канал субъединиц оккупированы молекулами
ГАМК [361]. Отражающий квазикооперативность взаимодействия
ГАМ -сРд—IAjMK индекс Хилла не изменяется бензодиазепинами
(см. рис, 6.2, 6.3). ГАМК также не влияет па кривых радиолиганд-
ного связывания 1,4-бензодиазепинов [434].
Не затрагивая стехиометрии взаимодействия ГАМК с Рд-ГАМК,
лиганды БДР изменяют вероятность эффективного, т.е. приводящего
к открытию хлорного канала, взаимодействия ГАМК срецеп орами,что
выражается в увеличении диазепамом частоты открытий сопряженных
с Рд-ГАМК .хлорных каналов [566] и в снижении частоты открытий
каналов под влиянием обратных агонистов [562].
Согласно одной из первых моделей, удовлетворительно объяс-
няющей этот феномен [567], Рд—ГАМК -БДР-хлорный капал комп-
лекс состоит из трех взаимосвязанных белков, которые присоединяют
бензодиазепины и барбитураты (БАР) (рис. 9.6). Активация
ГАМ Кд-рецепторов сопровождается открытием хлорного канала
(см. рис. 9.6, путь 7). В процесс, вероятно, вовлекается бензодиазе-
пипсрязывающий компонент -БДР- в качестве сопрягающей субъеди
ницы. Бензодиазепины повышают (см. рис. 9.6, путь 2), а обратные аго-
нисты снижают (путь 3) сопрягающую функцию, поскольку БДР ра
ботают как модуляторы аффинного состояния РА-ГАМК: 1,4-бенэодиа
зепчны увеличивают (путь 4), а обратные агонисты уменьшают аффи-
нитет ГАМК-рецептора. В свою очередь, ГАМК и ее агонисты повышают
связывай» 1,4-бензодиазепинов ( м рис. 9.6, путь 5) «понижают свя-
144
зывание обратных агонистов. Барбитураты усиливают процесс сопря-
жения (путь 7) Рд-ГАМК и СГ-канала (путь 6), по-видимому, увели-
чивая аффинитет ГАМК-рецептора к медиатору (путь 8), но в больших
концентрациях могут прямо открывать канал (путь 7).
Модель в общей форме раскрывает принцип аллостерической регу-
ляции сродства Рд—ГАМК к ГАМК лигандами БДР, что ведет к изме-
нению эффективности сопряжения Рд-ГАМК и хлорных каналов. Для
объяснения разного влияния на ГАМК-ергическую передачу агонистов,
обратных агонистов и антагонистов пригодна модель двух состояний,
допускающая связь модуляторов-сенсибилизаторов (агонистов) и мо-
дуляторов-ингибиторов (обратных агонистов) с двумя разными кон-
формерами БДР, каждая из которых может взаимодействовать с ан-
тимодуляторами (антагонистами БД!') [567 , 568].
В настоящее время имеются данные [361, 569], свидетельствую-
щие, что активируемые медиаторами рецепторы существуют в четырех
взаимопревращающихся конформациях: энергетически устойчивой
высокоаффинной к антагонистам нативной форме (Кт), энергетичес-
ки неустойчивой высокоаффинной к агонистам активной форме (Яд)
и в рефрактерных формах (Ад и Ад), т.е. в состояниях быстро и
медленно развивающейся десенситизации (рис. 9.7, 1-4). Аффин-
ность к агонистам повышается от Др к Др через Др и Др, а взаимо-
' действие любого медиатора с рецептором-каналом описывается двухсту-
пенчатой схемой: на первом этапе происходит быстрое связывание ме-
.диатора (см. рис. 9.7, 13) и рецептора с образованием нерабочего пре-
комплекса (см. рис. 9.7,2), а последний относительно медленно изоме-
ризуется в активный комплекс (см. рис. 9.7, 3) с открытым каналом.
Двухступенчато взаимодействуют с рецепторами также модуляторы,
например флунитразепам с БДР [412].
Неодинаковое сродство конформеров ГАМК-рецепторов к агонис-
ту (Л) позволяет полагать, что разные конформеры БДР отличаются
аффинностью и к определенному модулятору (В'). Именно это, по-
видимому, определяет разное влияние на эффекты ГАМК трех групп
лигандов БДР.
Модуляторы, аллостерически изменяющие сродство рецептора к
агонисту (метаффиноидные аллостерические модуляторы), влияют на
эффект агониста:
I ’ £лл/£тах = д>Т^йТ’ (9Л)
где Еа в< _ эффект агониста в присутствии модулятора; Amax- макси-
мальный эффект агониста; Кд — равновесная константа диссоциа-
ции А; /дВ' фактор, определяющий изменение сродства агониста к
рецептору [361, 563]. Изменение сродства А под влиянием такого рода
аллостерического модулятора, например Д к арб опина, возможно, если
| сродство модулятора к Д?-иД/?-формам рецепторов (Кт в' ^Ктв*)
145
го
Рис 9.7. Конформационные состояния мембранного рецепторе канала и действие
веществ, изменяющих ГАМК-ергическую передачу'
1-4 - нативная форма (/), образующая с агонистом нерабочий прекомплекс
(2), изомеризующийся в активную форму с открытым каналом (3}, и переход
последней в рефрактерную (десенситизированную) форму (4); 13 - агонист
(ГАМК); 14 - конкурентный антагонист (бикукуллин); 15 — ингибитор от-
крытой формы канала (пикротоксин); 16 - аллостерический метаффиноидный
модулятор (0-карболин, бензодиазепин); 17 -аллостерический неконкурентный
Модулятор (барбитурат)
больше сродства, к ним агониста, т.е. если Квв' > Kra ® зтом слУчае
взаимодействие 3' с рецептором предшествует взаимодействию с ним
агониста (см. рис. 9.7, 7) и, влияя на соотношение Я7- иЯр-форм, В
облегчает или затрудняет взаимодействие агониста с рецептором в за-
висимости от концентрации аллостерического регулятор3 [^'] и срод-
ства последнего к Т- или Я-конформапиям рецептора:
f , = 1+ктв'[В'] (9,2)
Ав {+кР.в'{В'\
Если Кгв=Квв, то fAB= 1 и В' не является модулятором, но, окку-
пируя места специфического связывания, например Б Др, препятствует
взаимодействию с ними модуляторов, т.е. обладает свойствами анти-
модулятора. К числу таких антимодуляторов относятся /3-ССЕ, ZK 93426,
Ro 15-1788 и некоторые другие лиганды БДР.
Если сродство В' к Я-конформсру выше, чем к Г-форме (Крв' >
> Ктв, Кт в * 0), то величина /л в' в уравнении (9.2) мала и Кд в
уравнении (9.1) уменьшается, т.е. сродство агониста, иапример ГАМК,
146
к рецепторам возрастает, а В' проявляет свойства аллостерического мо-
дулятора-сенсибилизатора. Такие свойства обнаружены у анксиолити-
чески действующих (3-карболинов, 1,4-бензодиазепинов, CL 218.872 и
др. Напротив, если К?в > Кв в' (высокое сродство модулятора В' к
7*-конформеру), то значение /хв' велико и сродство агониста к рецеп-
тору уменьшается. В этом случаев действует как аллостерический мо-
дулятор-ингибитор ГАМК-ергической передачи, что наблюдается для
(3-ССМ, ДМСМ, FG 7142 и некоторых других /3-карболинов.
Метаффиноцдные аллостерические модуляторы, в частности (3-кар-
болины, могут вызвать изменения сродства Рд—ГАМК к медиатору
без изменения максимального эффекта ГАМК только тогда, когда
Ктв' и Квв' > Крд. Сопоставление величин, характеризующих срод-
ство /3-карболинов и ГАМК соответственно к БДР и Ра-ГАМК, пока-
зывает, что данное условие в целом соблюдается. Аффинитет высоко-
и низкоаффинных (R- и Т-) форм РА—ГАМК к 3Н—ГАМК характери-
зуется величинами /Q порядка 100—300 нмоль/л и 1—3 мкмоль/л [386].
Величины 1CSO и Л/, отражающие сродство активных (3-карболинов к
БДР, колеблются от единицы до нескольких десятков наномолей в 1 л
(см. табл. 6.3), так же как и большинства 1,4-бензодиазепинов (_м.
табл. 6.1). Из них только сродство хлордиазепоксида намного мень ше
(7CS0 составляет сотни наномолей в 1 л). Сродство /3-карболико.- к
БДР, ие превышающее сродства ГАМК к высокоаффинной форме
Ра-ГАМК, присуще норгарману, гарману и его производным (см.
табл. 6.4), но в присутствии хлоридов аффинитет ГАМК к РА—ГАМК
на порядок снижается [386], а аффинитет хлордиазепоксида и гармана
к БДР возрастает [398], т.е. в физиологических условиях сродство и
этих модуляторов к БДР превышает сродство ГАМК к РА—ГАМК.
Уже подчеркивалось, что (3-карболины со свойствами обратных аго-
нистов должны обладать преимущественным сродством к Я^форме
БДР, а модуляторы-сенсибилизаторы (агонисты) — к Rp-форме. Ис-
следования на мембранных фрагментах, в которых часть БДР под-
верглась фотоаффинной инактивации флунитразепамом (последний
как агонист связывает преимущественно Яд-форму БДР), показы-
вает, что с оставшимися неинактивированными БДР (Я т-форма) взаи-
модействуют именно обратные агонисты и антагонисты: 3Н—ССМ,
3Н-ССЕ, ЭН-ССР, 3H-Ro 15-1788 (см. раздел 6.3).
Действие лигандов БДР отличается от действия барбитуратов, спо-
собных модулировать ГАМК-ергическую передачу. Барбитураты обла-
дают низким сродством к барбйтуратсвязывающим субъединицам
Рд—ГАМК-БДР-хлорканальных комплексов их Kj порядка
100 мкмоль/л существенно выше, чем ЭН-ГАМК (0,1—3 мкмоль/л).
Поэтому барбитураты взаимодействуют с уже образовавшимся комп-
лексом AR (см. рис 9 7, 2, 10) и замедляют переход открытой
формы рецептора-канала (см рис. 9.7.77) в десенситизированную (см
147
рис. 9.7, 12) [569], увеличивая среднее время жизни канала в откры-
том состоянии [570].
Хотя бикукуллин и пикротоксин тоже изменяют ГАМК-ергичес-
кую передачу и вызывают у животных и человека судороги, феномено-
логически идентичные судорогам от /3-ССМ и ДМСМ, влияние этих кон-
сультантов принципиально отлично от действия/З-карболинов.Бикукул
лии как конкурентный антагонист ГАМК предпочтительно взаимодей-
ствует с Ду-формой Рд—ГАМК и при сдвиге равновесия влево (см
рис. 9.7,1-5) препятствует Т Д-переходу ГАМ К-рецепторов, который
вызывается в отсутствие бикукуллина ?-аминомасляной кислотой.
Пикротоксин является блокатором открытой формы ГАМК-активи-
руемого рецептора-канала (см. рис. 9.7, 3, 6) и включает часть из их
обшей популяции. В отличие от бикукуллина он не только сдвигает
кривые концентрация—эффект ГАМК вправо, но и уменьшает макси-
мум ее эффекта (неконкурентный антагонист ГАМК).
Молекулярный механизм модулирующего влияния /З-карболинов
на функцию серотонинергических синапсов изучен пока недостаточно.
Важнейшие избирательно действующие активаторы Ргд—ОТ (8-ок-
си-2 (ди-н-пропи ламино) тетралин (8- ОН DPAT), ипсапирон и буспирон)
подавляют спайковую активность нейронов ЯШСМ [547,571], понижая
электрическое сопротивление мембран, и вызывают гиперполяризацию
нейронов гиппокампа [572] и перегородки [573], действуя подобно
серотонин/'. Последний, а также буспирон, ДЛК и 8-ОН—DP АТ угнетают
стимулированную форсколином аденилатциклазу (ECS0 соответствен-
но 54; 146, 24 и 18 нмоль/л) в суспензии мембран из гиппокампа мор-
ских свинок [574]. Если учесть, что вызываемые серотонином гипер-
поляризация и повышение К*-проводимости мембран нейронов гиппо-
кампа [575] и сенсорных ганглиев [551] крыс подавляются коклюш-
ным токсином, становится очевидным, что активация Р1А-ОТ транс-
формируется в изменение калиевой проницаемости мембран нейронов
посредством системы G-белок/аденилатциклаза и снижения внутрикле-
точного уровня цАМФ. По-видимому, активная форма Pj д—ОТ (Д-фор-
ма) способна образовывать функциональный комплекс с ГТФ-связы-
вающим ингибиторным белком (G,) и аденилатциклазой (Ас), что
приводит к уменьшению базисной активности фермента и внутрикле-
точного уровня цАМФ, а также активности цАМФ-зависимой протеин-
киназы и степени фосфорилирования субстрата К+-каналов.
Описанное в разделе 9.3 модулирующее (сенсибилизирующее и ин-
гибиторное) влияние /З-карболинов па ОТ j д-ергические процессы бази-
руется, по-видимому, на изменении эффективности сопряжения Pja—
ОТ и цАМФ G-зависимых Ю-каналов и сходно с модулирующим
влиянием /З-карболинов на Рд—ГАМК (БДР)хлорканальные комп-
лексы, т.е. состоит в облегчении или затруднении Т’-Д-перехода Pj А—
148
ОТ и соответствующем варьировании сродства их к серотонину в ре-
зультате взаимодействия триптамина или 0-кариолинов с триптамин-
связывающими участками Pj д—ОТ.
9.5. /3-КАРБОЛИНЫ КАК ЭНДОГЕННЫЕ РЕГУЛЯТОРЫ
УРОВНЯ ТРЕВОЖНОСТИ
С появлением бензодиазепиновых транквилизаторов и открытием
БДР возникло представление о связи этих рецепторов с регуляцией
уровня тревожности и возможном существовании эндогенных лигандов
БДР, которые являются естественными регуляторами уровня тревож-
ности у животных и человека [377]. Их поиск в мозге и некоторых
внутренних органах выявил наличие низкомолекулярного, устойчиво-
го к действию проназы вещества (веществ) , тормозящего связывание
3Н-диазепама с мембранами мозга [576]. Вскоре удалось установить,
. что некоторые небелковые метаболиты в ткани мозга ингибируют свя-
зывание 3Н-диазепама. Такими свойствами обладают пурины (аденин,
инозин, гуанозин, гипоксантин), из которых наиболее активен аденин
(7C5o-630 мкмоль/л), и пиримидины (цитозин, тимин, урацил) [577],
из которых никтотинамцд (/С5о=4500 мкмоль/л) воспроизводит важ-
нейшие свойства бензодиазепиновых транквилизаторов [578, 579].
Свойствами ингибиторов специфического связывания 311-диаэепама ха-
рактеризуются некоторые метаболиты триптофана — мелатонин и N-aue-
тил-5-метоксикинуренамин (1СК =2000 мкмоль/л) [580], а также вы-
деляемые из мозга небелковые вещества неизвестной структуры, моле-
кулярная масса которых не превышает 5000 [581] или 1000 Д [582].
Одновременно установлено существование эндогенных белков со
свойствами ингибиторов связывания 3Н-диаэепама [583, 584]. Содер-
I жащийся в экстракте из грубой фракции синаптосом белок, увеличи-
вающий Kd 3Н-диазепама, назван ингибитором связывания диазепа-
ма (ДВ1) [583]. Найдена его молекулярная масса (11 кД), расшифро-
ваны аминокислотный состав и частично первичная структура. ДВ1 кон-
курентно ингибирует связывание 3Н-диазепама, 3H-Ro IS 1788, но еще
более активно — 3Н-/?-карболинов (А}= 1-4 мкмоль/л). Хотя ДВ1 не
влияет на связывание 3Н—ГАМК, он препятствует вызываемому бен-
зодиазепинами повышению связывания 3Н—ГАМК. Влияние ДВ1 на
связывание 3Н—Ro 15-1788 мало изменяется в присутствии ГАМК, и с
этой точки зрения ДВ1 можно считать антимодулятором (антагонис-
том, см. табл. 6.7), что соответствует результатам опытов на животных,
где у ДВ1 обнаружены не только антибензодиазепиновые, но и анксио-
генные (проконфликтные) свойства [583, 585]. Активны также про-
дукты процессинга ДВ1: ДВ1з5-5о и ДВ142.50 [586].
Однако все упомянутые лиганды БДР не удовлетворяют в полной
мере тем трем критериям, которым должны отвечать вероятные эндо-
149
генные лиганды БДР: вещество должно быть выделено из мозга, оно
должно конкурентно тормозить специфическое связывание 3Н-бензо-
диазепинов в концентрациях, соответствующих его уровню в ткани
мозга; оно должно оказывать действие на животных, сходное или про-
тивоположное действию 1,4-бензодиазепинов [587]. Если первому и
последнему критериям соответствуют многие из упомянутых соедине-
ний, то большинство из них (кроме ДВ1, концентрация которого в моз-
ге 10-25 мкмоль/п) не содержатся в мозге в таких концентрациях
которые достаточны для 50 %-го ингибирования связывания 3Н-дназе-
пама. 1СК указанных небелковых веществ лежат в диапазоне 0,63-
4,5 ммоль/л.
Отвечать свойствам вероятного эндогенного лиганда БДР могли
бы эфиры /3-карболин-3-карбоновой кислоты, обладающие высоким
(наномоляриым) сродством к БДР и выраженным влиянием на уро-
вень тревоги у животных Однако первоначальное сообщение о высо-
ком содержании в мозге /3-ССЕ (20 нг на 1 г ткани) [417] в дальней-
шем не подтвердилось [428]. Оказалось, что /3-ССЕ образуется в про-
цессе выделения из ткани мозга и из мочи. Тем не менее предполагает-
ся, что /3-ССВ и [424] или не идентифицированные пока /3-карболины
с высоким аффинитетом к БДР могут быть эндогенными регулятора
ми тревожности [557,587,588].
Для такого предположения существуют некоторые основания
В частности, показано, что стрессирующие факторы (новая обстанов-
ка, удары электрического тока) воспроизводят сигнальное действие
/3-карболинов в дискриминационном тесте (см. раздел 7.1). Крыс обу
чали за пищевое подкрепление отличать инъекцию FG 7142 (5 мг/кг)
от введения растворителя. Установлено, что новая обстановка приво-
дит к частичному, а удары тока - к преимущественному выбору педа-
ли, соответствующей введению FG 7142, что свидетельствует о сходстве
состояния стресса и состояния, вызываемого у животного инъекцией
/3-карболина [589].
Из известных эндогенных 0-карболинов роль регулятора уровня тре-
вожности может выполнять гарман [557,580] . который обнаружен в кро-
вяных пластинках человека [591] и в ткани аркуатного ядра мозга крыс
[557] Гарман выделяется с мочой у человека и крыс (см. табл. 10.3) осо
бенно после нагрузки этанолом. Вероятно, он образуется в мозге из трип-
тамина в результате конденсации с ацетальдегидом и последующего дегмд
рирования тетрагидрогармана [592]. Гарман ингибирует специфичес
кое связывание 3Н-флунитразепама конкурентно (см. рис. 6.4) в мик
ромолярных концентрациях (/Cso=5,6-7,2 мкмоль/л, см. табл. 6 4)
В зависимости от дозы гарман оказывает двойственное (антик онфликт-
иое-проконфликтное, см. рис. 7.1) влияние на уровень тревожности
Он модулирует 1 АМК-ергическую передачу, проявляя свойства частнч-
150
ного агониста (агониста-аитагониста), т е. усиливает эффекты ГАМК в
малых (0,1—10 мкмоль/л) и угнетает в более высоких концентраци-
ях. Гарман аналогично действует и на OTi д-ергические процессы (см
рис. 9.5). Это весьма существенно, поскольку он модулирует функ-
цию тех двух физиологических систем, которые наиболее эффектив-
но регулируют уровень тревожности.
Способность /3-карболинов модулировать ОТ-ергическую передачу
позволяет рассматривать эндогенные регуляторы уровня тревожности
в совершенно ином аспекте: они не обязательно должны быть лиганда-
ми БДР и модуляторами Рд-ГАМК но могут быть также аллостери-
ческими регуляторами сродства Pj д-ОТ к серотонину
Глава 10
р-КАРБОЛИНЫ КАК АНТИДЕПРЕССАНТЫ
Депрессия (депрессивный синдром) — психическое расстройство,
основным признаком которого является подавленное, угнетенное или
тоскливое настроение, сочетающееся с расстройством мышления, изме-
нением двигательной активности и соматовегетативными нарушения
ми. Депрессивный синдром относится к группе аффективных синдро-
мов — состояний, характеризующихся различными болезненными из
менениями настроения. В свете современных взглядов депрессивный
аффект представляет собой одну из форм эмоционального реагирова-
ния человека. Он отличается от естественных эмоций значительно боль-
шей продолжительностью, интенсивностью н суицидальным риском
Как и любое другое эмоциональное состояние, депрессия складывает-
ся из двух компонентов: субъективного переживания отрицательного
аффекта н симптомов его выражения в поведении, мимике и жестах
[601]. Депрессии могут возникнуть при эндогенных психозах, в резуль-
тате соматических и церебрально-органических заболеваний, стрессо-
вых воздействий.
Проблема аффективной патологии, особенно депрессивных состоя
ний, имеет большое значение для клинической практики и теоретичес-
кой психиатрии. Это обусловлено прежде всего распространенностью
и значительным увеличением числа депрессий: из разнообразных де-
прессивных состояний одна лишь эндогенная депрессия (депрессивная
фаза маниакально-депрессивного психоза) встречается в 2—4 случаях
на 1000 человек [602], а по данным Всемирной организации здраво-
охранения (ВОЗ), депрессиями страдает около 5 % населения земного
шара. Среди пожилых и старых людей депрессивные состояния встре-
чаются значительно чаще, чем среди людей молодых и среднего возраста.
Некоторые авторы [603, 604] рассматривают депрессию как свое-
го рода болезнь цивилизации, подчеркивая важную роль в ее возникно-
вении стрессовых факторов В периоды катаклизмов — землетрясения,
наводнения и т п. — депрессии и депрессивные состояния могут приоб-
рести размеры эпидемий.
152
10.J. НЕЙРОХИМИЧЕСКИЕ МЕХАНИЗМЫ
ПАТОГЕНЕЗА ДЕПРЕССИЙ
Еще в начале 60-х годов XX в впервые было высказано предполо-
(жение о возможной роли кагехоламиновых и серотониновых систем
мозга в патогенезе депрессий [605]. Основой для понимания природы
аффективных состояний явилось установление способности резерпина
вызывать депрессию, сопровождающуюся истощением в мозге запасов
норадреналина (НА), серотонина (5-0 Г) и дофамина (ДА).
В результате многочисленных исследований накоплено много дан-
ных, позволивших предложить несколько гипотез, объясняющих па-
тогенез депрессий с нейрохимических позиций. Главными являются ка-
техоламиновая (норадреналиновая и дофаминовая), фенилэтиламино-
вая и индоламиновая гипотезы. Каждая из них выдедяет преимущест-
венно функциональную недостаточность при депрессивных состояниях
какой-либо одной нейромедиаторной системы, хотя не исключаются
сопутствующие изменения в других моноаминовых системах мозга.
Одну из первых наиболее убедительных гипотез предложил Шильд-
краут [606]. Согласно катехоламиновой гипотезе, при эндогенных
' депрессиях происходит существенное снижение активности адренерги-
ческих систем мозга, вызываемое тремя факторами: уменьшением со-
держания НА в отдельных структурах и областях мозга, изменением
соотношения активной (свободной) и неактивной (депонированной)
фракций НА или понижением возбудимости адренорецепторов. По мне-
нию Шйльдкраута, некоторые, если не все, депрессии возникают в связи
с абсолютным или относительным дефицитом катехоламинов.
К настоящему времени накоплено значительное количество экспо
риментальных и клинических нейрохимических исследований, свидо
тельствующих об изменениях в обмене катехоламинов при разных ви-
дах депрессии Так, обнаружено, что выделение с мочой З-метокси-4-
оксифенилэтилекгликоля (МОФЭГ) - основного продукта метаболиз-
ма в мозге НА — снижается при депрессии и повышается в гипоманиа-
кальном состоянии. При выздоровлении больных экскреция МОФЭГ
нормализуется Катехоламиновую гипотезу подтверждает антвдепрес-
сивное действие препаратов, усиливающих норадренергическую переда-
чу нервного возбуждения [607]. У депрессивных больных с понижен-
ным выделением МОФЭГ хороший терапевтический эффект оказывают
антидепрессанты трициклической природы, ингибирующие обратный
захват НА терминалями аксонов норадренергических нейронов. Повы-
шение активности адренергических систем является также одним из
механизмов действия антидепрессантов — ингибиторов моноаминокси-
даз Косвенными доказательствами значения норадренергичес эй не-
достаточности в патогенезе депрессий могут служить эффективность
витамина В6 (пиридоксина), участвующего в синтезе катехоламинов в
153
качестве кофактора дофадекарбоксилазы, а также данные об антиде-
прессивной эффективности у некоторых больных 0-адреномиметика -
салбугамола [608].
На возможную роль дофаминергической системы в развитии ма-
ниакальных состояний указывают случаи возникновения гипомании у
некоторых больных депрессией при приеме L-ДОФА в больших дозах
со значительным увеличением экскреции основного метаболита дофа-
мина - гомованилиновой кислоты (ГВК). Оборот дофамина у больных
депрессией с преобладанием заторможенности и апатии может быть за
медлен |609, 610] В спинно-мозговой жидкости этих больных отмече-
но уменьшение ГВК, и номифензин — препарат, оказывающий избира-
тельное активирующее действие на центральные дофаминергические
системы, оказывает выраженное терапевтическое действие. Отмечена
также клиническая эффективность других активаторов дофаминовой
системы — бромокриптина и S-аденилметионина.
В последние годы выдвинуто предположение [611] о существенной
роли в патогенезе депрессий дефицита в мозге фснилзтиламина, кото-
рый является биогенным амином с активирующим (фенаминоподоб-
ным) влиянием на поведение, способствующем возникновению субъек-
тивно переживаемых положительных эмоций. Однако функциональная
роль фснилзтиламина в центральной нервной системе и его значение
в патогенезе депрессий пока недостаточно ясны. Сабелли и соавторы
[611] считают его котрансмиттером норадреналина, нейромодулято-
ром, модифицирующим действие катехоламинов.
Гипотезы, связывающие патогенез депрессий с недостаточностью
центральных индолалкиламиновых, в первую очередь серотонинер-
гических, механизмов, возникли несколько позже катехоламиновой
гипотезы. Роль серотонина в патогенезе депрессий подтверждают дан-
ные [612, 613], указывающие на то, что у больных депрессией сильно
понижены содержание в спинно-мозговой жидкости и экскреция с мо-
чой основного метаболита серотонина — 5-оксииндолилуксусной кисло-
ты (5-ОИУК). Концентрация тирозина и триптофана в жидкости, взятой
из желудочков мозга больных депрессией, при меланхолии уменьшает-
ся, а при явлениях выраженной тревоги — повышается. Вместе с тем
попытки лечить депрессивных бол1 ных 5-окситриптофаном и триптофа-
ном — предшественниками серотонина— привели к противоречивым ре-
зультатам. В сообщениях о весьма положительном эффекте триптофана
как аптидепрессивного средства, не уступающем имипрамину,
амитриптилину или электросудорожной терапии, встречаются такие,
в которых говорится о незначительном его антвдепрессивном влиянии.
Однако в отличие от первоначального представления о дефиците
индолалкиламинов при депрессивных состояниях в настоящее время
существуют противоположные взгляды на повышенную функциональ-
ную активность серотонинергических структур с гиперчувствитсль-
154
ностью постсинаптических серотониновых рецепторов [614]. Экспери-
менты на животных показывают, что повышенное высвобождение се-
ротонина в центральных нейронах сопровождается угнетением поведен-
ческих реакций. Считается, что антисеротонииовое действие антидепрес-
сантов является одним из важнейших компонентов их тимоаналенти-
ческого эффекта. Оно в полной мере выражается при длительном при-
менении антидепрессантов [614] и обусловлено адаптационными из-
менениями чувствительности постсинаптических рецепторов.
Основываясь на данных о гиперактивности серотониновых рецеп-
торов у депрессивных больных, Костовски и Плазник [612] объяс-
няют терапевтический эффект антидепрессантов снижением чувстви-
тельности серотониновых рецепторов, которое достигается или их бло-
кадой, или развитием десенситизации к 5-ОТ, или повышением нор-
адренергической активности, нейтрализующей серотонинергическую ги
перактивность. Высказывается [614] предположение о том, что веду-
щим нейромедиаторным фактором в патогенезе депрессий служит ги-
перчувствительность не только постсинаптических серотонинергичес-
ких, ио и норадренергических рецепторов.
Психотропные вещества, вызывающие депрессию (резерпин, тетра
беназин), повышают функциональную активность адренорецепторов
лимбических структур мозга, связанных с аденилатциклазной систе-
мой, что сопровождается увеличением плотности /3-адренергических
рецепторов, т.е. числа участников связывания [614, 615]. Напротив, ан-
тидепрессанты — ингибиторы нейронального захвата НА — уменьшают
чувствительность системы цАМФ, стимулируемой ИА, причем плот-
ность ^-адренорецепторов уменьшается. Основанные на этих и других
результатах исследований предположения о патологическом измене-
нии рецепторной чувствительности при аффективных заболеваниях
представляют большой интерес, так как открывают новые подходы к
Пониманию молекулярных механизмов депрессии и действия антиде-
прессантов разных групп.
Таким образом, к настоящему времени наиболее разработана мо-
ноаминергическая теория патогенеза депрессий, причем большинство
исследователей полагают, что при разных депрессиях могут быть нару-
шены преимущественно либо адренергические, либо серотонинерги-
ческие механизмы, либо и те и другие вместе. Следует отметить что
нейромедиаторные системы мозга находятся в сложном динамичес-
ком взаимодействии Существуют достаточно четкие реципрокные от-
ношения между серотонинергической системой ядер шва и норадре-
нергическими нейронами синего пятна. Отмечается различная функцио-
нальная роль дорсальной и вентральной норадренергических систем
мозга, а также тесная связь холин-, дофамин- и ГАМК-ергичест :х ме-
ханизмов в лимбической и нигростриатной системах. Ни одно психо-
тропное средство, в том числе и антидепрессанты, не оказывает иэби-
155
рательного действия на определенное нейрохимиче кое звено, что
затрудняет понимание нейробиологических основ депрессивных
состояний.
10.2. ФАРМАКОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА
СОВРЕМЕННЫХ АНТИДЕПРЕССАНТОВ
Возможности терапии депрессий значительно расширились, когда
в 1957 г. почти одновременно было открыто антидепрессивное дей-
ствие двух препаратов — тофранила (имипрамина, мелипрамина) и ип
рониадиза. Имипрамин представляет собой гидрохлорид N-(3-диметил
аминопропил) иминодибензил, основу которого составляет трицикли-
ческое дибензоаз епиновое ядро, поэтому его и близкие к нему соеди-
нения называют трициклическими антидепрессантами.
Ипрониазид, или 1-изоникотиноил-2-изопропилгидраэин, обладает
характерной особенностью оказывать ингибирующее влияние на актив-
ность моноаминоксидазы — фермента, вызывающего дезаминирование
моноаминов. В результате ипрониазид и другие близкие к нему по дей-
ствию препараты называются антидепрессантами—ингибиторамимоно-
аминоксидазы (ИМАО).
Деление антидепрессантов на ИМАО и трициклические препараты
длительное время удовлетворяло запросам психофармакологии. Но в
последние годы получены антидепрессанты тетрациклического (инка-
зан, мапротилин, миансерин и др.) и бициклического строения (номи-
фензин, кароксазон и др.), а также препараты, в структуре которых нет
конденсированных циклических систем (табл. 10.1).
Способность трициклических антидепрессантов угнетать обратный
нейрональный захват нейромедиаторов дала основание антидепрессан-
ты этой группы назвать антидепрессантами-ингибиторами нейронально-
го захвата [616] и таким образом разделить антидепрессанты на две
группы по биохимическому признаку: ИМ АО.и ингибиторы нейрональ-
ного захвата. Такая классификация позволяет включить во вторую
группу не только соединения трициклической природы, но и препараты
другой химической структуры, е^ли они тормозят обратный захват
моноаминов.
Как блокаторы захвата антидепрессанты отличаются активностью
по влиянию на нейрональный захват НА, ДА и 5-ОТ. Хлоримипрамин
в равной степени блокирует захват всех трех моноаминов. Имипрамин
обладает сопоставимой активностью как ингибитор захвата НА и ОТ,
но не ДА. На захват НА преимущественно влияет дезипрамин, на нейро-
нальный захват ОТ амитриптилин, нортр» птилин и антидепрессанты
бициклической структуры (табл. 10.2).
Классификация антидепрессантов на ингибиторь МАО и ингибито-
156
Таблица 10.1 Антидепрессанты разной химической структуры
Соединение
Структурная
формула
Заместитель
Название
Тетрагидр 2
метипиэохи-
i нопины
Феноксиметип-
морфолины
Вилоксазин
Номифеизин
Адепрен
[Иминодибен
зиды
Фенотназины
R’ (CH,),N(Me),
R* :-(CHj)tNH Me
R‘:=CH-(CH3), N(Me),
R* =CH-(CH,)5 NH-Me
R1 .-(CH3),N(Me),
Ra -Cl
R1 -CH (CH3),-N(Mei
R’ Cl
Имипрамин
Дезметнлими-
ппамин
Амитриптилин
Нортриптилин
Кломипрамин
Хлорпротиксен
3,4-Диазафено-
ксазины
Пиперази-
но[2,3,17» кар-
базолы
Тетрагидропи-
разило] 1,2,3-
а в] р-карбо-
лины
Эганоантрацены
N
Меквитазин
R* :-(CH3)3-NH-Me
Мапротилин
Азафен
Пираэидол
Инкаэан
157
Таблица 10.2 Влияние антидепрессантов на нейрональный захват н импульсное
высвобождение 14С-иорадреналмна, ’Н-серотоннна н ЭН дофамина срезами мозга
крыс (619]
Вещество Концентрация, ингибирующая захват бноаминов на 50 %, мкмоль/и (ICS ttSxt) Концентрация, усиливающая высвобождение радиоактивной метки в два раза, мкмоль/л (ЕСа±$хг)
14 С НА ’НОТ | ’Н-ДА 14 С-НА ’Н ОТ ’Н-ДА
Имипрам>ш 0,2 *0,03 0,44*0 08 5,7 *1,3 0,26*0,11 4,9 *0,5 3,7 ±0,3
Дезипрамин Хлоримипра 0,21*0,01 2,9 *0,8 4,0 *0,8 0.48*0,16 3,0 *0,5 5,6 *0,4
МИН 0,47*0,03 0,32*0,03 0,37*0,03 0,61*0,01 0,56*0,04 3 1 *0,5
Амитриптилин 0,56*0,06 4,5 *0,9 2,4 *0,4 0,24*0,05 0,22*0,07 4,2 ±0,5
Нортриптилин 0,11*0,02 3,7 ±1,0 2,6 ±0,5 0,52*0,08 2,8 *0,3 5,4 ±0,6
Иприндол 40 *9 270 ±50 57 *13 0,59*0,22 3,2 *0,4 3,6 *0,8
Новерил 7,3 *0,6 51 ±7 26 ±7 0,57*0,3 5,2 *0,5 5,2 *0,5
Пиразидол 6,7 *1,6 7,9 ±1,1 4,3 ±0,5 4 5 ±1,6 34 *12 3,4 ±0,6
Lu 5-003 5,5 *2,2 0,44*0,08 2,9 ±0,4 5,1 *0,6 0,52*0,05 0,34*0,05
Lu 3-010 4,3 *2,3 0,47*0,05 6,1 ±0,7 3 4 *1,5 0,56*0,04 0,44*0,04
Тиролиберин 31 *22 45 ±12 56 *24 0,38*0,13 0,16*0,02 0,32*0,08
ПР 546* 78 *24 82 *22 80 ±16 0,26*0,04 0,12*0,02 0,28*0,06
Мепаностатин 46 *18 56 ±14 79 *11 0,32*0,02 0,35*0,11 0,20*0,05
* Аналог тиролиберина.
ры нейронального захвата базируется на нейрохимическом механизме
действия антидепрессантов, но она имеет недостатки. Как оказалось,
многие новые антидепрессанты (иприндол, миансерин, мапротилин, ви-
локсазин, тразодон и др.) не влияют на активность МАО и на процесс
нейронального захвата моноаминов [617—619], сохраняя высокую
клиническую эффективность В отличие от типичных трициклических
антидепрессантов и ингибиторов МАО, эти новые антидепрессанты на-
зываются атипичными. Малоактивные в качестве блокаторов нейро-
нального захвата моноаминов атипичные антидепрессанты усиливают
импульсное высвобождение меченых нейромедиаторов (,4С-НА,
3Н-ОТ и 3Н-ДА) срезами мозга в концентрациях, в десятки раз более
низких, чем концентрации, при которых эти вещества влияют на про-
цесс обратного захвата биоаминов (см. табл. 10.2).
Однако следует отметить, что степени влияния антидепрессантов
разной химической структуры на захват разных аминов и импульсное
высвобождение НА, ДА и ОТ существенно отличаются Прежде всего
отсутствует корреляция между влиянием антидепрессантов на захват
и импульсное высвобождение любого моноамина, коэффициенты кор-
реляции рангов для НА, ДА и ОТ составляют соответственно +0,05;
—0,2 и +0,17 (Р > 0,5) т.е. два компонента пресинаптического действия
антидепрессантов хотя и приводят к одинаковому конечному резуль
тату — повышению активной концентрации моноаминов в синапсе, од
нако лежащие в их основе механизмы различны [619].
158
Таким образом, пресицаптический механизм активирующего II.HC
действия не ингибирующих МАО антидепресс ант< в имеет двойственную
природу. Он может включать и торможение нейронального захвата мо-
ноаминов и (или) усиление импульсного их высвобождения. Хотя всем
ингибирующим МАО антидепрессантам присущи оба компонента преси-
наптического действия, степень выраженности их для разных антиде-
прессантов неодинаковая. В экспериментах на изолированных срезах
коры или полосатого тела мозга крыс установлено, что антидепрессан-
ты, для которых соотношение концентрации, ингибируюшей на 50 %
обратный захват биомина (/С50), к концентрации, усиливающей им-
пульсное высвобождение радиоактивной метки вдвое (ЕС2), близко
к единице (имипрамин, пираэидол, хлоримипрамлн, биииклическне
антидепрессанты Lu-ООЗ и Lu3-010), действительно обладают способ-
ностью повышать высвобождение НА, ДА и ОТ, поскольку прирост ра-
диоактивности в среде при электрическом раздражении среза мозга .мо-
жет быть как следствием усиления высвобождения нейромедиаторов,
так и результатом подавления обратного захвата высвободившихся
моноаминов. Для дезипрамина, нортриптилина и некоторых других
тимоаналептиков соотношение /С5О/ЕС2 меньше единицы, что свиде-
тельствует об их способности влиять преимущественно на процесс
нейронального захвата биоминов. Атипичные антидепрессанты (пове-
рил, иприндол), антидепрессанты-пептиды (тиролиберин, меланоста-
тин) оказывают аминопотенцирующее действие, заключающееся
в способности усиливать импульсное высвобождение аксонами мо-
ноаминергическИх нейронов, так как соотношение IC^/EC^ для этих
препаратов намного больше единицы.
С учетом особенностей механизма действия целесообразно выде-
лить среди антидепрессантов не только ингибиторы МАО и ингибиторы
обратного нейронального захвата (классические трициклические ан-
тидепрессанты), но и группу антидепрессантов, усиливающих импульс-
ное высвобождение моноаминов. К их числу можно отнести помимо
атипичных (инприндола, поверила и др.) антидепрессанты пептидного
происхождения (тиролиберин, меланостатин).
Экспериментальные и клинические исследования показывают, что
антидепрессанты обычно быстро проникают в кровь из желудочно-ки-
шечного тракта и относительно быстро выводятся из нее, поступая в
органы и ткани. Концентрация препарата в тканях мозга зависит от
дозы лекарственного вещества, концентрации в крови, времени про-
хождения препарата через гемато-энцефалический барьер и т.д. В кро-
ви и тканях мозга обнаруживаются неизмененные соединения и про-
дукты их метаболизма. Поскольку некоторые метаболиты обладают
фармакологической активностью [617], лечебный эффект следует рас-
сматривать как результат суммарного действия антидепрессанта и его
активных метаболитов. Необходимо учитывать, что антидепрессанты
159
Рис. 10.1. Соотношение психоэнергеэируюшего (/), тимоаналептического (2) и
транквилизирующего (3) действия в ряду антидепрессантов {602):
а — номифенэин, вилоксазин; б - дезипрамин, ннказан; в имнпрамнн, пиразн
дол; г - малротилин, миаясерин- д — амитриптилин, кломипрамин, е - тразо-
дон, омипрамол
и их метаболиты быстро и в большом.количестве связываются с белка
ми плазмы крови (преимущественно с кислотными гликопротеидами
и липопротеидами) Фармакологически активной является только сво-
бодная (несвязанная) фракция, содержание которой для трицикличес
ких антидепрессантов у разных больных составляет 6,4—23 % общего
содержания в плазме крови.
Основное свойство всех антидепрессантов - их тимоаналептическое
действие, т е способность улучшать подавленное настроение. Как и дру
гие психотропные средства, они оказывают многогранное влияние на
организм, действуя на различные функции мозга, периферические ор-
ганы и системы. Кроме того, многие антидепрессанты оказывают ан
ксиолитический и умеренный седативный эффекты (рис. 10,1). Для
некоторых препаратов характерно сочетание тимоаналептического и
психоэнергеэирующего эффектов.
Отличаются и фармакологические свойства данных препаратов
Большинство антидепрессантов трициклической природы обладают
антирезерпиновой активностью. Они уменьшают депрессивные реак
ции резерпина (гиполокомоцию, гипотермию, птоз, явления синхрони-
зации на ЭЭГ, кататонию). Имипраминоподобные препараты противо-
действуют депрессивным эффектам клонвдина, устраняя гиполоко-
моцию, снижение ориентировочной активности, гипотермию и т.д. Они
уменьшают обусловленную клонидином агрессивность у мышей и
крыс. Имипрамин и его аналоги понижают гипотермию, вызываемую
большими (свыше 5 мг/кг) дозами апоморфнна, но потенцируют дру
гие его эффекты (стереотипию, гиперлокомоцию агрессивность) Три-
циклические антидепрессанты усиливают стимулирующие свойства фе-
намина, токсичность и эффекты L-ДОФА. Неингибирующие МАО анти
депрессанты неоднозначно Влияют иа эффекты серотонинергических
160
веществ. Наряду с усилением центральных эффектов 5-окситрингафаиа
[они вызывают и антисерогониновое действие. Все трициклические ан-
[ тидепрессанты, и в большей степени амитриптилин, обладают цент-
ральной и периферической холинолитической активностью. У деамеги-
Кимипрамина и ноксиптилина холинолитические свойства выражены
меньше.
Дезметилимипрамин в отличие от других антидепрессантов трицик-
, лической структуры вызывает активацию двигательной способности у
Гмышей, т.е. обладает стимулирующим действием. У пминотрнптилина
наиболее выражен транквилизирующий компонент, который прояв-
ляется в повышении действия снотворных веществ, подавлении ориен-
тировочного поведения, уменьшении двигательной активности. Ами-
। триптилин характеризуется также выраженным антнсеротониновым,
противогистаминным и холинолитическим действием.
При выборе антидепрессанта для лечения больных, страдающих той
или иной формой депрессии, особенно при наличии сопутствующих за-
Гболеваний, необходимо учитывать не только специфическое психотроп-
ное действие препарата, но и другие его свойства, в том числе те, кото-
рые могут привести к нежелательным последствиям. Необходимо тд .
нимать во внимание и вытекающие из свойств препарата (фармаколо-
гических и токсикологических) противопоказания к его применение,
а также осложнения, которые могут возникнуть при сочетании анти-
депрессанта с другими лекарствами.
10.3 МЕТОДЫ ПЕРВИЧНОГО ФАРМАКОЛОГИЧЕСКОГО
ИЗУЧЕНИЯ АНТИДЕПРЕССАНТОВ
Основная практическая задача экспериментальной психофармако-
логии заключается в изыскании новых, более мощных и избирательно
действующих психотропных средств. Незнание глубоких, в первую
очередь биохимических, механизмов патогенеза психических расст-
ройств, биохимии и патофизиологии психозов и невозможность моде-
лирования на животных психических заболеваний человека затруднили
выполнение этой задачи. В психофармакологии сконцентрировались
противоречия, присущие фармакологии вообще: необходимость изыс-
кания действенных лекарств при недостаточном и неполном знании
физиологии регулируемых функций.
Естественно, что поиск новых психотропных лекарств проводил-
ся вначале в основном эмпирическим путем, по принципу ’’двойной ана-
логии”: сходства химическом структуры с прототипами и сходства их
эффектов в эксперименте на животных. Особое значение при брело
изыскание для каждого класса психоактивных средств специфичных
Тестов иа мелких лабораторных животных, результаты которых хоро-
bio коррелировали бы с клинической эффективностью лекарств, те
разработка информативных тестов. Эго привело к определенным успе
хам в разработке простых, экономичных и производительных инфор
мативных тестов, используемых при отборе соединений, предлагаемых
для клинического изучения в качестве антидепрессивных препаратов
(617]. Учитывая сложность патогенеза депрессий, их гетерогенность
и полиморфизм, трудно рассчитывать на то, что эксперименты на жи-
вотных могут быть достаточны для точного предсказания наличия н
характера антндепрессивной активности отобранных соединений
в клинике. Окончательно оценить эффективность антидепрессан-
тов можно только после соответствующего клинического иссле-
дования.
В настоящее время нет моделей, адекватно воспроизводящих в
эксперименте па животных депрессивные состояния у человека. Отдель-
ные тесты лишь частично отражают эмоциональные, двигательные или
другие нарушения, которые могут расцениваться как элементы де-
прессивпоподобных состояний Поэтому для выявления потенциальной
антндепрессивной активности у новых химических соединений исполь-
зуются тесты, базирующиеся на различных фармакологических, физио-
логических и биохимических показателях. Открытие аптидепрессив
ных свойств является результатом сопоставления совокупности дан-
ных, полученных разными методами.
К свойствам, которые тесно коррелируют с клинической эффек-
тивностью антидепрессантов, относятся присущая им адрено-, дофами
но-и серотониносеисибилиэирующая активность. В фармакологическом
эксперименте перечисленные виды активности легко выявляются по
способности изучаемых соединений противодействовать эффектам
резерпина, резерпиноподобных веществ (тетрабеназипа, Ro 41284),
а также потенцировать центральные эффекты фенамина, Ь-3,4-диокси
фениламина (L-ДОФЛ) и 5-окситриптофана (5-ОТФ).
Поскольку для фармакологических опытов с применением тестов
взаимодействия служат вещества, влияющие на определенные звенья
нейрохимических процессов мозга, по результатам таких эксперимен-
тов можно судить не только о потенциальной антидепрессивной актив-
ности, но и об элементах механизма действия соединений.
Высокой информативностью, позволяющей прогнозировать анти-
депрессивную активность препаратов, обладают биохимические мето-
ды, выявляющие влияние потенциальных антидепрессантов па актив
пость моноамнноксидазы, на нейрональный захват моноаминов и на
импульсное высвобождение биоа.минов при электростимуляции сре-
зов мозга.
Влияние потенциальных антидепрессантов на эффекты резерпина
и тетрабеназипа В опытах на животных установлено, что резерпин ока-
зывает депрессивное действие на центральную нервную систему заклю-
чающееся в уменьшении спонтанной двигательной активности, катаю
162
нии, гипотермии, блефаронтозе и т.д. Нейрохимической основой дей-
ствия резерпина является способность понижать содержание в централь-
ной нервной системе ссротонинп, норадреналина и дофамина. Аптиде-
прессанты подавляют или полностью снимают денремирующие эффек-
ты резерпина В результате стали использовать антатонизм с резерпи-
ном, а также с тетрабепазином, Ro 4-1284 и другими веществами. Су-
шествуют разные варианты постановок опытов с резерпином и резер-
I пиноподобными веществами, чаще всего на белых мышах или крысах.
Десять мышей рассаживают по одной под стеклянные воронки и выдержи-
вают в условиях свободного поведения на площади 450 см2 около 30 40 мин,
после чего дважды намеряют (с интервалом 15 мин) исходную температуру тела
с помощью электротермометра, электро термический датчик которого иогру-
1 жается в прямую кишку на 16 17 мм. Затем животным контрольной группы
I подкожно вводят дистиллированную воду, а опытной труппе - исследуемый нре-
I парат. Через 30 мин после первой инъекции внутрибрюшинно вводят резерпин
I (рауссдил) в дозе 1 мг/кг массы тела животного. Изменения температуры теле
I регистрируют через 2; 4; 6, 12 к 24 ч после введения резерпина а степень изме-
I нений оценивают разностным методом Среднюю величину изменения температу-
ры (ДГ) находят как среднюю арифметическую для каждого временного ин-
тервала.
Одновременно оценивают степень блефароспазма в баллах: G -
I глазная щель открыта полностью (> 2 мм), 1 — глазная щель прищ; -
рена (< 2 > 1 мм), 2 - глазная щель сильно прищурена (< 1 мм), 3 -
веки плотно сомкнуты (0 мм). Ширину глазной щели замеряют до вве-
дения и через 2; 4; 6; 12 и 24 ч после введения животным резерпина.
Степень блефароспазма оценивают по сумме баллов у всех мышей груи-
Г пы в каждый избранный интервал времени. Максимальный блефаро-
I спазм таким образом оценивается для 10 мышей в 30 баллов
Предложено также для оценки действия антидепрессантов исполь-
зовать резерпиновую модель депрессии поведения у котов. Резерпин
[ (0,1 мг/кг) вводят подкожно; определяют психофизиологические
(эмоциональные, мотивационные), соматомоторные и вегетативные
реакции. Через 18 24 ч наблюдают негативное эмоциональное состоя-
ние, уменьшение спонтанной двигательной активности, каталепсию и
вегетативные сдвиги. Однократное или повторное введение потенциаль-
ного антидепрессанта уменьшает или предотвращает развитие депрес-
сивных явлений.
Оценка фенамин-потенцируюгцего действия соединений. Эффекты
фенамина обусловлены высвобождением в синаптическую щель дофа-
мина и норадреналина, причем высвобождение дофамина в мезолимби-
I ческой области сопровождается увеличением двшательной активности,
а при вовлечении нигростриатпой области появляется стереотипия Ан-
тидепрессанты усиливают центральные эффекты фенамина. Для оценки
фенамин-потенцирующего действия изучают влияние веществ на 1ипер-
термический эффект и групповую токсичность фенамина у мышей и на
фенаминовую стереотипию у крыс.
4 163
Влияние на фенамнневую гипертермию исследуют на мышах, сгруппировал
дых по пять животных, находящихся в стеклянной емкости с площадью дн
700 см2. Животных выдерживают 30 мни, после чего измеряют элекгротермоме i
ром температуру тела в прямой кишке и внутрибрюшинно вводят дистиллиро
ванную воду в объеме 0,1 мп па 10 г массы тела (контрольная группа животных
или изучаемый препарат. Через 30 мин подкожно вводится фенамин в дозе
10 мг/кг (0,1 %-й раствор! и в интервалы 0.5 — 1 — 1,5— 2 ч измеряют температуру
тела. Разность температур) (,ф“,исх) суммируют для всей группы мышей, рас-
считывают АТ и доверительный интервал средней величины в каждый интервал
времени.
Метод групповой токсичности базируется на том, что токсичность фенамина
для мышей, ыруппированных в достаточно ограниченном пространстве, возрас-
тает 1ю сравнению с токсичностью для животных, которые нс контактируют с
особями того же вида. Животных группируют по 15 особей в стеклянных банка
на площади 70 см2. Исследуемые вещества вводят подкожно за 30 мин до внут-
рибрюшинного введения фенамина, и результаты опыта (количество погибши
мышей) учитывают через 24 ч.
Влияние потенциальных антидепрессантов на продолжительность фенамине
вой стереотипии изучают по методу, предложенному Н.Л.ЩелкуиовЫм [620]
Группе нз 10 крыс внутрибрюшинно вводят фенамин в дозе 7,5 мг/кг массы тс
па. Контрольные опыты проводят дважды: за 7 дней до и через 7 дней после ос-
новного эксперимента. В основном опыте исследуемые соединения вводят вну-
трибрюшинно за 30 мин до фенамина. Сравнивают для каждой крысы продолжи
тельность стереотипии в опыте с продолжительностью эффекта в контроле, вычис-
ляемой как средняя арифметическая нз двух определений. Данные обрабатываю
разностным методом и выражают в процентах к контролю.
Влияние соединений на эффекты L-ДОФА. L-3,4-Диоксифенила
нин предшественник катехоламинов — легко проникает через гема-
тоэнцефалический барьер. При введении L-ДОФА повышается главным
образом содержание дофамина в мозге, что обусловливает увеличение
двигательной активности, стереотипию и другие эффекты.
ДОФА тест предложен Эвереттом [621] в качестве скрининг-метода для
оценки действия антидепрессантов, которые потенцируют эффекты L-ДОФА. Мы
<ией, сгруппированных по 6 10 особей в стеклянных емкостях, выдерживают
30-40 мни и у каждого животного измеряют двигательную активность. Спонтан
ную двигательную активность оценивают с помощью актомегра либо по числу
пересечений лучей креста за 2 мин в условиях свободного перемещения животных
на нлошади 450 см2 Отсчет числа пересечений начинают через 2 мин после поме
щения мыши на круг с крестом либо в актометр. После определения исходного
уровня двигательной активности жипо'ным вводят исследуемое вещество или
(в контроле) воду 0,1 мл на 10 г массы тела, а через 30 мин - внутрибрюшинно
2,5 %-й раствор ДОФА и спустя 30; 60 и 90 мин вновь измеряют двигательную
активность, а также, подсчитывают в течение 1 мин количество дерущихся пар в
общности нз 6-10 животных. Изменения двигательной активности выражают в
процентах к контролю, число дерущихся пар - дробью контроль/опыт.
Оценка влияния исследуемых соединений на аффекты 5-окситрип
тофана (5-ОТФ). Влияние на действие 5 ОТФ и в первую очередь на фе-
номен встряхивания головы, - наиболее распространенный метод оцеп
ки воздействия на центральные серотониновые структуры.
164
Мышей рассаживают поодиночке под воронки, где выдерживают до опыта
15-20 мин. Сначала вводят воду (в контрольной rpj те) иди исследуемое ве-
щество подкожно и тотчас внутрибрюшинно - 2 % й раствор 5-ОТФ в розе
200 мг/кг массы тела животного. Через каждые 7 мин на протяжении 1 ч, т.е. во-
семь раз, подсчитывают в течение J мин число обтряхиваний головы у каждой мы-
ши Среднюю величину вычисляют как среднюю арифметическую из 8-10 опы-
тов. Доверительный интервал находят при Р ~ 0,05.
Одновременно с феноменом встряхивания головы регистрируют наличие и
степень тремора головы и туловища, который оценивают г баллах: 0 - тремора
нет, 1 - тремор слабый, 2 - тремор выраженный и 3 - енлткгый.
Антидепрессанты могут влиять не только на центральные, но л нт
периферические эффекты норадреналина, серотонина и других нейро-
медиаторных веществ. Одним из показателей действия антидепрессан-
тов служит их влияние на вызываемые нейромедиаторными вещества-
ми изменения артериального давления.
Оценка влияния потенциальных антидепрессантов на эффекты ка
техоламннов Опыты выполняются на интактных и наркотизированных
уретаном (1 мг/кг) и хлоралозой (0,05 мг/кг) крысах массой 180-
220 г, а также на наркотизированных кошках. Регистрируют уровень
артериального давления в сонной артерии. Изучают влияние соединений
на прессорные эффекты норадреналина и адреналина, вводимых в бед-
ренную вену в дозах 1-2,5 мкг/кг массы тела. Степень изменения прес-
сорных эффектов катехоламинов оценивают по изменению величины
и продолжительности этих эффектов через 15; 30 и 60 мин после вве-
дения исследуемого соединения. Вещества, обладающие свойствами по-
тенциального антидепрессанта, усиливают прессорные эффекты адрена-
лина и норадреналина, а также действие моноаминов на сокращение
мигательной перепонки у кошек.
Оценка антимоноаминоксидазной активности исследуемых соеди-
нений. Активность МАО находят колориметрическим методом в 10 %-м
гомогенате мозга крыс, приготовленном на 0,2 М фосфатном буфере,
содержащем 1,25 % исконного детергента 011-10 или тритон Х-100. Для
определения активности МАО типа А субстратом служит серотонин-
креатининсульфат, а для определения активности МАО типа Б в качест-
ве субстрата применяют и-нитрофенилэтиламин или бензиламин. При
катализируемом МАО окислительном дезаминировании и-питрофснил-
зтиламина образуется окрашенный продукт взаимодействия и-питро-
фенилуксусного альдегида с избытком субстрата, который в силыющс-
лочной среде экстрагируют н-бутанолом. Коломегрированию подвер-
гают прозрачную бутаноловую фазу. Исследуемый препарат вносится
в пробы в конечных концентрациях 10“ 7 и 10“3 монь/л. После инкуба-
ции определяют остаточную активность МАО. Зависимость между кон-
центрацией исследуемого вещества и активностью МАО оценивают гра-
фически и методом интерполяции находят р/50.
Оценка влияния исследуемых соединений на нейрональный захват
165
биоаминов Для изучения нейронального захвата и оценки влияния по-
тенциальных антидепрессантов на этот процесс наиболее часто исполь-
зуются радиоактивные изотопы. Удобной моделью для изучения фарма-
кологического воздействия на процесс нейронального захвата являются
синаптосомы целого мозга или его отделов. Описан состав инкубацион-
ной среды, в которой исследуют захват синаптосомамн радиолигандов
[622]. Выделение синаптосом из инкубационной среды и регистрацию
активности осуществляют по методу [623], Радиоактивность измеряют
методом жидкостного сцинтилляционного счета
Влияние на нейрональный захват моноаминов можно изучать также
на срезах мозга [624]. Тонкие срезы (200-250 мкм) коры больших
полушарий или полосатого тела мозга, приготовленные методом Мак
Ильвейна [625], инкубируют в среде инкубации при 37 °C и аэрации
кислородом с разными концентрациями тестируемого вещества После
15 мин предварительной инкубации в раствор (2 мл), содержащий сре-
зы и исследуемое вещество, добавляют радиоактивный изотоп (^-но-
радреналин, 3Н-серотонин или 3Н-дофамин в случае срезов полосатого
тела) в концентрации 10" 7 моль/л. Инкубация с меченым нейромедиа-
тором длится 10 мин, после чего срезы быстро отмывают охлажденной
средой инкубации, высушивают,взвешивают и солюбилизируют в при-
сутствии 5 %-го раствора тритона Х-100. Ингибирование (/, %) захвата
аминов тканью среза мозга определяют по формуле
юр,
1тк
где Im0 — количество импульсов в контроле и в опыте соответ-
ственно, мг"1-с“* . Активность исследуемого вещества выражают через
1С№.
Оценка влияния изучаемых соединений на импульсное высвобожде-
ние меченых нейромедиаторов в срезах мозга крыс. Опыты выполни
ются на срезах мозга крыс, преинкубированных 30 мин с 3Н-НА,
3Н-ОТ или 3Н-ДА в концентрации 1-Ю-7 моль/л в присутствии инги-
битора МАО ниаламида (1,25-10"s моль/л). После инкубации срезы
отмывают средой инкубации (без меченых нейромедиаторов) и перено-
сят на полиэтиленовые сетки перфузионных камер объемом 0,5 мл, по-
мещая между двумя платиновыми электродами. Срезы перфузируют
раствором следующего состава (ммоль/л): NaCl - 122; К.С1 - 3,1;
СаС12 —1,3; MgSO4 — 1,2; КН2РО4 — 0,4; NaHCO3 — 25; глюкоза —
10; аскорбиновая кислота - 1,14; ниаламид - 0,01 (pH среды 7,4);
скорость перфузии — Q.5 мл/мин. Пятиминутные порции перфузата
собирают через 30 мин от начала перфузии, т.е. с момента установле-
ния плато спонтанного выхода радиоактивной метки. Через 45 и 60 мин
срезы раздражают прямоугольными стимулами (5 Гц, 2 мс, 12 МА,
срезы хвостового ядра 24 мА) в течение 2 мин (С, и Сг). Исследуемое
вещество вносят в перфузионную среду за 13 мин до С2, время перфу-
166
зии веществом 15 мин После заливки проб перфузата сцинтилляцион-
ной жидкостью (10 мл), содержащей 3 мл этаио ia, 7 мл толуола, 0,4 %
2,5-дифенилоксазола (ГШО) и 0,01 % 1,4-ди [2-(5-фенил)оксазолил] бен-
зола (ПОПОП), измеряют радиоактивность с помощью сцинтилляцион-
ного счетчика. Выход радиоактивной метки при электростимуляции
выражают как коэффициент высвобождения (/):
f = ——| мин"1 ],
TAf
где А — активность порции перфузата; t — время сбора порции перфу-
зата; At — остаточная активность, определяемая суммированием оста-
точной активности среза и всех последующих порций перфузата. Изучая
влияние нескольких концентраций вещества, находят графически кон-
центрацию, при которой вызванное электростимуляцией среза высво-
бождение метки удваивается (ЕС2) по сравнению с высвобождением
радиоактивной метки только при раздражении током.
10.4. (3-КАРБОЛИ11Ы
КАК ПОТЕНЦИАЛЬНЫЕ АНТИДЕПРЕССАНТЫ
Несмотря на то что к Настоящему времени созданы новые анти-
депрессантные препараты, проблема фармакотерапии депрессий не раз-
решена. Имеющиеся препараты недостаточно совершенны: они эффек-
тивны не у всех больных, их лечебный эффект недостаточно стоек, они
могут вызывать побочные явления. Все указывает на необходимость
дальнейшего поиска новых антидепрессантов для амбулаторного ле-
чения больных депрессиями, а также средств для оказания помощи при
быстрых формах депрессий. Нужно создавать антидепрессанты длитель-
ного действия.
В последнее время интенсивно изучаются производные (3-карбо-
лина в качестве психотропных средств, так как важнейшие эффекты
/3-карболинов (гарманов) обусловлены их влиянием па моноа.минерги-
ческие системы мозга. Кроме того, гарманы синтезируются тканью моз-
га^ их обнаруживают в мозгу, надпочечниках, тромбоцитах животных,
а также в мозгу, клетках и плазме крови, моче человека.
Известно, что алкалоиды, ряда /3-карболинов являются продуктами
конденсации индолалкиламинов и биогенных альдегидов (ацетальдеги-
да, формальдегида) [626, 627]. Возможность получения алкалоидов
ряда (3-карболинов путем конъюгации ацетальдегида с индолалкилами-
нами подтверждена в работе [628], в которой показано, что при инку-
бации серотонина и ацетальдегида с гомогенатом головного мозга об-
разуется насыщенный продукт, идентифицированный как 1-метил-б-ок-
ситетрагидро-/3-карболин.
167
Следует отметить, что в организме человека и животных 0-карболи-
ны образуются путем конденсации триптофана, серотонина, 5-метокси-
триптамина и N-метищ-риптамина с донором метильных групп при фер-
ментативном метилировании 5-мегилтетрагидрофолатом. Реакция мо
ж-:т протекать в гомогенатах мозга человека (629] и крыс [630], а так-
же в других тканях животных, включая клетки крови человека [631]
Исследованиями in vitro установлено, что в присутствии НАДФ+ и
№ ,№°-метилентетрагидрофолатредуктазы метилтетрафолат превра-
щается в 5,10-метилентетрагидрофолат и формальдегид, которые кон-
денсируются с триптаминами неферментагивным путем, давая 0-кар-
болпни.
Благодаря развитию точных методов определения биосинтез этих
алкалоидов обнаружен в 12 семействах выснтих растений и в организме
животных и человека. Методами жидкостной хроматографии, масс-
спектрометрии и флуориметрии в плазме крови и тромбоцитах челове-
ка обнаружен 1-метил-Д-карболин (гарман) [591]. /З-Карболины (в на-
нограммовых количествах) были найдены в мозгу и надпочечниках
крыс и моче человека. Определено содержание тетрагидроноргармана
в моче человека и крыс и в ткани среднего мозга крыс [632,633]. Ве-
щество экстрагировали этиловым эфиром с последующим выделением
методом тонкослойной хроматографии. Спектрофотометрически уста-
нови .но количество тетрагидроноргармана в среднем мозге крыс, рав-
ное 47,3 нт/г ткани, и увеличение /3-карболина до 110 и 930 иг/r ткани
мозга соответственно после внутрибрюшинного введения 150 мг/кг
L-триптофана и L-триптамина. Концентрация тетрагидроиоргармана в
моче человека составляет 190—350 нг/мл.
Применив технику ультрафиолетовой лазерной флуориметрии
Шоемакер и сотрудники [553, 634] обнаружили /3-карболины в нерв
ных клетках N arcuatus мозга крыс. При облучении срезов n arcuatus
/3-карболины флуоресцируют (желто-зеленый цвет) при длине волн
445; 470 и 520 нм. Введение крысам ацетальдегида увеличивает интен
сивность флуоресценции в N.arcuatus на 40 %. Последующая экстракция
и использование тонкослойной хроматографии позволили идентифици
ровать соединения как 1,2,3,4-ТГБК и 1 метил-/3-карболин (гарман)
содержание которого в N arcuatus 1,3 лмоль/л ткани. Данные о выделе-
нии /З-карболинов из тканей и жидкостей организма млекопитающих
и человека представлены в табл 10 3
На основании экспериментальных результатов, свидетельствующих
о наличии гарманов в головном мозгу млекопитающих и моче челове
ка, а также нейро- и психотропной активности гармана и его лроизвод
ных сделана попытка определить влияние приведенной группы эндоген
пых веществ на метаболизм нейромедиаторов мозш. Этому также спо
собствовали работы [635, 636], в которых показано увеличение содер-
жания серотонина в головном мозгу крыс после длительного влияние
168
Таблица 10.3. Выделение 0-карболннов нэ тканей н экскретов организма челове-
ка н животных
Вещество Ткань или экскрет Литература
1 -Метил-0-карболин Моча человека, клетки крови человека; n.arcuatus мозга крыс [6,591,627]
Тетрагидро-0-карбо- лин СП'БК) Моча человека, плазма н клетки крови человека; мозг крыс [6, 627, 665)
1-Ме-ТГБК Моча человека, плазма и клетки крови человека; моча, мозг крысы [632,633. 665)
6 ОН-ТГБК Моча человека (после введения 5-О7Ф, триптофана, триптамина) ; клетки кро- ви крыс, мозг крыс [633,666)
6-МеО-ТГБК N.arcuatus мозга, мозг и надпочечник крыс [553,591,666]
гармана Отмечена способность ароматических и ненасыщенных (З-кар-
болинов, в частности гармана и гармалина, повышать уровень серотони-
на в мозгу мышей и крыс. Первые данные об избирательном нейрохи-
мическом действии тетрагидро-(3-карболинов получены Мак Айзиком и
его сотрудниками [638}, установившими, что при внутрибрюшинном
введении 6-МеО-ТГБК увеличивает содержание серотонина, не изменяя
уровня норадреналина и дофамина, и одновременно снижает концентра-
цию 5-оксииндолуксусной кислоты, основного метаболита серотонина
в головном мозгу мышей. Согласно [636], тетрагидроноргарман в за-
висимости от дозы (1—50 мг/кг, внутрибрюшинно) повышал в голов-
ном мозге крыс содержание серотонина и уменьшал концентрацию
5-ОИУК, не действуя на уровень норадреналина и дофамина. Эти изме-
нения сохранялись в течение 16 ч после введения препарата.
Результаты влияния (З-карболинов на обмен в центральной нерв-
ной системе норадреналина и дофамина разноречивы. Так, концентра-
ция обоих аминов, и в первую очередь дофамина и его метаболита —
гомованилиновой кислоты, в ткани стриатума кошек после повтор-
ных введений гармалина снижается [639]. С другой стороны, наблюда-
лось повышение уровня норадреналина и дофамина в ткани мозга под
влиянием ароматических (З-карболинов [640, 641]. Такой характер
обмена биоаминов в ЦНС после введения (З-карболинов объясняется
[642, 643] их способностью угнетать моноаминоксидазу. Существуют
два основных типа моноаминоксидаз (ЕС 1.4.3.4, МАО), классифици-
руемых условно по чувствительности и ингибирующему эффекту аце-
тиленового амина — хлоргилина. Те МАО, активность которых угне-
тается низкими (0,1 мкмоль/л) концентрациями хлоргилина, принято
называть МАО типа А Наиболее специфическим субстратом МАО ти-
па А, особенно в тканях человека, считается серотонин, в меньшей ме-
ре — норадреналин. К числу МАО типа Б относят те МАО, аки ность
которых ие ингибируется низкими концентрациями хлоргилина, напри-
мер бензиламин, а из числа биоаминов — (3-фенилэтиламин и телеметил-
гистамии
169
В начале 60-х годов С.Юденфриенд и сотрудники (644], используя
серотонин как субстрат, показали, что гармалин и родственные вещест-
ва ингибируют МАО митохондриальной фракции печени, что подтверж-
дено другими исследованиями. Так, гармин обратимо и конкурентно
тормозит в митохондриях печени крыс дезаминирование серотонина
(в концентрации 0,05 мкмоль/л) и тирамина (24 мкмоль/л). Несколь-
ко меньшей активностью как ингибиторы МАО обладают производные
тетрагидро-(3-карболииа (645]. 6-МеО-ТГБК в микромолярных кон
центрациях (3,7 мкмоль/л) угнетает окислительное дезаминирование
серотонина в мозгу крыс и мышей и лишь в миллимолярНых
(2500 мкмоль/л) концентрациях тормозит дезаминирование (3-фенил-
этиламина.
В опытах in vitro на митохондриях печени крыс производное (3-кар-
болина инказап тормозил дезаминирование серотонина в концентрации
J0-6 моль/л, а тирамина — в концентрации 5-10“3 моль/л, т.е. инказан,
как и другие производные |3-карболина, избирательно ингибирует МАО
типа А. Максимум ингибирующего МАО действия |3-карболинами на-
блюдался через 2—3 ч. ослабление и прекращение торможения процес-
сов дезаминирования серотонина исследуемыми препаратами — через
6 ч после введения веществ. Однако в работе [647] установлено, что
ингибирование на 56 % МАО типа А в ткани мозга, обусловленное вве-
дением мышам пинии CF 6-МеО-ТГБК, максимально развивалось через
1 ч, достигало 30 %-го уровня через 12 ч и прекращалось через 24 ч
после введения препарата.
Концентрация биоаминов в головном мозгу под влиянием 0-карбо-
линов увеличивается не только с участием механизма угнетения про-
цесса дезаминирования норадреналина, дофамина и серотонина. (З-Кар-
болины могут повышать содержание нейромедиаторов в ЦНС, ингиби-
руя нейрональный захват моноаминов, что подтверждено в эксперимен-
тах на синаптосомах, выделенных из мозга крыс [648, 649], а также
на тромбоцитах быков и кроликов [650] и срезах мозга крыс [619].
Гарман в концентрациях 0,1 1 мкмоль/л угнетает обратный захват
3Н-норадреналина в опытах с использованием фракции синаптических
пузырьков на 13 и 72 %. Более активно ингибирует процесс нейрональ-
ного захвата Н-норадреналина гарман, который в концентрации
0,1 мкмоль/л па 55±3 % уменьшал транспорт радиоактивной Метки
через мембрану синаптических пузырьков [651]. Введение МеО-грунпы
в положение 6 при углеродном атоме гармана снижает способность пре-
парат ингибировать процесс нейронального захвата биоаминов: 6-мс-
токсигармап всего на 3 % угнетает обратный захват 3Н-норадреналина
Дигидронроизводные (3-карболина (гармалин) более активны, чем
производные гармана [651]. Они угнетают нейрональный захват 3Н
норадреналина.
При изучении на синаптосомальной фракции мозга влияния |3-кар-
170
Таблица 10.4. Сравнительная характеристика (мкмоль/л) ингибирующего влня
ния ^-карболинов на нейрональный захват ЭН серотонина, ’И дофамина и ’Н-нор-
адреналина сннаптосомами мозга крыс [6481
Вещество ’Н-5-ОТ *Н- ДА *Н-НА
/си А/ 1С,о *(
5 ОТ 0,04 0,1 4,7 8,60 5,1 8,0
ТГБК 1,5 4,2 25,1 46,0 27,0 42,0
6-ОН-ТГБК 0,2 0,5 1,1 2,00 6,4 10,0
6-МеО-ТГБК 0,4 1,1 27,3 50,0 29,6 46,0
1 Ме-ТГБК 4,2 12,0 38,2 70,0 59,1 92,0
l-Me-6-ОН-ТГБК 1,4 4,0 22,9 42,0 55,3 86,0
1 Ме-6 МеО-ТГБК 1,5 4,3 87,3 160,0 173,6 270,0
Гарман 13,2 38,0 34,9 64,0 70,7 110,0
1 Ме-6-МеО-ДГБК 11,4 33,0 39,3 72,0 59,1 92,0
болина (норгармана), производных 1,2-дигидро-|3-карболина и тетра-
гидро-/3-карболина на нейрональный захват 3Н-норадреналина, 3Н-серо-
тонина и 3Н-дофамина отмечена {648] более высокая активность пере-
численных препаратов па захват 3Н-серотонина и меньшее влияние на
захват 3Н-дофамина, чем гармана (табл. 10.4). Высокая активность при
угнетении нейронального захвата 3Н-серотонина наблюдается у
6-ОН-ТГБК (/Cso=0,5 мкмоль/л), что, по мнению [636],намного мень-
ше концентрации, необходимой для угнетения дезаминирующей актив-
ности МАО.
[З-Карболины являются возможными лигандами распознающих
мест специфического связывания Н-иминрамина, ассоциируемых с
местами обратного захвата серотонина [652]. Тетратидро-0-карболин
(1800-2500 нмоль/л соответственно) ингибирует захват 14С-серотони-
на и специфическое связывание 3Н-имипрамина в препаратах синапто-
сом коры мозга крыс. Более высокой ингибирующей способностью
обладали 6-МеО- и 6-ОН-замещенные ТГБК. в концентрациях 150—
580 нмоль/л они ингибируют специфическое связывание 3Н-имипрами-
на, а в восемь раз более высоких (6-МеО-ТГБК) или равноэффектив-
иых (6 ОН-ТГБК) угнетают процесс нейронального захвата 14С-серо-
тонина (табл. 10.5).
Подобно трициклическим и другим антидепрессантам гарман и его
производные, обнаруживая свойства ингибиторов нейронального захва-
та монпаминов, усиливают и их импульсное высвобождение в срезах
мозга. Из табл. 10.6 видно, что гарман и некоторые его производные,
подобно атипичным антидепрессантам и антидепрессантам пептидной
природы (см. табл. 10.2), усиливают импульсное высвобождение био-
аминов в концентрациях, в десятки раз более низких, чем концентра-
ции, при которых эти вещества влияют на процесс нейронального захва-
та нейромедиаторов.
Усиление под влиянием [3-карболинов импульсного высвобождения
171
Таблица 10.5. Ингибирование р кзрболинамн спе-
цифического связывания ’ Н-нмнпрамнна с мем
бранными препаратами коры мозга крыс и угнете-
ние Нейронального захвата ,4С-серотоннна и ЭН
норадреналина сннаптосомамн (652]
Вещество 1СК, нмоль/л
Связывание * Н имипра- мниа Нейрональный захват
,4с-от ’ll-НА
6-Мст-ТГБК 150 950 4300
6-ОН-ТГБК 580 520 2250
ТГБК 1800 2500 1500
60)1 1 Me ТГБК 2000 2000 10000
ся усилением его высвобождения. Многим
Н-норадреналина обус-
ловлено их способностью
блокировать а2-адрено-
рецепторы терминалей
аксонов НА-ергических
нейронов мозга. Блока-
да устраняет аутоингиби-
руюшее влияние норад-
реналина, выделившего-
ся в синаптическую шель
под влиянием нервных
импульсов, на процесс
импульсного высвобож-
дения медиатора и, ес-
тественно, сопровождает-
классическим и атипичным
антидепрессантам, по-видимому, свойственно такое действие.
Экспериментальные доказательства возможности приведенного ме-
ханизма действия /3-карболинов на импульсное высвобождение медиа-
торов получены при исследовании гармана и его производных на функ-
цию пресинаптических с2 -адренорецепторов в норадренергических си-
напсах семявыносящих протоков крыс [653}. Показано, что гарман и
его производные подобно имипрамину устраняют угнетающее влияние
клонидина — известного стимулятора пресинаптических ^-адреноре-
цепторов — на вызванные трансмуральной стимуляцией сокращения
семявыносящего протока. В диапазоне концентраций 3 - 10~8 —
3-Ю-6 мопь/л эти вещества конкурентно противодействуют тормозно-
му влиянию клонидина. т.е. представляют собой конкурентные блока-
торы пресинаптических а2-адренорецепторов в норадренергических си-
напсах протока. Их активность как антагонистов клонидина характе-
ризуется величинами рЛ2, составляющими для гармана б,9±0,04, для
С-153 и имннрамина 6,10±0,06 и 7,9±0,07 мкмоль/л соответственно,
что сопоставимо с активностью иохимбипа, блокирующего пресинапти-
ческис а2-адренорецепторы в электрически стимулируемой полоске
легочной артерии кролика в концентрациях 3-10-8 — 1(У6 моль/л
[654].
При всем разнообразии перечисленных свойств /3-карболинов на
первый план выступает присущая большинству из них способность
влиять на моноамннергические механизмы мозга — процессы синтеза
высвобождения, обратного захвата и ферментативной инактивации мо
ноаминов [595, 637], что с точки зрения поиска психотропных средств
с антидепрессивпой активностью представляет существенный интерес.
Как и многие классические антидепрессанты, гарман и другие произ-
водные /3-карболипа противодействуют гипотермическому и блефарос-
пастичсскому действию резерпина, повышают агрессивность мышей,
172
Таблица 10.6. Влияние гармана н его производных на захват и импульсное высво-
бождение м С-иорадреналина,3 Н-серотонина и 3Н доф < мина срезами мозга крыс
[619]
Вещество Концентрация, усиливающая высвобождение радиоактивной метки в 2 раза, мкмоль/л (£’С, ±5л0 Концентрация, ингибирую- щая захват бноамннов на 50 %, мкмоль/л (/С, е ±5xf)
МС-НА *н ОТ ’Н-ДА и С-НА ’Н-ОТ ’Н-ДА
Гарман (С-357) З-Метилгармаи 0,32 ±0,04 0,52±0.04 5,3±0,5 25 ±5 3,0±0,8 28±5
(С-153) 0,40 ±0,05 0,45 ±0,08 5,6±0.4 28+4 3,7 ±0,5 29±8
С-356 6,2 ±0,6 3,0 ±0,5 3,4±0,8 47 + 12 21 ±4 43±4
С-307 0,5 ±0.08 3,2 ±0,4 3,2±0,4 38+6 27±5 4,6±0,7
С-394 5,1 ±0.7 3,0 ±0,5 4,0±0,8 62+19 5,4±0,8 52±15
С-395 3,6 ±0,9 42 ±8 3,0±0,2 20±12 7,6±1,0 31±5
С-383 3,5 ±0,4 3,2 ±0,8 4,2±0,5 42±4 6,6±1,5 30±4
обусловленную введением ДОФА, потенцируют его гипотермический эф-
фект, увеличивают продолжительность вызванной транилципрамином
стереотипии [655]. При исследовании фармакологических свойств
9-замешенных гармана (С-307) и 1-замещенных 4'-оксо-3,4-тетрамеТи-
лен-/3-карболина (С-394, С-395 и С-383) отмечена аминопотенцируюшая
активность указанных соединений, проявляющаяся в способности про-
лонгировать фенаминовую стереотипию у крыс (табл. 10.7) и усили-
вать гипотермический эффект и групповую токсичность фенамина у
мышей.
Аминопотенцирующее действие производных Д-карболина установ-
лено в острых опытах на наркотизированных крысах и кошках. В усло-
виях манометрической записи артериального давления показано, что
тетрагидропроизводные 0-карболина, в частности 6-МеО-ТГБК (9,95—
0,1 мг/кг), усиливают процессорное действие норадреналина и серото-
нина [656]. Аналогичный эффект обнаружен в экспериментах на кры-
сах при исследовании дигидропроизводного 0-карболина (гармалин).
Активирующее влияние производных 3,4-тетраметиленгармана наблю-
дается не только на центральные моноаминергические процессы, но и
на периферическое действие моноаминов. Они усиливают периферичес-
кие эффекты адреналина (процессорное действие) и в большей степе-
ни — серотонина (процессорное действие и сокращение мигательной пе-
репонки) , но мало изменяют такие же эффекты норадреналина.
При исследовании фармакологических свойств гармана и его
3-карбоксамид- и 3-аминометилпроизводных отмечен их антирезерпи-
новый эффект [499]. Отмечены антирезерпиновыс свойства у 6-МеО
ТГБК и других производных 0-карболина [656, 657]. Эти вещества
пролонгируют и потенцируют фенаминовую стереотипию у крыс и усн
ливают центральные эффекты предшественника серотонина 5-оксв
триптофана [658].
173
Таблица 10.7. Влияние производных гармана, имн-
прамнна н пнразидола на продолжительность фе-
наминовой стереотипии у крыс
Вещество Доза (в/б), мг/кг Удлинение верно да стереотипии (x±Sxt), % кон- троля
Контроль С-307 3,0 6,0 12,5 Земегарм (С-394) 3,0 6,0 12,5 Гармашами (С-395) . 12,5 Индотер (С-383, 5,0 амбокарб) 10,0 Имипрамин 6,5 13,0 Пмразндол 6,0 100 132+13 192±17 198112 127,7И0 138,6111 157,919,4 12515 126 12,4 135 19,2 133115 190 113 126И2
Действие, подобное
эффектам антидепрес-
сантов, обнаружено у
гармана и его производ-
ных при длительном,
многодневном, примене-
нии.
Клинический эф-
фект большинства анти-
депрессантов проявля-
ется через две-три неде-
ли систематического
применения [617, 659],
поэтому в фармаколо-
гических опытах было
выяснено изменение при
хроническом введении
/З-карболинов как наибо-
лее эффективных потенциальных антидепрессантов их первичных
свойств: торможения обратного захвата и усиления импульсного выс-
вобождения моноаминов.
В опытах на крысах установлено [660], что концентрации, при ко-
торых (3-карболины вызывают угнетение захвата 14С- норадреналина и
3П-серотонина срезами мозга на 50 %, не изменяются после двухнедель-
ного введения по сравнению с концентрациями, найденными на срезах
мозга крыс через сутки после однократного введения гармана и дру-
гих антидепрессантов (табл, 10.8). Вызванное электрической стимуля-
цией срезов, преинкубированных с 14С-норадреналином и 3Н-серотони-
ном, высвобождение радиоактивной метки из срезов мозга крыс, под-
готовленных многократным введением гармана и его производных,
усиливается при концентрациях (ЕС2), в 3-14 раз более низких, чем
из срезов мозга контрольных животных. Двухнедельное введение кры-
сам /З-карболинов и других антидепрессантов (имилрамина, пирадизо-
ла) ослабляет ингибирующее влияние клонидина и серотонина на им-
пульсное высвобождение 14С-норадреналииа и 3Н-серотонина мозга.
Следовательно, курсовое применение гарманов, как и антидепрессан-
тов другой химической природы, понижает чувствительность термина-
лей аксонов норадрен- и серотонинергических нейронов к аутоингиби-
ругощему высвобождение влиянию медиаторов.
На адаптивные изменения функции моноаминергических систем
моэга, общие для /З-карболинов (гармана и его производных) и анти-
депрессантов типа имипрамина и пиразидола, указывают изменения
поведенческих тестов у мышей, подготовленных в течение 14 дней вве-
дением исследуемых препаратов (табл. 10.9). После многодневного
174
Таблица 10.8. Влияние длительного введения гармана н других анги депрессантов
на нейрональный захват ЦС „) и импульсное высвобот ение (£'С, ) 14 С-иорадре-
малина (!4С НА) и 3 Н-серотоннна (’Н-ОТ)
Вещество В контроле В опыте
14 С НА ’Н-ОТ 14 С-НА ’Н 01
JCK iSx, моль/л
Имипрамин (2,0±0,3)-10-’ (4,410,8) -10-’ (1,810 8) 10-’ (2.6И,1)10-’
Пиразидол (6,7±1,7)-1О-* (7,911,1) 10’ (6,510,8) Ю"* (7,610,8) 10-*
Гарман (2,510,5)-10 ’ (3,0±0,8) -10“’ (2,7Ю 6)10-’ (3,4+1.1)10 ‘
С-153 (2,810,4) 10’ (3,710,5)-10"’ (3,211,5) *0 ’ (3.9+1,2) 10-’
С 307 (3,810,6)-10 5 (2,7Ю,5) 10 ’ (4,011 2) IO'3 (2 5+0,6) 10 ‘
С-394 (6,211,9). 10’’ (5,410,8)-IO'6 (6,0±0,8) 10 ’ (5,2+1.0) 10 ‘
С-395 (2,011,2) 10’ (7,611,0)10-’ (2,110,4)-10 ’ (7,710 8) IO"6
- ±5Л, моль/л
Имипрамин (4,910,5) >10'7 (3,210,6) 10“’ (3,2Ю,6) 10 ’ (5,210,2). 10 7
Пиразидол (4,5±1,6)-10'4 (3,4±1,2) IO'5 (2,410,8)-10’7 (4,010,6) 1 О'*
Гарман (3,2±0,4)-10’7 (5,2Ю,4) 10‘7 (1,410,5) 10’’ (6.410,8) 10*
С-153 (4,010,5)'10~7 (4,510,8)-10 7 (5,210,2)-10-’ (2,610,2)-Ю'*
С-307 (5,0±0,8).10’7 (3,210,4)-10’’ (3,611, DIO’’ (4,410.5) Ю’7
С-394 (5,13*0,7)40 6 (3,010,5)-Ю-4 (4,311,2) 10’7 (2,810,5) 10 7
С-395 (3,610,9)-10^ (4,210,8)-10-’ (1,210,4) Ю’7 (2,210,6)-10-*
введения веществ увеличивается ЕД50 клонидина, вызывающая угне-
тение двигательной активности и ориентировочной реакции у мышей.
При однократном введении С-307 и имипрамина величины ЕДю кло-
нидина уменьшаются, а в случае гармана и С-394 — возрастают. Хрони-
ческое введение препаратов повышает значение ЕД50 5-окситриитофа-
на, найденное по феномену встряхивания головы у мышей. В наиболь-
шей степени этот эффект выражен у имипрамина. Уменьшение ЕД50
пропранолола, угнетающего ориентировочную реакцию у мышей, наибо-
лее выражено при многодневном введении С-307 и имипрамина, хотя
при однократном введении препараты либо не изменяют, либо снижают
среднеэффективную дозу пропранолола.
Таким образом, /3-карболины при многодневном введении подоб-
но имипрамину и пиразидолу понижают чувствительность терминалей
аксонов моноаминергических нейронов к кЛонидину и серотонину, но
повышают чувствительность нейронов мозга к пропранололу. В основе
указанных свойств /З-карболинов, как и в основе аналогичного дей-
ствия имипрамина [614], лежит, по-видимому, уменьшение плотности
а2-адрено- и С2-серотониновых рецепторов, но возрастание плотности
(3-адренергических рецепторов.
При поиске новых антидепрессантов Р.Г.Глушковым и сотрудника-
ми синтезированы четырехциклические соединения, производные тетра-
и гексагидропиразино(1,2,3-л, в) (3-карболина. Наиболее эффективным
175
Таблица 10.9. Изменения д-карболинами при остром и хроническом введении мы-
шам величин ЕДИ (мт/кг), характеризующих поведенческую активность ве-
ществ-анализаторов [667 [
Препарат (доза, мг/кг), характер введения Клонндин, вызывающий угнетение 5-Оксн трипто- фан, феномен встряхивания головы Пропранолол, угнетение ори- ентировочной реакции
двигательной орнентировоч- актнвности ной реакции
Контроль 0,096*0 02 0 109*0,02 182,3 *18,2 6,47*1,47 Имнпрамин (10) однократно 0,052*0,012* 0,062*0,009* 117,6 *18,2* 5,88*1,55 хронически 0,137*0,02* 0,146*0,02* 325 *23,6* 1,59*0,64 Ннразндол (20) однократно 0,082*0,01 0,089*0,01 167,6*18,2 6,22*1,65 хронически 0,175*0,023* 0,168*0,018* 283,5*21,1* 4 30*0,50* Гарман (20) однократно 0 112*0,027 0,134*0,029 209,4*19,3 6,10*2,37 хронически 0,175*0,02* 0,175*0,03* 275 ±23,8* 2,78*0,60* С-307 (10) однократно 0,069*0,011* 0,062*0,012* 209 ±19,4 3,00*0,50* хронически 0,205x0,028* 0,195*0,228* 267,6*18,2* 1,64*1,23* С-394 (20) однократно 0,099*0,02 0,118*0,024 247,6*15* 4,00*0,30* хронически 0,152*0,012* 0,137*0,022 247,6*15 * 2,78*0,60* * Различия с контролем статистически достоверны при Р = 0,05.
но показателям антидепрессивной активности оказался З-метил-8-ме-
токси-ЗН,1,2,5,6-тетрагидропиразино-(1,2,3,д, в)-|3-карболин, гидрохло-
рид которого назван инказаном [617].
По данным [661, 662], инказан ослабляет резерииновую гипотер-
мию, блефароптоз, обусловленный тетрабеназином, в малой степени
усиливает фенаминовую стереотипию, но существенно потенцирует
групповую токсичность фенамина. Он ослабляет гипотермическое дей-
ствие £-ДОФА у мышей, практически не влияет на гипотермическое
действие апоморфина, усиливает (в дозе 3 мг/кг) гипертермический
эффект 5-окситриптофана у кроликов и вызываемые им встряхивания
головой у мышей (ЕД50=23±4 мг/кг, внутрь). Инказан снижает ката-
лептическую активность метеразина у крыс. В дозах 1-3 мг/кг препа-
рат усиливает действие адреналина и серотонина (но не норадреналина)
на мигательную перепонку у кошек, однако значительно не влияет на
прессорный эффект аминов В тех же дозах инказан заметно усиливает
и удлиняет прессорную реакцию на тирамин. В экспериментах на глад-
комышечных клетках семявыносящего протока крыс [663] инказан
потенцирует сократительную реакцию органа в ответ на электростиму-
ляцию адренергического нерва.
Инказан обладает непродолжительным обратимым анти-МАОэф-
фектом [646] В опытах in vitro он вызывал 50 %-е торможение дезами
176
нирования серотонина в концентрации 1 1СГ6, а тирамина в концен-
трации 5-10“3 моль/л. В экспериментах in vivo через 30 мин после вве-
дения препарата в дозе 25 мг/кг подкожно в тканях мозга, печени,
сердца и почек крыс торможение дезаминирования серотонина состав-
ляло 12,0; 28,5; 12,5 и 59 %, а тирамина 21,0;8,5;21,5 и 50 %.
Сравнительный анализ показал, что инказан уступает имипрамину
в способности уменьшать гипотермию и птоз, вызываемые резерпином
и тетрабеназином, а также усиливать фенаминовую стереотипию, су-
щественно не влияет на действие апоморфина. Кроме того, в отличие
от имипрамина он не проявляет холинолитического действия, обуслов-
ливающего тахикардию, затруднение мочеиспускания, сухость слизис-
тых оболочек и тд,, в связи с чем препарат лучше переносится боль-
ными. Инказан является антидепрессантом со стимулирующим ком-
понентом действия [664]. Он оказался наиболее эффективным у боль-
ных с вялой, адинамической, апатической, невротической и неглубоки-
ми ипохондрическими депрессиями и менее эффективным — при глу-
боких эндогенных депрессиях.
Таким образом, 0-карболины, представляя собой продукты мета
болизма в центральной нервной системе и оказывая влияние на функ-
цию аминергических структур мозга, обладают высокой физиологичес-
кой активностью. Создание оригинального отечественного антидепрес-
санта — инказана подтверждает целесообразность поиска новых анти-
депрессантов среди производных 0-карболина.
Глава 11
ОЛИНЫ КАК МОДУЛЯТОРЫ
ЦЕНТРАЛЬНЫХ НЕЙРОМЕДИАТОРНЫХ СИСТЕМ,
УЧАСТВУЮЩИХ В ПА ТОГЕНЕЗГ АЛКОГОЛИЗМА
Алкоголизм одна из наиболее распространенных токсикоманий.
Он вызывается этиловым спиртом биологически активным вещест-
вом с широким фармакологическим спектром действия. В отличие
от большинства психотропных средств этиловый спирт — не чуждый орга-
низму субстрат, так как принимает участие в процессах обмена веществ.
Причина злоупотребления этиловым алкоголем заключается в его влия-
нии на эмоциональную сферу. Психотропные средства, вызывающие
токсикоманию, употребляются для подавления отрицательных эмоций
и испытания положительных. Этанол снижает острому проблем, волную-
щих человека, создает приятное настроение или эйфорию [668]. Нали-
чие эмоционального напряжения, тревоги. Тоски и страха способствует
развитию влечения к этанолу.
Множественные и разнообразные фармакологические эффекты эта-
нола на центральную нервную систему (ЦНС) не оставляют сомнений
о влиянии его на функцию основных нейромедиаторных систем. Окис-
ление этанола и продуктов его метаболизма, особенно ацетальде-
гида, значительно изменяют обмен биогенных аминов, вызывая сущест-
венные нарушения в синаптической передаче. Образование активных
соединений в результате метаболизма этанола в организме, естественно,
влияет на механизм реализации биологических эффектов алкоголя
К подобным соединениям, образующимся путем конъюгации продукта
окисления этанола ацетальдегида с серотонином или триптофаном,
относятся /3-карболины. В настоящей главе обсуждается влияние 0-кар-
болинов на нейромедиаторные системы ЦНС, участвующие в формиро-
вании и течении алкоголизма.
11.1 НЕЙРОМЕДИАТОРНЫЕ СИСТЕМЫ
ОПРЕДЕЛЯЮЩИЕ РАЗВИТИЕ АЛКОГОЛИЗМА
11 1.1. РОЛЬ ГАМК-ЕРГИЧЕСКОЙ СИСТЕМЫ МОЗГА
В ПАТОГЕНЕЗЕ АЛКОГОЛИЗМА
Способность этанола подобно бензодиазепиновым транквилизато-
рам проявлять анксиолитическую активность в моделях тревожного
178
состояния животных [669], а также потенцирование эффектов 1,4-бен-
зодиазепинов (диазепама, хлордиазепоксида) послужили предпосыл-
кой для поиска общих механизмов, обеспечивающих нротивотревож-
ное действие веществ. Анксиолитический эффект 1,4-бензодиазеиинов
определяется преимущественно изменением под влиянием лиганда
функционального состояния беизодиазепинсвязывающего участка Рд—
ГАМК БДР- хлорканальных (см. раздел 6.1). Роль БДР и ГАМК-ерги
ческой системы мозга в реализации эффектов этанола остается неясной.
Данные о влиянии однократного и хронического введения этанола на
функциональное состояние Р—ГАМК и БДР, содержание ГАМК целого
мозга противоречивы. Отмечалось существенное снижение уровня
ГАМК в целом мозге мышей, находящихся в течение 10 дней под влия-
нием паров этанола [670]. Иные результаты — увеличение содержания
ГАМК в целом мозге — получены в экспериментах на крысах, потреб-
лявших этанол 21 день, и на мышах, получавших этанон с жидкой пи-
щей 28 суток [671]. Неоднозначные результаты установлены и при
определении влияния алкоголя на активность глютаматдекарбоксила-
зы [671, 672] и ГАМК-трансаминазы в гомогенатах мозга крыс [672].
Введение 20 %-го раствора этанола в желудок крыс в дозе 3 г/кг
способствовало снижению связывания 3Н -ГАМК с мембранными пре-
паратами мозжечка, но не коры, стриатума и черной субстанции, при-
чем это уменьшение зависит от снижения аффинитета рецепторов, так
как число мест связывания (Вп1ах) не изменяется [673]. Не изменяют-
ся и параметры связывания Р—ГАМК с ЧН ГАМК и в целом мозге
[674] Хроническое потребление этанола с жидкой пищей (59,6 г/л)
крысами в течение 21 дня также не повлияло на связывание рецепто-
ров ГАМК в гомогенате целого мозга [675]. Однако исследования
[676] на синклеровских свиньях, которые в течение 3 лет получали
10 %-й раствор этанола в дозе 4 г/кг ежедневно, показали существенное
увеличение мест связывания Р—ГАМК в мембранных препаратах, выде-
ленных из коры головного мозга и мозжечка.
Уменьшение аффинитета низкоаффинных мест связывания рецеп-
торов ГАМК с меченным по тритию лигандом отмечено [675] у крыс,
получавших алкоголь 21 день с последующей отменой этанола. В пери-
од отмены этанола снижение числа ниэкоаффинных мест связывания
и степени сродства Р—ГАМК к лигандам в мембранных препаратах ко-
ры головного мозга крыс установлено и в другой работе [674] Следу-
ет отметить, что подобное варьирование характеристик Р-ГАМК не вы-
явлено у крыс, хронически употреблявших этанол, но без признаков
абстиненции в период отмены алкоголя.
Влияние изменения уровня ГАМК на потребление алкоголя живот-
ными не известно, но имеются данные о веществах, изменяющих функ-
цию ГАМК-ергических синапсов мозга и фармакологические эффекты
этанола Установлено, что вещества, повышающие концентрацию ГАМК
179
в мозгу (аминооксимасляная кислота и дипропилацетат), угнетают су-
дорожные реакции у крыс и мышей, возникающие в период отмены ал-
коголя, Пикротоксин блокатор ГАМК-рецепторов типа А — усилива-
ет реакцию в период абстиненции {677]. В работе (678] отмечено по-
давление ГАМК обусловленного этанолом повышенной двигательной
активности у мышей. Подобный эффект наблюдался и после введения
7-оксимасляной кислоты, баклофена и аминооксиуксусной кисло-
ты [679],
Следовательно, ГАМК-ергическая система мозга не влияет на ме-
ханизм контроля за употреблением этанола, но имеет значение в реали-
зации некоторых фармакологических эффектов алкоголя. Функцио-
нальное ослабление этой системы в период отмены этанола способству-
ет формированию абстинентного синдрома.
Большой интерес представляют исследования по выявлению влия-
ния этанола на функциональные свойства бензодиазепиновых рецепто-
ров, являющихся участками аллостерического регулирования рецепто-
ров у-ампномасляной кислоты, образующих функциональные комп-
лексы с хлорными ионофорами в мембранах нервных клеток. Бензо-
диазепиновые рецепторы широко представлены в ЦНС млекопитающих
и других позвоночных (см. главу 6).
Большинство исследователей считают, что in vitro этанол не влияет
на специфическое связывание 3Н-бензодиазепинов с синаптосомаМи
мозга крыс и гомогенатом мозга мышей [680]. Однако при использо-
вании мембранных препаратов, предварительно (18 ч) замороженных и
промытых буфером с целью удаления эндогенных лигандов БДР и
ГАМК, отмечается повышение связывания 3Н-диазепама в присутствии
этанола в инкубационной среде, В таких условиях этанол в концентра-
циях от 5 до 100 ммоль/л (но не выше) увеличивает связывание 3Н-диа-
зепама с БДР [681]. Напротив, при развитии абстиненции у мышей в
результате отмены алкоголя снижается величина Втах для 3Н-флуни-
тразенама в митохондриальной фракции мозга от 1580 до 1340фмоль/мг
и повышается константа диссоциации (JQ) от 1,4 до 2,0 нмоль/л.
Уменьшение БДР после хронического введения этанола и снижение
аффинности к специфическим лигандам могут усугублять дисфоричес-
кие ощущения, чувство тревоги и страха, характерные для алкоголиз-
ма. По мнению [682], предшествующие изменения функции БДР могут
способствовать формированию алкогольной мотивации за счет усиле-
ния негативных эмоции и чувства страха, что подтверждено экспери-
ментально [669]. В опытах на крысах с разнонаправленной склон-
ностью к алкоголизму установлено, что после введения алкоголя у
предрасположенных к этанолу животных определяется (табл. 11.1) зна-
чительно большее количество бензодиазепиновых рецепторов, чем у
ненредрасположснных. Параметры, характеризующие связывание 3Н-
диазепама с БДР мозга крыс, идентичны у животных с различной
180
Таблица 11.1. Характеристики связывании ’Н-диазепама с бензодиазепиновыми
рецепторами мозга крыс с различной алкогольна мотивацией [6691
Группа крыс Изотонический раствор (М±т) Этанол 2,5 г/кг (М±т)
Kj, пмоль/л ®тах< фмоль/мг белка Krf пмопь/Л|Ятах,фмоль/мг белка
Кора Предрасположенные 6,9 ±2,8 (4) 1535±348 (4) 8,4 ±1,23(4) 1575±105 (4) к алкоголизму Непредрасполо- женные 7,15±2,0 (4) 1472±232(4) 5,88±1,77(3) 903±107*(3) Гиппокамп Предрасположенные к алкоголизму 4,45±0,67 (3) 1504±173(3) 4,45±0,56(3) 1233*140(3) Непредрасполо- жениые 4^5±0,7(4) 1280±153(4) 3,80*0,51(3) 1073±103(3) * Различия статистически значимы (Р < 0,05); в скобках указано число опытов.
изначальной алкогольной мотивацией, содержащихся в стандартных ус-
ловиях (см. табл. 11.1). Однако чувствительность и адаптивность БДР
у этих групп крыс к воздействию внешних факторов (внутрибрюшин-
ное введение этанола) различна.
11.1.2. РОЛЬ МОНОАМИНЕРГИЧЕСКИХ
(НОРАДРЕНАЛИН- И ДОФАМИНЕРГИЧЕСКИХ)
СИСТЕМ МОЗГА
В РАЗВИТИИ ЭКСПЕРИМЕНТАЛЬНОГО АЛКОГОЛИЗМА
Этанол не вызывает изменений в содержании норадреналина в це-
лом мозгу мышей [671] ,крыс и кроликов [683] либо способствует не-
значительному уменьшению его концентрации в теленцефалоне и гипо-
таламусе [684]. При изучении влияния алкоголя на отдельные этапы
метаболизма катехоламинов не установлено существенных изменений
в накоплении предшественника дофамина и норадреналина - диоксифе-
нилаланина — в целом мозгу мышей и крыс. Вместе с тем показано
[685, 686], что однократное введение этанола (2 г/кг, р желудок) кры-
сам значительно снижает концентрацию норадреналина и его предшест-
венников — ДОФА и дофамина — в гипоталамусе и среднем мозге
(табл. 11.2). Одновременно повышается содержание метаболитов но-
радреналина — норметанефрина и З-метокси-4-оксифенилэтиленглико-
ля. Прямыми опытами на синантосомах, выделенных из мозга крыс,
найдено ингибирующее влияние алкоголя на нейрональный захват нор-
181
Таблица 11.2 Влияние однократного и длительного введения этанола на содержа
нне дофамина, норадреналина, иорметанефрниа и 3 метокси-4-оксифеиилэтилен-
гликоля (М ФЭГ) в среднем мозгу крыс (иг/г [686]
Этап исследования Дофамин Норадреналин Норметанефрнн МОФЭГ
Контроль Этанол 276,7110,4 755,7114,6 52,614,5 49,612,9
однократное введение 189,5±15,1** 578,1121,7** 72,213,1**» 56,111,8**
длительное введение 226,4117,6* 630,9120,9* 81,512,9*** 61,511,6**
синдром отмены 373.3110,2*** 778,0124,4 57,413,7 50,614,2
* Р< 0,05.
** Г <0,01.
*** Р< 0,001.
адреналина. Таким образом, однократное введение этанола приводит
к активации процессов синтеза и утилизации норадреналина.
При длительном введении этанола в организм животных концен-
трация норадреналина мозга зависит от сроков алкоголизации Внутри-
желудочное введение этанола крысам пять—семь дней не приводит к
изменениям содержания мозгового норадреналина [687]. Однако по-
требление алкоголя животными в течение года способствовало увеличе-
нию концентрации норадреналина в стволе мозга Повышение содержа-
ния норадреналина в варолиевом мосту и других структурах мозга у
крыс после потребления от трех месяцев до года этанола (10 %-го
раствора) в качестве единственного источника жидкости подтвержде-
но и другими исследованиями [684,688].
Потребление алкоголя семь—десять дней (внутр ижелудочное вве-
дение) не влияет на уровень дофамина в целом мозгу и отдельных
структурах мозга животных. Увеличение уровня дофамина в хвоста
том ядре крыс отмечено только при длительном (360 дней) добро-
вольном потреблении раствора спирта [688]. Аналогичные данные
получены на мышах при ингаляции спирта в течение 10 дней [670]
В варьировании функциональной активности катехоламинергичес-
ких систем мозга при хроническом введении этанола может иметь зна-
чение чувствительность рецепторов. При исследовании динамики связы-
вания Н-спироперидола с гомогенатами стриатума выявлено повыше-
ние чувствительности дофаминовых рецепторов к лиганду у крыс пос-
ле трехнедельной алкоголизации [673]. Это увеличение связывания
обусловлено повышением аффинности рецепторов, а не их количест-
ва. На повышение аффинитета дофаминовых рецепторов в условиях ал
коголизации указано и в работе [689], в которой в качестве лигандов
использовались Н-сульпириди 3Н-спиперон.
Исследования с применением фармакологических средств, изме-
182
Таблица II 3 Влияние веществ, изменяющих функцию катехоламннергнческих
синапсов, на потребление 15 %-го раствора этанола к' леями, находящимися на
разных стадиях экспериментального алкоголизма [669]
Вещество; доза (мг/кг) х частоту введений в сутки 0-10 дней, % к контролю 4 месяца, % к фону Более 8 мес, % к фону
1-5-й день 6-10-й день Отме на 1-я неде- ля 2-я Отме неде- 1 на ля ' 1-я неде- ля 2-я неде- ля Отме- на
Б-ДОФА; 50x2 раза 162,0* 77,0 141,0* 77,3 87,0 102,5 84,2 66,2* 100,9 а-Метил-ДОФА; 50x2 раза 26,8* 28,7* 22,8* 35,9* 34,2* 42,7* 94.2 123,2 164,1* Феитоламин ,30x1 раз 4,2* 14,0* 8,0* 41,0* 55,0* 48,0* 70,1* 96,7 137,7 Пропранолол; 30x1 раз 58.2* 53.8* 102,0 67,0 112,0 89,0 71,8 95,5 79,5 Аломорфии; 0,1x2 раза 54,3* 72,8 76,2 99,3 110,2 141,9* 62,6 102,7 77 Галоперидол; 0,1x2 раза 53,2* 62,8 75,1 93,0 115,0 111,0 88.2 118,0 142,0* *£<0,05.
нягощих функцию различных звеньев катехоламинергической системы,
также показали значимость такой системы для регулирующих механиз-
мов потребления алкоголя. Активация катехоламинергической систе-
мы, достигаемая предварительным введением крысам /.-ДОФА, увели-
чивает потребление алкоголя, а угнетение ее активности после насыще-
ния организма а-метил-ДОФА — уменьшает (табл. 11.3). Угнетение ак-
тивности а-адренорецепторов фентоламином способствует сильному
уменьшению потребления этанола крысами Блокатор /3-адренорецеп-
торов (анаприлин) и средства, изменяющие активность дофаминерги-
ческой системы (апоморфин и галоперидол), незначительно влияют на
потребление алкоголя (см. табл. 11.3). Приведенные данные свидетель-
ствуют о небольшом влиянии дофаминергической системы и, напротив,
преимущественном участии норадренергической системы в формиро-
вании алкогольной мотивации.
11.1.3. УЧАСТИЕ СЕРОТОНИНЕРГИЧЕСКОЙ
СИСТЕМЫ МОЗГА В РАЗВИТИИ АЛКОГОЛИЗМА
Результаты изучения содержания серотонина (5-окситриптамина,
ОТ) в мозгу животных под влиянием однократного (2 4 г/кг) и хро-
нического (10-14 дней) введения этанола противоречивы Внутрибрю-
шинное введение этанола кроликам (4 г/кг) снижало уровень ОТ в
мозгу [690] или увеличивало его содержание [684] (рис. 11 1) либо не
изменяло уровня концентрации биоамина [683]. Алкоголизация крыс
183
Рис. 11.1 Влияние этанола на уровень серотонина в разных отделах мозга крыс
[687]:
1 шишковидная железа; 2 мозжечок; 3 - продолговатый мозг + мост; 4 -
гипоталамус; 5 средний мозг + таламус; 6 — стриатул; 7 - гиппокамп; 8 —
кора больших полушарий; 9 — целый мозг
внутрижелудочным введением этанола в дозе 9-13 г/кг в сутки (в те-
чение четырех дней) не повлияла на функциональное состояние серото-
ниновых рецепторов [691].
Большой интерес представляют исследования изменения функцио-
нальной активности серотонинергической системы под действием фар-
макологических средств и влияния этих изменений на потребление эта-
нола. Снижение содержания серотонина в мозгу (на 95 %), достигае-
мое оральным введением л-х лор фенилаланина в дозе 125 мг/кг, умень-
шает толерантность к мышечно-расслабляющему и гипотермическому
действию этанола. Разрушение серотонинер 'ических нейронов после
введения в желудочки мозга 5,7-диокситриптамина также снижает раз-
витие толерантности к этанолу по указанным тестам [692] и приводит
к увеличению потребления алкоголя крысами [693]. Повышение кон
184
центрации серотонина в мозгу, достш аемое внутрибрюшинным введе-
нием крысам предшественника серотонина — 5-окситриптофана
(150 мг/кг, три раза в день в течение 11 дней),значительно уменьшает
потребление животными этанола [694].
Аналогичные данные получены на крысах, которым в желудочки
мозга вводили серотонин [695], либо после внутрибрюшного введения
игнибитора МАО нергилина [696] мышам. Эффект 5-окситриптофана
иа потребление алкоголя животными блокировался Ro 4-4602 инги-
битором декарбоксилирования ароматических аминокислот, препят-
ствующим переходу 5-ОТФ в серотонин [697]. Сильное угнетение по-
требления крысами 6 %-го раствора этанола наблюдалось после четы-
рехдневного внутрибрюшинного введения флуоксетина — блокатора
нейронального захвата серотонина [698] .Другой ингибитор нейронально-
го захвата серотонина — зимелицин (25 мт/кг, внутрибрюшинно в те-
чение 9 дней) — также снижал потребление крысами-самцами алкоголя
от 10,3 до 6,5 г/кг в сутки и предупреждал влечение животных к этано-
лу, уменьшая число крыс, предпочитающих этанол, от 70 до 30 % [699].
Следовательно, снижение уровня серотонина мозга, достигаемое
применением фармакологических средств, способствует увеличению
потребления этанола. Напротив, фармакологические вещества, повы-
шающие концентрацию 5-окситриптамина в ткани мозга, приводят к
существенному снижению или отказу от потребления алкоголя жи-
вотными.
11.2. НЕЙРОМОДУЛИРУЮЩЕЕ ВЛИЯНИЕ
(3-КАРБОЛИНОВ
НА ФОРМИРОВАНИЕ И ТЕЧЕНИЕ АЛКОГОЛИЗМА
Пути метаболизма этанола в организме человека и животных пе-
реплетаются с метаболизмом моноаминов, в частности серотонина
(5-гидрокситриптамина). Основной продукт метаболизма алкоголя -
ацетальдегид — вовлекается в реакцию конденсации с индолами (трип-
тамином или серотонином), что приводит к образованию соединений
с дополнительным по сравнению с индолами гетероциклическим коль-
цом (/J-карболинам). В зависимости от степени насыщения этого коль-
ца различают 1,2,3,4-тетрагидро-/?-карболины (триптолипы, Т1БК),
3,4-дигидро-/?-карболины (ДГБК) и полностью ароматизированные
/3-карболины БК) [627, 628].
Результаты изучения влияния Р-карболинов на добровольное по-
требление этанола животными позволили сделать вывод об участии в
формировании влечения к алкоголю. Установлено двойственное влия-
ние 0-карболинов на развитие алкогольной мотивации в зависимости
от способа введения вещества в организм животных Введение ТГБК
185
Таблица 11.4 Влияние (3-карболинов на добровольное потребление 10 %-го раство-
ра этанола у мышей и на специфическое связывание ’Н-налоксона с гомогенатом
мозга крыс [669]
Соединение R R* ЛД.0 мг/кг Лоза, мг/кг Фон 5 дней, г/кг Среднесуточное по- требление в расчете на чистый этанол, % к фону мкмоль/л
Введение Отмена
Контроль — — — — 9,6 116 115
НК-424 осн, СН, 310 20 5,6 64* 63* 104,618,7
НК-459 он СН, 750 40 6,7 59* 62* 71,5111,8
НК-490 он с, 11, 430 43 8,8 77 130 8,3312,10
НК-486 он с, и, 500 50 8,0 52 * 72 1,73±0,74
НК-496 он С,Н, н 500 50 7,8 54* 75 5,8411,00
НК-485 он С.Н1.-Я 180 18 8,0 66* 48* 1,2010,40
НИО-6 — 10,5 1 7,4 118 75 65,4 110,4
* Различия статистически значимы по отношению к фоновому уровню (р < 0,05),
в латеральный желудочек мозга крыс способствовало увеличению по-
требления этанола [700, 701]. Напротив, внутрибрюшинное введение
[3-карболинов вызывало уменьшение потребления 4 %-го раствора эта-
нола у крыс [690]. Снижение на 50 % добровольного потребления алко-
голя мышами при внутрибрюшинном введении соединений, относящих-
ся к (3-карболинам, и более чем на 90 % после их отмены по сравнению
с контролем отмечено и в работах [669, 702, 703]. Сильнее других по-
нижают уровень добровольного потребления этанола 1-метил-6-ме-
токси- и метил-6-окси-ТГБК (табл. 11.4). Гомологи 1-метил-б-ме-
токси-ТГБК (НК-459) в меньшей степени ингибируют потребление
алкоголя, чем исходное соединение. Их активность исчезает при удли-
нении алифатической-цепочки всего лишь на один атом углерода и воз-
растает при наличии трех-четырех атомов углерода в указанном положе-
нии. Сила угнетающего действия на потребление алкоголя у рассматри-
ваемых соединений не обусловлена степенью их токсичности; у более
активных веществ меныпая токсичность, чем у менее активных.
Способность [3-карболинов конкурировать с 3Н-налоксоном за свя-
зывание с опиатными рецепторами мозга [447, 637] позволила пред-
положить, что способность гарманов модифицировать уровень добро-
вольного потребления этанола может быть опосредована через опиат-
ную систему ЦНС. Анализ табл. 11.4 позволяет выявить соединения с
достаточно высоким сродством к опиатным рецепторам мозга. Однако
соединения с наибольшим эффектом снижения потребления этанола
186
Г (НК 424, НК-459) обладают относительно низкой аффинностью и соот-
ветственно высокими Kj (104,6 и 71,5 мкмоль/л соответственно).
Вместе с тем соединения НК-486, НК-496, ГК-485 и НК-488 с достаточно
низкими величинами Kj (1,73; 5,84; 1,2 и 2,3 мкмоль/л) значительно
меньше влияют на уровень потребления алкоголя животными. Следо-
вательно, нет строгой корреляции между сродством 0-карболинов к
| опиатным рецепторам мозга и их способностью влиять на алкоголыгую
В мотивацию [669].
Изучено влияние высокоэффективных соединений НК-424 и НК-459
на алкогольную мотивацию крыс, добровольно потреблявших 15
раствор этанола свыше восьми месяцев (сроки, в которые может сфор-
мироваться физическая зависимость от алкоголя). Показано, что ха-
рактер изменений в потреблении алкоголя у крыс в указанных услови-
ях зависит от исходного уровня алкогольной мотивации. У крыс, по-
требляющих относительно большие количества этанола (от 7,5 до
11,8 г/кг), оба соединения понижают потребление алкоголя в период
применения и после отмены /3-карболинов, Напротив, у крыс, потреб-
ляющих относительно небольшое количество этанола (от 3 до 4,3 г/ кг),
потребление алкоголя возрастало на фоне применения гарманов.
Таким образом, наибольшим подавляющим эффектом на потреб-
ление алкоголя обладают циклические производные серотонина. Не-
|роятным нейрохимическим механизмом, посредством которого (3-кар-
болины опосредуют свое влияние на формирование алкогольной моти-
вации, является модуляция активности серотонинергической системы
мозга. В пользу данного представления свидетельствует не только су-
щественная роль серотонинергической системы мозга в регуляции доб-
ровольного потребления алкоголя, но и способность /3-карболинов из-
менять синтез и ингибировать нейрональный захват серотонина [618,
619, 637], а также способность гарманов выступать в роли аллостери-
ческих модуляторов серотониновых рецепторов, изменяющих их срод
ство к серотонину [552].
ЗАКЛЮЧЕНИЕ
Из нейрофармакологического анализа видно, что (3-карболины
универсальные модуляторы функций ГАМК и моноаминергических
синапсов мозга. Взгляд на ЦНС как на совокупность последовательных
и параллельных испей нервных клеток, в которых огромное множест-
во синаптических контактов обеспечивает не только передачу влияний
(возбуждающих, тормозящих) нейрона на нейрон, по и целостную дея-
тельность мозга, послужил основой для исследования и понимания при-
роды фармаколотических и терапевтических эффектов нейро-
и психотропных средств [704]. Сегодня, однако, очевидно, что синапсы
ис могут рассматриваться как исключительно релейные структуры. Они
обеспечивают не только передачу, но и модуляцию нервных влияний:
облегчение, потенциацию, ослабление или прекращение, переклю-
чение на иные синаптические входы.
Можно выделить три принципиальные разновидности модуляции
синаптической передачи, пре-, транс- и постсинаптические. Пресинапти-
ческая модуляция осуществляется собственным или иным медиатором,
воздействующим на аксонные терминалы нейрона и облегчающим или
затрудняющим импульсное высвобождение нейропередатчика. Анало-
гичное облегчение или затруднение пресинаптического высвобождения
трансмиттера за счет метаболитов медиаторов, их прекурсоров или ве-
ществ, высвобождающихся из иннервируемых клеток под влиянием
медиатора, составляет сущность трапссипаптической модуляции. Пост-
синачтическая модуляция происходит путем изменения чувствитель-
ности мембран иннервируемых клеток к определенному медиатору
другими биорегуляторами: медиаторами, сомедиаторами, гормонами,
продуктами их процессинга или м габолизма.
Эндогенные (3-карболины, в том числе гарман [553, 634] и тетра-
гидроноргарман [632], содержание которых в мозгу достигает десятков,
а при нагрузке L-триптофаном или триптамином — сотен нанограммов
па 1 г ткани, имеют экстранейрональное происхождение. Они образуют-
ся в результате превращений триптофана, метаболизм которого приво-
дит ко многим нейрорегуляторам. Превращение триптофана по кину-
рениновому пути ведет к кинуренину, хинолиновой и кипуреновой кис-
лотам, являющимся модуляторами глутаматергической передачи Об-
разующиеся из триптофана триптамин и (3-карболины служат транс- и
188
постсинаптическими модуляторами функций моноаминергических и
(или) ГАМК-ергических синапсов.
Действительно, многие /3-карболины, в том числе 1,2,3,4-тетрагвд-
ро-Дкарболин, гарман и их производные, усиливают импульсное высво-
бождение норадреналина, дофамина и серотонина воздействуя на ак-
сонные терминали моноаминергических нейронов (см. гл. 10). Повы-
шая внутрисинаптическую концентрацию названных аминов, /3-карбо-
лины проявляют антидепрессантоподобные свойства и воспроизводят
фармакологические эффекты классических антидепрессантов- (имипра-
мина, амитрипталина), способность которых нормализовать настроение
(тимоаналептическое действие) используется в лечении депрессий и
депрессивных состояний. Хотя повышение внутрисинаптической кон-
центрации моноаминов вызывается /3-карболинами и в результате
ингибирования обратного захвата аминов, антирезерпиновая и другие
виды антидепрессантоподобной активности /З-карболинов коррелируют
с их влиянием на импульсное высвобождение моноаминов.
Гарман и некоторые его производные усиливают также импульсное
высвобождение ГАМК аксонными терминалями I АМК-содержащих
нейронов. Однако ГАМК-ергические процессы в мозге/3-карболины из-
меняют, действуя преимущественно на постсинаптическом уровне. Не-
которые /3-карболины, особенно эфиры /З-карболин-З-карбоновой кис-
лоты, обладают свойствами высокоаффинных лигандов бензодиазепи-
новых рецепторов. Они аллостерическн модулируют сродство ГАМК к
ГАМК-связывающим центрам ГАМК -БДР- хлорканальных комплек-
сов, изменяя (повышая или снижая) чувствительность постсинаптичес-
ких мембран нейронов к влиянию ГАМК (см. гл. 6). Постсинапгичес-
кая модуляшш сродства ГАМК -БДР- хлор канальных мембранных
комплексов к уамипомасляной кислоте является, по-видимому, мо-
лекулярной основой влияния многих /З-карболинов на уровень
тревожности и судорожной готовности мозга животных и челове-
ка (см. гл. 7),
Свойства аллостерического сенсибилизатора и ингибитора ГАМК
(БДР)хлорканальных комплексов присущи 1арману, который в зави-
симости от концентрации (дозы) усиливает или уменьшает постсинап-
тические эффекты ГАМК и соответственно обладает анксиолитической
или анксиогенной активностью. Но гарман модулирует также сродство
1Л-серотониновых рецепторов и в зависимости от концентрации потен-
цирует или ингибирует 1Д-эффекты серотонина (см. гл. 9). Усиливая
или ослабляя ауторегулирующее тормозящее влияние серотони-
на на серотонин продуцирующие нейроны ядер шва среднего моз
га, гарман может существенно изменять уровень тревожности
животных.
Следовательно, гарман выступает постсинаптическим модулятором
и в ГАМК-ергических, и в серотонинергических синапсах, регулируя
189
функциональную активность двух важнейших нейрохимических сис-
тем, определяющих уровень тревожности.
Рассматривая /3-карболины (тетрагидро-0-карболин, гарман и пока
не идентифицированные /3-карболины) в качестве вероятных эндоген-
ных модуляторов функций ГАМК- и моиоаминергических синапсов, ес-
тественно ожидать, что синтетические /3-карболины могут оказаться эф-
фективными корректорами настроения и уровня тревожности, а также
найти применение в качестве противосудорожных средств. Отсюда ус-
тойчивый интерес к разработке методов синтеза /J-карболинов. Прин-
ципы и схемы синтеза /3-карболинов и их многочисленных производ-
ных описаны в главах 1—5,
Синтетические /3-карболины не обязательно полностью имитируют
свойства эндогенных. В отличие от гармана, например, они могут про-
являть преимущественно серотонинопозитивные (ОТ-негативные) ли-
бо только ГАМК-позитивные (негативные) свойства. Выраженная
1Л-серотониносенсибилизирующая, но слабая ГАМК-позитивная актив-
ность обнаружена у 3,4-тетрамети енгармана (С-412) и его 2-диметиль-
ного производного (С-394). Оба вещества обладают антидепрессанто-
подобными свойствами, а в дозах 5—6 мг/кг — противотревожной ак-
тивностью в модели конфликтной ситуации. У 4-оксопроизводных
3,4-тетраметиленгармана (С-410 и С-383) наряду с ОТ-сенсибилизирую-
щей наблюдается также ГАМК-потенцирующая активность: они оказы-
вают противотревожное действие уже в дозе 1 мг/кг. В отличие от
С-412 они обнаруживают и противосудорожные свойства (антагонизм
с коразолом и пикротоксином).
Клинические испытания С-383 (амбокарба, индотера) показали, что
амбокарб ( уточная доза 80-120 мг) обладает свойствами дневного
транквилизатора, близкого по действию и противотревожной актив-
ности к мезапаму (медазепаму, рудотелю). Амбокарб полностью ли-
шен гипнотического и миорелаксирующего действия — побочных эф-
фектов, свойственных 1,4-бензодиазепинам, в том числе, хотя и в мень-
шей степени, мезапаму, Амбокарб влияет на проявления психоэмоцио-
нального напряжения в структуре алкогольного аб тинентного синдро-
ма и в период становления ремиссии.
/З-Карболин-З-карбоксилаты, напротив, не изменяют функцию серо-
тонинергических синапсов, но обладают высоким аффинитетом к БДР.
Метиловые эфиры /Зкарболин-З-карбоновой кислоты (ССМ, ДМСМ)
являются аллостерическими ингибиторами ГАМК-БДР- хлорканаль-
ных комплексов нервных клеток и п давляют эффекты ГАМК, а эти-
ловый и пропиловый эфиры действуют как антим дуля оры Однако
4-мегил- и 4-метоксиметилпроизводные этилового эфира /З-карболин-З-
карболиновой кислоты обнаруживают свойства частичных или полных
190
аллостерических модуляторов (агонистов) ГАМК-БДР-хлорканаль-
ных комплексов В разной степени они потен фуют постсинаптичес-
кие эффекты ГАМК и обладают анксиолитической и противосудорож-
ной активностью. ZK 95962 и абекарнил (ZK 112119) исследуются
(фирма Schering AG, ФРГ) в качестве потенциальных анксиолитиков,
a ZK 93426 клинически изучается как средство, устраняющее замедле-
ние восприятий, наблюдаемое при употреблении бензодиазепиновых
транквилизаторов.
Несомненно, что и сегодня не исчерпаны возможности создания на
основе Дкарболинов эффективных корректоров настроения и уровня
тревожности,антиабстинентных и противосудорожных средств.
СПИСОК ЛИТЕРАТУРЫ
1. Механизмы действия анксиолитических, противосудорожных и снотворных
средств / С.А.Ацдронати, А.С.Яворский, В. М. Чене л ев и др. - Киев . Наук.
' думка, 1988. - 256 с.
2. Кермак В., Мак-Кейл Дж. // Гетероциклические соединения / Под ред.
Р.Эльдерфильда. - М.: Изд-во иностр, лит., 1965. - Т. 7. - С.185-265.
3. Abramovitch R., Spenser I. // Adv. Heterocycl. Chem. - 1964. - 3. - P.79-207.
4 TatsuiG. II J. Pharm. Soc. Jap. - 1928 - 48 - P.92-94.
5. Ungemach F., Cook J. Ц Heterocycles. - 1978. -9, N 8. - P 1089-1119.
6. Tarreilles J., Guerin M.-C., Previcro A. 11 Biochimic. 1985. -67. - P.929-947.
7. Bailey P. Ц J.Chem. Res. Synop. - 1987. - N 6. - P.202 203.
8. Nakagawa M„ l.iu J., Ogata K., Hino T // J.Chem. Soc. Chem. Coniinuns. — 1988.-
N7. - P.463-464.
9. Ghosai S„ Banerjee P. //Indian J. Chem.-1971.-9, N 4 P.289-293.
10. Hino T., Voji K., Akaboshi S. // Chem. and Pharm. Bull. - 1970. - 18 N 2. -
P.384-388.
11. KornetM, Thio А. Ц J.Med. Chem. - 1976. - 19, N 7. P.892-898.
12. Fraim J., Ulman R. 11 Austral J.Chem. - 1974 - 27, N 6. - P.1367 -1369.
13. l.ippke K., Schunack IP., Wenning W., Muller W. Ц J.Med Chem. 1983. - 26,
N 4 P.499- 503.
14 Coutts R., Micetich R., Baker G., Benderly A. 11 Heterocycles. - 1984 . 22,
N 1. -P.131-142.
15. Brossi A. Focella A., Teite! S. Ц J.Med. Chem. - 1973. - 16, N 4 P.418-420.
16. Pat. 3023562 BRD, C07D 471/041 U.Eder, GNeef, A.Iluthetal.- Pub! 21.01.82.
17. Pat 3540653 BRD, C 07D471/04/ A.Huth, R.Schmiachen, D -N. Stophens etal—
Publ. 14.05.87.
18. Akabori S., Saito К. Ц Chem. Ber. - 1930. - 63. - S.2245 2248.
19. Meek B., SzinaiS., Wallis D. // Chem. and Ind. - 1964. - 15. - P.622.
20. SupniewskiJ., Misztal S. // Diss. Pharm. 1964. - 16 N 1. - P 9-16.
21. LeeteE. 11 J.Chem. Soc. Chem. Communs. - 1979. N 18. P.821-822
22. BergmanJ. // Actachem. scand.-1971. -25, N 9. -P3296-3298.
23. GyntherJ. 11 Ibid. - 1988. -42, N 7. - P 433-441.
24. Taborsky R., Mclsaac W // J Med. Chem. - 1964. - 7, N 2. -P 135-141.
25. StrandtmannM., PuchalskiC., ShavelJ. 11 Ibid - P.141 146.
26. DeGraw J., Kennedy J., Skinner W. 11 Ibid. 1967. - 10, N 1 - P 127-128.
27. Razniilic I., Castillo M Lopez J. Ц J.Heterocycl. Chem. - 1980. 17, N 3
P.595-596.
28. Bobbitt J., Willis J. // J Org. Chem. 1980. -45, N 10. - P.1978-1984
29. Benforouz M., Zarrinmayeh H., Ogle M. et aL Ц J.Heterocycl. Chem. 1988. -
25, N6. — P 1627 1632.
30. Aiello A., Fattorusso E., Magno&, May о IL. Ц Tetrahedron. - 1987. 43 N 24
P 5929-5932. x
31 Стынгач ЕЛ, Ривилис ФШ., Фролова НМ. и др. Ц Химия гетероцикл, соеди-
нений. - 1974. - №8. С.1066-1069.
32. Стрынгач Е.П., Кучкова КН, Ефремова Т.М., Семенов АЛ Ц Там же. -
1973. №11.-С.1523-1527.
192
33- Jordaan A., Du Plessis I.., Joy nt К II J.S.Afr. Chem. Inst. - 1968. - 21, N 1
P.22—25.
34 Arbain D., Sardent M. II Austral. J.Chem. 1987. - 40, N 9. P.1527 1536.
35. Julia M. Bagot J.. Siffert O. //Bull. Soc. chim. France. -1973. N 4. P.1424
1426.
36. Hamaguchi F. Nagasaka T.. Ozawa N., Ohki S. // J.Pharm. Soc. Jap. - 1978. -
98, N 12. — P.1635-1641.
37. Willard N., Dorland E, Pandit U. // Heterocycles. - 1987. 26, N 6. - P.1549
1555
38. Bruyn A., Eeckhaut G. 11 Tetrahedron. — 1985. — 41. N 23. — P.5553-5561.
39. VercauterenJ., Massiot G., Levy J. 11 J.Org. Chem. - 1984 49, N 17. — P.3230—
3231.
40. Gootjes J., Nauta It'. // Recueil trav. chim. 1966. - 85, N 9/10. - P.966 972.
41. Fama пака E, Nakayama K., Yanagischtma N. et al. // Chem. and Pharm. Bull. -
1980. - 28, N 8. - P.2527 -2530.
42. Massiot G., Mulamba T., Levy J. // Bull. Soc. chim. France. — 1982. — 2, N 7/8. —
P.241 248.
43. Battersby A.. Burnett A., Parsons P. //J.Chem. Soc. C. 1969. - N 8. - P.l 193 —
1200.
44. Brown R., Leonard J., Sleigh S. // J.Chem. Soc. Chem. Communs. — 1977. -
N 18. - P.636-638.
45. Rueffer M„ Kan-Fan C„ Husson H. et al. // Ibid. -1979. N 22.-P.1016 1018.
46. Ahmad V., Feuerherd K, Wintcrfeldt E. // Chem. Ber. — 1977. 110, N 1 . —
S.3624—3635.
47. Overman L.. Malone T. // J. Org. Chem. - 1982. - 47, N 27. - P.5297-5300.
48. Piper L, Maclean D., Kvarnslrom L, Szarek IP. // Can. J.Chem. — 1983 61
N12. - P.2721-2728.
49. Погосян CL4., Матевосян ILA., Мелик-Оганджанян A.C. и др. Ц Хим.-фармац.
жури. - 1986, - 20, М 10.- С.1191-1195.
50. KuabeJ., Saggau R. // Arch. Pharm. — 1973. - 306 N 7 - P.500-509.
51. MisztalS. //Pharm. Pharmacol. - 1970. 22, N 2/3. P.127 135.
52. Gessner W., Brossi A., Bembenek M., Abell C. // Arch. Pharm. - 1988. 321
N2. - P.95-98.
53. Han S., Lakchmikantham M., Cava M. // Heterocycles. — 1985. — 23, N 7. -
P.1671-1673.
54. Harrison D., Sharma R. II Tetrahedron Lett. — 1986. — 27, N 4 - P.521 524.
55. Nakagawa M„ Fukushima H., Kawate T. et al. // Ibid. - N 28. — P.3235-3238.
56. Nakagawa M., Kodato S., Hongu M., Kwate T. // Ibid. - N 51. - P.6217-6220.
57. Boyd S. II J.Org.Chem. - 1987. - 52, N 9. P.1790 1794.
58. Hamaguchi F„ Hagasaka T, Ohki S. // J.Pharm. Soc. Jap. - 1974. - 94, N 3 -
P.351-358.
59. Shimizu M., Ishikawa M., Komoda Y„ Naka/ima T. // Chem. and Pharm. BulL —
1982. - 30, N3. - P.909-914.
60. Plate R., Hout R.H, Behm H., Ottenheijm H. 11 J Org. Chem. - 1987. - 52,
N4 -P555 560.
61. Saunders G., Hamilton R., McLean S. // Tetrahedron Lett. — 1982. -23, N 23. —
P.2359-2360.
62. Hamilton R., Saunders G., McLean S // Can. J.Chem. — 1983. — 61, N 2. —
P.284 -287.
63. MakiY., Kimoto H , Fujii S. et al // J.Fluor. Chem. - 1989. - 43, N 2. P.189-
206.
64 Wenkert E. Halls T Kwart L. et al. // Tetrahedron. - 1981. - 37 , N 23.-
P.4017-4025.
65. Bringmann G., Schneider S. // Tetrahedron Lett. 1986. - 27, N 2. - P.175-178.
193
66. Yamanaka E., Narushbna M , Inukai К etal. // Chem. and Pharm. Bull. - 1986.
34, Nl.-P.77 81
67. Takano S., Murakata Ch., Ogasawara К // Heterocycles.'- 1981. — 16, N 2. -
P.247-249.
68. Maclaren J. Ц Austral. J Chem. 1987.-40 N9. P.1617-1618.
69. Hiemstra H., Bieraugel H., Wi/nberg M., Pandit U. // Tetrahedron. - 1983. 39
N 23. - P.3981 -3986.
70. Bieraugel H., Plemp R., Pandit U. 11 Ibid. - P.3987-3989.
71. Bieraugel H., Plemp R., Pandit U. 11 Heterocycles. - 1980. - 14 N 7. - P.947-
950
72. Takano S., Masuda K., Ogasawara К 11 J.Chem. Soc.Chem. Communs. - 1980. —
N 18. - P.887-888.
73. Temelen E, Dorschel С. II Ibid. - 1976. - N 14. - P.529-530.
74 Teuber N J. Quantanilla Licea R., Raabe T. II J.Liebigs Ann. Chem. - 1988. -
N 12. - S.11J1-1120.
75. У эли LI., Говипдачари T. Ц Органические реакции / Под. ред. Р Адамса. - М.
Изд-во иностр, лиг., 1953. - Сб.6. С.177-217.
76. Hudlicky Т, Kutchan Т., Chen G. et al. Ц J Org. Chem. - 1981. - 46 N 8 -
P.173 8 1 741
77. Lio B, Mclsaac W., Walker К. Ц J.Pharm. ScL - 1968. - 57, N 8. P.1364 1369.
78 Ho B., Mclsaac W. Wayne Tansey E // Ibid 1969 - 58 N 8. - P.998-1001.
79. Pat. 4291039 'ISA, C 07 13 487114 / J.Dyke, E.Kurcliacova — Publ 22.09.81.
80. Pat. 110814 ЕР, C 07 D 471/04/ A.Huth, D.Rehtz, D Seldelmann et al. — Publ.
27 10.83.
81 Pat 2475394 FYance, C07D471 /16. - Publ. 14 08.81.
82. Lhi C., Sun S., Yu Q. // J.Org. Chem. - 1983. 48 N 1. - p.44-47.
83. Ripke K., Ferguson W. II J.Heterocycl. Chem. - 1982. - 19, N 4 -P 845- 848.
84 Takano S.. Shishido К , SatoM. etal // J.Chem. Soc. Chem. Communs. — 1978. —
N 21. P.943-944.
85. Takano S.. Кого S, Sato M , Ogasawara К. 11 Heterocycles. - 1977. - 6, N 9/10
P.1699-1704
86 Pat. 4005206 USA, C07 D 401/14/ J.-C.Gaignault, J.Vacher, D.Frechet. — Publ.
25.01.77.
87. Kuehne M. Huebner J„ Matsko T. Ц J.Org. Chem. - 1979. 44 N 14 -P2477-
2480.
88. Brennan J., Saxton J. 11 Tetrahedron. - 1986. - 42, N 24. - P.6719-6734
89. Pat. 7902839 France, C 07 D 471/04 / G.Koletar, R Dupont, P.Lardenois et al.
Publ. 29.08.80.
90. Pat 7910654 France, C 07 D 471/04 / G Koletar, J.Frost, R.Dupon etal. - Publ.
21.11.80.
91. Wasserman H„ Kuo G.H. // Tetrahedron Lett. - 1989. - 30, N 7. P.873 876.
92. Aguiar I.., Filho R., Gottlieb O. et al. Ц Phytochemistry. - 1980. - 19, N 8. -
P.1850-1860.
93. Neef G„ Eder U., Huth A etal. Ц Heterocycles. - 1983. - 20, N 7. P.1295-
1313
94 Pat. 0128415 ЕР. C 07 D 471/04 / CBraestrop, E.Petersen, T Honore et al. —
Publ. 19.12.84
95 Hester J. Ц J Org. Chem. - 1964 - 29, N 10 - P.2864 1867.
96 Afsan E„ Hammouda M, Hamama W. 11 Monatsh. Chem. - 1985. 116, N6/7.
S. 851-855.
97 Bobowski G. //J.Heterocycl. Chem. - 1981 - 18, N6. -P.1179-1187.
98. Bobowski G., Shavel J. // Ibid. - 1985. - 22, N 6. P 1679 1688
99. Carrasco N., Urzua A.. Qissels B. // J.Org. Chem. - 1973. - 38, N 25. - P.4342-
4343
194
100. Irikawa H, Окипшга Y. // Chem. Utt. - 1983. - N 7. - P.1055-1058.
101. Tanako S., Hatakeyama S., Ogasawara К II J.Amer. Chem. Soc. 1976. — 98,
N 10.-P 3022 3023.
102. Tanako S., Takahashi M. OgasawaraК. I/Ibid. 1980. 102,N12.-P.4282 4283.
103. Kametani T„ Suzuki T„ Sato E. etal. // J.Chem. Soc. Chem. Commons. - 1982. -
N 20. P.1201 -1203.
104. Sandrin J., Socrens D. Hutchins L. et al // Heterocycles. - 1976. — 4 N 6. -
P.1101—1105.
105. Soerens D. Sandrin J., Ungemach et al // J Org. Chem. — 1979. — 44 N 4.
P.535-545.
106. Jawdosiuk M., Cook J. // J.Org. Chem 1984. - 49 N 15. - P 2699 2701
107. Sandrin F„ Soerens D., Mokry P., Cook J. 11 Heterocycles. — 1977. — 6, N 8. —
P.1133 1139.
10%. Hibino S. Okaraki M, Sato K. etal. Ц Ibid. 1983. - 20, N 10. - P.1957 1958.
109. Chin M., Campos O.,t Guzman F„ Cook J. II J.Amer. Chem. Soc. — 1983. - 105,
N 4. -P.907-913
110. Ungemach F., Soerens D., Weber R. etal. Ц Ibid. — 1980. - 102, N 23. — P.6976 —
6984
111. Shimizu M., Ishikawa M., Komoda Y. et al // Chem..and Pharm. Bull. - 1982.
30, N9. — P.3453 -3456.
112. Shimizu M., Ishikawa M., Komoda Y. et al II Ibid. - 1984. - 32 N 4. - P 1313-
1325.
113. Gatta R, Misiti D // J.Heterocycl. Chem. 1987. - 24, N 4. - P.1183 1187.
114. Harrison D. 11 Tetrahedron Lett. - 1981. - 22, N 26 P.2501 2504.
115. O’Malley G., CavaM. //Ibid. - 1987.-28 Nil.-P.1131 1134.
116. Yamanaka E., Shibata N. Sakai S. // Heterocycles. — 1984. — 22, N 2. - P371 —
374
117. Мукерджи А.К, Суворов H.H. // Химия гетероцикл, соединений. - 1970.
№12.-С.1626 1630.
118. Ungemach F, DiPierro М Weber R. Cook J // Tetrahedron Lett. - 1979 —
N 35. - P.3225-3228
119. Ungemach F. DiPierro M., Weber R., Cook J. // J.Org. Chem. - 1981 - 46, N 1. -
P 164-168.
120. Massiot G., Mulamba T. // J.Chem. Soc. Chem. Commune. - 1983. N 20. -
P1147 1149
121. Shimizu M., Ishikawa M. Komode. Y etal. //Chem. and Pharm. Bull. - 1984 —
32 N 2. - P.463—474.
122 Zhang L. H, Cook J. //Heterocycles. 1988 27 N6. - P.1357-1363
123 Bailey P. Hollinshead S., McLay N. // Tetrahedron Lett. — 1987 — 28, N. 43. -
P.5177-5180
124. Nakagawa M, Kogato S. Hongu M. et al. 11 Ibid. -1986.—27 N51. P.6217 -
6220.
125 Bailey P. // Ibid. - 1987. - 28 N43. - P.5181 5184
126. Onanga M„ Khuong-Huu F. Ц Ibid. - 1983. - 24, N 34. - P.3627-3630.
127 McGee L, Reddy G.. ConfaloneP. // Ibid. - 1984. - 25 N 20 P 2115-2118
128 Vercauteren J, Lavaud C., Levy J Massiot G. II J.Org. Chem. 1984. 49
N12. — P.2278-2279
129. Bailey P., Hollinshead &, Dauter Z // J.Chem. Soc. Chem. Communs. - 1985 —
N. 21 -P 1507-1509
130 Henin J. Masslot G., Vercauteren J. // Tetrahedron Lett. 1987. — 28 N 12 -
P 1271-1274
131. Bailey P., Hollinshead S. // Ibid. - N 25. - P.2879-2882.
132. Legsek B., Henin J., Massiot G., Vercauteren J. II Ibid. - 1977. - 28, N 31. -
P 3573-3576.
195
133 Bailey P.. Hollinshead S. // J.Qiem. Soc. Perkin Trans. Pt 1. — 1988. - N 4.
P.739-745.
134. Maclaren J. Ц Austral. J.Chein. 4977. - 30, N 9. - P 2045-2051.
135. Kirkpatrick A., Ma'hren J. //Ibid. - 1983. -36, N4. -P.833- 838.
136. Stoit A.. Pandit V. // Heterocycles. - 1984 - 22, N 8. - P.1687-1691.
137. Bergman J., Bergman S. // Ibid. - 1981. - 16, N 3. - P.347 350.
13 8. Bergman J., Bergma nS. I/ J Org. Chem. - 1985. - 50, N 8. - P.l246-1255
139. Roscntreter U.. Born I.., Kurr J. 11 Ibid. - 1986. -51, N 8. - P. 1165-1171.
140. Supple J., Kelson D., Lyle R. // Tetrahedron Lett. - 1963. - N 24. - P 1645-
1649.
141 BesselievreR., Corson H„ Husson D. // Ibid. - 1980. - 21, N 1. -P.63-66.
142. Wenkert E, Wk kb erg B. // J. Amer. Chem. Soc. - 1965. 87, N 7. - P 1580-
1589.
143. Wenkert E., Massy-Westropp R., Lewis R. // Ibid. - 1962. - 84, N 19. - P.3732-
3736.
144 Wenkert E, DaveK.. Haglid F. // Ibid. 1965. - N 23. - P.5461-5467.
145. Chao S., К unng F.-A., Gu J.et al. // J.Org. Chem. - 1984 49 N 15. - P.2708
2711.
146. Wenkert E„ Sprague P.. Webb R. // Ibid. 1973. - 38, N 25. P.4305 43 08.
147. Chevolot I... Husson H.P., Potier P. //Tetrahedron. - 1975.- 31, N 20. -
P.2491 2494.
148 Astro ft W.. Joule J. // Tetrahedron Lett. - 1980. - 21 N 24 - P.2341-2344
149. Rotts K.. Lil/egren D. // J.Org. Chem. - 1963. - 28, N 11. - P.3066-3070.
150. Mandal S., Pakrashi S. 11 Heterocycles. - 1987. 26, N 6. - P. 1557-1662.
151. Wenkert E, Chang C.-J., Chawla H. et al. // J Amer. Chem. Soc. - 1976. - 98
N 12. - P.3645-3655.
152. Wenkert E. Halls T. Kunesch G. et al. // Ibid. - 1979. - 101, N 18 - P.5370-
5376.
153. Wenkert E, Vankor У, Yadav J. 11 Ibid. - 1980. 102, N 27. - P. 7971-7972.
154. Wenkert Ё., Pyrek J., Cesaio 8., Vankar Y. // Ibid. - 1982. - 104. N 8. -
P.2244-2246.
155. Wanner M.. Kooincti G., Pandit U. // Tetrahedron. 1983. 39 N 22.-P 3673
3681.
156. Spitzher D., Wenkert E. 11 Angew. Chem. 1984. - 96, N 12 S.972-973.
157. Wenkert E, Angell C., Drexler J. et al. // J.Org. Client. — 1986. — 51, N 15. —
P.2995 3000.
158. Spltzner D., Zaubitzer T., Shi Y.-J., Wenkert E. 11 Ibid. — 1988. - 53, N 10. -
P.2 274 -2 278.
159. Wenkert E., MoellerP, Shi Y.-J. // Ibid. P.2383 - 2386.
160. Wenkert E. //J. Serb. Chem. Soc. 1987.-52 N 12. - P.679 684
161. Grierson D., Harris M., Husson H. // Tetrahedron. — 1983 39, N 22 P.3683-
3694.
162. Sheriff A.. McLean S 11 Tetrahedron Lett - 1982. 23. N 47. P 4895-4898.
163. Takano S., Tamura N., Ogasawara К Ц J.Chem. Soc. Chem. Communs. - 1981. -
N 22. -P.1155-1156.
164. Speckamp W., Dijkink J. Fasman P Hubert J. //Z.Naturforsch. 13. 1978.- 33
N 1. - P.127 128.
165. A tta-ur-Rahinan, Char a la M , Sultana IV., Bashir M. //Tetrahedron Lett. — 1980.
21.N18. P.1773-1774.
166. Wenkert F, Wickberg В. Ц J.Amer. Chem. Soc. — 1962. - 84, N 24. - P.4914
4919.
167. Morrison G., Cetenko IV., Shard J. II J Org. Chem. - 1967. - 32, N 12. - P.4089-
4090.
168. Stork G., GuthikondaN. I/} Amcr.Chem. Soc. 1972. 94 N 14 -P.5109 5110.
196
169. Martin S. Rueger H, Williamson S.. Grze/szczak S. // Ibid. 1987. - 109, N 20.
' P.6124—6134.
170. Atmi N„ Yatnanaka E., Endo J. et al. // Tetrahedron. — 1973. - 29, N 14.
P.2015 2021.
171. Gutzwiller J., Ptzzokto G., Uskokovic M. Ц J.Amer. Chem. Soc. - 1971. 93,
N 22. - P.5907-5908.
172. Uskokovic M., LewisR., Partridge}, etal. // Ibid. - 1979. - 101, N 22. -P.6742-
6744.
173. Aimi N„ Yatnanaka E., Endo J. etal. // Tetrahedron Lett. 1972. — N 11. -
P.1081-1084
174. Wender P., Schaus J., White A. // J. Amer. Chem. Soc. - 1980. - 102, N 19- -
P.6157-6159.
175. Jung M., Light L. Ц Ibid. -1984 - 106, N 24 . - P.7614 7618.
176. Imanishi T., Inoue M., Wada Y., Hanaoka M. Ц Chem. and Pliarm. Bull. - 1982. —
30, N 5. - P.l925-1928.
177. Danteli B., Lerna G„ Polmiseno G. // J.Chem. Soc. Chem. Communs. - 1982.
N19. — P.1092-1093.
178. Fufii T„ Onba M Sasahi IV. Ц Heterocycles. - 1984 . 22, N 8. - P.1805 1810.
179. Chevolot L., Husson A., Кап Гап C. et al. // Bull. soc. chim. France. — 1976. -
N 7/8, pt 2. -1222-1226.
180 Husson H.-Р., Chevolot l,„ Langlois Y. et al. // J.Chem. Soc. Chem. Communs. —
1972. N 16.-P.930-931.
181. Tolvanen A., LonnastnaaM. // Tetrahedron. 1987. - 43, N 6. - P.1123—1127
182. Jokela R., Schuller S, Lonnastnaa MJ I Heterocycles. - 1985. - 23 N 7. - P.l 751
1757.
183. Lotniasmaa M., Karvinen E., Koskinen A., Jokela R. Ц Tetrahedron. 1987.
43, N 9. - P.2135-2146.
184 Jokela R„ Lunasmaa M. // Ibid. - N 24. - P.6001-6006.
185. Jokela R., Karvinen E„ Tolvanen A., Lounasmaa M. // Ibid. - 1988. -44, N 8. -
P. 2367-2375.
186. Aerdeis C., Dimmerling A. // Heterocycles. - 1984. - 22, N 10. -P.2277-2283.
IW1. Herdeis C., Bissinger G. /I Z.Naturforsch. B. - 1987. - 42, N 6. - P.785-790.
188. Суворов H.H., Виноград Л.Х., Турчин К.Ф. и др. Ц Химия гетероцикл, соеди-
нений. - 1984. - № 8. - С. 1093 1100.
189. Роиilhes A., Langlois Y. // Heterocycles. — 1985. —23, N4. -P.935 938.
190. Kline T, Benington E, Morin R., Beaton J. 11 J. Med. Chem. - 1982. - 25, N 3. -
P.908 913.
191. Strandtmann M„ Cohen M.. Shavel J. /I Ibid. - 1965. 8, N 2; - P.200-204.
192. Strandtmann M., Cohen M„ Shavel J. II Ibid. - 1963. - 5, N 6. - P.719-725.
193. Kokosi J., Hemiecz L, Szasz G., Mcczaros Z. 11 Tetrahedron. Lett. 1981. -22,
N 48. - P.4861-4862.
194. Hartnecz I., Kokosi J Horvath A et al. // J.Hctcrocycl. Chem 1987. - 24,
N4 P.1045-1051.
195. Толмаков Г.П., Грандберг И.И. // Химия гетероцикл, соединений. 1980. -
№3,-С.331 334
196. Токмаков Г.П., Землякова Т.Г. Грандберг И.И. // Там же. - 1984. № 1. —
С.56-60.
197. А.с. 593096 СССР, МКИ1 С 07 Д 471/04 / Г.П.Толмаков, И.И.Грандберг.
Опубл. 30.07.76, Бюл. № 28.
198. Токмаков Г.П., Землякова Т.Г., Грандберг И.И. // Химия гегероцикл. соеди-
нений. - 1986. №12. С.1662-1667.
199-Уэли В., Говиндачари Т. Ц Органические реакции / Под ред Р.Лдамса. М.:
Изд-во иностр, лит., 1955. Сб. 6. - С.98-176.
200. Stuart К.. Woo-Ming R. // Heterocycles. - 1975. -3, N3. Р.223 264.
197
201. Pandey G„ TtwariK. // Ibid. - 1981. - 16, N 3. P.449 485.
202 Kutney J. H The total synthesis of natural products I Ed. J.Apsimon. - New York
Wiley, 1977. - Vol. 3. -P 273-438.
203. Chatterjee A. 11 Pure and Appl chem. — 1986. - 58, N 5. - P.685—692.
204. Fodor G„ Nagubaudi S. // Tetrahedron. - 1980. - 36, N 10. - P.1279-1300.
205. Frost J., Gaudilliere B., Wick A. 11 J. Chem. Soc. Chem. Commune. 1985, -
N 13.-P. 895-897.
206. Gaignault J.-C., Frechet D., Nedelec L. // Ann. pharm. France. - 1978/79. 36,
N9/10. P. 401-408.
207. Bobowski G Ц J.Heterocycl. Chem. -1983.-20, N 1.-P 183-187.
20&. Hagen T., Cook J. // Tetrahedron Lett. - 1988 29, N 20. - P2421 2424
209 itoh N. Sugasawa S. II Tebahcdton. 1959. 6, N 1. - P 16-20.
210 Yates P., MacLachlan F., Rae I. etal. // J.Amer. Chem Soc. - 1973. - 95, N 23. -
P.7842-7850.
211. Herrmann J., Cregge R., Richman J //Ibid. - 1979. 101, N6 P.1540-1544
212. Tanako £, Hatakeyama S., Ogasawara К. Ц J.Chem. Soc. Chem. Communs.
1977. -N 2. - P.68.
213 Ihara M, Taniguchi N.r Fukumoto К, Kametani T 11 Ibid. - 1987. — N 19. -
P.1438 1439.
214. Langlois Y.. Pouilhes A., Genin D etal II Tetrahedron. - 1983. - 39, N 22. -
P.3755-3761.
215. Kametani T, Kajiwara M, Fukumoto К // Ibid. - 1974 30, N 9 — P 1053—
1058.
216. Kametani T, Suzuki T. Unno К Ц Ibid. - 1981 37, N 22. - P.3819-3823
217. Szabo L„ Sapl J., Nogradi K. etal. // Ibid. 1983. - 39, N 22. P.3749-3753.
218. Baggiolimi £., Phzolato G., Vskokovk M. // Ibid. -1988. - 44, Nil. - P.3203-
3208.
219 StoitA, Pandit U. // Ibid. - N19. - P 6187 6195
220 Banks B. Calverley M. i.dwirds P., Harley-Mason J //Tetrahedron Lett. - 1981.-
22, N 17.-P.1631-1634.
221 RosenmundP, Casutt M. Ц Ibid. - 1983. -24 N 17. —P 177} 1774.
222. Hatakeyama Saijo K., Takano S. 11 Ibid. - 1985. - 26, N 7. - P 865 868.
223. Nakagawa M, Liu J.J. Ogata K. Hino T // Ibid. - 1986 27, N60 P.6087-
6090.
224 Novak L., Szantay Cs. Ц Chem Ber. - 1969 - 102, Nil - S.3959- 3962
225. Kametani T, Takeda H, Hirai Y. et al. Ц J.Chem. Soc. Perkin Trans. Pt 1
1974.-N 18. P.2141-2145
226. Szabo L„ Kalaus G., Nogradi К Szantay Ct Ц Acta chim. Acad, set hund. -
1979. - 99, N 1. - P.73-80.
227. Fu/ii T, Yoshifuji &, Ito H. // Chem. and Pharm. Bull. 1988. - 36, N 9. -
P 3348-3353.
228. Jilek J., Pomykacek J., Jirkasky I., Protiva M. Ц Cesk. Farm. - 1963 - 13 -
P.229 233
229. Pandey G. TiwariK. // Heterocycles - 1979. - 12, N11. - P.1483-1485
230. Buzas A., Jacquet J P Lavielle G 11 J.Org.Chem. - 1980. -45, N 1. P.32 34
231. Mirand Richard C„ LeMen-Oltvier L., Levy J. LeMenJ. Ц Heterocycles. - 1979.-
12, Nil.-p 1409-1411
2j2. Nakagawa M., Kiuchl M., Obi M et al. // Chem. and Pharm Bull. - 1975. 23,
N 2. - P.304-312.
233 SuzukiT., TominoA., UnnoK, Kametani T Ц Ibid. - 1981.-29,N1 P.76 81
234 . McLean S., Dmitrienko G„ Szakolcai А I/ Can. J.Chem - 1976. - 54 N 8
P.1262-1277.
235 .Kalaus G„ Szabo L , Horvath J., Szantay C. /,' Heterocyirles. - 1977 - 6 N3 -
P321-325.
236 .Czantay C, Czabo L.,KalausG. //Tetrahedron. - 1977. 33, N14. -P.1803 -1808
198
231. Pearlman В. //J.Amer. Chem. Soc. - 1979 101, N 21. - P 6404 6408
238 Blasko G, Monty K., Novak L.t Szantay Cs. Ц fa chim. Acad, sci hung. -
1979.-99, Nl. P35 41.
239. Tbnako S., Hatakeyama S., Ogasawara K. // J.Chem. Perkin Tians. Pt 1. - 1980. -
N 2. - P.457—461.
240. Туляеанов T.C., Ибрагимов A.A., Юнусов С.Ю. и др. // Хим.-фармац. журн.
1987,— № 3. - С.295- 297.
247. Kalaus G., Galambos J, Kajtar-Peredy M. et al. Ц J Liebigs Ann. Chem - 1987.
N9. -S. 745 -749.
242 Kasanort S., Sato H. Komura N Kaneko С // Heterocycles. - 1985. - 23, N 5. -
P.1101-1106.
243 Whittaker N. /I J.Chem Soc C. - 1969 Nl. - P. 85-89.
244. Martin S., Benage B., Hunter J. 11 J.Amer. Chem. Soc - 1988. 110 N 17
P.5925-5927.
245. Andrtamtalisoa R., Langlois N., Langlois Y. // J.Org Chem. - 1985. 50, N7 -
P.961-967.
246. Kanaoka M, Sato E„ Ban Y 11 Chem. and Pharm Bull. - 1967. 15 Nl
P.101-107.
247. Kutney J. Ц Heterocycles. 1977 8, spec, issue. - P 813 -830.
248. Kutney J., Eigendorf G., Matsue H etal. 11 J.Amer. Chem. Soc. - 1978 -100
N3. P.938-943
249. Settiinj G., Del Ghidlce M„ Ferretti R„ Gatta F I/ J.Heterocycl. Chem. - 1988. —
25, N 5. P.1391 1397.
250 Takano S., Shishido K., Imamura Y. et al. Ц Heterocycles. — 1982 — 19 N 1
P.83-87.
251. Sainsbury M., Uttley N. // J.Chem. Soc. Perkin Trans. Pt 1. 1977. - N 19. -
P.2109-2115.
252. Yamada F., Saida Y., Somei M // Heterocycles. - 1986. - 24, N 9. - P.2619
2627.
253 A.c.495309 СССР, C 07 Д 27/62 / Д.Р.Лагидзе, Л.Я.Талакпадзе, P МЛагидзе. -
Опубл. 21.06.76, Бюл.№46.
254. Петрова М.Ф, Каверина Н.С., Меньшиков Т.П. // Журн. общ. химии. - 1963.-
33. №4. С.1333 1334.
255. Семенов Л-4., Терентьева И.В., Стынгач Е.П. // Химия гетероциклических
соединений. - Рига Зинатне 1967. - Сб. 1: Азотсодержащие гетероцик
лы. - С.38-43.
256. Стынгач Е.П., Семенов А.А. Ц Химия гетероцикл, соединений. - 1971.
№5.- С.621-622.
257. Ефремова ТМ., Кучкова К.И.. Семенов А.А. // Там же. - 1974. - № 10. —
С 13 82 1387.
258. Pandey G., TiwariК. Ц Synth. Communs. — 1980. — 10, N 7. - Р.523-527.
259 Murakami Y., Takahashi H., Nakarawa Y. et al. 11 Tetrahedron Lett - 1989. —
30, N 16. - P.2099-2100.
260. Hajicek J., Trojanek J // Collect. Czech. Chem. Communs. — 1982. — 47, N 3
P.809-813
26Л Haji?ekJ. Holubek J., Trojanek J. Ц Ibid. N40. P.2749-2761.
262. Ha/ilekJ., Trojanek J. Ц Ibid. - N 12 - P.3306 3311.
263. Szabo L., Dobay L., Kalaus G. et al. Ц Arch. Pharm. 1987 320 N 9.
P.781-789.
264. Pandit U., Das Biswanath С. 11 Tetrahedron. - 1987. 43, N 18. P.4235-
4239. . ......
265.Atta-ur-Rahrnan // J Chem. Soc. Perkin Trans. Pt 1. - 1972. - N 5.
P 36-738.
266. Kende A., Ebetino F., Battista R. et al. Il Heterocycles. - 1984. 21, Nl. -
P.91—106.
199
267. Rao A., Chavun S., Sivadasan L. / Indian J Chem. B. 1984. 23, N 6. —
P 496-497.
268 Rao A., ChavanS., Sivadasan Ц Tetrahedron. — 1986 . 42, N 18. — P.5065—
5071.
269. Snyder H.. Werber F. Ц J.Amer Chem. Soc. - 1950. - 72, N 7. -P 2962-2965.
270. Previero A., ColettiPrev его M.-A., Barry L.-G. II Can. J.Chem. - 1968. 46,
N 21. - P.3404 -3407.
211. Kametani T, Takagi N., Kanaya N., Honda T. Ц Heterocycles. - 1982. 19,
N3. - P.535-537.
272. Letellier &, Fleury B. // J.Heterocycl. Chem. - 1988. - 25, N 4. - P.1265-1270.
213, Ishida A., Nakamura T, Irie K., Oh-ishi T. // Heterocycles. — 1983. 20, Nl. -
P.128.
274. Ishida A , Nakamura T„ Irie К Oh-lshi T. Ц Chem. and Pharm Bull. - 1985 -
33, N 8.-P.3237-3249.
275. Takano S., Satan £, Ogasawara К. 11 J.Ctem. Soc. Client. Commons. - 1988. —
N 1. - P.59-60.
276 Yamada K„ Takeda M., Iwakura T. Ц Tetrahedron Lett. 1981. — 22, N 39. -
P.3869-3872.
277. Yamada K., Takeda M, Iwakuma T. 11J Chem. Soc. Perkin Trans. Pt 1. 1983
N 2. - P.265-270.
278. Shono T., Miyamoto T, Maukami M., Hamaguchi H // Tetrahedron Lett. —
1981. - 22, N 25. - P.2385-2388.
279. Schoenenberger B., Brossi А Ц Helv. chim. acta. - 1986. -69, N 6. - P.1486
1497.
280. Bremner J., Browne E., Davies P. 11 Austral J. Chem. - 1980. - 33, N 6.
P.1335-1343.
2ВЛ.. Mistral S., CeglaM. Ц Synthesis. - 1985. - N 12. -P.1134-1135.
282. Mohrle H„ Schillings P. // Arch. Pharm. - 1986. - 319, Nil.- P.1043-1049.
2K3. Plgulla J., RoderE // J.Liebigs Ann. Chem. - 1978. - N 9. - S.1390-1398.
284. Keberle H, Hoffmann K. // Gaz. chim. ital. - 1963. 93. P.23 8-243.
285. Rosenmund P., Trommer W., Doru-Zachertz D., Ewerdwalbesloh U // J Liebigs
Ann. Chem. - 1979. - Nil. - S.1643-1656.
286. Gribble G„ Johnson D. // Tetrahedron Lett. - 1987.-28, N44. - P.5259-5262.
287. Gribble G., Barden T., Johnson D. // Tetrahedron. - 1988. - 44, Nil. P.3195
288. Bobbitt J Kulkarni C„ Dutta C. et al // J.Org. Chem. 1978 - 43, N 18. -
P.3541-3544.
289. Curness K„ Dyke S. Ц Heterocycles. - 1979. - 12, N 9. - P 1133- 1135.
29(3. Mackay Ch , Waigh R. I j ibid.- 1984 - 22,N4 P687-689.
291. Семенов АЛ , Стынгач ЕП Куперман Г.М, // Химия гетероцикл, соедине-
ний. - 1968. - № 5. - С.878-880.
292. Семенов АЛ. Ц Химия гетероциклических соединений. - Рига : Зинатне,
1967. - Сб. 1. Азотсодержащие гетероциклы. С 44-45.
293 Кучкова К.И. Семенов АЛ. Ц Химия гетероцикл, соединений. - 1967.
N» 6.-С.1131.
294. Кучкова К.И., Семенов АЛ , Терентьева И.В. Ц Там же. 1970. №2.-
С.197-201.
295. Коган НЛ. // Там же. 1980. - № 1. - С.59 -62.
2', .Ainscough М„ Temple А Ц J Chem. Soc. Chem. Communs. - 1976. - N 17. -
P.695-697.
297. Westling M., Smith R„ Livinghouse T // J.Org, Chem 1986. 51, N 8. -
P.1159-1165.
298. Bonjouklian R , Moore R„ Patterson U. // Ibid. -1988. -S3, N 25 P.5866 5870.
299 Kobayashi G„ Matsuda Y, Natsuki R„ Tominaga К // J.Pharm. Soc Jap.
1972.- 92, N6.-P 713-718.
200
300 Lehmann J.. Chonetm K.. El-Gendy A. // Arch. Pharm. - 1987. - 320. N 1
P.30-36.
301. Lehmann J., Pohl U. //Ibid. 1988. 321, N 7. - P.411 414
302 Mashelkar U., Usgaonkar R. // Indian J. Chem. В - 1978. - 16, N 9. P.782 785.
303. Bradsher C. Litzinger E. Ц J.Heterocycl. Chem. 1964 - 1 N 4.
P.168 170
304 Ломакин A H., Терентьева И. В II Химия гетероцикл, соединений 1968. -
№6. С 1041-1043.
305. Tada М. Sa ki Н Oikawa А /I Bu Chem. Soc. Jap. - 1983. 56, N 5. -
P. 1450-1454
306. Cain M Weber R. Guzman F. et al. 11 J.Med. Chem. — 1982 — 25, N 9.
P1081-1091.
307. Hagen T, Guzman F„ Schultz C. et al. 11 Heterocycles. - 1986. 24, N 10.
P.2845-2855.
308 Cain M, Mantel R., Cook J. // J Org. Chem. - 1982. - 47 N 25. - P 4933-4936.
309 Ho B., Mi,Isaac M, Tansey L., Walker К /I J Pharm. Sci. - 1969. - 58, N 2. -
P.219 221.
310. Ho B., Li K.-C., Walker K. et al. // Ibid. - 1970. - 59, N 10. - P.1445 1448
311. Beugehnans-Verrier M.. Potter P. 11 Tetrahedron. — 1987. — 43, N 15. - P.3465-
3470
312. Julia M., Lallemand J. Ц Bull. Soc. chim. I rance. — 1973. N 6, Pt 2. - P.2058
2064.
313. Guzman 1., Cam M., Lorscheid P. et al Ц J.Med. Chem. - 1984. - 27, N 5.
P.564-570.
314. Trudell M„ Fukada N., Cook J. Ц J.Org. Chem. -1987. -52, N 19. - P.4293 -4296.
315. Fukada N Trudell M., Johnson B., Cook J. // Tetrahedron Lett. 1985. - 26,
N18. P2139 2142.
316. Hino T, Lai Z., Seki 11. et al Ц Chem. and Pharm. Bull. - 1989. - 37, N ll).
P.2596 - 2600
317. Kanaoka Y., Sato E., Yonunilsu О. Ц Chem. and Ind — 1968. - 37 — P.1250.
318. Jori G., Galiazzo G., Gennari G. /I Photochem. Photobiol. 1969 — 9, N 2. -
P.179- 181.
319 Mullet W„ Preup R., Winterfeldt E. // Chem Bei. - 1977. HO, N 7. - S.2424
2432.
320. Previero A , Barry L.-G., Torreilles J. // Tetrahedron. — 1984. - 40,N 1. P.221
234.
321. Becalski A., Kaczmarek 1.., Nantke-Namirski P. // Acta pol. pharm. 1984. — 41,
N6. -P.601 606
322. Kametard T„ Ogasawara K.; Yamanaka T. 11 J.Chem. Soc. C. - 1968. — N 8. —
P.1006 1007.
323. Boger D., Panek J. 11 Tetrahedron I eit. - 1984 - 25, N 30. - P.3 175 3178.
324. Moody C., Ward J. Ц J.Chem. Soc. Comm tins. 1982. — N 20. 1’ 1148- 1150.
325. Moody C, Ward J. // J.( hem. Soc. Perkin Tians. Pt 2. - 1984. bl 12. P.2895 -
2901.
326. Dtipas G., Lhijlos J., Qulguiner G. Ц J Heterocycl Chem. - 1983. — 20. bl 4. —
P.967-970
327. Biere H Riisse R . Seelen It' Ц J I rebigs Ann. Chem 1986. N10. - S. 1749
1764
328. Pat. 110813 LP.C07D471/04 I 11 Biere Pnbl. 13.06.84
329. Benson S„ Gross J., Snyder J. // J.Org.CJieni 1990. 55, N10. P.3257 3269
330. Plate R.. Mrard R., Ottenhei/in IL II Ikteiocyelcs. 1986. 24, Nil. 1’3105
3114
331. Л.о, 194093 СССР, Кд. 12p, 2 / Г ПЛорофеенко, Л.Н.Дукнко. — Опуб г.
30.03.1967, Ьюн. № 8.
201
332. Дорофеенко Г.Н., Дуленко В И. // Химия гетероцикл, соединений 1969. —
№ 3. - С.417-421.
333. Жданов Ю.А., Корнилов В.И., Дорофеенко Г. И. /I Докй. АН СССР. - 1968.
178, №4. С.849-851.
334. В0пюгйК И Angew.Chem. -1960.-72, N 10. - S.331-342.
335. Balaban A., Schroth W Fischer (j. // Adv. Heterocycl. Chem. — 1969. - 10 —
P.241 -326.
336. Balaban A., Dinculescu A., Dorofeenko G. et al // Ibid. - 1982. — 434 p. —
(Adv. Heterocycl.; Suppl. 2).
337. Brown I., Henbest H., Jones E. // I.Chem. Soc. - 1952. - N 8. - P 3172-3176.
338. Дуленко В.И., Дуленко Л.В., Семенов H.C. и др. // Реактивы и особо чистые
вещества. 1976. - Вып. 3. - С.18-20.
339. Дуленко В.И. Семенов НС., Николюкин ЮА и др. // Химия гетероцикл,
соединений 1971. - №4 С.568.
340. Комиссаров И.В., Семенов Н.С., Лукьяненко В.И. и др. II Хим.-фармац.
журн. - 1977. - № 5. - С.93 97.
341. Дорофеенко Г.Н., Дуленко Л.В., Семенов Н.С. Ц Химия гетероциклических
соединений. - Рига Зинатне, 1970. - Сб.2 : Кислородсодержащие гетеро-
циклы. С.24 5 249.
342. Zhdanov YuA., Kornilov V.I., Dorofeenko G.N Ц Carbohyd. Res. - 1968. -
N6. -P.414—4i7.
343. Дуленко В.И., Лукьяненко В.И., Кабальный А.В и др. Ц Химия гетероцикл,
соединений. - 1985. - № 3. - С.363-366.
344. Комиссаров И.В., Дуленко В И., ДолженкоА.Т и др. Ц Хим.-фармац. жури,-
1985. - №3,— С.172-176.
345. Вележева В.С., Севодин В.П., Ерофеев Ю.В. и др. Ц Химия гетероцикл, соеди-
нений. - 1977. .- № 3. - С.360-368.
346. Комиссаров И.В., Дуленко В.И., Долженко А.Т. и др. //Хим.-фармац. журн.-
1989. - №6. - С.675-678.
347. FYeterK. I/ J.Uebrgs Ann. Chem. - 1978. - N 8. - S.1357-1364.
348. Neef G., Ulrich E.. Andreas H. et al. Ц Heterocycles. 1983 — 20, N 7. —
P 1295-1313.
349 Ломакин АЛ.. Терентьева ИД // Журн. Всесоюэ. хим.об-ва им. Д И.Менделе-
ева. — 1968. — 13.-№ 3. - С.354-355.
350. Sultana N., Malik A., Siddiqui 5. // I.Chem. Soc. Pakistan. - 1981 - 3. N 3. -
P.l 35-13 8.
351. Siddiqui S.. Ahmad V., Khan M., Ismail S. // Z.Naturforsch. 1973. — 286,
N7/8. - P.486-487.
352. Rinehart К. Kobayashi J., Harbour G. et al. // I. Amer. Chem. Soc. — 1987. —
109, N 11. - P.3378-3387.
353. Pat. 3322894 NRD, C 07 D 471/04 I A.Huth.R.Schmiechen, D.Seidelman,
D.Pahtz Publ. 03.01.85.
354. Hath A., Beets I., Schumann I., Thic'-rt K. // Tetrahedron. 1987. —43, N6. —
P.1071-1074.
355 Kobayashi J., Taniguchi M, Hino T., Ohizumi Y. 11 J.Pharm and Pharmacol. -
1988. - 40. - P.62-63.
356. Dodd R., Quannes C., Prado C.L. et at Ц J.Med. Chem. - 1985. -28 N 6. -
P. 824-828.
357. Allen M. Hagen T„ Trudell M. et al. // Ibid. - 1988. - 31, N 9.
P.1854-1861.
358. Neef G., Eder U., Petroldt K. etal. 11 J.Chem. Soc. Chem. Communs. - 1982. —
N6.-P.366 367.
359. Сергеев П.В., Шимановский Н.Л. Рецепторы физиологически активных ве-
ществ. - М.: Медицина, 1987. 400 с.
202
360. Раевский КС, Георгиев В.П Медиаторные аминокислоты: Нефрофармакол.
и нейрохим.аспекты. - М Медицина, 1986. — 240 с.
361 Комиссаров НВ. Механизмы химической чувствительности синаптических
мембран. - Киев Наук, думка, 1986. — 240 с.
362. Корнеев А.Я., Лидеман Г.Р. // Успехи соврем, биологии. - 1985. - 100,
вып 1.-С.51-67.
363. Braestrup С, Nielsen М // Handb. PsychophannacoL - 1983. - 17. Р 185
2М
364 Richards J.G.,Mbhler Н. //Neuropharmacology -1984. 23, N 2В-Р.233-242.
365. Mohler И. Okada Т //Science. - 1977. - 198, N 4319. - Р. 849 851.
366. Squkes R.F., Braestrup С. 11 Nature. — 1977. - 266, N 5604. — P.732-734.
367. Richards j.G., Schoeh P., Haring P. et al /I Experientia. - 1985 - 41, N 6. -
P 611.'
368. Richards J.G., Mohler H. Battersby M.K 11 Neurosci. Lett 1980. - 19, Suppl.
5. - P. 70.
369 Braestrup C, Nielsen M. // Arzneimitt. Forsch. / Drug Res. - 1980. - 30 N 5A -
P.852- 857.
370. Haefely W. // Pharmacopsychiatry. — 1985. - 18, N 1. - P 163 166.
Ill Hunkeler W, Mohler H, Pieri L etal // Nature - 1981. - 290, N 5806. -
P.514-516
372. Yokoyama N., Ritter B., Noubert A.B. /I J.Med. Chem. - 1982. - 25, N 4.
Р.ЗЭ 7-339.
373 Stein L., Wise CB., Berger B.D.' Ц The Benzodiazepines. - New York Raven
Press, 1973. — P.299-326
374. Costa E, GuidottlA., Мао C.C., Suria А. Ц Life Set - 1975. - 17, N 2. - P.167-
186.
375. Pole P., Haefely W. // Naunyn — Schmiedeberg’s Arch. Pharmacol. - 1976. — 294,
Nl. - P.121-131
376- Zakusov V Y Ostrovskaya R.U., Markovitch V V. et aL 11 Arch. int. parmacodyn.
et ther. - 1975. - 214, N 2. - P.l 88-205.
37 7.IversenL.L. Ц Nature. - 1977. - 266, N 5604. - P.678.
378. Phillis J W., O'Regan MN /I Progr. Neuro4*sychopharmacoL and BioL Psychiatr.
1988. - 12, N4. - P.389-404.
379. Talleman J.F., Thomas J.W., Gallager D W. // Nature. - 1978. - 274, N 5653. —
P.383-385.
380. В*оц? E.H.F., Iversen LL Ц J.Neurochem. - 1985. - 44, N 4. - P.1162-1167
381 Costa E, Guidotti A. // Ann. Rev. Pharmacol, and Toxicil. - 1979. - 19, N 5. -
P.531-545.
382. Squres R.F., Benson D.J., Braestrup C. et al. 11 Pharmacol, and Biochem. Behav.—
1979. - 10, N 3. - P.825-830.
383. Gallager D. W Ц Eur. J. Pharmacol. - 1978. - 49, N 1. - P 133-143.
384. Choi D.W., Forb D.H., Fischbach G.D. // J.Neurophysiol. - 1981. -45, N 6. -
P.621-631.
385. Study RE, Barker J.L // Proc. Nat. Acad. Sci. USA. - 1981. - 78, N 11. -
P. 7180-7184
386. OlsenR.W. // Ann. Rev. Pharmacol. andToxicol. - 1982. - 22, N 2. - P.245 -277.
387. Аврамец ИИ, Комиссаров ИВ. // Бюл. эк спер им. биологии и медицины. -
1982. 94 № 16. - С.58-60.
388. Hatnil О.Р., Bormann J. Sakmann В. 11 Nature. - 1983. - 305 N 5937. - P.805-
808.
389. Hattori К Akalke N., Oomura J. etal Ц Amer J. PhysioL - 1984, - 246 N 15.-
P.259-265.
390. AkalkeN. II J.PharmacoL Soc. Jap. - 1985. - 105, N10. - P.926 -936.
391. Bowery N.G. //TrendsPharm. Set - 1982. - 3, N 10 -P.400-403.
203
392. Cherubini E„ North ЯЛ. // Neuroscience. - 1985. - 14, N 1. - P.309-315
393. Desarmenien M., Feltz P, Occhipinnti G. et al. Ц Brit. J .Pharmacol. - 1984 -
81, N 2. - P.327-334
394 Barnard E.A., Stephenson F.A. Sigel E etal. // Neuropharmacology. - 1984 -
23, N7B. — P.813—814.
395. Chang Li-Ren, Barnard ЕЛ. Ц J.Neurochem. 1982. - 39, N6 - P.1507- 1918.
396. Schofield P.R., DarlisonM.G,, Fujita N et al 11 Nature. - 1987. - 328, N6127. -
P. 221-227.
397. Ehler F.J., Roeske W.R., Braestrup C., Yamamura S.H // Eur J. Pharmacol. -
1981. - 70, N4. - P.593 -596.
398. Fujimoto M„ Mirai K.. Okabqyashi T. II Life Sci. - 1982. - 30, N 1. - P.51-57.
399. Enna S.J., Snyder S.H. Ц Mol. Pharmacol. - 1977. - 13, N 3. - P 442-453.
400. Chwen A. Y., Ulloque R.A., Swinyard E.A., Wole H.H. Ц Neurochein. Res. -
1985. - 10, N 7.-P.871-877.
AOT.Trifiletti R.R., Snowman A.M. Snyder S.H. // Eur. J.Pharmacol. - 1984 106
N2. _ p.441-447.
402. McAllister Williams R.H., Mitchell R. Ц Brit. J.Pharmacol. 1985 - 84, Suppl. —
P.60.
403. Unnerstall J.A., Kuhar M.J., Niehoff D.L., Palacios J M 11 J.Pharmacol. and Exp.
Ther. 1981.-218, N3.-P.797 804.
404. Braestrup C., Nielsen M. Ц Brain Res. 1978. - 147, N 1. - P.170-173.
405. Lippa A.S., Critchett D., Sana M.C. et al. Ц Pharmacol, and Biochem. Behav. -
1979. - 11, N 1. — P.99-106.
406. Regan J.W.. Roeske W.R., Malica J.B. et al. U Mol. Pharmacol. - 1981. - 20,
N 3. - P.477-48.3.
407. Klepiier C.A., Lippa A.S., Benson D.J. et al. // Pharmacol, and Biochem. Behav. —
1979. - 11, N3. -P.462-475.
408. Lippa A.&, Beer B., Sa no M. C. et al. Ц Life Sci. - 1981. - 28, N 20. - P.2343 -
2347.
409. Lippa A.S., Meyerson L.R., Beer B. // Ibid. 1982. - 31, N 16. - P.1409 1417.
410. Cooper S.J.. Kir кат T.C., Estall L.B. II Trends Pharmacol. Sci. - 1987. - 8, N 5. -
P.180-184.
411. Chiu Т.Н., Dryden D.M., Rosenberg H.C. // Mol. Pharmacol. — 1982. - 21, N 1. —
P.57-65.
412. Quast U., Mahlamn H. // Biochem. Pharmacol. - 1982. - 31, N 17. - P.2761-
2768.
413. GeeK.W.. Yamamura H.I. //Life Sci. - 1982. - 31, N 18. - P.l 939 1945.
414. Sieg hart IP. // J. Neural. Transmiss. - 1983. — 18, Suppl. — P.345-352.
415. Eichinger A., Sicghart W. [I J.Neurochem. - 1985. - 45 N 1. - P.219-226.
416. Skerritt J.H., Macdonald R.L. // Eur. J.Pharmacol. - 1984. - 101, N 1/2. -
P.127-134.
417. Braestrup C„ Nielsen M., Olsen C.E. II Proc. Nat. Acad. Sci. USA. - 1980. - 77,
N4. - P.2288-2292.
418. Braestrup C., Nielsen M. // Tctrahydrolsoquinolines. Proc, of a Workshop Held at
the Salk Institute. La Jolla (California. Dec. 1981). — New York. A.R. Liss INK.,
1982. - P.227-231.
4\9. Hirsch J.D., Lydigsen J.L. // Eur. J.Pharmacol. - 1981. - 72, N4. - P.357 360.
420. Schwarts R.D., Thanas J.W., Kempnes E.S. etal. // J.Neurochem. — 1985. — 45,
Nl. - P.108-115.
421. Patel J, Marangos P.J.. Goodwin F.K. Ц Eur. J. Pharmacol. - 1981.-72, N4.-
P.419—420.
422. Fchske K. J., Zube L, Borbe H.O. etal. //Naunyn Schiniedebcrgs Arch. Pharma-
col. - 1982.-319, N 2. - P.172-177.
204
423. Fehske KJ., Muller W.E. Ц Brain Res. - 1982. 238 N1. - P.286-291.
424 Medina J.H., Skin M. DeRobertis E. //J.Neurochem. 1989. -52, N3.-P.665—
670.
425. AndersonR.A.,Mitchell R. // Neuropharmacology. - 1984 23, Nil. — P.1331 —
1334.
426 Nielsen M., Schou H., Braestrup C. // J.Neurochem. 1981. - 36, N 1. - P.276 —
285.
427 Nielsen M., Braestrup C. // Nature. - 1980. - 286 N 5773. - P.606-607.
428. Braestrup C„ NielsenM. // Ibid. - 1981. - 294, N 5840. P.472-474
429 Braestrup C., Nielsen M., Honore T // J.Neurochem. - 1983. 41, N 2. P.454-
465.
430. Honort T.. Nielsen M., Braestrup C. // J.Neural Trahsm. - 1983. — 58, N 1/2. -
P.83 -98.
431. MarangosP J Patel J.. Htrata F. et al //Life Sci. - 1981. - 29 N 3. - P.259-267.
432. Chin P., Chin S., Mishra R.V. II Res. Commun. Pathol, and Pharmacol. - 1984. -
44, N 2. -P. 199-213.
433. Jacqmin P., Wibo M. Lesne M //J.Pharmacol. - 1986. - 17 N2. P 139 145.
434. Martin I.L., Candy J.M. // Neuropharmacology. - 1978. - 17 N6. - P.993-998.
435. Honore T, Drejer J. // J.Pharm. and Pharmacol. -1985. - 37, N12.-P.928—929.
436. Wood P.L., Pilapil C., La Faille F. et al. 11 Arch. int. pharmacodyn et ther. —
1984. - 268, N 2. - P.194-201.
437. Braestrup C„ Nielsen M., Honore T. et al. H Neuropharmacology. - 1983. - 22,
N 12B. P 1451-1457.
43E Mohler H. // Benzodiazepine recognition site ligands: biochemistry and pharma-
cology / Eds G.Biggio, E.Costa. - New York : Raven Press, 1983. - P.47-56.
439. Karobath M, Supravilai P. // Neuroscl. Lett — 1982. - 31. N 1. - P.65-69.
440. GeeK.W., Yamamura H.I. //Eur. J.Pharmacol. - 1982. 82, N 3/4. - P.239-241.
441. Brown Ch.L., Martin I.L. // Brit. J.Pharmacol. - 1982. - 77, Proc. P.312.
442. Dellouve-Courillon C., Lamboler B., Potier P., Dadd R.H. II Eur. J.Pharmacol. —
1989. - 166, N 3. - P 557-562.
443. Kellar KJ., Cascio C.S. // Ibid. - 1982.-78 N4. - P.475-478.
444. Casdio C.S., Kellar KJ. // Ncuropharmacology. — 1982. - 21, N 10. — P.1219—
1221.
445. Bruning G., Rommelspacher H // Life Set - 1984. - 34, N 15. — P.1441—1446.
446. Wood P.L., Loo P„ Brounwalder A.etal. II J.Pharmacol and Exp. Ther. - 1984 —
231, N3.-P.572-576.
447. A kaksinen M.M., Saano V., Steidel E. et al. 11 Acta pharmacol. et toxicol. —
1984. -55, N3. - P.280-385.
448. Muller IV.E, Fehske KJ., Borbe H.O. et al. 11 Pharmacol, and Biochem. Behav. —
1981.- 14, N5.-P.693-699.
449. Itoiuga Masahiro, Uruno Tsutomu, Kubota Kazuhiko // Jap. J.Pharmacol.
1988.-46, N 4. P.319 324.
450. Fawlik M., Rommelspacher H. // Eur. J.Pharmacol. - 1988. - 147, N 2. — P.163—
171.
451. Завилянский ИЛ., Блейхер ИМ. Психиатрический диагноз. - Киев : Здо-
ров’я, 1979. 224 с.
452. Lal Н., Emmett-Qglesby M.W. // Neuropharmacology. - 1983. - 22, N 12В.
Р.1423-1441.
453. Tbeit D. I/ Neurosci. and Behav. 1985. 9, N 2. P.203 -222.
454. Chopin Ph., Briley M. // Trends Pharmacol. Set - 1987. -8, N 10. - P.383—388.
455 Q-awley .LN. // Pharmacol, and Biochem. and Behav. - 1981. — 15, N 4. — P.695—
'699.
456. ListerR.G. // Psychopharmacology. 1987. 92, N 2. P.180-185.
205
457. File S.E Ц J.Neurosci. Methods. - 1980. - 2, N 2. - P.219 238.
458. Пошивалов В.П. Ц Бюл. эк спер им. биологии и медицины. - 1985. - 99,
№3.- С.323-325.
459. Poshivalov V.P., Nieminen S.A , Airaksinen ММ. // Aggressive Behav. — 1987. —
13, N 2. Р 141-147.
460. Ljunbberg Т„ Lidfors L., Enquist M Underst edt U. 11 Psychopharmacology
1987. - 92, N4. -P415-423.
461. Skobtlc Ph., Steven P. Crawley J. etal. Ц Eur. J. Pharmacol - 1981. - 69, N4. -
P.525-527.
462. Vellucci S.V, Webster R.A. //Psychopharmacology - 1982. -78, N3 — P.2S6
260.
463. Petersen E.N., Paschelke G., Kehr W. et al // Eur. I Pharmacol. - 1982. - 82,
N 3/4. — P.217-221
464. Shannon H.E., Guzman F„ Cook JM. // life Sci. - 1984 - 33, N 2. - P 2227-
2236.
465. Stephens D.N., Shearman G.T., Kehr W // Psychopharmacology. - 1984 83,
N 3. - P.233 -239.
466. Brown Ch.J,., Johnson A M. // Brit. J.Pharmacol. - 1982. — 75 Suppl - P.43.
467. Darragh A., Iambi R., Kenny M. et al. // Brit J.Clin. Pharmacol. - 1982. - 14,
N7.-P.677-682.
468. File S.E., Lister R.G., Nutt D.J. // Neucopharmacology. — 1982 21, N 10. —
P.IO33- 1037.
469. Hindley &И'., Hobbs A., Paterson I.A., Roberts M H.T 11 Brit. J.Pharmacol
1985. 86, N3. - P.753-761.
470. File S.E., Pellow Sh. // Ibid. - 1984.-82, Suppl. - P.45
471. File S.E., Pellow Sh. Braestrup С, Ц Pharmacol Biochem. and Behav. — 1985. -
22, N 6.—P 941-944
472. Pellow Sh., File S.E. // Physiol, and Behav. - 1985. - 35, N 4. - P 587-590.
473. Баргесян Г.Г., Пляшкевич Ю.Г., Демушкин В.П. Ц Бюл. эксперим. биологии
и медицины. - 1987. — 204, N* 11 - С.579-582.
474. File S.E., Pellow Sh. Ц Arch. ini. pharmacodyn. et ther. 1984. 271, N 2. -
P.198 205.
475. File S.E., Lister R.G., Martinov R., Tucker J. C. // Neuropharmacology. - 1984. -
23, N 4.- P.482 486.
476 File S.E., Pellow Sh., Jensen L.H. II J.Neural. Transm. — 1986 - 65, N 2. -
P.103-114
477. Novas M.L., Wolfman C., Medina J.H, De Robertis E. // Pharmacol. Biochem. and
Behav.- 1988 30, N 2. - P.331-336
478. Petersen E.N., Jensen L.H. 11 Eur. J. PliarmacoL - 1984. - 103, N 1/2. P.91-97.
479. Долженко A.T, Дуленко В.И., Зинъковская И.Я., Комиссаров ИВ. Ц Хим.-
фармац. жури. - 1982. - 16, № 12. - С.1474-1476.
480. Bekung С., MtsslinR., VogelЕ. etal. IIPharmacol. Biochem. and Behav. 1987.-
28, N 1 P.29-33.
481. Niman P.T., Jusel T.M., Cohen R.M. etal. // Science. - 1982. - 218, N 4579. -
P.1332-1334.
482. Dorow R., Horowski R., Paschelke G etal. 11 Lancet. — 1983. -N 8341.-P 98-99
483. Duka L, Goerke D, Dorow R. etal // Psychopharmacology. - 1988 -93, N4. —
P.463-471.
484 ThiebotM.-H. SoubriePh., SangerD //Ibid. 94, N4.-P452-463
485 Medina J H, Novas ML. De Boertis E. 11 J.Neijrochem. — 1983 - 41, N 3. -
P703 709.
486. Teitz E.I., Chiu Т.Н., Rosenberg H C. // Ibid. - 1985. -44, N 5. P 1524 1 534
487 Stephens D N. Kehr W., Schneider H.H., Braestrup C. // Neuropharmacology. -
1984.-23, N7B. -P879 880
206
488. Зинъковская Л.Я., Долженко А.Г., Комиссаров И.В. Ц Фармакология и ток-
сикология. - 1985. - 48, N* 2. - С.21-23.
489. А.с. 753093 СССР, С 07 Д471 /02 / В.ИЛукьянеИко И.В.Комиссаров, Т.ФЛа-
рина и др. Опубл. 5.03.1979.
490. Буров Ю.В., Орехов СМ., Ведерникова НМ. // Бюл. эксперим. биологии и
Мединины. - 1985. - 49 №4. С.453 455.
491. Stephens D.N., Kehr W, Schneider HM, Schmiechen R II NeuroscL Lett —
1984. -47, N3. - P333 338.
492. Stephens DM, Hansen J Andrews J., Schmiechen R. Ц Psychopharmacol. —
1988. —96, Suppl. - P. 16.
493. Petersen EM., Jensen L.H., Honore T. et al. 11 Ibid. — 1984. - 83, N 3. —P.240-
248.
494 Pellow Sh., FtteS.E. Ц Brain Res. - 1986. - 363, N 1. - P.174 177.
495. Wettstein J.G., Spealman R.G. Ц JPliarmacoL and Exp. Ther. — 1987. — 240
N2. -P 471-475.
496. Долженко A.T., Комиссаров ИВ. Ц Всесоюз. коллоквиум ”Химия, биохимия
и фармакология производных индола”: Тез. докл. Тбилиси, 1981. — С.163.
497. Машковский МД., Андреева Н.И., Паршин В.А. Ц Фармакология итоксико-
логия - 1988.-51, №4 - С.16-19
498. Cooper S.J. // Trends Pharmacol. Set - 1986. - 7, N6. - P.210-212.
499. Sigg E B., Gytrmek L„ Hill R.T Yen H.C. 11 Arch. int. pharmacodyn. - 1964. -
149, N 2. - P.164-180.
500 Rommdspacher H., Hara C., Borbe H O. etal. // Eur. J. Pharmacol. — 1981. — 70.
N3. P409 -416.
501. Morin AM. Tanaka LA. Wasterlain C.G. 11 Life Sei. - 1981 28, N 20. -
P.2257 2268.
502. San no И, Afraksfnen ММ. Ц Acta pharmacol. et toxicol. - 1982. - 51, N3. —
P.300-308.
503 Braestrup C., Petersen E„ Nielsen M. 11 Psychopharmacol. Bull. — 1982. - 18
N3. - P.8-10.
504 Schwert M., Cain M., Cook J. et al. II Pharmacol. Biochem. and Behav. —1982. —
17, N3. - P.457-460.
505. Valin A. Dodd R H, Liston D.R. et al. // Eur. J.PharmacoL - 1982. - 85, N 1, -
P.93 97.
506. Croucher M., De Sarro G., Jensen L., Meldrum В. I/ Ibid. — 1984. — 104, N 1/2. —
P.55-60.
507 Petersen EM. Ц Ibid. - 1983. - 94, N 1/2. - P.117-124
508. Oakley N.R., Jones B.J. 11 Ncuropharmacology. - 1982. -21, N6. - P.587-589.
509 Braestrup C., Schmiechen R., Neef G et al // Science. .— 1982. - 216 N4551 -
P. 1241-1243.
510. Schweri M.M Martin J. V., Mendelson IV B. etal. // Life Sci. — 1983. - 33, N15.
P 1505-1510.
511. Massotti M., Lucontfni D., Caporali M.G. et al // J.Pharmacol. and Exp. Ther. -
1985.- 234, N1 P.274-279.
512. Skolnik P Schweri MM., Paul SM et al Ц Life Sci. — 1983 . 32, N 21
P 2439-2445
513 Телей 5.5., Htrsch J.D // Nature. - 1980. - 288, N 5791 - P.609 610.
514 Oakley N.R., Jones B.J. // Eur.' LPharmacol. 1980 . 68, N 3. - P.381-
382.
515. Jones B.J., Oakley N.R. //Brit. J.Pharmacol. 1981. - 74, N 1. P.223 224
516. Pieri L„ Btry P. // Fur. J.PharmacoL - 1985. - 112, N 3. - p.355-361.
517. Rossier J.. Cepeda C., Tanaka T. // Electroencephalogr. and Clin. Neurophysiol.
1981 52 N3. P.153.
518. Mddrum B. // Neuropharmacology. - 1984. 23 N 7B. - P.845 846
207
519. Lewin E., Peris J., Bieck V. et al. // Eur. J. Pharmacol. — 1989. — 160 N 1. -
P.101-106.
520. MorinA.M //Brain Res. 1984 321, N 1. - P.151-154.
621. Stephens D.N., Turskl L., Schneider H.H. // Naunyn Schmiedebergs Arch
Pharmacol. 1989. - 339, Suppl. P.105.
522. Johnson D.D., Fischer T.E., Tuchek J.M., Crawford R.D. // Neuropharmacology.-
1984. -23, N 9. P.1015-1071.
523. Quvaiho L.P. de, Venault P., Potter M.-C., Dodd R H. // Eur. J.Pharmacol. —
1986.-129, N3 P.323-332.
524. Stuttmann J.M., Bohme G.A Cocheu M. ei al. // Psychopharmacol. - 1987. -
91. Nl.-P.74 - 79.
525. Jensen L.1L, Petersen E.L., Braestrup C.etal// Ibid. 1984. - 83, N 3. - P 249
256.
526. Комиссаров И.В., Абрам ец ИЯ // Бюл. эксперим. биологии и медицины. -
1982. 94, № 10. - С.61-63.
527 Mitchell R.,Martin /.// Eur. J.Pharmacol. - 1980. - 68, N 4. - P.513 514.
528. Chapman A.G., Cheetham Sh., Hart G.P. et al // J.Neurochem. — 1985. — 45,
N 2.-P.370-381.
529. Phillis J IE , O’Regan M.N. // Trends Pharmacol. Sci.- 1988. 9, N 5. -P.153-154
530. Vaught J„ Goode T. // FASEB J - 1989. - 3, N 3. - P.280.
531. Taylor S.C., Johnston A.L., Wilks L.J. etal. // Neuropharmacology. - 1988. - 19,
N4.-P.195 201.
532. Саровская Р.У. Нейрофизиологические и нейромедиаторные механизмы дей-
ствия бензодиазепиновых транквилизаторов. - М.: ВИНИТИ, 1979. - С.47-
80. - (Итоги науки н техники. Сер. Фармакология. Химиотерапевтические
средства; Т.Н).
533. Богат, ий А.В., Андронати С.А., Головенко Н.Я. Транквилизаторы. — Киев
Наук, думка, 1980.- 280 с.
534. ЬлеОиов Ю.4., Середенин С.Б. // Итоги науки и техники. Фармакология.
Химиотерапевтические средства / ВИНИТИ. - 1987. - 15. С.118 169.
535. Метен G, Corok MG., Carcanuin Р etal. И life Sci. - 1987. 40, N 14. -
P.14 23 1430.
536. Pole P., Ropert N., Wright D.M. // Brain Res. 1981. - 217, N I. - P.216 -220.
537. Chan Ch.Y., Farb D.H. // J.Neurosci. 1985. - 5, N 9 P.2365-2373.
538. Jensen M.S.. Lambert J.D.C. // Ncuiophannacology. - 1984. — 23, N 12A. -
P.1441 1450.
539. Lillie H.J. II Bin. J.Pharmacol. 1984. - 83, N 1. - P.57-68.
540. De Deyn P.P., Macdonald R.L. // J.Pharmacol. and I xp. Ther. - 1987. - 242
N 1. - P.48-55.
541 Mereu G., Fanni B. Serra M. et al. // I-ur. J. Pharmacol. — 1983. - 96 N 1/2 —
P. 129-132.
542 Глушанков П.Г., Воробьев B.C., Скребницкии В.О. // Бюл, эксперим. 6 ио по
тип п медицины, - 1985. - 100, № 12. - С.722- 724.
543. Глушанков П.Г., Нляшкевйч ЮГ. // Там же. - 1988. - 106, № 11. - С.563-
565.
544. Quintero S. Mollanby J., Thompson MR. et aL // Neuroscience. — 1985. - 16
N4. - P.875-884.
545. Metmini T., Gobbi M., Ponzio GarattiniS. // Arch. int. pliarmacodyn. 1986.—
279, N 1. - P.40-49.
546. Hjorrh &, Carlsson A. // Eur. J.Pharmacol. 1982. - 83, N 2. - P.299 -305.
547. Trubon ME.. Arasteh K. // J.Pharm. and Pharmacol. - 1986. - 38, N 5. -
P.380 382.
548. Jones B.J., Paterson LA, Roberts Mil // Pharmacol Biochem and Behav.
1986. - 24, N 5. - P.1487 1489.
208
549 Bteiss M. Romettlno £., Pellet J // Neurosci. Lett. — 1986 69 N 26, Suppl. —
P103.
550. Комиссаров И.В., Абрамец И.И. // Нейрофизиология. - 1980. - 12 №4
С.391-396.
551 Абрамец И.И., Комиссаров И.В., Самойлович ИМ Ц Там же. - 1989. 21
№ 1. С.86-93.
552. Комиссаров И.В, Абрамец ИИ, Самойлович И.М. Ц Докл. АН СССР.
1988. - 302, № 3. - С.749-752.
553 Shoemaker DW, Cummins J Т, Bidder T.G. et al. // Naunyn Schmiedebergs
Arch. Pharmacol. 1980. - 310, N 3 . - P.227-230.
554 Juorio A. K, Greenshaw A.J., Nguyen TV Ц J.Neurochem. 1987. -48, N 5.
P.1346-1350.
555. JonesR.S.C. // Neuropharmacology. 1982 21, N6. P511-520.
556 Комиссаров И.В. Абрамец ИИ., Самойлович И.М. Ц Нейрофизиоиогия
1989. - 21, № 3. - С.352-357.
557 Комиссаров И.В., Долженко А Т., Абрамец И.И. Ц Вести АМН СССР.
1984,- №11.-С.26 31.
558. Traber J., Glaser Т. // Trends Pharmacol. Sci. — 1987. 8, N 11. — P.432—437.
559. Dourish C.T. 11 Brain 5-НТ|д Receptors. — Chichester Ellis Horwood Ltd.,
1987. -P. 261-277.
560 Lehoullier P.F, TickuM K. // Eur. J.Pharmacol 1987.-135 N2. P.235-23R
561 Mehta A.K., Ticku MK. 11 J.Pharmacol. and Exp. Ther. - 1989. - 249 N 2
P.418 -423.
562 Nutt D J.. Cowen P J., Little H.J. // Nature. - 1982. - 295, N 5883. - P 117-235.
563 Комис 'аров И.В // Фармакология и токсикология. - 1985. - 48, № 5.
С 5-12.
564. NistriA., Constant! A. //Progr. Neurobiol. - 1979. - 13, N 2. - P 117 235.
565. Okamoto K., Quastel J.H. // Brit. J.Pharmacol. - 1976. 57, N 1. - P.3-15.
566 Barker J.L., Grats E Owen D G., Study R E. // Actions and Interaction of GABA
and Benzodiazepines / Edv. G.Bowery. - New York : Raven Press, 1983 - P 205
216.
567. Pole P., Bonetti E.P, Schaffer R. etal. // Naunyn—Schmiedebergs Arch. Pharma-
col. -1983. - 321, N2. P260-264.
568 EhlertFJ. II Trends Pharmacol. Sci. - 1986. - 7, N 1 - P.28-32
569. Changeux J. P„ Devillers-Thierg A , Chemouilli Ph. et al. // Science. - 1984. -
225, N4668.-P.1335 1345.
570. Study R.E., Barker J. L. // JAMA. 1982. - 247, N 15. - P.2147-2151.
571 Bosse-Tomask A., Rebec G.V I/ Eur. J.Pharmacol. - 1986 - 130 N 1/2 -
P 141-143.
572. ColinoA., Halliwele J V. // Ibid. - P.151—152.
573 Joels M., ShinnlckuGallagher P Gallagher J.P. // Brain Res. - 1987. - 417 N1 -
P 99-107
574. Vivo M. de, Maayani S. Ц J.Pharmacol. and Exp. Ther. - 1986. 238 N 1 -
P. 24 8-253.
575 Andrade R , Malenka R.C., Niciil R.A. 11 Science. - 1986. - 234 N 4781 -
P 1261-1265
576. Sperk G., Karobath M., Schonbeck G. // Neurosci. Lett. - 1978. - N 1, Suppl. -
P.318.
577 Marangos P J„ Paul S.M. Parma AM et al. // Lafe Sci. - 1979 - 24 N 9
P 851-858.
576. MShler H., PolcP., Cumin R. etql. Ц Nature. - 1979.-278, N 5704.-P.5r3 565.
579 Воронина T.A Ц Фармакология и токсикология. - 1981. - 44, № 6 С 680-
683.
560. MarangosPJ„ PatelJ. // Life Sci - 1981 -29.N16 -P 1705-1714
209
581 Кладницкий А В. Лукин А.Г. Ц Б юл. эксперим. биологии и медицины.
1984,—68 №10. Р 439 441.
582 Sangameswaran I Blas A L. Ц Proc. Nat. Acad. Set USA 1985. - 82. N 16. -
P.556 0 5564.
583. Guidotti A., Corda M.G., Costa E. // Benzodiazepine Recognition Site Ligands :
Biochemisttv and Pharmacology / Eds G. Biggio, E Costa. New York Raven
Press, 1983. - P.95-103.
584. Woolf EH. Nixon EC. // Biochanistry. - 1981. 20 N 11 P 4263-4269.
585. AlhoiL, Costa E„ Ferrero P. etal // Science. - 1985. - 229, N4709. - P.179-
182.
586 Barbaccia M.L.. Costa E, Guidotti A // Ann. Rev. Pharmacol, and Toxicol
1988. -28. — P.451 476.
587. IdeeE.M. // Set et techn. Phann. - 1982. 11, N 2. P 53 59.
588. Mohler H. // Trends Pharmacol. Sci. - 1981. 2, N 5. - P.116 119.
589. Letdenhetmer N.J. Schechter M.D. Ц Pharmacol. Biochem. and Behav 1988
30, N 2. -P 351 355
590. Rommelspacher H. // Pharmacopsychiatria. 1981 14, N4 —P.117-125.
591. Bidder T.G.,Shoemaker Г>. IE, Boottger H.G. etal. // Life Sci. — 1979. -25, N 2. -
P.157-164.
592 Rommelspacher IL, Straus S.. Lindeman J // 1'EBS lett. - 1980. 109 N 3
P 209 212.
593. A iraksinen M M Mikkonen E. //Med. biot. 1980. 58 N 6. - P341 344
594. AWe L., Massotti M., Gatta F. // Pharmacol. Biochan, and Behav 1988 -
30, Nl P.5-11.
595 Hirsch J.D., Dochman R.L., SammerP.R. // Mol. Pharmacol. 1982. 21, N4
P.618-628.
596. Robertson H.A., Baker G.B., Coutts E etal. //bur. J.Pharmacol 1981. 76,
N 2/3.-P.281-284.
597» Previcro A., Castellano C. Scuri R etal // Pharmacie. 1989. 44 N 4 -
P.435 441
598. Trullas R. Ginter H., Eacksen B. et al. // Life Sci. 1988 43, N 15. -P.l 189
1197.
599. Rommelspacher IL. Nanz C., Borbe H.O. et al. // Naunyn—Schmiedebergs Arch.
Pharmacol. - 1980. - 314, N I. - P.97-100.
600. Airaksinen MM., Lecklin A Saano V. et al //Pharmacol, and Toxicol. - 1987
60, Nl. - P.5-8.
601. Сйницкий B.IL Депрессивные состояния. Киев : Наук, думка, 1986. 272с
602. KielholzP. //Triangle. 1987. 26 N2.-Р91 99.
603. Ban Т.А. Psyihopharmacologv of depression. — London etc. Karger, 1981. —
130 p.
604. Авруцкий Г.Я., Недува A.A. Лечение психических больных. М.. Медицина.
1988. - 528 с.
605. Plaznik A., Kostowski И'., Archer Т. Progr. Neuro—PsychopharmacoL and Biol
Psychiat. - 1989 13, N 5. P623-633.
606. Schildkraut EJ. //Amer. J.Psychiat 1965. - 122.N5. -P.623-633.
607. Stahl S.M., Palazidou L. II Trends Pharmacol. Sci. - 1986. 7, N 9. P 349 354.
608. Lecrubier Y., Buech A. E, Frances H et al. 11 Acta psychiatr Scand. - 1981. -9
N 3 Suppl. P.290.
609. Praag H.M., van // Adv. Biochem. Psychopharmac. — 1974. -11, N3. - P.357 368.
610. HalarisA.E. // PsychopharmacoL Bull. 1982. 18 N3.— P.31 34.
611. Sabelli H.C., Borison R.L , Diamond B.l. et al. 11 Biochein Pharmacol. - 1 978.
27, N13. - P.1707-1711.
612. Kostowski W„ Plaznik A. //Psychiat. pol. - 1979. -32, N 2; -P.117-124.
613. Montero D //Rev. farmacol. clin. у exp. - 1989. 6. N3. P.131 134.
210
614. Вальдман А В. // Нейрофармакология антидепрессантов. - М., 1984 -
С.9 49.
615 Maggi A., U'Prichard D.C., Enn SJ Ц Eur J.Pharmacol. 1980 61 N 2. —
P.91 98.
616. Spencer P.S.J. //Brit J.Clin. Pharmacol. — 1977. - 4, N 1 P.57-68.
617. Машковский МД., Андреева Н.И. Полежаева А.И. Фармакология антиде-
прессантов. - М Медицина, 1983 . 240 с.
618. Долженко А.Т. // Бюл. эксперим. биологии и медицины. — 1982. 63 №3.
С.29 31.
619. Долженко А.Т. Ц Фармакология и токсикология. 1984. - 47, № 5.
С.22-25.
620. Щелкунов Е.Л. // Там же. 1964. - 27, № 5. С.628 633.
621. Everett G.M. // Antidepressant drugs. Int. Congr. Exp. Med Found Amsterdam,
1967.-P.164 167.
622. Minnema D. Michaelson LP. // J.Neurosci. Methods. — 1985. - 14, N 3. — P.193
206.
623. Raiteri M. Angelini F., Levi G. Ц Eur. J Pharmacol. 1974 25, N 4
P.411-414.
624. Митюшов М.И., Емельянов H.A., Мокрушин А.А. и др. Переживающий срез
мозга как объект нейрофизиологического и нейрохимического исследова-
ния. - Л.. Наука 1986. - 127 с.
625. McIlwain Н., Rodnight R. Practical Neurochemistry. — Boston : Little, Brown a.
Comp., 1962. — 524 p.
626. Deitrich R., Erwin И // Ann. Rev. Pharmacol, and Toxicol. — 1980. — 20
P.55-80
627. AEaksinen M.M, Kart I. // Med. Biol. 1981.-59 N4 -P.21-34
628. Saheb S.E., Dajani R.M. // Comp. Gen. Pharmacol. - 1974. -4, N14. P.225 227.
629. Wyatt R.J., ErdeleyiE., DoAmaral J.R. etal. // Science. 1975. - 187, N 4179. -
P.853-855.
630. Mandel L R. Rosegay A., Walker R.W. et al. // Ibid. - 1974. - 186 N 4165.
P. 741-743.
632. Stebbins R.D., Melter E., Rosengarten H et al. // Arch. Biochem. Biophys. —
1976. 173, N 6. P.673 -679.
632. Honecker H., Rommelspacher H // Naunyn-Schmiedebergs Arch. Pharmacol. —
1978. 305 N 2.-P.135-141
633. Rommelspacher H, Honecker H. Barbey M. Meinke B. // Ibid - 1979 - 310,
Nl. -P.35-41.
634. Shoemaker D. W., Cummins J T„ Bidder T.G. Ц Neuroscience. - 1978. 3 N 2. -
P.233-239
635. Rommelspacher H., Bade P, Coper H., Kossmehe G. // Naunyn-Schmiedebergs
Arch. Pharmacol.-1976.-292, N 1. P 93 95.
636. Rommelspacher H., Strauss S, Copnitz Ch. H. // Ibid. - 1978. - 303, N 3. -
P.229-233.
6 37. A iraksinen M M. Karl I // Med. Biol. 1981 -59 N4 -P.190-211.
638. Mclsaac W.M., Taylor D., Walker L.E, Ho B.T. // J.Neurochem. 1972 - 19
N 6.-P 1203-1206.
63 9. Poirier L.J. Singh P., Boucher R. // Can. J.Physiol. Pharmacol. - 1967 46
N 5.-P.585-589
640. Fuller R IV.. Hemrick Luecke, Susan К Pery K.W Ц J.Pharm. and Pharmacol -
1981.- 33, N4 P.255-256.
641 Drucker G., Raikoff K. Neafsey E.J., Collins M.A. // Brain Res. - 199C 509
N 1 -P 125-133.
642 Горкин В.З. Ц Вести. АМН СССР. - 1984. -№11. С 72-75.
643. Кривченкова Р.С. // Вопр. мед. химии. - 1983. - 29, № 4 - С 716
211
644. Udenfriend S., Wikop B. // Biochem. Pharmacol. - 1958. — 1, N 1. — P.160-165.
645. Miller E., Friedman E„ Schweitza-J.W., FriedhoffA J. Ц J.Neurochem. - 1977. -
28. N 5.—P 995 1000
646. Андреева Н.И. Машковский М.Д. Il Фармакология и токсикология. 1980,—
43, № 2. - С.133-137.
647 Sparks DI,. Buckholtz N.S. // Neurosci. Lett - 1980. — 20 N 1 - P 73 78.
648 Ko'’ulainen H, Tnomisto J., Airaksinen MM et al. // Acta pliarmacol. et toxi-
col. - 1980. 46, N 4 P 299-307.
649 Buckholtz M.S., Boggan W O. // Life Sci 1977. - 20 P.2093 -2100.
650 Airaksinen M.M Huang J.l . Ho B.T et al. Ц Acta pharmacol. et toxicol. —
1978. - 48, N 5. - P.375-380.
651. Slotkin T, Salvaggio M., Seidler F.J et al. // Mol. Pharmacoi. — 1979. —15.N3.—
P.607-619
652. Langer S.Z., Raisman R., Tahraoui I., eta I. // Eur. J. Pharmacol. - 1984 - 98,
N 1. - P.153-154.
653. Долженко A.T., Комиссаров И.В., Сердюк C.E. // Фармакология и токсико-
логия. 1983. - 46, № 1 - С.20-23.
654. Starke К., Borowski Е., Endo Т. Ц Eur. J. Pharmacol. — 1975. — 34, N 2. —
Р.385-388.
655. Misztal S.. Boksa J„ Chojnacka-Wojcik E. etal. Ц Pol. J. Pharmacol. Pharm. —
1986 . 38 N 5/6. — P.555-565.
656 Airaksinen M.M., Ho B.T. An R., Taylor D. // Arzncimittel-Forsch. 1978. - 28
Nl. -S.42-46.
657. Глушков Р.Г., Филенка Н.И., Машковский МД. и др. // Хим.-фармац. журн,-
1982. - 16, № 9. - С. 1054-1058.
658.Pcnnfer L., Rommelspacher Н. Ц Neuropharmacology. — 1981..— 20, N 1. P.l-8
659 Вальдман А.В. // Нейрохимические основы психотропного эффекта. - М.,
1982. - С.8-32.
660 Долженко А.Т„ Комиссаров ИВ. Ц Бюл. эксперим. биологии и медицины. -
1986. 101, №5.-С.569 570.
661 Андреева Н.И. // Фармакология и токсикология. - 1982. - 45, № 4. — С.9 13.
662 Дворянцева Г.Г Линдеман С.В., Стручков Ю Т. и др Ц Хим -фармац. журн
1985. 79,№ 12. - С.1424-1434.
663. Панасюк Л.В., Арефолов В .А, // Фармакология и токсикология. - 1982. -
45, №i.-С.13 17.
664. Матвеев В.Ф , Прокудин В.Н., Барденштейн А.М. Курашов А.С. Ц Новые ле-
карств. препараты (Экспресс-информация). — 1979. № 5. — С.11 — 18.
665. Krause W., Mengd Н., Nordholm L. // J.Pharm. Sci. — 1989. — 78< N 8. — P.622
626.
666. Susilo R. // Naunyn-Schmiedebergs Arch. Pliarmacol. — 1984. -325, N 5. P.76.
667 Абрамец И.И., Долженко A T. // Фармакология и токсикология. - 1986. -
49, №4.-С.15 18.
ббКМ&ский А.И., Ведерникова Н.Н., Чистяков В.В., Лакин В.В. Биологические
аспекты наркоманий, - М. Медицина, 1982. - 256 с.
669. Буров Ю.В.. Ведерникова Н.И. Нейрохимия и фармакология алкоголизма.-
М.: Медицина, 1985. - 240 с.
670. Griffiths Р. Littleton J., Oritz А // Brit. J.Pharmacol. - 1974. 50, N 5. —
P.4 89-498
671. Rawat A.K // J Neurocliem. - 1974 - 22, N 9. P.915 -922.
672 Sytin ky LA.. Guzikov B.N., Gomanko M P. et al. // Ibid. 1975. -25 N 1
P43-48
673 Reggiani A, Barbaccia M.. Spano P.F., Tfabucchi M. // Psychopharmacologia
(Berl.). 1980. 67, N3 P.261-264.
674. Volicer L., Biagionl T.M. // Neuropliarmacologv. - 1982. - 21, N 3. P.283 -286.
212
675- Ticku M. II Brit. J.Pharmacol. - 1980. - 70, N 4. - P.403-410.
676. Harris RA.. Fenner D Feller D et al. /I Pharmacol. Biochem. and Behav
1983. - 18, N 3. - P.363 -367.
677. Goldstein D. // J Pharmacol. and Exp. Ther. -1973. - 186, N1 - P.l-9.
678. Biswas B., CarlssonA. Ц Psychopharmacology. — 1978. —59, N 1. P.91—94
679. Cott J.M., Breese G.R., Cooper ВR. et al 11 J.Pharmacol. and Exp. Ther. -1976.—
196, N 6. - P.594-604
680 Frey G„ Vogel R, Madman R. Ц Alcoholism. 1979. - 3, N 3. P 278 279
681 Burch T.P., Ticku M.K. II Eur. J.Pharmacol. - 1980. - 67, N 2/3. - P.325-326.
682 Freund G. Ц J.Nutr. - 1970. - 100, N 1. . P.30-36.
683 Pohorecky L.A., Fewman В, Sun J., Bailey W.H. // J.Pharmacol. Exp. Ther —
1978. 204. N 2.-P 424-432.
684. TurckK., Vogel IP. Ц Ibid. - 198Z - 223, N 2. - P.34 8 3 54.
685. Анохина И.П., Московская И.В., Ma шипов KB Кудинова E.B. I / Фармако-
логия экспериментального алкоголизма. M , 1982. С.42 54.
686. Анохина И.П., Коган Б.М., Манъковская И.В. и др. // Фармакология и токси-
кология. - 1990. - 53, № 4. - С.4-9.
GBT.Ahtee L. // Proc. 6th Int Congr. Pharmacology. - Helsinki, 1975. P 41 50.
6 88. Post M, Sun A. II Res. Comm. Chem. Pharmacol. — 1973 6,N9. — P.887 894
689. Barbaccia M., Bosio A., Spano P.F., Trabucchi M Ц J.Neural Transm. — 1982. —
53, N 2,- P 169-177.
690. Geller I., Purdy R., Merritt JH. Ц Ann. N.J. Acad. Sci. - 1973. - 215, Nl. -
P.54 59.
691 Hunt W. Dalton T. II Pharmacol, and Biochem. Behav. — 1981. 14, N 5. —
P.733 -739.
692. Le A.D., Khanna J-M. Kolant H et al II Psychopharmacology. - 1980 - 67,
N2. - P.143-146
693. MyersR., Melchior C. // Science. - 1977. - 196, N4219. - P.554 -556
694. Geller I. Ц Pharmacol, and Biochem. Behav. - 1973. - 1, N 4. - P.361-365.
695 HfllS.I. Il BioL Psychiatr. - 1974. -8, Nl P.151-158.
696. Sand&s B„ Collins A.C., Wesley V.H. Ц Psychopharmacologla (Berk). - 1976. —
46, N1.-S.159-162.
697. Geller I, Hartman R Messiha F. // Pharmacol Biochem. and Behav. - 1981 —
15 N8. -P 871-874.
698. Lemberge- L., Rowe H, Bergstrom R.F. et al // Clin. Pharmacol, and Ther. -
1985. -37, N6. -P.658-664.
699. Rockman G.E., Amit Z., Carr G. et al. /I Arch. int. pharmacodyn. - 1979. - 251,
N 2. P.245—259
700. My&s R.D., Oblinger ММ. // Drug. Alcohol depend. — 1977. -2, N4 -P.463-
483.
701 Airaksinen M M. II Abstr Finnish-Soviet sympos. on psychoactive drugs. - Helsin-
ki, 1981. - P. 3.
702. Буров Ю.В., Орехов C.H., Ведерникова H Н Ц Бюл. эксперим. биологии и
медицины. — 1986.- 101, №4 - С.442 443.
703. Жуков В.Н. //Фармакология экспериментального алкоголизма. М., 1982,-
С.60-73.
704. Закусов В.В. фармакология центральных синапсов. - М- Медицина, 1973.
271с.
ОГЛАВЛЕНИЕ
ПРЕДИСЛОВИЕ.........................................
ГЛАВА 1. МЕТОДЫ ПОЛУЧЕНИЯ 1,2,3.4-ТЕТРА1 ИДРО-0-КАРБОЛИНОВ 4
1.1. Получение 1,23>4-тетра1идро-0-карболииов конденсаци-
ей триптаминов и триптофанов с карбонильными соеди-
нениями ........................................... *
1.1.1. Конденсация с альдегидами .............. 4
1.1.2. Конденсация с а-кетокислотами............ 14
1.1.3. Конденсация с кетонами ............... 18
1.1.4. Конденсация с карбонильными соединениями в
апротонной среде ..................... 21
1.1.5. Стереохимические аспекты реакции Пикте-Шпене-
лера ............................. 25
1.2. Внутримолекулярная циклизация енаминов........ %6
1.3 Метод окислительной циклизации...............
1.4. Модифицированная реакция Полоновского........ 85
1.5. Реакция Фишера .............................. 86
ГЛАВА 2. ПОЛУЧЕНИЕ 3,4 ДИГИДРО р КАРБОЛИНОВ. РЕАКЦИЯ БИШ
ЛЕРА - НАПИРАЛЬСКОГО......................................... 40
ГЛАВА 3. ДРУГИЕ МЕТОДЫ СИНТЕЗА ГИДРИРОВАННЫХ р-КАРБО-
ЛИНОВ ........................................... 50
ГЛАВА 4. МЕТОДЫ ПОЛУЧЕНИЯ АРОМАТИЧЕСКИХ 0-КАРБОЛИНОВ 58
4 1. Ароматизация 1,23,4-тетрагидро-0-карбо лннов. 58
4.2. Ароматизация 3,4-дигидро-р-карболинов......... 66
4.3 Синтез из некарбошновых предшественников ..... 69
44. Рециклизация еолей индоло 12,3-^] пирнлия...... 76
ГЛАВА 5. РЕАКЦИИ р КАРБО Л ИНОВ .......................... 81
ГЛАВА 6. р КАРБОЛИНЫ - ЛИГАНДЫ БЕНЗОДИАЗЕПИНОВЫХ И ДРУ
ГИХ МЕМБРАННЫХ РЕЦЕПТОРОВ .................................. 88
6 1 Бензодиазепиновые рецепторы нервных клеток ...... 88
6.2. 0-Карболкны как лиганды бензодиазепиновых рецеп-
торов ......................................... . 98
6.3. Место 0-карболннов среди других лигандов бензодиазе-
пиновых рецепторов.........,............... 103
214
6A. р-Карболины как лиганды других мембранных рецеп-
торов ................................................ /07
ГЛАВА 7. е КАРБОЛИНЫ КАК РЕГУЛЯТОРЫ УРОВНЯ ТРЕВОЖНОСТИ
У ЖИВОТНЫХ И ЧЕЛОВЕКА..................... ..................... ЦО
7.1. Экспериментальные модели тревожных состояний у жи-
вотных НО
7.2. Анксиогенные и антианксиолитнческие свойства (3-кар
болинов....................................... 112
7 3. Анксиолитические свойства /3-карболинов....... 7/7
ГЛАВА 8. СУДОРОЖНЫЕ. ПРОТИВОСУДОРОЖНЫЕ И ПРОСУДОРОЖ
НЫЕ СВОЙСТВА (3-КАРБОЛИНОВ.................................. 722
ГЛАВА 9. НЕЙРОФИЗИОЛОГИЧЕСКИЕ И МОЛЕКУЛЯРНЫЕ МЕХАНИЗ
МЫ ДЕЙСТВИЯ 0-КАРБОЛИНОВ................................... 729
9.1. ГАМК-ергические механизмы действия/3-карболинов . 729
9.2. Электрофизиологические корреляты поведенческих
эффектов /з-карболинов............................ 735
9.3. Серотонинергические механизмы действия (3-карболинов 736
94. Механизм аллостерического регулирования (3-карболина-
мнГАМК и серотонинергической синаптической передачи 7^7
9.5. /З-Карболины как эндогенные регуляторы уровня тре-
вожности..........................................
ГЛАВА 10 /3 КАРБОЛИНЫ КАК АНТИДЕПРЕССАНТЫ................... 752
10.1. Нейрохимические механизмы патогенеза депрессий ... 757
ЮЛ. Фармакологическая характеристика современных анти-
депрессантов .........................•....... 756
103 Методы первичного фармакологического изучения анти-
депрессантов ................................... 7°'
104. //-Карболины как потенциальные антидепрессанты .... 76 7
ГЛАВА 11. (З-КАРБОЛИНЫ КАК МОДУЛЯТОРЫ ЦЕНТРАЛЬНЫХ НЕЙ
РОМЕДИАТОРНЫХ СИСТЕМ, УЧАСТВУЮЩИХ В ПАТОГЕНЕ
ЗЕ АЛКОГОЛИЗМА.............................................. 1
11.1 . Нейромедиаторные системы, определяющие развитие
алкоголизма................................... • •
11.1,1. Роль ГАМКергической системы мозга в пато-
генезе алкоголизма..........................
11.1.2. Роль моноаминергическиХ (норадреналин- и до-
фаминергических) систем мозга в развитии эк-
спериментального алкоголизма ........... 75/
11.1.3. Участие серотонинергической системы мозга в
развитии алкоголизма ....................... 757
11.2 . Нейромодулирующее влияние /3-карболинов на форми
роваиие и течение алкоголизма...................
755
ЗАКЛЮЧЕНИЕ .................................................
СПИСОК ЛИТЕРАТУРЫ ....................................
192
ПАУКОВЕ ВИДАННЯ
Академия наук Украйи
.1нсипут фоикоорган1Чно1Х1мЦ'та вуглех1мл
ДУЛЕНКО Володимир 1ванович
KOMJCAPOB 1гор Васильевич
ДОЛЖЕНКО Анаталш Тимофшович
НИКОЛЮК1Н Юрш Аркадшович
(3-КАРБОЛШИ Х1М1Я IНЕЙРОБ1ОЛО11Я
РоеШськои новою
Оформления художника М.Е.КропивницьксЯ
Здано до набору 27.01.92 ГЦдп. До друку 05.06.92. Формат 60x64/16. Пашр офс.
№ 1. Гари Пресс Р ман. Друк офс. Ум. друк. арк. 12,56. Умфарб-в1дб 12,91.
Оби. вид. арк. 13,76. Тцраж 400 цр. Зам. №/-50
Оригшал-макет изготовлено у видавництв! ’’Паукова думка”. 252601 Ки1в 4,
вул Рвпша 3
Кигвська книжкова друкарня иауковог книги, 252004 Ки1в 4 вул. Реп1на 4