Автор: Ашмарин И.П. Николаев А.Я.
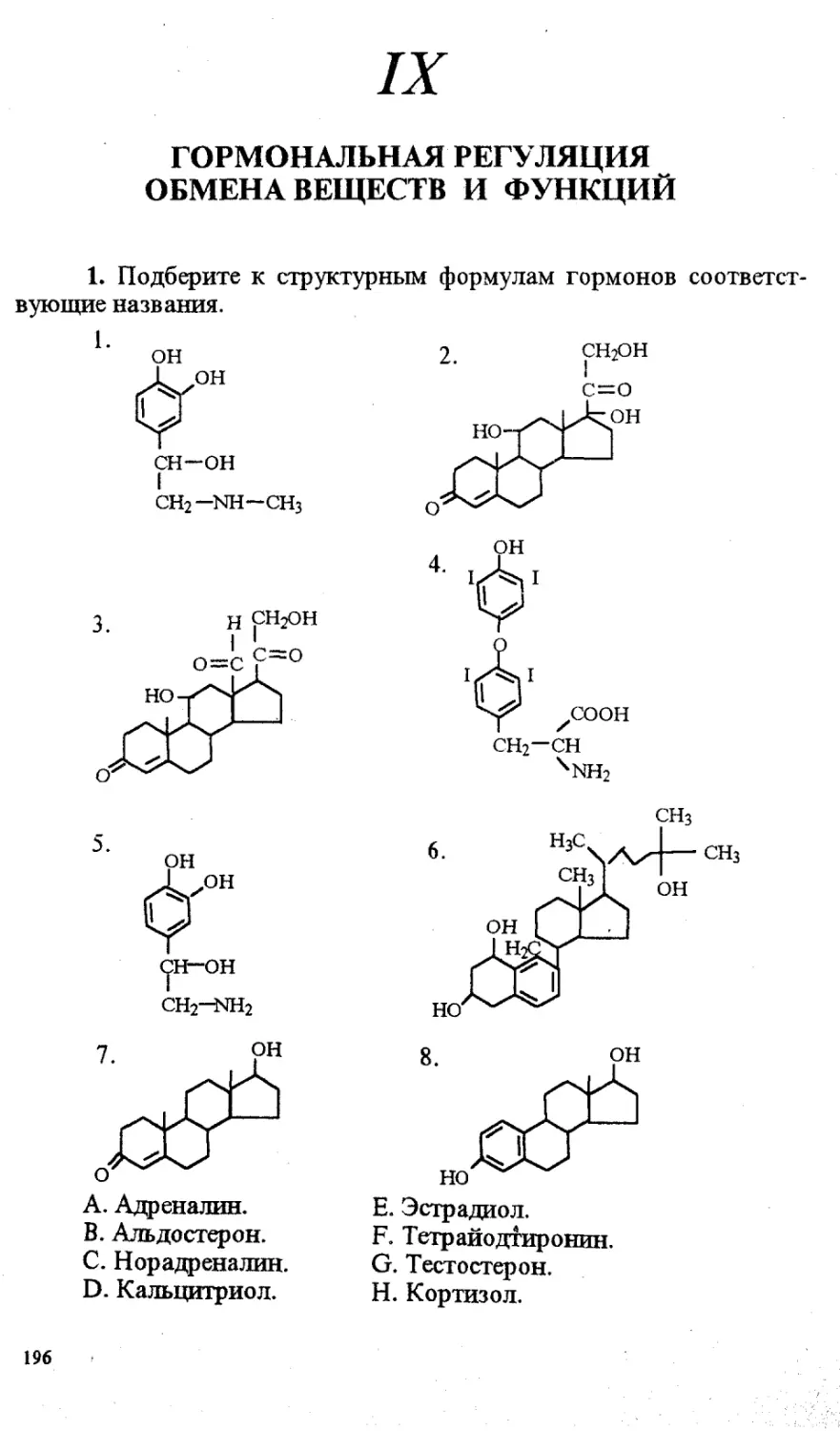
Теги: материальные основы жизни биохимия молекулярная биология биофизика общая биохимия химия биология сборник задач
ISBN: 5-211-03403-1
Год: 1996
СБОРНИК
ТЕСТОВ И ЗАДАЧ
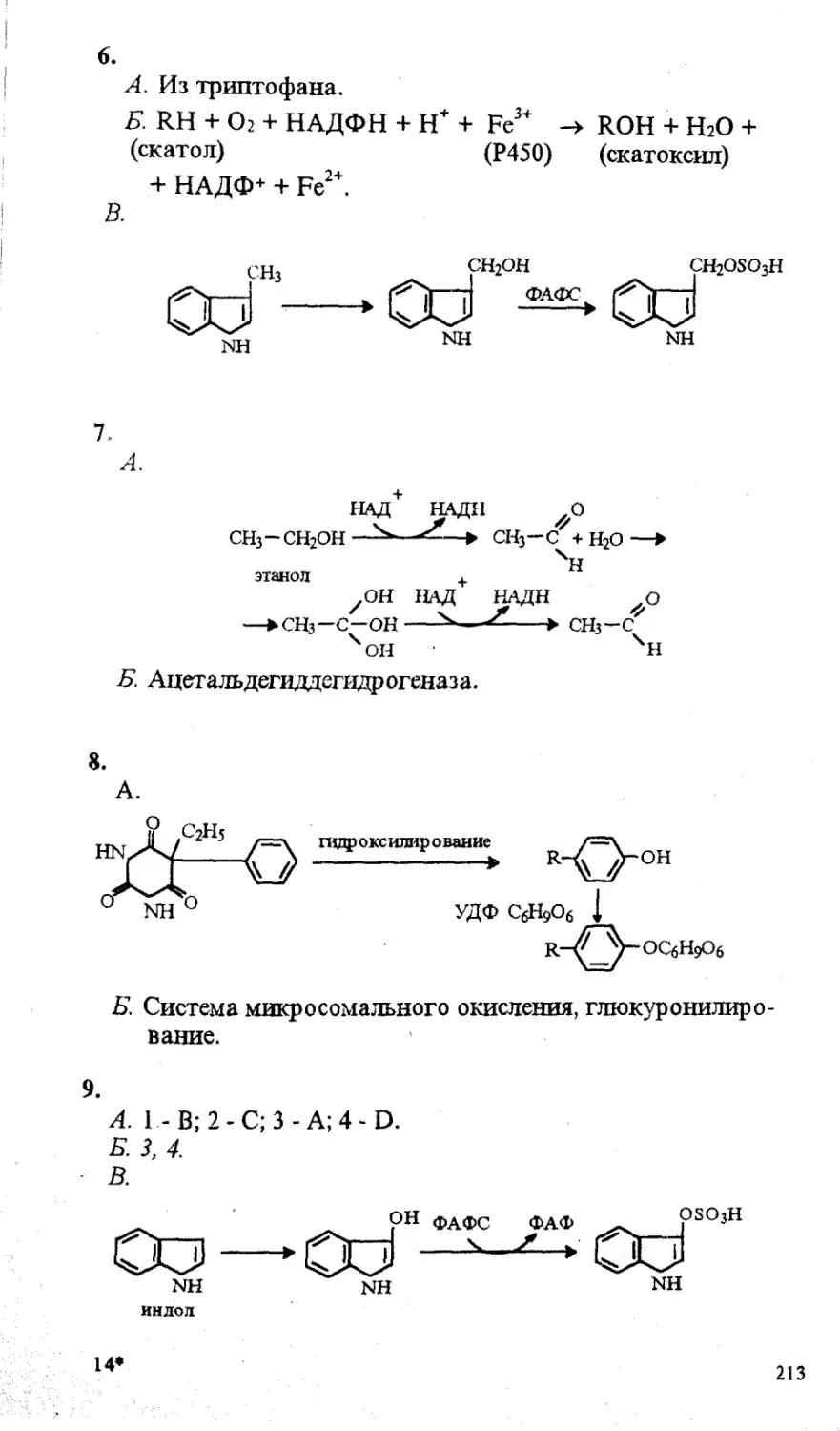
ПО БИОХИМИИ
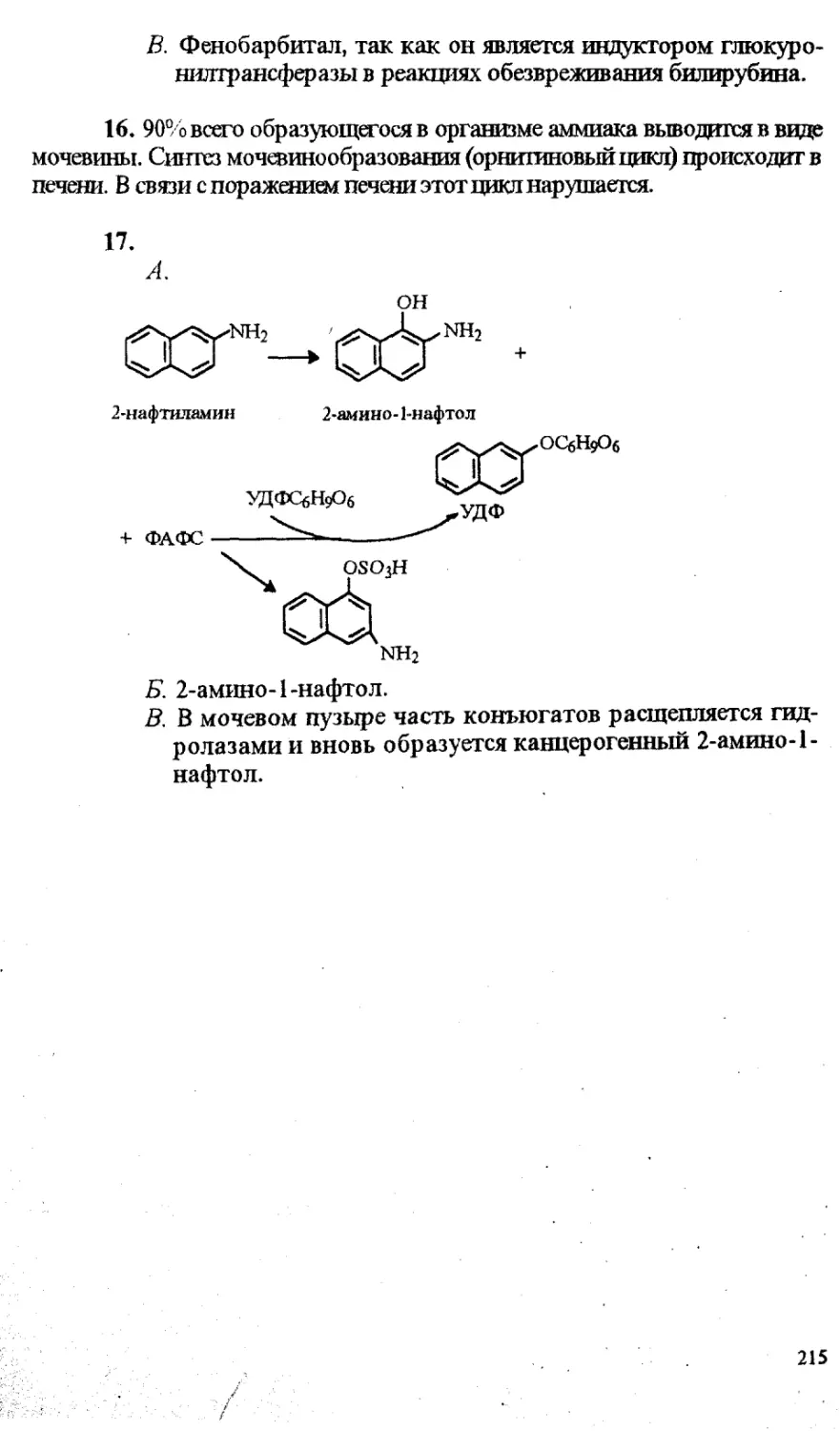
Под редакцией
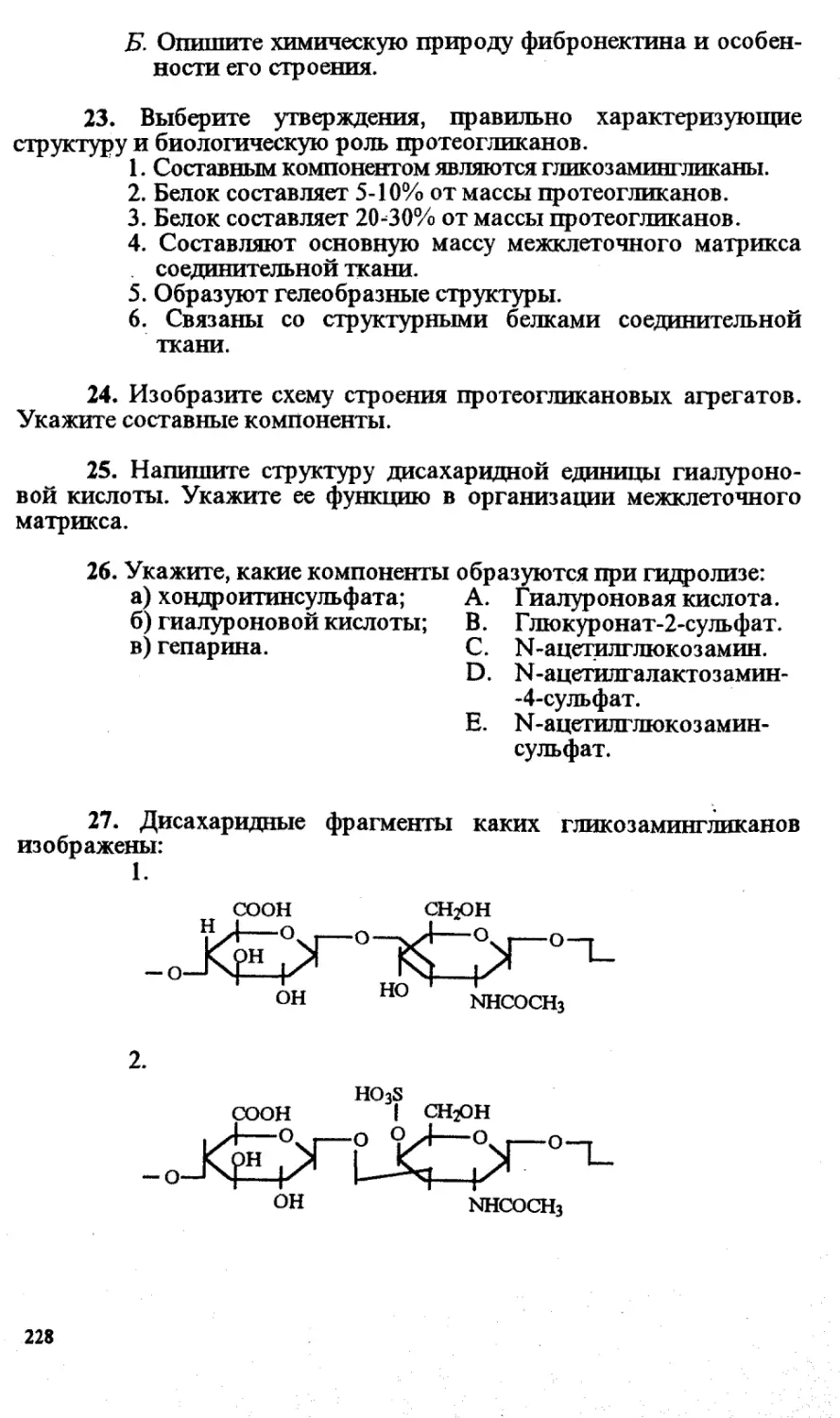
академика РАМН И.П.Ашмарина
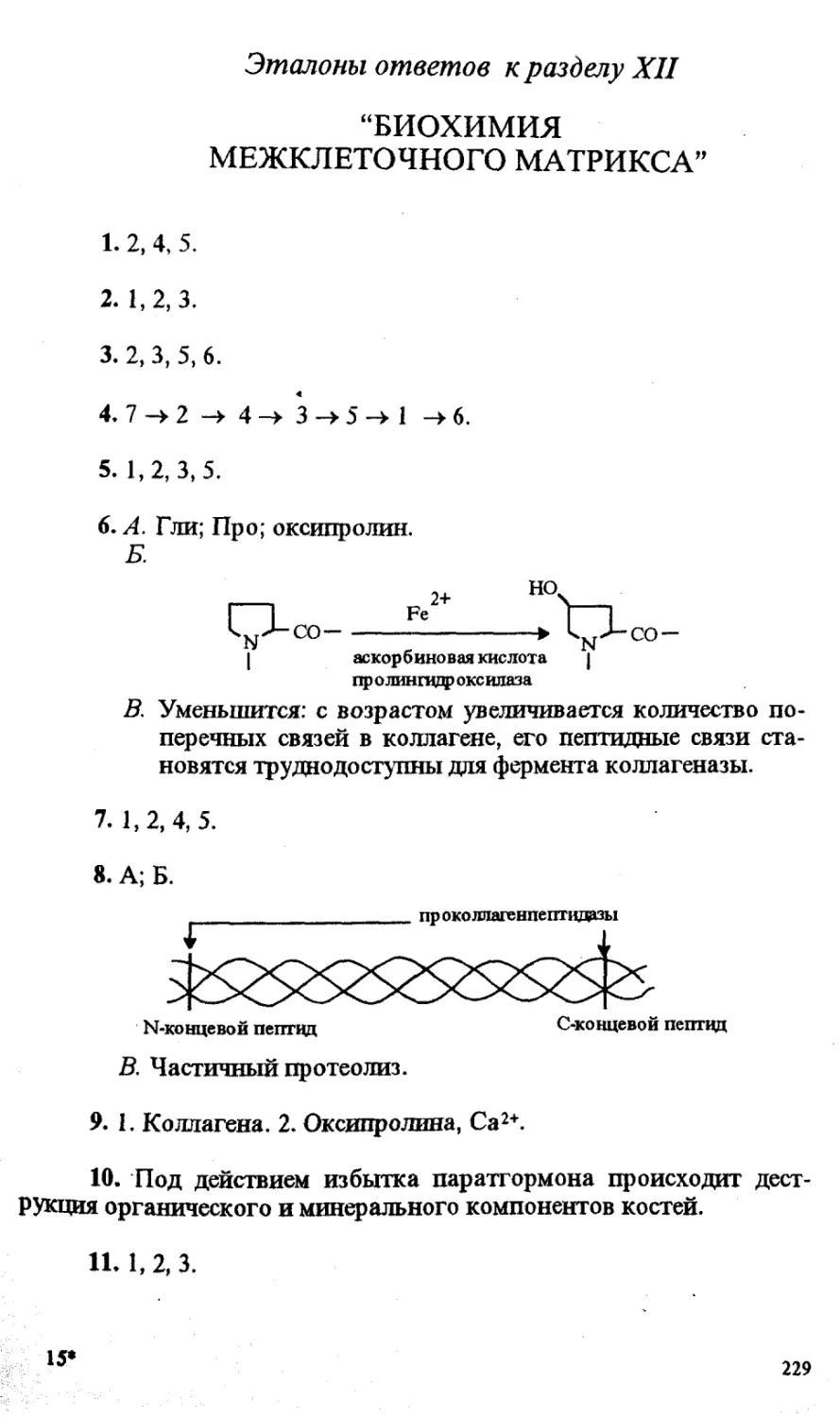
и профессора А.Я.Николаева
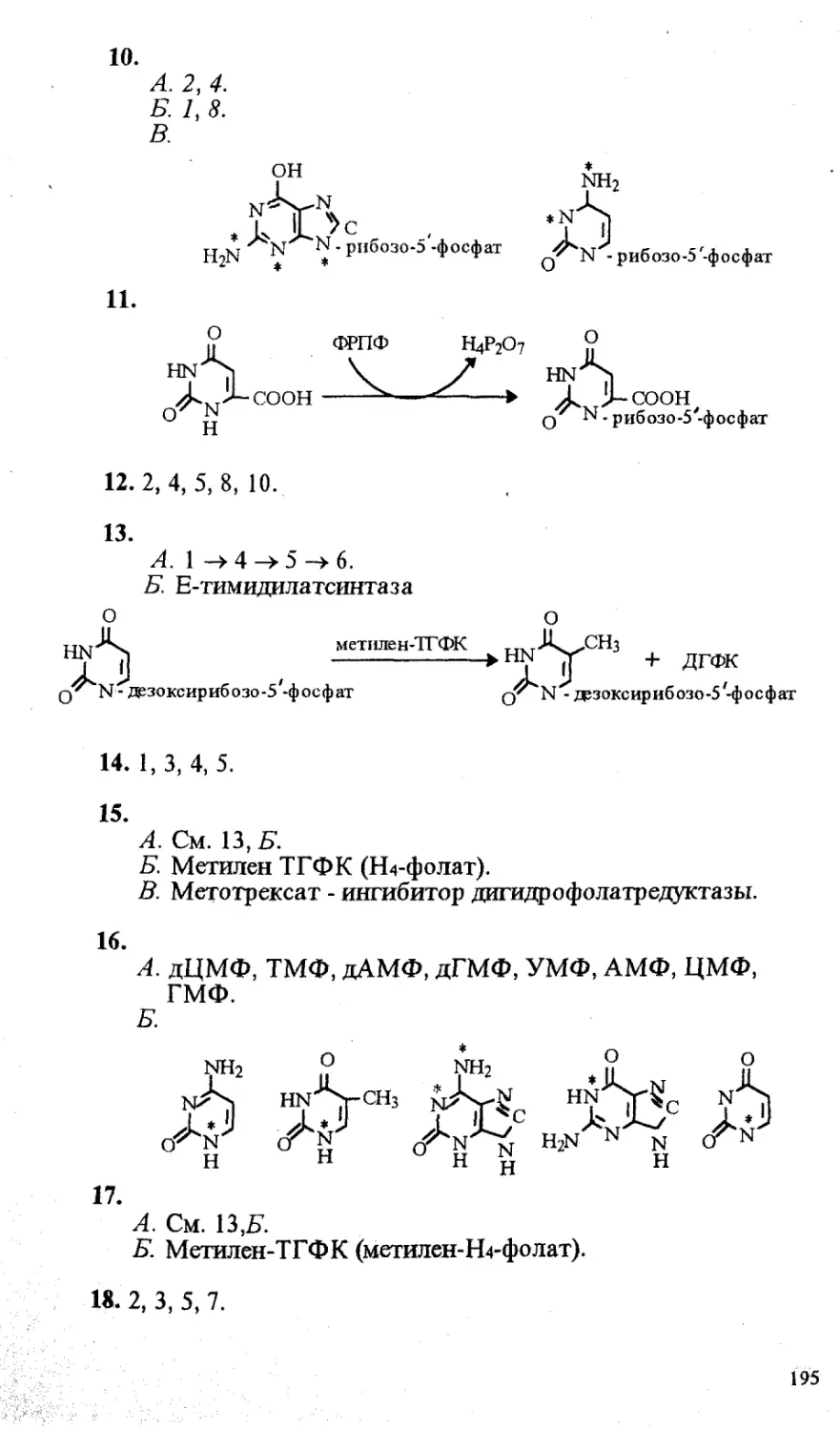
Рекомендовано Министерством общего и
профессионального образования Российской Федерации
в качестве учебного пособия для студентов
высших учебных заведений,
обучающихся по направлению "Биология*,
специальности ‘Биохимий*
1996
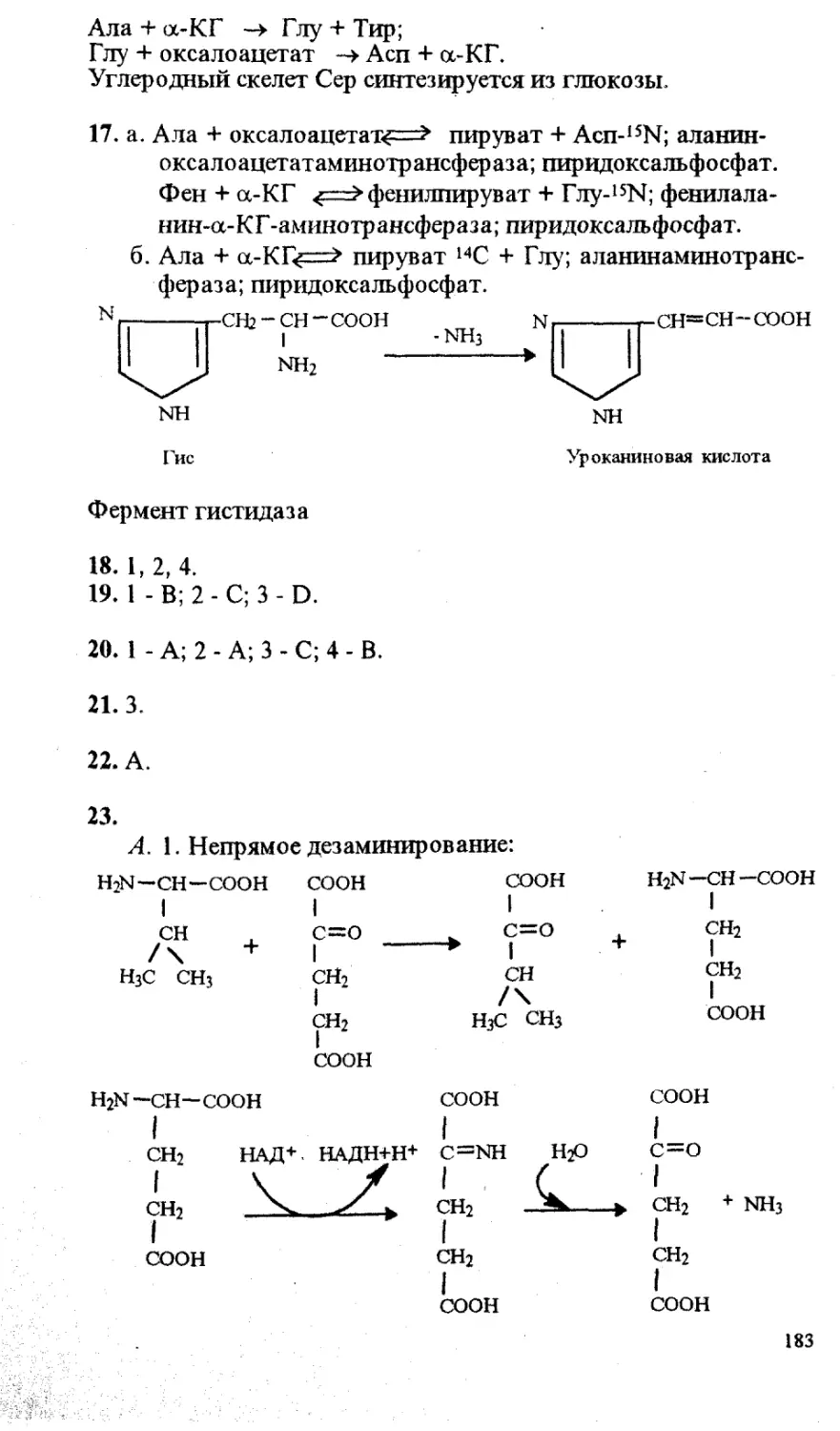
ББК 28.072.28.9
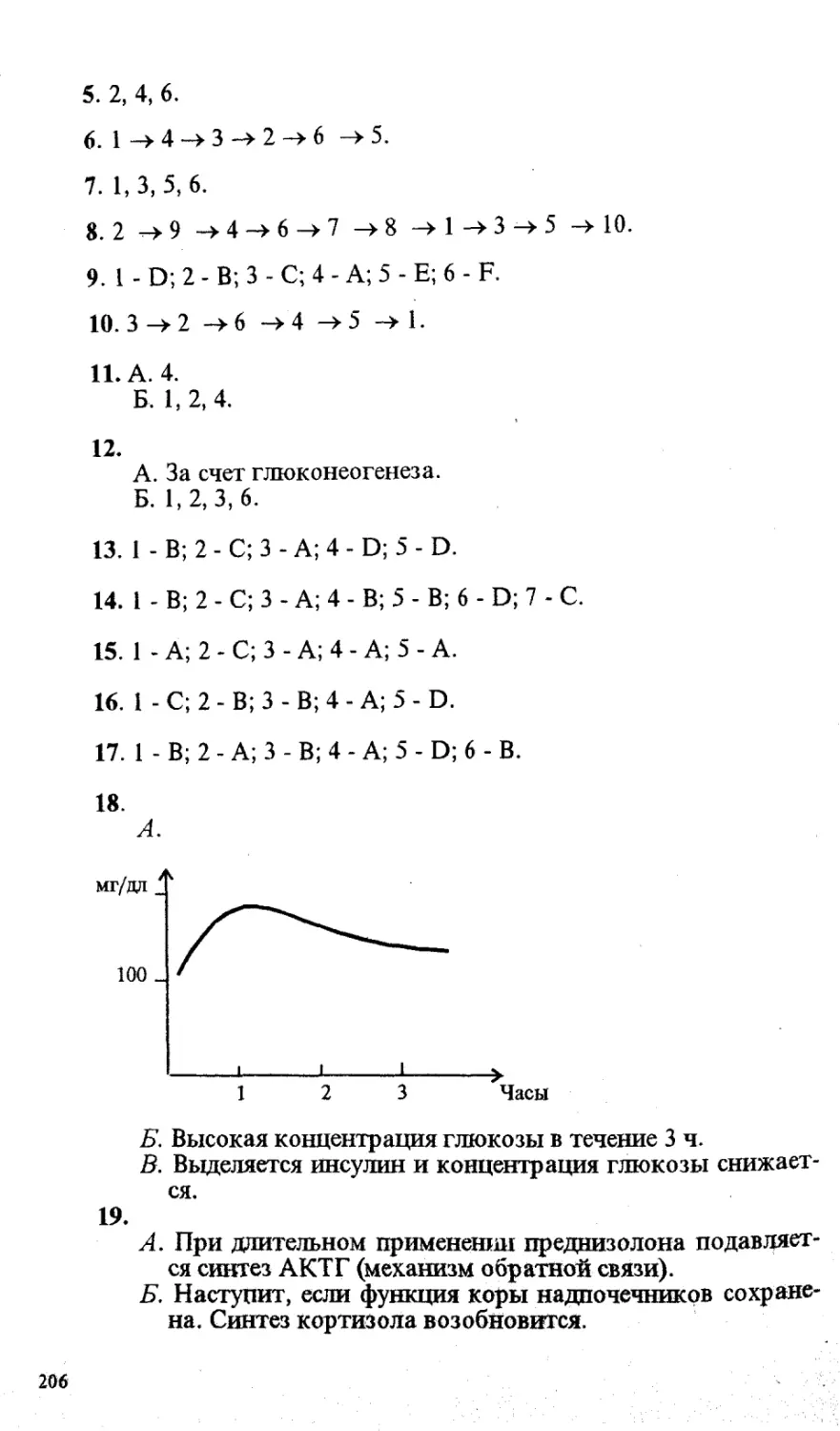
С23
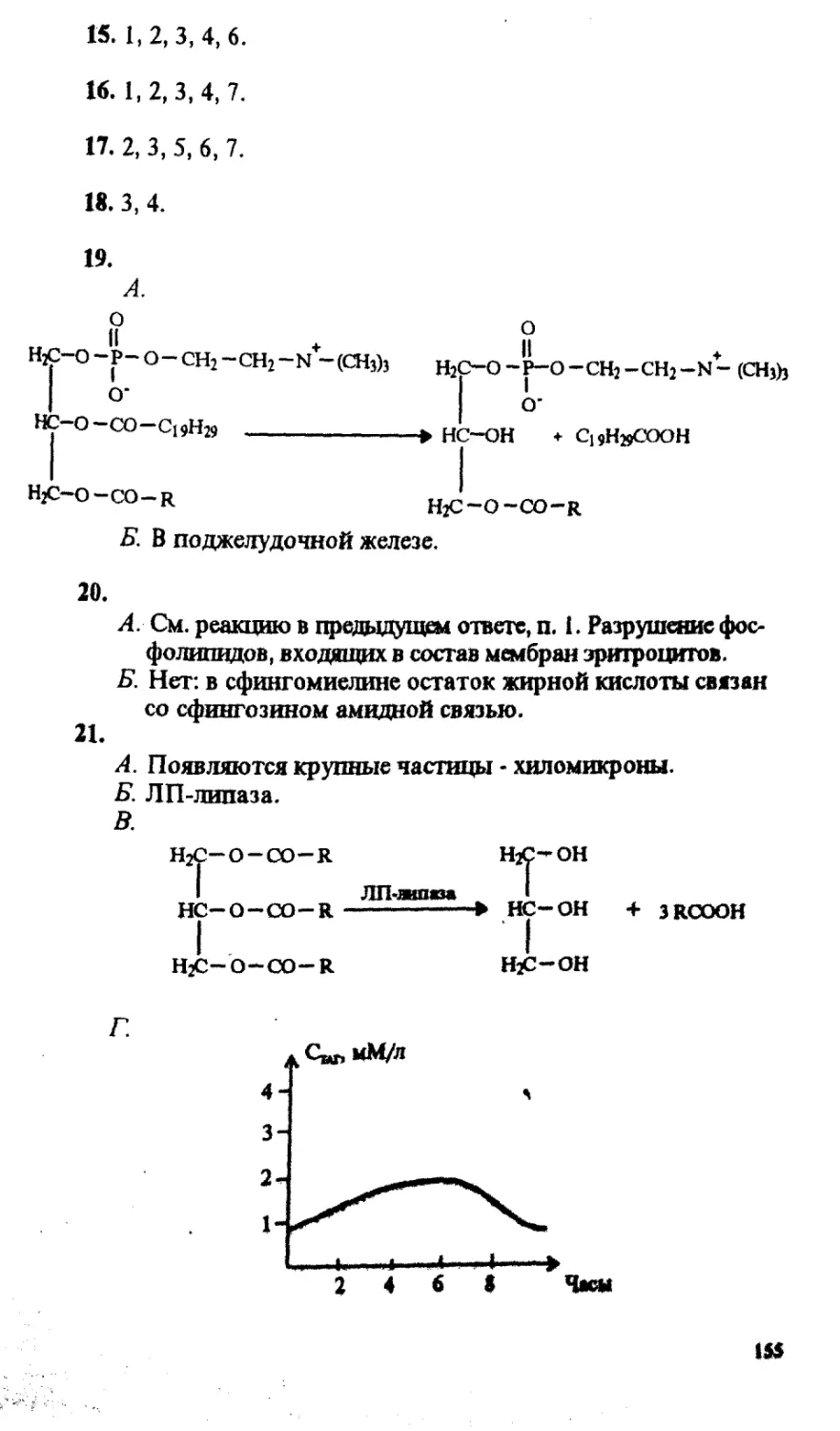
УДК 577.1
Рецензенты:
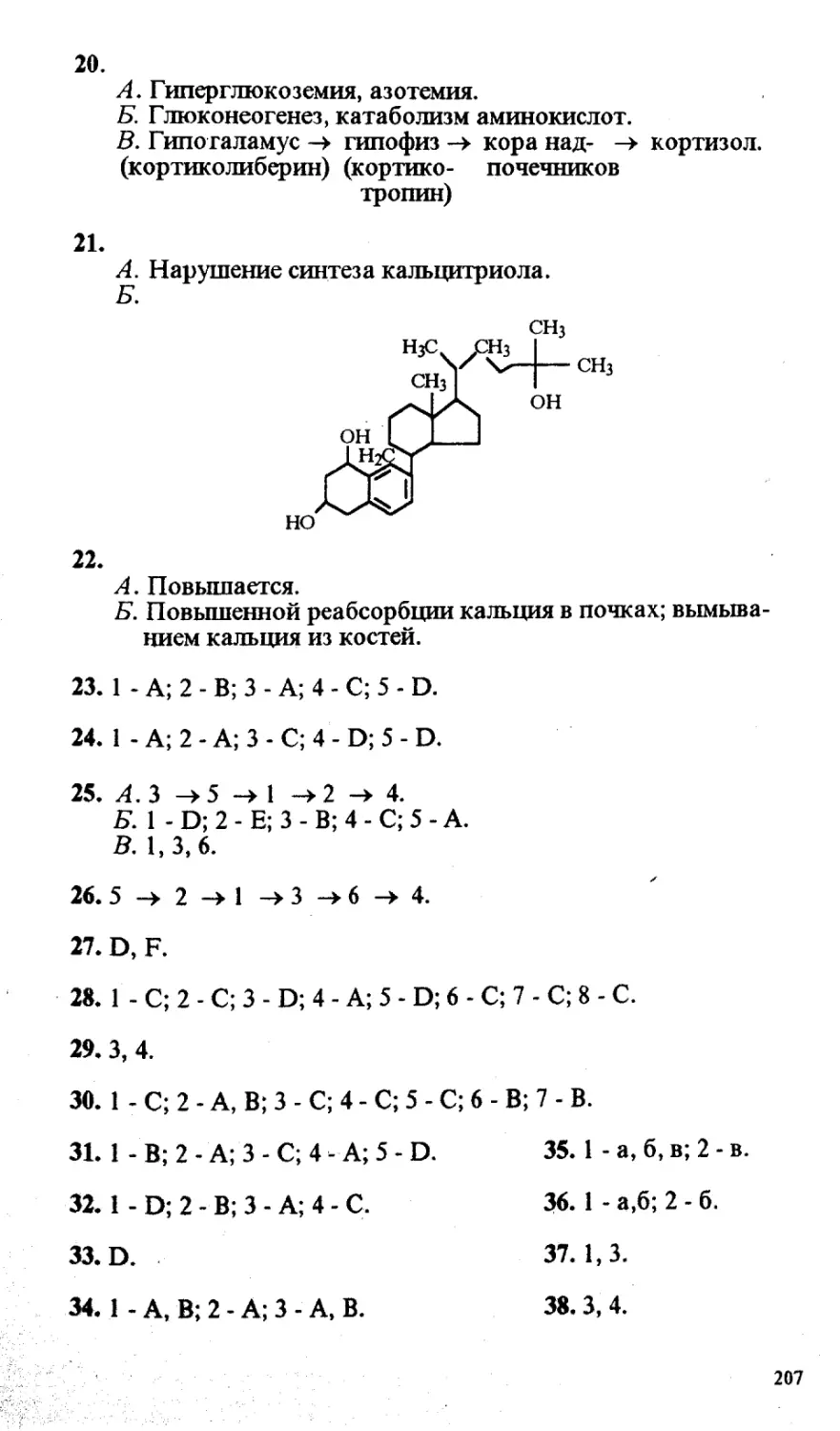
кафедра биохимии
Российского медицинского университета
(зав. кафедрой профессор Ю.С .Татаринов);
доктор биологических наук,
профессор А .А.Болдырев.
Федеральная целевая программа
книгоиздания России
С23 Сборник тестов и задач по биохимии.
Учебное пособие/Под ред. И.П.Ашмарина и А.Я.Николаева.
М.: Изд-во МГУ,1996.-233с.
ISBN 5-211-03403-1
В сборнике представлены различные типы задач и тестов по биохимии, состав-
ленные по форме, рекомендованной дая внедрения в практику медицинского и медико-
бирлогического образования.
Для студентов биологических и медицинских специальностей при подготовке к
занятиям, зачетам и экзаменам в режиме самоконтроля, а также для преподавателей
при подготовке и проведении занятий, дая контроля уровня знаний студентов и со-
ставления экзаменационных билетов как тестовой, так и традиционной формы.
4107000000 (4309000000>-050
С -—-------------------—.— Б«з объявл. -
077(02)-96
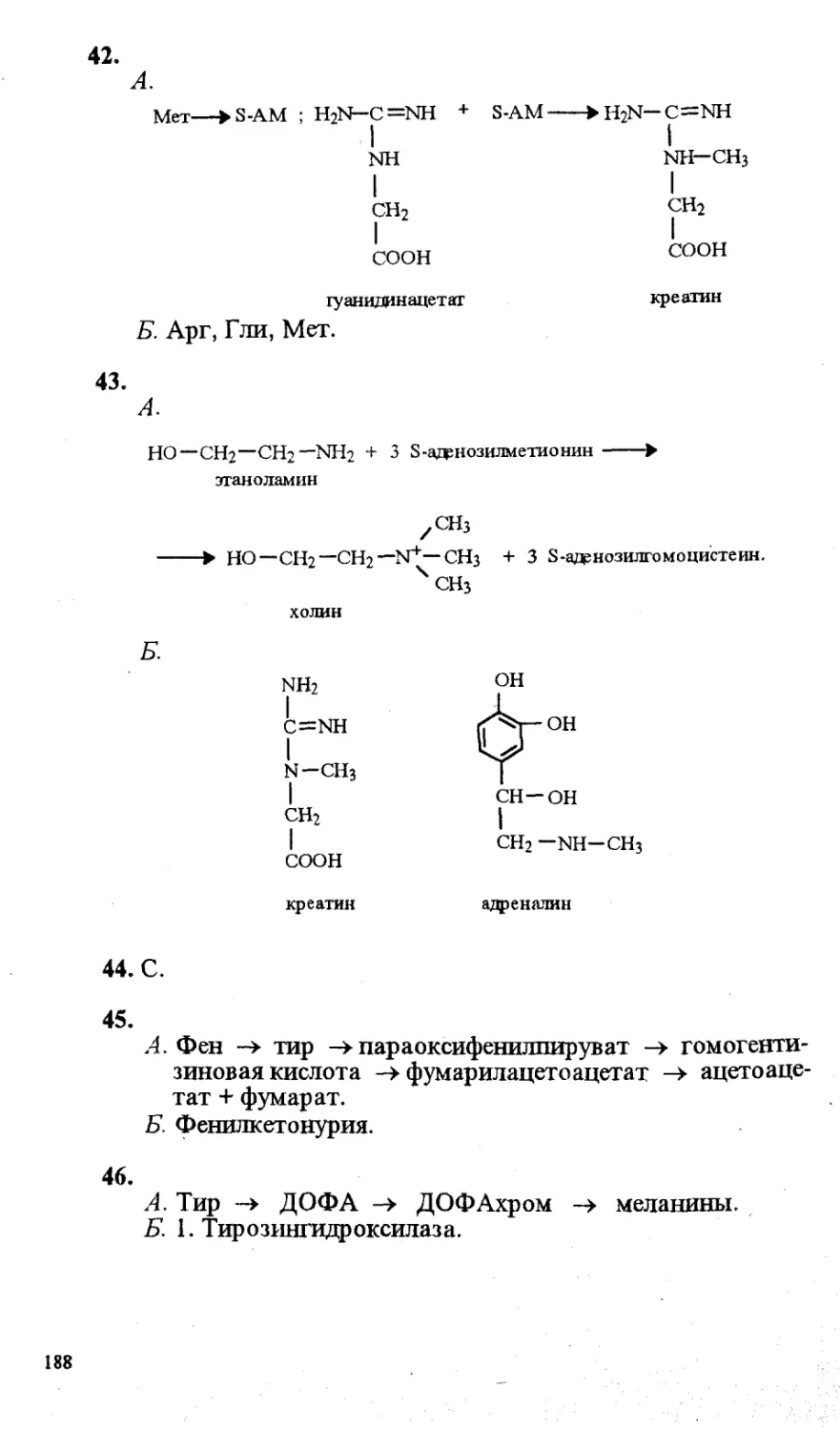
ISBN 5-211-034|3
ББК 78.07X28.9
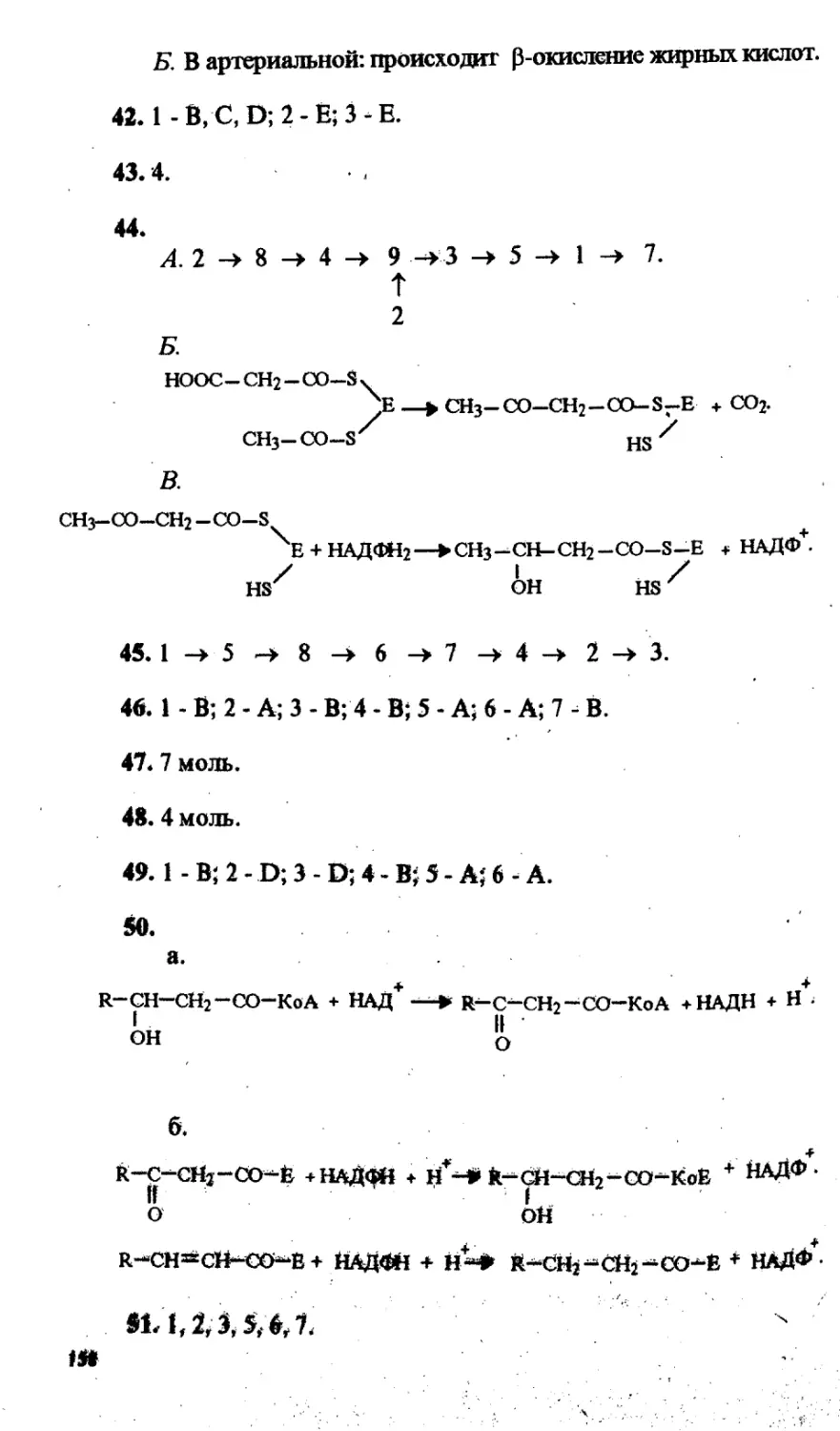
Содержание
Предисловие.......................................................... 4
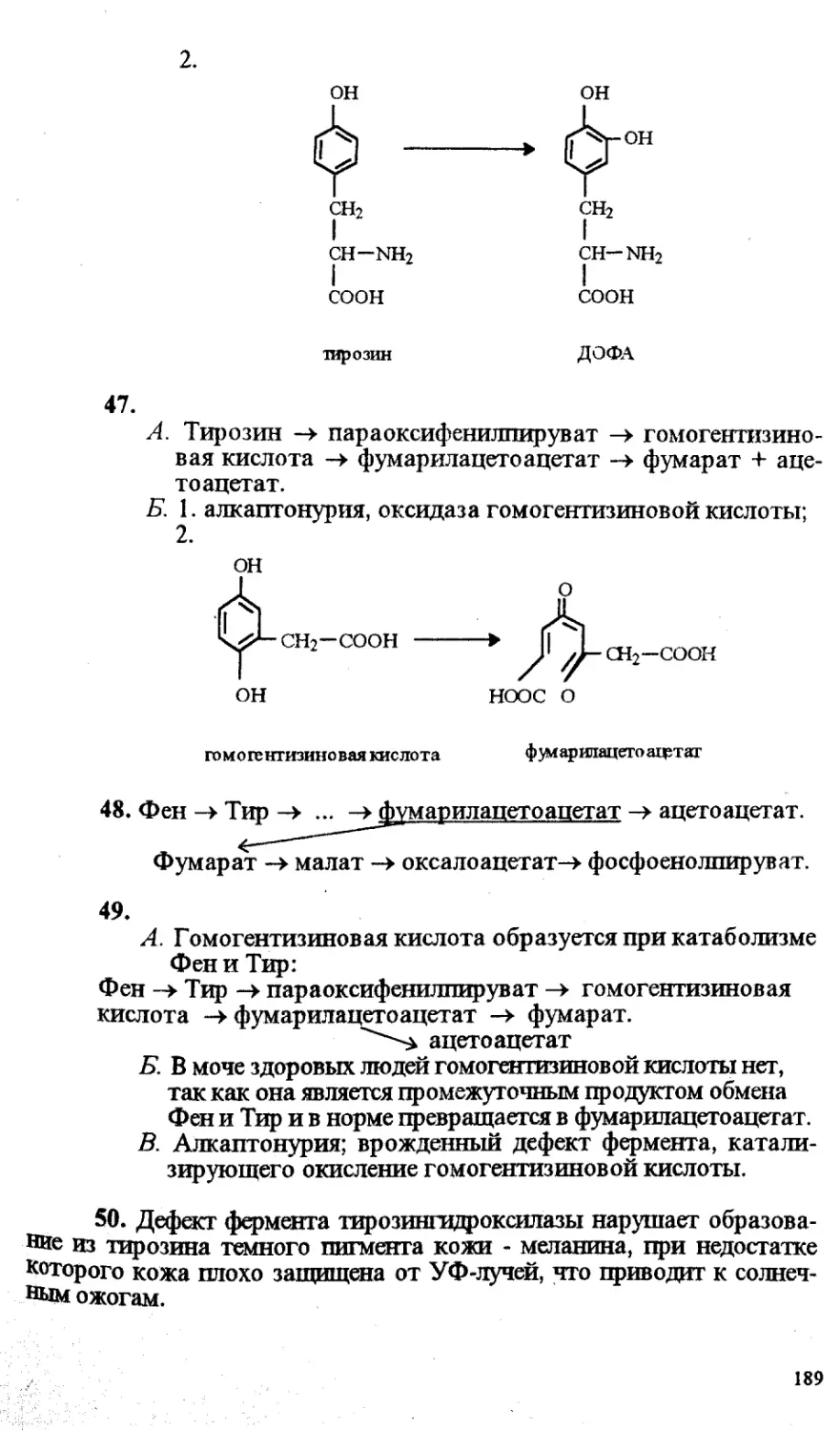
Принятые сокращения.................................................. 6
I
Строение, свойства и функции белков
(Н.Д.Воспельникова, Н.П,Волкова, С.Н.Силуянова).......... 8
II
Ферменты
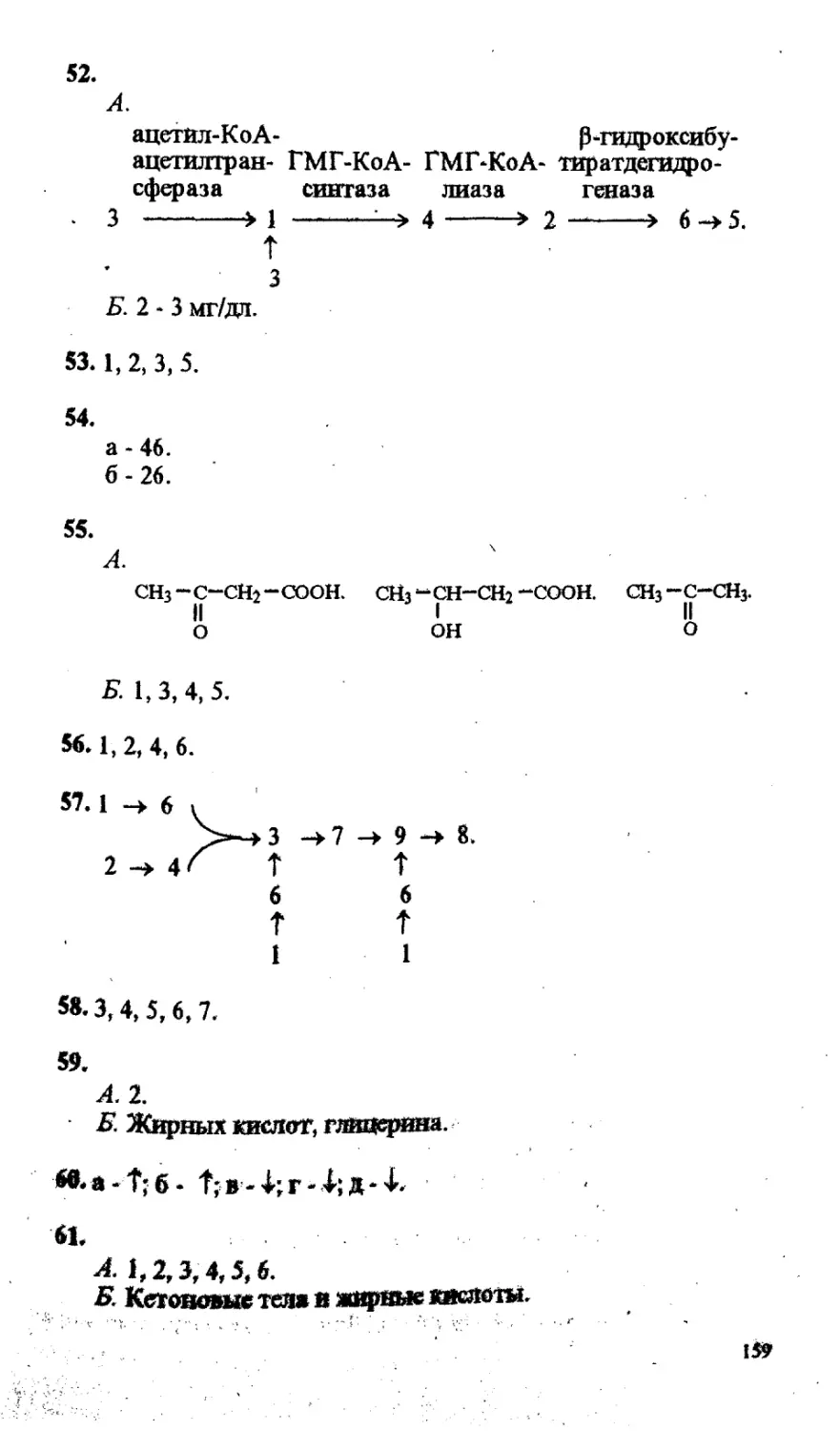
(Н.Д.Воспельникова, Н.П.Волкова, С.Н.Силуянова).......... 33
III
Матричные биосинтезы (С. А Силаева).................................... 59
IV
Энергетический обмен и общий путь катаболизма
(ГВ.Рубцова, Е.Г.Зезерое)................................................. 80
V
Обмен и функции углеводов (Т.А.Алейникова)........................... 95
. VI
Обмен и функции липидов (А.Е.Губарева, С.А.Силаева).................. 125
VII
Обмен аминокислот
(Н.ВЛихачева, С,А,Федорое, П.ГРубачев) ............................ 171
VIII
Обмен нуклеотидов (С.А.Силаева, ЛВ.Авдеева).......................... 191
IX
Гормональная регуляция обмена веществ и функций
(Л.В.Авдеева, А.Н.Смирнов)............................................... 196
X
Биохимия печени (С.Н.Силуянова).......................................... 208
XI
Биохимия крови (Е.В.Осипов, Л.АЛяпина)...............
XII
Биохимия межклеточного матрикса (А.Е.Губарева).
216
224
XIII
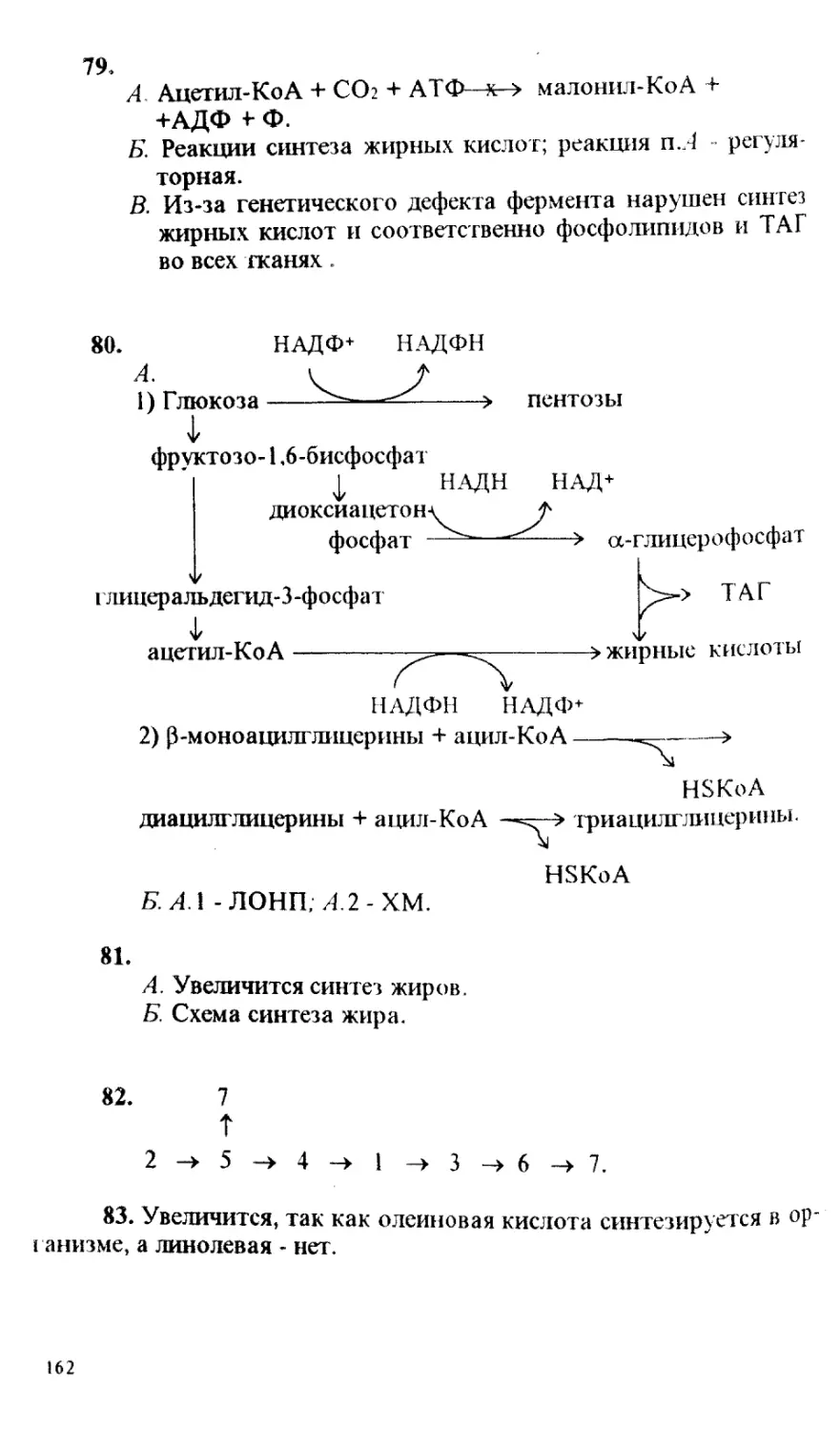
Иммуноглобулины и антигены (Е.Г.Зезерое)...... 231
з
ПРЕДИСЛОВИЕ
Предлагаемый сборник тестов и задач является результатом
многолетней работы преподавателей кафедры биохимии Москов-
ской медицинской академии им. И.М. Сеченова и кафедры физиоло-
гии человека и животных биологического факультета МГУ им. М.В.
Ломоносова. Наш сборник, предназначенный для обучения, кон-
троля и самоконтроля знаний, соответствует международным тре-
бованиям и может быть успешно использован в учебном процессе
студентами, аспирантами и преподавателями медико-биологических
и медицинских специальностей.
В сборник включены задания, основанные на тщательно ото-
бранном материале, в котором по возможности показаны связи с
другими дисциплинами, прежде всего с клиническими.
Задачи и различные типы тестов составлены по форме, реко-
мендованной ВОЗ для внедрения в медицинское и медико-
биологическое образование (1 - 4) или разработанной на кафедре
биохимии ММА им. И.М. Сеченова (Biochemical Education. 1990.
V.3) (5):
1) выбор наиболее правильного ответа из числа предложен-
ных(например, с.13, №21);
2) выбор правильной комбинации ответов (с. 10, №9; см.табл. 1);
3) выбор правильного ответа из возможных комбинаций при-
чинно-следственных связей (с. 43, №28; см. табл. 2);
4) вопрос - сопоставление: к ряду вопросов подобрать правиль-
ный ответ из числа предложенных (с. 10, №7);
5) ситуационные тесты - предлагаемая ситуация не встречалась
студенту в процессе обучения, но он имеет информацию для ее
решения (с. 161 , №124).
Преподаватели могут использовать сборник заданий для сле-
дующих целей:
1) организация процесса обучения с использованием тестов и
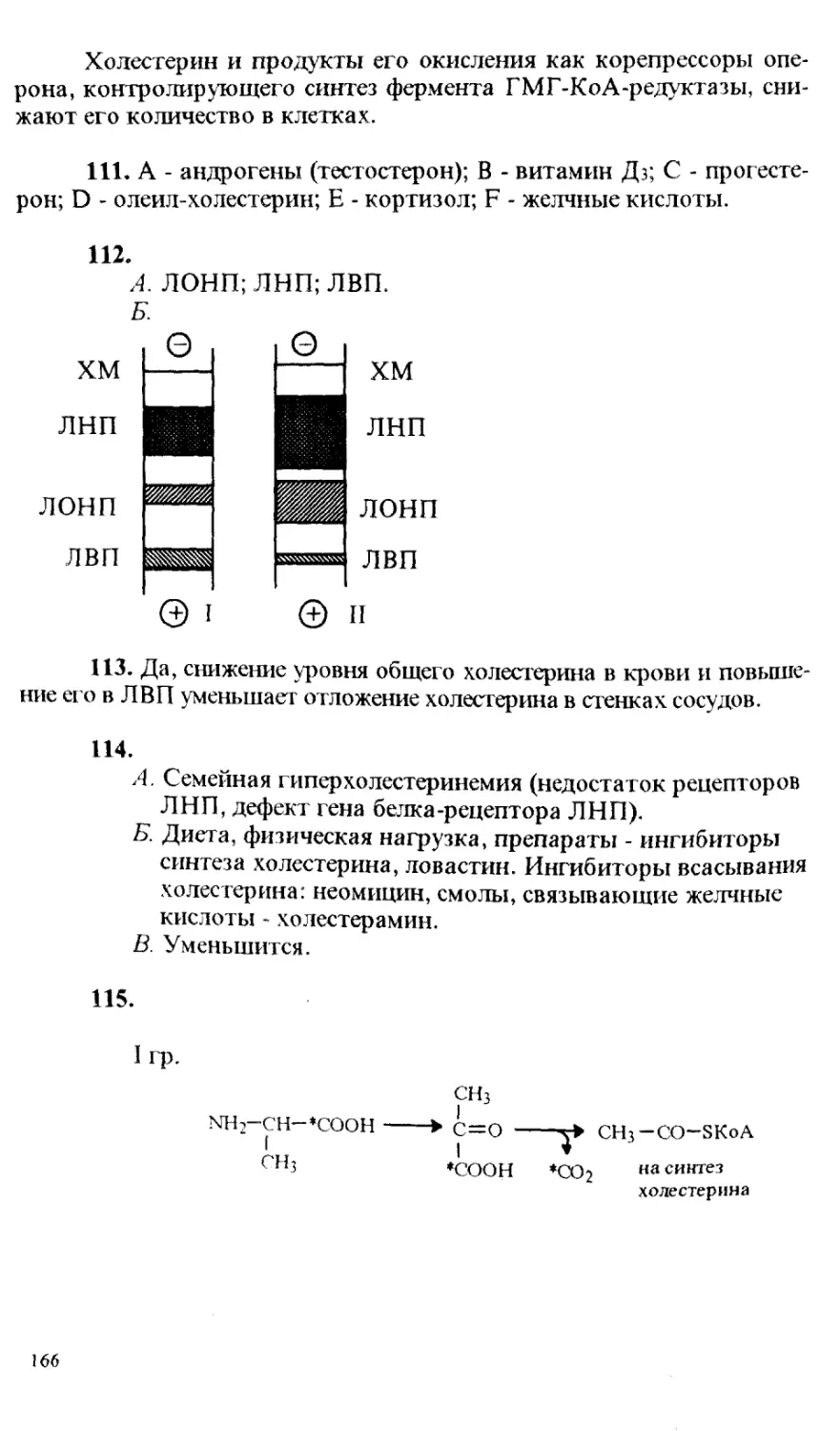
задач в обучающем режиме;
2) объективная оценка уровня знаний студентов на занятиях,
коллоквиумах, зачетах с минимальной затратой времени;
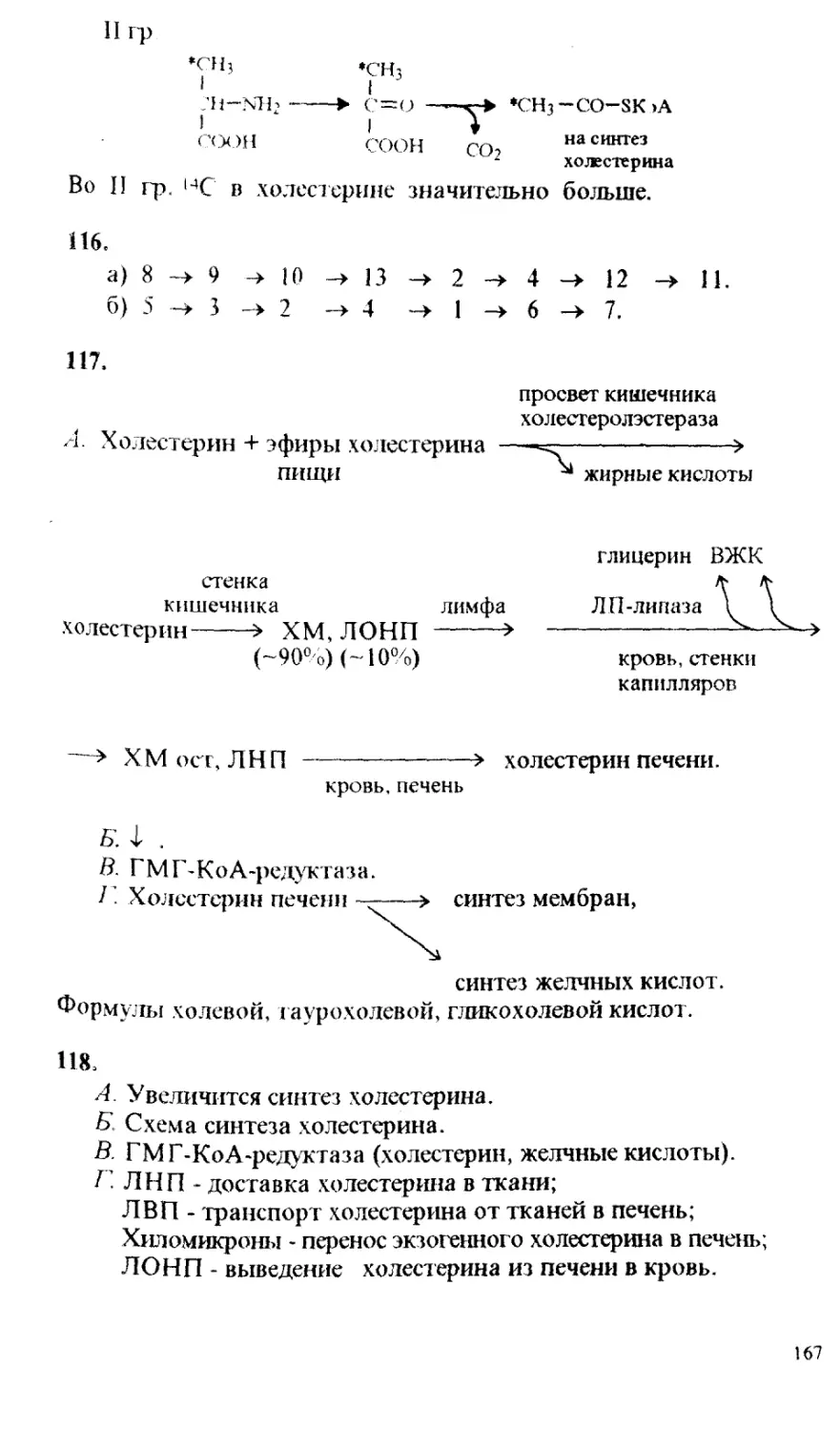
3) организация самостоятельной работы студентов;
4) составление экзаменационных билетов как тестовой, так и
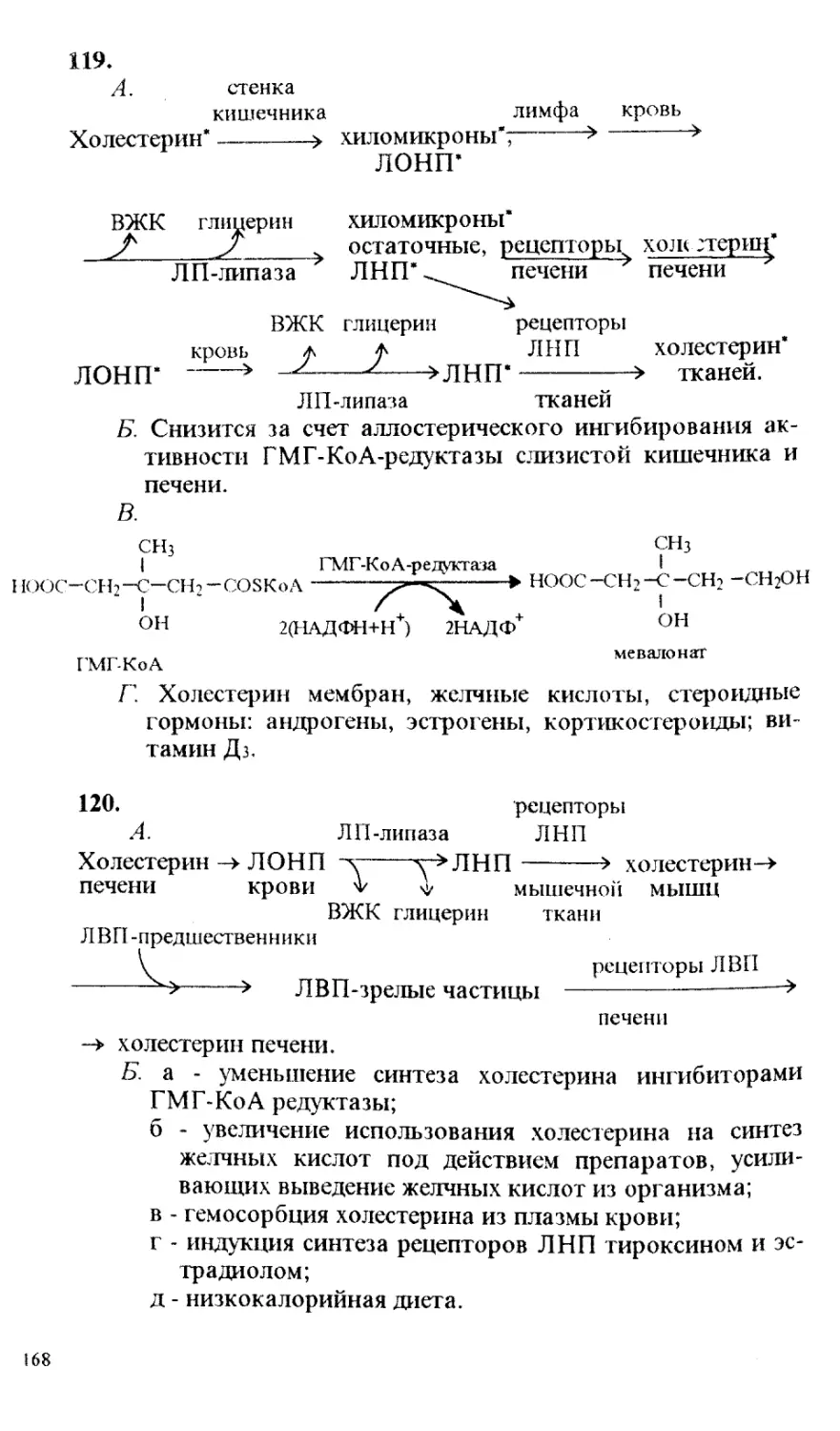
традиционной формы;
5) обучение слушателей ФПК эффективным методам препо-
давания и контроля знаний;
6) создание обучающих и контролирующих компьютерных
программ.
Студенты могут использовать эти задания при подготовке к
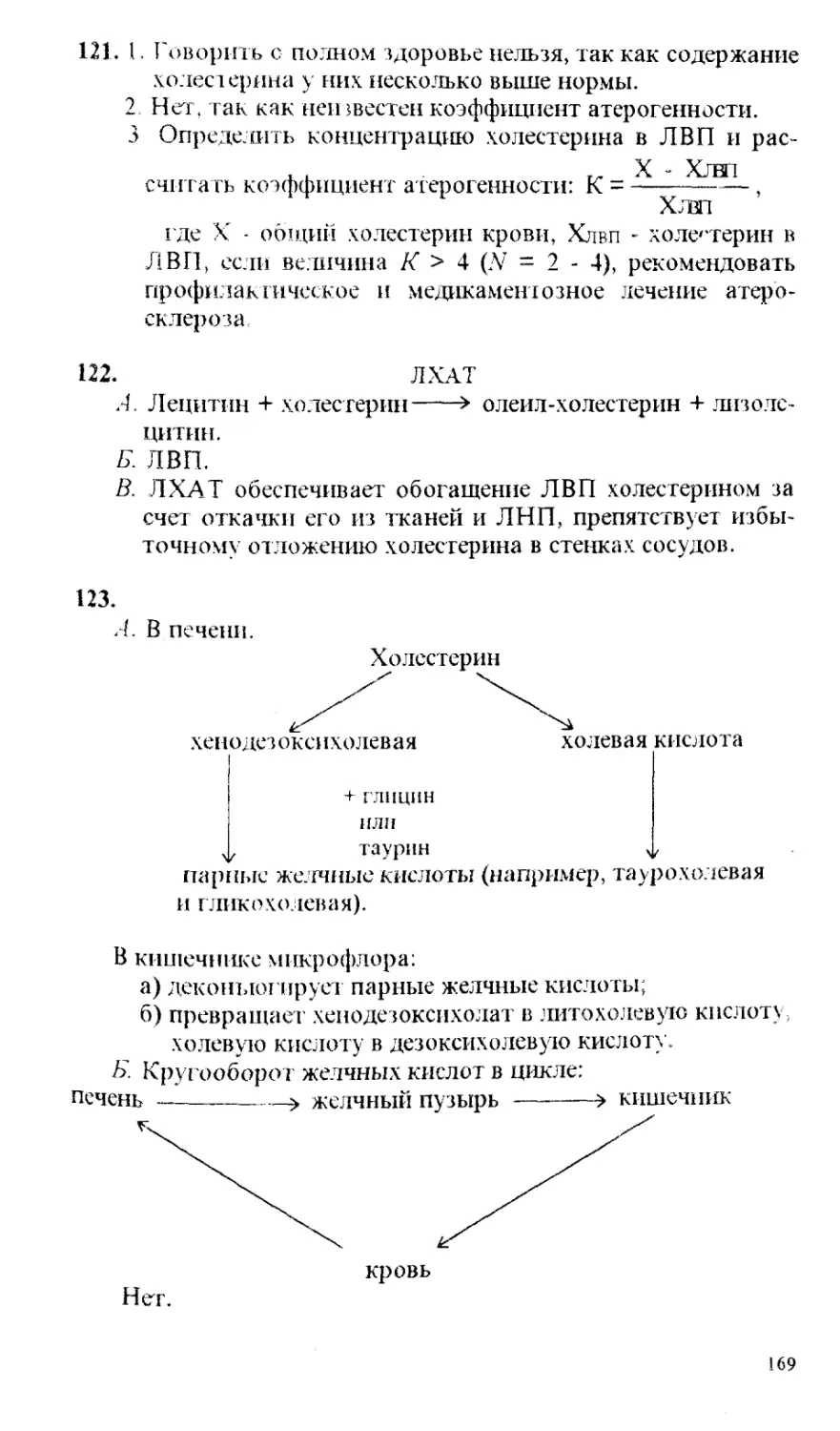
занятиям, зачетам и экзамену в режиме самоконтроля. Особенно
важно использовать такую форму самоконтроля при подготовке к
тестовому экзамену, так как при этом не только проверяется степень
4
подготовленности, но и совершенствуются навыки решения тестов,
что позволяет уложиться в строго определенное время тестового
экзамена. Все тесты, задачи и вопросы апробированы в учебном
процессе.
Ответы на ряд тестов даются по табл. 1 и 2.
В тестах с применением табл.1 предлагается 4 варианта отве-
тов. Выбрав правильные варианты (один или несколько), по табл. 1
находят букву, соответствующую правильным вариантам, и этой
буквой дается окончательный ответ. Например, ответ дается буквой
Е, если все 4 варианта ответов, предложенных в тесте, правильные.
Таблица 1
В качестве ответа выберите букву:
А, если 1,2,3 верно;
В, если 1,3 верно;
С, если 2, 4 верно;
D, если 4 верно;
Е, если все верно.
Тест с ответом по табл. 2 построен как сложноподчиненное
предложение, связанное словами “ПОТОМУ ЧТО”. Для выбора от-
вета по табл. 2 сначала нужно оценить правильность (“верно” или
“не верно”) первого (главного) предложения (т.е. до слов
“ПОТОМУ ЧТО”), затем правильность второго (придаточного)
предложения и далее - правильность смысловой связи между ними
“ПОТОМУ ЧТО”. В таблице находят букву, соответствующую по-
лученным сочетаниям оценок, и этой буквой дают окончательный
ответ. Например, если “верно” первое и второе предложение, но
смысловая связь между ними оценивается как “не верно”, пра-
вильный ответ на данный тест обозначается буквой В.
Таблица 2
Ответ Первое предложение Второе предложение Связь ’’ПОТОМУ ЧТО1 между предложениями
А верно верно верно
В верно верно не верно
С верно не верно не верно
D не верно верно не верно
Е не верно не верно не верно
Авторы благодарят кандидата медицинских наук А.Е. Губареву, доктора биоло-
гических наук Л.А. Ляпину, профессора Е.Г. Зезерова за организационную работу по под-
готовке сборника к изданию.
Принятые сокращения
А Аа - РНК-синтетаза АДФ Ала Альбумин-НЭЖК цАМФ Apr Асн Асп АТФ Ацетоацетил-Е Бутнрнл-Е Вал ВЖК Г Гал ГДФ Гис Гли Г лк Глн Глу ГМГ-КОА -аденин > аминоацил -тРНК-синтетаза - аденозиндифосфат -аланин - альбумин-неэстерифицированные жирные кислоты = циклический аденозинмонофосфалг - аргинин - аспарагиновая кислота - аспарагин аденозинтрифосфат - ацетоацетил, связанный с пальмитатсинтетазой - бутирил, связанный с пальмитатсинтетазой - валин - высшие жирные кислоты - гуанин - галактоза - гуанозиндифосфат - гистидин - глицин - глюкоза - глутамин - глутаминовая кислота • р-гидроксиметилглутарил-КоА
ГМГ -КОА-редуктаза * р-гидроксиметилглутарил-КоА -редуктаза
ГМГ-синтаза ГТФ ДАГ ДНК ИМФ Кротонил-Е ЛВП Лей Лиз ЛНП ЛОНП Л П-липаза - р-гидроксиметилглутарил-КоА-синтаза - гуанозинтрифосфат - диацилглицерины - дезоксирибонуклеиновая кислота - инозинмонофосфат - кротонил, связанный с пальмитатсинтетазой - липопротеины высокой плотности - лейцин - лизин - липопротеины низкой плотности - липопротеины очень низкой плотности • липопротеинлипаза
ЛХАТ 6 - лецитинколестеролацплтрансфераза
Малонил-Е - малонил, связанный с пальмитатсинтетазой
Мет - метионин
НАД+ - никотинамидадениндинукгеотнд
НК - нуклеиновые кислоты
ОМФ - оротидинмонофосфат
Про - пролин
РНК - рибонуклеиновая кислота
мРНК - матричная РНК
рРНК - рибосомальная РНК
тРНК - транспортная РНК
Сер • серин
Т -тимин
ТАГ - триацилглицерины
ТА Г-липаза - триацилглицеролипаза
Тир - тирозин
ТГФК - тетрагидрофолиевая кислота (Ш-фолат)
Три - триптофан
У - урацил
УДФ - уридиндифосфат
УТФ - уридинтрифосфат
ФАД - флавинадениндинуклеотцд
ФАФС 3' - фосфоаденозил-5 -фосфосульфат
фру - фруктоза
ХМост - хиломикроны остаточные
Ц - цитозин
ОДф - цитндинднфосфат
ЦПЭ - цепь переноса электронов
НТК - цикл трикарбоновых кислот
ЦТС - цитндинтрнфосфат
НЬ - гемоглобин
НЬА - нормальный гемоглобин взрослого человека
HbS - гемоглобин при серповидноклеточном анемии (р-глу6 -> Важ)
HbF - фетальный гемоглобин
Км - константа Михаэлиса
- максимальная скорость
I
СТРОЕНИЕ, СВОЙСТВА
И
ФУНКЦИИ БЕЛКОВ
1. Подберите к каждой аминокислоте соответствующее назва-
ние.
1. h2n—сн— соон 2. h2n—сн—соон 3. h2n—сн—соон
н2с-он сн (снг)4
нзс снз 1<н2
4. h2n—сн—соон 5. h2n—сн—СООН 6. H2N—сн—соон
I I I
СН2 (СН2)з сн3
СООН
h2n—c=nh
А. Асп.
В. Сер.
С. Apr.
D. Вал.
Е. Ала.
F. Лиз.
2. А. Напилите структурную формулу тирозина.
Б. Дайте название этой аминокислоте по номенклатуре
ИЮПАК.
В. Подчеркните функциональные группы, обозначьте угле-
родный атом и боковую цепь.
3. А. Напишите структурную формулу метионина.
Б. Дайте название этой аминокислоте по номенклатуре
ИЮПАК.
В. Подчеркните функциональные группы, обозначьте угле-
родный атом и боковую цепь.
4. Многие белки содержат ковалентно связанные углеводные
остатки. Как правило, местом присоединения углеводов к белку яв-
ляются оксиаминокислоты. Назовите известные Вам окси-амино-
кислоты и напишите их формулы.
5. Гистоны представляют собой небольшие основные белки,
связывающиеся с ДНК в хроматине. Они содержат относительно
8
много положительно заряженных аминокислот, радикалы которых
взаимодействуют с отрицательно заряженными остатками фосфор-
ной кислоты в ДНК. Предположите, какие диаминомонокарбоно-
вые кислоты входят в состав молекул гистонов. Напишите их фор-
мулы.
• 6. При pH 7,0 большинство аминокислот существует в виде
+H3N—CH—СОО-
цвиттер-ионов । (а-аминогруппа протонирована,
К.
а-карбоксильная группа депротонирована).
А. Назовите аминокислоты, имеющие при pH 7,0 дополни-
тельный отрицательный заряд, и напишите их формулы
в ионизированной форме.
Б. Назовите аминокислоты, имеющие при pH 7,0 дополни-
тельный положительный заряд, и напишите их формулы
в ионизированной форме.
7. Подберите к каждой из аминокислот соответствующее свой-
ство радикала
1. Три. А. Гидрофильный с анионной группой.
2. Асп. В. Гидрофильный с катионной группой.
3. Цис. С. Гидрофильный незаряженный.
4. Лей. D. Гидрофобный.
5. Apr.
6. Сер.
8. Напишите структурную формулу пентапептида следующего
строения:
Цис - Apr - Фен - Глу - Три.
А. Обозначьте N- и С-концы пептида.
Б. Отметьте регулярно повторяющиеся группы, образующие
пептидный остов и радикалы аминокислот.
В. Какие из изученных Вами цветных реакций будут поло-
жительны с данным пептидом?
9. А. Напишите формулу пептида Глу - Тир - Про - Гис.
Б. Какие из перечисленных ниже цветных реакций будут
положительными с данным пептидом?
1. Биуретовая.
2. Фоля.
3. Ксантопротеиновая.
4. Сакагутти.
Ответ по табл. 1.
9
10. О чем позволяют судить цветные реакции на белки?
1. О наличии белков в биологических жидкостях.
2. О первичной структуре белка.
3.0 наличии некоторых аминокислот в белках.
4. О функциях белков.
Ответ по табл. 1.
11. Определите последовательность аминокислот в тетрапеп-
тиде, используя следующие данные.
I. При анализе N-концевой аминокислоты и аминокис-
лотного состава пептида получено: Фен (Лиз, Глу,
Про).
2. После гидролиза трипсином (расщепляет пептидные
связи, в образовании которых участвуют карбоксиль-
ные группы Лиз или Apr) образуется трипептид, со-
держащий Лиз, Фен, Про.
12. Определите последовательность аминокислот в тетрапеп-
тиде, используя следующие данные.
1. При анализе N-концевой аминокислоты и аминокис-
лотного состава пептида получено: Асп- (Про, Тир,
Мет).
2. После гидролиза бромистым цианом (расщепляет пеп-
тидные связи, в которых участвует карбоксильная
группа Мет) образуется трипептид, содержащий Тир,
Мет, Асп.
13. Определите последовательность аминокислот в тетрапеп-
тиде, используя следующие данные.
1. При анализе N-концевой аминокислоты и аминокис-
лотного состава пептида получено: Цис- (Три, Про,
Сер).
2. После гидролиза химотрипсином (расщепляет в основ-
ном пептидные связи, в образовании которых участ-
вуют карбоксильные группы ароматических аминокис-
лот) образуется трипептид, содержащий Три, Цис,
Про.
14. Из приведенных ниже аминокислот выберите те, радикя-ПЫ
которых могут участвовать в образовании водородных связей:
Асп, Асн, Глн, Глу, Сер, Вал, Лиз, Гис, Гли.
' 15. На рисунке представлены функциональные группы амино-
кислот, образующие в белках определенные типы связей.
ю
он
1.-NH3+;-COO'. 2.-СН3; Q^CH2. З.-ОН; 0=0-
4. NH; 0=C. 5.-SH; O=C- 6. ~SH; HS~.
/ 4 I
nh2
А. Назовите типы связей, которые могут возникнуть ме-
жду функциональными группами каждой пронумеро-
ванной пары.
Б, Выпишите номера пар, участвующих в формировании
вторичной и третичной структуры.
А. Первичная структура.
В. Вторичная структура.
С. Третичная структура.
16. Разные уровни структурной организации белков стабили-
зированы определенными типами связей; подберите каждому прону-
мерованному типу связи буквенный ответ.
1. Связь между карбоксиль-
ными и аминогруппами
радикалов аминокислот.
2. Связь между а-амино и а-
карбоксильными груп-
пами аминокислот.
3. Связи между радикалами
цистеина.
4. Водородные связи между
пептидными группиров-
ками.
5. Водородные связи между
радикалами аминокислот.
6. Гидрофобные взаимодей-
ствия радикалов амино-
кислот.
17. Л. На фрагменте пептида
-NH-CH-CO-NH-CH-CO-NH-CH-CO-NH-CH-CO-NH-
Тир Цис Лей Apr
"CH-CO-NH-CH-CO-NH-CH-CO-
Вал Асп Ала
обозначьте пунктирной линией от одной аминокислоты
к другой связи, участвующие в образовании а-спирали.
Б. Радикалы каких аминокислот в данном фрагменте бел-
ка могут участвовать в образовании связей: I - гид-
11
рофобных, II - ионных, III - водородных, VI - дисуль-
фидных?
В. В формировании каких уровней структурной организа-
ции белка принимают участие связи, указанные в п. Б.?
18. Дан фрагмент полипептидной цепи:
-NH-CH-CO-NH-CH-CO-NH-CH-CO-NH-CH-CO-NH- СН-СО-
Сер Лиз Лей Цис Вал
В образовании каких типов связей могут участвовать ради-
калы каждой из аминокислот, входящих в состав этого пептида при
формировании третичной структуры белка?
v 19. В полипептидной цепи между радикалами аминокислот
могут возникать химические связи. Выберите пары аминокислот,
способных Образовывать связи и укажите тип этих связей.
1. Сер, Асн. 5. Гис, Асп.
2. Ала, Вал. 6. Фен, Apr.
3. Глу, Аси. 7. Цис, Ала.
4. Цис, Цис. 8. Глу, Лиз.
20. Подберите к каждому уровню структурной организации
белка соответствующее понятие.
1. Первичная структура. 2. Вторичная структура. 3. Третичная структура. 4. Четвертичная структура. А. Конформация пептидного остова, в формировании которой участвуют водородные связи между пептид- ными группировками. В. Порядок чередования аминокислот в белках. С. Пространственное расположение и характер взаимодействия пептидных цепей в олигомерном белке. D. Конформация полипептидной цепи, стабилизированная межрадикаль- ными связями.
21. Выберите определение первичной структуры белка.
1. Аминокислотный состав полипептидной пепи.
2. Линейная структура полипептидной цепи, образован-
ная ковалентными связями между радикалами амино-
кислот.
3. Порядок чередования аминокислот, соединенных пеп-
тидными связями в белке.
4. Структура полипептидной цепи, стабилизированная
водородными связями между атомами пептидного ос-
това.
12
22. Выберите определение вторичной структуры белка.
1. Способ укладки протомеров в олигомерном белке.
2. Последовательность аминокислот, соединенных пепти-
дной связью в полипептидной цепи.
3. Пространственная укладка полипептидной цепи, ста-
билизированная преимущественно слабыми связями
между радикалами аминокислот.
4. Способ укладки полипептидной цепи в виде а-спиралей
и [3-структур.
5. Объединение нескольких полипептидных цепей в фиб-
риллярные структуры.
23. Выберите определение третичной структуры белка.
1. Пространственная структура белка, стабилизирован-
ная водородными связями, образующимися между ато-
мами пептидного остова.
2. Конформация полипептидной цепи, обусловленная вза-
имодействием радикалов аминокислот.
3. Порядок чередования аминокислот в полипептидной це-
пи.
4. Конформация белка, стабилизированная преимуществе-
нно ковалентными связями между радикалами аминокис-
лот.
5. Способ укладки протомеров в олигомерном белке.
24. Выберите наиболее полное и правильное определение чет-
вертичной структуры белка.
1. Способ укладки полипептидной цепи в пространстве.
2. Пространственное расположение полипептидных цепей
в виде фибриллярных структур.
3. Количество протомеров, их расположение относительно
друг друга и характер связей между ними в олигомер-
ном белке.
4. Порядок чередования аминокислот в полипептидной
цепи.
5. Способ укладки полипептидной цепи в виде а-спиралей
иР-структур.
25. Что представляют собой контактные поверхности прото-
меров в олигомерном белке?
1. Поверхностные участки протомеров, между аминокис-
лотными остатками которых образуются преимущест-
венно ковалентные связи.
2. Поверхностные участки протомеров, комплементарные
друг другу. В результате геометрического и химиче-
ского соответствия между двумя взаимодействующими
13
поверхностями образуется большое количество слабых
связей.
3. Поверхностные участки протомеров, представленные
только небелковыми группами, за счет которых осуще-
ствляется контакт взаимодействующих полипептидных
, цепей.
4. Фрагменты полипептидных цепей, уложенных в про-
странстве в виде 0-структур.
26. Какие из перечисленных ниже взаимодействий обуслов-
лены комплементарностью молекул?
1. Белка с лигандом.
2. Протомеров в олигомерном белке.
3. Белка с диполями воды в растворе.
4. Функционально связанных ферментов при формирова-
нии полиферментных комплексов.
5. Различных белков в процессе самосборки клеточных
органелл.
6. Радикалов аминокислот при формировании третичной
структуры белка.
27. В молекуле олигомерного белка имеется 19 остатков ли-
зина, около 12 из них легко ацилируются ангидридами дикарбоно-
вых кислот (реагентами на МНг-группы). Ацилирование дополни-
тельно еще 2 остатков лизина приводит к диссоциации белка на
субъединицы. Оставшиеся 5 остатков лизина могут быть модифи-
цированы только после денатурации фермента. Предположите,
сколько остатков лизина расположено
а) на поверхности белка;
б) внутри глобулы;
в) на участке контакта между субъединицами.
28. Процесс самосборки протомеров характеризуется высокой
специфичностью, ПОТОМУ ЧТО узнавание протомеров происхо-
дит благодаря наличию комплементарных поверхностей.
Ответ по табл. 2.
29. Выберите правильное определение конформации белка.
1. Аминокислотная последовательность полипептиттной
цепи.
2. Число полипептидных цепей в олигомерном белке.
3. Количество а-спиралей и 0-складчатых структур в по-
липептидной цепи.
4. Пространственное взаиморасположение атомов в бел-
ковой молекуле.
Ответ по табл. 1.
14
30. Что понимают под изменением конформации белков?
1. Изменение аминокислотной последовательности поли-
пептидной цепи.
2. Изменение вторичной и третичной структуры полипеп-
тидных цепей.
3. Замену одной простетической группы в сложном белке
на другую простетическую группу.
4. Изменение взаиморасположения в пространстве субъе-
диниц олигомерного белка.
Ответ по табл. 1.
31. Для белков характерна конформационная лабильность,
ПОТОМУ ЧТО пространственная структура белка фиксирована
преимущественно слабыми взаимодействиями.
Ответ по табл. 2.
32. Что представляет собой центр узнавания белка лигандом?
1. Совокупность радикалов аминокислот, сближенных на
уровне третичной структуры.
2. Фрагмент пептидного остова.
3. Простетическую небелковую группу.
4. Участок белка, комплементарный лиганду.
Ответ по табл. 1.
33. Активный центр белка представлен радикалами аминокис-
лот, принадлежащими различным участкам полипептидного остова,
ПОТОМУ ЧТО активный центр белка образуется в результате фор-
мирования третичной структуры.
Ответ по табл. 2.
34. В основе биологической функции бежов лежит их способ-
ность взаимодействовать со специфическими лигандами, ПОТОМУ
ЧТО в бежах есть центры узнавания, комплементарные лигандам.
Ответ по табл. 2.
35. Биологические свойства бежов определяются их первич-
ной структурой, ПОТОМУ ЧТО формирование центра узнавания,
обеспечивающего специфическое взаимодействие с лигандом, про-
исходит на уровне первичной структуры бежа.
Ответ по табл. 2.
36. Какие процессы обусловлены способностью бежов к спе-
цифическим взаимодействиям с лигандами?
1. Образование надмолекулярных структур клетки.
2. Межклеточные взаимодействия в тканях.
3. Транспорт веществ через биологические мембраны.
15
4. Упорядоченность химических превращений веществ в
клетках.
Ответ по табл. 1.
37. Многие лекарственные вещества взаимодействуют с опре-
деленными белками организма, ПОТОМУ ЧТО они являются
структурными аналогами природных лигандов этих белков.
Ответ по табл. 2.
38. Подберите к каждому лиганду белок, с которым он может
взаимодействовать.
1. СО:. А. Взаимодействует только с НЬ.
2. О:. В. Взаимодействует только с
3.3-фосфоглицерат миоглобином
4. Н+. С. Взаимодействует с обоими
5. 2,3-бифосфоглицерат. белками.
D. Не взаимодействует ни с
одним из них.
39. Цитохром с - митохондриальный белок, участвующий в
переносе электронов в процессах биологического окисления. Изуче-
ны аминокислотные последовательности этого белка более чем у 100
видов. Количество аминокислотных замен по сравнению с цитохро-
мом человека (всего 104 аминокислоты) у шимпанзе, кенгуру, змеи и
пшеницы - 0, 10,14 и 35 соответственно. Какие общие закономерно-
сти связи первичной структуры и функции белков подтверждаются
этими данными?
1. Значительное совпадение первичной структуры разных
белков, выполняющих сходные, но неодинаковые
функции.
2. Большое сходство белков, выполняющих у разных ви-
дов одну и ту же функцию (сходство первичных струк-
тур более чем на 50% является достаточно большим).
3. Связь между эволюционной близостью видов и сходст-
вом первичной структуры белков, выполняющих одну
и ту же функцию.
4. Влияние отдельных аминокислотных замен на функцию
белка.
40. Какие общие закономерности подтверждаются сравнением
первичной структуры НЬ А и Hb S человека?
1. Значительное совпадение первичной структуры разных
белков, выполняющих сходные, но не одинаковые
функции;
2. Большое'сходство белков, выполняющих у разных ви-
дов одну и ту же функцию.
16
3. Влияние отдельных аминокислотных з гн на функцию
белка.
4. Связь между эволюционной близостью видов и сходст-
вом первичной структуры белков, выполняющих одну
и ту же функцию.
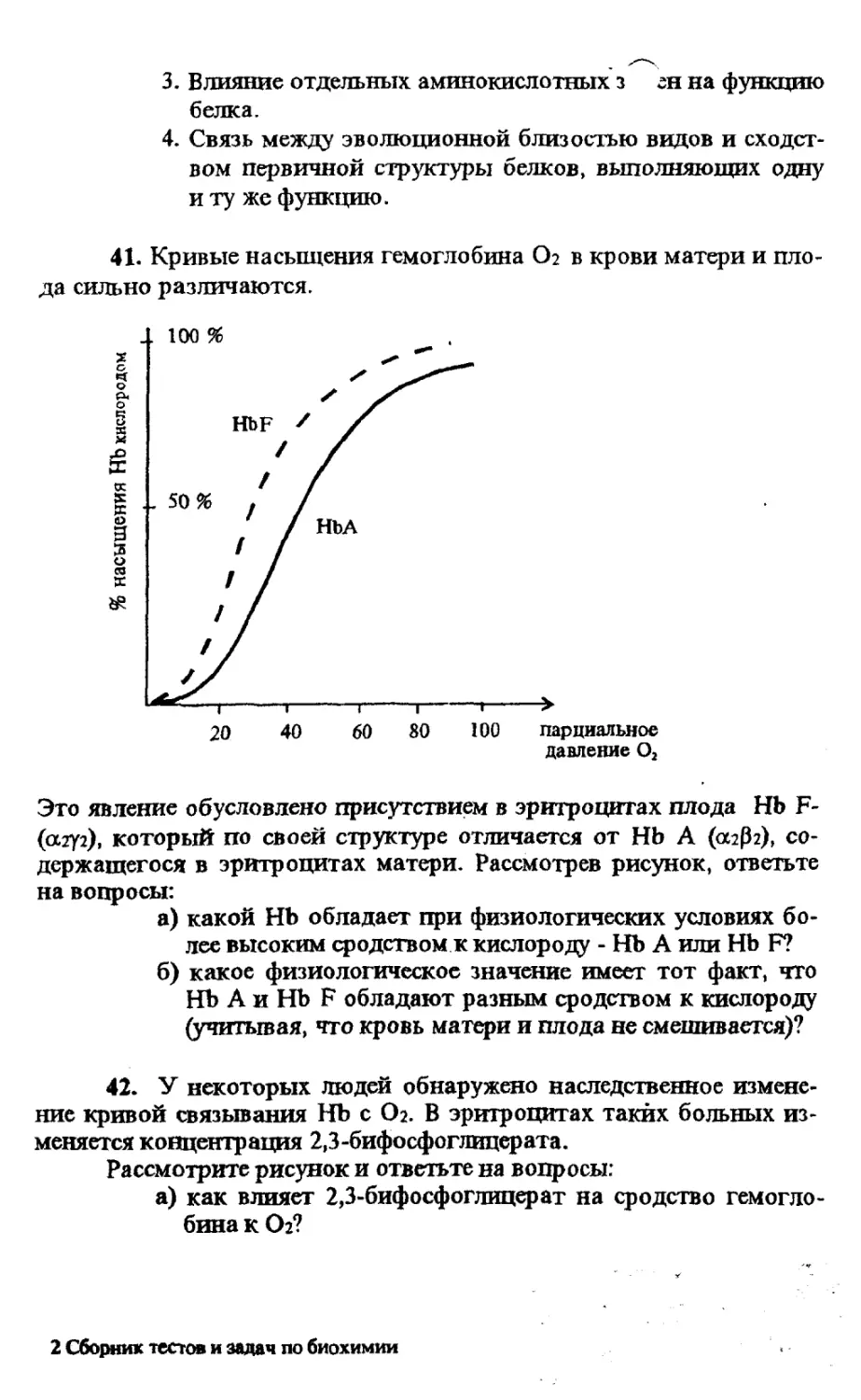
41. Кривые насыщения гемоглобина Ог в крови матери и пло-
да сильно различаются.
Это явление обусловлено присутствием в эритроцитах плода Hb F-
(азуг), который по своей структуре отличается от НЬ А (аз^з), со-
держащегося в эритроцитах матери. Рассмотрев рисунок, ответьте
на вопросы:
а) какой НЬ обладает при физиологических условиях бо-
лее высоким сродством к кислороду - НЬ А или Hb F?
б) какое физиологическое значение имеет тот факт, что
НЬ А и Hb F обладают разным сродством к кислороду
(учитывая, что кровь матери и плода не смешивается)?
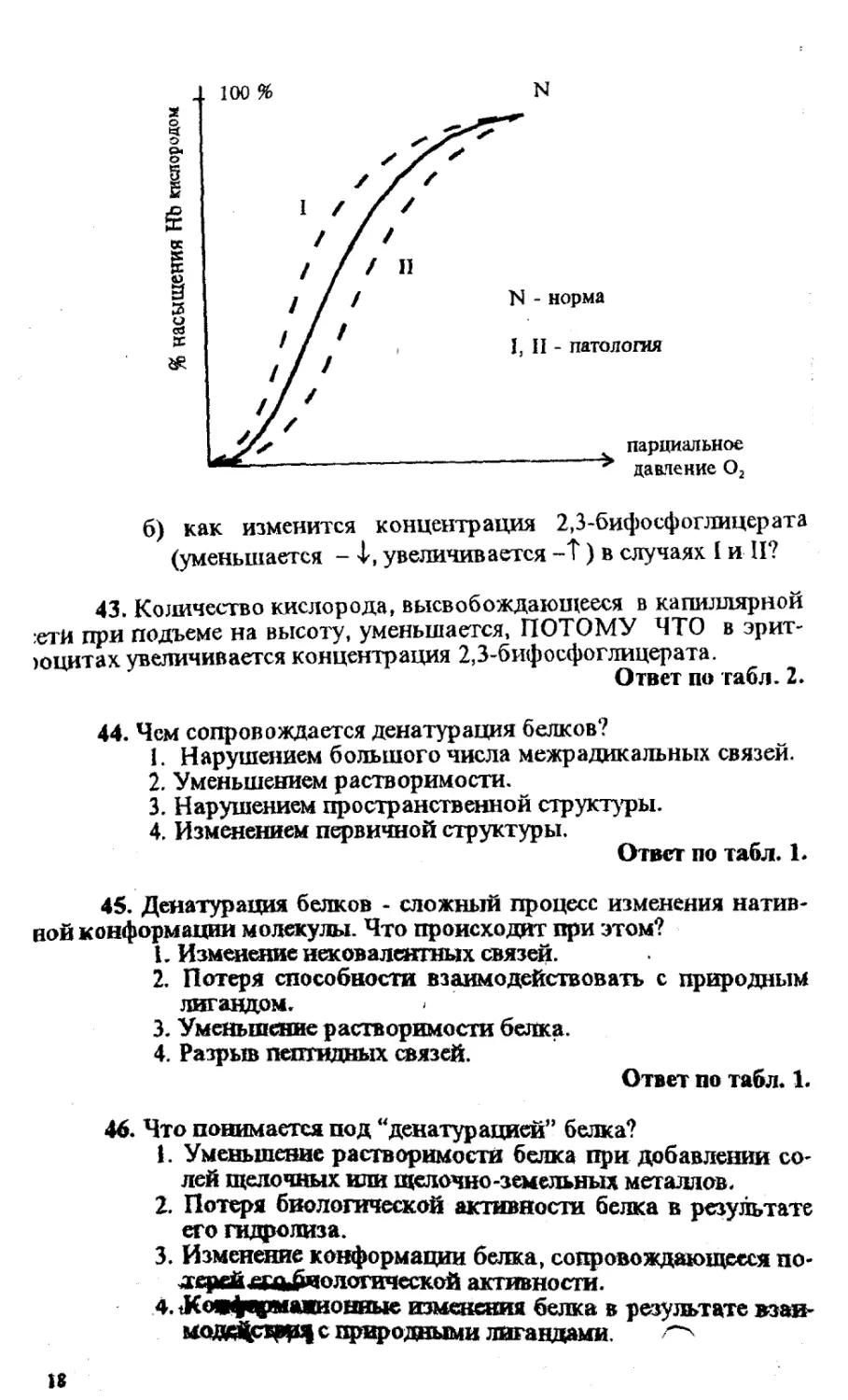
42. У некоторых людей обнаружено наследственное измене-
ние кривой связывания НЬ с Оз. В эритроцитах таких больных из-
меняется концентрация 2,3-бифосфоглицерата.
Рассмотрите рисунок и ответьте на вопросы:
а) как влияет 2,3-бифосфоглицерат на сродство гемогло-
бина к Оз?
2 Сборник тесте» и задач по биохимии
б) как изменится концентрация 2,3-бифосфоглицерата
(уменьшается -1, увеличивается -Т) в случаях I и П?
43. Количество кислорода, высвобождающееся в капиллярной
:ети при подъеме на высоту, уменьшается, ПОТОМУ ЧТО в эрит-
юцитах увеличивается концентрация 2,3-бифосфоглицерата.
Ответ по табл. 2.
44. Чем сопровождается денатурация белков?
1. Нарушением большого числа межрадикальных связей.
2. Уменьшением растворимости.
3. Нарушением пространственной структуры.
4. Изменением первичной структуры.
Ответ по табл. 1.
45. Денатурация белков - сложный процесс изменения натив-
ной конформации молекулы. Что происходит при этом?
I. Изменение иековалентных связей.
2. Потеря способности взаимодействовать с природным
лигандом.
3. Уменьшение растворимости белка.
4. Разрыв пептидных связей.
Ответ по табл. 1.
46. Что понимается под “денатурацией” белка?
1. Уменьшение растворимости белка при добавлении со-
лей щелочных или щелочно-земельных металлов.
2. Потеря биологической активности белка в результате
его гидролиза.
3. Изменение конформации белка, сопровождающееся по-
дервйиааь^ологической активности.
4. гКожфчрмажионные изменения белка в результате взаи-
мод^стррз с природными лигандами
18
47. При денатурации белков сохраняется их способность свя-
зывать специфические лиганды, ПОТОМУ ЧТО первичная струк-
тура белков при денатурации не изменяется.
Ответ по табл. 2.
48. При определенных условиях возможна ренативация дена-
турированного белка, ПОТОМУ ЧТО конформация пептидной
цепи определяется его первичной структурой.
Ответ по табл. 2.
49. При определенных условиях возможна ренативация белка,
ПОТОМУ ЧТО при денатурации сохраняется его способность свя-
зывать специфические лиганды.
Ответ по табл. 2.
50. При употреблении большого количества сырого яичного
белка может развиться (особенно у детей) гиповитаминоз биотина,
сопровождающийся специфическим дерматитом (болезнь Свифта).
Обнаружено, что в сырых яйцах содержится гликопротеин - авидин.
В желудочно-кишечном тракте авидин образует нерастворимый
комплекс с биотином. Почему вареные яйца такого эффекта не вы-
зывают?
51. Для разделения полипептидов часто используется разли-
чие в их растворимости. Перепишите в тетрадь таблицу. Укажите
около каждой аминокислоты, входящей в состав приведенных ниже
трипептидов, свойство ее радикала (гидрофильный - г или липо-
фильный - л, а также заряд: 0, «+» или «-»). Сравните растворимость
полипептидов 1 и 2 в каждой строчке (>, <, -).
pH Трипептиды Растворимость (>.<,=) __
1 2
7 Ала-Сер-Глу Асп-Сер-Гис
9 Глу-Цис-Три Вал-Гли-Арг
4 Арг-Тре-Ала Асп-Цис-Сер
52. Дан пептид Арг-Лиз-Асп-Сер.
А. Около каждой аминокислоты укажите заряд ее ради-
кала (0, +, -) при pH 7,0; определите область рН(> 7,0,
< 7,0 или 7,0), в которой лежит ИЭТ данного пептида.
К Что происходит с пептидом в электрическом поле при
pH 7,0: движение к аноду либо к катоду или остается на
старте?
В. Как изменится заряд пептида при pH 7,0, если амино-
кислоту Лиз заменить на Лей? Изменится ли и, если да,
то каким образом, направление его движения в элек-
трическом поле?
19
53. Укажите направление движения (к аноду, катоду или оста-
ется на старте) перечисленных ниже пептидов
а) при pH 3,0;
б) при pH 10,0.
1. Лиз-Гли-Ала-Гли. 4. Глу-Гли-Ала-Глу.
2. Лиз-Гли-Ала-Глу. 5. Гли-Гли-Ала-Лиз.
3. Гис-Гли-Ала-Глу.
54. Чем определяется растворимость белков в водной среде?
1. Ионизацией белковой молекулы.
2. Гидратацией белковых молекул при растворении.
3. Формой молекулы белка.
4. Способностью связывать природные лиганды.
Ответ по табл. 1.
55. Высаливание - один из методов фракционирования белков.
А. Выделите свойство белков, которое в наибольшей мере
зависит от концентрации солей.
1. Суммарный заряд. 3. Размер белковых молекул.
2. Степень гидратации белков. 4. Форма белковых молекул.
Б. Почему при изменении этого параметра растворимость
белка падает?
В. Почему при ступенчатом повышении концентрации
сульфата аммония (например, от 30 до 50%) на каждой
ступени из экстракта ткани выпадают в осадок не все
, белки, а лишь некоторые?
56. На каком различии основано фракционирование белков
методом гель-фильтрации?
1. По растворимости. 3. По суммарному заряду.
2. По форме молекул. 4. По молекулярной массе.
Ответ по табл. 1.
57. Какие из перечисленных ниже физико-химических свойств
белков лежат в основе их разделения методами ионообменной хро-
матографии и электрофореза?
1. Гидратация молекул.
2. Заряд молекул.
3. Форма молекул.
4. Молекулярная масса.
А. Используется в ионообменной
хроматографии.
В. Применяется для электрофореза.
С. Применяется для обоих методов.
D. Не используется в данных методах.
58. Что происходит с белками при высаливании и при денату-
рации?
20
1. Уменьшение
растворимости белка.
2. Изменение степени
гидратации.
3. Обратимое осаждение
белка.
4. Необратимое осаждение
белка.
5. Сохранение нативной
структуры.
6. Изменение молекулярной
массы.
7. Необратимое изменение
биологических свойств.
А. Характерно только для
высаливания.
В. Характерно только для
денатурации.
С. Характерно для обоих
процессов.
D. Не характерно ни для
одного из указанных
процессов.
59. На различиях каких физико химических свойств белков
основаны методы разделения и выделения индивидуальных белков?
1. Метод ультрацентрифугирования.
2. Метод электрофореза.
3. Метод гель-фильтрации.
4. Метод ионообменной
хроматографии.
5. Метод солевого фракционирования.
А. Ионизация.
В. Гидратация.
С. Молекуляр-
ная масса.
60. При изучении свойств белков используются (наряду с дру-
гими) методы диализа и гель-фильтрации. В каком из перечислен-
ных ниже процессов они находят свое применение?
1. Очистка белков от низко-
молекулярных соединений.
2. Фракционирование высоко-
молекулярных белков по различию
молекулярной массы.
3. Разделение белков по суммарному
заряду.
4, Определение молекулярной массы.
61. Дана смесь белков (см. таблицу).
А. В диализе.
В. В гель-фильтра-
ции.
С. В обоих методах.
D. Ни в том, ни в
другом.
Название белка Молекулярная масса PI белка
Цитохром 13 370 10,65
Химотрипсиноген 23 240 9,5
Миоглобин 16 900 7,0
Предложите методы, которые можно использовать для разде-
ления белков.
62. Дана смесь белков (см. таблицу).
2*
21
Название белка Молекулярная масса PI белка
Церулоплазмин 151 000 4,4
у-глобулин 150 000 6,3
р-лактоглобулин 37 100 5,2
Предложите методы разделения белков и укажите последова
тельность их выделения из смеси.
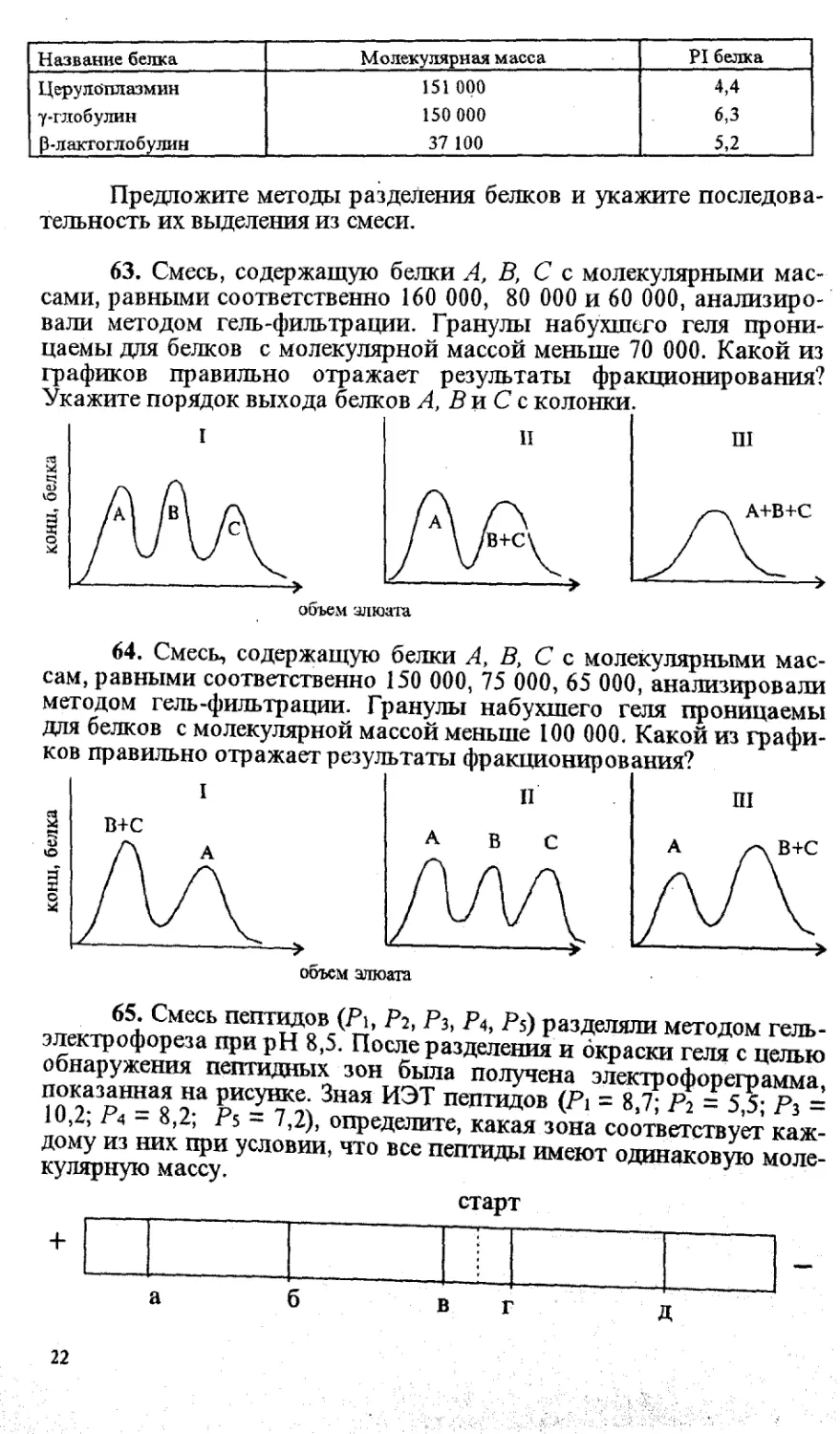
63. Смесь, содержащую белки А, В, С с молекулярными мас-
сами, равными соответственно 160 000, 80 000 и 60 000, анализиро-
вали методом гель-фильтрации. Гранулы набухшего геля прони-
цаемы для белков с молекулярной массой меньше 70 000. Какой из
графиков правильно отражает результаты фракционирования?
Укажите порядок выхода белков А, В и С с колонки.
I п ш
объем элюата
64. Смесь, содержащую белки А, В, С с молекулярными мас-
сам, равными соответственно 150 000, 75 000, 65 000, анализировали
методом гель-фильтрации. Гранулы набухшего геля проницаемы
для белков с молекулярной массой меньше 100 000. Какой из графи-
ков правильно отражает результаты фракционирования?
I П Ш
объем элюата
65. Смесь пептидов (Pi, Pi, Рг, Ра, Ps) разделяли методом гель-
электрофореза при pH 8,5. После разделения и окраски геля с целью
обнаружения пептидных зон была получена электрофореграмма,
показанная на рисунке. Зная ИЭТ пептидов (Pi = 8,7; Р2 = 5,5; Рз =
10,2, Ра — 8,2, Ps — 7,2), определите, какая зона соответствует каж-
дому из них при условии, что все пептиды имеют одинаковую моле-
кулярную массу.
старт
22
66. Смесь пептидов (Pi, Рз, Рз, Рд, Ps) разделяли методом гель-
электрофореза при pH 5,2. После разделения и окраски геля с целью
обнаружения пептидных, зон была получена электрофореграмма,
показанная на рисунке. Зная ИЭТ пептидов (Pi = 10,2; Рг = 8,7; Рз =
5,5; Рд ~ 6,0; А = 7,2), определите, какая зона соответствует каж-
дому из них (все пептиды имеют одинаковую молекулярную массу).
старт
а б в г д
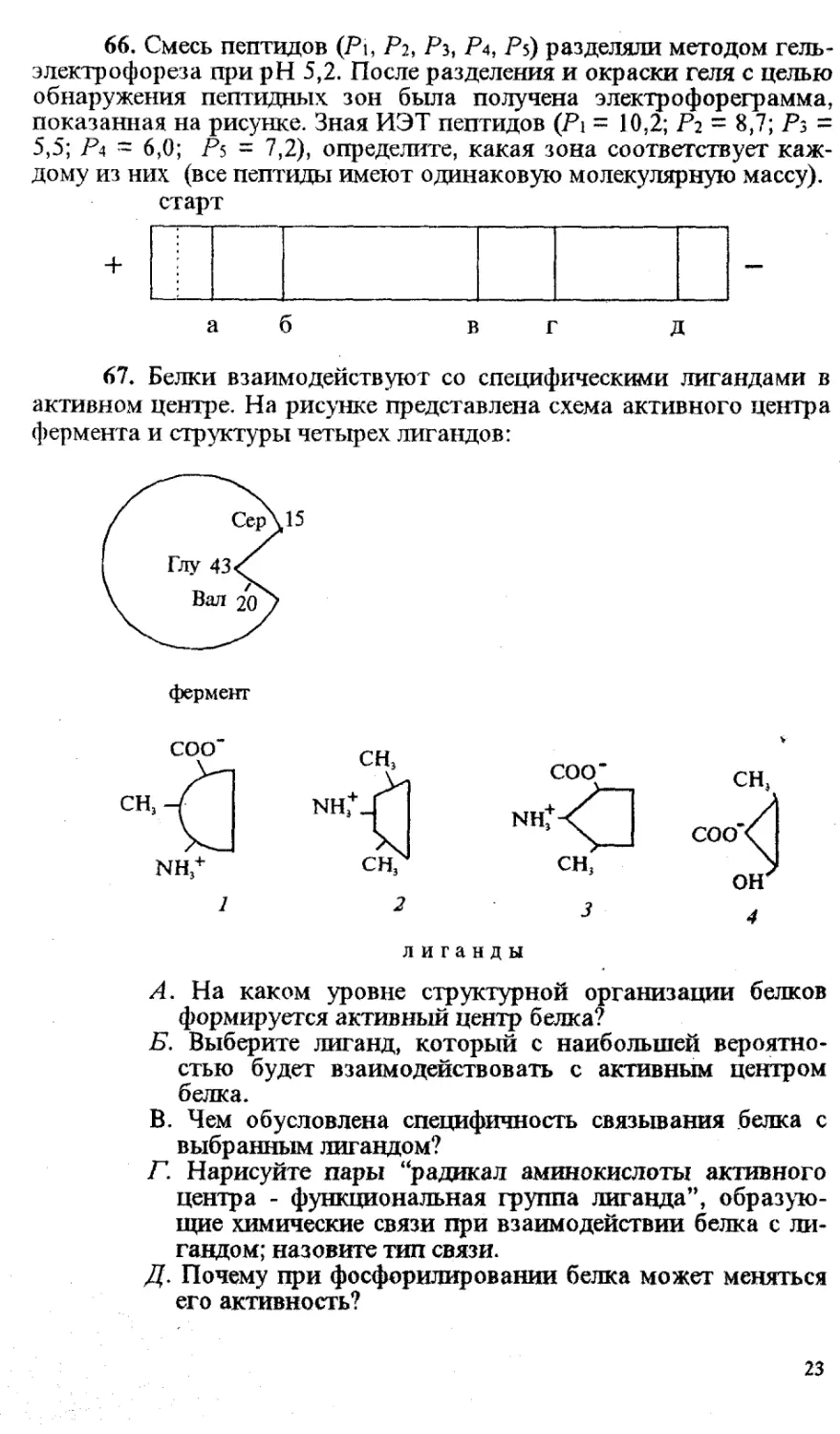
67. Белки взаимодействуют со специфическими лигандами в
активном центре. На рисунке представлена схема активного центра
фермента и структуры четырех лигандов:
лиганды
А. На каком уровне структурной организации белков
формируется активный центр белка?
Б. Выберите лиганд, который с наибольшей вероятно-
стью будет взаимодействовать с активным центром
белка.
В. Чем обусловлена специфичность связывания белка с
выбранным лигандом?
Г. Нарисуйте пары “радикал аминокислоты активного
центра - функциональная группа лиганда”, образую-
щие химические связи при взаимодействии белка с ли-
гандом; назовите тип связи.
Д. Почему при фосфорилировании белка может меняться
его активность?
23
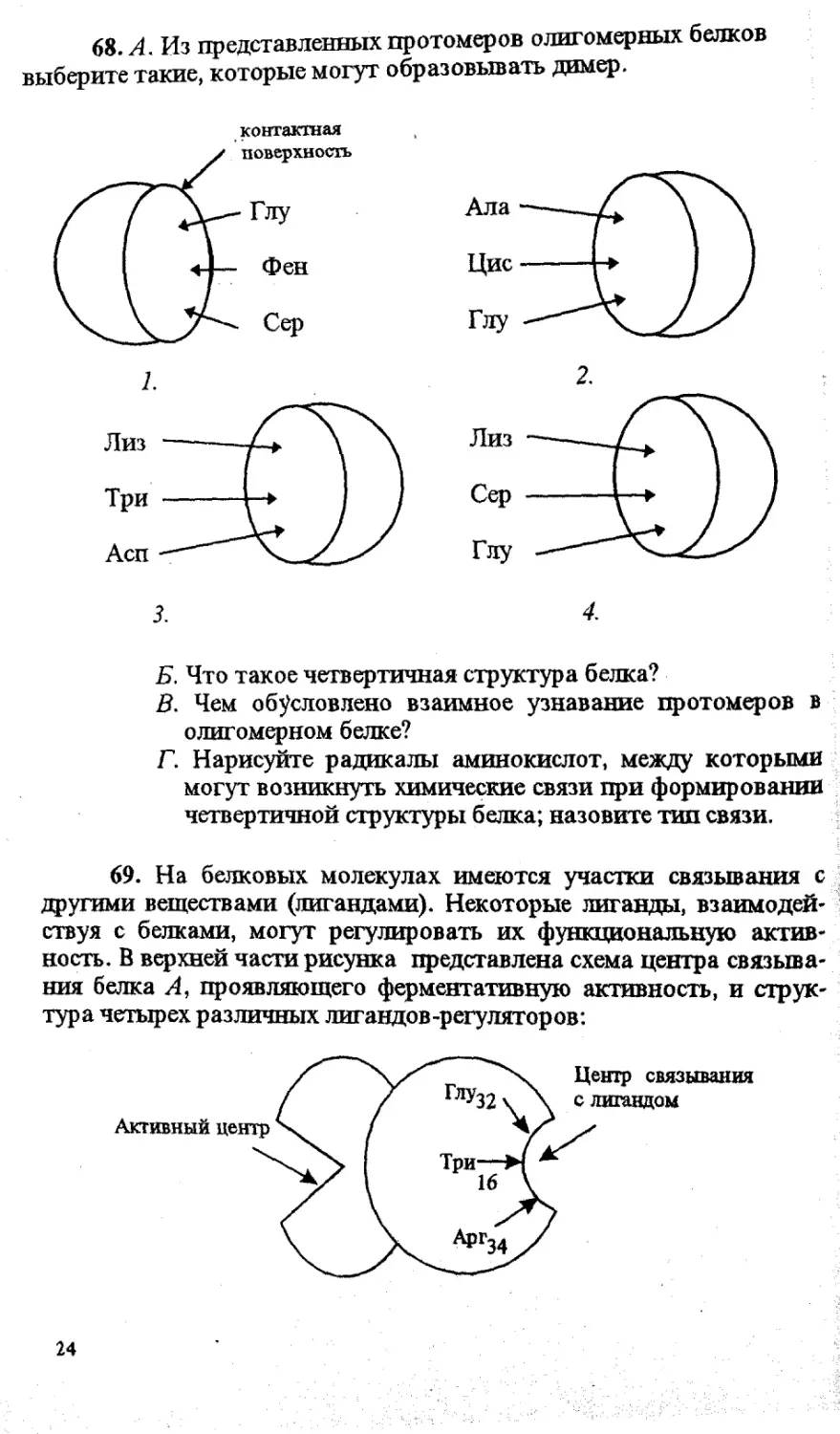
68. А. Из представленных протомеров олигомерных белков
выберите такие, которые могут образовывать димер.
Б. Что такое четвертичная структура белка?
В. Чем обусловлено взаимное узнавание протомеров в
олигомерном белке?
Г. Нарисуйте радикалы аминокислот, между которыми
могут возникнуть химические связи при формировании
четвертичной структуры белка; назовите тип связи.
69. На белковых молекулах имеются участки связывания с
другими веществами (лигандами). Некоторые лиганды, взаимодей-
ствуя с белками, могут регулировать их функциональную актив-
ность. В верхней части рисунка представлена схема центра связыва-
ния белка А, проявляющего ферментативную активность, и струк-
тура четырех различных лигандов-регуляторов:
24
А. На каком уровне структурной организации белка
формируется центр связывания с лигандом?
Б. Выберите лиганд, который с наибольшей вероятно-
стью будет взаимодействовать с центром связывания
белка.
В. Чем обусловлена специфичность связывания белка А с
выбранным лигандом?
Г. Нарисуйте пары “радикал аминокислоты - функцио-
нальная группа лиганда”, образующие химические свя-
зи при взаимодействии белка с лигандом.
Д. Почему при взаимодействии с лигандом-регулятором
изменяется активность белка?
70. На рисунке представлена схема строения олигомерного
белка, имеющего два центра (1 и 2) связывания с лигандами:
А. Нарисуйте два лиганда, которые могли бы специфиче-
ски взаимодействовать с этими центрами. Укажите их
функциональные группы, участвующие в связывании
белка с лигандом, назовите связи.
Б. Дайте определение понятиям “лиганд” и “комплемен-
тарность”.
В. Будет ли влиять взаимодействие одного из лигандов с
центром 1 на связывание другого лиганда с центром 2?
. Ответ объясните.
25
Г. Почему при изменении температуры в пределах, не вы-
зывающих необратимую денатурацию, сродство ли-
ганда к белку изменяется?
71. Известно, что конформация белковой молекулы может ме-
няться при воздействии различных факторов.
Какие из перечисленных факторов могут
а) регулировать биологическую активность белков в ор-
ганизме человека;
б) вызывать денатурацию белка?
1. Изменение температуры.
2. Взаимодействие с лигандами (субстратами, эффекто-
рами-регуляторами, кофакторами).
3. Отщепление части пептидной цепи при действии про-
теолитических ферментов.
4. Изменение pH.
5. Изменение химической модификации белков (присое-
динение фосфатной метильной или ацетильной групп к
молекуле белка).
6. Действие солей тяжелых металлов.
Эталоны ответов к разделу I
“СТРОЕНИЕ, СВОЙСТВА
И ФУНКЦИИ БЕЛКОВ”
1. 1 - В; 2 - D; 3 - F; 4 - А; 5 - С; 6 - Е.
2. А.
HO-G Л—сн2—сн—соон
У—9 I
nh2
Б. 2-амино-З-гидроксифенилпропановая кислота.
В. СООН, NH2, ОН - функциональные группы.
З.А. H}C-S-CH2-CH2-CH-COOH.
NH2
Б. 2-амино-4-метилтиобутановая кислота.
В. СООН, NH2, СН3 - функциональные группы.
4. Сер, Тре, Тир,
26
5. Лиз, Apr.
6. А. Глу, Асп.
Б. Лит, Apr, Гис.
7.1 - D; 2 - А; 3 - С; 4 - D; 5 - В; 6 - С.
8. А, Б.
N-конец
пептидный остов
С-конец
шг сн- со- NH- сн- со
сн2 (СН2Ь
SH NH
H2N- c*=nh
- NH- CH” СО -NH~CH~CO-NH- CH- СООН
аминокислот
В, Биуретовая; ксантопротеиновая; Фоля; Сакагутти.
9. А.
NH2-CH-CO-
(СН2)2
СООН
NH- CH- CO-N- CH- CO-NH- СН- СООН
IJ сн2
О
ОН NH
Б. В.
10. В. 12. Асп-Тир-Мет-Про.
11. Фен-Про-Лиз-Глу.
13. Цис-Про-Три-Сер.
14. Асп, Глу, Сер, Лиз, Гис - одна водородная связь; Асн, Глн -
две водородные связи.
15. А. I - ионная; 2 - гидрофобная; 3 - водородная; 4 - водо-
родная; 5 - водородная; 6 - дисульфидная.
Б. Вторичная структура - 4; третичная структура - I, 2, 3,
5, 6.
16. 1 - С; 2 - А; 3 - С; 4 - В; 5 - С; 6 - С.
17. А.
27
-NH-CH-CO-NH-CH-CO-NH-CH-CO-NH-CH-CO-NH-CH-CO-NH-CH-CO-NH-CH-CO
Тир Цис Лей Apr Вал Асп Ала
Б. I - Лей, Вал, Ала; II - Apr, Асп; III - Тир, Цис, Apr,
Асп; IV - Цис.
В. В формировании третичной и четвертичной структур.
18. Сер - водородная; Лиз - ионная или водородная; Лей - гид-
рофобная; Цис - водородная или дисульфидная; Вал - гидрофобная.
19. 1 - водородная; 5 - ионная; 8 - ионная. 2 - гидрофобная; 4 - дисульфидная;
20. 1 -B;2-A;3-D;4 - С. 31. А.
21. 3. 32. D.
22. 4. 33. А.
23. 2. 34. А.
24.3. 35. С.
25. 2. 36. Е.
26. 1; 2; 4; 5. 37. А.
27. а - 12; б-5; в-2. 38. 1 - А; 2 - С; 3 - D; 4 - С, 5 - А.
28. А. 39. 2; 3.
29. D. 40.3.
30. С.
41. a. HbF. б. Обеспечивает переход кислорода от НЬ матери к НЬ плода.
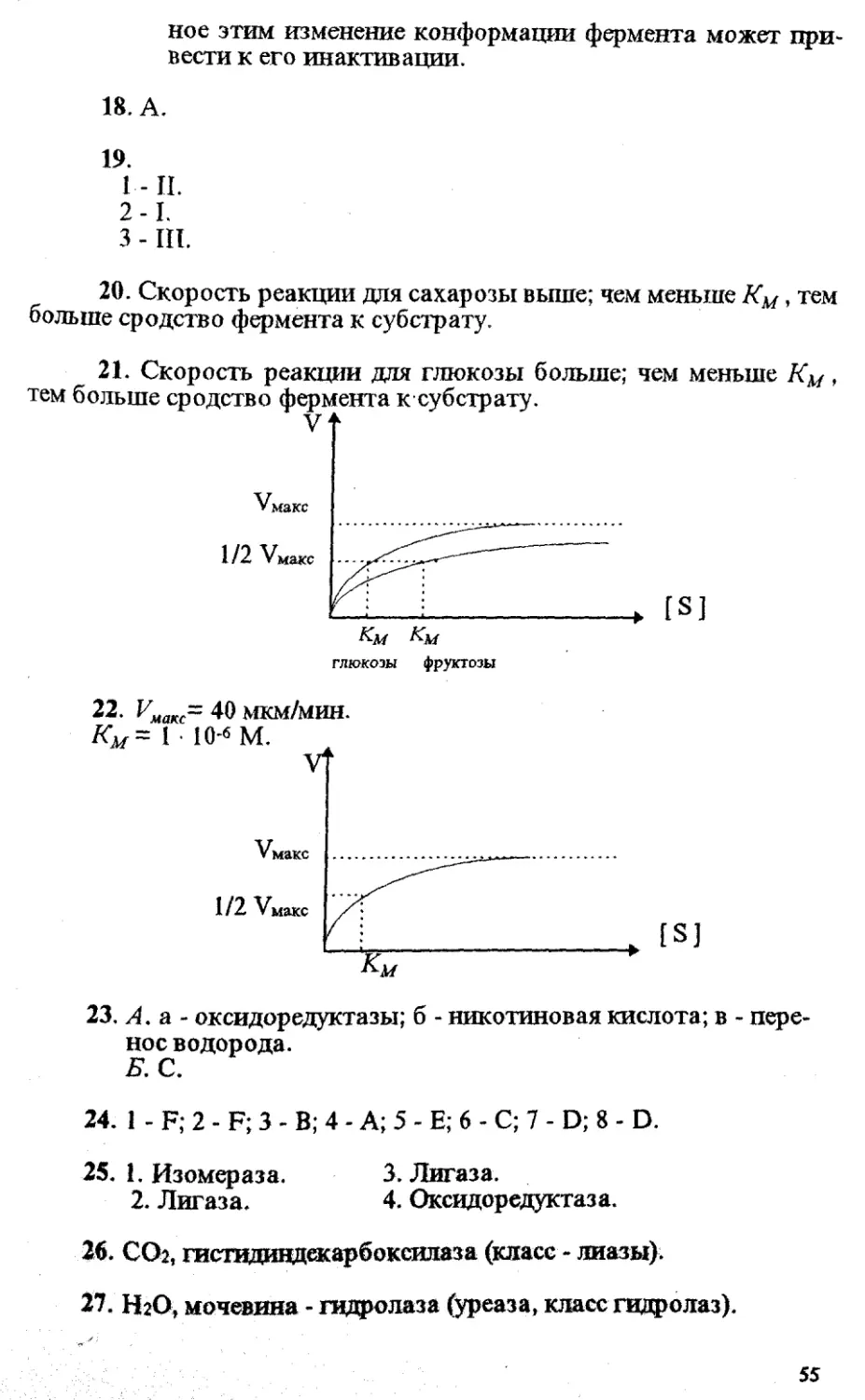
42. а. Уменьшает. б. I - Ф; II - Т . 46. 3.
43. D. 47. D.
28
I
44. A.
45. A.
48. A.
49. C.
50. Высокая температура вызывает денатурацию авидина, в
результате нарушается его способность связывать биотин.
51.
pH Трипептиды Растворимость
1 2
7 л г г Ала - Сер - Глу 0 0- г г г Асп - Сер - Гис 0 + 1 < 2
9 г г л Глу - Цис - Три - 0 0 л г г Вал - Гли - Apr 0 0 0 1 >2
4 г г л Apr - Тре - Ала + 00 г г г Асп - Цис - Сер 0 0 0 1 < 2
52. A. Apr - Лиз - Асп - Сер. pH > 7,0.
+ + - 0
Б. Движется к катоду.
В. Останется на старте.
53.
а: 1 - к катоду; 2 - к катоду; 3 - к катоду; 4 - на старте; 5 - к
катоду.
б: 1 - на старте; 2 - к аноду; 3 - к аноду; 4 - к аноду; 5 - на
старте.
54. А.
55. А. 2.
Б. Ионы соли, притягивая молекулы воды, уменьшают
количество воды, взаимодействующее с белками, и
снижают их растворимость.
В. При одной и той же концентрации соли ниже раство-
римость тех белков, на поверхности которых содер-
жится меньшее количество гидрофильных групп.
56. С.
57. 1 - D; 2 - С; 3 - D; 4 - В.
29
58. 1 - С; 2 - С; 3 - A; 4 - В; 5 - A; 6 - D; 7- В.
59.1 - С; 2 - А,С; 3 - С; 4 - А; 5 - В.
60.1 - С; 2 - В; 3 - D; 4 - В.
61. Электрофорез или ионообменная хроматография, осно-
ванные на различии в заряде белков.
62. Гель-фильтрация для отделения р-лактоальбумина
(различия в молекулярной массе), затем электрофорез или ионооб-
менная хроматография (различия в заряде белков).
63. 1 - А, В, С.
64. III.
о=с-
- СН2-ОН о
-СН2-СОО- NH3-
65. а - Р2; б - Р5; в - Р4; г - Pf, д - Р3.
66. а - Р3; б - Р4; в - Р5; г - Р2; д - Р,.
67. Л. На уровне третичной структуры.
Б. 3.
В. Комплементарностью активного центра белка и ли-
ганда.
Г.
(водородная)
(ионная)
(гидрофобная)
Д. Присоединение фосфатной группы Изменяет конформа-
ций) белка и его активность.
68. А 7 и Л -
Б. Количество и способ укладки Протомеров в олигомер-
ном белке. *
В. Комплементарностью контактных поверхностей двух
протомеров.
-сн/сн’
30
- CHj-COO' NH3+-CH2- (ионная)
-ch2-Q
(гидрофобная)
-сн2-он
о=с-сн2-
О
(водородная)
69. А. На уровне третичной структуры.
Б. 2.
В. Комплементариостыо центра связывания белка и ли-
ганда.
Г.
- СН2-СОО NH3 - (ионная)
NH
СНз - (гидрофобная)
ch2-nh-c=nh
NH3+
СОО“- (ионная)
Д. В результате кооперативных изменений в конформа-
ции протомеров.
70. А. Лиганда!
1. -NH2; НО-Сер (водородная)
31
СН2~Вал
-СНз; СНз
NH=C-NH-Apr
-COO”; Шз+
2.
СН3ч
;СН-Иле
-СНз; СНз
Фен^~^; СНз
-СНз; СНз-Ала
NH3+ ; СОО”-Глу
СОО"; ЫНз+ -Лиз
(гидрофобная)
(ионная)
(гидрофобная)
(гидрофобная)
(гидрофобная)
(ионная)
(ионная)
Б. Лиганд - молекула, связывающаяся с белком.
Комплементарность - химическое и пространственное
соответствие взаимодействующих молекул.
В. Да, так как между протомерами существуют коопера-
тивные взаимодействия.
Г. Изменяется конформация белка вследствие усиления
броуновского движения атомов, входящих в состав мо-
лекулы, и перераспределения связей.
71.
а - 2, 3, 5.
6-1,4, 5, 6.
32
II
ФЕРМЕНТЫ
1. Какие положения правильно характеризуют активный
центр ферментов?
1. Это участок, непосредственно взаимодействующий с суб-
стратом и участвующий в катализе.
2. Между активным центром и субстратом имеется компле-
ментарность.
3. Активный центр составляет относительно небольшую
часть молекулы фермента.
4. В активный центр входят только полярные аминокисло-
ты.
Ответ по табл. 1.
2. Назовите типы связей субстрата с активным центром фер-
мента.
1. Гидрофобные. 3. Ионные.
2. Водородные. 4. Ковалентные.
Ответ по табл. 1.
3. Что обеспечивает конформационная лабильность структу-
ры ферментов?
1. Превращение субстрата в области активного центра.
2. Специфичность связывания субстрата в активном центре.
3. Выход продуктов из области активного центра.
4. Кооперативное взаимодействие субъединиц в олигомер-
ном белке.
Ответ по табл. 1.
4. Важным свойством ферментов, определяющим многообра-
зие химических реакций в организме, является их специфичность.
Чем обусловлена субстратная специфичность ферментов? Выберите
один наиболее полный ответ.
1. Набором определенных функциональных групп в актив-
ном центре.
2. Химическим соответствием активного центра субстрату.
3. Наличием кофермента.
4. Пространственным соответствием активного центра суб-
страту.
5. Комплементарностью активного центра субстрату.
3 Сборник тестов и задач по биохимии
33
5. Что характерно для ферментов, обладающих абсолютной
специфичностью?
1. Катализируют один тип реакции с несколькими сходны-
ми субстратами.
2. Имеют конформацию активного центра, способную к не-
большим изменениям.
3. Способны катализировать единственную реакцию.
4. Соединение субстрата с активным центром осуществля-
ется по принципу комплементарности.
5. Радикалы аминокислот активного центра способны
взаимодействовать со стереоизомерами субстрата.
6. Какие из приведенных ниже утверждений характеризуют
апофермент?
1. Представляет собой комплекс белка и кофактора.
2. Обладает высокой каталитической активностью.
3. Представляет собой неорганический ион или органиче-
ское соединение, являющееся производным витамина.
4. Обладает низкой активностью, часто вообще неактивен.
Ответ по табл. 1.
7. Печень крысы гомогенизировали, затем фракционировали
на субклеточные фракции путем дифференциального центрифуги-
рования.
Условия опыта Субклеточные фракции
ядерная митохондри- альная микро- сомная клеточный сок
1. Количество превращенного субстрата (в мкмоль на пробу) 2. Время инкубации фермента с субстратом (в мин) 3. Объем пробы (в мл) 4. Концентрация белка (в мг/мл) 200 5 0,5 2,5 500 15 1,0 3,2 320 10 2,0 0,8 240 8 0,4 0,8
В каждой фракции определяли активность гистидазы - фермента,
катализирующего отщепление аминогруппы от гистидина. Условия
для определения активности фермента даны в таблице. Определите
локализацию гистидазы.
8. Оптимальные условия действия амилазы - фермента, рас-
щепляющего крахмал: pH 6,8; t = 37°С. Как изменится активность
фермента в каждом из следующих случаев (I - уменьшится; t - уве-
личится)? Укажите причину изменения активности.
1. pH инкубационной среды равен 5.
2. Температура инкубации - 70°С.
3. В инкубационную среду добавлен раствор CuSO4 (PbSCU).
34
4. В присутствии CuSCU (PbSO^) в среде увеличена концен-
трация крахмала.
А. Только при измене-
нии температуры.
В. Только при измене-
нии pH.
С. При изменении
обоих условий.
D. Не происходит ни
при каких измене-
ниях.
9. При изменении оптимальных условий инкубации аргиназы
- pH 9,5 и t = 37°С - на pH 5,0 и t = 70°С активность фермента изме-
няется. Укажите основную причину изменения активности фермен-
та. Подберите соответствующие пары,
1. Изменение конформации
молекулы фермента.
2. Изменение степени иони-
зации функциональных
групп фермента.
3. Изменение степени иони-
зации функциональных
групп субстрата.
4. Гидролиз пептидных свя-
зей.
5. Нарушение слабых связей
в молекуле фермента.
10. Препарат, содержащий 2,0 мг аргиназы, за 10 мин при
t=38°C и pH 9,0 катализировал образование 30 мкмоль мочевины.
Рассчитайте удельную активность аргиназы. Объясните, как и по-
чему изменится ( Ф - уменьшится, Т - увеличится) активность фер-
мента, если
1) инкубационную среду подкислить до pH 5,0;
2) в среду добавить гликоциамин
(NH2-C- NH“CH2 -СООН);
NH
3) в присутствии гликоциамина увеличить в среде кон-
центрацию аргинина.
11. Холинэстераза при оптимальных условиях (pH 8,4 и t =
37°С) в течение 15 мин катализирует гидролиз ацетилхолина с обра-
зованием 100 ммоль холина и уксусной кислоты. Рассчитайте ак-
тивность фермента. Объясните, как и почему изменится (Ф или Т)
активность фермента, если:
1) температуру инкубационной среды изменить от 5 до
40°С;
2) в инкубационную среду добавить прозерин;
3) в присутствии прозерина повышать концентрацию аце-
тилхолина.
12. По изменению концентрации каких веществ можно изме-
рить скорость реакций, катализируемых протеолитическими фер-
35
ментами? Какие цветные реакции можно использовать с этой це-
лью?
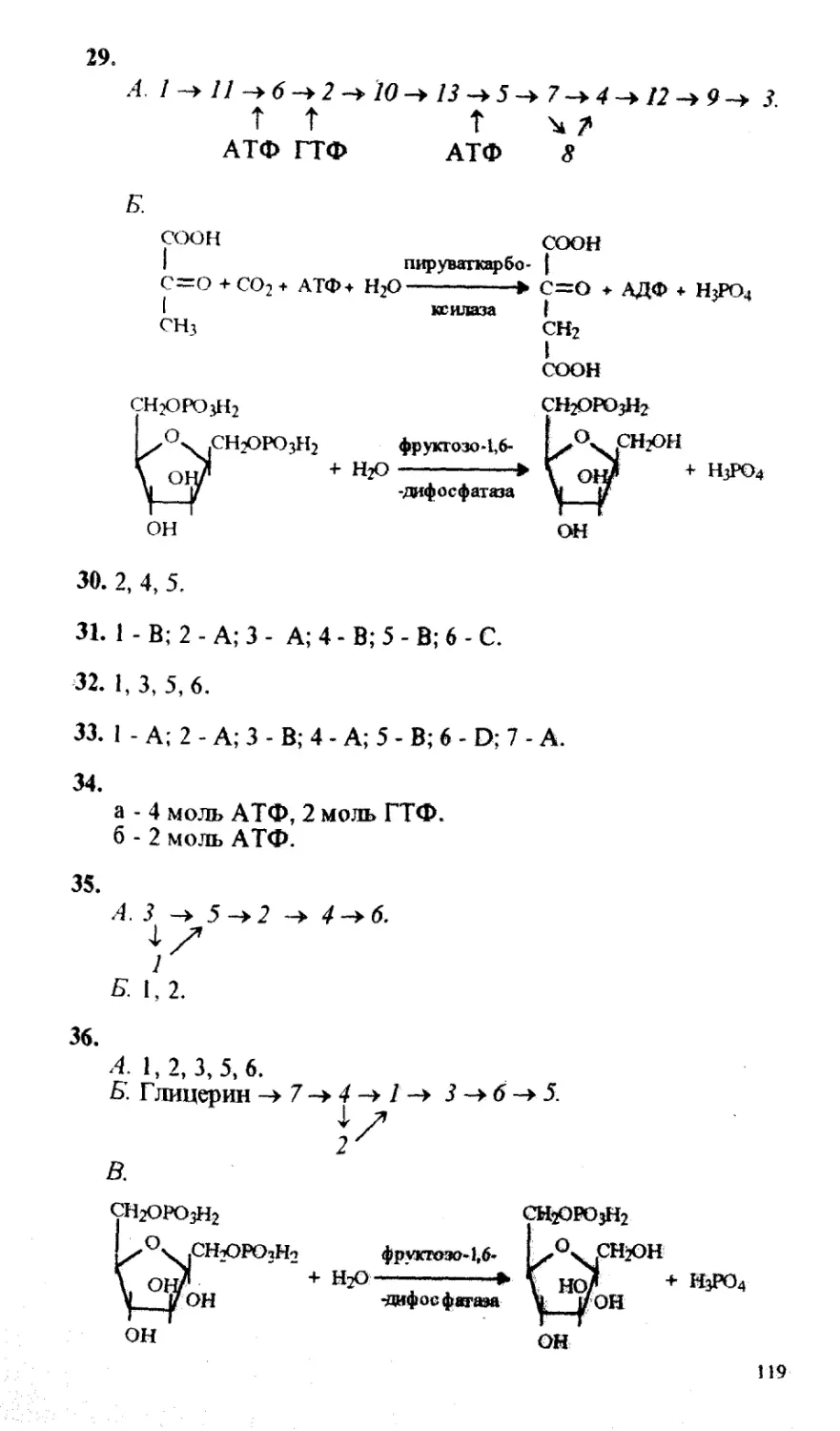
13. Пируват может превращаться в оксалоацетат.
СООН
СНз |
0=0 + С02 + АТФ ---► + ^дф + нЗр°4-
I 0=0
СООН I
СООН
пируват оксалоацетат
Как изменится скорость этой реакции при уменьшении в
клетке концентрации перечисленных веществ?
1. АДФ. t- увеличится.
2. СО2. Т- уменьшится.
3. Пируват. о - не изменится.
4. Пируваткарбоксилаза.
14. Глутаматдекарбоксилаза катализирует превращение:
глутаминовая
кислота
----►
С02
у-аминомасляная
кислота
А. По изменению концентрации каких веществ можно
охарактеризовать активность глутаматдекарбоксила-
зы?
Б. С участием какого кофермента протекает данная реак-
ция?
В. Как можно увеличить скорость данной реакции?
15. Укажите возможные функции металлов в ферментативном
катализе.
1. Участвуют в связывании фермента с субстратом.
2. Способствуют образованию комплементарной субстра-
ту конформации активного центра.
3. Участвуют в связывании фермента с коферментом.
4. Стабилизируют четвертичную структуру фермента.
Ответ по табл. 1.
16. Какие из приведенных ниже утверждений иллюстрирует
схема превращения гистидина?
36
уроканиновая кислота
гистамин
1. Фермент может катализировать однотипные превраще-
ния сходных по строению веществ.
2. Каждый фермент катализирует лишь определенное хи-
мическое превращение субстрата из всех возможных.
3. Фермент катализирует превращение того из стереоизо-
меров, пространственная структура которого компле-
ментарна активному центру данного фермента.
17. Объясните биохимический смысл некоторых требований
(подчеркнуты), предъявляемых к хранению и использованию фер-
ментных препаратов.
1. Растворение сухого препарата дистиллированной водой
комнатной температуры.
2. При растворении препарата перемешивать осторожно,
не допуская образования пены.
3. Хранение раствора препарата при низкой температуре.
4. При необходимости длительного хранения высушива-
ние препарата и запаивание в вакуумированные ампу-
лы.
18. Неодинаковая скорость протекания одного и того же ме-
таболического пути в разных органах может быть обусловлена раз-
личиями в определенных свойствах и строении ферментов. Выберите
правильный ответ.
1. Количество ферментов. 3. Изоферментный состав.
2. Активность ферментов. 4. Ферментный состав.
Ответ по табл. 1.
19. В схеме ферментативной реакции римскими цифрами обо-
значены основные этапы ферментативного катализа ( * - изменение
конформации):
I п ш
Е + S------► ES--------► ES*-------► Р + Е.
Запишите, на каких из этих стадий происходит:
3#
37
1) перераспределение электронной плотности в химичес-
ких связях субстрата;
2) увеличивается комплементарность между субстратом и
активным центром фермента;
3) образование новых химических связей в молекулах, пре-
вращаемых под действием фермента.
20. Фермент сахараза может катализировать следующие реак-
ции:
+Н2О
1. Глюкозо-фруктоза -> глюкоза + фруктоза.
(сахароза)
+Н2О
2. Фруктозо-глюкозо-галактоза -> фруктоза +
(рафиноза)
+ глюкоза + галактоза.
Если субстратом является сахароза, то = 0,05 мМ, если ра-
финоза, то Ки - 2,0 мМ. В каком случае при одинаковой концен-
трации субстратов скорость реакции будет больше?
21. Изобразите в виде графиков зависимость скорости реак-
ции, катализируемой гексокиназой, от концентрации субстратов -
глюкозы (Км = 0,04 мМ) и фруктозы (Км =1,5 мМ), - если считать
/макс одинаковой (10 мМ/мин).
гексокиназа
Гексоза + АТФ------------> АДФ + гексозо-6-фосфат.
В каком случае при одинаковой концентрации субстратов
(например, 0,1 мМ) скорость реакции будет больше?
22. В таблице представлены данные, характеризующие зави-
симость скорости ферментативной реакции (V) от концентрации
субстрата (S).
Ё, мкм/мин
1 • ю-6 20
2-10*5 32
1 • 10** 39
1 • 10'5 40
Используя данные таблицы, нарисуйте график зависимости
скорости реакции от концентрации субстрата. Найдите .приблизи-
тельное значение Имакс и Км.
23. А. Рассмотрите реакции и укажите-
а) класс ферментов;
38
б) витамин, входящий в состав кофермента;
в) функцию кофермента в реакциях
СООН 1 СООН 1
сн-он 1 СН2 + НАД+ ► 1 с=о 1 СН2 + НАДН + Н+
СООН СООН
СООН 1 СООН I
сн2 СН2 I
СН СООН + НАД+ ► СН-СООН + НАДН + н+ 1
сн—ОН I С=о 1
1 СООН СООН
Б. Выберите правильный ответ: чем определяется суб-
стратная специфичность ферментов, катализирующих
однотипные реакции?
1. Строением кофермента.
2. Строением субстрата.
3. Витамином, входящим в кофермент.
4. Апоферментом.
Ответ по табл. 1.
24. Укажите класс ферментов (обозначены буквами А - F), ка-
тализирующих следующие реакции.
1. Ала + тРНК + АТФ -> Ала - тРНК + АМФ + ФФ.
2. Ацетил-КоА + СО2 + АТФ малонил-КоА+ АДФ+ Н3РО4.
3. 1,3-дифосфоглицерат + АДФ -> 3-фосфоглицерат + АТФ.
4. Фен + НАДФН + Н+ + О2 -> Тир + НАДФ + НгО.
5. Фосфодиоксиацетон -> фосфоглицериновый альдегид.
6. Триацилглицерин глицерин + жирная кислота.
7. Фруктозе-1,6-дифосфат -> диоксиацетонфосфат + глице-
раль-дегидфосфат.
8. Глюкоза,, + Н3РО4 -> глюкозо-1-фосфат + глюкоза,,./.
А. Оксидоредуктазы.
В. Трансферазы.
С. Гидролазы.
D. Лиазы.
Е. Изомеразы.
F. Лигазы.
39
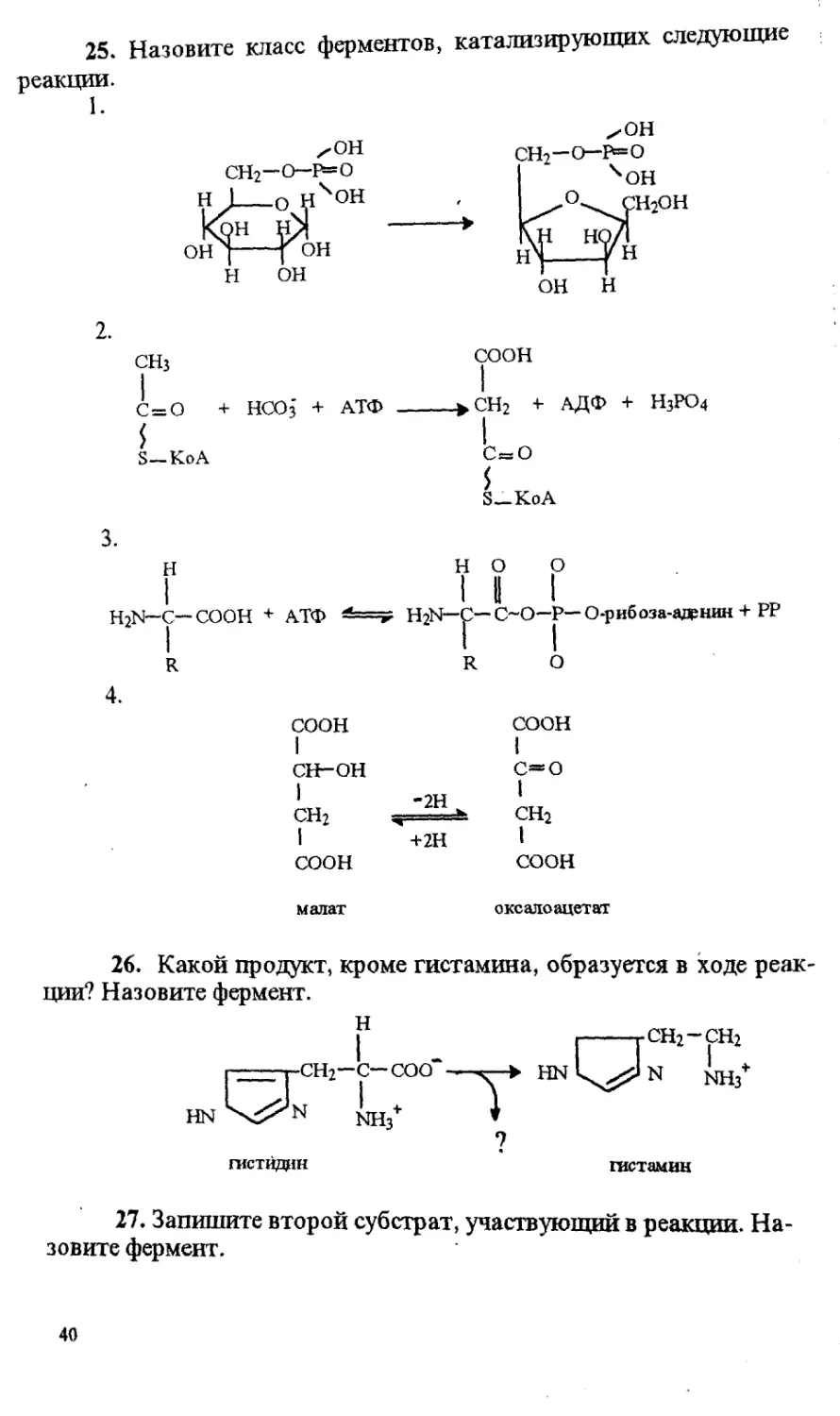
25. Назовите класс ферментов, катализирующих следующие
реакции.
1.
хон
СН2~О~В=О
Н J__о НЧ°Н
ОН ]---[ он
н он
сн2-о-в=о
4 он
^°\СН2ОН
sCт«
он н
2.
СНз
СООН
С = О + НСО3 + АТФ
>СН2 + АДФ + Н3РО4
S—Ко А
с=о
S—КоА
3.
но о
H2N-C— СООН + АТФ
R
4.
H2N—С—С~О—Р—О-рибоза-аденин + РР
R
СООН
СООН
сн-он
С=О
СН2
-2Н
СН2
+2Н
СООН
СООН
малат
оке ало ацет ат
26. Какой продукт, кроме гистамина, образуется в ходе реак-
ции? Назовите фермент.
н
HN
сн2—С—СОО*
> HN
СН2-СН2
NH3
гистидин
NH3
гистамин
27. Запишите второй субстрат, участвующий в реакции. На-
зовите фермент.
н
о
?
40
2NH3 + CO2.
мочевина
28. Рассмотрите схему превращения глутамата.
соон
А. Какие из перечисленных реакций протекают с участием
пиридоксальфосфата?
Б. Оцените верность утверждения: один и тот же кофер-
мент может участвовать в катализе разных химических
реакций, ПОТОМУ ЧТО специфичность пути распада
зависит главным образом от белковой части фермента.
Ответ по табл. 2.
29. Количество витамина Bi, содержащегося в основном в
оболочке семян хлебных злаков, существенно уменьшается при по-
лучении муки высших сортов. Преобладание в пище очищенных
круп или хлеба, выпеченного из муки высших сортов, приводит к
гиповитаминозу Вь Изменится ли при таком гиповитаминозе ско-
рость реакций, изображенных на схеме в задаче № 28?
30. При длительном приеме антибиотиков и сульфаниламидов
угнетается микрофлора кишечника, способная синтезировать пири-
доксин. В результате может возникнуть гиповитаминоз Вб. Какие
реакции превращения глутаминовой кислоты нарушаются в этом
случае? (см. схему в задаче № 28).
31. При длительном приеме сульфаниламидов или антибиоти-
ков у человека может возникнуть гиповитаминоз Вб. Чем это обу-
словлено?
1. Нарушением включения витамина в кофермент.
2. Недостатком витамина в пище.
41
3. Нарушением всасывания витамина.
4. Подавлением микрофлоры кишечника.
Ответ по табл. 1'
32. Рассмотрите схему ферментативной реакции. Сравните
структурные формулы субстратов и продуктов.
СООН 1 сн3 СООН 1 сн} + СН—
(СНз)2 + Г°
CH-NH2 СООН С*О ] СООН
1 СООН СООН
Глу пируват а - кето- Ала
пгутарат
А. Назовите класс фермента, катализирующего данную
реакцию.
Б, С участием какого кофермента протекает данная ре-
акция? Напишите структурную формулу витамина,
входящего в его состав.
В, Рассчитайте удельную активность фермента, если за
15 с 1 мг фермента при оптимальных условиях (pH 7,4,
37°С) превращает 20 мкмоль пирувата.
Г. Активность данного фермента уменьшается при изме-
нении pH от 7,4 до 5,0. Представьте последователь-
ность событий, приводящих к уменьшению активности
фермента, записав выбранные номера в нужной после-
довательности.
1. Нарушается комплементарность активного центра и
субстрата. '
2. Происходит гидролиз пептидных связей.
3. Изменяется ионизация функциональных групп фер-
мента и субстрата.
4. Изменяется конформация молекулы фермента.
33. Рассмотрите схему ферментативной реакции. Сравните
структурные формулы субстрата и продукта:
+ 2Н
СНз—С— СООН----------►
И
О -ж
СНз-СН-СООН
ОН
гшруваг лактат
А. Назовите класс фермента, катализирующего данную
реакцию.
Б. С участием какого кофермента протекает реакция? На-
пишите формулу витамина, входящего в его состав.
42
В. Рассчитайте удельную активность фермента, если за
30 с 1 мг фермента при оптимальных условиях инкуба-
ции (pH 7,2, 37°С) превращает 50 мкмоль пирувата.
34. Рассмотрите схему ферментативной реакции. Сравните
структурные формулы субстрата и продукта.
<рн3 (|оон
С=О + со2+АТФ-------► Сн2 + АДФ+ Н3РО4
СООН с=о
СООН
пируват оксалоацетат
А. Назовите класс фермента, катализирующего данную
реакцию.
Б. С участием какого кофермента протекает данная реак-
ция?
В. Рассчитайте удельную активность фермента, если за
20 с в результате реакции с участием 1 мг фермента при
оптимальных условиях (pH 8,0, 37°С) получается 25
мкмоль оксалоацетата.
Г. Выберите причины снижения активности фермента по-
сле инкубации в течение 10 мин при 60°С Представьте
последовательность событий, приводящих к уменьше-
нию активности данного фермента, записав выбранные
номера в нужной последовательности.
1. Происходит разрыв пептидных связей.
2. Происходит разрыв слабых связей (водородных, гид-
рофобных и ионных).
3. Нарушается комплементарность активного центра и
субстрата.
4. Изменяется конформация молекулы фермента.
35. Активность ферментов в присутствии ингибиторов может
быть снижена. Укажите причину этого, выбрав один наиболее пра-
вильный и полный ответ.
1. Взаимодействие ингибитора с функциональными груп-
пами аминокислот активного центра.
2. Взаимодействие ингибитора с функциональными груп-
пами аминокислот вне активного центра.
3. Конформационные изменения молекул фермента.
4. Уменьшение количества фермент-субстратного компле-
кса.
5. Взаимодействие ингибитора с функциональными груп-
пами аллостерического центра.
43
36. Выберите и запишите последовательность событии
(например: 3 -> 2 4...), происходящих при аллостерическом инги-
бировании активности фермента.
1. Уменьшается скорость ферментативной реакции.
2. Изменяется конформация фермента.
3. Эффектор присоединяется в активном центре.
4. Изменяется конформация аллостерического центра.
5. Нарушается комплементарность активного центра суб-
страту.
6. Эффектор присоединяется в аллостерическом центре.
7. Изменяется конформация активного центра.
37. Подберите способ регуляции (А - D) активности для каж-
дого из перечисленных ферментов.
цАМФ
1. Протеинкиназа (неакт.) --> протеинкиназа (акт.).
2. Гликогенсинтетаза (неакт.) —> Н3РО4 + гликогенсинтетаза (акт.),
адреналин
3. Аденилатциклаза (неакт.)------> аденил атциклаз а (акт.).
Н2О
4. Пепсиноген---> пепсин + пептид.
5. Фосфорилаза (неакт.) + АТФ -> фосфорилаза (акт.) + АДФ.
А. Аллостерическая регуляция.
В. Регуляция путем фосфорилирования или дефосфорили-
рования.
С. Регуляция путем ассоциации и диссоциации субъеди-
ниц.
D. Частичный протеолиз.
38. Сравните действие прозерина и диизопропилфторфосфата
(ДФФ) на фермент ацетилхолинэстеразу.
1 .Ингибирует ацетилхолинэстеразу.
2 .Конкурирует с субстратом за ме-
сто в активном центре.
3 . Действует необратимо.
4 . Ингибир ов ание у стр аняется из -
битком ацетилхолина.
А.Только прозерин.
В.Только ДФФ.
С.Оба вещества.
D-Ни одно из этих
веществ.
39. Установлено, что важнейшими факторами, регулирующи-
ми активность аллостерических ферментов, является концентрация
определенных метаболитов - субстратов и продуктов метаболи-
ческих путей.
Рассмотрите схематическое изображение трех метаболических
путей.
ДА
Лактат
I. Синтез глюкозы
АТФ
АДФ 4- фн
глюкоза
Активир ов анная
жирная кислота
II. Окисление жирных кислот
АДФ + фн АТФ
СО2 + Н2О
III. Распад глюкозы
Глюкоза —-------------------------> ССЬ +
АДФ + Фн АТФ
А. Как изменится ( Ф - уменьшится, t - увеличится) ско-
рость каждого из этих метаболических путей при
уменьшении соотношения (АТФ): (АДФ + А МФ)?
Б. Какие источники энергии для синтеза АТФ будут более
предпочтительны для клетки, если концентрация жир-
ных кислот в ней гораздо выше концентрации глюкозы?
40. Выберите возможные причины конформационных измене-
ний, приводящих к активации аллостерических ферментов.
1. Химическая модификация фермента.
2. Гидролиз пептидных связей.
3. Взаимодействие пространственно удаленных участков
фермента.
4. Разрыв связей между субъединицами.
5. Кооперативное взаимодействие субъединиц.
41. Пепсиноген (неактивная форма фермента) имеет молеку-
лярную массу 42 000. В желудочном соке пепсиноген превращается в
пепсин (активный фермент, катализирующий расщепление пептид-
ной связи в белках) с молекулярной массой 35 000. Выберите рису-
нок» иллюстрирующий данный способ активации.
45
3.
Обозначения: S - субстрат, Э - эффектор, Р - соединение,
являющееся донором фосфорной кислоты, П - фрагмент полипеп-
тидной цепи.
42. Регуляция активности ферментов путем фосфорилирова-
ния - широко распространенный в клетках процесс. Фермент проте-
инкиназа, осуществляющий фосфорилирование белков, активирует-
ся цАМФ. Взаимодействие цАМФ с регуляторной субъединицей
фермента приводит к освобождению активной каталитической
субъединицы.
Используя рисунки задачи № 41, зарисуйте активацию проте-
инкиназы.
43. Рассмотрите схему метаболического пути, в котором
предшественник с помощью ряда реакций превращается в продукт
F, причем каждая стадия процесса катализируется специфическим
ферментом (Ei, Ег и т. д.):
Ei Ез Ез Е4
А <---В <=>С е........... Е
АДФ + Фн АТФ
Значение этого процесса - синтез макроэргического соединения
АТФ- универсального поставщика энергии в клетке. Однако, если
АТФ не расходуется для энергетических нужд клетки, соединение С
не образуется даже лри наличии предшественников.
А. Что является причиной этого явления?
Б. Предположите, какой фермент является регуляторным.
В. Укажите основные особенности строения и функцио-
нирования ферментов, которые регулируются этим спо-
собом.
44. А. Выберите основные особенности строения и функцио-
нирования аллостерических ферментов.
1. Являются ключевыми ферментами Метаболических пу-
тей.
2. Имеют пространственно разделенные активный и регу*
ляторный центры.
3. Как правило, являются олигомерными белками.
46
4. Не проявляют регуляторные свойства при диссоциации
молекулы на протомеры.
5. При взаимодействии с лигандами происходит коопера-
тивное изменение субъединиц.
Б. Какие из выбранных особенностей строения и функ-
ционирования аллостерических ферментов подтвер-
ждают следующие данные?
Обнаружено, что кратковременное выдерживание большинст-
ва аллостерических ферментов при температуре выше комнатной (50
• 60°С) приводит к потере чувствительности к действию аллостери-
ческих эффектов при сохранении ферментативной активности. На-
пример: аспартаткарбамоилтрансфераза (молекула состоит из 12
протомеров) после выдерживания в течение 4 мин при 60°С теряла
чувствительность к ингибитору (ЦТФ) при сохранении фермента-
тивной активности. При этом происходила диссоциация фермента
на отдельные протомеры.
45. Фермент ацетилхолинэстераза катализирует гидролиз
ацетилхолина - нейромедиатора, выделяющегося в синапсах холи-
нэргических нервов. Продукты его распада - ацетат и холин - не
способны действовать как нейромедиаторы.
Фосфоорганические соединения типа диизопропилфторфос-
фата ингибируют фермент, взаимодействуя с ОН-группой серина в
активном центре фермента. Большинство этих веществ является
сильными ядами. Некоторые, например фосфакол, применяют в ка-
честве лекарственных средств.
А, В чем заключается причина изменения конформации
молекулы ацетилхолинэстеразы при действии на нее
фосфакола?
Б, Как при действии фосфакола изменяется ( Т - увеличит-
ся, Ф - уменьшится, <-» - не изменится) количество аце-
тилхолина в синаптической щели?
46. Установлено, что аспирин (жаропонижающее средство,
снимает слабые боли, уменьшает воспалительные процессы) являет-
ся ингибитором одного из ферментов, участвующих в синтезе про-
стагландинов - биологически активных веществ. Ингибирование
этого фермента аспирином отражает следующая схема:
47
СООН
СООН
"активный
фермент"
>Е—NH-С-СНз + Н
II
О
"не активный с алициловая
фермент" кислота
В чем заключается причина изменения активности молекул
фермента при действии на нее аспирина?
47. Регуляторная реакция в синтезе пиримидиновых нуклео-
тидов катализируется аспартаткарбамоилтрансферазой. Этот фер-
мент ингибируется (обозначено торможение реакции знаком —(|—)
сукцинатом, что отражает следующая схема:
ингибнтор-сукцинат
СООН
I
СООН
I
СН7 о о
I II и
H2N —СН—СООН + h2n—с—о—р-он
он
(СН2)2
СООН
—ll I—►
СООН
I
О СН,
II I
H2N—С—N—СН + Фн
Н СООН
аспартат карбамоилфосфат карбамоиласпартат фосфат
А. Сравните структурные формулы ингибитора и субстра-
тов. Почему можно предположить, что ингибитор свя-
зывается в активном центре фермента?
Б. Каким образом можно уменьшить ингибирующее дей-
ствие сукцината на активность фермента?
48. Фермент ацетилхолинэстераза катализирует гидролиз
ацетилхолина - нейромедиатора, выделяющегося в синапсах холи-
нэргических нервов. Продукты его распада - ацетат и холин - не
способны действовать как нейромедиаторы. Гидролиз ацетилхоли-
на прерывается, например, калимином. Этот лечебный препарат
используется при двигательных нарушениях после травм, парали-
чей, в восстановительном периоде после перенесенного полиомиели-
та, энцефалита и т. п. Ингибирование ацетилхолинэстеразы
(торможение реакции обозначено знаком —11— ) калимином отра-
жает следующая схема:
48
ингибитор калимин
? /СН3
fn-0-C~N^
h3cAnJJ он3
сн\ . | СНЧ
CHT-N+— (СН2-~сн2— о—с—СН3—1 Н* СН3—N+—СН2—СН2ОН + СН3СООН
ch3z и снз.
ацетилхолин холин уксусная
кислота
А. Сравните структурные формулы ингибитора и субстра-
та. Обоснуйте, почему можно предположить, что инги-
битор связывается в активном центре фермента?
Б. Как при действии калимина изменится проведение нер-
вного импульса? ( t - увеличится; Ф - уменьшится; «-> -
не изменится).
49. Какие требования предъявляют к ферментам, которые
можно использовать в целях энзимодиагностики?
1. Органоспецифичность ферментов.
2. Выход ферментов в кровь при повреждении органов.
3. Низкая, активность или полное отсутствие ферментов в
сыворотке крови в норме.
4. Высокая стабильность ферментов.
Ответ по табл. 1.
А. Фермент.
В. Субстрат для синтеза
ферментов.
С. Активатор фермента.
D. Ингибитор фермента.
50. Многие лекарственные препараты, использующиеся для
лечения энзимопатий, могут быть ферментами, субстратами для
синтеза коферментов, ингибиторами или активаторами ферментов.
Подберите к пронумерованным препаратам соответствующий бук-
венный ответ.
1. Химотрипсин.
2. Гиалуронидаза.
3. Пиридоксин.
4. Прозерин.
5. Трасилол.
6. Сульфаниламидные
препараты.
7. Никотиновая кислота.
51. Выберите основные направления использования в медици-
не протеолитических ферментов (пепсина, трипсина, коллагеназы,
эластазы).
1. Для очистки ран, тромбов и участков омертвевшей тка-
ни.
2. В лечении злокачественных новообразований.
4 Сборник тестов и задач по биохимии
49
3. Применение ферментов при их недостаточности в орга-
низме (например, при нарушении процесса переварива-
ния).
4. В аппаратах “искусственная почка” для специфического
разрушения некоторых метаболитов.
Ответ по табл. 1.
52. Вязкость гнойного содержимого зависит от концентрации
макромолекул в его составе.
А. С чем связано применение протеолитических ферментов
при обработке гнойных ран?
Б. Объясните механизм действия дезоксирибонуклеазы
при лечении гнойных бронхитов.
53. ДНКаза - фермент, расщепляющий нуклеотидные связи в
молекуле ДНК, задерживает размножение ДНК-содержащих виру-
сов (аденовирусов, вируса герпеса). Установлено, что в клетки этот
фермент и вирусы, подобно некоторым макромолекулам, попадают
путем пиноцитоза и таким образом оказываются изолированными в
пиноцитозных пузырьках. Почему этот фермент даже в очень
больших дозах не повреждает молекулы ДНК клетки?
54. Амилаза - тканеспецифический фермент поджелудочной
железы, участвующий в процессе пищеварения.
А. Какую реакцию катализирует амилаза?
Б. Какова амилазная активность в сыворотке крови и мо-
че здорового человека?
В. Как можно подтвердить диагноз острого панкреатита
(воспаление поджелудочной железы)?
55. В настоящее время широко применяются микроинкапсули-
рованные ферменты (уреаза, стрептокиназа), т.е. связанные
(иммобилизованные) с синтетическими полимерами. Как изменяют-
ся свойства ферментов в результате такой обработки?
I. Предотвращается выход ферментов из капсулы.
2. Повышается стабильность фермента.
3. Низкомолекулярные субстраты и продукты легко про-
ходят через стенки капсулы.
4. Ослабляются антигенные свойства ферментов.
Ответ по табл. 1.
56. Для чего используется количественное определение актив-
ности ферментов в тканях и биологических жидкостях?
1. Для диашостики заболеваний, связанных с нарушения-
ми функционирования ферментов.
50
2. При приготовлении ферментных препаратов, исполь-
зуемых в качестве лекарств.
3. Для контроля эффективности лечения ряда заболеваний.
4. Для оценки эффективности лекарственных препаратов,
действующих на ферменты-мишени.
Ответ по табл. 1.
57. 0,05 мг трипсина за 15 мин образуют 100 мкмоль тирозина
при оптимальных условиях инкубации: pH 8,0 и 37°С. Рассчитайте
удельную активность трипсина. Объясните, как и почему изменится
активность трипсина, если:
а) pH инкубационной среды снизить до 3,0;
б) температуру инкубационной среды повысить до t =
78°С;
в) в инкубационную среду добавить трасилол
(полипептид).
58. 1 мг фермента сукцинатдегидрогеназы за 5 мин катализи-
рует окисление янтарной кислоты с образованием 10 мкмоль фума-
ровой при 37°С и pH 7,0. Рассчитайте удельную активность фермен-
та в оптимальных условиях. Объясните, как и почему изменится ак-
тивность фермента, если:
а) pH инкубационной смеси 4,0;
б) к среде добавить малоновую кислоту;
в) в присутствии малоновой кислоты увеличить концен-
трацию янтарной кислоты.
59. 5 мг фермента лактатдегидрогеназы за 30 мин катализи-
руют превращение пирувата с образованием 20 мкмоль лактата при
t 37°С и pH 7,4. Рассчитайте, как и почему изменится активность
фермента, если:
а) pH инкубационной смеси 10,0;
б) снизить концентрацию НАД+.
60. Лцпаза в жировой ткани может находиться в двух формах
с различной активностью: в виде простого белка и фосфопротеина.
Объясните, каким путем происходит переход одной формы в другую
и почему этот переход сопровождается изменением активности.
61. Гликогенсинтетаза (фермент, участвующий в синтезе гли-
когена в печени) может находиться в двух формах с различной ак-
тивностыо: в виде простого белка (активный фермент) и в виде фос-
фопротеина (неактивный фермент). Объясните, каким путем одна
форма переходит в другую и почему этот переход сопровождается
изменением активности.
51
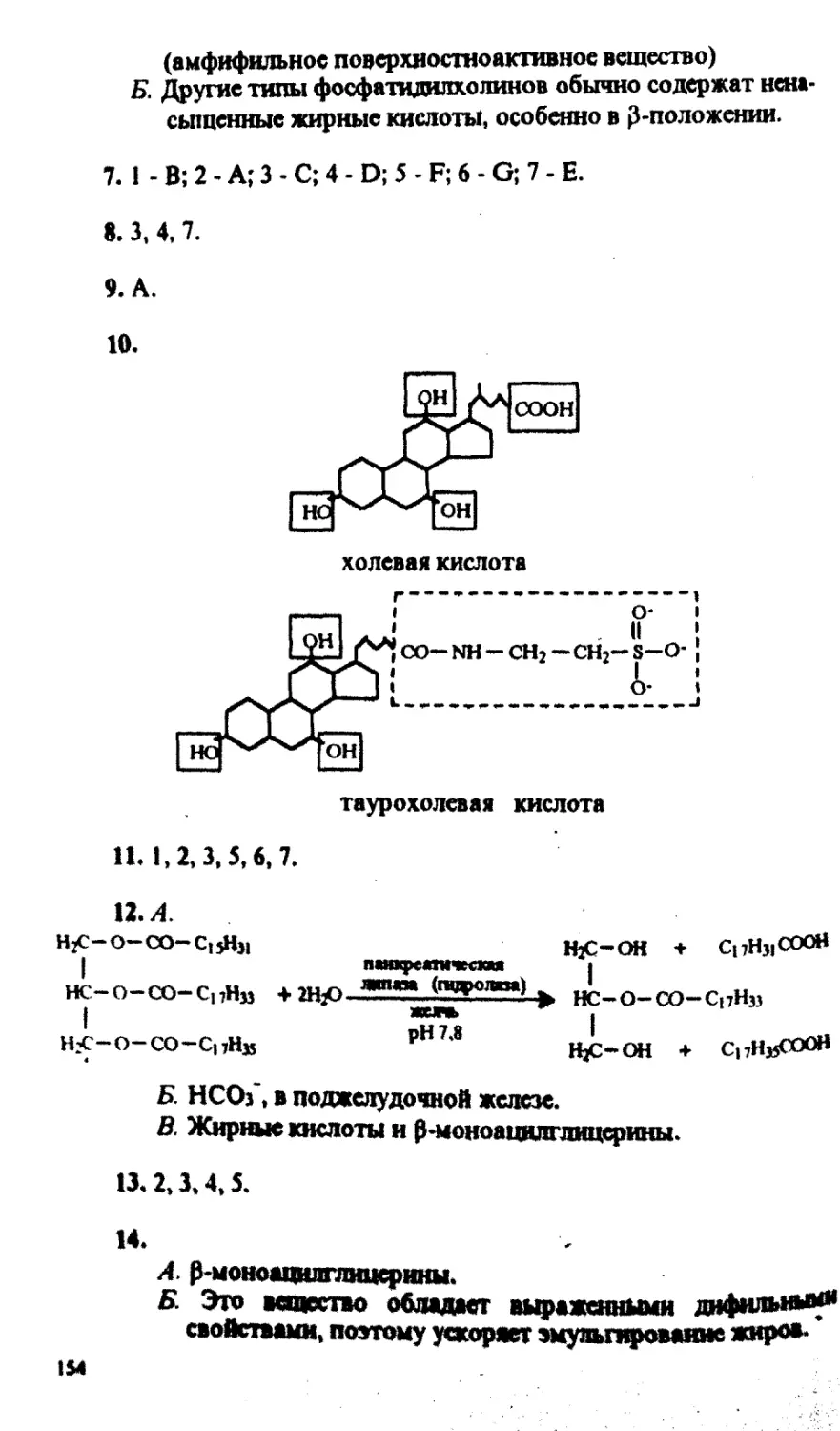
62. Холестерин синтезируется в клетках надпочечников в ре-
зультате ряда последовательных реакций:
Ei Ез Ез Еп
S1 + S2 с 1 > Pi э Р2 <==* Рз... холестерин.
Если холестерин не расходуется и его концентрация в клетке повы-
шается, синтез холестерина прекращается, несмотря на то что ис-
ходные вещества могут вступать в реакции, катализируемые фер-
ментами Ei и Ез с образованием продуктов Pi и Рз. Какой фермент
является регуляторным в данной цепи реакций? Назовите тип регу-
ляции. Каковы структурные особенности регуляторного фермента?
63. Рассмотрите схему последовательного окисления глюкозы
до СО2 и Н2О:
Ei Е2 Ез Е4 Е5
Глк—> А <—>В—>С<—> D <=> F... Q ^fCO2, Н2О, АТФ.
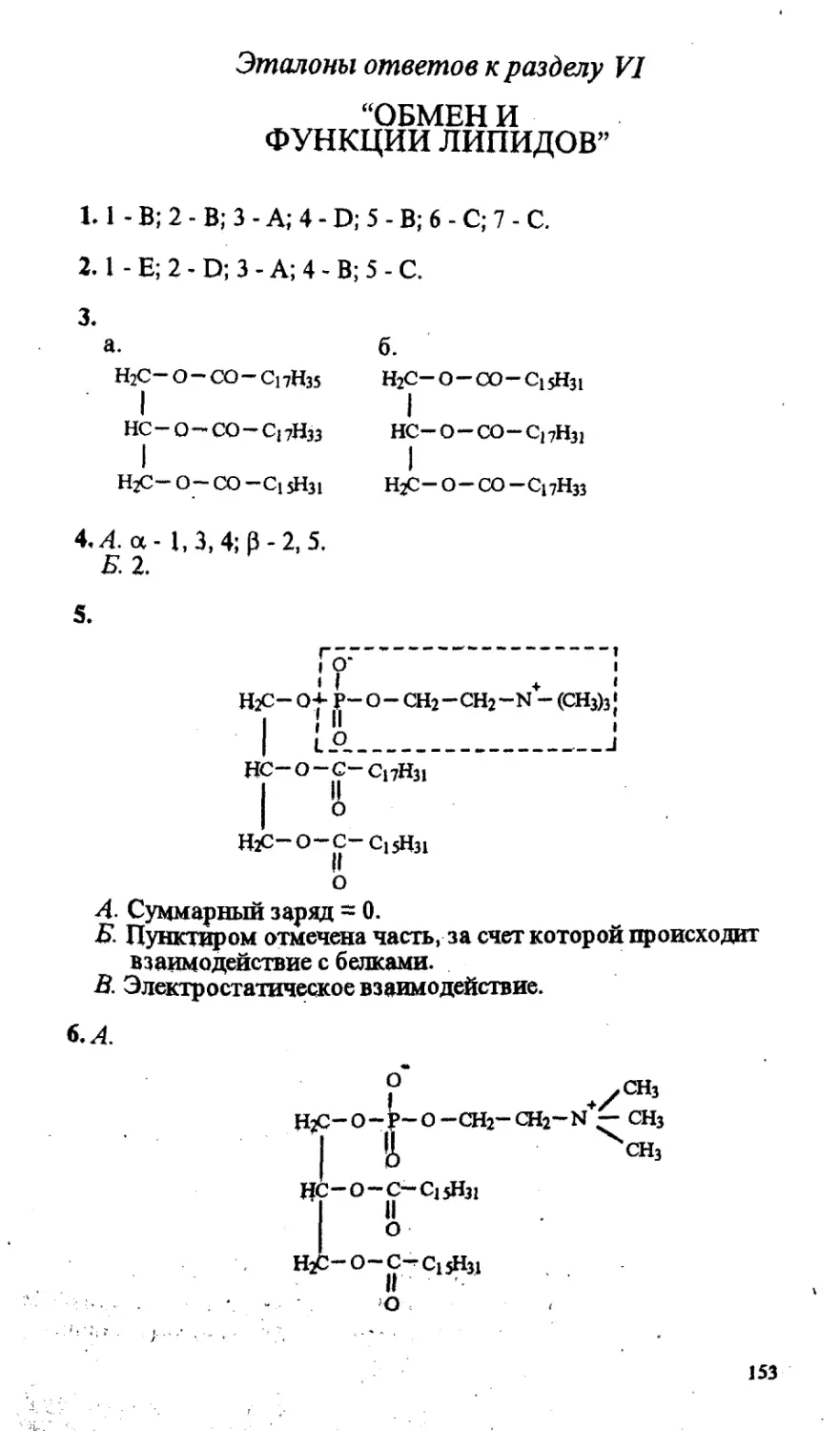
Основное значение этого процесса - синтез АТФ, универсаль-
ного поставщика энергии в клетке. Однако при избытке АТФ окис-
ления глюкозы не происходит.
А. Что является причиной этого явления?
Б. Предположите, какие ферменты являются регуляторными.
В. Назовите способ регуляции активности этого фермента и
основные особенности его строения.
64. В метаболической цепи реакций реакция, катализируемая
ферментом Ei, протекает с наименьшей скоростью.
Ei Е2 Ез Еп
S <-...> Pi <==>Р2 <==>Рз... <=* рп.
А. Какой фермент может быть регуляторным в данной цепи
реакций?
Б. Какой из продуктов реакций (Pi, Р2, Рз,Рп) может служить
ингибитором метаболического пути? Объясните, почему.
В. Назовите тип регуляции.
Г. Каковы структурные особенности регуляторного фермен-
та?
65. В клетках печени человека обнаружена высокая актив-
ность аминотрансфераз (аланиновой - АЛТ и аспарагиновой -
ACT).
АЛТ
Ала + а-кетоглутарат -» Глу + пируват.
ACT
Асп + а-кетоглутарат -> Глу + оксалоацетат.
52
АЛТ локализована лишь в цитоплазме, ACT на 1/3 - в мито-
хондриях, на 2/3 - в цитоплазме.
Некротические процессы в тканях (разрушение всех клеточ-
ных структур) сопровождаются выходом в кровь всех внутрикле-
точных ферментов. При воспалительных процессах повышается
проницаемость клеточных мембран, и в крови могут обнаруживать-
ся цитоплазматические ферменты.
В таблице приведено распределение активности аминотранс-
фераз в клетках печени и крови, выраженное в условных единицах.
Органы ткани ACT (условные единицы) АЛТ (условные единицы)
цитоплазма мигохондрии цитоплазма митохондрии
Печень 60 30 80 -
Кровь 8 5
Определите, каково будет соотношение активности АСТ/АЛТ
при остром инфекционном гепатите с некротическими явлениями.
Эталоны ответов к разделу II
ФЕРМЕНТЫ”
1.А. 4. 5.
2. Е. 5. 2, 3, 4.
3. Е. 6. D.
7. Расчет А)д во фракциях (в мкмоль S мин 1 мг -1)-
Ядерная: <п2<у-ё=32,0.
500
Митохондриальная:
Микросомная:
240
Клеточный сок: ^5^^ = 93,7.
Гистидаза в основном локализована в клеточном соке.
8. 1.1. Изменение ионизации функциональных ipynn приво-
дит к изменению конформации фермента и его активно-
го центра.
2. Ф. Денатурация.
3. Ф. Ионы меди влияют на конформацию фермента, взаи-
модействуя с полярными группами.
4. Активность фермента не восстановится, так как имеет
место неконкурентное ингибирование.
9. 1 - С; 2 - В; 3 - В; 4 - D; 5 - С.
10. А
30 -30
2-10 20
= 1,5 мкмоль мочевины мин1 мг -1.
1 - Ф. Изменение конформации фермента, его активного
центра в результате изменения ионизации функцио-
нальных групп.
2 - Ф. Конкурентное ингибирование.
зЛ.
11. Л = 1^.-6,7 мкмоль Р/мин, общая активность.
1 - Т. По правилу Ван-Гоффа.
2 - Ф. Конкурентное ингибирование.
з - Т.
12. Белков, аминокислот: биуретовая или цветные реакции на
отдельные аминокислоты.
13. I Л; 2 - Ф; 3 - Ф; 4 - Ф.
14. А. Глутаминовой кислоты, СО?, у-аминомасляной кислоты.
Б. С участием пиридоксальфосфата.
В. Увеличить концентрацию субстрата - глутаминовой ки-
слоты, кофермента - пиридоксальфосфата в случае из-
бытка апофермента, фермента.
15. Е.
16. 2.
17. 1. Дистиллированная вода освобождена от значительного
количества ионов металлов, которые могут изменить
конформацию бежа и его активность.
2. Белки денатурируют при ценообразовании на поверхно-
сти раздела фаз: вода - воздух.
3. Стабильность (устойчивость к изменению конформации)
повышается при низкой температуре, а следовательно,
более длительное время сохраняется нативная конфор-
мация фермента.
4. Кислород может вызвать окисление некоторых функцио-
нальных групп фермента, например SH-групп. Вызван-
54
ное этим изменение конформации фермента может при-
вести к его инактивации.
18. А.
19.
1 - П.
2-1.
3 - III.
20. Скорость реакции для сахарозы выше; чем меньше Км, тем
больше сродство фермента к субстрату.
21. Скорость реакции для глюкозы больше; чем меньше Км,
тем больше сродство фермента к субстрату.
Vt
Vmskc
Км
глюкозы фруктозы
23. А. а - оксидоредуктазы; б - никотиновая кислота; в - пере-
нос водорода.
Б. С.
24. 1 - F; 2 - F; 3 - В; 4 - А; 5 - Е; 6 - С; 7 - D; 8 - D.
25. 1. Изомераза. 3. Лигаза.
2. Лигаза. 4. Оксидоредуктаза.
26. СОг, гистидиндекарбоксилаза (класс - лиазы).
27. НгО, мочевина - гидролаза (уреаза, класс гидролаз).
55
28. A. 1; 3.
Б. В.
29. Не изменится.
30. Нарушатся реакции 1 и 3.
31. Е.
32. А. Трансфераза.
Б. Пиридоксальфосфат, Вб.
В. Ауд = 80 мкмоль S мин1 мг А
Г. 3 -> 4->1.
33. А. Оксидоредуктаза.
Б. НАД+, витамин РР.
В. Ауд = 100 мкмоль S мин-' • мг А
34. А. Лигаза.
Б. Биотин.
В. Ауд = 75 мкмоль Р мин1 • мг -1.
Г. 2 -> 4 3.
35. 4.
36. 6 -> 2-> 7-> 5->1.
37. 1 - С; 2 - В; 3 - А; 4 - D; 5 - В.
38. 1 - С; 2-А; 3-В; 4-А.
39. А. 1-1; II- t; III - Т.
Б. II.
40. 3;5.
41. 3.
42.
43. Л. Ингибирование по типу отрицательной обратной связи.
56
В. Аллостерический фермент имеет четвертичную структу-
ру и пространственно разделенные активный и аллосте-
рический центры.
44.
А. 1-5.
Б. 2, 3, 4.
45. А. Фосфорилирование фосфаколом ОН-группы серина в
активном центре холинэстеразы.
Б. t.
46. Ацетилирование NH:- группы фермента.
47. А. Ингибитор - структурный аналог субстрата (аспарта-.
та).
Б. Увеличить концентрацию аспартата.
48. А. Калимин - структурный аналог субстрата, группа
СНз
общая.
сн
з
К.Т.
49. А.
50. 1 - А; 2 - А; 3 - С; 4 - D; 5 - D; 6 - D; 7 - С.
51. С.
52. А. Гидролиз белков содержимого гноя уменьшает его вяз-
кость и облегчает его удаление из раны.
Б. Гидролиз нуклеиновых кислот, следствие как в п. А.
53. Локализация ДНКазы в пиноцитозных пузырьках предот-
вращает повреждение ДНК клетки, локализованной в ядре.
54.
А. Крахмал -> мальтоза + декстрины.
Б. Низкая.
В. Увеличение активности амилазы в сыворотке крови и
моче.
55. Е.
56. Е.
57. ^уд= мкмоль Р мин1 мг1.
57
a - Ф. Изменение конформации фермента, его активного цен-
тра в результате изменения ионизации функциональных групп.
б - денатурация как результат разрыва прежде всего слабых
межрадикальных взаимодействий.
в - Ф. Конкурентное ингибирование.
58. Ауд=^-=2 мкмоль Рмин4 мг-1.
а - Ф. Изменение конформации фермента, его активное™ в
результате изменения ионизации функциональных групп.
б - Ф. Конкурентное ингибирование.
в-Т.
20
59. Ауд=^-^=0ДЗ мкмоль Р • мин1 • мг -1.
а - Ф. Изменение конформации фермента, его активного цен-
тра в результате изменения ионизации функциональных групп.
б - Ф. НАД* - кофермент.
60. Изменение конформации и активация при фосфорилиро-
вании.
61. Путем дефосфорилирования происходит активация, отще-
пление фосфорной кислоты изменяет характер межрадикальных свя-
зей, конформацию фермента.
62. Ез, аллостерическая регуляция, IV структура, пространст-
венно разделенные активный и аллостерический центры.
63.
А. Ингибирование по типу отрицательной обратной связи.
Б. Ei и Ез.
В. Аллостерическая, IV структура, пространственно разде-
ленные активный и аллостерический центры.
64. А.Е2.
Б. Ри.
В. Аллостерическая.
Г. IV структура, пространственно разделенные активный и
аллостерический центры.
65. АСТ/АЛТ ~ 98:85 > 1.
МАТРИЧНЫЕ БИОСИНТЕЗЫ
1. «Распределите перечисленные азотистые основания по при-
надлежности к ДНК и РНК.
1. Аденин. А. Характерны только для ДНК.
2. Гуанин. В. Характерны только для РНК.
3. Тимин. С. Характерны для обеих НК.
4. Урацил. D. Нехарактерны ни для одной из НК.
5. Цитозин.
2. Распределите перечисленные соединения по группам.
1. Аденин. А. Нуклеозид.
2. Цитидин-5-монофосфат. * Азотистое основание.
3. Гуанозин. С- НуклеотВД-
4. Цитозин.
5. Аденозин.
6. Уридин.
7. Тимидин-5 -монофосфат.
3. К пронумерованным формулам подберите соответствующее
название.
59
А. Адениловая кислота.
В. Гуанозин.
С. ДезоксигуанозиЕ.
D. Цитидиловая кислота.
Е. Тимин.
F. Тимидин.
G. Уридиловая кислота.
4. Выберите утверждения,
структуру РНК и ДНК.
1. В состав мономеров НК входят
аденин, гуанин, цитозин.
2. В состав мономеров НК входят
аденин, гуанин, цитозин, урацил.
3. В состав мономеров биополимера
входит дТМФ.
характеризующие первичную
А. Характерно
для РНК.
В. Характерно
для ДНК.
С. Характерно
для обеих
4. Мономеры в молекуле биополимера НК.
связаны 3 -5 - фосфодиэфирными D. Не харак-
связями. терно ни для
5. Мономеры в молекуле биополимера одной из НК.
связаны пептидными связями.
6. Первичная структура представлена
порядком чередования нуклеотидов
в полинуклеотидной цепи.
7. Первичная структура представлена
порядком чередования аминокислот
в полипептидной цепи.
5. Из перечисленных пар азотистых оснований выберите ком-
плементарные пары, обеспечивающие формирование вторичной
структуры ДНК и РНК.
1. А-У. А. Характерно д ля ДНК.
2. А - Т. В. Характерно для РНК.
3. Г - Ц. С. Характерно дня обеих НК.
4. Ц - A. D. Не характерно ни для одной НК.
5. У - Г.
6. Какие связи обеспечивают формирование первичной и вто-
ричной структуры нуклеиновых кислот?
1. Гликозидные. 2. Сложно- эфирные. А. Характерны для первичной структу- ры. В. Характерны для вторичной сгрукту-
60
3. Простые эфир-
ные.
4. Водородные.
5. Гидрофобные.
ры.
С. Характерны для обоих типов струк-
тур.
D. Не характерны ни для одной из них.
7. Какие особенности строения характерны для вторичной
структуры ДНК?
1. Построена из двух полинуклеотидных цепей.
2. Цепи антипараллельны.
3. Азотистые основания цепей комплементарны друг другу.
4. Обе нити закручены в спираль, имеющую общую ось.
Ответ по табл. 1.
8. Выберите положения, характеризующие особенности
структуры ДНК.
1. Количество нуклеотидов А и Т одинаково.
2. Количество нуклеотидов Г и Ц одинаково.
3. Одна полинуклеотидная цепь комплементарна другой.
4. Нуклеотидная последовательность одной нити идентич-
на нуклеотидной последовательности другой нити.
5. П олинукл солидные нити в молекуле антипараллельны.
9. Выберите ответ, какими из перечисленных параметров раз-
личаются разные типы РНК.
1. Первичной структурой.
2. Молекулярной массой.
3. Вторичной структурой.
4. Способом соединения нуклеотидов в полгчтуклеотидной це-
пи.
Ответ по табл. 1.
10. Напишите формулу динуклеотида следующего строения:
5 -У-А;
5 -дГ-дТ.
11. Методом молекулярной гибридизации нуклеиновых ки-
слот, выделенных из тканей одного организма, в молекуле ДНК
можно обнаружить участки, комплементарные РНК, ПОТОМУ
ЧТО все типы РНК синтезируются на матрице ДНК.
Ответ по табл. 2.
12. Выберите правильное описание свойств мРНК, поступаю-
щей из ядра в цитоплазму.
I. Является полным транскриптом соответствующих генов.
2. Имеет более короткую полинуклеотидную цепь, чем пер-
вичный транскрипт гена.
3. При молекулярной гибридизации с ядерной ДНК дает co-
вишенные гибриды.
4. При гибрид изации не дает совершенных гибридов.
Ответ по табл. 1.
61
13. Укажите полноту гибридизации препаратов ДНК, выде-
ленных из разных структур.
1. Из органов и тканей одного организ- А. Совершен-
ма. ные гибри-
2. Из тканей разных особей одного вида. ды.
3. Из различных тканей организмов, В.Несовершен-
принадлежащих разным видам. ные гибри-
4. Из одних и тех же тканей организмов, ды.
принадлежащих разным видам.
14. Подберите к перечисленным функциям соответствующие
нуклеиновые кислоты.
1. Служат адаптерами аминокислот к кодонам А. мРНК.
мРНК. В. ДНК.
2. Осуществляют передачу генетической ин- С. тРНК.
формации дочерним клеткам. D. рРНК.
3. Являются структурными компонентами ри-
босом.
4. Служат матрицами для синтеза белка.
5. Служат матрицами для синтеза РНК.
15. Выберите утверждения, характеризующие особенности
строения и локализации в клетке хроматина и рибосом.
1. Находятся в ядре клетки. А. Характерно для хро-
2. Обнаруживаются в цитозоле и матина.
митохондриях. В. Характерно для ри-
3. Представляют собой рибонукле- босом.
опротеиновые частицы. С. Характерно для обо-
4. Содержат белки репликативного их типов структур.
комплекса. D. Не характерно для
5. Содержат ферменты репарации. этих типов структур.
6. Содержат РНК-полимеразу.
16. Подберите для каждого матричного биосинтеза соответст-
вующую матрицу.
1. Синтез белка. А. ДНК.
2. Синтез тРНК. В. мРНК.
3. Синтез ДНК. С. тРНК.
4. Синтез рРНК. D. Полипептиды.
5. Синтез мРНК.
17. Укажите для процесса репликации
а) матрицу;
б) субстраты;
в) источники энергии;
г) фермент, обеспечивающий соединение дезоксирибонук-
леотидов в биополимер;
д) локализацию в клетке;
е) фазу клеточного цикла, в которой происходит этот
процесс.
62
18. А. Укажите для процесса репарации
а) матрицу; г) комплекс ферментов;
б) субстраты; д) локализацию в клетке.
в) источники энергии;
Б. Связан ли этот процесс с фазами клеточного цикла?
19. А. Укажите для процесса транскрипции
а) матрицу; г) фермент;
б) субстраты; д) локализацию в клетке.
в) источники энергии;
Б. Какие из перечисленных положений отражают особен-
ности синтеза и строения РНК?
1. Идентичны матрице.
2. Не идентичны, но комплементарны матрице.
3. Не комплементарны матрице.
4. Синтез связан с S-фазой клеточного цикла.
5. Образование происходит постоянно и не связано с
фазами клеточного цикла.
В. Какие виды РНК могут синтезироваться в ходе этого
процесса?
20. При старении организма между гистонами и ДНК обра-
зуются ковалентные связи. Как могут повлиять эти изменения на
синтез ДНК, РНК и белка в клетках разных тканей?
21. Выберите положения, правильно характеризующие свой-
ства биологического кода.
1. Каждому кодону соответствует только одна амино-
кислота.
2. Одну аминокислоту могут кодировать несколько
триплетов.
3. Смысл кодонов одинаков для ВСЕХ живых организ-
мов на Земле.
4. Каждой аминокислоте соответствует только один ко-
дон.
5. Кодоны мРНК считываются в направлении от 5'- к 3'-
концу.
22. А. Выберите положения, правильно характеризующие син-
тез, строение и функционирование адапторных моле-
кул.
1. Синтезируются с использованием в качестве матрицы
определенных участков ДНК.
2. В молекуле есть четьфе спирализованных участка и
три или четыре одноцепочечные петли.
3. Необходимы для процесса транскрипции.
4. Имеют триплет, комплементарный кодону мРНК.
5. К концевой З'-ОН-группе могут присоединять амино-
кислоты.
6. Каждая молекула адаптера может связываться толь-
ко с определенной аминокислотой.
63
Б. Напишите реакцию, в которой Гис связывается с адаптор-
ной молекулой, назовите фермент.
В. Укажите последовательность нуклеотидов антикодона,
комплементарного одному из кодонов гистидина в мРНК.
23. Адаптерная функция тРНК определяется ее способностью
специфически взаимодействовать с определенными субстратами.
Укажите их.
1. МРНК. 4. аа-тРНК-синтетаза.
2. ДНК. 5. Белки рибосомных частиц.
3. Аминокислота.
24. Укажите, какие источники энергии используются на от-
дельных этапах биосинтеза белка, подобрав к перечисленным циф-
рами положениям соответствующие буквы.
1. Образование пептидных связей. А. Используется
2. Присоединение матричной РНК к энергия АТФ.
4OS субчастице рибосомы. В. Используется
3. Присоединение мет-тРНК к мРНК и энергия ГТФ.
субчастицам рибосомы. С. Используется
4. Перемещение рибосомы по мРНК на энергия суб-
I кодон. стратов.
5. Освобождение белка с рибосом. D. Без затраты
6. Присоединение аа-тРНК к амино а- энергии.
пильному центру.
25. Выберите компоненты, которые необходимы для подго-
товки рибосомы к синтезу белка на стадии инициации.
ГмРНК. 2. ГТФ. 3. АТФ. 4. мет-тРНК. 5. 40S субъединица рибосомы. 6. 60S субъединица рибосомы. 7. Лиз-тРНК. 8. Белки - факторы инициации.
26. Укажите для процесса трансляции:
а) матрицу;
б)субстраты;
в) источники энергии;
г) адаптерные молекулы;
д) частицы, являющиеся местом синтеза;
е) локализацию в клетке.
27. А. В молекуле препроинсулина в 33-м положении находит-
ся остаток глутаминовой кислоты. Напишите реакцию,
с помощью которой эта аминокислота присоединяется
к адаптерной молекуле. Назовите фермент.
64
Б. Опишите события, которые происходят на рибосоме на
стадии элонгации при включений Глу в растущую пеп-
тидную цепь препроинсулина.
28. Какие посттрансляционные изменения происходят с моле-
кулой препроинсулина в процессе превращения в функционально
активный белок?
29. Циклофосфан, попадая в опухолевые клетки, расщепляется
присутствующими там фосфатазами с образованием очень реакци-
онноспособного алкилирующего агента, который взаимодействует с
ДНК и повреждает ее структуру.
Какие матричные биосинтезы ингибирует этот препарат в
опухолевых клетках?
30. Антибиотик дауномицин внедряется между основаниями
ДНК, образуя нековалентные связи. Укажите, ингибитором какого
(или каких) процесса (процессов) является этот антибиотик и в борьбе с
какими заболеваниями его целесообразно использовать? Действует ли
этот препарат на матричные биосинтезы в организме больного?
31. Выберите, какие причины обусловливают фенотипические
различия органов и тканей многоклеточного организма.
1. Стойкая репрессия отдельных генов.
2. Аллостерическое ингибирование разных ферментов.
3. Различия в наборе мРНК, поступающих из ядра в цито-
плазму разных органов.
4. Разная скорость элонгации пептидных цепей в ходе
трансляции.
32. Выберите положения, правильно характеризующие регу-
ляцию синтеза белка по механизму репрессии у прокариот.
1. Регуляция осуществляется с помощью корепрессоров.
2. В отсутствие корепрессора белок-регулятор не связыва-
ется с оператором.
3. В отсутствие корепрессора белок-регулятор связан с
оператором.
4. Корепрессорами могут быть субстраты метаболических
путей.
5. Корепрессорами могут быть конечные продукты мета-
болических путей.
6. В присутствии корепрессора РНК-полимераза транс-
крибирует структурные гены оперона.
5 Сборник тестов и задач по биохимии
65
33. Выберите положения, которые правильно объясняют разли-
чия в наборе белков, синтезирующихся в разных органах и тканях ор-
ганизма.
1. Геном разных типов клеток одинаков, но функционально
активны разные гены.
2. В регуляции синтеза белков участвует ДНК-полимераза.
3. Структурные гены, которые кодируют белки, не синтези-
рующиеся в данном типе клеток, стойко репрессированы.
4. Стойко репрессированные гены дифференцированных кле-
ток в норме не активируются под воздействием факторов
внешней и внутренней среды.
34. А. Перечислите структурные компоненты лактозного опе-
рона E.coli.
Б. Опишите последовательность событий после внесения
лактозы в среду.
В. Опишите последовательность событий после исчерпа-
ния лактозы в среде.
Г. Какие преимущества микроорганизмы получают от
этого механизма регуляции?
35. В клетках Е. coli Иле (изолейцин) синтезируется из амино-
кислоты Тре. В присутствии Иле его синтез прекращается.
А. Как меняется активность структурных генов Иле опе-
рона в этих условиях? (Ответ: Т - возрастает; 4- - умень-
шается; «-> - не меняется).
Б. Как меняется сродство белка-регулятора к оператору?
В. Скорость каких матричных биосинтезов при этом из-
меняется и как (уменьшается - 4 или возрастает -1)?
1. -А-Т-Т-Г-Ц-А-А-А-Т-.
2. -А-Т-Г-Ц-А-А-А-Т-.
3. -А-Т-А-Ц-Г-Ц-А-А-А-Т-.
4. -А-Ц-Т-Г-Ц-А-А-А-Т-.
36. В определенном участке ДНК имеется следующая последо-
вательность нуклеотидов: ... - А- Т- Ц- Г- Ц- А- А- А- Т- -
Укажите, какому типу мутаций соответствуют перечисленные изме-
нения первичной структуры ДНК в этом участке.
. . — д Вставка.
В. Замена.
С. Деления.
D. Инверсия.
37. Выберите, к какому типу мутаций в геноме относятся ука-
занные изменения в структуре белков.
1. Синтез неизмененного белка при
изменении первичной структуры
одного из кодонов ДНК.
2. Синтез белка с сильно изменен-
ной первичной структурой.
3. Удлинение полипептидной цепи
А. Деления или
вставка со сдви-
гом рамки.
В. Замена нуклео-
тида.
С. Вставка без
66
белка. сдвига рамки.
4. Синтез белка с сохранением раз- D. Деления без
мера полипептидной цепи и не- сдвига рамки,
значительными изменениями в
первичной структуре.
38. Укажите возможные причины возникновения мутаций.
1. Повоеждение ДНК ультрафиолетом.
2. Ошибки репликации.
3. Повреждение ДНК химическими соединениями окру-
жающей среды.
4. Повреждение ДНК ионизирующей радиацией.
5. Ошибки транскрипции.
6. Снижение активности эндонуклеазы репарирующей.
39. Назовите возможные последствия “вредных” мутаций.
1. Трансформация клеток и развитие опухолей.
2. Непереносимость некоторых пищевых веществ и ле-
карств.
3. Иммунодефицитные состояния.
4. Предрасположенность к некоторым болезням.
5. Возникновение наследственных болезней.
40. Выберите, к каким из перечисленных изменений в структу-
ре белка могут привести мутации по типу вставки одного нуклеоти-
да.
1. Укорочение цепи на одну аминокислоту.
2. Удлинение полипептидной цепи на одну аминокислоту.
3. Синтез белка с одной измененной аминокислотой.
4. Синтез белка со “случайной” последовательностью
аминокислот на участке, закодированном в ДНК за
местом мутации.
Ответ по табл. 1.
41. Выберите, к каким из перечисленных изменений в структу-
ре белка могут привести мутации по типу замены одного нуклеоти-
да.
1. Синтезу белка с одной измененной аминокислотой.
2. Синтезу неизмененного белка.
3. Синтезу незавершенной молекулы белка.
4. Синтезу белка со “случайной” последовательностью ами-
нокислот, считанной с участка ДНК за местом мутации.
Ответ по табл. 1.
42. Задняя доля гипофиза секретирует два гормона - оксито-
цин и вазопрессин (пептиды, состоящие из 9 аминокислотных
остатков). Оба гормона образуются из белков-предшественников и
выполняют разные функции. Первичная структура этих пептидов
близка, различия отмечаются в двух положениях: у вазопрессина в
3-й и 8-й позициях цепи Фен и Apr, а у окситоцина - Иле и Лей со-
67
ответственно. Определите кодоны ДНК дня этих аминокислот. Мо-
гут ли эти различия быть результатом точечных мутаций?
43. При одной из форм гемоглобинопатий в 0-цепи гемогло-
бина вместо Гис обнаруживается Тир. Укажите типы мутаций, ко-
торые могли привести к появлению аномального гемоглобина. Для
ответа на этот вопрос сравните строение триплетов ДНК, коди-
рующих эти аминокислоты.
44. При отсутствии в организме фермента галактозо-1-
фосфат-уридилтрансферазы развивается тяжелая наследственная
болезнь - галактоземия. Больные дети плохо растут, отстают в ум-
ственном развитии, в крови отмечается высокое содержание галак-
тозы и продуктов ее превращения, оказывающих токсическое дей-
ствие. Предположите, какие типы мутаций в гене этого фермента
могут привести к возникновению галактоземии.
45. Произошла делеция 25 нуклеотидов в структурном гене
соматической клетки.
А, Наблюдается ли в этом случае сдвиг рамки прочтения
информации гена в ходе трансляции?
К Может ли такая мутация быть причиной наследствен-
ной болезни?
46. Снижение активности фермента - нуклеозидфосфорилазы,
вызванное заменой Глн в 89-м положении полипептида на Лиз, при-
водит к нарушению обмена пуриновых нуклеотидов. Используя
таблицу биологического кода, определите:
а) какие изменения в структуре кодона ДНК привели к заме-
не Глн на Лиз?
б) в каком случае это изменение в структуре ДНК будет про-
являться фенотипически как наследственная болезнь?
47. В ходе эволюции наблюдается увеличение количества и
разнообразия генов. Выберите положения, правильно объясняющие
этот процесс.
1. Удвоение генов (иногда многократное) и независимые
мутации в копиях.
2. Сохранение мутантных копий в геноме.
3. При рекомбинации обмен участками ДНК меныпей
д лины, чем гены.
4. Ускорение репликативных процессов.
Ответ по табл. 1*
48. Выберите понятия, правильно отражающие особенности
строения и биологической активности полиморфных белков.
1. Белки имеют близкую пространственную структуру.
2. Выполняют одну и ту же или близкие функции.
3. Имеют незначительные различия в аминокислотном соста-
ве.
68
4. В популяции могут быть представлены большим числом
вариантов.
5. Каждый вид имеет не более двух вариантов этого белка.
49. Выберите утверждения, правильно характеризующие про-
исхождение генов, кодирующих полиморфные варианты белков.
1. Являются результатом ошибок трансляции.
2. Имеют общий предковый ген.
3. Гены этих вариантов могут возникнуть при рекомбина-
ции в процессе мейоза.
4. Являются результатом независимых мутаций в аллелях
одного гена.
5. Являются результатом ошибок транскрипции.
50. Выберите, какие из перечисленных явлений можно объяс-
нить существованием полиморфных белков.
1. Трансплантационная несовместимость.
2. Возникновение наследственных болезней.
3. Предрасположенность к некоторым болезням.
4. Групповая принадлежность крови.
Ответ по табл. 1.
51. Гликозилтрансфераза, участвующая в построении груп-
поспецифических гликолипидов мембран эритроцитов, представле-
на в популяции людей тремя полиморфными формами: А, В, 0.
А. На какие генотипически различные группы можно раз-
делить всех людей по этому признаку?
Б. На сколько групп можно разделить всех людей по их
реакции на строение мембраны эритроцитов доноров?
52. Имеется 3 препарата ДНК. Известно, что один из них по-
лучен из печени мыши, другой - из мышц мыши, третий - из мышц
лошади. Этикетки на склянках с препаратами стерлись. Как узнать,
какому виду животных принадлежит каждый препарат?
53. Объясните, почему в клетках число различных мРНК дости-
гает нескольких десятков тысяч, а тРНК - только нескольких десятков.
54. Если повреждения структуры ДНК не репарируются, то
они могут быть летальными для клетки. Будут ли приводить к столь
Же тяжелым последствиям повреждения молекулы РНК?
55. Под действием ионизирующей радиации в молекуле ДНК
оказались отщепленными два азотистых основания из комплемен-
тарной пары А-Т. Может ли система, обеспечивающая стабильность
генома, устранить это повреждение в гаплоидных клетках?
56. В молекуле инсулина имеются три остатка глутаминовой
кислоты в положениях 14 и 17 цепи А и 13 цепи В.
5*
69
А. Пользуясь таблицей биологического кода, определите,
как эта аминокислота может быть закодирована в мо-
лекуле ДНК.
Б. Можно ли предсказать, какой из триплетов кодирует
эту аминокислоту в разных участках инсулина?
В. Зная первичную структуру молекулы белка, можно ли
установить единственную нуклеотидную последова-
тельность в гене инсулина?
57. Последовательность нуклеотидов в мРНК кодирует только
одну последовательность аминокислот в белке. Можно ли, исходя из
аминокислотной последовательности белкового гормона глюкагона
(29 аминокислот), предсказать нуклеотидную последовательность
реальной мРНК, кодирующей этот белок? Для обоснования ответа
используйте участок молекулы гормона
Н2К-Гис-Сер-Гли-....
58. Для профилактики и лечения рахита детям назначают ви-
тамин Дз. Превращаясь в гормон кальцитриол, он вызывает в клет-
ках кишечника увеличение содержания белков, обеспечивающих
всасывание кальция. Ответьте на вопросы.
А. Скорость какого матричного биосинтеза в этом случае
изменяется первично и как (Т или Ф).
Б. Какие субстраты, ферменты и кофакторы участвуют в
матричном биосинтезе, указанном Вами в п. Л?
В. Какое строение имеет продукт, если в качестве матрицы
для его синтеза исп9льзуется фрагмент молекулы сле-
дующего строения: 5 ... - ГТЦ-ЦАЦ-ТЦА- ...3
3 ... - ЦАГ-ГТГ-АГТ- ...5
и прочтение информации идет слева направо?
Г. Напишите строение пептида, зашифрованного во
фрагменте матрицы, полученной в п. В, отметьте N- и
С- концы пептида.
Д. Перечислите основные компоненты, необходимые дня
синтеза пептида, и их функции в этом процессе.
Е. Определите, сколько разных молекул тРНК требуется
для его синтеза:
а) изобразите строение тРНК, отметив функционально ак-
тивные участки этой молекулы;
б) напишите реакцию и укажите фермент, который будет
катализировать синтез первой аа-тРНК, принимающей
участие в образовании полученного пептида.
59. Гемоглобин представляет собой сложный белок гемопро-
теин, состоящий из а- и 0-цепей, каждая из которых синтезируется
на разных молекулах мРНК. Какие посттрансляционные превраще-
ния приводят к формированию функционально активного белка?
60. Оперон, контролирующий синтез ЦТФ в клетках E.coli,
включает 9 структурных генов. Выберите положения, правильно
отражающие события в опероне:
70
а) при высоких концентрациях ЦТФ;
б) при низких концентрациях ЦТФ в клетках.
Соедините выбранные Вами номера стрелками, указы-
вающими последовательность событий в этом процессе.
1. ЦТФ связывается с белком-регулятором.
2. РНК-полимераза присоединяется к промотору.
3. РНК-полимераза к промотору не присоединяется.
4. Комплекс ЦТФ с белком-регулятором присоединяется
к оператору.
5. Комплекс ЦТФ с белком-регулятором не присоединя-
ется к оператору.
6. Комплекс белка-регулятора с ЦТФ не образуется.
7. Синтезируются белки, закодированные в структур-
ных генах данного опер она.
8. Не синтезируются белки, закодированные в струк-
турных генах данного оперона.
61. При введении гормона альдостерона у животных наблю-
дается задержка ионов Na+ за счет увеличения количества белков -
переносчиков этих ионов.
Выберите положения, объясняющие действие гормона. Соеди-
ните выбранные номера стрелками, указывающими последователь-
ность событий, приводящих к увеличению количества переносчиков
ионов Na+.
1. В присутствии альдостерона транскрибируется ген, содер-
жащий информацию о белке-переносчике ионов Na+.
2. Комплекс гормона с белком-переносчиком поступает в яд-
ро.
3. РНК-полимераза не может присоединиться к промотору.
4. Гормон проходит через плазматическую мембрану.
5. РНК-полимераза присоединяется к промотору.
62. Выберите положения, правильно отражающие гено- и фе-
нотипические признаки клеток печени и почек человека.
1. Набор генов в обеих тканях одинаков.
2. Набор генов различен.
3. Большая часть структурных генов в клетках печени и почек
не транскрибируется.
4. Нетранскрибируемые участки ДНК гиперметилированы.
5. В печени и почках транскрибируются разные участки ге-
нома.
6. Различия в наборе белков обеспечиваются посттрансляци-
онными модификациями.
7. Нетранскрибируемые участки хроматина клеток печени и
почек обогащены гистонами и конденсированы.
8. В обеих тканях в синтезе белка участвуют разные наборы
мРНК.
63. В яйцеклетке в смысловой части гена, кодирующего строе-
ние фермента оксвдазы гомогентизиновой кислоты, произошла за-
мена 7-го нуклеотида с образованием терминирующего кодона.
71
А. Какие изменения в структуре белка произойдут в ходе
трансляции мутантного гена?
Б. К каким фенотипическим проявлениям приведет эта
мутация?
64. В (3-цепи одного из вариантов НЬ отсутствуют аминокис-
лоты с 92 по 94. Такое изменение первичной структуры белка делает
его нестабильным и повышает сродство к кислороду.
А. Какое изменение в структуре гена (3-цепи привело к
возникновению этого варианта НЬ?
Б. Как изменится поступление кислорода к тканям у инди-
видуумов, гомозиготных по этому гену?
65. а-2-антитрипсин - белковый ингибитор многих протеаз -
представлен в человеческой популяции 4 аллельными вариантами:
А, В, С, D. На какие генотипически различные группы можно разде-
лить всех людей по этому признаку?
66. Фермент глюкозо-6-фосфат-дегидрогеназа представлен в
популяции людей 2 вариантами, которые отличаются по одной
аминокислоте: в варианте 1 - Асп, в варианте 2 - Асн.
А. Определите, какие изменения в кодоне гена этого фер-
мента привели к появлению указанных вариантов?
Б. Объясните, что такое полиморфизм белков.
В. Являются ли описанные варианты фермента примером
полиморфных белков?
67. Сопоставьте особенности строения и функционирования
ДНК и белков, выделенных из разных тканей одного человека или
одних и тех же тканей разных людей, подобрав к каждому пронуме-
рованному утверждению подходящую букву.
1. Набор структурных генов одинаков. А. Характерно для
2. Набор структурных генов различен. разных тканей од-
s. Функционально активны одни и те ного человека.
же гены. В. Характерно для
4. Функционально активны разные одних и тех же тка-
гены. ней популяции лк)-
5. Набор белков в тканях одинаков. дей.
6. Набор белков различен. С. Характерно для тех
7. Имеется множественность аллельных и других,
вариантов одного белка. D. Не характерно НИ
8. Присутствует не более двух аллель- для одного из слу-
ных вариантов каждого белка. чаев.
Эталоны ответов к разделу III
“МАТРИЧНЫЕ БИОСИНТЕЗЫ”
1. 1 - С; 2 - С; 3 - А; 4 - В; 5 - С.
2.1 - В; 2-С; 3-А; 4-В; 5-А; 6-А; 7-С.
3. 1 - G; 2 - F; 3 - А; 4 - С; 5 - D.
4. 1 - С; 2 - А; 3 - В; 4 - С; 5 - D; 6 - С; 7 - D.
S. 1 - В; 2 - А; 3 - С; 4 - D; 5 - D.
6.1 - D; 2 - А; 3 - D; 4 - В; 5 - В.
7. Е.
8. 1, 2, 3, 5.
9. А.
10. Формула 5 -У-A* в его состав входят 5 -УМФ и 5 -АМФ -
компоненты РНК.
Формула 5 -Г-Т' в его состав входят 5 -дГМФ и 5 -дТМФ -
компоненты ДНК.
П- А. 12. С.
13. 1 - А; 2 - А; 3 - В; 4 - В. 14. 1 - С; 2 - В; 3 - D; 4 - А; 5 - В.
15. 1 - А; 2 - В; 3 - В; 16. 1 - В; 2 - А; 3 - А; 4 - А; 5 - А.
4-А;5-А;6-А.
17.
а - ДНК. г - ДНК-полимераза.
б-дАТФ, дТТФ.дГТФ, дЦТФ. д-ядро.
в - дНТФ-субстраты. е - в S-фазу.
18. А. а - неповрежденная нить ДНК.
б - дАТФ, дТТФ, дГТФ, дЦТФ.
в - субстраты - дНТФ.
г - эндонуклеаза, экзонуклеаза, ДНК-полимераза, ДНК-
лигаза.
Д-ядро.
Б. Нет, процесс протекает постоянно.
73
19. A. a - ДНК, одна нить. г - РНК-полимераза.
б - АТФ, ГТФ, УТФ, ЦТФ. д-ядро.
в - субстраты - НТФ.
Б. 2, 5.
В. тРНК, мРНК, рРНК.
20. Уменьшится скорость синтеза ДНК, РНК, белка.
21. 1, 2, 3, 5.
22. А. 1,2, 4, 5, 6.
Б.
О—C”CH“NH2
>он II I
У [ гистидал-тРНК- Д ^ис
H2N — СН —СООН + (ГУА) + АТФ —-синтетаза > (гУд) + ДМФ + Н4РР7.
Гис
В. ГУА, ГУГ.
23.1,3,4,5.
24. 1 - С; 2 - D; 3 - В; 4 - В; 5 - В; 6 - В.
25. 1, 2, 4, 5, 6, 8.
26.
а-мРНК.
б - аминокислоты.
в-АТФ, ГТФ.
г - тРНК.
д - рибосомы.
е - цитозоль клетки.
27.
А. Глутамил-тРНК-синтетаза.
O~C-CH-NH2
✓ он
h2n-^h-cooh + (цуу) + АТФ
Глу
шутам ил-тРНК-
-синтетаза
-------------->
Глу
+ АМФ+ Н4РР7-
Б. Включение Глу-тРНК в центр связывания.
Перенос растущего пептида на а-ЫН2-группу остатка
Глу (пептидилтрансферазная реакция).
Перемещение рибосомы на один кодон (транслокация)-
74
28.
1. Образование дисульфидных связей.
2. Частичный протеолиз.
3. Формирование нативной структуры белка.
29. Репликация, транскрипция.
30. Препарат нарушает синтез ДНК и РНК в быстрорастущих
тканях больного, но в меньшей степени, чем в опухолевых клетках.
Онкологические заболевания.
31. 1, 3, 4.
32. 1, 2, 5.
33. 1, 3, 4.
34.
А. а - ген-регулятор; в - оператор;
б - промотор; г - структурные гены.
Б. Лактоза связывается с белком-регулятором и уменьша-
ет его сродство к оператору. К промотору присоединя-
ется РНК-полимераза и структурные гены лактозного
оперона транскрибируются. Образовавшаяся мРНК
служит матрицей для синтеза белков, участвующих в
катаболизме лактозы. Лактоза используется клеткой.
В. При снижении концентрации лактозы в среде комплекс
белка-регулятора и лактозы не образуется, и белок-
регулятор присоединяется к оператору. Транскрипция
генов лактозного оперона прекращается.
Г. Синтезируются белки, которые необходимы клетке в
определенных условиях среды.
35. А -Ф.
К-Т.
В. Уменьшается скорость процессов транскрипции и транс-
ляции.
36. 1 - В; 2 - С; 3 - А; 4 - D. 39. 1, 2, 3, 4, 5.
37. 1 - В; 2 - А; 3 - С; 4 - В. 40. D.
38. 1,2,3,4,6. 41. А.
75
42. Белок 3-Я позиция амино- кислоты кодоны мРНК ДНК 8-я позиция амино- кислоты кодоны мРНК ДНК
Вазопрессин Окситоцин Фен -> УУУ -> ААА УУЦ ААГ Иле -> АУУ -»ТАА АУЦ ТАГ АУА ТАТ Apr -+ ЦГУ -> ГЦА ЦГЦ ГЦГ ЦГА ГЦ1 ЦГГ ЩЦ Лей -> УУА -> ААТ УУГ ААЦ ЦУУ ГАА ЦУА ГАТ ЦУГ ГАЦ
Различия в аминокислотном составе пептидов могут быть результа-
том точечных мутаций типа замены нуклеотида.
43. Замена нуклеотида с измененным смыслом кодона.
44.
1. Замена с изменением смысла кодона.
2. Делеция или вставка со сдвигом рамки считывания.
3. Делеция или вставка без сдвига рамки считывания.
4. Образование терминирующего кодона.
45.
А. Да.
Б. Нет.
46.
а. Замена Г в первом положении кодона на Т.
Аминокислоты Кодоны
мРНК ДНК
Глн -> < Лиз -» < ' Г ЦАА ГТТ . ЦАГ ГТЦ AAA ТТТ ААГ ТТЦ
б. При мутации в ДНК половых клеток.
47. А.
48. 1,2,3,4.
76
49. 2, 3, 4.
50. Е.
51.
А. ОО,А0,ВО,АА,АВ,ВВ.
Б. генотип антитела группа
00 анти Л, анти В 0(1)
А0,АА анти В Л (II)
В0,ВВ анти Л В (III)
АВ нет АВ (1У)
52.
1. Молекулярная гибридизация.
медленное
2. ДНК + ДНК -> денатурация ДНК 0„яяжгт*
и aj ла ждсгтс
1 2
а) совершенные гибриды ДНК мышц и печени мыши;
б) несовершенные гибриды, если в смеси ДНК мыши и
мышц лошади.
53. мРНК столько, сколько белков в организме, а тРНК адап-
тируют аминокислоты к кодонам мРНК, и так как код вырожден, то
их несколько десятков.
54. Нет, так как структура матрицы ДНК для синтеза РНК не
Повреждена, а время жизни поврежденной РНК невелико.
55. Нет, так как азотистые основания из комплементарной пары.
56.
А. РНК ДНК
ГАА ЦТТ
ГАГ ЦТЦ
Б. Нет.
В. Нет
57. Нет, так как код вырожден. НгЬГГис-Сер-Глн-...
в мРНК -► ЦАУ УЦУ ГГУ
ЦАЦ УЦЦ ГГЦ
УЦА ГГА
УЦГ ГГГ
58.
А. Транскрипция,Т.
Б. АТФ, ГТФ, УТФ, ЦТФ, РНК-полимераза, Mg*+.
77
В. Матрица з'... - ЦАГ-ГТГ-АГТ- ...5'.
Продукт 5'... - ГУЦ-ЦАЦ-УЦА- ...з'.
Г. N-конец: -Вал-Гис-Сер- С-конец.
Д. мРНК - матрица; аминокислоты - субстраты; тРНК
адаптеры; аа-тРНК-синтетазы - ферменты, связывающие
аминокислоты с соответствующими тРНК; рибосомы - ме-
сто синтеза белка; АТФ, ГТФ - источники энергии, факто-
ры инициации, элонгации; Mg2+, К+ - кофакторы.
Е. 3 тРНК: тРНКВал, тРНКГис, тРНКсч>.
а. А-ОН <- акцепторный участок
<- антикодон
Вал
Вал + тРНК + АТФ
валил-тРНК-
-сингетаза
Н3С СНз
- тРНК + АМФ + Н4Р2О7 .
1. Связывание с простетической группой.
2. Формирование третичной структуры протомеров.
3. Сборка протомеров в тетрамер.
а. 1 -> 4 -> 3 -> 8.
б. 6 -> 2 -> 7.
61. 4-»2->5-> 1.
62. 1, 3, 4, 5, 7, 8.
63.
А. Будет синтезироваться N-концевой дипептид.
Б. К наследственному заболеванию - алкаптонурии.
64.
А. Мутация по типу делении.
Б. Снизится.
78
65. 10 групп: АА, АВ, AC, AD, ВС, BD, ВВ, СС, CD, DD.
66.
А. Замена Ц -> Т в первом положении кодона,
кодоны
мРНК ДНК
Асп: ГАУ ЦТА
ГАЦ ЦТГ
Асн: ААУ ТТА
ААЦ ТТГ
Б. Множественные варианты одного белка в популяции лю-
Дей.
В. Да.
67. 1 - С; 2 - D; 3 - В; 4 - А; 5 - В; 6 - А; 7 - В; 8 - А. .
ЭНЕРГЕТИЧЕСКИЙ ОБМЕН
И
ОБЩИЙ ПУТЬ КАТАБОЛИЗМА
1. Выберите соединения, которые участвуют в переносе элек-
тронов от изоцитрата на кислород, и разместите их так, как они
располагаются в дыхательной цепи.
1. НАД+. 6. Кислород.
2. ФАД. 7. ФМН.
3. Цитохром с. 8. Н+АТФаза.
4. Цитохромы аау 9. Цитохромы Ьс{.
5. Убихинон.
2. Выберите соединения, участвующие в переносе электронов
от яблочной кислоты на кислород, и разместите их так, как они
располагаются в дыхательной цепи.
1. Q (убихинон).
2. Малатдегидрогеназа.
3. НАДН-дегидрогеназа.
4. Цитохром с.
5. НАДН.
6. рНг-дегидрогеназа.
7. Сукцинатдегидрогеназа.
8. НАДФ*.
9. Цитохромоксидаза.
10. Кислород.
3. Выберите соединения, участвующие в переносе электронов
от янтарной кислоты на кислород и разместите их так, как они рас-
полагаются в дыхательной цепи.
1. Цитохромоксидаза.
2. Q (убихинон).
3. НАДН-дегидрогеназа.
4. НАД*.
5. Цитохром с.
6. Кислород.
7. Малатдегидрогеназа.
8. НАДФ*.
9. Сукцинатдегидрогеназа.
10. QH2-дегидрогеназа.
5. Цитохром с.
6. рНг-дегидрогеназа.
7. Сукцинатдегидрогеназа.
8. Кислород.
4. Выберите соединения, являющиеся общими переносчикам»
электронов на кислород от яблочной и янтарной кислот, и размес-
тите их так, как они располагаются в дыхательной цепи.
1. НАДН-дегидрогеназа.
2. Q (убихинон).
3. НАД+.
4. Цитохромы ааг
5. Напишите реакцию окисления НАДН в ЦПЭ. Укажите
фермент и кофермент. Напишите формулу рабочей части НАД ®
окисленной и восстановленной форме.
80
6. Напишите формулу убихинона в окисленном и восстанов-
ленном виде. Назовите фермент дыхательной цепи, катализирую-
щий окисление убихинона.
7. Напишите формулу рабочей части ФАД в окисленном и
восстановленном виде. Назовите фермент в дыхательной цепи, в
состав которого входит ФАД.
8. Напишите формулу рабочей части ФМН в окисленной и
восстановленной формах. Назовите фермент дыхательной цепи, ко-
ферментом которого служит ФМН.
9. Какие из следующих утверждений правильно описывают
механизм окислительного фосфорилирования?
1. Функцией ЦПЭ является перенос протонов через внут-
реннюю мембрану в митохондриальный матрикс.
2. Энергия электронов, переносимых по ЦПЭ, трансформи-
руется в энергию электрохимического градиента.
3. Однонаправленный транспорт Н+ в межмембранное про-
странство создает градиент pH.
4. Протонофоры разобщают тканевое дыхание и фосфори-
лирование.
5. АТФаза осуществляет транспорт Н+ в межмембранное
пространство.
• 6. Энергия электрохимического градиента используется для
синтеза АТФ.
10. В эксперименте с изолированными митохондриями в каче-
стве окисляемого субстрата использовали малат. Как изменится ко-
эффициент P/О, если:
а) в инкубационную смесь добавить ингибитор НАДН-
дегидрогеназы?
б) вместе с ингибитором добавить донор электронов, вос-
станавливающий цитохром с?
И. В эксперименте с изолированными митохондриями в каче-
стве окисляемого субстрата использовали малат. Как изменится ко-
эффициент P/О, если:
а) в инкубационную смесь добавить ингибитор НАДН-
дегидрогеназы?
б) вместе с ингибитором добавить сукцинат?
12. Напишите суммарное уравнение реакций окислительного
Декарбоксилирования пировиноградной кислоты (пируват мечен по
второму углеродному атому - 14С).
А. Перечислите названия ферментов и коферментов.
Б. Покажите в виде схемы ЦПЭ путь водорода от субстра-
та к кислороду.
В. Определите коэффициент P/О для данной реакции.
Г. Напишите формулу продукта реакции, содержащего
метку 14С.
® Сборник тестов и задач по биохимии 81
13. Напишите в виде схемы последовательность реакций пре-
вращения ацетил-КоА в а-кетоглутаровую кислоту.
А. Перечислите названия ферментов.
Б. Выпишите реакции дегидрирования.
В. Покажите в виде схемы ЦПЭ путь водорода от дегид-
рируемого субстрата к кислороду.
Г. Определите энергетический эффект реакции дегидриро-
вания (в количестве моль АТФ).
14. Напишите реакции превращения фумарата в оксалоацетат.
А. Перечислите названия ферментов и коферментов.
Б. Выберите реакцию дегидрирования и покажите в виде
схемы ЦПЭ путь водорода от дегидрируемого субстра-
та к кислороду.
В. Определите коэффициент P/О для данной реакции.
15. Напишите реакции превращения янтарной кислоты в ок-
салоацетат.
А. Перечислите названия ферментов и коферментов.
Б. Покажите в виде схемы с участием ЦПЭ путь водорода
от первого дегидрируемого субстрата к кислороду.
В. Определите энергетический эффект (в количестве моль
АТФ) превращения янтарной кислоты в оксалоацетат.
16. Напишите суммарное уравнение реакций окислительного
декарбоксилирования пировиноградной кислоты (пируват мечен |4С
по 3-му углеродному атому).
А. Укажите положение метки 14С в продуктах реакции.
Б. Перечислите названия ферментов и коферментов.
В. Представьте в виде схемы путь водорода от субстрата к
кислороду.
Г. Определите коэффициент P/О д ля данной реакции.
Д. Выберите, какие из перечисленных соединений могут
снизить скорость тканевого дыхания при добавлении в
инкубационную смесь перечисленных веществ.
1. Цитрат. 4. KCN.
2. HSKoA. 5. Ротенон.
3. НАДН. 6. Малат.
Е. Подберите к каждому из выбранных соединений соот-
ветствующий механизм действия.
1. Ингибирование ферментов ЦПЭ.
2. Необратимое ингибирование цитохромоксидазы.
3. Ингибирование НАДН-дегидрогеназы.
4. Аллостерическое ингибирование ферментов ПДК.
5. Разобщение дыхания и фосфорилирования.
17. Суспензию неотмытых митохондрий печени крыс инкуби-
ровали в аэробных условиях при оптимальных температуре и pH.
Интенсивность дыхания измеряли по поглощению кислорода после
добавления к суспензии:
а) малата;
82
б) АТФ;
в) АДФ;
г) салициловой кислоты (протонофора).
А. Напишите реакцию окисления малата, назовите фер-
мент, кофермент.
Б. Представьте в виде схемы ЦПЭ путь водорода от де-
гидрируемого субстрата к кислороду.
В. Чему будет равен коэффициент P/О для малата при до-
бавлении каждого из указанных веществ?
18. А. Напишите реакции превращения сукцинил-КоА в малат.
Б. Укажите реакцию дегидрирования и назовите фермент
и кофермент.
В. Представьте в виде схемы ЦПЭ путь водорода от де-
гидрируемого субстрата к кислороду.
Г. Определите, какое количество АТФ (моль) на 1 моль
малата может синтезироваться за счет этих реакций.
Д. Как изменится скорость синтеза АТФ:
а) при отравлении угарным газом (СО);
б) в присутствии малоновой кислоты;
в) в присутствии 2,4-динитрофенола?
Е. Подберите к каждому из указанных в п. Д соединений
соответствующий механизм действия.
1. Разобщение дыхания и фосфорилирования.
2. Аллостерическая активация ферментов цитратного цик-
ла.
3. Конкурентное ингибирование дегидрогеназы.
4. Активация ферментов ЦПЭ.
5. Ингибирование ферментов ЦПЭ.
19. А. Напишите реакции превращения цитрата в а-
кетоглутаровую кислоту. Укажите названия фермен-
тов.
Б. Представьте в виде схемы ЦПЭ путь водорода от де-
гидрируемого субстрата к кислороду.
В. Выберите соединения, которые снижают коэффициент
P/О для данной реакции.
1. Валиномицин (ионофор).
2. Амитал.
3. АДФ.
4. Цитрат.
Г. Подберите к каждому из выбранных в п. В соединений
соответствующий механизм действия.
1. Аллостерическое ингибирование ферментов цитрат-
ного цикла.
2. Разобщение дыхания и фосфорилирования.
3. Аллостерическая активация ферментов цитратного
цикла.
4. Ингибирование ферментов ЦПЭ.
5. Активация ферментов ЦПЭ.
83
20. Промежуточные продукты цикла Кребса могут служить
для синтеза различных веществ. Например, а-КГ превращается в
Глу. Утечка метаболитов из цикла восполняется реакцией карбок-
силирования пирувата ( СНз - СО - СООН + СО2 + АТФ + НзО-»
СООН-СО-СН2-СООН + АДФ + Н3РО4). Учитывая это уравнение,
напишите в виде схемы реакции синтеза а-КГ из пирувата.
21. В опыте in vitro изучали тканевое дыхание на препаратах
изолированных митохондрий, наблюдая за тем, как изменится по-
глощение кислорода этими препаратами в зависимости от условий.
Если к суспензии митохондрий, использующих в качестве единст-
венного источника “топлива” пируват, добавить 0,01 М малоната
натрия, то дыхание резко снижается и накапливается один из про-
межуточных продуктов метаболизма.
А. Какова структура накапливающегося промежуточного
продукта?
Б. Почему он накапливается?
В. Почему прекращается потребление кислорода?
22. При изучении тканевого дыхания Кребс использовал пре-
парат мышцы, отравленной малонатом. Он установил следующее.
1. Малонат снижает скорость окисления ацетил-КоА и
приводит к накоплению в среде сукцината.
2. Накопление сукцината происходит и при добавлении к
мышцам последовательно циграта, а-КГ, фумарата и
оксалоацетата.
3. В отсутствие малоната одна молекула оксалоацетата
участвует в окислении многих молекул ацетил-КоА.
Представьте в виде схемы последовательность реакций цит-
ратного цикла и объясните, какие результаты опытов подтверждали
гипотезу Кребса о циклическом характере реакций, осуществляю-
щих окисление ацетил-КоА.
23. Промежуточные продукты цикла Кребса могут служить
для синтеза различных веществ. Сукцинил-КоА, например, исполь-
зуется в синтезе гема (2 молекулы сукцинил-КоА необходимы дня
синтеза одного пиррольного кольца). Утечка метаболитов из цикла
восполняется реакцией карбоксилирования пирувата:
СНз-СО-СООН + СОг + АТФ + Н2О -> СООН-СО-СН2-СООН +
+ АДФ + НзРО4.
Учитывая это, напишите схему реакций, приводящих к синтезу сук-
цинил-КоА из пирувата.
24. Выберите утверждения, которые правильно отражают
особенности регуляции реакций общего пути катаболизма.
1. Изоцитратдегидрогеназа является аллостерическим
ферментом.
2. Цитрат лимитирует аэробное окисление глюкозы.
3. Активность пируватдегидрогеназного комплекса не за-
висит от концентрации цитрата.
84
4. Скорость цитратного цикла не зависит от отношения
НАД+/НАДН.
5. Ингибиторы ферментов ЦПЭ снижают скорость реак-
ций цитратного цикла.
6. Разобщители дыхания и фосфорилирования не влияют
на скорость реакций общего пути катаболизма.
25'. Подберите к перечисленным регуляторным ферментам об-
щего пути катаболизма соответствующие модуляторы (эффекторы).
1. Пируватдегидрогеназ- А, Активируется цитратом,
ный комплекс. В. Ингибируется ацетил-КоА.
2. Цитратсингаза. С. Ингибируется АТФ.
3. Изоцитратдегидрогеназа. D. Ингибируется сукцинил-КоА.
4. а-кетоглутаратде-
гидрогеназный комплекс.
26. В эксперименте с изолированными митохондриями в каче-
стве окисляемого субстрата использовали изоцитрат.
А. В присутствии каких из перечисленных веществ будет
тормозиться окисление изоцитрата?
1. Амитал натрия.
2. АДФ.
3. Ротенон.
4. 2,4-динитрофенол.
Б. Как изменится скорость поглощения Ог, если в условиях
ингибирования изоцитратдегидрогеназы к митохонд-
риям добавить донор г, восстанавливающий цитохром-
c. например аскорбиновую кислоту?
В. Чему будет равен коэффициент Р/О?
27. В эксперименте на дышащих митохондриях в 2 пробы, со-
держащие по 1 мл суспензии митохондрий, добавили одинаковое
количество малата и АДФ; в одну из проб внесли еще дополнитель-
но глюкозу и гексокиназу. В какой из проб скорость поглощения О?
будет выше и почему?
28. В суспензию митохондрий добавили 2 ммоль цитрата и 2
ммоль АДФ. Скорость окисления субстрата измеряли по поглоще-
нию кислорода. Через некоторое время реакция прекратилась.
А. Объясните, почему это произошло.
Б. Сколько субстрата осталось неокисленным?
В. Какое вещество (вещества) можно добавить, чтобы ре-
акция возобновилась?
29. Гипоэнергетическое состояние может возникнуть вследст-
вие дефицита витамина Bi.
А. Объясните, какие реакции общего пути катаболизма
нарушаются при гиповитаминозе Вь
Б. Выпишите эти реакции, назовите участвующие в них
ферменты и коферменты.
6*
85
В. Улучшится ли состояние больных гиповитаминозом Bi
при увеличении в их пищевом рационе углеводов?
Ответ поясните.
30. 2,4-динитрофенол, который является разобщающим аген-
том, пытались использовать для борьбы с ожирением.
А. На чем основывался этот выбор?
Б. В настоящее время подобные вещества уже не применя-
ются в качестве лекарственных препаратов, так как из-
вестны случаи, когда их применение приводило к смер-
тельному исходу. Почему прием таких препаратов мо-
жет привести к гибели?
31. К каждой реакции общего пути катаболйзма, обозначен-
ной буквой от А до Е, подберите соответствующий пронумерован-
ный фермент.
А. Пируват + дегидролипоат-Ег -> СОг +ацетиллипоат-Е2.
В. Оксалоацетат + ацетил-КоА + НгО -> цитрат + HSKoA.
С. Изоцитрат + НАД+ -> альфакетоглутарат + СО2 +НАДН+
+Н+.
D. Сукцинил-КоА + ГДФ + Н3РО4 -> сукцинат + ГТФ +
+HSKoA.
Е. Фумарат + Н2О -> малат.
1. Ацетилтрансфераза.
2. Цитратсинтетаза.
3. Сукцинатдегидрогеназа.
4. Пируватдекарбоксилаза (Ei).
5. Сукцинаттиокиназа.
6. Фумараза.
7. Изоцитратдегидрогеназа.
32. В эксперименте с изолированными митохондриями опре-
деляли величину коэффициента P/О. Предполагаемые значения Р/О
обозначены буквами от А до Е. Оцените, при наличии каких суб-
стратов и других веществ в инкубационной среде (пп. 1-9) возможны
указанные значения коэффициента Р/О.
А. Более 3. 1. Сукцинат.
В. 3. 2. Ни при каких условиях.
С. 2. 3. Аскорбиновая кислота.
D. 1. 4. Пируват.
Е. 0. 5. При добавлении разобщителей дыхания и
фосфорилирования наряду с субстратами.
6. Пируват и барбитураты.
7. Пируват, барбитураты и аскорбиновая
кислота.
8. Сукцинат и барбитураты.
9. Сукцинат и малонат.
33. Сколько молекул АТФ (пп. 1-6) может синтезироваться
при участии указанных реакций (А-Е) общего пути катаболизма в
расчете на одну молекулу субстрата?
А. Пируват -> сукцинил-КоА. 1.0.
В. Малат -> оксалоацетат. 2. 1.
С. Сукцинил-КоА -> сукцинат. 3. 2.
86
D, Фумарат -> малат. 4. з.
Е. Сукцинат оксалоацетат. 5. 5.
6. 9.
34. В эксперименте с изолированными митохондриями в каче-
стве окисляемого субстрата использовали изоцитрат.
Л. В присутствии каких из перечисленных веществ будет
тормозиться окисление изоцитрата?
1. Амитал натрия. 4. 2,4-динитрофенол.
2. АДФ. 5. АТФ.
3. НАДН.
Б. Как изменится скорость поглощения кислорода, если в
условиях ингибирования изоцитратдегидрогеназы к
митохондриям добавить донор электронов, восстанав-
ливающий цитохром с, например аскорбиновую кисло-
ту?
1. Уменьшится. 2. Увеличится.
В. Чему будет равен коэффициент P/О при добавлении ас-
корбиновой кислоты на фоне полного угнетения изо-
цитратдегидр огеназы?
А. Более 3. D. 1.
в: 3. Е. 0.
С. 2.
35. Чем определяются анаболические функции цитратного
Цикла?
1. Использованием промежуточных продуктов цикла для
синтеза аминокислот и гема.
2. Образованием доноров водорода (НАДН, ФАДНг) для
цепи переноса электронов.
3. Использованием промежуточных продуктов цикла для
образования донора водорода НАДФН, необходимого
для синтеза жирных кислот и стероидов.
4. Синтезом цитрата.
36. Выберите предложения, которые правильно характеризу-
ют "микросомальное” окисление.
1. "Микросомальное” окисление происходит в гладком
эндоплазматическом ретикулуме печени и других орга-
нов, а также в митохондриях коры надпочечников и по-
ловых желез.
2. НАДН является донором водорода для реакций
"микросомального” окисления.
3. Главные ферменты системы - цитохром Р450 и НАДФ-
цитохром Р450-редуктаза.
4. Для образования гидроксильной группы в модифици-
руемом гидрофобном веществе используется атом ки-
слорода молекулы воды.
5. Цитохром Р450 (атом железа гема) переносит электроны
на атом кислорода с образованием молекулы воды.
87
6. В качестве побочных продуктов образуются активные
формы кислорода.
37. Выберите правильные утверждения.
1. Активные формы кислорода (супероксидный анион-
радикал, пероксид водорода, гидроксильный радикал)
могут образовываться в результате последовательного
одноэлектронного восстановления молекулярного ки-
слорода в ферментативных и неферментативных реак-
циях в клетке.
2. Активные формы кислорода инициируют свободнора-
дикальные процессы в организме, реагируют с нуклеи-
новыми кислотами, липидами, белками и могут вызы-
вать их повреждение.
3. Витамин Е является важнейшим компонентом системы
неферментативной антиоксидантной защиты клетки.
4. Бактерицидное действие фагоцитов обусловлено акти-
вацией ферментов антиоксидантной защиты.
Ответ по табл. 1.
Эталоны ответов к разделу IV
“ЭНЕРГЕТИЧЕСКИЙ ОБМЕН
И
ОБЩИЙ ПУТЬ КАТАБОЛИЗМА”
1. 1 -> 7 -» 5 -> 9 -> 3 —> 4 —> 6.
2. 2 —> 5 —> 3 -> 1 -> 6 —> 4 -> 9 -> 10.
3. 9->2-> 10->5-> 1 ->6.
4. 2—>6—>5—>4—>8.
5. Никотинамид (РР) НАДН + Н+ +
-> НАД+ + QH2.
НАДН-дегидрогеназа
Q ----------------►
(ФМН)
6. Убихинон, РНг-дегидрогеназа.
7. Рибофлавин (Вг), сукцинатдегидрогеназа.
в. Рибофлавин (В 2), НлДН-дсгидригсназа.
88
9. 2, 3, 4, 6.
10.
a. P/О I.
б.Р/О= 1.
11.
a. P/O = 0.
6. P/O = 2.
12. Пируват + HSKoA + НАД+ -» ацетил-КоА + COz +
+ НАДН + H+.
А. Пируватдекарбоксилаза (ТДФ);
дигидролипошп’рансацетилаза (ЛК), HS-KoA;
дигидролипоилдегидрогеназа (ФАД), НАД+.
Б. НАДН -> НАДН-дегидрогеназа (ФМН) -> Q ->
->()Н2-дегвдрогеназа (b, ci) -> цитохром с -> цитохро-
моксидаза (а, а3) -> 1/2 Ог -> НгО.
В. Р/О = 3.
Г.
СН3 —С* —8 —КоА
II
О
ЩУК 12 3
13. Ацетил-КоА*»*--► цитрат -> изоцитрат -> а-КГ.
А. Цитратсингаза; аконитаза; изоцитратдегидрогеназа
(НАД-).
Б. Изоцитрат -> а-КГ.
В. НАДН ->НАДН-дегидрогеназа (ФМН) -> Q -> QH2-
дегидрогепаза (b, с,) -> цитохром с -> цитохромоксида-
за (а, а3) -> 1/2 Ог -> НгО.
Г. 3 моль АТФ.
14.
соон
I НгО
СН (
It —
СН 1
соон
СООН НАД+ НАДН+Н+ соон 1
сн2 сн2
1 нс-он 2 с=о 1
соон соон
фумарат
оксалоацетат
А. Фумараза; малатдегидрогеназа (НАД-).
89
15.
Б. Малат у -------> ЩУК.
НАД+ НАДН -» НАДН-дегидрогеназа (ФМН) ->
2е-
-> Q -> QH2 -> (^Нг-дегидрогеназа (/>, ci) -> цитохром с
->цитохромоксидаза (а, аз) -> 1/2 О? -> НгО.
В. 3.
СООН Е/ФАД) Е/ФАДН2/
СН2 1
I
СООН
СООН
I
СН
II
СН
I
НгО
СООН
сукцинат
фумарат
2
♦
СООН НАД* НАДН+Н*
СН2 У*
> I —----------------►
СНОН 3
I
СООН
СООН
I
сн2
С=О
I
СООН
малат
оксалоацетат
А. Сукцинатдегидрогеназа (ФАД); фумараза; малатдегид-
рогеназа (НАД).
Б. Сукцинат -» сукцинатдегидрогеназа (ФАД) -> Q ->
2е-
-» QH2 -> рНг-дегидрогеназа (b, ct) -> цитохром с ->
-►цитохром оксидаз а (а, а3) -> 1/2 62 -> Н2О.
В. 5 АТФ.
СНз
16.
С-СООН + №КоА + НАД+—► СН3-С- З-КоА. +СО2 +НАДН+Н*.
О О
А. Во втором атоме С адсгил-КоА.
Б. Ферменты: пируватдегидрогеназа, дагидролипоатаде-
тилтрансфераза, дигидролипоагдегидрогеназа.
Коферменты: тиаминдифосфат, липоат, HSKoA, ФАД
НАД*.
В. Пируват -» НАДН+Н+ ---------> QH2
НАДН-дегид-
рогеназа
(ФМН)
2е-
---------->
РНг-дегид-
рогеназа
(Ъ, ci)
цитохромоксидаза (ааз)
-> цитохром с -------------------> 1/2 Ог -> НгО.
Г. Р/О = 3.
Д 3; 4; 5.
Е. 3-4; 4- 1,2; 5-1,3.
17.
А.
СООН п+ СООН
। ^д ।
СН2 ( сн2 +
I ----------Ь—►----------> I _ + НАДН + Н
снон малатдегидрогеназа с—О
СООН СООН
малат оксалоацетат
2е-
Б. НАДН+Н+----------► QH2--------► цитохром с —>
НАДН-дегид- ОНг-дегид-
рогеназа
(Р, ct)
1/2 О2 —►НгО.
рогеназа
(ФМН)
цитохромоксидаза (а,а3)
В. a - 3; б - < 3; в - <3; г - < 3.
18.
А.
СООН
I
СН2 ГДФ, Н3РО4
I
сн2
I
СО-
"(КоЛ, ГТФ)
СООН
сн2 + Q
। -------------------
сукцинатдегвдро
I геназа (<МД)
СООН
сукцинил-КоА
СООН
—> уН + QH2
СН
I
СООН
фумарат
сукцинат
СООН
+ НгО снон
----------------> ।
фумарапидратаза-СН2
f
СООН
малат
91
Б. Сукцинат -> фумарат, сукцинатдегидрогеназа, ФАД.
В.
соон
I
СН2 2
I ->ОН?--------—--------* пщохром с---------------► 1/2 Ог-^НгО
' v z QH2- дегидрогеназа г цитохромоксидаза
| 2 (Ъ.а) (w)
СООН
сукцинат
Г. 3 моль АТФ (2 моль окислительное + 1 моль субстрат-
ное фосфорилирование).
Д. Во всех случаях уменьшение скорости.
Е. а-5;б-3;в- 1.
19.
А.
СООН СООН | СООН
сн2 СН2 1 сн2
1 НООС-С-О1Г- аконитаза 1 > СН-СООН изоцитратде- 1 сн2 + со2 +
сн2 1 СН-ОН 1 гидрогеназа с=о 1
соон СООН соон
цитрат изо цитрат а-КГ
+ НАДН + н+.
2е-
Б. НАДН+Н+----------> QHz----------> цитохром с
НАДН-дегид- QHi-дегид-
рогеиаза (ФМН) рогеиаза {Ъ, с А
--------------------> 1/2 Ог -> Н20.
цитохромоксидаза (а, а3)
В. 1,2.
Г. 1 - 2; 2 - 4.
20.
1. Пируват + СОг -> ЩУК.
2. Пируват -> ацетил-КоА + СОг.
3. ЩУК + ацетил-КоА -> цитрат.
4. Цитрат -> изоцитрат -> а-КГ.
92
21.
A.
СООН
I
сн2
I
сн2
I
СООН
сукцинат
Б. Ингибируется сукцинатдегидрогеназа.
В. Отсутствие субстратов - доноров Н+ для ЦПЭ.
22. Ацетил-КоА + ЩУК -> цитрат -» изоцитрат -> d-КГ ->
-> сукцинил-КоА -> сукцинат -> фумарат -> малат->ЩУК.
1. Добавление цитрата, а-КГ, фумарата и ЩУК, накопле-
ние сукцината.
2. Фумарат -> ЩУК -» ->-> сукцинат.
3. 1 молекула ЩУК без ингибитора участвует в окислении
многих молекул ацетил-КоА.
.ЩУК
23. Пируват —► ацетил-КоА^* » цитрат-* изоцитрат —►
—► а-КГ—► сукцинил-КоА.
24. 1;2;5.
25. 1 - В, С; 2 - C.D; 3 - С; 4 - D.
26. А. 1;3.
Б. Увеличится.
В. Р/О= 1.
27. В той, где глюкоза,
гексокиназа
Глюкоза + АТФ —--------------> глюкозо-б-фосфат +
АДФ.
Так как концентрация АДФ увеличится, то скорость дыхания
также увеличится.
28. А. Исчерпание АДФ.
Б. 1 ммоль цитрата -> 12 ммоль АДФ,
х -* 2 ммоль АДФ.
х = 0,2 ммоль цитрата окислилось. Осталось неокислен-
ным: 2 ммоль - 0,2 = 1,8 ммоль цитрата.
В. АДФ.
93
29. А. Окислительное декарбоксилирование а-кетокислот.
Б. Окислительное декарбоксилирование пирувата и
а-КГ.
В. Нет, так как будет затруднено их окисление.
30. А, Усиление катаболизма при действии разобщителей,
Б. При разобщении снижается Р/О и наступает гипоэнер-
гетическое состояние.
t
31. А - 4; В - 2; С - 7; D - 5; Е - 6.
32. А - 2; В - 4; С - 1, 8; D - 3, 7; Е - 5, 6, 9.
33. А - 6; В - 4; С - 2; D - 1; Е - 5.
34. Л.1; 3; 5.
Б. 2.
В. D.
35. 1;3.
36. 1;3;5;6.
37. А.
ОБМЕН
И
ФУНКЦИИ УГЛЕВОДОВ
1. Какие углеводы пищи человека являются источниками глю-
козы при переваривании?
1. Сахароза.
2. Лактоза.
3. Крахмал.
4. Целлюлоза.
Ответ по табл. 1.
2. А. Подберите ферменты, расщепляющие связи между моно-
мерами в углеводах при переваривании их в желудоч-
но-кишечном тракте. 1. Глюкозо(а 1-4)-глюкоза. 2. Глюкозо(а 1-2)-фруктоза. 3. Глюкозо(а 1-6)-глюкоза. 4. Галактозо(Р 1-4)-глюкоза. 5. Глюкозо(Р 1-4)-глюкоза. 6. Глюкозо(а 1-4)-глюкозо(а 1-4)- глюкозо(а 1-4).... А. Сахараза. В. Лактаза. С. Мальтаза. D. Изомальтаза. Е. Амилаза. F. Ни один из пере- численных фер- ментов.
Б. Клетками каких структур синтезируются ферменты, пе-
речисленные в п. А справа:
1. Поджелудочной железы.
2. Слизистой желудка.
3. Слизистой тонкого кишечника.
4. Слизистой толстого кишечника.
3. Подберите названия к перечисленным углеводам.
1. Глюкозо(а 1-6)-глюкоза.
2. Глюкозо(а 1-2)-фруктоза.
3. Глюкозо(а 1-4)-глюкоза.
4. (Глюкозоф 1-4)-глюкозо)л.
А. Лактоза.
В. Мальтоза.
С. Сахароза.
D. Фрагмент крахмала.
95
5. Галактозо(0 1-4)-глюкоза.
6. Фруктозо(0 1-6)-галактоза.
7. (Глюкозо(а 1-4)-глюкозо)и.
Е. Изомальтоза.
F. Фрагмент целлюлозы.
G. Ни одан из этих углево-
дов.
4. А. Какие ферменты, участвующие в переваривании углево-
дов, содержатся в указанных секретах (форма ответа:
цифра - название фермента или ферментов)?
1. Слюна.
2. Секрет поджелудочной железы.
3. Секрет клеток слизистой кишечника.
Б. К какому классу относятся эти ферменты?
5. Выберите цифры, соответствующие суточной норме углево-
дов в питании человека.
1 - 50 г. 3 -100 г.
2 - 400 г. 4 - 200 г.
б. Выберите процессы, происходящие при пищеварении.
I. Расщепление дисахаридов до моносахаридов.
2. Распад моносахаридов до СО? и НзО.
3. Расщепление полисахаридов до моносахаридов.
4. Образование продуктов, которые могут всасываться в
клетки слизистой кишечника.
5. Распад моносахаридов с образованием лактата.
7. В эксперименте к раствору, содержащему сахарозу, лактозу
и крахмал, добавили сок поджелудочной железы и инкубировали в
оптимальных условиях.
А. Напишите схему реакции, которая может произойти в
данном опыте. Укажите фермент.
Б. Укажите качественные пробы, которые можно использо-
вать для обнаружения продуктов реакции.
8. В эксперименте к раствору, содержащему крахмал, сахаро-
зу, лактозу, добавили ферменты, экстрагированные из клеток слизи-
стой тонкого кишечника, и инкубировали в оптимальных условиях.
Напишите схемы реакций, которые могут произойти в данном опы-
те. Укажите ферменты.
9. У новорожденного ребенка после кормления молоком на*
блюдались диспепсические расстройства (рвота, понос). После перс-
вода на искусственное кормление раствором, содержащим глюкозу,
наблюдаемые явления проходили. Возможной причиной заболева-
ния является недостаточность активности одного из ферментов,
участвующего в переваривании углеводов.
96
А. Назовите этот фермент.
Б. Напишите схему реакции, которую он катализирует.
10. В клинику поступил больной ребенок с часто возникаю-
щей диарреей после приема молочной пищи. Для постановки диаг-
ноза провели тест на толерантность к лактозе. Больному натощак
давали 50 г лактозы, растворенной в воде. Через 30, 60 и 90 мин в
крови определяли концентрацию глюкозы и обнаружили, что кон-
центрация глюкозы не увеличилась. Объясните полученные резуль-
таты.
11. Выберите положения, правильно характеризующие физио-
логическое значение катаболизма глюкозы.
1. Синтезируется АТФ - донор энергии в биологических
процессах.
2. Промежуточные вещества используются в реакциях
анаболизма.
3. Катаболизм глюкозы может протекать как в аэробных,
так и в анаэробных условиях, и, следовательно, служить
источником АТФ для клетки в разных физиологических
ситуациях.
4. Аэробный распад глюкозы может происходить только в
клетках печени.
Ответ по табл. 1.
12. Выберите положения, правильно характеризующие физио-
логическое значение анаэробного распада глюкозы.
1. Обеспечивает энергозатраты скелетных мышц в нача-
льный период при выполнении срочной интенсивной ра-
боты.
2. Активируется в сердечной мышце при заболеваниях с
нарушением кровообращения и явлениями гипоксии.
3. Характерен для метаболизма клеток злокачественных
опухолей.
4. Является основным источником энергии для метаболиз-
ма эритроцитов.
5. Конечный продукт процесса выводится из организма.
6. Конечный продукт подвергается дальнейшим превращени-
ям.
13. Используя предложенную нумерацию реакций в процессе
катаболизма глюкозы, укажите:
Сборник тестов и задач по биохимии
97
Глюкоза
Ф;
Глюкозо-6-фосфат
Ф?
фруктозо-6-фосфат
Фз
9
глицеральдегид- ?
фосфат 5
Ф 6
?
i 7
?
Ф 8
2-ф о сф оглицер ат
Ф9
?
110 II
а) продукты, образующиеся в
реакциях: 3, 4, 6, 7, 9;
(обозначены знаком вопроса);
б) реакции, составляющие про
цесс аэробного гликолиза;
в) реакции, составляющие про
цесс анаэробного гликолиза;
г) необратимые реакции.
пируват -> лактат
Ф 12
общий путь катаболизма
14. Используя нумерацию реакций в процессе катаболизма
глюкозы, предложенную в тесте 13, укажите:
а) окислительно-восстановительные реакции, протекающие в
анаэробном гликолизе; напишите вторую из этих реакций
формулами, укажите фермент и кофермент;
б) реакции, сопряженные с синтезом АТФ без участия
ЦПЭ; напишите первую из этих реакций формулами,
укажите фермент.
15. А, Используя нумерацию реакций в процессе катаболизма
глюкозы, предложенную в тесте 13, укажите реакций,
сопряженные с синтезом АТФ, протекающие при
аэробном гликолизе.
Б. Напишите формулами реакцию, сопряженную с синте-
зом АТФ при участии ЦПЭ.
16. Подберите к перечисленным ферментам реакции, которые
они катализируют.
1. Лактатдегидрогеназа. А. Необратимые реакции.
2. Гексокиназа. В. Окислительно -
3. Фосфоглюкоизомераза. восстановительные.
98
4. Фосфофруктокиназа.
5. Фосфоглюкомутаза.
6. Пируваткиназа.
7. Енолаза.
8. Фосфоглицераткиназа.
9. Глицероальдегидфосфат-
дегидрогеназа.
С. Сопряженные с синтезом
АТФ без участия ЦПЭ.
D. Связанные с использо-
ванием Н3РО4.
Е. Связанные с использо-
ванием АТФ.
F. Ни одна из этих реакций.
17. Л. Сколько моль пирувата образуется при распаде 1 моль
глюкозы при аэробном гликолизе? Сколько моль АТФ
будет синтезироваться в этом процессе?
Б. Как изменится энергетический эффект, если окисление 1
моль глюкозы до пирувата будет происходить в ана-
эробных условиях?
18. А. Сколько моль молекулярного кислорода необходимо для
окисления 2 моль глицеральдегид-3-фосфата до пирови-
ноградной кислоты? Сколько моль АТФ при этом синте-
зируется ( при условии достаточной концентрации
НАД*)?
Б. Как изменится энергетический эффект, если распад 2
моль глицеральдегид-3-фосфата до пирувата будет про-
исходить без кислорода?
19. По предложенным цифровым данным (1 - 6) оцените,
сколько моль АТФ синтезируется или используется на каждом из
обозначенных буквами (А - D) этапов распада глюкозы ((2)- стехио-
метрический коэффициент).
A BCD
Глюкоза—>(2) глицеральдегид—>(2) пируват —>(2) ацетил-КоА —>
фосфат 1
-> СО2,Н2О.
цитратный цикл ’
1. Синтезируется 10 моль АТФ.
2. 2 моль АТФ (из общего числа) синтезируется без
участия ЦПЭ.
3. 6 моль АТФ синтезируется путем окислительного фос-
форилирования.
4. 2 моль АТФ затрачивается.
5. Этап не связан с синтезом АТФ.
6. Суммарный энергетический эффект составляет 24 АТФ.
20. При изучении гликолиза в эксперименте в качестве суб-
страта использовали глюкозу, меченную в положении !С.
А. Определите, в каком положении окажется метка в сое-
динениях, формулы которых указаны ниже.
99
Н2С"ОЮ3Н2 Н2С-ОН О=с—ОРО3Н2 1
1 'С=О 1 с—о нс-он 1
1 но-сн 1 H2C-OPO3H2 H2C-OPO3H2
нс-он
I
нс-он
I
НзС-ОРОзН?
Б Укажите названия этих соединений.
21.
А. Какой из процессов распада глюкозы обеспечивает
энергией метаболизм эритроцитов - клеток, лишенных
митохондрий? Используя пронумерованные метаболи-
ты, составьте схему этого процесса.
1. 2-фосфоглицерат. 7. Глюкозо-6-фосфат.
2. Глицеральдегид-З-фосфат. 8. 3-фосфоглицерат.
3. Фруктозо-6-фосфат. 9. Фосфоенолпируват.
4.1,3-дифосфоглицерат. 10. Лактат.
5. Глюкоза.
6. Фруктозо-1,6-дифосфат.
11. Пируват.
12. Диоксиацетонфосфат.
Б. Напишите формулами реакцию образования конечного
продукта в этом процессе; укажите фермент.
В, Выберите, какие из перечисленных утверждений пра-
вильно характеризуют написанный процесс.
1. Протекает в цитозоле клеток.
2. Характерен для многих тканей.
3. Сопряжен с синтезом АТФ на уровне субстратов и в
ЦПЭ.
4. Является источником энергии для интенсивно рабо-
тающей мышцы в начальный период.
5. Суммарный выход АТФ составляет 4 моль АТФ на 1
моль глюкозы.
22. А. Составьте схему специфической части катаболизма
глюкозы в аэробных условиях, используя пронумеро-
ванные метаболиты.
1. 2-фосфоглицерат. 7. Фруктозе-1,6-дифосфат.
2. Пируват. 8. Фруктозо-6-фосфат.
3. Глюкоза. 9. Фосфоенолпируват.
4. Глицеральдегидфосфат. 10. Глюкозо-6-фосфат.
5. 1,3-дифосфоглицерат. 11. 3-фосфоглицерат.
6. Лактат. 12. Диоксиацетонфосфат.
Б. Напишите реакцию, сопряженную с ЦПЭ.Б Выберите,
какие из перечисленных утверждений правильно харак-
теризуют написанный процесс.
1. Конечным продуктом является лактат.
2. Является источником энергии для клеток, лишенных
митохондрий.
100
3. Сопряжен с синтезом 8 моль АТФ на 1 моль глюкозы.
4. Протекает в цитозоле клеток.
23. Подберите особенности,
анаэробного гликолиза.
1. Пр оцесс требует постоянной
регенерации НАД+.
2. Акцептором водорода от
НАДН является пируват.
3. Сопряжен с синтезом АТФ
при участии ЦПЭ.
4. Является источником энергии
для клеток, лишенных мито-
хондрий.
5. Метаболиты процесса исполь-
зуются в анаболических про-
цессах.
6. Конечным продуктом является
лактат.
7. Протекает в цитозоле клеток.
характерные для аэробного
А. Характерно только
для аэробного глико-
лиза.
В. Характерно только
для анаэробного гли-
колиза.
С. Характерно для обоих
процессов.
D. Для указанных про-
цессов не характерно.
и
24. В опыте на гомогенатах мышечной ткани изучали ана-
эробный гликолиз. Как изменится скорость анаэробного распада
глюкозы в этом опыте при добавлении в инкубационную смесь вы-
соких концентраций перечисленных веществ?
1 .АДФ. А. Увеличится.
2 . АТФ. В. Уменьшится.
3. Сукцинат. С. Не изменится.
4. Цитрат.
5. Ацетил-КоА.
Перечислите регуляторные ферменты этого процесса:
25. При добавлении АТФ к гомогенату мышечной ткани сни-
зилась скорость гликолиза, концентрация глюкозо-6-фосфата и
Фруктозо-6-фосфата увеличилась, а концентрация всех других мета-
болитов гликолиза была при этом ниже. Укажите фермент, актив-
ность которого снижается при добавлении АТФ.
26. В опыте на гомогенате мышечной ткани изучали пр оцесс
анаэробного гликолиза. Как изменится концентрация лактата при
Добавлении в эту инкубационную смесь высоких концентраций пе-
речисленных веществ?
1. АМФ.
2. АТФ.
3. Цитрат.
4. Ацетил-КоА.
5. НАДН.
6. Малонат.
А. Увеличится.
В. Уменьшится.
С. Не изменится.
7»
101
27. Выберите утверждения, правильно характеризующие осо-
бенности метаболизма в клетках скелетных мышц в начале умерен-
ной физической работы по сравнению с состоянием покоя.
1. Пируват активно превращается в лактат.
2. Окислительное декарбоксилирование пирувата замедляет-
ся.
3. Активность пируваткиназы снижается.
4. Соотношение АТФ/АДФ снижается.
. 5. Активность фосфофруктокиназы повышается.
28. Выберите утверждения, правильно характеризующие про-
цесс глюконеогенеза.
1. Является одним из источников глюкозы в крови.
2. Регуляторные ферменты катализируют необратимые ре-
акции.
3. Ингибируется при накоплении в клетке АТФ.
4. Протекает главным образом в печени, а также корковом
веществе почек и слизистой оболочке кишечника.
5. Обеспечивает глюкозой мозг в тех условиях, когда глю-
коза в организм не поступает.
8. Диоксиацетонфосфат.
9. Глюкозо-6-фосфат.
10. 2-фосфоглицерат.
11. Пируват.
12. Фруктозо-6-фосфат.
13. 3-фосфоглицерат.
29. А. Составьте схему синтеза глюкозы из лактата, располо-
жив в необходимой последовательности перечисленные
компоненты. Над стрелками укажите реакции, идущие
с затратой АТФ, ГТФ.
1. Лактат.
2. Фосфоенолпируват.
3. Глюкоза.
4. Фруктозо-1,6-дифосфат.
5. 1,3-дифосфоглицерат.
6. Оксалоацетат.
7. Глицеральдегидфосфат.
Б. Напишите формулами регуляторные реакции. Укажите
ферменты.
30. Выберите утверждения, правильно характеризующие глю-
конеогенез из лактата.
1. Активно протекает в мышцах.
2. Протекает главным образом в печени и возвращает лактат
в метаболический фонд углеводов.
3. На синтез 1 моль глюкозы тратится 2 моль АТФ.
4. Регуляторные ферменты катализируют необратимые реак-
ции.
5. Скорость регулируется соотношением АТФ/АДФ в клетке.
31. В эксперименте на культуре клеток печени изучали глюко-
неогенез из лактата. Как изменится концентрация глюкозы при добав-
лении в инкубационную смесь высоких концентраций перечисленных
веществ?
••АДФ. А. Увеличится.
2. АТФ. В. Снизится.
102
3. Пируват.
4. АМФ.
5. Авидин (ингибитор
биотиновых ферментов).
6. Малонат.
С. Не изменится.
32. Какие из перечисленных превращений составляют глюко-
зо-лактатный цикл (цикл Кори)? Расположите их в порядке проте-
кания в цикле.
1. Лактат образуется в мышцах при анаэробном гликолизе.
2. Лактат поступает из мышц в кровь и окисляется во всех
тканях до СО? и Н2О.
3. Из мышц лактат поступает в кровь, а затем в печень.
4. Образующийся в сокращающейся мышце лактат активно
превращается этими клетками в глюкозу.
5. В печени лактат превращается в пируват и включается в
глюконеогенез.
6. Продукт глюконеогенеза - глюкоза поступает из печени в
кровь и используется мышцами как источник энергии.
33. Подберите утверждения, характеризующие аэробное окис-
ление лактата и глюконеогенез из лактата в печени.
1.
2.
3.
4.
5.
6.
7.
Скорость уменьшается при снижении в
клетке отношения АТФ/АДФ.
Скорость увеличивается при накоплении
цитрата.
Сопровождается синтезом 18 АТФ.
Требует затраты 6 моль АТФ.
Накопление НАДН ингибирует процесс.
Регуляторный фермент фумараза.
Регуляторный фермент пируваткарбокси-
лаза.
А. Глюконео-
генез из
лактата.
В. Окисление
лактата.
С. Оба про-
цесса.
D. Ни один из
процессов.
34. Рассчитайте:
а) сколько моль макроэргических соединений требуется
для синтеза 1 моль глюкозы из лактата в печени?
б) сколько моль АТФ образуется при ее анаэробном окис-
лении в мышцах?
35. А. Из перечисленных ниже метаболитов составьте схему
синтеза глюкозы из глицерина, учитывая, что после
фосфорилирования и дегидрирования глицерин пре-
вращается в диоксиацетонфосфат.
1. Диоксиацетонфосфат. ”
2. Фруктозо-6-фосфат.
3. Глицероальдегид-3-
фосфат.
4. Глюкозо-6-фосфат.
5. Фруктозо-1,6-
дифосфат.
6. Глюкоза.
Б. Выберите утверждения, характеризующие этот процесс.
1. Протекает главным образом в печени.
2. Является одним из источников для глюкозы в крови в
условиях, когда глюкоза в организм не поступает.
103
3. Регуляторный фермент катализирует реакцию
глюкозо-6-фосфат —> глюкоза + Н3РО4.
4. На синтез 1 моль глюкозы расходуется 8 моль АТФ.
36. А. Выберите, какие из перечисленных веществ могут быть
субстратами для глюконеогенеза.
1. Оксалоацетат.
2. Глицерин.
3. Пируват.
4. Ацетил-КоА.
5. а-кетоглутарат.
6. Сукцинат.
Б. Выберите из предложенных в п. А субстрат, для которо-
го можно составить полную схему глюконеогенеза из
перечисленных ниже метаболитов. Составьте эту схему.
1. Фруктозо-1,6-дифосфат.
2. Глицероальдегид-З-фосфат.
3. Фруктозо-6-фосфат.
4. Диоксиацетонфосфат.
5. Глюкоза.
6. Глюкозо-6-фосфат.
7. а-глицерофосфат.
В. Из написанной схемы выберите и напишите формулами
регуляторную реакцию. Укажите фермент.
37. А. Какие из перечисленных ниже веществ могут снижать
скорость синтеза глюкозы из глицерина?
1. Цитрат.
2. АТФ.
3. Ротенон.
4. АМФ.
5. Амитал натрия.
Б. Укажите механизм действия выбранных факторов.
38. В эксперименте на культуре клеток печени изучали глю-
конеогенез, используя в качестве субстрата глицерин, меченный по
Р-углеродному атому. В каком положении окажется метка в приве-
денных ниже метаболитах? Назовите эти вещества.
А. Б.
Н2С-ОРО3Н2
I
с=о
I
Нгс-он
H^c-OH
I
с=о
I
но—сн
I
нс-он
I
нс-он
I
HjC-OPOiH:
104
39. А. При отщеплении аминогруппы аланин превращается в пи-
руват, который включается в процессе глюконеогенеза.
Составьте схему синтеза глюкозы из аланина, расположив
перечисленные компоненты в необходимой последова-
тельности.
1. Ала.
2. Пируват.
3. Диоксиацетонфосфат.
4. Фруктозо-1,6-дифосфат.
5. Глюкозо-6-фосфат.
6. Фруктозо-6-фосфат.
7. Оксалоацетат.
8. Фосфоенолпируват.
9. Глицеральдегидфосфат.
10. 1,3-диЛосфоглицерат.
11.2-фосфоглицерат.
12. 3-фосфоглицерат.
13. Глюкоза.
Б. Напишите формулами реакцию, протекающую с затра-
той энергии ГТФ, укажите фермент.
40. А. При отщеплении аминогруппы аспарагиновая кислота
превращается в оксалоацетат, который включается в про-
цессе глюконеогенеза. Составьте схему синтеза глюкозы
из аспарагиновой кислоты, расположив в необходимой
последовательности перечисленные компоненты.
1. Глюкозо-6-фосфат. 7. Фруктозо-1,6-дифосфат.
2. Оксалоацетат. 8. Глицеральдегидфосфат
3. Фруктозо-6-фосфат. 9. 3-фосфоглицерат.
4. 2-фосфоглицерат. 10. Диоксиацетонфосфат.
5. 1,3-дифосфоглицерат. 11. Глюкоза.
6. Фосфоенолпируват
Б.
Напишите формулами окислительно-восстановитель-
ную реакцию, укажите фермент.
41. Л. Выберите ферменты, катализирующие регуляторные ре-
акции глюконеогенеза из аспарагиновой кислоты.
1. Фосфофруктокиназа.
2. Пируваткарбоксилаза.
3. Фруктозо- 1,6-дифосфатаза.
4. Альдолаза.
5. Гексокиназа.
6. Фосфатаза глюкозо-6-фосфата.
Б. Из перечисленных веществ выделите а- активаторы,
б- ингибиторы для выбранного в п. А регуляторного фер-
мента.
1. Малонат. 3. АМФ.
2. Цитрат. 4. АТФ.
‘ 42. Выберите утверждения, характеризующие процесс регуля-
ции гликолиза и глюконеогенеза.
1. Процесс активируется при высоком
энергетическом заряде клетки.
2. Скорость процесса увеличивается
при накоплении в клетке цитрата.
3. Скорость процесса уменьшается при
А. Характерно
для гликолиза.
В. Характерно
для глюконео-
генеза.
105
накоплении в клетке ацетил-КоА. С. Характерно
4. Действие регуляторов направлено для обоих про-
на необратимые реакции. цессов.
5. Регуляторный фермент фосфофрук-
токиназа.
6. Регуляторный фермент пируваткар-
боксилаза.
7. Гиповитаминозы могут быть при-
чиной снижения скорости процесса.
43. В эксперименте к клеточному гомогенату печени добавили
авидин (яичный белок), который является сильным специфическим
ингибитором биотиновых ферментов. Какие из перечисленных пре-
вращений будут блокированы?
1. Глюкоза -» пируват. 3. Оксалоацетат -> глюкоза.
2. Пируват —> глюкоза. 4. Пируват —> ацетил-КоА.
44. Гиповитаминоз Bi часто наблюдается у больных алкого-
лизмом и является следствием нарушения питания (основную массу
калорий (50%) они получают при окислении спирта). Симптомами
гиповитаминоза Bi являются расстройства нервной системы, психо-
зы, потеря памяти (синдром Вернике - Корсакова). Почему к дефи-
циту Bi особенно чувствительны клетки нервной ткани?
45. Будет ли протекать глюконеогенез, если в клетке цитрат-
ный цикл и ЦПЭ полностью ингибированы? Ответ поясните.
46. К гомогенату скелетной мышцы лягушки добавили 5
ммоль/л фруктозо-6-фосфата и 10 ммоль/л АТФ. Начавшаяся реак-
ция через некоторое время прекратилась. Почему?
Если в опытную среду внести фруктозо- 1,6-бифосфатазу, то
реакция вновь начнется. Почему?
47. Выберите утверждения, характеризующие биохимические
изменения в организме человека в условиях острой алкогольной ин-
токсикации.
1. Окисление этанола создает избыток НАДН и дефицит
НАД-.
2. Избыток НАДН стимулирует восстановление кетокислот в
оксикислоты и приводит к дефициту кетокислот.
3. Несмотря на избыток “этанольного” ацетил-КоА, снижа-
ется шпенсивность цитратного цикла.
4. Снижается скорость глюконеогенеза в печени.
5. Вследствие своей амфифильности этанол уменьшает вяз-
кость мембран и таким образом нарушает функциониро-
вание мембранных рецепторов.
106
48. Может ли этанол превращаться в организме в гликоген?
Ответ поясните.
49. Какие из следующих утверждений, характеризующих про-
цесс депонирования гликогена, правильны?
1. На присоединение каждого мономера требуется энергия
2 моль макроэргических соединений.
2. Депонируется преимущественно в печени и мышцах.
3. Хранится в клетке в растворимой форме.
4. Увеличивает осмотическое давление в клетке.
5, Высокая степень разветвленности молекулы снижает
скорость ее мобилизации.
6. Изменение концентрации в печени определяется пре-
имущественно ритмом питания.
7. Изменение концентрации в мышцах зависит преимуще-
ственно от режима мышечной работы.
8. Стимулируется глюкагоном.
9. Стимулируется инсулином.
6. УТФ.
7. АТФ.
8. Гликоген.
9. АДФ.
10. Пирофосфат.
50. А. Используя перечисленные метаболиты, составьте схему
процесса превращения глюкозы в печени здорового че-
ловека, скорость которого нарастает через 1 час после
еды, содержащей преимущественно углеводную пищу.
1. Глюкоза.
2. Глюкозе-1-фосфат.
3. Глюкозо-6-фосфат.
4. УДФ-глюкоза.
5. Фруктозо-6-фосфат.
Б. Выберите ферменты, которые катализируют этот про-
цесс и расставьте их в необходимом порядке.
1. УДФ-глюкопирофосфорилаза.
2. Гексокиназа.
3. Глюкозо-6-фосфатаза.
4. Фосфоглюкомутаза.
5. Фосфорилаза активная.
6. Фермент “ветвления”.
7. Гликогенсинтаза.
8. Глюкозо-6-фосфатаза.
9. Протеинкиназа активная.
* 51. А. Из перечисленных ниже метаболитов выберите и со-
ставьте схему процесса, протекающего в печени через
4-5 ч после еды.
1. Глюкозо-6-фосфат. 6. Пирофосфат.
2. Глкжозо-1-фосфат. 7. Глюкоза.
107
3. УДФ-глюкоза. 8. Н3РО4.
4. Гликоген. 9. АТФ.
5. АМФ.
Б. Какой из перечисленных гормонов стимулирует этот
процесс?
1. Инсулин.
2. Адреналин.
3. Глюкагон.
В. Расставьте’перечисленные ниже события в клетке, вы-
званные действием выбранного в п.Б1 гормона в порядке
их протекания.
1. Активная аденилатциклаза катализирует в плазма-
тической мембране образование циклического АМФ
(цАМФ)изАТФ.
2. Активная протеинкиназа фосфорилирует киназу
фосфорилазы и гликогенсинтазу.
3. Гормон связывается с плазматической мембраной
клетки печени и активирует аденилатциклазу.
4. Повышение внутриклеточного содержания цАМФ
активирует протеинкиназу.
5. Фосфорилирование фосфорилазы посредством кина-
зы фосфорилазы “включает” процесс.
52. Выберите утверждения, правильно характеризующие распад
гликогена в печени и мышцах (подберите пары из двух столбцов).
1. Конечный продукт - глюкоза. А. Характерно для про-
2. Конечный продукт поступает в цесса в печени.
В. Характерно для про-
цесса в мышцах.
С. Характерно д ля про-
цессов в печении
мышцах.
D. Не характерно для
этих тканей.
кровь.
3. Конечный продукт используется
как источник энергии.
4. Процесс активируется адренали-
ном.
5. Процесс активируется глюкаго-
ном.
6. Наследственный дефект фосфори-
лазы не приводит к гипогликозе-
МИИ.
53. А. Какой процесс является источником энергии для скелетных
мышц в начальный период их интенсивных сокращений в
условиях, когда физическая работа выполняется через
3-4 ч после обеда? Из представленного ниже перечня вы-
берите метаболиты и составьте схему этого процесса.
1. Пируват. 7.Тлюкозо-6-фосфат.
2. Гликоген. 8. Метаболиты цитратного
3. УДФ-глюкоза. цикла.
4. Глюкоза. 9. Ацетил-КоА.
5. Глюкозо-1 -фосфат. 10. СО?, НзО.
6. Лактат. 11. Метаболиты гликолиза.
Б. Какой из перечисленных гормонов стимулирует этот
процесс?
108
1. Инсулин.
2. Глюкагон.
3. Адреналин.
4. Кортизол.
В. Какие из перечисленных утверждений правильно ха-
рактеризуют выбранный гормон?
1. Взаимодействует с рецепторами клеток.
2. “Включает” внутриклеточный каскад реакций, усили-
вающий действие гормона.
3. Вырабатывается клетками надпочечников.
4. Синтезируется в клетках поджелудочной железы.
54. Выберите утверждения, характеризующие распад гликоге-
на и глюконеогенез в печени.
1. Является источником глюкозы кро- А. Характерно дая
ви. глюконеогенеза.
2. В период между приемами пищи В. Характерно дая
активируется в первую очередь. распада
3. Является источником глюкозы дая гликогена.
мозга при длительном голодании. С. Характерно дая
4. Регуляторный фермент фосфорилаза. обоих процессов.
5. Аллостерическим активатором регу- D. Не характерно
ляторного фермента является цитрат. ни дая одного из
6. Процесс регулируется гормоном. процессов.
7. Образование 1 моль глюкозы сопря-
жено с затратой 6 моль макроэргиче-
ских соединений.
8. Образование 1 моль глюкозы не со-
пряжено с затратой энергии.
55. Энергозатраты парашютиста в обычной обстановке перед
полетом составляют 350 кДж в час. Расход энергии во время полета в
воздухе увеличивается в 2-3 раза. Концентрация глюкозы в крови при
этом не меняется, а потребление кислорода возрастает примерно на
Учитывая эти данные, укажите, какие пути обмена глюкозы, про-
нумерованные на схеме, будут в этих условиях усиливаться: а - в скелет-
ных мышцах, б - в печени.
гликоген
2 Ф 1 Т/0 9
в кровь <— глюкоза <— ’ из крови
4- 3 Т 7 8
пируват > аэробное окисление
Ф4 Т . 6
лактат аминокислоты,
глицерин
56. У больного наблюдалась выраженная гипоглюкоземия на-
тощак. При исследовании биоптата печени оказалось, что синтез
гликогена из глюкозо-6-фосфата в клетках не происходит. Выберите
109
из перечисленных, ниже ферментов те, недостатс ая активность
которых может быть причиной заболевания.
1. фосфорилаза.
2. Фруктозодифосфатаза.
3. Гликогенсинтетаза.
4. УДФ-глюкопирофосфорилаза.
5. Пируваткарбоксилаза.
6. Глюкокиназа.
7. Глюкозо-6-фосфатаза.
8. Фосфоглюкомутаза.
57. На препаратах мышечной ткани изучали влияние адрена-
лина на обмен гликогена у мышей мутантной линии. Обнаружили,
что после внесения адреналина в инкубационную среду, содержа-
щую кусочки мышечной ткани, концентрация цАМФ в клетках по-
вышалась, но фосфорилаза присутствовала только в форме “в”.
А. Дефект каких ферментов в мышцах мышей наиболее
вероятен?
Б. Могут ли эти животные выполнять внезапную интен-
сивную работу, например убегать от опасности?
В. Могут ли эти животные выполнять работу в обычных
условиях?
Ответы поясните.
58. Изучение анаэробного гликолиза на препарате мышечной
ткани показало, что при использовании в качестве субстрата глико-
гена лактат не образуется, тогда как добавление глюкозо-1-фосфата
или глюкозы приводило к нормальному гликолизу с образованием
лактата. Напишите реакцию, нарушение которой было причиной
этих наблюдений, укажите фермент.
59. Исследовали образование лактата в биоптатах мьппп
больного гликогенезом и здоровых людей (контрольные пробы),
используя различные субстраты гликолиза. Рассмотрите полу-
ченные результаты, предположите причину заболевания.
Субстрат гликолиза Концентрация лактата
больной, мкмоль/г контрольная группа, мкмоль/г
Гликоген 9 291
Глюкоз о-1 «фосфат 301 300
Глюкозо-6-фосфат 334 326
Фрухтозо-6-фосфат 273 295
Фруктозо-1,6-дифосфат 276 296
60. А. Выберите, какие реакции протекают в пентозофосфат-
ном цикле превращения глюкозы.
1. Дегидрирование.
по
2. Декарбоксилирование и одновременно дегидрирование.
3. Перенос 2- и 3-углеродных фрагментов с одной молеку-
лы на другую.
4. Карбоксилирование.
5. Образование пентоз из глюкозо-6-фосфата.
6. Взаимопревращение пентоз.
7. Образование глюкозо-6-фосфата из пентоз.
Б. Из перечисленных выше реакций выберите:
а - реакции, протекающие в окислительном пути синте-
за пентоз;
б - реакции, протекающие в неокислительном пути син-
теза пентоз.
1.НАДФН + Н+.
2.Рибозо-5-фосфат.
3. Глидер о а ль дегид-
фосфат.
4. Фруктозо-6-фосфат.
61. Выберите пути использования метаболитов пентозофос-
фатного цикла превращений глюкозы.
А. Синтез нуклеотидов.
В. Восстановительные реакции при
синтезе жирных кислот.
С. Реакции гидроксилирования.
D. Аэробный и анаэробный глико-
лиз.
62. Выберите утверждения, правильно характеризующие пен-
тозофосфатный цикл превращений глюкозы.
I. Активно протекает в жировой ткани.
2. Включает совместное протекание окислительного пути
синтеза пентоз и пути возвращения пентоз в гексозы.
3. Промежуточные продукты могут включаться в аэроб-
ный и анаэробный гликолиз.
4. Протекают реакции, сопряженные с ЦПЭ.
5. Образуются восстановленные коферменты, водород ко-
торых используется для восстановительных синтезов.
6. Образуются пентозы, используемые для синтеза нуклео-
тидов.
63. Выберите определения, характеризующие свойства восста-
новленных коферментов НАД* и НАДФ*.
1. Является коферментом дегидро- А. Характерно для
геназ. НАДН.
2. Служит донором водорода для
ЦПЭ.
3. Используется в реакции:
рибозо-5-фосфат -> рибулозо-5-
фосфат.
4. Образуется в окислительной
части пентозофосфатного цик-
В. Характерно для
НАДФН.
С. Характерно для
обоих.
D. Не характерно
для этих кофер-
ментов.
ш
ла превращений глюкозы.
5. Образуется в гликолизе.
6. Образуется в световой части
фотосинтеза.
7. Используется в реакциях гид-
рирования при синтезе липи-
дов.
64. В эксперименте на клетках жировой ткани изучали превра-
щение глюкозы в пентозы окислительным путем. В качестве субстрата
использовали глюкозу с радиоактивной меткой по *С. Выберите и рас-
положите в необходимой последовательности метаболиты окислитель-
ного пути синтеза пентоз; отметьте метаболиты, несущие метку.
1. Глюкоза. 2. Рибозо-5-фосфат. 3. Глюкозо-6-фосфат. 4. Рибулозо-5-фосфат. 5. Фруктозо-6-фосфат. 6. 6-фосфоглюконолактон. 7. 6-фосфоглюконат. 8. СОз. 9. НАДФ+. 10. НАДФ + Н+.
65. В эксперименте на гомогенатах скелетной мышцы и печени
изучали превращение глюкозы в рибозо-5-фосфат окислительным
путем. В качестве субстрата использовали глюкозу с радиоактивной
меткой по >С.
А. Будет ли метка обнаруживаться в пентозе?
Б. В опыте с гомогенатом печени или мышцы скорость
включения метки будет выше?
66. В эксперименте к раствору, содержащему сахарозу, лакто-
зу и крахмал, добавили сок поджелудочной железы здорового чело-
века и больного, перенесшего тяжелую форму панкреатита. Обе
пробы инкубировали одинаковое время при оптимальных условиях.
А. Напишите реакцию, происходящую в данном опыте,
укажите фермент.
Б. Определите, в каком из опытов содержание продуктов
переваривания будет выше и почему?
67. Какие изменения в метаболизме углеводов характерны ДЛЯ
перечисленных состояний организма человека?
1. Через 1-2 ч после приема
пищи в состоянии покоя.
2. Состояние во время бега
спринтера на дистанции
200 м.
3. Голодание в течение двух
суток.
4. Физическая работа в тече-
112
А. В печени усиливается распад глико-
гена.
В. В печени усиливается синтез глико-
гена.
С. В мышцах преобладает анаэробный
распад глюкозы.
D. В мышцах усиливается аэробный
распад глюкозы.
ние трех часов после обеда.
5. Утром натощак (постаб-
сорбтивное состояние).
6. Острое алкогольное от-
равление.
Е. В печени усиливается глюконеоге-
нез из лактата.
Е В печени снижается скорость глю-
конеогенеза.
G. В печени усиливается глюконеоге-
нез из глицерина и аминокислот.
68. Если препарат скелетной мышцы обработан смесью йодаце-
тата (ингибитор дегидрогеназы глицеральдегидфосфата), то мышца
теряет способность сокращаться в ответ на электростимуляцию. Если
препарат скелетной мышцы обработан ротеноном (ингибитор НАДН-
дегидрогеназы), то способность к сокращению сохраняется.
А. Объясните результаты опытов.
К Напишите схему процесса, который служит источником
энергии для сокращения мышцы во втором опыте.
В. Напишите реакцию образования конечного продукта.
Укажите фермент и кофермент.
69. При изучении анаэробного гликолиза в опыте инкубировали:
1 ммоль глицеральдегидфосфата,
5 ммоль неорганического фосфата,
0,01 ммоль НАД+
и глицерофосфатдегидрогеназу.
Реакция началась, но очень быстро достигла состояния равнове-
сия.
А. Напишите реакцию, которая начинается после смеши-
вания этих компонентов. Отметьте обратимость реак-
ции. Под стрелками поставьте исходную концентрацию
веществ. Объясните, почему реакция переходит в равно-
весное состояние?
Б. Изменится ли равновесие этой реакции, если в инкуба-
ционную смесь добавить 5 ммоль пирувата и лактатде-
гидрогеназу? Ответ аргументируйте. Напишите проте-
кающую в данном опыте реакцию.
70. У человека в первые минуты при выполнении интенсивной
физической нагрузки сердечно-сосудистая и дыхательная системы не
Удовлетворяют резко возросшую потребность мышц в кислороде, но
Уже через 3-5 мин объем доставляемого в мышцы с кровью кислоро-
да увеличивается приблизительно в 20 раз. Напишите схему процес-
са обмена глюкозы, обеспечивающего энергией основное время ра-
боты мышц бегуна на дистанции 5 км.
А. Напишите суммарное уравнение процесса.
Б. Из специфического пути катаболизма глюкозы выпи-
шите реакцию, в которой восстанавливается НАД и
укажите механизм переноса водорода в ЦПЭ.
8 Сборник тестов и задач по биохимии 1 i 3
71. А. Каким превращениям подвергается лактат в печени в
период восстановления после интенсивной мышечной
работы?
Б. Напишите схемы этих процессов. В схеме укажите реак-
ции, протекающие с затратой или синтезом АТФ, энер-
гетический эффект этих процессов.
72. Сколько моль лактата необходимо окислить в печени до
СО2 и Н2О для того, чтобы обеспечить энергией синтез 2 моль глю-
козы из лактата?
А. Напишите суммарное уравнение синтеза глюкозы из
лактата.
Б. Окисление лактата проиллюстрируйте схемой. В схеме
укажите:
а) реакции, связанные с синтезом АТФ;
б) реакции окисления свяжите с ЦПЭ и покажите путь
водорода от окисляемого субстрата к кислороду, от-
метьте точки сопряжения в ЦПЭ с синтезом АТФ.
73. В больницу доставлен человек без сознания с признаками
алкогольного отравления. При лабораторном исследовании крови
получены следующие данные:
алкоголь - 320 мг/дл, концентрация в норме - 5 мг/дл;
глюкоза - 50 мг/дл, концентрация в норме - 60-100 мг/дл;
лактат - 28 мг/дл, концентрация в норме - 13 мг/дл.
Приведите возможные причины изменения концентрации глюкозы и
лактата в крови при остром алкогольном отравлении.
74. Человек совершает срочную физическую работу
(например, убегает от опасности) через 30 мин после обеда, состоя-
щего преимущественно из углеводной пищи.
А. Какой процесс протекает в этой ситуации в скелетных
мышцах? Синтез гликогена или его распад? Ответ аргу-
ментируйте и напишите схему этого процесса.
Б. Укажите физиологическое значение процесса.
В. Какой гормон стимулирует этот процесс? Проиллюст-
рируйте в схеме механизм действия этого гормона.
75. В эксперименте на гомогенатах разных тканей изучали
процесс распада глюкозы до ацетил-КоА и путь превращения глю-
козы в рибозо-5-фосфат. Опыт ставили следующим образом: одну
пробу гомогената скелетной мышцы инкубировали с глюкозой, ме-
ченной по ’С, другую - с глюкозой, меченной по 3С. В пробах созда-
вали все необходимые условия для протекания обоих изучаемых
процессов. Определяли радиоактивность СО2.
114
А. Будет ли обнаруживаться радиоактивность СО? в этих
пробах? Ответ поясните.
К Будет ли обнаруживаться радиоактивность СО2, если в
опыте использовать гомогенат жировой ткани? Условия
постановки опыта те же.
76. Какие пути обмена глюкозы в печени, пронумерованные
на схеме, преобладают:
а) через 1 ч после приема пищи, содержащей 200 г углеводов;
б) при голодании через 48 ч;
в) через 10 мин после выполнения интенсивной физической
работы?
гликоген
2 I 1 9 8
в кровь <------- глюкоза <---------- из крови воротной
I 3 Т 7 вены
пируват
/Л\(
? ? ?
В схему впишите вещества, которые могут быть источниками
пирувата при глюконеогенезе.
77. Укажите, какие процессы обмена глюкозы, указанные на
схеме, будут преобладать в скелетных мышцах:
гликоген
2 I 1 Ф 7 8
в кровь<--------- глюкозам------------ из крови
4г 3 9
пируват ---------> аэробное окисление
4" 4 15
лактат
I/O
в кровь
а) в состоянии покоя через 1-2 ч после еды,
б) при выполнении 20-минутной интенсивной физической
работы сразу после еды.
78. Известны заболевания, связанные с разного рода дефекта-
ми фосфофруктокиназы печени.
1. Дефект аллостерического центра, приводящий к нару-
шению взаимодействия его с цитратом; вследствие это-
го снижается тормозящее действие цитрата на актив-
ность фермента.
115
2. Дефект каталитического центра и вследствие этого
снижение активности фермента.
В каком их этих случаев будет наблюдаться накопление гли-
когена?
Эталоны ответов к разделу V
“ОБМЕН И
ФУНКЦИИ УГЛЕВОДОВ”
1. А.
2.
А. 1 - С; 2 - А; 3 - D; 4 - В; 5 - F; 6 - Е.
Б. 1 - Е; 2 - F; 3 - А, В, С, D;4-F.
3. 1 - Е; 2 - С; 3 - В; 4 - F; 5 - А; 6 - G; 7 - D.
4.
А. 1 - амилаза. 2 - амилаза. 3 - сахараза, лактаза, мальтаза,
изомальтаза.
Б. Гидролазы.
5. 2.
6. 1,3, 4.
7.
амилаза амилаза
А. Крахмал ------> декстрины-----> мальтоза + изомаль-
тоза.
Б. Проба с йодом, проба Троммера.
сахараза
8. Сахароза--------> глюкоза + фруктоза,
лактаза
Лактоза * галактоза + глюкоза.
9.
А. Лактаза.
Б. Лактоза----------> галактоза + глюкоза.
Иб
10. Вероятно, у ребенка недостаточность активности лактазы,
поэтому лактоза не расщепляется в кишечнике с образованием глю-
козы и галактозы.
11. А.
12. 1,2, 3,4,6.
13.
а) 3 - фруктозе-1,6-дифосфат; 4 - диоксиацетонфосфат;
6 - 1,3-дифосфоглицерат; 7 - 3-фосфоглицерат; 9 - фос-
фоенолпируват.
б) 1-10.
в) 1-11.
г) 1. 3.10.
14.
а - б, 11.
СН3 -СО - СООН + НАДН + Н %-* СН3 -СНОН -СООН + НАД*.
Лакгатдегидрогеназа, НАД.
б - 7,10.
О=С-О~РОзН2
НС-ОН + АДФ
I
НзС -ОРО3Н2
о=с-он
I
НС-ОН + АТФ.
I
H2C-O-PO3H,
Фосфоглицераткиназа.
15.
А. 6. 7, 10.
Б.
О=с—Н 0=С-0~РОзН2
I + 1
НС-ОН + НАД + Н3РО4—► НС-ОН
I I
Н2С-ОР03Н2 Н2С-ОР03Н2
НАДН + Н*.
16. 1 - В; 2 - А, Е; 3 - F; 4 - А, Е; 5 - F; 6 - А, С; 7 - F; 8 - С;
9 - В, D.
А. 2 моль пирувата; 8 моль АТФ.
Б. 2 моль АТФ.
8»
117
18.
A. 1 моль O2; 10 моль АТФ.
Б. 4 моль АТФ.
19. 1 - В; 2 - D; 3 - В, С; 4 - А; 5 - А; 6 - D.
20.
А. 1 - Ci; 2 - Сз; 3 - Сз.
Б. 1 - фруктозо-1,6-дифосфат; 2 - диоксиацетонфосфат; 3
1,3-дифосфоглицерат.
21.
А. 5 -> 7 -> 3 -» 6 2 -> 4 8 1 -> 9 11 -► 10.
12
Б.
СН3 - СО - СООН + НАДН + H+w=* СНз -СНОН - СООН + НАД+.
Лактатдегидрогеназа.
В. 1, 2, 4.
22.
’/1. 3-»20->Я->7-> 11 -> 1 -> 9 -» 2.
72
Б.
О=с-Н О=С-О~РО3Н2
НС-ОН + НАД* + НзРО4—> НС-ОН + НАДН + Н+ .
I I
HjC - ОРО3Н2 Н2С - ОРО3Н2
В. 3, 4.
23. 1 - С; 2 - В; 3 - А; 4 - В; 5 - С; 6 - В; 7 - С.
24. 1 - А; 2-В; 3-С; 4-В; 5-В.
1 - гексокиназа; 2 - фосфофруктокиназа; 3 - пируваткиназа.
25. Фосфофруктокиназа.
26. 1 - А; 2 - В; 3 - В; 4 - В; 5 - В; 6 - С.
27. 4,5.
28.1,2,4,5.
118
29.
A. 1-+11-+6-+2-+1013-+5-+7-*4-ь 12-+9-+3.
ft t 7
АТФ ГТФ АТФ 8
Б.
COOH COOH
I пирувагкарбо- [
C=O + CO2 + АТФ+ H2O-----► C=O + АДФ * H3PO4
I ксилаза I
CH1 CH2
I
COOH
CH-OPOjHj
фруктозо-1,6-
+ HjO---------------►
-дафосфатаза
CH/JPOjH?
L/Xchtoh
\ он/ +
OH
НзРО4
30. 2, 4, 5.
31. 1-В; 2-A; 3- A; 4-В; 5-В; 6-C.
32. 1, 3, 5, 6.
33. 1 - A; 2 - A; 3 - В; 4 - A; 5 - В; 6 - D; 7 - A.
a - 4 моль АТФ, 2 моль ГТФ.
б - 2 моль АТФ.
35.
А. 3 -> 5-+2 4->6.
Г />
1
Б. 1, 2.
Л. 1,2, 3,5,6.
Б. Глицерин ->7->4->7-> 3 ->6-^5.
2^
В.
СН2ОЮ3Н2
Kz^X.CH-iOPOiHi фр»ктозо*1,б*
\ ojjl ' ’’ + Н2°~ГТ—•
у иОН дифосфатам
ОН
СН2ОГО3Н2
Lo. CHjOH
\ НС/ г + Из1”0-»
U 1/ОН
он
119
37.
A. 1,3, 4, 5.
Б. АМФ, цитрат - аллостерические ингибиторы фруктозо-
1,6-бифосфатазы; ротенон, амитал натрия - ингибиторы
ферментов ЦПЭ, сопряженной с реакцией дегидрирова-
ния а-глицерофосфата.
38.
A. С2, диоксиацетонфосфат.
Б. С2, Сз, фруктозо-6-фосфат.
39.
А. ] 2-> 7 8 1]-> 12 10 9-> 4 6 5-^ 13.
I/1
3
Б.
соон соон
I I
С=О, + ГТФ ------► с—ОРО3Н2 + СО2 + ГДФ.
СН2 СН2
соон
Карбоксикиназа фосфоенолпирувата
О=С-О-РОзН2 о=с-он
1 . + I +
HC-OH + НАДН+Н_________► НС- ОН +H3PO4+ НАД .
Н2С -О - РО3Н2 НгС- о - РО3Н2
Дегидрогеназа глицероальдегидфосфата.
41.
А. 3.
Б. а - 2, 4; б - 3.
42. 1 - В; 2-В; 3-А; 4-С; 5-А; 6-В; 7-С.
43. 2.
120
44. Нарушается аэробный распад глюкозы - основной источ-
ник энергии для нервной ткани.
45. Нет, так как ингибирован синтез АТФ.
46. Реакция прекратится после того, как израсходуется фрук-
тозо-6-фосфат. Затем вновь начнется, так как одновременно будут
протекать две реакции, приводящие к образованию субстрата реак-
ции и расходованию оставшейся АТФ.
АТФ А АДФ
фруктозо-6-фосфат v фрукгозо-1,6-бифосфат
НзРО4
47.1,2,3,4,5.
48. Нет, так как этанол превращается в ацетил-КоА, а реак-
ция пируват -» ацетил-КоА необратима.
49. 1, 2, 6, 7, 9.
50.
АТ\^Г\4^'
7 9 6 10
Б. 2, 4, 1, 7, 6.
51.
Л. 4 —> 2 —> 1 —> 7.
t ' Ф
8 8
Б. 3.
В. 3 ->!-► 4->2->5.
52.1 - А; 2 - А; 3 - С; 4 - С; 5 - А; 6 - В.
Л.2 -> 5-» 7-> 11-> 6.
Б. 3.
В. 1, 2, 3.
54.1 - С; 2 - В; 3 - А; 4 - В; 5 - А; 6 - С; 7 - А; 8 - В.
55. а-1,3, 8, 9; б - 1,2.
121
56. 3, 4, 8.
А. Протеинкиназы, киназы фосфорилазы.
Б. Нет, так как отсутствует фосфорилаза “а”.
В. Да, так как фосфорилаза “Ь” активируется в при-
сутствии АМФ.
НзРО4
58. Гликоген--------> глюкозо-1-фосфат. Фосфорилаза.
59. Недостаточная активность гликогенфосфорилазы.
А. 1,2, 3,5, 6, 7.
Б. а - 1.2, 5, 6; б - 3, 5. 6.
61. 1 - А, В, С; 2 - А; 3 - D; 4 - D.
62. 1, 2, 3, 5, 6.
63. 1 - С; 2 - А; 3 - D; 4 - В; 5 - А; 6 - В; 7 - В.
9 10 9 10
А. Нет. Радиоактивная метка будет обнаруживаться в
СО2.
Б. В опыте с клетками печени.
А. Крахмал -> декстрины -> мальтоза + изомальтоза
(амилаза).
Б. В первом опыте. При тяжелых формах панкреатита
возможно повреждение секретирующих клеток, умень-
шение секреции панкреатического сока и снижение ко-
личества амилазы.
67. 1 - В; 2 - А, С, Е; 3 - G; 4 - A, D; 5 - G; 6 - F.
68.
А. Обработка йодацетатом ингибирует аэробный и ана-
эробный гликолиз в мышцах. При обработке ротеноном
122
возможность анаэробного гликолиза сохраняется, он и
служит источником энергии дои сокращения мышцы в
ответ на электростимуляцию.
Б. Схема анаэробного гликолиза.
В. Пируват + НАДН + Н+ < лактат + НАД+
(лактатдегидрогеназа, НАД+).
69.
А. Глицеральдегидфосфат + НАД+ + Н3РО4 21
1 мМ 0,01 мМ 5,0 мМ
< > 1,3-дифосфоглицерат + НАДН + Н+.
Равновесное состояние достигается тогда, когда 0,01 ммоль
НАД прореагирует с 0,01 ммоль глицеральдегидфосфата.
Б. Изменится, так как в опыте будет протекать реакция,
приводящая к регенерации НАД+ из НАДН:
пируват + НАДН + Н+ < * лактат + НАД*.
70. Схема аэробного распада глюкозы.
Л. Глюкоза + 6O2 -> 6СО2 + 6Н2О + энергия (36-38 моль
АТФ).
Б. Глицероальдегид-З-фосфат + НАД* + Н3РО4 <--*
< > 1,3-бифосфоглицерат + НАДН + Н*.
Челночный механизм транспорта водорода из цито-
плазмы в митохондрии.
71.
А. Окисление лактата до СОг и Н2О или глюконеогенез из
лактата.
Б. Схемы этих процессов; 18 моль АТФ синтезируется при
окислении 1 моль лактата до СОг и НгО. 6 АТФ требу-
ется для синтеза 1 моль глюкозы из лактата.
^2. Для синтеза 2 моль глюкозы необходимо 12 моль АТФ
АТл + &АТФ), 1 моль лактата окисляется с образованием 18 моль
‘Ф- Таким образом, необходимо окислить 0,7 моль лактата.
А. 2 лактат + 6 АТФ + 6 Н2О -> глюкоза + 6 АДФ +
+ 6 НзРО4.
Д'. СО2
а’Яактат>—пируват ХЦ ацетил-КоА ->цитратный -> СО2 + НгО
I \ ( \ 00101
^МНАДН+Н* НАД НАДН+Н* (12 АТФ)
(ЗАТФ) (ЗАТФ)
123
НАДН-дегидрогеназа рНг-дегидро-
б. S + НАД+ -> НАДН + Н+-------------------> QH2 -------------->
ФМН (e-ci)
геназа цитохромоксидаза
------> с ------------------> 1/2 02 -> НгО.
(а-аз)
73. Метаболизм спирта приводит к повышению соотношения
НАДН/НАД+, следовательно, к повышению образования лактата из
пирувата, снижению скорости глюконеогенеза и снижению содер-
жания глюкозы в крови.
74.
А. Схема распада гликогена.
Б. Служит источником глюкозы.
В. Адреналин, схема каскадного механизма действия гор-
мона.
75.
А. Радиоактивность в СОг будет обнаруживаться во вто-
рой пробе, так как 3С глюкозы в процессе распада пре-
вращается в ‘С диоксиацетонфосфат, затем в карбок-
сильную группу пирувата, которая при последующем
декарбоксилировании превращается в СОг. В первой
. пробе 'С глюкозы в процессе распада до ацетил-КоА в
СО2 не превращается, а пентозофосфатный путь пре-
вращения глюкозы, при котором происходит декарбок-
силирование по 1С, для скелетных мышц нехарактерен. ~
Б. Радиоактивность в СОг будет обнаруживаться в первой
и второй пробах. В первой пробе СО2 образуется при
декарбоксилировании 6-фосфоглюконата по С, во вто-
рой - при декарбоксилировании по 3С пирувата.
76. 4 - лактат; 5 - глицерин; 6 - аминокислоты,
а - 8, 9; б - 5, 6, 7, 2; в -1, 2, 4, 7.
77. а - 8, 7; б -1, 3, 4, 9, 10.
78. Во втором случае.
ОБМЕН
И
ФУНКЦИИ ЛИПИДОВ
А.Жиры.
В. Фосфолипиды.
С. Производные холестери-
на.
D. Производные арахидоно-
вой кислоты.
1. К какой группе липидов и их производных относятся пере-
численные соединения?
1. Лецитин.
2. Фосфатидилинозитол.
3. Триацилглицерины.
4. Простагландины.
5. Сфингомиелин.
6. Витамин Дз.
7. Таурохолевая кислота.
2. Укажите продукты, образующиеся при гидролизе перечис-
ленных липидов.
1. Лецитин
(фосфатидилхолин).
2. Сфингомиелин.
3. Жиры.
4. Воска.
5. Цереброзиды.
А. Глицерин + жирные кислоты.
В. Высокомолекулярный спирт +
жирная кислота.
С. Сфингозин + жирная кислота +
простой сахар.
D. Сфингозин + жирная кислота +
+ Н3РО4 + холин.
Е. Глицерин + жирная кислота +
+ Н3РО4 + холин.
3. Напишите по одной формуле триацилглицеринов, харак-
терных для:
а) твердого животного жира,
б) растительного масла.
4. Выберите, какие из перечисленных жирных кислот в при-
родных (нейтральных) жирах и фосфолипидах располагаются пре-
имущественно у а-углеродного атома глицерина, какие - у 0-атома
тяицерофосфолипидов человека (ответ: а-..., 0-...).
А. 1. Пальмитиновая. 4. Стеариновая.
2. Арахидоновая. 5. Линолевая.
3. Миристиновая.
Б. Какая из перечисленных Ж1фных кислот является непо-
средственным предшественником в биосинтезе проста-
гландинов?
125
5. Напишите структурную формулу фосфатидилхолина.
А. Какой суммарный заряд имеет эта молекула при pH = 7?
Б. Обведите ту часть, которая в мембране может взаимо-
действовать с периферическими белками.
В. За счет каких сил происходит это взаимодействие?
6. Важнейшим компонентом сурфактанта - липопротеина, вы-
стилающего альвеолы и необходимого для нормальной работы лег-
ких, является дипальмитоилфосфатидилхолин.
А. Напишите его структурную формулу.
Б. Фосфатидилхолины, входящие в состав цитоплазматиче-
ских мембран клеток, отличаются по составу жирных
кислот от этого фосфатидилхолина. Укажите, в чем со-
стоит это отличие.
- 7. Подберите к каждому типу липидов и их производных со-
ответствующую функцию.
1. Триацилглицерины. А. Источники энергии, структурные
2. Жирные кислоты.
3. Сфингомиелины.
4. Простагландины.
5. Таурохолевая
кислота.
6. Витамин Е.
7. Витамин К.
компоненты других липидов.
В. Запасная форма источника энергии.
С. Структурный компонент мембран.
D. Регуляторы тонуса гладкой муску-
латуры.
Е. Антигеморрэтический фактор.
F. Эмульгатор.
G. Антиоксидант.
5. Пальмитиновая кислота.
6. Олеиновая кислота.
7. Витамин А.
8. Какие из перечисленных липидов являются незаменимыми
факторами питания?
1. Холестерин.
2. Сфингомиелины.
3 Витамин Д.
4. Линолевая кислота.
9. Методом газожидкостной хроматографии изучен состав
жирных кислот подкожного жира человека и подкожного жира ба-
рана. Какой из вариантов соответствует жиру человека?
А. С 16:0 - 20%, Б. Сию - 35%,
Сию-5%, Сию-20%,
018:1 - 55%, 018:1 - 35%,
С18:2-10%. С18:2 - 3%. .
10. Напишите структурные формулы холевой кислоты и <»
производных - парных желчных кислот. Общепите части Молекул,
сообщающие им амфифильные свойства: сплошной пинией - гиДР0"
фобные, пунктирной линией - гидрофильные.
126
11. Выберите положения, правильно характеризующие функ-
ции желчи.
1. Эмульгирует жиры.
2. Активирует липазу.
3. Способствует всасыванию моноацилглицеринов.
4. Гидролизует жиры.
5. Способствует всасыванию холестерина.
6. Способствует всасыванию витамина Д.
7. Способствует всасыванию витамина К.
12. А. Напишите реакции, происходящие при переваривании
пальмитоолеилстеароилглицерина. Над стрелкой ука-
жите название фермента, катализирующего эту реак-
цию, его класс, факторы, необходимые для нормально-
го протекания этой реакции в кишечнике.
Б. Какое вещество создает оптимум pH для этого фермен-
та? Где оно образуется?
В. Какие продукты переваривания жиров будут преобла-
дать?
13. Выберите из перечисленных веществ компоненты, участ-
вующие в переваривании жиров.
1. ЛП-липаза.
2. Панкреатическая липаза.
3. НСО3‘.
4. Таурохолевая и гликохолевая кислоты.
5. Холевая и хенодезоксихолевая кислоты.
14. Один из продуктов переваривания жиров существенно ус-
коряет этот процесс.
А. Какой это продукт?
Б. Почему он ускоряет переваривание жиров?
15. Какие особенности функций И обмена жиров связаны с
гиДрофобностью их молекул?
I. Транспорт кровью и лимфой в составе липопротеинов.
2. Всасывание в составе мицелл.
3. Участие эмульгаторов в переваривании.
4. Являются более компактной по сравнению с гликогеном
формой запасания энергетического материала.
5. Нормальное переваривание и всасывание жиров необ-
ходимо для Поступления в организм витаминов РР, Вб.
6. Нормальное переваривание и всасывание жиров необ-
ходимо для поступления в организм витаминов А, Д, Е,
К.
127
16. Какие последствия может иметь нарушение всасывания
жиров?
1. Стеаторрея.
2. Гиповитаминоз Д.
3. Гиповитаминоз К.
4. Ухудшение зрения в темноте (куриная слепота).
5. Гиповитаминоз РР.
6. Нарушение синтеза насыщенных жирных кислот.
7. Уменьшение содержания арахидоновой кислоты в тка-
нях.
17. Из перечисленных ниже веществ выберите те, которые
входят в состав мицелл, всасывающихся в тонком кишечнике.
1. Триацилглицерины.
2. Моноацилглицерины.
3. Жирные кислоты.
4. Эфиры холестерина.
5. Холестерин.
6. Таурохолевая кислота.
7. Гликохолевая кислота.
18. У человека, длительно не употреблявшего в пищу жиров,
но получавшего достаточное количество углеводов и белков, обна-
ружены дерматит, плохое заживление ран, ухудшение зрения, сни-
жена половая функция. При назначении терапевтической диезы,
содержащей рыбий жир, симптомы исчезли. Выберите возможные
причины нарушения обмена.
1. Недостаток пальмитиновой кислоты.
2. Недостаток олеиновой кислоты.
3. Недостаток линолевой кислоты.
4. Недостаточное поступление витаминов А, Д, Е, К.
5. Недостаточное поступление витаминов Н, РР.
6. Низкая калорийность диеты.
19. Предшественником простагландинов является арахидоно-
вая кислота, которая отщепляется от фосфолипидов под действием
фосфолипазы Аг.
А. Напишите эту реакцию, используя в качестве субстрата
фосфатидилхолин.
Б. Этот фермент имеется в клетках различных тканей, уча-
ствует в метаболизме фосфолипидов и арахидоновой
кислоты, гидролизует пищевые жиры. Где синтезирует-
ся фосфолипаза Аг, участвующая в переваривании пи-
щевых фосфолипидов?
20. А. Яд некоторых змей содержит фосфолипазу Аг. Если к
цельной крови добавить небольшое количество яда, то
быстро наступает гемолиз. Напишите реакцию, кото-
рая будет происходить под действием этого фермента -
компонента яда. Объясните причину гемолиза в ДОЯ'
ном случае.
Б. Будет ли изменяться структура сфингомиелина под дей-
ствием этого фермента? Ответ поясните.
128
21. После приема жирной пищи сыворотка крови становится
мутной, но вскоре опять возвращается к исходному состоянию.
А. Почему сыворотка крови становится мутной?
Б. Под действием какого фермента происходит “просвет-
ление” сыворотки крови?
В. Напишите реакцию, которую катализирует этот фер-
мент.
Б Нарисуйте график изменения концентрации триацил-
глицеринов в сыворотке крови после приема жирной
пищи в норме.
22. У пациента натощак была исследована сыворотка крови.
Сыворотка имела молочный цвет, на ее поверхности при помещении
на холод всплывали белые жирные хлопья. Содержание триацил-
глицеринов составило 8 ммоль/л. Укажите возможные причины за-
болевания, признаки которого описаны.
1. Недостаточная активность ЛП-липазы.
2. Недостаточная активность панкреатической липазы.
3. Дефект аполипопротеинов в составе хиломикронов.
4. Дефект аполипопротеинов в составе ЛВП.
5. Недостаточное поступление витаминов А, Д, Е, К.
23. А. Напишите реакции, происходящие с р-моноацилглице-
рином в клетках слизистой тонкого кишечника во вре-
мя пищеварения.
Б. Какова дальнейшая судьба продукта этих реакций?
24. А. Укажите правильную последовательность перечислен-
ных ниже этапов ассимиляции пищевых жиров в орга-
низме человека (поставьте цифры в соответствующем
порядке).
1. Образование хиломикронов.
2. Ресинтез ТАГ.
3. Транспорт кровью.
4. Всасывание.
5. Эмульгирование.
6. Гидролиз жира с образованием преимущественно р-
моноацилглицеринов и жирных кислот.
7. Гидролиз жиров с образованием глицерина и жирных
кислот.
8. Образование смешанных мицелл.
9. Включение жирных кислот в метаболизм клеток пе-
риферических тканей.
Б. Для каких стадий необходимы ферменты, обозначенные
ниже буквами (составьте соответствующие пары)?
а) ЛП-липаза;
б) панкреатическая липаза;
в) ацил-КоА-синтетаза.
9 Сборник тестов и задач по биохимии
129
25. Сравните свойства следующих ферментов, подобрав к ка-
ждой цифре букву.
1. Субстрат фермента находится в со-
ставе липопротеинов.
2. Субстрат фермента находится в ви-
де эмульсии.
А. Панкреатиче-
ская липаза.
В. ЛП-липаза.
С. ТАГ-липаза.
3. Фермент активируется гепарином.
4. Фермент активируется в результате
действия глюкагона на клетки.
5. Продукты реакции - глицерин и
жирные кислоты.
26. Выберите из перечисленных веществ те, которые являются
промежуточными в основном пути синтеза жира (и его составных
частей):
а) в слизистой тонкого кишечника;
б) в печени;
1. Диацилглицерины. 5. Фосфатидная кислота.
2. Моноацилглицерины. 6. Диоксиацетонфосфат.
3. Ацил-КоА. 7.Лизофосфатидная кислота.
4. Глицерофосфат.
27. В эксперименте лабораторным животным (крысам) дали с
пищей около 30 г триацилглицеринов следующего состава:
Н2С-О-СО-С17Н35
НС-О-СО-С17Н35
Н2С-О-СО-С17Н35
Будет ли депонированный жир отличаться от пищевого? Почему?
28. Для каждого типа липопротеинов подберите соответст-
вующий состав.
1. ЛВП. д. и 9Q% триацилглицеринов и 2%
2. Хиломикроны. белков.
а пгшгт В.« 50 % эфиров холестерина и
4. ЛОНП. холестерина.
С.« 50% белков и 20% эфиров хо-
лестерина и холестерина.
D.« 10% белков и 50 - 55% триа-
цилглидер инов.
29. Выберите основные причины нарушения переваривания и
всасывания жира.
1. Нарушение синтеза панкреатической липазы.
1»
3. Нарушение поступления желчи в кишечник.
4. Затруднение поступления панкреатического сока в ки-
шечник.
5. Недостаточная секреция НСОу.
6. Недостаточная секреция НС1.
30. Укажите, какие из представленных ниже липидограмм со-
ответствуют следующим состояниям (подберите пары)?
1. Утром натощак до завтрака в норме.
2. Через 3 ч после еды нормальной калорийности.
3. Через 14-16 ч после еды у больного с содержанием в
крови патологического компонента - флотирующих ли-
попротеинов.
31. Пациенты А и В, находящиеся на нормальном сбаланси-
рованном питании, во время последнего приема пищи получили:
А В
углеводов 200 г 200 г
жиров - 40 г
белков 50 г 50 г
Какие из указанных липидограмм, полученных методом гель-
электрофореза через 3-4 ч после еды, соответствуют состоянию па-
циентов А и В?
32. Укажите место образования липопротеинов в организме
человека.
1. ЛНП. А. Кровь.
131
2. ЛОНП. В. Просвет кишечника.
3. Хиломикроны. С. Слизистая тонкого
4. Альбумин-НЭЖК кишечника.
5. ЛВП-предшественники. D. Печень.
33- А. Используя цифровые обозначения перечисленных ве-
ществ, расположите их в той последовательности, в
• которой они образуются при распаде жирных кислот.
Схема должна начинаться с жирной кислоты, посту-
пившей из крови в цитоплазму клетки (например: 2
-> 3 ...). Над стрелками укажите названия соответ-
ствующих ферментов.
1. 0-кетоацил-КоА. 5. Ацил (Сп)-КоА.
2. Ацилкарнитин. 6. р-гидроксиацил-КоА.
3. Жирная кислота. 7.. Ацил-КоА (Сп-2) + ацетил-
КоА.
4. Еноил-КоА.
Б. Напишите реакцию, катализируемую регуляторным
ферментом этого процесса.
34. А. Подберите к предложенным ниже схемам реакций ₽-
окисления жирных кислот соответствующие ферменты.
1. Ацил-КоА + карнитин —> ацил-карнитин + HS Ко А.
2. Ацил-КоА -> еноил-КоА.
3. р-кетоацил-КоА -> ацетил-КоА + ацил-КоА.
(с=п) (с=п-2)
4. p-гидроксиацил-КоА -> Р-кетоацил-КоА.
5. Еноил-КоА -> Р-гидроксиацил-КоА.
А. Ацил-КоА-дегидрогеназа.
В. Карнитин-ацилтрансфераза.
С. Тиолаза (Р-кетотиолаза).
D. Кротоназа (еноил-КоА-гидратаза).
Е. Р-гидроксиацил-КоА-дегидрогеназа.
Б. Укажите коферменты перечисленных выше ферментов
(например: А -..., В -...).
35. А. Рассчитайте, сколько молекул АТФ образуется при
окислении 1 молекулы стеариновой кислоты до СО2 и
Н2О.
Б. Если окисляется линолевая кислота, то на сколько мо-
лекул АТФ образуется меньше?
36. А. Рассчитайте, сколько молекул АТФ образуется при
окислении капроновой кислоты до СО2 и Н2О.
132
Б. Сравните с выходом АТФ при полном окислении глю-
козы (то же число атомов С). Убедитесь, какая молекула
имеет больший запас энергии.
37. Концентрация жирных кислот в артериальной плазме, по-
ступающей в миокард - 0,8 ммоль/л, в венозной, выходящей из мио-
карда - 0,4 ммоль/л. Количество липидов в миокарде не изменяется.
Ответьте на следующие вопросы.
А. В каком виде жирные кислоты транспортируются к ор-
ганам кровью, в частности к миокарду?
Б. Напишите схему метаболического пути жирных кислот,
которая поясняет, почему при прохождении крови через
миокард концентрация жирных кислот в ней снижается.
В. Укажите регуляторный фермент этого пути.
38. У мальчика 6 лет наблюдается быстрая утомляемость, не-
способность к выполнению физической работы. При исследовании
клеток мышц, взятых путем биопсии, обнаружили большие включе-
ния триацилглицеринов. При определении их количества в таких
клетках их концентрации оказались в несколько раз больше, чем в
норме, а концентрация карнитина в 5 раз меньше. Почему при дан-
ном заболевании резко снижается способность выполнять длитель-
ную физическую нагрузку?
39. А. Назовите основной источник энергии скелетных мышц
через 40-50 мин после начала работы.
Б. Напишите схему процесса, происходящего в этих усло-
виях в мышцах с пальмитиновой кислотой.
40. У экспериментального животного определяли разницу в
концентрации жирных кислот в крови, питающей интенсивно рабо-
тающую скелетную мышцу, и в крови, оттекающей от этой мышцы
на 1-й и на 20-й минуте работы. В каком случае разница в концен-
трации жирных кислот будет больше? Почему?
41. При интенсивной физической нагрузке в течение 30 мин в
крови экспериментальных животных определяли концентрацию
жирных кислот. Для случаев А и Б укажите, где эта величина боль-
ше.
А. В крови, питающей жировую ткань (артериальной),
или в крови, оттекающей от нее (венозной). Напишите
реакции обмена жиров, которые в этих условиях в жи-
ровой ткани являются причиной артериовенозной раз-
ницы.
Б. В крови, питающей миокард (артериальной), или в кро-
ви, оттекающей от него (венозной). Ответ объясните.
9*
133
42. Подберите к каждому пронумерованному утверждению
соответствующий буквенный ответ.
1. Жирные кислоты синтези-
руются в организме челове-
ка из ацетил-КоА.
2. Жирная кислота не синте-
зируется в организме,
должна поступать с пищей.
3. Жирная кислота синтезиру-
ется из незаменимой жир-
ной кислоты, поступающей
с пищей.
А. Линолевая кислота.
В. Пальмитиновая кислота.
С. Олеиновая кислота.
D. Стеариновая кислота.
Е. Арахидоновая кислота.
43. Выберите доноры водорода, необходимые для синтеза
жирных кислот в организме человека.
1. ФАДН2. 4. НАДФН.
2. НАДН. 5. ОН2.
3. Аскорбиновая кислота.
44. А. Из предложенных веществ выберите необходимые и со-
жирных кислот. Схема может
6. Бутирил-КоА.
7. Бутирил-Е.
8. Малонил-КоА.
9. Малонил-ацетил-Е.
ставьте схему синтеза
быть разветвленной.
1. Кротонил-Е.
2. Ацетил-КоА.
3. Ацетоацетил-Е.
4. Малонил-Е.
5. 0-гидроксибутирил-Е.
Б. Напишите реакцию, в которой образуется ацетоацетил-Е.
В. Напишите реакцию, в которой ацетоацетил-Е является
субстратом.
45. При гликолизе увеличивается концентрация АТФ в клет-
ках печени и ускоряется синтез жирных кислот. Покажите правиль-
ную последовательность событий из представленных ниже элемен-
тов схемы.
1. Увеличение концентрации АТФ в клетках печени.
2. Активация ацетил-КоА-карбоксилазы.
3. Образование малонил-КоА.
4. Образование ацетил-КоА.
5. Ингибирование изоцитратдегидрогеназы.
6. Переход цитрата в цитоплазму.
7. Действие цитратлиазы.
8. Увеличение концентрации цитрата в митохондриях.
134
А.р-окисление.
В. Биосинтез
жирных кис-
лот.
С. Оба процесса.
D.Hh один из
указанных
процессов.
46. Сравните процессы р-окисления и биосинтеза жирных
кислот, подобрав соответствующие пары утверждений.
1. Процесс локализован ь цитозо-
ле.
2. Процесс локализован в мито-
хондриях.
3. Один из ферментов этого про-
цесса имеет кофермент биотин.
4. Один из ферментов имеет ко-
фермент НАДФН.
5. Один из ферментов имеет ко-
фермент НАД*.
6. Процесс связан с синтезом АТФ.
7. Процесс связан с расходом АТФ.
47. Рассчитайте количество моль глюкозы, которое должно
окислиться в пентозофосфатном пути, чтобы обеспечить НАДФН
биосинтез 1 моль пальмитиновой кислоты.
48. Сколько моль глюкозы должно окислиться до ацетил-КоА,
чтобы из него синтезировать 1 моль пальмитиновой кислоты? При-
нимайте в расчет только количество углерода.
. А. р-окисление.
В. Биосинтез жир-
ных кислот.
С. Оба процесса.
D-Ни один из ука-
занных процес-
сов.
49. Сравните процессы р-окисления и биосинтеза жирных
кислот, подобрав соответствующие пары.
1. Регуляторный фермент аце-
тил-КоА-карбоксилаза.
2. Регуляторный фермент ацил-
КоА-дегидрогеназа.
3. Регуляторный фермент паль-
митатсинтетаза.
4. Активатор регуляторного
фермента - цитрат.
5. Регуляторный фермент кар-
нитин-ацилтрансфераза.
6. Ингибитор регуляторного
фермента - малонил-КоА.
50. Напишите окислительно-восстановительные реакции,
происходящие с участием коферментов НАД* и НАДФН при:
а) р-окислении жирных кислот;
б) биосинтезе жирных кислот.
51, Выберите утверждения, правильно характеризующие осо-
бенности обмена арахидоновой кислоты в организме.
1. Является предшественником в синтезе простагландинов.
135
2. Находится в основном в p-положении молекул фосфо-
липидов.
3. Подвергается перекисному окислению.
4. Может синтезироваться в организме из пальмитиновой
кислоты.
5. Может синтезироваться в организме из линолевой кис-
лоты.
6. Является предшественником в синтезе тромбоксанов.
7. Является предшественником в синтезе простациклинов.
52. А. Из представленных ниже метаболитов постройте схему
синтеза кетоновых тел в организме человека (1 -> 2 ...).
Укажите названия ферментов над стрелками.
1. Ацетоацетил-КоА.
2. Ацетоацетат.
3. Ацетил-КоА.
4. Р-гидрокси-р-метилглутарил-КоА.
5. Ацетон.
6. Р-гидроксибутират.
Б. Какова концентрация кетоновых тел в норме в крови?
53. Какие органы и ткани используют кетоновые тела в ка-
честве источника энергии при голодании?
1. Мозг. 4. Печень.
2. Скелетные мышцы. 5. Корковый слой почек.
3. Сердце.
54. Какое количество моль АТФ образуется при полном окис-
лении:
а) 2 моль ацетоацетата;
б) 1 моль р-гидроксибутилата?
55. А. Напишите формулы кетоновых тел.
Б, Выберите утверждения, правильно характеризующие
последствия накопления кетоновых тел.
1. В мышцах и в мозге кетоновые тела становятся важ-
ным источником энергии.
2. Печень начинает использовать кетоновые тела как
источник энергии.
3. Нарастает ацидоз.
4. Возрастает кетонурия.
5. С выдыхаемым воздухом выделяется ацетон.
56. Какие из перечисленных ниже процессов активируются
при длительном голодании?
1. Липолиз в жировой ткани.
136
2. Р-окисление в печени.
3. Окисление ацетил-КоА в печени.
4. Синтез кетоновых тел в печени.
5. Окисление кетоновых тел в печени.
6. Окисление кетоновых тел в мышечной ткани.
57. Выберите компоненты, необходимые для синтеза жиров в
печени, и составьте из них схему (схема будет нелинейной).
1. Жирные кислоты. 2. Диоксиацетонфосфат. 3. Лизофосфатидная кислота. 4. Глицерофосфат. 5. Моноацилглицерины. 6. Ацил-КоА. 7. Фосфатидная кислота. 8. Триацилглицерины. 9. Диацилглицерины.
58. Выберите компоненты, используемые при биосинтезе жи-
ров в печени.
1. 3-фосфоглицериновая кислота. 5. НАДН.
2. 2-фосфоглицериновая кислота. 6. Ацетил-КоА.
3. Диоксиацетонфосфат. 7. а-глицерофосфат.
4. НАДФН.
59. А. Какой из перечисленных ферментов будет активироваться
при увеличении в крови концентрации глюкагона?
1. Панкреатическая липаза.
2. Липаза адипоцитов.
3. Глицеролкиназа.
4. Глицеролфосфатацилтрансфераза.
5. ЛП-липаза.
Б. Содержание каких метаболитов жирового обмена будет
увеличиваться в крови в результате действия фермента,
выбранного Вами в п. А1
60. Животному в двухдневном эксперименте вводили внутри-
венно различные вещества:
а) адреналин, г) глюкозу,
б) глюкагон, д) глюкозу + инсулин.
в) инсулин,
Как изменится (увеличится - Т, уменьшится - 4, не изменится
<->) содержание жирных кислот в плазме крови в каждом случае?
61. Человек голодает в течение 24 ч.
А. Какие из следующих утверждений правильно характе-
ризуют метаболизм в этих условиях.
I. Активность ТАГ-липазы в жировой ткани увеличива-
ется.
2. Активность протеинкиназы в клетках жировой ткани
увеличивается.
137
3. Концентрация жирных кислот в крови повышена,
увеличено их поступление в печень.
4. Активность процесса Р-оКисления жирных кислот в
печени увеличена.
5. Скорость реакций ЦТК в клетках печени уменыпает-
6. В клетках печени повышена скорость синтеза ГМГ-
КоА, ацетоацетата.
Б. Какие вещества используются мышечной тканью в ка-
честве источников энергии в этих условиях?
А. Увеличивается.
В. Снижается.
С. Соответствует
нормальному
состоянию.
62. Человек голодает в течение 5 дней.
А. Если сравнить состояние его обмена с нормой, то како-
вы будут значения следующих показателей (подберите
соответствующие пары цифра-буква).
1. Концентрация глюкагона в крови.
2. Активность ТАГ-липазы в жировой
ткани.
3. Скорость реакций ЦТК в печени.
4. Скорость синтеза ацетоацетата.
5. Концентрация жирных кислот в
крови.
6. Активность фермента ГМГ-
синтазы в печени.
Б. Нарисуйте схему изменения метаболизма жиров в жи-
ровой ткани, начиная с этапа воздействия глюкагона на
жировую клетку и заканчивая выделением соответст-
вующих метаболитов в кровь.
А. Панкреатическая
липаза.
В. Тканевая липаза.
С. ЛП-липаза.
D.Свойственно всем
типам липаз.
Е. Не свойственно ни
одному типу ли-
паз.
63. Сравните свойства липаз, участвующих в обмене жиров в
организме человека (цифра-буква).
1. Относятся к классу гидролаз.
2. Относятся к классу лиаз.
3. Расщепляет экзогенные жиры.
4. Расщепляет жиры в составе
хиломикронов и Л ОНП.
5. Активируется в результате
действия адреналина и глюка-
гона.
6. Активность фермента зависит
от присутствия желчи.
7. Локализована в эндотелии
кровеносных сосудов.
8. Локализована в адипоцитах.
64. Какие из перечисленных ферментов участвуют в метабо-
лизме жиров в гепатоцитах?
1. ЛП-липаза. 4. Глицерофосфатдегидрогеназа.
2. Глицеролкиназа. 5. Ацил-КоА-синтетаза.
3. Ацил-КоА-трансфераза.
138
65. Из представленных ниже компонентов составьте схему
процесса, активность которого возрастает в жировой ткани при
ТГТТгГЛТЧ/лУ^тжтг ^-^4 .1. —--*----------—--------
интенсивной физической нагрузке. 1. Протеинкиназа неактивная. 2. Протеинкиназа активная. 3. ТАГ-липаза нефосфоритированная. 4. ТАГ-липаза фосфорилированная. 5. Аденилатциклаза неактивная. 6. Аденилатцикла- за активная. 7-цАМФ. 8. АТФ. 9. Адреналин.
66. Из представленных ниже компонентов составьте схему
синтеза фосфатидилхолина.
1. Этаноламин. 4. Фосфатидилэтаноламин.
2. ЦДФ-этаноламин. 5. Фосфатидилхолин.
3. Фосфоэтаноламин.
67. Из представленных ниже компонентов выберите те, кото-
рые являются промежуточными компонентами или субстратами
биосинтеза
а) триацилглицеринов в печени;
б) фосфатидилхолина в печени.
1. Фосфатидная кислота. 5. ЦДФ-этаноламин.
2. Диацилглицерин. 6. S-аденозилметионин.
3. Фосфатидилэтаноламин. 7. Моноацилглицерин.
4. ЦТФ.
68. А. Укажите, какие связи расщепляют фосфолипазы At, Аз,
С, D.
Б. К какому классу относятся эти ферменты?
В. Где синтезируются фосфолипазы, участвующие в пере-
варивании фосфолипидов пищи?
H2C-O-CO-R1
I 2
I 4
HC-O-CO-R2
0
I II +
Н2С-ОГ- рТ О - СН2 ~ СН2 - N - (СНз)з
3 4
69. Рассчитайте, сколько моль глюкозы необходимо для обра-
зования 1 моль дипальмитоолеилглицерина. Расчет провести только
ВДя необходимого количества углерода при условии, что глюкоза
является единственным его источником.
70. Какие показатели обмена веществ характерны для пере-
ЧИсленных состояний организма человека?
139
1. Переохлаждение орга-,
низма в течение несколь-
ких часов.
2. Через 3-4 ч после приема
жирной пищи.
3. Голодание в течение не-
скольких дней.
4. Наследственный дефект
гена, ответственного за
синтез липопротеинлипа-
зы.
5. Сахарный даабет
(недостаточное поступле-
ние глюкозы в клетки).
А. Концентрация жирных кислот
в сыворотке крови 0,8-1,0 мг-
экв/л (норма - 0,5).
В. “Молочный” цвет плазмы
крови через 14 ч после приема
жирной пищи.
С. Концентрация кетоновых телв
плазме 50 мг/дд.
□.Концентрация триацилглице-
ринов в сыворотке крови око-
ло 4 ммоль/л
(норма -1 ммоль/л).
Е. Щелочной резерв крови ниже
нормы.
71. Какие утверждения правильно характеризуют роль цитра-
та в обмене жиров?
1. Цитрат активирует ацетил-КоА-карбоксилазу.
2. Цитрат активирует ацил-КоА-карнитинтрансферазу.
3. В абсорбционном периоде в митохондриях увеличивает-
ся скорость реакции:
ацетил-КоА + ЩУК -> цитрат + HSKoA.
4. В абсорбционном периоде в цитозоле увеличивается
скорость реакции:
ацетил-КоА + СО: + АТФ -> малонил-КоА + АДФ +Ф
5. В составе цитрата избыток ацетил-КоА из митохондрий
переносится в цитозоль.
72. Человек выполняет интенсивную физическую работу в те-
чение нескольких часов.
А. Напишите реакции обмена жиров, скорость которых в
жировой ткани существенно возрастает при этом. Ука-
жите гормон, увеличивающий скорость этих реакции.
К Какова судьба продуктов этих реакций в данных усл°'
; виях:
а) в печени,
б) в мышцах?
73. Человек пробежал 10 км ~ за 60 мин.
А. Как изменится метаболизм жиров в жировой теа11ИЛ^яа
30-40 мин после начала бега? Напишите реакции обм
жиров, скорость которых изменится. v J[
Б. Как изменится обмен жирных кислот в мышечной ткани*
Напишите схему метаболического пути жирных кисло <
скорость которого увеличится в этих условиях в мышцах.
140
74. В результате 3-дневного полного голодания происходят
существенные изменения метаболизма. Дайте характеристику неко-
торым из этих изменений, ответив на следующие вопросы.
А. Как изменится концентрация жирных кислот в крови?
Действие какого гормона вызывает изменение их кон-
центрации в крови в этих условиях?
Б. Нарисуйте схему действия этого гормона на жировую
клетку.
В. Какой путь обмена жирных кислот - синтез или распад -
будет преобладать в печени в этих условиях? Напишите
окислительно-восстановительные реакции этого пути.
75. А. Как изменится метаболизм жирных кислот в жировой
ткани через 1,5-2 ч после приема пищи, содержащей
250- 300 г углеводов?
Б. Напишите схему того пути обмена жирных кислот, ак-
тивность которого нарастает в этих условиях. На схеме
укажите ферменты и коферменты, затраты АТФ.
В. Напишите реакцию, катализируемую регуляторным
ферментом этого пути обмена жирных кислот, укажите
активатор фермента.
Г. Напишите те компоненты, которые образуются при
окислении глюкозы и необходимы для протекания ре-
акций, описанных Вами в п. 2.
76. Человек получил с пищей 300 г углеводов.
А. Как изменится содержание ЛОНП в крови через 2-3 ч
после еды?
Б. Проследите основные этапы превращения глюкозы в
жиры в печени по данной схеме. К каждой цифре схемы
подберите букву, которой обозначены участвующие в
данном процессе вещества.
а СО:
Глюкоза....> 1 -------------> 2 «СО: + «НАДФН
1 +HSKoA >ИиАТФ
4 3
<- НАДН .
НАД* HS КоА
Глицерофосфат.............5
$—> НзРО<
6
ацил-КоА
4» HS КоА
7
Ф
ЛОНП в кровь
141
Примечание:-------------> одна реакция;
........> несколько последовательных реакций.
А. Фосфатидная кислота. Е. Триацилглицерин.
В. Ацетил-КоА. F. Диоксиацетонфосфат.
С. Ацил-КоА. G. Диацилглицерин.
D. Пируват.
77. Больному поставлен диагноз - феохромоцитома (гормон-
продуцирующая опухоль мозгового слоя надпочечников).
А. Как отличается обмен жиров в жировой ткани в этом со-
стоянии от нормы? Напишите схему процесса, активность
которого существенно увеличена в жировой ткани.
Б, Какой процесс обмена жирных кислот в миокарде проте-
кает более активно по сравнению с нормой? Почему? На-
пишите схему процесса.
78. А. Опишите все этапы ассимиляции пищевых жиров на их
пути от желудочно-кишечного тракта до клеток жиро-
вой ткани (ответ дайте в виде схемы:
фермент
жиры пищи продукт -> транспортная форма -> ••)•
Б. Напишите реакции, проходящие при депонировании
жиров.
79. У маленького ребенка имеются нарушения функций лег-
ких, мозга, мышц. В биоптате печени и фибробластах кожи отсутст-
вует ацетил-КоА-карбоксилаза.
А. Напишите биохимическую реакцию, которая у данного
ребенка протекает с нарушениями.
Б. Какой метаболический путь нарушен? Напишите реакций
этого пути; укажите роль реакции, описанной в п. А.
В. Сделайте предположение, почему нарушены функции раз'
нообразных тканей.
80. А. Напишите схемы:
1) синтеза жиров из углеводов в печени;
2) ресинтеза жира в слизистой кишечника, происходя-
щего при поступлении с пищей жиров.
Б. Количество каких липопротеинов преимущественно
увеличится в крови в результате активации процессов}
указанных в пп. А. 1 и А .2?
81. Нелактирующая молочная железа лишена ЛП-липазЫ-
задолго до родов под действием пролактина ее активность в эндотв-
лии капилляров молочной железы резко увеличивается, а в жировой
ткани снижается.
142
А. Как изменится метаболизм жиров в клетках молочной
железы после родов?
Б. Напишите реакции, иллюстрирующие Ваш ответ.
82. В норме после приема с пищей большого количества угле-
водов увеличивается активность ЛП-липазы в жировой ткани. По-
кажите связь между обменом жиров и углеводов, построив из пред-
ложенных процессов правильную последовательность событий.
1. Ускорение синтеза жиров в печени.
2. Увеличение концентрации глюкозы в крови.
3. Ускорение синтеза ЛОНП.
4. Увеличение утилизации глюкозы клетками печени.
5. Увеличение концентрации инсулина в крови.
6. Увеличение активности ЛП-липазы в жировой ткани.
7. Увеличение скорости синтеза жиров в жировой ткани.
83. В общих липидах сыворотки крови здоровых людей соотно-
шение жирных кислот С20:3 и С20:4 равно 0,4. С?о:з - кислота синтезирует-
ся из олеиновой кислоты, а С20М - из линолевой. Как изменится это со-
отношение при нарушении переваривания и всасывания жиров?
84. А. Какие из перечисленных веществ являются предшест-
венниками кетоновых тел ?
1. Аминокислоты (Ала, Асп, Глу, Гис).
2. Глюкоза.
3. Жирные кислоты.
Б. Как изменится синтез кетоновых тел у человека, при-
нявшего пищу после трехдневного голодания?
В. Напишите схему синтеза кетоновых тел.
Г. Рассчитайте, сколько моль АТФ образуется при окис-
лении 3 моль р-гидроксибутирата.
85. Приблизительно одна треть жиров, получаемых с пищей,
Должна быть растительного происхождения. Подтвердите это, дав
ответы на следующие вопросы.
А, Назовите известные Вам незаменимые факторы пита-
ния, которые содержатся в растительных маслах.
Б. Синтез каких регуляторных молекул производных ли-
пвдов будет нарушен при недостатке этих факторов?
В. Какие функции выполняют в организме эти производ-
ные щшццов?
86. Напылите формулу холестерина и укажите пределы нор-
^альной концентрации его в крови взрослого человека.
143
87. К перечисленным ниже процессам, которые характеризуют
поступление и экскрецию холестерина и его производных у челове-
ка, подберите обозначенные буквами среднесуточные количествен-
ные характеристики.
1. Синтез эндогенного холестерина. А. 1,0-1,3 г/сут.
2. Поступление холестерина с пищей прира- В. 0,8-1,0 г/сут.
циональном питании. С. 0,5-0,6 г/сут.
3. Синтез желчных кислот. D. 0,3-0,5 г/сут.
4. Экскреция холестерина и желчных кислот с
калом.
88. К пронумерованным формулам подберите названия ве-
ществ:
А. Холевая кислота. D. Кортизол.
В. Апил-холестерин. Е. Витамин Дз.
С. Тауродезоксихолевая кислота.
89. Выберите положения, правильно характеризующие функ-
цш! холестерина в животном организме.
1. Является предшественником стероиттных гормонов.
2. Входит в состав биологических мембран.
3. Является предшественником витамина Дз.
4. Является продуктом катаболизма гема.
5. Является предшественником желчных кислот.
144
90. Выберите, какие из перечисленных гормонов являются
производными холестерина.
1. Эстрогены. 4. Катехоламины.
2. Кортикостероиды. 5. Минералкортикоиды.
3. Андрогены.
91. А. В каких органах происходит синтез холестерина “на
экспорт”?
1. Мышцы. 4. Печень.
2. Тонкий кишечник. 5. Жировая ткань.
3. Нервная ткань.
Б. Укажите, в виде каких липопротеинов синтезирован-
ный холестерин поступает в кровь из выбранных Вами
органов (к цифрам и. А подберите букву).
А. Хиломикроны. С. ЛНП.
В. ЛОНП. D. ЛВП.
ные номера стрелками:
1. Малонил-КоА.
2. Ацетил-КоА.
3. ГМГ-КоА.
4. Мевалоновая кислота.
92. А. Выберите из перечисленных соединений субстраты и
промежуточные продукты синтеза холестерина и рас-
положите их в порядке образования, соединив выбран-
6. Ацетоацетил-КоА.
7. Прогестерон.
8. Ланостерин.
9. Холестерин.
5. Сквален.
Б. Назовите фермент, который катализирует ключевую
регуляторную реакцию синтеза холестерина и напиши-
те эту реакцию.
В. Перечислите метаболиты, которые ингибируют актив-
ность этого фермента в организме.
93. А. Напишите последовательность реакций превращения
ацетил-КоА в мевалонат в процессе синтеза холестери-
на. Укажите ферменты и коферменты.
Б. Назовите органы, в которых у человека идет синтез хо-
лестерина.
В. В какой форме основное количество холестерина, син-
тезированного в печени, поступает из печени в кровь?
94. А. Рассчитайте, сколько молекул глюкозы будет затрачено
на синтез молекулы холестерина, если известно, что в
синтезе одной молекулы холестерина используется
шесть молекул мевалоната (расчет по атомам углеро-
Б- Напишите реакцию образования мевалоната, указав
фермент и кофермент.
В. Сколько атомов углерода в молекуле холестерина будет
радиоактивными, если в экспериментах использовали
глюкозу, все углеродные атомы которой содержат изо-
топ |4С.
10 Сборник тестов изадач по биохимии I45
95. Определите принадлежность перечисленных частиц к оп-
ределенной группе липопротеинов (назовите их) на основании дан-
ных о процентном содержании в них триацилглицеринов и этери-
фицированного холестерина.
Триацилглицерины Эфиры холестерина
1. 5 20
2. 85-90 4
3. 7 40
4. 50 15
96. Няпшпите формулу олеил-холестерина. Для каких липо-
протеинов превращение в зрелые частицы связано с увеличением
содержания этерифицированного холестерина?
97. В каких липопротеинах активно протекает ацилирование хо-
лестерина, катализируемое ЛХАТ? Назовите и напишите формулу со-
единения, которое является донором жирной кислоты в этой реакций.
98. Я. На схеме, показывающей транспорт холестерина от пе-
чени к другим органам и избытка холестерина от раз-
ных органов в печень, к каждой цифре подберите соот-
ветствующую форму липопротеина.
1 2
Холестерин-------> ...... —----> .....—--------г
(печень) Ф
♦ холестерин
3 0ф. органов)
—--------—— —.... <-----........... -4
Б. Укажите фермент, который участвует в превращении
1 ->2. {
В. Концентрация каких липопротеинов обычно увеличена
и каких снижена при атеросклерозе (t, Ф)?
99. Сравните особенности образования, транспорта и превраще-
ний основной части экзогенного и эндогенного холестерина, подобрав
к перечисленным утверждениям соотвеггсгвующия буквенные ответы-
1. Включается в липопротеншл, обра- А. Характерно для
зующиеся в эпителии кишечника. экзогенного холе-
2. Включается в ЛОНП, образующиеся стерина.
впечеж. В. Харакгернодая
3. В составе хиломжроновпоступаетв эндогенного холе-
'лимфу. стерина.
ставе жпопретежсданйюсредствен- > обоих видов холе-
но поступает вкровь. етернна
5. Липопротеины, содержащие холесте- D. Нехарактерно ни
рин, после действия на них Л П- для одного ич них
липазы поглощаются печенью.
100. Концентрация холестерина в сыворотке крови ребенка
первого года жизни колеблется в пределах 50±20 мг/да. Во сколько
раз она отличается от содержания холестерина у взрослого челове-
ка?
101. Какие химические превращения в печени увеличивают
амфифильность первичных желчных кислот? Напишите формулы
этих производных для дезоксихолевой кислоты.
102. Как называются, где и из каких предшественников обра-
зуются желчные кислоты, формулы которых .приведены ниже?
А.
103. А. Назовите производные холестерина, которые будут
проходить следующий путь:
кишечник----——► воротная вена печень
t-----------— желчный пузырь “
К. Выберите, какие из приведенных утверждений
правильно характеризуют значение этого процесса.
147
L Обеспечивает многократное использование организ-
мом поверхностно активных веществ, необходимых
для переваривания.
2. Увеличивает выделение холестерина из организма.
3. Обеспечивает усвоение экзогенных липидов.
4. При недостаточном поступлении этих веществ из
желчного пузыря в кишечник развивается гиповита-
миноз А, Д, Е, К.
104. Выберите из перечисленных ниже, какие нарушения в об-
мене липидов наблюдаются при недостаточном поступлении желч-
ных кислот в кишечник.
I. Пересыщение желчи холестерином.
2. Склонность к образованию желчных камней.
3. Появление в фекалиях нерасщепленных жиров.
4. Недостаточность линолевой и -линоленовой кислот.
5. Недостаточность незаменимых аминокислот.
6. Гиповитаминоз жирорастворимых витаминов А, Д, Е, К.
105. Объясните, с чем связано использование хенодезоксихолевой
кислоты в качестве лекарственного препарата при лечении желчнока-
менной болезни, если камни состоят в основном из холестерина.
106. У женщин желчнокаменная болезнь зачастую является след-
ствием высокого уровня эстрогенов в организме. Известно, что эстро-
гены угнетают синтез желчных кислот и увеличивают количество фер-
мента ГМГ-КоА-редуктазы. Почему изменения в обмене холестерина,
вызванные эстрогенами, могут быть причиной болезни?
107. Напишите формулу расчета коэффициента атерогенности
и укажите пределы его значений в норме.
108. А. Какое звено обмена холестерина нарушено при семей-
ной гиперхолестеринемии?
Б. Содержание каких липопротеинов повышено в крови
у этих больных?
В. Какие причины приводят к их накоплению?
109. При росте и делении клеток увеличивается их потреб-
ность в холестерине. Почему?
ПО. Если с пищей человек получил 1-1,5 г холестерина, то его
синтез в организме снижается за счет снижения активности И
уменьшения количества ферментов, принимающих участие в синтезе
холестерина. Опишите последовательность событий, приводящих К
снижению синтеза холестерина.
111. На синтез каких соединений используется холестерин в
ситуациях, обозначенных буквами?
А. В клетках семенников в ходе сперматогенеза.
В. В коже при инсоляции организма.
С. В желтом теле и плаценте при беременности.
D. Под действием ЛХАТ при переходе холестерина из
клеток в ЛВП.
Е. В коре надпочечников при гиперпродукции глюкокор-
тикоидов.
F. В печени, когда выведение части мицелл желчи с калом
увеличено в результате действия холестираминовых
смол.
112. А. Назовите липопротеины, концентрацию которых нео-
бходимо контролировать в ходе лечения больного ате-
росклерозом.
Б. Нарисуйте липидограммы здорового человека и боль-
ного, причиной атеросклероза которого является йедос-
таточность рецепторов ЛНП. Липидограммы получе-
ны через 10 ч после приема пищи.
113. В результате специальной д иеты и интенсивных физических
упражнений, регулярно выполняемых в течение 2 Месяцев, в крови об-
следуемой группы людей концентрация холестерина в ЛВП увеличи-
лась приблизительно на 10%, а концентрация общего холестерина
уменьшилась ~ на 20 мг/дл. Способствуют ли такие изменения умень-
шению риска заболевания атеросклерозом? Ответ поясните.
114. У человека 20 лет концентрация общего холестерина в
крови 480 мг/дл, количество ЛНП в крови почти в 2 раза превышает
норму. При беседе с больным выяснилось, что его отец умер в 45 лет
от инфаркта миокарда.
А. Предположите возможную причину гиперхолестерине-
мии у данного больного.
Б. Какие способы снижения концентрации холестерина в
крови Вам известны?
В. Если в процессе лечения у пациента увеличилось коли-
чество холестерина в ЛВП, как это влияет на риск ате-
росклероза?
115. Вместо очередного кормления двум группам эксперимен-
тальных животных дали смесь сахарозы с добавкой аланина, содер-
жащего ис. В I группе аланин мечен по первому атому С, во II
группе - по третьему. Через ~ 60 мин животных забивали, из печени
выделяли холестерин и определяли в нем содержание радиоактивно-
го углерода. У животных какой группы содержание 14С в холестери-
не будет значительно большим? Напишите схему превращений, под-
тверждающую ответ.
116. Используя цифры, покажите правильный порядок этапов
поступления холестерина:
а) из кишечника в печень;
б) из печени в периферические ткани.
1. Образование ЛНП.
2. Транспорт кровью.
3. Упаковка в ЛОНП (орган, где образуется основная масса
ЛОНП).
4. Действие ЛП-липазы.
5. Синтез холестерина и его эфиров.
6. Захват липопротеинов специфическими рецепторами тканей.
7. Поступление холестерина в клетки различных тканей.
8. Гидролиз эфиров холестерина пищи.
9. Образование смешанных мицелл.
10. Всасывание.
11. Захват печенью остаточных хиломикронов.
12. Образование остаточных хиломикронов.
13. Образование хиломикронов.
117. Человек ежедневно получает с пищей около 1 г холестерина.
А. Опишите путь экзогенного холестерина в клетки печяи.
Необходимо указать все этапы превращений и транспорта
холестерина, поступившего с пищей (холестерин - соответ-
ствующая транспортная форма и т. д.).
Б. Как изменится синтез эндогенного холестерина в слизи-
стой кишечника и печени в этих условиях?
В. Активность какого фермента синтеза холестерина непо-
средственно зависит от количества холестерина, посту-
пившего с пищей?
Г. Перечислите основные пути использования холестерина в
печени. Напишите формулу холевой кислоты и ее конъю-
гатов.
118. Чедовек питался разнообразной пищей, но затем в тече-
ние нескольких дней получал только растительную пищу.
А. Как изменится обмен холестерина в результате такого
питания?
Б. Напишите схему пути обмена холестерина, активность
которого изменится в этих условиях.
В. Укажите регуляторный фермент и его эффекторы.
Г. Какова функция различных типов липопротеинов Я
транспорте холестерина? >
150
119. Животных содержали на рационе, содержащем около 300
мг меченого по 14С холестерина.
А. Опишите путь экзогенного холестерина в органы и
ткани. Укажите формы транспорта и этапы превраще-
ний.
Б. Как изменится синтез эндогенного холестерина в слизи-
стой кишечника и печени в этих условиях?
В. Назовите фермент, активность которого зависит от ко-
личества холестерина, поступающего с пищей, и напи-
шите катализируемую им реакцию.
Г. В составе каких соединений через сутки будет обнару-
живаться метка, принадлежащая холестерину?
120. Опишите путь эндогенного холестерина в клетки мышеч-
ной ткани и возвращения избытка холестерина из тканей в печень.
А. Холестерин -> транспортная форма -> ...
(место синтеза) характер
превращений
Б. Перечислите способы уменьшения количества холесте-
рина в организме человека.
121. При диспансерном обследовании пациентов А и В в воз-
расте 40 лет содержание общего холестерина у них оказалось рав-
ным 260 мг/дл (7,2 мМ).
1. Можно ли говорить, что эти пациенты здоровы?
2. Имеется ли у них равная предрасположенность к атеро-
склерозу?
3. На содержание каких компонентов необходимо иссле-
довать кровь этих людей?
122. В стационар поступил юноша 24 лет с симптомами ишеми-
ческой болезни сердца в результате атеросклероза. В хода обследования
обнаружилось, что у больного липопротеины содержат малоактивный
фермент лецитшт-холестфол-ациттрансферазу (ЛХАТ).
А. Напишите реакцию, которую катализирует ЛХАТ.
Б. Какие фракции липопротеинов богаты ЛХАТ?
В. Почему недостаточность ЛХАТ может привести к раз-
витию атеросклероза?
123. В печени часть неэтерифицированного холестерина идет
' на образование желчных кислот.
А. Покажите, какие желчные кислоты образуются в клетках
пвчени и какие превращения с ними происходят в кишеч-
нике? .
151
Б. Что такое энтерогепатическая циркуляция? Все ли моле-
кулы первичных желчных кислот возвращаются в печень в
неизменном ви де?
В. Как влияет конъюгация с глицином и таурином на амфи-
фильные свойства желчных кислот? Ответ проиллюстри-
руйте на примере формул холевой и таурохолевой кислот.
Г. Перечислите функции желчных кислот в организме. К ка-
ким нарушениям обмена веществ ведет снижение секреции
желчных кислот в желчь или прекращение поступления
желчи в кишечник?
124. Человек съел 250 г картофеля. До еды и после у него ис-
следовали концентрацию глюкозы в крови. Ответьте на вопросы:
А. Соответствует ли приведенный график норме?
Б. Действию какого гормона соответствует изменение
концентрации глюкозы, отраженной на участке графи-
ка, обозначенного буквами А и В?
1. Кортизол.
2. Адреналин.
3. Инсулин.
4. Глюкагон.
В. Из предложенных метаболитов составьте путь обмена
жирных кислот, интенсивность которого будет нарас-
тать в печени данного человека через 2 ч после еды.
6. Ацетоацетил-Е.
7. Малонил-Е.
8. Малонил-КоА.
9.Ацетил-Е.
10. ₽-гидроксиацил-Е.
1. Кротонил-Е.
2. Ацилкарнитин.
3. Ацетил-КоА.
4. Бутирил-Е.
5. Бутирил-КоА. , , ______
Г. Как изменится синтез холестерина у этого человека че-
рез 2 ч после еды"? .
152
Эталоны ответов к разделу VI
“ОБМЕНИ
ФУНКЦИИ ЛИПИДОВ”
1.1 - В; 2 - В; 3 - А; 4-D; 5 - В; 6 - С; 7 - С.
2.1 - Е; 2 - D; 3 - А; 4 - В; 5 - С.
3.
а.
Н2С-О-СО-С17Н35
I
НС-О-СО-С17Нзз
Нгс-о-со-сцнз!
4. Л. а - 1,3,4; В-2, 5.
Б. г.
б.
Н2С-О-СО-С15Нз1
I
НС-О-СО-С17Н31
НзС-О-СО-СпНзз
Н2С-0+ p-o-ch2-ch2-n-<снз)з
I II
I L-°_____________________J
НС-О-С-С17Н31
HjC-O-C-C15H3i
о
А. Суммарный заряд = 0.
Б. Пунктиром отмечена часть, за счет которой происходит
взаимодействие с белками.
В. Электростатическое взаимодействие.
6. А.
о уСНз
н?с- о - Р- о —сн2— СН2-N*— СНз
I 'А ^СНз
ЦС-О~С-С)5Нз1
I °
Н2С-О-С-С15НЗЗ
о
153
(амфифильное поверхностноактивное вещество)
Б. Другие типы фосфатидалхолинов обычно сод ержат нена-
сыщенные жирные кислоты, особенно в ^-положении.
7. 1 - В; 2 - А; 3 - С; 4 - D; 5 - F; 6 - G; 7 - Е.
8. 3, 4, 7.
9. А.
10.
11.1,2,3,5,6,7.
12. Л.
н<-о-со-с15Нл HjC-OH + С,7НЭ|СООН
I пвижоежшчеехм i
НС-О-СО-СпН» 4 2НР-??”* » нС-О-СО-СцНзз
| желчь ।
н<-о- со-спнв ₽Н7*8 HjC-OH + СцНиСООН
Б. НСОз', в поджелудочной железе.
В. Жирные кислоты и 0-моноацилглицерины.
13.2,3.4,5.
14.
А 0-моноацнлглнцерины.
Б. Это вещество обладает выраженными днфильяыи*
свойствами, поэтому ускорает эмульгирование жиров
IM
15. 1,2,3, 4,6.
16. 1,2, 3,4, 7.
17. 2, 3, 5, 6, 7.
18. 3, 4.
19.
A.
I? + 0
HjC-0-P-O-CH2-CH2~N -(СНз)з H2C—О—P—О—CH2—CH2—N — (CHsh
I _o- I O-
HC-O co C19H29 --------------► HC_OH + C19H»COOH
И^-О-СО-Я HjC~O~CO-R
Б. В поджелудочной железе.
20.
А. См. реакцию в предыдущем ответе, п. 1. Разрушение фос-
фолипидов, входящих в состав мембран эритроцитов.
Б. Нет: в сфингомиелине остаток жирной кислоты связан
со сфингозином амидной связью.
21.
А. Появляются крупные частицы - хиломикроны.
Б. ЛП-липаза.
В.
HjC-o-co-r НгС-он
I ЛП-жми
НС-О-СО-R-----------► НС-ОН + 3RCOOH
НгС-О-СО-R HjC-OH
г.
15$
22.1, 3.
23.
A.
НгС- ОН Н2С- О - СО - R
НС-О—СО— R + RCO~SKoA ----► HC-O-CO-R +2HSKoA.
НгС-ОН H2C-O-CO-R
Б. В составе хиломикронов поступают в лимфу крови.
24.
А. 5->6->8->4-»2 -> 1 -» 3-> 7 -> 9.
Б. а - 7; б - 6; в - 2, 9.
25.1 - В; 2 - А; 3 - В; 4 - С; 5 - В, С.
26. а -1,2,3; б -1,3,4, 5, 6,7.
27. Да: при ресинтезе жира в тонком кишечнике происходит
изменение его состава.
28 .1 - С; 2-А; 3 - В; 4-D
29.1,3,4,5.
30. 1 - В; 2 - С; 3 - А.
31. А-3;В-2.
32. 1 -А;2-С, D; 3 - С; 4 - А; 5 - D.
33.
А.
(ацил-КоА- (ацил-КоА-карни- (ацил-КоА-карни-
синтетаза) тинтрансфераза) тинтрансфераза)
3-----:----> 5 -------------» 2-------:------> 5
(ацил-КоА- (еноил-КоА- (0-оксиацил-КоА- КоА-
дегидрогеназа) гидратаза) дегидрогеназа) (тиолаза)
---------> 4 --------> ——----------> 1----—* '•
156
R-CO-SKoA + (CH3)3—N—CH2—CH—CH2—COOH ч=-Ь
ОН
Ч—* HSKoA + (СН3)3—N —СН2—СН—СН2—СООН.
O-C-R
II
О
34.
A. 1 - В; 2 - А; 3 - С; 4 - Е; 5 - D.
Б. А - ФАД; С - HSKoA; Е - НАД+.
35.
А. 147.
2. на 4 молекулы.
36.
Б. 45.
2. 38. Капроновая кислота имеет больший запас энергии.
37.
А. В комплексе с альбуминами.
Б. Жирная кислота -> ацил-КоА -> ацилкарнитин ->
-> ацил-КоА -> еноил-КоА -> [3-гидроксиацил-КоА ->
-> Р-кетоацил-КоА -> ацил-КоА + ацил-КоА(с„-2).
3. Ацил-КоА-карнитинтрансфераза.
38. Поскольку количество карнитина снижено, то и окисление
«ирных кислот в мышцах происходит очень медленно. Вследствие
этого жир накапливается в мышечных клетках. Окисление жирных
кислот - важный источник энергии, поэтому в данном случае спо-
собность к выполнению физической работы заметно снижена.
39.
А. Жирные кислоты.
Б. См. схему: 37. п. Б;
40. На 20-й мин. В первую минуту мышца работает в анаэроб-
йЫх условиях, р-окисление не происходит. На 20-й мин увеличивает-
ся ириток жирных кислот за счет мобилизации жиров и начинается
°кисиение жирных кислот.
41.
А. В венозной: ТАГ -> глицерин + 3 RCOOH.
157
Б. В артериальной: происходит р-окисление жирных кислот.
42.1 -В, С, D;2-E;3-E.
43.4.
44.
А. 2 -> 8 -» 4 -» 9 3 -> 5 -> 1 -> 7.
t
2
Б.
НООС-СН2 - CO-S .
^Е —> СН3—СО—СН2—СО—S—Е + СО2.
CHj-CO-S^
в.
—СО—СН2—СО—S
В + НАДФН2—► СНз—СН—СН2—СО—S—Е + НАДФ+
HS^ ОН HS /
45.1 -> 5 8 -> 6 -> 7 -> 4 -> 2 -> 3.
46.1 - В; 2 - А; 3 - В; 4 - В; 5 - А; 6 - А; 7 В.
47. 7 моль.
48. 4 моль.
49.1 - В; 2 - D; 3 - D; 4 - В; 5 - А? 6 - А.
50.
а.
+ **
R- сн-СН2—СО-КоА + НАД —♦ R—С-СН2-СО-КоА +НАДН + Н
I Н
6.
R-C-CH2-CO-E + НАДОЙ ♦ Н+-» R-CH-CH2-CO-KoE + НАДФ-
О ОН
r-CH=CH-CO-E + НАДФН + Н+-Ч> R-CH2-CH2-^CO-E + НАДФ*-
I»
52.
ацетйл-КоА- (З-гидроксибу-
ацетилтран- ГМГ-КоА- ГМ Г* Ко А- тиратдегидро-
сфераза сингаза лиаза геиаза
3 ---------> 1 —----_4----------> 2 _-----> 6 -> 5.
т
з
Б. 2 - 3 мг/дл.
S3.1, 2, 3, 5.
54.
а-46.
6-26.
55.
А.
СН3-С-СН2-СООН. СН3-СН-СН2-СООН. СН3-С-СН3.
О ОН о
Б. 1,3, 4, 5.
56.1, 2, 4, 6.
57.1 -> 6 i
S—> 3 -> 7 -► 9 -> 8.
2 -» 4' Т Т
6 6
f t
1 1
58.3,4, 5, 6, 7.
59.
А. 2.
Ь’Жирных кислсгг, глицерина.
6O.a-f;6-
61.
^4. i, 2,3,4,5,6.
Б. Кетоновые тел» и жирные кислоты.
159
62.
A. 1 - A; 2 - A; 3 - В; 4 - A; 5 - A; 6 - A.
Б.
аденилатциклаз a
неактивная
адреналин
аденилатциклаза
активная
протеинкиназа
неактивная
ТАГ-липаза
неактивная
протеинкиназа
активная
ТАГ-липаза
активная
ТАГ —> в кровь: жирные кислоты + глицерин.
63. I - D; 2 - Е; 3 - А; 4 - С; 5 - В; 6 - А; 7 - С; 8 - В.
64. 2, 3, 4, 5,
65. 9->5->6->8->7->1->3-> 4.
66. 1 -> 3 -> 2 -> 4 -> 5.
67. а - 1.2; б - 1,2, 3, 4,5,6.
А. 1 - Ai; 2 - Аг; 3 - С; 4 - D.
Б. Гидролазы.
В. Поджелудочная железа.
69. 25,5 моль.
70.1 - А; 2 - D; 3 - А, С, Е; 4 - В, D; 5 - А, С, Е.
71. 1,3,4, 5.
72.
А. Реакции гидролиза жира. Адреналин.
Б. Жирные кислоты поступают в кровь
а) в печени - ₽- окисление жирных кислот и синтез кето-
новых тел;
б) в мышцах - окисление до СОг и НгО.
А. Увеличивается гидролиз жира. Схема гидролиза жира.
160
Ь Увеличивается скорость р-окисления жирных кислот.
Схема [Токисления.
74е
А. Увеличится; глюкагона.
Б. Схема активации ТА Г-липазы под действием аденилат-
циклазной системы, см. ответ к заданию № 62, раздел VI.
В. Р-окисление.
75,
А. Увеличится синтез.
Б. Схема синтеза жирных кислот.
а цетил -Ко А-
карбоксилаза
цитрат (+)
В. Ацетил-КоА + СО? + АТФ-----------> малонил-КоА +
+ АДФ + Ф.
Г 4. Ацетил-КоА, АТФ, НАДФН.
76.
А. Т.
Б. 1 - D; 2 - В; 3 - С; 4 - F; 5 - А; 6 - G; 7 - Е.
’ 77.
А. Увеличится мобилизация жира. Схема гидролиза жира.
Б. Схема р-окнсления. Увеличивается интенсивность рас-
хода АТФ,
78. панкреатическая
липаза
А. Жиры-------> р-МАГ + жирные -> смешанные
кислоты мицеллы
^всасывание > ресинтез ТАГ * образование транспорт ->
хиломикронов кровью
ЛП-липаза
-----> глицерин + жирные кислоты -* в жировую клетку.
Б. ос-глицер о фосфат + ацил- КоА —> лизофосфагидная —>
кислота
.ИЗ КоА ацил-КоА
7”---фосфатидная —=> ДАТ ТАГ.
ацил-КоА кислота v
НзРОц HS КоА
13 Сборник тестов и задач по биохимии
161
79.
А. Ацетил-КоА + CO2 + АТФ к > малонил-Ко А +
+АДФ < Ф.
Б. Реакции синтеза жирных кислот; реакция п.1 регуля-
торная.
В. Из-за генетического дефекта фермента нарушен синтез
жирных кислот и соответственно фосфолипидов и ТАГ
во всех тканях.
80.
А.
I) Глюкоза
НАДФ+ НАДФН
пентозы
фруктозо-1,6-бисфосфат
J, НАДН НАД+
диоксиацетон-
фосфат
> ос-глицерофосфат
глицеральдегид-3-фосфат
ТАГ
ацетил-КоА
> жирные кислоты
НАДФН НАДФ
2) p-моноацилглицерины + ацил-КоА
»
HSKoA
диацилглицерины + ацил-КоА —гриацилглицерины.
HSKoA
5J.1 -ЛОНП, Л.2-ХМ.
81.
А. Увеличится синтез жиров.
Б. Схема синтеза жира.
82.
7
Т
2 -> 5 -» 4 -> 1 -> 3 6 -> 7.
83. Увеличится, так как олеиновая кислота синтезируется в ор-
ганизме, а линолевая - нет.
162
84.
A 3.
Б Уменьшится.
В См. ответ к задаче 52. А.
Г. 78 моль АТФ.
85.
А. Эссенциальные жирные кислоты, жирорастворимые ви-
тамины.
Б. Простагландины (тромбоксаны, лейкотриены).
В. Являются гормонами местного действия.
86. 200 ± 50 мг/дл.
87. 1 . В; 2 - D; 3 - С; 4 - А.
88. 1 - D; 2 - Е; 3 - А; 4 - В; 5 - С.
89. 1, 2, 3, 5.
90. 1,2, 3,5.
91.
А. 2, 4.
Б. 2 - А, В; 4 - В.
92.
А. 2 -> 6 ->3->4->5->8->9.
Б, ГМГ - КоА-редуктаза.
он
I +
HOOC“CH2~C“CH?-C'SKoA + 2 (НАДФН + Н ) —►
СН3 О
ОН
---► HSKoA + НООС-СН--С-СН2-СН2ОН + 2НАДФ
I
СН3
В. Холестерин, желчные кислоты.
163
93.
ТИЛПЯ1Я ГМГ-КоА-синтаза
2CHj—CO~SKoA———СНз -CO-CH2CO-SKOA>
ОН СН
НООС-СН2-С-СН2СО-ЗКоАГ^—оА^уклаза* НООС~СН2-C-CIb-СНтОН
I / V 1
СН-1 + + СНз
3 2НАДФН+Н 2НАДФ
Б. Печень, кишечник, надпочечники, кожа.
R ЛОНП.
94.
А. 6 молекул 18 ацетил-КоА 9 молекул глюкозы,
мевалоната
К
| 4- ГМГ-КоА-редукгаза
HOOC”CH2-C-CH2-CO~SKoA+ 2 (НАДФН + Н ) ----------------►
I
СНз
он
I +
---------► НООС-<Н2-С-€Н2-СН2ОН+ 2 НАДФ .
СН
3
В. Все атомы углерода (27).
95. 1 - ЛВП; 2 - хиломикроны; 3 - ЛНП; 4 - ЛОНП.
96. См. №88 на с. 144, п.4. ЛВП.
97. ЛВП. Фосфатидилхолин.
о
II
Н2с- О-С-R[
О
II
нс—о—с—r2
он
1
Н2С-О-Р-О-СН2 ~СН2 —N+— (СН3)з
о
98.
А. 1 - ЛОНП; 2 - ЛНП; 3 - ЛВП.
164
Б. Л И-липаз а.
В. Т - ЛОНП, ЛНП; - ЛВП.
99. I - А; 2-В; 3-А; 4-В; 5-С.
100. В 4 раза.
101. Конъюгация с глицерином и таурином. Формулы глико- и
rajp о дез оксих о лев ой кислот.
102. В кишечнике.
А. литохолевая образуется из хенодезоксихолевой кислоты
и ее конъюгатов.
Б. дезоксихолевая - из холевой кислоты и ее конъюгатов.
103.
А. Желчные кислоты.
F. 1, 3, 4.
104.3,4,6.
105. Она ингибирует эндогенный синтез холестерина и попол-
няет фонд эндогенных желчных кислот, применяется в больших до-
зах и способствует переходу холестерина в жидкое состояние.
106. Эстрогены индуцируют синтез холестерина, но снижают
образование желчных кислот. В результате мицеллы желчи будут
перенасыщены холестерином, что вызовет образование желчных
камней.
107. К = — -224L, где X - общий холестерин крови,
Хш1
Хлвп - холестерин в ЛВП.
В норме К=2 - 4.
108.
А. Поступление холестерина в ткани.
Б. ЛНП.
В. Недостаточность рецепторов ЛНП.
109. Холестерин расходуется на построение мембран клеток.
НО. Холестерин связывается с регуляторной субъединицей
ГМГ-КоА-редуктазы и ингибирует ее активность по аллостериче-
скому механизму.
И*
165
Холестерин и продукты его окисления как корепрессоры опе-
рона, контролирующего синтез фермента ГМГ-КоА-редуктазы, сни-
жают его количество в клетках.
111, А - андрогены (тестостерон); В - витамин Дз; С - прогесте-
рон; D - олсил-холестерин; Е - кортизол; F - желчные кислоты.
112,
113. Да, снижение уровня общего холестерина в крови и повыше-
ние его в ЛВП уменьшает отложение холестерина в стенках сосудов.
114.
А. Семейная гиперхолестеринемия (недостаток рецепторов
ЛНП, дефект гена белка-рецептора ЛНП).
Б. Диета, физическая нагрузка, препараты - ингибиторы
синтеза холестерина, ловастин. Ингибиторы всасывания
холестерина: неомицин, смолы, связывающие желчные
кислоты - холестерамин.
13. Уменьшится.
115.
I гр.
СНз
NH2-СН-*СООН-------► С=О ------СНз-СО-SKoA
СН3 *СООН *СО2 на синтез
холестерина
166
II гр
*сн3 *сн3
.'Н-Nil; --► С = О —*CH3~CO-SK,A
С<Х)Н СООН СО? на синтез
2 холестерина
Во II гр. 14С в холестерине значительно больше.
116.
а) 8 9 -> Ю -> 13 2 -> 4 -> 12 -> 11.
б) 5 •-> 3 -> 2 -->4 -> 1 _> 6 -> 7,
117.
А. Холестерин + эфиры холестерина
пищи
просвет кишечника
холестеролэстераза
------------------->
жирные кислоты
глицерин ВЖК
стенка
кишечника лимфа
холестерин-----> ХМ, ЛОНП ---------э
(-90%) (-10%)
ЛП-липаза
кровь, стенки
капилляров
ХМ ост, ЛНП ------------------> холестерин печени.
кровь, печень
б. ;.
В. ГМГ’КоА-редуктаза.
Б. Холестерин печени —--> синтез мембран,
синтез желчных кислот.
Формулы холевой, гаурохолевой, гликохолевой кислот.
118.
А. Увеличится синтез холестерина.
В, Схема синтеза холестерина.
В. ГМГ-КоА-редуктаза (холестерин, желчные кислоты).
% ЛНП - доставка холестерина в ткани;
ЛВП - транспорт холестерина от тканей в печень;
Хиломикроны - перенос экзогенного холестерина в печень;
ЛОНП - выведение холестерина из печени в кровь.
167
119.
А. стенка
кишечника
Холестерин* —-------->
лимфа
хиломикроны*;
ЛОНП*
кровь
------->
ВЖК глицерин хиломикроны*
у у остаточные, рецепторы^ холе зтериц*
ЛП-липаза ЛНП* ^^^печени печени
ВЖК глицерин рецепторы
кровь а * Л Н П холестерин*
ЛОНП*--------> -»ЛНП*------------> тканей.
ЛП-липаза тканей
Б. Снизится за счет аллостерического ингибирования ак-
тивности ГМГ-КоА-редуктазы слизистой кишечника и
печени.
В.
СНз
СНз
ГМГ-КоА-редуктаза I
HOOC-CH2-C-CH2-COSKoz\--------------------► НООС-СНэНЗ-СНэ СН2ОН
он
2(НАДФН+Н ) 2НАДФ
он
ГМГЖоА
мевалонат
Г. Холестерин мембран, желчные кислоты, стероидные
гормоны: андрогены, эстрогены, кортикостероиды; ви-
тамин Дз.
120. рецепторы
А. ЛП-липаза ЛНП
Холестерин -> ЛОНП ——у>ЛНП--------------> холестерин-*
печени крови Ф мышечной мышц
ВЖК глицерин ткани
ЛВП-предшественники
V рецепторы ЛВП
-------------> ЛВП-зрелые частицы---------------------
печени
-э» холестерин печени.
Б. а - уменьшение синтеза холестерина ингибиторами
ГМГ-КоА редуктазы;
б - увеличение использования холестерина на синтез
желчных кислот под действием препаратов, усили-
вающих выведение желчных кислот из организма;
в - гемосорбция холестерина из плазмы крови;
г - индукция синтеза рецепторов ЛНП тироксином и эс-
традиолом;
д - низкокалорийная диета.
168
121. 1, Говорить с полном здоровье нельзя, так как содержание
холестерина у них несколько выше нормы.
2 Нет, так как неизвестен коэффициент атерогенности.
3 Определить концентрацию холестерина в ЛВП и рас-
“ Xjm
считать коэффициент атерогенности: К =--------,
Хлзп
где X - общий холестерин крови, Хлвп - холестерин в
ЛВП, если величина К > 4 (А -2-4), рекомендовать
профилактическое и медикаментозное лечение атеро-
склероза,
122. ЛХАТ
.4. Лецитин + холестерин---> олеил-холестерин + лизоле-
цитин.
К ЛВП.
В. ЛХАТ обеспечивает обогащение ЛВП холестерином за
счет откачки его из тканей и ЛНП, препятствует избы-
точному отложению холестерина в стенках сосудов.
123.
А, В печени.
Холестерин
хенодезоксихолевая холевая кислота
+глицин
НЛП
v таурин ф
парные желчные кислоты (например, таурохолевая
и гликохолевая).
В кишечнике микрофлора:
а) деконъюгирует парные желчные кислоты;
б) превращает хенодезоксихолат в литохолевую кислоту.
холевую кислоту в дезоксихолевую кислоту.
Я. Кругооборот желчных кислот в цикле:
Her.
169
В. Конъюгация увеличивает амфифильность молекул за
счет увеличения гидрофильной части молекул.
У холевой кислоты У таурохолевой кислоты
4 гидрофильные группы 6 гидрофильных групп
Г. Наблюдается нарушение следующих процессов:
1) поддержания холестерина желчи в растворимом со-
стоянии;
2) эмульгирования жиров пищи;
3) образования смешанных мицелл с продуктами гидро-
лиза жира, которые всасываются стенкой кишечника;
4) выведения холестерина из организма.
124,
Л. Да.
Б. А - 3; В - 4.
R 3 -» 8 -> 6 -> 10 -► 1 ->4.
Г. Синтез холестерина увеличится.
170
VII
ОБМЕН
АМИНОКИСЛОТ
1. Выберите, чем определяется пищевая ценность белков.
1. Аминокислотным составом.
2. Наличием заряда белковых молекул.
3. Возможностью расщепления в желудочно-кишечном тракте.
4. Порядком чередования аминокислот в молекуле белка.
5. Молекулярной массой белков.
2. Что происходит при активации протеолитических фермен-
тов (расположите выбранные пункты в необходимом порядке)?
1. Отщепление части пептида.
2. Образование новых слабых взаимодействий.
3. Образование активного центра.
4. Изменение взаиморасположения аминокислотных остатков.
3. Укажите, какие связи преимущественно расщепляются в
пептиде перечисленными ферментами.
А. Карбоксипептидаза.
В. Химотрипсин.
С. Трипсин.
D. Пепсин.
12 3 4
Ала - Гли - Тир - Тре - Apr - Вал - Иле.
4. Подберите к каждому проферменту соответствующий акти-
ватор.
1. Пепсиноген.
2. Трипсиноген.
3. Химотрипсиноген.
4. Прокарбоксипептидаза.
5. Подберите для каждой из перечисленных аминокислот со-
ответствующую
1. Гли.
2. Лей.
3. Apr.
4. Ала.
5. Лиз.
А. Бикарбонат натрия.
В. НС1.
С. Трипсин.
D. Энтеропептидаза.
А. Незаменимая аминокислота.
В. Заменимая аминокислота.
С. Частично заменимая.
хар актеристику.
6. Гис.
7. Сер.
8. Фен.
9. Глу.
10. Три.
6. В желудочно-кишечный тракт с белковой пищей поступили
пептиды следующего состава:
1 2 3 4 5
Ала - Тре - Тир - Сер - Apr - Иле - Вал.
171
А, Какие связи расщепляются приведенными ниже фермента-
ми?
А. Пепсин. D. Карбоксипептидаза.
В. Трипсин. Е. Аминопептидаза.
С. Химотрипсин.
Б. Укажите место синтеза для каждого фермента.
В. Продукты, которые образуются в результате совместно-
го действия ферментов, и их дальнейшую судьбу в желу-
дочно-кишечном тракте.
7. Крысам скармливали белковую смесь, содержащую поли-
пептидные фрагменты следующего состава:
~Цис-МеТ”Арг-ГлИ“Ала-Фен-Вал-Сер-
А. Под действием каких ферментов кишечника при перевари-
вании данного фрагмента белка появятся пептиды, С-
концевыми аминокислотами которых являются Apr и Фен?
Б. Объясните биологический смысл секреции этих ферментов в
виде проферментов и механизм активации.
В. Назовите группу пептидаз, к которой они относятся.
8. В состав белков пищи, которую скармливали животным,
входили пептиды следующего состава:
123456789
Ала-Сер-Гли-Тир-Гис-Фен-Лиз-Три-ВаЛ"Лей.
А. Назовите ферменты (и номер соответствующей связи),
которые расщепляют эти пептиды:
а) в желудке;
б) в просвете тонкого кишечника;
в) в слизистой тонкого кишечника (кишечной кайме).
Б. Назовите продукты, которые образуются в результате
совместного действия ферментов, и укажите их даль-
нейшую судьбу.
В. Ответьте на вопросы.
1. Какие из поступивших в клетки кишечника аминокис-
лот являются:
а) заменимыми; в) частично заменимыми;
б) незаменимыми; г) условно заменимыми.
2. Могут ли возникнуть нарушения в развитии молодых
крыс, если их долго держать на диете, в состав которой
будут входить в качестве пищевого белка только пере-
численные аминокислоты и почему?
9. После введения крысам аминокислоты, меченной 15N по а-
аминогруппе, метка быстро появляется в а-аминогруппах всех ами-
нокислот печени (кроме Лиз и Тре), ПОТОМУ ЧТО в печени ак-
тивно функционируют аминотрансферазы.
Ответ по табл. 2.
10. Сравните процессы трансаминирования и дезаминирова-
ния аминокислот.
172
1. Является этапом катаболизма А. Дезаминирование,
аминокислот. В. Трансаминирование.
2. Может служить для синтеза С. Оба процесса,
аминокислот. D. Ни один из процес-
3. Не приводит к изменению об- сов.
щего количества аминокислот.
4. Приводит к увеличению обще-
го количества аминокислот.
5. Сопровождается образованием
аммиака.
11. Для каждой из аминокислот укажите возможный тип де-
заминирования, подобрав соответствующие пары:
1. Гис. 5. Ала. А. Только прямое.
2. Тир. 6. Глу. В. Только непрямое.
3. Сер. 7. Фен. С. Оба типа дезаминирования.
4. Асп.
12. Выберите реакции и компоненты, характерные для процес-
сов прямого и непрямого дезаминирования.
1. Трансаминирование с А. Характерно толь-
а-кетоглутаратом.
2. Дезаминирование Глу.
3. Трансаминирование с оксало-
ацетатом.
4. Участвует фосфопиридоксаль.
5. Участвует НАД+.
6. Процесс не связан с трансами-
нированием.
7. Процесс сопряжен с синтезом
АТФ в ЦПЭ (цепи переноса
электронов - е).
ко для прямого де-
заминирования.
В. Характерно толь-
ко для непрямого
дез аминиров ания.
С. Характерно для
обоих процессов.
D. Не характерно ни
для одного из на-
званных процес-
сов.
13. Напишите реакцию трансаминирования между глутами-
новой и пировиноградной кислотами.
А. Укажите полное название фермента по прямой и об-
ратной реакциям, назовите кофермент.
Б, Для каких целей используется определение активности
трансаминаз в клинической практике?
14. А. Напишите реакцию трансаминирования между аспара-
гиновой и ос-кетоглутаровой кислотами, дайте назва-
ние фермента и кофермента.
Б. Выберите пункты, отражающие значение реакций тран-
саминирования.
1. Обеспечивают образование заменимых аминокислот.
2. Являются этапом катаболизма аминокислот.
3. Обеспечивают перераспределение аминного азота
между аминокислотами в организме.
4. Обеспечивают синтез незаменимых аминокислот.
Ответ по табл. 1,
173
15. Пациенту с острыми болями в области сердца определяли
активность аминотрансфераз в крови.
А. Активность какой из аминотрансфераз в наибольшей
степени увеличится при этой патологии?
Б. Напишите реакцию, катализируемую этим ферментом,
укажите кофермент.
16. Животных длительное время содержали на белковой диете
с искусственной смесью аминокислот, в которой отсутствовали глу-
таминовая, аспарагиновая кислоты и серин, однако нарушений в
развитии этих животных не обнаружили. Как можно объяснить этот
факт? Ответ подтвердите реакциями.
17. Крысам скармливали белковую пищу, содержащую пепти-
ды следующего состава:
-Ала-Сер-Гли-Фен-Гис- Лиз-Вал-.
Аминогруппы Ала, Фен, Гис содержали изотоп 15N, а угле-
родный скелет этих аминокислот - изотоп 14С.
Через 40 мин в печени обнаружили:
а) присутствие метки 15N в аспартате и глутамате;
б) меченные по 14С пировиноградную и уроканиновую ки-
слоты.
Напишите реакции, в которых образовались эти соединения из
соответствующих аминокислот. Укажите ферменты и коферменты.
18. Выберите процессы, сопровождающиеся образованием
аммиака в организме.
1. Дезаминирование аминокислот.
2. Обезвреживание биогенных аминов окислительным путем.
3. Распад мочевины.
4. Дезаминирование АМФ.
5. Аминирование а-КГ.
19. Подберите к пронумерованным реакциям обезвреживания
аммиака соответствующий фермент.
1. Глу + NH3 + АТФ -> Глн + А. В. Глутаминаза. Глутаминсинтетаза.
+АДФ + Ф.
2. а-КГ + NH3 + НАДНг ?=* Глу + НАД . С. Глутаматдегидро- геназа.
3. СОз + NH3 + 2 АТФ -> кар- бамоилфосфат + 2 АДФ + ф. D. Карбамоилфосфат- синтетаза.
20. Подберите к данным реакциям орнитинового цикла недос-
тающий компонент.
1. ? +аспартат -» аргининосукцинат. А. Цитруллин.
2. Орнитин + карбамоилфосфат -> ? В. Фумарат.
3. Аргинин -> мочевина + ? С. Орнитин.
4. Аргининосукцинат -> аргинин + ? D. Аргинин.
Е. Сукцинат.
174
21. Известно наследственное заболевание аргининосукцинату-
рия, при котором суточная экскреция аргининосукцината достигает 3 г
(в норме отсутствует). Укажите, дефект какого из перечисленных фер-
ментов орнитинового цикла приводит к данной патологии.
1. Карбамоилфосфатсинтетаза.
2. Орнитинкарбамоилтрансфераза.
3. Аргининосукцинатлиаза.
4. Аргининосукцинатсинтетаза.
5. Аргиназа.
22. При гриппе у детей может возникнуть тяжелая гипераммони-
емия, сопровождающаяся рвотой, потерей сознания, судорогами. Обна-
ружено, что вирус гриппа может вызвать нарушение синтеза карбамо-
илфосфатсинтетазы I. Концентрация каких веществ в крови при этом
увеличится?
1. Аммиака. 3. Аланина.
2. Глутамина. 4. Аргинина.
Ответ по табл. 1.
23. А. Покажите путь азота от аминогруппы валина до азота
мочевины:
1. Напишите реакцию дезаминирования этой аминокисло-
ты.
2. Напишите схему орнитинового цикла.
Б. Напишите реакцию, которая будет блокирована при
нарушении синтеза карбамоилфосфатсинтетазы I.
24. При тяжелых вирусных гепатитах у больных может раз-
виться печеночная кома, обусловленная, в частности, токсическим
: действием аммиака на клетки мозга.
А. Какова причина столь значительного накопления ам-
миака в крови?
I Б. Как изменится концентрация мочевины в крови у дан-
! ных больных?
25. Известно наследственное заболевание аргининосукцинату-
рия, при котором суточная экскреция аргининосукцината достигает 3 г
(в норме отсутствует). Заболевание протекает с судорогами, нарушени-
ем координации движений, аномалиями электроэнцефалограммы. Па-
тологоанатомически - некротические процессы в мозге.
А. Напишите схему орнитинового цикла и укажите место
блока.
Б. Запишите реакцию, которая будет блокирована при
данной патологии.
В. Объясните причину нарушения функции ЦНС.
Г. Можно ли таким больным вводить белковые препара-
ты, например для парентерального питания?
26. Известно наследственное заболевание цитруллинемия, кото-
рое проявляется у детей тяжелой рвотой, нарушением сознания, судоро-
гами. В крови обнаруживается значительное Количество цитруллина.
175
Л. Напишите схему реакций орнитинового цикла, на схеме
укажите место ферментного блока.
Б. Запишите реакцию, которая будет блокирована при
данной патологии.
В. Какую диету можно рекомендовать таким больным?
27. В 1962 г. впервые было описано наследственное заболевание:
семейная гипераммониемия (передается по аутосомно-рецессивному
типу). Это заболевание характеризуется стойким увеличением содержа-
ния в крови аммиака и полным отсутствием цитруллина. Основные
клинические симптомы связаны с поражением центральной нервной
системы.
А. Напишите реакцию, которая блокирована при данной
патологии.
Б. Почему состояние больных улучшается после введения
глутаминовой кислоты?
В, Как изменится суточное выделение мочевины при этой
патологии?
28. При синдроме Баттлера-Олбрайта отмечаются следующие
нарушения: снижается выделение солей аммония с мочой, повышается
экскреция натрия и калия (что приводит к гипонатриемии и гипока-
лиемии), возникает ацидоз. Цредположите, активность какого фермен-
та снижена в почках? Напишите реакцию, которую он катализируег.
Почему развивается ацидоз и увеличивается потеря калия и натрия?
29. Аммиак поступает в цикл синтеза мочевины в результате об-
разования карбамоилфосфата под действием карбамоилфосфатсинте-
тазы I (КФС-1). Этого фермента особенно много в митохондриях пече-
ни (до 15 - 20% от всего белка митохондрий). КФС-1 для проявления
своей активности нуждается в активаторе N-ацетилглутамате - продук-
те ацетилирования глутаминовой кислоты с помощью ацетил-КоА.
Концентрация N-ацетилглутамата в митохондриях жестко определяет-
ся концентрацией в них глутаминовой кислоты. Как будет осуществ-
ляться регуляция орнитинового цикла при чрезмерном поступлении
белков с пищей (не забудьте о регенерации аспарагиновой кислоты)?
30. Биохимическое исследование крови и мочи больного показа-
ло, что концентрация мочевины в моче равна 180 ммоль/сутки, а в кро-
ви - 1,5 ммоль/л. Нарушение какого метаболического пути можно пред-
положить? Каковы возможные причины этих нарушений?
31. Выберите процессы, в которых участвует без азотистый ос-
таток аминокислот:
1. Синтез заменимых аминокислот. 3. Синтез глюкозы.
2. Окисление до СОз и Н2О. 4. Синтез кетоновых тел.
Ответ по табл. 1.
32. Выберите, к какой группе по судьбе безазотистого остатка
относится каждая из перечисленных аминокислот.
1. Глу. А. Гликогенные.
176
2. Фен. В. Кетогенные.
3. Ала. С. Смешанные.
4. Лиз.
5. Вал.
33. Проследите пути превращения Лей, поступившего с пищей
в организм человека. Для этого ответьте на следующие вопросы.
А. К какой группе аминокислот по возможности синтеза в
организме относится Лей?
Б, Напишите реакцию дезаминирования Лей.
В. Каким образом образовавшийся аммиак будет обез-
врежен в мышцах? Напишите реакции.
Г. К какой группе аминокислот по судьбе безазотистого
остатка относится Лей?
34. Проследите пути превращения Ала, поступившего с пищей
в организм человека. Для этого ответьте на следующие вопросы.
А. К какой группе аминокислот - заменимым или незаме-
нимым - относится Ала?
Б. Напишите реакцию дезаминирования Ала.
В. Каким образом образовавшийся аммиак будет обез-
врежен в клетках мозга? Напишите реакцию.
Г К какой группе аминокислот по судьбе безазотистого
.остатка относится Ала? Напишите схему, подтвер-
ждающую Ваш ответ.
35. На изолированных гепатоцитах исследовали синтез глюкозы
из аминокислот. Для этого к культуре клеток добавляли различные
аминокислоты и регистрировали скорость образования глюкозы. В
контрольном опыте (без добавления аминокислот) скорость глюконео-
генеза составляла 0,15 мкмоль глюкозы в минуту. При введении в инку-
бационную среду Ала, Про, Глу скорость увеличивалась до 0,17-
0,18 мкмоль/мин, а при добавлении Лиз и Лей не изменялась. Как Вы
объясните это наблюдение? Напишите реакции глюконеогенеза из Ала
До образования фосфоенолпирувата.
36. Была предпринята попытка выяснить влияние молочной ки-
слоты на метаболизм печени. В качестве модели использовали срезы
печени, которые инкубировали в солевом буферном растворе. Через два
часа после добавления в инкубационную смесь лактата в среде опреде-
ляли содержание некоторых веществ. В качестве контроля использовали
Инкубационную смесь без добавления лактата. Результаты опытов
Субстрат О пр еделяемые вещества (в ммоль/л)
глюкоза аланин мочевина аммиак
Контроль (без добав- ления лактата) 0,48 0,05 0,76 0,13
Опыт (с 10 ммоль лак- тата) 3,47 0,36 0,51 0,08
Как Вы объясните наблю
12 Сборник тестов и задач по биохимии
177
37. Выберите пункты, отражающие роль метионина в обмене
веществ.
1. Донор метильной группы при синтезе ряда соединений.
2. Источник серы при синтезе цистеина.
3. Участвует в инициации процесса трансляции.
4. Донор метильной группы при обезвреживании гормо-
нов и лекарственных веществ.
5. Участвует в глюконеогенезе.
38. Выберите из предложенных процессы обмена, которые бу-
дут нарушены при недостатке фолиевой кислоты.
1. Образование S-аденозилметионина.
2. Синтез метионина из гомоцистеина.
3. Синтез пуриновых нуклеотидов (ДНК, РНК).
4. Превращение серина в глицин.
5. Превращение серина в цистеин.
39. В метаболизме Сер и Гли принимает участие витамин, вы-
полняющий важную роль в синтезе ряда соединений.
А. Назовите этот витамин и его производное, выполняю-
щее коферментную функцию.
Б. Напишите реакцию образования Гли из Сер, укажите
фермент.
40. Сульфаниламиды являются эффективными антибактери-
альными препаратами, которые нарушают у бактерий перенос од-
ноуглеродных фрагментов; некоторые лекарственные препараты -
новокаин и др., содержащие остаток л-аминобензойной кислоты и
распадающиеся в организме с ее освобождением, могут оказывать
значительное антисульфаниламидное действие.
А. Какие метаболические процессы будут нарушены при
приеме сульфаниламидов?
Б. Произойдут ли такие же нарушения в клетках человека?
В. Какова причина антисульфаниламидного действия но-
вокаина?
41. Животному ввели серин с меченым атомом углерода 14С в со-
положении. Через некоторое время метка была обнаружена в креатине.
А. Напишите формулу креатина и укажите меченый угле-
родный атом.
Б. Отсутствие какого витамина может привести к наруше-
нию синтеза креатина?
42. Крысам ввели метионин с меченной 14С метильной груп-
пой. Через некоторое время метка была обнаружена в креатине.
А. Напишите реакцию, в результате которой меченый
атом углерода включился в креатин.
Б. Перечислите аминокислоты, принимающие участие в
синтезе креатина.
178
43» Животному ввели метионин с меченной 14С метильной
группой. Через некоторое время метка была обнаружена в составе
холина.
А. Напишите реакцию, в результате которой меченый
атом метионина включился в состав холина.
Б. Напишите формулы еще двух соединений, для синтеза
которых необходима метильная группа метионина.
44. Генетический дефект фенилаланингидроксилазы проявляется
как наследственная болезнь - фенилкетонурия, ПОТОМУ ЧТО в отсут-
ствие фермента в крови уменьшается содержание фенилаланина.
Ответ по табл. 2.
45. А. Дополните схему пути катаболизма фенилаланина в пе-
чени, подставив вместо цифр названия промежуточных
продуктов:
Фен -э- 1 2 -> 3 4 ацетоацетат + фумарат.
Б. Назовите наследственное заболевание, которое может
возникнуть при нарушении первой реакции этого мета-
болического пути.
46. Л. Дополните схему пути обмена тирозина в меланоцитах,
подставив вместо цифр названия промежуточных ме-
таболитов:
Тир -> 1 -> 2 -> меланины.
Б. При наследственном дефекте одного из ферментов этого
метаболического пути у больных нарушено образование
пигментов (альбинизм), увеличена чувствительность к
солнечному свету.
1. Назовите фермент, дефект которого приводит к дан-
ному заболеванию.
2. Напишите реакцию, которая будет блокирована при
отсутствии этого фермента.
47. Л. Дополните схему пути катаболизма тирозина в печени,
подставив вместо цифр названия промежуточных ме-
таболитов:
Тир _> I 2 -> 3 -> фумарат + ацетоацетат.
Б. При наследственном дефекте одного из ферментов это-
го метаболического пути у больных моча на воздухе
приобретает черный цвет.
1. Назовите заболевание и фермент, дефект которого
приводит к данному заболеванию.
2. Напишите реакцию, которая будет блокироваться
при отсутствии этого фермента.
48. Пептид, поступивший в организм с пищей, содержал фенила-
ланин, все атомы углерода которого были мечены 14С. Позже эти угле-
родные атомы обнаружили в ацетоацетате и фосфоенолпирувате. На-
пишите схему метаболического пути, приведшего к включению 14С в
вышеуказанные соединения.
179
49. В моче больного найдено значительное количество гомо-
гентизиновой кислоты.
А. Как образуется гомогентизиновая кислота в организме
(напишите схему)?
Б. Содержится ли гомогентизиновая кислота в моче здо-
ровых людей?
В. Назовите заболевание, обнаруженное у вышеуказанно-
го больного, и причину его возникновения.
50. Альбиносы (люди с очень бледной кожей и белыми волосами)
плохо переносят воздействие солнца, загар у них не развивается, а по-
являются ожоги. Какое нарушение метаболизма лежит в основе этого
явления?
51. У ребенка обнаружили повышенное содержание фенилпи-
рувата в моче, содержание фенилаланина в крови составило
35 мг/дл (норма около 1,5 мг/дд). Для какого заболевания характер-
ны представленные признаки? Укажите причины его возникнове-
ния.
52. Подберите каждому из указанных биогенных аминов ами-
нокислоту (или ее производное), из которой он образуется.
1. Гистамин. 2. у-аминомасляная кислота. 3. Ацетилхолин. 4. Серотонин. А. Сер. В. Три. С. Гис. D. Глу.
53. Выберите ферменты, которые участвуют в реакциях инак-
тивации биогенных аминов:
1. Декарбоксилаза. 4. Фосфорилаза.
2. Моноаминооксидаза. 5. Трансметилаза.
3. Трансаминаза.
54. Подберите ферментам, участвующим в обмене аминокис-
лот, соответствующие коферменты.
1. Декарбоксилазы.
2. Аминотрансферазы.
3. Глутаматдегидрогеназа.
4. Моноаминооксидазы.
5. Метилтрансферазы.
А. ФАД.
В. НАД+.
С. Фосфопиридоксаль.
D. Нд-фолат.
Е. Тиаминпирофосфат.
F. Биотин.
55. Животному ввели смесь аминокислот, атомы углерода ко-
торых были мечены 14С. Через некоторое время в крови обнаружили
адреналин с мечеными углеродными атомами в ароматическом
кольце. Метаболизм какой аминокислоты, поступившей с пищей,
привел к образованию этого соединения? Ответ подтвердите соот-
ветствующей схемой.
56. При болезни Паркинсона выражен дефицит дофамина, по-
этому для лечения применяют препараты ДОФА или ингибиторы
180
МАО (ипраниазид и др.). Объясните действие названных лекарст-
венных препаратов, написав соответствующие реакции.
57. Накопление биогенных аминов - продуктов декарбоксили-
рования аминокислот - можег вызвать ряд серьезных нарушении в
организме, однако существуют механизмы инактивации и выведе-
ния этих соединений.
А. Напишите в общем виде реакцию инактивации биоген-
ных аминов окислительным путем.
Б. Укажите фермент и кофермент.
58. При беременности питание плода у человека осуществляется
за счет глюкозы и аминокислот крови матери (жиры через плаценту
практически не проходят). Эти вещества плод использует и для пласти-
ческих нужд (роста), и в качестве источника энергии. Концентрация
глюкозы в крови матери на протяжении беременности снижается, осо-
бенно на поздних сроках. В организме матери усиливается глюконеоге-
нез, в частности из аминокислот, однако и этот процесс не обеспечивает
необходимого количества глюкозы. Укажите источник аминокислот в
организме матери, если поступление белков с пищей ограничено. Кон-
центрация каких веществ будет повышена в крови у матери в этих усло-
виях? Возможен ли синтез жира в организме плода из аминокислот?
59. Животные длительное время получали пищу, содержащую
только белки, однако концентрация глюкозы в крови находилась на
постоянном уровне.
А. Напишите схему превращений, которые поддерживают
постоянную концентрацию глюкозы в крови (на приме-
ре Глу).
Б, Назовите аминокислоты, которые могут включаться в
этот процесс.
60. При длительном голодании белки скелетных мышц ис-
пользуются в качестве источника энергии. Перечислите, какие пре-
вращения должны произойти с этими белками и продуктами их рас-
пада в скелетных мышцах и в печени, прежде чем сердечная мышца
и мозг смогут использовать энергию их распада.
Эталоны ответов к разделу VII
“ОБМЕН АМИНОКИСЛОТ”
1. 1,3- з. 1 - D; 2 - В; 3 - С; 4 - А.
2. 1 -> 4 -> 2 -> 3. 4. 1 - В; 2 - D; 3 - С; 4 - С.
5. 1 - В; 2 - А; 3 - С; 4 - В; 5 - А; 6 - С; 7 - В; 8 - А; 9 - В; 10 - А.
6.
А. 1 - Е; 2 - А; 3 - С; 4 - В; 5 - D.
181
12*
Б. А - желудок; В, С, D - поджелудочная железа; Е - кишеч-
ная кайма.
В. Отдельные аминокислоты пептида поступают в клетки
слизистой кишечника.
7.
А. Трипсин, химотрипсин.
Б. Частичный протеолиз; защита от разрушения белков кле-
ток.
В. Эндопептидазы.
8.
А. а. Пепсин, связи - 3, 5.
б. Карбоксипептидаза - 9; химотрипсин- 6, 8; трипсин- 7.
в. Аминопептидаза - 1; дипептидазы - 2, 4.
Б. Аминокислоты; путем активного транспорта они посту-
пают в клетки эпителия кишечника.
В. 1. а. Ала, Сер, Гли.
б. Фен, Лиз, Три, Вал, Лей.
в. Гис.
г. Тир.
2. Могут, так как отсутствуют 3 незаменимые аминокисло-
ты.
9. А.
10. 1 - С; 2-В; 3-В; 4-D; 5-А.
И. 1 - С; 2 - В; 3 - С; 4 - В; 5 - В; 6 - А; 7 - В.
12. 1 - В; 2 - С; 3 - D; 4 - В; 5 - С; 6 - А; 7 - С.
13. Глу + пируват t > а-КГ + Ала (формулами).
А. Глутаматпируватаминотрансфераза; аланинаминотранс-
фераза; пиридоксальфосфат.
Б. Для подтверждения диагноза повреждения печени или
сердца.
14. а-КГ + Асп > Глу + оксалоацетат (формулами).
А. Глутаматоксалоацетатаминотрансфераза, аспартата-
минотрансфераза, пиридоксальфосфат.
Б. А.
15.
А. Аспартатаминотрансфераза.
Б. Глу + оксалоацетат <----> а-КГ + Асп. (формулами).
Кофермент пиридоксальфосфат.
16. Глу, Асп, Сер - заменимые аминокислоты; они легко синте-
зируются в организме путем трансаминирования имеющихся ами-
нокислот с соответствующими кетокислотами. Например:
. 182
Ала + ос-КГ —» Глу + Тир;
Глу + оксалоацетат -> Асп + а-КГ.
Углеродный скелет Сер синтезируется из глюкозы.
17. а. Ала + оксалоацетат<£=> пируват + Acn-15N; аланин-
оксалоацетатаминотрансфераза; пиридоксальфосфат.
Фен + а-КГ ^=>фенилпируват + Diy-15N; фенилала-
нин-а-КГ-аминотрансфераза; пиридоксальфосфат.
б. Ала + а-КГ^=> пируват 14С + Глу; аланинаминотранс-
фераза; пиридоксальфосфат.
Уроканиновая кислота
Фермент гистидаза
18. 1, 2, 4.
19. 1 - В; 2 - С; 3 - D.
20. 1 - А; 2 - А; 3 - С; 4 - В.
21.3.
22. А.
23.
А. 1. Непрямое дезаминирование:
h2n—сн—соон
Н3С СНз
h2n— сн—соон
сн2
сн2
соон
соон
I
с=о
I
сн2
I
сн2
соон
НАД+ НАДН+Н+
соон
I
с=о
I
сн
Н3С СНз
H2N—сн-соон
I
сн2
I
сн2
I
соон
соон
C=NH
сн2
сн2
соон
нр
соон
с=о
I
СН2 + NH3
сн2
соон
183
2.
Б. NHs + С02 + 2АТФ + Н2О -» H2N-CO-OPO3H2 +
+ 2АДФ + Н3РО4.
24.
А. Массивное поражение гепатоцитов -> уменьшение нор-
мально функционирующего объема ткани печени сни-
жение скрости синтеза мочевины накопление NH3.
Б. Снижена.
25.
А. Схема синтеза мочевины (см. № 23, А.2); аргининосукци-
натлиаза.
Б.
СООН hn=c—nh2
NH==C“NH—СН I I NH СООН
1 1 NH СН2 ► (СН2)3 + сн
1 1 1 II
(СН2)з СООН сн—nh2 СН
CH-NIb соон СООН
СООН
В, Дефект фермента приводит к накоплению аргининосукци-
ната, его предшественников, следовательно, и аммиака.
Эти соединения оказывают токсическое действие на нерв-
ные клетки.
Г. Нельзя (чтобы не увеличивать концентрацию аммиака,
накапливающегося при катаболизме аминокислот).
26
А. Схема реакций орнитинового цикла (см. № 23, А.2) ар-
гининоелг^ттднатсинтетя з а.
184
Б.
H2N—С=О СООН
I I
NH H2N—СН
I I
(СН2)з + СН2 + АТФ
I I
ch-nh2 СООН
СООН аспартат
цитруллин
СООН
I
HN=C-NH—СН
I I
---► NH СН2 +АМФ+ФФ
I I
(СН2)з СООН
CH“NH2
СООН
аргинин о сукцинат
Я С малым содержанием белка.
разой.
NH?
I '
СН2
I
СН2 +
СН2
I
СН-nh2
СООН
орнитин
27.
А. Реакция, катализируемая орнитинкарбамоилтрансфе-
nh2
nh2 с=о
I I
С=О --------► NH
ОРО3Н2 (СН2)3
ch—nh2
COOH
кар б ам о и лф ос ф аг цир ушшн
Я Глутаминовая кислота участвует в обезвреживании ам-
миака (увеличенное поступление глутамата способству-
ет большему связыванию аммиака —> уменьшение его
токсического действия).
Я Уменьшится.
28. Фермент - глутаминаза.
h2n—сн-соон h2n-ch-cooh
СН, СН2
I * I
СН, ---------------------► СН2 + NH3
СО—NH2 СООН
Глу Глу
185
Ион аммония участвует в поддержании кислотно-щелочного
равновесия, т. е. способствует выведению протона и аниона кислоты; в
отсутствие NH4+ анионы кислот выводятся в виде натриевых и калие-
вых солей.
29. Увеличенное поступление аминокислот приведет к их усилен-
ному катаболизму, следовательно, образованию аммиака. В митохонд-
рии печени увеличится поток глутамина. Глутамин под действием глу-
таминазы превращается в глутаминовую кислоту и NH3. При возраста-
нии концентрации Глу в митохондриях увеличится образование N-
ацетилглутамата, следовательно, активируется карбамоилсинтетаза I и
усилится синтез мочевины.
30. Концентрация мочевины ниже нормы, снижена скорость
орнитинового цикла, причиной этого может быть значительное по-
ражение печени - цирроз, гепатит и др.
31. Е.
32. 1-А; 2-С; 3-А; 4-В; 5-А.
33.
А. Незаменимая.
Б.
соон
сн—nh2
I
сн2
сн
/\
Н3С сн3
СООН
I
С«О
а-КГ
сн2
сн
/\
Н3С сн3
Глу
Глу + НАД+ ---► а-КГ + НАДН2 + NH3.
В. NH3 + а-КГ + НАДН? -> Глу + НАД.
Глу + пируват <=> а-КГ + Ала (который покидает
мышцы).
Г. Кетогенные.
34.
А. Заменимая.
Б. Ала + а-КГ <=> пируват + Глу.
Глу + НАД* -> а-КГ + НАДНг + NH3.
В. NH3 + Глу + АТФ -> Глн + АДФ + Ф.
Г. Гликогенная: Ала —> пируват -> оксалоацетат —>
-> фосфоенолпируват -» ... -> глюкоза.
186
35. Ала, Про, Глу - гликогенные аминокислоты, а Лиз и Лей -
кетогенные, поэтому из них синтез глюкозы невозможен.
Ала -> пируват оксалоацетат -» фосфоенолпируват.
36. Без добавления лактата в гепатоцитах идет глюконеогенез
из аминокислот (в частности, из Ала), что отражается в увеличен-
ном количестве мочевины и аммиака.
В присутствии лактата начинается активный синтез глюкозы
из него. Образование мочевины и аммиака уменьшается. Аминокис-
лоты используются для других целей.
37. 1,2, 3,4, 5.
38. 2, 3, 4, 5.
39.
А. Фолиевая кислота, Нд-фолат.
Я
Н2С-—ОН сериноксиметил-
j трансфераза
НС~NH2 + Нд-фолат ------------► Н2С—NH2
I I
СООН СООН + 5,10-метилен-Нд-фолат + Н/
Сер Гли
40.
А. Синтез пуриновых нуклеотидов (ДНК, РНК); синтез
Гли и Цис; синтез Мет из гомоцистеина.
Б. Нет, так как для человека витамином является целиком
фолиевая кислота.
В. и-Аминобензойная кислота, образующаяся при распаде
новокаина, будет использоваться бактериями для синтеза
фолиевой кислоты.
41.
А.
h2n—c=nh
N—СН3
*сн2
I
соон
Б. Фолиевой кислоты.
187
42.
A.
Мет— ->S-AM ; H2N-C=NH + S-AM — —►h2n— c=nh
NH NH—СНз 1
СН2 1 1 сн2
1 СООН СООН
гуаниданацетаг креатин
Б. Apr, Гли, Мет.
43.
А.
H0“CH2~СН2 —Nib + 3 S-аденозилметионин-----------►
этан о лам ин
/СНз
> НО—СН2“СН2—N+— СНз + 3 S-аденозилгомоцистеин,
4 СНз
ХОЛИН
Б.
NH2
I
C=NH
I
N—СНз
I
сн2
I
СООН
CH2 —NH—СНз
креатин адреналин
44. С.
45.
А. Фен -> тар -» параоксифенилпируват -> гомогенти-
зиновая кислота -> фумарилацетоацетат -> ацетоаце-
тат + фумарат.
Б. Фенилкетонурия.
46.
А. Тир -» ДОФА -> ДОФАхром -> меланины.
Б. 1. Тирозингидроксилаза.
188
2.
он
ch-nh2
соон
сн—nh2
соон
тирозин ДОФА
47.
А. Тирозин параоксифенилпируват -> гомогентизино-
вая кислота фумарилацетоацетат -» фумарат 4- аце-
тоацетат.
Я 1. алкаптонурия, оксидаза гомогентизиновой кислоты;
2.
он
сн2—соон
он
ф ум арилацето ацетат
го м о гентизино вая кис лота
48. Фен -> Тир^-»^^->^умарилацетоацетат -> ацетоацетат.
Фумарат -> малат -» оксалоацетат-* фосфоенолпируват.
49.
А. Гомогентизиновая кислота образуется при катаболизме
Фен и Тир:
Фен -> Тир -> параоксифенилпируват гомогентизиновая
кислота -> фумарилацетоацетат -> фумарат.
ацетоацетат
Б. В моче здоровых людей гомогентизиновой кислоты нет,
так как она является промежуточным продуктом обмена
Фен и Тир и в норме превращается в фумарилацетоацегат.
В. Алкаптонурия; врожденный дефект фермента, катали-
зирующего окисление гомогентизиновой кислоты.
50. Дефект фермента тирозингидроксилазы нарушает образова-
ние из тирозина темного пигмента кожи - меланина, при недостатке
которого кожа плохо защищена от УФ-лучей, что приводит к солнеч-
ным ожогам.
189
51. Заболевание - фенилкетонурия, возникает вследствие дефекта
фермента фенилаланингидроксилазы, что приводит к нарушению син-
теза тирозина из фенилаланина и к накоплению фенилпирувата.
52. 1 - С; 2 - D; 3 - А; 4 - В.
53. 2, 5.
54. 1 - С; 2 - С; 3 - В; 4 - А; 5 - D.
55. Фен ->Тир -> ДОФА -> дофамин норадреналин
адреналин.
56. ДОФА -> дофамин (препарат ДОФА способствует увели-
чению концентрации дофамина).
.он
дофамин
Применение ингибиторов МАО также приводит к увеличению
концентрации дофамина.
57.
А.
о2
R—СН2 —NH2 + Н2О ---► R—ОН + NH3 + Н2О2.
58. Источник аминокислот - белки тканей организма матери:
мышцы, печень. Будет повышена концентрация аминокислот - Ала,
Глу; мочевины; кетоновых тел.
Синтез жира из аминокислот возможен:
аминокислоты -» ацетил-КоА -> жирные кислоты -> жиры.
59.
А Глу -> а-КГ -> сукцинил-КоА -> сукцинат -> фу-
марат -> малат -> оксалоацетат -> фосфоенолпи-
руват -> ... -> глицеральдегид-фосфат -> ... глюкоза.
Б. Гликогенные аминокислоты - все, кроме Лей и Лиз.
60. Распад белков в скелетных мышцах, транспорт аминокис-
лот в печень, дезаминирование и использование углеродного скеле-
та аминокислот на глюконеогенез в печени, транспорт глюкозы в
мозг и сердечную мышцу.
190
VIII
ОБМЕН НУКЛЕОТИДОВ
1. Выберите процессы, в
нуклеотиды и их производные.
1. НАДФН.
2. дТТФ.
3. УДФ-глюкоза.
4. УДФ-глюкуронат.
5. цАМФ.
которых участвуют перечисленные
А. Биосинтез ДНК.
В. Биосинтез гликогена.
С. Биосинтез стероидов.
D. Обезвреживание веществ в
печени.
Е. Активация протеинкиназ.
F. Окисление жирных кислот.
2. Выберите из перечисленных условий возможные причины
подагры.
1. Избыточный синтез пуриновых нуклеотидов.
2. Нарушение синтеза ОМФ.
3. Избыточное поступление нуклеиновых кислот с пищей.
4. Снижение скорости реутилизации пуриновых оснований.
5. Снижение скорости образования мочевой кислоты.
6. Ускорение синтеза нуклеиновых кислот.
3. Выберите неверно указанные причины эффективности ал-
лопуринола при лечении подагры.
1. Является конкурентным ингибитором ксантиноксидазы.
2. Увеличивает скорость выведения мочевой кислоты почками.
3. Уменьшает скорость образования мочевой кислоты.
4. Ускоряет катаболизм пиримидиновых нуклеотидов.
5. Повышает концентрацию гипоксантина в моче.
4. Используя цифровые обозначения, расположите перечис-
ленные метаболиты в порядке их участия в синтезе пиримидиновых
нуклеотидов. 1. СОг. 2. Аспартат. 3. УМФ. 4. АТФ. 5. Карбамоилфосфат. 6. Глн. 7. ОМФ. 8. Карбамоиласпартат. 9. Дигидрооротат. 10.5-фосфорибозил-1 - дифосфат. 11. Оротат.
5. Дополните недостающими компонентами реакции синтеза
Нуклеотидов.
1. Глн + СОг + ? -» карбамоилфосфат + Глу + 2АДФ +
НзРО4.
2. Рибозо-5-фосфат + АТФ -> ? + АМФ.
3. 5-фосфорибозил-1 -дифосфат + Глн -> ? + Глу.
4. Оротат + ? -» ОМФ + Н4Р2О7.
191
5. ИМФ + ? + ГТФ -> АМФ + ГДФ + фумарат + Н3РО4.
6. ОМФ -> ? + СО2.
А. 5-фосфорибозил-1-амин.
В. Аспартат.
С. 2 АТФ.
D. 5-фосфорибозил-1-дифосфат.
Е. УМФ.
6. Выберите соединения, являющиеся донорами азота в синте-
зе пуриновых и пиримидиновых нуклеотидов.
1. Глицин. 2. Глутамин. 3. Аспартат. 4. Аланин. 5. Формил-ТГФК. А. Синтез пуринов. В. Синтез пиримидинов. С. Синтез обеих групп. D. Не является донором для указанных групп.
7. Выберите соединения, являющиеся донорами углерода в
синтезе пуриновых и пиримидиновых нуклеотидов.
1. Глицин. 2. Глутамин. 3. Метилен-ТГФК. 4. Аспартат. 5. Метенил-ТГФК. А. Синтез пуринов. В. Синтез пиримидинов. С. Синтез обеих групп. D. Не является донором для указанных групп.
6. СО2.
8. Выберите регуляторные ферменты синтеза пуриновых и пи-
римидиновых нуклеотидов.
1. Карбамоилфосфатсинтетаза II. А. Синтез пуринов.
2. Ксантиноксидаза. В. Синтез пиримиди-
3. Амидофосфорибозил- нов.
трансфераза. С. Оба процесса.
4. Нуклеозидмонофосфаткиназа. D. Ни один из про-
цессов.
9. Назовите ингибиторы перечисленных регуляторных фер-
ментов синтеза пуриновых и пиримидиновых нуклеотидов (цифра -
буква).
1. Карбамоилфосфатсинтетаза II. А. ЦТФ.
2. Рибонуклеотидредуктаза. В. 5-фосфорибозил-1-
3. Амидофосфорибозилтрансфе- дифосфат.
раза. С. ГМФ.
D. дАТФ.
10. В химиотерапии опухолей применяется антибиотик азасе-
рин - структурный аналог глутамина, который ингибирует ами-
дотрансферазные реакции. Выберите на представленных схемах
этапы, протекающие с участием глутамина.
1 2
А. Рибозо-5-фосфат -> 5-фосфорибозил-1-дифосфат ->
192
3^ АМФ
-> 5-фосфорибозил-1-амин -> ИМФ^
4* ГМФ
1 2 3
Б. COi + X + У —> Карбамоилфосфат -» Дигидрооротят ->
л 4 5 6 7 8
-> Оротат -> ОМФ -> УМФ -> УДФ ->УТФ -> ЦТФ.
В. Напишите формулы ГМФ и ЦМФ и отметьте атомы
азота, происходящие из амидной группы глутамина.
11. При наследственной оротацидурии с мочой выводится до
1,5 г оротовой кислоты. Напишите реакцию, торможение которой
приводит к возникновению оротацидурии.
12. Выберите компоненты, необходимые для синтеза дезокси-
рибонуклеотидов.
1. Нуклеозидмонофосфаты. 6. АТФ.
2. Нуклеозиддифосфаты. 7. Дезоксирибоза.
3. Нуклеозидтрифосфаты. 8. Тиоредоксинредуктаза.
4. НАДФН. 9. НАДН.
5. Рибонуклеотидредуктаза. 10. Тиоредоксин.
13. Субстратом для синтеза дТМФ является дУМФ.
А. Представьте последовательность реакций синтеза
дУМФ из УМФ, используя перечисленные нуклеотиды.
1. УМФ. 4. УДФ. 7. дУТФ.
2. АТФ. 5. дУДФ.
3. УТФ. 6. дУМФ.
Б. Напишите реакцию превращения дУМФ в дТМФ, на-
зовите фермент и кофермент.
14. Выберите, какие реакции будут блокированы аналогами
фолиевой кислоты.
1. Биосинтез ИМФ.
2. Биосинтез АМФ из
ИМФ.
3. Превращение серина в
4. Образование дТМФ из
дУМФ.
5. Биосинтез ДНК.
6. Биосинтез полисахаридов
глицин.
15. Структурный аналог фолиевой кислоты - метотрексат -
тормозит синтез тимидиловых нуклеотидов и используется в качест-
ве лечебного препарата, подавляющего опухолевый рост.
А. Напишите реакцию, которая тормозится в присутствии
метотрексата.
Б. Назовите производные фолиевой кислоты, участвую-
щие в реакции.
В. Объясните, почему метотрексат снижает скорость этой
реакции.
13 Сборник тестов и задач по биохимии
193
16. Через час после внутривенного введения животным аспар-
тата, содержащего изотоп 15N, радиоактивная метка была обнару-
жена в РНК и ДНК разных органов и тканей.
А. В каких нуклеотидах ДНК и РНК окажется “метка”?
Б. Напишите формулы азотистых оснований, входящих в
состав этих нуклеотидов и обозначьте в них радиоак-
тивный азот.
17. В химиотерапии рака используют 5-фторурацил - струк-
турный аналог тимина. Установлено, что он подавляет синтез ДНК
в быстрорастущих тканях, ингибируя тимидилатсинтазу.
А. Напишите реакцию, катализируемую тимидилатсинта-
зой.
Б. Назовите кофермент.
5. 5-фтордезоксиуридин.
6. НАДФН.
7. Аминоптерин.
18. Выберите из перечисленных соединений вещества, сни-
жающие активность тимидилатсинтегазы.
1-дУМФ.
2. 5-фторурацил.
3. Метотрексат.
4. Метилен-ТГФК
(метилен - Нд-фолат).
Эталоны ответов к разделу VIII
“ОБМЕН НУКЛЕОТИДОВ”
1. 1 - С; 2 - А; 3 - В; 4 - D; 5 - Е.
2. 1, 3, 4.
3. 2, 4.
\ \ 10ч Ч
4.1 ^>5 8 -» 9 —> 11 Ч»7 -АЗ.
4 !
5. 1 - С; 2 - D; 3 - А; 4 - D; 5 - В; 6 - Е.
6. 1 - А; 2 - С; 3 - С; 4 - D; 5 - D.
7. 1 - А; 2 - D; 3 - В; 4 - В; 5 - А; 6 - С.
8. 1 - В; 2 - D; 3 - А; 4 - D.
9. 1 - А; 2 - D; 3 - С.
194
10.
A. 2, 4.
Б. 1, 8.
В.
11.
он
nh2
о' N - рибозо-5 '-фосфат
*
h2n
ФРПФ
Н4Р2О7
HN >
X Z-COOH,
□ N - рибозо-5'-фосфат
12. 2, 4, 5,8, 10.
13.
А 1 ->4->5->6.
Б. Е-тимидилатсинтаза
о
метилен-ТГФК
O^N - дезоксирибозо-5 -фосфат
О
А. .снз
<Г + ДГФК
q' N - дезоксирибозо-б'-фосфат
14. 1, 3, 4, 5.
15.
А. См. 13, Б.
Б. Метилен ТГФК (Нд-фолат).
В. Метотрексат - ингибитор дигидрофолатредуктазы.
16.
А. дЦМФ, ТМФ, дАМФ, дГМФ, УМФ, АМФ, ЦМФ,
ГМФ.
Б.
н^Мс
H2N N N
н
о
А. См. 13,К
Б. Метилен-ТГФК (метилен-Нд-фолат).
18. 2, 3, 5, 7.
195
IX
ГОРМОНАЛЬНАЯ РЕГУЛЯЦИЯ
ОБМЕНА ВЕЩЕСТВ И ФУНКЦИЙ
1. Подберите к структурным формулам гормонов соответст-
вующие названия.
сн—он
I
СН2—NH—СН3
сн2—сн
4nh2
сн2—nh2
А. Адреналин.
В. Альдостерон.
С. Норадреналин.
D. Кальцитриол.
Е. Эстрадиол.
F. Тетрайодтиронин.
G. Тестостерон.
Н. Кортизол.
196
2. Распределите перечисленные гормоны по группам (А - С) в
соответствии с их химическим строением:
— 5. Кортизол.
6. Тиротропин.
7. Соматотропин.
8. Кортикотропин.
1. Паратгормон.
2. Прогестерон.
3. Трийодтиронин.
4. Инсулин.
А. Белки.
В. Стероиды.
С. Производные аминокислот.
А. Почки.
В. Костная ткань.
С. Кишечник.
D. Печень.
3. К указанным гормонам подберите соответствующие орга-
ны-мишени.
1. Кальцитонин.
2. Альдостерон.
3. Кальцитриол.
4. Паратгормон.
5. Глюкагон.
4. Выберите гормоны, которые обеспечивают указанные из-
менения в органах-мишенях.
1. Стимулирует распад гликогена в печени и мыш- А. Адре-
цах. налин.
2. Стимулирует липолиз в жировой ткани. В. Инсу-
3. Стимулирует глюконеогенез. лин.
4. Усиливает катаболизм аминокислот в мышцах. С. Корти-
5. Увеличивает скорость поступления глюкозы в зол.
клетки мышц и жировой ткани.
6. Стимулирует синтез жиров в жировой ткани.
5. Выберите положения, правильно отражающие функцию
глюкокортикоидов.
1. Увеличивают скорость поступления глюкозы в клетки
мышц и жировой ткани.
2. Уменьшают скорость поступления аминокислот в клетки
мышечной ткани.
3. Стимулируют синтез специфических белков в лимфоид-
ной и соед инительной ткани.
4. Стимулируют глюконеогенез.
5. Стимулируют синтез гликогена в печени.
6. Увеличивают скорость катаболизма аминокислот в пече-
ни и мышцах.
7. Стимулируют липолиз в жировой ткани.
6. Представьте последовательность событий, происходящих
при передаче гормонального сигнала в клетки жировой ткани при
участии глюкагона, используя цифровые обозначения.
13*
197
1. Взаимодействие гормона со специфическим рецептором.
2. Активация протеинкиназы.
3. Образование цАМФ.
4. Активация аденилатциклазы.
5. Гидролиз триацилглицеринов.
6. Фосфорилирование ТАГ-липазы.
7. Выберите утверждения, правильно характеризующие дейст-
вие паратгормона.
1. Усиливает мобилизацию кальция из костей.
2. Стимулирует задержку натрия в организме.
3. Усиливает реабсорбцию кальция.
4. Усиливает реабсорбцию воды.
5. Активирует аденилатциклазу в клетках-мишенях.
6. Снижает реабсорбцию фосфатов.
8. Используя цифровые обозначения, представьте последова-
тельность событий, обеспечивающих стимуляцию глюконеогенеза при
голодании.
1. Проникновение кортизола в клетки печени.
2. Синтез и секреция кортиколиберина.
3. Взаимодействие кортизола с рецептором.
4. Взаимодействие кортикотропина с рецептором.
5. Связывание комплекса гормон-рецептор с хроматином.
6. Активация аденилатциклазы.
7. Синтез и секреция кортизола.
8. Связывание кортизола с транскортином.
9. Синтез и секреция кортикотропина.
10. Индукция синтеза ферментов глюконеогенеза.
9. Дополните схему в одно-солевого обмена в условиях крово-
потери, заменив цифры буквами, соответствующими подходящим
выражениям.
— ф объем крови «
L>1 артериальное^ | Ф давление 1 4 \ Ф 2 ф образование ангиотензина II 1 1 -» задержка Na+ . 5 задержка воды 6 потребление воды
198
А. Секреция ренина.
В. Образование ангиотензина.
С. Сужение сосудов.
D. Секреция альдостерона.
Е. Секреция антидиуретического гормона.
F. Чувство жажды.
• 10. Расставьте цифры в порядке, отражающем последователь-
ность событий, происходящих в гепатоците под влиянием ядрена линя
1. Гликоген-* глюкозо-1-фосфат.
2. Аденилатциклаза неактивная -> аденилатциклаза ак-
тивная.
3. Адреналин -> комплекс гормон-рецептор.
4. Протеинкиназа неактивная -> протеинкиназа активная.
5. Фосфорилаза “Ь” -> фосфорилаза “а”.
6. АТФ -> цАМФ.
11. При поступлении в организм большого количества углеводов
усиливаются процессы депонирования энергетического материала.
А. Выберите гормоны, обеспечивающие эти процессы.
1. Глюкагон.
2. Альдостерон.
3. Адреналин.
4. Инсулин.
5. Кальцитонин.
6. Кортизол.
Б. Выберите изменения метаболизма, возникающие в орга-
нах-мишенях под влиянием выбранных Вами гормонов.
1. Усиление синтеза гликогена в печени.
2. Усиление синтеза жиров из углеводов.
3. Усиление распада гликогена в печени и мышцах.
4. Увеличение скорости поступления глюкозы и амино-
кислот в ткани.
5. Ускорение липолиза в жировой ткани.
6. Ускорение глюконеогенеза в печени.
12. По мере исчерпания запаса гликогена в организме усили-
вается катаболизм жиров. Известно, что “жиры сгорают в пламени
углеводов”.
А. За счет какого процесса в этих условиях поддерживает-
ся необходимая концентрация глюкозы?
Б. Выберите признаки, характерные для 3-дневного голо-
дания.
1. Кетонемия. 4. Гиперглюкоземия.
2. Азотемия. 5. Алкалоз.
3. Азотурия. 6. Гипоглюкоземия.
199
13. Выберите изменения метаболизма, которые вызывают
кортизол и глюкагон. А. Характерно для
1. Стимулирует мобилизацию
2. гликогена в печени. Стимулирует глюконеогенез. кортизола. В. Характерно для
3. Стимулирует распад белков в глюкагона.
4. мышцах. Стимулирует синтез жиров из С. Характерно для обоих г эрмонов.
5. углеводов. Стимулирует мобилизацию D. Не характерно ни для одного из гор-
гликогена в мышцах. монов.
характерные для голодания и сахар
14. Выберите симптомы,
ного диабета.
1. Гиперглюкоземия.
2. Кетонемия.
3. Гипоглюкоземия.
4. Глюкозурия.
5. Полиурия.
6. Алкалоз.
7. Ацидоз.
А. Характерно для голодания.
В. Характерно для сахарного диа-
бета.
С. Характерно для обоих случаев.
D. Не характерно ни для одного из
состояний.
15. Выберите симптомы, характерные для сахарного и неса-
харного диабета.
1. Гиперглюкозе- А. Характерно только для сахарного
мия. диабета.
2. Полиурия. 3. Кетонемия. 4. Аццдоз. 5. Азотемия. В. Характерно только для несахарного диабета. С. Характерно для обоих заболеваий. D. Не характерно ни д ля одного из забо- леваний.
16. Выберите симптомы, характерные для сахарного и стеро-
идного диабета.
1. Гиперглюкозе- мия. 2. Кетонемия. 3. Полиурия. 4. Гипертензия. 5, Гипоглюкоземия. А. Характерно для стероидного д иа- бета. В. Характерно для сахарного диабета. С. Характерно для обоих случаев. D. Не характерно ни для одного.
17. Выберите изменения, характерные для избыточной секре-
ции кортизола и альдостерона.
1. Повышение концентрации А. Характерно для гипо-
натрия в плазме крови. кортицизма.
2. I ипоглюкоземия. В. Характерно для гинер-
200
3. Гипертензия.
4. Увеличение 17-кето-
стероидов в моче.
5. Повышенное выведение
натрия с мочой.
6. Нарушение водно-
электролитного обмена.
альдостеронизма.
С. Характерно для обоих
заболеваний.
D. Не характерно ни для
одного.
18. При обследовании больного с подозрением на скрытый диа-
бет был использован метод определения толерантности к глюкозе. Ре-
зультаты исследования подтвердили предварительный диагноз.
А. Изобразите “сахарную кривую”, характерную для данного
случая.
F. Объясните, какие изменения в характере кривой дали возмож-
ность подтвердить диагноз.
В. Почему у здоровых людей таких изменений не наблюдается?
19. Больному, страдающему хроническим инфекционно-
аллергическим заболеванием, в течение длительного периода назна-
чали преднизолон (структурный аналог кортизола). После улучше-
ния состояния препарат отменили. Вскоре после этого появились
признаки гипокортицизма (слабость, гипотония, гипоглюкоземия).
Концентрация 17-кетостероидов в моче ниже нормы.
А. Чем объясняется ухудшение состояния больного?
Б. Наступит ли улучшение в состоянии больного, если ему
ввести кортикотропин?
20. У больного обнаружена опухоль надпочечников, продуци-
рующая повышенное количество кортизола.
А. Перечислите изменения показателей крови, наиболее
характерные для этого случая.
Б. Назовите основные процессы, обусловливающие дан-
ные изменения.
В. Составьте схему, отражающую механизм “обратной
связи” в регуляции синтеза и секреции кортизола.
21. У 4-месячного ребенка ярко выражены явления рахита.
Расстройств пищеварения не отмечается. Ребенок много находится
на солнце. В течение 2 месяцев ребенок получал витамин Дз, однако
проявления рахита не уменьшились.
А. Чем можно объяснить развитие рахита у этого ребенка?
Б, Напишите формулу гормона, образующегося из витамина Дз.
22. Гиперпаратиреоидизм - заболевание, в основе которого
лежит гиперпродукция паратгормона. У больных отмечается мы-
201
щечная слабость, остеопороз и деформация костей, образование
почечных камней.
А. Как меняется концентрация кальция в крови у таких
больных?
Б. За счет стимуляции каких процессов это происходит?
23. Выберите симптомы, характерные для гиперальдостеро-
низма и несахарного диабета.
1. Гипертензия. А. Характерно для гипераль-
2. Полиурия. досгеронизма.
3. Повышение осмотического В. Характерно для несахарно-
давления. го диабета.
4. Повышенная жажда. С. Характерно для обоих за-
s. Гиперглюкоземия. болеваний.
D. Не характерно ни для од-
ного.
24. Выберите изменения, характерные для гипопар атиреои-
рахита.
1. Снижение концентра-
ции кальция в крови.
2. Остеопороз.
3. Уменьшение всасывания
кальция в кишечнике.
4. Повышение реабсорб-
ции кальция в почках.
5. Повышение концентра-
ции кальция в крови.
А. Характерно для гипопа-
ратиреоидизма.
В. Характерно для рахита.
С. Характерно для обоих
заболеваний.
D. Не характерно ни для
одного.
25. Л. Выберите из перечисленных веществ составляющие ре-
нин-ангиотензиновой системы и расположите их в по-
рядке функционирования:
1) ангиотензин I; 4) альдостерон;
2) ангиотензин И; 5) ангиотензиноген.
3) ренин;
Б. Подберите каждому из гормонов соответствующее ме-
сто синтеза. 1. Вазопрессин. 2. Альдостерон. 3. Ренин. 4. Кортикотропин. 5. Ангиотензиноген. А. Печень. В. Почки. С. Гипофиз. D. Гипоталамус. Е. Надпочечники.
В. Выберите положения, правильно отражающие образо
ванне и функции ангиотензина II.
1. Стимулирует сужение сосудов.
2. Является протеолитическим ферментом.
202
3. Стимулирует синтез альдостерона.
4. Является субстратом ренина.
5. Является продуктом частичного протеолиза ангио-
тензиногена.
6. Образуется из ангиотензина I путем частичного про-
теолиза.
26. Расположите события, происходящие при синтезе и секре-
ции тиреоидных гормонов в необходимом порядке, используя циф-
ровые обозначения.
1. Иодирование остатков тирозина в тиреоглобулине.
2. Синтез тиреоглобулина в гипоталамусе.
3. Объединение двух йодированных молекул тирозина с
образованием три- и тетрайодпроизводных.
4. Поступление йодтиронинов в клетки-мишени.
5. Синтез и секреция тиротропина.
6. Связывание йодтиронинов с тироксинсвязываюшим белком.
27. Выберите типы клеток, не являющихся мишенями тирео-
идных гормонов.
А. Гепатоциты.
В. Адипоциты.
С. Мышечные клетки.
D. Половые клетки.
Е. Клетки соединительной ткани.
F. Клетки мозга.
А. Только
гормоны.
В. Только ме-
диаторы.
С. Оба.
D. Ни те, ни
другие.
28. Выберите свойства, характерные для тканевых гормонов и
нейромедиаторов.
1. Действуют при очень низких концентрациях.
2. Действуют через специфические рецепторы.
3. Поступают в клетки-мишени из крови.
4. Секретируются специализированными эндок-
ринными клетками.
5. Используются в качестве энергетического или
строительного материала.
6. Обладают тканевой избирательностью дейст-
вия.
7. Вызывают специфический спектр эффектов.
8. Облад ают коротким периодом полужизни.
• 29. Выберите свойства гормонов, отличающие их от других
биологических регуляторов.
1. Действуют при очень низких концентрациях.
2. Действуют через специфические рецепторы.
3. Поступают в клетки-мишени из крови.
4. Секретируются специализированными эндокринными
клетками.
5. Обладают относительной стабильностью.
203
А. Рецепторы с тирозинкиназной
активностью.
В. Рецепторы с активностью фак-
торов транскрипции.
С. Рецепторы-модуляторы G-
белков.
30. Подберите соответствующий тип рецепторов к перечис-
ленным гормонам.
1. Тироксин.
2. Инсулин.
3. Адреналин.
4. Вазопрессин.
5. Тиротропин.
6. Прогестерон.
7. Ретиноевая кислота.
31. Под берите к гормонам соответствующие транспортные белки.
1. Кальцитриол. А. Сексстероидсвязывающий белок.
2. Эстрадиол. В. Транскальциферин.
3. Кортизол. С. Транскортин.
4. Тестостерон. D. Транспортные белки неизвестны.
5. Вазопрессин.
32. Взаимодействию с эстрадиолом каких белков соответ-
ствуют равновесные константы диссоциации?
1. Альбумин. А. 0,1 нМ.
2. Антитела к эстрадиолу. В. 1 нМ.
3. Рецептор эстрогенов. С. 100 нМ.
4. Сексстероидсвязывающий белок. D. 10000 нМ.
33. Определите основную структурную детерминанту лиган-
дов сексостероидсвязывающего белка по известным величинам
сродства гормонов к белку: 5а-дагидрогестостерон - 100% тестостерон - 50% эстрадиол - 10% прогестерон - 0,1% кортикостерон - 0,01% А. А4-3-кетогруппа. В. 3-кетогруппа. С. 3-оксигруппа. D. 17р-оксигруппа. Е. 20-кетогруппа. F. 11 р-оксигруппа. G. 17а-оксигруппа.
34. Какие свойства гормонов изменяются при указанных пре-
вращениях?
1. 25-оксивитамин Дз -> 1,25-диоксивитамин Дз.
2. Тестостерон 5а-дигидротестостерон.
3. Тироксин -» трийодгиронин.
А. Повышение сродства к рецепторам.
В. Снижение сродства к транспортным белкам.
35. Подберите возможные гфичины указанных патологиче-
ских состояний.
1. Мужской ложный гермафродитизм.
2. Синдром тестикулярной феминизации:
а) недостаточность секреции андрогенов;
б) недостаточность 5а-редуктазы;
в) недостаточность рецептора андрогенов.
204
36. при анализе связывания 3Н-эстрадцола (3Н-Е2)-рецепторами
эстрогенов, выделенными из опухоли молочной железы двух больных,
В каком случае можно ожидать ремиссии опухоли?
а. После овариэктомии;
б. После лечения антиэстрогеном.
37. Чем обусловлена десенситизация клетки к адреналину при
избыточности гормона?
1. Интернализацией рецептора.
2. Кластеризацией рецептора.
3. Фосфорилированием рецептора.
38. Тестостерон, прогестерон, альдостерон способны воспро-
изводить некоторые эффекты кортизола. Чем обусловлена перекре-
стная активность этих гормонов?
I. Гомологичностыо гормон-связывающих участков соот-
ветствующих рецепторов.
2. Взаимодействием гормонов с “чужим” рецептором.
3. Гомологичностыо ДНК-связывающих доменов соответ-
ствующих рецепторов.
4. Сходством гормон-чувствительных элементов контро-
лируемых этими гормонами генов.
Эталоны ответов к разделу IX
“ГОРМОНАЛЬНАЯ РЕГУЛЯЦИЯ
ОБМЕНА ВЕЩЕСТВ И ФУНКЦИЙ”
1. 1 - А; 2 - Н; 3 - В; 4 - F; 5 - С; 6 - D; 7 - G; 8 - Е.
2. А- 1,4,6, 7, 8; В-2, 5; С - 3.
3. 1 - В; 2 - А; 3 - В, С; 4 - А, В, С; 5 - D.
4. 1-А; 2-А; 3-С; 4-С; 5-В; 6-В.
205
5. 2, 4, 6.
6. l->4-»3->2->6 -> 5.
7. 1,3, 5, 6.
8. 2 —> 9 —> 4 —> 6 —> 7 —> 8 —> 1 —> 3 —>5 —> 10.
9. 1 - D; 2 - В; 3 - C; 4 - A; 5 - E; 6 - F.
10. 3 -> 2 ->6 -> 4 ->5 -> 1.
11. A. 4.
Б. 1, 2, 4.
12.
А. За счет глюконеогенеза.
Б. 1,2, 3,6.
13. 1 - В; 2-С; 3-A; 4-D; 5-D.
14. 1 - В; 2 - С; 3 - A; 4 - В; 5 - В; 6 - D; 7 - С.
15. 1 - А; 2 - С; 3 - А; 4 - А; 5 - А.
16. 1 - С; 2 - В; 3 - В; 4 - А; 5 - D.
17. 1 - В; 2 - А; 3 - В; 4 - А; 5 - D; 6 - В.
18.
Б. Высокая концентрация глюкозы в течение 3 ч.
В. Выделяется инсулин и концентрация глюкозы снижает-
ся.
19.
А. При длительном применении преднизолона подавляет-
ся синтез АКТГ (механизм обратной связи).
Б. Наступит, если функция коры надпочечников сохране-
на. Синтез кортизола возобновится.
206
20.
А. Гиперглюкоземия, азотемия.
Б. Глюконеогенез, катаболизм аминокислот.
В. Гипоталамус -» гипофиз -> кора над- -> кортизол,
(кортиколиберин) (кортико- почечников
тропин)
21.
А. Нарушение синтеза кальцитриола.
Б.
22.
А. Повышается.
Б. Повышенной реабсорбции кальция в почках; вымыва-
нием кальция из костей.
23. 1 - А; 2 - В; 3 - А; 4 - С; 5 - D.
24. 1 - А; 2 - А; 3 - С; 4 - D; 5 - D.
25. А. 3 -> 5 -» 1 -> 2 -» 4.
Б. 1 - D; 2 - Е; 3 - В; 4 - С; 5 - А.
В. 1,3, 6.
26. 5 -» 2 -> 1 -» 3 -> 6 -+ 4.
27. D, F.
28. 1 - С; 2 - С; 3 - D; 4 - А; 5 - D; 6 - С; 7 - С; 8 - С.
29. 3, 4.
30. 1 - С; 2 - А, В; 3 - С; 4 - С; 5 - С; 6 - В; 7 - В.
31. 1 - В; 2 - А; 3 - С; 4 - А; 5 - D. 35. 1 - а, б, в; 2 - в.
32. 1 - D; 2 - В; 3 - А; 4 - С. 36. 1 - а,б; 2 - б.
33. D. 37.1,3.
34. 1 - А, В; 2 - А; 3 - А, В. 38. 3, 4.
207
БИОХИМИЯ ПЕЧЕНИ
1. В эксперименте через 1-2 ч после экстирпации (полного
удаления) печени концентр алия каких из перечисленных веществ в
крови уменьшится?
1. Глюкоза. 6. ЛОНП.
2. Аммиак. 7. Креатин.
3. Аминокислоты. 8. Белки свертывания крови.
4. Мочевина. 9. Альбумин.
5. Прямой билирубин.
2. Пациенту в лечебных целях назначили диету с низким со-
держанием углеводов. Количество белков и жиров в рационе доста-
точно. Концентрация глюкозы в крови нормальная, уровень глико-
гена в печени несущественно снижен.
А. За счет какого процесса (преимущественно) поддержива-
ется уровень глюкозы в крови?
Б. Какие субстраты могут быть использованы в этом про-
цессе:
а) при интенсивной мышечной нагрузке;
б) через 5-6 ч после еды;
в) при голодании в течение 7 дней?
3. Как изменится скорость перечисленных ниже процессов, про-
исходящих в печени после приема пищи, богатой углеводами в период
пищеварения (Т - увеличится; - уменьшится; <-> - не изменится)?
1. Синтез гликогена. 4. Синтез кетоновых тел.
2. Синтез мочевины. 5. Синтез фосфолипидов.
3. Синтез глюкозы. 6. Синтез альбуминов.
4. Какие из перечисленных процессов происходят в печени?
1. Синтез гликогена.
2. Синтез холестерина.
3. Синтез альбумина.
4. Синтез мочевины.
5. Синтез инсулина.
6. Синтез глюкозы.
7. Синтез кетоновых тел.
8. Синтез фосфолипидов.
5. Скорость каких реакций
(обозначены цифрами) увеличится?
а) после еды;
б) при голодании;
в) при сахарном диабете?
обмена ацетил-КоА в печени
208
11
тела
6. В результате жизнедеятельности кишечной микрофлоры
образуется ряд соединений, токсичных для организма, например
скатол:
А. Из какой аминокислоты образуется скатол?
NH
Б. Составьте схему процесса микросомального окисления
скатола, используя перечисленные ниже компоненты:
1) О2;
2) цитохром Р450;
3) НАДФН-дегидрогеназа;
4) Ре3+-белок.
В. Напишите формулами реакции дальнейшего обезврежи-
вания этого соединения в организме.
7. При лечении хронического алкоголизма применяют тету-
Рам, в результате чего происходит накопление в организме уксусно-
го альдегида.
А. Напишите схему метаболизма этанола до стадии обра-
зования уксусной кислоты.
Б. Какой фермент ингибируется при лечении тетурамом?
8. Фенобарбитал (снотворное) в печени обезвреживается гид-
роксилированием в «-положении ароматического кольца и в после-
дующем подвергается глюкуронированию.
А. Напишите реакции обезвреживания фенобарбитала.
И Сборник тестов и задач по биохимии
209
В. Какой лекарственный препарат можно использовать
для предотвращения развития этой желтухи у новорож-
денных и почему?
16. Для моделирования острого поражения печени животаым
вводят per os или внутрибрюшинно ССЬ 0,2 мл в растительном мас-
ле на 100 г веса животного. У животного развивается центролобу-
лярный некроз паренхимы печени с пиком через 34 часа. Объясните,
почему в этот период у животных в крови увеличивается содержание
аммиака? Ответ проиллюстрируйте схемой реакций.
17.
nh2
- 2-нафтил-амин, относящийся к группе аро-
матических аминов, используется в производстве анилиновых кра-
сителей. Известно, что путь “обезвреживания” в организме этого
соединения включает микросомальное окисление, реакции конъю-
гации.
А. Напишите реакции окисления и конъюгации данного
соединения.
Б. Как называется промежуточный продукт, который яв-
ляется канцерогеном?
Я Почему при работе с анилиновым красителем возника-
ет рак мочевого пузыря?
Эталоны ответов к разделу X
“БИОХИМИЯ ПЕЧЕНИ”
1. 1,3, 5,6,7, 8, 9.
2.
А. Глюконеогенез.
Б, а - лактат; б - глицерин; в - аминокислоты.
3. 1 - Т ; 2 -1; 3 - Ф; 4 - о; 5 -1; 6 - о .
4. 3,4, 7.
5. а -1,6, 7, 9, 11.
6-2,3, 4, 5, 8, 10.
в-2, 3, 5, 8, 10.
212
А. Из триптофана.
Б. RH + О2 + НАДФН + Н+ + Fe3+ -» ROH + НгО +
(скатол) (Р450) (скатоксил)
+ НАДФ+ + Fe2+.
над+ надя ^о
СН3-СН2ОН —г~—► СН3—С + Н2О —►
этанол +
ZOH НАД НАДН О
—►СНз—С—ОН Ь.—-Z------> СНз-с'
4 ОН ЧН
Б. Ацетальдегиддегидрогеназа.
8.
гидроксилирование
----------------->
Б. Система микросомального окисления, глюкуронилиро-
вание.
А. 1 - В; 2-С; 3-А; 4-D.
Б. 3, 4.
В.
ИНДОЛ
14*
213
10. Ацетилизониазид
А.
СО—NH—NH— С “СНз *
II
О
ацетилирование
//°
CrCv ГИДО О ЛИЗ
|) NH-NH2----►
N
О СООН
+ 2NH3
N
изониазид
из оникотиновая кислота
Б. Кофермента НАД+.
И- <
А. Так как этанол является индуктором микросомального
окисления, то система обезвреживания будет протекать
с повышенной скоростью.
Б. Эффективность использования наркотических средств
будет снижена.
12. А - 3, 7; В - 1, 2, 4, 6; С - 5, 8.
13. Г>- 1; С - 2; В -3;А - 4;А - 5.
14.
А. Определить количественное содержание билирубина в
сыворотке крови; можно ожидать повышения содержа-
ния прямого билирубина.
Б. НЬ -» вердогемоглобин -> биливердин -> билирубин.
Далее билирубин в соединении с альбумином транспор-
тируется кровью в печень, где происходит его конъюга-
ция с глюкуроновой кислотой.
В. Определение в клинике содержания общего билирубина и
его фракций имеет важное значение при дифференциаль-
ной диагностике желтух. При гемолитической желтухе ги-
пербилирубинемия возникает в основном в результате об-
разования непрямого билирубина. При печеночной желту-
хе нарушена экскреция прямого билирубина в желчные
каналы, и он попадает в кровь, увеличивается его содер-
жание, увеличивается количество и непрямого билирубина.
При механической желтухе нарушено желчевыделение,
резко повышено содержание прямого билирубина в крови.
15.
А. Гемолитическая.
Б. См. ответ к задаче 14.
214
В. Фенобарбитал, так как он является индуктором глюкуро-
нилтрансферазы в реакциях обезвреживания билирубина.
16. 90% всего образующегося в организме аммиака выводится в виде
мочевины. Синтез мочевинообразования (орнитиновый цикл) происход ит в
печени. В связи с поражением печени этот цикл нарушается.
2-нафтиламин 2-амиио-1-нафтол
Б. 2-амино-1-нафтол.
В. В мочевом пузыре часть конъюгатов расщепляется гид-
ролазами и вновь образуется канцерогенный 2-амино-1-
нафтол.
215
XI
БИОХИМИЯ
КРОВИ
1. Цитрат натрия целесообразно добавлять в донорскую
кровь, чтобы сохранить ее в жидком состоянии, ПОТОМУ ЧТО
возникает искусственный дефицит одного из факторов свертывания
крови - ионов кальция.
Ответ по табл. 2.
2. В отсутствие ионов Са2+ кровь свертывается, ПОТОМУ
ЧТО ионы Са2+ необходимы для формирования функционально ак-
тивных факторов II, VII, IX, X.
Ответ по табл. 2.
3. В клинике дикумарол используется для предупреждения об-
разования тромбов. На чем основано такое применение дикумаро-
ла?
4. Почему свертываемость крови в пробирке сохраняется при
добавлении дикумарола?
5. Каким образом гепарин предупреждает свертываемость крови?
6. Если допустить, что каждый этап каскада протеолитиче-
ских реакций свертывания крови сопровождается образованием 100
молекул соответствующего активного фактора свертывания под
действием одной молекулы предшествующего фактора, то сколько
молекул фибрина образуется в результате каскада реакций, начиная
с активации фактора Хагемана (XII)?
7. Почему у людей с наследственной недостаточностью фак-
тора Хагемана (XII) кровь не сворачивается в пробирке, но сохра-
няет способность сворачиваться в организме больного?
8. Сколько молекул глицина необходимо для синтеза 1 моле-
кулы гема?
216
9. Выберите наиболее часто встречающиеся причины возник-
новения желез одефицитных анемии.
1. Систематические кровопотери.
2. Дефицит витамина В12.
3. Беременность.
4. Врожденная недостаточность трансферрина.
5. Гиперальдостеронизм.
6. Операции на желудочно-кишечном тракте.
10. Назовите причины возникновения гемохроматоза.
1. Повышенное всасывание железа в кишечнике.
2. Интенсивная лактация.
3. Частые и массивные переливания крови.
4. Пониженная секреция желудочного сока.
11. Выберите, какими факторами может быть обусловлено
развитие метгемоглобинемий.
1. Отравление окислителями.
2. Низкое парциальное давление кислорода.
3. Наследственный дефект метгемоглобииредуктазы.
4. Отравление угарным газом.
12. Какие ферменты участвуют в реакциях инактивации ак-
тивных форм кислорода?
1. Глутатионпероксидаза. 4. Каталаза.
2. Глутатио нредуктаз а. 5. Супер оксиддисмутаз а.
3. Глутаматдегидрогеназа.
13. Присутствующая в эритроцитах НАДФН-редуктаза вос-
станавливает вводимую внутривенно метиленовую синь, которая в
свою очередь, переводит метгемоглобин в гемоглобин. Когда целе-
сообразно использовать этот антидот?
14. Кислород необходим для ряда реакций, приводящих к об-
разованию соединений пероксидной природы, с помощью которых
лейкоциты уничтожают фагоцитированные микроорганизмы. Ка-
кие процессы при этом активизируются в лейкоцитах?
1. Продуцирование супероксидного иона.
2. Ускорение реакций цитратного цикла.
3. Образование перекиси водорода.
4. Ускорение реакций пентозофосфагного пути.
5. Повышение активности НАДФН и НАДН-оксидаз.
217
15. Гипоальбуминемия может возникать по следующим причи-
нам.
1. Нарушения усвоения белка.
2. Повышенный распад белков при отрицательном азоти-
стом балансе.
3. Обезвоживание организма при диаррее.
4. Поражение клеток печени при острых отравлениях ток-
сическими веществами.
5. Недостаток одной незаменимой аминокислоты в пище-
вых белках.
16. Альбумин составляет более половины всех белков сыво-
ротки крови. Какие из перечисленных функций он выполняет?
1. Связывает и транспортирует эндогенные метаболиты.
2. Участвует в поддержании осмотического давления кро-
ви.
3. Участвует в иммунных процессах.
4. Транспортирует многие ксенобиотики, в том числе ряд
лекарств.
17. На какой каталитической поверхности происходит каскад
реакций плазменных белков свертывания крови?
18. Каков внутренний механизм свертывания крови?
19. Каков внешний механизм свертывания крови?
20. Каков общий путь для внутреннего и внешнего механиз-
мов свертывания крови?
21. Взаимной резистентностью каких трех компонентов обес-
печиваются механизмы регуляции гемостаза?
1. Сосудистая стенка. 4. Лейкоциты.
2. Эритроциты. 5. Свертывающие белки
3. Тромбоциты. плазмы крови.
22. К каким явлениям могут привести аномалии в механизмах
регуляции гемостаза?
23. Каким образом происходит связывание фибрина с клетка-
ми?
218
24. Каким образом осуществляется регуляция свертывания
крови?
25. Что служит барьером между кровью и ее соединительно-
тканными элементами?
26. Какие из перечисленных белков являются адгезивными и
участвуют в инактивации свертывания крови?
1. Фактор Виллибрандга.
2. Антитромбин III.
3. Тромбин.
4. Тромбомодулин.
5. Тромбоспондин.
6. Фактор XII.
7. Фибриноген.
8. Фибронектин.
27. Кратко опишите структуру основного свертывающего
белка крови - фибриногена.
28. Назовите универсальное свойство тромбоцитов.
29. Для чего вырабатываются в кровотоке глюкозаминогликаны?
4. Дерматансульфат.
5. Хондроитин-6-сульфат.
6. Хондроитин-4-сульфат.
30. Отберите из перечисленных глюкозаминогликанов один - с
наивысшими антикоагулянтными свойствами, - играющий важную
роль в предотвращении тромбозов.
1. Гиалуроновая кислота.
2. Кератансульфат.
3. Гепарин.
31. Как известно, гепарин в крови в свободном виде практиче-
ски не существует, а в силу своих структурных особенностей взаи-
модействует с белками крови, аминами, пептидами, аминокислота-
ми. Какую роль в организме играют комплексные соединения гепа-
рина, возникающие в крови при активации функции противосвер-
тывающей системы?
32. Отберите те протеолитические ферменты, при действии
которых возможно превращение фибриногена в фибрин.
1. Тромбин. 4. Фактор X.
2. Плазмин. 5. Фактор XII.
3. Стафилокоагулаза. 6. Фактор XIII.
33. При быстром и обильном поступлении в кровоток массив-
ных количеств тромбопластических веществ или тромбина и разви-
тии вследствие этого частичной афибриногенемии возможно час-
219
тичное свертывание крови. Это может наблюдаться при патологии
или даже при стрессорных воздействиях на здоровый организм. Ос-
новной причиной развития геморрагий в таких случаях является
высокая фибринолитическая и антикоагулянтная активность крови.
Появление при этом в крови каких агентов вызывает повышение
фибринолитической, а каких - антикоагулянтной активности крови?
1. Гепарин. 5.
2. Активатор плазмино-
гена. 6.
3. Плазмин. 7.
4. Плазминоген. 8.
Комплексы гепарина с
белками крови.
Тромбин.
Фибриноген.
Фактор XII.
34. Известно, что в молекуле фибриногена имеется 160-170 пеп-
тидных связей, чувствительных к действию плазмина. В зависимости от
продолжительности его воздействия на фибрин/фибриноген расщепля-
ется большее или меньшее число пептидных связей и, следовательно,
образуются продукты деградации, отличающиеся молекулярной массой
и представляющие разные участки молекулы фибриногена. Различают
ранние и поздние продукты деградации (ПДФ) фибриногена/фибрина.
Какие фрагменты фибриногена из перечисленных ниже относят-
ся к ранним, а какие к поздним продуктам деградации (при действии
плазмина на фибриноген) и какими свойствами (свертывающими или
антикоагулянтными) они обладают?
1. Высокомолекулярный фрагмент X.
2. Высокомолекулярный фрагмент Y.
3. Низкомолекулярный фрагмент А.
4. Низкомолекулярный фрагмент В.
5. Низкомолекулярный фрагмент С.
6. Фрагмент D.
7. Фрагмент Е.
35. Отберите из представленных биологически активных ве-
ществ и фармакологических препаратов те, которые усиливают
фибринолитические свойства крови за счет выброса в кровоток из
сосудистой стенки активатора плазминогена.
6. Люминал.
7. Прогестерон.
8. Гидрокортизон.
9. Простагландин Ei.
1. Но-шпа.
2. Дибазол.
3. Теофиллин.
4. Нитроглицерин.
5. Эфирный наркоз.
36. Как меняется фибринолиз крови при употреблении сли-
вочного масла более 45 г?
1. Усиливается. 2. Угнетается.
220
Эталоны ответов к разделу XI
“БИОХИМИЯ КРОВИ”
1. А.
2. D.
3. Дикумарол является антивитамином К. В результате сни-
жается концентрация протромбина, в синтезе которого принимает
участие витамин К. Так как действие дикумарола связано с наруше-
нием синтеза ряда факторов свертывания крови (VII, IX, и X), его
эффект проявляется не быстро.
4. Являясь антагонистом витамина К, дикумарол препятству-
ет посттрансляционному карбоксилированию в печени остатков
глутаминовой кислоты в составе протромбина и других неактивных
предшественников свертывания крови. В пробирке для этого нет
условий.
5. Гепарин способствует образованию неактивных комплек-
сов антитромбина с тромбином и другими факторами свертывания
крови.
6. Обеспечение очень быстрого тромбообразования связано с
образованием в конечном итоге 10iC молекул фибрина.
7. Фактор XII активируется только в результате его взаимо-
действия с чужеродной поверхностью (коалином, стеклом, коллаге-
ном). В организме этот фактор не играет существенной роли, так
как свертывание крови преимущественно идет по внешнему меха-
низму за счет активации тканевого фактора III - тромбопластина.
8. 8 молекул.
9.1,3, 4, 6.
10.1,3.
11. 1,3.
12. 1, 2, 4, 5.
13. При острых отравлениях окислителями, сопровождающих-
ся метгемоглобинемией.
221
14.1,3,5.
15. 1,2, 4,5.
16. 1,2,4.
17. На поверхности “активированных” тромбоцитов, которая
в результате перераспределения зарядов в отдельных участках двой-
ного фосфолипидного слоя плазменной мембраны приобретает от-
рицательный заряд, а также на отрицательно заряженной поверхно-
сти коллагена субэндотелия.
18. При нарушении целостности кровеносных сосудов отрица-
тельно заряженная поверхность коллагена субэндотелия, а также по-
верхность активированных тромбоцитов являются высокоаффинными
для ряда белков свертывания крови, и в первую очередь для фактора
XII и высокомолекулярного кининогена (ВМК), находящегося в ком-
плексе с прекалликреином и фактором XI. Спонтанно активированный
на поверхности фактор ХПа стимулирует образование фермента кал-
ликреина, который по принципу положительной обратной связи усили-
вает активацию фактора XII. Фактор ХПа активирует фактор XI. Об-
разованием фактора Х1а завершается контактная стадия свертывания
крови, а фактор Х1а стимулирует активацию фактора XI, который пре-
вращает фактор X в фактор Ха.
19. При глубоком повреждении сосудистой стенки и окружающих
тканей, а также под воздействием адреналина и при некоторых патоло-
гических состояниях в кровоток поступают тромбопластические веще-
ства, представляющие комплекс белка - тканевого фактора с фосфоли-
пидами. Они активируют фактор YII, который превращает фактор X в
фактор Ха.
20. Начиная с фактора Ха, который представляет собой физио-
логический активатор протромбина. Последний превращается в ключе-
вой фермент свертывания - тромбин. Тромбин, действуя на фибриноген,
отщепляет от него фибринопептиды А и В. Образуется фибрин-
мономер, который спонтанно при физиологических условиях (рН7) по-
лимеризуется в агрегат фибрин-мономера или нестабилизированный
фибрин с непрочными водородными связями. Далее, при действии на
такой фибрин фактора ХШа транспептидазы происходит стабилиза-
ция фибрина. Образующийся стабилизированный фибрин имеет проч-
ные ковалентные связи, которые могут разрушить только протеоли-
тические ферменты.
21. 1,3, 5.
222
22. К тромбозу или геморрагиям.
23. Через посредство фибронектина - высокомолекулярного
белка плазмы крови и клеток.
24. Двумя путями: на биохимическом и клеточном уровнях и
при участии нейрогуморальных механизмов.
25. Монослой эндотелиальных клеток, расположенный на
внутренней поверхности сосудистой стенки.
26. 1,4,5, 7,8.
27. Гликопротеин. Белковая часть представляет собой димер,
состоящий из трех пар полипептидных цепей, соединенных дисуль-
фидными связями.
28. Способность к агрегации.
29. Для создания высокого отрицательного заряда, способст-
вующего увеличению тромборезистентности сосудистой стенки.
30.3.
31. Процесс комплексообразования гепарина с белками и дру-
гими компонентами крови создает в организме высокий антикоагу-
лянтный и фибринолитический фон, необходимый для предотвра-
щения свертывания крови или для лизиса уже образовавшихся фиб-
риновых сгустков.
32.1,3,6.
33. Повышение фибринолитической активности - 2, 3, 5; по-
вышение антикоагулянтной активности -1,5.
34. Ранние - 1, 2 - обладают свертывающими свойствами;
поздние - 6, 7 - обладают антикоагулянтными свойствами.
35.1,2,7.
36. 2.
XII
БИОХИМИЯ
МЕЖКЛЕТОЧНОГО МАТРИКСА
1. Выберите признаки, характерные для соединительной тка-
ни.
1. Преобладание глобулярных белков.
2. Преобладание фибриллярных белков.
3. Наличие большого количества липопротеинов.
4. Преобладание межклеточного вещества по сравнению с
клеточными элементами.
5. Большое количество протеогликанов.
2. Выберите аминокислоты, преобладающие в коллагене.
1. Пролин. 4. Лизин.
2. Оксипролин. 5. Метионин.
3. Глинин.
3. Какие из перечисленных ниже особенностей правильно ха-
рактеризуют коллаген?
1. Коллаген является полноценным пищевым источником
аминокислот.
2. Коллаген не гидролизуется протеазами желудочно-
кишечного тракта.
3. Коллаген составляет 1/3 от общего количества белка в
организме, является основным структурным белком.
4. При старении увеличивается скорость обмена коллагена.
5. В коже и костях, стенках сосудов, базальных мембранах
содержатся различные типы коллагеновых молекул.
6. В составе коллагена преобладают пролин, оксипролин,
глицин.
7. В составе коллагена преобладают лизин, оксилизин, ала-
нин.
4. Укажите правильный порядок этапов биосинтеза коллагена
и образования коллагеновых волокон (например, 3 -> 4 -» и т.д.):
1. Фибриллогенез.
2. Гидроксилирование пролина и лизина.
3 . Образование проколлагена.
4. Гликозилирование.
5. Отщепление N- и С-концевых фрагментов.
6. Образование коллагеновых волокон.
7. Синтез пептидных цепей проколлагена.
5. Чем обусловлена высокая прочность коллагеновых воло-
кон?
1. Множеством ковалентных связей между молекулами тро-
поколлагена.
224
2. Образованием тройной спирали из полипептидных це-
пей,
3. Взаимодействием протеогликанов с коллагеновыми фиб-
риллами.
4. Гидрофобными связями между молекулами тропоколла-
гена.
5. Сдвигом молекул тропоколлагена на 1/4 относительно
друг друга.
6. А. Какие аминокислоты преобладают в коллагене?
Б. Напишите реакцию окисления радикала одной из этих
аминокислот, происходящую при посттрансляционных
изменениях коллагена. Укажите фермент и кофакторы.
Я Как изменится с возрастом суточное выделение с мочой
продукта реакции, написанной Вами в п. Ь? Почему?
7. Какие последствия может иметь недостаток витамина С в
организме?
1. Снижение активности пролилгидроксилазы фибробла-
стов.
2. Уменьшение прочности структуры коллагена.
3. Повышение количества оксипролина в коллагене.
4. Снижение количества оксипролина в коллагене.
5. Уменьшение скорости гликозилирования оксипролина.
6. Увеличение количества водородных связей между поли-
пептидными цепями коллагена.
8. Одна из форм коллагенового заболевания - синдром Элер-
са-Данлоса, сопровождающийся деформацией суставов и искривле-
нием позвоночника, обусловлен недостаточностью проколлагенпеп-
тидаз.
А. Изобразите схему строения проколлагена.
Б. На схеме укажите место действия проколлагенпептидаз.
В, Какой из этапов посттрансляционных изменений колла-
гена нарушен при этом заболевании?
9. Увеличение количества кальцитриола, например при гипер-
витаминозе Дз, приводит к деструкции как минерального, так и ор-
ганического компонентов костей.
А. Катаболизм какого белка соединительной ткани будет
нарастать при этом состоянии?
2>. Концентрация каких компонентов будет увеличиваться в
моче?
1(к При гиперпаратиреоидизме увеличивается в моче количе-
ство оксипролина и количество кальция. Объясните этот факт.
11. При старении возрастает ригидность связок, сухожилий,
уменьшается тургор тканей. Укажите возможные причины этого
явления.
15 Сборник тестов и задач по биохимии
1. Увеличение количества поперечных связей между моле-
кулами тропоколлагена.
2. Уменьшается соотношение: основное вещество/волокна.
3. Снижается способность межклеточного вещества связы-
вать воду.
4. Увеличивается количество протеогликанов в межкле-
точном матриксе.
12. Препараты кортикостероидов, в частности кортизон, ин-
гибируют деление фибробластов и образование мРНК проколлаге-
на. Как повлияет длительное введение кортизона эксперименталь-
ным животным на выведение оксипролина с мочой?
13. Системная склеродермия - заболевание, при котором уве-
личивается синтез коллагена, развивается фиброз кожи и внутрен-
них органов.
А. По какому компоненту мочи можно судить об интен-
сивности обмена коллагена и как он изменяется при
этом заболевании?
Б. Как изменится этот показатель при лечении больного
стероидными препаратами, если известно, что они, в
частности, угнетают образование мРНК проколлагена
( Т, 1, <->)?
14. Какие факторы могут явиться причиной изменения струк-
туры коллагена? Подберите соответствующие пары.
Изменение первичной А. Дефицит витамина С.
структуры коллагена. Нарушение первичной В. Мутации в ДНК фиб- робластов.
структуры лизилами- С. Дефицит Си2+.
нооксидазы. Снижение активности пролилгидроксилазы. Снижение активности лизил амино оксидазы. D. Дефицит витамина А.
15. Выберите положения, правильно характеризующие эла-
стин.
1. Эластин является фибриллярным белком.
2. Эластин способен к обратимому растяжению.
3. Эластин располагается в стенках крупных сосудов, обес-
печивая их упругие свойства.
4. Эластин преобладает в структуре крупных сухожилий.
5. Десмозин обеспечивает сетчатую структуру эластина.
16. В составе эластина преобладают следующие аминокисло-
ты.
1 .Ала. 3. Вал.
2 . Гли. 4. Оксипролин.
Ответ по табл. 1*
226
17. Покажите преимущественное распределение коллагена и
эластина в следующих органах, подобрав правильный буквенный
ответ.
1. Сухожилия. А. Эластин.
2. Кости. В. Коллаген.
3. Стенка аорты. С. Преимущественного распределения
4. Шейные связки. указанных веществ нет.
18. Какие компоненты необходимы для проявления активно-
сти пролингидроксилазы?
1. Ch. 4. Витамин С.
2. Витамин Be. 5. НАДФ+.
3. Fe2+. 6. а-кетоглутарат.
19. А. Какие из компонентов необходимы для проявления ак-
тивности аминооксидазы лизина?
I.O2. 3. ВитаминС.
2. Ионы меди. 4. Витамин Вь
Б. Из предложенных утверждений выберите те, которые
правильно характеризуют последствия недостаточности
амино оксидазы лизина.
1. Нарушается синтез десмозина.
2. Увеличивается количество растворимого эластина.
3. Уменьшается прочность эластина.
4. Уменьшается прочность аорты.
5. В эластине увеличивается количество лизина и сни-
жается количество десмозина.
20. Выберите положения, правильно характеризующие состав
и строение фибронектина.
1. Является липопротеином.
2. Является гликопротеином.
3. Имеет доменную структуру.
4. Является простым белком.
5. Имеет несколько центров связывания (поливалентный
белок).
6. Является металлопротеином.
21. Фибронектин является фактором, связывающим коллаге-
новые волокна, протеогликаны, клетки. Какими свойствами это
объясняется?
1. Располагается внутри клеток.
2. Располагается в межклеточном пространстве.
3. Является простым белком.
4. Является поливалентным белком.
5. Имеет центры связывания фибробластов, коллагена.
22. При изучении свойств клеток при малигнизации обнару-
жено, что количество фибронектина на их поверхности снижается.
А. Предположите, какое из свойств злокачественных кле-
ток может явиться следствием этого факта.
227
Б. Опишите химическую природу фибронектина и особен-
ности его строения.
23. Выберите утверждения, правильно характеризующие
структуру и биологическую роль протеогликанов.
1. Составным компонентом являются гликозамингликаны.
2. Белок составляет 5-10% от массы протеогликанов.
3. Белок составляет 20-30% от массы протеогликанов.
4. Составляют основную массу межклеточного матрикса
соединительной ткани.
5. Образуют гелеобразные структуры.
6. Связаны со структурными белками соединительной
ткани.
24. Изобразите схему строения протеогликановых агрегатов.
Укажите составные компоненты.
25. Напишите структуру дисахаридной единицы гиалуроно-
вой кислоты. Укажите ее функцию в организации межклеточного
матрикса.
26. Укажите, какие компоненты образуются при гидролизе:
а) хондроитинсульфата; А. Гиалуроновая кислота,
б) гиалуроновой кислоты; В. Глюкуронат-2-сульфат.
в) гепарина. С. N-ацетилглюкозамин.
D. N-ацетилгалактозамин-
-4-сульфат.
Е. N-ацетилглюкозамин-
сульфат.
27. Дисахаридные фрагменты каких гликозамингликанов
изображены:
1.
СНгОН
NHCOCH3
2.
HO3S
СООН I СН2ОН
ОН NHCOCH3
228
Эталоны ответов к разделу XII
“БИОХИМИЯ
МЕЖКЛЕТОЧНОГО МАТРИКСА”
1. 2, 4, 5.
2. 1,2, 3.
3. 2,3, 5,6.
5. 1,2, 3, 5.
6. А. Гли; Про; оксипролин.
Б.
но.
,___, 2+
Fe
<N>J-c°--------------------► kN>-co-
| аскорбиновая кислота |
пр о лингидр оксидаза
В. Уменьшится: с возрастом увеличивается количество по-
перечных связей в коллагене, его пептидаые связи ста-
новятся труднодоступны для фермента коллагеназы.
7. 1,2,4, 5.
В. Частичный протеолиз.
9. 1. Коллагена. 2. Оксипролина, Са2+.
10. Под действием избытка паратгормона происходит дест-
рукция органического и минерального компонентов костей.
И. 1, 2, 3.
15*
229
12. Так как при введении кортизона уменьшается синтез коллаге-
на, то уменьшится и количество оксипролина, выводимого с мочой.
13. А. Оксипролин: при данном заболевании его выведение с
мочой увеличивается.
Б. Ф.
14. 1-В; 2-В; 3-А; 4-С. 18.1,3,4.6.
15. 1,2,3,5. 19. А. 1,2.
Б. 1,2, 3,4, 5.
16. А. 20.2,3,5.
17. 1-В; 2-В; 3-А; 4-А. 21.2,4,5.
22. А. Метастазирование (из-за уменьшения связывания клеток
с окружающей тканью).
Б. Гликопротеин. Имеет доменную структуру и несколько
центров связывания.
23. 1, 2, 3, 4, 5.
24.
25.
соон СН2ОН
К глюкуроновой кислоте присоединяются протеогликаны,
образуя структуру “ершика”.
26. а - A, D; б - А, С; в - В, Е.
27. 1 - глюкуроновая кислота.
2 - хондроитин-4-сульфат.
230
XIII
ИММУНОГЛОБУЛИНЫ
и
АНТИГЕНЫ
1. Известно, что белки плазмы крови при электрофорезе (pH
7-8) разделяются на ряд фракций, из которых наибольшей по-
движностью (по направлению к положительному электроду - аноду)
обладают альбумины, а наименьшей - гамма-глобулины, включающие
в себя фракцию иммуноглобулинов. Выберите признаки, характерные
ДЛЯ альбуминов и иммуноглобулинов (ответ: цифра - буква).
1. Состоят из нескольких полипептидных А. Иммуногло-
цепей. булины.
2. Содержание дикарбоксильных амино- В. Альбумины,
кислот больше.
3. Молекулярная масса меньше.
4. Гидратная оболочка меньше.
5. Осаждаются полностью в полунасы-
щенном растворе сульфата аммония.
6. Синтезируются в В-лимфоцитах.
7. Специфически взаимодействуют с ан-
тигенами.
2. Классы иммуноглобулинов различаются по числу входящих
в их состав полипептидных цепей, формирующих один или несколь-
ко тетрамеров.
А. Какое количество полипептидных цепей содержит одна
молекула иммуноглобулина G?
Б. Укажите количество тетрамеров в иммуноглобулинах
классов G, М, A, D, Е.
3. Назовите правильные положения применительно к молеку-
лам иммуноглобулинов класса G.
1. Общее число полипептидных цепей - две.
2. Число разных типов полипептидных цепей - две.
3. Основной вид связей между разными полипептидными
цепями - водородная.
4. Число активных центров (центров связывания антигенов)
-два.
5. Активный центр формируется за счет N-концевых вариа-
бельных фрагментов легкой и тяжелой цепей.
231
4. По каким признакам классы иммуноглобулинов различа-
ются между собой?
1. Функция.
2. Молекулярная масса.
3. Первичная структура тяжелых цепей.
4. Первичная структура легких цепей.
5. Как формируется активный центр антител (центр связыва-
ния антигена)?
1. Только за счет тяжелой цепи молекулы.
2. При взаимодействии вариабельных областей тяжелой и
легкой цепей.
3. Только за счет легкой цепи.
4. Связывает антиген посредством образования множества
нековалентных связей.
6. Сколько в каждом классе иммуноглобулинов разных типов
а) легких цепей, б) тяжелых цепей?
7. Каждая молекула иммуноглобулина G содержит два актив-
ных центра и, следовательно, имеет две иммунологические валент-
ности. Сколько валентностей в иммуноглобулинах разных классов?
8. Чем определяется класс иммуноглобулина?
1. Типом легкой цепи.
2. Типом тяжелой цепи.
3. Первичной структурой N-фрагмента цепи, выбранной по
пп. 1 или 2.
4. Первичной структурой С-фрагмента цепи, выбранной по
пп. 1 или 2.
9. Выберите правильные по смыслу сочетания буквы и цифры.
1. Тип тяжелой цепи-у (гамма).
2. Тип тяжелой цепи-p. (мю).
3. Тип легкой цепи-1 (лямбда)
или - к (каппа).
4. Из всех белков плазмы кро-
ви электрофоретическая
подвижность наибольшая.
А. Иммуноглобулины
класса G.
В. Иммуноглобулины
класса М.
С. Оба класса.
D. Ни тот, ни другой.
10. Выберите правильные положения.
1. Иммуноглобулины класса G являются основными за-
щитными белками плазмы крови.
2 р состйв TgG входит о дин тип легкой пели
3. Молекулярная масса IgG составляет 150000 Да.
4. В состав IgG входит тяжелая цепь типа а.
232
11. Назовите правильные свойства антигенной детерминанты.
1. Комплементарна активному центру антител.
2. Является частью поверхности молекулы белка-антигена
3. Формируется радикалами аминокислот простых белков.
4. Формируется олигосахаридами гликолипидов.
12. Подберите правильные по смыслу сочетания буквы и циф-
ры.
1. Предсуществуют в организме до его
контакта с антигеном в виде попу-
ляции из примерно 107 клонов с раз-
ными структурными генами имму-
ноглобулинов.
2. В цитоплазматическую мембрану
клеток встроены антитела или близ-
кие к ним белки (рецепторы антиге-
на).
3. После контакта с антигеном начи-
нают делиться и секретируют анти-
тела, соответствующие антигену.
4. Участвуют в реакциях клеточного
иммунитета.
А. В-лимфоциты.
В. Т-лимфоциты.
С. Оба вида лим-
фоцитов.
D. Указанное
свойство Т-и В-
лимфоцитам не
присуще.
Эталоны ответов к разделу XIII
“ИММУНОГЛОБУЛИНЫ
И АНТИГЕНЫ”
1. 1 - А; 2-В; 3-В; 4-А;
5 - А; 6 - А; 7 - А.
2. Л. Четыре цепи.
2>. IgG, D, Е - один;
IgA - два-четыре;
IgM - пять.
3. 2, 4, 5.
4.1,2, 3.
5. 2, 4.
7. IgG, D, Е - 2;
IgA - 4-8; IgM -10.
8. 2, 4.
9.1 -А;2-В;3- C;4-D.
10. 1, 3.
11. 1,2,3, 4.
12.1 - А; 2 - С; 3 - А; 4 - В
6. а - 2; б -1.
233
Учебное издание
Сборник тестов
и задач по биохимии
Зав. редакцией
И. И. Щехура
Редактор
Г. Г. Есакова
Художественный редактор
Л. В. Мухина
Обложка художника
А.А. Кущенко
Технический редактор
3. С. Кондрашова
Корректоры
Г. В. Сибирцева
И. В. Бабаева
ИБ№7334
ЛР№ 040414 от 27.03.92
Сдано в набор 26.04.95 Подписано а печать 19,10.96.
Формат 60^90 1/16. Бумага офс.
Офсетная печать.
Усл. печ. л. 15,0 Уч.-изд. л. 13,78
Тираж 4000 экз. Заказ Изд № 5648
Ордена “Знак Почета**
Издательство Московского университета.
103009, Москва, ул. Б. Никитская, 5/7.
Типография ордена
“Знак Почета** изд-ва МГУ.
119899. Москва, Воробьевы горы
Издательство
Московского университета
готовит к выпуску
в 1996-1997 гг.
следующие книги:
Реутов П.А., Курц А.Л., Бутин К.П.
ОРГАНИЧЕСКАЯ ХИМИЯ. 4.1, 2:
Учебник. - 80 л. (в пер.)
Учебник составлен в соответствии с вузовской програм-
мой, содержит описание органических соединений по
классам и ряд глав, посвященных наиболее важным про-
блемам физической органической химии. Строение и
свойства органических соединений рассмотрены с пози-
ций как теории электронных смещений, так и теории мо-
лекулярных орбиталей. Это составляет наиболее важное
отличие данного учебника от других учебных пособий по
органической химии.
Для студентов и аспирантов химических специальностей
вузов.
Темплам 1996 г.
ЭЛЕМЕНТЫ ПАТОЛОГИЧЕСКОЙ ФИЗИОЛОГИИ
И БИОХИМИИ
Под ред. академика АМН СССР И.П.Ашмарина
Учеб, пособие. -14 л. (в пер.)
Предлагаемое учебное пособие имеет задачей подготов-
ку специалистов по фундаментальным аспектам физиоло-
гии, биохимии, молекулярной биологии, биофизики, ци-
тологии и др. Избранные разделы данного пособия
включают элементы патофизиологии, патобиохимии пи-
тания и обмена белков, углеводов и липидов. Рассматри-
ваются механизмы язвы желудка и кишечника, авитами-
нозы и дефициты минерального питания. В отдельные
главы выделены вопросы, связанные с патологическим
состоянием сердца (ишемическая болезнь), сосудов
(гипертония), центральной нервной системы (психо-
патология). Отдельно рассматриваются механизмы
стресса, алкоголизма и наркомании.
Для студентов кафедр физиолого-биохимических и меди-
ко-биологических отделений университетов и медвузов.
Темплан 1996 г.
Шульговский В.В.
ФИЗИОЛОГИЯ ЦЕНТРАЛЬНОЙ НЕРВНОЙ
СИСТЕМЫ:
Учебник. - 30 л. (в пер.)
Учебник написан на основе лекционных курсов по общей
и частной нейрофизиологии, читаемых авторами на про-
тяжении ряда лет студентам кафедр физиологии, высшей
нервной деятельности биологического факультета МГУ.
Излагаются современные сведения о функционировании
нейронов и нервной регуляции основных видов деятель-
ности организма.
Для студентов биологических, медико-биологических,
психологических специальностей университетов, а также
аспирантов и научных работников.
Темплан 1997 г.
Шубникова Е.А.
ЭПИТЕЛИАЛЬНЫЕ ТКАНИ
Учеб, пособие. - 15 л.
В пособии в сравнительно-эволюционном аспекте дается
детальное описание морфодициологических особенно-
стей различных эпителиев: покровных, серозных и слизи-
стых, а также эпителиев паренхимы внутренних органов.
Приводятся сведения по микро- и ультраструктурной ор-
ганизации, пролиферации, развитию в онто- и филогене-
зе. Рассматриваются общие вопросы гистологии: про-
блемы регенерации и эволюции тканей.
Для студентов биологических и медицинских факульте-
тов вузов, аспирантов и научных работников.
По вопросам приобретения этой книги
обращайтесь непосредственно
в Издательство МГУ
по тел. 939-33-23, 229-75-41